Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится в общем смысле к бифункциональным молекулам, включая (a) TGFβRII или его фрагмент, способный связывать с TGFβ, и (b) антитело или его антигенсвязывающий фрагмент, который связывает белок иммунологической контрольной точки, такой как лиганд программируемой смерти 1 (PD-L1, Programmed Death Ligand 1), к применению таких молекул (напр., для лечения рака) и к способам создания таких молекул.
Уровень техники
[0002] В терапии рака давно считается признанным, что химиотерапия ассоциирована с высокой токсичностью и может приводить к появлению устойчивых вариантов раковых клеток. Даже при терапии, направленной против сверхэкспрессирующихся или активированных онкобелков, важных для выживания и роста опухоли, раковые клетки неизбежно мутируют и адаптируются, снижая зависимость от целевого пути передачи сигнала, например, используя резервный путь. Иммунотерапия рака является новой парадигмой в лечении рака, сосредоточенной на активации иммунной системы, а не на направленном действии на раковые клетки. Принципом иммунотерапии рака является реактивация иммунного ответа хозяина, особенно адаптивного Т-клеточного ответа, обеспечивающая уничтожение раковых клеток средствами иммунологического надзора, в частности, минимального остаточного заболевания, которое ускользнуло от других форм лечения, что приводит к развитию продолжительного защитного иммунитета.
[0003] Одобрение Управлением по контролю за продуктами питания и лекарствами ипилимумаба, антитела к CTLA-4, для лечения меланомы, в 2011 г. открыло новую эру в иммунотерапии рака. Становление иммунотерапии рака произошло после демонстрации индукции продолжительного ответа на терапию, направленную против PD-1 или PD-L1, при меланоме, раке почек и легких в рамках клинических исследований (Pardoll, D.M., Nat Immunol. 2012; 13:1129-32). Однако терапия ипилимумабом ограничивается его профилем токсичности, предположительно, из-за того, что анти-CTLA-4 терапия, действуя на первичную Т-клеточную ингибиторную контрольную точку, может привести к образованию новых аутореактивных Т-клеток. В то время как ингибирование взаимодействия PD-L1/PD-1 приводит к растормаживанию существующих хронических иммунных ответов в истощенных Т-клетках, большинство из которых являются противовирусными или противораковыми по своей природе (Wherry, E.J., Nat Immunol. 2011; 12:492-9), анти-PD-1 терапия может тем не менее иногда вызвать потенциально летальные связанные с легкими аутоиммунные нежелательные явления. Несмотря на показанную на сегодняшний день многообещающую клиническую активность анти-PD1 и анти-PD-L1, повышение терапевтического индекса либо посредством повышения терапевтической активности, либо посредством снижения токсичности, либо посредством того и другого вместе, остается основной целью разработки иммунотерапевтических средств.
Краткое содержание изобретения
[0004] Настоящее изобретение основано на открытии того, что бифункциональный белок, содержащий по меньшей мере часть рецептора TGFβ II (TGFβRII), способную связывать TGFβ, и антитело или его антигенсвязывающий фрагмент, который связывает белок иммунологической контрольной точки, такой как человеческий белок «лиганд программируемой смерти 1» (PD-L1, Programmed Death Ligand 1), может быть эффективным противоопухолевым и противораковым терапевтическим средством. Белок может оказывать синергическое действие при лечении рака по сравнению с эффектом введения двух агентов в отдельности.
[0005] Соответственно, в первом аспекте настоящее изобретение представляет белок, включающий (a) человеческий TGFβRII или его фрагмент, способный связывать TGFβ (напр., растворимый фрагмент); и (b) антитело или его антигенсвязывающий фрагмент, который связывает PD-L1 (напр., любое из антител или фрагментов антител, описанных в настоящей заявке).
[0006] В родственном аспекте настоящее изобретение представляет полипептид, включающий (a) по меньшей мере вариабельный домен тяжелой цепи антитела, связывающий PD-L1 (напр., 1-120 аминокислоты SEQ ID NO: 2); и (b) человеческий TGFβRII или его растворимый фрагмент, способный связывать TGFβ (напр., внеклеточный домен человеческого TGFβRII (ECD, extra-cellular domain), 24-159 аминокислоты SEQ ID NO: 9, или любой из описанных в настоящей заявке). Полипептид может также включать аминокислотный линкер, соединяющий С-конец вариабельного домена с N-концом человеческого TGFβRII или его растворимого фрагмента, способного связывать TGFβ. Полипептид может включать аминокислотную последовательность SEQ ID NO: 3 или аминокислотную последовательность, в основном идентичную SEQ ID NO: 3. Фрагментом антитела может быть scFv, Fab, F(ab')2 или Fv фрагмент.
[0007] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает SEQ ID NO: 2, и человеческий TGFβRII. Антитело, при желании, может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0008] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает SEQ ID NO: 2, и фрагмент человеческого TGFβRII, способный связывать TGFβ (напр., растворимый фрагмент). Антитело, при желании, может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0009] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает SEQ ID NO: 2, и внеклеточный домен человеческого TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0010] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает 1-120 аминокислоты SEQ ID NO: 2, и человеческий TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0011] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает 1-120 аминокислоты SEQ ID NO: 2, и фрагмент человеческого TGFβRII, способный связывать TGFβ (напр, растворимый фрагмент). Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0012] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает 1-120 аминокислоты SEQ ID NO: 2, и внеклеточный домен человеческого TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0013] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает гипервариабельные участки, присутствующие в SEQ ID NO: 2, и человеческий TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0014] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает гипервариабельные участки, присутствующие в SEQ ID NO: 2, и фрагмент человеческого TGFβRII, способный связывать TGFβ (напр, растворимый фрагмент). Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0015] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, который включает гипервариабельные участки, присутствующие в SEQ ID NO: 2, и внеклеточный домен человеческого TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0016] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий SEQ ID NO: 12, и человеческий TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0017] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий SEQ ID NO: 12, и фрагмент человеческого TGFβRII, способный связывать TGFβ (напр, растворимый фрагмент). Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0018] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий SEQ ID NO: 12, и внеклеточный домен человеческого TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0019] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий гипервариабельные участки, присутствующие в SEQ ID NO: 12, и человеческий TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0020] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий гипервариабельные участки, присутствующие в SEQ ID NO: 12, и фрагмент человеческого TGFβRII, способный связывать TGFβ (напр, растворимый фрагмент). Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0021] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий гипервариабельные участки, присутствующие в SEQ ID NO: 12, и внеклеточный домен человеческого TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0022] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий SEQ ID NO: 14, и человеческий TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0023] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий SEQ ID NO: 14, и фрагмент человеческого TGFβRII, способный связывать TGFβ (напр, растворимый фрагмент). Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0024] В определенных вариантах осуществления настоящего изобретения белок или полипептид включает антитело или его антигенсвязывающий фрагмент, включающий SEQ ID NO: 14, и внеклеточный домен человеческого TGFβRII. Антитело может включать модифицированную константную область (напр., любую, описанную в настоящей заявке, включая С-концевую замену Lys→Ala, мутацию последовательности Leu-Ser-Leu-Ser (SEQ ID NO: 19) до Ala-Thr-Ala-Thr (SEQ ID NO: 20) или гибридную константную область, включающую шарнирную область IgG1 и домен CH2 IgG2).
[0025] Настоящее изобретение также представляет нуклеиновую кислоту, включающую нуклеотидную последовательность, которая кодирует полипептид, описанный выше. В определенных вариантах осуществления настоящего изобретения нуклеиновая кислота также включает вторую нуклеотидную последовательность, кодирующую по меньшей мере вариабельный домен легкой цепи антитела, который при комбинировании с полипептидом, образует антигенсвязывающий сайт, который связывает PD-L1 (напр., включая 1-110 аминокислоты SEQ ID NO: 1). Вторая нуклеотидная последовательность может кодировать аминокислотную последовательность SEQ ID NO: 1 (секретируемую анти-PD-L1 легкую цепь лямбда) или аминокислотную последовательность, в основном идентичную SEQ ID NO: 1. Настоящее изобретение также представляет клетку, включающую любые из описанных выше нуклеиновых кислот.
[0026] Настоящее изобретение также представляет способ получения белка, включающего (a) внеклеточный домен человеческого TGFβRII или его фрагмент, способный связывать TGFβ (напр., растворимый фрагмент), и (b) антитело или его антигенсвязывающий фрагмент, который связывает человеческий PD-L1. Способ включает поддержание описанной клетки в условиях, обеспечивающих экспрессию белка. Способ может также включать сбор белка.
[0027] Настоящее изобретение также представляет белок, включая полипептид, описанный выше, и по меньшей мере вариабельный домен легкой цепи антитела, который при комбинировании с полипептидом, образует антигенсвязывающий сайт, который связывает PD-L1. Белок может включать (a) два полипептида, каждый из которых имеет аминокислотную последовательность, состоящую из аминокислотной последовательности SEQ ID NO: 3, и (b) два дополнительных полипептида, каждый из которых имеет аминокислотную последовательность, состоящую из аминокислотной последовательности SEQ ID NO: 1.
[0028] Настоящее изобретение также представляет описанный выше белок для применения в терапии. Терапия может включать применение лучевой терапии или введение химиотерапевтического средства, биологического средства или вакцины.
[0029] Настоящее изобретение также представляет описанный выше белок для применения для стимуляции местного снижения TGFβ в опухоли.
[0030] Настоящее изобретение также представляет описанный выше белок для применения для ингибирования фосфорилирования SMAD3 в клетке (напр., в опухолевой клетке или в иммунной клетке).
[0031] Настоящее изобретение также представляет описанный выше белок для применения в лечении рака или для применения для ингибирования роста опухоли. Рак или опухоль можно выбрать из группы, состоящей из колоректального рака, рака молочной железы, яичников, поджелудочной железы, желудка, простаты, почек, шейки матки, миеломы, лимфомы, лейкемии, рака щитовидной железы, эндометрия, матки, мочевого пузыря, нейроэндокринной опухоли, рака головы и шеи, печени, носоглотки, семенников, мелкоклеточного рака легких, немелкоклеточного рака легких, меланомы, базальноклеточного рака кожи, плоскоклеточного рака кожи, выбухающей дерматофибросаркомы, карциномы из клеток Меркеля, глиобластомы, глиомы, саркомы, мезотелиомы и миелодиспластических синдромов. Применение может также включать применение лучевой терапии или введение химиотерапевтического средства, биологического средства или вакцины.
[0032] Настоящее изобретение также представляет способ стимуляции снижения TGFβ. Способ включает введение описанного выше белка, где белок связывает TGFβ в растворе, связывает PD-L1 на поверхности клетки и переносит связанный TGFβ в клетку (напр., в раковую клетку).
[0033] Настоящее изобретение также представляет способ ингибирования фосфорилирования SMAD3 в клетке (напр., в опухолевой клетке или в иммунной клетке), при этом способ включает обработку клетки в опухолевом микроокружении описанным выше белком.
[0034] Настоящее изобретение также представляет способ ингибирования роста опухоли или лечения рака. Способ включает обработку опухоли описанным выше белком. Способ может также включать обработку опухоли излучением или химиотерапевтическим средством, биологическим средством или вакциной. В определенных вариантах осуществления настоящего изобретения опухоль или рак выбирают из группы, состоящей из колоректального рака, рака молочной железы, яичников, поджелудочной железы, желудка, простаты, почек, шейки матки, миеломы, лимфомы, лейкемии, рака щитовидной железы, эндометрия, матки, мочевого пузыря, нейроэндокринной опухоли, рака головы и шеи, печени, носоглотки, семенников, мелкоклеточного рака легких, немелкоклеточного рака легких, меланомы, базальноклеточного рака кожи, плоскоклеточного рака кожи, выбухающей дерматофибросаркомы, карциномы из клеток Меркеля, глиобластомы, глиомы, саркомы, мезотелиомы и миелодиспластических синдромов.
[0035] «TGFβRII» или « рецептор TGFβ II» обозначает полипептид, содержащий последовательность человеческого рецептора TGFβ типа 2 изоформы А дикого типа (напр., аминокислотную последовательность эталонной последовательности NCBI (National Center for Biotechnology Information, Национального центра биотехнологической информации) с учетным номером NP_001020018 (SEQ ID NO: 8)), или полипептид, содержащий последовательность человеческого рецептора TGFβ типа 2 изоформы В дикого типа (напр., аминокислотную последовательность эталонной последовательности NCBI с учетным номером NP_003233 (SEQ ID NO: 9)) или содержащий последовательность, в основном идентичную аминокислотной последовательности SEQ ID NO: 8 или SEQ ID NO: 9. TGFβRII может сохранять по меньшей мере 0,1%, 0,5%, 1%, 5%, 10%, 25%, 35%, 50%, 75%, 90%, 95% или 99% TGFβ-связывающей активности последовательности дикого типа. Полипептид экспрессирующегося TGFβRII лишен сигнальной последовательности.
[0036] «Фрагмент TGFβRII, способный связывать TGFβ» обозначает любую часть эталонной последовательности NCBI с учетным номером NP_001020018 (SEQ ID NO: 8) или эталонной последовательности NCBI с учетным номером No. NP_003233 (SEQ ID NO: 9) или последовательность, в основном идентичную SEQ ID NO: 8 или SEQ ID NO: 9, длина которой составляет по меньшей мере 20 аминокислот (напр., по меньшей мере 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 175 или 200), которые по меньшей мере частично сохраняют TGFβ-связывающую активность (напр., по меньшей мере 0,1%, 0,5%, 1%, 5%, 10%, 25%, 35%, 50%, 75%, 90%, 95% или 99%) рецептора дикого типа или соответствующего фрагмента дикого типа. Как правило, такой фрагмент является растворимым фрагментом. Примером такого фрагмента является внеклеточный домен TGFβRII, имеющий последовательность SEQ ID NO: 10.
[0037] «В основном идентичный» обозначает полипептид, обладающий по меньшей мере 50%, желательно, 60%, 70%, 75% или 80%, желательнее, 85%, 90% или 95%, и наиболее предпочтительно, 99% идентичность аминокислотной последовательности эталонной аминокислотной последовательности. Длина последовательностей сравнения составляет, как правило, по меньшей мере 10 аминокислот, желательно, по меньшей мере 15 расположенных непрерывно аминокислот, желательнее, по меньшей мере 20, 25, 50, 75, 90, 100, 150, 200, 250, 300 или 350 расположенных непрерывно аминокислот и, наиболее предпочтительно, полноразмерную аминокислотную последовательность.
[0038] «Пациент» обозначает либо человека, либо животное, не являющееся человеком (напр., млекопитающее).
[0039] «Лечение» заболевания, нарушения или состояния (напр., рака) у пациента обозначает уменьшение по меньшей мере одного симптома заболевания, нарушения или состояния посредством введения терапевтического агента пациенту.
[0040] «Рак» обозначает совокупность аномально делящихся клеток.
[0041] Другие варианты осуществления и подробности настоящего изобретения представлены в настоящей заявке ниже.
Краткое описание чертежей
[0042] Фиг. 1A является схематическим изображением молекулы анти-PD-L1/TGFβ ловушки, содержащей одно антитело к PD-L1, слитое с двумя внеклеточными доменами рецептора TGFβ II посредством линкера (Gly4Ser)4Gly. Фиг. 1B является фотографией результата анализа анти-PD-L1/TGFβ ловушки, проведенного с помощью электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия в невосстанавливающих и восстанавливающих условиях.
[0043] Фиг. 2 является фотографией ПААГ после электрофореза в присутствии додецилсульфата натрия, показывающей анализ степени расщепления анти-PD-L1/TGFβ ловушки, экспрессирующийся клоном 02B15 при разном уровне удвоения популяции (PDL, population doubling level). Анти-PD-L1/TGFβ ловушку из клона 02B15 после проведения одной стадии хроматографии на протеине А анализировали с помощью электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия в восстанавливающих условиях. На дорожках 1 и 10 - стандарты молекулярного веса Blue Plus 2 MW Standard; дорожка 2 - очищенная эталонная анти-PD-L1/TGFβ ловушка; дорожка 3 - клон 02B15 при PDL0; дорожка 4 - клон 02B15 при PDL30; дорожка 5 - клон 02B15 при PDL60; и дорожка 6 - клон 02B15 при PDL90. (PDL, population doubling level, уровень удвоения популяции).
[0044] Фиг. 3 является графиком, показывающим анализ связывания анти-PD-L1/TGFβ ловушки с клетками HEK, трансфицированными для экспрессии человеческого PD-L1, проведенный посредством сортинга клеток с активированной флуоресценцией (FACS, Fluorescence Activated Cell Sorting).
[0045] Фиг. 4 является графиком, показывающим способность анти-PD-L1/TGFβ ловушки ингибировать индуцированное TGFβ фосфорилирование SMAD3 с помощью клеточной линии с репортерным геном pSMAD3-люциферазы (закрашенный кружок: анти-PD-L1; X: анти-PD-L1(mut); закрашенный квадрат: анти-PD-L1/TGFβ ловушка; закрашенный треугольник: анти-PD-L1(mut)/TGFβ ловушка; +: антитело к TGFβ 1D11; звездочка: TGFβ RII-Fc).
[0046] Фиг. 5A и 5B являются графиками, показывающими фармакокинетику внутривенно введенной анти-PD-L1/TGFβ ловушки и родственных белков у мышей.
[0047] Фиг. 6A является графиком, показывающим опосредованный PD-L1 эндоцитоз анти-PD-L1/TGFβ ловушки. Фиг. 6B является графиком, показывающим опосредованный PD-L1 эндоцитоз анти-PD-L1. Фиг. 6C является графиком, показывающим процент интернализации анти-PD-L1/TGFβ ловушки и анти-PD-L1, связанных с клетками HEK/PD-L1.
[0048] Фиг. 7A-7C являются графиками, показывающими противоопухолевую эффективность анти-PD-L1/TGFβ ловушки и родственных белков в подкожной модели карциномы молочной железы EMT-6 (Пример 7). Фиг. 7A показывает кривые роста опухоли, построенные по среднему объему опухоли у выживших мышей из разных групп лечения (звездочка: группа 1; закрашенный кружок: группа 2; закрашенный треугольник: группа 3; закрашенный квадрат: группа 4; пустой квадрат: группа 5; закрашенный квадрат/штриховая линия: группа 6; закрашенный квадрат/ пунктирная линия: группа 7). Фиг. 7B показывает кривые роста опухоли, построенные по индивидуальному объему опухоли в разных группах лечения. Фиг. 7C является графиком Каплана-Майера процента выживания в разных группах лечения (обозначения такие же, как на 7A).
[0049] Фиг. 8 является графиком, показывающим противоопухолевую эффективность анти-PD-L1/TGFβ ловушки и родственных белков в подкожной модели колоректальной карциномы MC38 (Пример 8; звездочка: группа 1; закрашенный кружок: группа 2; закрашенный кружок/штриховая линия: группа 3; закрашенный треугольник: группа 4; закрашенный треугольник/штриховая линия: группа 5; закрашенный квадрат: группа 6; закрашенный квадрат/штриховая линия: группа 7).
[0050] Фиг. 9 является графиком, показывающим противоопухолевую эффективность анти-PD-L1/TGFβ ловушки и родственных белков в ортотопической модели рака молочной железы EMT-6 (Пример 9; звездочка: группа 1; закрашенный кружок/штриховая линия: группа 2; закрашенный треугольник: группа 3; закрашенный треугольник/штриховая линия: группа 4; закрашенный ромб: группа 5).
[0051] Фиг. 10 является графиком, показывающим противоопухолевую эффективность анти-PDL1/TGFβ ловушки и родственных белков во внутримышечной модели колоректальной карциномы MC38 (Пример 10; звездочка: группа 1; закрашенный кружок: группа 2; закрашенный кружок/ штриховая линия: группа 3; закрашенный ромб/ штриховая линия: группа 4; закрашенный квадрат: группа 5; закрашенный квадрат/штриховая линия: группа 6; закрашенный ромб: группа 7).
[0052] Фиг. 11 является графиком, показывающим противоопухолевую эффективность анти-PD-L1/TGFβ ловушки и комбинации контроля анти-PD-L1 и TGFβ ловушки, введенных таким образом, чтобы обеспечить эквивалентное суммарное количество в кровотоке in vivo в ортотопической модели рака молочной железы EMT-6 (Пример 11; звездочка: группа 1; закрашенный квадрат: группа 2; пустой квадрат: группа 3; закрашенный ромб: группа 4; пустой ромб: группа 5).
[0053] Фиг. 12A-12C являются графиками, показывающими противоопухолевую эффективность анти-PD-L1/TGFβ ловушки и комбинации анти-PD-L1 и контрольной TGFβ ловушки, введенных таким образом, чтобы обеспечить эквивалентное суммарное количество в кровотоке in vivo во внутримышечной модели колоректальной карциномы MC38 (Пример 12). Фиг. 12A показывает кривые роста опухоли у мышей, обработанных как промежуточными, так и низкими дозами белков (звездочка: группа 1; закрашенные квадраты: группа 2; пустые квадраты: группа 3; закрашенные ромбы: группа 4; пустые ромбы: группа 5). Фиг. 12B (звездочка: группа 1; закрашенный квадрат: группа 2; закрашенный ромб: группа 4; *: p<0,0001 по сравнению с группой 1; **: p<0,0001 по сравнению с группой 2) и 12C (звездочка: группа 1; закрашенный квадрат: группа 3; закрашенный ромб: группа 5; *: p<0,0001 по сравнению с группой 1; **: p<0,0001 по сравнению с группой 3) показывают статистический анализ кривых роста опухоли у мышей, обработанных промежуточными и низкими дозами белков, соответственно.
[0054] Фиг. 13A-13B являются графиками, показывающими противоопухолевую эффективность анти-PD-L1(YW)/TGFβ ловушки и родственных белков в ортотопической модели рака молочной железы EMT-6 (Пример 13; звездочка: группа 1; закрашенный кружок: группа 2; закрашенный треугольник: группа 3; закрашенный квадрат: группа 4; закрашенный ромб: группа 5). Фиг. 13A показывает кривые роста опухоли у мышей из разных групп лечения. Фиг. 13B является графиком Каплана-Майера процента выживания в разных группах лечения.
[0055] Фиг. 14A-14B являются графиками, показывающими противоопухолевую эффективность анти- PD-L1(YW)/TGF-β ловушки и родственных белков на основании (A) объемов опухоли и (B) веса опухоли во внутримышечной модели колоректальной карциномы MC38 (Пример 14; звездочка: группа 1; закрашенный кружок: группа 2; закрашенный треугольник: группа 3; закрашенный квадрат: группа 4; закрашенный ромб: группа 5).
[0056] Фиг. 15 является графиком сравнения противоопухолевой эффективности обработки антителом к PD-1 с контролем TGFβ ловушки или без контроля TGFβ ловушки в ортотопической модели рака молочной железы EMT-6 (Пример 15; звездочка: группа 1; закрашенный квадрат: группа 2; закрашенный перевернутый треугольник: группа 3; пустой перевернутый треугольник: группа 4).
[0057] Фиг. 16 является графиком сравнения противоопухолевой эффективности обработки антителом к PD-1 с контролем TGFβ ловушки или без контроля TGFβ ловушки во внутримышечной модели колоректальной опухоли MC38 (Пример 16; звездочка: группа 1; закрашенный квадрат: группа 2; закрашенный перевернутый треугольник: группа 3; пустой перевернутый треугольник: группа 4).
[0058] Фиг. 17 является графиком сравнения противоопухолевой эффективности обработки антителом к LAG3 или к TIM3 с контролем TGFβ ловушки или без контроля TGFβ ловушки в ортотопической модели рака молочной железы EMT-6 (Пример 17; звездочка: группа 1; закрашенный квадрат: группа 2; закрашенный треугольник: группа 3; закрашенный перевернутый треугольник: группа 4; пустой треугольник: группа 5; пустой перевернутый треугольник: группа 6).
[0059] Фиг. 18 является графиком сравнения противоопухолевой эффективности обработки антителом к LAG3 или к TIM3 с контролем TGFβ ловушки или без контроля TGFβ ловушки во внутримышечной модели колоректальной опухоли MC38 (Пример 18; звездочка: группа 1; закрашенный квадрат: группа 2; закрашенный треугольник: группа 3; закрашенный перевернутый треугольник: группа 4; пустой треугольник: группа 5; пустой перевернутый треугольник: группа 6).
Подробное описание изобретения
[0060] Настоящее изобретение позволяет локализовано снизить TGFβ в опухолевом микроокружении посредством захвата TGFβ с помощью растворимого цитокинового рецептора (TGFβRII), прикрепленного к фрагменту антитела, узнающему клеточный рецептор иммунологической контрольной точки, находящийся на наружной поверхности определенных опухолевых клеток или иммунных клеток. Примером фрагмента антитела настоящего изобретения к белку иммунологической контрольной точки является анти-PD-L1. Эта бифункциональная молекула, в настоящей заявке иногда называемая «антитело-цитокиновой ловушкой», является эффективной именно потому, что антитело к рецептору и цитокиновая ловушка физически связаны друг с другом. Получаемое в результате преимущество (по сравнению, например, с введением антитела и рецептора в виде отдельных молекул) частично обусловлено тем, что цитокины работают в основном в локальном окружении, выполняя аутокринные и паракринные функции. Фрагмент антитела направляет цитокиновую ловушку в опухолевое микроокружение, где она будет наиболее эффективной, нейтрализуя местные иммуносупрессорные аутокринные или паракринные эффекты. Более того, в тех случаях, где мишень антитела интернализуется при связывании антитела реализуется эффективный механизм клиренса комплекса «цитокин/цитокиновый рецептор». Опосредованная антителом интернализация мишени была показана для PD-L1. Это является важным преимуществом перед применением антитела к TGFβ, поскольку, во-первых, антитело к TGFβ может не быть полностью нейтрализующим, и во-вторых, антитело может действовать как носитель, увеличивающий время полужизни цитокина, и комплексы «антитело/цитокин» часто действуют как циркулирующий резервуар, который собирается и в конечном счета диссоциирует, высвобождая цитокин обратно в кровоток (Montero-Julian et al., Blood. 1995; 85:917-24). Применение цитокиновой ловушки для нейтрализации лиганда также может быть лучшей стратегией, чем блокирование рецептора с помощью антитела, как в случае CSF-1. Поскольку CSF-1 выводится из кровотока посредством опосредованного рецептором эндоцитоза, блокада антителом к рецептору CSF-1 вызывает существенное повышение концентрации CSF-1 в кровотоке (Hume et al., Blood. 2012;119:1810-20).
[0061] Действительно, как описано ниже, обработка анти-PD-L1/TGFβ ловушкой вызывает развитие синергического противоопухолевого эффекта вследствие одновременной блокировки взаимодействия между PD-L1 на опухолевых клетках и PD-1 на иммунных клетках и нейтрализации TGFβ в опухолевом микроокружении. Как показано в следующих примерах, анти-PDL1/TGFβ ловушка обладает эффективностью, превосходящей эффективность отдельных контрольных агентов анти-PD-L1 или TGFβ ловушки. Не желая быть связанными с какой-либо теорией, авторы полагают, что это может быть обусловлено синергическим эффектом одновременной блокировки двух основных механизмов избегания иммунологического надзора и, дополнительно, направленным истощением TGFβ в опухолевом микроокружении с помощью одной молекулы. Такое истощение достигается посредством (1) направленного действия на PD-L1 на опухолевых клетках; (2) связывания аутокринного/паракринного TGFβ в опухолевом микроокружении с помощью ловушки TGFβ; и (3) разрушение связанного TGFβ посредством опосредованного рецептором PD-L1 эндоцитоза. Указанные выше механизмы действия не могут быть реализованы посредством комбинированной терапии двумя отдельными агентами анти-PD-L1 и TGFβ ловушкой. Более того, TGFβRII, слитый с С-концом Fc (фрагмента кристаллизации IgG), был в несколько раз сильнее TGFβRII-Fc, где TGFβRII размещен на N-конце Fc (см. Пример 3). Высокая эффективность анти-PDL1/TGFβ ловушки также снимает некоторое беспокойство, связанное с тем, что TGFβRII не ловит TGFβ2. Как указывают Yang et al., Trends Immunol. 2010; 31:220-227, хотя некоторые типы опухолей исходно не секретируют TGFβ2, по мере прогрессии опухоли TGFβ в опухолевом микроокружении в основном секретируется суопрессорными клетками миелоидного происхождения, которые секретируют TGFβ1. В дополнение к перспективам применения в качестве эффективного иммуноонкологического терапевтического средства обработка растворимым TGFβRII может, вероятно, уменьшать кардиотоксические проблемы действующей на TGFβ терапии, особенно, ингибиторов киназы TGFβRI. Это связано с важной роль TGFβ2 в эмбриональном развитии сердца, а также в восстановлении повреждений миокарда после ишемически-реперфузионного повреждения (Roberts et al., J Clin Invest. 1992; 90:2056-62).
TGFβ как опухолевая мишень
[0062] TGFβ считался в некоторой степени сомнительной мишенью иммунотерапии рака из-за парадоксальной роли двуликого Януса при раке (Bierie et al., Nat Rev Cancer. 2006; 6:506-20). Как и некоторые другие цитокины, активность TGFβ зависит от стадии развития и окружения. Действительно, TGFβ может работать либо как опухолевый активатор, либо как опухолевый супрессор, действуя на инициацию образования опухоли, на прогрессию опухоли и метастазирование. Механизмы, лежащие в основе такой двойственной роли TGFβ остаются неясными (Yang et al., Trends Immunol. 2010; 31:220-227). Хотя предполагали, что ингибирование роста при передаче сигнала через TGFβ опосредовано зависящим от Smad путем передачи сигнала, в то время как независящие от Smad пути обусловливают активирующий рост опухоли эффект TGFβ, существуют также данные, показывающие, что зависящие от Smad пути вовлечены в прогрессию опухоли (Yang et al., Cancer Res. 2008; 68:9107-11).
[0063] Как лиганд TGFβ, так и его рецептор активно изучали в качестве терапевтических мишеней. Существует три изоформы лиганда: TGFβ1, 2 и 3, каждая из которых существует в виде гомодимеров. Также существует три рецептора TGFβ (TGFβR, TGFβ receptor), называемые TGFβR типа I, II и III (López-Casillas et al., J Cell Biol. 1994; 124:557-68). TGFβRI является звеном сигнального пути и не способен связывать лиганд. TGFβRII с высокой аффинностью связывает лиганд TGFβ1 и 3, но не TGFβ2. Комплекс TGFβRII/TGFβ привлекает TGFβRI с образованием сигнального комплекса (Won et al., Cancer Res. 1999; 59:1273-7). TGFβRIII является положительным регулятором связывания TGFβ с его сигнальными рецепторами и связывает все 3 изоформы TGFβ с высокой аффинностью. На поверхности клетки комплекс TGFβ/TGFβRIII связывает TGFβRII, а затем привлекает TGFβRI, который замещает TGFβRIII с образованием сигнального комплекса.
[0064] Хотя все три разные изоформы TGFβ передают сигнал через один и тот же рецептор, они, как известно, обладают разными профилями экспрессии и неперекрывающимися функциями in vivo. Нокаутные по трем разным изоформам TGFβ мыши обладают определенным фенотипом, что указывает на многочисленные нескомпенсированные функции (Bujak et al., Cardiovasc Res. 2007; 74:184-95). В то время как мыши без TGFβ1 имеют нарушения кроветворения и образования сосудов, а мыши без TGFβ3 имеют нарушения развития легких и нарушение образования неба, мыши без TGFβ2 обладают различными аномалиями развития, наиболее выраженными из которых являются множественные пороки сердца (Bartram et al., Circulation. 2001; 103:2745-52; Yamagishi et al., Anat Rec. 2012; 295:257-67). Более того, TGFβ играет основную роль в восстановлении повреждений миокарды после ишемическо-реперфузионного повреждения. В сердце взрослого кардиомиоциты секретируют TGFβ, который действует как аутокринный фактор, поддерживая спонтанное сердцебиения. Важно отметить, что 70-85% TGFβ, секретирующегося кардиомиоцитами, является TGFβ2 (Roberts et al., J Clin Invest. 1992; 90:2056-62). Таким образом, учитывая ведущую роль TGFβ1 и TGFβ2 в опухолевом микроокружении и физиологии сердца, соответственно, терапевтический агент, нейтрализующий TGFβ1, но не TGFβ2, мог бы обеспечить оптимальный терапевтический индекс, минимизировав кардиотоксичность без уменьшения противоопухолевой активности. Таким образом, это согласуется с открытиями авторов настоящего изобретения, которые наблюдали отсутствие токсичности, включая кардиотоксичность, у анти-PD-L1/TGFβ ловушки у обезьян.
[0065] Терапевтические подходы к нейтрализации TGFβ включают применение внеклеточных доменов рецепторов TGFβ в качестве растворимых рецепторных ловушек и нейтрализующих антител. В подходе, связанном с применением рецепторных ловушек, может показаться, что очевидный выбор падает на растворимый TGFβRIII, поскольку он связывает все три лиганда TGFβ. Однако, TGFβRIII, который в природе существует в виде 280-330 кДа глюкозаминогликанового (GAG, glucosaminoglycan) гликопротеина с внеклеточным доменом из 762 аминокислотных остатков, является очень сложным белком для разработки в качестве биотерапевтического средства. Растворимый TGFβRIII, лишенный GAG, можно получить в клетках насекомых и можно показать, что он способен быть сильным нейтрализующим TGFβ агентом (Vilchis-Landeros et al, Biochem J 355:215, 2001). Два отдельных домена связывания (эндоглин-связанный и уромодулин-связанный) TGFβRIII можно экспрессировать независимо, но было показано, что они обладают аффинностью в 20-100 раз меньшей, чем растворимый TGFβRIII, и сильно сниженной нейтрализующей активностью (Mendoza et al., Biochemistry. 2009; 48:11755-65). Вместе с тем, внеклеточный домен TGFβRII имеет длину всего 136 аминокислотных остатков и может быть получен в виде гликозилированного 25-35 кДа белка. Также было показано, что рекомбинантный растворимый TGFβRII связывает TGFβ1 с KD равной 200 пМ, что приблизительно похоже на KD равную 50 пМ для полноразмерного TGFβRII на клетках (Lin et al., J Biol Chem. 1995; 270:2747-54). Растворимый TGFβRII-Fc исследовали в качестве противоракового агента и показали, что он ингибирует рост сформировавшейся мышиной злокачественной мезотелиомы в модели рака (Suzuki et al., Clin Cancer Res. 2004; 10:5907-18). Поскольку TGFβRII не связывает TGFβ2, а TGFβRIII связывает TGFβ1 и 3 с пониженной аффинностью по сравнению с TGFβRII, получили в бактериях слитый белок, содержащий эндоглинный домен TGFβRIII и внеклеточный домен TGFβRII и в клеточных исследованиях показали, что он эффективнее ингибирует передачу сигнала через TGFβ1 и 2, чем TGFβRII или RIII (Verona et al., Protein Eng Des Sel. 2008; 21:463-73). Несмотря на многообещающую противоопухолевую активность, показанную в моделях рака, насколько нам известно, ни одна ловушка на основе рекомбинантного рецепторного белка TGFβ еще не была исследована в рамках клинических испытаний.
[0066] Еще одним подходом к нейтрализации всех трех изоформ лигандов TGFβ является поиск универсального нейтрализующего антитела к TGFβ или антитела к рецептору, которое препятствует связыванию рецептора с TGFβ1, 2 и 3. GC1008, человеческое антитело, специфичное ко всем трем изоформам TGFβ, проходило исследование фазы I/II на пациентах с распространенной злокачественной меланомой или почечно-клеточной карциномой (Morris et al., J Clin Oncol 2008; 26:9028 (Meeting abstract)). Хотя было обнаружено, что лечение является безопасным и хорошо переносимым, наблюдали лишь ограниченную клиническую эффективность, и, следовательно, трудно было интерпретировать важность анти-TGFβ терапии без дальнейшей характеристики иммунологических эффектов (Flavell et al., Nat Rev Immunol. 2010; 10:554-67). Также клинические испытания проходили антитела, специфичные к изоформе TGFβ. Метелимумаб, антитело, специфичное к TGFβ1, изучали в рамках клинического исследования фазы 2 в качестве лечения для предотвращения распространенного послеоперационного рубцевания при операции по поводу глаукомы; а лерделимумаб, антитело, специфичное к TGFβ2, оказалось безопасным, но неэффективным в отношении улучшения рубцевания после операции на глазах в исследовании фазы 3 (Khaw et al., Ophthalmology 2007; 114:1822-1830). Также было показано, что антитела к TGFβRII, препятствующие связыванию рецептора со всеми тремя изоформами TGFβ, такие как антитело TR1 к человеческому TGFβRII и антитело MT1 к мышиному TGFβRII MT1, обладают некоторой терапевтической эффективностью в отношении роста первичной опухоли и метастазирования в мышиных моделях (Zhong et al., Clin Cancer Res. 2010; 16:1191-205). На сегодняшний день подавляющее большинство исследований противораковой терапии, действующей на TGFβ, включая низкомолекулярные ингибиторы передачи сигнала через TGFβ, которые часто являются достаточно токсичными, находятся в основном на доклинической стадии, и их противоопухолевая эффективность ограничена (Calone et al., Exp Oncol. 2012; 34:9-16; Connolly et al., Int J Biol Sci. 2012; 8:964-78).
[0067] Ловушка «антитело-TGFβ» настоящего изобретения представляет собой бифункциональный белок, содержащий по меньшей мере часть человеческого рецептора TGFβ II (TGFβRII), способную связывать TGFβ. В одном варианте осуществления настоящего изобретения полипептид-ловушка TGFβ является растворимой частью человеческого рецептора TGFβ типа 2 изоформы A (SEQ ID NO: 8), способной связывать TGFβ. В другом варианте осуществления настоящего изобретения полипептид-ловушка TGFβ содержит по меньшей мере 73-184 аминокислоты SEQ ID NO:8. В еще одном варианте осуществления настоящего изобретения полипептид-ловушка TGFβ содержит по меньшей мере 24-184 аминокислоты SEQ ID NO:8. В другом варианте осуществления настоящего изобретения полипептид-ловушка TGFβ является растворимой частью человеческого рецептора TGFβ типа 2 изоформы B (SEQ ID NO: 9), способной связывать TGFβ. В другом варианте осуществления настоящего изобретения полипептид-ловушка TGFβ содержит по меньшей мере 48-159 аминокислоты SEQ ID NO:9. В еще одном варианте осуществления настоящего изобретения полипептид-ловушка TGFβ содержит 24-159 аминокислоты SEQ ID NO:9. В еще одном варианте осуществления настоящего изобретения полипептид-ловушка TGFβ содержит 24-105 аминокислоты SEQ ID NO:9.
Растормаживание иммунологической контрольной точки
[0068] Подход, заключающийся в направленном действии на Т-клеточные ингибиторные контрольные точки для их растормаживания с помощью терапевтических антител является областью активных исследований (см. обзор Pardoll, Nat Rev Cancer. 2012; 12:253-264). Один подход заключается в том, что функциональная группа антитела или его антигенсвязывающего фрагмента направленно действует на рецепторные белки Т-клеточной ингибиторной контрольной точки на Т-клетках, такие как, например, CTLA-4, PD-1, BTLA, LAG-3, TIM-3 и LAIR1. Другой подход заключается в том, что функциональная группа антитела направленно действует на контррецепторы на антигенпрезентирующих клетках и на опухолевых клетках (которые приобретают некоторые из этих контррецепторов для собственного ускользания от иммунной системы), такие как, например, PD-L1 (B7-H1), B7-DC, HVEM, TIM-4, B7-H3 или B7-H4.
[0069] Настоящее изобретение охватывает антитела-ловушки TGFβ, которые направленно действуют на Т-клеточные ингибиторные контрольные точки для их растормаживания через свои функциональные группы антитела или его антигенсвязывающего фрагмента. В связи с этим авторы настоящего изобретения исследовали противоопухолевую эффективность комбинации ловушки TGFβ с антителами, направленно действующими на различные рецепторные белки Т-клеточных ингибиторных контрольных точек, такими как анти-PD-1, анти-PD-L1, анти-TIM-3 и анти-LAG3. Результаты экспериментов приведены подробно далее в Примерах 7-18. Авторы настоящего изобретения обнаружили, что комбинация ловушки TGFβ с антителом к PD-L1 обладает значительной противоопухолевой активностью, превосходящей противоопухолевую активность монотерапии. Напротив, ни одна из других комбинаций с антителами, направленно действующими на перечисленные выше мишени, не обладала повышенной эффективностью. В частности, можно было предположить, что комбинированная обработка ловушкой TGFβ с антителом к PD-1 будет проявлять такую же активность, как и обработка с анти-PD-L1, поскольку PD-1/PD-L1 являются родственными рецепторами, которые связываются друг с другом, вызывая ингибирование иммунологической контрольной точки. Однако это не то, что обнаружили авторы настоящего изобретения.
Антитела к PD-L1
[0070] Настоящее изобретение может включать любое антитело к PD-L1 или его антигенсвязывающий фрагмент, описанные в области техники, к которой относится изобретение. Антитела к PD-L1 являются коммерчески доступными, например, антитело 29E2A3 (Biolegend, каталожный номер 329701). Антитела могут быть моноклональными, химерными, гуманизированными или человеческими. Фрагменты антител включают фрагменты Fab, F(ab')2, scFv и Fv, подробнее описанные ниже.
[0071] Примеры антител описаны в Публикации заявки согласно PCT WO 2013/079174. Эти антитела могут включать полипептид вариабельной области тяжелой цепи, включая последовательность HVR-H1, HVR-H2 и HVR-H3, где:
(a) последовательностью HVR-H1 является X1YX2MX3;
(b) последовательностью HVR-H2 является SIYPSGGX4TFYADX5VKG;
(c) последовательностью HVR-H3 является IKLGTVTTVX6Y;
где также: X1 является K, R, T, Q, G, A, W, M, I или S; X2 является V, R, K, L, M или I; X3 является H, T, N, Q, A, V, Y, W, F или M; X4 является F или I; X5 является S or T; X6 является E или D.
[0072] В одном варианте осуществления настоящего изобретения X1 является M, I, или S; X2 является R, K, L, M, или I; X3 является F или M; X4 является F или I; X5 является S или T; X6 является E или D.
[0073] В другом варианте осуществления настоящего изобретения X1 является M, I, или S; X2 является L, M, или I; X3 является F или M; X4 является I; X5 является S или T; X6 является D.
[0074] В еще одном варианте осуществления настоящего изобретения X1 является S; X2 является I; X3 является M; X4 является I; X5 является T; X6 является D.
[0075] В другом аспекте настоящего изобретения полипептид также включает каркасные последовательности вариабельной области тяжелой цепи, расположенные между гипервариабельными участками (HVR, hypervariable region) в соответствии с формулой: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4).
[0076] В еще одном аспекте настоящего изобретения каркасные последовательности происходят из консенсусных человеческих каркасных последовательностей или из каркасных последовательностей зародышевой линии человека.
[0077] В еще одном аспекте настоящего изобретения по меньшей мере одна из каркасных последовательностей следующая:
HC-FR1 является EVQLLESGGGLVQPGGSLRLSCAASGFTFS;
HC-FR2 является WVRQAPGKGLEWVS;
HC-FR3 является RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR;
HC-FR4 является WGQGTLVTVSS.
[0078] В еще одном аспекте настоящего изобретения полипептид тяжелой цепи также комбинирован с вариабельной областью легкой цепи, включающий HVR-L1, HVR-L2 и HVR-L3, где:
(a) последовательностью HVR-L1 является TGTX7X8DVGX9YNYVS;
(b) последовательностью HVR-L2 является X10VX11X12RPS;
(c) последовательностью HVR-L3 является SSX13TX14X15X16X17RV;
где также: X7 является N или S; X8 является T, R, или S; X9 является A или G; X10 является E или D; X11 является I, N или S; X12 является D, H или N; X13 является F или Y; X14 является N или S; X15 является R, T или S; X16 является G или S; X17 является I или T.
[0079] В другом варианте осуществления настоящего изобретения X7 является N или S; X8 является T, R или S; X9 является A или G; X10 является E или D; X11 является N или S; X12 является N; X13 является F или Y; X14 является S; X15 является S; X16 является G или S; X17 является T.
[0080] В еще одном варианте осуществления настоящего изобретения X7 является S; X8 является S; X9 является G; X10 является D; X11 является S; X12 является N; X13 является Y; X14 является S; X15 является S; X16 является S; X17 является T.
[0081] В еще одном аспекте настоящего изобретения легкая цепь также включает каркасные последовательности вариабельной области легкой цепи, расположенные между гипервариабельными участками в соответствии с формулой: (LC-FR1MHVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4).
[0082] В еще одном аспекте настоящего изобретения каркасные последовательности легкой цепи происходят из консенсусных человеческих каркасных последовательностей или из каркасных последовательностей зародышевой линии человека.
[0083] В еще одном аспекте настоящего изобретения каркасные последовательности легкой цепи являются последовательностями легкой цепи лямбда.
[0084] В еще одном аспекте настоящего изобретения по меньшей мере одна из каркасных последовательностей следующая:
LC-FR1 является QSALTQPASVSGSPGQSITISC;
LC-FR2 является WYQQHPGKAPKLMIY;
LC-FR3 является GVSNRFSGSKSGNTASLTISGLQAEDEADYYC;
LC-FR4 является FGTGTKVTVL.
[0085] В другом варианте осуществления настоящее изобретение представляет антитело к PD-L1 или антигенсвязывающий фрагмент, включая последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь включает HVR-H1, HVR-H2 и HVR-H3, где также: (i) последовательностью HVR-H1 является X1YX2MX3; (ii) последовательностью HVR-H2 является SIYPSGGX4TFYADX5VKG; (iii) последовательностью HVR-H3 является IKLGTVTTVX6Y, и;
(b) легкая цепь включает HVR-L1, HVR-L2 и HVR-L3, где также: (iv) последовательностью HVR-L1 является TGTX7X8DVGX9YNYVS; (v) последовательностью HVR-L2 является X10VX11X12RPS; (vi) последовательностью HVR-L3 является SSX13TX14X15X16X17RV; где: X1 является K, R, T, Q, G, A, W, M, I или S; X2 является V, R, K, L, M или I; X3 является H, T, N, Q, A, V, Y, W, F или M; X4 является F или I; X5 является S или T; X6 является E или D; X7 является N или S; X8 является T, R или S; X9 является A или G; X10 является E или D; X11 является I, N или S; X12 является D, H или N; X13 является F или Y; X14 является N или S; X15 является R, T или S; X16 является G или S; X17 является I или T.
[0086] В одном варианте осуществления настоящего изобретения X1 является M, I или S; X2 является R, K, L, M или I; X3 является F или M; X4 является F или I; X5 является S или T; X6 является E или D; X7 является N или S; X8 является T, R или S; X9 является A или G; X10 является E или D; X11является N или S; X12 является N; X13 является F или Y; X14 является S; X15 является S; X16 является G или S; X17 является T.
[0087] В другом варианте осуществления настоящего изобретения X1 является M, I или S; X2 является L, M или I; X3 является F или M; X4 является I; X5 является S или T; X6 является D; X7 является N или S; X8 является T, R или S; X9 является A или G; X10 является E или D; X11 является N или S; X12 является N; X13 является F или Y; X14 является S; X15 является S; X16 является G или S; X17 является T.
[0088] В одном варианте осуществления настоящего изобретения X1 является S; X2 является I; X3 является M; X4 является I; X5 является T; X6 является D; X7 является S; X8 является S; X9 является G; X10 является D; X11 является S; X12 является N; X13 является Y; X14 является S; X15 является S; X16 является S; X17 является T.
[0089] В другом аспекте настоящего изобретения вариабельная область тяжелой цепи включает одну или несколько каркасных последовательностей, расположенных между гипервариабельными участками следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельная область легкой цепи включает одну или несколько каркасных последовательностей, расположенных между гипервариабельными участками следующим образом: (LC-FR1 MHVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4).
[0090] В еще одном аспекте настоящего изобретения каркасные последовательности происходят из консенсусных человеческих каркасных последовательностей или из последовательностей зародышевой линии человека.
[0091] В еще одном аспекте настоящего изобретения одна или несколько каркасных последовательностей тяжелой цепи являются следующими:
HC-FR1 является EVQLLESGGGLVQPGGSLRLSCAASGFTFS;
HC-FR2 является WVRQAPGKGLEWVS;
HC-FR3 является RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR;
HC-FR4 является WGQGTLVTVSS.
[0092] В еще одном аспекте настоящего изобретения каркасные последовательности легкой цепи являются последовательностями легкой цепи лямбда.
[0093] В еще одном аспекте настоящего изобретения одна или несколько каркасных последовательностей легкой цепи являются следующими:
LC-FR1 является QSALTQPASVSGSPGQSITISC;
LC-FR2 является WYQQHPGKAPKLMIY;
LC-FR3 является GVSNRFSGSKSGNTASLTISGLQAEDEADYYC;
LC-FR4 является FGTGTKVTVL.
[0094] В еще одном аспекте настоящего изобретения полипептид вариабельной области тяжелой цепи, антитело или фрагмент антитела также включает по меньшей мере один домен CH1.
[0095] В более частном аспекте настоящего изобретения полипептид вариабельной области тяжелой цепи, антитело или фрагмент антитела также включает домен CH1, CH2 и CH3.
[0096] В еще одном аспекте настоящего изобретения полипептид вариабельной области легкой цепи, антитело или фрагмент антитела также включает домен CL.
[0097] В еще одном аспекте настоящего изобретения антитело также включает домен CH1, CH2, CH3 и CL.
[0098] В более частном аспекте настоящего изобретения антитело также включает человеческую или мышиную константную область.
[0099] В еще одном аспекте настоящего изобретения человеческая константная область выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4.
[00100] В более частном аспекте настоящего изобретения человеческая или мышиная константная область является IgG1.
[00101] В еще одном варианте осуществления настоящее изобретение представляет антитело к PD-L1, включающее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь включает HVR-H1, HVR-H2 и HVR-H3, имеющие по меньшей мере 80% идентичность всей последовательности с SYIMM, SIYPSGGITFYADTVKG и IKLGTVTTVDY, соответственно, и
(b) легкая цепь включает HVR-L1, HVR-L2 и HVR-L3, имеющие по меньшей мере 80% идентичность всей последовательности с TGTSSDVGGYNYVS, DVSNRPS и SSYTSSSTRV, соответственно.
[00102] В конкретном аспекте настоящего изобретения идентичность последовательности составляет 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
[00103] В еще одном варианте осуществления настоящее изобретение представляет антитело к PD-L1, включающее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь включает HVR-H1, HVR-H2 и HVR-H3, имеющие по меньшей мере 80% идентичность всей последовательности с MYMMM, SIYPSGGITFYADSVKG и IKLGTVTTVDY, соответственно, и
(b) легкая цепь включает HVR-L1, HVR-L2 и HVR-L3, имеющие по меньшей мере 80% идентичность всей последовательности с TGTSSDVGAYNYVS, DVSNRPS и SSYTSSSTRV, соответственно.
[00104] В конкретном аспекте настоящего изобретения идентичность последовательности составляет 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
[00105] В еще одно аспекте настоящего изобретения у антитела или фрагмента антитела в соответствии с настоящим изобретением по сравнению с последовательностями HVR-H1, HVR-H2 и HVR-H3 неизменными остаются по меньшей мере те аминокислоты, которые выделены подчеркиванием ниже:
(a) в HVR-H1 SYIMM,
(b) в HVR-H2 SIYPSGGITFYADTVKG,
(c) в HVR-H3 IKLGTVTTVDY;
и также где по сравнению с последовательностями HVR-L1, HVR-L2 и HVR-L3 неизменными остаются по меньшей мере те аминокислоты, которые выделены подчеркиванием ниже:
(a) HVR-L1 TGTSSDVGGYNYVS
(b) HVR-L2 DVSNRPS
(c) HVR-L3 SSYTSSSTRV.
[00106] В другом аспекте настоящего изобретения вариабельная область тяжелой цепи включает одну или несколько каркасных последовательностей, расположенных между гипервариабельными участками следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельные области легкой цепи включают одну или несколько каркасных последовательностей, расположенных между гипервариабельными участками следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4).
[00107] В еще одном аспекте настоящего изобретения каркасные последовательности происходят из последовательностей зародышевой линии человека.
[00108] В еще одном аспекте настоящего изобретения одна или несколько каркасных последовательностей тяжелой цепи являются следующими:
HC-FR1 является EVQLLESGGGLVQPGGSLRLSCAASGFTFS;
HC-FR2 является WVRQAPGKGLEWVS;
HC-FR3 является RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR;
HC-FR4 является WGQGTLVTVSS.
[00109] В еще одном аспекте настоящего изобретения каркасные последовательности легкой цепи происходят из последовательности легкой цепи лямбда.
[00110] В еще одном аспекте настоящего изобретения одна или несколько каркасных последовательностей легкой цепи являются следующими:
LC-FR1 является QSALTQPASVSGSPGQSITISC;
LC-FR2 является WYQQHPGKAPKLMIY;
LC-FR3 является GVSNRFSGSKSGNTASLTISGLQAEDEADYYC;
LC-FR4 является FGTGTKVTVL.
[00111] В другом конкретном аспекте настоящего изобретения антитело также включает человеческую или мышиную константную область.
[00112] В еще одном аспекте настоящего изобретения человеческая константная область выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4.
[00113] В еще одном варианте осуществления настоящее изобретение представляет антитело к PD-L1, включающее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательность тяжелой цепи по меньшей мере на 85% идентична последовательности тяжелой цепи:
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYIMMVWRQAPGKGLEWVSSIYPSGGITFYADWKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARIKLGTVTTVDYWGQGTLVTVSS, и
(b) последовательность легкой цепи по меньшей мере на 85% идентична последовательности легкой цепи:
QSALTQPASVSGSPGQSITISCTGTSSDVGGYNYVSWYQQHPGKAPKLMIYDVSNRPSGVSNRFSGSKSGNTASLTISGLQAEDEADYYCSSYTSSSTRVFGTGTKVTVL.
[00114] В конкретном аспекте настоящего изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
[00115] В еще одном варианте осуществления настоящее изобретение представляет антитело к PD-L1, включающее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательность тяжелой цепи по меньшей мере на 85% идентична последовательности тяжелой цепи:
EVQLLESGGGLVQPGGSLRLSCAASGFTFSMYMMMWVRQAPGKGLEVWSSIYPSGGITFYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAIYYCARIKLGTVTTVDYWG QGTLVTVSS, и
(b) последовательность легкой цепи по меньшей мере на 85% идентична последовательности легкой цепи:
QSALTQPASVSGSPGQSITISCTGTSSDVGAYNYVSWYQQHPGKAPKLMIYDVSNRPSGVSNRFSGSKSGNTASLTISGLQAEDEADYYCSSYTSSSTRVFGTGTKVTVL.
[00116] В конкретном аспекте настоящего изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
[00117] В другом варианте осуществления настоящего изобретения антитело связывает PD-L1 человека, мыши или яванского макака. В конкретном аспекте настоящего изобретения антитело способно блокировать взаимодействие PD-L1 человека, мыши или яванского макака с соответствующими рецепторами PD-1 человека, мыши или яванского макака.
[00118] В другом варианте осуществления настоящего изобретения антитело связывает человеческий PD-L1 с KD равной 5×10-9 M или менее, предпочтительно, с KD равной 2×10-9 M или менее, и, предпочтительнее, с KD равной 1×10-9 M или менее.
[00119] В другом варианте осуществления настоящее изобретение относится к антителу к PD-L1 или к его антигенсвязывающему фрагменту, который связывает функциональный эпитоп, включая остатки Y56 и D61 человеческого PD-L1.
[00120] В конкретном аспекте настоящего изобретения функциональный эпитоп также включает E58, E60, Q66, R113 и M115 человеческого PD-L1.
[00121] В более конкретном аспекте настоящего изобретения антитело связывает конформационный эпитоп, включающий остатки 54-66 и 112-122 человеческого PD-L1.
[00122] В другом варианте осуществления настоящее изобретение относится к антителу к PD-L1 или к его антигенсвязывающему фрагменту, который перекрестно конкурирует за связывание с PD-L1 с антителом в соответствии с настоящим изобретением, как описано в настоящей заявке.
[00123] В другом варианте осуществления настоящее изобретение представляет белки и полипептиды, включая любые из описанных выше антител к PD-L1 в комбинации по меньшей мере с одним фармацевтически приемлемым носителем.
[00124] В другом варианте осуществления настоящее изобретение представляет выделенную нуклеиновую кислоту, кодирующую полипептид или последовательность вариабельной области легкой цепи или тяжелой цепи антитела к PD-L1 или его антигенсвязывающего фрагмента, как описано в настоящей заявке. В другом варианте осуществления настоящее изобретение представляет выделенную нуклеиновую кислоту, кодирующую последовательность вариабельной области легкой цепи или тяжелой цепи антитела к PD-L1, где:
(a) тяжелая цепь включает последовательности HVR-H1, HVR-H2 и HVR-H3, идентичные по меньшей мере на 80% последовательностям SYIMM, SIYPSGGITFYADTVKG и IKLGTVTTVDY, соответственно, или
(b) легкая цепь включает последовательности HVR-L1, HVR-L2 и HVR-L3, идентичные по меньшей мере на 80% последовательностям TGTSSDVGGYNYVS, DVSNRPS и SSYTSSSTRV, соответственно.
[00125] В конкретном аспекте настоящего изобретения идентичность последовательности составляет 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
[00126] В другом аспекте настоящего изобретения последовательностью нуклеиновой кислоты тяжелой цепи является:
 и последовательностью нуклеиновой кислоты легкой цепи является:
и последовательностью нуклеиновой кислоты легкой цепи является:

[00127] Другие примеры антител к PD-L1, которые можно применять в анти-PD-L1/TGFβ ловушке описаны в публикации патентной заявки США US 2010/0203056. В одном варианте осуществления настоящего изобретения функциональная группа антитела является YW243.55S70. В другом варианте осуществления настоящего изобретения функциональная группа антитела является MPDL3280A.
[00128] В другом варианте осуществления настоящее изобретение представляет функциональную группу антитела к PD-L1, включающую последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательность тяжелой цепи по меньшей мере на 85% идентична последовательности тяжелой цепи:
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYY ADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSS (SEQ ID NO:12), и
(b) последовательность легкой цепи по меньшей мере на 85% идентична последовательности легкой цепи:
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR (SEQ ID NO:13).
[00129] В конкретном аспекте настоящего изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%.
[00130] В другом варианте осуществления настоящее изобретение представляет функциональную группу антитела к PD-L1, включающую последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательностью вариабельной области тяжелой цепи является:
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSS (SEQ ID NO:12), и
(b) последовательностью вариабельной области легкой цепи является:
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR (SEQ ID NO:13).
[00131] В другом варианте осуществления настоящее изобретение представляет функциональную группу антитела к PD-L1, включающую последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательностью вариабельной области тяжелой цепи является:
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSA (SEQ ID NO:14), и
(b) последовательностью вариабельной области легкой цепи является:
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR (SEQ ID NO:13).
[00132] Другие примеры антител к PD-L1, которые можно применять в анти-PD-L1/TGFβ ловушке описаны в публикации патента США US 7943743.
[00133] В одном варианте осуществления настоящего изобретения антителом к PD-L1 является MDX-1105.
[00134] В другом варианте осуществления настоящего изобретения антителом к PD-L1 является MEDI-4736.
Константная область
[00135] Белки и пептиды настоящего изобретения могут включать константную область иммуноглобулина или фрагмент, аналог, вариант, мутант или производное константной области. В предпочтительных вариантах осуществления настоящего изобретения константная область происходит из тяжелой цепи человеческого иммуноглобулина, например, IgG1, IgG2, IgG3, IgG4 или других классов. В одном варианте осуществления настоящего изобретения константная область включает домен CH2. В другом варианте осуществления настоящего изобретения константная область включает домены CH2 и CH3 или включает шарнир-CH2-CH3. Альтернативно, константная область может включать всю шарнирную область или ее часть, домен CH2 и/или домен CH3.
[00136] В одном варианте осуществления настоящего изобретения константная область содержит мутацию, которая снижает аффинность к Fc-рецептору или ослабляет Fc-эффекторную функцию. Например, константная область может содержать мутацию, которая уничтожает сайт гликозилирования внутри константной области тяжелой цепи IgG. В некоторых вариантах осуществления настоящего изобретения константная область содержит мутации, делеции или вставки в положениях аминокислот, соответствующих Leu234, Leu235, Gly236, Gly237, Asn297 или Pro331 IgG1 (аминокислоты пронумерованы в соответствии с номенклатурой ЕС). В частном варианте осуществления настоящего изобретения константная область содержит мутацию в положении аминокислоты, соответствующем Asn297 IgG1. В альтернативных вариантах осуществления настоящего изобретения константная область содержит мутации, делеции или вставки в положениях аминокислот, соответствующих Leu281, Leu282, Gly283, Gly284, Asn344 или Pro378 IgG1.
[00137] В некоторых вариантах осуществления настоящего изобретения константная область содержит домен CH2, происходящий из тяжелой цепи человеческого IgG2 или IgG4. Предпочтительно, чтобы домен CH2 содержал мутацию, которая уничтожает сайт гликозилирования внутри домена CH2. В одном варианте осуществления настоящего изобретения мутация меняет аспарагин в аминокислотной последовательности Gln-Phe-Asn-Ser (SEQ ID NO: 15) внутри домена CH2 тяжелой цепи IgG2 или IgG4. Предпочтительно, чтобы мутация меняла аспарагин на глутамин. Альтернативно, мутация меняет как фенилаланин, так и аспарагин внутри аминокислотной последовательности Gln-Phe-Asn-Ser (SEQ ID NO: 15). В одном варианте осуществления настоящего изобретения аминокислотная последовательность Gln-Phe-Asn-Ser (SEQ ID NO: 15) заменена аминокислотной последовательностью Gln-Ala-Gln-Ser (SEQ ID NO: 16). Аспарагин внутри аминокислотной последовательности Gln-Phe-Asn-Ser (SEQ ID NO: 15) соответствует Asn297 IgG1.
[00138] В другом варианте осуществления настоящего изобретения константная область содержит домен CH2 и по меньшей мере часть шарнирной области. Шарнирная область может происходить из тяжелой цепи иммуноглобулина, напр., IgG1, IgG2, IgG3, IgG4 или других классов. Предпочтительно, чтобы шарнирная область происходила из человеческого IgG1, IgG2, IgG3, IgG4 или иммуноглобулинов других подходящих классов. Предпочтительнее, чтобы шарнирная область происходила из тяжелой цепи человеческого IgG1. В одном варианте осуществления настоящего изобретения цистеин в аминокислотной последовательности Pro-Lys-Ser-Cys-Asp-Lys (SEQ ID NO: 17) шарнирной области IgG1 изменен. В предпочтительном варианте осуществления настоящего изобретения аминокислотная последовательность Pro-Lys-Ser-Cys-Asp-Lys (SEQ ID NO: 17) заменена аминокислотной последовательностью Pro-Lys-Ser-Ser-Asp-Lys (SEQ ID NO: 18). В одном варианте осуществления настоящего изобретения константная область включает домен CH2, происходящий из первого изотипа антител, и шарнирную область, происходящую из второго изотипа антител. В конкретном варианте осуществления настоящего изобретения домен CH2 происходит из тяжелой цепи человеческого IgG2 или IgG4, в то время как шарнирная область происходит из измененной тяжелой цепи человеческого IgG1.
[00139] Изменение аминокислот около соединения Fc-части и не-Fc-части может существенно повысить время полужизни слитого Fc-белка в сыворотке (Публикация заявки согласно PCT WO 01/58957, раскрытие которой включено в настоящую заявку посредством ссылки). Соответственно, область соединения белка или полипептида настоящего изобретения может содержать изменения по сравнению с встречающимися в природе последовательностями тяжелой цепи иммуноглобулина и эритропоэтина, которые, предпочтительно, расположены в пределах 10 аминокислот от места соединения. Эти изменения аминокислот могут вызвать повышение гидрофобности. В одном варианте осуществления настоящего изобретения константная область происходит из последовательности IgG, в которой С-концевой остаток лизина заменен. Предпочтительно, чтобы С-концевой лизин в последовательности IgG был заменен нелизиновой аминокислотой, такой как аланиин или лейцин, чтобы сильнее увеличить время полужизни в сыворотке. В другом варианте осуществления настоящего изобретения константная область происходит из последовательности IgG, в которой аминокислотная последовательность Leu-Ser-Leu-Ser (SEQ ID NO: 19) около С-конца константной области заменена с целью уничтожения потенциальных Т-клеточных эпитопов. Например, в одном варианте осуществления настоящего изобретения аминокислотная последовательность Leu-Ser-Leu-Ser заменена аминокислотной последовательностью Ala-Thr-Ala-Thr (SEQ ID NO: 20). В других вариантах осуществления настоящего изобретения аминокислотная последовательность внутри сегмента Leu-Ser-Leu-Ser (SEQ ID NO: 19) заменена другими аминокислотами, такими как глицин или пролин. Подробно способы получения аминокислотных замен в сегменте Leu-Ser-Leu-Ser (SEQ ID NO: 19) около С-конца IgG1, IgG2, IgG3, IgG4 или молекул иммуноглобулинов других классов описаны в Публикации патентной заявки США № 2003/0166877, раскрытие которой включено в настоящую заявку посредством ссылки.
[00140] Подходящие шарнирные области для настоящего изобретения могут происходить из IgG1, IgG2, IgG3, IgG4 и из или иммуноглобулинов других классов. Шарнирная область IgG1 содержит три цистеина, два из которых участвуют в образовании дисульфидных связей между двумя тяжелыми цепями иммуноглобулина. Именно эти цистеины обеспечивают образование эффективной и надежной дисульфидной связи между частями Fc. Следовательно, предпочтительная шарнирная область настоящего изобретения происходит из IgG1, предпочтительнее, из человеческого IgG1. В некоторых вариантах осуществления настоящего изобретения первый цистеин внутри шарнирной области человеческого IgG1 мутирован до другой аминокислоты, предпочтительно, до серина. Шарнирная область изотипа IgG2 содержит четыре дисульфидные связи, которые способствуют олигомеризации и, возможно, неправильному образованию дисульфидных связей во время секреции в рекомбинантных системах. Подходящая шарнирная область может происходить из шарнира IgG2; при этом предпочтительно, чтобы первые два цистеина были мутированы до другой аминокислоты. Известно, что шарнирная область IgG4 неэффективно образует межцепочечные дисульфидные связи. Однако подходящая шарнирная область для настоящего изобретения может происходить из шарнирной области IgG4, предпочтительно, содержащей мутацию, которая способствует правильному образованию дисульфидных связей между функциональными группами тяжелых цепей (Angal S, et al. (1993) Mol. Immunol., 30:105-8).
[00141] В соответствии с настоящим изобретением константная область может содержать домены CH2 и/или CH3 и шарнирную область, которые происходят из антител разных изотипов, т.е. гибридную константную область. Например, в одном варианте осуществления настоящего изобретения константная область содержит домены CH2 и/или CH3, происходящие из IgG2 или IgG4, и мутантную шарнирную область, происходящую из IgG1. Альтернативно, мутантную шарнирную область из другого подкласса IgG применяют в гибридной константной области. Например, можно применять мутантную форму шарнирной области IgG4, которая обеспечивает эффективное образование дисульфидной связи между двумя тяжелыми цепями. Мутантный шарнир также может происходить из шарнира IgG2, в котором каждый из первых двух цистеинов мутирован до другой аминокислоты. Получение таких гибридных константных областей было описано в Публикации патента США № 2003/0044423, раскрытие которой включено в настоящую заявку посредством ссылки.
[00142] В соответствии с настоящим изобретением константная область может содержать одну или несколько мутаций, описанных в настоящей заявке. Комбинации мутаций в Fc-части могут оказывать аддитивное или синергическое действие на увеличение времени полужизни в сыворотке и повышение активности бифункциональной молекулы in vivo. Таким образом, в одном примере варианта осуществления настоящего изобретения константная область может содержать (i) область, полученную из последовательности IgG, в которой аминокислотная последовательность Leu-Ser-Leu-Ser (SEQ ID NO: 19) заменена аминокислотной последовательностью Ala-Thr-Ala-Thr (SEQ ID NO: 20); (ii) С-концевой остаток аланина вместо лизина; (iii) домен CH2 и шарнирную область, которые происходят из антител разных изотипов, например, домен CH2 IgG2 и измененную шарнирную область IgG1; и (iv) мутацию, которая уничтожает сайт гликозилирования внутри домена CH2, происходящего из IgG2, например, аминокислотную последовательность Gln-Ala-Gln-Ser (SEQ ID NO: 16) вместо аминокислотной последовательности Gln-Phe-Asn-Ser (SEQ ID NO: 15) внутри домена CH2, происходящего из IgG2.
Фрагменты антител
[00143] Белки и полипептиды настоящего изобретения также могут включать антигенсвязывающие фрагменты антител. Примеры фрагментов антител включают scFv, Fv, Fab, F(ab')2 и однодоменные фрагменты VHH, таких как антитела верблюжьего происхождения.
[00144] Одноцепочечные фрагменты антител, также известные как одноцепочечные антитела (scFv), являются рекомбинантными полипептидами, которые обычно связываются с антигенами или рецепторами; при этом данные фрагменты содержат по меньшей мере один фрагмент аминокислотной последовательности вариабельной области тяжелой цепи антитела (VH), соединенный с по меньшей мере одним фрагментом последовательности вариабельной область легкой цепи антитела (VL) посредством одного или нескольких связующих линкеров или без них. Такой линкер может быть коротким гибким пептидом, выбранным так, чтобы обеспечить надлежащую трехмерную укладку доменов VL и VH при связывании, чтобы поддержать специфичность связывания молекулы-мишени целым антителом, из которого происходит одноцепочечный фрагмент антитела. Как правило, карбоксильный конец последовательности VL или VH ковалентно связан таким пептидным линкером с аминоконцом комплементарной последовательности VL и VH. Одноцепочечные фрагменты антител можно получить с помощью молекулярного клонирования, библиотек, полученных посредством фагового дисплея или похожих техник. Эти белки можно получить либо в эукариотических клетках, либо в прокариотических клетках, в том числе в бактериях.
[00145] Фрагменты одноцепочечных антител содержат аминокислотные последовательности, содержащие по меньшей мере одну из вариабельных областей или один из определяющих комплементарность участков (CDR, complementarity-determining region) целых антител, раскрытых в данном описании изобретения, но лишенные некоторых или всех константных доменов этих антител. Эти константные домены не являются необходимыми для связывания антигена, но составляют основную часть структуры целых антител. Фрагменты одноцепочечных антител могут таким образом преодолеть некоторые проблемы, связанные с применением антител, содержащих часть или целый константный домен. Например, для фрагментов одноцепочечных антител, как правило, не характерно нежелательное взаимодействие между биологическими молекулами и константной областью тяжелой цепи или другая нежелательная биологическая активность. Кроме того, фрагменты одноцепочечных антител существенно меньше целых антител и поэтому могут обладать большей капиллярной проницаемостью, чем целые антитела, что обеспечивает более эффективную локализацию фрагментов одноцепочечных антител и связывание с целевыми антигенсвязывающими сайтами. Также фрагменты антител можно получить в относительно большом количестве в прокариотических клетках, что облегчает их получение. Более того, относительно малый размер фрагментов одноцепочечных антител снижает вероятность индукции иммунного ответа у реципента по сравнению с целыми антителами.
[00146] Также могут присутствовать фрагменты антител, обладающих такими же или сравнимыми характеристиками связывания, как и целые антитела. Такие фрагменты могут содержать один или оба Fab-фрагмента или F(ab')2-фрагмент. Фрагменты антител могут содержать все шесть определяющих комплементарность участков целого антитела, хотя фрагменты, содержащие менее шести таких участков, например, содержащие три, четыре или пять определяющих комплементарность участков, также являются функциональными.
Получение белка
[00147] Антитело-цитокиновые белки-ловушки, как правило, получают рекомбинантно, применяя клетки млекопитающих, содержащие нуклеиновую кислоту, созданную для экспрессии белка. Хотя один пример подходящей клеточной линии и способ получения белка описан в Примерах 1 и 2, для получения биофармацевтических средств на основе антител применяют широкий спектр подходящих векторов, клеточных линий и способов получения белка, и их можно применять для синтеза этих антитело-цитокиновых белков-ловушек.
Показания к применению
[00148] Белки анти-PD-L1/TGFβ ловушки, описанные в настоящей заявке, можно применять для лечения рака или уменьшения роста опухоли у пациента. Примеры рака включают колоректальный рак, рак молочной железы, яичников, поджелудочной железы, желудка, простаты, почек, шейки матки, миелому, лимфому, лейкемию, рак щитовидной железы, эндометрия, матки, мочевого пузыря, нейроэндокринную опухоль, рак головы и шеи, печени, носоглотки, семенников, мелкоклеточный рак легких, немелкоклеточный рак легких, меланому, базальноклеточный рак кожи, плоскоклеточный рак кожи, выбухающую дерматофибросаркому, карциному из клеток Меркеля, глиобластому, глиому, саркому, мезотелиому и миелодиспластические синдромы.
[00149] Рак или опухоль, подлежащую лечению с помощью анти-PD-L1/TGFβ ловушки можно выбрать на основании экспрессии или повышенной экспрессии PD-L1 и TGFβ в опухоли, корреляции их уровней экспрессии с прогнозом или прогрессией заболевания и доклиническим и клинических опытом, касающимся чувствительности опухоли к лечению, действующему на PD-L1 и TGFβ. Такие виды рака включают, но не ограничиваются колоректальным раком, раком молочной железы, яичников, поджелудочной железы, желудка, простаты, почек, шейки матки, мочевого пузыря, головы и шеи, печени, немелкоклеточным раком легких, меланомой, карциномой из клеток Меркеля и мезотелиомой.
Фармацевтические композиции
[00150] Настоящее изобретение также охватывает фармацевтические композиции, содержащие терапевтически эффективное количество белка, описанного в настоящей заявке. Композицию можно составлять в форме для применения в ряде систем доставки лекарственных средств. В композицию также можно включать один или несколько физиологически приемлемых эксципиентов или носителей для получения надлежащей формы. Подходящие формы для применения в настоящем изобретении указаны в Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, Pa., 17th ed., 1985. Краткие обзор способов доставки лекарственных средств см., напр., в Langer (Science 249:1527-1533, 1990).
[00151] Фармацевтические композиции предназначены для парентерального, интраназального, местного, перорального или локального введения, например, с помощью трансдермальных средств, для терапевтического воздействия. Фармацевтические композиции можно вводить парентерально (напр., с помощью внутривенной, внутримышечной или подкожной инъекции), посредством перорального приема внутрь или посредством местного нанесения или внутрисуставной инъекции в области с сосудистыми нарушениями или раковым поражением. Дополнительные способы введения включают внутрисосудистое, внутриартериальное, внутриопухолевое, внутрибрюшинное, внутрижелудочковое, интраэпидуральное, а также назальное, окулярное, интрасклеральное, интраорбитальное, ректальное, местное введение или введение посредством аэрозольной ингаляции. Таким образом, настоящее изобретение представляет композиции для парентерального введения, которые включают указанные выше агенты, растворенные или суспендированные в приемлемом носителе, предпочтительно, в водном носителе, напр., в воде, буферной воде, солевом растворе, фосфатно-солевом буфере и подобном. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества в соответствии с требованиями приближения к физиологическим условиям, такие как регулирующие рН и буферные агенты, регулирующие тоничность агенты, увлажняющие агенты, детергенты и подобное. Настоящее изобретение также представляет композиции для перорального введения, которые могут содержать инертные ингредиенты, такие как связывающие вещества или наполнители для выпуска в форме таблеток, капсул и подобного. Более того, настоящее изобретение представляет композиции для местного введения, которые могут содержать инертные ингредиенты, такие как растворители или эмульгаторы для выпуска в форме крема, мази и подобного.
[00152] Эти композиции можно стерилизовать с помощью стандартных техник стерилизации или можно стерилизовать фильтрованием. Полученные в результате растворы можно упаковать для применения в этом виде или лиофилизировать, а лиофилизированный препарат комбинировать со стерильным водным носителем перед введением. Значение рН препаратов, как правило, будет находиться между 3 и 11, предпочтительнее, между 5 и 9 или между 6 и 8, и еще предпочтительнее, между 7 и 8, например, между 7 и 7,5. Полученные в результате композиции в твердой форме можно упаковать в виде многих однократных доз, каждая из которых содержит фиксированное количество упомянутого выше агента или агентов, например, в виде запаянной упаковки таблеток или капсул. Композицию в твердой форме также можно упаковать в контейнер с адаптируемым количеством, в такой как мягкая туба, предназначенная для местного нанесения крема или мази.
[00153] Оптимальная доза антитело-TGFβ ловушки основана на проценте связывания рецептора с функциональной группой антитела, необходимым для достижения максимального терапевтического эффекта, поскольку цитокиновая ловушка применяется в большом избытке. Например, терапевтическая доза моноклонального антитела, направленно действующего на клеточный рецептор, определяется таким образом, чтобы минимальный уровень составлял приблизительно от 10 до 100 мкг/мл, т.е. от 60 до 600 нМ (для антитела с константой диссоциации (KD) равной 6 нМ этот минимальный уровень обеспечит связывание 90-99% целевых рецепторов на клетке антителом). При этом цитокины находятся в избытке, как правило, присутствуя в кровотоке в концентрации от пг/мл до нг/м.
[00154] Оптимальная доза полипептида «антитело-TGFβ ловушки» настоящего изобретения будет зависеть от заболевания, подлежащего лечению, степени тяжести заболевания и наличия побочных эффектов. Оптимальную дозу можно определить с помощью стандартных исследований. При парентеральном введении можно вводить дозу от 0,1 мг/кг до 100 мг/кг, альтернативно, от 0,5 мг/кг до 50 мг/кг, альтернативно, от 1 мг/кг до 25 мг/кг, альтернативно, от 2 мг/кг до 10 мг/кг, альтернативно, от 5 мг/кг до 10 мг/кг, и вводить дозу, например, раз в неделю, раз в две недели, раз в три недели или раз в месяц в рамках цикла лечения.
Примеры
[00155] Описанное в общих чертах изобретение станет понятнее на следующих примерах, которые включены исключительно в целях иллюстрации определенных аспектов и вариантов осуществления настоящего изобретения и не предназначены для какого-либо ограничения объема настоящего изобретения.
Пример 1. Получение ДНК и экспрессия белков
[00156] Анти-PD-L1/TGFβ ловушка представляет собой слитый белок «анти-PD-L1 антитело- рецептор TGFβ II». Легкая цепь молекулы идентична легкой цепи анти-PD-L1 антитела (SEQ ID NO:1). Тяжелая цепь молекулы (SEQ ID NO:3) представляет собой слитый белок, содержащий тяжелую цепь анти-PD-L1 антитела (SEQ ID NO:2), генетически слитую посредством гибкого (Gly4Ser)4Gly линкера (SEQ ID NO:11) с N-концом растворимого рецептора TGFβ II (SEQ ID NO:10). В месте соединения С-концевой остаток лизина тяжелой цепи антитела был мутирован до аланина, чтобы уменьшить протеолитическое расщепление. Для экспрессии анти-PD-L1/TGFβ ловушки, ДНК, кодирующую легкую цепь анти-PD-L1 (SEQ ID NO:4), и ДНК, кодирующую анти-PD-L1/рецептор TGFβ II (SEQ ID NO:5), либо в составе одного экспрессионного вектора, либо в составе нескольких экспрессионных векторов, применяли для трансфекции клеток млекопитающих в соответствии со стандартными протоколами для транзиентной или стабильной трансфекции. Собирали кондиционированную культуральную среду и очищали слитый белок анти-PD-L1/TGFβ ловушки с помощью стандартной хроматографии на протеин А-сефарозе. Очищенный белок, содержащий одну молекулу антитела к PD-L1 и две молекулы растворимого рецептора TGFβ II (Фиг. 1A), имел кажущийся молекулярный вес приблизительно равный 190 килодальтон, по данным гель-фильтрационной хроматографии и электрофореза в ПААГ в присутствии додецилсульфата натрия в невосстанавливающих условиях. В восстанавливающих условиях молекулярный вес легкой и тяжелой цепей составляет 28 и 75 килодальтон, соответственно (Фиг. 1B).
[00157] Схожим образом получали слитой белок анти-PD-L1(mut)/TGFβ ловушки, который содержал аналогичный слитый полипептид тяжелой цепи (SEQ ID NO:7) и легкой цепи с мутациями A31G, D52E, R99Y в вариабельной области, которые не позволяли связывать PD-L1 (SEQ ID NO:6). Такой белок применяли в последующих экспериментах в качестве контроля ловушки TGFβ.
Пример 2. Получение анти-PD-L1/TGFβ ловушки в качестве биотерапевтического средства
[00158] Было обнаружено, что анти-PD-L1/TGFβ ловушка, полученная посредством транзиентной трансфекции клеток эмбриональной почки человека 293 (HEK, 293, human embryonic kidney 293), содержит в разной степени расщепленные фрагменты, которые визуализируются в виде слабой полосы с кажущимся молекулярным весом равным приблизительно 60 кДа на ПААГ после электрофореза в присутствии додецилсульфата натрия в восстанавливающих условиях (Фиг. 1B). Эта полоса, по подтвержденным данным, была тяжелой цепью анти-PD-L1/TGFβ ловушки, расщепленной в сайте в N-концевой части TGFβRII рядом с местом соединения.
[00159] Стабильные клоны, экспрессирующие анти-PD-L1/TGFβ ловушку, получали в линии клеток-хозяев CHO-S, предварительно адаптированной для роста в бессывороточной среде в виде суспензионной культуры. Клетки трансфицировали экспрессионным вектором, содержащим ген, кодирующий анти-PD-L1-TGFβRII белок и селективный маркер - глутаминсинтетазу. Последующую селекцию стабильных интегрантов проводили с помощью L-метионинсульфоксимина (MSX, L-methionine sulfoximine). Клеточные линии, экспрессирующие анти-PD-L1/TGFβ ловушку, получали с помощью минипулов и последующего помещения одиночных клеток в 384-луночные планшеты с помощью сортера клеток с активированной флуоресценцией Beckton-Dickinson (FACS, fluorescence activated cell sorter Aria II). Рост, продуктивность и качество белка оценивали с помощью типового платформенного исследования периодических культур с подпиткой. На основании проведенных анализов отбирали 14 клонов в качестве основных кандидатов для дальнейших исследований. Исследование стабильности клонов проводили до ~90 PDL (population doubling level, уровня удвоения популяции) из исследовательских клеточных банков, сформированных во время наращивания клонов. По результатам разработки минипулов было обнаружено, что субъединица «тяжелая цепь-линкер-TGFβRII» подвергалась расщеплению, что было заметно при транзиентной экспрессии. Все клоны в исследовании стабильности образовывали расщепленные фрагменты, хотя результаты очистки на протеине А показали, что процент расщепленных фрагментов относительно интактной субъединицы варьировал в разных клонах. Дополнительно, был разработан усовершенствованный процесс очистки, состоящий из хроматографии на протеине А и последующего сильного катионирования для снижения присутствия расщепленных фрагментов при очистке. Даже с применением усовершенствованного процесса очищенный материал с заданными конечными уровнями расщепленных фрагментов, составляющими <5%, можно было достичь только при применении клонов, образующих расщепленные фрагменты на низком уровне. На основании этих комбинированных анализов в качестве конечного кандидатного клона был отобран клон 02B15. Анализ анти-PD-L1/TGFβ ловушки, экспрессирующейся этим клоном при нулевом PDL, при тридцати PDL, при шестидесяти PDL и при девяноста PDL показывает, что процент расщепления не повышается с увеличением уровня удвоения популяции (Фиг. 2).
Пример 3. Анализ связывания анти-PD-L1/TGFβ ловушки и контролей с человеческим PD-L1 на клетках с помощью сортинга клеток с активированной флуоресценцией (FACS, fluorescence-activated cell sorting)
[00160] Связывание анти-PD-L1 антитела и слитых белков с клетками HEK, стабильно трансфицированными для экспрессии человеческого PD-L1, исследовали с помощью следующей процедуры.
[00161] Следующую приведенную в качестве примера процедуру применяли для определения связывания PD-L1 с помощью FACS:
a. готовили серию разведений тестируемых образцов объемом 50 мкл в буфере FACS.
b. 50 мкл клеток HEK, стабильно трансфицированных для экспрессии человеческого PD-L1, в количестве 5×106 клеток/мл распределяли по лункам с тестируемыми образцами и перемешивали.
c. планшет(ы) инкубировали в темноте на льду в течение 1 часа
d. клетки осаждали при 300×g в течение 5 минут
e. удаляли супернатант, ресуспендировали клетки в 300 мкл буфера FACS и снова осаждали при 300×g в течение 5 минут.
f. повторяли промывку образцов.
g. клетки ресуспендировали в 100 мкл буфера FACS, содержащего DyLight 488, конюъгированный с цельными козьими IgG к человеческим IgG, Fcγ (разведение 1:300).
h. планшет(ы) инкубировали в темноте на льду в течение 45 минут.
i. клетки осаждали при 300×g в течение 5 минут.
j. удаляли супернатант, ресуспендировали клетки в 300 мкл буфера FACS и снова осаждали при 300×g в течение 5 минут
k. повторяли промывку образцов и проводили конечное ресуспендирование клеток в 200 мкл буфера FACS.
l. Данные получали на приборе FACS Caliber и анализировали с помощью Microsoft Excel. EC50 (effective concentration 50, полумаксимальная эффективная концентрация) рассчитывали с помощью нелинейной регрессии (сигмоидальная кривая дозозависимости) с помощью Graphpad Prism5.
[00162] Как показано на Фиг. 3, анализ с помощью FACS показал, что слитый белок анти-PD-L1/TGFβ ловушки сохраняет схожую с положительным контролем (антителом к PD-L1) связывающую активность в отношении клеток HEK, стабильно трансфицированных для экспрессии человеческого PD-L1 (клеток HEK/PD-L1). EC50 для анти-PD-L1/TGFβ ловушки и анти-PD-L1 составляют 0,116 мкг/мл (0,64 нМ) и 0,061 мкг/мл (0,41 нМ), соответственно. Наблюдаемая средняя интенсивность флуоресценции MFI (mean fluorescent intensity) была специфична по отношению к связыванию с человеческим PD-L1, поскольку MFI исходных нетрансфицированных клеток HEK была равна нулю. Отрицательный контроль - анти-PD-L1(mut)/TGFβ ловушка - не демонстрировал никакого связывания с клетками HEK, стабильно трансфицированными для экспрессии человеческого PD-L1.
Пример 4. Определение способности анти-PD-L1/TGFβ ловушки ингибировать индуцированное TGFβ фосфорилирование SMAD3
[00163] Способность анти-PD-L1/TGFβ ловушки нейтрализовать TGFβ определяли с помощью клеток 4T1, несущих SMAD3-люциферазный репортер. В исследовании, подробно описанном ниже, ингибирование индуцированного TGFβ фосфорилирования SMAD3 измеряли с помощью люциферазного репортера, находящегося под контролем промотора SMAD3.
[00164] Приведенное в качестве примера исследование для оценки способности ингибировать индуцированную TGFβ активность репортера, проводили следующим образом:
1. За день до исследования клеткам 4T1, несущим SMAD3-люциферазный репортер, добавляли питательную среду.
2. В день 0 клетки рассаживали в 96-луночные планшеты Biocoat в концентрации равной 5×104 клеток/лунку в 100 мкл свежей среды и инкубировали в течение ночи при 37°C и 5% CO2.
3. В день 1:
i. В лунки добавляли 50 мкл свежей полной среды, содержащей указанную концентрацию тестируемых образцов анти-PD-L1/TGFβ или контролей, и инкубировали в течение часа. Все образцы исследовали в трех повторах.
ii. В каждую лунку добавляли 50 мкл свежей полной среды, содержащей 20 нг/мл человеческого TGFβ, и инкубировали образцы в течение ночи (конечная концентрация в лунке составляла 5 нг/мл).
4. В день 2:
i. Удаляли 100 мкл культурального супернатанта, добавляли 100 мкл свежей полной среды, содержащей 150 мкг/мл D-люциферина, и инкубировали образцы в течение по меньшей мере пяти минут.
ii. Люминесценцию измеряли с помощью планшетного спектрофотометра Envision 2104, регистрируя число импульсов в минуту (CPM, counts per minute).
5. Данные анализировали с помощью MS Excel или Graphpad prism 5. Активность люциферазы регистрировали как CPM. Ингибиторную активность (%) рассчитывали с помощью следующего уравнения:
Ингибирование (%)=(1-CPM образца /CPMmax обработанного анти-PD-L1 образца)×100
6. Подбор с помощью нелинейной регрессии проводили, применяя сигмоидальную кривую дозозависимости (с переменным наклоном) в Graphpad prism 5. Рассчитывали значения IC50 (inhibitory concentration 50, полумаксимальная ингибирующая концентрация).
[00165] Фиг. 4 показывает, что анти-PD-L1/TGFβ ловушка дозозависимо ингибирует индуцированную TGFβ репортерную активность pSMAD3. Тот факт, что контрольная анти-PD-L1(mut)/TGFβ ловушка обладала сравнимой активностью и IC50 (концентрацией, необходимой для ингибирования 50% максимальной активности), плюс тот факт, что антитело к PD-L1 не оказывало эффекта, свидетельствуют о том, что данное ингибирование передачи сигнала не зависит от анти-PD-L1 активности. Неожиданно оказалось, что анти-PD-L1/TGFβ ловушка обладает в несколько раз большей активностью, чем TGFβRII-Fc (R&D Systems), где TGFβRII располагается на N-конце, вместо С-конца слитого белка. Также примечательно, что анти-PD-L1/TGFβ ловушка обладает существенно большей активностью, чем 1D11 (GC1008), которое является антителом к TGFβ, исследованном на пациентах с распространенной злокачественной меланомой или почечно-клеточной карциномой (Morris et al., J Clin Oncol 2008; 26:9028 (Meeting abstract)). В этом исследовании 1D11 и TGFβRII-Fc демонстрировали схожую активность.
Пример 5 - Фармакокинетический анализ, проведенный на мышах
[00166] Восемнадцать самцов мышей C57BL/6 в возрасте 5-6 недель рандомизировали по 3 группам (N=6/группа), и каждая группа получала один из трех белков (анти-PD-L1/TGFβ ловушку, анти-PD-L1(mut)/TGFβ ловушку и анти-PD-L1). Вес тела мышей регистрировали перед введением дозы. После короткого прогревания под нагревательной лампой каждой мыши вводили 120 мкг белка в 200 мкл внутривенно (в/в) в хвостовую вену вне зависимости от веса тела. Каждую группу, получившую один и тот же белок затем делили на 2 подгруппы (n=3). Образцы крови брали поочередно у каждой из двух подгрупп, т.е. у одной подгруппы брали образцы крови в 1 ч, 24 ч, 72 ч и 168 ч, в то врем как у другой подгруппы брали образцы крови в 7 ч, 48 ч, 120 ч и 240 ч. В каждой временной точки у каждой мыши из хвостовой вены отбирали образец крови объемом приблизительно 50 мкл с помощью стеклянного микрокапилляра с гепарином (емкостью 100 мкл). Затем образец крови переносили в пробирку, предварительно покрытую Li-гепарином, и хранили при 4°C. В течение 10 минут после сбора образцы крови центрифугировали при 14000 об/мин в течение 10 мин. По меньшей мере 20 мкл образца плазмы переносили в новый набор промаркированных заранее пробирок и хранили при -20°C до дня проведения анализа.
[00167] Для измерения общего содержания человеческих IgG с помощью твердофазного иммуноферментного анализа (ELISA, enzyme-linked immunosorbent assay) применяли лунки, покрытые козьими антителами к человеческим IgG (H+L) (тяжелой и легкой цепи) (Jackson ImmunoResearch Laboratories), для связывания и связанные с пероксидазой мышиные антитела AffiniPure к человеческим IgG, F(ab')2 (Jackson ImmunoResearch Laboratories) для детекции. Для измерения количества полностью функциональных антител к PD-L1 и/или слитого белка с помощью ELISA применяли лунки, покрытые PD-L1-Fc (внеклеточный домен человеческого PD-L1, слитый с Fc) (покрытые с концентрацией 1,25 мкг/мл), для связывания и связанные с пероксидазой мышиные антитела AffiniPure к человеческим IgG, F(ab')2 (Jackson ImmunoResearch Laboratories) для детекции. Для измерения количества полностью функциональных антител к PD-L1 и интактного TGFβRII с помощью ELISA применяли лунки, покрытые PD-L1-Fc, для связывания и биотинилированное антитело к человеческому TGFβRII (R&D Systems) для детекции.
[00168] Фиг. 5A показывает, что слитый белок анти-PD-L1/TGFβ ловушки обладал фармакокинетическим профилем, очень схожим с фармакокинетическим профилем антитела к PD-L1. Например, по данным измерения общего содержания человеческих IgG с помощью ELISA, концентрация анти-PD-L1/TGFβ ловушки и анти-PD-L1 в сыворотке во временной точке 168 ч составляла 16,8 и 16,2 мкг/мл, соответственно, а соответствующая площадь под кривой (AUC, area under the curve) от 0 до 168 ч составляла 4102 и 3841 ч*мкг/мл. Аналогично, при измерении общей концентрации в сыворотке анти-PD-L1 с помощью ELISA, концентрации анти-PD-L1/TGFβ ловушки и анти-PD-L1 в сыворотке во временной точке 168 ч составляли 9,5 и 11,1 мкг/мл, соответственно, а соответствующая AUC от 0 до 168 ч составляла 3562 и 3086 ч*мкг/мл. Концентрацию интактного слитого белка анти-PD-L1/TGFβ ловушки в сыворотке определяли с помощью способа ELISA, который детектирует полностью функциональное антитело к PD-L1 и слитый TGFβRII. В этом случае концентрация анти-PD-L1/TGFβ ловушки в сыворотке составляла 5,9 мкг/мл во временной точке 168 ч, а AUC (от 0 до 168 ч) составляла 2656 ч*мкг/мл, что было несколько ниже значений, полученных при анализе полностью функционального антитела к PD-L1 с помощью ELISA, вероятно, вследствие деградации функциональной группы TGFβRII в результате опосредованного рецептором эндоцитоза. Было показано, что связывание антитела с PD-L1 приводит к PD-L1-опосредованному эндоцитозу; также известно, что у слитого белка «антитело-Х» происходит деградация функциональной группы «Х» после опосредованного рецептором эндоцитоза (Gillies et al., Clin Cancer Res. 2002; 8:210-6). Это подтверждает приведенное на Фиг. 5 наблюдение того факта, что в отсутствие связывания остатка антитела с PD-L1, как в случае контрольной анти-PD-L1(mut)/TGFβ ловушки, суммарное количество соединения в кровотоке приблизительно в 3 раза больше, при этом концентрация в сыворотке составляет 53 мкг/мл во временной точке 168 ч и AUC (от 0 до 168 ч) составляет 9585 ч*мкг/мл, что указывает на то, что клиренс по меньшей мере частично опосредован рецептором.
[00169] Чтобы подтвердить ~3-кратное различие суммарного количества соединения в кровотоке между анти-PD-L1/TGFβ ловушкой и анти-PD-L1(mut)/TGFβ ловушкой, повторяли фармакокинетический эксперимент и определяли концентрацию слитых белков в образцах сыворотки. Мышам (самкам мышей B6.129S2 в возрасте 8 недель, Jackson Lab) инъецировали анти-PD-L1/TGFβ ловушку или анти-PD-L1(mut)/TGFβ ловушку (164 мкг/мышь). Концентрацию двух слитых белков в сыворотке измеряли с помощью ELISA, применяя антитела к человеческим IgG Fab (Jackson Immunoresearch, West Grove, PA) для связывания и биотинилированные антитела к человеческому TGFβRII (R&D Systems, Minneapolis, MN) и конъюгированный с пероксидазой стрептавидин (Zymed/ThermoFisher Scientific, Grand Island, NY) для детектирования интактных белков анти-PD-L1/TGFβ ловушки. Концентрация интактных слитых белков в сыворотке в разных временных точках показана в Таблице ниже и на графике на Фиг. 5В. Общая площадь под кривой (AUC, area under the curve) вплоть до 336 ч составляет 11781 ч*мкг/мл для анти-PD-L1/TGFβ ловушки и 35575 ч*мкг/мл для анти-PD-L1(mut)/TGFβ ловушки (Таблица 1), что подтверждает трехкратное отличие суммарного количества исследуемого соединения от суммарного количества молекул контрольной ловушки.
Таблица 1. Суммарное количество анти-PD-L1/TGFβ ловушки и контрольной анти-PD-L1(mut)/TGFβ ловушки, определенное по площади под кривой (AUC, area under the curve) на фармакокинетическом графике на Фиг. 5B.
Пример 6. Опосредованный PD-L1 эндоцитоз анти-PD-L1/TGFβ ловушки
[00170] Опосредованный рецептором эндоцитоз изучали с помощью техник гашения флуоресценции Alexa Fluor 488 в соответствии с протоколом производителя (Life Technologies, Carlsbad, CA). Вкратце, клетки HEK, экспрессирующие PD-L1 (клетки HEK/PD-L1), инкубировали с 10 мкг/мл конъюгированной с Alexa Fluor 488 анти-PD-L1/TGFβ ловушки на льду в течение приблизительно 1 ч и промывали 4 раза холодной средой. Промытые клетки затем нагревали при 37°C в течение 0,25, 0,5, 0,75, 1, 1,5, 2, 3 и 4 ч для интернализации. Затем образцы клеток, отобранные в каждой временной точке, разделяли на две части. Одну часть инкубировали на льду и измеряли общую флуоресценцию связавшейся с клеточной поверхностью и интернализованной конъюгированной с Alexa Fluor 488 анти-PD-L1/TGFβ ловушки; другую часть инкубировали с антителами к Alexa Fluor 488 при 4°C в течение приблизительно одного часа и измеряли негашеную флуоресценцию интернализованной конъюгированной с Alexa Fluor 488 анти-PD-L1/TGFβ ловушки. График, показывающий временную зависимость негашеной и общей средней интенсивности флуоресценции (MFI, mean fluorescence intensity) анти-PD-L1/TGFβ ловушки при 37°C, приведен на Фиг. 6A. Кинетика опосредованной рецептором интернализации очень похожа на кинетику антитела к PD-L1, показанную на Фиг. 6B. Процент опосредованной рецептором интернализации анти-PD-L1/TGFβ ловушки и анти-PD-L1 на клетках HEK/PD-L1 в разных временных точках при 37°C показан на Фиг. 6C с применением следующей формулы для учета того факта, что гашение антителами к Alexa Fluor 488 не является 100%:
Интернализованная флуоресценция=общая MFI - (общая MFI - негасимая MFI)/эффективность гашения
Пример 7. Анти-PD-L1/TGFβ ловушка оказывала превосходящий противоопухолевый эффект, который является синергическим эффектом активностей анти-PD-L1 и TGFβ ловушки в подкожной модели EMT-6 (карцинома молочной железы)
[00171] Самкам Jh (Igh-Jtm1Dhu) мышей Balb/C в возрасте 8-12 недель (Taconic Farms, Hudson, NY) подкожно инокулировали 0,5×106 жизнеспособных клеток EMT6 в 0,1 мл фосфатно-солевого буфера в правый бок. Приблизительно через пять дней, когда средний размер опухоли достигал 20-30 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить внутривенные инъекции (День 0). Группа 1 получала 400 мкг изотипического контрольного антитела три раза в неделю (или «через день»); Группа 2 получала 400 мкг антитела к PD-L1 три раза в неделю; Группа 3 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки три раза в неделю; Группа 4 получала 492 мкг анти-PD-L1/TGFβ ловушки три раза в неделю; Группа 5 получала 492 мкг анти-PD-L1/TGFβ ловушки два раза в неделю (количество, эквимолярное 400 мкг антитела к PD-L1); Группа 6 получала 164 мкг анти-PD-L1/TGFβ ловушки три раза в неделю; и Группа 7 получала 55 мкг анти-PD-L1/TGFβ ловушки три раза в неделю. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00172] Все обработки хорошо переносились. Ингибирование роста опухоли при различных обработках показано на Фиг. 7A, демонстрирующей средний объем опухоли у выживших мышей, и на Фиг. 7B, демонстрирующей индивидуальный объем опухоли у выживших мышей, учитывая тот факт, что мышей с опухолью больше 2500 мм3 умерщвляли. Анти-PD-L1/TGFβ ловушка демонстрировала высокую противоопухолевую эффективность, достигая соотношения T/C равного 0,30, 0,40 и 0,44 в группе обработанных высокой дозой (492 мкг, Группа 4), средней дозой (164 мкг, Группа 6) и низкой дозой (55 мкг, Группа 7), соответственно, в День 28. В то время как антитело к PD-L1 (Группа 2, T/C =0,87, p>0,05 в День 16, последний день, для которого доступны данные по среднему объему опухоли всех мышей, т.е. перед умерщвлением мышей с опухолью больше 2500 мм3) или контрольная ловушка TGFβ (Группа 2, T/C =0,97 в День 16, p>0,05) в индивидуальном виде были малоэффективны в данной модели, комбинирование этих двух агентов в одной молекуле привело к выраженному синергическому противоопухолевому эффекту. Это очевидно из данных по медианному времени выживания, наблюдаемому при дозе 492 мкг (58 и более чем 80 дней для приема три раза в неделю и два раза в неделю, соответственно) и при дозе 164 мкг (35 дня) слитого белка (логранговый критерий: p<0,0001) (Фиг. 7C). Важно отметить, что анти-PD-L1/TGFβ ловушка в средней дозе равной 164 мкг (Группа 6) с медианой выживания равной 35 дней была значительно эффективнее, чем такая же доза анти-PD-L1(mut)/TGFβ ловушки (Группа 3), или в три раза больше, чем эквивалентная доза анти-PD-L1 (Группа 2), при каждой из которых медиана выживания составляла 22 дня, соответственно (логранговый критерий: p<0,0001). Такая синергическая противоопухолевая активность является особенно неожиданной, поскольку суммарное количество функциональной группы ловушки TGFβ при дозе 164 мкг ловушки PD-L1(mut)/TGFβ должно быть в три раза выше, чем при дозе 164 мкг ловушки PD-L1/TGFβ из-за опосредованного рецептором клиренса последней (см. Примеры 5 и 6). Примечательно, что опухоли у мышей, получивших высокую дозу анти-PD-L1/TGFβ ловушки, продолжали уменьшаться после прекращения введения доз в День 18 (у 3 из 10 животных из Группы 4 и у 6 из 10 из Группы 5 с полной регрессией в День 78), демонстрируя долгосрочный иммунологический противоопухолевый эффект направленного действия одновременно на два иммуносупрессорных механизма (Фиг. 7C). Также примечательно, что эффективность в Группе 4 не превышает эффективность в Группе 5, что позволяет предположить, что доза 492 мкг, вводимая два раза в неделю, была близка к насыщающей дозе, или что режим дозирования был более оптимальным, чем при введении дозы 492 мкг три раза в неделю.
[00173] Защитный эффект противоопухолевого иммунитета, вызванный обработкой анти-PD-L1/TGFβ ловушкой, стал очевидным, когда мышам с полной регрессией опухоли давали нагрузку в виде подкожной инъекции 25000 жизнеспособных клеток EMT6. В то время как у десяти не обработанных ранее мышей из контрольной группы образовывались опухоли со средним объемом 726 мм3 ко Дню 18 после нагрузки, ни у одной из одиннадцати мышей, ранее обработанных PD-L1/TGFβ ловушкой (трех из Группы 4, шести из Группы 5 и одной из каждой из Групп 6 и 7) не было никаких признаков роста опухоли.
Пример 8. Анти-PD-L1/TGF-β ловушка проявляла выраженную синергическую противоопухолевую активность в подкожной модели опухоли MC38 (колоректальной карциномы).
[00174] Самкам мышей B6.129S2-Ighmtm1Cgn/J (Jackson Laboratory, Bar Harbor, ME) в возрасте 8-12 недель подкожно инъецировали 0,5×106 жизнеспособных клеток MC38 в 0,1 мл фосфатно-солевого буфера в правый бок. Приблизительно через восемь дней, когда средний размер опухоли достигал приблизительно 80-100 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить внутривенные инъекции (День 0). Группа 1 получала 400 мкг изотипического контрольного антитела; Группа 2 получала 400 мкг антитела к PD-L1; Группа 3 получала 133 мкг антитела к PD-L1; Группа 4 получала 492 мкг анти-PD-L1(mut)/TGFβ ловушки; Группа 5 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки; Группа 6 получала 492 мкг анти-PD-L1/TGFβ ловушки; и Группа 7 получала 164 мкг анти-PD-L1/TGFβ ловушки. Обработку проводили три раза в неделю на протяжении двух недель. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00175] Все обработки хорошо переносились. Ингибирование роста опухоли с помощью различных обработок показано на Фиг. 8. В День 19 исследования анти-PD-L1/TGFβ ловушка продемонстрировала высокую дозозависимую противоопухолевую эффективность, соотношения T/C достигали 0,18 (p<0,001) и 0,38 (p<0,001) для групп получавших высокую дозу (492 мкг, Группа 6) и низкую дозу (164 мкг, Группа 7), соответственно. В то же время, ни анти-PD-L1, ни анти-PD-L1(mut)/TGFβ ловушка не обладали никакой противоопухолевой активностью. Таким образом, высокая синергическая противоопухолевая активность достигалась при комбинировании групп антитела к PD-L1 и ловушки TGFβ в составе одной молекулы для одновременного направленного действия на эти два иммуносупрессорных механизма.
Пример 9. Анти-PDL1/TGFβ ловушка была эффективной в ортотопической модели метастазирующего рака молочной железы EMT-6.
[00176] Самкам мышей Jh (Igh-Jtm1Dhu) Balb/C (Taconic Farms, Hudson, NY) в возрасте 8-12 недель инокулировали 0,25×106 жизнеспособных клеток EMT6 в 0,1 мл фосфатно-солевого буфера в жировую подушку правой молочной железы. Приблизительно через неделю, когда средний размер опухоли достигал приблизительно 50 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить внутривенные инъекции (День 0). Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 133 мкг антитела к PD-L1; Группа 3 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки; Группа 4 получала 164 мкг анти-PD-L1/TGFβ ловушки; и Группа 5 получала комбинацию 133 мкг анти-PD-L1 и 164 мкг анти-PD-L1(mut)/TGFβ ловушки. Обработку повторяли в Дни 0, 2, 4, 7, 9, 11 (т.е. 3 раза в неделю на протяжении двух недель). Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00177] Все обработки хорошо переносились. Ингибирование роста опухоли с помощью различных обработок показано на Фиг. 9. Анти-PD-L1/TGFβ ловушка демонстрировала высокую противоопухолевую эффективность, соотношение T/C достигало 0,03 (p<0,001) в День 21. В то же время, эквимолярные дозы анти-PD-L1 или анти-PD-L1(mut)/TGFβ ловушки были менее эффективными, соотношения T/C достигали 0,31 (p<0,001 по сравнению с Группой 1; p<0,001 по сравнению с Группой 4) и 0,68 (p<0,001 по сравнению с Группой 1; p<0,001 по сравнению с Группой 4), соответственно. Комбинированная терапия эквимолярными дозами анти-PD-L1 и анти-PD-L1(mut)/TGFβ ловушки была почти столько же эффективной, что и противоопухолевая эффективность слитого белка, хотя суммарное количество ловушки TGFβ в составе слитого белка (Группа 4), по оценкам, было в 3 раза меньшей, чем суммарное количество TGFβ в комбинации анти-PD-L1(mut)/TGFβ ловушки (Группа 5), по данным фармакокинетического анализа (см. Пример 5). Также примечательно, что опухоли в Группах 4 и 5 продолжали уменьшаться после последнего дня введения дозы, напр., средний размер опухоли уменьшался с 212 мм3 в День 11, последний день введения дозы, до 26 мм3 в День 24 при обработке анти-PD-L1/TGFβ ловушкой, демонстрируя долгосрочный иммунологический противоопухолевый эффект направленного действия одновременно на два иммуносупрессорных механизма.
Пример 10. Анти-PD-L1/TGFβ ловушка обладает большей противоопухолевой эффективностью, чем комбинация анти-PD-L1 и TGFβ ловушки во внутримышечной модели колоректальной карциномы MC38.
[00178] Самкам мышей B6.129S2-Ighmtm1Cgn/J (Jackson Laboratory, Bar Harbor, ME) в возрасте 8-12 недель внутримышечно инъецировали 0,5×106 жизнеспособных опухолевых клеток MC38 в 0,1 мл фосфатно-солевого буфера в правое бедро. Приблизительно через неделю, когда средний размер опухоли достигал приблизительно 50 мм3, мышей распределяли по группам (N=8) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали делать внутривенные инъекции (День 0), которые повторяли через два дня (в День 2). Группа 1 получала 400 мкг изотипического контрольного антитела; Группа 2 получала 400 мкг антитела к PD-L1; Группа 3 получала 133 мкг антитела к PD-L1; Группа 4 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки; Группа 5 получала 492 мкг анти-PD-L1/TGFβ ловушки; Группа 6 получала 164 мкг анти-PD-L1/TGFβ ловушки; и Группа 7 получала комбинацию 133 мкг анти-PD-L1 и 164 мкг анти-PD-L1(mut)/TGFβ ловушки. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00179] Все обработки хорошо переносились. Ингибирование роста опухоли с помощью различных обработок показано на Фиг. 10. Анти-PD-L1/TGFβ ловушка демонстрировала очень высокую противоопухолевую эффективность, соотношение T/C достигало 0,024 (p<0,001) и 0,052 (p<0,001) для групп получавших высокую дозу (492 мкг, Группа 5) и низкую дозу (164 мкг, Группа 6), соответственно, в День 15. В то же время, эквимолярные дозы анти-PD-L1 были менее эффективными, соотношения T/C достигали 0,59 (p<0,001) и 0,45 (p<0,001) для групп получавших высокую дозу (400 мкг, Группа 2) и низкую дозу (133 мкг, Группа 3), соответственно. Анти-PD-L1(mut)/TGFβ ловушка при дозе 164 мкг (Группа 4) была совсем неэффективной, и следует отметить, что хотя эта доза эквимолярна низкой дозе в группе анти-PD-L1/TGFβ ловушки (Группа 6), суммарное количество TGFβ ловушки будет приблизительно таким же, как и при высокой дозе в группе анти-PD-L1/TGFβ ловушки (Группа 5) из-за различий в фармакокинетике (см. Пример 5). Таким образом, эти данные показали, что анти-PD-L1/TGFβ ловушка обладает высокой синергической противоопухолевой активностью в этой модели. Особенно примечательно, что анти-PD-L1/TGFβ ловушка была более эффективной, чем комбинированная терапия эквимолярными дозами анти-PD-L1 и анти-PD-L1(mut)/TGFβ ловушки с соотношением T/C равным 0,16 (p<0,001 по сравнению с Группой 1 и p>0,05 по сравнению с Группой 6), несмотря на более высокое (приблизительно трехкратное) суммарное количество ловушки TGFβ (см. Пример 5). Дополнительно, обработка анти-PD-L1/TGFβ ловушкой привела к полной регрессии опухоли у 4 из 10 мышей, в то время как комбинация анти-PD-L1 и контрольной ловушки вызывала полную регрессию лишь у 2 из 10 мышей (данные не показаны). Также примечательно, что опухоли у мышей, обработанных анти-PD-L1/TGFβ ловушкой продолжали уменьшаться после последнего дня введения дозы в День 2 и оставались в состоянии полной регрессии и дальше (по меньшей мере до Дня 102), демонстрируя выраженный и долгосрочный иммунологический противоопухолевый эффект данного слитого белка. Не желая быть связанными с какой-либо теорией, авторы полагают, что эти данные указывают на механизм, при котором слитый белок анти-PD-L1/TGFβ ловушки не только оказывает синергический эффект блокировки двух основных механизмов избегания иммунологического надзора, но также превосходит комбинированную терапию, благодаря направленному действию на опухолевое микроокружение с помощью одной молекулы. Многие иммуносупрессорные цитокины, секретируемые опухолевыми клетками или «предательскими» иммунными клетками (напр., опухолеассоциированными макрофагами, супрессорными клетками миелоидного происхождения), выполняют аутокринные или паракринные функции. Таким образом, анти-PD-L1/TGFβ ловушка способна доставлять ловушку TGFβ в опухолевое микроокружение, связываясь с PD-L1+ опухолевыми клетками, где ловушка нейтрализует локально секретируемый TGFβ. Дополнительно, вместо того, чтобы быть лишь резервуаром для связанного TGFβ, который накапливается в кровотоке, TGFβ, связанный с анти-PD-L1/TGFβ ловушкой, может быть эффективно уничтожен посредством опосредованного рецептором PD-L1 эндоцитоза (Примеры 5 и 6).
Пример 11. Обработка анти-PDL1/TGFβ ловушкой или комбинацией анти-PD-L1 и контрольной ловушки TGFβ в эквивалентном суммарном количестве в ортотопической модели метастазирующего рака молочной железы.
[00180] В эквимолярных дозах анти-PDL1/TGFβ ловушка обладает такой же эффективностью, как и комбинация анти-PD-L1 и контрольной ловушки TGFβ в ортотопической модели рака молочной железы EMT-6 (Пример 9). В следующем исследовании изучали эффективность анти-PDL1/TGFβ ловушки или комбинации анти-PD-L1 и контрольной ловушки TGFβ, введенных в эквивалентном суммарном количестве.
[00181] Самкам мышей Jh (Igh-Jtm1Dhu) Balb/C (Taconic Farms, Hudson, NY) в возрасте 8-12 недель инокулировали 0,25×106 жизнеспособных клеток EMT6 в 0,1 мл фосфатно-солевого буфера в жировую подушку правой молочной железы. Приблизительно через неделю, когда средний размер опухоли достиг приблизительно 80 мм3, мышей распределяли по группам (N=12) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить внутривенные инъекции в День 0, и повторяли их через 7 дней. Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 164 мкг анти-PD-L1/TGFβ ловушки; Группа 3 получала 55 мкг анти-PD-L1/TGFβ ловушки; Группа 4 получала комбинацию 133 мкг анти-PD-L1 и 55 мкг анти-PD-L1(mut)/TGFβ ловушки; и Группа 5 получала комбинацию 44,3 мкг анти-PD-L1 и 18,3 мкг анти-PD-L1(mut)/TGFβ ловушки. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00182] Все обработки хорошо переносились. Анти-PD-L1/TGFβ ловушка и комбинированная терапия демонстрировали высокую противоопухолевую эффективность при обеих исследуемых дозах.
Пример 12. Анти-PD-L1/TGF-β ловушка обладает большей противоопухолевой эффективностью, чем комбинация анти-PD-L1 и ловушки TGFβ, вводимых таким образом, чтобы обеспечить эквивалентное суммарное количество в кровотоке, во внутримышечной модели колоректальной карциномы MC38.
[00183] Результаты, полученные в Примере 10 позволяют предположить, что эквимолярные дозы анти-PD-L1/TGF-β ловушки обладают большей противоопухолевой эффективностью, чем комбинация анти-PD-L1 и контрольной ловушки TGFβ, даже если суммарное количество контрольной анти-PD-L1(mut)/TGFβ ловушки в кровотоке in vivo приблизительно в 3 раза превышает количество анти-PD-L1/TGFβ ловушки (Пример 5). В исследовании последующего наблюдения сравнивали эффективность анти-PD-L1/TGFβ ловушки и комбинации анти-PD-L1 и анти-PD-L1(mut)/TGFβ ловушки при равном суммарном количестве в кровотоке. Вводили меньшие дозы, чем указанные в Примере 10, чтобы избежать введения доз, близких к насыщению.
[00184] Самкам мышей B6.129S2-Ighmtm1Cgn/J (Jackson Laboratory, Bar Harbor, ME) в возрасте 8-12 недель внутремышечно инъецировали 0,5×106 жизнеспособных опухолевых клеток MC38 в 0,1 мл фосфатно-солевого буфера в правое бедро. Приблизительно через неделю, когда средний размер опухоли достигал приблизительно 200 мм3, мышей распределяли по группам (N=12) таким образом, чтобы средний размер опухоли во всех группах был схожим. Обработку посредством внутривенных инъекций начинали в День 0 и продолжали в День 4. Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 164 мкг анти-PD-L1/TGFβ ловушки; Группа 3 получала 55 мкг анти-PD-L1/TGFβ ловушки; Группа 4 получала комбинацию 133 мкг анти-PD-L1 и 55 мкг анти-PD-L1(mut)/TGFβ ловушки; и Группа 5 получала комбинацию 44,3 мкг анти-PD-L1 и 18,3 мкг анти-PD-L1(mut)/TGFβ ловушки. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00185] Все обработки хорошо переносились. Анти-PD-L1/TGFβ ловушка демонстрировала очень высокую противоопухолевую эффективность, соотношение T/C достигало 0,13 (p<0,001) и 0,19 (p<0,001) для групп получавших промежуточную дозу (164 мкг, Группа 2, названная промежуточной дозой относительно высокой дозы 492 мкг, которая, вероятно, была насыщающей в Примере 10) и низкую дозу (55 мкг, Группа 3), соответственно, в День 9. В то же время, комбинация анти-PD-L1 и анти-PD-L1(mut)/TGFβ ловушки была менее эффективной, соотношения T/C достигали 0,34 (p<0,001) и 0,37 (p<0,001) для групп получавших промежуточную дозу (Группа 4) и низкую дозу (Группа 5), соответственно (Фиг. 12А или Таблица). Особенно примечательно, что при введении, обеспечивающем эквивалентное суммарное количество in vivo компонентов антитела к PD-L1 и ловушки TGFβ в кровотоке, анти-PD-L1/TGFβ ловушка была значительно более эффективной, чем комбинированная терапия анти-PD-L1 и анти-PD-L1(mut)/TGFβ ловушкой при обеих дозах (при промежуточной дозе соотношение T/C составляло 0,13 для анти-PD-L1(mut)/TGFβ ловушки по сравнению с 0,34 для комбинации p<0,001 (Фиг. 12В); при низкой дозе соотношение T/C составляло 0,19 для анти-PD-L1/TGFβ ловушки по сравнению с 0,37 для комбинации p<0,0001 (Фиг. 12С)).
Пример 13. Анти-PD-L1(YW)/TGFβ ловушка оказывает превосходящий противоопухолевый эффект, который является синергическим эффектом активностей анти-PD-L1 и TGFβ ловушки в ортотопической модели EMT-6 (карцинома молочной железы).
[00186] YW243.55S70 представляет собой человеческое антитело, узнающее как человеческий, так и мышиный PD-L1 (Публикация патентной заявки США № US2010/0203056 A1). Его последовательность вариабельной области тяжелой цепи (VH) и последовательность вариабельной области легкой цепи (VL) (представленные как SEQ ID NO: 14 и SEQ ID NO: 13, соответственно) применяли для замещения соответствующих последовательностей вариабельной области анти-PD-L1/TGFβ ловушки, описанной в Примере 1, чтобы получить анти-PD-L1(YW)/TGFβ ловушку, посредством стандартных молекулярно-биологических техник. После конструирования ДНК, кодирующей анти-PD-L1(YW)/TGFβ ловушку, слитый с антителом белок экспрессировали, как описано в Примере 1. Схожим образом экспрессировали антитело к PD-L1 YW243.55S70 для сравнения эффективности в мышиных моделях опухолей.
[00187] Самкам мышей Jh (Igh-Jtm1Dhu) Balb/C (Taconic Farms, Hudson, NY) в возрасте 8-12 недель инокулировали 0,25×106 жизнеспособных клеток EMT6 в 0,1 мл фосфатно-солевого буфера в жировую подушку правой молочной железы. Приблизительно через неделю, когда средний размер опухоли достиг приблизительно 50-100 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить внутривенные инъекции (День 0). Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 133 мкг антитела к PD-L1(YW); Группа 3 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки; Группа 4 получала 164 мкг анти-PD-L1(YW)/TGFβ ловушки; и Группа 5 получала комбинацию 133 мкг анти-PD-L1(YW) и 164 мкг анти-PD-L1(mut)/TGFβ ловушки. Обработку повторяли в Дни 4 и 7. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно).
[00188] Все обработки хорошо переносились. Ингибирование роста опухоли с помощью различных обработок показано на Фиг. 13А, демонстрирующей средний объем опухоли у мышей в День 17, последний день для которого доступны данные по среднему объему опухоли у всех мышей, т.е. перед тем как мышей с опухолью больше 2500 мм3 умерщвляли. Анти-PD-L1(YW)/TGFβ ловушка демонстрировала высокую противоопухолевую эффективность, соотношение T/C достигало 0,25 (p<0,0001), что немного выше, чем значение, полученной при применении комбинированной обработки в Группе 5 (T/C=0,19, p<0,0001), и значительно выше значения, полученного для анти-PD-L1(YW) антитела в Группе 2 (T/C=0,57, p<0,0001) и для контрольной ловушки TGFβ в Группе 3 (T/C=0,66, p<0,0001). Синергический противоопухолевый эффект слитого с антителом белка также обеспечивал более длительное выживание обработанных мышей, как показано на Фиг. 13B. Среднее время выживания в обработанной анти-PD-L1/TGFβ ловушкой группе составляло 65 дней, что значительно лучше среднего времени выживания в обработанной анти-PD-L1(YW) антителом группе (24 дня) или в обработанной контрольной ловушкой TGFβ группе (21 день). Это хорошо согласуется со среднем временем выживания в группе комбинированной обработки равным 53,5 дня. Несмотря на то, что введение доз прекращали после Дня 7, продолжающееся ингибирование роста опухоли и более продолжительное выживание обработанных анти-PD-L1(YW)/TGFβ ловушкой мышей демонстрируют продолжительный иммунологический противоопухолевый эффект, обусловленный двойной блокировкой двух основных иммуносупрессорных путей.
Пример 14. Анти-PD-L1(YW)/TGFβ ловушка оказывает превосходящий противоопухолевый эффект, который является синергическим эффектом активностей анти-PD-L1 и TGFβ ловушки во внутримышечной модели опухоли MC38 (колоректальной карциномы)
[00189] Самкам мышей B6.129S2-Ighmtm1Cgn/J (Jackson Laboratory, Bar Harbor, ME) в возрасте 8-12 недель делали внутримышечную инъекцию 0,5×106 жизнеспособных опухолевых клеток MC38 в 0,1 мл фосфатно-солевого буфера в правое бедро. Приблизительно через неделю, когда средний размер опухоли достигал приблизительно 150-200 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали обработку посредством внутривенных инъекций (День 0), и повторяли обработку через четыре дня (День 4). Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 133 мкг анти-PD-L1(YW) антитела; Группа 3 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки; Группа 4 получала 164 мкг анти-PD-L1(YW)/TGFβ ловушки; и Группа 5 получала комбинацию 133 мкг анти-PD-L1(YW) и 164 мкг анти-PD-L1(mut)/TGFβ ловушки. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00190] Все обработки хорошо переносились. Ингибирование роста опухоли с помощью различных обработок представлено на Фиг. 14А, показывающей средний объем опухоли у мышей в День 10, последний день, для которого доступны данные по среднему объему опухоли у всех мышей. Анти-PD-L1(YW)/TGFβ ловушка демонстрировала очень высокую противоопухолевую эффективность, соотношение T/C достигало 0,14 (p<0,0001), что немного лучше, чем значение, полученной при применении комбинированной обработки в Группе 5 (T/C=0,19, p<0,0001), и значительно лучше значения, полученного для анти-PD-L1(YW) антитела в группе 2 (T/C=0,34, p<0,0001) и для контрольной ловушки TGFβ в Группе 3 (T/C=0,99, p<0,0001), которая не проявляла активность в данной модели. Противоопухолевая эффективность анти-PD-L1(YW)/TGFβ ловушки также была подтверждена измерениями веса опухоли, сделанными в День 11. К этому времени животных из группы изотипического контроля пришлось умертвить, поскольку опухоли превысили размер 2500 мм3. Поэтому эксперимент завершили, животных во всех группах умертвили и опередили вес опухолей. Вес отдельных опухолей представлен на Фиг. 14B. Анализ веса опухолей подтвердил, что терапия анти-PD-L1(YW)/TGFβ ловушкой значительно ингибировала рост опухоли MC38 (T/C=0,13; p<0,0001). Эффективность анти-PD-L1(YW)/TGFβ ловушки была существенно выше, чем эффективность анти-PD-L1 (T/C=0,37; p=0,003) или контрольной ловушки TGFβ (T/C=1,0, p<0,0001). Противоопухолевая эффективность анти-PD-L1(YW)/TGFβ ловушки, по данным анализа веса опухоли, не превышала статистически достоверно эффективность комбинации анти-PD-L1 и контрольной ловушки TGFβ у мышей (T/C=0,17; p=0,96).
Пример 15. Комбинированная обработка анти-PD-1 и ловушкой TGFβ не оказывает никакого аддитивного противоопухолевого эффекта в ортотопической модели EMT-6 (карцинома молочной железы)
[00191] В данном исследовании мы изучали, оказывает ли комбинированная обработка анти-PD-1 и ловушкой TGFβ какой-либо аддитивный противоопухолевый эффект в ортотопической модели EMT-6. CT-011, также известное как пидилузумаб, представляет собой гуманизированное антитело к человеческому PD1, исследуемое в клинических условиях для лечения гематологических злокачественных опухолей (Berger et al, Clin Cancer Res. 2008; 14:3044-3051). Оно также узнает мышиный PD-1 и, как было показано, проявляет противоопухолевую активность, оказывающую синергическое действие с циклофосфамидом и вакцинальной терапией в сингенных моделях опухолей (Mkrtichyan et al., Eur J Immunol. 2011; 41:2977-86). Последовательности VH и VL CT-011 применяли для получения рекомбинантного антитела с человеческими константными областями IgG1/kappa с помощью стандартных молекулярно-биологических техник.
[00192] Самкам мышей Jh (Igh-Jtm1Dhu) Balb/C (Taconic Farms, Hudson, NY) в возрасте 8-12 недель инокулировали 0,25×106 жизнеспособных клеток EMT6 в 0,1 мл фосфатно-солевого буфера в жировую подушку правой молочной железы. Приблизительно через неделю, когда средний размер опухоли достиг приблизительно 100 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить обработку посредством внутривенных инъекций (День 0). Группа 1 получала 364 мкг изотипического контрольного антитела; Группа 2 получала 164 мкг анти-PD-L1(mut)/TGFβ ловушки, служащей контрольной ловушкой TGFβ; Группа 3 получала 200 мкг анти-PD-1(CT-011); и Группа 4 получала комбинацию 200 мкг анти-PD-1(CT-011) и 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки. Обработку повторяли в Дни 2, 4, 7, 9 и 11, т.е. три раза в неделю на протяжении двух недель. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00193] Все обработки хорошо переносились. Анти-PD-1(CT-011) демонстрировало очень малую противоопухолевую эффективность (T/C=0,87 p>0,05) в данной модели, в то время как в комбинации с контрольной ловушкой TGFβ она обладала такой же эффективностью, как и одна контрольная ловушка TGFβ (Фиг.15).
Пример 16. Комбинированная обработка анти-PD-1 и ловушкой TGFβ не оказывает никакого аддитивного противоопухолевого эффекта во внутримышечной модели опухоли MC38 (колоректальной карциномы).
[00194] В данном исследовании мы изучали, оказывает ли комбинированная обработка анти-PD-1 и ловушкой TGFβ какой-либо аддитивный противоопухолевый эффект во внутримышечной модели колоректальной опухоли MC38. Самкам мышей B6.129S2-Ighmtm1Cgn/J (Jackson Laboratory, Bar Harbor, ME) в возрасте 8-12 недель делали внутримышечную инъекцию 0,5×106 жизнеспособных опухолевых клеток MC38 в 0,1 мл фосфатно-солевого буфера в правое бедро. Приблизительно через неделю, когда средний размер опухоли достиг приблизительно 190 мм3, мышей распределяли по группам (N=10) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить обработку посредством внутривенных инъекций (День 0). Группа 1 получала 364 мкг изотипического контрольного антитела в Дни 0, 2, 4 и 7; Группа 2 получала 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки в Дни 0 и 2; Группа 3 получала 200 мкг анти-PD-1(CT-011) в Дни 0, 2, 4 и 7; и Группа 4 получала комбинацию 200 мкг анти-PD-1(CT-011) в Дни 0, 2, 4 и 7 и 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки в Дни 0 и 2. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00195] Все обработки хорошо переносились. Анти-PD-1(CT-011) демонстрировало очень малую противоопухолевую эффективность (T/C=0,87 p>0,05), в то время как контрольная анти-PD-L1(mut)/TGFβ ловушка не обладала эффективностью в данной модели, как показано в предыдущих примерах. Комбинация анти-PD-1(CT-011) с контрольной ловушкой TGFβ не обладала какой-либо эффективностью (Фиг.15).
Пример 17. Комбинированная обработка ловушкой TGFβ и либо анти-LAG3, либо анти-TIM-3 не оказывает никакого аддитивного противоопухолевого эффекта в ортотопической модели EMT-6 (карцинома молочной железы)
[00196] В данном исследовании мы изучали, оказывает ли комбинированная обработка ловушкой TGFβ и либо анти-LAG3, либо анти-TIM-3 какой-либо аддитивный противоопухолевый эффект в ортотопической модели EMT-6. Применяемое анти-LAG3 антитело является крысиным моноклональным антителом IgG1 к мышиному LAG3 C9B7W (BioXcell, Beverly, MA), которое, как было показано, обладает синергическим действием при обработке с антителом к мышиному PD-1 в сингенных моделях опухолей (Woo et al, Cancer Res, 2011; 72:917-27). Применяемое анти-TIM-3 антитело является крысиным моноклональным антителом IgG2a к мышиному TIM3 RMT3-23 (BioXcell, Beverly, MA), которое также, как было показано, обладает синергическим действием при обработке с антителом к мышиному PD-1 в сингенных моделях опухолей, хотя его эффективность в качестве монотерапии относительно мала (Ngiow et al, Cancer Res, 2011; 71:3540-51).
[00197] Самкам мышей Jh (Igh-Jtm1Dhu) Balb/C (Taconic Farms, Hudson, NY) в возрасте 8-12 недель инокулировали 0,25×106 жизнеспособных клеток EMT6 в 0,1 мл фосфатно-солевого буфера в жировую подушку правой молочной железы. Приблизительно через неделю, когда средний размер опухоли достиг приблизительно 110 мм3, мышей распределяли по группам (N=9) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить обработку посредством внутривенных инъекций (День 0). Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки; Группа 3 получала 200 мкг анти-LAG3; Группа 4 получала 250 мкг анти-TIM3; Группа 5 получала комбинацию 200 мкг анти-LAG3 и 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки; и Группа 6 получала комбинацию 250 мкг анти-TIM3 и 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки. Обработку повторяли в Дни 2, 4, 7, 9 и 11, т.е. три раза в неделю на протяжении двух недель. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00198] Как наблюдали ранее, контрольная анти-PD-L1(mut)/TGFβ ловушка (Группа 2) обладала очень малой эффективностью в этой модели EMT-6. Анти-TIM3 антитело (Группа 4) в качестве монотерапии обладало такой же низкой эффективностью, как и контрольная ловушка, а при комбинированной терапии с контрольной ловушкой (Группа 6) не демонстрировало никакого аддитивного эффекта. Анти-LAG3 антитело как в качестве монотерапии (Группа 3), так и в комбинированной терапии с контрольной ловушкой (Группа 5) не демонстрировало никакой эффективности.
Пример 18. Комбинированная обработка ловушкой TGFβ и либо анти-LAG3, либо анти-TIM-3 не оказывает никакого аддитивного противоопухолевого эффекта во внутримышечной модели опухоли MC38 (колоректальной карциномы)
[00199] В данном исследовании мы изучали, оказывает ли комбинированная обработка ловушкой TGFβ и либо анти-LAG3 (C9B7W), либо анти-TIM3 (RMT3-23) какой-либо аддитивный противоопухолевый эффект во внутримышечной модели колоректальной опухоли MC38.
[00200] Самкам мышей B6.129S2-Ighmtm1Cgn/J (Jackson Laboratory, Bar Harbor, ME) в возрасте 8-12 недель делали внутримышечную инъекцию 0,5×106 жизнеспособных опухолевых клеток MC38 в 0,1 мл фосфатно-солевого буфера в правое бедро. Приблизительно через неделю, когда средний размер опухоли достиг приблизительно 50 мм3, мышей распределяли по группам (N=8) таким образом, чтобы средний размер опухоли во всех группах был схожим, и начинали проводить обработку посредством внутривенных инъекций (День 0). Группа 1 получала 133 мкг изотипического контрольного антитела; Группа 2 получала 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки; Группа 3 получала 200 мкг анти-LAG3; Группа 4 получала 250 мкг анти-TIM3; Группа 5 получала комбинацию 200 мкг анти-LAG3 и 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки; и Группа 6 получала комбинацию 250 мкг анти-TIM3 и 164 мкг контрольной анти-PD-L1(mut)/TGFβ ловушки. Обработку повторяли в Дни 2, 4, 7, 9, 11, 15 и 18. Вес тела измеряли дважды в неделю для наблюдения за токсичностью. Объем опухоли определяли в разных временных точках по формуле: объем опухоли (мм3)=длина×ширина×высота×0,5236. Всех мышей с опухолью больше 2500 мм3 умерщвляли в соответствии с принятым ветеринарным протоколом. Противоопухолевую эффективность выражали как отношение T/C, где T и C представляют средние объемы опухоли в группе, обработанной антителом или слитым белком, и в группе, обработанной изотипическим контролем, соответственно.
[00201] Как наблюдали ранее, контрольная анти-PD-L1(mut)/TGFβ ловушка (Группа 2) не обладала никакой эффективностью в этой модели MC38. Анти-TIM3 антитело в качестве монотерапии (Группа 3) обладало умеренной эффективностью, соотношение T/C достигало 0,66 (p<0,05). Однако комбинация с контрольной ловушкой (Группа 5) не увеличивала его эффективность. Анти-TIM3 антитело как в качестве монотерапии (Группа 4), так и в комбинированной терапии с контрольной ловушкой (Группа 6) не демонстрировало никакой эффективности.
Последовательности
SEQ ID NO: 1
Пептидная последовательность секретируемой легкой цепи лямбда антитела к PD-L1
QSALTQPASVSGSPGQSITISCTGTSSDVGGYNYVSWYQQHPGKAPKLMIYDVSNRPSG VSNRFSGSKSGNTASLTISGLQAEDEADYYCSSYTSSSTRVFGTGTKVTVLGQPKANPTVTLFP PSSEELQANKATLVCLISDFYPGAVTVAWKADGSPVKAGVETTKPSKQSNNKYAASSYLSLTPE QWKSHRSYSCQVTHEGSTVEKTVAPTECS
SEQ ID NO: 2
Пептидная последовательность секретируемой тяжелой цепи антитела к PDL1
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYIMMWVRQAPGKGLEWVSSIYPSGGITF YADTVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARIKLGTVTTVDYWGQGTLVTVSSAST KGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSS VVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPK DTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQD WLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSD IAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKS LSLSPGK
SEQ ID NO: 3
Пептидная последовательность секретируемой тяжелой цепи анти-PDL1/TGFβ ловушки
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYIMMWVRQAPGKGLEWVSSIYPSGGITF YADTVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARIKLGTVTTVDYWGQGTLVTVSSAST KGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSS VVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPK DTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQD WLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSD IAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKS LSLSPGAGGGGSGGGGSGGGGSGGGGSGIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFS TCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIM KEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD
SEQ ID NO: 4
Последовательность ДНК от кодона инициации трансляции до кодона остановки трансляции легкой цепи лямбда антитела к PD-L1 (лидерная последовательность перед VL является сигнальным пептидом из урокиназного активатора плазминогена)
atgagggccctgctggctagactgctgctgtgcgtgctggtcgtgtccgacagcaagggcCAGTCCGCCCTGACCCAGCCTGCCTCCGTGTCTGGCTCCCCTGGCCAGTCCATCACCATCAGCTGCACCGGCACCTCCAGCGACGTGGGCGGCTACAACTACGTGTCCTGGTATCAGCAGCACCCCGGCAAGGCCCCCAAGCTGATGATCTACGACGTGTCCAACCGGCCCTCCGGCGTGTCCAACAGATTCTCCGGCTCCAAGTCCGGCAACACCGCCTCCCTGACCATCAGCGGACTGCAGGCAGAGGACGAGGCCGACTACTACTGCTCCTCCTACACCTCCTCCAGCACCAGAGTGTTCGGCACCGGCACAAAAGTGACCGTGCTGggccagcccaaggccaacccaaccgtgacactgttccccccatcctccgaggaactgcaggccaacaaggccaccctggtctgcctgatctcagatttctatccaggcgccgtgaccgtggcctggaaggctgatggctccccagtgaaggccggcgtggaaaccaccaagccctccaagcagtccaacaacaaatacgccgcctcctcctacctgtccctgacccccgagcagtggaagtcccaccggtcctacagctgccaggtcacacacgagggctccaccgtggaaaagaccgtcgcccccaccgagtgctcaTGA
SEQ ID NO: 5
Последовательность ДНК от кодона инициации трансляции до кодона остановки трансляции (mVK лидерный сигнальный пептид: строчные буквы с подчеркиванием; VH: прописные буквы; IgG1m3 с мутацией K до A: строчные буквы; (G4S)×4-G линкер: прописные полужирные буквы; TGFβRII: строчные полужирные буквы с подчеркиванием; два стоп-кодона: прописные полужирные буквы с подчеркиванием)
atggaaacagacaccctgctgctgtgggtgctgctgctgtgggtgcccggctccacaggcGAGGTGCAGCTGCTGGAATCCGGCGGAGGACTGGTGCAGCCTGGCGGCTCCCTGAGACTGTCTTGCGCCGCCTCCGGCTTCACCTTCTCCAGCTACATCATGATGTGGGTGCGACAGGCCCCTGGCAAGGGCCTGGAATGGGTGTCCTCCATCTACCCCTCCGGCGGCATCACCTTCTACGCCGACACCGTGAAGGGCCGGTTCACCATCTCCCGGGACAACTCCAAGAACACCCTGTACCTGCAGATGAACTCCCTGCGGGCCGAGGACACCGCCGTGTACTACTGCGCCCGGATCAAGCTGGGCACCGTGACCACCGTGGACTACTGGGGCCAGGGCACCCTGGTGACAGTGTCCTCCgctagcaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagagagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctatagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtccccgggtgctGGCGGCGGAGGAAGCGGAGGAGGTGGCAGCGGTGGCGGTGGCTCCGGCGGAGGTGGCTCCGGAatccctccccacgtgcagaagtccgtgaacaacgacatgatcgtgaccgacaacaacggcgccgtgaagttccctcagctgtgcaagttctgcgacgtgaggttcagcacctgcgacaaccagaagtcctgcatgagcaactgcagcatcacaagcatctgcgagaagccccaggaggtgtgtgtggccgtgtggaggaagaacgacgaaaacatcaccctcgagaccgtgtgccatgaccccaagctgccctaccacgacttcatcctggaagacgccgcctcccccaagtgcatcatgaaggagaagaagaagcccggcgagaccttcttcatgtgcagctgcagcagcgacgagtgcaatgacaacatcatctttagcgaggagtacaacaccagcaaccccgacTGATAA
SEQ ID NO: 6
Полипептидная последовательность секретируемой легкой цепи лямбда анти-PD-L1(mut)/TGFβ ловушки с мутациями A31G, D52E, R99Y
Qsaltqpasvsgspgqsitisctgtssdvggynyvswyqqhpgkapklmiyevsnrpsgvsnrfsgsksgntasltisglqaedeadyycssytssstyvfgtgtkvtvlgqpkanptvtlfppsseelqankatlvclisdfypgavtvawkadgspvkagvettkpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
SEQ ID NO: 7
Полипептидная последовательность секретируемой тяжелой цепи анти-PD-L1(mut)/TGFβ ловушки
EVQLLESGGGLVQPGGSLRLSCAASGFTFSMYMMMWVRQAPGKGLEWVSSIYPSGGITFYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAIYYCARIKLGTVTTVDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGAGGGGSGGGGSGGGGSGGGGSGIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD
SEQ ID NO: 8
Полипептидный предшественник человеческого TGFβRII изоформы A (эталонная последовательность NCBI с учетным номером NP_001020018)
MGRGLLRGLWPLHIVLWTRIASTIPPHVQKSDVEMEAQKDEIICPSCNRTAHPLRHINNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDLLLVIFQVTGISLLPPLGVAISVIIIFYCYRVNRQQKLSSTWETGKTRKLMEFSEHCAIILEDDRSDISSTCANNINHNTELLPIELDTLVGKGRFAEVYKAKLKQNTSEQFETVAVKIFPYEEYASWKTEKDIFSDINLKHENILQFLTAEERKTELGKQYWLITAFHAKGNLQEYLTRHVISWEDLRKLGSSLARGIAHLHSDHTPCGRPKMPIVHRDLKSSNILVKNDLTCCLCDFGLSLRLDPTLSVDDLANSGQVGTARYMAPEVLESRMNLENVESFKQTDVYSMALVLWEMTSRCNAVGEVKDYEPPFGSKVREHPCVESMKDNVLRDRGRPEIPSFWLNHQGIQMVCETLTECWDHDPEARLTAQCVAERFSELEHLDRLSGRSCSEEKIPEDGSLNTTK
SEQ ID NO: 9
Полипептидный предшественник человеческого TGFβRII изоформы B (эталонная последовательность NCBI с учетным номером NP_003233
MGRGLLRGLWPLHIVLWTRIASTIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDLLLVIFQVTGISLLPPLGVAISVIIIFYCYRVNRQQKLSSTWETGKTRKLMEFSEHCAIILEDDRSDISSTCANNINHNTELLPIELDTLVGKGRFAEVYKAKLKQNTSEQFETVAVKIFPYEEYASWKTEKDIFSDINLKHENILQFLTAEERKTELGKQYWLITAFHAKGNLQEYLTRHVISWEDLRKLGSSLARGIAHLHSDHTPCGRPKMPIVHRDLKSSNILVKNDLTCCLCDFGLSLRLDPTLSVDDLANSGQVGTARYMAPEVLESRMNLENVESFKQTDVYSMALVLWEMTSRCNAVGEVKDYEPPFGSKVREHPCVESMKDNVLRDRGRPEIPSFWLNHQGIQMVCETLTECWDHDPEARLTAQCVAERFSELEHLDRLSGRSCSEEKIPEDGSLNTTK
SEQ ID NO: 10
Полипептид внеклеточного домена человеческого TGFβRII изоформы B
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD
SEQ ID NO: 11
(Gly4Ser)4Gly линкер
GGGGSGGGGSGGGGSGGGGSG
SEQ ID NO: 12
Полипептидная последовательность секретируемой вариабельной области тяжелой цепи антитела MPDL3280A к PD-L1
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSS
SEQ ID NO: 13
Полипептидная последовательность секретируемой вариабельной области легкой цепи лямбда антитела MPDL3280A к PD-L1 и антитела YW243.55S70 к PD-L1
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR
SEQ ID NO: 14
Полипептидная последовательность секретируемой вариабельной области тяжелой цепи антитела YW243.55S70 к PD-L1
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSA
Включение посредством ссылки
[00202] Раскрытие каждого из патентных документов и научных статей, на которые даны ссылки в настоящей заявке, полностью включено в настоящую заявку посредством ссылки в любых целях.
Эквиваленты
[00203] Настоящее изобретение можно осуществить в других конкретных формах, не отклоняясь от его сути и основных характеристик. Поэтому приведенные выше варианты осуществления настоящего изобретения следует рассматривать во всех аспектах как иллюстративные, а не как ограничивающие изобретение, описанное в настоящей заявке. Различные структурные элементы разных вариантов осуществления настоящего изобретения и разные раскрытые стадии способов можно применять в разных комбинациях и в разном порядке, и все такие варианты следует считать формами настоящего изобретения. Таким образом, объем настоящего изобретения определен формулой изобретения, а не приведенным выше описанием, и все изменения, соответствующие значению и предела эквивалентности формулы изобретения, как предполагается, включены в объем настоящего изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПАТЕНТ MERCK GMBH
<120> НАПРАВЛЕННОЕ ИНГИБИРОВАНИЕ TGFБЕТА
<130> NRS/FP7105141
<140> PCT/EP2015/052781
<141> 2015-02-10
<150> 61/938,048
<151> 2014-02-10
<160> 49
<170> PatentIn версия 3.5
<210> 1
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223>/примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 1
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 2
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 2
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 3
<211> 607
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 3
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
450 455 460
Ser Gly Gly Gly Gly Ser Gly Ile Pro Pro His Val Gln Lys Ser Val
465 470 475 480
Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro
485 490 495
Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln
500 505 510
Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro
515 520 525
Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr
530 535 540
Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile
545 550 555 560
Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys
565 570 575
Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn
580 585 590
Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
595 600 605
<210> 4
<211> 711
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полинуклеотид»
<400> 4
atgagggccc tgctggctag actgctgctg tgcgtgctgg tcgtgtccga cagcaagggc 60
cagtccgccc tgacccagcc tgcctccgtg tctggctccc ctggccagtc catcaccatc 120
agctgcaccg gcacctccag cgacgtgggc ggctacaact acgtgtcctg gtatcagcag 180
caccccggca aggcccccaa gctgatgatc tacgacgtgt ccaaccggcc ctccggcgtg 240
tccaacagat tctccggctc caagtccggc aacaccgcct ccctgaccat cagcggactg 300
caggcagagg acgaggccga ctactactgc tcctcctaca cctcctccag caccagagtg 360
ttcggcaccg gcacaaaagt gaccgtgctg ggccagccca aggccaaccc aaccgtgaca 420
ctgttccccc catcctccga ggaactgcag gccaacaagg ccaccctggt ctgcctgatc 480
tcagatttct atccaggcgc cgtgaccgtg gcctggaagg ctgatggctc cccagtgaag 540
gccggcgtgg aaaccaccaa gccctccaag cagtccaaca acaaatacgc cgcctcctcc 600
tacctgtccc tgacccccga gcagtggaag tcccaccggt cctacagctg ccaggtcaca 660
cacgagggct ccaccgtgga aaagaccgtc gcccccaccg agtgctcatg a 711
<210> 5
<211> 1887
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полинуклеотид»
<400> 5
atggaaacag acaccctgct gctgtgggtg ctgctgctgt gggtgcccgg ctccacaggc 60
gaggtgcagc tgctggaatc cggcggagga ctggtgcagc ctggcggctc cctgagactg 120
tcttgcgccg cctccggctt caccttctcc agctacatca tgatgtgggt gcgacaggcc 180
cctggcaagg gcctggaatg ggtgtcctcc atctacccct ccggcggcat caccttctac 240
gccgacaccg tgaagggccg gttcaccatc tcccgggaca actccaagaa caccctgtac 300
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgcgc ccggatcaag 360
ctgggcaccg tgaccaccgt ggactactgg ggccagggca ccctggtgac agtgtcctcc 420
gctagcacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 480
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 540
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 600
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 660
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagag agttgagccc 720
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 780
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 840
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 900
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 960
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 1020
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 1080
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggaggag 1140
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 1200
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1260
ctggactccg acggctcctt cttcctctat agcaagctca ccgtggacaa gagcaggtgg 1320
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 1380
cagaagagcc tctccctgtc cccgggtgct ggcggcggag gaagcggagg aggtggcagc 1440
ggtggcggtg gctccggcgg aggtggctcc ggaatccctc cccacgtgca gaagtccgtg 1500
aacaacgaca tgatcgtgac cgacaacaac ggcgccgtga agttccctca gctgtgcaag 1560
ttctgcgacg tgaggttcag cacctgcgac aaccagaagt cctgcatgag caactgcagc 1620
atcacaagca tctgcgagaa gccccaggag gtgtgtgtgg ccgtgtggag gaagaacgac 1680
gaaaacatca ccctcgagac cgtgtgccat gaccccaagc tgccctacca cgacttcatc 1740
ctggaagacg ccgcctcccc caagtgcatc atgaaggaga agaagaagcc cggcgagacc 1800
ttcttcatgt gcagctgcag cagcgacgag tgcaatgaca acatcatctt tagcgaggag 1860
tacaacacca gcaaccccga ctgataa 1887
<210> 6
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 6
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 7
<211> 607
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 7
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Met Tyr
20 25 30
Met Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
450 455 460
Ser Gly Gly Gly Gly Ser Gly Ile Pro Pro His Val Gln Lys Ser Val
465 470 475 480
Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro
485 490 495
Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln
500 505 510
Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro
515 520 525
Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr
530 535 540
Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile
545 550 555 560
Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys
565 570 575
Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn
580 585 590
Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
595 600 605
<210> 8
<211> 592
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Met Gly Arg Gly Leu Leu Arg Gly Leu Trp Pro Leu His Ile Val Leu
1 5 10 15
Trp Thr Arg Ile Ala Ser Thr Ile Pro Pro His Val Gln Lys Ser Asp
20 25 30
Val Glu Met Glu Ala Gln Lys Asp Glu Ile Ile Cys Pro Ser Cys Asn
35 40 45
Arg Thr Ala His Pro Leu Arg His Ile Asn Asn Asp Met Ile Val Thr
50 55 60
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
65 70 75 80
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
85 90 95
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
100 105 110
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
115 120 125
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
130 135 140
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
145 150 155 160
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
165 170 175
Glu Tyr Asn Thr Ser Asn Pro Asp Leu Leu Leu Val Ile Phe Gln Val
180 185 190
Thr Gly Ile Ser Leu Leu Pro Pro Leu Gly Val Ala Ile Ser Val Ile
195 200 205
Ile Ile Phe Tyr Cys Tyr Arg Val Asn Arg Gln Gln Lys Leu Ser Ser
210 215 220
Thr Trp Glu Thr Gly Lys Thr Arg Lys Leu Met Glu Phe Ser Glu His
225 230 235 240
Cys Ala Ile Ile Leu Glu Asp Asp Arg Ser Asp Ile Ser Ser Thr Cys
245 250 255
Ala Asn Asn Ile Asn His Asn Thr Glu Leu Leu Pro Ile Glu Leu Asp
260 265 270
Thr Leu Val Gly Lys Gly Arg Phe Ala Glu Val Tyr Lys Ala Lys Leu
275 280 285
Lys Gln Asn Thr Ser Glu Gln Phe Glu Thr Val Ala Val Lys Ile Phe
290 295 300
Pro Tyr Glu Glu Tyr Ala Ser Trp Lys Thr Glu Lys Asp Ile Phe Ser
305 310 315 320
Asp Ile Asn Leu Lys His Glu Asn Ile Leu Gln Phe Leu Thr Ala Glu
325 330 335
Glu Arg Lys Thr Glu Leu Gly Lys Gln Tyr Trp Leu Ile Thr Ala Phe
340 345 350
His Ala Lys Gly Asn Leu Gln Glu Tyr Leu Thr Arg His Val Ile Ser
355 360 365
Trp Glu Asp Leu Arg Lys Leu Gly Ser Ser Leu Ala Arg Gly Ile Ala
370 375 380
His Leu His Ser Asp His Thr Pro Cys Gly Arg Pro Lys Met Pro Ile
385 390 395 400
Val His Arg Asp Leu Lys Ser Ser Asn Ile Leu Val Lys Asn Asp Leu
405 410 415
Thr Cys Cys Leu Cys Asp Phe Gly Leu Ser Leu Arg Leu Asp Pro Thr
420 425 430
Leu Ser Val Asp Asp Leu Ala Asn Ser Gly Gln Val Gly Thr Ala Arg
435 440 445
Tyr Met Ala Pro Glu Val Leu Glu Ser Arg Met Asn Leu Glu Asn Val
450 455 460
Glu Ser Phe Lys Gln Thr Asp Val Tyr Ser Met Ala Leu Val Leu Trp
465 470 475 480
Glu Met Thr Ser Arg Cys Asn Ala Val Gly Glu Val Lys Asp Tyr Glu
485 490 495
Pro Pro Phe Gly Ser Lys Val Arg Glu His Pro Cys Val Glu Ser Met
500 505 510
Lys Asp Asn Val Leu Arg Asp Arg Gly Arg Pro Glu Ile Pro Ser Phe
515 520 525
Trp Leu Asn His Gln Gly Ile Gln Met Val Cys Glu Thr Leu Thr Glu
530 535 540
Cys Trp Asp His Asp Pro Glu Ala Arg Leu Thr Ala Gln Cys Val Ala
545 550 555 560
Glu Arg Phe Ser Glu Leu Glu His Leu Asp Arg Leu Ser Gly Arg Ser
565 570 575
Cys Ser Glu Glu Lys Ile Pro Glu Asp Gly Ser Leu Asn Thr Thr Lys
580 585 590
<210> 9
<211> 567
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Met Gly Arg Gly Leu Leu Arg Gly Leu Trp Pro Leu His Ile Val Leu
1 5 10 15
Trp Thr Arg Ile Ala Ser Thr Ile Pro Pro His Val Gln Lys Ser Val
20 25 30
Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro
35 40 45
Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln
50 55 60
Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro
65 70 75 80
Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr
85 90 95
Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile
100 105 110
Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys
115 120 125
Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn
130 135 140
Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Leu
145 150 155 160
Leu Leu Val Ile Phe Gln Val Thr Gly Ile Ser Leu Leu Pro Pro Leu
165 170 175
Gly Val Ala Ile Ser Val Ile Ile Ile Phe Tyr Cys Tyr Arg Val Asn
180 185 190
Arg Gln Gln Lys Leu Ser Ser Thr Trp Glu Thr Gly Lys Thr Arg Lys
195 200 205
Leu Met Glu Phe Ser Glu His Cys Ala Ile Ile Leu Glu Asp Asp Arg
210 215 220
Ser Asp Ile Ser Ser Thr Cys Ala Asn Asn Ile Asn His Asn Thr Glu
225 230 235 240
Leu Leu Pro Ile Glu Leu Asp Thr Leu Val Gly Lys Gly Arg Phe Ala
245 250 255
Glu Val Tyr Lys Ala Lys Leu Lys Gln Asn Thr Ser Glu Gln Phe Glu
260 265 270
Thr Val Ala Val Lys Ile Phe Pro Tyr Glu Glu Tyr Ala Ser Trp Lys
275 280 285
Thr Glu Lys Asp Ile Phe Ser Asp Ile Asn Leu Lys His Glu Asn Ile
290 295 300
Leu Gln Phe Leu Thr Ala Glu Glu Arg Lys Thr Glu Leu Gly Lys Gln
305 310 315 320
Tyr Trp Leu Ile Thr Ala Phe His Ala Lys Gly Asn Leu Gln Glu Tyr
325 330 335
Leu Thr Arg His Val Ile Ser Trp Glu Asp Leu Arg Lys Leu Gly Ser
340 345 350
Ser Leu Ala Arg Gly Ile Ala His Leu His Ser Asp His Thr Pro Cys
355 360 365
Gly Arg Pro Lys Met Pro Ile Val His Arg Asp Leu Lys Ser Ser Asn
370 375 380
Ile Leu Val Lys Asn Asp Leu Thr Cys Cys Leu Cys Asp Phe Gly Leu
385 390 395 400
Ser Leu Arg Leu Asp Pro Thr Leu Ser Val Asp Asp Leu Ala Asn Ser
405 410 415
Gly Gln Val Gly Thr Ala Arg Tyr Met Ala Pro Glu Val Leu Glu Ser
420 425 430
Arg Met Asn Leu Glu Asn Val Glu Ser Phe Lys Gln Thr Asp Val Tyr
435 440 445
Ser Met Ala Leu Val Leu Trp Glu Met Thr Ser Arg Cys Asn Ala Val
450 455 460
Gly Glu Val Lys Asp Tyr Glu Pro Pro Phe Gly Ser Lys Val Arg Glu
465 470 475 480
His Pro Cys Val Glu Ser Met Lys Asp Asn Val Leu Arg Asp Arg Gly
485 490 495
Arg Pro Glu Ile Pro Ser Phe Trp Leu Asn His Gln Gly Ile Gln Met
500 505 510
Val Cys Glu Thr Leu Thr Glu Cys Trp Asp His Asp Pro Glu Ala Arg
515 520 525
Leu Thr Ala Gln Cys Val Ala Glu Arg Phe Ser Glu Leu Glu His Leu
530 535 540
Asp Arg Leu Ser Gly Arg Ser Cys Ser Glu Glu Lys Ile Pro Glu Asp
545 550 555 560
Gly Ser Leu Asn Thr Thr Lys
565
<210> 10
<211> 136
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp
130 135
<210> 11
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 11
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly
20
<210> 12
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 13
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 14
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 15
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 15
Gln Phe Asn Ser
1
<210> 16
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 16
Gln Ala Gln Ser
1
<210> 17
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223>/примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 17
Pro Lys Ser Cys Asp Lys
1 5
<210> 18
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 18
Pro Lys Ser Ser Asp Lys
1 5
<210> 19
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 19
Leu Ser Leu Ser
1
<210> 20
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 20
Ala Thr Ala Thr
1
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<220>
<221> ВАРИАНТ
<222> (1)..(1)
<223> /замена="Arg" или "Thr" или "Gln" или "Gly" или "Ala" or
"Trp" или "Met" или "Ile" или "Ser"
<220>
<221> ВАРИАНТ
<222> (3)..(3)
<223> /замена="Arg" или "Lys" или "Leu" или "Met" или "Ile"
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /замена="Thr" или "Asn" или "Gln" или "Ala" или "Val" or
"Tyr" или "Trp" или "Phe" или "Met"
<220>
<221> дополнительный признак
<222> (1)..(5)
<223> /примечание=«варианты остатков, приведенные в последовательности, не являются
предпочтительными относительно указанных в аннотациях к вариантам положений»
<400> 21
Lys Tyr Val Met His
1 5
<210> 22
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Ile"
<220>
<221> ВАРИАНТ
<222> (14)..(14)
<223> /замена="Thr"
<220>
<221> дополнительный признак
<222> (1)..(17)
<223> /примечание=«варианты остатков, приведенные в последовательности, не являются
предпочтительными относительно указанных в аннотациях к вариантам положений»
<400> 22
Ser Ile Tyr Pro Ser Gly Gly Phe Thr Phe Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 23
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Asp"
<220>
<221> дополнительный признак
<222> (1)..(11)
<223> /примечание=«варианты остатков, приведенные в последовательности, не являются
предпочтительными относительно указанных в аннотациях к вариантам положений»
<400> 23
Ile Lys Leu Gly Thr Val Thr Thr Val Glu Tyr
1 5 10
<210> 24
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 24
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 25
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 25
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
1 5 10
<210> 26
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 26
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 27
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 27
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 28
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Ser"
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /замена="Arg" или "Ser"
<220>
<221> ВАРИАНТ
<222> (9)..(9)
<223> /замена="Gly"
<220>
<221> дополнительный признак
<222> (1)..(14)
<223> /примечание=«варианты остатков, приведенные в последовательности, не являются
предпочтительными относительно указанных в аннотациях к вариантам положений»
<400> 28
Thr Gly Thr Asn Thr Asp Val Gly Ala Tyr Asn Tyr Val Ser
1 5 10
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<220>
<221> ВАРИАНТ
<222> (1)..(1)
<223> /замена="Asp"
<220>
<221> ВАРИАНТ
<222> (3)..(3)
<223> /замена="Asn" или "Ser"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="His" или "Asn"
<220>
<221> дополнительный признак
<222> (1)..(7)
<223> /примечание=«варианты остатков, приведенные в последовательности, не являются
предпочтительными относительно указанных в аннотациях к вариантам положений»
<400> 29
Glu Val Ile Asp Arg Pro Ser
1 5
<210> 30
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<220>
<221> ВАРИАНТ
<222> (3)..(3)
<223> /замена="Tyr"
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /замена="Ser"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Thr" или "Ser"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /замена="Ser"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Thr"
<220>
<221> дополнительный признак
<222> (1)..(10)
<223> /примечание=«варианты остатков, приведенные в последовательности, не являются
предпочтительными относительно указанных в аннотациях к вариантам положений»
<400> 30
Ser Ser Phe Thr Asn Arg Gly Ile Arg Val
1 5 10
<210> 31
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 31
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys
20
10> 32
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 32
Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu Met Ile Tyr
1 5 10 15
<210> 33
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 33
Gly Val Ser Asn Arg Phe Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser
1 5 10 15
Leu Thr Ile Ser Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys
20 25 30
<210> 34
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 34
Phe Gly Thr Gly Thr Lys Val Thr Val Leu
1 5 10
<210> 35
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 35
Ser Tyr Ile Met Met
1 5
<210> 36
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> / примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 36
Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Thr Val Lys
1 5 10 15
Gly
<210> 37
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 37
Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr
1 5 10
<210> 38
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 38
Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Tyr Val Ser
1 5 10
<210> 39
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 39
Asp Val Ser Asn Arg Pro Ser
1 5
<210> 40
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 40
Ser Ser Tyr Thr Ser Ser Ser Thr Arg Val
1 5 10
<210> 41
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 41
Met Tyr Met Met Met
1 5
<210> 42
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»<400> 42
Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 43
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 43
Thr Gly Thr Ser Ser Asp Val Gly Ala Tyr Asn Tyr Val Ser
1 5 10
<210> 44
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 44
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Met Val Trp Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Trp Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 45
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 45
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 46
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 46
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Met Tyr
20 25 30
Met Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Val Trp
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 47
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 47
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Ala Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 48
<211> 1407
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полинуклеотид из библиотеки человеческих Fab»
<400> 48
atggagttgc ctgttaggct gttggtgctg atgttctgga ttcctgctag ctccagcgag 60
gtgcagctgc tggaatccgg cggaggactg gtgcagcctg gcggctccct gagactgtct 120
tgcgccgcct ccggcttcac cttctccagc tacatcatga tgtgggtgcg acaggcccct 180
ggcaagggcc tggaatgggt gtcctccatc tacccctccg gcggcatcac cttctacgcc 240
gacaccgtga agggccggtt caccatctcc cgggacaact ccaagaacac cctgtacctg 300
cagatgaact ccctgcgggc cgaggacacc gccgtgtact actgcgcccg gatcaagctg 360
ggcaccgtga ccaccgtgga ctactggggc cagggcaccc tggtgacagt gtcctccgcc 420
tccaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc 480
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg 540
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga 600
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac 660
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagaaagt tgagcccaaa 720
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct ggggggaccg 780
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 840
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 900
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 960
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1020
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa 1080
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcacg ggatgagctg 1140
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc 1200
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1260
gactccgacg gctccttctt cctctatagc aagctcaccg tggacaagag caggtggcag 1320
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1380
aagagcctct ccctgtcccc gggtaaa 1407
<210> 49
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> / примечание=«Описание искусственной последовательности: синтетический
полинуклеотид из библиотеки человеческих Fab»
<400> 49
atggagttgc ctgttaggct gttggtgctg atgttctgga ttcctgcttc cttaagccag 60
tccgccctga cccagcctgc ctccgtgtct ggctcccctg gccagtccat caccatcagc 120
tgcaccggca cctccagcga cgtgggcggc tacaactacg tgtcctggta tcagcagcac 180
cccggcaagg cccccaagct gatgatctac gacgtgtcca accggccctc cggcgtgtcc 240
aacagattct ccggctccaa gtccggcaac accgcctccc tgaccatcag cggactgcag 300
gcagaggacg aggccgacta ctactgctcc tcctacacct cctccagcac cagagtgttc 360
ggcaccggca caaaagtgac cgtgctgggc cagcccaagg ccaacccaac cgtgacactg 420
ttccccccat cctccgagga actgcaggcc aacaaggcca ccctggtctg cctgatctca 480
gatttctatc caggcgccgt gaccgtggcc tggaaggctg atggctcccc agtgaaggcc 540
ggcgtggaaa ccaccaagcc ctccaagcag tccaacaaca aatacgccgc ctcctcctac 600
ctgtccctga cccccgagca gtggaagtcc caccggtcct acagctgcca ggtcacacac 660
gagggctcca ccgtggaaaa gaccgtcgcc cccaccgagt gctca 705
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
| СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ РЕЦЕПТОР TGF-БЕТА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2776204C1 |
| СЛИТЫЕ БЕЛКИ С АЛЬБУМИН-СВЯЗЫВАЮЩИМИ ДОМЕНАМИ | 2018 |
|
RU2786444C2 |
| МОНОСПЕЦИФИЧЕСКИЕ И БИСПЕЦИФИЧЕСКИЕ БЕЛКИ С РЕГУЛИРОВАНИЕМ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2793167C2 |
| АНТИ-PD-L1 АНТИТЕЛО ДЛЯ ДЕТЕКЦИИ PD-L1 | 2018 |
|
RU2758723C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СЛИТОГО БЕЛКА РЕЦЕПТОРА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА БЕТА И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2791683C2 |
| БЕЛКИ УПРАВЛЕНИЯ, НАВИГАЦИИ И КОНТРОЛЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2811457C2 |
| АНТИ-PD-L1 АНТИТЕЛА | 2015 |
|
RU2722212C2 |
| АНТИ-GDF15 АНТИТЕЛА, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2795457C2 |
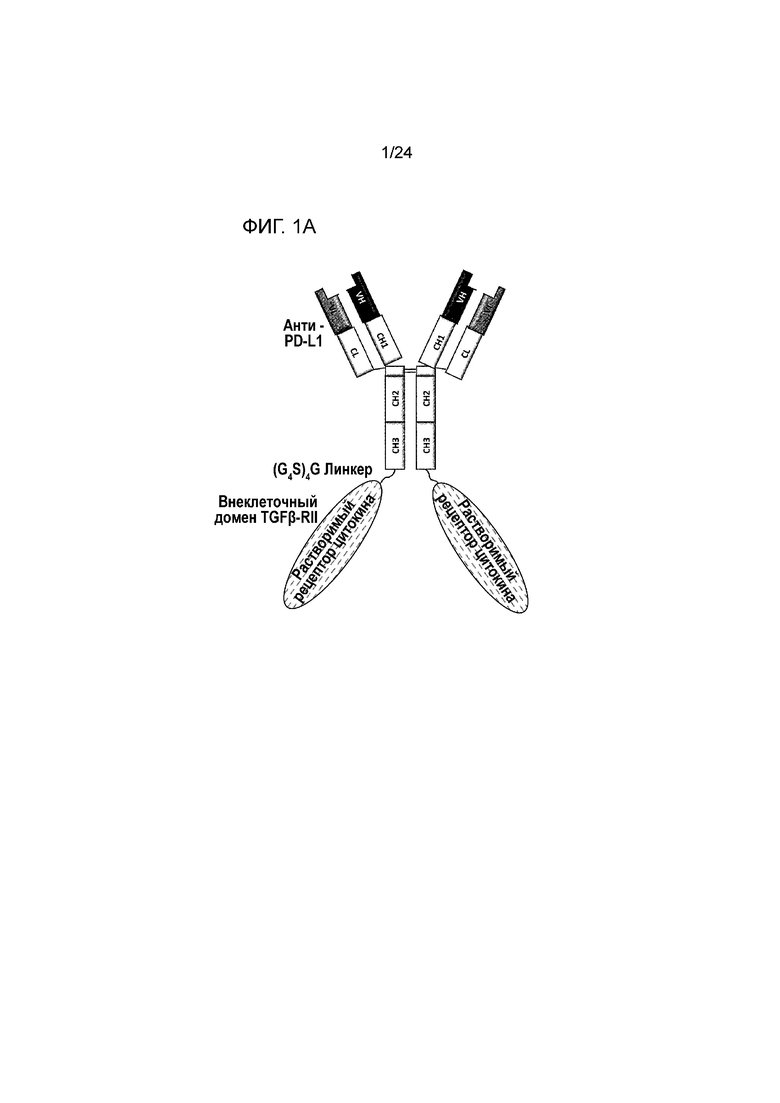

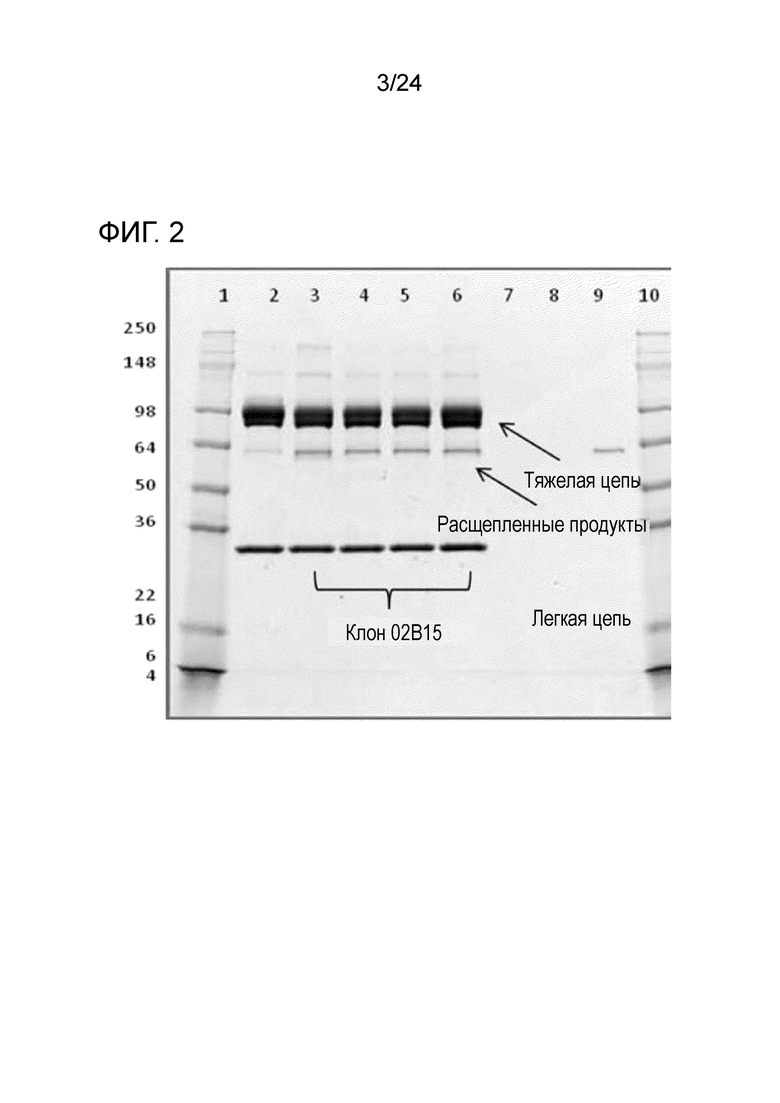
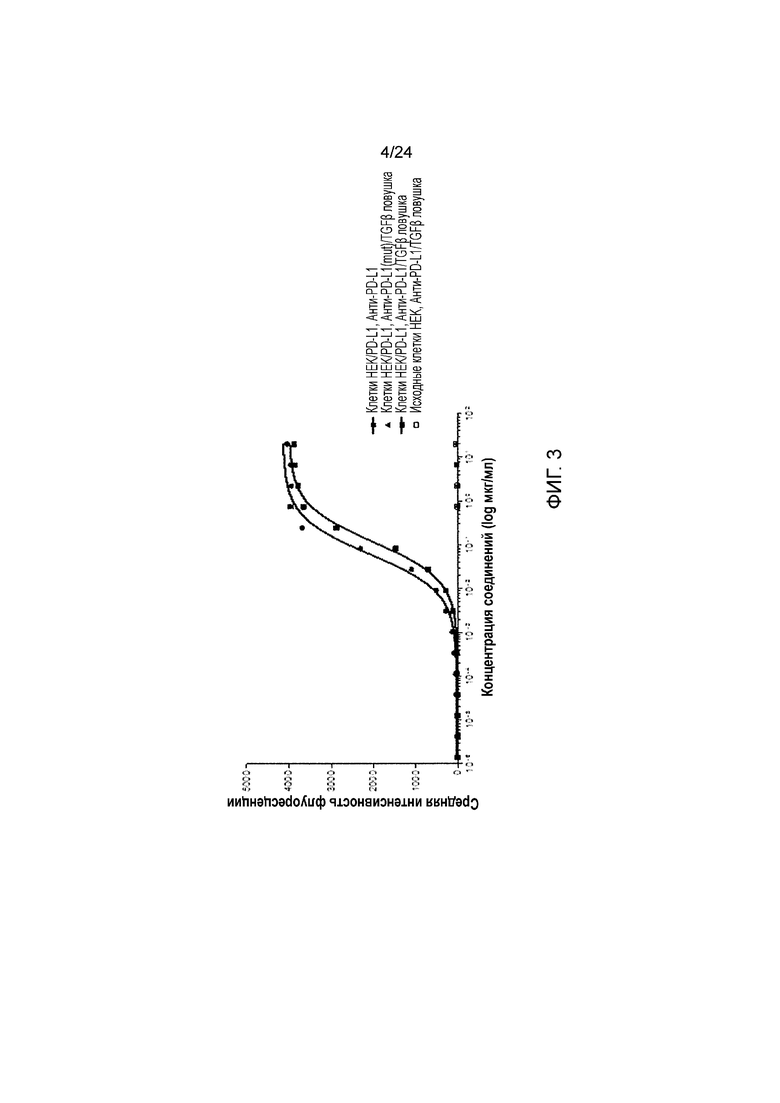
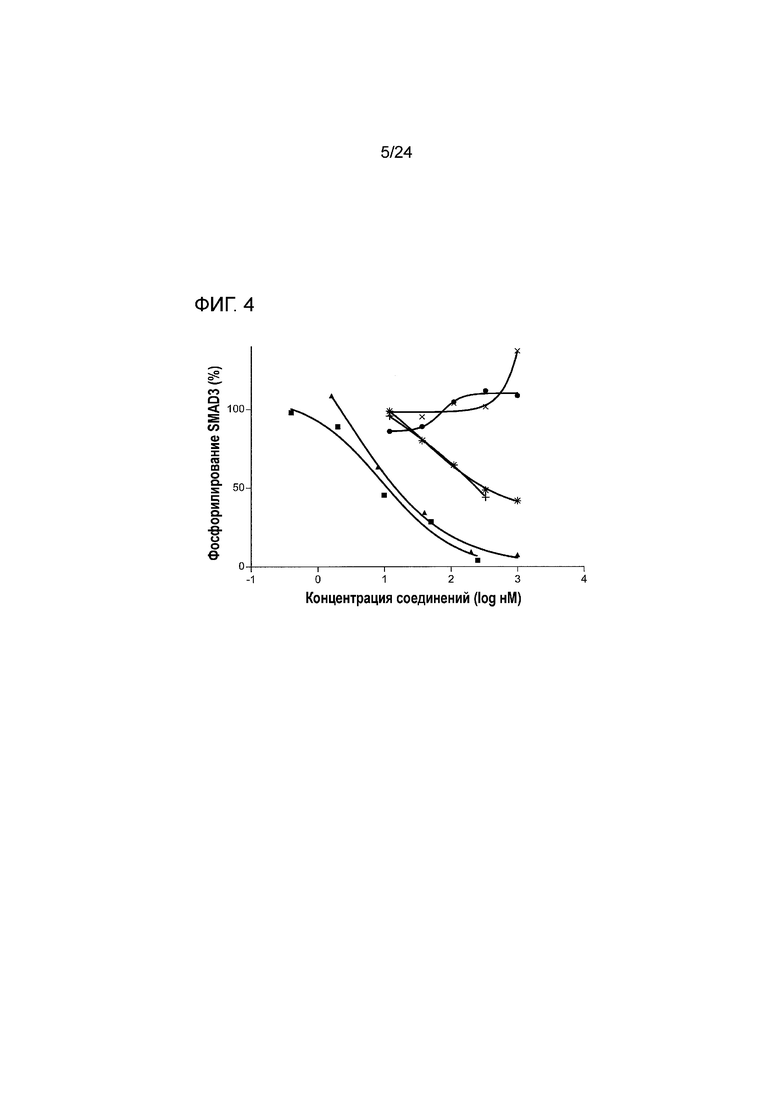
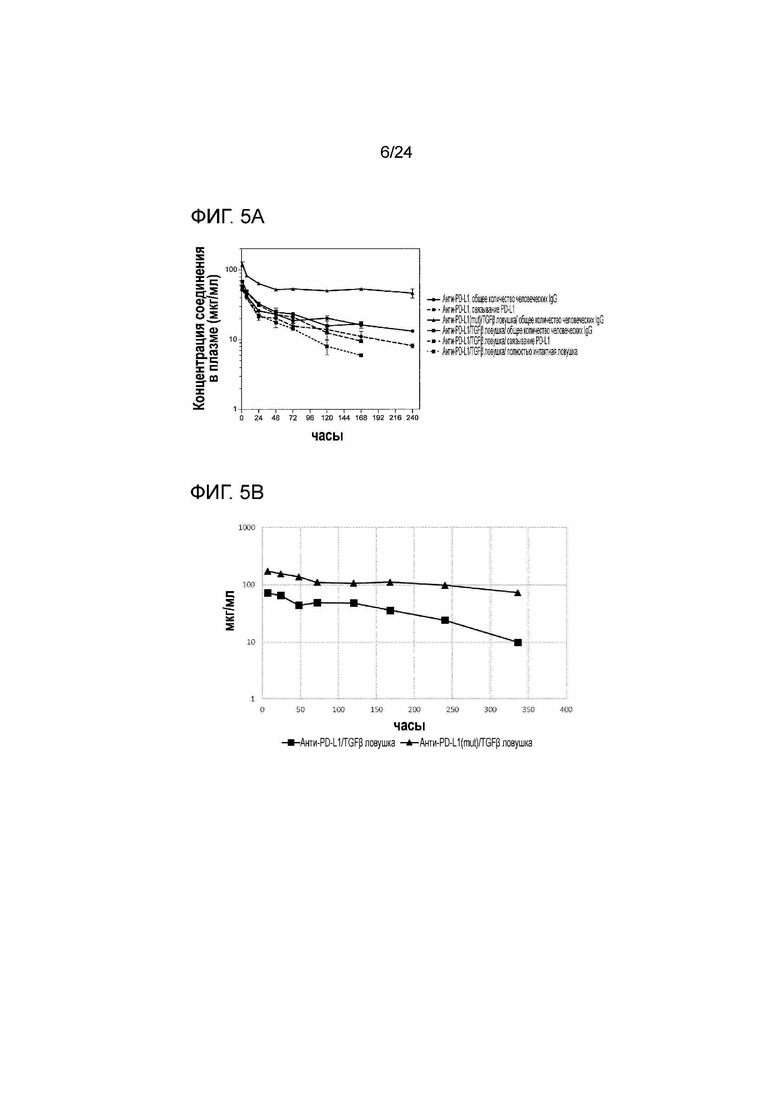
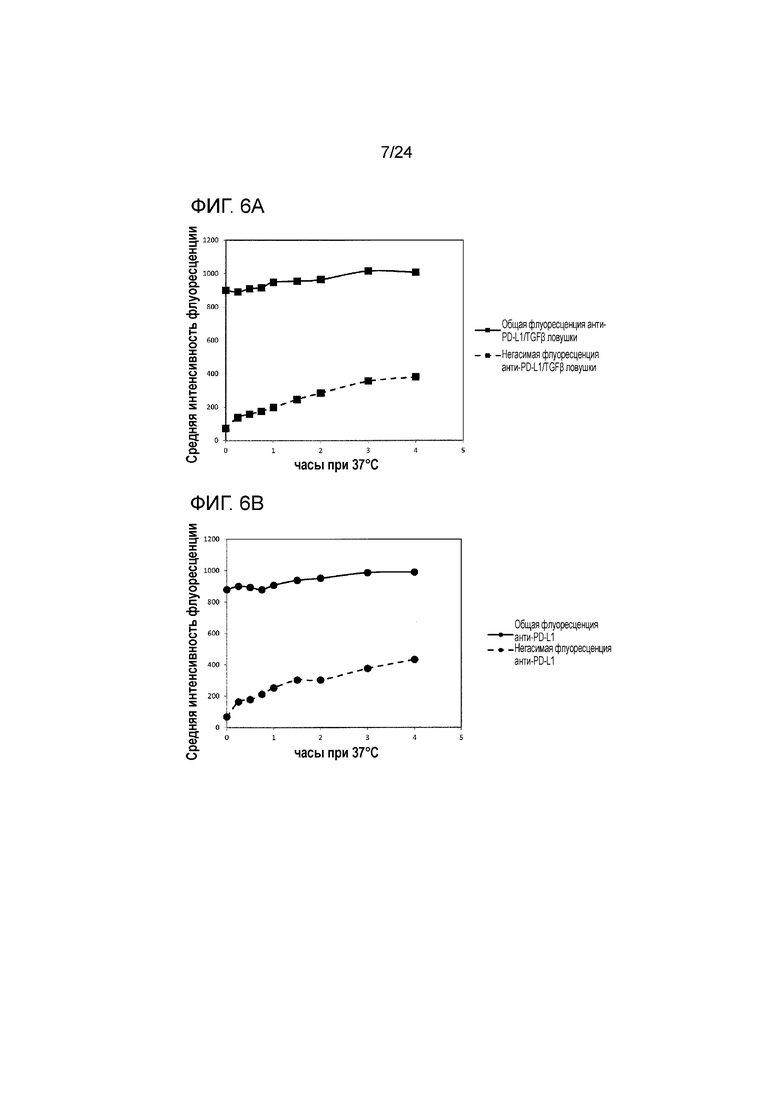
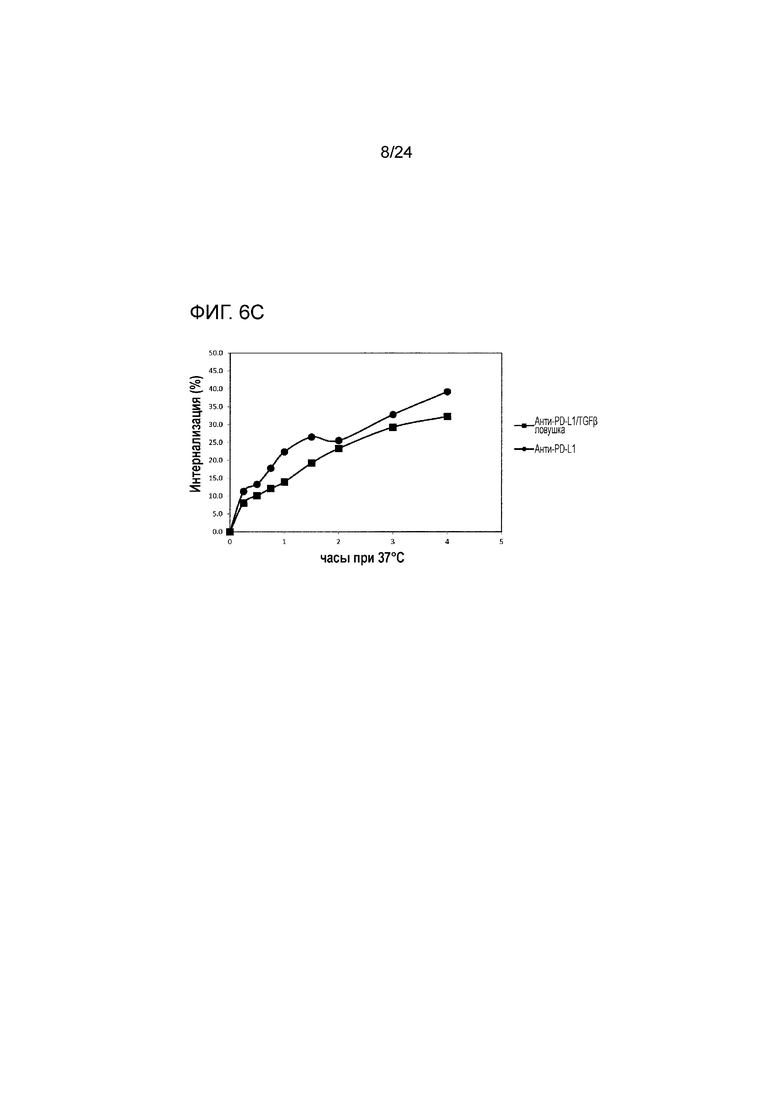
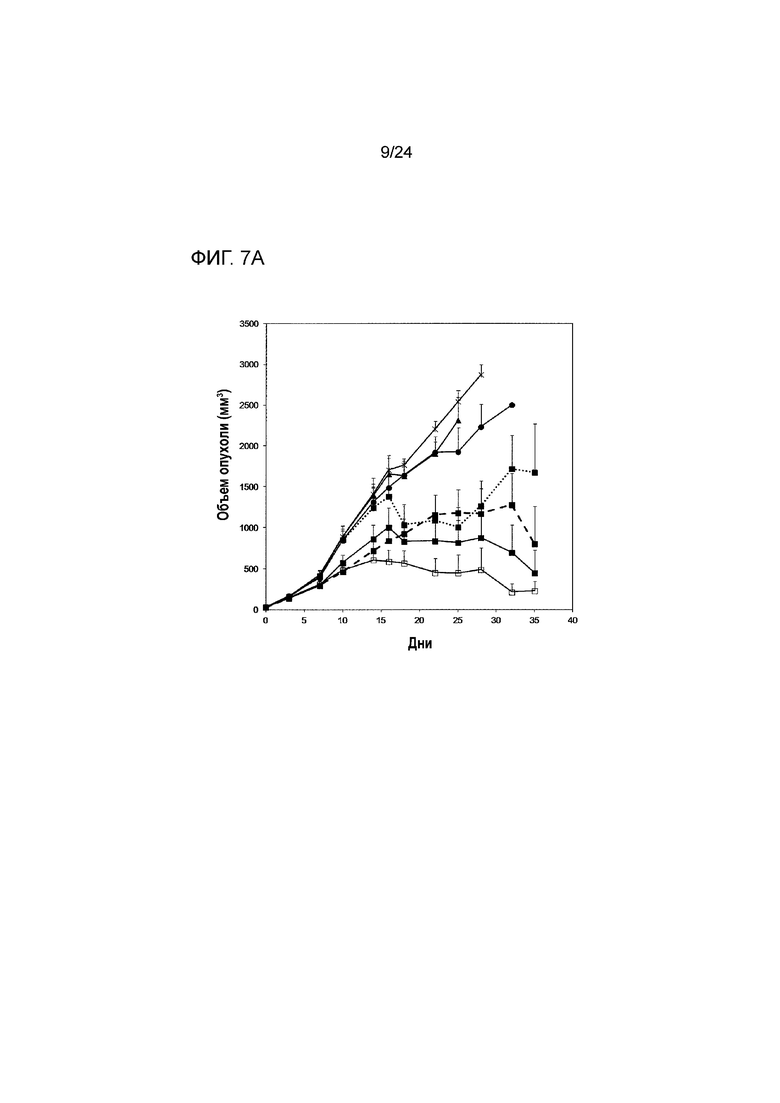
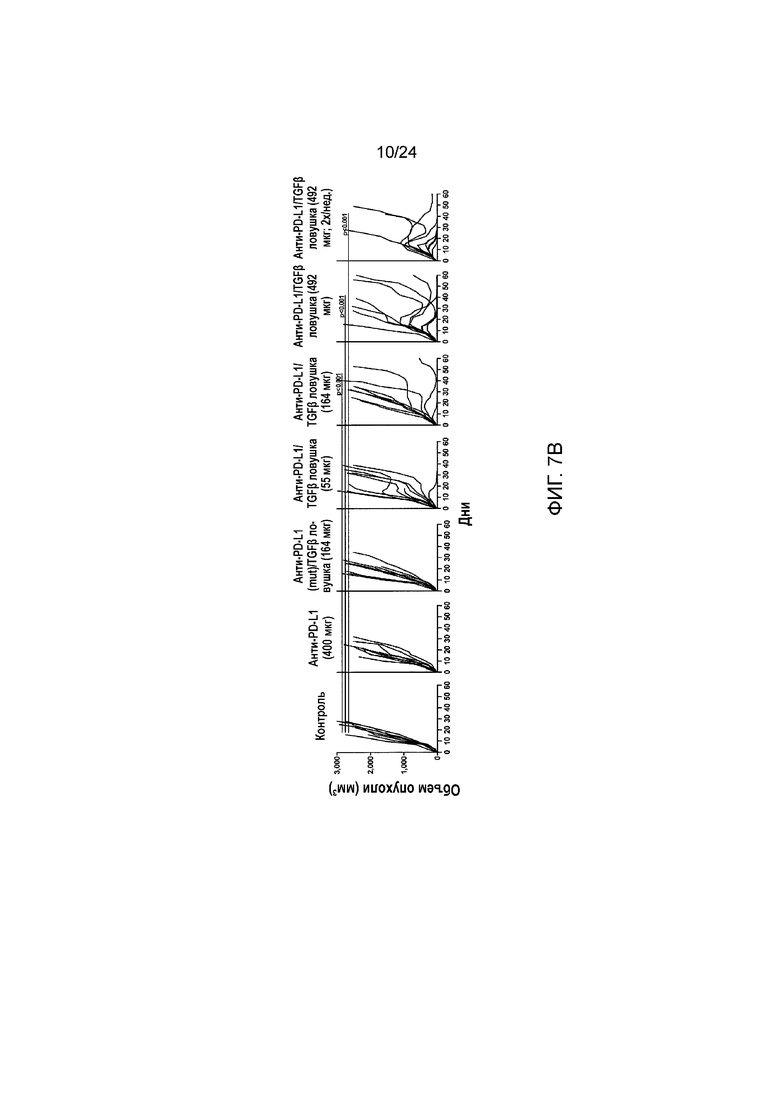
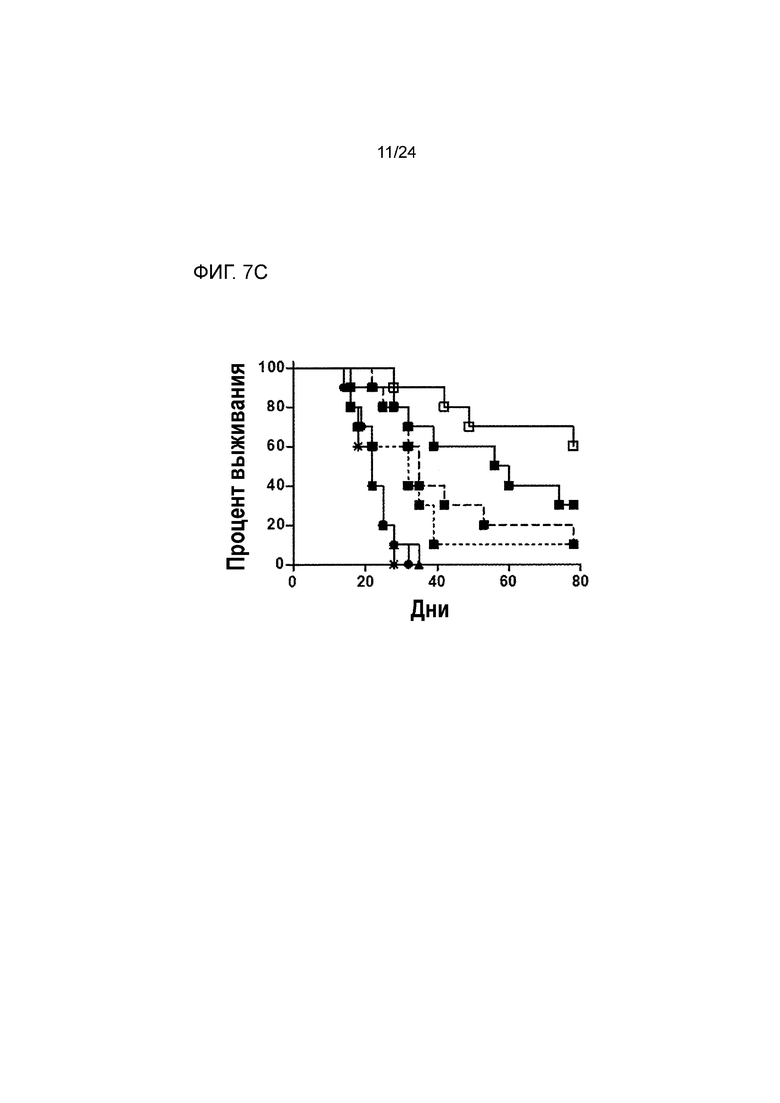
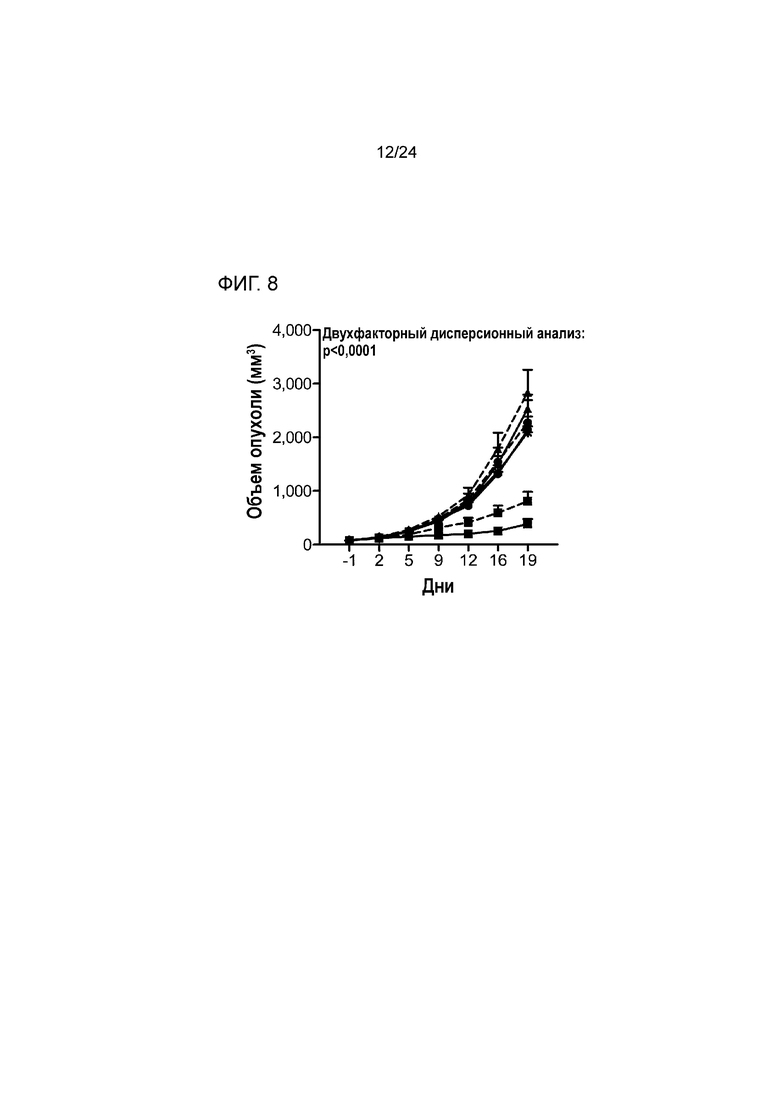
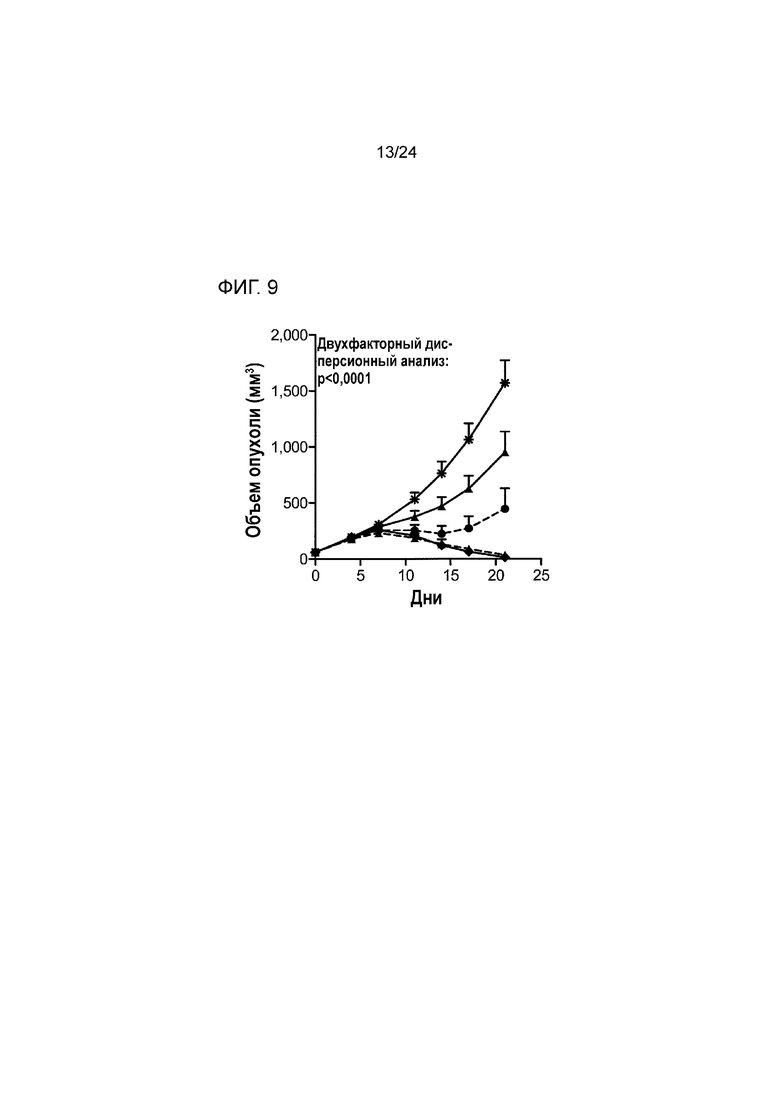
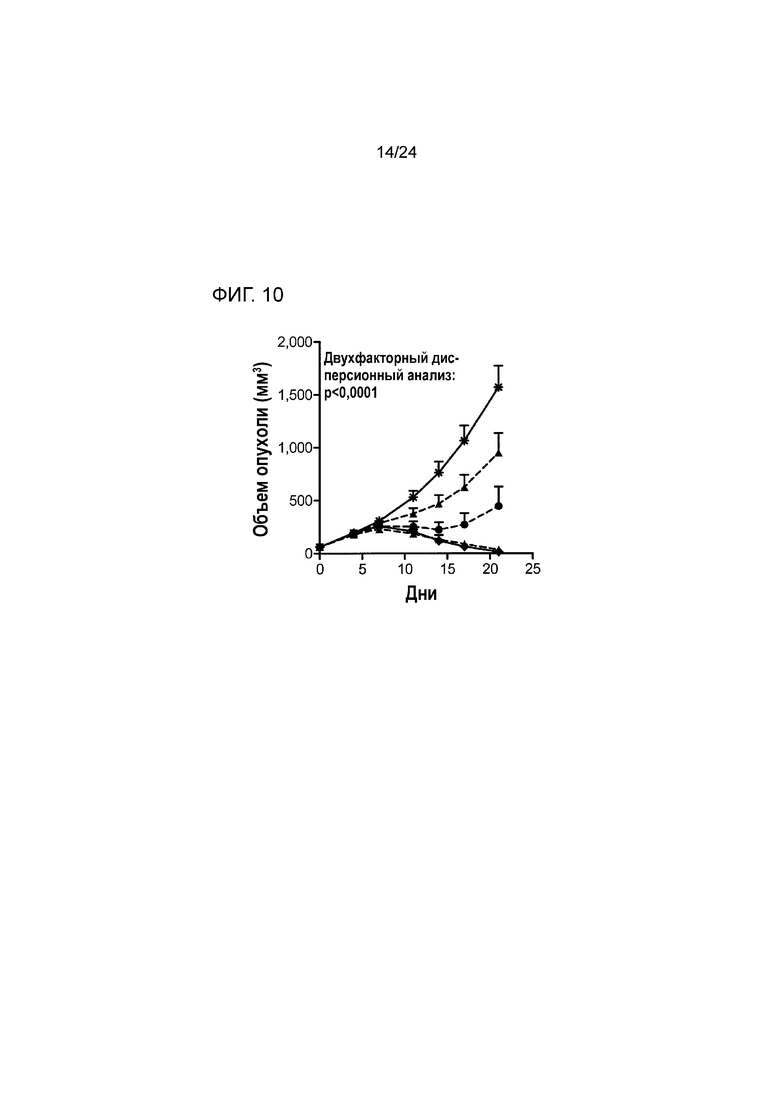
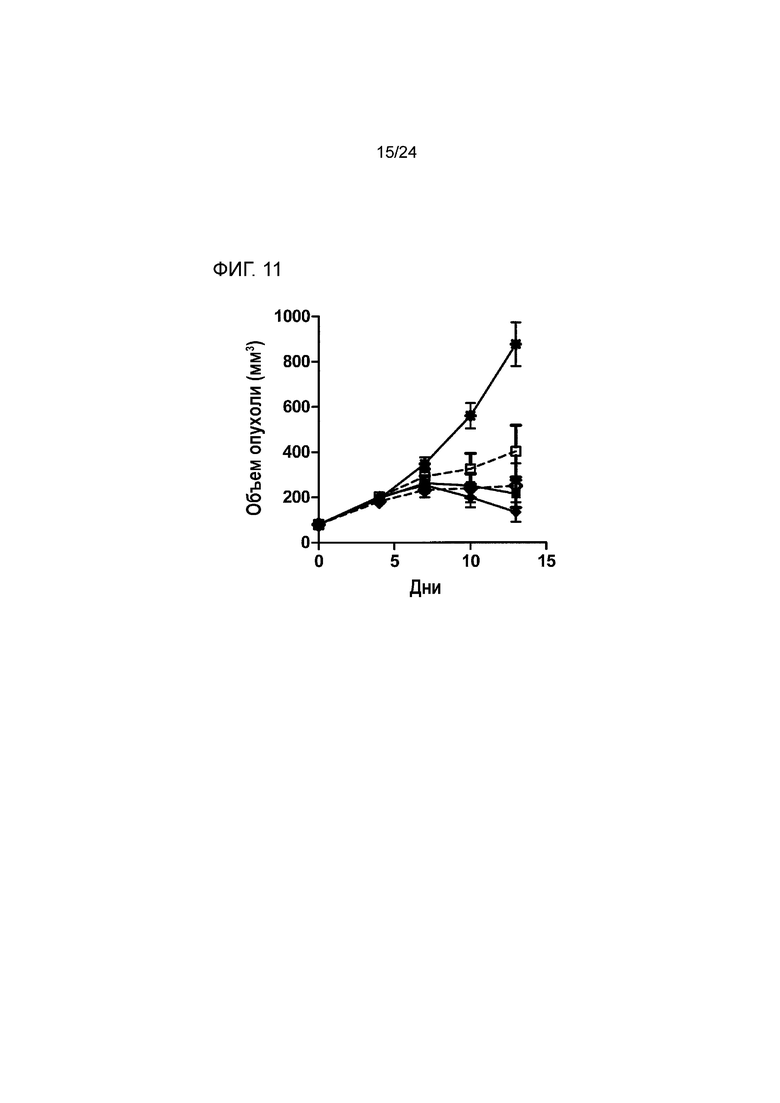
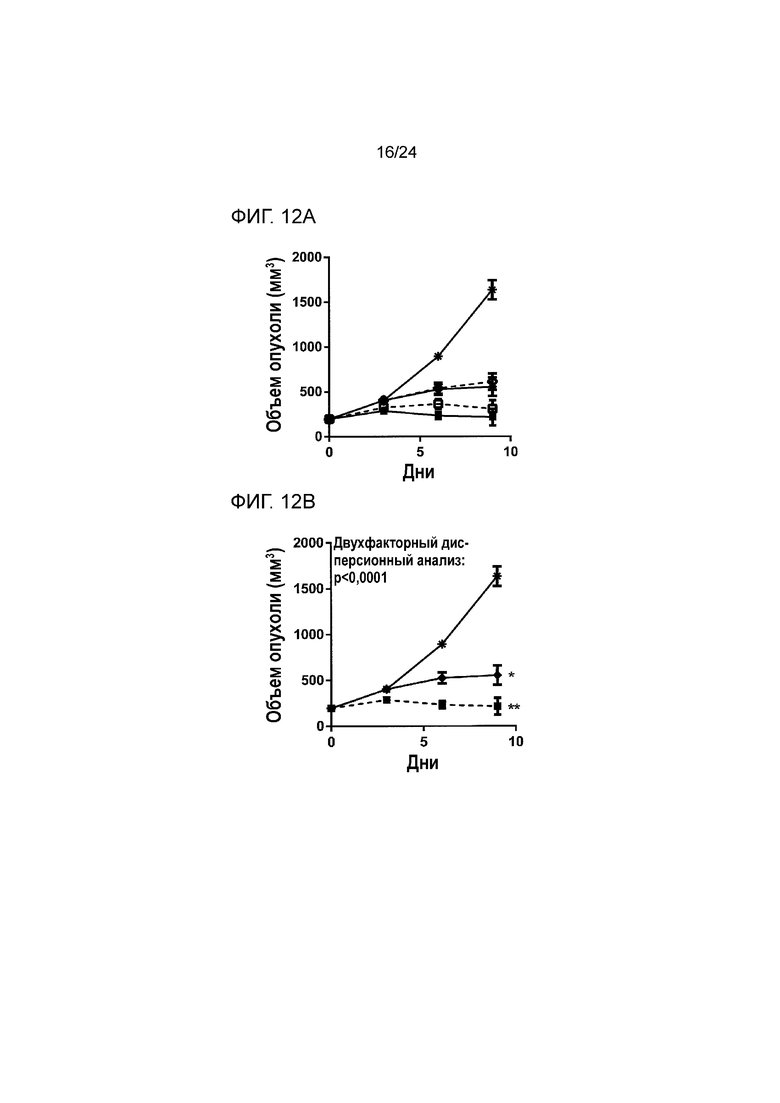
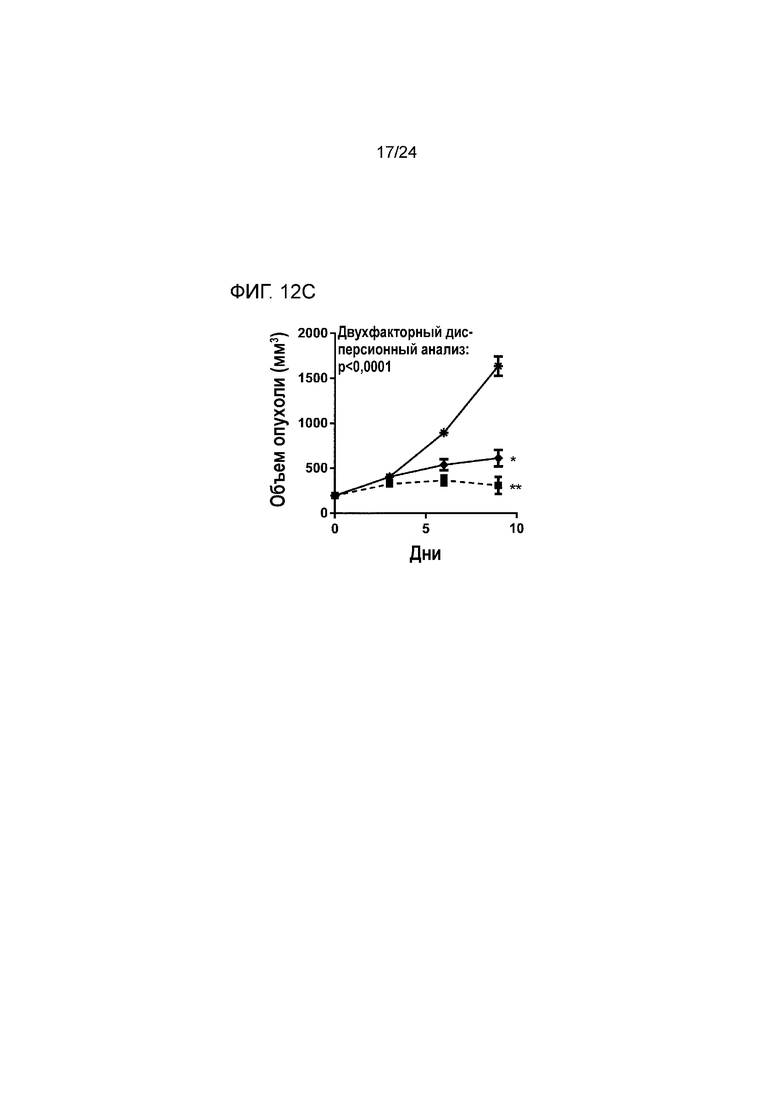
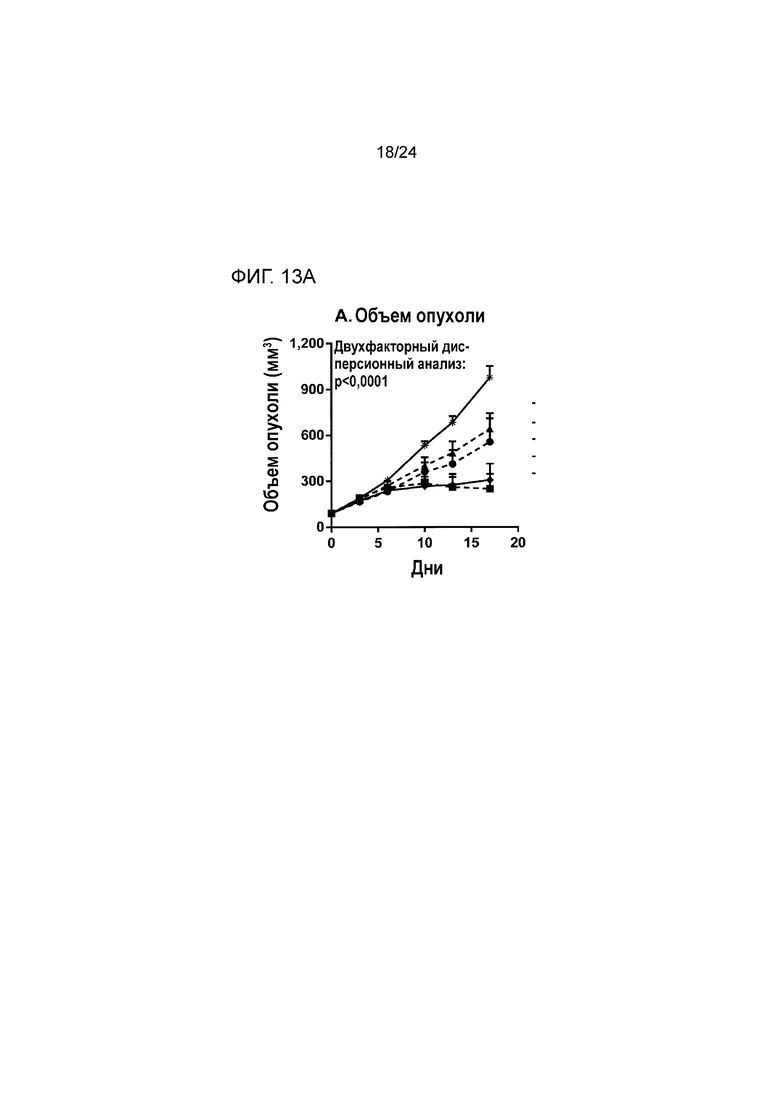
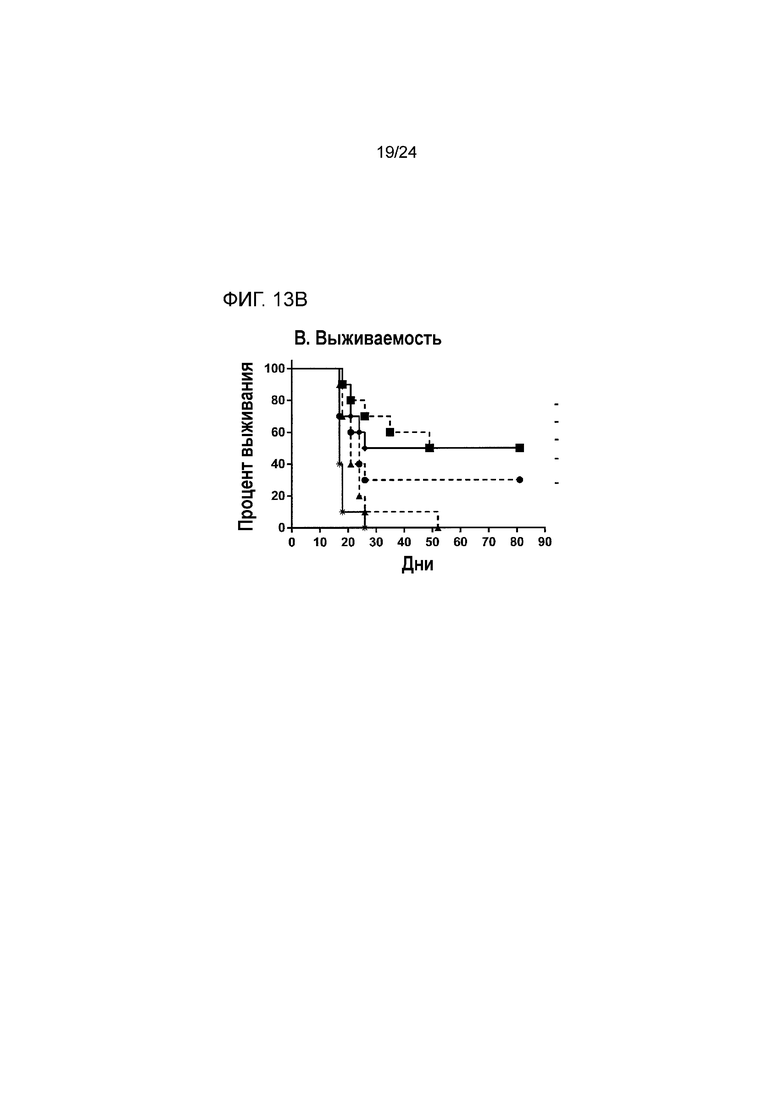
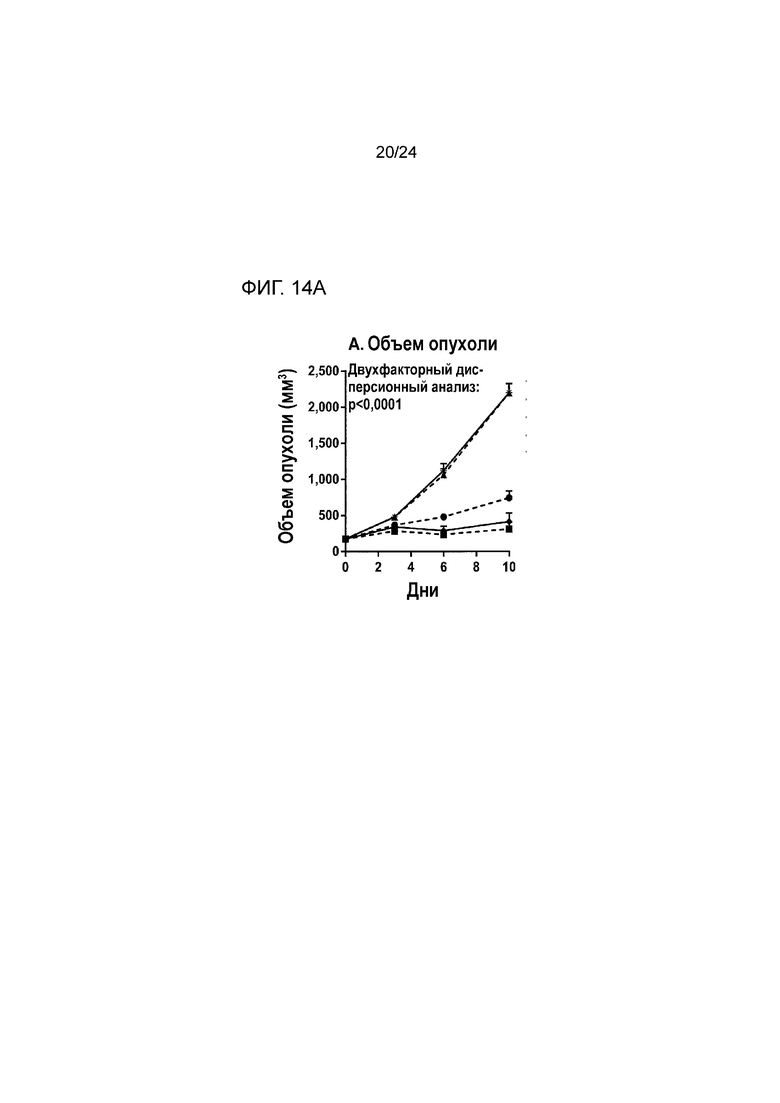
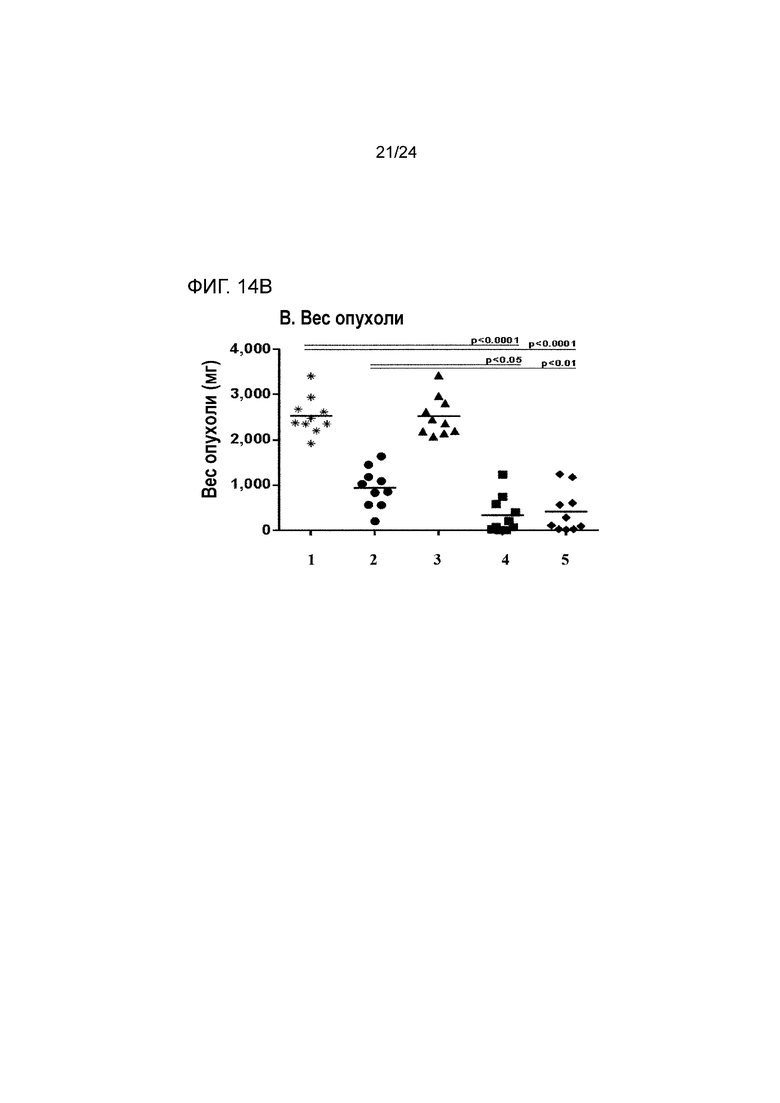
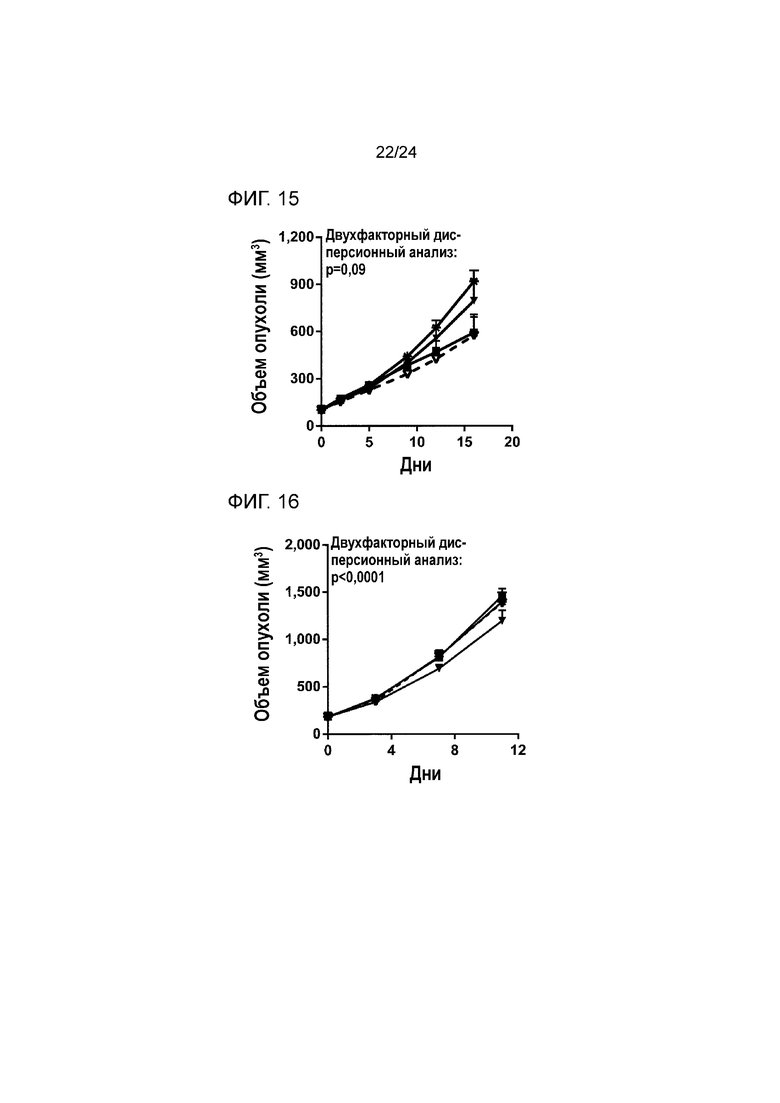
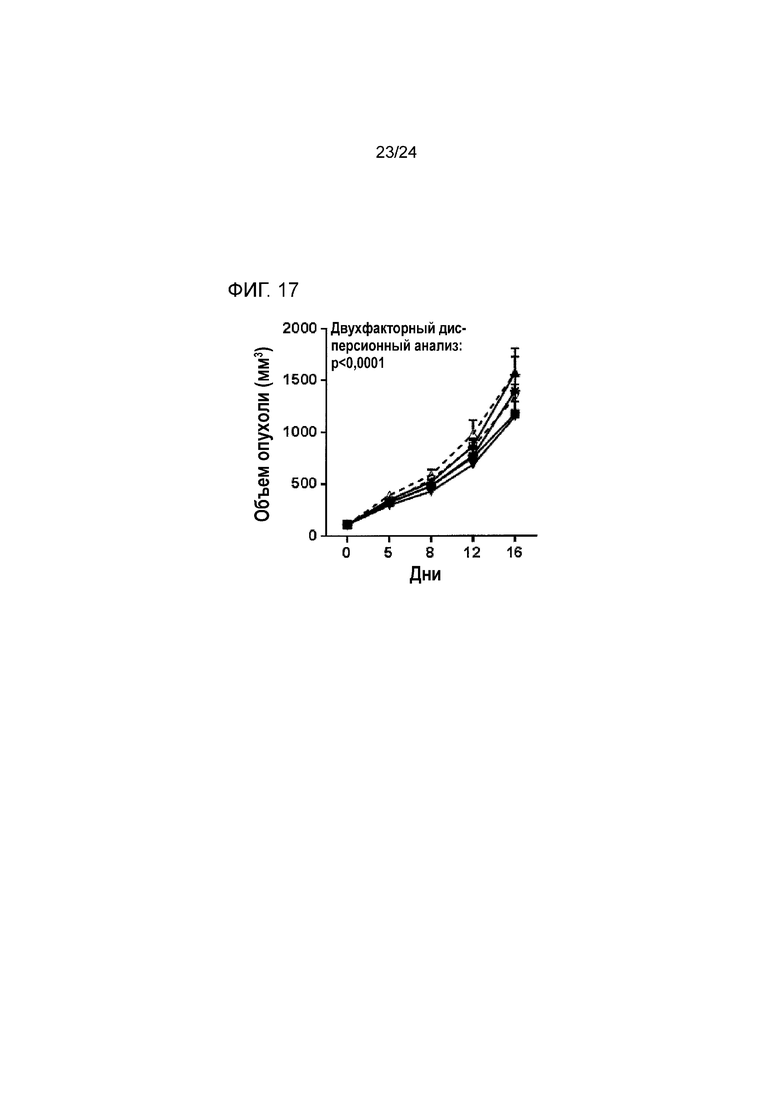
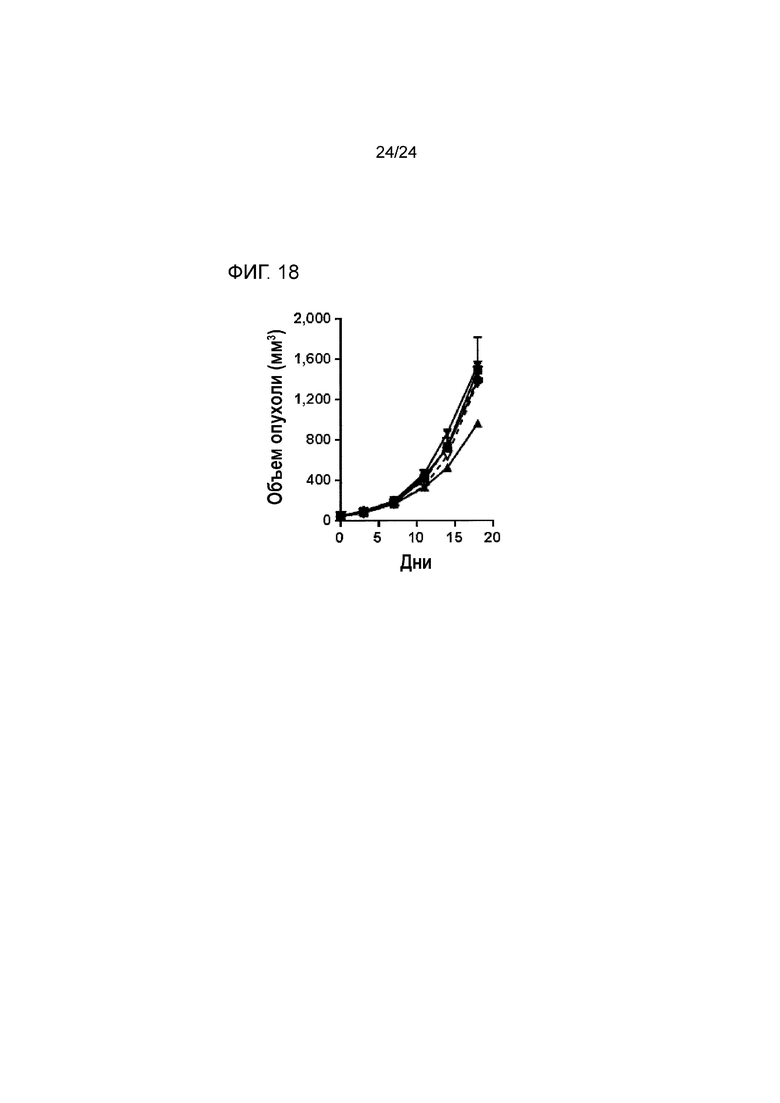
Настоящее изобретение относится к белку, содержащему первый полипептид, который связывает человеческий белок лиганд программируемой смерти 1 (PD-L1) и способный связывать TGFβ и второй полипептид, содержащий по меньшей мере вариабельный домен легкой цепи антитела, который связывает PD-L1, где тяжелая цепь первого полипептида и легкая цепь второго полипептида при комбинировании образует антигенсвязывающий сайт, который связывает PD-L1, а также к молекуле нуклеиновой кислоты, кодирующей вышеуказанный белок, к выделенной клетке, содержащей молекулу нуклеиновой кислоты, для применения при получении белка, к способу получения белка, к фармацевтической композиции для лечения опухоли или рака, к применению белка при производстве лекарственного средства для ингибирования роста опухоли у пациента или для лечения рака у пациента, к способу ингибирования роста опухоли у пациента и к способу лечения рака у пациента. 9 н. и 8 з.п. ф-лы, 1 табл., 18 пр., 18 ил.
1. Белок, содержащий:
первый полипептид, содержащий
a) по меньшей мере вариабельный домен тяжелой цепи антитела, который связывает человеческий белок лиганд программируемой смерти 1 (PD-L1); и
b) человеческий рецептор трансформирующего фактора роста β типа 2 (TGFβRII) или его фрагмент, способный связывать TGFβ, и
второй полипептид, содержащий по меньшей мере вариабельный домен легкой цепи антитела, который связывает PD-L1,
где первый полипептид содержит аминокислотную последовательность SEQ ID NO: 3,
где второй полипептид содержит аминокислотную последовательность SEQ ID NO:1, и
где тяжелая цепь первого полипептида и легкая цепь второго полипептида при комбинировании образует антигенсвязывающий сайт, который связывает PD-L1.
2. Белок по п. 1, содержащий два полипептида, каждый из которых имеет аминокислотную последовательность, состоящую из аминокислотной последовательности SEQ ID NO: 3, и два дополнительного полипептида, каждый из которых имеет аминокислотную последовательность, состоящую из аминокислотной последовательности SEQ ID NO: 1.
3. Молекула нуклеиновой кислоты, кодирующая белок по п. 1, содержащая первую нуклеотидную последовательность, кодирующую первый полипептид белка по п. 1, и вторую нуклеотидную последовательность, кодирующую второй полипептид белка по п. 1.
4. Выделенная клетка, содержащая молекулу нуклеиновой кислоты по п. 3, для применения при получении белка по п. 1.
5. Способ получения белка, включающего а) TGFβRII или его фрагмент, способный связывать TGFβ, и b) антитело или его антигенсвязывающий фрагмент, связывающий человеческий белок лиганд программируемой смерти 1 (PD-L1), при этом способ включает поддержание клетки по п. 4 в условиях, обеспечивающих экспрессию белка.
6. Способ по п. 5, дополнительно включающий сбор белка.
7. Белок по п. 1 или 2 для применения в терапии.
8. Фармацевтическая композиция для лечения опухоли или рака, содержащая терапевтически эффективное количество белка по п. 1 или 2.
9. Применение белка по п. 1 или 2 при производстве лекарственного средства для ингибирования роста опухоли у пациента.
10. Применение белка по п. 1 или 2 при производстве лекарственного средства для лечения рака у пациента.
11. Применение по п. 9 или 10, дополнительно включающее обработку пациента излучением и/или введение химиотерапевтического средства.
12. Применение по любому из пп. 9-11, где опухоль или рак выбран из группы, состоящей из колоректального рака, рака молочной железы, яичников, поджелудочной железы, желудка, простаты, почек, шейки матки, миеломы, лимфомы, лейкемии, рака щитовидной железы, эндометрия, матки, мочевого пузыря, нейроэндокринной опухоли, рака головы и шеи, печени, носоглотки, семенников, мелкоклеточного рака легких, немелкоклеточного рака легких, меланомы, базальноклеточного рака кожи, плоскоклеточного рака кожи, выбухающей дерматофибросаркомы, карциномы из клеток Меркеля, глиобластомы, глиомы, саркомы, мезотелиомы и миелодиспластических синдромов.
13. Белок по п. 1 или 2, где белок блокирует взаимодействие между человеческим PD-L1 и человеческим PD-1 рецептором.
14. Способ ингибирования роста опухоли у пациента, где способ включает воздействие на опухоль белком по п. 1 или 2.
15. Способ лечения рака у пациента, где способ включает введение пациенту белка по п. 1 или 2.
16. Способ по п. 14 или 15, дополнительно включающий воздействие на пациента излучением и/или введение химиотерапевтического средства.
17. Способ по любому из пп. 14-16, где опухоль или рак выбран из группы, состоящей из колоректального рака, рака молочной железы, яичников, поджелудочной железы, желудка, простаты, почек, шейки матки, миеломы, лимфомы, лейкемии, рака щитовидной железы, эндометрия, матки, мочевого пузыря, нейроэндокринной опухоли, рака головы и шеи, печени, носоглотки, семенников, мелкоклеточного рака легких, немелкоклеточного рака легких, меланомы, базальноклеточного рака кожи, плоскоклеточного рака кожи, выбухающей дерматофибросаркомы, карциномы из клеток Меркеля, глиобластомы, глиомы, саркомы, мезотелиомы и миелодиспластических синдромов.
| WO 2011109789 A2, 09.09.2011 | |||
| WO 2011109789 A2, 09.09.2011 | |||
| WO 2010077634 A1, 08.07.2010 | |||
| СИНГЕР М | |||
| и др., Гены и геномы, "Мир", 1998, том 1 | |||
| RUDIKOFF S | |||
| et al., Single amino acid substitution altering antigen-binding specificity, Proceedings of the National Academy of Sciences, 1982, Т.79, N6, pp.1979-1983 | |||
| GANSS R | |||
| et al., Tumor |
Авторы
Даты
2021-07-28—Публикация
2015-02-10—Подача