Группа изобретений, связанных единым изобретательским замыслом, относится к области медицинской микробиологии, в частности, к лабораторной диагностике возбудителей инфекционных заболеваний и может быть использована для ускоренной диагностики коклюша и коклюшеподобных заболеваний.
Несмотря на более чем 50-летнюю успешную массовую вакцинопрофилактику, коклюш до сих пор остается проблемой общественного здравоохранения: регистрируется высокая заболеваемость среди детей до 1 года и локальные вспышки с формированием очагов разной интенсивности в организованных детских коллективах [1, 2, 3]. Кроме того, в последние годы в структуре заболеваемости увеличивается удельный вес стертых и легких форм болезни среди детей старшей возрастной группы и взрослых [2, 4, 5], а также участились случаи выявления бактерионосителей среди практически здоровых людей [5, 6]. Согласно действующим санитарно-эпидемиологическим правилам [7] с 2014 года лабораторная диагностика коклюша в России проводится с помощью бактериологического, серологического и молекулярно-генетического методов исследования, выбор которых определяется сроком заболевания.
Бактериологический метод считается «золотым стандартом» в лабораторной диагностике коклюшной инфекции, так как предусматривает выделение возбудителя заболевания из патологического материала. Однако бактериологическое исследование имеет целый ряд недостатков: низкая эффективность выделения В.pertussis, что обусловлено как биологическими особенностями самого возбудителя, так и недостатками на преаналитическом этапе исследования; продолжительность исследования занимает от 5 до 8 дней; бактерии B.pertussis биохимически малоактивны, поэтому возникают сложности на этапе идентификации микроорганизма при изучении его ферментативных свойств [8, 9]. Наряду с этим, результативность этой диагностики зависит и от сроков обследования пациентов от начала заболевания и приема антибактериальных препаратов до обследования [10]. Поэтому применение бактериологического исследования ограничено его использованием в период спазматического кашля (2-3-я недели болезни) и до начала приема антибактериальных препаратов.
Серологические методы лабораторной диагностики коклюшной инфекции основываются на определении уровня специфических антител (IgM, IgA, IgG) к определенным антигенам / группам антигенов В.pertussis [11]. В настоящее время использование ИФА для выявления антител IgA, IgG, IgM в сыворотке крови в практическом здравоохранении РФ позволяет подтвердить диагноз коклюша при легких и стертых формах заболевания, информативно для непривитых детей старше 1 года и взрослых. При этом недостатками серологической диагностики является то, что этот метод используется в основном ретроспективно (с 3-й недели заболевания), поскольку существует сложность интерпретации диагноза у привитых и детей первого полугодия жизни, у которых на ранних сроках болезни результаты серодиагностики могут быть отрицательными и лишь обследование в динамике (на 4-5-й неделях болезни) может подтвердить диагноз [12, 13].
Наиболее эффективным среди методов лабораторной диагностики коклюша является молекулярно-генетический, позволяющий выявить фрагмент / фрагменты генома В.pertussis, в том числе геномов нескольких видов бордетелл методом полимеразной цепной реакции (ПЦР) в режиме реального времени, начиная с 1-й по 4-ю недели заболевания.
Молекулярно-генетические методы лабораторной диагностики коклюша стали применяться в различных странах мира с конца 1980-х годов [14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27]. По данным многочисленных источников чувствительность метода ПЦР при обнаружении ДНК В.pertussis в исследуемом материале варьирует от 73% до 100% [14, 18, 19, 22]. При этом унифицированной ПЦР тест-системы для диагностики коклюша на сегодняшний день не существует, так как различия в выборе генов-мишеней и систем для их детектирования препятствуют стандартизации метода и созданию единой концепции диагностики коклюша с помощью амплификационных технологий. Тем не менее, применение методов генодиагностики обеспечивает быструю и раннюю диагностику коклюша и эффективно как у пациентов с различными формами клинического течения болезни, так и у пациентов, обследование которых проводится через три недели после начала кашля и/или на фоне антибиотикотерапии и не зависит от вакцинального статуса.
В настоящее время предложены разные ПЦР-технологии (nested-ПЦР, ПЦР-РВ), с помощью которых возможно проводить идентификацию различных участков генома B.pertussis: гена коклюшного токсина [14, 20, 23, 24], порина [21, 22], аденилатциклазного токсина [16], повторяющихся последовательностей хромосомы [15, 17, 19, 25, 26]. Опыт применения ПЦР для идентификации возбудителей бордетеллезов показал, что наиболее точные результаты получают при использовании праймеров, расположенных в промоторной зоне коклюшного токсина, повторяющихся последовательностях IS481 и IS1001 или гене суаА [27]. В последнее время популярность приобрели технологии на основе изотермической амплификации, одной из которых является LAMP [28, 29]. Метод петлеобразующей изотермической амплификации, обладающий высокой чувствительностью, специфичностью и амплификационной эффективностью, был использован и при диагностике коклюша [30, 31].
Однако в последние годы в зарубежной литературе появилось значительное количество публикаций, свидетельствующих об увеличении циркуляции среди населения штаммов В. holmesii [32, 33, 34, 35, 36, 37, 38]. В. holmesii является мелкой Gram-палочкой, которая впервые была описана Центром по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, CDC) в 1995 г. [39]. Выделение В. holmesii сначала ассоциировалось с септицемией, эндокардитом, пневмонией чаще у иммунокомпрометированных лиц (пациенты со спленэктомией, серповидноклеточной анемией) [40]. В 1999 г. впервые было представлено описание клинической картины коклюшеподобного заболевания, вызванного В. holmesii [41]. За последние пять лет случаи коклюшеподобного заболевания, этиологическим агентом которых являлась В. holmesii, зарегистрированы на территории Австралии, Северной и Южной Америки, Азии, Японии, Ирана, Европы и Чили [32, 33, 34, 35, 36, 37, 38, 42, 43, 44, 45, 46, 47]. Вместе с тем, идентификация В. holmesii затруднена в связи с высокой гомологией с B.pertussis и, как результат, случаи, вызванные В. holmesii, докладываются как В.pertussis-положительные [35, 37, 42]. Распространенность инфекции, вызванной В. holmesii, в различных странах мира колеблется в пределах 0,4 - 29% [32, 33, 34, 35, 37, 38, 42, 43, 44, 45, 46, 47]. По данным некоторых ученых [45] у 20% взрослых и подростков во Франции коклюш вызван инфицированием В. holmesii. Наибольшее количество таких случаев зарегистрировано в течение 2010 года в Ohio [32], где примерно у трети обследованных взрослых детей от 11 до 18 лет выделена В. holmesii. Вместе с тем в некоторых странах, таких как Финляндия, Дания, Франция, при проведении аналогичных исследований В. holmesii не была обнаружена в клиническом материале от пациентов с коклюшеподобными симптомами [36, 48], что, по мнению авторов, может быть связано с недостаточным уровнем лабораторной диагностики, позволяющей идентифицировать этого возбудителя.
По данным зарубежных исследователей, инфекция, вызванная В. holmesii, ранее воспринималась как связанная с B.pertussis в связи с тем, что геномы этих двух возбудителей являются наиболее близкородственными [42] и инсерционная последовательность IS481, которая является ДНК-мишенью для большинства ПЦР-тест систем, имеется у этих двух видов бордетелл. Поэтому дифференциация B.pertussis и В. holmesii для большинства лабораторий затруднительна [49, 50, 51].
Следовательно, разработка методов своевременной и быстрой идентификации не только B.pertussis, В.parapertussis, В. bronchiseptica, но и В. holmesii, несомненно, будет способствовать быстрому выявлению больных и бактерионосителей, назначению своевременной терапии.
Наиболее близким по технологии и формату ПЦР является официально зарегистрированный на территории РФ один набор реагентов для выявления и дифференциации ДНК возбудителей коклюша, паракоклюша и бронхисептикоза в биологическом материале методом ПЦР в режиме реального времени с гибридизационно-флуоресцентной детекцией «АмплиСенс® Bordetella multi-FL» [52, 53]. В этой тест-системе одной из мишеней является область гена ptxA, кодирующего коклюшный токсин (КТ), которая имеется в геномах B.pertussis, B.parapertussis и В.bronchiseptica, вторая мишень - уникальна для B.pertussis, третья - имеется только в геноме В.bronchiseptica. Также в тесте для учета эффективности всех этапов ПЦР-анализа используется и четвертая мишень - внутренний контроль. Обнаружение ДНК трех видов бордетелл осуществляется путем выделения ДНК с использованием контрольных образцов; приготовления реакционной смеси, содержащей набор праймеров и флуоресцирующих зондов для выявления ДНК бордетелл; проведение амплификации, включающей денатурацию при 95°С - 15 мин, циклирование при 95°С - 10 сек, 60°С - 20 сек, 72°С - 10 сек - 10 циклов, циклирование при 95°С - 10 сек, 60°С - 20 сек, 72°С - 10 сек - 35 циклов; оценка результатов по кривым накопления флуоресцентных сигналов по каждому из заданных для образцов каналов. Недостаток данного набора заключается в том, что с его помощью возможна идентификация только ДНК B.pertussis, B.parapertussis и В.bronchiseptica, а идентификация ДНК В.holmesii невозможна.
Другим близким аналогом является разработанная коллективом авторов ФГБУ НИИЭМ им. Н.Ф. Гамалеи МЗ РФ в 2010-х годах видоспецифичная тест-система на основе ПЦР в режиме реального времени, позволяющая выявлять в клинических образцах B.pertussis, содержащие интеграции IS481 и IS1002 в опероне вирулентности bvgAS [54, 55]. В качестве исследуемого субстрата используется смыв с носоглоточного тампона. Преимуществом предложенной тест-системы ПЦР в режиме реального времени является возможность осуществления диагностики типичных и атипичных форм коклюша, бактерионосительства и изучение изменения фазового состава популяции возбудителя - B.pertussis. Недостатком этой тест-системы является невозможность идентификаций ДНК B.parapertussis и В.holmesii.
Также близкими по назначению методами амплификации нуклеиновых кислот являются два технических решения, ранее предложенных нами для ускоренной диагностики коклюша [56, 57, 58, 59], основанные на технологии изотермической амплификации. Разработанные методы включали проведение следующих этапов: взятие клинического материала из ротоглотки больного, выделение ДНК, проведение амплификации и детекция продуктов амплификации методом электрофореза. При этом в первом техническом решении (патент РФ на изобретение №2542396 [58]) пробоподготовка клинического материала заключалась в первичном прогреве образцов при 95°С, обработке лизоцимом при 37°С±2°С и протеиназой K при 70°С. Выделение ДНК осуществляли с помощью лизирующего раствора при 65°С с последующей обработкой сорбентом, отмывочным раствором и элюировании ТЕ-буфером при 65°С. Постановку ПЦР осуществляли с использованием ПЦР реакционной смеси, включающей 10Ч ПЦР буфер с (NH4)2SO4, 2 mM dNTP, 25 mM MgCl2, 5% DMSO, три пары праймеров и Bst ДНК-полимеразу.
Во втором техническом решении ускоренного метода диагностики коклюшной инфекции на основе изотермической амплификации (патент РФ на изобретение №2542396 [59]) взятие клинического материала производили двумя сухими стерильными одноразовыми зондами-тампонами с задней стенки ротоглотки с последующим помещением в одну пробирку типа эппендорф с физиологическим раствором. Выделение ДНК осуществляли с помощью коммерческих наборов реагентов в соответствии с инструкцией по применению. Приготовление реакционной смеси проводили путем смешивания двух смесей. Состав смеси №1 - 10х реакционный буфер для ПЦР, 2 mM смесь нуклеотидов (dNTP), 25 mM MgCl2, раствор Betaine и три пары праймеров. Состав смеси №2 - рабочее разведение Bst ДНК-полимеразы. В смесь №1 вносили пробы ДНК, затем прогревали и охлаждали. После чего в каждую пробу вносили смесь №2, перемешивали на вортексе. Амплификацию в двух технических решениях проводили при 65°С - 60 мин, затем при 80°С - 2 мин с последующей детекцией результатов с помощью электрофореза и дальнейшим сопоставлением полученных фрагментов ДНК с ДНК контрольных образцов штамма B.pertussis. Общая продолжительность исследования в первом варианте составляла 9-10 часов от начала исследования и эффективность метода не превышала 84,9%, в то время как во втором варианте продолжительность исследования составила 4,5-5 часов с эффективностью 99,4%. Все разработанные способы позволяют выявить ДНК B.pertussis в клиническом материале без этапа выделения чистой культуры микроорганизма. Недостатком представленных технических решений является невозможность идентификации возбудителей коклюшеподобных заболеваний - B.parapertussis и В. holmesii.
Технической проблемой, решаемой при создании настоящего изобретения является разработка способа и набора для ускоренной генодиагностики коклюша, что позволяет выявлять возбудителей заболевания - B.pertussis, B.parapertussis и В. holmesii непосредственно в клиническом материале от больного с помощью полимеразной цепной реакции в режиме реального времени в мультиплексном формате.
Техническим результатом является повышение эффективности обнаружения ДНК трех видов бордетелл - B.pertussis, B.parapertussis и В. holmesii методом ПЦР в реальном времени в мультиплексном формате за счет конструирования набора, содержащего три пары специфичных олигонуклеотидных праймеров и трех флуоресцирующих ДНК-зондов, подбора условий для проведения ПЦР, обеспечивающей минимальный риск контаминации при проведении исследования и исключающего субъективность при оценке результатов.
Заявленная группа изобретений позволяет выявлять ДНК трех возбудителей коклюша и коклюшеподобных заболеваний - B.pertussis, B.parapertussis и В. holmesii в течение 3 часов от начала исследования непосредственно в материале от больного, что способствует быстрой постановке диагноза, назначению своевременной и адекватной терапии, а также быстрому выявлению и изоляции больных коклюшем и коклюшеподобных заболеваний при проведении противоэпидемических мероприятий в очагах коклюшной инфекции.
В соответствии с поставленной задачей был разработан способ и набор для ускоренной диагностики коклюша.
Сущность предлагаемой группы изобретений заключается в следующем.
Для генодиагностики коклюша и коклюшеподобных заболеваний проводят следующие этапы: забор клинического материала из ротоглотки больного; выделение ДНК с использованием образца для контроля специфики реакции; приготовление реакционной смеси, содержащей набор праймеров и флуоресцирующие зонды для выявления ДНК бордетелл; проведение амплификации, включающей денатурацию при 95°С - 10 мин, циклирование при 95°С - 10 сек, при 60°С - 60 сек в течение 50 циклов; оценка результатов по кривым накопления флуоресцентных сигналов по каждому из заданных для образцов каналов.
Взятие клинического материала производили двумя сухими стерильными одноразовыми зондами-тампонами с задней стенки ротоглотки. Рабочие части зондов помещали в одну пробирку типа эппендорф с 0,5 мл физиологического раствора.
Пробоподготовку образца проводили путем смыва клинического материала с тампона в физиологический раствор.
Выделение ДНК осуществляли с помощью коммерческих наборов реагентов в соответствии с инструкцией по применению.
Приготовление реакционной смеси проводили путем смешивания следующих реактивов: реакционного буфера для ПЦР-РВ (qPCRmix-HS-впервые применен в реакционном буфере), 25 mM MgCl2 и 9 праймеров:
Используемые праймеры:
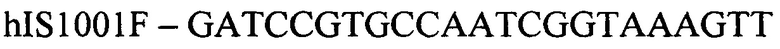 (прямой праймер)
(прямой праймер)
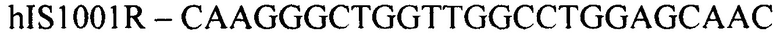 (обратный праймер)
(обратный праймер)
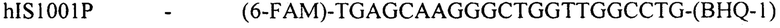 (флуоресцентный зонд)
(флуоресцентный зонд)
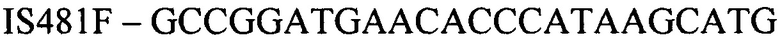 (прямой праймер)
(прямой праймер)
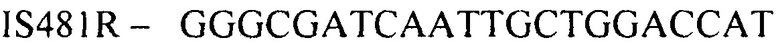 (обратный праймер)
(обратный праймер)
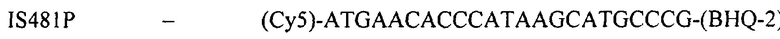 (флуоресцентный зонд)
(флуоресцентный зонд)
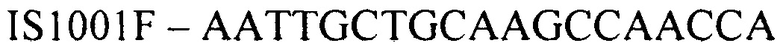 (прямой праймер)
(прямой праймер)
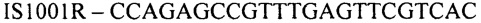 (обратный праймер)
(обратный праймер)
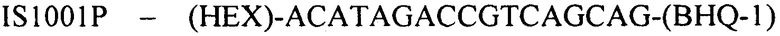 (флуоресцентный зонд).
(флуоресцентный зонд).
Конструирование специфических праймеров hIS1001F, hIS1001R, IS481F, IS481R и IS1001R осуществляли с помощью компьютерной программы BLAST на основании анализа нуклеотидных последовательностей референтных штаммов, опубликованных в GenBank. Последовательности флуоресцентно меченных зондов hIS1001P, IS481P, IS1001F и IS1001P были взяты из опубликованных протоколов [35, 37]. Нами были подобраны информативные флуоресцентные красители зондов, позволяющие проводить ПЦР в реальном времени в мультиплексном формате. При конструировании праймеров и модификации зондов учитывали следующее: степень гомологии с выбранными участками генов; отсутствие самокомплементарных участков внутри олигонуклеотидов и комплементарности друг другу с целью недопущения возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига праймеров.
В реакционную смесь объемом 20 мкл вносили 5 мкл ДНК клинического образца. В качестве положительных контролей амплификации использовали - ДНК штамма B.pertussis №143, ДНК штамма Bordetella parapertussis 38б, Bordetella bronchiseptica 9 (Государственная коллекция патогенных микроорганизмов и клеточных культур «ГКПМ - ОБОЛЕНСК» ФБУН ГНЦ ПМБ), Bordetella holmesii АТСС 51541 (American Type Culture Collection).
Амплификацию в режиме реального времени проводили с помощью прибора Rotor-Gene Q 5 plex HRM (QIAGEN GmbH, Германия) при следующих условиях: денатурацию при 95°С в течение 10 мин - 1 цикл, циклирование при 95°С - 10 сек, при 60°С - 60 сек, 50 циклов. Анализ и интерпретацию результатов проводили с помощью программного обеспечения прибора Rotor-Gene Q 5 plex HRM (QIAGEN GmbH, Германия). Интерпретацию результатов проводили путем оценки по кривым накопления флуоресцентного сигнала по каждому из заданных для образцов каналов - Green (FAM), Yellow (HEX), Red (Cy5). При наличии положительных сигналов по каналам Green (FAM) и Red (Су5), также как и у контрольного образца ДНК Bordetella holmesii АТСС 51541, данные образцы идентифицируются как образцы, содержащие ДНК В. holmesii; при наличии положительного сигнала по каналу Yellow (HEX), также как и у контрольного образца ДНК Bordetella parapertussis 38б, такие образцы идентифицируются как образцы, содержащие ДНК B.parapertussis; при наличии положительного сигнала по каналу Red (Су5), также как и у контрольного образца ДНК B.pertussis №143, такие образцы идентифицируются как образцы, содержащие ДНК B.pertussis. При учете результатов пороговая линия (threshold) устанавливается вручную на уровне 20% от максимального уровня флуоресценции в последнем цикле амплификации. Уровень пороговой линии (threshold) составил не более 0,01.
Значение показателя «Ct» (точка накопления сигнала флюоресценции) определяли в автоматическом режиме. В положительных образцах кривая флуоресценции пересекает линию threshold и имеет вид экспоненциальной кривой. В отрицательных образцах флуоресценции не наблюдается, что отражается прямой детекции на уровне или ниже линии threshold.
Пример осуществления изобретения
Подготовка проб
Клинический материал от пациента отбирается двумя сухими стерильными одноразовыми зондами-тампонами (COPAN, Италия) с задней стенки ротоглотки, не касаясь щек и языка и предварительно аккуратно прижав язык пациента индивидуальным шпателем. Рабочие части зондов с вискозными тампонами помещали в одну пробирку типа эппендорф с 0,5 мл физиологического раствора и отламывали их концы.
Выделение ДНК из клинического материала
Закрытую пробирку типа эппендорф с 0,5 мл физиологического раствора и рабочими частями зондов с вискозными тампонами перемешивают на вортексе в течение 5 мин и центрифугируют при 5000 g в течение 5 сек. Медицинским пинцетом, предварительно прожженным в пламени горелки, аккуратными движениями вынимают тампоны, после чего осаждают смывы центрифугированием при 6700 g в течение 10 мин. Наконечником с аэрозольным барьером удаляют основной объем супернатанта, оставляя в пробирке полученный осадок и 100 мкл надосадочной жидкости, из чего в последующем и выделяют ДНК.
Выделение ДНК из клинического материала проводят с помощью коммерческого набора реагентов «РИБО-преп» (ООО «НекстБио», Москва) в соответствии с инструкцией по применению. Пробы очищенных ДНК хранят в замороженном виде при минус 20°С.
Постановка ПЦР в режиме реального времени
Приготовление реакционной ПЦР смеси. Состав реакционной смеси (на 1 пробу):
5 мкл qPCRmix-HS,
1 мкл 25 mM MgCl2
10,75 мкл воды деионизованной
0,75 мкл (300 nM конечная концентрация) hIS1001F,
0,75 мкл (300 nM конечная концентрация) hIS1001R
0,25 мкл (100 nM конечная концентрация) hIS1001P
0,75 мкл (300 nM конечная концентрация) IS481F
0,75 мкл (300 nM конечная концентрация) IS481R
0,25 мкл (100 nM конечная концентрация) IS481P
0,75 мкл (300 nM конечная концентрация) IS1001F
0,75 мкл (300 nM конечная концентрация) IS1001R
0,25 мкл (100 nM конечная концентрация) IS1001P
Смесь перемешивают на вортексе и раскапывают по 20 мкл в каждую пробу; вносят по 5 мкл ДНК пробы; слегка перемешивают на вортексе.
Помещают пробы в амплификатор Rotor-Gene Q 5 plex HRM (QIAGEN GmbH, Германия). Режим амплификации: 95°С - 10 мин - 1 цикл, 95°С - 10 сек, 60°С - 60 сек, 50 циклов.
Анализ и интерпретацию результатов проводят с помощью программного обеспечения прибора Rotor-Gene Q 5 plex HRM (QIAGEN GmbH, Германия). Детекция осуществляется по каналам Green (FAM), Yellow (HEX), Red (Cy5). По каналам Green (FAM) и Red (Cy5) идентифицируются образцы, содержащие ДНК В. holmesii и контрольный образец ДНК Bordetella holmesii АТСС 51541, по каналу Yellow (HEX) идентифицируются образцы, содержащие ДНК B.parapertussis и контрольный образец ДНК Bordetella parapertussis 38б, по каналу Red (Су5) идентифицируются образцы, содержащие ДНК B.pertussis и контрольный образец ДНК B.pertussis №143.
Апробация набора и клинические испытания способа ускоренной генодиагностики коклюша и коклюшеподобных заболеваний были проведены совместно с инфекционистами клинического отдела ФБУН МНИИЭМ им.Г.Н. Габричевского Роспотребнадзора на базе ГБУЗ ИКБ №1 Департамента здравоохранения г. Москвы, а также на клинических образцах, полученных от больных, обследованных с подозрением на коклюш и коклюшеподобные заболевания, из лечебно-профилактических организаций г. Москвы.
В ИКБ №1 обследовано 62 пациента, находящихся на различных сроках от начала заболевания, из них 51 пациент с клиническим диагнозом коклюш (разной степени тяжести), 2 пациента - с атипичной формой коклюша, 2 пациента - с паракоклюшем и 7 пациентов с коклюшеподобными симптомами. Возраст больных колебался от 0 месяца до 14 лет, в том числе 37 (59,7%) пациентов были в возрасте до 1 года, 25 (40,3%) пациентов - от 1 года 1 мес до 14 лет. Тяжесть коклюша оценивалась согласно общепринятой классификации, в соответствии с которой у 8 (15,7%) детей коклюш протекал в тяжелой форме, у 34 (66,7%) - в среднетяжелой форме и у 9 (17,6%) - в легкой форме. Диагноз коклюша устанавливался на основании характерной клинической картины заболевания и оценки эпидемиологической ситуации в окружении больного. Для оценки специфичности разработанного способа генодиагностики коклюша и коклюшеподобных заболеваний, в исследование была включена контрольная группа из 25 пациентов с другими респираторными заболеваниями. В исследование также было включено 37 клинических образцов, полученных от пациентов, обследованных с подозрением на коклюш и коклюшеподобные заболевания из ЛПО г. Москвы. В качестве сравнения заявленного набора использовали коммерческую тест-систему «АмплиСенс® Bordetella multi-FL» / «ПЦР-комплект» вариант FRT-100 F (ФБУН ЦНИИЭ Роспотребнадзора, Москва) для выявления ДНК B.pertussis, B.parapertussis и В.bronchiseptica.
Всего в исследование включено 124 клинических образца. При изучении клинических образцов в соответствии с разработанной нами ПЦР-РВ в мультиплексном формате обнаружено 74 (59,7%) образца, содержащих ДНК B.pertussis, 10 (8,1%) образцов, содержащих ДНК B.parapertussis, 7 (5,6%) образцов, содержащих ДНК В. holmesii, и 33 (26,6%) образца, в которых ДНК возбудителей не выявлена.
Среди пациентов, госпитализированных в ИКБ №1, у всех 53 пациентов с клиническим диагнозом коклюш (типичная и атипичная форма) обнаружена ДНК B.pertussis, у 2 пациентов с диагнозом паракоклюш обнаружена ДНК B.parapertussis, у 7 пациентов с коклюшеподобными симптомами в клинических образцах обнаружена ДНК В. holmesii. У всех 25 пациентов контрольной группы с другими заболеваниями ДНК возбудителей не выявлена, что свидетельствует о высокой специфичности разработанной ПЦР-РВ тест-системе.
Среди клинических образцов, полученных из лечебно-профилактических организаций г. Москвы при обследовании пациентов на коклюш и коклюшеподобные заболевания, у 21 пациента обнаружена ДНК B.pertussis, у 8 пациентов обнаружена ДНК B.parapertussis и у 8 пациентов - отрицательные результаты ПЦР-диагностики.
При сравнении результатов, полученных с помощью разработанной ПЦР-РВ в мультиплексном формате и коммерческой тест-системы «АмплиСенс® Bordetella multi-FL», установлено полное совпадение результатов по выявлению ДНК B.pertussis и ДНК B.parapertussis, а также отсутствие положительных результатов в ДНК-отрицательных образцах.
Таким образом, проведенные исследования показали высокую диагностическую эффективность и специфичность при обследовании больных с коклюшем различной степени тяжести, в том числе с атипичной формой, а также при обследовании больных с паракоклюшем. Кроме того, важным достижением применения разработанного способа генодиагностики является возможность идентификации ДНК В. holmesii у больных с коклюшеподобным заболеванием, вызванным В. holmesii, что в целом расширяет возможности обследования пациентов с коклюшем и коклюшеподобными заболеваниями на территории России, что до настоящего времени было невозможно.
Литература
1. Басов, А.А. Особенности распространения коклюша в организованном коллективе с высоким уровнем привитости против этой инфекции / А.А. Басов, О.В. Цвиркун, А.Г. Герасимова, О.Ю. Борисова, Н.В. Россошанская, В.Н. Бабенко // Жизнь без опасностей. Здоровье. Профилактика. Долголетие. - 2013. - Т. 8, №4. - С. 60-64.
2. Бабаченко, И.В. Коклюш у детей: монография / И.В. Бабаченко, С.М. Харит, Н.Н. Курова, Г.Я. Ценева. - М.: Комментарий, 2014. - 176 с.
3. Петрова, М.С. Коклюш у детей раннего возраста / М.С. Петрова, О.П. Попова, О.Ю. Борисова, Е.Н. Абрамова, Р.В. Вартанян, Е.И. Келли // Эпидемиология и инфекционные болезни. - 2012. - №6. - С.12-24.
4. Попова, О.П. Клинические особенности коклюша у взрослых / О.П. Попова, М.С. Петрова, О.Ю. Борисова, Т.А. Скирда, Н.М. Грачева, Н.А. Малышев // Терапевтический архив. - 2014. - Т. 86, №11. - С. 78-81.
5. Versteegh, F.G. Bordetella pertussis and mixed infections / F.G. Versteegh, T.A. Mooi-Kokenberg, J.F. Schellekens, J.J. Roord // Minerva Pediatrica. - 2006. - Vol. 58, №2. - P. 131-137.
6. Waters, V. Outbreak of atypical pertussis detected by polymerase chain reaction in immunized preschool-aged children / V. Waters, F. Jamieson, S.E. Richardson, M. Finkelstein, A. Wormsbecker, S.A. Halperin // The Pediatric Infectious Disease Journal. - 2009. - Vol. 28, №7. - P. 582-587.
7. Профилактика коклюша: санитарно-эпидемиологические правила СП 3.1.2.3162-14: утверждены Главным государственным санитарным врачом РФ 17.03.2014. - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2015. - 23 с.
8. Степаншина, В.Н. Взаимосвязь состава питательных сред с ростовыми и биологическими свойствами B.pertussis / В.Н. Степаншина, Л.Н. Алексеева, О.В. Коробова, Л.В. Логачева, А.П. Шепелин, Г.А. Анисимов, К.И. Волковой // Журнал микробиологии, эпидемиологии и иммунобиологии. - 1994. - №6. -С. 26-27.
9. Ценева, Г.Я. Микробиологическая характеристика возбудителя коклюша и лабораторная диагностика коклюша / Г.Я. Ценева, Н.Н. Курова // Клиническая микробиология и антимикробная химиотерапия. - 2003. - Т. 5, №4. - С. 329-341.
10. Wood, N. Pertussis: review of epidemiology, diagnosis, management and prevention / N. Wood, P. McIntyre // Paediatric Respiratory Reviews. - 2008. - Vol. 9, №3. - P. 201-211.
11. Viljanen, M.K. Serological diagnosis of pertussis: IgM, IgA and IgG antibodies against Bordetella pertussis measured by enzymelinked immunosorbent assay (ELISA) / M.K. Viljanen, O. Ruuskanen, C. Granberg, T.T. Salmi // Scandinavian Journal of Infectious Diseases. - 1982. - Vol. 14, №2. - P. 117-122.
12. Грачева, H.M. Коклюш (клиника, диагностика, лечение): методические рекомендации / Н.М. Грачева, Н.А. Малышев, М.С. Петрова, О.П. Попова, О.Ю. Борисова, Е.И. Келли, Е.Н. Абрамова. - М.: Департамент здравоохранения города Москвы, 2009. - 26 с.
13. Попова, О.П. Диагностическая ценность метода ИФА при коклюше у детей / О.П. Попова, Т.А. Скирда, И.М. Федорова, М.С. Петрова, О.Ю. Борисова, С.Ю. Комбарова, С.В. Бунин, М.В. Пенкина // Детские инфекции. - 2016. - Т. 15, №2. - С. 36-40.
14. Birkebaek, N.H. Bordetella pertussis diagnosed by polymerase chain reaction / N.H. Birkebaek, I. Heron, K. Skjodt // APMIS. - 1994. - Vol. 102, №4. - P. 291 -294.
15. Backman, A. Nested PCR optimized for detection of Bordetella pertussis in clinical nasopharyngeal samples / A. Backman, B. Johansson, P. Olcen // Journal of Clinical Microbiology. - 1994. - Vol. 32, №10. - P. 2544-2548.
16. Douglas, E. Identification of Bordetella pertussis in nasopharyngeal swabs by PCR amplification of a region of the adenylate cyclase gene / E. Douglas, J.G. Coote, R. Parton, W. McPheat // Journal of Medical Microbiology. - 1993. - Vol. 38, №2. - P. 140-144.
17. Glare, E.M. Analysis of a repetitive DNA sequence from Bordetella pertussis and its application to the diagnosis of pertussis using the polymerase chain reaction / E.M. Glare, J.P. Paton, R.R. Premier, A.J. Lawrence, I.T. Nisbet // Journal of Clinical Microbiology. - 1990. - Vol. 28, №9. - P. 1982-1987.
18. Farrell, D.J. Nested duplex PCR to detect Bordetella pertussis and Bordetella parapertussis and its application in diagnosis of Pertussis in Nonmetropolitan Southeast Queensland, Australia / D.J. Farrell, G. Daggard, T.K.S. Mukkur // Journal of Clinical Microbiology. - 1999. - Vol. 37, №3. - P. 606-610.
19. He, Q. Comparison of polymerase chain reaction with culture and enzyme immunoassay for diagnosis of pertussis / Q. He, J. Mertsola, H. Soini, M. Skurnik, O. Ruuskanen, M.K. Viljanen // Journal of Clinical Microbiology. - 1993. - Vol. 31, №3. - P. 642-645.
20. Houard, S. Specific identification of Bordetella pertussis by the polymerase chain reaction / S. Houard, C. Hackel, A. Herzog, A. Bollen // Research in Microbiology. - 1989. - Vol. 140, №7. - P. 477-487.
21. Li, Z.M. Identification of Bordetella pertussis infection by shared-primer PCR / Z.M. Li, D.L. Jansen, T.M. Finn, S.A. Halperin, A. Kasina, S.P.  T. Aoyama, C.R. Manclark, M.J. Brennan // Journal of Clinical Microbiology. - 1994. -Vol. 32, №3. - P. 783-789.
T. Aoyama, C.R. Manclark, M.J. Brennan // Journal of Clinical Microbiology. - 1994. -Vol. 32, №3. - P. 783-789.
22. Lanotte, Ph. Evaluation of four commercial Real-Time PCR assays for detection of Bordetella spp. in nasopharyngeal aspirates / Ph. Lanotte, Ch. Plouzeau, Ch. Burucoa, C. Grelaud, S. Guillot, N. Guiso, F. Gamier // Journal of Clinical Microbiology. - 2011. - Vol. 49, №11. - P. 3943-3946.
23. Schlapfer, G. Use of the polymerase chain reaction to detect Bordetella pertussis in patients with mild or atypical symptoms of infection / G. Schlapfer, H.P. Senn, R. Berger, M. Just // European Journal of Clinical Microbiology and Infectious Diseases. - 1993. - Vol. 12, №6. - P. 459-463.
24. Schlapfer, G. Polymerase chain reaction identification of Bordetella pertussis infections in vaccinees and family members in a pertussis vaccine efficacy trial in Germany / G. Schlapfer, J.D. Cherry, U. Heininger, M. Uberal, S. Schmitt-Grohe, S. Laussucq, M. Just, K. Stehr // The Pediatric Infectious Disease Journal. - 1995. - Vol. 14, №3. - P. 209-214.
25. van der Zee, A. Polymerase chain reaction assay for pertussis: simultaneous detection and discrimination of Bordetella pertussis and Bordetella parapertussis / A. van der Zee, C. Agterberg, M. Peeters, J. Schellekens, F.R. Mooi // Journal of Clinical Microbiology. - 1993. - Vol. 31, №8. - P. 2134-2140.
26. van der Zee, A. A clinical validation of Bordetella pertussis and Bordetella parapertussis polymerase chain reaction: comparison with culture and serology using samples from patients with suspected whooping cough from a highly immunized population / A. van der Zee, C. Agterberg, M. Peeters, F. Mooi, J. Schellekens // The Journal of Infectious Diseases. - 1996. - Vol. 174, №1. - P. 89-96.
27. Loeffelholz, M. Towards improved accuracy of Bordetella pertussis nucleic acid amplification tests / M. Loeffelholz // Journal of Clinical Microbiology. - 2012. - Vol. 50, №7. - P. 2186-2190.
28. Notomi, T. Loop-mediated isothermal amplification of DNA / T. Notomi, H. Okayama, H. Masubuchi, T. Yonekawa, K. Watanabe, N. Amino, T. Hase // Nucleic Acids Research. - 2000. - Vol. 28, №12. - P. E63.
29. Notomi, T. Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects / T. Notomi, Y. Mori, N. Tomita, H. Kanda // The Journal of Microbiology. -2015. - Vol. 53, №l. - P. 1-5.
30. Kamachi, K. Development and evaluation of a loop-mediated isothermal amplification method for rapid diagnosis of Bordetella pertussis infection / K. Kamachi, H. Toyoizumi-Ajisaka, K. Toda, S.C. Soeung, S. Sarath, Y. Nareth, Y. Horiuchi, K. Kojima, M. Takahashi, Y. Arakawa // Journal of Clinical Microbiology. - 2006. - Vol. 44, №5. - P. 1899-1902.
31. Brotons, P. Validation of a loop-mediated isothermal amplification assay for rapid diagnosis of pertussis infection in nasopharyngeal samples / P. Brotons, H.D. de Paz, C. Esteva, I. Latorre, C. Munoz-Almagro // Expert Review of Molecular Diagnostics. - 2016. - Vol. 16, №1. - P. 125-130.
32. Rodgers, L. Epidemiologic and Laboratory Features of a Large Outbreak of Pertussis-Like Illnesses Associated With Cocirculating Bordetella holmesii and Bordetella pertussis- Ohio, 2010-2011 / L. Rodgers, S.W. Martin, A. Cohn, J. Budd, M. Marcon, A. Terranella, S. Mandal, D. Salamon, A. Leber, M. Tondella, K. Tatti, K. Spicer, A. Emanuel, E. Koch, L. McGlone, L. Pawloski, M. LeMaile-Williams, N. Tucker, R. Iyer, T. Clark, M. DiOrio // Clinical Infectious Diseases. - 2013. - Vol. 56, №3. - P. 322-331.
33. Kamiya, H. Transmission of Bordetella holmesii during pertussis outbreak, Japan / H. Kamiya, N. Otsuka, Y. Ando, F. Odaira, S. Yoshino, K. Kawano, H. Takahashi, T. Nishida, Y. Hidaka, H. Toyoizumi-Ajisaka, K. Shibayama, K. Kamachi, T. Sunagawa, K. Taniguchi, N. Okabe // Emerg Infect Dis. - 2012. - Vol. 18, №7. - P. 1166-1169.
34. Miranda, C. Bordetella holmesii in nasopharyngeal samples from Chilean patients with suspected Bordetella pertussis infection / C. Miranda, L. Porte, P. Garcia// J Clin Microbiol. - 2012. - Vol. 50. - P. 1505.
35. Fong, W. Detection and incidence of Bordetella holmesii in respiratory specimens from patiens with pertussis-like symptoms in New South Wales, Australia / W. Fong, V. Timms, N. Holmes, V. Sintchenko Pathology 2018;50:322-326.
36. Mooi, F.R. Characterization of Bordetella holmesii isolates from patients with pertussis-like illness in Netherlands / F.R. Mooi, S. Bruisten, I. Linde, F. Reubsaet, K. Heuvelman, S. van der Lee S, A,J, King // FEMS Immunol Med Microbiol. - 2012. - Vol. 64. - P. 289-291.
37. Lotfi, M.N. Molecular detection of Bordetella holmesii in two infants with pertussis-like syndrome: the first report from Iran / M.N. Lotfi, V.S. Nikbin, O. Nasiri, F. Badmasti, F. Shahcheraghi // Iranian Journal of Microbology. - 2017. - Vol. 9, №4. - P. 219-223.
38. Mir-Cross, A. Emergence of Bordetella holmesii as a Causative Agent of Whooping Cough, Barcelona, Spain / A. Mir-Cross, G. Codina, T.M. Martin-Gomez, A. Fabrega, X. Martinez, M. Jane, D. an Esso, T. Cornejo, C. Rodrigo, M. Campins, T. Pumarola, J. Jose Gonzalez-Lopez // Emerg Infect Dis. - 2017. - Vol. 23, №11. - P. 1856-1859.
39. Yih, K.W. Bordetella holmesii- Like Organisms Isolated from Massachusetts Patiens with Pertussis - Like Symptoms, Boston, Massachusetts, USA / K.W. Yih, E.A. Silva, J. Ida, N. Harrington, S.M. Lett, H. George // Emerg Infect Dis. - 1999. - Vol. 5, №3. - P. 441-443.
40. Weyant, R.S. Bordetella holmesii sp.now., a new gram-negative species associated with septicemia / R.S. Weyant, D.G. Hollis, R.E. Weaver, M.F. Amin, A.G. Steigerwalt, S.P.  A. Whitney, M.I. Daneshvar, C. Wayne Moss, D.J. Brenner // J Clin Microbiol. - 1995. - Vol. 33. - P. 1-7.
A. Whitney, M.I. Daneshvar, C. Wayne Moss, D.J. Brenner // J Clin Microbiol. - 1995. - Vol. 33. - P. 1-7.
41. Shepard, C.W. Bordetella holmesii bacteremia: A newly recognized clinical entity among asplenic patients / C.W. Shepard, M.I. Daneshwar, R.M, Kaiser, D.A. Ashford, D. Lonsway, J.B. Patel, Shepard CW, Daneshwar MI, Kaiser RM, Ashford DA, Lonsway D, Patel JB, R.E. Morey, J.G. Jordan, R.S. Weyant, M. Fischer// Clin Infect Dis. - 2004. - Vol. 38. - P. 799-804.
42. Pittet, L. F. Bordetella holmesii: Still Emerging and Elusive 20 Years On / L.F. Pittet, K.M. Posfay-Barbe // Microbiology Spectrum. - 2016. - Vol. 4, №2. - P. 1-12.
43. Dinu, S. Whooping cough in south-East Romania: a 1-year study / S. Dinu, S. Guillot, C.C. Dragomirescu, D. Drun, S. Lazar, G. Vancea, B.M. Ionescu, M.F. Gherman, A.F. Bjerkesrtand, V. Ungureanu, N. Guiso, M. Damian S. // Diagn Microbiol Dis. - 2014. - Vol.78. - P. 302-306.
44. Guthrie, J.L. Novel duplex real-time PCR assay detects Bordetella holmesii in specimens from patients with pertussis-like symptoms in Ontario, Canada. // J.L. Guthrie, A.V. Robertson, P. Tang, F. Jamieson, S.J. Drews // J Clin Microbiol. - 2010. - Vol. 48. - P. 1435-1437.
45. Njamkepo, E. Significant finding of Bordetella holmesii DNA in nasopharyngeal samples from French patients with suspected pertussis / E. Njamkepo, S. Bonacorsi, M. Debruyne, S.A. Gibaud, S. Guillot, N. Guiso // J Clin Microbiol. - 2011. Vol. 49. - P. 4347-4348.
46. Bottero, D. Bordetella holmesii in children suspected of pertussis in Argentina / D. Bottero, M.M. Griffith, C. Lara, D. Flores, L. Pianciola, M. Gaillard, M. Mazzeo, M.I. Zamboni, M.J. Spoleti, E. Anchart, D. Ruggeri, C. Sorhouet, S. Fiori, M. Galas, M.L. Tondella, D.F. Hozbor // Epidemiol Infect. - 2013. - Vol. 141. - P. 714-717.
47. Wei, Q. A cautionary tale from Colorado: Bordetella holmesii circulates and can lead to false positive results in commonly-used Bordetella pertussis PCR / Q. Wei, C.C. Robinson, M.A. Lovell, R.J. Hengartner, K.A. Kelly, K.D. Murry // J Mol Diagn. - 2010. - Vol.12. - P. 883.
48. Antila, M. Bordetella holmesii DNA is not detected in nasopharyngeal swabs from Finnish and Dutch patients with suspected pertussis / M. Antila, Q. He, C. De Jong, I. Aarts, H. Verbakel, S. Bruisten // J Med Microbiol. - 2006. - Vol.55. - P. 1043-1051.
49. Dalby, T. Evaluation of PCR methods for the diagnosis of pertussis by the European surveillance network for vaccine-preventable diseases (EUVAC.NET) / T. Dalby, N.K. Fry, K.A. Krogfelt, J.S. Jensen, Q. He // Eur J Clin Microbiol Infect Dis. - 2013. - Vol. 32. - P. 1285-1289.
50. Tatti, K.M. Qualitative assessment of pertussis diagnostics in United States laboratories / K.M. Tatti, S.W. Martin, K.O. Boney, K. Brown, T.A. Clark, M.L. Tondella // Pediatr Infect Dis J. - 2013. - Vol. 32. - P. 942-945.
51. Williams, M.M. Harmonization of Bordetella pertussis real-time PCR diagnostics in the United States in 2012 / M.M. Williams, Т.Н. Taylor, D.M. Warshauer, M.D. Martin, A.M. Valley, M.L. Tondella // J Clin Microbiol. - 2015. - Vol. 53. - P. 118-123.
52. Прадед, М.Н. ПЦР-диагностика инфекций, вызванных B.pertussis, B.parapertussis и B.bronchiseptica / М.Н. Прадед, СБ. Яцышина, Т.С Селезнева, С.В. Малинина, Н.В. Бирюлева, Т.Е. Любимова, Н.С Воробьева // Клиническая лабораторная диагностика. - 2013. - №1. - С. 53-56.
53. Прадед, М.Н. Клиническая апробация набора реагентов для диагностики коклюша методом ПЦР / М.Н. Прадед, С.Б. Яцышина, Т.С.Селезнева, Н.С. Воробьева, С.В. Малинина, Т.Е. Любимова, Л.А. Наумова, Т.Т. Козыренко, Л.В. Королева, Т.Т. Лазарова, Т.А. Гречанинова, Г.В. Забулаева, Т.В. Демакова, Н.С.Григорьева, М.А. Юферова, B.C. Лямина, Л.Н. Сушкова, И.Б. Блиман, Н.Н. Зверякина, Л.Ю. Жирнова // Молекулярная диагностика 2014: сб. тр. VIII Всерос. науч.-практ. конф. с междунар. участием в 2 т. - М.: ООО «Издательство МБА», 2014. - Т. 1. - Разд. 10. - С. 325-326.
54. Каратаев, Г.И. Инсерционная инактивация оперона вирулентности в популяции персистирующих бактерий Bordetella pertussis / Г.И. Каратаев, Л.Н. Синяшина, А.Ю. Медкова, Е.Г. Семин, З.В. Шевцова, А.З. Матуа, И.Г. Конджария, А.А. Амичба, Д.Т. Кубрава, З.Я. Миквабиа // Генетика. - 2016. - Т. 52, №4. - С. 422.
55. Медкова, А.Ю. Распространенность стертых форм коклюша и анализ фазовых состояний бактерий Bordetella pertussis / А.Ю. Медкова, Ю.С. Аляпкина, Л.Н. Синяшина, И.П. Амелина, Я.И. Алексеев, Г.И. Каратаев, А.Г. Боковой // Детские инфекции. - 2010. - Т. 9, №4. - С. 19-22.
56. Борисова, О.Ю. Ускоренный молекулярно-генетический метод выявления возбудителя коклюша / О.Ю. Борисова, Н.Т. Гадуа, М.С. Петрова, О.П. Попова, С.Ю. Комбарова, И.К. Мазурова, В.А. Алешкин // Медицинский альманах. - 2009. - №2. - С. 51-53.
57. Борисова, О.Ю. Прямой ускоренный метод выявления возбудителя коклюша / О.Ю. Борисова, М.С. Петрова, Н.Т. Гадуа, В.Г. Скачкова, B.C. Савинкова, О.П. Попова, И.К. Мазурова, А.В. Алешкин // Клиническая лабораторная диагностика. - 2010. - №5. - С. 53-55.
58. Патент № 2346987, Российская Федерация, МПК C12Q 1/68, C12N 15/10. Способ и набор для ускоренной диагностики коклюша / О.Ю. Борисова, И.К. Мазурова, С.Ю. Комбарова, Н.Т. Гадуа, М.С. Петрова, О.П. Попова, А.В. Алешкин; заявитель и патентообладатель ФГУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора. - №2007147797/13; заявл. 25.12.2007; опубл. 10.02.2009, Бюл. №5. - 6 с.
59. Патент № 2542396, Российская Федерация, МПК G01N 33/569. Способ и набор для ускоренной лабораторной диагностики коклюшной инфекции / О.Ю. Борисова, А.С. Пименова, А.В. Алешкин, М.С. Петрова, В.А. Алешкин; заявитель и патентообладатель ФБУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора. - №2013149234/15; заявл. 06.11.2013; опубл. 20.02.2015, Бюл. №5. - 8 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И НАБОР ДЛЯ УСКОРЕННОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КОКЛЮШНОЙ ИНФЕКЦИИ | 2013 |
|
RU2542396C1 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ТИПИРОВАНИЯ ШТАММОВ Bordetella pertussis | 2012 |
|
RU2495132C1 |
| Способ генотипирования B.pertussis из клинических образцов на основе вложенной ПЦР | 2023 |
|
RU2822353C1 |
| СПОСОБ И НАБОР ДЛЯ УСКОРЕННОЙ ДИАГНОСТИКИ КОКЛЮША | 2007 |
|
RU2346987C2 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ BORDETELLA PERTUSSIS | 2005 |
|
RU2299908C1 |
| СПОСОБ ДИАГНОСТИКИ КОКЛЮША И ОПРЕДЕЛЕНИЯ АВИРУЛЕНТНЫХ МУТАНТОВ ВОЗБУДИТЕЛЯ И ДИАГНОСТИЧЕСКИЙ НАБОР | 2011 |
|
RU2506316C2 |
| АТТЕНУИРОВАННЫЕ БАКТЕРИИ BORDETELLA PERTUSSIS, ВАКЦИНА ПРОТИВ ВОЗБУДИТЕЛЯ КОКЛЮША | 2010 |
|
RU2455024C1 |
| Способ и набор для диагностики дифтерии с верификацией токсигенных штаммов возбудителя | 2016 |
|
RU2623149C1 |
| ПОЛИНУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, КОДИРУЮЩАЯ СКОНСТРУИРОВАННЫЙ БЕЛОК ПЕРТАКТИН, ВЕКТОР, ВКЛЮЧАЮЩИЙ ТАКУЮ ПОСЛЕДОВАТЕЛЬНОСТЬ, И ВАКЦИННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ БЕЛОК ПЕРТАКТИНА ИЛИ ВЕКТОР | 2008 |
|
RU2499046C2 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ШТАММОВ БАКТЕРИЙ ПО ГЕНУ РИБОСОМАЛЬНОЙ РНК | 2008 |
|
RU2386695C1 |
Предложенная группа изобретений относится к области медицинской микробиологии. Предложены способ и набор для генодиагностики коклюша, содержащие реакционный буфер qPCRmix-HS, 25 mM MgCl2 и 9 праймеров: hIS1001F, hIS1001R, hIS1001P, IS481F, IS481R, IS481P, IS1001F, IS1001R, IS1001P. При наличии положительных сигналов по каналам Green (FAM) и Red (Су5) образцы идентифицируются как образцы, содержащие ДНК Bordetella holmesii. При наличии положительного сигнала по каналу Yellow (HEX) образцы идентифицируются как образцы, содержащие ДНК Bordetella parapertussis. При наличии положительного сигнала по каналу Red (Су5) образцы идентифицируются как образцы, содержащие ДНК Bordetella pertussis. Предложенная группа изобретений обеспечивает повышение эффективности обнаружения ДНК трех видов бордетелл - B.pertussis, B.parapertussis и В.holmesii методом ПЦР в реальном времени в мультиплексном формате. 2 н.п. ф-лы, 1 пр.
1. Способ генодиагностики коклюша и коклюшеподобных заболеваний, предусматривающий забор клинического материала из ротоглотки больного; выделение из него ДНК; проведение ПЦР в режиме реального времени в мультиплексном формате с использованием ПЦР-реакционной смеси, содержащей реакционный буфер qPCRmix-HS, 25 mM MgCl2 и 9 праймеров: hIS1001F, hIS1001R, hIS1001P, IS481F, IS481R, IS481P, IS1001F, IS1001R, IS1001P; амплификацию, включающую денатурацию при 95°С в течение 10 мин - 1 цикл, циклирование при 95°С - 10 сек, при 60°С - 60 сек повторно 50 циклов; анализ и интерпретацию результатов путем оценки по кривым накопления флуоресцентного сигнала по каждому из заданных для образцов каналов: Green (FAM), Yellow (HEX), Red (Су5), согласно которым при наличии положительных сигналов по каналам Green (FAM) и Red (Су5), соответствующих таковым контрольного образца ДНК штамма Bordetella holmesii, такие образцы идентифицируются как образцы, содержащие ДНК Bordetella holmesii; при наличии положительного сигнала по каналу Yellow (HEX), соответствующего таковому контрольного образца ДНК штамма Bordetella parapertussis, такие образцы идентифицируются как образцы, содержащие ДНК Bordetella parapertussis; при наличии положительного сигнала по каналу Red (Су5), соответствующего таковому контрольного образца ДНК штамма Bordetella pertussis, такие образцы идентифицируются как образцы, содержащие ДНК Bordetella pertussis.
2. Набор для генодиагностики коклюша, содержащий реакционную смесь для постановки ПЦР в режиме реального времени в мультиплексном формате, включающую qPCRmix-HS, 25 mM MgCl2 и 9 праймеров: hIS1001F, hIS1001R, hIS1001P, IS481F, IS481R, IS481P, IS1001F, IS1001R, IS1001P, a также контрольные образцы, содержащие ДНК штаммов Bordetella holmesii, Bordetella parapertussis и Bordetella pertussis.
| TATTI K.M | |||
| et al | |||
| Novel multitarget real-time PCR assay for rapid detection of Bordetella species in clinical specimens | |||
| J Clin Microbiol | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| СПОСОБ И НАБОР ДЛЯ УСКОРЕННОЙ ДИАГНОСТИКИ КОКЛЮША | 2007 |
|
RU2346987C2 |
| WO 2018024903 A1, 08.02.2018 | |||
| LOTFI M.N | |||
| et al | |||
| Molecular detection of Bordetella holmesii in two infants with pertussis-like syndrome: the first report from Iran | |||
| Iran J Microbiol | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2019-10-07—Публикация
2018-10-12—Подача