Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и может быть использовано в микробиологической промышленности для производства рекомбинантной глутаматоксалоацетаттрансаминазы человека для применения в здравоохранении, в частности для лечения ишемического инсульта.
Уровень техники
Показано, что при введении в кровь животных с моделируемым инсультом рекомбинантная глутаматоксалоацетаттранаминаза (рГОТ1 или rGOT1) приводит к падению уровня глутамата сыворотки. Падение уровня сывороточного глутамата ведет к ускорению выведения глутамата из головного мозга и обрывает патологический биохимический каскад, что приводит к уменьшению вторичного повреждения нейронов и ускоренному восстановлению неврологических функций. Разработка препарата для лечения ишемического инсульта на основе рекомбинантной глутаматоксалоацетаттранаминазы (рГОТ1) требует в первую очередь создания штамма-продуцента растворимого целевого белка. При этом продуцируемый штаммом-продуцентом белок должен обладать свойствами, предполагающими дальнейшую высокоэффективную аффинную очистку при сохранении высокой ферментативной активности белка.
Известны работы по получению активной формы рГОТ1 из Е. coli (Expression, purification and preliminary crystallographic studies of human glutamate oxaloacetate transaminase 1 (GOT1). Jiang X, Chang H, Zhou Y. Protein Expr Purif. 2015 Sep; 113:102-6). Однако, известные трансформированные штаммы характеризуются получением белка с очень низкой активностью (менее 5 Ед/мг) и уровнем экспрессии (менее 10%). Данный продукт используется в качестве концентрационного стандарта при постановке методик ИФА и Вестерн-блот. Однако, в связи с низкой удельной ферментативной активностью и низким уровнем экспрессии, он не применим в качестве действующего вещества препарата для лечения ишемического инсульта.
Раскрытие изобретения
Решаемой технической проблемой являлось создание штамма-продуцента активной формы глутаматоксалоацетаттрансаминазы (ГОТ1) человека с высоким уровнем экспрессии и ферментативной активности, достаточной для применения полученного белка в качестве действующего вещества препарата для лечения ишемического инсульта.
Техническим результатом является получение штамма с высоким уровнем экспрессии целевого белка в растворимой активной форме (более 40%), характеризующегося высоким уровнем активности фермента (не менее 35 Ед/мг).
Технический результат реализуется посредством получения штамма бактерий Escherichia coli rhGOT1-His - продуцента рекомбинантной активной глутаматоксалоацетаттрансаминазы человека с десятью C-концевыми гистидинами (hGOT1-His), который депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под № В-12963.
Настоящим изобретением предлагается штамм-продуцент Е. coli несущий плазмидную ДНК phGOT1-His со встроенным геном, кодирующим растворимую и активную рГОТ человека, который получен методом кальциевой трансформации клеток BL21(DE3)Rosetta2pLysS, при этом экспрессия белка осуществляется в периплазматическое пространство.
Краткое описание чертежей
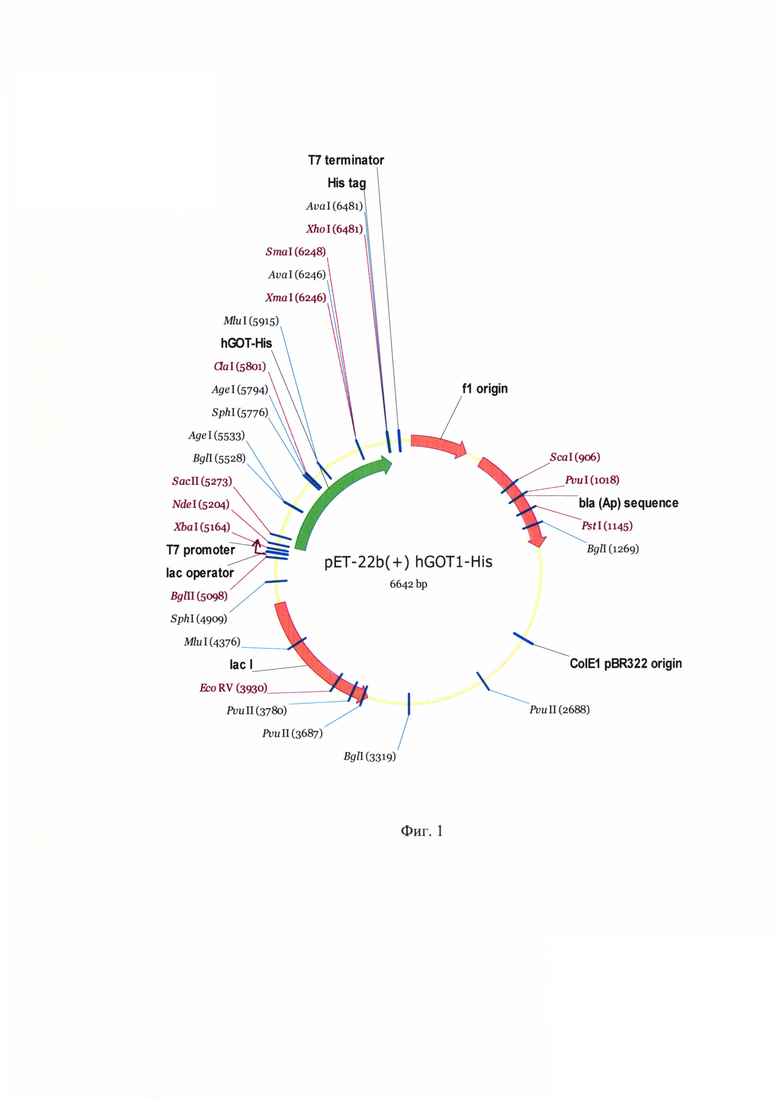
На фиг. 1 представлена физическая карта плазмиды pET22b(+)hGOT1-His.
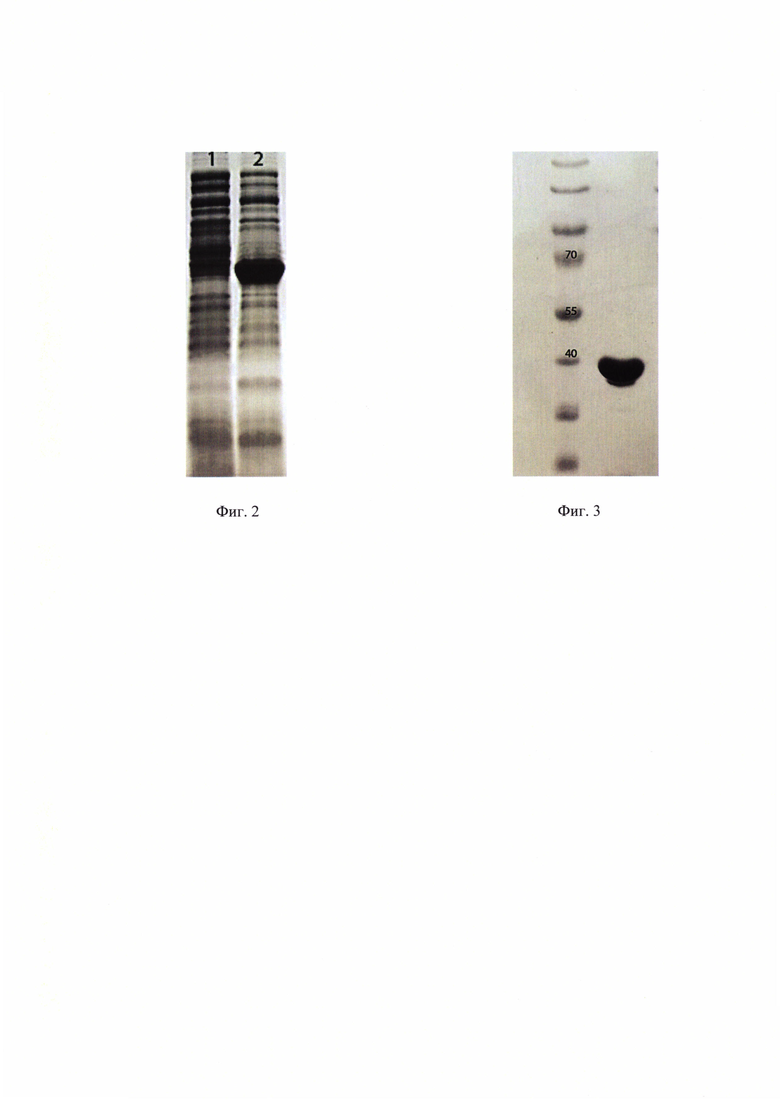
На фиг. 2, 3 представлены фотографии результатов электрофоретического анализа полученного белка в денатурирующем полиакриламидном геле, при этом на фиг. 2 представлены результаты, демонстрирующие уровень экспрессии целевого белка (рГОТ1) в штамме-продуценте, где 1 - уровень до индукции индуктора ИПТГ (изопропил-β-D-тиогалактопиранозид), 2 - после индукции ИПТГ, на фиг. 3 представлен результат, демонстрирующий степень очистки препарата (белка) рГОТ1.
Осуществление изобретения
Рекомбинантный штамм бактерий Escherichia coli BL21(DE3)Rosetta2pLysS содержит плазмидный вектор рЕТ22b с клонированной в него последовательностью GOT1 с десятью C-концевыми гистидинами и используемый для экспрессии гена GOT1 (нуклеотидная последовательность SEQ ID NO 1), кодирующей человеческую глутаматоксалоацетаттрансаминазу, имеющую аминокислотную последовательность SEQ ID NO 2
Условия хранения.
Штамм может храниться без потери полезных свойств при температуре -70°С в среде следующего состава: 1% бакто-триптона, 0,5% дрожжевого экстракта, 0,5% NaCl, рН 7,0, 15% глицерина, 7% ДМСО не менее 6 месяцев с обязательным пересевом не реже одного раза в 2 месяца.
Культурально-морфологические признаки штамма.
Клетки представляют собой короткие (длина 1-3 мкм, ширина 0,5-0,8 мкм) полиморфные подвижные грамотрицательные палочки, не образующие спор.
На мясопептонном бульоне дают обильный рост при значительном помутнении среды; осадок небольшой, сероватого цвета, легкоразбивающийся. Образуют пристеночное кольцо, пленка на поверхности бульона обычно отсутствует. На мясопептонном агаре колонии прозрачные с серовато-голубым отливом, легко сливающиеся между собой. На среде Эндо образуют плоские красные колонии средней величины с темным металлическим блеском.
Физиолого-биохимические свойства.
Факультативный аэроб. Температурный диапазон роста - 18-38°С. Оптимальная температура роста 37°С. Растет при значениях рН среды - 5,0-8,0. Оптимум рН роста - 6,5-7,5. Отрицательная реакция Фогис-Параскау; положительная реакция на образование индола; отрицательная реакция на образование сероводорода; отрицательная реакция на цитрат; отрицательная реакция на образование малоната; отрицательная реакция на образование мочевины; положительная реакция на лизиндекарбоксилазу; отрицательная реакция на орнитин; положительная реакция на газообразование; отрицательная реакция на синтез лактозы; положительная реакция на расщепление маннита.
Вид Е. Coli, к которому отнесен штамм BL21(DE3) Rosetta2pLysS (Novagen, USA), не числится в качестве патогенного в «Положении о порядке учета, хранения, обращения, отпуска и пересылки культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бактериальных токсинов, ядов биологического происхождения», отсутствует в списках патогенных бактерий по Положению Минздрава и в списках патогенных бактерий в Official Journal of the European Communities NC 217/3237, 24.08.92. Материнским штаммом является штамм E.Coli BL21(DE3) (Novagen, USA).
Характеристика штамма:
Семейство Enterobacteriaceae, Род Escherichia, Вид Escherichia coli;
Происхождение Protogene, источник выделения - желудочно-кишечный тракт крупного рогатого скота;
Генотип: F- ompT hsdSb(rB- mB-) gal dcm (DE3) pLysSRARE2 (CamR).
Биотехнологическая характеристика:
Штамм-продуцент содержит плазмидную ДНК, полученную на основе вектора pET22b (cat # 69744-3, Merck, USA), несущего N-концевую pelB сигнальную последовательность, позволяющую экспрессировать белок в периплазматическое пространство клетки, и C-концевую последовательность 10 гистидинов для последующей очистки методами металл-хелатной хроматографии (карта плазмиды представлена на фиг. 1).
Общие сведения о клонированном фрагменте, размер и включенные в его состав гены
Включенные в состав вектора гены: нуклеотидная последовательность полноразмерный рГОТ1, оптимизированная для экспрессии в Е. coli с сохранением аминокислотной последовательности человеческой рГОТ1 (5021 bp - 6255 bp), 6 His-tag (6256 bp - 6283 bp), для очистки полученного белка методом металл-хелатной хроматографии.
Генетическая карта клонированного фрагмента (размер - 1280 bp) - SEQ ID NO 1. Аминокислотная последовательность полученного белка - SEQ ID NO 2.
Продуцируемое полезное вещество - человеческая трансаминаза ГОТ1. Обладает всеми характерными признаками трансаминаз и катализирует обращение оксалоацетата в аспартат, перенося NH3 на первую молекулу. Уровень продуктивности штамма составляет 40% и более.
Пример осуществления изобретения.
Плазмидная ДНК phGOT1-His, несущая ген, кодирующий глутаматоксалоацетаттрансаминазу человека, создана в соответствии с представленной на фиг. 1 картой и заданными нуклеотидной и аминокислотной последовательностями с использованием стандартных методов молекулярной биологии известных из научно-технической литературы (Molecular Cloning: A Laboratory Manual (Third Edition) By Joseph Sambrook, Peter MacCallum, David Russell). Последовательность ГОТ1 была оптимизирована для экспрессии в Е. coli, синтезирована методом твердофазного синтеза (Genescript, USA, https://www.genscript.com/express_gene_synthesis.html) и клонирована по сайтам рестрикции NdeI и XhoI в вектор рЕТ22b.
Полученную плазмиду, содержащую ген hGOT1-His, трансформировали в клетки E.coli штамма BL21(DE3)Rosetta2pLysS (cat # 70956, Merck, USA) методом кальциево-фосфатной трансформации (Molecular Cloning: A Laboratory Manual (Third Edition) By Joseph Sambrook, Peter MacCallum, David Russell).
Проводили аналитическую экспрессию целевого белка с использованием химического индуктора ИПТГ (изопропил-β-D-тиогалактопиранозид). Для этого колонии E.coli, несущие ген целевого белка, выращивали на жидкой питательной среде LB с ампициллином в пробирках в течение 15±2 часов при температуре 37°С при постоянном покачивании в качалке. Далее добавляли 0.5 мл полученной клеточной суспензии в колбы объемом 250 мл, содержащие 50 мл жидкой среды LB с ампициллином. Растили при температуре 37°С при постоянном покачивании до оптической плотности 0.5±0.1 (OD540). Затем добавляли химический индуктор ИПТГ до конечной концентрации 1 мМ и наращивали далее в течение 3 часов при температуре 30°С при постоянном покачивании. Биомассу собирали центрифугированием в пластиковых пробирках на 50 мл (15 минут, 3000 g).
Проводили электрофоретический анализ полученного клеточного белка в полиакриламидном геле в денатурирующих условиях. Для этого к аликвоте клеток 10 мг добавляли 40 мкл воды, перемешивали на встряхивателе и добавляли 40 мкл 2х буфера для образцов для белкового денатурирующего электрофореза. Образец прогревали при 95°С в течение 4 минут и наносили на денатурирующий гель с концентрацией акриламида 12%. После проведения электрофоретического разделения гель промывали дистиллированной водой, после чего окрашивали краской, содержащей краситель Кумасси. Избыток краски отмывали раствором, содержащим этанол и уксусную кислоту.
Анализ наличия целевого белка проводили визуально, сравнивая набор клеточных белков в неиндуцированных клетках и клетках, индуцированных ИПТГ. Для определения молекулярной массы полученного целевого белка использовали набор белков с известными молекулярными весами (PageRuler™ Prestained Protein Ladder, 10 to 180 kDa, ThermoFisher, USA).
Проводили анализ количества целевого белка по отношению к общему клеточному белку. Для этого гель сканировали на сканере Epson 1660 Photo. Полученное изображение обрабатывали с помощью программы Onedscan.
Результаты экспрессии показали высокий уровень синтеза целевого белка, содержание целевого белка составило не менее 43% от общего клеточного белка (в отличие от аналогов, характеризующихся содержанием целевого белка, в среднем 20-25%) см. фиг. 2.
Для очистки белка клетки центрифугировали 15 мин при 3000 g, осадок обрабатывали ультразвуком на Sonics Vibra Cell (USA), полученную суспензию центрифугировали 20 мин при 18000 g и собирали супернатант. Выделение белка из супернатанта проводили при +4°С методом металл-хелатной хроматографии набором В-PER 6-His spin purification kit (ThermoFisher, USA) в соответствии с инструкцией производителя. Белок растворяли в фосфатно-солевом буфере рН 7,4.
Проводили электрофоретический анализ полученного белка в полиакриламидном геле в денатурирующих условиях. Для этого к аликвоте белка 10 мкг (40 мкл) добавляли 20 мкл 2х буфера для образцов для белкового денатурирующего электрофореза. Образец прогревали при 95°С в течение 4 минут и наносили на денатурирующий гель с концентрацией акриламида 12%. После проведения электрофоретического разделения гель промывали дистиллированной водой, после чего окрашивали краской, содержащей краситель Кумасси. Избыток краски отмывали раствором, содержащим этанол и уксусную кислоту. Чистота полученного белка составила 90% (см фиг. 3).
Определение активности полученного белка проводили на биохимическом анализаторе Konelab 500 с использованием набора для определения активности аспартатаминотрансферазы DiaSys ASAT (GOT) FS (IFCC mod) в автоматическом режиме определения в соответствии с инструкцией производителя. Активность препарата составила 37 Ед/мг.



Изобретение относится к биотехнологии и может быть использовано для получения глутаматоксалоацетаттрансаминазы человека. Предложен рекомбинантный штамм бактерий Escherichia coli rhGOT1-His ВКПМ № В-12963, продуцирующий глутаматоксалоацетаттрансаминазу человека с аминокислотной последовательностью SEQ ID NO:2, полученный трансформацией штамма BL21(DE3)Rosetta2pLysS плазмидой рЕТ22b, содержащей клонированную последовательностью GOT1 с десятью C-концевыми гистидинами. Изобретение обеспечивает высокий уровень экспрессии целевого белка в растворимой активной форме, характеризующегося высоким уровнем активности фермента. 1 з.п. ф-лы, 3 ил., 1 пр.
1. Рекомбинантный штамм бактерий Escherichia coli rhGOT1-His ВКПМ № В-12963, продуцент глутаматоксалоацетаттрансаминазы человека с аминокислотной последовательностью SEQ ID NO: 2, полученный трансформацией штамма BL21(DE3)Rosetta2pLysS плазмидой рЕТ22b, содержащей клонированную последовательностью GOT1 с десятью C-концевыми гистидинами.
2. Рекомбинантный штамм по п.1, характеризующийся тем, что в качестве последовательности GOT1 с десятью C-концевыми гистидинами используют нуклеотидную последовательность SEQ ID NO: 1.
| JIANG Х | |||
| ET AL | |||
| Expression, purification and preliminary crystallographic studies of human glutamate oxaloacetate transaminase 1 (GOT1) | |||
| Способ обработки грубых шерстей на различных аппаратах для мериносовой шерсти | 1920 |
|
SU113A1 |
| YOUNG C.L | |||
| ET AL | |||
| Recombinant protein expression and purification: A comprehensive review of affinity tags and microbial applications | |||
| Biotechnol | |||
| J | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Fusion Tags in Protein Purification, https://www.uq.edu.au/pef/content/fusion-tags-protein-purification, размещено в электронной среде 10.05.2016 на основании данных Web.archive.org см | |||
| https://web.archive.org/web/20160510171624/https://www.uq.edu.au/pef/content/fusion-tags-protein-purification | |||
| CN102807988 А, 05.12.2012 | |||
| БЕРЕЗОВ Т.Т | |||
| И ДР | |||
| Биологическая химия: Учебник/ Под ред | |||
| С.С | |||
| Дебова | |||
| -М.: Медицина, 1982, 752 с, см | |||
| с | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
Авторы
Даты
2019-10-15—Публикация
2018-06-20—Подача