Область техники
Группа заявляемых изобретений относится к биотехнологии, в частности к биосинтезу эндоглюканаз, и представляет собой рекомбинантный штамм Escherichia coli, способный синтезировать рекомбинантную секретируемую термостабильную эндоглюканазу ThiTeEgh12 и полученный путем трансформации штамма Escherichia coli BL21 (DE3) плазмидой pET-ThiTeEgh12, содержащей ген β-1,3-1,4-глкжаназы ThiTeEgh12 Thielavia terrestris ВКПМ F-144 под контролем промотора T7lac.
Уровень техники
Зерновые культуры составляют основу кормовых смесей для сельскохозяйственных животных. Некрахмалистые полисахариды (НКП), входящие в состав зерна, являются причиной высокой вязкости кормовых смесей, а также кормовой массы в желудочно-кишечном тракте (ЖКТ) животных, значительно снижая усвояемость и перевариваемость кормов. При этом НКП не расщепляются в пищеварительной системе моногастричных животных, таких как свиньи и птицы, а также в пищеварительной системе человека, из-за дефицита соответствующих ферментов. Основными НКП зерна являются β-глюканы -полисахариды, состоящие из единиц целлотриозы и целлотетрозы, связанных β-(1,3)-гликозидными связями. β-Глюканы из различных видов злаков или разных частей растения значительно варьируют по экстрагируемости, молекулярному весу и вязкости [Rykov S.V., Kornberger P., Herlet J., Tsurin N.V., Zorov I.N., Zverlov V.V., Liebl W., Schwarz W.H., Yarotsky S.V., Berezina O.V. Novel endo-(1,4)-β-glucanase Bgh12A and xyloglucanase Xgh12B from Aspergillus cervinus belong to GH12 subgroup I and II, respectively. Appl. Microbiol. Biotechnol, 2019, 103, 7553-7566]. Ферментативный гидролиз - эффективный способ снижения вязкости зерновых смесей. Ферменты, способные специфически гидролизовать β-1,4-гликозидные связи β-(1,3)-(1,4)-глюканов, называются β-(1,3)-(1,4)-глюканазами (эндоглюканазами) и относятся к группе с ферментативной активностью ЕС 3.2.1.73. Согласно данным базы CAZy ферменты с β-(1,3)-(1,4)-глюканазной активностью найдены в семействах гликозил-гидролаз 6, 7, 9, 12, 16, 17, 26, 51 (http://www.cazy.org). Ферменты, специфически гидролизующие β-(1,3)-(1,4)-глюкан, могут проявлять побочную активность на растворимой и нерастворимой целлюлозе, ксилоглюкане, лихенане и ламиранане.
Эндоглюканазы входят в состав мультиферментных препаратов для гидролиза НКП в кормовых смесях с целью снижения их вязкости (например, мультиферментные комплексы и композиции Vilzim, Алтавим, Кемзайм, Фидбест VGPro G). Поскольку кормовые смеси на основе комбикормов перед использованием часто запаривают горячей водой, содержащиеся в них кормовые ферменты могут разрушаться. В этом случае кормовые ферменты из термофильных микроорганизмов имеют значительное преимущество перед их аналогами из мезофильных источников.
В источниках информации имеются сведения о различных природных продуцентах эндоглюканаз: Aspergillus japonicus, Chrysosporium lucknowense, Trichoderma reesei [EP 2041294; Markov A.V., Gusakov A.V., Kondratyeva E.G., Okunev O.N., Bekkarevich A.O., Sinitsyn A.P. New effective method for analysis of the component composition of enzyme complexes from Trichoderma reesei. Biochemistry (Mosc), 2005, 70(6), 657-663; Qi H., Bai F., Liu A. Purification and characteristics of xyloglucanase and five other cellulolytic enzymes from Trichoderma reesei QM9414. Biochemistry (Mosc), 2013, 78(4), 424-430], Aspergillus aculeatus [RU 2303057], Penicillium oxalicum [Zhu, Z., Qu, J., Yu, L. Three glycoside hydrolase family 12 enzymes display diversity in substrate specificities and synergistic action between each other. Mol. Biol. Rep., 2019, 46(5), 5443-5454], Aspergillus oryzae [Matsuzawa Т., Kameyama A., Nakamichi Y., Yaoi K. Identification and characterization of two xyloglucan-specific endo-1,4-glucanases in Aspergillus oryzae. Appl. Microbiol. Biotechnol, 2020, 104(20), 8761-8773], Malbranchea cinnamomea strain CBS 343.55, Thielavia australiensis strain ATCC 28236 и Paecilomyces byssochlamydoides strain NRRL 3658 [WO 2014138983], Penicilliumfuniculosum [RU 2323254].
Рекомбинантные продуценты эндоглюканаз обладают рядом несомненных преимуществ, основным из которых является повышенная продуктивность рекомбинантных штаммов по целевому белку. В качестве реципиентов для гетерологичной экспрессии грибных эндоглюканазы используют штаммы грибов и бактерий. Например, собственные эндоглюканазы экспрессированы в Penicillium canescens [RU 2358756] и в Aspergillus niger [Hasper A.A., Dekkers E., van Mil M., van de Vondervoort P.J., de Graaff L.H. EglC, a new endoglucanase from Aspergillus niger with major activity towards xyloglucan. Appl. Environ. Microbiol, 2002, 68(4), 1556-1560]. К недостаткам штаммов-продуцентов на основе микроскопических грибов относят сложности с проведением генетических манипуляций на штаммах вследствие нестандартизированного и недостаточно разработанного генетического инструментария [Demain AL, Vaishnav P. Production of recombinant proteins by microbes and higher organisms. Biotechnol. Adv., 2009, 27(3), 297-306].
Описаны полученные методами генной инженерии штаммы дрожжей Pichia pastoris - продуценты рекомбинантной эндо-бета-1,4-D-глюканазы Aspergillus niger [Shumiao Z., Huang J., Zhang C., Deng L, Hu N, Liang Y. High-level expression of an Aspergillus niger endo-beta-l,4-glucanase in Pichia pastoris through gene codon optimization and synthesis. J. Microbiol. Biotechnol, 2010, 20(3), 467-473] PoCell2A, PoCell2B и PoCell2C Penicillium oxalicum [Zhu, Z., Qu, J., Yu, L. Three glycoside hydrolase family 12 enzymes display diversity in substrate specificities and synergistic action between each other. Mol. Biol. Rep., 2019, 46(5), 5443-5454], эндо-бета-1,3(4)-D-глюканазы Paenibacillus sp.F-40 [Yang P., Shi P., Wang Y., Bai Y., Meng K., Luo H., Yuan Т., Yao B. Cloning and overexpression of a Paenibacillus beta-glucanase in Pichia pastoris: purification and characterization of the recombinant enzyme. J. Microbiol. Biotechnol, 2007, 17(1), 58-66], эндоглюканаз из Aspergillus cervinus и Thielavia terrestris [Rykov S.V., Selimzyanova A.I., Nikolaeva A.Y., Lazarenko V.A., Tsurin N.V., Akentyev P.I., Zverlov V.V., Liebl W., Schwarz W.H., Berezina O.V. Unusual substrate specificity in GH family 12: structure-function analysis of glucanases Bghl2A and Xghl2B from Aspergillus cervinus, and Eghl2 from Thielavia terrestris. Appl. Microbiol. Biotechnol, 2022, 106, 1493-1509]. Недостатком штаммов-продуцентов на основе дрожжей является их способность к посттрансляционным модификациям, в частности, различным типам гликозилирования, что мешает получению белков в гомогенной форме, подходящей для биохимических исследований и кристаллизации.
Описаны полученные методами генной инженерии штаммы Escherichia coli - продуценты рекомбинантных эндоглюканаз из Bacillus subtilis [Huang Z., Ni G., Zhao X., Wang F., Qu M. Characterization of a GH8 β-1,4-Glucanase from Bacillus subtilis Bill and Its Saccharification Potential for Agricultural Straws. J. Microbiol. Biotechnol, 2021, 31(10), 1446-1454], Bacillus licheniformis, Lactobacillus fermentum и L. johnsonii [Sun Z-B., Xu J-L., Lu X., Zhang W., Ji C., Ren Q. Directed mutation of β-glucanases from probiotics to enhance enzymatic activity, thermal and pH stability. Arch. Microbiol, 2020, 202, 1749-1756], термостабильной β-(1,3/1,4)-глюканазы из Bacillus altitudinis [Mao S., Lu Z., Zhang C., Lu F., Bie X. Purification, characterization, and heterologous expression of a thermostable β-1,3-1,4-glucanase from Bacillus altitudinis YC-9. Appl Biochem. Biotechnol, 2013, 169, 960-975], термостабильной эндоглюканазы из Thermotoga naphthophila [Akram F., Haq I.U. Overexpression and characterization of TnCell2B, a hyperthermophilic GH12 endo-1,4-β-glucanase cloned from Thermotoga naphthophila RKU-10T. Anal. Biochem., 2020, 599].
Thielavia terrestris (анаморф: Acremonium alabamense) - широко распространенный ацидофильный и термофильный гриб, способный расти при повышенных температурах, в том числе в геотермальных источниках, при температуре до 55°С. Штаммы Т. terrestris являются важным источником гликозил-гидролаз для промышленной биотехнологии. В заявляемом изобретении ген термостабильной эндоглюканазы семейства 12 гликозил-гидролазы из штамма Т. terrestris ВКПМ F-144 гетерологично экспрессирован в штамме Escherichia coli, получен штамм-продуцент и разработан способ микробиологического синтеза термостабильной эндоглюканазы на основе этого штамма.
Ближайшим аналогом заявляемого штамма является рекомбинантный штамм Escherichia coli BL21 (DE3) - продуцент эндо-β-(1,4)-глюканазы семейства из Bacillus licheniformis АТСС 14580, кодируемой геном bgl С, интегрированным в рекомбинантную плазмиду рЕТ-22b под контроль промотора T7lac [Aftab S.
Cloning and expression of endo-1,4-β-glucanase gene from Bacillus licheniformis ATCC 14580 into Escherichia coli BL21 (DE 3). Afr. J. Biotechnol, 2011, 11(12), 2846-2854].
Ближайшим аналогом заявляемого способа микробиологического синтеза эндоглюканазы является способ синтеза рекомбинантной эндо-β-(1,4)-глюканазы при ферментации штамма Escherichia coli BL21 (DE3) [Aftab S. Cloning and expression of endo-1,4-β-glucanase gene from Bacillus licheniformis ATCC 14580 into Escherichia coli BL21 (DE 3). Afr. J. Biotechnol, 2011, 11(12), 2846-2854].
Технической проблемой, на решение которой направлена заявляемая группа изобретений, является расширение арсенала рекомбинантных эндоглюканаз, штаммов-продуцентов и способов микробиологического синтеза рекомбинантных эндоглюканаз.
Раскрытие сущности изобретения
Техническим результатом заявляемого изобретения является получение рекомбинантной эндоглюканазы из Thielavia terrestris, которая характеризуется высокими температурным максимумом активности и высокой термостабильностью.
Для достижения технического результата предложен рекомбинантный штамм Escherichia coli ВКПМ В-14340 - продуцент эндоглюканазы семейства GH12 ThiTeEgh12, имеющий аминокислотную последовательность SEQ ID NO 2. Предложен способ микробиологического синтеза эндоглюканазы семейства GE112 ThiTeEgh12, имеющий аминокислотную последовательность SEQ ID NO 2, предусматривающий культивирование рекомбинантного штамма бактерии Escherichia coli по п. 1 в аэробных условиях в подходящей питательной среде до максимального накопления целевого продукта.
Технический результат достигают путем:
- конструирования рекомбинантного штамма Escherichia coli ВКПМ В-14340 - продуцента эндоглюканазы семейства GH12 ThiTeEghl2 (SEQ ID NO 2), содержащего ген ThiTeEgh12 (SEQ ID NO 1), клонированный из гриба Thielavia terrestris ВКПМ F-144;
- разработки способа микробиологического синтеза эндоглюканазы, предусматривающего культивирование рекомбинантного штамма бактерии Escherichia coli, содержащего ген эндоглюканазы, в аэробных условиях в подходящей питательной среде до максимального накопления целевого продукта, отличающийся тем, что в качестве продуцента используют рекомбинантный штамм Escherichia coli ВКПМ В-14340, а целевым продуктом является эндоглюканаза семейства GH12.
Краткое описание чертежей
Изобретение проиллюстрировано следующими фигурами графических изображений:
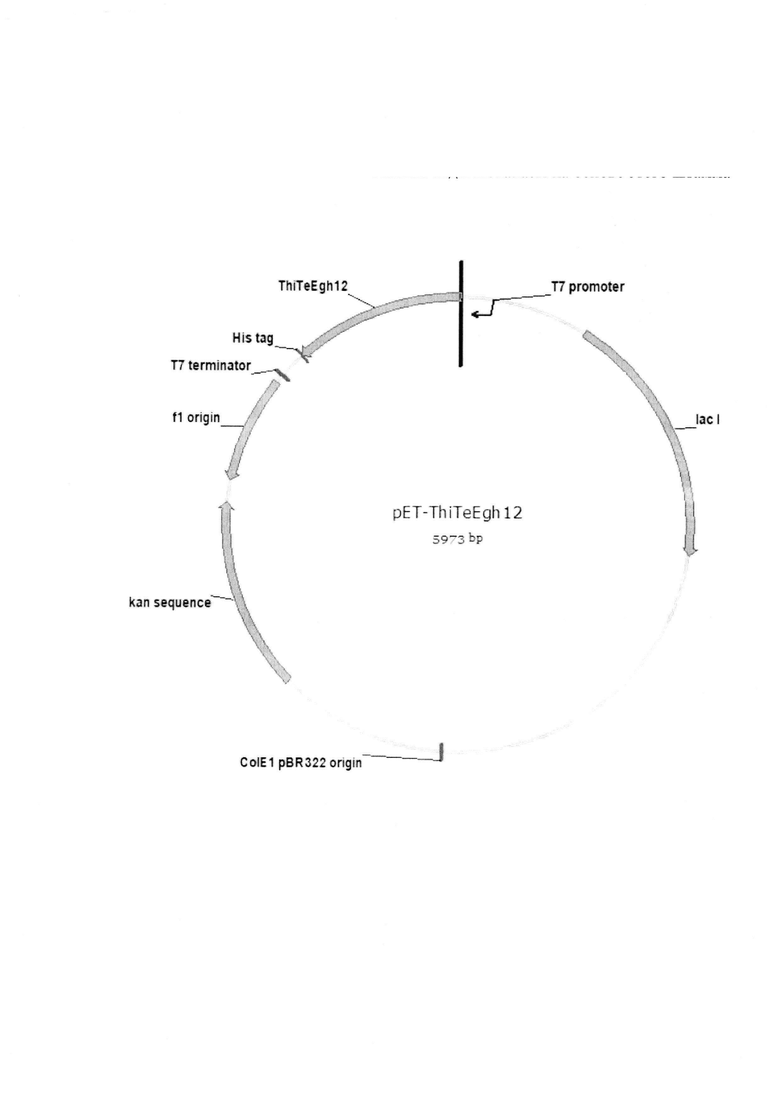
На фигуре изображена схема рекомбинантной плазмидной ДНК рЕТ- ThiTeEgh12. В состав плазмидного вектора pET-ThiTeEgh12 входят: кодирующая часть гена ThiTeEgh12 с полигистидиновой последовательностью на 3’-конце; кодирующая область гена кап, обеспечивающая устойчивость штаммов Е. coli к канамицину; кодирующая область гена lacI; репликон ColEl (pBR-322).
Осуществление изобретения
Процесс получения заявляемого штамма состоит из нескольких этапов:
конструирования плазмидной ДНК (плазмиды) pET-ThiTeEgh12, содержащей структурную часть гена эндоглюканазы семейства GH12 из Thielavia terrestris ВКПМ F-144,
- конструирования заявляемого рекомбинантного штамма Escherichia coli ВКПМ В-14340.
Этап 1. Конструирование плазмидной ДНК (плазмиды) pET-ThiTeEgh12 содержащей процессированный вариант гена эндоглюканазы ThiTeEgh12
Анализ транскриптома Т. terrestris (синоним Thermothielavioides terrestris, штамм NRRL 8126) выявил наличие последовательности THITE 2117762 (NCBI Ref. Seq. ХМ 003654584), гомологичной генам гликозил-гидролаз из семейства 12. На основе последовательности гена ТН1ТЕ_2117762 конструируют праймеры для амплификации кодирующей части гена эндоглюканазы семейства 12 из I terrestris ВКПМ F-144. В состав прямого и обратного праймеров вводят сайты рестриктаз NdeI и XhoI, соответственно, для клонирования в вектор рЕТ-28b.
Амплификацию кодирующей части гена эндоглюканазы семейства 12 из Т. terrestris ВКПМ F-144 (без интронов и сигнальной последовательности) проводят методом ПЦР на матрице кДНК штамма Т. terrestris ВКПМ F-144. Препарат кДНК получают синтезом одно- и двухцепочечных ДНК на матрице тотальной РНК штамма Т. terrestris ВКПМ F-144 методом обратной транскрипции. Полученный амплификацией фрагмент ДНК размером 696 пар нуклеотидов содержит кодирующую часть гена эндоглюканазы семейства 12 из штамма Т. terrestris ВКПМ F-144.
Плазмиду pET-ThiTeEgh12 конструируют путем клонирования полученного амплификацией фрагмента ДНК, содержащего структурную часть гена ThiTeEgh12, в вектор рЕТ-28b, разработанный для индуцируемой высокоэффективной экспрессии гомологичных и гетерологичных белков в Escherichia coli. Вектор рЕТ-28b размером 5367 пар оснований содержит промотор фага Т7; терминатор фага Т7; сайт множественного клонирования с кодирующей полигистидиновый хвост последовательностью на 3'-конце; кодирующую область гена lacI; кодирующую область гена кап, обеспечивающего устойчивость штаммов Е. coli к канамицину; репликон ColE1 (pBR-322).
Сконструированная плазмида pET-ThiTeEgh12 (SEQ ID NO 3), размером 5973 пар оснований, наряду с генами вектора рЕТ-28b, содержит кодирующую область гена ThiTeEgh12 эндоглюканазы под контролем промотора Т71ас (Фиг. 1).
Этап 2. Получение заявляемого рекомбинантного штамма Escherichia coli ВКПМ-14340.
В качестве штамма-реципиента используют штамм Escherichia coli BL21(DE3) (Agilent Technologies). Компетентные клетки данного штамма трансформируют плазмидой pET-ThiTeEgh12. В результате получают заявляемый рекомбинантный штамм Escherichia coli BL21(DE3)[pET-ThiTeEgh12], способный синтезировать эндоглюканазу семейства GH12 из Thielavia terrestris ВКПМ F-144.
Заявляемый штамм Escherichia coli депонирован во Всероссийской коллекции промышленных микроорганизмов как Escherichia coli ВКПМ В-14340.
Морфологические и физиолого-биохимические характеристики заявляемого штамма.
Заявляемый штамм Escherichia coli ВКПМ В-14340 имеет следующие морфологические и физиолого-биохимические характеристики:
Морфологические признаки: Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки: клетки хорошо растут на обычно используемых питательных средах. На агаризованной LB-среде (вес.%: триптон - 1, дрожжевой экстракт - 0,5, хлорид натрия - 1, агар - 1,5, остальное - вода) образуются гладкие, серые, блестящие, круглые с ровным краем колонии. Рост в жидкой среде LB характеризуется равномерным помутнением среды.
Физиолого-биохимические признаки: клетки штамма продуцента растут в диапазоне температур 20-42°С, оптимум составляет 37°С. Наиболее благоприятные для роста значения рН находятся в интервале 6,8-7,2. При росте в аэробных условиях культура может усваивать азот как органических соединений (пептон, триптон, аминокислоты, дрожжевой экстракт), так и аммонийных и нитратных солей. Углерод усваивается в форме углеводов и аминокислот. Клетки проявляют устойчивость к канамицину (до 50 мкг/мл), обусловленную наличием в плазмиде pET-ThiTeEgh12 гена kan.
Штамм Escherichia coli ВКПМ В-14340 синтезирует рекомбинантную эндоглюканазу ThiTeEgh12.
Способ микробиологического синтеза эндоглюканазы ThiTeEgh12 в общем виде.
Посевной материал, представляющий собой клетки рекомбинантного штамма- продуцента Escherichia coli ВКПМ В-14340, подготавливают путем инкубации в течение 16-18 часов при температуре 30-37°С с аэрацией на среде LB, содержащей 25 мг/мл канамицина. Выросшую культуру переносят в соотношении 1:100 (по объему) в среду LB, содержащую 25 мг/мл канамицина. Процесс культивирования ведут при температуре 30-37°С с аэрацией. Синтез целевого белка индуцируют путем добавления индуктора изопропил-β-D-1-тиогалактопиранозида (ИПТГ) до конечной концентрации 0,1 мМ при OD600=0,8-1,0 ОЕ. Биомассу клеток отделяют центрифугированием при об/мин и дважды промывают натрий-фосфатный буфером (вес.%: NaCl - 0,8, KCl - 0,02, Na2HPO4 - 0,15, КН2РО4 - 0,024, остальное - вода). Выделение эндоглюканазы проводят методом металл-афинной хроматографии [Green M.R., Sambrook J. Molecular Cloning: a Laboratory Manual. (Fourth Edition). Cold Spring Harbor Laboratory Press, 2012, 2028 р.]. Уровень синтеза целевого продукта определяют с помощью денатурирующего электрофореза в полиакриламидном геле [Green M.R., Sambrook J. Molecular Cloning: a Laboratory Manual. (Fourth Edition). Cold Spring Harbor Laboratory Press, 2012, 2028 р.]. Количество целевого белка составляет: в виде телец включения - 10 и более процентов от суммарного белка клетки в зависимости от количества индуктора, и не менее 330 единиц активности физиологически активного белка на 1 грамм влажной биомассы.
Пример 1. Конструирование рекомбинантной плазмидной ДНК рЕТ-ThiTeEgh12, содержащей процессированный вариант гена эндоглюканазы ThiTeEgh12
Все стандартные генно-инженерные и микробиологические манипуляции проводят по известным методикам [Green M.R., Sambrook J. Molecular Cloning: a Laboratory Manual. (Fourth Edition). Cold Spring Harbor Laboratory Press, 2012, 2028 p.].
Для получения полноразмерной, не содержащей интронов и сигнального пептида, кодирующей части гена ThiTeEgh12 проводят амплификацию на матрице кДНК, полученной с генетического материала культуры штамма Thielavia terrestris ВКПМ F-. кДНК получают синтезом одно- и двухцепочечных ДНК с матрицы тотальной РНК методом обратной транскрипции с использованием набора реагентов Mint (Евроген, Россия) по протоколам производителя. Выделение тотальной РНК производят с помощью реагента ExtractRNA (Евроген, Россия) по протоколам производителя. Амплификацию фрагмента, содержащего ген ThiTeEgh12, проводят методом ПЦР с помощью высокоточной полимеразы Phusion (Thermo Scientific) по протоколам производителя с использованием следующих праймеров: прямого - SP-Th.ter.GH12-NdeI - TTTCATATGGAACCCAGGCAGCAGGCAAC, и обратного - ASP-Th.ter.GH 12- XhoI - TTTCTCGAGCGAAACGTTGGCCGAGAACTGCGACACC. В прямой праймер был введен сайт NdeI, а в обратный - сайт XhoI. Фрагмент конструируют с таким расчетом, чтобы рамка считывания продолжилась полигистидиновой последовательностью на С-конце рекомбинантного белка, кодируемого последовательностью на векторе рЕТ-28b. Очистку полученного амплификацией фрагмента ДНК проводят с помощью гель-электрофореза в 1,8% агаровом геле с последующим выделением нужной полосы с помощью набора для выделения ДНК из агарозных гелей (Евроген, Россия).
Плазмиду pET-ThiTeEgh12 конструируют путем клонирования фрагмента, содержащего ген ThiTeEgh12 в вектор рЕТ-28b.
Гидролиз плазмиды рЕТ-28b и фрагмента ДНК, содержащего ген ThiTeEgh12, проводят рестриктазами NdeI и XhoI (Thermo scientific, EU). Очистку полученных фрагментов ДНК проводят с помощью гель-электрофореза в 1,8% агаровом геле с последующим выделением нужной полосы с помощью набора для выделения ДНК из агарозных гелей (Евроген, Россия). Лигирование проводят в реакционной смеси объемом 20 мкл, содержащей 20 нг ДНК вектора, 20 нг ДНК фрагмента и 5 ед. Т4 ДНК лигазы (Thermo scientific, EU), согласно методике производителя. Полученной лигазной смесью в количестве 5 мкл трансформируют компетентные клетки штамма Escherichia coli XL1 blue MRF' (Stratagene, США) (генотип - Δ(mcrA)183 Δ(mcrCB-hsdSMR-mrr)173 endA1 supE44 thi-1 recA1 gyrA96 relA1 lac [F' proAB lacIqZΔM15 Tn10 (Tetr)]). Плазмидную ДНК полученных трансформантов анализируют путем гидролиза рестриктазами NdeI и XhoI. В результате отбирают клоны, содержащие NdeI/XhoI фрагменты размером, равным исходному фрагменту вставки. Правильность клонирования подтверждают секвенированием вставки методом Сэнгера на генетическом анализаторе ABI 3500 (Life technology, США).
В конечном итоге получают рекомбинантную плазмиду pET-ThiTeEgh12 размером 5973 пар оснований, содержащую наряду с генами вектора рЕТ-28b, также ген ThiTeEgh12, кодирующий эндоглюканазу семейства GH12 из Thielavia terrestris ВКПМ F-144 (SEQ ID NO 3) (Фиг. 1).
Пример 2. Конструирование заявляемого штамма-продуцента эндоглюканазы ThiTeEgh12
С целью получения рекомбинантного штамма-продуцента эндоглюканазы, клетки штамма Escherichia coli BL21(DE3) (генотип - Е. coli В F- ompT hsdS(rB-mB-) dcm+Tetr gal λ(DE3)endA The) трансформируют плазмидой pET-ThiTeEgh12. Трансформацию проводят 10 нг плазмидной ДНК методом химической трансформации по стандартной методике [Green M.R., Sambrook J. Molecular Cloning: a Laboratory Manual. (Fourth Edition). Cold Spring Harbor Laboratory Press, 2012, 2028 р.]. Селекцию трансформантов проводят на LB-arape, содержащем канамицин (25 мг/л). В результате получают штамм Escherichia coli, синтезирующий эндоглюканазу ThiTeEgh12, модифицированную на С-конце полигистидиновым «хвостом» His-Tag с целью последующей очистки методом металл-афинной хроматографии.
Штамм-продуцент эндоглюканазы ThiTeEgh12 Escherichia coli BL21(DE3)[pET-ThiTeEgh12] депонирован во Всероссийской коллекции промышленных микроорганизмов как Escherichia coli ВКПМ В-14340.
Пример 3. Микробиологический синтез рекомбинантной эндоглюканазы ThiTeEgh12 с использованием заявляемого штамма
Исходным посевным материалом служит культура Escherichia coli ВКПМ В-14340, выращенная при температуре 30°С в течение 18 часов на среде LB, содержащей 25 мг/мл канамицина. Процесс биосинтеза ведут к колбах Эрленмейера объемом 750 мл, содержащих 100 мл среды LB с канамицином (25 мг/л). Посевной материал вносят в ферментационную среду в количестве, необходимом для создания его концентрации около 1 об.%. Процесс культивирования продуцента ведут при температуре 30°С на круговой качалке со скоростью вращения 130 об/мин до достижения оптической OD600=0,8-1,0 ОЕ (около 3 часов культивирования), после чего в культуральную жидкость добавляют ИПТГ до концентрации 0,1 мМ. Ферментацию продолжают при тех же условиях в течение еще 5 часов. Биомассу клеток отделяют центрифугированием при 3000 об/мин, промывают 0,1М натрий-фосфатным буфером и вновь центрифугируют.Контроль экспрессии осуществляют с помощью денатурирующего электрофореза в полиакриламидном геле.
Полученную биомассу ресуспендируют в 50 мМ фосфатном буфере, рН 8,0, содержащем 150 мМ хлорида натрия и 10 мМ имидазола. Клетки разрушают обработкой ультразвуком, проводя процедуру на льду. Целые клетки и нерастворимую фракцию отделяют центрифугированием (16000 об/мин, 25 мин). К супернатанту добавляют равный объем 50% суспензии Ni-NTA агарозы (Qiagen, EU), предварительно уравновешенной вышеуказанным буфером и интенсивно перемешивают в течение 1 часа. Колонку заполняют полученной суспензией, промывают промывочным буфером (50 мМ фосфатный буфер, 150 мМ хлорида натрия, 20 мМ имидазола) и элюируют целевой белок с колонки буфером для смыва (50 мМ фосфатный буфер, 150 мМ хлорида натрия, 400 мМ имидазола). Полученные фракции, содержащие эндоглюканазу ThiTeEgh12, объединяют и подвергают диализу против дистиллированной воды. Активность ферментных препаратов, содержащих эндоглюканазу, определяют по скорости гидролиза ксилоглюкана в следующих условиях: рН 4,6, температура 50 С, концентрация субстрата - 0,5 г/л. Рекомбинантная эндоглюканаза ThiTeEgh12, продуцируемая штаммом Escherichia coli ВКПМ В-14340, является термостабильной: при инкубации препарата фермента в течении 2 часов при 55, 60 и 65°С, рН 4.6, фермент при тестировании на β-глюкане сохраняет 100%, 80% и 60% ферментативной активности, соответственно. Рекомбинантная эндоглюканаза ThiTeEgh12, продуцируемая штаммом Escherichia coli ВКПМ В-14340, проявляет максимальную активность при 70°С, рН 4.6.
Количество полученного целевого белка в виде нерастворимых телец включения составляет 10% от суммарного белка клетки. Количество полученного целевого физиологически активного белка составляет 376 единицам активности на 1 грамм влажной биомассы.
Таким образом сконструирована плазмида для гетерологичной экспрессии гена ThiTeEgh12 в бактерии Escherichia coli, сконструирован рекомбинантный штамм Escherichia coli - продуцент эндоглюканазы ThiTeEgh12 и разработан способ микробиологического синтеза эндоглюканазы ThiTeEgh12 на основе штамма Escherichia coli и не уступающий по продуктивности ближайшему аналогу.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="РЕКОМБИНАНТНЫЙ
ШТАММ ESCHERICHIA COLI – ПРОДУЦЕНТ ЭНДОГЛЮКАНАЗЫ ИЗ ГРИБА THIELAVIA
TERRESTRIS И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЭНДОГЛЮКАНАЗЫ НА
ОСНОВЕ ЭТОГО ШТАММА.xml" softwareName="WIPO Sequence"
softwareVersion="2.2.0" productionDate="2023-01-25">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText></ApplicationNumberText>
<FilingDate></FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>00002</ApplicantFileReference>
<ApplicantName languageCode="ru">Национальный исследовательский
центр «Курчатовский институт» </ApplicantName>
<ApplicantNameLatin>National Research Center Kurchatov
Institute</ApplicantNameLatin>
<InventorName languageCode="ru">Селимзянова Алина
Ильдаровна</InventorName>
<InventorNameLatin>Selimzanova Alina Ildarovna</InventorNameLatin>
<InventionTitle languageCode="ru">РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA
COLI – ПРОДУЦЕНТ ЭНДОГЛЮКАНАЗЫ ИЗ ГРИБА THIELAVIA TERRESTRIS И СПОСОБ
МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ЭНДОГЛЮКАНАЗЫ НА ОСНОВЕ ЭТОГО
ШТАММА</InventionTitle>
<SequenceTotalQuantity>3</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>705</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..705</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Thielavia
terrestris</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggaacccaggcagcaggcaacactctgcgaccagtatggctactggt
ccggcaatggttacgaggttaacaacaacctttggggcgagagcgcagccacctcaggctcgcagtgcac
gtacgtggacggcagctcttctggcggcgtccaatggcacacgacgtggacgtggaacggcggagacaac
aacgtgaagagcttcgcctactcgggcaggcagatcaccaagggccagaagatctcctccatcagcagca
tacagacgtcggtctcgtggtcgtacagcaacaccaacatccgcgctgacgtcgcgtacgacatcttcac
cgccgcggaccccaaccactccaccagcagcggcgactacgagctcatgatctggctcgccaagtacggc
agcatctccccgatcggctcgtcggtcggcacggtcaacgtgggcggccgcagctgggacctgtgggtgg
gctacaacggcgccatgaaggtgttcagcttcgtcgcgccgagccccgtcaccagcttcagcgccaacgt
caaggacttcttcaactacctgcagaacaatcagggcttccccgccagcagccagaatctgcttactttc
caaatcggcacggaacccttcacgggcggaccggccaccttcacggtgtcgcagttctcggccaacgttt
cgctcgagcaccaccaccaccaccac</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>235</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..235</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Thielavia
terrestris</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MEPRQQATLCDQYGYWSGNGYEVNNNLWGESAATSGSQCTYVDGSSSGG
VQWHTTWTWNGGDNNVKSFAYSGRQITKGQKISSISSIQTSVSWSYSNTNIRADVAYDIFTAADPNHSTS
SGDYELMIWLAKYGSISPIGSSVGTVNVGGRSWDLWVGYNGAMKVFSFVAPSPVTSFSANVKDFFNYLQN
NQGFPASSQNLLTFQIGTEPFTGGPATFTVSQFSANVSLEHHHHHH</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>5973</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..5973</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q7">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tatggctgccgcgcggcaccaggccgctgctgtgatgatgatgatgatg
gctgctgcccatggtatatctccttcttaaagttaaacaaaattatttctagaggggaattgttatccgc
tcacaattcccctatagtgagtcgtattaatttcgcgggatcgagatctcgatcctctacgccggacgca
tcgtggccggcatcaccggcgccacaggtgcggttgctggcgcctatatcgccgacatcaccgatgggga
agatcgggctcgccacttcgggctcatgagcgcttgtttcggcgtgggtatggtggcaggccccgtggcc
gggggactgttgggcgccatctccttgcatgcaccattccttgcggcggcggtgctcaacggcctcaacc
tactactgggctgcttcctaatgcaggagtcgcataagggagagcgtcgagatcccggacaccatcgaat
ggcgcaaaacctttcgcggtatggcatgatagcgcccggaagagagtcaattcagggtggtgaatgtgaa
accagtaacgttatacgatgtcgcagagtatgccggtgtctcttatcagaccgtttcccgcgtggtgaac
caggccagccacgtttctgcgaaaacgcgggaaaaagtggaagcggcgatggcggagctgaattacattc
ccaaccgcgtggcacaacaactggcgggcaaacagtcgttgctgattggcgttgccacctccagtctggc
cctgcacgcgccgtcgcaaattgtcgcggcgattaaatctcgcgccgatcaactgggtgccagcgtggtg
gtgtcgatggtagaacgaagcggcgtcgaagcctgtaaagcggcggtgcacaatcttctcgcgcaacgcg
tcagtgggctgatcattaactatccgctggatgaccaggatgccattgctgtggaagctgcctgcactaa
tgttccggcgttatttcttgatgtctctgaccagacacccatcaacagtattattttctcccatgaagac
ggtacgcgactgggcgtggagcatctggtcgcattgggtcaccagcaaatcgcgctgttagcgggcccat
taagttctgtctcggcgcgtctgcgtctggctggctggcataaatatctcactcgcaatcaaattcagcc
gatagcggaacgggaaggcgactggagtgccatgtccggttttcaacaaaccatgcaaatgctgaatgag
ggcatcgttcccactgcgatgctggttgccaacgatcagatggcgctgggcgcaatgcgcgccattaccg
agtccgggctgcgcgttggtgcggatatctcggtagtgggatacgacgataccgaagacagctcatgtta
tatcccgccgttaaccaccatcaaacaggattttcgcctgctggggcaaaccagcgtggaccgcttgctg
caactctctcagggccaggcggtgaagggcaatcagctgttgcccgtctcactggtgaaaagaaaaacca
ccctggcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgaca
ggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtaagttagctcactcattaggcacc
gggatctcgaccgatgcccttgagagccttcaacccagtcagctccttccggtgggcgcggggcatgact
atcgtcgccgcacttatgactgtcttctttatcatgcaactcgtaggacaggtgccggcagcgctctggg
tcattttcggcgaggaccgctttcgctggagcgcgacgatgatcggcctgtcgcttgcggtattcggaat
cttgcacgccctcgctcaagccttcgtcactggtcccgccaccaaacgtttcggcgagaagcaggccatt
atcgccggcatggcggccccacgggtgcgcatgatcgtgctcctgtcgttgaggacccggctaggctggc
ggggttgccttactggttagcagaatgaatcaccgatacgcgagcgaacgtgaagcgactgctgctgcaa
aacgtctgcgacctgagcaacaacatgaatggtcttcggtttccgtgtttcgtaaagtctggaaacgcgg
aagtcagcgccctgcaccattatgttccggatctgcatcgcaggatgctgctggctaccctgtggaacac
ctacatctgtattaacgaagcgctggcattgaccctgagtgatttttctctggtcccgccgcatccatac
cgccagttgtttaccctcacaacgttccagtaaccgggcatgttcatcatcagtaacccgtatcgtgagc
atcctctctcgtttcatcggtatcattacccccatgaacagaaatcccccttacacggaggcatcagtga
ccaaacaggaaaaaaccgcccttaacatggcccgctttatcagaagccagacattaacgcttctggagaa
actcaacgagctggacgcggatgaacaggcagacatctgtgaatcgcttcacgaccacgctgatgagctt
taccgcagctgcctcgcgcgtttcggtgatgacggtgaaaacctctgacacatgcagctcccggagacgg
tcacagcttgtctgtaagcggatgccgggagcagacaagcccgtcagggcgcgtcagcgggtgttggcgg
gtgtcggggcgcagccatgacccagtcacgtagcgatagcggagtgtatactggcttaactatgcggcat
cagagcagattgtactgagagtgcaccatatatgcggtgtgaaataccgcacagatgcgtaaggagaaaa
taccgcatcaggcgctcttccgcttcctcgctcactgactcgctgcgctcggtcgttcggctgcggcgag
cggtatcagctcactcaaaggcggtaatacggttatccacagaatcaggggataacgcaggaaagaacat
gtgagcaaaaggccagcaaaaggccaggaaccgtaaaaaggccgcgttgctggcgtttttccataggctc
cgcccccctgacgagcatcacaaaaatcgacgctcaagtcagaggtggcgaaacccgacaggactataaa
gataccaggcgtttccccctggaagctccctcgtgcgctctcctgttccgaccctgccgcttaccggata
cctgtccgcctttctcccttcgggaagcgtggcgctttctcatagctcacgctgtaggtatctcagttcg
gtgtaggtcgttcgctccaagctgggctgtgtgcacgaaccccccgttcagcccgaccgctgcgccttat
ccggtaactatcgtcttgagtccaacccggtaagacacgacttatcgccactggcagcagccactggtaa
caggattagcagagcgaggtatgtaggcggtgctacagagttcttgaagtggtggcctaactacggctac
actagaaggacagtatttggtatctgcgctctgctgaagccagttaccttcggaaaaagagttggtagct
cttgatccggcaaacaaaccaccgctggtagcggtggtttttttgtttgcaagcagcagattacgcgcag
aaaaaaaggatctcaagaagatcctttgatcttttctacggggtctgacgctcagtggaacgaaaactca
cgttaagggattttggtcatgaacaataaaactgtctgcttacataaacagtaatacaaggggtgttatg
agccatattcaacgggaaacgtcttgctctaggccgcgattaaattccaacatggatgctgatttatatg
ggtataaatgggctcgcgataatgtcgggcaatcaggtgcgacaatctatcgattgtatgggaagcccga
tgcgccagagttgtttctgaaacatggcaaaggtagcgttgccaatgatgttacagatgagatggtcaga
ctaaactggctgacggaatttatgcctcttccgaccatcaagcattttatccgtactcctgatgatgcat
ggttactcaccactgcgatccccgggaaaacagcattccaggtattagaagaatatcctgattcaggtga
aaatattgttgatgcgctggcagtgttcctgcgccggttgcattcgattcctgtttgtaattgtcctttt
aacagcgatcgcgtatttcgtctcgctcaggcgcaatcacgaatgaataacggtttggttgatgcgagtg
attttgatgacgagcgtaatggctggcctgttgaacaagtctggaaagaaatgcataaacttttgccatt
ctcaccggattcagtcgtcactcatggtgatttctcacttgataaccttatttttgacgaggggaaatta
ataggttgtattgatgttggacgagtcggaatcgcagaccgataccaggatcttgccatcctatggaact
gcctcggtgagttttctccttcattacagaaacggctttttcaaaaatatggtattgataatcctgatat
gaataaattgcagtttcatttgatgctcgatgagtttttctaagaattaattcatgagcggatacatatt
tgaatgtatttagaaaaataaacaaataggggttccgcgcacatttccccgaaaagtgccacctaaattg
taagcgttaatattttgttaaaattcgcgttaaatttttgttaaatcagctcattttttaaccaataggc
cgaaatcggcaaaatcccttataaatcaaaagaatagaccgagatagggttgagtgttgttccagtttgg
aacaagagtccactattaaagaacgtggactccaacgtcaaagggcgaaaaaccgtctatcagggcgatg
gcccactacgtgaaccatcaccctaatcaagttttttggggtcgaggtgccgtaaagcactaaatcggaa
ccctaaagggagcccccgatttagagcttgacggggaaagccggcgaacgtggcgagaaaggaagggaag
aaagcgaaaggagcgggcgctagggcgctggcaagtgtagcggtcacgctgcgcgtaaccaccacacccg
ccgcgcttaatgcgccgctacagggcgcgtcccattcgccaatccggatatagttcctcctttcagcaaa
aaacccctcaagacccgtttagaggccccaaggggttatgctagttattgctcagcggtggcagcagcca
actcagcttcctttcgggctttgttagcagccggatctcagtggtggtggtggtggtgctcgagcgaaac
gttggccgagaactgcgacaccgtgaaggtggccggtccgcccgtgaagggttccgtgccgatttggaaa
gtaagcagattctggctgctggcggggaagccctgattgttctgcaggtagttgaagaagtccttgacgt
tggcgctgaagctggtgacggggctcggcgcgacgaagctgaacaccttcatggcgccgttgtagcccac
ccacaggtcccagctgcggccgcccacgttgaccgtgccgaccgacgagccgatcggggagatgctgccg
tacttggcgagccagatcatgagctcgtagtcgccgctgctggtggagtggttggggtccgcggcggtga
agatgtcgtacgcgacgtcagcgcggatgttggtgttgctgtacgaccacgagaccgacgtctgtatgct
gctgatggaggagatcttctggcccttggtgatctgcctgcccgagtaggcgaagctcttcacgttgttg
tctccgccgttccacgtccacgtcgtgtgccattggacgccgccagaagagctgccgtccacgtacgtgc
actgcgagcctgaggtggctgcgctctcgccccaaaggttgttgttaacctcgtaaccattgccggacca
gtagccatactggtcgcagagtgttgcctgctgcctgggttcca</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к биотехнологии. Предложен рекомбинантный штамм Escherichia coli ВКПМ В-14340, являющийся продуцентом эндоглюканазы семейства GH12 ThiTeEgh12, имеющей аминокислотную последовательность SEQ ID NO.: 2. Также предложен способ микробиологического синтеза эндоглюканазы семейства GH12 ThiTeEgh12, имеющей аминокислотную последовательность SEQ ID NO.: 2, предусматривающий культивирование указанного штамма Escherichia coli ВКПМ В-14340. Изобретение обеспечивает получение рекомбинантной эндоглюканазы из Thielavia terrestris, которая характеризуется высоким температурным максимумом активности и высокой термостабильностью. 2 н.п. ф-лы, 1 ил., 3 пр.
1. Рекомбинантный штамм Escherichia coli ВКПМ В-14340 - продуцент эндоглюканазы семейства GH12 ThiTeEgh12, имеющей аминокислотную последовательность SEQ ID NO 2.
2. Способ микробиологического синтеза эндоглюканазы семейства GH12 ThiTeEgh12, имеющей аминокислотную последовательность SEQ ID NO 2, предусматривающий культивирование рекомбинантного штамма бактерии Escherichia coli по п. 1 в аэробных условиях в подходящей питательной среде до максимального накопления целевого продукта.
| AFTAB S | |||
| ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| African Journal of Biotechnology, 9 February, 2012, Vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ПРИЕМНАЯ РАДИОСЕТЬ | 1925 |
|
SU2846A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Рекомбинантная секретируемая термостабильная бета-глюканаза, рекомбинантный штамм дрожжей Pichia pastoris - продуцент этой бета-глюканазы, способ микробиологического синтеза бета-глюканазы на основе этого штамма | 2020 |
|
RU2756331C1 |
| CN 104862290 B, | |||
Авторы
Даты
2024-01-11—Публикация
2022-12-27—Подача