Изобретение относится к области фармацевтики и медицины, конкретно к новым N-метоксибензильным производным даунорубицина формулы I, обладающим антипролиферативными свойствами,

где R=Н (а), ОСН3 (b),
и их фармацевтически приемлемым солям.
Изобретение может быть использовано для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток, в частности немелкоклеточного рака легкого, рабдомиосаркомы, карциномы кишечника, аденокарциномы молочной железы.
В настоящее время для лечения перечисленных заболеваний в медицинской практике широко применяется противоопухолевый препарат даунорубицин (II) [Машковский М.Д. Лекарственные средства. М.: Новая волна, 2016, с. 999].
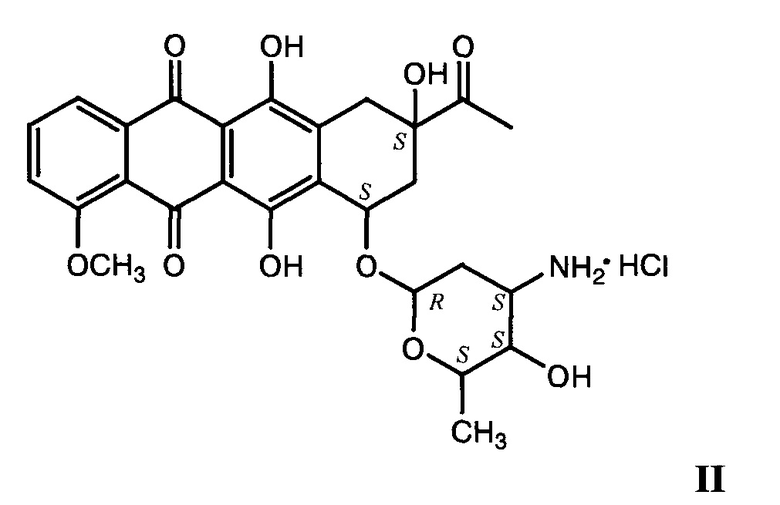
Однако это соединение обладает высокой кардиотоксичностью, его применение в химиотерапии рака сопряжено с рядом побочных эффектов, присущих соединениям антрациклиновой структуры [Woodman R.J., Cysyk R.L., Kline I., Gang M., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695; Thorn C.F., Oshiro C., Marsh S., Hernandez-Boussard Т., McLeod H., Klein Т.Е., Altman R.B. Pharmacogenetics & Genomics, 2011, 21 (7), 440-446].
Антипролиферативными свойствами обладает и целый ряд производных даунорубицина. Однако они так же, как и сам даунорубицин, проявляя антипролиферативную активность в субмикромолярных концентрациях, имеют высокую кардиотоксичность [Машковский М.Д. Лекарственные средства. М.: Новая волна, 2016, с. 998-201; Olsufyeva T.N., Tevyashova A.N., Trestchalin I.D., Preobrazhenskaya M.N., Platt D., Klyosov A.A. Carbohydrate Research, 2003, 338 (13), 1359-1367].
Существует потребность в расширении арсенала противоопухолевых средств за счет соединений, проявляющих сильное антипролиферативное действие в отношении различных опухолевых образований и характеризующихся при этом низкой токсичностью.
Такой потребности удовлетворяют наиболее близкие к заявляемым соединениям N-пиперонильные производные даунорубицина IIIa и IIIb, обладающие высокой антипролиферативной активностью и относительно низкой острой токсичностью [Брель В.К., Артюшин О.И., Шарова Е.В., Генкина Г.К., Виноградова Н.М., Моисеева А.А., Клочков С.Г., Аникина Л.В. Патент РФ №2642068; Бюл. №3 (2018)].

Задачей настоящего изобретения является создание новых, более эффективных, производных даунорубицина, обладающих широким спектром антипролиферативных свойств при относительно низкой острой токсичности.
Задача решается новыми N-метоксибензильными производными даунорубицина общей формулы

где R=Н (Ia), ОСН3 (Ib),
и их фармацевтически приемлемыми солями.
Указанные соединения обладают высокой антипролиферативной активностью, существенно превосходящей активность ближайших структурных аналогов IIIa и IIIb, содержащих 1,3-бенздиоксолилметильную группу при атоме азота даунорубицина, и относительно низкой острой токсичностью, сравнимой с токсичностью замещенных даунорубицинов IIIa и IIIb.
Заявляемые соединения формулы I, их физико-химические свойства и биологическая активность ранее не были известны.
Соединения формулы I получали восстановительным алкилированием даунорубицина ароматическими альдегидами аналогично описанному в [Masquelier М., Tirzitis G., Peterson C.O., Palsson M., Amolins A., Plotniece M., Plotniece A., Makarova N., Vitols S.G. Eur. J. Med Chem., 2000, 35 (4), 429-438] по приведенной ниже схеме, используя в качестве исходных соединений даунорубицина гидрохлорид и соответствующие 2,4-ди- и 2,4,5-триметоксибензальдегиды, а в качестве восстановителя - цианоборгидрид натрия:

Реакцию проводили в среде водного ацетонитрила при комнатной температуре (20-25°С) и получали соединение Ia с выходом 36%, а соединение Ib с выходом 47%.
Структура соединений Ia и Ib доказана данными спектроскопии ЯМР (1Н и 13С), а индивидуальность и химическая чистота - данными элементного анализа.
Исследование антипролиферативной активности заявляемых соединений показало наличие ингибирующего действия в отношении целого ряда опухолей мышечной ткани: рабдомиосаркомы (RD), карциномы кишечника (НСТ116), аденокарциномы молочной железы (MCF7) - и немелкоклеточного рака легкого (А549) (см. таблицу, в которой приведены IC50 - концентрации соединений, вызывающие 50%-ное ингибирование роста популяции клеток).

Анализ данных, приведенных в таблице, показывает, что заявляемые соединения существенно превосходят по величине антипролиферативного действия как ближайшие структурные аналоги, так и эталонный препарат - даунорубицин.
Анализ острой токсичности заявляемых соединений Ia и Ib показал, что их LD50 (при внутрибрюшинном введении мышам) составляет 112,0 и 59,0 мг/кг соответственно, т.е. они относятся к умеренно (Ia) и мало (Ib) токсичным веществам по классификации токсичности Сидорова [Сидоров К.К. О классификации токсичности ядов при парентеральных способах введения. - В сб.: Токсикология новых промышленных химических веществ (вып. 13). М.: Медицина, 1973, 47-51], тогда как даунорубицин относится к высокотоксичным веществам: его LD50 при внутрибрюшинном введении мышам составляет 1,8 мг/кг [Woodman R.J., Cysyk R.L., Kline I., Gang М., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695]. Таким образом, острая токсичность заявляемых соединений соответственно в 62 и 32 раза ниже острой токсичности широко применяемого препарата даунорубицина.
Сравнение заявляемых соединений Ia и Ib с ближайшими структурными аналогами, соединениями IIIa и IIIb, показывает, что соединение Ia более токсично, чем соединения IIIa и IIIb (правда, всего в 1,8 раза), а соединение Ib характеризуется чуть меньшей острой токсичностью, по сравнению с соединениями IIIa и IIIb. Однако по антипролиферативному действию заявляемые соединения Ia и Ib в 2, 5, 10, 220 и даже 1570 раз (в случае линии немелкоклеточного рака легкого А549) более эффективны, по сравнению с соединениями IIIa и IIIb, что позволяет заключить: новые N-метоксибензильные производные даунорубицина по изобретению обладают более высокими значениями химиотерапевтического индекса.
Сочетание широкого спектра эффективного антипролиферативного действия и относительно низкой острой токсичности заявляемых соединений свидетельствует о потенциальной возможности их использования для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.
Технический результат настоящего изобретения состоит в создании новых умеренно и малотоксичных производных даунорубицина, существенно превосходящих по антипролиферативному действию ближайшие структурные аналоги и эталонный препарат даунорубицин.
Для получения заявляемых соединений использовали следующие коммерческие реагенты и растворители: даунорубицин, 2,4-ди- и 2,4,5-триметоксибензальдегиды (Acros Organics), ацетонитрил, сульфат натрия (осушитель), силикагель для колоночной хроматографии, метанол, хлороформ (Acros Organics).
Настоящее изобретение иллюстрируется приведенными примерами и данными таблицы, которые не ограничивают объем заявляемого изобретения.
Пример 1. Получение (9S-цис)-9-ацетил-7-{[3-(2,4-диметоксибензил)амино-2,3,6-тридезокси-алъфа-L-ликсогексопиранозил]окси}-7,8,9,10-тетрагидро-6,9,11-тригидрокси-4-метокси-5,12-нафтацендиона (Ia)
В колбу, защищенную от света черной бумагой, помещают раствор 0,60 г (3,6 ммоль) 2,4-диметоксибензальдегида в смеси 6 мл CH3CN и 2 мл воды, к нему прибавляют 0,1 г (0,18 ммоль) даунорубицина гидрохлорида и перемешивают 30 мин при ~20°С,. после чего прибавляют 0,034 г (0,53 ммоль) NaBH3CN (содержание основного вещества не менее 98%) и перемешивают при той же температуре 2 ч. Реакционную смесь разлагают добавлением 15 мл воды и 15 мл CHCl3, органический слой отделяют, водный экстрагируют CHCl3 (3×15 мл). Объединенные органические экстракты промывают 30 мл воды, водный экстракт промывают CHCl3 (2×15 мл), органические экстракты объединяют и сушат Na2SO4. Растворитель удаляют на роторном испарителе, остаток очищают хроматографией на силикагеле (колонка:  см, d 2 см). Сначала хлороформом элюируют избыток альдегида, затем смесью CHCl3:МеОН=50:1,5 - целевой продукт ярко-красного цвета. После отгонки растворителей его сушат в вакууме над Р2О5 до постоянного веса. Получают 44 мг (36%) кристаллического соединения Ia, разлагающегося при нагревании до 200°С (до наступления плавления).
см, d 2 см). Сначала хлороформом элюируют избыток альдегида, затем смесью CHCl3:МеОН=50:1,5 - целевой продукт ярко-красного цвета. После отгонки растворителей его сушат в вакууме над Р2О5 до постоянного веса. Получают 44 мг (36%) кристаллического соединения Ia, разлагающегося при нагревании до 200°С (до наступления плавления).

1H ЯМР-спектр (CDCl3, 400,13 МГц), δ, м.д.: 1,39 (д, 3H, 3JHH=6,4 Гц, 5'-СН3); 1,74-1,77 и 1,91-1,95 (два м, 1Н+1H, 2'-СН2); 2,09 (дд, 1Н, 2JHH=14,0 Гц, 3JHH=4,0 Гц, 8-HB); 2,37 (д, 1H, 2JHH=14,0 Гц, 8-НА); 2,43 (с, 3H, 14-СН3); 2,87 и 3,16 (два д, 1Н+1H, 2JHH=16,0 Гц, 10-СН2); 2,95 (уш. с, 1H, 3'-Н); 3,58 и 3,64 (два д, 1Н+1H, 2JHH=14,4 Гц, N-CH2); 3,74 (уш. с, 6Н, 4''-ОСН3+6''-ОСН3); 3,79 (уш. с, 1Н, 4'-Н); 4,05 (кв, 1H, 3JHH=6,8 Гц, 5'-Н); 4,07 (с, 3H, 4-ОСН3); 4,80 (уш. с, 1Н, NH); 5,25 (уш. с, 1Н, 7-Н); 5,50 (уш. с, 1Н, 1'-Н); 6,31 (д, 1Н, 3JHH=7,8 Гц, 2''-Н); 6,35 (уш. с, 1H, 5''-Н); 7,01 (д, 1Н, 3JHH=7.8 Гц, 3''-Н); 7,36 (д, 1Н, 3JHH=8.0 Гц, 3-Н); 7,75 (т, 1Н, 3JHH=8,0 Гц, 2-Н); 7,99 (д, 1Н, 3JHH=8,0 Гц, 1-Н); 13,22 (уш. с, 1Н, 11-ОН); 13,87 (уш. с, 1H, 6-ОН). 13С ЯМР-спектр (CDCl3, 100,61 МГц), δ, м.д.: 17,10 (5'-СН3); 24,68 (14-СН3); 27,80 (2'-С); 33,14 (8-С); 34,66 (10-С); 48,08 (N-CH2); 54,97 (3'-С); 55,09 и 56,44 (4''-ОСН3+6''-ОСН3); 66,85 (4-ОСН3); 68,01 (5'-С); 69,47 (7-С); 76,69 (9-С); 98,20 (1'-С); 101,34 (5''-С); 103,53 (уш. с, 2''-С+3''-С); 110,94 (5а-С); 111,07 (11а-С); 118,18 (1-С); 119,51 (2-С); 120,14 (10а-С); 120,65 (1''-С); 130,91 (4а-С); 134,23 (6а-С); 134,32 (12а-С); 135,43 (3-С); 155,62 (11-С); 156,28 (6-С); 158,05 (4-С); 159,55 и 160,77 (6''-С+4''-С); 186,36 (5-С); 186,62 (12-С); 211,95 (13-С). Вычислено для C37H41NO13⋅0,5CHCl3 (%): С 58,69; Н 5,45; N 1,83. Найдено (%): С 58,21; Н 5,64; N 1,84.
Пример 2. Получение (9S-цис)-9-ацетил-7-{[3-(2,4,5-триметоксибензил)амино-2,3,6-тридезокси-альфа-L-ликсогексопиранозил]окси}-7,8,9,10-тетрагидро-6,9,11-три-гидрокси-4-метокси-5,12-нафтацендиона (Ib)
В колбу, защищенную от света черной бумагой, помещают раствор 0,65 г (3,6 ммоль) 2,4,5-триметоксибензальдегида в смеси 6 мл CH3CN и 2 мл воды, к нему прибавляют 0,1 г (0,18 ммоль) даунорубицина гидрохлорида и перемешивают 30 мин при ~20°С, после чего прибавляют 0,034 г (0,53 ммоль) NaBH3CN (содержание основного вещества не менее 98%) и перемешивают при той же температуре 2 ч. Реакционную смесь разлагают добавлением 15 мл воды и 15 мл CHCl3, органический слой отделяют, водный экстрагируют CHCl3 (3×15 мл). Объединенные органические экстракты промывают 30 мл воды, водный экстракт промывают CHCl3 (2×15 мл), органические экстракты объединяют и сушат Na2SO4. Растворитель удаляют на роторном испарителе, остаток очищают хроматографией на силикагеле (колонка: 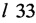 см, d 2 см). Сначала хлороформом элюируют избыток альдегида, затем смесью CHCl3:МеОН=50:1,5 - целевой продукт ярко-красного цвета. После отгонки растворителей его сушат в вакууме над Р2О5 до постоянного веса. Получают 60 мг (47%) кристаллического соединения Ib, разлагающегося при нагревании до 200°С (до наступления плавления).
см, d 2 см). Сначала хлороформом элюируют избыток альдегида, затем смесью CHCl3:МеОН=50:1,5 - целевой продукт ярко-красного цвета. После отгонки растворителей его сушат в вакууме над Р2О5 до постоянного веса. Получают 60 мг (47%) кристаллического соединения Ib, разлагающегося при нагревании до 200°С (до наступления плавления).

1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ, м.д.: 1,40 (д, 3H, 3JHH=6,4 Гц, 5'-СН3); 1,60-1,65 и 1,75-1,85 (два м, 1Н+1Н, 2'-СН2); 2,09 (дд, 1H, 2JHH=14,4 Гц, 3JHH=4,0 Гц, 8-HB); 2,36 (д, 1H, 2JHH=15,2 Гц, 8-НА); 2,42 (с, 3H, 14-СН3); 2,81 и 3,13 (два д, 1Н+1H, 2JHH=16,8 Гц, 10-СН2); 2,91-2,94 (м, 1H, 3'-Н); 3,61 и 3,69 (два д, 1Н+1H, 2JHH=14,4 Гц, N-CH2); 3,75, 3,76, 3,81 (три с, по 3H, 2''-ОСН3+4''-ОСН3+5"-ОСН3); 3,70-3,76 (м, 2Н, 4'-Н+5'-Н); 4,07 (с, 3H, 4-ОСН3); 4,69 (уш. с, 1Н, NH); 5,23 (уш. с, 1Н, 7-Н); 5,49 (уш. с, 1Н, 1'-Н); 6,44 и 6,71 (два с, по 1Н, 3''-Н+6''-Н); 7,37 (д, 1H, 3JHH=8.0 Гц, 3-Н); 7,75 (т, 1Н, 3JHH=8,0 Гц, 2-Н); 7,97 (д, 1Н, 3JHH=8,0 Гц, 1-Н); 13,82 (уш. с, 2Н, 11-ОН+6-ОН). 13С ЯМР-спектр (CDCl3, 100,61 МГц), δ, м.д.: 16,98 (5'-СН3); 24,61 (14-СН3); 30,07 (2'-С); 33,01 (8-С); 34,66 (10-С); 44,71 (N-CH2); 51,53 (3'-С); 55,79, 55,93 и 56,35 (2''-ОСН3 + 4''-ОСН3+5''-ОСН3); 66,34 (4-ОСН3); 68,01 (5'-С); 69,70 (7-С); 76,64 (9-С); 97,06 (1'-С); 100,90 (3''-С); 110,89 (5а-С); 111,04 (11а-С); 113,87 (6''-С); 118,17 (1-С); 118,51 (2-С); 119,51 (1''-С); 120,49 (10а-С); 134,09 (6а-С); 135,15 (12а-С); 135,47 (3-С); 142,51 (4''-С); 148,66 (5''-С); 151,56 (2''-С); 155,54 (11-С); 156,18 (6-С); 160,74 (4-С); 186,24 (5-С); 186,62 (12-С); 211,68 (13-С). Вычислено для C37H41NO13⋅0,3 CHCl3 (%): С 60,82; Н 5,53; N 1,95. Найдено (%): С 60,44; Н 5,65; N 2,16.
Биологическая активность полученных соединений
Определение острой токсичности
Острую токсичность соединений Ia и Ib оценивали по экспресс-методу Прозоровского на беспородных белых мышах массой 22-24 г [Прозоровский В.Б., Прозоровская М.П., Демченко В.М. Фармакология и токсикология, 1978, 41 (4); 497-502] при внутрибрюшинном способе введения. Результаты определения острой токсичности приведены в таблице. LD50 заявляемых соединений Ia и Ib составляет 112,0 (98-127) и 59,0 (41-85) мг/кг соответственно, что позволяет отнести соединение Ia к 4-му («Малотоксичные вещества»), а соединение Ib к 3-му классу веществ («Умеренно токсичные вещества») по классификации токсичности Сидорова [Сидоров К.К. О классификации токсичности ядов при парентеральных способах введения. - В сб.: Токсикология новых промышленных химических веществ (вып. 13). М.: Медицина, 1973, 47-51]. LD50 даунорубицина при внутрибрюшинном введении мышам составляет 1,8 мг/кг [Woodman R.J., Cysyk R.L., Kline I., Gang М., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695]. Это означает, что данное вещество относится ко 2-му классу («Высокотоксичные вещества») по классификации токсичности Сидорова.
Определение антипролиферативных свойств
Антипролиферативные свойства заявляемых соединений Ia и Ib были определены по МТТ-тесту [Mather J.P., Roberts Р.Е. Introduction to cell and tissue culture. Theory and technique.New York: Plenum Press, 1998, pp. 75-194]. Культуры клеток человека A549 (ATCC® CCL-185™), RD (АТСС® CC-136™) и HCT116 (ATCC® CCL-247™) выращивали в среде DMEM (НЛП «ПанЭко»), а клеток MCF7 (ATCC® НТВ-22™) - в среде ЕМЕМ (НЛП «ПанЭко»). В ростовую среду добавляли эмбриональную телячью сыворотку (HyClone®, Thermo Scientific) до концентрации 10%, L-глутамин (НЛП «ПанЭко») до концентрации 2 ммоль/л, гентамицин (ОАО «Биохимик») в качестве антибиотика до концентрации 1% и инкубировали при 37°С в атмосфере 5% CO2 и 95% воздуха. Клетки сеяли в 96-луночный планшет (CELLTREAT™) в количестве 1×104 клеток/200 мкл и культивировали при 37°С во влажной атмосфере, содержащей 5% CO2. После 24 ч инкубации к культурам клеток добавляли растворы тестируемых соединений различных концентраций (от 100 до 0,0012 мкмоль/л) и далее клетки культивировали в тех же условиях в течение 72 ч. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все соединения растворяли в ДМСО (PANREAC QUIMICA S.L.U). Конечная концентрация ДМСО в лунке не превышала 0,1% и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 0,1%. После инкубации в каждую лунку добавляли 20 мкл раствора 5 мг МТТ [бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия] (Sigma-Aldrich) в 1 мл ДМСО и дополнительно инкубировали в течение 2 ч. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм, за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50%-ное ингибирование роста популяции клеток (IC50), оценивали на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0. Результаты определения концентраций заявляемых соединений, вызывающих 50%-ное ингибирование роста популяции клеток, приведены в таблице. Как видно из таблицы, соединения общей формулы I обладают расширенным спектром антипролиферативных свойств как в отношении опухолей мышечной ткани: рабдомиосаркомы (RD), карциномы кишечника (НСТ116), аденокарциномы молочной железы (MCF7), так и в отношении немелкоклеточного рака легкого (А549), и, следовательно, могут быть использованы для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ПИПЕРОНИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2017 |
|
RU2642068C1 |
| ФОСФОНИЕВЫЕ СОЛИ НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2011 |
|
RU2466728C1 |
| Производные пиридоксина и ацетона с противоопухолевой активностью | 2017 |
|
RU2639879C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2550080C1 |
| НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2012 |
|
RU2513089C1 |
| Оксазолидиноны на основе производных пиридоксина, обладающие антибактериальной активностью | 2024 |
|
RU2836570C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | 2024 |
|
RU2839138C1 |
| Фосфорсодержащие бетаины с липофильными октильными заместителями у атома азота, обладающие бактерицидной активностью | 2022 |
|
RU2794901C1 |
| Антибактериальные средства на основе производных ципрофлоксацина | 2016 |
|
RU2636751C1 |
Изобретение относится к N-метоксибензильным производным даунорубицина общей формулы I, где R=Н, ОСН3. Технический результат: получены новые соединения, обладающие хорошими антипролиферативными свойствами при сравнительно низкой острой токсичности, которые могут найти применение в медицине для лечения онкологических заболеваний, в частности немелкоклеточного рака легкого, рабдомиосаркомы, карциномы кишечника, аденокарциномы молочной железы. 1 з.п. ф-лы, 1 табл., 2 пр.
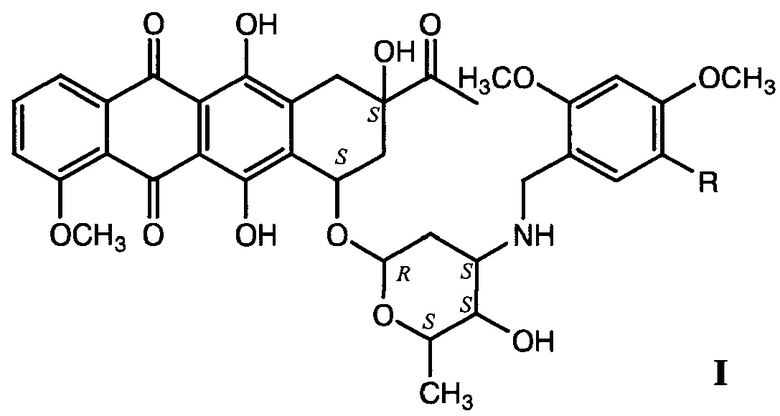
1. N-Метоксибензильные производные даунорубицина общей формулы

где R=Н, ОСН3,
и их фармацевтически приемлемые соли.
2. Соединения по п. 1, обладающие антипролиферативными свойствами и относительно низкой острой токсичностью.
| N-ПИПЕРОНИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2017 |
|
RU2642068C1 |
| Артюшин О.И., Шарова Е.В., Виноградова Н.М., Генкина Г.К., Моисеева А.А., Ходак А.А., Брель В.К | |||
| СИНТЕЗ НОВЫХ N-ПРОИЗВОДНЫХ ДАУНОРУБИЦИНА ОДНОСТАДИЙНЫМ ВОССТАНОВИТЕЛЬНЫМ АМИНИРОВАНИЕМ | |||
| Журнал общей химии | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Т | |||
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| РЕЛЕ | 1924 |
|
SU1051A1 |
| WO 2009124468 A1, 15.10.2009. | |||
Авторы
Даты
2019-10-28—Публикация
2019-07-09—Подача