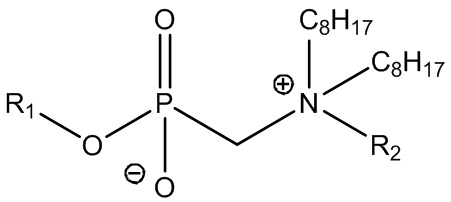
Изобретение относится к области фосфорорганической химии, в частности, к фосфорсодержащим бетаинам, а именно алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонатам общей формулы (I) :

(I),
R1 = C4H9 (бутил), R2 = CH3 (метил) (Ia),
R1 = C4H9 (бутил), R2 = C2H5 (этил) (Ib),
R1 = C4H9 (бутил), R2 = CH2C6H5 (бензил) (Ic),
R1 = i-C4H9 (изо-бутил), R2 = CH3 (метил) (Id),
R1 = i-C4H9 (изо-бутил), R2 = C2H5 (этил) (Ie),
R1 = i-C4H9 (изо-бутил), R2 = CH2C6H5 (бензил) (If),
обладающие бактерицидной активностью при низких концентрациях, которые могут найти применение в области ветеринарии и сельского хозяйства в качестве дезинфицирующих средств.
Ближайшими аналогами фосфорсодержащие бетаинов по структуре являются четвертичные аммониевые соли и их фосфорилированные производные.
Из исследованного уровня техники выявлены соединения, содержащие фрагменты четвертичных аммониевых солей.
Известен мирамистин ((бензилдиметил[3-(миристоиламино)пропил]-аммонийхлорид моногидрат) - антисептическое средство широкого спектра действия в отношении как грамположительных, так и грамотрицательных бактерий, патогенных грибов, простейших и некоторых видов вирусов. [Агафонов А.П., Скарнович М.О., Петрищенко В.А. и соавт. Изучение in vitro антивирусных свойств Мирамистина® в отношении вирусов кори и паротита // Антибиотики и химиотерапия. - 2005. - Вып. 50.- № 5-6. - С. 17-19., Криворутченко Ю.Л. Дозозависимая инактивация мирамистином внеклеточного вируса иммунодефицита человека // Вопр. вирусол. - 1998. - № 3. - С. 122-124.].
Недостатком известного препарата является то, что хотя антимикробная активность 0,01% мирамистина позволяет лечить больных с инфекционно-воспалительными заболеваниями, при двукратном разбавлении эффективность препарата значительно падает [Багаева В.В., Попова В.М., Пашкова Г.С., Исаджанян К.Е., Никитин В.В., Жиленков Е.Л. Изучение эффективности и безопасности применения антимикробных средств // Research'n Practical Medicine Journal. - 2015. - Т.2. - №3. - С. 35-42].
Известен аналог по назначению - препарат Хлоргексидин, который эффективен против грамположительных бактерий, резистентных микроорганизмов, включая устойчивый к метициллину золотистый стафилококк, устойчивый к ванкомицину энтерококк, стрептококки и синегнойную палочку [WHO Guidelines Approved by the Guidelines Review Committee. WHO Guidelines on Hand Hygiene in Health Care: First Global Patient Safety Challenge Clean Care Is Safer Care. Geneva: World Health Organization; 2009].
Недостатком известного препарата является то, что он несколько менее активен против грамотрицательных бактерий, и кроме, того, антисептическая обработка поверхности кожи 0,05% водным раствором хлоргексидина биглюконата при катетеризации центральных вен менее эффективна по сравнению с 70% раствором этилового спирта [Ионов, О.В. / Раствор хлоргексидина биглюконата и этиловый спирт: какой из антисептиков эффективнее у новорожденных? // О.В. Ионов, И.В. Никитина, А.Р. Киртбая, Е.Н. Балашова, А.А. Ленюшкина, Л.А. Любасовская, Ю.В. Родченко, Т.В. Припутневич, В.В. Зубков, Д.Н. Дегтярев. - Неонатология: новости, мнения, обучение. - 2017. - №1. - 79-85]
Известен аналог по назначению - бензалкония хлорид (алкилдиметилбензиламмония хлорид) - антисептическое средство, относящееся к классу четвертичных аммониевых солей [Янгсон Р.М. Медицинский энциклопедический словарь (Collins), М.: АСТ Астрель, 2006, 1375 с.].
Недостатком известного препарата является то, что выявлены сведения о его цитотоксическом действии на кожно-мышечные и легочные фибропласты эмбриона человека. [Еропкина Е.М., Афиногенов Г.Е., Еропкин М. Ю. Сравнительное исследование антимикробного и цитотоксического действия антисептиков in vitro с применением модели культуры эмбриональных фибробластов человека // Токсикологический вестник. - 1997. - Т. 2. - С. 12-17].
Известен аналог по назначению хлорид деквалиния - антимикробное средство широкого бактерицидного действия. [Mendling W, Weissenbacher E.R., Gerber S.,V. Prasauskas, P Grob Use of locally delivered dequalinium chloride in the treatment of vaginal infections: a review // Arch Gynecol Obstet. - 2016. - V. 293, №3. - P. 469-84].
Недостатком известного препарата является то, что в ряде источниках сообщается о его токсичности [G. Gamboa-Vujicic, D.A. Emma, S.Y. Liao, C. Fuchtner, A. Manetta Toxicity of the Mitochondria1 Poison Dequalinium Chloride in a Murine Model System // J. Pharm. Sci. 1993. - V. 82. - P. 231-235, Tischer M., Pradel G., Ohlsen K., U. Holzgrabe Quaternary Ammonium Salts and Their Antimicrobial Potential: Targets or Nonspecific Interactions? // J. Chem. Med. Chem. - 2012. - V. 7, Iss. 1. - P. 22-31].
Известен аналог по назначению октенидин дигидрохлорид, обладающий более сложной структурой, чем у типичных соединений этого класса: два пиридиновых атома азота, связанных алкильным мостиком, имеют алкиламиновые заместители в пара-положении [Vereshchagin A.N. Quaternary Ammonium Compounds (QACs) and Ionic Liquids (ILs) as Biocides: From Simple Antiseptics to Tunable Antimicrobials / A.N. Vereshchagin, N.A. Frolov, K.S. Egorova, M.M. Seitkalieva, V.P. Ananikov // Int. J. Mol. Sci. - 2021. - V. 22, Iss. 13. - P. 1-74.] Благодаря своей молекулярной структуре проявляет широкий спектр антибактериальной активности, воздействуя на тест-культуры S. aureus, S. epidermidis, P. mirabilis, K. pneumoniae, E. coli, P. aeruginosa и др. [Bailey, D.M. Bispyridinamines: A new class of topical antimicrobial agents as inhibitors of dental plaque. D.M. Bailey, C.G. DeGrazia, S.J. Hoff, P.L. Schulenberg, J.R. O'Connor, D.A. Paris, A.M. Slee // J. Med. Chem. - 1984. - 27. - 1457-1464].
Недостатком известного технического решения является то, что при использовании препаратов, содержащих октенидин, возможно возникновение аллергических реакций [Bührer, C. Use of 2% 2-phenoxyethanol and 0.1% octenidine as antiseptic in premature newborn infants of 23-26 weeks gestation / C. Bührer, S. Bahr, J. Siebert, R. Wettstein, C. Geffers, M. Obladen // J Hosp Infect. 2002;51:305-307].
Известен аналог по назначению - цетилпиридиния хлорид, который является часто используемым антимикробным препаратом из группы четвертичных соединений аммония, который оказывает бактерицидное действие на грамположительные и грамотрицательные бактерии, а также действует как консервант. Препарат широко используется в стоматологической практике и входит в состав многих безрецептурных продуктов, таких как жидкости для полоскания рта или средства для ухода за зубами.
Недостатком известного технического решения является то, что хотя результаты исследований исследований указывают на отсутствие долгосрочного воздействия препарата на микробиоту полости рта или кожи в течение заданных периодов времени, опубликованных данных слишком мало, чтобы сделать вывод о том, что долгосрочное воздействие в низких концентрациях может вообще не иметь побочных эффектов. Кроме того, риск появления устойчивых к препарату бактерий в ротовой полости до сих пор систематически не изучался. [Mao, X. Cetylpyridinium Chloride: Mechanism of Action, Antimicrobial Efficacy in Biofilms, and Potential Risks of Resistance / X. Mao, D.L. Auer, W. Buchalla, K.A. Hiller, T. Maisch, E. Hellwig, A. Al-Ahmad, F. Cieplik // American Society for Microbiology Antimicrobial Agents and Chemotherapy. - 2020. - V. 64, - Is. 8. - 1-14].
Кроме того, известное соединение обладает и иными недостатками, а именно - выработка к нему резистентности и достаточно высокая токсичность - ЛД 50 цетилпиридиния хлорида на мышах при пероральном введении, которая составляет 108 мг/кг, что соответствует 2 классу токсичности по Измерову [Н.Ф. Измеров, И. В. Саноцкий, К.К. Сидоров Параметры токсикометрии промышленных ядов при однократном воздействии / Москва: Медицина, 1977. - 240 с., Bodor N. Labile quaternary ammonium salts as soft antimicrobials // J. Med. Chem. - 1980. - V.23, Is. 5. - P. 469-474].
Известны аналоги по структуре, содержащие в молекуле аминофосфорильный фрагмент и фрагмент четвертичной аммониевой соли [USP 4983750 США. Phosphobetaines, methods for their synthesis and their use especially for industrial purposes / Giersberg J., Kollmeier H. // 1991], заявленные в патенте в качестве поверхностно-активных веществ для использования в промышленных целях.
Недостатком известных соединений является отсутствие данных об их бактерицидной активности.
Таким образом, анализ уровня техники, проведенный заявителем, показал, что структурных аналогов заявленных соединений общей формулы (I), на основе алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонатов, обладающих бактерицидной активностью, из выявленного уровня техники на дату подачи настоящей заявки не выявлено, поэтому формула изобретения составлена без ограничительной части.
Техническим результатом заявленного технического решения являются новые соединения - алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонаты (I), не требующие сложных процедур синтеза и очистки, обладающие высокой бактерицидной активностью, расширяющие арсенал известных средств указанного назначения.
Сущностью заявленного технического решения являются фосфорсодержащие бетаины алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонаты общей формулы (I)

(I),

обладающие бактерицидной активностью.
Заявленное техническое решение иллюстрируется чертежом, на котором приведена Таблица бактерицидной активности заявленных алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонатов формулы (I) по сравнению с известными препаратами.
Далее заявителем приведено описание заявленного технического решения.
Сущностью заявленного технического решения являются фосфорсодержащие бетаины общей формулы (I)

(I),
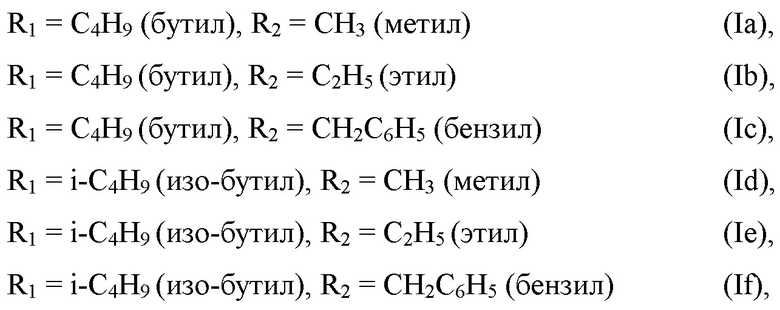
обладающие бактерицидной активностью.
Заявленное техническое решение иллюстрируется Фиг., на которой приведена Таблица бактерицидной активности заявленных алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонатов формулы (I) по сравнению с известными препаратами.
Далее заявителем приведено описание заявленного технического решения.
Заявленный технический результат достигается получением фосфорсодержащих бетаинов алкил[(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонатов формулы (I), обладающих бактерицидной активностью.
Заявленные соединения получают в три этапа (Схема 1).
1 этап: Берут диалкилфосфит, (II) параформ и диоктиламин в мольном соотношение диалкилфосфит : парафом : диоктиламин = 1:1:1, добавляют ацетонитрил в качестве растворителя и п-толуолсульфокислоту в качестве катализатора, смешивают и нагревают на водяной бане при 60°С до полного растворения параформа. Затем повышают температуру до кипения смеси (Т = 125-133°С) и греют при энергичном перемешивании в течение часа. Растворитель отгоняют на роторном испарителе. Получают аминофосфонат (III).
2 этап: Проводят реакцию щелочного гидролиза полученного на 1 этапе аминофосфоната (III). Для этого к аминофосфонату (III) добавляют избыток 50% водного раствора гидроксида калия в 1,4-диоксане в мольном соотношении аминофосфонат (III) : гидроксид калия = 1:1.2 и нагревают при температуре кипения 1,4-диоксана в течение 10 часов. Растворитель отгоняют на роторном испарителе, продукт высушивают в вакуум-эксикаторе. Получают калиевую соль аминофосфоната (IV).
3 этап: Проводят алкилирование полученной на 1 этапе калиевой соли аминофосфоната (IV) алкилйодидами (бензилхлоридом) (V). Для этого к калиевой соли аминофосфоната (IV) добавляют алкилйодид (бензилхлорид) в пропаноле-2 в мольном соотношении соединение (IV) : соединение (V) = 1:1 и нагревают при температуре 60 °С в течение трех часов. Растворитель отгоняют на роторном испарителе.
Очистку полученных соединений проводят следующим образом:
1. Растворяют полученные продукты в хлороформе и наблюдают выпадение оставшегося в смеси галогенида калия.
2. Осадок отделяют центрифугированием, затем удаляют растворитель на роторном испарителе.
3. Продукты очищают декантацией петролейным эфиром и ацетонитрилом и высушивают в вакуум-эксикаторе.
Получают заявленное соединение формулы (I).
Далее заявителем приведено описание исходных реагентов.
Дибутилфосфит является коммерчески доступным соединением [https://chimmed.ru/products/dibutyl-phosphite-id=4288601].
Диизобутилфосфит получают из 2-метилпропанола-1 и треххлористого фосфора. Метод синтеза диалкилфосфитов описан в работе [Кормачев, В.В. Препаративная химия фосфора / В.В. Кормачев, М.С. Федосеев. Пермь: УрО РАН. 1992. - 457 с].
Метилйодид является коммерчески доступным соединением [https://chemline.ru/catalog/product-catalog/metil-yodistyy/].
Этилйодид является коммерчески доступным соединением [https://chemstore.spb.ru/catalog/khimicheskie-reaktivy/etil-yodistyy-yodetan.html].
Бензилхлорид является коммерчески доступным соединением [https://chimmed.ru/products/1-id=615341]
Диоктиламин является коммерчески доступным соединением [http://www.acros.com/DesktopModules/Acros_Search_Results/Acros_Search_Results.aspx?search_type=CatalogSearch&SearchString=dioctylamine].
Гидроксид калия является коммерчески доступным соединением [https://chimmed.ru/products/kaliya-gidroksid-hlopya-pure-ep-nf-id=410501].
Параформ является коммерчески доступным соединением [https://pcgroup.ru/products/paraformaldegid-91-n/].
Далее заявителем приведены примеры получения заявленных соединений.
Пример 1. Получение бутил [(N-метил-N,N-диоктиламмонио)метил]фосфоната (Ia) (Схема 2).
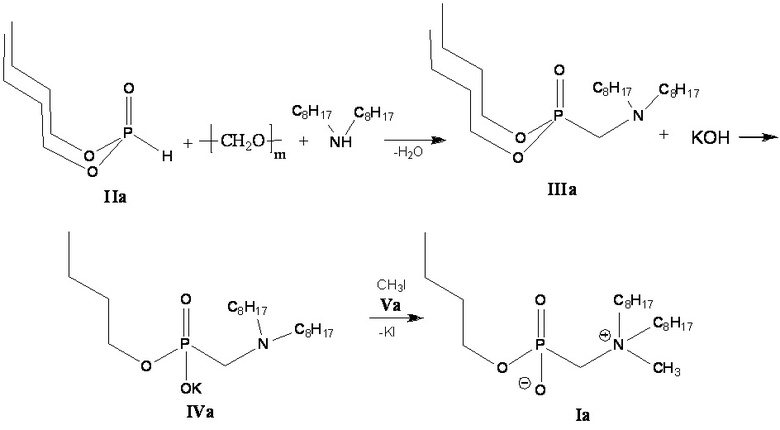
Схема 2
1-й этап: Получение дибутил ((диоктиламино)метил)фосфоната (IIIa).
Эквимольное количество реагентов, например, по 0.05 моль дибутилфосфита, параформа, диоктиламина, 1 ммоль п-толуолсульфокислоты и 20 мл ацетонитрила в качестве растворителя смешивают и нагревают на водяной бане до полного растворения параформа (в течение, например, около 1 часа) при 60 °С, затем повышают температуру до 125-133°С и греют при энергичном перемешивании в течение часа. Растворитель отгоняют на роторном испарителе.
Выход 0.048 моль (98.0 %), бесцветная жидкость.
C25H54NO3P.
Спектр ЯМР 31Р{1H}(CH3CN), δР, м.д.: 25.2.
2 этап: Получение калиевой соли бутил[(диоктиламино)метил]фосфоната (IVa)
К 0.048 моль дибутил((диоктиламино)метил)фосфоната (IIIa), полученного на 1-м этапе, добавляют 6.5 гр. 50% водного раствора гидроксида калия (0.058 моль) в 20 мл 1,4-диоксана и нагревают при температуре кипения 1,4-диоксана в течение 10 часов. Растворитель отгоняют на роторном испарителе, продукт высушивают в вакуум-эксикаторе.
Выход 0.038 моль (80.0 %), белая масса.
ИК-спектр, см-1: 1063 (P-О-С), 1198 (P=O).
C21H45KNO3P.
Спектр ЯМР 31Р{1H} (1,4-диоксан), δP м.д: 19.3.
3-й этап: Получение соединения (Ia).
К 0.038 моль калиевой соли бутил[(диоктиламино)метил]фосфоната (IVa), полученного на 2-м этапе, добавляют 0.038 моль метилйодида в 25 мл пропанола-2 и нагревают при температуре 60°С в течение трех часов. Растворитель отгоняют на роторном испарителе. Полученный продукт растворяют в хлороформе, выпавший осадок йодида калия отделяют центрифугированием, затем удаляют растворитель на роторном испарителе. Проводят декантацию остатка петролейным эфиром и ацетонитрилом, затем высушивают в вакуум-эксикаторе.
Получают бутил[(N-метил-N,N-диоктиламмонио)метил]фосфонат (Ia). Выход 12.78 г (83 %), густое масло.
ИК-спектр, см-1: 1081,1066,1043,1029 (P-O-C), 1220 (Р=О).
Спектр ЯМР 1Н (CDCl3), δH, м.д.: 0.84 т. (6Н, [CH3]2, 3JHH 6.45 Гц), 0.88 т. (3Н, CH3 3JHH 7.28 Гц), 1.15-1.95 м. (28H CH3(CH2)6, CH3(CH2)2CH2O), 3.21 с. (3H, NCH3), 3.25-3.37 м. (6H, PCH2N, NCH2CH2) 3.75-3.83 м. (2H, CH2OP).
Спектр ЯМР 13С{1H} (CDCl3), δС, м.д.: 13.82 c., 14.01 c. 19.04 c., 22.54 c., 22.64 c., 26.25 c., 29.03 c., 29.12 c., 31.56 c., 31.60 c. (CH3(CH2)6, CH3CH2CH2CH2O), 33.12 д. (POCCH2, 3JCP 6.57 Гц), 50.86 с. (CH3N), 57.78 д. (NCH2P, 1JCP 126.91 Гц), 63.72 д. (NCH2, 3JCP 4.58 Гц), 64.45 д. (CH2OP, 2JCP 5.98 Гц).
Спектр ЯМР 31P {1H} (CDCl3), δР, м.д.: 4.4
C22H48NO3P.
Пример 2. Получение бутил [(N-этил-N,N-диоктиламмонио)метил]фосфоната (Ib).
1-й этап: Получение дибутил((диоктиламино)метил) фосфоната (IIIa) - проводят аналогично Примеру 1 (Схема 1, Схема 2).
2-й этап: Получение калиевой соли бутил[(диоктиламино)метил]фосфоната (IVa) - проводят аналогично Примеру 1 (Схема 1, Схема 2).
3 этап: Получение соединения (Ib) (Схема 3).
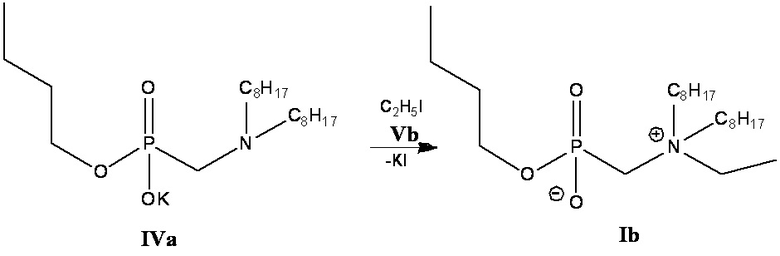
Схема 3
К 0.038 моль калиевой соли бутил[(диоктиламино)метил]фосфоната (IVa), полученного на 2-м этапе, добавляют 0.038 моль этилйодида в 25 мл пропанола-2 и нагревают при температуре 60°С в течение трех часов. Растворитель отгоняют на роторном испарителе. Полученный продукт растворяют в хлороформе, выпавший осадок йодида калия отделяют центрифугированием, затем удаляют растворитель на роторном испарителе. Проводят декантацию остатка петролейным эфиром и ацетонитрилом, затем высушивают в вакуум-эксикаторе.
Получают бутил[(N-этил-N,N-диоктиламмонио)метил]фосфонат (Ib). - соединение (Ib). Выход 11.96 г (75 %), густое масло.
ИК-спектр, см-1: 1081,1063,1044,1029 (P-O-C), 1216 (Р=О).
Спектр ЯМР 1Н (CDCl3), δH, м.д.: 0.83 т. (6Н, [CH3]2, 3JHH 6.24 Гц), 0.88 т. (3Н, CH3 3JHH 7.42 Гц), 1.14-1.91 м. (31H CH3(CH2)6, CH3(CH2)2CH2O, CH3CH2N), 3.29 д. (2H, PCH2N, 2JPH 12.22 Гц), 3.32-3.37 м. (4H, NCH2CH2), 3.55-3.62 м. (2H, NCH2,), 3.86-3.91 м. (2H, CH2OP).
Спектр ЯМР 13С{1H} (CDCl3), δС, м.д.: 13.73 c., 14.01 c. 19.12 c., 22.46 c., 22.54 c., 26.12 c., 29.07 c., 29.15 c., 31.55 c., 31.65 c. (CH3(CH2)6, CH3CH2CH2CH2O, CH3CH2N), 32.11 д. (POCCH2, 3JCP 6.22 Гц), 55.71 д. (NCH2P, 1JCP 129.51 Гц), 62.98 c. (NCH2), 64.57 д. (CH2OP, 2JCP 5.90 Гц).
Спектр ЯМР 31P{1H} (CDCl3), δР, м.д.: 4.9
C23H50NO3P.
Пример 3. Получение бутил[(N-бензил-N,N-диоктиламмонио)метил]фосфоната (Ic):
1-й этап: Получение дибутил((диоктиламино)метил)фосфоната (IIIa) - проводят аналогично Примеру 1 (Схема 1, Схема 2).
2-й этап: Получение калиевой соли бутил [(диоктиламино)метил]фосфоната (IVa) - проводят аналогично Примеру 1 (Схема 1, Схема 2).
3 этап: Получение соединения (Ic) (Схема 4).
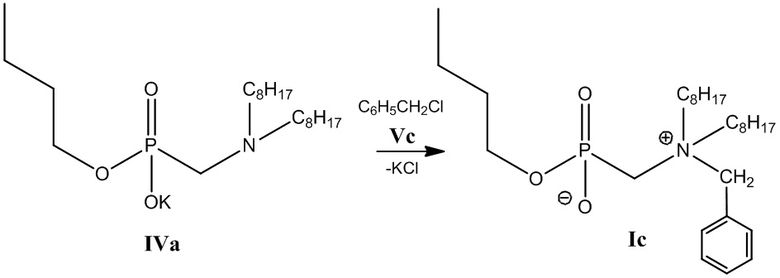
Схема 4
К 0.038 моль калиевой соли бутил[(диоктиламино)метил]фосфоната (IVa), полученного на 2-м этапе, добавляют 0.038 моль бензилхлорида в 25 мл пропанола-2 и нагревают при температуре 60°С в течение часа. Растворитель отгоняют на роторном испарителе. Полученный продукт растворяют в хлороформе, выпавший осадок хлорида калия отделяют центрифугированием, затем удаляют растворитель на роторном испарителе. Проводят декантацию остатка петролейным эфиром и ацетонитрилом, затем высушивают в вакуум-эксикаторе.
Получают бутил[(N-бензил-N,N-диоктиламмонио)метил]фосфонат (Ib). - соединение (Ib). Выход 14.83 г (81 %), густое масло.
ИК-спектр, см-1: 1096,1066,1047,1030 (P-O-C), 1236 (Р=О).
Спектр ЯМР 1Н (CDCl3), δH, м.д.: 0.84 т. (6Н, [CH3]2, 3JHH 7.69 Гц), 0.88 т. (3Н, CH3 3JHH 7.48 Гц), 1.15-1.85 м. (28H CH3(CH2)6, CH3(CH2)2) 3.05 д. (2H, PCH2N, 2JPH 12.29 Гц), 3.38 д.т. (4H, NCH2, 2JH1H2 12.40, 3JHH 3.89 Гц), 3.82-3.86 м. (2H, CH2OP), 4.74 с. (2H, CH2C6H5), 7.30-7.51 м. (5H, С6Н5).
Спектр ЯМР 13С{1H} (CDCl3), δС, м.д.: 14.22 c., 18.25 c., 22,54 c., 22.72 c., 26.42 c., 29.21 c., 29.35 c., 29.25 c., 31.74 c., (CH3(CH2)6, CH3CH2CH2CH2O), 31.32 д. (POCCH2, 3JCP 6.28 Гц), 57.52 д. (NCH2P, 1JCP 126.91 Гц), 60.44 д. (NCH2, 3JCP 4.58 Гц), 62.92 c. (NCH2Ar), 64.41 д. (CH2OP, 2JCP 5.90 Гц), 127.45 с. 129.36 c. 130.68 с. 133.09 c. (C6H5).
Спектр ЯМР 31P{1H} (CDCl3), δР, м.д.: 4.4
C28H52NO3P.
Пример 4. Получение изобутил[(N-метил-N,N-диоктиламмонио)метил]фосфоната (Id) (Схема 5).
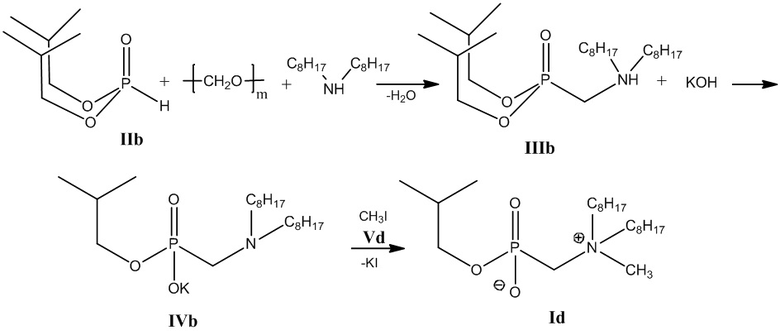
Схема 5
1-й этап: Получение диизобутил((диоктиламино)метил)фосфоната (IIIb).
Эквимольное количество реагентов, например, 0.05 моль диизобутилфосфита, параформа, диоктиламина, 1 ммоль п-толуолсульфокислоты и 20 мл ацетонитрила в качестве растворителя, смешивают и нагревают на водяной бане до полного растворения параформа (в течение, например, около 1 часа) при 60 °С, затем повышают температуру до 125-133 °С и греют при энергичном перемешивании в течение часа. Растворитель отгоняют на роторном испарителе.
Выход 0.048 моль (98.0 %), бесцветная жидкость.
C25H54NO3P.
Спектр ЯМР 31Р{1H}(CH3CN), δР, м.д.: 25.1.
2 этап: Получение калиевой соли изобутил[(диоктиламино)метил]фосфоната (IVb)
К 0.048 моль диизобутил((диоктиламино)метил)фосфоната (IIIb), полученного на 1-м этапе, добавляют 6.5 гр. 50% водного раствора гидроксида калия (0.058 моль) в 20 мл 1,4-диоксана и нагревают при температуре кипения 1,4-диоксана в течение 10 часов. Растворитель отгоняют на роторном испарителе, продукт высушивают в вакуум-эксикаторе.
Выход 0.038 моль (80.0 %), белая масса.
ИК-спектр, см-1: 1040 (P-О-С), 1194 (P=O).
C21H45KNO3P.
Спектр ЯМР 31Р{1H} (1,4-диоксан), δP м.д: 19.5.
3-й этап: Получение соединения (Id).
К 0.038 моль калиевой соли изобутил[(диоктиламино)метил]фосфоната (IVb), полученного на 2-м этапе, добавляют 0.038 моль метилйодида в 25 мл пропанола-2 и нагревают при температуре 60°С в течение трех часов. Растворитель отгоняют на роторном испарителе. Полученный продукт растворяют в хлороформе, выпавший осадок йодида калия отделяют центрифугированием, затем удаляют растворитель на роторном испарителе. Проводят декантацию остатка петролейным эфиром и ацетонитрилом, затем высушивают в вакуум-эксикаторе.
Получают изобутил[(N-метил-N,N-диоктиламмонио)метил]фосфонат (Id). Выход 13.25 г (86 %), густое масло.
ИК-спектр, см-1: 1082,1035 (P-O-C), 1231 (Р=О).
Спектр ЯМР 1Н (CDCl3), δH, м.д.: 0.84 т. (6Н, [CH3]2, 3JHH 6.60 Гц), 0.89 д. (6Н, (CH3)2CH, 3JHH 6.67 Гц), 1.23-1.97 м. (25H, CH3(CH2)6, (CH3)2CHCH2), 3.20 c. (3H, CH3N), 3.28-3.37 м. (6H, PCH2N, NCH2CH2), 3.51-3.54 м. (2H, CH2OP).
Спектр ЯМР 13С{1H} (CDCl3), δС, м.д.: 14.16 c., 19.25 c., 22,67 c., 22.75 c., 26.38 c., 29.17 c., 29.25 c., 29.25 c., 31.72 c., (CH3(CH2)6, [(CH3)2CHCH2]), 50.52 с. (CH3N), 59.14 д. (NCH2P, 1JCP 125.36 Гц), 63.22 д. (NCH2, 3JCP 3.41 Гц), 70.91 д. (CH2OP, 2JCP 6.31 Гц)
Спектр ЯМР 31P{1H} (CDCl3), δР, м.д.: 4.4
C22H48NO3P.
Пример 5. Получение изобутил[(N-этил-N,N-диоктиламмонио)метил]фосфоната (Ie).
1-й этап: Получение диизобутил ((диоктиламино)метил) фосфоната (IIIb) - проводят аналогично Примеру 4 (Схема 1, Схема 5).
2-й этап: Получение калиевой соли изобутил [(диоктиламино)метил] фосфоната (IVb) - проводят аналогично Примеру 4 (Схема 1, Схема 5).
3 этап: Получение соединения (Ie) (Схема 6).
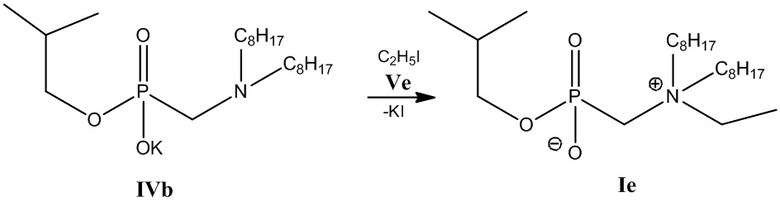
Схема 6
К 0.038 моль калиевой соли изобутил [(диоктиламино)метил] фосфоната (IVb), полученного на 2-м этапе, добавляют 0.038 моль этилйодида в 25 мл пропанола-2 и нагревают при температуре 60 °С в течение трех часов. Растворитель отгоняют на роторном испарителе. Полученный продукт растворяют в хлороформе, выпавший осадок йодида калия отделяют центрифугированием, затем удаляют растворитель на роторном испарителе. Проводят декантацию остатка петролейным эфиром и ацетонитрилом, затем высушивают в вакуум-эксикаторе.
Получают изобутил[(N-этил-N,N-диоктиламмонио)метил]фосфонат (Ie). Выход 13.22 г (83 %), густое масло.
ИК-спектр, см-1: 1036,1082 (P-O-C), 1226 (Р=О).
Спектр ЯМР 1Н (CDCl3), δH, м.д.: 0.83 т. (6Н, [CH3]2, 3JHH 6.65 Гц), 0.89 д. (6Н, [(CH3)2CH]2, 3JHH 6.61 Гц), 1.13-1.84 м. (28H, CH3(CH2)6, (CH3)2CHCH2, CH3CH2N), 3.29 д. (2H, PCH2N, 2JPH 12.4 Гц), 3.38-3,40 м. (4H, NCH2CH2), 3.58-3.61 м. (2H, NCH2), 3.64-3.68 м. (2H, CH2OP).
Спектр ЯМР 13С{1H} (CDCl3), δС, м.д.: 14.06 c., 19.11 c., 22,28 c., 22.57 c., 26.37 c., 29.08 c., 29.13 c., 31.63 c., (CH3(CH2)6, [(CH3)2CHCH2], CH3CH2N), 29.54 д. (POCCH2, 3JCP 6.29 Гц), 55.3 д. (NCH2P, 1JCP 129.43 Гц), 59.99 c. (NCH2CH2), 80.84 д. (CH2OP, 2JCP 6.32 Гц).
Спектр ЯМР 31P {1H} (CDCl3), δР, м.д.: 5.1
C23H50NO3P.
Пример 6. Получение изобутил[(N-бензил-N,N-диоктиламмонио)метил]фосфоната (If):
1-й этап: Получение диизобутил((диоктиламино)метил)фосфоната (IIIb) - проводят аналогично Примеру 4 (Схема 1, Схема 5).
2-й этап: Получение калиевой соли изобутил[(диоктиламино)метил]фосфоната (IVb) - проводят аналогично Примеру 4 (Схема 1, Схема 5).
3 этап: Получение соединения (If) (Схема 7).
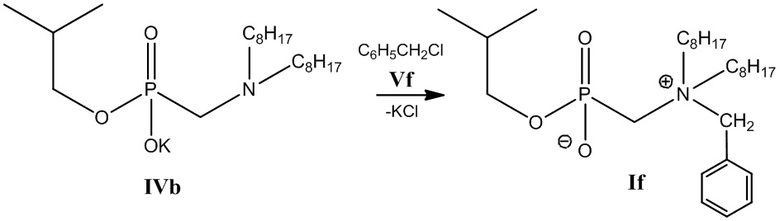
Схема 7
К 0.038 моль калиевой соли изобутил [(диоктиламино)метил] фосфоната (IVb), полученного на 2-м этапе, добавляют 0.038 моль бензилхлорида в 25 мл пропанола-2 и нагревают при температуре 60°С в течение часа. Растворитель отгоняют на роторном испарителе. Полученный продукт растворяют в хлороформе, выпавший осадок хлорида калия отделяют центрифугированием, затем удаляют растворитель на роторном испарителе. Проводят декантацию остатка петролейным эфиром и ацетонитрилом, затем высушивают в вакуум-эксикаторе.
Получают изобутил [(N-бензил-N,N-диоктиламмонио)метил] фосфонат - соединение (If). Выход 14.64 г (80 %), густое масло.
ИК-спектр, см-1: 1040, 1082 (P-O-C), 1231(Р=О).
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.84 т. (6Н, [CH3]2, 3JHH 6.56 Гц), 0.88 д. (6Н, [(CH3)2CH]2, 2JHH 6.68 Гц), 1.10-1.87 м. (25H, CH3(CH2)6, [(CH3)2CHCH2]), 3.55 д. (2H, PCH2N, 2JPH 12.24 Гц), 3.38 д.т. (4H, NCH2, 2JH1H2 12.88, 3JHH 3.86 Гц), 3.59-3.62 м. (2H, CH2OP), 4.75 с. (2H, CH2C6H5), 7.30-7.37 м. (5H, С6Н5).
Спектр ЯМР 13С{1H} (CDCl3), δС, м.д.: 13.88 c., 14.03 c., 22.35 c., 22.47 c, 25.78 c., 26.21 c., 26.87 c., 29.09 c., 29.14 c., 31.77 c., 31.66 c. (CH3(CH2)6, [(CH3)2CH]), 59.14 д. (NCH2P, 1JCP 125.36 Гц), 63.22 д. (NCH2, 3JCP 3.41 Гц), 70.91 д. (CH2OP, 2JCP 6.31 Гц), 62.99 c. (NCH2Ar), 127.40 с. 129.30 c. 130.65 с. 133.01 c. (C6H5).
Спектр ЯМР 31P{1H} (CDCl3), δР, м.д.: 4.2
C28H52NO3P.
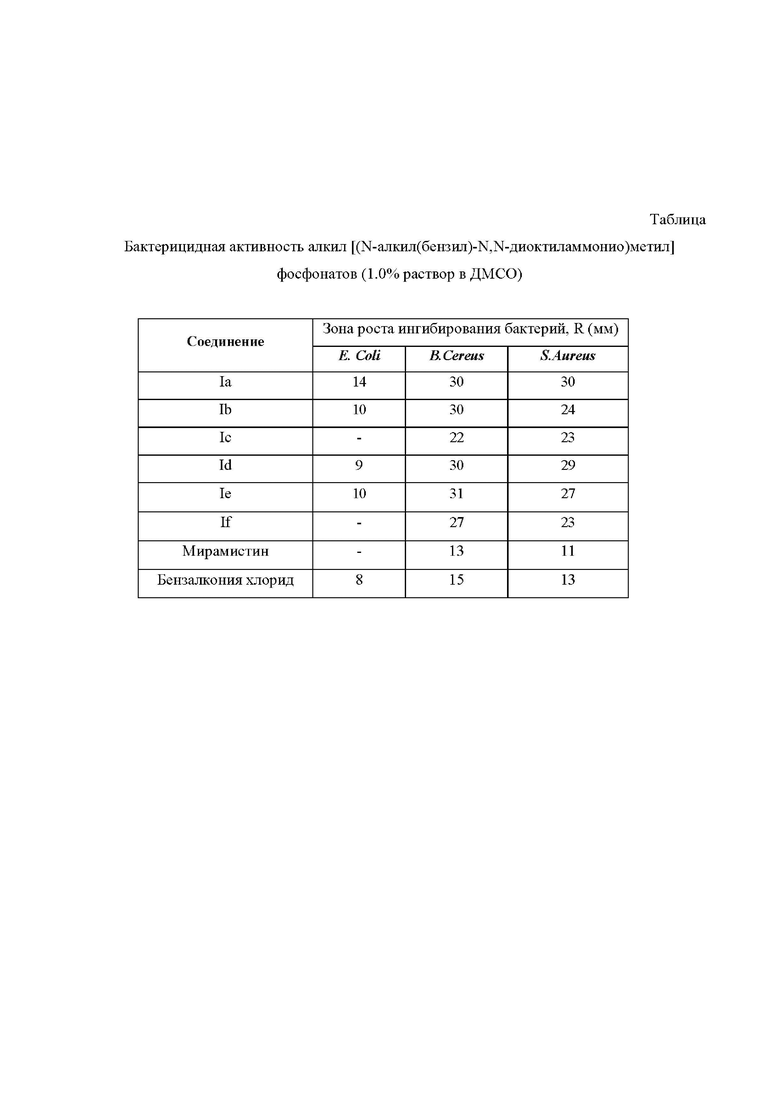
Пример 7. Исследование бактерицидной активности соединений формулы (I).
Бактерицидные свойства заявленных фосфорсодержащих бетаинов формулы (I) исследовали на на тест-культурах: Escherichia coli (E. coli), Bacillus cereus (B.cereus), Staphylococcus aureus (S.aureus), по известному методу [Першин Г.Н. Методы экспериментальной химиотерапии. // Москва: Медицина, 1971. - 245 с.].
Для оценки бактерицидной активности заявленные соединения формулы (I) вносили в лунки агаризированной питательной среды. О бактерицидной активности судили по наличию зоны ингибирования роста тест-культур, которая образуется вокруг лунок с исследуемым веществом.
Результаты исследования бактерицидной активности алкил [(N-алкил(бензил)-N,N-диоктиламмонио)метил]фосфонатов (I) представлены в Таблице на Фиг.
В качестве контроля исследованы аналоги: мирамистин и бензалкония хлорид.
Из данных, приведенных в Таблице, можно сделать вывод, что антибактериальная активность заявленных фосфорсодержащих бетаинов, содержащих бутильные и изобутильные заместители у атома фосфора, отличаются незначительно. Все соединения (Ia - If) обладают высокой активностью в отношении бактерий B.Cereus и золотистого стафилокока S.Aureus. Введение бензильного заместителя к атому фосфора (соединения Ic и If) приводит к некоторому снижению активности заявленных фосфорсодержащих бетаинов (I) в отношении всех исследуемых штаммов бактерий. Все изученные соединения Ia-If показали бактерицидную активность выше, чем у известных аналогов, в особенности в отношении бактерий B.Cereus и S.Aureus.
Таким образом, из описанного выше можно сделать вывод, что заявителем достигнут заявленный технический результат, а именно: получены новые фосфорсодержащие бетаины - алкил [(N-алкил(бензил)-N,N-диоктиламмонио)метил] фосфонаты формулы (I), не требующие сложных процедур синтеза и очистки, обладающие высокой бактерицидной активностью, расширяющие арсенал известных средств указанного назначения. Преимуществами заявленных соединений является то, что они обладают высокой бактерицидной активностью по отношению как к грамположительным, так и к грамотрицательным штаммам микроорганизмов.
Заявленное техническое решение соответствует условию патентоспособности «новизна» предъявляемому к изобретениям, т.к. из исследованного уровня техники не выявлено средство, обладающее совокупностью заявленных в формуле изобретения признаков, позволяющих получить заявленный технический результат, а именно - фосфорсодержащие бетаины с липофильными октильными заместителями у атома азота, обладающие высокой бактерицидной активностью, расширяющие арсенал известных средств указанного назначения.
Заявленное техническое решение соответствует условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, т.к. совокупность заявленных признаков обеспечивает получение неочевидных для специалиста технических результатов, а именно - получение неизвестных из уровня техники соединений.
Заявленное техническое решение соответствует условию патентоспособности «промышленная применимость» предъявляемому к изобретениям, так как может быть осуществлено на стандартном оборудовании с использованием известных реагентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕПАТОПРОТЕКТОР | 1996 |
|
RU2156130C1 |
| α-Гидроксифосфонаты с алкильными заместителями у атома фосфора, обладающие антимикробной активностью | 2024 |
|
RU2834476C1 |
| Фосфорилсодержащие четвертичные соли аммония с высшими алкильными заместителями, обладающие бактерицидной и фунгицидной активностью | 2021 |
|
RU2770537C1 |
| Четвертичные аммониевые соединения на основе 3-гидроксипиридина, обладающие антибактериальной активностью | 2021 |
|
RU2778507C1 |
| Бис-аммониевые соединения на основе пиридоксина, обладающие антибактериальными и антимикотическими свойствами | 2020 |
|
RU2731999C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Бромсодержащие пространственно-затрудненные фенолы, обладающие противоопухолевой активностью | 2023 |
|
RU2822270C1 |
| ФОСФОНИЕВЫЕ СОЛИ НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2011 |
|
RU2466728C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОСФОНАТОВ ИЗ ДИАЛКИЛФОСФИТОВ И ПРОИЗВОДНЫХ НЕПРЕДЕЛЬНЫХ КАРБОНОВЫХ КИСЛОТ | 2014 |
|
RU2551287C1 |
| ОТВЕРДИТЕЛЬ И УСКОРИТЕЛЬ ОТВЕРЖДЕНИЯ С ОГНЕЗАЩИТНЫМ ДЕЙСТВИЕМ ДЛЯ ОТВЕРЖДЕНИЯ ЭПОКСИДНЫХ СМОЛ (II) | 2016 |
|
RU2711163C2 |
Изобретение относится к области ветеринарии и сельского хозяйства, в частности к фосфорсодержащим бетаинам, которые могут быть полезны в качестве дезинфицирующих средств. Раскрываются фосфорсодержащие бетаины общей формулы (I), где R1 = C4H9 (бутил), R2 = CH3 (метил) (Iа), R1 = C4H9 (бутил), R2 = С2H5 (этил) (Ib), R1 = C4H9 (бутил), R2 = CH2С6H5 (бензил) (Ic), R1 = i-C4H9 (изо-бутил), R2 = CH3 (метил) (Id), R1 = i-C4H9 (изо-бутил), R2 = С2H5 (этил) (Ie), R1 = i-C4H9 (изо-бутил), R2 = CH2С6H5 (бензил) (If), обладающие бактерицидной активностью. Изобретение обеспечивает высокую бактерицидную активность при низких концентрациях. 1 ил., 7 пр.
 (I)
(I)
Фосфорсодержащие бетаины общей формулы (I):

(I),
R1 = C4H9 (бутил), R2 = CH3 (метил) (Ia),
R1 = C4H9 (бутил), R2 = C2H5 (этил) (Ib),
R1 = C4H9 (бутил), R2 = CH2C6H5 (бензил) (Ic),
R1 = i-C4H9 (изо-бутил), R2 = CH3 (метил) (Id),
R1 = i-C4H9 (изо-бутил), R2 = C2H5 (этил) (Ie),
R1 = i-C4H9 (изо-бутил), R2 = CH2C6H5 (бензил) (If),
обладающие бактерицидной активностью.
| Фосфорилсодержащие четвертичные соли аммония с высшими алкильными заместителями, обладающие бактерицидной и фунгицидной активностью | 2021 |
|
RU2770537C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОЭФИРОВ М-ЗАМЕЩЕННЫХ а-АМИНОАЛКИЛФОСФОНОВЫХ КИСЛОТ | 0 |
|
SU292986A1 |
| O-ЭТИЛФОСФОНАТЫ ДИМЕТИЛ(2-ОКСИ-5-АЛКИЛБЕНЗИЛ)АММОНИЯ, ОБЛАДАЮЩИЕ ФУНГИСТАТИЧЕСКОЙ, ФУНГИЦИДНОЙ, БАКТЕРИОСТАТИЧЕСКОЙ, БАКТЕРИЦИДНОЙ, СПОРОЦИДНОЙ, ДЕЗИНФЕКЦИОННОЙ, ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ, И КАК ПРОТРАВИТЕЛИ СЕМЯН | 1985 |
|
SU1269479A1 |
| US 4983750 A1, 08.01.1991 | |||
| NATAL'YA DAVLETSHINA et al | |||
| FTIR spectroscopic analyses of the pentyl { [benzyl(dibutyl)ammonio]methyl} phosphonate copper(II) complex | |||
| Journal of Organometallic Chemistry, 2020, vol | |||
| Усилитель двойного действия с одновременным усилением высокой и низкой частоты | 1923 |
|
SU916A1 |
Авторы
Даты
2023-04-25—Публикация
2022-07-13—Подача