ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к модифицированному белку интерлейкина-7 и к способу его применения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Интерлейкин-7 или полипептид, имеющий подобную активность (далее обозначаемый "IL-7"), представляет собой иммуностимулирующий цитокин, который может содействовать иммунным ответам, опосредованным В-клетками и Т-клетками, в частности, IL-7 играет важную роль в адаптивной иммунной системе. IL-7 в основном секретируется стромальными клетками в костном мозге и тимусе, однако он также продуцируется кератиноцитами, дендритными клетками, гепатоцитами, нейронами и эпителиальными клетками (Heufler Cet al., 1993, J.Exp. Med.178 (3): 1109-14; Kroncke Ret al., 1996, Eur. J.Immunol.26 (10): 2541-4: Sawa Yet al., 2009, Immunity 30 (3): 447-57; Watanabe Met al., 1995, J.Clin. Invest.95 (6): 2945-53).
В частности, IL-7 активирует иммунные функции посредством повышения выживаемости и дифференцировки Т-клеток и В-клеток, повышения выживаемости лимфоидных клеток, стимуляции активности природных киллерных (NK) клеток и т. д., причем особенно важную роль IL-играет в развитии Т-клеток и В-клеток. IL-7 связывается с фактором роста гепатоцитов (HGF) и функционирует как фактор, стимулирующий рост пре-про-В-клеток и кофактор V(D)J-реаранжировки Т-клеточного рецептора бета (TCRβ) (Muegge K, 1993, Science261 (5117): 93-5).
Кроме того, IL-7 регулирует развитие лимфатических узлов при посредстве клеток-индукторов лимфоидной ткани (LTi) и стимулирует выживание и деление наивных Т-клеток или Т-клеток памяти. В соответствии с недавно опубликованными результатами клинических исследований вирусной инфекции, IL-7 поддерживает наивные Т-клетки или Т-клетки памяти (Amila Patel, J Antimicrob Chemother 2010). Кроме того, IL-7 усиливает иммунный ответ у человека путем стимуляции секреции IL-2 и интерферона-γ.
То есть IL-7 представляет собой цитокин, способствующий выживанию и пролиферации Т-клеток, В-клеток и других иммунных клеток, а кроме того он является превосходным веществом-кандидатом на роль иммунного терапевтического средства, которое можно использовать для лечения разных заболеваний, таких как вирусная инфекция, рак и повреждение иммунной системы. В последнее время получены результаты нескольких клинических исследований по поводу злокачественных опухолей и инфекции вируса иммунодефицита человека (ВИЧ), которые подтверждают способность IL-7 усиливать иммунитет в организме человека (Fry TJ et al., 2002, Blood 99 (11): 3892-904; Muegge K et al., 1993, Science 261 (5117): 93-5; Rosenberg SA et al., J. Immunother. 29 (3): 313-9). IL-7 также можно использовать для восстановления иммунитета после трансплантации аллогенных стволовых клеток (Snyder KM, 2006, Leuk. Lymphoma 47 (7): 1222-8) и лечения лимфопении.
Рак представляет собой опасное для жизни заболевание. Раковые клетки генерируют среду, способную ингибировать иммунную систему и обеспечивать рост раковых клеток, не распознаваемых иммунными клетками. У раковых пациентов наблюдается ухудшение иммунитета, характеризующееся уменьшением числа Т-клеток, в основном обусловленным противоопухолевым лечением (таким как химиотерапия, лучевая терапия), или наблюдающимся во время диагностики рака. Кроме того, хотя цитотоксические Т-лимфоциты, эффекторные Т-клетки и макрофаги собираются в раковой ткани, они не могут эффективно удалять раковые клетки. Иммунные клетки также не могут эффективно ингибировать пролиферацию раковых клеток, поскольку в раковой ткани присутствуют регуляторные Т-клетки (Treg), миелоидные супрессорные клетки (MDSC) и т.д., которые ингибируют функцию иммунных эффекторных клеток.
В свете указанных обстоятельств недавно были отмечены иммунотерапевтические способы лечения. Иммунную терапию можно использовать в сочетании с химиотерапией или лучевой терапией, которые в настоящее время применяются для лечения рака. В частности, использование IL-7 рассматривается как альтернатива усиления иммунных функций путем преодоления лимфопении, характеризующейся уменьшением числа Т-клеток.
Хроническая инфекция поддерживается благодаря индукции истощения Т-клеток, которые распознают вирусы. Например, при заражении вирусами, такими как ВИЧ, вирус гепатита B (HBV), вирус гепатита C (HCV) и вирус иммунодефицита обезьян (SIV), вначале индуцируется интенсивный иммунный ответ, однако функции вирус-специфичных Т-клеток постепенно уменьшаются со временем. В частности, функции вирус-специфичных Т-клеток уменьшаются под действием PD-1, LAG-3, TIM-3, рецептора IL-10, рецептора TGF-β и др.
Однако IL-7 восстанавливает уменьшение функций вирус-специфичных Т-клеток, или ингибирует снижение их функций путем преодоления сигнальной системы, ингибирующей иммунитет (Pellegrini M, 2009 May, 15 (5): 528-36). Кроме того, IL-7 индуцирует пролиферацию Т-клеток и увеличивает экспрессию Bcl-2, тем самым способствуя размножению и выживанию Т-клеток.
IL-7 также индуцирует продукцию цитокинов и способствует сохранению их функций путем ингибирования экспрессии SOCS3, который является медиатором ингибирования цитокинового сигнального пути. Кроме того, IL-7 уменьшает иммунопатологию благодаря продукции IL-22 (Som G. Nanjappa, Blood. 2011; 117 (19): 5123-5132, Marc Pellegrini, Cell 144, 601-613, February 18, 2011).
Однако при получении рекомбинантного IL-7 с целью его применения в качестве лекарственного средства возникают проблемы, связанные с повышенным содержанием примесей по сравнению с обычными рекомбинантными белками, уровнем деградации IL-7 и трудностями при разработке крупномасштабного производства. Ранее в Cytheris Inc. был получен синтетический IL-7, который является конформером, содержащим особые дисульфидные связи (Cys: 1-4, 2-5, 3-6) (патент США № 7558547). Однако, поскольку при получении синтетического IL-7 требуется проведение сложного процесса денатурации, способ промышленного получения не является простым. Соответственно, существуют настоятельная потребность в разработке модифицированного белка IL-7, который можно получить в крупном масштабе с помощью простого промышленного способа.
В соответствии с вышесказанным был получен модифицированный IL-7, который можно производить в крупном масштабе с помощью простого промышленного способа, и тем самым настоящее изобретение было завершено.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Целью настоящего изобретения является получение модифицированного IL-7.
Другой целью настоящего изобретения является получение слитых белков, содержащих модифицированный IL-7.
Следующей целью настоящего изобретения является получение нуклеиновой кислоты, кодирующей модифицированный IL-7 или содержащий его слитый белок, вектора, содержащего указанную нуклеиновую кислоту, и клетки-хозяина, содержащей вектор, а также разработка способа получения модифицированного IL-7 или содержащих его слитых белков.
Другой целью настоящего изобретения является получение фармацевтической композиции, включающей модифицированный IL-7 или содержащие его слитые белки, и ее применение.
РЕШЕНИЕ ПРОБЛЕМЫ
Для достижения вышеуказанных целей настоящее изобретение предлагает модифицированный IL-7, к которому присоединен олигопептид, состоящий из 1-10 аминокислот.
Кроме того, настоящее изобретение относится к слитым белкам IL-7, включающим первый домен, который содержит полипептид, обладающий активностью IL-7 или подобной активностью; второй домен, который содержит аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания; и третий домен, который продлевает период полужизни слитых белков интерлейкина-7.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей модифицированный IL-7 или слитый белок IL-7, вектору экспрессии, содержащему нуклеиновую кислоту, и клетке-хозяину, содержащей вектор экспрессии.
Кроме того, настоящее изобретение относится к способу продуцирования или получения модифицированного IL-7 или слитого белка IL-7 с использованием нуклеиновой кислоты, вектора экспрессии и клетки-хозяина.
Настоящее изобретение также относится к способу профилактики или лечения заболевания с помощью модифицированного IL-7 или слитого белка IL-7.
ПРЕДПОЧТИТЕЛЬНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Модифицированный IL-7 настоящего изобретения получают с высоким выходом, не используя процесс денатурации. Соответственно, модифицированный IL-7 настоящего изобретения, или содержащие его слитые белки, можно использовать в разных областях медицины.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
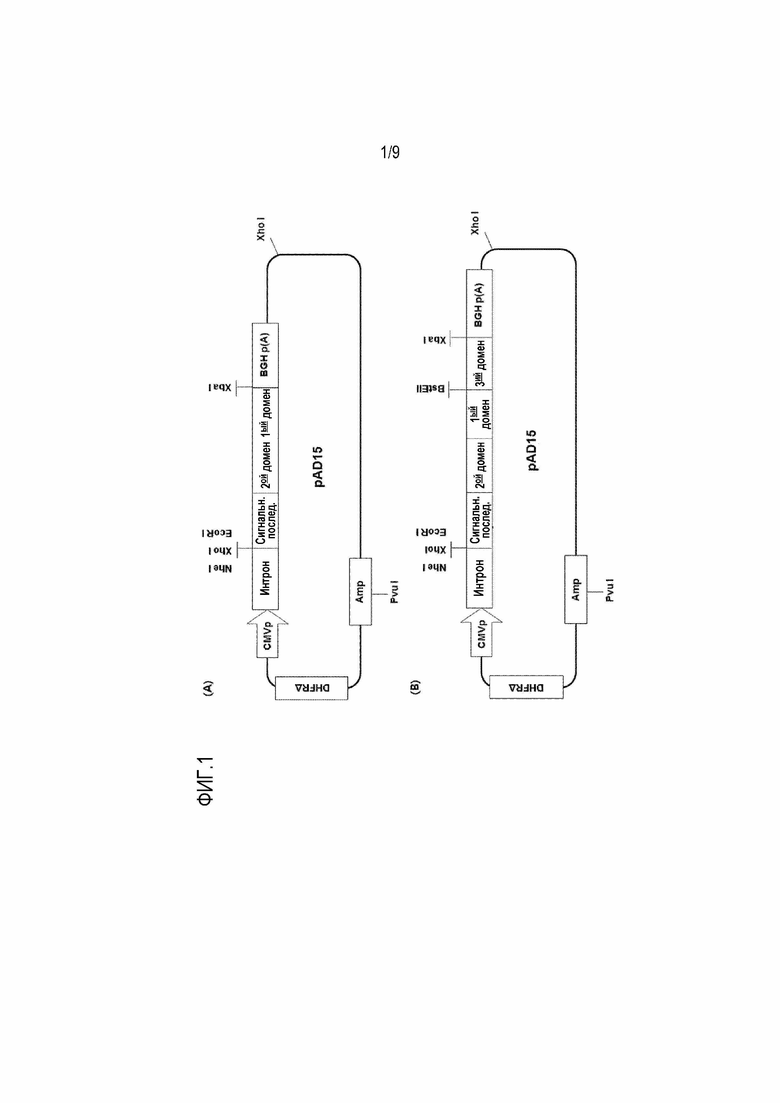
На фиг.1 приведено схематическое изображение генной конструкции, используемой для получения модифицированного IL-7 настоящего изобретения или содержащих его слитых белков.
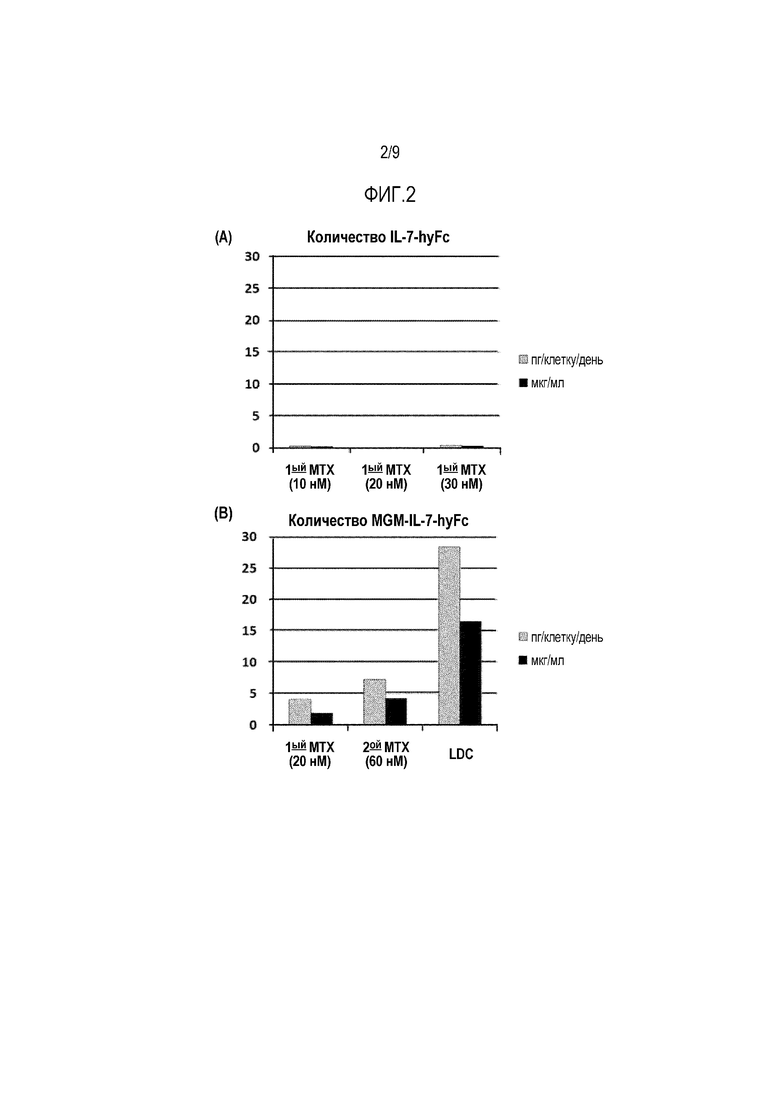
На фиг.2 показан результат оценки суточной продуктивности одной клетки, продуцирующей слитый белок IL-7 (пг/клетку/день, п/к/д), причем на фиг. 2A показано количество IL-7-hyFc в культуральной среде, а на фиг. 2B показано количество MGM-IL-7-hyFc в культуральной среде.
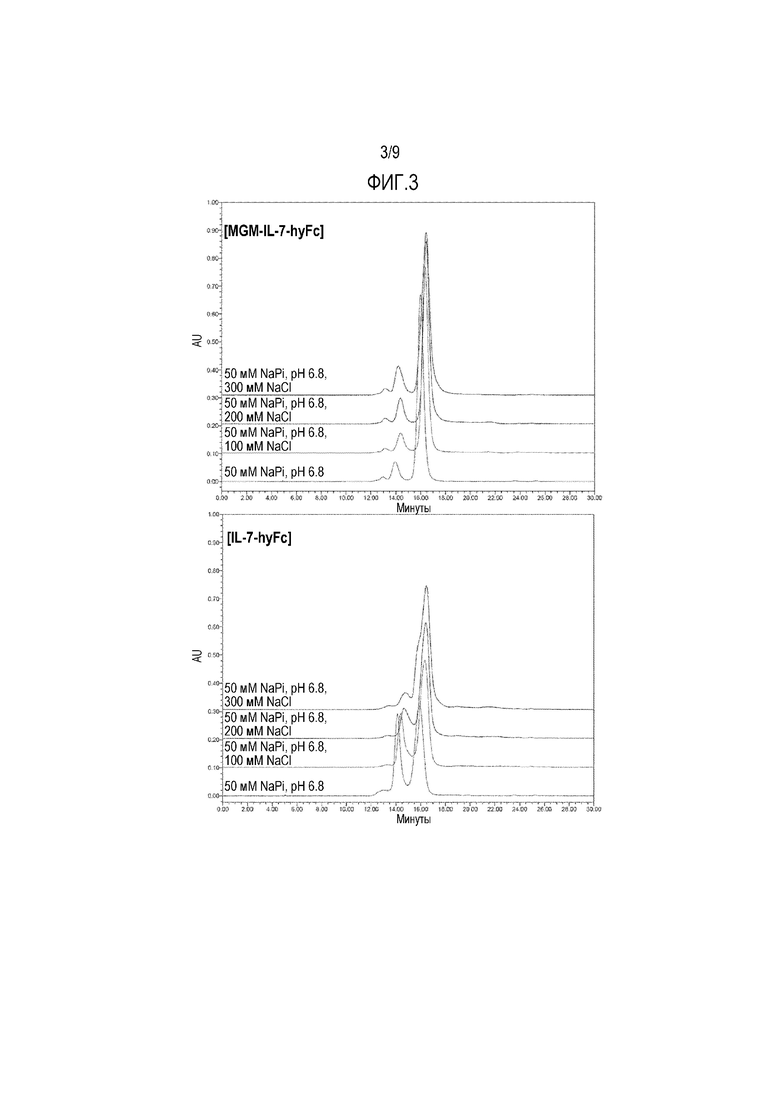
На фиг.3 показан результат сравнения стабильности IL-7-hyFc и MGM-IL-7-hyFc, в том числе при разных концентрациях хлорида натрия.
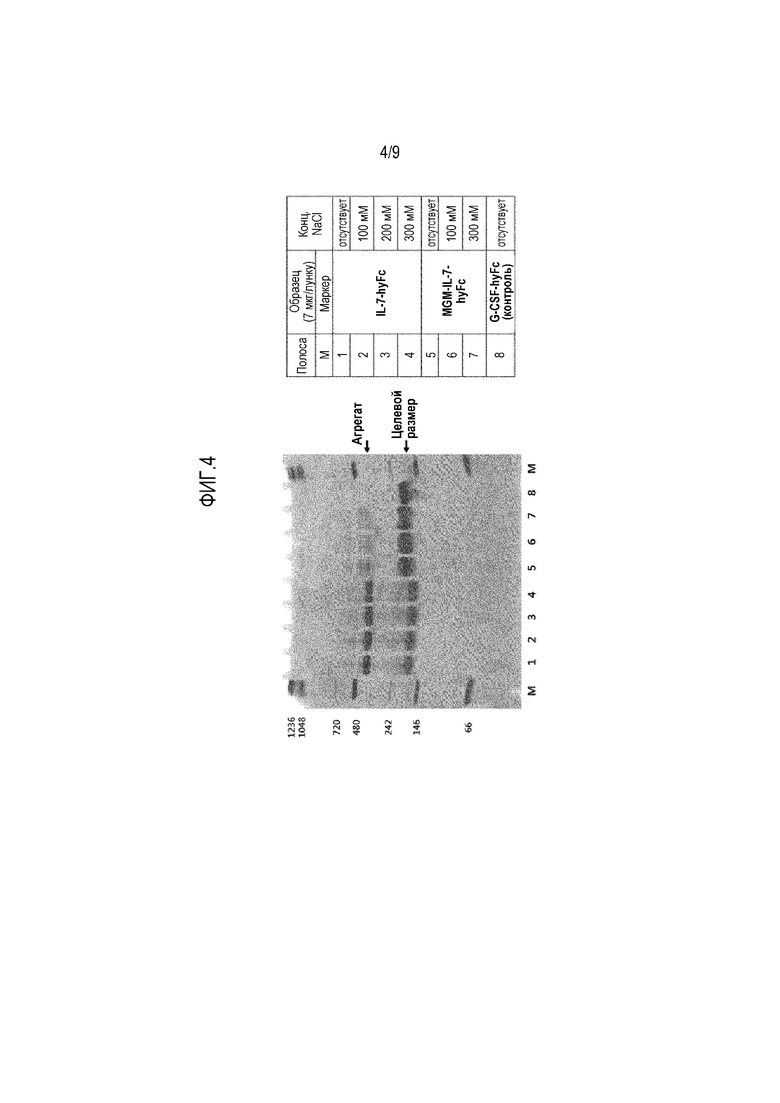
На фиг.4 показано сравнение результатов нативного PAGE IL-7-hyFc и MGM-IL-7-hyFc при разных концентрациях хлорида натрия.
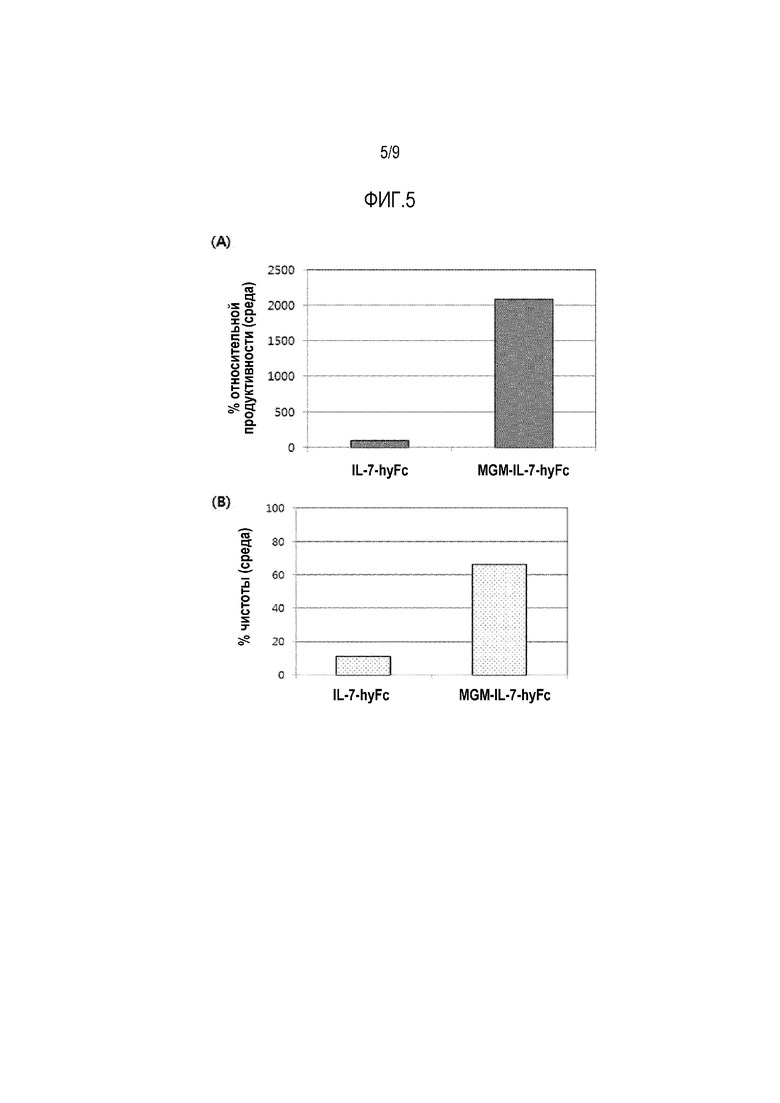
На фиг.5 показан результат сравнения относительного выхода (рис. 5А) и чистоты (рис. 5B) полученных слитых белков IL-7, соответственно.
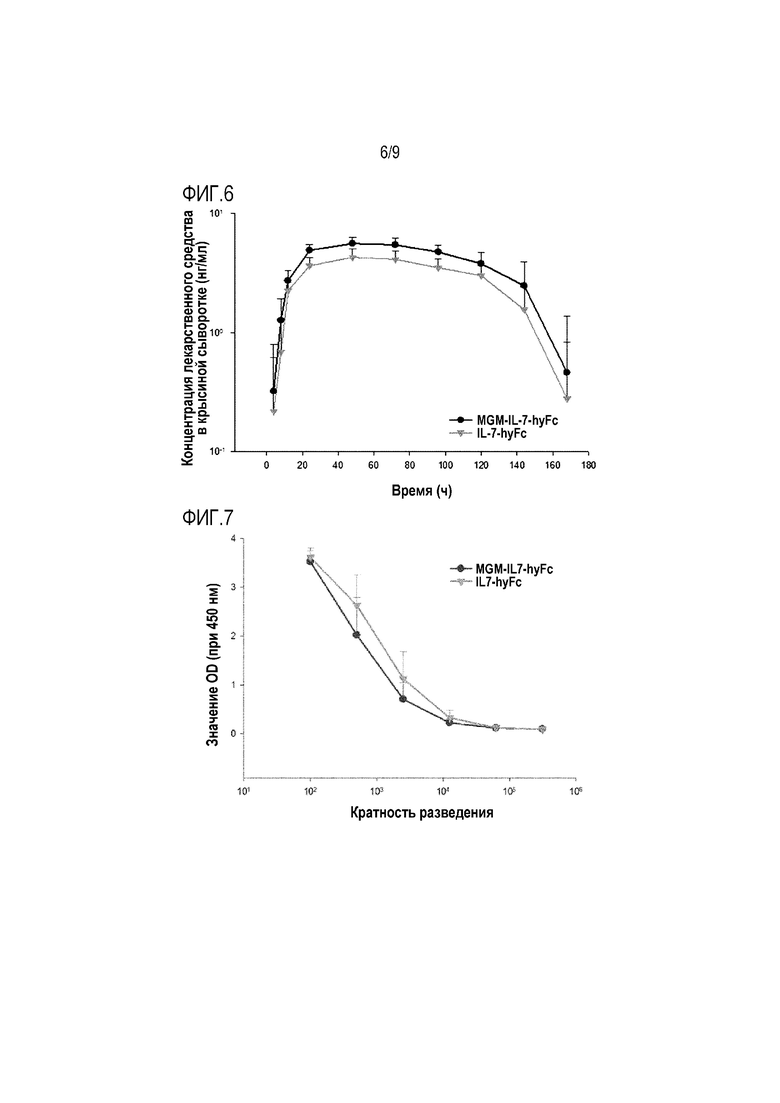
На фиг.6 показан график, иллюстрирующий уровень лекарственного средства в сыворотке в зависимости от времени после подкожного введения крысиной модели SD полученных слитых белков IL-7.
На фиг.7 показаны результаты, иллюстрирующие уровни продукции антитела против лекарственного средства (ADA) после подкожного введения крысиной модели SD каждого из полученных слитых белков IL-7.
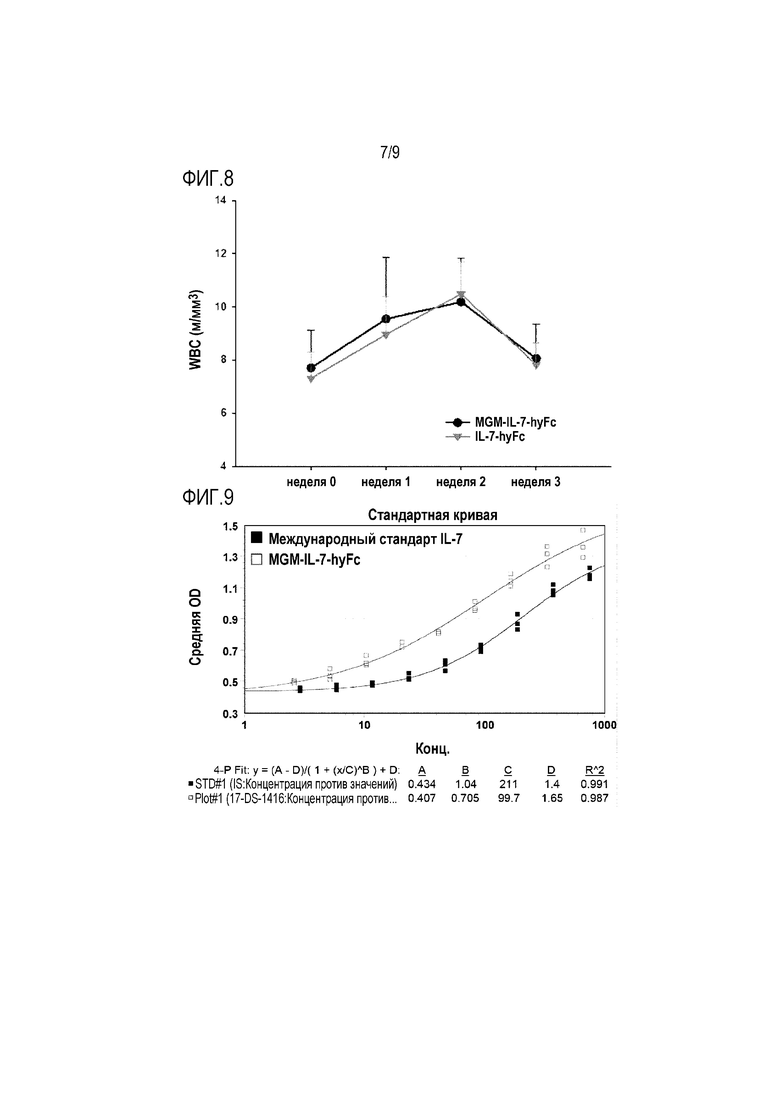
На фиг.8 показан график, иллюстрирующий увеличение числа лейкоцитов (WBC) в зависимости от времени после подкожного введения крысиной модели SD полученных слитых белков IL-7.
На фиг.9 показан результат сравнения активности полученных слитых белков IL-7 и стандартного вещества.
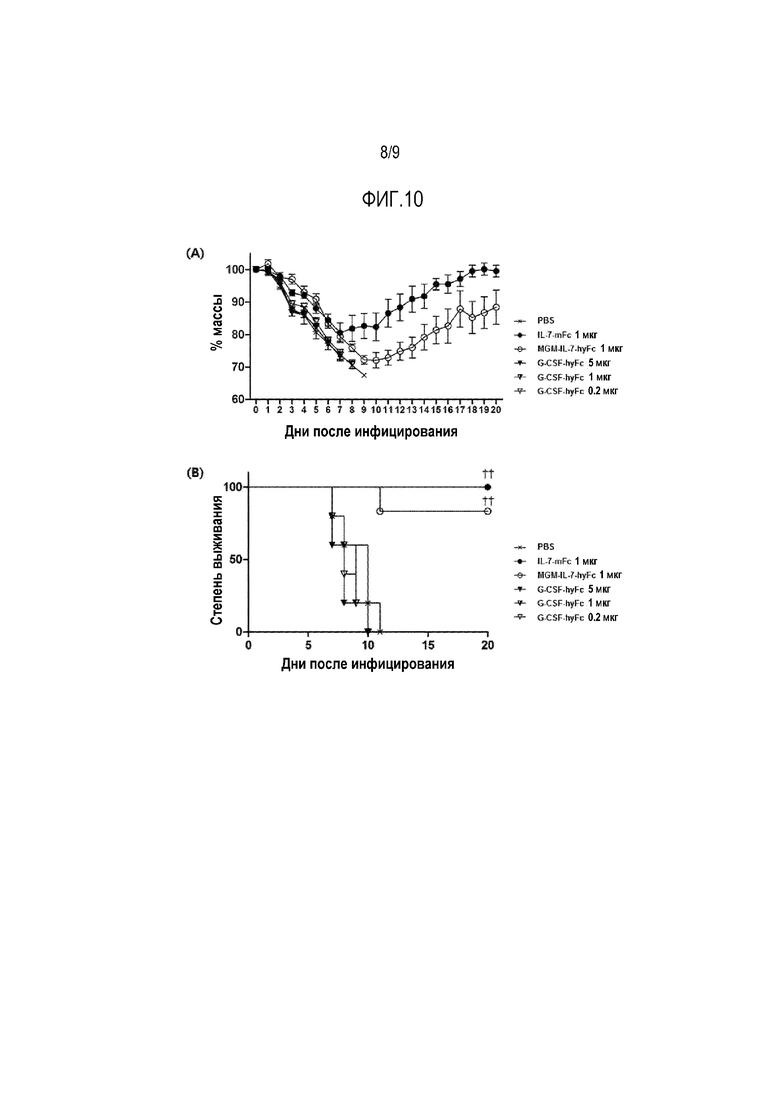
На фиг.10 показан график, иллюстрирующий изменение массы тела (рис. 10А) и изменение процента выживания (рис. 10B) у модели смертельного заболевания гриппом после введения полученных слитых белков IL-7.
На фиг.11 показаны изображения результатов морфологического анализа противоракового эффекта у модели заболевания, вызванного трансплантацией раковых клеток, после введения полученных слитых белков IL-7.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к модифицированному IL-7, имеющему следующую структуру:
A-IL-7;
где А представляет собой олигопептид, состоящий из 1-10 аминокислотных остатков, и IL-7 представляет собой интерлейкин 7 или полипептид, обладающий подобной активностью.
В данном описании термин "полипептид, обладающий активностью IL-7 или подобной активностью" относится к полипептиду или белку, имеющему такую же или подобную последовательность и активность, как и IL-7. Если в настоящем изобретении не указано иное, данный термин и термин "первый домен слитых белков IL-7" можно использовать как взаимозаменяемые.
IL-7 включает полипептид, состоящий из аминокислотной последовательности, описанной в SEQ ID NO: 1-6. Кроме того, IL-7 может иметь последовательность, примерно на 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98%, 99% или более идентичную последовательностям SEQ ID NO: 1-6.
IL-7 может включать белок IL-7 или его фрагмент. В частности, IL-7 может представлять собой белок, полученный из организма человека, крысы, мыши, обезьяны, коровы или овцы.
В частности, человеческий IL-7 может иметь аминокислотную последовательность, описанную в SEQ ID NO: 1 (№ доступа Genbank P13232); крысиный IL-7 может иметь аминокислотную последовательность, описанную в SEQ ID NO: 2 (№ доступа Genbank P56478); мышиный IL-7 может иметь аминокислотную последовательность, описанную в SEQ ID NO: 3 (№ доступа Genbank P10168); обезьяний IL-7 может иметь аминокислотную последовательность, описанную в SEQ ID NO: 4 (№ доступа Genbank NP_001279008); бычий IL-7 может иметь аминокислотную последовательность, описанную в SEQ ID NO: 5 (№ доступа Genbank P26895), а овечий IL-7 может иметь аминокислотную последовательность, описанную в SEQ ID NO: 6 (№ доступа Genbank Q28540).
Кроме того, белок IL-7, или его фрагмент, может включать разные модифицированные белки или пептиды, то есть варианты. Вышеуказанную модификацию можно осуществить путем замещения, делеции или добавления по меньшей мере одного остатка в последовательности IL-7 дикого типа без изменения функции IL-7. Указанные разные белки или пептиды могут быть на 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологичны белку дикого типа.
Обычно аминокислотный остаток последовательности дикого типа заменяют на аланин, однако можно осуществить консервативную аминокислотную замену, которая не влияет или мало влияет на общий заряд белка, то есть полярность или гидрофобность.
Консервативные аминокислотные замены приведены ниже в таблице 1.
[Таблица 1]
Лизин (Lys, K)
Гистидин (His, H)
Аспарагиновая кислота (Asp, D)
Аспарагин (Asn, N)
Серин (Ser, S)
Треонин (Thr, T)
Тирозин (Tyr, Y)
Триптофан (Trp, W)
Цистеин (Cys, C)
Глицин (Gly, G)
Аланин (Ala, A)
Валин (Val, V)
Пролин (Pro, P)
Метионин (Met, M)
Лейцин (Leu, L)
Норлейцин
Изолейцин
Дополнительная консервативная замена любой аминокислоты включает замену на "гомолог" аминокислоты. В частности, термин "гомолог" относится к аминокислоте, содержащей дополнительную метиленовую группу (СН2) в бета-положении боковой цепи аминокислоты. Примеры "гомолога" могут включать, без ограничения, гомофенилаланин, гомоаргинин, гомосерин и т.д.
В настоящем описании термин "белок IL-7" может быть использован как понятие, включающее "белок IL-7 и его фрагмент". Если не указано иное, термины "белок", "полипептид" и "пептид" можно использовать как взаимозаменяемые.
В структуре модифицированного IL-7 А может быть присоединен к IL-7 непосредственно по N-концу или через линкер и, если не указано иное, данный термин и термин "второй домен слитых белков IL-7" могут использоваться как взаимозаменяемые.
В настоящем изобретении А может быть связан с N-концом IL-7. А может содержать от 1 до 10 аминокислот, выбранных из группы, состоящей из метионина, глицина и их сочетания.
Метионин и глицин не вызывают иммунных ответов в организме человека. Белковые терапевтические средства, продуцируемые E. Coli, всегда содержат метионин на N-конце, однако сообщения об их побочных реакциях отсутствуют. Кроме того, глицин широко используется в качестве линкера GS и не индуцирует иммунных ответов на коммерческие продукты, такие как дулаглутид (Cell Biophys. 1993 Jan-Jun; 22(103):189-224).
В иллюстративном варианте осуществления А может представлять собой олигопептид, содержащий от 1 до 10 аминокислот, выбранных из группы, состоящей из метионина (Met, М), глицина (Gly, G) и их сочетания, предпочтительно олигопептид содержит 1-5 аминокислот. Например, А может содержать N-концевую последовательность, выбранную из группы, состоящей из метионина, глицина, метионин-метионина, глицин-глицина, метионин-глицина, глицин-метионина, метионин-метионин-метионина, метионин-метионин-глицина, метионин-глицин-метионина, глицин-метионин-метионина, метионин-глицин-глицина, глицин-метионин-глицина, глицин-глицин-метионина и глицин-глицин-глицина. А именно, А может представлять собой аминокислотную последовательность, выбранную из группы, состоящей из метионина, глицина, метионин-метионина, глицин-глицина, метионин-глицина, глицин-метионина, метионин-метионин-метионина, метионин-метионин-глицина, метионин-глицин-метионина, глицин-метионин-метионина, метионин-глицин-глицина, глицин-метионин-глицина, глицин-глицин-метионина и глицин-глицин-глицина.
Другой аспект настоящего изобретения относится к слитому белку IL-7, содержащему: первый домен, содержащий полипептид, обладающий активностью IL-7 или подобной активностью; второй домен, содержащий аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания; и третий домен, который продлевает период полужизни слитого белка интерлейкина-7.
Третий домен может быть связан с N-концом или С-концом первого домена или второго домена. Кроме того, IL-7, включающий первый домен и второй домен, может быть связан с обоими концами третьего домена.
Третий домен может представлять собой партнер по гибридизации, увеличивающий период полужизни in vivo, предпочтительно выбранный из группы, состоящей из Fc-участка иммуноглобулина или его фрагмента, альбумина, альбумин-связывающего полипептида, Pro/Ala/Ser (PAS), C-концевого пептида (CTP) β-субъединицы человеческого хорионического гонадотропина, полиэтиленгликоля (PEG), длинных неструктурированных гидрофильных последовательностей аминокислот (XTEN), гидроксиэтилкрахмала (HES), альбуминсвязывающей малой молекулы и их сочетаний.
Если третий домен представляет собой Fc-участок иммуноглобулина, он может включать Fc-участок модифицированного иммуноглобулина. В частности, Fc-участок модифицированного иммуноглобулина может представлять собой Fc-участок, обладающий ослабленной антителозависимой клеточной цитотоксичностью (ADCC) или комплемент-зависимой цитотоксичностью (CDC) вследствие изменения сродства связывания в отношении Fc-рецептора и/или комплемента. Модифицированный иммуноглобулин может быть выбран из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и их сочетаний. А именно, Fc-участок модифицированного иммуноглобулина может содержать шарнирный участой, домен CH2 и домен CH3 в направлении от N-конца к C-концу. В частности, шарнирный участок может включать шарнирный участок человеческого IgD; домен CH2 может содержать часть аминокислотных остатков домена CH2 человеческого IgD и часть аминокислотных остатков домена CH2 человеческого IgG4; а домен СН3 может содержать часть аминокислотных остатков домена CH3 человеческого IgG4.
Кроме того, два слитых белка могут образовывать димер, например, если третий домен представляет собой Fc-участок, Fc-участки могут связываться друг с другом, способствуя образованию димера.
Используемые здесь термины "Fc-участок", "Fc-фрагмент" или "Fc" относятся к белку, который содержит константный участок 2 тяжелой цепи (CH2) и константный участок 3 тяжелой цепи (CH3) иммуноглобулина, но не содержит вариабельные домены тяжелой цепи и легкой цепи и константный участой легкой цепи (CL1) иммуноглобулина, кроме того, он может дополнительно содержать шарнирный участок константного домена тяжелой цепи. В настоящем изобретении гибридный Fc или гибридный фрагмент Fc также называют "hFc" или "hyFc".
В данном описании термин "вариант Fc-участка" относится к последовательности, полученной путем замещения части аминокислот Fc-участка, или путем объединения Fc-участков разных видов. Вариант Fc-участка может препятствовать вырезанию из шарнирного участка. А именно, 144 аминокислота и/или 145 аминокислота в SEQ ID NO: 9 может быть изменена. Предпочтительно вариант может представлять собой последовательность, в которой 144 аминокислота, K, заменена на G или S, или последовательность, в которой 145 аминокислота, E, заменена на G или S.
Кроме того, Fc-участок или вариант Fc-участка модифицированного иммуноглобулина может быть представлен нижеследующей формулой (I):
[Формула (I)]
N'- (Z1)р-Y-Z2-Z3-Z4-C'
В приведенной выше формуле (I)
N' обозначает N-конец полипептида, а С' обозначает С-конец полипептида;
p обозначает целое число 0 или 1;
Z1 обозначает аминокислотную последовательность, содержащую от 5 до 9 последовательных аминокислотных остатков, от аминокислотного остатка в положении 98 в направлении N-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 90 до 98 SEQ ID NO: 7;
Y обозначает аминокислотную последовательность, содержащую от 5 до 64 последовательных аминокислотных остатков от аминокислотного остатка в положении 162 в направлении N-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 99 до 162 SEQ ID NO: 7;
Z2 обозначает аминокислотную последовательность, содержащую от 4 до 37 последовательных аминокислотных остатков от аминокислотного остатка в положении 163 в направлении С-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 163 до 199 SEQ ID NO: 7;
Z3 обозначает аминокислотную последовательность, содержащую от 71 до 106 последовательных аминокислотных остатков от аминокислотного остатка в положении 220 в направлении N-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 115 до 220 SEQ ID NO: 8; и
Z4 обозначает аминокислотную последовательность, содержащую от 80 до 107 последовательных аминокислотных остатков от аминокислотного остатка в положении 221 в направлении С-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 221 до 327 SEQ ID NO: 8.
Кроме того, Fc-фрагмент настоящего изобретения может находиться в виде формы, содержащей нативные сахарные цепи, повышенное число сахарных цепей или пониженное число сахарных цепей по сравнению с нативной формой, или он может находиться в виде дегликозилированной формы. Сахарные цепи Fc иммуноглобулина можно модифицировать традиционными методами, такими как химический метод, ферментативный метод и метод генной инженерии с использованием микроорганизма. Удаление сахарных цепей из Fc-фрагмента приводит к резкому уменьшению сродства к части C1q первого компонента комплемента C1 и к уменьшению или потере ADCC или CDC, и тем самым предотвращает появление нежелательных иммунных ответов in vivo. В данной связи Fc-участок иммуноглобулина в виде дегликозилированной или агликозилированной формы может быть более подходящим для целей настоящего изобретения как носитель лекарственного средства. Используемый здесь термин "дегликозилирование" относится к ферментативному удалению сахаров из Fc-фрагмента. Термин "агликозилирование" означает, что Fc-фрагмент продуцируется прокариотом, предпочтительно E. Coli, в негликозилированной форме.
Кроме того, Fc-участок модифицированного иммуноглобулина может содержать аминокислотную последовательность SEQ ID NO: 9 (hyFc), SEQ ID NO: 10 (hyFcM1), SEQ ID NO: 11 (hyFcM2), SEQ ID NO: 12 (hyFcM3) или SEQ ID NO: 13 (hyFcM4). Fc-участок модифицированного иммуноглобулина также может содержать аминокислотную последовательность SEQ ID NO: 14 (нелитический мышиный Fc).
В соответствии с настоящим изобретением Fc-участок модифицированного иммуноглобулина может представлять собой Fc-участок, описанный в патенте США № 7867491, а получение Fc-участка модифицированного иммуноглобулина можно проводить по способу, описанному в патенте США № 7867491.
Второй домен может быть присоединен к первому домену непосредственно по N-концу или через линкер. А именно, полученная молекула может представлять собой конъюгат второй домен-первый домен или второй домен-линкер-первый домен.
Третий домен может быть присоединен к первому домену или второму домену непосредственно или через линкер. А именно, полученная молекула может представлять собой конъюгат второй домен-первый домен-третий домен, третий домен-второй домен-первый домен, второй домен-первый домен-линкер-третий домен, третий домен-линкер-второй домен-первый домен, второй домен-линкер-первый домен-линкер-третий домен, или третий домен-линкер-второй домен-первый домен.
Если линкер представляет собой пептид, присоединение можно осуществить по любому связывающему участку. Линкер можно присоединить с помощью сшивающего средства, известного в данной области техники. Примеры сшивающего агента могут включать, без ограничения, эфиры N-гидроксисукцинимида, такие как 1,1-бис(диазоацетил)-2-фенилэтан, глутаровый альдегид и 4-азидосалициловая кислота; имидоэфиры, в том числе дисукцинимидиловые сложные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), и бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан.
Кроме того, линкер может представлять собой альбуминовый линкер или пептидный линкер. Пептидный линкер может представлять собой пептид, содержащий 10-20 аминокислотных остатков, состоящих из остатков Gly и Ser.
Если в качестве линкера используют химическую связь, она может представлять собой дисульфидную связь, диаминовую связь, сульфидаминовую связь, карбоксиаминовую связь, сложноэфирную связь и ковалентную связь.
В иллюстративном варианте осуществления модифицированный IL-7 настоящего изобретения может иметь структуру A-IL-7, содержащую полипептид, обладающий активностью IL-7 или подобной активностью, и олигопептид, состоящий из 1-10 аминокислот.
В конкретном варианте осуществления модифицированный IL-7 может иметь аминокислотную последовательность, выбранную из SEQ ID NO: 15-20. Кроме того, модифицированный IL-7 может иметь последовательность, на 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98% или 99% гомологичную одной из аминокислотных последовательностей, описанных в SEQ ID NO: 15-20.
В другом иллюстративном варианте осуществления изобретение относится к модифицированному IL-7 или слитому белку IL-7 настоящего изобретения, который содержит первый домен, включающий полипептид, обладающий активностью IL-7 или подобной активностью; второй домен, включающий аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания; и третий домен, который представляет собой Fc-участок модифицированного иммуноглобулина, связанный с С-концом первого домена.
Слитый белок IL-7 может содержать аминокислотную последовательность, выбранную из SEQ ID NO: 21-25. Кроме того, слитый белок IL-7 может иметь последовательность, на 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% гомологичную одной из аминокислотных последовательностей, описанных в SEQ ID NO: 21-25.
Другой аспект настоящего изобретения относится к выделенной молекуле нуклеиновой кислоты, кодирующей модифицированный IL-7 или слитый белок IL-7.
Молекула нуклеиновой кислоты может представлять собой молекулу, кодирующую полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15-25. Молекула нуклеиновой кислоты может содержать полинуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 29-39.
Молекула нуклеиновой кислоты может дополнительно содержать сигнальную последовательность или лидерную последовательность.
В данном описании термин "сигнальная последовательность" относится к фрагменту, управляющему секрецией биологически активной молекулы лекарственного средства и слитого белка, который вырезается после трансляции в клетке-хозяине. Сигнальная последовательность настоящего изобретения представляет собой полинуклеотид, кодирующий аминокислотную последовательность, инициирующую перемещение белка через мембрану эндоплазматического ретикулума (ER). Сигнальные последовательности, подходящие для применения в настоящем изобретении, включают сигнальную последовательность легкой цепи антитела, например, антитела 14.18 (Gillies et al., J. Immunol. Meth 1989. 125:191-202), сигнальную последовательность тяжелой цепи антитела, например, сигнальную последовательность тяжелой цепи антитела MOPC141 (Sakano et al., Nature, 1980. 286: 676-683), и другие сигнальные последовательности, известные в данной области (например, см. Watson et al., Nucleic Acid Research, 1984. 12:5145-5164).
Характеристики сигнальных пептидов хорошо известны в данной области техники, и хотя сигнальные пептиды обычно содержат от 16 до 30 аминокислот, они могут содержать большее или меньшее число аминокислотных остатков. Обычные сигнальные пептиды состоят из трех участков основного N-концевого домена, центрального гидрофобного участка и более полярного С-концевого участка.
Центральный гидрофобный участок содержит от 4 до 12 гидрофобных остатков, которые способствуют иммобилизации сигнальной последовательности на липидном бислое мембраны во время перемещения незрелого полипептида. После инициации сигнальная последовательность часто вырезается в просвете ER клеточным ферментом, известным как сигнальная пептидаза. В частности, сигнальная последовательность может представлять собой секреторную сигнальную последовательность, обеспечивающую активацию тканевого плазминогена (tPa), сигнальную последовательность гликопротеина D вируса простого герпеса (HSV gDs) или гормона роста. Предпочтительно секреторную сигнальную последовательность используют в эукариотических клетках высших животных, таких как млекопитающие и т.д. Кроме того, в качестве секреторной сигнальной последовательности можно использовать сигнальную последовательность, входящую в состав IL-7 дикого типа, или ее можно использовать после введения путем замены кодона, характеризующегося высокой частотой экспрессии в клетке-хозяине.
Другой аспект настоящего изобретения относится к вектору экспрессии, содержащему выделенную молекулу нуклеиновой кислоты, кодирующую модифицированный IL-7 или слитый белок IL-7.
Используемый здесь термин "вектор" относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, которая может быть введена в клетку-хозяина с последующей рекомбинацией и вставкой в геном клетки-хозяина, или которая может спонтанно реплицироваться в виде эписомы. Вектор может включать линейные нуклеиновые кислоты, плазмиды, фагемиды, космиды, РНК-векторы, вирусные векторы и их аналоги. Примеры вирусных векторов могут включать, без ограничения, ретровирусы, аденовирусы и адено-ассоциированные вирусы.
Используемый здесь термин "экспрессия гена" или "экспрессия" целевого белка относится к транскрипции последовательности ДНК, трансляции транскрипта мРНК и секреции продукта в виде слитого белка или его фрагмента.
Используемый здесь термин "клетка-хозяин" относится к прокариотической клетке или эукариотической клетке, в которую может быть введен рекомбинантный вектор экспрессии. В данном описании термины "трансдуцированный", "трансформированный" и "трансфицированный" относятся к введению нуклеиновой кислоты (например, вектора) в клетку с использованием технологии, известной в данной области.
Используемый здесь термин "экспрессия гена" или "экспрессия" целевого белка относится к транскрипции последовательности ДНК, трансляции транскрипта мРНК и секреции продукта в виде слитого белка Fc или антитела, или фрагмента антитела.
Подходящий для применения вектор экспрессии может представлять собой RcCMV (Invitrogen, Carlsbad) или его вариант. Вектор экспрессии может содержать человеческий цитомегаловирус (CMV), способный обеспечивать непрерывную транскрипцию гена-мишени в клетке млекопитающего, и последовательность сигнала полиаденилирования бычьего гормона роста, повышающую стабильность РНК после транскрипции. В иллюстративном варианте осуществления настоящего изобретения вектор экспрессии представляет собой pAD15, который представляет собой модифицированную форму RcCMV.
В другом аспекте настоящее изобретение относится к клетке-хозяину, содержащей вектор экспрессии. Соответствующую клетку-хозяина можно использовать для экспрессии и/или секреции целевого белка путем трансдукции или трансфекции последовательности ДНК настоящего изобретения.
Примеры клетки-хозяина, подходящей для применения в настоящем изобретении, могут включать иммортализованную гибридомную клетку, клетку миеломы NS/0, клетку 293, клетку яичника китайского хомячка (CHO), клетку HeLa, клетку, полученную из амниотической жидкости человека (клетка CapT) или клетку COS.
В следующем аспекте настоящее изобретение относится к способу получения белка, включающему культивирование клеток, трансформированных вектором экспрессии; и сбор модифицированного IL-7 или слитого белка IL-7, из культуры или клеток, полученных в процессе культивирования.
Модифицированный IL-7 или слитый белок IL-7 можно выделить из культуральной среды или клеточного экстракта. Например, можно получить супернатант культуральной среды, в которую секретируется рекомбинантный белок, и затем сконцентрировать его с помощью фильтра для концентрирования белка, который можно приобрести на коммерческой основе, такого как устройство для ультрафильтрации Amicon или Millipore Pellicon. Затем концентрат можно очистить с помощью известного в данной области способа. Например, очистку можно проводить на носителе с иммобилизованным белком А.
В следующем аспекте настоящее изобретение относится к способу получения модифицированного IL-7, включающему присоединение олигопептида, содержащего аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания, к N- концу полипептида, обладающего активностью IL-7 или подобной активностью.
Описанный выше способ получения может дополнительно включать стадию присоединения полипептида, состоящего из гетерогенной последовательности, причем с помощью указанного способа можно получить слитый белок IL-7. В частности, полипептид, состоящий из гетерогенной последовательности, может представлять собой любой полипептид, выбранный из группы, состоящей из Fc-участка иммуноглобулина или его фрагмента, альбумина, альбуминсвязывающего полипептида, PAS, CTP β-субъединицы хорионического гонадотропина человека, PEG, XTEN, HES, альбумин-связывающей малой молекулы и их сочетания.
В другом аспекте настоящее изобретение относится к способу получения модифицированного IL-7, включающему: присоединение полинуклеотида, кодирующего олигопептид, содержащий аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания, к N-концу полинуклеотида, кодирующего полипептид, содержащий аминокислотную последовательность первого домена, обладающую активностью IL-7 или подобной активностью, с получением полинуклеотида, содержащего соединенные фрагменты; и экспрессию полученного полинуклеотида с последующим сбором модифицированного белка IL-7.
Описанный выше способ получения может дополнительно включать стадию присоединения полипептида, состоящего из гетерогенной последовательности, причем с помощью указанного способа можно получить слитый белок IL-7. В частности, полипептид, состоящий из гетерогенной последовательности, может представлять собой любой полипептид, выбранный из группы, состоящей из Fc-участка иммуноглобулина или его фрагмента, альбумина, альбумин-связывающего полипептида, PAS, CTP β-субъединицы хорионического гонадотропина человека, PEG, XTEN, HES, альбумин-связывающей малой молекулы и их сочетания.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболевания, содержащей модифицированный IL-7 или слитый белок IL-7.
Модифицированный IL-7 или слитый белок IL-7, настоящего изобретения можно вводить с целью содействия росту или выживанию наивных, или уже существуюших Т-клеток, или трансплантированных Т-клеток, или пролиферации выделенных агрегатов Т-клеток in vitro.
Заболевание может представлять собой хронический гепатит, рак или инфекционное заболевание. Рак может представлять собой рак головы и шеи или рак шейки матки, а хронический гепатит может представлять собой гепатит В или гепатит С. Инфекционное заболевание может представлять собой вирусную инфекцию, а вирус может быть выбран из группы, состоящей из вируса гриппа, CMV, HSV-1, HSV-2, HIV, HCV, HBV, вирус лихорадки Западного Нила и вирус денге. Кроме того, заболевание может представлять собой лимфоцитопению (лимфопению) или любой симптом, болезнь и синдром, обусловленные низким числом лимфоцитов, особенно Т-клеток.
Фармацевтическая композиция настоящего изобретения, в состав которой входит модифицированный IL-7 или слитый белок IL-7, может дополнительно содержать фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может представлять собой любое нетоксичное вещество, подходящее для доставки пациентам. В качестве носителя можно использовать дистиллированную воду, спирты, жиры, воски или неактивные твердые вещества. Кроме того, композиция также может содержать любые фармацевтически приемлемые вспомогательные средства (забуферивающие средства, диспергирующие средства).
Фармацевтическую композицию настоящего изобретения, в состав которой входит модифицированный IL-7 или слитый белок IL-7, можно вводить индивидуумам разными способами. Например, композицию можно вводить парентерально, например, подкожно, внутримышечно или внутривенно. Композицию можно стерилизовать с помощью обычных способов. Композиция может содержать фармацевтически приемлемые вспомогательные средства, необходимые для регуляции физиологических условий, такие как средства, регулирующие рН, средства, регулирующие токсичность, и их аналоги. Конкретные примеры могут включать ацетат натрия, хлорид калия, хлорид кальция, лактат натрия и др. Концентрация слитого белка, входящего в состав композиции, может широко варьировать. Например, концентрация слитого белка может составлять менее чем примерно 0,5% и обычно составляет, или составляет, по меньшей мере, примерно от 1% до 15-20%, в зависимости от массы. Концентрация может быть выбрана в зависимости от конкретного способа введения, объема жидкости, вязкости и т.д.
В следующем аспекте настоящее изобретение относится к способу профилактики или лечения заболевания путем введения композиции, содержащей в качестве активного ингредиента модифицированный IL-7 или слитый белок IL-7 настоящего изобретения.
Способ включает введение терапевтически эффективного количества модифицированного IL-7 или слитого белка IL-7 настоящего изобретения индивидууму, нуждающемуся в этом, состояние здоровья которого непосредственно связано или не связано с заболеванием-мишенью. Индивидуум может представлять собой млекопитающее, предпочтительно человека.
Композицию настоящего изобретения можно вводить любым способом. Композицию настоящего изобретения можно предоставлять животным путем непосредственного введения, например, локального (путем инъекции, трансплантации или местного введения в участок ткани) или системного (например, парентерального или перорального) с помощью соответствующих средств. Композиция настоящего изобретения, предназначенная для парентерального введения, такого как внутривенное, интраокулярное, внутрибрюшинное, внутримышечное, пероральное, интраректальное, интраорбитальное, интрацеребральное, интракраниальное, интраспинальное, внутрижелудочковое, интратекальное, интрацистинальное, интракапсулярное, интраназальное или аэрозольное введение, предпочтительно содержит водную или физиологически приемлемую суспензию биологической жидкости или часть ее раствора. Как таковой, физиологически приемлемый носитель или транспортер может быть добавлен в композицию и доставлен пациентам, не оказывая при этом отрицательного влияния на электролитический и/или объемный баланс пациентов. Соответственно, физиологически приемлемый носитель или транспортер может представлять собой физиологический раствор.
Кроме того, ДНК-конструкцию (или геномную конструкцию), содержащую нуклеиновую кислоту, кодирующую модифицированный IL-7 или слитый белок IL-7 настоящего изобретения, можно использовать как часть метода генной терапии.
В соответствии с настоящим изобретении для восстановления или дополнения функций целевого белка в конкретную клетку можно ввести вектор, способный обеспечить экспрессию слитого белка, вместе с любым биологически эффективным носителем. Такой носитель может представлять собой любую композицию, или композицию, которая может обеспечить эффективную доставку гена, кодирующего целевой белок или слитый белок IL-7, в клетку in vivo.
Для проведения генной терапии с использованием нуклеиновой кислоты, кодирующей модифицированный IL-7 или слитый белок IL-7, конкретный ген можно вставить в вирусный вектор, рекомбинантную бактериальную плазмиду или рекомбинантную эукариотическую плазмиду. Вирусный вектор может представлять собой рекомбинантный ретровирус, аденовирус, адено-ассоциированный вирус, вирус простого герпеса 1 и т.д. Доза нуклеиновой кислоты, кодирующей слитый белок настоящего изобретения, вводимая с целью проведения генной терапии человека, может составлять от 0,1 мг до 200 мг. В иллюстративном варианте осуществления предпочтительная доза нуклеиновой кислоты, кодирующей слитый белок настоящего изобретения, для человека может составлять от 0,6 до 100 мг. В другом иллюстративном варианте осуществления предпочтительная доза нуклеиновой кислоты, кодирующей слитый белок настоящего изобретения, для человека может составлять от 1,2 до 50 мг.
Разовая доза модифицированного IL-7 или слитого белка IL-7 настоящего изобретения, может находиться в диапазоне от 0,001 до 10 мг/кг. В иллюстративном варианте осуществления разовая доза модифицированного IL-7 или слитого белка IL-7, может находиться в диапазоне от 0,01 мг/кг до 2 мг/кг. В другом иллюстративном варианте осуществления разовая доза белка для человека может составлять от 0,02 до 1 мг/кг. Разовая доза может варьировать в зависимости от заболевания, подлежащего лечению, и наличия неблагоприятных эффектов. Введение модифицированного белка IL-7 можно осуществлять путем периодических болюсных инъекций или с использованием внешних резервуаров (например, внутривенных мешков), или путем непрерывного внутривенного, подкожного или внутрибрюшинного введения из внутреннего источника (такого как биоразрушаемый имплантат).
Модифицированный IL-7 или слитый белок IL-7 настоящего изобретения, можно вводить в сочетании с другим лекарственным средством (другими лекарственными средствами) или физиологически активным веществом (физиологически активными веществами), которое оказывает профилактическое или лечебное воздействие на заболевание, подлежащее профилактике или лечению, или он может входить в состав комбинированного препарата вместе с другим лекарственным средством (другими лекарственными средствами), например, его можно вводить в сочетании с иммуностимулятором, таким как гемопоэтический фактор роста, цитокин, антиген и адъювант. Гемопоэтический фактор роста может представлять собой фактор стволовых клеток (SCF), G-CSF, GM-CSF или лиганд Flt-3. Цитокин может представлять собой γ-интерферон, IL-2, IL-15, IL-21, IL-12, RANTES или B7-1.
Способ профилактики или лечения заболеваний с использованием композиции, в состав которой входит модифицированный IL-7 или слитый белок IL-7 настоящего изобретения, также может включать введение в сочетании с другими лекарственными средствами или физиологически активными веществами, причем способ сочетанного введения, период введения и доза могут зависеть от типа заболевания, состояния здоровья пациента, цели лечения или профилактики и типа других лекарственных средств или физиологически активных веществ, подлежащих введению в сочетании.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение подробно разъясняется посредством примеров. Нижеследующие примеры предназначены для дополнительной иллюстрации настоящего изобретения, но не ограничения его объема.
Пример 1. Получение модифицированного белка IL-7, в котором олигопептид присоединен к IL-7
Получают модифицированный IL-7, в котором олигопептид присоединен к N-концу IL-7. В качестве IL-7 используют последовательность человеческого IL-7 (SEQ ID NO: 1), а в качестве олигопептида используют метионин (M), глицин (G), MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM.
Как показано на фиг.1А, получают разные формы модифицированного IL-7, имеющего структуру A'-IL-7. В данном примере в качестве 2 домена (олигопептид, A') используют метионин (M), глицин (G), MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM. В качестве IL-7 или 1 домена, к которому присоединяют олигопептид, используют нуклеотидную последовательность SEQ ID NO: 28. Получают полноразмерную нуклеотидную последовательность, которая содержит последовательность, кодирующую IL-7, и присоединенную к ней последовательность, кодирующую олигопептид, и затем вставляют ее в вектор экспрессии. В качестве отрицательного контроля аналогичным способом получают белок IL-7, не содержащий олигопептид.
Вектор экспрессии, содержащий ген A-IL-7, трансфицируют в клетку HEK293. На основе 300 мл суспензионной культуры получают полиплекс, используя 208,3 мкг ДНК и 416,6 мкг (мкл) полиэтиленимина (PEI) (масс/масс), и затем трансфицируют его в клетку HEK293F. Через шесть дней после трансфекции получают культуру клеток, которую подвергают анализу методом вестерн-блоттинга, чтобы определить уровень экспрессии целевого белка. Затем культуру центрифугируют при 8000 об/мин в течение 30 минут и после удаления культурального дебриса фильтруют с помощью фильтра-насадки для бутылок с размером пор 0,22 мкм. В результате получают культуральную жидкость, содержащую модифицированный IL-7, после использования M-IL-7, G-IL-7, MM-IL-7, GG-IL-7, MG-IL-7, GM-IL-7, MMM-IL-7, MMG-IL-7, MGM-IL-7, GMM-IL-7, MGG-IL-7, GMG-IL-7, GGM-IL-7, GGG-IL-7, DDD- IL-7 и MMMM-IL-7.
Пример 2. Получение слитого белка IL-7, в котором Fc-участок присоединен к C-концу IL-7
Получают слитый белок IL-7 со структурой второй домен-первый домен-третий домен, в котором полипептид, состоящий из гетерогенной аминокислотной последовательности, также присоединен к C-концу модифицированного IL-7. В качестве первого домена используют последовательность человеческого IL-7 (SEQ ID NO: 1), а в качестве второго домена используют M, G, MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM. В качестве третьего домена используют последовательность Fc-участка (SEQ ID NO: 9 или 14).
Как показано на фиг.1В, получают разные формы слитых белков IL-7, состоящие из второго домена, первого домена и третьего домена. В этом примере в качестве второго домена используют метионин (M), глицин (G), MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM; в качестве первого домена используют человеческий IL-7; а в качестве третьего домена используют гибридный Fc (hFc, hyFc) или нелитический мышиный Fc.
В частности, в качестве гибридного Fc используют hFc (гибридный Fc), раскрытый в патенте США № 7867491. hFc можно присоединить к физиологически активному белку и тем самым продемонстрировать превосходный период полужизни in vivo по сравнению с Fc-участком существующего модифицированного иммуноглобулина.
Вектор экспрессии гена получают по способу примера 1, трансфицируют им клетки и затем клетки культивируют с получением культуральной жидкости, содержащей разные формы слитых белков IL-7. В результате получают культуральную жидкость, содержащую белок G-IL-7-hyFc, M-IL-7-hyFc, MM-IL-7-hyFc, GG-IL-7-hyFc, MG-IL-7-hyFc, GM-IL-7-hyFc, MMM-IL-7-hyFc, MMG-IL-7-hyFc, MGM-IL-7-hyFc, GMM-IL-7-hyFc, MGG-IL-7-hyFc, GMG-IL-7-hyFc, GGM-IL-7-hyFc, GGG-IL-7-hyFc, DDD-IL-7-hyFc или MMMM-IL-7-hyFc. Кроме того, получают культуральную жидкость, содержащую белок IL-7-hyFc, состоящий из первого домена и третьего домена, которую используют в качестве контроля.
Пример 3. Получение и очистка модифицированного IL-7 и слитого белка, содержащего модифицированный IL-7
Сравнивают уровень продукции модифицированных белков IL-7 и слитых белков, содержащих модифицированный IL-7, полученных в предыдущих примерах. Измеряют количество каждого из слитых белков в культуральной жидкости и в клетках.
Концентрацию белков, секретируемых во внеклеточную среду, измеряют в культуральной жидкости, а концентрацию белков в клетке измеряют после лизиса клеток методом ELISA. В качестве первичного антитела используют человеческое IL-7-специфичное антитело (Southern Biotech, № по каталогу 10122-01), а в качестве вторичного антитела используют биотин (BD, № по каталогу 554494) и стрептавидин-HRP (BD, № по каталогу 554066).
Изменение уровня продукции при присоединении олигопептида к N-концу показано ниже в таблице 2.
[Таблица 2]
(мкг/мл)
точная конц B (мкг/мл)
(мкг/мл)
Как показано в таблице 2, уровень продукции MGM-IL-7 превышает уровни продукции IL-7, к которому не присоединен олигопептид, и DDD-IL-7, к которому присоединена аминокислота, отличная от метионина и глицина.
Кроме того, показано, что при дополнительном присоединении hyFc к C-концу модифицированного IL-7 полученный белок присутствует в высокой концентрации, а его относительная общая продукция увеличивается примерно в 2,8 раз.
Пример 4. Определение уровня продукции полученных модифицированного IL-7 или слитого белка IL-7
Среди генных конструкций, полученных в примере 2, выбирают гены, кодирующие белки IL-7-hyFc и MGM-IL-7-hyFc, и вставляют их в вектор pAD15. Затем вектором pAD15 трансфицируют клетки CHO DG44 (Колумбийский университет, США) в адгезионной или суспензионной культуре, используя метод электропорации. Через пять часов после электропорации среду адгезионной культуры заменяют средой, содержащей 10% dFBS (Gibco, США, 30067-334), альфа-MEM (Gibco, 12561, США, № по каталогу 12561-049), HT (5-гидрокситрипамин, Gibco, США, 11067-030). Через сорок восемь часов после трансфекции среду заменяют средой альфа-MEM, содержащей 10% dFBS и не содержащей HT, и проводят HT-отбор. Клоны, полученные в результате HT-отбора, подвергают МТХ-амплификации с целью повышения продуктивности, после чего клетки субкультивируют 2 или 3 раза для стабилизации.
Удельную продукцию (пг/клетку/день, пкд, п/к/д) модифицированного IL-7 (A-IL-7) и слитого белка IL-7 (A-IL-7-hyFc) оценивают во время HT-отбора и МТХ-амплификации. В процессе субкультивирования извлекают культуральный супернатант и измеряют число клеток и количество каждого белка в супернатанте, используя набор ELISA для определения человеческого IgG (Bethyl, USA). Удельную продукцию рассчитывают по приведенному ниже уравнению 1 и оценивают продуцирующую клеточную линию (пг/клетку/день, пкд):
[Уравнение 1]
Удельная продукция (пг/клетку/день, пкд)=Культуральная продукция (пг/мл×общий объем культуры)/Число живых клеток (клетки/T25)×число дней культивирования (дни)
Клонирование методом серийных разведений (LDC) проводят с использованием клонов, выбранных по результатам оценки удельной продукции, и, следовательно, представляющих собой клоны, полученные из отдельных клеток, обладающих повышенной продуктивностью. Отобранные клоны, полученные из одной клетки, культивируют в виде суспензионной клеточной линии с использованием бессывороточной среды. Тестирование на долговременную стабильность (LTS) проводят путем получения одной 3-дневной субкультуры с последующим субкультивированием 35 раз, результаты показаны на фиг. 2.
Как показано на фиг.2А, увеличение концентрации MTX не приводит к увеличению продукции слитого белка IL-7, который не содержит олигопептид, присоединенный к N-концу. В данном случае обработку MTX проводят до 4 раз с целью дополнительного повышения продуктивности, но безрезультатно. Однако, как показано на фиг.2B, увеличение концентрации MTX приводит к значительному увеличению продукции слитого белка IL-7 (MGM-IL-7-hyFc), который содержит олигопептид, присоединенный к N-концу. После работы с LDL показано, что продукция белка составляет примерно 28 пг/клетку/день и примерно 16 мкг/мл.
Полученные результаты подтверждают, что присоединение олигопептида к белку IL-7 может привести к значительному повышению продукции рекомбинантного IL-7.
Пример 5. Подтверждение стабильности полученных модифицированного IL-7 или слитого белка IL-7
Образцы культуральной жидкости, содержащие белки IL-7-hyFc и MGM-IL-7-hyFc, полученные в предыдущих примерах, подвергают очистке, после чего очищенные белки подвергают эксклюзионной (SE) ВЭЖХ и определяют стабильность белков в зависимости от концентрации хлорида натрия.
Вначале белки IL-7-hyFc и MGM-IL-7-hyFc разводят буфером до концентрации 1 мг/мл. Разведенные белки фильтруют с использованием шприца объемом 1 мл и фильтра 0,2 мкм и вносят во флаконы. Флаконы помещают во вставной блок и закрывают крышками. Белки вводят в систему SE-ВЭЖХ в количестве 20 мкл, соответственно. SE-ВЭЖХ проводят в указанных ниже условиях, подтверждая чистоту посредством величин полученных пиков.
<Условия проведения SE-ВЭЖХ>
Колонка: колонка TSK-GEL G3000SWxL (7,8 мм×300 мм) (Tosoh, Япония)
Температура колонки: 25°C
Мобильная фаза: смешанный буфер, содержащий 50 мМ фосфат натрия и 100 мМ, 200 мМ или 300 мМ хлорид натрия (рН 6,8)
Скорость потока: 0,6 мл/мин
Время анализа: 40 мин
Метод анализа: изократический метод
Как показано на фиг.3, результаты свидетельствуют о том, что белок MGM-IL-7-hyFc является стабильным даже при изменении концентрации хлорида натрия, в отличие от белка IL-7-hyFc.
Пример 6. Подтверждение методом нативного PAGE полученных модифицированного IL-7 или слитого белка IL-7
Различие в стабильности слитого белка, содержащего модифицированный IL-7, и слитого белка, содержащего IL-7, в зависимости от концентрации хлорида натрия, обнаруженное в примере 5, подтверждают следующим образом.
А именно, нативный PAGE проводят в условиях, описанных ниже в таблице 3, используя IL-7-hyFc и MGM-IL-7-hyFc, полученные в условиях, приведенных в предыдущих примерах. G-CSF-hyFc используют в качестве контроля.
[Таблица 3]
(Invitrogen, LC2673)
(Invitrogen, LC2672)
Как показано на фиг.4, результаты свидетельствуют о том, что белок MGM-IL-7-hyFc не образует агрегатов, в отличие от белка IL-7-hyFc, что согласуется с результатом SE-ВЭЖХ.
Пример 7. Анализ культуральных образцов, содержащих полученные модифицированный IL-7 и слитый белок IL-7
Согласно результатам примеров 5 и 6 среди клеточных линий, способных продуцировать белок IL-7-hyFc или MGM-IL-7-hyFc, выбирают клеточные линии с наивысшей продуктивностью. Затем культуральную жидкость, полученную после субкультивирования, подвергают анализу методом SE-ВЭЖХ, используя способ и условия, описанные в примере 5.
Как показано на фиг. 5A, результаты свидетельствуют о том, что относительная продукция MGM-IL-7-hyFc составляет 2,091%, что примерно в 21 раз превышает количество продуцируемого белка IL-7-hyFc, которое принимают за 100%. Кроме того, если количество целевого белка определяют по сравнению с общим содержанием белков, продуцируемых каждой клеткой-хозяином, то чистота IL-7-hyFc составляет примерно 11,3%, а чистота белка MGM-IL-7-hyFc составляет примерно 66,4%, что свидетельствует о примерно 6-кратном увеличении (фиг.5В).
Полученные результаты подтверждают, что присоединение олигопептида к белку IL-7 может приводить к значительному повышению чистоты и продукции рекомбинантного слитого белка IL-7.
Пример 8. Фармакокинетические профили полученных модифицированного IL-7 и слитого белка IL-7
Фармакокинетические профили (PK) подтверждают путем сравнения значений периодов полужизни и площадей под кривой (AUC) полученных рекомбинантных белков IL-7-hyFc и MGM-IL-7-hyFc.
Вначале самцам крыс Sprague Dawley (SD) (5 крыс/группу) подкожно вводят каждый из рекомбинантных белков в количестве 0,2 мг/кг соответственно. Образцы крови собирают перед введением и через 4, 8, 12, 24, 48, 72, 96, 120, 144 и 168 часов после введения и хранят при комнатной температуре в течение 30 минут, чтобы достичь агрегации образцов крови. Агрегированные образцы крови центрифугируют при 3000 об/мин в течение 10 минут, поредством чего получают сыворотку крови из каждого образца и хранят ее в морозильной камере.
Образцы анализируют с помощью метода тестирования, специально разработанного для обнаружения интактной формы рекомбинантного белка, которая не подвергается расщеплению. А именно, данный метод включает детекцию целевого белка с помощью вторичного антитела (Southern Biotech, № по каталогу 9190-05), конъюгированного с HRP, присоединенной к человеческому иммуноглобулину G4 (IgG4) мышиного происхождения, после загрузки биообразца, содержащего полученный рекомбинантный белок, на планшет, покрытый улавливающим антителом мышиного происхождения (R&D, № по каталогу MAB207), которое связывается с человеческим IL-7. Количественное определение образцов осуществляют после 10-кратного разведения 1×PBS, содержащим 10% обезжиренного молока, чтобы провести анализ на линейном участке стандартной кривой. Результаты, показанные на фиг. 6, приведены в виде количества белка, остающегося в крови на каждый момент времени, и площади под кривой, отражающей концентрацию лекарственного средства.
Полученные результаты показывают, что рекомбинантные белки IL-7-hyFc и MGM-IL-7-hyFc характеризуются сходными значениями AUC (различающимися примерно в 1,2 раза). Как таковые, результаты подтверждают, что олигопептид, входящий в состав гибрида в качстве второго домена, не вызывает изменений в фармакокинетике первого домена. Следовательно, рекомбинантный белок MGM-IL-7-hyFc и рекомбинантный белок IL-7-hyFc могут иметь сходные фармакокинетические профили in vivo.
Пример 9. Иммуногенность полученных модифицированного IL-7 и слитого белка IL-7
Сравнивают способность полученных ранее рекомбинантных белков IL-7-hyFc и MGM-IL-7-hyFc индуцировать после введения образование антител против лекарственного средства (ADA), и таким образом оценивают антигенность каждого слитого белка IL-7.
Вначале образцы крови, полученные по способу, описанному в примере 8, помещают в планшет, покрытый рекомбинантными белками IL-7-hyFc или MGM-IL-7-hyFc в количестве 0,2 мкг/лунку. Затем образцы анализируют с помощью метода тестирования, разработанного для детекции ADA у крыс, с использованием антитела против крысиных иммуноглобулинов (Southern Biotech, № по катаогу 1031-05), конъюгированного с HRP.
В частности, образцы анализируют путем разведения до концентрации, при которой реакция ADA достигает уровня реакции нормальной крысиной сыворотки (пороговое значение отрицательного результата, NCO), и измерения реакции образцов по оптической плотности в зависимости от кратности разведения. Результаты показаны на фиг. 7.
Как показано на фиг. 7, результаты свидетельствуют о том, что для достижения порогового значения отрицательного результата (NCO), нужны сходные разведения IL-7-hyFc и MGM-IL-7-hyFc. Полученные результаты подтверждают, что введение в состав гибрида олигопептида в качестве второго домена не повышает антигенность.
Пример 10. Фармакодинамический профиль полученных модифицированного IL-7 и слитого белка IL-7
Сравнивают число белых кровяных клеток (WBC) после введения полученных ранее рекомбинантных белков MGM-IL-7-hyFc и IL-7-hyFc и получают фармакодинамический профиль для каждого белка.
Вначале самцам крыс SD (5 крыс/группу) подкожно вводят каждый белок в количестве 0,2 мг/кг. Затем у крыс собирают образцы крови до введения и на 1, 2 и 3 неделе после введения. Чтобы предотвратить агрегацию, образцы крови помещают в пробирки, обработанные ЭДТА, перемешивают в течение 5 минут и стабилизируют, после чего определяют число WBC с помощью полного анализа крови (CBC).
Как показано на фиг. 8, результаты свидетельствуют о том, что рекомбинантные белки IL-7-hyFc и MGM-IL-7-hyFc увеличивают число WBC до максимального уровня сходным образом на 2 неделе после введения. То есть, введение олигопептида в состав гибрида в качестве второго домена не приводит к изменению фармакодинамики. Соответственно, подтверждено, что рекомбинантные белки IL-7-hyFc и MGM-IL-7-hyFc могут иметь сходные фармакодинамические профили.
Пример 11. Сравнение in vitro активности полученных модифицированного IL-7 и слитого белка IL-7
Анализ биологической активности проводят с использованием клеток 2E8 (АТСС, TIB-239), которые представляют собой мышиные незрелые В-лимфоциты.
Вначале клетки высевают в 96-луночный планшет (1×105 клеток/50 мкл/лунку), затем MGM-IL-7-hyFc постадийно разводят до получения концентрации от 750 пМ до 2,93 пМ и вносят в лунки. Клетки культивируют в инкубаторе (37°С, 5% СО2) в течение 70 часов, обрабатывают MTS в концентрации 20 мкл/лунку и снова культивируют в инкубаторе (37°С, 5% СО2) в течение 4 часов. Затем измеряют поглощение при 490 нм. В качестве контрольной группы используют международный стандарт ВОЗ человеческого IL-7 (код NIBSC: 90/530, 100000 единиц). Получают калибровочную кривую в соответствии с используемой концентрацией MGM-IL-7-hyFc (4-параметрическая подгонка), результат анализа показан на фиг. 9.
Как показано на фиг. 9, результаты свидетельствуют о том, что при сравнении с международным стандартом, 100000 единиц, активность MGM-IL-7-hyFc, выраженная в виде logEC50, соответствует 126000 единиц, а активность при сравнении с PLA соответствует 371000 единиц. Это указывает на то, что с учетом числа молекул IL-7 активность MGM-IL-7-hyFc подобна активности международного стандарта IL-7, или превышает ее.
Пример 12. Профилактический и лечебный эффект полученного слитого белка, содержащего модифицированный IL-7, у модели, инфицированной летальной дозой вируса гриппа
Мышиную модель с летальной дозой вируса гриппа получают путем обезболивания с последующим введением вируса 3LD50 H5N2 (A/Aquatic bird/Korea/W81/2005) через носовую полость. Как правило, инфицированные вирусом мыши начинают терять вес через 2-3 дня и умирают через неделю или позже. Полученной таким образом модели болезни вводят через носовую полость рекомбинантные белки IL-7, полученные в примерах 2 и 4, а в качестве контроля используют IL-7-mFc (мышиный Fc) (SEQ ID NO: 27).
G-CSF может ингибировать раннюю стадию инфекции вируса гриппа и индуцировать пролиферацию нейтрофилов, тем самым стимулируя иммунный ответ. Таким образом, G-CSF-hyFc используют для введения другой экспериментальной группе.
Каждая экспериментальная группа состоит из шести мышей, которым через носовую полость вводят IL-7-mFc (IL-7-мышиный Fc), MGM-IL-7-hyFc или G-CSF-hyFc за 14 дней до инфицирования летальной дозой вируса гриппа. Затем вводят вирус 3LD50 H5N2 и после этого в течение 20 дней ведут наблюдение за массой тела и выживаемостью.
Как показано на фиг. 10, масса тела начинает уменьшаться во всех группах (фиг.10А). Однако в группе, обработанной IL-7-mFc, и в группе, обработанной MGM-IL-7-hyFc, скорость снижения массы тела постепенно уменьшается, масса тела постепенно восстанавливается, и наблюдается высокая степень выживаемости, в отличие от контрольной группы. В группе, получающей IL-7-mFc, выживаемость составляет 100%, а в группе, получающей MGM-IL-7-hyFc, выживаемость составляет 83% (фиг.10В).
Причиной более низкого эффекта MGM-IL-7-hyFc по сравнению с IL-7-mFc, по-видимому, является различие между видами. То есть, в организме мыши in vivo человеческий Fc вызывает более низкий эффект, чем мышиный Fc.
Между тем в группе, получающей PBS или G-CSF-hyFc, наблюдается очень низкий эффект, и, следовательно, выживаемость мышей, инфицированных летальной дозой вируса гриппа, через 10 дней составляет 0%.
В заключение необходимо отметить, что рекомбинантные белки MGM-IL-7-hyFc оказывают сильный эффект на модель гриппа, в отличие от G-CSF-hyFc, свидетельствуя о том, что MGM-IL-7 является высокоэффективным средством против гриппа.
Пример 13. Лечебный эффект, оказываемый полученным слитым белком, содержащим модифицированный IL-7, на модель ракового заболевания TC-1
Чтобы получить модель рака эндометрия, мышам вводят внутрибрюшинно 3 мг Depo-Provera для корректировки периода менструации. Через 4 дня мышам вводят ноноксинол-9 (N9, USP, № по каталогу 1467950) во влагалище, чтобы стимулировать ткань влагалища, а оставшийся N9 удаляют промыванием PBS. Затем в матку трансплантируют раковые клетки путем введения 1×105 клеток TC-1 (д-р Jae-Tae LEE, школа медицины, Национальный университет Кюнгпука), а через 1 день в шейку матки вводят 1 мкг MGM-IL-7-hyFc.
Через 28 дней после введения слитого белка опухолевые клетки TC-1 трансплантируют в шейку матки или внутрь влагалища и оставляют расти. То есть, как показано на фиг. 11, раковые клетки пролиферируют и появляются снаружи влагалищного отверстия. В контрольной группе, получающей PBS, у 6 из 10 мышей наблюдается пролиферация клеток TC-1, причем одна из указанных мышей умирает вследствие чрезмерной пролиферации раковых клеток.
И наоборот, в экспериментальной группе, получающей слитый белок MGM-IL-7, только у двух из 10 мышей наблюдается симптом пролиферации клеток TC-1, причем ни одна мышь не умирает. Соответственно, полученные результаты подтверждают, что слитый белок, содержащий модифицированный IL-7, можно эффективно использовать для профилактики и лечения рака.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УВЕЛИЧЕНИЯ КОЛИЧЕСТВА ЛИМФОЦИТОВ В ОПУХОЛЯХ С ПОМОЩЬЮ ГИБРИДНОГО БЕЛКА IL-7 | 2020 |
|
RU2822396C1 |
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из функционального фрагмента человеческого IL-1RA и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2821896C1 |
| СЛИТЫЕ БЕЛКИ IL-7 | 2004 |
|
RU2369616C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО (Н14.18) НА ОСНОВАНИИ АНТИТЕЛА 14.18 МЫШИ, СВЯЗЫВАЮЩЕЕСЯ С GD2, И ЕГО СЛИЯНИЕ С IL-2 | 2003 |
|
RU2366664C2 |
| Рекомбинантный дрожжевой трансформант и способ получения с его использованием Fc-фрагмента иммуноглобулина | 2014 |
|
RU2664862C2 |
| БИОЛОГИЧЕСКИ АКТИВИРУЕМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ОСНОВЕ ЦИТОКИНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2819307C2 |
| НОВЫЕ IL-17-СВЯЗЫВАЮЩИЕ СОЕДИНЕНИЯ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2010 |
|
RU2550272C2 |
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из растворимого экстраклеточного фрагмента человеческого IL-6R и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2818329C1 |
| КОМПЛЕКСЫ АНТИТЕЛ С НЕСКОЛЬКИМИ ЦИТОКИНАМИ | 2000 |
|
RU2263118C2 |
| СЛИТНЫЕ БЕЛКИ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2530168C2 |





































Настоящее изобретение относится к области биотехнологии, конкретно к модифицированному интерлейкину-7 (IL-7) и рекомбинантному способу его получения, и может быть использовано в медицине для лечения вирусных заболеваний, выбранных из гриппа, гепатита В и гепатита С, лимфоцитопении и раковых заболеваний. Интерлейкин-7 модифицирован присоединением олигопептида из 1-10 аминокислотных остатков, состоящих из метионина, глицина или их комбинации. При этом олигопептид не является единичным метионином. На основе модифицированного IL-7 получен слитый белок, дополнительно включающий домен, который продлевает период полужизни слитого белка. Изобретение позволяет получить стабильный модифицированный IL-7 с высоким выходом. 20 н. и 16 з.п. ф-лы, 11 ил., 3 табл., 13 пр.
1. Стабильный модифицированный интерлейкин-7, имеющий следующую структуру:
A-IL-7,
где A обозначает олигопептид, состоящий из 1-10 аминокислотных остатков, состоящих из метионина, глицина или их комбинации,
олигопептид не является единичным метионином, и
IL-7 обозначает интерлейкин-7 или полипептид, имеющий идентичность аминокислотной последовательности 70% или более SEQ ID NO: 1 и обладающий активностью интерлейкина-7.
2. Модифицированный интерлейкин-7 по п.1, где IL-7 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-6.
3. Модифицированный интерлейкин-7 по п.1, где А присоединен к N-концу IL-7.
4. Модифицированный интерлейкин-7 по п.1, где А обозначает любой фрагмент, выбранный из группы, состоящей из глицина, метионин-метионина, глицин-глицина, метионин-глицина, глицин-метионина, метионин-метионин-метионина, метионин-метионин-глицина, метионин-глицин-метионина, глицин-метионин-метионина, метионин-глицин-глицина, глицин-метионин-глицина, глицин-глицин-метионина и глицин-глицин-глицина.
5. Слитый белок интерлейкина-7, содержащий нижеследующие домены (a), (b) и (c):
(a) первый домен, содержащий интерлейкин-7, или полипептид, имеющий идентичность аминокислотной последовательности 70% или более SEQ ID NO: 1 и обладающий активность интерлейкина-7;
(b) второй домен, включающий олигопептид, содержащий от 1 до 10 аминокислотных остатков, состоящих из метионина, глицина или их сочетания, где указанный олигопептид не является единичным метионином; и
(c) третий домен, который продлевает период полужизни слитого белка, содержащего интерлейкин-7;
третий домен представляет собой любой фрагмент, выбранный из группы, состоящей из Fc-участка иммуноглобулина или его фрагмента, альбумина, альбуминсвязывающего полипептида, Pro/Ala/Ser (PAS), С-концевого пептида (CTP) β-субъединицы человеческого хорионического гонадотропина, длинных неструктурированных гидрофильных последовательностей аминокислот (XTEN) и их сочетания.
6. Слитый белок интерлейкина-7 по п.5, где третий домен присоединен к N-концу или С-концу первого домена или второго домена.
7. Слитый белок интерлейкина-7 по п.5, где второй домен представляет собой любой фрагмент, выбранный из группы, состоящей из глицина, метионин-метионина, глицин-глицина, метионин-глицина, глицин-метионина, метионин-метионин-метионина, метионин-метионин-глицина, метионин-глицин-метионина, глицин-метионин-метионина, метионин-глицин-глицина, глицин-метионин-глицина, глицин-глицин-метионина и глицин-глицин-глицина.
8. Слитый белок интерлейкина-7 по п.5, где третий домен содержит Fc-участок модифицированного иммуноглобулина.
9. Слитый белок интерлейкина-7 по п.8, где модифицированный иммуноглобулин выбран из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и их сочетаний.
10. Слитый белок интерлейкина-7 по п.8, где Fc-участок модифицированного иммуноглобулина содержит шарнирный участок, домен CH2 и домен CH3 в направлении от N-конца к С-концу,
где шарнирный участок содержит шарнирный участок человеческого IgD, домен CH2 содержит часть аминокислотных остатков домена CH2 человеческого IgD и человеческого IgG4, и домен CH3 содержит часть аминокислотных остатков домена CH3 человеческого IgG4.
11. Слитый белок интерлейкина-7 по п.8, где Fc-участок модифицированного иммуноглобулина представлен нижеследующей формулой (I):
[Формула (I)]
N'-(Z1)p-Y-Z2-Z3-Z4-C',
где N' обозначает N-концевой полипептид, а С' обозначает С-концевой полипептид;
p обозначает целое число, равное 0 или 1;
Z1 обозначает аминокислотную последовательность, содержащую от 5 до 9 последовательных аминокислотных остатков, от аминокислотного остатка в положении 98 в направлении N-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 90 до 98 SEQ ID NO: 7;
Y обозначает аминокислотную последовательность, содержащую от 5 до 64 последовательных аминокислотных остатков, от аминокислотного остатка в положении 162 в направлении N-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 99 до 162 SEQ ID NO: 7;
Z2 обозначает аминокислотную последовательность, содержащую от 4 до 37 последовательных аминокислотных остатков, от аминокислотного остатка в положении 163 в направлении С-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 163 до 199 SEQ ID NO: 7;
Z3 обозначает аминокислотную последовательность, содержащую от 71 до 106 последовательных аминокислотных остатков, от аминокислотного остатка в положении 220 в направлении N-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 115 до 220 SEQ ID NO: 8; и
Z4 обозначает аминокислотную последовательность, содержащую от 80 до 107 последовательных аминокислотных остатков, от аминокислотного остатка в положении 221 в направлении С-конца, выбранных из аминокислотных остатков, присутствующих в положениях от 221 до 327 SEQ ID NO: 8.
12. Слитый белок интерлейкина-7 по п.5, где третий домен имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9-14.
13. Выделенная молекула нуклеиновой кислоты, кодирующая модифицированный интерлейкин-7 по любому из пп.1-4.
14. Молекула нуклеиновой кислоты по п.13, где молекула нуклеиновой кислоты кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15-20.
15. Молекула нуклеиновой кислоты по п.13, где молекула нуклеиновой кислоты содержит полинуклеотид, имеющий последовательность оснований, выбранную из группы, состоящей из SEQ ID NO: 29-34.
16. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по любому из пп.13-15.
17. Клетка-хозяин для получения модифицированного интерлейкина-7 по любому из пп.1-4, содержащая вектор экспрессии по п.16, где указанная клетка-хозяин не является эмбриональной клеткой человека.
18. Способ получения модифицированного интерлейкина-7 по любому из пп.1-4, включающий:
(a) культивирование клеток, трансформированных вектором экспрессии по п.16, где указанные клетки не являются эмбриональными клетками человека; и
(b) сбор модифицированного интерлейкина-7 из культуры или клеток, полученных на стадии (а).
19. Способ получения стабильного модифицированного интерлейкина-7 по любому из пп.1-4, включающий присоединение второго домена, содержащего аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания, где указанная аминокислотная последовательность не является единичным метионином, к N-концу первого домена, обладающего активностью интерлейкина-7.
20. Способ получения слитого белка интерлейкина-7 по любому из пп.5-12, включающий:
присоединение второго домена, содержащего аминокислотную последовательность, состоящую из 1-10 аминокислотных остатков, выбранных из метионина, глицина или их сочетания, где указанная аминокислотная последовательность не является единичным метионином, к N-концу первого домена, обладающего активностью интерлейкина-7; и
присоединение С-конца первого домена к третьему домену;
где третий домен представляет собой любой фрагмент, выбранный из группы, состоящей из Fc-участка иммуноглобулина или его фрагмента, альбумина, альбуминсвязывающего полипептида, PAS, CTP β-субъединицы хорионического гонадотропина человека, XTEN и их сочетаний.
21. Способ получения стабильного модифицированного интерлейкина-7 по любому из пп.1-4, включающий:
(a) получение собранного полинуклеотида путем присоединения полинуклеотида, кодирующего полипептид, имеющий аминокислотную последовательность второго домена, содержащую от 1 до 10 аминокислотных остатков, состоящих из метионина, глицина или их сочетания, где указанная аминокислотная последовательность не является единичным метионином, к N-концу полинуклеотида, кодирующего первый домен, обладающий активностью интерлейкина-7; и
(b) сбор модифицированного интерлейкина-7 путем экспрессии собранного полинуклеотида.
22. Способ получения слитого белка интерлейкина-7 по любому из пп.5-12, включающий:
(a) получение собранного полинуклеотида путем присоединения полинуклеотида, кодирующего полипептид, имеющий аминокислотную последовательность второго домена, содержащую от 1 до 10 аминокислотных остатков, состоящих из метионина, глицина или их сочетания, где указанная аминокислотная последовательность не является единичным метионином, и полинуклеотида, кодирующего третий домен, к N-концу и С-концу полинуклеотида, кодирующего первый домен, обладающего активностью интерлейкина-7, соответственно; и
(b) сбор интерлейкина-7 путем экспрессии собранного полинуклеотида, где третий домен представляет собой любой фрагмент, выбранный из группы, состоящей из Fc-участка иммуноглобулина или его фрагмента, альбумина, альбуминсвязывающего полипептида, PAS, CTP β-субъединицы хорионического гонадотропина человека, XTEN и их сочетаний.
23. Фармацевтическая композиция для профилактики или лечения раковых заболеваний, содержащая эффективное количество модифицированного интерлейкина-7 по любому из пп.1-4 или слитого белка интерлейкина-7 по любому из пп.5-12 и фармацевтически приемлемый носитель.
24. Фармацевтическая композиция по п.23, где указанное раковое заболевание представляет собой рак головы и шеи или рак шейки матки.
25. Фармацевтическая композиция для профилактики или лечения вирусных заболеваний, выбранных из гриппа, гепатита В и гепатита С, содержащая эффективное количество модифицированного интерлейкина-7 по любому из пп.1-4 или слитого белка интерлейкина-7 по любому из пп.5-12 и фармацевтически приемлемый носитель.
26. Фармацевтическая композиция для профилактики или лечения лимфоцитопении (лимфопении), содержащая эффективное количество модифицированного интерлейкина-7 по любому из пп.1-4 или слитого белка интерлейкина-7 по любому из пп.5-12 и фармацевтически приемлемый носитель.
27. Способ профилактики или лечения раковых заболеваний, включающий введение эффективного количества модифицированного интерлейкина-7 по любому из пп.1-4 или слитого белка интерлейкина-7 по любому из пп.5-12 и фармацевтически приемлемого носителя индивидууму, нуждающемуся в этом.
28. Способ по п.27, где указанное раковое заболевание представляет собой рак головы и шеи или рак шейки матки.
29. Способ профилактики или лечения вирусных заболеваний, выбранных из гриппа, гепатита В и гепатита С, включающий введение эффективного количества модифицированного интерлейкина-7 по любому из пп.1-4 или слитого белка интерлейкина-7 по любому из пп.5-12 и фармацевтически приемлемого носителя индивидууму, нуждающемуся в этом.
30. Способ профилактики или лечения лимфоцитопении (лимфопении), включающий введение эффективного количества модифицированного интерлейкина-7 по любому из пп.1-4 или слитого белка интерлейкина-7 по любому из пп.5-12 и фармацевтически приемлемого носителя индивидууму, нуждающемуся в этом.
31. Выделенная молекула нуклеиновой кислоты, кодирующая слитый белок интерлейкина-7 по любому из пп.5-12.
32. Молекула нуклеиновой кислоты по п.31, где молекула нуклеиновой кислоты кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 21-25.
33. Молекула нуклеиновой кислоты по п.32, где молекула нуклеиновой кислоты содержит полинуклеотид, имеющий последовательность оснований, выбранную из группы, состоящей из SEQ ID NO: 35-39.
34. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по любому из пп.31-33.
35. Клетка-хозяин для получения слитого белка интерлейкина-7 по любому из пп.5-12, содержащая вектор экспрессии по п.34, где указанная клетка-хозяин не является эмбриональной клеткой человека.
36. Способ получения слитого белка интерлейкина-7 по любому из пп.5-12, включающий:
(a) культивирование клеток, трансформированных вектором экспрессии по п.34, где указанные клетки не являются эмбриональными клетками человека; и
(b) сбор слитого белка интерлейкина-7 из культуры или клеток, полученных на стадии (а).
| Головка смазочного шприца | 1947 |
|
SU70834A1 |
| Способ очистки сточных вод | 1987 |
|
SU1527179A1 |
| Курительный прибор | 1928 |
|
SU12802A1 |
| US 2011243887, 06.10.2011. | |||
Авторы
Даты
2019-12-04—Публикация
2016-06-10—Подача