Перекрестная ссылка на связанные заявки
В этой заявке заявлены преимущества предварительной заявки США № 62/895 787, поданной 4 сентября 2019 г., и предварительной заявки США № 62/935 828, поданной 15 ноября 2019 г.
Предшествующий уровень техники
Т-клетки распознают антигены злокачественных опухолей, разрушают злокачественные опухолевые клетки, дифференцируются и пролиферируют в клетки памяти, таким образом, играя ключевую роль в иммунном ответе, направленном на рак. Следовательно, разнообразие распознавания, способное распознавать различные антигены раковых клеток, экспрессируемые в Т-клетках, размножение клонов Т-клеток, которые реагируют на антигены, специфические для рака, и дифференцировка в Т-клетки памяти в тканях рака могут максимизировать лечение, направленное против рака. Кроме того, цитотоксическая химиотерапия и лучевая терапия, которые используются в качестве стандартных способов лечения рака, разрушают костный мозг и иммунные клетки в крови, что приводит к потере Т-клеток, необходимых для противораковой иммунной функции, уменьшает противоопухолевый эффект от иммунотерапевтических лекарственных средств. Согласно недавнему отчету, дефицит Т-клеток у онкологических больных связан со снижением скорости ответа на химиотерапию и снижением выживаемости пациентов. На сегодняшний день IL-2 (Aldesleukin®) является единственным цитокиновым лечением, одобренным в качестве лечения, индуцирующеего пролиферацию и гиперфункцию Т-клеток. Однако введение IL2 имеет ограниченную эффективность из-за пролиферации регуляторных Т-клеток, вызывающих иммуносупрессию, а серьезные побочные эффекты, такие как цитокиновый шторм и синдром повышенной проницаемости капилляров, вызванные чрезмерным иммунным ответом, ограничивают фактическое клиническое применение введения IL2.
В противоположность этому, интерлейкин-7 (IL-7) является важным фактором роста и активации Т-клеток и в первую очередь участвует в дифференцировке, пролиферации и выживании наивных Т-клеток и Т-клеток памяти, которые участвуют в распознавании антигена и нацеливании на него, разрушая при этом злокачественные раковые клетки. IL-7 не индуцирует пролиферацию регуляторных Т-клеток, которые ингибируют активацию эффекторных Т-клеток. Кроме того, при повышении уровня IL-7 в организме происходит пролиферация Т-клеток, и через связывание с рецептором IL-7 (CD127), который в основном экспрессируется в размножившихся Т-клетках, IL-7 перемещается внутрь клетки (трансцитоз). IL-7 поддерживает гомеостаз и известен как гомеостатический цитокин. Поэтому серьезные побочные эффекты, связанные с иммунитетом, такие как цитокиновый шторм, вызванный чрезмерным иммунным ответом, которые были основной проблемой клинической безопасности других цитокинов, не были зарегистрированы в предыдущих клинических испытаниях рекомбинантного человеческого IL-7 (rhIL-7) компании Cytheris под кодовым названием CYT107.
IL-7 кодируется геном IL7 и связывается с рецептором IL-7 (CD127). IL-7 представляет собой иммуностимулирующий цитокин, который может стимулировать иммунные ответы, опосредованные В-клетками и Т-клетками. IL-7 играет важную роль в адаптивной иммунной системе.
В одновременно находящейся на рассмотрении заявке (заявка США № 15/126313), полное содержание которой включено в настоящее описание ссылкой, представлены модифицированный белок IL-7 с повышенной экспрессией и периодом полувыведения, гибридный белок, содержащий модифицированный IL-7, и способ их получения.
Сущность изобретения
В настоящем изобретении предлагается способ увеличения количества лимфоцитов с использованием модифицированного IL-7 или гибридного белка, содержащего модифицированный IL-7.
В одном воплощении предлагается способ увеличения количества лимфоцитов у нуждающегося в этом объекта, включающий введение объекту модифицированного IL-7 или его гибридного белка.
Субъект, нуждающийся в этом, может быть млекопитающим, страдающим рака или злокачественной опухоли. Рак может быть солидной опухолью. В типичном воплощении солидная опухоль может представлять собой местно-распространенную или метастатическую солидную опухоль или глиобластому.
В частном случае субъект может быть человеком.
В одном частном случае субъект ранее подвергался или параллельно подергается лечению рака. Модифицированный IL-7 или его гибридный белок можно вводить отдельно или одновременно с другим(ими) противоопухолевым(ыми) средством(ами).
Следовательно, различные аспекты изобретения включают следующие частные случаи.
1. Способ увеличения числа лимфоцитов у субъекта, нуждающегося в этом, включающий введение
(i) модифицированного интерлейкина-7 следующей формулы (I):
А - IL-7 формулы (I),
где А представляет собой олигопептид, состоящий из 1-10 аминокислотных остатков, а
IL-7 представляет собой полипептид, способный связываться с рецептором IL-7; или
(ii) гибридного белка интерлейкина-7, содержащего
первый домен, включающий модифицированный интерлейкин-7 формулы (I),
второй домен, включающий олигопептид, содержащий от 1 до 10 аминокислотных остатков, состоящий из метионина, глицина или их комбинации; и
третий домен, который продлевает время полувыведения гибридного белка интерлейкина-7,
субъекту в дозе более чем 600 мкг/кг.
2. Способ по вышеуказанному 1, отличающийся тем, что субъект страдает от онокологического заболевания, инфекции, хронической недостаточности правого желудочка сердца, болезни Ходжкина и рака лимфатической системы, лейкоза, протечки или разрыва грудного протока, побочными эффектами рецептурных препаратов, включая противораковые средства (например, химиотерапию), противовирусных средств и глюкокортикоидов, недоедания в результате диеты с низким содержанием белка, лучевой терапии, уремита, аутоиммунных расстройств, синдромов иммунодефицита, высокого уровня стресса, травмы, тимэктомии или их комбинации; или идиопатического, острого лучевого синдрома (англ. acute radiation syndrome, ARS) или их комбинации.
3. В способе по вышеуказанному 1 или 2 IL-7 имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-6.
4. Способ по любому из вышеуказанных 1-3, отличающийся тем, что А связан с N-концом IL-7.
5. Способ по любому из вышеуказанных 1-4, отличающийся тем, что А представляет собой метионин (М), глицин (G), метионин-метионин, глицин-глицин, метионин-глицин, глицин-метионин, метионин-метионин-метионин, метионин-метионин- глицин, метионин-глицин-метионин, глицин-метионин-метионин, метионин-глицин-глицин, глицин-метионин-глицин, глицин-глицин-метионин, глицин-глицин-глицин, MMMM, MGMM, MGGM, MGGG, MGMG, GMMM, GMGG, GGGG, MMMMM, MMGMM, MMGGM, MGMMG, MMMMG, GGGGG, GGMMM, GGGMG, MGMGMG, MMMGGG, MMGGMM, GGMMGG, MGMGMGMG, MMMMGGGG, MMGGMMGG, MMMMGGGG, MGMGMGMGMG или и MMMMMGGGGG.
6. Способ по вышеуказанному 5, отличающийся тем, что третий домен связан с N-концом или С-концом первого домена или второго домена. В одном частном случае третий домен связан с С-концом второго домена.
7. Способ по любому из вышеуказанных 1-6, отличающийся тем, что третий домен представляет собой любой домен, выбранный из группы, состоящей из Fc-области иммуноглобулина или его части, альбумина, полипептида, связывающего альбумин, Pro/Ala/Ser (PAS), С-концевого пептида (CTP) β-субъединицы хорионического гонадотропина человека, полиэтиленгликоля (PEG), длинных неструктурированных гидрофильных последовательностей аминокислот (XTEN), гидроксиэтилкрахмала (HES), малой молекулы, связывающей альбумин, и их комбинации.
8. Способ по любому из вышеуказанных 1-7, отличающийся тем, что третий домен содержит Fc-область модифицированного иммуноглобулина.
9. Способ по любому из вышеуказанных 1-8, отличающийся тем, что модифицированный иммуноглобулин выбран из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и их комбинации.
10. Способ по любому из вышеуказанных 1-9, отличающийся тем, что Fc-область модифицированного иммуноглобулина содержит шарнирную область, домен СН2 и домен СН3 от N-конца к С-концу,
при этом шарнирная область содержит шарнирную область IgD человека,
домен CH2 включает часть аминокислотных остатков домена CH2 IgD человека и IgG4 человека, и
домен СН3 включает часть аминокислотных остатков домена СН3 из IgG4 человека.
11. Способ по любому из вышеуказанных 1-10, отличающийся тем, что Fc-область модифицированного иммуноглобулина представлена следующей формулой (I):
формула (I)
N'-(Z1)p-Y-Z2-Z3-Z4-C'
где N’ представляет собой N-конец полипептида, а C' представляет собой С-конец полипептида;
p представляет собой целое число 0 или 1;
Z1 представляет собой аминокислотную последовательность, имеющую от 5 до 9 последовательных аминокислотных остатков от аминокислотного остатка в положении 98 относительно N-конца среди аминокислотных остатков в положениях от 90 до 98 из SEQ ID NO: 7; и
Y представляет собой аминокислотную последовательность, имеющую от 5 до 64 последовательных аминокислотных остатков от аминокислотного остатка в положении 162 относительно N-конца среди аминокислотных остатков в положениях от 99 до 162 из SEQ ID NO: 7;
Z2 представляет собой аминокислотную последовательность, имеющую от 4 до 37 последовательных аминокислотных остатков от аминокислотного остатка в положении 163 относительно С-конца среди аминокислотных остатков в положениях от 163 до 199 из SEQ ID NO: 7;
Z3 представляет собой аминокислотную последовательность, имеющую от 71 до 106 последовательных аминокислотных остатков от аминокислотного остатка в положении 220 относительно N-конца среди аминокислотных остатков в положениях от 115 до 220 из SEQ ID NO: 8; и
Z4 представляет собой аминокислотную последовательность, имеющую от 80 до 107 последовательных аминокислотных остатков от аминокислотного остатка в положении 221 относительно С-конца среди аминокислотных остатков в положениях от 221 до 327 из SEQ ID NO: 8.
12. Способ по любому из вышеуказанных 1-11, отличающийся тем, что третий домен имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9-14.
13. Способ по любому из вышеуказанных 2-12, отличающийся тем, что рак представляет собой солидную опухоль, злокачественное новообразование лимфатической системы или лейкоз.
14. Способ по указанному выше 13, отличающийся тем, что солидная опухоль представляет собой синовиальную саркому, инфильтрирующую протоковую карциному, рак прямой кишки, рак ободочной кишки, рак яичников, рак восходящей кишки, рак анального канала, инвазивную протоковую карциному, аденокарциному, рак прямой кишки с парааортальным метастатическим поражением, нейроэндокринную карциному (шейки матки), рак сигмовидной кишки или глиобластому.
15. Способ по любому из вышеуказанных 1-14, отличающийся тем, что субъект ранее получал или одновременно получает один или несколько способов лечения рака, включая хирургическое вмешательство, лучевую терапию и/или химиотерапию.
16. Способ по любому из вышеуказанных 1-15, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе в диапазоне от более чем 600 мкг/кг до около 2000 мкг/кг.
17. Способ по любому из вышеуказанных 1-16, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе около 720 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг.
18. Способ по любому из вышеуказанных 1-16, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе около 720 мкг/кг или больше, около 840 мкг/кг или больше или около 1440 мкг/кг или выше.
19. Способ по любому из вышеуказанных 1-16, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе 720 мкг/кг или больше, 840 мкг/кг или больше, 960 мкг/кг или выше, 1200 мкг/кг или больше, 1440 мкг/кг или больше, 1700 мкг/кг или выше или 2000 мкг/кг.
20. Способ по любому из вышеуказанных 1-19, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недель, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель или 12 недель.
21. Способ по любому из вышеуказанных 1-19, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз с интервалом 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней.
22. Способ по любому из вышеуказанных 1-21, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят парэнтерально, внутримышечно, подкожно, офтальмологически, внутривенно, внутрибрюшинно, внутрикожно, интраорбитально, интрацеребрально, интракраниально, интраспинально, интравентрикулярно, интратекально, интрацистернально, интракапсулярно или интратуморально.
23. Способ по любому из вышеуказанных 1-22, включающий введение (ii) гибридного белка интерлейкина-7.
24. Способ по любому из вышеуказанных 1-23, отличающийся тем, что (i) модифицированный интерлейкин-7 имеет аминокислотную последовательность SEQ ID NO: 18, и (ii) гибридный белок интерлейкина-7 содержит аминокислотную последовательность SEQ ID NO: 24.
25. Способ по любому из вышеуказанных 1-24, отличающийся тем, что количество лимфоцитов у субъекта составляет 1000 или менее лимфоцитов/мкл крови и/или сыворотки, как определено в соответствии с общей терминологией критериев нежелательных явлений (CTCAE) версии 4.0.
26. Способ по любому из вышеуказанных 1-25, отличающийся тем, что лимфоцит представляет собой Т-клетку.
27. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз в количестве около 720 мкг/кг с интервалом около 1 неделя, около 2 недель, около 3 недель или около 4 недель.
28. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз в количестве около 840 мкг/кг с интервалом около 2 неделя, около 3 недель, около 4 недель или около 5 недель.
29. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз в количестве около 960 мкг/кг с интервалом около 2 недели, около 3 недель, около 4 недель, около 5 недель или около 6 недель.
30. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз в количестве около 1200 мкг/кг с интервалом около 3 недели, около 4 недели, около 5 недель, около 6 недель, около 7 недель или около 8 недель.
31. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят два или более раз в количестве около 1440 мкг/кг с интервалом около 3 недели, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 10 недель, или около 12 недель, или около 2 месяцев, или около 3 месяцев.
32. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе более чем около 600 мкг/кг, более чем около 700 мкг/кг, более чем около 800 мкг/кг, более чем около 900 мкг/кг, более чем около 1000 мкг/кг, более чем около 1100 мкг/кг, более чем около 1200 мкг/кг, более чем около 1300 мкг/кг, более чем около 1400 мкг/кг, более чем около 1500 мкг/кг, более чем около 1600 мкг/кг, более чем около 1700 мкг/кг, более чем около 1800 мкг/кг, более чем около 1900 мкг/кг или более чем около 2000 мкг/кг.
33. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе от около 610 мкг/кг до около 1200 мкг/кг, от около 650 мкг/кг до около 1200 мкг/кг, от около 700 мкг/кг до около 1200 мкг/кг, от около 750 мкг/кг до около 1200 мкг/кг, от около 800 мкг/кг до около 1200 мкг/кг от около 850 мкг/кг до около 1200 мкг/кг, от около 900 мкг/кг до около 1200 мкг/кг, от около 950 мкг/кг до около 1200 мкг/кг, от около 1000 мкг/кг до около 1200 мкг /кг, от около 1050 мкг/кг до около 1200 мкг/кг, от около 1100 мкг/кг до около 1200 мкг/кг, от около 1200 мкг/кг до около 2000 мкг/кг, от около 1300 мкг/кг и около 2000 мкг/кг, от около 1500 мкг/кг до около 2000 мкг/кг, от около 1700 мкг/кг до около 2000 мкг/кг, от около 610 мкг/кг до около 1000 мкг/кг, от около 650 мкг/кг и около 1000 мкг/кг, от около 700 мкг/кг до около 1000 мкг г/кг, от около 750 мкг/кг до около 1000 мкг/кг, от около 800 мкг/кг до около 1000 мкг/кг, от около 850 мкг/кг до около 1000 мкг/кг, от около 900 мкг/кг до около 1000 мкг/кг или от около 950 мкг/кг до около 1000 мкг/кг.
34. Способ по вышеуказанному 1 или 26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе от около 700 мкг/кг до около 900 мкг/кг, от около 750 мкг/кг и около 950 мкг/кг, от около 700 мкг/кг до около 850 мкг/кг, от около 750 мкг/кг до около 850 мкг/кг, от около 700 мкг/кг до около 800 мкг/кг, от около 800 мкг/кг до около 900 мкг/кг, от около 750 мкг/кг до около 850 мкг/кг или от около 850 мкг/кг до около 950 мкг/кг.
35. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе около 650 мкг/кг, около 680 мкг/кг, около 700 мкг/кг, около 720 мкг/кг, около 740 мкг/кг, около 750 мкг/кг, около 760 мкг/кг, около 780 мкг/кг, около 800 мкг/кг, около 820 мкг/кг, около 840 мкг/ кг, около 850 мкг/кг, около 860 мкг/кг, около 880 мкг/кг, около 900 мкг/кг, около 920 мкг/кг, около 940 мкг/кг, около 950 мкг/кг, около 960 мкг/кг, около 980 мкг/кг, около 1000 мкг/кг, около 1020 мкг/кг, около 1040 мкг/кг, около 1060 мкг/кг, около 1080 мкг/кг, около 1100 мкг/кг, около 1120 мкг/кг, около 1140 мкг/кг, около 1160 мкг/кг, около 1180 мкг/кг, около 1200 мкг/кг, около 1220 мкг/кг, около 1240 мкг/кг, около 1260 мкг/кг, около 1280 мкг/кг, около 1300 мкг/ кг, около 1320 мкг/кг, около 1340 мкг/кг, около 1360 мкг/кг, около 1380 мкг/кг, около 1400 мкг/кг, около 1420 мкг/кг, около 1440 мкг/кг, около 1460 мкг/кг, около 1480 мкг/кг, около 1500 мкг/кг, около 1520 мкг/кг, около 1540 мкг/кг, около 1560 мкг/кг, около 1580 мкг/кг, около 1600 мкг/кг, около 1620 мкг/кг, около 1640 мкг/кг, около 1660 мкг/кг, около 1680 мкг/кг, около 1700 мкг/кг, около 1720 мкг/кг, около 1740 мкг/кг, около 1760 мкг/кг, около 1780 мкг/кг, около 1800 мкг/кг, около 1820 мкг/кг, около 1840 мкг/кг, около 1860 мкг/ кг, около 1880 мкг/кг, около 1900 мкг/кг, около 1920 мкг/кг, около 1940 мкг/кг, около 1960 мкг/кг, около 1980 мкг/кг или около 2000 мкг/кг.
36. Способ по любому из вышеуказанных 32-35, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят с частотой дозирования один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в 10 недель, один раз в 11 недель или один раз в 12 недель.
37. Способ по вышеуказанному 26, отличающийся тем, что Т-клетка представляет собой CD4+ Т-клетку и/или CD8+ Т-клетку.
38. Способ по вышеуказанному 26, отличающийся тем, что Т-клетка представляет собой CD4+/CD8+ Т-клетку.
39. Способ по любому из вышеуказанных 1-38, отличающийся тем, что количество лимфоцитов у субъекта составляет 800 лимфоцитов или менее/мкл крови.
40. Способ по любому из вышеуказанных 1-39, отличающийся тем, что количество лимфоцитов у субъекта составляет 500 лимфоцитов или менее/мкл крови.
41. Способ по любому из вышеуказанных 1-40, отличающийся тем, что количество лимфоцитов у субъекта составляет 200 лимфоцитов или менее/мкл крови.
42. Способ по любому из вышеуказанных 15-41, отличающийся тем, что субъекту одновременно вводят противоопухолевый агент.
43. Способ по вышеуказанному 42, отличающийся тем, что противоопухолевый агент представляет собой противоопухолевое химическое соединение.
44. Способ по любому из вышеуказанных 1-43, отличающийся тем, что количество лимфоцитов, инфильтрирующих опухоль (TIL), в опухоли увеличивается после введения (i) модифицированного интерлейкина-7 или (ii) гибридного белка интерлейкина-7 по сравнению с количеством TIL в опухоли перед введением.
45. Способ по любому из вышеуказанных 1-44, отличающийся тем, что TIL представляют собой CD4+ TIL.
46. Способ по любому из вышеуказанных 1-44, отличающийся тем, что TIL представляют собой CD8+ TIL.
47. Способ по любому из вышеуказанных 44-46, отличающийся тем, что после введения количество TIL увеличивается по меньшей мере на около 10%, по меньшей мере на около 20%, по меньшей мере на около 30%, по меньшей мере на около 40%, по меньшей мере на около 50%, при по меньшей мере на около 60%, по меньшей мере на около 70%, по меньшей мере на около 80%, по меньшей мере на около 90%, по меньшей мере на около 100%, по меньшей мере на около 125%, по меньшей мере на около 150%, по меньшей мере на около 200%, по меньшей мере на около 250% или по меньшей мере на около 300%.
48. Способ по любому из вышеуказанных 1-26, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе около 650 мкг/кг - 680 мкг/кг, около 680 мкг/кг - 700 мкг/кг, около 700 мкг/кг - 720 мкг/кг, около 720 мкг/кг - 740 мкг/кг, около 740 мкг/кг - 750 мкг/кг, около 750 мкг/кг - 760 мкг/ кг, около 760 мкг/кг - 780 мкг/кг, около 780 мкг/кг - 800 мкг/кг, около 800 мкг/кг - 820 мкг/кг, около 820 мкг/кг - 840 мкг/кг, около 840 мкг/кг - 850 мкг/кг, около 850 мкг/кг - 860 мкг/кг, около 860 мкг/кг - 880 мкг/кг, около 880 мкг/кг - 900 мкг/кг, около 900 мкг/кг - 920 мкг/кг, около 920 мкг/кг - 940 мкг/кг, около 940 мкг/кг - 950 мкг/кг, около 950 мкг/кг - 960 мкг/кг, около 960 мкг/кг - 980 мкг/кг, около 980 мкг/кг - 1000 мкг/кг, около 1000 мкг/кг - 1020 мкг/кг, около 1020 мкг/кг - 1040 мкг/кг, около 1040 мкг/кг - 1060 мкг/кг, около 1060 мкг/кг - 1080 мкг/кг, около 1080 мкг/кг - 1100 мкг/кг, около 1100 мкг/кг - 1120 мкг/кг, около 1120 мкг/кг - 1140 мкг/кг, около 1140 мкг/кг - 1160 мкг/кг, около 1,1 60 мкг/кг - 1180 мкг/кг, около 1180 мкг/кг - 1200 мкг/кг, около 1200 мкг/кг - 1220 мкг/кг, около 1220 мкг/кг - 1240 мкг/кг, около 1240 мкг/кг - 1260 мкг/кг, около 1260 мкг/кг - 1280 мкг/кг, около 1280 мкг/кг - 1300 мкг/кг, около 1300 мкг/кг -1320 мкг/кг, около 1320 мкг/кг - 1340 мкг/кг, около 1340 мкг/кг - 1360 мкг/кг, около 1360 мкг/кг - 1380 мкг/кг, около 1380 мкг/кг - 1400 мкг/кг, около 1400 мкг/кг - 1420 мкг/кг, около 1420 мкг/кг - 1440 мкг /кг, около 1440 мкг/кг - 1460 мкг/кг, около 1480 мкг/кг, около 1480 мкг/кг - 1500 мкг/кг, около 1500 мкг/кг - 1520 мкг/кг, около 1520 мкг/кг - 1540 мкг /кг, около 1540 мкг/кг - 1560 мкг/кг, около 1560 мкг/кг - 1580 мкг/кг, около 1580 мкг/кг - 1600 мкг/кг, около 1600 мкг/кг - 1620 мкг/кг, около 1620 мкг/кг - 1640 мкг/кг, около 1640 мкг/кг - 1660 мкг/кг, около 1660 мкг/кг - 1680 мкг/кг, около 1680 мкг/кг - 1700 мкг/кг, около 1700 мкг/кг - 1720 мкг/ кг, около 1720 мкг/кг - 1740 мкг/кг, около 1740 мкг/кг - 1760 мкг/кг, около 1760 мкг/кг - 1780 мкг/кг, около 1780 мкг/кг - 1800 мкг/кг, около 1800 мкг/кг - 1820 мкг/кг, около 1820 мкг/кг - 1840 мкг/кг, около 1840 мкг/кг - 1860 мкг/кг, около 1860 мкг/кг - 1880 мкг/кг, около 1880 мкг/кг - 1900 мкг/кг, около 1900 мкг/кг - 1920 мкг/кг, около 1920 мкг/кг - 1940 мкг/кг, около 1940 мкг/кг - 1960 мкг/кг, около 1960 мкг/кг - 1980 мкг/кг или около 1980 мкг/кг - 2000 мкг/кг.
49. Способ согласно вышеуказанному пункту 48, отличающийся тем, что (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят дважды, трижды, четыре раза или пять раз в вышеуказанной дозе с интервалом в около 2 недели, около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 9 недель, около 10 недель, около 11 недель, около 12 недель, около 13 недель, около 14 недель или около 15 недель.
Краткое описание чертежей
На фиг. 1А, 1В и 1С показаны фармакокинетические профили при внутривенном, подкожном и внутримышечном введении у крыс, соответственно.
На фиг. 2A и 2B показаны профили зависимости концентрации GX-I7 от времени в зависимости от дозы, показанные в линейной шкале и логарифмической шкале.
На фиг. 3А и 3В показана экспозиция в сыворотке (Cmax и AUClast) и корреляция с дозой, соответственно.
На фиг. 4А и 4В показаны изменения абсолютного количества лимфоцитов (англ. absolute lymphocyte count, ALC) по сравнению с исходным значением в группах с низкой дозой (60-120 мкг/кг), средней дозой (240-480 мкг/кг) и высокой дозой (720-1200 мкг/кг). На фиг. 7A показаны результаты для группы пациентов с солидной злокачественной опухолью, а на фиг. 7B показаны результаты для группы пациентов с глиобластомой.
На фиг. 5А и 5В показаны изменения количества CD3+ по сравнению с исходным уровнем в группах с низкой дозой (60-120 мкг/кг), средней дозой (240-480 мкг/кг) и высокой дозой (720-1200 мкг/кг). На фиг. 5A показаны результаты для группы пациентов с солидной злокачественной опухолью, а на фиг. 5B показаны результаты для группы пациентов с глиобластомой.
На фиг. 6А и 6В показаны изменения количества CD4+ по сравнению с исходным значением в группах с низкой дозой (60-120 мкг/кг), средней дозой (240-480 мкг/кг) и высокой дозой (720-1200 мкг/кг). фиг. 6A показаны результаты для группы пациентов с солидной злокачественной опухолью, а на фиг. 6B показаны результаты для группы пациентов с глиобластомой.
На фиг. 7А и 7В показаны изменения количества CD8+ по сравнению с исходным значением в группах с низкой дозой (60-120 мкг/кг), средней дозой (240-480 мкг/кг) и высокой дозой (720-1200 мкг/кг). фиг. 7A показаны результаты для группы пациентов с солидной злокачественной опухолью, а на фиг. 7B показаны результаты для группы пациентов с глиобластомой.
На фиг. 8A и 8B показаны изменения абсолютного количества лимфоцитов (ALC) в группе пациентов с солидной злокачественной опухолью без лимфопении (исходный уровень ALC ≥1000 клеток/мм3) и в группе пациентов с солидной злокачественной опухолью с лимфопенией (исходный уровень ALC <1000 клеток/мм3), соответственно, которые разделены на группы с низкой дозой (60-120 мкг/кг), средней дозой (240-480 мкг/кг) и высокой дозой (720-1200 мкг/кг). *p<0,05, **p<0,01, ***p<0,001 по сравнению с исходной группой (0 неделя) по знаковому ранговому критерию Уилкоксона для согласованных пар.
На фиг. 9A и 9B показаны изменения абсолютного количества лимфоцитов (ALC) в группе пациентов с глиобластомой без лимфопении (исходный уровень ALC ≥1000 клеток/мм3) и в группе пациентов с солидной злокачественной опухолью с лимфопенией (исходный уровень ALC<1000 клеток/мм3), соответственно, которые разделены на группы с низкой дозой (60-120 мкг/кг), средней дозой (240-480 мкг/кг) и высокой дозой (720-1200 мкг/кг). *p<0,05, **p<0,01, ***p<0,001 по сравнению с исходной группой (0 неделя) по знаковому ранговому критерию Уилкоксона для согласованных пар.
На фиг. 10А, 10В и 10С показаны изменения соотношения Ki67, CD127 и Treg в клетках CD4+ и CD8+, соответственно после введения гибридного белка IL-7 в низкой дозе (60-120 мкг/кг), средней дозе (240-480 мкг/кг). мкг/кг) и группы высоких доз (720-1200 мкг/кг). NS: Незначимо, *p<0,05, **p<0,01, ***p<0,001 по сравнению с исходной группой (0 неделя) по знаковому ранговому критерию Уилкоксона для согласованных пар.
На фиг. 11 представлена временная шкала взятия образцов крови в обезьяньей модели.
На фиг. 12А и 12В показаны паттерны экспрессии Ki67 в клетках CD8+ и CD4+, соответственно, в образцах крови тестируемых обезьян.
На фиг. 13A и 13B показаны изменения абсолютного количества лимфоцитов (ALC) по сравнению с исходным значением при многократном введении в течение времени от нуля (0 неделя) до 15 недель в группе с низкой дозой (120 мкг/кг) (фиг. 13A) и в группах со средней дозой (360-600 мкг/кг) и высокой дозой (840-1440 мкг/кг) (фиг. 13В).
На фиг. 14A, 14B и 14C показаны изменения абсолютного количества лимфоцитов (ALC) по сравнению с исходным значением (нулевая неделя) при многократном введении гибридного белка IL-7 с интервалами в 8 недель или дольше у пациентов с глиобластомой при химиотерапии с использованием TMZ (темозоломид 150 мг/м2), авастин/иринотекан (A; авастин 10 мг/кг, I; иринотекан 100 мг/м2) и PCV (PCV; CCNU 240 мг, винкристин 2 мг, прокарбазин 150 и 100 мг, винкристин 2 мг), соответственно.
На фиг. 15А и 15В показаны изменения в субпопуляциях CD4+ и CD8+ Т-клеток и изменения в хемокиновом рецепторе CCR и других иммунных клетках (В-клетках и NK-клетках) после введения гибридного белка IL-7. NS; Незначительно, p>0,05, *p<0,05, **p<0,01, ***p<0,001 по сравнению с исходной группой (0 неделя) по знаковому ранговому критерию Уилкоксона для согласованных пар.
Частные случаи
Определения
До тех пор, пока не установлено иное или ясно не следует из контекста, следующие термины и фразы охватывают значения, представленные ниже. До тех пор, пока ясно не установлено иное или не очевидно из контекста, термины и фразы, представленные ниже, не исключают значения, которое термин или фраза приобрели в области техники, к которой они относятся. Определения предоставлены для помощи в описании конкретных частных случаев и не предназначены для ограничения аспектов, представленных в настоящем документе, поскольку объем аспектов, представленных в настоящем документе, ограничен только формулой изобретения. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно подразумевается специалистом в области техники, к которой относятся представленные в данном документе аспекты.
Термин «фармацевтическая композиция» определяется в данном документе как относящийся к смеси или раствору, содержащему по меньшей мере один терапевтический агент, который вводят млекопитающему для предотвращения или лечения конкретного заболевания или состояния, поражающего млекопитающее. В частных случаях млекопитающим может быть человек.
Термин «фармацевтически приемлемый» определен в данном документе для обозначения тех соединений, материалов, композиций и/или лекарственных форм, которые в рамках здравого медицинского суждения подходят для контакта с тканями пациента без чрезмерной токсичности, раздражающего аллергического ответа и других проблемных осложнений, соизмеримых с разумным соотношением польза/риск.
Используемый в данном документе термин «лечить» или «лечение» включает лечение, облегчающее, снижающее, уменьшающее или смягчающее по меньшей мере один симптом у пациента-человека или вызывающее задержку прогрессии заболевания. Например, лечение может заключаться в уменьшении одного или нескольких симптомов расстройства или полном искоренении расстройства, такого как рак. В понимании настоящего описания термин «лечить» также означает остановку, отсрочку начала (т.е. период до клинического проявления заболевания) и/или снижение риска развития или ухудшения заболевания. Термин «защищать» используется в данном документе для обозначения предотвращения, отсрочки или лечения или всего перечисленного, в зависимости от обстоятельств, развития, продолжения или обострения заболевания у субъекта.
Термин «предотвращать», «предотвращающий» или «профилактика», используемый в настоящем документе, включает предотвращение по меньшей мере одного симптома, связанного или вызванного состоянием, заболеванием или расстройством, которое предотвращается.
Термин «фармацевтически эффективное количество» или «клинически эффективное количество» комбинации терапевтических средств представляет собой количество, достаточное для обеспечения наблюдаемого улучшения по сравнению с исходными клинически наблюдаемыми признаками и симптомами нарушения, обрабатываемого комбинацией.
Фраза «пациент-человек, нуждающийся в таком лечении» при использовании в данном документе относится к пациенту-человеку, у которого диагностировано или который страдает от идентифицированного пролиферативного заболевания.
Термин «около» или «приблизительно» должен иметь значение в пределах 10%, 9%, 8%, 7%, 6% или в пределах 5% от заданного значения или диапазона.
Термины «уменьшенный» или «уменьшение» используются в данном документе в основном для обозначения уменьшения на статистически значимую величину. В некоторых частных случаях «уменьшенный» или «уменьшение» означает снижение по меньшей мере на 10% по сравнению с контрольным уровнем, например снижение по меньшей мере на около 20%, или по меньшей мере на около 30%, или по меньшей мере на около 40%, или по меньшей мере на около 50%, или по меньшей мере на около 60%, или по меньшей мере на около 70%, или по меньшей мере на около 80%, или по меньшей мере на около 90%, или до 100% включительно (например, отсутствие уровня или неопределяемый уровень по сравнению с референсным уровнем) или любое снижение на 10-100% по сравнению с референсным уровнем. В контексте маркера или симптома под этими терминами подразумевается статистически значимое снижение такого уровня. Уменьшение может составлять, например, не менее 10%, не менее 20%, не менее 30%, не менее 40% или более и предпочтительно до уровня, принятого в качестве нормального для индивидуума без данного заболевания.
Модифицированный IL-7
Модифицированный IL-7, который можно использовать в частных случаях, может иметь следующую структуру:
А - IL-7 формулы (I),
где А представляет собой олигопептид, состоящий из 1-10 аминокислотных остатков, а IL-7 представляет собой интерлейкин 7, полипептид, способный связываться с рецептором IL-7 (также известный как CD127), или полипептид, обладающий активностью IL-7 или аналогичной ему активностью.
Используемый в данном документе термин «полипептид, обладающий активностью IL-7 или подобной ему активностью» относится к полипептиду или белку, имеющему такую же или подобную последовательность и активность, что и IL-7. Если в частном случае не указано иное, этот термин можно использовать взаимозаменяемо с первым доменом гибридного белка IL-7 или модифицированным гибридным белком IL-7, как взаимозаменяемо используется в настоящем документе.
IL-7 включает полипептид, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 1-6. Кроме того, IL-7 может иметь идентичность последовательности около 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% или выше с последовательностями SEQ ID NO: 1-6. Идентичность по последовательности пептидной последовательности может быть определена с использованием известного программного обеспечения для выравнивания или сравнения последовательностей. Например, идентичность по последовательности можно определить с помощью программы BLASTP (blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE=Proteins) с ее настройками по умолчанию.
IL-7 может включать белок IL-7 или его фрагмент, при этом указанный фрагмент способен связываться с рецептором IL-7. Используемый в данном документе термин «белок IL-7» может использоваться в качестве концепции, чтобы охватить «белок IL-7 и его фрагмент, где фрагмент способен связываться с рецептором IL-7». IL-7 может быть получен от людей, крыс, мышей, обезьян, коров или овец.
Если не указано иное, термины «белок», «полипептид» и «пептид» могут использоваться как взаимозаменяемые понятия.
В частности, IL-7 человека может иметь аминокислотную последовательность, представленную SEQ ID NO: 1 (учетный номер Genbank № Р13232); IL-7 крысы может иметь аминокислотную последовательность, представленную в SEQ ID NO: 2 (учетный номер Genbank № Р56478); IL-7 мыши может иметь аминокислотную последовательность, представленную SEQ ID NO: 3 (учетный номер Genbank № Р10168); IL-7 обезьяны может иметь аминокислотную последовательность, представленную SEQ ID NO: 4 (учетный номер Genbank № NP_001279008); IL-7 коровы может иметь аминокислотную последовательность, представленную SEQ ID NO: 5 (учетный номер Genbank № P26895), а IL-7 овцы может иметь аминокислотную последовательность, представленную SEQ ID NO: 6 (учетный номер Genbank № Q28540).
Кроме того, белок IL-7 или его фрагмент могут включать различные модифицированные белки или пептиды, т.е. варианты. Вышеупомянутая модификация может быть осуществлена методом замены, делеции или добавления по меньшей мере одного белка к IL-7 дикого типа без изменения функции IL-7. Эти различные белки или пептиды могут иметь по меньшей мере около 70%, по меньшей мере около 75%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 86%, по меньшей мере около 87%, по меньшей мере около 88%, по меньшей мере около 89%, по меньшей мере около 90%, по меньшей мере около 91%, по меньшей мере около 92%, по меньшей мере около 93%, по меньшей мере около 94%, по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98% или по меньшей мере около 99% идентичности последовательности с белком дикого типа.
Обычно аминокислотный остаток дикого типа заменяют аланином, но замена может быть осуществлена консервативной заменой аминокислоты, которая не влияет или оказывает слабое влияние на весь заряд белка, т.е. полярность или гидрофобность.
Для замены консервативной аминокислоты можно обратиться к приведенной ниже таблице 1.
Таблица 1
Лизин (Lys, K)
Гистидин (His, H)
Аспарагиновая кислота (Asp, D)
Аспарагин (Asn, N)
Серин (Ser, С)
Треонин (Thr, T)
Тирозин (Tyr, Y)
Триптофан (Trp, W)
Цистеин (Cys, C)
Глицин (Gly, G)
Аланин (Ala, А)
Валин (Val, V)
Пролин (Pro, P)
Метионин (Met, M)
Лейцин (Leu, L)
Норлейцин
Изолейцин
Для каждой аминокислоты дополнительная консервативная замена включает «гомолог» аминокислоты. В частности, «гомолог» относится к аминокислоте, в которой метиленовая группа (СН2) встроена в боковую цепь бета-положения боковой цепи аминокислоты. Примеры «гомолога» могут включать гомофенилаланин, гомоаргинин, гомосерин и т.д., без ограничения указанным.
В структуре модифицированного IL-7 из А-IL-7 фрагмент А может быть связан с N-концом IL-7 непосредственно или через линкер, и, если не указано иное, этот термин может использоваться взаимозаменяемо со вторым доменом гибридных белков IL-7.
В одном частном случае А может быть связан с N-концом IL-7. А характеризуется тем, что включает от 1 до 10 аминокислот, и аминокислота может быть выбрана из группы, состоящей из метионина, глицина и их комбинации. В одном частном случае, когда А представляет собой один аминокислотный остаток, он представляет собой глицин.
Метионин и глицин не вызывают иммунных реакций в организме человека. Белковые терапевтические средства, полученные из E. coli, всегда включают метионин на N-конце, но о побочных реакциях не сообщалось. Кроме того, глицин широко используется в качестве линкера GS, и сообщалось, что он не вызывает иммунных ответов на коммерческие продукты, такие как дулаглутид (Cell Biophys. 1993 Jan-Jun; 22(103):189-224).
В типичном воплощении A может представлять собой олигопептид, включающий от 1 до 10 аминокислот, выбранных из группы, состоящей из метионина (Met, M), глицина (Gly, G) и их комбинации. В частном случае А может представлять собой олигопептид, состоящий из 1-5 аминокислот. Например, А может иметь N-концевую последовательность, выбранную из группы, состоящей из метионина (М), глицина (G), метионин-метионина, глицин-глицина, метионин-глицина, глицин-метионина, метионин-метионин-метионина, метионин-метионин-глицина, метионин-глицин-метионина, глицин-метионин-метионина, метионин-глицин-глицина, глицин-метионин-глицина, глицин-глицин-метионина, глицин-глицин-глицина, MMMM, MGMM, MGGM, MGGG, MGMG, GMMM, GMGG, GGGG, MMMMM, MMGMM, MMGGM, MGMMG, MMMMG, GGGGG, GGMMM, GGGMG, MGMGMG, MMMGGG, MMGGMM, GGMMGG, MGMGMGMG, MMMMGGGG, MMGGMMGG, MMMMGGGG, MGMGMGMGMG или и MMMMMGGGGG. В одном частном случае А может представлять собой метионин, глицин, метионин-метионин, глицин-глицин, метионин-глицин, глицин-метионин, метионин-метионин-метионин, метионин-метионин-глицин, метионин-глицин-метионин, глицин-метионин- метионин, метионин-глицин-глицин, глицин-метионин-глицин, глицин-глицин-метионин или глицин-глицин-глицин.
Гибридный белок модифицированного IL-7 или модифицированный гибридный белок IL-7
В другом аспекте предложен гибридный белок IL-7, содержащий: первый домен, содержащий полипептид, обладающий активностью IL-7 или аналогичной ему активностью; второй домен, включающий аминокислотную последовательность, содержащую от 1 до 10 аминокислотных остатков, состоящую из метионина, глицина или их комбинации; и третий домен, который продлевает время полувыведения гибридного белка IL-7.
Третий домен может быть связан с N-концом или С-концом первого домена или второго домена. Кроме того, модифицированный IL-7, включающий первый домен и второй домен, может быть связан с обоими концами третьего домена.
Третий домен может быть партнером по слиянию для увеличения времени полувыведения in vivo и предпочтительно может включать любой домен, выбранный из группы, состоящей из Fc-области иммуноглобулина или ее части, альбумина, полипептида, связывающего альбумин, Pro/Ala /Ser (PAS), C-концевого пептида (CTP) β-субъединицы хорионического гонадотропина человека, полиэтиленгликоля (PEG), длинных неструктурированных гидрофильных последовательностей аминокислот (XTEN), гидроксиэтилкрахмала (HES), малой молекулы, связывающей альбумин, и их комбинации.
Когда третий домен представляет собой Fc-область иммуноглобулина, он может быть Fc-областью модифицированного иммуноглобулина. В частности, Fc-область модифицированного иммуноглобулина может представлять собой область, в которой антителозависимая клеточная цитотоксичность (ADCC) или комплементзависимая цитотоксичность (CDC) ослаблена из-за модификации аффинности связывания с Fc-рецептором и/или комплементом. Модифицированный иммуноглобулин может быть выбран из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE и их комбинации. В частности, Fc-область модифицированного иммуноглобулина может включать шарнирную область, домен СН2 и домен СН3 от N-конца к С-концу. В частности, шарнирная область может включать шарнирную область IgD человека; домен CH2 может включать часть аминокислотных остатков IgD человека и часть аминокислотных остатков домена CH2 из IgG4 человека; и домен СН3 может включать часть аминокислотных остатков домена СН3 из IgG4 человека.
Кроме того, два гибридных белка могут образовывать димер, например, когда третий домен представляет собой Fc-область, Fc-области могут связываться друг с другом и таким образом образовывать димер.
Используемые в данном документе термины «Fc-область», «Fc-фрагмент» или «Fc» относятся к белку, который включает константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина, но не включают его вариабельные области тяжелой цепи и легкой цепи и константную область легкой цепи (CL1), и белок может дополнительно включать шарнирную область константной области тяжелой цепи. В одном частном случае гибридный Fc или его гибридный Fc-фрагмент может называться «hFc» или «hyFc».
Кроме того, используемый в настоящем документе термин «вариант Fc-области» относится к варианту, полученному путем замены части аминокислот в Fc-области или путем комбинирования Fc-областей разных типов. Вариант Fc-области может защищен от разрезания в шарнирной области. В частности, 144-я аминокислота и/или 145-я аминокислота SEQ ID NO: 9 могут быть модифицированы. Предпочтительным вариантом может быть вариант, в котором 144-я аминокислота К заменена на G или S, и вариант, в котором 145-я аминокислота Е заменена на G или S.
Кроме того, Fc-область или вариант Fc-области модифицированного иммуноглобулина могут быть представлены следующей формулой (I):
формула (I)
N'-(Z1)p-Y-Z2-Z3-Z4-C'.
В приведенной выше формуле (I)
N' представляет собой N-конец полипептида, а C' представляет собой С-конец полипептида;
p представляет собой целое число 0 или 1;
Z1 представляет собой аминокислотную последовательность, имеющую от 5 до 9 последовательных аминокислотных остатков от аминокислотного остатка в положении 98 относительно N-конца среди аминокислотных остатков в положениях от 90 до 98 из SEQ ID NO: 7; и
Y представляет собой аминокислотную последовательность, имеющую от 5 до 64 последовательных аминокислотных остатков от аминокислотного остатка в положении 162 относительно N-конца среди аминокислотных остатков в положениях от 99 до 162 из SEQ ID NO: 7;
Z2 представляет собой аминокислотную последовательность, имеющую от 4 до 37 последовательных аминокислотных остатков от аминокислотного остатка в положении 163 относительно С-конца среди аминокислотных остатков в положениях от 163 до 199 из SEQ ID NO: 7;
Z3 представляет собой аминокислотную последовательность, имеющую от 71 до 106 последовательных аминокислотных остатков от аминокислотного остатка в положении 220 относительно N-конца среди аминокислотных остатков в положениях от 115 до 220 из SEQ ID NO: 8; и
Z4 представляет собой аминокислотную последовательность, имеющую от 80 до 107 последовательных аминокислотных остатков от аминокислотного остатка в положении 221 относительно С-конца среди аминокислотных остатков в положениях от 221 до 327 из SEQ ID NO: 8.
Кроме того, Fc-фрагмент может быть в форме, характеризующейся наличием нативных сахарных цепей, увеличенными сахарными цепями или уменьшенными сахарными цепями по сравнению с нативной формой, или может быть в дегликозилированной форме. Сахарные цепи иммуноглобулина Fc можно модифицировать обычными способами, такими как химический способ, ферментативный способ и способ генной инженерии, использующий микроорганизм. Удаление сахарных цепей из Fc-фрагмента приводит к резкому снижению аффинности связывания с частью C1q первого компонента комплемента C1, а также к уменьшению или потере ADCC или CDC, тем самым не вызывая каких-либо ненужных иммунных ответов in vivo. В этом отношении Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей для субъекта частные случаи в качестве носителя лекарственного средства. Используемый в данном документе термин «дегликозилирование» относится к Fc-области, в которой сахара ферментативно удаляются из Fc-фрагмента. Кроме того, термин «агликозилирование» означает, что Fc-фрагмент продуцируется в негликозилированной форме прокариотом и предпочтительно в E. coli.
Кроме того, Fc-область модифицированного иммуноглобулина может включать аминокислотную последовательность SEQ ID NO: 9 (hyFc), SEQ ID NO: 10 (hyFcM1), SEQ ID NO: 11 (hyFcM2), SEQ ID NO: 12 (hyFcM3) или SEQ ID NO: 13 (hyFcM4). Кроме того, Fc-область модифицированного иммуноглобулина может включать аминокислотную последовательность SEQ ID NO: 14 (нелитический Fc мыши).
Fc-область модифицированного иммуноглобулина может быть той, что описана в пат. США № 7867491, и получение Fc-области модифицированного иммуноглобулина может быть осуществлено, опираясь на изобретение по пат. США № 7867491, полное содержание которого включено в данный документ ссылкой.
Второй домен может быть непосредственно связан с N-концом первого домена или связан линкером. В частности, конечный продукт может быть в виде «второй домен-первый домен» или «второй домен-линкер-первый домен».
Третий домен может быть непосредственно связан с первым доменом или вторым доменом или может быть связан линкером. Конкретно конечный продукт может быть в виде «второй домен-первый домен-третий домен», «третий домен-второй домен-первый домен», «второй домен-первый домен-линкер-третий домен», «третий домен домен-линкер-второй домен-первый домен», «второй домен-линкер-первый домен-линкер-третий домен» или «третий домен-линкер-второй домен-первый домен».
Когда линкер представляет собой пептидный линкер, соединение может происходить в любой связывающей области. Они могут быть соединены с использованием сшивающего агента, известного в данной области техники. Примеры сшивающего агента могут включать сложные эфиры N-гидроксисукцинимида, такие как 1,1-бис(диазоацетил)-2-фенилэтан, глутаровый альдегид и 4-азидосалициловая кислота; имидоэфиры, включая дисукцинимидиловые эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), и бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан, без ограничения указанным.
Кроме того, линкер может представлять собой альбуминовый линкер или пептидный линкер. Пептидный линкер может представлять собой пептид из 10-20 аминокислотных остатков, состоящий из остатков Gly и Ser.
Когда линкер образован линкером, выбранным из группы, состоящей из химической связи, химическая связь может быть дисульфидной связью, диаминовой связью, сульфид-аминной связью, карбокси-аминной связью, сложноэфирной связью и ковалентной связью.
Модифицированный IL-7 может иметь структуру A-IL-7, включая полипептид, обладающий активностью IL-7 или подобной ему активностью, и олигопептид, состоящий из 1-10 аминокислот.
В одном частном случае модифицированный IL-7 может иметь аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15-20. Кроме того, модифицированный IL-7 может иметь последовательность, имеющую идентичность последовательности по меньшей мере на около 70%, по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 86%, по меньшей мере на около 87%. %, по меньшей мере около 88%, по меньшей мере около 89%, по меньшей мере около 90%, по меньшей мере около 91%, по меньшей мере около 92%, по меньшей мере около 93%, по меньшей мере около 94%, по меньшей мере около 95%, по меньшей мере на около 96%, по меньшей мере на около 97%, по меньшей мере на около 98% или по меньшей мере на около 99% с аминокислотной последовательностью SEQ ID NO: 15, 16, 17, 18, 19 или 20.
В другом иллюстративном воплощении модифицированный IL-7 или гибридный белок IL-7, содержащий первый домен, включающий полипептид, обладающий активностью IL-7 или аналогичной ему активностью; второй домен, содержащий аминокислотную последовательность, имеющую от 1 до 10 аминокислотных остатков, состоящую из метионина, глицина или их комбинации; и третий домен, который представляет собой Fc-область модифицированного иммуноглобулина, связанный с С-концом первого домена.
Гибридный белок IL-7 может иметь аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 21-25. Кроме того, гибридный белок IL-7 может иметь последовательность, имеющую идентичность последовательности по меньшей мере на около 70%, по меньшей мере около 75%, по меньшей мере около 80%, 85%, по меньшей мере около 86%, по меньшей мере около 87%, по меньшей мере около 88%, по меньшей мере около 89%, по меньшей мере около 90%, по меньшей мере около 91%, по меньшей мере около 92%, по меньшей мере около 93%, по меньшей мере около 94%, по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98% или по меньшей мере около 99% с аминокислотной последовательностью SEQ ID NO: 21, 22, 23, 24 или 25.
Гибридный белок IL-7 с SEQ ID NO: 21-25 может кодироваться полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 29-39.
Молекула нуклеиновой кислоты может дополнительно включать сигнальную последовательность или лидерную последовательность.
Используемый в данном документе термин «сигнальная последовательность» относится к фрагменту, направляющему секрецию биологически активной молекулы лекарственного средства и гибридного белка, и он отсекается после трансляции в клетке-хозяине. Сигнальная последовательность в частном случае представляет собой полинуклеотид, кодирующий аминокислотную последовательность, инициирующую движение белка, проникающего через мембрану эндоплазматического ретикулума (англ. endoplasmic reticulum, ER). Полезные сигнальные последовательности в частном случае включают сигнальную последовательность легкой цепи антитела, например, антитело 14.18 (Gillies et al., J. Immunol. Meth 1989. 125:191-202), сигнальную последовательность тяжелой цепи антитела, например, MOPC141, сигнальную последовательность тяжелой цепи антитела (Sakano et al., Nature, 1980. 286: 676-683), и другие сигнальные последовательности, известные в данной области (например, см. Watson et al., Nucleic Acid Research, 1984. 12:5145-5164).
Характеристики сигнальных пептидов хорошо известны специалистам, и обычно сигнальные пептиды содержат от 16 до 30 аминокислот, но они могут включать большее или меньшее количество аминокислотных остатков. Обычные сигнальные пептиды состоят из трех областей: основной N-концевой области, центральной гидрофобной области и более полярной С-концевой области.
Центральная гидрофобная область включает от 4 до 12 гидрофобных остатков, которые иммобилизуют сигнальную последовательность через липидный бислой мембраны во время транслокации незрелого полипептида. После инициации сигнальная последовательность часто отсекается в просвете ER клеточным ферментом, известным как сигнальная пептидаза. В частности, сигнальная последовательность может представлять собой секреторную сигнальную последовательность для активации тканевого плазминогена (tPa), сигнальную последовательность гликопротеина D вируса простого герпеса (HSV gD) или гормона роста. Предпочтительно можно использовать секреторную сигнальную последовательность, используемую в высших эукариотических клетках, включая млекопитающих и т.д. Кроме того, в качестве секреторной сигнальной последовательности можно использовать сигнальную последовательность, включенную в IL-7 дикого типа, или ее можно использовать после замены кодонами, характризующимися высокой частотой экспрессии в клетке-хозяине.
Выделенная молекула нуклеиновой кислоты, кодирующая модифицированный IL-7 или гибридный белок IL-7, может содержаться в экспрессирующем векторе.
Используемый в данном документе термин «вектор» понимается как средство нуклеиновой кислоты, которое включает нуклеотидную последовательность, которая может быть введена в клетку-хозяин для рекомбинации и вставки в геном клетки-хозяина или спонтанно реплицирована в виде эписомы. Вектор может включать линейные нуклеиновые кислоты, плазмиды, фагемиды, космиды, РНК-векторы, вирусные векторы и их аналоги. Примеры вирусных векторов могут включать ретровирусы, аденовирусы и аденоассоциированные вирусы, без ограничения указанным.
Используемый в данном документе термин «генная экспрессия» или «экспрессия» белка-мишени понимается как относящийся к транскрипции последовательности ДНК, трансляции транскрипта мРНК и секреции продукта гибридного белка или его фрагмента.
Используемый в данном документе термин «клетка-хозяин» относится к прокариотической клетке и эукариотической клетке, в которую может быть введен рекомбинантный экспрессирующий вектор. Используемые в данном документе термины «трансдуцированный», «трансформированный» и «трансфицированный» относятся к введению нуклеиновой кислоты (например, вектора) в клетку с использованием технологии, известной в данной области.
Используемый в настоящем документе термин «экспрессия гена» или «экспрессия» белка-мишени понимается как относящийся к транскрипции последовательности ДНК, трансляции транскрипта мРНК и секреции продукта Fc-гибридного белка или антитела или фрагмента антитела.
Полезным экспрессирующим вектором может быть RcCMV (Invitrogen, Карлсбад) или его вариант. Экспрессирующий вектор может включать цитомегаловирус человека (CMV) для промотирования непрерывной транскрипции гена-мишени в клетке млекопитающего и сигнальную последовательность полиаденилирования бычьего гормона роста для повышения состояния стабильности РНК после транскрипции. В типичном воплощении экспрессирующий вектор представляет собой pAD15, который представляет собой модифицированную форму RcCMV.
Экспрессирующий вектор может быть включен в подходящую клетку-хозяина, подходящую для экспрессии и/или секреции белка-мишени, путем трансдукции или трансфекции последовательности ДНК согласно воплощению.
Примеры подходящей клетки-хозяина могут включать, без ограничения указанным, бессмертную гибридомную клетку, клетку миеломы NS/0, клетку 293, клетку яичника китайского хомяка (CHO), клетку HeLa, клетку, полученную из амниотической жидкости человека (CapT-клетка), или клетку COS.
Модифицированный белок IL-7 и его гибридный белок могут быть получены способом, описанным в одновременно рассматриваемой заявке (заявка США № 15/126313), полное содержание которой включено в настоящий документ ссылкой.
Композиция
В заявке США № 15/773273, полное содержание которой включено в данный документ ссылкой, описан состав, содержащий модифицированный гибридный белок IL-7. В некоторых частных случаях фармацевтический состав может содержать (а) модифицированный гибридный белок IL-7; b) базальный буфер с концентрацией от 10 до 50 мМ; (c) сахар с концентрацией от 2,5 до 5 масс./об.%; и (d) поверхностно-активное вещество с концентрацией от 0,05 до 6 масс./об.%. Состав может дополнительно содержать аминокислоту, сахарный спирт (например, сорбит, ксилит, мальтит, маннит или их смесь). Состав может иметь рН около 5.
Фармацевтическую композицию, содержащую модифицированный IL-7 или гибридный белок IL-7, можно вводить субъекту путем прямого введения (например, местно путем инъекции, трансплантации или местного введения в область ткани) или системно (например, парентерально или перорально) с помощью соответствующих средств. Когда композицию вводят парентерально путем внутривенного, подкожного, внутриглазного, внутрибрюшинного, внутримышечного, перорального, интраректального, интраорбитального, интрацеребрального, интракраниального, интраспинального, интравентрикулярного, подоболочечного, интрацистенального, интракапсулярного, интраназального или аэрозольного введения, композиция предпочтительно содержит водную или физиологически применимую суспензию жидкостей организма или часть их раствора. Таким образом, физиологически приемлемый носитель или транспортер может быть добавлен в композицию и доставлен пациентам, и это не оказывает отрицательного влияния на электролитный и/или объемный баланс пациентов. Соответственно, физиологически приемлемый носитель или транспортер может представлять собой физиологический раствор.
Кроме того, конструкция ДНК (или геномная конструкция), включающая нуклеиновую кислоту, включающую модифицированный IL-7 или гибридный белок IL-7, может быть использована как часть протокола генной терапии.
Для воссоздания или дополнения функций желаемого белка экспрессирующий вектор, способный экспрессировать гибридный белок в конкретной клетке, можно вводить вместе с любым биологически эффективным носителем. Это может быть любой состав или композиция, которые могут эффективно доставлять ген, кодирующий желаемый белок или гибридный белок IL-7, в клетку in vivo.
В целях генной терапии с использованием нуклеиновой кислоты, кодирующей модифицированный IL-7 или гибридный белок IL-7, соответствующий ген может быть встроен в вирусный вектор, рекомбинантную бактериальную плазмиду или рекомбинантную эукариотическую плазмиду. Вирусный вектор может включать рекомбинантный ретровирус, аденовирус, аденоассоциированный вирус и вирус простого герпеса-1 и т.д., трансплантированные Т-клетки или пролиферирующие in vitro выделенные агрегаты Т-клеток.
Применение модифицированного IL-7 или его гибридного белка и схема лечения
Применение модифицированного IL-7 или его гибридного белка в приготовлении лекарственного средства для лечения пролиферативного заболевания, при этом лекарственное средство содержит терапевтически эффективную дозу в диапазоне от более около 600 мкг/кг до около 2000 мкг/кг до вводить дважды или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель субъекту, нуждающемуся в этом.
Применение модифицированного IL-7 или его гибридного белка в приготовлении лекарственного средства для применения при лечении пролиферативного заболевания, при этом лекарственное средство содержит терапевтически эффективную дозу в диапазоне от более чем около 600 мкг/кг до около 2000 мкг/кг вводимую дважды или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель субъекту, нуждающемуся в этом.
Применение модифицированного IL-7 или его гибридного белка для лечения пролиферативного заболевания, включающего введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка дважды или более раз с интервалом в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель или с интервалом в 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней субъекту, нуждающемуся в этом.
Применение модифицированного IL-7 или его гибридного белка для приготовления лекарственного средства для лечения пролиферативного заболевания, включающее введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1700 мкг/кг или больше, или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка дважды или больше раз с интервалом в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель или с интервалом в 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней субъекту, нуждающемуся в этом.
Применение модифицированного IL-7 или его гибридного белка для лечения пролиферативного заболевания, включающего введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 840 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1440 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг модифицированного IL-7 или его гибридный белок дважды или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель или с интервалом в 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней субъекту, нуждающемуся в этом.
Применение модифицированного IL-7 или его гибридного белка для приготовления лекарственного средства для лечения пролиферативного заболевания, включающее введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 840 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1440 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка дважды или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель или с интервалом в 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней нуждающемуся в этом субъекту.
Применение модифицированного IL-7 или его гибридного белка в приготовлении лекарственного средства для увеличения количества лимфоцитов или продуцирования лимфоцитов у субъекта, нуждающегося в этом, где лекарственное средство содержит терапевтически эффективную дозу в диапазоне от более чем около 600 мкг/кг до около 2000 мкг/кг для введения субъекту два или более раз с интервалом в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель.
В одном частном случае применение модифицированного IL-7 или его гибридного белка при приготовлении лекарственного средства для применения для увеличения количества лимфоцитов или продуцирования лимфоцитов у субъекта, нуждающегося в этом, где лекарственное средство содержит терапевтически эффективную дозу в диапазоне от более чем около 600 мкг/кг до около 2000 мкг/кг для введения субъекту два или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель.
Применение модифицированного IL-7 или его гибридного белка для увеличения количества лимфоцитов или продуцирования лимфоцитов у нуждающегося в этом субъекта, включающее введение субъекту соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка дважды или более раз с интервалом в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель, или с интервалом 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней.
Применение модифицированного IL-7 или его гибридного белка для приготовления лекарственного средства для увеличения количества лимфоцитов или продуцирования лимфоцитов у нуждающегося в этом субъекта, включающее введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 960 мкг/кг или больше, 1200 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка дважды или более раз с интервалом в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель, или с интервалом 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней субъекту.
Применение модифицированного IL-7 или его гибридного белка для увеличения количества лимфоцитов или продуцирования лимфоцитов у нуждающегося в этом субъекта, включающее введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 840 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1440 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка дважды или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель или с интервалом в 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней субъекту.
Применение модифицированного IL-7 или его гибридного белка для приготовления лекарственного средства для увеличения количества лимфоцитов или продуцирования лимфоцитов у нуждающегося в этом субъекта, включающее введение соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективной дозе около 720 мкг/кг или больше, около 840 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1440 мкг/кг или больше, около 1700 мкг/ кг или выше, или около 2000 мкг/кг модифицированного IL-7 или его гибридного белка два или более раз с интервалом 1 неделя, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недели, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель или 15 недель или с интервалом 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или 100 дней субъекту.
В одном частном случае пролиферативное заболевание для вышеуказанных применений представляет собой рак или опухоль, которые могут быть, без ограничения указанным, солидной опухолью, злокачественным новообразованием лимфатической системы или лейкозом.
Солидная опухоль может быть синовиальной саркомой, инфильтрирующей карциномой протоков, раком прямой кишки, раком ободочной кишки, раком яичников, раком восходящей кишки, раком анального канала, инвазивной протоковой карциномой, аденокарциномой, раком прямой кишки с парааортальным метастатическим поражением, нейроэндокринной карциномой (шейки матки), раком сигмовидной ободочной кишки или глиобластомой.
В одном частном случае субъект мог ранее получать или одновременно получать один или несколько способов лечения рака, включая хирургическое вмешательство, лучевую терапию и химиотерапию.
(i) Модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7, или фармацевтическую композицию, содержащую их, можно вводить парентерально, внутримышечно, подкожно, офтальмологически, внутривенно, внутрибрюшинно, внутрикожно, интраорбитально, интрацеребрально, внутричерепно, интраспинально, интравентрикулярно, интратекально, интрацистемально, интракапсулярно или интратуморально.
В некоторых аспектах субъект может иметь количество лимфоцитов, составляющее 1000 лимфоцитов или менее/мкл крови, как определено в соответствии с общей терминологией критериев нежелательных явлений (CTCAE) версии 4.0. Лимфоцит может быть Т-клеткой. Т-клетка может включать CD4+ и/или CD8+ Т-клетку. Для измерения лимфоцитов в образце крови можно использовать цельную кровь или сыворотку. Следовательно, термин «кровь», используемый в отношении количества лимфоцитов, включает цельную кровь и/или сыворотку.
В другом аспекте субъект имеет количество лимфоцитов, равное 800 лимфоцитов или менее/мкл крови, количество лимфоцитов, равное около 500 лимфоцитов или менее/мкл крови, или количество лимфоцитов, равное около 200 лимфоцитов или менее/мкл крови.
В одном аспекте количество инфильтрирующих опухоль лимфоцитов (TIL) в опухоли увеличивается после введения по сравнению с количеством TIL в опухоли после введения (i) модифицированного интерлейкина-7 или (ii) гибридного белка интерлейкина-7. TIL могут быть CD4+ TIL и/или CD8+ TIL.
Количество TIL может быть увеличено по меньшей мере на около 10%, по меньшей мере на около 20%, по меньшей мере на около 30%, по меньшей мере на около 40%, по меньшей мере на около 50%, по меньшей мере на около 60%, по меньшей мере на около 70%, по меньшей мере на около 80%, по меньшей мере на около 90%, по меньшей мере на около 100%, по меньшей мере на около 125%, по меньшей мере на около 150%, по меньшей мере на около 200%, по меньшей мере на около 250% или по меньшей мере на около 300% после введения.
В одном частном случае (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить два или более раз в количестве около 720 мкг/кг с интервалом около 1 недели, около 2 недель, около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель или около 8 недель.
В одном частном случае (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить два или более раз в количестве около 840 мкг/кг с интервалом около 2 недель, около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель или около 8 недель.
В другом воплощении (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить два или более раз в количестве около 960 мкг/кг с интервалом около 2 недель, около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 9 недель или около 10 недель.
В еще одном частном случае (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить два или более раз в количестве около 1200 мкг/кг с интервалом около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 9 недель, около 10 недель, около 11 недель или около 12 недель.
В еще одном частном случае (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить два или более раз в количестве около 1440 мкг/кг с интервалом около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 9 недель, около 10 недель, около 11 недель, около 12 недель, около 13 недель, около 14 недель, около 15 недель, около 1 месяца, около 2 месяцев или около 3 месяцев.
В соответствии с воплощением (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить в дозе более чем около 600 мкг/кг, более чем около 700 мкг/кг, более чем около 800 мкг/кг, более чем около 900 мкг/кг, более чем около 1000 мкг/кг, более чем около 1100 мкг/кг, более чем около 1200 мкг/кг, более чем около 1300 мкг/кг, более чем около 1400 мкг/ кг, более чем около 1500 мкг/кг, более чем около 1600 мкг/кг, более чем около 1700 мкг/кг, более чем около 1800 мкг/кг, более чем около 1900 мкг/кг или более чем около 2000 мкг/кг, при частоте дозирования один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в 10 недель, один раз в 11 недель, один раз в 12 недель, один раз в 13 недель, один раз в 14 недель или один раз в 15 недель.
В соответствии с некоторым аспектом, (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить в дозе от около 610 мкг/кг до около 1200 мкг/кг, от около 650 мкг/кг до около 1200 мкг/кг, от около 700 мкг/кг до около 1200 мкг/кг, от около 750 мкг/кг до около 1200 мкг/кг, от около 800 мкг/кг до около 1200 мкг/кг, от около 850 мкг/кг и около 1200 мкг/кг, от около 900 мкг/кг до около 1200 мкг/кг, от около 950 мкг/кг до около 1200 мкг/кг, от около 1000 мкг/кг до около 1200 мкг/кг, от около 1050 мкг/кг и около 1200 мкг/кг, от около 1100 мкг/кг и около 1200 мкг/кг, от около 1200 мкг/кг и около 2000 мкг/кг, от около 1300 мкг/кг и около 2000 мкг/кг, от около 1500 мкг/кг до около 2000 мкг/кг, от около 1700 мкг/кг до около 2000 мкг/кг, от около 610 мкг/кг до около 1000 мкг/кг, от около 650 мкг/кг до около 1000 мкг/кг, от около 700 мкг/кг до около 1000 мкг/кг, от около 750 мкг/кг до около 1000 мкг/кг, от около 800 мкг/кг до около 1000 мкг/кг, от около 850 мкг/кг до около 1000 мкг/кг, от около 900 мкг/кг до около 1000 мкг/кг или от около 950 мкг/кг до около 1000 мкг/кг при частоте дозирования один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в 10 недель, один раз в 11 недель, один раз в 12 недель, один раз в 13 недель, один раз в 14 недель или один раз в 15 недель.
Согласно другому аспекту, (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить в дозе от около 700 мкг/кг до около 900 мкг/кг, от около 750 мкг/кг до около 950 мкг/кг, от около 700 мкг/кг до около 850 мкг/кг, от около 750 мкг/кг до около 850 мкг/кг, от около 700 мкг/кг до около 800 мкг/кг, от около 800 мкг/кг до около 900 мкг/кг, от около 750 мкг/кг до около 850 мкг/кг или от около 850 мкг/кг до около 950 мкг/кг при частоте дозирования один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в 10 недель, один раз в 11 недель, один раз в 12 недель, один раз в 13 недель, один раз в 14 недель или один раз в 15 недель.
В соответствии с еще одним воплощением (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 можно вводить в дозе около 650 мкг/кг, около 680 мкг/кг, около 700 мкг/кг, около 720 мкг/кг, около 740 мкг/кг, около 750 мкг/кг, около 760 мкг/кг, около 780 мкг/кг, около 800 мкг/кг, около 820 мкг/кг, около 840 мкг/кг, около 850 мкг /кг, около 860 мкг/кг, около 880 мкг/кг, около 900 мкг/кг, около 920 мкг/кг, около 940 мкг/кг, около 950 мкг/кг, около 960 мкг/кг, около 980 мкг/кг, около 1000 мкг/кг, около 1020 мкг/кг, около 1040 мкг/кг, около 1060 мкг/кг, около 1080 мкг/кг, около 1100 мкг/кг, около 1120 мкг/кг, около 1140 мкг/кг, около 1160 мкг/кг, около 1180 мкг/кг, около 1200 мкг/кг, около 1220 мкг/кг, около 1240 мкг/кг, около 1260 мкг/кг, около 1280 мкг/кг, около 1300 мкг/кг, около 1320 мкг /кг, около 1340 мкг/кг, около 1360 мкг/кг, около 1380 мкг/кг, около 1400 мкг/кг, около 1420 мкг/кг, около 1440 мкг/кг, около 1460 мкг/кг, около 1480 мкг/кг, около 1500 мкг/кг, около 1520 мкг/кг, или около 1540 мкг/кг, около 1560 мкг/кг, около 1580 мкг/кг, около 1600 мкг/кг, около 1620 мкг/кг, около 1640 мкг/кг, около 1660 мкг/кг, около 1680 мкг/кг, около 1700 мкг/кг, около 1720 мкг/кг, около 1740 мкг/кг, около 1760 мкг/кг, около 1780 мкг/кг, около 1800 мкг/кг, около 1820 мкг/кг, около 1840 мкг/кг, около 1860 мкг/ кг, около 1880 мкг/кг, около 1900 мкг/кг, около 1920 мкг/кг, около 1940 мкг/кг, около 1960 мкг/кг, около 1980 мкг/кг или около 2000 мкг/кг при частоте дозирования один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в 10 недель, один раз в 11 недель, один раз в 12 недель, один раз в 13 недель, один раз в 14 недель или один раз в 15 недель.
В одном частном случае (i) модифицированный интерлейкин-7 или (ii) гибридный белок интерлейкина-7 вводят в дозе около 650 мкг/кг - 680 мкг/кг, около 680 мкг/кг - 700 мкг/кг, около 700 мкг/кг - 720 мкг/кг, около 720 мкг/кг - 740 мкг/кг, около 740 мкг/кг - 750 мкг/кг, около 750 мкг/кг - 760 мкг/кг, около 760 мкг/кг - 780 мкг/кг, около 780 мкг/кг - 800 мкг/кг, около 800 мкг/кг - 820 мкг/кг, около 820 мкг/кг - 840 мкг/кг, около 840 мкг/кг - 850 мкг/кг, около 850 мкг/кг - 860 мкг/кг, около 860 мкг/кг - 880 мкг/кг, около 880 мкг/кг - 900 мкг/кг, около 900 мкг/кг - 920 мкг/кг, около 920 мкг/кг - 940 мкг/кг, около 940 мкг/кг - 950 мкг/кг, около 950 мкг/кг - 960 мкг/кг, около 960 мкг/кг - 980 мкг/кг, около 980 мкг/кг - 1000 мкг/кг, около 1000 мкг/кг - 1020 мкг/кг, около 1020 мкг/кг - 1040 мкг/кг, около 1040 мкг/кг - 1060 мкг/кг, около 1060 мкг/кг - 1080 мкг/кг, около 1080 мкг/кг - 1100 мкг /кг, около 1100 мкг/кг - 1120 мкг/кг, около 1120 мкг/кг - 1140 мкг/кг, около 1140 мкг/кг - 1160 мкг/кг, около 1160 мкг/кг - 1180 мкг/кг, или около 1180 мкг/кг - 1200 мкг/кг, около 1200 мкг/кг - 1220 мкг/кг, около 1220 мкг/кг - 1240 мкг/кг, около 1240 мкг/кг - 1260 мкг/кг, около 1260 мкг/кг - 1280 мкг/кг, около 1280 мкг/кг - 1300 мкг/кг, около 1300 мкг/кг - 1320 мкг/кг, около 1320 мкг/кг - 1340 мкг/кг, около 1340 мкг/кг - 1360 мкг/кг, около 1360 мкг/кг - 1380 мкг/кг, около 1380 мкг/кг - 1400 мкг/кг, около 1400 мкг/кг - 1420 мкг/кг, около 1420 мкг/кг - 1440 мкг/кг, около 1440 мкг/кг - 1460 мкг/кг, около 1480 мкг/кг, около 1480 мкг/кг - 1500 мкг/кг, около 1500 мкг/кг - 1520 мкг/кг, около 1520 мкг/кг - 1540 мкг/кг, около 1540 мкг/кг - 1560 мкг/кг, около 1560 мкг/кг - 1580 мкг/кг, около 1580 мкг/кг - 1600 мкг/кг, около 1600 мкг/кг - 1620 мкг/кг, около 1620 мкг/кг - 1640 мкг/кг, около 1640 мкг/кг - 1660 мкг/кг, около 1660 мкг/кг - 1680 мкг/кг, около 1680 мкг/кг - 1700 мкг/кг, около 1700 мкг/кг - 1720 мкг/кг, около 1720 мкг/кг - 1740 мкг /кг, около 1740 мкг/кг - 1760 мкг/кг, около 1760 мкг/кг - 1780 мкг/кг, около 1780 мкг/кг - 1800 мкг г/кг, около 1800 мкг/кг - 1820 мкг/кг, около 1820 мкг/кг - 1840 мкг/кг, около 1840 мкг/кг - 1860 мкг/кг, около 1860 мкг/кг - 1880 мкг/кг, около 1880 мкг/кг - 1900 мкг/кг, около 1900 мкг/кг - 1920 мкг/кг, около 1920 мкг/кг - 1940 мкг/кг, около 1940 мкг/кг - 1960 мкг/кг, около 1960 мкг/кг - 1980 мкг/кг или около 1980 мкг/кг - 1200 мкг/кг при частоте введения дозы один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в 10 недель, один раз в 11 недель, один раз в 12 недель, один раз в 13 недель или один раз в 10 дней, один раз в 20 дней, один раз в 30 дней, один раз каждые 40 дней, один раз каждые 50 дней, один раз каждые 60 дней, один раз каждые 90 дней или один раз каждые 100 дней.
В одном частном случае субъект получал, получает или будет получать химиотерапию. Химиотерапевтическое средство и модифицированный IL-7 или его гибридный белок можно вводить одновременно или последовательно.
Сравнительный пример 1. получение модифицированного белка IL-7, в котором олигопептид связан с IL-7
Был получен модифицированный IL-7, в котором олигопептид связан с N-концом IL-7. Для IL-7 использовали последовательность IL-7 человека (SEQ ID NO: 1) и в качестве олигопептида использовали последовательность метионин (M), глицин (G), MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM.
Как показано на фиг. 1А, были получены различные формы модифицированного IL-7, имеющего структуру 'A'-IL-7. В этом примере последовательность метионина (M), глицина (G), MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM использовали в качестве 2-го домена (олигопептид «А»). Кроме того, MGMM, MGGM, MGGG, MGMG, GMMM, GMGG, GGGG, MMMMM, MMGMM, MMGGM, MGMMG, MMMMG, GGGGG, GGMMM, GGGMG, MGMGMG, MMMGGG, MMGGMM, GGMMGG, MGMGMGMG, MMMMGGGG, MMGGMMGG, MMMMGGGG, MGMGMGMGMG и MMMMMGGGGG продуцируются как «A».
Для IL-7 в качестве 1-го домена, объединенного с олигопептидом, использовали последовательность нуклеиновой кислоты SEQ ID NO: 28. Полная последовательность нуклеиновой кислоты в форме, в которой IL-7 был объединен с олигопептидом, была получена и затем вставлена в экспрессирующий вектор. В качестве отрицательного контроля таким же образом готовили белок IL-7 без модификации олигопептида.
Экспрессирующий вектор, включающий ген A-IL-7, трансфицировали в клетку HEK293. На основе 300 мл суспензионной культуры готовили полиплекс с использованием 208,3 мкг ДНК и 416,6 мкг (мкл) полиэтиленимина (PEI) (масс./масс.), а затем трансфицировали в клетку HEK293F. Через шесть дней после трансфекции получали культуру клеток и подвергали вестерн-блоттингу, и таким образом оценивали скорость экспрессии белка-мишени. Затем культуру центрифугировали при 8000 об/мин в течение 30 минут, остатки культуры удаляли и фильтровали с использованием фильтра Bottle Top с размером пор 0,22 мкм. В результате получали культуральную жидкость, содержащую модифицированный IL-7 из числа M-IL-7, G-IL-7, MM-IL-7, GG-IL-7, MG-IL-7, GM-IL-7, MMM-IL-7, MMG-IL-7, MGM-IL-7, GMM-IL-7, MGG-IL-7, GMG-IL-7, GGM-IL-7, GGG-IL-7, DDD-IL-7 и MMMM-IL-7. Кроме того, продуцировали MGMM-IL-7, MGGM-IL-7, MGGG-IL-7, MGMG-IL-7, GMMM-IL-7, GMGG-IL-7, GGGG-IL-7, MMMMM-IL-7, MMGMM-IL-7, MMGGM-IL-7, MGMMG-IL-7, MMMMG-IL-7, GGGGG-IL-7, GGMMM-IL-7, GGGMG-IL-7, MGMGMG-IL-7, MMMGGG-IL-7, MMGGMM-IL-7, GGMMGG-IL-7, MGMGMGMG-IL-7, MMMMGGGG-IL-7, MMGGMMGG-IL-7, MMMMGGGG-IL-7, MGMGMGMGMG-IL-7 и MMMMMGGGGG-IL-7.
Сравнительный пример 2. Получение гибридного белка IL-7, в котором Fc-область связана с С-концом IL-7
Был получен гибридный белок IL-7, т.е. второй домен-первый домен-третий домен, в котором полипептид, состоящий из гетерогенной аминокислотной последовательности, был дополнительно связан с С-концом модифицированного IL-7. Для первого домена использовали последовательность человеческого IL-7 (SEQ ID NO: 1), а в качестве второго домена использовали последовательность M, G, MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM. Для третьего домена использовали последовательность Fc-области (SEQ ID NO: 9 или 14). В других частные случаях изобретения получают гибридный белок IL-7 - Fc, в котором MGMM, MGGM, MGGG, MGMG, GMMM, GMGG, GGGG, MMMMM, MMGMM, MMGGM, MGMMG, MMMMG, GGGGG, GGMMM, GGGMG, MGMGMG, MMMGGG, MMGGMM, GGMMGG, MGMGMGMG, MMMMGGGG, MMGGMMGG, MMMMGGGG, MGMGMGMGMG или MMMMMGGGGG связаны с N-концом IL-7 - Fc.
Были получены различные формы гибридных белков IL-7, состоящих из второго домена, первого домена и третьего домена. В этом примере в качестве второго домена использовали последовательность метионина (M), глицина (G), MM, GG, MG, GM, MMM, MMG, MGM, GMM, MGG, GMG, GGM, GGG, DDD или MMMM; в качестве первого домена использовали IL-7 человека; и в качестве третьего домена использовали гибридный Fc (hFc, hyFc) или мышиный нелитический Fc. В дополнительных экспериментах MGMM, MGGM, MGGG, MGMG, GMMM, GMGG, GGGG, MMMMM, MMGMM, MMGGM, MGMMG, MMMMG, GGGGG, GGMMM, GGGMG, MGMGMG, MMMGGG, MMGGMM, GGMMGG, MGMGMGMG, MMMMGGGG, MMGGMMGG, MMMMGGGG, MGMGMGMGMG или MMMMMGGGGG используют в качестве второго домена для получения модифицированных гибридных белков IL-7.
В частности, для гибридного Fc, hFc (гибридный Fc), раскрытого в пат. США № 7867491, полное содержание которого включено в настоящее описание ссылкой. hFc может быть связан с физиологически активным белком и, таким образом, демонстрирует превосходное время полувыведения in vivo по сравнению с Fc-областью существующего модифицированного иммуноглобулина.
Вектор генной экспрессии готовили так же, как в Примере 1, и трансфицировали, и клетки культивировали для получения культуральной жидкости, содержащей различные формы гибридных белков IL-7. В результате была получена культуральная жидкость, содержащая белок G-IL-7-hyFc, M-IL-7-hyFc, MM-IL-7-hyFc, GG-IL-7-hyFc, MG-IL-7-hyFc, GM-IL-7-hyFc, MMM-IL-7-hyFc, MMG-IL-7-hyFc, MGM-IL-7-hyFc, GMM-IL-7-hyFc, MGG-IL-7-hyFc, GMG-IL-7-hyFc, GGM-IL-7-hyFc, GGG-IL-7-hyFc, DDD-IL-7-hyFc или MMMM-IL-7-hyFc. Продуцируются MGMM-IL-7-hyFc, MGGM-IL-7-hyFc, MGGG-IL-7-hyFc, MGMG-IL-7-hyFc, GMMM-IL-7-hyFc, GMGG-IL-7-hyFc, GGGG-IL-7-hyFc, MMMMM-IL-7-hyFc, MMGMM-IL-7-hyFc, MMGGM-IL-7-hyFc, MGMMG-IL-7-hyFc, MMMMG-IL-7-hyFc, GGGGG-IL-7-hyFc, GGMMM-IL-7-hyFc, GGGMG-IL-7-hyFc, MGMGMG-IL-7-hyFc, MMMGGG-IL-7-hyFc, MMGGMM-IL-7-hyFc, GGMMGG-IL-7-hyFc, MGMGMGMG-IL-7-hyFc, MMMMGGGG-IL-7-hyFc, MMGGMMGG-IL-7-hyFc, MMMMGGGG-IL-7-hyFc, MGMGMGMGMG-IL-7-hyFc или MMMMMGGGGG-IL-7-hyFc.
В одном аспекте может быть использован гибридный белок модифицированный IL-7-Fc под кодовым названием GX-I7 (SEQ ID NO: 24). GX-17 содержит модифицированный IL-7 из SEQ ID NO: 18 и hyFc, объединенный с С-концом модифицированного IL-7.
В одном аспекте гибридный белок IL-7 можно вводить в дозе около 60 мкг/кг или выше. Доза может находиться в диапазоне от около 60 мкг/кг до около 2000 мкг/кг. Доза может составлять около 60 мкг/кг или больше, около 120 мкг/кг или больше, около 240 мкг/кг или больше, около 480 мкг/кг или больше, около 720 мкг/кг или больше, около 960 мкг/кг или больше, около мкг/кг или больше, 1200 мкг/кг или больше, около 1700 мкг/кг или больше или около 2000 мкг/кг. В другом воплощении доза может составлять около 60 мкг/кг или больше, около 360 мкг/кг или больше, около 600 мкг/кг или больше, около 840 мкг/кг или больше или около 1440 мкг/кг или выше.
В частном случае доза может составлять около 60 мкг/кг или больше, около 120 мкг/кг или больше, около 240 мкг/кг или больше, около 360 мкг/кг или больше, около 480 мкг/кг или больше, около 600 мкг/кг или больше, около 720 мкг/кг или больше, около 840 мкг/кг или больше, около 960 мкг/кг или больше, около 1200 мкг/кг или больше, около 1440 мкг/кг или больше, около 1700 мкг/ кг или выше, или около 2000 мкг/кг.
В некоторых аспектах модифицированный интерлейкин-7 или гибридный белок интерлейкина-7 вводят два или более раз в количестве около 720 мкг/кг с интервалом около 1 недели, около 2 недель, около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель или около 8 недель. В некоторых аспектах модифицированный интерлейкин-7 или гибридный белок интерлейкина-7 вводят два или более раз в количестве около 840 мкг/кг с интервалом около 2 недель, около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель или около 8 недель. В других аспектах модифицированный интерлейкин-7 или гибридный белок интерлейкина-7 вводят два или более раз в количестве около 960 мкг/кг с интервалом около 2 недели, около 3 недели, около 4 недели, около 5 недель, около 6 недель, около 7 недель, около 8 недель, или 9 недель, или около 10 недель. В некоторых аспектах модифицированный интерлейкин-7 или гибридный белок интерлейкина-7 вводят два или более раз в количестве около 1200 мкг/кг с интервалом около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 9 недель, около 10 недель, около 11 недель или около 12 недель. В некоторых других аспектах модифицированный интерлейкин-7 или гибридный белок интерлейкина-7 вводят два или более раз в количестве около 1440 мкг/кг с интервалом около 3 недель, около 4 недель, около 5 недель, около 6 недель, около 7 недель, около 8 недель, около 9 недель, около 10 недель, около 11 недель, около 12 недель, около 13 недель, около 14 недель или около 15 недель.
I. Доклиническое исследование
A. Фармакокинетический тест после однократного введения гибридного белка IL-7 в крысу
Для изучения фармакокинетических свойств гибридного белка IL-7 был проведен фармакокинетический тест с использованием нормальных крыс. Фармакокинетические испытания проводили при внутривенном, подкожном и внутримышечном введении. GX-I7 (SEQ ID NO: 24) использовали в качестве гибридного белка IL-7.
Результаты испытаний для оценки кинетики и биодоступности лекарственного средства при однократном внутривенном, подкожном и внутримышечном введении гибридного белка IL-7 in vivo нормальным крысам.
При внутривенном введении AUClast и Cmax составляли, соответственно 349,7 (0,1 мг/кг), 1440,6 (0,3 мг/кг), 4225,9 (1,0 мг/кг) ч⋅нг/мл и 34,3 (0,1 мг/кг), 86,7 (0,3 мг /кг), 324,5 (1,0 мг/кг) нг/мл, подтверждая, что они увеличиваются дозозависимым образом. Tmax составлял 0,083 часа, конечный T1/2 составлял 22,6, 22,6 и 22,0 часа в каждой группе введения 0,1, 0,3 и 1,0 мг/кг, а средний терминальный T1/2 составлял 22,4 часа. Биодоступность рассчитывали на основе 72 часов (0,1 мг/кг), 120 часов (0,3 мг/кг) и 168 часов (1,0 мг/кг), которые были временными точками, в которые может быть измерена концентрация в крови группы внутривенного введения.
При подкожном введении AUClast и Cmax составляли 363,8 (0,1 мг/кг), 1675,9 (0,3 мг/кг), 9765,4 (1,0 мг/кг) ч⋅нг/мл и 4,1 (0,1 мг/кг), 16,4 (0,3 мг/мл) и 105,9 (1,0 мг/кг) нг/мл, соответственно. Было подтверждено, что Tmax увеличился до 48,0, 36,0, 48,0 часов в каждой группе введения 0,1, 0,3 и 1,0 мг/кг, а терминальный T1/2 составил 39,4 и 24,3 часа в каждой группе введения 0,3 и 1,0 мг/кг. Было обнаружено, что биодоступность составляет 104 (0,1 мг/кг), 116 (0,3 мг/кг) и 231 (1,0 мг/кг) в зависимости от концентрации в крови группы внутривенного введения.
При внутримышечном введении AUClast и Cmax составляли 732,3 (0,1 мг/кг), 2898,3 (0,3 мг/кг), 11027,8 (1,0 мг/кг) ч⋅нг/мл и 12,5 (0,1 мг/кг), 51,2 (0,3 мг/ кг) и 147,9 (1,0 мг/кг) нг/мл, соответственно. Было подтверждено, что эти значения увеличиваются дозозависимым образом. Tmax составлял около 10,0 часов во всех группах введения 0,1, 0,3 и 1,0 мг/кг, конечный T1/2 составлял 48,3, 39,0 и 25,6 часа в каждой группе введения 0,1, 0,3 и 1,0 мг/кг. Было обнаружено, что биодоступность составляет 209 (0,1 мг/кг), 201 (0,3 мг/кг) и 261 (1,0 мг/кг) в зависимости от концентрации в крови группы внутривенного введения.
Интересно, что в этом эксперименте модифицированный гибридный белок IL-7, введенный внутримышечно, показал более высокую биодоступность, чем при внутривенном введении, тогда как большинство существующих лекарственных соединений демонстрируют более низкую биодоступность при подкожном или внутримышечном введении, чем при внутривенном введении. См. фиг. 1А-1С.
B. Фармакокинетический тест после введения гибридного белка IL-7 обезьяне
Фармакокинетический профиль яванского макака был подтвержден кинетикой токсичности после одной дозы теста на токсичность в течение 4 недель. После однократного введения 0,6, 2, 6 мг/кг гибридного белка IL-7 измеряли кинетику токсичности в течение 1 недели. В результате AUClast и Cmax составили 608 (0,6 мг/кг), 2730 (2 мг/кг), 15824 (6 мг/кг) ч⋅нг/мл и 6 (0,6 мг/кг), 29 (2 мг/кг), 172 (6 мг/кг) нг/мл, демонстрируя дозозависимое увеличение. Tmax составлял 22-40 часов, а терминальный T1/2 составлял 164, 90 и 69 часов в каждой группе введения 0,6, 2 и 6 мг/кг. Предполагается, что терминальный T1/2 в группе, получавшей 0,6 мг/кг, обусловлен тенденцией к небольшому увеличению концентрации гибридного белка IL-7 в крови в терминальной фазе как биологическая вариация из-за низкой концентрации уровня гибридного белка IL-7 в крови. Таким образом, средний терминальный T1/2 остальных групп, за исключением группы введения 0,6 мг/кг, был рассчитан и составил около 80 часов. Результаты представлены в таблице 2.
Таблица 2. Фармакокинетические параметры
(ч)
(ч)
(нг/мл)
(ч⋅нг/мл)
(0-72 ч)
IV-внутривенно
SC-подкожно
IM-внутримышечно
1) НО: не обнаружено
С. Тест на безопасность с использованием обычных крыс и обезьян
Чтобы установить дозу для токсичности повторного введения гибридного белка IL-7, тест проводили в течение 2 недель с использованием нормальных крыс и яванских макак, и измеряли (суб)хроническую токсичность в соответствии с повторными введениями в установленных дозах и продолжительностью введения лекарственного средства. Повторные тесты на токсичность проводились в течение 4 недель для оценки ухудшения, отсроченного возникновения и обратимости явлений токсичности. Фармакологический тест на безопасность проводили при дозах 0, 1,2, 4, 12 мг/кг гибридного белка IL-7 (GX-I7) у нормальных крыс и 0, 0,6, 2, 6 мг/кг у яванских макак. Как у нормальных крыс, так и у яванских макак все оцененные дозы гибридного белка IL-7 (GX-I7) не показали значительного влияния на общее поведение, нервную систему, дыхательную систему и сердечно-сосудистую систему тестируемых животных.
При подкожном введении гибридного белка IL-7 (GX-I7) нормальным крысам один раз в неделю, всего 5 раз в течение 4 недель, даже в дозах до 12 мг/кг/неделю токсикологических явлений, вызванных лекарственными средствами, не наблюдалось. Несмотря на то, что наблюдались симптомы, связанные с исследуемым лекарственным средством, после повторных введений не наблюдалось воздействия лекарственного средства на кровь. По-видимому, это экранирующий эффект лекарственно-специфического антитела (антитела против лекарственного средства), и, как следствие, максимальная нетоксическая доза (NOAEL) для введения гибридного белка IL-7 (GX-I7) один раз в неделю в течение 4 недель у нормальных крыс определить не удалось. В 4-недельном повторном тесте на подкожную токсичность у яванских макак токсичность лекарственного средства не наблюдалась даже при дозах до 6 мг/кг/неделю, поэтому максимальная нетоксичная доза (NOAEL) гибридного белка IL-7 (GX-I7) была установлена на уровне 6 мг/кг/неделю. Это соответствует около 2 мг/кг при переводе в эквивалентную дозу для человека (англ. human equivalent dose, HED).
II. Клиническое исследование
A. Цель и демографические данные
Это клиническое исследование было проведено на (а) пациентах с местнораспространенным или метастатическим солидным злокачественным новообразованием и (b) пациентах с глиобластомой с тяжелой лимфопенией, связанной с лечением после адъювантной химиотерапии. Гибридный белок IL-7 вводили с интервалами каждые 3 недели, каждые 4 недели, каждые 6 недель, каждые 8 недель, каждые 9 недель или каждые 12 недель, и оценивали безопасность, переносимость и эффекты увеличения абсолютного количества лимфоцитов.
(1) Все субъекты, включенные в группу пациентов с метастатическим солидным злокачественным новообразованием в фазе повышения дозы, ранее не получали существующего стандартного лечения или имели гистологический диагноз местно-прогрессирующего, рецидивирующего или метастатического неизлечимого солидного злокачественного новообразования. Пациенты были проверены с помощью истории диагноза рака и соответствующей лечения, и было подтверждено, что они соответствуют критериям отбора/исключения для этого исследования с помощью другой истории болезни и скрининг-тестов. 21 зарегистрированный субъект состоял из рака ободочной кишки 10 (47,6%), рака прямой кишки 5 (23,8%), рака молочной железы 2 (9,5%), рака яичников 1 (4,7%), синовиальной саркомы 1 (4,7%), рака анального канала 1 (4,7%) и рак шейки матки 1 (4,7%). На основании всех собранных результатов анализа безопасности, фармакокинетического/фармакокинетического/иммуногенного анализа была выбрана доза для оценки на стадии увеличения дозы (рекомендуемая доза для фазы 2, RP2D) и интервалы введения.
(2) Клиническое исследование пациентов с глиобластомой было проведено для выбора рекомендуемой дозы Фазы 2 (RP2D) на основе результатов анализа безопасности, фармакодинамического/иммуногенного анализа у пациентов, включенных в когорту 1-5 стадии повышения дозы (всего 15 пациентов). Субъектам без серьезной токсичности и без клинического значения прогрессирования заболевания продолжали вводить тестируемое лекарственное средство на основании клинической значимости и оценки риска.
Возраст участвующих пациентов колеблется от 32 до 81 года и включает как женщин, так и мужчин. Ранее у пациентов диагностировали синовиальную саркому, инфильтрирующую протоковую карциному, рак прямой кишки, рак ободочной кишки, рак яичников, рак восходящей кишки, рак анального канала, инвазивный протоковый рак, аденокарциному, рак прямой кишки с парааортальным метастатическим поражением, нейроэндокринную карциному (шейки матки), рак сигмовидной кишки или глиобластому. Участвующие пациенты ранее получали один или несколько способов лечения онкологических заболеваний, включая хирургическое вмешательство, лучевую терапию и химиотерапию.
B. Дизайн исследования
Пациентам с местнораспространенным или метастатическим солидным злокачественным новообразованием и глиобластомой, включенным в стадию повышения дозы (21, 28, 42, 56, 63 или 84 дня за 1 цикл), вводили с интервалами 21, 28, 42, 56, 63 или 84 дня с фиксированной дозой модифицированного гибридного белка IL-7 (GX-I7) внутримышечно в первый день каждого цикла.
Стадия увеличения дозы включает внутримышечное введение гибридного белка IL-7 в 9 стадий (или 5 стадий) доз (60, 120, 240, 480, 720, 960, 1200, 1700 и 2000 мкг/кг; или 60, 360, 600, 840, 1440 мкг/кг), как показано в таблице 3, и оценивали безопасность, переносимость и фармакокинетические/фармакодинамические изменения. При внутримышечной инъекции место инъекции разделяют и вводят таким образом, чтобы объем инъекции не превышал 2 мл на одно место инъекции.
Таблица 3. Группа дозирования и Эскалация дозы
(мкг/кг)
(мкг/кг)
С. Безопасность
1. Пациенты с солидной опухолью
Безопасность оценивали по побочным реакциям (отклонения от нормы лабораторных показателей, клинические симптомы и признаки, на которые жаловались субъекты, оценка исследователя и т.д.) у субъектов на стадии эскалации дозы (всего 21 пациент с местнораспространенным или метастатическим солидным злокачественным новообразованием). Результаты представлены в таблице 4.
Из общего числа нежелательных реакций 44 случая нежелательных лекарственных реакций (англ. adverse drug reactions, ADR), оцененных как «относящиеся к тестируемому лекарственному средству», произошли у 16 из 21 (76,2%). Когда степени были классифицированы в соответствии с NCI-CTCAE (версия 4.0) для тяжести нежелательных лекарственных реакций (ADR), 29 случаев были легкими (Степень 1), 15 случаев были умеренными (Степень 2), и не сообщалось об ADR 3, 4, 5 степени. Всего было зарегистрировано 3 серьезных нежелательных явления (англ. Serious Adverse Events, SAE), все из которых были оценены как «отсутствие связи с исследуемым лекарственным средством». Согласно сообщениям о частоте ADR, сообщалось о реакции в месте инъекции возникали чаще всего, с 25 случаями зарегистрированными у 14 из 21 (66,7%), 8 случаями лихорадки, 4 случаями сыпи или популезной сыпи, 2 случаями снижения аппетита и по 1 случаю астении, боли в спине, запора, гриппоподобных заболеваниях и миалгии. Соответственно, было подтверждено отсутствие серьезных побочных реакций, вызванных лекартсвенным средством.
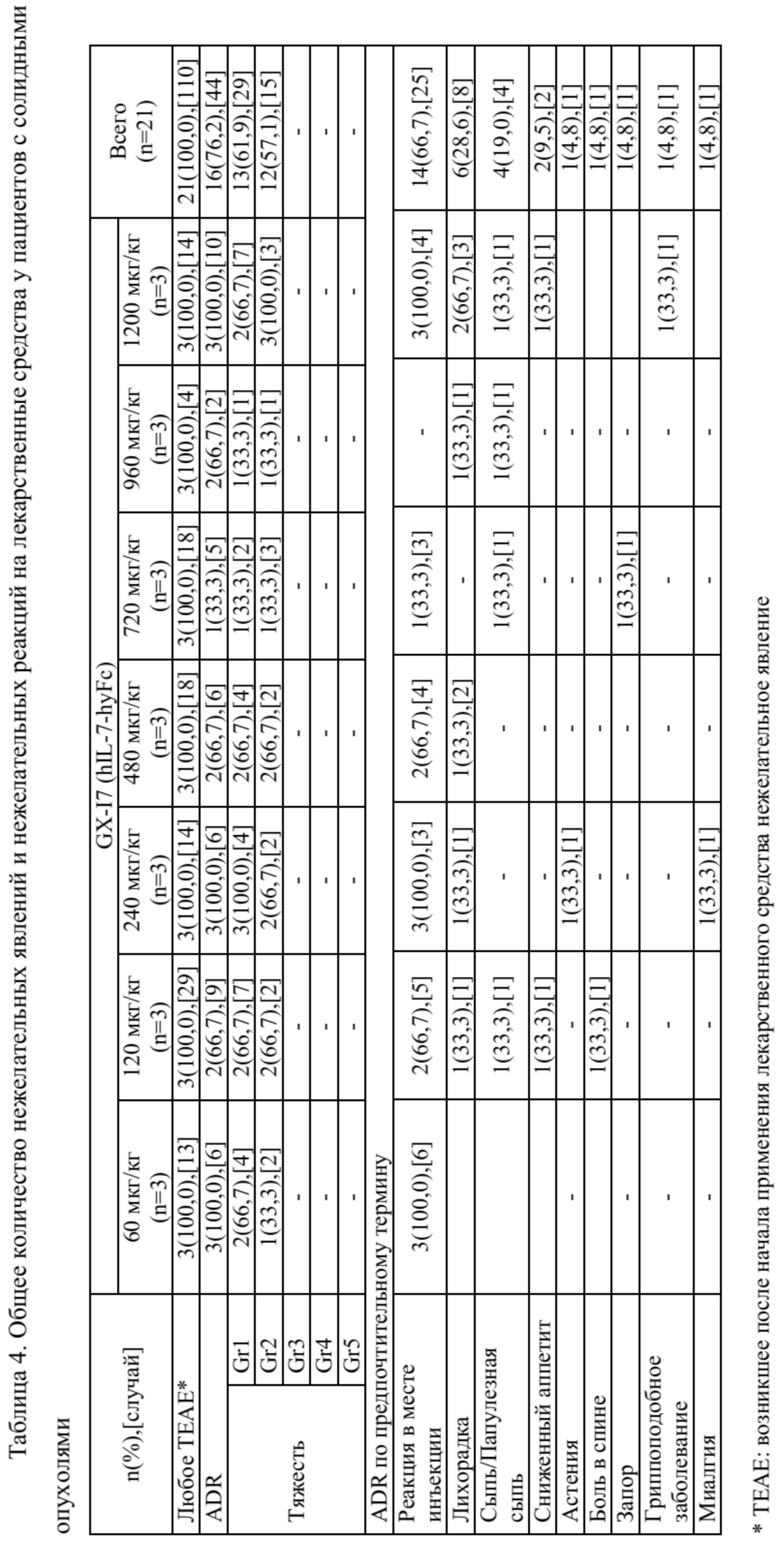
2. Пациенты с глиобластомой
Безопасность оценивали по побочным реакциям (отклонения от нормы лабораторных показателей, клинические симптомы и признаки, на которые жаловались субъекты, оценка исследователя и т.д.) у 15 пациентов с глиобластомой, о которых сообщалось на стадии с шагом повышения дозы. См. таблицу 5.
Из общего числа нежелательных реакций 32 случая нежелательных лекарственных реакций (ADR), оцененных как «относящиеся к тестируемому лекарственному средству», произошли у 13 из 15 субъектов (86,7%). В каждой группе по одному пациенту в группе 60 мкг/кг (33,3%, 2 случая), 3 пациента в группе 360 мкг/кг (100,0%, 10 случаев) и 3 пациента в группе 600 мкг/кг. (100,0%, 5 случаев), 3 пациента (100,0%, 7 случаев) в группе 840 мкг/кг и 3 пациента (100,0%, 8 случаев) в группе 1440 мкг/кг. Когда степени были классифицированы в соответствии с NCI-CTCAE (версия 4.0) для тяжести нежелательных лекарственных реакций (ADR), сообщалось, что 21 случай был легким (Степень 1) и 11 случаев были умеренными (Степень 2), и ни одного ADR степеней 3, 4, 5. Согласно сообщениям о частоте побочных реакций, наиболее часто возникали реакции в месте инъекции, при этом сообщалось о 9 случаях в 11 из 15 случаев (66,0%). Сообщалось о 6 случаях крапивницы, 3 случаях зуда и по 2 случаям для каждого из числа чувства жара, лихорадки и отека, а также по 1 случаю для каждого из числа боли в месте инъекции, миалгии, периферического отека, усталости и сыпи. Соответственно, было подтверждено отсутствие серьезных побочных реакций, вызванных лекартсвенным средством.
Таблица 5. Общее количество нежелательных явлений и нежелательных реакций на лекарственные средства у пациентов с глиобластомой
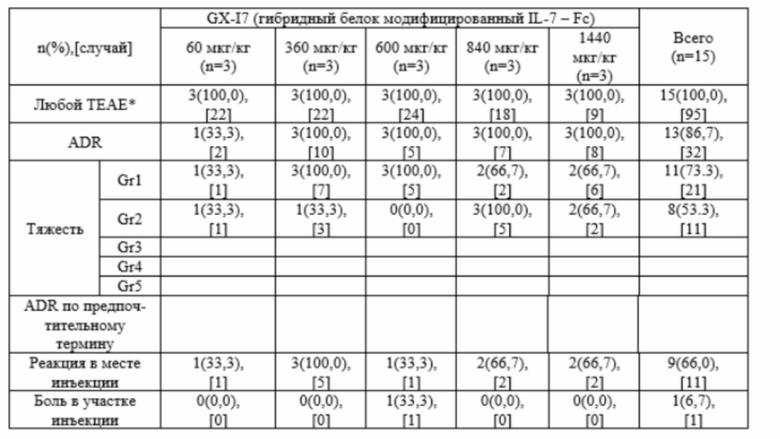
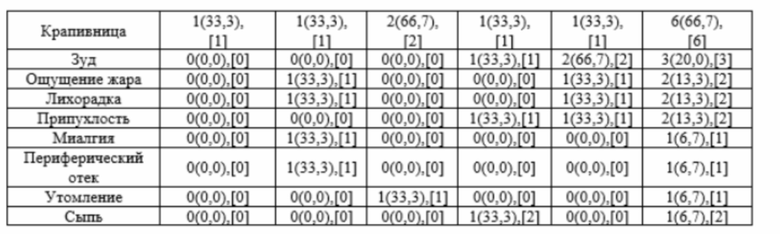
ADR-неблагоприятная побочная реакция
* TEAE: возникшее после начала применения лекарственного средства нежелательное явление
3. Фармакокинетика
Значения фармакокинетических параметров рассчитывали для каждого субъекта, а их среднее значение, стандартное отклонение, минимум и максимум представляли в виде описательной статистики для каждой дозовой группы.
Кровь собирали до (0 часов) и через 0,5, 6, 12, 24, 48, 72, 168, 336 и 504 часа после введения модифицированного IL-7, гибридного белка GX-I7, и концентрацию IL-7 в крови анализировали с использованием имеющегося в продаже набора ELISA (Human IL-7 Quantikine HS ELISA Kit HS750 от R&D Systems), и результаты представлены в таблицах (фармакокинетические параметры) и графиках.
Кривая зависимости концентрации в крови от времени для каждого субъекта в каждой дозовой группе показана на [фиг. 2], а фармакокинетические параметры представлены в таблице 6. Результаты измерения концентрации в крови при внутримышечном введении гибридного белка IL-7 до и после введения во всех дозовых группах. Было замечено, что концентрация IL-7 в крови увеличивалась дозозависимым образом.
При первом внутримышечном введении концентрация в крови модифицированного гибридного белка IL-7 снижалась после достижения максимальной концентрации в крови в среднем от 12 до 48 часов для каждой дозы, а период полувыведения (t1/2) составлял от 33 до 147 часов. Между ними была разница.
Хотя существуют различия между отдельными людьми, Cmax и AUClast имели тенденцию к увеличению по мере увеличения дозы тестируемого лекарственного средства, а Cmax и AUClast увеличивались больше по сравнению с увеличением дозы до 1200 мкг/кг с 960 мкг/кг. Показал паттерн. Корреляция между изменением Cmax и AUClast в зависимости от дозы представлена на фиг. 3А и 3В.
Таблица 6. Резюме фармакокинетических параметров гибридного белка IL-7 в сыворотке после однократных внутримышечных инъекций
(мкг/кг)
(n=3)
(n=3)
(n=3)
(n=3)
(n=3)
(n=3)
(n=3)
(n=2)
[Примечание] Cmax=максимальная концентрация; tmax=время достижения максимальной концентрации; AUC0-168h = площадь под кривой от нулевого момента времени до 168-часового момента времени; 1) Медиана (мин, макс), 2) Среднее геометрическое ± стандартное отклонение
4. Фармакодинамические (ФД) характеристики
(а) Клинические испытания на пациентах с солидной злокачественной опухолью
Для оценки биомаркера, который можно применять в качестве исследовательского фармакодинамического индикатора активности гибридного белка IL-7 у пациентов с местнораспространенным или метастатическим солидным злокачественным новообразованием, исследуемое лекарственное средство вводили 21 субъекту, включенному в стадию эскалации дозы. Периферическую кровь собирали до и после и измеряли различные типы иммунных клеток и процентные изменения в крови.
(b) Клиническое исследование пациентов с глиобластомой
Периферические исследования до и после введения тестируемого препарата у 15 субъектов, включенных в стадию повышения дозы, для оценки биомаркеров, которые можно применять в качестве поисковых фармакодинамических показателей активности гибридного белка IL-7 у пациентов с глиобластомой. Собирали кровь и измеряли различные типы иммунных клеток и изменения соотношения в крови.
4.1 Изменения абсолютного числа лимфоцитов (ALC) при введении гибридного белка IL-7
Для измерения абсолютного количества лимфоцитов (ALC) в соответствии с каждой дозовой группой (Когортой) для всей группы пациентов у пациентов собирали кровь до и через 3 недели после введения гибридного белка IL-7. Абсолютное значение ALC измеряли с помощью анализатора.
Группа пациентов с солидной злокачественной опухолью и глиобластомой при низкой дозе (60-120 мг/кг и 60 мг/кг), средней дозе (240-480 мг/кг и 360-600 мг/кг), высокой дозе (720-1200 мг/кг и 840-1440 мкг/кг), а изменение абсолютных значений ALC в течение 3 недель по сравнению с исходным уровнем представлено на фиг. 4А и 4В. В результате было подтверждено, что в группе с высокой дозой (720-1440 мкг/кг) изменение абсолютного значения ALC увеличилось до 4,4 раза по сравнению с исходным значением. Было подтверждено, что эта картина демонстрирует одинаковую картину увеличения в CD3+, CD4+ и CD8+ Т-клетках. См. фиг. 5А, 5В, 6А, 6В, 7А и 7В.
4.2 Изменения ALC у пациентов с лимфопенией
Для всех пациентов с солидной злокачественной опухолью и пациентов с глиобластомой пациенты с исходными уровнями ALC ниже 1000 клеток/мм3 до введения гибридного белка IL-7 классифицировались как пациенты с лимфопенией, и гибридный белок IL-7 вводили с интервалами каждые 3 или 6 недель (солидный злокачественное новообразование) и каждые 4 недели, каждые 8 недель, каждые 9 недель или каждые 12 недель (GBM). После этого изменения в ALC наблюдали для каждой группы пациентов с лимфопенией и нелимфопенией, и результаты показаны на фиг. 8А, 8В, 9А и 9В.
В результате анализа было подтверждено, что значение ALC значительно увеличилось в группе пациентов без лимфопении, а значение ALC через 3 недели приема увеличилось до нормального диапазона в группе пациентов с лимфопенией с ALC ниже 1000 клеток/мм3. Кроме того, было подтверждено, что величина изменения по сравнению с исходным значением в группе пациентов без лимфопении увеличивалась аналогичным образом в группе пациентов с лимфопенией, особенно в группе с высокой дозой.
4.3 Результаты анализа Ki67, CD127 (IL-7Rα) и подтипов Т-клеток (подмножества)
Из изменений в экспрессии Ki67 в качестве ведущего индикатора увеличения ALC у пациентов с солидной злокачественной опухолью было подтверждено, что количество экспрессии Ki67 как в CD4+ T-клетках, так и в CD8+ T-клетках увеличивалось в зависимости от дозы как в CD4+ Т-клетках, так и в CD8+ Т-клетках. С другой стороны, было подтверждено, что уровень экспрессии CD127, рецептора IL-7, значительно снижался по сравнению с исходным уровнем при высоких дозах. Кроме того, изменения количества CD4+ Т-клеток и CD8+ Т-клеток (отношение CD4+/Treg и CD8+/Treg) по сравнению с регуляторными Т-клетками (Treg-клетками), которые регулируют иммунную систему, указывают на то, что количество CD4+ и CD8+ Т-клеток увеличилось больше, чем количество Treg-клеток по сравнению с исходным уровнем, во всех дозовых группах. См. фиг. 10А, 10В и 10С.
4.4 Анализ изменений экспрессии Ki67 и ALC для выбора оптимального интервала введения
4.4.A. Результаты доклинических исследований по установлению интервала дозирования
Чтобы подтвердить реактивность гибридного белка IL-7 для установления интервала введения, реактивность Ki67 подтверждали через 7 дней после стимуляции гибридным белком IL-7 в каждый момент времени in vitro с использованием образцов крови, полученных в экспериментах на обезьянах. Момент времени взятия образцов крови показан на фиг. 11.
В результате в РВМС за 14, 10 и 3 дня до введения гибридного белка IL-7 экспрессия Ki67 увеличивалась за счет стимуляции гибридным белком IL-7, после введения гибридного белка IL-7. В образцах крови, полученных на 4-й, 11-й и 18-й дни, было подтверждено снижение экспрессии Ki67 из-за гибридного белка IL-7. Эта тенденция наблюдалась как в CD4+, так и в CD8+ Т-клетках, и было подтверждено, что экспрессия Ki67 увеличивалась в образцах крови на 31-й, 45-й, 59-й и 73-й дни.
Результаты предполагают, что после первой пролиферации Т-клеток гибридным белком IL-7 может пройти определенный период времени, прежде чем начнется повторная пролиферация. Предполагается, что будет нарастающая точка перегиба. Кроме того, у некоторых особей (ZC5M03) наблюдалось восстановление реакции через около 5-6 недель. фиг. 12A и 12B.
4.4.B. Результаты клинических исследований по установлению интервала введения
Результаты измерения изменений ALC в соответствии с однократным введением гибридного белка IL-7 в качестве однократной терапии у онкологических больных показали, что увеличение ALC при первом введении в группе с высокой дозой сохранялось до 12 недель. Это предполагает, что можно поддерживать интервал от 8 до 12 недель или дольше (например, 15 недель) при установлении интервала введения. См. фиг. 13A и 13B.
В исследовании пациентов с глиобластомой фактический гибридный белок IL-7 вводили не только отдельно, но и в сочетании с различными другими противоопухолевыми лекарственными средствами, включая химиотерапию (TMZ), в качестве стандартного лечения пациентов с глиобластомой. ALC значительно увеличивалась при повторных введениях. Результаты показывают, что количество абсолютного числа лимфоцитов (ALC), которое обычно снижается с помощью существующих химиотерапевтических лекарственных средств (которые преимущественно убивают быстро пролиферирующие клетки), может поддерживаться выше определенного уровня однократным или повторным введением гибридного белка IL-7. Следовательно, ожидается, что гибридный белок IL-7 усилит или улучшит существующие противораковые способы лечения. Фиг. 14А, 14В и 14С.
4.5 Изменения в субпопуляциях Т-клеток, NK-клеток и В-клеток после введения гибридного белка IL-7
В результате анализа подтипов CD4+ Т-клеток и CD8+ Т-клеток в группе пациентов, получавших GX-I7 в качестве гибридного белка IL-7, наблюдалось дозозависимое увеличение CD4+ Т-клеток и CD8+ Т-клеток. Увеличение наивных CD4+ и CD8+ Т-клеток было самым большим по сравнению с исходным уровнем. Экспрессия CCR5 в них также увеличивалась по сравнению с исходным значением при каждой дозе, что свидетельствует о том, что введение гибридного белка IL-7 может индуцировать миграцию Т-клеток в участок опухоли. NK-клетки также показали дозозависимое увеличение по сравнению с исходным уровнем. Однако увеличения В-клеток по сравнению с исходным уровнем не наблюдалось. См. фиг. 15A и 15B
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Genexine, Inc.
NeoImmune Tech., Inc.
<120> СПОСОБ УВЕЛИЧЕНИЯ КОЛИЧЕСТВА ЛИМФОЦИТОВ В ОПУХОЛЯХ
С ПОМОЩЬЮ ГИБРИДНОГО БЕЛКА IL-7
<130> F257963
<150> US 62/935,828
<151> 2019-11-15
<150> US 62/895,787
<151> 2019-09-04
<160> 40
<170> KoPatentIn 3.0
<210> 1
<211> 177
<212> PRT
<213> Homo sapiens
<220>
<223> аминокислотная последовательность IL-7 человека (Учетный номер: P13232)
<400> 1
Met Phe His Val Ser Phe Arg Tyr Ile Phe Gly Leu Pro Pro Leu Ile
1 5 10 15
Leu Val Leu Leu Pro Val Ala Ser Ser Asp Cys Asp Ile Glu Gly Lys
20 25 30
Asp Gly Lys Gln Tyr Glu Ser Val Leu Met Val Ser Ile Asp Gln Leu
35 40 45
Leu Asp Ser Met Lys Glu Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe
50 55 60
Asn Phe Phe Lys Arg His Ile Cys Asp Ala Asn Lys Glu Gly Met Phe
65 70 75 80
Leu Phe Arg Ala Ala Arg Lys Leu Arg Gln Phe Leu Lys Met Asn Ser
85 90 95
Thr Gly Asp Phe Asp Leu His Leu Leu Lys Val Ser Glu Gly Thr Thr
100 105 110
Ile Leu Leu Asn Cys Thr Gly Gln Val Lys Gly Arg Lys Pro Ala Ala
115 120 125
Leu Gly Glu Ala Gln Pro Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu
130 135 140
Lys Glu Gln Lys Lys Leu Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu
145 150 155 160
Gln Glu Ile Lys Thr Cys Trp Asn Lys Ile Leu Met Gly Thr Lys Glu
165 170 175
His
<210> 2
<211> 154
<212> PRT
<213> Rattus norvegicus
<220>
<223> аминокислотная последовательность IL-7 крысы (Учетный номер: P56478)
<400> 2
Met Phe His Val Ser Phe Arg Tyr Ile Phe Gly Ile Pro Pro Leu Ile
1 5 10 15
Leu Val Leu Leu Pro Val Thr Ser Ser Asp Cys His Ile Lys Asp Lys
20 25 30
Asp Gly Lys Ala Phe Gly Ser Val Leu Met Ile Ser Ile Asn Gln Leu
35 40 45
Asp Lys Met Thr Gly Thr Asp Ser Asp Cys Pro Asn Asn Glu Pro Asn
50 55 60
Phe Phe Lys Lys His Leu Cys Asp Asp Thr Lys Glu Ala Ala Phe Leu
65 70 75 80
Asn Arg Ala Ala Arg Lys Leu Arg Gln Phe Leu Lys Met Asn Ile Ser
85 90 95
Glu Glu Phe Asn Asp His Leu Leu Arg Val Ser Asp Gly Thr Gln Thr
100 105 110
Leu Val Asn Cys Thr Ser Lys Glu Glu Lys Thr Ile Lys Glu Gln Lys
115 120 125
Lys Asn Asp Pro Cys Phe Leu Lys Arg Leu Leu Arg Glu Ile Lys Thr
130 135 140
Cys Trp Asn Lys Ile Leu Lys Gly Ser Ile
145 150
<210> 3
<211> 154
<212> PRT
<213> Mus musculus
<220>
<223> аминокислотная последовательность IL-7 мыши (Учетный номер: P10168)
<400> 3
Met Phe His Val Ser Phe Arg Tyr Ile Phe Gly Ile Pro Pro Leu Ile
1 5 10 15
Leu Val Leu Leu Pro Val Thr Ser Ser Glu Cys His Ile Lys Asp Lys
20 25 30
Glu Gly Lys Ala Tyr Glu Ser Val Leu Met Ile Ser Ile Asp Glu Leu
35 40 45
Asp Lys Met Thr Gly Thr Asp Ser Asn Cys Pro Asn Asn Glu Pro Asn
50 55 60
Phe Phe Arg Lys His Val Cys Asp Asp Thr Lys Glu Ala Ala Phe Leu
65 70 75 80
Asn Arg Ala Ala Arg Lys Leu Lys Gln Phe Leu Lys Met Asn Ile Ser
85 90 95
Glu Glu Phe Asn Val His Leu Leu Thr Val Ser Gln Gly Thr Gln Thr
100 105 110
Leu Val Asn Cys Thr Ser Lys Glu Glu Lys Asn Val Lys Glu Gln Lys
115 120 125
Lys Asn Asp Ala Cys Phe Leu Lys Arg Leu Leu Arg Glu Ile Lys Thr
130 135 140
Cys Trp Asn Lys Ile Leu Lys Gly Ser Ile
145 150
<210> 4
<211> 177
<212> PRT
<213> Chlorocebus sabaeus
<220>
<223> аминокислотная последовательность IL-7 обезьяны (Учетный номер:
NP_001279008)
<400> 4
Met Phe His Val Ser Phe Arg Tyr Ile Phe Gly Leu Pro Pro Leu Ile
1 5 10 15
Leu Val Leu Leu Pro Val Ala Ser Ser Asp Cys Asp Ile Glu Gly Lys
20 25 30
Asp Gly Lys Gln Tyr Glu Ser Val Leu Met Val Ser Ile Asp Gln Leu
35 40 45
Leu Asp Ser Met Lys Glu Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe
50 55 60
Asn Phe Phe Lys Arg His Leu Cys Asp Asp Asn Lys Glu Gly Met Phe
65 70 75 80
Leu Phe Arg Ala Ala Arg Lys Leu Lys Gln Phe Leu Lys Met Asn Ser
85 90 95
Thr Gly Asp Phe Asp Leu His Leu Leu Lys Val Ser Glu Gly Thr Thr
100 105 110
Ile Leu Leu Asn Cys Thr Gly Lys Val Lys Gly Arg Lys Pro Ala Ala
115 120 125
Leu Gly Glu Pro Gln Pro Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu
130 135 140
Lys Glu Gln Lys Lys Leu Asn Asp Ser Cys Phe Leu Lys Arg Leu Leu
145 150 155 160
Gln Lys Ile Lys Thr Cys Trp Asn Lys Ile Leu Met Gly Thr Lys Glu
165 170 175
His
<210> 5
<211> 176
<212> PRT
<213> Bos taurus
<220>
<223> аминокислотная последовательность IL-7 коровы (Учетный номер: P26895)
<400> 5
Met Phe His Val Ser Phe Arg Tyr Ile Phe Gly Ile Pro Pro Leu Ile
1 5 10 15
Leu Val Leu Leu Pro Val Ala Ser Ser Asp Cys Asp Ile Ser Gly Lys
20 25 30
Asp Gly Gly Ala Tyr Gln Asn Val Leu Met Val Asn Ile Asp Asp Leu
35 40 45
Asp Asn Met Ile Asn Phe Asp Ser Asn Cys Leu Asn Asn Glu Pro Asn
50 55 60
Phe Phe Lys Lys His Ser Cys Asp Asp Asn Lys Glu Ala Ser Phe Leu
65 70 75 80
Asn Arg Ala Ser Arg Lys Leu Arg Gln Phe Leu Lys Met Asn Ile Ser
85 90 95
Asp Asp Phe Lys Leu His Leu Ser Thr Val Ser Gln Gly Thr Leu Thr
100 105 110
Leu Leu Asn Cys Thr Ser Lys Gly Lys Gly Arg Lys Pro Pro Ser Leu
115 120 125
Ser Glu Ala Gln Pro Thr Lys Asn Leu Glu Glu Asn Lys Ser Ser Lys
130 135 140
Glu Gln Lys Lys Gln Asn Asp Leu Cys Phe Leu Lys Ile Leu Leu Gln
145 150 155 160
Lys Ile Lys Thr Cys Trp Asn Lys Ile Leu Arg Gly Ile Lys Glu His
165 170 175
<210> 6
<211> 176
<212> PRT
<213> Ovis aries
<220>
<223> аминокислотная последовательность IL-7 овцы (Учетный номер: Q28540)
<400> 6
Met Phe His Val Ser Phe Arg Tyr Ile Phe Gly Ile Pro Pro Leu Ile
1 5 10 15
Leu Val Leu Leu Pro Val Ala Ser Ser Asp Cys Asp Phe Ser Gly Lys
20 25 30
Asp Gly Gly Ala Tyr Gln Asn Val Leu Met Val Ser Ile Asp Asp Leu
35 40 45
Asp Asn Met Ile Asn Phe Asp Ser Asn Cys Leu Asn Asn Glu Pro Asn
50 55 60
Phe Phe Lys Lys His Ser Cys Asp Asp Asn Lys Glu Ala Ser Phe Leu
65 70 75 80
Asn Arg Ala Ala Arg Lys Leu Lys Gln Phe Leu Lys Met Asn Ile Ser
85 90 95
Asp Asp Phe Lys Leu His Leu Ser Thr Val Ser Gln Gly Thr Leu Thr
100 105 110
Leu Leu Asn Cys Thr Ser Lys Gly Lys Gly Arg Lys Pro Pro Ser Leu
115 120 125
Gly Glu Ala Gln Pro Thr Lys Asn Leu Glu Glu Asn Lys Ser Leu Lys
130 135 140
Glu Gln Arg Lys Gln Asn Asp Leu Cys Phe Leu Lys Ile Leu Leu Gln
145 150 155 160
Lys Ile Lys Thr Cys Trp Asn Lys Ile Leu Arg Gly Ile Thr Glu His
165 170 175
<210> 7
<211> 384
<212> PRT
<213> Homo sapiens
<220>
<223> аминокислотная последовательность константной области IgD человека (учетный номер Genbank
No. P01880)
<400> 7
Ala Pro Thr Lys Ala Pro Asp Val Phe Pro Ile Ile Ser Gly Cys Arg
1 5 10 15
His Pro Lys Asp Asn Ser Pro Val Val Leu Ala Cys Leu Ile Thr Gly
20 25 30
Tyr His Pro Thr Ser Val Thr Val Thr Trp Tyr Met Gly Thr Gln Ser
35 40 45
Gln Pro Gln Arg Thr Phe Pro Glu Ile Gln Arg Arg Asp Ser Tyr Tyr
50 55 60
Met Thr Ser Ser Gln Leu Ser Thr Pro Leu Gln Gln Trp Arg Gln Gly
65 70 75 80
Glu Tyr Lys Cys Val Val Gln His Thr Ala Ser Lys Ser Lys Lys Glu
85 90 95
Ile Phe Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro
100 105 110
Thr Ala Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala
115 120 125
Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys
130 135 140
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu
145 150 155 160
Cys Pro Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala
165 170 175
Val Gln Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val
180 185 190
Val Gly Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly
195 200 205
Lys Val Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser
210 215 220
Asn Gly Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu
225 230 235 240
Trp Asn Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu
245 250 255
Pro Pro Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro
260 265 270
Val Lys Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala
275 280 285
Ala Ser Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile
290 295 300
Leu Leu Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe
305 310 315 320
Ala Pro Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala
325 330 335
Trp Ser Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr
340 345 350
Tyr Thr Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala
355 360 365
Ser Arg Ser Leu Glu Val Ser Tyr Val Thr Asp His Gly Pro Met Lys
370 375 380
<210> 8
<211> 327
<212> PRT
<213> Homo sapiens
<220>
<223> аминокислотная последовательность частичной константной области IgD человека
(Учетный номер Genbank № AAH25985)
<400> 8
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 9
<211> 245
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность hyFc
<400> 9
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys
245
<210> 10
<211> 245
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность hyFcM1
<400> 10
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly Gly Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys
245
<210> 11
<211> 245
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность hyFcM2
<400> 11
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly Ser Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys
245
<210> 12
<211> 245
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность hyFcM3
<400> 12
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Ser Gly Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys
245
<210> 13
<211> 245
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность hyFcM4
<400> 13
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Ser Ser Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys
245
<210> 14
<211> 243
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность варианта Fc из IgG мыши
<400> 14
Ala Ser Ala Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys
1 5 10 15
Lys Cys Pro Ala Pro Asn Leu Glu Gly Gly Pro Ser Val Phe Ile Phe
20 25 30
Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val
35 40 45
Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile
50 55 60
Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr
65 70 75 80
His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro
85 90 95
Ile Gln His Gln Asp Trp Met Ser Gly Lys Ala Phe Ala Cys Ala Val
100 105 110
Asn Asn Lys Asp Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro
115 120 125
Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu
130 135 140
Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp
145 150 155 160
Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr
165 170 175
Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser
180 185 190
Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu
195 200 205
Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His
210 215 220
His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys Gly Gly Gly Asn
225 230 235 240
Ser Gly Ser
<210> 15
<211> 153
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(M)
<400> 15
Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser Val
1 5 10 15
Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile Gly
20 25 30
Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile Cys
35 40 45
Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys Leu
50 55 60
Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His Leu
65 70 75 80
Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly Gln
85 90 95
Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr Lys
100 105 110
Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn Asp
115 120 125
Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp Asn
130 135 140
Lys Ile Leu Met Gly Thr Lys Glu His
145 150
<210> 16
<211> 154
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MM)
<400> 16
Met Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser
1 5 10 15
Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile
20 25 30
Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile
35 40 45
Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys
50 55 60
Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His
65 70 75 80
Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly
85 90 95
Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr
100 105 110
Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn
115 120 125
Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp
130 135 140
Asn Lys Ile Leu Met Gly Thr Lys Glu His
145 150
<210> 17
<211> 155
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MMM)
<400> 17
Met Met Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu
1 5 10 15
Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu
20 25 30
Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His
35 40 45
Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg
50 55 60
Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu
65 70 75 80
His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr
85 90 95
Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro
100 105 110
Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu
115 120 125
Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys
130 135 140
Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His
145 150 155
<210> 18
<211> 155
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MGM)
<400> 18
Met Gly Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu
1 5 10 15
Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu
20 25 30
Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His
35 40 45
Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg
50 55 60
Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu
65 70 75 80
His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr
85 90 95
Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro
100 105 110
Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu
115 120 125
Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys
130 135 140
Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His
145 150 155
<210> 19
<211> 155
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(DDD)
<400> 19
Asp Asp Asp Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu
1 5 10 15
Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu
20 25 30
Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His
35 40 45
Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg
50 55 60
Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu
65 70 75 80
His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr
85 90 95
Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro
100 105 110
Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu
115 120 125
Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys
130 135 140
Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His
145 150 155
<210> 20
<211> 156
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MMMM)
<400> 20
Met Met Met Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr
1 5 10 15
Glu Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys
20 25 30
Glu Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg
35 40 45
His Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala
50 55 60
Arg Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp
65 70 75 80
Leu His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys
85 90 95
Thr Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln
100 105 110
Pro Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys
115 120 125
Leu Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr
130 135 140
Cys Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His
145 150 155
<210> 21
<211> 398
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(M), объединенного с hyFc
<400> 21
Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser Val
1 5 10 15
Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile Gly
20 25 30
Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile Cys
35 40 45
Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys Leu
50 55 60
Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His Leu
65 70 75 80
Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly Gln
85 90 95
Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr Lys
100 105 110
Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn Asp
115 120 125
Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp Asn
130 135 140
Lys Ile Leu Met Gly Thr Lys Glu His Arg Asn Thr Gly Arg Gly Gly
145 150 155 160
Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu
165 170 175
Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe
180 185 190
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
195 200 205
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
210 215 220
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
225 230 235 240
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
245 250 255
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
260 265 270
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
275 280 285
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
290 295 300
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
305 310 315 320
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
325 330 335
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
340 345 350
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
355 360 365
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
370 375 380
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390 395
<210> 22
<211> 399
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MM), объединенного с hyFc
<400> 22
Met Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser
1 5 10 15
Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile
20 25 30
Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile
35 40 45
Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys
50 55 60
Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His
65 70 75 80
Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly
85 90 95
Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr
100 105 110
Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn
115 120 125
Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp
130 135 140
Asn Lys Ile Leu Met Gly Thr Lys Glu His Arg Asn Thr Gly Arg Gly
145 150 155 160
Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg
165 170 175
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
180 185 190
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
195 200 205
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
210 215 220
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
225 230 235 240
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
245 250 255
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
260 265 270
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
275 280 285
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
290 295 300
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
305 310 315 320
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
325 330 335
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
340 345 350
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
355 360 365
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
370 375 380
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390 395
<210> 23
<211> 400
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MMM), объединенного с hyFc
<400> 23
Met Met Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu
1 5 10 15
Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu
20 25 30
Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His
35 40 45
Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg
50 55 60
Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu
65 70 75 80
His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr
85 90 95
Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro
100 105 110
Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu
115 120 125
Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys
130 135 140
Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His Arg Asn Thr Gly Arg
145 150 155 160
Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu
165 170 175
Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly
180 185 190
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
195 200 205
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
210 215 220
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
225 230 235 240
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
245 250 255
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
260 265 270
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
275 280 285
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
290 295 300
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
305 310 315 320
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
325 330 335
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
340 345 350
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
355 360 365
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
370 375 380
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390 395 400
<210> 24
<211> 400
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MGM), объединенного с hyFc
<400> 24
Met Gly Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu
1 5 10 15
Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu
20 25 30
Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His
35 40 45
Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg
50 55 60
Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu
65 70 75 80
His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr
85 90 95
Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro
100 105 110
Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu
115 120 125
Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys
130 135 140
Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His Arg Asn Thr Gly Arg
145 150 155 160
Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu
165 170 175
Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly
180 185 190
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
195 200 205
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
210 215 220
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
225 230 235 240
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
245 250 255
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
260 265 270
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
275 280 285
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
290 295 300
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
305 310 315 320
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
325 330 335
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
340 345 350
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
355 360 365
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
370 375 380
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390 395 400
<210> 25
<211> 401
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность модифицированного IL-7(MMMM), объединенного с hyFc
<400> 25
Met Met Met Met Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr
1 5 10 15
Glu Ser Val Leu Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys
20 25 30
Glu Ile Gly Ser Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg
35 40 45
His Ile Cys Asp Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala
50 55 60
Arg Lys Leu Arg Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp
65 70 75 80
Leu His Leu Leu Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys
85 90 95
Thr Gly Gln Val Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln
100 105 110
Pro Thr Lys Ser Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys
115 120 125
Leu Asn Asp Leu Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr
130 135 140
Cys Trp Asn Lys Ile Leu Met Gly Thr Lys Glu His Arg Asn Thr Gly
145 150 155 160
Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu
165 170 175
Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu
180 185 190
Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
195 200 205
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
210 215 220
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
225 230 235 240
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
245 250 255
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
260 265 270
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
275 280 285
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
290 295 300
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
305 310 315 320
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
325 330 335
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
340 345 350
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
355 360 365
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
370 375 380
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
385 390 395 400
Lys
<210> 26
<211> 397
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность IL-7 человека, объединенного с hyFc
<400> 26
Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser Val Leu
1 5 10 15
Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile Gly Ser
20 25 30
Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile Cys Asp
35 40 45
Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys Leu Arg
50 55 60
Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His Leu Leu
65 70 75 80
Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly Gln Val
85 90 95
Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr Lys Ser
100 105 110
Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn Asp Leu
115 120 125
Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp Asn Lys
130 135 140
Ile Leu Met Gly Thr Lys Glu His Arg Asn Thr Gly Arg Gly Gly Glu
145 150 155 160
Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr
165 170 175
Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu
180 185 190
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
195 200 205
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
210 215 220
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
225 230 235 240
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
245 250 255
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
260 265 270
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
275 280 285
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
290 295 300
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
305 310 315 320
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
325 330 335
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
340 345 350
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
355 360 365
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
370 375 380
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
385 390 395
<210> 27
<211> 395
<212> PRT
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность IL-7 человека, объединенного с нелитическим Fc мыши
<400> 27
Asp Cys Asp Ile Glu Gly Lys Asp Gly Lys Gln Tyr Glu Ser Val Leu
1 5 10 15
Met Val Ser Ile Asp Gln Leu Leu Asp Ser Met Lys Glu Ile Gly Ser
20 25 30
Asn Cys Leu Asn Asn Glu Phe Asn Phe Phe Lys Arg His Ile Cys Asp
35 40 45
Ala Asn Lys Glu Gly Met Phe Leu Phe Arg Ala Ala Arg Lys Leu Arg
50 55 60
Gln Phe Leu Lys Met Asn Ser Thr Gly Asp Phe Asp Leu His Leu Leu
65 70 75 80
Lys Val Ser Glu Gly Thr Thr Ile Leu Leu Asn Cys Thr Gly Gln Val
85 90 95
Lys Gly Arg Lys Pro Ala Ala Leu Gly Glu Ala Gln Pro Thr Lys Ser
100 105 110
Leu Glu Glu Asn Lys Ser Leu Lys Glu Gln Lys Lys Leu Asn Asp Leu
115 120 125
Cys Phe Leu Lys Arg Leu Leu Gln Glu Ile Lys Thr Cys Trp Asn Lys
130 135 140
Ile Leu Met Gly Thr Lys Glu His Ala Ser Ala Glu Pro Arg Gly Pro
145 150 155 160
Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Glu
165 170 175
Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu
180 185 190
Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val Val Asp Val Ser
195 200 205
Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu
210 215 220
Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr
225 230 235 240
Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser
245 250 255
Gly Lys Ala Phe Ala Cys Ala Val Asn Asn Lys Asp Leu Pro Ala Pro
260 265 270
Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln
275 280 285
Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val
290 295 300
Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val
305 310 315 320
Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu
325 330 335
Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg
340 345 350
Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val
355 360 365
Val His Glu Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg
370 375 380
Thr Pro Gly Lys Gly Gly Gly Asn Ser Gly Ser
385 390 395
<210> 28
<211> 531
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность IL-7 человека
<400> 28
atgttccacg tgagcttcag gtacatcttc ggcctgccac ccctgatcct ggtgctgctg 60
cctgtggcca gctccgactg cgacatcgag ggaaaagacg gcaagcagta cgaaagcgtg 120
ctgatggtgt ccatcgacca gctgctggat tctatgaagg agattgggag taactgcctg 180
aacaatgagt tcaacttctt caaacggcac atttgtgatg ccaacaagga gggaatgttc 240
ctgtttcggg ccgctagaaa actgaggcag ttcctgaaga tgaacagcac cggagacttt 300
gatctgcatc tgctgaaagt gtctgagggc accacaatcc tgctgaactg cactgggcag 360
gtgaaaggaa ggaagcctgc cgctctggga gaggctcagc caaccaagtc actggaggaa 420
aacaaaagcc tgaaggaaca gaagaaactg aatgacctgt gctttctgaa acggctgctg 480
caggagatca aaacatgttg gaacaagatt ctgatgggca caaaggaaca c 531
<210> 29
<211> 534
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(M)
<400> 29
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgga ctgcgacatc gagggcaagg acggcaagca gtacgagagc 120
gtgctgatgg tgagcatcga ccagctgctg gacagcatga aggagatcgg cagcaactgc 180
ctgaacaacg agttcaactt cttcaagaga cacatctgcg acgccaacaa ggagggcatg 240
ttcctgttca gagccgccag aaagctgaga cagttcctga agatgaacag caccggcgac 300
ttcgacctgc acctgctgaa ggtgagcgag ggcacaacca tcctgctgaa ctgcaccggc 360
caggtgaagg gcagaaagcc cgccgccctg ggcgaggccc agcccaccaa gagcctggag 420
gagaacaaga gcctgaagga gcagaagaag ctgaacgacc tgtgcttcct gaagagactg 480
ctgcaggaga tcaagacctg ctggaacaag atcctgatgg gcaccaagga gcac 534
<210> 30
<211> 537
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MM)
<400> 30
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgat ggactgcgac atcgagggca aggacggcaa gcagtacgag 120
agcgtgctga tggtgagcat cgaccagctg ctggacagca tgaaggagat cggcagcaac 180
tgcctgaaca acgagttcaa cttcttcaag agacacatct gcgacgccaa caaggagggc 240
atgttcctgt tcagagccgc cagaaagctg agacagttcc tgaagatgaa cagcaccggc 300
gacttcgacc tgcacctgct gaaggtgagc gagggcacaa ccatcctgct gaactgcacc 360
ggccaggtga agggcagaaa gcccgccgcc ctgggcgagg cccagcccac caagagcctg 420
gaggagaaca agagcctgaa ggagcagaag aagctgaacg acctgtgctt cctgaagaga 480
ctgctgcagg agatcaagac ctgctggaac aagatcctga tgggcaccaa ggagcac 537
<210> 31
<211> 540
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MMM)
<400> 31
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgat gatggactgc gacatcgagg gcaaggacgg caagcagtac 120
gagagcgtgc tgatggtgag catcgaccag ctgctggaca gcatgaagga gatcggcagc 180
aactgcctga acaacgagtt caacttcttc aagagacaca tctgcgacgc caacaaggag 240
ggcatgttcc tgttcagagc cgccagaaag ctgagacagt tcctgaagat gaacagcacc 300
ggcgacttcg acctgcacct gctgaaggtg agcgagggca caaccatcct gctgaactgc 360
accggccagg tgaagggcag aaagcccgcc gccctgggcg aggcccagcc caccaagagc 420
ctggaggaga acaagagcct gaaggagcag aagaagctga acgacctgtg cttcctgaag 480
agactgctgc aggagatcaa gacctgctgg aacaagatcc tgatgggcac caaggagcac 540
<210> 32
<211> 540
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MGM)
<400> 32
atgttccacg tgagcttcag gtacatcttc ggcctgccac ccctgatcct ggtgctgctg 60
cctgtggcca gctccatggg gatggactgc gacatcgagg gaaaagacgg caagcagtac 120
gaaagcgtgc tgatggtgtc catcgaccag ctgctggatt ctatgaagga gattgggagt 180
aactgcctga acaatgagtt caacttcttc aaacggcaca tttgtgatgc caacaaggag 240
ggaatgttcc tgtttcgggc cgctagaaaa ctgaggcagt tcctgaagat gaacagcacc 300
ggagactttg atctgcatct gctgaaagtg tctgagggca ccacaatcct gctgaactgc 360
actgggcagg tgaaaggaag gaagcctgcc gctctgggag aggctcagcc aaccaagtca 420
ctggaggaaa acaaaagcct gaaggaacag aagaaactga atgacctgtg ctttctgaaa 480
cggctgctgc aggagatcaa aacatgttgg aacaagattc tgatgggcac caaggagcac 540
<210> 33
<211> 540
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(DDD)
<400> 33
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcgacga tgacgactgc gacatcgagg gcaaggacgg caagcagtac 120
gagagcgtgc tgatggtgag catcgaccag ctgctggaca gcatgaagga gatcggcagc 180
aactgcctga acaacgagtt caacttcttc aagagacaca tctgcgacgc caacaaggag 240
ggcatgttcc tgttcagagc cgccagaaag ctgagacagt tcctgaagat gaacagcacc 300
ggcgacttcg acctgcacct gctgaaggtg agcgagggca caaccatcct gctgaactgc 360
accggccagg tgaagggcag aaagcccgcc gccctgggcg aggcccagcc caccaagagc 420
ctggaggaga acaagagcct gaaggagcag aagaagctga acgacctgtg cttcctgaag 480
agactgctgc aggagatcaa gacctgctgg aacaagatcc tgatgggcac caaggagcac 540
<210> 34
<211> 543
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MMMM)
<400> 34
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgat gatgatggac tgcgacatcg agggcaagga cggcaagcag 120
tacgagagcg tgctgatggt gagcatcgac cagctgctgg acagcatgaa ggagatcggc 180
agcaactgcc tgaacaacga gttcaacttc ttcaagagac acatctgcga cgccaacaag 240
gagggcatgt tcctgttcag agccgccaga aagctgagac agttcctgaa gatgaacagc 300
accggcgact tcgacctgca cctgctgaag gtgagcgagg gcacaaccat cctgctgaac 360
tgcaccggcc aggtgaaggg cagaaagccc gccgccctgg gcgaggccca gcccaccaag 420
agcctggagg agaacaagag cctgaaggag cagaagaagc tgaacgacct gtgcttcctg 480
aagagactgc tgcaggagat caagacctgc tggaacaaga tcctgatggg caccaaggag 540
cac 543
<210> 35
<211> 1284
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(M), объединенная с hyFc
<400> 35
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgga ctgcgacatc gagggcaagg acggcaagca gtacgagagc 120
gtgctgatgg tgagcatcga ccagctgctg gacagcatga aggagatcgg cagcaactgc 180
ctgaacaacg agttcaactt cttcaagaga cacatctgcg acgccaacaa ggagggcatg 240
ttcctgttca gagccgccag aaagctgaga cagttcctga agatgaacag caccggcgac 300
ttcgacctgc acctgctgaa ggtgagcgag ggcacaacca tcctgctgaa ctgcaccggc 360
caggtgaagg gcagaaagcc cgccgccctg ggcgaggccc agcccaccaa gagcctggag 420
gagaacaaga gcctgaagga gcagaagaag ctgaacgacc tgtgcttcct gaagagactg 480
ctgcaggaga tcaagacctg ctggaacaag atcctgatgg gcaccaagga gcacaggaac 540
acaggcagag gcggcgagga gaagaagaag gagaaggaga aggaggagca ggaggaaaga 600
gagaccaaga cccccgagtg ccccagccac acccagcccc tgggcgtgtt cctgttccct 660
cccaagccca aggacaccct gatgatcagc agaacccccg aggtgacctg cgtggtcgtg 720
gatgtgagcc aggaagatcc cgaagtgcag ttcaactggt acgtggatgg cgtggaagtg 780
cacaacgcca agaccaagcc cagagaagag cagttcaact ccacctacag agtggtgagc 840
gtgctgaccg tgctgcacca ggactggctg aacggcaagg agtacaagtg caaggtgtcc 900
aacaaaggcc tgcccagctc catcgagaag accatcagca aagccaaagg ccagcccaga 960
gaaccccagg tgtacaccct gcctcccagc caggaagaga tgaccaagaa ccaggtgtcc 1020
ctgacctgcc tggtgaaagg cttctacccc agcgacatcg ccgtggagtg ggaaagcaac 1080
ggccagcccg agaacaatta caagacaacc cctcccgtgc tggatagcga tggcagcttc 1140
tttctgtaca gcagactgac cgtggacaag agcagatggc aggaaggcaa cgtgttcagc 1200
tgcagcgtga tgcacgaagc cctgcacaac cactacaccc agaagagcct gtccctgagc 1260
ctgggcaagt gactcgagtc taga 1284
<210> 36
<211> 1272
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MM), объединенная с hyFc
<400> 36
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgat ggactgcgac atcgagggca aggacggcaa gcagtacgag 120
agcgtgctga tggtgagcat cgaccagctg ctggacagca tgaaggagat cggcagcaac 180
tgcctgaaca acgagttcaa cttcttcaag agacacatct gcgacgccaa caaggagggc 240
atgttcctgt tcagagccgc cagaaagctg agacagttcc tgaagatgaa cagcaccggc 300
gacttcgacc tgcacctgct gaaggtgagc gagggcacaa ccatcctgct gaactgcacc 360
ggccaggtga agggcagaaa gcccgccgcc ctgggcgagg cccagcccac caagagcctg 420
gaggagaaca agagcctgaa ggagcagaag aagctgaacg acctgtgctt cctgaagaga 480
ctgctgcagg agatcaagac ctgctggaac aagatcctga tgggcaccaa ggagcacagg 540
aacacaggca gaggcggcga ggagaagaag aaggagaagg agaaggagga gcaggaggaa 600
agagagacca agacccccga gtgccccagc cacacccagc ccctgggcgt gttcctgttc 660
cctcccaagc ccaaggacac cctgatgatc agcagaaccc ccgaggtgac ctgcgtggtc 720
gtggatgtga gccaggaaga tcccgaagtg cagttcaact ggtacgtgga tggcgtggaa 780
gtgcacaacg ccaagaccaa gcccagagaa gagcagttca actccaccta cagagtggtg 840
agcgtgctga ccgtgctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 900
tccaacaaag gcctgcccag ctccatcgag aagaccatca gcaaagccaa aggccagccc 960
agagaacccc aggtgtacac cctgcctccc agccaggaag agatgaccaa gaaccaggtg 1020
tccctgacct gcctggtgaa aggcttctac cccagcgaca tcgccgtgga gtgggaaagc 1080
aacggccagc ccgagaacaa ttacaagaca acccctcccg tgctggatag cgatggcagc 1140
ttctttctgt acagcagact gaccgtggac aagagcagat ggcaggaagg caacgtgttc 1200
agctgcagcg tgatgcacga agccctgcac aaccactaca cccagaagag cctgtccctg 1260
agcctgggca ag 1272
<210> 37
<211> 1275
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MMM), объединенная с hyFc
<400> 37
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgat gatggactgc gacatcgagg gcaaggacgg caagcagtac 120
gagagcgtgc tgatggtgag catcgaccag ctgctggaca gcatgaagga gatcggcagc 180
aactgcctga acaacgagtt caacttcttc aagagacaca tctgcgacgc caacaaggag 240
ggcatgttcc tgttcagagc cgccagaaag ctgagacagt tcctgaagat gaacagcacc 300
ggcgacttcg acctgcacct gctgaaggtg agcgagggca caaccatcct gctgaactgc 360
accggccagg tgaagggcag aaagcccgcc gccctgggcg aggcccagcc caccaagagc 420
ctggaggaga acaagagcct gaaggagcag aagaagctga acgacctgtg cttcctgaag 480
agactgctgc aggagatcaa gacctgctgg aacaagatcc tgatgggcac caaggagcac 540
aggaacacag gcagaggcgg cgaggagaag aagaaggaga aggagaagga ggagcaggag 600
gaaagagaga ccaagacccc cgagtgcccc agccacaccc agcccctggg cgtgttcctg 660
ttccctccca agcccaagga caccctgatg atcagcagaa cccccgaggt gacctgcgtg 720
gtcgtggatg tgagccagga agatcccgaa gtgcagttca actggtacgt ggatggcgtg 780
gaagtgcaca acgccaagac caagcccaga gaagagcagt tcaactccac ctacagagtg 840
gtgagcgtgc tgaccgtgct gcaccaggac tggctgaacg gcaaggagta caagtgcaag 900
gtgtccaaca aaggcctgcc cagctccatc gagaagacca tcagcaaagc caaaggccag 960
cccagagaac cccaggtgta caccctgcct cccagccagg aagagatgac caagaaccag 1020
gtgtccctga cctgcctggt gaaaggcttc taccccagcg acatcgccgt ggagtgggaa 1080
agcaacggcc agcccgagaa caattacaag acaacccctc ccgtgctgga tagcgatggc 1140
agcttctttc tgtacagcag actgaccgtg gacaagagca gatggcagga aggcaacgtg 1200
ttcagctgca gcgtgatgca cgaagccctg cacaaccact acacccagaa gagcctgtcc 1260
ctgagcctgg gcaag 1275
<210> 38
<211> 1275
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MGM), объединенная с hyFc
<400> 38
atgttccacg tgagcttcag gtacatcttc ggcctgccac ccctgatcct ggtgctgctg 60
cctgtggcca gctccatggg gatggactgc gacatcgagg gaaaagacgg caagcagtac 120
gaaagcgtgc tgatggtgtc catcgaccag ctgctggatt ctatgaagga gattgggagt 180
aactgcctga acaatgagtt caacttcttc aaacggcaca tttgtgatgc caacaaggag 240
ggaatgttcc tgtttcgggc cgctagaaaa ctgaggcagt tcctgaagat gaacagcacc 300
ggagactttg atctgcatct gctgaaagtg tctgagggca ccacaatcct gctgaactgc 360
actgggcagg tgaaaggaag gaagcctgcc gctctgggag aggctcagcc aaccaagtca 420
ctggaggaaa acaaaagcct gaaggaacag aagaaactga atgacctgtg ctttctgaaa 480
cggctgctgc aggagatcaa aacatgttgg aacaagattc tgatgggcac aaaggaacac 540
cgcaatactg ggcggggcgg ggaggaaaag aaaaaggaga aggaaaagga ggaacaggag 600
gaaagagaga ctaagacccc agaatgtccc agccatactc agcccctggg ggtgttcctg 660
tttcccccta aacctaagga taccctgatg atcagcagga cacccgaggt gacctgcgtg 720
gtcgtggatg tgagccagga agatcccgaa gtgcagttca actggtacgt ggatggcgtg 780
gaagtgcaca acgccaagac caagcccaga gaagagcagt tcaactccac ctacagagtg 840
gtgagcgtgc tgaccgtgct gcaccaggac tggctgaacg gcaaggagta caagtgcaag 900
gtgtccaaca aaggcctgcc cagctccatc gagaagacca tcagcaaagc caaaggccag 960
cccagagaac cccaggtgta caccctgcct cccagccagg aagagatgac caagaaccag 1020
gtgtccctga cctgcctggt gaaaggcttc taccccagcg acatcgccgt ggagtgggaa 1080
agcaacggcc agcccgagaa caattacaag acaacccctc ccgtgctgga tagcgatggc 1140
agcttctttc tgtacagcag actgaccgtg gacaagagca gatggcagga aggcaacgtg 1200
ttcagctgca gcgtgatgca cgaagccctg cacaaccact acacccagaa gagcctgtcc 1260
ctgagcctgg gcaag 1275
<210> 39
<211> 1278
<212> DNA
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированного IL-7(MMMM), объединенная с hyFc
<400> 39
atgttccacg tgagcttcag atacatcttc ggcctgcccc ccctgatcct ggtgctgctg 60
cccgtggcca gcagcatgat gatgatggac tgcgacatcg agggcaagga cggcaagcag 120
tacgagagcg tgctgatggt gagcatcgac cagctgctgg acagcatgaa ggagatcggc 180
agcaactgcc tgaacaacga gttcaacttc ttcaagagac acatctgcga cgccaacaag 240
gagggcatgt tcctgttcag agccgccaga aagctgagac agttcctgaa gatgaacagc 300
accggcgact tcgacctgca cctgctgaag gtgagcgagg gcacaaccat cctgctgaac 360
tgcaccggcc aggtgaaggg cagaaagccc gccgccctgg gcgaggccca gcccaccaag 420
agcctggagg agaacaagag cctgaaggag cagaagaagc tgaacgacct gtgcttcctg 480
aagagactgc tgcaggagat caagacctgc tggaacaaga tcctgatggg caccaaggag 540
cacaggaaca caggcagagg cggcgaggag aagaagaagg agaaggagaa ggaggagcag 600
gaggaaagag agaccaagac ccccgagtgc cccagccaca cccagcccct gggcgtgttc 660
ctgttccctc ccaagcccaa ggacaccctg atgatcagca gaacccccga ggtgacctgc 720
gtggtcgtgg atgtgagcca ggaagatccc gaagtgcagt tcaactggta cgtggatggc 780
gtggaagtgc acaacgccaa gaccaagccc agagaagagc agttcaactc cacctacaga 840
gtggtgagcg tgctgaccgt gctgcaccag gactggctga acggcaagga gtacaagtgc 900
aaggtgtcca acaaaggcct gcccagctcc atcgagaaga ccatcagcaa agccaaaggc 960
cagcccagag aaccccaggt gtacaccctg cctcccagcc aggaagagat gaccaagaac 1020
caggtgtccc tgacctgcct ggtgaaaggc ttctacccca gcgacatcgc cgtggagtgg 1080
gaaagcaacg gccagcccga gaacaattac aagacaaccc ctcccgtgct ggatagcgat 1140
ggcagcttct ttctgtacag cagactgacc gtggacaaga gcagatggca ggaaggcaac 1200
gtgttcagct gcagcgtgat gcacgaagcc ctgcacaacc actacaccca gaagagcctg 1260
tccctgagcc tgggcaag 1278
<210> 40
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетический олигопептид
<400> 40
Met Met Met Met
1
<---
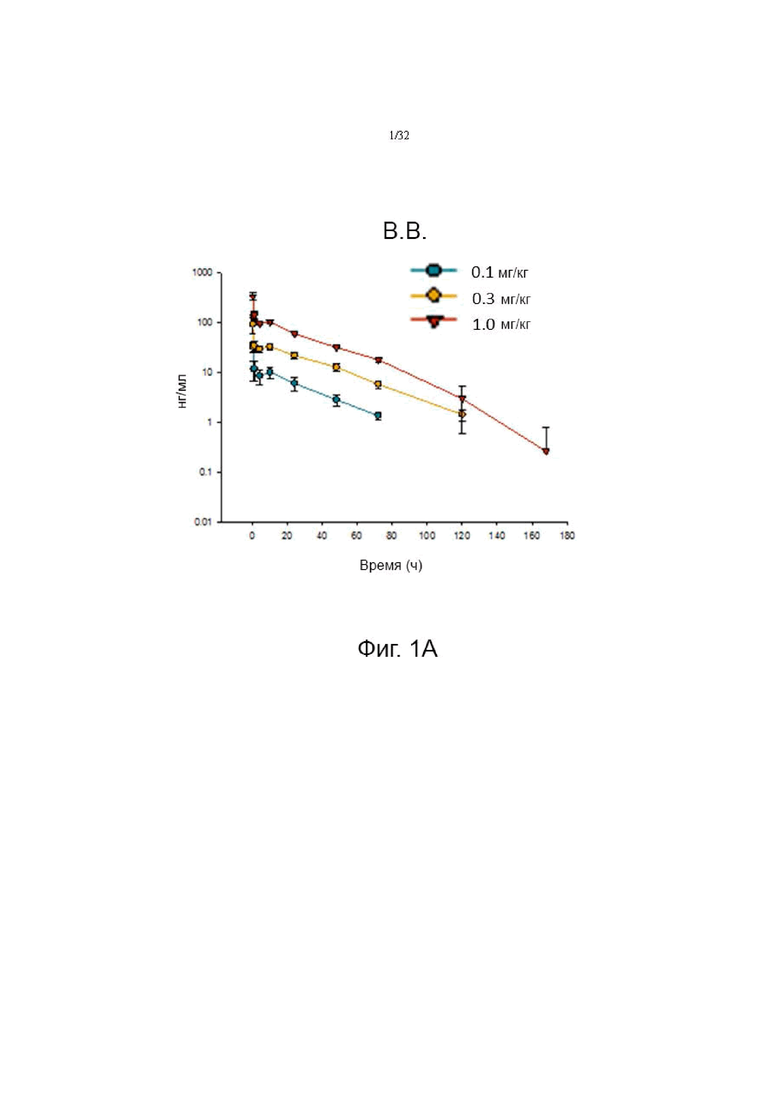
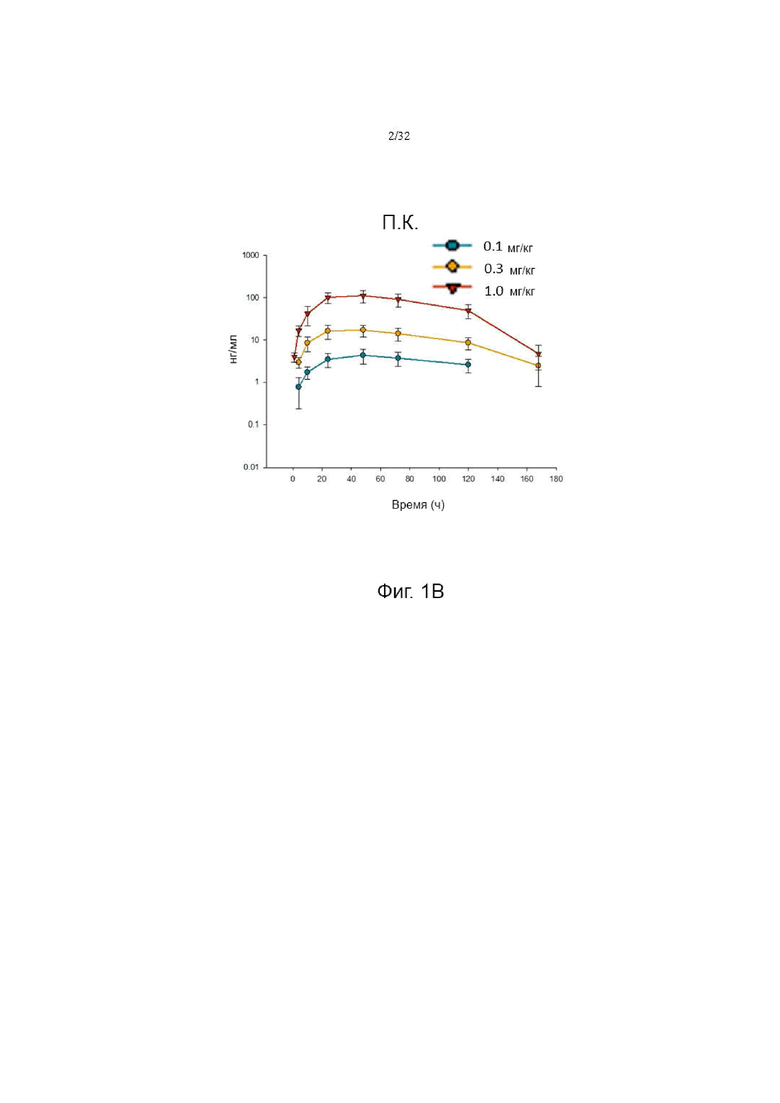
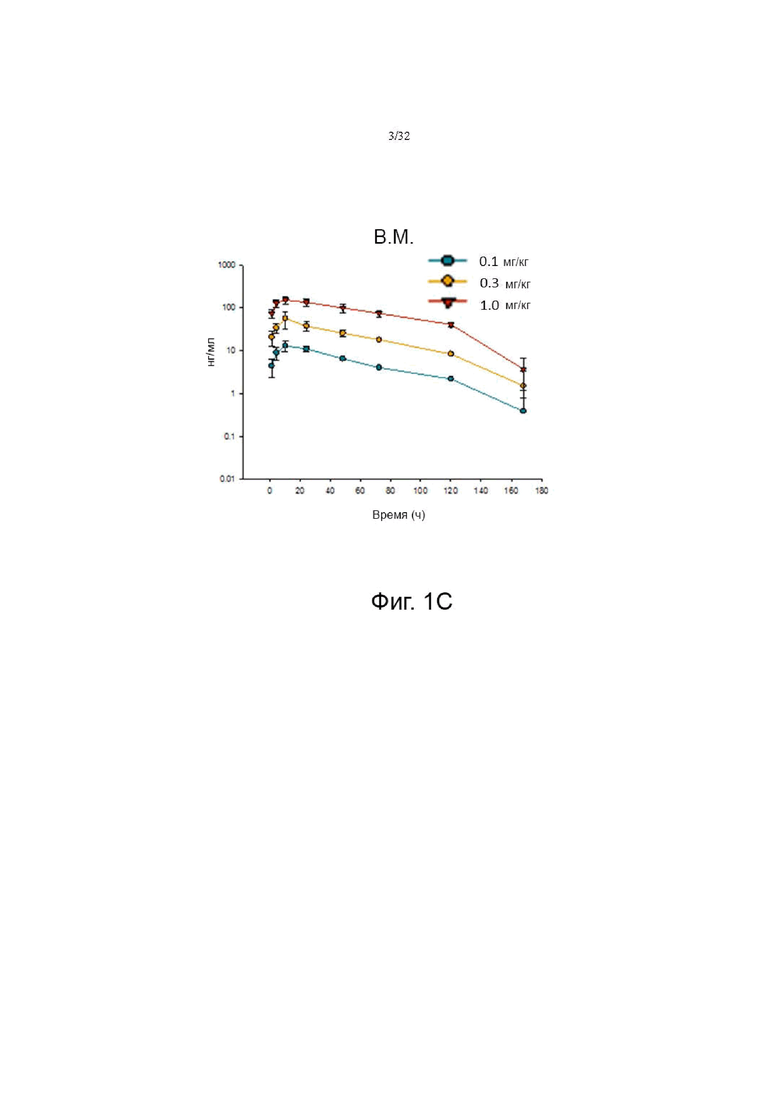
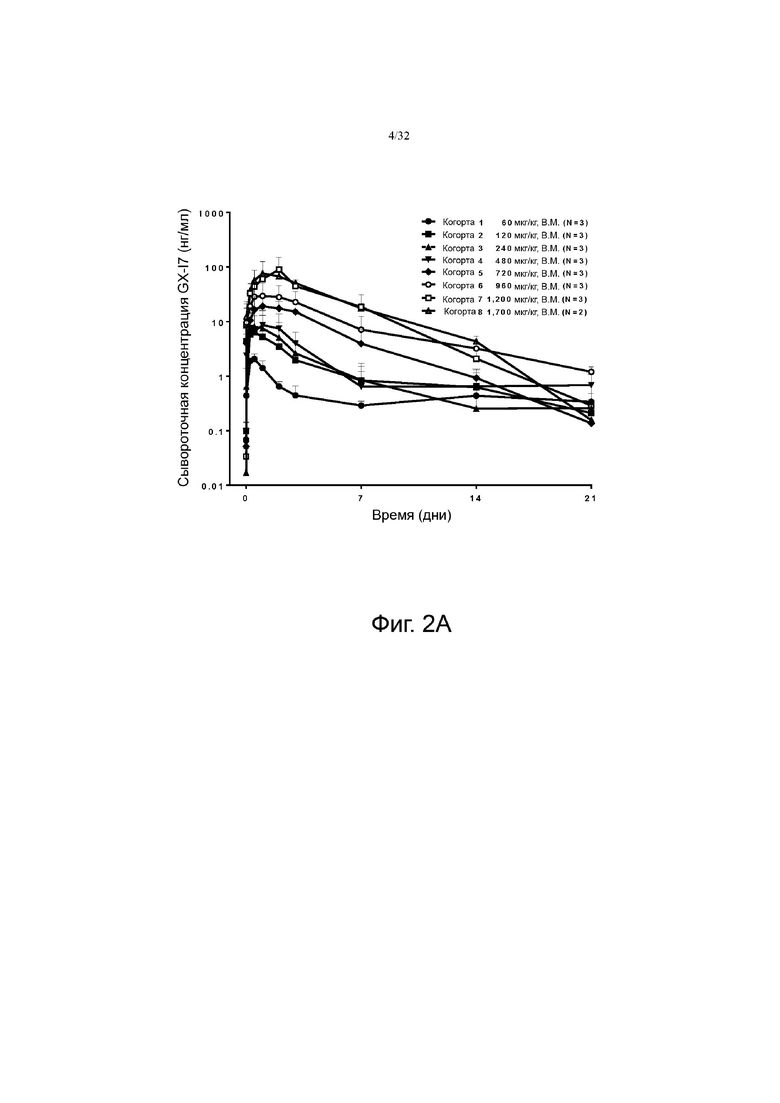
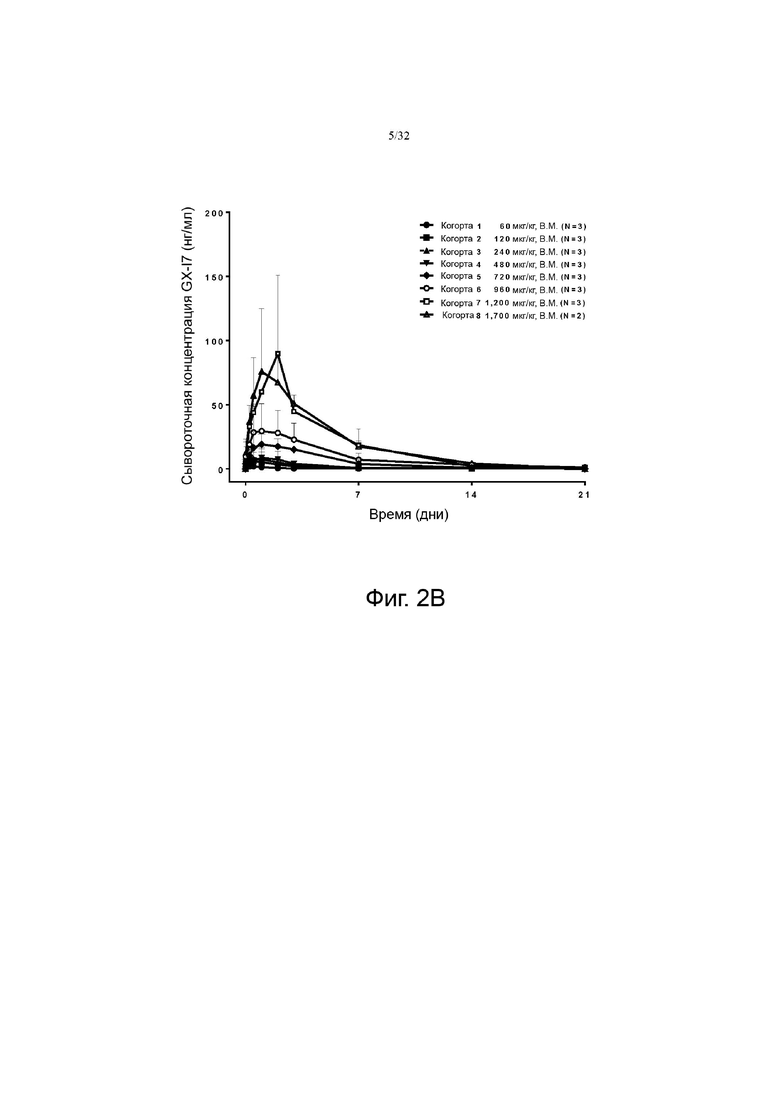
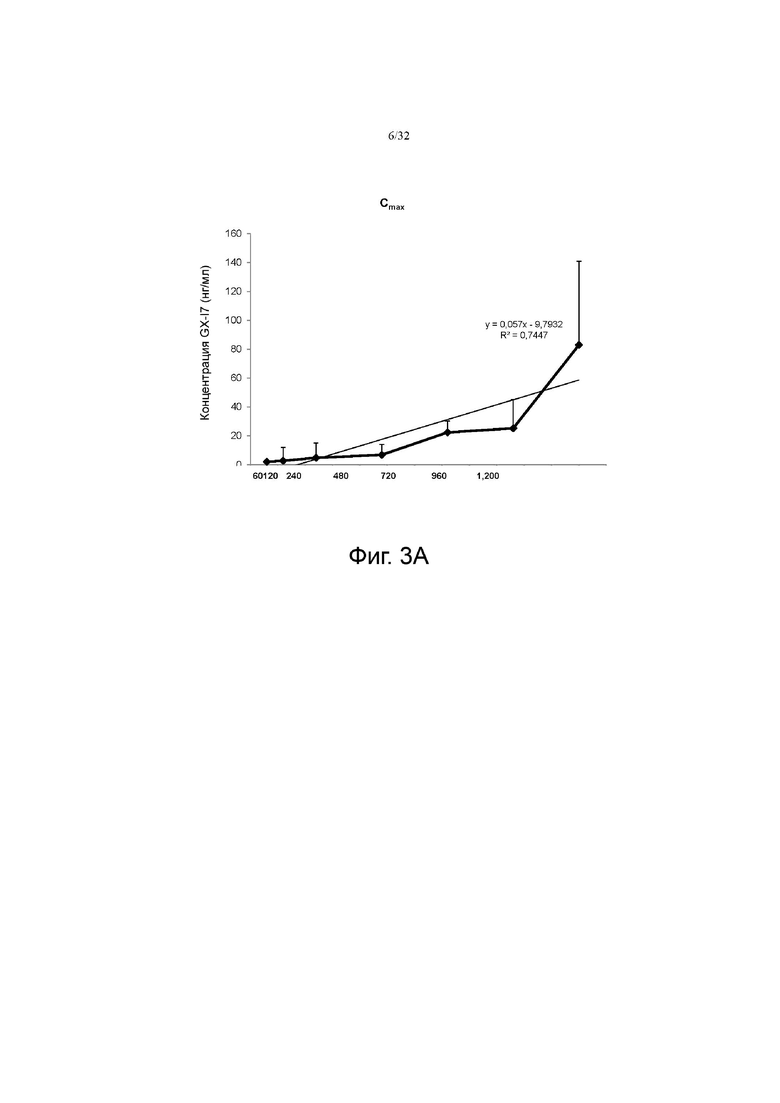
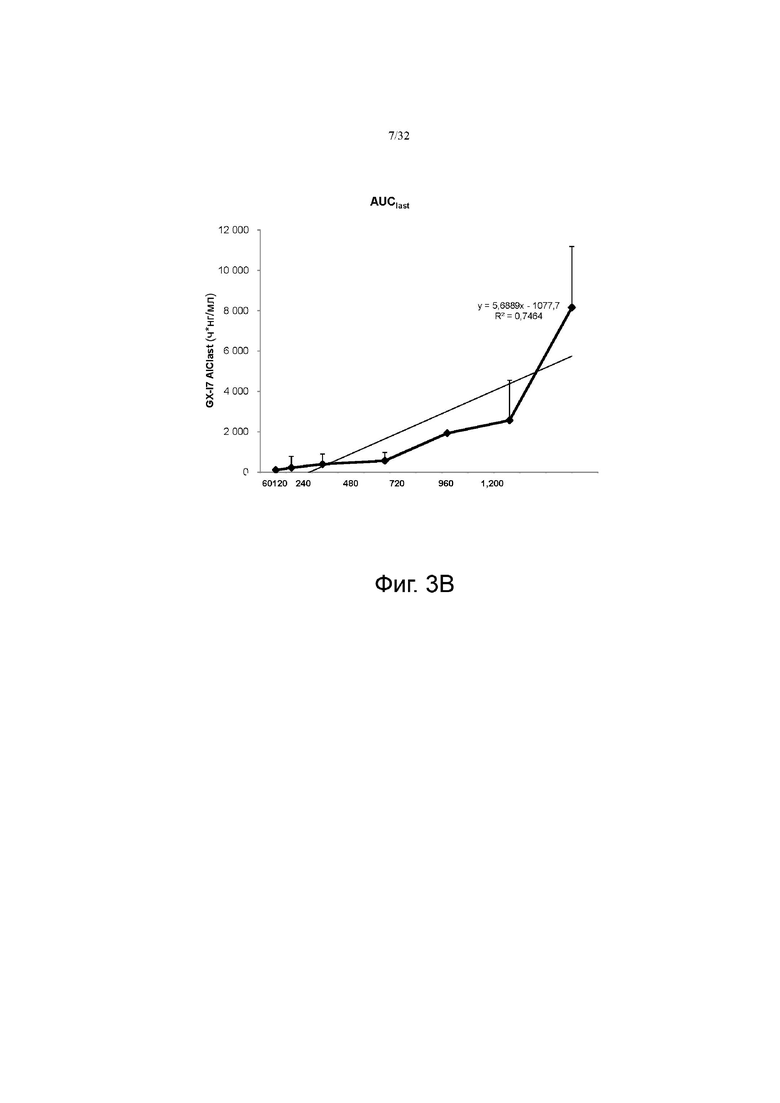
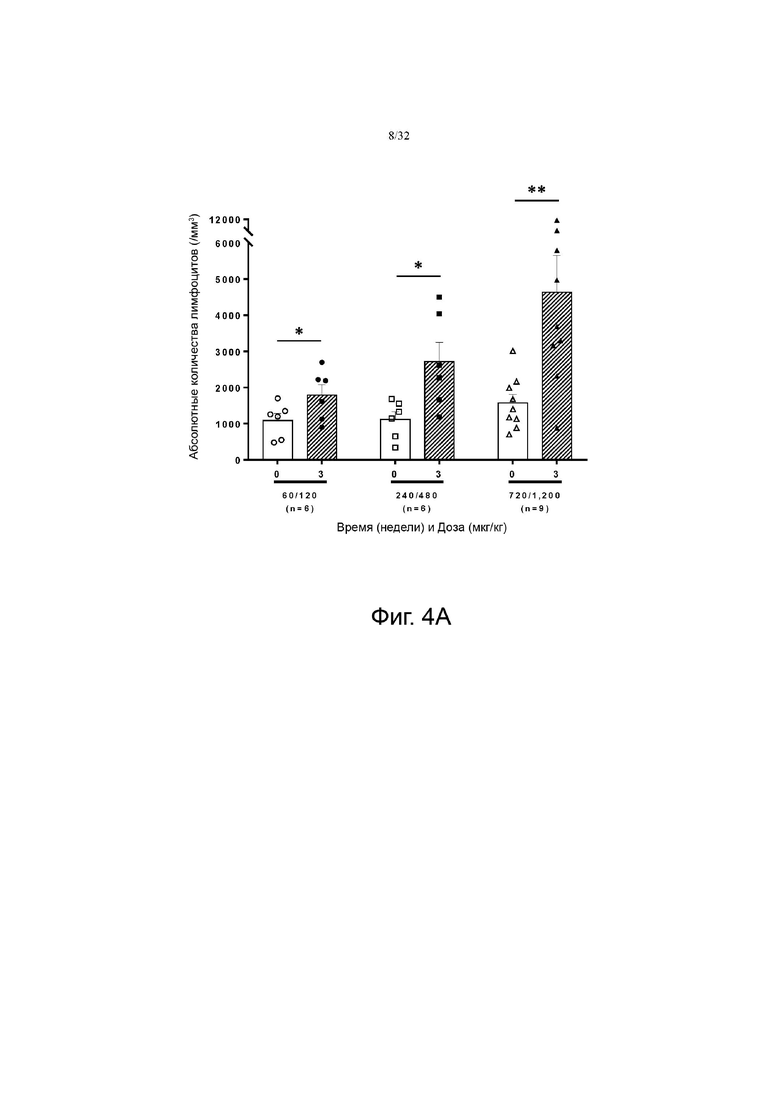

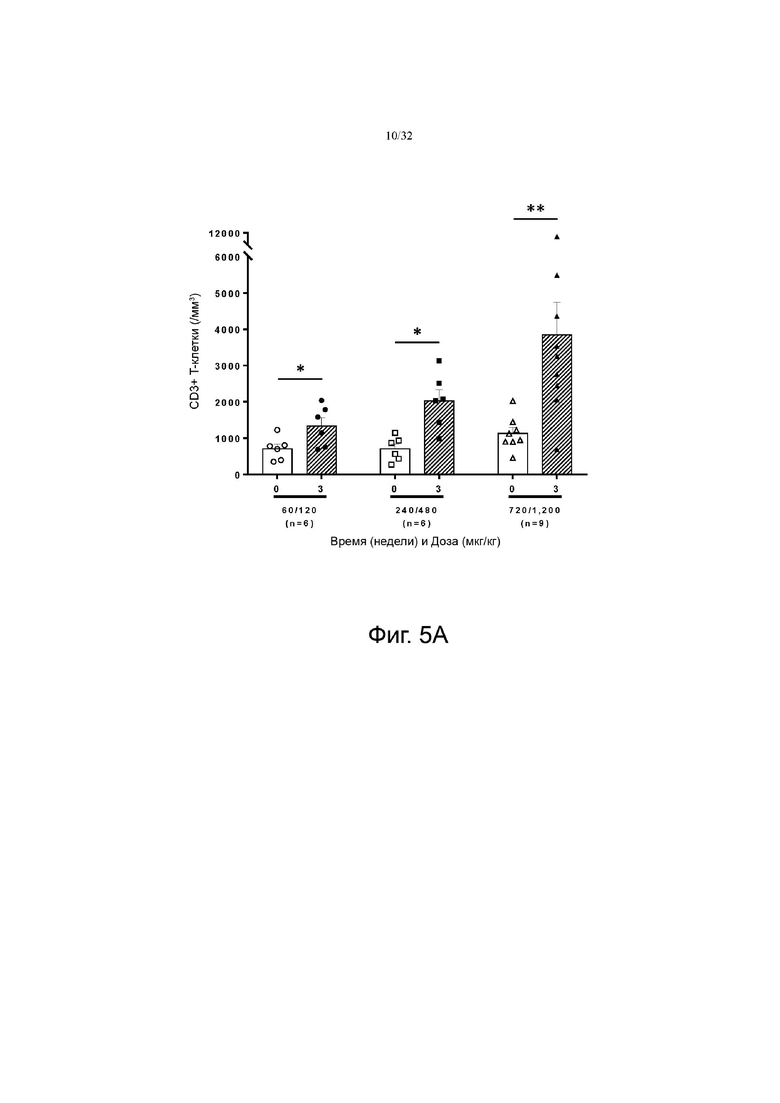
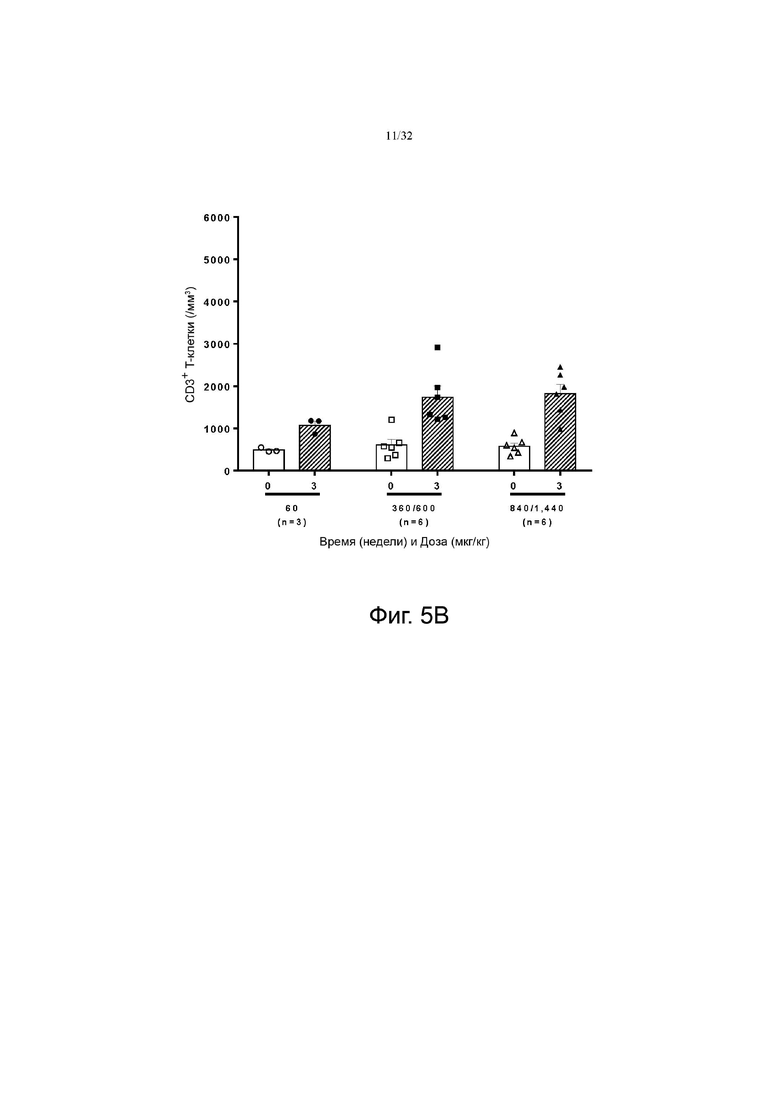

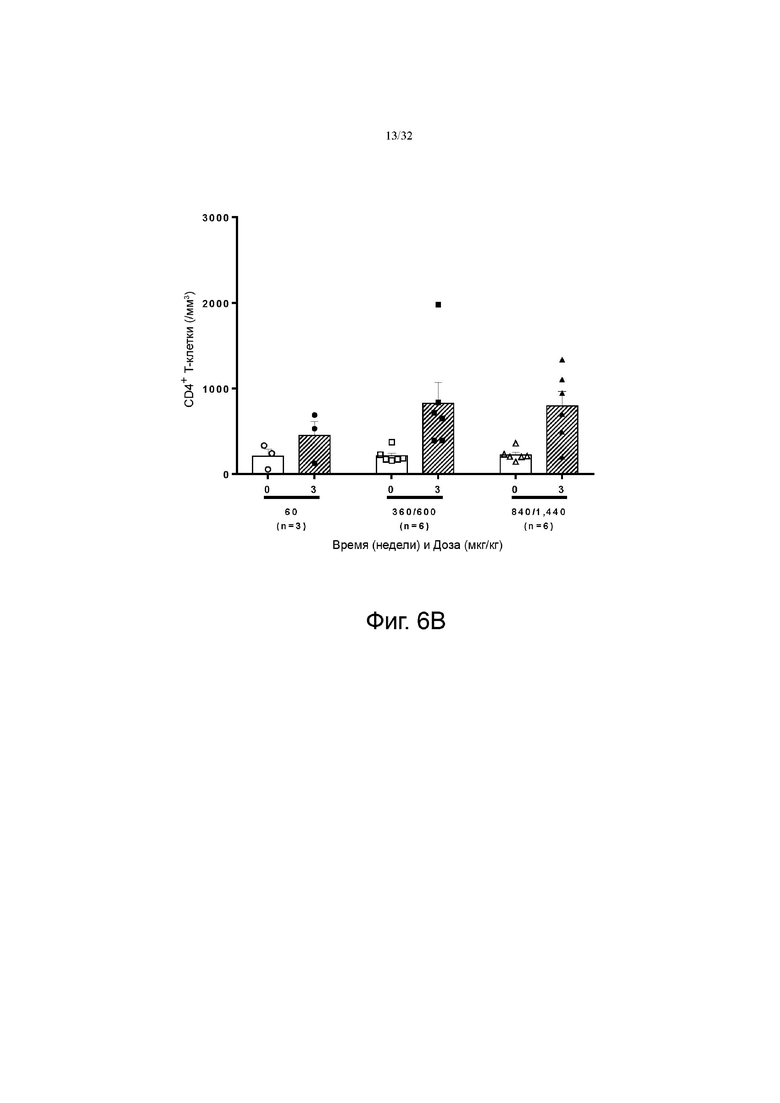
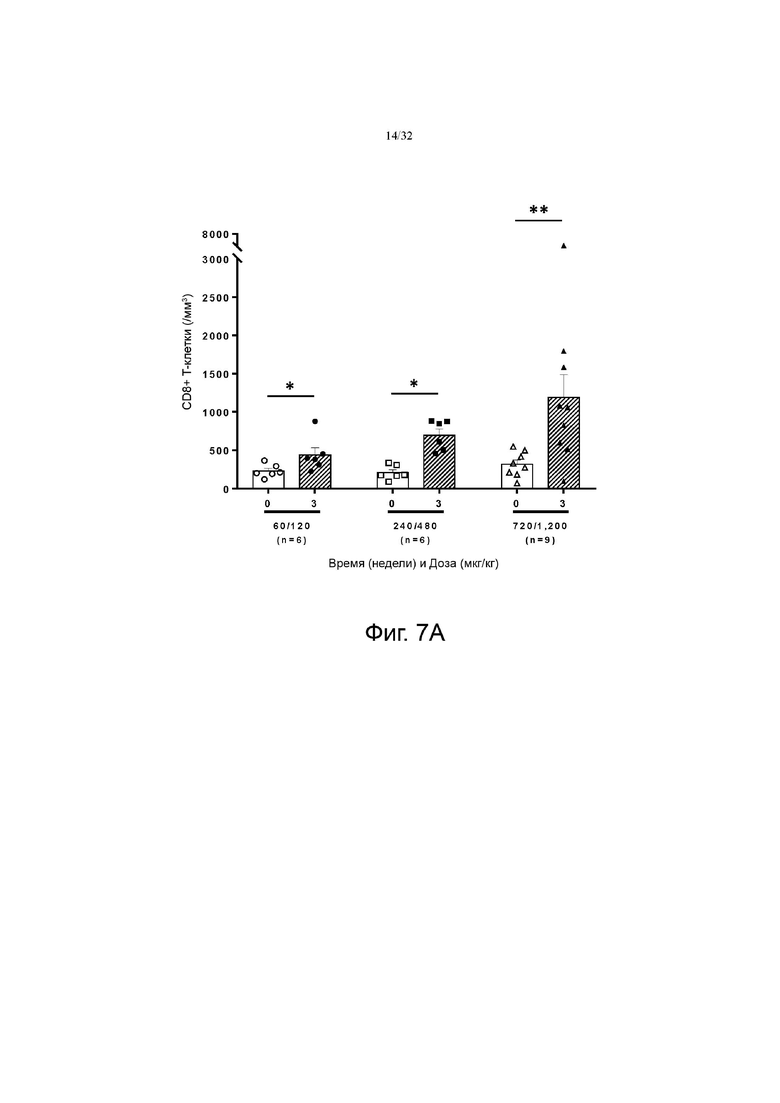
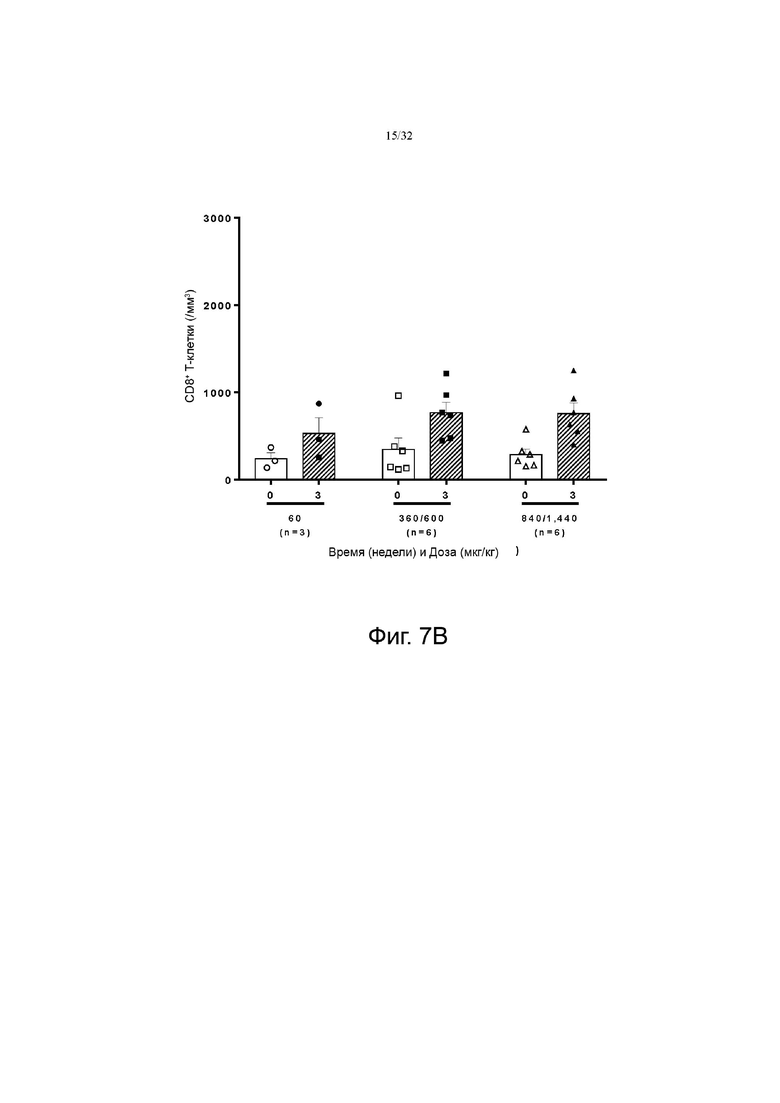
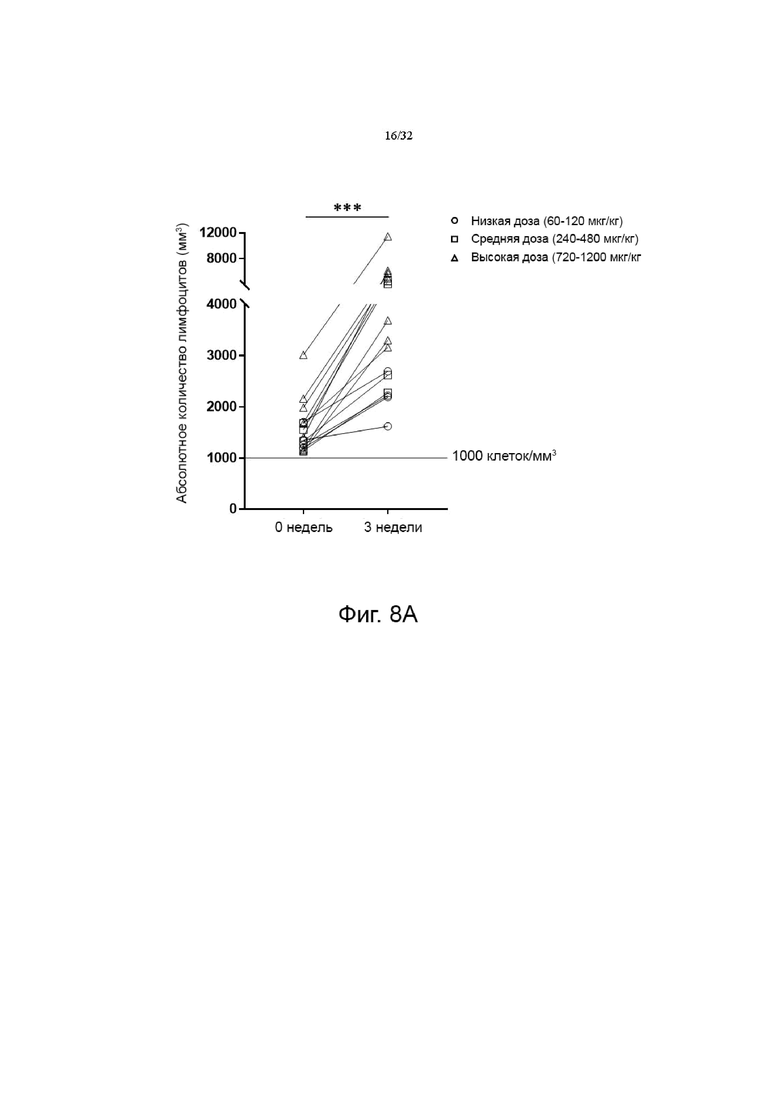

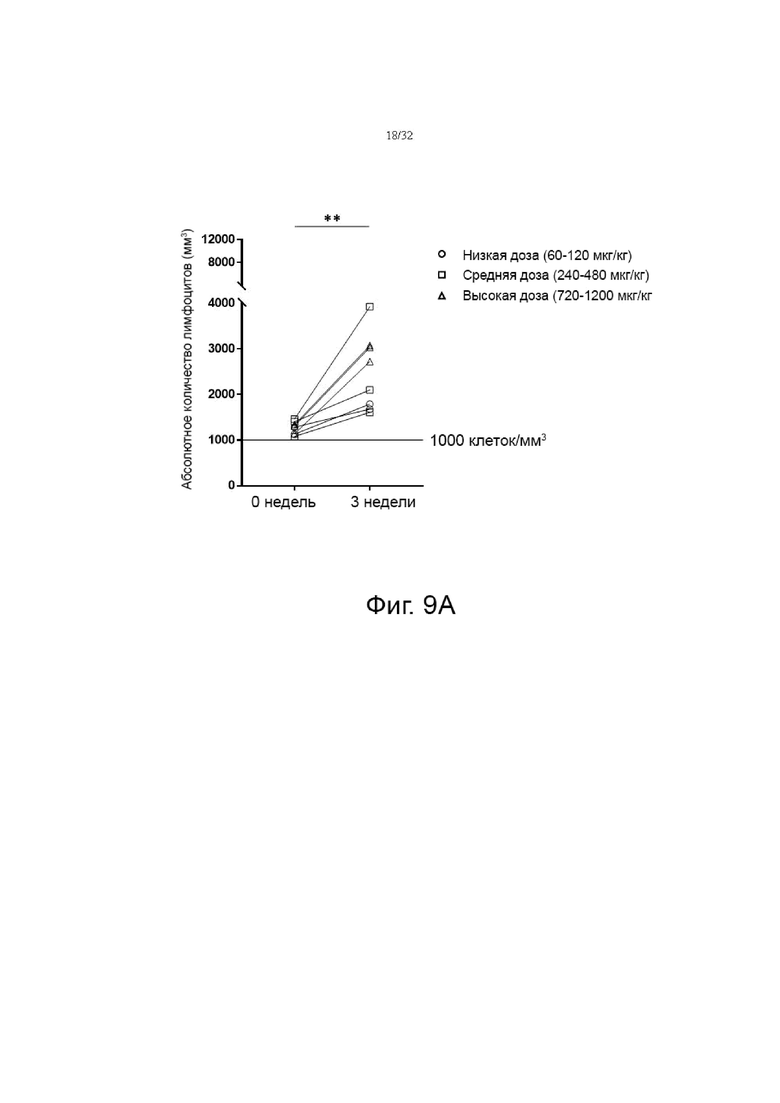
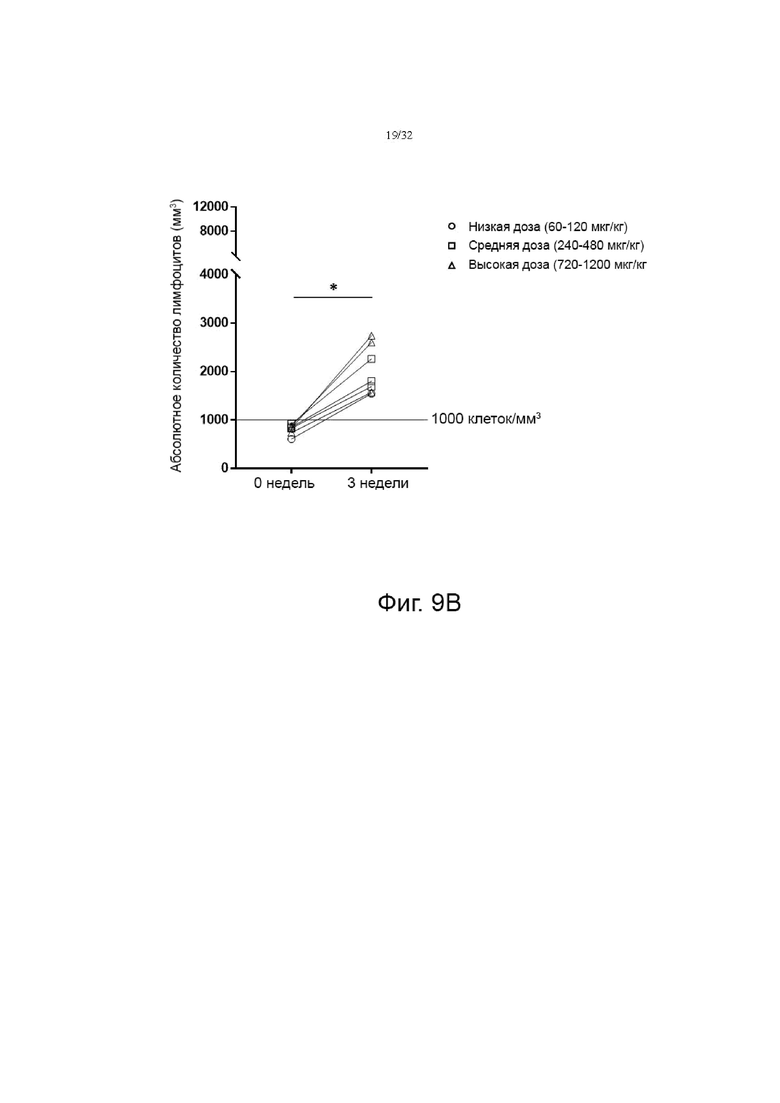
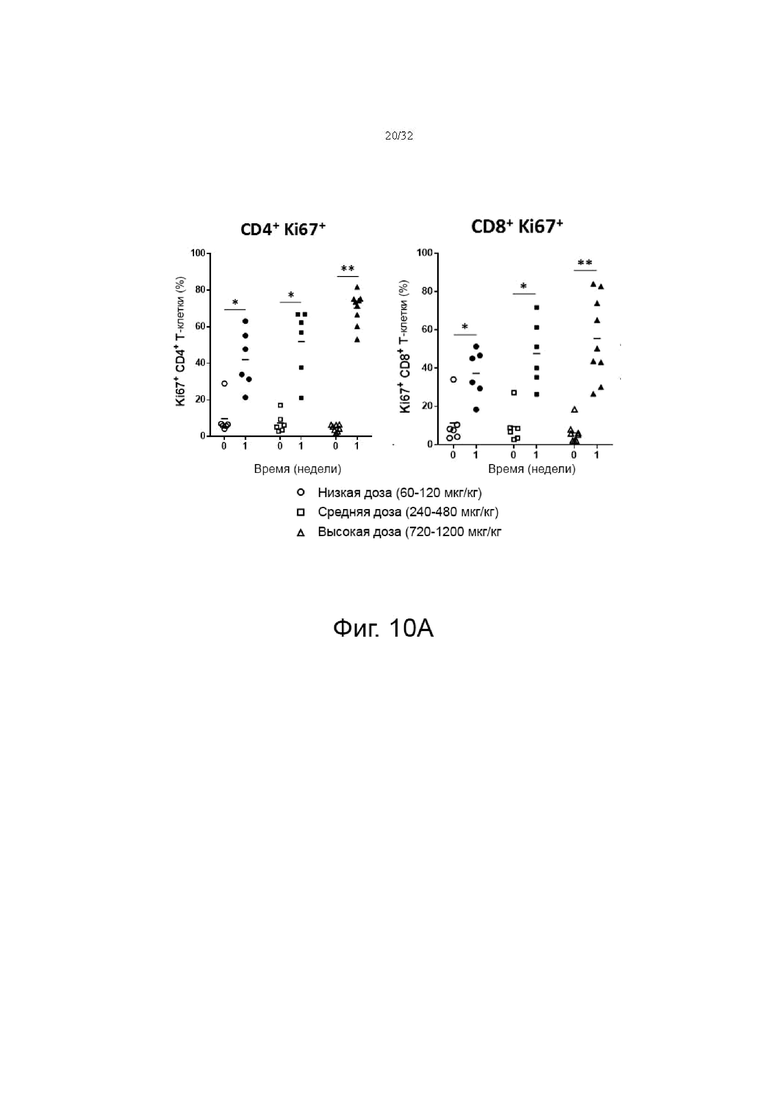

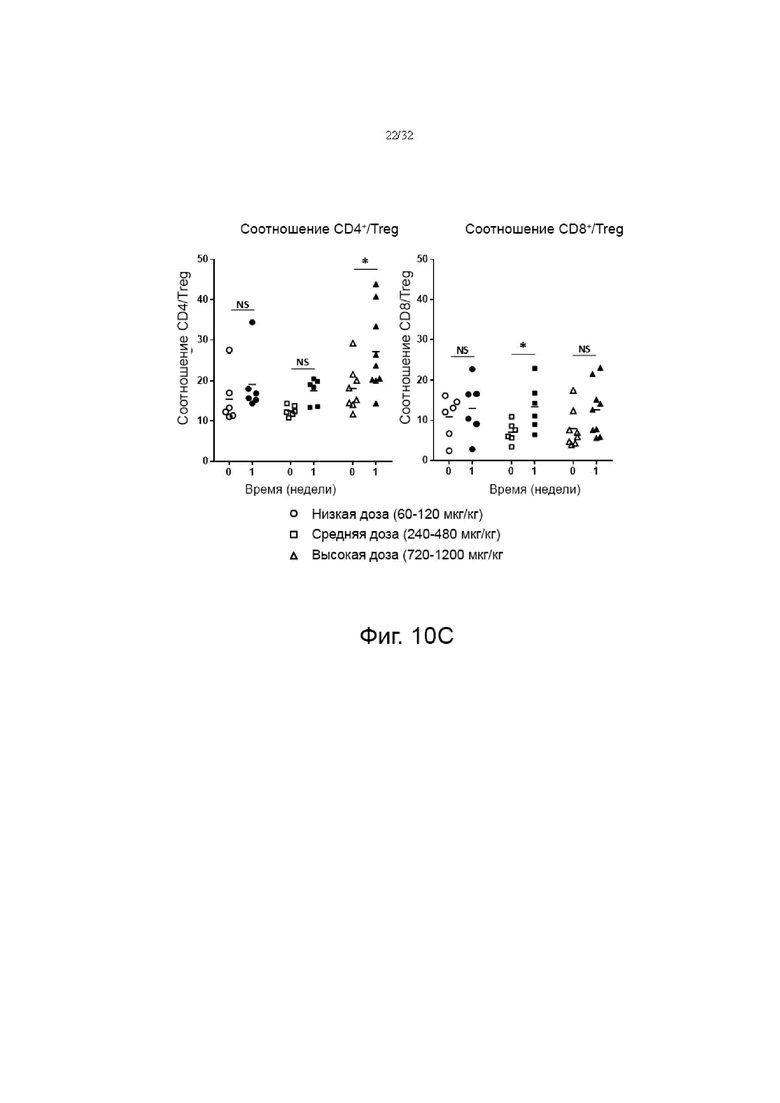

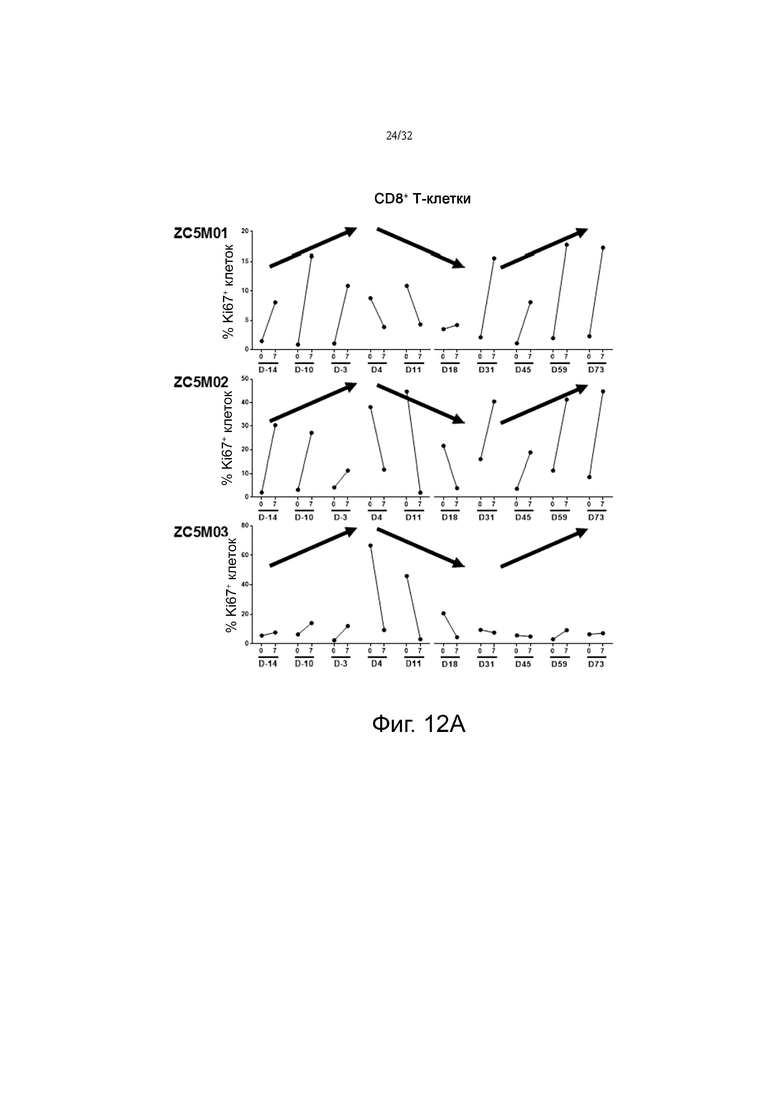
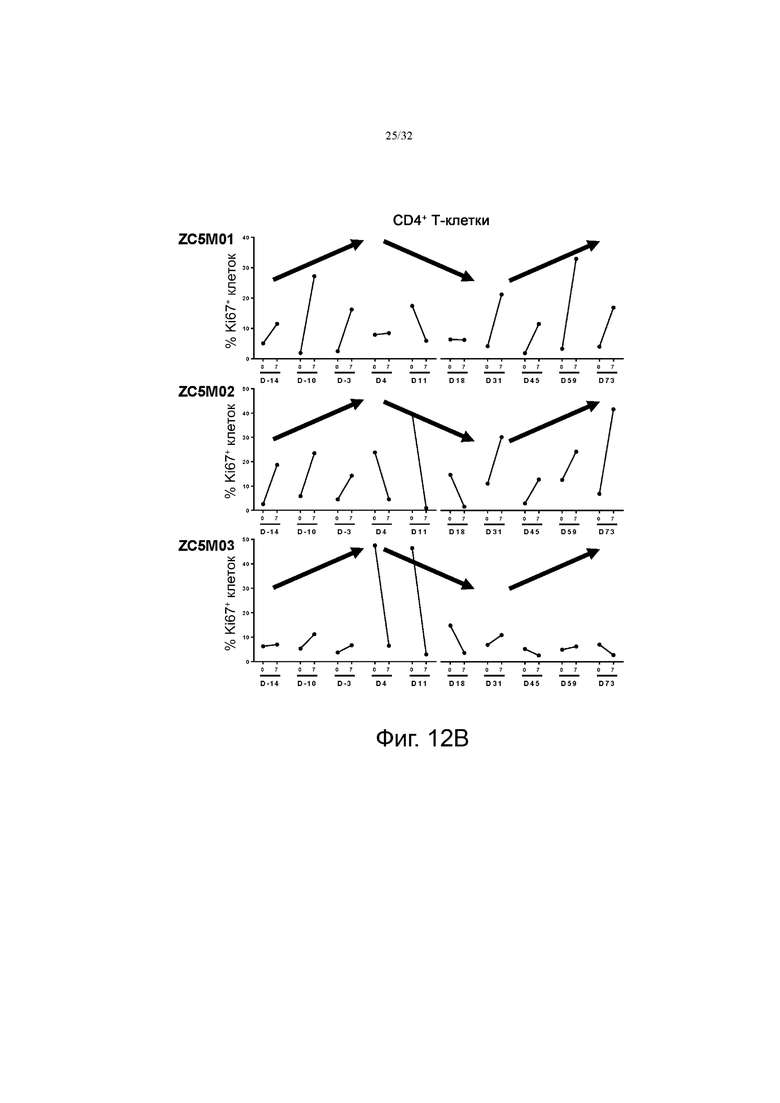
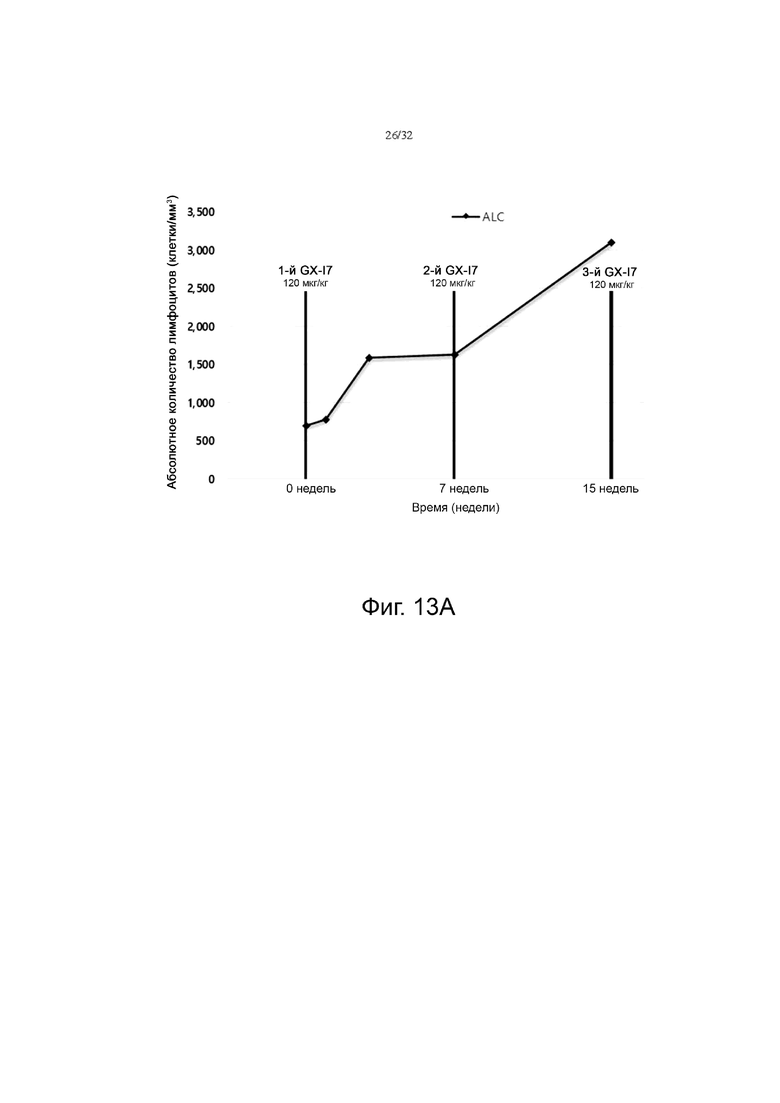
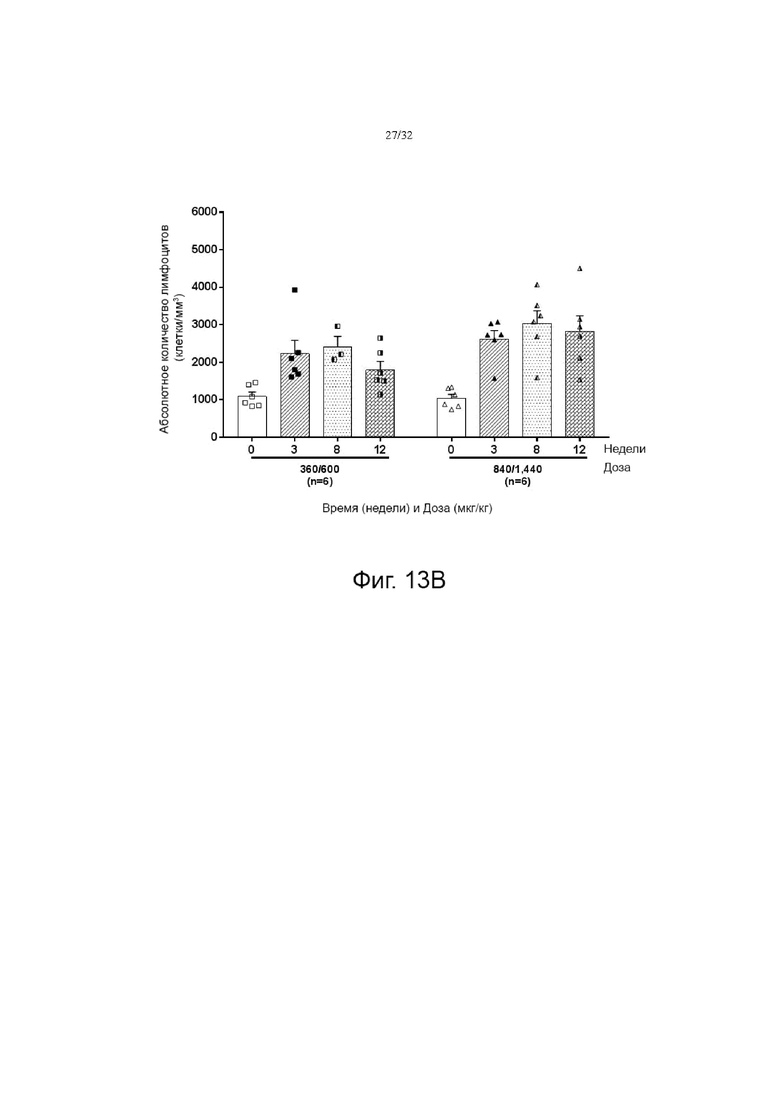

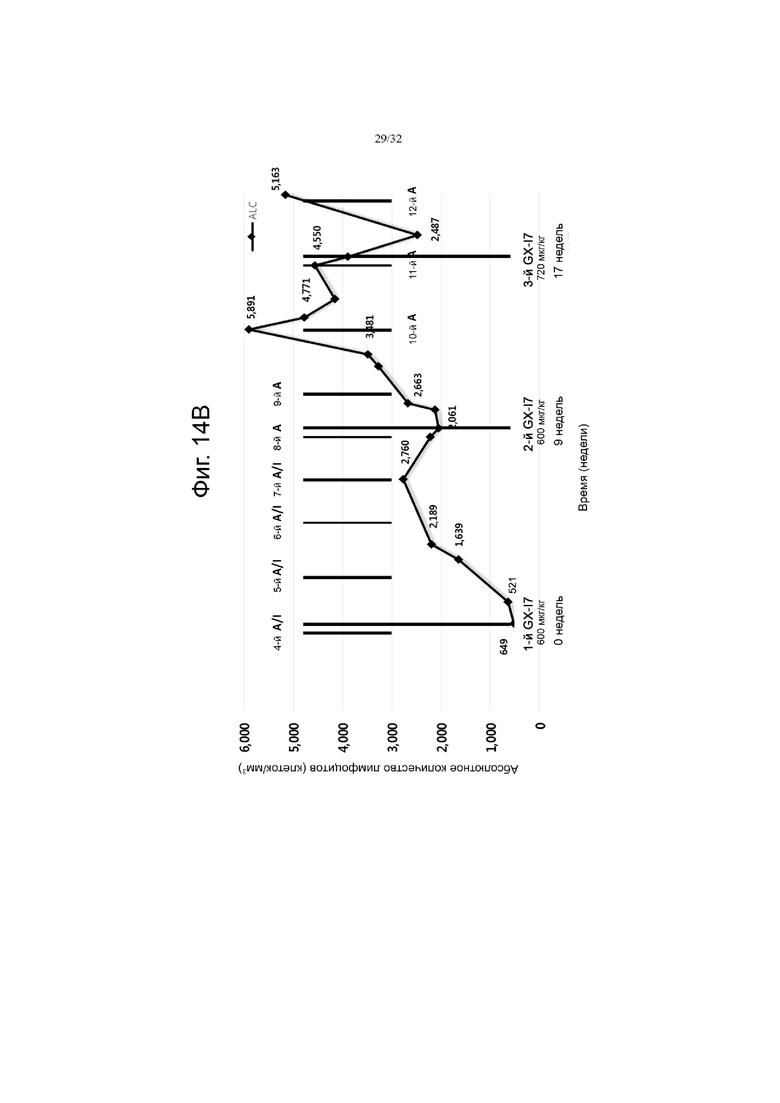
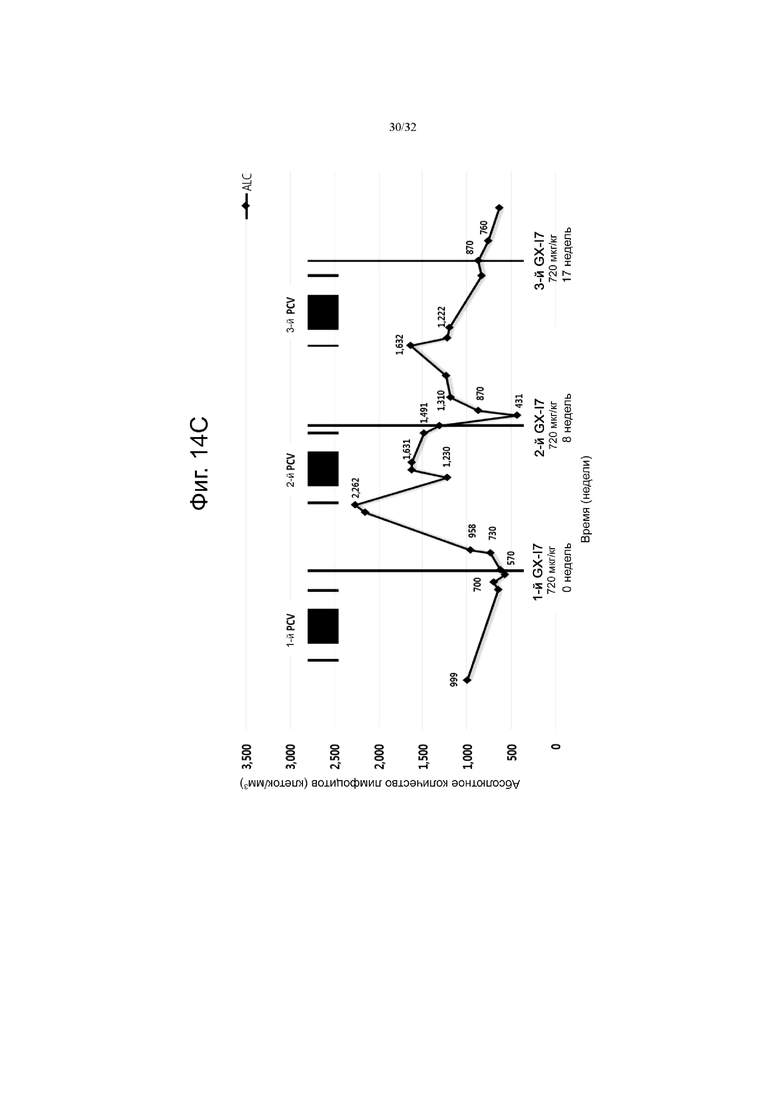

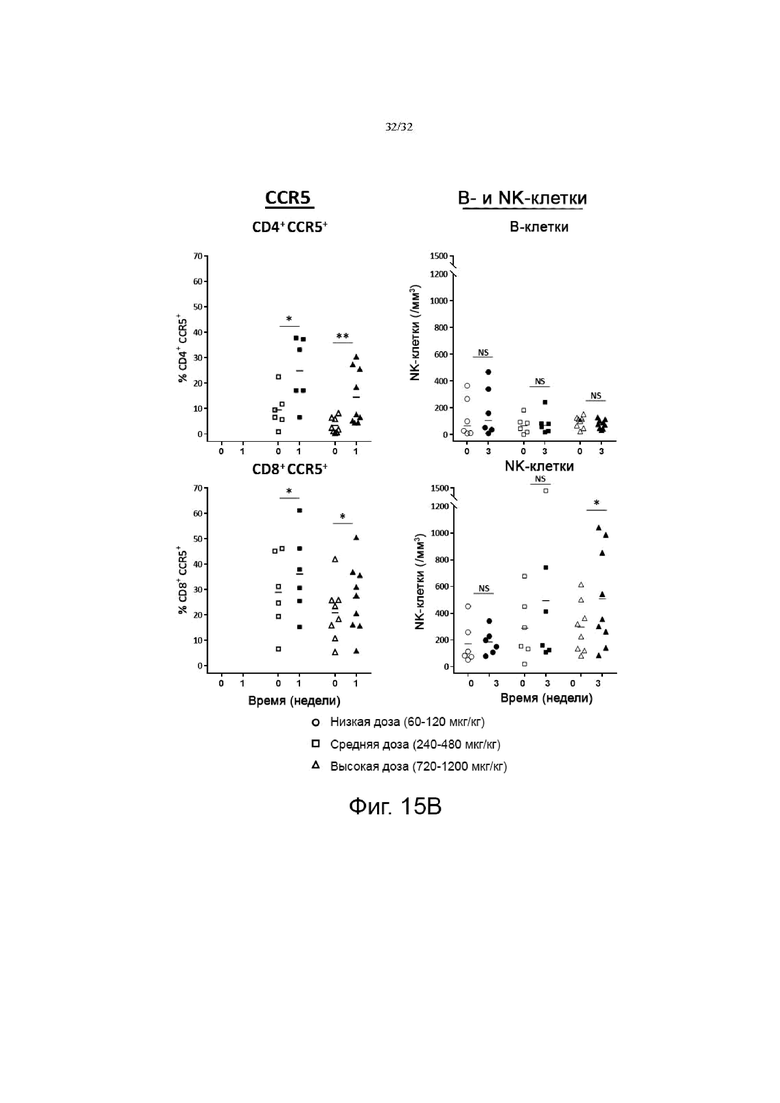
Группа изобретений относится к области фармацевтической промышленности, а именно к способам увеличения числа лимфоцитов. Способ увеличения числа лимфоцитов у субъекта, нуждающегося в этом, включающий введение субъекту гибридного белка интерлейкина-7 (IL-7), содержащего первый домен, второй домен и третий домен, где (а) первый домен включает белок IL-7, который способен связываться с рецептором IL-7, (b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а (c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7, при этом указанный способ отличается тем, что от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 вводят каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней. Способ увеличения количества лимфоцитов у субъекта, нуждающегося в этом, включающий введение субъекту гибридного белка интерлейкина-7 (IL-7), причем этот гибридный белок IL-7 содержит: (a) набор аминокислотных последовательностей, представленных в любой из SEQ ID NO: от 15 до 20, и (b) фрагмент, который продлевает период полувыведения гибридного белка IL-7, и при этом указанный способ отличается тем, что от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 вводят каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней. Применение гибридного белка интерлейкина-7 (IL-7) для увеличения числа лимфоцитов у нуждающегося в этом субъекта, где гибридный белок IL-7 содержит первый домен, второй домен и третий домен, где (а) первый домен включает белок IL-7, который способен связываться с рецептором IL-7, (b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а (c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7, где от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 вводят каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней. Применение гибридного белка интерлейкина-7 (IL-7) при изготовлении лекарственного средства для увеличения количества лимфоцитов у субъекта, нуждающегося в этом, где от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 подходит для введения субъекту каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней, и где гибридный белок IL-7 содержит первый домен, второй домен и третий домен, где (а) первый домен содержит белок IL-7, который способен связываться с рецептором IL-7, (b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а (c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7. Применение фармацевтической композиции, содержащей в качестве активного ингредиента гибридный белок интерлейкина-7 (IL-7), содержащий первый домен, второй домен и третий домен, где: (а) первый домен содержит белок IL-7, который способен связываться с рецептором IL-7; (b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а (c) третий домен, содержит фрагмент, который продлевает время полужизни гибридного белка IL-7, для введения субъекту от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней, и где субъект нуждается в увеличении количества лимфоцитов. Использование группы изобретений обеспечивает увеличение числа лимфоцитов у нуждающегося в этом субъекта, применение при изготовлении лекарственного средства. 5 н. и 38 з.п. ф-лы, 15 ил., 6 табл., 2 пр.
1. Способ увеличения числа лимфоцитов у субъекта, нуждающегося в этом, включающий введение субъекту гибридного белка интерлейкина-7 (IL-7), содержащего первый домен, второй домен и третий домен, где
(а) первый домен включает белок IL-7, который способен связываться с рецептором IL-7,
(b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а
(c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7,
при этом указанный способ отличается тем, что от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 вводят каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней.
2. Способ по п. 1, отличающийся тем, что субъект страдает от рака; инфекции; хронической недостаточности правого желудочка сердца; болезни Ходжкина; утечки или разрыва грудного протока; побочных эффектов лекарственных средств, отпускаемых по рецепту, включая противораковые средства, такие как химиотерапия, противовирусных средств или глюкокортикоидов; недоедания, вызванного диетами с низким содержанием белка, лучевой терапии, уремией, аутоиммунных расстройств, синдромов иммунодефицита, тимэктомии или их комбинации; или идиопатического, острого лучевого синдрома (ARS) или их комбинации.
3. Способ по п. 1 или 2, где белок IL-7 имеет аминокислотную последовательность, которая по меньшей мере на 70 % идентична с любой аминокислотной последовательностью из представленных в SEQ ID NO: 1-6.
4. Способ по любому из пп. 1-3, отличающийся тем, что второй домен связан с первым доменом.
5. Способ по любому из пп. 1-4, отличающийся тем, что олигопептид указанного второго домена представляет собой метионин, глицин, метионин-метионин, глицин-глицин, метионин-глицин, глицин-метионин, метионин-метионин-метионин, метионин-метионин-глицин, метионин-глицин-метионин, глицин-метионин-метионин, метионин-глицин-глицин, глицин-метионин-глицин, глицин-глицин-метионин или глицин-глицин-глицин.
6. Способ по любому из пп. 1-5, отличающийся тем, что третий домен связан с N-концом или С-концом первого домена или второго домена.
7. Способ увеличения количества лимфоцитов у субъекта, нуждающегося в этом, включающий введение субъекту гибридного белка интерлейкина-7 (IL-7), причем этот гибридный белок IL-7 содержит: (a) набор аминокислотных последовательностей, представленных в любой из SEQ ID NO: от 15 до 20, и (b) фрагмент, который продлевает период полувыведения гибридного белка IL-7, и при этом указанный способ отличается тем, что от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 вводят каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней.
8. Способ по п. 7, отличающийся тем, что субъект страдает от рака; инфекции; хронической недостаточности правого желудочка сердца; болезни Ходжкина; утечки или разрыва грудного протока; побочных эффектов лекарственных средств, отпускаемых по рецепту, включая противораковые средства, такие как химиотерапия, противовирусных средств или глюкокортикоидов; недоедания, вызванного диетами с низким содержанием белка, лучевой терапии, уремией, аутоиммунных расстройств, синдромов иммунодефицита, тимэктомии или их комбинации; или идиопатического, острого лучевого синдрома (ARS) или их комбинации.
9. Способ по любому из пп. 1-8, отличающийся тем, что фрагмент, который продлевает время полужизни гибридного белка IL-7, представляет собой Fc-область иммуноглобулина или его часть, альбумин, полипептид, связывающий альбумин, Pro/Ala/Ser (PAS), С-концевой пептид (CTP) β-субъединицы хорионического гонадотропина человека, полиэтиленгликоль (PEG), длинные неструктурированные гидрофильные последовательности аминокислот (XTEN), гидроксиэтилкрахмал (HES), малую молекулу, связывающую альбумин, или их комбинацию.
10. Способ по п. 9, отличающийся тем, что фрагмент, который продлевает время полужизни гибридного белка IL-7, представляет собой Fc-область модифицированного иммуноглобулина.
11. Способ по п. 10, отличающийся тем, что модифицированный иммуноглобулин выбран из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgD, IgE или их комбинации.
12. Способ по любому из пп. 9-11, отличающийся тем, что Fc-область модифицированного иммуноглобулина содержит шарнирную область, домен СН2 и домен СН3 от N-конца к С-концу,
при этом шарнирная область содержит шарнирную область IgD человека,
домен CH2 включает часть аминокислотных остатков домена CH2 IgD человека и IgG4 человека, и
домен СН3 включает часть аминокислотных остатков домена СН3 из IgG4 человека.
13. Способ по п. 12, отличающийся тем, что Fc-область модифицированного иммуноглобулина представлена следующей формулой (I):
формула (I)
N'-(Z1)p-Y-Z2-Z3-Z4-C'
где N' представляет собой N-конец полипептида, а C' представляет собой С-конец полипептида;
p представляет собой целое число 0 или 1;
Z1 представляет собой аминокислотную последовательность, имеющую от 5 до 9 последовательных аминокислотных остатков от аминокислотного остатка в положении 98 относительно N-конца среди аминокислотных остатков в положениях от 90 до 98 из SEQ ID NO: 7; и
Y представляет собой аминокислотную последовательность, имеющую от 5 до 64 последовательных аминокислотных остатков от аминокислотного остатка в положении 162 относительно N-конца среди аминокислотных остатков в положениях от 99 до 162 из SEQ ID NO: 7;
Z2 представляет собой аминокислотную последовательность, имеющую от 4 до 37 последовательных аминокислотных остатков от аминокислотного остатка в положении 163 относительно С-конца среди аминокислотных остатков в положениях от 163 до 199 из SEQ ID NO: 7;
Z3 представляет собой аминокислотную последовательность, имеющую от 71 до 106 последовательных аминокислотных остатков от аминокислотного остатка в положении 220 относительно N-конца среди аминокислотных остатков в положениях от 115 до 220 из SEQ ID NO: 8; и
Z4 представляет собой аминокислотную последовательность, имеющую от 80 до 107 последовательных аминокислотных остатков от аминокислотного остатка в положении 221 относительно С-конца среди аминокислотных остатков в положениях от 221 до 327 из SEQ ID NO: 8.
14. Способ по любому из пп. 1-6 и 9-13, отличающийся тем, что третий домен имеет аминокислотную последовательность, представленную любой из SEQ ID NO: 9-14.
15. Способ по любому из пп. 2-16 и 8-14, отличающийся тем, что рак представляет собой солидную опухоль, злокачественное новообразование лимфатической системы или лейкоз.
16. Способ по п. 15, отличающийся тем, что солидная опухоль представляет собой синовиальную саркому, инфильтрирующую протоковую карциному, рак прямой кишки, рак ободочной кишки, рак яичников, рак восходящей кишки, рак анального канала, инвазивную протоковую карциному, аденокарциному, рак прямой кишки с парааортальным метастатическим поражением, нейроэндокринную карциному (шейки матки), рак сигмовидной кишки или глиобластому.
17. Способ по любому из пп. 1-16, отличающийся тем, что субъект ранее получал, одновременно получает или будет получать один или несколько способов лечения рака, где одно или более лечений рака включает хирургическое вмешательство, лучевую терапию и/или химиотерапию.
18. Способ по любому из пп. 1-17, отличающийся тем, что 600 мг/кг, 720 мкг/кг, 840 мг/кг, 960 мкг/кг, 1200 мкг/кг, 1440 мг/кг, 1700 мкг/кг или 2000 мкг/кг гибридного белка IL-7 вводят субъекту.
19. Способ по любому из пп. 1-18, отличающийся тем, что гибридный белок IL-7 вводят парэнтерально, внутримышечно, подкожно, офтальмологически, внутривенно, внутрибрюшинно, внутрикожно, интраорбитально, интрацеребрально, интракраниально, интраспинально, интравентрикулярно, интратекально, интрацистернально, интракапсулярно или интратуморально.
20. Способ по любому из пп. 1-19, отличающийся тем, что гибридный белок IL-7 содержит аминокислотную последовательность, представленную в SEQ ID NO: 24.
21. Способ по любому из пп. 1-20, отличающийся тем, что перед введением количество лимфоцитов у субъекта составляет 1000 или менее лимфоцитов/мкл крови, как определено в соответствии с общей терминологией критериев нежелательных явлений (CTCAE) версии 4.0.
22. Способ по п. 21, отличающийся тем, что лимфоцит представляет собой Т-клетку.
23. Способ по любому из пп. 1-22, отличающийся тем, вводят 720 мкг/кг гибридного белка IL-7 каждые 3 недели, 4 недели, 5 недель или 6 недель.
24. Способ по любому из пп. 1-22, отличающийся тем, что вводят 840 мкг/кг гибридногой белка IL-7 каждые 3 недели, 4 недели, 5 недель или 6 недель.
25. Способ по любому из пп. 1-22, отличающийся тем, что вводят 960 мкг/кг гибридного белка IL-7 каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель или 9 недель.
26. Способ по любому из пп. 1-22, отличающийся тем, что вводят 1200 мкг/кг гибридного белка IL-7 каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель или 10 недель.
27. Способ по любому из пп. 1-22, отличающийся тем, что вводят 1440 мкг/кг гибридного белка IL-7 каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 2 месяца или 3 месяца.
28. Способ по любому из пп 1-17 и 19-22, отличающийся тем, что 650 мкг/кг, 680 мкг/кг, 700 мкг/кг, 720 мкг/кг, 740 мкг/кг, 750 мкг/кг, 760 мкг/кг, 780 мкг/кг, 800 мкг/кг, 820 мкг/кг, 840 мкг/кг, 850 мкг/кг, 860 мкг/кг, 880 мкг/кг, 900 мкг/кг, 920 мкг/кг, 940 мкг/кг, 950 мкг/кг, 960 мкг/кг, 980 мкг/кг, 1000 мкг/кг, 1020 мкг/кг, 1040 мкг/кг, 1060 мкг/кг, 1080 мкг/кг, 1100 мкг/кг, 1120 мкг/кг, 1140 мкг/кг, 1160 мкг/кг, 1180 мкг/кг, 1200 мкг/кг, 1220 мкг/кг, 1240 мкг/кг, 1260 мкг/кг, 1280 мкг/кг, 1300 мкг/кг, 1320 мкг/кг, 1340 мкг/кг, 1360 мкг/кг, 1380 мкг/кг, 1400 мкг/кг, 1420 мкг/кг, 1440 мкг/кг, 1460 мкг/кг, 1480 мкг/кг, 1500 мкг/кг, 1520 мкг/кг, 1540 мкг/кг, 1560 мкг/кг, 1580 мкг/кг, 1600 мкг/кг, 1620 мкг/кг, 1640 мкг/кг, 1660 мкг/кг, 1680 мкг/кг, 1700 мкг/кг, 1720 мкг/кг, 1740 мкг/кг, 1760 мкг/кг, 1780 мкг/кг, 1800 мкг/кг, 1820 мкг/кг, 1840 мкг/кг, 1860 мкг/кг, 1880 мкг/кг, 1900 мкг/кг, 1920 мкг/кг, 1940 мкг/кг, 1960 мкг/кг или 1980 мкг/кг гибридного белка IL-7 вводят субъекту.
29. Способ по п. 28, отличающийся тем, что 700 мкг/кг, 800 мкг/кг, 900 мкг/кг, 1000 мкг/кг, 1100 мкг/кг, 1300 мкг/кг, 1400 мкг/кг, 1500 мкг/кг, 1600 мкг/кг, 1800 мкг/кг, 1900 мкг/кг гибридного белка IL-7 вводят субъекту.
30. Способ по любому из пп. 1-17 и 19-22, отличающийся тем, что 610 мкг/кг до 1200 мкг/кг, от 650 мкг/кг до 1200 мкг/кг, от 700 мкг/кг до 1200 мкг/кг, от 750 мкг/кг до 1200 мкг/кг, от 800 мкг/кг до 1200 мкг/кг от 850 мкг/кг до 1200 мкг/кг, от 900 мкг/кг до 1200 мкг/кг, от 950 мкг/кг до 1200 мкг/кг, от 1000 мкг/кг до 1200 мкг /кг, от 1050 мкг/кг до 1200 мкг/кг, от 1100 мкг/кг до 1200 мкг/кг, от 1200 мкг/кг до 2000 мкг/кг, от 1300 мкг/кг и 2000 мкг/кг, от 1500 мкг/кг до 2000 мкг/кг, от 1700 мкг/кг до 2000 мкг/кг, от 610 мкг/кг до 1000 мкг/кг, от 650 мкг/кг до 1000 мкг/кг, от 700 мкг/кг до 1000 мкг г/кг, от 750 мкг/кг до 1000 мкг/кг, от 800 мкг/кг до 1000 мкг/кг, от 850 мкг/кг до 1000 мкг/кг, от 900 мкг/кг до 1000 мкг/кг или от 950 мкг/кг до 1000 мкг/кг гибридного белка IL-7 вводят субъекту.
31. Способ по любому из пп. 1-17 и 19-22, отличающийся тем, что от 700 мкг/кг до 900 мкг/кг, от 750 мкг/кг до 950 мкг/кг, от 700 мкг/кг до 850 мкг/кг, от 750 мкг/кг до 850 мкг/кг, от 700 мкг/кг до 800 мкг/кг, от 800 мкг/кг до 900 мкг/кг, от 750 мкг/кг до 850 мкг/кг или от 850 мкг/кг до 950 мкг/кг гибридного белка IL-7 вводят субъекту.
32. Способ по любому из пп. 22-31, отличающийся тем, что Т-клетка представляет собой Т-клетку CD4+, Т-клетку CD8+ или Т-клетку CD4+/CD8+.
33. Способ по любому из пп. 21-32, отличающийся тем, что перед введением количество лимфоцитов у субъекта составляет 800 лимфоцитов или менее/мкл крови.
34. Способ по любому из пп. 21-32, отличающийся тем, что перед введением количество лимфоцитов у субъекта составляет 500 лимфоцитов или менее/мкл крови.
35. Способ по любому из пп. 21-32, отличающийся тем, что перед введением количество лимфоцитов у субъекта составляет 200 лимфоцитов или менее/мкл крови.
36. Способ по любому из пп. 1-35, отличающийся тем, что субъекту вводили, одновременно вводят или будут вводить противоопухолевый агент.
37. Способ по п. 36, отличающийся тем, что противоопухолевый агент представляет собой противоопухолевое химическое соединение.
38. Способ по любому из пп. 1-37, отличающийся тем, что количество лимфоцитов, инфильтрирующих опухоль (TIL), в опухоли увеличивается после введения гибридного белка IL-7 по сравнению с количеством TIL в опухоли перед введением.
39. Способ по п. 38, отличающийся тем, что TIL представляют собой CD4+ TIL или CD8+ TIL.
40. Способ по п. 38 или 39, отличающийся тем, что после введения количество TIL увеличивается по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 200%, по меньшей мере на 250% или по меньшей мере на 300%.
41. Применение гибридного белка интерлейкина-7 (IL-7) для увеличения числа лимфоцитов у нуждающегося в этом субъекта, где гибридный белок IL-7 содержит первый домен, второй домен и третий домен, где
(а) первый домен включает белок IL-7, который способен связываться с рецептором IL-7,
(b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а
(c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7,
где от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 вводят каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней.
42. Применение гибридного белка интерлейкина-7 (IL-7) при изготовлении лекарственного средства для увеличения количества лимфоцитов у субъекта, нуждающегося в этом, где от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 подходит для введения субъекту каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней, и где
гибридный белок IL-7 содержит первый домен, второй домен и третий домен, где
(а) первый домен содержит белок IL-7, который способен связываться с рецептором IL-7,
(b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а
(c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7.
43. Применение фармацевтической композиции, содержащей в качестве активного ингредиента гибридный белок интерлейкина-7 (IL-7), содержащий первый домен, второй домен и третий домен, где:
(а) первый домен содержит белок IL-7, который способен связываться с рецептором IL-7;
(b) второй домен содержит олигопептид, содержащий от 1 до 10 аминокислотных остатков; а
(c) третий домен содержит фрагмент, который продлевает время полужизни гибридного белка IL-7,
для введения субъекту от 600 мкг/кг до 2000 мкг/кг этого гибридного белка IL-7 каждые 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 10 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 80 дней, 90 дней или 100 дней, и где субъект нуждается в увеличении количества лимфоцитов.
| US 2019106471 A1, 11.04.2019 | |||
| СЛИТЫЕ БЕЛКИ IL-7 | 2004 |
|
RU2369616C2 |
| MAEURER M.J | |||
| et | |||
| al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Scandinavian Journal Of Immunology, 1997, 45: pp | |||
| Затвор для дверей холодильных камер | 1920 |
|
SU182A1 |
| XU X | |||
| et al | |||
| Newcastle Disease Virus | |||
Авторы
Даты
2024-07-04—Публикация
2020-09-04—Подача