Изобретение относится к микробиологии и биотехнологии и касается получения трансформантов дрожжей Pichia pastoris способных продуцировать фитазу.
Фосфор является важным минеральным питательным веществом для роста и развития животных. В большинстве источников сырья, используемого в животноводстве, такого, например, как зерновые и бобовые культуры, фосфор, в основном, содержится в форме фитата (мио-инозитол гексакисфосфат) [Advanced Food Research, 1982, 28, 1-92.]. Однако моногастричные животные не способны усваивать фитатный фосфор из-за отсутствия необходимого фермента в пищеварительном тракте [Can J Anim Sci., 2013, 93, 9-21.]. Кроме того, фитаты препятствуют эффективному усвоению кальция, магния, цинка, железа и других минеральных веществ комбикормов, а также связывают белки в недоступные для переваривания комплексы [Current Topics In Nutraceutical Research, 2008, 6(3), 131-144.].
Ферменты фитазы (мио-инозитол гексакисфосфат фосфогидролазы) гидролизуют фитат с отщеплением фосфатных групп и с успехом используются в качестве кормовой добавки, значительно повышая усвоение фосфора [J. Sci. Food Agric., 2015, 95, 878-896.]. Они обеспечивают высвобождение не только фитат-связанного фосфора, но также белков, макро- и микроэлементов, повышая питательные свойства кормов [British Poultry Science, 2004, 45(1), 101-108.].
В настоящее время фитазы получают микробиологическим путем с использованием рекомбинантных штаммов-продуцентов и потребность промышленности в эффективных продуцентах постоянно возрастает Afr. J. Biotechnol., 2009, 8(17), 4229-4232.]. Наиболее часто для высокоэффективной продукции гетерологичных белков используются метилотрофные дрожжи Pichia pastoris [J. Mol. Recognit., 2005, 18(2), 119-138. doi: 10.1002/jmr.687], которые обладают мощными системами экспрессии и секреции рекомбинантных белков (в том числе, фитаз) и для которых разработаны питательные среды и отработан процесс ферментации с использованием культуры высокой плотности.
Одним из способов, позволяющих обеспечить высокоэффективную продукцию целевых белков является оптимизация кодонового состава нуклеотидных последовательностей генов, кодирующих гетерологичные ферменты [Appl Microbiol Biotechnol., 2007, 74, 1074-1083, Appl Microbiol Biotechnol., 2006, 72(5), 1039-47.]. Суть способа заключается в следующем. Из-за вырожденности генетического кода одна и та же аминокислота может кодироваться несколькими кодонами, и зачастую ей соответствует несколько изоакцепторных тРНК. Частоты встречаемости разных тРНК в клетках различных организмов неодинаковы. Причем, как показали исследования, эти частоты положительно коррелируют с частотами использования кодонов в клетках тех же организмов [Mol Biol Evol, 1985. 2(1): p. 13-34.]. Это обстоятельство является определенным препятствием для процесса трансляции в случае гетерологичной экспрессии генов, поскольку в реципиентных клетках для некоторых кодонов чужеродного гена может не хватать тРНК.
Для клеток многих видов микроорганизмов выявлены частоты встречаемости кодонов (http://www.kazusa.or.jp/codon/P.html). Эти данные используют для оптимизации нуклеотидных последовательностей гетерологичных генов с целью увеличения эффективности экспрессии.
Известны примеры использования оптимизированных синтетических нуклеотидных последовательностей для создания продуцентов гетерологичных фитаз на основе дрожжей Pichia pastoris.
Получены оптимизированные по кодоновому составу синтетические гены фитаз Citrobacter amalonaticus [ВМС Biotechnology, 2015, 15, 88.], Escherichia coli [J. Agric. Food Chem., 2013, 61(25), 6007-6015., CN 102586294, CN 102943083], Peniophora lycii [Appl Microbiol Biotechnol., 2006, 72(5), 1039-47.], Citrobacter braakii [Acta Microbiologica Sinica, 46(6), 945-950.], при экспрессировании которых в P. pastoris продуктивность некоторых штаммов возросла в 2,0-2,9 раз.
Используя известные правила оптимизации [Biotechnoi Annu Rev, 2007. 13: p. 27-42., https://eu.idtdna.com/CodonOpt, https://www.genscript.com/tools/rare-codon-analysis] можно получать различные варианты нуклеотидных последовательностей, кодирующих один и тот же фермент, при этом, интеграция в хромосому этих последовательностей приводит к существенным различиям в уровне их экспрессии и продукции целевого гетерологичного фермента. Показано [Microbial Cell Factories, 2012, 11, 61.], что уровень продукции белка при использовании двух различных вариантов оптимизированных последовательностей гена целлобиогидролазы 2 из Trichoderma reesei различается в 4 раза.
Разные варианты оптимизации гена, кодирующего фитазу из Citrobacter freundii, осуществлены в работах [Appl Biochem Biotechnol., 2010, 162, 2157-2165, Journal of Microbiological Methods, 2010, 81(2), 147-152.], что привело к получению трансформантов с продуктивностью 193,2 ед/мл и 450 ед/мл культуральной жидкости, соответственно.
Таким образом, важной задачей является создание такого варианта оптимизированной нуклеотидной последовательности гетерологичного гена, который приведет к повышению эффективности ее экспрессии в штамме-хозяине.
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих фитазы.
Задача решена путем получения трансформанта дрожжей P. pastoris, продуцирующего фитазу из Citrobacter freundii, несущего в составе хромосомы оптимизированный синтетический ген, кодирующий указанную фитазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID N0:1.
Получение заявляемого трансформанта включает синтез оптимизированного синтетического гена phyCf-mod, кодирующего фитазу из С.freundii [AAR89622.1, GenBank], и его трансформация в клетки дрожжей P. pastoris с помощью экспрессионной кассеты, включающей оптимизированный ген, промотор, работающий в дрожжах P. pastoris, сигнальный пептид для осуществления секреции фермента в культуральную жидкость, терминатор, маркерный ген и, предпочтительно, сайт для гомологичной интеграции в хромосому. Интеграцию осуществляют путем как гомологичной, так и негомологичной рекомбинации. Трансформацию экспрессионной кассеты в клетки дрожжей P. pastoris осуществляют любым подходящим методом, например, методом электоропорации [http://tools.thermofisher.com/content/sfs/manuals/pich_man.pfd] или методом с использованием полиэтиленгликоля или протопластов [http://www.thermofisher.com/order/catalog/product/K173001].
Конструирование экспрессионных кассет осуществляют стандартными методами генетической инженерии [Рыбчин В.Н. Основы генетической инженерии. - СПб.: СПбГТУ, 1999, Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989.] с использованием генетических элементов, подходящих для работы с дрожжами Pichia pastoris. В качестве промоторов могут быть использованы AOX1, DAS, FLD1, ICL1, PHO89, THI11, ADH1, ENO1, GUT1, GAP, TEF1, PGK1, GCW14, G1, G6 или другие [Appl Microbiol Biotechnoi (2014) 98:5301-5317]. В качестве сигнальных пептидов используют α-фактор, PHO1, SUC2, PHA-E, KILM1, pGKL, CLY, CLY-L8, K28 pre-pro-toxin или другие [Appl Microbiol Biotechnol (2014) 98:5301-5317]. В качестве селективных маркеров используют любые подходящие маркеры, например, гены резистентности к антибиотикам зеоцину, генетицину (G418) или бластицидину С, а также гены комплементирующие ауксотрофные мутации в геноме Pichia pastoris, например, HIS4, МЕТ2, ADE1, ARG4, URA3, URA5, GUT1 [Yeast 2005; 22: 249-270]. В качестве плечей для гомологичной интеграции используют, например, последовательности генов АОХ1, HIS4 [http://www.thermofisher.com/order/catalog/product/V17520] или другие последовательности, гомологичные участкам хромосомы дрожжей Pichia pastoris.
Изобретение проиллюстрировано следующими фигурами.
Фиг. 1 Экспрессионная кассета 1
Фиг. 2 Экспрессионная кассета 2
Пример 1. Конструирование трансформантов дрожжей Pichia pastoris. содержащих оптимизированный ген. кодирующий фитазу из С. freundii
При конструировании интегративной экспрессионной кассеты используют метод "фьюжн-ПЦР" [Gene. 1989 Apr 15; 77(1): 61-8.].
Последовательность гена, кодирующего фитазу из С. freundii оптимизированную с использованием вышеупомянутых правил оптимизации, синтезируют методом, описанным в [Journal of Microbiological Methods, 2010, 81(2), 147-152.] и получают ДНК последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1.
Полученную последовательность ДНК встраивают в состав экспрессионной кассеты 1 (фиг. 1), в состав которой входят следующие генетические элементы:
1. Ген, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора
2. Терминатор транскрипции ТТАОХ1
3. Дрожжевой селективный маркер HIS4, фланкированный сайтами lox 66 и lox 71, комплементирующий у дрожжей Pichia pastoris мутацию в гене HIS4.
4. Область интеграции - нуклеотидную последовательность гена АОХ1
Полученную интегративную экспрессионную кассету трансформируют в штамм Pichia pastoris GS115 (his4-), который предварительно выращивают в жидкой питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут и промывают в ледяном растворе 1М сорбитола. Далее клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25 uF. После порации добавляют 1 мл ледяного раствора 1М сорбитола.
Селекцию трансформантов ведут в течение 5 суток при температуре 30°С на агаризованной среде следующего состава (мас. %): Na2HPO4 - 0,6; KH2PO4 - 0,3; NaCl - 0,05; NH4Cl - 0,1; MgSO4 7H2O - 0,065; агар - 2; глюкоза - 2; CaCl2 - 0,07; биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота - 0,05; CuSO4 - 0,004; KJ - 0,01; FeCl3 - 0,02; натрий молибдат - 0,02; ZnSO4 - 0,04, вода - остальное.
Наличие целевого гена в составе хромосомной ДНК полученных трансформантов определяют методом ПЦР с использованием праймеров PhyCf-m-F gaagagcagaaeggtatgaaact, PhyCf-m-R ttattccgtaactgcacactc.
Наличие ПЦР-фрагментов размером 1236 п.н. подтверждает присутствие синтетического гена в составе хромосомы полученных трансформантов.
В качестве контрольного образца используют трансформанты, несущие нативный ген кодирующий фитазу из С. freundii.
Фрагмент ДНК, содержащий кодирующую область нативного гена бактериальной фитазы из С. freundii синтезируют методом ПЦР с использованием праймеров PhyCf-F gaggctgaagcttacgtagaattcgaagagcagaacggtatgaa и PhyCf-R aggcgaattaattcgcggccgcttacttattccgtaactgca. В качестве матрицы используют общую ДНК бактерии С. freundii.
Полученную последовательность ДНК встраивают в состав экспрессионной кассеты 2 (фиг. 2), которая состоит из генетических элементов, указанных в составе кассеты 1.
Трансформацию экспрессионной кассеты 2 и селекцию полученных трансформантов осуществляют как описано выше.
Наличие нативного гена в составе хромосомной ДНК полученных трансформантов определяют методом ПЦР с использованием праймеров PhyCf-m-F gaagagcagaacggtatgaaact, PhyCf-m-R ttattccgtaactgcacactc.
Наличие ПЦР-фрагментов размером 1236 п.н. подтверждает присутствие нативного гена в составе хромосомы полученных трансформантов.
Пример 2. Оценка продуктивности трансформантов Pichia pastoris с оптимизированным геном фитазы из С. freundii
Для оценки влияния оптимизации нуклеотидного состава гена на уровень продукции фитазы произвольно отбирают по десять трансформантов Pichia pastoris с оптимизированным и нативным (для использования в качестве контроля) генами фитазы из С. freundii и проводят ферментацию.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
Ферментацию проводят при 30°С на качалке (250 об/мин) в питательной среде YP с добавлением 1% глюкозы в течение 24 ч, затем индуцируют экспрессию гена фитазы путем добавления метанола до конечной концентрации 1% каждые 24 ч в течение 5 суток.
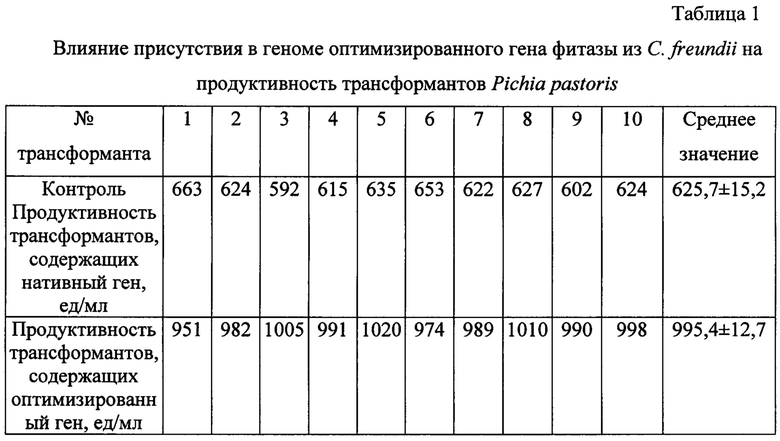
Продуктивность трансформантов Pichia pastoris оценивают по уровню активности фитазы из С. freundii в культуральной жидкости. Для этого по окончании ферментации клетки трансформанта осаждают центрифугированием, а в отделенном супернатанте определяют фитазную активность модифицированным методом Фиске-Субарроу [.J Microbiol Methods, 1999, 39(1), 17-22.]. Результаты измерения продуктивности трансформантов с оптимизированным геном фитазы представлены в табл. 1, из которой следует, что среднее значение продуктивности трансформантов Pichia pastoris с оптимизированным геном фитазы из С. freundii на 59% превышает таковое для трансформантов Pichia pastoris с нативным геном фитазы С. freundii.
Таким образом, заявляемое изобретение позволяет получать трансформанты Pichia pastoris с повышенной продуктивностью фитазы из С. freundii.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы | 2018 |
|
RU2701498C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы Escherichia coli | 2019 |
|
RU2751595C2 |
| Трансформант дрожжей Pichia pastoris, продуцирующий фитазу Escherichia coli | 2019 |
|
RU2737621C1 |
| Мутантная рекомбинантная термостабильная фитаза | 2018 |
|
RU2706086C1 |
| Трансформант дрожжей Komagataella phaffi - продуцент фитазы Citrobacter gillenii | 2020 |
|
RU2771582C1 |
| Трансформант дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2771079C1 |
| Трансформант дрожжей Komagataella phaffii, продуцирующий фитазу Cronobacter turicensis | 2021 |
|
RU2756330C1 |
| Способ оценки продуктивности рекомбинантных трансформантов дрожжей Pichia pastoris, секретирующих фитазы, относящиеся к кислым гистидиновым фосфатазам | 2017 |
|
RU2665836C1 |
| Интегративная кассета для экспрессии генов и ее использование при конструировании трансформанта дрожжей Komagataella mondaviorum | 2023 |
|
RU2836330C1 |



Изобретение относится к микробиологии и биотехнологии. Получен трансформант дрожжей Pichia pastoris, продуцирующий фитазу из Citrobacter freundii, несущий в составе хромосомы оптимизированный синтетический ген, кодирующий указанную фитазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1. Данное изобретение расширяет арсенал рекомбинантных микроорганизмов, продуцирующих фитазы. 1 табл., 2 пр., 2 ил.
Трансформант дрожжей Pichia pastoris, продуцирующий фитазу из Citrobacter freundii, несущий в составе хромосомы оптимизированный синтетический ген, кодирующий указанную фитазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1.
| GORDEEVA T.V | |||
| et al., Improved PCR-based gene synthesis method and its application to the Citrobacter freundii phytase gene codon modification, Journal of Microbiological Methods, 2010, vol.81, N2, pp.147-152 | |||
| HSUEH-MING TAI et al., Overexpression of Escherichia coli Phytase in Pichia pastoris and Its Biochemical Properties, Journal of |
Авторы
Даты
2019-12-06—Публикация
2019-02-22—Подача