Изобретение относится к микробиологии и биотехнологии и касается получения штаммов дрожжей Pichia pastoris, способных продуцировать фитазу.
Фосфор является важным минеральным питательным веществом для роста и развития животных. В большинстве источников сырья, используемого в животноводстве, такого, например, как зерновые и бобовые культуры, фосфор, в основном, содержится в форме фитата (мио-инозитол гексакисфосфат) [Advanced Food Research, 1982, 28, 1-92.]. Однако моногастричные животные не способны усваивать фитатный фосфор из-за отсутствия необходимого фермента в пищеварительном тракте [Can J Anim Sci., 2013, 93, 9-21.]. Кроме того, фитаты препятствуют эффективному усвоению кальция, магния, цинка, железа и других минеральных веществ комбикормов, а также связывают белки в недоступные для переваривания комплексы [Current Topics In Nutraceutical Research, 2008, 6(3), 131-144.].
Ферменты фитазы (мио-инозитол гексакисфосфат фосфогидролазы) гидролизуют фитат с отщеплением фосфатных групп и с успехом используются в качестве кормовой добавки, значительно повышая усвоение фосфора [J. Sci. Food Agric., 2015, 95, 878-896.]. Они обеспечивают высвобождение не только фитат-связанного фосфора, но также белков, макро- и микроэлементов, повышая питательные свойства кормов [British Poultry Science, 2004, 45(1), 101-108.].
В настоящее время фитазы получают микробиологическим путем с использованием рекомбинантных штаммов-продуцентов, потребность промышленности в которых постоянно растет [Afr. J. Biotechnol, 2009, 8(17), 4229-4232.]. Наиболее часто для высокоэффективной продукции гетерологичных белков используются метилотрофные дрожжи Pichia pastoris [J. Mol. Recognit., 2005, 18(2), 119-138. doi: 10.1002/jmr.687], которые обладают мощными системами экспрессии и секреции рекомбинантных белков (в том числе, фитаз) и для которых разработаны питательные среды и отработан процесс ферментации с использованием культуры высокой плотности.
Одним из способов, позволяющих обеспечить эффективную продукцию целевых ферментов является оптимизация кодонового состава нуклеотидных последовательностей генов, кодирующих гетерологичные ферменты [Appl Microbiol Biotechnol, 2007, 74, 1074-1083, Appl Microbiol Biotechnol, 2006, 72(5), 1039-47.]. Суть способа заключается в следующем. Из-за вырожденности генетического кода одна и та же аминокислота может кодироваться несколькими кодонами, и зачастую ей соответствует несколько изоакцепторных тРНК. Частоты встречаемости разных тРНК в клетках различных организмов неодинаковы. Эти частоты положительно коррелируют с частотами использования кодонов в клетках тех же организмов [Mol Biol Evol, 1985. 2(1): p. 13-34.], что является определенным препятствием для процесса трансляции в случае гетерологичной экспрессии генов, поскольку в реципиентных клетках для некоторых кодонов чужеродного гена может не хватать тРНК.
Для клеток микроорганизмов многих видов выявлены частоты встречаемости кодонов (http://www.kazusa.or.jp/codon/P.html), и эти данные используют для оптимизации нуклеотидных последовательностей гетерологичных генов с целью увеличения эффективности экспрессии.
Известны примеры использования оптимизированных синтетических нуклеотидных последовательностей для создания продуцентов гетерологичных фитаз на основе дрожжей Pichia pastoris.
Получены оптимизированные по кодоновому составу синтетические гены фитаз Citrobacter amalonaticus [ВМС Biotechnology, 2015, 15, 88.], Escherichia coli [J. Agric. Food Chem., 2013, 61(25), 6007-6015., CN 102586294, CN 102943083], Peniophora lycii [Appl Microbiol Biotechnol, 2006, 72(5), 1039-47.], Citrobacter braakii [Acta Microbiologica Sinica, 46(6), 945-950.], при экспрессировании которых в P. pastoris продуктивность некоторых штаммов возросла в 2,0-2,9 раз.
Используя известные правила оптимизации [Biotechnol Annu Rev, 2007. 13: p. 27-42., https://eu.idtdna.com/CodonOpt, https://www.genscript.com/tools/rare-codon-analysis] получают различные варианты нуклеотидных последовательностей, кодирующих один и тот же фермент, при этом, интеграция в хромосому этих последовательностей приводит к существенным различиям в уровне их экспрессии и продукции целевого гетерологичного фермента. Так, в работе [Microbial Cell Factories, 2012, 11, 61.] показано, что уровень продукции белка при использовании двух различных вариантов оптимизированных последовательностей гена целлобиогидролазы 2 из Trichoderma reesei различается в 4 раза.
Разные варианты оптимизации гена, кодирующего фитазу из Citrobacter freundii, осуществлены в работах [Appl Biochem Biotechnol., 2010, 162, 2157-2165, Journal of Microbiological Methods, 2010, 81(2), 147-152.], что привело к получению трансформантов с продуктивностью 193,2 ед/мл и 450 ед/мл культуральной жидкости, соответственно.
Таким образом, важной задачей является создание такого варианта оптимизированной нуклеотидной последовательности гетерологичного гена, который приведет к повышению эффективности ее экспрессии в штамме-хозяине.
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих фитазы.
Задача решена путем получения штамма дрожжей P. pastoris, продуцирующего фитазу, содержащего в составе хромосомы оптимизированную последовательность гена, кодирующего фитазу С. freundii.
Рекомбинантный штамм получен путем интеграции в состав хромосомы штамма Pichia pastoris (HIS4-) Y-4334 экспрессионной кассеты, в состав которой входит оптимизированная последовательность гена, кодирующего фитазу С. freundii.
Штамм является продуцентом фитазы и депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика как Pichia pastoris BCf9 ВКПМ Y-4484.
Культурально-морфологические характеристики заявляемого штамма.
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YP следующего состава (мас. %: пептон - 2, дрожжевой экстракт - 1, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %), клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют. Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 1.0, ацетат натрия - 0.5, глюкоза - 1.0, агар - 2.0, вода - остальное. Аски имеют тетраэдрическую форму, включают 4 аскоспоры.
На агаризованной среде YP с добавлением глюкозы (2 мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией. При росте в жидкой среде YP следующего состава (мас. %: пептон - 2, дрожжевой экстракт - 1, вода - остальное) с добавлением глюкозы (2 мас. %), при 28°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки:
Трансформант способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода способен использовать метанол, этанол, глюкозу, глицерин, лактат, сукцинат, не способен ассимилировать мальтозу, сахарозу, ацетат, крахмал, лактозу.
При культивировании в присутствии метанола трансформанты способны синтезировать фитазу.
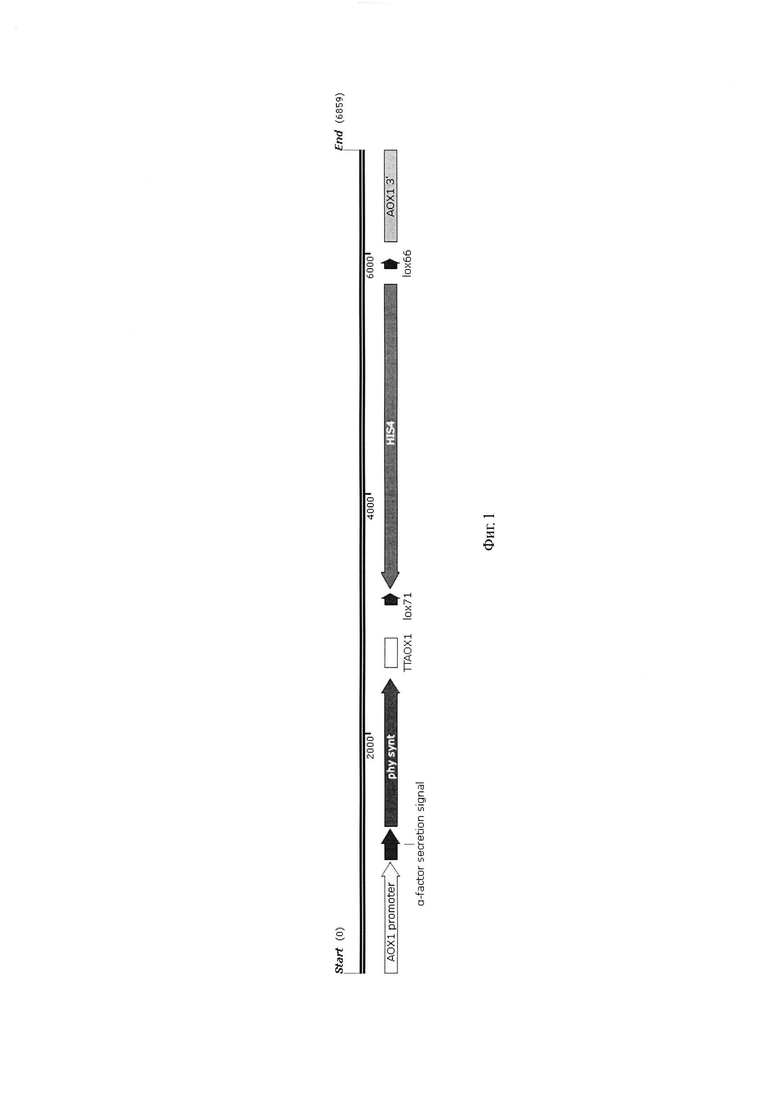
Изобретение проиллюстрировано следующей фигурой.
Фиг. 1 Экспрессионная кассета 1
Пример 1. Конструирование штамма дрожжей Pichia pastoris, содержащего оптимизированный ген, кодирующий фитазу С. freundii
При конструировании интегративной экспрессионной кассеты используют метод "фьюжн-ПЦР" [Gene. 1989 Apr 15;77(1):61-8.].
Последовательность гена, кодирующего фитазу С. freundii, оптимизированную с использованием вышеупомянутых правил оптимизации, синтезируют известным методом [Journal of Microbiological Methods, 2010, 81(2), 147-152.].
Полученную последовательность ДНК встраивают в экспрессионную кассету 1 (фиг. 1), в состав которой входят следующие генетические элементы:
1. Ген, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем модифицированного АОХ1 промотора [ВМС Biotechnology. - 2015, - V. 15, - Р. 88.].
2. Терминатор транскрипции ТТАОХ1
3. Дрожжевой селективный маркер HIS4, фланкированный сайтами lox 66 и lox 71, комплементирующий у дрожжей Pichia pastoris мутацию в гене HIS4.
4. Область интеграции - нуклеотидную последовательность гена АОХ1
Интегративную экспрессионную кассету трансформируют в клетки штамма Pichia pastoris (HIS4-) Y-4334, которые предварительно выращивают в жидкой питательной среде YP с добавлением глюкозы (2 мас. %) до концентрации 1×108 клеток на 1 мл. Клетки отделяют центрифугированием, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут и промывают в ледяном растворе 1М сорбитола. Далее клетки ресуспендируют в ледяном растворе 1М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25uF. После порации добавляют 1 мл ледяного раствора 1М сорбитола.
Селекцию трансформантов ведут в течение 5 суток при температуре 30°С на агаризованной среде следующего состава (мас. %): Na2HPO4 - 0,6; KH2PO4 - 0,3; NaCl - 0,05; NH4Cl - 0,1; MgSO4 7H2O - 0,065; агар - 2; глюкоза - 2; CaCl2 - 0,07; биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота - 0,05; CuSO4 - 0,004; KJ - 0,01; FeCl3 - 0,02; натрий молибдат - 0,02; ZnSO4 - 0,04, вода - остальное.
Наличие целевого гена в составе хромосомной ДНК полученных трансформантов определяют методом ПЦР с использованием праймеров PhyCf-m-F gaagagcagaacggtatgaaact, PhyCf-m-R ttattccgtaactgcacactc.
Наличие ПЦР-фрагментов размером 1236 п.н. подтверждает присутствие синтетического гена в составе хромосомы полученных трансформантов.
Для отбора наиболее продуктивных трансформантов проводят их культивирование в жидкой ферментационной питательной среде.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 28°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
Ферментацию проводят в колбах при 28°С на качалке (250 об/мин) в питательной среде YP с добавлением 2% глицерина в течение 24 ч. Экспрессию гена фитазы индуцируют путем добавления 0,5% метанола, через три часа 0,5% метанола, далее 1% метанола каждые 24 часа в течение 4 дней.
Продуктивность трансформантов Pichia pastoris оценивают по активности фитазы, образовавшейся в культуральной жидкости. Для этого клетки трансформанта осаждают центрифугированием, а супернатант используют для определения фитазной активности модифицированным методом Фиске-Субарроу [. J Microbiol Methods, 1999, 39(1), 17-22.].
По результатам ферментации отбирают наиболее продуктивный трансформант, который в указанных условиях синтезирует фитазу С. freundii в концентрации 1403 ед./мл культуральной жидкости.
Трансформант депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика как Pichia pastoris BCf9 ВКПМ Y-4484.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы Escherichia coli | 2019 |
|
RU2751595C2 |
| Трансформант дрожжей Pichia pastoris, продуцирующий фитазу | 2019 |
|
RU2708446C1 |
| Трансформант дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2771079C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий фитазу Escherichia coli | 2019 |
|
RU2737621C1 |
| Трансформант дрожжей Komagataella phaffi - продуцент фитазы Citrobacter gillenii | 2020 |
|
RU2771582C1 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2785901C1 |
| Трансформант дрожжей Komagataella phaffii, продуцирующий фитазу Cronobacter turicensis | 2021 |
|
RU2756330C1 |
| Штамм дрожжей Komagataella phaffii с инактивированным геном HIS4 - реципиент для конструирования безмаркерных штаммов-продуцентов гетерологичных белков | 2022 |
|
RU2787584C1 |
| Штамм дрожжей Komagataella phaffii с инактивированным геном LEU2 - реципиент для конструирования штаммов-продуцентов гетерологичных белков | 2022 |
|
RU2788528C1 |
Изобретение относится к микробиологии и биотехнологии. Предложен рекомбинантный штамм дрожжей Pichia pastoris ВКПМ Y-4484, продуцирующий фитазу. Указанный штамм содержит в составе хромосомы оптимизированную последовательность гена, кодирующего фитазу Citrobacter freundii. Штамм синтезирует фитазу Citrobacter freundii в концентрации 1403 ед./мл культуральной жидкости. 1 ил., 1 пр.
Рекомбинантный штамм дрожжей Pichia pastoris ВКПМ Y-4484 - продуцент фитазы, содержащий в составе хромосомы оптимизированную последовательность гена, кодирующего фитазу Citrobacter freundii.
| ГОРДЕЕВА Т.Л | |||
| И ДР | |||
| Рекомбинантный продуцент кормового фермента фитазы на основе дрожжей Pichia pastoris | |||
| Актуальная биотехнология, 2018, N/3(26), с | |||
| Аппарат для испытания прессованных хлебопекарных дрожжей | 1921 |
|
SU117A1 |
| ГОРДЕЕВА Т.Л | |||
| И ДР | |||
| Сравнительный анализ эффективности экспрессии генов бактериальных фитаз в дрожжах Pichia pastoris с помощью чашечного теста | |||
| Биотехнология, 2017, Т.33, N | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Пуговица | 0 |
|
SU83A1 |
| МУТАНТНАЯ РЕКОМБИНАНТНАЯ ТЕРМОСТАБИЛЬНАЯ ФИТАЗА (ВАРИАНТЫ), ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ УКАЗАННУЮ ФИТАЗУ (ВАРИАНТЫ), ШТАММ Pichia pastoris - ПРОДУЦЕНТ УКАЗАННОЙ ФИТАЗЫ (ВАРИАНТЫ) | 2009 |
|
RU2472855C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА ДЛЯ ЭКСПРЕССИИ В ДРОЖЖАХ PICHIA PASTORIS ГЕНА ФИТАЗЫ (ВАРИАНТЫ), ШТАММ ДРОЖЖЕЙ PICHIA PASTORIS - ПРОДУЦЕНТ ФИТАЗЫ (ВАРИАНТЫ) | 2009 |
|
RU2409670C1 |
| CN 102586294 A, 18.07.2012. | |||
Авторы
Даты
2019-09-26—Публикация
2018-12-24—Подача