Область техники
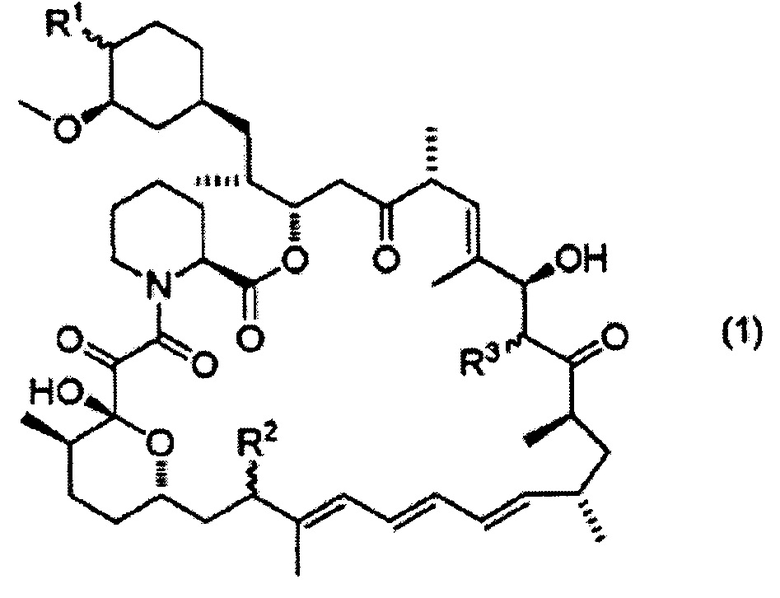
[0001] Настоящее изобретение относится к профилактическому и/или терапевтическому средству против дисфункции мейбомиевых желез, содержащему соединение, представленное формулой (1):
[Формула 1]
 ,
,
где
R1 представляет собой гидроксильную группу, метоксигруппу, гидроксиметоксигруппу, этоксигруппу, 1-гидроксиэтоксигруппу, 2-гидроксиэтоксигруппу, 2-метоксиэтоксигруппу, 2-этоксиэтоксигруппу, формилоксигруппу, карбоксиоксигруппу, ацетоксигруппу, гидроксиацетоксигруппу, пропионилоксигруппу, 2-гидроксипропионилоксигруппу, 3-гидроксипропионилоксигруппу, 2-метилпропионилоксигруппу, 2-(гидроксиметил)пропионилоксигруппу, 3-гидрокси-2-(гидроксиметил)пропионилоксигруппу, 2,2-диметилпропионилоксигруппу, 2-(гидроксиметил)-2-метилпропионилоксигруппу, 2,2-бис(гидроксиметил)пропионилоксигруппу, метилфосфиноилоксигруппу, диметилфосфиноилоксигруппу или 1H-тетразол-1-ильную группу;
R2 представляет собой атом водорода, гидроксильную группу, метоксигруппу, меркаптогруппу или метилтиогруппу;
R3 представляет собой атом водорода, гидроксильную группу или метоксигруппу;
волнистая линия указывает на то, что атом углерода, присоединенный к R1, R2 или R3, может иметь или S или R конфигурацию;
(в данном описании иногда ссылаются как на "настоящее соединение"), или его фармацевтически приемлемая соль в качестве активного ингредиента.
Предшествующий уровень
[0002] Мейбомиевая железа присутствует в толще хряща глазного века, представляет собой сальную железу, имеющую выводные протоки, устья, на концах верхних и нижних век, и секретируемый мейбомиевой железой липид, играет множественную роль в поверхностных оболочках глаза.
[0003] В непатентном документе 1 описано, что среди пациентов, посещавших офтальмолога, обращались с симптомами, такими как глазной дискомфорт, как основная жалоба, при этом причиной этого в значительной мере становится дисфункция мейбомиевых желез (далее также называемая как "MGD"), что и вызывает у многих пациентов снижение качества жизни.
[0004] Однако никогда не был известен способ эффективного лечения MGD и, в первую очередь, до сих пор не было установлено четкого определения MGD или самих диагностических критериев. Таким образом, в последние годы, во всем мире приковано внимание к определению MGD как самостоятельного заболевания и к подготовке его диагностических критериев, и в Японии MGD была определена как заболевание, «которое является состоянием, при котором функция мейбомиевых желез является причиной распространения патологических изменений, вызванных ею, и сопровождается хроническим глазным дискомфортом» (см. непатентный документ 1).
[0005] Также в непатентном документе 1 описано, что MGD подразделяется на тип MGD сниженной секреции и тип MGD повышенной секреции, и в нем также описано, что при типе MGD сниженной секреции секреция липидов мейбомиевых желез снижается при закупорке выводных протоков мейбомиевых желез и тому подобное. Кроме того, в непатентном документе 1 также описано, что если три из <1> субъективного симптома, такого как глазной дискомфорт, <2> признаков/полученных данных по патологическим изменениям вокруг выводных протоков мейбомиевых желез, таких как вазодилатация, и <3> признаков/полученных данных по закупорке выводных протоков мейбомиевых желез, являются положительными, диагностируются как тип MGD сниженной секреции.
[0006] В этой связи, такое развитие болезни мейбомиевых желез, как киста мейбомиевой железы (халязион), внутренний ячмень и т.д., как известно, являются другими, чем MGD, и в непатентном документе 1 описано, что эти заболевания являются местными заболеваниями и отличаются от MGD, в которых мейбомиевая железа препятствует диффузному процессу. Кроме того, MGD иногда вызывает обезвоживание, способствуя синдрому "сухого глаза", при этом в непатентном документе 1 описано, что существует случай, где синдром "сухого глаза" отсутствует, сопровождаемый зависимостью от количества слезной жидкости, срока заболевания или степени тяжести.
[0007] В непатентном документе 2 описан способ классификации MGD в США, и в нем также описано, что тип MGD сниженной секреции (состояние MGD сниженной слезопродукции) может быть дополнительно классифицирован как два - "гипосекреторная MGD (мейбомиевая гипосекреция)" и "обструктивная MGD (обструкция мейбомиевых желез)". Также в непатентном документе 2 сделано предположение, что MGD является одним из заболеваний, которые вызывают постериальный блефарит.
[0008] Сиролимус (также называемый рапамицином) известен в качестве иммунодепрессанта и используется в виде перорального препарата в США, и т.д. Также известно, что производное (в данном описании иногда называемое "производным сиролимуса"), в котором часть структуры сиролимуса модифицирована, обладает активностью, идентичной активности сиролимуса, и в производном сиролимуса содержатся дефоролимус, эверолимус, темсиролимус, зотаролимус, биолимус, новолимус и т.д.
[0009] В патентном документе 1 описана офтальмологическая композиция, содержащая ингибитор mTOR, такой как сиролимус, эверолимус, темсиролимус и т.д., первое поверхностно-активное вещество, имеющее индекс HLB, превышающий примерно 10, и второе поверхностно-активное вещество, имеющее индекс HLB, превышающий примерно 13. Однако, в патентном документе 1, нет какого-либо описания того, обладает ли ингибитор mTOR лечебным эффектом против MGD или нет.
[0010] Также в патентном документе 2 было предложено, что производным пипеколиновой кислоты, таким как рапамицин, можно лечить расстройство зрения, и в расстройство зрения включена карцинома мейбомиевой железы и внутренний ячмень (ячмень мейбомиевой железы). Однако карцинома мейбомиевой железы является заболеванием, безусловно отличающимся от MGD, а также состояний, приведенных выше, при этом внутренний ячмень также является заболеванием, отличающимся от MGD.
[0011] Как указано выше, в патентных документах 1 и 2 отсутствует какое-либо описание и предложение о том, обладает ли настоящее соединение лечебным эффектом против MGD или нет.
[0012] Кроме того, для специалиста в данной области неочевидно, сможет или нет лекарственное средство, которое может лечить сухость глаз или постериальный блефарит, предотвратить и/или лечить саму MGD.
Документы предшествующего уровня
Патентные документы
[0013] Патентный документ 1: JP 2010-540682A
Патентный документ 2: JP 2002-522485A
Непатентные документы
[0014] Непатентный документ 1: Journal of the Eye, 27(5), 627-631 (2010)
Непатентный документ 2: Investigative Ophthalmology & Visual Science, 52(4), 1930-1937 (2011)
Описание изобретения
Проблемы, решаемые изобретением
[0015] Задачей настоящего изобретения является обеспечение профилактического и/или терапевтического средства против дисфункции мейбомиевых желез (MGD).
Средства для решения проблем
[0016] Авторы настоящего изобретения провели тщательное изучение проблемы для поиска профилактического и/или терапевтического средства против дисфункции мейбомиевых желез (MGD), и в результате обнаружили, что соединение, представленное формулой (1):
[Формула 2]
 ,
,
где
R1 представляет собой гидроксильную группу, метоксигруппу, гидроксиметоксигруппу, этоксигруппу, 1-гидроксиэтоксигруппу, 2-гидроксиэтоксигруппу, 2-метоксиэтоксигруппу, 2-этоксиэтоксигруппу, формилоксигруппу, карбоксиоксигруппу, ацетоксигруппу, гидроксиацетоксигруппу, пропионилоксигруппу, 2-гидроксипропионилоксигруппу, 3-гидроксипропионилоксигруппу, 2-метилпропионилоксигруппу, 2-(гидроксиметил)пропионилоксигруппу, 3-гидрокси-2-(гидроксиметил)пропионилоксигруппу, 2,2-диметилпропионилоксигруппу, 2-(гидроксиметил)-2-метилпропионилоксигруппу, 2,2-бис(гидроксиметил)пропионилоксигруппу, метилфосфиноилоксигруппу, диметилфосфиноилоксигруппу или 1H-тетразол-1-ильную группу;
R2 представляет собой атом водорода, гидроксильную группу, метоксигруппу, меркаптогруппу или метилтиогруппу;
R3 представляет собой атом водорода, гидроксильную группу или метоксигруппу;
волнистая линия указывает на то, что атом углерода, присоединенный к R1, R2 или R3, может иметь или S или R конфигурацию,
или его фармацевтически приемлемая соль может уменьшать число обструкций в выводных протоках мейбомиевых желез, и соединение приведенной выше формулы (1) или его фармацевтически приемлемая соль обладает лечебным воздействием на MGD и подавляет обструкцию мейбомиевых желез, что было достигнуто настоящим изобретением.
[0017] Таким образом, настоящее изобретение относится к профилактическому и/или терапевтическому средству против дисфункции мейбомиевых желез (MGD), которое содержит соединение приведенной выше формулы (1) (настоящее соединение) или его фармацевтически приемлемую соль в качестве активного ингредиента (в данном описании иногда называемый "настоящим средством").
[0018] Также настоящее соединение предпочтительно представляет собой соединение приведенной выше формулы (1), где R1 представляет собой гидроксильную группу, 2-гидроксиэтоксигруппу, 2-этоксиэтоксигруппу, 2,2-бис(гидроксиметил)пропионилоксигруппу, диметилфосфиноилоксигруппу или 1H-тетразол-1-ильную группу; R2 представляет собой атом водорода, гидроксильную группу, метоксигруппу или метилтиогруппу; и R3 представляет собой атом водорода или метоксигруппу, или его фармацевтически приемлемую соль.
[0019] Кроме того, настоящее соединение предпочтительно представляет собой соединение приведенной выше формулы (1), где R1 представляет собой гидроксильную группу или диметилфосфиноилоксигруппу; R2 представляет собой метоксигруппу; R3 представляет собой метоксигруппу, или его фармацевтически приемлемую соль.
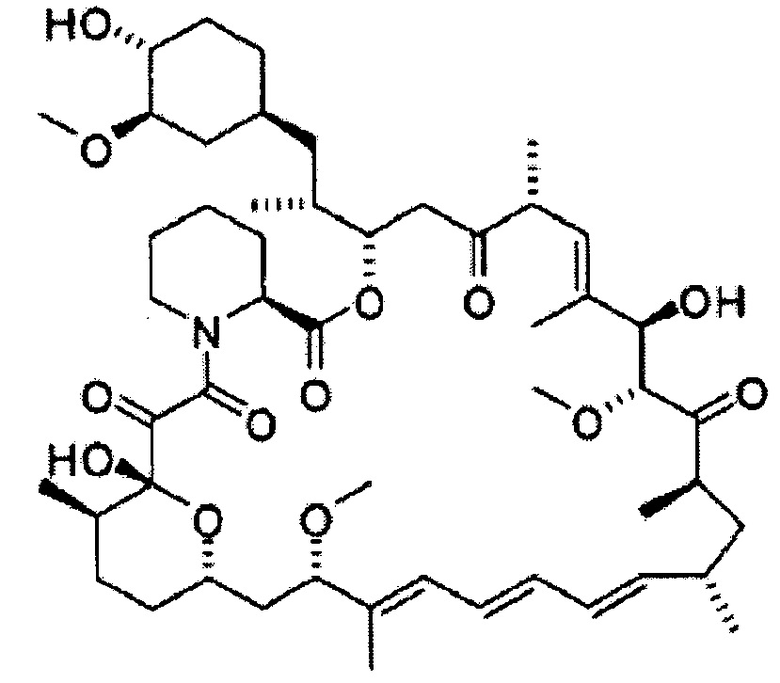
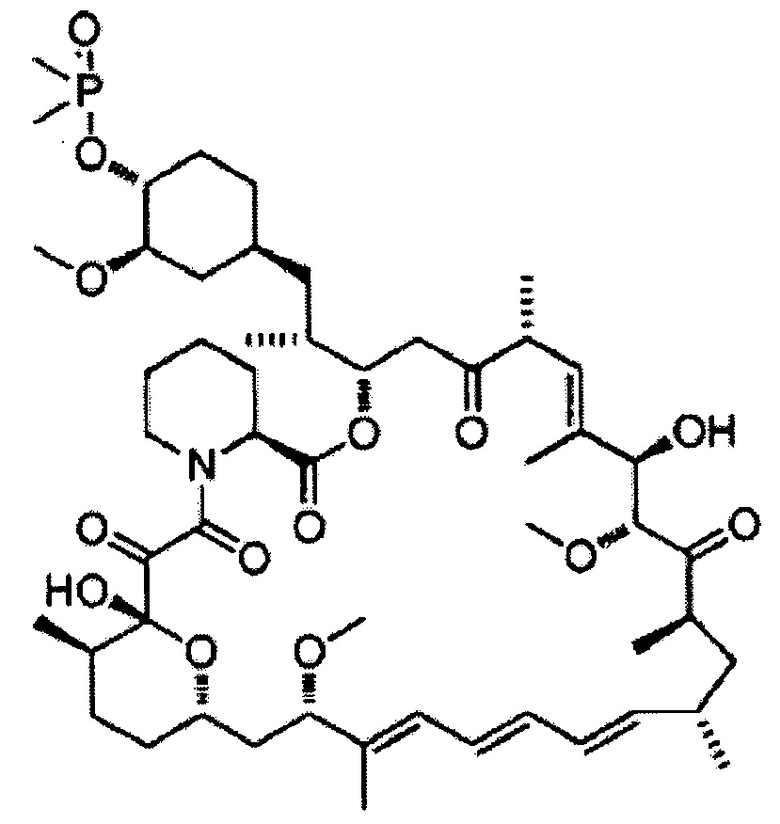
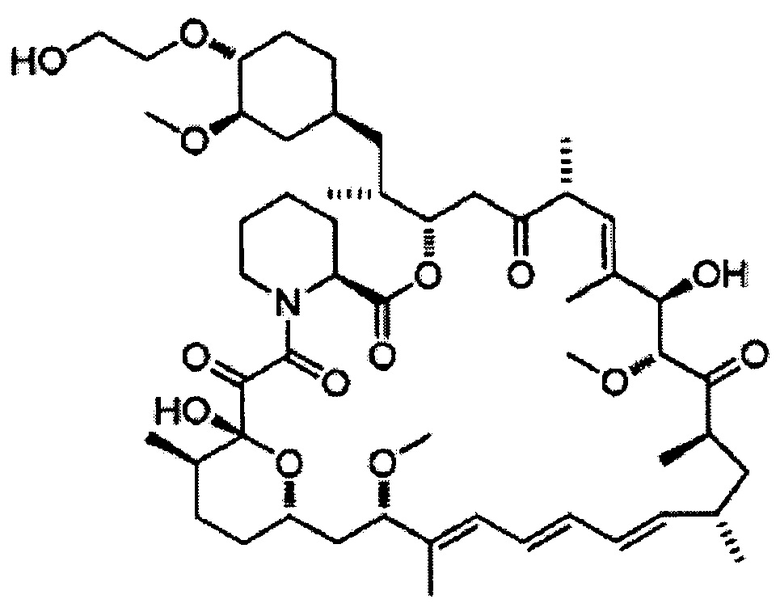
[0020] Более того, настоящее соединение предпочтительно представляет собой сиролимус, дефоролимус, эверолимус, темсиролимус, зотаролимус, биолимус, новолимус, 7-эпирапамицин, 7-тиометилрапамицин, 7-эпитиометилрапамицин, 7-деметоксирапамицин, 32-деметоксирапамицин или их фармацевтически приемлемые соли, особенно предпочтительно сиролимус, дефоролимус или их соль.
[0021] Кроме того, форма введения настоящего средства предпочтительно представляет собой введение инстилляцией или введение в кожу век.
[0022] Также дозированная форма настоящего средства предпочтительно представляет собой глазные капли, офтальмологическую мазь или мазь (исключая офтальмологическую мазь), и глазные капли предпочтительно являются суспензией или эмульсией.
[0023] Другие варианты осуществления настоящего изобретения относятся к композиции для подавления обструкции мейбомиевых желез, содержащей настоящее соединение или его фармацевтически приемлемую соль в качестве активного ингредиента (в данном описании иногда называемая "настоящей композицией").
[0024] Более того, активный ингредиент настоящей композиции предпочтительно представляет собой сиролимус, дефоролимус или их соль.
[0025] Кроме того, другие варианты осуществления настоящего изобретения относятся к фармацевтической композиции для профилактики и/или лечения дисфункции мейбомиевых желез (MGD), содержащей соединение приведенной выше формулы (1) (настоящее соединение) или его фармацевтически приемлемую соль и фармацевтически приемлемую добавку.
[0026] Также другие варианты осуществления настоящего изобретения относятся к соединению приведенной выше формулы (1) (настоящее соединение) для применения в подавлении обструкции мейбомиевых желез.
[0027] Далее, другие варианты осуществления настоящего изобретения относятся к соединению приведенной выше формулы (1) (настоящее соединение) для применения в подавлении телеангиоэктазии вокруг выводных протоков мейбомиевых желез.
[0028] Более того, другие варианты осуществления настоящего изобретения относятся к соединению приведенной выше формулы (1) (настоящее соединение) для применения при профилактике и/или лечении дисфункции мейбомиевых желез (MGD).
[0029] Кроме того, другие варианты осуществления настоящего изобретения относятся к применению соединения приведенной выше формулы (1) (настоящее соединение) при производстве композиции для подавления обструкции мейбомиевых желез.
[0030] Также другие варианты осуществления настоящего изобретения относятся к применению соединения приведенной выше формулы (1) (настоящее соединение) при производстве композиции для подавления телеангиоэктазии вокруг выводных протоков мейбомиевых желез.
[0031] Далее, другие варианты осуществления настоящего изобретения относятся к применению соединения приведенной выше формулы (1) (настоящее соединение) при производстве медицинского препарата для профилактики и/или лечения дисфункции мейбомиевых желез (MGD).
[0032] Более того, другие варианты осуществления настоящего изобретения относятся к способу подавления обструкции мейбомиевых желез, включающему введение соединения приведенной выше формулы (1) (настоящее соединение) человеку или животному.
[0033] Кроме того, другие варианты осуществления настоящего изобретения относятся к способу подавления телеангиоэктазии вокруг выводных протоков мейбомиевых желез, включающему введение соединения приведенной выше формулы (1) (настоящее соединение) человеку или животному.
[0034] Другие варианты осуществления настоящего изобретения также относятся к способу профилактики и/или лечения дисфункции мейбомиевых желез (MGD), включающему введение соединения приведенной выше формулы (1) (настоящее соединение) человеку или животному.
Эффекты изобретения
[0035] Соединение приведенной выше формулы (1) или его фармацевтически приемлемая соль полезны в качестве профилактического и/или терапевтического средства против дисфункции мейбомиевых желез (MGD).
Наилучшие варианты осуществления изобретения
[0036] (A) Настоящее соединение представляет собой соединение, в котором соответствующие группы являются группами, показанными ниже в соединении, представленном формулой (1):
[Формула 3]
 .
.
[0037] (A1) R1 представляет собой гидроксильную группу, метоксигруппу, гидроксиметоксигруппу, этоксигруппу, 1-гидроксиэтоксигруппу, 2-гидроксиэтоксигруппу, 2-метоксиэтоксигруппу, 2-этоксиэтоксигруппу, формилоксигруппу, карбоксиоксигруппу, ацетоксигруппу, гидроксиацетоксигруппу, пропионилоксигруппу, 2-гидроксипропионилоксигруппу, 3-гидроксипропионилоксигруппу, 2-метилпропионилоксигруппу, 2-(гидроксиметил)пропионилоксигруппу, 3-гидрокси-2-(гидроксиметил)пропионилоксигруппу, 2,2-диметилпропионилоксигруппу, 2-(гидроксиметил)-2-метилпропионилоксигруппу, 2,2-бис(гидроксиметил)пропионилоксигруппу, метилфосфиноилоксигруппу, диметилфосфиноилоксигруппу или 1H-тетразол-1-ильную группу;
(A2) R2 представляет собой атом водорода, гидроксильную группу, метоксигруппу, меркаптогруппу, метилтиогруппу, фенильную группу, 2,4,6-тригидроксифенильную группу или 2,4,6-триметоксифенильную группу; и
(A3) R3 представляет собой атом водорода, гидроксильную группу или метоксигруппу.
То есть, настоящее соединение представляет собой вещество, в котором соответствующие группы, перечисленные в представленных выше (A1), (A2) и (A3), объединены в соединении, представленном приведенной выше формулой (1).
[0038] (B) В качестве предпочтительного примера настоящего соединения, может быть представлено соединение, где соответствующие группы являются группами, показанными ниже в соединении, представленном приведенной выше формулой (1).
(B1) R1 представляет собой гидроксильную группу, 2-гидроксиэтоксигруппу, 2-этоксиэтоксигруппу, 2,2-бис(гидроксиметил)пропионилоксигруппу, диметилфосфиноилоксигруппу или 1H-тетразол-1-ильную группу;
(B2) R2 представляет собой атом водорода, гидроксильную группу, метоксигруппу, метилтиогруппу или 2,4,6-триметоксифенильную группу; и
(B3) R3 представляет собой атом водорода или метоксигруппу.
То есть, предпочтительным примером настоящего соединения является вещество, в котором соответствующие группы, перечисленные в представленных выше (B1), (B2) и (B3), объединены в приведенной выше формуле (1).
[0039] (C) В качестве более предпочтительного примера настоящего соединения может быть представлено соединение, в котором соответствующие группы являются группами, приведенными ниже в приведенной выше формуле (1).
(C1) R1 представляет собой гидроксильную группу, 2-гидроксиэтоксигруппу, 2-этоксиэтоксигруппу, 2,2-бис(гидроксиметил)пропионилоксигруппу или диметилфосфиноилоксигруппу;
(C2) R2 представляет собой метоксигруппу;
(C3) R3 представляет собой метоксигруппу;
То есть, более предпочтительным примером настоящего соединения является вещество, в котором соответствующие группы, перечисленные в представленных выше (C1), (C2) и (C3), объединены в соединении, представленном приведенной выше формулой (1).
[0040] В приведенной выше формуле (1) волнистая линия указывает на то, что атом углерода, присоединенный к R1, R2 или R3, может иметь или S или R конфигурацию, и в настоящем изобретении атом углерода, присоединенный к R1, предпочтительно имеет R-конфигурацию, и когда R2 или R3 не являются атомом водорода, атом углерода, присоединенный к R2, предпочтительно имеет S-конфигурацию, и атом углерода, присоединенный к R3, предпочтительно имеет R-конфигурацию.
[0041] Конкретные примеры настоящего соединения могут представлять собой следующие соединения.
[0042]
Сиролимус [Формула 4]
[0043]
Дефоролимус [Формула 5]
[0044]
Эверолимус [Формула 6]
[0045]
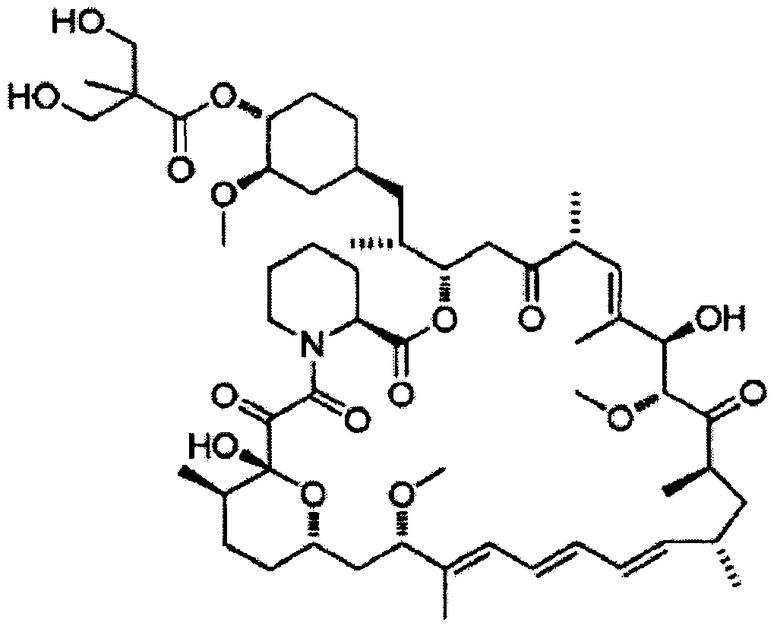
Темсиролимус [Формула 7]
[0046]
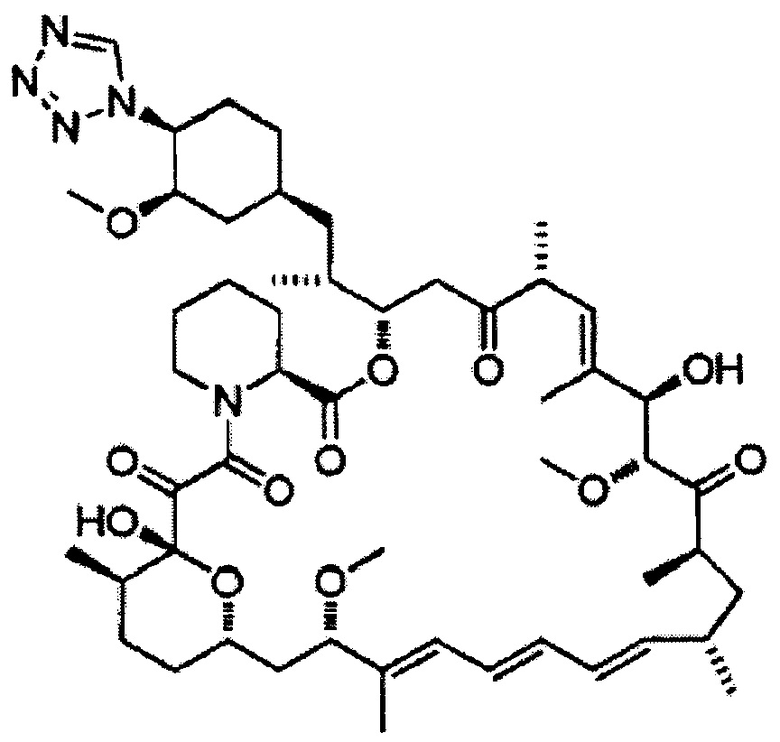
Зотаролимус [Формула 8
[0047]
Биолимус [Формула 9]
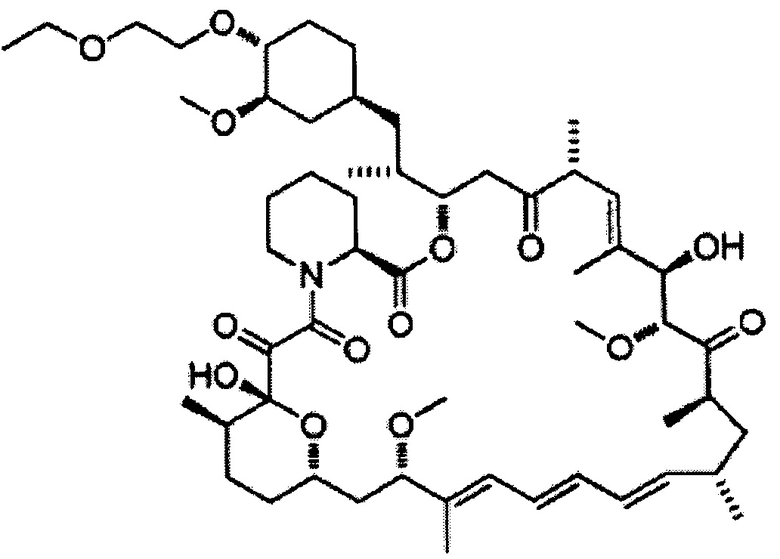
[0048]
Новолимус [Формула 10]
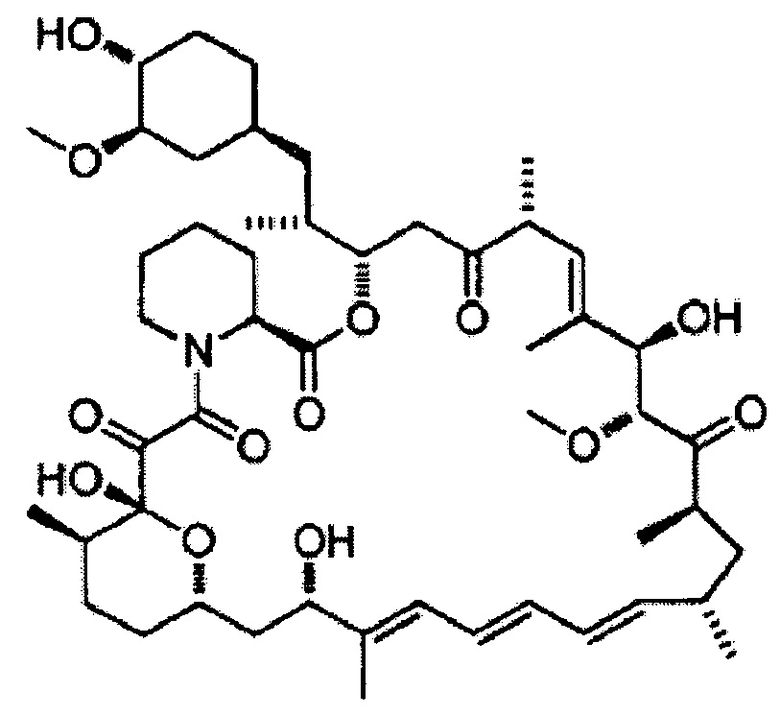
[0049]
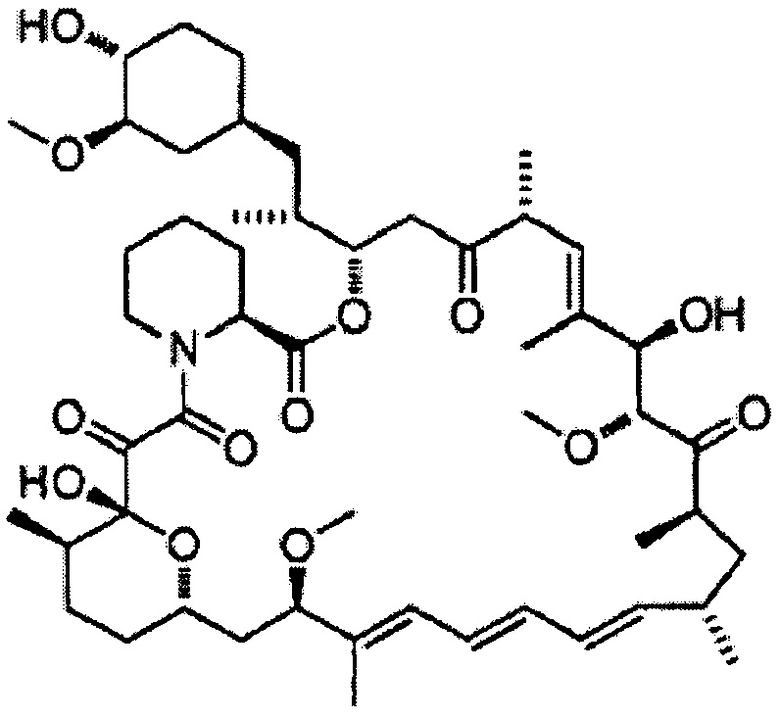
7-Эпирапамицин [Формула 11]
[0050]
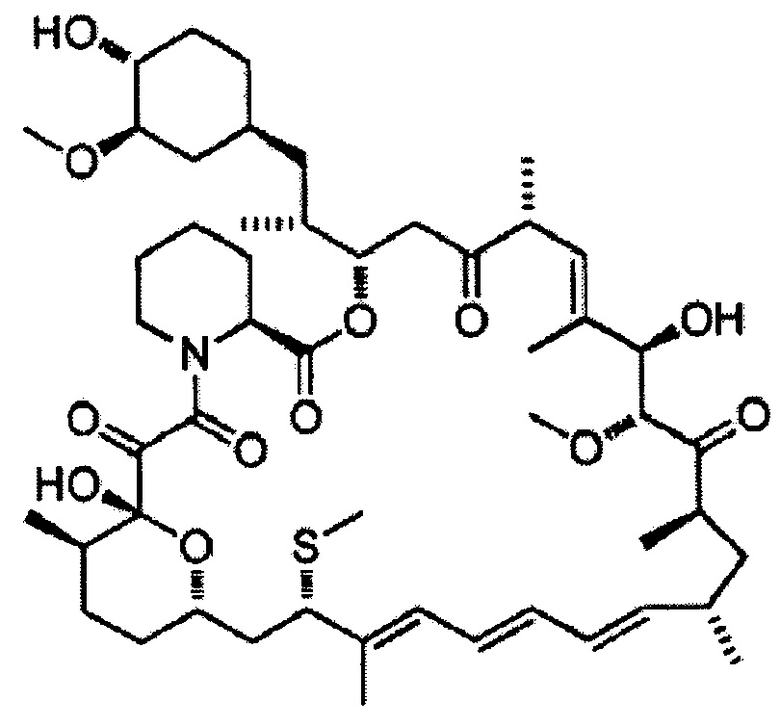
7-Тиометилрапамицин [Формула 12]
[0051]
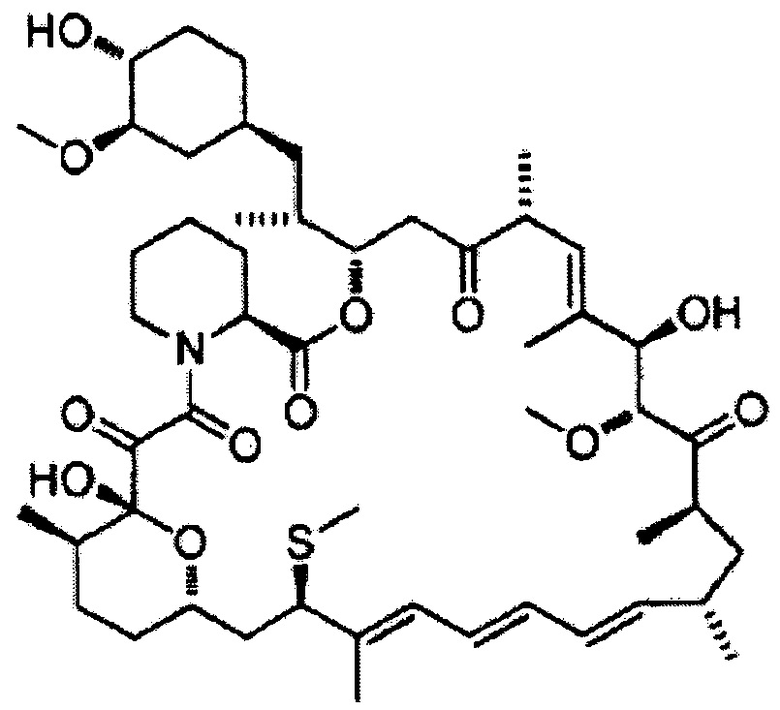
7-Эпитиометилрапамицин [Формула 13]
[0052]

7-Деметоксирапамицин [Формула 14]
[0053]
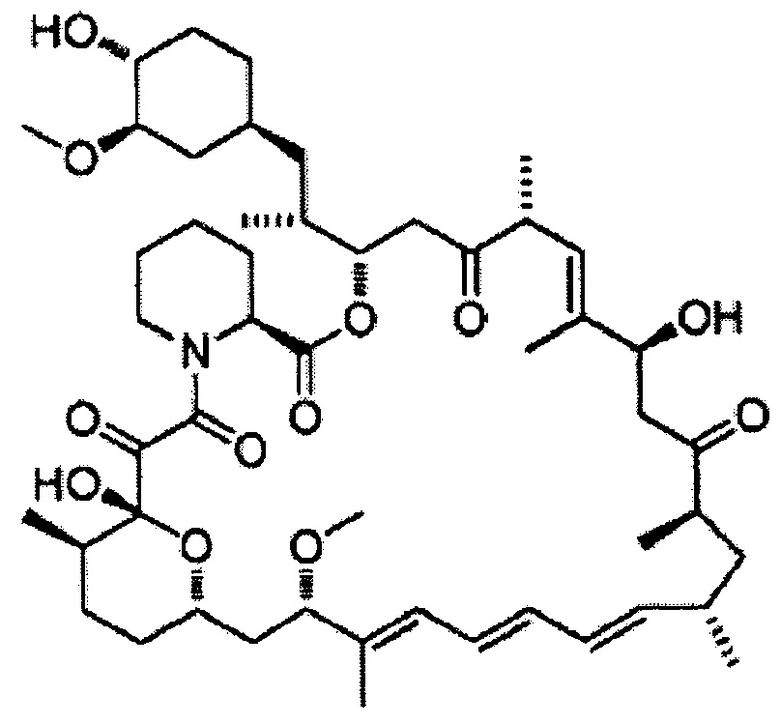
32-Деметоксирапамицин [Формула 15]
[0054] Предпочтительными конкретными примерами настоящего соединения является сиролимус или дефоролимус, и сиролимус является особенно предпочтительным.
[0055] Настоящее соединение или его фармацевтически приемлемая соль может быть получена согласно обычному способу в области химии органического синтеза и в частности, что касается сиролимуса, может быть использован коммерчески доступный от LKT Laboratories, Inc., (Catalog number: R0161). Кроме того, что касается дефоролимуса, он может быть получен согласно способу, описанному в JP 2005-516065A.
[0056] Фармацевтически приемлемая соль настоящего соединения может быть представлена, в качестве примера, солью с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, азотная кислота, серная кислота и фосфорная кислота; солью с органической кислотой, такой как уксусная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, лимонная кислота, винная кислота, адипиновая кислота, глюконовая кислота, глюкогептоновая кислота, глюкуроновая кислота, терефталевая кислота, метансульфоновая кислота, молочная кислота, гиппуровая кислота, 1,2-этандисульфоновая кислота, изетионовая кислота, лактобионовая кислота, олеиновая кислота, памоевая кислота, полигалактуроновая кислота, стеариновая кислота, танниновая кислота, трифторметансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, лаурилсульфат, метилсульфат, нафталинсульфоновая кислота и сульфосалициловая кислота; солью четвертичного аммония с метилбромидом и метилйодидом; и солью с ионом галогена, включая ион брома, ион хлора и ион йода.
[0057] Также настоящее соединение или фармацевтически приемлемая соль может быть получена в форме гидрата или сольвата.
[0058] Когда настоящее соединение или его фармацевтически приемлемая соль существует в форме геометрического изомера или оптического изомера, данный(ые) изомер(ы) или его(их) соль также входит(ят) в объем настоящего изобретения. Кроме того, когда в настоящем соединении или его фармацевтически приемлемой соли существует протонный таутомеризм, данный(ые) таутомер(ы) или его(их) соль также включен(ы) в объем настоящего изобретения.
[0059] Когда кристаллический полиморфизм и кристаллическая полиморфная группа (кристаллическая полиморфная система) существует в настоящем соединении или фармацевтически приемлемой соли (включая гидрат или сольват), эти кристаллические полиморфы и кристаллическая полиморфная группа (кристаллическая полиморфная система) также включены в объем настоящего изобретения. В данном описании кристаллическая полиморфная группа (кристаллическая полиморфная система) означает кристаллическую форму на соответствующих стадиях, когда кристаллическая форма этих кристаллов изменяется в зависимости от условий и параметров получения, образования кристаллов, сохранения и т.д. (при этом их состояние после составления в композицию также включено в указанные выше состояния), и всех процессов.
[0060] Настоящее соединение или его фармацевтически приемлемая соль может быть использовано при профилактике и/или лечении дисфункции мейбомиевых желез (MGD).
[0061] Определением дисфункции мейбомиевых желез (MGD) является, например, "состояние, при котором функция мейбомиевых желез является причиной распространения патологических изменений, вызванной ею, и сопровождается хроническим глазным дискомфортом". В данном описании "состояние, при котором функция мейбомиевых желез является причиной распространения патологических изменений" означает, что, например, незначительные патологические изменения в мейбомиевых железах определены как при халязионе, внутреннем ячмене и т.д., но патологические изменения в мейбомиевых железах, такие как телеангиоэктазия, обструкция выводных протоков мейбомиевых желез и т.д., определяются при диффузионных процессах. Также MGD классифицирована как тип MGD сниженной секреции (состояние сниженной слезопродукции) и тип MGD повышенной секреции (состояние высокой слезопродукции), в дополнение к типу MGD сниженной секреции (состояние сниженной слезопродукции MGD), они могут быть представлены как "гипосекреторная MGD (мейбомиевая гипосекреция)" и "обструктивная MGD (обструкция мейбомиевых желез)".
[0062] При типе MGD сниженной секреции, секреция липидов мейбомиевых желез снижается при сужении выводных протоков мейбомиевых желез и т.д. Также, при типе MGD повышенной секреции, секреция липидов мейбомиевых желез увеличивается посредством ряда причин.
[0063] С другой стороны, состояние, при котором сужение выводных протоков мейбомиевых желез может быть допустимо, но сопровождается без субъективных симптомов, иногда называют, например, "инфарктом мейбомиевых желез (уплотнением мейбомиевых желез)", и инфаркт мейбомиевых желез также включен в MGD по настоящему изобретению.
[0064] В качестве MGD, которая может быть подвергнута лечению настоящим соединением или его фармацевтически приемлемой солью, наиболее предпочтительным является тип MGD сниженной секреции.
[0065] Кроме того, как указано в предшествующем уровне, MGD иногда становится причиной синдрома "сухого глаза", и имеется возможность возникновения постериального блефарита.
[0066] MGD включают "MGD, которая сопровождается синдромом "сухого глаза" и/или постериальным блефаритом (сложная)", "MGD, которая становится причиной синдрома "сухого глаза" и/или постериального блефарита", "MGD, которая не сопровождается синдромом "сухого глаза" (не сложная)", "MGD, которая не становится причиной синдрома "сухого глаза", "MGD, которая не сопровождается постериальным блефаритом (не сложная)" и "MGD, которая не становится причиной постериального блефарита".
[0067] В настоящем изобретении "профилактическое и/или терапевтическое средство против MGD" означает медицинское средство, которое предотвращает и/или лечит MGD. В данном описании "лечить и/или предотвращать MGD" означает, что среди трех индексов для определения пациентов с MGD в представленном выше непатентном документе 1 (<1> субъективный симптом, такой как глазной дискомфорт, <2> признаки/полученные данные по патологическим изменениям вокруг выводных протоков мейбомиевых желез, таким как вазодилатация, и <3> признаки/полученные данные по закупорке выводных протоков мейбомиевых желез) может быть распознано по меньшей мере улучшение "признаков/полученных данных по закупорке выводных протоков мейбомиевых желез", предпочтительно могут быть определены улучшения в "признаках/полученных данных по патологическим изменениям вокруг выводных протоков мейбомиевых желез, такой как вазодилатация" и "признаки/полученные данные по закупорке в выводных протоках мейбомиевых желез".
[0068] Улучшение в "признаках/полученных данных по патологическим изменениям вокруг выводных протоков мейбомиевых желез, таком как вазодилатация", означает, что, например, телеангиоэктазия вокруг выводных протоков мейбомиевых желез подавлена и т.д.
[0069] В настоящем изобретении "подавление телеангиоэктазии вокруг выводных протоков мейбомиевых желез" означает, что, например, "признаки/полученные данные по патологическим изменениям вокруг выводных протоков мейбомиевых желез, признаки/полученные данные по вазодилатации" должны быть нормализованы.
[0070] Улучшение по "признакам/полученным данным по закупорке в выводных протоках мейбомиевых желез" означает, что например, закупорка выводных протоков мейбомиевых желез подавлена.
[0071] В настоящем изобретении "подавление обструкции мейбомиевых желез" означает, что, например, "признаки/полученные данные по закупорке в выводных протоках мейбомиевых желез" должны быть нормализованы.
[0072] В настоящем изобретении настоящее средство или настоящая композиция может содержать активный ингредиент, отличный от настоящего соединения или его фармацевтически приемлемой соли, и может содержать настоящее соединение или его фармацевтически приемлемую соль в качестве единственного активного ингредиента.
[0073] В настоящем изобретении настоящее средство или настоящая композиция могут быть введены пациенту, например, перорально или парентерально, и предпочтительно введены парентерально. В качестве парентеральной формы введения может быть представлено введение инстилляцией (включая инстилляцию офтальмологической мази), субконъюнктивальное введение, введение вглубь конъюнктивального мешка, введение во влагалище глазного яблока и т.д., и введение инстилляцией является особенно предпочтительным.
[0074] Кроме того, парентеральная форма введения может также включать, например, дермальное введение, и дермальным введением, согласно настоящему изобретению, является введение в кожу век, которое является особенно предпочтительным.
[0075] В настоящем изобретении препарат, содержащий соединение по настоящему изобретению или его фармацевтически приемлемую соль в качестве активного ингредиента, сформулирован в дозированную форму с подходящей фармацевтически приемлемой добавкой, если необходимо. Дозированная форма, подходящая для перорального введения, может быть представлена, например, в форме капсул, мелких гранул, гранул, порошков, пилюль, таблеток и т.д. Также дозированная форма, подходящая для парентерального введения, может быть представлена, например, глазными каплями, офтальмологическими мазями, мазями (включая офтальмологические мази), инъекциями, препаратами для интраокулярных имплантатов (включая точечную блокаду), интеркалирующими средствами, пластырями, гелями и т.д. Кроме того, она может быть получена использованием общепринятых методик, применяемых в данной области техники. Более того, настоящее соединение или его фармацевтически приемлемая соль могут быть сформулированы в виде DDS (система доставки лекарственного средства), такой как микросферы.
[0076] Как указано выше, настоящее средство или настоящую композицию предпочтительно вводят инстилляцией, так что предпочтительной дозированной формой настоящего средства или настоящей композиции являются глазные капли или офтальмологические мази, и глазные капли являются наиболее предпочтительными. Кроме того, когда настоящее соединение или его фармацевтически приемлемую соль получают в форме глазных капель, характеристиками глазных капель может быть растворенный тип раствора (растворимый тип глазных капель), суспензия (суспендированный тип глазных капель) или эмульсия (эмульсия глазных капель), предпочтительно суспензия или эмульсия.
[0077] Так же, как указано выше, настоящее средство или настоящую композицию предпочтительно вводят в кожу век, так что предпочтительной дозированной формой настоящего средства или настоящей композиции являются мази (включая офтальмологические мази).
[0078] К настоящему соединению или его фармацевтически приемлемой соли может быть добавлен эксципиент, необязательно выбранный, например, из такого как микрокристаллическая целлюлоза, лактоза, глюкоза, D-маннит, безводный двухосновный фосфат кальция, крахмал и сахароза; дезинтегратор, такой как карбоксиметилцеллюлоза, кальцийкарбоксиметилцеллюлоза, натрийкроскармеллоза, кросповидон, крахмал, частично предварительно желатинизированный крахмал и низкой степени замещения гидроксипропилцеллюлоза; связующее вещество, такое как гидроксипропилцеллюлоза, этилцеллюлоза, гуммиарабик, крахмал, частично предварительно желатинизированный крахмал, поливинилпирролидон и поливиниловый спирт; лубрикант, такой как стеарат магния, стеарат кальция, тальк, гидратированный диоксид кремния и гидрогенизированное масло; покрывающий агент, такой как рафинированный белый сахар, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза и поливинилпирролидон; корригент, такой как лимонная кислота, аспартам, аскорбиновая кислота и ментол, для получения капсул, мелких гранул, гранул, порошков, пилюль или таблеток.
[0079] В настоящем изобретении глазные капли могут быть получены путем выбора и использования, например, масляного компонента, такого как триглицерид жирной кислоты со средней цепью (MCT); вещества, придающего изотоничность, такого как хлорид натрия, хлорид калия и глицерин; буферирующего агента, такого как фосфат натрия, ацетат натрия и ε-аминокапроновая кислота; поверхностно-активного вещества, такого как тилоксапол, полоксамер 188, моноолеат полиоксиэтиленсорбитана, полиоксилстеарат 40 и отвержденное полиоксиэтиленкасторовое масло; стабилизатора, такого как цитрат натрия и эдетат натрия; консерванта, такого как бензалконийхлорид и парабен, в зависимости от необходимости. pH глазных капель может находиться в интервале, приемлемом для офтальмологического препарата, и предпочтительно он составляет интервал от 4 до 8.
[0080] В настоящем изобретении офтальмологические мази или мази (включая офтальмологические мази) могут быть получены использованием, как правило, основы, например, белого вазелина, жидкого парафина и т.д.
[0081] В настоящем изобретении инъекции могут быть получены путем выбора и использования, например, вещества, придающего изотоничность, такого как хлорид натрия; буферирующего агента, такого как фосфат натрия; поверхностно-активного вещества, такого как моноолеат полиоксиэтиленсорбитан; загустителя, такого как метилцеллюлоза, в зависимости от необходимости.
[0082] В настоящем изобретении препарат для интраокулярного имплантата может быть получен использованием, например, биоразлагаемого полимера, такого как полимолочная кислота, полигликолевая кислота, сополимер молочной кислоты-гликолевой кислоты и гидроксипропилцеллюлоза.
[0083] В настоящем изобретении интеркалирующие средства могут быть получены измельчением и смешиванием, например, биоразлагаемого полимера, такого как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксивиниловый полимер и полиакриловая кислота, с настоящим соединением, и сжатием литьем данного порошка и, если необходимо, эксципиента, связующего, стабилизатора и/или с использованием регулятора pH.
[0084] В настоящем изобретении вводимая доза настоящего соединения или его фармацевтически приемлемой соли может необязательно изменяться в зависимости от дозированной формы, тяжести симптомов, возраста или массы тела пациента и решения лечащего врача, и т.д., и, например, она может вводиться взрослому пациенту, как правило, от 0,000001 до 1000 мг один раз в день или разделена на несколько раз.
[0085] Когда настоящее соединение или его фармацевтически приемлемая соль применяется на глазах в виде глазных капель, например, глазных капель с концентрацией активного ингредиента от 0,0001 до 1% (масс./об.), предпочтительно 0,001-1% (масс./об.), более предпочтительно 0,01-0,5% (масс./об.), они могут применяться на глазах взрослого пациента один раз в день или разделены на несколько раз, предпочтительно 1-2 раза в день, более предпочтительно один раз в день.
[0086] Когда настоящее соединение или его фармацевтически приемлемая соль применяется на глазах (инстилляция) в форме офтальмологической мази или нанесением мази на кожу век (включая офтальмологические мази), например, офтальмологической мази с концентрацией активного ингредиента 0,0001-1% (масс./масс.), предпочтительно 0,001-1% (масс./масс.), более предпочтительно 0,01-0,5% (масс./масс.), ее можно применять на глазах (инстилляция) или наносить на кожу век взрослого пациента один раз в день или разделять на несколько раз.
[0087] Когда настоящее соединение или его фармацевтически приемлемую соль вводят в виде инъекции, например, инъекции, содержащей 0,000001-1000 мг активного ингредиента, ее можно вводить взрослому пациенту один раз в день или разделять на несколько раз.
[0088] Когда настоящее соединение или его фармацевтически приемлемую соль вводят в виде препарата для интраокулярного имплантата, например, препарата для интраокулярного имплантата, содержащего 0,000001-1000 мг активного ингредиента, он может быть имплантирован взрослому пациенту.
[0089] Когда настоящее соединение или его фармацевтически приемлемую соль вводят в виде интеркалирующего средства, например, интеркалирующего средства, содержащего 0,000001-1000 мг активного ингредиента, он может быть вставлен взрослому пациенту.
[0090] В следующем показаны результаты фармакологических тестов и примеры препаратов, при этом данные примеры предназначены для лучшего понимания настоящего изобретения и не ограничивают объема настоящего изобретения.
Примеры
[0091] [Тест с использованием полного адъюванта Фрейнда, введенного кролику]
С использованием полного адъюванта Фрейнда, введенного кролику, распознавали телеангиоэктазию вокруг выводных протоков мейбомиевых желез и обструкцию выводных протоков мейбомиевых желез, которые аналогичны признакам/полученным данным MGD. Исследовали воздействия сиролимуса, который представлял пример настоящего соединения, на телеангиоэктазию и обструкцию (см. JP 2014-024835A).
[0092] (Получение образца)
0,1% (масс./об.) суспензия сиролимуса: ее получали суспендированием в 0,01% (масс./об.) гидроксипропилметилцеллюлозе. При этом использовали сиролимус, который был закуплен у LKT Laboratories, Inc., (Catalog number: R0161) (то же самое и в следующих примерах).
[0093] (Методика тестирования)
10 мкл полного адъюванта Фрейнда вводили в правое верхнее веко (3 порциями) самцам около 2 кг японских белых кроликов, соответственно. На 4 день после индуцирования обследовали правое верхнее веко с использованием щелевой лампы вокруг выводных протоков мейбомиевых желез, оценивали телеангиоэктазию и обструкцию выводных протоков мейбомиевых желез.
[0094] Кроме того, в отношении оценки телеангиоэктазии, согласно критериям в следующих таблицах 1 и 2, край века верхнего века в равной степени разделяли на три части - на сторону уха, центральную часть и на сторону носа, оценку телеангиоэктазии вокруг выводных протоков мейбомиевых желез проводили в отношении соответствующих частей, и сумму баллов из трех частей рассчитывали как оценку одного глаза. В данном описании присутствие или отсутствие расширения капилляров оценивали по состоянию капилляров, которые обычно не могут быть обнаружены невооруженным глазом, обнаруживаются ли они или нет в результате расширения диаметра кровеносного сосуда. Также присутствие или отсутствие обструкции выводных протоков мейбомиевых желез оценивали по состоянию выводных протоков мейбомиевых желез, являются ли они мутными или нет.
[0095]
[0097] Кроликов распределяли по группам, на группу с введением физиологического раствора и группу с введением 0,1% суспензии сиролимуса, и тестировали по 7 или 8 глаз в каждой группе так, чтобы колебания значений средней величины соответствующих оценок становились небольшими. На 5 день после индуцирования физиологический солевой раствор (50 мкл/глаз, дважды в день) или 0,1% суспензию сиролимуса (50 мкл/глаз, дважды в день) закапывали в правый глаз в течение 10 дней. На 11 и 15 дни после индуцирования выводные протоки вокруг мейбомиевых желез правых верхних век обследовали с использованием щелевой лампы, оценивая, таким образом, телеангиоэктазию и измеряя число обструктивных выводных протоков.
[0098] (Результаты тестирования)
Результаты тестирования (оценка телеангиоэктазии и среднее значение числа обструктивных выводных протоков) показаны в таблице 3.
[0099]
[0100] (Обсуждение)
0,1% суспензия сиролимуса снижала оценку телеангиоэктазии вокруг выводных протоков мейбомиевых желез и число обструктивных выводных протоков. То есть, поскольку сиролимус устраняет патологические изменения мейбомиевых желез, это показывает, что настоящее соединение или его фармацевтически приемлемая соль обладает лечебным эффектом в отношении MGD.
[0101] [Тест с использованием корма HR-AD, которым кормили голых мышей]
Известно, что вскормленные кормом HR-AD Hos: HR-1 серия голых мышей могут быть исследованы на обструкцию выводных протоков мейбомиевых желез по аналогичным признакам/полученным данным MGD (патентная заявка Японии № 2012-137778). Таким образом, воздействия сиролимуса и дефоролимуса, которые являются репрезентативными примерами настоящих соединений, исследовали на обструкцию.
[0102] (Получение образца)
0,1% (масс./об.) суспензия сиролимуса: ее получали суспендированием в 0,01% (масс./об.) гидроксипропилметилцеллюлозе.
0,1% (масс./об.) суспензия дефоролимуса: ее получали суспендированием в 0,1% (масс./об.) гидроксипропилметилцеллюлозе. Кроме того, дефоролимус, использованный в настоящем тесте, получали согласно способу, описанному в JP 2005-516065A.
[0103] (Методика тестирования)
Шестинедельных самок Hos: HR-1 серии голых мышей, разбивали по группам, на группу из 5 мышей, вскармливаемых нормальным кормом (корм CRF-1, доступный от Oriental Yeast Co., Ltd.), и группу из 15 мышей, вскармливаемых кормом HR-AD (доступный от Nosan Corporation), и кормили нормальным кормом или кормом HR-AD, соответственно, которые давали спонтанно. На 28 день с начала кормления обследовали выводные протоки мейбомиевых желез с использованием щелевой лампы и измеряли число обструктивных выводных протоков у восьми выводных протоков мейбомиевых желез в центре верхнего века. При этом присутствие или отсутствие обструкции выводных протоков мейбомиевых желез оценивали состоянием выводных протоков мейбомиевых желез, являются ли они мутными или увеличенными или нет (см. JP 2014-023526A).
[0104] Пятнадцать мышей группы кормления кормом HR-AD разбивали на группу введения физиологического солевого раствора, группу введения 0,1% суспензии сиролимуса и группу введения 0,1% суспензии дефоролимуса (5 мышей в каждой группе), и на 29 день с начала кормления капали в глаз физиологический солевой раствор (2 мкл/глаз, дважды в день), 0,1% суспензию сиролимуса (2 мкл/глаз, дважды в день) или 0,1% (масс./об.) суспензию дефоролимуса (2 мкл/глаз, дважды в день) в течение 28 дней. На 42 день и 56 день с начала кормления измеряли число обструкций выводных протоков мейбомиевых желез с использованием щелевой лампы.
[0105] (Результаты тестирования)
Результаты тестирования показаны в таблице 4.
[0106]
[0107] (Обсуждение)
0,1% суспензия сиролимуса и 0,1% суспензия дефоролимуса уменьшают число обструкций выводных протоков мейбомиевых желез. То есть, поскольку суспензия сиролимуса и суспензия дефоролимуса устраняет патологические изменения мейбомиевых желез, это показывает, что настоящие соединения или их фармацевтически приемлемая соль обладают лечебным эффектом в отношении MGD.
[0108] [Примеры получения]
Лекарственные средства по настоящему изобретению более конкретно поясняются со ссылкой на примеры получения, но настоящее изобретение не ограничивается только этими примерами получения.
[0109] Пример рецептуры 1: Глазные капли (0,1% (масс./об.))
В 100 мл
[0110] К очищенной стерилизованной воде добавляли сиролимус и другие, приведенные выше компоненты, отличные от него, и смесь тщательно смешивали с получением глазных капель. Характеристиками настоящих глазных капель являлась эмульсия. Путем изменения формулирования количества сиролимуса получали глазные капли с концентрацией сиролимуса 0,05% (масс./об.), 0,5% (масс./об.) или 1% (масс./об.).
[0111] Пример рецептуры 2: Глазные капли (0,1% (масс./об.))
В 100 мл
[0112] К очищенной стерилизованной воде добавляли дефоролимус и другие, приведенные выше компоненты, отличные от него, и смесь тщательно смешивали с получением глазных капель. Характеристиками настоящих глазных капель являлась эмульсия. Путем изменения формулирования количества дефоролимуса получали глазные капли с концентрацией дефоролимуса 0,05% (масс./об.), 0,5% (масс./об.) или 1% (масс./об.).
[0113] Пример рецептуры 3: Офтальмологическая мазь или мазь (включая офтальмологическую мазь) (1% (масс./масс.))
В 100 г
[0114] Сиролимус добавляли в равномерно расплавленный белый вазелин и жидкий парафин, и смесь тщательно смешивали и затем градиентно охлаждали с получением офтальмологической мази или мази (включая офтальмологическую мазь). Путем изменения формулирования количества сиролимуса получали офтальмологическую мазь или мазь (включая офтальмологическую мазь) с концентрацией сиролимуса 0,05% (масс./масс.), 0,1% (масс./масс.) или 0,5% (масс./масс.).
[0115] Пример рецептуры 4: Офтальмологическая мазь или мазь (включая офтальмологическая мазь) (1% (масс./масс.))
В 100 г
[0116] Дефоролимус добавляли в равномерно расплавленный белый вазелин и жидкий парафин, и смесь тщательно смешивали и затем градиентно охлаждали с получением офтальмологической мази или мази (включая офтальмологическую мазь). Путем изменения формулирования количества дефоролимуса получали офтальмологическую мазь или мазь (включая офтальмологическую мазь) с концентрацией дефоролимуса 0,05% (масс./масс.), 0,1% (масс./масс.) или 0,5% (масс./масс.).
Промышленная применимость
[0117] Как ясно видно из результатов тестов с использованием полного адъюванта Фрейнда, введенного крысам и вскормленным кормом HR-AD голым мышам, сиролимус и дефоролимус подавляют обструкцию мейбомиевых желез, таким образом, настоящие соединения или их фармацевтически приемлемая соль могут применяться в качестве профилактического и/или терапевтического средства против MGD.
Группа изобретений относится к области медицины и фармацевтики. Первый объект представляет собой офтальмологическое средство для профилактики и/или лечения дисфункции мейбомиевых желез в форме глазных капель, содержащее от 0,01 до 0,5% масс./об. сиролимуса или его фармацевтически приемлемой соли в качестве единственного активного ингредиента, где глазные капли представляют собой суспензию. Второй и третий объекты – способ профилактики и/или лечения дисфункции мейбомиевых желез, включающий глазное введение средства в форме глазных капель, где глазные капли представляют собой суспензию, содержащую от 0,01 до 0,5% масс./об. сиролимуса или его фармацевтически приемлемой соли в качестве единственного активного ингредиента, где указанное средство вводят в глаза 2 раза в день. Технический результат заключается в осуществлении профилактики и/или лечения дисфункции мейбомиевых желез с помощью средства по изобретению. 3 н. и 4 з.п. ф-лы, 4 табл., 3 пр.
1. Офтальмологическое средство для профилактики и/или лечения дисфункции мейбомиевых желез в форме глазных капель, содержащее от 0,01 до 0,5% масс./об. сиролимуса или его фармацевтически приемлемой соли в качестве единственного активного ингредиента, где глазные капли представляют собой суспензию.
2. Средство для профилактики и/или лечения по п.1, содержащее 0,1% масс./об. сиролимуса.
3. Средство для профилактики и/или лечения по любому из пп.1 или 2, где дисфункция мейбомиевых желез представляет собой состояние со сниженным выделением секрета мейбомиевых желез.
4. Способ профилактики и/или лечения дисфункции мейбомиевых желез, включающий глазное введение средства в форме глазных капель, содержащего от 0,01 до 0,5% масс./об. сиролимуса или его фармацевтически приемлемой соли в качестве единственного активного ингредиента, где глазные капли представляют собой суспензию.
5. Способ по п.4, где средство содержит 0,1% масс./об. сиролимуса.
6. Способ по любому из пп.4 или 5, где указанное средство вводят в глаза 2 раза в день.
7. Способ профилактики и/или лечения дисфункции мейбомиевых желез, включающий глазное введение средства в форме глазных капель, где глазные капли представляют собой суспензию, содержащую от 0,01 до 0,5% масс./об. сиролимуса или его фармацевтически приемлемой соли в качестве единственного активного ингредиента, где указанное средство вводят в глаза 2 раза в день.
| WO 2009025763 A2, 26.02.2009 | |||
| US 20120244177 A1, 27.09.2012 | |||
| US 20090221503 A1, 03.09.2009 | |||
| WO 2010044893 A1, 22.04.2010 | |||
| WO 9402136 A1, 03.02.1994 | |||
| CA 2937492 A1, 20.05.2010 | |||
| BARBER L.D | |||
| et al | |||
| Phase III safety evaluation of cyclosporine 0.1% ophthalmic emulsion administered twice daily to dry eye disease patients for up to 3 years // |
Авторы
Даты
2019-12-18—Публикация
2014-03-12—Подача