Изобретение относится к медицине, а именно к кардиологии, педиатрии и акушерству-гинекологии и предназначено для прегравидарного прогнозирования риска формирования спорадических септальных врожденных пороков сердца без хромосомных заболеваний в последующих поколениях.
Спорадические септальные врожденные пороки сердца без хромосомных заболеваний (ВПС) остаются ведущей патологией среди всех врожденных аномалий развития плода (http://www.eurocat-network.eu; Dray, Е. М., & Marelli, A. J. (2016). Changing Epidemiology of Congenital Heart Disease. In Congenital Heart Disease and Adolescence (pp. 3-14). Springer International Publishing). На сегодняшний день, несмотря на высокие достижения в кардиологии и генетике, этиология спорадических септальных врожденных пороков сердца без хромосомных заболеваний до сих пор неизвестна. (Yu D, Feng Y, Yang L, et al. Maternal Socioeconomic Status and the Risk of Congenital Heart Defects in Offspring: A Meta-Analysis of 33 Studies. Wallace GR, ed. PLoS ONE. 2014; 9(10):el 11056. doi:10.1371/journal.pone.0111056.). С помощью современных молекулярно-генетических технологий удалось показать, что лишь в 10% случаев врожденные пороки сердца возникают в результате спонтанных генетических мутаций, которых нет у родителей, братьев и сестер. Предполагается, что большая часть пороков имеет мультифакториальную природу с участием в их развитии как генетических, так и средовых факторов. В данном случае речь идет об ассоциативном влиянии комплекса повреждающих экзо- и эндогенных факторов в критические периоды развития эмбриона или отдельных его органов (Radhika S. Ganu, R. Alan Harris, Kiara Collins and Kjersti M. Aagaard Early Origins of Adult Disease: Approaches for Investigating the Programmable Epigenome in Humans, Nonhuman Primates, and Rodents ILAR J (2012) 53 (3-4): 306-321. doi: 10.1093/ilar.53.3-4.306), что можно представить через эпигенетическое влияние различных ксенобиотиков и метаболитов на процессы эмбриогенеза. Широко обсуждается вопрос о пост-трансляционных модификациях в белках, участвующих в регуляции эмбриогенеза сердца (Kiersten A Liddy, 1 Melanie Y White, 1,2 and Stuart J Cordwell 1,2 Functional decorations: post-translational modifications and heart disease delineated by targeted proteomics Genome Med. 2013; 5(2): 20. Published online 2013 Feb 28. doi: 10.1186/gm424 PMCID: PMC3706772; Oyama K, El-Nachef D, Zhang Y, Sdek P and MacLellan WR (2014) Epigenetic regulation of cardiac myocyte differentiation. Front. Genet. 5:375. doi: 10.3389/fgene.2014.00375). Формирование ВПС непосредственно связано с материнским микроокружением, участвующим, как в синтезе и метаболизме новых эпигенетических факторов (Aagaard-Tillery KM, Grove K, Bishop J, Ke X, Fu Q, McKnight R, Lane RH Developmental origins of disease and determinants of chromatin structure: Maternal diet modifies the primate fetal epigenome. J Mol Endocrinol. 2008. 41: 91-102; Kumar H, Lund R, Laiho A, Lundelin K, Ley RE, Isolauri E, Salminen S. 2014. Gut microbiota as an epigenetic regulator: pilot study based on whole-genome methylation analysis. mBio 5(6):e02113-14. doi: 10.1128/mBio.02113-14), так и в защите эмбриона от них и от факторов окружающей среды (Хаитов Р.М., Алексеев Л.П., Кофиади И.А. Роль иммуногенетики в решении фундаментальных и прикладных задач персонализированной медицины // Медицина экстремальных ситуаций. - 2016. - №. 3 (57). Сепиашвили Р.И. Функциональная система иммунного гомеостаза // Аллергология и иммунология. - 2015. - Т. 16. - №. 1. - С. 91-100).
Известен способ прогнозирования риска формирования ВПС в зависимости от таких медико-социальных факторов, как образ жизни матери (курение, алкоголизм), статус семьи (полная/неполная семья), наличия медицинских критериев в анамнезе матери: инфекции TORCH-комплекса, медицинские аборты, 4-х и более беременностей, обострения хронических заболеваний и анемии у матери во время беременности (Сафиуллина А.Р., Яковлева Л.В. Анализ факторов риска развития врожденных септальных пороков сердца // Современные проблемы науки и образования. - 2012. - №4; URL: http://www.science-education.ru/ru/article/view?id=6678). В исследовании достоверно показана значимость анализируемых прогностических критериев в формировании ВПС в последующих поколениях. Однако, для данного способа прогнозирования не были определены чувствительность, специфичность и прогностическая значимость, что значительно снижает качество и достоверность модели.
Неоднократно показано, что реализация тератогенеза связана с иммунными нарушениями в системе «мать-эмбрион/плод». Эмбриогенез сердца приходится на 3-5 неделю гестации, а влияние различных тератогенов, мутагенов в этот временной промежуток приводит к формированию большого количества комбинированных и изолированных врожденных пороков сердца.
Проведены собственные исследования влияния материнских генов HLA-G 3'utr 14-bp ins/del на формирование септальных ВПС в последующем поколении (Шабалдин А.В., Цепокина А.В., Шмулевич С.А., Понасенко А.В., Крюков П.М., Шабалдина Е.В. Особенности распределения аллелей и генотипов HLA-G 3'utr 14-bp ins/del у женщин, имеющих детей с врожденными пороками сердца или репродуктивные потери в ранние сроки гестации // Медицинская иммунология. 2017. Т. 19. №6. С. 763-770). В работе показана положительная ассоциативная связь материнского гомозиготного минориного генотипа HLA-G 3'utr 14-bp ins/ ins с репродуктивными потерями, но не с врожденными пороками сердца. Эти данные показывают значимость иммунных нарушений в системе «мать-эмбрион/плод» на вынашивание беременности, а определение родительских управляемых иммунных факторов может стать основой для создания эффективной программы прогнозирования и профилактики ВПС.
Наиболее близким к заявляемому, является способ прегравидарного прогнозирования риска формирования септальных врожденных пороков сердца у плода [Пат. РФ 2617249 МПК G01N 33/53 Способ прогнозирования на прегравидарном этапе риска формирования септальных форм врожденных пороков сердца у плода / А.В. Шабалдин, С.А. Шмулевич, А.В. Цепокина, М.В. Табакаев; заявитель и патентообладатель патентообладатель Федеральное гос. бюдж. научное уч-е «Научно-иссл. инс-т компл. проблем сердечно-сосудистых заболеваний» (RU). - №2016111571/14; заявл. 28.03.16; опубл. 24.04.17, Бюлл. №12. - 11 с.], при котором на прегравидарном этапе проводят генетическое типирование HLA-DRB1* супругов, детерминирующих ограничения иммунных взаимодействий в системе «мать-эмбрион/плод», и рассчитывают вероятность риска формирования септального ВПС по формуле логистической регрессии. Полученная модель прогнозирования обеспечивает чувствительность решающего правила прогноза - 44,5%, чувствительность теста - 98,9%, а специфичность - 94,5%.
Основной недостаток данного метода связан с тем, что он основан на генетическом прогнозировании и тем самым не предусматривает возможности иммунной коррекции в семейной паре для улучшения их репродуктивной функции, в том числе с позиции профилактики тератогенеза.
Если принять во внимание, что иммунные взаимодействия по антигенам тканевой совместимости между материнским иммунным окружением и тканями полуаллогенного эмбриона определяют выраженность иммунной защиты против ксенобиотиков с тератогенным эффектом (Сотникова, Н.Ю. Иммунные аспекты беременности // Russian journal of immunology. - 2005. - V. 9(2). - С. 15-16; Иммунологическая загадка беременности / Под редакцией Н.Ю. Сотниковой // Иваново: Издательство МИК. - 2005. - 276 с.), то можно ограничиться исследованиями этих взаимодействий посредством краткосрочной смешанной культуры лимфоцитов (СКЛ) супругов. Лимфоциты женщины в этом тесте будут выступать прототипом иммунокомпетентных клеток материнского иммунного микроокружения эмбриона, а лимфоциты супруга - прототипом клеток эмбриона/плода, несущие антигены главного комплекса тканевой совместимости (для человека HLA).
Техническим результатом изобретения является повышение точности прогнозирования риска формирования спорадических септальных врожденных пороков сердца у плода на прегравидарном этапе, за счет определения прогностических коэффициентов экспрессии поверхностных маркеров лимфоцитов HLA-DR, детерминирующих нарушения в аллогенных иммунных взаимодействиях супругов и расчета вероятного риска с использованием формулы логистической регрессии.
Для выявления общепопуляционных критериев вероятности риска формирования спорадических септальных ВПС без хромосомных заболеваний у 41 семейной пары, планирующих беременность, проведено иммунологическое исследование СКЛ в различных питательных средах - с 15% эмбриональной телячьей сывороткой и в среде с дополнительной 10% женской аутосывороткой. Полученные данные были проверены при помощи логистической регрессии и выявлены три основные прогностические коэффициенты: коэффициент блокирования 10% женской аутосывороткой экспрессии CD3,HLA-DR на женских Т-лимфоцитах в женской СКЛ; эффективный коэффициент прироста экспрессии CD3,HLA-DR на женских Т-лимфоцитах в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ; эффективный коэффициент прироста экспрессии CD3, HLA-DR на женских В-лимфоцитах в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ, на 99,9% определяют риск формирования спорадических септальных ВПС в последующих поколениях (таблица 1).

Так была выявлена отрицательная ассоциация с риском формирования ВПС коэффициента блокирования (КБ) женской аутосывороткой экспрессии CD3,HLA-DR на женских Т-лимфоцитах в женской СКЛ и эффективного коэффициента прироста экспрессии CD3,HLA-DR на женских Т-лимфоцитах (ЭКПCD3+) в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ, то есть чем ниже в семейной паре данные коэффициенты, тем выше вероятность формирования у их детей септальных спорадических ВПС. Напротив, для эффективного коэффициента прироста экспрессии CD3,HLA-DR на женских В-лимфоцитах (ЭКПCD3-) в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ была получена положительная ассоциация, указывающая на то, что чем выше данный коэффициент в семейной паре, тем выше риск формирования ВПС у их детей.
Все действия по подготовке краткосрочной смешанной культуры лимфоцитов (СКЛ) супругов выполняли в боксированном помещении для культуральных работ, в ламинарном шкафу, предназначенном для работ с микроорганизмами 3-4 группы патогенности. Лимфоцитарную взвесь каждого из супругов получали на градиенте плотности 1,077. Для женских лимфоцитов использовали антитела, конъюгированные с флуоресцентным красителем перидинин-хлорофиллом (РС-5), а для мужских - РС-7 Biolegend (USA). Далее пробирки с женскими и мужскими лимфоцитами и с соответствующими конъюгатами моноклональных антител с флуоресцентными красителями инкубировали в течение 15 минут при комнатной температуре в темноте. После однократной отмывки в пробирки женских и мужских лимфоцитов вносили по 1000 мкл среды, содержащей эмбриональную телячью сыворотку (ЭТС) из расчета 15%. Полученную среду осторожным пипетированием в объеме 500 мкл клеточной взвеси переносили в отдельные пробирки куда дополнительно вводили женскую аутосыворотку (А) из расчета 10%. Тем самым получали по две пробирки с женскими и мужскими лимфоцитами, одни из которых содержали лимфоциты в ростовой среде с 15% ЭТС, а другие - с дополнительным содержанием 10% женской аутосыворотки. Далее в пластиковые пробирки для проточной цитофлуориметрии (Beckman coulter, USA или Becton dickinson, USA) вносили лимфоциты (в концентрации 2000 клеток в мкл), как в среде с 15% ЭТС, так и с добавлением 10% аутосыворотки (в объеме 200 мкл). Все постановки дублировали, поэтому для каждого этапа использовали две пробирки. Первые две пробирки (№1 и №2) были предназначены для смешанной культуры лимфоцитов, поэтому в каждую пробирку (№1 и №2) вносили и смешивали лимфоциты мужчины и женщины в общем объеме по 100 мкл (конечный объем 200 мкл). В пробирки №3 и №4 вносили лимфоциты (200 мкл) женщины и это была монокультура лимфоцитов женщин. В пробирки №5 и №6, соответственно, вносили лимфоциты (200 мкл) мужчины (супруга) и эта - монокультура лимфоцитов мужчины. Аналогичную процедуру проводили для лимфоцитов с добавлением 10% аутосыворотки. Пробирки №7, 8 - СКЛ с добавлением 10% аутосыворотки; №9-10 - женская монокультура с 10% женской аутосывороткой и №11-12 - мужская монокультура с 10% женской аутосывороткой. Далее, закрыв, пробирки помещали в СО2 инкубатор на 2 часа при 37°С. После окончания инкубации проводили однократную отмывку лимфоцитов каждой пробирки.
На окончательном этапе выполняли окрашивание лимфоцитов (смешанной культуры и отдельных монокультур) с помощью конъюгатов флуоресцентных красителей (флуорисцеин изотиоцианат - FITC и фикоэритрин - РЕ) с моноклональными антителами к CD3,HLA-DR, добавляя в каждую пробирку по 5 мкл красителя (Beckman coulter, USA). Соотношение объема антител к количеству лимфоцитов, время и температура инкубаций соответствовали прилагаемым инструкциям к каждому конъюгированному моноклональному антителу. Инкубирование проводилось в течение 15 минут при комнатной температуре в темноте. После окончательной отмывки в каждую пробирку вносили раствор фиксатора OptiLyse (Beckman coulter, USA) в объеме 300 мкл.
Оценку экспрессии поверхностных маркеров лимфоцитов CD3, HLA-DR в краткосрочной смешанной культуре лимфоцитов супругов проводили на проточном цитофлуориметре Cytomics FC 500 с программным обеспечением СХР (Beckman Coulter, USA).
Для снятия результатов использовали специальный протокол проточной цитофлуориметрии с анализом гистограмм соответственно мужских и женских субпопуляций лимфоцитов CD3+HLADR+, CD3-HLADR+. Анализ проводился как в смешанной культуре лимфоцитов, так и в монокультурах; как в ростовой среде с добавление 15% ЭТС, так и в среде с добавлением 10% женской аутосыворотки.
При этом, в смешанной культуре лимфоцитов оценивали краткосрочное увеличение или уменьшение мембранной экспрессии CD3, HLA-DR на различных субпопуляциях лимфоцитов по отношению к базовой экспрессии этой молекулы в спонтанных культурах. Таким образом, рассчитывали коэффициент прироста экспрессии CD3,HLA-DR на женских Т-лимфоцитах (КПCD3+) и В-лимфоцитах (КПCD3-) в женской смешанной культуре лимфоцитов с добавлением 15% эмбриональной телячьей сыворотки (ЭТС) и в смешанной культуре лимфоцитов с 10% аутосывороткой (А).
КПCD3+Ж=((CD3+ЖСКЛ-CD3+ЖКОН)×100)/CD3+ЖКОН,
где CD3+ЖСКЛ - относительное число субпопуляции CD3+HLA-DR+ в женской смешанной культуре лимфоцитов с соответствующей ростовой средой, %;
CD3+ЖКОН - относительное число субпопуляции CD3+HLA-DR+ в женской монокультуре анализируемого донора, %;
КПCD3-Ж=((CD3-ЖСКЛ-CD3-Жкон.)×100)/CD3-ЖКОН,
где CD3-ЖСКЛ - относительное число субпопуляции CD3-HLA-DR+ в женской смешанной культуре В-лимфоцитов в соответствующей ростовой среде, %;
CD3-ЖКОН - относительное число субпопуляции CD3-HLA-DR+ в женской монокультуре анализируемого донора, %.
После чего, по аналогичным формулам рассчитывали те же коэффициенты для мужских Т- и В-лимфоцитов в мужской СКЛ как в среде с 15% ЭТС, так и в СКЛ с 10% женской аутосывороткой:
КПCD3+М=((CD3+МСКЛ-CD3+МКОН)×100/CD3+МКОН,
где CD3+МСКЛ - относительное число субпопуляции CD3+HLA-DR+ в мужской смешанной культуре лимфоцитов с соответствующей ростовой средой, %;
CD3+МКОН - относительное число субпопуляции CD3+HLA-DR+ в мужской монокультуре анализируемого донора, %;
КПCD3-М=((CD3-МСКЛ-CD3-Мкон.)×100)/CD3-МКОН,
где CD3-МСКЛ - относительное число субпопуляции CD3-HLA-DR+ в мужской смешанной культуре В-лимфоцитов в соответствующей ростовой среде, %;
CD3-МКОН - относительное число субпопуляции CD3-HLA-DR+ в мужской монокультуре анализируемого донора, %.
Следует отметить, что мембранная краткосрочная экспрессия молекул HLA-DR не связана с экспрессией соответствующих генов. Следовательно, изменение экспрессии HLA-DR также свидетельствует о краткосрочных мембранных реаранжировках HLA-DR под воздействие аллогенных межклеточных контактов.
Расчет коэффициента блокирования (КБ) 10% женской аутосывороткой экспрессии CD3,HLA-DR на женских Т-лимфоцитах в женской СКЛ, определяли как разницу коэффициентов прироста соответствующих субпопуляций, как в СКЛ с ЭТС, так и в СКЛ с добавлением 10% женской аутосыворотки:
КБ=((КПCD3+АЖ-КПCD3+ЭТСЖ)×100)/|КПCD3+ЭТСЖ|,
где КПCD3+АЖ - коэффициент прироста CD3+HLA-DR+ в женской СКЛ с 10% женской аутосывороткой;
КПCD3+ЭТСЖ - коэффициент прироста CD3+HLA-DR+ в женской СКЛ с ЭТС;
|КПCD3+ЭТСЖ| - модуль коэффициента прироста CD3+HLA-DR+ в СКЛ в ростовой среде с ЭТС. Модульное значение КП в этом элементе формулы необходимо для снятия отрицательного знака и отмены вычислительного значения, где деление отрицательного значения на отрицательное значение дает положительный знак и не отражает присутствующий блокирующий эффект женской аутосыворотки.
Отрицательное значение показателя КБ демонстрировало блокирующий эффект женской аутосыворотки на клеточные реакции в СКЛ, а положительное - стимулирующий.
Учитывая современные представления об иммунологии репродукции, признавали, что мужские лимфоциты не могут быть сенсибилизированы к женским молекулам тканевой совместимости и женские растворимые сывороточные факторы не имеют тропизма к клеточным реакциям мужских лимфоцитов и, соответственно, принимали реакции мужских лимфоцитов к женским - контрольным для данной семейной пары. Таким образом, рассчитывали эффективные коэффициенты прироста экспрессии (ЭКП) CD3,HLA-DR по следующей формуле:
ЭКП=((КПЖ-КПМ)×100)/|КПМ|,
где КПЖ - коэффициент прироста в клеточных реакциях «женщина против мужчины»,
КПМ - коэффициент прироста в клеточных реакциях «мужчина против женщины»,
|КПМ| - модуль коэффициента прироста в клеточных реакциях «мужчина против женщины».
Значение эффективного коэффициента прироста экспрессии CD3, HLA-DR на женских Т-лимфоцитах в женской СКЛ с ЭТС (КПCD3+ЭТСЖ) по отношению к соответствующей мужской СКЛ (КПCD3+ЭТСМ) рассчитывали как:
ЭКПCD3+=(КПCD3+ЭТСЖ-КПCD3+ЭТСМ)×100)/|КПCD3+ЭТСМ|,
где КПCD3+ЭТСЖ - коэффициент прироста в клеточных реакциях «женщина против мужчины» экспрессии HLA-DR на женских Т-лимфоцитах с фенотипом CD3+HLA-DR+ в ростовой среде с 15% ЭТС;
КПCD3+ЭТСМ - коэффициент прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских Т-лимфоцитах с фенотипом CD3+HLA-DR+ в ростовой среде с 15% ЭТС;
|КПCD3+ЭТСМ| - модуль коэффициента прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских Т-лимфоцитах с фенотипом CD3+HLA-DR+ в ростовой среде с 15% ЭТС.
Значения эффективного коэффициента прироста экспрессии CD3, HLA-DR на женских В-лимфоцитах (ЭКПCD3-) в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ:
ЭКПCD3-=(КПCD3-ЭТСЖ-КПCD3-ЭТСМ)×100)/|КПCD3-ЭТСМ|,
где КПCD3-ЭТСЖ - коэффициент прироста в клеточных реакциях «женщина против мужчины» экспрессии HLA-DR на женских В-лимфоцитах с фенотипом CD3-HLA-DR+ в ростовой среде с ЭТС;
КПCD3-HLAЭТСМ - коэффициент прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских В-лимфоцитах с фенотипом CD3-HLA-DR+ в ростовой среде с 15% ЭТС;
|КПCD3-ЭТСМ| - модуль коэффициента прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских В-лимфоцитах с фенотипом CD3-HLA-DR+ в ростовой среде с 15% ЭТС.
С учетом полученных значений прогностических коэффициентов, на основе логистической регрессии (метод Quasi-Newton), отражающей нелинейную зависимость бинарной переменной (семьи с детьми, имеющие ВПС - основная группа и семьи со здоровыми детьми - группа сравнения) от различных иммунных показателей, полученных в краткосрочной смешанной культуре лимфоцитов супругов, была получена формула для расчета вероятности риска формирования спорадического септального ВПС без хромосомных заболеваний в последующих поколениях:
Y=(EXP(Z)/(1+EXP(Z)))×100%,
при этом Y - вероятность риска формирования ВПС в последующих поколениях (%);
a Z=(0,678-(КБ×0,004)-(ЭКПCD3+×0,002)+(ЭКПCD3-×0,003)),
где КБ - коэффициент блокирования женской аутосывороткой экспрессии CD3+HLA-DR на женских Т-лимфоцитах в женской СКЛ;
ЭКПCD3+ - эффективный коэффициент прироста экспрессии CD3,HLA-DR на женских Т-лимфоцитах в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ;
ЭКПCD3- - эффективный коэффициент прироста экспрессии CD3,HLA-DR на женских В-лимфоцитах в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ.
Для выявленных в логистической регрессии предикторов спорадических септальных ВПС без хромосомных заболеваний была высчитана чувствительность и специфичность, как для отдельных предикторов, так и для уравнения определения риска формирования ВПС в целом (все предикторы). Данные представлены в таблице 2.
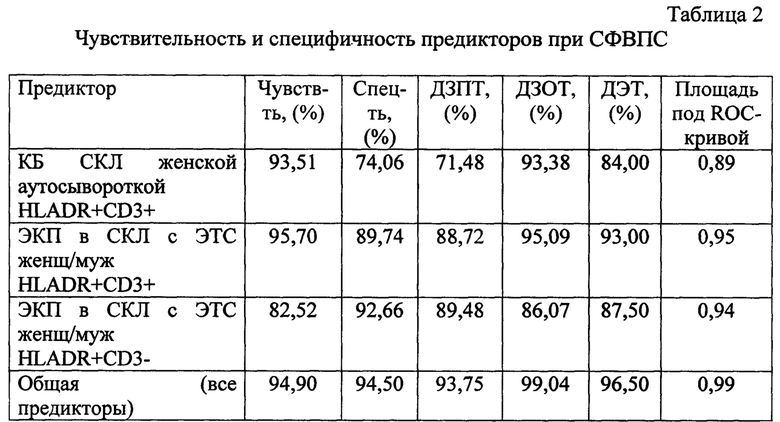
Примечание: ДЗПТ - диагностическая значимость положительного теста, ДЗОТ - диагностическая значимость отрицательного теста, ДЭТ - диагностическая эффективность теста.
Как видно из таблицы 2 диагностическая эффективность предложенного способа в целом составляет 94,9%.
Расчет коэффициентов прироста, коэффициента блокирования, эффективных коэффициентов прироста и вероятного риска формирования спорадических септальных ВПС без хромосомных заболеваний, может быть проведен в ручную, либо в программном обеспечении проточных цитофлуориметров с представлением результатов исследования в виде цифровых значений данных коэффициентов, включая конечный коэффициент риска формирования ВПС.
Кроме того, были получены данные о среднем популяционном значения коэффициента вероятности риска формирования спорадических септальных ВПС без хромосомных заболеваний в последующих поколениях (19,23%: 0,00; 49,72%). Соответственно, для прегравидарного скрининга спорадических септальных ВПС без хромосомных заболеваний учитывались величины индивидуальных коэффициентов вероятности риска превышающих 50%.
Апробация способа проведена на базе ООО «Современные медицинские технологии» г. Кемерово на 10 семейных парах, планирующих беременность. У двух семейных пар по формуле был рассчитана высокая степень риска (в пределах 60-90%) рождения ребенка с спорадическим септальным ВПС. Учет результатов родов, всех наблюдаемых семейных пар показал, что в выделенной группе риска по рождению детей с септальными ВПС таких детей родилось двое, что составило 100%, а в группе с отрицательным результатом скрининга таких детей не было (0%). Эти данные указывают на эффективность проведения прегравидарного скрининга для выявления группы риска по формированию спорадических септальных ВПС без хромосомных заболеваний.
Пример 1. Семейная пара. Женщина М-на Л., 21 года обратилась в ООО «Современные медицинские технологии» г. Кемерово с целью планирования беременности. При объективном обследовании выставлен диагноз - здорова. Мужчина (супруг) М-н А., 22 года жалоб не предъявляет, при объективном обследовании выставлен диагноз - здоров. Была проведена смешанная культура лимфоцитов супругов. Результаты исследования представлены ниже
Протокол исследования СКЛ с эмбриональной телячьей сывороткой супругов: женщина М-на Л. 21 год и мужчина М-на А., 22 года.

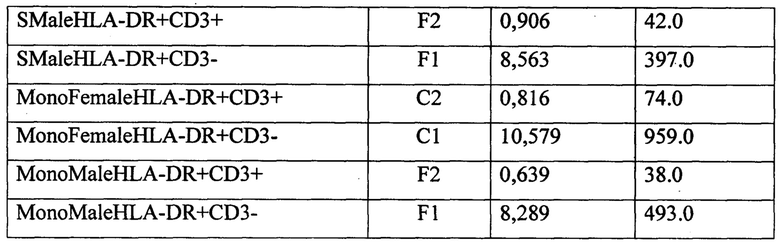
Примечание: SFemale - мужская смешанная культура лимфоцитов (МСКЛ), SMale - женская смешанная культура лимфоцитов (ЖСКЛ), MonoFemale - женская монокультура анализируемого донора (ЖКОН), MonoMale - мужская монокультура анализируемого донора (МКОН).
Протокол исследования СКЛ с 10% женской аутосывороткой супругов: женщина М-на Л. 21 год и мужчина М-на А., 22 года.
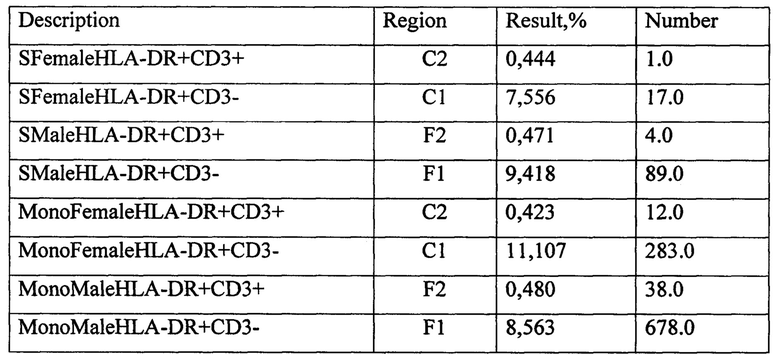
Примечание: SFemale - мужская смешанная культура лимфоцитов (МСКЛ), SMale - женская смешанная культура лимфоцитов (ЖСКЛ), MonoFemale - женская монокультура анализируемого донора (ЖКОН), MonoMale - мужская монокультура анализируемого донора (МКОН).
Проведены расчеты прогностических коэффициентов экспрессии CD3, HLA-DR на женских Т-лимфоцитах и В-лимфоцитах в женских СКЛ с 15% ЭТС и в СКЛ с 10% аутосывороткой, и те же коэффициенты для мужских Т-и В-лимфоцитов в мужской СКЛ.
Для женской СКЛ с 15% ЭТС были получены следующие коэффициенты прироста:
КПCD3+ЭТСЖ=((CD3+ЖСКЛ-CD3+ЖКОН)×100)/CD3+ЖКОН=((1,084-0,816)×100)/0,816=32,84%;
КПCD3-ЭТСЖ=((CD3-ЖСКЛ-CD3-ЖКОН)×100)/CD3-ЖКОН=((9,373-10,579)×100)/10,579=-11,39%.
Для мужской СКЛ с 15% ЭТС были получены следующие коэффициенты прироста:
КПCD3+ЭТСМ=((СD3+МСКЛ-CD3+МКОН.)×100)/CD3+КОН=((0,906-0,639)×100)/0,639=41,78%;
КПCD3-ЭТСМ=((CD3-МСКЛ-CD3-HLA-DR+кон.)×100)/CD3-МКОН=((8,563-8,289)×100)/8,289=3,31%.
Для женской СКЛ с 10% аутосывороткой были получены следующие коэффициенты прироста:
КПCD3+АЖ=((CD3+ЖСКЛ-CD3+ЖКОН)×100)/CD3+HLA-DR+кон=((0,444-0,423)×100)/0,423=4,96%;
Рассчитан коэффициент блокирования женской аутосывороткой экспрессии CD3, HLA-DR на женских Т-лимфоцитах в женской СКЛ.
КБ=((КПCD3+АЖ-КПCD3+ЭТСЖ)×100)/|КПCD3+ЭТСЖ|,=((4,96-32,84)×100)/32,84=-84,89%
На основании полученных данных был рассчитан эффективный коэффициент прироста экспрессии CD3, HLA-DR на женских Т-лимфоцитах (ЭКПCD3+) в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ.
ЭКПCD3+=((КПCD3+ЭТСЖ-КПCD3+ЭТСМ)×100)/|КПCD3+ЭТСМ|=((32,84-41,78)×100)/41,78=-21,39%
Далее был рассчитан эффективный коэффициент прироста экспрессии HLA-DR на женских В-лимфоцитах (ЭКПCD3-) в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ.
ЭКПCD3-=ЭКПCD3-=(КПCD3-ЭТСЖ-КПCD3-ЭТСМ)×100)/|КПCD3-ЭТСМ|=((_11,39-3,31)×100)/3,31=-444,11%.
На основании полученных коэффициентов провели расчет риска формирования спорадических септальных ВПС без хромосомных заболеваний в последующем поколении по формуле.
Y=(EXP(Z)/(1+EXP(Z)))×100%, где
Z=(0,678-(КБ×0,004)-(ЭКПCD3+×0,002)+(ЭКПCD3-×0,003))=(0,678-(-84,89×0,004)-(-21,39×0,002)+(-444,11×0,003))=-0,27
Y=(ЕХР(-0,27)/(1+ЕХР(-0,27)))×100%=27,58%
Выявлена низкая вероятность риска формирования спорадического септального ВПС без хромосомных заболеваний. При внутриутробном ультразвуковом скрининге дефекты межжелудочковой перегородки не визуализировались.
Пример 2. Семейная пара. Женщина С-кая В. 22 лет обратилась в ООО «Современные медицинские технологии» г. Кемерово с целью планирования беременности. После объективного обследования выставлен диагноз - здорова.
Мужчина (супруг) П-ов С., 24 лет жалоб не предъявляет, при объективном обследовании выставлен диагноз - здоров. В результате проведенного исследования получены следующие результаты:
Протокол исследования СКЛ с эмбриональной телячьей сывороткой супругов: женщина С-кая В, 22 года и мужчина П-ов С., 24 года.
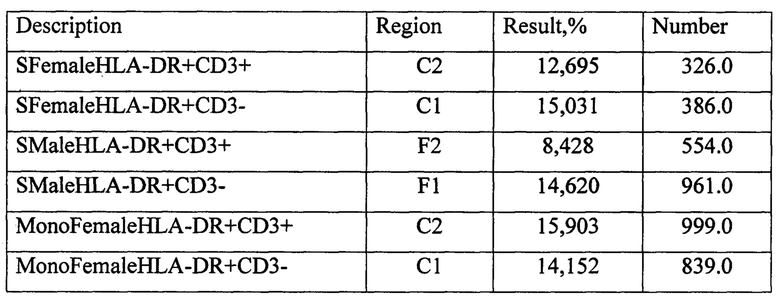
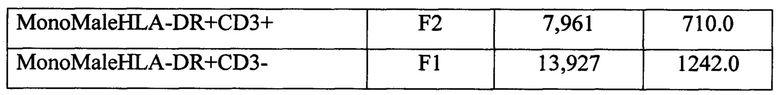
Примечание: SFemale - мужская смешанная культура лимфоцитов (МСКЛ), SMale - женская смешанная культура лимфоцитов (ЖСКЛ), MonoFemale - женская монокультура анализируемого донора (ЖКОН), MonoMale - мужская монокультура анализируемого донора (МКОН).
Протокол исследования СКЛ с 10% женской аутосывороткой супругов: женщина С-кая В., 22 года и мужчина П-ов С., 24 года.
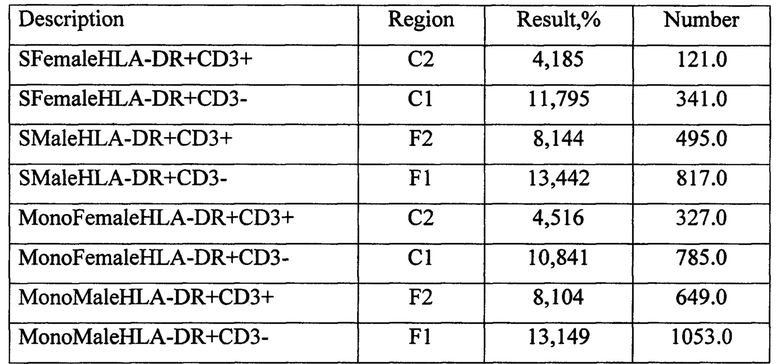
Примечание: SFemale - мужская смешанная культура лимфоцитов (МСКЛ), SMale - женская смешанная культура лимфоцитов (ЖСКЛ), MonoFemale - женская монокультура анализируемого донора (ЖКОН), MonoMale - мужская монокультура анализируемого донора (МКОН).
Были проведены расчеты коэффициентов прироста (КП) экспрессии HLA-DR на женских Т-лимфоцитах и В-лимфоцитах в женских СКЛ с ЭТС и в СКЛ с 10% аутосывороткой, и те же коэффициенты для мужских Т- и В-лимфоцитов в мужской СКЛ.
Для женской СКЛ с ЭТС было получены следующие КП:
КПCD3+ЭТСЖ=((CD3+ЖСКЛ-CD3+ЖКОН)×100)/CD3+ЖКОН=((12,695-15,903)×100)/15,903=-20,17%;
КПCD3-ЭТСЖ=((CD3-ЖСКЛ-CD3-HLA-DR+КОН)×100)/CD3-ЖКОН=((15,031-14,152)×100)/14,152=6,21%.
Для мужской СКЛ с 15% ЭТС было получены следующие КП:
КПCD3+ЭТСМ=((CD3+МСКЛ-CD3+МКОН)×100)/CD3+МКОН=((8,428-7,961)×100/7,961=5,866%;
КПCD3-ЭТСМ=((CD3-МСКЛ-CD3-МКОН)×100)/CD3-МКОН=((14,620-13,927)×100)/13,927=4,975%.
Для женской СКЛ с 10% женской аутосывороткой было получены следующие КП:
КПCD3+АЖ=((CD3+ЖСКЛ-CD3+ЖКОН)×100)/CD3+ЖКОН=((4,185-4,516)×100)/4,516=-7,33%;
Далее был рассчитан коэффициент блокирования (КБ) 10% женской аутосывороткой экспрессии HLA-DR на женских Т-лимфоцитах в женской СКЛ.
КБ=((КПCD3+АЖ-КПCD3+ЭТСЖ)×100)/|КПCD3+ЭТСЖ|=((-7,33-(-20,17))×100)/20,17=63,65
На основании полученных данных был рассчитан эффективный коэффициент прироста (ЭКП) экспрессии HLA-DR на женских Т-лимфоцитах в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ.
ЭКПCD3+=((КПCD3+ЭТСЖ-КПCD3+ЭТСМ)×100)/|КПCD3+ЭТСМ|=((-20,17-5,87))*100)/5,87=-443,61%.
Был рассчитан эффективный коэффициент прироста (ЭКП) экспрессии HLA-DR на женских В-лимфоцитах в женской СКЛ с ЭТС по отношению к соответствующей мужской СКЛ.
ЭКПCD3-=(КПCD3-ЭТСЖ-КПCD3-ЭТСМ)×100)/|КПCD3-ЭТСМ|=((-6,21-4,98)×100)/4,98=-224,69%.
На основании полученных коэффициентов провели расчет риска формирования спорадических септальных ВПС без хромосомных заболеваний в последующем поколении по формуле:
Y=(EXP(Z)/(1+EXP(Z)))×100%,
где Z=(0,678-(КБ×0,004)-(ЭКПCD3+×0,002)+(ЭКПCD3-×0,003))=(0,678-(63,65×0,004)-(-443,61×0,002)+(-224,69×0,003))=1,985
Y=(ЕХР(1,985)/(1+ЕХР(1,985)))×100%=87,92%
Таким образом, риск формирования спорадического септального врожденного порока сердца без хромосомных заболеваний составил 87,92%. При внутриутробном ультразвуковом скрининге обнаружен дефект межжелудочковой перегородки у плода.
Представленные примеры показывают эффективность исследования аллогенных иммунных взаимодействий в краткосрочной СКЛ супругов для выявления группы риска по формированию спорадических септальных ВПС без хромосомных заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ АЛЛОГЕННОГО ИММУННОГО ОТВЕТА В КРАТКОВРЕМЕННОЙ СМЕШАННОЙ КУЛЬТУРЕ МОНОНУКЛЕАРОВ НЕРОДСТВЕННЫХ ДОНОРОВ | 2014 |
|
RU2581925C2 |
| СПОСОБ ПРЕГРАВИДАРНОГО ПРОГНОЗИРОВАНИЯ РИСКА ФОРМИРОВАНИЯ СЕПТАЛЬНЫХ ФОРМ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА У ПЛОДА | 2016 |
|
RU2617249C1 |
| Способ получения гамма-глобулиновой фракции человека для прегравидарной профилактики врожденных пороков сердца в последующем поколении | 2023 |
|
RU2817352C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К АЛЛОГЕННЫМ HLA-G | 2015 |
|
RU2585091C1 |
| Способ выявления антиотцовских антител после иммунизации женщин с идиопатическим привычным выкидышем лимфоцитами полового партнера | 2016 |
|
RU2614729C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИТОТОКСИЧНОСТИ СЫВОРОТКИ ЖЕНЩИНЫ К МУЖСКИМ МОНОКЛЕАРНЫМ КЛЕТКАМ | 2014 |
|
RU2558054C1 |
| СПОСОБЫ БЫСТРОГО ВЫЯВЛЕНИЯ РИСКА Т-ХЕЛПЕРНОГО ДЕФИЦИТА У ЛЮДЕЙ В УСЛОВИЯХ АРКТИКИ | 2016 |
|
RU2614702C1 |
| Способ оценки лекарственной чувствительности Mycobacnerium tuberculosis на основе результатов определения иммунологических показателей крови у больного туберкулезом легких человека | 2016 |
|
RU2659958C2 |
| СПОСОБ ОЦЕНКИ РЕПРОДУКТИВНОЙ ФУНКЦИИ МУЖЧИН С ИДИОПАТИЧЕСКИМ БЕСПЛОДИЕМ | 2021 |
|
RU2759147C1 |
| СПОСОБ ДИАГНОСТИКИ ИММУНОЛОГИЧЕСКОЙ ФОРМЫ БЕСПЛОДИЯ | 2014 |
|
RU2553341C1 |
Изобретение относится к области медицины, в частности к кардиологии, педиатрии, акушерству и гинекологии. Предложен способ прегравидарного прогнозирования риска формирования спорадических септальных врожденных пороков сердца без хромосомных заболеваний в последующих поколениях. Способ включает определение прогностических коэффициентов экспрессии поверхностных маркеров лимфоцитов HLA-DR, детерминирующих нарушения в аллогенных иммунных взаимодействиях супругов и расчет вероятного риска с использованием формулы логистической регрессии. Изобретение обеспечивает повышение точности прогнозирования риска формирования спорадических септальных врожденных пороков сердца у плода на прегравидарном этапе. 6 табл., 2 пр.
Способ прегравидарного прогнозирования риска формирования спорадических септальных врожденных пороков сердца без хромосомных заболеваний в последующих поколениях, включающий исследование маркеров главного комплекса гистосовместимости человека (HLA) у семейной пары, планирующей беременность, на догестационном этапе и расчет вероятного риска по формуле логистической регрессии, отличающийся тем, что проводят иммунологическое исследование экспрессии поверхностных маркеров лимфоцитов CD3, HLA-DR в краткосрочной смешанной культуре лимфоцитов (СКЛ) супругов в ростовой среде с 15% эмбриональной телячьей сывороткой (ЭТС) и в среде с дополнительным содержанием 10% женской аутосыворотки (А), после чего по результатам проточной цитофлуориметрии рассчитывают значения таких прогностических коэффициентов, как: коэффициент блокирования (КБ) экспрессии CD3, HLA-DR на женских Т-лимфоцитах в женской СКЛ; эффективного коэффициента прироста экспрессии CD3, HLA-DR на женских Т-лимфоцитах (ЭКПCD3+) в женской СКЛ с 15% ЭТС по отношению к соответствующей мужской СКЛ, а также эффективного коэффициента прироста экспрессии CD3, HLA-DR на женских В-лимфоцитах (ЭКПСD3-) в женской СКЛ с 15% ЭТС по отношению к соответствующей мужской СКЛ, при этом коэффициент блокирования рассчитывают по формуле:
КБ=((КПCD3+АЖ-КПCD3+ЭТСЖ)×100)/|КПCD3+ЭТСЖ|,
где КПCD3+АЖ - коэффициент прироста CD3+HLA-DR+ в женской СКЛ с 10% женской аутосывороткой;
КПCD3+ЭТСЖ - коэффициент прироста CD3+HLA-DR+ в женской СКЛ с 15% ЭТС;
|КПCD3+ЭТСЖ| - модуль коэффициента прироста CD3+HLA-DR+ в СКЛ в ростовой среде с 15% ЭТС, а расчет коэффициентов прироста экспрессии CD3+HLA-DR в женской СКЛ для каждой ростовой среды осуществляют по формуле:
КПCD3+Ж=((CD3+ЖСКЛ-CD3+ЖКОН.)×100)/CD3+ЖКОН.,
где CD3+ЖСКЛ - относительное число субпопуляции CD3+HLA-DR+ в женской смешанной культуре лимфоцитов с соответствующей ростовой средой, %;
CD3+ЖКОН - относительное число субпопуляции CD3+HLA-DR+ в женской монокультуре анализируемого донора, %;
тогда эффективный коэффициент прироста экспрессии CD, HLA-DR на женских Т-лимфоцитах в женской СКЛ с 15% ЭТС (ЭКПCD3+ЭТСЖ) по отношению к соответствующей мужской СКЛ (ЭКПCD3+ЭТСМ) рассчитывали как:
ЭКПCD3+=((КПCD3+ЭТСЖ-КПCD3+ЭТСМ)×100)/|КПCD3+ЭТСМ|,
где КПCD3+ЭТСЖ - коэффициент прироста в клеточных реакциях «женщина против мужчины» экспрессии HLA-DR на женских Т-лимфоцитах с фенотипом CD3+HLA-DR+;
КПCD3+ЭТСМ - коэффициент прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских Т-лимфоцитах с фенотипом CD3+HLA-DR+,
|КПCD3+ЭТСМ| - модуль коэффициента прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских Т-лимфоцитах с фенотипом CD3+HLA-DR+, а коэффициент прироста экспрессии CD3+HLA-DR в мужской СКЛ с 15% ЭТС рассчитывают как:
КПCD3+ЭТСМ=((CD3+MСКЛ-CD3+МКОН.)×100)/CD3+МКОН.,
где CD3+МСКЛ - относительное число субпопуляции CD3+HLA-DR+ в мужской смешанной культуре лимфоцитов в ростовой среде с 15% ЭТС, %; CD3+MКОН - относительное число субпопуляции CD3+HLA-DR+ в мужской монокультуре анализируемого донора, %;
соответственно эффективный коэффициент прироста экспрессии CD, HLA-DR на женских В-лимфоцитах в женской СКЛ с 15% ЭТС по отношению к соответствующей мужской СКЛ, рассчитывают по формуле:
ЭКПCD3-=(КПCD3-ЭТСЖ - КПCD3-ЭТСМ)×100)/|КПCD3-ЭТСМ|,
где КПCD3-ЭТСЖ - коэффициент прироста в клеточных реакциях «женщина против мужчины» экспрессии HLA-DR на женских В-лимфоцитах с фенотипом CD3-HLA-DR+ в ростовой среде с 15% ЭТС;
КПCD3-ЭТСМ - коэффициент прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских В-лимфоцитах с фенотипом CD3-HLA-DR+ в ростовой среде с 15% ЭТС;
|КПCD3-ЭТСМ| - модуль коэффициента прироста в клеточных реакциях «мужчина против женщины» экспрессии HLA-DR на мужских В-лимфоцитах с фенотипом CD3-HLA-DR+ ростовой среде с 15% ЭТС, при этом расчет коэффициентов прироста экспрессии HLA-DR на мужских и женских В-лимфоцитах с фенотипом CD3-HLA-DR+ осуществляют по формуле:
КПCD3-ЭТСМ(Ж)=((CD3-СКЛМ(Ж)-CD3-КОНМ(Ж).)×100)/СD3-КОНМ(Ж),
где СD3-ЭТСМ(Ж) - относительное число субпопуляции CD3-HLA-DR+ в мужской (женской) смешанной культуре лимфоцитов в ростовой среде с 15% ЭТС, %;
CD3-КОН - относительное число субпопуляции CD3- в мужской (женской) монокультуре анализируемого донора, %;
а расчет вероятностного риска формирования спорадического септального врожденного порока сердца без хромосомных заболеваний в последующих поколениях осуществляют по формуле:
Y=(EXP(Z)/(1+EXP(Z)))×100%,
при этом Y - вероятность риска формирования врожденного порока сердца в последующих поколениях (%);
a Z=(0,678-(КБ×0,004)-(ЭКПCD3+×0,002)+(ЭКПСD3-×0,003)).
| СПОСОБ ПРЕГРАВИДАРНОГО ПРОГНОЗИРОВАНИЯ РИСКА ФОРМИРОВАНИЯ СЕПТАЛЬНЫХ ФОРМ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА У ПЛОДА | 2016 |
|
RU2617249C1 |
| EP 2924440 A2, 30.09.2015 | |||
| СПОСОБ ОЦЕНКИ АЛЛОГЕННОГО ИММУННОГО ОТВЕТА В КРАТКОВРЕМЕННОЙ СМЕШАННОЙ КУЛЬТУРЕ МОНОНУКЛЕАРОВ НЕРОДСТВЕННЫХ ДОНОРОВ | 2014 |
|
RU2581925C2 |
Авторы
Даты
2019-12-19—Публикация
2018-08-10—Подача