Изобретение относится к медицинской биотехнологии, в частности к способу получения гриппозной вакцины.
Ежегодно эпидемия гриппа является серьезной проблемой для здоровья людей, и фармацевтические компании работают по ряду направлений научных проектов для создания новых гриппозных вакцин (1).
Основные типы вакцин против гриппа, лицензированные для клинического использования, являются живыми или инактивированными.
Живые гриппозные вакцины весьма эффективны, но для профилактики гриппа пока не удается получить аттенуированные штаммы, которые обеспечивали бы не только высокую иммуногенную активность, но и вместе с тем были бы полностью безопасны, особенно для вакцинации детей.
В настоящее время для профилактики гриппа в подавляющем большинстве стран применяются следующие инактивированные гриппозные вакцины: цельновирионные, расщепленные и субъединичные.
Цельновирионные вакцины содержат убитые корпускулярные (цельные) вирусы гриппа.
Расщепленные вакцины представляют собой смесь структурных компонентов вириона (поверхностных и внутренних), разъединенных с помощью различных детергентов.
Субъединичные вакцины содержат антигены гемагглютинина (ГА) и нейраминидазы (НА) - очищенные гликопротеины внешней оболочки вируса гриппа. Эти вакцины являются наиболее безопасными.
Однако эффективность гриппозных вакцин, содержащих очищенные белковые фрагменты вируса, обычно снижается из-за недостаточной иммуногенности, чего не скажешь о вакцинах, основанных на цельных вирионах, содержащих множество стимулирующих иммунитет компонентов и не нуждающихся в помощи при проникновении в организм.
В связи с этим возникает необходимость использования в составе очищенных вакцин так называемых адъювантов - веществ, действующих неспецифически и повышающих специфический иммунный ответ. К тому же использование адъюванта позволяет снизить содержание антигена в вакцине.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает безопасность препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа.
Существует два основных способа действия адъювантов, один из них направлен на изменение свойств антигена, другой на стимуляцию функций организма.
Комплексное взаимодействие иммунокомпетентных клеток с адъювантами находится под частичным или полным генетическим контролем организма, но сложность и гетерогенность строения антигенов и адъювантов затрудняет выяснение механизма иммунного ответа (2).
Согласно ранее существовавшим представлениям роль адъювантов сводилась только к удержанию антигена на месте введения, благодаря чему последующее его освобождение приводило к вторичному иммунному ответу после первичной стимуляции (3). В настоящее время установлено, что адъюванты взаимодействуют с наиболее важными антигенпрезентирующими клетками (макрофаги, клетки Лангерганса, дендритные клетки) и эффекторными клетками (плазматические клетки и естественные киллеры), Т-хелперами и клетками воспаления (полиморфно-ядерные базофилы, эозинофилы).
В зависимости от адъюванта каждый тип клеток может вести себя по-разному: пролиферировать, дифференцироваться, менять клеточные рецепторы и т.д. Различные адъюванты влияют на индукцию и регуляцию синтеза разных классов антител, образование В-клеток памяти и развитие клеточного иммунитета. Нет универсальных адъювантов, каждый из них имеет свои особенности. Один и тот же адъювант с различными антигенами стимулирует иммунитет в различной степени (4) и для каждого вида антигена адъювант подбирается индивидуально: после изучения его иммуностимулирующих свойств.
Адъюванты, используемые в вакцинах, можно классифицировать по происхождению:
1. минеральные - наиболее часто используются гидрат окиси алюминия и фосфат алюминия;
2. растительные - сапонин;
3. микробные, наиболее известные - это нуклеонат натрия (гидролизат дрожжевой РНК), мурамилдипептид (компонент пептидогликана клеточной стенки бактерий);
4. «вода-в-масле» или «масло-в-воде» - токоферол;
5. сложные искусственные адъювантные системы - липосомы, микрокапсулы;
6. синтезируемые полимеры и сополимеры - полиоксидоний и др.
Наиболее используемыми адъювантами при производстве инактивированных вакцин являются минеральные масла (5, 6, 7) и соли алюминия (8, 9).
Известна противогриппозная вакцина, где в качестве иммуностимулирующего агента используют мурамилпептидные производные (10).
Известны вакцины, содержащие в качестве адъюванта смесь глутамата хитозония (11), хитозана деацетилированного (12).
Известна иммуногенная композиция, где в качестве носителя и адъюванта предложено использовать живые бактериальные клетки микроорганизмов, относящихся к роду Bifidobacterium - бифидобактерии (13).
В последнее время для получения вакцин разработаны и используются новые синтетические адъюванты - полимеры и сополимеры. Синтетические полимерные адъюванты - это новые и более эффективные иммуномодуляторы и иммуностимуляторы.
Известна композиция, стимулирующая иммунный ответ, содержащая наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида (14).
Известна вирусная вакцина, где в качестве вспомогательного иммуностимулирующего агента используется состав, выбранный среди акриловых и метакриловых полимеров и малеинового ангидрида (15).
На отечественном рынке известна одна вакцина против гриппа с полимерным иммуностимулирующем носителем (адъювантом) - это тривалентная полимер-субъединичная вакцина «Гриппол» (16), содержащая в качестве адъюванта и носителя производное поли-1,4-этиленпиперазина - Полиоксидоний® (17). Эта вакцина является наиболее близким аналогом данного изобретения.
Способ получения включает:
1. Культивирование вируса гриппа в развивающихся куриных эмбрионах.
2. Получение вирусного концентрата.
3. Очистка вирусного концентрата методом ультрацентрифугирования в градиенте плотности сахарозы.
4. Инактивация вирусного материала.
5. Расщепление вирусного концентрата детергентом.
6. Выделение антигенов вируса гриппа.
7. Сведение моновакцин в тривакцину.
8. Добавление иммуностимулятора «Полиоксидоний».
Синтетический полимер «Полиоксидоний» - это умеренно растворимый синтетический полимер, обладающий иммуностимулирующим действием. Препарат Полиоксидоний увеличивает иммунную резистентность организма в отношении локальных и генерализованных инфекций, оказывает дезинтоксикационное действие (18). В гриппозной вакцине адъювант-носитель Полиоксидоний обеспечивает высокую иммуногенность и стабильность антигенов в готовом препарате, позволяет существенно (в три раза по сравнению с мировым стандартом для гриппозных вакцин) снизить прививочную дозу антигенов (17).
На сегодняшний день имеется большой выбор новых адъювантов на стадии разработки и испытаний, направленных на инициацию различных типов иммунного ответа, сочетающих в себе различные уровни показателей эффективности и безопасности. Поэтому исследования по включению различных типов адъювантов в состав инактивированных вакцин весьма актуальны, их проводят большинство фармацевтических компаний, занимающихся производством вакцин (19).
Задача, на решение которой направлено настоящее изобретение, заключается в расширении арсенала противогриппозных вакцин, повышающих общую резистентность организма к вирусу гриппа, обладающих высокой эффективностью и безопасностью.
Технический результат предлагаемого изобретения заключается в разработке промышленного способа и получении поливалентной гриппозной вакцины в комплексе с иммуностимулирующим агентом сополимером 2-метил-5-винилпиридин и N-винилпирролидона, обладающей высокой антигенной активностью, безопасностью и стабильностью при хранении.
Сущность изобретения заключается в получении очищенных антигенов вируса гриппа в комплексе с иммуностимулирующим носителем-адъювантом сополимером 2-метил-5-винилпиридин и N-винилпирролидона.
Заявляемый способ предусматривает культивирование вируса гриппа в развивающихся куриных эмбрионах с последующим отделением вируссодержащей аллантоисной жидкости, концентрирование, очистку, инактивацию и расщепление вируса. Концентрирование и очистку осуществляют сорбцией вируса на куриных эритроцитах с последующим ультрацентрифугированием в градиенте плотности сахарозы. Инактивацию и расщепление вируса проводят любыми разрешенными к применению средствами. Расщепленный концентрат вируса центрифугируют и подвергают ультрафильтрации. Полученный концентрат очищенных антигенов каждого штамма вируса гриппа рассматривается как моновакцина. После сведения моновакцин в поливакцину добавляют сополимер 2-метил-5-винилпиридин и N-винилпирролидона при соотношении антиген-носитель 1:5-30.
Предлагаемая полимерная поливалентная вакцина содержит штаммы вируса гриппа типа A, B и сополимер 2-метил-5-винилпиридин и N-винилпирролидона, где соотношение антиген-носитель составляет 1:5-30.
В отличие от прототипа в заявляемом способе получения гриппозной вакцины используют новый синтетический полимерный носитель и адъювант - сополимер 2-метил-5-винилпиридин и N-винилпирролидона.
Сополимер 2-метил-5-винилпиридин и N-винилпирролидона - это водорастворимый полимер, с средневязкостной молекулярной массой Мη=30000÷55000 дальтон, нетоксичный, обладающий иммуностимулирующим действием (20).
Исследования иммуностимулирующей активности проводились на животных: телятах и овцах при сибирской язве и подсвинках при классической чуме свиней.
Краткое изложение способа получения
Для приготовления вакцины используются штаммы вируса гриппа, соответствующие рекомендации ВОЗ.
Для получения вируссодержащей аллантоисной жидкости (ВАЖ) заражение куриных эмбрионов вирусом гриппа проводят на автоматических машинах. Заражение разными типами вируса гриппа проводят в разное время и разными системами заражения.
После заражения куриные эмбрионы инкубируют 48-72 ч при температуре (34±2)°C.
По окончании периода инкубации яйца овоскопируют. Сбор вируссодержащей аллантоисной жидкости осуществляют на автоматической поточной линии в бутыли. Гемагглютинирующий титр должен быть не ниже 1:80 для всех типов вируса.
После определения гемагглютинирующей активности (ГА) в бутыль добавляют формализированные куриные эритроциты.
Полнота сорбции вируса гриппа контролируется определением титра ГА в надосадочной жидкости.
К осадку эритроцитов добавляют фосфатно-буферный раствор (ФБР). Взвесь эритроцитов центрифугируют при частоте вращения (1800±200) об/мин. Полученный элюат подается на непрерывно-поточную ультрацентрифугу. Вирус распределяется в градиенте плотности сахарозы. Фосфатным буферным раствором вытесняют фракции градиента из ротора и собирают в стерильные бутылки.
Разведенный для инактивации концентрат вируса пропускают через ультрафиолетовую установку или инактивируют раствором формалина.
В бутыль с разведенным инактивированным концентратом вносят расчетное количество 1% раствора тетрадецилтриметиламмония бромида (ТДТАБ). По окончании процесса получения расщепленного концентрата отделение вирусного антигена от детергента проводят на ультрафильтрационной установке.
После стерилизующей фильтрации полуфабрикаты моновакцин типов A и B сводят в поливакцину.
Полученную поливакцину контролируют на общий белок, специфическую активность и пирогенность. Затем в бутыль с поливакциной через сифон добавляют концентрат сополимера 2-метил-5-винилпиридин и N-винилпирролидона в соотношении антиген-носитель 1:5-30. Полученный препарат фильтруют и разливают в ампулы или шприцы.
Полученная полимерная вакцина против гриппа соответствует высоким критериям иммуногенности и безопасности.
Предложенный способ осуществляется следующим образом.
Пример 1.
Для получения гриппозной вакцины используются штаммы вируса гриппа типа A(H1N1), A(H3H2) и B.
Куриные эмбрионы 10-12-суточного возраста заражают в аллантоисную полость. Лотки с зараженными эмбрионами помещают в термальную комнату при температуре (34±2)°C и влажности от 70 до 80% на 48-72 ч в зависимости от используемого штамма. По окончании инкубации эмбрионы проверяют с помощью овоскопов. Жизнеспособные эмбрионы помещают в холодильную камеру при температуре (1±1)°C на (18±2) ч для охлаждения.
Сбор вируссодержащей аллантоисной жидкости (далее по тексту - ВАЖ) осуществляют на поточной линии. После заполнения сосуда к 9 л собранной ВАЖ добавляют 1 флакон с 45 мл раствора канамицина.
В бутыль с ВАЖ добавляют 50% взвесь формалинизированных эритроцитов (4-11% от объема ВАЖ). Выдерживают смесь ВАЖ с эритроцитами в течение 24-72 ч при температуре (4±2)°С. Затем надосадочную жидкость сливают. Осадок эритроцитов с адсорбировавшимся вирусом дважды отмывают фосфатно-буферным раствором, после чего помещают в водяную баню при температуре (37±2)°С для элюции вируса. Взвесь эритроцитов центрифугируют. Полученный элюат концентрируют и очищают в 50-60% градиенте плотности сахарозы при скорости вращения ротора (30000±2000) об/мин на ультрацентрифуге «Hitachi».
К вирусному концентрату добавляют фосфатно-буферный раствор и доводят содержание вирусного белка не менее 1 мг/мл.
Для инактивации вируса используют установку, содержащую источник ультрафиолетовых лучей, с мощностью излучения (1450±50)мкВт/см2.
В бутыль с разведенным инактивированным концентратом вносят расчетное количество 1% раствора ТДТАБ.
Для получения очищенного концентрата антигенов вируса гриппа расщепленный концентрат вируса центрифугируют при 16000 об/мин в течение 2 ч. Затем производят ультрафильтрацию в тангенциальном потоке на кассете с мембраной 30 000 дальтон, до тех пор пока концентрация детергента в фильтрате не снизится до 10 мкг/мл.
Полученный концентрат очищенных антигенов вируса гриппа рассматривается как моновакцина. Моновакцину фильтруют через два последовательно соединенных фильтра с размером пор 0,45 и 0,22 мкм.
Поливакцину получают сведением моновакцин типов A(H1N1), A(H3N2) и В через фильтр, заправленный мембраной 0,22 мкм. Затем в полученный полуфабрикат добавляют адъювант сополимер 2-метил-5-винилпиридин и N-винилпирролидона в соотношении антиген-носитель 1:5. Розлив готовой вакцины осуществляют в шприцы или ампулы.
Пример 2.
Для получения гриппозной вакцины используются штаммы вируса гриппа типа A(H5N1), A(H3N2) и B.
В бутыль с разведенным вирусным концентратом, полученным, как описано в примере 1, для инактивации вируса добавляют раствор формалина из расчета 0,5% его конечной концентрации.
Очищенную поливакцину получают сведением моновакцин типов A(H5N1), A(H3N2) и B. На завершающем этапе получения вакцины вносимое количество адъюванта в тривакцину определяется соотношением антиген-носитель 1:30.
Пример 3. Изучение безопасности вакцины. Безопасность заявленной вакцины оценивали по результатам аномальной токсичности и гистопатологиии.
Изучение аномальной токсичности проводили при однократном внутрибрюшинном введении белым мышам массой 10-12 г и при подкожном введении морским свинкам массой 250-350 г.
Животные были поделены на группы. Первой группе животных вводили прививочную дозу заявленной вакцины с содержанием адъюванта сополимера 2-метил-5-винилпиридин и N-винилпирролидона - 250 мкг (вариант №1), второй - прививочную дозу заявленной вакцины с содержанием адъюванта - 500 мкг (вариант №2), третьей - прививочную дозу вакцины Гриппол с содержанием адъюванта полиоксидоний 500 мкг на дозу (вариант №3). Четвертая группа была контрольная - животным вводили физиологический раствор.
В результате проведенных исследований установлено следующее.
Все три варианта вакцин являются нетоксичными, не отмечено отрицательного влияния препаратов на общее состояние, динамику массы тела и поведенческие реакции животных. Не выявлены отклонения от нормы состояния шерстяного покрова, изменения физиологии глаз, ушей, зубов, мочеиспускания и экскрементов. В тестах на ускоренное старение в заявленной вакцине отклонений качественных характеристик от исходных не обнаружено.
Для проведения гистологических исследований использовали образцы печени, сердца, селезенки, легкого, головного мозга и тонкого отдела кишечника. В результате проведенных исследований установлено, что у лабораторных животных, иммунизированных вышеперечисленными вакцинами, в исследованных органах не обнаружено специфических патологических изменений.
Пример 4. Изучение иммуногенных свойств вакцины.
Иммуногенные свойства вакцинных препаратов были изучены путем оценки антигенной активности и гуморального иммунного ответа (иммуногенность).
При определении антигенной активности трех вышеперечисленных вариантов вакцин исследовали образование антител в сыворотках крови животных. Опыты проводились на белых беспородных мышах массой тела 10-12 г. После двукратного с интервалом 7 сут внутрибрюшинного введения вакцины сыворотки иммунизированных мышей исследовались в реакции торможения гемагглютинации (РТГА) с гомологичными антигенами вакцины.
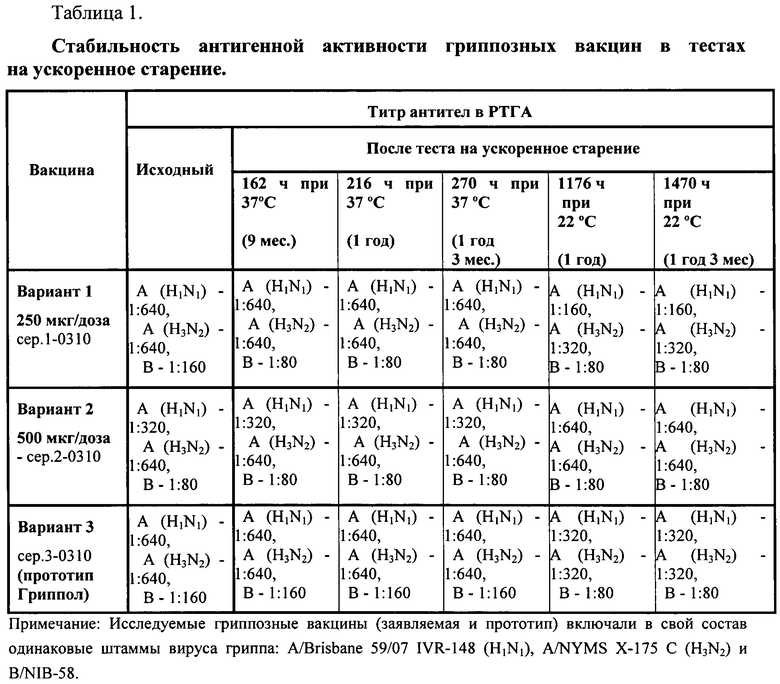
Показатели антигенной активности заявленной вакцины и прототипа приведены в табл.1.
При сравнительной оценке антигенной активности трех вариантов вакцины было выявлено, что гемагглютинирующий титр сравниваемых препаратов был не менее 1:80 к каждому из трех входящих в ее состав штаммов вирусов гриппа A и B (согласно НТД не ниже 1:40).
Изучение стабильности антигенной активности во время хранения заявленного препарата проводилось методом «ускоренного старения».
Образцы заявленных вакцин №1, 2 закладывали на ускоренное хранение при температуре 37°C и 22°C. Результаты исследования стабильности антигенной активности показали, что разработанный препарат имеет высокую стабильность, сохраняя показатели, соответствующие требованиям нормативных документов.
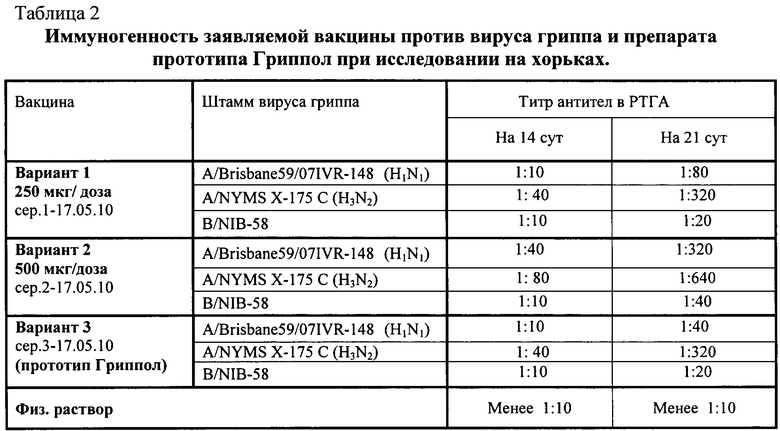
Исследования иммуногенности проводили на хорьках массой тела 1100-1500 г. Животные были поделены на 4 группы, по 10 хорьков в каждой группе. Номера групп соответствуют вариантам вакцин по примеру 3, четвертая группа была контрольная - животным вводили 0,5 мл физиологического раствора.
Напряженность гуморального иммунитета была оценена путем определения титра антител к гемагглютининам вирусов гриппа типа A и B. Сыворотки крови лабораторных животных групп №1-4 получали до иммунизации, на 14 и 21 сут после иммунизации. Титр антител определяли в РТГА с куриными эритроцитами, обработанными RDE. Результаты определения титра вирусспецифических антител у лабораторных животных представлены в табл.2.
Данные, приведенные в табл.2, свидетельствуют о том, что внутримышечное введение одной прививочной дозы вакцины вызывает формирование вирусспецифического иммунитета в каждой группе иммунизированных животных. При этом вакцина, по варианту №2, проявляет максимальный иммуногенный ответ: величина титра вирусспецифических антител в РТГА для вируса гриппа В составила на 14 сут 1:10 и на 21 сут 1:40, для вируса гриппа A (H3N2) - на 14 сут 1:80 и на 21 сут 1:640, а для вируса гриппа A (H1N1) - на 14 сут 1:40 и на 21 сут 1:320.
Пример 5. Безопасность и защитная эффективность заявляемой вакцины на людях.
Эффективность вакцины против вируса гриппа определяется способностью вызывать иммунитет у привитого организма и тем самым предупреждать заболеваемость гриппом. Гуморальный иммунный ответ достаточно полно отражает защитный эффект вакцины против гриппа, поскольку существует корреляция между титром специфических антител к гемагглютининам вируса гриппа и уровнем защищенности от гриппа. При оценке потенциальной эффективности гриппозной вакцины титр специфических антител к гемагглютининам не ниже 1:40 считается защитным (21). На этом показателе основаны официальные требования, предъявляемые к иммунологической эффективности вакцин против вируса гриппа (МУ 3.3.2.1758-03 и СРМР ЕМЕА от 2001 г.).
В рамках простого слепого рандомизированного многоцентрового исследования проводилась оценка безопасности и иммуногенных свойств предлагаемой гриппозной вакцины. Серонегативным добровольцам, отобранным в ходе скрининга, препараты вводили однократно внутримышечно в верхнюю треть наружной поверхности плеча (в область дельтовидной мышцы) в прививочной дозе 0,5 мл. Клиническое исследование было проведено в два этапа.
На первом этапе клинических исследований изучали переносимость, реактогенность и безопасность заявляемой вакцины на ограниченном контингенте добровольцев (90 добровольцев) в возрасте от 18 до 60 лет. В качестве контроля использовали физиологический раствор (плацебо).
На втором этапе исследовали переносимость, реактогенность, безопасность и иммуногенность заявляемой вакцины на расширенном контингенте добровольцев (240 добровольцев) в возрасте 18-60 лет в сравнении с коммерческой вакциной Гриппол. Исследуемые гриппозные вакцины (заявляемая и прототип) включали в свой состав одинаковые штаммы вируса гриппа: А/Калифорния/07/2009 A(H1N1)v, А/Висконсин/15/2009 A(H3N2) и В/Брисбен/60/2008. Данные штаммы были рекомендованы ВОЗ и Комиссией по гриппозным вакцинным и диагностическим штаммам (Решение №1 от 25.02.2010) для состава гриппозных вакцин на сезон 2010-2011 гг. Исходный титр специфических антител ко всем трем вакцинным штаммам гриппа у всех добровольцев был не выше 1:20, т.е. добровольцы были серонегативными. На 21-е сутки вакцинации у добровольцев производили забор крови для определения титра специфических антител к гемагглютининам вируса гриппа.
Реактогенность и безопасность гриппозных вакцин оценивали по витальным показателям (АД, ЧСС, температура тела), результатам неврологического осмотра, данным лабораторных анализов (ОАМ, АОК, биохимический анализ крови, IgE) и нежелательным явлениям (местные и системные реакции). Оценку местных и системных реакций проводили согласно МУ 3.3.2.1758-03 «Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа».
У подавляющего большинства добровольцев, иммунизированных заявляемой вакциной и вакциной Гриппол (91,8% и 92,4% соответственно), отсутствовали побочные реакции. Статистически значимая разница между частотой развития поствакцинальных реакций в группах, привитых сравниваемыми препаратами, не выявлена (р>0,05).
В ходе проведения клинического исследования не были выявлены местные и системные реакции сильной степени выраженности. Все реакции, как местные, так и системные, не требовали лечения и имели кратковременный характер.
Средние показатели общего анализа крови и биохимического анализа во всех группах добровольцев в течение динамического наблюдения оставались в пределах нормальных значений. Показатели общего анализа мочи не обнаруживали патологических изменений.
Данные неврологического осмотра в динамике не выявили никаких отклонений от нормальных показателей.
Анализ уровня общего IgE в сыворотках крови не обнаружил существенных изменений в динамике во всех группах и не выявил достоверных различий между группами (t≤2).
В результате проведенных исследований выявлено, что заявляемая вакцина является ареактогенной, обладает хорошей переносимостью и высоким профилем безопасности. Полученные данные свидетельствуют об отсутствии у нее аллергизирующих свойств.
Иммуногенную активность вакцин оценивали в реакции торможения гемагглютинации (РТГА), исследуя парные сыворотки крови добровольцев, взятые на этапе скринирования (до вакцинации) и 21-е сутки после вакцинации. Оценку иммуногенности проводили в соответствии с критериями иммуногенности СРМР ЕМЕА (2001 г.) и МУ 3.3.2.1758-03. Согласно нормативно-технической документации протективными считаются титры антител не менее 1:40.
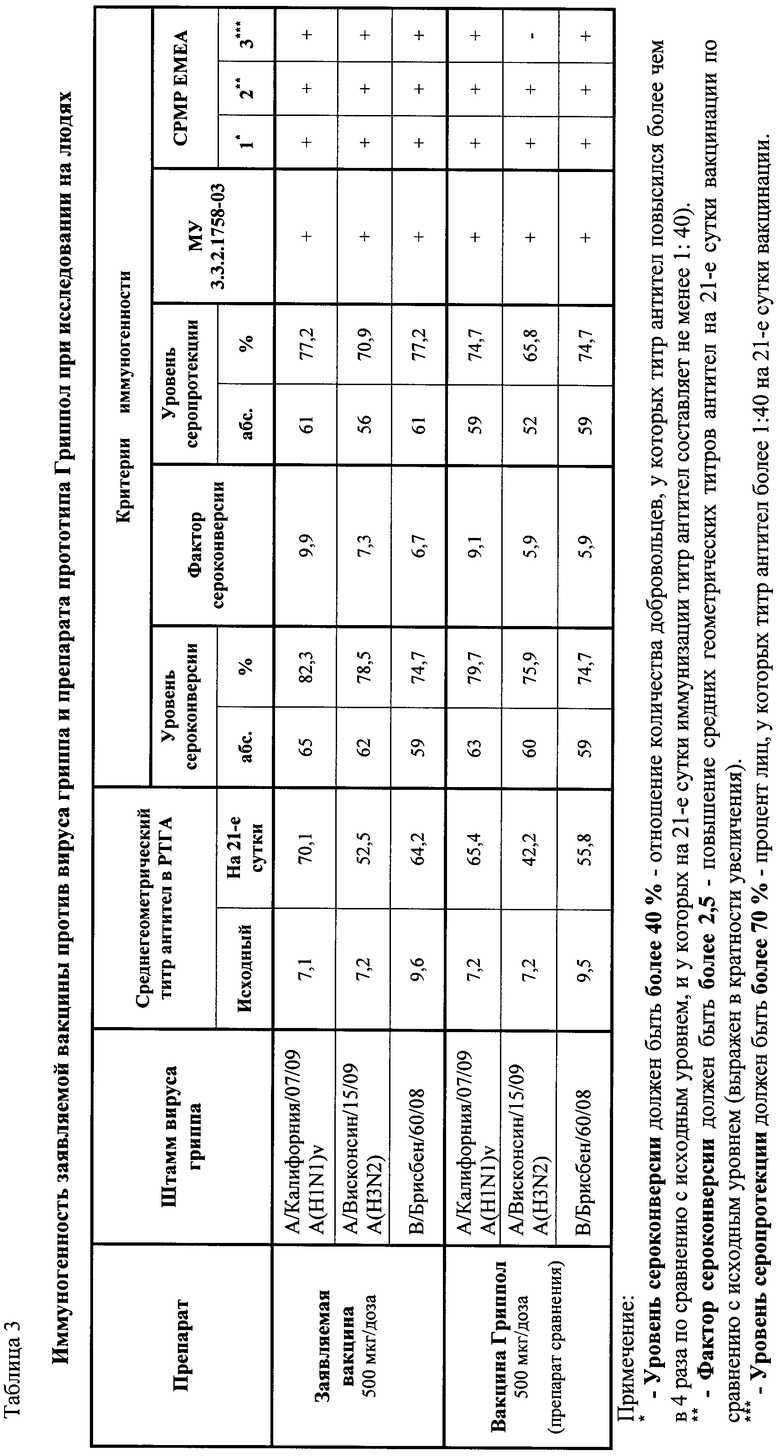
Результаты изучения иммуногенности вакцин представлены в табл.3.
Полученные данные свидетельствуют, что заявляемая вакцина против вируса гриппа вызывает у людей образование защитного титра антител: уровень сероконверсии заявляемой вакцины по трем штаммам вируса гриппа варьировал в пределах 74,7-82,3% (по требованиям СРМР ЕМЕА должен быть более 40%), фактор сероконверсии - 6,7-9,9 (по требованиям СРМР ЕМЕА - более 2,5) и уровень серопротекции - 70,9-77,2% (по требованиям СРМР ЕМЕА - более 70%; по требованиям МУ 3.3.2.1758-03 - для вируса гриппа типа А - более 70%, типа В - 60%). Таким образом, заявляемая вакцина по своим качественным характеристикам (критериям иммуногенности) соответствует требованиям нормативно-технической документации. Предложенная вакцина обеспечивает высокие уровни сероконверсии и серопротекции по всем трем штаммам вируса гриппа и несколько превышает соответствующие значения прототипа. Заявляемая вакцина удовлетворяет всем критериям иммуногенности МУ 3.3.2.1758-03 и СРМР ЕМЕА.
Таким образом, в результате проведенных исследований установлено, что качественные характеристики разработанного препарата - безопасность, антигенная активность и иммуногенность удовлетворяют требованиям нормативно-технической документации к гриппозным вакцинам. Заявленная вакцина является безопасной для людей, обладает хорошей защитной эффективностью и стабильностью во время хранения.
Наличие в препарате полимерного носителя-иммуностимулятора обеспечивает большую стабильность антигенов и повышение иммуногенности вакцины при снижении прививочной дозы антигенов. Предложенный способ получения вакцины против вируса гриппа позволяет получать препарат, обладающий высокой антигенной (иммуногенной) активностью, безопасный для применения.
Список литературы
1. Sesardic D., Dobbelaer R. European union regulatory developments for new vaccine adjuvants and delivery systems // Vaccine. - 2004. - Vol.23-22, №19. - P.2452-2458.
2. Cox J.C., Coulter A.R. Adjuvants--a classification and review of their modes of action // Vaccine. - 1997. - Vol.15, №3. - 248-256.
3. Bennett В, Check IJ, Olsen MR, Hunter RL. A comparison of commercially available adjuvants for use in research //J Immunol Methods. - 1992. Vol.153, №1-2. - P.31-40.
4. Воробьев А.А., Васильев Н.Н. Адъюванты / - М.: Медицина, 1969. - 207 с.
5. Патент US 2009220544, опубл. 2009.09.03.
6. Патент US 2009040343, опубл. 2009.02.12.
7. Патент US 2009047353, опубл. 2009.02.19.
8. Патент WO 0122992, опубл. 2001.04.05.
9. Патент WO 0047222, опубл. 2000.18.17.
10. Патент РФ 2074192, опубл. 1997.02.27.
11. Патент РФ 2323742, опубл. 2008.05.10.
12. Патент US 6534065, опубл. 2003.03.18.
13. Патент РФ 2308289, опубл. 2007.10.20.
14. Патент РФ 2379028, опубл. 2008.06.20.
15. Патент WO 9944633, опубл. 1999.09.10.
16. ФСП 42-0504550004, Гриппол.
17. Патент РФ 2164148, опубл. 2001.03.20.
18. ФС № рег. PN002935/01 - 20.05.2009, Полиоксидоний.
19. Reed S.G. et al. New horizons in adjuvants for vaccine development // Trends. Immunol. - 2009. Vol.30, №1. - P.23-32.
20. Патент РФ №2000004, опубл. 1993.02.15.
21. Перадзе Т.В., Фридман Э.А., Шилд Дж. Противогриппозные профилактические препараты / - М.: Медицина, 1986. - С.114-130.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАВАЛЕНТНОЙ СУБЪЕДИНИЧНОЙ ПРОТИВОГРИППОЗНОЙ ВАКЦИНЫ | 2019 |
|
RU2740751C1 |
| Пентавалентная субъединичная вакцина против респираторных инфекций и способ ее получения | 2022 |
|
RU2804948C2 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| ВАКЦИНА ГРИППОЗНАЯ ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2584594C1 |
| Штамм вируса гриппа A/HK/HK/6:2/2016 (H9N2) для получения инактивированных и живых гриппозных вакцин | 2018 |
|
RU2702833C1 |
| Штамм вируса гриппа A/UNL/HK/2:6/2017 (H5N8) для получения инактивированных и живых гриппозных вакцин | 2018 |
|
RU2702834C1 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ПРОТИВ ГРИППА | 2009 |
|
RU2423995C1 |
| ВАКЦИНА ПРОТИВ ГРИППА | 2014 |
|
RU2546861C1 |
| СПОСОБ ПРОФИЛАКТИКИ ГРИППА ПУТЕМ СОЧЕТАННОГО ПРИМЕНЕНИЯ ИНТЕРФЕРОНА ГАММА И ИНАКТИВИРОВАННОЙ ПРОТИВОГРИППОЗНОЙ ВАКЦИНЫ | 2011 |
|
RU2546540C2 |
Группа изобретений относится к области медицины и касается вакцины против гриппа и способа ее получения. Сущность группы изобретений включает вакцину против гриппа, содержащую соединение очищенных антигенов вирусов гриппа с полимерным носителем, представляющим собой сополимер 2-метил-5-винилпиридина и N-винилпирролидона в соотношении 1:5-30, и способ получения вакцины против гриппа, включающий культивирование штаммов вируса гриппа в куриных эмбрионах, получение очищенного вирусного концентрата, инактивирование, расщепление вирусного концентрата с последующим получением очищенных антигенов вируса гриппа и соединение их с полимерным носителем, представляющим собой сополимер 2-метил-5-винилпиридина и N-винилпирролидона в соотношении 1:5-30. 2 н.п. ф-лы, 5 пр., 3 табл.
1. Вакцина против вируса гриппа, включающая соединение очищенных антигенов вирусов гриппа с полимерным носителем, представляющим собой сополимер 2-метил-5-винилпиридина и N-винилпирролидона в соотношении 1:5-30.
2. Способ получения вакцины против вируса гриппа по п.1, включающий культивирование штаммов вируса гриппа в куриных эмбрионах, получение очищенного вирусного концентрата, инактивирование, расщепление вирусного концентрата с последующим получением очищенных антигенов вируса гриппа и соединение их с полимерным носителем, представляющим собой сополимер 2-метил-5-винилпиридина и N-винилпирролидона в соотношении 1:5-30.
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2164148C1 |
| RU 2000004 C, 15.02.1993 | |||
| СОПОЛИМЕР 2-МЕТИЛ-5-ВИНИЛПИРИДИНА И N-ВИНИЛПИРРОЛИДОНА, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2015993C1 |
Авторы
Даты
2012-04-10—Публикация
2010-07-20—Подача