Область техники
[0001] Настоящее изобретение относится к новому антителу против Igβ человека, которое является пригодным в качестве активного ингредиента фармацевтической композиции.
Предшествующий уровень техники
[0002] B-клеточный рецептор (BCR) состоит молекул мембранного иммуноглобулина (mIg), собранных с гетеродимерами Igα (CD79A) и Igβ (CD79B). Антиген связывается с mIg и обеспечивает агрегацию рецепторов и субъединицы Igα/Igβ передает сигнал внутрь B-клетки (Mol. Immunol., Vol. 41, p. 599-613, 2004).
[0003] Касательно семейства белков рецептора Fcγ (FcγR), который представляет собой Fc-рецептор к антителу IgG, были описаны FcγRIa (CD64A), FcγRIIa (CD32A) и FcγRIIIa (CD16A), которые обладают иммуноактивными функциями, и FcγRIIb (CD32B) который обладает иммуносупрессивными функциями. Опубликовано, что, когда BCR и FcγRIIb в B-клетках являются сшитыми через иммунный комплекс IgG, активность B-клеток подавляется, и, таким образом, пролиферация B-клеток и образование антител подавляются (Nat. Rev. Immunol., Vol. 10, p. 328-343, 2010; Nat. Rev. Immunol., Vol. 8, p. 34-47, 2008; Nat. Rev. Immunol., Vol. 2, p. 580-592, 2002).
[0004] Опубликовано, что регуляция активности B-клеток посредством такого FcγRIIb в значительной степени участвует в патологии аутоиммунных заболеваний, таких как ревматоидный артрит и системная красная волчанка.
[0005] В отношении ревматоидного артрита опубликовано, что у мышей с нокаутом FcγRIIb гуморальный иммунитет не регулируется соответствующим образом (Nature, Vol. 379, p. 346- 349, 1996; J. Immunol., Vol. 163, p. 618- 622, 1999), и повышается предрасположенность к индуцированному коллагеном артриту (J. Exp. Med., Vol. 189, p. 187-194, 1999). Кроме того, подтверждали, что экспрессия FcγRIIb в B-клетки памяти у пациентов с ревматоидным артритом снижается (J. Immunol., Vol. 190, p. 6015-6022, 2013).
[0006] В отношении системной красной волчанки опубликовано, что начало заболевания системной красной волчанки значительно подавляется у трансгенной мыши, у которой экспрессия FcγRIIb является повышенной конкретно в B-клетках (J. Exp. Med., Vol. 205, p. 883-895, 2008). Подтверждали, что в отношении мыши с нокаутом FcγRIIb появляются самореактивные B-клетки или плазматические клетки, и спонтанно развивается состояние заболевания системной красной волчанки (Immunity, Vol. 13, p. 277-285, 2000; J. Exp. Med., Vol. 207, p. 2767-2778, 2010). Кроме того, опубликовано увеличение экспрессии FcγRIIb в B-клетках памяти у пациентов с системной красной волчанкой (J. Exp. Med., Vol. 203, p. 2157-2164, 2006; J. Immunol., Vol. 178, p. 3272-3280, 2007) и взаимосвязь между генетическим полиморфизмом в трансмембранной области FcγRIIb клетки и частотой начала системной красной волчанки (Arthritis Rheum., Vol. 46, p. 1242-1254, 2002).
[0007] Кроме того, подавление образования антител посредством регуляции активности B-клеток через FcγRIIb является эффективным для лечения аутоиммунного заболевания, при котором аутоантитело связано с патологическим состоянием.
[0008] Идиопатическая тромбоцитопеническая пурпура представляет собой аутоиммунное заболевание, при котором аутоантитело против тромбоцитов пациента приводит к разрушению тромбоцитов (Autoimmun. Rev., Vol. 13, p. 577-583, 2014). Опубликовано, что у животного, которому вводят антитело против тромбоцитов, индуцируется тромбоцитопения (Br. J. Haematol., Vol. 167, p. 110-120, 2014), а увеличение аутоантитела является эффективным для лечения идиопатической тромбоцитопенической пурпуры (Ther. Apher. Dial. Vol. 16, p. 311-320, 2012; Lupus, Vol. 22, p. 664-674, 2013).
[0009] Таким образом, в случае, если можно разработать моноклональное антитело, которое сшивает BCR и FcγRIIb и повышает иммуносупрессивную функцию FcγRIIb, ожидают, что такое моноклональное антитело является пригодным для профилактики или лечения аутоиммунных заболеваниях, таких как ревматоидный артрит, системная красная волчанка и идиопатическая тромбоцитопеническая пурпура.
[0010] Относительно антитела, которое сшивает BCR и FcγRIIb, опубликовано DART, которое представляет собой биспецифическое антитело против Igβ и FcγRIIb (патентный документ 1 и непатентный документ 1), и антитело против CD19 S267E/L328F, которое содержит вариабельную область, связывающуюся с CD19, который является частью комплекса BCR, и Fc-область, аффинность которой к FcγRIIb, является повышенной (патентный документ 2 и непатентный документы 2 и 3). Среди них, в частности, рассматривают антитело против CD19 S267E/L328F и подтверждают его ингибирующее действие в отношении активности B-клеток, в которых стимулируют BCR, и его понижающее действие на концентрацию титра антитела человека в крови у мыши, которой трансплантировали мононуклеарные клетки периферической крови (PBMC) человека (патентный документ 2 и непатентные документы 2 и 3).
Связанная область
Патентный документ
[0011] [Патентный документ 1] WO 2012/018687
[Патентный документ 2] WO 2008/150494
Непатентный документ
[0012] [Непатентный документ 1] Arthritis & Rheumatism (US) 2010; 62(7): 1933-1943
[Непатентный документ 2] Molecular Immunology (US) 2008; 45(15): 3926-3933
[Непатентный документ 3] The Journal of Immunology (US) 2011; 186(7): 4223-4233
Описание изобретения
Задачи, подлежащие решению посредством изобретения
[0013] Целью настоящего изобретения является предоставление антитела против Igβ человека, которое сшивает BCR и FcγRIIb и обладает большей иммуносупрессивной функцией, чем иммуносупрессивная функция антитела на известном уровне техники.
Средства решения задач
[0014] В результате тщательного исследования по получению антитела против Igβ человека авторы настоящего изобретения получали ряд антител против Igβ человека, содержащих вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности с номерами аминокислот от 31 до 35 SEQ ID NO: 2, CDR2, состоящую из аминокислотной последовательности с номерами аминокислот от 50 до 65 SEQ ID NO: 2, и CDR3, состоящую из аминокислотной последовательности с номерами аминокислот от 98 до 108 SEQ ID NO: 2, и вариабельную область легкой цепи, содержащую CDR1, состоящую из аминокислотной последовательности с номерами аминокислот от 24 до 38 SEQ ID NO: 4, CDR2, состоящую из аминокислотной последовательности с номерами аминокислот от 54 до 60 SEQ ID NO: 4, и CDR3, состоящую из аминокислотной последовательности с номерами аминокислот от 93 до 101 SEQ ID NO: 4, в которых константная область тяжелой цепи антитела представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W (примеры 1-3), и было выявлено, что эти антитела связываются с Igβ человека на B-клетках человека (примеры 4 и 5) и ингибируют активацию B-клеток человека, индуцированную антителом против IgM (пример 6). В результате предоставляют описанное выше антитело против Igβ человека, таким образом, выполняя настоящее изобретение. Кроме того, выявлено, что антитело подавляет титр антитела человека в плазме на модели переноса PBMC человека на мышах NOG (пример 7) и подавляет специфическое к антигену антитело, без влияния на общие титры антител в плазме на модели сенсибилизации антигеном TTx на обезьянах (пример 8).
[0015] Таким образом, настоящее изобретение относится к следующему ниже изобретению в качестве вещества или способа, который находит применение в медицине или промышленности.
(1) Антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности с номерами аминокислот от 31 до 35 SEQ ID NO: 2, CDR2, состоящую из аминокислотной последовательности с номерами аминокислот от 50 до 65 SEQ ID NO: 2, и CDR3, состоящую из аминокислотной последовательности с номерами аминокислот от 98 до 108 SEQ ID NO: 2, вариабельную область легкой цепи, содержащей CDR1, состоящую из аминокислотной последовательности с номерами аминокислот от 24 до 38 SEQ ID NO: 4, CDR2, состоящую из аминокислотной последовательности с номерами аминокислот от 54 до 60 SEQ ID NO: 4, и CDR3, состоящую из аминокислотной последовательности с номерами аминокислот от 93 до 101 SEQ ID NO: 4, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
(2) Антитело против Igβ человека по пункту (1) выше, которое представляет собой гуманизированное антитело.
(3) Антитело против Igβ человека по пункту (1) выше, выбранное из группы, состоящей из следующих ниже 1)-4):
1) Антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 6, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 8, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W;
2) Антитело против Igβ человека, содержащую вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 2, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 4, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W;
3) Антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, состоящей из аминокислотной последовательности с номерами аминокислот 1 до 119 SEQ ID NO: 10, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 12, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W; и
4) Антитело против Igβ человека, которое получают в результате посттрансляционной модификации антитела против Igβ человека по любому из указанных выше пунктов (1)-(3).
(4) Антитело против Igβ человека по указанному выше пункту (3), содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 6, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 8, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
(5) Антитело против Igβ человека по указанному выше пункту (3), содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 2, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 4, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
(6) Антитело против Igβ человека по указанному выше пункту (3), содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 10, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 12, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
(7) Антитело против Igβ человека, которое получают в результате посттрансляционной модификации антитела против Igβ человека по любому из указанных выше пунктов (4)-(6).
(8) Антитело против Igβ человека по любому из указанного выше пункта (3) или (7), где посттрансляционная модификация представляет собой пироглутамилирование на N-конце вариабельной области тяжелой цепи и/или делецию лизина на C-конце тяжелой цепи.
(9) Антитело против Igβ человека по любому из указанных выше пунктов (1)-(8), содержащее константную область легкой цепи, которая представляет собой константную область Igκ человека.
(10) Антитело против Igβ человека по указанному выше пункту (1), содержащее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8.
(11) Антитело против Igβ человека по пункту (1), содержащее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
(12) Антитело против Igβ человека по указанному выше пункту (1), содержащее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
(13) Антитело против Igβ человека, которое получают в результате посттрансляционной модификации антитела против Igβ человека по любому из указанных выше пунктов (10)-(12).
(14) Антитело против Igβ человека по указанному выше пункту (13), где посттрансляционная модификация представляет собой пироглутамилирование на N-конце вариабельной области тяжелой цепи и/или делецию лизина на C-конце тяжелой цепи.
(15) Антитело против Igβ человека по указанному выше пункту (13), содержащее тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 6, в которой глутамин аминокислоты под номером 1 модифицирован в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO:8.
(16) Антитело против Igβ человека по указанному выше пункту (13), содержащее тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO:2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO:4.
(17) Антитело против Igβ человека по указанному выше пункту (13), содержащее тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO:10, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO:12.
(18) Полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6).
(19) Полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6).
(20) Экспрессирующий вектор, содержащий полинуклеотид по указанному выше пункту (18) и/или (19).
(21) Клетка-хозяин, трансформированная экспрессирующим вектором по указанному выше пункту (20), выбранному из группы, состоящей из следующих ниже пунктов (a)-(d):
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6), и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6), и экспрессирующий вектор, содержащий полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6); и
(d) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6).
(22) Клетка-хозяин, трансформированная экспрессирующим вектором по указанному выше пункту (20), выбранным из группы, состоящей из следующих ниже пунктов (a)-(d):
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13), и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13), и экспрессирующий вектор, содержащий полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13); и
(d) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13).
(23) Способ получения антитела против Igβ человека, включающий культивирование клетки(ток)-хозяина(ев), выбранный из группы, состоящей из следующих ниже пунктов (a)-(c), для экспрессии антитела против Igβ человека:
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6), и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6), и экспрессирующий вектор, содержащий полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела; и
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (1)-(6), и клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела.
(24) Способ получения антитела против Igβ человека, включающий культивирование клетки(ток)-хозяина(ев), выбранных из группы, состоящей из следующих ниже пунктов (a)-(c), для экспрессии антитела против Igβ человека:
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13), и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13), и экспрессирующий вектор, содержащий полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела; и
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из указанных выше пунктов (10)-(13), и клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела.
(25) Антитело против Igβ человека, которое получают способом по указанному выше пункту (23).
(26) Антитело против Igβ человека, которое получают способом по указанному выше пункту (24).
(27) Фармацевтическая композиция, содержащая антитело против Igβ человека по любому из указанных выше пунктов (1)-(17), (25) и (26) и фармацевтически приемлемый эксципиент.
(28) Фармацевтическая композиция, содержащая антитело против Igβ человека по указанному выше пункту (10), антитело против Igβ человека по указанному выше пункту (15) и фармацевтически приемлемый эксципиент.
(29) Фармацевтическая композиция по любому указанному выше пункту (27) или (28), которая представляет собой фармацевтическую композицию для профилактики или лечения аутоиммунного заболевания.
(30) Фармацевтическая композиция по указанному выше пункту (29), где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
(31) Способ для профилактики или лечения аутоиммунного заболевания, включающий введение терапевтически эффективного количества антитела против Igβ человека по любому из указанных выше пунктов (1)-(17), (25) и (26).
(32) Способ по указанным выше пунктам (1)-(17), (25) и (26), где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
(33) Антитело против Igβ человека по любому из указанных выше пунктов (1)-(17), (25) и (26) для применения для профилактики или лечения аутоиммунного заболевания.
(34) Антитело против Igβ человека по указанному выше пункту (33), где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
(35) Использование антитела против Igβ человека по любому из указанный выше пунктов (1)-(17), (25) и (26) для производства фармацевтической композиции для профилактики или лечения аутоиммунного заболевания.
(36) Использование по указанному выше пункту (35), где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
Эффекты изобретения
[0016] Антитело против Igβ человека по настоящему изобретению обладает прекрасным иммуносупрессивным действием посредством ингибирования активации B-клеток, и его можно использовать в качестве средства для профилактики или лечения аутоиммунных заболеваниях, таких как системная красная волчанка, ревматоидный артрит и идиопатическую тромбоцитопеническую пурпуру.
Краткое описание чертежей
[0017] На фиг. 1 продемонстрировано ингибирующее действие гуманизированного антитела против Igβ на индуцированную антителом к IgM клеточную пролиферацию в B-клетках человека. По вертикальной оси указана скорость пролиферации B-клеток, и по горизонтальной оси указана концентрация добавляемого антитела (мкг/мл).
[0018] На фиг. 2 продемонстрировано ингибирующее действие гуманизированного антитела против Igβ на повышение титров антитела IgM человека в плазме, индуцированное переносом PBMC человека мыши NOG. По вертикальной оси указан титр антитело IgM человека в плазме (мкг/мл), и по горизонтальной оси указано время (сутки) после переноса PBMC человека мыши NOG.
[0019] На фиг. 3 продемонстрировано ингибирующее действие гуманизированного антитела против Igβ на повышение титров антитела IgE человека в плазме, индуцированное переносом PBMC человека мыши NOG. По вертикальной оси указан титр антитела IgE человека в плазме (нг/мл), и по горизонтальной оси указано время (сутки) после переноса PBMC человека мыши NOG.
[0020] На фиг. 4 продемонстрировано ингибирующее действие гуманизированного антитела против Igβ на повышение антитела против адсорбированного столбнячного токсина в плазме, вызываемого иммунизацией адсорбированным столбнячным токсином обезьяны. По вертикальной оси указан титр антитела против адсорбированного столбнячного токсина в плазме (Ед/мл), и по горизонтальной оси указано время (сутки) после иммунизации адсорбированным столбнячным токсином обезьяны.
[0021] На фиг. 5 продемонстрировано действие гуманизированного антитела против Igβ общего титра антитела IgM в плазме обезьяны, иммунизированной адсорбированным столбнячным токсином. По вертикальной оси указан общий титр антитела IgM в плазме (Ед/мл), и по горизонтальной оси указано время (сутки) после иммунизации адсорбированным столбнячным токсином обезьяны.
[0022] На фиг. 6 представлено действие гуманизированного антитела против Igβ против общего титра антитела IgA в плазме обезьяны, иммунизированной адсорбированным столбнячным токсином. По вертикальной оси указана общий титр антитела IgA в плазме (Ед/мл), и по горизонтальной оси указано время (сутки) после иммунизации адсорбированным столбнячным токсином обезьяны.
[0023] На фиг. 7 представлено действие гуманизированного антитела против Igβ против общего титра антитела IgG в плазме обезьяны, иммунизированной адсорбированным столбнячным токсином. По вертикальной оси указан общий титр антитела IgG в плазме (Ед/мл), и по горизонтальной оси указано время (сутки) после иммунизации адсорбированным столбнячным токсином обезьяны.
Варианты осуществления изобретения
[0024] Далее в настоящем описании более подробно описано настоящее изобретение.
[0025] Существует пять классов антитела IgG, IgM, IgA, IgD и IgE. Основная структура молекулы антител сформирована тяжелыми цепями с молекулярной массой от 50000 до 70000 и легкими цепями с молекулярной массой от 20000 до 30000 в каждом из классов в совокупности. Тяжелая цепь, как правило, состоит из полипептидной цепи, содержащей приблизительно 440 аминокислот, имеет отличную структуру для каждого из классов, и ее обозначают как Igγ, Igμ, Igα, Igδ и Igε, соответствующую IgG, IgM, IgA, IgD и IgE, соответственно. Кроме того, для IgG существует четыре подкласса IgG1, IgG2, IgG3 и IgG4, и тяжелые цепи, соответственно соответствующие им, обозначают как Igγ1, Igγ2, Igγ3 и Igγ4. Легкая цепь, как правило, состоит из полипептидной цепи, содержащей 220 аминокислот, два типа из которых тип L и тип K являются известными, и их обозначают как Igλ и Igκ. В конфигурации пептида основной структуры молекул антител два гомологичные тяжелые цепи и два гомологичные легкие цепи связаны дисульфидными связями (связь S-S) и нековалентными связями, и их молекулярная масса составляет 150000 до 190000. Два вида легких цепей могут являться спаренными с любой тяжелой цепью. Соответствующие молекулы антител, как правило, состоят из двух идентичных легких цепей и двух идентичных тяжелых цепей.
[0026] Что касается внутрицепьевых связей S-S, четыре связи S-S содержаться в тяжелой цепи (пять в μ- и ε-цепях), и две из них содержаться в легкой цепи; на 100-110 аминокислотных остатков формируется одна петля, и такая стерическая структура является схожей среди петель, и ее обозначают как структурную единицу или домен. Домен, располагаемый на стороне амино-конца (сторона N-конца) в тяжелой цепи и легкой цепи, аминокислотная последовательность которых не является постоянной даже в случае образца из одного и того же класса (подкласса) того же вида животного, обозначают как вариабельную область, и соответствующие домены обозначают как вариабельную область тяжелой цепи и вариабельную область легкой цепи. Аминокислотная последовательность стороны карбокси-конца (сторона C-конца) из вариабельной области является практически постоянной в каждом классе или подклассе, и ее обозначают как константную область.
[0027] Антигенный участок связывания антитела состоит из вариабельной области тяжелой цепи и вариабельной области легкой цепи, и специфичность связывания зависит от аминокислотной последовательности этого участка. С другой стороны, виды биологической активности, такие как связывание с комплементами и различными клетками, отражает различия в структурах константной области в каждом классе Ig. Следует понимать, что вариабельность вариабельных областей легких цепей и тяжелых цепей в основном ограничена тремя небольшими гипервариабельными областями, присутствующими в обеих цепях, и эти области обозначают как определяющие комплементарность области (CDR: CDR1, CDR2 и CDR3 со стороны N-конца). Оставшуюся часть вариабельной области обозначают как каркасную область (FR), и она является относительно постоянной.
[0028] Антитело против Igβ человека по настоящему изобретению
Антитело против Igβ человека по настоящему изобретению относится к антителу против Igβ человека, обладающему следующими ниже характеристиками.
Антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности с номерами аминокислот от 31 до 35 SEQ ID NO: 2, CDR2, состоящую из аминокислотной последовательности с номерами аминокислот от 50 до 65 SEQ ID NO: 2, и CDR3, состоящую из аминокислотной последовательности с номерами аминокислот от 98 до 108 SEQ ID NO: 2, вариабельную область легкой цепи, содержащую CDR1, состоящую из аминокислотной последовательности с номерами аминокислот от 24 до 38 SEQ ID NO: 4, CDR2, состоящую из аминокислотной последовательности с номерами аминокислот от 54 до 60 SEQ ID NO: 4, и CDR3, состоящую из аминокислотной последовательности с номерами аминокислот от 93 до 101 SEQ ID NO: 4, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
[0029] В одном из вариантов осуществления антитело против Igβ человека по настоящему изобретению представляет собой гуманизированное антитело. "Гуманизированное антитело" в настоящем описании означает антитело в форме, содержащей CDR, получаемые из антитела мыши и других участков антитела, получаемых из антитела человека. Способ получения гуманизированного антитела известен в данной области, и его можно получать со ссылкой на USP №. 5225539, 6180370 и т.п.
[0030] В одном из вариантов осуществления антитело против Igβ человека по настоящему изобретению представляет собой антитело против Igβ человека, описанное в любом из следующих ниже пунктов 1)-3):
1) антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 2, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 4, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W;
2) антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 6, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 8, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W; и
3) антитело против Igβ человека, содержащее вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 10, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 12, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
[0031] Номер остатка по отношению к введению мутаций аминокислот в константной области антитела, используемый в настоящем описании, соответствует индексу EU (Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institute of Health, Bethesda). S239D представляет собой замену серина в положении 239 аминокислоты в соответствии с индексом EU по Kabat et al. в константной области Igγ1 человека аспарагиновой кислотой. H268D представляет собой замену гистидина в положении 268 аминокислоты в соответствии с индексом EU по Kabat et al. в константной области Igγ1 человека аспарагиновой кислотой. L328W представляет собой замену лейцина в положении 328 аминокислоты в соответствии с индексом EU по Kabat et al. в константной области Igγ1 человека триптофаном. Примеры константной области Igγ1 человека, несущие мутации аминокислот S239D, H268D и L328W, включают константную область Igγ1 человека, состоящую из аминокислотной последовательности с номерами аминокислот от 120 до 449 SEQ ID NO: 2.
[0032] Что касается константной области легкой цепи антитела против Igβ человека по настоящему изобретению, можно выбирать любую из константной области Igλ и Igκ, но предпочтительно является константная область Igκ человека. Примеры константной области Igκ человека включают константную область Igκ человека, состоящую из аминокислотной последовательности с номерами аминокислот от 113 до 218 SEQ ID NO: 4.
[0033] В одном из вариантов осуществления антитело против Igβ человека по настоящему изобретению представляет собой антитело против Igβ человека, выбранное из любого из следующих пунктов i)-iii):
i) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
ii) антитела против Igβ человека содержащего тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8; и
iii) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[0034] Известно, что когда антитело экспрессируется в клетках, антитело подвергается модификации после трансляции. Примеры посттрансляционной модификации включают отщепление лизина на C-конце тяжелой цепи карбоксипептидазой; модификацию глутамина или глутаминовой кислоты на N-конце тяжелой цепи и легкой цепь до пироглутаминовой кислоты пироглутамилированием; гликозилирование; окисление; деамидирование и гликирование, и известно, что такие посттрансляционные модификации возникают в различных антителах (Journal of Pharmaceutical Sciences, Vol. 97, p. 2426-2447, 2008).
[0035] Антитело против Igβ человека по настоящему изобретению относится к антителу против Igβ человека, которое подвергается посттрансляционной модификации. Примеры антитела против Igβ человека по настоящему изобретению, которое подвергается посттрансляционной модификации, включают антитела против Igβ человека, которые подвергаются пироглутамилированию на N-конце вариабельной области тяжелой цепи и/или делеции лизина на C-конце тяжелой цепи. В данной области известно, что такая посттрансляционная модификация вследствие пироглутамилирования на N-конце и делеции лизина на C-конце не оказывает какого-либо влияния на активность антитела (Analytical Biochemistry, Vol. 348, p. 24-39, 2006).
[0036] Например, антитела против Igβ человека по настоящему изобретению включают антитело против Igβ человека, описанное в любом из следующих ниже пунктов 1)-3):
1) антитело против Igβ человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 2, в которой глутаминовую кислоту под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты и/или лизин под номером аминокислоты 449 удаляют, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
2) антитело против Igβ человека содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 6, в которой глутаминовую кислоту под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты и/или лизин под номером аминокислоты 449 удаляют, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8; и
3) антитело против Igβ человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 10, в которой глутаминовую кислоту под номером аминокислоты 1 модифицируют до пироглутаминовой кислоты и/или лизин под номером аминокислоты 449 удаляют, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[0037] В одном из вариантов осуществления антитело против Igβ человека по настоящему изобретению представляют собой антитело против Igβ человека, выбранное из любого из следующих ниже пунктов i)-iii):
i) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
ii) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 6, в которой глутамин под номером аминокислоты 1 модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8; и
iii) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 10, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[0038] Любой специалист в данной области может получать слитую форму антитела и другой пептид или белок, а также может получать модифицированную форму, с которой связывается модифицирующее средство на основании настоящего изобретения, и антитело по настоящему изобретению относится к антителу в этих формах. Другие пептиды или белки, используемые для слияния, не являются конкретно ограниченными при условии, что активность связывания антитела не снижается, и их примеры включают сывороточный альбумин человека, различные пептиды-метки, искусственный спиральный пептид-мотив, мальтоза-связывающие белки, глутатион-S-трансферазу, различные токсины, другие пептиды или белки, способные поддерживать мультимеризацию и т.п. Модифицирующее средство, используемое для модификации, конкретно не ограничено при условии, что активность связывания антитела не снижается, и их примеры включают полиэтиленгликоль, сахарные цепи, фосфолипиды, липосомы, низкомолекулярные соединения и т.п.
[0039] "Антитело против Igβ человека" в настоящем описании означает антитело, связывающееся с Igβ человека. Связывается ли "антитело против Igβ человека" с Igβ человека подтверждают известными способами измерения активности связывания. Примеры способа измерения активности связывания включают способ твердофазного иммуноферментного анализа (ELISA) и т.п. В случае использования ELISA, например, Igβ человека-белок Flag (например, кодируемый основной последовательностью SEQ ID NO: 13) подвергают отверждению на планшете ELISA и добавляют к нему тестируемое антитело, которое должно реагировать. После взаимодействия вторичное антитело, такое как антитело против IgG, меченное ферментом, таким как пероксидаза хрена (HRP) или т.п., взаимодействует, и его отмывают, а затем возможно подтверждать, связывается ли тестируемое антитело с Igβ человека путем идентификации связывания вторичного антитела посредством измерения активности с использованием реагента, детектирующего активность (например, в случае мечения HRP, BM-Chemiluminescence ELISA Substrate (POD) (Roche Diagnostics Inc.)). В качестве конкретного способа измерения можно использовать способ, описанный в примере 4 ниже.
[0040] Антитело против Igβ человека по настоящему изобретению включает в дополнение к связыванию с Igβ человека антитело, связывающееся с Igβ, получаемом от других животных (например, Igβ обезьяны), при условии, что антитело связывается с Igβ человека.
[0041] В качестве способа оценки активности антитела против Igβ человека по настоящему изобретению можно оценивать активность связывания на B-клетках человека или активность ингибирования активации B-клеток человека, индуцируемой стимуляцией BCR. В качестве способов оценки такой активности можно использовать способы, описанные в примерах 5 и 6 ниже. Предпочтительно антитело против Igβ человека по настоящему изобретению обладает активностью связывания с Igβ человека и ингибирования активации B-клеток человека, активированной стимуляцией BCR.
[0042] Специалист в данной области может легко получать антитело против Igβ человека по настоящему изобретению известным в данной области способом на основе информации последовательности тяжелой цепь и легкой цепи антитела по настоящему изобретению, которое описано в настоящем описании. Антитело против Igβ человека по настоящему изобретению не является конкретно ограниченным, и его можно получать способом, описанным в разделе "Способ получения антитела против Igβ человека по настоящему изобретению и антитела против Igβ человека, получаемые способом", описанным ниже.
[0043] Антитело против Igβ человека по настоящему изобретению дополнительно очищают по мере необходимости, формулируют общепринятым способом, его и можно использовать для профилактики или лечения аутоиммунных заболеваний, таких как системная красная волчанка, ревматоидный артрит, идиопатическая тромбоцитопеническая пурпура, тяжелая миастения, болезнь Грейва, оптический нейромиелит, аутоиммунная гемолитическая анемия, обыкновенная пузырчатка, синдром антифосфолипидных антител, ассоциированный с ANCA васкулит, синдром Шегрена, тиреоидит Хашимото, хроническая воспалительная демиелинизирующая нейропатия или синдром хронической усталости.
[0044] Полинуклеотид по настоящему изобретению
Полинуклеотид по настоящему изобретению относится к полинуклеотиду, содержащему основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и полинуклеотиду, содержащему основную последовательность, кодирующую легкую цепь антитела против Igβ человека по настоящему изобретению.
[0045] В одном из вариантов осуществления полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, представляет собой полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2, полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, или полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10.
[0046] Примеры полинуклеотида, содержащего основную последовательность, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 2, включают полинуклеотид, содержащий основную последовательность, представленную SEQ ID NO: 1 или 15. Примеры полинуклеотида, содержащего основную последовательность, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, включают полинуклеотид, содержащий основную последовательность, представленную SEQ ID NO: 5. Примеры полинуклеотида, содержащего основную последовательность, кодирующую тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, включают полинуклеотид, содержащий основная последовательность, представленную SEQ ID NO: 9.
[0047] В одном из вариантов осуществления полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по настоящему изобретению, представляет собой полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, или полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[0048] Примеры полинуклеотида, содержащего основную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, включают полинуклеотид, содержащий основную последовательность, представленную SEQ ID NO: 3. Примеры полинуклеотида, содержащего основную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, включают полинуклеотид, содержащий основную последовательность, представленную SEQ ID NO: 7. Примеры полинуклеотида, содержащего основную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12, включают полинуклеотид, содержащий основную последовательность, представленную SEQ ID NO: 11.
[0049] Специалист в данной области может легко получать полинуклеотид по настоящему изобретению известным в данной области способом на основе основной последовательности. Например, полинуклеотид по настоящему изобретению можно синтезировать известным в данной области способом синтеза генов. В качестве способа синтеза генов можно использовать различные способы, такие как способ синтеза генов антитела, описанный в WO90/07861, известный специалисту в данной области.
[0050] Экспрессирующий вектор по настоящему изобретению.
Экспрессирующий вектор по настоящему изобретению относится к экспрессирующему вектору, содержащем полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, экспрессирующему вектору, содержащему полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по настоящему изобретению, и экспрессирующему вектору, содержащему полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела.
[0051] Экспрессирующий вектор, используемый для экспрессии полинуклеотида по настоящему изобретению, не является конкретно ограниченным при условии, что полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и/или полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по настоящему изобретению, можно экспрессировать в различных клетках-хозяевах эукариотических клеток (например, клетках животных, клетках насекомых, растительных клетках и дрожжах) и/или прокариотических клетках (например, Escherichia coli) и можно получать кодируемые ими полипептиды. Примеры экспрессирующего вектора включают плазмидные векторы, вирусные векторы (например, аденовирус или ретровирус) и т.п. Предпочтительно можно использовать pEE6.4 или pEE12.4 (Lonza Biologics, Inc.).
[0052] Экспрессирующий вектор по настоящему изобретению может содержать промотор, который является функционально связанным с полинуклеотидом по настоящему изобретению. Примеры промотора для экспрессии полинуклеотида по изобретению клетками животных включают получаемый из вируса промотор, такой как CMV, RSV или SV40, промотор актина, промотор 1α EF (фактора элонгации) и промотор теплового шока. Примеры промоторов для экспрессии полинуклеотида по изобретению бактериями (например, Escherichia) включают промотор trp, промотор lac, промотор λPL и промотор tac. Кроме того, примеры промоторов для экспрессии полинуклеотида по изобретению дрожжами включают промотор GAL1, промотор GAL10, промотор PH05, промотор PGK, промотор GAP и промотор ADH.
[0053] В случае использования клетки животного, клетки насекомого или дрожжей в качестве клетки-хозяина экспрессирующий вектор по настоящему изобретению может содержать инициирующий кодон и терминирующий кодон. В этом случае экспрессирующий вектор по настоящему изобретению может содержать энхансерную последовательность, нетранслируемую область на 5'-конце и 3'-конце генов, кодирующих антитело по настоящему изобретению или тяжелую цепь или легкую цепь, последовательность сигнала секреции, участок сплайсинга, участок полиаденилирования или единицу репликации. Когда в качестве клетки-хозяина используют Escherichia coli, экспрессирующий вектор по настоящему изобретению может содержать инициирующий кодон, терминирующий кодон, область терминатора и единицу репликации. В этом случае экспрессирующий вектор по настоящему изобретению может содержать селективный маркер (например, гены устойчивости к тетрациклину, гены устойчивости к ампициллину, гены устойчивости к канамицину, гены устойчивости к неомицину или гены дигидрофолатредуктазы), которые, как правило, используют по мере необходимости.
[0054] Трансформированная клетка-хозяин по настоящему изобретению
Трансформированная клетка-хозяин по настоящему изобретению относится к клетке-хозяину, трансформированной экспрессирующим вектором по настоящему изобретению, который выбран из группы, состоящей из следующих ниже пунктов (a)-(d):
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и
(d) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела против Igβ человека по настоящему изобретению.
[0055] Примеры предпочтительной трансформированной клетки-хозяина по настоящему изобретению включают клетку-хозяина, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела, и клетку-хозяина, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и экспрессирующий вектор, содержащий полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела.
[0056] Трансформированная клетка-хозяин конкретно не является ограниченной при условии, что клетка-хозяин является подходящей для используемого экспрессирующего вектора, трансформирована экспрессирующим вектором и может экспрессировать антитело. Примеры трансформированной клетки-хозяина включают различные клетки, такие как природные клетки или искусственно созданные клетки, которые, как правило, используют в области, к которой принадлежит настоящее изобретение, (например, клетки животных (например, клетки CHO-K1SV), клетки насекомых (например, Sf9), бактерии (например, Escherichia), дрожжи (например, Saccharomyces или Pichia) или т.п.). Предпочтительно можно использовать культивируемые клетки, такие как клетки CHO-K1SV, клетки CHO-DG 44, клетки293 или клетки NS0.
[0057] Способ трансформации клетки-хозяина не является конкретно ограниченным, и, например, можно использовать способ с использования фосфата кальция или способ электропорации.
[0058] Способ получения антитела против Igβ человека по настоящему изобретению и антитело против Igβ человека, получаемое способом
Способ получения антитела против Igβ человека по настоящему изобретению включает способ получения антитела против Igβ человека посредством культивирования клетки(ток)-хозяина(ев), выбранной из группы, состоящей из следующих ниже пунктов (a)-(c), для экспрессии антитела против Igβ человека:
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела, и
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по настоящему изобретению, и клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела.
[0059] Способ получения антитела против Igβ человека по настоящему изобретению не является конкретно ограниченным при условии, что он включает этап культивирования трансформированных клеток-хозяев по настоящему изобретению для экспрессии антитело против Igβ человека. Примеры предпочтительных клеток-хозяев, используемых в способе, включают предпочтительные трансформированные клетки-хозяева по настоящему изобретению, как описано выше.
[0060] Трансформированную клетку-хозяина можно культивировать известными способами. Условия культивирования, например, температура, pH среды для культивирования и время культивирования выбирают соответствующим образом. В случае, когда клетка-хозяин представляет собой клетку животного, примеры среды для культивирования включают среду для культивирования MEM, дополненную приблизительно от 5% до 20% эмбриональной телячьей сывороткой (Science, Vol. 130, p. 432-437, 1959), среду для культивирования DMEM (Virology, Vol. 8, p. 396, 1959), среду для культивирования RPMI1640 (J. Am. Med. Assoc., Vol. 199, p. 519, 1967) и среду для культивирования 199 (Exp. Biol. Med., Vol. 73, p. 1-8, 1950). pH среды для культивирования предпочтительно составляет приблизительно от 6 до 8, и культивирование, как правило, проводят при приблизительно от 30°C до 40°C приблизительно в течение от 15 часов до 72 часов при вентиляции воздуха и перемешивании при необходимости. В случае, когда клетка-хозяин представляет собой клетку насекомого, в качестве среды для культивирования можно использовать, например, среду Грейса для культивирования (Proc. Natl. Acad. Sci. USA, Vol. 82, p. 8404, 1985), дополненную эмбриональной телячьей сывороткой. pH среды для культивирования предпочтительно составляет приблизительно от 5 до 8, и культивирование, как правило, проводят при приблизительно от 20°C до 40°C в течение приблизительно от 15 часов до 100 часов при вентиляции воздуха и перемешивании при необходимости. В случае, когда клетка-хозяин представляет собой Escherichia coli или дрожжи, в качестве среды для культивирования подходящей является, например, жидкая среда для культивирования, дополненная источников питательных веществ. Предпочтительно, чтобы питательная среда для культивирования включала источник углерода, неорганический источник азота или органический источник азота, необходимый для роста трансформированной клетки-хозяина. Примеры источника углерода включают глюкозу, декстран, растворимый крахмал и сахарозу, и примеры неорганического источника азота или органического источника азота включают аммонийные соли, нитратные соли, аминокислоты, жидкий кукурузный экстракт, пептон, казеин, мясной экстракт, жмых соевых бобов и экстракт картофеля. При желании можно вводить другие питательные вещества (например, неорганические соли (например, хлорид кальция, дигидрофосфат натрия и хлорид магния), витамины) и антибиотики (например, тетрациклин, неомицин, ампициллин и канамицин). pH среды для культивирования предпочтительно составляет приблизительно от 5 до 8. В случае, когда клетка-хозяин представляет собой Escherichia coli, предпочтительные примеры среды для культивирования включают среду для культивирования LB и среду для культивирования M9 (Mol. Clo., Cold Spring Harbor Laboratory, Vol. 3, A2.2). Культивирование, как правило, проводят при приблизительно от 14°C до 43°C в течение приблизительно от 3 часов до 24 часов при вентиляции воздуха и перемешивании при необходимости. В случае, когда клетка-хозяин представляет собой дрожжи, в качестве среды для культивирования можно использовать, например, минимальную среду Беркхолдера (Proc. Natl. Acad, Sci, USA, Vol. 77, p. 4505, 1980). Культивирование, как правило, проводят при приблизительно от 20°C до 35°C в течение приблизительно от 14 часов до 144 часов при вентиляции воздуха и перемешивании при необходимости. В результате проведения культивирования описанным выше образом возможно экспрессировать антитело против Igβ человека по настоящему изобретению.
[0061] Способ получения антитело против Igβ человека по настоящему изобретению может включать восстановление, предпочтительно выделение или очистку антитело против Igβ человека из трансформированной клетки-хозяина в дополнение к культивированию трансформированной клетки-хозяина по настоящему изобретению для экспрессии антитела против Igβ человека. Примеры способа выделения или очистки включают способы с использованием растворимости, такого как высаливание и способ осаждения растворителем, способы с использованием разницы молекулярной массы, такие как диализ, ультрафильтрация и гель-фильтрация, способы с использованием электрического заряда, такие как ионообменная хроматография и хроматография на гидроксиапатите, способы с использованием специфической аффинности, такие как аффинная хроматография, способы с использованием разницы в гидрофобности, такие как обращенно-фазовая высокоэффективная жидкостная хроматография, и способы с использованием разницы изоэлектрической точки, такие как изоэлектрофокусирование с электрофорезом. Предпочтительно антитело, накапливаемое в супернатанте культуры, можно очищать различными хроматографическими способами, например, колоночной хроматографией с использованием колонки с белком A или колонки с белком G.
[0062] Антитело против Igβ человека по настоящему изобретению также относится к антителу против Igβ человека, получаемому способом получения антитела против Igβ человека по настоящему изобретению.
[0063] Фармацевтическая композиция по настоящему изобретению
Фармацевтические композиции по настоящему изобретению включают фармацевтическую композицию, содержащую антитело против Igβ человека по настоящему изобретению и фармацевтически приемлемые эксципиенты. Фармацевтическую композицию по настоящему изобретению можно получать способом, как правило, используемым с эксципиентами, а именно, эксципиентами для лекарственного препарата или носителями для лекарственного препарата, как правило, используемыми в данной области. Примеры лекарственных форм фармацевтических композиций включают парентеральное лекарственное средство, такое как инъецируемое лекарственное средство и лекарственное средство для капельного введения, и их можно вводить посредством внутривенного введения, подкожного введения или т.п. При получении лекарственных средств можно использовать эксципиенты, носители и добавки в соответствии с лекарственными формами в фармацевтически приемлемом диапазоне.
[0064] Фармацевтические композиции по настоящему изобретению могут содержать многие виды антител против Igβ человека по настоящему изобретению. Например, настоящее изобретение относится к фармацевтической композиции, содержащей антитело, которое не подвергается посттрансляционной модификации, и антитело, получаемое в результате посттрансляционной модификации антитела.
[0065] В одном из вариантов осуществления фармацевтическая композиция по настоящему изобретению содержит антитело против Igβ человека, выбранное из группы, состоящей из следующих ниже пунктов (1)-(3), и антитела против Igβ человека, получаемого в результате посттрансляционной модификации антитела против Igβ человека:
(1) антитела против Igβ человека, содержащего вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 6, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 8, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W;
(2) антитела против Igβ человека, содержащего вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 2, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 4, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W, и
(3) антитела против Igβ человека, содержащего вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 119 SEQ ID NO: 10, вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 112 SEQ ID NO: 12, и константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
[0066] Фармацевтические композиции по настоящему изобретению включают фармацевтическую композицию, содержащую антитело, в котором лизин на C-конце тяжелой цепи удаляют, антитело, которое подвергалось посттрансляционной модификации на N-конце, антитело, в котором лизин на C-конце тяжелой цепи удаляют, и которое подвергалось посттрансляционной модификации на N-конце, и/или антитело, которое содержит лизин на C-конце тяжелой цепи и не подвергалось посттрансляционной модификации на N-конце.
[0067] В одном из вариантов осуществления фармацевтическая композиция по настоящему изобретению, содержащая антитело против Igβ человека, содержит фармацевтическую композицию, содержащую два или более антител против Igβ человека, выбранных из следующих ниже пунктов (1)-(4):
(1) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
(2) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 2, в которой глутаминовую кислоту под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
(3) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 2, в которой глутаминовую кислоту под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, и
(4) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO:2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0068] В одном из вариантов осуществления фармацевтическая композиция по настоящему изобретению, содержащая антитело против Igβ человека, включает фармацевтическую композицию, содержащую два или более антител против Igβ человека, выбранных из следующих ниже пунктов (1)-(4):
(1) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 6, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8;
(2) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 6, в которое глутамин под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8;
(3) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 6, в которой глутамин под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, и
(4) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO:6, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8.
[0069] В одном из вариантов осуществления фармацевтическая композиция по настоящему изобретению, содержащая антитело против Igβ человека, содержит фармацевтическую композицию, содержащую два или более антител против Igβ человека, выбранных из следующих ниже пунктов (1)-(4):
(1) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 10, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(2) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 10, в которой глутаминовую кислоту под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(3) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 10, в которой глутаминовую кислоту под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12, и
(4) антитела против Igβ человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[0070] Кроме того, в одном из вариантов осуществления фармацевтическая композиция по настоящему изобретению представляет собой фармацевтическую композицию, описанную ниже:
фармацевтическую композицию, содержащую антитело против Igβ человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, антитело против Igβ человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот от 1 до 448 SEQ ID NO: 6, в которой глутамин под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, и фармацевтически приемлемый эксципиент.
[0071] Добавляемое количество антитела против Igβ человека по настоящему изобретению в состав изменяется в зависимости от степени симптомов пациента, возраста пациента, лекарственной формы лекарственного средства, которое следует использовать, титра связывания антитела или т.п., и, например, можно использовать добавляемое количество приблизительно от 0,001 мг/кг до 100 мг/кг.
[0072] Фармацевтическую композицию по настоящему изобретению можно использовать в качестве средства для лечения аутоиммунных заболеваний, таких как системная красная волчанка, ревматоидный артрит, идиопатическая тромбоцитопеническая пурпура, тяжелая миастения, болезнь Грейва, оптический нейромиелит, аутоиммунная гемолитическая анемия, обыкновенная пузырчатка, синдром антифосфолипидных антител, ассоциированный с ANCA васкулит, синдром Шегрена, тиреоидит Хашимото, хроническая воспалительная демиелинизирующая нейропатия, синдром хронической усталости или т.п.
[0073] Настоящее изобретение относится к фармацевтической композиции для профилактики или лечения системной красной волчанки, ревматоидного артрита или идиопатической тромбоцитопенической пурпуры, содержащей антитело против Igβ человека по настоящему изобретению. Кроме того, настоящее изобретение относится к способу для профилактики или лечения системной красной волчанки, ревматоидной артрита или идиопатической тромбоцитопенической пурпуры, включающему введение терапевтически эффективного количества антитела против Igβ человека по настоящему изобретению. Кроме того, настоящее изобретение относится к антителу против Igβ человека по настоящему изобретению для применения для профилактики или лечения системной красной волчанки, ревматоидного артрита или идиопатической тромбоцитопенической пурпура. Кроме того, настоящее изобретение относится к использованию антитела против Igβ человека по настоящему изобретению для производства фармацевтической композиции для профилактики или лечения системной красной волчанки, ревматоидного артрита или идиопатической тромбоцитопенической пурпуры.
[0074] Описано настоящее изобретение и ниже предоставлены конкретные примеры, приводимые для лучшего понимания, но они представляют собой только примеры и настоящее изобретение не ограничено ими.
Примеры
[0075] Что касается деталей с использованием коммерчески доступных наборов или реагентов, тестирования проводят в соответствии с прилагаемым протоколом, если не указано иное.
[0076] Пример 1: получение белков Igβ-Flag человека и обезьяны
Получали Белок, в котором метка Flag связывается с Igβ человека (белок Igβ человека-Flag) и белок, в котором метка Flag связывается с Igβ обезьяны (белок Igβ-Flag обезьяны). Ген Igβ человека-Flag (SEQ ID NO: 13) вводили в вектор GS pEE6.4 (Lonza Biologics, Inc.). Ген Igβ обезьяны-Flag (SEQ ID NO: 14) вводили в GS вектор pEE6.4 (Lonza Biologics, Inc.). Соответствующие получаемые векторы трансфицировали с генами в клетки FreeStyle 293 (Life Technologies, Inc.) с использованием реагента FreeStyle MAX (Life Technologies, Inc.). Соответствующие клетки культивировали в не содержащей сыворотке смеси для культивирования с использованием среды FreeStyle 293 Expression (Life Technologies, Inc.) в течение 1 недели и получали супернатанты культур, соответственно содержащие белок Igβ человека-Flag и белок Igβ обезьяны-Flag. Белки выделяли с использованием аффинного геля с антителом против Flag M2 (SIGMA-ALDRICH Corporation) из получаемых супернатантов культур, а затем использовали для последующего тестирования.
[0077] Пример 2: получение антитела против Igβ человека
Для получения антитела против Igβ человека белок Igβ человека-Flag и белок Igβ обезьяны-Flag, получаемые в примере 1, инъецировали мыши C3H/HeJJmsSlc-lpr/lpr (Japan SLC, Inc.) совместно с адъювантом для вызывания иммунного ответа для проведения иммунизации. Мышь иммунизировали несколько раз и проводили конечную иммунизацию. В соответствии с общепринятым способом экстрагировали селезенку и лимфоузел у иммунизированной мыши и собирали лимфоциты и сливали клетки с миеломными клетками мыши SP2/0 (ATCC CRL-1581), получая, таким образом, гибридому. Получали образец гибридомы с лимитирующим разведением и моноклонировали гибридому. Соответствующие клоны размножали и культивировали, среду для культивирования заменяли на SFM для гибридомы (Life Technologies, Inc.), которая представляет собой не содержащую сыворотку среду для культивирования, а затем культивировали клоны в течение от 3 до 5 суток. Антитело выделяли из получаемого супернатант культуры с использованием набора для очистки антитела (Protein G Purification kit; Proteus, Inc.).
[0078] В отношении антител, получаемых из соответствующих клонов, оценивали активность связывания с белками Igβ человека-Flag и Igβ обезьяны-Flag и активность связывания с B-клетками человека и B-клетками обезьяны. В результате было выявлено, что антитело, обозначаемый как CL6_40, связывалось с белками Igβ человека-Flag и Igβ обезьяны-Flag и обладало высокой активностью связывания с B-клетками человека и B-клетками обезьяны. В отношении CL6_40 клонировали гены, кодирующие тяжелую цепь и легкую цепь, из гибридомы и проводили определение последовательности.
[0079] Пример 3: получение гуманизированного антитела
CDR тяжелой цепи и легкой цепь CL6_40 трансплантировали в другие антитела человека и получали ряд генов тяжелых цепей и легких цепей гуманизированных антител. Конструировали экспрессирующий вектор, содержащий гены тяжелой цепи и легкой цепи советующих гуманизированных антител, с использованием вектора GS (Lonza Biologics, Inc.). В частности, гены, кодирующие сигнальные последовательности (N. Whittle et al., Protein Eng., Vol. 1, p. 499-505, 1987), и ген константной области Igγ1 человека (состоящей из основной последовательности основных номеров от 358 до 1350 SEQ ID NO: 1), несущей мутации аминокислот S239D, H268D и L328W, соответственно лигировали на 5'-конце и 3'-конце генов вариабельной области тяжелой цепи соответствующих гуманизированных антител, а затем гены тяжелой цепи вводили в вектор GS pEE6.4. Кроме того, гены, кодирующие сигнальные последовательности (N. Whittle et al., указанная выше), и гены константной области κ-цепи человека (состоящей из основной последовательности основных номеров от 337 до 657 SEQ ID NO: 3) соответственно лигировали на 5'-конце и 3'-конце генов вариабельной области легкой цепи соответствующих гуманизированных антител, а затем гены легкой цепи вводили в вектор GS pEE12.4.
[0080] Основная последовательность тяжелой цепи получаемого гуманизированного антитела CL6_40m12_DDW представлена SEQ ID NO: 1 и 15, аминокислотная последовательность, кодируемая основной последовательностью представлена SEQ ID NO: 2, основная последовательность легкой цепи антитела представлена SEQ ID NO: 3, и аминокислотная последовательность, кодируемая основной последовательностью представлена SEQ ID NO: 4. Вариабельная область тяжелой цепи, представленная SEQ ID NO: 2, состоит из аминокислотной последовательности номеров аминокислот от 1 до 119 SEQ ID NO: 2, и каждая из CDR1, CDR2 и CDR3 тяжелой цепи состоит из аминокислотной последовательности номеров аминокислот от 31 до 35, от 50 до 65 и от 98 до 108 SEQ ID NO: 2. Вариабельная область легкой цепи, представленная SEQ ID NO: 4, состоит из аминокислотной последовательности номеров аминокислот от 1 до 112 SEQ ID NO: 4, и каждая из CDR1, CDR2 и CDR3 легкой цепи состоит из аминокислотной последовательности номеров аминокислот от 24 до 38, от 54 до 60 и от 93 до 101 SEQ ID NO: 4.
[0081] Основная последовательность тяжелой цепи получаемого гуманизированного антитела CL6_40m14_DDW представлена SEQ ID NO: 5, аминокислотная последовательность, кодируемая основной последовательностью, представлена SEQ ID NO: 6, основная последовательность легкой цепи антитела представлена SEQ ID NO: 7, и аминокислотная последовательность, кодируемая основной последовательностью, представлена SEQ ID NO: 8. Вариабельная область тяжелой цепи, представленная SEQ ID NO: 6, состоит из аминокислотной последовательности номеров аминокислот от 1 до 119 SEQ ID NO: 6, и CDR1, CDR2 и CDR3 тяжелой цепи соответственно состоят из аминокислотной последовательности номеров аминокислот от 31 до 35, от 50 до 65 и от 98 до 108 SEQ ID NO: 6. Вариабельная область легкой цепи, представленная SEQ ID NO: 8, состоит из аминокислотной последовательности номеров аминокислот от 1 до 112 SEQ ID NO: 8, и CDR1, CDR2 и CDR3 легкой цепи соответственно состоят из аминокислотной последовательности номеров аминокислот от 24 до 38, от 54 до 60 и от 93 до 101 SEQ ID NO: 8.
[0082] Основная последовательность тяжелой цепи получаемого гуманизированного антитела CL6_40m16_DDW представлена SEQ ID NO: 9, аминокислотная последовательность, кодируемая основной последовательностью, представлена SEQ ID NO: 10, основная последовательность легкой цепи антитела, представлена SEQ ID NO: 11, и аминокислотная последовательность, кодируемая основной последовательностью, представлена SEQ ID NO: 12. Вариабельная область тяжелой цепи SEQ ID NO: 10 состоит из аминокислотной последовательности номеров аминокислот от 1 до 119 SEQ ID NO: 10, и CDR1, CDR2 и CDR3 тяжелой цепи соответственно состоят из аминокислотной последовательности номеров аминокислот от 31 до 35, от 50 до 65 и от 98 до 108 SEQ ID NO: 10. Вариабельная область легкой цепи, представленная SEQ ID NO: 12, состоит из аминокислотной последовательности номеров аминокислот от 1 до 112 SEQ ID NO: 12, и CDR1, CDR2 и CDR3 легкой цепи соответственно состоят из аминокислотной последовательности номеров аминокислот от 24 до 38, от 54 до 60 и от 93 до 101 SEQ ID NO: 12.
[0083] CDR1, CDR2 и CDR3 каждой из тяжелых цепей, представленных SEQ ID NO: 6 и 10, являются такими же как CDR1, CDR2 и CDR3 тяжелой цепи, представленной SEQ ID NO: 2, и CDR1, CDR2 и CDR3 каждой из легких цепей, представленных SEQ ID NO: 8 и 12, являются такими же как CDR1, CDR2 и CDR3 легкой цепи, представленной SEQ ID NO: 4.
[0084] Для получения каждого гуманизированного антитела, описанный выше вектор GS, в который соответственно вводили гены тяжелой цепи и легкой цепи каждого антитела, расщепляли с использованием рестрикционного фермента NotI и PvuI и проводили лигирование с использованием набора Ligation-Convenience (NIPPONGENE Co., Ltd.), таким образом, конструируя вектор, несущий два гена, в который вводили оба гена тяжелой цепи и легкой цепи. Затем несущий два гена вектор трансфицировали с использованием ExpiFectamine 293 (Life Technologies, Inc.) и культивировали в течение 5 суток в клетках Expi 293 (Life Technologies, Inc.), культивируемых в среде для экспрессии Expi 293 (Life Technologies, Inc.) приблизительно при 3000000 клеток/мл. Затем получали очищенные антитела соответствующих гуманизированных антител с использованием белка G (GE Healthcare Japan Corporation) из получаемых супернатантов культур. Что касается конститутивной экспрессии антитела экспрессировали посредством трансфекции описанным выше несущим два гена вектором клеток CHO-K1SV (Lonza Biologics, Inc.). Затем получали очищенные антитела соответствующих гуманизированных антител с использованием MabSelect SuRe (GE Healthcare Japan Corporation) из супернатантов культур. В результате анализа модификации аминокислот соответствующих очищенных гуманизированных антител в большей части очищенных антител делеция лизина на C-конце тяжелой цепи встречалась в CL6_40m12_DDW, пироглутамилирование на N-конце тяжелой цепи и делеция лизина на C-конце тяжелой цепи встречались в CL6_40m14_DDW, и делеция лизина на C-конце тяжелой цепи встречалась в CL6_40m16_DDW.
[0085] Пример 4: анализ ELISA антигена
Для измерения антигенсвязывающей активности гуманизированного антитела использовали ELISA для антигена. Получали белок Igβ человека-Flag, получаемый в примере 1, с забуференным Tris физиологическим раствором (TBS; Wako Pure Chemical Industries, Ltd.), таким образом, чтобы концентрация составляла 5000 нг/мл, добавляли в белый планшет NUNC MaxiSorp 384 (планшет Maxisorp 384: Nunc Corporation) в количестве 15 мкл на лунку, а затем отверждали при комнатной температуре в течение 1 часа. Получаемый продукт дважды промывали TBS-T (0,05% Tween-20, содержащим TBS: Wako Pure Chemical Industries, Ltd.), добавляли к нему 120 мкл блокирующего средства (Blocking One: Nacalai tesque, Inc.), получаемый продукт оставляли при комнатной температуре в течение 1 часа и удаляли раствор. Получали серийное разведение (8 этапов с конечной концентрацией от 0,46 нг/мл до 1 мкг/мл) соответствующих гуманизированных антител, получаемых в примере 3, с использованием разбавленного раствора, получаемого добавлением того же количества блокирующего средства и TBS, а затем добавляли к нему в количестве количество 15 мл. Получаемый продукт оставляли при комнатной температуре в течение 1 часа, промывали промывной жидкостью TBS-T три раза и добавляли к нему 20 мкл меченного пероксидазой хрена (HRP) антитела кролика против Ig человека (Dako Ltd.), которое разбавляли в 3000 раз разбавленным раствором. Затем, получаемый продукт оставляли при комнатной температуре в течение 1 часа, а затем промывали промывной жидкостью TBS-T три раза. Затем к нему добавляли 30 мкл субстрата BM-Chemiluminescence ELISA (POD) (Roche Diagnostics Inc.), который представляет собой хемилюминесцентный реагент для детекции и измеряли количество хемилюминесценции посредством счетчика EnVision (PerkinElmer, Co., Ltd.). Тем же способом проводили анализ ELISA для антигена с использованием белка Igβ обезьяны-Flag, получаемого в примере 1. Когда рассчитывали активности связывания в соответствующих концентрациях тестируемых антител, измеряемое количество лунки, в которую не добавляли тестируемое антитело, принимали за 0% и величину сходимости максимальной активности тестируемого антитела принимали за 100%. Анализировали рассчитываемые активности связывания и рассчитывали значения EC50 тестируемых антител путем аппроксимации кривой.
[0086] В результате величины EC50 белков Igβ человека-Flag и Igβ обезьяны-Flag CL6_40m12_DDW соответственно составляли 128 нг/мл и 183 нг/мл. Величины EC50 белков Igβ человека-Flag и Igβ обезьяны-Flag CL6_40m14_DDW соответственно составляли 100 нг/мл и 106 нг/мл. Величины EC50 белков Igβ человека-Flag и Igβ обезьяны-Flag CL6_40m16_DDW соответственно составляли 132 нг/мл и 118 нг/мл. Подтверждали, что все соответствующие гуманизированные антитела обладали высокими активностями связывания с обоими белками Igβ человека-Flag и Igβ обезьяны-Flag.
[0087] Пример 5: анализ FACS PBMC человека и обезьяны
Для оценки активности связывания гуманизированных антител с клетками человека и обезьяны проводили анализ активируемой флуоресценцией сортировки клеток (FACS) на PBMC человека и обезьяны с показателем CD20, который является маркером B-клеток, с использованием B-клеток, содержащихся в PBMC, в качестве мишени. PBMC обезьяны получали разведением крови обезьяны в том же количестве PBS (Life Technologies, Inc.), расслаивая разбавленную кровь в таком же количестве фиколла (GE Healthcare Japan Corporation) и проводя обработку центрифугированием при комнатной температуре и при 1500 об./мин. в течение 30 минут. Затем PBMC человека (AllCells, Inc.) или PBMC обезьяны высевали в количестве 200000 на лунку в 96-луночный планшет (Greiner Bio-One) в суспендированном состоянии в 30 мл буфера для окрашивания (Becton, Dickinson Company). Получали серийное разведение (4 этапа с конечной концентрацией 0,03 нг/мл до 30 мкг/мл) каждого из гуманизированных антител, получаемых в примере 3, с использованием буфера для окрашивания и добавляли 30 мкл серийного разведения. Получаемый продукт оставляли на льду в течение 30 минут, промывали буфером для окрашивания три раза и добавляли к нему 40 мкл раствора, содержащего меченный фикоэритрином фрагмент Fcγ козы IgG против человека (JACKSON, Inc.), который разбавляли в 200 раз буфером для окрашивания, и меченное аллофикоцианином антитело мыши против CD20 (Becton, Dickinson Company), разбавленное в 8 раз буфером для окрашивания. Получаемый продукт оставляли на льду в течение 30 минут и дважды промывали буфером для окрашивания, измеряли интенсивность флуоресценции с использованием FACSArray (Becton, Dickinson Company), а затем рассчитывали среднюю интенсивность флуоресценции:MFI). Для анализа использовали FlowJo (TOMY DIGITAL BIOLOGY Co., Ltd.).
[0088] В результате подтверждали, что все соответствующие гуманизированные антитела обладали высокими активностями связывания с B-клетками человека и обезьяны.
[0089] Пример 6: оценка индуцированной антителом против IgM пролиферативной активности клеток
Для оценки ингибирующего действия гуманизированных антител в отношении активации B-клеток человека в результате стимуляции BCR оценивали индуцированную антителом против IgM пролиферативную активность клеток в B-клетках человека. Антитело против IgM активирует B-клетки, обеспечивая агрегацию BCR. Связывание антитела с BCR и FcγRIIb мобилизует FcγRIIb к BCR и, таким образом, можно ингибировать пролиферацию B-клеток. В этом примере в качестве антитела сравнения использовали антитело против CD19 S267E/L328F (патентный документ 2). В качестве контрольного антитела использовали антитело IgG1 человека (Ab против KLH) против KLH (гемоцианин морского блюдечка), которое является антигеном, не встречающимся в живом организме (WO 2013/094723). Затем B-клетки человека (AllCells, Inc.) высевали в количестве 30000 на лунку в 96 луночном планшете (Iwaki, Co., Ltd.) с использованием 60 мкл среды для культивирования RPMI (SIGMA-ALDRICH Corporation). Затем получали серийное разведение (3 этапа с конечной концентрацией от 0,3 нг/мл до 30 мкг/мл) соответствующих полных антитела человека, получаемых в примере 3, антитела против CD19 S267E/L328F или Ab против KLH и добавляли в количестве 20 мкл с использованием среды для культивирования RPMI. Добавляли 20 мкл антитела против IgM (JACKSON, Inc.), получаемого таким образом, что его конечную концентрацию в среде для культивирования RPMI доводили до 5 мкг/мл, и инкубировали в инкубаторе CO2 в течение 4 суток. Затем проводили анализа клеточной пролиферации с использованием CellTiter-Glo (Promega K.K.). Кроме того, в этом примере получали группу без добавления тестируемого антитела/без добавления антитела против IgM и группу без добавления тестируемого антитела/с добавлением антитела против IgM соответственно в качестве отрицательного контроля и положительного контроля, а затем проводили тестирование. Соответствующие антитела тестировали в двух повторениях.
[0090] На фиг. 1 представлены результаты скорости пролиферации B-клеток человека. Скорости пролиферация группы введения тестируемого антитела рассчитывали путем принятия группы без добавления тестируемого антитела/без добавления антитела против IgM в качестве отрицательного контроля (скорость пролиферации: 0%) и группы без добавления тестируемого антитела/без добавления антитела против IgM в качестве положительного контроля (скорость пролиферации: 100%). Это означает, что ингибирующая активность в отношении BCR тестируемого антитела является больше, когда значение скорости пролиферации является меньше.
[0091] Как продемонстрировано на фиг. 1, несмотря на то, что скорость пролиферации в 30 мкг/мл антитела против CD19 S267E/L328F составляла 52,3%, скорости пролиферации в 30 мкг/мл CL6_40m12_DDW, CL6_40m14_DDW и CL6_40m16_DDW соответственно составляли 2,8%, 20,2% и 23,2%. Таким образом, очевидно, что все описанные выше полностью принадлежащие человеку антитела обладают сильной ингибирующей активностью в отношении индуцированной антителом против IgM клеточной пролиферации в B-клетках человека по сравнению с антителом против CD19 S267E/L328F.
[0092] Пример 7: оценка эффективности лекарственного средства на модели переноса PBMC человека мыши NOG
С целью подтверждения эффективности гуманизированного антитела по отношению к образованию антител in vivo оценивали действие различных антител при введении для лечения в отношении повышения титров антитела человека, индуцированного переносом PBMC человека мыши NOG. В настоящей модели полагают, что B-клетки человека, искусственным образом активированные в результате распознавания чужеродного объекта (мыши), дифференцируются в клетки (предшественники) плазмы в организме мыши, и настоящая модель является подходящей для оценки фармакологического действия тестируемого лекарственного средства в отношении активности клеток B-серий человека.
[0093] PBMC человека (AllCells, Inc.) суспендировали при 10000000 клеток/мл в PBS (Wako Pure Chemical Industries, Ltd.) и вводили в хвостовую вену самцу мыши NOG в возрасте 11 недель (In-vivo Science, Inc.) в количестве 0,25 мл (2500000 клеток). На сутки 34 (сутки 34 после переноса PBMC) измеряли массу и отбирали образец крови. Измеряли титр антитела IgM человека и IgE в плазме с использованием ELISA (Bethyl Laboratories, Inc.). Группирование проводили на основании титра антитела IgM человека, IgE в плазме и данных массы.
[0094] В этом примере в качестве антитела сравнения использовали антитело против CD19 S267E/L328F. В качестве контрольного антитела использовали Ab против KLH. мыши вводили 10 мг/10 мл/кг тестируемого антитела путем подкожного введение на сутки 35 и сутки 42. Отбор образцов крови проводили на сутки 42 и 49 и измеряли титр антитело IgM человека и IgE в плазме с использованием ELISA (Bethyl Laboratories, Inc.). Тестирование проводили в единице группы из 4 или 5 животных. Результаты тестирования представлены как "среднее значение±стандартная ошибка". Определение значимого отличия группы Ab против KLH и различных групп тестируемого антитела проводили с использованием t-критерия Стьюдента и случай, где значение p составляло менее 0,05, считали статистически значимым. Описанное выше определение проводили с использованием GraphPad Prism (версия 5.04).
[0095] На фиг. 2 представлено действие тестируемого антитела в отношении титра антитела IgM человека в плазме. Титр антитела IgM человека в плазме значительно снижался CL6_40m12_DDW и CL6_40m14_DDW по сравнению с Ab KLH. Действие снижения CL6_40m12_DDW и CL6_40m14_DDW в отношении титра антитела IgM человека в плазме проявлялось очень рано, и его распознавали с первой недели после того, как начинали введение (сутки 42). При этом для антитела против CD19 S267E/L328F действие снижения в отношении титра антитела IgM человека в плазме являлось значимым только после 2 недель после того, как начинали введение (сутки 49).
[0096] Затем на фиг. 3 представлено действие тестируемого антитела в отношении титра антитела IgE человека в плазме. В CL6_40m12_DDW и CL6_40m14_DDW титр антитела IgE человека в плазме быстро и значимо снижался по сравнению с Ab против KLH. При этом в группе антитела против CD19 S267E/L328F, титр антитела IgE человека в плазме не снижался.
[0097] Как представлено на фиг. 2 и 3, очевидно, что оба описанных выше CL6_40m12_DDW и CL6_40m14_DDW обалдеют сильными ингибирующими активностями по отношению к повышению титра антитела человека по сравнению с антителом против CD19 S267E/L328F.
[0098] Пример 8: оценка эффективности лекарственного средства на модели сенсибилизации антигеном TTx на обезьянах
Специфический к антигену TTx IgG получали путем однократной сенсибилизации антигеном адсорбированного столбнячного токсина (TTx) обезьяны. В настоящей модели можно оценивать общие титры антител в плазме в дополнение к специфическому к антигену TTx IgG в плазме. Таким образом, в настоящей модели можно оценивать безопасность в дополнение к эффективности при лечении аутоиммунных заболеваний.
[0099] С использованием самца яванского макака (район происхождения: Китай, в возрасте 3 года или старше) смешивали от 2 мг/кг до 5 мг/кг (0,05 мл/кг: USP Corporation) золазепама гидрохлорида и от 2,5 мг/кг до 5 мг/кг тилетамина гидрохлорида под анестезией и проводили сенсибилизацию TTx (сутки сенсибилизации устанавливали как сутки 0). Сенсибилизацию TTx проводили посредством инъекций 0,6 мл/обезьяну столбнячного токсина (TTx, 10 ФЕд./мл, Denka Seika Co., Ltd.) в мышцу бедра и 0,6 мл/обезьяну (соответственно 50 мкл до 12 мест) в заднюю часть внутрикожно. Что касается групп обработки использовали группу носителя (растворитель (20 мМ буфера цитрата натрия /120 мМ, NaCl (pH: 6,0); KOHJIN BIO Co., Ltd.) 1 мл/кг, n=3) и группу введения антитела (10 мг/1 мл/кг, гуманизированное антитело CL6_40m14_DDW (разбавленное растворителем), n=3). Время введения устанавливали на сутки 14 после сенсибилизации TTx и проводили введение в вену в дозе 1 мл/кг при пробуждении.
[0100] После введения CL6_40m14_DDW описанному выше яванскому макаку отбирали образец крови в моменты времени, например, через 4 часа, 72 часа, 168 часов и 336 часов и подвергали обработке центрифугой, а затем выделяли плазму. Концентрацию лекарственных средств в плазме измеряли с использованием рабочей станции Gyrolab™ xP (Gyros AB). В качестве способа и диска использовали компактные диски 200-3W-001-A и Bioaffy 200 (Gyros AB). Кроме того, в качестве отвержденного антигена и детектируемого антитела использовали меченный биотином рекомбинантный CD79B человека (Novoprotein, Inc.) и меченное Alexa антитело козы против IgG человека (Southern Biotechnology Associates, Inc.). Как приведено в таблице 1, концентрация лекарственных средств в плазме CL6_40m14_DDW поддерживалась во время периода оценки модели.
Таблица 1: Переход концентрации лекарственных средств в плазме в отношении гуманизированного антитела против Igβ у обезьяны
Таблица 1
[0101] У описанного выше яванского макака отбирали образец кровь в моменты времени на сутки 13 (через 13 суток после того, как яванского макака иммунизировали адсорбированным столбнячным токсином), сутки 14, сутки 17, сутки 21 и сутки 28, проводили обработку центрифугированием и выделяли плазму. Для измерения антитела против адсорбированного столбнячного токсина (IgG против TTx) в выделенной плазме использовали ELISA для антигена. Адсорбированным столбнячным токсином (Denka Seika Co., Ltd.) разбавляли в 20 раз фосфатно-солевым буфером (PBS; Wako Pure Chemical Industries, Ltd.), добавляли в 96-луночный планшет NUNC MaxiSorp (96-луночный планшет Maxisorp: Nunc Corporation) в количестве 100 мкл на лунку, а затем проводили отверждение при 4°C в течение одной ночи. Получаемый продукт промывали PBS-T (0,05% Tween-20, содержащим PBS: Thermo Scientific, Inc.) четыре раза, добавляли к нему 200 мкл блокирующего средства (блокирующий казеин в PBS; Life Technologies, Inc.), получаемый продукт оставляли при комнатной температуре в течение 2 часов и удаляли раствор. Затем к нему добавляли 100 мкл выделенной плазмы и 100 мкл образца для калибровочной кривой соответственно. В качестве образца для калибровочной кривой использовали образец, смешанный с плазмой, собираемой через 21 сутки и 23 суток после иммунизации яванского макака адсорбированным столбнячным токсином, его количество доводили до 100 Ед/мл и использовали серийные разведения (от 0,488 мЕд/мл до 500 мЕд/мл), получаемое с использованием блокирующего средства в качестве разбавленного раствора. Получаемый продукт оставляли при комнатной температуре в течение 2 часов, промывали промывной жидкостью PBS-T четыре раза и добавляли к нему 100 мкл меченного пероксидазой хрена (HRP) антитела коза против IgG обезьяны (Nordic, Inc.), которое разбавляли в 3000 раз блокирующим средством. В дальнейшем получаемый продукт оставляли при комнатной температуре в течение 1 часа, а затем промывали промывной жидкостью PBS-T четыре раза. Затем проводили измерение с использованием системы TMB Microwell Peroxidase Substrate (KPL, Inc.). Измеряли оптическую плотность посредством SpectraMax (Molecular Devices, Inc.).
[0102] На фиг. 4 представлено действие тестируемого антитела в отношении титра антитела против адсорбированного столбнячного токсина в плазме. Титр антитело против адсорбированного столбнячного токсина в плазме (IgG против TTX) снижался в группе CL6-40m14_DDW по сравнению с группой носителя.
[0103] Общие титры антитела (IgM, IgA и IgG) в плазме, выделяемой у яванского макака на сутки 14, сутки 17, сутки 21 и сутки 28.измеряли следующим ниже способом. Поликлональное антитело кролика против IgM обезьяны (COVANCE, Inc.) и поликлональное антитело кролика против IgA человека (Bethyl Laboratories, Inc.) разбавляли в 100 раз, 500 раз и 1000 раз фосфатно-солевым буфером (PBS: Wako Pure Chemical Industries, Ltd.), добавляли в 96-луночный планшет NUNC MaxiSorp (96-луночный планшет Maxisorp: Nunc Corporation) в количестве 100 мкл, а затем отверждали при 4°C в течение одной ночи. Получаемый продукт промывали PBS-T (0,05% Tween-20, содержащим PBS: Thermo Scientific, Inc.) четыре раза, добавляли к нему 200 мкл блокирующего средства (блокирующий казеин в PBS; Life Technologies, Inc.) и оставляли получаемый продукт при комнатной температуре в течение 1 часа, и промывали промывной жидкостью PBS-T четыре раза. Получали серийное разведение образца для калибровочной кривой и собранной плазмы обезьяны с использованием блокирующего средства в качестве разбавленного раствора и добавляли 100 мкл серийного разведения. В качестве образца для калибровочной кривой разбавляли плазму, получаемую от нормального яванского макака, а затем использовали. Получаемый продукт оставляли при комнатной температуре в течение 2 часов, промывали промывной жидкостью PBS-T четыре раза и разбавляли меченное пероксидазой хрена (HRP) антитело против антитела IgM обезьяны (KPL, Inc.), меченное пероксидазой хрена (HRP) антитело против антитела IgA человека (Bethyl Laboratories, Inc.) и меченное пероксидазой хрена (HRP) антитело против антитела IgG обезьяны (KPL, Inc.) соответственно в 1000 раз, 5000 раз и 3000 раз блокирующим средством и добавляли в количестве 100 мкл соответственно. Затем получаемый продукт оставляли при комнатной температуре в течение 2 часов, а затем промывали промывной жидкостью PBS-T четыре раза. Затем проводили измерение с использованием системы TMB Microwell Peroxidase Substrate (KPL, Inc.). Оптическую плотность измеряли посредством SpectraMax (Molecular Devices, Inc.).
[0104] На фиг. 5, 6 и 7 представлено действие тестируемых антител в отношении общих титров антител (IgM, IgA и IgG) в плазме. CL6_40m14_DDW не влиял на общие титры антитела (IgM, IgA и IgG) в плазме по сравнению с группой носителя.
[0105] На основании результатов, описанных выше, очевидно, что CL6_40m14_DDW подавляет специфическое к антигену антитело, не оказывая влияния на общие титры антител в плазме. Кроме того, также очевидно, что CL6_40m14_DDW обладает прекрасными показателями безопасности в дополнение к эффективности во время лечения аутоиммунных заболеваний.
Применимость в промышленности
[0106] Антитело против Igβ человека по настоящему изобретению является пригодным для профилактики и лечения аутоиммунных заболеваний. Кроме того, полинуклеотид, экспрессирующий вектор, трансформированная клетка-хозяин и способы получения антитела по настоящему изобретению являются пригодными для получения g антитела против Igβ человека.
Список последовательностей в свободной форме
[0107] Под числом с заголовком <223> списка последовательностей приведено описание "искусственной последовательности". В частности, основные последовательности, представленные SEQ ID NO: 1 и 3 списка последовательностей, представляют собой основные последовательности тяжелой цепи и легкой цепи e CL6_40m12_DDW, соответственно, и аминокислотные последовательности, представленные SEQ ID NO: 2 и 4, представляют собой аминокислотные последовательности тяжелой цепи и легкой цепи, кодируемые SEQ ID NO: 1 и 3, соответственно. Основные последовательности, представленные SEQ ID NO: 5 и 7 списка последовательностей, представляют собой основные последовательности тяжелой цепи и легкой цепи CL6_40m14_DDW, соответственно, и аминокислотные последовательности, представленные SEQ ID NO: 6 и 8, представляют собой аминокислотные последовательности тяжелой цепи и легкой цепи, кодируемые SEQ ID NO: 5 и 7, соответственно. Основные последовательности, представленные SEQ ID NO: 9 и 11 списка последовательностей, представляют собой основные последовательности тяжелой цепи и легкой цепи CL6_40m16_DDW, соответственно, и аминокислотные последовательности, представленные SEQ ID NO: 10 и 12 списка последовательностей, представляют собой аминокислотные последовательности тяжелой цепи и легкой цепи, кодируемые SEQ ID NO: 9 и 11, соответственно. Основная последовательность, представленная SEQ ID NO: 13 списка последовательностей, представляет собой основную последовательность гена Igβ человека-Flag, и основная последовательность, представленная SEQ ID NO: 14 списка последовательностей, представляет собой основную последовательность гена Igβ обезьяны-Flag. Основная последовательность, представленная SEQ ID NO: 15 списка последовательностей, представляет собой основную последовательность тяжелой цепи CL6_40m12_DDW.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ АНТИТЕЛО ПРОТИВ TIE-2 ЧЕЛОВЕКА | 2015 |
|
RU2702553C2 |
| НОВОЕ АНТИТЕЛО К TSLP-РЕЦЕПТОРУ ЧЕЛОВЕКА | 2014 |
|
RU2689528C2 |
| АНТИТЕЛО ПРОТИВ Fn14 ЧЕЛОВЕКА | 2019 |
|
RU2787044C2 |
| АНТИТЕЛО К CD73 ЧЕЛОВЕКА | 2017 |
|
RU2754058C2 |
| НОВЫЙ FAB-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ CEACAM5 ЧЕЛОВЕКА | 2018 |
|
RU2779165C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО ПРОТИВ ОСТЕОПОНТИНА ЧЕЛОВЕКА | 2007 |
|
RU2429016C2 |
| УЛУЧШЕННОЕ ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К ЧЕЛОВЕЧЕСКОМУ α9-ИНТЕГРИНУ | 2009 |
|
RU2503720C2 |
| НОВЫЙ Fab-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ MUC1 ЧЕЛОВЕКА | 2017 |
|
RU2767793C2 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ Fab-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ MUC1 ЧЕЛОВЕКА, ПЕПТИДНЫЙ ЛИНКЕР И/ИЛИ ЛИГАНД | 2019 |
|
RU2814073C2 |
| АНТИТЕЛО ПРОТИВ Siglec-15 | 2010 |
|
RU2539790C2 |
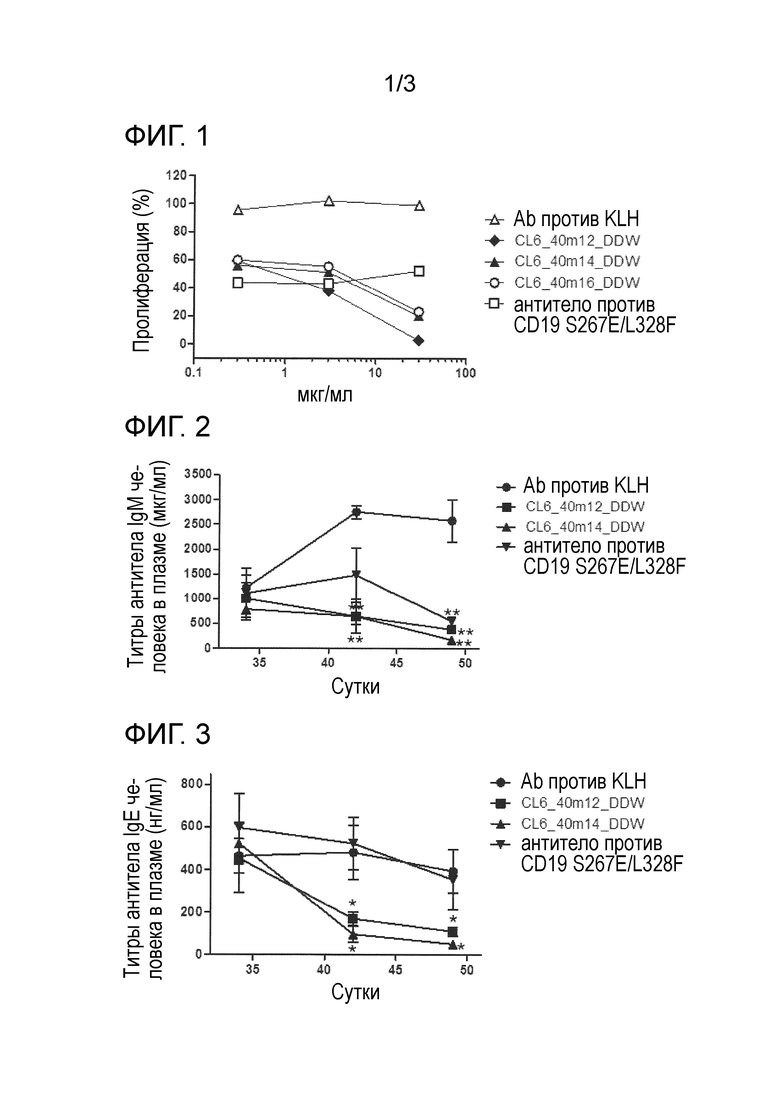
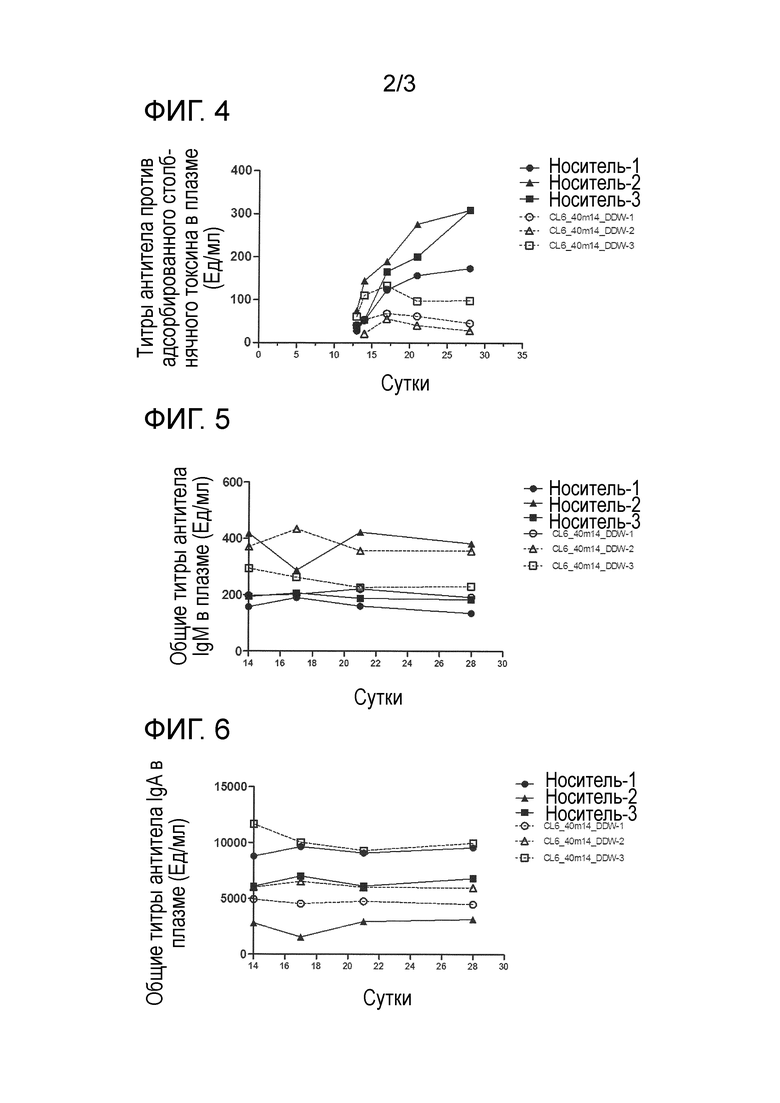
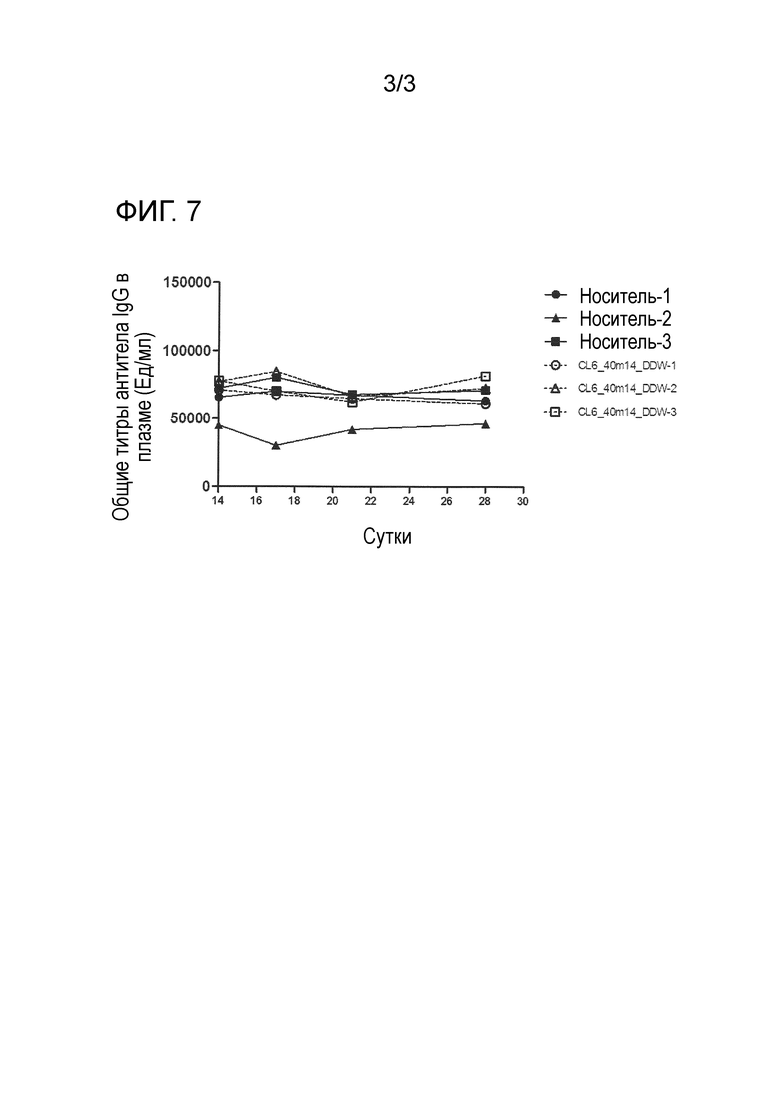
Изобретение относится к области биохимии, в частности к антителу против Igβ. Также раскрыты полинуклеотид, кодирующий указанное антитело, экспрессионный вектор, содержащий указанный полинуклеотид, клетка-хозяин для получения указанного антитела, фармацевтическая композиция, содержащая указанное антитело. Раскрыты способ получения указанного антитела, способ профилактики или лечения заболевания, ассоциированного с Igβ, применение указанного антитела. Изобретение обладает способностью эффективно лечить заболевания, ассоциированные с Igβ. 17 н. и 17 з.п. ф-лы, 8 пр., 1 табл., 7 ил.
1. Антитело против Igβ человека, содержащее
вариабельную область тяжелой цепи, содержащую
CDR1, состоящую из аминокислотной последовательности с номерами аминокислот 31-35 SEQ ID NO: 2,
CDR2, состоящую из аминокислотной последовательности с номерами аминокислот 50-65 SEQ ID NO: 2, и
CDR3, состоящую из аминокислотной последовательности с номерами аминокислот 98-108 SEQ ID NO: 2,
вариабельную область легкой цепи, содержащую
CDR1, состоящую из аминокислотной последовательности с номерами аминокислот 24-38 SEQ ID NO: 4,
CDR2, состоящую из аминокислотной последовательности с номерами аминокислот 54-60 SEQ ID NO: 4, и
CDR3, состоящую из аминокислотной последовательности с номерами аминокислот 93-101 SEQ ID NO: 4, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
2. Антитело против Igβ человека по п.1, которое представляет собой гуманизированное антитело.
3. Антитело против Igβ человека по п.1, выбранное из группы, состоящей из следующих ниже пунктов (1)-(4):
(1) антитела против Igβ человека, содержащего
вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-119 SEQ ID NO: 6,
вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-112 SEQ ID NO: 8, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W;
(2) антитела против Igβ человека, содержащего
вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-119 SEQ ID NO: 2,
вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-112 SEQ ID NO: 4, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W;
(3) антитела против Igβ человека, содержащего
вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-119 SEQ ID NO: 10,
вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-112 SEQ ID NO: 12, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W, и
(4) антитела против Igβ человека, которое получают в результате посттрансляционной модификации антитела против Igβ человека по любому из указанных выше пунктов (1)-(3),
где посттрансляционная модификация представляет собой пироглуматилирование на N-конце вариабельной области тяжелой цепи и/или делецию лизина на С-конце тяжелой цепи.
4. Антитело против Igβ человека по п.3, содержащее
вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-119 SEQ ID NO: 6,
вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-112 SEQ ID NO: 8, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
5. Антитело против Igβ человека по п.3, содержащее
вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-119 SEQ ID NO: 2,
вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-112 SEQ ID NO: 4, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
6. Антитело против Igβ человека по п.3, содержащее
вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-119 SEQ ID NO: 10,
вариабельную область легкой цепи, состоящую из аминокислотной последовательности с номерами аминокислот 1-112 SEQ ID NO: 12, и
константную область тяжелой цепи, которая представляет собой константную область Igγ1 человека, несущую мутации аминокислот S239D, H268D и L328W.
7. Антитело против Igβ человека, которое получают в результате посттрансляционной модификации антитела против Igβ человека по любому из пп.4-6,
где посттрансляционная модификация представляет собой пироглуматилирование на N-конце вариабельной области тяжелой цепи и/или делецию лизина на С-конце тяжелой цепи.
8. Антитело против Igβ человека по любому из пп.1-7, содержащее константную область легкой цепи, которая представляет собой константную область Igκ человека.
9. Антитело против Igβ человека по п.1, содержащее
тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 6, и
легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 8.
10. Антитело против Igβ человека по п.1, содержащее
тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 2, и
легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 4.
11. Антитело против Igβ человека по п.1, содержащее
тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 10, и
легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 12.
12. Антитело против Igβ человека, которое получают в результате посттрансляционной модификации антитела против Igβ человека по любому из пп.9-11,
где посттрансляционная модификация представляет собой пироглуматилирование на N-конце вариабельной области тяжелой цепи и/или делецию лизина на С-конце тяжелой цепи.
13. Антитело против Igβ человека по п.12, содержащее
тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот 1-448 SEQ ID NO: 6, в которой глутамин под номером 1 аминокислоты модифицируют до пироглутаминовой кислоты, и
легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 8.
14. Антитело против Igβ человека по п.12, содержащее
тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот 1-448 SEQ ID NO: 2, и
легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 4.
15. Антитело против Igβ человека по п.12, содержащее
тяжелую цепь, состоящую из аминокислотной последовательности с номерами аминокислот 1-448 SEQ ID NO: 10, и
легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 12.
16. Полинуклеотид, кодирующий тяжелую цепь антитела против Igβ человека по любому из пп.1-6.
17. Полинуклеотид, кодирующий легкую цепь антитела против Igβ человека по любому из пп.1-6.
18. Экспрессирующий вектор, содержащий полинуклеотид по п.16 и/или 17.
19. Клетка-хозяин для получения антитела по пп.1-6, выбранная из группы, состоящей из следующих ниже пунктов (a)-(b):
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.1-6, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.1-6;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.1-6, и экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.1-6.
20. Клетка-хозяин для получения антитела по п.9-12, выбранная из группы, состоящей из следующих ниже пунктов (a)-(b):
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.9-12, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.9-12;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.9-12, и экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.9-12.
21. Способ получения антитела против Igβ человека, включающий культивирование клетки(ток)-хозяина(ев), выбранной(ых) из группы, состоящей из следующих ниже пунктов (a)-(c), для экспрессии антитела против Igβ человека:
(a) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.1-6, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.1-6;
(b) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.1-6, и экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.1-6, и
(c) клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.1-6, и клетки-хозяина, трансформированной экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.1-6.
22. Способ получения антитела против Igβ человека, включающий культивирование клетки(ток)-хозяина(ев), выбранной(ых) из группы, состоящей из следующих ниже пунктов (a)-(c), для экспрессии антитела против Igβ человека:
(a) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.9-12, и полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.9-12;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.9-12, и экспрессирующий вектор, содержащий полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.9-12; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую тяжелую цепь антитела против Igβ человека по любому из пп.9-12, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий основную последовательность, кодирующую легкую цепь антитела по любому из пп.9-12.
23. Антитело против Igβ человека, которое получают способом по п.21.
24. Антитело против Igβ человека, которое получают способом по п.22.
25. Фармацевтическая композиция для профилактики или лечения аутоиммунного заболевания, связанного с Igβ, содержащая эффективное количество антитела против Igβ человека по любому из пп.1-15, 23 и 24 и фармацевтически приемлемый эксципиент.
26. Фармацевтическая композиция для профилактики или лечения аутоиммунного заболевания, связанного с Igβ, содержащая эффективное количество антитело против Igβ человека по п.9, антитело против Igβ человека по п.13 и фармацевтически приемлемый эксципиент.
27. Фармацевтическая композиция по п.25 или 26, которая представляет собой фармацевтическую композицию для профилактики или лечения аутоиммунного заболевания.
28. Фармацевтическая композиция по п.27, где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
29. Способ профилактики или лечения аутоиммунного заболевания, связанного с Igβ, включающий введение терапевтически эффективного количества антитела против Igβ человека по любому из пп.1-15, 23 и 24.
30. Способ по п.29, где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
31. Применение антитела против Igβ человека по любому из пп.1-15, 23 и 24 для профилактики или лечения аутоиммунного заболевания, связанного с Igβ.
32. Применение по п.31, где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
33. Применение антитела против Igβ человека по любому из пп.1-15, 23 и 24 для производства фармацевтической композиции для профилактики или лечения аутоиммунного заболевания, связанного с Igβ.
34. Применение по п.33, где аутоиммунное заболевание представляет собой системную красную волчанку, ревматоидный артрит или идиопатическую тромбоцитопеническую пурпуру.
| US 8404236 B2, 26.03.2013 | |||
| WO 2006130855 A2, 07.12.2006 | |||
| US 20020150573 A1, 17.10.2002 | |||
| РЕКОМБИНАНТНОЕ АНТИТЕЛО ПРОТИВ ОСТЕОПОНТИНА И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2305111C2 |
Авторы
Даты
2019-12-26—Публикация
2015-08-05—Подача