Предшествующий уровень техники
Хроническая травматическая энцефалопатия (ХТЭ) представляет собой хроническое нейродегенеративное заболевание, триггером которого являются повторяющиеся эпизоды легкой и средне-тяжелой черепно-мозговой травмы. [McKee AC, Cairns NJ, Dickson DW, Folkerth RD, Keene CD, Litvan I, Perl DP, Stein TD, Vonsattel JP, Stewart W, Tripodis Y, Crary JF, Bieniek KF, Dams-O'Connor K, Alvarez VE, Gordon WA, group TC. The first NINDS/NIBIB consensus meeting to define neuropathological criteria for the diagnosis of chronic traumatic encephalopathy. Acta Neuropathol. 2016; 131:75-86.]. Ведущим симптомом ХТЭ является прогрессирующий когнитивный дефицит, который связан с усилением нейрональной гибели в следствие накопления в клетках головного мозга β-амилоида и фосфорилированного tau- белка. [Chauhan NB. Chronic neurodegenerative consequences of traumatic brain injury. Restor Neurol Neurosci. 2014; 32:337-365.]. В виду того, что основным патофизиологическим механизмом, опосредующим клинические проявления ХТЭ является увеличение степени деградации нейронов для лечения данного заболевания, как правило, применяются средства, обладающие церебропротекторным действием, использование которых направлено на ограничение вторичных механизмов повреждения клеток мозга после травмы. [Somayaji MR, Przekwas AJ, Gupta RK. Combination Therapy for Multi-Target Manipulation of Secondary Brain Injury Mechanisms. Curr Neuropharmacol. 2018; 16(4):484-504. doi:10.2174/1570159X15666170828165711]. На сегодняшний день церебропротекторы представлены препаратами метаболического действия (кортексин, холина альфосцерат, цитиколин), антиоксидантами (ресвератрол, Egb671), ГАМК-ергическими средствами (гопантеновая кислота). [Евтушенко И.С. Ноотропы и нейропротекторы в современной клинической нейрофармакологии // Международный неврологический журнал. - 2013. - №.3 (57).] Однако применение существующих церебропротекторных препаратов зачастую не оказывает должного эффекта у пациентов с ХТЭ. [Tharmaratnam Т, Iskandar MA, Tabobondung ТС, Tobbia I, Gopee-Ramanan P, Tabobondung ТА. Chronic Traumatic Encephalopathy in Professional American Football Players: Where Are We Now?. Front Neurol. 2018; 9:445. Published 2018 Jun 19. doi:10.3389/fheur.2018.00445]
Вследствие этого актуальной задачей является поиск новых соединений, обладающих выраженным церебропротекторным действием в условиях хронической травматической энцефалопатии.
Целью изобретения является поиск нового производного пиримидин-4(1Н)-она, обладающего более выраженной церебропротекторной активностью и низкой токсичностью по сравнению с известными препаратами, синтез которого экономически выгоден и технологически несложен.
Среди структурных аналогов разрабатываемого объекта, обнаружено немало соединений, обладающих психотропной [Воронков А.В., Шабанова Н.Б., Поздняков Д.И., Луговой И.С., Кодониди И.П. Влияние новых производных пиримидин-4(1н)-она на психоэмоциональный дисбаланс и некоторые нарушения энергетического обмена у крыс на фоне ишемии головного мозга Современные проблемы науки и образования. 2017. №5. С. 13.], гипотензивной [А.с. 1822149 СССР МКИ А61К 31/505. Опубл. 12.10.92 г. - 8 с.] и антиоксидантной [Е.В. Петрова, Э.Т. Оганесян, И.П. Кодониди Сравнительная антиоксидантная и антигипоксическая активность нового производного 1,4-дигидро-4-оксопиримидина -соединения PDMpT HCl и мексидола Экспериментальная и клиническая фармакология. - 2013. - №6. - С. 38-40.] активностью.
В.качестве ближайших аналогов по действию, обладающие выраженной церебропротекторной активностью и низкой токсичностью, могут быть указаны N-арилзамещенные [Тюренков И.Н., Петрова Е.В., Кодониди И.П., Оганесян Э.Т., Жогло Е.Н. Церебропротективное действие N-арилзамещенных производных 1,4-дигидропиримидина и их влияние на мозговое кровообращение. Вестник Волгоградского гос. мед. университета / - Волгоград; 2011. - Вып. 4(40). - С. 22-25.], а также N-пептидные производные пиримидин-4(1Н)-она [И.С. Луговой1, И.П. Кодониди1, А.В. Воронков1, Н.Б. Шабанова1, М.И. Кодониди Целенаправленный синтез n-пептидных производных пиримидин-4(1н)-она, обладающих церебропротекторными свойствами Журнал научных статей Здоровье и образование в XXI веке. 2017. Т. 19. №8. С. 195-199.], [Воронков А.В., Шабанова Н.Б., Кодониди И.П., Луговой И.С. Церебропротекторная активность новых производных пиримидин-4(1Н)-она PIR-9 и PIR-10 при необратимой окклюзии общих сонных артерий Фармация и фармакология. - 2018. Т 6 №2, - С. 168 - 181.].
Способ получения 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида (I) основан на взаимодействии N-ацетил-3-оксо-2-фенилпентанамида с 4-аминобензолсульфонамидом в среде ледяной уксусной кислоты при добавлении каталитических количеств диметилформамида.
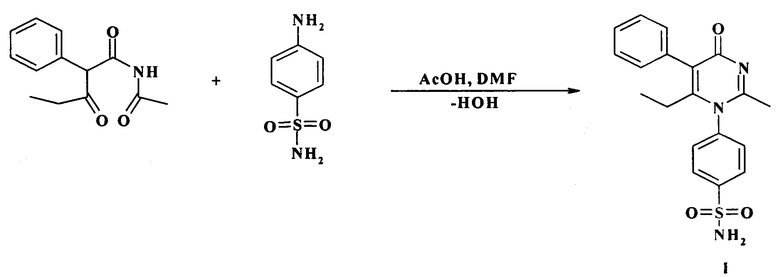
Пример синтеза 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида (I).
Смесь 2,33 г (0,01 моль) N-ацетил-3-оксо-2-фенилпентанамида и 1,72 г (0,01 моль) 4-аминобензолсульфонамида растворяют при нагревании в 7 мл ледяной уксусной кислоте, далее прибавляют 0,5 мл диметилформамида и кипятят 2 часа. После охлаждения реакционной среды до комнатной температуры продукт выделяют диэтиловым эфиром. Осадок фильтруют и высушивают на воздухе. Полученный сырец 2,51 г очищают перекристаллизацией из этанола. Выход 68%. Вещество представляет собой белый мелкокристаллический порошок без запаха. Растворим в диметилсульфоксиде, малорастворим в этиловом спирте, нерастворим в диэтиловом эфире и воде. Т. пл: 294-296°С (из этанола). ИК-спектр (вазелиновое масло): 3341, 3180, 1631, 1624, 1587, 1324, 1162 см-1. УФ-спектр λmax: 204 и 256 нм. Rf(этанол)=0,74.
Молекулярная масса: 369,45 г/моль. Брутто формула: C19H19N3O3S.
Элементный состав:
Найдено, %: С 61,79; Н 5,16; О 12,96; S 8,67.
Вычислено, %: С 61,77; Н 5,18; О 12,99; S 8,68.
Спектр 1Н ЯМР (300 Мгц), δ, м.д. в DMSO-d6: 0,62-0,67 (т, 3Н, СН3); 1,01-1,06 (к. 2Н, СН2); 1,97-2,01 (т, 3Н, СН3); 7,20-7,22 (д, 2Н ArH); 7,33-7,41 (м. 3Н, ArH); 7,59 (с, 2Н, NH2); 7,83-7,89 (т, 2Н, ArH); 8,01-8,03 (д, 2Н, ArH).
Оценка фармакологической эффективности и безопасности применения 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида.
Пример. 1
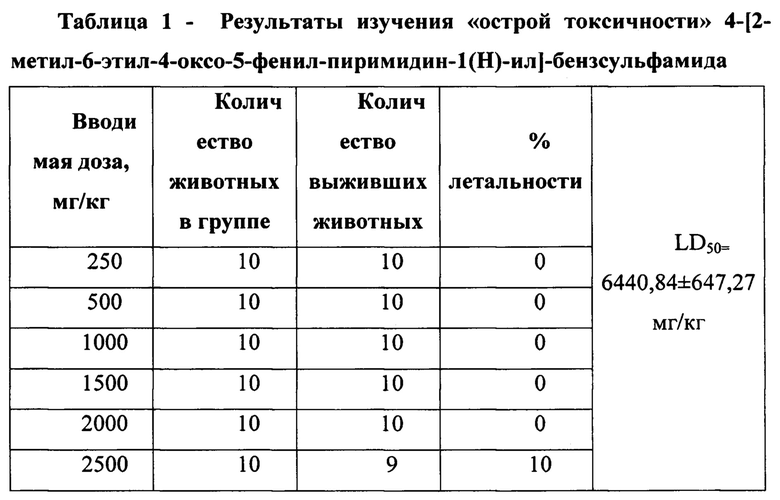
Оценку «острой токсичности» 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида производили на 70 мышах-самцах линии Balb/c. Разрабатываемое соединение вводили per os дробно с 2-х часовым временным интервалом, учитывая величину максимально допустимого объема перорального введения для данного вида животных в следующем интервале доз: 250 мг/кг; 500 мг/кг; 1000 мг/кг; 1500 мг/кг; 2000 мг/кг и 2500 мг/кг. Группа контроля (n=10) получала дистиллированную воду в эквиобъемном количестве. В ходе постановки эксперимента дальнейшего увеличения дозы избегали в виду возможной «перегрузки» животных вводимым объемом жидкости. Наблюдение за животными осуществляли на протяжении 14-дней, при этом в первые сутки мониторинг производился непрерывно. Регистрировали гибель животных, на основании чего рассчитывали показатель LD50 методом Финни. [Finney, D.J. Probit Analysis: A Statistical Treatment of the Sigmoid Response Curve. Cambridge University Press, London and New York, 1947.]
Данные, полученные при изучении «острой токсичности» 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида представлены в таблице 1. При проведении данного блока экспериментальной работы установлено, что при пероральном введении 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида в дозе 2500 мг/кг погибло одно животное (4-й день исследования). Введение разрабатываемого объекта в других вариантах дозирования гибели животных не вызвало. При этом у выживших мышей на всем временном интервале наблюдения изменений в поведенческой активности, сенсорном восприятии, состоянии кожного покрова и слизистых оболочек, а также частоте актов дефекации и мочеиспускания по отношению к контрольной группе животных не установлено. Значение LD50 для соединения 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамид составило 6440,84±647,27 мг/кг, что позволяет отнести данный объект к 5 классу токсичности по СГС-классификации (Нью-Йорк и Женева, 2011).
Пример. 2
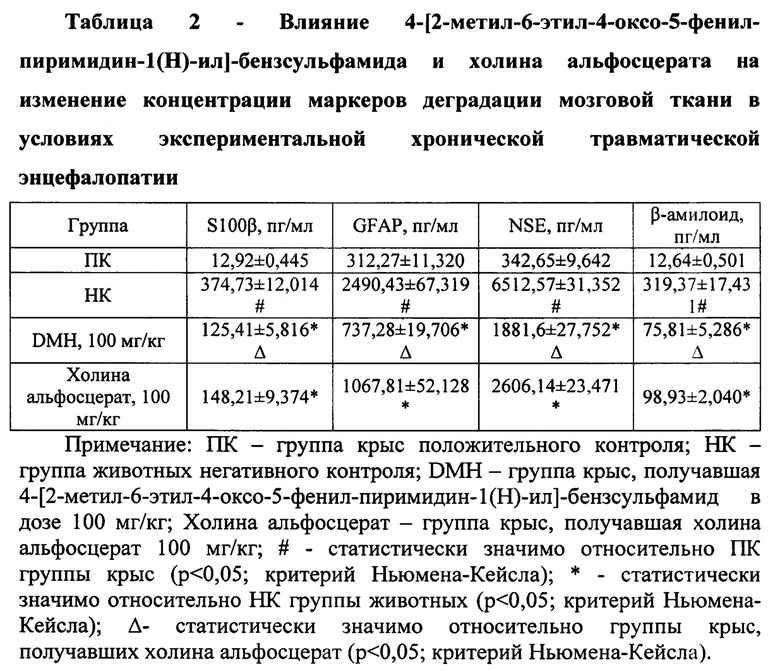
Влияние 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида (DMH) на сохранение памятного следа и изменение концентрации специфических маркеров нейрональной деструкции у животных изучали на экспериментальной модели ХТЭ. На данном этапе работы в качестве биологической модели использовали 40 крыс-самцов линии Wistar массой 240-260 грамм. ХТЭ моделировали методом свободного падения груза массой 150 г с высоты 50 см. на теменную область черепной коробки крыс. Травму наносили однократно в день на протяжении 7-ми дней. [Turner RC, Lucke-Wold BP, Logsdon AF, et al. Modeling Chronic Traumatic Encephalopathy: The Way Forward for Future Discovery. Front Neurol. 2015; 6:223.] Перед началом эксперимента животных подвергали тренировочным тестам по стандартным протоколам оценки памятного следа - «условный рефлекс пассивного избегания» и «тест экстраполяционного избавления» до выработки устойчивых поведенческих стереотипов. [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - с. 20-23]. При проведении данного исследования было сформировано 4 экспериментальные группы животных, сопоставимых по поведенческой активности в тестах «условный рефлекс пассивного избегания» и «тест экстраполяционного избавления»: группа крыс положительного контроля (ПК, n=10); группа животных негативного контроля (НК, n=10, не получавшая фармакологическую поддержку), группа крыс, которым вводили разрабатываемый объект и препарат сравнения (n=10 каждая экспериментальная группа). Изучаемое соединение вводили один раз в сутки интрагастрально в дозе 100 мг/кг (доза соответствующая таковой у референтного препарата) через 30 мин после нанесения травмы. Препарат сравнения (холина альфосцерат «Церепро» Верофарм, 100 мг/кг) вводили по аналогичной схеме. [Сысоев Ю.И., Оковитый С.В., Узуегбунам Б. Влияние нового производного диэтиламиноэтанола на выраженность неврологического дефицита у крыс после черепно-мозговой травмы // Биомедицина, 2018; 2: 95-105]. На 8-й день исследования во всех экспериментальных группах животных повторно воспроизводили тесты «условный рефлекс пассивного избегания» и «экстраполяционного избавления». При этом согласно протоколу испытания в тесте «условный рефлекс пассивного избегания» определяемым параметром служило латентное время захода в темный отсек установки. В тесте «экстраполяционного избавления» оценивали изменение следующих показателей: латентное время выполнения задачи («подныривание») и количество неудачных попыток избегания («прыжков»). [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А.Н. Миронова. - М.: Гриф и К, 2012. - с. 20-23]. После оценки изменения памятного следа у крыс производили забор венозной крови и далее животных декапитировали под хлоралгидратной анестезией (350 мг/кг, интраперитонеально) извлекали головной мозг, который гомогенизировали в механическом гомогенизаторе Поттера в 0,01 ммоль/л PBS с рН 7,2 (соотношение 1:7). Полученный гомогенат центрифугировали в режиме 5 мин. 10000g и супернатант мозговой ткани удаляли для проведения ИФА-исследования. Венозную кровь центрифугировали в режиме 15 мин 1000g с получением сыворотки, которую использовали в качестве биоматериала для ИФА-исследования. Методом ИФА в сыворотке крови определяли концентрацию белка S100β, глиального фибриллярного кислого белка (GFAP) и нейрон-специфичной енолазы (NSE) - соединений-биомаркеров повреждения головного мозга. В супернатанте мозговой ткани оценивали изменение концентрации β-амилоида, как специфичного маркера развития ХТЭ. [Wang KK, Yang Z, Zhu Т, et al. An update on diagnostic and prognostic biomarkers for traumatic brain injury. Expert Rev Mol Diagn. 2018; 18(2): 165-180. doi:10.1080/14737159.2018.1428089]. В работе применялись стандартные наборы реактивов для ИФА производства компании Cloud clone (США). Пробоподготовка биоматериала и ход анализа соответствовал инструкции, прилагаемой к каждому набору.
Статистическую обработку полученных результатов проводили с применением программного комплекса STATISTICA 6.0. Данные выражали в вид M±SEM. Сравнение средних осуществляли методом ANOVA с пост-тестом Ньюмена-Кейсла. Различия считались статистически значимыми при р<0,05.
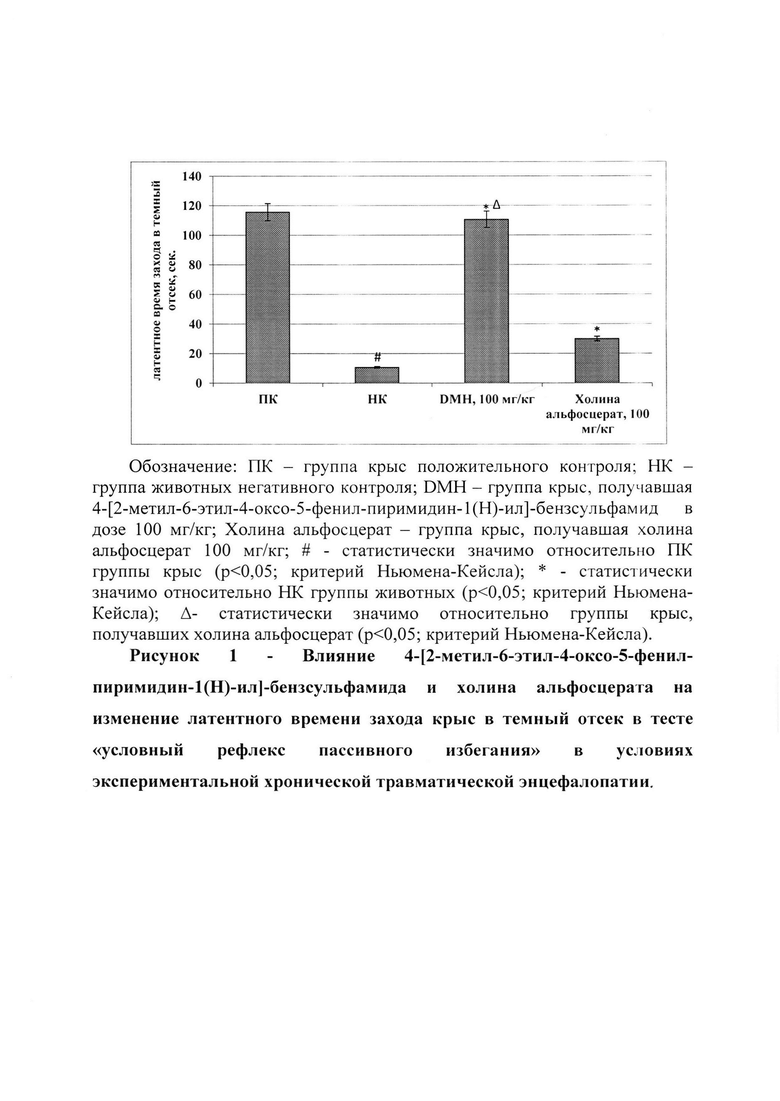
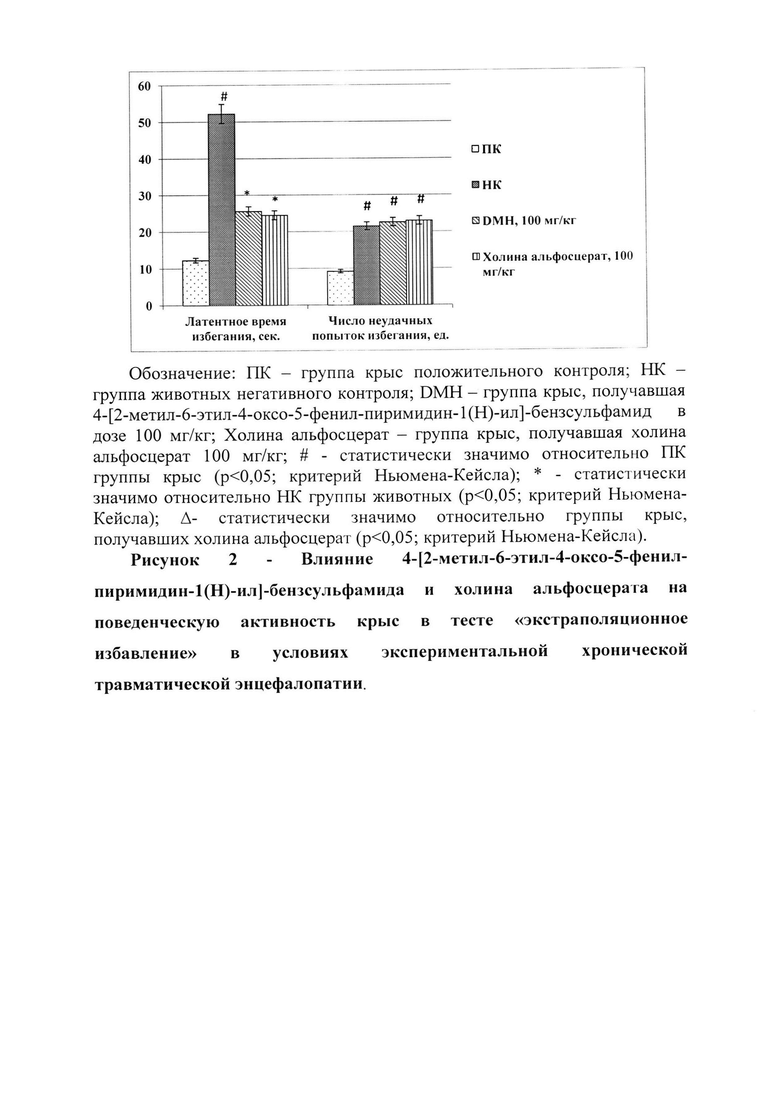
В ходе исследования установлено, что у крыс в условиях экспериментальной ХТЭ наблюдается ухудшение памятного следа, что подтверждалось данными, полученными в тестах «условный рефлекс пассивного избегания» и «экстраполяционное избавление». Так у крыс НК группы в тесте «условный рефлекс пассивного избегания» в сравнении с ПК группой животных наблюдалось снижение латентного времени захода в темный отсек установки (рис. 1) в 10,8 раза (р<0,05), в тоже время в тесте «экстраполяционное избавление» (рис. 2) у крыс, лишенных фармакологической поддержки, по отношению к ПК группе животных отмечено повышение времени выполнения задачи («подныривание») в 4,2 раза (р<0,05) и числа неудачных попыток избегания в 2,28 раза (р<0,05). Также у НК группы крыс концентрация белка S100β, GFAP, NSE и β-амилоида увеличилась в сравнении с ПК группой животных в 29 раз (р<0,05); 8 раз (р<0,05); 19 раз (р<0,05) и 25,3 раза (р<0,05) соответственно (табл. 2).
На фоне введения животным холина альфосцерата по сравнению с НК группой крыс наблюдалось увеличение латентного времени захода в темный отсек в тесте «условный рефлекс пассивного избегания» (рис. 1) в 2,8 раза (р<0,05). Также применение холина альфосцерата способствовало сокращению времени принятия решения животными (время, необходимое для «подныривания») в тесте «экстраполяционное избавление» в 2,13 (р<0,05), но при этом значимого влияния на изменение числа неудачных попыток «избегания» не оказало (рис. 2). Кроме того, введение холина альфосцерата крысам с экспериментальной ХТЭ способствовало снижению относительно НК группы животных содержания протеина S100β - в 2,53 раза (р<0,05), GFAP - 2,3 раза (р<0,05), NSE - 2,5 раза (р<0,05) и β-амилоида - 3,23 раза (р<0,05) (табл. 2).
Применение разрабатываемого соединения DMH в условиях экспериментальной ХТЭ способствовало восстановлению памятного следа у крыс, что выражалось в увеличении латентного времени захода в затемненный отсек установки в тесте «условный рефлекс пассивного избегания» (рис. 1) по отношению к НК группе животных в 10,4 раза (р<0,05), а также уменьшении времени «избегания» в тесте «экстраполяционное избавление» (рис. 2) в 2,04 раза (р<0,05). При этом время выполнения задачи (заход в темный отсек) в тесте «условный рефлекс пассивного избегания» у крыс, получавших соединение DMH, было в 3,69 раза (р<0,05) выше аналогичного показателя животных, которым вводили холина альфосцерат. Также на фоне введение крысам соединения DMH относительно животных, лишенных фармакологической поддержки, отмечено снижение концентрации S100β, GFAP, NSE и β-амилоида в 2,99 раза (р<0,05); 3,4 раза (р<0,05); 3,5 раза (р<0,05); и 4,2 раза (р<0,05) соответственно. Необходимо отметить, что у крыс, получавших соединение DMH, содержание белка S100β было на 18,3% (р<0,05) меньше аналогичного показателя группы животных, которым вводили холина альфосцерат. Кроме того, концентрация GFAP, NSE и β-амилоида была на 44,8% (р<0,05); 38,5% (р<0,05) и 30,5% (р<0,05) соответственно меньше у крыс, получавших разрабатываемое соединение DMH в сравнении с животными, которым в качестве фармакологической поддержки вводили холина альфосцерат (табл. 2).
Таким образом применение 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамида в условиях экспериментальной ХТЭ способствует сохранению памятного следа у крыс, а также препятствует деструкции мозговой ткани, превосходя при этом действие референтного препарата - холина альфосцерата в эквивалентной дозе.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ЦЕРЕБРОПРОТЕКТОРНЫМ, ЭНДОТЕЛИОПОЗИТИВНЫМ И АНТИТРОМБОТИЧЕСКИМ ДЕЙСТВИЕМ | 2015 |
|
RU2594254C1 |
| N-(ацетилсалицилоил)пиразол, обладающий церебропротекторным действием при недостаточности мозгового кровообращения | 2016 |
|
RU2632005C1 |
| ФЕНИЛГИДРАЗИД (4-ФЕНИЛ-2-ПИРРОЛИДОН-1-ИЛ)-УКСУСНОЙ КИСЛОТЫ, ОБЛАДАЮЩИЙ НООТРОПНОЙ, АНТИДЕПРЕССИВНОЙ И АНКСИОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2440981C1 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, ОБЛАДАЮЩИЕ НООТРОПНОЙ И АНТИГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2507198C1 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, ОБЛАДАЮЩИЕ АНТИДЕПРЕССИВНОЙ, АНКСИОЛИТИЧЕСКОЙ И НООТРОПНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2507199C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИДЕПРЕССИВНЫМ, АНКСИОЛИТИЧЕСКИМ И НООТРОПНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2437659C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ НЕЙРОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ В УСЛОВИЯХ ИШЕМИЧЕСКОГО НАРУШЕНИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ | 2015 |
|
RU2586301C1 |
| Натриевая соль 4-{ 2-[2-(4-гидрокси-3-метоксифенил)-винил]-6-этил-4-оксо-5-фенил-4H-пиримидин-1-ил} -бензсульфамида, обладающая противоопухолевым действием | 2021 |
|
RU2763899C1 |
| ПРОИЗВОДНОЕ 3-ГИДРОКСИПИРИДИНА С АНКСИОЛИТИЧЕСКОЙ И НООТРОПНОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2664453C1 |
| ПРИМЕНЕНИЕ 1-ГЕТАРИЛ-2-НИТРО-2-(3-ФЕНИЛ-1,2,4-ОКСАДИАЗОЛ-5-ИЛ) ЭТАНОВ В КАЧЕСТВЕ ПСИХОТРОПНЫХ ВЕЩЕСТВ | 2009 |
|
RU2420521C1 |
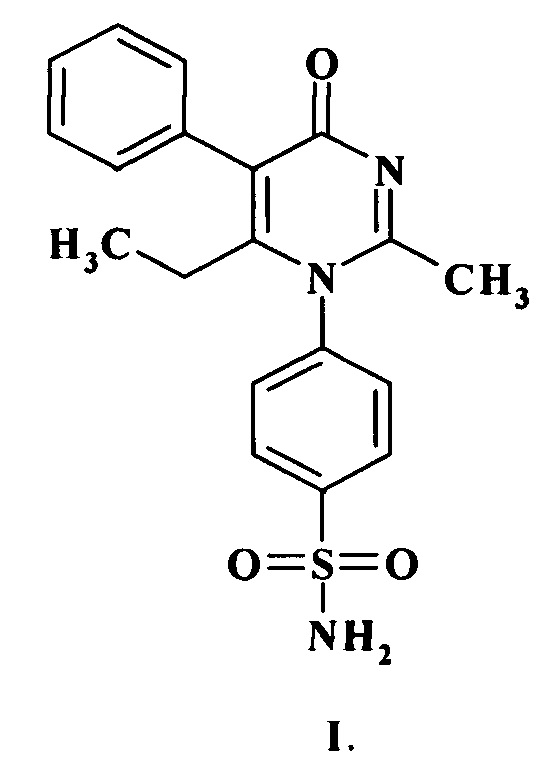
Изобретение относится к соединению формулы (I)
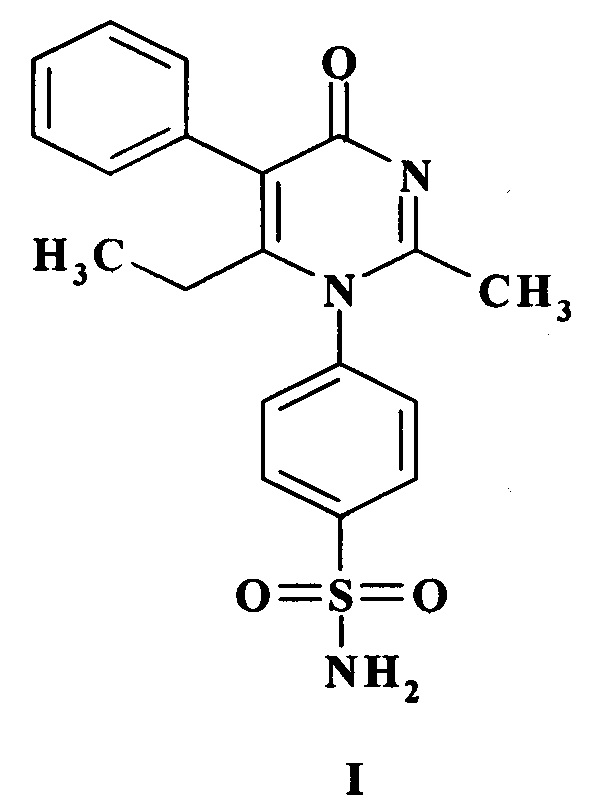 ,
,
которое может быть использовано для создания лекарственных средств церебропротекторного действия для лечения хронической травматической энцефалопатии. 2 ил., 2 табл., 2 пр.
Соединение 4-[2-метил-6-этил-4-оксо-5-фенил-пиримидин-1(Н)-ил]-бензсульфамид, общей формулы I, обладающее церебропротекторной активностью в условиях хронической травматической энцефалопатии
Авторы
Даты
2020-01-17—Публикация
2019-07-29—Подача