Область техники
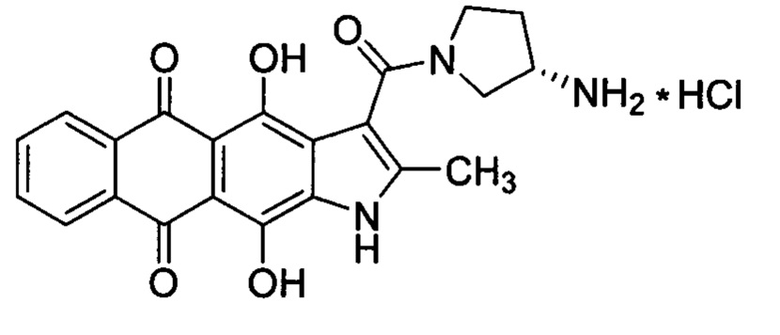
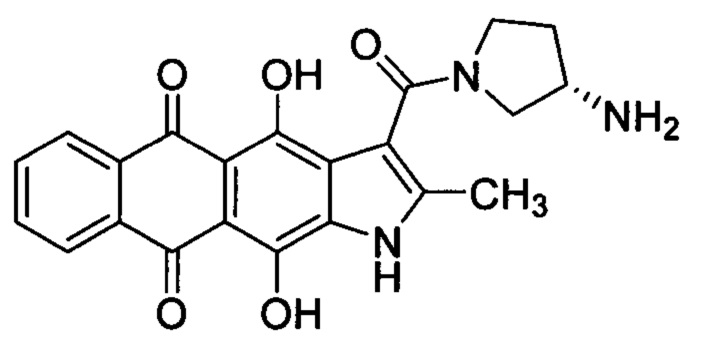
Изобретение относится к химико-фармацевтической промышленности и представляет собой субстанцию на основе (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона для лечения онкологических заболеваний.
Уровень техники
Противоопухолевые препараты на основе соединений антрахинона, такие как доксорубицин, эпирубицин, валрубицин, митоксантрон и др. длительное время применяются для лечения широкого спектра онкологических заболеваний. Благодаря высокой эффективности эти соединения используются как в режиме монотерапии, так и в комбинации с другими препаратами. Тем не менее, использование антрациклинов и их аналогов ограничивается высокой общей токсичностью, кардиотоксичностью, а также развитием множественной лекарственной устойчивости опухолевых клеток в ответ на химиотерапию. Поэтому поиск новых производных антрахинона для разработки противоопухолевых препаратов с улучшенным профилем эффективности и безопасности представляет существенный интерес для химико-фармацевтической отрасли.
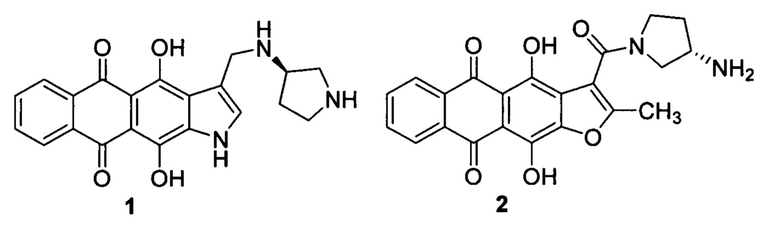
Производные линейных гетероарен-конденсированных антрахинонов, содержащие фрагмент циклического диамина, связанного с гетероциклическим ядром, являются высокоактивным классом противоопухолевых соединений [Щекотихин А.Е. и др. Патент РФ №2412166 (2011); Щекотихин А.Е. и др. Патент РФ №2631100 (2017)]. Авторами изобретения проведены интенсивные химико-биологические исследования, в результате которых были найдены закономерности связи между структурой и активностью [Tikhomirov A.S. et al. Eur. J. Med. Chem. 2018,148, 128; Volodina Y.L. et al. Eur. J. Med. Chem. 2019,165, 31], а также отобрано и детально изучено несколько химических соединений-лидеров, например, антрафуран 1 и нафтоиндол 2 [Щекотихин А.Е. и др. Патент РФ №2554939 (2015); Щекотихин А.Е. и др. Патент РФ №2581022 (2016); Щекотихин А.Е. и др. Патент РФ №2639479 (2017)]. Важной особенностью соединений этого ряда является одновременное воздействие на различные мишени опухолевых клеток, прежде всего, дуплекс ДНК, топоизомеразы 1 и 2, протеинкиназу Aurora В, а также способность генерации активных форм кислорода. Предполагается, что именно мультитаргетный механизм действия на опухолевые клетки во многом обуславливает эффективность этих соединений (производные 1 и 2) в отношении резистентных опухолей [Treshalina Н.М. et al. 2017, Eur. J. Pharm. Sci. 2017, 165, 31; Shchekotikhin A.E. et al. Eur. J. Med. Chem. 2016, 112, 114; Shchekotikhin A.E. et al. Eur. J. Med. Chem. 2014, 86, 797]. Поэтому разработка улучшенных лекарственных препаратов на основе соединений антрахинона в ряду амидов линейных гетероарен-конденсированных антрахинонов обладает обоснованными перспективами.
Раскрытие изобретения
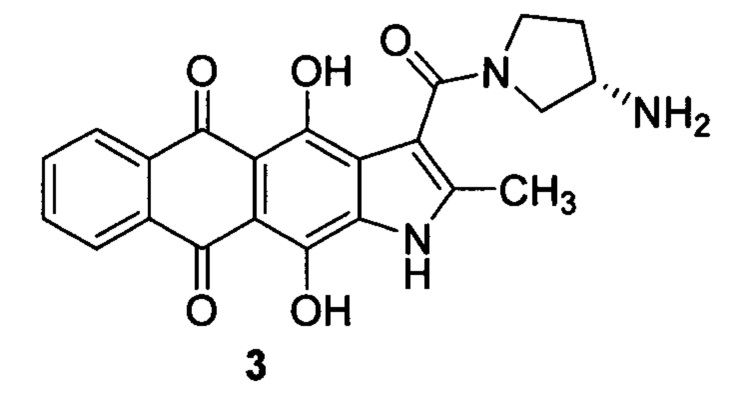
Настоящее изобретение призвано получить (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион (3) и его фармацевтически приемлемые соли, обладающие противоопухолевым эффектом.
Экспериментально установлено, что нафтоиндол-3-карбоксамид формулы 3 проявляет высокую антипролиферативную активность в отношении клеток различного гистогенеза (включая, клетки карциномы кишки, карциномы легкого, и различных видов лейкозов), сопоставимую с препаратами сравнения - доксорубицином и этопозидом. Более того, нафтоиндол-3-карбоксамид 3 продемонстрировал достоверный противоопухолевый эффект на мышах с внутрибрюшинно перевитым лимфолейкозом Р-388. Так, при ежедневном пятикратном внутрибрюшинном применении нафтоиндол-3-карбоксамида 3 в дозе 20 мг/кг увеличение продолжительности жизни (УПЖ) животных с внурибрюшинно перевитым лимфолейкозом Р-388 составило 53±6%. Пятикратное внутрибрюшинное ведение препарата формулы 3 в дозе 60 мг/кг мышам с подкожно перевитым лимфолейкозом Р-388 приводило к достоверному торможению роста опухоли (ТРО) на 14 сутки после трансплантации опухоли, равному 94%. Оба показателя удовлетворяют критериям отбора соединений для углубленных доклинических исследований в качестве противоопухолевых средств [Трещалина Е.М. и др. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: изд. Гриф о К., 2012, гл. 39, стр. 642.].
Важно отметить, что предмет изобретения - нафтоиндол-3-карбоксамид 3 обладает меньшей токсичностью по сравнению антрафураном 2, при сопоставимой противоопухолевой эффективности обоих соединений. Так, при внутрибрюшинном введении препарата формулы 3 в дозе 60 мг/кг × 5/24 ни одно животное (из 10) не пало от токсичности, в то время как величина LD50 антрафурана 2 составляет 52 мг/кг [Treshalina Н.М. et al. 2017, Eur. J. Pharm. Sci. 2017, 165, 31; Shchekotikhin A.E. et al. Eur. J. Med. Chem. 2016,112, 114].
Другим преимуществом настоящего изобретения является лучшая растворимость соединения формулы 3 в фармацевтически приемлемых средах. Показано, что растворимость метансульфоната нафтоиндол-3-карбоксамида 3 в дистиллированной воде при комнатной температуре составила 22 мг/мл, в то время как растворимость аналогичной соли антрафурана 2 составляет около 1 мг/мл. Таким образом, предмет настоящего изобретения - противоопухолевое производное нафтоиндол-3-карбоксамида формулы 3, расширяющее арсенал химиотерапевтических средств.
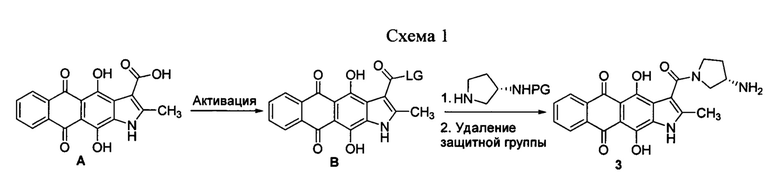
(S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион (3), являющийся предметом настоящего изобретения, может быть получен различными способами, например, в результате двухстадийной схемы (схема 1). Способ включает активацию 4,11-дигидрокси-5,10-диоксо-2-метилнафто[2,3-ƒ]индол-3-карбоновой кислоты А и последующее замещение 3-(S)-аминопирролидином уходящей группы (LG). Активация кислоты А может проходить как с выделением, так и без выделения/очистки активированных производных В. Для селективности реакции ацилирования предпочтительно использование моно-N-защищенного 3-(S)-аминопирролидина с дальнейшим удалением защитных групп (PG), что приводит к нафтоиндол-3-карбоксамиду 3 (схема 1). Исходная 4,11-дигидрокси-5,10-диоксо-2-метилнафто[2,3-ƒ]индол-3-карбоновая кислота может быть получена описанными ранее методами [Тихомиров А.С. и др. ХГС, 2017, 10, 1072]. Другие материалы и реагенты, используемые при получении соединения формулы 3, являются коммерческими химическими реактивами, поставляемыми фирмами, такими как Merck, ABCR, Acros Organics и др. или их можно получить методами, известными специалисту в данной области или описанными в литературе. Все реакции проходят в инертных органических растворителях в интервале температур от 0 до 80°С.
Если не указано иное, термины, используемые в описании заявки и пунктах формулы изобретения, имеют значения, указанные ниже, а формы единственного числа включают также формы множественного числа.
"Инертный органический растворитель" означает растворитель, не вступающий в химические реакции в условиях процесса, описываемого в тексте. Перечень инертных органических растворителей включает, например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, диоксан, пиридин и т.п. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, являются инертными растворителями.
"Таутомеры" означает соединения, структуры которых отличаются пространственным расположением атомов, но находятся в равновесном состоянии. Соединение формулы 3 содержит группы, которые могут находиться в таутомерном равновесии. Подразумевается, что, если соединение формулы 3 могут существовать в таутомерных формах, то настоящее изобретение включает все таутомерные формы, а названия соединений не исключают любую таутомерную форму.
Термином "защитная группа" обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакций, как описано литературе [Green T.W., Wuts P.G.M. Protective Groups in Organic Synthesis. J.Wiley & Sons, N.-Y., 1991, 351 рр.]. Пример таких групп для блокирования аминогруппы включает трет-бутоксикарбонильную (Вое), адамантилоксикарбонильную (Adoc), флуоренилметилоксикарбонильную (Fmoc) и карбонибензилокси (Cbz), этоксикарбонильную, ацетильную группы и т.п.
"Уходящая группа" означает группу, название которой обычно ассоциируется с ее использованием в синтетической органической химии, т.е. означает атом или группу атомов, которая замещается в условиях реакции. Примеры уходящей группы включают, без ограничения перечисленным, галоген, алкансульфонилокси (такие, как метансульфонилокси, этансульфонилокси), аренсульфонилокси, (такие, как бензолсульфонилокси, тозилокси), алкокси (метокси), алкилтио (тиометил), арилокси (фенокси, префторфенокси, и-нитрофенокси), сукцинилокси, амино (диметиламино), гетероциклил (имидазолил), и т.п.
"Фармацевтически приемлемые соли" соединения означают соли, которые являются фармацевтически приемлемыми и которые обладают необходимой фармакологической активностью исходного соединения. Такие соли включают: (1) кислотно-аддитивные соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и т.п., или органических кислот, таких как уксусная кислота, бензойная кислота, лимонная кислота, фумаровая кислота, глутаминовая кислота, гликолевая кислота, молочная кислота, малеиновая кислота, яблочная кислота, метансульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, толуолсульфоновая кислота и т.п.или (2) Подразумевается, что фармацевтически приемлемые соли включают сольваты или кристаллические формы (полиморфные образования) указанной кислотно-аддитивной соли. Предпочтительными фармацевтически приемлемыми солями являются соли соляной кислоты, метансульфоновой кислоты, серной кислоты, уксусной кислоты, малеиновой кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты.
Пример 1
Получение метансульфоната ((S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона.
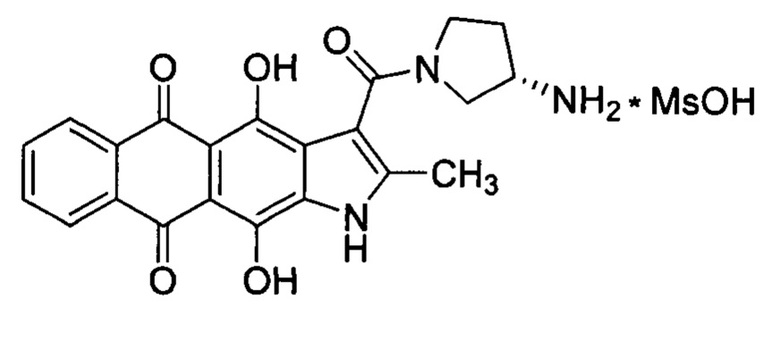
Суспензию 4,11-дигидроксинафто[2,3-ƒ]индол-3-карбоновой кислоты (0.12 г, 0.36 ммоль) в бензоле (25.0 мл) и SOCl2 (0.5 мл, 7 ммоль) интенсивно перемешивают при кипении 30 мин и отгоняют растворитель в вакууме. Остаток растворяют в хлороформе (10 мл) и прибавляют раствор (S)-3-(трет-бутоксикарбониламино)пирролидина (0.1 г, 0.53 ммоль) и пиридина (0.2 мл) в хлороформе (2 мл). Реакционную смесь кипятят 10 мин, разбавляют хлороформом (30 мл) промывают 5%-м водным раствором НCl, водой (2×10 мл), сушат над MgSO4 и отгоняют растворитель в вакууме. Полученное Вос-производное очищают хроматографически (хлороформ-метанол, 10:1→5:1), растворяют в хлороформе (5 мл), прибавляют метансульфокислоту (50 мкл, 0.8 ммоль). Смесь перемешивают 2 ч и отгоняют растворитель в вакууме. Остаток растворяют в воде (2 мл), фильтруют и осаждают смесью ацетон-диэтиловый эфир (2:1). Осадок отфильтровывают и сушат. Выход 60 мг (33%). Т.пл.>250°С. ВЭЖХ (Kromasil-100-5-мкм С-18 колонка (4.6×250 мм); LW=260; элюент: А - Н3РO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10/50%, 30 мин) tR=22.1 мин, чистота 97%. Спектр ЯМР 1Н (ДМСО-d6, осн. конформер), δ, м. д. (J, Гц): 15.05 (1H, уш с, ОН); 14.81 (1Н, уш с, ОН); 13.23 (Ш, уш с, NH); 8.33-8.31 (2Н, м, Н-6,9); 7.98 (3Н, уш с, NH3); 7.91-7.89 (2Н, м, Н-7,8); 3.93-3.90 (1Н, м, CH2NCH2CH2); 3.80-3.71 (2Н, м, CH2NCH2CH2); 3.66-3.59 (1Н, м, CH2NCH2CH2); 3.21-3.17 (1Н, м, СН2СН2СH); 2.34 (3Н, с, СН3); 2.35 (3Н, с, Ms); 2.02-1.92 (2Н, м, NCH2CH2). HRMS: найдено, m/z: 406.1388. Вычислено для [М+Н]+C22H19N3O5: m/z: 406.1391.
Пример 2
Получение гидрохлорида (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона.
Суспензию 4,11-дигидроксинафто[2,3-ƒ]индол-3-карбоновой кислоты (0.24 г, 0.72 ммоль) в тетрагидрофуране (30.0 мл) и SOCl2 (1.0 мл, 14.0 ммоль) интенсивно перемешивают при кипении до полного растворения осадка. После этого раствор дополнительно кипятят в течение 10 мин, охлаждают до комнатной температуры и отгоняют растворитель в вакууме. Остаток растворяют в хлороформе (15 мл) и прибавляют раствор (S)-3-(трет-бутоксикарбониламино)пирролидина (0.20 г, 1.06 ммоль) и пиридина (0.1 мл) в хлороформе (2 мл). Реакционную массу кипятят 10 мин, охлаждают до комнатной температуры и отфильтровывают остаток, промывая хлороформом (5 мл). Фильтрат промывают 5%-м водным раствором НCl (10 мл), водой (2×10 мл), сушат над MgSO4 и отгоняют растворитель в вакууме. Полученное Вос-производное очищают хроматографически (хлороформ-метанол, 10:1→5:1), растворяют в хлороформе (10 мл) и прибавляют раствор (7.3 мас. %) НCl в этиловом эфире (1 мл). Смесь перемешивают 12 ч при комнатной температуре и отгоняют растворитель в вакууме. Остаток растворяют в воде (3 мл), фильтруют и осаждают продукт смесью ацетон-диэтиловый эфир (2:1). Осадок отфильтровывают и сушат. Выход 0.20 г (63%). ВЭЖХ (Kromasil-100-5-мкм С-18 колонка (4.6×250 мм); LW=260; элюент: А - Н3РO4 (0.01 М) рН=2.6, В - MeCN; градиент В 10/50%, 30 мин) tR=22.1 мин, чистота 99%. Спектр ЯМР 1Н(ДМСО-d6, осн. конформер), δ, м. д. (J, Гц): 15.03 (1Н, уш с, ОН); 14.78 (1H, уш с, ОН); 13.20 (1H, уш с, NH); 8.31-8.29 (2Н, м, Н-6,9); 7.91 (3Н, уш с, NH3); 7.89-7.86 (2Н, м, Н-7,8); 3.91-3.89 (1Н, м, CH2NCH2CH2); 3.79-3.69 (2Н, м, CH2NCH2CH2); 3.64-3.56 (1Н, м, CH2NCH2CH2); 3.20-3.16 (1H, м, СН2СН2СH); 2.34 (3Н, с, СН3); 2.00-1.90 (2Н, м, NCH2CH2). HRMS: найдено, m/z: 406.1383. Вычислено для [М+Н]+C22H19N3O5: m/z: 406.1387.
Пример 3
Антипролиферативная активность метансульфоната (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона.
Тестирование антипролиферативной активности заявленного соединения формулы 3 проводилось в тестах in vitro на культурах клеток аденокарциномы поджелудочной железы Сараn-1, карциномы кишки НСТ-116, карциномы легкого NCI-H460, острого лимфобластного лейкоза DND-41, острого миелоидного лейкоза HL-60 и хронического миелоидного лейкоза K562.
Данные об антипролиферативной активности (IС50 - концентрация, ингибирующая рост клеток на 50%) заявленного по изобретению (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона (3) и препаратов сравнения - доксорубицина и этопозида приведены в таблице 1. Определение значения IC50 проводилось с помощью МТТ-теста по стандартной методике, описанной в литературе [Mossman Т.J. Immunol. Methods, 1983, 65, 55].
Данные таблицы 1 показывают, что (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион (3), являющийся предметом настоящего изобретения, эффективно ингибирует пролиферацию опухолевых клеток различного гистогенеза в субмикромолярных концентрациях. Новое соединение демонстрирует величины IС50, близкие к препаратам сравнения - доксорубицину и этопозиду, применяемым в клинической практике для лечения онкологических заболеваний.

Пример 4
Противоопухолевая эффективность метансульфоната (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона на мышах с внутрибрюшинно перевитым лимфолейкозом Р-388.
Исследование противоопухолевой активности (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона (3) проведено на мышах BDF1 (C57Bl х DBA2, самцы, 20-22 г) на модели внутрибрюшинно перевитого лимфолейкоза Р-388. Для тестирования были сформированы группы:
 1 группа - контроль роста опухоли (10 особей);
1 группа - контроль роста опухоли (10 особей);
 2 группа - производное 3 в дозе 20 мг/кг х 5/24 (10 особей).
2 группа - производное 3 в дозе 20 мг/кг х 5/24 (10 особей).
Штамм лимфолейкоза Р-388, полученный из банка опухолевых штаммов НМИЦ им. Н.Н. Блохина (5 пассаж), трансплантировали по стандартной методике внутрибрюшинно по 1 млн клеток. Субстанцию (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион метансульфонат (3) растворяли в 5% растворе глюкозы и в 0,2% концентрации вводили мышам внутрибрюшинно ежедневно в течение 5 дней. Терапию начинали через 24 ч после трансплантации опухоли. Наблюдали за состоянием и поведением животных ежедневно до гибели последней мыши. Отмечали количество павших мышей и сроки их гибели.
Противоопухолевый эффект для мышей с асцитной опухолью (лимфолейкоз Р-388) оценивали по увеличению средней продолжительности жизни леченных животных по сравнению с нелеченым контролем (УПЖ%), которое рассчитывается по формуле:
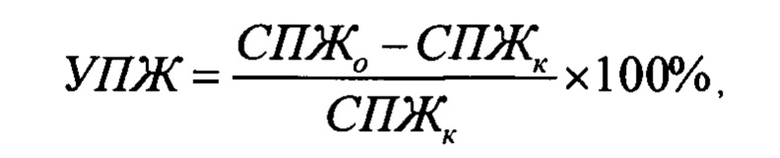
где СПЖо - средняя продолжительность жизни животных, получавших лечение, СПЖк - средняя продолжительность жизни нелеченых животных. Результаты исследования приведены в таблице 2.
Установлено, что соединение ((S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона (3), являющееся предметом настоящего изобретения, обладает противоопухолевым эффектом и в дозе 20 мг/кг при пятикратном внутрибрюшинном введении увеличивает продолжительность жизни лабораторных животных с внутрибрюшинно перевитым лимфолейкозом Р-388 на 53,0±6,3% (по сравнению с нелечеными животными). Гибели животных от токсичности препарата в указанной дозе не наблюдалось. Следует отметить, что значение УПЖ=53% для (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона метансульфоната (3) удовлетворяет критериям, предъявляемым к новым лекарственным кандидатам. [А.Н. Миронов, Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: Гриф и К, 2012, - 944 С.].
Пример 5
Противоопухолевая эффективность метансульфоната (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона на мышах с подкожно перевитым лимфолейкозом Р-388.
Исследование противоопухолевой активности (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона (3) на модели с подкожно перевитым лимфолейкозом Р-388 проведено на мышах BDF1 (С57Bl х DBA2) самцах, массой 20-22 грамма. Для тестирования были сформированы группы:
 1 группа - контроль роста опухоли (10 особей);
1 группа - контроль роста опухоли (10 особей);
 2 группа - соединение 3 в дозе 20 мг/кг ×5/24 (10 особей);
2 группа - соединение 3 в дозе 20 мг/кг ×5/24 (10 особей);
 3 группа - соединение 3 в дозе 60 мг/кг × 5/24 (10 особей).
3 группа - соединение 3 в дозе 60 мг/кг × 5/24 (10 особей).
Штамм лимфолейкоза Р-388, полученный из банка опухолевых штаммов НМИЦ им. Н.Н. Блохина (5 пассаж), трансплантировали по стандартной методике подкожно по 1 млн клеток. Субстанцию (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диона (3) растворяли в 5% растворе глюкозы и в 0,2% концентрации вводили мышам внутрибрюшинно ежедневно в течение 5 дней. Терапию начинали через 24 ч после трансплантации опухоли. Наблюдали за состоянием и поведением животных ежедневно. На 14 и 18 сутки после трансплантации измеряли размеры опухоли, которые определяли перемножением трех диаметров. На 19 сутки после трансплантации животных подвергали эвтаназии.
Противоопухолевый эффект оценивали по торможению роста опухолей леченных животных по сравнению с нелеченым контролем (ТРО%), которое рассчитывается по формуле:
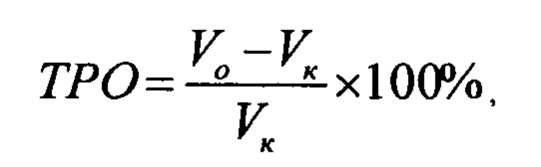
где: Vо - средний объем опухолей в подопытной группе, Vк - средний объем опухолей в контрольной группе. Результаты исследования приведены в таблице 3.
Установлено, что соединение (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион (3), являющееся предметом настоящего изобретения, обладает высоким достоверным противоопухолевым эффектом в отношении подкожно перевитого лимфолейкоза Р-388. Так, торможение роста опухоли (ТРО) на 14 сутки после введения препарата в дозах 20 мг/кг (Группа 2) и 60 мг/кг (Группа 3) составило 67% и 94%, соответственно, а на 18 сутки - 65% и 89% при достоверном отличии от контроля.
| название | год | авторы | номер документа |
|---|---|---|---|
| Новые производные гетероаренантрацен-2-карбоксамидов, ингибирующие опухолевый рост | 2016 |
|
RU2631100C1 |
| ПРОТИВООПУХОЛЕВЫЙ АНТРАФУРАНДИОН И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ | 2014 |
|
RU2554939C1 |
| ЦИТОТОКСИЧЕСКИЕ ЛИНЕЙНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АНТРАЦЕНДИОНА, СОДЕРЖАЩИЕ В БОКОВОЙ ЦЕПИ ЦИКЛИЧЕСКИЕ ДИАМИНЫ, АКТИВНЫЕ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК С МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТЬЮ | 2009 |
|
RU2412166C1 |
| Пероральные противоопухолевые средства и способ лечения онкологических заболеваний | 2016 |
|
RU2639479C1 |
| МУЛЬТИТАРГЕТНЫЕ ИНГИБИТОРЫ ОПУХОЛЕВОГО РОСТА НА ОСНОВЕ ЛИНЕЙНЫХ ГЕТЕРОАРЕНАНТРАЦЕНДИОНОВ | 2013 |
|
RU2527273C1 |
| Производное класса N-гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов - N-{ 12-(β-D-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с] карбазол-6-ил} пиридин-2-карбоксамид, обладающее цитотоксической и противоопухолевой активностью | 2017 |
|
RU2667906C1 |
| ПРОТИВООПУХОЛЕВЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2015 |
|
RU2581022C1 |
| Средство для терапии опухолей | 2019 |
|
RU2726801C1 |
| N-ГЛИКОЗИДЫ ИНДОЛО[2,3-a]ПИРРОЛО[3,4-c]КАРБАЗОЛОВ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2548045C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2572691C1 |
Изобретение относится к новому соединению - (S)-3-(3-аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-диону и его фармацевтически приемлемой соли. Соединения обладают противоопухолевой активностью и могут быть использованы для лечения онкологических заболеваний, например различных видов лейкоза. (S)-3-(3-Аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион соответствует формуле
3 табл., 5 пр.
(S)-3-(3-Аминопирролидин-1-карбонил)-4,11-дигидрокси-2-метилнафто[2,3-ƒ]индол-5,10-дион формулы I и его фармацевтически приемлемая соль, обладающие противоопухолевой активностью
| ПРОТИВООПУХОЛЕВЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2015 |
|
RU2581022C1 |
| Пероральные противоопухолевые средства и способ лечения онкологических заболеваний | 2016 |
|
RU2639479C1 |
| Новые производные гетероаренантрацен-2-карбоксамидов, ингибирующие опухолевый рост | 2016 |
|
RU2631100C1 |
| Громкоговоритель | 1932 |
|
SU31473A1 |
| WO 2006031719 А3, 23.03.2006. | |||
Авторы
Даты
2020-01-24—Публикация
2019-10-16—Подача