ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к фармацевтической композиции, обогащенной атропоизомерами галогенированных тетрафенилбактериохлоринов и хлоринов, способу ее получения и применению в фотодинамической терапии.
УРОВЕНЬ ТЕХНИКИ
Было обнаружено, что сульфонамиды тетрафенилхлоринов и тетрафенилбактериохлоринов с атомами галогена в орто-положениях фенильных групп обладают особенно полезными свойствами для фотодинамической терапии (ФДТ) (1-4). ФДТ представляет собой терапевтический способ лечения, основанный на комплексном применении фотосенсибилизирующего лекарственного средства, света с длиной волны, поглощаемой этим лекарственным средством, и молекулярного кислорода для генерации активных форм кислорода (АФК) в целевой ткани. Терапевтический эффект опосредован оксидативным стрессом, локально производимым АФК. Производные тетрафенилпорфиринов, тетрафенилхлоринов и тетрафенилбактериохлоринов часто используют в качестве фотосенсибилизаторов для ФДТ (5). Эти молекулы имеют одинарные связи фенил-макроцикл с затрудненным вращением. Когда фенильные группы содержат атомы галогена в орто-положениях, вращение вокруг одинарной связи между фенильной группой и макроциклом может отсутствовать или быть значительно заторможенным. Хотя стерическое затруднение вращения вокруг одинарной связи фенил-макроцикл может, в принципе, быть преодолено при высоких температурах, период полураспада этого вращения в галогенированных тетрафенилпорфиринах, тетрафенилхлоринах и тетрафенилбактериохлоринах при комнатной температуре и температуре тела может быть достаточно долгим для разделения и независимого использования стереоизомеров, которые могут существовать у этого класса молекул. Существование стереоизомеров чаще всего обусловлено наличием хиральных атомов. Известно, что энантиомеры или диастереомеры, обусловленные наличием хиральных атомов, являются основой лекарственных средств с весьма различающимися взаимодействиями с биологическими мишенями. Галогенированные тетрафенилбактериохлорины, тетрафенилхлорины и тетрафенилбактериохлорины не имеют хиральных атомов в макроцикле или в фенильных группах, однако имеют разделимые стереоизомеры, поскольку стерически затрудненная одинарная связь фенил-макроцикл может приводить к различному пространственному распределению объемных заместителей. Этот эффект реализуется в таких молекулах, когда они содержат несимметричные заместители в орто- и/или мета-положениях, и барьер вращения вокруг одинарной связи фенил-макроцикл является высоким. Стереоизомеры, возникающие в результате медленного вращения вокруг оси, называются атропоизомерами (6). Атропоизомеры галогенированных тетрафенилпорфиринов в случае, когда заместители в двух мета-положениях фенильных групп, различаются (7-9). Соединения по изобретению впервые доказывают, что атропоизомеры орто-галогенированных тетрафенилхлоринов и орто-галогенированных тетрафенилбактериохлоринов разделимы, и что атропоизомеры обладают различнымы терапевтическими эффектами в качестве фотосенсибилизаторов для ФДТ.
Может быть неожиданным то, что атропоизомеры, различающиеся лишь конформацией вокруг одинарной связи, могут вызывать оксидативные стрессы с существенно различными терапевтическими результатами. Неожиданно, авторы настоящего изобретения обнаружили, что обогащение смеси атропоизомеров атропоизомерами, в которых более объемные группы расположены на одной и той же стороне плоскости, определяемой макроциклом, может позволить излечить мышей с подкожно имплантированными опухолями в условиях, при которых использование смеси, обогащенной атропоизомерами, в которых равное количество объемных групп расположено на обеих сторонах плоскости макроцикла, не привело к излечению каких-либо животных. Более высокая эффективность в ФДТ композиции атропоизомеров, обогащенной атропоизомерами, в которых большая часть мета-заместителей фенильной группы связана с макроциклом на одной и той же стороне плоскости, определенной указанным макроциклом, не могла бы быть предсказана экспертом в данной области техники. Действительно, по-видимому, более ранние исследования фототоксичности, проведенные с тетрафенилпорфиринами, указывали на совершенно обратное, т.е. предполагалось, что четыре выделяемых атропоизомера «частокольных» тетрафенилпорфиринов не различались по своей фотосенсибилизирующей способности (10). Кроме того, два региоизомера кольца А одноосновной кислоты производного бензопорфирина, известного как вертепорфин и применяемого в клинической практике в качестве фотосенсибилизатора для ФДТ возрастной макулярной дегенерации, являются одинаково сильнодействующими фотосенсибилизаторами опухолевых клеток in vitro и in vivo (11). Более того, каждый из двух региоизомеров вертепорфина состоит из рацемической смеси двух энантиомеров, все из которых обладают схожей фармакологической активностью (12). На основании всех доступных данных эксперт в данной области техники был бы убежден в том, что атропоизомеры любого фотосенсибилизатора взаимодействуют со светом и кислородом очень схожим образом, и заключил бы, что эффективности атропоизомеров в ФДТ должны быть очень похожи. В настоящем изобретении впервые раскрываются терапевтически полезные фармацевтические композиции атропоизомеров галогенированных производных тетрафенилхлорина или тетрафенилбактериохлорина для применения в ФДТ, обогащенные атропоизомером, в котором все мета-заместители фенильной группы связаны с макроциклом на одной и той же стороне плоскости, определенной указанным макроциклом (атропоизомер α4), так что относительное количество атропоизомера α4 в фармацевтической композиции составляет более 20%. Вопреки всем ожиданиям, продемонстрировано, что эффективность в ФДТ in vitro предпочтительного атропоизомера α4 может быть на порядки выше, чем эффективность в ФДТ in vitro наименее фотоактивного атропоизомера αβαβ в котором объемные заместители в мета-положениях соседних фенильных колец расположены на противоположных сторонах плоскости, определенной макроциклическим кольцом.
Фиг. 1 иллюстрирует различные стереоизомеры, существующие в сульфонамидах галогенированных тетрафенилбактериохлоринов с атомами галогена в орто-положениях фенильных колец и сульфонамидными группами в одном из мета-положений. Трехмерная ориентация атомов стереоизомеров, показанная на Фиг. 1, различна и может быть интерконвертирована в результате вращения вокруг одинарных связей фенил-макроцикл. Такая интерконверсия является очень медленной при комнатной температуре или при температуре тела из-за наличия атомов галогена (F, Cl, Br) в орто-положениях фенильных колец, что позволяет разделять и индивидуально использовать каждый из атропоизомеров. Жирные линии в молекулярных структурах на Фиг. 1 указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, приблизительно определенной макроциклическим кольцом, которое, как известно, несколько отличается от плоскостной геометрии, но, тем не менее, определяет ограниченную пространственную ориентацию групп R'. Расположение всех R' на одной и той же стороне плоскости, определенной макроциклом, представлено как α4, когда три R' расположено на одной и той же стороне плоскости и последний R' расположен на другой стороне, атропоизомер представлен как α3β, когда по два R' расположено на каждой стороне рядом друг с другом, атропоизомер представлен как α2β2, и, наконец, когда по два R' расположено на каждой стороне, но в различных положениях по отношению к плоскости макроцикла, атропоизомер представлен как αβαβ.
Было показано, что атропоизомеры галогенированных тетрафенилпорфиринов могут быть разделены и могут иметь различные молярные коэффициенты поглощения в красной области электромагнитного спектра (7, 9). Высокий молярный коэффициент поглощения в красной области спектра, где ткани человека обладают большей прозрачностью, чем в других областях видимого спектра, является желательным свойством для ФДТ, поскольку краситель, поглощающий больше света, с большей долей вероятности будет инициировать каскад фотохимических реакций, генеририрующих АФК. С другой стороны, атропоизомеры галогенированных тетрафенилпорфиринов, тетрафенилхлоринов и тетрафенилбактериохлоринов могут иметь различные времена жизни в возбужденном состоянии (13), что может влиять на их эффективность в ФДТ. Более короткие времена жизни триплетного состояния в аэрированных растворах связаны с более сильными взаимодействиями с молекулярным кислородом, возможно опосредованными взаимодействиями с переносом заряда (4). Примечательно, что атропоизомеры на Фиг. 1 имеют различное количество и ориентацию полярных групп на каждой стороне макроцикла и, следовательно, обладают различными полярностями. Различия в полярности, форме и исключенном объеме молекулы могут обеспечить основу для их разделения, а также оказывают воздействие на их биологическую активность. Следовательно, различия в молярном коэффициенте поглощения, времена жизни в возбужденном состоянии, полярности и исключенном объеме молекулы атропоизомеров могут привести к различиям в их взаимодействиях с молекулярным кислородом и биологическими мишенями, и оказывать ранее неизвестное воздействие на их активность в ФДТ. Более того, на основании по меньшей мере обсужденного выше специалист в данной области техники ожидал бы, что атропоизомеры с более высокими молярными коэффициентами поглощения должны быть более эффективными в фотодинамической терапии. Тем не менее, неожиданно, атропоизомер по настоящему изобретению, показавший себя как наиболее эффективный в фотодинамической терапии, не является атропоизомером, поглощающим больше света.
Тетрафенилбактериохлорины являются относительно нестабильными (14, 15), и нельзя было ожидать, что разделение их атропоизомеров будет реализуемо экономически выгодными способами. Введение атомов галогена в орто-положения фенильных колец затрудняет вращение вокруг связи фенил-макроцикл, а также стабилизирует макроцикл в отношении окисления. Следовательно, галогенированные тетрафенилбактериохлорины имеют уникально стабильные атропоизомеры, обладающие высокими барьерами вращения вокруг связи фенил-макроцикл и такими же высокими окислительными потенциалами, как тетрафенилпорфирины. Эти свойства позволяют разделять атропоизомеры галогенированных тетрафенилбактериохлоринов при температурах, равных или превышающих комнатную температуру, и в присутствии света и кислорода. Следовательно, разделение таких атропоизомеров является экономически выгодным.
Фотосенсибилизаторы генерируют различные АФК. Наиболее важные АФК, генерируемые бактериохлоринами в присутствии света подходящей длины волны и молекулярного кислорода, представляют собой: синглетный кислород (т.е. низшее электронно-возбужденное состояние молекулярного кислорода), супероксид-ион, пероксид водорода и гидроксильный радикал (16). Наиболее реакционноспособным из этих АФК является гидроксильный радикал. Он может взаимодействовать с большим количеством биологических мишеней, а также может взаимодействовать с фотосенсибилизатором, приводя к его обесцвечиванию. Электронно-возбужденный фотосенсибилизатор можно рассматривать как особый катализатор, генерирующий АФК при столкновении с молекулярным кислородом. Тем не менее, после обесцвечивания посредством АФК фотосенсибилизатор больше не может генерировать АФК. Следовательно, эффективность фотосенсибилизатора обусловлена хрупким равновесием между способностью фотосенсибилизатора активно взаимодействовать с молекулярным кислородом и его способностью выдерживать это взаимодействие без обесцвечивания (4). Различные пространственные ориентации мета-заместителей в атропоизомерах α4, α3β, α2β2 и αβαβ могут обеспечить различные и неожиданные взаимодействия с молекулярным кислородом. Данное изобретение впервые демонстрирует, что атропоизомеры α4, α3β, α2β2 и αβαβ по-разному взаимодействуют с молекулярным кислородом и/или АФК, что выражается в различных временах жизни триплетного состояния и/или квантовых выходах фоторазложения. Эти различия могут объяснить различающуюся активность атропоизомеров в ФДТ.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Разделение атропоизомеров α4 и α3β и фармацевтические композиции, обогащенные атропоизомерами α4 и α3β, раскрытые в настоящем изобретении, являются первым доказательством того, что атропоизомеры обладают различной активностью в ФДТ, и что различия между ними могут быть использованы для улучшения терапевтических результатов ФДТ. Под «соединением, обогащенным атропоизомером» понимается смесь атропоизомеров, полученная в результате синтеза галогенированных тетрафенилхлоринов и галогенированных тетрафенилбактериохлоринов, подвергнутая очистке для частичного удаления наименее фотоактивных атропоизомеров αβαβ и α2β2, присутствующих в статистической смеси атропоизомеров, полученной в результате синтеза, где тетрафенилхлорины и тетрафенилбактериохлорины имеют атомы галогена в по меньшей мере одном из орто-положений фенильных групп, или, когда оба орто-положения заняты одним и тем же атомом галогена, имеют различные заместители в двух мета-положениях фенильных групп.
В настоящем изобретении предложен способ получения фармацевтических композиций, обогащенных атропоизомерами α4 и α3β, обеспечивающий новый набор фотоактивных соединений с более высокой активностью в ФДТ. Включены фармацевтические композиции, в которых атропоизомеры, представленные на Фиг. 1, более чем половина групп R' которых расположена на одной и той же стороне плоскости, определенной макроциклом, составляют более 70% всего количества атропоизомеров, присутствующих в композиции.
В способе получения фармацевтической композиции по изобретению используется возможность разделять атропоизомеры галогенированных тетрафенилхлоринов или галогенированных тетрафенилбактериохлоринов при комнатной температуре или даже при температурах выше комнатной, возможно в присутствии света и кислорода, используя различия в растворимости или коэффициентах распределения в подходящих растворителях или различные времена удерживания в хроматографии. Различная пространственная ориентация полярных групп, присутствующих на фенильных кольцах тетрафенилпорфиринов, тетрафенилхлоринов или тетрафенилбактериохлоринов, приводит к различным полярностям, формам и исключенным объемам, и позволяет проводить хроматографическое разделение атропоизомеров. Более того, различия в растворимости или коэффициентах распределения атропоизомеров в различных растворителях позволяют изменять композицию атропоизомеров с помощью селективного осаждения, избирательной перекристаллизации, экстракции растворителем или просто промыванием смеси атропоизомеров подходящим растворителем. Возможно уменьшать фракцию конкретного атропоизомера, обладающего более низкой эффективностью в ФДТ, присутствующего в смеси, или увеличивать фракцию другого атропоизомера, обладающего более высокой эффективностью в ФДТ, также присутствующего в смеси, просто путем растворения части желаемого или не желаемого атропоизомера растворителем с подходящей полярностью. Также возможно частично превращать один атропоизомер в другой путем термической или фотохимической обработки, так что молекулы приобретают достаточное количество энергии для преодоления затрудненного вращения вокруг одинарных связей фенил-макроцикл, изменяя тем самым состав смеси атропоизомеров.
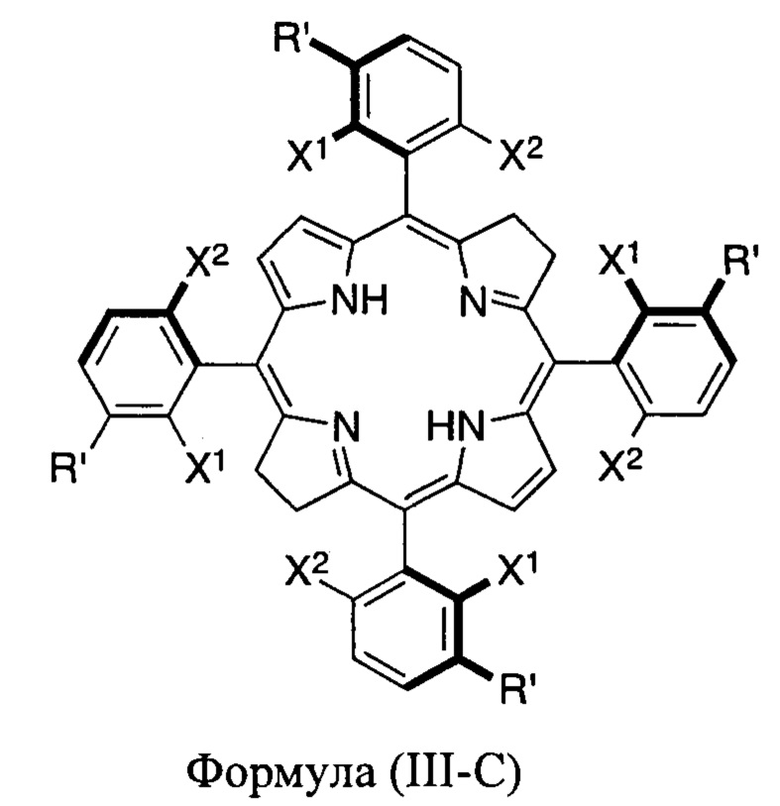
В настоящем изобретении раскрыты наиболее эффективные атропоизомеры галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов для фотодинамической терапии гиперпролиферативных расстройств и бактериальных и вирусных инфекций, и фармацевтическая композиция, обогащенная указанными двумя наиболее эффективными атропоизомерами галогенированных тетрафенилхлоринов, а именно, α3β и α4, представленными формулами (I-C) и (I-D), соответственно, характеризующимися наличием наиболее объемных заместителей в мета-положении фенильных групп на одной и той же стороне плоскости макроцикла,


где:
 представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой -ОН, -OR или -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, -аминокислоты, -OR, -NHR или -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8, независимо представляют собой Н, -ОН, -OR, -Cl или -NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода;
или их фармацевтически приемлемыми солями, где относительное количество указанных атропоизомеров или их фармацевтически приемлемых солей составляет более 70% стереоизомеров, присутствующих в указанной фармацевтической композиции.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция обогащена более эффективными атропоизомерами галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов, α3β и α4, так что указанные эффективные атропоизомеры или их фармацевтически приемлемые соли составляют (в совокупности) более 70, 75, 80, 85, 90 или 95% атропоизомеров, присутствующих в указанной фармацевтической композиции.
Таким образом, соединения формул (I-C) и (I-D) могут представлять собой производные хлорина, имеющие формулы:


Альтернативно, соединения формул (I-C) и (I-D) могут представлять собой производные бактериохлорина, имеющие формулы:

где:
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
Согласно изобретению X2 представляют собой атомы галогена (F, Cl, Br);
Согласно изобретению X1 представляют собой атомы водорода или галогена (F, Cl, Br);
Согласно изобретению R' представляют собой -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, -аминокислоты, -OR, -NHR или -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода; или их фармацевтически приемлемые соли.
Предпочтительными атропоизомерами формул (III-С) и (III-D) являются такие, в которых X2 представляют собой атом фтора или хлора, и X1 представляют собой атом фтора или хлора, или водорода, и R' представляют собой -SO2NHRn, где Rn представляют собой алкил, имеющий от 1 до 6 атомов углерода.
В частности, предпочтительным является атропоизомером α4 формулы (III-D), в котором X2 представляют собой атом фтора или хлора, и X1 представляют собой атом фтора или хлора, или водорода, и R' представляют собой -SO2NHRn, где Rn представляют собой алкил, имеющий от 1 до 6 атомов углерода.
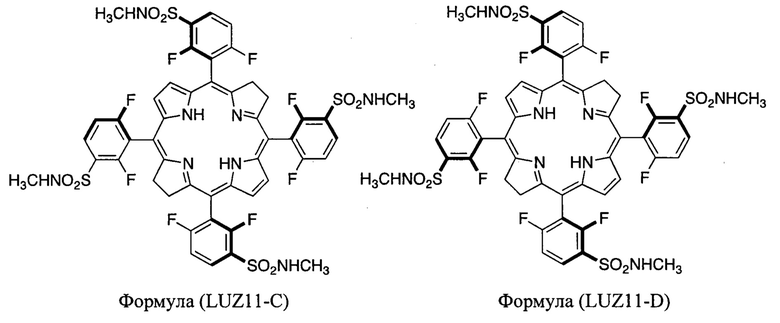
Конкретные предпочтительные соединения по изобретению включают атропоизомер α4 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина формулы LUZ11-D, и атропоизомер α3β 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина формулы LUZ11-C.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция обогащена наиболее эффективным атропоизомером галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов, α4, все объемные заместители которого расположены на одной и той же стороне плоскости, определенной макроциклом, так что указанный эффективный атропоизомер или его фармацевтически приемлемая соль составляет более 20% атропоизомеров, присутствующих в указанной фармацевтической композиции.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция обогащена вторым по эффективности атропоизомером галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов, α3β, большая часть объемных заместителей которого расположена на одной и той же стороне плоскости, определенной макроциклом, так что указанный эффективный атропоизомер или его фармацевтически приемлемая соль составляет более 60% атропоизомеров, присутствующих в указанной фармацевтической композиции.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция обогащена вторым по эффективности атропоизомером галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов, α3β, большая часть объемных заместителей которого расположена на одной и той же стороне плоскости, определенной макроциклом, так что указанный эффективный атропоизомер или его фармацевтически приемлемая соль составляет более 70, 75, 80, 85, 90 или 95% атропоизомеров, присутствующих в указанной фармацевтической композиции.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция обогащена наиболее эффективным атропоизомером галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов, α4, так что указанный эффективный атропоизомер или его фармацевтически приемлемая соль составляет более 20, 30, 40, 50, 60, 70, 75, 80, 85, 90 или 95% атропоизомеров, присутствующих в указанной фармацевтической композиции.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель.
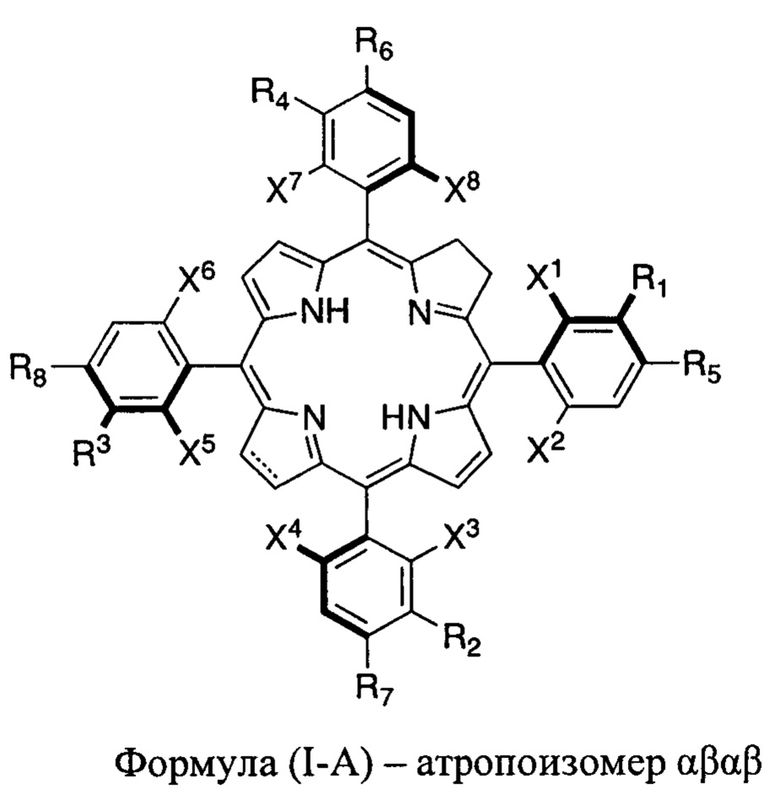
В настоящем изобретении также раскрыт способ получения фармацевтической композиции, обогащенной двумя наиболее эффективными атропоизомерами галогенированных тетрафенилхлоринов и тетрафенилбактериохлоринов, а именно, атропоизомерами α3β и α4, большая часть объемных заместителей которых расположена на одной и той же стороне плоскости, определенной макроциклом, включающий стадию выделения смеси атропоизомеров хлорина или бактериохлорина формул:



где:
 представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой -ОН, -OR или -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, аминокислоты, -OR, -NHR или -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8 независимо представляют собой Н, -ОН, -OR, -Cl или -NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода;
где атропоизомеры, в которых большая часть групп R1, R2, R3 или R4 расположена на одной и той же стороне плоскости макроцикла, являются, по меньшей мере частично, разделенными селективным осаждением, хроматографией, экстракцией растворителем, термической или фотохимической вращательной изомеризацией или селективным фоторазложением. Следовательно, фармацевтические композиции, обогащенные желаемыми атропоизомерами формул, раскрытых в настоящем описании, (например, обогащенные α3β и α4, α3β или α4) могут быть получены любым способом, включая селективное осаждение, хроматографию, экстракцию растворителем, термическую или фотохимическую вращательную изомеризацию или селективное фоторазложение, или могут быть обогащены объединением выделенных или обогащенных смесей одного атропоизомера или комбинации атропоизомеров с получением композиции, имеющей желаемое соотношение атропоизомеров формул, раскрытых в настоящем описании.
Обогащение фармацевтической композиции является возможным, поскольку возможно частично разделять атропоизомеры αβαβ, α2β2, α3β и α4, используя различия в полярности, и/или исключенном объеме, и/или форме, и/или фотостабильности атропоизомеров, в которых большая часть групп R1, R2, R3 или R4 расположена на одной и той же стороне плоскости, относительно атропоизомеров, в которых равное количество групп R1, R2, R3 или R4 расположено на каждой стороне плоскости. Это разделение возможно благодаря стабильности каждого из атропоизомеров, а также высокому барьеру вращения вокруг связи макроцикл-фенил в атропоизомерах формулы (I).
В другом варианте осуществления настоящего изобретения селективное осаждение смеси атропоизомеров хлорина или бактериохлорина, сначала растворенной в первом растворителе более высокой полярности, а затем селективно осажденной добавлением к раствору растворителя более низкой полярности, приводит к выпадению осадка, обогащенного атропоизомерами αβαβ и α2β2, и раствору, обогащенному атропоизомерами α3β и α4, таким образом, что их концентрации составляют по меньшей мере 70% (например, по меньшей мере 75, 80 85, 90, 95%) концентрации всех атропоизомеров, присутствующих в растворе. При прочих равных условиях, смесь атропоизомеров может сначала быть растворена в растворителе более низкой полярности, а селективное осаждение может быть произведено добавлением растворителя более высокой полярности.
В другом варианте осуществления настоящего изобретения экстракция растворителем включает первую стадию растворения смеси атропоизомеров хлорина или бактериохлорина в полярном растворителе; и вторую стадию добавления менее полярного растворителя, вызывающего фазовое разделение жидкость-жидкость с полярным растворителем, обеспечивая тем самым экстракцию менее полярных атропоизомеров.
В другом варианте осуществления настоящего изобретения перекристаллизация включает образование кристаллов, содержащих атропоизомеры, в которых большая часть групп R1, R2, R3 или R4 расположена на одной и той же стороне плоскости макроцикла, что комплементарно композиции атропоизомеров в маточном растворе.
В другом варианте осуществления настоящего изобретения термическая или фотохимическая вращательная изомеризация включает первую стадию избирательного связывания по меньшей мере одного атропоизомера из смеси атропоизомеров хлорина или бактериохлорина с подложкой, к которой указанный по меньшей мере один атропоизомер обладает высокой аффинностью; и вторую стадию обеспечения достаточного количества термической энергии или энергии излучения, способствуя избирательной вращательной изомеризации атропоизомеров, менее связанных с подложкой.
В другом варианте осуществления настоящего изобретения подложка предпочтительно представляет собой силикагель, и атропоизомер, избирательно связанный с подложкой, представляет собой атропоизомер формулы (I-D).
В другом варианте осуществления настоящего изобретения селективное фоторазложение включает первую стадию растворения смеси атропоизомеров хлорина или бактериохлорина в аэрированном растворителе; и вторую стадию облучения светом, поглощаемым смесью атропоизомеров, для фоторазложения в большей степени менее фотостабильных атропоизомеров.
Одно из преимуществ атропоизомеров α3β и α4 по настоящему изобретению состоит в их способности более активно взаимодействовать с молекулярным кислородом, генерируя больше активных форм кислорода и локально оказывая более сильный оксидативный стресс. Другим преимуществом является их повышенная фотостабильность, повышающая метаболизм активных форм кислорода для поглощения большего количества фотонов.
Целью данного изобретения также является раскрытие применения фармацевтических композиций, раскрытых в настоящем описании, для лечения гиперпролиферативных расстройств, включающих, но не ограниченных указанными, раковые заболевания или карциномы, миеломы, псориаз, макулярную дегенерацию, а также предраковые состояния, включающие, но не ограниченные указанными, дисплазию шейки матки и дисплазию полости рта.
Целью данного изобретения также является раскрытие применения фармацевтических композиций, раскрытых в настоящем описании, для лечения инфекционных заболеваний, вызываемых микроорганизмами, включающими, но не ограниченными указанными, вирусы, бактерии, риккетсии, микоплазму, простейших, грибы; или паразитами, включающими, но не ограниченными указанными, обычно микроскопических или очень маленьких многоклеточных беспозвоночных, или их яйцами или ювенильными типами.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Без цели ограничения настоящего изобретения, к данной заявке приложены графические материалы, иллюстрирующие варианты осуществления для упрощения их понимания.
Фиг. 1. Атропоизомеры галогенированных тетрафенилбактериохлоринов, где жирные линии представляют собой связи, расположенные над плоскостью макроцикла и определяющие ориентацию группы R над или под этой плоскостью, как проиллюстрировано схемами под структурами. Группа R' представляет собой -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, -аминокислоты, -OR, -NHR и -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода. Каждый из атомов X1 и X2 независимо выбран из атомов галогена (F, Cl, Br) и водорода, при условии что по меньшей мере все X2 представляют собой атомы галогена.
Фиг. 2. УВЭЖХ (ультра высокоэффективная жидкостная хроматография) хроматограмма с детекцией при 380 нм образца 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)хлорина, полученного синтезом без использования растворителя.
Фиг. 3. 1Н-ЯМР (ядерный магнитный резонанс) спектр образца 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)хлорина, полученного синтезом без использования растворителя.
Фиг. 4. ВЭЖХ (высокоэффективная жидкостная хроматография) хроматограмма образца 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина, полученного синтезом без использования растворителя.
Фиг. 5. 1Н-ЯМР спектр образца 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина, полученного синтезом без использования растворителя.
Фиг. 6. ВЭЖХ хроматограммы образцов LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D, разделенных с помощью препаративной ВЭЖХ.
Фиг.7. 1Н-ЯМР спектр образца LUZ11-A.
Фиг. 8. 1Н-ЯМР спектр образца LUZ11-B.
Фиг. 9. 1Н-ЯМР спектр образца LUZ11-С.
Фиг. 10. 1Н-ЯМР спектр образца LUZ11-D.
Фиг. 11. Структура атропоизмера α4 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина, полученная с помощью рентгеноструктурного анализа, где атомы фтора представлены светло-серым цветом, атомы азота - черным с белыми точками, атомы серы - серым, атомы кислорода - темно-серым и атомы углерода - черным.
Фиг. 12. А) Спектры поглощения в этаноле образцов LUZ11-А, LUZ11-В, LUZ11-С и LUZ11-D. Б) Градуировочные графики Бугера-Ламберта-Бера этих же образцов, использованные для расчета молярных коэффициентов поглощения образцов, при условии, что вся взвешенная масса представляет собой массу LUZ11.
Фиг. 13. ВЭЖХ хроматограммы фракций X и Y, демонстрирующие обогащение фракцией Y суммой атропоизомеров α3β и α4.
Фиг. 14. Уменьшение поглощения на пике наибольшей длины волны для образцов LUZ11-A (744,5 нм), LUZ11-B (744,5 нм), LUZ11-C (745 нм) и LUZ11-D (746 нм) в метаноле:PBS (3:2), в виде функции от времени облучения.
Фиг. 15. Фракции выживших клеток НТ-29 при увеличении доз фотосенсибилизатора, представляющего собой образцы LUZ11, LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D, и постоянной дозе света, составляющей 1 Дж/см2, использованные для получения значений IC50 и IC90, представленных в Таблице 5.
Фиг. 16. Фракции выживших клеток СТ26 при увеличении доз фотосенсибилизатора, представляющего собой образцы LUZ11, LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D, и постоянной дозе света, составляющей 1 Дж/см2, использованные для получения значений IC50 и IC90, представленных в Таблицах 1 и 5.
Фиг. 17. График Каплана-Мейера возобновления роста опухоли СТ26 у мышей BALB/c после ФДТ с 0,7 мг/кг фотосенсибилизатора, указанного на графике, и плотностью потока света 41 Дж/см2. Мышей, не имевших опухолей по истечении 60 суток лечения, считали излеченными.
Фиг. 18. График Каплана-Мейера возобновления роста опухоли СТ26 у мышей BALB/c после ФДТ с 0,7 мг/кг композиций атропоизомеров, указанных на графике, и плотностью потока света 41 Дж/см2. Мышей, не имевших опухолей по истечении 60 суток после лечения, считали излеченными. Образец X и Образец Y были получены в Примере 3.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Со ссылкой на графические материалы в настоящем описании более детально раскрыты необязательные варианты осуществления, которые, тем не менее, не предназначены для ограничения объема настоящей заявки.
А. Определения
В контексте настоящей заявки применимы следующие определения:
Термин «стереоизомер» относится к соединениям, имеющим одинаковое химическое строение, но различающимся пространственным расположением атомов или групп атомов.
«Атропоизомер» представляет собой стереоизомер, возникающий в результате медленного вращения вокруг оси одинарной связи, может быть интерконвертирован в результате термического или фотохимического воздействия, но интерконверсия является достаточно медленной при комнатной температуре в условиях освещенности окружающей среды для аналитического разделения.
«Статистическая смесь атропоизомеров» галогенированных тетрафенилпорфиринов, тетрафенилхлоринов или тетрафенилбактериохлоринов относится к смеси атропоизомеров αβαβ, α2β2, α3β и α4, полученной в результате синтеза, в которой указанные атропоизомеры присутствуют в следующих соотношениях: (α2β2)/(αβαβ) от 1,5 до 2,5, (α3β)/(αβαβ) от 3,0 до 4,5, (α4)/(αβαβ) от 0,6 до 1,2.
Под фармацевтическими композициями, «обогащенными атропоизомерами α4 и α3β», понимаются смеси атропоизомеров с относительно более низким содержанием наименее фотоактивных атропоизомеров αβαβ и α2β2 относительно содержания наиболее фотоактивных атропоизомеров α4 и α3β, присутствующих в статистической смеси атропоизомеров, полученной в результате синтеза фотоактивного соединения, так что атропоизомеры α4 и α3β составляют более 70% указанной смеси.
«Эффективность в ФДТ» представляет собой способность фотоактивного соединения уничтожать клетки, бактерии или вирусы или разрушать пораженную ткань для данного лекарственного средства и дозы света. Более высокая эффективность в ФДТ соответствует большей степени уничтожения клеток, уничтожения микроорганизмов или некроза ткани при одной и той же дозе фотоактивного соединения и света.
«Доза света» является мерой числа фотонов, доставленных в целевую ткань, в которой присутствует фотоактивное соединение.
«LUZ11» является кодовым наименованием 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина. «LUZ11-А» представляет собой образец, по существу состоящий из атропоизомера αβαβ LUZ11. «LUZ11-В» представляет собой образец, по существу состоящий из атропоизомера α2β2 LUZ11. «LUZ11-С» представляет собой образец, по существу состоящий из атропоизомера α3β LUZ11. «LUZ11-D» представляет собой образец, по существу состоящий из атропоизомера α4 LUZ11.
«По существу состоящий» в данном контексте относится к композиции, в которой атропоизомер составляет по меньшей мере 80% атропоизомеров, присутствующих в образце.
ВЭЖХ обозначает высокоэффективную жидкостную хроматографию.
При использовании в настоящем описании «гиперпролиферативные расстройства» обозначают расстройства, имеющие основное патологическое состояние, выражающееся в избыточной пролиферации клеток, вызванной нерегулируемым или атипичным ростом клеток, и включают неконтролируемый ангиогенез. Примеры гиперпролиферативных расстройств включают, но не ограничиваются указанными, раковые заболевания или карциномы, миеломы, псориаз, макулярную дегенерацию.
«Гиперпролиферативная ткань» при использовании в настоящем описании обозначает бесконтрольно растущую ткань и включает опухоли и неукротимый рост сосудов, такой как рост кровяных сосудов, наблюдаемый при возрастной макулярной дегенерации.
При использовании в настоящем описании «инфицирующий агент» относится к инвазивным микроорганизмам или паразитам. При использовании в настоящем описании «микроорганизм» обозначает вирус, бактерию, риккетсии, микоплазму, простейших, грибы и подобные микроорганизмы, и «паразит» обозначает патогенных, обычно микроскопических или очень маленьких многоклеточных беспозвоночных, или их яйца или ювенильные типы.
В изобретении также предложена фармацевтическая композиция, содержащая эффективное количество соединения, раскрытого в настоящем описании (например, атропоизомеров формул, раскрытых в настоящем описании), и фармацевтически приемлемый носитель.
Фактические уровни дозировок и продолжительность введения активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьировать, так чтобы получить количество активного ингредиента, эффективное для достижения желаемого терапевтического ответа для конкретного пациента, композиции и режима введения, которое не являются при этом токсичным (или неприемлемо токсичным) для пациента.
При применении по меньшей мере одно соединение согласно настоящему изобретению (например, атропоизомеры формул, раскрытых в настоящем описании) вводится в фармацевтически эффективном количестве субъекту, нуждающемуся в этом, в фармацевтическом носителе посредством внутривенной, внутримышечной, подкожной, внутриочаговой или интрацеребровентрикулярной инъекции, или посредством перорального введения или местного применения. Согласно настоящему изобретению соединение по изобретению может вводиться по отдельности или совместно со вторым, отличающимся терапевтическим средством. Под «совместно с» подразумевается вместе, по существу одновременно или последовательно. В одном из вариантов осуществления соединение по изобретению вводится однократно. Следовательно, соединение по изобретению может вводиться при кратковременном лечении, таком как от приблизительно 1 дня до приблизительно 1 недели. В другом варианте осуществления соединение по изобретению может вводиться в течение большего периода времени для облегчения хронических расстройств, такого как, например, в течение от приблизительно одной недели до нескольких месяцев, в зависимости от состояния, подлежащего лечению.
Под «фармацевтически приемлемым количеством» в настоящем описании подразумевается количество соединения по изобретению (например, атропоизомеров формул, раскрытых в настоящем описании), достаточно большое для того, чтобы существенно улучшить состояние, подлежащее лечению, но достаточно малое для того, чтобы избежать серьезных побочных эффектов (с разумным соотношением польза/риск), в объеме компетентного медицинского суждения. Фармацевтически эффективное количество соединения по изобретению может варьировать в зависимости от конкретной цели, которую требуется достичь, возраста и физического состояния пациента, подлежащего лечению, степени тяжести основного патологического состояния, продолжительности лечения, особенности сопутствующей терапии и конкретного используемого соединения. Например, терапевтически эффективное количество соединения по изобретению, вводимое ребенку или новорожденному, будет пропорционально уменьшено в соответствии с компетентными медицинскими суждениями. Эффективное количество соединения по изобретению будет, таким образом, минимальным количеством, обеспечивающим желаемый эффект. Кроме того, при фото динамической терапии «фармацевтически эффективное количество» фармацевтической композиции или соединения частично зависит от других факторов, таких как доза света и кислород, оба из которых необходимы для достижения терапевтического результата. Следовательно, при лечении субъекта или пациента предусмотрено также «эффективное количество» света, а также количество кислорода. Другие важные факторы, влияющие на определение «фармацевтически эффективного количества» лекарственного средства, света и кислорода, включают лекарственно-световые интервалы (время между введением лекарственного средства и облучением ткани). Лекарственно-световой интервал важен, поскольку, например, введение более высокой дозы лекарственного средства, составляющей 50 мг/кг, и облучение ткани одну неделю спустя дозой света 500 Дж/см2 может быть столь же недейственным или неэффективным, как применение дозы лекарственного средства 0,01 мг/кг и облучение ткани через 10 минут после введения дозой света 0,1 Дж/см2. Выведение (метаболизм) лекарственного средства организмом между введением лекарственного средства и облучением может снизить эффективность терапии при увеличении лекарственно-светового интервала (когда он становится длиннее). Тем не менее, увеличение лекарственно-светового интервала может обеспечить более селективную терапию и меньше нежелательных эффектов. Следовательно, в силу по меньшей мере этих причин лекарственно-световой интервал является важным фактором, который необходимо принимать во внимание при определении «фармацевтически эффективного количества» композиций по настоящему изобретению.
Помимо рассмотренных выше факторов, влияющих на определение «эффективного количества» лекарственного средства, света, кислорода и лекарственно-светового интервала, специалист в данной области техники также примет во внимание плотность светового потока (сколько фотонов доставляются на единицу площади за единицу времени). Плотность потока важна, поскольку доставка слишком большого количества фотонов со слишком высокой скоростью может истощить кислород в ткани и привести к недейственной или неэффективной терапии.
Наконец, еще одним параметром, важным для эффективного лечения, является граница облучаемой опухоли или ткани. При фотодинамической терапии облучаемая ткань является основной мишенью терапии и погибнет первой, однако могут также наблюдаться системные эффекты (вне облучаемой области) в результате стимуляции иммунной системы организма-хозяина и/или других каскадов биологических эффектов, вызываемых действием фотодинамической терапии на основную мишень. Следовательно, выбор границы является столь же важным при лечении субъекта или пациента посредством фотодинамической терапии, как и при хирургическом лечении.
Несомненным практическим преимуществом настоящего изобретения является то, что соединение (например, атропоизомеры формул, раскрытых в настоящем описании) может вводиться подходящим способом, таким как внутривенный, внутримышечный, подкожный, пероральный, внутриочаговый или интрацеребровентрикулярный пути введения, или посредством местного применения, например в виде кремов или гелей. В зависимости от пути введения может потребоваться покрыть активные ингредиенты, содержащие соединение по изобретению, материалом для защиты соединения от действия ферментов, кислот и других естественных условий, под действием которых соединение может быть инактивировано. Для введения соединения по изобретению путями, отличными от парентерального введения, соединение может быть покрыто материалом или введено совместно с ним для предотвращения инактивации или улучшения растворимости.
Соединение (например, атропоизомеры формул, раскрытых в настоящем описании) может вводиться парентерально или интраперитонеально. Также могут быть приготовлены дисперсии, например, в глицерине, жидких полиэтиленгликолях и их смесях, и в маслах.
Фармацевтические формы, подходящие для инъекционного применения, включают стерильные растворы (в случае растворимости) или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий для немедленного приема. Во всех случаях форма должна быть стерильной и текучей в степени, обеспечивающей возможность введения через шприц. Она должна быть стабильной в условиях производства и хранения. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, ДМСО (диметилсульфоксид), этанол, многоатомный спирт (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобные), их подходящие смеси и растительные масла. Надлежащая текучесть может поддерживаться, например, за счет использованиия покрытия, такого как лецитин, соблюдения требуемого размера частиц в случае дисперсии. Во многих случаях будет предпочтительным включать агенты, придающие изотоничность, например, сахара или хлорид натрия.
Стерильные инъецируемые растворы получают включением соединения по изобретению в необходимом количестве в подходящий растворитель с другими различными ингредиентами, перечисленными выше, по мере необходимости, с последующей стерилизацией путем фильтрации. Обычно дисперсии получают включением различных стерилизованных соединений в стерильный носитель, содержащий базовую дисперсионную среду и другие необходимые ингредиенты, перечисленные выше. В случае стерильных порошков для получения стерильных инъецируемых растворов предпочтительными способами получения являются техника вакуумной сушки и лиофилизации, в результате которой получают порошок активного ингредиента с любым дополнительным желаемым ингредиентом из его раствора, предварительно стерилизованного путем фильтрации.
Для перорального терапевтического введения соединение может быть объединено с эксципиентами и применяться в форме таблеток для проглатывания, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и тому подобного. Композиции или препараты согласно настоящему изобретению получают таким образом, чтобы единица дозирования формы для перорального введения содержала концентрацию соединения, достаточную для лечения расстройства у субъекта.
Некоторыми примерами веществ, которые могут служить в качестве фармацевтических носителей, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетаты целлюлозы; порошок трагакантовой камеди; солод; желатин; тальк; стеариновые кислоты; стеарат магния; сульфат кальция; растительные масла, такие как арахисовые масла, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; многоатомные спирты, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; агар; альгиновые кислоты; апирогенная вода; изотонический раствор и натрий-фосфатный буфер; порошок обезжиренного молока, а также другие нетоксичные совместимые вещества, используемые в фармацевтических композициях, такие как, например, витамин С, эстроген и эхинацея. Также могут присутствовать.смачивающие агенты и смазывающие вещества, такие как лаурилсульфат натрия, а также красители, вкусовые добавки, смазывающие вещества, эксципиенты, агенты для изготовления таблеток, стабилизаторы, антиоксиданты и консерванты.
В другом варианте осуществления изобретения предложена композиция, имеющая диапазон дозировок, или способ, как описано выше, где эффективное количество соединения, определенного в настоящем описании (например, атропоизомеров формул, раскрытых в настоящем описании), составляет от приблизительно 0,005 мкг/кг до приблизительно 200 мг/кг.В некоторых вариантах осуществления эффективное количество соединения формул, раскрытых в настоящем описании (например, атропоизомеров формул, раскрытых в настоящем описании) составляет от приблизительно 0,02 мг/кг до приблизительно 20 мг/кг.В дополнительном варианте осуществления эффективное количество соединения, определенного в настоящем описании, составляет от приблизительно 0,2 мг/кг до 2 мг/кг. В дополнительном варианте осуществления эффективное количество соединения, определенного в настоящем описании, составляет от приблизительно 0,2 мг/кг до 1 мг/кг, и доза света составляет от 30 до 300 Дж/см2. В дополнительном варианте осуществления эффективное количество соединения, определенного в настоящем описании, составляет от приблизительно 0,5 мг/кг до 2 мг/кг, и доза света составляет от 20 до 150 Дж/см2. В дополнительном варианте осуществления эффективное количество соединения, определенного в настоящем описании, составляет от приблизительно 0,05 мг/кг (50 нг/мл) до 5 мг/кг, доза света составляет от 3 до 300 Дж/см2, и лекарственно-световой интервал выбирают из совпадающего с введением лекарственного средства до одной недели после введения лекарственного средства.
В других вариантах осуществления изобретения предложен способ, как описано выше, где эффективное количество соединения, определенного в настоящем описании (например, атропоизомеров формул, раскрытых в настоящем описании), в целевой ткани в момент облучения составляет от приблизительно 0,1 нМ до приблизительно 50 мкМ. В некоторых вариантах осуществления эффективное количество составляет от приблизительно 10,0 пМ до приблизительно 10 нМ. В другом варианте осуществления эффективное количество составляет от приблизительно 0,2 нМ до приблизительно 2 нМ. В другом варианте осуществления эффективное количество составляет от приблизительно 0,1 мкМ до приблизительно 100 мкМ.
Другим объектом настоящего изобретения является набор, содержащий фармацевтическую композицию, определенную в настоящем описании, и инструкции по введению композиции. Набор может предусматривать фармацевтическую композицию в любой подходящей емкости (т.е., флаконе, бутылке, шприце, ампуле, пробирке) и включать инструкции, такие как инструкции для фотодинамической терапии/введения (например, инструкции по световому воздействию, длине волны и инструкции по продолжительности проведения).
Другим объектом настоящего изобретения является применение соединения, описанного в настоящем описании (например, атропоизомеров формул, раскрытых в настоящем описании), для производства лекарственного препарата для применения в лечении расстройства или заболевания, описанного в настоящем описании. Другим объектом настоящего изобретения является применение соединения, описанного в настоящем описании (например, атропоизомеров формул, раскрытых в настоящем описании), для применения в лечении расстройства или заболевания, описанного в настоящем описании.
Раскрытие списка химических групп в любом определении переменной в настоящем описании включает определения этой переменной в виде любой отдельной группы или комбинации перечисленных групп. Раскрытие варианта осуществления для переменной в настоящем описании включает этот вариант осуществления по отдельности или в комбинации с любыми другими вариантами осуществления или их частями. Раскрытие варианта осуществления в настоящем описании включает этот вариант осуществления по отдельности или в комбинации с любыми другими вариантами осуществления или их частями.
В. Соединения-предшественники
Предшественники порфирина могут быть получены с помощью способа, описанного в патентах РСТ/ЕР/012212 (1) и РСТ/РТ2009/000057 (2), включающего следующие стадии:
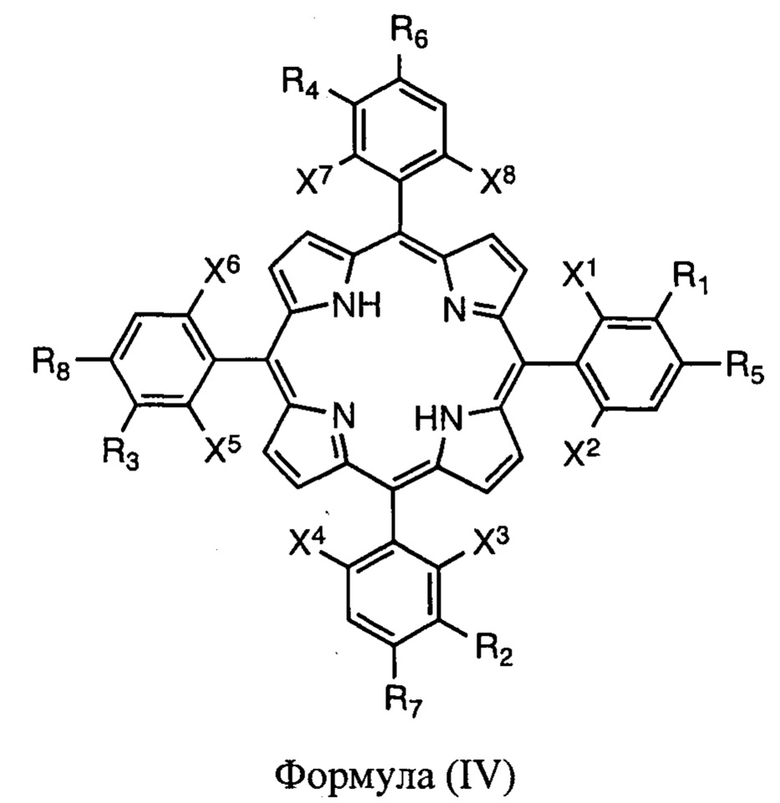
(i) восстановление порфирина формулы (IV)
где:
присутствует статистическая смесь атропоизомеров;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой -ОН, -OR или -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, -аминокислоты, -OR, -NHR, -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8 независимо представляют собой Н, -ОН, -OR, -Cl или -NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода,
до производных хлорина и/или бактериохлорина формулы
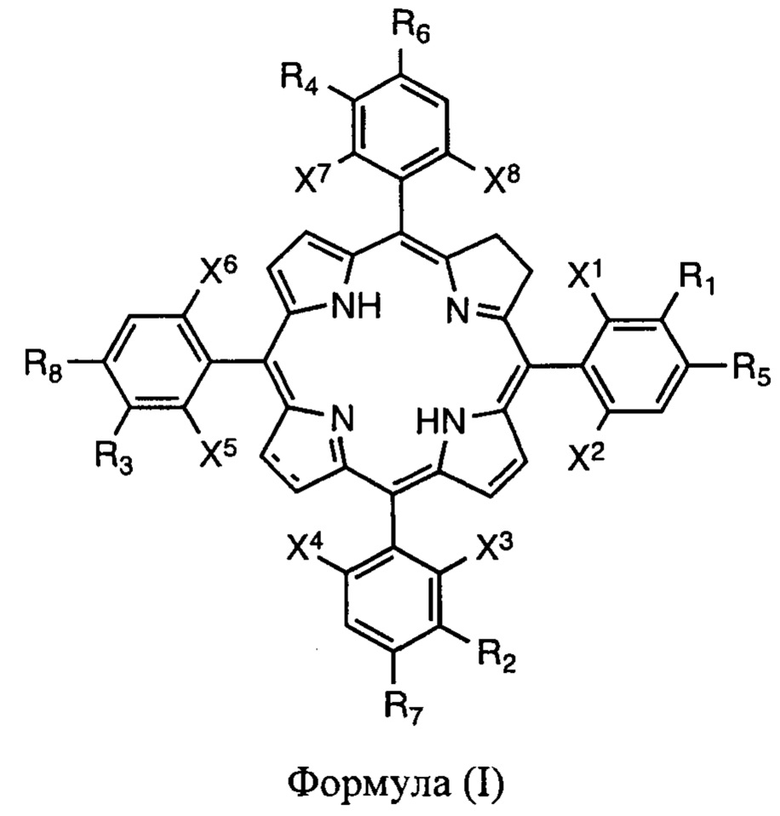
где:
 представляет собой одинарную или двойную углерод-углеродную связь;
представляет собой одинарную или двойную углерод-углеродную связь;
присутствует статистическая смесь атропоизомеров;
с помощью гидразидов и в присутствии стерически затрудненных органических оснований, как описано в патенте РСТ/ЕР/012212 (1); необязательно стадия восстановления может быть проведена в отсутствие растворителей и в отсутствие оснований, как описано в патенте PCT/РТ2009/000057 (2).
Предпочтительно, гидразид представляет собой пара-толуолсульфонилгидразид, гидразид 4-хлорбензолсульфоновой кислоты, 4,4'-оксибис(бензолсульфонил)гидразид, бензолсульфонилгидразид, 4-метоксибензолсульфонилгидразид или гидразид бензойной кислоты.
Согласно изобретению стерически затрудненное основание выбрано из 1,4-диазобицикло[2.2.2]октана (DABCO) и 1,8-диазобицикло[5.4.0]ундец-7-ена (DBU).
Согласно изобретению стадию восстановления проводят при температуре от 70 до 200°С. Предпочтительно, стадию восстановления проводят при температуре по меньшей мере 100°С. Предпочтительно, стадию восстановления проводят в течение по меньшей мере 5 минут.
Согласно изобретению стадию восстановления проводят в инертной атмосфере.
Согласно изобретению вариант проведения реакции в отсутствие растворителей требует использования температуры выше точки плавления одного из реагентов, так что другой реагент или реагенты являются частично растворенными или диспергированными в расплавленном реагенте. В случае твердофазных реакций между гидризадами и производными порфирина их согласно изобретению проводят при температуре выше точки плавления гидразида.
C. Инструменты
Элементные анализы проводили на элементном анализаторе Leco TruSpec CHNS. 1Н-ЯМР и спектры регистрировали на Bruker Avance 400 МГц. Отнесение сигналов 1H проводили с помощью экспериментов 2D COSY и NOESY. Данные ПИА-ЭСИ (проточно-инжекционного анализа с ионизацией в электроспрее) с тандемной TOF (времяпролетной) масс-спектрометрией высокого разрешения получали с помощью масс-спектрометра Micromass Autospec. ВЭЖХ Shimadzu Prominence, оборудованный диодно-матричным детектором (модель SPD 20 AV). Разделения проводили при 743 нм, 23°С на полупрепаративной колонке Inertsil-Phenyl (250*10 мм; 5 мкм).
Спектры поглощения регистрировали на спектрофотометре Shimadzu UV-2100. Спектры флуоресценции измеряли с помощью спектрофотометра Spex Fluorolog 3, с коррекцией для зависимости от длины волны (фотоумножитель RCA С31034). Спектры нестационарного поглощения регистрировали с помощью спектрометра Applied Photophysics LKS 60 для изучения кинетики лазерного наносекундного импульсного фотолиза, используя третью гармонику лазера Spectra-Physics Quanta Ray GCR 130-01 Nd/YAG для возбуждения, фотоумножитель Hamamatsu 1Р28 и осциллограф Hewlett-Packard Infinium (1 Гвыб/с). Измерения импульсного фотолиза проводили в присутствие воздуха в растворах, насыщенных аргоном. Фосфоресценцию синглетного кислорода при комнатной температуре измеряли при 1270 нм с помощью фотоумножителя Hamamatsu R5509-42, охлажденного до 193 K в камере с жидким азотом (Products for Research, модель PC176TSCE005), после лазерного возбуждения аэрированных растворов при 355 нм, с помощью адаптированного спектрометра от Applied Photophysics. Для облучения бактериохлоринов в экспериментах по фотообесцвечиванию использовали лазер непрерывной генерации, испускающий при 749+/-3 нм от Omicron Laserage.
D. Способы
Подходящее количество каждой фракции растворяли в аналитическом растворителе с получением концентрации 0,025 мг/мл. Фракцию полученного раствора объемом 15 мкл затем анализировали с помощью ВЭЖХ с детектором УФ-(ультрафиолетового) и видимого диапазонов. Разделение атропоизомеров проводили с помощью колонки Zorbax XDB Eclipse Phenyl (150*4,6 мм; 5 мкм) и программы градиента двух подвижных фаз: метанола (подвижная фаза А) и раствора буфера ацетата аммония, 100 мМ, рН 9,5 в метаноле в соотношении 25:75, об/об (подвижная фаза В), подаваемых с постоянной скоростью потока 1,0 мл/мин. Температуру колонки поддерживали постоянной при 20°С. Относительное количество четырех атропоизомеров LUZ11 определяли при 743 нм.
Эксперименты по фотообесцвечиванию проводили в растворах метанол:PBS (3:2), где PBS относится к растворам натрий-фосфатного буфера. Растворы облучали в кювете с длиной оптического пути 1 см с помощью лазера непрерывной генерации, испускающего при 749±3 нм от Omicron Laserage. Полная выходная мощность составляла 640 мВт. Для каждого соединения поглощение регистрировали за интервалы времени от нескольких минут до нескольких часов облучения. Изначальные величины поглощения соединений составляли приблизительно 1,0.
Спектры триплет-триплетного поглощения и времена жизни триплетного состояния атропоизомеров (τT) измеряли с помощью оборудования для регистрации спектров нестационарного поглощения, описанного выше, с возбуждением при 355 нм, где растворы имели величину поглощения от 0,25 до 0,30.
Квантовые выходы синглетного кислорода в этаноле получали с помощью процедуры, описанной в источнике (17), используя феналенон в качестве стандарта. Описанное в источнике значение для квантового выхода синглетного кислорода, полученного с феналеноном в этаноле, составляет ФΔ=0,95 (18).
Фармацевтические композиции, описанные в настоящем описании, оценивали в исследованиях in vitro с помощью культивирования опухолевых клеток и облучения диодным лазером при 749 нм. Клетки НТ-29 (карциномы толстой кишки человека) и СТ26 (карциномы толстой кишки мыши) культивировали в Среде Игла в модификации Дульбекко (Sigma-Aldrich, Штайнхайм, Германия) с добавками 10%-ной инактивированной нагреванием фетальной бычьей сыворотки (FBS) (Biochrom, Берлин, Германия) и 100 МЕ/мл пенициллина - 100 мкг/мл стрептомицина (Lonza, Вервье, Бельгия). Линии клеток поддерживали в культуральных матрасах объемом 75 см2 (Orange Scientific, Брен-л'Алле, Бельгия) при 37°С в увлажненной атмосфере с 5% СО2. Клетки с конфлюэнтностью 85-90% отделяли с помощью раствора Трипсин-Версена-ЭДТА (Lonza, Вервье, Бельгия), подсчитывали и засевали в черные 96-луночные планшеты DB Falcon с прозрачным плоским дном (Franklin Lakes, Нью-Джерси, США) с желаемыми плотностями, в 100 мкл культуральной среды, и оставляли на ночь для адгезии. Исходные растворы исследуемых соединений готовили в диметилсульфоксиде и разбавляли культуральной средой для получения желаемой концентрации для инкубации с клетками при 37°С в течение 24 ч в темноте. Каждую концентрацию исследовали по меньшей мере трижды. После инкубации клетки однократно промывали 200 мкл PBS для удаления непоглощенного соединения и добавляли 100 мкл свежей культуральной среды. Клетки облучали (каждую лунку отдельно) с помощью изготовленного по заказу диодного лазера модели LDM750.300.CWA.L.M с контроллером 1201-08Р и излучателем 1201-08D (Omicron, Родгау, Германия), испускающим при 749 нм. Лазерный луч был связан с оптоволокном, имеющим на конце настраиваемую рассеивающую линзу, зафиксированную на подложке и направленную перпендикулярно планшету с клетками. Линзу волокна настраивали так, чтобы облучаемая область точно совпадала с областью дна лунок планшета, чтобы обеспечить полное облучение каждой лунки отдельно с плотностью потока энергии 8,0 мВт/см2 на уровне планшета. Измерение мощности лазера проводили с помощью карманного измерителя мощности LaserCheck (Coherent, Inc., Санта-Клара, Калифорния, США). Время облучения, соответствующее дозе света 1,0 Дж/см2, составляет 125 секунд.
Жизнеспособность клеток оценивали через 24 ч после облучения с помощью редуктазной пробы с резазурином. Вкратце, исходный раствор (0,1 мг/мл в PBS) натриевой соли резазурина (Sigma-Aldrich, Штайнхайм, Германия) разбавляли на 10% культуральной средой без FBS или антител, и добавляли по 200 мкл к клеткам в каждой лунке. Планшеты инкубировали в течение 3-4 ч при 37°С. Величины поглощения в каждой лунке измеряли при 540 нм и 630 нм с помощью ридера для микропланшетов Multiskan Ex (Thermo - Electron Corporation, Вантаа, Финляндия). Результаты оценки жизнеспособности клеток выражали в виде среднего ±СКО (среднеквадратичное отклонение) повторных измерений в тех же условиях в по меньшей мере двух независимых экспериментах.
Исследования жизнеспособности клеток позволяют получить информацию о цитотоксичности лекарственных средств. Ее количественно определяли отношением гибели клеток к необработанным клеткам (% контрольных клеток, которые держали в темноте). Результаты наносили на график в виде кривых зависимости от дозы (% жизнеспособности клеток в виде функции от концентрации лекарственного средства), что позволило определить концентрацию, уменьшающую жизнеспособность на 50% (IC50), и концентрацию, уменьшающую жизнеспособность на 90% (IC90) при данной дозе света.
Мыши, использованные в настоящем исследовании, представляли собой самок BALB/c весом 20-25 г (Charles River Laboratories, Барселона, Испания). Мышей держали на стандартной лабораторной диете, предоставляя свободный доступ к питьевой воде. Использование этих животных в целях эксперимента было одобрено Национальной ветеринарной службой (National Veterinary Authority) (авторизационный №DGVA 0420/000/000/2011). Для образования опухоли 350000 клеток СТ26 (CRL-2638™, АТСС-LCG Standards, Барселона, Испания) в 0,1 мл PBS подкожно инокулировали в правое бедро каждой мыши. Опухоли лечили через 8-10 дней после инокуляции, когда их диаметры достигали приблизительно 5 мм. Мышей лечили по протоколу сосудисто-направленной ФДТ, который начинался с внутривенной инъекции соединения (0,7 мг/кг) с облучением по прошествии 15 минут опухоли с помощью диодного лазера Omicron при 749 нм и мощности лазера 173 мВт. Лазерный луч был связан с оптоволокном, имеющим фиксированную рассеивающую линзу, расположенную перпендикулярно поверхности опухоли для облучения области площадью 1,33 см2 и сообщения общей дозы света 55 Дж.
Е. Свойства соединений
Величины поглощений соединений измеряли в различных концентрациях в мкМ, и во всех случаях наблюдалось соответствие закону Бугера-Ламберта-Бера. Кроме того, длина волны максимального поглощения (λmax) в инфракрасном диапазоне не менялась в зависимости от исследуемого диапазона концентраций. Это указывает на небольшую степень агрегации между молекулами, которые главным образом существует в виде мономеров для этих концентраций в исследованных растворителях. В Таблице 1 представлены молярные коэффициенты поглощения в инфракрасном диапазоне (εmax) и максимальные значения длины волны в этаноле, полученные для 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина (образец LUZ11) и его очищенных атропоизомеров (образцы LUZ11-А, LUZ11-В, LUZ11-С, LUZ11-D). Этот бактериохлорин обладает большой величиной поглощения излучения в ближнем инфракрасном диапазоне, где ткани человека обладают большей прозрачностью, чем в видимом диапазоне, что является предпочтительным свойством фотосенсибилизатора для ФДТ. Атропоизомеры обладают небольшим различием в εmax. Например, εmax от образца LUZ11-A к образцу LUZ11-D снижается на 3%. В этой же таблице также представлены времена жизни триплетного состояния (τT) в аэрированных этанольных растворах, квантовый выход фоторазложения (ФPD) в аэрированных растворах метанол:PBS (3:2) и квантовые выходы синглетного кислорода (ФΔ) в аэрированных этанольных растворах.


Времена жизни нестационарного состояния измеряли при 400, 610 и 790 нм. Все распады триплетных состояний имели явный моноэкспоненциальный характер, и времена жизни триплетного состояния в насыщенном воздухом этаноле составили 200-300 наносекунд. Такие значения согласуются с диффузионным переносом ограниченного количества энергии с триплетного состояния фотосенсибилизатора на молекулярный кислород посредством взаимодействия с переносом заряда (4). Для фоторазложения использовали лазер непрерывной генерации, испускающий при 749±3 нм, общей мощностью 640 мВт. Для всех соединений наблюдалось моноэкспоненциальное снижение интенсивностей поглощения. Наиболее фотостабильным атропоизомером в Таблице 1 является образец LUZ11-D, имеющий квантовый выход фоторазложения ФРD=9×10-6.
Все эмиссии синглетного кислорода, измеренные в аэрированных этанольных растворах, очень хорошо описываются моноэкспоненциальным характером распада, с типичными временами жизни синглетного кислорода (τΔ≈16 мкс). Значения ФΔ в Таблице 1 были получены способами, описанными выше.
Используя вышеописанные способы, дополнительно подробно описанные в нижеследующих примерах, были определены концентрации различных атропоизомеров, необходимые для уничтожения 50% клеток СТ26 in vitro при дозе лазерного излучения 1 Дж/см2, также представленные в Таблице 1. Значительную разницу в фотоксичности образцов LUZ11-A и LUZ11-D нельзя было ожидать, основываясь на известном механизме действия ФДТ, который основан на оксидативном стрессе, вызываемом генерацией АФК при поглощении фотосенсибилизатором света в присутствии кислорода. Фактически, нельзя было ожидать, что атропоизомер αβαβ, имеющий лишь небольшое отличие в поглощении света и эффективности генерации синглетного кислорода в сравнении с α4, будет значительно худшим фотосенсибилизатором. Ранее при применении фотосенсибилизаторов в ФДТ не учитывалось, что атропоизомеры с равным количеством объемных групп на разных сторонах плоскости, определенной макроциклом, не вносят существенный вклад в эффективность смеси атропоизомеров в ФДТ. Главной целью настоящего изобретения является описать впервые фармацевтические композиции, обогащенные атропоизомерами α3β и α4, где эти атропоизомеры представляют более 70% всех атропоизомеров, присутствующих в смеси, превосходящие эффективность в ФДТ статистической смеси атропоизомеров, полученной в результате их синтеза. Целью настоящего изобретения также является описать фармацевтическую композицию, обогащенную атропоизомером α3β, где этот атропоизомер представляет более 60% всех атропоизомеров, присутствующих в смеси, и улучшает ее эффективность в ФДТ. Целью настоящего изобретения также является описать фармацевтическую композицию, обогащенную атропоизомером α4, где этот атропоизомер представляет более 20% всех атропоизомеров, присутствующих в смеси, и улучшает ее эффективность в ФДТ. Еще одной целью настоящего изобретения является описать впервые применение химических процессов разделения при температурах выше 20°С и в присутствии света и кислорода для обогащения смеси атропоизомеров атропоизомерами α3β и α4 тетрафенилбактериохлоринов, ранее считавшихся неустойчивыми.
ПРИМЕРЫ
Это изобретение будет далее более подробно описано в следующих неограничивающих примерах, со ссылкой на следующие графические материалы:
ПРИМЕР 1. СИНТЕЗ И ХАРАКТЕРИСТИКА АТРОПОИЗОМЕРОВ, ПРИСУТСТВУЮЩИХ ВО ФТОРИРОВАННОМ СУЛЬФОНАМИД ТЕТРАФЕНИЛХЛОРИНЕ
Химический синтез смеси атропоизомеров, соответствующих формуле (II),

где X1 и X2 представляют собой атомы фтора, и R' представляет собой группу -SO2NHCH3, и их характеристику проводили следующим образом:
Синтез 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)хлорина проводили взаимодействем пара-толуолсульфонилгидразида (700±10 мг) с 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)порфирином (100±10 мг) при давлении ниже 0,6 мбар, с нагревом до 140±1°С в течение 15 минут. После охлаждения до комнатной температуры неочищенный продукт реакции растворяли в дихлорметане (≈50 мл) и последовательно промывали гидроксидом натрия (0,5 М) и водой (3 раза). Органическую фазу сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали. Смесь соединений осаждали гексаном. Твердое вещество растворяли в диметоксиэтане (DME) (20 мл) и к раствору добавляли FeCl3⋅6Н2О (1 экв.) с последующим добавлением 0,1 мл пероксида водорода (3%-ный в воде). Конечный раствор выдерживали при перемешивании при комнатной температуре. По прошествии 90 минут добавляли 0,1 мл пероксида водорода (3%-ный в воде) и останавливали реакцию, когда пик поглощения бактериохлорина (≈750 нм) исчезал (90 минут). К раствору добавляли диэтилкарбонат, и затем органическую фазу дважды промывали насыщенным раствором тиосульфата натрия, дважды - дистиллированной водой, и затем сушили над безводным Na2SO4. Растворитель испаряли и очищали колоночной хроматографией на силикагеле (дихлорметан/этилацетат). 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)хлорин, содержащий смесь атропоизомеров, получали с выходом 80±5% (80±5 мг). На Фиг. 2 представлена УВЭЖХ хроматограмма с детекцией при 380 нм. Разделение всех атропоизомеров хлорина проводили с помощью колонки Acquity ВЕН С18 (150*2,1 мм; 1,7 мкм) и программы градиента трех подвижных фаз: буфера ацетата аммония, 50 мМ (подвижная фаза А), изопропанола (подвижная фаза В) и раствора метанола:ацетонитрила (70:30 об/об) (подвижная фаза С), подаваемых с постоянной скоростью потока 0,2 мл/мин. Температуру колонки поддерживали постоянной при 40°С. Примечательно, что наибольший пик, ожидаемый для статистически благоприятного образования атропоизомера α3β, расщеплен на два. Это связывают с различием положения восстановленной группы пиррола макроцикла между двумя фенильными группами с объемными заместителями на одной и той же стороне плоскости макроцикла, и положением восстановленной группы пиррола между двумя фенильными группами с объемными заместителями на разных сторонах этой плоскости. Этот пример иллюстрирует, что возможно разделять атропоизомеры производных тетрафенилхлорина при 40°С благодаря неожиданной комбинации стабильности тетрафенилхлоринов и медленному вращению связей макроцикл-фенил при этой температуре.
ЯМР и МС образца тетрафенилхлорина являются следующими:
ЯМР 1Н (400 МГц, CDCl3), δ, млн-1: 8,57 (m, 2Н, β-Н); 8,33-8,21 (m, 8Н, Ar-Н+β-Н); 7,41-7,36 (m, 4Н, Ar-Н); 4,81-4,79 (m, 4Н, NH); 4,22-4,19 (m, 4Н, β-Н); 2,82-2,76 (m, 12Н, СН3); -1,49 (s, 2Н, NH). Спектр ЯМР представлен на Фиг. 3.
МС (ПИА-ЭСИ-TOF): m/z рассч. для (C48H37F8N8O8S4) [М+Н]+: 1133,1484, найдено [М+Н]+: 1133,1466
ПРИМЕР 2. СИНТЕЗ, ХАРАКТЕРИСТИКА И РАЗДЕЛЕНИЕ АТРОПОИЗОМЕРОВ, ПРИСУТСТВУЮЩИХ ВО ФТОРИРОВАННОМ СУЛЬФОНАМИД ТЕТРАФЕНИЛБАКТЕРИОХЛОРИНЕ
Химический синтез смеси атропоизомеров, соответствующих формуле (III),

где X1 и X2 представляют собой атомы фтора, и R' представляет собой группу -SO2NHCH3, их разделение на каждый из атропоизомеров и их характеристику проводили следующим образом:
Синтез 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорина (LUZ11) проводили прямым взаимодействием пара-толуолсульфонилгидразида (7±0,1 г) с 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)порфирином (1±0,05 г), при давлении ниже 0,6 мбар, с нагревом до 140°С±1°С в течение 60 минут. После охлаждения до комнатной температуры неочищенный продукт реакции растворяли и очищали колоночной хроматографией на силикагеле (дихлорметан/этилацетат). 5,10,15,20-тетракис(2,6-дифтор-3-N-метилсульфамоилфенил)бактериохлорин, содержащий смесь четырех атропоизомеров, получали с выходом 85±5% (850±50 мг) с чистотой по ВЭЖХ более 95%. На Фиг. 4 представлена ВЭЖХ хроматограмма образца LUZ11. Подходящее количество образца растворяли в аналитическом растворителе (раствор N,N-диметилформамида с Твин 20 при 2% масс/об). Фракцию полученного раствора объемом 20 мкл затем анализировали с помощью ВЭЖХ с детектором УФ- и видимого диапазонов. Разделение атропоизомеров проводили с помощью колонки Inertsil Phenyl (250*4,6 мм; 5 мкм) и программы градиента концентраций трех подвижных фаз: метанола (подвижная фаза А), раствора триэтаноламина, рН 7,0 (подвижная фаза В) и смеси раствора триэтаноламина с рН 7,0 с метанолом (25:75, об/об) (подвижная фаза С), подаваемых с постоянной скоростью потока 0,5 мл/мин. Температуру колонки поддерживали постоянной при 60°С. Этот пример иллюстрирует, что возможно разделять атропоизомеры производных тетрафенилбактериохлорина при 60°С благодаря очень неожиданной комбинации стабильности тетрафенилбактериохлоринов и медленному вращению связей макроцикл-фенил при этой температуре.
ЯМР и МС выделенного образца LUZ11 являются следующими:
ЯМР 1Н: (400 МГц, CDCl3) δ млн-1: 8,24 (m, 4Н, β-Н); 8,01-7,99 (m, 4Н, Ar-Н); 7,39-7,31 (m, 4Н, Ar-Н); 4,76-4,67 (m, 4Н, NH); 4,05 (s, 8H, β-Н); 2,81-2,70 (m, 12Н, СН3); -1,39 (s, 2Н, NH). Спектр ЯМР представлен на Фиг. 5.
МС (ПИА-ЭСИ-TOF): m/z рассч. для C48H39F8N8O8S4 [М+Н]+: 1135,1640, найдено [М+Н]+: 1135,1612.
Элементный анализ (C48H38F8N8O8S4.H2O): рассч. С 50,00, Н 3,50, N 9,72, S 11,12, найдено С 49,88, Н 3,47, N 9,38, S 10,94.
Выделение четырех атропоизомеров, присутствующих в образце LUZ11, синтезированном как описано выше, было достигнуто растворением 300 мг образца LUZ11 в 12 мл диметилформамида (DMF) и 2,5 мл воды. После обработки ультразвуком в течение 5 минут для полной солюбилизации образца LUZ11 атропоизомеры разделяли с помощью ВЭЖХ, используя препаративную колонку и следующие общие условия: колонка - Inertsil-Phenyl (250*10 мм, 5 мкм), поток - 3 мл/мин, детекция - 743 нм, печь -23°С, объем пробы - 100 мкл, время анализа - 70 мин, подвижная фаза А - ацетонитрил (ACN) градиентной чистоты, подвижная фаза В - вода. Градиенты, использованные при отделении каждого из атропоизомеров, представлены в Таблице 2:

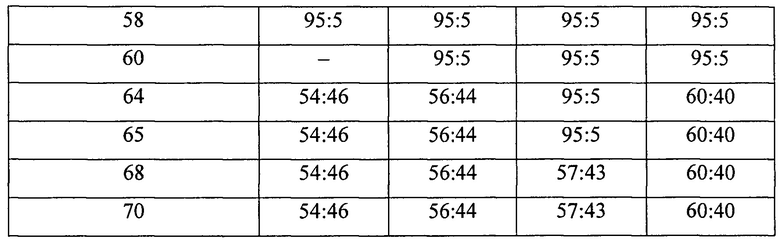
На Фиг. 6 представлены ВЭЖХ хроматограммы разделенных образцов LUZ11-A, LUZ11-В, LUZ11-С и LUZ11-D, полученных способом, описанным выше. Четыре образца были охарактеризованы с помощью ЯМР-спектроскопии, масс-спектрометрии и элементного анализа. Результаты представлены ниже:
LUZ11 - А (в основном αβαβ):
ЯМР 1Н (400 МГц, CDCl3): δ, млн-1: 8,31-8,26 (m, 4Н, Ar-Н); 8,04 (s, 4Н, β-Н); 7,45-7,41 (m, 4Н, Ar-Н); 4,65-4,63 (m, 4Н, NH); 4,08 (s, 8Н, β-Н); 2,85-2,83 (m, 12Н, СН3); -1,36 (s, 2Н, NH). Спектр ЯМР представлен на Фиг. 7.
МС (ПИА-ЭСИ-TOF): m/z рассч. для (C48H39F8N8O8S4) [М+Н]+: 1135,1640, найдено [М+Н]+: 1135,1665.
Элементный анализ (C48H38F8N8O8S4): рассч. С 50,79, Н 3,37, N 9,87, найдено С 50,27, Н 3,89, N9,30.
LUZ11-В (в основном α2β2):
ЯМР 1Н (400 МГц, CDCl3): δ, млн-1: 8,27-8,24 (m, 4Н, Ar-Н); 8,03-8,00 (m, 4Н, β-Н); 7,43-7,36 (m, 4Н, Ar-Н); 4,71-4,65 (m, 4Н, NH); 4,06 (s, 8H, β-Н); 2,84-2,77 (m, 12Н, СН3); -1,38 (s, 2Н, NH). Спектр ЯМР представлен на Фиг. 8.
МС (ПИА-ЭСИ-TOF): m/z рассч. для (C48H39F8N8O8S4) [М+Н]+: 1135,1640, найдено [М+Н]+: 1135,1586.
Элементный анализ (C48H38F8N8O8S4): рассч. С 50,79, Н 3,37, N 9,87, найдено С 50,98, Н 3,67, N 9,47.
LUZ11-С (в основном α3β):
ЯМР 1Н (400 МГц, CDCl3): δ, млн-1: 8,27-8,24 (m, 4Н, Ar-Н); 8,03-8,00 (m, 4Н, β-Н); 7,43-7,36 (m, 4Н, Ar-Н); 4,71-4,65 (m, 4Н, NH); 4,06 (s, 8H, β-Н); 2,84-2,77 (m, 12Н, СН3); -1,38 (s, 2Н, NH). Спектр ЯМР представлен на Фиг. 9.
МС (ПИА-ЭСИ-TOF): m/z рассч. для (C48H39F8N8O8S4) [М+Н]+: 1135,1640, найдено [М+Н]+: 1135,1657.
Элементный анализ (C48H38F8N8O8S4.H2O): рассч. С 50,79, Н 3,37, N 9,87, найдено С 50,00, Н 3,50, N 9,72.
LUZ11-D (в основном α4):
ЯМР 1H (400 МГц, CDCl3): δ, млн-1: 8,29-8,26 (m, 4Н, Ar-Н); 8,04-8,02 (m, 4Н, β-Н); 7,46-7,41 (m, 4Н, Ar-Н); 4,65-4,64 (m, 4Н, NH); 4,07 (s, 8H, β-Н); 2,85-2,82 (m, 12Н, СН3); -1,37 (s, 2Н, NH). Спектр ЯМР представлен на Фиг. 10.
МС (ПИА-ЭСИ-TOF): m/z рассч. для (C48H39F8N8O8S4) [М+Н]+: 1135,1640, найдено [М+Н]+: 1135,1632.
Элементный анализ (C48H38F8N8O8S4.H2O): рассч. С 50,79, Н 3,37, N 9,87, найдено С 50,38, Н 3,66, N9,13.
Был получен кристалл атропоизомера LUZ11-D для рентгеноструктурного анализа с целью подтвердить выделение. Структура, полученная для LUZ11-D с помощью рентгеноструктурного анализа, представлена на Фиг. 11 и подтверждает, что он представляет собой атропоизомер α4. Фотофизические свойства образцов LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D определяли, используя инструменты и способы, описанные выше. На Фиг. 12 представлены спектры поглощения четырех образцов. В Таблице 1 собраны соответствующие данные. На Фиг. 12 также представлены графики Бугера-Ламберта-Бера, построенные для того, чтобы определить молярные коэффициенты поглощения для каждого образца, исходя из того, что вся масса, взвешенная для расчета концентраций, представляла собой массу атропоизомеров LUZ11.
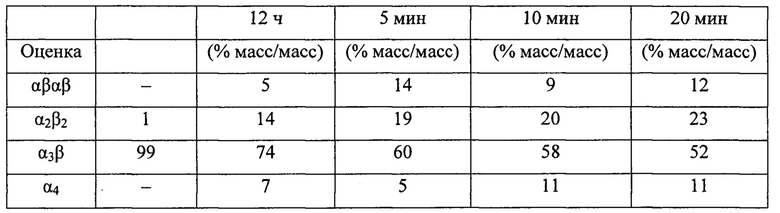
Этот пример демонстрирует, что атропоизомеры α4 и α3β являются достаточно стабильными для получения с высокой чистотой с помощью химических процессов очистки при температурах выше 20°С и в присутствии света и кислорода. Стабильность этих атропоизомеров была исследована при нагреве образца LUZ11-C в диметилформамиде при высоких температурах и в течение различных периодов времени, как показано в Таблице 3. Интерконверсия атропоизомеров происходит с высокой скоростью при высоких температурах в отсутствие ощутимого разложения фторированного сульфонамида бактериохлорина.

ПРИМЕР 3. ОБОГАЩЕНИЕ СМЕСИ АТРОПОИЗОМЕРОВ С ПОМОЩЬЮ СЕЛЕКТИВНОГО ОСАЖДЕНИЯ
Этот пример демонстрирует, что смесь атропоизомеров, полученная в результате синтеза галогенированных тетрафенилбактериохлоринов, может быть разделена на фракции с помощью простых и масштабируемых способов, и что одна из фракций селективно обогащена атропоизомерами α3β и α4.
Полграмма LUZ11 растворяли в 50 мл дихлорметана в круглодонной колбе. Добавляли 50 мл гексана и соединяли колбу с вакуумным насосом на 1 минуту при осторожном перемешивании. Часть LUZ11, присутствующего в растворе, осаждалась в колбу. Образец фильтровали с получением образца X. Этот растворитель, содержащий дихлорметан и гексан, испаряли до сухости с получением образца Y. Оба образца анализировали с помощью ВЭЖХ для оценки относительного количества атропоизомера в каждом образце. На Фиг. 13 представлены ВЭЖХ хроматограммы с детекцией при 743 нм, описанные в разделе Способы, демонстрирующие, что пики атропоизомеров αβαβ и α2β2 увеличиваются в образце X относительно исходного образца LUZ11, и что пик атропоизомера α4 увеличивается в образце Y относительно исходного образца LUZ11. В Таблице 4 представлены относительные количества четырех атропоизомеров, присутствовавших в исходном образце LUZ11 и во фракциях X и Y. Атропоизомер α2β2 имеет два пика, идентифицированные как В1 и В2, поскольку в бактериохлоринах группы R', расположенные на одной и той же стороне плоскости, могут быть разделены метановой (=С-) группой или метиленовым (-СН2-) мостиком. Примечательно, что в то время как исходный образец LUZ11 содержит 65,9% атропоизомеров α3β плюс α4, образец Y содержит 80,4% атропоизомеров α3β плюс α4.
Таким образом, образец Y представляет собой композицию, в которой атропоизомеры, большая часть групп R' которых расположена на одной и той же стороне плоскости, определенной макроциклом, составляют более 70% всего количества атропоизомеров, присутствующих в композиции.

Относительно количество атропоизомеров α3β плюс α4 в образце может составлять любое значение, вплоть до 100%, всего количества атропоизомеров, присутствующих в композиции.
ПРИМЕР 4. РАЗЛИЧНАЯ СТАБИЛЬНОСТЬ АТРОПОИЗОМЕРОВ ГАЛОГЕНИРОВАННЫХ И СУЛЬФОНИРОВАННЫХ БАКТЕРИОХЛОРИНОВ ПРИ ПОГЛОЩЕНИИ ИНФРАКРАСНОГО ИЗЛУЧЕНИЯ
Этот пример демонстрирует, что атропоизомеры галогенированных и сульфонированных бактериохлоринов обладают различным квантовыми выходами фоторазложения при облучении одним и тем же инфракрасным излучением, используемым в ФДТ, что может привести к различным эффективностям ФДТ.
Образцы LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D, полученные в Примере 2, по отдельности растворяли в растворах PBS:метанол (2:3), переносили в кварцевые кюветы с длиной оптического пути 1 см и регистрировали их спектры поглощения. Каждую кварцевую кювету последовательно помещали в луч диодного лазера Omicron при 749 нм, предварительно расфокусированный для того, чтобы диаметр луча совпадал с окошком кварцевой кюветы. Измеренная мощность лазера в этих условиях составляла 640 мВт. Облучение приостанавливали через регулярные промежутки времени и регистрировали новый спектр поглощения. Кинетика фотообесцвечивания во временном интервале эксперимента соответствовала реакции первого порядка. На Фиг. 14 продемонстрировано уменьшение поглощений на пике наибольшей длины волны поглощения образцов в виде функции от времени облучения. Период полураспада образцов LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D в этих условиях составил 4,6, 4,8, 6,4 и 6,5 минут, соответственно. Квантовые выходы фоторазложения рассчитывали как исходную степень исчезновения молекулы фотосенсибилизатора, разделенную на исходную степень поглощения фотонов. Результаты расчетов представлены в Таблице 1. Наиболее стабильным является атропоизомер α4, за которым следует α3β.
ПРИМЕР 5. ФОТОТОКСИЧНОСТЬ АТРОПОИЗОМЕРОВ LUZ11 IN VITRO
Этот пример демонстрирует, что образцы LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D, обогащенные каждым из выделенных атропоизомеров, и исходный образец LUZ11, имеют различные эффективности в ФДТ в отношении линий раковых клеток.
Была измерена фотосенсибилизирующая активность исходного образца LUZ11 и образцов LUZ11-А, LUZ11-В, LUZ11-С и LUZ11-D, полученных в Примере 2, с помощью ранее описанных материалов и способов. ВЭЖХ хроматограммы с детекцией при 380 нм указывают на то, что содержание образцов LUZ11, обогащенных разделенными образцами атропоизомеров, составляет более 80%. Небольшие различия в чистоте не оказывают влияния на результаты исследования фототоксичности.
Выжившие фракции для доз света 1 Дж/см2 и времени инкубации 24 часа относительно контроля, выдерживавшегося в темноте, показаны на Фиг. 15 (НТ-29) и Фиг. 16 (СТ26). Концентрации, вызвавшие 50%-ную или 90%-ную гибель клеток при дозе света 1 Дж/см2, представлены в Таблице 5 и были рассчитаны интерполяцией с использованием нелинейного регрессионного анализа с помощью программного обеспечения GraphPad Prism 5 (log[ингибитор] как функция нормализованного ответа - переменный наклон), за исключением значений, помеченных звездочкой, которые были получены экстраполяцией.

* Экстраполированы из нелинейной кривой регрессии
Фототоксичности, проиллюстрированные на Фиг. 15 и 16 и в Таблице 5, ясно демонстрируют, что атропоизомеры LUZ11 обладают различной эффективностью в ФДТ in vitro. Фототоксичность образцов повышается с А по D. Исходный образец LUZ11, содержащий статистическую смесь атропоизомеров, полученную в результате синтеза, менее фототоксичен in vitro, чем образцы, обогащенные атропоизомерами α3β и α4. Важнейшим открытием данного изобретения является то, что атропоизомеры, в которых большая часть мета-заместителей фенильных групп расположена на одной и той же стороне плоскости, определенной макроциклом, являются более фототоксичными, чем атропоизомеры с равным количеством таких заместителей на обеих сторонах этой плоскости. Это открытие не могло быть предсказано специалистом в данной области техники.
ПРИМЕР 6. ФДТ КАРЦИНОМЫ ТОЛСТОЙ КИШКИ МЫШИ У МЫШЕЙ BALB/C С АТРОПОИЗОМЕРАМИ LUZ11-А, LUZ11-В, LUZ11-С И LUZ11-D
Этот пример демонстрирует, что каждый из атропоизомеров LUZ11 обеспечивает индивидуальный профиль долгосрочной эффективности в лечении модели опухоли мыши посредством ФДТ.
Моделью опухоли являлись мыши BALB/c с подкожной опухолью СТ26. Клетки СТ26 культивировали в среде ДМЕМ с добавками фетальной бычьей сыворотки и антибиотиков. Клетки выращивали при 37°С в увлажненной атмосфере с 5% СО2. Клетки СТ26 (~350000) в 0,1 мл PBS подкожно имплантировали в правое бедро мышей BALB/C. Опухоли росли до достижения 5 мм в диаметре в течение приблизительно от 8 до 10 дней после имплантации. Лечение начинали, когда опухоль достигала 5 мм в диаметре у каждого животного. На сутки, когда опухоли достигали необходимого для лечения размера, мышам инъецировали дозу 0,7 мг/кг фотосенсибилизатора в носителе, содержащем Кремофор EL (макроголглицерол рицинолеат), этанол и 0,9%-ный солевой раствор NaCl в пропорциях 0,1:0,5:99,4 для LUZ11 и LUZ11-A, и 0,5:0,5:99,0 для LUZ11-В, LUZ11-C и LUZ11-D, и подвергали лечению, как описано в разделе Способы. Доза света, использованная в лечении, составляла 41 Дж/см2 (т.е., 50 Дж на 1,33 см2 поверхности). Дозы каждого соединения были нормализованы с учетом содержания LUZ11 в каждом образце. Контрольная группа (n равно 6) получала только носитель, не содержащий фотосенсибилизатора, и подвергалась облучению в тех же условиях, что и остальные экспериментальные группы.
Мышей ежедневно осматривали, опухоли измеряли с помощью двух перпендикулярных измерений L и W (перпендикулярно к L), и записывали объемы, рассчитанные по формуле V=L×W2/2. Когда наибольший диаметр любой из опухолей достигал 15 мм (основание для усыпления из гуманных соображений), мышь, несущую такую опухоль, умерщвляли, и записывали число суток, прошедших с начала лечения. На Фиг.17 представлен график Каплана-Мейера для образцов LUZ11, LUZ11-A, LUZ11-B, LUZ11-C и LUZ11-D согласно Примеру 2. Значительно большая фототоксичность атропоизомера α4 проявилась в смерти, вызванной ФДТ, в группе образца LUZ11-D, 2 мышей на сутки после лечения. Превышение дозы атропоизомера α4 в комбинации дозы лекарственного средства - света для других смесей атропоизомеров не привело к смертям, вызванным ФДТ. Это наблюдение согласуется с фототоксичностью in vitro и демонстрирует, что атропоизомер α4 обладает наибольшей эффективностью в ФДТ.
ПРИМЕР 7. ФДТ КАРЦИНОМЫ ТОЛСТОЙ КИШКИ МЫШИ У МЫШЕЙ BALB/C С ПОМОЩЬЮ ОБОГАЩЕННЫХ КОМПОЗИЦИЙ АТРОПОИЗОМЕРОВ
Этот пример демонстрирует, что фармацевтическая композиция, обогащенная более фотоактивными атропоизомерами, является предпочтительной для ФДТ, поскольку она обеспечивает лучший профиль долгосрочной эффективности при лечении модели опухоли мыши посредством ФДТ.
Мышь и модель опухоли являются такими же, как в Примере 6. ФДТ также проводили по тому же протоколу: внутривенная инъекция номинальной дозы фотосенсибилизатора 0,7 мг/кг, и облучение 15 минут спустя круга площадью 1,33 см2 с 55 Дж. Эта номинальная концентрация, по весу образца, соответствует концентрации 0,52 мг/кг фактического количества стереоизомеров бактериохлорина, присутствовавших в образцах LUZ11, LUZ11-Х, относительно образца X, и LUZ11-Y, относительно образца Y. Носитель, использованный для внутривенного введения, был таким же, как и в Примере 6, но были использованы образцы X и Y согласно Примеру 3, параллельно с образцом LUZ11, охарактеризованным в Таблице 4. На Фиг. 18 представлен график Каплана-Мейера для образца LUZ11 и образцов X и Y.
Фиг. 18 демонстрирует, что с исходной фракцией LUZ11 невозможно получить долгосрочное излечение с данным протоколом лечения. Отсутствие долгосрочного излечения также наблюдалось для группы, проходившей лечение с образцом X. Более того, среднее время выживания при лечении с образцом X было на 2 суток короче (18 суток против 20), чем среднее время выживания для образца LUZ11. С другой стороны, группа, проходившая лечение с образцом Y, имела более длительное время выживания и уровень излечения 50%.
Примечательная способность фармацевтических композиций со смесями атропоизомеров, обогащенных атропоизомерами α3β и α4, улучшать уровни излечения в ФДТ, является неожиданной и впервые раскрыта в настоящем изобретении.
ПРИМЕР 8. ВЫДЕЛЕНИЕ АТРОПОИЗОМЕРА LUZ11-C (α3β) РЕВЕРСИВНОЙ ФАЗОВОЙ КЛАССИЧЕСКОЙ КОЛОНОЧНОЙ ХРОМАТОГРАФИЕЙ И ПОЛУПРЕПАРАТИВНОЙ ВЭЖХ
Очистку LUZ11-C проводили в две стадии: i) обогащение образца α3β из смеси четырех атропоизомеров (αβαβ, α2β2, α3β, α4 и примеси, появившиеся в процессе синтеза) с помощью реверсивно-фазовой гравитационной хроматографии на силикагеле (С-18) в качестве неподвижной фазы со смесью MeOH/CN3CN/H2O (40:40:20, об/об) в качестве подвижной фазы; ii) очистка ранее полученной смеси, обогащенной α3β, полупрепаративной ВЭЖХ.
i) Обогащение LUZ1-C (α3β) реверсивно-фазовой хроматографией
LUZ11 (1 г; чистота 75%) растворяли в ацетонитриле (10 мл) и метаноле (10 мл), и смесь подвергали обработке ультразвуком в течение 5 мин. После полной солюбилизации медленно добавляли 5 мл воды. Стеклянную хроматографическую колонку (диаметр - 3,5 см * высота - 65 см) подготавливали, используя суспензию элюента (МеОН/CN3CN/Н2О (40:40:20, об/об)) и диоксид кремния С-18 для реверсивно-фазовой хроматографии (~150 г). Полученный образец LUZ11 осторожно переносили в колонку. Смесь подвижной фазы медленно элюировали через колонку и собирали фракции, содержащие атропоизомер α3β. В ходе всего процесса хроматографии стеклянная хроматографическая колонка, а также собранные фракции, были защищены от света. Органический растворитель удаляли в ротационном испарителе (Т менее 35°С). Смесь переносили в экстракционную воронку и выделяли LUZ11-C жидкостной экстракцией с помощью дихлорметана. Органическую фазу сушили и удаляли растворитель в ротационном испарителе (Т менее 35°С). Колбу с продуктом соединяли с вакуумным насосом на по меньшей мере 72 ч при 18-23°С и защите от света. Получали приблизительно 300 мг LUZ11-С.
ii) Выделение LUZ11-C (α3β) полупрепаративной ВЭЖХ
Образец (300 мг) обогащенной α3β фракции LUZ11-С, предварительно полученной реверсивно-фазовой хроматографией на силикагеле С-18, растворяли в 12 мл DMF и 2,5 мл воды и подвергали обработке ультразвуком в течение 5 минут или до полной солюбилизации. Условия проведения ВЭЖХ для выделения LUZ11-С описаны ниже:
Колонка: Inertsil-Phenyl (250*10 мм; 5 мкм)
Поток: 3 мл/мин
Детекция: видимый диапазон, 743 нм
Печь: 23°С
Объем пробы: 100 мкл
Время анализа: 70 мин
Подвижная фаза: Подвижная фаза А: Ацетонитрил градиентной чистоты
Подвижная фаза В: Вода

Смесь переносили в экстракционную воронку и выделяли LUZ11-C жидкостной экстракцией с помощью дихлорметана. Органическую фазу сушили и удаляли растворитель в ротационном испарителе (Т менее 35°С). Колбу с продуктом соединяли с вакуумным насосом на по меньшей мере 72 ч при 18-23°С с защитой от света. С помощью этого способа был получен LUZ11-C с чистотой от 94 до 96%. Примесный состав этой обогащенной α3β фракции LUZ11-C показал, что атропоизомеры αβαβ, α2β2 и α4 присутствовали в количестве менее 2%.
ЦИТИРУЕМЫЕ ДОКУМЕНТЫ
1. М.М. Pereira, L.G. Arnaut, S.J. Formosinho, С.J.P. Monteiro, PCT/EP/012212, Ed. (University of Coimbra, Portugal, 2005), chap.PCT/EP/012212.
2. L.G. Arnaut, M.M. Pereira, S.J. Formosinho, S.  , G. Stochel, K. Urbanska, PCT/PT2009/000057, Ed. (University of Coimbra, Portugal, 2009), chap. PCT/PT2009/000057.
, G. Stochel, K. Urbanska, PCT/PT2009/000057, Ed. (University of Coimbra, Portugal, 2009), chap. PCT/PT2009/000057.
3. J.M. Dabrowski, M. Krzykawska, L.G. Arnaut, M.M. Pereira, C.J.P. Monteiro, S. Simoes, K. Urbanska, G. Stochel, Tissue uptake and photodynamic therapy of mice bearing melanoma with a non-toxic, effective chlorin. ChemMedChem 6, 1715-1726 (2011).
4. L.G. Arnaut, M.M. Pereira, J.M. Dabrowski, E.F.F. Silva, F.A. Schaberle, A.R. Abreu, L.B. Rocha, M.M. Barsan, K. Urbanska, G. Stochel, С.M. A. Brett, Photodynamic Therapy Efficacy Enhanced by Dynamics: The Role of Charge Transfer and Photostability in the Selection of Photo sensitizers. Chem. Eur. J. 20, 5346-5357 (2014).
5. L.G. Arnaut, Design of Porphyrin-Based Photosensitizers. Adv. Inorg. Chem. 63, 187-233 (2011).
6. S.R. LaPlante, P.J. Edwards, L.D. Fader, A. Jakalian, O. Hucke, Revealing atropisomer axial chirality in drug discovery. ChemMedChem 6, 505-513 (2011).
7. A.S.M.  , M. Pineiro, L.G. Arnaut, A. M. d. A. R. Gonsalves, Atropisomers of 5,10,15,20-tetrakis(2,6-dichloro-3-sulfamoyl-phenyl)porphyrins J. Porphyrins Phthalocyanines 11, 50-57 (2007).
, M. Pineiro, L.G. Arnaut, A. M. d. A. R. Gonsalves, Atropisomers of 5,10,15,20-tetrakis(2,6-dichloro-3-sulfamoyl-phenyl)porphyrins J. Porphyrins Phthalocyanines 11, 50-57 (2007).
8. A.C.  , A.M.S. Silva, I. Alkorta, J. Elguero, Atropisomerism and corformational aspectes of meso-tetraarylporphyrins and related compounds. J. Phorphyrins Phthalocyanines 15, 1-28 (2011).
, A.M.S. Silva, I. Alkorta, J. Elguero, Atropisomerism and corformational aspectes of meso-tetraarylporphyrins and related compounds. J. Phorphyrins Phthalocyanines 15, 1-28 (2011).
9. C.J.P. Monteiro, M.M. Pereira, N.  , C.G. Carvalho, A.R. Abreu, L.G. Arnaut, A.M.S. Silva, Separation and atropisomer isolation of ortho-halogenated tetraarylporphyrins by HPLC. Full characterization using ID and 2D NMR. J. Porphyrins Phthalocyanines 16, 316-323 (2012).
, C.G. Carvalho, A.R. Abreu, L.G. Arnaut, A.M.S. Silva, Separation and atropisomer isolation of ortho-halogenated tetraarylporphyrins by HPLC. Full characterization using ID and 2D NMR. J. Porphyrins Phthalocyanines 16, 316-323 (2012).
10. W.J. Hagan, D.C. Barber, D.G. Whitten, M. Kelly, F. Albrecht, S.L. Gibson, R. Hilf, Picket-fence porphyrins as potential phototherapeutic agents. Cancer Res. 48, 1148-1152(1988).
11. С.J.P. Monteiro, J. Pina, M. M. Pereira, L. G. Arnaut, On the singlet states of porphyrins, chlorins and bacteriochlorins and their ability to harvest red/infrared light. Photochem. Photobiol. Sci. 11, 1233-1238 (2012).
12. E.F.F. Silva, C. Serpa, J.M. Dabrowski, C.J.P. Monteiro, L.G. Arnaut, S.J. Formosinho, G. Stochel, K. Urbanska, S. Simoes, M. M. Pereira, Mechanisms of singlet oxygen and superoxide ion generation by porphyrins and bacteriochlorins. Chem. Eur. J. 16, 9273-9286 (2010).
13. J.M. Dabrowski, M.M. Pereira, L.G. Arnaut, C.J.P. Monteiro, A.F. Peixoto, A. Karocki, K. Urbanska, G. Stochel, Synthesis, photophysical studies and anticancer activity of a new halogenated water-soluble porphyrin. Photochem. Photobiol. 83, 897-903 (2007).
14. R. Schmidt, C. Tanielian, R. Dunsbach, C. Wolff, Phenalenone, a universal reference compounds for the determination of quantum yields of singlet oxygen. J. Photochem. Photobiol. A: Chem. 79, 11-17 (1994).
15. Sternberg ED, Dolphin D. Porphyrin-based photosensitizers for use in photodynamic therapy. Tetrahedron 1998;54:4151-202.
16. Silva EFF, Serpa C, Dabrowski JM, Monteiro CJP, Arnaut LG, Formosinho SJ, et al. Mechanisms of singlet oxygen and superoxide ion generation by porphyrins and bacteriochlorins. Chem Eur J. 2010; 16:9273-86.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИНОВ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2009 |
|
RU2513483C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПОРФИРИНОВ, В ЧАСТНОСТИ ХЛОРИНЫ И/ИЛИ БАКТЕРИОХЛОРИНЫ, И ИХ ПРИМЕНЕНИЕ В ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2399622C2 |
| НИЗКОМОЛЕКУЛЯРНЫЕ ПРОИЗВОДНЫЕ КАРБОКСАМИДНЫХ ГАЛОГЕНИРОВАННЫХ ПОРФИРИНОВ, А ИМЕННО ХЛОРИНОВ И БАКТЕРИОХЛОРИНОВ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2718923C2 |
| СОЕДИНЕНИЕ | 2002 |
|
RU2323940C2 |
| ПРОИЗВОДНЫЕ ФТОРИРОВАННОГО ПОРФИРИНА, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2019 |
|
RU2707754C1 |
| Борированные производные фторированных бактериохлоринов и их металлокомплексов, обладающие противоопухолевой активностью | 2015 |
|
RU2615770C1 |
| Фотосенсибилизатор и способ его получения | 2021 |
|
RU2772691C1 |
| Способ получения водорастворимого металлокомплекса хлорина е6 с медью | 2022 |
|
RU2810784C1 |
| ФОТОСЕНСИБИЛИЗИРУЮЩИЕ КОМПОЗИЦИИ | 2010 |
|
RU2574019C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2005 |
|
RU2323722C2 |


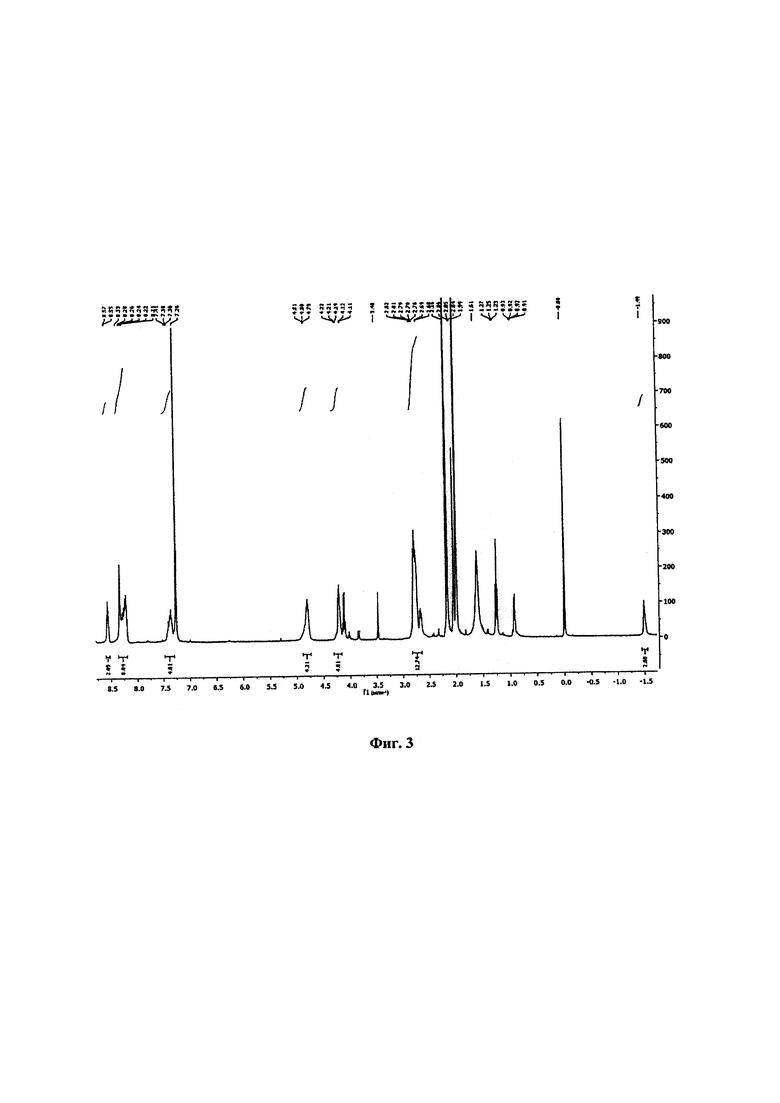


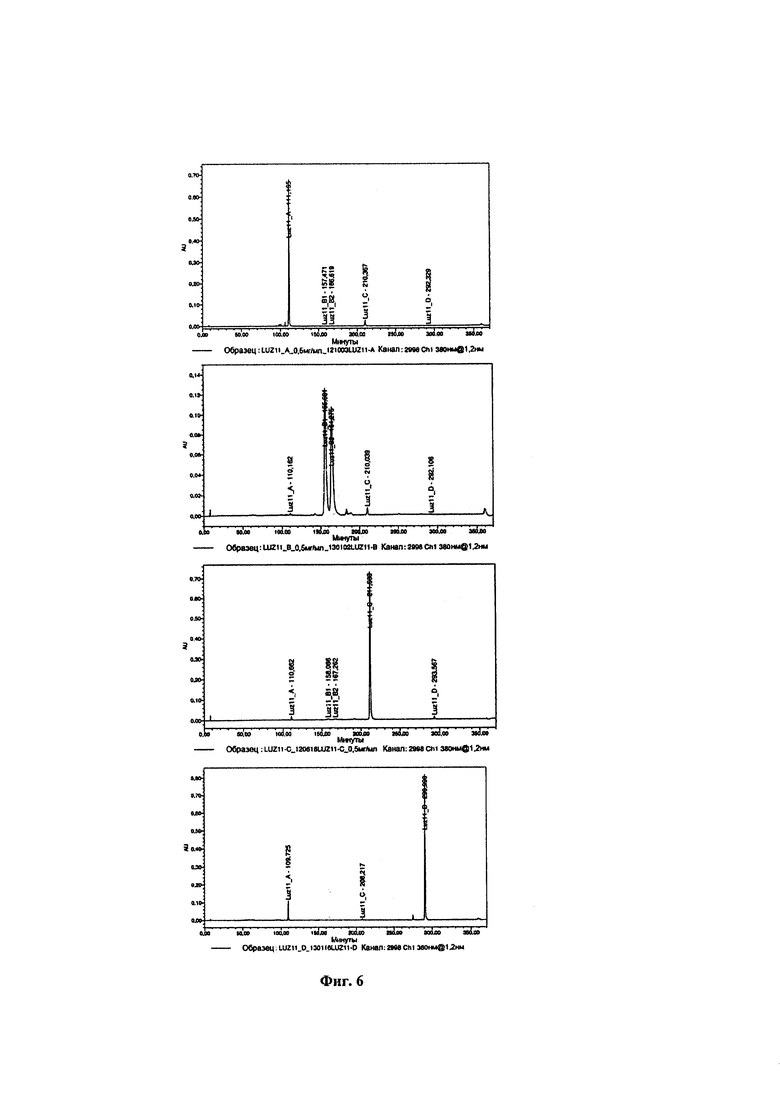
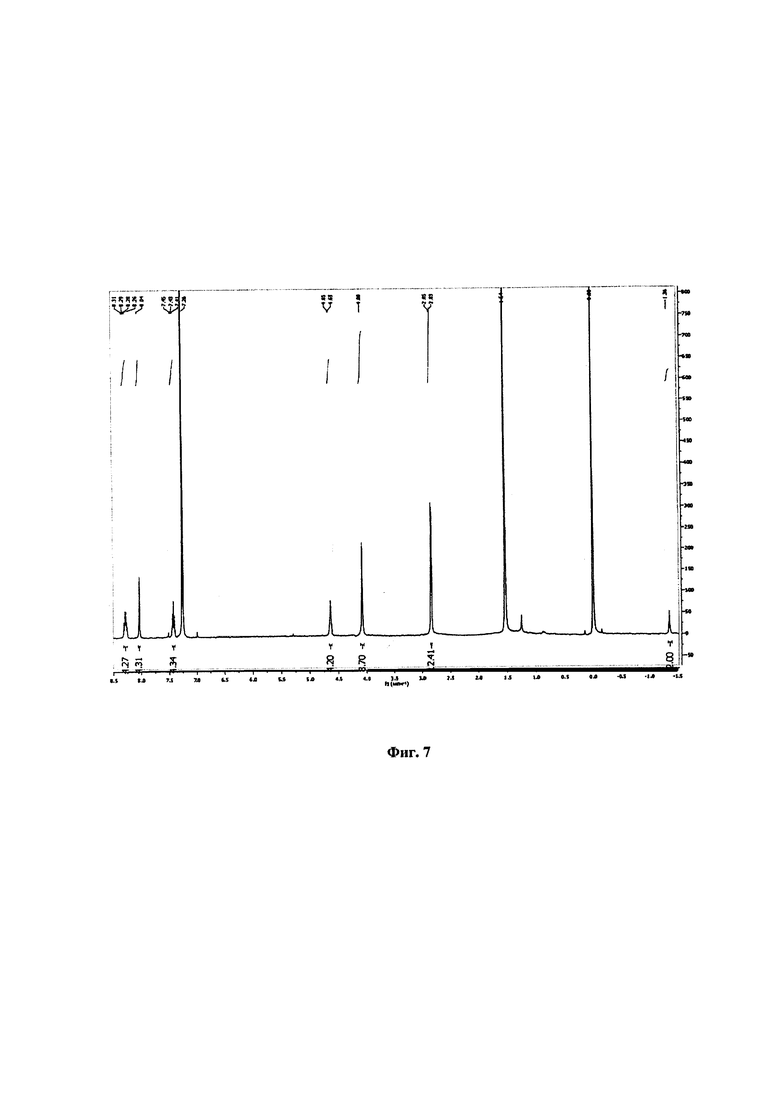
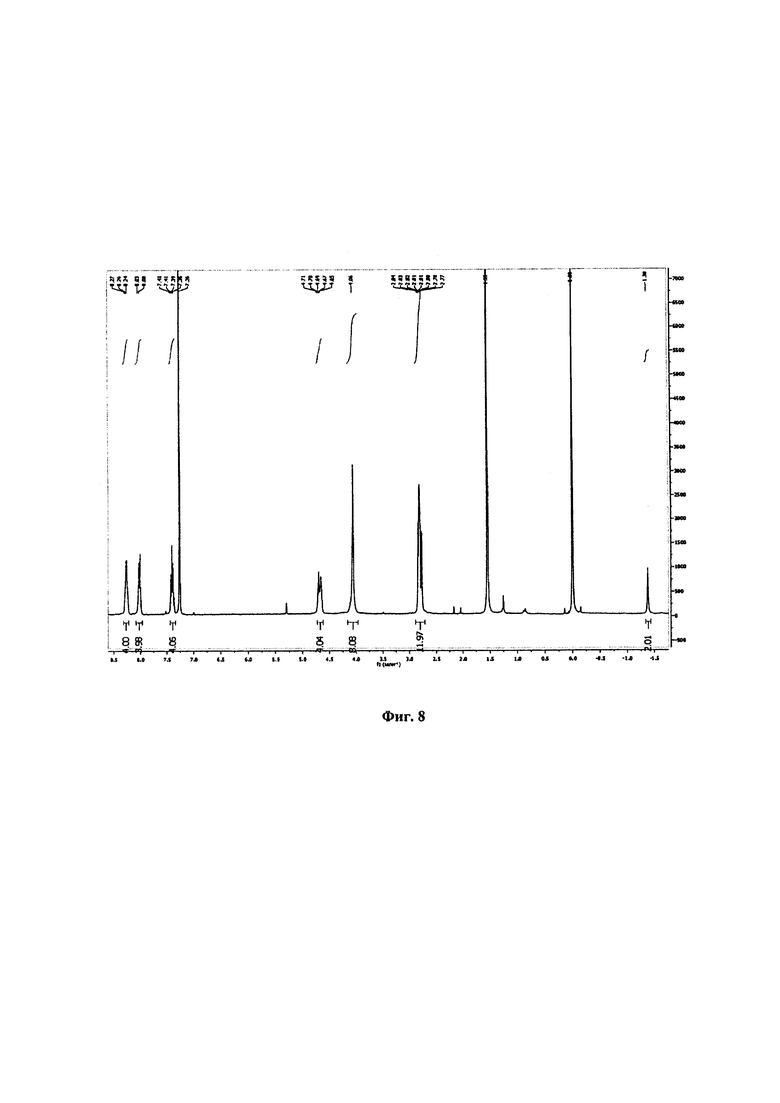



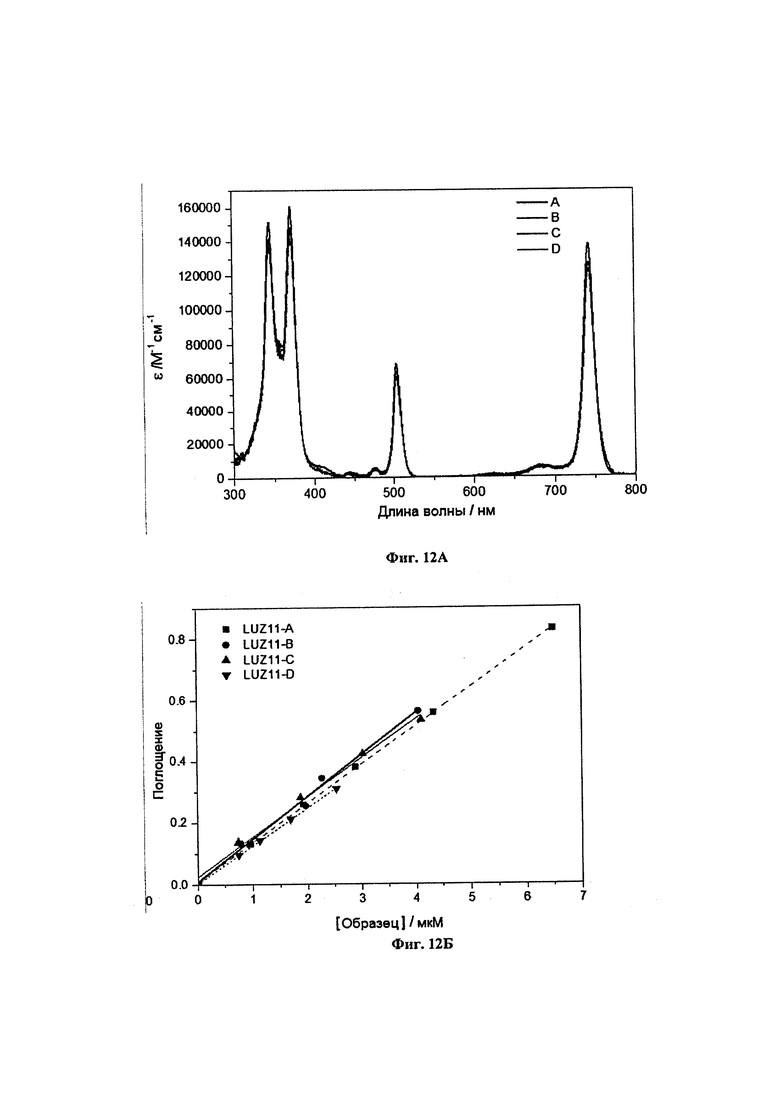
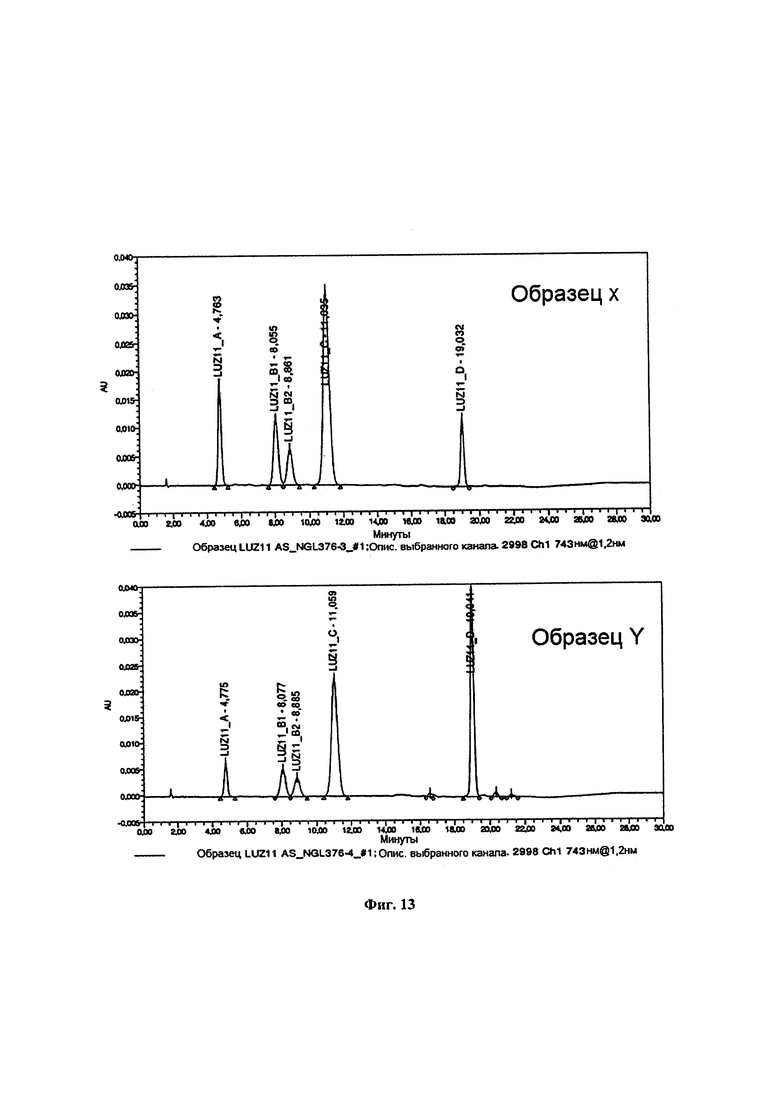
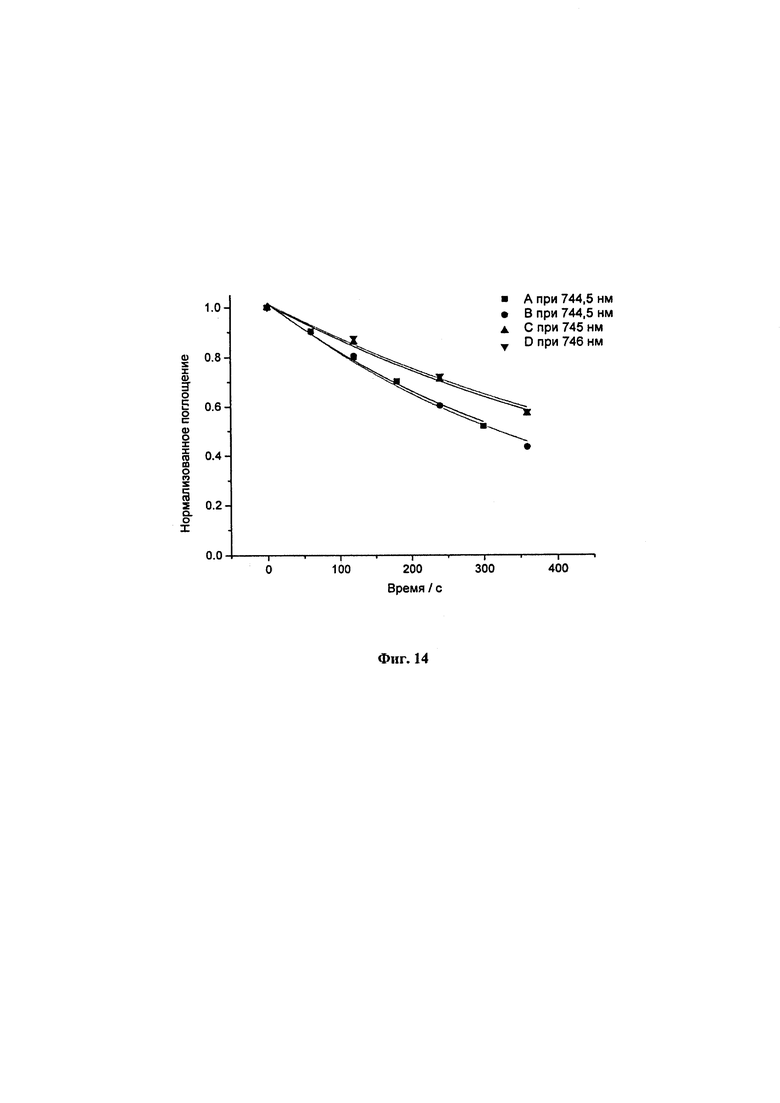

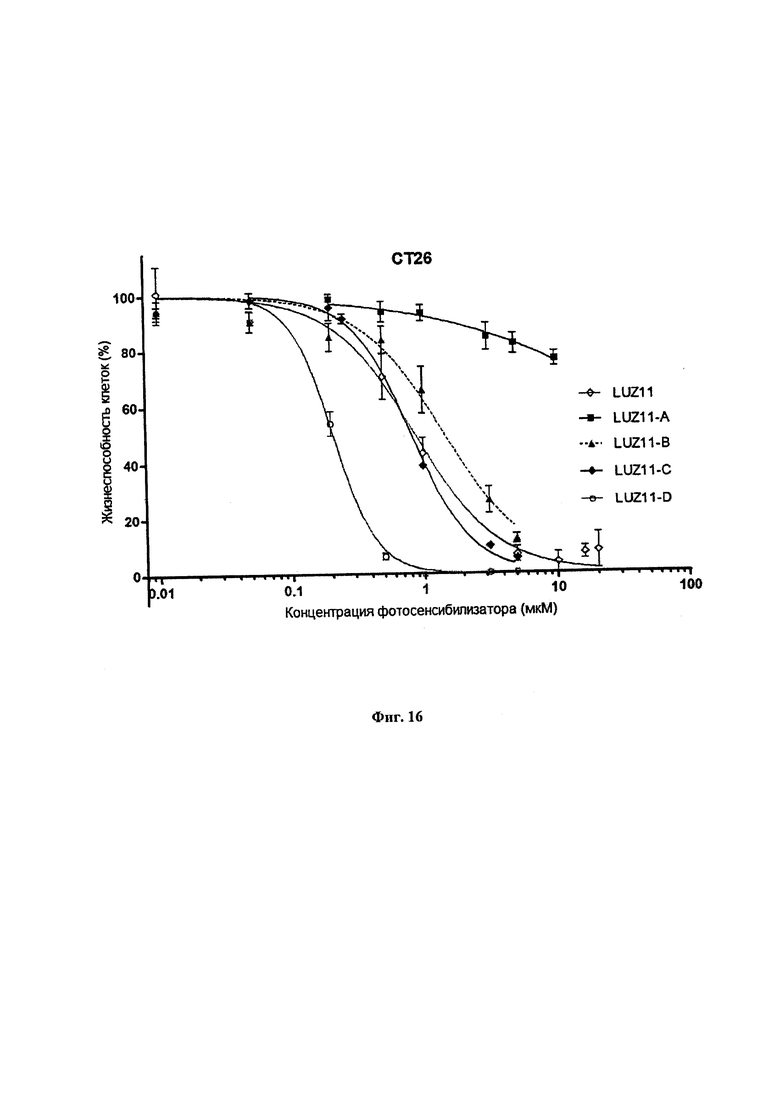

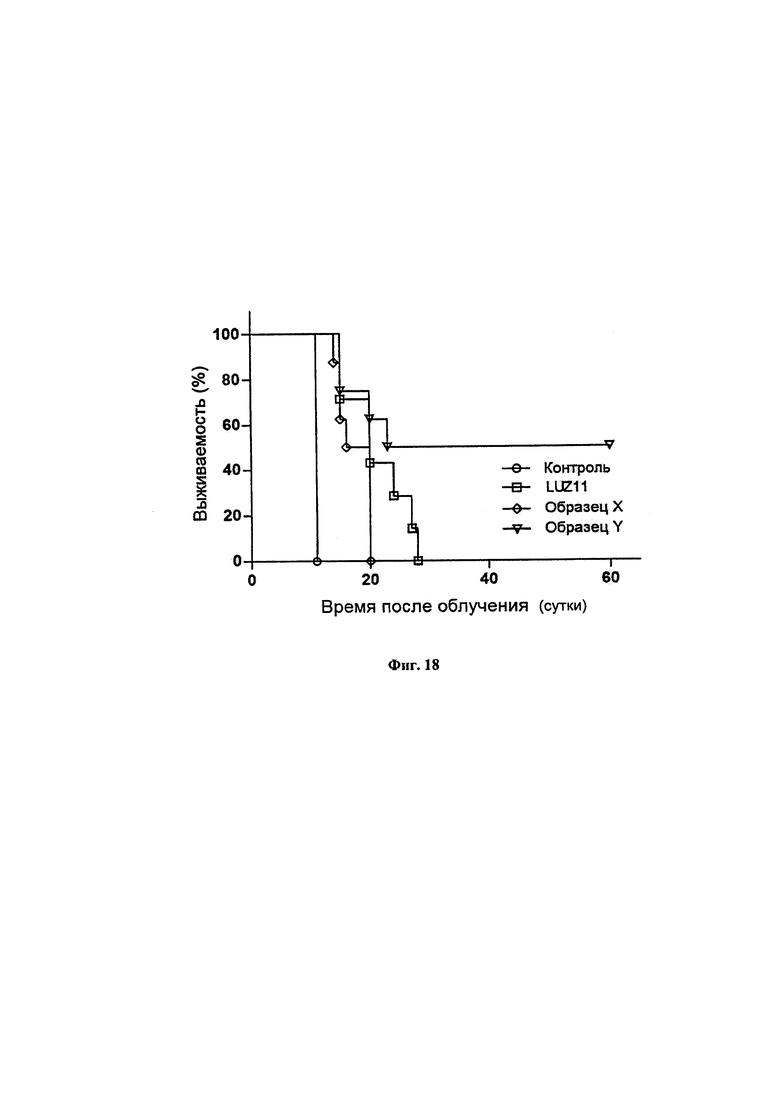
Изобретение относится к фармацевтической композиции, содержащей более 70% атропоизомеров формул I-C и I-D, способу ее получения и набору для фотодинамической терапии. В общей формуле I-C и I-D  представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь; жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом; X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br); X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода; R1, R2, R3 и R4 независимо представляют собой -ОН, -OR или -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, -аминокислоты, -OR, -NHR или -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода; R5, R6, R7 и R8 независимо представляют собой Н, -ОН, -OR, -Cl или -NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода. 3 н. и 10 з.п. ф-лы, 18 ил., 6 табл., 8 пр.
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь; жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом; X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br); X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода; R1, R2, R3 и R4 независимо представляют собой -ОН, -OR или -SO2R'', где каждый R'' независимо выбран из -Cl, -ОН, -аминокислоты, -OR, -NHR или -NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода; R5, R6, R7 и R8 независимо представляют собой Н, -ОН, -OR, -Cl или -NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода. 3 н. и 10 з.п. ф-лы, 18 ил., 6 табл., 8 пр.


1. Фармацевтическая композиция для фотодинамической терапии, содержащая атропоизомеры формул:

где:
 представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой –OH, –OR или –SO2R’’, где каждый R’’ независимо выбран из –Cl, –OH, –аминокислоты, –OR, –NHR или –NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8 независимо представляют собой H, –OH, –OR, –Cl или –NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода;
где относительное количество указанных атропоизомеров составляет более 70 % всех атропоизомеров в указанной фармацевтической композиции, которая дополнительно содержит фармацевтически приемлемый носитель.
2. Фармацевтическая композиция по п. 1, где относительное количество атропоизомера формулы:

где:
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2 независимо выбраны из атома галогена (F, Cl, Br);
X1 независимо выбраны из атомов галогена (F, Cl, Br) или водорода; и
R’ представляют собой –SO2R’’, где каждый R’’ независимо выбран из –Cl, –OH, –аминокислоты, –OR, –NHR или –NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, и R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
составляет более 20 % всех атропоизомеров в указанной фармацевтической композиции.
3. Фармацевтическая композиция по п. 1, где относительное количество атропоизомера формулы:

где:
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2 независимо выбраны из атома галогена (F, Cl, Br);
X1 независимо выбраны из атомов галогена (F, Cl, Br) или водорода; и
R’ представляют собой –SO2R’’, где каждый R’’ независимо выбран из –Cl, –OH, –аминокислоты, –OR, –NHR или –NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода
составляет более 60 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 70 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 80 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 90 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 95 % всех атропоизомеров в указанной фармацевтической композиции.
4. Способ получения фармацевтической композиции, описанной в любом из пп. 1-3, включающий стадию выделения смеси атропоизомеров хлорина или бактериохлорина формул:


где:
 представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой –OH, –OR или –SO2R’’, где каждый R’’ независимо выбран из –Cl, –OH, –аминокислоты, –OR, –NHR или –NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8 независимо представляют собой H, –OH, –OR, –Cl или –NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода;
где атропоизомеры I-C и I-D являются, по меньшей мере частично, отделенными селективным осаждением, хроматографией, экстракцией растворителем, термической или фотохимической вращательной изомеризацией или селективным фоторазложением.
5. Способ по п. 4, где селективное осаждение атропоизомеров хлорина или бактериохлорина производят сначала растворением смеси атропоизомеров в растворителе более высокой полярности и затем селективным осаждением атропоизомеров формул (I-A) и (I-B)
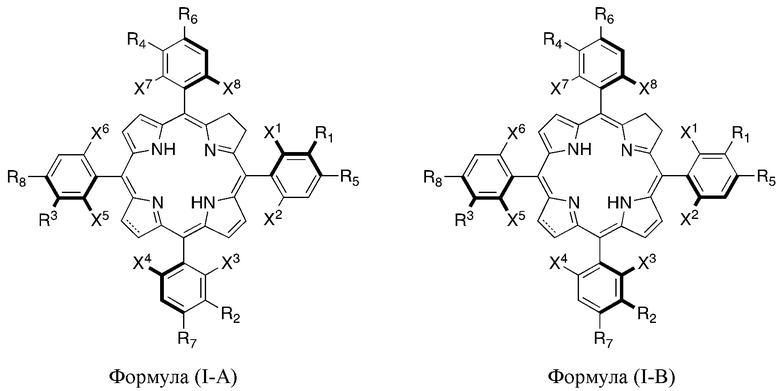
где:
 представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой –OH, –OR или –SO2R’’, где каждый R’’ независимо выбран из –Cl, –OH, –аминокислоты, –OR, –NHR или –NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8 независимо представляют собой H, –OH, –OR, –Cl или –NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода,
добавлением к раствору растворителя более низкой полярности, получая раствор, обогащенный атропоизомерами формул (I-C) и (I-D)

где:
 представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
представляет собой одинарную углерод-углеродную связь или двойную углерод-углеродную связь;
жирные линии указывают на то, что выделенные жирным атомы и присоединенные к ним группы стерически ограничены таким образом, что располагаются над плоскостью, определенной макроциклическим кольцом;
X2, X4, X6 и X8 представляют собой атом галогена (F, Cl, Br);
X1, X3, X5 и X7 представляют собой атомы галогена (F, Cl, Br) или водорода;
R1, R2, R3 и R4 независимо представляют собой –OH, –OR или –SO2R’’, где каждый R’’ независимо выбран из –Cl, –OH, –аминокислоты, –OR, –NHR или –NR2, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода, или R2 представляет собой циклоалкил, имеющий от 2 до 12 атомов углерода;
R5, R6, R7 и R8 независимо представляют собой H, –OH, –OR, –Cl или –NHR, где R представляют собой алкил, имеющий от 1 до 12 атомов углерода,
где сумма концентраций атропоизомеров формул (I-C) и (I-D) в растворе составляет по меньшей мере 70 % концентрации всех атропоизомеров, присутствующих в растворе, или, более предпочтительно, более 70 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 80 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 90 % всех атропоизомеров в указанной фармацевтической композиции, или, более предпочтительно, более 95 % всех атропоизомеров в указанной фармацевтической композиции.
6. Способ по п. 4, где экстракция растворителем включает первую стадию растворения атропоизомеров хлорина или бактериохлорина в полярном растворителе; и вторую стадию добавления менее полярного растворителя, вызывающего фазовое разделение жидкость-жидкость с полярным растворителем, обеспечивая тем самым экстракцию менее полярных атропоизомеров.
7. Способ по п. 4, где перекристаллизация включает образование кристаллов, содержащих атропоизомеры I-C и I-D, что комплементарно композиции атропоизомеров в маточном растворе.
8. Способ по п. 4, где термическая или фотохимическая вращательная изомеризация включает первую стадию избирательного связывания по меньшей мере одного атропоизомера из смеси атропоизомеров хлорина или бактериохлорина с подложкой, к которой указанный по меньшей мере один атропоизомер обладает высокой аффинностью; и вторую стадию обеспечения достаточного количества термической энергии или энергии излучения для избирательной вращательной изомеризации атропоизомеров, менее связанных с подложкой.
9. Способ по п. 4 или 8, где подложка предпочтительно представляет собой силикагель, и атропоизомер, избирательно связанный с подложкой, представляет собой атропоизомер формулы:
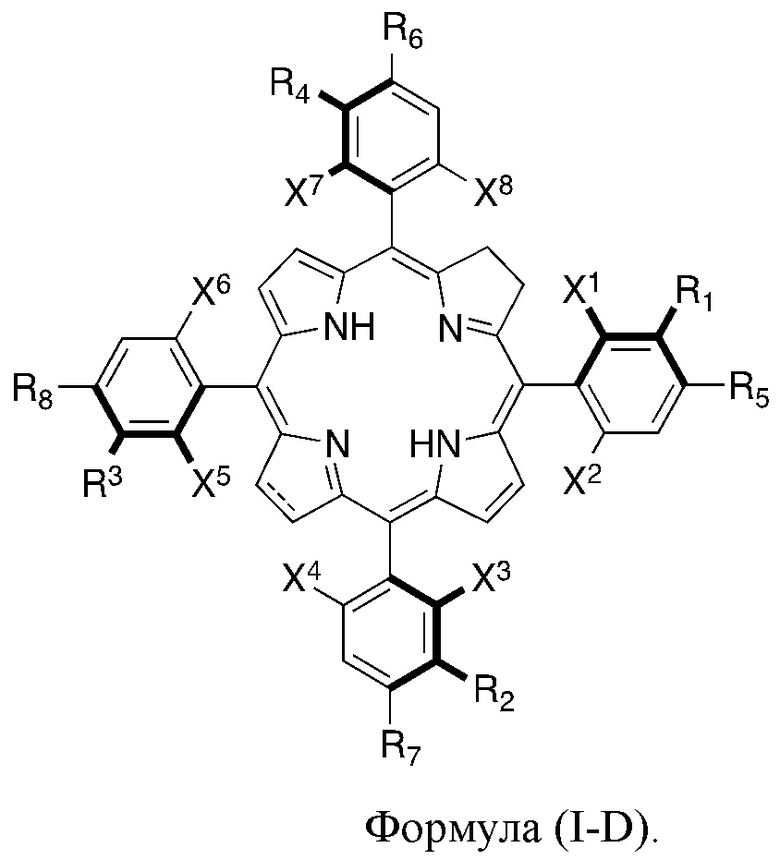
10. Способ по п. 4, где селективное фоторазложение включает первую стадию растворения смеси атропоизомеров хлорина или бактериохлорина в аэрированном растворителе и вторую стадию облучения светом, поглощаемым смесью атропоизомеров, для фоторазложения в большей степени менее фотостабильных атропоизомеров.
11. Фармацевтическая композиция, описанная в любом из пп. 1-3 и полученная способом, описанным в любом из пп. 4-10, для применения в лечении гиперпролиферативных расстройств, включающих, но не ограниченных указанными, раковые заболевания или карциномы, миеломы, псориаз, макулярную дегенерацию и предраковые состояния.
12. Фармацевтическая композиция, описанная в любом из пп. 1-3 и полученная способом, описанным в любом из пп. 4-10, для применения в лечении инфекционных заболеваний, вызванных микроорганизмами, включающими, но не ограниченными указанными, вирусы, бактерии, риккетсии, микоплазму, простейших, грибы; или паразитами, включающими, но не ограниченными указанными, обычно микроскопических или очень маленьких многоклеточных беспозвоночных, или их яйцами или ювенильными типами.
13. Набор для фотодинамической терапии, содержащий фармацевтическую композицию, описанную в любом из пп. 1-3, и инструкции для фотодинамической терапии/введения композиции субъекту.
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИНОВ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2009 |
|
RU2513483C2 |
| WO 2010047611 A9, 29.04.2010 | |||
| WO 2006053707 A1, 26.05.2006 | |||
| Crossley M.J | |||
| et al | |||
| "Steric effects on atropisomerism in tetraarylporphyrins", J | |||
| AM | |||
| CHEM | |||
| SOC, vol | |||
| Шкив для канатной передачи | 1920 |
|
SU109A1 |
| Кардочесальная машина | 1923 |
|
SU341A1 |
| Monteiro Carlos J | |||
| P | |||
| et al | |||
| "Separation and atropisomer isolation of ortho-halogenated tetraarylporphyrins by HPLC: Full | |||
Авторы
Даты
2020-01-28—Публикация
2016-03-18—Подача