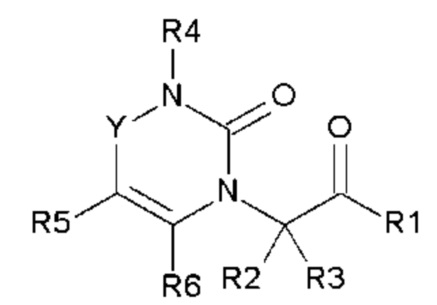
Изобретение относится к новым гетероциклическим соединениям общей формулы (I):
 (I).
(I).
Также изобретение относится к их применению в качестве лекарственного средства, в частности, в профилактике и/или лечении воспалительных заболеваний с нейрогенным компонентом, или в качестве косметического средства. Соединения по настоящему изобретению действуют в качестве антагонистов рецептора CGRP-R.
Пептид, кодируемый геном кальцитонина (CGRP), представляет собой нейропептид, состоящий из 37 аминокислот, содержащих С-концевую амидную группу и циклическую структуру, образованную N-концевым Cys-Cys дисульфидным мостиком (Poyner et al., "The mammalian calcitonin gene-related peptides, adrenomedullin, amylin, and calcitonin receptors", 2002). CGRP в значительной степени экспрессирован в центральной и периферической нервной системе и вовлечен в определенное количество биологических функций (Edvinsson et al., "CGRP antagonism и migraine", 2010). Все больше доказательств того, что CGRP играет важную роль в качестве нейромодулятора (Ho et al., "CGRP and its receptors provide new insights into migraine pathophysiology", 2010), однако он известен, в основном, как эффективное сосудорасширяющее средство (Brain et al., "Calcitonin gene-related peptide is a potent vasodilator", 1985).
CGRP сигнализирует главным образом через рецептор (CGRP-R), который является гетеродимером, образованным ассоциацией рецептора, сопряженного с G белком (RCPG) класса B (рецептор кальцитонина (CLR или кальцитониноподобный рецептор)), с трансмембранным белком, модифицирующим активность рецепторов (RAMP1 или модифицирующий активность рецептора белок 1) (McLatchie et al., "RAMPs regulate the transport and ligand specificity of the calcitonin receptor-like receptor", 1998).
Роль CGRP и активность рецептора CGRP являлись предметом многочисленных исследований.
В качестве руководства, авторы настоящего изобретения могут указать, в частности, результаты исследований, которые показывают, что криз мигрени связан с высвобождением CGRP менингиальными ноцицепторами тройничного ганглия и что CGRP может, таким образом, играть активную роль в мигрени (Edvinsson et al., "Functional role of perivascular peptides in the control of cerebral circulation", 1985; Goadsby et al., "Vasoactive peptide release in the extracerebral circulation of humans during migraine headache", 1990; Lassen et al., "CGRP may play a causative role in migraine", 2002).
Возрастающий объем доказательств связи CGRP с мигренью вызвал интерес к разработке средств, способных блокировать действия указанного нейропептида. В частности, для лечения мигрени, исследования были сосредоточены на получении малых молекул, которые являются прямыми антагонистами рецепторов CGRP ("гепанты") и не являются сосудосуживающими.
Эти молекулы описаны в литературе для применения пероральным способом и, таким образом, демонстрируют метаболическую стабильность на уровне печени (олцегепант, телкагепант и MK-3207).
Однако при их разработке неожиданно возникли проблемы, связанные с токсическим поражением печени.
Кроме того, помимо их роли в мигрени, высвобождение CGRP тройничным нервом, иннервирующим лицо, может быть связано с нейрогенным воспалением, ответственным за хроническую эритему при розацеа типа 1. Эта гипотеза подтверждается общими характеристиками между розацеа и мигренью, которая включает нейрогенный компонент с вазоактивными симптомом, активацию системы тройничного нерва и высвобождение нейровоспалительных пептидов (CGRP, вещество P и т.д.). Полагают, что CGRP оказывает сосудорасширяющие действие, главным образом, воздействуя на клетки гладких мышц и эндотелиальные клетки подкожных сосудов.
Розацеа является распространенным хроническим и прогрессирующим воспалительным дерматозом, связанным с расслаблением сосудов. В основном розацеа поражает центральную область лица и характеризуется покраснением лица или ʺприливамиʺ, лицевой эритемой, папулами, пустулами, телеангиэктазией и иногда поражениями глаз, называемыми глазной розацеа.
Кроме того, эти первичные характеристики связаны с вторичным нейрогенным компонентом, то есть гиперреактивностью кожи лица и шеи, характеризующейся покраснением и субъективными ощущением зуда или прурита, жжения или жара, покалывания, формикации, дискомфорта, приступами резкой боли и т.д.
Таким образом, розацеа традиционно лечится путем перорального или местного введения активных веществ, таких как антисеборейные и противоинфекционные средства, например, бензоилпероксид, ретиноевая кислота, метронидазол или циклины.
Тем не менее, эти способы лечения, которые воздействуют на инфекцию и гиперсеборею, не обеспечивают эффективное лечение и/или профилактику всех симптомов, ассоциированных с розацеа, в частности, лечение нейрогенного компонента этого расстройства и, в частности, гиперреактивности кожи и покраснение.
При этом более известен патент EP0774729, в котором описано применение антагониста CGRP для лечения покраснения кожи нейрогенного происхождения и, в частности, розацеа и/или ʺстыдливойʺ эритемы.
Однако единственным описанным антагонистом является CGRP 8-37, анти-CGRP пептид. Он должен снижать вазодилатацию, вызываемую капсаицином, и/или вызывать ингибирование высвобождения CGRP чувствительными нервными волокнами, и/или вызывать ингибирование сокращения гладкой мускулатуры семявыносящего протока, вызванного CGRP.
С учетом вышеизложенного, существует, таким образом, потребность в активных веществах, которые эффективны при лечении воспалительных заболеваний с нейрогенным компонентом, таких как розацеа, и которые могут применяться в течение длительного времени с как можно меньшими побочными эффектами.
Одна из задач, на решение которой направлено настоящее изобретение, заключается в том, чтобы предложить лечение для уменьшения или полного устранения указанного воспаления с использованием непептидного антагониста рецептора CGRP для нацеливания на нейрогенное воспаление, в результате чего эффект сохраняется после прекращения лечения, при этом ограничивая побочные эффекты для пациента, в частности, риски токсического поражения печени.
Таким образом, заявитель обнаружил новые гетероциклические соединения, которые являются антагонистами рецептора CGRP, селективными в отношении рецептора человека, и которые обладают очень хорошим потенциалом в смысле биологической активности. Неожиданно эти новые соединения демонстрируют метаболическую нестабильность на уровне печени, что должно ограничивать возможность возникновения гепатотоксичности, обнаруживаемой со многими антагонистами CGRP, известными из уровня техники, такими как, например, олцегепант, телкагепант и MK-3207.
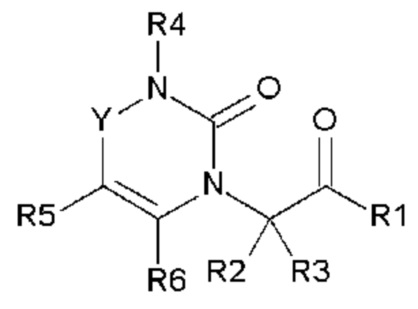
Настоящее изобретение относится к гетероциклическому соединению, выбранному из соединений общей формулы (I):
 (I)
(I)
в которой R1, R2, R3, R4, R5, R6 и Y определены в подробном описании ниже, а также фармацевтически приемлемым солям соединений общей формулы (I) и энантиомерам соединений общей формулы (I).
Настоящее изобретение также относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение общей формулы (I) и фармацевтически приемлемый носитель, предпочтительно подходящей для местного введения.
Кроме того настоящее изобретение относится к применению соединения общей формулы (I) в области косметики.
Настоящее изобретение также относится к соединению общей формулы (I), которое предназначено для использования в качестве лекарственного средства.
Настоящее изобретение относится, в частности, к соединению общей формулы (I) для использования в профилактике и/или лечении воспалительных заболеваний с нейрогенным компонентом.
Настоящее изобретение далее относится к применению соединения общей формулы (I) для получения лекарственного средства, предназначенного для профилактики и/или лечения воспалительных заболеваний с нейрогенным компонентом.
Настоящее изобретение также относится к способу профилактики и/или лечения воспалительных заболеваний с нейрогенным компонентом, включающему введение, по меньшей мере, одного соединения общей формулы (I).
Изобретение и его преимущества будут лучше поняты при чтении описания и следующих неограничивающих объем настоящего изобретения вариантов осуществления, описанных со ссылкой на прилагаемые чертежи, в которых:
- На фиг.1 представлен общий способ синтеза, в обычных условиях, соединений по настоящему изобретению в соответствии с реакционной схемой № 1;
- На фиг.2 представлен общий способ синтеза, в обычных условиях, соединений по настоящему изобретению в соответствии с реакционной схемой № 2, в которой P' обозначает защитную группу бензила, 4-метоксибензила, бензгидрила, -COOtBu или другого типа;
- На фиг.3 представлен общий способ синтеза, в обычных условиях, соединений по настоящему изобретению в соответствии с реакционной схемой № 3, в которой P' обозначает защитную группу бензила, 4-метоксибензила, бензгидрила, -COOtBu или другого типа; и
- На фиг.4 представлен общий способ синтеза, в обычных условиях, соединений по настоящему изобретению в соответствии с реакционной схемой № 4.
Следует учесть, что когда в настоящем описании указаны диапазоны концентраций, они включают верхний и нижний пределы указанного диапазона, если не указано иное.
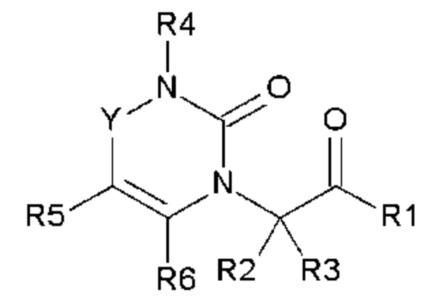
Соединения по настоящему изобретению представляют собой новые гетероциклические соединения, которые являются антагонистами рецептора CGRP, выбранными из соединений общей формулы (I):
 (I)
(I)
в которой
- Y выбран из -CH2, -C(O), -C(CH3)2 или спироциклопропила;
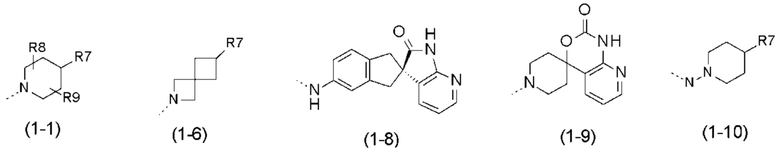
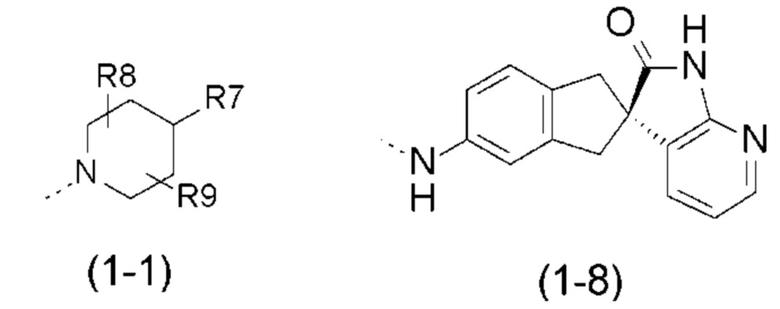
- R1 выбран из следующих групп (1-1) - (1-12):
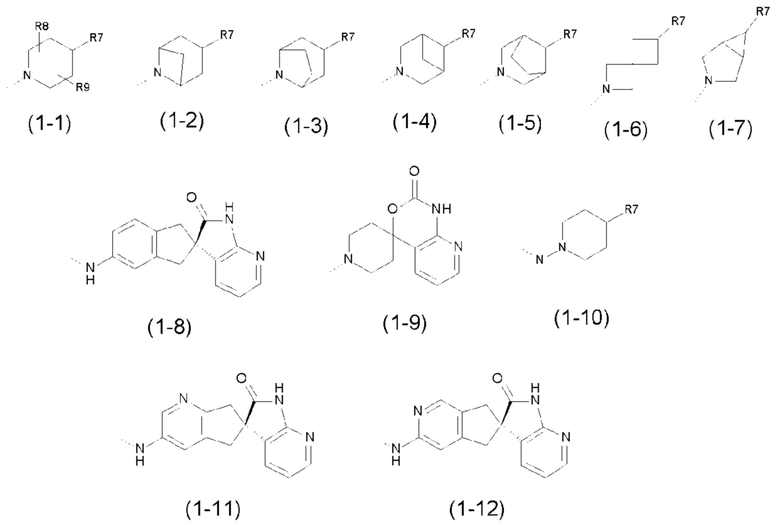 ;
;
- R2, R3, R6, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
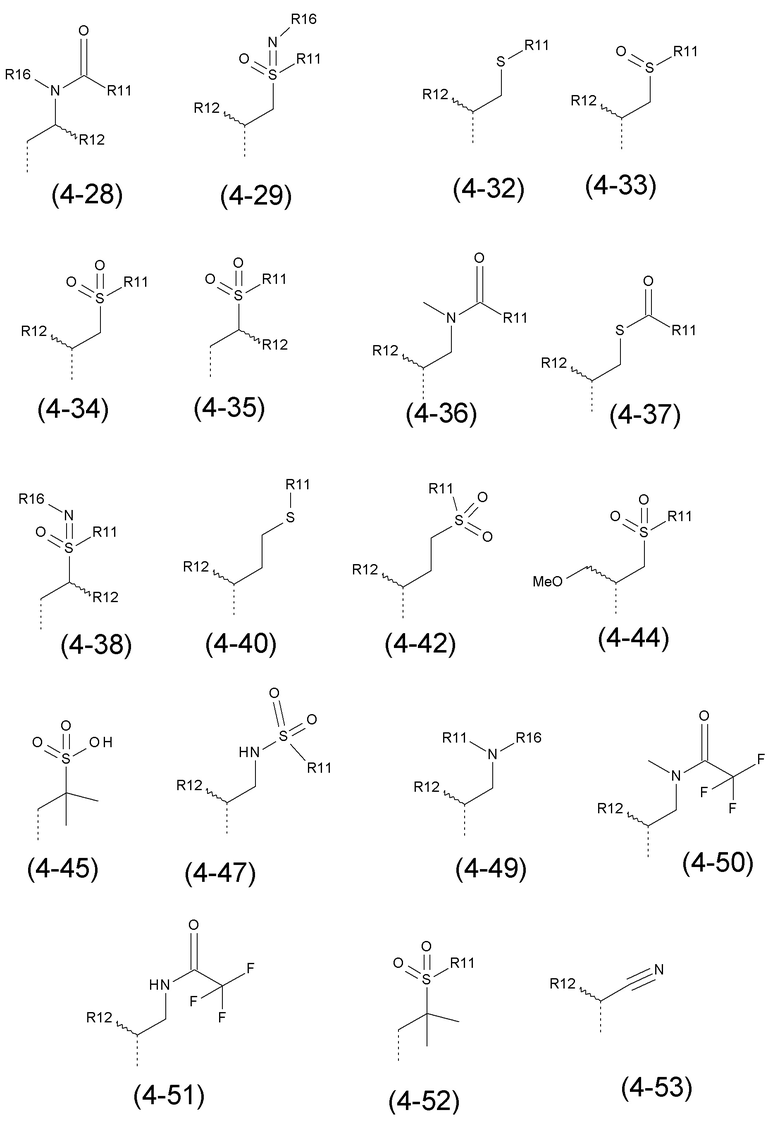
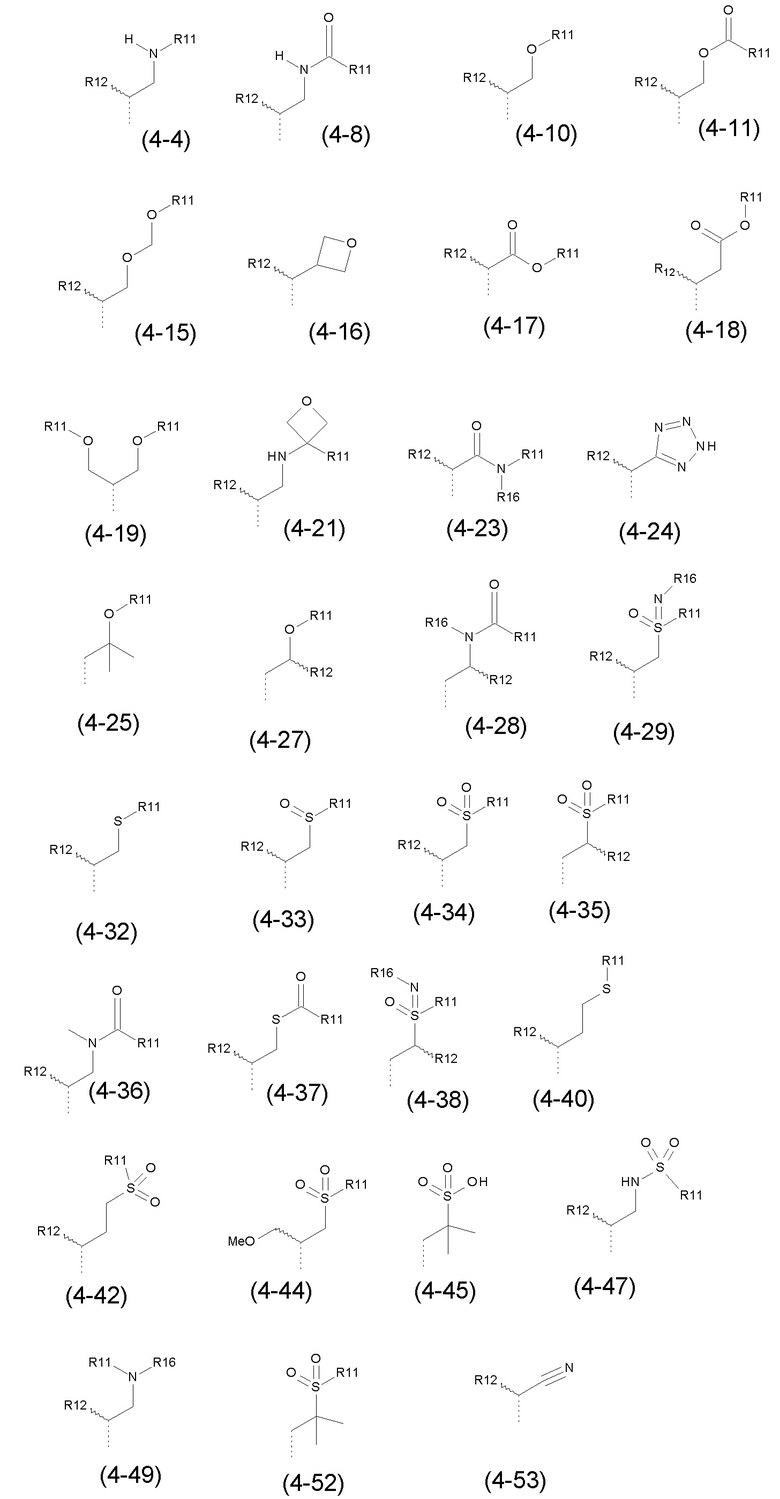
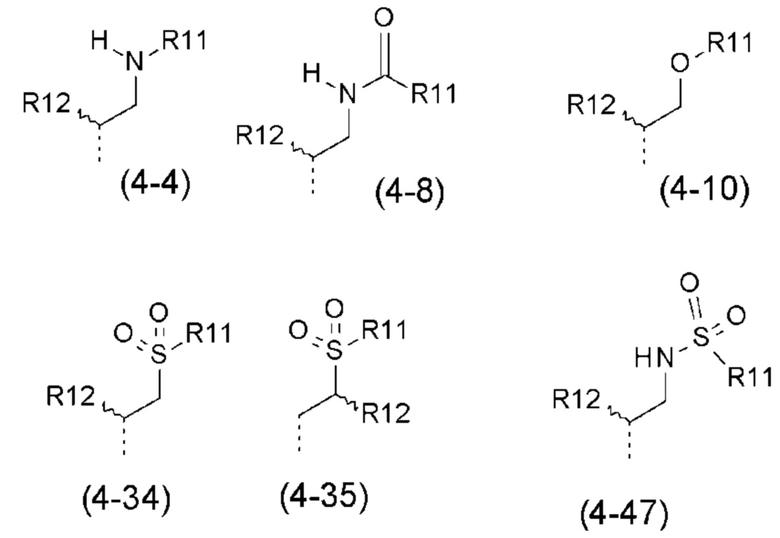
- R4 выбран из атома водорода, алкила, алкена, алкина, циклоалкила, циклоалкена, аралкила, гетероаралкила или следующих групп (4-1) - (4-55):
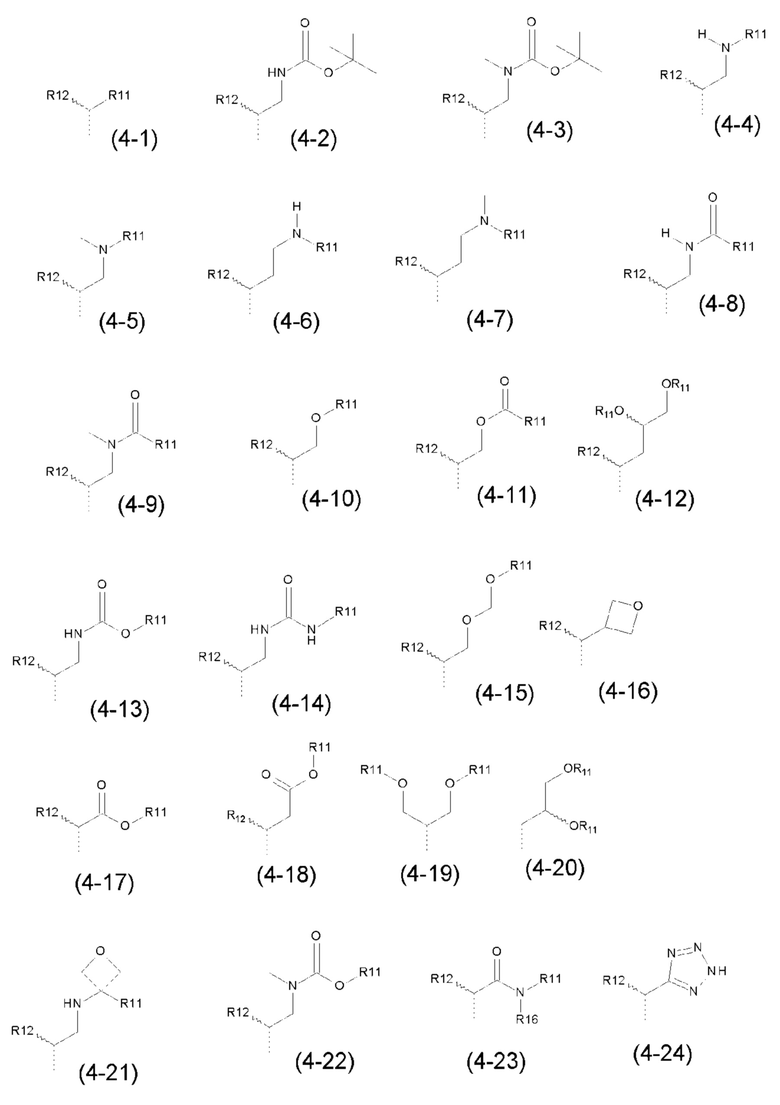
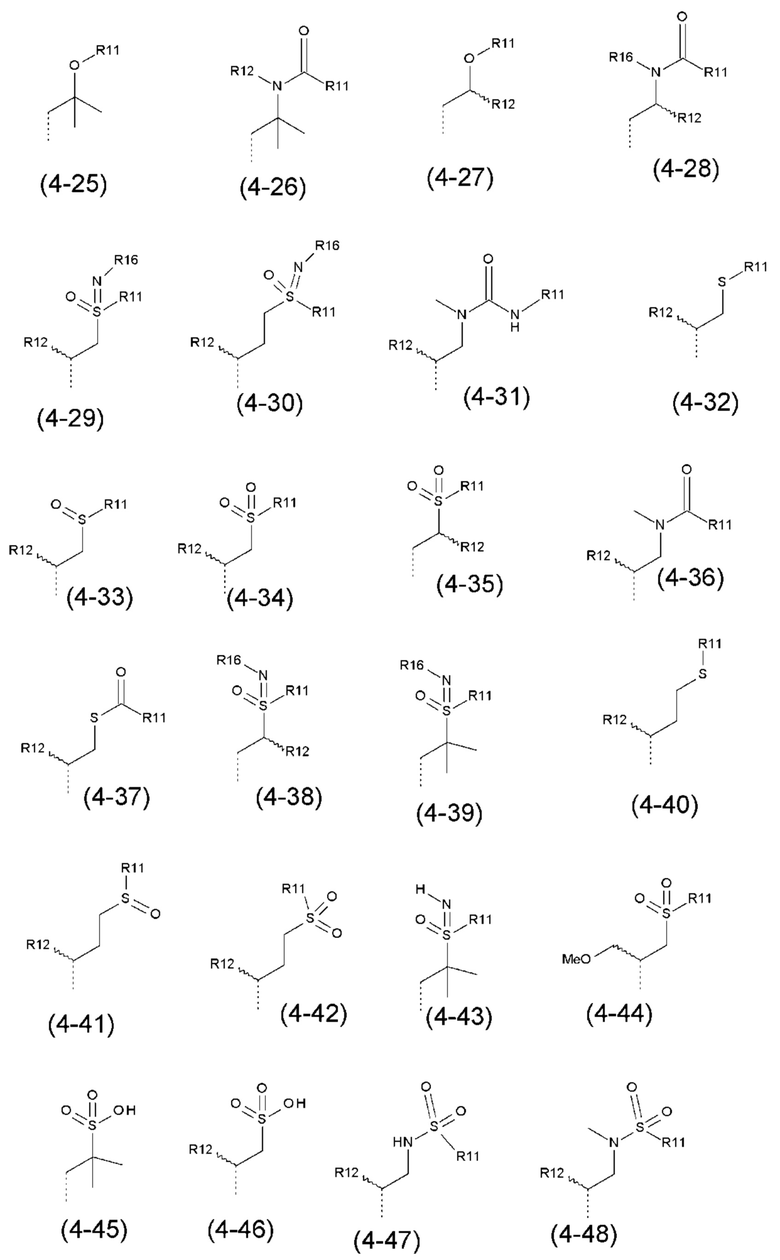
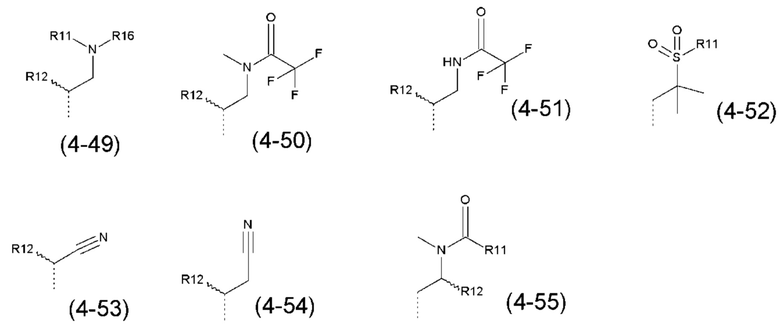
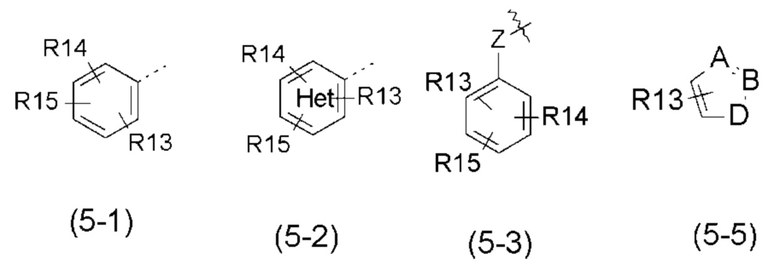
- R5 выбран из галогена, алкила, циклоалкила, необязательно замещенного R13, R14 и/или R15, алкена, циклоалкена, алкина, простого эфира или следующих групп (5-1) - (5-5):
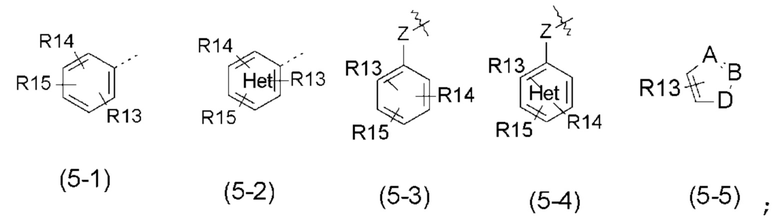
с группой Het, представляющей 1-3 атома азота в числе 6 атомов ароматического кольца, и эти атомы азота могут быть, независимо друг от друга, замещены атомом кислорода с образованием N-оксидной группы;
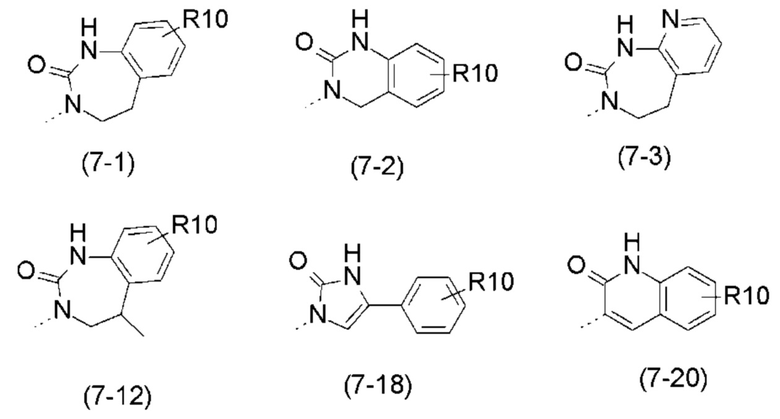
- R7 выбран из следующих групп (7-1) - (7-28):
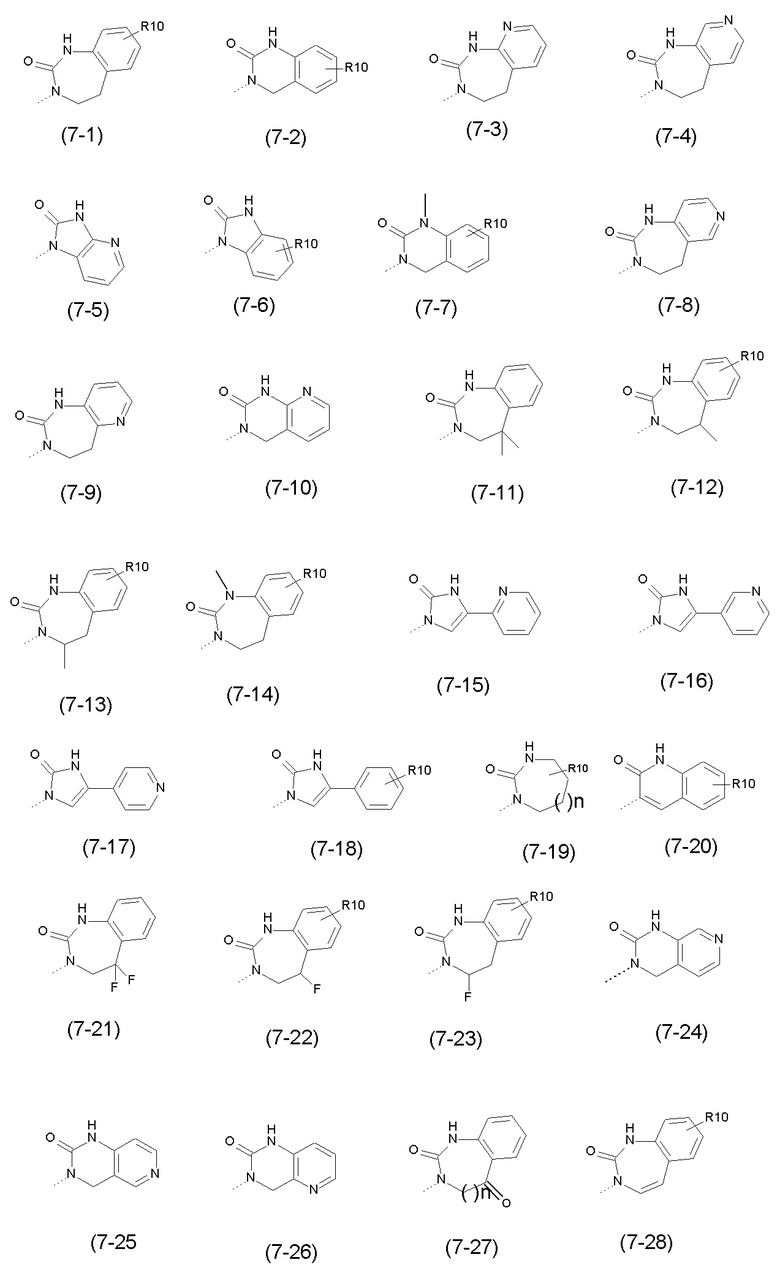
причем n=0 или 1;
- R8, R9, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
- R10 выбран из атома водорода, -OR11, -SR11, -NR11R12, -S(O)R11, -SO2R11, -OC(O)R11, -CO2R11, галоген, -NO2, -CN, -C(O)NR11R12, -CF3 или -OCF3;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила, CF3 или простого эфира;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила, циклоалкила, -OR16, -NR16R17, галогена, -OCF3, -CF3, -CN, -CO2R16, -CONR16R17, -NO2, -OCH2OR16, -SR16, -S(O)R16, -SO2R16 или простого эфира;
- A, B, D, которые могут быть одинаковыми или различными, выбраны из атома C, N, O или S;
- R16 и R17, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила или -C(O)R18;
- Z выбран из -CH2, O или -NR18; и
- R18 выбран из атома водорода, C1-C6 алкила,
а также их фармацевтически приемлемые соли и их энантиомеры.
ʺФармацевтически приемлемая сольʺ обозначает соли представляющего интерес соединения, которые обладают желаемой биологической активностью. Фармацевтически приемлемые соли включают соли кислотых или основных групп, присутствующих в указанных соединениях. Фармацевтически приемлемые кислотно-аддитивные соли включают соли, но ими не ограничиваясь, гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизатин, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метилэтил-бис(2-гидрокси-3-нафтоат)). Подходящие основные соли включают, но ими не ограничиваясь, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Перечень фармацевтически приемлемых солей опубликован, в частности, в обзоре Berge et al. (J. Pharm. Sci. 1977, 66(1), 1-19).
Термин энантиомер обозначает R- или S-конфигурации соединений общей формулы (I) по настоящему изображению.
Если не указано иное, определения, приведенные ниже, по умолчанию применяются ко всем радикалам, используемым для определения структуры соединений общей формулы (I).
Когда характеристика заместителя отличается от характеристики, указанной в приведенных ниже определениях, это различие указано в явной форме.
Например, алкил, содержащий только от 3 до 7 атомов углерода, будет обозначаться как С3-С7-алкил; алкен, содержащий только от 3 до 7 атомов углерода и который является линейным, будет обозначаться как линейный C3-C7-алкен, причем все остальные характеристики, кроме того, являются такими же, как характеристики, которые определены по умолчанию для каждого радикала, приведенного ниже.
В соответствии с настоящим изобретением:
Алкил обозначает, в частности, насыщенную, линейную или разветвленную углеводородную цепь, содержащую от 1 до 8 атомов углерода, необязательно замещенную одним или несколькими атомами фтора.
Алкен обозначает, в частности, ненасыщенную линейную или разветвленную углеводородную цепь, содержащую от 2 до 8 атомов углерода и содержащую одну или две двойные связи, необязательно замещенную одним или несколькими атомами фтора.
Алкин обозначают, в частности, ненасыщенную линейную или разветвленную углеводородную цепь, содержащую от 2 до 8 атомов углерода и содержащую одну или две тройные связи, необязательно замещенную одним или несколькими атомами фтора.
Ациклоалкил обозначает, в частности, насыщенную циклическую углеводородную цепь, содержащую от 3 до 7 атомов углерода, необязательно замещенную одним или несколькими атомами фтора.
Циклоалкен обозначает, в частности, ненасыщенную циклическую углеводородную цепь, содержащую от 4 до 7 атомов углерода и содержащую одну или две двойные связи, необязательно замещенную одним или несколькими атомами фтора.
Арил обозначает, в частности, углеводородсодержащее ароматическое кольцо или два конденсированных углеводородсодержащих ароматических кольца. Предпочтительные арильные радикалы выбраны из фенильных и нафтильных радикалов, необязательно замещенных одной или несколькими группами атомов, выбранных из алкила, алкокси, арила, галогена, гидроксила, циано, трифторметила, сульфида, пентафторсульфида, сульфоксида, сульфона, карбоновой кислоты, сложного эфира и нитро.
Аралкил обозначает, в частности, алкил, замещенный арилом.
Гетероарил обозначает, в частности, ароматический гетероциклический радикал, то есть циклическую или полициклическую, ароматическую углеводородную цепь, содержащую один или несколько гетероатомов, выбранных из О, S и N, необязательно замещенный одной или несколькими группами атомов, выбранных, например, из алкила, алкокси, арила, замещенного арила, галогена, гидрокси, циано, трифторметила, сульфида, пентафторсульфида, сульфоксида, сульфона, карбоновой кислоты, сложного эфира и нитро.
Гетероаралкил обозначает, в частности, алкил, замещенный гетероарилом.
Гетероцикл обозначает, в частности, циклическую или бициклическую, насыщенную или ненасыщенную углеводородную цепь, содержащую один или несколько гетероатомов, выбранных из О, S и N, необязательно замещенную одной или несколькими группами, выбранными из алкила, алкокси, галогена, гидроксила, циано, трифторметила, сульфида, пентафторсульфида, сульфоксида, сульфона, карбоновой кислоты, сложного эфира и нитро.
Галоген обозначает атом фтора, хлора или брома.
Алкокси обозначает атом кислорода, замещенный алкильным радикалом.
Эфир обозначает, в частности, насыщенную, линейную или разветвленную углеводородную цепь, содержащую от 1 до 8 атомов углерода, и в которой 1-3 атома углерода замещены соответственно 1-3 атомами кислорода, причем два атома кислорода всегда разделяются, по крайней мере, одним атомом углерода, и указанная цепь необязательно замещена одним или несколькими атомами фтора.
Соединения по настоящему изобретению предпочтительно выбраны из соединений общей формулы (I), в которой:
- Y выбран из -CH2 или -C(O);
- R1 выбран из следующих групп:
-R2, R3, R6, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
- R4 выбран из C1-C4-алкила, аралкила, гетероаралкила или следующих групп: 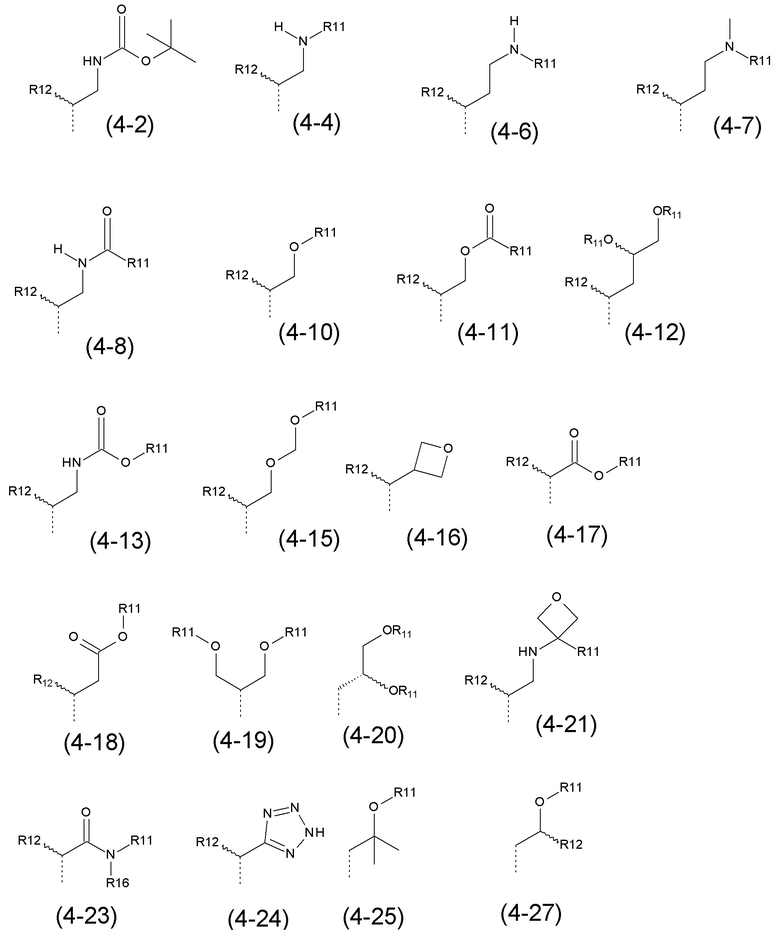
- R5 выбран из Br, -CH3, циклогексена или следующих групп:
с группой Het, представляющей от 1 до 2 атомов азота в числе 6 атомов ароматического кольца, и эти атомы азота могут, независимо друг от друга, замещаться атомом кислорода с образованием N-оксидной группы;
- R7 выбран из следующих групп:
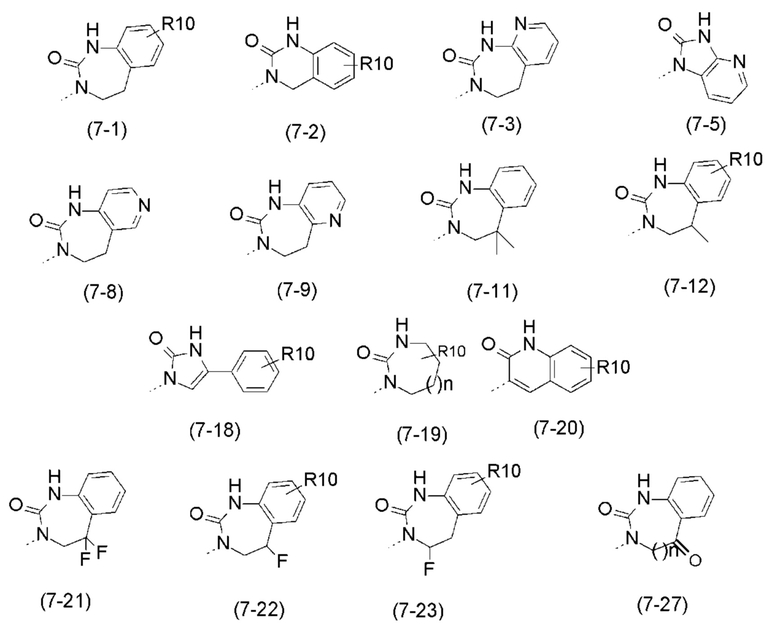
причем n=1;
- R8, R9, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
- R10 выбран из атома водорода, -OR11, -SR11, -S(O)R11, -SO2R11, -CO2H или галогена, выбранного из Br или F;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила или CF3;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -CH3, -OR16, галогена, -OCF3, -CN, -CO2R16, -SR16, -S(O)R16 или -SO2R16;
- A, B, д, которые могут быть одинаковыми или различными, выбраны из атома C, N или S;
- R16 выбран из атома водорода или алкила; и
- Z выбран из -CH2 или O.
Для этой цели, соединения общей формулы (I) по настоящему изобретению более предпочтительно выбраны из следующих соединений:
Соединение 1: 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 2: 5-(2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 3: 5-(2,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 4: 5-(3-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 5: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-5-(1H-пиразол-3-ил)-1H-пиримидин-2,4-дион;
Соединение 6: 5-(3-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 7: 5-(3-гидроксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 8: 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 9: 5-циклогекс-1-енил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 10: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-5-фенил-1H-пиримидин-2,4-дион;
Соединение 11: 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-дион;
Соединение 12: 5-(2,3-дифторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 13: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 14: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 15: 5-(2,3-дифторфенил)-3-метил-1-[1-метил-2-оксо-2-[4-(2-оксо-1,4-дигидрохиназолин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 16: 5-(2,3-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 17: 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 18: 5-(2-хлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 19: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-(2-трифторметоксифенил)-1H-пиримидин-2,4-дион;
Соединение 20: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-тиофен-3-ил-1H-пиримидин-2,4-дион;
Соединение 21: 5-(2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 22: 5-(3-хлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 23: 5-(3-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 24: 5-(3-хлор-2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 25: 5-(2-метокси-3-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 26: 5-(3-хлор-2-гидроксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 27: 5-(2,3-диметоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 28: 5-(3-фтор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 29: 5-(3-хлор-2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 30: 5-(2,3-диметилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 31: 5-(2-хлор-3-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 32: 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 33: 5-(3-фтор-2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 34: 5-(2,6-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 35: 5-(3,5-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 36: 4-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрил;
Соединение 37: 3-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрил;
Соединение 38: 2-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрил;
Соединение 39: 3-метил-5-(3-метил-пиридин-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 40: 3-метил-5-(2-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 41: 3-метил-5-(4-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 42: 3-метил-5-(6-метил-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 43: 3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 44: 3-метил-5-(1-метил-1H-пиразол-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 45: 5-(5-хлор-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 46: 5-бензил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 47: 5-(3,4-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 48: 5-(5-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 49: 5-(4,5-диметил-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 50: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-фенокси-1H-пиримидин-2,4-дион;
Соединение 51: 5-(2,3-диметилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 52: 5-(3-хлор-2-метилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 53: 5-(2,3-дихлорфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 54: 5-(2-хлор-3-фторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 55: 5-(3-хлор-2-метоксифенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 56: 5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-дион;
Соединение 57: 5-(2-хлор-3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-дион;
Соединение 58: 1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-дион;
Соединение 59: 5-(3-хлор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 60: 5-(3-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 61: 5-(3-фтор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 62: 5-(2,3-дифторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 63: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 64: 3-изопропил-5-(2-метокси-3-метилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 65: 5-(3-хлор-4-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 66: 5-(2-фторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 67: 5-(3,4-дихлорфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 68: 5-(2,3-диметилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 69: 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 70: 5-(5-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 71: 5-(2,3-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 72: (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-ацетонитрил;
Соединение 73: 3-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-пропионовая кислота;
Соединение 74: метил 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойный ацетат;
Соединение 75: 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойная кислота;
Соединение 76: 5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 77: 5-(2-хлор-3-метансульфинил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 78: 5-(2-хлор-3-метансульфонил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 79: метил 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойный ацетат;
Соединение 80: 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойная кислота;
Соединение 81: 5-(3,4-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 82: 5-(3,5-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 83: 5-(2,3-дихлорфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 84: 5-(2-хлор-3-фторфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 85: 5-(2,3-диметилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 86: 5-(3-фтор-2-метилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 87: [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-карбаминовой кислоты трет-бутиловый эфир;
Соединение 88: 3-(2-аминоэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 89: 3-(2-аминоэтил)-5-(2,3-дихлорфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 90: 5-(2,3-дихлорфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 91: 3-((R)-2,3-дигидроксипропил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 92: 3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 93: 5-(2,3-диметилфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 94: 5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 95: 5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 96: 5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 97: 5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 98: 5-(2,3-диметилфенил)-3-(2-гидроксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 99: 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 100: 5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 101: N-[2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид;
Соединение 102: 5-(2,3-диметилфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 103: метил (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-ацетат;
Соединение 104: (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-уксусная кислота;
Соединение 105: 5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 106: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 107: метил (5-бром-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-ацетат;
Соединение 108: 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 109: 5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 110: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 111: метил 2-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-пропионат;
Соединение 112: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 113: 5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион;
Соединение 114: метил 3-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-пропионат;
Соединение 115: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 116: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 117: N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид;
Соединение 118: N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-N-метил-ацетамид;
Соединение 119: 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 120: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-метансульфонамид;
Соединение 121: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-1H-пиримидин-2,4-дион;
Соединение 122: 5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 123: (S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил ацетат;
Соединение 124: 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 126: 5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 127: 5-(2,3-дихлорфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 128: 5-(2,3-дифторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 129: 5-(2,3-диметоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 130: 5-(2-хлор-3-метоксифенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 131: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 132: 5-(2,3-дихлорфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 133: 5-(2,3-диметоксифенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 134: 5-(3-бром-2-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 135: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 136: 5-(2,3-дифторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 137: 5-(2,3-дихлорфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 138: 5-(2,3-диметилфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 139: 5-(2,3-диметоксифенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 140: 5-(2-хлор-3-метоксифенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 141: 3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-метил-1H-пиримидин-2,4-дион;
Соединение 142: 5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 143: 5-(2-хлор-3-фторфенил)-3-((R)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 144: 5-(2,3-дихлорфенил)-3-((S)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 145: 5-(2,3-дихлорфенил)-3-((R)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 146: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 147: 5-(2,3-диметоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 148: 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 149: 5-(2-фтор-3-метоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 150: 3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-(2-трифторметоксифенил)-1H-пиримидин-2,4-дион;
Соединение 151: 3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-(3-трифторметоксифенил)-1H-пиримидин-2,4-дион;
Соединение 152: 3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-(3-метокси-2-трифторметоксифенил)-1H-пиримидин-2,4-дион;
Соединение 153: 5-(2,3-дифторфенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 154: 5-(2-хлор-3-этоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 155: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метилсульфанил-этил)-1H-пиримидин-2,4-дион;
Соединение 156: 5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 157: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(метилсульфонимидоил)этил]пиримидин-2,4-дион;
Соединение 158: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-пропионамид;
Соединение 159: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-((S)-2-метокси-1-метилэтил)-1H-пиримидин-2,4-дион;
Соединение 160: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метансульфонил-этил)-1H-пиримидин-2,4-дион;
Соединение 161: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 162: N-[(S)-2-(5-(2,3-дихлорфенил)-3-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 163: 5-(2-хлор-3-фторфенил)-1-{2-[4-(9-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-изопропил-1H-пиримидин-2,4-дион;
Соединение 164: 5-(2,3-дифторфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-3H-имидазо[4,5-b]пиридин-1-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 165: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 166: 5-(2-хлор-3-фторфенил)-3-изопропил-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 167: 5-(2,3-дифторфенил)-3-[(1S)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 168: 2-[5-(2-хлор-3-фторфенил)-2,4-диоксо-1H-пиримидин-3-ил]уксусная кислота-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 169: 5-(2-хлор-3-метоксифенил)-3-(2-метилсульфонилэтил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 170: 5-(2,3-дихлорфенил)-3-(2-метилсульфонилэтил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 171: 5-(2,3-диметоксифенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 172: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 173: 5-(2-хлор-3-фторфенил)-3-(3-метилсульфонилпропил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 174: 5-(2,3-дихлорфенил)-3-метил-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 175: 5-(2-хлор-3-фторфенил)-3-[(1S)-1-метил-2-метилсульфонил-этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 176: 5-(2-хлор-3-метоксифенил)-3-[2-метокси-1-(метоксиметил)этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 177: 5-(2,3-дихлорфенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 178: 5-(2,3-дихлорфенил)-3-[(1S)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 179: 5-(2-хлор-3-фторфенил)-3-[2-метокси-1-(метоксиметил)этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 180: N-[2-[5-(2-хлор-3-фторфенил)-2,4-диоксо-пиримидин-3-ил]этил]ацетамид-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 181: 5-(2-хлор-3-фторфенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 182: 5-(2,3-дихлорфенил)-3-[2-метокси-1-(метоксиметил)этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 183: 5-(2-хлор-3-фторфенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид;
Соединение 184: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метансульфонил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 185: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метансульфонил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 186: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 187: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 188: 5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 189: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 190: 3-(1-{2-[5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 191: 3-(1-{2-[5-(2,3-дихлорфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 192: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 193: 3-(1-{2-[5-(2-хлор-3-метоксифенил)-3-изопропил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 194: 3-(1-{2-[5-(2,3-дихлорфенил)-2-оксо-3-(2,2,2-трифторэтил)-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 195: 1'-[2-[5-(2,3-дихлорфенил)-3-метил-2-оксо-4H-пиримидин-1-ил]ацетил]спиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-2-он;
Соединение 196: 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-4-фенил-2,3-дигидро-имидазол-1-ил)-пиперидин-1-ил]-этил}-3,4-дигидро-1H-пиримидин-2-он;
Соединение 197: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 198: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-этил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 199: 3-(1-{2-[5-(2,3-дихлорфенил)-3-этил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 200: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-изопропил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 201: 3-(1-{2-[5-(2,3-дихлорфенил)-3-изопропил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он;
Соединение 202: N-[2-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид;
Соединение 203: N-[(R)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 204: N-[(R)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-2,2,2-трифтор-ацетамид;
Соединение 205: N-[(S)-2-(5-(2,3-дихлорфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 206: N-[(S)-2-(5-(2-хлор-3-метоксифенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 207: N-[2-(5-(2,3-дихлорфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид;
Соединение 208: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-5-фенил-1H-имидазол-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 209: 2-[5-(2,3-дихлорфенил)-3-метил-2,4-диоксо-пиримидин-1-ил]-N-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]ацетамид;
Соединение 210: 5-(2,3-дихлорфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 211: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-(2-оксоспиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-1'-ил)этил]пиримидин-2,4-дион;
Соединение 212: 2-[3-этил-2,4-диоксо-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-5-ил]бензонитрил;
Соединение 213: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[2,3-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 214: 5-(2,3-диметилфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-5-фенил-1H-имидазол-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 215: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-1H-хинолин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 216: 5-(2,3-диметилфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[4,3-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 217: 5-(2,3-диметилфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[3,2-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 218: 5-(2,3-диметилфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[2,3-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 219: 5-(2,3-диметилфенил)-3-метил-1-[2-[4-(1-метил-2-оксо-4,5-дигидро-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 220: 5-(3,4-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 221: 1-[2-[4-(7-бром-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-5-(2-хлор-3-фторфенил)-3-изопропил-пиримидин-2,4-дион;
Соединение 222: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[4-метил-4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 223: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[(2S)-2-метил-4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 224: 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]пропионовая кислота;
Соединение 225: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[4-(7-метилсульфинил-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 226: 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]ацетамид;
Соединение 227: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфинилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 228: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 229: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион;
Соединение 230: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[4-(7-метокси-5,5-диметил-2-оксо-1,4-дигидро-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 231: 5-(2,3-дифторфенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 232: 5-(2-хлор-3-фторфенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 233: 5-(2-хлор-3-фторфенил)-3-[(1S)-2-метокси-1-метилэтил]-1-[2-[4-(7-метилсульфанил-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 234: 5-(2-хлор-3-фторфенил)-3-(2-гидрокси-2-метилпропил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 235: 5-(2-хлор-3-фторфенил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]-3-(2H-тетразол-5-илметил)пиримидин-2,4-дион;
Соединение 236: 5-(2,3-дифторфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 237: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[(1S)-1-метилпропил]пиримидин-2,4-дион;
Соединение 238: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[(1R)-1-метилпропил]пиримидин-2,4-дион;
Соединение 239: 5-(2-хлор-3-фторфенил)-3-[1-(метоксиметил)пропил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 240: 5-(2-хлор-3-фторфенил)-3-(2-метокси-2-метилпропил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 241: 5-(2-хлор-3-метоксифенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 242: 5-(2,3-дихлорфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 243: 5-(2-хлор-3-метоксифенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 244: 5-(2-хлор-3-фторфенил)-3-[(1S)-1-метил-2-метилсульфонил-этил]-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 245: 5-(2,3-дихлорфенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 246: 3-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропионовая кислота;
Соединение 247: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(1,3,4-оксадиазол-2-ил)этил]пиримидин-2,4-дион;
Соединение 248: 2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]уксусная кислота;
Соединение 249: 5-(2-хлор-3-фторфенил)-3-[(1R)-1-метил-2-метилсульфонил-этил]-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион;
Соединение 250: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[2-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-6-азаспиро[3,3]гептан-6-ил]этил]пиримидин-2,4-дион;
Соединение 251: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(1,2,4-триазол-4-ил)этил]пиримидин-2,4-дион;
Соединение 252: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-фтор-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[(1R)-1-метил-2-метилсульфонил-этил]пиримидин-2,4-дион;
Соединение 253: 3-[1-[2-[5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-2,4-диоксо-пиримидин-1-ил]ацетил]-4-пиперидил]-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-7-карбоновая кислота;
Соединение 254: S-[2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]этил]этантиоат;
Соединение 255: N-[(2S)-2-[5-(2,3-дихлорфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]пропил]ацетамид;
Соединение 256: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]пропил]ацетамид;
Соединение 257: 2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]этансульфоновая кислота;
Соединение 258: 5-(2-хлор-3-фторфенил)-3-[(1S)-1-(метоксиметил)-2-метилсульфонил-этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион;
Соединение 259: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-(2-метил-2-метилсульфонил-пропил)пиримидин-2,4-дион;
Соединение 260: N-[(2S)-2-[5-(2-хлор-3-метоксифенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]пропанамид;
Соединение 261: N-[(2S)-2-[5-(2,3-дихлорфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]пропанамид;
Соединение 262: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-4-метил-2,6-диоксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 263: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]-2-метил-пропанамид;
Соединение 264: N-[(2S)-2-[5-(2-хлор-3-метоксифенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]-2-метил-пропанамид;
Соединение 265: 3-[1-[2-[5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-4,4-диметил-2-оксо-пиримидин-1-ил]ацетил]-4-пиперидил]-8-метокси-4,5-дигидро-1H-1,3-бензодиазепин-2-он;
Соединение 266: 3-[1-[2-[4-(2-хлор-3-фторфенил)-8-[(1S)-2-метокси-1-метилэтил]-7-оксо-6,8-диазаспиро[2,5]окт-4-ен-6-ил]ацетил]-4-пиперидил]-8-метокси-4,5-дигидро-1H-1,3-бензодиазепин-2-он;
Соединение 267: N-[(2S)-2-[5-(2-хлор-3-метоксифенил)-3-[2-[4-(8-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-6,6-диметил-2-оксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 268: N-[(2S)-2-[4-(2-хлор-3-метоксифенил)-6-[2-[4-(8-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-7-оксо-6,8-диазаспиро[2,5]окт-4-ен-8-ил]пропил]ацетамид;
Соединение 269: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(5,5-дифтор-7-метокси-2-оксо-1,4-дигидро-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 270: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(5-фтор-7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 271: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(4-фтор-7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 272: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[2,6-диметил-4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 273: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-3-[2-[3,5-диметил-4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропил]ацетамид;
Соединение 274: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{1-фтор-2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 275: N-[(S)-2-(5-(2-хлор-3-фторфенил)-4-фтор-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 276: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[3-фтор-4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид;
Соединение 277: N-[(S)-2-(5-(2-хлор-3-метоксифенил)-3-{2-[4-(7-метокси-2,5-диоксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид.
Соединения по настоящему изобретению еще более предпочтительно выбраны из соединений общей формулы (I), в которой:
- Y выбран из -CH2 или -C(O);
- R1 выбран из следующих групп:
- R2, R3, R6 представляют собой атом водорода;
- R4 выбран из C1-C4-алкила, гетероаралкила формулы
 или
или 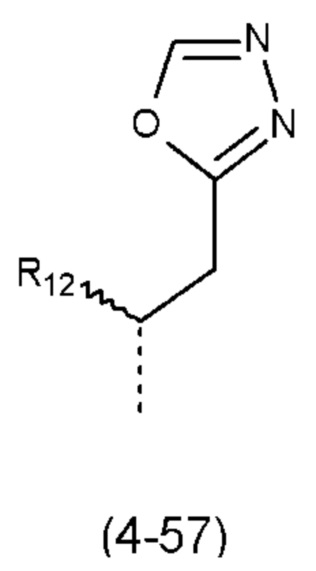 или следующих групп:
или следующих групп:
- R5 представляет собой 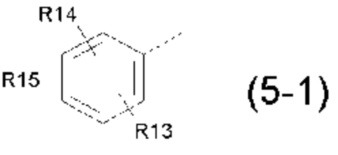 ;
;
- R7 выбран из следующих групп:
- R8, R9 представляют собой атом водорода;
- R10 выбран из атома водорода, -OR11, -SR11, -S(O)R11, -SO2R11, -CO2H или галогена, выбранного из Br или F;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода или C1-C2 алкила;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -CH3, -OR16, галогена или -OCF3; и
- R16 выбран из атома водорода или алкила.
Для этой цели, соединения по настоящему изобретению еще более предпочтительно выбраны из соединений, перечисленных в таблице I ниже и для которых активность антагониста в отношении рецептора CGRP, определяемая явным Kd или Kdapp, составляет менее 10 нМ (обозначается как класс A в таблице I).
В числе соединений по настоящему изобретению, когда Y представляет собой -C(O), соединения по настоящему изобретению предпочтительно являются производными урацила.
В соответствии с особенно предпочтительным вариантом осуществления изобретения соединения выбраны из соединений общей формулы (I), в которой:
- Y представляет собой -C(O);
- R1 выбран из следующих групп:
- R2, R3, R6 представляют собой атом водорода;
- R4 выбран из следующих групп:
- R5 представляет собой 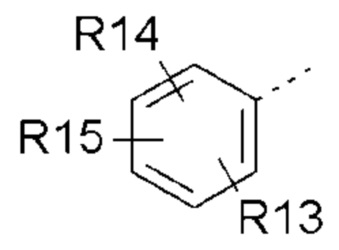 (5-1);
(5-1);
- R7 представляет собой 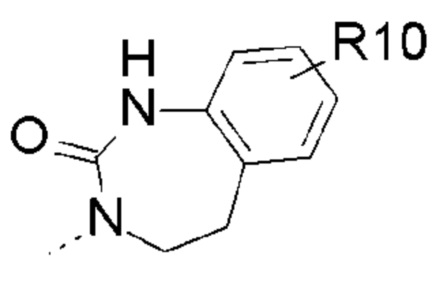 (7-1);
(7-1);
- R8, R9 представляют собой атом водорода;
- R10 выбран из атома водорода, -OR11, -SR11 или Br;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода или C1-C2 алкила;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -OR16 или галогена, выбранного из F и Cl; и
- R16 представляет собой C1-C3 алкил.
В соответствии с еще более предпочтительным вариантом осуществления изобретения, соединения выбраны из соединений общей формулы (I), в которой:
- Y представляет собой -C(O);
- R1 представляет собой 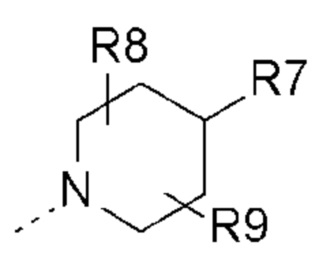 (1-1);
(1-1);
- R2, R3, R6 представляют собой атом водорода;
- R4 представляет собой 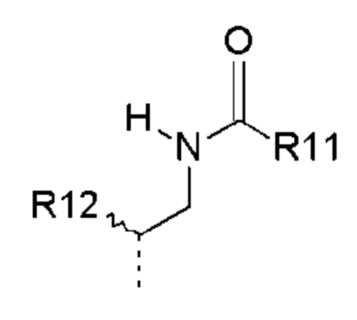 (4-8);
(4-8);
- R5 представляет собой 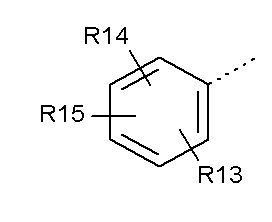 (5-1);
(5-1);
- R7 представляет собой 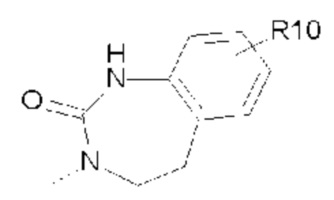 (7-1);
(7-1);
- R8, R9 представляют собой атом водорода;
- R10 представляет собой -OR11;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из -CH3 или -CH2CH3;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -OR16 или галогена, выбранного из F и Cl; и
- R16 представляет собой C1-C3 алкил.
Различные примеры получения соединений по настоящему изобретению будут описаны в иллюстративных целях и без каких-либо ограничений.
Соединения по настоящему изобретению могут быть получены, не ограничиваясь, с использованием обычных условий органического синтеза в соответствии с общими способами проведения реакций, представленными на схемах реакции № 1, 2, 3 и 4, на фиг. 1, 2, 3 и 4 соответственно. Условия эксперимента, относящиеся к каждой схеме синтеза, описаны в приведенных ниже примерах, которые, в каждом случае, относятся к схеме, применяемой для их получения. Таким образом, специалист в данной области техники сможет оценить, подходят ли условия, описанные в этих схемах для введения желаемых функциональных групп, и, возможно, будет адаптировать способ синтеза путем использования подходящих защитных групп, которые являются стабильными в условиях реакции. Определенные промежуточные соединения, обеспечивающие введение определенных групп R1, предусмотренных в соединениях по настоящему изобретению, получают заранее в соответствии со способами получения, уже описанными в литературе или описанными в примерах ниже.
Более конкретно, приведенные ниже примеры описывают не исчерпывающие процедуры, используемые для получения соединений в соответствии со схемами синтеза № 1, 2, 3 или 4. Каждое соединение в основном характеризуется спектром 1H ЯМР, регистрируемым на спектрометре ядерного магнитного резонанса Bruker 400 МГц.
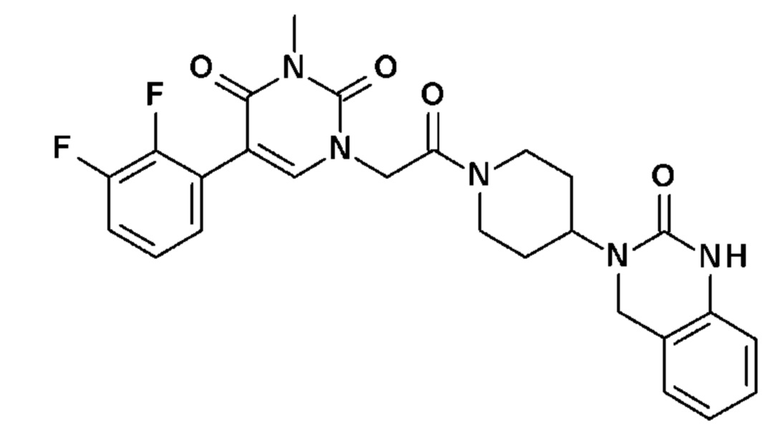
Пример 1: 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 1)
1.1: [2-(1-бензил-пиперидин-4-илкарбамоил)-фенил]-трет-бутилкарбамат
К раствору 10 г (42,1 ммоль) 2-трет-бутоксикарбониламинобензойной кислоты, 10,3 мл (50,6 ммоль) 1-бензил-пиперидин-4-иламина, 6,3 г (46,3 ммоль) 1-гидроксибензотриазола и 17,6 мл (126,3 ммоль) триэтиламина в 120 мл диметилформамида добавляли 8,9 г (46,3 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида. Затем реакционную смесь перемешивали. Реакционную смесь нагревали при 70°С в течение 5 часов, затем гидролизовали водным раствором гидрокарбоната натрия и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органическую фазу дважды промывали насыщенным водным раствором гидрокарбоната натрия, потом насыщенным водным раствором хлорида натрия и водой, сушили над сульфатом магния и фильтровали. Растворители концентрировали в вакууме. Получали 17 г (100%) [2-(1-бензил-пиперидин-4-илкарбамоил)-фенил]-трет-бутилкарбамата в виде твердого вещества бежевого цвета.
1.2: 2-амино-N-(1-бензил-пиперидин-4-ил)-бензамид
К раствору 17 г (41,5 ммоль) 2-(1-бензил-пиперидин-4-илкарбамоил)-фенил]-трет-бутилкарбамата в 170 мл дихлорметана, предварительно охлажденного до 0°С, добавляли по каплям 30 мл (415 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивали при температуре от 0°С до комнатной температуры в течение 20 часов. После концентрирования в вакууме, остаток гидролизовали водным раствором гидрокарбоната натрия и далее разбавляли этилацетатом. Продукт дважды экстрагировали этилацетатом. Органическую фазу промывали один раз водой, затем один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 14 г (100%) 2-амино-N-(1-бензил-пиперидин-4-ил)-бензамида в виде бежевого твердого вещества.
1.3: (2-аминобензил)-(1-бензил-пиперидин-4-ил)-амин
К раствору 5,2 г (135,7 ммоль) алюмогидрида лития в 260 мл диоксана, предварительно нагретого с обратным холодильником, очень медленно добавляли 12 мг (38,8 ммоль) 2-амино-N-(1-бензил-пиперидин-4-ил)-бензамида, разбавленного в 72 мл диоксана. Затем реакционную смесь (суспензию серого цвета) перемешивали и нагревали с обратным холодильником в течение 3 часов. Смесь охлаждали до 0°С, потом медленно гидролизовали 5,2 мл 15 М водного раствора карбоната натрия и 15,5 мл воды. Затем реакционную смесь разбавляли 240 мл диэтилового эфира и перемешивали при комнатной температуре в течение 55 минут. После фильтрования солей, фильтрат концентрировали в вакууме, получая 10,7 г (93%) (2-аминобензил)-(1-бензил-пиперидин-4-ил)-амина в виде прозрачного масла.
1.4: 3-(1-бензил-пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он
К раствору 1,6 г (5,2 ммоль) (2-аминобензил)-(1-бензил-пиперидин-4-ил)-амина в 25 мл тетрагидрофурана добавляли 0,9 г (5,7 ммоль) карбонилдиимидазола. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли в вакууме, затем реакционную смесь гидролизовали и разбавляли этилацетатом. После экстракции этилацетатом, органические фазы дважды промывали водой, потом насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученное неочищенное твердое вещество растирали с 15 мл диэтилового эфира, затем фильтровали и сушили в вакууме с получением 1,2 г (72%) 3-(1-бензил-пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-она в виде твердого вещества белого цвета.
1.5: 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-он
К раствору 1,2 г (3,7 ммоль) 3-(1-бензил-пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-она в 30 мл метанола, предварительно дегазированного азотом, добавляли 120 мг палладия на угле (10 масс%). Затем смесь помещали в атмосферу водорода в течение 48 часов и далее фильтровали через целит. Фильтрат концентрировали в вакууме с получением 0,9 г (100%) 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-она в виде твердого вещества белого цвета.
1.6: 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
К раствору 500 мг (2 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты в 12 мл диметилформамида добавляли 326 мг (2,4 ммоль) 1-гидроксибензотриазола и 462 мг (2,4 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида. После перемешивания при комнатной температуре в течение 10 минут, добавляли 560 мг (2,4 ммоль) 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-она. Потом перемешивали реакционную смесь при комнатной температуре в течение 18 часов, затем гидролизовали водным раствором гидрокарбоната натрия и разбавляли 20 мл этилацетата. Продукт экстрагировали этилацетатом и затем н-бутанолом. Органические фазы объединяли, промывали один раз насыщенным водным раствором гидрокарбоната натрия и один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток растворяли в смеси гептан/этилацетат, затем фильтровали и сушили в атмосфере азота. Получали 900 мг (97%) 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
1.7: 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
К раствору 400 мг (0,9 ммоль) 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в 12 мл диметилформамида добавляли 143 мг (1 ммоль) карбоната калия и 0,1 мл (1,3 ммоль) метилиодида. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы промывали один раз водой, потом насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали препаративной тонкослойной хроматографией, элюировали смесью дихлорметан/метанол 90/10. Получали 160 мг (39%) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества светло-желтого цвета.
1.8: 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 1)
К раствору 160 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона и 0,5 мл (1 ммоль) 2M водного раствора карбоната калия в 12 мл диметилформамида и 2 мл воды, предварительно дегазированному азотом, добавляли 19 мг (0,01 ммоль) тетракис(трифенилфосфин)палладия(0) и 265 мг (1,7 ммоль) 2,3-дифторфенилбороновой кислоты. Реакционную смесь нагревали при 90°C в течение 2 часов. Реакционную смесь обрабатывали добавлением воды, затем продукт экстрагировали три раза этилацетатом. Органическую фазу промывали водой, потом насыщенным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 95/5. Получали 60 мг (36%) 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,56-1,75 (м, 3H), 1,76-1,91 (м, 1H), 2,70 (т, J=12,8 Гц, 1H), 3,17 (т, J=12,8 Гц, 1H), 3,26 (с, 3H), 3,98 (д, J=13,5 Гц, 1H), 4,30 (д, J=3,9 Гц, 2H), 4,35-4,51 (м, 2H), 4,81 (с, 2H), 6,77 (д, J=8,0 Гц, 1H), 6,86 (т, J=7,5 Гц, 1H), 7,07-7,17 (м, 2H), 7,18-7,32 (м, 2H), 7,40-7,53 (м, 1H), 7,94 (с, 1H), 9,27 (с, 1H).
Пример 2: 5-(2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 2, соединение 2)
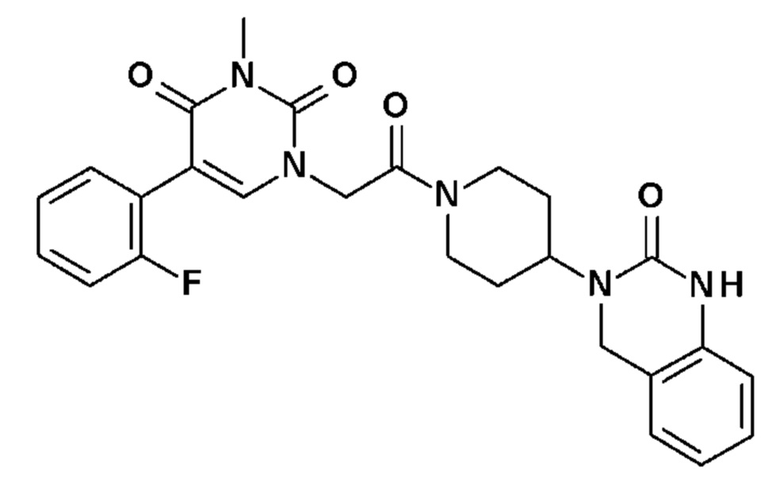
2.1: 1-бензгидрил-5-бром-1H-пиримидин-2,4-дион
К раствору 2 г (10,5 ммоль) 5-бром-1H-пиримидин-2,4-диона в 40 мл ацетонитрила добавляли 6,4 мл (26,2 ммоль) N,O-бис(триметилсилил)ацетамида. Реакционную смесь перемешивали до получения прозрачного раствора, затем добавляли 3,9 г (15,8 ммоль) бензгидрилбромида и 267 мг (1,1 ммоль) иода. Реакционную смесь нагревали с обратным холодильником в течение 5 часов и далее оставляли при комнатной температуре в течение 18 часов. Растворители концентрировали в вакууме, потом остаток растворяли в 50 мл этилацетата и 50 мл воды. Органическую фазу промывали один раз водой, затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт подвергали хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и затем 50/50. Получали 2,5 г (67%) 1-бензгидрил-5-бром-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
2.2: 1-Бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-дион
К раствору 500 мг (1,4 ммоль) 1-бензгидрил-5-бром-1H-пиримидин-2,4-диона в 10 мл диметилформамида добавляли 290 мг (2,1 ммоль) карбоната калия и 0,1 мл (2,1 ммоль) метилиодида. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом и органическую фазу промывали один раз водой, один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 490 мг (94%) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
2.3: 5-бром-3-метил-1H-пиримидин-2,4-дион
К раствору, охлажденному до 0°C, содержащему 2 мл метансульфоновой кислоты и 4,9 мл трифторуксусной кислоты, добавляли 490 мг (1,3 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона. Реакционную смесь перемешивали при 0°C и далее при комнатной температуре в течение 43 часов. Эту смесь выливали на 50 г льда, затем добавляли 150 мл насыщенного водного раствора гидрокарбоната натрия. Продукт экстрагировали три раза этилацетатом. Органические фазы промывали один раз водой, потом насыщенным водным раствором хлорида натрия и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3 Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3. Получали 195 мг (72%) 5-бром-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества светло-желтого цвета.
2.4: 3-[1-(2-гидроксиацетил)-пиперидин-4-ил]-3,4-дигидро-1H-хиназолин-2-он
К раствору 100 мг (1,3 ммоль) гидроксиуксусной кислоты в 10 мл диметилформамида добавляли 212 мг (1,6 ммоль) 1-гидроксибензотриазола и 307 мг (1,6 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида. Реакционную смесь перемешивали в течение 5 минут при комнатной температуре и добавляли 304 мг (1,6 ммоль) 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-она (полученный способом, описанным в примере 1.5). После перемешивания в течение двух часов при комнатной температуре, реакционную смесь гидролизовали насыщенным водным раствором гидрокарбоната натрия и разбавляли этилацетатом. Продукт дважды экстрагировали этилацетатом и один раз н-бутанолом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия. Эти фазы сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3. Получали 140 мг (35%) 3-[1-(2-гидроксиацетил)-пиперидин-4-ил]-3,4-дигидро-1H-хиназолин-2-она в виде твердого вещества белого цвета.
2.5: 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
К раствору 100 мг (0,5 ммоль) 5-бром-3-метил-1H-пиримидин-2,4-диона, 140 мг (0,5 ммоль) 3-[1-(2-гидроксиацетил)-пиперидин-4-ил]-3,4-дигидро-1H-хиназолин-2-она и 321 мг (1,2 ммоль) трифенилфосфина в 10 мл тетрагидрофуранадобавляли 0,2 мл (1,2 ммоль) диизопропилазодикарбоксилата. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли 15 мл диэтилового эфира; суспензию перемешивали в течение 10 минут и потом фильтровали. Полученное твердое вещество промывали один раз диэтиловым эфиром. Полученное твердое вещество промывали один раз диэтиловым эфиром, затем сушили в печи в вакууме в течение 3 час. Получали 160 мг (74%) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
2.6: 5-(2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 2)
Аналогично примеру 1.8, используя 62 мг (0,4 ммоль) 2-фторфенилбороновой кислоты и 140 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона, получали 70 мг (50%) 5-(2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,57-1,70 (м, 3H), 1,83 (кв, J=12,4 Гц, 1H), 2,70 (т, J=12,6 Гц, 1H), 3,16 (т, J=12,6 Гц, 1H), 3,25 (с, 3H), 3,97 (д, J=13,7 Гц, 1H), 4,30 (д, J=4,1 Гц, 2H), 4,37-4,51 (м, 2H), 4,80 (с, 2H), 6,77 (дд, J=7,9, 1,2 Гц, 1H), 6,86 (т, J=7,5 Гц, 1H), 7,06-7,16 (м, 2H), 7,20-7,32 (м, 2H), 7,36-7,48 (м, 2H), 7,86 (с, 1H), 9,26 (с, 1H).
Пример 3: 5-(2,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 3)
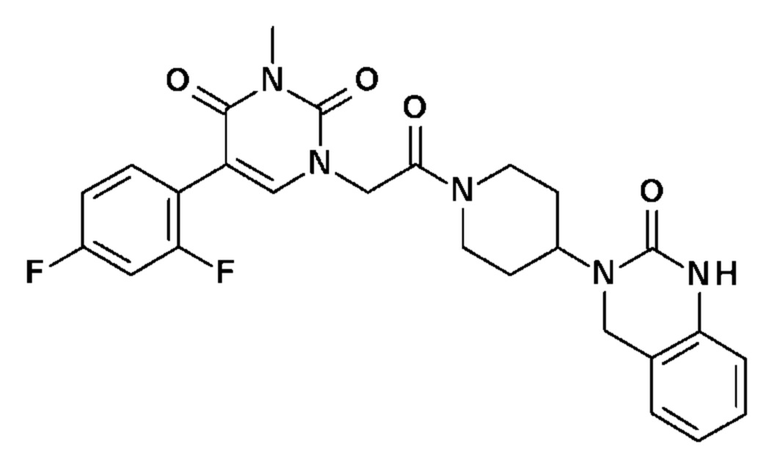
Аналогично примеру 1.8, используя 249 мг (1,6 ммоль) 2,4-дифторфенилбороновой кислоты и 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), получали 80 мг (51%) 5-(2,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,54-1,72 (м, 3H), 1,83 (кв, J=13,7 Гц, 1H), 2,69 (т, J=12,1 Гц, 1H), 3,16 (т, J=12,6 Гц, 1H), 3,25 (с, 3H), 3,97 (д, J=13,5 Гц, 1H), 4,29 (д, J=4,0 Гц, 2H), 4,42 (м, 2 H), 4,79 (с, 2H), 6,77 (д, J=7,8 Гц, 1H), 6,86 (т, J=7,5 Гц, 1H), 7,04-7,23 (м, 3H), 7,33 (т, J=9,8 Гц, 1H), 7,43 (кв, J=8,6 Гц, 1H), 7,85 (с, 1H), 9,26 (с, 1H).
Пример 4: 5-(3-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 4)
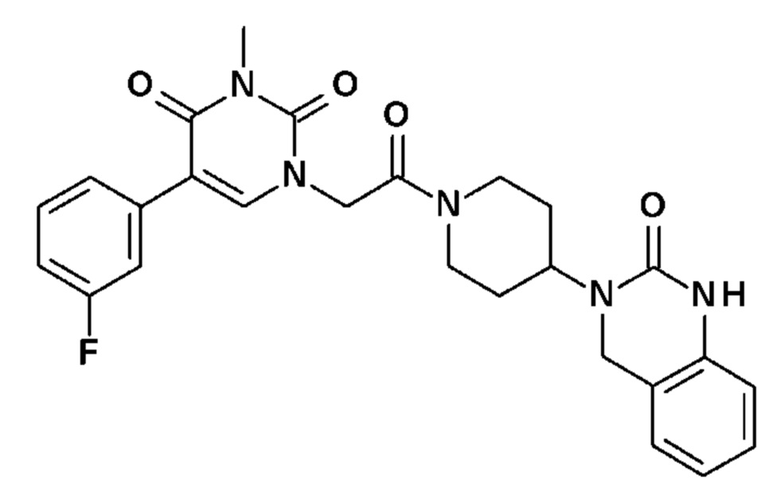
Аналогично примеру 1.8, используя 66 мг (0,5 ммоль) 3-фторфенилбороновой кислоты и 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), получали 30 мг (20%) 5-(3-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 240°C.
1H ЯМР (δ, ДМСО): 1,54-1,73 (м, 3H), 1,77-1,92 (м, 1H), 2,70 (т, J=12,0 Гц, 1H), 3,19 (т, J=13,0 Гц, 1H), 3,27 (с, 3H), 3,99 (д, J=13,5 Гц, 1H), 4,31 (д, J=4,0 Гц, 2H), 4,37-4,52 (м, 2H), 4,82 (д, J=3,7 Гц, 2H), 6,77 (д, J=7,9 Гц, 1H), 6,87 (т, J=7,5 Гц, 1H), 7,05-7,23 (м, 3H), 7,39-7,51 (м, 3H), 8,07 (с, 1H), 9,27 (с, 1H).
Пример 5: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-5-(1H-пиразол-3-ил)-1H-пиримидин-2,4-дион (схема реакции 1, соединение 5)
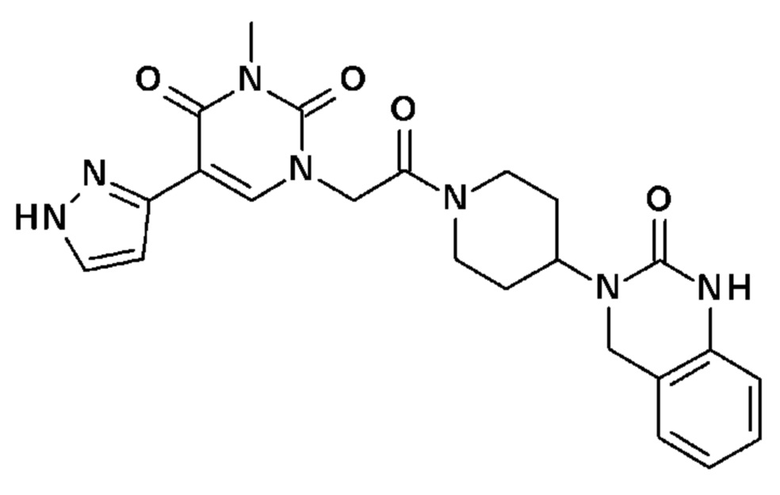
Аналогично примеру 1.8, используя 70 мг (0,6 ммоль) 1H-пиразол-3-илбороновой кислоты, 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), 131 мг (1,2 ммоль) карбоната натрия и 13 мг (0,02 ммоль) комплекса дихлорметана и 1,1'-бис(дифенилфосфино)ферроцен-дихлорпалладия(II), получали 10 мг (7%) 3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-5-(1H-пиразол-3-ил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
ВЭЖХ анализ (колонка Kinetex C18, 150×3 мм, 2,6 мкм, элюент: вода/ацетонитрил с 0,1% муравьиной кислотой, время анализа=30 мин): время удерживания=12,64 мин.
Пример 6: 5-(3-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 6)
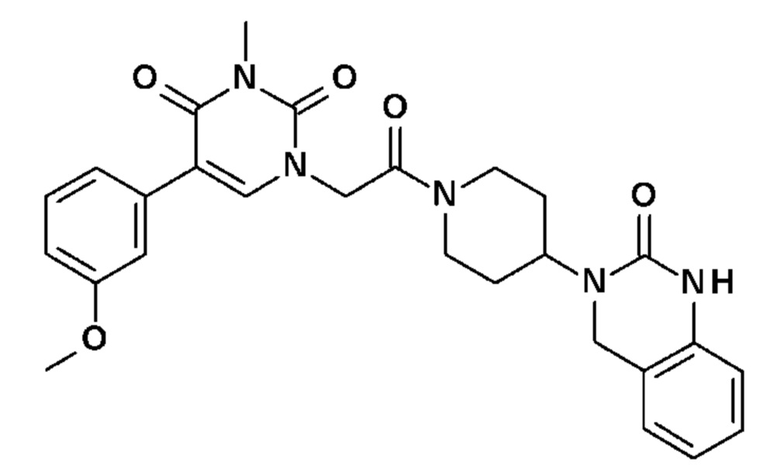
Аналогично примеру 1.8, используя 71 мг (0,5 ммоль) 3-метоксифенилбороновой кислоты и 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), получали 120 мг (77%) 5-(3-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 251°C.
1H ЯМР (δ, ДМСО): 1,55-1,74 (м, 3H), 1,84 (кв, J=12,3 Гц, 1H), 2,62-2,76 (м, 1H), 3,19 (т, J=13,0 Гц, 1H), 3,26 (с, 3H), 3,78 (с, 3H), 3,93-4,03 (м, 1H), 4,31 (д, J=3,9 Гц, 2H), 4,42-4,46 (м, 2 H), 4,81 (д, J=3,8 Гц, 2H), 6,77 (д, J=7,8 Гц, 1H), 6,82-6,94 (м, 2H), 7,06-7,20 (м, 4H), 7,32 (т, J=8,0 Гц, 1H), 7,96 (с, 1H), 9,27 (с, 1H).
Пример 7: 5-(3-гидроксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 7)
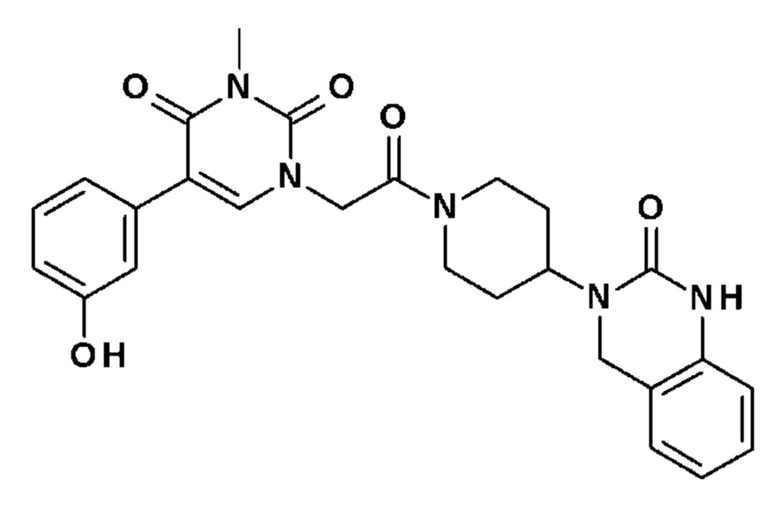
Аналогично примеру 1.8, используя 217 мг (1,6 ммоль) 3-гидроксифенилбороновой кислоты и 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), получали 30 мг (20%) 5-(3-гидроксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета.
1H ЯМР (δ, ДМСО): 1,56-1,72 (м, 3H), 1,77-1,89 (м, 1H), 2,64-2,75 (м, 1H), 3,12-3,23 (м, 1H), 3,26 (с, 3H), 3,98 (д, J=13,2 Гц, 1H), 4,31 (д, J=4,0 Гц, 2H), 4,38-4,49 (м, 2H), 4,81 (с, 2H), 6,69-6,80 (м, 2H), 6,87 (т, J=7,4 Гц, 1H), 6,94 (д, J=7,7 Гц, 1H), 7,02 (д, J=2,0 Гц, 1H), 7,08-7,24 (м, 3H), 7,88 (с, 1H), 9,26 (с, 1H), 9,44 (с, 1H).
Пример 8: 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 8)
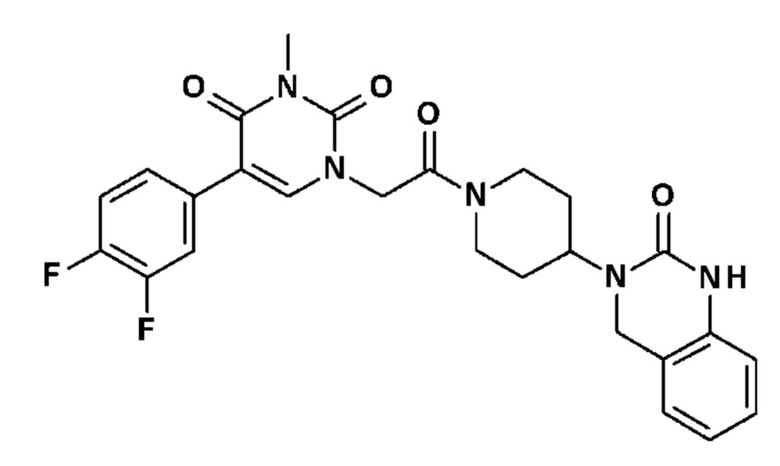
Аналогично примеру 1.8, используя 245 мг (1,6 ммоль) 3,4-дифторфенилбороновой кислоты и 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5). После кристаллизации в смеси гептан/этилацетат 70/30, фильтрования и сушки в вакууме в течении 24 часов, получали 40 мг (25%) 5-(3,4-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 153°C.
1H ЯМР (δ, ДМСО): 1,55-1,74 (м, 3H), 1,77-1,90 (м, 1H), 2,64-2,77 (м, 1H), 3,19 (т, J=13,0 Гц, 1H), 3,27 (с, 3H), 3,99 (д, J=13,1 Гц, 1H), 4,31 (д, J=3,9 Гц, 2H), 4,36-4,52 (м, 2H), 4,81 (д, J=4,5 Гц, 2H), 6,77 (д, J=7,8 Гц, 1H), 6,87 (т, J=7,5 Гц, 1H), 7,11 (д, J=8,0 Гц, 2H), 7,40-7,56 (м, 2H), 7,60-7,74 (м, 1H), 8,06 (с, 1H), 9,27 (с, 1H).
Пример 9: 5-циклогекс-1-енил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 2, соединение 9)
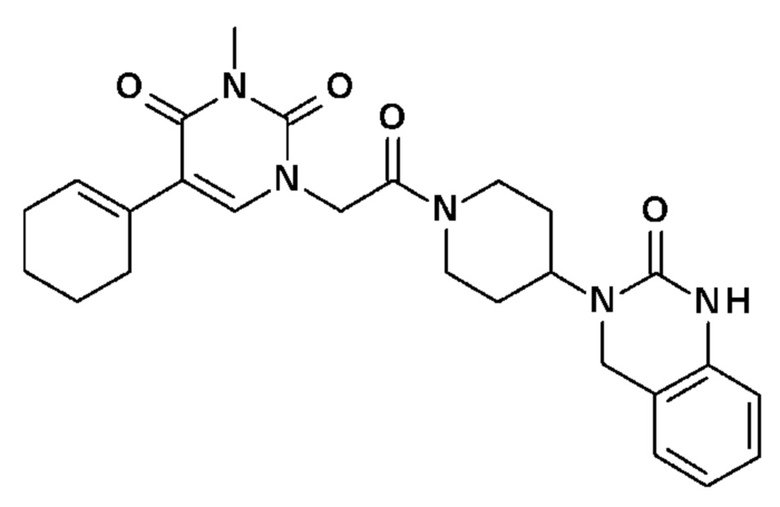
В 3 мл метанола растворяли 50 мг (0,1 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), 33,9 мкл (0,16 ммоль) пинакол 1-циклогексенилбороната, 30,1 мкл (0,2 ммоль) 5,2M раствор метоксида натрия и 3,7 мг (0,01 ммоль) хлорида бис(трифенилфосфин палладия(II) и нагревали при 70°C в герметично закрытом сосуде в микроволновой печи в течение 5 минут. Реакционную смесь гидролизовали и далее разбавляли этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 99/1, и затем обрабатывали в смеси гептан/этилацетат 80/20 и фильтровали. Полученные твердые вещества сушили в вакууме в течение 72 часов с получением 35 мг (65%) 5-циклогекс-1-енил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
1H ЯМР (δ, ДМСО): 1,56-1,68 (м, 7H), 1,75-1,90 (м, 1H), 2,10-2,18 (м, 2H), 2,20-2,30 (м, 2H), 2,49-2,51 (м, 1H), 3,15-3,17 (м, 1H), 3,18 (с, 3H), 3,90-4,00 (м, 1H), 4,30 (д, J=4,4 Гц, 2H), 4,35-4,48 (м, 2H), 4,74 (с, 2H), 6,17 (м, 1H), 6,77 (д, J=7,7 Гц, 1H), 6,87 (м, 1H), 7,11 (д, J=7,5 Гц, 2H), 7,53 (с, 1H), 9,26 (с, 1H).
Пример 10: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-5-фенил-1H-пиримидин-2,4-дион (схема реакции 1, соединение 10)
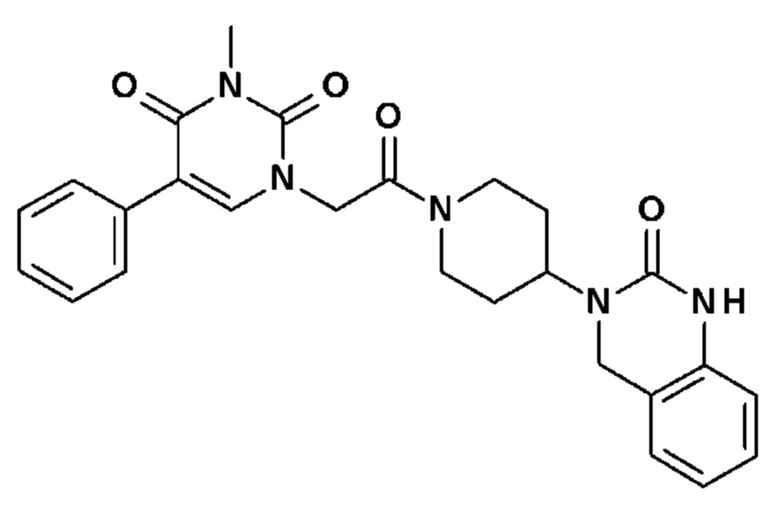
Аналогично примеру 1.8, используя 61 мг (0,5 ммоль) фенилбороновую кислоту и 160 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.5), получали 110 мг (70%) 3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-5-фенил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 220°C.
1H ЯМР (δ, ДМСО): 1,57-1,73 (м, 3H), 1,77-1,90 (м, 1H), 2,70 (т, J=12,7 Гц, 1H), 3,18 (т, J=12,5 Гц, 1H), 3,27 (с, 3H), 3,99 (д, J=13,5 Гц, 1H), 4,31 (д, J=3,8 Гц, 2H), 4,37-4,49 (м, 2H), 4,82 (д, J=2,5 Гц, 2H), 6,78 (д, J=8 Гц, 1H), 6,87 (т, J=7,4 Гц, 1H), 7,08-7,14 (м, 2H), 7,29-7,36 (м, 1H), 7,38-7,45 (м, 2H), 7,51-7,58 (м, 2H), 7,93 (с, 1H), 9,27 (с, 1H).
Пример 11: 5-(2,3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-дион (схема реакции 1, соединение 11)
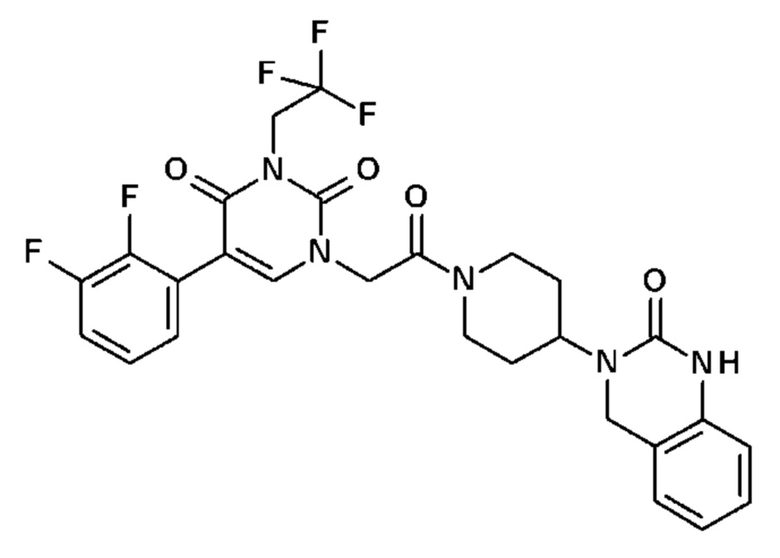
11.1: 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-дион
Аналогично примеру 1.7, используя 230 мг (0,5 ммоль) 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 1.6) и 0,1 мл (0,8 ммоль) 1,1,1-трифтор-2-иодэтана, получали 140 мг (51%) 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
11,2: 5-(2,3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-дион (соединение 11)
Аналогично примеру 1.8, используя 203 мг (1,3 ммоль) 2,3-дифторфенилбороновой кислоты и 140 мг (0,3 ммоль) 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-диона, получали 75 мг (50%) 5-(2,3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-3-(2,2,2-трифторэтил)-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
1H ЯМР (δ, ДМСО): 1,55-1,75 (м, 3H), 1,76-1,92 (м, 1H), 2,71 (т, J=12,8 Гц, 1H), 3,17 (т, J=12,8 Гц, 1H), 3,97 (д, J=13,4 Гц, 1H), 4,30 (д, J=3,5 Гц, 2H), 4,37-4,52 (м, 2H), 4,74 (кв, J=9,1 Гц, 2H), 4,85 (д, J=2,8 Гц, 2H), 6,77 (д, J=7,8 Гц, 1H), 6,86 (т, J=7,2 Гц, 1H), 7,07-7,17 (м, 2H), 7,20-7,34 (м, 2H), 7,43-7,55 (м, 1H), 8,04 (с, 1H), 9,26 (с, 1H).
Пример 12: 5-(2,3-дифторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (схема реакции 1, соединение 12)
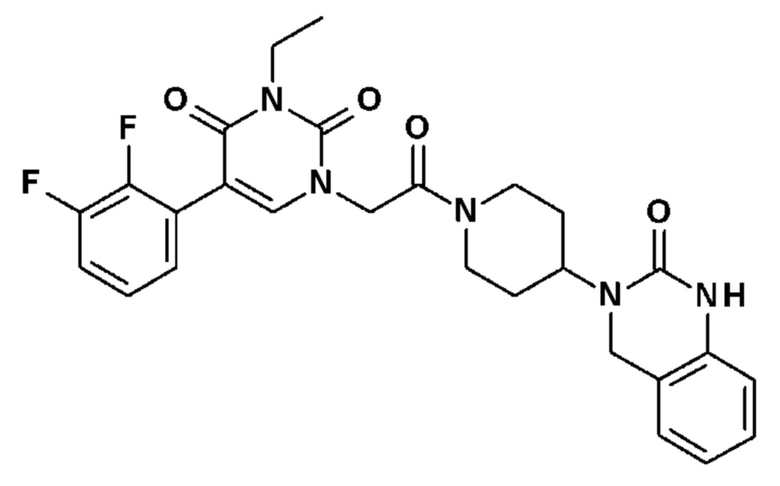
12.1: 5-бром-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 1.7, используя 240 мг (0,5 ммоль) 5-бром-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 1.6) и 86 мкл (1,1 ммоль) иодэтана, получали 150 мг (59%) 5-бром-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
12.2: 5-(2,3-дифторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 12)
Аналогично примеру 1.8, используя 241 мг (1,5 ммоль) 2,3-дифторфенилбороновой кислоты и 150 мг (0,3 ммоль) 5-бром-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона, получали 75 мг (48%) 5-(2,3-дифторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
1H ЯМР (δ, ДМСО): 1,14 (т, J=7,0 Гц, 3H), 1,54-1,75 (м, 3H), 1,75-1,93 (м, 1H), 2,70 (т, J=12,8, 3,2 Гц, 1H), 3,17 (т, J=12,9 Гц, 1H), 3,82-4,02 (м, 3H), 4,30 (д, J=4,1 Гц, 2H), 4,37-4,53 (м, 2H), 4,80 (с, 2H), 6,77 (д, J=7,8 Гц, 1H), 6,86 (т, J=7,4 Гц, 1H), 7,05-7,19 (м, 2H), 7,18-7,35 (м, 2H), 7,39-7,51 (м, 1H), 7,92 (с, 1H), 9,27 (с, 1H).
Пример 13: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 1, соединение 13)
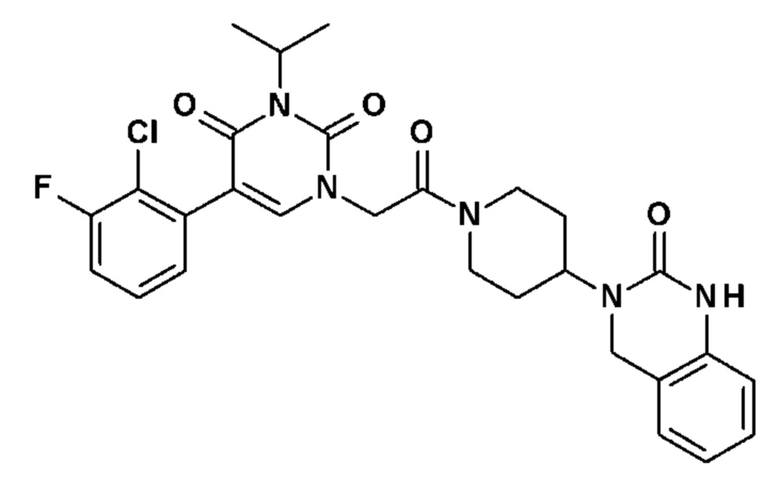
13.1: 2-(5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К раствору 25 г (128 ммоль) 5-бромурацила и 17,7 г (128 ммоль) карбоната калия в 441 мл диметилформамида добавляли 12 мл (128 ммоль) метилбромацетата. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Указанную смесь гидролизовали и разбавляли этилацетатом. Водную фазу нейтрализовали 5%-ным водным раствором лимонной кислоты, затем продукт экстрагировали один раз этилацетатом и три раза н-бутанолом. Органические фазы объединяли, промывали дважды водой, затем насыщенным водным раствором хлорида натрия и концентрировали в вакууме. Полученный неочищенный продукт обрабатывали в 150 мл этилацетата и нагревали при 80°C в течение 10 минут. После снижения температуры до значения комнатной температуры, суспензию фильтровали, и полученное твердое вещество промывали диэтиловым эфиром, затем сушили в печи в вакууме в течение 20 часов. Получали 17 г (50%) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
13.2: (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К охлажденному до 0°C раствору 6,5 г (24,7 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в 130 мл диметилформамида добавляли частями 1 г (30 ммоль) гидрида натрия. Реакционную смесь перемешивали в течение 5 минут и затем добавляли 3,5 мл (37 ммоль) 2-бромпропана. После перемешивания в течение 30 минут при комнатной температуре, затем в течение 4 час при 50°C, добавляли 2,8 мл (30 ммоль) 2-бромпропана и реакционную смесь нагревали при 50°C в течение еще 2 часов и в течение 20 часов при комнатной температуре. Реакционную смесь гидролизовали и далее разбавляли этилацетатом. Органическую фазу промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью гептан/этилацетат 50/50. Получали 3,5 г (46%) 2-(5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества кремового цвета.
13.3: [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору, предварительно дегазированному азотом в течении 5 минут, содержащему 600 мг (2 ммоль) 2-(5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата, 625 мг (5,9 ммоль) карбоната натрия и 411 мг (2,4 ммоль) 2-хлор-3-фторфенил бороновой кислоты в 60 мл 1,4-диоксана и 6 мл воды добавляли 80 мг (0,1 ммоль) комплекса дихлорметана и 1,1'-бис(дифенилфосфино)ферроцен-дихлорпалладия(II). Реакционную смесь нагревали при 100°C в течение 30 минут и затем добавляли 343 мг (2 ммоль) 2-хлор-3-фторфенил бороновой кислоты. Смесь нагревали при 100°C в течение еще одного часа. Добавляли 3 мл (3 ммоль) 1M водного раствора гидроксида лития и 3 мл воды. Температуру реакционной смеси снижали до значения комнатной температуры и перемешивали в течение 1 часа. Эту смесь гидролизовали и далее разбавляли этилацетатом. Значение рН водной фазы доводили до кислого значения рН с помощью 1н водного раствора соляной кислоты. Продукт экстрагировали этилацетатом. Органическую фазу промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Продукт обрабатывали в диэтиловом эфире и концентрировали в вакууме. Получали 680 мг (100%) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
13.4: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 13)
К раствору, предварительно перемешанному в течении 5 минут, содержащему 150 мг (0,4 ммоль) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, 70 мг (0,5 ммоль) 1-гидроксибензотриазола и 101,3 мг (0,5 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида в 6 мл диметилформамида, добавляли 112 мг (0,5 ммоль) 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-она (полученный способом, описанным в примере 1.5) и 0,1 мл (0,5 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь гидролизовали насыщенным водным раствором гидрокарбоната натрия и далее разбавляли этилацетатом. Органическую фазу один раз промывали насыщенным водным раствором гидрокарбоната натрия, один раз водой и один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, затем фильтровали и концентрировали в вакууме. Неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 95/5, затем перекристаллизовывали из этилацетата. Получали 39 мг (16%) 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6 H); 1,64-1,68 (м, 3 H); 1,82-1,85 (м, 1 H); 2,67-2,73 (м, 1 H); 3,17 (т, J=13,1 Гц, 1 H); 3,96 (д, J=13,6 Гц, 1 H); 4,30 (д, J=3,3 Гц, 2 H); 4,39-4,48 (м, 2 H); 4,76 (с, 2 H); 5,07-5,14 (м, 1 H); 6,77-6,79 (м, 1 H); 6,84-6,88 (м, 1 H); 7,09-7,15 (м, 2 H); 7,21-7,23 (м, 1 H); 7,43-7,46 (м, 2 H); 7,79 (с, 1 H); 9,24 (с, 1 H).
Пример 14: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 1, соединение 14)
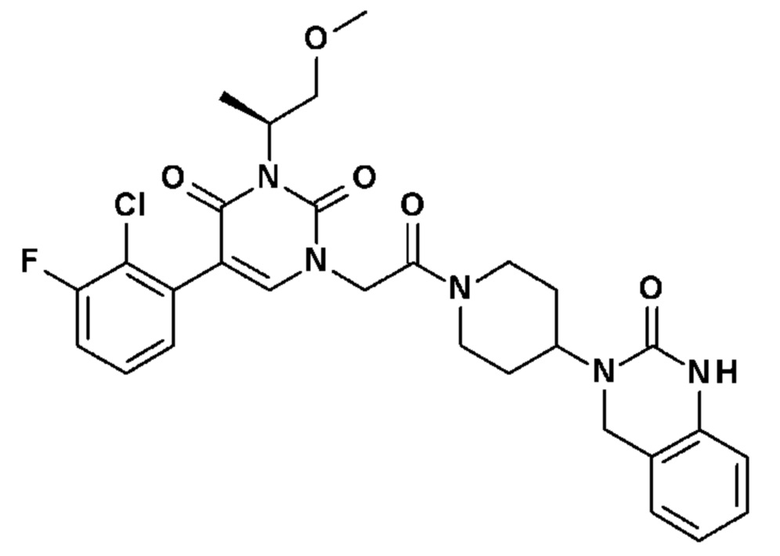
14.1: [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 2.5, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата 0,4 мл (4 ммоль) (R)-1-метокси-пропан-2-ола и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 60/40, получали 1,2 г (78%) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
14.2: [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 1.8, используя 250 мг (1,4 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 400 мг (1,2 ммоль) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 345 мг (78%) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
14.3: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 14)
Аналогично примеру 13.4, используя 345 мг (0,9 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, получали 170 мг (30%) 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,34 (д, J=7,0 Гц, 3H); 1,66 (м, 3H); 1,82-1,85 (м, 1H); 2,68-2,74 (м, 1H); 3,17 (т, J=13,0 Гц, 1H); 3,24 (с, 3H); 3,53-3,57 (м, 1H); 3,90-3,98 (м, 2H); 4,29-4,30 (м, 2H); 4,42-4,48 (м, 2H); 4,76 (с, 2H); 5,14-5,16 (м, 1H); 6,77-6,79 (м, 1H); 6,84-6,88 (м, 1H); 7,09-7,15 (м, 2H); 7,21-7,23 (м, 1H); 7,44-7,47 (м, 2H); 7,81 (с, 1H); 9,24 (с, 1H).
Пример 15: 5-(2,3-дифторфенил)-3-метил-1-[1-метил-2-оксо-2-[4-(2-оксо-1,4-дигидрохиназолин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион (реакционная схема № 2, соединение 15)
15.1: 1-бензгидрил-5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 1.8, используя 4,3 г (27 ммоль) 2,3-дифторфенилбороновой кислоты и 2 г (5,4 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2), получали 1,6 г (73%) 1-бензгидрил-5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
15.2: 5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 1,6 г (4 ммоль) 1-бензгидрил-5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона, получали 900 мг (96%) 5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
15.3: 3-[1-(2-бром-пропионил)-пиперидин-4-ил]-3,4-дигидро-1H-хиназолин-2-он
Аналогично примеру 2.4, используя 0,2 мл (2,7 ммоль) 2-бромпропионовой кислоты и 300 мг (1,2 ммоль) 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-она (полученный способом, описанным в примере 1.5), получали 400 мг (94%) 3-[1-(2-бром-пропионил)-пиперидин-4-ил]-3,4-дигидро-1H-хиназолин-2-она в виде твердого вещества кремового цвета.
15.4: 5-(2,3-дифторфенил)-3-метил-1-[1-метил-2-оксо-2-[4-(2-оксо-1,4-дигидрохиназолин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион (соединение 15)
Аналогично примеру 2.2, используя 50 мг (0,2 ммоль) 5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона и 72 мг (0,2 ммоль) 3-[1-(2-бром-пропионил)-пиперидин-4-ил]-3,4-дигидро-1H-хиназолин-2-она, и после очистки неочищенного остатка хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 98/2, получали 20 мг (18%) 5-(2,3-дифторфенил)-3-метил-1-[1-метил-2-оксо-2-[4-(2-оксо-1,4-дигидрохиназолин-3-ил)-1-пиперидил]этил]пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,43-1,73 (м, 7H), 2,62-2,78 (м, 1H), 3,25 (с, 1H), 3,29 (с, 3H); 4,06-4,21 (м, 1H), 4,22-4,36 (м, 2H), 4,36-4,51 (м, 2H), 5,64-5,76 (м, 1H), 6,77 (д, J=7,8 Гц, 1H), 6,86 (т, J=7,6 Гц, 1H), 7,02-7,17 (м, 2H), 7,20-7,32 (м, 2H), 7,38-7,51 (м, 1H), 7,92 (с, 1H), 9,26 (с, 1H).
Пример 16: 5-(2,3-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 16)
16.1: (1-бензил-пиперидин-4-ил)-[2-(2-нитрофенил)-этил]-амин
К 4 г (17,4 ммоль) 1-(2-бромэтил)-2-нитробензола добавляли 8 мл (40 ммоль) 1-бензил-пиперидин-4-иламина и смесь нагревали при 100°C в течение 18 часов. После охлаждения добавляли диэтиловый эфир, смесь фильтровали и фильтрат концентрировали. Неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гептан 60/40 и затем смесью дихлорметан/метанол/аммиак 95/3/2. Получали 4,9 г (82%) (1-бензил-пиперидин-4-ил)-[2-(2-нитрофенил)-этил]-амина в виде масла оранжевого цвета.
16.2: [2-(2-аминофенил)-этил]-(1-бензил-пиперидин-4-ил)-амин
Аналогично примеру 1.5, используя 4,8 г (14 ммоль) (1-бензил-пиперидин-4-ил)-[2-(2-нитрофенил)-этил]-амина, 140 мг оксида платины (10 моль%) и после очистки остатка хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/аммиак 90/8/2, получали 4,6 г (100%) [2-(2-аминофенил)-этил]-(1-бензил-пиперидин-4-ил)-амина в виде масла коричневого цвета.
16.3: 3-(1-бензил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично примеру 1.4, используя 1 г (6,5 ммоль) [2-(2-аминофенил)-этил]-(1-бензил-пиперидин-4-ил)-амина, получали 3,9 г (78%) 3-(1-бензил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде порошка белого цвета.
16.4: 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично примеру 1.5, используя 3,7 г (11 ммоль) 3-(1-бензил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, помещая реакционную смесь в атмосферу водорода при давлении 5 бар (0,5 МПа), получали 2,6 г (96%) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде порошка белого цвета.
16.5: 1-бензгидрил-5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 1.8, используя 2 г (5,4 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2) и 4,3 г (27 ммоль) 2,3-дифторфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 80/20, получали 1,6 г (73%) 1-бензгидрил-5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
16.6: 5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 2,3, используя 1,6 г (4 ммоль) 1-бензгидрил-5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона и после растирания неочищенного остатка в диэтиловом эфире, фильтрования и сушки в атмосфере азота, получали 900 мг (96%) 5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
16.7: [5-(2,3-дифторфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 13.1, используя 450 мг (1,9 ммоль) 5-(2,3-дифторфенил)-3-метил-1H-пиримидин-2,4-диона и 0,2 мл (2,1 ммоль) метилхлорацетата, получали 475 мг (81%) [5-(2,3-дифторфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
16.8: [5-(2,3-дифторфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору 475 мг (1,5 ммоль) [5-(2,3-дифторфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 15 мл тетрагидрофурана и 3 мл воды добавляли 2,3 мл (2,3 ммоль) 1н водного раствора гидроксида лития. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов,, затем доводили значение pH до значения, равного 6, добавлением 4 мл 1н водного раствора уксусной кислоты. Продукт экстрагировали этилацетатом. Органическую фазу промывали водой, затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 400 мг (88%) [5-(2,3-дифторфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
16.9: 5-(2,3-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 16)
Аналогично примеру 1.6, используя 100 мг (0,3 ммоль) [5-(2,3-дифторфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 100 мг (0,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) и после кристаллизации в смеси гептан/этилацетат 70/30, получали 120 мг (67%) 5-(2,3-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 160°C.
1H ЯМР (δ, ДМСО): 1,46-1,62 (м, 1H), 1,62-1,82 (м, 3H), 2,67 (т, J=16 Гц, 1H), 2,89 (т, J=4,9 Гц, 2H), 3,15 (т, J=16 Гц, 1H), 3,25 (с, 3H), 3,33-3,41 (м, 2H), 3,95 (д, J=13,5 Гц, 1H), 4,27-4,37 (м, 1H), 4,41 (д, J=8 Гц, 1H), 4,79 (с, 2H), 6,73-6,85 (м, 1H), 6,96-7,10 (м, 3H), 7,16-7,34 (м, 2H), 7,38-7,55 (м, 1H), 7,93 (с, 1H), 8,54 (с, 1H).
Пример 17: 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 17)
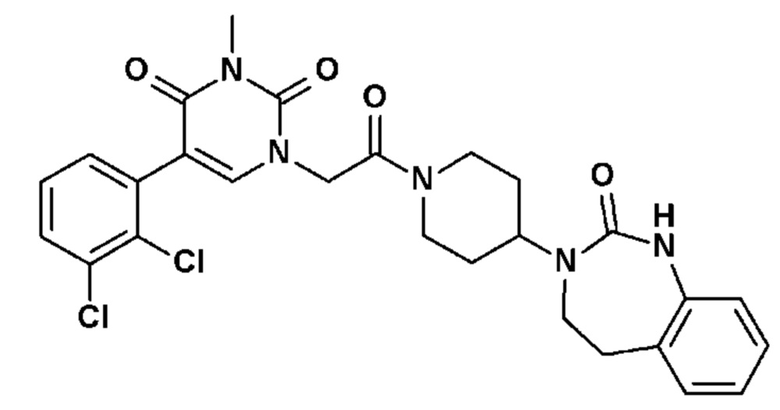
17.1: (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 13.1, используя 1,5 г (7,1 ммоль) 5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.3) и 0,7 мл (7,8 ммоль) метилхлорацетата, 1,6 г (79%) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата, получали в виде твердого вещества белого цвета.
17.2: (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусная кислота
Аналогично примеру 16.8, используя 1,6 г (5,6 ммоль) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата, получали 1,1 г (76%) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты в виде твердого вещества белого цвета.
17.3: 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 1.6, используя 960 мг (3,7 ммоль) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты и 895 мг (3,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 1,7 г (95%) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
17.4: 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 17)
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона и 58 мг (0,3 ммоль) 2,3-дихлорфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 99/1, получали 40 мг (35%) 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,39-1,53 (м, 1H), 1,55-1,72 (м, 3H), 2,61 (т, J=12,4 Гц, 1H), 2,77-2,88 (м, 2H), 3,08 (т, J=12,7 Гц, 1H), 3,18 (с, 3H), 3,27-3,34 (м, 2H), 3,87 (д, J=13,6 Гц, 1H), 4,24-4,34 (м, 1H), 4,35 (д, J=12,9 Гц, 1H), 4,70 (д, J=3,4 Гц, 2H), 6,66-6,80 (м, 1H), 6,89-7,04 (м, 3H), 7,26 (дд, J=7,7, 1,6 Гц, 1H), 7,36 (т, J=7,8 Гц, 1H), 7,62 (дд, J=8,1, 1,6 Гц, 1H), 7,76 (с, 1H), 8,48 (с, 1H).
Пример 18: 5-(2-хлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидробензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 18)
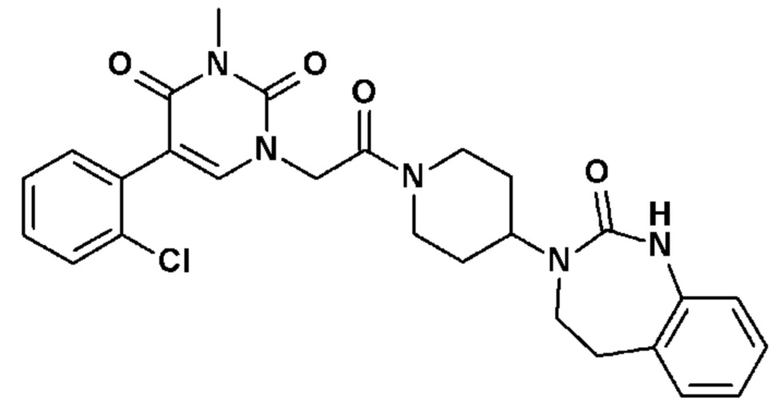
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3), и 48 мг (0,3 ммоль) 2-хлорфенилбороновой кислоты, получали 40 мг (38%) 5-(2-хлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5 тетрагидробензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 175°C.
1H ЯМР (δ, ДМСО): 1,40-1,55 (м, 1H), 1,58-1,70 (м, 3H), 2,55-2,68 (м, 1H), 2,82 (т, J=4,7 Гц, 2H), 3,05-3,12 (м, 1H), 3,18 (с, 3H), 3,30 (т, J=4,4 Гц, 2H), 3,88 (м, 1H), 4,20-4,30 (м, 1H), 4,38 (м, 1H), 4,70 (д, J=4,2 Гц, 2H), 6,72-6,75 (м, 1H), 6,95-6,98 (м, 3H), 7,26-7,28 (м, 1H), 7,31-7,36 (м, 2H), 7,46-7,48 (м, 1H), 7,71 (с, 1H), 8,47 (с, 1H).
Пример 19: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-(2-трифторметоксифенил)-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 19)
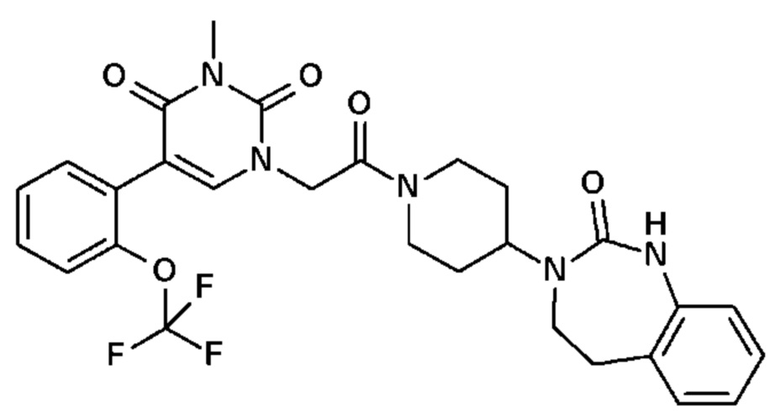
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3), и 63 мг (0,3 ммоль) 2-(трифторметокси)бензолбороновой кислоты, 40 мг (34%) 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-(2-трифторметоксифенил)-1H-пиримидин-2,4-диона получали в виде твердого вещества розового цвета с температурой плавления 235°C.
1H ЯМР (δ, ДМСО): 1,40-1,55 (м, 1H), 1,58-1,72 (м, 3H), 2,55-2,68 (м, 1H), 2,82 (т, J=4,5 Гц, 2H), 3,05-3,15 (м, 1H), 3,18 (с, 3H), 3,30 (т, J=4,5 Гц, 2H), 3,90 (м, 1H), 4,20-4,30 (м, 1H), 4,35 (м, 1H), 4,71 (с, 2H), 6,71-6,75 (м, 1H), 6,95-6,98 (м, 3H), 7,33-7,40 (м, 3H), 7,44-7,48 (м, 1H), 7,74 (с, 1H), 8,47 (с, 1H).
Пример 20: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-тиофен-3-ил-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 20)
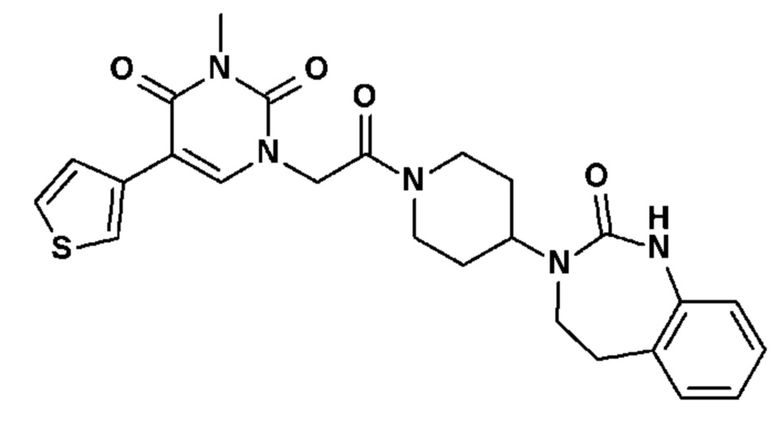
Аналогично примеру 9, используя 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3), и 59 мг (0,5 ммоль) тиофен-3-бороновой кислоты, получали 70 мг (46%) 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-тиофен-3-ил-1H-пиримидин-2,4-диона в виде твердого вещества розового цвета с температурой плавления 283°C.
1H ЯМР (δ, ДМСО): 1,40-1,55 (м, 1H), 1,58-1,70 (м, 3H), 2,60-2,68 (м, 1H), 2,83 (т, J=4,5 Гц, 2H), 3,05-3,15 (м, 1H), 3,20 (с, 3H), 3,32 (т, J=4,6 Гц, 2H), 3,85-3,95 (м, 1H), 4,20-4,30 (м, 1H), 4,35-4,40 (м, 1H), 4,72 (д, J=4,3 Гц, 2H), 6,72-6,76 (м, 1H), 6,95-6,98 (м, 3H), 7,37 (дд, J=1,2-5 Гц, 1H), 7,52 (дд, J=3,0-5,1 Гц, 1H), 7,91 (дд, J=1,2-3 Гц, 1H), 8,10 (с, 1H), 8,48 (с, 1H).
Пример 21: 5-(2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 21)
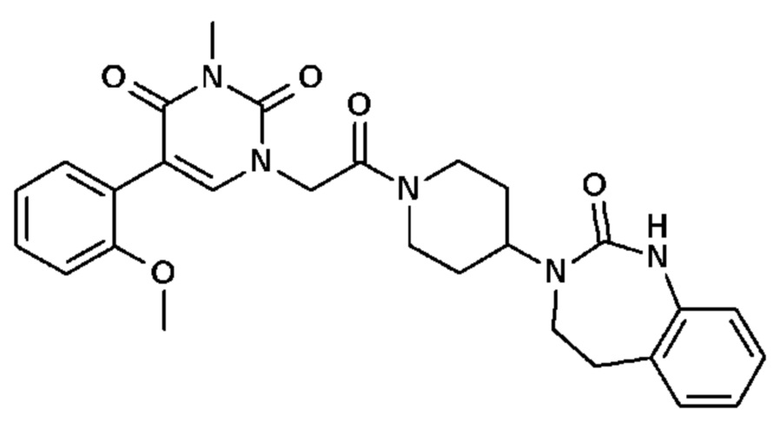
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 47 мг (0,3 ммоль) 2-метоксифенилбороновой кислоты, получали 25 мг (24%) 5-(2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 250°C.
1H ЯМР (δ, ДМСО): 1,40-1,55 (м, 1H), 1,56-1,72 (м, 3H), 2,55-2,65 (м, 1H), 2,82 (т, J=4,6 Гц, 2H), 3,05-3,14 (м, 1H), 3,15 (с, 3H), 3,29 (т, J=4,9 Гц, 2H), 3,67 (с, 3H), 3,88 (м, 1H), 4,20-4,30 (м, 1H), 4,35 (м, 1H), 4,68 (д, J=5,8 Гц, 2H), 6,70-6,78 (м, 1H), 6,90 (м, 1H), 6,95-7,00 (м, 4H), 7,10 (дд, J=1,72-7,4 Гц, 1H), 7,30 (м, 1H), 7,57 (с, 1H), 8,47 (с, 1H).
Пример 22: 5-(3-хлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 22)
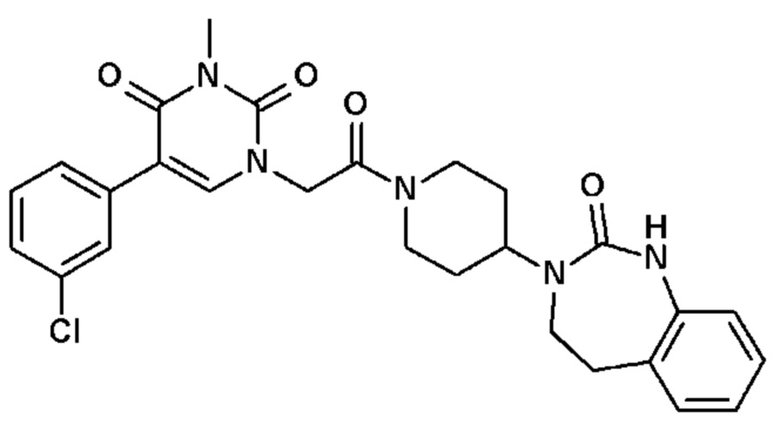
Аналогично примеру 1.8, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3), и 48 мг (0,3 ммоль) 3-хлорфенилбороновой кислоты, получали 55 мг (52%) 5-(3-хлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 220°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,62-1,70 (м, 3H), 2,69 (м, 1H), 2,90 (т, J=4,8 Гц, 2H), 3,26 (м, 1H), 3,33 (с, 3H), 3,38 (т, J=4,6 Гц, 2H), 3,95 (м, 1H), 4,30-4,40 (м, 1H), 4,45 (м, 1H), 4,81 (с, 2H), 6,79-6,82 (м, 1H), 7,03-7,05 (м, 3H), 7,38-7,41 (м, 1H), 7,45 (т, J=7,9 Гц, 1H), 7,55-7,65 (м, 1H), 7,65 (д, J=1,8 Гц, 1H), 8,05 (с, 1H), 8,55 (с, 1H).
Пример 23: 5-(3-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 23)
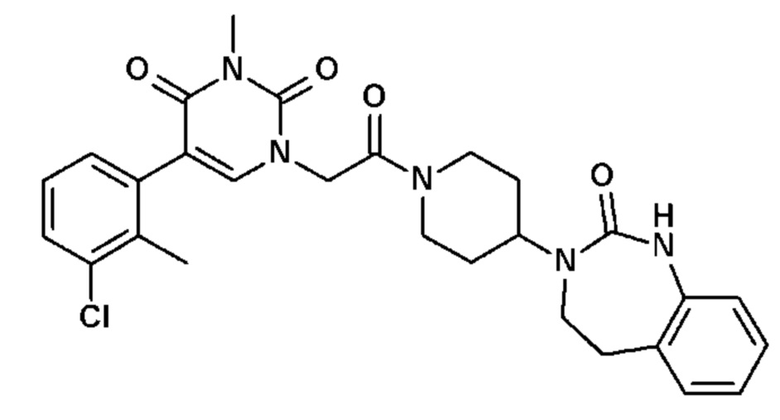
Аналогично примеру 9, используя 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 78 мг (0,5 ммоль) 3-хлор-2-метилфенилбороновой кислоты, получали 75 мг (46%) 5-(3-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 190°C.
1H ЯМР (δ, ДМСО): 1,45-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,20 (с, 3H), 2,70 (м, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,15 (м, 1H), 3,25 (с, 3H), 3,37 (т, J=4,8 Гц, 2H), 3,95 (м, 1H), 4,35 (м, 1H), 4,45 (м, 1H), 4,76 (д, J=2,6 Гц, 2H), 6,78-6,85 (м, 1H), 7,02-7,05 (м, 3H), 7,13 (д, J=6,8 Гц, 1H), 7,26 (т, J=7,8 Гц, 1H), 7,47 (д, J=7,2 Гц, 1H), 7,72 (с, 1H), 8,54 (с, 1H).
Пример 24: 5-(3-хлор-2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 24)
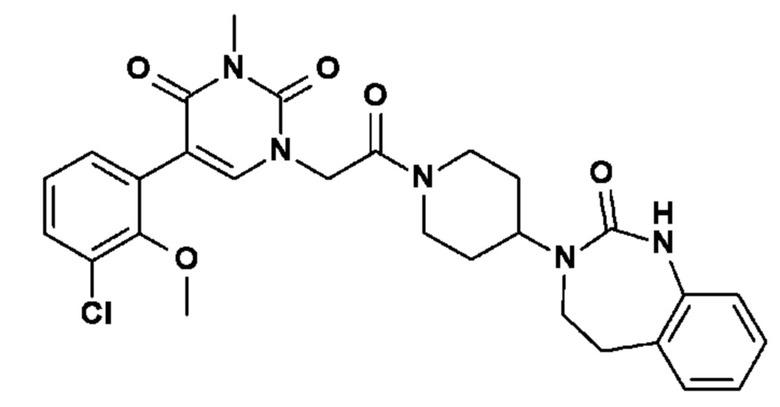
Аналогично примеру 9, используя 150 мг (0,3 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 86 мг (0,5 ммоль) 3-хлор-2-метоксифенилбороновой кислоты, получали 60 мг (36%) 5-(3-хлор-2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 260°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,68 (м, 1H), 2,89 (т, J=4,4 Гц, 2H), 3,15 (м, 1H), 3,26 (с, 3H), 3,37 (т, J=4,5 Гц, 2H), 3,65 (с, 3H), 3,95 (м, 1H), 4,30 (м, 1H), 4,45 (м, 1H), 4,78 (д, J=2,44 Гц, 2H), 6,78-6,85 (м, 1H), 7,02-7,05 (м, 3H), 7,18 (т, J=7,8 Гц, 1H), 7,27 (дд, J=1,7-7,7 Гц, 1H), 7,49 (дд, J=1,7-8,0 Гц, 1H), 7,80 (с, 1H), 8,54 (с, 1H).
Пример 25: 5-(2-метокси-3-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 25)
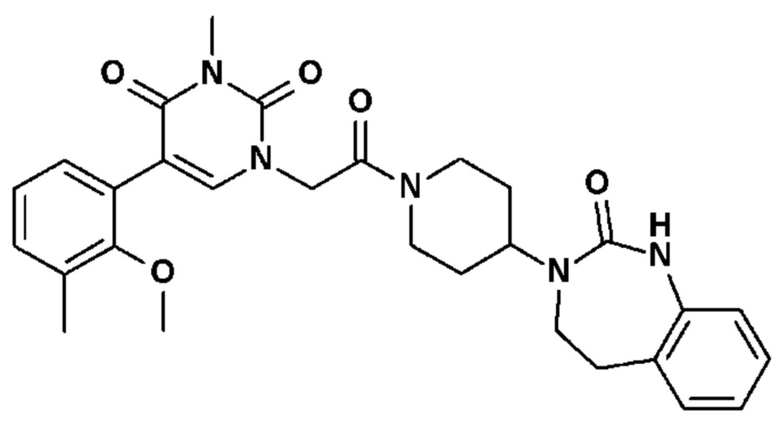
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 51 мг (0,3 ммоль) 2-метокси-3-метил фенилбороновой кислоты, получали 20 мг (17%) 5-(2-метокси-3-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 148°C.
1H ЯМР (δ, ДМСО): 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,26 (с, 3H), 2,70 (м, 1H), 2,90 (м, 2H), 3,15 (м, 1H), 3,25 (с, 3H), 3,40 (м, 2H), 3,53 (с, 3H), 3,95 (м, 1H), 4,35 (м, 1H), 4,45 (м, 1H), 4,77 (д, J=3,92 Гц, 2H), 6,85 (м, 1H), 7,00-7,08 (м, 4H), 7,10 (м, 1H), 7,20 (м, 1H), 7,72 (с, 1H), 8,54 (с, 1H).
Пример 26: 5-(3-хлор-2-гидроксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 26)
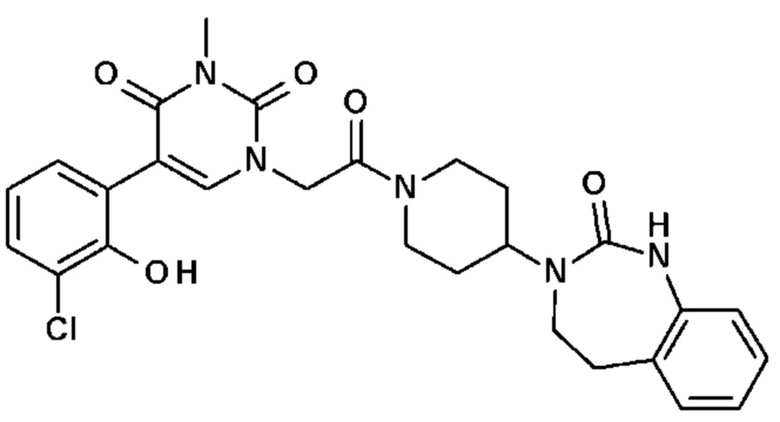
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 53 мг (0,3 ммоль) 3-хлор-2-гидроксифенилбороновой кислоты, получали 45 мг (41%) 5-(3-хлор-2-гидроксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 270°C.
1H ЯМР (δ, ДМСО): 1,45-1,58 (м, 1H), 1,65-1,76 (м, 3H), 2,68 (т, J=12,4 Гц, 1H), 2,90 (д, J=3,4 Гц, 2H), 3,12-3,18 (м, 1H), 3,24 (с, 3H), 3,36 (д, J=4,0 Гц, 2H), 3,96 (д, J=12,6 Гц, 1H), 4,30-4,35 (м, 1H), 4,42 (д, J=12,2 Гц, 1H), 4,71-4,83 (м, 2H), 6,52-6,78 (м, 1H), 6,86 (т, J=7,8 Гц, 1H), 7,02-7,09 (м, 4H), 7,37 (дд, J=1,2-7,9 Гц, 1H), 7,76 (с, 1H), 8,54 (с, 1H), 9,34 (с, 1H).
Пример 27: 5-(2,3-диметоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 27)
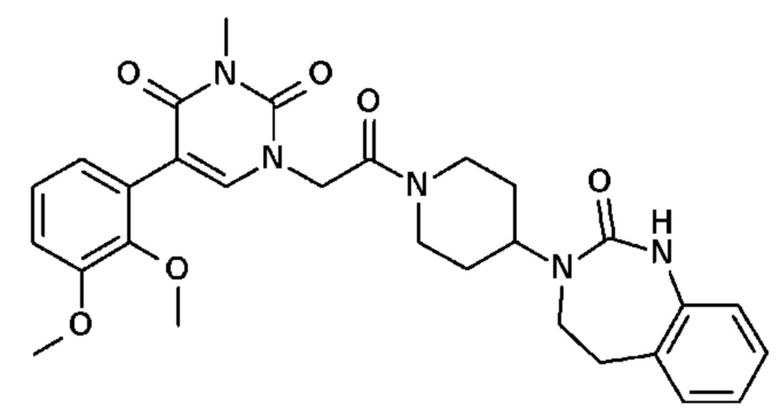
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 56 мг (0,3 ммоль) 2,3-диметоксифенилбороновой кислоты, получали 54 мг (60%) 5-(2,3-диметоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 236°C.
1H ЯМР (δ, ДМСО): 1,51-1,55 (м, 1H), 1,64-1,76 (м, 3H), 2,64-2,70 (м, 1H), 2,89 (т, J=3,5 Гц, 2H), 3,14-3,19 (м, 1H), 3,24 (с, 3H), 3,37 (т, J=4,1 Гц, 2H), 3,66 (с, 3H), 3,83 (с, 3H), 3,94 (д, J=12,9 Гц, 1H), 4,30-4,35 (м, 1H), 4,42 (д, J=12,8 Гц, 1H), 4,76 (д, J=3,2 Гц, 2H), 6,78-6,82 (м, 2H), 7,02-7,08 (м, 5H), 7,64 (с, 1H), 8,54 (с, 1H).
Пример 28: 5-(3-фтор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 28)
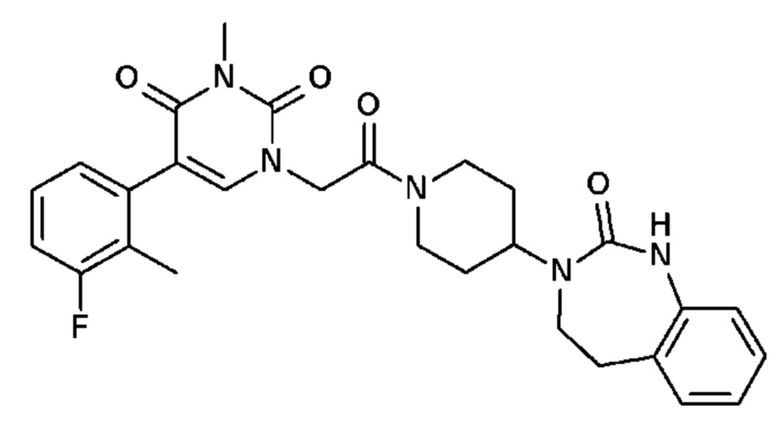
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 47 мг (0,3 ммоль) 3-фтор-2-метилфенилбороновой кислоты, получали 50 мг (47%) 5-(3-фтор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 160°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,55-1,74 (м, 3H), 2,08 (д, J=2 Гц, 3H), 2,55-2,70 (м, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,10-3,20 (м, 1H), 3,25 (с, 3H), 3,37 (д, J=4,4 Гц, 2H), 3,95 (д, J=13,7 Гц, 1H), 4,30-4,40 (м, 1H), 4,42 (д, J=12,5 Гц, 1H), 4,77 (д, J=2 Гц, 2H), 6,78-6,82 (м, 1H), 7,00-7,05 (м, 4H), 7,18 (т, J=8,8 Гц, 1H), 7,24-7,27 (м, 1H), 7,71 (с, 1H), 8,54 (с, 1H).
Пример 29: 5-(3-хлор-2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 29)
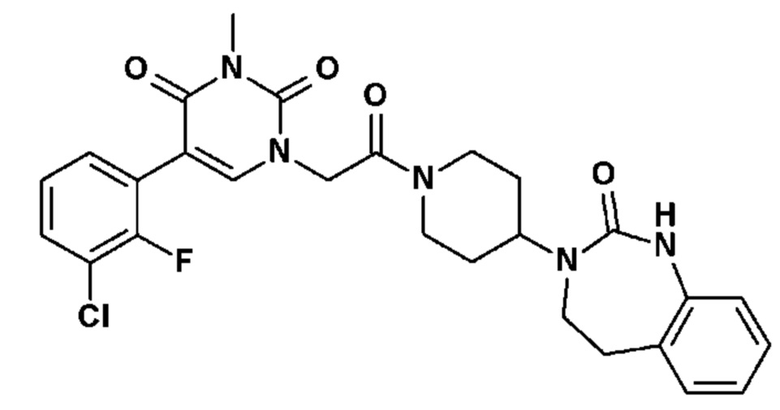
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 53 мг (0,3 ммоль) 3-хлор-2-фторфенилбороновой кислоты, получали 65 мг (57%) 5-(3-хлор-2-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 206°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,65-1,80 (м, 3H), 2,69 (т, J=12 Гц, 1H), 2,90 (м, 2H), 3,16 (т, J=10 Гц, 1H), 3,26 (с, 3H), 3,37 (м, 2H), 3,95 (д, J=12,6 Гц, 1H), 4,30-4,40 (м, 1H), 4,42 (д, J=11,7 Гц, 1H), 4,80 (с, 2H), 6,81 (д, J=3,7 Гц, 1H), 7,03-7,04 (м, 3H), 7,29 (т, J=7,8 Гц, 1H), 7,37 (т, J=6,5 Гц, 1H), 7,61 (т, J=7,2 Гц, 1H), 7,93 (с, 1H), 8,54 (с, 1H).
Пример 30: 5-(2,3-диметилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 30)
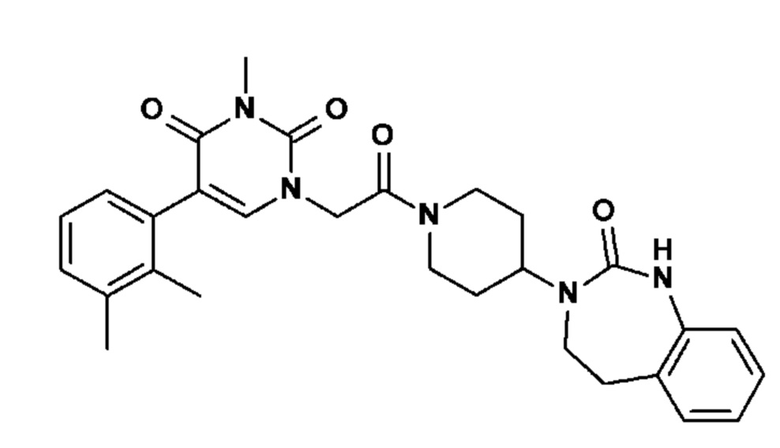
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 46 мг (0,3 ммоль) 2,3-диметилфенилбороновой кислоты, получали 50 мг (48%) 5-(2,3-диметилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета с температурой плавления 253°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,55-1,80 (м, 3H), 2,06 (с, 3H), 2,28 (с, 3H), 2,68 (т, J=12 Гц, 1H), 2,90 (т, J=4 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,25 (с, 3H), 3,39 (т, J=4 Гц, 2H), 3,95 (д, J=12 Гц, 1H), 4,30-4,40 (м, 1H), 4,44 (д, J=12 Гц, 1H), 4,77 (д, J=4 Гц, 2H), 6,79-6,83 (м, 1H), 6,96 (д, J=8 Гц, 1H), 7,02-7,05 (м, 3H), 7,11 (т, J=8 Гц, 1H), 7,18 (д, J=8 Гц, 1H), 7,60 (с, 1H), 8,52 (с, 1H).
Пример 31: 5-(2-хлор-3-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 31)
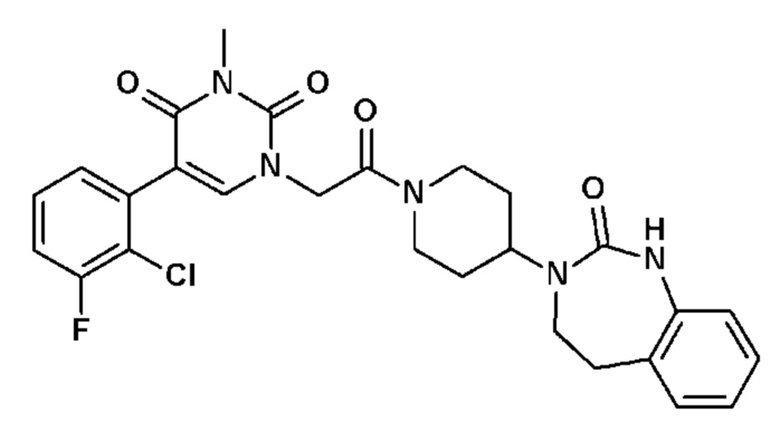
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 53 мг (0,3 ммоль) 2-хлор-3-фторфенил-фенилбороновой кислоты, получали 75 мг (68%) 5-(2-хлор-3-фторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 162°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,65-1,75 (м, 3H), 2,68 (т, J=12 Гц, 1H), 2,89 (т, J=4,4 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,25 (с, 3H), 3,37 (т, J=4,3 Гц, 2H), 3,94 (д, J=12 Гц, 1H), 4,31-4,34 (м, 1H), 4,42 (д, J=12 Гц, 1H), 4,78 (д, J=1,96 Гц, 2H), 6,78-6,82 (м, 1H), 7,02-7,05 (м, 3H), 7,20-7,22 (м, 1H), 7,43-7,47 (м, 2H), 7,84 (с, 1H), 8,54 (с, 1H).
Пример 32: 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 32)
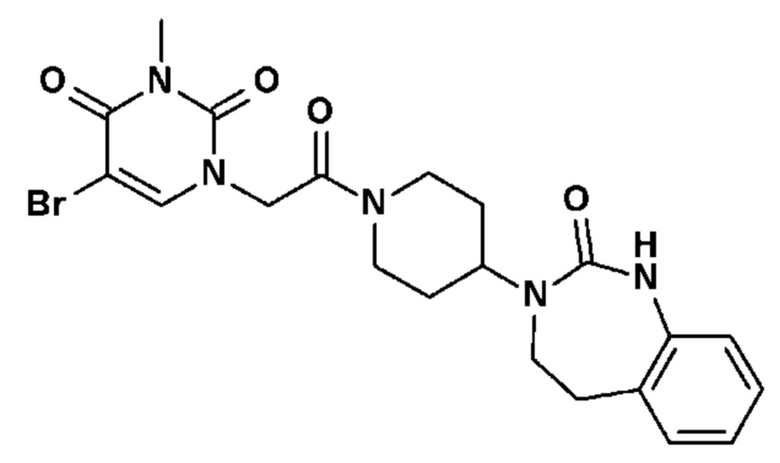
Аналогично примеру 1.6, используя 930 мг (3,5 ммоль) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты (полученный способом, описанным в примере 17.2) и 1 г (4,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 1,4 г (80%) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,65-1,80 (м, 3H), 2,70 (т, J=12 Гц, 1H), 2,90 (т, J=4 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,23 (с, 3H), 3,40 (т, J=4 Гц, 2H), 4,95 (д, J=12 Гц, 1H), 4,30-4,38 (м, 1H), 4,40 (д, J=12 Гц, 1H), 4,73 (с, 2H), 6,80-6,85 (м, 1H), 7,04 (м, 3H), 8,20 (с, 1H), 8,54 (с, 1H).
Пример 33: 5-(3-фтор-2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 33)
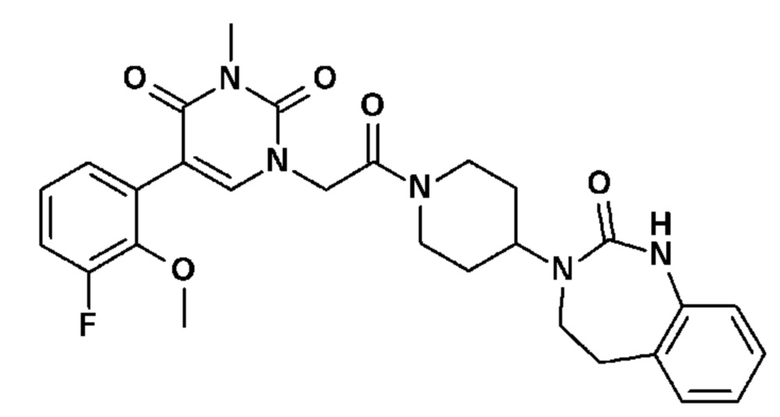
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 52 мг (0,3 ммоль) 3-фтор-2-метоксифенилбороновой кислоты, получали 75 мг (68%) 5-(3-фтор-2-метоксифенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества серого цвета с температурой плавления 152°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,55-1,80 (м, 3H), 2,68 (д, J=12 Гц, 1H), 2,89 (т, J=4 Гц, 2H), 3,15 (д, J=12 Гц, 1H), 3,25 (с, 3H), 3,37 (т, J=4 Гц, 2H), 3,78 (д, J=1,4 Гц, 3H), 3,94 (д, J=12 Гц, 1H), 4,30-4,40 (м, 1H), 4,42 (д, J=12 Гц, 1H), 4,77 (д, J=2,3 Гц, 2H), 6,78-6,82 (м, 1H), 7,02-7,07 (м, 4H), 7,11-7,16 (м, 1H), 7,26-7,31 (м, 1H), 7,73 (с, 1H), 8,54 (с, 1H).
Пример 34: 5-(2,6-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 34)
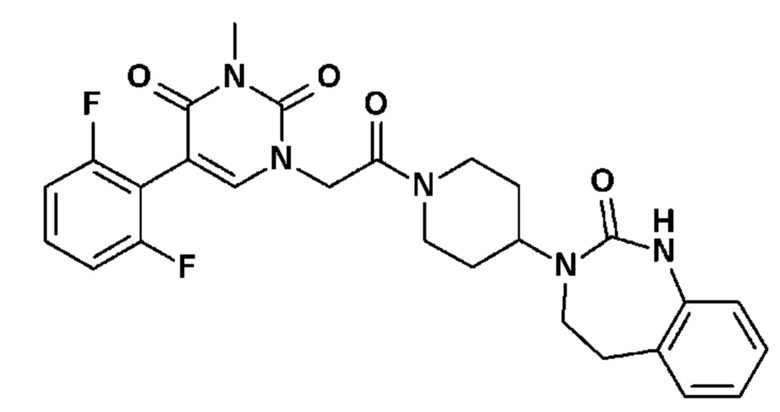
К раствору 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 0,5 мл (1 ммоль) 2M водного раствора трехосновного фосфата калия в 5 мл диметилформамида, предварительно дегазированному азотом добавляли 2,3 мг (0,01 ммоль) ацетата палладия(II), 7,2 мг (0,02 ммоль) 2-дициклогексилфосфин бифенил и 164,3 мг (1 ммоль) 2,6-дифторфенилбороновой кислоты. Реакционную смесь нагревали при 90°C в течение 2 часов. Реакционную смесь обрабатывали добавлением воды,, затем продукт экстрагировали три раза этилацетатом. Органическую фазу промывали водой и потом насыщенным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 96/4. Получали 8 мг (6%) 5-(2,6-дифторфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,4-дигидро-2H-хиназолин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,55-1,65 (м, 1H), 1,70-1,85 (м, 3H), 2,74 (т, J=12 Гц, 1H), 2,95 (м, 2H), 3,24 (т, J=12 Гц, 1H), 3,31 (с, 3H), 3,45 (м, 2H), 3,99 (д, J=12 Гц, 1H), 4,30-4,40 (м, 1H), 4,47 (д, J=12 Гц, 1H), 4,84 (с, 2H), 6,84-6,88 (м, 1H), 7,08-7,10 (м, 3H), 7,25 (т, J=8,6 Гц, 2H), 7,54-7,58 (м, 1H), 7,96 (с, 1H), 8,59 (с, 1H).
Пример 35: 5-(3,5-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 35)
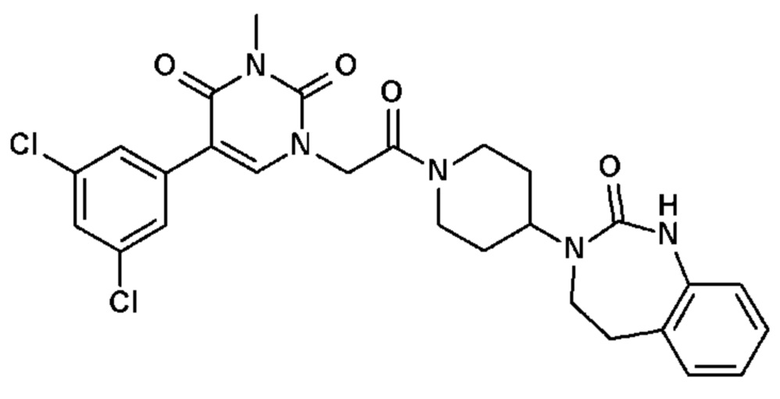
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 78 мг (0,4 ммоль) 3,5-дихлорфенилбороновой кислоты, и после кристаллизации в смеси гептан/этилацетат 70/30, получали 50 мг (44%) 5-(3,5-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,40-1,55 (м, 1H), 1,58-1,70 (м, 3H), 2,55 (м, 1H), 2,83 (т, J=4,4 Гц, 2H), 3,10 (м, 1H), 3,20 (с, 3H), 3,31 (т, J=4,7 Гц, 2H), 3,90 (м, 1H), 4,30 (м, 1H), 4,35 (м, 1H), 4,74 (с, 2H), 6,71-6,76 (м, 1H), 6,96-6,98 (м, 3H), 7,49-7,63 (м, 3H), 8,11 (с, 1H), 8,47 (с, 1H).
Пример 36: 4-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрил (реакционная схема № 3, соединение 36)
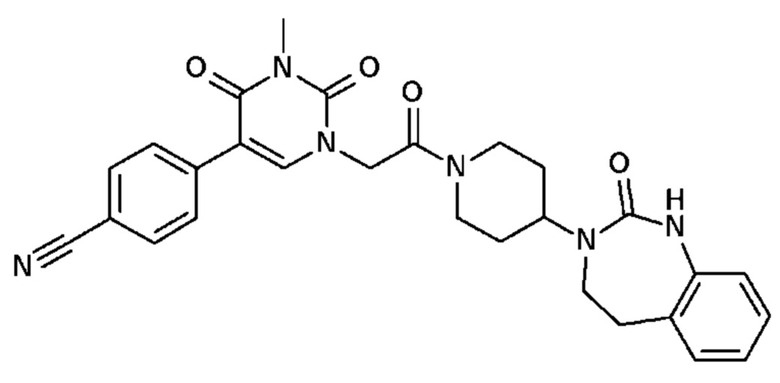
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 45 мг (0,3 ммоль) 4-(цианофенил)-бороновой кислоты, получали 13 мг (11%) 4-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрила в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,7 (м, 1H), 2,90 (т, 2H), 3,15 (м, 1H), 3,27 (с, 3H), 3,40 (т, 2H), 3,95 (д, 1H), 4,30-4,40 (м, 1H), 4,42 (д, 1H), 4,83 (с, 2H), 6,80 (м, 1H), 7,00-7,05 (м, 3H), 7,80 (д, J=8,6 Гц, 2H), 7,88 (д, J=8,5 Гц, 2H), 8,15 (с, 1H), 8,54 (с, 1H).
Пример 37: 3-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрил (реакционная схема № 3, соединение 37)
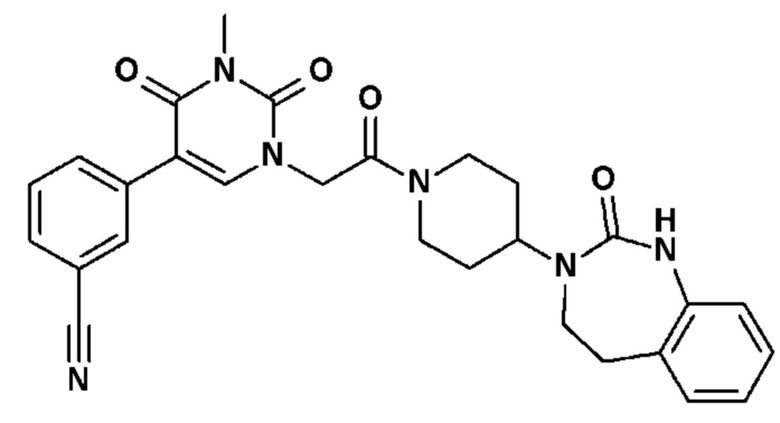
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 45 мг (0,3 ммоль) 3-(цианофенил)-бороновой кислоты, получали 50 мг (46%) 3-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрила в виде твердого вещества белого цвета с температурой плавления 258°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,7 (м, 1H), 2,90 (т, 2H), 3,15 (м, 1H), 3,27 (с, 3H), 3,40 (т, 2H), 3,95 (д, 1H), 4,30-4,40 (м, 1H), 4,42 (д, 1H), 4,83 (с, 2H), 6,80 (м, 1H), 7,00-7,05 (м, 3H), 7,64 (т, J=8,0 Гц, 1H), 7,79 (д, J=7,6 Гц, 1H), 7,95 (д, J=8,0 Гц, 1 H), 8,01 (с, 1 H), 8,13 (с, 1H), 8,54 (с, 1H).
Пример 38: 2-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрил (реакционная схема № 3, соединение 38)
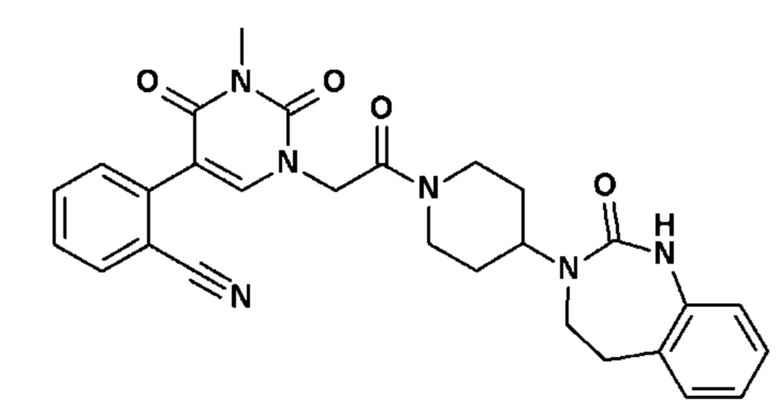
Аналогично примеру 9, используя 100 мг (0,2 ммоль) 5-бром-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 17.3) и 45 мг (0,3 ммоль) 2-(цианофенил)-бороновой кислоты, получали 60 мг (57%) 2-(3-метил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензонитрила в виде твердого вещества бежевого цвета с температурой плавления 196°C.
1H ЯМР (δ, ДМСО): 1,50-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,70 (т, J=12 Гц, 1H), 2,89 (т, J=4,6 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,27 (с, 3H), 3,37 (т, J=4,6 Гц, 2H), 3,95 (д, J=12 Гц, 1H), 4,30-4,40 (м, 1H), 4,42 (д, J=12 Гц, 1H), 4,81 (с, 2H), 7,02-7,05 (м, 1H), 7,02-7,08 (м, J=0,6-7,8 Гц, 3H), 7,50 (дд, J=06-7,8 Гц, 1H), 7,59 (дд, J=1,2-7,6 Гц, 1H), 7,76 (дд, J=1,4-7,7 Гц, 1H), 7,92 (дд, J=0,9-7,7 Гц, 1H), 7,98 (с, 1H), 8,53 (с, 1H).
Пример 39: 3-метил-5-(3-метил-пиридин-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 39)
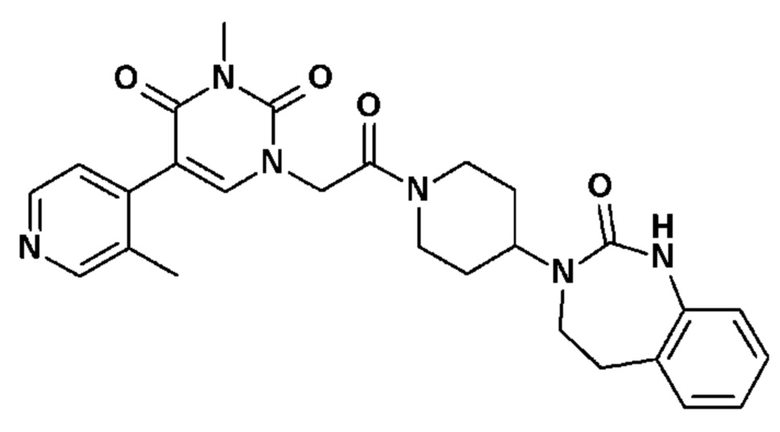
39.1: 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично примеру 2,4, используя 300 мг (1,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) и 254 мг (2,7 ммоль) хлоруксусной кислоты, получали 350 мг (89%) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде твердого вещества белого цвета.
39.2: 1-бензгидрил-3-метил-5-(3-метил-пиридин-4-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 1.8, используя 280 мг (0,8 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2), и 207 мг (1,5 ммоль) 3-метилпиридинe-4-бороновой кислоты, получали 250 мг (86%) 1-бензгидрил-3-метил-5-(3-метил-пиридин-4-ил)-1H-пиримидин-2,4-диона в виде бесцветного масла.
39.3: 3-метил-5-(3-метил-пиридин-4-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 2,3, используя 250 мг (0,7 ммоль) 1-бензгидрил-3-метил-5-(3-метил-пиридин-4-ил)-1H-пиримидин-2,4-диона, получали 50 мг (35%) 3-метил-5-(3-метил-пиридин-4-ил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
39.4: 3-метил-5-(3-метил-пиридин-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 39)
Аналогично примеру 13,1, используя 82 мг (0,3 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1), и 50 мг (0,2 ммоль) 3-метил-5-(3-метил-пиридин-4-ил)-1H-пиримидин-2,4-диона, и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3, получали 60 мг (52%) 3-метил-5-(3-метил-пиридин-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 178°C.
1H ЯМР (δ, ДМСО): 1,40-1,55 (м, 1H), 1,58-1,70 (м, 3H), 2,13 (с, 3H), 2,61 (т, J=12 Гц, 1H), 2,82 (т, J=4,5 Гц, 2H), 3,08 (т, J=12 Гц, 1H), 3,18 (с, 3H), 3,30 (т, J=4,6 Гц, 2H), 3,87 (д, J=13 Гц, 1H), 4,20-4,30 (м, 1H), 4,35 (д, J=13 Гц, 1H), 4,71 (с, 2H), 6,71-6,75 (м, 1H), 6,95-6,98 (м, 3H), 7,10 (д, J=4,9 Гц, 1H), 7,72 (с, 1H), 8,34 (д, J=4,8 Гц, 1H), 8,41 (с, 1H), 8,45 (с, 1H).
Пример 40: 3-метил-5-(2-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 40)
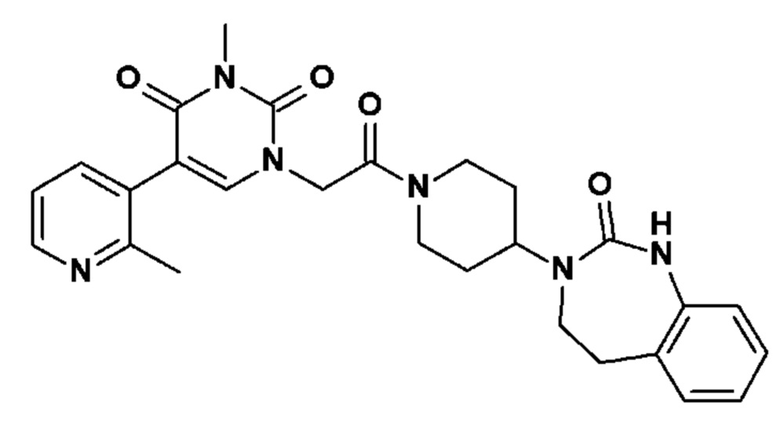
40.1: 1-бензгидрил-3-метил-5-(2-метил-пиридин-3-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 1.8, используя 280 мг (0,8 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2) и 207 мг (1,5 ммоль) 2-метилпиридинe-3-бороновой кислоты, получали 40 мг (14%) 1-бензгидрил-3-метил-5-(2-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона в виде бесцветного масла.
40.2: 3-метил-5-(2-метил-пиридин-3-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 2,3, используя 40 мг (0,1 ммоль) 1-бензгидрил-3-метил-5-(2-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона, получали 23 мг (100%) 3-метил-5-(2-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
40.3: 3-метил-5-(2-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 40)
Аналогично примеру 13,1, используя 37 мг (0,1 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1) и 23 мг (0,1 ммоль) 3-метил-5-(2-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона, получали 15 мг (28%) 3-метил-5-(2-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 163°C.
1H ЯМР (δ, ДМСО): 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,38 (с, 3H), 2,70 (т, J=12 Гц, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,25 (с, 3H), 3,37 (т, J=4,5 Гц, 2H), 3,95 (д, J=12 Гц, 1H), 4,28-4,38 (м, 1H), 4,42 (д, J=12 Гц, 1H), 4,77 (с, 2H), 6,78-6,83 (м, 1H), 7,02-7,04 (м, 3H), 7,27 (м, 1H), 7,53 (дд, J=1,7-7,7 Гц, 1H), 7,75 (с, 1H), 8,45 (кв, J=1,7 Гц, 1H), 5,84 (с, 1H).
Пример 41: 3-метил-5-(4-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 41)
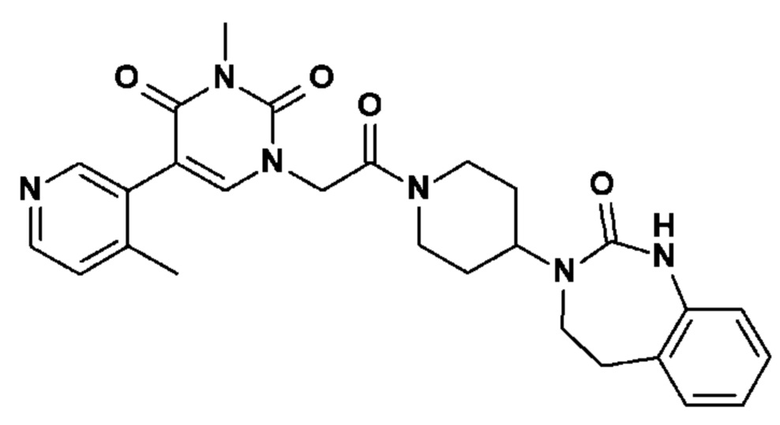
41.1: 1-бензгидрил-3-метил-5-(4-метил-пиридин-3-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 1.8, используя 280 мг (0,8 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2) и 207 мг (1,5 ммоль) 4-метилпиридинe-3-бороновой кислоты, получали 270 мг (93%) 1-бензгидрил-3-метил-5-(4-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона в виде масла оранжевого цвета.
41.2: 3-метил-5-(4-метил-пиридин-3-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 270 мг (0,7 ммоль) 1-бензгидрил-3-метил-5-(4-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона, получали 153 мг (100%) 3-метил-5-(4-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
41.3: 3-метил-5-(4-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 41)
Аналогично примеру 13.1, используя 140 мг (0,4 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1) и 86 мг (0,4 ммоль) 3-метил-5-(4-метил-пиридин-3-ил)-1H-пиримидин-2,4-диона, получали 20 мг (10%) 3-метил-5-(4-метил-пиридин-3-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,21 (с, 3H), 2,7 (т, J=12 Гц, 1H), 2,88 (т, J=4,3 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,25 (с, 3H), 3,36 (т, J=4,4 Гц, 2H), 3,95 (д, J=12 Гц, 1H), 4,28-4,38 (м, 1H), 4,45 (д, J=12 Гц, 1H), 4,78 (с, 2H), 6,78-6,82 (м, 1H), 7,01-7,04 (м, 3H), 7,31 (д, J=5 Гц, 1H), 7,79 (с, 1H), 8,28 (с, 1H), 8,43 (д, J=5 Гц, 1H), 8,54 (с, 1H).
Пример 42: 3-метил-5-(6-метил-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 42)
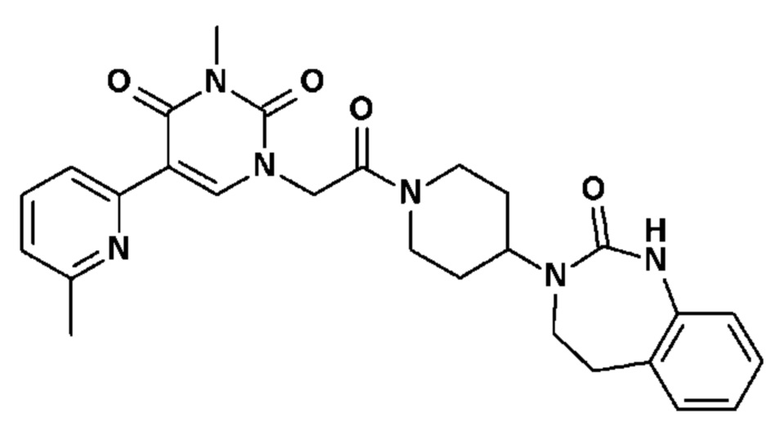
42.1: 1-бензгидрил-3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1H-пиримидин-2,4-дион
К раствору 500 мг (1,4 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2), 294 мг (2,7 ммоль) 2-пиколин-N-оксида и 279 мг (2 ммоль) карбоната калия в 10 мл толуола, предварительно дегазированному азотом в течение 10 минут, добавляли 15 мг (0,1 ммоль) ацетата палладия(II) и 20 мг (0,1 ммоль) три-трет-бутилфосфония тетрафторбората. Реакционную смесь нагревали при 110°C в герметично закрытом сосуде в течение 40 часов. Эту смесь фильтровали через целит и фильтрат концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/ацетон 70/30. Получали 220 мг (41%) 1-бензгидрил-3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
42.2: 1-бензгидрил-3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-дион
К раствору 125 мг (0,3 ммоль) 1-бензгидрил-3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1H-пиримидин-2,4-диона в 9,4 мл уксусной кислоты добавляли 87 мг (2 ммоль) железа. Реакционную смесь нагревали при 70°C в герметично закрытом сосуде в течение 4 часов. Эту смесь фильтровали через целит и далее фильтрат гидролизовали насыщенным водным раствором гидрокарбоната натрия. Продукт экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия, затем водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 120 мг (100%) 1-бензгидрил-3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
42.3: 3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 135 мг (0,4 ммоль) 1-бензгидрил-3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-диона, получали 76 мг (100%) 3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
42.4: 3-метил-5-(6-метил-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 42)
Аналогично примеру 13.1, используя 136 мг (0,4 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1) и 66 мг (0,4 ммоль) 3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-диона, получали 105 мг (59%) 3-метил-5-(6-метил-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 248°C.
1H ЯМР (δ, ДМСО): 1,65-1,71 (м, 4 H); 2,50 (с, 3 H); 2,69 (т, J=12,3 Гц, 1 H); 2,88-2,93 (м, 2 H); 3,18 (т, J=13,1 Гц, 1 H); 3,28 (с, 3 H); 3,38-3,41 (м, 2 H); 3,95 (д, J=13,6 Гц, 1 H); 4,29-4,36 (м, 1 H); 4,43 (д, J=13,0 Гц, 1 H); 4,94 (с, 2 H); 6,80-6,82 (м, 1 H); 7,03-7,05 (м, 3 H); 7,16 (д, J=7,6 Гц, 1 H); 7,71 (т, J=7,8 Гц, 1 H); 8,08 (д, J=8,0 Гц, 1 H); 8,45 (с, 1 H); 8,54 (с, 1 H).
Пример 43: 3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 43)
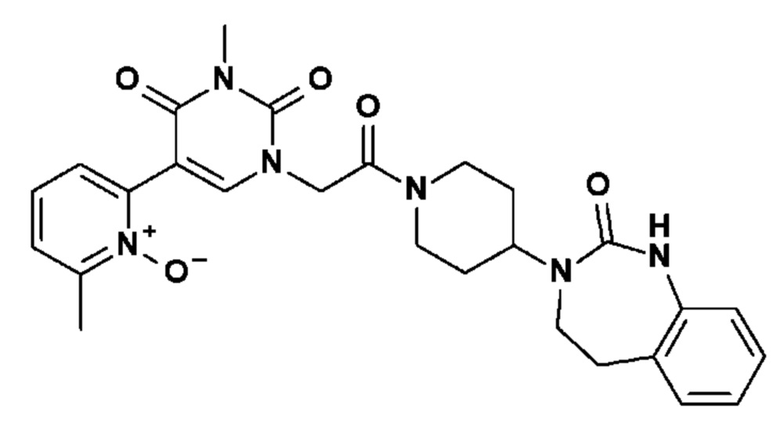
43.1: 3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 63 мг (0,2 ммоль) 1-бензгидрил-3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 42.1), получали 37 мг (100%) 3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
43.2: 3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 43)
Аналогично примеру 13.1, используя 61 мг (0,2 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1) и 37 мг (0,2 ммоль) 3-метил-5-(6-метил-пиридин-2-ил)-1H-пиримидин-2,4-диона, получали 15 мг (18%) 3-метил-5-(6-метил-1-окси-пиридин-2-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,62-1,69 (м, 4H); 2,38 (с, 3H); 2,68 (м, 1H); 2,88-2,90 (м, 2H); 3,15 (м, 1H); 3,24 (с, 3 H); 3,36-3,38 (м, 2H); 3,94 (д, J=13,7 Гц, 1H); 4,32 (м, 1H); 4,42 (д, J=13,0 Гц, 1H); 4,81 (с, 2H); 6,80-6,82 (м, 1H); 7,03-7,05 (м, 3H); 7,27 (т, J=7,8 Гц, 1H); 7,47-7,50 (м, 2H); 8,29 (с, 1H); 8,54 (с, 1H).
Пример 44: 3-метил-5-(1-метил-1H-пиразол-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 44)
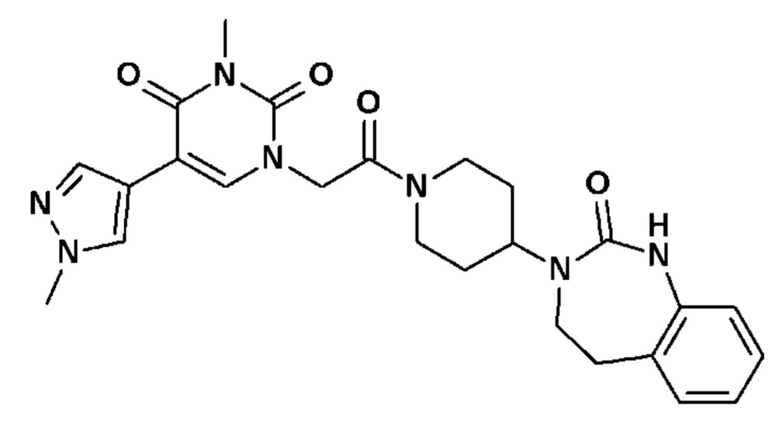
44.1: [3-метил-5-(1-метил-1H-пиразол-4-ил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, содержащему 300 мг (1,1 ммоль) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 17.1), 338 мг (1,6 ммоль) 1-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1H-пиразола и 344 мг (3,3 ммоль) карбоната натрия в 30 мл 1,4-диоксана и 3 мл воды, предварительно дегазированному азотом в течение 5 минут, добавляли 44.2 мг (50 мкмоль) комплекса дихлорметана и 1,1ʹ-бис(дифенилфосфино)ферроцен-дихлорпалладия(II). Затем реакционную смесь нагревали при 100°C в течение 1 часа. Эту смесь гидролизовали и далее разбавляли этилацетатом. Продукт экстрагировали этилацетатом, органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3. Получали 60 мг (20%) [3-метил-5-(1-метил-1H-пиразол-4-ил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
44.2: [3-метил-5-(1-метил-1H-пиразол-4-ил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 60 мг (0,2 ммоль) [3-метил-5-(1-метил-1H-пиразол-4-ил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 57 мг (100%) [3-метил-5-(1-метил-1H-пиразол-4-ил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
44.3: 3-метил-5-(1-метил-1H-пиразол-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 44)
Аналогично примеру 1.6, используя 67 мг (0,2 ммоль) [3-метил-5-(1-метил-1H-пиразол-4-ил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 58 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из этанола, получали 45 мг (42%) 3-метил-5-(1-метил-1H-пиразол-4-ил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 290°C.
1H ЯМР (δ, ДМСО): 1,61-1,70 (м, 4H); 2,69 (т, J=12,8 Гц, 1H); 2,91 (м, 2H); 3,10-3,26 (м, 2H); 3,25 (с, 3H); 3,36-3,41 (м, 2H); 3,86 (с, 3H); 3,98 (д, J=13,6 Гц, 1H); 4,28-4,38 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,75 (д, J=6,0 Гц, 2H); 6,80-6,82 (м, 1H); 7,04-7,05 (м, 3H); 7,74 (с, 1H); 8,03 (с, 1H); 8,10 (с, 1H); 8,55 (с, 1H).
Пример 45: 5-(5-хлор-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 45)
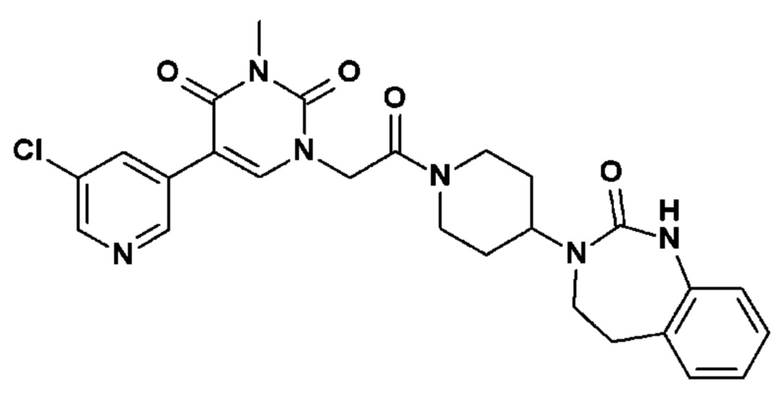
45.1: 1-бензгидрил-5-(5-хлор-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 44.1, используя 191 мг (1,2 ммоль) 5-хлорпиридинe-3-бороновой кислоты и 300 мг (0,8 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2), получали 340 мг (96%) 1-бензгидрил-5-(5-хлор-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
45.2: 5-(5-хлор-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 326 мг (0,8 ммоль) 1-бензгидрил-5-(5-хлор-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона, получали 190 мг (99%) 5-(5-хлор-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
45.3: 5-(5-хлор-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 45)
Аналогично примеру 13.1, используя 190 мг (0,8 ммоль) 5-(5-хлор-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона и 283 мг (0,9 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1), после нагревания при 80°C в течение 1,5 ч и очистки хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 95/5, получали 180 мг (43%) 5-(5-хлор-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 250°C.
1H ЯМР (δ, ДМСО): 1,56-1,65 (м, 4H); 2,69 (т, J=12,2 Гц, 1H); 2,87-2,92 (м, 2H); 3,16-3,21 (м, 1H); 3,27 (с, 3H); 3,36-3,39 (м, 2H); 3,97 (д, J=13,6 Гц, 1H); 4,27-4,40 (м, 1H); 4,42 (д, J=13,1 Гц, 1H); 4,81 (с, 2H); 6,80-6,81 (м, 1H); 7,02-7,05 (м, 3H); 8,14 (т, J=2,1 Гц, 1H); 8,22 (с, 1H); 8,55 (с, 1H); 8,58 (д, J=2,4 Гц, 1H); 8,75 (д, J=1,9 Гц, 1H).
Пример 46: 5-бензил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 46)
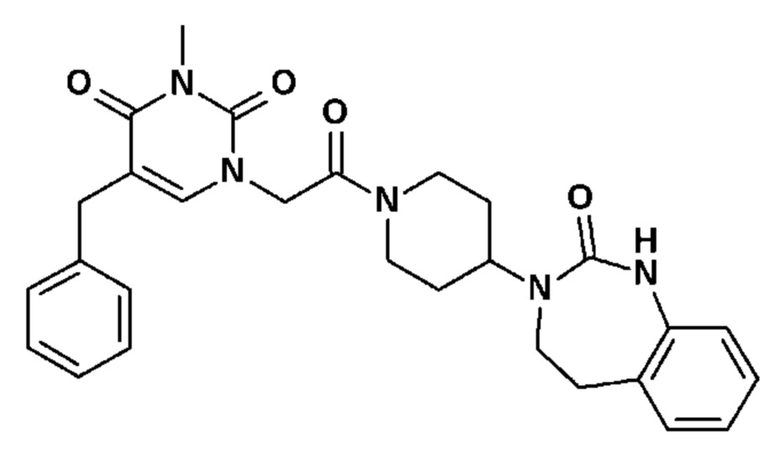
46.1: 5-бензил-1H-пиримидин-2,4-дион
К раствору 2 г (14 ммоль) 5-гидроксиметил-1H-пиримидин-2,4-диона в 40 мл трифторуксусной кислоты добавляли 20 мл бензола. Смесь нагревали при 130°C в течение 20 минут в герметично закрытых сосудах. После охлаждения, растворители упаривали, и остаток растворяли в дихлорметане. Продукт осаждался; его фильтровали и сушили в вакууме. Получали 2,4 г (84%) 5-бензил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
46.2: (5-бензил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 13.1, используя 200 мг (1 ммоль) 5-бензил-1H-пиримидин-2,4-диона, получали 105 мг (39%) (5-бензил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
46.3: (5-бензил-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусная кислота
К раствору (5-бензил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в 5 мл диметилформамида добавляли 75,6 мг (0,6 ммоль) карбоната калия и 27 мкл (0,4 ммоль) иодметана. Реакционную смесь нагревали при 50°C в течение 1,5 ч. Добавляли 0,6 мл (0,6 ммоль) 1M водного раствора гидроксида лития с 1 мл воды и 2,5 мл тетрагидрофурана. После перемешивания в течение 20 часов при комнатной температуре, смесь гидролизовали с помощью 1н водного раствора соляной кислоты и далее разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали дважды водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 100 мг (100%) (5-бензил-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты в виде бесцветного масла.
46.4: 5-бензил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 46)
Аналогично примеру 1.6, используя 100 мг (0,4 ммоль) (5-бензил-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты и 107 мг (0,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 150 мг (79%) 5-бензил-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 266°C.
1H ЯМР (δ, ДМСО): 1,56-1,68 (м, 4H); 2,67 (т, J=12,6 Гц, 1H); 2,87-2,92 (м, 2H); 3,11-3,14 (м, 1H); 3,18 (м, 3H); 3,36-3,39 (м, 2H); 3,59 (с, 2H); 3,93 (д, J=13,6 Гц, 1H); 4,32 (м, 1H); 4,42 (д, J=13,0 Гц, 1H); 4,71 (д, J=2,6 Гц, 2H); 6,80-6,81 (м, 1H); 7,04-7,05 (м, 3H); 7,24-7,26 (м, 5H); 7,53 (с, 1H); 8,54 (с, 1H).
Пример 47: 5-(3,4-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 47)
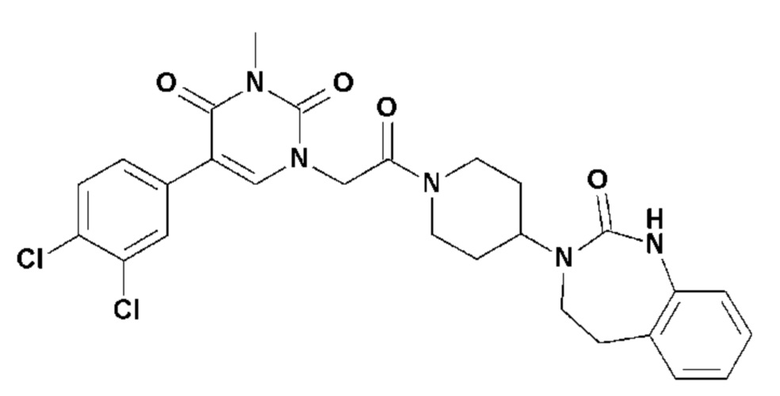
47.1: [5-(3,4-дихлорфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 450 мг (1,6 ммоль) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 17.1) и 620 мг (3,3 ммоль) 3,4-дихлорфенилбороновой кислоты, и после добавления 5 мл 1н водного раствора соды и нагревания при 100°C в течение 1 часа, получали 520 мг (97%) [5-(3,4-дихлорфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
47.2: 5-(3,4-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 47)
Аналогично примеру 1.6, используя 400 мг (1,2 ммоль) [5-(3,4-дихлорфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 358 мг (1,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 320 мг (47%) 5-(3,4-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,52-1,61 (м, 4 H). 2,63 (т, J=10,6 Гц, 1 H); 2,84 (м, 2 H); 3,10 (м, 1 H); 3,19 (с, 3 H), 3,30-3,33 (м, 2 H); 3,90 (д, J=13,6 Гц, 1 H); 4,26 (м, 1 H); 4,35 (д, J=12,5 Гц, 1 H); 4,74 (с, 2 H); 6,73-6,74 (м, 1 H); 6,96-6,97 (м, 3 H); 7,55 (дд, J=8,5, 2,1 Гц, 1 H); 7,62 (д, J=8,5 Гц, 1 H); 7,81 (д, J=2,1 Гц, 1 H); 8,05 (с, 1 H); 8,47 (с, 1 H).
Пример 48: 5-(5-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 48)
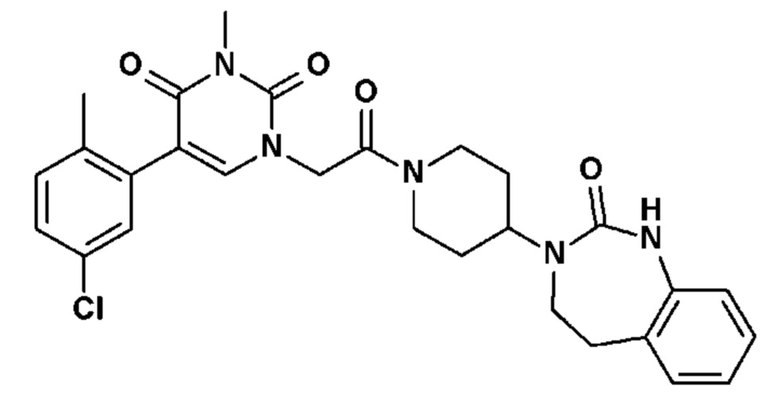
48.1: [5-(5-хлор-2-метилфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 47.1, используя 400 мг (1,4 ммоль) (5-бром-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 17.1) и 492 мг (2,9 ммоль) (5-хлор-2-метилфенил)бороновой кислоты, и после добавления 5 мл 1н водного раствора соды и нагревания при 100°C в течение 1 часа, получали 440 мг (99%) [5-(5-хлор-2-метилфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
48.2: 5-(5-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 48)
Аналогично примеру 1.6, используя 445 мг (1,4 ммоль) [5-(5-хлор-2-метилфенил)-3-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 424 мг (1,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 162 мг (19%) 5-(5-хлор-2-метилфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,57-1,66 (м, 4 H); 2,16 (с, 3 H); 2,68 (т, J=12,6 Гц, 1 H); 2,89 (д, J=6,7 Гц, 2 H); 3,15 (т, J=12,3 Гц, 1 H); 3,24 (с, 3 H); 3,35-3,38 (м, 2 H); 3,94 (д, J=13,7 Гц, 1 H); 4,26-4,39 (м, 1 H); 4,42 (д, J=12,9 Гц, 1 H); 4,76 (д, J=2,6 Гц, 2 H); 6,79-6,80 (м, 1 H); 7,03-7,05 (м, 3 H); 7,19 (д, J=2,3 Гц, 1 H); 7,29 (д, J=8,3 Гц, 1 H); 7,34 (дд, J=8,2, 2,3 Гц, 1 H); 7,73 (с, 1 H); 8,52 (с, 1 H).
Пример 49: 5-(4,5-диметил-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 49)
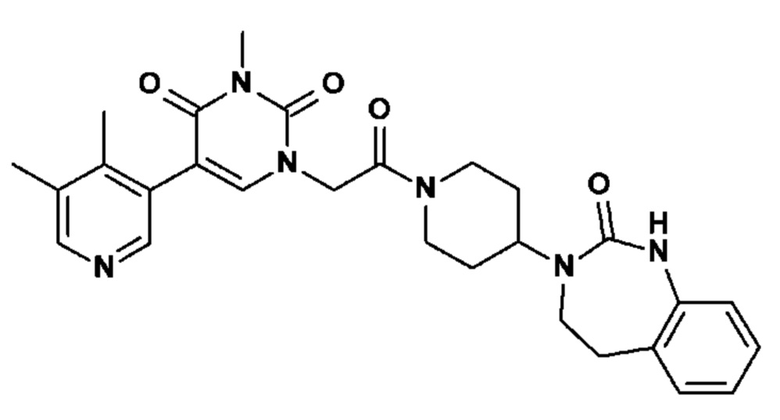
49.1: 1-бензгидрил-5-(4,5-диметил-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 44.1, используя 244 мг (1,6 ммоль) 4,5-диметил-пиридин бороновой кислоты и 400 мг (1,1 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.2), получали 290 мг (68%) 1-бензгидрил-5-(4,5-диметил-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона в виде прозрачного масла желтого цвета.
49.2: 5-(4,5-диметил-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 290 мг (0,7 ммоль) 1-бензгидрил-5-(4,5-диметил-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона, получали 120 мг (71%) 5-(4,5-диметил-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
49.3: 5-(4,5-диметил-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 49)
Аналогично примеру 13.1, используя 120 мг (0,5 ммоль) 5-(4,5-диметил-пиридин-3-ил)-3-метил-1H-пиримидин-2,4-диона и 184 мг (0,6 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1), после нагревания при 50°C в течение 18 часов и очистки путем кристаллизации в этаноле, получали 120 мг (45%) 5-(4,5-диметил-пиридин-3-ил)-3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 225°C.
1H ЯМР (δ, ДМСО): 1,58-1,70 (м, 4H); 2,10 (с, 3H); 2,28 (с, 3H); 2,69 (т, J=12,5 Гц, 1H); 2,87-2,92 (м, 2H); 3,16 (т, J=12,2 Гц, 1H); 3,26 (с, 3H); 3,36-3,39 (м, 2H); 3,96 (д, J=13,6 Гц, 1H); 4,33 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,78 (с, 2H); 6,80-6,81 (м, 1H); 7,03-7,04 (м, 3H); 7,75 (с, 1H); 8,12 (с, 1H); 8,33 (с, 1H); 8,54 (с, 1H).
Пример 50: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-фенокси-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 50)
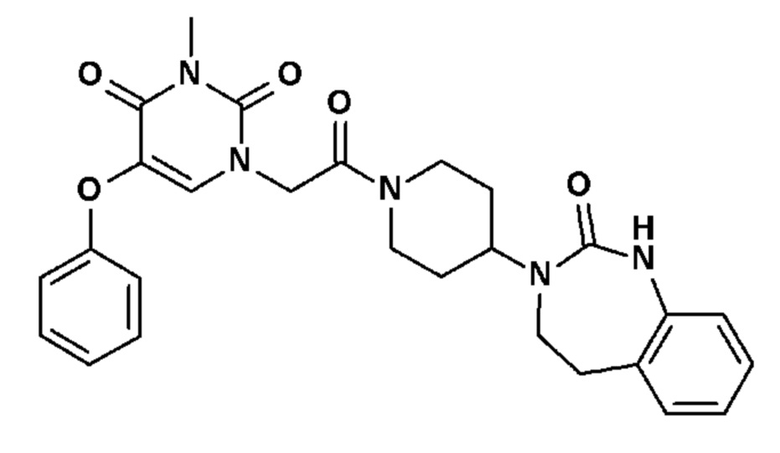
50.1: 1-бензгидрил-3-метил-5-фенокси-1H-пиримидин-2,4-дион
К раствору 500 мг (1,4 ммоль) 1-бензгидрил-5-бром-3-метил-1H-пиримидин-2,4-диона в 2,5 мл 1-метил-2-пирролидинона, предварительно дегазированного азотом, добавляли 254 мг (2,7 ммоль) фенола, 67 мг (0,7 ммоль) хлорида меди, 25 мг (0,1 ммоль) 2,2,6,6-тетраметил-3,5-гептандиона и 878 мг (2,7 ммоль) карбоната цезия. Реакционную смесь нагревали при 120°C в течение 22 часов, затем разбавляли в 6 мл этилацетата и фильтровали через целит. Растворители упаривали, остаток промывали один раз 1н водным раствором соляной кислоты, затем 1н водным раствором гидроксида натрия и водой. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью гептан/этилацетат 80/20. Получали 105 мг (20%) 1-бензгидрил-3-метил-5-фенокси-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
50.2: 3-метил-5-фенокси-1H-пиримидин-2,4-дион
Аналогично примеру 2.3, используя 145 мг (0,4 ммоль) 1-бензгидрил-3-метил-5-фенокси-1H-пиримидин-2,4-диона, получали 85 мг (100%) 3-метил-5-фенокси-1H-пиримидин-2,4-диона в виде масла желтого цвета.
50.3: 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-фенокси-1H-пиримидин-2,4-дион (соединение 50)
Аналогично примеру 13,1, используя 85 мг (0,4 ммоль) 3-метил-5-фенокси-1H-пиримидин-2,4-диона, 125 мг (0,4 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1), и после нагревания при 50°C в течение 18 часов, получали 65 мг (32%) 3-метил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-5-фенокси-1H-пиримидин-2,4-диона в виде твердого вещества светло-желтого цвета с температурой плавления 163°C.
1H ЯМР (δ, ДМСО): 1,55-1,68 (м, 4H); 2,69 (т, J=12,5 Гц, 1H); 2,90 (м, 2H); 3,15 (м, 1H); 3,21 (с, 3H); 3,38 (м, 2H); 3,94 (д, J=13,6 Гц, 1H); 4,33 (м, 1H); 4,44 (д, J=13,0 Гц, 1H); 4,74 (с, 2H); 6,80-6,83 (м, 1H); 7,01-7,03 (м, 6H); 7,33 (т, J=7,8 Гц, 2H); 7,92 (с, 1H); 8,54 (с, 1H).
Пример 51: 5-(2,3-диметилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 51)
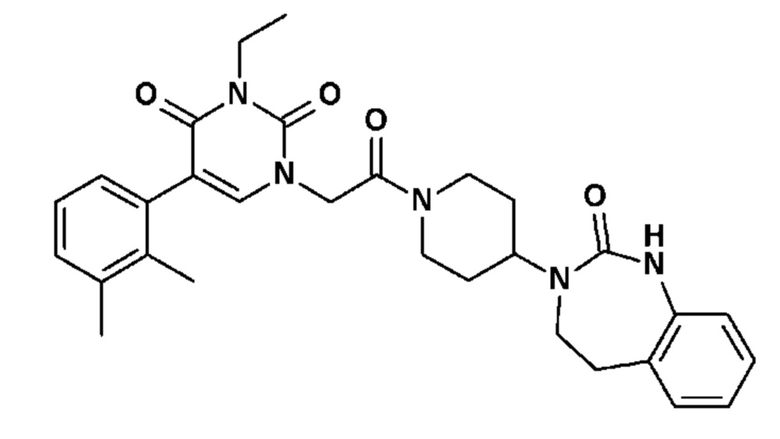
51.1: (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К раствору 3 г (11 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) в 60 мл диметилформамида добавляли 2,4 г (17 ммоль) карбоната калия и 1,4 мл (17 ммоль) иодэтана. Реакционную смесь нагревали при 50°C в течение 2 часов, затем гидролизовали и экстрагировали этилацетатом. Органическую фазу промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток обрабатывали в диэтиловом эфире, затем фильтровали и сушили в атмосфере азота. Получали 1,7 г (50%) (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества кремового цвета.
51.2: [5-(2,3-диметилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44,1, используя 350 мг (1,2 ммоль) (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 289 мг (1,9 ммоль) 2,3-диметилфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30, получали 255 мг (67%) [5-(2,3-диметилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
51.3: [5-(2,3-диметилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16,8, используя 255 мг (0,8 ммоль) [5-(2,3-диметилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 220 мг (90%) [5-(2,3-диметилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
51.4: 5-(2,3-диметилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 51)
Аналогично примеру 1.6, используя 220 мг (0,7 ммоль) [5-(2,3-диметилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, 196 мг (0,8 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) и 0,1 мл (0,9 ммоль) триэтиламина и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3, с последующей кристаллизацией в смеси гептан/этилацетат 70/30, получали 280 мг (72%) 5-(2,3-диметилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,13 (т, J=7 Гц, 3H), 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,05 (т, 3H), 2,30 (т, 3H), 2,68 (т, J=11,7 Гц, 1H), 2,89 (т, J=4,6 Гц, 2H), 3,15 (т, J=11,7 Гц, 1H), 3,37 (т, J=4,6 Гц, 2H), 3,88-3,95 (м, 3H), 4,28-4,36 (м, 1H), 4,43 (д, J=12,7 Гц, 1H), 4,75 (д, J=6,4 Гц, 2H), 6,77-6,83 (м, 1H), 6,96 (д, J=7 Гц, 1H), 7,02-7,06 (м, 3H), 7,10 (т, J=7,5 Гц, 1H), 7,17 (д, J=7,3 Гц, 1H), 7,58 (с, 1H), 8,52 (с, 1H).
Пример 52: 5-(3-хлор-2-метилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 52)
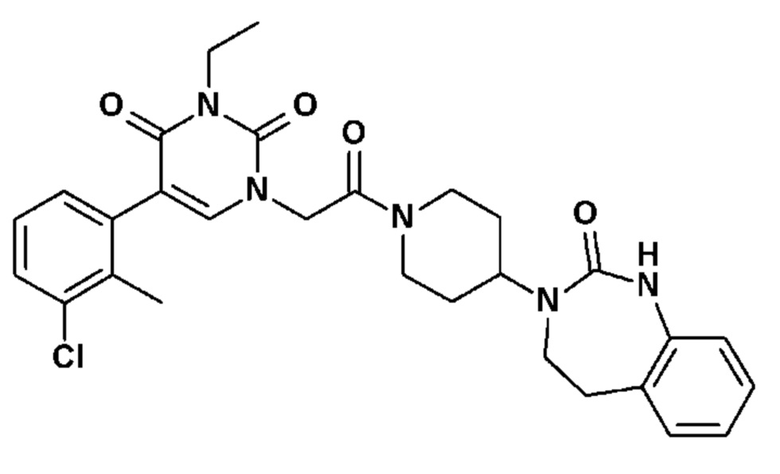
52.1: [5-(3-хлор-2-метилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 350 мг (1,2 ммоль) (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 51.1) и 328 мг (1,9 ммоль) 3-хлор-2-метилфенилбороновой кислоты, получали 330 мг (85%) [5-(3-хлор-2-метилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
52.2: 5-(3-хлор-2-метилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 52)
Аналогично примеру 51.4, используя 330 мг (1 ммоль) [5-(3-хлор-2-метилфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 276 мг (1,1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 290 мг (51%) 5-(3-хлор-2-метилфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 247°C.
1H ЯМР (δ, ДМСО): 1,13 (т, J=7 Гц, 3H), 1,50-1,62 (м, 1H), 1,52-1,80 (м, 3H), 2,19 (с, 3H), 2,68 (т, J=12,2 Гц, 1H), 2,89 (т, J=4,1 Гц, 2H), 3,15 (т, J=12,2 Гц, 1H), 3,37 (т, J=4,1 Гц, 2H), 3,88-3,96 (м, 3H), 4,29-4,35 (м, 1H), 4,43 (д, J=12,7 Гц, 1H), 4,76 (д, J=4,2 Гц, 2H), 6,78-6,83 (м, 1H), 7,02-7,05 (м, 3H), 7,14 (д, J=6,8 Гц, 1H), 7,26 (т, J=7,8 Гц, 1H), 7,46 (д, J=7,2 Гц, 1H), 7,70 (с, 1H), 8,52 (с, 1H).
Пример 53: 5-(2,3-дихлорфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 53)
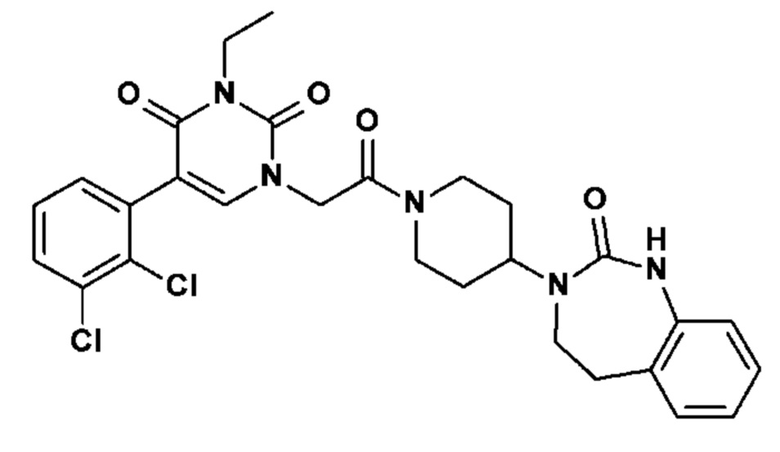
53.1: [5-(2,3-дихлорфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 350 мг (1,2 ммоль) (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 51.1) и 367 мг (1,9 ммоль) 2,3-дихлорфенилбороновой кислоты, получали 120 мг (29%) [5-(2,3-дихлорфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
53.2: 5-(2,3-дихлорфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 53)
Аналогично примеру 51.4, используя 120 мг (0,4 ммоль) [5-(2,3-дихлорфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 94 мг (0,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 130 мг (63%) 5-(2,3-дихлорфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион в виде твердого вещества бежевого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,13 (т, J=6,9 Гц, 3H), 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,68 (т, J=11 Гц, 1H), 2,88 (т, J=4,4 Гц, 2H), 3,15 (т, J=11 Гц, 1H), 3,37 (т, J=4,0 Гц, 2H), 3,89-3,91 (м, 2H), 3,95 (д, J=13 Гц, 1H), 4,28-4,38 (м, 1H), 4,45 (д, J=13 Гц, 1H), 4,76 (д, J=5,2 Гц, 2H), 6,75-6,83 (м, 1H), 7,02-7,04 (м, 3H), 7,33 (дд, J=1,6-7,6 Гц, 1H), 7,42 (т, J=7,8 Гц, 1H), 7,68 (дд, J=1,6-8,1 Гц, 1H), 7,80 (с, 1H), 8,54 (с, 1H).
Пример 54: 5-(2-хлор-3-фторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 54)
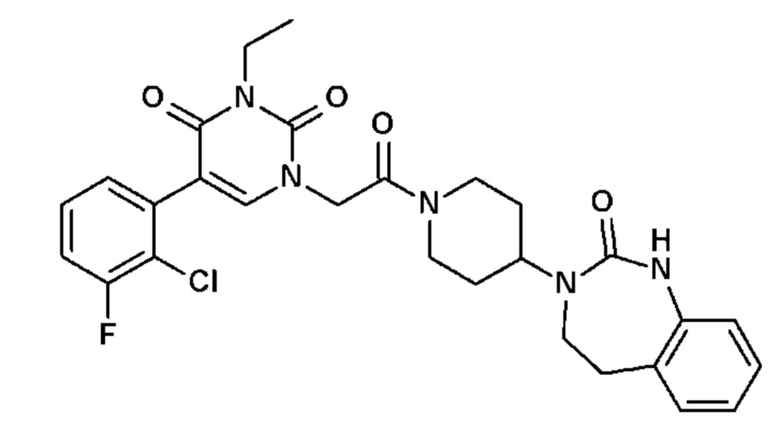
54.1: [5-(2-хлор-3-фторфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13,3, используя 300 мг (1 ммоль) (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 51.1) и 270 мг (1,6 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 255 мг (76%) [5-(2-хлор-3-фторфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества коричневого цвета.
54.2: 5-(2-хлор-3-фторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 54)
Аналогично примеру 51.4, используя 255 мг (0,8 ммоль) [5-(2-хлор-3-фторфенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 211 мг (0,9 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 190 мг (44%) 5-(2-хлор-3-фторфенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 248°C.
1H ЯМР (δ, ДМСО): 1,13 (т, J=6,9 Гц, 3H), 1,45-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,68 (т, J=12,1 Гц, 1H), 2,89 (т, J=4,2 Гц, 2H), 3,15 (т, J=10,3 Гц, 1H), 3,37 (т, J=4,2 Гц, 2H), 3,88-3,95 (м, 3H), 4,3-4,35 (м, 1H), 4,43 (д, J=12,6 Гц, 1H), 4,77 (д, J=4,4 Гц, 2H), 6,78-6,82 (м, 1H), 7,02-7,05 (м, 3H), 7,21-7,23 (м, 1H), 7,43-7,48 (м, 2H), 7,82 (с, 1H), 8,54 (с, 1H).
Пример 55: 5-(3-хлор-2-метоксифенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 55)
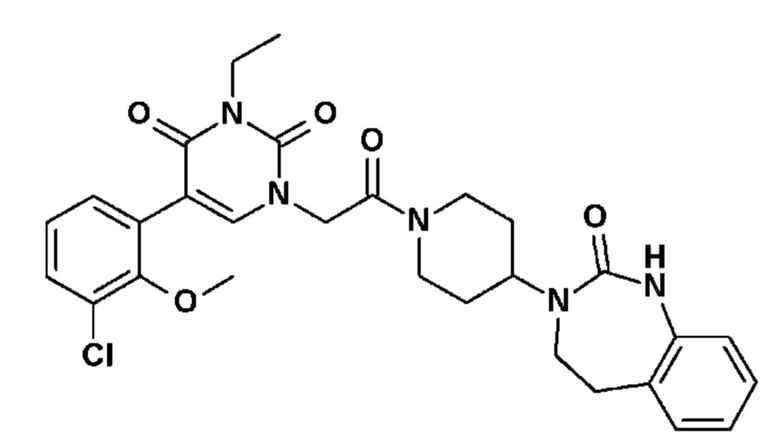
55.1: [5-(3-хлор-2-метоксифенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 400 мг (1,4 ммоль) (5-бром-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 51.1) и 410 мг (2,2 ммоль) 3-хлор-2-метоксифенилбороновой кислоты, получали 307 мг (65%) [5-(3-хлор-2-метоксифенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
55.2: 5-(3-хлор-2-метоксифенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 55)
Аналогично примеру 51.4, используя 300 мг (0,9 ммоль) [5-(3-хлор-2-метоксифенил)-3-этил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 239 мг (1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 395 мг (78%) 5-(3-хлор-2-метоксифенил)-3-этил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 219°C.
1H ЯМР (δ, ДМСО): 1,14 (т, J=7,0 Гц, 3H); 1,45-1,80 (м, 4H); 2,68 (т, J=12,5 Гц, 1H); 2,86-2,91 (м, 2H); 3,15 (т, J=12,5 Гц, 1H); 3,34-3,39 (м, 2H); 3,67 (с, 3H); 3,90-3,93 (м, 3H); 4,28-4,35 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,77-4,79 (м, 2H); 6,79-6,80 (м, 1H); 7,03-7,05 (м, 3H); 7,18 (т, J=7,8 Гц, 1H); 7,27 (дд, J=7,7, 1,7 Гц, 1H); 7,49 (дд, J=8,0, 1,7 Гц, 1H); 7,77 (с, 1H); 8,54 (с, 1H).
Пример 56: 5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 56)
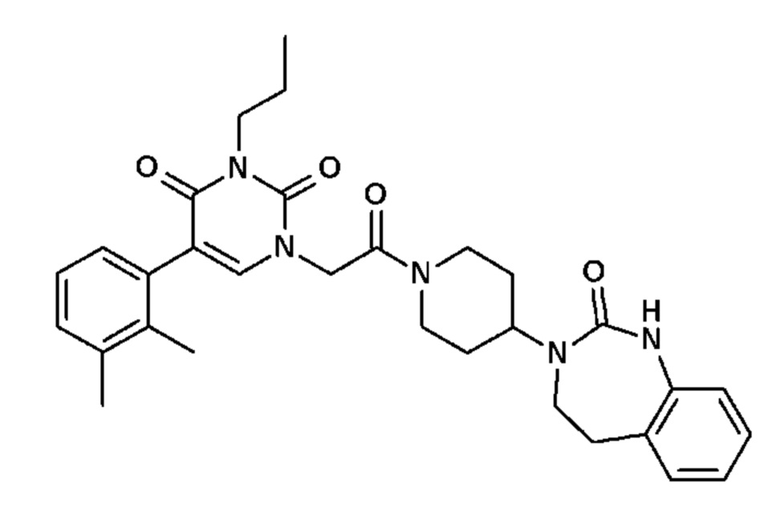
56.1: (5-бром-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 51.1, используя 4 г (20 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 2,1 мл (20 ммоль) 1-бромпропана, получали 2,9 г (61%) (5-бром-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
56.2: [5-(2,3-диметилфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 300 мг (1 ммоль) (5-бром-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 221 мг (1,5 ммоль) 2,3-диметилфенилбороновой кислоты, получали 260 мг (80%) [5-(2,3-диметилфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
56.3: [5-(2,3-диметилфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 260 мг (0,8 ммоль) [5-(2,3-диметилфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 230 мг (92%) [5-(2,3-диметилфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
56.4: 5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-дион (соединение 56)
Аналогично примеру 51.4, используя 230 мг (0,7 ммоль) [5-(2,3-диметилфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 196 мг (0,8 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 250 мг (63%) 5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 194°C.
1H ЯМР (δ, ДМСО): 0,86 (т, J=3,7 Гц, 3H), 1,52-1,60 (м, 3H), 1,62-1,80 (м, 3H), 2,04 (с, 3H), 2,27 (с, 3H), 2,67 (т, J=11 Гц, 1H), 2,89 (т, J=4,4 Гц, 2H), 3,14 (т, J=11 Гц, 1H), 3,37 (т, J=4,4 Гц, 2H), 3,83 (т, J=7 Гц, 2H), 3,93 (д, J=13,7 Гц, 1H), 4,28-4,38 (м, 1H), 4,43 (д, J=12,6 Гц, 1H), 4,75 (д, J=6,2 Гц, 2H), 6,78-6,82 (м, 1H), 6,96 (д, J=7,2 Гц, 1H), 7,01-7,05 (м, 3H), 7,10 (т, J=7,5 Гц, 1H), 7,17 (д, J=7,3 Гц, 1H), 7,59 (с, 1H), 8,54 (с, 1H).
Пример 57: 5-(2-хлор-3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 57)
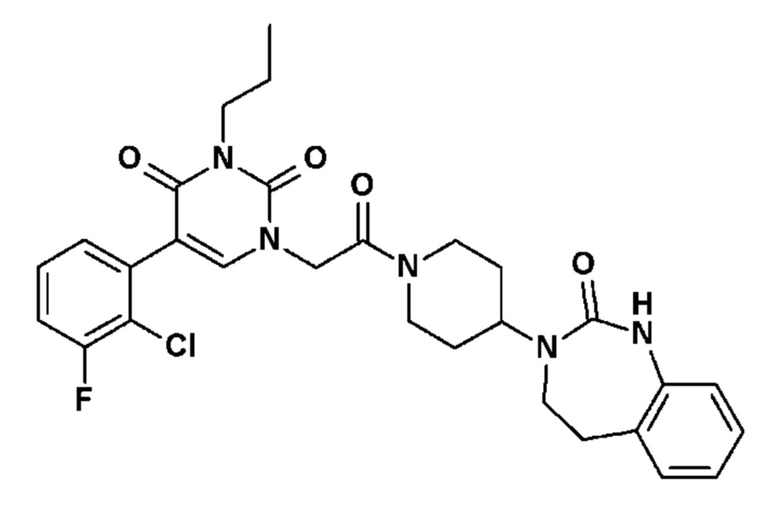
57.1: [5-(2-хлор-3-фторфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (1 ммоль) (5-бром-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 56.1) и 257 мг (1,5 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 200 мг (60%) [5-(2-хлор-3-фторфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
57.2: 5-(2-хлор-3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-дион (соединение 57)
Аналогично примеру 51.4, используя 200 мг (0,6 ммоль) [5-(2-хлор-3-фторфенил)-2,4-диоксо-3-пропил-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 158 мг (0,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из этанола, получали 240 мг (71%) 5-(2-хлор-3-фторфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 242°C.
1H ЯМР (δ, ДМСО): 0,88 (т, J=7,4 Гц, 3 H); 1,54-1,85 (м, 6 H); 2,68 (т, J=12,6 Гц, 1 H); 2,89 (м, 2 H); 3,15 (т, J=12,6 Гц, 1 H); 3,35-3,38 (м, 2 H); 3,84 (т, J=7,3 Гц, 2 H); 3,94 (д, J=13,6 Гц, 1 H); 4,28-4,36 (м, 1 H); 4,42 (д, J=13,6 Гц, 1 H); 4,77 (д, J=3,5 Гц, 2 H); 6,79-6,81 (м, 1 H); 7,02-7,05 (м, 3 H); 7,21 (дд, J=6,6, 2,5 Гц, 1 H); 7,43-7,47 (м, 2 H); 7,82 (с, 1 H); 8,54 (с, 1 H).
Пример 58: 1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 58)
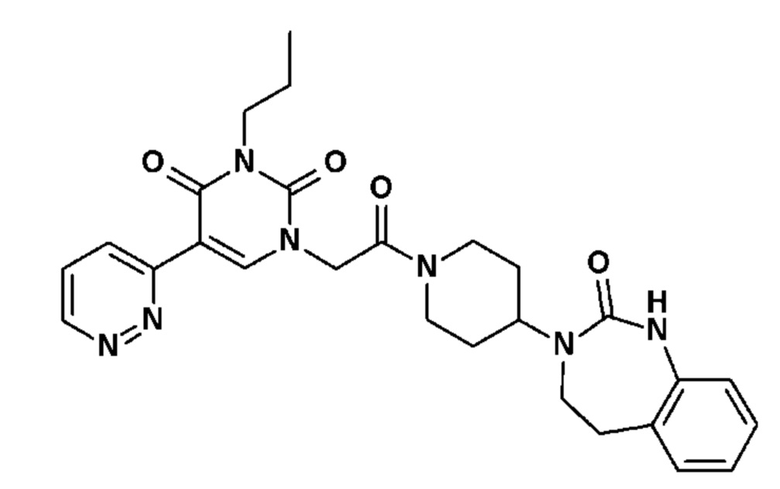
58.1: 1-бензгидрил-5-бром-3-пропил-1H-пиримидин-2,4-дион
Аналогично примеру 2.2, используя 3 г (8,4 ммоль) 1-бензгидрил-5-бром-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.1) и 1,2 мл (12,6 ммоль) 1-бромпропана, получали 2,5 г (73%) 1-бензгидрил-5-бром-3-пропил-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
58.2: 1-бензгидрил-5-(2-окси-пиридазин-3-ил)-3-пропил-1H-пиримидин-2,4-дион
Аналогично примеру 42.1, используя 500 мг (1,3 ммоль) 1-бензгидрил-5-бром-3-пропил-1H-пиримидин-2,4-диона и 241 мг (2,5 ммоль) N-оксид-пиридазина в 5 мл диоксана, получали 250 мг (48%) 1-бензгидрил-5-(2-окси-пиридазин-3-ил)-3-пропил-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
58.3: 1-бензгидрил-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-дион
Аналогично примеру 42.2, используя 250 мг (0,6 ммоль) 1-бензгидрил-5-(2-окси-пиридазин-3-ил)-3-пропил-1H-пиримидин-2,4-диона, получали 120 мг (50%) 1-бензгидрил-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
58.4: 3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-дион
Аналогично примеру 42.3, используя 120 мг (0,3 ммоль) 1-бензгидрил-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-диона, получали 70 мг (100%) 3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-диона в виде твердого вещества желтого цвета.
58.5: 1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-дион (соединение 58)
Аналогично примеру 13.1, используя 70 мг (0,3 ммоль) 3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-диона и 107 мг (0,3 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1), и после очистки флэш-хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 95/5, и рекристаллизации из этанола, получали 60 мг (38%) 1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3-пропил-5-пиридазин-3-ил-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 210°C.
1H ЯМР (δ, ДМСО): 0,89 (т, J=7,4 Гц, 3H); 1,50-1,90 (м, 6H); 2,70 (т, J=11,7 Гц, 1H); 2,91 (м, 2H); 3,17 (т, J=12,8 Гц, 1H); 3,38-3,41 (м, 2H); 3,89-3,92 (м, 3H); 4,30-4,37 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,96 (д, J=4,5 Гц, 2H); 6,80-6,82 (м, 1H); 7,03-7,05 (м, 3H); 7,73 (дд, J=8,7, 4,9 Гц, 1H); 8,37 (дд, J=8,7, 1,6 Гц, 1H); 8,55 (с, 1H); 8,75 (с, 1H); 9,16 (дд, J=4,9, 1,6 Гц, 1H).
Пример 59: 5-(3-хлор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 59)
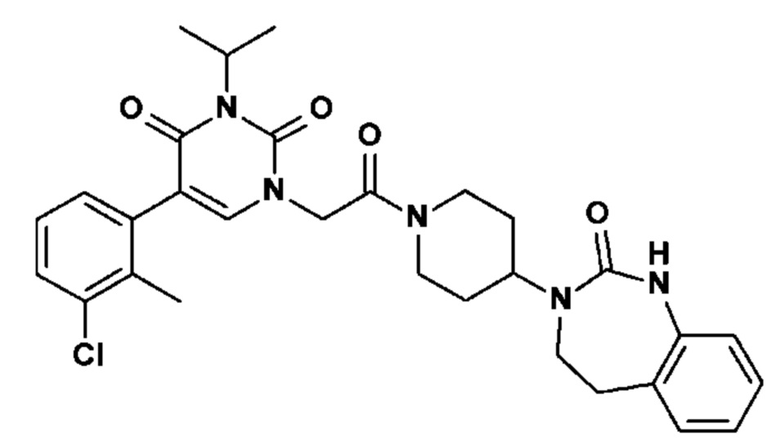
59.1: (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 51.1, используя 5 г (19 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 2,7 мл (29 ммоль) 2-бромпропана, получали 3,4 г (59%) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
59.2: [5-(3-хлор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 300 мг (1 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 275 мг (1,5 ммоль) 3-хлор-2-метилфенилбороновой кислоты, получали 190 мг (55%) [5-(3-хлор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
59.3: [5-(3-хлор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 190 мг (0,5 ммоль) [5-(3-хлор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 180 мг (99%) [5-(3-хлор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
59.4: 5-(3-хлор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 59)
Аналогично примеру 51.4, используя 180 мг (0,5 ммоль) [5-(3-хлор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 144 мг (0,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 250 мг (83%) 5-(3-хлор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 166°C.
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6H), 1,51-1,59 (м, 1H), 1,68-1,79 (м, 3H), 2,19 (с, 3H), 2,68 (т, J=12,9 Гц, 1H), 2,89 (т, J=4,3 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,38 (т, J=4,4 Гц, 2H), 3,93 (д, J=13 Гц, 1H), 4,29-4,36 (м, 1H), 4,43 (д, J=13 Гц, 1H), 4,73 (дд, J=16,3-20,2 Гц, 2H), 5,08-5,15 (м, 1H), 7,78-6,84 (м, 1H), 7,02-7,06 (м, 3H), 7,13 (дд, J=1-7,7 Гц, 1H), 7,25 (т, J=7,7 Гц, 1H), 7,45 (д, J=7,2 Гц, 1H), 7,65 (с, 1H), 8,50 (с, 1H).
Пример 60: 5-(3-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 60)
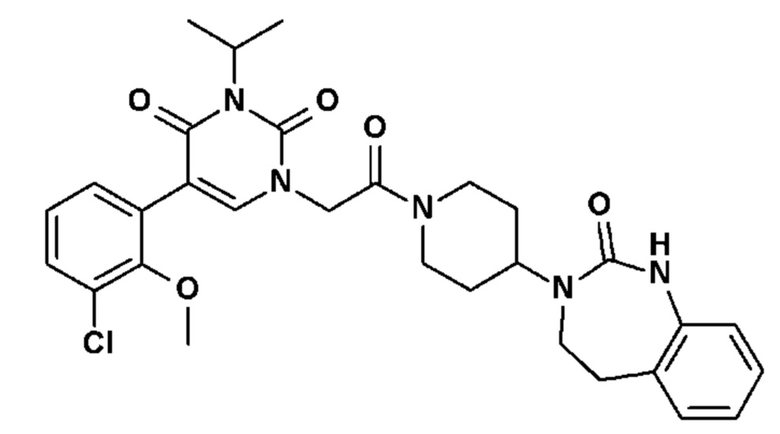
60.1: [5-(3-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 300 мг (1 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 293 мг (1,6 ммоль) 3-хлор-2-метоксифенилбороновой кислоты, получали 325 мг (90%) [5-(3-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
60.2: [5-(3-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 325 мг (0,9 ммоль) [5-(3-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 300 мг (96%) [5-(3-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
60.3: 5-(3-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 60)
Аналогично примеру 51.4, используя 180 мг (0,5 ммоль) [5-(3-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 230 мг (0,9 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 400 мг (81%) 5-(3-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 155°C.
1H ЯМР (δ, ДМСО): 1,40 (д, J=7 Гц, 6H), 1,53-1,60 (м, 1H), 1,65-1,78 (м, 3H), 2,67 (т, J=12 Гц, 1H), 2,89 (т, J=4,7 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,37 (т, J=4,6 Гц, 2H), 3,68 (с, 3H), 3,94 (д, J=12,7 Гц, 1H), 4,29-4,35 (м, 1H), 4,43 (д, J=12,6 Гц, 1H), 4,73 (дд, J=16,2-19,6 Гц, 2H), 5,09-5,16 (м, 1H), 6,79-6,83 (м, 1H), 7,02-7,06 (м, 3H), 7,17 (т, J=7,9 Гц, 1H), 7,25 (дд, J=1,6-7,6 Гц, 1H), 7,48 (дд, J=1,6-8 Гц, 1H), 7,71 (с, 1H), 8,50 (с, 1H).
Пример 61: 5-(3-фтор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 61)
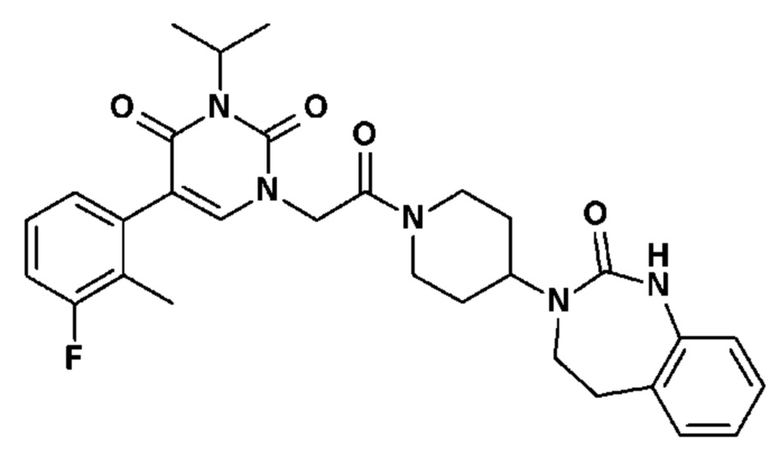
61.1: [5-(3-фтор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 200 мг (0,7 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 161 мг (1,1 ммоль) 3-фтор-2-метилфенилбороновой кислоты, и после очистки флэш-хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 94/6 с 0,1% уксусной кислоты, получали 175 мг (83%) [5-(3-фтор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
61.2: 5-(3-фтор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 61)
Аналогично примеру 51.4, используя 180 мг (0,5 ммоль) [5-(3-фтор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 134 мг (0,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 240 мг (79%) 5-(3-фтор-2-метилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 244°C.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,8 Гц, 6H), 1,52-1,57 (м, 1H), 1,64-1,73 (м, 3H), 2,06 (д, J=2,1 Гц, 3H), 2,68 (д, J=11 Гц, 1H), 2,88 (т, J=4,4 Гц, 2H), 3,14 (д, J=11 Гц, 1H), 3,37 (т, J=4,4 Гц, 2H), 3,93 (д, J=13 Гц, 1H), 4,31-4,33 (м, 1H), 4,43 (д, J=13 Гц, 1H), 4,73 (д, J=6,6 Гц, 2H), 5,11 (кв, J=6,9 Гц, 1H), 6,78-6,82 (м, 1H), 7,00-7,05 (м, 4H), 7,15-7,19 (м, 1H), 7,23-7,28 (м, 1H), 7,66 (с, 1H), 8,54 (с, 1H).
Пример 62: 5-(2,3-дифторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 62)
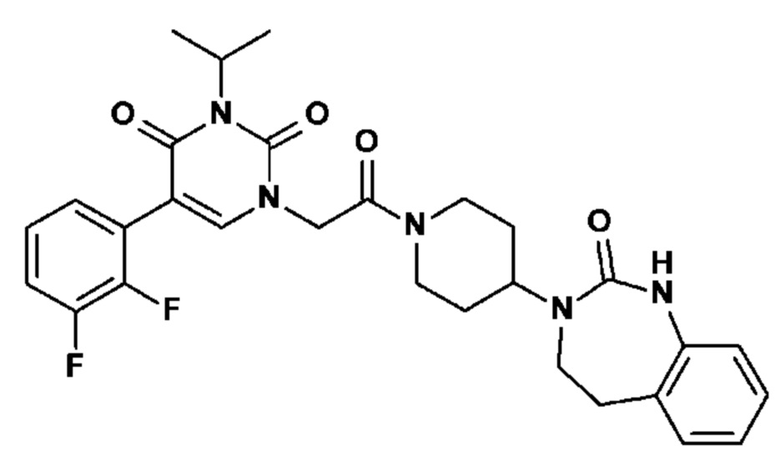
62.1: [5-(2,3-дифторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 200 мг (0,7 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 422 мг (2,6 ммоль) 2,3-дифторфенилбороновой кислоты, получали 110 мг (50%) [5-(2,3-дифторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
62.2: [5-(2,3-дифторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 135 мг (0,4 ммоль) [5-(2,3-дифторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 130 мг (100%) [5-(2,3-дифторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде бесцветного масла.
62.3: 5-(2,3-дифторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 62)
Аналогично примеру 51.4, используя 130 мг (0,4 ммоль) [5-(2,3-дифторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 98 мг (0,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 160 мг (72%) 5-(2,3-дифторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 242°C.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,9 Гц, 6H), 1,45-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,68 (т, J=12 Гц, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,15 (т, J=12 Гц, 1H), 3,38 (т, J=4,4 Гц, 2H), 3,95 (д, J=12 Гц, 1H), 4,30-4,40 (м, 1H), 4,45 (д, J=12 Гц, 1H), 4,75 (д, J=2 Гц, 2H), 5,11 (кв, J=6,9 Гц, 1H), 6,78-6,82 (м, 1H), 7,02-7,04 (м, 3H), 7,19-7,26 (м, 2H), 7,44 (дд, J=1,9-10,2 Гц, 1H), 7,86 (с, 1H), 8,55 (с, 1H).
Пример 63: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 63)
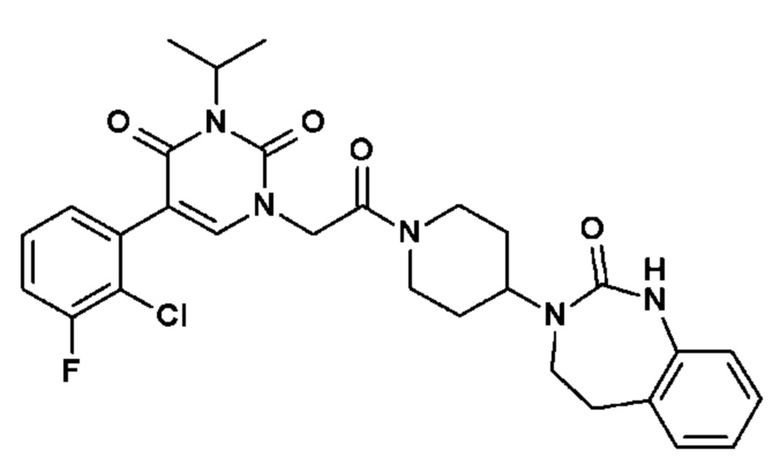
63.1: [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 200 мг (0,7 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 183 мг (1,1 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 130 мг (56%) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
63.2: [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 165 мг (0,5 ммоль) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 160 мг (100%) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
63.3: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 63)
Аналогично примеру 51.4, используя 160 мг (0,5 ммоль) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 115 мг (0,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 170 мг (63%) 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 254°C.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,8 Гц, 6H), 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,68 (т, J=12 Гц, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,14 (т, J=12 Гц, 1H), 3,37 (т, J=4,5 Гц, 2H), 3,93 (д, J=13,9 Гц, 1H), 4,28-4,38 (м, 1H), 4,43 (д, J=13,9 Гц, 1H), 4,74 (д, J=6,2 Гц, 2H), 5,10 (кв, J=6,9 Гц, 1H), 6,78-6,82 (м, 1H), 7,02-7,04 (м, 3H), 7,20-7,22 (м, 1H), 7,41-7,47 (м, 2H), 7,77 (с, 1H), 8,54 (с, 1H).
Пример 64: 3-изопропил-5-(2-метокси-3-метилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 64)
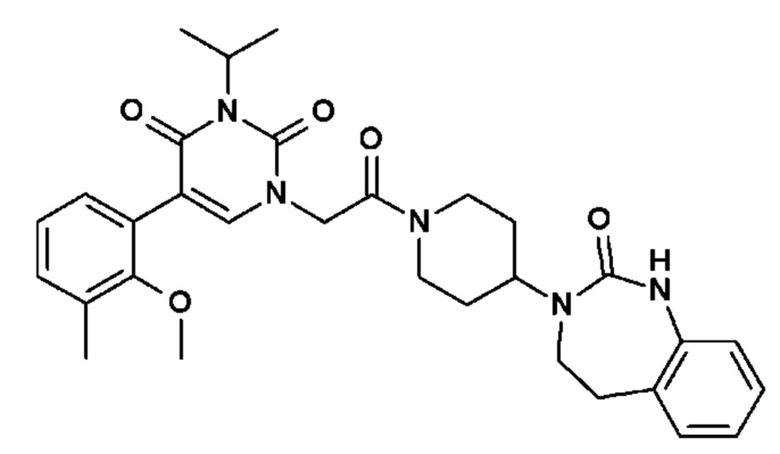
64.1: [3-изопропил-5-(2-метокси-3-метилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 500 мг (1,6 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 408 мг (2,5 ммоль) 2-метокси-3-метилфенилбороновой кислоты, получали 495 мг (91%) [3-изопропил-5-(2-метокси-3-метилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
64.2: 3-изопропил-5-(2-метокси-3-метилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 64)
Аналогично примеру 51.4, используя 495 мг (1,5 ммоль) [3-изопропил-5-(2-метокси-3-метилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 384 мг (1,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из н-бутанола, получали 285 мг (34%) 3-изопропил-5-(2-метокси-3-метилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 260°C.
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 6H); 1,52-1,59 (м, 4H); 2,19 (с, 3H); 2,60 (т, J=12,6 Гц, 1H); 2,79-2,84 (м, 2H); 3,07 (т, J=12,7 Гц, 1H); 3,29-3,32 (м, 2H); 3,47 (с, 3H); 3,86 (д, J=13,5 Гц, 1H); 4,24-4,28 (м, 1H); 4,36 (д, J=12,9 Гц, 1H); 4,66 (д, J=7,7 Гц, 2H); 5,05-5,07 (м, 1H); 6,72-6,74 (м, 1H); 6,94-7,02 (м, 5H); 7,12 (д, J=7,3 Гц, 1H); 7,56 (с, 1H); 8,47 (с, 1H).
Пример 65: 5-(3-хлор-4-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 65)
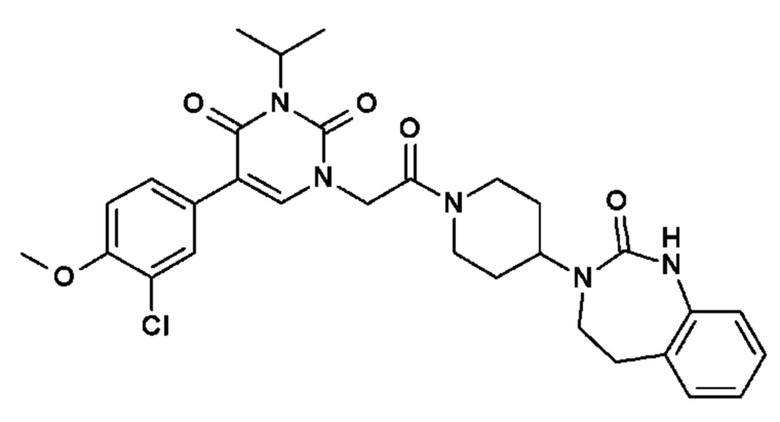
65.1: [5-(3-хлор-4-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (1 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 367 мг (2 ммоль) 3-хлор-4-метоксифенилбороновой кислоты, получали 160 мг (46%) [5-(3-хлор-4-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества желтого цвета.
65.2: 5-(3-хлор-4-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 65)
Аналогично примеру 51.4, используя 150 мг (0,4 ммоль) [5-(3-хлор-4-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 125 мг (0,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 138 мг (55%) 5-(3-хлор-4-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 250°C.
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6 H); 1,57 (д, J=13,0 Гц, 1 H); 1,63-1,76 (м, 3 H); 2,69 (т, J=12,5 Гц, 1 H); 2,91 (с, 2 H); 3,16 (т, J=12,1 Гц, 1 H); 3,40 (д, J=6,6 Гц, 2 H); 3,89 (с, 3 H); 3,96 (д, J=13,5 Гц, 1 H); 4,33 (м, 1 H); 4,44 (д, J=12,9 Гц, 1 H); 4,76 (с, 2 H); 5,14-5,16 (м, 1 H); 6,80-6,82 (м, 1 H); 7,04-7,06 (м, 3 H); 7,19 (д, J=8,7 Гц, 1 H); 7,51 (дд, J=8,6, 2,3 Гц, 1 H); 7,62 (д, J=2,2 Гц, 1 H); 7,89 (с, 1 H); 8,54 (с, 1 H).
Пример 66: 5-(2-фторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 66)
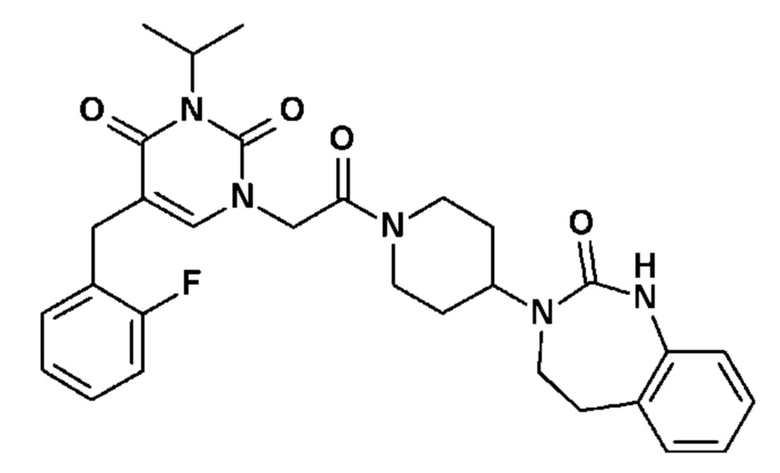
66.1: [5-(2-фторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 100 мг (0,3 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 186 мг (0,8 ммоль) эфира 2-фтор-бензил пинакол бороновой кислоты, получали 35 мг (33%) [5-(2-фторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
66.2: 5-(2-фторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 66)
Аналогично примеру 51.4, используя 35 мг (0,1 ммоль) [5-(2-фторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 32 мг (0,1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 20 мг (29%) 5-(2-фторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,35 (д, J=6,9 Гц, 6H); 1,54-1,69 (м, 4H); 2,60-2,73 (м, 1H); 2,90 (м, 2H); 3,13 (т, J=12,6 Гц, 1H); 3,33 (м, 2H); 3,59 (м, 2H); 3,91 (д, J=13,8 Гц, 1H); 4,31 (м, 1H); 4,42 (д, J=12,9 Гц, 1H); 4,68 (с, 2H); 5,05-5,08 (м, 1H); 6,80-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,15-7,17 (м, 2H); 7,29 (м, 2H); 7,36 (с, 1H); 8,53 (с, 1H).
Пример 67: 5-(3,4-дихлорфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 67)
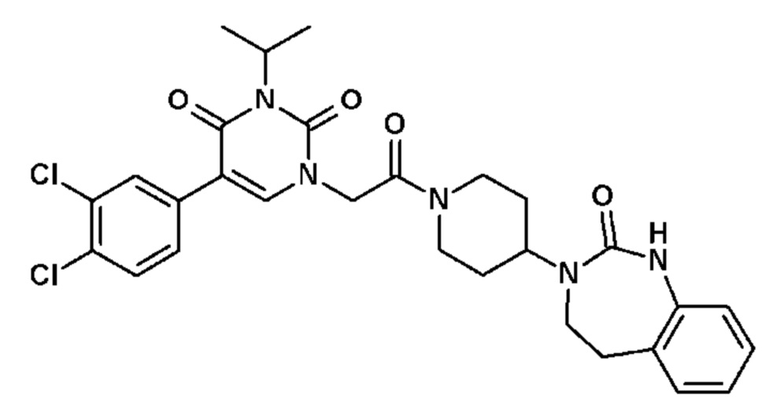
67.1: [5-(3,4-дихлорфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 650 мг (2 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 691 мг (3,6 ммоль) 3,4-дихлор-фенилбороновой кислоты, получали 700 мг (92%) [5-(3,4-дихлорфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
67.2: 5-(3,4-дихлорфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 67)
Аналогично примеру 51.4, используя 760 мг (2 ммоль) [5-(3,4-дихлорфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 627 мг (2,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в изопропаноле, получали 1 г (88%) 5-(3,4-дихлорфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 237°C.
1H ЯМР (δ, ДМСО): 1,42 (д, J=6,9 Гц, 6 H); 1,71-1,60 (м, 4 H); 2,69 (т, J=12,5 Гц, 1 H); 2,89-2,92 (м, 2 H); 3,24-3,11 (м, 1 H); 3,96 (д, J=13,6 Гц, 2 H); 4,27-4,38 (м, 1 H); 4,29-4,45 (м, J=12,9 Гц, 1 H); 4,78 (с, 2 H); 5,14-5,15 (м, 1 H); 6,80-6,81 (м, 1 H); 7,04-7,05 (м, 3 H); 7,59 (дд, J=8,5, 2,1 Гц, 1 H); 7,68 (д, J=8,5 Гц, 1 H); 7,85 (д, J=2,1 Гц, 1 H); 8,54 (с, 1 H); 8,05 (с, 1 H).
Пример 68: 5-(2,3-диметилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 68)
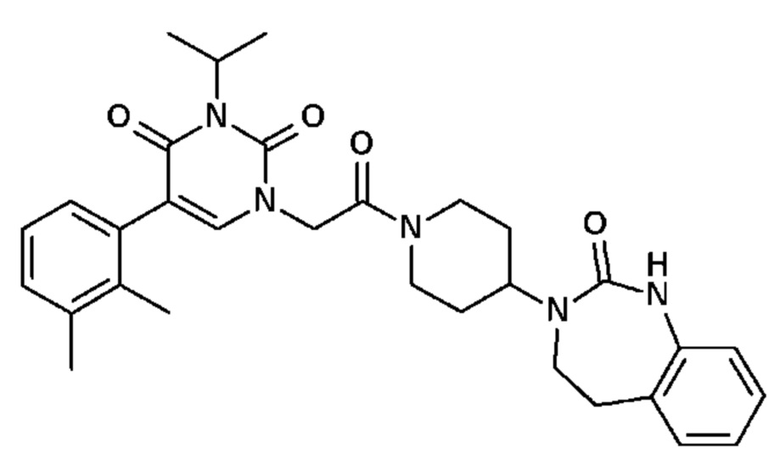
68.1: [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 300 мг (1 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 236 мг (1,6 ммоль) 2,3-диметилфенилбороновой кислоты, получали 200 мг (62%) [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
68.2: [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 200 мг (0,6 ммоль) [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 190 мг (99%) [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
68.3: 5-(2,3-диметилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 68)
Аналогично примеру 51.4, используя 190 мг (0,6 ммоль) [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 162 мг (0,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 200 мг (61%) 5-(2,3-диметилфенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 269°C.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,8 Гц, 6H), 1,52-1,56 (м, 1H), 1,64-1,76 (м, 3H), 2,04 (с, 3H), 2,27 (с, 3H), 2,67 (т, J=12,5 Гц, 1H), 2,88 (т, J=4,4 Гц, 2H), 3,14 (т, J=12,5 Гц, 1H), 3,37 (т, J=4,6 Гц, 2H), 3,93 (д, J=13,3 Гц, 1H), 4,31-4,33 (м, 1H), 4,43 (д, J=13,3 Гц, 1H), 4,71 (д, J=8,5 Гц, 2H), 5,09-5,13 (м, 1H), 6,78-6,82 (м, 1H), 6,95 (д, J=7,1 Гц, 1H), 7,01-7,05 (м, 3H), 7,09 (т, J=7,5 Гц, 1H), 7,16 (д, J=7,4 Гц, 1H), 7,54 (с, 1H), 8,53 (с, 1H).
Пример 69: 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 69)
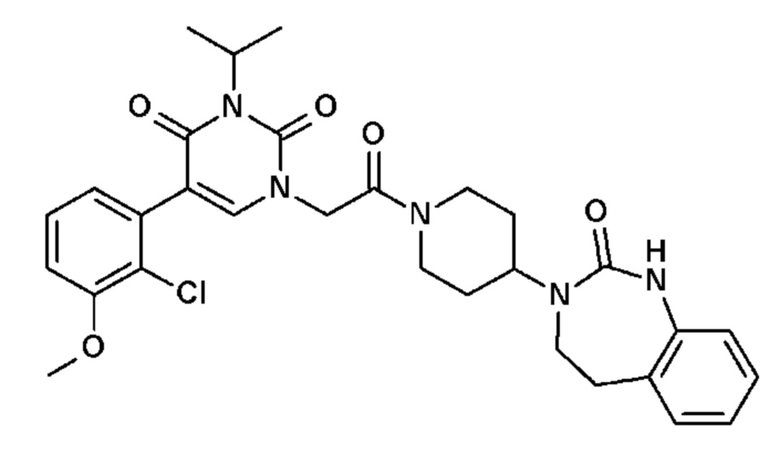
69.1: [5-(2-хлор-3-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (1 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 275 мг (1,5 ммоль) 2-хлор-3-метоксифенилбороновой кислоты, получали 115 мг (33%) [5-(2-хлор-3-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
69.2: 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 69)
Аналогично примеру 51.4, используя 105 мг (0,3 ммоль) [5-(2-хлор-3-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 88 мг (0,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 85 мг (48%) 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,9 Гц, 6 H); 1,53-1,56 (м, 1H); 1,65-1,70 (м, 3H); 2,60-2,75 (м, 1H); 2,90 (м, 2H); 3,10-3,20 (м, 1H); 3,38 (м, 2 H); 3,89 (с, 3 H); 3,90 (м, 1H); 4,20-4,40 (м, 1H); 4,40-4,50 (м, 1H); 4,73 (д, J=6,0 Гц, 2 H); 5,10 (т, J=6,9 Гц, 1 H); 6,80-6,82 (м, 1 H); 6,91 (дд, J=7,6, 1,4 Гц, 1 H); 7,04-7,06 (м, 3 H); 7,17-7,18 (м, 1 H); 7,34 (т, J=8,0 Гц, 1 H); 7,67 (с, 1 H); 8,53 (с, 1 H).
Пример 70: 5-(5-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 70)
70.1: [5-(5-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 500 мг (1,6 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 458 мг (2,5 ммоль) 5-хлор-2-метоксифенилбороновой кислоты, получали 275 мг (46%) [5-(5-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде масла коричневого цвета.
70.2: [5-(5-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 270 мг (0,7 ммоль) [5-(5-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 241 мг (93%) [5-(5-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
70.3: 5-(5-хлор-2-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 70)
Аналогично примеру 51.4, используя 230 мг (0,7 ммоль) [5-(5-хлор-2-метоксифенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 192 мг (0,8 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 308 мг (81%) 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,9 Гц, 6 H); 1,59-1,71 (м, 4 H); 2,66 (д, J=12,7 Гц, 1 H); 2,90 (с, 2 H); 3,13 (д, J=12,8 Гц, 1 H); 3,38 (т, J=4,7 Гц, 2H); 3,75 (с, 3 H); 3,94 (д, J=13,3 Гц, 1 H); 4,33 (т, J=9,9 Гц, 1 H); 4,43 (д, J=13,0 Гц, 1 H); 4,72 (д, J=5,1 Гц, 2 H); 5,09-5,10 (м, 1 H); 6,80-6,81 (м, 1 H); 7,05-7,06 (м, 4 H); 7,25 (д, J=2,7 Гц, 1 H); 7,39 (дд, J=8,8, 2,7 Гц, 1 H); 7,68 (с, 1 H); 8,53 (с, 1 H).
Пример 71: 5-(2,3-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 71)
71.1: 2-(2,3-дифторбензил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан
Аналогично примеру 1.8, используя 2 мл (16 ммоль) 2,3-дифторбензилбромида и 4,8 г (19 ммоль) биспинаколборана, получали 2,5 г (62%) 2-(2,3-дифторбензил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана в виде бесцветного масла.
71.2: [5-(2,3-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 300 мг (1 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1) и 1 г (4 ммоль) 2-(2,3-дифторбензил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана, получали 270 мг (32%) [5-(2,3-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
71.3: 5-(2,3-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 71)
Аналогично примеру 51.4, используя 270 мг (0,8 ммоль) [5-(2,3-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 235 мг (1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 60 мг (13%) 5-(2,3-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 230°C.
1H ЯМР (δ, ДМСО): 1,35 (д, J=6,9 Гц, 6H); 1,50-1,80 (м, 4H); 2,67 (т, J=12,5 Гц, 1H); 2,90 (м, 2H); 3,13 (т, J=10,5 Гц, 1H); 3,39 (м, 2H); 3,63 (с, 2H); 3,92 (д, J=13,6 Гц, 1H); 4,31 (м, 1H); 4,42 (д, J=12,9 Гц, 1H); 4,68 (д, J=2,9 Гц, 2H); 5,05-5,06 (м, 1H); 6,80-6,82 (м, 1H); 7,03-7,05 (м, 3H); 7,12-7,14 (м, 2H); 7,28-7,31 (м, 1H); 7,42 (с, 1H); 8,54 (с, 1H).
Аналогично примеру 70, используя соответствующие коммерчески доступные или предварительно полученные реагенты, получали следующие соединения:
Соединение 72: (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-ацетонитрил
1H ЯМР (400 МГц, ДМСО): δ (м.д.) 1,56 (д, J=13,8 Гц, 1H); 1,65-1,77 (м, 3H); 2,70 (т, J=12,5 Гц, 1H); 2,90 (т, J=4,9 Гц, 2H); 3,17 (т, J= 12,6 Гц, 1H); 3,38 (с, 2H); 3,93-3,96 (м, 1H); 4,33 (т, J=11,4 Гц, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,85 (с, 2H); 4,94 (с, 2H); 6,79-6,83 (м, 1H); 7,04 (т, J=4,5 Гц, 3H); 7,24-7,29 (м, 4H); 7,44-7,49 (м, 2H); 7,98 (с, 1H); 8,53 (с, 1H).
Соединение 73: 3-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-пропионовая кислота
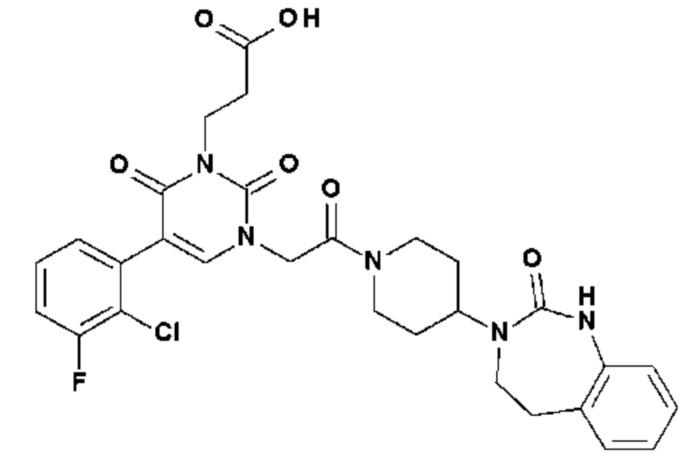
1H ЯМР (400 МГц, ДМСО): δ (м.д.) 1,55 (д, J=12,9 Гц, 1H); 1,72 (т, J=21,2 Гц, 3H); 2,50 (м, 2H); 2,69 (т, J=12,4 Гц, 1H); 2,90 (м, 2H); 3,16 (м, 1H); 3,38 (м, 2H); 3,95 (д, J=13,6 Гц, 1H); 4,09 (т, J=7,7 Гц, 2H); 4,33 (с, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,78 (с, 2H); 6,81 (дт, J=7,8, 4,2 Гц, 1H); 7,04 (т, J=4,0 Гц, 3H); 7,22 (дд, J=6,3, 2,8 Гц, 1H); 7,43-7,46 (м, 2H); 7,84 (с, 1H); 8,53 (с, 1H).
Пример 74: 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-метилбензойный ацетат (реакционная схема № 3, соединение 74)
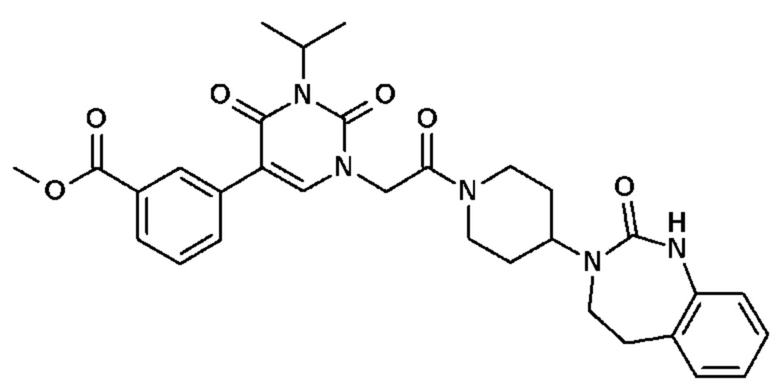
74.1: (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусная кислота
Аналогично примеру 16.8, используя 1,9 г (10 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1), получали 1,8 г (100%) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты в виде твердого вещества белого цвета.
74.2: 5-бром-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 1.6, используя 1 г (3 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-уксусной кислоты и 1 г (4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 1,8 г (100%) 5-бром-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
74.3: 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-метилбензойный ацетат (соединение 74)
Аналогично примеру 44.1, используя 300 мг (0,6 ммоль) 5-бром-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона и 146 мг (0,8 ммоль) 3-метоксикарбонилфенилбороновой кислоты, получали 51 мг (15%) 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-метилбензойного ацетата в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,43 (д, J=6,9 Гц, 6 H); 1,55-1,61 (м, 1 H); 1,62-1,82 (м, 3H); 2,68 (м, 1 H); 2,91 (м, 2 H); 3,17 (т, J=12 Гц, 1 H); 3,41 (м, 2 H); 3,89 (с, 3 H); 4,03 (д, J=8 Гц; 1 H); 4,34 (м, 1 H); 4,45 (д, J=12 Гц, 1 H); 4,80 (с, 2 H); 5,15-5,18 (м, 1 H); 6,81-6,83 (м, 1 H); 7,04-7,06 (м, 3 H); 7,52 (т, J=7,8 Гц, 1 H); 7,78 (д, J=7,5 Гц, 1 H); 7,89 (д, J=7,7 Гц, 1 H); 7,95 (с, 1 H); 8,12 (с, 1 H); 8,53 (с, 1 H).
Пример 75: 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойная кислота (реакционная схема № 3, соединение 75)
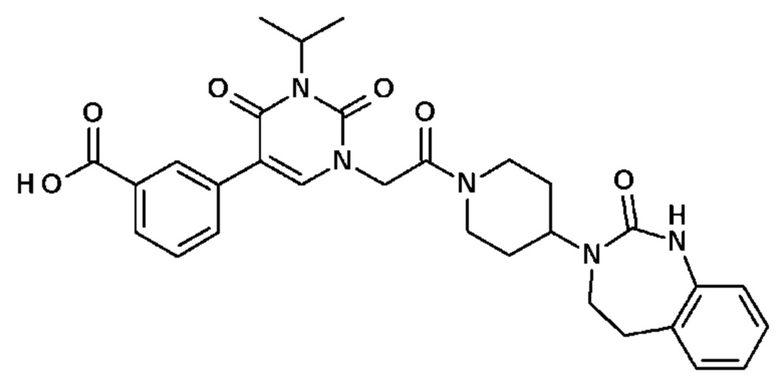
Аналогично примеру 44.1, используя 300 мг (0,6 ммоль) 5-бром-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона и 146 мг (0,8 ммоль) 3-метоксикарбонил фенилбороновой кислоты, и после очистки препаративной высокоэффективной жидкостной хроматографией (колонка Xbridge C18, изократическая хроматография, 41% ацетонитрил в воде), получали 92 мг (28%) 3-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойной кислоты в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,43 (д, J=6,9 Гц, 6 H); 1,55-1,61 (м, 1 H); 1,62-1,82 (м, 3H); 2,68 (м, 1 H); 2,91 (м, 2 H); 3,17 (т, J=12 Гц, 1 H); 3,41 (м, 1 H); 3,96 (д, J=12 Гц; 1 H); 4,03 (с, 1 H); 4,34 (м, 1 H); 4,45 (д, J=12 Гц, 1 H); 4,80 (с, 2 H); 5,15-5,18 (м, 1 H); 6,81-6,83 (м, 1 H); 7,04-7,06 (м, 3 H); 7,52 (т, J=7,8 Гц, 1 H); 7,78 (д, J=7,5 Гц, 1 H); 7,89 (д, J=7,7 Гц, 1 H); 7,95 (с, 1 H); 8,12 (с, 1 H); 8,53 (с, 1 H).
Пример 76: 5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 76)
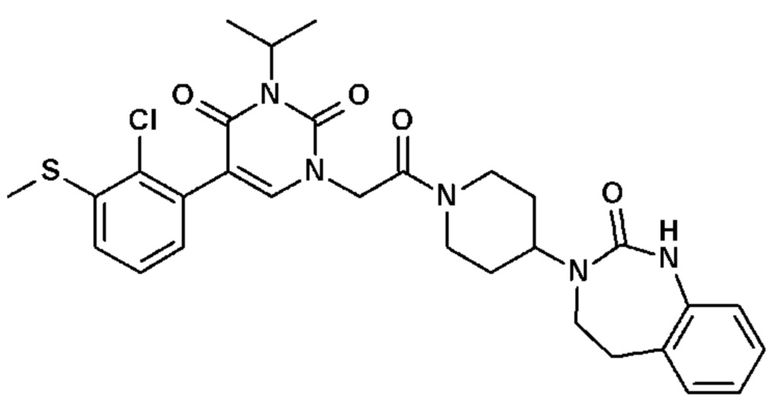
76.1: 1-бром-2-хлор-3-метилсульфанил-бензол
К охлажденному до -78°C раствору 1 г (3,7 ммоль) 1,3-дибром-2-хлорбензола в 20 мл диэтилового эфира добавляли 1,6 мл (4 ммоль) 2,5M раствора н-бутиллития в гексане. Смесь перемешивали при -78°C в течение 30 минут, затем добавляли по каплям 0,4 мл (4 ммоль) диметилдисульфида. Реакционную смесь перемешивали в течение 15 минут при -78°C и далее 30 минут при комнатной температуре. Эту смесь медленно гидролизовали и затем экстрагировали этилацетатом. Органическую фазу промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, потом сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя чистым гептаном. Получали 0,4 г (43%) 1-бром-2-хлор-3-метилсульфанил-бензола в виде бесцветного масла.
76.2: [5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору предварительно дегазированного азотом 380 мг (1,6 ммоль) 1-бром-2-хлор-3-метилсульфанил-бензола, 447 мг (1,8 ммоль) биспинаколборана и 471 мг (4,8 ммоль) ацетата калия в 15 мл диметилформамида добавляли 65 мг (0,1 ммоль) комплекса дихлорметана и 1,1ʹ-бис(дифенилфосфино)ферроцен-дихлорпалладия(II). Реакционную смесь нагревали при 90°C в течение 2 часов. После охлаждения, добавляли 565 мг (5,3 ммоль) карбоната натрия, 488 мг (1,6 ммоль) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 59.1), 65 мг (0,1 ммоль) комплекса дихлорметана и 1,1ʹ-бис(дифенилфосфино)ферроцен-дихлорпалладия(II) и 1,5 мл воды. Через 4 ч нагревания при 90°C, реакционную смесь гидролизовали и далее разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали водой, затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30. Получали 80 мг (13%) [5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
76.3: [5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 80 мг (0,2 ммоль) [5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 70 мг (91%) [5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества желтого цвета.
76.4: 5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 76)
К раствору 80 мг (0,2 ммоль) [5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, 29 мг (0,3 ммоль) 1-окси-пиридин-2-ола и 50 мг (0,3 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид хлорида в 3,2 мл диметилформамида добавляли 64 мг (0,3 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) и 40 мкл (0,3 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Эту смесь гидролизовали насыщенным водным раствором гидрокарбоната натрия и далее разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным водным раствором гидрокарбоната натрия, водой, затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3. Продукт кристаллизовался в этилацетате. Получали 70 мг (54%) 5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидробензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 261°C.
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,9 Гц, 6H); 1,50-1,80 (м, 4H); 2,55 (с, 3H); 2,68 (т, J=12,4 Гц, 1H); 2,90 (м, 2H); 3,15 (т, J=12,3 Гц, 1H); 3,38 (м, 2H); 3,94 (д, J=13,5 Гц, 1H); 4,33 (м, 1H); 4,44 (д, J=12,8 Гц, 1H); 4,73 (д, J=5,4 Гц, 2H); 5,08-5,11 (м, 1H); 6,79-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,11 (дд, J=7,5, 1,6 Гц, 1H); 7,31-7,33 (м, 1H); 7,40 (т, J=7,7 Гц, 1H); 7,70 (с, 1H); 8,53 (с, 1H).
Пример 77: 5-(2-хлор-3-метансульфинил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 77)
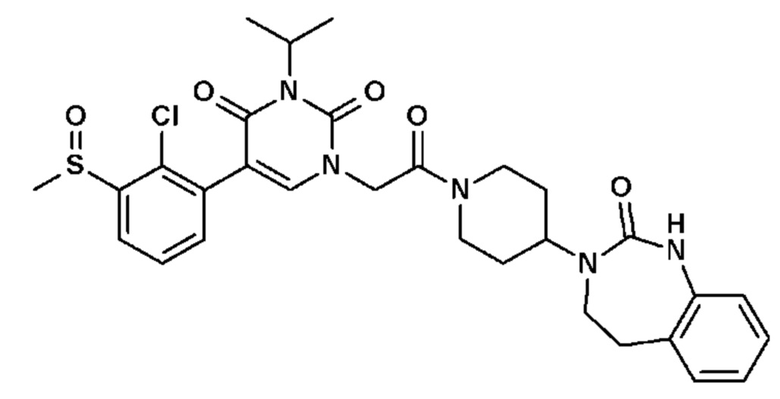
К раствору 20 мг (0,03 ммоль) 5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 76.4) в 0,2 мл дихлорметанадобавляли 7,5 мг (0,03 ммоль) 3-хлорпероксибензойной кислоты в 0,2 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Эту смесь разбавляли дихлорметаном. Органическую фазу промывали один раз насыщенным водным раствором гидрокарбоната натрия, один раз 10% водный раствор тиосульфата натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3. Получали 12 мг (58%) 5-(2-хлор-3-метансульфинил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6H); 1,53-1,76 (м, 4H); 2,66-2,72 (м, 1H); 2,83 (с, 3H); 2,90 (м, 2H); 3,15 (т, J=11,9 Гц, 1H); 3,38 (м, 2H); 3,94 (д, J=13,6 Гц, 1H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,75 (м, 2H); 5,07-5,14 (м, 1H); 6,79-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,56 (дд, J=7,5, 1,7 Гц, 1H); 7,71 (т, J=7,7 Гц, 1H); 7,80 (с, 1H); 7,87 (дд, J=7,8, 1,6 Гц, 1H); 8,53 (с, 1H).
Пример 78: 5-(2-хлор-3-метансульфонил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 78)
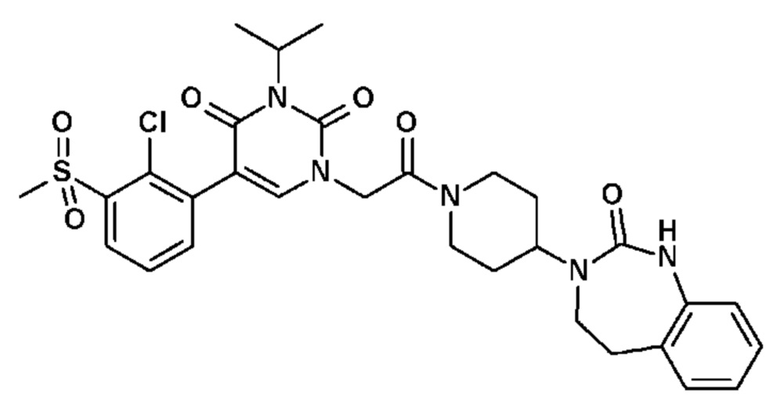
Раствор, содержащий 2 мг (2 мкмоль) аммония молибдата тетрагидрата в 76 мкл (0,7 ммоль) перекиси водорода, добавляли к 22 мг (40 мкмоль) 5-(2-хлор-3-метилсульфанил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 76.4), в 0,9 мл этанола. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, гидролизовали насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали этилацетатом. Органическую фазу промывали дважды 10% водным раствором тиосульфата натрия, один раз водой, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Продукт осаждали в диэтиловый эфир, затем растворитель удаляли в атмосфере азота и полученное твердое вещество белого цвета сушили в вакууме. Получали 18 мг (76%) 5-(2-хлор-3-метансульфонил-фенил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,42 (д, J=6,9 Гц, 6H); 1,51-1,74 (м, 4H); 2,69 (т, J=12,4 Гц, 1H); 2,89-2,91 (м, 2H); 3,15 (т, J=12,3 Гц, 1H); 3,37-3,39 (м, 2H); 3,42 (с, 3H); 3,94 (д, J=13,6 Гц, 1H); 4,30-4,35 (м, 1H); 4,44 (д, J=12,9 Гц, 1H); 4,71-4,81 (м, 2H); 5,08-5,15 (м, 1H); 6,79-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,65-7,74 (м, 2H); 7,81 (с, 1H); 8,11 (дд, J=7,7, 1,9 Гц, 1H); 8,53 (с, 1H).
Пример 79: 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-метилбензойный ацетат (реакционная схема № 3, соединение 79)
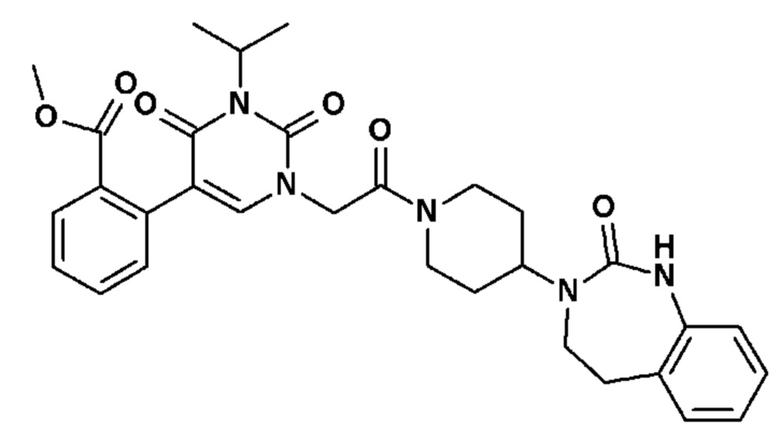
Аналогично примеру 44.1, используя 400 мг (0,8 ммоль) 5-бром-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 74.2) и 278 мг (1,5 ммоль) 2-метоксикарбонил фенил бороновой кислоты, и после очистки препаративной высокоэффективной жидкостной хроматографией (колонка Xbridge C18, изократическая хроматография, 46% ацетонитрил в воде), получали 150 мг (33%) 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-метилбензойного ацетата в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,39 (д, J=6,9 Гц, 6 H); 1,62-1,51 (м, 1 H); 1,80-1,63 (м, 3 H); 2,70 (т, J=12,1 Гц, 1 H); 2,90 (м, 2 H); 3,16 (т, J=12,6 Гц, 1 H); 3,39 (м, 2 H); 3,68 (с, 3 H); 3,96 (д, J=13,5 Гц, 1 H); 4,34 (м, 1 H); 4,46 (д, J=12,9 Гц, 1 H); 4,77 (с, 2 H); 5,11-5,04 (м, 1 H); 6,83-6,79 (м, 1 H); 7,05 (т, J=3,6 Гц, 3 H); 7,32-7,30 (м, 1 H); 7,49 (тд, J=7,6, 1,3 Гц, 1 H); 7,63 (тд, J=7,6, 1,5 Гц, 1 H); 7,74 (с, 1 H); 7,80 (дд, J=7,7, 1,4 Гц, 1 H); 8,54 (с, 1 H).
Пример 80: 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойная кислота (реакционная схема № 3, соединение 80)
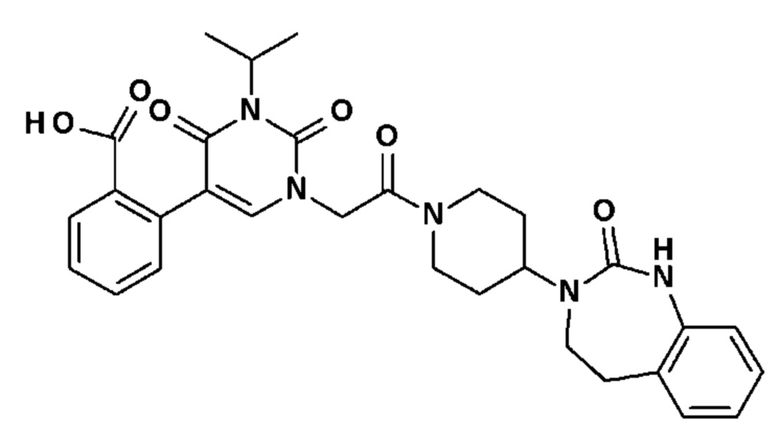
К раствору 45 мг (78 мкмоль) 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-метилбензойного ацетата в 2 мл метанола добавляли 371 мг (1,2 ммоль) октагидрата гидроксида бария. Смесь перемешивали при комнатной температуре в течение 25 часов. К смеси добавляли воду. pH водной фазы доводили до значения, равного 5, с помощью 1н водного раствора соляной кислоты, затем, после экстракции этилацетатом, органическую фазу сушили над безводным сульфатом натрия и далее фильтровали и концентрировали досуха. Неочищенный остаток очищали препаративной высокоэффективной жидкостной хроматографией (колонка Xbridge C18, изократическая хроматография, 37% ацетонитрил в воде). Получали 12 мг (27%) 2-(3-изопропил-2,4-диоксо-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1,2,3,4-тетрагидро-пиримидин-5-ил)-бензойной кислоты в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 0,67 (д, J=6,9 Гц, 6H), 0,86-1,20 (м, 4H), 1,96 (т, J=13,0 Гц, 1H), 2,14-2,23 (м, 2H), 2,41-2,44 (м, 1H), 2,63-2,79 (м, 3H), 3,25 (д, J=13,7 Гц, 1H), 3,54-3,69 (м, 1H), 3,79-3,96 (м, 2H), 4,32-4,45 (м, 1H), 6,00-6,16 (м, 2H), 6,26 (д, J=7,7 Гц, 2H), 6,53 (д, J=7,5 Гц, 1H), 6,59-6,70 (м, 2H), 6,74 (т, J=7,4 Гц, 1H), 7,12 (д, J=7,8 Гц, 1H).
Пример 81: 5-(3,4-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 81)
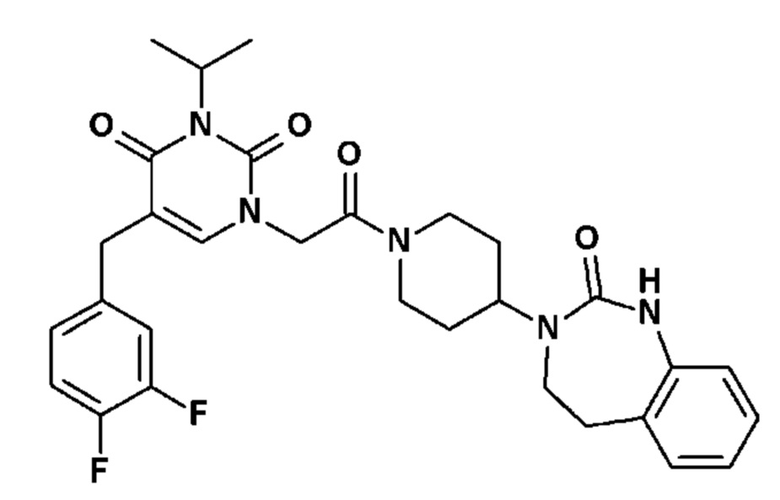
81.1: 5-(трет-бутил-диметил-силанилоксиметил)-1H-пиримидин-2,4-дион
К раствору 2 г (10 ммоль) 5-гидроксиметил-1H-пиримидин-2,4-диона и 2,4 г (40 ммоль) имидазола в 20 мл диметилформамида добавляли 2,6 г (20 ммоль) трет-бутил-диметил-хлорсилана. Реакционную смесь нагревали при 60°C в течение 1,5 час. Эту смесь гидролизовали и далее разбавляли этилацетатом. Органическую фазу промывали водой, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученную пасту белого цвета обрабатывали в 10 мл метанола и 100 мл диэтилового эфира. Суспензию фильтровали с получением 2,8 г (78%) 5-(трет-бутил-диметил-силанилоксиметил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
81.2: [5-(трет-бутил-диметил-силанилоксиметил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 13,1, используя 2,8 г (11 ммоль) 5-(трет-бутил-диметил-силанилоксиметил)-1H-пиримидин-2,4-диона и 1 мл (11 ммоль) метилбромацетата, получали 3,5 г (96%) [5-(трет-бутил-диметил-силанилоксиметил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
81.3: [5-(трет-бутил-диметил-силанилоксиметил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 1.7, используя 3,5 г (11 ммоль) [5-(трет-бутил-диметил-силанилоксиметил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 2 мл (21 ммоль) 2-бромпропана, и, после очистки флеш-хроматографией на силикагеле, элюируя смесью гептан/этилацетат 80/20, получали 2,7 г (68%) [5-(трет-бутил-диметил-силанилоксиметил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
81.4: (5-гидроксиметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К раствору 1,5 г (4 ммоль) [5-(трет-бутил-диметил-силанилоксиметил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 15 мл тетрагидрофурана, охлаженного до 0°C, добавляли 6,1 мл (6 ммоль) 1M раствора фторида тетрабутиламмония. Реакционную смесь перемешивали при комнатной температуре в течение 45 минут. Реакционную смесь гидролизовали насыщенным водным раствором хлорида аммония и далее разбавляли этилацетатом. Органическую фазу промывали водой и потом насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 98/2. Получали 0,75 г (72%) (5-гидроксиметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде бесцветного масла.
81.5: (5-бромметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К раствору 0,6 г (2,3 ммоль) (5-гидроксиметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в 12 мл дихлорметана, охлажденному до 0°C, добавляли 0,2 мл (2,5 ммоль) раствор трибромида фосфора в 4 мл дихлорметана. Смесь перемешивали при 0°C в течение 30 минут. После нагревания до комнатной температуры, смесь гидролизовали водой и затем насыщенным водным раствором гидрокарбоната натрия. Продукт экстрагировали дихлорметаном. Органическую фазу промывали один раз водой, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 99/1. Получали 0,41 г (29%) (5-бромметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
81.6: [5-(3,4-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 34, используя 210 мг (0,7 ммоль) (5-бромметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 156 мг (1 ммоль) 3,4-дифторфенилбороновой кислоты, 45 мг (20%) [5-(3,4-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты получали в виде масла желтого цвета.
81.7: 5-(3,4-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 81)
Аналогично примеру 13.4, используя 45 мг (0,1 ммоль) [5-(3,4-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 39 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3, получали 35 мг (46%) 5-(3,4-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 224°C.
1H ЯМР (δ, ДМСО): 1,35 (д, J=6,9 Гц, 6H); 1,56-1,68 (м, 4H); 2,67 (т, J=12,6 Гц, 1H); 2,90 (м, 2H); 3,09-3,15 (м, 1H); 3,36-3,41 (м, 2H); 3,56 (с, 2H); 3,92 (д, J=13,5 Гц, 1H); 4,31 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,67 (д, J=3,5 Гц, 2H); 5,05-5,06 (м, 1H); 6,80-6,81 (м, 1H); 7,04-7,05 (м, 4H); 7,32-7,33 (м, 2H); 7,44 (с, 1H); 8,54 (с, 1H).
Пример 82: 5-(3,5-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 82)
82.1: [5-(3,5-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 34, используя 200 мг (0,6 ммоль) (5-бромметил-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 81.5) и 158 мг (1 ммоль) 3,5-дифторфенилбороновой кислоты, и после добавления 0,9 мл (0,9 ммоль) 1M водного раствора гидроксид лития, получали 60 мг (28%) [5-(3,5-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
82.2: 5-(3,5-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидробензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 82)
Аналогично примеру 13.4, используя 60 мг (0,2 ммоль) [5-(3,5-дифторбензил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 52 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3, и осаждения продукта в диэтиловый эфир, фильтрования и сушки, получали 55 мг (54%) 5-(3,5-дифторбензил)-3-изопропил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 238°C.
1H ЯМР (δ, ДМСО): 1,35 (д, J=6,9 Гц, 6H); 1,50-1,80 (м, 4H); 2,68 (м, 1H); 2,90 (м, 2H); 3,14 (м, 1H); 3,39 (м, 2H); 3,59 (с, 2H); 3,93 (д, J=13,6 Гц, 1H); 4,32 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,68 (д, J=3,4 Гц, 2H); 5,05-5,06 (м, 1H); 6,80-6,81 (м, 1H); 6,96-6,99 (м, 2H); 7,04-7,06 (м, 4H); 7,49 (с, 1H); 8,54 (с, 1H).
Пример 83: 5-(2,3-дихлорфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 83)
83.1: (5-бром-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 1.7, используя 2 г (8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 1,2 мл (11 ммоль) 1-бром-2-метилпропана, и после нагревания смеси при 50°C в течение 4 часов, получали 1,8 г (74%) (5-бром-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
83.2: [5-(2,3-дихлорфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 400 мг (1,3 ммоль) (5-бром-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 717 мг (3,8 ммоль) 2,3-дихлорфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 80/20, получали 260 мг (54%) [5-(2,3-дихлорфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества светло-желтого цвета.
83.3: [5-(2,3-дихлорфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 260 мг (0,7 ммоль) [5-(2,3-дихлорфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 250 мг (100%) [5-(2,3-дихлорфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
83.4: 5-(2,3-дихлорфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 83)
Аналогично примеру 13.4, используя 250 мг (0,7 ммоль) [5-(2,3-дихлорфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 192 мг (0,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в этилацетате, получали 290 мг (71%) 5-(2,3-дихлорфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 248°C.
1H ЯМР (δ, ДМСО): 0,86 (д, J=6,7 Гц, 6H), 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,03 (м, 1H), 2,67 (т, J=12 Гц, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,14 (т, J=12 Гц, 1H), 3,36 (т, J=4,5 Гц, 2H), 3,71 (д, J=7,3 Гц, 2H), 3,92 (д, J=13 Гц, 1H), 4,28-4,38 (м, 1H), 4,42 (д, J=13 Гц, 1H), 4,76 (д, J=2,2 Гц, 2H), 6,75-6,82 (м, 1H), 7,01-7,04 (м, 3H), 7,32 (дд, J=1,5-7,6 Гц, 1H), 7,42 (т, J=7,8 Гц, 1H), 7,68 (дд, J=1,48 Гц, 1H), 7,81 (с, 1H), 8,53 (с, 1H).
Пример 84: 5-(2-хлор-3-фторфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 84)
84.1: [5-(2-хлор-3-фторфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (0,9 ммоль) (5-бром-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 83.1) и 246 мг (1,4 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 215 мг (64%) [5-(2-хлор-3-фторфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла желтого цвета.
84.2: 5-(2-хлор-3-фторфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидробензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 84)
Аналогично примеру 13.4, используя 215 мг (0,6 ммоль) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 164 мг (0,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из ацетона, получали 140 мг (38%) 5-(2-хлор-3-фторфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 248°C.
1H ЯМР (δ, ДМСО): 0,87 (д, J=6,7 Гц, 6H), 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,04 (м, 1H), 2,68 (т, J=11 Гц, 1H), 2,89 (т, J=4,3 Гц, 2H), 3,15 (т, J=11 Гц, 1H), 3,37 (т, J=4,3 Гц, 2H), 3,72 (д, J=7,3 Гц, 2H), 3,94 (д, J=13,4 Гц, 1H), 4,32 (м, 1H), 4,42 (д, J=13,1 Гц, 1H), 4,77 (д, J=2,2 Гц, 2H), 6,78-6,82 (м, 1H), 7,02-7,05 (м, 3H), 7,20-7,22 (м, 1H), 7,43-7,47 (м, 2H), 7,83 (с, 1H), 8,54 (с, 1H).
Пример 85: 5-(2,3-диметилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 85)
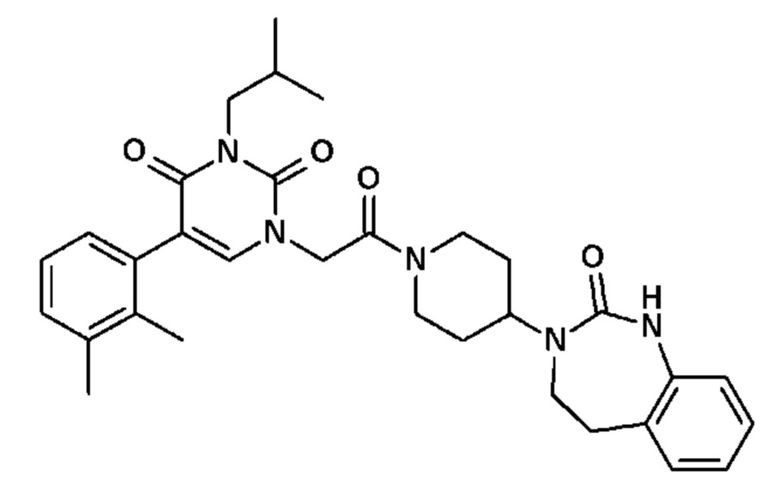
85.1: [5-(2,3-диметилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 300 мг (0,9 ммоль) (5-бром-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 83.1) и 211 мг (1,4 ммоль) 2,3-диметилфенилбороновой кислоты, получали 255 мг (79%) [5-(2,3-диметилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде масла желтого цвета.
85.2: [5-(2,3-диметилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 255 мг (0,7 ммоль) [5-(2,3-диметилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 230 мг (94%) [5-(2,3-диметилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
85.3: 5-(2,3-диметилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 85)
Аналогично примеру 13.4, используя 230 мг (0,7 ммоль) [5-(2,3-диметилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 188 мг (0,8 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из смеси ацетон/гептан 50/50, получали 170 мг (43%) [5-(2,3-диметилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 270°C.
1H ЯМР (δ, ДМСО): 0,86 (д, J=6,7 Гц, 6H), 1,48-1,60 (м, 1H), 1,62-1,80 (м, 3H), 2,03 (с, 3H), 2,06 (м, 1H), 2,27 (с, 3H), 2,67 (т, J=11 Гц, 1H), 2,89 (т, J=4,5 Гц, 2H), 3,15 (т, J=11 Гц, 1H), 3,37 (т, J=4,4 Гц, 2H), 3,72 (д, J=7,2 Гц, 2H), 3,95 (д, J=13 Гц, 1H), 4,28-4,38 (м, 1H), 3,95 (д, J=13 Гц, 1H), 4,75 (д, J=5,2 Гц, 2H), 6,80-6,82 (м, 1H), 6,96 (д, J=7,1 Гц, 1H), 7,02 (с, 1H), 7,04 (д, J=3,7 Гц, 2H), 7,10 (т, J=7,5 Гц, 1H), 7,17 (д, J=7,4 Гц, 1H), 7,60 (с, 1H), 8,54 (с, 1H).
Пример 86: 5-(3-фтор-2-метилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 86)
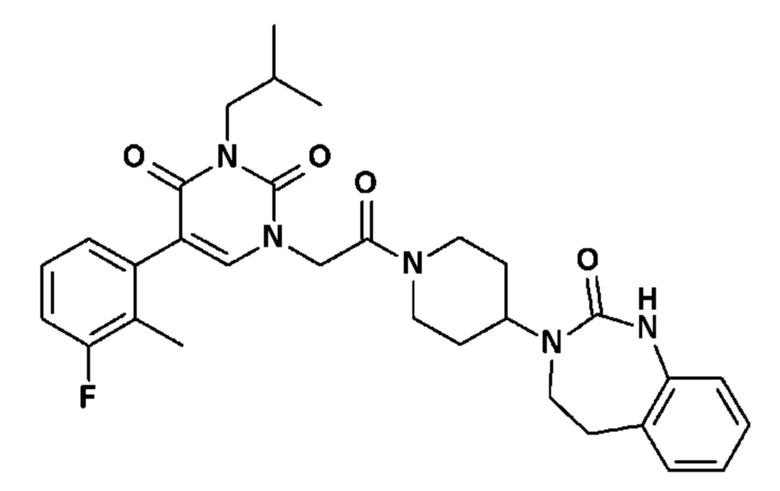
86.1: [5-(3-фтор-2-метилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 500 мг (1,6 ммоль) (5-бром-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 83.1) и 386 мг (2,5 ммоль) 3-фтор-2-метилфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 80/20, получали 620 мг (100%) [5-(3-фтор-2-метилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде масла желтого цвета.
86.2: [5-(3-фтор-2-метилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 545 мг (1,6 ммоль) [5-(3-фтор-2-метилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 440 мг (84%) [5-(3-фтор-2-метилфенил)-3-изобутил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
86.3: 5-(3-фтор-2-метилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 86)
Аналогично примеру 13.4, используя 440 мг (1,3 ммоль) [5-(3-фтор-2-метилфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 355 мг (1,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из этанола, получали 530 мг (71%) [5-(3-фтор-2-метилфенил)-3-изобутил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 251°C.
1H ЯМР (δ, ДМСО): 0,87 (д, J=6,7 Гц, 6H); 1,52-1,73 (м, 4H); 2,01-2,07 (м, 4H); 2,68 (т, J=12,6 Гц, 1H); 2,86-2,91 (м, 2H); 3,15 (т, J=12,4 Гц, 1H); 3,34-3,39 (м, 2H); 3,73 (д, J=7,3 Гц, 2H); 3,94 (д, J=13,7 Гц, 1H); 4,28-4,35 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,77 (д, J=3,2 Гц, 2H); 6,79-6,80 (м, 1H); 7,00-7,05 (м, 4H); 7,16-7,27 (м, 2H); 7,72 (с, 1H); 8,54 (с, 1H).
Пример 87: [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-карбаминовой кислоты трет-бутиловый эфир (реакционная схема № 3, соединение 87)
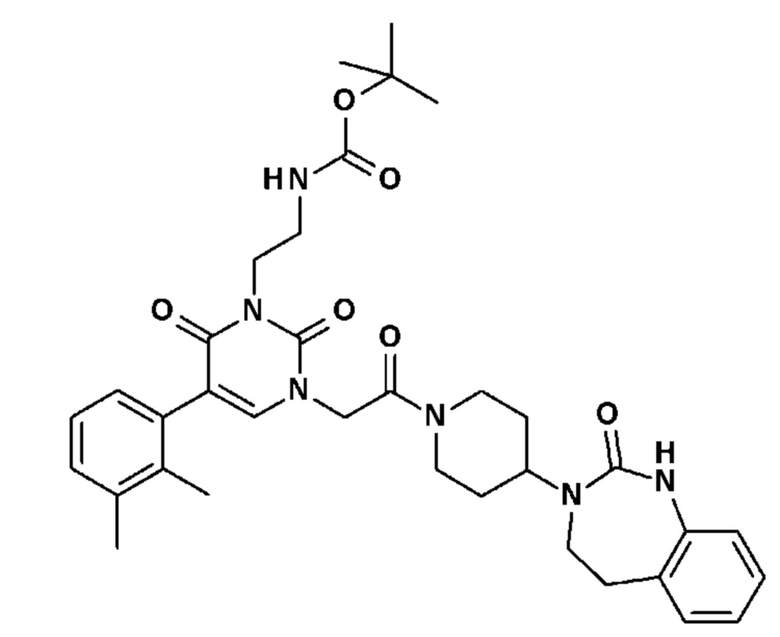
87.1: [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 1.7, используя 0,5 г (2 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), и 511 мг (2 ммоль) трет-бутил-N-(2-бромэтил)карбамата, и после нагревания смеси при 50°C в течение 3 часов, получали 0,63 мг (82%) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
87.2: [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 632 мг (1,6 ммоль) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 350 мг (2,3 ммоль) 2,3-диметилфенилбороновой кислоты, получали 380 мг (59%) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
87.3: [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамат (соединение 87)
Аналогично примеру 13.4, используя 380 мг (0,9 ммоль) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 246 мг (1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в смеси гептан/этилацетат 70/30, получали 325 мг (55%) [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамата в виде твердого вещества бежевого цвета с температурой плавления 169°C.
1H ЯМР (δ, ДМСО): 1,36 (с, 9H); 1,55-1,67 (м, 4H); 2,07 (с, 3H); 2,27 (с, 3H); 2,68 (т, J=12,5 Гц, 1H); 2,89 (м, 2H); 3,11-3,19 (м, 3H); 3,35-3,40 (м, 2H); 3,94 (м, 3H); 4,30 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,74 (с, 2H); 6,80-6,83 (м, 2H); 6,95 (д, J=7,5 Гц, 1H); 7,02-7,04 (м, 3H); 7,10 (т, J=7,5 Гц, 1H); 7,17 (д, J=7,6 Гц, 1H); 7,57 (с, 1H); 8,53 (с, 1H).
Пример 88: 3-(2-аминоэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 88)
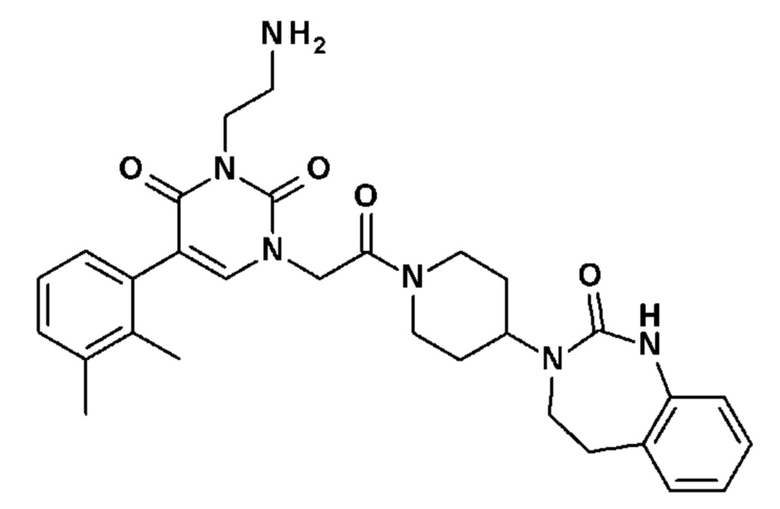
К 100 мг (0,2 ммоль) [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамата (полученный способом, описанным в примере 87.3) добавляли 2 мл (5 ммоль) 2,5M раствора хлористоводородной кислоты в этаноле. Реакционную смесь перемешивали в течение 3 часов при комнатной температуре и затем концентрировали в вакууме. Смесь гидролизовали насыщенным водным раствором гидрокарбоната натрия и далее разбавляли этилацетатом. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия, затем водой и насыщенным водным раствором хлорида натрия; сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученное твердое вещество белого цвета обрабатывали в диэтиловом эфире, потом фильтровали и сушили в вакууме. Получали 80 мг (93%) 3-(2-аминоэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 230°C.
1H ЯМР (δ, ДМСО): 1,55-1,80 (м, 6H); 2,05 (с, 3H); 2,27 (с, 3H); 2,64-2,71 (м, 3H); 2,89 (м, 2H); 3,14 (т, J=12,5 Гц, 1H); 3,37 (м, 2H); 3,87 (т, J=7,0 Гц, 2H); 3,94 (д, J=13,5 Гц, 1H); 4,32 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,75 (д, J=6,1 Гц, 2H); 6,79-6,81 (м, 1H); 6,95-7,04 (м, 4H); 7,08-7,18 (м, 2H); 7,58 (с, 1H); 8,54 (с, 1H).
Пример 89: 3-(2-аминоэтил)-5-(2,3-дихлорфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 89)
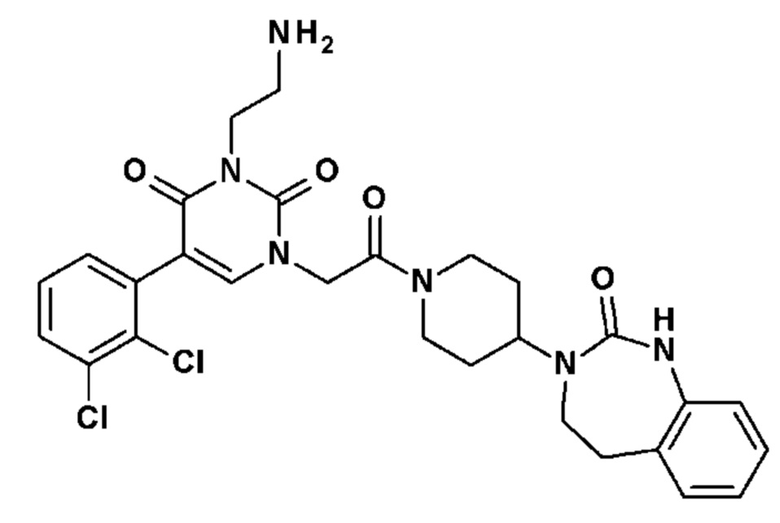
89.1: [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 700 мг (1,7 ммоль) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 87.1) и 526 мг (2,8 ммоль) 2,3-дихлорфенилбороновой кислоты, получали 210 мг (27%) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла оранжевого цвета.
89.2: [2-(5-(2,3-дихлорфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамат
Аналогично примеру 13.4, используя 210 мг (0,5 ммоль) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 112 мг (0,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 190 мг (60%) [2-(5-(2,3-дихлорфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутил-карбамата в виде твердого вещества белого цвета.
89.3: 3-(2-аминоэтил)-5-(2,3-дихлорфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 89)
Аналогично примеру 88, используя 190 мг (0,3 ммоль) [2-(5-(2,3-дихлорфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутил-карбамата, получали 145 мг (88%) 3-(2-аминоэтил)-5-(2,3-дихлорфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 250°C.
1H ЯМР (δ, ДМСО): 1,48-1,85 (м, 4H); 2,65-2,73 (м, 3H); 2,89 (м, 2H); 3,11-3,16 (м, 1H); 3,35-3,50 (м, 2H); 3,89-3,93 (м, 3H); 4,32 (м, 1H); 4,42 (д, J=12,7 Гц, 1H); 4,79 (с, 2H); 6,79-6,81 (м, 1H); 7,02-7,04 (м, 3H); 7,34 (дд, J=7,6, 1,6 Гц, 1H); 7,43 (т, J=7,9 Гц, 1H); 7,69 (дд, J=8,0, 1,6 Гц, 1H); 7,85 (с, 1H); 8,55 (с, 1H).
Пример 90: 5-(2,3-дихлорфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 90)
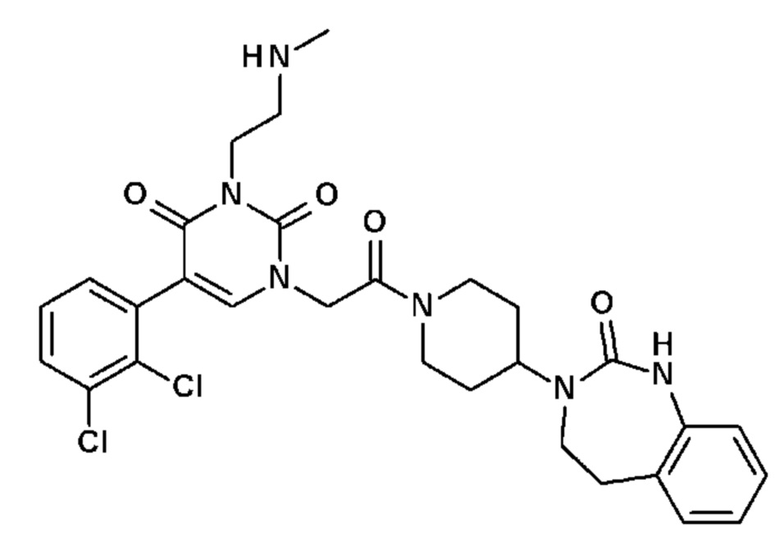
90.1: [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 700 мг (1,7 ммоль) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 87.1) и 526 мг (2,8 ммоль) 2,3-дихлорфенилбороновой кислоты, получали 130 мг (16%) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
90.2: [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.2, используя 130 мг (0,3 ммоль) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 26 мкл (0,4 ммоль) иодметана, получали 100 мг (77%) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества светло-желтого цвета.
90.3: [2-(5-(2,3-дихлорфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамат
Аналогично примеру 13.4, используя 100 мг (0,2 ммоль) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2,3-дихлорфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 52 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 95 мг (64%) [2-(5-(2,3-дихлорфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамата в виде твердого вещества белого цвета.
90.4: 5-(2,3-дихлорфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 90)
Аналогично примеру 88, используя 95 мг (0,1 ммоль) [2-(5-(2,3-дихлорфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамата, и после рекристаллизации из этанола, получали 55 мг (66%) 5-(2,3-дихлорфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 225°C.
1H ЯМР (δ, ДМСО): 1,45-1,69 (м, 4H); 2,29 (с, 3H); 2,65-2,71 (м, 3H); 2,90 (м, 2H); 3,14-3,20 (м, 1H); 3,38 (м, 2H); 3,95 (т, J=7,0 Гц, 2H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,77 (д, J=2,9 Гц, 2H); 6,80-6,81 (м, 1H); 7,03-7,05 (м, 3H); 7,34 (дд, J=7,7, 1,6 Гц, 1H); 7,43 (т, J=7,9 Гц, 1H); 7,69 (дд, J=8,0, 1,6 Гц, 1H); 7,81 (с, 1H); 8,53 (с, 1H).
Пример 91: 3-((R)-2,3-дигидроксипропил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 91)
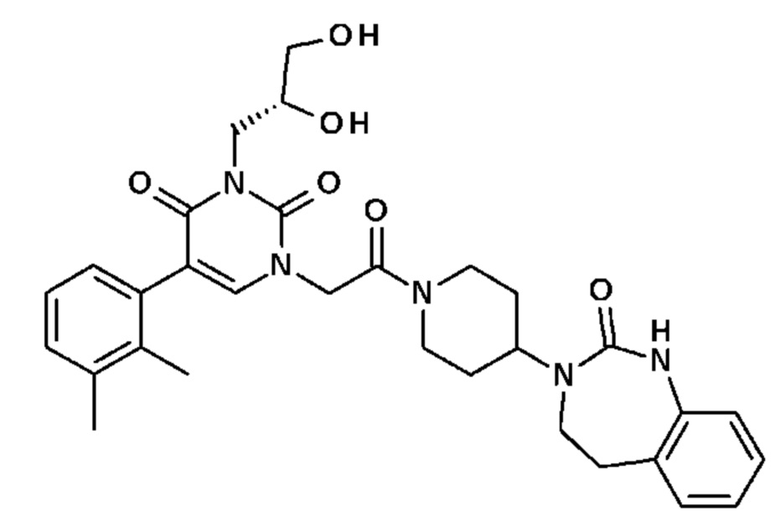
91.1: [5-бром-3-((R)-2,2-диметил-[1,3]диоксолан-4-илметил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) в 25 мл диметилформамида добавляли 0,8 г (5,7 ммоль) карбоната калия и 0,6 мл (4,6 ммоль) (S)-(-)-4-(хлорметил)-2,2-диметил-1,3-диоксолана. Реакционную смесь нагревали при 70°C в течение 2,5 ч. Добавляли 1,5 г (4 ммоль) иодида тетрабутиламмония, а также 0,5 мл (4 ммоль) (S)-(-)-4-(хлорметил)-2,2-диметил-1,3-диоксолана. После нагревания в течение 20 часов при 130°C, реакционную смесь гидролизовали и далее разбавляли этилацетатом. Значение pH водной фазы доводили до значения, равного 5, с помощью 1н водного раствора соляной кислоты. Продукт экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3. Получали 115 мг (8%) [5-бром-3-((R)-2,2-диметил-[1,3]диоксолан-4-илметил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла оранжевого цвета.
91.2: 5-бром-3-((R)-2,3-дигидроксипропил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 13.4, используя 115 мг (0,3 ммоль) [5-бром-3-((R)-2,2-диметил-[1,3]диоксолан-4-илметил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 82 мг (0,3 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 16 мг (9%) 5-бром-3-((R)-2,3-дигидроксипропил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета.
91.3: 3-((R)-2,3-дигидроксипропил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 91)
Аналогично примеру 44.1, используя 16 мг (30 мкмоль) 5-бром-3-((R)-2,3-дигидроксипропил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона и 7 мг (40 мкмоль) 2,3-диметилфенилбороновой кислоты, получали 4 мг (20%) 3-((R)-2,3-дигидроксипропил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества светло-желтого цвета.
ВЭЖХ анализ (колонка Kinetex C18, 150×2,1 мм, 1,7 мкм, элюент: вода/ацетонитрил с 0,1% муравьиной кислотой, время проведения анализа 30 мин): время удерживания=9,37 мин.
Пример 92: 3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 92)
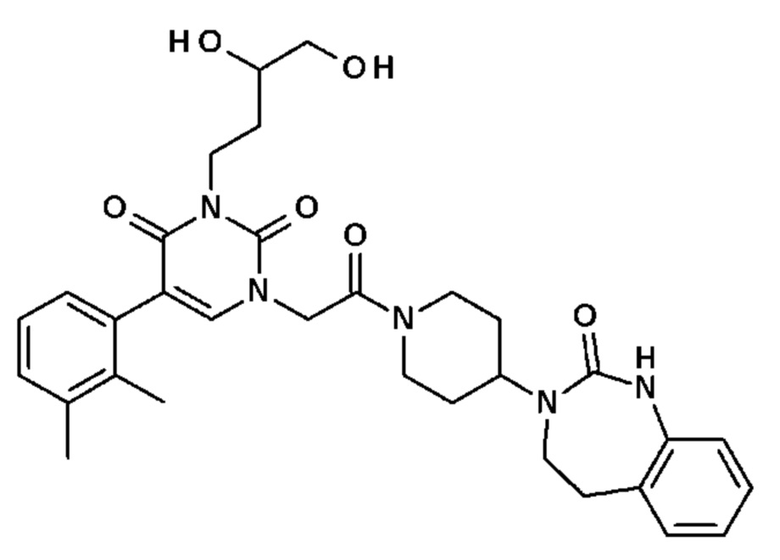
92.1: [5-бром-3-((S)-2-оксиранил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 83.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 0,6 г (3,8 ммоль) (S)-2-(2-бромэтил)-оксирана, получали 0,8 г (66%) [5-бром-3-((S)-2-оксиранил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
92.2: [3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 400 мг (1,2 ммоль) [5-бром-3-((S)-2-оксиранил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 270 мг (1,8 ммоль) 2,3-диметилфенилбороновой кислоты, получали 280 мг (64%) [3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества розового цвета.
92.3: 3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 92)
Аналогично примеру 13.4, используя 280 мг (0,8 ммоль) [3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 227 мг (0,9 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 75 мг (16%) 3-(3,4-дигидроксибутил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества розового цвета с температурой плавления 175°C.
1H ЯМР (δ, ДМСО): 1,49-1,80 (м, 6H); 2,04 (с, 3H); 2,27 (с, 3H); 2,68 (т, J=12,4 Гц, 1H); 2,89 (м, 2H); 3,14 (т, J=12,4 Гц, 1H); 3,22-3,24 (м, 1H); 3,30-3,32 (м, 1H); 3,35-3,39 (м, 2H); 3,45-3,48 (м, 1H); 3,83-3,88 (м, 1H); 3,94 (д, J=13,7 Гц, 1H); 4,05-4,08 (м, 1H); 4,28-4,36 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,53-4,54 (м, 2H); 4,75 (д, J=3,5 Гц, 2H); 6,79-6,80 (м, 1H); 6,96 (д, J=7,5 Гц, 1H); 7,03-7,05 (м, 3H); 7,10 (т, J=7,5 Гц, 1H); 7,17 (д, J=7,5 Гц, 1H); 7,59 (с, 1H); 8,55 (с, 1H).
Пример 93: 5-(2,3-диметилфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 93)
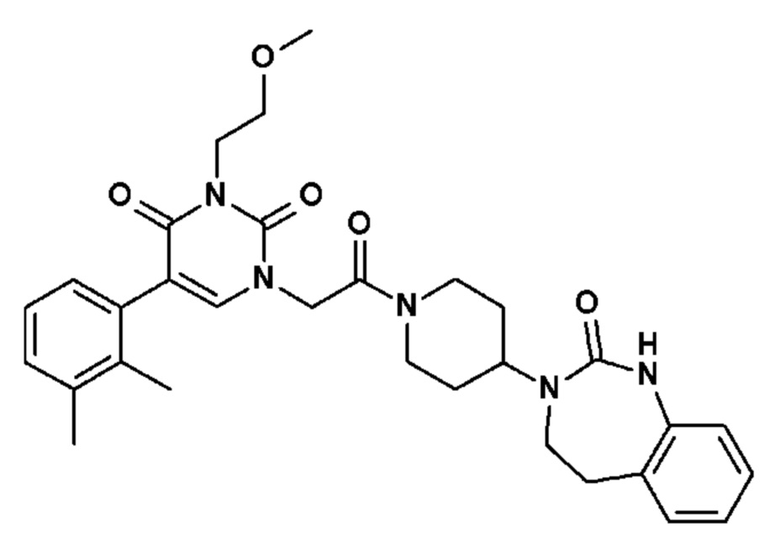
93.1: [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 83.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), и 0,8 г (5,7 ммоль) 2-бромэтилметилового эфира, получали 0,8 г (62%) [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
93.2: [5-(2,3-диметилфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 400 мг (1,3 ммоль) [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 280 мг (1,9 ммоль) 2,3-диметилфенилбороновой кислоты, получали 410 мг (99%) [5-(2,3-диметилфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла оранжевого цвета.
93.3: 5-(2,3-диметилфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 93)
Аналогично примеру 13.4, используя 410 мг (1,2 ммоль) [5-(2,3-диметилфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 363 мг (1,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из этанола, получали 400 мг (57%) 5-(2,3-диметилфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 227°C.
1H ЯМР (δ, ДМСО): 1,50-1,80 (м, 4H); 2,05 (с, 3H); 2,28 (с, 3H); 2,68 (т, J=12,6 Гц, 1H); 2,86-2,91 (м, 2H); 3,15 (т, J=12,5 Гц, 1H); 3,26 (с, 3H); 3,36-3,39 (м, 2H); 3,52 (т, J=6,1 Гц, 2H); 3,94 (д, J=13,6 Гц, 1H); 4,07 (т, J=6,1 Гц, 2H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,76 (д, J=4,9 Гц, 2H); 6,80-6,81 (м, 1H); 6,97 (д, J=7,5 Гц, 1H); 7,04-7,06 (м, 3H); 7,11 (т, J=7,5 Гц, 1H); 7,18 (д, J=7,5 Гц, 1H); 7,60 (с, 1H); 8,53 (с, 1H).
Пример 94: 5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 94)
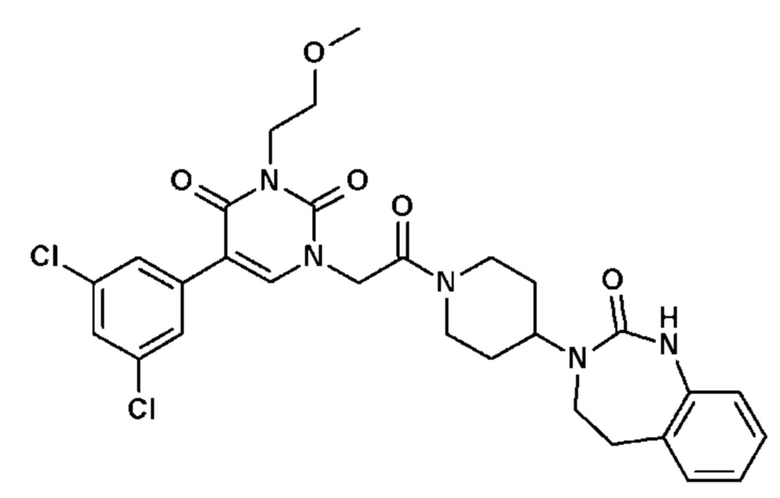
94.1: [5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 430 мг (1,3 ммоль) [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 93.1) и 383 мг (2 ммоль) 3,5-дихлорфенилбороновой кислоты, получали 580 мг (100%) [5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
94.2: 5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 94)
Аналогично примеру 13.4, используя 500 мг (1,3 ммоль) [5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 394 мг (1,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из этанола, получали 350 мг (43%) 5-(3,5-дихлорфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 148°C.
1H ЯМР (δ, ДМСО): 1,56-1,65 (м, 4H); 2,67-2,71 (м, 1H); 2,87-2,92 (м, 2H); 3,13-3,20 (м, 1H); 3,25 (с, 3H); 3,36-3,39 (м, 2H); 3,52 (т, J=6,0 Гц, 2H); 3,95 (д, J= 12,9 Гц, 1H); 4,08 (т, J=6,1 Гц, 2H); 4,28-4,40 (м, 1H); 4,42 (д, J=12,9 Гц, 1H); 4,81 (с, 2H); 6,79-6,80 (м, 1H); 7,03-7,05 (м, 3H); 7,57 (с, 1H); 7,69 (д, J=1,9 Гц, 2H); 8,17 (с, 1H); 8,55 (с, 1H).
Пример 95: 5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 95)
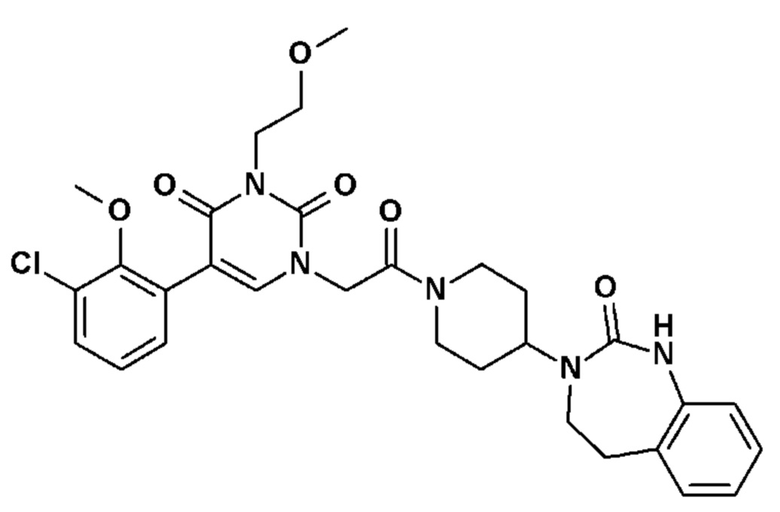
95.1: [5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (0,9 ммоль) [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 93.1) и 261 мг (1,4 ммоль) 3-хлор-2-метоксифенилбороновой кислоты, получали 340 мг (98%) [5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
95.2: 5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 95)
Аналогично примеру 13.4, используя 340 мг (0,9 ммоль) [5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 271 мг (1,1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из этанола, получали 360 мг (63%) 5-(3-хлор-2-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 206°C.
1H ЯМР (δ, ДМСО): 1,61-1,69 (м, 4H); 2,68 (т, J=12,6 Гц, 1H); 2,90 (м, 2H); 3,15 (т, J=12,6 Гц, 1H); 3,26 (с, 3H); 3,36-3,39 (м, 2H); 3,53 (т, J=6,1 Гц, 2H); 3,67 (с, 3H); 3,95 (д, J=13,6 Гц, 1H); 4,08 (т, J=6,1 Гц, 2H); 4,29-4,36 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,79 (с, 2H); 6,80-6,81 (м, 1H); 7,03-7,05 (м, 3H); 7,19 (т, J=7,8 Гц, 1H); 7,27 (дд, J=7,7, 1,7 Гц, 1H); 7,50 (дд, J=7,9, 1,7 Гц, 1H); 7,78 (с, 1H); 8,53 (с, 1H).
Пример 96: 5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 96)
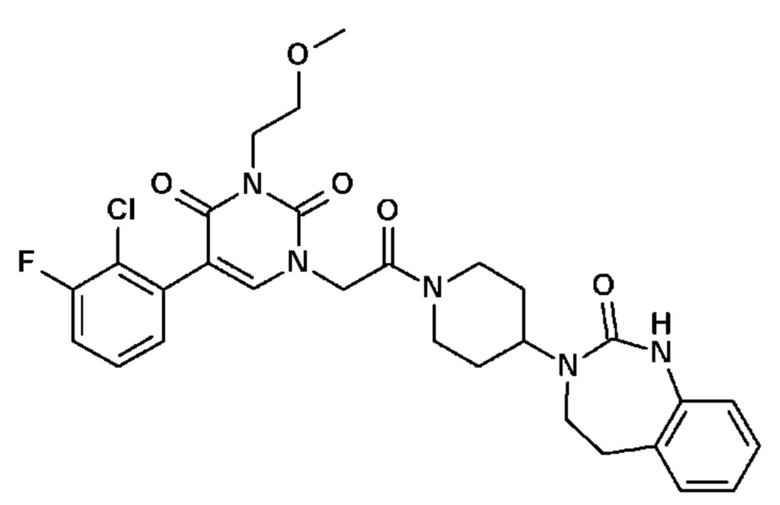
96.1: [5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (0,9 ммоль) [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 93.1) и 244 мг (1,4 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 300 мг (90%) [5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
96.2: 5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 96)
Аналогично примеру 13.4, используя 300 мг (0,8 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 248 мг (1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из смеси н-бутанол/этанол, получали 140 мг (27%) 5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 232°C.
1H ЯМР (δ, ДМСО): 1,59-1,71 (м, 4H); 2,69 (т, J=12,6 Гц, 1H); 2,90 (м, 2H); 3,15 (т, J=12,3 Гц, 1H); 3,26 (с, 3H); 3,36-3,39 (м, 2H); 3,53 (т, J=6,0 Гц, 2H); 3,95 (д, J=13,6 Гц, 1H); 4,07 (т, J=6,1 Гц, 2H); 4,26-4,37 (м, 1H); 4,43 (д, J=13,0 Гц, 1H); 4,78 (д, J=2,7 Гц, 2H); 6,80-6,81 (м, 1H); 7,03-7,05 (м, 3H); 7,21-7,22 (м, 1H); 7,45-7,46 (м, 2H); 7,84 (с, 1H); 8,54 (с, 1H).
Пример 97: 5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 97)
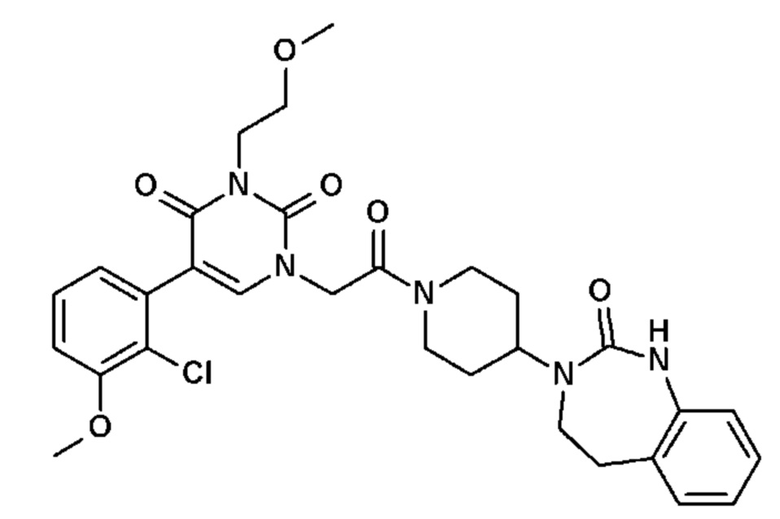
97.1: [5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 200 мг (0,6 ммоль) [5-бром-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 93.1) и 232 мг (1,3 ммоль) 2-хлор-3-метоксифенилбороновой кислоты, получали 158 мг (69%) [5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла желтого цвета.
97.2: 5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 97)
Аналогично примеру 13.4, используя 150 мг (0,4 ммоль) [5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 120 мг (0,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 180 мг (72%) 5-(2-хлор-3-метоксифенил)-3-(2-метоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,55 (м, 1 H); 1,71 (м, 3 H); 2,68-2,70 (м, 1 H); 2,90 (м, 2 H); 3,13-3,17 (м, 1 H); 3,26 (с, 3 H); 3,38 (м, 2 H); 3,51 (т, J=6,1 Гц, 2 H); 3,89 (с, 3 H); 3,94 (д, J=14,0 Гц, 1 H); 4,06 (т, J=6,1 Гц, 2 H); 4,31-4,33 (м, 1 H); 4,43 (д, J=12,8 Гц, 1 H); 4,76-4,78 (м, 2 H); 6,80-6,81 (м, 1 H); 6,92 (дд, J=7,6, 1,4 Гц, 1 H); 7,04-7,06 (м, 3 H); 7,19 (дд, J=8,4, 1,4 Гц, 1 H); 7,35 (т, J=8,0 Гц, 1 H); 7,73 (с, 1 H); 8,54 (с, 1 H).
Пример 98: 5-(2,3-диметилфенил)-3-(2-гидроксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 98)
98.1: [3-(2-бензилокси-этил)-5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 83.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), и 0,7 мл (4,2 ммоль) бензил-2-бромэтилового эфира, получали 0,9 г (60%) [3-(2-бензилокси-этил)-5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат в виде твердого вещества бежевого цвета.
98.2: [3-(2-бензилокси-этил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 400 мг (1 ммоль) [3-(2-бензилокси-этил)-5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 242 мг (1,6 ммоль) 2,3-диметилфенилбороновой кислоты, получали 410 мг (100%) [3-(2-бензилокси-этил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла оранжевого цвета.
98.3: 3-(2-бензилокси-этил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 13.4, используя 410 мг (1 ммоль) [3-(2-бензилокси-этил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 296 мг (1,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 320 мг (50%) 3-(2-бензилокси-этил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества светло-розового цвета.
98.4: 5-(2,3-диметилфенил)-3-(2-гидроксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 98)
Аналогично примеру 1.5, используя 320 мг (0,5 ммоль) 3-(2-бензилокси-этил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона и 256 мг (0,1 ммоль) 10% палладия на угле, помещая реакционную смесь в атмосферу водорода при давлении 3 бар (0,3 МПа) в течении 24 часов, получали 180 мг (66%) 5-(2,3-диметилфенил)-3-(2-гидроксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 237°C.
1H ЯМР (δ, ДМСО): 1,58-1,70 (м, 4H); 2,05 (с, 3H); 2,28 (с, 3H); 2,68 (т, J=12,5 Гц, 1H); 2,89 (м, 2H); 3,15 (т, J=12,3 Гц, 1H); 3,36-3,39 (м, 2H); 3,53 (кв, J=6,4 Гц, 2H); 3,94-3,97 (м, 3H); 4,33-4,34 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,70-4,85 (м, 3H); 6,80-6,81 (м, 1H); 6,97 (д, J=7,5 Гц, 1H); 7,04-7,06 (м, 3H); 7,11 (т, J=7,5 Гц, 1H); 7,18 (д, J=7,5 Гц, 1H); 7,59 (с, 1H); 8,53 (с, 1H).
Пример 99: 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 99)
99.1: [5-бром-3-(2-диметиламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 83.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), 0,7 г (4,6 ммоль) 2-диметиламиноэтилхлоридгидрохлорида и 0,6 мл (4,6 ммоль) триэтиламина, получали 0,7 г (55%) [5-бром-3-(2-диметиламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
99.2: 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 400 мг (1,2 ммоль) [5-бром-3-(2-диметиламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 269 мг (1,8 ммоль) 2,3-диметилфенилбороновой кислоты, получали 60 мг (15%) 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
99.3: 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 99)
Аналогично примеру 13.4, используя 60 мг (0,2 ммоль) 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 51 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 50 мг (50%) 3-(2-диметиламиноэтил)-5-(2,3-диметилфенил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 170°C.
1H ЯМР (δ, ДМСО): 1,55-1,68 (м, 4H); 2,05 (с, 3H); 2,23 (с, 6H); 2,28 (с, 3H); 2,49-2,51 (м, 2H); 2,68 (м, 1H); 2,89 (м, 2H); 3,15 (т, J=9,7 Гц, 1H); 3,38 (м, 2H); 3,96-4,00 (м, 3H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,76 (д, J=4,2 Гц, 2H); 6,81 (м, 1H); 6,97 (д, J=7,5 Гц, 1H); 7,04-7,06 (м, 3H); 7,11 (т, J=7,5 Гц, 1H); 7,18 (д, J=7,5 Гц, 1H); 7,60 (с, 1H); 8,53 (с, 1H).
Пример 100: 5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 100)
100.1: [5-бром-3-(2-метоксиметоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 83.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), и 0,5 мл (4,6 ммоль) 1-бром-2-метоксиметоксиэтана, получали 0,6 г (43%) [5-бром-3-(2-метоксиметоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
100.2: [5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (0,9 ммоль) [5-бром-3-(2-метоксиметоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 205 мг (1,4 ммоль) 2,3-диметилфенилбороновой кислоты, получали 250 мг (81%) [5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
100.3: 5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 100)
Аналогично примеру 13.4, используя 250 мг (0,7 ммоль) [5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 203 мг (0,8 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из смеси гептан/ацетон 50/50, получали 200 мг (49%) 5-(2,3-диметилфенил)-3-(2-метоксиметоксиэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 160°C.
1H ЯМР (δ, ДМСО): 1,50-1,80 (м, 4H); 2,05 (с, 3H); 2,28 (с, 3H); 2,68 (м, 1H); 2,89 (м, 2H); 3,16 (м, 1H); 3,23 (с, 3H); 3,38 (м, 2H); 3,65 (т, J=6,1 Гц, 2H); 4,95 (д, J=12,9 Гц, 1H); 4,10 (т, J=6,2 Гц, 2H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,54 (с, 2H); 4,76 (д, J=3,8 Гц, 2H); 6,80-6,81 (м, 1H); 6,96 (д, J=7,5 Гц, 1H); 7,03-7,05 (м, 3H); 7,11 (т, J=7,5 Гц, 1H); 7,18 (д, J=7,5 Гц, 1H); 7,61 (с, 1H); 8,53 (с, 1H).
Пример 101: N-[2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид (реакционная схема № 3, соединение 101)
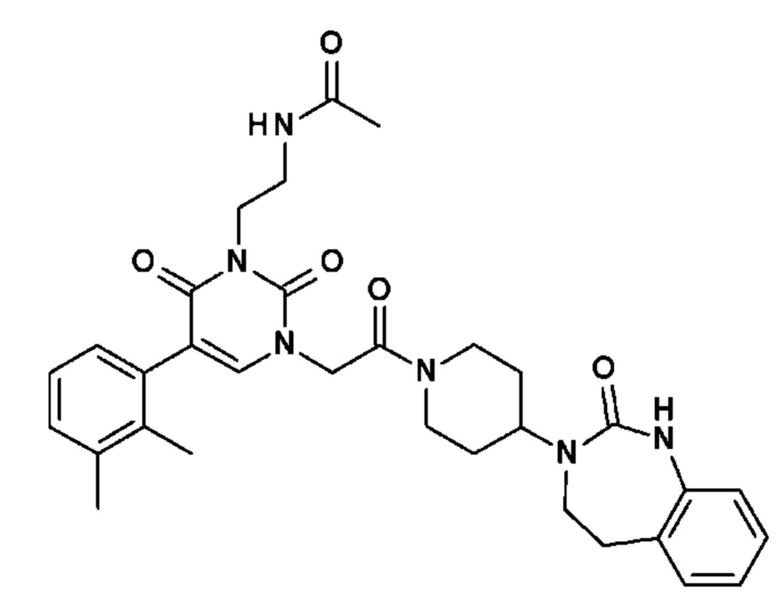
101.1: [3-(2-ацетиламиноэтил)-5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 83.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 0,4 мл (3,8 ммоль) N-(2-хлор-этил)-ацетамида, получали 170 мг (13%) [3-(2-ацетиламиноэтил)-5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества светло-желтого цвета.
101.2: [3-(2-ацетиламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 170 мг (0,5 ммоль) [3-(2-ацетиламиноэтил)-5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 117 мг (0,8 ммоль) 2,3-диметилфенилбороновой кислоты, получали 35 мг (20%) [3-(2-ацетиламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества розового цвета.
101.3: N-[2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид (соединение 101)
Аналогично примеру 13.4, используя 35 мг (0,1 ммоль) [3-(2-ацетиламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 29 мг (0,1 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в этилацетате, получали 8 мг (14%) N-[2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамида в виде твердого вещества белого цвета с температурой плавления 267°C.
1H ЯМР (δ, ДМСО): 1,56-1,68 (м, 4 H), 1,76 (с, 3 H), 2,07 (с, 3 H), 2,28 (с, 3 H), 2,68-2,72 (м, 1 H), 2,90 (м, 2 H), 3,14 (т, 1 H), 3,25-3,28 (м, 2 H), 3,36-3,38 (м, 2 H), 3,95 (м, 3 H), 4,32 (м, 1 H), 4,44 (м, 1 H), 4,76 (с, 2 H), 6,81 (м, 1 H), 6,96 (д, J=7,5 Гц, 1 H), 7,05 (м, 3 H), 7,11 (т, J=7,5 Гц, 1 H), 7,18 (д, J=7,5 Гц, 1 H), 7,58 (с, 1 H), 7,92 (т, J=5,9 Гц, 1 H), 8,52 (с, 1 H).
Пример 102: 5-(2,3-диметилфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 102)
102.1: [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 500 мг (1,2 ммоль) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 87.1) и 295 мг (2 ммоль) 2,3-диметилфенилбороновой кислоты, получали 460 мг (90%) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
102.2: [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 90.2, используя 100 мг (0,2 ммоль) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 93 мкл (1,5 ммоль) иодметана, и после перемешивания в течение 4 часов в 5 мл тетрагидрофурана, получали 85 мг (82%) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде бесцветного масла.
102.3: [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамат
Аналогично примеру 13.4, используя 85 мг (0,2 ммоль) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2,3-диметилфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 58 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 110 мг (85%) [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамата в виде твердого вещества белого цвета.
102.4: 5-(2,3-диметилфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 102)
Аналогично примеру 88, используя 110 мг (0,2 ммоль) [2-(5-(2,3-диметилфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамата, и после рекристаллизации из смеси ацетон/гептан 50/50, получали 50 мг (48%) 5-(2,3-диметилфенил)-3-(2-метиламиноэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества бежевого цвета с температурой плавления 203°C.
1H ЯМР (δ, ДМСО): 1,53-1,67 (м, 4H); 2,04 (с, 3H); 2,26-2,27 (м, 6H); 2,63-2,66 (м, 3H); 2,88 (м, 2H); 3,14 (т, J=12,4 Гц, 1H); 3,36 (м, 2H); 3,92-3,96 (м, 3H); 4,32 (м, 1H); 4,42 (д, J=12,9 Гц, 1H); 4,74 (д, J=6,4 Гц, 2H); 6,80 (м, 1H); 6,96 (д, J=7,7 Гц, 1H); 7,03-7,05 (м, 3H); 7,10 (т, J=7,5 Гц, 1H); 7,17 (д, J=7,6 Гц, 1H); 7,58 (с, 1H); 8,54 (с, 1H).
Пример 103: (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат (реакционная схема № 3, соединение 103)
103.1: (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 2.2, используя 1 г (2,8 ммоль) 1-бензгидрил-5-бром-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.1) и 346 мкл (3,6 ммоль) метилбромацетата, получали 960 мг (80%) (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата в виде пасты белого цвета.
103.2: [3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 500 мг (1,2 ммоль) (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата и 305 мг (1,8 ммоль) 2-хлор-3-фторфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 80/20, получали 208 мг (37%) [3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
103.3: [5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 2.3, используя 200 мг (0,4 ммоль) [3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилацетата и после перемешивания в течение 10 дней при комнатной температуре, получали 75 мг (57%) [5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилацетата в виде масла коричневого цвета.
103.4: (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат (соединение 103)
Аналогично примеру 39.4, используя 74 мг (0,2 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1) и 65 мг (0,2 ммоль) [5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 72 мг (57%) (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,51-1,59 (м, 1 H); 1,65-1,75 (м, J=22,0 Гц, 3 H); 2,69 (т, J=12,6 Гц, 1 H); 2,88-2,90 (м, 2 H); 3,15 (т, J=12,0 Гц, 1 H); 3,36-3,38 (м, 2 H); 3,69 (с, 3 H); 3,95 (д, J=13,5 Гц, 1 H); 4,30-4,33 (м, 1 H); 4,43 (д, J=12,9 Гц, 1 H); 4,66 (с, 2 H); 4,82 (с, 2 H); 6,81 (дт, J=7,7, 4,2 Гц, 1 H); 7,06-7,04 (м, 3 H); 7,24 (дд, J=6,5, 2,7 Гц, 1 H); 7,48-7,46 (м, 2 H); 7,93 (с, 1 H); 8,53 (с, 1 H).
Пример 104: (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-уксусная кислота (реакционная схема № 3, соединение 104)
Аналогично примеру 16,8, используя 50 мг (80 мкмоль) (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата, и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 98/2, получали 10 мг (20%) (5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-уксусной кислоты в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,51-1,59 (м, 1 H); 1,65-1,75 (м, J=22,0 Гц, 3 H); 2,69 (т, J=12,6 Гц, 1 H); 2,88-2,90 (м, 2 H); 3,15 (т, J=12,0 Гц, 1 H); 3,36-3,38 (м, 2 H); 3,95 (д, J=13,5 Гц, 1 H); 4,30-4,33 (м, 1 H); 4,43 (д, J=12,9 Гц, 1 H); 4,66 (с, 2 H); 4,82 (с, 2 H); 6,81 (дт, J=7,7, 4,2 Гц, 1 H); 7,06-7,04 (м, 3 H); 7,24 (дд, J=6,5, 2,7 Гц, 1 H); 7,48-7,46 (м, 2 H); 7,93 (с, 1 H); 8,53 (с, 1 H).
Пример 105: 5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 105)
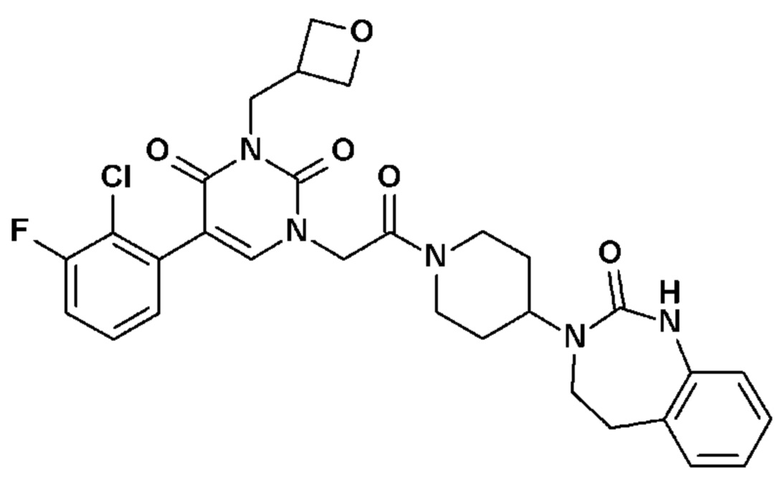
105.1: (5-бром-3-оксетан-3-илметил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 13.2, используя 500 мг (1,9 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 0,15 мл (2,9 ммоль) 3-бромметил-оксетана, получали 310 мг (49%) (5-бром-3-оксетан-3-илметил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
105.2: [5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 44.1, используя 310 мг (0,9 ммоль) (5-бром-3-оксетан-3-илметил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 243 мг (1,4 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 80 мг (23%) [5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
105.3: 5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 105)
Аналогично примеру 13.4, используя 80 мг (0,2 ммоль) [5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 59 мг (0,2 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 30 мг (22%) 5-(2-хлор-3-фторфенил)-3-оксетан-3-илметил-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 244°C.
1H ЯМР (δ, ДМСО): 1,53-1,56 (м, 1 H); 1,66-1,72 (м, 3 H); 2,69 (т, J=12,3 Гц, 1 H); 2,90 (м, 2 H); 3,15 (т, J=12,2 Гц, 1 H); 3,25-3,30 (м, 1 H); 3,37-3,39 (м, 2 H); 3,92-3,95 (м, 1 H); 4,19 (д, J=6,7 Гц, 2 H); 4,33 (м, 1 H); 4,40-4,43 (м, 3 H); 4,60 (дд, J=7,9, 6,0 Гц, 2 H); 4,78 (с, 2 H); 6,79-6,83 (м, 1 H); 7,02-7,05 (м, 3 H); 7,21-7,23 (м, 1 H); 7,44-7,48 (м, 2 H); 7,85 (с, 1 H); 8,53 (с, 1 H).
Пример 106: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 106)
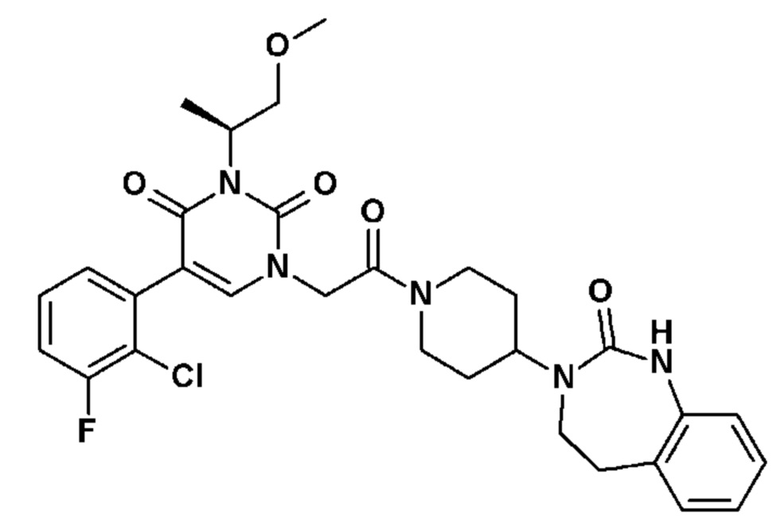
106.1: [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 2.5, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), добавляли 0,8 мл (7,8 ммоль) (R)-1-метокси-пропан-2-ола и 1,2 мл (7,6 ммоль) диэтилазодикарбоксилата при 0°C, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 60/40, получали 1,2 г (78%) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
106.2: [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 300 мг (0,9 ммоль) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 234 мг (1,3 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 1,3 мл (2,7 ммоль) 2M водного раствора карбоната калия в 8 мл толуола, получали 130 мг (38%) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
106.3: [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 130 мг (0,3 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 125 мг (100%) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде бесцветного масла.
106.4: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 106)
Аналогично примеру 13.4, используя 125 мг (0,3 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 99 мг (0,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в этилацетате, получали 150 мг (73%) 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 228°C.
1H ЯМР (δ, ДМСО): 1,34 (д, J=7,0 Гц, 3H); 1,50-1,80 (м, 4H); 2,68 (т, J=12,5 Гц, 1H); 2,90 (м, 2H); 3,15 (м, 1H); 3,33 (с, 3H); 3,38 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,90-3,95 (м, 2H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,75 (м, 2H); 5,15 (м, 1H); 6,80-6,81 (м, 1H); 7,04-7,06 (м, 3H); 7,20-7,21 (м, 1H); 7,44-7,45 (м, 2H); 7,80 (с, 1H); 8,53 (с, 1H).
Пример 107: (5-бром-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат (реакционная схема № 3, соединение 107)
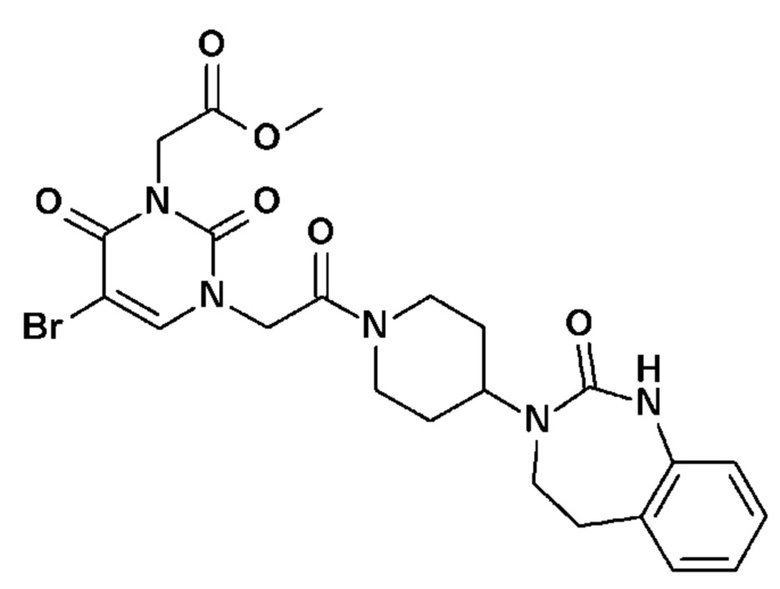
107.1: (5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 2.3, используя 400 мг (0,9 ммоль) (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 103.1), получали 172 мг (70%) (5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
107.2: (5-бром-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат (соединение 107)
Аналогично примеру 83.1, используя 160 мг (0,6 ммоль) (5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата и 215 мг (0,7 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 39.1), получали 300 мг (89%) (5-бром-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,54 (м, 1H); 1,71 (м, 3 H); 2,69 (м, 1 H); 2,91 (с, 2 H); 3,15 (м, 1 H); 3,39 (с, 2 H); 3,69 (с, 3 H); 3,90 (м, 1H); 4,33 (м, 1 H); 4,42 (м, 1 H); 4,64 (с, 2 H); 4,78 (с, 2 H); 6,82 (с, 1 H); 7,06-7,04 (м, 3 H); 8,29 (с, 1 H); 8,53 (с, 1 H).
Пример 108: 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 108)
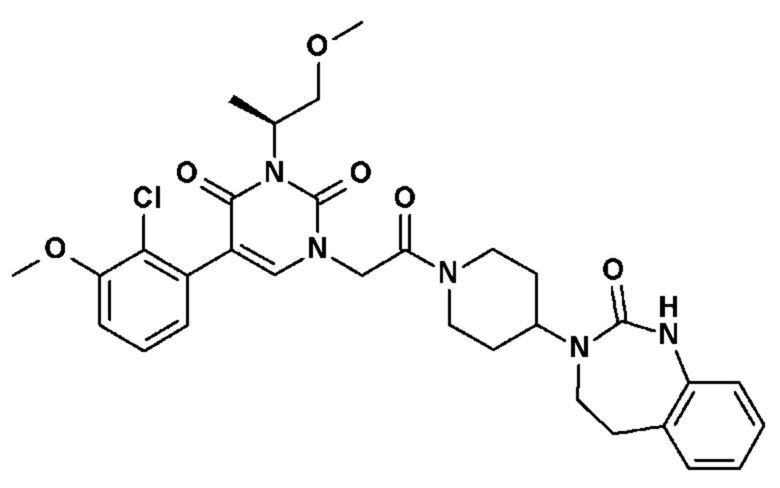
108.1: [5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 800 мг (2,4 ммоль) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 106.1) и 534 мг (2,9 ммоль) 2-хлор-3-метоксифенилбороновой кислоты, получали 912 мг (100%) [5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
108.2: 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 108)
Аналогично примеру 13.4, используя 450 мг (1,2 ммоль) [5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 346 мг (1,4 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в этилацетате, получали 250 мг (35%) 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 274°C.
1H ЯМР (δ, ДМСО): 1,33 (д, J=6,9 Гц, 3H); 1,53-1,56 (м, 1H); 1,65-1,70 (м, 3H); 2,68 (т, J=12,4 Гц, 1H); 2,88-2,90 (м, 2H); 3,14 (т, J=12,5 Гц, 1H); 3,23 (с, 3H); 3,37-3,39 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,89 (с, 3H); 3,91-3,95 (м, 2H); 4,26-4,36 (м, 1H); 4,42-4,45 (м, 1H); 4,73-4,77 (м, 2H); 5,09-5,19 (м, 1H); 6,79-6,83 (м, 1H); 6,91 (дд, J=7,6, 1,4 Гц, 1H); 7,02-7,05 (м, 3H); 7,18 (дд, J=8,4, 1,4 Гц, 1H); 7,33-7,37 (м, 1H); 7,69 (с, 1H); 8,53 (с, 1H).
Пример 109: 5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 109)
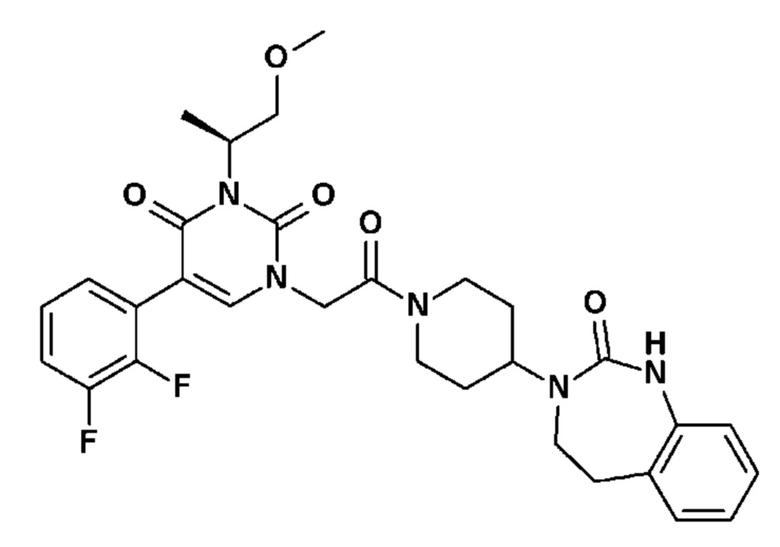
109.1: [5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 1,4 г (4,2 ммоль) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 106.1) и 2,7 г (16,7 ммоль) 2,3-дифторфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 60/40, получали 0,9 г (60%) [5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
109.2: [5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 920 мг (2,5 ммоль) [5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 840 мг (95%) [5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
109.3: 5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 109)
Аналогично примеру 76.4, используя 150 мг (0,4 ммоль) [5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 125 мг (0,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 150 мг (59%) 5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 234°C.
1H ЯМР (δ, ДМСО): 1,34 (д, J=7,0 Гц, 3H); 1,53-1,80 (м, 4H); 2,69 (т, J=12,4 Гц, 1H); 2,90 (м, 2H); 3,15 (т, J=12,3 Гц, 1H); 3,23 (с, 3H); 3,38-3,40 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,90-3,95 (м, 2H); 4,28-4,38 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,77 (с, 2H); 5,15-5,17 (м, 1H); 6,79-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,19-7,29 (м, 2H); 7,42-7,49 (м, 1H); 7,89 (с, 1H); 8,53 (с, 1H).
Пример 110: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 110)
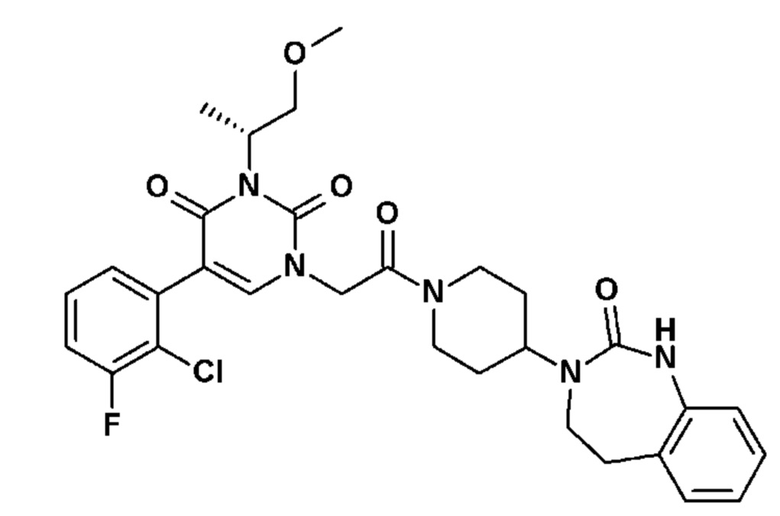
110.1: [5-бром-3-((R)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 106.1, используя 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), и 0,4 мл (4,2 ммоль) (S)-1-метокси-пропан-2-ола, получали 0,8 г (63%) [5-бром-3-((R)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
110.2: [5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 300 мг (0,9 ммоль) [5-бром-3-((R)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 156 мг (0,9 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 180 мг (54%) [5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
110.3: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 110)
Аналогично примеру 13.4, используя 180 мг (0,5 ммоль) [5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 143 мг (0,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после кристаллизации в этилацетате, получали 105 мг (36%) 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 225°C.
1H ЯМР (δ, ДМСО): 1,34 (д, J=7,0 Гц, 3H); 1,50-1,80 (м, 4H); 2,68 (т, J=12,5 Гц, 1H); 2,90 (м, 2H); 3,15 (м, 1H); 3,33 (с, 3H); 3,38 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,90-3,95 (м, 2H); 4,33 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,75 (м, 2H); 5,15 (м, 1H); 6,80-6,81 (м, 1H); 7,04-7,06 (м, 3H); 7,20-7,21 (м, 1H); 7,44-7,45 (м, 2H); 7,80 (с, 1H); 8,53 (с, 1H).
Пример 111: 2-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионат (реакционная схема № 3, соединение 111)
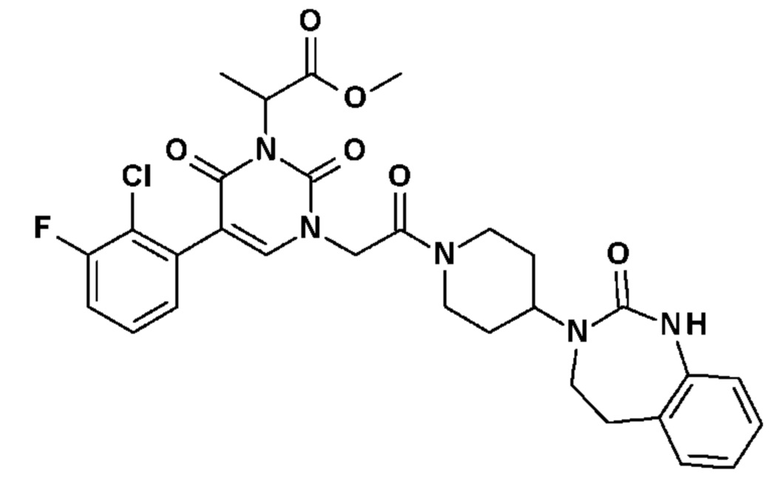
111.1: (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетат
Аналогично примеру 2.2, используя 10 г (30 ммоль) 1-бензгидрил-5-бром-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.1) и 3,5 мл (40 ммоль) метилбромацетата, получали 11,1 г (92%) (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
111.2: 2-(3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионат
К раствору, содержащему 1 г (2 ммоль) (3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилацетата в 20 мл тетрагидрофурана, предварительно охлажденному до -78°C, добавляли 3,7 г (20 ммоль) бис(триметилсилил)амида калия и 1,7 мл (20 ммоль) иодметана. Смесь перемешивали при -78°C в течение 2 часов, затем выливали в насыщенный раствор хлорида аммония и экстрагировали дихлорметаном. Органическую фазу сушили над безводным сульфатом натрия, затем фильтровали и концентрировали досуха. Получали 640 мг (62%) 2-(3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионата в виде твердого вещества желтого цвета.
111.3: 2-[3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионат
Аналогично примеру 44.1, используя 450 мг (1 ммоль) 2-(3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионата и 354 мг (2 ммоль) 2-хлор-3-фторфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (5% - 30% этилацетата в гептане), получали 150 мг (30%) 2-[3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата в виде твердого вещества желтого цвета.
111.4: 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионат
Аналогично примеру 2.3, используя 150 мг (0,3 ммоль) 2-[3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата, получали 125 мг (126%) 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата в виде масла коричневого цвета.
111.5: 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично примеру 2.4, используя 5 г (20 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) и 4,2 г (44,8 ммоль) хлоруксусной кислоты, получали 7 г (107%) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде твердого вещества белого цвета.
111.6: 2-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионат (соединение 111)
Раствор, содержащий 125 мг (0,4 ммоль) 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата в 2,5 мл N,N-диметилформамида, добавляли к 148 мг (0,5 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, 63 мг (0,5 ммоль) карбоната калия и 13 мг (0,1 ммоль) иодида калия. Смесь перемешивали в течение 45 минут при 50°C. Эту смесь гидролизовали и затем экстрагировали этилацетатом. Органическую фазу промывали водой, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха. Полученнное масло желтого цвета очищали препаративной ВЭЖХ. После упаривания, получали 95 мг (40%) 2-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионата в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, MeOD-d4) δ: 1,59 (д, J=6,9 Гц, 3H), 1,68-2,02 (м, 4H), 2,79 (м, 1H), 2,95-3,08 (м, 2H), 3,19-3,31 (м, 1H), 3,48-3,62 (м, 2H), 3,72 (с, 3H), 4,05 (м, 1H), 4,36-4,51 (м, 1H), 4,56-4,69 (м, 1H), 4,71-5,03 (м, 2H), 5,55 (кв, J=6,9 Гц, 1H), 6,86-6,97 (м, 2H), 7,09 (м, 2H), 7,24 (м, 1H), 7,30 (м, 1H), 7,39 (м, 1H), 7,71 (с, 1H); NH not observed in метанол.
Пример 112: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 112)
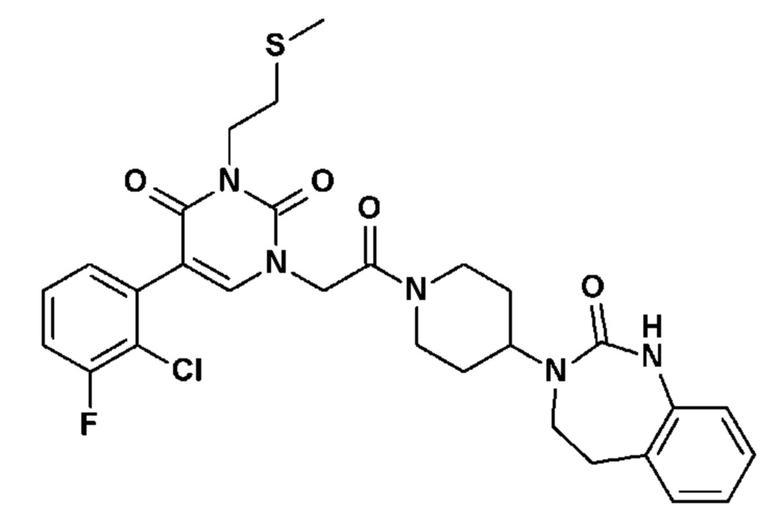
112.1: [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 1.7, используя 0,5 г (1,9 ммоль) 5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 420 мг (3,8 ммоль) 2-хлорэтилметилсульфида, и после нагревания смеси при 50°C в течение 5 часов, получали 520 мг (81%) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат в виде твердого вещества белого цвета.
112.2: [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 13.3, используя 520 мг (1,5 ммоль) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 296 мг (1,7 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 490 мг (85%) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
112.3: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 112)
Аналогично примеру 13.4, используя 490 мг (1,3 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 387 мг (1,6 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), и после рекристаллизации из н-бутанола, получали 470 мг (58%) 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 207°C.
1H ЯМР (δ, ДМСО): 1,50-1,80 (м, 4H), 2,12 (с, 3H), 2,69 (т, 3H, J=7,19 Гц), 2,90 (м, 2H), 3,16 (м, 1H), 3,38 (м, 2H), 3,95 (д, 1H, J=13,66 Гц), 4,08 (т, 2H, J=7,21 Гц), 4,33 (м, 1H), 4,43 (д, 1H, J=12,91 Гц), 4,79 (с, 2H), 6,79-6,83 (м, 1H), 7,02-7,05 (м, 3H), 7,21-7,23 (м, 1H), 7,44-7,48 (м, 2H), 7,85 (с, 1H), 8,52 (с, 1H).
Пример 113: 5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 113)
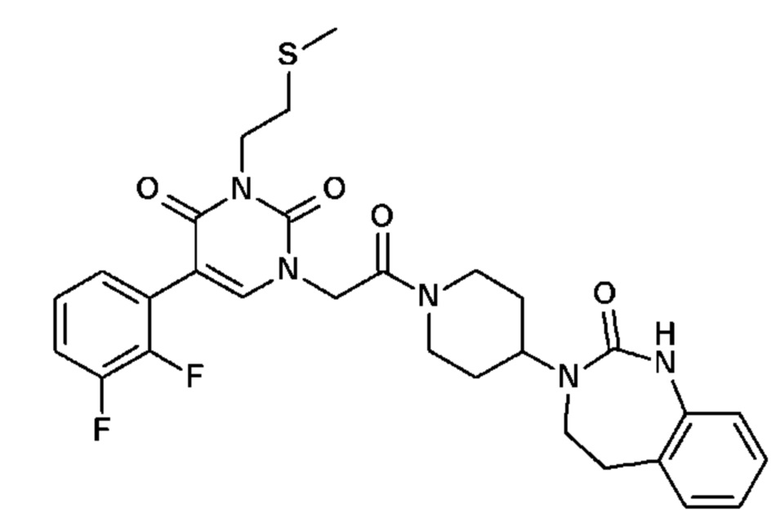
113.1: (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К раствору, содержащему 30 г (0,2 ммоль) 5-бромурацила в 294 мл ацетонитрила добавляли 23 мл (0,2 ммоль) 1,8-диазабицикло[5,4,0]ундец-7-ена. Смесь превращали в раствор и затем превращали в смесь через 5 мин. Потом ее охлаждали до -5°C на бане со льдом и ацетоном, затем добавляли 16 мл (0,2 ммоль) метилбромацетата. Среду перемешивали в течение 45 минут при комнатной температуре, обрабатывали, выливая в 150 мл воды, затем фильтровали. Белый осадок промывали небольшим количеством трет-бутилового эфира и сушили в вакууме при 40°C. Получали 25,5 г (63%) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
113.2: [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 1.7, используя 1,2 г (4,6 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата и 1,4 мл (13,7 ммоль) 2-хлорэтилметилсульфида, и после нагревания смеси при 50°C в течение ночи, получали 850 мг (55%) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла, которое кристаллизуется.
113.3: [5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44.1, используя 550 мг (1,6 ммоль) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 1,1 г (6,5 ммоль) 2,3-дифторфенилбороновой кислоты, получали 450 мг (75%) [5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
113.4: [5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16.8, используя 450 мг (1,2 ммоль) [5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 430 мг (99%) [5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
113.5: 5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион (соединение 113)
Аналогично примеру 13,4, используя 200 мг (0,6 ммоль) [5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 165 мг (0,7 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, и после кристаллизации в смеси гептан/этилацетат 50/50, получали 230 мг (65%) 5-(2,3-дифторфенил)-3-(2-метилсульфанил-этил)-1-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 220°C.
1H ЯМР (400 МГц, ДМСО-d6) δ: 1,50-1,63 (м, 1H), 1,69 (м, 3H), 2,12 (с, 3H), 2,69 (м, 3H), 2,82-2,97 (м, 2H), 3,16 (м, 1H), 3,35-3,48 (м, 2H), 3,95 (м, 1H), 4,03-4,15 (м, 2H), 4,28-4,38 (м, 1H), 4,43 (м, 1H), 4,80 (с, 2H), 6,73-6,88 (м, 1H), 6,96-7,10 (м, 3H), 7,17-7,35 (м, 2H), 7,46 (м, 1H), 7,94 (с, 1H), 8,53 (с, 1H).
Пример 114: 3-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионат (реакционная схема № 3, соединение 114)
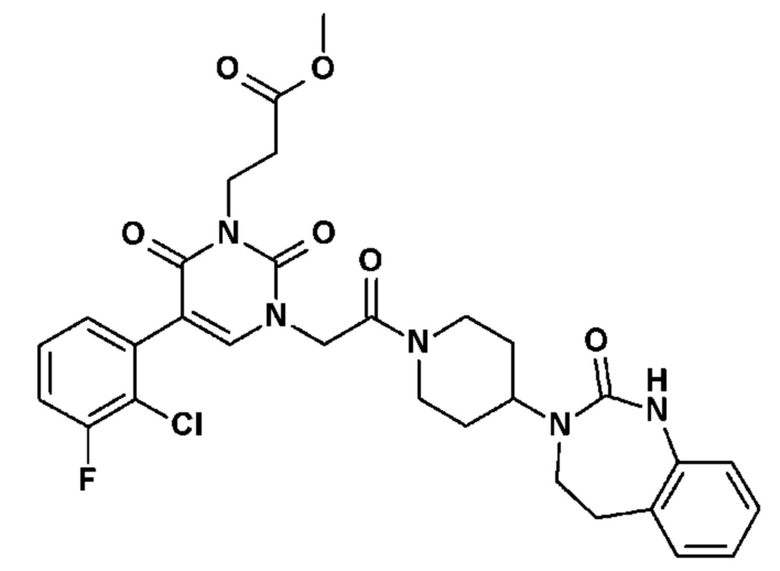
114.1: 3-(3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионат
Аналогично примеру 2.2, используя 1 г (2,8 ммоль) 1-бензгидрил-5-бром-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 2.1) и 608 мг (3,6 ммоль) метил 3-бромпропионата, получали 1,1 г (85%) 3-(3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионата в виде твердого вещества белого цвета.
114.2: 3-[3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионат
Аналогично примеру 44.1, используя 1,1 г (2,4 ммоль) 3-(3-бензгидрил-5-бром-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионата и 620 мг (3,6 ммоль) 2-хлор-3-фторфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 80/20, получали 660 мг (57%) 3-[3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата в виде твердого вещества желтого цвета.
114.3: 3-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионат
Аналогично примеру 2.3, используя 500 мг (1,0 ммоль) 3-[3-бензгидрил-5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата, 310 мг (94%) 3-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата получали в виде твердого вещества желтоватого цвета.
114.4: 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично примеру 2.4, используя 6 г (24,5 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) и 5 г (53,8 ммоль) хлоруксусной кислоты, получали 6,4 г (81%) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде твердого вещества белого цвета.
114.5: 3-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионат (соединение 114)
Аналогично примеру 111.6, используя 150 мг (0,5 ммоль) 3-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил]-метилпропионата и 163 мг (0,5 ммоль) 3-[1-(2-хлорацетил)-пиперидин-4-ил]-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, и после кристаллизации в этилацетате и затем гептане, получали 230 мг (80%) 3-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-метилпропионата в виде твердого вещества кремового цвета.
1H ЯМР (δ, ДМСО): 1,55 (д, J=13,8 Гц, 1H); 1,69 (д, J=23,0 Гц, 3H); 2,59 (т, J=7,4 Гц, 2H); 2,69 (т, 1H); 2,90 (м, 2H); 3,16 (ушир с, 1H); 3,38 (м, 2H); 3,60 (с, 3H); 3,95 (д, J=13,5 Гц, 1H); 4,13 (т, J=7,4 Гц, 2H); 4,33 (ушир с, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,78 (с, 2H); 6,81 (дт, J=7,8, 4,3 Гц, 1H); 7,04 (т, J=3,8 Гц, 3H); 7,21-7,23 (м, 1H); 7,44-7,47 (м, 2H); 7,85 (с, 1H); 8,52 (с, 1H).
Синтезировали другое соединение, в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 202: N-[2-(5-(2-хлор-3-фторфенил)-2,6-диоксо-3-{2-оксо-2-[4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-этил}-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид
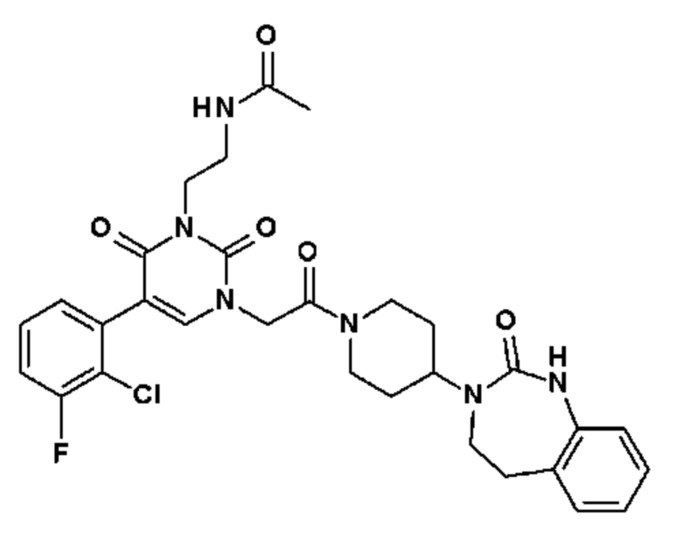
1H ЯМР (δ, ДМСО): 1,47-1,83 (м, 4H), 1,76 (с, 3H), 2,62 -2,77 (м, 1H), 2,81-2,97 (м, 2H), 3,07-3,20 (м, 1H), 3,26 (кв, J=6,43 Гц, 2H), 3,34-3,44 (м, 2H), 3,84-4,04 (м, 3H), 4,25-4,38 (м, 1H), 4,43 (д, J=13,11 Гц, 1H), 4,78 (с, 2H), 6,68-6,87 (м, 1H), 6,90-7,10 (м, 3H), 7,14-7,31 (м, 1H), 7,34-7,56 (м, 2H), 7,82 (с, 1H), 7,92 (т, J=5,91 Гц, 1H), 8,52 (с, 1H).
Пример 115: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид (схема реакции 3 или 4, соединение 115)
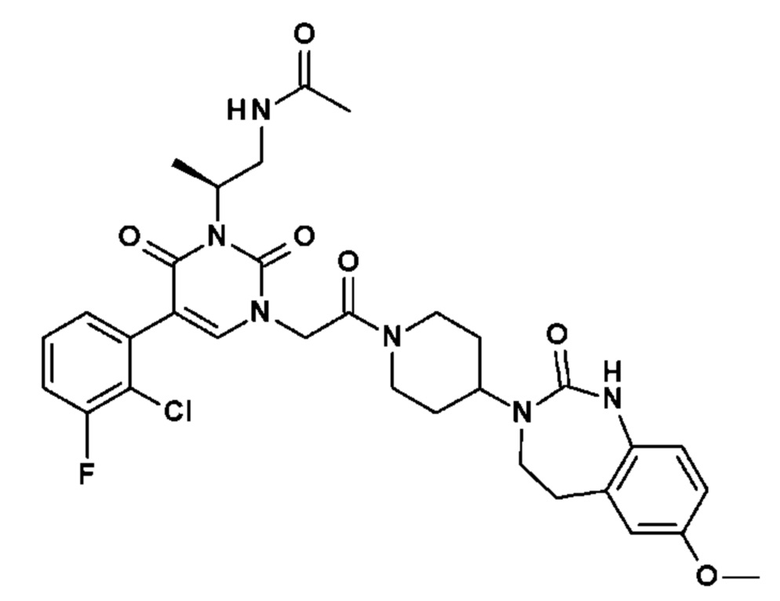
115.1: (5-метокси-2-нитрофенил)-ацетонитрил
К раствору, содержащему 53,6 г (478 ммоль) трет-бутилата калия в 610 мл N,N-диметилформамида, добавляли раствор, содержащий 30,5 г (199 ммоль) 4-нитроанизола и 40 г (239 ммоль) (4-хлорфенокси)-ацетонитрила в 305 мл N,N-диметилформамида, при -20°C в атмосфере азота. Реакционную смесь оставляли нагреваться до 0°C и содержали при этой температуре. Через 1 час реакционную смесь охлаждали до -50°C и медленно гидролизовали 1000 мл охлажденного льдом водного раствора 6н соляной кислоты, затем добавляли 1000 мл этилацетата и 500 мл воды. Водную фазу экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида аммония и затем водой, и потом сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный остаток обрабатывали в толуоле и упаривали. Полученное таким образом масло растворяли, при перемешивании, в 250 мл смеси этилацетат/гептан (50/50) в течение ночи, затем смесь охлаждали на бане со льдом и фильтровали. После промывки гептаном, получали 26,7 г (68%) (5-метокси-2-нитрофенил)-ацетонитрила в виде твердого вещества оранжевого цвета.
115.2: 2-(5-метокси-2-нитрофенил)-этиламин
К раствору, содержащему 26 г (136 ммоль) (5-метокси-2-нитрофенил)-ацетонитрила в 130 мл 2-метилтетрагидрофурана, при 60°C добавляли 200 мл (200 ммоль) раствора комплекса боран-тетрагидрофуран. Через 3 часа нагревание прекращали и медленно добавляли 35 мл (863 ммоль) метанола, а также 200 мл 1н водного раствора гидроксида натрия. Затем водную фазу экстрагировали 250 мл метилтетрагидрофурана. Органическую фазу промывали водой, сушили над безводным сульфатом натрия, фильтровали и концентрировали частично. Добавляли 400 мл трет-бутилового эфира и 10 мл (175 ммоль) уксусной кислоты. Смесь охлаждали, оставляли при перемешивании в течение ночи, затем концентрировали и совместно упаривали с толуолом. Получали 40,6 г (100%) 2-(5-метокси-2-нитрофенил)-этиламинацетата в виде масла коричневого цвета.
115.3: 4-[2-(5-метокси-2-нитрофенил)-этиламино]-пиперидин-1-метилкарбоксилат
К раствору в атмосфере азота, содержащему 40,6 г (136 ммоль) 2-(5-метокси-2-нитрофенил)-этиламинуксусной кислоты, 35,9 г (180 ммоль) N-(трет-бутоксикарбонил)-4-пиперидона в 360 мл 2-метилтетрагидрофурана, добавляли 44,5 г (210 ммоль) триацетоксигидробората натрия. Через 2 часа, реакционную смесь гидролизовали 2н водным раствором гидроксида натрия. Водную фазу экстрагировали метилтетрагидрофураном. Для доведения значения pH до 6, органическую фазу промывали водой, сушили сульфатом натрия, фильтровали и упаривали. Получали 69,2 г (100%) 4-[2-(5-метокси-2-нитрофенил)-этиламино]-пиперидин-1-метилкарбоксилата в виде темного масла.
115.4: 4-[2-(2-амино-5-метоксифенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат
К раствору, содержащему 69,2 г (137 ммоль) 4-[2-(5-метокси-2-нитрофенил)-этиламино]-пиперидин-1-метилкарбоксилата в 130 мл 2-метилтетрагидрофурана, 130 мл метанола и 130 мл воды, добавляли 3,7 г (70 ммоль) хлорида аммония и 31,3 г (560 ммоль) железа. Реакционную смесь нагревали с обратным холодильником в течение 4 часов и затем оставляли охлаждаться до комнатной температуры. Через 16 часов, реакционную смесь фильтровали через целит, и фильтрат концентрировали до тех пор, пока метанол не испарился. Добавляли метилтетрагидрофуран, а также 10%-ный раствор этилендиаминтетрауксусной кислоты. Органическую фазу промывали водой и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали. Получали 53,2 г (100%) 4-[2-(2-амино-5-метоксифенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата в виде масла оранжевого цвета.
115.5: 4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилат
К раствору, содержащему 53,2 г (137 ммоль) 4-[2-(2-амино-5-метоксифенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата при 90% в 1000 мл толуола, добавляли частями 27,2 г (168 ммоль) N,N'-карбонилдиимидазола. Через 1 час, образовавшийся осадок фильтровали, и фильтрат концентрировали частично. Остаток промывали дважды водным раствором хлорида аммония. Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали. Получали 58 г масла оранжевого цвета. После очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (20% - 70% этилацетата в гептане), получали 35 г твердого вещества желтого цвета и обрабатывали в 200 мл изопропилового эфира при нагревании с обратным холодильником, 100 мл изопропилового эфира, 100 мл тетрагидрофурана, 80 мл этанола и 300 мл метанола. Смесь фильтровали и затем концентрировали. После очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (20% - 100% этилацетата в гептане), получали 21,1 г (34%) 4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата в виде твердого вещества бежевого цвета.
115.6: 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
К раствору, содержащему 83% 4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата в 300 мл дихлорметана, добавляли 35 мл (380 ммоль) трифторуксусной кислоты при 0°C. Через 15 часов, реакционную смесь медленно концентрировали на роторном испарителе. Остаток совместно упаривали с толуолом, обрабатывали в 250 мл дихлорметана, затем pH смеси доводили до значения, равного 10, с помощью 1н водного раствора гидроксида натрия. Водную фазу экстрагировали дихлорметаном, органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали. Получали 12,7 г (96%) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде твердого вещества бежевого цвета.
115.7: [5-бром-3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 2.5, используя 3,3 г (12,6 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 2 г (11,4 ммоль) ((R)-2-гидроксипропил)-трет-бутилкарбамата, и после очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (20% - 50% этилацетата в гептане), получали 4,1 г (85%) [5-бром-3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде вязкого масла.
115.8: [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 44,1, используя 1,9 г (11,1 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 3,1 г (7,4 ммоль) [5-бром-3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 2,4 г (68%) [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде меренги.
115.9: [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 16,8, используя 1 г (2,1 ммоль) [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 983 мг (101%) [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества бежевого цвета.
115.10: [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-трет-бутилкарбамат
К раствору, содержащему 971 мг (2,1 ммоль) [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в 5 мл N,N-диметилформамида, добавляли 490 мг (2,6 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида и 284 мг (2,6 ммоль) 1-окси-пиридин-2-ола. Реакционную смесь перемешивали в течение 5 минут, затем добавляли 645 мг (2,3 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она и 0,4 мл (2,6 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и потом разбавляли этилацетатом и водой. Водную фазу экстрагировали три раза этилацетатом, органическую фазу промывали насыщенным раствором карбоната натрия и затем с помощью 1н водного раствора соляной кислоты. После сушки над сульфатом магния, раствор фильтровали и концентрировали в вакууме. После очистки с помощью хроматографии на силикагеле, элюируя смесью метанол в дихлорметане, в соответствии с градиентом полярности (0% - 5% метанола в дихлорметане), получали 1,2 г (79%) [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-трет-бутилкарбамата в виде твердого вещества бежевого цвета.
115.11: 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
К раствору, содержащему 800 мг (1,1 ммоль) [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-трет-бутилкарбамата в 7 мл дихлорметана, добавляли 0,8 мл (7,8 ммоль) трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение двух часов и затем добавляли два эквивалента трифторуксусной кислоты. Смесь концентрировали в вакууме, растворяли в дихлорметане и обрабатывали 1н водным раствором гидроксида натрия. Водную фазу экстрагировали три раза дихлорметаном; органическую фазу промывали водой и затем насыщенным солевым раствором. Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха. Получали 646 мг (94%) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета.
115.12: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид (соединение 115)
К раствору, содержащему 391 мг (0,6 ммоль) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в 3,2 мл тетрагидрофурана, добавляли 0,1 мл (0,8 ммоль) триэтиламина и 68 мг (0,7 ммоль) уксусного ангидрида при -10°C. Через 5 мин при -10°C смесь гидролизовали водой и разбавляли этилацетатом. Водную фазу экстрагировали три раза этилацетатомом, органическую фазу промывали 1н раствором соды и затем насыщенным солевым раствором. После сушки над сульфатом магния, раствор фильтровали и затем концентрировали. Осадок обрабатывали в этилацетате и перемешивали в течение 24 часов при комнатной температуре. Получали 190 мг (44%) N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамида в виде твердого вещества белого цвета с температурой плавления 200°C.
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,5 Гц, 3H), 1,42-1,75 (м, 4H), 1,77 (с, 3H), 2,60-2,75 (м, 1H), 2,82-2,93 (м, 2H), 3,14 (т, J=12,6 Гц, 1H), 3,32-3,42 (м, 2H), 3,40-3,61 (м, 2H),3,67 (с, 3H), 3,94 (bt д, J=13,3 Гц, 1H), 4,18-4,38 (м, 1H), 4,43 (д, J=12,7 Гц, 1H), 4,58-4,90 (м, 2H), 4,99 (м, 1H), 6,62 (д, J=2,9 Гц, 1H), 6,66 (дд, J=2,9, 8,8 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,13-7,31 (м, 1H), 7,35-7,57 (м, 2H), 7,8 (с, 1H), 7,88-8,02 (м, 1H), 8,32 (с, 1H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 203: N-[(R)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид
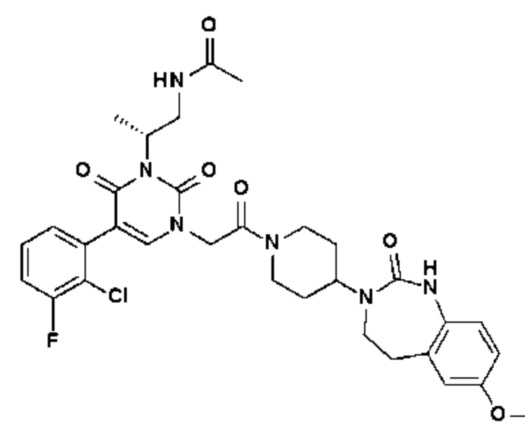
1H ЯМР (δ, ДМСО): 1,34 (дд, J=6,8, 1,4, 3H), 1,45-1,75 (м, 4H), 1,67-1,87 (м, 3H), 2,62-2,78 (м, 1H), 2,81-2,94 (м, 2H), 3,14 (т, J=12,5 Гц, 1H), 3,32-3,43 (м, 2H), 3,39-3,62 (м, 2H), 3,67 (с, 3H), 3,87-3,99 (м, 1H), 4,17-4,35 (м, 1H), 4,44 (д, J=12,6 Гц, 1H), 4,60-4,86 (м, 2H), 4,99 (кв, J=7,2 Гц, 1H), 6,44-6,76 (м, 2H), 6,98 (д, J=8,8 Гц, 1H), 7,21 (дд, J=5,7, 3,3 Гц, 1H), 7,39-7,58 (м, 2H), 7,79 (с, 1H), 7,93 (т, J=6,1, 1H), 8,32 (с, 1H).
Соединение 204: N-[(R)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-2,2,2-трифтор-ацетамид
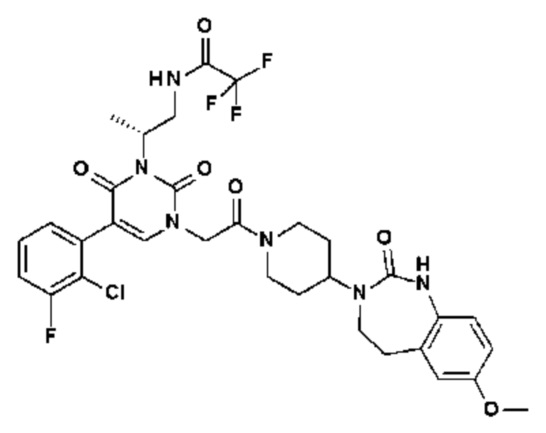
1H ЯМР (δ, ДМСО): 1,39 (дд, J=7,0 Гц, 2,3, 3H), 1,47-1,83 (м, 4H), 2,63-2,76 (м, 1H), 2,87 (д, J=5,9 Гц, 2H), 3,04-3,26 (м, 1H), 3,36 (д, J=4,7 Гц, 2H), 3,56-3,66 (м, 1H), 3,67 (с, 3H), 3,75 (д, J=8,1 Гц, 1H), 3,96 (д, J=13,6 Гц, 1H), 4,22-4,37 (м, 1H), 4,44 (д, J=12,7 Гц, 1H), 4,68 (д, J=16,5 Гц, 1H), 4,82 (д, J=16,5 Гц, 1H), 4,98-5,33 (м, 1H), 6,45-6,80 (м, 2H), 6,98 (д, J=8,8 Гц, 1H), 7,12-7,26 (м, 1H), 7,37-7,58 (м, 2H), 7,80 (с, 1H), 8,33 (с, 1H), 9,58 (д, J=5,3 Гц, 1H).
Соединение 205: N-[(S)-2-(5-(2,3-дихлорфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид
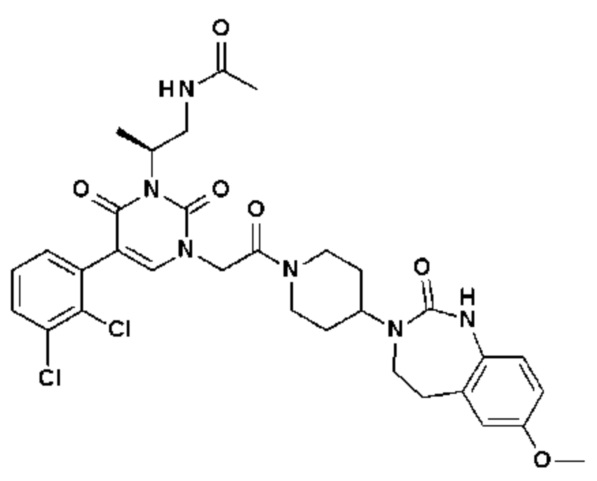
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 1,56-1,71 (м, 4H); 1,77 (с, 3H); 2,68 (т, J=12,3 Гц, 1H); 2,88 (м, 2H); 3,15 (м, 1H); 3,36 (м, 2H); 3,46-3,58 (м, 2H); 3,67 (с, 3H); 3,95 (д, J=13,6 Гц, 1H); 4,28 (м, 1H); 4,44 (д, J=12,8 Гц, 1H); 4,67-4,81 (м, 2H); 4,99 (м, 1H); 6,63-6,68 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,33 (д, J=7,7 Гц, 1H); 7,43 (т, J=7,9 Гц, 1H); 7,68 (дд, J=8,0, 1,6 Гц, 1H); 7,77 (с, 1H); 7,93 (т, J=5,9 Гц, 1H); 8,32 (с, 1H).
Соединение 206: N-[(S)-2-(5-(2-хлор-3-метоксифенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид
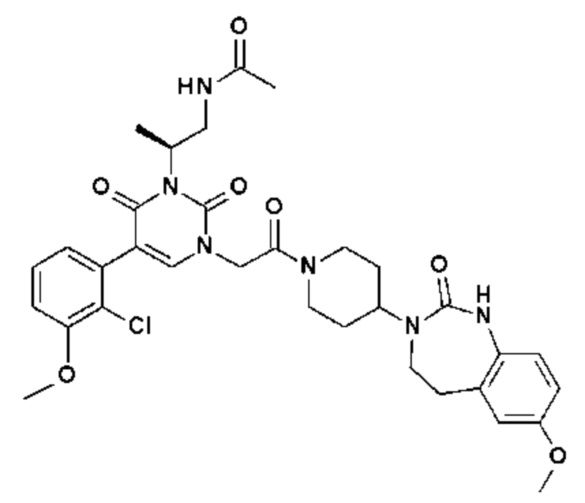
1H ЯМР (δ, ДМСО): 1,33 (д; J=6,91 Гц; 3 H); 1,56 (м; 1 H); 1,68 (м; J=20,83 Гц; 3 H); 1,77 (с;3 H); 2,68 (т; J=12,42 Гц; 1 H); 2,88 (д; J=6,51 Гц; 2 H); 3,14 (т; J=12,32 Гц; 1 H); 3,36 (д; J=6,38 Гц; 2 H); 3,46-3,41 (м; 1 H); 3,59-3,54 (м; 1 H); 3,67 (с;3 H); 3,89 (с;3 H); 3,94 (д; J=13,73 Гц; 1 H); 4,28 (м; 1 H); 4,44 (д; J=12,77 Гц; 1 H); 4,80-4,66 (м; 2 H); 4,99-4,97 (м; 1 H); 6,69-6,63 (м; 2 H); 6,91 (д; J=7,64 Гц; 1 H); 6,98 (д; J=8,79 Гц; 1 H); 7,18 (дд; J=8,37; 1,40 Гц; 1 H); 7,34 (т; J=7,96 Гц; 1 H); 7,68 (с;1 H); 7,92 (т; J=5,78 Гц; 1 H); 8,32 (с;1 H).
Пример 116: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид (реакционная схема № 4, соединение 116)
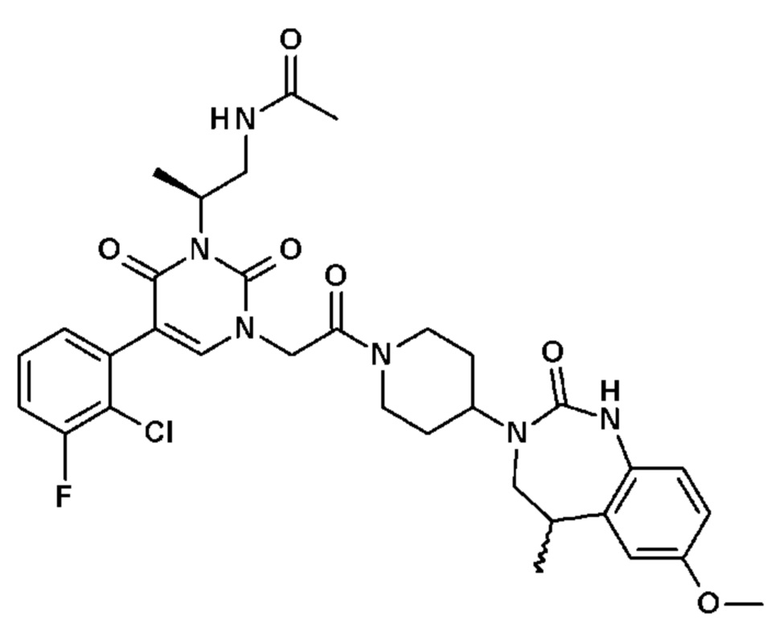
116.1: 2-(5-метокси-2-нитрофенил)-пропионитрил
К раствору, содержащему 208 мг (5,2 ммоль) гидрида натрия в 7 мл (91 ммоль) N,N-диметилформамида, при 0°C добавляли раствор, содержащий 1 г (5,2 ммоль) (5-метокси-2-нитрофенил)-ацетонитрила (полученный способом, описанным в примере 115.1) и 0,6 мл (8,9 ммоль) иодметана в 5 мл N,N-диметилформамида. Через 1 ч, смесь разбавляли этилацетатом и затем водой. Водную фазу экстрагировали три раза этилацетатом, органическую фазу промывали водой и затем насыщенным солевым раствором. После сушки над сульфатом магния, раствор фильтровали и затем концентрировали в вакууме. После очистки с помощью хроматографии на силикагеле, получали 663 мг (62%) 2-(5-метокси-2-нитрофенил)-пропионитрила в виде прозрачного масла.
116.2: 2-(5-метокси-2-нитрофенил)-пропиламин
Аналогично примеру 115.2, используя 663 мг (3,2 ммоль) 2-(5-метокси-2-нитрофенил)-пропионитрила, получали 900 мг (104%) 2-(5-метокси-2-нитрофенил)-пропиламина в виде масла.
116.3: 4-[2-(5-метокси-2-нитрофенил)-пропиламино]-пиперидин-1-трет-бутилкарбоксилат
Аналогично примеру 115.3, используя 677 мг (3,2 ммоль) 2-(5-метокси-2-нитрофенил)-пропиламина, получали 1,2 г (95%) 4-[2-(5-метокси-2-нитрофенил)-пропиламино]-пиперидин-1-трет-бутилкарбоксилата в виде масла оранжевого цвета.
116.4: 4-[2-(2-амино-5-метоксифенил)-пропиламино]-пиперидин-1-трет-бутилкарбоксилат
Аналогично примеру 115.4, используя 1,2 г (3,2 ммоль) 4-[2-(5-метокси-2-нитрофенил)-пропиламино]-пиперидин-1-трет-бутилкарбоксилата, получали 1,2 г (103%) 4-[2-(2-амино-5-метоксифенил)-пропиламино]-пиперидин-1-трет-бутилкарбоксилата в виде твердого вещества оранжевого цвета.
116.5: 4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилат
Аналогично примеру 115.5, используя 1,2 г (3,2 ммоль) 4-[2-(2-амино-5-метоксифенил)-пропиламино]-пиперидин-1-трет-бутилкарбоксилата, получали 455 мг (36%) 4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата в виде твердого вещества бежевого цвета.
116.6: 7-метокси-5-метил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично примеру 115.6, используя 455 мг (1,2 ммоль) 4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата, получали 335 мг (99%) 7-метокси-5-метил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде твердого вещества бежевого цвета.
116.7: [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-трет-бутилкарбамат
Аналогично примеру 115.10, используя 549 мг (1,2 ммоль) [3-((S)-2-трет-бутоксикарбониламино-1-метилэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты (полученный способом, описанным в примере 115.9) и 332 мг (1,2 ммоль) 7-метокси-5-метил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, получали 832 мг (100%) [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-трет-бутилкарбамата.
116.8: 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 115.11, используя 836 мг (1,2 ммоль) [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-]-трет-бутилкарбамата, и после добавления 412 мг (1,2 ммоль) (+)-o,o-дибензоил-D-винной кислоты в метаноле, нагревания и очистки хроматографией на силикагеле, получали 492 мг (68%) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона.
116.9: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид (соединение 116)
Аналогично примеру 115.12, используя 100 мг (0,2 ммоль) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона, получали 7 мг (6%) N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-5-метил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамида в виде твердого вещества бежевого цвета.
1H ЯМР (400 МГц, ДМСО-d6) δ: 1,18 (м, 3H), 1,34 (дд, J=7,0, 1,8 Гц, 3H), 1,68 (м, 4H), 1,76 (с, 3H), 2,59-2,73 (м, 1H), 3,04 (м, 1H), 3,13 (м, 1H), 3,30 (м, 2H), 3,51 (м, 2H), 3,68 (с, 3H), 3,95 (м, 1H), 4,25 (м, 1H), 4,44 (м, 1H), 4,57-4,86 (м, 2H), 4,98 (м, 1H), 6,57-6,73 (м, 2H), 6,97 (д, J=8,6 Гц, 1H), 7,21 (м, 1H), 7,36-7,52 (м, 2H), 7,79 (с, 1H), 7,95 (т, J=6,1 Гц, 1H), 8,36 (с, 1H).
Пример 117: N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид (реакционная схема № 3, соединение 117)
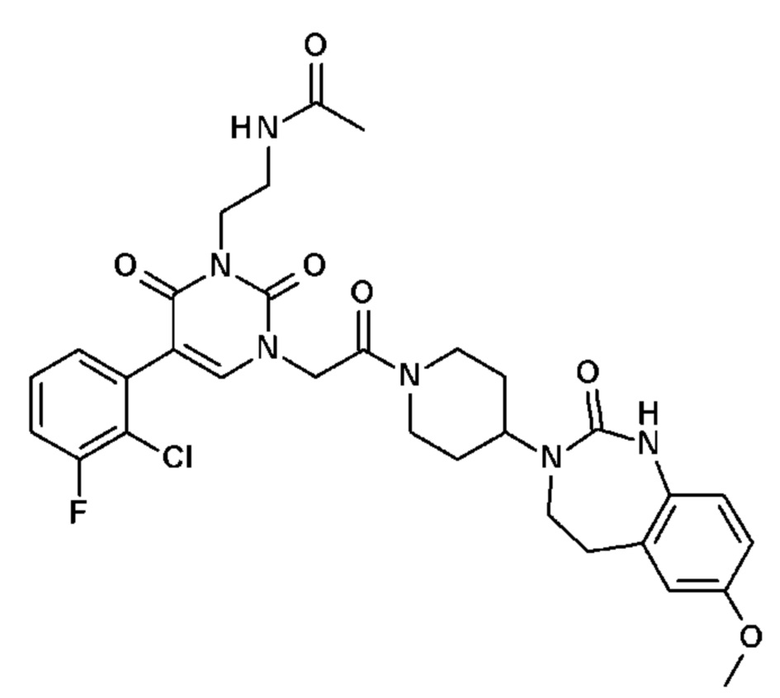
117.1: [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, содержащему 3 г (11,4 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) в 60 мл N,N-диметилформамида, добавляли 2,4 г (17,1 ммоль) карбоната калия и 3,1 г (13,7 ммоль) N-(2-бромэтил)трет-бутилкарбамата. Реакционную смесь нагревали при 50°C в течение 2 часов, затем гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом, органическую фазу дважды промывали водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Продукт осаждали в 100 мл диэтилового эфира, и потом фильтровали и сушили в вакууме в течение 2 часов. Получали 3,5 г (76%) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
117.2: [3-(2-трет-бутоксикарбониламиноэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя 429 мг (2,5 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 500 мг (1,2 ммоль) [5-бром-3-(2-трет-бутоксикарбониламиноэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, и после очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (40% - 80% этилацетата в гептане), получали 370 мг (66%) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
117.3: [3-(2-трет-бутоксикарбониламиноэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 115.9, используя 370 мг (0,8 ммоль) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 353 мг (98%) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества желтого цвета.
117.4 [2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамат
Аналогично примеру 115.10, используя 353 мг (0,8 ммоль) [3-(2-трет-бутоксикарбониламиноэтил)-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 242 мг (0,9 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6), получали 270 мг (48%) [2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамата в виде бесцветной пасты.
117.5: 3-(2-аминоэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
Аналогично примеру 115.11, используя 270 мг (13,1 ммоль) [2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-трет-бутилкарбамата, получали 240 мг (104%) 3-(2-аминоэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона.
117.6: N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид (соединение 117)
Аналогично примеру 115.12, используя 240 мг (0,4 ммоль) 3-(2-аминоэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d] [1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона и 2,5 мг (0,02 ммоль) 4-диметиламинопиридинe, получали 202 мг (76%) N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамида в виде твердого вещества белого цвета с температурой плавления 266°C.
1H ЯМР (δ, ДМСО): 1,56-1,51 (1 H, м), 1,73-1,65 (3 H, м), 1,76 (3 H, с), 2,68 (1 H, т, J=12,29 Гц), 2,88 (2 H, м), 3,15 (1 H, т, J=11,94 Гц), 3,28-3,23 (2 H, м), 3,40-3,30 (2 H, м), 3,67 (3 H, с), 3,95 (3 H, т, J=6,79 Гц), 4,28 (1 H, м), 4,43 (1 H, д, J=12,86 Гц), 4,78 (2 H, с), 6,68-6,62 (2 H, м), 6,98 (1 H, д, J=8,78 Гц), 7,22-7,20 (1 H, м), 7,47-7,44 (2 H, м), 7,82 (1 H, с), 7,93 (1 H, т, J=5,87 Гц), 8,33 (1 H, с).
Еще одно соединение синтезировали в соответствии с аналогичной процедурой, используя соответствующие реагенты, или предварительно полученные:
Соединение 207: N-[2-(5-(2,3-дихлорфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]ацетамид
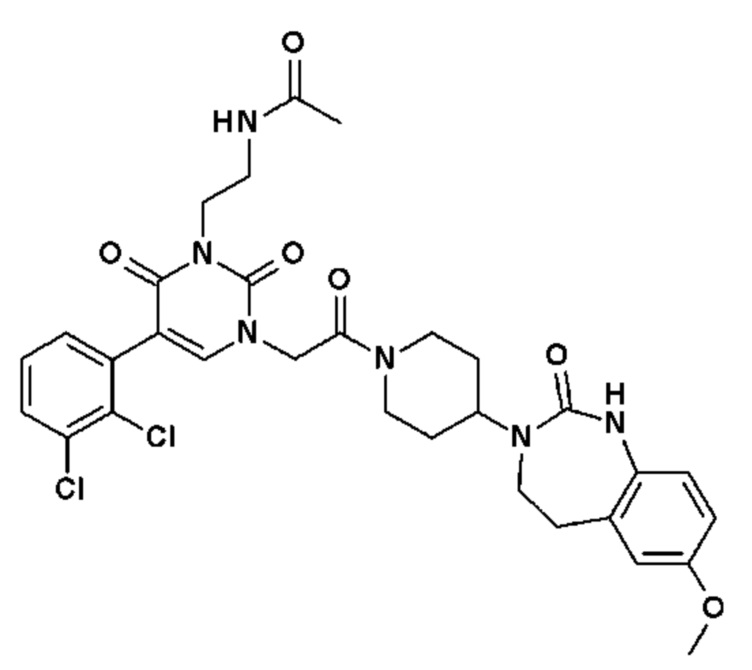
Масса=657
Пример 118: N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-N-метил-ацетамид (реакционная схема № 3, соединение 118)
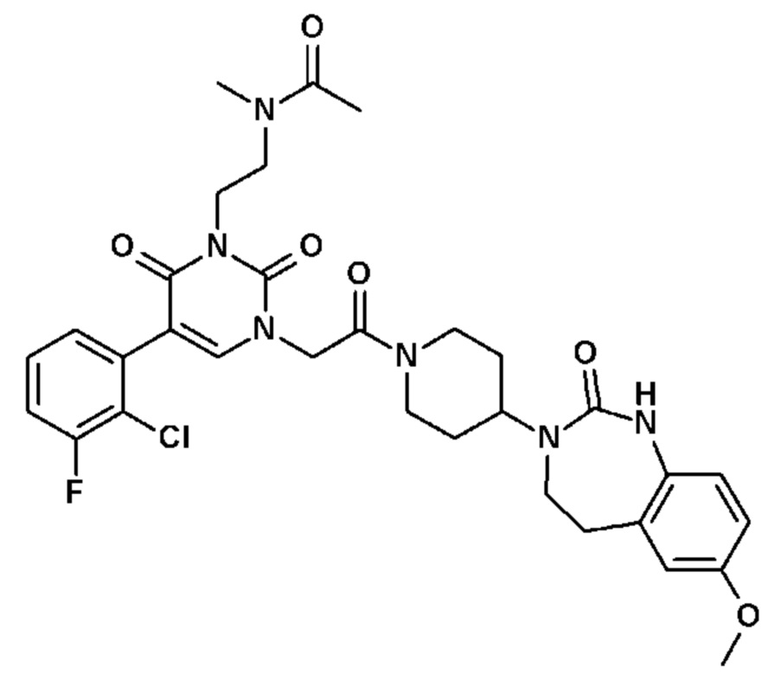
118.1: (2-хлор-этил)-метил-трет-бутилкарбамат
К раствору, содержащему 0,5 г (5,3 ммоль) (2-хлор-этил)-метиламина в 10 мл дихлорметана, добавляли 1,2 г (5,6 ммоль) ди-трет-бутилдикарбоната. Смесь перемешивали при комнатной температуре в течение двух часов, добавляли воду и потом продукт экстрагировали дихлорметаном. Органическую фазу сушили над безводным сульфатом натрия, затем фильтровали и концентрировали досуха. Получали 1 г (97%) (2-хлор-этил)-метил-трет-бутилкарбамата в виде бесцветного масла.
118.2: [5-бром-3-[2-(трет-бутоксикарбонил-метиламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, содержащему 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) в 13 мл N,N-диметилформамида добавляли 0,6 г (4,2 ммоль) карбоната калия и 0,8 г (4,2 ммоль) (2-хлор-этил)-метил-трет-бутилкарбамата. Смесь нагревали при 70°C в течение трех часов, затем добавляли воду и смесь экстрагировали дважды этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния, фильтровали и упаривали. После очистки с помощью хроматографии на силикагеле, получали 300 мг (19%) [5-бром-3-[2-(трет-бутоксикарбонил-метиламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
118.3: [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя 300 мг (0,7 ммоль) [5-бром-3-[2-(трет-бутоксикарбонил-метиламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 249 мг (1,4 ммоль) 2-хлор-3-фторфенилбороновой кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (40% - 70% этилацетата в гептане), получали 140 мг (42%) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
118.4: [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 115.9, используя 140 мг (0,3 ммоль) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 160 мг (118%) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде бесцветного масла.
118.5: [2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамат
Аналогично примеру 115.10, используя 160 мг (0,4 ммоль) [3-[2-(трет-бутоксикарбонил-метиламино)-этил]-5-(2-хлор-3-фторфенил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 106 мг (0,4 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6), получали 120 мг (48%) [2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамата в виде бесцветного масла.
118.6: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метиламиноэтил)-1H-пиримидин-2,4-дион
Аналогично примеру 115.11, используя 120 мг (0,2 ммоль) [2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-метил-трет-бутилкарбамата, получали 120 мг (116%) 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метиламиноэтил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
118.7: N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-N-метил-ацетамид (соединение 118)
добавляли 0,03 мл (0,2 ммоль) триэтиламина и 1 мг (0,01 ммоль) 4-диметиламинопиридина к раствору, содержащему 120 мг (0,2 ммоль) 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метиламиноэтил)-1H-пиримидин-2,4-диона в 6 мл тетрагидрофурана. Смесь охлаждали до -10°C, затем добавляли 0,01 мл (0,2 ммоль) ацетилхлорида. После перемешивания в течение 30 минут при -10°C, смесь выливали в насыщенный водный раствор карбоната натрия, и затем дважды экстрагировали этилацетатом. Органическую фазу сушили над безводным сульфатом натрия, затем фильтровали и концентрировали досуха. Полученное твердое вещество очищали хроматографией на силикагеле, элюируя смесью метанола в дихлорметане, в соответствии с градиентом полярности (0% - 5% метанола в дихлорметане). После обработки в дихлорметане и гептане, осаждения и концентрирования досуха, получали 58 мг (45%) N-[2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-этил]-N-метил-ацетамида в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6) δ: 1,46-1,61 (м, 1H), 1,61-1,82 (м, 3H), 1,89 (с, 1,5H), 1,95 (с, 1,5H), 2,67 (м, 1H), 2,87 (м, 2H), 2,82 (с, 1,5H), 2,95 (с, 1,5H), 3,14 (м, 1H), 3,33-3,42 (м, 2H), 3,52 (м, 2H), 3,67 (с, 3H), 3,95 (м, 1H), 4,01-4,18 (м, 2H), 4,28 (м, 1H), 4,42 (д, J=12,8 Гц, 1H), 4,78 (д, J=10,3 Гц, 2H), 6,98 (д, J=8,7 Гц, 1H), 7,19 (м, 1H), 7,45 (м, 2H), 7,84 (д, J=28 Гц, 1H), 8,32 (с, 1H).
Пример 119: 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 119)
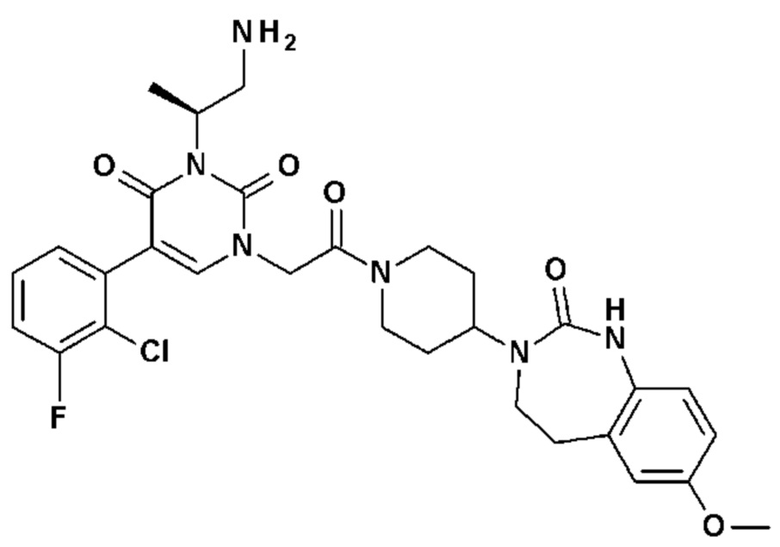
Аналогично примеру 115.10, используя 280 мг (0,5 ммоль) [(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-трет-бутилкарбамата (полученный способом, описанным в примере 115.10), и после очистки с помощью хроматографии на силикагеле, получали 265 мг (95%) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества кремового цвета с температурой плавления 206°C.
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H), 1,38-1,58 (м, 3H), 1,67 (м, 3H), 2,68 (м, 1H), 2,80-2,94 (м, 3H), 3,04 (м, 1H), 3,14 (м, 1H), 3,34-3,43 (м, 2H), 3,67 (с, 3H), 3,93 (д, J=13,5 Гц, 1H), 4,19-4,35 (м, 1H), 4,43 (д, J=13,0 Гц, 1H), 4,74 (м, 2H), 4,82 (м, 1H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,22 (м, 1H), 7,36-7,53 (м, 2H), 7,78 (с, 1H), 8,32 (с, 1H).
Пример 120: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-метансульфонамид (реакционная схема № 3 or 4, соединение 120)
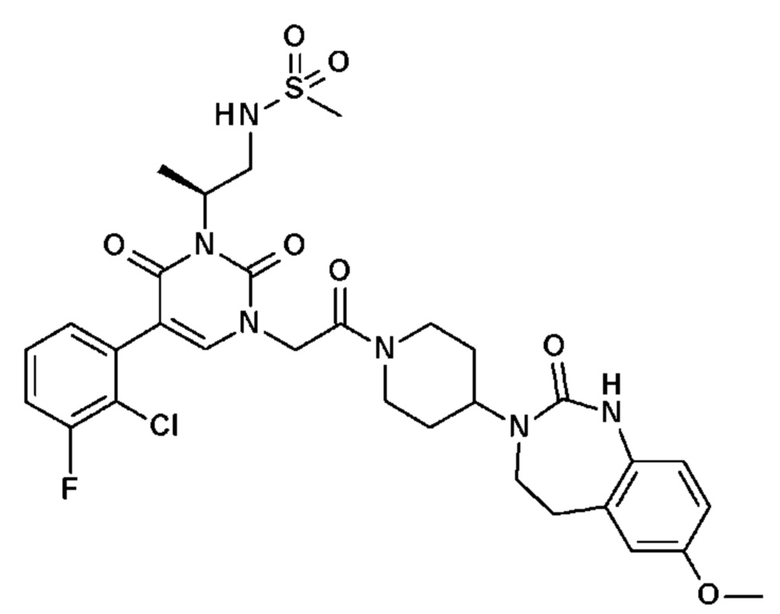
К раствору, содержащему 1,5 г (2,5 ммоль) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 119) в 15 мл дихлорметана добавляли при 0°C 0,3 мл (3,7 ммоль) метансульфонилхлорида и 0,5 мл (3,7 ммоль) триэтиламина. Через 30 минут добавляли дихлорметан и реакционную смесь гидролизовали с помощью 1н водного раствора соляной кислоты. Водную фазу вновь экстрагировали дихлорметаном. Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали. После очистки хроматографией, растворения в пентане и фильтрования получали 0,8 г (45%) N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-метансульфонамида в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,36 (дд, J=2,1, 7,0 Гц, 3H), 1,43-1,80 (м, 4H), 2,59-2,72 (м, 1H), 2,86 (ушир с, 3+2H), 3,13 (т, J=12,4 Гц, 1H), 3,34-3,40 (м, 2H), 3,46-3,63 (м, 2H), 3,66 (с, 3H), 3,94 (д, J=13,5 Гц, 1H), 4,18-4,35 (м, 1H), 4,42 (д, J=12,9 Гц, 1H), 4,66-4,82 (м, 2H), 4,88-5,16 (м, 1H), 6,61 (д, J=3,0 Гц, 1H), 6,66 (дд, J=3,0, 8,7 Гц, 1H), 6,97 (д, J=8,8 Гц, 1H), 7,15-7,30 (м, 2H), 7,38-7,51 (м, 2H), 7,80 (с, 1H), 8,34 (с, 1H).
Пример 121: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 121)
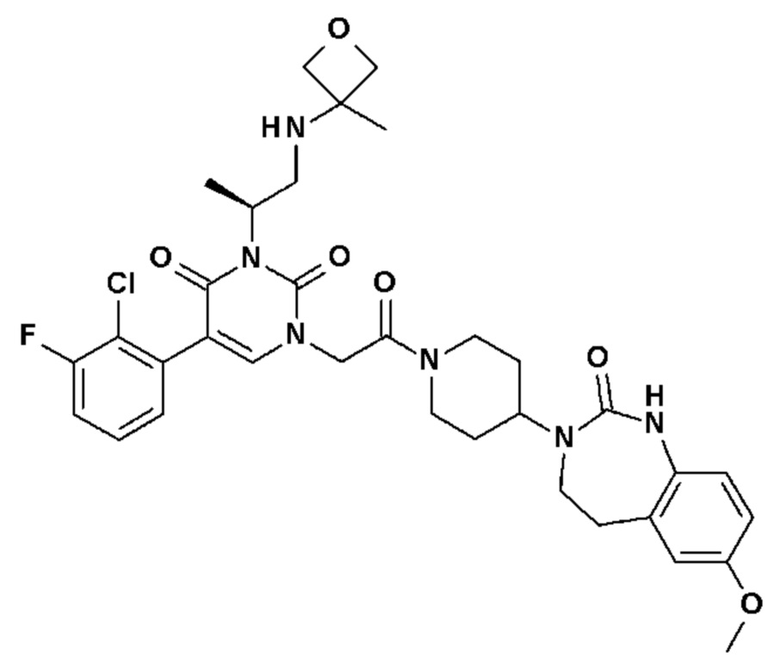
121.1: [5-бром-3-((S)-2-хлор-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, предварительно охлажденному до 0°C, содержащему 1 г (3,8 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1), 0,4 мл (4,6 ммоль) (R)-1-хлор-пропан-2-ола и 1,5 г (5,7 ммоль) трифенилфосфина в 20 мл тетрагидрофурана, медленно добавляли 1,3 г (5,7 ммоль) ди-трет-бутилазодикарбоксилата. После перемешивания при комнатной температуре в течение 4 часов тетрагидрофуран удаляли в вакууме, и затем остаток растворяли в этилацетате. Органическую фазу промывали один раз насыщенным водным раствором гидрокарбоната натрия, один раз водой, затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. После очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (2% - 50% этилацетата в гептане), получали 1,2 г (93%) [5-бром-3-((S)-2-хлор-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
121.2: [5-бром-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, содержащему 1,2 г (3,5 ммоль) [5-бром-3-((S)-2-хлор-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 12 мл тетрагидрофурана и 2,7 мл (151 ммоль) воды, добавляли 1 мл (7,1 ммоль) триэтиламина и 3,6 мл метанола. Реакционную смесь нагревали при 70°C в течение 22 часов, затем растворители концентрировали в вакууме. Получали 440 мг (39%) [5-бром-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде прозрачного масла.
121.3: [5-бром-3-((S)-1-метил-2-оксо-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, содержащему 440 мг (1,4 ммоль) [5-бром-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 13 мл дихлорметана при комнатной температуре добавляли 697 мг (1,6 ммоль) периодинана Десса-Мартина. Через 20 часов добавляли воду и дихлорметан. Органическую фазу отделяли и затем концентрировали в вакууме. Получали 440 мг [5-бром-3-((S)-1-метил-2-оксо-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата.
121.4: [5-бром-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
В 8,8 мл дихлорметана разбавляли 440 мг (1,4 ммоль) [5-бром-3-((S)-1-метил-2-оксо-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 0,1 мл (1,4 ммоль) уксусной кислоты и 0,1 мл (1,4 ммоль) 3-метилоксетан-3-амина. Затем добавляли 409 мг (1,9 ммоль) триацетоксиборогидрида натрия и 87 мг (1,4 ммоль) цианоборогидрида натрия. Перемешивание при комнатной температуре осуществляли в течение 20 часов. Потом смесь выливали в 1н водный раствор гидроксида натрия и затем экстрагировали дихлорметаном. Органическую фазу сушили над безводным сульфатом натрия, затем фильтровали и концентрировали досуха. Получали 220 мг (41%) [5-бром-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил}-метилацетата в виде бесцветного масла.
121.5: [5-(2-хлор-3-фторфенил)-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя раствор, содержащий 220 мг (0,6 ммоль) [5-бром-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил}-метилацетата в 2,2 мл толуола и 1,4 мл карбоната калия, и после очистки с помощью хроматографии на силикагеле, элюируя смесью метанола в дихлорметане, в соответствии с градиентом полярности (0% - 5% метанола в дихлорметане), получали 30 мг (12%) [5-(2-хлор-3-фторфенил)-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде масла желтого цвета.
121.6: [5-(2-хлор-3-фторфенил)-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил}-уксусная кислота
Аналогично примеру 115.9, используя 30 мг (0,1 ммоль) [5-(2-хлор-3-фторфенил)-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 29 мг (100%) [5-(2-хлор-3-фторфенил)-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил}-уксусной кислоты, получали в виде масла коричневого цвета.
121.7: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-1H-пиримидин-2,4-дион (соединение 121)
К раствору, содержащему 30 мг (0,1 ммоль) [5-(2-хлор-3-фторфенил)-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в 0,6 мл N,N-диметилформамида, добавляли 10 мг (0,1 ммоль) 1-окси-пиридин-2-ола и 21 мг (0,1 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6). Добавляли 17,6 мг (0,1 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида, и перемешивали в течение 20 часов при комнатной температуре. Смесь выливали в воду, затем экстрагировали дихлорметаном. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия и затем промывали водой, сушили над безводным сульфатом натрия, потом фильтровали и концентрировали досуха. После очистки с помощью хроматографии на силикагеле, элюируя смесью метанола в дихлорметане, в соответствии с градиентом полярности (0% - 10% метанола в дихлорметане), получали 18 мг (37%) 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил]-3-[(S)-1-метил-2-(3-метил-оксетан-3-иламино)-этил]-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,33 (с;3 H); 1,36-1,39 (м; 4 H); 1,53-1,56 (м; 1 H); 1,65-1,75 (м; 3 H); 2,68 (м; 1 H); 2,87-2,92 (м; 3 H); 3,02-3,07 (м; 1 H); 3,12-3,22 (м; 1 H); 3,36 (м; 2H); 3,67 (с;3 H); 3,94 (д; J=13,50 Гц; 1 H); 4,16 (т; J=5,37 Гц; 2 H); 4,28 (м; 1 H); 4,39 (д; J=5,31 Гц; 2 H); 4,43 (д; J=12,35 Гц; 1 H); 4,74 (м; 2 H); 4,89 (м; 1 H); 6,62 (д; J=2,75 Гц; 1 H); 6,67 (дд; J=8,79; 2,92 Гц; 1 H); 6,98 (д; J=8,79 Гц; 1 H); 7,20-7,22 (м; 1 H); 7,43-7,46 (м; 2 H); 7,78 (с;1 H); 8,32 (с;1 H).
Пример 122: 5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3 или 4, соединение 122)
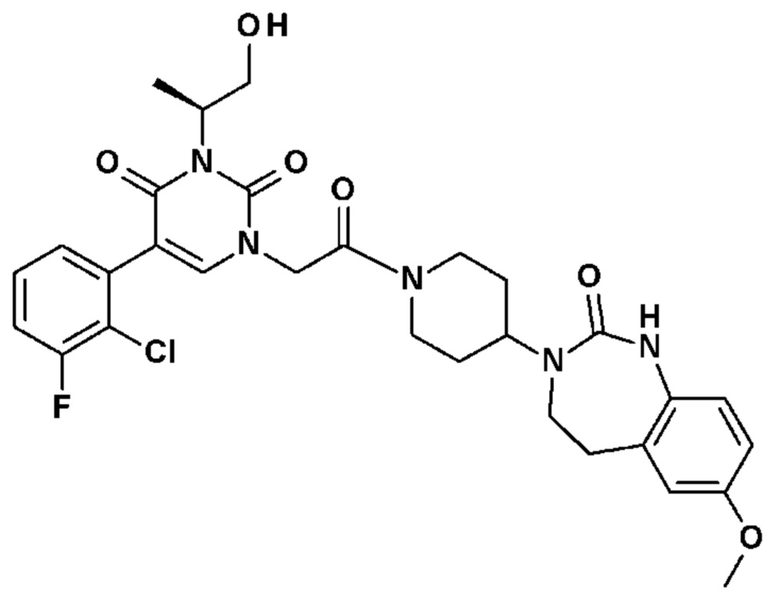
122.1: [5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 115.8, используя 366 мг (2,1 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 450 мг (1,4 ммоль) [5-бром-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 121.2), получали 500 мг (100%) [5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты.
122.2: 5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 122)
Аналогично примеру 115.10, используя 110 мг (0,3 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 93 мг (0,3 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6), получали 150 мг (78%) 5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 138°C.
1H ЯМР (δ, ДМСО): 1,32 (дд, J=7,1, 2,1 Гц, 3H), 1,55 (м, 1H), 1,61-1,83 (м, 3H), 2,68 (м, 1H), 2,82-2,92 (м, 2H), 3,14 (м, 1H), 3,34-3,41 (м, 2H), 3,67 (с, 3H), 3,69 (м, 1H), 3,83 (м, 1H), 3,94 (д, J=13,7 Гц, 1H), 4,27 (м, 1H), 4,43 (д, J=13,0 Гц, 1H), 4,74 (м, 2H), 4,79 (т, J=5,7 Гц, 1H), 4,96 (гептен, J=6,9 Гц, 1H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,9, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,21 (м, 1H), 7,35-7,52 (м, 2H), 7,78 (с, 1H), 8,32 (с, 1H).
Пример 123: (S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил ацетат (реакционная схема № 3, соединение 123)
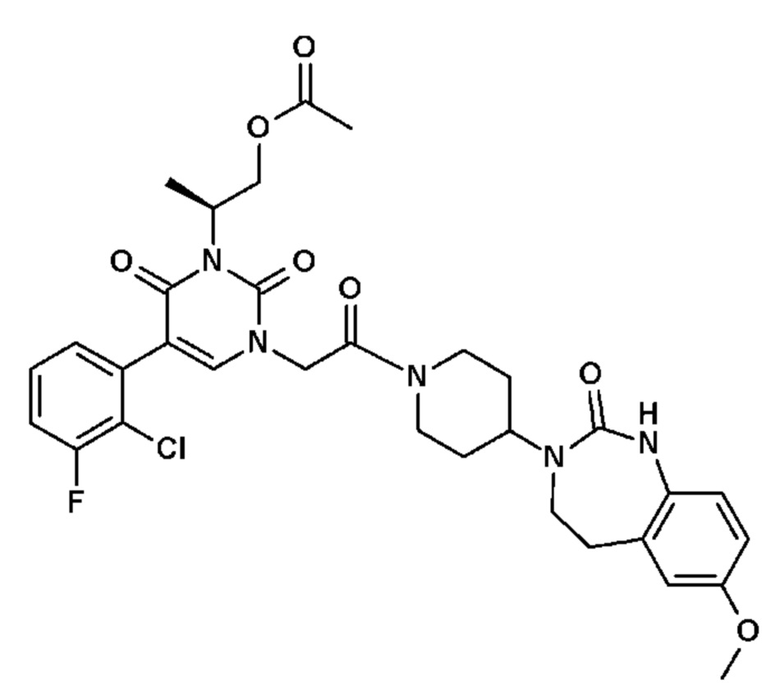
Аналогично примеру 115.12, используя 80 мг (0,1 ммоль) 5-(2-хлор-3-фторфенил)-3-((S)-2-гидрокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона (полученный способом, описанным в примере 122.2), получали 62 мг (71%) (S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропилацетата в виде твердого вещества белого цвета с температурой плавления 193°C.
1H ЯМР (δ, ДМСО): 1,39 (д, J=6,9 Гц, 3H), 1,55 (м, 1H), 1,70 (м, 3H), 1,97 (с, 3H), 2,68 (м, 1H), 2,78-2,93 (м, 2H), 3,14 (м, 1H), 3,34-3,43 (м, 2H), 3,67 (с, 3H), 3,93 (д, J=13,7 Гц, 1H), 4,18-4,38 (м, 2H), 4,46 (м, 2H), 4,66-4,85 (м, 2H), 5,18 (кв, J=7,2 Гц, 1H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,7, 2,9 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,22 (м, 1H), 7,37-7,55 (м, 2H), 7,82 (с, 1H), 8,32 (с, 1H).
Пример 124: 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 124)
124.1: [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 2.5, используя 3 г (11,4 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 1,2 мл (12,6 ммоль) (R)-1-метокси-пропан-2-ола, и после очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (30% - 50% этилацетата в гептане), получали 2,6 г (67%) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
124.2: [5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору, содержащему 800 мг (2,4 ммоль) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 80 мл 1,4-диоксана и 8 мл воды, добавляли 759 мг (7,2 ммоль) карбоната натрия и 979 мг (5,3 ммоль) 2-хлор-3-метоксифенилбороновой кислоты. Смесь дегазировали азотом в течение 15 минут, затем добавляли 194 мг (0,2 ммоль) комплекса дихлорметана и 1,1ʹ-бис(дифенилфосфино)ферроцен-дихлорпалладия(II) и смесь нагревали при 100°C в течение 2 часов. После охлаждения добавляли 3,6 мл гидроксида лития моногидрата и 16 мл воды к реакционной смеси, которую оставляли отстаиваться в течение ночи. К реакционной смеси добавляли воду и этилацетат. Водную фазу подкисляли до pH4 с помощью 1н водного раствора соляной кислоты. Эту фазу экстрагировали дважды этилацетатом. Органическую фазу промывали водой, затем насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха. Получали 912 мг (100%) [5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
124.3: 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 124)
Аналогично примеру 115.10, используя 415 мг (1,1 ммоль) [5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 328 мг (1,2 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6), получали 180 мг (26%) 5-(2-хлор-3-метоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 269°C.
1H ЯМР (δ, ДМСО): 1,33 (д, J=6,9 Гц, 3H); 1,55-1,69 (м, 4H); 2,67-2,68 (м, 1H); 2,87 (м, 2H); 3,13 (м, 1H); 3,23 (с, 3H); 3,35-3,37 (м, 2H); 3,52-3,56 (м, 1H); 3,67 (с, 3H); 3,89 (с, 3H), 3,91 (м, 2H); 4,28 (м, 1H); 4,41-4,44 (м, 1H); 4,73 (м, 2H); 5,14 (м, 1H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,91 (дд, J=7,6, 1,4 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,18 (дд, J=8,4, 1,4 Гц, 1H); 7,35 (м, 1H); 7,69 (с, 1H); 8,33 (с, 1H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 125: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 1,52-1,80 (м, 4H); 2,68 (т, J=12,4 Гц, 1H); 2,88 (м, 2H); 3,14 (т, J=12,4 Гц, 1H); 3,24 (с, 3H); 3,35-3,37 (м, 2H); 3,52-3,56 (м, 1H); 3,67 (с, 3H); 3,92 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,75 (с, 2H); 5,15 (м, 1H); 6,62-6,68 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,20-7,22 (м, 1H); 7,43-7,47 (м, 2H); 7,80 (с, 1H); 8,33 (с, 1H).
Соединение 126: 5-(2,3-дифторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,34 (д, J=7,0 Гц, 3H); 1,52-1,70 (м, 4H); 2,68 (т, J=12,5 Гц, 1H); 2,88 (м, 2H); 3,15 (т, J=12,4 Гц, 1H); 3,23 (с, 3H); 3,36-3,38 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,67 (с, 3H); 3,90-3,95 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,77 (с, 2H); 5,16 (м, 1H); 6,63-6,69 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,19-7,29 (м, 2H); 7,42-7,49 (м, 1H); 7,88 (с, 1H); 8,33 (с, 1H).
Соединение 127: 5-(2,3-дихлорфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
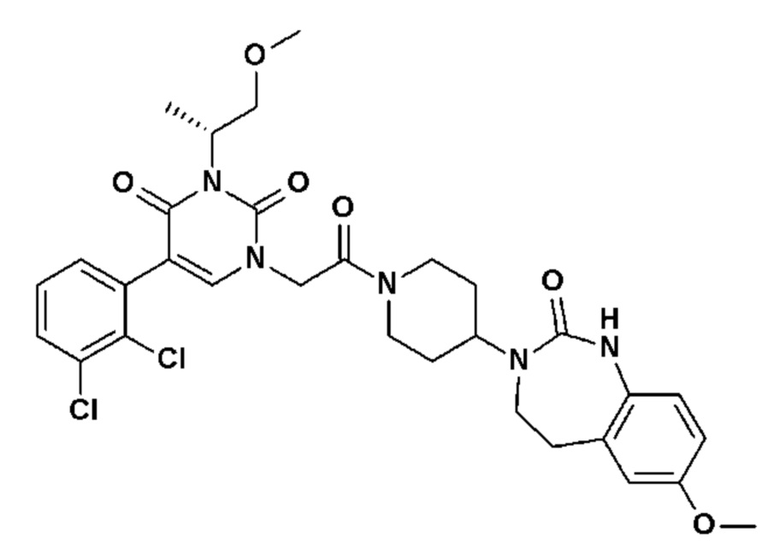
1H ЯМР (δ, ДМСО): 1,33 (д, J=7,0 Гц, 3H); 1,54 (д, J=14,1 Гц, 1H); 1,67 (д, J=21,3 Гц, 3H); 2,68 (т, J=12,4 Гц, 1H); 2,87 (м, 2H); 3,15 (д, J=13,4 Гц, 1H); 3,23 (с, 3H); 3,36 (д, J=6,2 Гц, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,67 (с, 3H); 3,90-3,95 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,74 (д, J=4,4 Гц, 2H); 5,14 (м, 1H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,33 (дд, J=7,6, 1,6 Гц, 1H); 7,42 (т, J=7,9 Гц, 1H); 7,69 (дд, J=8,0, 1,6 Гц, 1H); 7,79 (с, 1H); 8,34 (с, 1H).
Соединение 128: 5-(2,3-дифторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
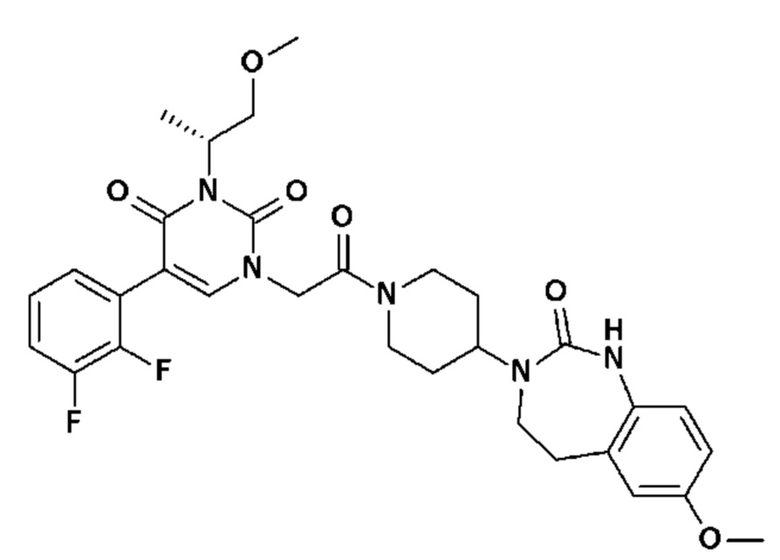
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 1,53-1,56 (м, 1H); 1,65-1,71 (м, 3H); 2,68 (т, J=12,5 Гц, 1H); 2,88 (д, J=6,5 Гц, 2H); 3,14 (т, J=10,2 Гц, 1H); 3,23 (с, 3H); 3,37 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,67 (с, 3H); 3,94 (д, J=11,6 Гц, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,77 (с, 2H); 5,17 (м, 1H); 6,63-6,68 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,19-7,29 (м, 2H); 7,46 (кв, J=8,9 Гц, 1H); 7,89 (с, 1H); 8,33 (с, 1H).
Соединение 129: 5-(2,3-диметоксифенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
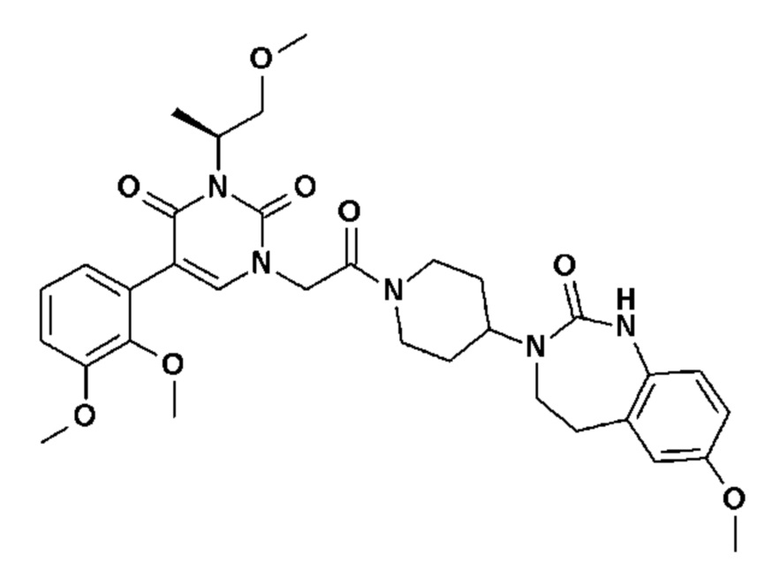
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 1,49-1,58 (м, 1H); 1,62-1,79 (м, 3H); 2,64-2,70 (м, 1H); 2,86-2,88 (м, 2H); 3,13 (т, J=12,5 Гц, 1H); 3,24 (с, 3H); 3,35-3,37 (м, 2H); 3,55 (дд, J=9,9, 5,9 Гц, 1H); 3,68 (д, J=4,4 Гц, 6H); 3,83 (с, 3H); 3,91-3,95 (м, 2H); 4,24-4,32 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,73 (д, J=3,6 Гц, 2H); 5,12-5,17 (м, 1H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,79 (т, J=4,6 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,06-7,07 (м, 2H); 7,57 (с, 1H); 8,32 (с, 1H).
Соединение 130: 5-(2-хлор-3-метоксифенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
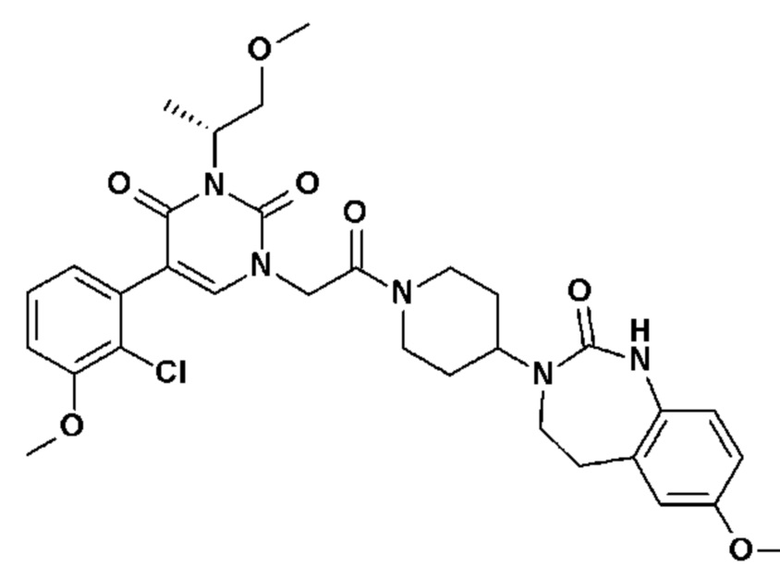
1H ЯМР (δ, ДМСО): 1,33 (д, J=6,9 Гц, 3H); 1,55 (м, 1H); 1,70 (м, 3H); 2,67 (т, J=11,9 Гц, 1H); 2,88 (д, J=6,9 Гц, 2H); 3,13 (м, 1H); 3,23 (с, 3H); 3,36 (д, J=6,6 Гц, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,67 (с, 3H); 3,89 (с, 3H); 3,93 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,73 (м, 2H); 5,14 (м, 1H); 6,62-6,68 (м, 2H); 6,91 (дд, J=7,6, 1,4 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,18 (дд, J=8,4, 1,4 Гц, 1H); 7,35 (т, J=8,0 Гц, 1H); 7,69 (с, 1H); 8,33 (с, 1H).
Соединение 131: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
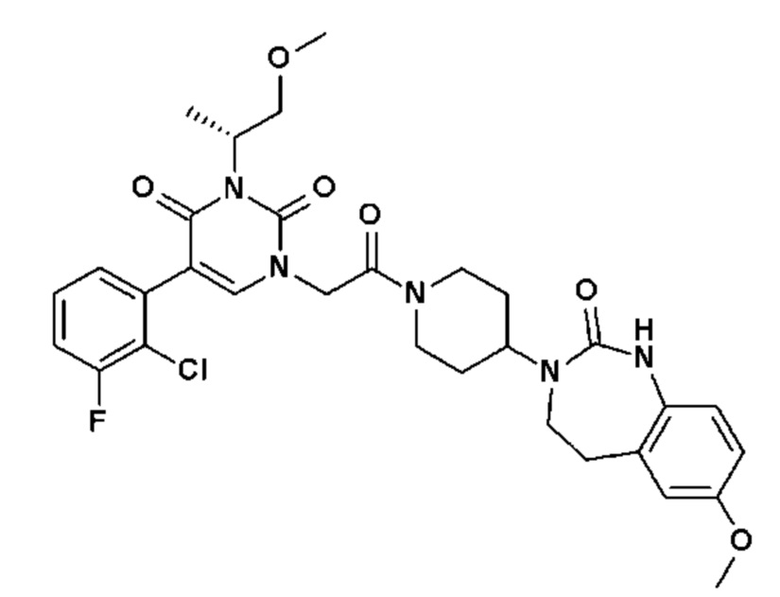
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 1,53-1,56 (м, 1H); 1,65-1,70 (м, 3H); 2,68 (т, J=12,5 Гц, 1H); 2,88 (м, 2H); 3,14 (м, 1H); 3,24 (с, 3H); 3,36 (д, J=6,5 Гц, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,67 (с, 3H); 3,92 (т, J=10,3 Гц, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,75 (с, 2H); 5,15 (м, 1H); 6,62-6,68 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,20-7,22 (м, 1H); 7,44-7,47 (м, 2H); 7,80 (с, 1H); 8,33 (с, 1H).
Соединение 132: 5-(2,3-дихлорфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
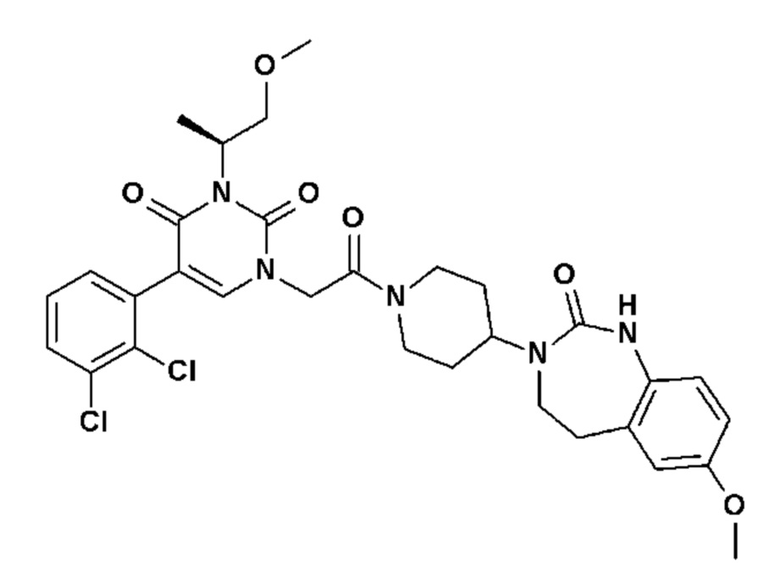
1H ЯМР (δ, ДМСО): 1,32 (д, J=6,9 Гц, 3H); 1,49-1,58 (м, 1H); 1,63-1,74 (м, 3H); 2,64-2,70 (м, 1H); 2,85-2,87 (м, 2H); 3,10-3,16 (м, 1H); 3,22 (с, 3H); 3,34-3,36 (м, 2H); 3,53 (дд, J=9,9, 5,9 Гц, 1H); 3,66 (с, 3H); 3,89-3,95 (м, 2H); 4,22-4,29 (м, 1H); 4,42 (д, J=12,8 Гц, 1H); 4,72-4,73 (м, 2H); 5,08-5,15 (м, 1H); 6,61 (д, J=2,9 Гц, 1H); 6,66 (дд, J=8,8, 2,9 Гц, 1H); 6,97 (д, J=8,8 Гц, 1H); 7,32 (дд, J=7,7, 1,6 Гц, 1H); 7,41 (т, J=7,9 Гц, 1H); 7,68 (дд, J=8,0, 1,6 Гц, 1H); 7,77 (с, 1H); 8,32 (с, 1H).
Соединение 133: 5-(2,3-диметоксифенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
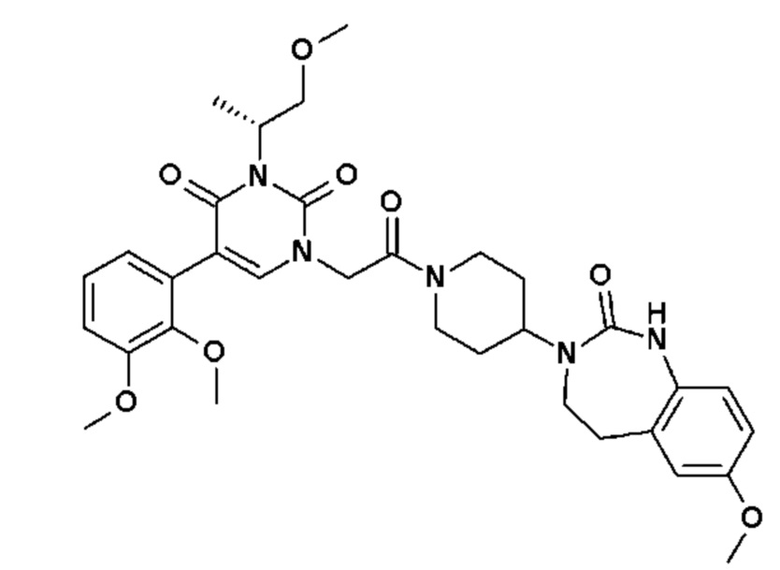
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 1,54 (д, J=13,8 Гц, 1H); 1,67 (ушир д, J=19,0 Гц, 3H); 2,68 (м, 1H); 2,87 (м, 2H); 3,13 (т, J=12,5 Гц, 1H); 3,24 (с, 3H); 3,36 (д, J=6,3 Гц, 2H); 3,55 (дд, J=9,9, 5,9 Гц, 1H); 3,68 (д, J=4,4 Гц, 6H); 3,83 (с, 3H); 3,93 (т, J=9,3 Гц, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,73 (с, 2H); 5,15 (м, 1H); 6,62-6,68 (м, 2H); 6,79 (т, J=4,6 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,07 (д, J=4,7 Гц, 2H); 7,57 (с, 1H); 8,33 (с, 1H).
Соединение 134: 5-(3-бром-2-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
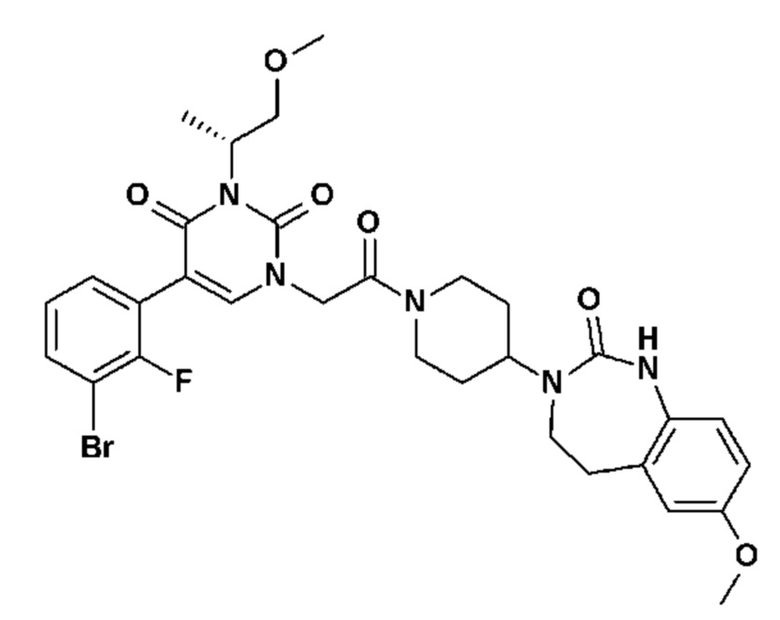
1H ЯМР (δ, ДМСО): 1,21-1,46 (м, 3H), 1,48-1,81 (м, 4H), 2,63-2,74 (м, 1H), 2,83-2,95 (м, 2H), 3,14 (т, J=11,8 Гц, 1H), 3,23 (с, 3H), 3,34-3,47 (м, 2H), 3,54 (дд, J=9,9, 5,9 Гц, 1H), 3,67 (с, 3H), 3,85-3,99 (м, 2H), 4,20-4,34 (м, 1H), 4,43 (д, J=12,9, 1H), 4,76 (с, 2H), 5,07-5,27 (м, 1H), 6,53-6,77 (м, 2H), 6,98 (д, J=8,8 Гц, 1H), 7,22 (тд, J=7,8, 0,8 Гц, 1H), 7,40 (dдд, J=8,2, 6,7, 1,7 Гц, 1H), 7,72 (dдд, J=8,2, 6,7, 1,7 Гц, 1H), 7,87 (с, 1H), 8,32 (с, 1H).
Пример 135: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 135)
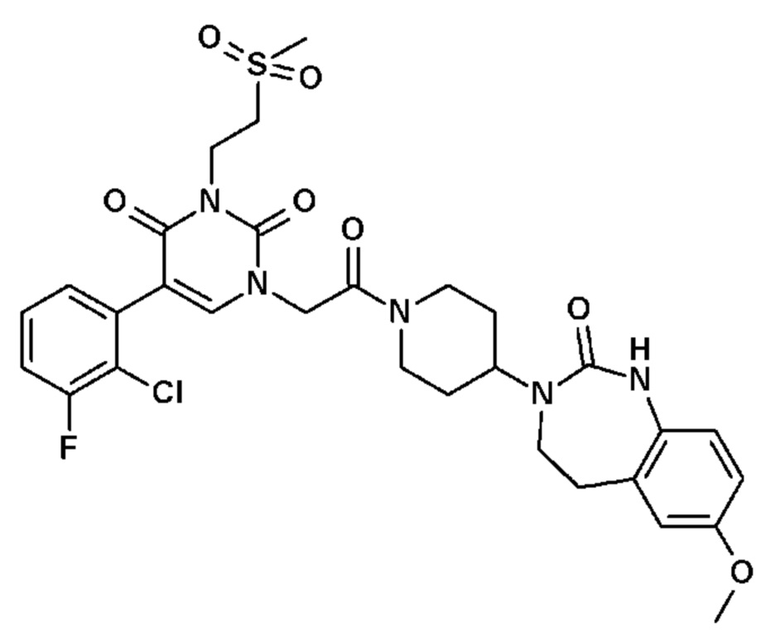
135.1: [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 115.8, используя 300 мг (0,9 ммоль) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 112.1) и 171 мг (1,0 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 320 мг (96%) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества коричневого цвета.
135.2: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метилсульфанил-этил)-1H-пиримидин-2,4-дион
Аналогично примеру 115.10, используя 284 мг (1,0 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6) и 320 мг (0,9 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3, получали 325 мг (60%) 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метилсульфанил-этил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
135.3: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 135)
Смесь, содержащую 71 мг (0,06 ммоль) аммония молибдата тетрагидрата в 311 мг (9,2 ммоль) перекиси водорода добавляли к раствору, содержащему 240 мг (0,4 ммоль) 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метилсульфанил-этил)-1H-пиримидин-2,4-диона в 4,8 мл этанола. После перемешивания при комнатной температуре в течение 46 часов, добавляли 5 мл дихлорметана и реакционную смесь перемешивали при комнатной температуре в течение еще 48 часов. Затем эту смесь гидролизовали насыщенным водным раствором гидрокарбоната натрия и продукт экстрагировали дихлорметаном. Органическую фазу промывали дважды 10% водным раствором тиосульфата натрия и один раз водой, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт подвергали хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 97/3, полученное твердое вещество белого цвета обрабатывали в 2 мл этилацетата и медленно перемешивали при комнатной температуре в течение 16 часов. Полученную суспензию фильтровали и полоскали один раз 2 мл диэтилового эфира, затем сушили в вакууме. Получали 150 мг (59%) 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 212°C.
1H ЯМР (δ, ДМСО): 1,45-1,61 (м, 1H), 1,70 (м, 3H), 2,68 (м, 1H), 2,80-2,93 (м, 2H), 3,08 (с, 3H), 3,14 (м, 1H), 3,36 (м, 2H), 3,41 (т, J=7,3 Гц, 2H), 3,67 (с, 3H), 3,95 (д, J=13,8 Гц, 1H), 4,31 (м, 3H), 4,42 (д, J=12,9 Гц, 1H), 4,80 (м, 2H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,7, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,15-7,28 (м, 1H), 7,37-7,54 (м, 2H), 7,88 (с, 1H), 8,35 (с, 1H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 136: 5-(2,3-дифторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,51-1,70 (м, 4H); 2,68 (т, J=12,4 Гц, 1H); 2,88 (м, 2H); 3,09 (с, 3H); 3,15 (т, J=12,5 Гц, 1H); 3,36-3,44 (м, 4H); 3,67 (с, 3H); 3,96 (д, J=13,5 Гц, 1H); 4,31 (м, 3H); 4,42 (д, J=12,7 Гц, 1H); 4,81 (с, 2H); 6,63-6,69 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,22-7,31 (м, 2H); 7,44-7,51 (м, 1H); 7,97 (с, 1H); 8,35 (с, 1H).
Соединение 137: 5-(2,3-дихлорфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-(2-метилсульфонилэтил)пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,52-1,70 (м, 4H); 2,68 (т, J=12,2 Гц, 1H); 2,88 (м, 2H); 3,08 (с, 3H); 3,15 (м, 1H); 3,36 (м, 2H); 3,41 (т, J=7,2 Гц, 2H); 3,67 (с, 3H); 3,95 (д, J=13,4 Гц, 1H); 4,29-4,33 (м, 3H); 4,43 (д, J=12,7 Гц, 1H); 4,79 (с, 2H); 6,62-6,68 (м, 2H); 6,98 (д, J=8,8 Гц, 1H); 7,33 (дд, J=7,7, 1,6 Гц, 1H); 7,44 (т, J=7,9 Гц, 1H); 7,70 (дд, J=8,1, 1,6 Гц, 1H); 7,87 (с, 1H); 8,33 (с, 1H).
Соединение 138: 5-(2,3-диметилфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,56 (м, 1H), 1,70 (м, 3H), 2,07 (с, 3H), 2,28 (с, 3H), 2,71 (м, 1H), 2,87 (м, 2H), 3,08 (с, 3H), 3,14 (м, 1H), 3,34-3,38 (м, 2H), 3,41 (т, J=7,1 Гц, 2H), 3,67 (с, 3H), 3,95 (д, J=13,7 Гц, 1H), 4,29 (м, 3H), 4,43 (д, J=13,0 Гц, 1H), 4,77 (м, 2H), 6,62 (д, J=2,9 Гц, 1H), 6,67 (дд, J=8,7, 2,9 Гц, 1H), 6,97 (м, 2H), 7,11 (т, J=7,5 Гц, 1H), 7,19 (д, J=7,4 Гц, 1H), 7,63 (с, 1H), 8,32 (с, 1H).
Соединение 139: 5-(2,3-диметоксифенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
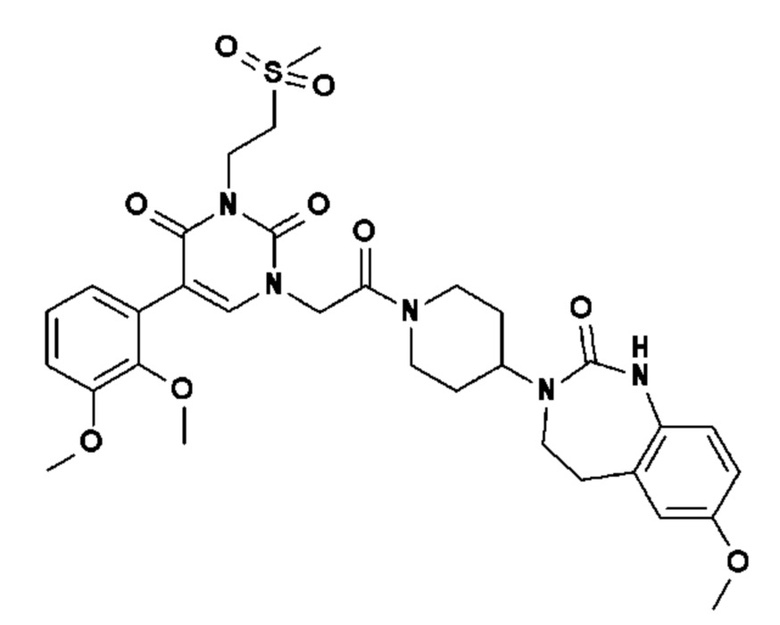
1H ЯМР (δ, ДМСО): 1,50-1,80 (м, 4H); 2,68 (м, 1H); 2,88 (м, 2H); 3,08 (с, 3H); 3,14 (т, J=13,0 Гц, 1H); 3,36 (м, 2H); 3,41 (т, J=7,2 Гц, 2H); 3,68 (д, J=3,5 Гц, 6H); 3,84 (с, 3H); 3,95 (д, J=13,4 Гц, 1H); 4,29-4,33 (м, 3H); 4,43 (д, J=12,7 Гц, 1H); 4,78 (с, 2H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,81 (дд, J=5,3, 3,9 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,08-7,09 (м, 2H); 7,67 (с, 1H); 8,32 (с, 1H).
Соединение 140: 5-(2-хлор-3-метоксифенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
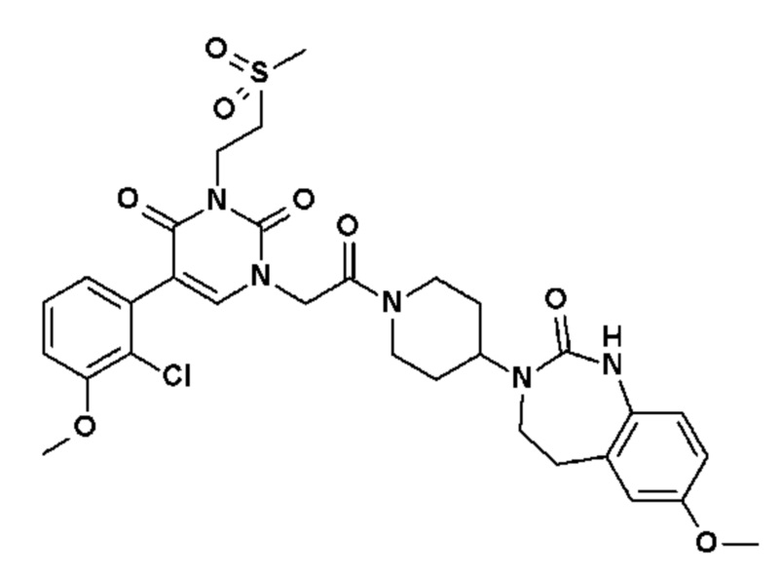
1H ЯМР (δ, ДМСО): 1,55 (1 H, м), 1,68 (3 H, м), 2,68 (1 H, т, J=12,29 Гц), 2,88 (2 H, м), 3,08 (3 H, с), 3,15 (1 H, т, J=12Hz), 3,42-3,33 (4 H, м), 3,67 (3 H, с), 3,90 (3 H, с), 3,95 (1 H, д, J=14,37 Гц), 4,30 (3 H, т, J=7,38 Гц), 4,43 (1 H, д, J=12,88 Гц), 4,78 (2 H, с), 6,68-6,62 (2 H, м), 6,93-6,91 (1 H, м), 6,98 (1 H, д, J=8,78 Гц), 7,20 (1 H, д, J=8,34 Гц), 7,36 (1 H, т, J=7,98 Гц), 7,77 (1 H, с), 8,33 (1 H, с).
Пример 141: 3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-метил-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 141)
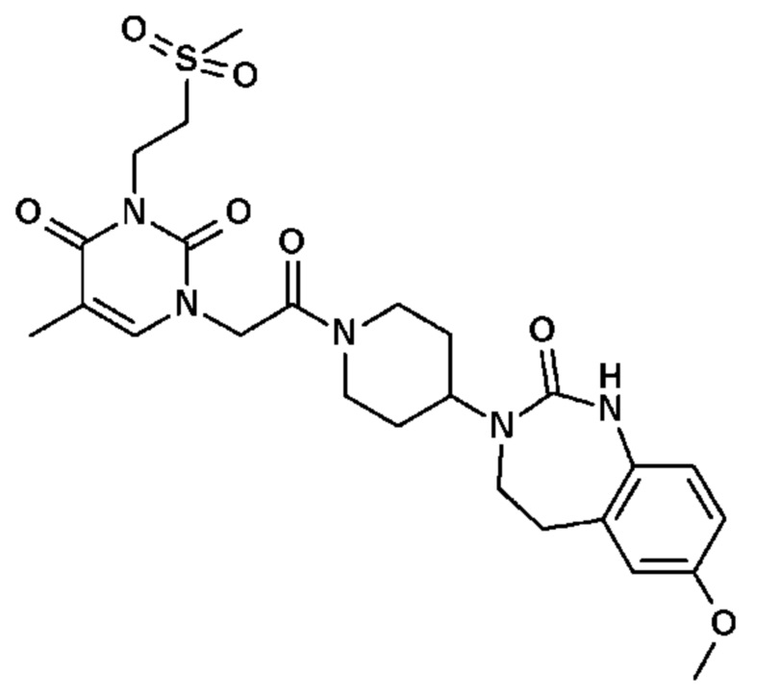
141.1: [5-бром-3-(2-метансульфонил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 135.3, используя 2,4 г (7,1 ммоль) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 112.1), получали 2,2 г (82%) [5-бром-3-(2-метансульфонил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
141.2: [3-(2-метансульфонил-этил)-5-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
В 5 мл диоксана растворяли 500 мг (1,4 ммоль) [5-бром-3-(2-метансульфонил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 562 мг (4,1 ммоль) карбоната калия и 0,2 мл (1,4 ммоль) триметилбороксина. Смесь дегазировали азотом в течение 5 минут, затем 111 мг (0,1 ммоль) комплекса дихлорметана и 1,1ʹ-бис(дифенилфосфино)ферроцен-дихлорпалладия(II) добавляли. Реакционную смесь нагревали при 100°C в течение 1 часа. Смесь выливали в воду и затем дважды экстрагировали этилацетатом. Органическую фазу сушили над безводным сульфатом натрия, затем фильтровали и концентрировали досуха. После очистки с помощью хроматографии на силикагеле, элюируя смесью метанола в дихлорметане, в соответствии с градиентом полярности (0% - 10% метанола в дихлорметане), получали 170 мг (41%) [3-(2-метансульфонил-этил)-5-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде масла коричневого цвета.
141.3: [3-(2-метансульфонил-этил)-5-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 115.9, используя 170 мг (0,6 ммоль) [3-(2-метансульфонил-этил)-5-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 130 мг (80%) [3-(2-метансульфонил-этил)-5-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла коричневого цвета.
141.4: 3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-метил-1H-пиримидин-2,4-дион (соединение 141)
Аналогично примеру 115.10, используя 136 мг (0,5 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6) и 130 мг (0,5 ммоль) [3-(2-метансульфонил-этил)-5-метил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, и после очистки с помощью хроматографии на силикагеле, элюируя смесью ацетонитрил/вода 24/76, получали 11 мг (4%) 3-(2-метансульфонил-этил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-метил-1H-пиримидин-2,4-диона в виде масла коричневого цвета.
1H ЯМР (δ, хлороформ): 1,87 (м, 4H), 1,97 (с, 3H), 2,73 (т, J=12,6 Гц, 1H), 3,00 (м, 2H), 3,06 (с, 3H), 3,27 (т, J=12,8 Гц, 1H), 3,40 (т, J=6,9 Гц, 2H), 3,48 (д, J=8,9 Гц, 2H), 3,78 (с, 3H), 3,93 (д, J=13,4 Гц, 1H), 4,35 (д, J=15,8 Гц, 1H), 4,46 (т, J=7 Гц, 3H), 4,71 (д, J=13,4 Гц, 1H), 4,81 (д, J=15,9 Гц, 1H), 6,63 (т, J=1,5 Гц, 1H), 6,66-6,77 (м, 3H), 7,02 (д, J=1,8 Гц, 1H).
Пример 142: 5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 142)
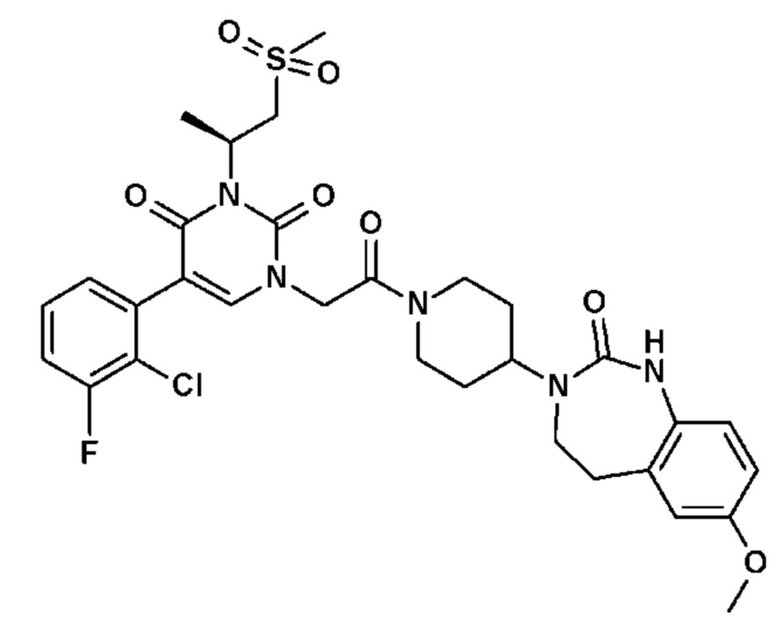
142.1: (R)-1-метилсульфанил-пропан-2-ол
К раствору, содержащему 7,2 г (103,3 ммоль) метантиолата натрия в 32 мл ацетонитрила, добавляли по каплям 4,8 мл (69 ммоль) (R)-(+)-пропилен-1,2 оксида. Смесь перемешивали в герметично закрытом сосуде в течение 4 часов при 80°C, затем разбавляли водой и дихлорметаном. Водную фазу экстрагировали три раза дихлорметаном, органическую фазу промывали водой и потом насыщенным солевым раствором. После сушки над сульфатом магния, раствор фильтровали и затем концентрировали в вакууме. Получали 3,5 г (48%) (R)-1-метилсульфанил-пропан-2-ола в виде масла янтарного цвета.
142.2: [5-бром-3-((S)-1-метил-2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 121,1, используя 3,7 г (14,1 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 1,5 г (14,1 ммоль) (R)-1-метилсульфанил-пропан-2-ола, получали 1,6 г (32%) [5-бром-3-((S)-1-метил-2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде вязкого масла.
142.3: [5-(2-хлор-3-фторфенил)-3-((S)-1-метил-2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя 1,6 г (4,6 ммоль) [5-бром-3-((S)-1-метил-2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и 1,6 г (9,1 ммоль) 2-хлор-3-фторфенилбороновой кислоты, получали 1,7 г (93%) [5-(2-хлор-3-фторфенил)-3-((S)-1-метил-2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат в виде твердого вещества коричневого цвета.
142.4: [5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К смеси, содержащей 262 мг (0,2 ммоль) аммония молибдата тетрагидрата в 4,3 мл (42,4 ммоль) 30% водного раствора перекиси водорода, при 0°C добавляли 1,7 г (4,2 ммоль) 5-(2-хлор-3-фторфенил)-3-((S)-1-метил-2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата. После перемешивания в течение 2 часов при комнатной температуре смесь гидролизовали 30 мл воды и затем экстрагировали этилацетатом. Органическую фазу промывали водным раствором сульфата натрия, водой и затем насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в вакууме. Получали 1,8 г (96%) [5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества.
142.5: 5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К 20 мл тетрагидрофурана и 2,8 мл (5,5 ммоль) 1н водного раствора гидроксида натрия добавляли 1,8 г (4,2 ммоль) [5-(2-хлор-3-фторфенил)-3-((R)-2-метансульфонил-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата. Через 2 часа смесь разбавляли этилацетатом и водой, pH водной фазы доводили до значения, равного 3, с помощью 1н водного раствора соляной кислоты. Затем эту фазу экстрагировали три раза этилацетатом, органическую фазу промывали водой и далее насыщенным солевым раствором. После сушки над безводным сульфатом магния, раствор фильтровали и затем концентрировали в вакууме. Получали 1,4 г (80%) 5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла.
142.6: 5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 142)
Аналогично примеру 115.10, используя 1,4 г (3,3 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 1 г (3,7 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6), получали 720 мг (31%) 5-(2-хлор-3-фторфенил)-3-((S)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,23 (д, J=6,9 Гц, 3H), 1,44-1,83 (м, 4H), 2,67 (дд, J=3,5, 1,8 Гц, 1H), 2,87 (д, J=7,6 Гц, 2H), 3,05 (с, 3H), 3,09-3,21 (м, 1H), 3,32-3,40 (м, 2H), 3,52 (ушир с, 1H), 3,66 (с, 3H), 3,93 (д, J=13,2 Гц, 1H), 4,12-4,35 (м, 3H), 4,42 (д, J=13,1 Гц, 1H), 4,79 (с, 2H), 6,54-6,73 (м, 2H), 6,97 (д, J=8,8 Гц, 1H), 7,15-7,26 (м, 1H), 7,41-7,51 (м, 2H), 7,89 (с, 1H), 8,31 (с, 1H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой с использованием соответствующих коммерчески доступных или предварительно полученных реагентов:
Соединение 143: 5-(2-хлор-3-фторфенил)-3-((R)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
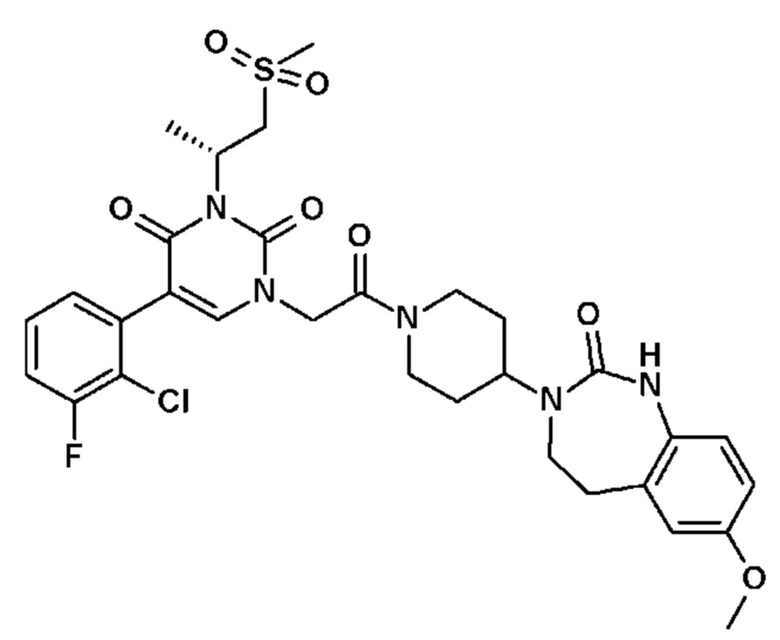
1H ЯМР (δ, ДМСО): 1,24 (д, J=7,0 Гц, 3 H); 1,55 (м, 1 H); 1,80-1,60 (м, 3 H); 2,68 (т, J=12,5 Гц, 1 H); 2,88 (м, 2 H); 3,06 (с, 3 H); 3,15 (т, J=12,5 Гц, 1 H); 3,40-3,32 (м, 2 H); 3,53 (м, 1 H); 3,67 (с, 3 H); 3,94 (д, J=13,5 Гц, 1 H); 4,28-4,22 (м, 3 H); 4,43 (д, J=12,8 Гц, 1 H); 4,80 (с, 2 H); 6,68-6,62 (м, 2 H); 6,98 (д, J=8,8 Гц, 1 H); 7,23 (дд, J=6,3, 2,8 Гц, 1 H); 7,48-7,45 (м, 2 H); 7,90 (с, 1 H); 8,32 (с, 1 H).
Соединение 144: 5-(2,3-дихлорфенил)-3-((S)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
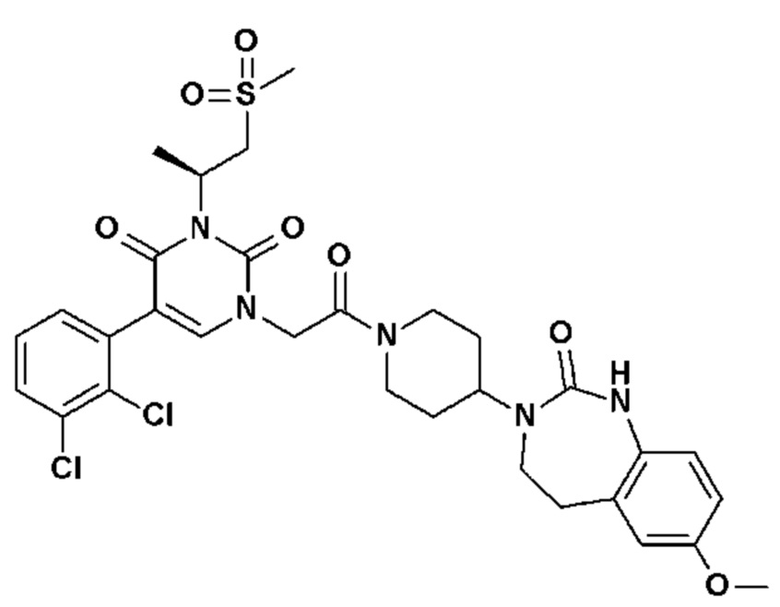
1H ЯМР (δ, ДМСО): 1,24 (д, J=7,02 Гц, 3H), 1,42-1,83 (м, 4H), 2,62-2,77 (м, 1H), 2,83-2,96 (м, 2H), 3,06 (с, 3H), 3,10-3,23 (м, 1H), 3,33-3,39 (м, 2H), 3,52 (дт, J=7,17, 11,03 Гц, 1H), 3,67 (с, 3H), 3,94 (д, J=13,53 Гц, 1H), 4,13-4,38 (м, 3H), 4,43 (д, J=12,91 Гц, 1H), 4,79 (с, 2H), 6,62 (д, J=2,91 Гц, 1H), 6,67 (дд, J=2,97, 8,78 Гц, 1H), 6,98 (д, J=8,78 Гц, 1H), 7,35 (дд, J=1,59, 7,68 Гц, 1H), 7,44 (т, J=7,85 Гц, 1H), 7,71 (дд, J=1,61, 8,03 Гц, 1H), 7,89 (с, 1H), 8,33 (с, 1H).
Соединение 145: 5-(2,3-дихлорфенил)-3-((R)-2-метансульфонил-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
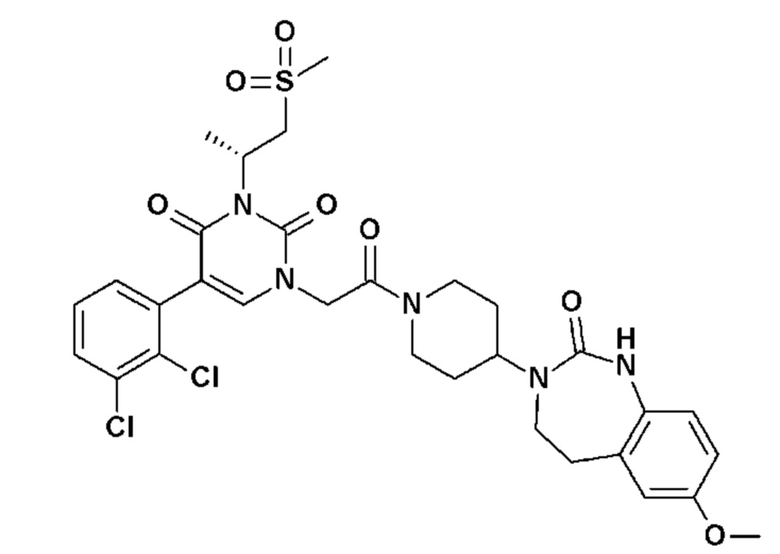
1H ЯМР (δ, ДМСО): 1,23 (д, J=7,02 Гц, 3H), 1,40-1,81 (м, 4H), 2,61-2,75 (м, 1H), 2,77-2,96 (м, 2H), 3,05 (с, 3H), 3,09-3,28 (м, 1H), 3,32-3,41 (м, 2H), 3,45-3,61 (м, 1H), 3,67 (с, 3H), 3,94 (д, J=13,4 Гц, 1H), 4,12-4,35 (м, 3H), 4,42 (д, J=12,9 Гц, 1H), 4,79 (ушир с, 2H), 6,42-6,78 (м, 2H), 6,97 (д, J=8,8 Гц, 1H), 7,34 (дд, J=1,6, 7,6 Гц, 1H), 7,44 (т, J=7,9 Гц, 1H), 7,70 (дд, J=1,57, 8,1 Гц, 1H), 7,88 (с, 1H), 8,32 (с, 1H).
Пример 146: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 146)
146.1: (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетат
К предварительно охлажденному до 0°C раствору 6,5 г (24,7 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) в 130 мл N,N-диметилформамида частями добавляли 1,2 г (29,7 ммоль) гидрида натрия. Реакционную смесь перемешивали в течение 5 минут и потом добавляли 6,3 мл (66,7 ммоль) 2-бромпропана. Реакционную смесь нагревали при 50°C в течение 6 часов и затем перемешивали при комнатной температуре в течение ночи. Смесь гидролизовали и далее разбавляли этилацетатом. Продукт экстрагировали этилацетатом, органическую фазу промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. После очистки с помощью хроматографии на силикагеле, элюируя смесью гептан/этилацетат 50/50, получали 3,5 г (46%) (5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества кремового цвета.
146.2: [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя 3,4 г (19,7 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 3,0 г (9,8 ммоль) 5-бром-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата, получали 1,4 г (34%) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества бежевого цвета.
146.3: [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 142.5, используя 500 мг (1,4 ммоль) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 470 мг (98%) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла.
146.4: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 146)
Аналогично примеру 115.10, используя 427 мг (1,6 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6) и 480 мг (1,4 ммоль) [5-(2-хлор-3-фторфенил)-3-изопропил-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, получали 684 мг (81%) 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 230°C.
1H ЯМР (δ, ДМСО): 1,39 (д, J=6,9 Гц, 6 H); 1,51-1,69 (м, 4 H); 2,66 (м, 1 H); 2,85 (д, J=6,7 Гц, 2 H); 3,12 (т, J=11,9 Гц, 1 H); 3,36-3,33 (м, 2 H); 3,66 (с, 3 H); 3,89-3,93 (м, 1 H); 4,24-4,30 (м, 1 H); 4,41 (д, J=12,8 Гц, 1 H); 4,72 (д, J=6,4 Гц, 2 H); 5,05-5,12 (м, 1 H); 6,60 (д, J=2,9 Гц, 1 H); 6,63-6,66 (м, 1 H); 6,96 (д, J=8,8 Гц, 1 H); 7,20 (д, J=2,6 Гц, 1 H); 7,41-7,45 (м, 2 H); 7,76 (с, 1 H); 8,33 (с, 1 H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 147: 5-(2,3-диметоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
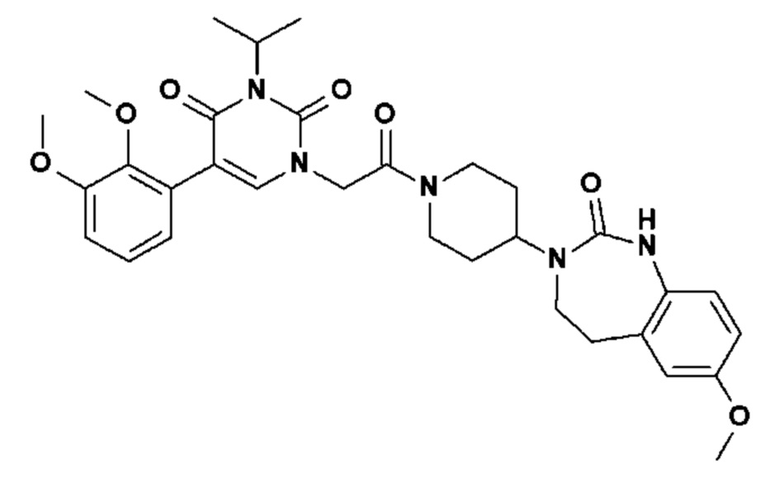
1H ЯМР (δ, ДМСО): 1,39 (6 H, д, J=6,9 Гц); 1,56-1,47 (1 H, м); 1,74-1,62 (3 H, м); 2,65 (1 H, ушир т, J=12,4 Гц); 2,86-2,84 (2 H, м); 3,11 (1 H, ушир т, J=12,6 Гц); 3,35-3,32 (2 H, м); 3,65 (3 H, с); 3,67 (3 H, с); 3,81 (3 H, с); 3,91 (1 H, Ушир д, J=13,4 Гц); 4,26 (1 H, тт, J=11,6, 4,2 Гц); 4,41 (1 H, д, J=12,9 Гц); 4,70-4,69 (2 H, м); 5,13-5,06 (1 H, м); 6,60 (1 H, д, J=2,9 Гц); 6,65 (1 H, дд, J=8,8, 2,9 Гц); 6,77 (1 H, т, J=4,6 Гц); 6,96 (1 H, д, J=8,8 Гц); 7,05 (2 H, д, J=4,7 Гц); 7,54 (1 H, с); 8,30 (1 H, с).
Соединение 148: 5-(2-хлор-3-метоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
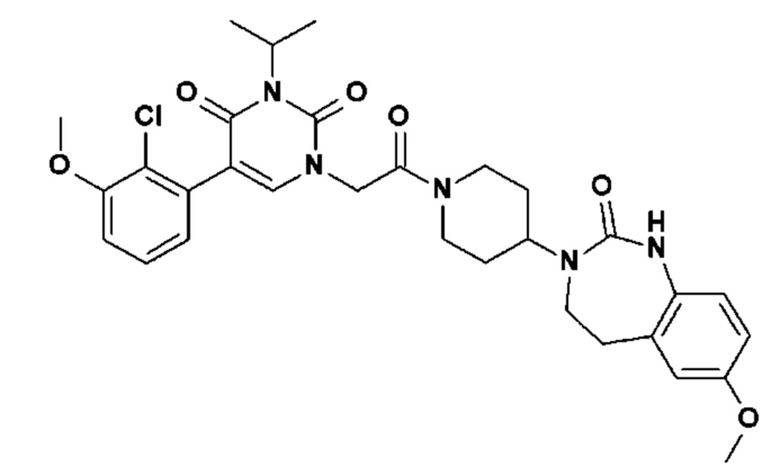
1H ЯМР (δ, ДМСО): 1,38 (6 H, д, J=6,89 Гц); 1,55-1,68 (4 H, м); 2,69-2,63 (1 H, м); 2,85 (2 H, с); 3,12 (1 H, ушир т, J=12,3 Гц); 3,35-3,33 (2 H, м); 3,65 (3 H, с); 3,87 (3 H, с); 3,92 (1 H, м); 4,30-4,22 (1 H, м); 4,41 (1 H, д, J=12,9 Гц); 4,76-4,66 (2 H, м); 5,11-5,04 (1 H, м); 6,66-6,60 (2 H, м); 6,89 (1 H, дд, J=7,6,1,4 Гц); 6,96 (1 H, д, J=8,8 Гц); 7,16 (1 H, дд, J=8,4, 1,4 Гц); 7,32 (1 H, т, J=8,0 Гц); 7,65 (1 H, с); 8,30 (1 H, с).
Соединение 149: 5-(2-фтор-3-метоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
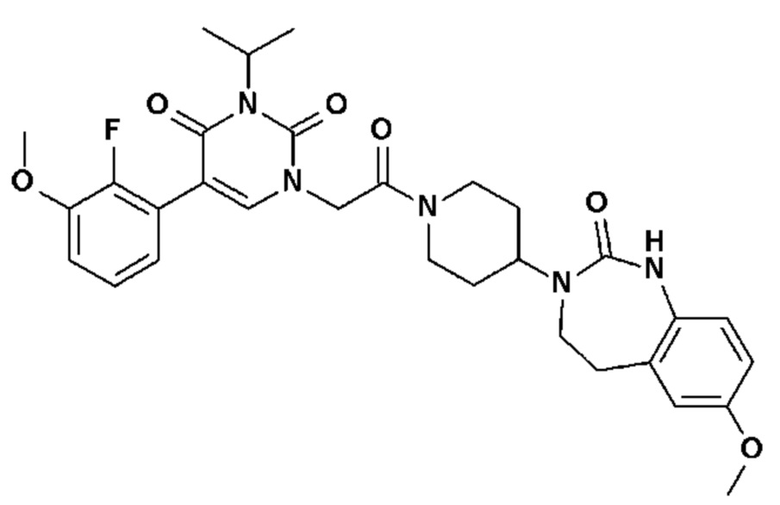
1H ЯМР (δ, ДМСО): 1,38 (6 H, д, J=6,89 Гц); 1,57-1,48 (1 H, м); 1,69-1,63 (3 H, м); 2,65 (1 H, ушир т, J=12,5 Гц); 2,87-2,85 (2 H, м); 3,12 (1 H, ушир т, J=12,4 Гц); 3,36-3,34 (2 H, м); 3,65 (3 H, с); 3,85 (3 H, с); 3,91 (1 H, Ушир д, J=13,6 Гц); 4,26 (1 H, тт, J=11,5, 4,3 Гц); 4,41 (1 H, д, J=12,9 Гц); 4,72 (2 H, д, J=3,0 Гц); 5,13-5,06 (1 H, м); 6,61 (1 H, д, J=2,9 Гц); 6,65 (1 H, дд, J=8,8, 3,0 Гц); 6,89-6,84 (1 H, м); 6,96 (1 H, д, J=8,8 Гц); 7,18-7,11 (2 H, м); 7,74 (1 H, с); 8,30 (1 H, с).
Соединение 150: 3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-(2-трифторметоксифенил)-1H-пиримидин-2,4-дион
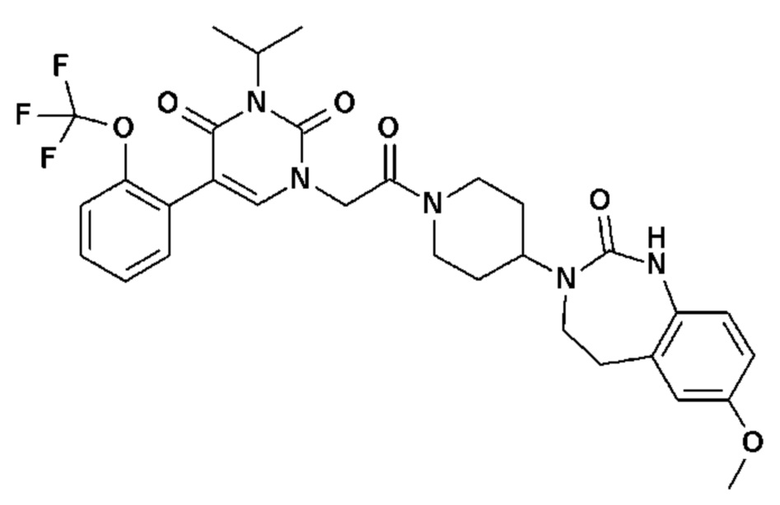
1H ЯМР (δ, ДМСО): 1,38 (д, J=6,9 Гц, 6H); 1,50-1,73 (м, 4H); 2,65 (т, J=12,5 Гц, 1H); 2,86 (ушир с, 2H); 3,12 (т, J=12,2 Гц, 1H); 3,33-3,35 (м, 2H); 3,65 (с, 3H); 3,92 (д, J=13,6 Гц, 1H); 4,24-4,27 (м, 1H); 4,41 (д, J=12,9 Гц, 1H); 4,72 (д, J=2,6 Гц, 2H); 5,04-5,11 (м, 1H); 6,60-6,66 (м, 2H); 6,96 (д, J=8,8 Гц, 1H); 7,38-7,48 (м, 4H); 7,73 (с, 1H); 8,31 (с, 1H).
Соединение 151: 3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-(3-трифторметоксифенил)-1H-пиримидин-2,4-дион
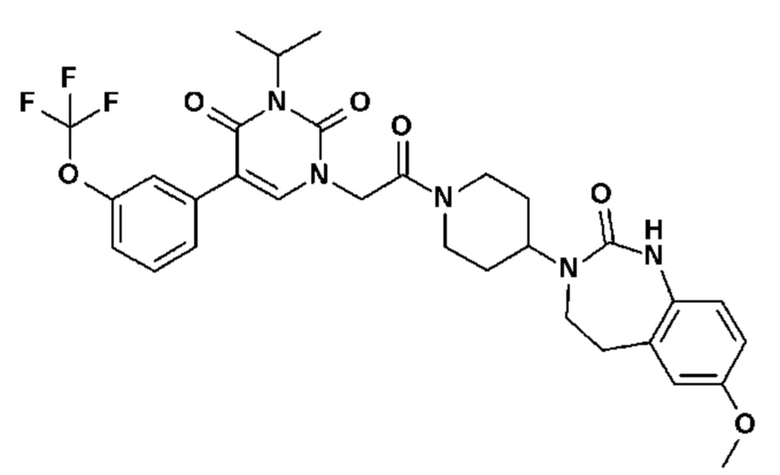
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,9 Гц, 6H); 1,50-1,68 (м, 4H); 2,63-2,69 (м, 1H); 2,87 (ушир с, 2H); 3,10-3,17 (м, 1H); 3,35-3,37 (м, 2H); 3,65 (с, 3H); 3,94 (д, J=13,5 Гц, 1H); 4,23-4,31 (м, 1H); 4,41 (д, J=12,9 Гц, 1H); 4,76 (ушир с, 2H); 5,10-5,17 (м, 1H); 6,61-6,67 (м, 2H); 6,96 (д, J=8,8 Гц, 1H); 7,31 (д, J=8,0 Гц, 1H); 7,51-7,59 (м, 3H); 7,99 (с, 1H); 8,32 (с, 1H).
Соединение 152: 3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-5-(3-метокси-2-трифторметоксифенил)-1H-пиримидин-2,4-дион
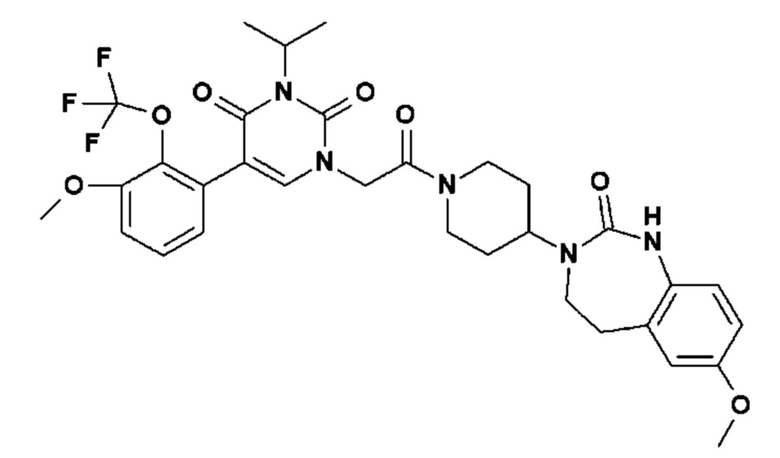
1H ЯМР (δ, ДМСО): 1,37 (д, J=6,9 Гц, 6 H); 1,49-1,72 (м, 4 H); 2,62-2,68 (м, 1 H); 2,85-2,87 (м, 2 H); 3,06-3,14 (м, 1 H); 3,33-3,35 (м, 2 H); 3,65 (с, 3 H); 3,86 (с, 3 H); 3,92 (д, J=13,3 Гц, 1 H); 4,24 (д, J=11,7 Гц, 1 H); 4,41 (д, J=13,0 Гц, 1 H); 4,71 (д, J=3,3 Гц, 2 H); 5,04-5,11 (м, 1 H); 6,60-6,66 (м, 2 H); 6,89-6,96 (м, 2 H); 7,24 (дд, J=8,4, 1,5 Гц, 1 H); 7,37 (т, J=8,0 Гц, 1 H); 7,71 (с, 1 H); 8,31 (с, 1 H).
Соединение 153: 5-(2,3-дифторфенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
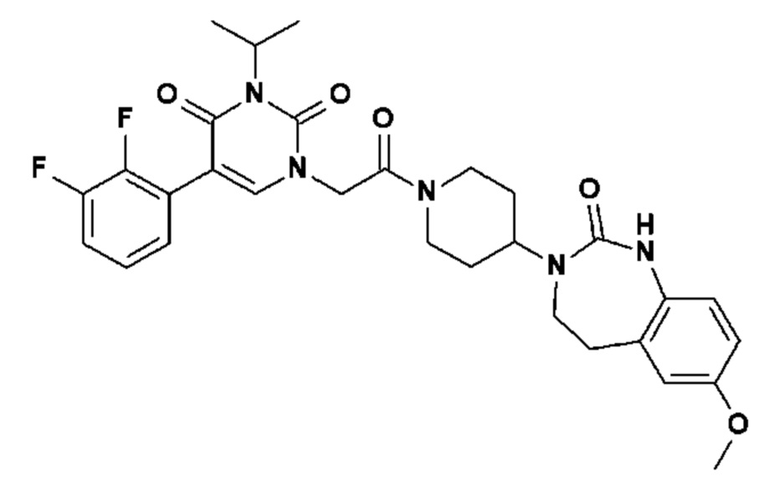
1H ЯМР (δ, ДМСО): 1,39 (д, J=6,9 Гц, 6 H); 1,50-1,73 (м, 4 H); 2,66 (т, J=12,4 Гц, 1 H); 2,86 (ушир с, 2 H); 3,13 (т, J=12,1 Гц, 1 H); 3,34-3,36 (м, 2 H); 3,65 (с, 3 H); 3,92 (д, J=13,5 Гц, 1 H); 4,21-4,27 (м, 1 H); 4,41 (д, J=12,9 Гц, 1 H); 4,74 (с, 2 H); 5,06-5,13 (м, 1 H); 6,61-6,67 (м, 2 H); 6,96 (д, J=8,8 Гц, 1 H); 7,17-7,27 (м, 2 H); 7,40-7,48 (м, 1 H); 7,85 (с, 1 H); 8,31 (с, 1 H).
Соединение 154: 5-(2-хлор-3-этоксифенил)-3-изопропил-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
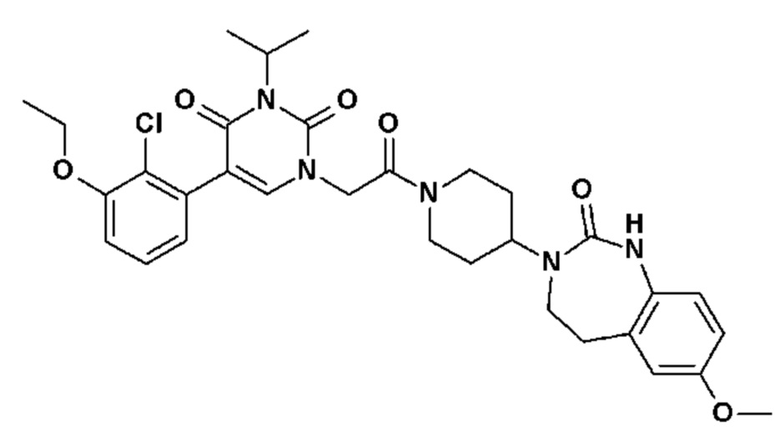
1H ЯМР (δ, ДМСО): 1,36-1,41 (м, 9H); 1,53-1,68 (м, 4H); 2,67-2,68 (м, 1H); 2,87 (м, 2H); 3,14 (м, 1H); 3,37 (м, 2H); 3,67 (с, 3H); 3,93 (д, J=13,4 Гц, 1H); 4,15 (кв, J=7,0 Гц, 2H); 4,28 (м, 1H); 4,43 (д, J=12,7 Гц, 1H); 4,71-4,73 (м, 2H); 5,08-5,11 (м, 1H); 6,62-6,68 (м, 2H); 6,89 (дд, J=7,6, 1,4 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,16 (дд, J=8,4, 1,4 Гц, 1H); 7,31 (т, J=8,0 Гц, 1H); 7,66 (с, 1H); 8,33 (с, 1H).
Пример 155: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метилсульфанил-этил)-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 155)
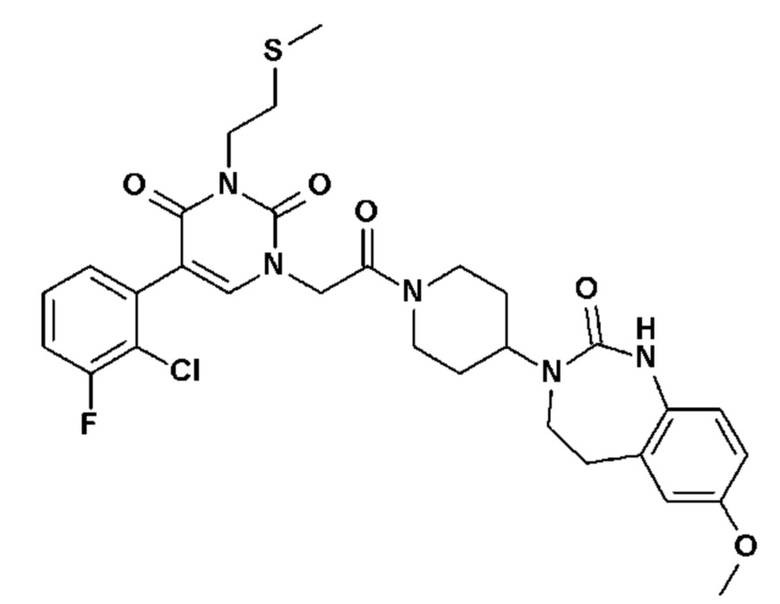
Аналогично примеру 115.10, используя 284 мг (1 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6) и 320 мг (0,9 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты (полученный способом, описанным в примере 125.1), получали 325 мг (60%) 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метилсульфанил-этил)-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 230°C.
1H ЯМР (δ, ДМСО): 1,50-1,80 (м, 4H); 2,12 (с, 3H); 2,65-2,71 (м, 3H); 2,88 (м, 2H); 3,15 (т, J=12,1 Гц, 1H); 3,35-3,37 (м, 2H); 3,67 (с, 3H); 3,94 (д, J=13,6 Гц, 1H); 4,08 (т, J=7,2 Гц, 2H); 4,22-4,32 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,79 (с, 2H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,21-7,23 (м, 1H); 7,40-7,50 (м, 2H); 7,85 (с, 1H); 8,33 (с, 1H).
Пример 156: 5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 156)
156.1: [5-бром-3-(3-метилсульфанил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 121.1, используя 3 г (11,4 ммоль) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата (полученный способом, описанным в примере 13.1) и 1,4 мл (13,7 ммоль) 3-метилтиопропанола, получали 3,5 г (87%) [5-бром-3-(3-метилсульфанил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
156.2: [5-(2-хлор-3-фторфенил)-3-(3-метилсульфанил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя 695 мг (4 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 1 г (2,9 ммоль) [5-бром-3-(3-метилсульфанил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 750 мг (66%) [5-(2-хлор-3-фторфенил)-3-(3-метилсульфанил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
156.3: [5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 125.3, используя 750 мг (1,9 ммоль) [5-(2-хлор-3-фторфенил)-3-(3-метилсульфанил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 810 мг (100%) [5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде меренги бежевого цвета.
156.4: [5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
Аналогично примеру 115.9, используя 810 мг (1,9 ммоль) [5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, получали 750 мг (96%) [5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде меренги бежевого цвета.
156.5: 5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 156)
Аналогично примеру 115.10, используя 226 мг (0,9 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6) и 343 мг (0,8 ммоль) [5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, получали 400 мг (72%) 5-(2-хлор-3-фторфенил)-3-(3-метансульфонил-пропил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета с температурой плавления 189°C.
1H ЯМР (δ, ДМСО): 1,53-1,70 (м, 4H); 1,96-2,04 (м, 2H); 2,68 (т, J=12,4 Гц, 1H); 2,88 (м, 2H); 2,98 (с, 3H); 3,15-3,19 (м, 3H); 3,35-3,37 (м, 2H); 3,67 (с, 3H); 3,94 (д, J=13,7 Гц, 1H); 4,01 (т, J=7,1 Гц, 2H); 4,28 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,79 (с, 2H); 6,63 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 3,0 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,23-7,25 (м, 1H); 7,44-7,47 (м, 2H); 7,86 (с, 1H); 8,33 (с, 1H).
Пример 157: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(метилсульфонимидоил)этил]пиримидин-2,4-дион (реакционная схема № 3, соединение 157)
157.1: [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
Аналогично примеру 115.8, используя 1,9 г (11,1 ммоль) 2-хлор-3-фторфенилбороновой кислоты и 2,5 г (7,4 ммоль) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата (полученный способом, описанным в примере 112.1), получали 2,2 г (77%) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества кремового цвета.
157.2: [5-(2-хлор-3-фторфенил)-3-(2-метансульфинил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору, охлажденному до 0°C, содержащему 1,5 г (3,9 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 30 мл дихлорметана, добавляли 0,9 г (4,1 ммоль) 3-хлорпероксибензойной кислоты. Затем смесь оставляли медленно нагреваться до комнатной температуры. Добавляли по каплям 20 мл 1н водного раствора гидроксида натрия при 10°C к 20 мл воды и потом реакционную смесь декантировали. Водную фазу дважды экстрагировали дихлорметаном. Органическую фазу промывали водным раствором тиосульфата натрия, сушили над сульфатом магния, фильтровали и упаривали. Полученное масло осаждали дихлорметаном и гептаном. Твердое вещество фильтровали, промывали гептаном и сушили. Получали 1,4 г (90%) [5-(2-хлор-3-фторфенил)-3-(2-метансульфинил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
157.3: 2-[5-(2-хлор-3-фторфенил)-3-[2-(метилсульфонимидоил)этил]-2,4-диоксо-пиримидин-1-ил]метилацетат
К раствору, содержащему 1,4 г (3,5 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метансульфинил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 786 мг (7 ммоль) 2,2,2-трифторацетамида, 560 мг (13,9 ммоль) оксида магния и 184 мг (0,4 ммоль) тетраацетата диродия в 42 мл дихлорметана, добавляли 1,7 г (5,2 ммоль) иодбензолдиацетата. Смесь перемешивали при комнатной температуре в течение 4 часов, затем фильтровали и упаривали. Остаток растворяли в 42 мл метанола и потом добавляли 2,4 г (17,4 ммоль) карбоната калия. Смесь перемешивали при комнатной температуре в течение 30 минут, затем метанол упаривали и остаток растворяли в этилацетате и потом воде. Водную фазу экстрагировали дважды этилацетатом. Органическую фазу промывали водой, сушили над сульфатом магния, фильтровали и упаривали. После очистки с помощью хроматографии на силикагеле, элюируя этилацетатом и затем 10% метанолом, получали 460 мг (32%) 2-[5-(2-хлор-3-фторфенил)-3-[2-(метилсульфонимидоил)этил]-2,4-диоксо-пиримидин-1-ил]метилацетата в виде твердого вещества светло-желтого цвета.
157.4: 2-[5-(2-хлор-3-фторфенил)-3-[2-(метилсульфонимидоил)этил]-2,4-диоксо-пиримидин-1-ил]уксусная кислота
Аналогично примеру 115.9, используя 180 мг (0,4 ммоль) 2-[5-(2-хлор-3-фторфенил)-3-[2-(метилсульфонимидоил)этил]-2,4-диоксо-пиримидин-1-ил]метилацетата, получали определенное количество 2-[5-(2-хлор-3-фторфенил)-3-[2-(метилсульфонимидоил)этил]-2,4-диоксо-пиримидин-1-ил]уксусной кислоты в виде твердого вещества светло-желтого цвета.
157.5: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(метилсульфонимидоил)этил]пиримидин-2,4-дион (соединение 157)
Аналогично примеру 115.10, используя 113 мг (0,4 ммоль) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 115.6) и 150 мг (0,4 ммоль) 2-[5-(2-хлор-3-фторфенил)-3-[2-(метилсульфонимидоил)этил]-2,4-диоксо-пиримидин-1-ил]уксусной кислоты, и после очистки хроматографией на силикагеле, получали 23 мг (9%) 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(метилсульфонимидоил)этил]пиримидин-2,4-диона в виде твердого вещества светло-розового цвета с температурой плавления 197°C.
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,61-1,83 (м, 3H), 2,65 (м, 1H), 2,88 (м, 2H), 2,98 (с, 3H), 3,07-3,22 (м, 1H), 3,67 (с, 3H), 3,84 (с, 1H), 3,95 (д, J=13,7 Гц, 1H), 4,28 (м, 3H), 4,43 (д, J=13,0 Гц, 1H), 4,79 (м, 2H), 6,62 (д, J=2,9 Гц, 1H), 6,67 (дд, J=8,6, 3,0 Гц, 1H), 6,98 (д, J=8,9 Гц, 1H), 7,22 (м, 1H), 7,37-7,56 (м, 2H), 7,87 (с, 1H), 8,32 (с, 1H). 4 отсутствующих протона расположены ниже пика воды и/или ДМСО.
Пример 158: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-пропионамид (реакционная схема № 3, соединение 158)
К раствору 1 г (1,6 ммоль) 3-((S)-2-амино-1-метилэтил)-5-(2-хлор-3-фторфенил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона, полученного способом, описанным в примере 119, и 0,25 мл (1,8 ммоль) триэтиламина в 20 мл дихлорметана добавляли 156 мкл (1,8 ммоль) пропаноилхлорида. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, гидролизовали и экстрагировали дихлорметаном. Органические фазы объединяли, промывали один раз водой, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 96/4. Получали 0,7 г (64%) N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-пропионамида в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 0,96 (тд, J=7,6, 1,7 Гц, 3H), 1,24-1,41 (д, J=8,0 Гц, 3H), 1,55 (м, 1H), 1,60-1,84 (м, 3H), 2,03 (кв.д, J=9,0, 8,3, 2,6 Гц, 2H), 2,60-2,76 (м, 1H), 2,80-2,96 (м, 2H), 3,15 (м, 1H), 3,36 (м, 2H), 3,52 (м, 2H), 3,67 (с, 3H), 3,95 (д, J=13,4 Гц, 1H), 4,29 (м, 1H), 4,44 (д, J=12,8 Гц, 1H), 4,57-4,88 (м, 2H), 5,00 (м, 1H), 6,60-6,70 (м, 2H), 6,98 (д, J=8,8 Гц, 1H), 7,20 (м, 1H), 7,36-7,54 (м, 2H), 7,79 (с, 1H), 7,85 (м, 1H), 8,34 (с, 1H).
Пример 159: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-((S)-2-метокси-1-метилэтил)-1H-пиримидин-2,4-дион (реакционная схема № 3, соединение 159)
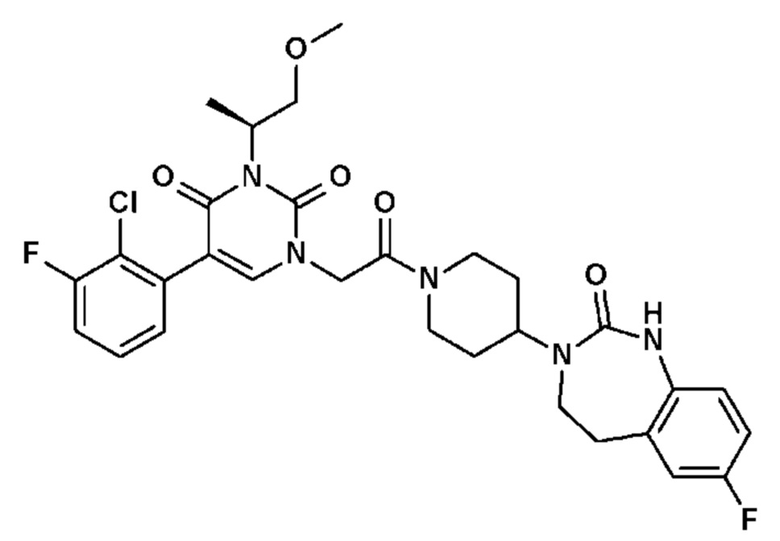
159.1: 7-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
Аналогично последовательности, описанной в примере 115 (115.1-115.9), используя 1 г (5,5 ммоль) 2-(5-фтор-2-нитрофенил)ацетонитрила, получали 315 мг 7-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она.
159.2: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-пропионамид
Аналогично примеру 115.10, используя 150 мг (0,6 ммоль) 7-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она и 176 мг (0,5 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты (полученный способом, описанным в примере 106.3), получали 60 мг (21%) N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]-пропионамида.
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 160: 5-(2-хлор-3-фторфенил)-1-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-(2-метансульфонил-этил)-1H-пиримидин-2,4-дион
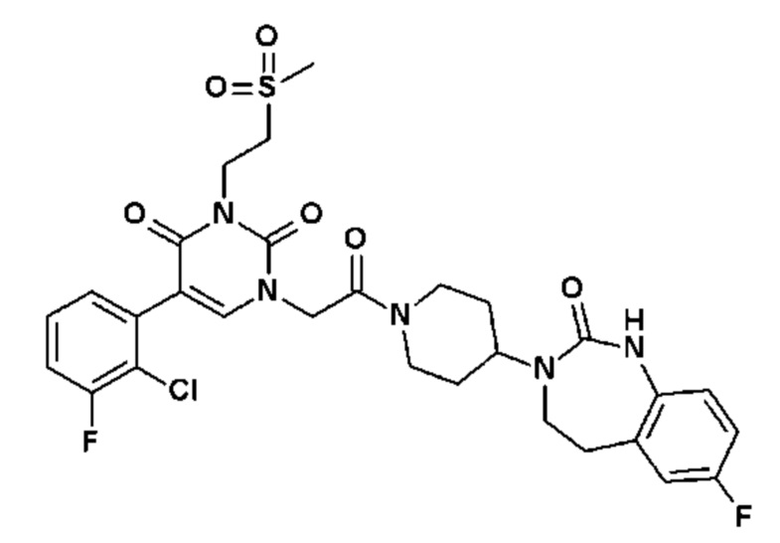
1H ЯМР (δ, ДМСО): 1,56 (м, 1H), 1,68 (м, 3H), 2,69 (м, 1H), 2,84-2,94 (м, 2H), 3,08 (с, 3H), 3,15 (м, 1H), 3,35-3,47 (м, 4H), 3,96 (д, J=13,3 Гц, 1H), 4,31 (м, 3H), 4,43 (д, J=13,1 Гц, 1H), 4,80 (м, 2H), 6,92 (м, 2H), 7,03-7,13 (м, 1H), 7,16-7,29 (м, 1H), 7,37-7,55 (м, 2H), 7,87 (с, 1H), 8,56 (с, 1H).
Соединение 161: N-[(S)-2-(5-(2-хлор-3-фторфенил)-3-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид
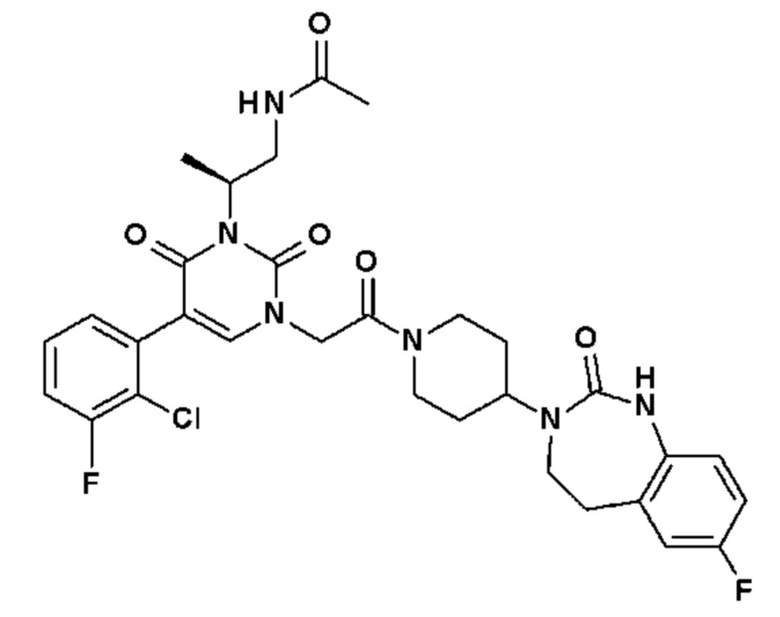
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,8 Гц, 3H), 1,56 (м, 1H), 1,68 (м, 3H), 1,77 (с, 3H), 2,68 (м, 1H), 2,84-2,94 (м, 2H), 3,15 (м, 1H), 3,38 (м, 2H), 3,41-3,63 (м, 2H), 3,95 (д, J=13,6 Гц, 1H), 4,29 (м, 1H), 4,44 (д, J=13,0 Гц, 1H), 4,58-4,87 (м, 2H), 4,91-5,12 (м, 1H), 6,81-6,99 (м, 2H), 7,07 (м, 1H), 7,21 (м, 1H), 7,34-7,51 (м, 2H), 7,78 (с, 1H), 7,93 (т, J=5,9 Гц, 1H), 8,55 (с, 1H).
Соединение 162: N-[(S)-2-(5-(2,3-дихлорфенил)-3-{2-[4-(7-фтор-2-оксо-1,2,4,5-тетрагидробензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-2,6-диоксо-3,6-дигидро-2H-пиримидин-1-ил)-пропил]ацетамид
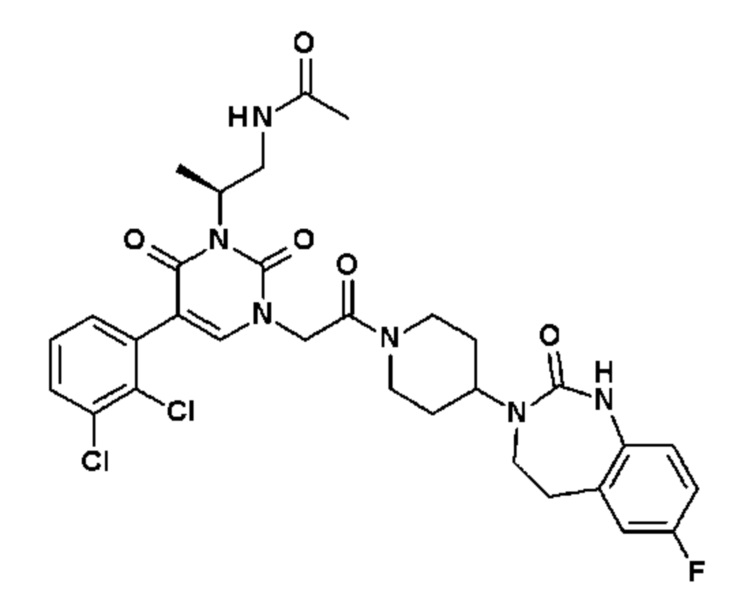
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H), 1,55 (м, 1H), 1,71 (м, 3H), 1,77 (с, 3H), 2,68 (м, 1H), 2,82-2,97 (м, 2H), 3,14 (м, 1H), 3,37 (м, 2H), 3,51 (м, 2H), 3,95 (д, J=13,6 Гц, 1H), 4,29 (м, 1H), 4,44 (д, J=13,0 Гц, 1H), 4,61-4,86 (м, 2H), 5,06-4,89 (м, 1H), 6,81-7,00 (м, 2H), 7,07 (м, 1H), 7,33 (м, 1H), 7,42 (т, J=7,8 Гц, 1H), 7,68 (дд, J=8,0, 1,6 Гц, 1H), 7,77 (с, 1H), 7,92 (т, J=5,9 Гц, 1H), 8,55 (с, 1H).
Соединение 163: 5-(2-хлор-3-фторфенил)-1-{2-[4-(9-фтор-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-3-изопропил-1H-пиримидин-2,4-дион
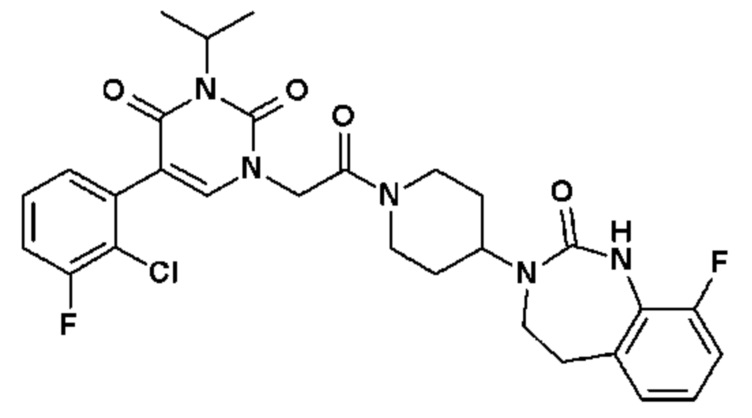
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,8 Гц, 6H), 1,59 (м, 1H), 1,73 (м, 3H), 2,62-2,77 (м, 1H), 2,87-3,04 (м, 2H), 3,15 (м, 1H), 3,37-3,52 (м, 2H), 3,94 (д, J=13,8 Гц, 1H), 4,28 (м, 1H), 4,44 (д, J=13,4 Гц, 1H), 4,74 (м, 2H), 5,11 (гептет, J=6,7 Гц, 1H), 6,87 (м, 1H), 6,94 (д, J=7,4 Гц, 1H), 7,00-7,12 (м, 1H), 7,15-7,27 (м, 1H), 7,35-7,50 (м, 3H), 7,77 (с, 1H).
Пример 164: 5-(2,3-дифторфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-3H-имидазо[4,5-b]пиридин-1-ил)-1-пиперидил]этил]пиримидин-2,4-дион (реакционная схема № 4, соединение 164)
164.1: этиловый эфир 4-(2-хлор-пиридин-3-иламино)-пиперидин-1-карбоновой кислоты
К раствору 20 г (156 ммоль) 3-амино-2-хлорпиридина и 26 мл (171 ммоль) 4-оксо-1-пиперидинэтилкарбоксилата в 250 мл изопропилацетата в течение 5 мин добавляли 23 мл (311 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивали в течение 30 минут при комнатной температуре и затем добавляли 40 г (19 ммоль) триацетоксиборгидрида натрия. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, затем добавляли 23 мл 10% раствора гидроксида натрия, доводя значение pH до 8-9, и смесь нагревали до 50°C. После охлаждения реакционную смесь декантировали и затем экстрагировали этилацетатом. Органические фазы объединяли и сушили над сульфатом натрия. Растворители упаривали, и остаток очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат 60/40. Получали 43,2 г (98%) 4-(2-хлор-пиридин-3-иламино)-пиперидин-1-этилкарбоксилата в виде бесцветного масла.
164.2: 4-[1-(2-хлор-пиридин-3-ил)-уреидо]-пиперидин-1-этилкарбоксилат
К раствору 15,8 мл (51 ммоль) хлорсульфонилизоцианата в 100 мл тетрагидрофурана добавляли 43,3 г (42,3 ммоль) 4-(2-хлор-пиридин-3-иламино)-пиперидин-1-этилкарбоксилата в растворе в 200 мл смеси тетрагидрофуран/изопропилацетат 1/1. Реакционную смесь перемешивали в течение 1 часа при комнатной температуре и далее гидролизовали 15 мл воды. После перемешивания в течение 18 ч при комнатной температуре, реакцию останавливали добавлением 10%-ного раствора гидроксида натрия, доводя значение pH до 8-9, и затем экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Растворители упаривали и затем остаток растворяли в эфире и фильтровали. Получали 32 г (74%) 4-[1-(2-хлор-пиридин-3-ил)-уреидо]-пиперидин-1-этилкарбоксилата в виде порошка белого цвета.
164,3: 4-(2-оксо-2,3-дигидро-имидазо[4,5-b]пиридин-1-ил)-пиперидин-1-этилкарбоксилат
К раствору, предварительно дегазированного азотом в течение 1 часа, 1 г (3,1 ммоль) 4-[1-(2-хлор-пиридин-3-ил)-уреидо]-пиперидин-1-этилкарбоксилата и 1,3 г (9,2 ммоль) карбоната калия в 10 мл изопропанола добавляли 13,7 мг (0,06 ммоль) диацетата палладия и 52 мг (0,12 ммоль) дифенилфосфинобутана. Реакционную смесь перемешивали в течение 3 часов при 83°C, изопропанол концентрировали, добавляли 20 мл воды и смесь экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Растворители упаривали, затем остаток растворяли в изопропилацетате и затем фильтровали. Получали 797 мг (90%) 4-(2-оксо-2,3-дигидро-имидазо[4,5-b]пиридин-1-ил)-пиперидин-1-этилкарбоксилата в виде порошка белого цвета.
164.4: 1-пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-он дихлорид
К раствору 667 мг (2,3 ммоль) 4-(2-оксо-2,3-дигидро-имидазо[4,5-b]пиридин-1-ил)-пиперидин-1-этилкарбоксилата в 1,4 мл этанола добавляли 1,8 мл (34,5 ммоль) 50% раствора гидроксида натрия и 1,7 мл воды. Реакционную смесь перемешивали в течение 18 ч при 80°C. Реакцию останавливали добавлением 10 мл воды, затем смесь оставляли при комнатной температуре и промывали этилацетатом. Водную фазу концентрировали досуха путем азеотропной перегонки с изопропанолом. Неочищенный остаток обрабатывали 5 мл изопропанола и затем фильтровали с удалением солей. Добавляли 6н раствор хлористоводородной кислоты в изопропаноле; продукт осаждался. После нагревания при 50°C в течение 10 минут и затем охлаждения до комнатной температуры, осадок фильтровали и промывали изопропанолом. Получали 502 мг (75%) 1-пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-он дихлорида в виде порошка белого цвета.
164.5: 5-(2,3-дифторфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-3H-имидазо[4,5-b]пиридин-1-ил)-1-пиперидил]этил]пиримидин-2,4-дион (соединение 164)
Аналогично описанным выше примерам, используя 100 мг (0,34 ммоль) 2-[5-(2,3-дифторфенил)-3-метил-2,4-диоксо-пиримидин-1-ил]уксусной кислоты и 197 мг (0,7 ммоль) 1-пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-он дихлорида, получали 100 мг (59%) 5-(2,3-дифторфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-3H-имидазо[4,5-b]пиридин-1-ил)-1-пиперидил]этил]пиримидин-2,4-диона.
1H ЯМР (δ, ДМСО): 1,69-1,91 (м, 2H), 2,09 (м, 1H), 2,34 (м, 1H), 2,70-2,87 (м, 1H), 3,27 (м, 4H), 3,35 (д, 1H), 4,50 (м, 2H), 4,87 (м, 2H), 7,00 (дд, J=7,8, 5,2 Гц, 1H), 7,14-7,36 (м, 2H), 7,46 (dтд, J=10,1, 8,1, 1,8 Гц, 1H), 7,59 (дд, J=8,0, 1,4 Гц, 1H), 7,91 (дд, J=5,2, 1,3 Гц, 1H), 8,00 (с, 1H), 11,60 (с, 1H).
Пример 165: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид (схема реакции 4, соединение 165)
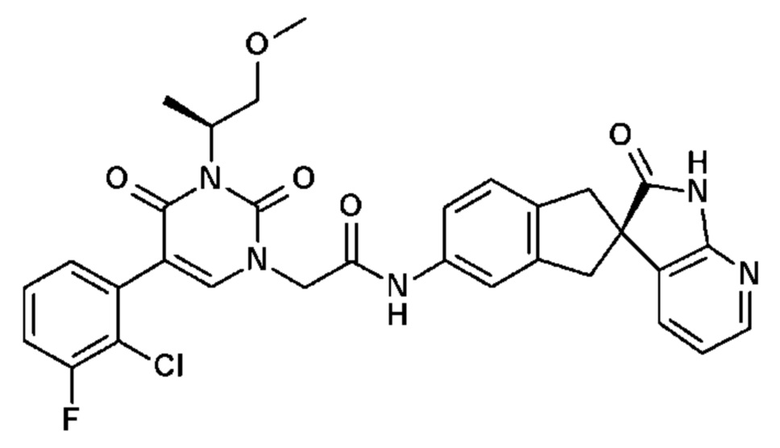
165.1: 5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил-метилацетат
К раствору 30 г (150 ммоль) 5-бромурацила в 294 мл N,N-диметилформамида добавляли 21,3 г (150 ммоль) карбоната калия и 14,5 мл (150 ммоль) метилбромацетата. Реакционную смесь перемешивали при комнатной температуре в течение 50 мин, затем гидролизовали (250 мл воды и 50 мл 1н водного раствора NaOH) и экстрагировали дихлорметаном (300 мл). Водные фазы объединяли и промывали один раз 100 мл дихлорметана. Водная фаза содержала целевой продукт. Значение pH водной фазы доводили до значения, равного 6-7, с помощью 300 мл водного раствора хлористоводородной кислоты C=1н и 8 мл концентрированной хлористоводородной кислоты (для устранения избыточного объема воды). Продукт осаждался. Суспензию перемешивали в течение 2 ч и затем фильтровали. Полученное твердое вещество промывали водой и диэтиловым эфиром и далее сушили в вакууме при 50°C в течение 24 ч с получением 22 г (54%) (5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в виде твердого вещества белого цвета.
165.2: [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К охлажденному до 0°C раствору 1 г (3,8 ммоль) 5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата, 0,8 мл (8 ммоль) (R)-1-метокси-пропан-2-ола и 2 г (7,6 ммоль) трифенилфосфина в 20 мл тетрагидрофуранапо каплям добавляли 2,7 мл (11,4 ммоль) диэтилазодикарбоксилата. Реакционную смесь (суспензию белого цвета) перемешивали при комнатной температуре в течение 48 часов. Тетрагидрофуран удаляли в вакууме, затем остаток растворяли в этилацетате. Органическую фазу промывали один раз насыщенным водным раствором гидрокарбоната натрия, один раз водой, затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат 60/40. Получали 1,2 г (78%) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде бесцветного масла.
165.3: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору 400 мг (1,3 ммоль) [5-бром-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 417 мг (4 ммоль) карбоната натрия и 571 мг (3,3 ммоль) 2-хлор-3-фторфенилбороновой кислоты в 44 мл 1,4-диоксана и 4 мл воды, предварительно дегазированного в течение 5 мин, добавляли 54 мг (70 мкмоль) комплекса 1,1'-бис(дифенилфосфино)ферроцен палладия(II) дихлорида и дихлорметана. Потом реакционную смесь нагревали при 100°C в течение 2 ч. Затем добавляли 2 мл 1M водного раствора моногидрата гидроксида лития и 2,2 мл воды и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь гидролизовали и далее разбавляли этилацетатом. Первая органическую фазу отбраковывали (примеси) и pH водной фазы доводили до кислого значения с помощью водного раствора соляной кислоты 1н концентрации. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 95/5+0,1% уксусной кислоты. Получали 240 мг (49%) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде масла желтого цвета.
165.4: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид (соединение 165)
К предварительно перемешанному раствору 240 мг (0,65 ммоль) [5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты, 114 мг (0,8 ммоль) 1-гидроксибензотриазола и 161 мг (0,8 ммоль) 1-этил-3-(3-диметиламинопропил)-карбодиимид гидрохлорида в 5 мл N,N-диметилформамида в течение 5 мин добавляли 162 мг (0,65 ммоль) (R)-5-амино-1,3-дигидроспиро[инден-2,3'-пирроло[2,3-b)пиридин]-2'(1'H)-она, полученного способом, описанным в патенте WO2011/005731. Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и далее разбавляли этилацетатом. Органическую фазу промывали один раз насыщенным водным раствором гидрокарбоната натрия, один раз водой и один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле (HP15), элюируя смесью дихлорметан/метанол 96/4. Получали 155 мг (39%) 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамида в виде твердого вещества белого цвета.
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H); 3,04-3,11 (м, 2H); 3,23 (с, 3H); 3,33-3,37 (м, 2H); 3,54 (дд, J=9,9, 5,9 Гц, 1H); 3,92 (дд, J=9,9, 8,2 Гц, 1H); 4,65 (с, 2H); 5,13-5,15 (м, 1H); 6,87 (дд, J=7,3, 5,3 Гц, 1H); 7,18 (дд, J=7,3, 1,6 Гц, 1H); 7,21-7,24 (м, 2H); 7,38 (д, J=8,3 Гц, 1H); 7,43-7,46 (м, 2H); 7,62 (с, 1H); 7,93 (с, 1H); 8,07 (дд, J=5,3, 1,6 Гц, 1H); 10,35 (с, 1H); 11,09 (с, 1H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 166: 5-(2-хлор-3-фторфенил)-3-изопропил-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
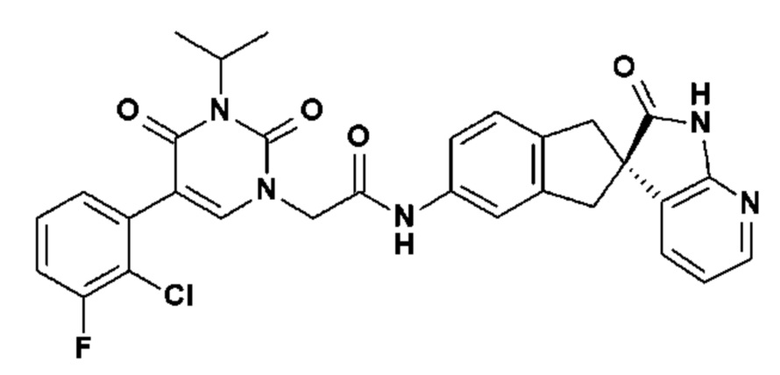
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6H); 3,08 (м, 2H); 3,33 (м, 2H); 4,65 (м, 2H); 5,10-5,11 (м, 1H); 6,87 (дд, J=7,3, 5,3 Гц, 1H); 7,18 (м, 1H), 7,23 (м, 2H); 7,38 (м, 1H), 7,45 (м, 2H), 7,63 (м, 1H); 7,91 (с, 1H); 8,07 (дд, J=5,3, 1,6 Гц, 1H); 10,35 (с, 1H); 11,09 (с, 1H).
Соединение 167: 5-(2,3-дифторфенил)-3-[(1S)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
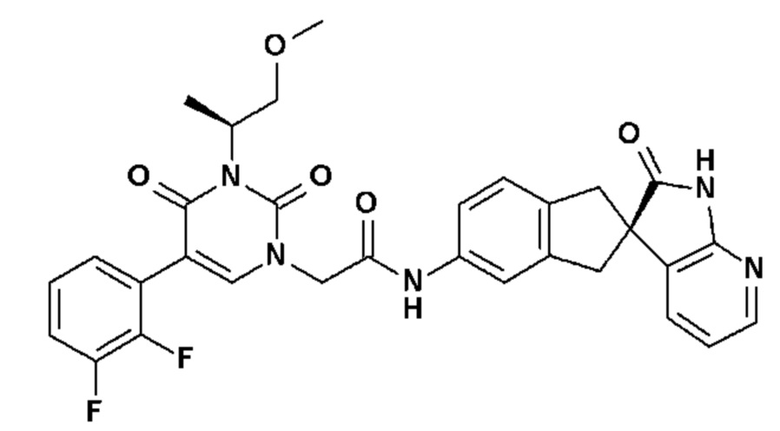
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,9 Гц, 3H), 3,08 (м, 2H), 3,23 (с, 3H), 3,34 (м, 2H), 3,54 (м, 1H), 3,93 (м, 1H), 4,66 (м, 2H), 5,16 (кв, J=7,1 Гц, 1H), 6,87 (дд, J=7,3, 5,3 Гц, 1H), 7,18 (дд, J=7,3, 1,7 Гц, 1H), 7,20-7,31 (м, 3H), 7,39 (м, 1H), 7,46 (м, 1H), 7,61 (м, 1H), 8,02 (с, 1H), 8,07 (дд, J=5,3, 1,7 Гц, 1H), 10,35 (с, 1H), 11,09 (с, 1H).
Соединение 168: 2-[5-(2-хлор-3-фторфенил)-2,4-диоксо-1H-пиримидин-3-ил]уксусная кислота-1-[(2R)-2'-оксоспиро[1,3 дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
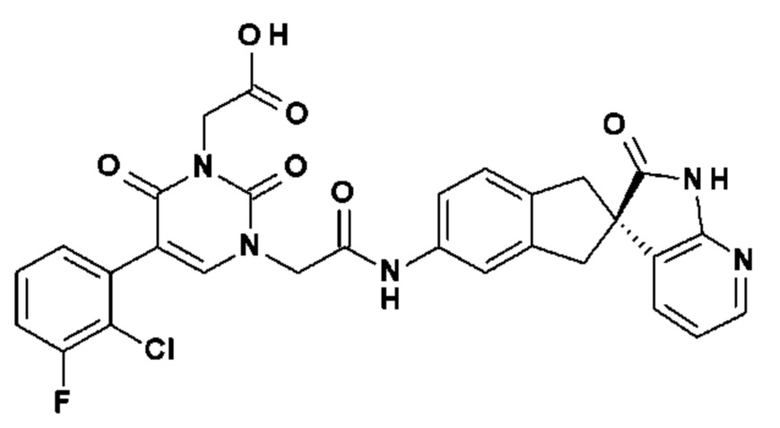
1H ЯМР (δ, ДМСО): 3,08 (дд, J=16,1, 12,1 Гц, 2H), 3,36 (м, 2H), 4,53 (с, 2H), 4,71 (с, 2H), 6,87 (дд, J=7,3, 5,3 Гц, 1H), 7,18 (дд, J=7,4, 1,7 Гц, 1H), 7,24 (м, 2H), 7,38 (дд, J=8,2, 2,0 Гц, 1H), 7,42-7,53 (м, 2H), 7,61 (м, 1H), 8,03 (с, 1H), 8,07 (дд, J=5,3, 1,7 Гц, 1H), 10,37 (с, 1H), 11,09 (с, 1H), 13,02 (ушир.с, 1H).
Соединение 169: 5-(2-хлор-3-метоксифенил)-3-(2-метилсульфонилэтил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
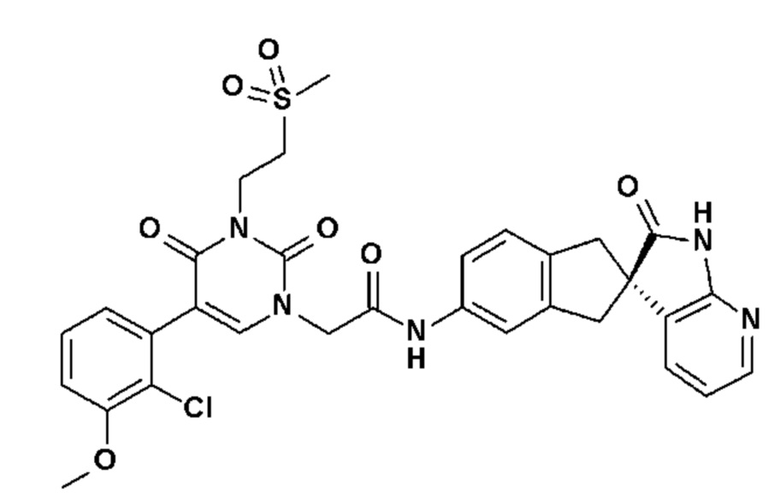
1H ЯМР (δ, ДМСО): 3,08-3,12 (м, 5H); 3,33-3,42 (м, 4H); 3,90 (с, 3H); 4,30 (т, J=7,2 Гц, 2H); 4,69 (м, 2H); 6,87 (дд, J=7,3, 5,3 Гц, 1H); 6,93 (дд, J=7,6, 1,4 Гц, 1H); 7,16-7,24 (м, 3H); 7,34-7,39 (м, 2H); 7,61 (м, 1H); 7,90 (с, 1H); 8,07 (дд, J=5,3, 1,6 Гц, 1H); 10,35 (с, 1H); 11,08 (с, 1H).
Соединение 170: 5-(2,3-дихлорфенил)-3-(2-метилсульфонилэтил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
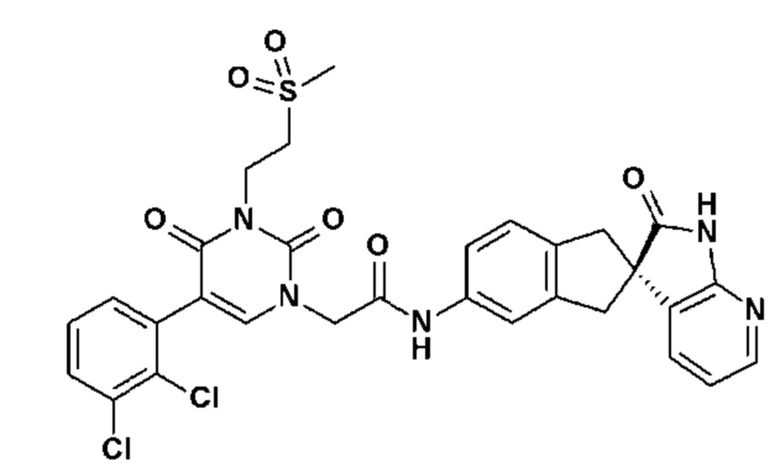
1H ЯМР (δ, ДМСО): 3,03-3,15 (м, 5H), 3,33-3,46 (м, 4H), 4,31 (дд, J=8,4, 6,1 Гц, 2H), 4,69 (с, 2H), 6,87 (дд, J=7,3, 5,3 Гц, 1H), 7,18 (дд, J=7,3, 1,6 Гц, 1H), 7,24 (д, J=8,1 Гц, 1H), 7,35 (дд, J=7,7, 1,6 Гц, 1H), 7,38 (дд, J=8,1, 2,0 Гц, 1H), 7,44 (т, J=7,9 Гц, 1H), 7,61 (д, J=2,0 Гц, 1H), 7,70 (дд, J=8,0, 1,6 Гц, 1H), 8,00 (с, 1H), 8,07 (дд, J=5,2, 1,6 Гц, 1H), 10,36 (с, 1H), 11,08 (ушир.с, 1H).
Соединение 171: 5-(2,3-диметоксифенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
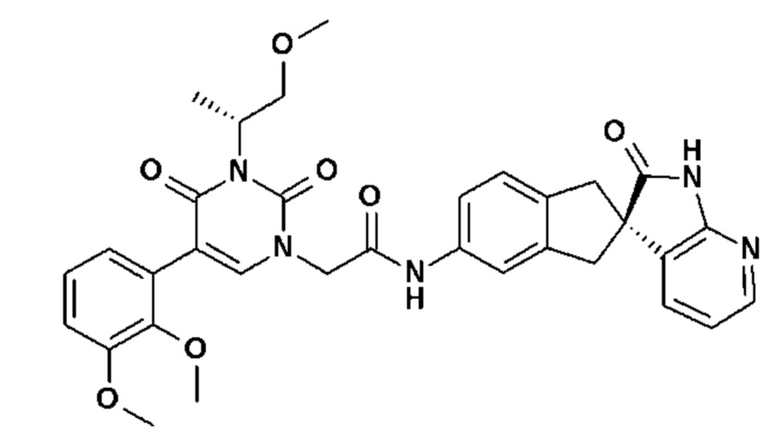
1H ЯМР (δ, ДМСО): 1,34 (д, J=6,8 Гц, 3H), 3,08 (м, 2H), 3,24 (с, 3H), 3,36 (м, 2H), 3,54 (м, 1H), 3,70 (с, 3H), 3,83 (с, 3H), 3,93 (м, 1H), 4,63 (с, 2H), 5,15 (м, 1H), 6,80 (м, 1H), 6,87 (м, 1H), 7,07 (д, J=4,5 Гц, 2H), 7,18 (д, J=7,4 Гц, 1H), 7,23 (д, J=8,2 Гц, 1H), 7,39 (д, J=8,1 Гц, 1H), 7,61 (с, 1H), 7,70 (с, 1H), 8,06 (дд, J=5,3, 1,5 Гц, 1H), 10,32 (с, 1H), 11,08 (с, 1H).
Соединение 172: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
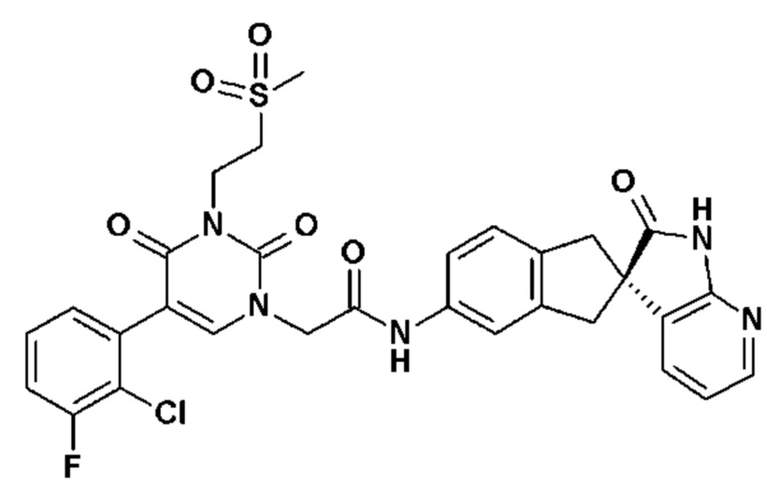
1H ЯМР (δ, ДМСО): 3,09 (м, 5H), 3,28-3,39 (м, 2H), 3,42 (т, J=7,3 Гц, 2H), 4,31 (т, J=7,2 Гц, 2H), 4,70 (с, 2H), 6,87 (м, 1H), 7,18 (м, 1H), 7,23 (м, 2H), 7,38 (д, J=8,1 Гц, 1H), 7,42-7,52 (м, 2H), 7,61 (с, 1H), 8,01 (с, 1H), 8,07 (д, J=5,2 Гц, 1H), 10,36 (с, 1H), 11,08 (с, 1H).
Соединение 173: 5-(2-хлор-3-фторфенил)-3-(3-метилсульфонилпропил)-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
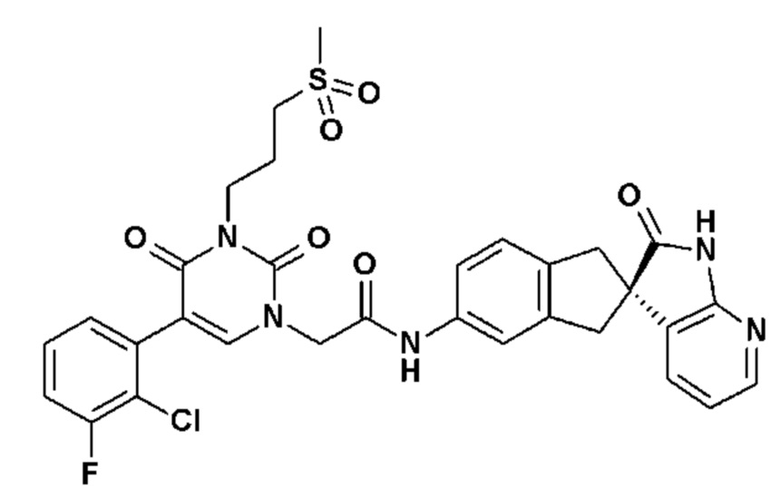
1H ЯМР (δ, ДМСО): 1,96-2,04 (м, 2H); 2,98 (с, 3H); 3,09 (м, 2H); 3,18 м, 2H); 3,33-3,37 (м, 2H); 4,01 (т, J=7,0 Гц, 2H); 4,69 (с, 2H); 6,87 (дд, J=7,3, 5,3 Гц, 1H); 7,18 (дд, J=7,3, 1,6 Гц, 1H); 7,22-7,25 (м, 2H); 7,39 (м, 1H); 7,44-7,47 (м, 2H); 7,61 (м, 1H); 7,99 (с, 1H); 8,07 (дд, J=5,3, 1,6 Гц, 1H); 10,36 (с, 1H); 11,08 (с, 1H).
Соединение 174: 5-(2,3-дихлорфенил)-3-метил-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
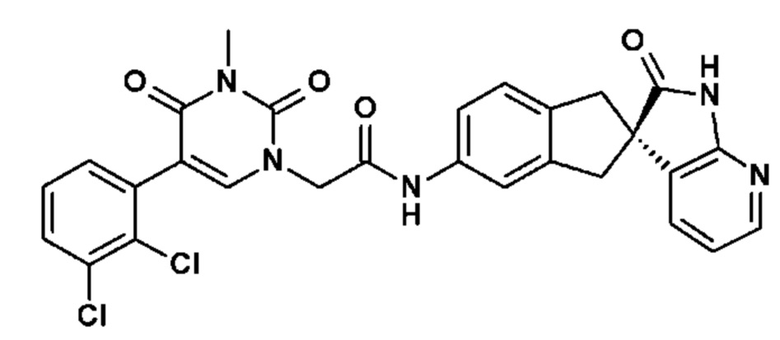
1H ЯМР (δ, ДМСО): 3,09 (дд, J=16,1, 11,9 Гц, 2H), 3,26 (с, 3H), 3,28-3,40 (м, 2H), 4,68 (с, 2H), 6,87 (дд, J=7,3, 5,3 Гц, 1H), 7,18 (дд, J=7,3, 1,6 Гц, 1H), 7,24 (д, J=8,1 Гц, 1H), 7,34 (дд, J=7,7, 1,7 Гц, 1H), 7,39 (дд, J=8,1, 2,0 Гц, 1H), 7,43 (т, J=7,8 Гц, 1H), 7,61 (д, J=2,0 Гц, 1H), 7,70 (дд, J=8,0, 1,6 Гц, 1H), 7,96 (с, 1H), 8,07 (дд, J=5,2, 1,7 Гц, 1H), 10,35 (с, 1H), 11,09 (с, 1H).
Соединение 175: 5-(2-хлор-3-фторфенил)-3-[(1S)-1-метил-2-метилсульфонил-этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
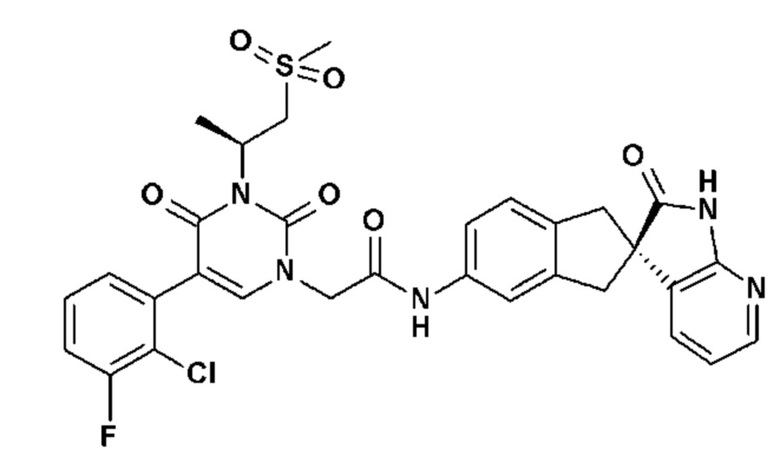
1H ЯМР (δ, ДМСО): 1,24 (д, J=7,0 Гц, 3H), 3,05 (с, 6H), 3,33-3,40 (м, 1H), 3,54 (м, 1H), 4,16-4,36 (м, 2H), 4,70 (с, 2H), 6,87 (м, 1H), 7,19 (дд, J=7,5, 1,7 Гц, 1H), 7,21-7,28 (м, 2H), 7,37 (дд, J=8,3, 2,0 Гц, 1H), 7,42-7,52 (м, 2H), 7,61 (м, 1H), 8,03 (с, 1H), 8,07 (дд, J=5,1, 1,9 Гц, 1H), 10,35 (с, 1H), 11,08 (с, 1H).
Соединение 176: 5-(2-хлор-3-метоксифенил)-3-[2-метокси-1-(метоксиметил)этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
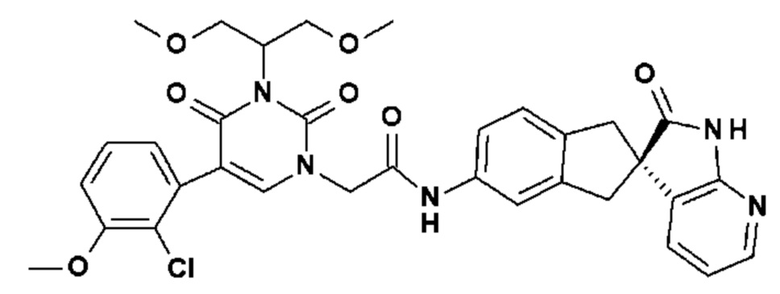
1H ЯМР (δ, ДМСО): 3,04-3,11 (м, 2H); 3,23 (с, 6H); 3,33-3,37 (м, 2H); 3,60 (м, 2H); 3,84 (м, 2H); 3,89 (с, 3H); 4,65 (с, 2H); 5,26 (ушир с, 1H); 6,87 (м, 1H); 6,93 (дд, J=7,6, 1,4 Гц, 1H); 7,16-7,19 (м, 2H); 7,24 (д, J=8,2 Гц, 1H); 7,33-7,39 (м, 2H); 7,62 (м, 1H); 7,84 (с, 1H); 8,07 (дд, J=5,3, 1,6 Гц, 1H); 10,34 (с, 1H); 11,08 (с, 1H).
Соединение 177: 5-(2,3-дихлорфенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
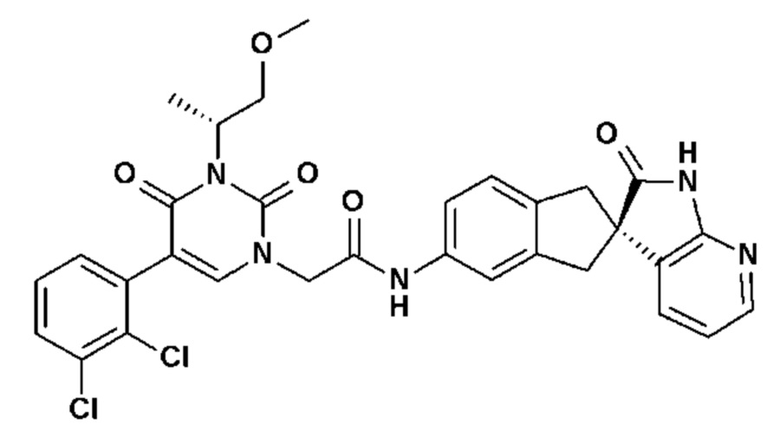
1H ЯМР (δ, ДМСО): 1,33 (д, J=6,9 Гц, 3H), 3,08 (м, 2H), 3,23 (с, 3H), 3,33-3,40 (м, 2H), 3,54 (м, 1H), 3,92 (м, 1H), 4,65 (с, 2H), 5,14 (м, 1H), 6,87 (м, 1H), 7,18 (дд, J=7,3, 1,7 Гц, 1H), 7,24 (д, J=8,2 Гц, 1H), 7,35 (дд, J=7,7, 1,6 Гц, 1H), 7,38 (дд, J=8,1, 2,0 Гц, 1H), 7,43 (т, J=7,9 Гц, 1H), 7,62 (м, 1H), 7,69 (дд, J=8,0, 1,5 Гц, 1H), 7,92 (с, 1H), 8,07 (дд, J=5,3, 1,7 Гц, 1H), 10,35 (с, 1H), 11,08 (с, 1H).
Соединение 178: 5-(2,3-дихлорфенил)-3-[(1S)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
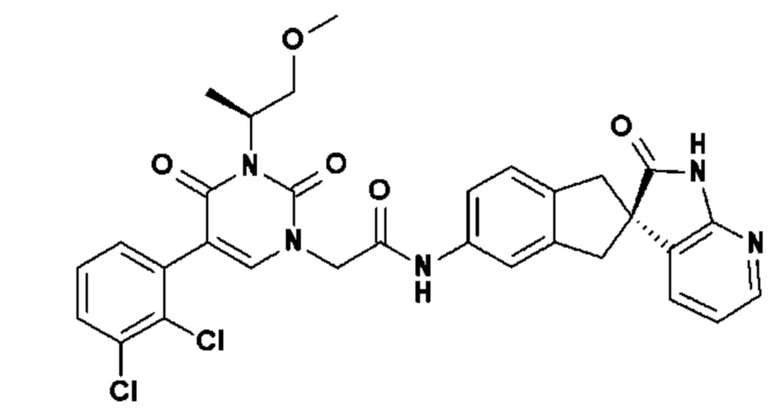
1H ЯМР (δ, ДМСО): 1,33 (д, J=6,9 Гц, 3H), 3,01-3,14 (м, 2H), 3,23 (с, 3H), 3,40 (м, 2 H), 3,54 (м, 1H), 3,92 (м, 1H), 4,64 (с, 2H), 5,14 (м, 1H), 6,87 м, 1H), 7,18 (дд, J=1,7, 7,3 Гц, 1H), 7,24 (д, J=8,2 Гц, 1H), 7,30-7,47 (м, 3H), 7,62 (м, 1H), 7,69 (дд, J=1,6, 8 Гц, 1H), 7,92 (с, 1H), 8,07 (дд, J=1,6, 5,3 Гц, 1H), 10,34 (с, 1H), 11,08 (с, 1H).
Соединение 179: 5-(2-хлор-3-фторфенил)-3-[2-метокси-1-(метоксиметил)этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
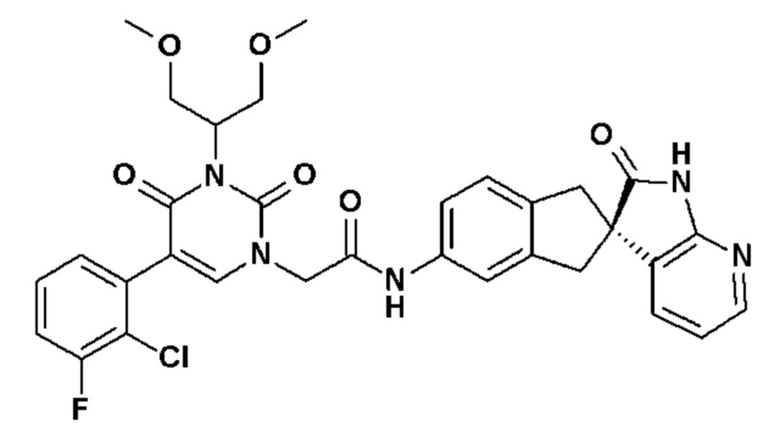
1H ЯМР (δ, ДМСО): 3,02-3,14 (м, 2H), 3,24 (с, 6H), 3,33-3,39 (м, 2H), 3,60 (м, 2H), 3,85 (м, 2H), 4,66 (с, 2H), 5,27 (ушир.с, 1H), 6,87 (м, 1H), 7,15-7,21 (м, 1H), 7,23 (м, 2H), 7,32-7,43 (м, 1H), 7,42-7,53 (м, 2H), 7,62 (с, 1H), 7,95 (с, 1H), 8,07 (дд, J=1,7, 5,4 Гц, 1H), 10,34 (с, 1H), 11,08 (с, 1H).
Соединение 180: N-[2-[5-(2-хлор-3-фторфенил)-2,4-диоксо-пиримидин-3-ил]этил]ацетамид-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
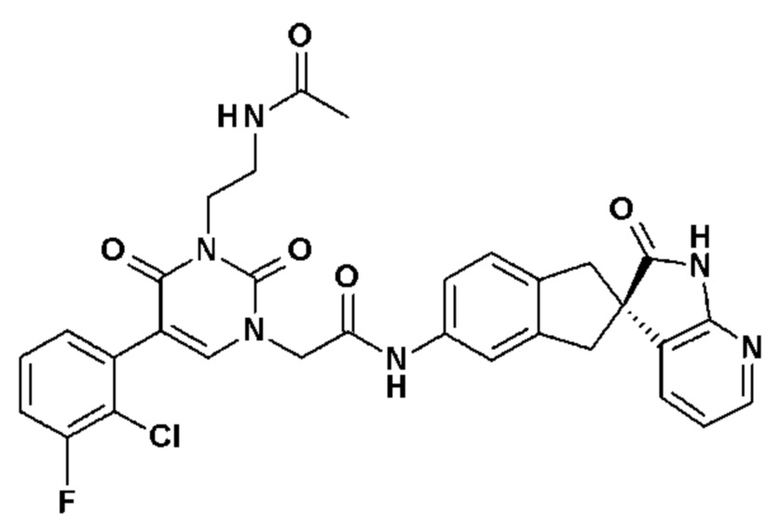
1H ЯМР (δ, ДМСО): 1,75 (с, 3H), 2,98-3,15 (м, 2H), 3,27-3,40 (м, 4H), 3,95 (т, J=6,3 Гц, 2H), 4,68 (с, 2H), 6,87 (м, 1H), 7,18 (дд, J=7,2, 1,6 Гц, 1H), 7,20-7,28 (м, 2H), 7,39 (дд, J=8,1, 2,0 Гц, 1H), 7,42-7,51 (м, 2H), 7,61 (м, 1H), 7,93 (т, J=6,0 Гц, 1H), 7,95 (с, 1H), 8,07 (дд, J=5,3, 1,7 Гц, 1H), 10,32 (с, 1H), 11,08 (с, 1H).
Соединение 181: 5-(2-хлор-3-фторфенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
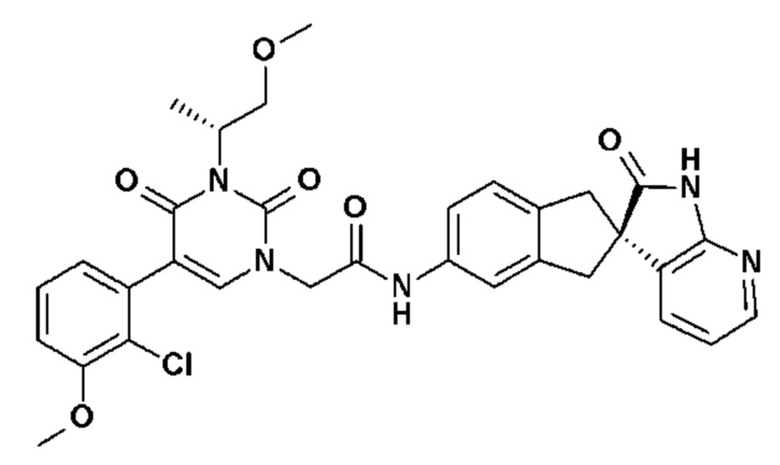
1H ЯМР (δ, ДМСО): 1,33 (д, J=6,9 Гц, 3H); 3,08 (м, 2H); 3,23 (с, 3H); 3,36 (м, 2H); 3,54 (м, 1H); 3,89-3,91 (м, 4H); 4,64 (с, 2H); 5,13 (м, 1H); 6,87 (м, 1H); 6,93 (д, J=7,6 Гц, 1H); 7,18 (м, 2H); 7,24 (д, J=7,7 Гц, 1H); 7,33-7,39 (м, 2H); 7,63 (с, 1H); 7,82 (с, 1H); 8,07 (д, J=5,2 Гц, 1H); 10,33 (с, 1H); 11,08 (с, 1H).
Соединение 182: 5-(2,3-дихлорфенил)-3-[2-метокси-1-(метоксиметил)этил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
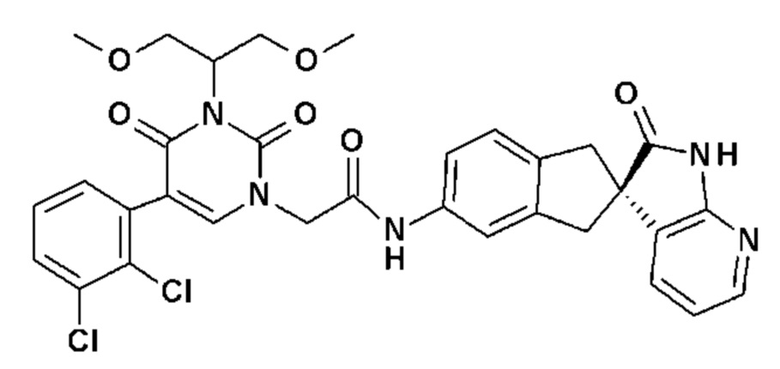
1H ЯМР (δ, ДМСО): 3,04-3,11 (м, 2H); 3,24 (с, 6H); 3,33-3,34 (м, 2H); 3,60 (м, 2H); 3,85 (м, 2H); 4,66 (с, 2H); 5,22-5,29 (ушир.с, 1H); 6,87 (дд, J=7,3, 5,3 Гц, 1H); 7,18 (дд, J=7,3, 1,6 Гц, 1H); 7,24 (д, J=8,2 Гц, 1H); 7,33-7,44 (м, 3H); 7,62 (м, 1H); 7,69 (дд, J=8,0, 1,6 Гц, 1H); 7,94 (с, 1H); 8,07 (дд, J=5,3, 1,6 Гц, 1H); 10,35 (с, 1H); 11,08 (с, 1H).
Соединение 183: 5-(2-хлор-3-фторфенил)-3-[(1R)-2-метокси-1-метилэтил]-пиримидин-2,4-дион-1-[(2R)-2'-оксоспиро[1,3-дигидроинден-2,3'-1H-пирроло[2,3-b]пиридин]-5-ил]ацетамид
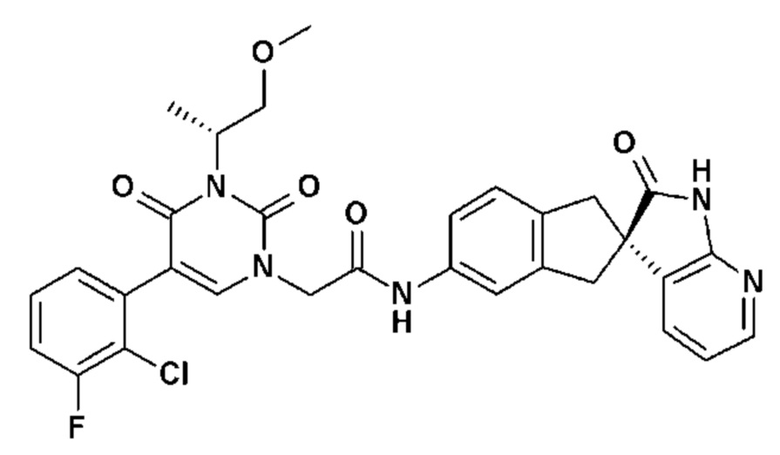
1H ЯМР (δ, ДМСО): 1,34 (д, J=7,0 Гц, 3H), 3,08 (м, 2H), 3,23 (с, 3H), 3,36 (м, 2H), 3,54 (м, 1H), 3,92 (м, 1H), 4,65 (с, 2H), 5,14 (кв, J=7,2 Гц, 1H), 6,87 (м, 1H), 7,18 (дд, J=7,2, 1,7 Гц, 1H), 7,21-7,28 (м, 2H), 7,38 (дд, J=8,1, 1,9 Гц, 1H), 7,41-7,50 (м, 2H), 7,63 (м, 1H), 7,93 (с, 1H), 8,07 (дд, J=5,3, 1,6 Гц, 1H), 10,34 (с, 1H), 11,08 (с, 1H).
Пример 184: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метансульфонил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 4, соединение 184)
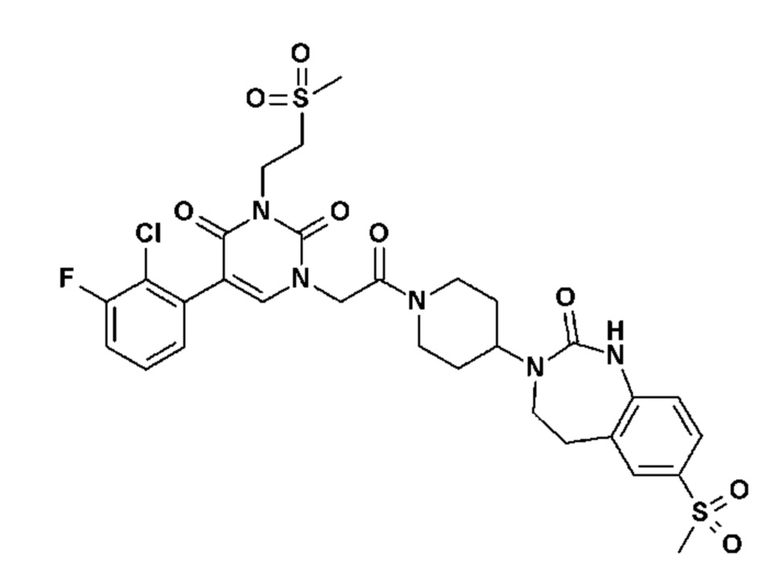
184.1: 2-(5-метилсульфанил-2-нитрофенил)ацетонитрил
Раствор 6 г (47 ммоль) (4-хлорфенокси)-ацетонитрила и 6 г (40 ммоль) 1-метилсульфанил-4-нитробензола в 60 мл N,N-диметилформамида по каплям добавляли к предварительно охлажденного до -10°C раствору 10,6 г (94 ммоль) трет-бутоксида калия в 120 мл N,N-диметилформамида. Перед гидролизом охлажденным льдом раствором концентрированной соляной кислоты, реакционную смесь перемешивали при -10°C в течение 45 мин и затем экстрагировали этилацетатом. Органическую фазу промывали водой и потом насыщенным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и затем концентрировали в вакууме. Сырой продукт реакции обрабатывали раствором гептан:EtOAc 1:1 и, после растирания в течение 1 часа, смесь фильтровали и твердое вещество промывали раствором гептан:EtOAc 1:1 с получением 2,9 г 2-(5-метилсульфанил-2-нитрофенил)ацетонитрила (58%) в виде твердого вещества.
184.2: 2-(5-метилсульфанил-2-нитрофенил)этанамин
К раствору 2,9 г (14 ммоль) 2-(5-метилсульфанил-2-нитрофенил)ацетонитрила в 18 мл тетрагидрофурана добавляли по каплям 28 мл 1M раствора комплекса борана и тетрагидрофурана в тетрагидрофуране при комнатной температуре. Затем смесь нагревали с обратным холодильником в течении 3 ч. Потом смесь охлаждали до комнатной температуры и медленно добавляли 6 мл метанола. Через 10 мин перемешивания и метанолиза борана, смесь концентрировали в вакууме. Остаток растворяли в 2-метил-тетрагидрофуране и органическую фазу промывали 1н водным раствором гидроксида натрия. Водную фазу экстрагировали три раза 2-метил-тетрагидрофураном, и органические фазы объединяли и частично концентрировали. Осторожно добавляли 1 мл уксусной кислоты и обеспечивали возвращение температуры смеси к значению комнатной температуры при медленном перемешивании. Затем смесь концентрировали в вакууме. Получали 3 г (79%) 2-(5-метилсульфанил-2-нитрофенил)этанамина в виде масла.
184.3: 4-[2-(5-метилсульфанил-2-нитрофенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат
К 40 мл 2-метилтетрагидрофурана добавляли 3 г (14 ммоль) 2-(5-метилсульфанил-2-нитрофенил)этанамина и 3,1 г (15,4 ммоль) 1-Boc-4-пиперидона. Реакционная смесь имеет низкую растворимость, однако медленно частями добавляли 4,5 г (21 ммоль) триацетоксиборгидрида натрия. Смесь перемешивали при комнатной температуре в течение 12 ч и потом гидролизовали 15 мл водного раствора гидроксида натрия с концентрацией 2н и экстрагировали 2-метил-тетрагидрофураном. Органическую фазу вновь промывали водой до тех пор, пока значение pH не стало равным 6, сушили над сульфатом магния и затем концентрировали. Получали 6,2 г (100%) 4-[2-(5-метилсульфанил-2-нитрофенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата в виде масла оранжевого цвета.
184.4: 4-[2-(2-амино-5-метилсульфанил-фенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат
К раствору 5,5 г (14 ммоль) 4-[2-(5-метилсульфанил-2-нитрофенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата в 14 мл метанола, 14 мл 2-метил-тетрагидрофурана (14,00 мл) и 14 мл воды добавляли 3,1 г (56 ммоль) железа и 0,4 г (7 ммоль) хлорида аммония. Негомогенную реакционную смесь нагревали с обратным холодильником в течение 3 ч. После завершения реакции смесь фильтровали через целит и осадок промывали метанолом. Фильтрат концентрировали до тех пор, пока метанол не был полностью удален, затем обрабатывали 2-метил-тетрагидрофураном и гидролизовали 10 мл 10% раствора ЭДТА. Полученную органическую фазу промывали водой, сушили над сульфатом магния, фильтровали и упаривали. Получали 6,1 г (100%) неочищенного остатка 4-[2-(2-амино-5-метилсульфанил-фенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата в виде твердого вещества оранжевого цвета.
184.5: 4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилат
К раствору 5,1 г (14 ммоль) 4-[2-(2-амино-5-метилсульфанил-фенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата в 77 мл ацетонитрила добавляли частями 2,5 г (20 ммоль) N,N'-карбонилдиимидазола. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и потом разбавляли этилацетатом и гидролизовали насыщенным водным раствором хлорида аммония. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат с возрастающей полярностью 7/3-5/5. Получали 2,4 г (44%) 4-[2-(2-амино-5-метилсульфанил-фенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата.
184.5: 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
К раствору 1,2 г (3 ммоль) 4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата в 7 мл дихлорметана добавляли 0,8 мл (8 ммоль) трифторуксусной кислоты. Смесь перемешивали в течение 12 часов при комнатной температуре и затем концентрировали в вакууме. Неочищенный продукт реакции обрабатывали в толуоле и совместно упаривают несколько раз. Получали 0,8 г (90%) 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она и использовали на стадии 184.9 без дополнительной очистки.
184.6: [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К раствору 15 г (57 ммоль) 2-(5-бром-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-метилацетата в 250 мл N,N-диметилформамида добавляли 11,8 г (85,5 ммоль) карбоната калия, затем 10,7 мл (109 ммоль) 2-хлорэтилметилсульфида. Реакционную смесь нагревали при 60°C в течение 9 ч и потом гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали дважды водой и один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат 60/40. Получали 13,3 г (69%) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
184.7: [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
267 мг (0,3 ммоль) комплекса дихлорметана и 1,1'-бис(дифенилфосфино)ферроценпалладия(II) дихлорида добавляли к раствору 2,2 г (6,5 ммоль) [5-бром-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата, 2,1 г (19,6 ммоль) карбоната натрия и 2,5 г (8,5 ммоль) 2-хлор-3-фторфенилбороновой кислоты в 220 мл 1,4-диоксана и 22 мл воды, предварительно дегазированному в вакууме/азотом в течение 5 мин. Потом реакционную смесь нагревали при 100°C в течение 1,5 ч, затем гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме.
Неочищенный продукт очищали хроматографией на силикагеле HP 15, элюируя смесью гептан/этилацетат 70/30. Получали 1,4 г (55%) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества кремового цвета.
184.8: [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору 1,4 г (3,6 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в 28 мл тетрагидрофурана добавляли 5,4 мл (5,4 ммоль) гидроксида лития моногидрата и 2,8 мл воды. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем гидролизовали и разбавляли этилацетатом. Значение pH водной фазы доводили значения кислого pH водным раствором соляной кислоты с концентрацией 1н. Продукт экстрагировали этилацетатом, органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и затем концентрировали в вакууме. Получали 1,3 г (98%) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества кремового цвета.
184.9: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
К 0,3 г (0,8 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в 2 мл N,N-диметилформамида добавляли 185 мг (1 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 107 мг (1 ммоль) 1-окси-пиридин-2-олА. Реакционную смесь перемешивали в течение 5 мин и потом добавляли 281 мг (1 ммоль) 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в 184.4) и 0,15 мл (1 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, затем разбавляли дихлорметаном и водой. Водную фазу экстрагировали три раза дихлорметаном, органические фазы объединяли и промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия. После сушки над сульфатом магния, раствор фильтровали и затем концентрировали в вакууме. Полученный неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат 7/3. Получали 520 мг (100%) 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в виде твердого вещества белого цвета.
184.10: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метансульфонил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 184)
К 517 мг (0,8 ммоль) 5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона в 3 мл этанола, предварительно охлажденного до 0°C, добавляли 50 мг (0,04 ммоль) аммония молибдата тетрагидрата и 146 мкл (24 ммоль) 30% водного раствора перекиси водорода. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и далее гидролизовали водой (30 мл) и экстрагировали дихлорметаном (3×30 мл). Органические фазы объединяли, промывали насыщенным водным раствором тиосульфата натрия (30 мл × 4), водой (20 мл × 2) и насыщенным водным раствором хлорида натрия (20 мл × 2), затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. После растирания неочищенного остатка в этилацетате в течение 12 часов и фильтрования, получали 210 мг (35%) 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метансульфонил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона.
1H ЯМР (400 МГц, ДМСО): δ (м.д.) 1,52-1,75 (м, 4 H); 2,68 (т, J=11,7 Гц, 1 H); 2,98 (ушир т, 2 H); 3,06 (с, 3 H); 3,10 (с, 3 H); 3,14-3,18 (ушир. м, 1 H); 3,40 (ушир. м, 4 H); 3,95 (д, J=13,5 Гц, 1 H); 4,27-4,43 (м, 4 H); 4,79 (с, 2 H); 7,18-7,23 (м, 2 H); 7,42-7,45 (м, 2 H); 7,54-7,58 (м, 2 H); 7,86 (с, 1 H); 9,13 (с, 1 H).
Еще одно соединение синтезировали в соответствии с аналогичной процедурой, используя соответствующие или предварительно полученные реагенты:
Соединение 185: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метансульфонил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
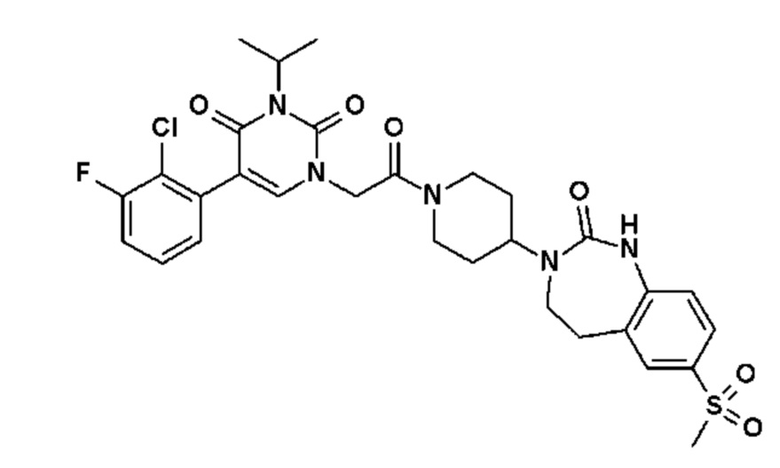
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6H), 1,57 (м, 1H), 1,70 (м, 3H), 2,64-2,77 (м, 1H), 2,93-3,05 (м, 2H), 3,12 (с, 3H), 3,17 (м, 1H), 3,37-3,48 (м, 2H), 3,95 (м, 1H), 4,28-4,50 (м, 2H), 4,64-4,84 (м, 2H), 5,10 (h, J=6,8 Гц, 1H), 7,18-7,27 (м, 2H), 7,40-7,49 (м, 2H), 7,54-7,62 (м, 2H), 7,77 (с, 1H), 9,15 (с, 1H).
Пример 186: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (реакционная схема № 4, соединение 186)
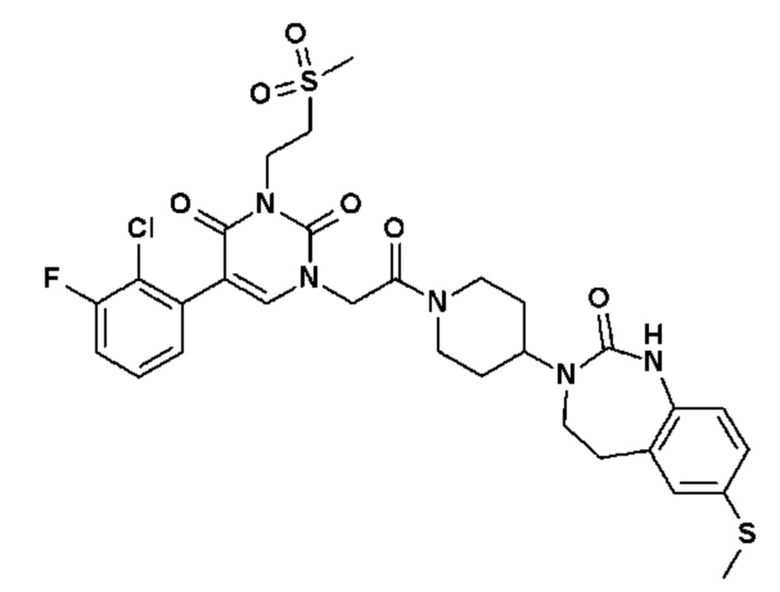
186.1: [5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
К раствору [5-(2-хлор-3-фторфенил)-3-(2-метилсульфанил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты (полученной способом, описанным в 184.8) добавляли раствор 50 мг (0,04 ммоль) аммония молибдата тетрагидрата и 146 мкл (24 ммоль) 30% водного раствора перекиси водорода. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, гидролизовали водой (30 мл) и экстрагировали этилацетатом (3×30 мл). Органические фазы объединяли, промывали насыщенным водным раствором тиосульфата натрия, водой и затем насыщенным водным раствором хлорида натрия. После сушки над сульфатом натрия и вакуумного фильтрования, получали 320 мг (98%) [5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и использовали на следующей стадии без очистки.
186.2: 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион (соединение 186)
К раствору 320 мг (0,8 ммоль) [5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в 2 мл N,N-диметилформамида добавляли 182 мг (1 ммоль) 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 105 мг (1 ммоль) 1-окси-пиридин-2-ола. Реакционную смесь перемешивали в течение 5 мин, затем добавляли 253 мг (0,9 ммоль) 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она и 0,15 мл (1 ммоль) триэтиламина. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, потом разбавляли дихлорметаном и водой. Водную фазу экстрагировали три раза дихлорметаном, органические фазы объединяли и промывали насыщенным раствором гидрокарбоната натрия, водой и затем насыщенным водным раствором хлорида натрия. После сушки над сульфатом магния, раствор фильтровали и затем концентрировали в вакууме.
После растирания неочищенного остатка в этилацетате в течение 12 часов и фильтрования, получали 210 мг (36%) 5-(2-хлор-3-фторфенил)-3-(2-метансульфонил-этил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-диона.
1H ЯМР (400 МГц, ДМСО): δ (м.д.) 1,50-1,73 (м, 4 H); 2,38 (с, 3 H); 2,67 (т, J=12,4 Гц, 1 H); 2,86 (д, J=6,8 Гц, 2 H); 3,06 (с, 3 H); 3,13 (т, J=12,4 Гц, 1 H); 3,33-3,41 (m,4 H); 3,94 (д, J=13,6 Гц, 1 H); 4,29 (т, J=7,4 Гц, 3 H); 4,41 (д, J=12,9 Гц, 1 H); 4,78 (с, 2 H); 6,99 (д, J=10,8 Гц, 3 H); 7,19-7,21 (м, 1 H); 7,43-7,46 (м, 2 H); 7,86 (с, 1 H); 8,55 (с, 1 H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 187: 5-(2-хлор-3-фторфенил)-3-((R)-2-метокси-1-метилэтил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
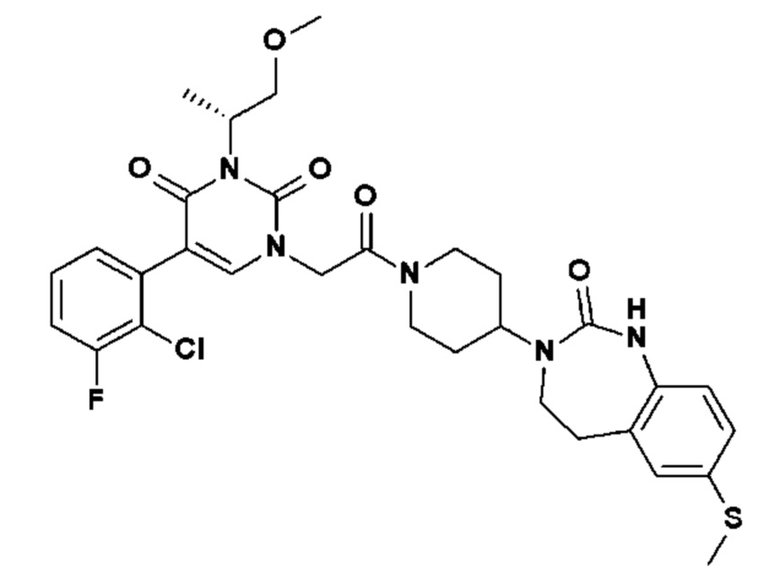
1H ЯМР (δ, ДМСО): 1,33 (д, J=7,0 Гц, 3H), 1,56 (м, 1H), 1,67 (м, 3H), 2,40 (с, 3H), 2,68 (м, 1H), 2,88 (м, 2H), 3,14 (м, 1H), 3,23 (с, 3H), 3,34-3,42 (м, 2H), 3,54 (м, 1H), 3,83-4,04 (м, 2H), 4,33 (м, 1H), 4,43 (д, J=12,8 Гц, 1H), 4,75 (м, 2H), 5,15 (м, 1H), 7,01 (м, 3H), 7,21 (м, 1H), 7,45 (м, 2H), 7,79 (с, 1H), 8,57 (с, 1H).
Соединение 188: 5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
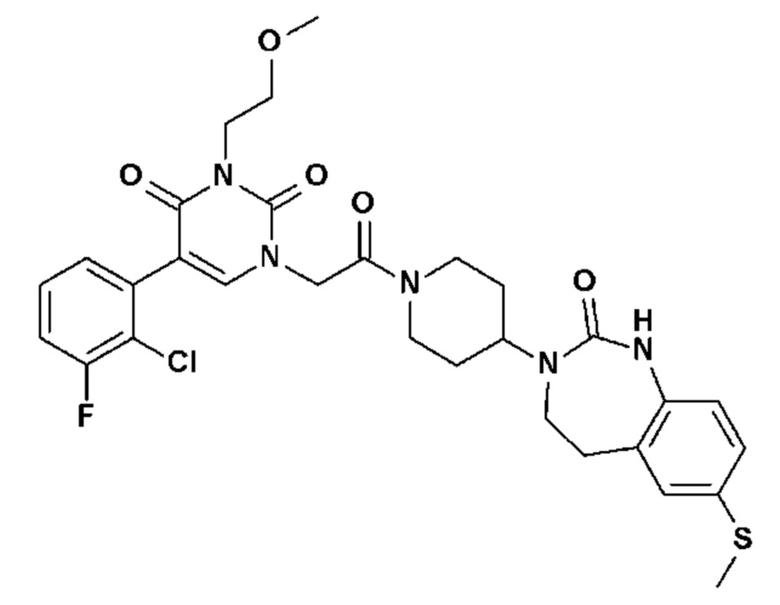
1H ЯМР (δ, ДМСО): 1,45-1,61 (м, 1H), 1,70 (м, 3H), 2,40 (с, 3H), 2,61-2,75 (м, 1H), 2,82-2,93 (м, 2H), 3,09-3,21 (м, 1H), 3,26 (с, 3H), 3,34-3,42 (м, 2H), 3,52 (т, J=6,1 Гц, 2H), 3,94 (д, J=13,5 Гц, 1H), 4,07 (м, 2H), 4,32 (м, 1H), 4,43 (д, J=13,0 Гц, 1H), 4,78 (м, 2H), 6,91-7,09 (м, 3H), 7,17-7,29 (м, 1H), 7,36-7,54 (м, 2H), 7,83 (с, 1H), 8,57 (с, 1H).
Соединение 189: 5-(2-хлор-3-фторфенил)-3-изопропил-1-{2-[4-(7-метилсульфанил-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
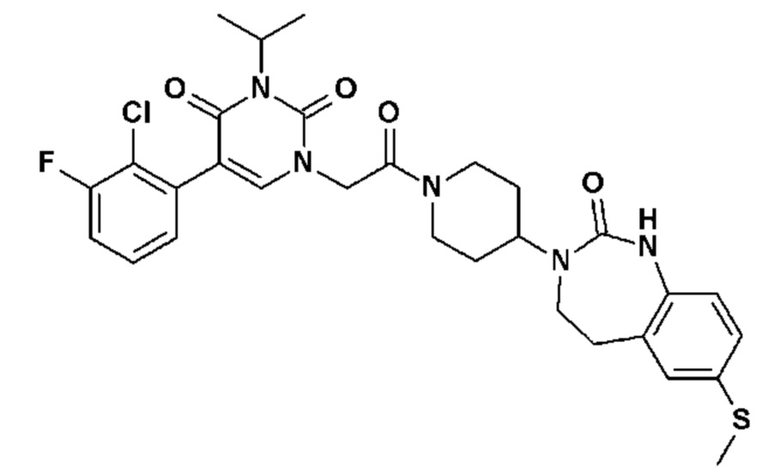
1H ЯМР (δ, ДМСО): 1,41 (д, J=7,0 Гц, 6H), 1,56 (м, 1H), 1,63-1,86 (м, 3H), 2,40 (с, 3H), 2,68 (м, 1H), 2,78-2,95 (м, 2H), 3,15 (м, 1H), 3,33-3,45 (м, 2H), 3,94 (д, J=13,6 Гц, 1H), 4,31 (м, 1H), 4,43 (д, J=12,9 Гц, 1H), 4,74 (м, 2H), 5,11 (p, J=6,9 Гц, 1H), 7,01 (м, 3H), 7,15-7,27 (м, 1H), 7,35-7,52 (м, 2H), 7,77 (с, 1H), 8,56 (с, 1H).
Пример 190: 3-(1-{2-[5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он (реакционная схема № 3, соединение 190)
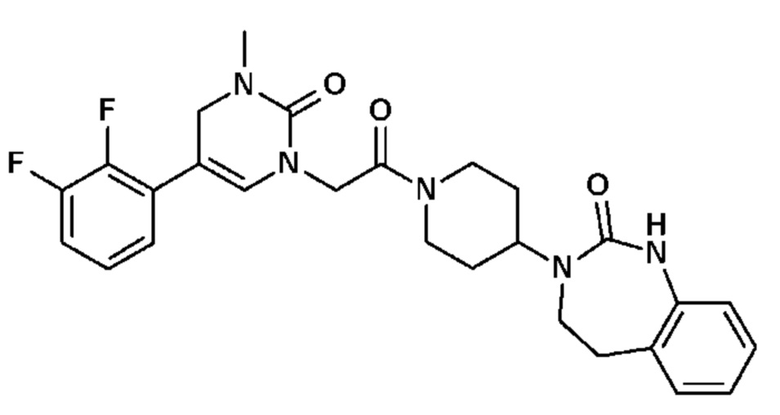
190.1: 5-бром-1-(4-метоксибензил)-1H-пиримидин-2-он
К раствору 5 г (30 ммоль) 5-бром-2-гидроксипиридина в 150 мл дихлорметана добавляли 4 мл (30 ммоль) триэтиламина и затем 4,3 мл 4-метоксибензил хлорида. Реакционную смесь перемешивали при комнатной температуре в течение 48 ч, затем гидролизовали и разбавляли дихлорметаном. Продукт экстрагировали дихлорметаном и затем этилацетатом. Органические фазы объединяли и концентрировали в вакууме. Полученный неочищенный продукт обрабатывали 60 мл этилацетата и затем фильтровали. Полученные твердые вещества сушили с помощью азота в течение 2 ч с получением 4,9 г (46%) 5-бром-1-(4-метоксибензил)-1H-пиримидин-2-она в виде твердого вещества кремового цвета.
190.2: 5-бром-1-(4-метоксибензил)-3,4-дигидро-1H-пиримидин-2-он
К 4,9 г (16,6 ммоль) 5-бром-1-(4-метоксибензил)-1H-пиримидин-2-она в 392 мл изопропанола добавляли 2,5 мл (5,5 ммоль) раствора изопропоксида циркония в гептане с концентрацией 2M. Реакционную смесь (первоначально суспензия белого цвета) нагревали при 90°C в течение 48 часов. Растворители концентрировали в вакууме. Остаток растворяли в дихлорметане и воде. Продукт экстрагировали дихлорметаном. Органические фазы объединяли, промывали три раза водой и затем фильтровали с удалением нерастворимых веществ (солей циркония). Фильтрат концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат 50/50, с получением 3,45 г (70%) 5-бром-1-(4-метоксибензил)-3,4-дигидро-1H-пиримидин-2-она в виде твердого вещества белого цвета.
190.3: 5-бром-1-(4-метоксибензил)-3-метил-3,4-дигидро-1H-пиримидин-2-он
К раствору 1,5 г (5,1 ммоль) 5-бром-1-(4-метоксибензил)-3,4-дигидро-1H-пиримидин-2-она в 23 мл тетрагидрофурана частями добавляли 242 мг (6,1 ммоль) гидрида натрия. Реакционную смесь перемешивали при комнатной температуре в течение 10 мин перед добавлением 0,5 мл (7,6 ммоль) иодметана. Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, потом сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением 1,6 г (100%) 5-бром-1-(4-метоксибензил)-3-метил-3,4-дигидро-1H-пиримидин-2-она в виде масла желтого цвета. Продукт использовали на следующей стадии без очистки.
190.4: 5-(2,3-дифторфенил)-1-(4-метоксибензил)-3-метил-3,4-дигидро-1H-пиримидин-2-он
К предварительно дегазированному раствору 1,6 г (5,1 ммоль) 5-бром-1-(4-метоксибензил)-3-метил-3,4-дигидро-1H-пиримидин-2-она и 12,9 мл (25,7 ммоль) водного раствора карбоната калия с концентрацией 2М в 48 мл N,N-диметилформамида и 16 мл воды добавляли 297 мг (0,3 ммоль) тетракис(трифенилфосфин)палладия(0) и затем 4 г (25,7 ммоль) 2,3-дифторфенилбороновой кислоты. Реакционную смесь нагревали при 90°C в течение 1,5 ч. После охлаждения, реакционную смесь гидролизовали и далее разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью гептан/этилацетат 80/20, с получением 0,7 г (41%) 5-(2,3-дифторфенил)-1-(4-метоксибензил)-3-метил-3,4-дигидро-1H-пиримидин-2-она в виде масла желтого цвета.
190.5: 5-(2,3-дифторфенил)-3-метил-3,4-дигидро-1H-пиримидин-2-он
В 5 мл трифторуксусной кислоты растворяли 640 мг (1,9 ммоль) 5-(2,3-дифторфенил)-1-(4-метоксибензил)-3-метил-3,4-дигидро-1H-пиримидин-2-она. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем концентрировали досуха в вакууме, разбавляли дихлорметаном и, наконец, гидролизовали насыщенным водным раствором гидрокарбоната натрия. Продукт экстрагировали дихлорметаном. Органические фазы объединяли, промывали один раз водой, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученный неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью дихлорметан/этилацетат 80/20. Получали 85 мг (20%) 5-(2,3-дифторфенил)-3-метил-3,4-дигидро-1H-пиримидин-2-она.
190.6: [5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетат
К 85 мг (0,4 ммоль) 5-(2,3-дифторфенил)-3-метил-3,4-дигидро-1H-пиримидин-2-она в растворе в 4,5 мл N,N-диметилформамида добавляли частями 18,2 мг (0,45 ммоль) гидрида натрия. После перемешивания в течение 2 мин при комнатной температуре, добавляли 40 мкл (0,45 ммоль) метилхлорацетата. Реакционную смесь перемешивали при комнатной температуре в течение 40 мин, затем гидролизовали и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 100 мг (89%) [5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата в виде твердого вещества белого цвета.
190.7: 5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусная кислота
В 5 мл тетрагидрофурана и 0,5 мл воды растворяли 100 мг (0,3 ммоль) [5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-метилацетата и затем добавляли 0,5 мл 1M водный раствор гидроксида лития моногидрата. Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, гидролизовали и далее разбавляли этилацетатом. Эту первую этилацетатную фазу отбраковывали. Водную фазу подкисляли до pH=5-6 водным раствором уксусной кислоты с концентрацией C=1M. Продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 80 мг (84%) [5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты в виде твердого вещества белого цвета.
190.8: 3-(1-{2-[5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он (соединение 190)
Аналогично примеру 51.4, используя 80 мг (0,3 ммоль) [5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-уксусной кислоты и 70 мг (0,3 ммоль) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4), получали 80 мг (55%) 3-(1-{2-[5-(2,3-дифторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она.
1H ЯМР (400 МГц, ДМСО): δ (м.д.): 1,59-1,40 (м, 1H), 1,65 (м, 3H), 2,70-2,56 (м, 1H), 2,88 (м, 5H), 3,07 (м, 1H), 3,42-3,35 (м, 2H), 3,90 (д, J=13,6 Гц, 1H), 4,34-4,17 (м, 3H), 4,39 (с, 2H), 4,44 (д, 1H), 6,86-6,69 (м, 2H), 7,13-6,91 (м, 4H), 7,36-7,15 (м, 2H), 8,54 (с, 1H).
Следующие соединения синтезировали в соответствии с аналогичной процедурой, используя соответствующие коммерчески доступные или предварительно полученные реагенты:
Соединение 191: 3-(1-{2-[5-(2,3-дихлорфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
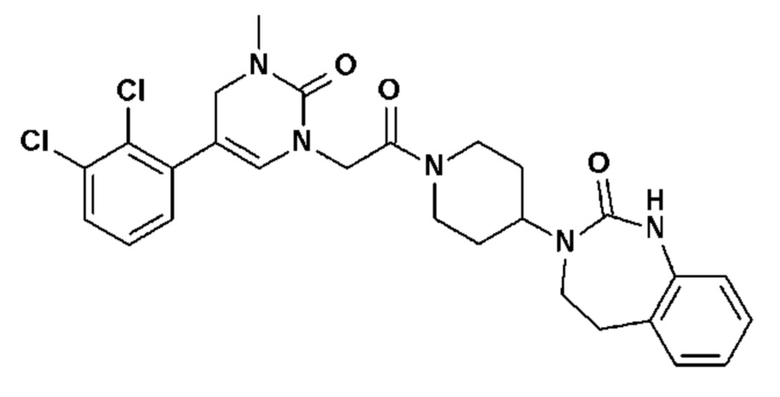
1H ЯМР (δ, ДМСО): 1,45-1,60 (м, 1H), 1,61-1,75 (м, 3H), 2,60 (м, 1H), 2,84 (с, 3H), 2,88 (м, 2H), 3,07 (м, 1H), 3,36 (м, 2H), 3,90 (м, 1H), 4,21 (д, J=2,5 Гц, 2H), 4,25-4,35 (м, 3H), 4,43 (м, 1H), 6,41 (с, 1H), 6,78-6,82 (м, 1H), 7,01-7,04 (м, 3H), 7,30 (дд, J=1,7-7,7 Гц, 1H), 7,36 (т, J=7,8 Гц, 1H), 7,57 (дд, J=1,7-7,9 Гц, 1H), 8,52 (с, 1H).
Соединение 192: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-(2-метоксиэтил)-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
1H ЯМР (δ, ДМСО): 1,53 (м, 1 H); 1,67 (м, 3 H); 2,59-2,64 (м, 1 H); 2,89 (м, 2 H); 3,08 (м, 1 H); 3,27 (с, 3 H); 3,35-3,38 (м, 2 H); 3,46-3,50 (м, 4 H); 3,91 (д, J=13,5 Гц, 1 H); 4,35 (м, 5 H); 4,44 (д, J=13,0 Гц, 1 H); 6,46 (с, 1 H); 6,80-6,82 (м, 1 H); 7,04-7,06 (м, 3 H); 7,18 (м, 1 H); 7,35-7,36 (м, 2 H); 8,52 (с, 1 H).
Соединение 193: 3-(1-{2-[5-(2-хлор-3-метоксифенил)-3-изопропил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
1H ЯМР (δ, ДМСО): 1,21 (д, J=6,9 Гц, 6H), 1,65-2,00 (м, 4H), 2,67-2,82 (м, 1H), 2,94-3,07 (м, 2H), 3,20 (м, 1H), 3,35 (м, 1H), 3,52 (м, 2H), 3,91 (с, 3H), 4,04 (д, 1H), 4,18 (м, 2H), 4,34 (д, J=16,6 Гц, 1H), 4,43 (м, 1H), 4,55 (д, J=16,6 Гц, 1H), 4,60-4,73 (м, 2H), 6,25 (с, 1H), 6,86-6,99 (м, 3H), 7,04 (дд, J=8,6, 1,3 Гц, 1H), 7,06-7,13 (м, 2H), 7,26 (т, J=8,0 Гц, 1H).
Соединение 194: 3-(1-{2-[5-(2,3-дихлорфенил)-2-оксо-3-(2,2,2-трифторэтил)-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
1H ЯМР (δ, ДМСО): 1,53 (м, 1H), 1,65 (м, 3H), 2,62 (м, 1H), 2,79-2,97 (м, 2H), 3,08 (м, 1H), 3,34-3,43 (м, 2H), 3,90 (д, J=13,4 Гц, 1H), 4,17 (м, 2H), 4,24-4,52 (м, 6H), 6,45 (с, 1H), 6,80 (м, 1H), 7,03 (м, 3H), 7,25-7,51 (м, 2H), 7,56-7,72 (м, 1H), 8,53 (с, 1H).
Соединение 195: 1'-[2-[5-(2,3-дихлорфенил)-3-метил-2-оксо-4H-пиримидин-1-ил]ацетил]спиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-2-он
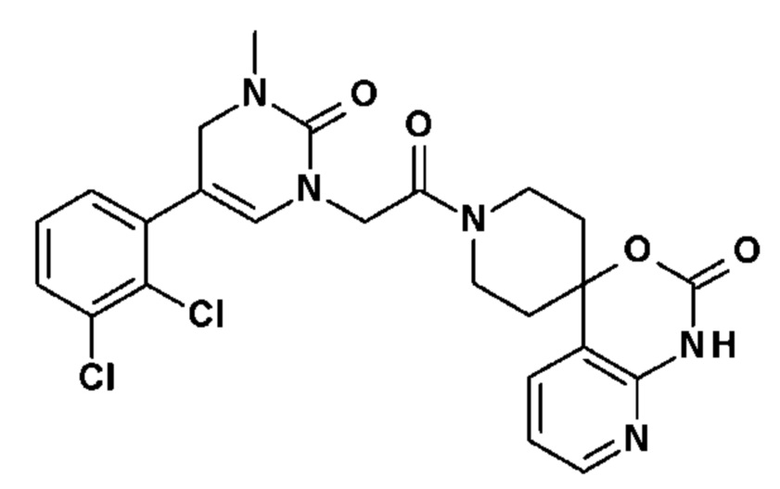
1H ЯМР (δ, ДМСО): 2,00 (м, 4H), 2,85 (с, 3H), 2,93 (м, 1H), 3,39 (м, 1H), 3,85 (д, J=13,7 Гц, 1H), 4,22 (м, 2H), 4,37 (м, 3H), 6,41 (с, 1H), 7,09 (м, 1H), 7,22-7,45 (м, 2H), 7,58 (дд, J=7,8, 1,8 Гц, 1H), 7,71 (д, J=7,6 Гц, 1H), 8,21 (д, J=4,9 Гц, 1H), 10,86 (с, 1H).
Соединение 196: 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-4-фенил-2,3-дигидро-имидазол-1-ил)-пиперидин-1-ил]-этил}-3,4-дигидро-1H-пиримидин-2-он
1H ЯМР (δ, ДМСО): 1,54-1,93 (м, 4H), 2,70 (м, 1H), 2,85 (с, 3H), 3,15 (м, 1H), 3,95 (д, J=13,4 Гц, 1H), 4,11 (м, 1H), 4,22 (м, 2H), 4,37 (с, 2H), 4,48 (д, J=13,2 Гц, 1H), 6,40 (с, 1H), 7,10-7,22 (м, 2H), 7,35 (м, 4H), 7,50 (д, J=7,3 Гц, 2H), 7,54-7,61 (м, 1H), 10,71 (ушир.с, 1H).
Соединение 197: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-метил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
1H ЯМР (δ, ДМСО): 1,52 (м, 1H), 1,65 (м, 3H), 2,61 (м, 1H), 2,85 (с, 3H), 2,88 (м, 2H), 3,08 (м, 1H), 3,37 (м, 2H), 3,90 (д, J=13,7 Гц, 1H), 4,11-4,55 (м, 6H), 6,48 (с, 1H), 6,71-6,88 (м, 1H), 7,03 (м, 3H), 7,19 (дт, J=7,3, 1,5 Гц, 1H), 7,35 (м, 2H), 8,52 (с, 1H).
Соединение 198: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-этил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
1H ЯМР (δ, ДМСО): 1,08 (т, J=7,1 Гц, 3H), 1,41-1,59 (м, 1H), 1,66 (м, 3H), 2,60 (м, 2H), 2,80-2,93 (м, 2H), 3,08 (м, 1H), 3,34-3,45 (м, 3H), 3,90 (д, J=13,5 Гц, 1H), 4,16-4,38 (м, 5H), 4,42 (д, J=13,5 Гц, 1H), 6,46 (с, 1H), 6,73-6,88 (м, 1H), 7,03 (м, 3H), 7,13-7,23 (м, 1H), 7,27-7,47 (м, 2H), 8,53 (с, 1H).
Соединение 199: 3-(1-{2-[5-(2,3-дихлорфенил)-3-этил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
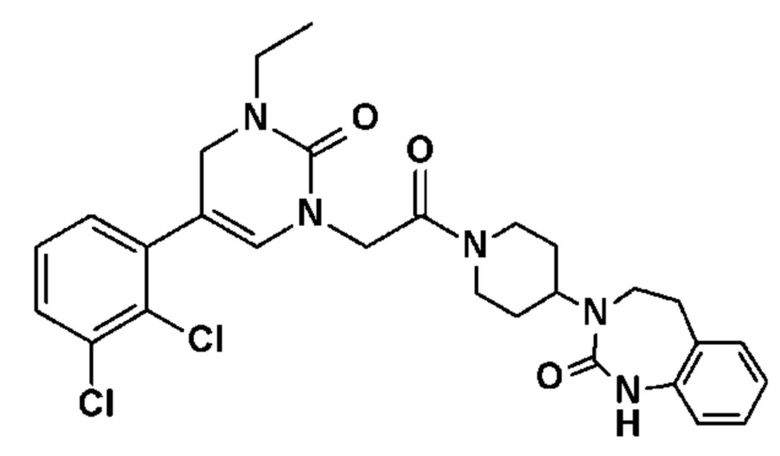
1H ЯМР (δ, ДМСО): 1,08 (т, J=7,1 Гц, 3H), 1,52 (м, 1H), 1,64 (м, 3H), 2,61 (м, 1H), 2,88 (м, 2H), 3,08 (м, 1H), 3,36 (м, 4H), 3,90 (д, J=13,4 Гц, 1H), 4,12-4,56 (м, 6H), 6,40 (с, 1H), 6,80 (м, 1H), 7,03 (м, 3H), 7,22-7,45 (м, 2H), 7,58 (дд, J=7,7, 1,8 Гц, 1H), 8,52 (с, 1H).
Соединение 200: 3-(1-{2-[5-(2-хлор-3-фторфенил)-3-изопропил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
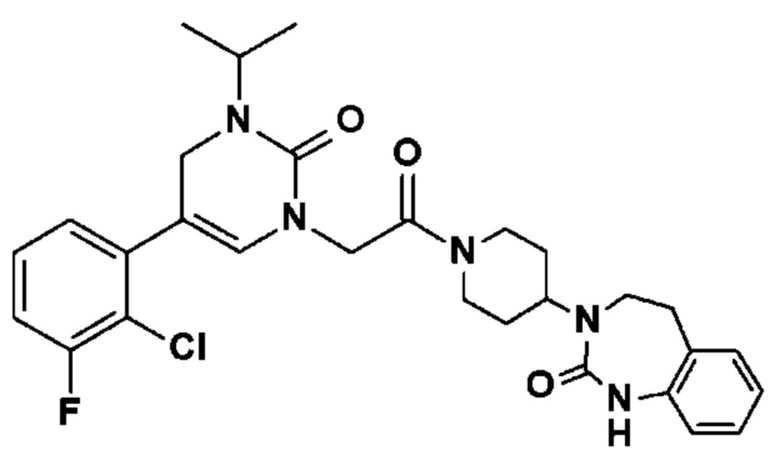
1H ЯМР (δ, ДМСО): 1,11 (д, J=6,8 Гц, 6H), 1,40-1,57 (м, 1H), 1,67 (м, 3H), 2,53-2,71 (м, 1H), 2,79-2,96 (м, 2H), 2,98-3,16 (м, 1H), 3,34-3,41 (м, 2H), 3,91 (д, J=13,8 Гц, 1H), 4,09 (м, 2H), 4,21-4,60 (м, 5H), 6,46 (с, 1H), 6,70-6,88 (м, 1H), 6,93-7,10 (м, 3H), 7,15-7,23 (м, 1H), 7,27-7,44 (м, 2H), 8,53 (с, 1H).
Соединение 201: 3-(1-{2-[5-(2,3-дихлорфенил)-3-изопропил-2-оксо-3,4-дигидро-2H-пиримидин-1-ил]-ацетил}-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он
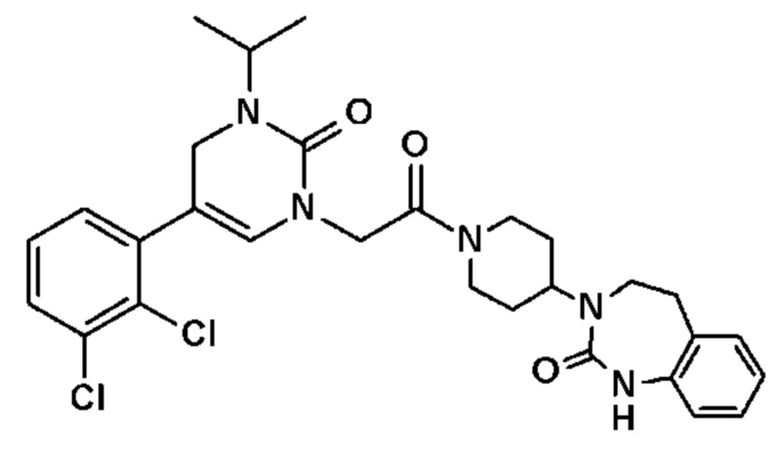
1H ЯМР (δ, ДМСО): 1,17 (д, J=6,8 Гц, 6H), 1,58 (м, 1H), 1,71 (м, 3H),2,56- 2,73 (м, 1H), 2,94 (м, 2H), 3,14 (м, 1H), 3,41-3,51 (м, 2H), 3,97 (д, J=13,9 Гц, 1H), 4,12 (м, 2H), 4,33-4,44 (м, 3H), 4,46-4,62 (м, 2H), 6,46 (с, 1H), 6,86 (м, 1H), 7,09 (м, 3H), 7,33-7,47 (м, 2H), 7,64 (дд, J=8,0, 1,8 Гц, 1H), 8,58 (с, 1H).
Соединения, описанные ниже, также получали в соответствии с процедурами, аналогичными описанным выше во всей экспериментальной части, используя соответствующие коммерчески доступные или предварительно полученные реагенты в соответствии с обычными способами органического синтеза:
Соединение 208: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-5-фенил-1H-имидазол-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
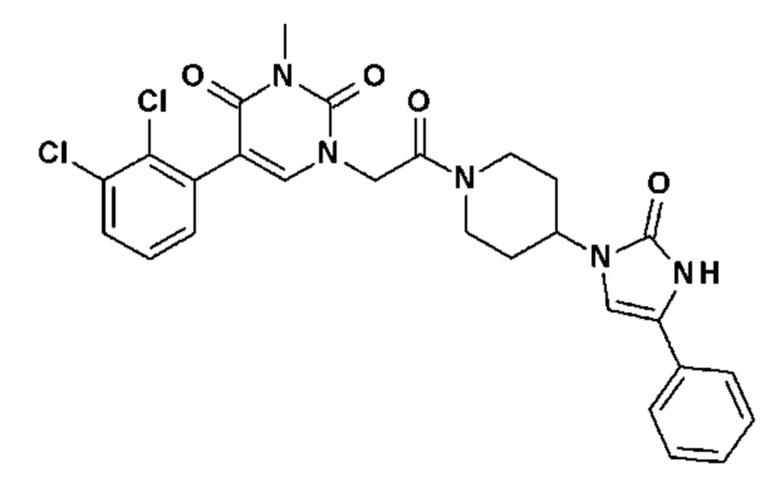
1H ЯМР (δ, ДМСО): 1,54-1,94 (м, 4H), 2,69-2,84 (м, 1H), 3,21 (м, 1H), 3,25 (с, 3H), 4,01 (д, J=13,0 Гц, 1H), 4,09-4,26 (м, 1H), 4,46 (д, J=12,7 Гц, 1H), 4,66-4,95 (м, 2H), 7,11-7,22 (м, 2H), 7,33 (м, 3H), 7,43 (т, J=7,8 Гц, 1H), 7,47-7,54 (м, 2H), 7,69 (дд, J=8,0, 1,6 Гц, 1H), 7,84 (с, 1H), 10,74 (м, 1H).
Соединение 209: 2-[5-(2,3-дихлорфенил)-3-метил-2,4-диоксо-пиримидин-1-ил]-N-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]ацетамид
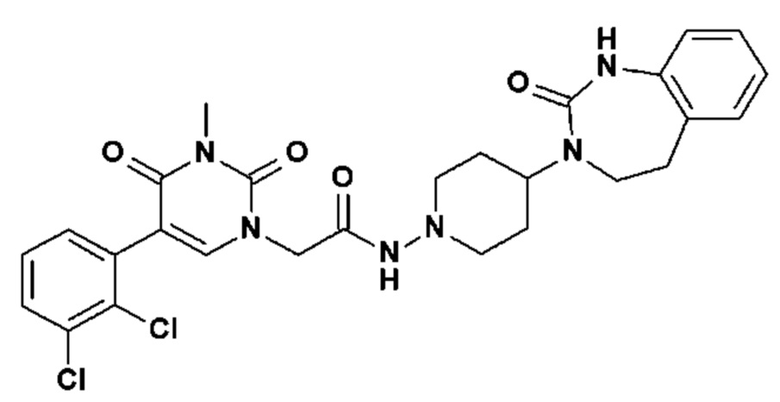
1H ЯМР (δ, ДМСО): 1,48-1,74 (м, 2H), 1,75-1,96 (м, 2H), 2,62 (м, 2H), 2,90 (м, 2H), 2,99 (д, J=10,6 Гц, 1H), 3,07 (м, 1H), 8,97 (ушир.с, 1H), 3,24 (м, 3H), 3,40 (м, 2H), 4,03 (м, 1H), 4,76 (с, 2H), 6,68-6,90 (м, 1H), 7,04 (д, J=4,7 Гц, 3H), 7,32 (м, 1H), 7,43 (т, J=7,8 Гц, 1H), 7,69 (дд, J=8,0, 1,6 Гц, 1H), 7,89 (м, 1H), 8,50 (м, 1H).
Соединение 210: 5-(2,3-дихлорфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
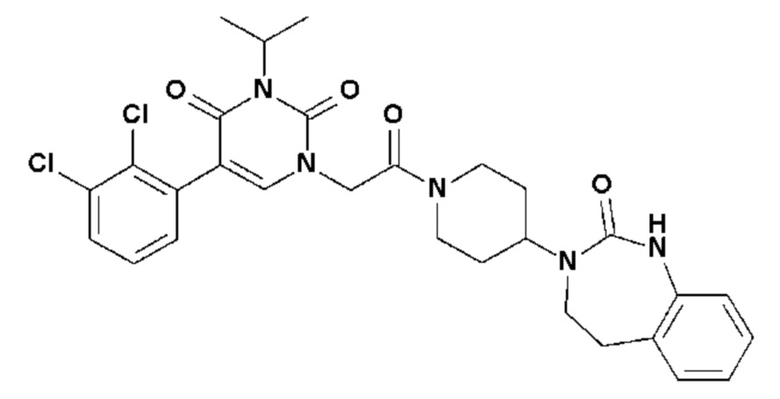
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,9 Гц, 6H), 1,48-1,60 (м, 1H), 1,64-1,80 (м, 3H), 2,68 (м, 1H), 2,89 (м, 2H), 3,14 (м, 1H), 3,37 (м, 2H), 3,91 (д, J=12,8 Гц, 1H), 4,25-4,38 (м, 1H), 4,43 (д, J=12,8 Гц, 1H), 4,73 (м, 2H), 5,10 (м, 1H), 6,78-6,82 (м, 1H), 7,01-7,04 (м, 3H), 7,32 (дд, J=1,6-7,7 Гц, 1H), 7,41 (т, J=7,8 Гц, 1H), 7,68 (дд, J=1,6-8,0 Гц, 1H), 7,76 (с, 1H), 8,54 (с, 1H).
Соединение 211: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-(2-оксоспиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-1'-ил)этил]пиримидин-2,4-дион
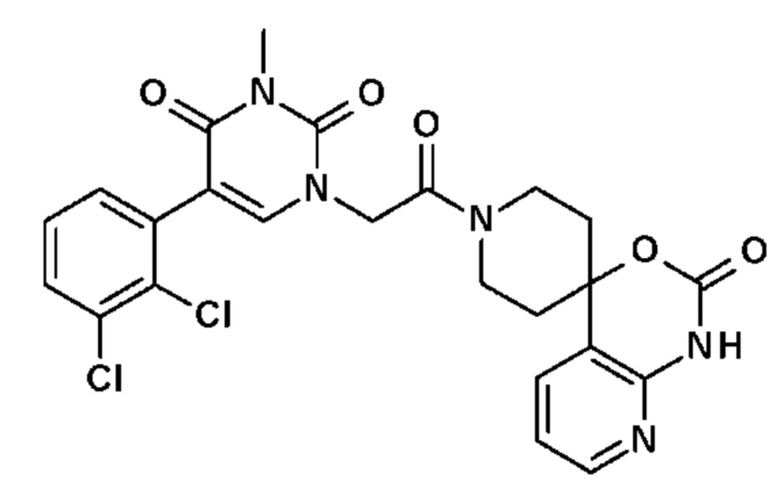
1H ЯМР (δ, ДМСО): 1,90-2,15 (м, 4H), 2,99 (м, 1H), 3,25 (с, 3H), 3,43 (м, 1H), 3,90 (д, J=12 Гц, 1H), 4,35 (д, J=12 Гц, 1H), 4,82 (м, 2H), 7,08-7,11 (м, 1H), 7,32 (дд, J=1,6-7,6 Гц, 1H), 7,43 (т, J=7,8 Гц, 1H), 7,68-7,71 (м, 2H), 7,81 (с, 1H), 8,21 (дд, J=1,6-4,9 Гц, 1H), 10,88 (ушир.с, 1H).
Соединение 213: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[2,3-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
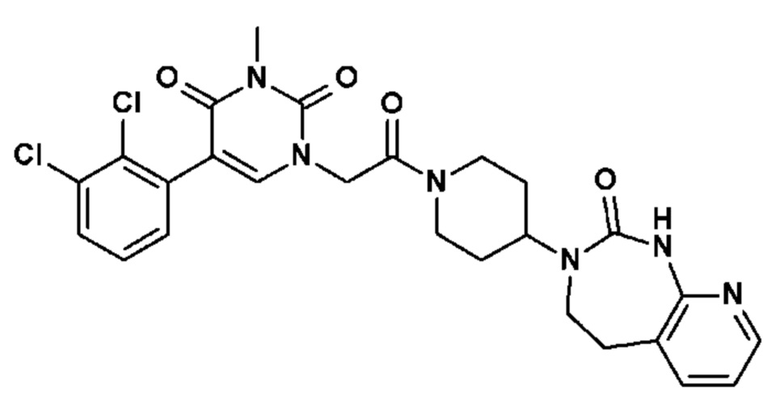
1H ЯМР (δ, ДМСО): 1,56 (м, 1H), 1,71 (м, 3H), 2,69 (м, 1H), 2,84-2,93 (м, 2H), 3,16 (м, 1H), 3,25 (с, 3H), 3,39-3,46 (м, 2H), 3,95 (д, J=14,2 Гц, 1H), 4,33 (м, 1H), 4,43 (д, J=12,4 Гц, 1H), 4,78 (с, 2H), 7,06 (м, 1H), 7,32 (дд, J=7,6, 1,6 Гц, 1H), 7,43 (т, J=7,9 Гц, 1H), 7,50 (дд, J=7,6, 1,7 Гц, 1H), 7,68 (м, 1H), 7,82 (с, 1H), 8,18 (дд, J=5,2, 1,7 Гц, 1H), 8,91 (с, 1H).
Соединение 214: 5-(2,3-диметилфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-5-фенил-1H-имидазол-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
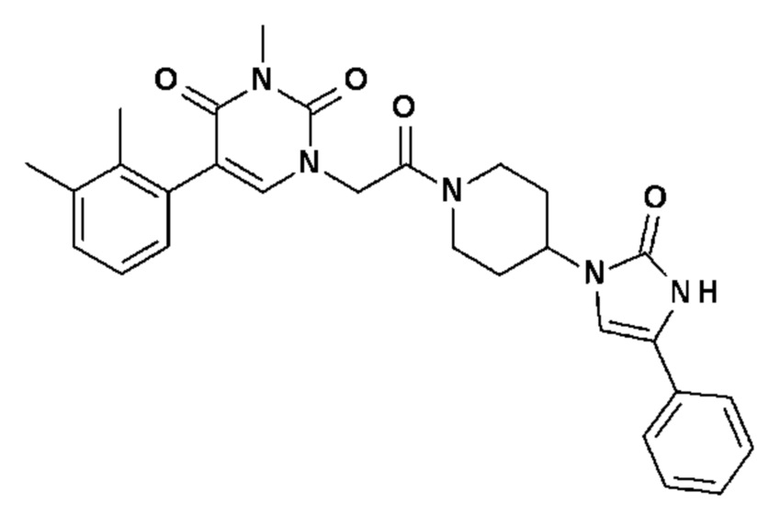
1H ЯМР (δ, ДМСО): 1,54-1,95 (м, 4H), 2,05 (с, 3H), 2,28 (с, 3H), 2,77 (м, 1H), 3,25 (м, 4H), 3,86-4,06 (д, J=13,1 Гц, 1H), 4,15 (м, 1H), 4,47 (д, J=13,1 Гц, 1H), 4,79 (м, 2H), 6,96 (д, J=7,3 Гц, 1H), 7,14 (м, 4H), 7,33 (т, J=7,6 Гц, 2H), 7,50 (д, J=7,8 Гц, 2H), 7,59 (с, 1H), 10,72 (с, 1H).
Соединение 215: 5-(2,3-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-1H-хинолин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,36-1,66 (м, 2H), 1,91 (м, 2H), 2,66-2,82 (м, 1H), 3,06 (м, 1H), 3,15-3,22 (м, 1H), 3,24 (с, 3H), 4,00 (д, J=13,1 Гц, 1H), 4,49 (д, J=13,0 Гц, 1H), 4,79 (с, 2H), 7,10-7,19 (м, 1H), 7,28 (д, J=8,1 Гц, 1H), 7,32 (дд, J=7,7, 1,6 Гц, 1H), 7,41 (д, J=7,9 Гц, 1H), 7,43-7,48 (м, 1H), 7,63 (дд, J=8,0, 1,4 Гц, 1H), 7,66-7,73 (м, 2H), 7,86 (с, 1H), 11,80 (с, 1H).
Соединение 216: 5-(2,3-диметилфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[4,3-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,8 Гц, 6H), 1,50-1,62 (м, 1H), 1,63-1,80 (м, 3H), 2,04 (с, 3H), 2,27 (с, 3H), 2,68 (м, 1H), 2,90 (м, 2H), 3,15 (м, 1H), 3,40 (м, 2H), 3,95 (м, 1H), 4,30-4,40 (м, 1H), 4,45 (д, J=13 Гц, 1H), 4,75 (м, 2H), 5,15 (м, 1H), 6,93-6,98 (м, 2H), 7,10 (т, 1H), 7,18 (д, 1H), 7,54 (с, 1H), 8,09 (д, J=5,6 Гц, 1H), 8,14 (с, 1H), 9,11 (с, 1H).
Соединение 217: 5-(2,3-диметилфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[3,2-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,40 (д, J=6,8 Гц, 6H), 1,5-1,62 (м, 1H), 1,65-1,85 (м, 3H), 2,04 (с, 3H), 2,27 (с, 3H), 2,68 (м, 1H), 3,03 (м, 2H), 3,14 (м, 1H), 3,45 (м, 2H), 3,93 (д, J=12,6 Гц, 1H), 4,25-4,48 (м, 1H), 4,43 (д, J=13,2 Гц, 1H), 4,72 (м, 2H), 5,11 (м, 1H), 6,96 (д, J=7 Гц, 1H), 7,08-7,13 (м, 2H), 7,16 (д, J=7,2 Гц, 1H), 7,42 (дд, J=1,3-8,2 Гц, 1H), 7,55 (с, 1H), 8,03 (м, 1H), 8,67 (с, 1H).
Соединение 218: 5-(2,3-диметилфенил)-3-изопропил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-пиридо[2,3-d][1,3]диазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
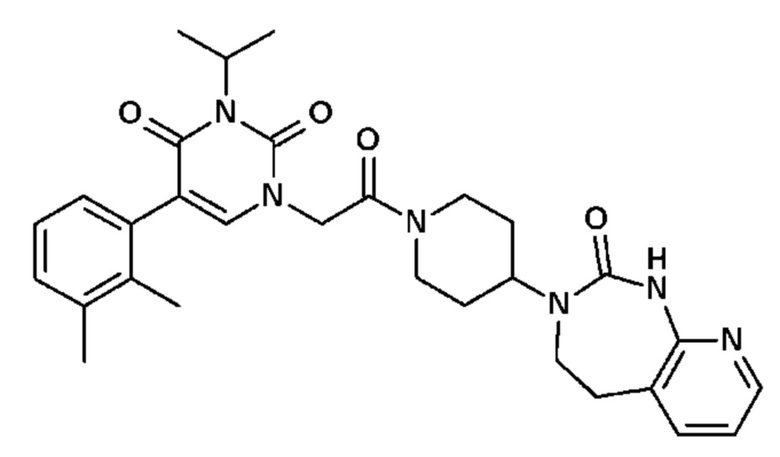
1H ЯМР (δ, ДМСО): 1,40 (д, 6H), 1,5-1,62 (м, 1H), 1,63-1,80 (м, 3H), 2,04 (с, 3H), 2,27 (с, 3H), 2,68 (м, 1H), 2,89 (м, 2H), 3,15 (м, 1H), 3,42 (м, 2H), 3,95 (д, J=13 Гц, 1H), 4,28-4,38 (м, 1H, 4,45 (д, J=13 Гц, 1H), 4,72 (м, 2H), 5,11 (м, 1H), 6,89-6,92 (м, 1H), 6,95 (д, J=7,2 Гц, 1H), 7,09 (т, J=7,5 Гц, 1H), 7,16 (д, J=7,2 Гц, 1H), 7,49-7,51 (м, 1H), 7,54 (с, 1H), 8,08 (м, 1H), 8,31 (с, 1H).
Соединение 219: 5-(2,3-дихлорфенил)-3-метил-1-{2-оксо-2-[4-(2-оксо-[1,3]диазепан-1-ил)-пиперидин-1-ил]-этил}-1H-пиримидин-2,4-дион
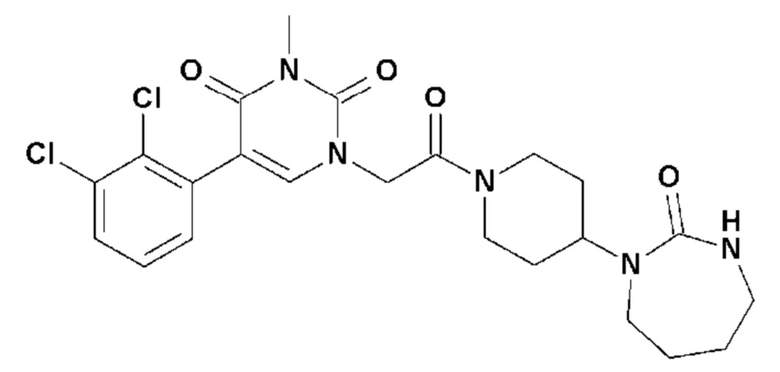
1H ЯМР (δ, ДМСО): 1,33-1,57 (м, 5H), 1,57-1,75 (м, 3H), 2,63 (м, 1H), 2,91 (м, 2H), 3,02 (м, 2H), 3,10 (м, 1H), 3,24 (с, 3H), 3,82-4,06 (м, 2H), 4,39 (д, J=13,0 Гц, 1H), 4,65-4,87 (м, 2H), 5,93 (т, J=4,2 Гц, 1H), 7,32 (дд, J=7,5, 1,5 Гц, 1H), 7,42 (т, J=7,9 Гц, 1H), 7,69 (дд, J=8,0, 1,5 Гц, 1H), 7,82 (с, 1H).
Соединение 220: 5-(3,4-дихлорфенил)-3-метил-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
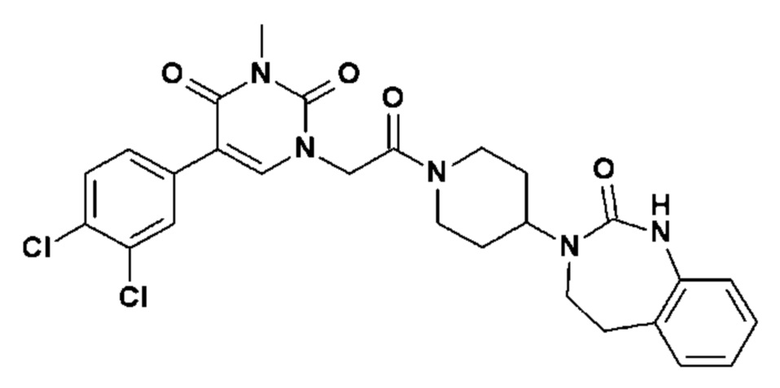
1H ЯМР (δ, ДМСО): 1,39-1,56 (м, 1H), 1,56-1,75 (м, 3H), 2,62 (м, 1H), 2,79-2,88 (м, 2H), 3,03-3,16 (м, 1H), 3,19 (с, 3H), 3,31 (м, 2H), 3,90 (м, 1H), 4,17-4,32 (м, 1H), 4,35 (д, J=13,6 Гц, 1H), 4,74 (м, 2H), 6,67-6,83 (м, 1H), 6,90-7,06 (м, 3H), 7,54 (дд, J=8,5, 2,0 Гц, 1H), 7,62 (д, J=8,8 Гц, 1H), 7,81 (д, J=2,0 Гц, 1H), 8,05 (с, 1H), 8,46 (с, 1H).
Соединение 221: 1-[2-[4-(7-бром-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-5-(2-хлор-3-фторфенил)-3-изопропил-пиримидин-2,4-дион
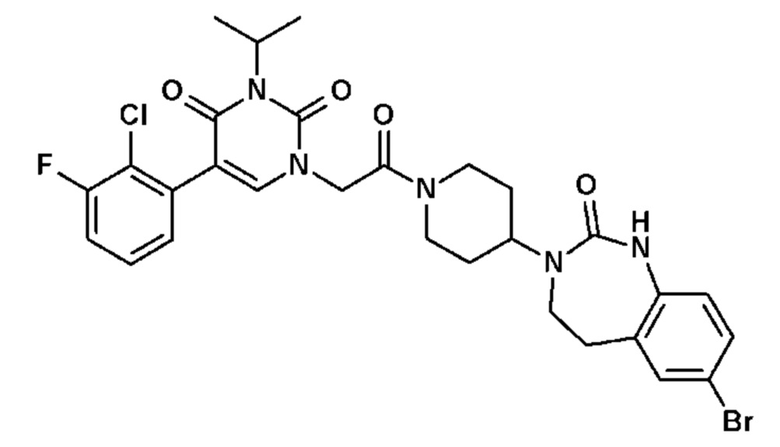
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,8 Гц, 6H), 1,55 (м, 1H), 1,61-1,82 (м, 3H), 2,65 (м, 1H), 2,84-2,94 (м, 2H), 3,15 (м, 1H), 3,34-3,42 (м, 2H), 3,84-4,03 (м, 1H), 4,32 (м, 1H), 4,38-4,51 (м, 1H), 4,64-4,84 (м, 2H), 5,11 (гептет, J=7,0 Гц, 1H), 7,01 (д, J=8,7 Гц, 1H), 7,16-7,30 (м, 3H), 7,35-7,52 (м, 2H), 7,77 (с, 1H), 8,71 (с, 1H).
Соединение 222: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[4-метил-4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
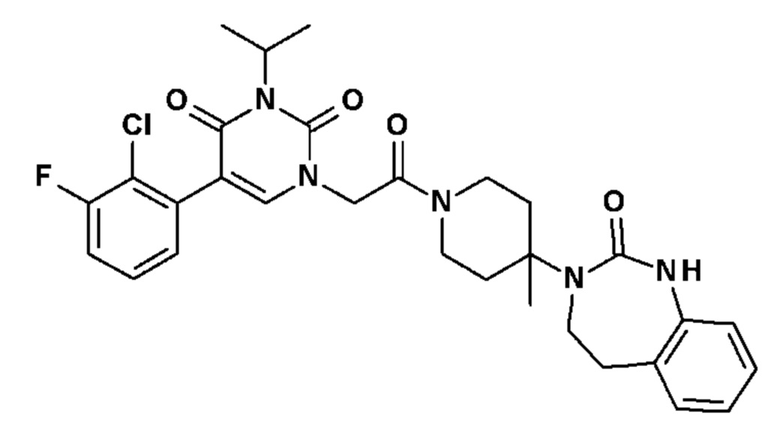
1H ЯМР (δ, ДМСО): 1,47-1,50 (м, 9 H); 1,91-1,93 (м, 1 H); 2,05-2,09 (м, 1 H); 2,22-2,29 (м, 1 H); 2,41-2,46 (м, 1 H); 3,09 (м, 2H); 3,34 (м, 1H), 3,45-3,52 (м, 2H); 3,53-3,60 (м, 2 H); 3,63-3,69 (м, 2 H); 4,68 (д, J=16,5 Гц, 1H); 4,79 (д, J=16,4 Гц, 1H); 5,16-5,23 (м, 1 H); 6,99-6,88 (м, 2H), 7,12-7,06 (м, 1H), 7,14 (дд, J=7,7, 1,4 Гц, 1H), 7,18 (дт, J=7,7, 1,3 Гц, 1H), 7,29-7,23 (м, 1H), 7,35 (м, 1H); 7,54 (с, 1H).
Соединение 223: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[(2S)-2-метил-4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,19 (д, J=6,0 Гц, 3H), 1,41 (д, J=6,7 Гц, 6H), 1,61 (м, 1H), 1,72-1,92 (м, 2H), 2,01 (м, 1H), 2,53 (м, 1H), 2,88-2,97 (м, 2H), 3,41-3,50 (м, 2H), 3,77 (ушир.с, 1H), 4,06 (м, 1H), 4,54-4,86 (м, 2H), 5,10 (гептет, J=6,9 Гц, 1H), 6,82 (м, 1H), 6,95-7,10 (м, 3H), 7,16-7,29 (м, 1H), 7,35-7,52 (м, 2H), 7,84 (с, 1H), 8,52 (с, 1H).
Соединение 224: 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]пропионовая кислота
Масса=598.
Соединение 225: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[4-(7-метилсульфинил-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,41 (д, J=6,9 Гц, 6H), 1,48-1,63 (м, 1H), 1,63-1,86 (м, 3H), 2,67 (м, 4H), 2,97 (м, 2H), 3,15 (м, 1H), 3,36-3,49 (м, 2H), 3,94 (д, J=13,5 Гц, 1H), 4,35 (м, 1H), 4,44 (д, J=13,5 Гц, 1H), 4,75 (м, 2H), 5,11 (гептет, J=6,8 Гц, 1H), 7,18-7,26 (м, 2H), 7,36 (м, 2H), 7,40-7,49 (м, 2H), 7,77 (с, 1H), 8,90 (с, 1H).
Соединение 226: 2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]ацетамид
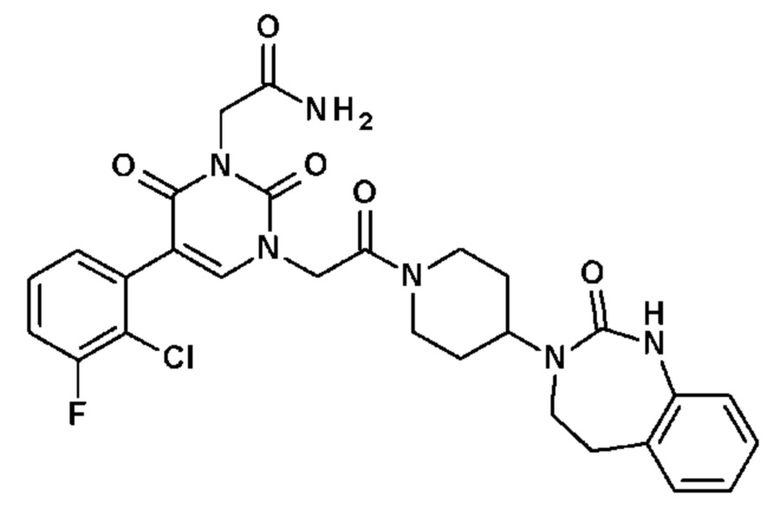
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,71 (м, 3H), 2,69 (м, 1H), 2,83-2,95 (м, 2H), 3,08-3,23 (м, 1H), 3,34-3,44 (м, 2H), 3,96 (д, J=13,7 Гц, 1H), 4,33 (м, 1H), 4,44 (м, 3H), 4,79 (с, 2H), 6,72-6,91 (м, 1H), 6,99-7,07 (м, 3H), 7,11 (ушир.с, 1H), 7,19-7,29 (м, 1H), 7,40-7,52 (м, 2H), 7,56 (ушир.с, 1H), 7,87 (с, 1H), 8,52 (с, 1H).
Соединение 227: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфинилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
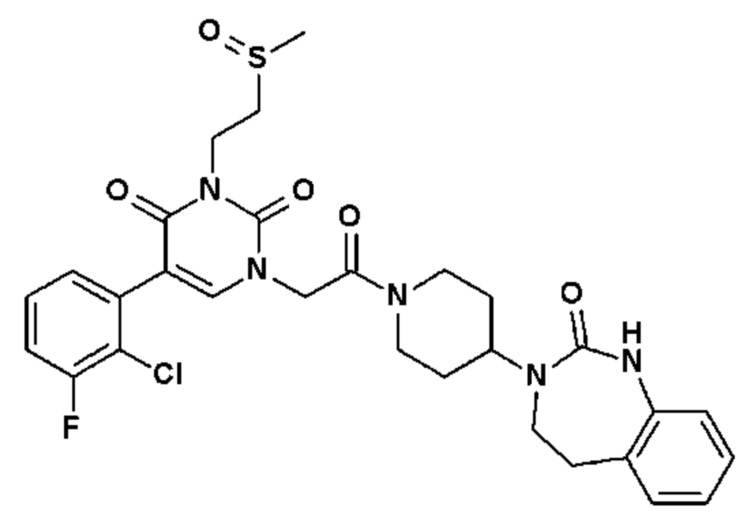
1H ЯМР (δ, ДМСО): 1,47-1,62 (м, 1H), 1,69 (м, 3H), 2,61 (с, 3H), 2,69 (м, 1H), 2,86-2,93 (м, 2H), 2,95 (м, 1H), 3,06 (м, 1H), 3,16 (м, 1H), 3,34-3,47 (м, 2H), 3,95 (д, J=13,6 Гц, 1H), 4,23 (м, 3H), 4,43 (д, J=12,7 Гц, 1H), 4,80 (с, 2H), 6,73-6,89 (м, 1H), 6,96-7,10 (м, 3H), 7,16-7,29 (м, 1H), 7,38-7,54 (м, 2H), 7,87 (с, 1H), 8,53 (с, 1H).
Соединение 228: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
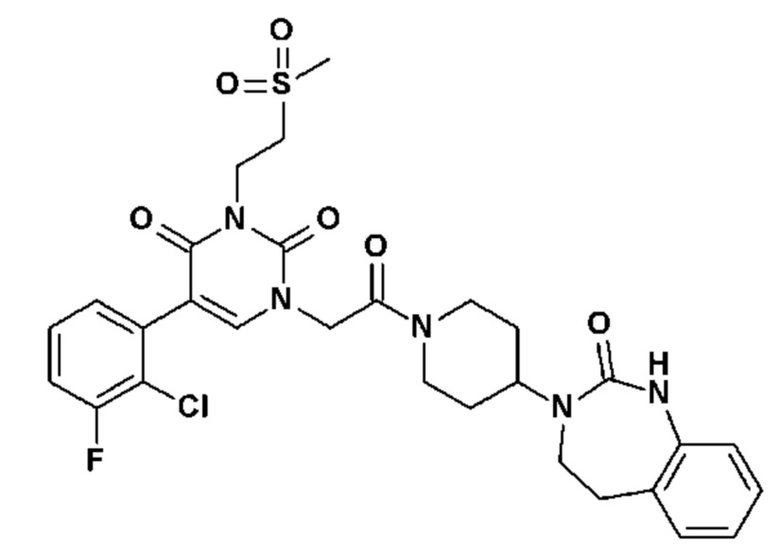
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,71 (м, 3H); 2,69 (м, 1H); 2,90 (м, 2H); 3,09 (с, 3H); 3,16 (м, 1H); 3,36-3,43 (м, 4H); 3,96 (д, J=13,6 Гц, 1H); 4,29-4,33 (м, 3H); 4,43 (д, J=12,9 Гц, 1H); 4,80 (с, 2H); 6,79-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,21-7,23 (м, 1H); 7,45-7,49 (м, 2H); 7,88 (с, 1H); 8,55 (с, 1H).
Соединение 229: 5-(2-хлор-3-фторфенил)-3-((S)-2-метокси-1-метилэтил)-1-{2-[4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-ил]-2-оксо-этил}-1H-пиримидин-2,4-дион
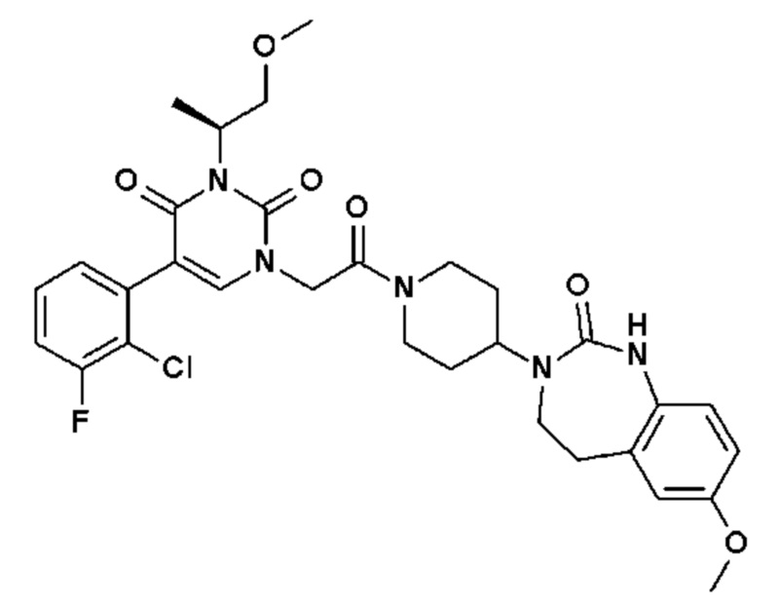
1H ЯМР (δ, ДМСО): 1,33 (дд, J=7,0, 1,8 Гц, 3H); 1,55 (м, 1H), 1,70 (м, 3H), 2,68 (м, 1H); 2,88 (м, 2H); 3,14 (м, 1H); 3,24 (с, 3H); 3,35-3,37 (м, 2H); 3,52-3,56 (м, 1H); 3,67 (с, 3H); 3,92 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,75 (м, 2H); 5,15 (м, 1H); 6,62 (д, J=2,9 Гц, 1H), 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H); 7,20-7,22 (м, 1H); 7,43-7,47 (м, 2H); 7,80 (с, 1H); 8,33 (с, 1H).
Соединение 230: 5-(2-хлор-3-фторфенил)-3-изопропил-1-[2-[4-(7-метокси-5,5-диметил-2-оксо-1,4-дигидро-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
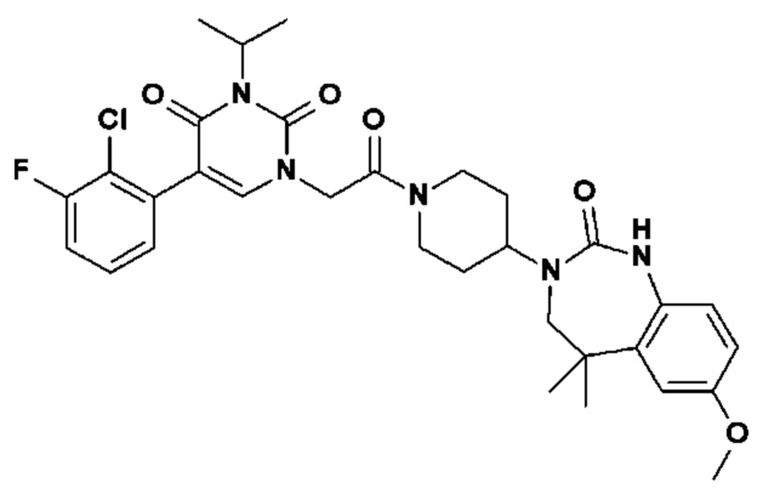
1H ЯМР (δ, ДМСО): 1,27 (д, 6H), 1,41 (д, J=6,8 Гц, 6H), 1,72 (м, 3H), 1,87 (м, 1H), 2,64 (м, 1H), 3,11 (м, 1H), 3,23 (с, 2H), 3,69 (с, 3H), 3,94 (д, J=13,4 Гц, 1H), 4,01 (м, 1H), 4,44 (д, J=12,7 Гц, 1H), 4,74 (м, 2H), 5,11 (p, J=6,8 Гц, 1H), 6,67 (дд, J=9,0, 3,0 Гц, 1H), 6,84 (д, J=3,0 Гц, 1H), 6,96 (д, J=8,9 Гц, 1H), 7,15-7,28 (м, 1H), 7,37-7,52 (м, 2H), 7,78 (с, 1H), 8,23 (с, 1H).
Соединение 231: 5-(2,3-дифторфенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,44-1,61 (м, 1H), 1,70 (м, 3H), 2,68 (м, 1H), 2,87 (м, 2H), 3,14 (м, 1H), 3,24 (с, 6H), 3,35-3,44 (м, 2H), 3,60 (м, 2H), 3,67 (с, 3H), 3,77-3,90 (м, 2H), 3,94 (д, J=13,8 Гц, 1H), 4,28 (м, 1H), 4,43 (д, J=13,2 Гц, 1H), 4,78 (м, 2H), 5,29 (ушир.с, 1H), 6,63 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,12-7,34 (м, 2H), 7,39-7,54 (м, 1H), 7,90 (с, 1H), 8,33 (с, 1H).
Соединение 232: 5-(2-хлор-3-фторфенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,55 (м, 1 H); 1,68 (м, 3 H); 2,68 (м, 1 H); 2,88 (м, 2 H); 3,14 (м, 1 H); 3,24 (с, 6H), 3,37 (м, 2 H); 3,60 (м, 2 H); 3,67 (с, 3 H); 3,86 (м, 2 H); 3,94 (д, J=13,5 Гц, 1 H); 4,28 (м, 1 H); 4,43 (д, J=12,9 Гц, 1 H); 4,78 (м, 2 H); 5,30 (ушир.с, 1 H); 6,62 (д, J=3,0 Гц, 1H); 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1 H); 7,21-7,23 (м, 1 H); 7,43-7,46 (м, 2 H); 7,82 (с, 1 H); 8,33 (с, 1 H).
Соединение 233: 5-(2-хлор-3-фторфенил)-3-[(1S)-2-метокси-1-метилэтил]-1-[2-[4-(7-метилсульфанил-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,33 (м, 3H), 1,55 (м, 1H), 1,70 (м, 3H), 2,40 (с, 3H), 2,68 (м, 1H), 2,82-2,93 (м, 2H), 3,14 (м, 1H), 3,23 (с, 3H), 3,34-3,42 (м, 2H), 3,54 (м, 1H), 3,82-3,99 (м, 2H), 4,31 (м, 1H), 4,43 (д, J=12,7 Гц, 1H), 4,75 (м, 2H), 5,14 (м, 1H), 7,01 (м, 3H), 7,21 (м, 1H), 7,36-7,55 (м, 2H), 7,79 (с, 1H), 8,57 (с, 1H).
Соединение 234: 5-(2-хлор-3-фторфенил)-3-(2-гидрокси-2-метилпропил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
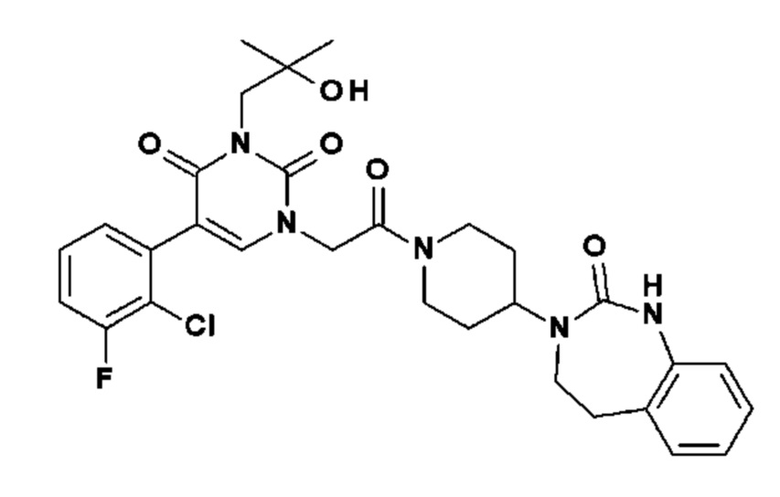
1H ЯМР (δ, ДМСО): 1,10 (с, 6H), 1,55 (м, 1H), 1,68 (м, 3H), 2,69 (м, 1H), 2,83-2,96 (м, 2H), 3,15 (м, 1H), 3,35-3,42 (м, 2H), 3,96 (м, 3H), 4,33 (м, 1H), 4,44 (м, 2H), 4,78 (м, 2H), 6,69-6,89 (м, 1H), 6,96-7,10 (м, 3H), 7,15-7,26 (м, 1H), 7,38-7,54 (м, 2H), 7,83 (с, 1H), 8,53 (с, 1H).
Соединение 235: 5-(2-хлор-3-фторфенил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]-3-(2H-тетразол-5-илметил)пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,68 (м, 3H), 2,70 (м, 1H), 2,89 (м, 2H), 3,18 (м, 2H), 3,37 (м, 2H), 3,95 (д, J=13,9 Гц, 1H), 4,33 (м, 1H), 4,43 (д, J=13,1 Гц, 1H), 4,81 (с, 2H), 5,36 (м, 2H), 6,81 (м, 1H), 7,04 (м, 3H), 7,17-7,31 (м, 1H), 7,37-7,56 (м, 2H), 7,94 (с, 1H), 8,53 (с, 1H).
Соединение 236: 5-(2,3-дифторфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,71 (м, 3H); 2,70 (м, 1H); 2,90 (м, 2H); 3,08 (с, 3H); 3,16 (м, 1H); 3,36-3,43 (м, 4H); 3,97 (д, J=13,5 Гц, 1H); 4,32 (м, 3H); 4,43 (д, J=12,9 Гц, 1H); 4,82 (с, 2H); 6,79-6,83 (м, 1H); 7,02-7,05 (м, 3H); 7,21-7,30 (м, 2H); 7,44-7,51 (м, 1H); 7,97 (с, 1H); 8,54 (с, 1H).
Соединение 237: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[(1S)-1-метилпропил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 0,80 (т, J=7,4 Гц, 3H), 1,38 (д, J=6,8 Гц, 3H), 1,54 (м, 1H), 1,70 (м, 3H), 2,00-2,14 (м, 1H), 2,53 (м, 1H), 2,67 (м, 1H), 2,88 (м, 2H), 3,14 (м, 1H), 3,36 (м, 2H), 3,67 (с, 3H), 3,93 (д, J=13,4 Гц, 1H), 4,28 (м, 1H), 4,43 (д, J=13,0 Гц, 1H), 4,65-4,84 (м, 2H), 4,89 (м, 1H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,14-7,28 (м, 1H), 7,36-7,52 (м, 2H), 7,79 (с, 1H), 8,34 (с, 1H).
Соединение 238: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[(1R)-1-метилпропил]пиримидин-2,4-дион
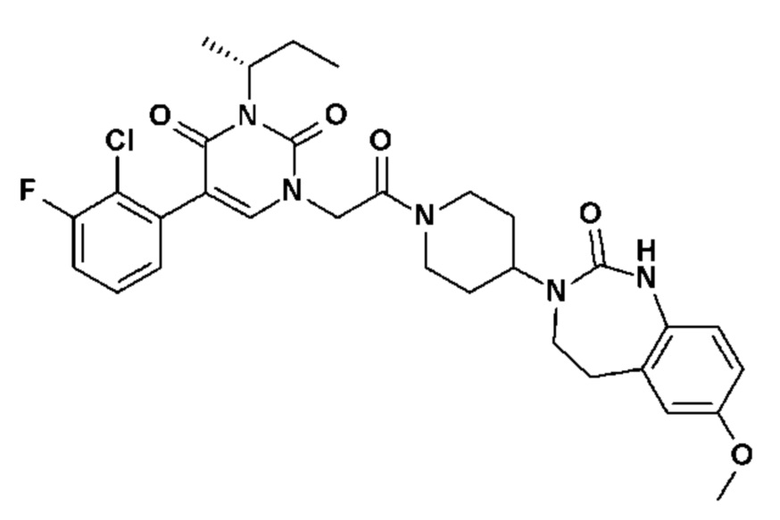
1H ЯМР (δ, ДМСО): 0,80 (т, J=7,4 Гц, 3H), 1,39 (д, J=6,8 Гц, 3H), 1,54 (м, 1H), 1,67 (м, 3H), 2,05 (м, 1H), 2,67 (м, 1H), 2,88 (м, 2H), 3,14 (м, 1H), 3,36 (м, 3H), 3,67 (с, 3H), 3,93 (д, J=13,6 Гц, 1H), 4,28 (м, 1H), 4,43 (д, J=12,9 Гц, 1H), 4,65-4,83 (м, 2H), 4,88 (м, 1H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,7, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,21 (м, 1H), 7,37-7,55 (м, 2H), 7,79 (с, 1H), 8,33 (с, 1H).
Соединение 239: 5-(2-хлор-3-фторфенил)-3-[1-(метоксиметил)пропил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 0,82 (т, J=7,4 Гц, 3H); 1,55 (м, 1H); 1,65-1,75 (м, 3H); 1,97 (м, 1H); 2,53 (м, 2H), 2,67 (м, 1H); 2,88 (м, 2H); 3,14 (м, 1H); 3,23 (с, 3H); 3,36-3,36 (м, 2H); 3,56 (м, 1H); 3,67 (с, 3H); 3,92 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,76 (ушир с, 1H); 5,02 (ушир с, 1H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H); 7,21-7,23 (м, 1H); 7,43-7,46 (м, 2H); 7,81 (с, 1H); 8,33 (с, 1H).
Соединение 240: 5-(2-хлор-3-фторфенил)-3-(2-метокси-2-метилпропил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,12 (с, 6H); 1,55 (м, 1H); 1,68 (м, 3H); 2,68 (м, 1H); 2,88 (м, 2H); 3,16 (м, 4H); 3,36 (м, 2H); 3,67 (с, 3H); 3,94 (д, J=13,9 Гц, 1H); 4,01 (м, 2H); 4,28 (м, 1H); 4,43 (д, J=12,8 Гц, 1H); 4,77 (м, 2H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,19-7,21 (м, 1H); 7,44-7,47 (м, 2H); 7,82 (с, 1H); 8,33 (с, 1H).
Соединение 241: 5-(2-хлор-3-метоксифенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,44-1,62 (м, 1H), 1,67 (м, 3H), 2,66 (м, 1H), 2,83-2,92 (м, 2H), 3,13 (м, 1H), 3,24 (с, 6H), 3,36 (м, 2H), 3,60 (м, 2H), 3,67 (с, 3H), 3,83 (м, 2H), 3,89 (с, 3H), 3,93 (д, J=13,4 Гц, 1H), 4,28 (м, 1H), 4,43 (д, J=12,8 Гц, 1H), 4,74 (м, 2H), 5,26 (ушир.с, 1H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,9, 3,0 Гц, 1H), 6,91 (дд, J=7,5, 1,5 Гц, 1H), 6,98 (д, J=8,7 Гц, 1H), 7,19 (дд, J=8,5, 1,5 Гц, 1H), 7,31-7,38 (м, 1H), 7,70 (с, 1H), 8,32 (с, 1H).
Соединение 242: 5-(2,3-дихлорфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
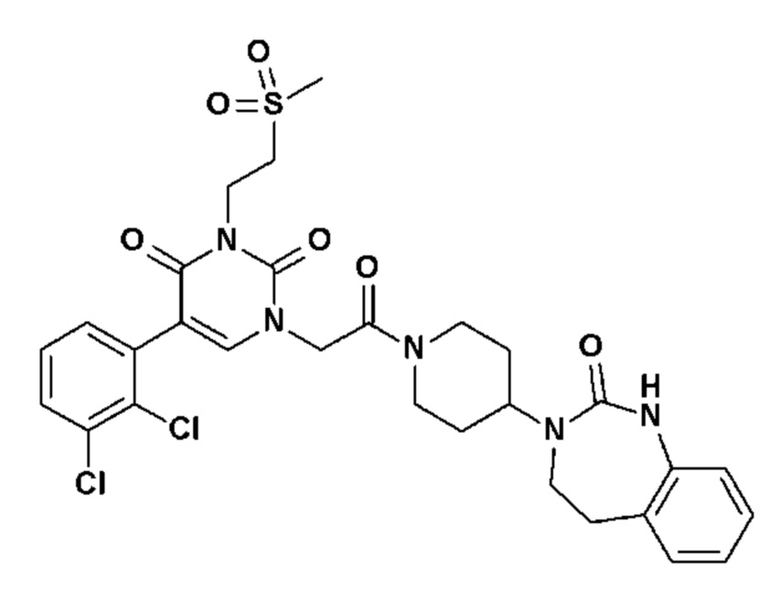
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,72 (м, 3H); 2,69 (м, 1H); 2,90 (м, 2H); 3,08 (с, 3H); 3,20 (м, 1H); 3,43-3,39 (м, 4H); 3,95 (д, J=11,9 Гц, 1H) 4,31 (м, 3H); 4,44 (д, J=11,9 Гц, 1H); 4,79 (с, 2H); 6,83-6,79 (м, 1H); 7,04 (м, 3H); 7,33 (дд, J=7,7, 1,6 Гц, 1H); 7,44 (т, J=7,9 Гц, 1H); 7,70 (дд, J=8,1, 1,6 Гц, 1H); 7,87 (с, 1H); 8,53 (с, 1H).
Соединение 243: 5-(2-хлор-3-метоксифенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
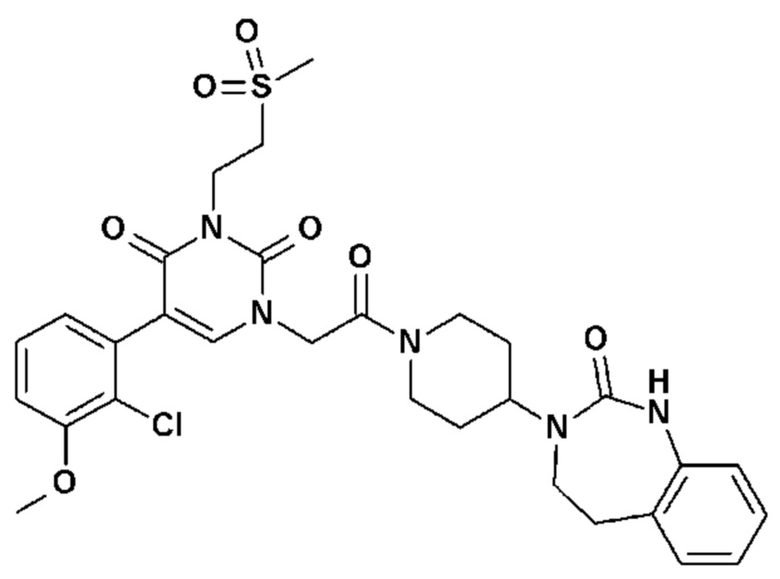
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,71 (м, 3H); 2,53 (м, 2H), 2,68 (м, 1H); 2,90 (м, 2H); 3,08 (с, 3H); 3,15 (м, 1H); 3,38 (м, 2H), 3,90 (с, 3H); 3,95 (д, J=13,6 Гц, 1H); 4,28-4,32 (м, 3H); 4,43 (д, J=13,0 Гц, 1H); 4,79 (с, 2H); 6,79-6,83 (м, 1H); 6,92 (дд, J=7,6, 1,4 Гц, 1H); 7,02-7,05 (м, 3H); 7,19-7,21 (м, 1H); 7,36 (т, J=8,0 Гц, 1H); 7,78 (с, 1H); 8,53 (с, 1H).
Соединение 244: 5-(2-хлор-3-фторфенил)-3-[(1S)-1-метил-2-метилсульфонил-этил]-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
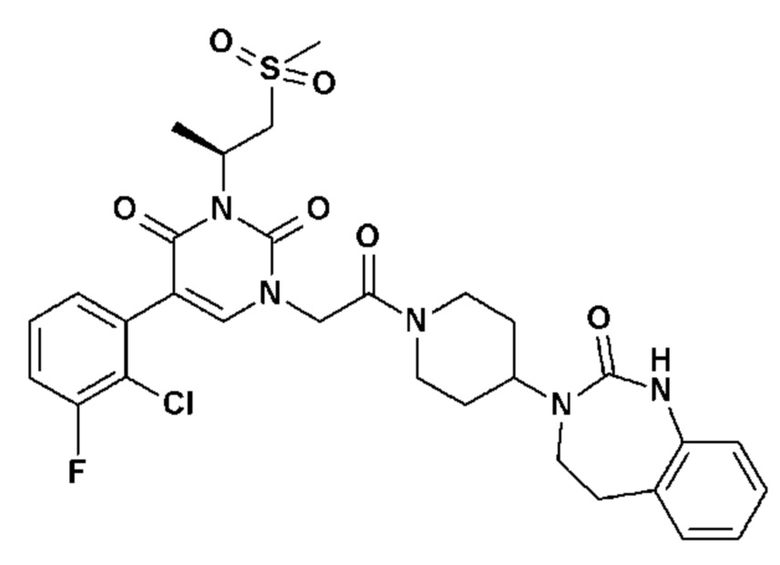
1H ЯМР (δ, ДМСО): 1,24 (д, J=7,0 Гц, 3H), 1,57 (м, 1H), 1,69 (м, 3H), 2,70 (с, 1H), 2,84-2,95 (м, 2H), 3,06 (с, 3H), 3,16 (м, 1H), 3,35-3,43 (м, 2H), 3,53 (м, 1H), 3,95 (д, J=13,6 Гц, 1H), 4,11-4,39 (м, 3H), 4,43 (д, J=12,4 Гц, 1H), 4,80 (с, 2H), 6,81 (м, 1H), 7,04 (м, 3H), 7,23 (м, 1H), 7,38-7,54 (м, 2H), 7,90 (с, 1H), 8,52 (с, 1H).
Соединение 245: 5-(2,3-дихлорфенил)-3-[2-метокси-1-(метоксиметил)этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
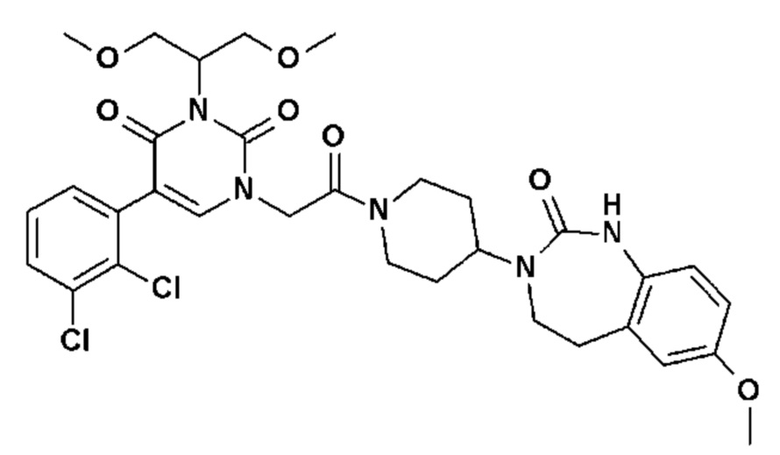
1H ЯМР (δ, ДМСО): 1,50-1,58 (м, 1H); 1,65-1,77 (м, 3H); 2,64-2,70 (м, 1H); 2,85-2,87 (м, 2H); 3,10-3,16 (м, 1H); 3,23 (с, 6H); 3,34-3,36 (м, 2H); 3,59 (м, 2H); 3,66 (с, 3H); 3,80-3,85 (м, 2H); 3,91-3,94 (м, 1H); 4,24-4,30 (м, 1H); 4,40-4,43 (м, 1H); 4,74 (м, 2H); 5,26 (ушир с, 1H); 6,61 (д, J=2,9 Гц, 1H); 6,66 (дд, J=8,8, 2,9 Гц, 1H); 6,97 (д, J=8,8 Гц, 1H); 7,33 (дд, J=7,7, 1,6 Гц, 1H); 7,42 (т, J=7,9 Гц, 1H); 7,68 (дд, J=8,1, 1,6 Гц, 1H); 7,79 (с, 1H); 8,31 (с, 1H).
Соединение 246: 3-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]пропионовая кислота
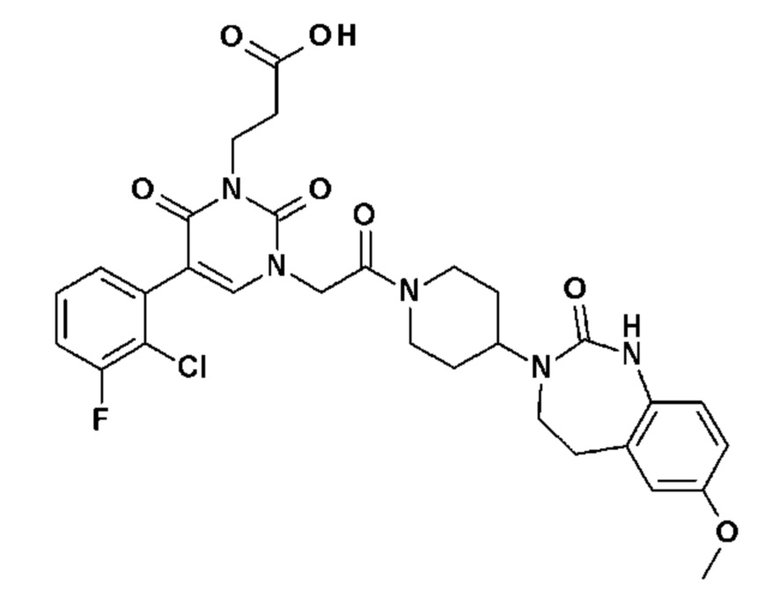
1H ЯМР (δ, ДМСО): 1,55 (м, 1H), 1,70 (м, 3H), 2,50 (м, 4H), 2,68 (м, 1H), 2,80-2,95 (м, 2H), 3,15 (м, 1H), 3,67 (с, 3H), 3,94 (д, J=13,6 Гц, 1H), 4,02-4,17 (м, 2H), 4,28 (м, 1H), 4,43 (д, J=12,8 Гц, 1H), 4,78 (с, 2H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,8, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,10-7,30 (м, 1H), 7,37-7,54 (м, 2H), 7,84 (с, 1H), 8,32 (с, 1H), 12,45 (ушир.с, 1H).
Соединение 247: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(1,3,4-оксадиазол-2-ил)этил]пиримидин-2,4-дион
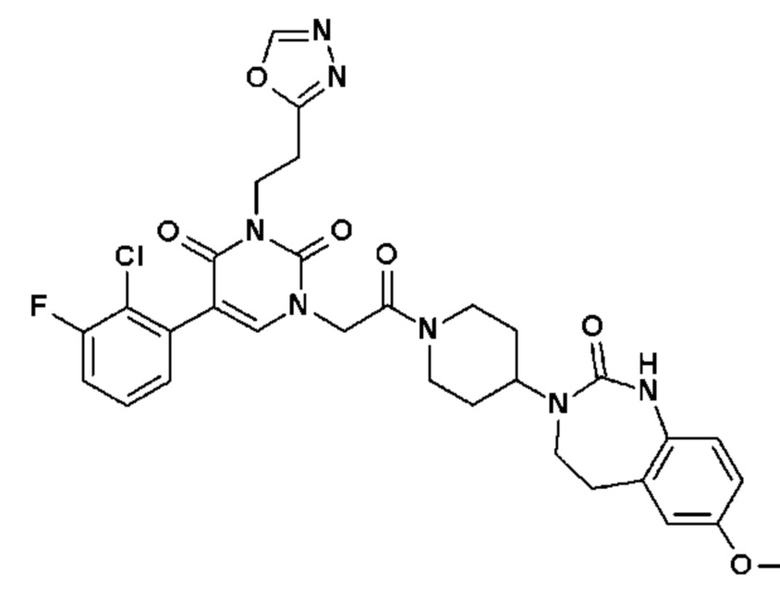
1H ЯМР (δ, ДМСО): 1,54 (м, 1H); 1,68 (м, 3H); 2,68 (м, 1H); 2,88 (м, 2H); 3,19 (м, 3H); 3,36 (м, 2H); 3,67 (с, 3H); 3,94 (д, J=13,5 Гц, 1H); 4,25 (м, 3H); 4,43 (д, J=12,8 Гц, 1H); 4,77 (с, 2H); 6,63 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,18 (м, 1H); 7,46 (м, 2H); 7,86 (с, 1H); 8,33 (с, 1H); 9,13 (с, 1H).
Соединение 248: 2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]уксусная кислота
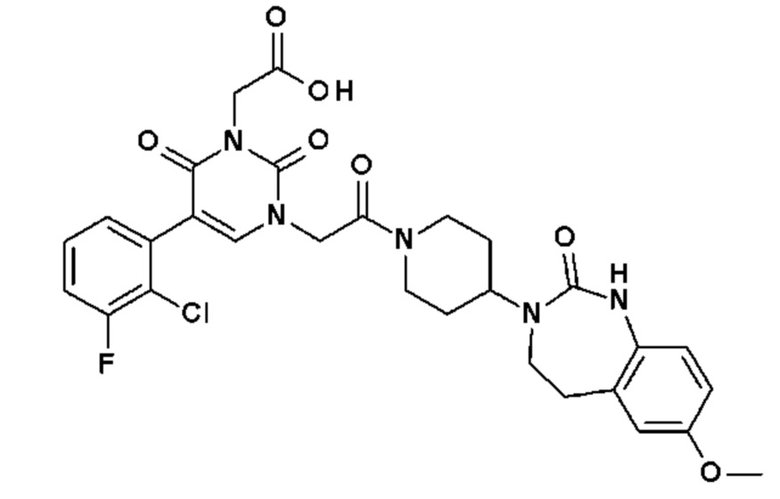
1H ЯМР (δ, ДМСО): 1,49-1,58 (м, 1H); 1,61-1,74 (м, 3H); 2,68 (м, 1H); 2,87-2,89 (м, 2H); 3,12-3,18 (м, 1H); 3,36 (м, 2H), 3,67 (с, 3H); 3,95 (д, J=13,6 Гц, 1H); 4,25-4,31 (м, 1H); 4,43 (д, J=12,9 Гц, 1H); 4,52 (м, 2H); 4,81 (с, 2H); 6,62 (д, J=2,9 Гц, 1H); 6,67 (дд, J=8,8, 2,9 Гц, 1H); 6,98 (д, J=8,8 Гц, 1H); 7,22-7,24 (м, 1H); 7,44-7,48 (м, 2H); 7,90 (с, 1H); 8,32 (с, 1H); 13,05 (ушир.с, 1H).
Соединение 249: 5-(2-хлор-3-фторфенил)-3-[(1R)-1-метил-2-метилсульфонил-этил]-1-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-2,4-дион
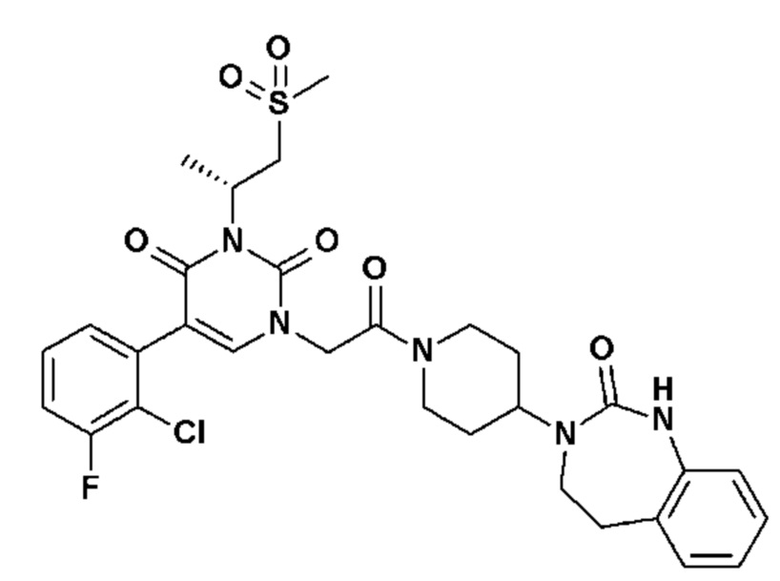
1H ЯМР (δ, ДМСО): 1,24 (д; J=7,03 Гц; 3 H); 1,53-1,56 (м; 1 H); 1,66-1,72 (м; 3 H); 2,69 (м; 1 H); 2,89-2,91 (м; 2 H); 3,06 (с;3 H); 3,16 (м; 1 H); 3,38 (м; 2 H); 3,53 (м; 1 H); 3,95 (д; J=13,62 Гц; 1 H); 4,17-4,24 (м; 1 H); 4,27-4,32 (м; 2 H); 4,43 (д; J=12,93 Гц; 1 H); 4,81 (м; 2 H); 6,81 (м; 1 H); 7,04 (м; 3 H); 7,22-7,24 (м; 1 H); 7,45-7,49 (м; 2 H); 7,90 (с;1 H); 8,53 (с;1 H).
Соединение 250: 5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-1-[2-оксо-2-[2-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-6-азаспиро[3,3]гептан-6-ил]этил]пиримидин-2,4-дион
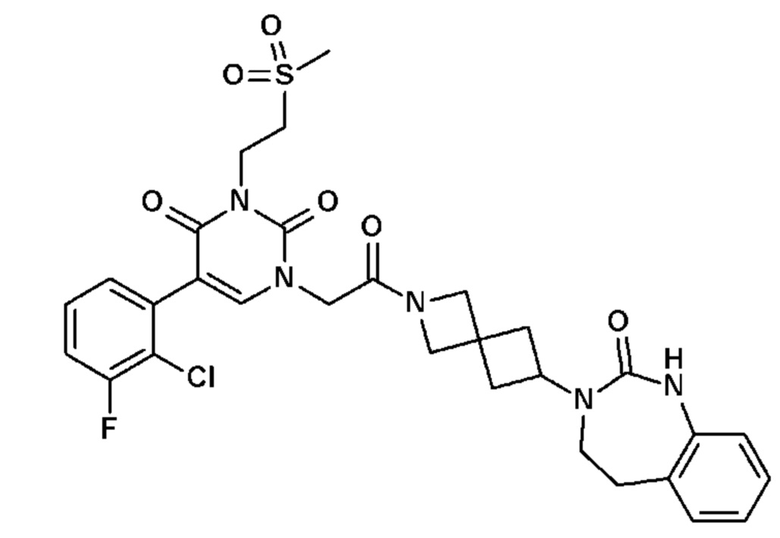
1H ЯМР (δ, ДМСО): 2,32-2,38 (м, 4H); 2,91-2,93 (м, 2H); 3,07 (с, 3H); 3,40-3,43 (м, 4H); 3,88 (с, 1H); 4,01 (с, 1H); 4,18 (с, 1H); 4,29-4,31 (м, 3H); 4,46-4,51 (м, 3H); 6,81-6,85 (м, 1H); 7,04-7,08 (м, 3H); 7,19-7,21 (м, 1H); 7,44-7,47 (м, 2H); 7,88 (м, 1H); 8,53 (м, 1H).
Соединение 251: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[2-(1,2,4-триазол-4-ил)этил]пиримидин-2,4-дион
Масса=651
Соединение 252: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-фтор-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-[(1R)-1-метил-2-метилсульфонил-этил]пиримидин-2,4-дион
1H ЯМР (δ, ДМСО): 1,14-1,36 (м, 5H), 1,55 (м, 1H), 1,71 (м, 3H), 2,69 (м, 1H), 2,86-2,93 (м, 2H), 3,06 (с, 3H), 3,15 (м, 1H), 3,34-3,41 (м, 2H), 3,53 (м, 1H), 3,94 (д, J=13,6 Гц, 1H), 4,15-4,33 (м, 3H), 4,43 (д, J=13,0 Гц, 1H), 4,80 (м, 2H), 6,87-6,96 (м, 2H), 7,02-7,11 (м, 1H), 7,19-7,27 (м, 1H), 7,43-7,51 (м, 2H), 7,89 (с, 1H), 8,55 (с, 1H).
Соединение 253: 3-[1-[2-[5-(2-хлор-3-фторфенил)-3-(2-метилсульфонилэтил)-2,4-диоксо-пиримидин-1-ил]ацетил]-4-пиперидил]-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-7-карбоновая кислота
1H ЯМР (δ, ДМСО): 1,56 (м, 1H), 1,69 (м, 3H), 2,71 (м, 1H), 2,95 (м, 2H), 3,08 (с, 3H), 3,16 (м, 1H), 3,36-3,48 (м, 4H), 3,96 (д, J=13,4 Гц, 1H), 4,31 (м, 2H), 4,35-4,51 (м, 2H), 4,80 (м, 2H), 7,11 (д, J=8,5 Гц, 1H), 7,17-7,27 (м, 1H), 7,40-7,54 (м, 2H), 7,61 (дд, J=8,5, 2,0 Гц, 1H), 7,64 (д, J=2,0 Гц, 1H), 7,89 (с, 1H), 9,01 (с, 1H), 12,35 (ушир.с, 1H).
Соединение 254: S-[2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]этил] этантиоат
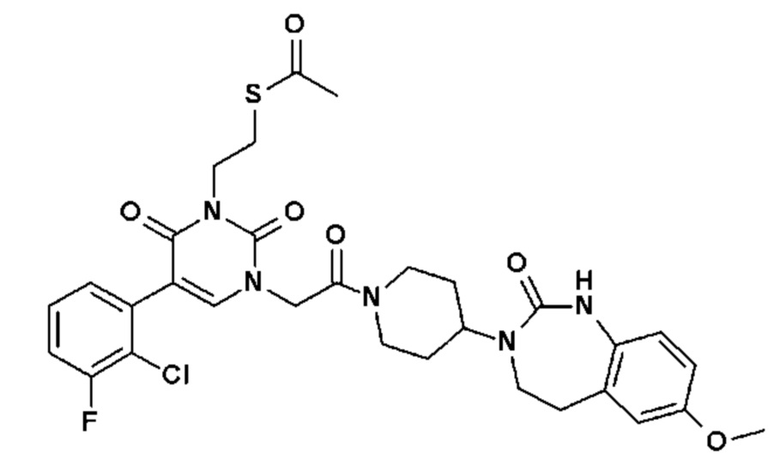
1H ЯМР (δ, ДМСО): 1,56 (м, 1H), 1,68 (м, 3H), 2,33 (м, 4H), 2,81-2,94 (м, 2H), 3,12 (м, 3H), 3,34-3,40 (м, 2H), 3,67 (с, 3H), 3,95 (д, J=14,0 Гц, 1H), 4,07 (м, 2H), 4,28 (м, 1H), 4,43 (д, J=12,7 Гц, 1H), 4,78 (с, 2H), 6,63 (д, J=2,9 Гц, 1H), 6,67 (дд, J=8,9, 2,9 Гц, 1H), 6,98 (д, J=8,7 Гц, 1H), 7,17-7,29 (м, 1H), 7,37-7,55 (м, 2H), 7,84 (с, 1H), 8,33 (с, 1H).
Соединение 255: N-[(2S)-2-[5-(2,3-дихлорфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]пропил]ацетамид
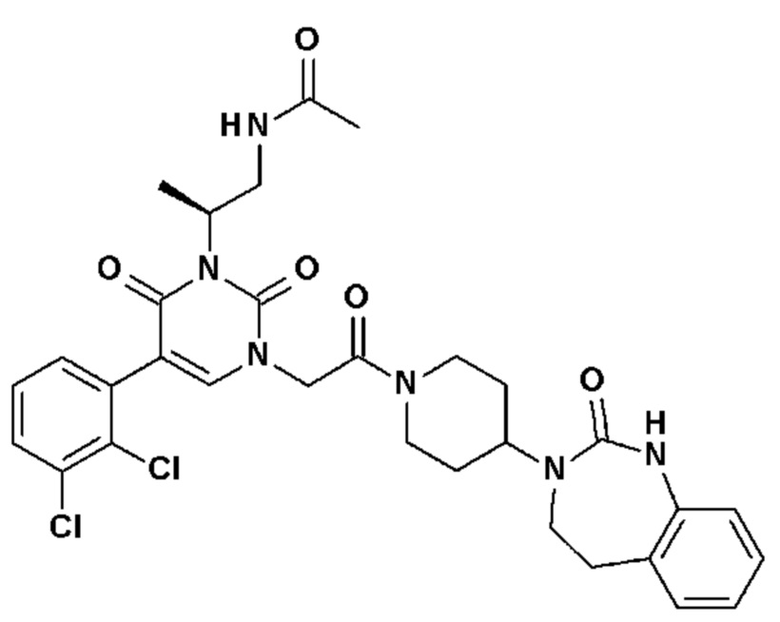
1H ЯМР (δ, ДМСО): 1,34 (3 H, д, J=6,91 Гц), 1,57 (1 H, м), 1,69 (3 H, м), 1,77 (3 H, с), 2,68-2,72 (1 H, м), 2,90 (2 H, м), 3,15 (1 H, м), 3,38 (2 H, м), 3,44-3,57 (2 H, м), 3,95 (1 H, д, J=13,54 Гц), 4,33 (1 H, м), 4,44 (1 H, д, J=12,82 Гц), 4,67-4,81 (2 H, м), 4,99 (1 H, м), 6,81 (1 H, м), 7,04 (3 H, м), 7,33 (1 H, м), 7,43 (1 H, т, J=7,87 Гц), 7,68 (1 H, дд, J=8,04, 1,58 Гц), 7,78 (1 H, с), 7,93 (1 H, м), 8,52 (1 H, с).
Соединение 256: N-[(2S)-2-[5-(2-хлор-3-фторфенил)-2,6-диоксо-3-[2-оксо-2-[4-(2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]этил]пиримидин-1-ил]пропил]ацетамид
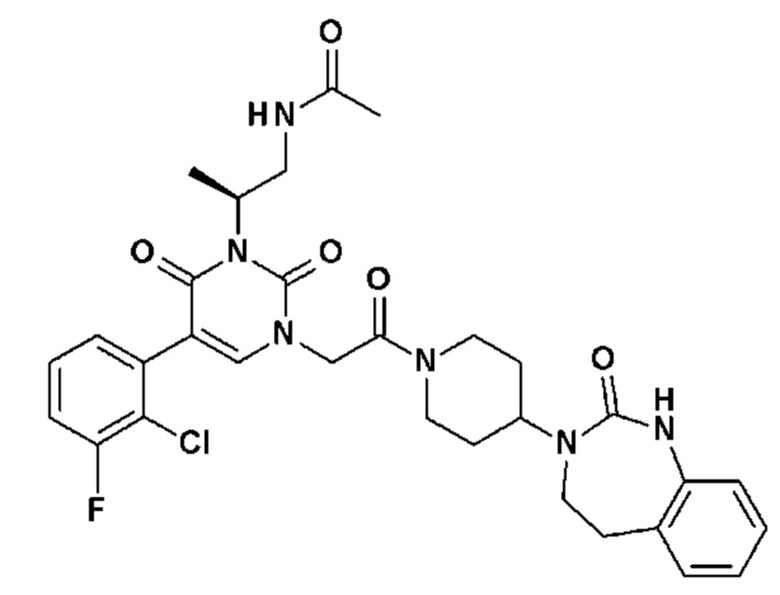
1H ЯМР (δ, ДМСО): 1,35 (д; J=6,85 Гц; 3 H); 1,57 (м; 1 H); 1,70 (м; 3 H); 1,77 (с;3 H); 2,69-2,72 (м; 1 H); 2,90 (м; 2 H); 3,16 (м; 1 H); 3,39 (м; 2 H); 3,49-3,57 (м; 2 H); 3,96 (д; J=13,24 Гц; 1 H); 4,33 (м; 1 H); 4,45 (д; J=12,80 Гц; 1 H); 4,75 (м; 2 H); 4,99 (м; 1 H); 6,82 (м; 1 H); 7,03-7,05 (м; 3 H); 7,22 (м; 1 H); 7,45 (м; 2 H); 7,79 (с;1 H); 7,93 (м; 1 H); 8,53 (с;1 H).
Соединение 257: 2-[5-(2-хлор-3-фторфенил)-3-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-2,6-диоксо-пиримидин-1-ил]этансульфоновая кислота
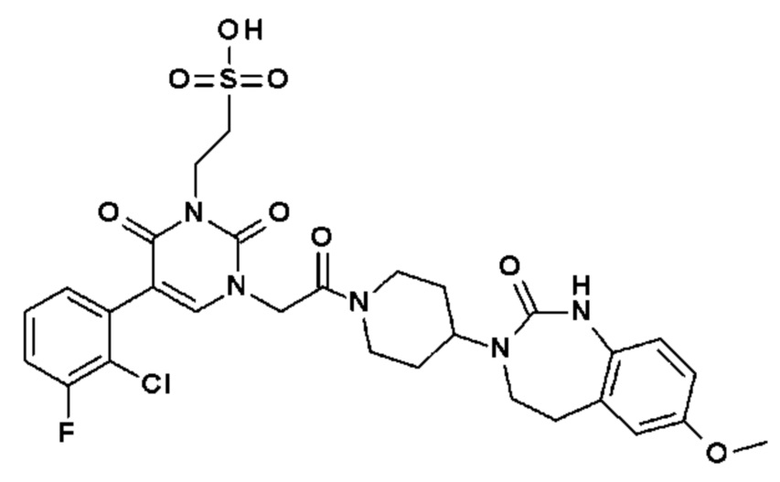
1H ЯМР (δ, ДМСО): 1,56 (м, 1H), 1,62-1,84 (м, 3H), 2,59-2,74 (м, 3H), 2,83-2,95 (м, 2H), 3,06-3,16 (м, 1H), 3,18 (с, 2H), 3,28-3,43 (м, 2H), 3,67 (с, 3H), 3,95 (д, J=13,5 Гц, 1H), 4,06-4,19 (м, 2H), 4,21-4,35 (м, 1H), 4,43 (д, J=12,8 Гц, 1H), 4,77 (м, 2H), 6,63 (д, J=3,0 Гц, 1H), 6,66 (дд, J=8,6, 2,9 Гц, 1H), 6,97 (д, J=8,8 Гц, 1H), 7,22 (м, 1H), 7,39-7,50 (м, 2H), 7,80 (с, 1H), 8,31 (с, 1H).
Соединение 258: 5-(2-хлор-3-фторфенил)-3-[(1S)-1-(метоксиметил)-2-метилсульфонил-этил]-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]пиримидин-2,4-дион
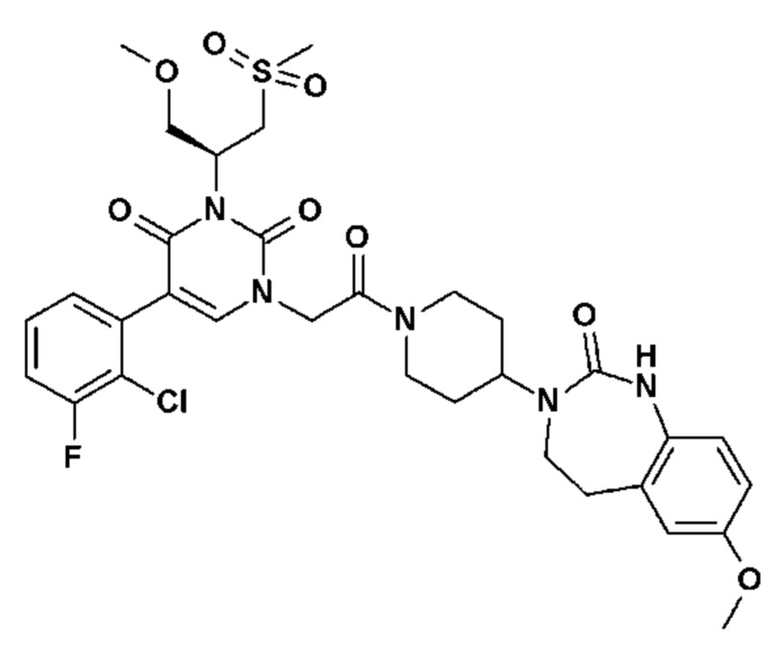
1H ЯМР (δ, ДМСО): 1,54 (м, 1H), 1,71 (м, 3H), 2,65 (м, 2H), 2,87 (м, 2H), 3,07 (с, 3H), 3,15 (м, 1H), 3,26 (с, 3H), 3,36 (м, 2H), 3,55-3,76 (м, 5H), 3,95 (м, 1H), 4,36 (м, 8,2 Гц, 4H), 4,80 (с, 2H), 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,6, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1H), 7,15-7,28 (м, 1H), 7,38-7,53 (м, 2H), 7,89 (с, 1H), 8,32 (с, 1H).
Соединение 259: 5-(2-хлор-3-фторфенил)-1-[2-[4-(7-метокси-2-оксо-4,5-дигидро-1H-1,3-бензодиазепин-3-ил)-1-пиперидил]-2-оксо-этил]-3-(2-метил-2-метилсульфонил-пропил)пиримидин-2,4-дион
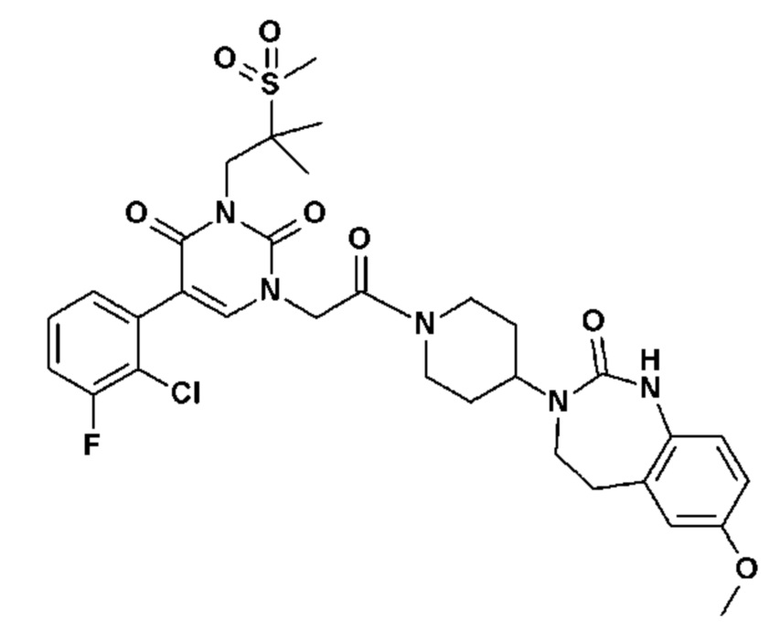
1H ЯМР (δ, ДМСО): 1,30 (с, 6 H); 1,52-1,58 (м, 1 H); 1,64-1,77 (м, 3 H); 2,68 (т, J=12,5 Гц, 1 H); 2,88 (м, 2 H); 3,06 (с, 3 H); 3,15 (т, J=13,0 Гц, 1 H); 3,36 (м, 2 H); 3,67 (с, 3 H); 3,94 (д, J=13,5 Гц, 1 H); 4,25-4,35 (м, 3 H); 4,43 (д, J=13,7 Гц, 1 H); 4,80 (с, 2 H); 6,62 (д, J=3,0 Гц, 1H), 6,67 (дд, J=8,9, 3,0 Гц, 1H), 6,98 (д, J=8,8 Гц, 1 H); 7,22-7,24 (м, 1 H); 7,45-7,48 (м, 2 H); 7,89 (с, 1 H); 8,33 (с, 1 H).
Кроме того, в целях иллюстрации, приведенные ниже примеры описывают, не исчерпывающе, процедуры, используемые для получения групп R1 соединений по настоящему изображению.
1-Пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-он дигидрохлорид:
4-(2-хлор-пиридин-3-иламино)-пиперидин-1-этилкарбоксилат:
К раствору 2-хлор-пиридин-3-иламина и 4-оксо-пиперидин-1-этилкарбоксилата в изопропилацетате медленно добавляли трифторуксусную кислоту. Реакционную смесь перемешивали при комнатной температуре в течение одного часа и затем частями добавляли триацетоксиборогидрид натрия. После перемешивания в течение двух часов при комнатной температуре, добавляли 10% водный раствор соды, и смесь экстрагировали изопропилацетатом. Органическую фазу сушили над сульфатом магния, фильтровали в вакууме и затем концентрировали досуха. Получали 4-(2-хлор-пиридин-3-иламино)-пиперидин-1-этилкарбоксилат в виде масла оранжевого цвета.
4-[1-(2-хлор-пиридин-3-ил)-уреидо]-пиперидин-1-этилкарбоксилат:
Раствор, содержащий 4-(2-хлор-пиридин-3-иламино)-пиперидин-1-этилкарбоксилат, растворенный в тетрагидрофуране, добавляли к раствору хлорсульфонилизоцианата в тетрагидрофуранн, охлажденному до -10°C в струе азота. Добавляли изопропилацетат и смесь перемешивали в течение одного часа при -10°C. Добавляли воду, затем 10% водный раствор соды. Органическую фазу отделяли и затем концентрировали. Твердое вещество бежевого цвета осаждалось; его фильтровали, промывали изопропилацетатом и затем сушили в вакууме при 60°C. Получали 4-[1-(2-хлор-пиридин-3-ил)-уреидо]-пиперидин-1-этилкарбоксилат в виде твердого вещества белого цвета.
4-(2-оксо-2,3-дигидро-имидазо[4,5-b]пиридин-1-ил)-пиперидин-1-этилкарбоксилат:
к суспензии 4-[1-(2-хлор-пиридин-3-ил)-уреидо]-пиперидин-1-этилкарбоксилата в изопропаноле, дегазированном в атмосфере азота добавляли карбонат калия, тример ацетат палладия и 1,4-бис(дифенилфосфино)-бутан. Смесь перемешивали при нагревании с обратным холодильником в течение 21 часов. Добавляли воду и этилацетат. Органическую фазу сушили над сульфатом магния, фильтровали в вакууме и затем концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией на силикагеле, элюируя смесью дихлорметан/метанол 95/5. Получали 4-(2-оксо-2,3-дигидро-имидазо[4,5-b]пиридин-1-ил)-пиперидин-1-этилкарбоксилат в виде твердого вещества светло-желтого цвета.
1-Пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-он дигидрохлорид:
К раствору 4-(2-оксо-2,3-дигидро-имидазо[4,5-b]пиридин-1-ил)-пиперидин-1-этилкарбоксилата в этаноле и воде добавляли водный раствор соды. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 12 часов, затем концентрировали и обрабатывали в изопропаноле. Добавляли 5н водный раствор соляной кислоты; продукт осаждался, фильтровали, промывали изопропанолом и затем сушили в вакууме при 60°C. Получали дигидрохлорид 1-пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-она в виде твердого вещества бежевого цвета.
1-(4-пиперидил)-3H-имидазо[4,5-b]пиридин-2-он:
Аналогично синтезу 1-пиперидин-4-ил-1,3-дигидро-имидазо[4,5-b]пиридин-2-она, описанному выше, используя 2-хлор-фениламин, получали 1-(4-пиперидил)-3H-имидазо[4,5-b]пиридин-2-он в виде твердого вещества белого цвета.
3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-он:
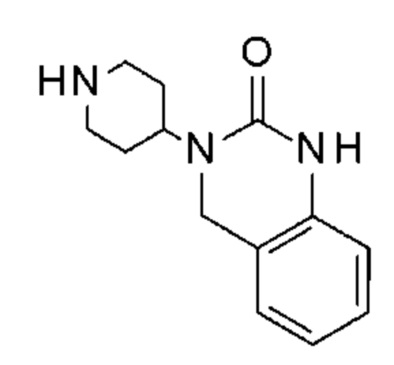
[2-(1-бензил-пиперидин-4-илкарбамоил)-фенил]-трет-бутилкарбамат:
К раствору 10 г (42,1 ммоль) 2-трет-бутоксикарбониламинобензойной кислоты, 10,3 мл (50,6 ммоль) 1-бензил-пиперидин-4-иламина, 6,3 г (46,3 ммоль) 1-гидроксибензотриазола и 17,6 мл (126,3 ммоль) триэтиламина в 120 мл диметилформамидадобавляли 8,9 г (46,3 ммоль) 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорид. Затем реакционную смесь перемешивали перед добавлением [...]. Реакционную смесь нагревали при 70°C в течение 5 часов, затем гидролизовали водным раствором гидрокарбоната натрия и разбавляли этилацетатом. Продукт экстрагировали этилацетатом. Органическую фазу дважды промывали насыщенным водным раствором гидрокарбоната натрия и потом насыщенным водным раствором хлорида натрия и водой, сушили над сульфатом магния и фильтровали. Растворители концентрировали в вакууме. Получали 17 г (100%) [2-(1-бензил-пиперидин-4-илкарбамоил)-фенил]-трет-бутилкарбамата в виде твердого вещества бежевого цвета.
2-амино-N-(1-бензил-пиперидин-4-ил)-бензамид:
К раствору 17 г (41,5 ммоль) 2-(1-бензил-пиперидин-4-илкарбамоил)-фенил]-трет-бутилкарбамата в 170 мл дихлорметана, предварительно охлажденного до 0°C, по каплям добавляли 30 мл (415 ммоль) трифторуксусной кислоты. Реакционную смесь перемешивали при температуре от 0°С до комнатной температуры в течение 20 часов. После концентрирования в вакууме, остаток гидролизовали водным раствором гидрокарбоната натрия и далее разбавляли этилацетатом. Продукт дважды экстрагировали этилацетатом. Органическую фазу промывали один раз водой, затем один раз насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали 14 г (100%) 2-амино-N-(1-бензил-пиперидин-4-ил)-бензамида в виде твердого вещества бежевого цвета.
(2-аминобензил)-(1-бензил-пиперидин-4-ил)-амин:
К раствору 5,2 г (135,7 ммоль) алюмогидрида лития в 260 мл диоксана, предварительно нагретого с обратным холодильником, очень медленно добавляли 12 г (38,8 ммоль) 2-амино-N-(1-бензил-пиперидин-4-ил)-бензамида, разбавленного в 72 мл диоксана. Потом реакционную смесь (суспензия серого цвета) перемешивали и нагревали с обратным холодильником в течение 3 часов. Смесь охлаждали до 0°C и далее медленно гидролизовали 5,2 мл 15M водного раствора соды и 15,5 мл воды. Затем реакционную смесь разбавляли 240 мл диэтилового эфира и перемешивали при комнатной температуре в течение 55 минут. После фильтрования солей, фильтрат концентрировали в вакууме с получением 10,7 г (93%) (2-аминобензил)-(1-бензил-пиперидин-4-ил)-амина в виде прозрачного масла.
3-(1-бензил-пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-он:
К раствору 1,6 г (5,2 ммоль) (2-аминобензил)-(1-бензил-пиперидин-4-ил)-амина в 25 мл тетрагидрофурана добавляли 0,9 г (5,7 ммоль) карбонилдиимидазола. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Растворитель удаляли в вакууме, затем реакционную смесь гидролизовали и разбавляли этилацетатом. После экстракции этилацетатом, органические фазы дважды промывали водой и потом насыщенным водным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Полученное неочищенное твердое вещество растирали с 15 мл диэтилового эфира, потом фильтровали и сушили в вакууме с получением 1,2 г (72%) 3-(1-бензил-пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-она в виде твердого вещества белого цвета.
3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-он:
К раствору 1,2 г (3,7 ммоль) 3-(1-бензил-пиперидин-4-ил)-3,4-дигидро-1H-хиназолин-2-она в 30 мл метанола, предварительно дегазированного азотом, добавляли 120 мг палладия на угле (10 масс%). Затем смесь помещали в атмосферу водорода в течение 48 часов, затем фильтровали через целит. Фильтрат концентрировали в вакууме с получением 0,9 г (100%) 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-она в виде твердого вещества белого цвета.
3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
(1-бензил-пиперидин-4-ил)-[2-(2-нитрофенил)-этил]-амин:
К 4 г (17,4 ммоль) 1-(2-бромэтил)-2-нитробензола добавляли 8 мл (40 ммоль) 1-бензил-пиперидин-4-иламина и смесь нагревали при 100°C в течение 18 часов. После охлаждения добавляли диэтиловый эфир, смесь фильтровали и фильтрат концентрировали. Неочищенный остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гептан 60/40 и затем смесью дихлорметан/метанол/аммиак 95/3/2. Получали 4,9 г (82%) (1-бензил-пиперидин-4-ил)-[2-(2-нитрофенил)-этил]-амина в виде масла оранжевого цвета.
[2-(2-аминофенил)-этил]-(1-бензил-пиперидин-4-ил)-амин:
Аналогично примеру 1.5, используя 4,8 г (14 ммоль) (1-бензил-пиперидин-4-ил)-[2-(2-нитрофенил)-этил]-амина, 140 мг оксида платины (10 моль%) и после очистки остаткахроматографией на силикагеле, элюируя a дихлорметан/метанол/аммиак 90/8/2, получали 4,6 г (100%) [2-(2-аминофенил)-этил]-(1-бензил-пиперидин-4-ил)-амина в виде масла коричневого цвета.
3-(1-бензил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
Аналогично примеру 1.4, используя 1 г (6,5 ммоль) [2-(2-аминофенил)-этил]-(1-бензил-пиперидин-4-ил)-амина, получали 3,9 г (78%) 3-(1-бензил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде порошка белого цвета.
3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
Аналогично примеру 1.5, используя 3,7 г (11 ммоль) 3-(1-бензил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, реакционную смесь помещали в атмосферу водорода при давлении 5 бар (~5,1 атм), получали 2,6 г (96%) 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде порошка белого цвета.
7-бром-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он:
К раствору 3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (полученный способом, описанным в примере 16.4) в диметилформамиде добавляли N-бомсукцинимид. Смесь перемешивали в течение одного часа при комнатной температуре, затем добавляли воду и этилацетат. После экстракции этилацетатом, органические фазы объединяли, промывали водой и затем насыщенным раствором гидрохлоридом натрия. После сушки над сульфатом магния, фильтрования и упаривания, неочищенный продукт очищали инверсией фаз. Получали 7-бром-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он в виде твердого вещества бежевого цвета.
7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
(5-метокси-2-нитрофенил)-ацетонитрил:
К раствору, содержащему 53,6 г (478 ммоль) трет-бутилата калия в 610 мл N,N-диметилформамида, при -20°C в атмосфере азота добавляли раствор, содержащий 30,5 г (199 ммоль) 4-нитроанизола и 40 г (239 ммоль) (4-хлорфенокси)-ацетонитрила в 305 мл N,N-диметилформамида. Реакционную смесь оставляли нагреваться до 0°C и содержали при этой температуре. Через 1 час реакционную смесь охлаждали до -50°C и медленно гидролизовали 1000 мл охлажденного льдом 6н водного раствора соляной кислоты, затем добавляли 1000 мл этилацетата и 500 мл воды. Водную фазу экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида аммония, затем водой и потом сушили над безводным сульфатом натрия, фильтровали и концентрировали. Полученный остаток обрабатывали в толуоле и упаривали. Полученное таким образом масло обрабатывали, при перемешивании, в 250 мл смеси этилацетат/гептан (50/50) в течение ночи, затем смесь охлаждали на бане со льдом и фильтровали. После промывки гептаном, получали 26,7 г (68%) (5-метокси-2-нитрофенил)-ацетонитрила в виде твердого вещества оранжевого цвета.
2-(5-метокси-2-нитрофенил)-этиламин:
К раствору, содержащему 26 г (136 ммоль) (5-метокси-2-нитрофенил)-ацетонитрила в 130 мл 2-метилтетрагидрофурана, при 60°C добавляли 200 мл (200 ммоль) раствора комплекса боран-тетрагидрофуран. Через 3 часов, нагревание прекращали и медленно добавляли 35 мл (863 ммоль) метанола, а также 200 мл 1н водного раствора гидроксида натрия. Затем водную фазу экстрагировали 250 мл метил-тетрагидрофуран. Органическую фазу промывали водой, сушили над безводным сульфатом натрия, фильтровали и концентрировали частично. Добавляли 400 мл трет-бутилового эфира и 10 мл (175 ммоль) уксусной кислоты. Смесь охлаждали, перемешивали в течение ночи, затем концентрировали и совместно упаривали с толуолом. Получали 40,6 г (100%) 2-(5-метокси-2-нитрофенил)-этиламина ацетата в виде масла коричневого цвета.
4-[2-(5-метокси-2-нитрофенил)-этиламино]-пиперидин-1-метилкарбоксилат:
К раствору, содержащему 40,6 г (136 ммоль) 2-(5-метокси-2-нитрофенил)-этиламин уксусной кислоты, 35,9 г (180 ммоль) N-(трет-бутоксикарбонил)-4-пиперидона в 360 мл 2-метилтетрагидрофурана добавляли 44,5 г (210 ммоль) триацетоксигидробората натрия в атмосфере азота. Через 2 часа реакционную смесь гидролизовали 2н водным раствором гидроксида натрия. Водную фазу экстрагировали метилтетрагидрофураном. Органическую фазу промывали водой для доведения значения pH до 6, сушили сульфатом натрия, фильтровали и упаривали. Получали 69,2 г (100%) 4-[2-(5-метокси-2-нитрофенил)-этиламино]-пиперидин-1-метилкарбоксилата в виде темного масла.
4-[2-(2-амино-5-метоксифенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат:
К раствору, содержащему 69,2 г (137 ммоль) 4-[2-(5-метокси-2-нитрофенил)-этиламино]-пиперидин-1-метилкарбоксилата в 130 мл 2-метилтетрагидрофурана, 130 мл метанола и 130 мл воды добавляли 3,7 г (70 ммоль) хлорида аммония и 31,3 г (560 ммоль) железа. Реакционную смесь нагревали с обратным холодильником в течение 4 часов и затем оставляли остывать до комнатной температуры. Через 16 часов, реакционную смесь фильтровали через целит и фильтрат концентрировали до тех пор, пока метанол не испарился. Добавляли метилтетрагидрофуран, а также 10% раствор этилендиаминтетрауксусной кислоты. Органическую фазу промывали водой, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали. Получали 53,2 г (100%) 4-[2-(2-амино-5-метоксифенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата в виде масла оранжевого цвета.
4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилат:
К раствору, содержащему 53,2 г (137 ммоль) 4-[2-(2-амино-5-метоксифенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилата при 90% в 1000 мл толуола, частями добавляли 27,2 г (168 ммоль) N,N'-карбонилдиимидазола. Через 1 ч образовавшийся осадок фильтровали, и фильтрат частично концентрировали. Остаток дважды промывали водным раствором хлорида аммония. Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали. Получали 58 г продукта в виде масла оранжевого цвета. После очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (20% - 70% этилацетата в гептане), получали 35 г твердого вещества желтого цвета и обрабатывали в 200 мл изопропилового эфира при нагревании с обратным холодильником, 100 мл изопропилового эфира, 100 мл тетрагидрофурана, 80 мл этанола и 300 мл метанола. Смесь фильтровали и затем концентрировали. После очистки с помощью хроматографии на силикагеле, элюируя смесью этилацетата в гептане, в соответствии с градиентом полярности (20% - 100% этилацетата в гептане), получали 21,1 г (34%) 4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата в виде твердого вещества бежевого цвета.
7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
К раствору, содержащему 83% 4-(7-метокси-2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутилкарбоксилата в 300 мл дихлорметана, при 0°C добавляли 35 мл (380 ммоль) трифторуксусной кислоты. Через 15 часов реакционную смесь медленно концентрировали на роторном испарителе. Остаток совместно упаривали с толуолом, обрабатывали в 250 мл дихлорметана и затем смесь доводили pH до значения, равного 10, 1н водным раствором гидроксида натрия. Водную фазу экстрагировали дихлорметаном, органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали. Получали 12,7 г (96%) 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она в виде твердого вещества бежевого цвета.
3-(4-метил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
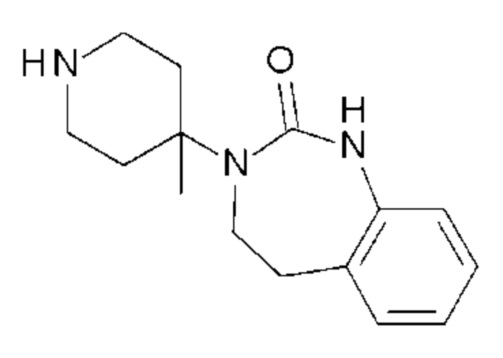
4-метил-4-[2-(2-нитрофенил)-ацетиламино]-пиперидин-1-трет-бутилкарбоксилат:
Аналогично примеру 1.6, используя 2-нитрофенилуксусную кислоту и 4-амино-4-метил-пиперидин-1-трет-бутилкарбоксилат, получали 4-метил-4-[2-(2-нитрофенил)-ацетиламино]-пиперидин-1-трет-бутилкарбоксилат в виде твердого вещества белого цвета.
4-метил-4-[2-(2-нитрофенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат:
Аналогично примеру 115,2, используя 4-метил-4-[2-(2-нитрофенил)-ацетиламино]-пиперидин-1-трет-бутилкарбоксилат и комплекс боран-метилсульфид, получали 4-метил-4-[2-(2-нитрофенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат в виде пасты белого цвета.
4-[2-(2-аминофенил)-этиламино]-4-метил-пиперидин-1-трет-бутил-карбоксилат:
Аналогично примеру 115,4, используя 4-метил-4-[2-(2-нитрофенил)-этиламино]-пиперидин-1-трет-бутилкарбоксилат, получали 4-[2-(2-аминофенил)-этиламино]-4-метил-пиперидин-1-трет-бутил-карбоксилат в виде бесцветного масла.
4-метил-4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутил-карбоксилат:
Аналогично примеру 1.4, используя 4-[2-(2-аминофенил)-этиламино]-4-метил-пиперидин-1-трет-бутил-карбоксилат, получали 4-метил-4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутил-карбоксилат в виде твердого вещества белого цвета.
3-(4-метил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
Аналогично примеру 115,11, используя 4-метил-4-(2-оксо-1,2,4,5-тетрагидро-бензо[d][1,3]диазепин-3-ил)-пиперидин-1-трет-бутил-карбоксилат, получали 3-(4-метил-пиперидин-4-ил)-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он в виде бесцветного масла.
9-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
N-(1-бензил-пиперидин-4-ил)-2-(3-фтор-2-нитрофенил)-ацетамид:
Аналогично примеру 1.6, используя 4-амино-1-бензилпиперидин и 2-(3-фтор-2-нитрофенил) уксусную кислоту, получали N-(1-бензил-пиперидин-4-ил)-2-(3-фтор-2-нитрофенил)-ацетамид в виде твердого вещества желтого цвета.
[2-(2-амино-3-фторфенил)-этил]-(1-бензил-пиперидин-4-ил)-амин:
Аналогично примеру 1.3, используя N-(1-бензил-пиперидин-4-ил)-2-(3-фтор-2-нитрофенил)-ацетамид, получали [2-(2-амино-3-фторфенил)-этил]-(1-бензил-пиперидин-4-ил)-амин в виде масла коричневого цвета.
3-(1-бензил-пиперидин-4-ил)-9-фтор-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
Аналогично примеру 1.4, используя [2-(2-амино-3-фторфенил)-этил]-(1-бензил-пиперидин-4-ил)-амин, получали 3-(1-бензил-пиперидин-4-ил)-9-фтор-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он в виде масла желтого цвета.
9-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
Аналогично примеру 1.5, используя 3-(1-бензил-пиперидин-4-ил)-9-фтор-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он, получали 9-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он в виде масла желтого цвета.
7-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
Аналогично синтезу 9-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, используя 2-(5-фтор-2-нитрофенил)-этиламин и 1-Boc-4-пиперидон, получали 7-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он в виде твердого вещества желтого цвета.
7-пиперидин-4-ил-5,6,7,9-тетрагидро-1,7,9-триаза-бензоциклогептен-8-он:
Аналогично синтезу 9-фтор-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, используя (2-амино-пиридин-3-ил)-уксусную кислоту и 4-амино-1-бензилпиперидин, получали 7-пиперидин-4-ил-5,6,7,9-тетрагидро-1,7,9-триаза-бензоциклогептен-8-он в виде твердого вещества белого цвета.
7-пиперидин-4-ил-5,6,7,9-тетрагидро-2,7,9-триаза-бензоциклогептен-8-он:
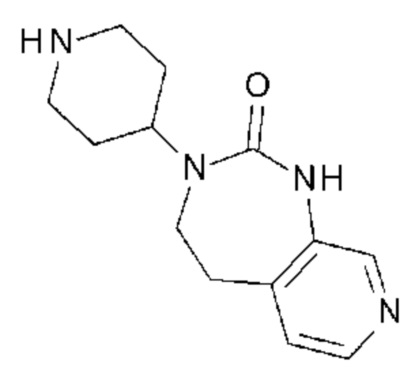
Аналогично синтезу 7-пиперидин-4-ил-5,6,7,9-тетрагидро-1,7,9-триаза-бензоциклогептен-8-она, используя (3-амино-пиридин-4-ил)-уксусную кислоту и 4-амино-1-бензилпиперидин, получали 7-пиперидин-4-ил-5,6,7,9-тетрагидро-2,7,9-триаза-бензоциклогептен-8-он в виде твердого вещества белого цвета.
7-пиперидин-4-ил-5,7,8,9-тетрагидро-2,5,7-триаза-бензоциклогептен-6-он:
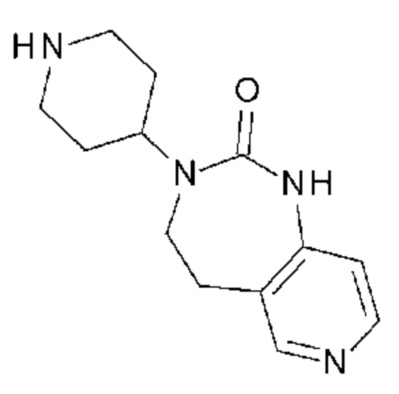
Аналогично синтезу 7-пиперидин-4-ил-5,6,7,9-тетрагидро-1,7,9-триаза-бензоциклогептен-8-она, используя (4-амино-пиридин-3-ил)-уксусную кислоту и 4-амино-1-бензилпиперидин, получали 7-пиперидин-4-ил-5,7,8,9-тетрагидро-2,5,7-триаза-бензоциклогептен-6-он в виде твердого вещества белого цвета.
7-пиперидин-4-ил-5,7,8,9-тетрагидро-1,5,7-триаза-бензоциклогептен-6-он:
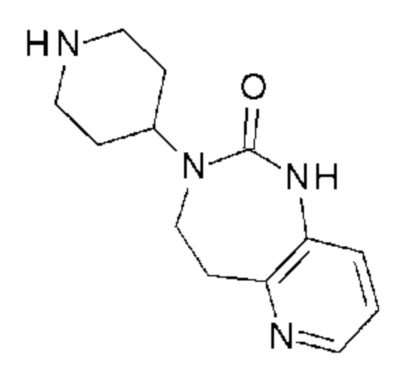
Аналогично синтезу 7-пиперидин-4-ил-5,6,7,9-тетрагидро-1,7,9-триаза-бензоциклогептен-8-она, используя (5-амино-пиридин-3-ил)-уксусную кислоту и 4-амино-1-бензилпиперидин, получали 7-пиперидин-4-ил-5,7,8,9-тетрагидро-1,5,7-триаза-бензоциклогептен-6-он в виде твердого вещества белого цвета.
3-пиперидин-4-ил-3,4-дигидро-1H-пиридо[2,3-d]пиримидин-2-он:
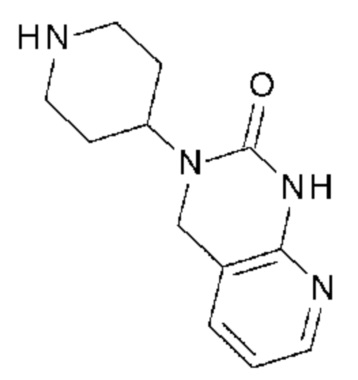
Аналогично синтезу 3-пиперидин-4-ил-3,4-дигидро-1H-хиназолин-2-он (описанный в примере 1.5), и используя 2-трет-бутоксикарбониламино-никотиновую кислоту, получали 3-пиперидин-4-ил-3,4-дигидро-1H-пиридо[2,3-d]пиримидин-2-он в виде твердого вещества бежевого цвета.
7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он:
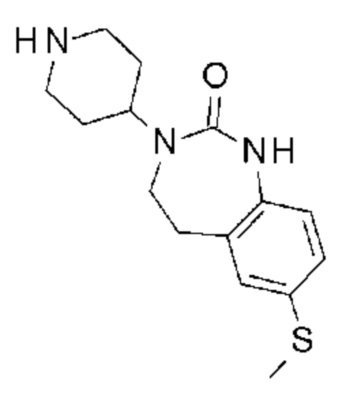
Аналогично синтезу 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (описанный в примере 115.6), и используя 1-Boc-4-пиперидон и 2-(5-метилсульфанил-2-нитрофенил)-этиламин, получали 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он в виде твердого вещества белого цвета.
7-метилсульфинил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он:
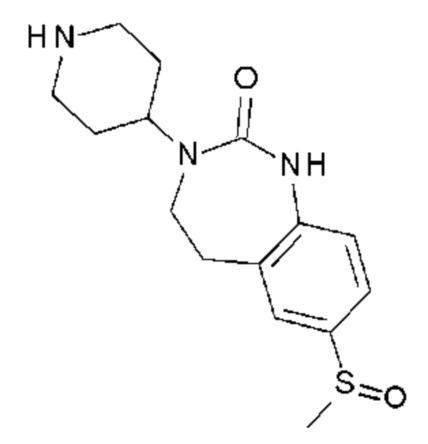
Аналогично синтезу 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, и после окисления 3-хлорпероксибензойной кислотой, получали 7-метилсульфинил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он в виде твердого вещества белого цвета.
7-метилсульфонил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он:
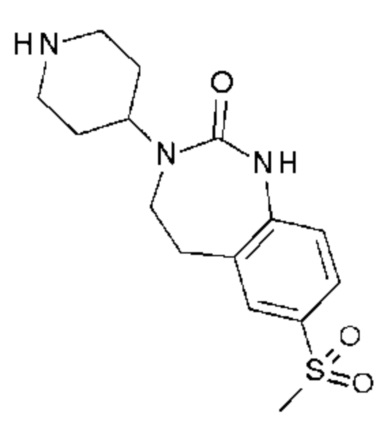
Аналогично синтезу 7-метилсульфанил-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она, и после окисления перекисью водорода в присутствии аммония молибдата тетрагидрата, 3-хлорпероксибензойной кислоты, получали 7-метилсульфонил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он в виде твердого вещества белого цвета.
3-пиперидин-4-ил)-2-оксо-2,3,4,5-тетрагидро-1H-бензо[d][1,3]диазепин-7-карбоновая кислота:
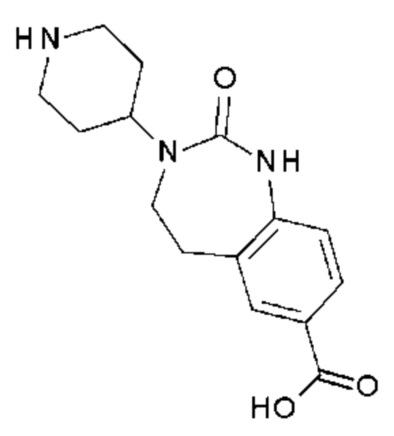
используя 7-бром-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он, и после карбоксилирования с помощью гидрида натрия, н-бутиллития и диоксида углерода, получали 3-пиперидин-4-ил)-2-оксо-2,3,4,5-тетрагидро-1H-бензо[d][1,3]диазепин-7-карбоновую кислоту в виде твердого вещества белого цвета.
5,5-диметил-3-(4-пиперидил)-1,4-дигидро-1,3-бензодиазепин-2-он:
Аналогично синтезу 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он (описанный в примере 115.6), и используя 1-Boc-4-пиперидон и 2-(5-метокси-2-нитрофенил)-2-метил-пропиламин, получали 5,5-диметил-3-(4-пиперидил)-1,4-дигидро-1,3-бензодиазепин-2-он в виде твердого вещества бежевого цвета.
5-метил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он:
Аналогично синтезу 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-он (описанный в примере 115.6), и используя 1-Boc-4-пиперидон и 2-(5-метокси-2-нитрофенил)-пропиламин, 5-метил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он получали в виде твердого вещества белого цвета.
4-метил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он:
Аналогично синтезу 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (описанный в примере 115.6), и используя 1-Boc-4-пиперидон и 2-(5-метокси-2-нитрофенил)-1-метил-этиламин, получали 4-метил-3-(4-пиперидил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он в виде твердого вещества белого цвета.
3-(6-азаспиро[3,3]гептан-2-ил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он:
Аналогично синтезу 7-метокси-3-пиперидин-4-ил-1,3,4,5-тетрагидро-бензо[d][1,3]диазепин-2-она (описанный в примере 115.6), и используя 1-(2-бромэтил)-2-нитробензол и 6-амино-2-аза-спиро[3,3]гептан-2-трет-бутилкарбоксилат, получали 3-(6-азаспиро[3,3]гептан-2-ил)-4,5-дигидро-1H-1,3-бензодиазепин-2-он в виде твердого вещества белого цвета.
4-фенил-1-пиперидин-4-ил-1,3-дигидро-имидазол-2-он:
4-(2-оксо-4-фенил-2,3-дигидро-имидазол-1-ил)-пиперидин-1-трет-бутил-карбоксилат:
К раствору 2-бромацетофенона в дихлорметане добавляли N-Boc-4-амино-пиперидин и N,N-диизопропилэтиламин в растворе в дихлорметане. Реакционную смесь перемешивали при комнатной температуре в течение шестнадцати часов, затем добавляли цианат натрия, а также ледяную уксусную кислоту. После экстракции водой и дихлорметаном, органическую фазу сушили, затем фильтровали и концентрировали досуха. Получали 4-(2-оксо-4-фенил-2,3-дигидро-имидазол-1-ил)-пиперидин-1-трет-бутил-карбоксилат в виде твердого вещества кремового цвета.
4-фенил-1-пиперидин-4-ил-1,3-дигидро-имидазол-2-он:
Аналогично примеру 1.2, используя 4-(2-оксо-4-фенил-2,3-дигидро-имидазол-1-ил)-пиперидин-1-трет-бутил-карбоксилат, получали 4-фенил-1-пиперидин-4-ил-1,3-дигидро-имидазол-2-он в виде твердого вещества оранжевого цвета.
спиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-2-он:
(6-хлор-пиридин-2-ил)-трет-бутилкарбамат:
В тетрагидрофуране растворяли 2-амино-6-хлорпиридин и бис(триметилсилил)амид натрия. По каплям добавляли раствор ди-трет-бутилдикарбоната в тетрагидрофуране. Реакционную смесь перемешивали при комнатной температуре в течение двадцати часов. Добавляли воду и этилацетат, и продукт экстрагировали этилацетатом. Органические фазы объединяли, промывали один раз водой и один раз насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Получали (6-хлор-пиридин-2-ил)-трет-бутилкарбамат в виде твердого вещества коричневого цвета.
7'-хлор-2'-оксо-1',2'-дигидро-1H-спиро[пиперидин-4,4'-пиридо[2,3-d][1,3]оксазин]-1-бензилкарбоксилат:
К раствору N,N,N',N'-тетраметилэтилендиамина в тетрагидрофуране при -20°C добавляли по каплям н-бутиллитий. После перемешивания в течение тридцати минут, смесь охлаждали до -78°C и добавляли раствор (6-хлор-пиридин-2-ил)-трет-бутилкарбамата в тетрагидрофуране. Поддерживали температуру реакционной смеси равной -50°C в течение двух часов и затем по каплям добавляли раствор 4-оксо-пиперидин-1-бензилкарбоксилата в тетрагидрофуране. Температуру реакционной смеси медленно снижали до значения комнатной температуры и затем нагревали при 40°C в течение 18 часов. Реакционную смесь гидролизовали насыщенным водным раствором гидрокарбоната натрия и затем разбавляли дихлорметаном. Продукт экстрагировали дихлорметаном, органические фазы объединяли, промывали один раз водой, затем сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенный продукт подвергали хроматографии на силикагеле, элюируя смесью гептан/этилацетат 70/30 и затем 50/50. Получали 7'-хлор-2'-оксо-1',2'-дигидро-1H-спиро[пиперидин-4,4'-пиридо[2,3-d][1,3]оксазин]-1-бензилкарбоксилат в виде твердого вещества желтого цвета.
спиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-2-он:
Аналогично примеру 98.4, используя 7'-хлор-2'-оксо-1',2'-дигидро-1H-спиро[пиперидин-4,4'-пиридо[2,3-d][1,3]оксазин]-1-бензилкарбоксилат, получали спиро[1H-пиридо[2,3-d][1,3]оксазин-4,4'-пиперидин]-2-он в виде твердого вещества желтого цвета.
Изобретение также относится к соединениям по настоящему изобретению для использования в качестве лекарственного средства.
Предпочтительно, соединения по настоящему изобретению используются в профилактике и/или лечении воспалительных заболеваний с нейрогенным компонентом.
Термин ʺпрофилактикаʺ или ʺпредупреждатьʺ воспалительные заболевания с нейрогенным компонентом означает снижение частоты и/или устранение появления симптомов этих заболеваний.
Термин ʺлечениеʺ или ʺлечитьʺ воспалительные заболевания с нейрогенным компонентом означает ослабление и/или сдерживание развития этих заболеваний и/или их симптомов.
ʺВоспалительные заболевания с нейрогенным компонентомʺ означает воспалительные заболевания кожи с нейрогенным компонентом, выбранные из розацеа (эритематозная) I типа и II типа (папулопустулярная), атопического дерматита, хронической экземы рук, псориаза в его различных формах (вульгарный псориаз, псориаз волосистой части головы, артритный псориаз, пустулезный псориаз, каплевидный псориаз), лицевой эритемы, ʺстыдливойʺ эритемы, крапивницы (острая, старческий зуд, узловатая почесуха) и акне или головных болей при нейрогенном воспалении, таких как мигрень.
Воспалительные заболевания кожи с нейрогенным компонентом выбраны из розацеа (эритематозной) I типа, атопического дерматита, вульгарного псориаза и псориаза кожи головы, и крапивницы типа старческого зуда и узловатой почесухи, еще более предпочтительно розацеа (эритематозной) I типа.
Соединения по настоящему изобретению также могут применяться в профилактике и/или лечении воспалительных заболеваний с сосудистым компонентом, таких как младенческая гемангиома или пурпурозный дерматит.
Интерес к новым антагонистам рецептора CGRP - гетероциклическим соединениям по настоящему изобретению при лечении воспалительных заболеваний с нейрогенным компонентом основан на клинических элементов, подчеркивающих параллель между, в частности, розацеа и мигренью:
- лицевая локализация очагов поражения у пациентов с розацеа аналогична зонам иннервации тройничного нерва, который также вовлечен в мигрень;
- распространенность мигрени у пациентов с розацеа подтверждается эпидемиологическими исследованиями (≥27% в сравнении с 13% в общей популяции населения).
Также он основан на экспериментальных данных:
- клинически был продемонстрирован сосудорасширяющий эффект CGRP в отношении кожных сосудов: инъекция низких доз CGRP подкожно индуцирует эритему, которое длится в течение нескольких часов;
- местное применение капсаицина индуцирует высвобождение нейропептидов, включая CGRP, что находит отражение в расширении подкожных сосудов;
- внутривенная инъекция αCGRP мышам вызывает внезапный прилив крови, который преимущественно определяется на уровне морды животного. У мышей, нокаутных по гену MRamp1, не наблюдают какого-либо сосудорасширяющего ответа на этот внезапный прилив, вызываемый CGRP. Кроме того, у этих мышей, в модели локального нейрогенного воспаления, вызванного местным применением агониста TRPV1, не проявляется отечность. Эти результаты, по-видимому, подтверждают важную роль высвобождения CGRP в нейрогенном воспалении и внезапном приливе крови.
В этом смысле, обычно, соединения по настоящему изобретению обладают хорошим сродством к рецептору CGRP и соответственно хорошей активностью в отношении рецептора CGRP.
Эта активность более конкретно иллюстрируется GPCR GeneBLAzer® клеточным анализом доз, который обеспечивает единый метод контроля клеточного ответа на потенциальные лекарственные средства.
В клеточной модели GeneBLAzer® GPCR, поставляемой Invitrogen (Lifetechnologies), активация рецептора CALCLR:RAMP1 приводит к экспрессии репортерного гена (бета-лактамазы). Активность бета-лактамазы количественно определяется посредством FRET (резонансный перенос энергии флуоресценции) в присутствии флуоресцентного субстрата и прямо пропорциональна активации рецептора.
Линии GeneBLAzer® CALCRL:RAMP CRE-bla HEK293F представляют собой клетки HEK293F, стабильно сверхэкспрессирующие рецепторы RAMP1 и CALCRL, а также репортерный ген бета-лактамазы под контролем цАМФ-ответного элемента (CRE).
Субстрат бета-лактамазы содержит два флуорофора (флуоресцеин и кумарин), связанных вместе посредством ядра бета-лактама. При отсутствии бета-лактамазы и когда она возбуждается при λ=409 нм, субстрат остается интактным и длина волны излучения флуоресценции от кумарина (λ=460 нм) возбуждает флуоресцеин, который, в свою очередь, излучает волны (λ=530 нм). Однако, когда бета-лактамаза экспрессируется, субстрат расщепляется, разделяя два флуорофора и прерывая FRET. Излучение от кумарина затем будет пропорционально активации рецептора.
Клетки высевают в 384-луночные микропланшеты с концентрацией 10000 клеток на лунку и инкубируют в течение 18 часов при 37°С. Добавляли вертикальные серийные разведения агониста (кодируемый геном кальцитонина пептид альфа для RAMP1) в конкуренции с горизонтальными серийными разведениями исследуемых антагонистов. После инкубации в течение 3 часов при 37°С в каждую лунку добавляют субстрат бета-лактамазы и микропланшет инкубируют в течение 2 часов при комнатной температуре. Затем флуоресценцию измеряют с помощью считывающего устройства для микропланшетов (λвозбуждение=409 нм, λизлучение 1=460 нм, λизлучение 2=530 нм).
В следующей таблице описаны различные условия, применяемые к различным используемым линиям:
(нM)
(нM)
RAMP1
(NEOMPS, #SC113)
Данные флуоресценции нормализуются с использованием отрицательных контролей (нестимулированных клеток) и положительных контролей (агонист при насыщающей концентрации).
Вычисляют константы диссоциации для каждого состояния рецептора ["Mechanistic analysis of the function of agonists и allosteric modulators: reconciling two-state и operational models" David Roche, British Journal of Pharmacology (2013) 169 1189-1202] (KdR=сродство в состоянии покоя и KdA=сродство в активированном состоянии), и отношение KdR/KdA представляет внутреннюю активность исследуемого лиганда: если KdR=KdA, исследумый лиганд является нейтральным антагонистом.
Различные значения EC50 агониста, полученные при каждой концентрации исследуемого антагониста, приводятся к линейному виду (Schild regression ["Quantitation in receptor pharmacology" Terry P. Kenakin, Receptors и Channels (2001) 7 371-385]), чтобы определить кажущееся сродство (Kdapp) антагониста. Это значение называется кажущимся, поскольку оно может изменяться как функция конститутивной активации и экспрессии рецептора и сравнимо с Kb в случае нейтрального антагониста.
Результаты сродства, полученные таким образом для каждого из исследуемых соединений, представлены в таблице I ниже, в которой:
Kdapp соответствует сродству соединения к рецептору CGRP;
A соответствует Kdapp <10 нМ;
B соответствует Kdapp в диапазоне от 10 до 100 нМ;
C соответствует Kdapp в диапазоне от 101 до 500 нМ; и
D соответствует Kdapp в диапазоне от 501 нМ до 5000 нМ.
Таблица 1:
(<10 нМ)
(10-100 нМ)
(101-500 нМ)
(501-5000 нМ)
Принимая во внимание результаты, представленные в приведенной выше таблице, соединения по настоящему изобретению, демонстрирующие Kdapp класса A, имеют очень сильное сродство к рецептору CGRP. Кроме того, эти соединения имеют отношение KdR/KdA=1 и, соответственно, обладают антагонистической активностью рецептора CGRP.
Поскольку нейрогенное воспаление играет важную роль в физиопатологии, в частности в розацеа и мигрени, антагонисты рецептора CGRP по настоящему изобретению должны, таким образом, уменьшить или полностью устранить это воспаление, обеспечивая эффект, который сохраняется после прекращения лечения.
Помимо их способности, с точки зрения биологической активности, работать в качестве мощного и селективного антагониста человеческого CGRP-R, эти соединения, предпочтительно производные урацила, демонстрируют метаболическую нестабильность на уровне печени и, соответственно, существует небольшой риск токсического поражения печени.
Это иллюстрируется, в частности, исследованием метаболической стабильности в присутствии микросом печени человека, представленным ниже.
Человеческие печеночные микросомы (Becton Dickinson) инкубируют при концентрации белка 0,5 мг/мл в реакционной смеси.
Реакционная смесь микросом состоит из фосфатного буфера с рН: 7,4 при 100 мМ, MgCl2 при 100 мМ (50/50), системы для генерирования АТФ, состоящей из смеси никотинамидадениндифосфата (НАДФ), глюкозо-6-фосфата (G6P) при концентрации 1 мг/мл и глюкозо-6-фосфатдегидрогеназы (G6PDH) при концентрации 4 ед/мл. Соединения исследуют при 1 мкм (ДМСО 0,1%).
Образцы берут из инкубационной среды после добавления микросом в течение 15 мин. Метаболическую реакцию останавливают добавлением метанола (1 объем инкубационной среды/3 объема метанола). Выраженное в процентах количество исходного продукта, оставшегося через 15 минут, измеряют с помощью анализа ЖХ/МС/МС.
Полученные результаты представлены в таблице 2 ниже.
Таблица 2:
В соответствии с полученными результатам, соединения формулы (I) по настоящему изобретению демонстрируют метаболическую нестабильность на уровне печени по сравнению с соединениями, известными из предшествующего уровня техники, и поэтому должен присутствовать небольшой риск токсического поражения печени.
Соединения по настоящему изобретению также могут быть включены в состав фармацевтических композиций для применения человеком. Указанные композиции содержат, по меньшей мере, одно соединение общей формулы (I) по настоящему изобретению в фармацевтически приемлемом носителе.
ʺФармацевтически приемлемый носительʺ означает носитель, подходящий для использования в контакте с клетками человека, совместимый с кожей, слизистой оболочкой и придатками без возникновения токсичности, раздражения, чрезмерной аллергической реакции, соизмеримых с разумным соотношением польза/риск.
Предпочтительно, соединение общей формулы (I) по настоящему изобретению присутствует в фармацевтической композиции для местного применения, что значительно снижает любой побочный эффект на уровне печени.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833354C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2013 |
|
RU2623221C2 |
| (3-ЦИКЛОАЛКИЛ-2,3,4,5-ТЕТРАГИДРО-1Н-БЕНЗО[d]АЗЕПИН-7-ИЛОКСИ)ПРОИЗВОДНЫЕ, ИХ ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ Н3 РЕЦЕПТОРОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПОЛУЧЕНИЯ | 2003 |
|
RU2388752C2 |
| ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ СЕЛЕКТИВНОГО ИНГИБИРОВАНИЯ СВЯЗЫВАНИЯ αβ ИНТЕГРИНА У МЛЕКОПИТАЮЩЕГО | 2000 |
|
RU2263109C2 |
| ПРОИЗВОДНЫЕ АРИЛМЕТОКСИ ИЗОИНДОЛИНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2567753C2 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛА | 2005 |
|
RU2382786C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
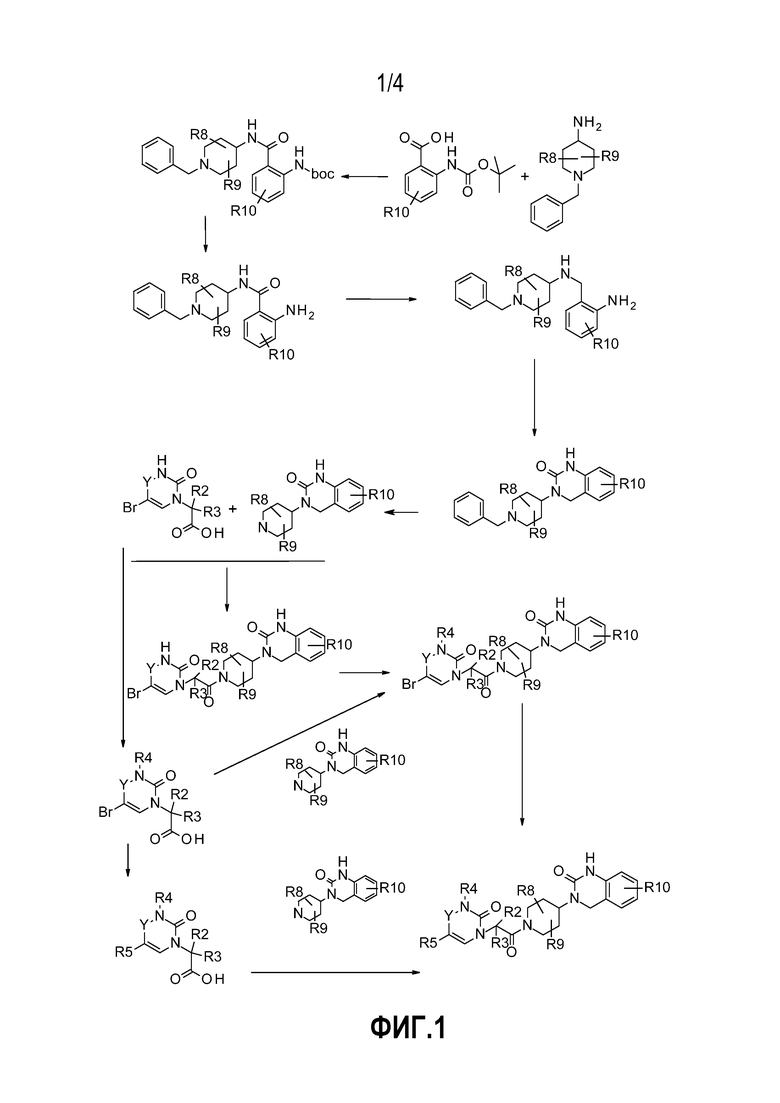
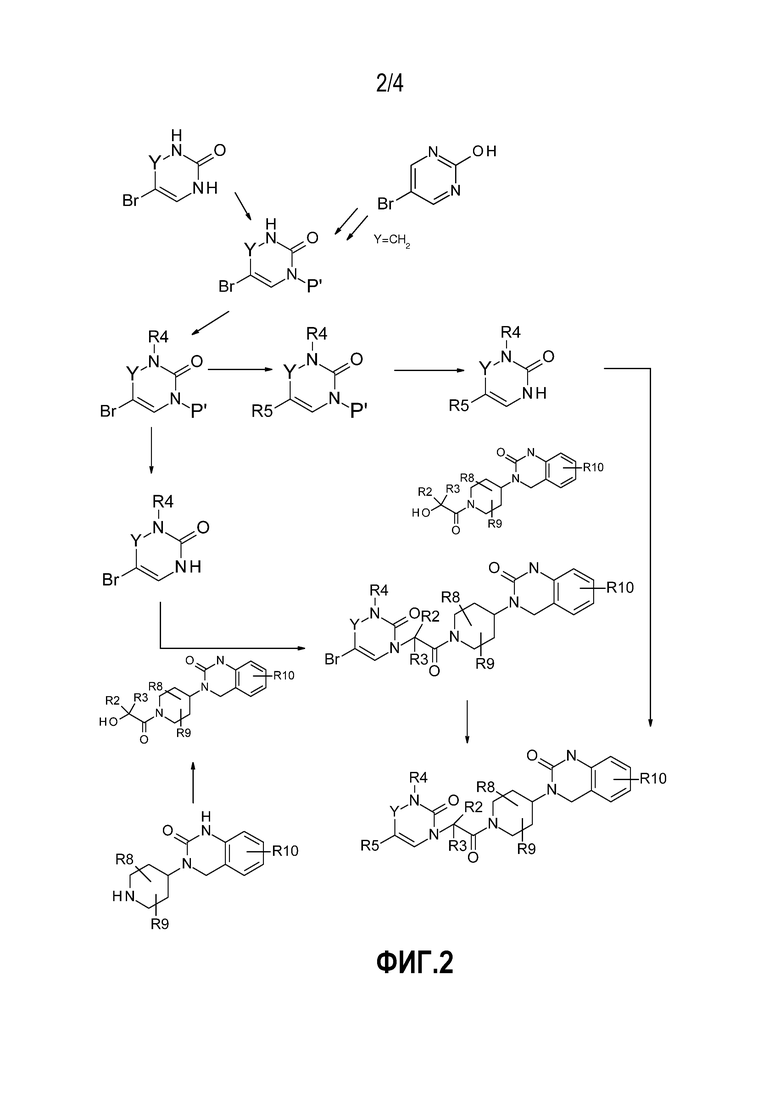
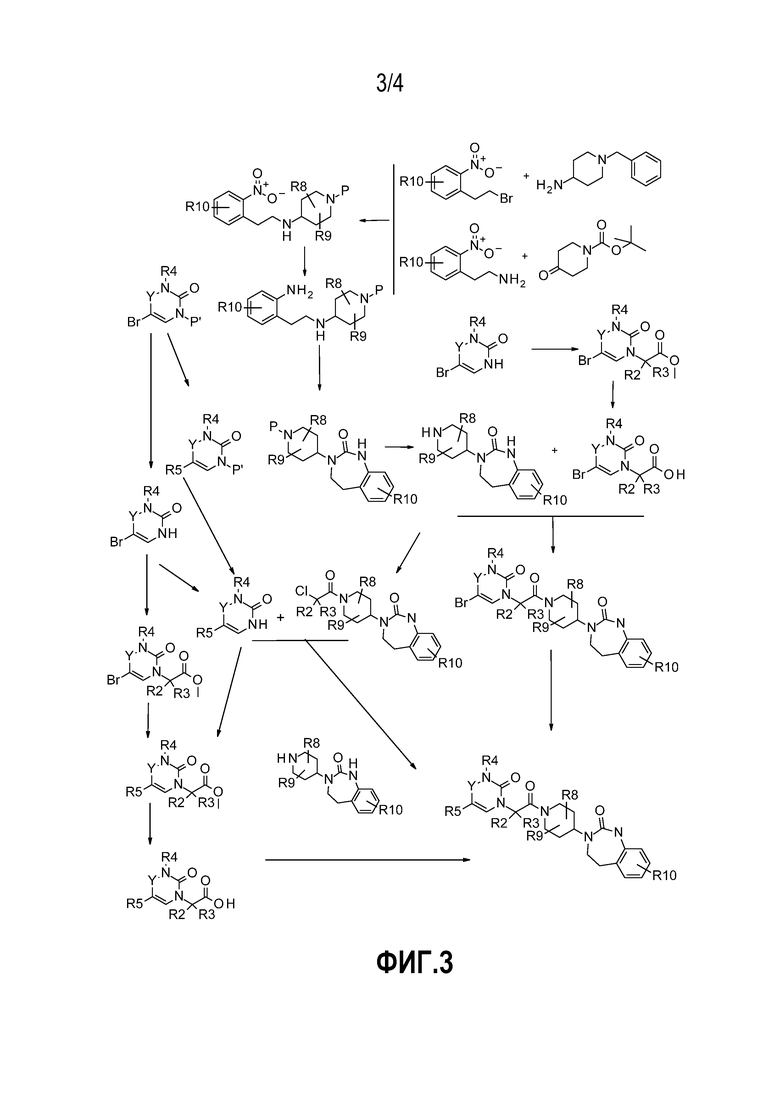
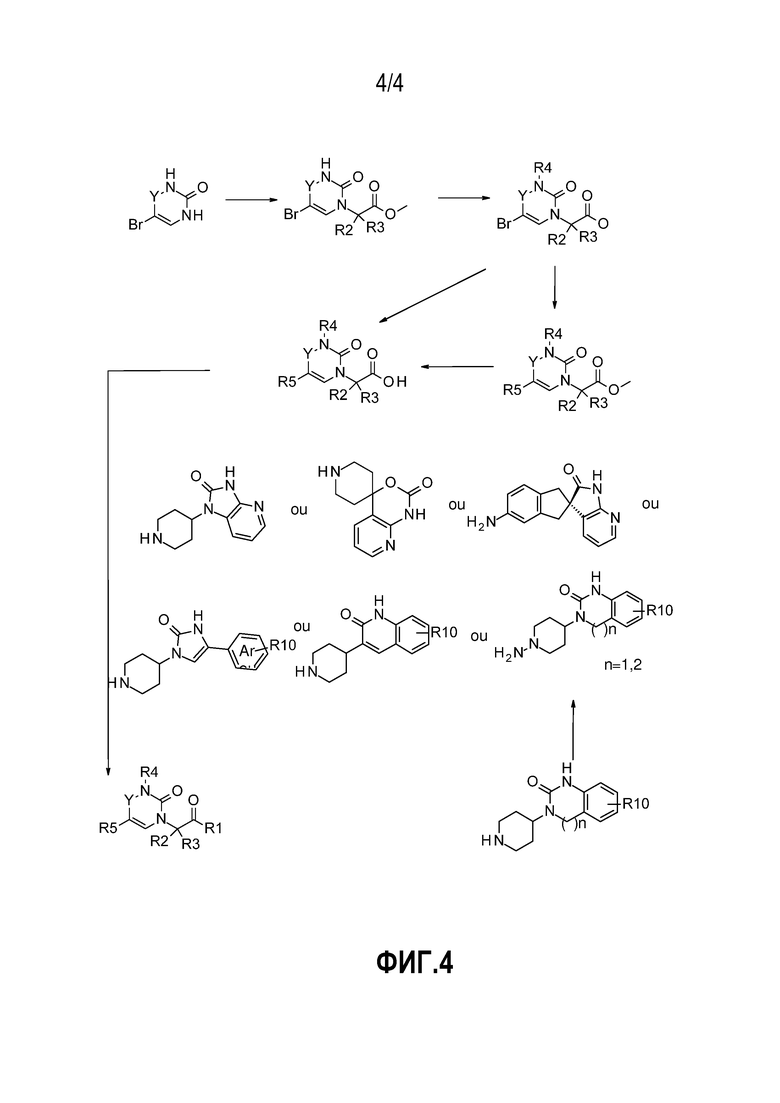
Изобретение относится к новому гетероциклическому соединению общей формулы (I), к его фармацевтически приемлемой соли и его энантиомеру. Соединения обладают свойствами антагониста рецептора CGRP-R и могут найти применение в профилактике и/или лечении воспалительных заболеваний с нейрогенным компонентом, например в профилактике и/или лечении розацеа (эритематозной) I типа, для лечения мигрени. В соединении формулы (I) 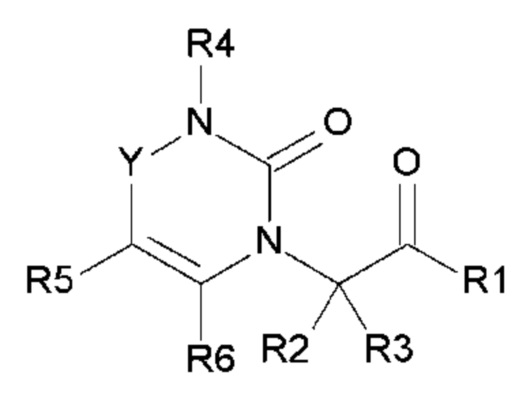 Y выбран из -CH2 или -C(O); R1 выбран из следующих групп (1-1), (1-6), (1-9) и (1-10):
Y выбран из -CH2 или -C(O); R1 выбран из следующих групп (1-1), (1-6), (1-9) и (1-10):
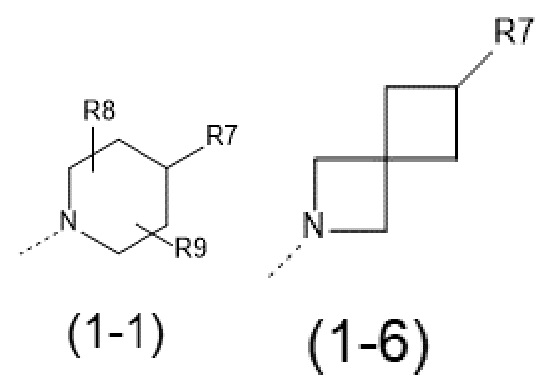
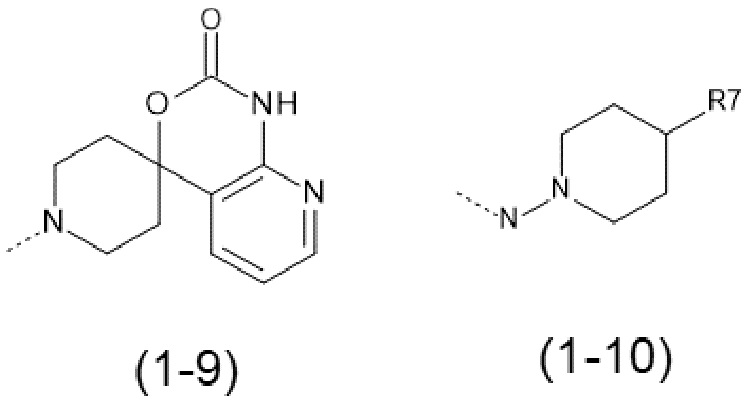
R2, R3, R6 представляют собой атом водорода; R4 выбран из атома водорода или групп, выбранных из указанных в п. 1 формулы изобретения, R5 выбран из галогена, C1-C4 алкила, C4-C7 циклоалкена или следующих групп:
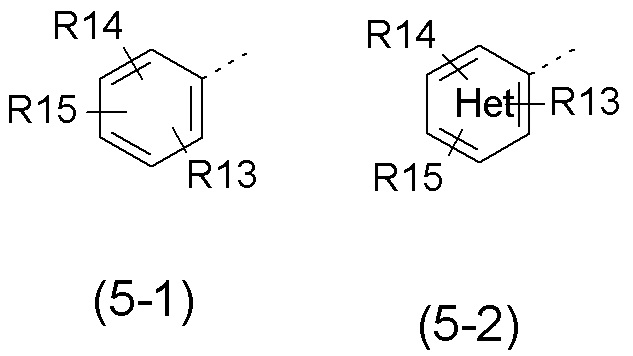
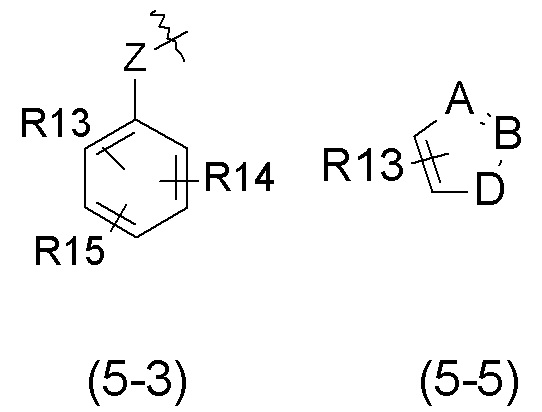
с группой Het, представляющей 1-2 атома азота в числе 6 атомов ароматического кольца и эти атомы азота могут быть, независимо друг от друга, замещены атомом кислорода с образованием N-оксидной группы; R7 выбран из следующих групп
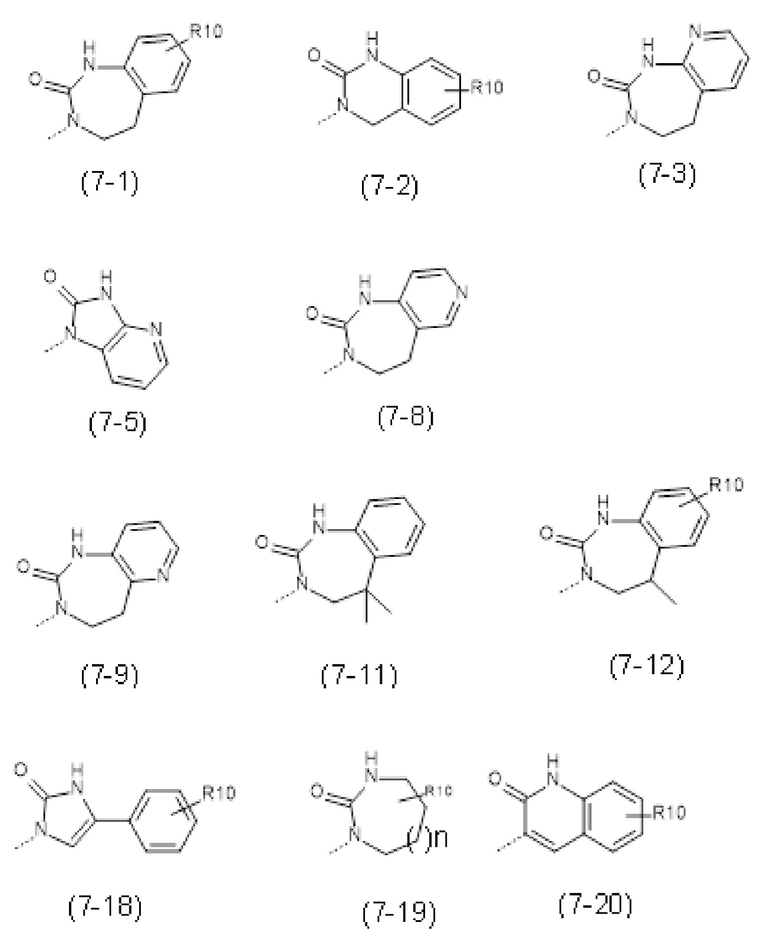
причем n=0 или 1; R8, R9, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3; R10 выбран из атома водорода, -OR11, -SR11, -S(O)R11, -SO2R11, -CO2R11 или галогена; R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила, CF3 или простого эфира C1-C6 алкила; R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила, циклоалкила, -OR16, галогена, -OCF3, -CF3, -CN, -CO2R16, -CONR16R17, -NO2, -OCH2OR16, -SR16, -S(O)R16 или -SO2R16; A, B, D, которые могут быть одинаковыми или различными, выбраны из атома C, N или S; R16 и R17, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила или -C(O)R18; Z выбран из -CH2 или O и R18 выбран из атома водорода, C1-C6 алкила. 2 н. и 8 з.п. ф-лы, 4 ил., 3 табл., 167 пр.
1. Гетероциклическое соединение, выбранное из соединений общей формулы (I):
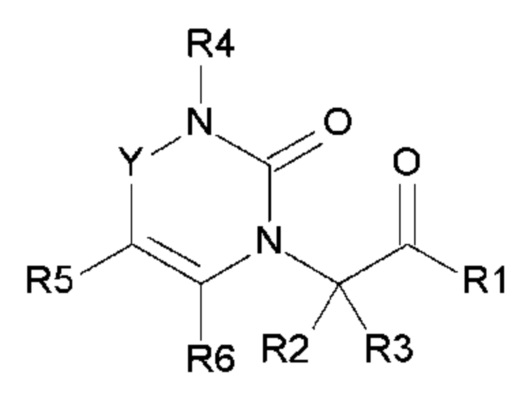 (I)
(I)
в которой
- Y выбран из -CH2 или -C(O);
- R1 выбран из следующих групп (1-1), (1-6), (1-9) и (1-10):
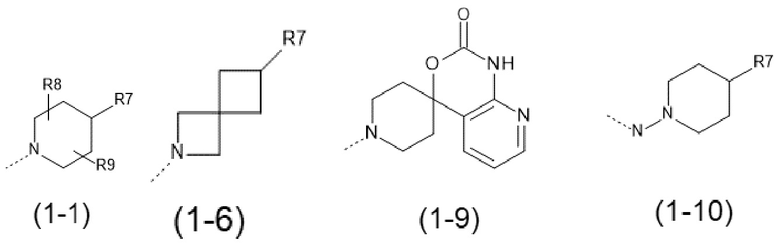
- R2, R3, R6 представляют собой атом водорода;
- R4 выбран из атома водорода или следующих групп:
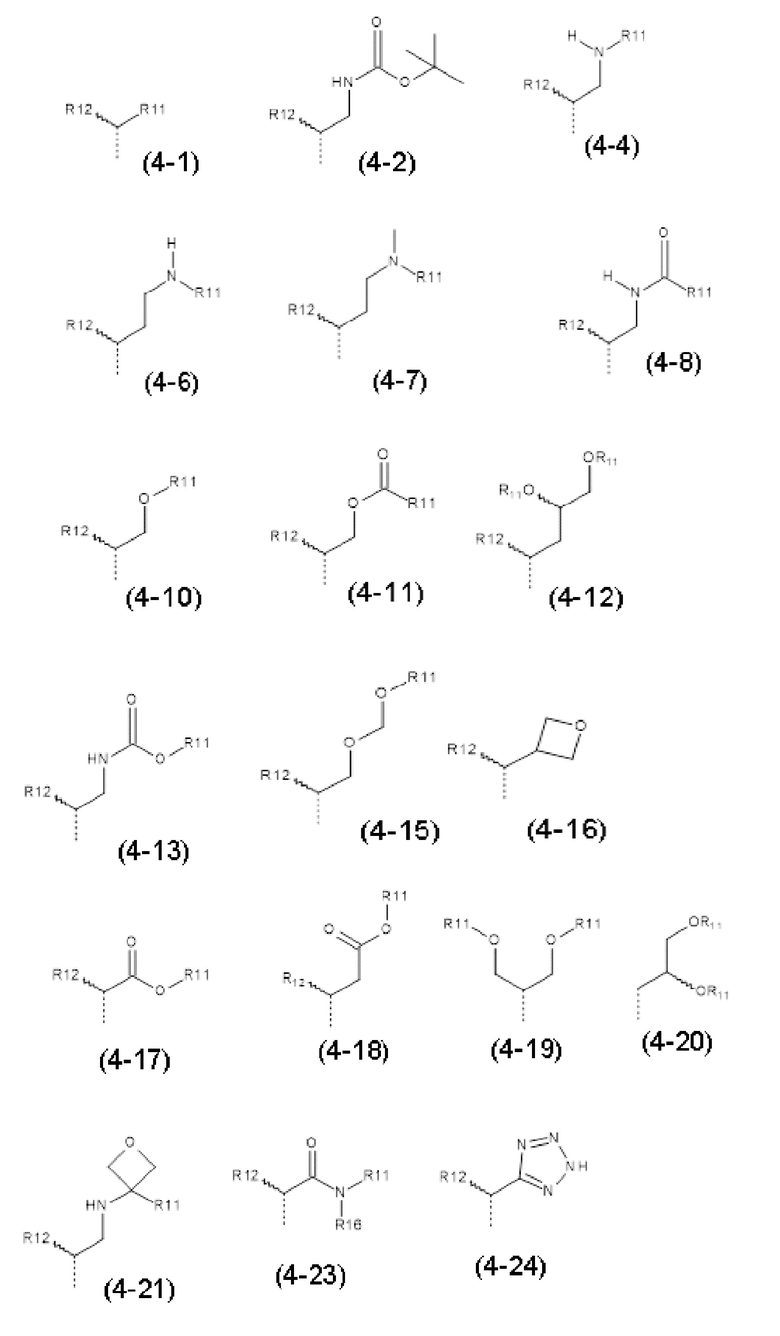
- R5 выбран из галогена, C1-C4 алкила, C4-C7 циклоалкена или следующих групп:
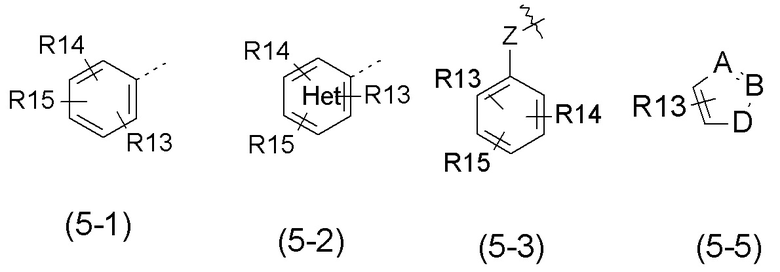
с группой Het, представляющей 1-2 атома азота в числе 6 атомов ароматического кольца и эти атомы азота могут быть, независимо друг от друга, замещены атомом кислорода с образованием N-оксидной группы;
- R7 выбран из следующих групп:
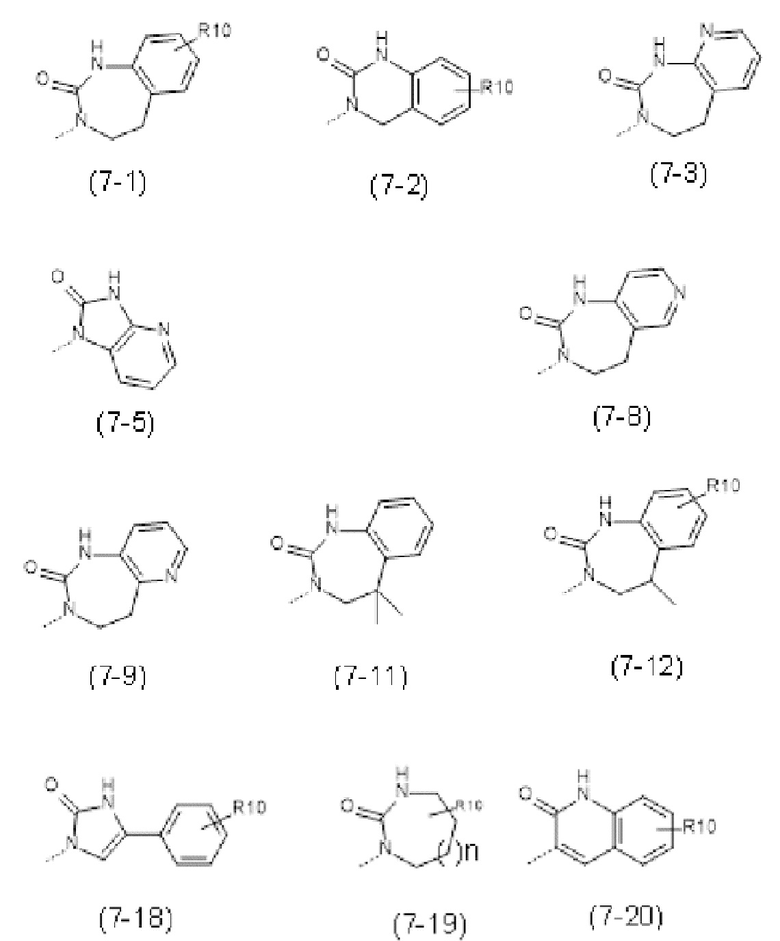
причем n=0 или 1;
- R8, R9, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
- R10 выбран из атома водорода, -OR11, -SR11, -S(O)R11, -SO2R11, -CO2R11 или галогена;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила, CF3 или простого эфира C1-C6 алкила;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила, циклоалкила, -OR16, галогена, -OCF3, -CF3, -CN, -CO2R16, -CONR16R17, -NO2, -OCH2OR16, -SR16, -S(O)R16 или -SO2R16;
- A, B, D, которые могут быть одинаковыми или различными, выбраны из атома C, N или S;
- R16 и R17, которые могут быть одинаковыми или различными, выбраны из атома водорода, C1-C6 алкила или -C(O)R18;
- Z выбран из -CH2 или O; и
- R18 выбран из атома водорода, C1-C6 алкила,
а также его фармацевтически приемлемые соли и его энантиомеры.
2. Соединение общей формулы (I) по п. 1, в которой:
- Y выбран из -CH2 или -C(O);
- R1 выбран из следующих групп:
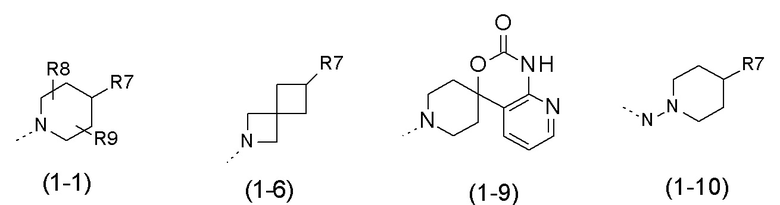
- R2, R3, R6, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
- R4 выбран из следующих групп:
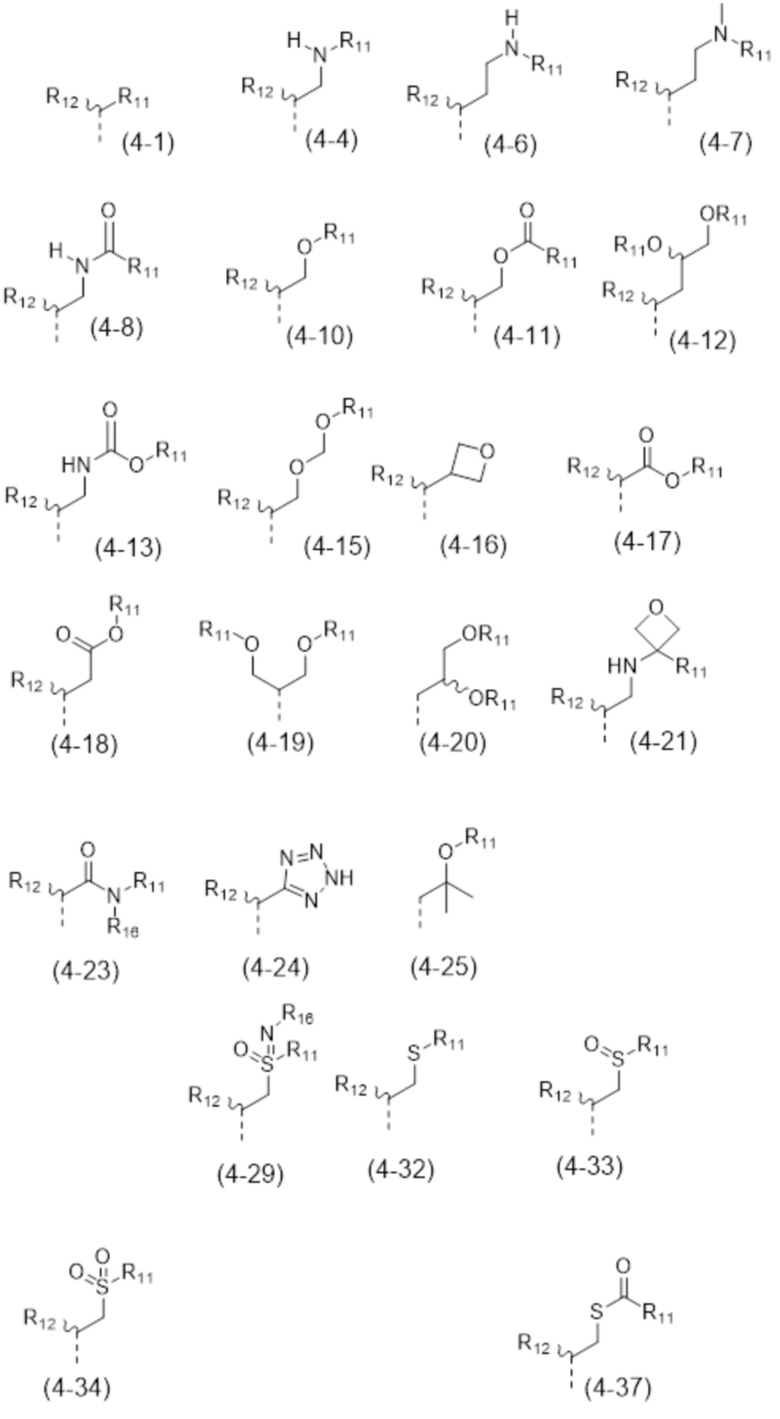
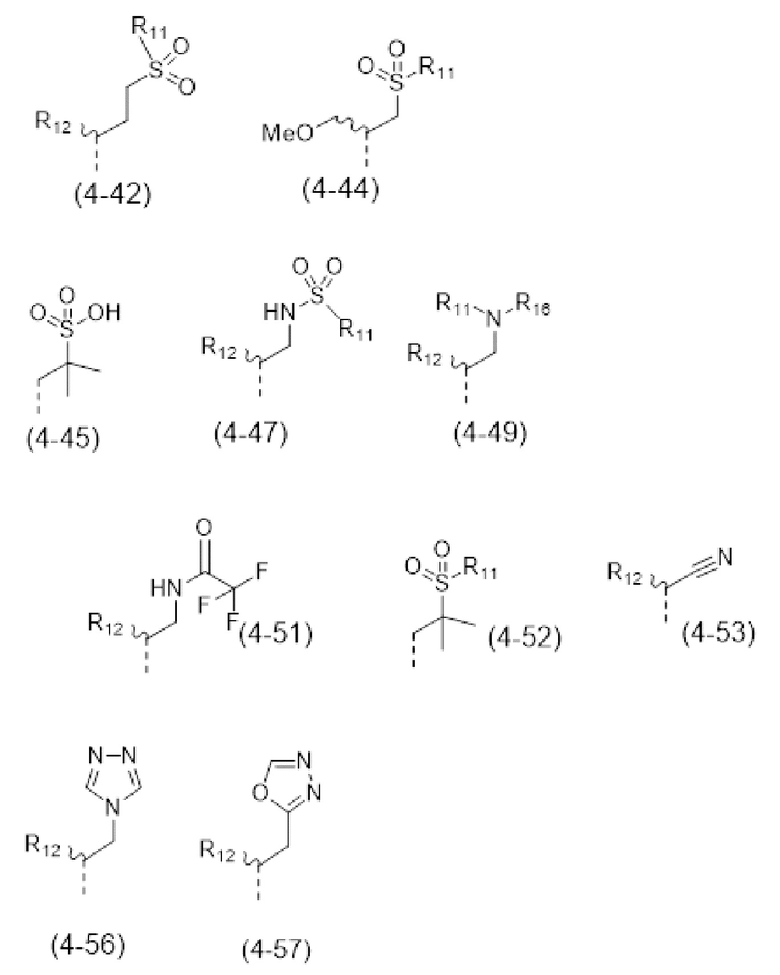
- R5 выбран из Br, -CH3, C4-C7 циклогексена или следующих групп:
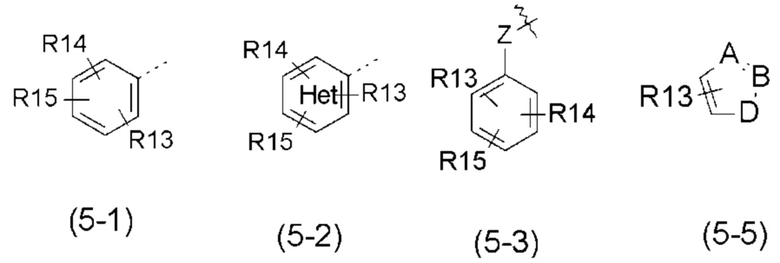 ,
,
с группой Het, представляющей 1-2 атома азота в числе 6 атомов ароматического кольца, причем эти атомы азота могут, независимо друг от друга, замещаться атомом кислорода с образованием N-оксидной группы;
- R7 выбран из следующих групп:
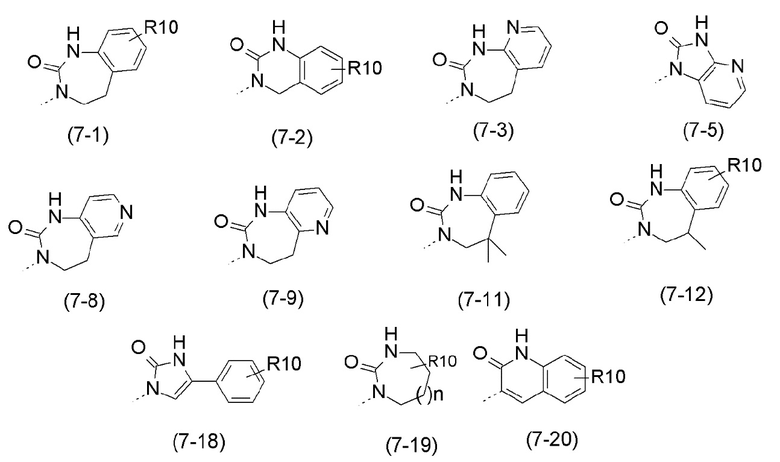
причем n=1;
- R8, R9, которые могут быть одинаковыми или различными, выбраны из атома водорода, F или -CH3;
- R10 выбран из атома водорода, -OR11, -SR11, -S(O)R11, -SO2R11, -CO2H или галогена, выбранного из Br или F;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода или C1-C3 алкила;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -CH3, -OR16, галогена, -OCF3, -CN, -CO2R16, -SR16, -S(O)R16 или -SO2R16;
- A, B, D, которые могут быть одинаковыми или различными, выбраны из атома C, N или S;
- R16 выбран из атома водорода или алкила; и
- Z выбран из -CH2 или O.
3. Соединение общей формулы (I) по п. 1 или 2, в которой:
- Y выбран из -CH2 или -C(O);
- R1 выбран из 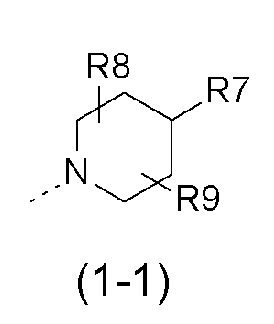 ;
;
- R2, R3, R6 представляют собой атом водорода;
- R4 выбран из следующих групп:
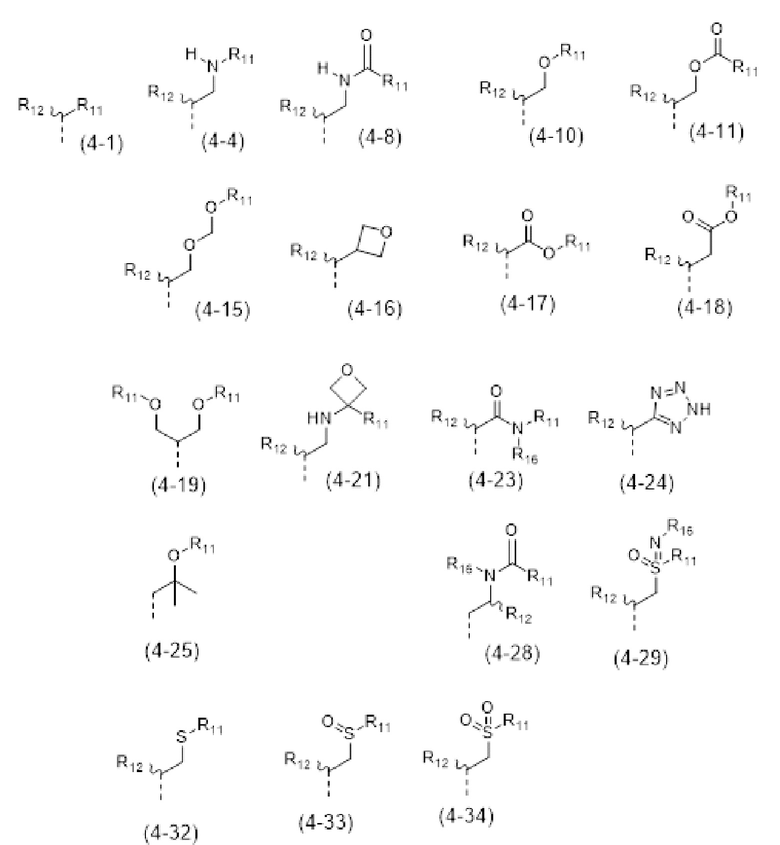
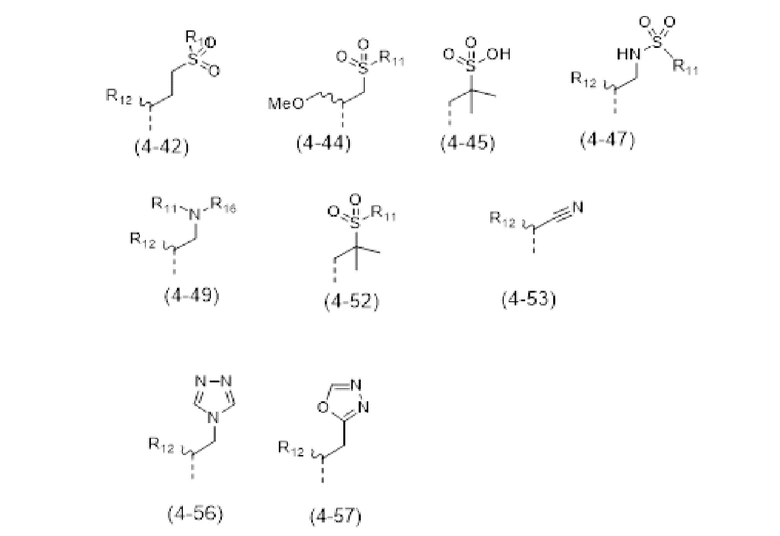
- R5 представляет собой 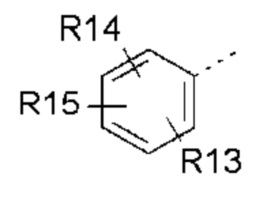 (5-1);
(5-1);
- R7 выбран из следующих групп:
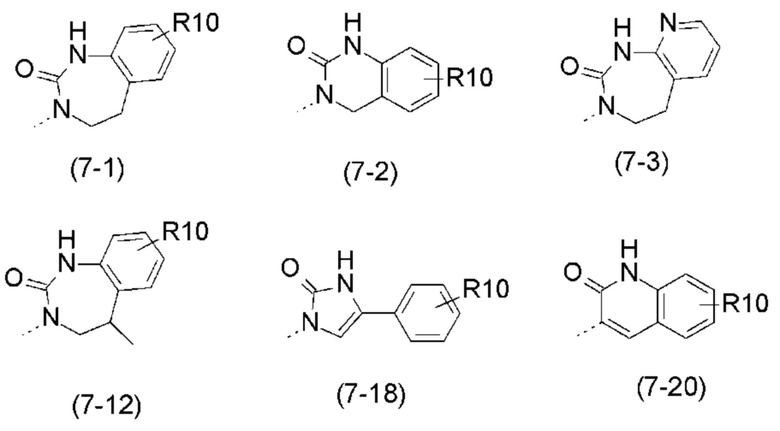
- R8, R9 представляют собой атом водорода;
- R10 выбран из атома водорода, -OR11, -SR11, -S(O)R11, -SO2R11, -CO2H или галогена, выбранного из Br или F;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода или C1-C2 алкила;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -CH3, -OR16, галогена или -OCF3; и
- R16 выбран из атома водорода или алкила.
4. Соединение общей формулы (I) по одному из пп. 1-3, в которой:
- Y представляет собой -C(O);
- R1 выбран из 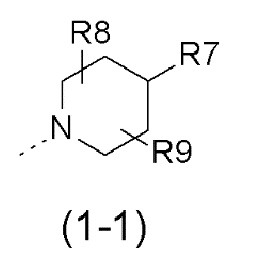 ;
;
- R2, R3, R6 представляют собой атом водорода;
- R4 выбран из следующих групп:
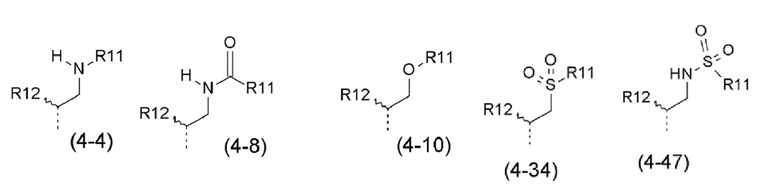
- R5 представляет собой
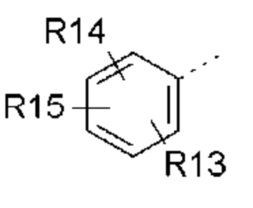 (5-1);
(5-1);
- R7 представляет собой
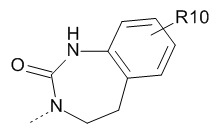 (7-1);
(7-1);
- R8, R9 представляют собой атом водорода;
- R10 выбран из атома водорода, -OR11, -SR11 или Br;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из атома водорода или C1-C2 алкила;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -OR16 или галогена, выбранного из F и Cl; и
- R16 представляет собой C1-C3 алкил.
5. Соединение общей формулы (I) в соответствии с одним из предшествующих пунктов, в которой:
- Y представляет собой -C(O);
- R1 представляет собой 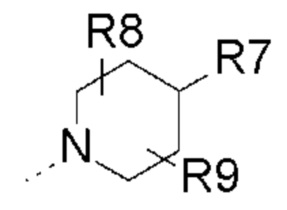 (1-1);
(1-1);
- R2, R3, R6 представляют собой атом водорода;
- R4 представляет собой 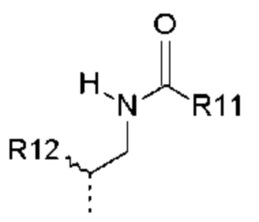 (4-8);
(4-8);
- R5 представляет собой 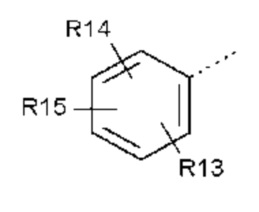 (5-1);
(5-1);
- R7 представляет собой  (7-1);
(7-1);
- R8, R9 представляют собой атом водорода;
- R10 представляет собой -OR11;
- R11, R12, которые могут быть одинаковыми или различными, выбраны из -CH3 или -CH2CH3;
- R13, R14, R15, которые могут быть одинаковыми или различными, выбраны из атома водорода, -OR16 или галогена, выбранного из F и Cl; и
- R16 представляет собой C1-C3 алкил.
6. Соединение общей формулы (I) по любому из предшествующих пунктов, обладающее свойствами антагониста рецептора CGRP-R, для получения лекарственного средства.
7. Соединение общей формулы (I) по п. 6 для получения лекарственного средства для использования в профилактике и/или лечении воспалительных заболеваний с нейрогенным компонентом.
8. Соединение общей формулы (I) по п. 7 для использования в профилактике и/или лечении розацеа (эритематозной) I типа.
9. Соединение общей формулы (I) по п. 7 для использования в лечении мигрени.
10. Фармацевтическая композиция, обладающая свойствами антагониста рецептора CGRP-R, содержащая эффективное количество, по меньшей мере, одного соединения общей формулы (I) по любому из пп. 1-5 и фармацевтически приемлемый носитель, предпочтительно подходящий для местного введения.
| WO 2006029153 A2, 16.03.2006 | |||
| WO 2004083187 A1, 30.09.2004 | |||
| WO 2010139717 A1, 09.12.2010 | |||
| WO 2008130512 A1, 30.10.2008 | |||
| WO 20081112159 А2, 18.09.008 | |||
| ПРИМЕНЕНИЕ АНТАГОНИСТА CGRP ДЛЯ ОБРАБОТКИ ПОКРАСНЕНИЙ КОЖИ НЕВРОГЕННОГО ПРОИСХОЖДЕНИЯ И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1996 |
|
RU2152798C1 |
| WO 2011005731 A2, 13.10.2011 | |||
| НОВЫЕ БЕНЗОЛСУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ И КОСМЕТИКЕ | 2010 |
|
RU2528826C2 |
Авторы
Даты
2020-02-03—Публикация
2015-12-22—Подача