Изобретение относится к области селеноорганической химии, в частности способу получения селенсодержащих производных фенолов, а именно бис(3,5-диалкил-4-гидроксибензил)селенидов, имеющему потенциальное применение в синтезе супрамолекул (циклофанов, селенокаликсаренов и др.), а также мультифункциональных антиоксидантов.
Известен способ получения дибензилселенидов, основанный на реакции восстановительного сочетания бензилселеноцианатов с бензилгалогенидами. Так, реакцию между 1-(селеноцианометил)-3-метилбензолом и 1-(хлорметил)-3-метилбензолом (1.04:1), в присутствии избытка NaBH4, проводят в среде бензол-EtOH (1:2) при комнатной температуре в течение 1 часа, что приводит к бис(3-метилбензил)селениду с выходом 79% (в расчете на бензилгалогенид) [1].
Известен способ получения диселеноциклофанов по реакции бис(галогенметил)бензолов с бис(селеноцианометил)бензолами. Так, взаимодействием 1,4-бис(селеноцианометил)бензола с 1,4-бис(бромметил)бензола (1.02:1) в смеси EtOH-ТГФ (1:1) в присутствии избытка NaBH4 (в атмосфере аргона) при 40-50°С в течение 13 часов, получен 3,7-диселено-1,5(1,4)-дибензеноциклооктафан с выходом 73% (в расчете на бензилгалогенид) [2].
Также известен способ получения симметричных дибензилселенидов, в котором реакцию бензилгалогенидов проводят с гидроселенидом натрия. Так, реакция гидроселенида натрия с 1,3-бис(бромметил)-5-трет-бутил-2-метоксибензолом (1.1:1) в среде EtOH-ТГФ (1:6.25) в атмосфере аргона при комнатной температуре с выходом 86% (в расчете на бензилгалогенид) приводит к смеси селенокаликсаренов [3].
Недостаток представленных способов - использование в качестве промежуточных соединений малодоступных бензилхлоридов и бензилбромидов, имеющих малый срок хранения, синтез которых зачастую не протекает гладко и требует особой техники работы: так, типичные выходы хлорметильных (бромметильных) производных, получаемых на основе триметилбензола, 3-(4-гидроксифенил)пропановой кислоты и 4,4'-диметоксибифенила составляют 30-61% [4-6].
Известен способ получения симметричных дибензилселенидов основанный на каталитической реакции бензиловых спиртов с селеном в присутствии триэтилсилана. Так по реакции пара-хлорбензилового спирта с селеном (2:1) в присутствии InI3 (0.1 мол. %) и Et3SiH (6 экв.) в дихлорэтане в атмосфере азота получен бис(4-хлорбензил)селенид с выходом 45% [7]. Недостатками данного метода являются использование дорогостоящих реагентов (InI3 и Et3SiH) и низкий выход.
Изобретение решает задачу разработки эффективного способа синтеза дибензилселенидов. Предлагаемый способ позволяет получать бис(3,5-диалкил-4-гидроксибензил)селениды из доступных реагентов (2,6-диалкилфенолов, формальдегида, селена, NaBH4 и KOH) в одну стадию с выходами 86-99%.
Технический результат достигается предлагаемым способом синтеза бис-бензилселенидов, а именно бис(3,5-диалкил-4-гидроксибензил)селенидов, по реакции 2,6-диалкилфенола, формальдегида, селена, NaBH4 и KOH в соответствии со схемой:
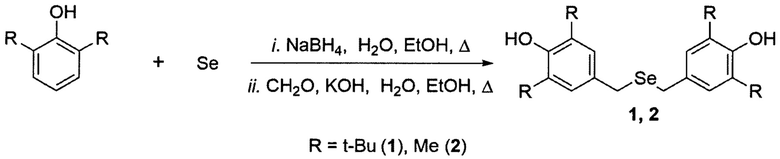
Предложенный способ получения соединений 1 и 2 осуществляется следующим образом. К смеси 2,6-диалкилфенола, селена, EtOH и воды порциями прибавляли NaBH4. После растворения селена к реакционной массе прибавляли KOH, нагревали до кипения и в один прием добавляли формалин, кипятили с обратным холодильником. Выполненные эксперименты позволяют получить бис(3,5-ди-трет-бутил-4-гидроксибензил)селенид на основе 2,6-ди-трет-бутилфенола с выходом 99% и бис(3,5-диметил-4-гидроксибензил)селенид на основе 2,6-диметилфенола с выходом 86%.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1.
Получение бис(3,5-ди-трет-бутил-4-гидроксибензил)селенида (1). К смеси 2,6-ди-трет-бутилфенола (4.17 г, 20.0 ммоля), Se (0.79 г, 10.0 ммоля), EtOH (62.5 мл) и воды (62.5 мл) при 40°С порциями прибавили NaBH4 (1.11 г, 29.4 ммоля). После растворения селена к реакционной массе прибавили KOH (0.45 г, 6.8 ммоля), нагревали до кипения и в один прием добавили 6.06 мл формалина (80.0 ммоля), кипятили с обратным холодильником 1 часа. Далее смесь охладили, перенесли в делительную воронку, прибавили 250 мл раствора NaCl, обработали EtOAc (3×100 мл), экстракт промыли раствором NaCl до рН≈7, высушили над Na2SO4, растворитель упарили, остаток высушили при пониженном давлении, получили 5.13 г продукта (выход 99%) в виде белых кристаллов (с содержанием основного вещества 98.8% по ВЭЖХ). Т.пл. 134.5-135.6°С (из EtOH). Найдено (%): С, 69.54; Н, 9.01; C30H46O2Se; Вычислено (%): С, 69.61; Н, 8.96. Спектр УФ (EtOH), λmax/нм (lg ε): 237 (4.25), 278 (3.60). ИК-спектр (CCl4), ν/см-1: 3646 (ОН). Спектр ЯМР 1H (δ, м.д., J/Гц): 1.43 (с, 36 Н, But); 3.74 (с, 4 Н, СН2); 5.12 (с, 2 Н, ОН); 7.10 (с, 4 Н, ArH). Спектр ЯМР 13С (δ, м.д.): 28.43 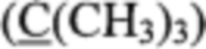 , 30.20 (СН3), 34.18 (СН2), 125.32 (С(3), С(5), С(3'), С(5')), 129.71 (С(4), С(4')), 135.78 (С(2), С(6), С(2'), С(6')), 152.42 (С(1), С(1')). Спектр ЯМР 77Se (δ, м.д.): 313.30. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 518 [М]+ (1), 219 [М - C15H23OSe]+ (100).
, 30.20 (СН3), 34.18 (СН2), 125.32 (С(3), С(5), С(3'), С(5')), 129.71 (С(4), С(4')), 135.78 (С(2), С(6), С(2'), С(6')), 152.42 (С(1), С(1')). Спектр ЯМР 77Se (δ, м.д.): 313.30. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 518 [М]+ (1), 219 [М - C15H23OSe]+ (100).
Пример 2.
Получение бис(3,5-диметил-4-гидроксибензил)селенида (2). К смеси 2,6-диметилфенола (2.44 г, 20.0 ммоля), Se (0.79 г, 10.0 ммоля), EtOH (62.5 мл) и воды (62.5 мл) при 40°С порциями прибавили NaBH4 (1.11 г, 29.4 ммоля). После растворения селена к реакционной массе прибавили KOH (0.45 г, 6.8 ммоля), нагревали до кипения и в один прием добавили 6.06 мл формалина (80.0 ммоля), кипятили с обратным холодильником 3 часа. Далее смесь охладили, перенесли в делительную воронку, прибавили 250 мл раствора NaCl, обработали EtOAc (3×100 мл), экстракт промыли раствором NaCl до рН≈7, высушили над Na2SO4, растворитель упарили, получали 3.49 г кристаллической массы. Перекристаллизация из 40 мл смеси PhMe - гексан (5:3) давала 3.00 г (выход 86%) продукта в виде белых кристаллов (с содержанием основного вещества 98.2% по ВЭЖХ). Т.пл. 97.3-97.7°С. Найдено (%): С, 61.95; Н, 6.28; C18H22O2Se; Вычислено (%): С, 61.89; Н, 6.35. Спектр УФ (EtOH), λmax/нм (lg ε): 237 (4.20), 279 (3.50). ИК-спектр (CHCl3), ν/см-1: 3609 (ОН). Спектр ЯМР 1Н (δ, м.д., J/Гц): 2.20 (с, 12 Н, СН3); 3.63 (с, 4 Н, СН2); 4.56 (с, 2 Н, ОН); 6.85 (с, 4 Н, ArH). Спектр ЯМР 13С (δ, м.д.): 15.75 (СН3), 27.15 (СН2), 122.81 (С(4), С(4')), 129.01 (С(3), С(5), С(3'), С(5')), 129.01 (С(2), С(6), С(2'), С(6')), 150.77 (С(1), С(1')). Спектр ЯМР 77Se (δ, м.д.): 326.02. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 350 [М]+ (3.7), 135 [M - C9H11OSe]+ (100).
Спектры ЯМР регистрировали для растворов в CDCl3 на спектрометре «Bruker Avance 600» (1Н, 600.13 МГц; 13С-{1H}, 150.90 МГц; 77Se-{1H}, 114.51 МГц). ИК-спектры регистрировали для растворов в CCl4 с концентрацией 2⋅10-2 моль⋅л-1 в кюветах из KBr ( =0.5 мм) на приборе «Agilent Cary 600 Series FTIR». УФ-спектры записаны на спектрометре «Shimadzu UV-1800» для растворов в EtOH с концентрацией 4⋅10-5 моль⋅л-1. ВЭЖХ анализ проводили на приборе «Agilent Infinity 1220» (ZORBAX SB-C18, 5 мкм, 150×4.6 мм). ГХ/МС анализ осуществляли на хроматографе «Agilent 7890В» (HP-5MS UI, 30 м × 0.25 мм, газ-носитель - гелий) с масс-детектором «Agilent 5977А» (ЭУ, 70 эВ). В описании масс-спектров приведены пики ионов с интенсивностью ≥20%, включающих наиболее распространенные изотопы. Температуры плавления определяли в капилляре (скорость нагрева 0.5°С мин-1) на приборе «МР 50 Mettler Toledo». Все реакции проводили в инертной атмосфере. Растворители перед использованием очищали и высушивали по стандартным методикам [8].
=0.5 мм) на приборе «Agilent Cary 600 Series FTIR». УФ-спектры записаны на спектрометре «Shimadzu UV-1800» для растворов в EtOH с концентрацией 4⋅10-5 моль⋅л-1. ВЭЖХ анализ проводили на приборе «Agilent Infinity 1220» (ZORBAX SB-C18, 5 мкм, 150×4.6 мм). ГХ/МС анализ осуществляли на хроматографе «Agilent 7890В» (HP-5MS UI, 30 м × 0.25 мм, газ-носитель - гелий) с масс-детектором «Agilent 5977А» (ЭУ, 70 эВ). В описании масс-спектров приведены пики ионов с интенсивностью ≥20%, включающих наиболее распространенные изотопы. Температуры плавления определяли в капилляре (скорость нагрева 0.5°С мин-1) на приборе «МР 50 Mettler Toledo». Все реакции проводили в инертной атмосфере. Растворители перед использованием очищали и высушивали по стандартным методикам [8].
Таким образом решена задача разработки эффективного способа синтеза дибензилселенидов, имеющего потенциальное применение в синтезе супрамолекул (циклофанов, селенокаликсаренов и др.), а также мультифункциональных антиоксидантов. Бис(3,5-диалкил-4-гидроксибензил)селениды получены из доступных реагентов (2,6-диалкилфенолов, формальдегида, селена, NaBH4 и KOH) в одну стадию с выходами 86-99%.
Источники информации
1. Otsubo Т., Ogura F, Yamaguchi Н, Higuchi Н, Misumi S. Pyrolysis of dibenzyl selenides to bibenzyls // Synthetic Communications. 1980. №10(8). P. 595-601.
2. Hiroyuki H., Keita Т., Tetsuo О., Yoshiteru S., Soichi M. New synthetic sethod of [2.2]cyclophanes via diselena[3.3]cyclophanes // Bulletin of the Chemical Society of Japan. 1987. №60(11). P. 4027-4036.
3. Thomas J., Maes W., Robeyns K., Ovaere M., Meervelt L.V., Smet M., Dehaen W. Homoselenacalix[n]arenes // Organic Letters. 2009. №11(14). P. 3040-3043.
4. Fuson R.C., Rabjohn N. Mesitylacetic acid // Organic Syntheses. 1945. №25. P. 65.
5. Du Y., Weng H., Huang J., Zhang D., Ma H., Chen D., Zhou X., Constant J-F. Oligonucleotide-selenide conjugate: Synthesis and its inducible sequence-specific alkylation of DNA // Bioorganic & Medicinal Chemistry. 2010. №18. P. 4149-4153.
6. Weng X., Ren L., Weng L., Huang J., Zhu S., Zhou X., Weng L. Synthesis and biological studies of inducible DNA cross-linking agents // Angewandte Chemie - International Edition. 2007. №46(42). P. 8020-8023.
7. Miyazaki Т., Katayama M., Yoshimoto S., Ogiwara Y., Sakai N. Indium-catalyzed direct preparation of dibenzyl sulfides from benzyl alcohols and elemental sulfur with a hydrosilane and its application to the preparation of dibenzyl selenide // Tetrahedron Letters. 2016. №57(6). P. 676-679.
8. Armarego W.L.F. Purification of Laboratory Chemicals. Elsevier, 2018. 1176 P.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИС-(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)ПРОПИЛ)СЕЛЕНИД, ОБЛАДАЮЩИЙ АНТИОКСИДАНТНОЙ И ГИПОГЛИКЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2586067C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИАЛКИЛ-ГЕКСАГИДРО-1Н,5Н-2,3А,4А,6,7А,8А-ГЕКСААЗАЦИКЛОПЕНТА[def]ФЛУОРЕН-4,8-ДИОНОВ | 2014 |
|
RU2556009C1 |
| Диэтил 2,2-диалкилмалонат и 2,2-диалкил-1,3-диметоксипропан, содержащие 6,6-диметилбицикло[3.1.1]гептановый фрагмент природного происхождения, способ их получения и титан-магниевый катализатор полимеризации пропилена, содержащий эти соединения в своем составе | 2023 |
|
RU2819723C1 |
| ДВУХСТАДИЙНЫЙ СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИТИРОЗОЛА ИЗ ТИРОЗОЛА | 2019 |
|
RU2722142C1 |
| ПРОИЗВОДНЫЕ АРИЛЦИКЛОАЛКИЛАМИНОВ, НЕЙРОПРОТЕКТОР (ВАРИАНТЫ), ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ СОЧЕТАННЫМ НЕЙРОПРОТЕКТОРНЫМ, АНАЛЬГЕТИЧЕСКИМ И АНТИДЕПРЕССИВНЫМ ДЕЙСТВИЕМ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ | 2016 |
|
RU2637928C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,7-ДИТИА-3,5-ДИАЗАЦИКЛОАЛКАН-4-ОНОВ | 2014 |
|
RU2565778C1 |
| Способ получения диалкил 2,3-диизобутилсукцината, компонента титан-магниевых катализаторов полимеризации олефинов | 2020 |
|
RU2752516C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАТИОННЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ С ДИИМИНОВЫМИ ЛИГАНДАМИ | 2014 |
|
RU2556224C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ | 2012 |
|
RU2551647C2 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ И УРСАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ШИСТОСОМОЗА | 2013 |
|
RU2576658C2 |
Изобретение относится к способу получения селенсодержащих производных фенолов, а именно бис(3,5-диалкил-4-гидроксибензил)селенидов. Предлагаемый способ позволяет получать бис(3,5-диалкил-4-гидроксибензил)селениды с высоким выходом в одну стадию:
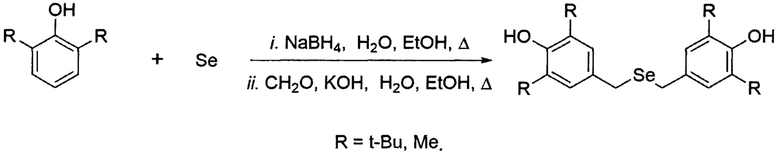
Полученные соединения могут найти применение в синтезе супрамолекул (циклофанов, селенокаликсаренов и др.), а также мультифункциональных антиоксидантов. 2 пр.
Одностадийный способ получения дибензилселенидов, а именно бис(3,5-диалкил-4-гидроксибензил)селенидов, по реакции 2,6-диалкилфенола, формальдегида, селена, NaBH4 и KOH в соответствии со схемой:
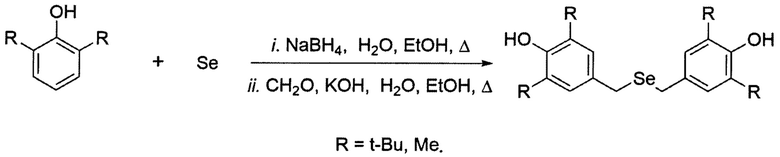
| БИС-(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)ПРОПИЛ)СЕЛЕНИД, ОБЛАДАЮЩИЙ АНТИОКСИДАНТНОЙ И ГИПОГЛИКЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2586067C1 |
| US 4050937 A1, 27.09.1977 | |||
| WO 2012164118 A1, 06.12.2012. | |||
Авторы
Даты
2020-02-04—Публикация
2019-08-05—Подача