ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на полезный эффект следующих заявок, содержания которых полностью включены в настоящее описание посредством ссылки:
Предварительная патентная заявка US 62/170563, поданная 3 июня 2015 г. и озаглавленная "Compositions, Systems, and Methods for Sequencing Polynucleotides Using Tethers Anchored to Polymerases Adjacent to Nanopores" (Композиции, системы и способы секвенирования полинуклеотидов с применением соединительных структур, прикрепленных к полимеразам, расположенным вблизи нанопор).
Настоящая заявка родственна следующим заявкам, содержания которых полностью включены в настоящее описание посредством ссылки:
Предварительная патентная заявка US 62/007248, поданная 3 июня 2014 г. и озаглавленная "Compositions, Systems, and Methods for Detecting Events Using Tethers Anchored to or Adjacent to Nanopores (Композиции, системы и способы обнаружения событий с применением соединительных структур, прикрепленных к нанопорам или вблизи нанопор)";
Предварительная патентная заявка US 62/157371, поданная 5 мая 2015 г. и озаглавленная "Compositions, Systems, and Methods for Detecting Events Using Tethers Anchored to or Adjacent to Nanopores" (Композиции, системы и способы обнаружения событий с применением соединительных структур, прикрепленных к нанопорам или вблизи нанопор); и
Патентная заявка US 14/728721, поданная 2 июня 2015 г. и озаглавленная "Compositions, Systems, and Methods for Detecting Events Using Tethers Anchored to or Adjacent to Nanopores" (Композиции, системы и способы обнаружения событий с применением соединительных структур, прикрепленных к нанопорам или вблизи нанопор).
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит Перечень Последовательностей, представленный в электронном виде в формате ASCII и полностью включенный в настоящее описание посредством ссылки. Указанная копия ASCII, созданная 25 апреля 2016 г., имеет наименование Перечень Последовательностей - 12957-180-28_SL.txt, и ее размер составляет 665 байт.
ОБЛАСТЬ ТЕХНИКИ
В общем, настоящая работа относится к секвенированию полинуклеотидов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Секвенированию полинуклеотидов, таких как ДНК, посвящено значительное количество времени и энергии деятелей как академической, так и прикладной науки. Например, в публикации Olsen et al. "Electronic Measurements of Single-Molecule Processing by DNA Polymerase I (Klenow Fragment)" (Электронные измерения обработки одной молекулы ДНК-полимеразой I (фрагментом Кленова)), JACS 135: 7855-7860 (2013), содержание которой полностью включено в настоящее описание посредством ссылки, рассмотрено биосвязывание единичных молекул фрагмента Кленова (сокращенно KF от англ. Klenow Fragment) ДНК-полимеразы I с электронными наносхемами, которое позволяет производить электрическую запись ферментативного функционирования и динамической изменчивости с разрешением, которое позволяет определять единичное событие встраивания нуклеотида. Или, например, в публикации Hurt et al. "Specific Nucleotide Binding and Rebinding to Individual DNA Polymerase Complexes Captured on a Nanopore" (Специфичное связывание нуклеотидов и повторное связывание с индивидуальными комплексами ДНК-полимеразы, захваченными на нанопоре), JACS 131: 3772-3778 (2009), содержание которой полностью включено в настоящее описание посредством ссылки, рассмотрено измерение времени пребывания комплексов ДНК с KF на нанопоре при приложении электрического поля. Или, например, в публикации Kim et al. "Detecting single-abasic residues within a DNA strand immobilized in a biological nanopore using an integrated CMOS sensor" (Обнаружение остатков с одним отсутствующим азотистым основанием в цепочке ДНК, иммобилизованной в биологической нанопоре, с помощью интегрированного КМОП-датчика), Sens. Actuators В Chem. 177: 1075-1082 (2012), содержание которой полностью включено в настоящее описание посредством ссылки, рассмотрено применение датчика для измерения тока или потока в экспериментах, включающих ДНК, захваченную в нанопоре α-гемолизина. Или, например, в публикации Garalde et al. "Distinct Complexes of DNA Polymerase I (Klenow Fragment) for Based and Sugar Discrimination during Nucleotide Substrate Selection" (Отдельные комплексы ДНК-полимеразы I (фрагмента Кленова) для распознавания оснований и Сахаров в процессе выбора нуклеотидного субстрата), J. Biol. Chem. 286: 14480-14492 (2011), содержание которой полностью включено в настоящее описание посредством ссылки, рассмотрено распознавание KF-ДНК комплексов на основании их свойств при захвате в электрическом поле на поре α-гемолизина. Другие публикации, в которых рассмотрены измерения, включающие применение α-гемолизина, включают следующие работы, содержания которых полностью включены в настоящее описание посредством ссылки, выполненные Howorka et al.: "Kinetics of duplex formation for individual DNA strands within a single protein nanopore" (Кинетика дуплексного образования индивидуальных цепочек ДНК в единичной нанопоре белка), PNAS 98: 12996-13301 (2001); "Probing Distance and Electrical Potential within a Protein Pore with Tethered DNA" (Расстояние зондирования и электрический потенциал внутри поры белка с закрепленной ДНК), Biophysical Journal 83: 3202-3210 (2002); и "Sequence-specific detection of individual DNA strands using engineered nanopores" (Последовательность-специфичное обнаружение индивидуальных цепочек ДНК с помощью сконструированных нанопор), Nature Biotechnology 19: 636-639(2001).
В патенте US 8652779, Turner et al., содержание которого полностью включено в настоящее описание посредством ссылки, рассмотрены композиции и способы секвенирования нуклеиновых кислот с применением единичного комплекса фермента полимеразы, включающего полимеразный фермент и матричную нуклеиновую кислоту, присоединенную вблизи нанопоры, и нуклеотидные аналоги в растворе. Нуклеотидные аналоги включают метки, блокирующие заряд, которые присоединены к полифосфатной части нуклеотидного аналога таким образом, что метки, блокирующие заряд, отщепляются при встраивании нуклеотидного аналога в растущую нуклеиновую кислоту. По данным Turner, метка, блокирующая заряд, определяется нанопорой, которая распознает наличие и идентификационную информацию встраиваемого нуклеотида и, таким образом, определяет последовательность матричной нуклеиновой кислоты. В опубликованной патентной заявке US 2014/0051069, Jayasinghe et al., содержание которой полностью включено в настоящее описание посредством ссылки, рассмотрены конструкции, которые включают субъединицу поры трансмембранного белка и фермент для обработки нуклеиновой кислоты.
Однако описанные ранее композиции, системы и способы, такие как композиции, системы и способы, раскрытые Olsen, Hurt, Kim, Garalde, Howorka, Turner и Jayasinghe, могут оказаться недостаточно надежными, воспроизводимыми или чувствительными и могут иметь недостаточно высокую производительность для практического применения, например, для трудоемкого коммерческого применения, такого как секвенирование генома в клинических и других условиях, в которых необходимо выполнение экономичных и высокоточных операций. Соответственно, необходимо создание усовершенствованных композиций, систем и способов секвенирования полинуклеотидов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Примеры осуществления настоящего изобретения относятся к композициям, системам и способам секвенирования полинуклеотидов с применением соединительных структур, прикрепленных к полимеразам, расположенным вблизи нанопор.
Согласно одному из аспектов, композиция включает нанопору, имеющую первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны. Композиция также может включать множество нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер. Композиция также может включать первый и второй полинуклеотиды, где первый полинуклеотид комплементарен второму полинуклеотиду. Композиция также может включать полимеразу, расположенную вблизи первой стороны нанопоры, причем полимераза выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов, к первому полинуклеотиду на основании последовательности второго полинуклеотида. Композиция также может включать долговременную соединительную структуру, включающую головную область, хвостовую область и расположенное между ними удлиненное тело, причем головная область закреплена на полимеразе, в то время как удлиненное тело находится в отверстии нанопоры. Композиция также может включать первый фрагмент, расположенный на удлиненном теле, причем первый фрагмент выполнен с возможностью связывания с удлиненным маркером первого нуклеотида, на который воздействует полимераза, а также репортерную область, расположенную на удлиненном теле, причем репортерная область выполнена с возможностью указания на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида.
В некоторых примерах осуществления первый фрагмент выполнен с возможностью формирования первого сигнального состояния в ответ на воздействие полимеразы на первый нуклеотид, и первый нуклеотид может быть идентифицирован при помощи первого сигнального состояния. В некоторых примерах осуществления воздействие полимеразы на первый нуклеотид включает связывание полимеразой первого нуклеотида. В некоторых примерах осуществления первое сигнальное состояние включает генерацию электрического или оптического сигнала.
В некоторых примерах осуществления репортерная область выполнена с возможностью формирования второго сигнального состояния, и при помощи второго сигнального состояния может быть определена комплементарность или не комплементарность первого нуклеотида следующему нуклеотиду второго полинуклеотида. В некоторых примерах осуществления репортерная область выполнена с возможностью формирования второго сигнального состояния в ответ на успешное встраивание первого нуклеотида в первый полинуклеотид под действием полимеразы.
В некоторых примерах осуществления репортерная область выполнена с возможностью формирования второго сигнального состояния в ответ на высвобождение пирофосфата вследствие успешного встраивания первого нуклеотида в первый полинуклеотид под действием полимеразы. В некоторых примерах осуществления полимераза модифицирована для обеспечения задержки высвобождения пирофосфата в ответ на встраивание первого нуклеотида в первый полинуклеотид. В некоторых примерах осуществления полимераза включает модифицированную рекомбинантную полимеразу Ф29, В103, GA-1, PZA, Ф15, BS32, M2Y, Nf, G1, Ср-1, PRD1, PZE, SF5, Ср-5, Ср-7, PR4, PR5, PR722 или L17. В некоторых примерах осуществления полимераза включает модифицированную рекомбинантную Ф29 ДНК-полимеразу, содержащую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из: замещения аминокислоты в положении 484, замещения аминокислоты в положении 198 и замещения аминокислоты в положении 381. В некоторых примерах осуществления полимераза модифицированную рекомбинантную Ф29 ДНК-полимеразу, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из E375Y, K512Y, T368F, А484Е, A484Y, N387L, T372Q, T372L, K478Y, 1370W, F198W и L381A.
В некоторых примерах осуществления репортерная область выполнена с возможностью формирования второго сигнального состояния в ответ на конформационное изменение полимеразы. В некоторых примерах осуществления величина или временная продолжительность конформационного изменения полимеразы чувствительна к комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду второго полинуклеотида, причем величина и/или временная продолжительность второго сигнального состояния зависит от конформационного изменения полимеразы.
В некоторых примерах осуществления второе сигнальное состояние включает генерацию электрического сигнала. В некоторых примерах осуществления второе сигнальное состояние включает генерацию оптического сигнала.
В некоторых примерах осуществления удлиненный маркер включает первую нуклеотидную последовательность, и первый фрагмент включает вторую нуклеотидную последовательность, которая комплементарна первой нуклеотидной последовательности. Система может включать такую композицию и дополнительно может включать измерительную электрическую схему, выполненную с возможностью определения первого состояния электрического тока или потока, проходящего через отверстие. В некоторых примерах осуществления первое состояние электрического тока или потока зависит от удлиненного маркера, и первый нуклеотид может быть идентифицирован на основании первого состояния электрического тока или потока. В некоторых примерах осуществления измерительная схема дополнительно выполнена с возможностью определения второго состояния электрического тока или потока, проходящего через отверстие. В некоторых примерах осуществления второе состояние электрического тока или потока зависит от положения репортерной области внутри отверстия, и на основании второго состояния электрического тока или потока можно определить комплементарен или не комплементарен первый нуклеотид следующему нуклеотиду во втором полинуклеотиде.
В некоторых примерах осуществления первый фрагмент и второй фрагмент соединительной структуры способны гибридизоваться друг с другом с образованием шпилькообразной структуры. В некоторых примерах осуществления композиция дополнительно включает источник напряжения, выполненный с возможностью подачи напряжения через первую и вторую стороны. В некоторых примерах осуществления первый фрагмент и второй фрагмент соединительной структуры способны подвергаться дегибридизации с отщеплением друг от друга в соответствии с двухэтапным механизмом в ответ на воздействие напряжения.
Согласно другому аспекту, способ может включать предоставление нанопоры, имеющей первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны. Способ может дополнительно включать предоставление множества нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер. Способ может дополнительно включать предоставление первого и второго полинуклеотидов, где первый полинуклеотид комплементарен второму полинуклеотиду. Способ может дополнительно включать предоставление полимеразы, располагаемой вблизи первой стороны нанопоры, причем полимераза выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов, к первому полинуклеотиду на основании последовательности второго полинуклеотида, и при этом полимераза прикреплена к долговременной соединительной структуре, включающей головную область, хвостовую область и расположенное между ними удлиненное тело, причем удлиненное тело находится в отверстии нанопоры. Способ может дополнительно включать определение того, что полимераза воздействует на первый нуклеотид на основании связывания удлиненного маркера с первым фрагментом, расположенным на удлиненном теле. Способ может дополнительно включать указание на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида при помощи репортерной области, расположенной на удлиненном теле.
В некоторых примерах осуществления определение включает формирование первого сигнального состояния в ответ на воздействие полимеразы на первый нуклеотид и идентификацию первого нуклеотида на основании первого сигнального состояния. В некоторых примерах осуществления воздействие полимеразы на первый нуклеотид включает связывание полимеразой первого нуклеотида. В некоторых примерах осуществления первое сигнальное состояние включает генерацию электрического или оптического сигнала.
В некоторых примерах осуществления указание включает обнаружение второго сигнального состояния и определение на основании второго сигнального состояния комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду второго полинуклеотида. В некоторых примерах осуществления способ включает формирование второго сигнального состояния в ответ на встраивание первого нуклеотида в первый полинуклеотид под действием полимеразы.
В некоторых примерах осуществления способ включает формирование второго сигнального состояния вследствие высвобождения пирофосфата в ответ на встраивание первого нуклеотида в первый полинуклеотид под действием полимеразы. В некоторых примерах осуществления полимеразу подвергают модификации с целью обеспечения задержки высвобождения пирофосфата в ответ на встраивание первого нуклеотида в первый полинуклеотид. В некоторых примерах осуществления полимераза включает модифицированную рекомбинантную полимеразу Ф29, В103, GA-1, PZA, Ф15, BS32, M2Y, Nf, G1, Ср-1, PRD1, PZE, SF5, Ср-5, Ср-7, PR4, PR5, PR722 или L17. В некоторых примерах осуществления полимераза включает модифицированную рекомбинантную Ф29 ДНК-полимеразу, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из: замещения аминокислоты в положении 484, замещения аминокислоты в положении 198 и замещения аминокислоты в положении 381. В некоторых примерах осуществления полимераза включает модифицированную рекомбинантную Ф29 ДНК-полимеразу, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из E375Y, K512Y, T368F, А484Е, A484Y, N387L, T372Q, T372L, K478Y, 1370W, F198W и L381A.
В некоторых примерах осуществления способ включает формирование второго сигнального состояния в ответ на конформационное изменение полимеразы. В некоторых примерах осуществления величина или временная продолжительность конформационного изменения полимеразы чувствительная к комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду полинуклеотида, причем величина и/или временная продолжительность второго сигнального состояния зависит от конформационного изменения полимеразы.
В некоторых примерах осуществления второе сигнальное состояние включает генерацию электрического сигнала. В некоторых примерах осуществления второе сигнальное состояние включает генерацию оптического сигнала.
В некоторых примерах осуществления удлиненный маркер включает первую нуклеотидную последовательность, и первый фрагмент включает вторую нуклеотидную последовательность, которая комплементарна первой нуклеотидной последовательности. В некоторых примерах осуществления определение дополнительно включает определение первого состояния электрического тока или потока, проходящего через отверстие. В некоторых примерах осуществления первое состояние электрического тока или потока зависит от удлиненного маркера, и определение дополнительно включает идентификацию первого нуклеотида на основании первого уровня электрического тока или потока. В некоторых примерах осуществления указание включает перемещение репортерной области в отверстии в ответ на воздействие полимеразы на первый нуклеотид. В некоторых примерах осуществления указание дополнительно включает определение второго состояния электрического тока или потока, проходящего через отверстие. В некоторых примерах осуществления второе состояние электрического тока или потока зависит от положения репортерной области внутри отверстия, и указание дополнительно включает определение комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду во втором полинуклеотиде на основании второго состояния электрического тока или потока.
В некоторых примерах осуществления первый фрагмент и второй фрагмент соединительной структуры гибридизуются друг с другом с образованием шпилькообразной структуры. Некоторые примеры осуществления дополнительно включают приложение напряжения к первой и второй сторонам. В некоторых примерах осуществления первый фрагмент и второй фрагмент соединительной структуры подвергаются дегибридизации с отщеплением друг от друга в соответствии с двухэтапным механизмом в ответ на воздействие напряжения.
В одном из примеров осуществления способ включает определение того, что на следующий нуклеотид воздействует полимераза на основании связывания удлиненного маркера с первым фрагментом, расположенным на удлиненном теле; и указание на комплементарность или некомплементарность следующего нуклеотида нуклеотиду, который следует за следующим нуклеотидом в последовательности второго полинуклеотида, при помощи репортерной области, расположенной на удлиненном теле. Некоторые примеры осуществления включают повторение рассмотренных этапов при анализе множества последующих нуклеотидов, которые комплементарны или некомплементарны множеству нуклеотидов, которые следуют за следующим нуклеотидом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1A-1D схематично представлены композиции для секвенирования полинуклеотидов с применением соединительной структуры, прикрепленной к полимеразе, расположенной вблизи нанопоры, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 2А схематично представлена система, включающая измерительную схему, выполненную с возможностью определения перемещения по меньшей мере одной репортерной области в отверстии нанопоры, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 2В схематично представлен вид сверху системы, включающей измерительную схему, выполненную с возможностью определения перемещения соответствующих репортерных областей в соответствующих отверстиях множества нанопор, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 3 представлен способ секвенирования полинуклеотидов с применением соединительной структуры, прикрепленной к полимеразе, расположенной вблизи нанопоры, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 4А-4Е схематично представлен пример применения композиции для секвенирования полинуклеотида с использованием соединительной структуры, прикрепленной к полимеразе, расположенной вблизи нанопоры, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 4F схематично представлен пример сигнала, который может быть сформирован с помощью композиции, представленной на Фиг. 4А-4Е, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 5A-5D схематично представлен пример применения композиции для секвенирования полинуклеотида с использованием соединительной структуры, прикрепленной к полимеразе, расположенной вблизи нанопоры, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 6 схематично представлен пример сигнала, который может быть сформирован при помощи композиции, представленной на Фиг. 5A-5D, согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 7А-7В схематично представлены примеры конформационных изменений полимеразы.
На Фиг. 7C-7D схематично представлена композиция, включающая соединительную структуру, прикрепленную к полимеразе, расположенной вблизи нанопоры, которая выполнена с возможностью применения в секвенировании полинуклеотида согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 8 представлен пример параметров реакции, например, констант скорости и времени пребывания, для схем реакции, в которых нуклеотид, на который воздействует полимераза, соответственно является соответствующим или несоответствующим (адаптация работы Johnson "The kinetic and chemical mechanism of high-fidelity DNA polymerases" (Кинетический и химический механизм высокоточных ДНК-полимераз), Biochim. Biophys. Acta 1804(5): 1041-1048 (2010), содержание которой полностью включено в настоящее описание посредством ссылки).
На Фиг. 9А схематично представлен пример нуклеотида, включающего удлиненный маркер, содержащий фрагмент, который взаимодействует с фрагментом соединительной структуры, показанной на Фиг. 1A-1D, в способе секвенирования полинуклеотида согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 9В-9С схематично представлены примеры нуклеотидов, включающих удлиненные маркеры, содержащие соответствующие фрагменты, которые могут взаимодействовать с примерами соединительных структур в способе секвенирования полинуклеотида согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 9D схематично представлен пример соединительной структуры и фрагментов, которые могут взаимодействовать с соединительной структурой в способе секвенирования полинуклеотида согласно некоторым примерам осуществления настоящего изобретения. На приведенном изображении представлена SEQ ID NO: 1.
На Фиг. 10А-10В схематично представлено перемещение (движение) примера соединительной структуры в ответ на гибридизацию с фрагментом удлиненного маркера примера нуклеотида в способе секвенирования полинуклеотида согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 11А-11С схематично представлены примеры структур, подходящих для изменения константы скорости в схеме реакции, которая может быть использована в способе секвенирования полинуклеотида согласно некоторым примерам осуществления настоящего изобретения.
На Фиг. 12А-12В представлены примеры структур согласно некоторым примерам осуществления настоящего изобретения, подходящих для изменения константы скорости в схеме реакции, в которой на нуклеотид воздействует полимераза.
СВЕДЕНИЯ. ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Примеры осуществления настоящего изобретения относятся к композициям, системам и способам секвенирования полинуклеотидов с применением соединительных структур, прикрепленных к полимеразам, расположенным вблизи нанопор.
В частности, композиции, системы и способы согласно настоящему изобретению могут быть подходящим образом применены для надежного и воспроизводимого секвенирования полинуклеотидов с высокой чувствительностью и высокой производительностью. Например, композиции согласно настоящему изобретению могут включать нанопору и долговременную соединительную структуру, которая прикреплена к полимеразе, расположенной вблизи нанопоры. Нанопора может включать первую и вторую стороны и отверстие, проходящее через первую и вторую стороны. Долговременная соединительная структура может включать головные и хвостовые области и расположенное между ними удлиненное тело. В определенных примерах осуществления головная область соединительной структуры прикреплена к полимеразе, которая расположена вблизи первой стороны нанопоры, и удлиненное тело находится в отверстии нанопоры. Кроме того, композиции согласно настоящему изобретению могут включать множество нуклеотидов, каждый из которых включает удлиненный маркер. Соединительная структура или удлиненный маркер или оба этих объекта могут включать один или более элементов, способствующих секвенированию полинуклеотида, например, матричного полинуклеотида. Например, соединительная структура или удлиненный маркер или оба этих объекта могут включать один или более элементов, обеспечивающих формирование первого сигнального состояния в ответ на воздействие полимеразы на нуклеотид, и могут включать один или более элементов, обеспечивающих формирование второго сигнального состояния на основании комплементарности или некомплементарности нуклеотида следующему нуклеотиду в последовательности секвенируемого полинуклеотида. В некоторых примерах осуществления идентичность нуклеотида, на который воздействует полимераза, может быть определена на основании первого сигнального состояния. Кроме того, в некоторых примерах осуществления комплементарность этого нуклеотида следующему нуклеотиду в последовательности секвенируемого полинуклеотида может быть определена на основании второго сигнального состояния, которое может способствовать распознаванию комплементарности нуклеотида секвенируемому полинуклеотиду, или, напротив, способствовать распознаванию того, что полимераза временно воздействует на нуклеотид, который некомплементарен следующему нуклеотиду в последовательности секвенируемого полинуклеотида, но при этом добавление этого нуклеотида к растущему комплементарному полинуклеотиду не происходит. Таким образом, второе сигнальное состояние может быть применено при осуществлении распознавания азотистых оснований при проведении секвенирования нуклеиновых кислот, например, для обнаружения ошибок. Следует понимать, что указанные первое и второе сигнальные состояния, которые, соответственно, могут указывать на идентичность нуклеотидов или на соответствие или несоответствие таких нуклеотидов, не обязательно должны наступать разновременно и на практике могут наступать одновременно. Например, измеряемый сигнал (например, оптический или электрический) может включать композицию, включающую более одного сигнального состояния (например, из двух сигнальных состояний), и каждое из сигнальных состояний предоставляет информацию об идентичности нуклеотидов и/или о соответствии или несоответствии нуклеотида.
К настоящему времени уже известны способы секвенирования синтезом (англ. sequencing by synthesis, сокращенно SBS). Например, однонитевая ДНК (сокращенно онДНК, также называемая одноцепочечной ДНК) (англ. single stranded, сокращенно ssDNA) может проходить через биологическую нанопору, такую как белковая нанопора, которая заключена в барьер, такой как липидный бислой, чувствительный к приложению электрического потенциала к нанопоре. При секвенировании, которое может быть названо "нитевым (цепочечным)" секвенированием, по мере прохождения нуклеотидов однонитевой ДНК через сужение поры, комбинации этих нуклеотидов могут уникальным образом препятствовать течению электрического тока или потока в зависимости от типа нуклеотидов, находящихся в конкретных комбинациях, которые проходят через сужение. Цепочки (нити), подвергаемые секвенированию не имеют долговременного соединения с порой или полимеразой. Напротив, эти цепочки перемещаются через пору таким образом, что точное положение цепочки по отношению к поре изменяется. Однако чрезвычайно высокая скорость перемещения онДНК (~1 нуклеотид/микросекунда), а также естественное разрешение сужения, в котором заключена комбинация нуклеотидов, а не один нуклеотид, может затруднять точное измерение уровня запирания электрического тока или потока от нуклеотида к нуклеотиду. Для замедления скорости перемещения до скорости, более приемлемой для сбора данных (миллисекунды на нуклеотид), применяют ферментативные "моторы". Однако применение таких моторов в методиках цепочечного секвенирования может приводить к включению ошибочных режимов, таких как перепрыгивание, проскок и переключение, что может затруднять надежное определение нуклеотидов в онДНК. Эти и другие, не зависящие от действия мотора ошибочные режимы, которые могут проявиться во время цепочечного секвенирования, могут появляться в результате "пружинистости" или эластичности онДНК, находящейся между мотором и сужением нанопоры. Пружинистость может быть особенностью последовательности онДНК и может приводить к образованию разных электрических токов или потоков при прохождении сужения одной и той же комбинации нуклеотидов, если различные примеры этой комбинации, соответственно, окружены различными последовательностями онДНК. Кроме того, поскольку сужение может быть относительно небольшим, например, приблизительно 2 нуклеотида, и поскольку Броуновское движение всегда имеет место, размер "читающей головки" поры может эффективно составлять приблизительно 4 нуклеотида; например, за один раз сужение считывает комбинацию из приблизительно 4 нуклеотидов, затрудняя, таким образом, уникальную идентификацию каждого нуклеотида, поскольку в способе имеется 4^4 (256) электрических тока или потока, которые необходимо отличать друг от друга.
Соответственно, имеется необходимость в усовершенствованиях способов SBS, например, необходимость создания экономичных, точных композиций, систем и способов SBS, подходящих для идентификации длинных прочтений и имеющих высокую производительность. Одним из потенциальных решений, благодаря воспроизводимости в наномасштабах и легкости получения требуемых белков, является применение в способах SBS нанопор, например, биологических нанопор. Учитывая вышеизложенное, можно ожидать, что подход, не включающий применения мотора (например, с применением нуклеиновых ферментов в качестве детектора, связанного с нанопорой, а не мотора, который модулирует прохождение целевой цепочки через нанопору), менее чувствительный к Броуновскому движению и имеющий разрешение порядка одного нуклеотида, будет чрезвычайно перспективным для проведения секвенирования ДНК на нанопорах.
Ниже сначала будут приведены краткие определения некоторых терминов, используемых в настоящей работе. Затем будут рассмотрены примеры композиций и примеры систем, включающих измерительную схему (например, электрическую или оптическую измерительную схему), которые могут быть применены в комбинации с композициями согласно настоящему изобретению, а также примеры способов, которые могут быть применены в комбинации с композициями согласно настоящему изобретению, и некоторые определенные примеры композиций, которые могут быть применены для осуществления этих способов.
Некоторые термины
Используемый в настоящем описании термин "пора" означает структуру, которая включает отверстие, через которое молекулы могут перемещаться с первой стороны поры на вторую сторону поры. Таким образом, отверстие проходит через первую и вторую стороны поры. Молекулы, которые могут проходить через отверстие поры, могут включать, например, ионы или растворимые в воде молекулы, такие как нуклеиновые кислоты, белки, нуклеотиды и аминокислоты. Пора может быть расположена внутри барьера. Если по меньшей мере часть отверстия поры имеет ширину, составляющую 100 нм или менее, например, 10 нм или менее или 2 нм или менее, то пора необязательно может быть названа "нанопорой". Необязательно часть отверстия может быть  либо первой, либо второй стороны поры, либо уже обеих этих сторон, и в этом случае эта часть отверстия может быть названа "сужением". В альтернативном варианте или кроме того, отверстие поры, или сужение поры (если таковое имеется), или оба этих элемента, могут составлять более 0,1 нм, 0,5 нм, 1 нм, 10 нм или более. Пора может включать множество сужений, например, по меньшей мере два или три, или четыре, или пять или более пяти сужений.
либо первой, либо второй стороны поры, либо уже обеих этих сторон, и в этом случае эта часть отверстия может быть названа "сужением". В альтернативном варианте или кроме того, отверстие поры, или сужение поры (если таковое имеется), или оба этих элемента, могут составлять более 0,1 нм, 0,5 нм, 1 нм, 10 нм или более. Пора может включать множество сужений, например, по меньшей мере два или три, или четыре, или пять или более пяти сужений.
Используемый в настоящей работе термин "барьер" означает структуру, которая обычно затрудняет проникновение молекул с одной стороны барьера на другую сторону барьера. Молекулы, проникновение которых затрудняется, могут включать, например, ионы или растворимые в воде молекулы, такие как нуклеиновые кислоты, белки, нуклеотиды и аминокислоты. Пора может быть расположена внутри барьера, и отверстие поры может быть достаточным для прохождения молекулы с одной стороны барьера на другую сторону барьера. Барьеры включают мембраны биологического происхождения и небиологические барьеры, такие как твердотельные мембраны.
Используемый в настоящей работе термин "соединительная структура" означает удлиненный элемент, имеющий головную область, хвостовую область и расположенное между ними удлиненное тело. Соединительная структура включает молекулу. Соединительная структура может необязательно находиться в удлиненном состоянии, например, может включать удлиненную молекулу. Например, удлиненное тело соединительной структуры может иметь вторичные или третичные конфигурации, такие как шпильки, сгибы, спиральные или подобные конфигурации. Соединительные структуры могут включать полимеры, такие как полинуклеотиды или синтетические полимеры. Соединительные структуры могут иметь длины (например, измеряемые в растянутом или максимально вытянутом состоянии), составляющие, например, от приблизительно 5 нм до приблизительно 500 нм, например, от приблизительно 10 нм до приблизительно 100 нм. Соединительные структуры могут иметь ширины, составляющие, например, от приблизительно 1 нм до приблизительно 50 нм, например, от приблизительно 2 нм до приблизительно 20 нм. Соединительные структуры могут быть неразветвленными (линейными) или разветвленными. Соединительная структура может считаться "долговременной" ("перманентной"), если она не удаляется из композиции согласно изобретению в условиях применения композиции, например, при проведении способа определения. Соединительная структура, используемая при проведении циклической или повторной реакции, также может считаться "долговременной", если изменение положения соединительной структуры не происходит при переходе от одного цикла к следующему или при переходе от одной реакции к повторной реакции. Следует понимать, что положение долговременной соединительной структуры может изменяться в течение одного цикла или реакции, даже несмотря на то, что чистое изменение положения при проведении нескольких циклов или реакций не происходит.
Используемый в настоящей работе термин "головная область" соединительной структуры означает функциональную группу соединительной структуры, которая присоединена к другому элементу. Присоединение может быть осуществлено через химическую связь, например, через ковалентную связь, водородную связь, ионную связь, диполь-дипольную связь, Лондоновские дисперсионные силы или любую подходящую комбинацию перечисленных связей. В одном из примеров осуществления присоединение может быть осуществлено посредством гибридизации первого олигонуклеотида головной области со вторым олигонуклеотидом другого элемента. В альтернативном варианте присоединение может быть осуществлено через физические или биологические взаимодействия, например, взаимодействие между первой белковой структурой головной области и второй белковой структурой другого элемента, которая препятствует отрыву головной области от другого элемента. Примеры элементов, к которым может быть присоединена головная область соединительной структуры, включают пору, например, первую или вторую сторону поры, барьер, в котором расположена пора, и молекулу, такую как белок, расположенную либо на первой, либо на второй стороне поры. Если головная область соединительной структуры присоединена к другому элементу, который расположен либо на первой, либо на второй стороне поры, то можно сказать, что головная область соединительной структуры расположена вблизи поры. Головная область необязательно может быть расположена на конце соединительной структуры.
Используемый в настоящей работе термин "прикреплен" означает соединение (присоединение) между первым элементом и вторым элементом, которое является долговременным, например, достаточно стабильным для применения при секвенировании полинуклеотида, или, например, подвижное соединение, которое, тем не менее, не подвергается отчетливому перемещению в тех условиях, в которых применяют присоединенные элементы. В некоторых примерах осуществления в тех условиях, в которых применяют присоединенные элементы, например, при выполнении способа определения, долговременное соединение обычно необратимо. В других примерах осуществления долговременное соединение обратимо, но сохраняется в течение по меньшей мере того периода времени, который необходим для секвенирования полинуклеотида. Например, соединительная структура может быть долговременным образом присоединена к или расположена вблизи полимеразы во время использования соединительной структуры для секвенирования полинуклеотида, после чего она может быть удалена или замещена другой соединительной структурой. Ковалентные связи являются лишь одним примером присоединения, которое может быть подходящим образом применено для прикрепления первого элемента ко второму элементу. Другие примеры включают дуплексы между олигонуклеотидами, пептид-пептидные взаимодействия и взаимодействия стрептавидин-биотин или стрептавидин-дестиобиотин.
Используемый в настоящей работе термин "хвостовая область" соединительной структуры означает часть соединительной структуры, которая расположена дистально по отношению к головной области. Хвостовая область может представлять собой свободное продолжение головной области, например, может оставаться неприсоединенной к любому другому элементу. В альтернативном варианте хвостовая область может быть присоединена. Присоединение может быть осуществлено через химическую связь, например, через ковалентную связь, водородную связь, ионную связь, диполь-дипольную связь, Лондоновские дисперсионные силы или любую подходящую комбинацию перечисленных связей. В одном из примеров осуществления присоединение может быть осуществлено посредством гибридизации первого олигонуклеотида хвостовой области со вторым нуклеотидом другого элемента. В альтернативном варианте присоединение может быть осуществлено посредством физических или биологических взаимодействий, например, взаимодействия между первой белковой структурой хвостовой области и второй белковой структурой другого элемента, которая препятствует отрыву хвостовой области от другого элемента. Любой элемент, к которому присоединена хвостовая область, необязательно может представлять собой то же самый элемент, к которому присоединена головная область. Хвостовая область необязательно может расположена на конце соединительной структуры.
Используемый в настоящей работе термин "удлиненное тело" означает часть элемента, такого как соединительная структура, которая имеет достаточную длину и достаточно малую ширину для ее размещения в по меньшей мере части отверстия поры. Если удлиненное тело присоединено к нуклеотиду, на который производится воздействие, то удлиненное тело может быть названо "удлиненным маркером" для его отличия от удлиненного тела соединительной структуры. Удлиненное тело может быть образовано из любого подходящего материала биологического происхождения или небиологического происхождения или их комбинации. В одном из примеров удлиненное тело включает полимер. Полимеры могут быть биологическими или синтетическими полимерами. Примеры биологических полимеров, подходящих для включения в удлиненное тело, включают полинуклеотиды, полипептиды, полисахариды, аналоги полинуклеотидов и аналоги полипептидов. Пример полинуклеотидов и аналогов полинуклеотидов, подходящих для включения в удлиненное тело, включают ДНК, энантиомерную ДНК, РНК, ПНК (пептид-нуклеиновую кислоту, англ. PNA, peptide nucleic acid), морфолиновые олигонуклеотиды и ЗНК (запертую нуклеиновую кислоту, англ. - LNA, locked nucleic acid). Примеры синтетических полипептидов могут включать заряженные аминокислоты, а также гидрофильные и нейтральные остатки. Примеры синтетических полимеров, которые подходят для включения в удлиненное тело, включают ПЭГ (полиэтиленгликоль), ППГ (полипропиленгликоль), ПВС (поливиниловый спирт), ПЭ (полиэтилен), ПЭНП (полиэтилен низкой плотности), ПЭВП (полиэтилен высокой плотности), полипропилен, ПВХ (поливинилхлорид), ПС (полистирол), нейлон (алифатические полиамиды), тефлон® (тетрафторэтилен), термопластические полиуретаны, полиальдегиды, полиолефины, полиэтиленоксиды, сложные эфиры поли-ω-алкеновых кислот, полиалкилметакрилаты и другие полимерные химические и биологические линкеры, такие как линкеры, описанные в публикации Hermanson, Bioconjugate Techniques, третье изд., Academic Press, London (2013). Кроме того, удлиненное тело необязательно может включать фрагмент, который может взаимодействовать с другим фрагментом. Такие фрагменты могут включать, например, биологические полимеры ДНК, РНК, ПНК, ЗНК, морфолиновые олигонуклеотиды или энантиомерную DNA. Области удлиненного тела могут быть иметь заряд или могут быть нейтральными в зависимости от конкретного воплощения методики считывания репортера.
Используемый в настоящей работе термин "репортерная область" означает фрагмент, который при соответствующем изменении может быть обнаружен с помощью подходящего способа определения или системы определения. Изменение может включать, без ограничений, перемещение (движение). Перемещения могут составлять приблизительно 10 нм или менее или приблизительно 5 нм или менее, или приблизительно 2 нм или менее, или приблизительно 1 нм или менее, или приблизительно 0,5 нм или менее, или приблизительно 0,2 нм или менее, или даже приблизительно 0,1 нм или менее, и могут быть обнаружены с помощью репортерной области и подходящего способа определения или системы определения. Фрагмент может иметь подходящее для обнаружения физическое, химическое, электрическое, оптическое или биологическое свойство или другое подходящее свойство, препятствующее протеканию потока. Например, фрагмент может иметь оптическое свойство, которое обеспечивает оптическое определение или получение оптических характеристик. Оптические свойства включают флуоресценцию и генерацию Рамановского сигнала. В одном из иллюстративных примеров фрагмент представляет собой донор или акцептор резонансного переноса энергии флуоресценции (англ. fluorescent resonance energy transfer, сокращенно FRET), который взаимодействует с соответствующим акцептором или донором FRET, испуская свет определенной длины волны, который может быть обнаружен. Донор и акцептор могут рассматриваться как пара партнеров для FRET. Или, например, фрагмент может иметь свойство блокировать электрический ток или поток. Свойство блокировать электрический ток или поток включают электростатический заряд, например, положительный заряд или отрицательный заряд. Или, например, фрагмент может иметь физическое свойство. Физические свойства включают объем и форму фрагмента. В одном из иллюстративных примеров перемещение фрагмента в отверстии приводит к доступному для измерения изменению величины электрического тока или потока через отверстие или его сужение за счет изменения уровня запирания электрического тока или потока, протекающего через отверстие или сужение. Или, например, фрагмент может иметь химическое или биологическое свойство, которое облегчает химическое или биологическое определение. Химические или биологические свойства включают наличие химической или биологической группы, например, радиоактивной группы или группы, имеющей ферментативную активность. Одно или более электрических, физических, химических, биологических или других свойств, обеспечивающих запирание потока фрагментом, может обеспечивать подходящее для измерения изменение электрического тока через отверстие или сужение или создание оптического сигнала. В одном из иллюстративных примеров перемещение фрагмента в отверстии вызывает подходящее для измерения изменение электрического тока, протекающего через отверстие или сужение, или вызывает подходящее для измерения изменение потока молекул, протекающего через отверстие или сужение, причем изменение потока может быть подходящим для определения с помощью электрических, химических, биологических или оптических средств. Нуклеотид с отсутствующим азотистым основанием представляет собой один из неограничивающих примеров фрагмента, перемещение которого может вызывать подходящее для измерения изменение электрического тока через отверстие или сужение или подходящее для измерения изменение потока молекул через отверстие или сужение.
Используемый в настоящей работе термин "движение" или "перемещение" может означать трансляционное, ротационное или конформационное перемещение или их комбинацию.
Используемый в настоящей работе термин "воздействие" полимеразы на нуклеотид может включать введение нуклеотида в активный сайт полимеразы. Воздействие полимеразы на нуклеотид также может включать, без ограничений, химическое изменение нуклеотида или части нуклеотида в результате действия полимеразы. Химические изменения могут включать удаление части нуклеотида под действием полимеразы, добавление нуклеотида к другой молекуле под действием полимеразы, связывание или отщепление нуклеотида от полимеразы, модификацию нуклеотида или части нуклеотида под действием полимеразы и образование или расщепление химической связи под действием полимеразы, например, в процессе синтеза полинуклеотида и подобные воздействия. Например, воздействие полимеразы на нуклеотид может включать добавление нуклеотида к полинуклеотиду. Воздействие полимеразы на нуклеотид необязательно может включать как перемещение, так и химическое изменение полимеразы, нуклеотида или их обоих. В качестве неограничивающих иллюстративных примеров можно отметить воздействие полимеразы на нуклеотид, которое может включать одно или более из следующих воздействий: тестирование нуклеотида полимеразой, отклонение нуклеотида полимеразой, если нуклеотид не соответствует следующему нуклеотиду в полинуклеотиде, подвергаемом секвенированию, вырезание нуклеотида полимеразой из полинуклеотида под действием экзонуклеазы, и вырезание нуклеотида полимеразой из полинуклеотида под действием пирофосфорилазы. На Фиг. 8 представлен пример параметров реакции, например, константы скорости и время пребывания, для схем реакции, в которых нуклеотид, на который воздействует полимераза, соответственно является соответствующим или несоответствующим (адаптация работы Johnson "The kinetic and chemical mechanism of high-fidelity DNA polymerases" (Кинетический и химический механизм высокоточных ДНК-полимераз), Biochim. Biophys. Acta 1804(5): 1041-1048 (2010), содержание которой полностью включено в настоящее описание посредством ссылки). Полимеразы, такие как Т7 Pol, обычно различают соответствующие и несоответствующие нуклеотиды на основании комбинации повышенного сродства к связыванию соответствующего нуклеотида (например, приблизительно 10-кратное предпочтение соответствующего несоответствующему), значительно сниженной скорости каталитической реакции для несоответствующего нуклеотида (например, приблизительно 1000-кратное замедление для несоответствующего нуклеотида) и значительно повышенной скорости диссоциации для несоответствующего нуклеотида из закрытого каталитического состояния (например, приблизительно 300-кратное ускорение для несоответствующего нуклеотида).
Используемый в настоящей работе термин "конформационное изменение" означает изменение формы молекулы (например, изменение относительных атомных координат молекулы). Конформационное изменение может включать перемещение одной части молекулы относительно другой части молекулы. Химическая реакционная способность части молекулы может изменяться при относительном перемещении этой части или другой части молекулы. Молекула может претерпевать конформационное изменение в ответ на влияние воздействующего фактора (раздражителя). Воздействующий фактор может включать, без ограничений, изменения в молекуле или силы, приложенные к молекуле, взаимодействия с другими молекулами или внешние факторы. Изменения в молекуле или силы, приложенные к молекуле, могут включать физическую силу, приложенную к молекуле или ее части, электрическое поле, приложенное к молекуле, или химическую реакцию с молекулой или ее частью или комбинацию перечисленных воздействий, например, связывание с подложкой, катализ и/или высвобождение продукта. Взаимодействия с другими молекулами могут включать присутствие другой молекулы, концентрацию другой молекулы, воздействие другой молекулы или на другую молекулу или комбинацию перечисленных воздействий. Пример взаимодействия с другой молекулой включает гибридизацию двух олигонуклеотидов или воздействие полимеразы на нуклеотид. Внешние факторы могут включать изменение pH или изменение температуры или их комбинацию.
Используемый в настоящем описании термин "нуклеотид" означает молекулу, которая включает сахар и по меньшей мере одну фосфатную группу, а также необязательно включает нуклеиновое основание. Нуклеотид, не содержащий нуклеинового основания, может быть назван нуклеотидом, "лишенным азотистого основания". Нуклеотиды включают дезоксирибонуклеотиды, модифицированные дезоксирибонуклеотиды, рибонуклеотиды, модифицированные рибонуклеотиды, пептидные нуклеотиды, модифицированные пептидные нуклеотиды, модифицированные нуклеотиды с сахарофосфатной основной цепью и их смеси. Примеры нуклеотидов включают аденозинмонофосфат (АМФ), аденозиндифосфат (АДФ), аденозинтрифосфат (АТФ), тимидинмонофосфат (ТМФ), тимидиндифосфат (ТДФ), тимидинтрифосфат (ТТФ), цитидинмонофосфат (ЦМФ), цитидиндифосфат (ЦДФ), цитидинтрифосфат (ЦТФ), гуанозинмонофосфат (ГМФ), гуанозиндифосфат (ГДФ), гуанозинтрифосфат (ГТФ), уридинмонофосфат (УМФ), уридиндифосфат (УДФ), уридинтрифосфат (УТФ), дезоксиаденозинмонофосфат (дАМФ), дезоксиаденозиндифосфат (дАДФ), дезоксиаденозинтрифосфат (дАТФ), дезокситимидинмонофосфат (дТМФ), дезокситимидиндифосфат (дТДФ), дезокситимидинтрифосфат (дТТФ), дезоксицитидиндифосфат (дЦДФ), дезоксицитидинтрифосфат (дЦТФ), дезоксигуанозинмонофосфат (дГМФ), дезоксигуанозиндифосфат (дГДФ), дезоксигуанозинтрифосфат (дГТФ), дезоксиуридинмонофосфат (дУМФ), дезоксиуридиндифосфат (дУДФ), и дезоксиуридинтрифосфат (дУТФ).
Термин "нуклеотид" также включает любой аналог нуклеотида, представляющий собой тип нуклеотида, который включает нуклеиновое основание, сахар и/или фосфатный фрагмент, модифицированный по сравнению с встречающимися в природе нуклеотидами. Примеры модифицированных нуклеиновых оснований, которые могут быть включены в полинуклеотид, как имеющих нативную основную цепь, так и аналогичную структуру, включают: инозин, ксантин (xathanine), гипоксантин (hypoxathanine), изоцитозин, изогуанин, 2-аминопурин, 5-метилцитозин, 5-гидроксиметилцитозин, 2-аминоаденин, 6-метиладенин, 6-метилгуанин, 2-пропилгуанин, 2-пропиладенин, 2-тиоурацил, 2-тиотимин, 2-тиоцитозин, 15-галогенурацил, 15-галогенцитозин, 5-пропинилурацил, 5-пропинилцитозин, 6-азоурацил, 6-азоцитозин, 6-азотимин, 5-урацил, 4-тиоурацил, 8-галогенаденин или гуанин, 8-аминоаденин или гуанин, 8-тиоладенин или гуанин, 8-тиоалкиладенин или гуанин, 8-гидроксиладенин или гуанин, 5-галогенозамещенный урацил или цитозин, 7-метилгуанин, 7-метиладенин, 8-азагуанин, 8-азааденин, 7-деазагуанин, 7-деазааденин, 3-деазагуанин, 3-деазааденин или подобные основания. Как известно в данной области техники, некоторые аналоги нуклеотидов не могут встраиваться в полинуклеотид, например, такие аналоги нуклеотидов, как аденозин-5'-фосфосульфат.
Примеры нуклеотидов, модифицированных по фосфатному фрагменту, включают, например, аналоги нуклеотидов, рассмотренные в следующих публикациях: Lee et al. "Synthesis and reactivity of novel γ-phosphate modified ATP analogues" (Синтез и реакционная способность новых аналогов АТФ, модифицированных по γ-фосфату), Bioorganic & Medicinal Chemistry Letters 19: 3804-3807 (2009); Kumar et al. "PEG-labeled nucleotides and nanopore detection for single molecule DNA sequencing by synthesis" (Нуклеотиды, меченные ПЭГ, и определение единичной молекулы ДНК секвенированием синтезом с применением нанопор), Scientific Reports 2: 684 (2012); Kumar et al. "Terminal phosphate labeled nucleotides: synthesis, applications, and linker effect on incorporation by DNA polymerases" (Меченые нуклеотиды с концевыми фосфатными группами: синтез, применение и эффект линкера при встраивании в ДНК-полимеразы), Nucleosides, Nucleotides, and Nucleic Acids 24: 401-408 (2005), и Mulder et al. "Nucleotide modification at the y-phosphate leads to the improved fidelity of HIV-1 reverse transcriptase" (Модификация нуклеотида по γ-фосфату приводит к повышенной точности воспроизведения обратной транскриптазы ВИЧ-1), Nucleic Acids Research 33: 4865-4873 (2005); содержания публикаций полностью включено в настоящее описание посредством ссылки. Lee et al. рассмотрены определенные примеры аналогов АТФ модифицированных по γ-фосфатной группе, имеющих следующие структуры:
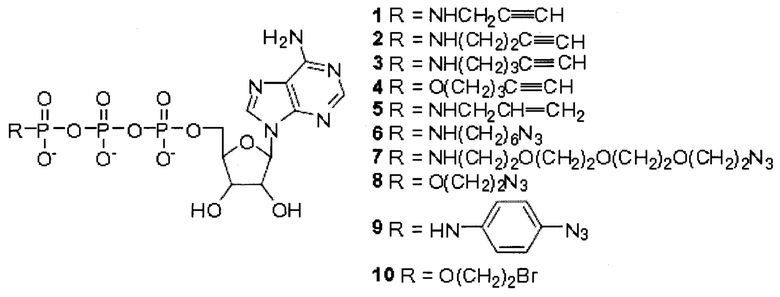
В работе Kumar et al. (2012) рассмотрены маркеры, содержащие структуру ПЭГ-кумарин с ПЭГ различной длины, которые могут быть присоединены к терминальному фосфату дНТФ или НТФ (дНТФ/НТФ, что означает дезоксинуклеозидтрифосфат/нуклеозидтрифосфат) или к терминальному фосфату тетрафосфатных нуклеотидов (dN4P/N4P). Примеры длин включают, например, кумарин-ПЭГ16-dN4P/N4P, кумарин-ПЭГ20-dN4P/N4P, кумарин-ПЭГ24-dN4P/N4P и кумарин-ПЭГ36-dN4P/N4P. В работе Kumar et al. (2005) рассмотрены нуклеотиды, содержащие модифицированные тетра- и пентафосфатные группы, которые включают красители, присоединенные через линкеры или без них. Как указано в работе Kumar et al. (2005) примеры красителей, присоединенных в отсутствие линкеров, включают DDAO (англ. 9H-(1,3-dichloro-9,9-dimethylacridin-2-one-7-yl), что означает 9Н-(1,3-дихлор-9,9-диметилакридин-2-он-7-ил)), резоруфин, кумарины, алкилксантены, нитрофенол, гидроксииндол, ELF и ВВТ (англ. 2,5-bis(benzoxazol-2-yl)thiophene-3,4-diol, что означает 2,5-бис(бензоксазол-2-ил)тиофен-3,4-диол); примеры красителей, присоединенных через линкеры, включают R110, REG, TAMRA (англ. 5-carboxytetramethylrhodamine, рус. 5-карбокситетраметилродамин), ROX, красители Су и красители ЕТ; и примеры линкеров включают диаминопропан, диаминогептан, диаминододекан, ЕЕА, РАР, диаминоциклогексан, диаминоксилол и пентализин. В работе Mulder et al. рассмотрены химически модифицированные нуклеотиды, включающие 1-аминонафталин-5-сульфонат (АНС), присоединенный к γ-фосфату нуклеотида, например, γ-Р-аминонафталин-5-сульфонат-дезокси- или -рибонуклеотиды (дНТФ или НТФ), такие как АНС-АТФ, АНС-ЦТФ, АНС-ГТФ и АНС-ТТФ, и/или дезокси-формы этих или других нуклеотидов.
Используемый в настоящем описании термин "полинуклеотид" означает молекулу, которая включает последовательность нуклеотидов, связанных друг с другом. Примеры полинуклеотидов включают дезоксирибонуклеиновую кислоту (ДНК), рибонуклеиновую кислоту (РНК) и их аналоги. Полинуклеотид может представлять собой одноцепочечную (однонитевую) последовательность нуклеотидов, такую как РНК или одноцепочечная ДНК, двухцепочечную (двухнитевую) последовательность нуклеотидов, такую как двухцепочечная ДНК, или может включать смесь одноцепочечных и двухцепочечных последовательностей нуклеотидов. Двухцепочечная (двухнитевая) ДНК (днДНК) включает геномную ДНК, а также продукты ПЦР и амплификации. Одноцепочечная ДНК (онДНК) может быть превращена в днДНК и наоборот. Точная последовательность нуклеотидов в полинуклеотиде может быть известной или неизвестной. Ниже приведены иллюстративные примеры полинуклеотидов: ген или фрагмент гена (например, зонд, праймер, маркер экспрессируемой последовательности (англ. expressed sequence tag, сокращенно EST) или маркер серийного анализа экспрессии генов (англ. Serial Analysis of Gene Expression, сокращенно SAGE)), геномная ДНК, фрагмент геномной ДНК, экзон, интрон, информационная (матричная) РНК (мРНК), транспортная РНК, рибосомная РНК, рибозим, кДНК (комплементарная ДНК), рекомбинантный полинуклеотид, синтетический полинуклеотид, разветвленный полинуклеотид, плазмида, вектор, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, зонд на основе нуклеиновой кислоты, праймер или амплифицированная копия любого из перечисленных объектов.
Используемый в настоящей работе термин "гибридизоваться" означает нековалентное связывание первого полинуклеотида со вторым полинуклеотидом. Прочность связывания между первым и вторым полинуклеотидам повышается по мере повышения комплементарности между этими полинуклеотидами.
Используемый в настоящем описании термин "белок" означает молекулу, которая включает полипептид или состоит из полипептида, который образует трехмерную структуру. Полипептид включает фрагменты, которые при образовании трехмерной структуры придают белку биологическую активность.
Используемый в настоящем описании термин "фермент" означает молекулу, которая модифицирует другую молекулу в результате каталитического процесса. Ферменты могут включать белки, а также некоторые другие типы молекул, такие как полинуклеотиды. Примеры ферментов, являющихся белками, включают полимеразы, экзонуклеазы и геликазы.
Используемый в настоящей работе термин "полимераза" означает фермент, имеющий активный сайт, который собирает полинуклеотиды посредством полимеризации нуклеотидов с образованием полинуклеотидов. Полимераза может связывать примированную одноцепочечную полинуклеотидную матрицу и может последовательно добавлять нуклеотиды к растущему праймеру с образованием полинуклеотида, имеющего последовательность, комплементарную матричной последовательности.
Примеры композиций, систем и способов секвенирования нуклеотидов
Ниже с помощью Фиг. 1A-1D рассмотрены примеры композиций, включающих соединительные структуры, прикрепленные к полимеразам вблизи нанопор. Согласно одному из аспектов, композиция включает нанопору, имеющую первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны. Композиция также может включать множество нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер. Композиция также может включать первый и второй полинуклеотиды, где первый полинуклеотид комплементарен второму полинуклеотиду. Композиция также может включать полимеразу, расположенную вблизи первой стороны нанопоры, причем полимераза выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов, к первому полинуклеотиду на основании последовательности второго полинуклеотида. Композиция также может включать долговременную соединительную структуру, включающую головную область, хвостовую область и расположенное между ними удлиненное тело, причем головная область закреплена на полимеразе, и удлиненное тело находится в отверстии нанопоры. Композиция также может включать первый фрагмент, расположенный на удлиненном теле, где первый фрагмент выполнен с возможностью связывания с удлиненным маркером первого нуклеотида, на который воздействует полимераза. Композиция также может включать одну или более репортерных областей, расположенных на удлиненном теле, где одна или более репортерных областей выполнены с возможностью указания на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида.
Например, на Фиг. 1А схематично представлено поперечное сечение примера композиции, которая включает нанопору 100, долговременную соединительную структуру 110, множество нуклеотидов 120 (на иллюстрации для простоты показан только один из них), полимеразу 130, первый полинуклеотид 140 и второй полинуклеотид 150. Нанопора 100 включает первую сторону 101, вторую сторону 102, отверстие 103 и сужение 104. Долговременная соединительная структура 110 включает головную область 111, хвостовую область 112 и удлиненное тело 113. В примере осуществления, представленном на Фиг. 1А, полимераза 130 расположена вблизи первой стороны 101 нанопоры 100, головная область 111 долговременной соединительной структуры 110 прикреплена к полимеразе 130, хвостовая область 112 долговременной соединительной структуры 110 свободно расположена на второй стороне 102 нанопоры 100, и удлиненное тело 113 долговременной соединительной структуры 110 способно перемещаться в отверстии 103 нанопоры 100. Удлиненное тело 113 долговременной соединительной структуры 110 включает первый фрагмент 115 и одну или более репортерных областей 114. Нуклеотид 120 включает удлиненный маркер 121, который включает второй фрагмент 122. Полимераза 130 выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов 120, к первому полинуклеотиду 140 в соответствии с последовательностью второго полинуклеотида 150.
Как показано на Фиг. 1В, в результате действия полимеразы 130 на нуклеотид 120 первый фрагмент 115 удлиненного тела 113 долговременной соединительной структуры 110 способен связываться с удлиненным маркером 121 нуклеотида 120, например, способен связываться со вторым фрагментом 122. Например, полимераза 130 может включать активный сайт (явным образом не показан), который принимает и связывает нуклеотид 120, который размещает второй фрагмент 122 в относительной близи к первому фрагменту 115 в течение периода времени, достаточного для того, чтобы первый фрагмент 115 и второй фрагмент 122 взаимодействовали друг с другом, например, связывались друг с другом (что также может быть названо образованием дуплекса между фрагментами). Например, в некоторых примерах осуществления первый фрагмент 115 включает первый олигонуклеотид, и второй фрагмент 122 включает второй олигонуклеотид, который комплементарен первому олигонуклеотиду и гибридизуется с первым олигонуклеотидом.
Первый фрагмент 115 может быть выполнен с возможностью формирования по меньшей мере первого сигнального состояния в ответ на воздействие полимеразы 130 на нуклеотид 120, и нуклеотид 120 может быть идентифицирован на основании первого сигнального состояния способами, более подробно рассмотренными ниже. Например, образование дуплекса фрагментом 115 и фрагментом 122 может приводить к такому расположению одной или более репортерных областей 114 в отверстии 103, которое приводит к созданию уникальной величины электрического тока или потока через отверстие 103, на основании чего нуклеотид 120 может быть идентифицирован. Иллюстративный пример первого сигнального состояния может включать электрический сигнал или оптический сигнал.
Кроме того, одна или более репортерных областей 114 удлиненного тела 113 долговременной соединительной структуры 110 может быть выполнена с возможностью индикации комплементарности или некомплементарности нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида 150. Например, в некоторых примерах осуществления положение одной или более репортерных областей 114 в отверстии 103 может зависеть от конкретной конформации полимеразы 130, которая может зависеть от того, соответствует или не соответствует нуклеотид 120 следующему нуклеотиду в последовательности второго полинуклеотида 150. Дополнительная информация о различиях конформации полимеразы и кинетике взаимодействия между соответствующими и не соответствующими нуклеотида ми приведена в следующих документах, содержания которых полностью включены в настоящее описание посредством ссылки: Freudenthal et al. "New structural snapshots provide molecular insights into the mechanism of high fidelity DNA synthesis" (Новые снимки структуры предоставляют достоверные знания о молекулярных механизмах высокоточного синтеза ДНК), DNA Repair, doi:10.2016/j.dnarep/2015.04.007 (доступно в Интернете от 30 апреля 2015 г.); Freudenthal et al. "Watching a DNA polymerase in action" (Наблюдение за действием ДНК-полимеразы), Cell Cycle 13: 691-692, doi:10.4161/cc.27789 (2014), и Freudenthal et al. "Observing a DNA polymerase choose right from wrong" (Наблюдение за тем, как ДНК-полимераза отличает верное от неверного), Cell 154: 157-168, doi:10,1016/j.cell.2013.05.048 (2013).
Например, как показано на Фиг. 1В, если нуклеотид 120 соответствует следующему нуклеотиду в последовательности второго полинуклеотида 150, то полимераза 130 может иметь модифицированную конформацию 130', в результате чего одна или более репортерные области 114 располагаются в таком участке отверстия 103, что через отверстие 103 протекает электрический ток или поток уникальной величины, в соответствии с которой может быть установлено соответствие нуклеотида 120. Для сравнения, как показано на Фиг. 1В, если нуклеотид 120 не соответствует следующему нуклеотиду в последовательности второго полинуклеотида 150, то полимераза 130 может иметь модифицированную конформацию 130'', в результате чего одна или более репортерные области 114 располагаются в таком участке отверстия 103, что через отверстие 103 протекает электрический ток или поток уникальной величины, в соответствии с которой может быть установлено несоответствие нуклеотида 120.
Следует отметить, что в примере осуществления, представленном на Фиг. 1В, репортерная область (области) 114 могут обеспечить информацией о соответствии или несоответствии даже тогда, когда фрагмент 115 и фрагмент 122 связаны друг с другом. В альтернативном варианте, как показано на Фиг. 1D, если нуклеотид 120 соответствует следующему нуклеотиду в последовательности второго полинуклеотида 150, то полимераза 130 также может иметь модифицированную конформацию 130', в результате чего репортерная область (области) 114 располагается в таком участке отверстия 103, что через отверстие 103 протекает электрический ток или поток уникальной величины, на основании чего может быть установлено соответствие или несоответствие нуклеотида 120. Однако фрагмент 115 и фрагмент 122 не обязательно должны быть связаны друг с другом для того, чтобы репортерная область (области) 114 служила таким индикатором. Например, фрагмент 115 и фрагмент 122 могут отщепляться друг от друга, например, в результате флуктуации температуры в отверстии 103 или в ответ на приложение достаточной разности потенциалов между первой стороной 101 и второй стороной 102, и положение репортерной области (областей) 114 в отверстии 103 во время диссоциации фрагментов 115 и 122 может указывать на соответствие или несоответствие нуклеотида 120. Для сравнения, если нуклеотид 120 не является соответствием, то полимераза 130 может иметь конформацию 130'', аналогичную показанной на Фиг. 1С, которая обеспечивает расположение репортерной области (областей) 114 в таком участке отверстия 103, что через отверстие 103 протекает электрический ток или поток уникальной величины, на основании которой может быть определено несоответствие нуклеотида 120.
Кроме того, если нуклеотид 120 соответствует, то полимераза 130 может встраивать нуклеотид 120 в первый полинуклеотид и может отщеплять удлиненный маркер 121 от нуклеотида 120, который может диффундировать на цис-сторону (например, первую сторону) нанопоры 100. Кроме того, если полимераза 130 успешно встраивает нуклеотид 120 в первый полинуклеотид 140, то полимераза 130 может высвобождать пирофосфат или другой фосфорсодержащий оксианион, который может включать две или более фосфатных субъединицы, например, две, три, четыре, пять или шесть фосфатных субъединиц (специально не показаны). При этом, если полимераза 130 не встраивает успешно нуклеотид 120 в первый полинуклеотид 140, то полимераза 130 не высвобождает пирофосфат.
Репортерная область 114 сконструирована таким образом, что она способна формировать один или более сигналов в зависимости от одного или более эффектов, создаваемых при воздействии полимеразы 130 на нуклеотид 120 или создаваемых в результате комплементарности или некомплементарности нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида 150, например, в зависимости от одного или более эффектов, возникающих при связывании нуклеотида 120 с активным сайтом полимеразы 130 или из-за нахождения нуклеотида 120 на активном сайте полимеразы 130, или в зависимости от успешного или неуспешного встраивания нуклеотида 120 в первый полинуклеотид 140 под действием полимеразы 130. Более подробно примеры второго сигнального состояния рассмотрены ниже со ссылками на Фиг. 3, 4A-4F, 5А-5D и 6. В соответствии с одним или более сигналам может быть обнаружено, воздействует ли полимераза 130 на первый нуклеотид, или комплементарен или некомплементарен первый нуклеотид следующему нуклеотиду второго полинуклеотида, или факт одновременного воздействия полимеразы 130 и при этом комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду второго полинуклеотида. В одном из иллюстративных примеров каждый из одного или более сигналов независимо может включать электрический сигнал или оптический сигнал.
Необязательно, удлиненное тело 113 может включать более одной репортерной области; например, оно может включать любое подходящее количество репортерных областей, например, одну или две или три, или четыре, или пять, или более пяти репортерных областей. Каждая репортерная область может быть идентична любой другой репортерной области. В альтернативном варианте каждая репортерная область может отличаться от любой другой репортерной области. Кроме того, некоторые репортерные области могут быть идентичны друг другу, в то время как другие репортерные области могут отличаться друг от друга. В одном из иллюстративных неограничивающих примеров удлиненное тело 113 включает полинуклеотид, который включает один или более нуклеотидов с отсутствующим азотистым основанием, которые определяют репортерную область 114. Нуклеотид с отсутствующим азотистым основанием может быть обнаружен внутри отверстия нанопоры способами, рассмотренными, например, в публикации Wilson "Electronic Control of DNA Polymerase Binding and Unbinding to Single DNA Molecules Tethered in a Nanopore" (Электронный контроль связывания и отщепления ДНК-полимеразы с единичными молекулами ДНК, закрепленными в нанопоре), диссертация на соискание степени Ph.D., University of California Santa Cruz (2009), содержание которой полностью включено в настоящее описание посредством ссылки. В одном из иллюстративных примеров перемещение или присутствие одного или более нуклеотидов с отсутствующим азотистым основанием или другой подходящей репортерной области (областей) 114 может вызывать подходящие для измерения изменения величины электрического тока через отверстие 103 или сужение 104, подходящие для определения изменения потока молекул через отверстие 103 или сужение 104, или приводить к образованию оптического сигнала. Например, изменение потока молекул, протекающего через отверстие 103 или сужение 104, может быть обнаружено электрическими, химическими, биологическими или оптическими средствами.
В примерах осуществления, показанных на Фиг. 1A-1D, головная область 111, хвостовая область 112 и удлиненное тело 113 соединительной структуры 110 могут включать любой подходящий материал или комбинацию материалов. Например, головная область 111 может быть сконструирована так, чтобы она могла прикрепляться к полимеразе 130 посредством химической связи, например, посредством ковалентной связи, водородной связи, ионной связи, диполь-дипольной связи, Лондоновских дисперсионных сил или любой подходящей комбинации перечисленных связей. Например, головная область 111 может включать первый фрагмент, который связывается, например, ковалентно, со вторым фрагментом полимеразы 130. Примеры ковалентных связей, которые могут скреплять головную область 111 с полимеразой 130, включают углерод-углеродные связи, связи углерод-азот, связи углерод-кислород, связи кислород-кислород, связи сера-сера, связи фосфор-кислород, связи фосфор-сера, амидные связи, простые тиоэфирные связи, гидразидные связи, связи углерод-сера и связи, полученные по реакции оксиамина с карбонилами (альдегидами и кетонами), по реакции пары реагентов Штаудингера, таких как фосфин и азиды, или пары клик-химии, такие как азиды и алкины. Однако соединения не обязательно должны содержать ковалентные связи. Например, такие соединения могут быть образованы гибридизацией первого олигонуклеотида головной области со вторым олигонуклеотидом полимеразы 130. В альтернативном варианте такие соединения могут быть образованы посредством физических или биологических взаимодействий, например, взаимодействия между первой белковой структурой головной области и второй белковой структурой полимеразы 130, которая препятствует отрыву головной области от полимеразы 130. Например, головная область 111 может включать первую альфа-спираль, и полимераза может включать вторую альфа-спираль, которая закреплена на головной области 111, ингибируя, тем самым, отщепление головной области 111 от полимеразы. Также могут быть использованы взаимодействия между рецепторами и лигандами, примеры которых включают взаимодействия авидин-биотин или взаимодействия их аналогов, взаимодействия антитело-эпитоп, взаимодействия лектин-углевод и подобные взаимодействия.
Удлиненное тело 113 может быть присоединено, например, ковалентной связью, к головной области 111, и хвостовая область 112 может ограничивать конец удлиненного тела 113, удаленный от головной области 111. Удлиненное тело 113 может включать любой подходящий материал биологического происхождения или небиологического происхождения или их комбинацию. Как более подробно рассмотрено ниже, удлиненное тело 113 может включать одну или более репортерных областей, которые указывают на комплементарность или некомплементарность нуклеотида, на который воздействует полимераза 130, следующему нуклеотиду в последовательности второго полинуклеотида 150. Удлиненное тело 113 также может включать первый фрагмент 115, который может взаимодействовать с удлиненным маркером 121, например, связываться с удлиненным маркером 121 нуклеотида 120, на который воздействует полимераза 130. Примеры биологических материалов, которые могут быть включены в удлиненное тело 113, включают биологические полимеры, такие как полинуклеотиды, полипептиды, полисахариды и аналоги перечисленных веществ. Примеры синтетических полимеров, которые могут быть подходящим образом включены в удлиненное тело 113, включают ПЭГ (полиэтиленгликоль), ППГ (полипропиленгликоль), ПВС (поливиниловый спирт), ПЭ (полиэтилен), ПЭНП (полиэтилен низкой плотности), ПЭВП (полиэтилен высокой плотности), полипропилен, ПВХ (поливинилхлорид), ПС (полистирол), нейлон (алифатические полиамиды), тефлон® (тетрафторэтилен), термопластические полиуретаны, полиальдегиды, полиолефины, полиэтиленоксиды, сложные эфиры поли-ω-алкеновых кислот, полиалкилметакрилаты и другие полимерные химические и биологические линкеры, такие как линкеры, рассмотренные в публикации Hermanson et al., упомянутой выше.
Нанопора 100 может иметь любую подходящую конфигурацию, позволяющую расположить полимеразу 130 вблизи первой стороны 101 нанопоры 100 таким образом, чтобы головная область 111 соединительной структуры 110 была прикреплена к полимеразе 130, и удлиненное тело 113 соединительной структуры 110 находилось в, например, могло бы быть расположено в отверстии 103 нанопоры 100. В некоторых примерах осуществления нанопора 100 может представлять собой биологическую пору, твердотельную пору или биологическую и твердотельную гибридную пору. "Биологическая пора" означает пору, полученную из одного или более материалов биологического происхождения. "Биологическое происхождение" относится к материалу, полученному или выделенному из биологического окружения, такого как организм или клетка, или синтетически изготовленному варианту доступной биологической структуры. Биологические поры включают, например, полипептидные поры и полинуклеотидные поры.
Термин "полипептидная пора" означает пору, полученную из одного или более полипептидов. Один или более полипептидов могут включать мономер, гомополимер или гетерополимер. Структуры полипептидных пор включают, например, пору, образуемую пучком α-гемолизину, и пору, образуемую β-баррелем, а также все другие структуры, хорошо известные в данной области техники. Примеры полипептидных пор включают α-гемолизин, порин A Mycobacterium smegmatis, грамицидин А, мальтопорин, OmpF, OmpC, PhoE, Tsx, F-pilus, SP1, митохондриальный порин (VDAC), Tom40, фосфолипазу А наружной мембраны и липопротеин аутопереноса Neisseria (NaIP). "Порин A Mycobacterium smegmatis (MspA)" представляет собой порин мембраны, выделяемый микобактериями (Mycobacteria), который позволяет гидрофильным молекулам попадать внутрь бактерии. MspA образует плотно взаимосвязанный октамер и трансмембранный бета-баррель, который напоминает по форме кубок и имеет центральное сужение. Дополнительная информация, относящаяся к α-гемолизину, может быть найдена в патенте US 6015714, содержание которого полностью включено в настоящее описание посредством ссылки. Дополнительная информация, относящаяся к SP1, может быть найдена в публикации Wang et al., Chem. Commun., 49:1741-1743, 2013, содержание которой полностью включено в настоящее описание посредством ссылки. Дополнительная информация, относящаяся к MspA, может быть найдена в публикации Butler et al. "Single-molecule DNA detection with an engineered MspA protein nanopore" (Обнаружение единичной молекулы ДНК с помощью сконструированной нанопоры из белка MspA), Proc. Natl. Acad. Sci. 105: 20647-20652 (2008) и Derrington et al. "Nanopore DNA sequencing with MspA" (Секвенирование ДНК на нанопоре с использованием MspA), Proc. Natl. Acad. Sci. USA, 107:16060-16065 (2010), содержания которых полностью включены в настоящее описание посредством ссылки. Другие поры включают, например, гомолог MspA, полученный из Norcadia farcinica, и лизенин. Дополнительная информация, относящаяся к лизенину, может быть найдена в патентной публикации РСТ WO 2013/153359, содержание которой полностью включено в настоящее описание посредством ссылки.
Термин "полинуклеотидная пора" означает пору, полученную из одного или более полимеров, составленных из нуклеиновых кислот. Полинуклеотидная пора может включать, например, полинуклеотидное оригами.
Термин "твердотельная пора" означает пору, которая получена из одного или более материалов небиологического происхождения. Термин "твердотельный" относится к материалам, которые не являются материалами биологического происхождения. Твердотельная пора может быть получена из неорганических или органических материалов. Твердотельные поры включают, например, поры из нитрида кремния, поры из диоксида кремния и поры из графена.
Термин "биологическая и твердотельная гибридная пора" означает гибридную пору, полученную из материалов как биологического, так и небиологического происхождения. Определение материалов биологического происхождения приведено выше, и они включают, например, полипептиды и полинуклеотиды. Биологическая и твердотельная гибридная пора включает, например, полипептид-твердотельную гибридную пору и полинуклеотид-твердотельную пору.
Следует понимать, что различные типы нанопор могут иметь размеры, отличающиеся множеством аспектов. Например, как показано на Фиг. 1А, нанопора 100 может быть охарактеризована первым размером Н1, определяющим толщину нанопоры 100, например, толщину, измеряемую от наружной поверхности первой стороны 101 до наружной поверхности второй стороны 102, расположенной вблизи отверстия 103. В тех примерах осуществления, в которых нанопора 100 включает сужение 104, характеристика нанопоры 100 также может включать второй размер Н2, определяющий глубину сужения, например, глубину, измеряемую от наружной поверхности первой стороны 101 до самой узкой части сужения 104, расположенной вблизи отверстия 103. Характеристика нанопоры 100 также может включать первый диаметр D1, определяющий диаметр отверстия 103, например, диаметр отверстия 103, измеряемый в самой широкой части отверстия. В тех примерах осуществления, в которых нанопора 100 включает сужение 104, характеристика нанопоры 100 также может включать второй диаметр D2, определяющий диаметр сужения, например, диаметр сужения 104 в самой узкой части сужения. Следует понимать, что указанные размеры нанопоры 100 не должны восприниматься как ограничивающие, и что нанопора 100 может иметь другие подходящие размеры. Например, первый размер Н1 нанопоры 100 может изменяться по боковому измерению, например, если нанопора 100 включает относительно тонкий барьер, в котором расположена относительно крупная пора. Или, например, в тех примерах осуществления, в которых нанопора 100 включает сужение 104, второй размер Н2 нанопоры 100 может быть различным в зависимости от локализации сужения 104 относительно наружной поверхности первой стороны 101. Таким образом, сужение 104 может быть расположено в любом подходящем месте внутри нанопоры 100, и в реальном случае даже может быть расположено на удалении от наружной поверхности первой стороны 101 или второй стороны 102. Отверстие 103 и сужение 104 не обязательно должны быть абсолютно круглыми, но при этом они могут быть охарактеризованы приблизительным диаметром или любыми другими подходящими размерами. Кроме того, нанопора 100 может включать множество сужений, каждое из которых может быть предпочтительно охарактеризовано подходящими размерами.
В некоторых примерах осуществления первый размер Н1 нанопоры 100 составляет приблизительно 100 нм или менее, или приблизительно 50 нм или менее, или приблизительно 20 нм или менее, или приблизительно 10 нм или менее, или приблизительно 5 нм или менее, или приблизительно 2 нм или менее. Например, Н1 может составлять от приблизительно 2 нм до приблизительно 100 нм, или от приблизительно 5 нм до приблизительно 50 нм, или от приблизительно 10 нм до приблизительно 20 нм. В тех примерах осуществления, которые включают сужение 104, второй размер Н2 нанопоры 100 составляет приблизительно 100 нм или менее, или приблизительно 50 нм или менее, или приблизительно 20 нм или менее, или приблизительно 10 нм или менее, или приблизительно 5 нм или менее, или приблизительно 2 нм или менее, или приблизительно 1 нм или менее. Например, Н2 может составлять от приблизительно 1 нм до приблизительно 100 нм, или от приблизительно 2 нм до приблизительно 50 нм, или от приблизительно 5 нм до приблизительно 20 нм. В одном из иллюстративных примеров Н1 может составлять от приблизительно 5 нм до приблизительно 50 нм, и Н2 может составлять от приблизительно 1 нм до приблизительно 5 нм. В одном из иллюстративных примеров осуществления Н1 составляет приблизительно 10 нм, и Н2 составляет приблизительно 5 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 10 нм, и Н2 составляет приблизительно 6 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 10 нм, и Н2 составляет приблизительно 7 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 10 нм, и Н2 составляет приблизительно 8 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 10 нм, и Н2 составляет приблизительно 9 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 10 нм, и Н2 составляет приблизительно 10 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 5 нм, и Н2 составляет приблизительно 2 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 5 нм, и Н2 составляет приблизительно 3 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 5 нм, и Н2 составляет приблизительно 4 нм. В другом иллюстративном примере осуществления Н1 составляет приблизительно 5 нм, и Н2 составляет приблизительно 5 нм. Термин "приблизительно" означает, что реальная величина может отклоняться от указанного значения на величину, составляющую до 10%, как в большую, так и в меньшую сторону.
В некоторых примерах осуществления первый диаметр D1 отверстия 103 нанопоры 100 составляет приблизительно 100 нм или менее, или приблизительно 50 нм или менее, или приблизительно 20 нм или менее, или приблизительно 10 нм или менее, или приблизительно 5 нм или менее, или приблизительно 2 нм или менее. Например, D1 может составлять от приблизительно 2 нм до приблизительно 100 нм или от приблизительно 5 нм до приблизительно 50 нм, или от приблизительно 10 нм до приблизительно 20 нм. В примерах осуществления, включающих сужение 104, второй диаметр D2 сужения 104 нанопоры 100 составляет приблизительно 100 нм или менее, или приблизительно 50 нм или менее, или приблизительно 20 нм или менее, или приблизительно 10 нм или менее, или приблизительно 5 нм или менее, или приблизительно 2 нм или менее, или приблизительно 1 нм или менее. Например, D2 может составлять от приблизительно 1 нм до приблизительно 100 нм или от приблизительно 2 нм до приблизительно 50 нм, или от приблизительно 5 нм до приблизительно 20 нм. В одном из иллюстративных примеров D1 может составлять от приблизительно 5 нм до приблизительно 50 нм, и D2 (если таковой имеется) может составлять от приблизительно 1 нм до приблизительно 5 нм.
В одном из иллюстративных примеров осуществления D1 составляет приблизительно от 5 до 10 нм, и D2 составляет приблизительно от 1 до 1,2 нм. В другом иллюстративном примере осуществления D1 составляет приблизительно от 5 до 10 нм, и D2 составляет приблизительно от 1,2 до 1,4 нм. В другом иллюстративном примере осуществления D1 составляет приблизительно от 5 до 10 нм, и D2 составляет приблизительно от 1,4 до 1,6 нм. В другом иллюстративном примере осуществления D1 составляет приблизительно от 5 до 10 нм, и D2 составляет приблизительно от 1,6 до 1,8 нм. В другом иллюстративном примере осуществления D1 составляет приблизительно от 5 до 10 нм, и D2 составляет приблизительно от 1,8 до 2,0 нм. В тех иллюстративных примерах осуществления, в которых пора образована MspA, D1 может составлять, например, приблизительно 4,8 нм, D2 может составлять, например, приблизительно от 1,1 до 1,2 нм, Н1 может составлять, например, приблизительно 9,6 нм, и Н2 может составлять, например, приблизительно от 7,9 до 8,1 нм. В тех иллюстративных примерах осуществления, в которых пора образована α-гемолизином, D1 может составлять, например, приблизительно 2,6 нм, D2 может составлять, например, приблизительно от 1,4 до 1,5 нм, Н1 может составлять, например, приблизительно 10 нм, и Н2 может составлять, например, приблизительно 5 нм. Для других типов пор могут быть подходящим образом выбраны другие подходящие комбинации размеров.
Характеристики долговременной соединительной структуры 110 могут быть подходящим образом выбраны в зависимости от одного или более размеров нанопоры 100. Например, удлиненное тело 113 соединительной структуры 110 может иметь ширину, выбранную в зависимости от D1 и/или D2. Например, ширина удлиненного тела 113 может быть выбрана таким образом, чтобы удлиненное тело 113 было способно перемещаться в отверстии 103, например, ширина удлиненного тела 113 составляет меньше первого диаметра D1 отверстия 103. В тех примерах осуществления, которые включают сужение 104, ширина удлиненного тела 113 также может быть выбрана таким образом, чтобы по меньшей мере часть удлиненного тела 113 могла перемещаться вблизи сужения 104; например, удлиненное тело имеет ширину, которая меньше или равна второму диаметру D2. Необязательно, в тех примерах осуществления, которые включают сужение 104, ширина удлиненного тела 113 также может быть выбрана таким образом, чтобы по меньшей мере часть удлиненного тела 113 могла перемещаться через сужение 104; например, удлиненное тело имеет ширину, составляющую существенно меньше второго диаметра D2 что позволяет удлиненному телу 113 перемещаться через сужение 104. Если нанопора 100 включает множество сужений (не показаны), то ширина удлиненного тела 113 может быть выбрана таким образом, чтобы удлиненное тело 113 было способно перемещаться через некоторые или, если это требуется, через все сужения.
Длина удлиненного тела 113 соединительной структуры 110 может быть выбрана в зависимости от Н1 и/или Н2. Например, длина удлиненного тела 113 может быть выбрана таким образом, чтобы она была короче величины Н1, и в этом случае хвостовая область 112 не выступает за наружную поверхность второй стороны 102 нанопоры 100, даже если удлиненное тело 113 полностью протягивается через сужение 104 по направлению ко второй стороне 102. Или, например, в примерах осуществления, включающих сужение 104, длина удлиненного тела 113 может быть выбрана таким образом, чтобы она была короче величины Н2, и в этом случае хвостовая область 112 не выступает за пределы сужения 104 нанопоры 100, даже если удлиненное тело 113 полностью вытягивается в направлении второй стороны 103. В других примерах осуществления длина удлиненного тела 113 может быть выбрана таким образом, чтобы она превышала Н1, и в этом случае хвостовая область 112 выступает за пределы наружной поверхности второй стороны 102 нанопоры 100, если удлиненное тело 113 полностью протягивается через сужение 104 в направлении второй стороны 102. Или, например, в тех примерах осуществления, которые включают сужение 104, длина удлиненного тела 113 может быть выбрана таким образом, чтобы она превышала Н2, и в этом случае хвостовая область 112 выступает за пределы сужения 104 нанопоры 100, если удлиненное тело 113 полностью вытягивается в направлении второй стороны 103.
Длина удлиненного тела 113 может быть выбрана таким образом, чтобы удлиненное тело 113 могло относительно свободно перемещаться в отверстии 103, по меньшей мере на первой стороне 101 нанопоры 100, по существу без стерических затруднений или других помех, создаваемых самим удлиненным телом. Так, удлиненное тело 113 может быть сконструировано таким образом, что оно занимает лишь часть объема отверстия 103 на первой стороне 101 нанопоры 100, например, занимает менее 50% объема отверстия 103 на первой стороне 101 нанопоры 100 или менее 20% объема отверстия 103 на первой стороне 101 нанопоры 100, или менее 10% объема отверстия 103 на первой стороне 101 нанопоры 100, или менее 5% объема отверстия 103 на первой стороне 101 нанопоры 100, или менее 1% объема отверстия 103 на первой стороне 101 нанопоры 100. Кроме того, в примере осуществления, представленном на Фиг. 1А-1D, хвостовая область 112 соединительной структуры 110 может быть не прикреплена к нанопоре 100 или любому другому элементу, что позволяет всему удлиненному телу 113 относительно свободно перемещаться относительно головной области 111. В альтернативном варианте в примерах осуществления, подобных примерам, рассмотренным ниже при описании Фиг. 4A-4F, 5A-5D и 6, хвостовая область 112 может быть присоединена к другому элементу, что затрудняет отщепление полимеразы 130 от нанопоры 100.
В одном из неограничивающих примеров одна или более репортерных областей 114 может обеспечивать измерение трансляционного, ротационного или конформационного перемещения или определение присутствия (или как измерение перемещения, так и определение присутствия) удлиненного тела 113 в ответ на воздействие полимеразы 130 на нуклеотид 120 или в ответ на конформационное изменение полимеразы 130 в зависимости от комплементарности или некомплементарности нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида 140, или в ответ на воздействие полимеразы 130 на нуклеотид 120 и конформационное изменение полимеразы 130 в зависимости от комплементарности или некомплементарности нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида 140. В одном из иллюстративных примеров осуществления размер D1 отверстия 103 предпочтительно выбран таким образом, чтобы обеспечить применение репортерной области (областей)) в целях измерения перемещения удлиненного тела 113. Например, отверстие 103 может быть достаточно узким, так, чтобы можно было определить его взаимодействие с одной или более репортерными областями 114 при перемещении репортерной области (областей)) 114. В одном из примеров репортерная область 114 имеет характеристику, связанную с запиранием электрического тока или потока, и ширину отверстия 103 выбирают таким образом, чтобы перемещение репортерной области (областей)) 114 приводило к подходящему для обнаружения изменению электрического тока или потока, проходящего через отверстие 103 при приложении напряжения к нанопоре 100. Например, более крупные нуклеотиды (такие как А и G) могут сильнее блокировать отверстие, в котором они находятся, например, за счет расположения удлиненного маркера в сужении MspA, в отличие от нуклеотида Т, имеющего менее крупный удлиненный маркер. Примеры диапазонов процентного снижения электрического тока или потока по сравнению с величиной электрического тока или потока, получаемой при открытой поре, составляют от 0 до 10%, от 10% до 20%, от 20% до 30%, от 30% до 40%, от 40% до 50%, от 60% до 70%, от 70% до 80%, от 80% до 90% и от 90% до 100%. В одном из иллюстративных примеров осуществления для MspA в 300 мМ растворе KCl при сдвиге 180 мВ и при электрическом токе или потоке в открытой поре, составляющем 110 пикоАмпер, этот диапазон составляет от 20% до 70%. Другие неограничивающие примеры репортерных областей 114 более подробно рассмотрены ниже.
Несмотря на то, что на Фиг. 1А представлен один из примеров расположения компонентов нанопоры 100, полимеразы 130 и долговременной соединительной структуры 110, следует понимать, что могут быть применены другие подходящие конструкции. Например, вместо этого полимераза 130, к которой прикреплена головная область 111, может быть расположена вблизи второй стороны 102. Или, например, вместо расположения, указанного на изображении, хвостовая область 112 долговременной соединительной структуры 110 может быть расположена на первой стороне 101 нанопоры 100. Или, например, вместо расположения, указанного на изображении, хвостовая область 112 долговременной соединительной структуры 110 может быть прикреплена либо к первой стороне 101, либо ко второй стороне 102 нанопоры 100 или к другому элементу, который расположен либо на первой стороне 101, либо на второй стороне нанопоры 100. Некоторые из таких комбинаций признаков рассмотрены в настоящей работе, а также в предварительных патентных заявках, включенных в настоящее описание посредством ссылки; однако, следует понимать, что все такие комбинации признаков включены в настоящее изобретение и могут быть созданы на его основе.
Длины удлиненных тел согласно настоящему изобретению могут быть различными, так что хвостовые области согласно настоящему изобретению могут быть расположены на любом подходящем участке относительно нанопоры 100. Например, удлиненное тело 113 не обязательно должно иметь длину, достаточную для того, чтобы хвостовая область 112 была расположена за пределами второй стороны 102 нанопоры 100 так, как показано на Фиг. 1A-1D. Напротив, длина удлиненного тела 113 может быть достаточной для того, чтобы хвостовая область 112 располагалась на первой стороне 101 нанопоры 100, или достаточной для того, чтобы хвостовая область 112 располагалась на второй стороне 102 нанопоры 100, но не за пределами второй стороны 102. Кроме того, согласно настоящему изобретению хвостовые области не обязательно остаются незакрепленными и могут быть присоединены к любому подходящему элементу.
Кроме того, следует понимать, что в примерах осуществления, рассмотренных в настоящей работе, например, таких как примеры, показанные на Фиг. 1A-1D, могут быть применены нанопоры 100 любого подходящего типа, полимеразы 130 любого подходящего типа и долговременные соединительные структуры 110 любого подходящего типа. Например, как уже было указано выше, нанопора может включать биологическую пору, твердотельную пору или биологическую и твердотельную гибридную пору. Например, нанопора 100 может включать один или более твердотельных материалов. Примеры твердотельных материалов, подходящих для создания твердотельной нанопоры, включают кремний (Si), нитрид кремния (SiN или SiNx), графен и оксид кремния (SiO2 или SiOx). Дополнительная информация, относящаяся к твердотельным нанопорам, может быть найдена в приведенных ниже публикациях, содержания которых полностью включены в настоящее описание посредством ссылки: Dekker, "Solid-state nanopores" (Твердотельные нанопоры), Nature Nanotechnology 2: 209-215 (2007); Schneider et al. "DNA Translocation through Graphene Nanopores" (Перемещение ДНК через графеновые нанопоры), Nano Letters 10: 3163-3167 (2010); Merchant et al. Nano Letters 10:2915-2921 (2010) и Garaj et al. "Graphene as a subnanometre trans-electrode membrane" (Графен в качестве субнанометровой транс-электродной мембраны), Nature 467: 190-193 (2010). Биологические поры включают, например, полипептидные поры и полинуклеотидные поры. Биологические поры могут быть расположены внутри барьера, который включает мембрану биологического происхождения или твердотельную мембрану. Неограничивающие примеры биологических нанопор включают MspA и альфа-гемолизин. Примеры мембран биологического происхождения включают липидные бислои. Примеры твердотельных мембран включают мембраны из кремния и графена. Дополнительная информация, относящаяся к примерам гибридных нанопор и их получению, может быть найдена в приведенных ниже публикациях, содержания которых полностью включены в настоящее описание посредством ссылки: Hall et al. "Hybrid pore formation by directed insertion of alpha hemolysin into solid-state nanopores" (Образование гибридых пор направленным введением альфα-гемолизина в твердотельные нанопоры), Nature Nanotechnology 5: 874-877 (2010) и Cabello-Aguilar et al. "Slow translocation of polynucleotides and their discrimination by α-hemolysin inside a single track-etched nanopore designed by atomic layer deposition" (Медленное перемещение полинуклеотидов и их распознавание α-гемолизином внутри нанопоры с одним вытравленным каналом движения, полученной атомно-слоевым осаждением), Nanoscale 5: 9582-9586 (2013).
В некоторых примерах осуществления, таких как примеры, более подробно рассмотренные ниже со ссылками на Фиг. 7A-7D и 8, полимераза 130, показанная на Фиг. 1A-1D необязательно может быть модифицирована для отсрочивания действия одного или более параметров реакции при использовании композиции, показанной на Фиг. 1A-1D для секвенирования полинуклеотида. Например, полимераза 130 необязательно может быть модифицирована для отсрочивания высвобождения пирофосфата вследствие встраивания нуклеотида 130 в первый полинуклеотид 140.
Кроме того, следует понимать, что головная группа соединительной структуры может быть присоединена к полимеразе множеством различных способов. Например, могут быть применены реагенты хорошо известной химии биоконъюгатов, такие как реагенты, рассмотренные в публикации Hermanson, указанной выше. В иллюстративных примерах осуществления полимераза включает химический фрагмент, образующий соединение, такой как цистеин, или пептидный линкер, такой как SpyTag. Дополнительная информация о маркерах SpyTag и их применении для образования соединений может быть найдена, например, в приведенных ниже публикациях, содержания которых полностью включены в настоящее описание посредством ссылки: Zakeri et al. "Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesin" (Пептидный маркер, быстро образующий ковалентную связь с белком, посредством конструирования бактериального адгезина), Proc. Nat. Acad. Sci. USA 109: E690-E697 (2012) и Fiereret al. "SpyLigase peptide-peptide ligation polymerases affibodies to enhance magnetic cancer cell capture" (Полимеразные аффитела SpyLigase для пептид-пептидного лигирования для улучшения магнитного захвата раковых клеток), Proc. Nat. Acad. Sci. USA 111: E1176-E1181 (2014). Другие примеры линкеров включают: образование конъюгатов между сложными NHS-эфирными, изоцианатными и изотиоцианатными линкерами и аминами, малеимидами и цистеинами, реактивами клик-химии, содержащими азиды, и алкинами, применение маркеров сплавления, таких как Halotag, Spycatcher-Spytag, и другие аналогичные способы биоконъюгации белок-белок. Дополнительная информация о примерах линкеров, которые могут быть применены, может быть найдена в приведенных ниже публикациях, содержания которых полностью включены в настоящее описание посредством ссылки: Hermanson, Bioconjugate Techniques, 2-ое изд., Elsevier, 2008, и Liu et al. "Specific Enzyme Immobilization Approaches and Their Application with Nanomaterials" (Специфичные подходы к иммобилизации ферментов и их применение в комбинации с наноматериалами), Topics in Catalysis 55(16-18): 1146-1156 (2012).
Ниже со ссылками на Фиг. 2А-2В рассмотрены примеры систем для секвенирования полинуклеотидов с применением соединительных структур, прикрепленных к полимеразам, расположенным вблизи нанопор. На Фиг. 2А схематично представлена система 270, включающая композицию, такую как композиция, показанная на Фиг. 1A-1D, и измерительную схему (например, электрическую или оптическую измерительную схему), выполненную с возможностью измерения уровня электрического тока или потока в зависимости от связывания первого фрагмента 115 удлиненного тела 113 с удлиненным маркером 121 нуклеотида 120, на который воздействует полимераза 130, и/или в зависимости от указания, полученного от одной или более репортерных областей 114, о комплементарности или некомплементарности этого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида (второй полинуклеотид не показан явно на Фиг. 2А, но он может быть аналогичен полинуклеотиду, показанному на Фиг. 1A-1D). Система 270 включает нанопору 100, долговременную соединительную структуру 110, нуклеотид 120, полимеразу 130 и измерительную схему 230. Нанопора 100 включает первую сторону 101, вторую сторону 102, отверстие 103 и сужение 104. Долговременная соединительная структура 110 включает головную область 111, хвостовую область 112 и удлиненное тело 113. Нуклеотид 120 включает удлиненный маркер 121 и второй фрагмент 122. Полимераза 130 может иметь свойства, аналогичные рассмотренным в другой части настоящего описания. Кроме того, удлиненное тело 113 может включать первый фрагмент 115, который выполнен с возможностью связывания удлиненного маркера 121 нуклеотида 120, на который воздействует полимераза 130, а также репортерную область (области) 114, выполненные с возможностью указания на комплементарность или некомплементарность нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида (который не показан явно на Фиг. 2А, но может быть аналогичен полинуклеотиду, показанному при описании Фиг. 1A-1D).
В одном из иллюстративных примеров нанопора 100, соединительная структура 110, нуклеотид 120, полимераза 130 и первый и второй полинуклеотиды, такие как полинуклеотиды, показанные на Фиг. 1A-1D, могут быть погружены в проводящую текучую среду, например, водный раствор соли. Измерительная схема 230 может находиться в соединении с первым электродом 231 и вторым электродом 232 и может быть выполнена с возможностью приложения напряжения между первым электродом 231 и вторым электродом 232, в результате чего между сторонами нанопоры 100 создается напряжение. Подходящим может быть применение напряжения, создаваемого как постоянным электрическим током (англ. direct current, сокращенно DC), так и переменным электрическим током (англ. alternating current, сокращенно АС). В некоторых примерах осуществления измерительная схема 230 может быть дополнительно выполнена с возможностью применения первого электрода 231 и второго электрода 232 с целью измерения величины электрического тока или потока через отверстие 103. В некоторых примерах осуществления измерительная схема 230 может дополнительно включать оптический, биологический или химический датчик, сконструированный, соответственно, для измерения оптическим, биологическим или химическим способом величины потока молекул через отверстие 203. Примеры оптических датчиков включают устройства с зарядовой связью (англ. charge coupled device, сокращенно CCD) и фотодиоды. В некоторых примерах осуществления измерительная схема включает один или более агентов, которые вступают в химическую или биологическую реакцию с потоком молекул, проходящим через отверстие 103, что приводит к формированию сигнала, доступного для оптического обнаружения. Примеры сигналов (например, оптических или электрических сигналов), которые могут быть сформированы с помощью системы 270, показанные на Фиг. 2А, описаны ниже при рассмотрении Фиг. 4F и 6.
Первый фрагмент 115 удлиненного тела 113 соединительной структуры 110 может быть выполнен с возможностью формирования по меньшей мере одного сигнала в ответ на воздействие полимеразы 130 на нуклеотид 120, причем нуклеотид 120 может быть идентифицирован на основании такого сигнала. Например, как указано выше при рассмотрении Фиг. 1В и как показано на Фиг. 2А, первый фрагмент 115 может взаимодействовать, например, связываться, например, гибридизоваться со вторым фрагментом 122 удлиненного маркера 121. Связывание первого фрагмента 115 со вторым фрагментом 122 может приводить к образованию дуплекса, имеющего достаточно большой размер, который не позволяет ему проходить через сужение 104 нанопоры 100; вместо этого он может застревать в сужении 104 или вблизи сужения 104 под напряжением, создаваемым первым электродом 231 и вторым электродом 232, которое приложено к нанопоре 100. Фрагмент 122 удлиненного маркера 121 может быть выбран таким образом, чтобы нуклеотид 120 можно было идентифицировать в соответствии с уровнем электрического тока или потока, протекающего через отверстие 103 при наличии в сужении 104 или рядом с ним дуплекса. Например, каждый из различных типов нуклеотида 120 (например, А, С, Т или G) может включать отличный от других соответствующий удлиненный маркер 121, например, каждый из них включает отличающийся второй фрагмент 122, который связывается с соответствующей частью первого фрагмента 115, отличной от других связывающихся частей. В одном из неограничивающих примеров удлиненный маркер 121 включает первую нуклеотидную последовательность, и первый фрагмент 115 включает вторую нуклеотидную последовательность, которая комплементарна первой нуклеотидной последовательности. Измерительная схема 230 может быть выполнена с возможностью измерения соответствующего уровня электрического тока или потока, проходящего через отверстие 103. Уровень электрического тока или потока может зависеть от вида удлиненного маркера, и идентификацию нуклеотида 120 выполняют на основании величины электрического тока или потока.
Например, фрагмент 122 удлиненного маркера 121 первого нуклеотида 120 (например, одного из А, С, Т или G) может включать нуклеотидную последовательность, отличающуюся от последовательности фрагмента 122 удлиненного маркера 121 второго нуклеотида 120 (например, другого нуклеотида из А, С, Т или G), и нуклеотидную последовательность, отличающуюся от последовательности фрагмента 122 удлиненного маркера 122 третьего нуклеотида 120 (например, еще одного нуклеотида из А, С, Т или G), и нуклеотидную последовательность, отличающуюся от последовательности фрагмента 122 удлиненного маркера 122 четвертого нуклеотида 120 (например, оставшегося нуклеотида из А, С, Т или G). В одном из иллюстративных примеров каждый из различных фрагментов может связываться (например, гибридизоваться) с соответствующей частью первого фрагмента 115, с которой не связываются другие фрагменты, и при иммобилизации полученного дуплекса в сужении 104 или вблизи сужения 104 (или иного взаимодействия с сужением 104) уровни электрического тока или потока будут отличаться друг от друга. Кроме того или в альтернативном варианте иммобилизация полученного дуплекса в сужении 104 или вблизи сужения 104 (или иное взаимодействие с сужением 104) может приводить к тому, что репортерная область (области) 114 будет располагаться в определенном участке отверстия 103, что приводит к тому, что уровень электрического тока или потока в конкретном случае будет отличаться от уровня электрического тока или потока в случае других дуплексов и будет соответствовать именно этому нуклеотиду. Соответственно, на основании уровня электрического тока или потока, проходящего через отверстие, соответствующего удлиненному маркеру 122 конкретного нуклеотида 120, на который воздействует полимераза 130, этот нуклеотид может быть идентифицирован.
Физические, химические, оптические, электрические, биологические или другие подходящие свойства репортерной области (областей) 114, обеспечивающие блокировку потока, могут отличаться от соответствующих свойств одной или более других областей удлиненного тела 113, и свойства репортерной области (областей) 114 могут позволять ей идентифицировать нуклеотид 120 или указывать на комплементарность или некомплементарность нуклеотида 120, на который воздействует полимераза 130 следующему нуклеотиду в последовательности второго полинуклеотида (не показан специальным образом на Фиг. 2А, но может иметь конфигурацию, показанную на Фиг. 1A-1D), или репортерная область (области) 114 может как идентифицировать нуклеотид 120, так и указывать на комплементарность или некомплементарность нуклеотида 120, на который воздействует полимераза 130, следующему нуклеотиду в последовательности второго полинуклеотида. Например, репортерная область (области) может обеспечивать наличие или формировать один или более уникальных характеристических электрических токов или потоков (например, сигнальных состояний), которые индивидуальным образом идентифицируют нуклеотид, на который производится воздействие, или может индивидуально указывать на комплементарность или некомплементарность этого нуклеотида следующему нуклеотиду второго полинуклеотида, или осуществлять обе эти функции: индивидуальным образом идентифицировать нуклеотид, на который производится воздействие, и индивидуально указывать на то, комплементарен или не комплементарен этот нуклеотид следующему нуклеотиду второго полинуклеотида. Например, репортерная область (области) может формировать сигнальное состояние (например, электрический ток или поток) в ответ на связывание полимеразой 130 или нахождение в активном сайте полимеразы 130 некоторых частей или всего нуклеотида 120, где нуклеотид 120 комплементарен или некомплементарен следующему нуклеотиду в секвенируемом полинуклеотиде, или в ответ на успешное встраивание нуклеотида 120 под действием полимеразы 130 во второй полинуклеотид в положение, которое является комплементарным следующему нуклеотиду (не показано явным образом на Фиг. 2А, но может иметь конфигурацию, показанную на Фиг. 1A-1D).
Например, величина или временная продолжительность конформационного изменения полимеразы 130 может быть чувствительна к тому, комплементарен или некомплементарен нуклеотид 120 следующему нуклеотиду второго полинуклеотида, и величина и/или временная продолжительность соответствующего сигнала может зависеть от конформационного изменения полимеразы 130. В некоторых иллюстративных примерах осуществления измерительная схема 130 может быть выполнена с возможностью определения положения репортерной области (областей)) 114 относительно сужения 104, и это положение может указывать на комплементарность или некомплементарность нуклеотида, на который воздействует полимераза 130, следующему нуклеотиду в последовательности второго полинуклеотида. Например, положение репортерной области (областей)) 114 может зависеть от конформационного изменения полимеразы 130, которое может происходить после того, как полимераза 130 успешно добавляет нуклеотид 120 к первому полинуклеотиду, как рассмотрено в настоящем описании. Кроме того, как указано в настоящем описании, в некоторых примерах осуществления положение репортерной области (областей)) 114 относительно сужения 104 может зависеть от конкретного вида нуклеотида 120. Соответственно, определенное сигнальное состояние (например, электрический ток или поток), которое может быть обнаружено (например, оптическим или электрическим способом) системой 270, может указывать на информацию, идентифицирующую нуклеотид 120, и/или на комплементарность или некомплементарность нуклеотида 120 следующему нуклеотиду в секвенируемом полинуклеотиде.
В другом примере репортерная область 114 может иметь физическое свойство, отличающееся от физических свойств некоторых или всех других областей удлиненного тела 113. Например, репортерная область 114 может вызывать запирание электрического тока или потока, проходящего через отверстие 103, которое отлично от запирания, создаваемого другими областями удлиненного тела 113. Кроме того или в альтернативном варианте свойство блокировать электрический ток или поток репортерной области 114 может отличаться от аналогичного свойства некоторых или всех других областей удлиненного тела 113. Например, репортерная область 114 может иметь электростатический заряд, в то время как некоторые или все остальные области удлиненного тела 113 могут иметь другие электростатические заряды или могут не иметь заряда (например, могут быть электрически нейтральными). Или, например, репортерная область 114 может не иметь заряда, в то время как некоторые или все остальные области удлиненного тела 113 могут иметь электростатический заряд. Или, например, репортерная область 114 может иметь некоторое физическое свойства. Физические свойства включают объем и форму репортерной области 114. В одном из иллюстративных примеров перемещение репортерной области 114 в отверстии 103 вызывает подходящие для измерения изменения электрического тока или потока, проходящего через отверстие или необязательно через сужение 104 отверстия, посредством модуляции запирания электрического тока или потока, проходящего через отверстие или сужение. Или, например, репортерная область 114 может обладать химическим или биологическим свойством, которое позволяет производить обнаружение химическими или биологическими средствами. Химические или биологические свойства включают наличие химической или биологической группы, например, радиоактивной группы или группы, проявляющей ферментативную активность.
Одно или более электрических, физических, химических, оптических, биологических или других свойств репортерной области 114, обеспечивающих запирание потока, могут подходить для определения изменения величины электрического тока, протекающего через отверстие 103 или сужение 104, подходить для определения изменения величины потока молекул, проходящего через отверстие 103 или сужение 104, или обеспечивать формирование оптического сигнала. В одном из иллюстративных примеров перемещение или присутствие репортерной области 114 в отверстии 103 вызывает подходящее для измерения изменение величины электрического тока, протекающего через отверстие 103 или сужение 104, или вызывает подходящее для измерения изменение величины потока молекул, проходящего через отверстие 103 или сужение 104, причем изменение потока может быть обнаружено электрическими, химическими, биологическими или оптическими средствами. Например, присутствие или перемещение репортерной области 114 в отверстии 103 или сужении 104 может вызывать запирание ионного тока или запирание молекулярного потока, которое может быть обнаружено оптическими, электрическими, химическими или биологическими средствами. В одном из иллюстративных примеров градиент молекул на транс-стороне может создавать естественный молекулярный поток, который может быть частично заблокирован репортерной областью 114. Измерительная схема 130 может быть выполнена с возможностью измерения такого молекулярного потока неэлектрическими средствами (например, оптическими средствами), используя потоки люминесцентных (например, флуоресцентных или хемолюминесцентных) молекул или потоки реагентов, которые становятся хемолюминесцентными в присутствии других реагентов. Например, ионы Са2+ могут проходить с одной стороны нанопоры на другую сторону, где они встречают чувствительный к кальцию краситель, такой как Fluo-2, Fluo-4, Fluo-8 или подобный краситель, индуцирующий флуоресценцию. Другие пары реагентов, которые могут быть применены, включают, без ограничений, люминол и окислители, кальций и экворин или АТФ и люциферазу. Дополнительная информация, относящаяся к оптическим определениям молекулярных потоков через отверстие или сужение, может быть найдена в публикации Ivankin et al. "Label-Free Optical Detection of Biomolecular Translocation through Nanopore Arrays" (Оптическое определении биомолекулярного перемещения через массивы нанопор без применения меток), ACSNano 8(10): 10774-10781 (2014), содержание которой полностью включено в настоящее описание посредством ссылки.
В неограничивающих примерах осуществления, таких как примеры, более подробно описанные ниже при рассмотрении Фиг. 4A-4F, 5A-5D и 6, приложение по обеим сторонам нанопоры 100 достаточно высокого напряжения может вызывать диссоциацию дуплекса, образованного первым фрагментом 115 и вторым фрагментом 122, на указанные фрагменты, после чего одна или более репортерные области 114 могут занимать определенное положение в отверстии 103, которое зависит от конформационного состояния полимеразы 130. Соответственно, нуклеотид 120 может быть идентифицирован на основании первого сигнального состояния, а второе сигнальное состояние может указывать на конформационное состояние полимеразы 130, которое может указывать на комплементарность или некомплементарность нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида. Полярность напряжения, приложенного к сторонам нанопоры 100, может быть многократно изменена для проведения многократного связывания первого фрагмента со вторым фрагментом, после чего производят определение первого сигнального состояния, затем происходит отщепление первого фрагмента от второго фрагмента, после чего производят определение второго сигнального состояния требуемое количество раз для идентификации нуклеотида 120, на который воздействует полимераза 130, и для определения комплементарноости или некомплементарности нуклеотида 120 следующему нуклеотиду в последовательности второго полинуклеотида с требуемой точностью.
В этом отношении следует отметить, что в уже известных методиках секвенирования единичных молекул в режиме реального времени относительно часто появляются ошибки, и эти методики отличаются относительно низкой точностью, поскольку в таких методиках не всегда достаточно правильно устанавливается комплементарен или некомплементарен нуклеотид, на который оказывается воздействие, следующему нуклеотиду в последовательности второго полинуклеотида, или не всегда устанавливается, что такой нуклеотид представляет собой элемент "несоответствующего" комплекса с полимеразой и примированной нуклеиновой кислотой. Для сравнения, композиции, системы и способы согласно настоящему изобретению подходят для идентификации нуклеотида, на который оказывается воздействие, например, на основании первого сигнального состояния, а также позволяют определять комплементарность или некомплементарность нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида (т.е. соответствие) на основании второго сигнального состояния, что, таким образом, может значительно повысить точность секвенирования полинуклеотида. Следует понимать, что другие схемы формирования сигнальных состояний, указывающих на комплементарность или некомплементарность нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида, подобные схемам, представленным в настоящем описании, также могут значительно повысить точность секвенирования полинуклеотида.
Например, каждая из одной или более репортерных областей 114 может иметь физическое свойство, отличающееся от физических свойств некоторых или всех остальных областей удлиненного тела 113. В некоторых примерах осуществления репортерная область (области) 114 может создавать запирание электрического тока или потока, протекающего через отверстие 103, отличное от запирания, создаваемого другими областями удлиненного тела 113. Кроме того или в альтернативном варианте свойство репортерной области (областей) 114 блокировать электрический ток или поток может отличаться от аналогичного свойства некоторых или всех остальных областей удлиненного тела 113. Например, репортерная область (области) 114 может иметь электростатический заряд, в то время как некоторые или все остальные области удлиненного тела 113 могут иметь другие электростатические заряды или могут не иметь заряда (например, могут быть электрически нейтральными). Или, например, репортерная область (области) 114 может не иметь заряда, в то время как некоторые или все остальные области удлиненного тела 113 могут иметь электростатический заряд. Состояние (например, величина) электрического тока или потока, проходящего через отверстие 103, может зависеть от положения репортерной области (областей)) 114 в отверстии 103, которое может зависеть от конформационного состояния полимеразы 130, и продолжительность нахождения электрического тока или потока в определенном состоянии может зависеть от продолжительности пребывания одной или более репортерных областей в некотором положении без изменения. В одном из иллюстративных неограничивающих примеров удлиненное тело 113 включает полинуклеотид, который включает один или более нуклеотидов с отсутствующим азотистым основанием, которые формируют одну или более репортерных областей 114.
В одном из иллюстративных примеров осуществления нанопора 100 представляет собой биологическую нанопору. Неограничивающие примеры биологических нанопор включают MspA и альфа-гемолизин. Репортерная область 114 соединительной структуры 111 может включать один или более остатков, лишенных азотистого основания, выполненных с возможностью расположения внутри или вблизи одного или более сужений 104 биологической нанопоры. Перемещение одного или более должным образом расположенных остатков, лишенных азотистого основания, через сужение любой поры может привести к созданию сигнала, доступного для обнаружения, например, подходящего для обнаружения изменения электрического тока или потока, протекающего через сужение (сужения)) 104. Биологические нанопоры, такие как MspA и альфа-гемолизин, могут включать полезные сужения, которые могут служить для концентрации влияния репортерной области (областей)) 114. Например, материал MspA, включающий одно сужение, диаметр которого составляет приблизительно 1,2 нм, а длина - приблизительно 0,5 нм, может обеспечивать подходящее пространственное разрешение, поскольку величина запирания ионного тока или потока, проходящего через сужение, в основном зависит от сегмента удлиненного тела, пропускаемого через узкую область (сужение) нанопоры.
В одном из иллюстративных примеров осуществления одна или более репортерные области 114 имеют электростатический заряд, и первое и второе сигнальные состояния, генерируемые системой 270, которые, соответственно, формируются в ответ на действие полимеразы на нуклеотид 120 (первое сигнальное состояние) и указывают на комплементарность или некомплементарность нуклеотида 120 следующему нуклеотиду второго полинуклеотида (второе сигнальное состояние), соответствуют определенному состоянию электрического тока или потока, проходящего через сужение 104. Однако следует понимать, что измерительная схема 230 может включать или находиться в соединении с любым элементом или комбинацией элементов, обеспечивающих обнаружение любой подходящей репортерной области (областей), и не обязательно должна быть основана на измерении электрического тока или потока, проходящего через сужение 104, или даже на перемещении репортерной области (областей)). Кроме того, репортерная область (области) 114 не обязательно должна быть присоединена к соединительной структуре 110 и вместо этого может быть присоединена к нуклеотиду 120 или другой молекуле, на которую оказывается воздействие, или она может быть присоединена к полимеразе 130. Например, в опубликованной патентной заявке US 2011/0312529, Не et al., содержание которой полностью включено в настоящее описание посредством ссылки, рассмотрен пример модифицированных полимераз, которые могут показывать конформационное состояние полимеразы, например, являются конформационно меченными.
Конкретные свойства одной или более репортерных областей, например, репортерной области (областей) 114 или репортерной области, находящейся в композиции и системе в другом месте, могут быть выбраны, исходя из конкретной конфигурации системы 270, так, чтобы облегчить анализ этой репортерной области (областей). Например, одна или более репортерные области могут иметь определенное оптическое свойство, и система 270 может включать или находиться в соединении с оптическим датчиком, выполненным с возможностью определения оптического свойства, и формирования одного или более сигнальных состояний на основании идентификационных признаков нуклеотида 120 или на основании комплементарности или некомплементарности нуклеотида 120, на который воздействует полимераза 130, следующему нуклеотиду в последовательности второго полинуклеотида (не представлен явным образом на Фиг. 2А, но может иметь конфигурацию, рассмотренную при описании Фиг. 1A-1D), или на основании идентификационных признаков нуклеотида 120 и комплементарности или некомплементарности нуклеотида 120, на который воздействует полимераза 130, следующему нуклеотиду в последовательности второго полинуклеотида. В одном из иллюстративных примеров осуществления репортерная область (области) 114 или другая репортерная область, расположенная в другом месте в композиции и системе, может включать первый партнер пары для FRET, например, донор или акцептор FRET, который взаимодействует с соответствующим вторым партнером пары для FRET, например, акцептором или донором FRET, с испусканием света определенной длины волны, который способна обнаруживать измерительная схема 230. Или, например, репортерная область (области) 114 или другая репортерная область, расположенная в другом месте в композиции и системе, может обладать определенным химическим или биологическим свойством, и система 270 может включать или находиться в соединении с датчиком химического или биологического обнаружения, выполненным с возможностью определения химического или биологического свойства и формирования второго сигнального состояния, если нуклеотид 120, на который воздействует полимераза 130, комплементарен или некомплементарен следующему нуклеотиду в последовательности второго полинуклеотида (не представлен явным образом на Фиг. 2А, но может иметь конфигурацию, рассмотренную при описании Фиг. 1A-1D). В другом примере репортерная область может обеспечивать перекрывание молекулярного потока, которое модулирует поток молекул через отверстие или сужение, и этот поток может быть обнаружен оптическими, электрическими, химическими или биологическими средствами.
В одном из неограничивающих примеров измерительная схема 230 выполнена с возможностью определения сигнального состояния, сформированного репортерной областью (областями) 114 в ответ на высвобождение пирофосфата или другого фосфористого оксианиона вследствие успешного встраивания нуклеотида 120 в первый полинуклеотид (не представлен явным образом на Фиг. 2А, но может иметь конфигурацию, рассмотренную при описании Фиг. 1A-1D) под действием полимеразы 130. Например, репортерная область (области) 114 может быть выполнена с возможностью связывания с пирофосфатом, который высвобождается вследствие успешного встраивания нуклеотида 120 в первый полинуклеотид под действием полимеразы 130 согласно механизму, аналогичному рассмотренному ниже при описании Фиг. 11А-11С.
В связи с изложенным следует отметить, что полимераза 130 необязательно может быть модифицирована для обеспечения задержки высвобождения пирофосфата в ответ на встраивание нуклеотида 120 в первый полинуклеотид. Например, в некоторых примерах осуществления полимераза 130 может включать модифицированную рекомбинантную полимеразу Ф29, В103, GA-1, PZA, Ф15, BS32, M2Y, Nf, G1, Ср-1, PRD1, PZE, SF5, Ср-5, Ср-7, PR4, PR5, PR722 или L17. В некоторых примерах осуществления полимераза 130 может включать модифицированную рекомбинантную ДНК-полимеразу Ф29, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из: замещения аминокислоты в положении 484, замещения аминокислоты в положении 198 и замещения аминокислоты в положении 381. В некоторых примерах осуществления полимераза 130 может включать модифицированную рекомбинантную ДНК-полимеразу Ф29, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из E375Y, K512Y, T368F, А484Е, A484Y, N387L, T372Q, T372L, K478Y, 1370W, F198W и L381A. Дополнительная информация, относящаяся к примерам модифицированных полимераз, которые могут обеспечивать задержку высвобождения пирофосфата в ответ на встраивание нуклеотида в полинуклеотид, может быть найдена в патенте US 8133672, Bjornson et al., содержание которого полностью включено в настоящее описание посредством ссылки.
В другом неограничивающем примере измерительная схема 230 выполнена с возможностью определения сигнального состояния, сформированного репортерной областью (областями) 114 в ответ на высвобождение удлиненного маркера 121 вследствие успешного встраивания нуклеотида 120 в первый полинуклеотид (не представлен явным образом на Фиг. 2А, но может иметь конфигурацию, рассмотренную при описании Фиг. 1A-1D) под действием полимеразы 130.
Например, репортерная область (области) 114 может быть выполнена с возможностью связывания с частью удлиненного маркера 121, которая высвобождается в ответ на успешное встраивание нуклеотида 120 в первый полинуклеотид под действием полимеразы 130. В одном из иллюстративных примеров, если аллостерический аптамер, который может распознавать только что отщепленный пирофосфат и подвергаться конформационному изменению, которое делает олигонуклеотид доступным для воздействия, расположен на линкерной части маркера, то этот аптамер может предоставлять олигонуклеотид, который связывается с соединительной структурой после успешного встраивания. При связывании может образовываться новое сигнальное состояние отрыва. Например, в одном из неограничивающих примеров осуществления удлиненный маркер, присоединенный к нуклеотиду, может включать два фрагмента, способных гибридизоваться с соединительной структурой так, как показано на Фиг. 11А-11С. Один из таких фрагментов может находиться вблизи фосфатов и, таким образом, может удерживаться вдали от соединительной структуры и вблизи активного сайта полимеразы. Второй такой фрагмент может находиться в удалении от нуклеотида и может быть способен связываться с соединительной структурой, в то время как нуклеотид находится в активном сайте полимеразы. Первый сигнал отрыва может быть сформирован удаленным фрагментом, при условии, что нуклеотид удерживается в активном сайте, и цикл изменения напряжения (переменный ток) соответствует циклу, рассмотренному в настоящем описании. Этот сигнал удаленного фрагмента может указывать на тип нуклеотида, находящегося в активном сайте. Если нуклеотид покидает активный сайт без отщепления фосфата и встраивания, то ближний фрагмент может гибридизоваться с соединительной структурой и может генерировать сигнал отрыва, который формируется за счет его оставшегося соединения с нуклеотидом. Такое сигнальное состояние может указывать на отсутствие встраивания нуклеотида. При отщеплении фосфата и встраивании ближний фрагмент может гибридизоваться с соединительной структурой и может генерировать другой сигнал отрыва, поскольку нуклеотид уже не присутствует. Такое сигнальное состояние может указывать на встраивание нуклеотида и отщепление фосфата.
Следует понимать, что для параллельного секвенирования множества полинуклеотидов может быть применен массив (множество) нанопор. Например, на Фиг. 2 В схематично представлен вид сверху системы 260, включающей измерительную схему 240, выполненную с возможностью определения перемещения одной или более соответствующих репортерных областей внутри соответствующих отверстий массива нанопор. Множество систем 250, каждая из которых может быть сконструирована аналогично системе 270, рассмотренной выше со ссылкой на Фиг. 2А, может быть размещено в объединенном виде на общей подложке (субстрате, англ. substrate), или системы могут быть получены по отдельности и расположены друг рядом с другом. Каждая система 250 может включать нанопору 100, соединительную структуру (соединительные структуры не показаны явным образом) и адресуемый электрод 241. Конструкция измерительной схемы 240 может быть аналогична конструкции измерительной схемы 230, и схема 240 может быть электрически соединена с каждым из адресуемых электродов 241 каждой системы 250 через подходящий канал связи, например, проводник (соединение показано только для одной из систем 250) и с общим электродом 242. Измерительная схема 240 может быть выполнена с возможностью селективного приложения напряжения к каждой нанопоре 100 посредством приложения напряжения к адресуемому электроду 241 этой нанопоры и к общему электроду 242 и для селективного измерения электрического тока или потока, проходящего через эту нанопору при приложенном напряжении. Аналогичные массивы могут быть успешно сконструированы для других типов систем определения, например, систем определения с помощью световых, химических или биологических средств.
Ниже рассмотрены некоторые примеры способов секвенирования полинуклеотидов и примеры композиций, которые могут быть применены в этих способах. Согласно одному из аспектов, способ включает предоставление нанопоры, имеющей первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны; предоставление множества нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер; и предоставление первого и второго полинуклеотидов, где первый полинуклеотид комплементарен второму полинуклеотиду. Способ также мог включать предоставление полимеразы, располагаемой вблизи первой стороны нанопоры, причем полимераза выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов, к первому полинуклеотиду на основании последовательности второго полинуклеотида, и полимераза прикреплена к долговременной соединительной структуре, включающей головную область, хвостовую область и расположенное между ними удлиненное тело, причем удлиненное тело находится в отверстии нанопоры. Способ также может включать обнаружение того, что на первый нуклеотид воздействует полимераза на основании связывания удлиненного маркера с первым фрагментом, расположенным на удлиненном теле; и установление комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида с помощью одной или более репортерных областей, расположенных на удлиненном теле.
Например, на Фиг. 3 представлен иллюстративный способ 300 секвенирования полинуклеотида с использованием композиции, включающей соединительную структуру, прикрепленную к полимеразе, расположенной вблизи нанопоры. Способ 300 включает предоставление нанопоры, имеющей первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны (этап 301). Нанопора может иметь любую подходящую конфигурацию, например, такую как конфигурация, рассмотренная выше при описании Фиг. 1A-1D. Например, нанопора 100, показанная на Фиг. 1А, включает первую сторону 101, вторую сторону 102 и отверстие 103, проходящее через первую и вторую стороны.
Этап 301 также не обязательно может включать получение нанопоры. Например, этап 301 может включать создание барьера и размещение нанопоры на барьере или в барьере. Способы получения нанопор известны в данной области техники. Например, иллюстративные способы получения MspA нанопор рассмотрены в публикации Butler et al. "Single-molecule DNA detection with an engineered MspA protein nanopore" (Обнаружение единичной молекулы ДНК с помощью сконструированной нанопоры из белка MspA), Proc. Natl. Acad. Sci. 105: 20647-20652 (2008), содержание которой полностью включено в настоящее описание посредством ссылки. Или, например, иллюстративные способы получения альфа-гемолизиновых нанопор рассмотрены в публикациях Howorka et al. "Sequence-specific detection of individual DNA strands using engineered nanopores" (Последовательность-специфичное обнаружение индивидуальных цепочек ДНК с помощью сконструированных нанопор), Nature Biotechnology 19: 636-639 (2001), и Clarke et al. "Continuous base identification for single-molecule nanopore DNA sequencing" (Непрерывная идентификация оснований при секвенировании единичной молекулы ДНК с применением нанопор), Nature Nanotechnology 4: 265-270 (2009), содержания которых полностью включены в настоящее описание посредством ссылки.
Способ 300, представленный на Фиг. 3, также включает предоставление множества нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер (этап 302). Например, на Фиг. 9А схематично представлен иллюстративный нуклеотид 920, включающий удлиненный маркер 921, включающий второй фрагмент 922, который взаимодействует с первым фрагментом 115 соединительной структуры 110, показанной на Фиг. 1A-1D, в процессе обнаружения нуклеотида, на который воздействует полимераза 130. В неограничивающем примере, показанном на Фиг. 9А, удлиненный маркер 921 иллюстративного нуклеотида 920, например, Т, может включать олигонуклеотидный фрагмент 922, присоединенный к гамма-фосфату нуклеотида 920, например, через дельта-фосфатную связь. Олигонуклеотидный фрагмент 922 может включать любую подходящую последовательность нуклеотидов, выбранную с целью гибридизации с соответствующей последовательностью нуклеотидов фрагмента 115 соединительной структуры 110. Например, олигонуклеотидный фрагмент 922, показанный на Фиг. 9А, может включать иллюстративную последовательность 5' GCAT 3', и фрагмент 115 может включать комплементарную последовательность 5' ATGC 3'.
Каждый из нуклеотидов различных типов может включать соответствующий удлиненный маркер, который присоединен к гамма-фосфату нуклеотида средствами, аналогичными средствам, показанным на Фиг. 9А, или присоединен другими подходящими средствами. Например, на Фиг. 9В-9С схематично представлены примеры нуклеотидов, включающих удлиненные маркеры, включающие соответствующие фрагменты, которые взаимодействуют с примерами соединительных структур в способе секвенирования полинуклеотида. Как показано на Фиг. 9В, нуклеотиды А, Т, С и G могут включать соответствующие удлиненные маркеры, которые включают отличающиеся друг от друга фрагменты, например, соответствующим образом изображенные треугольником, ромбом, квадратом и кружком. Могут быть подходящим образом выбраны определенные фрагменты, которые взаимодействуют, например, гибридизуются с соответствующим фрагментом долговременной соединительной структуры, что приводит к различным соответствующим конформационным изменениям соединительной структуры. На Фиг. 9С показаны неограничивающие примеры фрагментов, которые могут быть включены в удлиненные маркеры, показанные на Фиг. 9В. Каждый такой фрагмент может взаимодействовать, например, гибридизоваться с различными соответствующими частями соответствующего фрагмента долговременной соединительной структуры, что приводит к различным соответствующим конформационным изменениям соединительной структуры.
Например, на Фиг. 9D схематично представлен пример соединительной структуры, которая включает головную область 911, хвостовую область 912 и удлиненное тело 913, которое включает одну или более репортерных областей 914 и фрагмент 915. Головная область 911 может включать химический линкер, такой как 3'-малеимидная группа ("Mai") для сопряжения с цистеиновым (Cys) остатком, находящимся на поре. Хвостовая область 912 может включать 5'-фосфатную группу ("phos"), имеющую заряд, и, таким образом, способствующую протягиванию соединительной структуры через отверстие поры под действием прикладываемого напряжения. Удлиненное тело 913 может включать полимер, например, полинуклеотид, такой как полинуклеотид, показанный на Фиг. 9С, или любой другой подходящий полимер, такой как биологический полимер или синтетический полимер. Репортерная область 914 включает один или более нуклеотидов с отсутствующим азотистым основанием, обозначенных "X", и в одном из иллюстративных примеров осуществления репортерная область 914 может быть расположена на расстоянии приблизительно 14-15 оснований от малеимида, который в некоторых типах нанопор может располагаться на расстоянии, приблизительно составляющем Н2, от отверстия поры в направлении сужения поры. Фрагмент 915 может включать последовательность нуклеотидов, например, GGGTATAT, с которой может взаимодействовать, например, гибридизоваться, отличным от других образом каждый из фрагментов, присоединенных к нуклеотидам А, Т, С и G, на которые должно оказываться воздействие.
Как указано в настоящем описании, различные взаимодействия между фрагментом долговременной соединительной структуры, присоединенным к полимеразе, и фрагментами нуклеотидов, на которые оказывается воздействие, могут приводить к формированию сигнальных состояний, на основании которых может быть идентифицирован нуклеотид или на основании которых может быть определена возможная комплементарность этого нуклеотида следующему нуклеотиду в секвенируемом полинуклеотиде. На Фиг. 10А-10В схематично представлено движение (перемещение) примера соединительной структуры вследствие гибридизации с фрагментом удлиненного маркера иллюстративного нуклеотида в способе секвенирования полинуклеотида согласно некоторым примерам осуществления настоящего изобретения. Головная область 1011 соединительной структуры прикреплена к полимеразе 1030, которая расположена вблизи нанопоры 100, которая необязательно включает сужение 1004, и удлиненное тело 1013 проходит через отверстие 1003, например, таким образом, что репортерная область 1014 находится внутри или вблизи сужения 1014. В примере осуществления, представленном на Фиг. 10А-10В, удлиненное тело 1013 включает полинуклеотид, такой как онДНК, нуклеотиды которого представлены горизонтальными штрихами 1016. Репортерная область 1014 включает один или более сайтов полинуклеотида, например, онДНК, которые лишены азотистого основания. Фрагмент 1015 включает последовательность нуклеотидов, выбранную таким образом, чтобы она могла гибридизоваться с соответствующим фрагментом, например, с комплементарной последовательностью нуклеотидов удлиненного маркера нуклеотида, на который воздействует полимераза 1030 (нуклеотид, на который оказывается воздействие, и его удлиненный маркер не представлены явным образом на Фиг. 10А-10В).
Как показано на Фиг. 10А, перед связыванием фрагмента 1015 с соответствующим фрагментом нуклеотида, на который оказывается воздействие, нуклеотиды 1016 расположены на расстоянии приблизительно 5 Ангстрем друг от друга. Кроме того, полимераза 1030 может иметь конформационное состояние, соответствующее несвязанному состоянию нуклеотида или его отсутствию в активном сайте полимеразы. Как показано на Фиг. 10В, вследствие взаимодействия, например, гибридизации фрагмента 1015 с соответствующим фрагментом нуклеотида, на который оказывается воздействие, например, в ответ на образование фрагментами дуплекса двухцепочечной ДНК, расстояние между нуклеотидами 1016 внутри фрагмента 1015 уменьшается до приблизительно 3,3 Ангстрема. Изменение длины соединительной структуры может быть вызвано образованием двухцепочечной (двухнитевой) ДНК (днДНК) из онДНК, которая соответственно включается во фрагмент 1015 и фрагмент маркера нуклеотида, на который оказывается воздействие. Например, онДНК длиннее, чем днДНК приблизительно на 1,5 Ангстрем на нуклеотид, что находится в пределах разрешения систем согласно настоящему изобретению, например, системы 270, показанной на Фиг. 2А, или системы 260, показанной на Фиг. 2С. Каждый нуклеотид может включать соответствующий олигонуклеотидный фрагмент, который выбран для образования днДНК различной длины после гибридизации этого фрагмента с фрагмент 1015, укорачивая, таким образом, соединительную структуру на расстояние, которое соответствует нуклеотиду, на который воздействует полимераза 1050. В некоторых примерах осуществления формула, по которой можно рассчитать относительное укорочение полностью натянутой соединительной структуры, такой как соединительная структура, проходящая через пору под действием приложенного напряжения, может быть следующей:

где N - количество гибридизованных оснований, Ds - расстояние, на которое укорачивается соединительная структура, Lss - длина между нуклеотидами в онДНК (приблизительно 5 Ангстрем), и Lds - длина между нуклеотидами в днДНК (приблизительно 3,3 Ангстрема). Короткой черной вертикальной линией на Фиг. 10В обозначена гибридизация 5 оснований, при которой происходит укорочение соединительной структуры и перемещение репортерной области 1014 в новое место. Дуплексы из 6, 7 или 8 оснований могут быть еще короче, чем показано на Фиг. 10В, например, как показано на Фиг. 9C-9D.
Кроме того, в зависимости от комплементарности или некомплементарности нуклеотида, на который оказывается воздействие, следующему нуклеотиду в секвенируемом полинуклеотиде (полинуклеотид явным образом не показан) может изменяться конформация полимеразы 1030. Например, как показано на Фиг. 10В, полимераза 1030 может принимать модифицированную конформацию 1030', если нуклеотид соответствует следующему нуклеотиду в последовательности секвенируемого полинуклеотида, в результате чего репортерная область (области) 1014 располагаются в таком месте отверстия 1003, что это приводит к получению уникальной величины электрического тока или потока, проходящего через отверстие 1003, на основании чего может быть установлено, является ли этот нуклеотид соответствующим. Для сравнения, полимераза 1030 может иметь другую модифицированную конформацию (например, конформацию 1030'', показанную на Фиг. 10С), если нуклеотид не соответствует следующему нуклеотиду в последовательности секвенируемого полинуклеотида, в результате чего репортерная область (области) 1014 располагаются в таком месте отверстия 1003, что это приводит к получению уникальной величины электрического тока или потока, проходящего через отверстие 1003, на основании чего может быть установлено, является ли этот нуклеотид несоответствующим. В этом отношении следует отметить, что определенное сигнальное состояние (например, состояние электрического тока или потока) может указывать как на идентичность нуклеотида, так и на соответствие или несоответствие нуклеотида. Соответственно, следует понимать, что различные сигнальные состояния, которые могут указывать на идентичность нуклеотидов или на соответствие или несоответствие этих нуклеотидов, не обязательно должны наблюдаться разновременно и в действительности могут наблюдаться одновременно друг с другом. Например, измеряемый сигнал (например, оптический или электрический) может представлять собой комбинацию из более чем одного сигнального состояния (например, из двух сигнальных состояний), и каждое сигнальное состояние предоставляет информацию об одном или более идентификационном признаке нуклеотидов или о соответствии или несоответствии такого нуклеотида.
Следует отметить, что фрагменты, показанные на Фиг. 9A-9D, приведены исключительно для примера и не ограничивают объем изобретения. Однако фрагменты, присоединяемые к нуклеотидам, на которые должно оказываться воздействие, могут быть выбраны так, чтобы они удовлетворяли одному или более из следующих параметров и, необязательно, всем нижеследующим параметрам:
1. Взаимодействия фрагментов, присоединенных к различающимся между собой нуклеотидам, с фрагментом соединительной структуры могут быть различными, и это различие может быть, например, определено по величинам электрического тока или потока, проходящего через сужение поры.
2. Стабильность дуплекса, образуемого фрагментом нуклеотида и соответствующим фрагментом соединительной структуры, достаточно низка, в результате чего такие фрагменты, присоединенные к "свободным" нуклеотидам (нуклеотиды, на которые не воздействует полимераза и которые, таким образом, временно взаимодействуют с соединительной структурой), лишь в течение короткого времени взаимодействуют с фрагментом соединительной структуры, например, в течение времени, составляющего менее 1 миллисекунды. Например, стабильность дуплекса, образуемого фрагментом нуклеотида и фрагментом соединительной структуры, может быть выражена в виде Tm или температур плавления дуплекса. Ожидается, что рабочая температура системы составляет приблизительно 20°C, то есть равна комнатной температуре. Предположительно, фрагменты длиной приблизительно 5-8 нуклеотидов имеют Tm<12°C, которая может обеспечивать достаточно низкую стабильность при комнатной температуре, так что фрагменты, присоединенные к "свободным" нуклеотидам, будут лишь в течение короткого времени взаимодействовать с фрагментом соединительной структуры.
3. Стабильность дуплекса, образуемого фрагментом нуклеотида и соответствующим фрагментом соединительной структуры, достаточно высока, и, таким образом, во время встраивания полимераза воздействует на нуклеотид и удерживает его в течение нескольких миллисекунд (например, от 1 до 30 миллисекунд); такое воздействие повышает эффективную концентрацию фрагмента нуклеотида по отношению к фрагменту соединительной структуры, что способствует дальнейшему протеканию реакции между фрагментами и повышает стабильность, в результате чего эффективная Tm дуплекса составляет более 20°C (или предполагаемой рабочей температуры системы), например, составляет более 30°C или более 40°C или более 50°C.
4. Длина удлиненного маркера нуклеотида, на который оказывается воздействие, например, длина от фрагмента до гамма-фосфата, может быть достаточной для того, чтобы после стабильной гибридизации фрагмента с соответствующим фрагментом соединительной структуры, на нуклеотид по существу не воздействовали никакие силы. Если эта длина слишком мала, то соединительная структура может создавать силу, воздействующую на удлиненный маркер нуклеотида, что, как ожидается, приводит к снижению эффективности полимеразы.
5. После присоединения соединительной структуры к полимеразе ожидается, что положение репортера может изменяться в зависимости от соответствия или несоответствия нуклеотида, находящегося в активном сайте полимеразы, поскольку на конформацию полимеразы может влиять комплементарность нуклеотида следующему нуклеотиду в секвенируемом полинуклеотиде, а, следовательно, относительное положение репортерной области внутри отверстия, например, относительно сужения. Таким образом, идентичность нуклеотида, а также комплементарность нуклеотида может быть определена по положению репортера в сужении поры.
Дополнительная информация о гибридизации олигонуклеотидов приведена в патенте US 8652779, Turner et al., содержание которого полностью включено в настоящее описание посредством ссылки. По данным Turner et al., при таком масштабе олигонуклеотид должен проходить свое пространство конфигураций приблизительно в 100 раз быстрее времени встраивания нуклеотида под действием полимеразы. Применяя этот принцип к композициям согласно настоящему изобретению, полагают, что весьма вероятно, что фрагмент нуклеотида, на который оказывается воздействие, легко "находит" и взаимодействует с соответствующим фрагментом соединительной структуры, а также будет отщепляться от соединительной структуры после отщепления фрагмента от нуклеотида, на который оказывается воздействие.
Следует отметить, что среди иллюстративных фрагментов, показанных на Фиг. 9D, каждый фрагмент, присоединенный к нуклеотиду, на который оказывается воздействие, может образовывать только одну подходящую гибридизацию с соответствующим фрагментом 915 соединительной структуры, которая включает от 5 до 8 оснований. В то время как существуют другие возможные виды гибридизации, не приводящие к полной гибридизации, можно предположить, что эти виды существенно менее стабильны, чем виды гибридизации с полной длиной.
Вновь обращаясь к Фиг. 1А-1С можно отметить, что действие полимеразы 130 на нуклеотид 120 может удерживать фрагмент 122 в относительной близости к фрагменту 115 соединительной структуры 110, что приводит к временному повышению локальной концентрации олигонуклеотидного фрагмента 122, что может приводить к временной гибридизации между фрагментами 122 и 115, более предпочтительной по сравнению с гибридизацией с фрагментами, присоединенным к нуклеотидам, на которые в данный момент не воздействует полимераза 130. Кроме того, как было отмечено выше, полимераза 130 может отщеплять удлиненный маркер 121 при встраивании нуклеотида 120 в полинуклеотид, вследствие чего фрагмент 122 может отщепляться от фрагмента 115. Подходящие способы получения нуклеотидов, включающих удлиненные маркеры, несложно предоставить.
Способ 300, представленный на Фиг. 3, также включает предоставление первого и второго полинуклеотидов, где первый полинуклеотид комплементарен второму полинуклеотиду (этап 303). Например, этап 303 может включать предоставление второго полинуклеотида, который также может быть назван "целевым" или "матричным", то есть должен быть подвергнут секвенированию. Этап 303 также может включать предоставление, известными способами, первого полинуклеотида, который комплементарен второму полинуклеотиду, но может быть короче второго полинуклеотида. В одном из иллюстративных примеров первый полинуклеотид может включать праймер, который комплементарен части второго полинуклеотида и гибридизуется с ней.
Способ 300, представленный на Фиг. 3, также включает предоставление полимеразы, располагаемой вблизи первой стороны нанопоры (этап 304). Полимераза может быть выполнена с возможностью добавления нуклеотидов, взятых из множества нуклеотидов (предоставленного в этапе 302), к первому полинуклеотиду (предоставленному в этапе 303) на основании последовательности второго полинуклеотида (также предоставленного в этапе 303). Примеры подходящих полимераз рассмотрены в настоящей работе или известны в данной области техники. Необязательно, полимераза может быть модифицирована для формирования сигнала, зависящего от конформации полимеразы, например, как рассмотрено в опубликованной патентной заявке US 2011/0312529, Не et al., или для замедления высвобождения пирофосфата, например, как рассмотрено в патенте US 8133672, содержания которых полностью включены в настоящее описание посредством ссылки.
Кроме того, полимераза, предоставленная в этапе 304, может быть прикреплена к долговременной соединительной структуре, включающей головную область, хвостовую область и расположенное между ними удлиненное тело, где удлиненное тело включает одну или более репортерных областей, и головная область прикреплена к или вблизи первой стороны или второй стороне нанопоры. Соединительная структура может иметь любую подходящую конфигурацию, такую как конфигурация, рассмотренная выше при описании Фиг. 1A-1D или в ином разделе настоящей работы. Например, длина удлиненного тела соединительной структуры может превышать первый размер Н1, определяющий толщину нанопоры, например, такой как показано на Фиг. 1A-1D. Или, например, длина удлиненного тела может быть равна первому размеру Н1, определяющему толщину нанопоры, или быть меньше первого размера Н1. Или, например, в тех примерах осуществления, которые включают сужение, длина удлиненного тела может превышать второй размер Н2, определяющий глубину сужения, например, такой как показано на Фиг. 1A-1D. Или, например, в тех примерах осуществления, которые включают сужение, длина удлиненного тела может быть меньше второго размера Н2. Или, например, одна или более репортерные области могут быть расположены в участке удлиненного тела, выбранном таким образом, чтобы при полностью или частично вытянутом удлиненном теле и головной области, прикрепленной к полимеразе, полимераза располагалась вблизи нанопоры, первый фрагмент 115 удлиненного тела отщеплялся от второго фрагмента 122 удлиненного маркера, репортерная область (области) располагалась в отверстии нанопоры, например, располагалась вблизи сужения или в сужении, таким образом, как показано на Фиг. 1A-1D. Может быть применена любая подходящая комбинация перечисленных признаков.
Этап 304 также не обязательно может включать получение соединительной структуры. Например, этап 304 может включать создание удлиненного тела, которое включает части, ограничивающие головную область, хвостовую область и одну или более репортерных областей. Например, как указано в настоящем описании, соединительная структура может включать ДНК. Олигонуклеотид ДНК достаточной длины может быть получен с помощью процедур, хорошо известных в данной области техники. Например, олигонуклеотиды, имеющие первичную 5'- или 3'-аминогруппу, могут быть коммерчески приобретены у таких поставщиков, как Integrated DNA Technologies, Inc. (Coralville, Iowa). Могут быть заказаны олигонуклеотиды, которые включают один или более фрагментов, лишенных азотистого основания, которые могут быть применены в качестве одной или более репортерных областей, рассмотренных в настоящей работе. Бифункциональный линкер, такой как сульфо-SMCC (от англ. sulfosuccinimidyl-4-(N-maleimidomethyl)cyclohexane-1-carboxylate, т.е. сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат), который включает реакционноспособную аминогруппу (NHS) и реакционноспособную тиольную группу (малеимид), может быть приобретен из коммерческих источников, например, предоставлен Компанией Thermo Fisher Scientific, Inc. (Rockford, Illinois). Такой линкер может быть введен в реакцию с олигонуклеотидом в подходящих, хорошо известных в данной области техники условиях реакции, с образованием стабильной амидной связи. После очистки олигонуклеотида от непрореагировавшего сульфо-SMCC, модифицированный олигонуклеотид (получивший реакционноспособную тиольную группу за счет малеимидной группы) может быть введен в реакцию с полимеразой. Полимераза может быть получена заранее и включать по меньшей мере один доступный для растворителя цистеиновый остаток, имеющий тиольную (SH) группу в восстановленной форме. Восстановленная форма может быть получена, например, инкубацией с 5 мМ трис(2-карбоксиэтил)фосфина (англ. tris(2-carboxyethyl)phosphine, сокращенно ТСЕР), который представляет собой легкодоступное коммерческое соединение. Модифицированный олигонуклеотид, например, взятый в молярном избытке, может быть смешан с восстановленной полимеразой в условиях реакции, хорошо известных в данной области техники, в которых малеимид образует стабильную связь простого тиоэфира. Конъюгат из полимеразы и олигонуклеотида может быть отделен от избытка непрореагировавшего олигонуклеотида. В другом примере соединения, подходящие для включения в соединительную структуру на основе полиэтиленгликоля (ПЭГ), например, малеимида-ПЭГ, доступны из коммерческих источников, например, могут быть предоставлены Laysan Bio, Inc. (Arab, Alabama). Например, малеимид может образовывать конъюгат с восстановленным цистеинтиолом, аналогичный соединению, рассмотренному выше. В ПЭГ могут быть выделены одна или более подходящие репортерные области. В другом примере дисульфидная связь между олигонуклеотидом и альфа-гемолизиновой нанопорой может быть создана так, как описано в публикации Howorka et al. "Kinetics of duplex formation for individual DNA strands within a single protein nanopore" (Кинетика дуплексного образования индивидуальных цепочек ДНК в единичной нанопоре белка), PNAS 98: 12996-13301 (2001), содержание которой полностью включено в настоящее описание посредством ссылки.
Этап 304 может дополнительно включать расположение удлиненного тела соединительной структуры в отверстии нанопоры. В зависимости от длины удлиненного тела, удлиненное тело необязательно может проходить через все отверстие нанопоры. Например, в примерах осуществления, рассмотренных выше при описании Фиг. 1A-1D, длина удлиненного тела соединительной структуры необязательно может быть достаточной для того, чтобы хвостовая область соединительной структуры располагалась с противоположной стороны сужения (если оно имеется) нанопоры относительно головной области соединительной структуры, и необязательно хвостовая область может располагаться за пределами стороны нанопоры, противоположной размещению головной области соединительной структуры. В одном из иллюстративных примеров удлиненное тело соединительной структуры может быть расположено в отверстии нанопоры посредством приложения к удлиненному телу соединительной структуры подходящей направленной силы. Например, как указано в настоящем описании при рассмотрении Фиг. 2А-2С, к нанопоре может быть приложено напряжение, и удлиненное тело соединительной структуры может включать по меньшей мере один заряженный фрагмент, который под действием напряжения притягивает хвостовую область соединительной структуры к той стороне нанопоры, которая противоположна стороне, к которой присоединена головная область соединительной структуры или у которой головная область соединительной структуры присоединена к первому элементу, что вызывает перемещение хвостовой области, приводящее к расположению всей или части удлиненного тела соединительной структуры в отверстии нанопоры.
Кроме того, этап 304 необязательно может включать расположение полимеразы вблизи первой стороны нанопоры. Например, полимераза может быть присоединена к или вблизи первой стороны нанопоры с помощью химической связи, например, ковалентной связи, водородной связи, ионной связи, диполь-дипольной связи, Лондоновских дисперсионных сил или любой подходящей комбинации перечисленных взаимодействий. Или, например, полимераза может быть присоединена к первой стороне нанопоры посредством взаимодействия между первой белковой структурой, находящейся на полимеразе, и второй белковой структурой, которая присоединена к или находится вблизи первой стороны нанопоры. Например, первая и вторая структуры могут включать альфа-спирали, переплетенные друг с другом. Присоединение полимеразы вблизи первой стороны нанопоры может быть долговременным; при этом полимераза удерживается в практически фиксированном положении по отношению к первой стороне нанопоры.
В одном из иллюстративных примеров осуществления восстановленная тиольная (-SH) группа (также называемая сульфгидрильной группой) цистеинового остатка полимеразы или нанопоры может быть введена в реакцию с реакционноспособной тиольной группой другой полимеразы или нанопоры. Примеры таких групп включают малеимид и йодоацетамид. Как более подробно рассмотрено в публикации www.lifetechnoloqies.com/us/en/home/references/molecular-probes-the-handbook/thiol-reactive-probes/introduction-to-thiol-moclification-and-detection.html#head2. реагенты, содержащие первичную реакционноспособную тиольную группу, включающие йодоацетамиды, малеимиды, бензилгалогениды и бромметилкетоны, могут производить S-алкилирование тиолов с образованием стабильных простых тиоэфиров; арилирующие реагенты, такие как галогениды 7-нитробенз-2,1,3-оксадиазола (англ. 7-nitrobenz-2,1,3-oxadiazole, сокращенно NBD) могут реагировать с тиолами или аминами, аналогично замещая ароматический галогенид нуклеофилом; и поскольку тиолятный анион является более сильным нуклеофилом, чем нейтральный тиол, цистеин более реакционноспособен выше своей pKa. Кроме того, как более подробно рассмотрено в публикации www.piercenet.com/method/sulfhydryl-reactive-crosslinker-chemistry, реакционноспособные сульфгидрильные химические группы включают галогеноацетилы, малеимиды, азиридины, акрилоилы, арилирующие агенты, винилсульфоны, пиридилдисульфиды, тиолы TNB (2-нитро-5-тиобензойной кислоты) и дисульфидные восстановители; такие группы могут образовывать конъюгаты с сульфгидрилами посредством алкилирования (например, посредством образования простых тиоэфирных связей) или обмена дисульфидом (например, образования дисульфидной связи). Также могут быть применены подходящие реакции обмена сульфгидрила. В альтернативном варианте целью могут быть амины (-NH2). Например, относительно реакционноспособными являются первичный амин остатка лизина и N-концевая группа полипептида. На аминные остатки могут воздействовать сложные N-гидроксисукцинимидные эфиры (NHS сложные эфиры), которые могут образовывать стабильную амидную связь, или сшивающие агенты на основе сложных имидоэфиров, которые могут реагировать с первичными аминами с образованием амидиновых связей. Существует множество других реакционноспособных аминосоединений. Например, как показано в публикации www.piercenet.com/method/amine-reactive-crosslinker-chemistry, синтетические химические группы, которые могут образовывать химические связи с первичными аминами, включают изотиоцианаты, изоцианаты, ацилазиды, сложные NHS-эфиры, сульфонилхлориды, альдегиды, глиоксали, эпоксиды, оксираны, карбонаты, арилгалогениды, сложные имидоэфиры, карбодиимиды, ангидриды и сложные эфиры фторфенила; такие группы могут образовывать конъюгаты с аминами, например, посредством ацилирования или алкилирования. В других примерах осуществления, для введения новой функциональной группы, такой как азид или алкин, который применяют в клик-химии, может быть использован модифицированный аминокислотный остаток. Например, функциональные тиольные или аминогруппы, рассмотренные выше, могут быть применены в сочетании с линкерами, которые позволяют присоединять функциональные азидогрупы или алкинные группы, для дальнейшего применения в реакциях клик-химии.
Этап 304, показанный на Фиг. 3, необязательно может дополнительно включать присоединение хвостовой области соединительной структуры либо к первой стороне, либо ко второй стороне нанопоры, либо ко второму элементу. Может быть применено любое подходящее соединение, как рассмотренное в настоящем описании, так и известное в данной области техники. Например, этап 304 необязательно может включать присоединение хвостовой области соединительной структуры ко второй стороне нанопоры. Или, например, этап 304 необязательно может включать присоединение хвостовой области соединительной структуры ко второму элементу (такому как олигонуклеотид), расположенному на той стороне нанопоры, которая противоположна стороне расположения головной области. В этом отношении следует отметить, что для того, чтобы полимераза 130 оставалась связанной с нанопорой, полимераза 130 не обязательно должна быть прикреплена к первой стороне нанопоры. Например, в некоторых условиях приложение направленной силы к удлиненному телу соединительной структуры может вызывать перемещение хвостовой области, в результате которого вся соединительная структура располагается в отверстии нанопоры. При приложении силы достаточной величины может происходить временное размещение полимеразы, которая присоединена к соединительной структуре, в или на нанопоре. Несмотря на отсутствие ограничений в отношении физической конфигурации, результат может быть определен как 'закупоривание' нанопоры полимеразой. Закупоривание может быть замедлено или предотвращено посредством ограничения силы, прикладываемой к соединительной структуре (например, приложением к нанопоре напряжения менее 180 мВ), ограничения периода времени, в течение которого сила действует на систему, или посредством применения достаточно крупного белка, что позволяет избежать закупоривания. В альтернативном варианте или кроме того, для обращения взаимодействия между белком и нанопорой (называемого 'раскупориванием'), к системе может быть приложено напряжение обратной полярности. Альтернативой замедлению или предотвращению закупоривания или облегчению раскупоривания является удаление из отверстия нанопоры заряженных аминокислот или наличие комплементарных зарядов на поверхности белка, позволяющих снизить зарядовое сродство между двумя компонентами. Дополнительный полезный эффект может быть достигнут при добавлении в структуру белка сшивающих агентов (например, сконструированных цистеиновых пар, образующих дисульфидные поперечные связи, или химических сшивающих агентов) для стабилизации глобулярной структуры белка.
Закупоривание может быть обнаружено посредством определения характеристического поведения электрического тока или потока, которое отличается от поведения при других конфигурациях системы нанопор. Отличающееся поведение может наблюдаться, например, при приложении к системе нанопор положительного или отрицательного напряжения смещения. Соответственно, поведение электрического тока или потока может наблюдаться во время сборки или во время использования системы, которая включает белок, присоединенный к нанопоре через соединительную структуру, которая присоединена к белку и расположена в просвете нанопоры. Определение этого поведения может быть применено для мониторинга сборки (например, для предотвращения закупоривания), для проведения раскупоривания или для иной оптимизации целевой сборки.
Следует отметить, что, поскольку головная область соединительной структуры присоединена к полимеразе, направленная сила также может подтянуть полимеразу ближе или полностью или частично расположить в отверстии нанопоры так, как описано в настоящей работе при рассмотрении Фиг. 1A-1D. Например, притяжение хвостовой области к стороне нанопоры, противоположной стороне, на которой головная область соединительной структуры присоединена к первому элементу, также может приводить к перемещению первого элемента в положение, находящееся вблизи или полностью или частично внутри отверстия нанопоры. При нахождении полимеразы в таком положении хвостовая область 112 соединительной структуры 110 может быть прикреплена к другому элементу, например, может быть гибридизована с олигонуклеотидом, который комплементарен олигонуклеотиду, находящемуся в хвостовой области 112 соединительной структуры, и такое прикрепление хвостовой области 112 может затруднять отщепление полимеразы от нанопоры100.
Способ 300, представленный на Фиг. 3, также включает определение того, что на первый нуклеотид воздействует полимераза, на основании связывания удлиненного маркера с первым фрагментом, расположенным на удлиненном теле (этап 305). Например, как показано выше при рассмотрении Фиг. 1A-1D и 2А-2В, связывание между первым фрагментом 115 удлиненного тела и вторым фрагментом 122 удлиненного маркера может приводить к образованию дуплекса, который формирует первое сигнальное состояние, например, первое электрическое или оптическое сигнальное состояние, которое доступно для обнаружения подходящей измерительной схемой, например, измерительной схемой 230, показанной на Фиг. 2А, или измерительной схемой 240, показанной на Фиг. 2В. Различные нуклеотиды могут включать фрагменты 122, отличающиеся друг от друга, и эти фрагменты могут генерировать сигналы, отличающиеся друг от друга, которые позволяют, таким образом, идентифицировать конкретный нуклеотид, на который воздействует полимераза 130, на основании полученного сигнала.
Способ 300, представленный на Фиг. 3, также включает определение комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида (этап 306) при помощи одной или более репортерных областей, расположенных на удлиненном теле. Например, как показано выше при рассмотрении Фиг. 1A-1D и 2А-2С, репортерная область (области) может быть выполнена с возможностью формирования сигнального состояния в зависимости от того, комплементарен ли первый нуклеотид следующему нуклеотиду во втором полинуклеотиде, например, на основании конформационного изменения полимеразы, высвобождения пирофосфата или другого подходящего фосфористого оксианиона, высвобождения удлиненного маркера нуклеотида или подобного изменения.
Например, полимераза может переходить из состояния, называемого "открытым состоянием", в котором полимераза не связывает нуклеотид, в "закрытое состояние", в котором полимераза связывает нуклеотид, и обратно. См., например, публикацию Xia et al. "Alteration in the cavity size adjacent to the active site of RB69 DNA polymerase changes its conformational dynamics" (Изменения размеров полости, расположенной вблизи активного сайта ДНК-полимеразы RB69, изменяет ее конформационную динамику), Nucl. Acids Res. (2013), nar.gkt674, содержание которой полностью включено в настоящее описание посредством ссылки. См. также публикацию Santoso et al. "Conformational transitions in DNA polymerase I revealed by single-molecule FRET" (Конформационные переходы ДНК-полимеразы I, обнаруживаемые с помощью резонансного переноса энергии флуоресценции (FRET) одной молекулой), Proc. Natl. Acad. Sci. USA, 107(2): 715-720 (2010), содержание которой полностью включено в настоящее описание посредством ссылки.
Известно, что конформационные изменения амплитудой порядка нескольких нанометров происходят в течение каталитического цикла встраивания нуклеотида по мере того, как полимераза переходит из открытого в закрытое состояния, или при переходе полимеразы в режим редактирования. Например, на Фиг. 7А-7В схематично представлены относительно большие конформационные изменения (>1 нм) двух различных полимераз. На Фиг. 7А показана полимераза RB69, которая претерпевает относительно значительное конформационное изменение, которое приводит к относительному перемещению между доменом большого пальца и доменом пальцев; перемещение этой полимеразы между открытой и закрытой конформациями, как указано Xia et al. составляет 3 нм. На Фиг. 7В представлен Pol I (Фрагмент Кленова или KF), который, как показано Santoso et al., подвергается конформационным изменениям во время встраивания нуклеотида. α-Углеродная основная цепь полимеразы показана бежевым цветом. Матричная цепочка ДНК показана темно-серым цветом, а цепочка праймера - светло-серым цветом. Терминальная пара оснований на активном сайте показана лиловым цветом. По данным Santoso, атомы β-углерода двух боковых цепей служат сайтами присоединения флуорофора; они представлены в виде зеленых и красных сфер, с помощью которых указаны конформационные изменения полимеразы. Стрелками указаны расстояния в ангстремах между зелеными и красными положениями Сβ в открытой и закрытой конформациях. Также имеются свидетельства, что конформационные изменения полимеразы могут зависеть от конкретного встраиваемого нуклеотида, например, как рассмотрено в публикации Olsen et al. "Electronic Measurements of Single-Molecule Processing by DNA Polymerase I (Klenow Fragment)" (Электронные измерения при обработке единичной молекулы ДНК-полимеразой I (Фрагмент Кленова)), JACS 135: 7855-7860 (2013), содержание которой полностью включено в настоящее описание посредством ссылки. В тех примерах осуществления настоящего изобретения, в которых применяют нанопоры, домен пальцев может быть прикреплен к нанопоре, в то время как соединительная структура присоединена к домену большого пальца. В альтернативном варианте домен большого пальца может быть прикреплен к нанопоре, в то время как соединительная структура присоединена к домену пальцев. В любой конструкции относительное перемещение между доменом пальцев и доменом большого пальца в процессе действия полимеразы может быть обнаружено в виде перемещения соединительной структуры относительно нанопоры. В тех примерах осуществления настоящего изобретения, в которых применяют нанопоры, могут быть применены средства химического присоединения, которые применяли для прикрепления оптических зондов (например, пар FRET) в работах, цитируемых в настоящем описании. В конструкции полимераза-нанопора могут быть применены другие точки присоединения, при условии, что конформационные изменения полимеразы преобразуется в перемещение соединительной структуры относительно нанопоры.
На Фиг. 7C-7D схематично представлен пример композиции, включающей долговременную соединительную структуру, прикрепленную к полимеразе, расположенную вблизи нанопоры и выполненную с возможностью применения в обнаружении конформационного изменения полимеразы вследствие воздействия полимеразы на нуклеотид. Нанопора включает биологическую пору 605, которая может находиться в барьере (не показан), например, в мембране биологического происхождения, такой как липидный бислой, или в твердотельной мембране. Биологическая пора 605 включает отверстие 603 и сужение 604. Долговременная соединительная структура включает головную область 611, удлиненное тело 613 и одну или более репортерных областей 614. Полимераза 650 располагается вблизи биологической поры 605 и необязательно может быть присоединена к биологической поре 605. Полимераза 650 выполнена с возможностью доставки к ней матричного полинуклеотида, например, кольцевой или неразветвленной онДНК, которую подвергают секвенированию, с целью синтеза полинуклеотида, содержащего последовательность, комплементарную последовательности онДНК, где синтез включает последовательную доставку, связывание и добавление нуклеотидов к полинуклеотиду в соответствии с последовательностью онДНК. Головная область 611 долговременной соединительной структуры может быть прикреплена к участку полимеразы 650, который подвергается конформационному изменению, например, в ответ на доставку нуклеотида, связывание нуклеотида или добавление нуклеотида к полинуклеотиду 660, и при этом происходит перемещение репортерной области (областей) 614 в другой участок относительно сужения 604, в результате чего генерируется сигнал, который указывает на комплементарность или некомплементарность нуклеотида, на который оказывается воздействие, следующему нуклеотиду в последовательности онДНК. Например, головная область 611 может быть присоединена к домену пальцев полимеразы или к домену большого пальца полимеразы. Примеры точек присоединения в домене пальцев и домене большого пальца полимеразы и химические средства присоединения фрагментов к этим точкам рассмотрены в опубликованной патентной заявке US 2011/0312529 А1, содержание которой включено в настоящее описание посредством ссылки.
Дополнительная информация о структуре и функциях полимераз семейства А и В имеется в публикации Patel et al. "Getting a grip on how DNA polymerases function" (Понимание функционирования ДНК-полимераз), Nature Structural Biology 8: 656-659 (2001), содержание которой полностью включено в настоящее описание посредством ссылки. Дополнительная информация о структуре и функциях таких полимераз, как Pol I, изложена в следующих публикациях, содержания которых полностью включены в настоящее описание посредством ссылки: Olsen et al. "Electronic Measurements of Single-Molecule Processing by DNA Polymerase I (Klenow Fragment)" (Электронные измерения обработки одной молекулы ДНК-полимеразой I (фрагментом Кленова)), JACS 135: 7855-7860 (2013); Torella et al. "Identifying molecular dynamics in single-molecule FRET experiments with burst variance analysis" (Идентификация молекулярной динамики в экспериментах FRET с единичной молекулой с помощью вариационного анализа потомства вируса из одной лизированной клетки), Biophysics J. 100: 1568-1577 (2011); Santoso et al. Santoso et al. "Conformational transitions in DNA polymerase I revealed by single-molecule FRET" (Конформационные переходы ДНК-полимеразы I, обнаруженные с помощью резонансного переноса энергии флуоресценции (FRET) одной молекулой), Proc. Natl. Acad. Sci. USA, 107(2): 715-720 (2010); Markiewicz et al. "Single-molecule microscopy reveals new insights into nucleotide selection by DNA polymerase I" (Микроскопия единичной молекулы приводит к новому пониманию выбора нуклеотидов ДНК-полимеразой I), Nucleic Acids Res. 40: 7975-7984 (2012); Gill et al. "DNA Polymerase activity at the single-molecule level" (Активность ДНК-полимеразы на уровне одной молекулы), Biochem. Soc. Trans. 39: 595-599 (2011), и Johnson et al. "Processive DNA synthesis observed in a polymerase crystal suggests a mechanism for the prevention of frameshift mutations" (Поступательный синтез ДНК, наблюдаемый в кристаллах полимеразы, позволяет предложить механизм предотвращения мутаций со сдвигом рамки считывания), Proc. Natl. Acad. Sci. USA 100: 3895-3900 (2003). Любые два остатка или домена, которые по свидетельствам приведенных выше публикаций (или цитируемой в них литературы) изменяют свое относительное положение при действии полимеразы, могут служить точками соединения с нанопорой и соединительной структурой, соответственно, в примере осуществления настоящего изобретения.
В одном из примеров к нанопоре 605 может быть приложено напряжение, например, с помощью измерительной схемы 230 и электродов 231, 232, описанных выше при рассмотрении Фиг. 2А, или измерительной схемы 240 и электродов 241, 242, описанных выше при рассмотрении Фиг. 2В. Репортерная область 614 или удлиненное тело 613 имеет электростатический заряд, который вследствие приложения напряжения приводит к прохождению удлиненного тела 613 через сужение 604, в результате чего репортерная область (области) 614 размещаются внутри или вблизи сужения 604, если первый фрагмент 615 удлиненного тела 613 не связан со вторым фрагментом удлиненного маркера нуклеотида, на который оказывается воздействие. Необязательно, приложенное напряжение может вызывать натяжение удлиненного тела 613, если первый фрагмент 615 удлиненного тела 613 не связан со вторым фрагментом удлиненного маркера нуклеотида, на который оказывается воздействие. Как показано в настоящей работе, если первый фрагмент 615 удлиненного тела 613 связан со вторым фрагментом удлиненного маркера нуклеотида, на который оказывается воздействие, полученный дуплекс может плотно располагаться в сужении или вблизи сужения нанопоры под действием напряжения, приложенного к нанопоре, что приводит к формированию первого сигнального состояния, которое позволяет идентифицировать нуклеотид. Как показано на Фиг. 7D, по мере перемещения белковых доменов полимеразы 605, например, по мере изменения конформации по сравнению с конформацией, представленной на Фиг. 7D, сопутствующие перемещения приводят к воздействию силы на головную область 611, что, в свою очередь, приводит к воздействию силы на удлиненное тело 613, которое передает силу к репортерной области (областям) 614, что приводит к трансляционному перемещению репортерной области (областей)) 614 в отверстии 603, например, к перемещению относительно сужения 604. В результате конформационное изменение полимеразы 650 может быть превращено или преобразовано в подходящее для измерения изменение электрического тока или потока, проходящего через отверстие 603, которое также может быть названо запиранием электрического тока или потока. С помощью второго сигнального состояния может быть обнаружено, комплементарен или не комплементарен нуклеотид, на который оказывается воздействие, следующему нуклеотиду онДНК.
В одном из иллюстративных примеров осуществления репортерную область (области) 614 конструируют с применением модифицированных нуклеотидов. Например, нуклеотиды с отсутствующим азотистым основанием обычно создают снижение величины электрического тока, составляющее 70 пикоАмпер, в отличие от остатков, которые включают такие основания, как dT остатки, которые создают снижение величины электрического тока, составляющее лишь 20 пикоАмпер, в следующих условиях: буфер 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (англ. 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid, сокращенно HEPES) с концентрацией 10 мМ, pH 8,0, 300 мМ KCl, 1 мМ MgCl2, 1 мМ DL-дитиотреитол (англ. DL-dithiothreitol, сокращенно DTT), мутантная пора MspA М2 (D90N, D91N, D93N, D118R, D134R и E139K), напряжение 180 мВ, приложенное к бислою из 1,2-дифитаноил-sn-глицеро-3-фосфохолина (англ. 1,2-diphytanoyl-sn-glycero-3-phosphocholine, сокращенно DPhPC).
Перемещения остатков, лишенных азотистого основания, на расстояния порядка, например, лишь нескольких ангстрем, могут вызывать вполне доступные для обнаружения изменения электрического тока или потока, например, составляющие от одного до десятков пикоАмпер. Поскольку перемещения некоторых полимераз составляют порядка нанометров, и одно основание в соединительной структуре соответствует приблизительно 0,5 нанометрам, предполагают, что перемещения соединительной структуры под влиянием конформационных изменений полимеразы, к которой прикреплена соединительная структура, могут быть заметными и легко преобразуемыми в электрические токи или потоки. Поскольку конкретная конформация полимеразы может зависть от того, комплементарен или некомплементарен нуклеотид, на который воздействует полимераза, следующему нуклеотиду в онДНК, на основании сигнального состояния (состояния электрического тока или потока) может быть установлено комплементарен или некомплементарен этот нуклеотид следующему нуклеотиду в онДНК. Кроме того, поскольку особенности нуклеотида влияют как на величину конформационного изменения, так и на продолжительность пребывания в закрытом состоянии, сигнальное состояние (состояние электрического тока или потока) также потенциально может служить индивидуальным идентификатором нуклеотидов по мере их встраивания, подтверждая, таким образом, идентификацию нуклеотида, установленную в этапе 305 на основании первого сигнального состояния. Например, в некоторых примерах осуществления, таких как примеры, показанные на Фиг. 5 В, идентичность нуклеотида может быть выявлена в соответствии с локализацией репортера 514, который гибридизуется с фрагментом 522. Соответствующий сигнал представлен на Фиг. 6, часть "В." Если имеется точное соответствие, как соответствие, показанное на Фиг. 5С, полимераза может принимать определенную конформацию. Соответствующий сигнал изображен на Фиг. 6, часть "D". Сигналы, представленные на Фиг. 6, части "С" и "D", различаются и могут, соответственно, уникальным образом указывать на соответствие или несоответствие.
Величина и/или временная продолжительность конформационного изменения (изменений) полимеразы может зависеть от конкретного нуклеотида, на который воздействует полимераза. В Таблице 1 приведены примеры кинетических параметров одной молекулы, которые были определены при обработке матриц фрагментом Кленова на основании изменений величины электрического тока при присоединении одностенной (однослойной) углеродной нанотрубки (англ. single-wall carbon nanotube, сокращенно SWNT) к единичной полимеразе; эти данные были опубликованы Olsen et al. В Таблице 1 τlo означает период времени, проведенный полимеразой в закрытой конформации, rlo означает среднюю нормализованную дисперсию для τlo, τhi означает период времени, проведенный полимеразой в открытой конформации, rhi означает среднюю нормализованную дисперсию для τhi, и скорость означает скорость обработки, например, скорость добавления полимеразой нуклеотида к матрице. Olson et al. сообщали, что средняя величина Н представляет собой аппроксимацию степени механического закрытия ферментом. В системах, способах и композициях согласно настоящему изобретению величина Н может рассматриваться как степень конформационного изменения при переходе между двумя точками привязки, находящимися на полимеразе, измеренного в единицах длины. Например, Н может соответствовать величине механического закрытия, на которое влияет соответствие или несоответствие нуклеотида.
В композициях, способах и системах согласно изобретению сигнал, который соотносится с временной продолжительностью открытого состояния Thi, величиной конформационного изменения Н и скоростью обработки, может быть применен для указания комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду онДНК, и потенциально сигналы могут различаться в соответствии с уникальными характеристиками каждого основания. Скорости встраивания также могут сильно изменяться в результате селективного применения модифицированных нуклеотидов, таких как альфа- или гамма-тиолнуклеотиды. См., например, опубликованную патентную заявку US 2011/0312529, Не et al., содержание которой полностью включено в настоящее описание посредством ссылки.
В одном из иллюстративных примеров осуществления матричная ДНК закольцована, и полимераза 650 представляет собой полимеразу, вытесняющую цепь (такую как Phi29). Таким образом, матрица может быть подвергнута секвенированию множество раз в режиме катящегося кольца, известном в данной области техники. В таком примере осуществления также может замедляться непланируемое протягивание матричной ДНК в сужение 604 или через сужение 604, поскольку перемещаться может только онДНК. Ожидается, что любая случайная онДНК, которая может проникать через сужение 604 (или в случае применения неразветвленной матрицы), быстро проходит через пору и выдает сигнал в виде шума. В альтернативном варианте может быть применена одна или более положительно заряженные репортерные области 614 при обратной полярности - в этом случае только репортерная область (области) затягивается в сужение 604, в то время как отрицательно заряженные ДНК отталкиваются.
В некоторых примерах осуществления полимераза 650 может быть присоединена, например, закреплена у входа биологической поры 605. Это может быть осуществлено, например, с помощью связывания (конъюгирования)с применением цистеина/тиола. Такое связывание может обеспечивать закрепление полимеразы 650 в воспроизводимой и стабильной ориентации, которая может улучшить превращение конформационного движения полимеразы 650 в трансляционное перемещение репортерной области (областей)) 614. Однако, связывание полимеразы с порой не обязательно. Например, сила, создаваемая соединительной структурой в ответ на приложенное напряжение, может быть достаточной для удержания полимеразы на месте, или для ингибирования отщепления полимеразы от нанопоры к концу хвостовой области соединительной структуры может быть прикреплен другой элемент (например, олигонуклеотид).
Кроме того, следует отметить, что для создания требуемого электрического поля вместо электрического тока постоянного напряжения может быть применен электрический ток быстрого переменного напряжения. Преимущество такого решения состоит в замедлении истощения AgCl электрода и увеличении продолжительности его бесперебойной работы.
Следует отметить, что дуплекс, образуемый фрагментом удлиненного маркера и фрагментом соединительной структуры, может находиться в термодинамическом равновесии. Следует понимать, что находящийся в термодинамическом равновесии дуплекс может иметь скорости ассоциации и диссоциации, зависящие от длины и характера последовательности нуклеиновых кислот, и время от времени дуплекс может диссоциировать. Может быть полезным, если средний период времени, проведенный в состоянии дуплекса (величина, обратная скорости диссоциации), меньше среднего времени жизни комплекса полимераза-нуклеотид в течение события встраивания; таким образом, после встраивания и высвобождения маркера из нуклеотида, маркер отдаляется и не блокирует подход приближающихся нуклеотидных маркеров. Влияние на скорость может быть достаточно сильным и приводить к относительно быстрому повторному связыванию по сравнению со временем жизни комплекса полимераза-нуклеотид, что позволяет обнаруживать событие встраивания, и дуплекс повторно образуется после любого события диссоциации, происходящего во время встраивания нуклеотида. Скорость ассоциации имеет псевдопервый порядок по концентрации удлиненного маркера нуклеотида, что позволяет предложить это явление в качестве стохастического показателя концентрации удлиненного маркера. Следует отметить, что свободно диффундирующие удлиненные маркеры могут иметь относительно низкую концентрацию (например, от 10 нМ до 100 нМ или от 100 нМ до 250 нМ, или от 250 нМ до 500 нМ, или от 500 нМ до 1 ультраМоль), в то время как удлиненный маркер нуклеотида, на который оказывается воздействие, обычно имеет относительно высокую концентрацию, поскольку он связан с нуклеотидом, который удерживается на месте полимеразой во время встраивания и, таким образом, не может свободно диффундировать от места встройки.
В некоторых иллюстративных примерах осуществления, рассмотренных в настоящей работе, удлиненное тело соединительной структуры и удлиненный маркер нуклеотида, на который воздействует полимераза, соответственно могут включать или даже могут состоять только из одноцепочечных ДНК (онДНК). Однако следует понимать, что могут быть применены другие подходящие типы молекул. Например, может быть применена любая подходящая соединительная структура, которая включает удлиненное тело, имеющее один или более следующих признаков и, необязательно, имеющее все перечисленные ниже признаки:
1. Удлиненное тело может включать область, которая взаимодействует с фрагментами, соответственно присоединенными к нуклеотидам различных типов таким образом, что фрагменты можно отличить друг от друга, например, посредством измерения электрического тока или потока, проходящего через сужение поры.
2. Удлиненное тело может включать заряженную область, под действием которой, вызванным приложением напряжения, удлиненное тело протягивается через сужение поры. В такой конфигурации удлиненное тело может находиться в натянутом состоянии. Заряженная область может располагаться вблизи сужения поры, что приводит к возникновению чистой (результирующей) силы.
3. Удлиненное тело может включать одну или более репортерные области, которые формируют ясно различимое сигнальное состояние в зависимости от того, комплементарен или некомплементарен нуклеотид, на который воздействует полимераза, следующему нуклеотиду в последовательности секвенируемого полинуклеотида. Репортерная область (области) и заряженная область могут быть одной и той же областью; таким образом, одна область может одновременно служить и репортерной областью, и заряженной областью. Кроме того, следует понимать, что различные сигнальные состояния, которые могут соответствовать типу нуклеотидов или соответствию или несоответствию нуклеотидов, не обязательно возникают разновременно и в действительности могут возникать одновременно. Например, измеряемый сигнал (например, оптический или электрический) может включать комбинацию из более чем одного сигнального состояния (например, из двух сигнальных состояний), каждое из которых предоставляет информацию о типе нуклеотида и/или соответствии или несоответствии такого нуклеотида.
Примеры материала, который может быть включен в удлиненное тело соединительной структуры или удлиненный маркер нуклеотида, на который оказывается воздействие, или в обе эти структуры, является полимер. Полимеры включают биологические полимеры и синтетические полимеры. Примеры биологических полимеров, подходящих для включения в удлиненное тело соединительной структуры или удлиненный маркер нуклеотида, на который оказывается воздействие, или в обе эти конструкции, включают полинуклеотиды, полипептиды, полисахариды, аналоги полинуклеотидов и аналоги полипептидов. Примеры полинуклеотидов и аналогов полинуклеотидов, подходящих для включения в удлиненное тело соединительной структуры или удлиненный маркер нуклеотида, на который оказывается воздействие, или в обе эти конструкции, включают ДНК, энантиомерную ДНК, РНК, ПНК (пептид-нуклеиновую кислоту), морфолиновые олигонуклеотиды и ЗНК (запертую нуклеиновую кислоту). Пример синтетических полипептидов могут включать заряженные аминокислоты, а также гидрофильные и нейтральные остатки. В некоторых примерах осуществления соединительная структура не представляет собой нуклеиновую кислоту или не включает нуклеотиды. Например, из соединительной структуры могут быть исключены встречающиеся в природе нуклеотиды, не встречающиеся в природе аналоги нуклеотидов или оба эти типа нуклеотидов. Из соединительной структуры могут быть исключены один или более нуклеотидов согласно изобретению или другие нуклеотиды, известные в данной области техники.
Примеры других полимеров, которые могут быть подходящими для включения в удлиненное тело соединительной структуры или удлиненный маркер нуклеотида, на который оказывается воздействие, или в обе эти конструкции, включают синтетические полимеры, такие как ПЭГ (полиэтиленгликоль), ППГ (полипропиленгликоль), ПВС (поливиниловый спирт), ПЭ (полиэтилен), ПЭНП (полиэтилен низкой плотности), ПЭВП (полиэтилен высокой плотности), полипропилен, ПВХ (поливинилхлорид), ПС (полистирол), нейлон (алифатические полиамиды), тефлон (тетрафторэтилен, TEFLON®), термопластические полиуретаны, полиальдегиды, полиолефины, полиэтиленоксиды, сложные эфиры поли-ω-алкеновых кислот, полиалкилметакрилаты и другие полимерные химические и биологические линкеры, такие как материалы, рассмотренные в публикации Hermanson, упомянутой выше. Кроме того, как отмечено выше, фрагменты удлиненного тела соединительной структуры или удлиненный маркер нуклеотида, на который оказывается воздействие, или в обе эти конструкции, могут представлять собой индивидуальные короткие нуклеотидные последовательности, которые взаимодействуют друг с другом. Эти фрагменты могут не взаимодействовать с полимеразой и представлять собой, например, метки РНК, ПНК или ЗНК, морфолиновые олигонуклеотиды или энантиомерную ДНК. Фрагменты не обязательно должны быть получены из того же полимера, что и другие части удлиненного тела соединительной структуры или удлиненный маркер нуклеотида, на который оказывается воздействие. В данной области техники хорошо известно, что удлиненные маркеры могут быть легко присоединены к гамма-фосфату нуклеотидов. Кроме того, в одном из иллюстративных примеров осуществления основания изоG и изоС могут быть включены в удлиненные маркеры нуклеотида и/или в соединительную структуру для ингибирования гибридизации удлиненных маркеров или соединительной структуры с ДНК, подвергаемой секвенированию. Кроме того, для укорачивания вторичной структуры в соединительной структуре могут быть применены другие схемы, например, образование шпильки.
Кроме того, следует отметить, что соединительная структура может включать множество фрагментов, каждый из которых, соответственно, взаимодействует с фрагментом, присоединенным к нуклеотиду заданного типа. В результате взаимодействия фрагмента нуклеотида с соответствующим фрагментом соединительной структуры репортерная область (области) соединительной структуры может перемещаться на соответствующее расстояние, что позволяет идентифицировать соответствующий нуклеотид посредством сигнала, например, посредством электрического тока или потока, проходящего через отверстие поры.
В одном из неограничивающих иллюстративных примеров осуществления пора включает MspA, который может обеспечить удовлетворительное разделение электрических токов или потоков, специфичных для нуклеотида, например, разделение электрических токов или потоков, специфичных для нуклеотида, в 3,5 раза превышающее разделение, обеспечиваемое альфа-гемолизином. Однако следует понимать, что альфа-гемолизин или поры других типов могут быть подходящим образом применены для работы с композициями, системами и способами согласно настоящему изобретению.
Кроме того, следует отметить, что в тех примерах осуществления, в которых к поре прикладывают напряжение, и перемещения репортерной области (областей)) определяют с помощью измерения электрического тока или потока, протекающего через пору, подходящее напряжение может быть создано как постоянным электрическим током (DC), так и переменным электрическим током (АС). Применение переменного электрического тока может увеличивать срок службы электрода и способствовать выбрасыванию отщепленных удлиненных маркеров из поры, если маркеры в ней застревают. Кроме того, следует отметить, что при использовании положительно заряженной соединительной структуры к поре может быть приложено обратное напряжение смещения, которое препятствует затягиванию подвергаемой секвенированию ДНК в пору. Кроме того, следует отметить, что при использовании положительно заряженной соединительной структуры и положительно заряженных удлиненных маркеров к поре может быть приложено обратное напряжение смещения, препятствующее затягиванию в пору подвергаемой секвенированию ДНК.
Кроме того, может быть применен способ стохастического определения. В такой системе для перемещения гибридизованного дуплекса, расположенного вблизи сужения, может быть применен переменный электрический ток. Например, на Фиг. 4А-4Е схематично представлена композиция, включающая соединительную структуру, прикрепленную к или расположенную вблизи нанопоры, и выполненная с возможностью применения при обнаружении воздействия полимеразы на нуклеотид с использованием соединительной структуры, прикрепленной к или расположенной вблизи нанопоры, в ответ на изменение электрического потенциала, приложенного к нанопоре, и на Фиг. 4F представлен пример сигнала, который может быть сформирован при применении такой композиции.
Композиция, представленная на Фиг. 4А, включает нанопору 400, включающую первую сторону, вторую сторону, отверстие, проходящее через первую и вторую стороны, и сужение, расположенное между первой и второй сторонами (компоненты нанопоры 400 специальным образом не отмечены, но могут быть аналогичны компонентам, показанным на Фиг. 7C-7D); долговременную соединительную структуру 410, включающую головную область, прикрепленную к первой стороне нанопоры 400, хвостовую область, которая необязательно соединена с другим элементом 460 (например, олигонуклеотидом), который затрудняет отщепление полимеразы 430 от нанопоры 400, и удлиненное тело, которое включает одну или более репортерных областей 414 и первый фрагмент 415 (другие компоненты соединительной структуры 410 специальным образом не отмечены, но могут быть аналогичны компонентам, показанным на. 7C-7D); и полимеразу 430. Как показано на Фиг. 4А, если полимераза 430 не находится в процессе воздействия, то полимераза может находиться в открытом состоянии. Сигнал, показанный на Фиг. 4F, расположенный под Фиг. 4А, включает состояние электрического тока или потока, соответствующее расположению репортерной области (областей) 414 на участке, характерном для открытого состояния полимеразы 430, при приложенном к нанопоре 400 положительном напряжении, например, +180 мВ, где +180 мВ составляет 0 мВ на первой стороне нанопоры и +180 мВ на второй стороне нанопоры.
Композиция, представленная на Фиг. 4В, дополнительно включает нуклеотид 420, включающий удлиненный маркер 421, который включает второй фрагмент 422. Полимераза 430 воздействует на нуклеотид 420, что вызывает изменение конформации полимеразы 430, которая переходит в закрытое состояние, такое, как показано на Фиг. 4В. Сигнал, представленный на Фиг. 4F под Фиг. 4В, показывает состояние электрического тока или потока, соответствующее расположению репортерной области (областей) 414 на участке, характерном для закрытого состояния полимеразы 430, при приложении к нанопоре 400 положительного напряжения, например, +180 мВ. Следует отметить, что при положительном напряжении первый фрагмент 415 может быть расположен на той стороне нанопоры 400, которая противоположна расположению фрагмента 422 нуклеотида 420, что затрудняет образование дуплекса между фрагментом 415 и фрагментом 422 при приложении положительного напряжения. Следует отметить, что фрагмент 415 может располагаться в любом подходящем участке удлиненного маркера соединительной структуры 410, например, может располагаться между хвостовой областью и репортерной областью (областями) 414 так, как показано на Фиг. 4А, или может располагаться вблизи головной области, вблизи хвостовой области, вблизи репортерной области или между головной областью и репортерной областью (областями) 414.
Как показано на Фиг. 4С, взаимодействие между фрагментом 422 нуклеотида 420 и фрагментом 415 соединительной структуры 410 при напряжении обратной полярности может приводить к образованию дуплекса 423, например, при отрицательном напряжении, приводящем к тому, что оба фрагмента 415 и 422 располагаются на одной стороне нанопоры 400. Сигнал, представленный на Фиг. 4F под Фиг. 4С, показывает состояние электрического тока или потока, соответствующее положениям репортерной области (областей)) 414 и дуплекса 423 при приложенном к нанопоре 400 отрицательном напряжении, например, -180 мВ, где -180 мВ составляет 0 мВ на первой стороне нанопоры и -180 мВ - на второй стороне нанопоры. В зависимости от того, на каком участке соединительная структура присоединена к полимеразе, положение репортерной области 414 может быть подходящим для распознавания соответствия или несоответствия нуклеотидов аналогично тому, что описано в публикациях Freudenthal, упомянутых выше.
Как показано на Фиг. 4D, при перемене знака напряжения на положительный, например, +180 мВ, дуплекс 423 может застревать или располагаться вблизи сужения нанопоры. Сигнал, представленный на Фиг. 4F под Фиг. 4D, показывает состояние электрического тока или потока, соответствующее положению дуплекса 423, а также конкретным фрагментам, составляющим дуплекс 423, при приложении к нанопоре 400 положительного напряжения, например, +180 мВ. Если фрагмент 422 выбран таким образом, что он соответствует одному типу нуклеотида, то сигнал может быть использован для определения того нуклеотида, на который воздействует полимераза 430. Следует отметить, что дуплекс 423, образованный фрагментом 415 и фрагментом 422, может быть достаточно крупным, что затрудняет перемещение дуплекса через сужение.
Как показано на Фиг. 4Е, при непрерывном действии положительного напряжения, например, +180 мВ, дуплекс 423 может диссоциировать. Эта диссоциация может рассматриваться как "разрыв" дуплекса 423, образованного фрагментом 415 и фрагментом 422. В некоторых примерах осуществления фрагмент 415 может перемещаться через сужение и затем располагаться на второй стороне нанопоры 400. В части Фиг. 4F, расположенной непосредственно под Фиг. 4Е, показан пример электрического тока или потока, проходящего через отверстие при положительном напряжении после отщепления фрагмента 415 от фрагмента 422. Сигнал, представленный на Фиг. 4F под Фиг. 4Е, показывает состояние электрического тока или потока, соответствующее расположению репортерной области (областей) 414 на участке, характеризующем закрытое состояние полимеразы 430, при приложении к нанопоре 400 положительного напряжения, например, +180 мВ. Фрагмент 422 может быть сконструирован таким образом, что он остается на первой стороне нанопоры 400, даже если фрагмент 415 переходит на вторую сторону нанопоры 400, что временно затрудняет взаимодействие между фрагментами 415 и 422. Как показано на Фиг. 4С, после диссоциации напряжение, приложенное к отверстию 403, вновь может быть изменено, например, может быть возвращено к первому значению напряжения, вследствие чего фрагменты 415 и 422 могут вновь взаимодействовать друг с другом с образованием дуплекса 423.
Следует понимать, что сигналы, соответствующие относительному положению репортерной области (областей)) 414, дуплекса 423 и определенных фрагментов, составляющих дуплекс 423, могут быть доступны для обнаружения любыми подходящими средствами. Например, композиция может находиться в рабочем соединении с измерительной схемой, такой как схема, описанная выше при рассмотрении Фиг. 2А или Фиг. 2В. Измерительная схема может быть выполнена с возможностью обнаружения электрического тока или потока, проходящего через отверстие нанопоры 400, который может изменяться с течением времени в зависимости от конформационного состояния полимеразы 430 и в зависимости от типа фрагмента 422 конкретного нуклеотида 420, на который воздействует полимераза 430. В одном из иллюстративных примеров осуществления нанопора 400, соединительная структура 410, полимераза 430 и нуклеотид 420 могут быть погружены в проводящую текучую среду, например, водный раствор соли. Измерительная схема, сконструированная аналогично измерительной схеме 230, показанной на Фиг. 2А, или измерительной схеме 240, показанной на Фиг. 2В, может находиться в соединении с первым и вторым электродами и может быть выполнена с возможностью создания первого напряжения между этими электродами, в результате чего к нанопоре 400 прикладывается напряжение, что показано знаками "+" и "-" на Фиг. 4А, а также для измерения величины электрического тока или потока, проходящего через отверстие 403 при первом напряжении, с помощью имеющихся в схеме электродов. Например, на части Фиг. 4F, находящейся непосредственно под Фиг. 4А, представлен пример электрического тока или потока, проходящего через отверстие нанопоры 400 при первом напряжении. Свойство репортерной области 414 блокировать электрический ток или поток может отличаться от блокирующих свойств некоторых или всех остальных областей удлиненного тела соединительной структуры (явным образом не отмечены). Например, репортерная область (области) 414 может иметь электростатический заряд, в то время как некоторые или все остальные области удлиненного тела могут иметь другие электростатические заряды или могут не иметь заряда (например, могут быть электрически нейтральными). Или, например, репортерная область (области) 414 может не иметь заряда, в то время как некоторые или все остальные области удлиненного тела могут иметь электростатический заряд. В одном из иллюстративных неограничивающих примеров удлиненное тело соединительной структуры включает полинуклеотид, который включает один или более нуклеотидов с отсутствующим азотистым основанием, которые составляют репортерную область (области) 414. Величина электрического тока или потока, протекающего через отверстие нанопоры 400, может претерпевать доступные для измерения изменения, зависящие от относительного расположения репортерной области (областей)) 414 в отверстии 403, относительного расположения дуплекса 423 и фрагментов, составляющих дуплекс 423, на основании чего может быть определено конформационное состояние полимеразы 430 и действие полимеразы 430.
Следует отметить, что в некоторых примерах осуществления выбирают подходящее сочетание соответствующих длины удлиненного тела соединительной структуры и линкера, связывающего нуклеотид и удлиненный маркер, соответствующих локализаций фрагментов 415 и 422 и соответствующей локализации репортерной области (областей)) 414 с целью снижения или предотвращения воздействия на нуклеотид 420 силы во время воздействия на нуклеотид полимеразы 430, что позволяет избежать воздействия на полимеразу силы, модифицирующей полезные свойства полимеразы. В одном из иллюстративных примеров осуществления взаимодействие между фрагментом 415 и фрагментом 422 приводит к образованию дуплекса 423. Сочетание длины удлиненного тела соединительной структуры и расположения фрагмента 415 в удлиненном теле может быть выбрано таким образом, чтобы этот фрагмент 415 мог проходить через сужение нанопоры 400 при приложении подходящего напряжения, что может приводить, например, к отщеплению фрагмента 415 от фрагмента 422. Размер дуплекса 423 может затруднять перемещение дуплекса через сужение нанопоры 400 и может экранировать нуклеотид 420 от воздействия сил, которые в противном случае могли бы воздействовать на нуклеотид 420 через удлиненный маркер 421. В одном из иллюстративных примеров осуществления репортерная область (области) 414 расположена в подходящих участках удлиненного тела соединительной структуры 410, так что при отщеплении фрагментов 415 и 422 друг от друга под действием положительного напряжения, репортерная область (области) 414 располагается в или вблизи сужения нанопоры 400.
Согласно другому иллюстративному примеру, на Фиг. 5A-5D схематично представлена композиция, включающая соединительную структуру, прикрепленную к или расположенную вблизи нанопоры, и выполненная с возможностью применения в целях обнаружения воздействия полимеразы на нуклеотид при помощи соединительной структуры, прикрепленной к или расположенной вблизи нанопоры, вследствие изменения электрического потенциала, прикладываемого к нанопоре, и на Фиг. 6 представлены примеры сигналов, которые могут быть сформированы при использовании такой композиции.
Композиция, представленная на Фиг. 5А, включает нанопору 500, включающую первую сторону, вторую сторону, отверстие, проходящее через первую и вторую стороны, и сужение, расположенное между первой и второй сторонами (компоненты нанопоры 500 явным образом не отмечены, но могут быть аналогичны компонентам, показанным на Фиг. 7C-7D); долговременную соединительную структуру 510, включающую головную область, прикрепленную к первой стороне нанопоры 500, хвостовую область, которая необязательно соединена с другим элементом 560 (например, олигонуклеотидом), который затрудняет отщепление полимеразы 530 от нанопоры 500, и удлиненное тело, которое включает одну или более репортерных областей 514 и первый фрагмент 515 (другие компоненты соединительной структуры 510 специальным образом не отмечены, но могут быть аналогичны компонентам, показанным на. 7C-7D); нуклеотид 520, включающий удлиненный маркер (не помечен), который включает второй фрагмент 522; и полимеразу 530. Как показано на Фиг. 5А, если полимераза 530 не находится в процессе воздействия на нуклеотид 520, то полимераза может находиться в открытом состоянии или закрытом состоянии, каждое из которых создает уникальный сигнал, относящийся к их несвязанному состоянию. Сигнал, представленный на Фиг. 6 и обозначенный "А" (крупный пунктир), показывает состояние электрического тока или потока, соответствующее расположению репортерной области (областей) 514 на участке, характерном для несвязанных состояний полимеразы 530, под действием положительного напряжения, приложенного к нанопоре 500, например, +180 мВ.
Композиция, представленная на Фиг. 5В, включает полимеразу 530, воздействующую на нуклеотид 520, вследствие чего конформация полимеразы 530 меняется на закрытую. Кроме того, взаимодействие между фрагментом 522 нуклеотида 520 и фрагментом 515 соединительной структуры 510 может приводить к образованию дуплекса 523. Под действием положительного напряжения, например, +180 мВ, дуплекс 523 может застревать в или располагаться вблизи сужения нанопоры 500. Сигнал, представленный на Фиг. 6 и обозначенный "В" (сплошная линия), показывает состояние электрического тока или потока, соответствующее положению дуплекса 523, а также конкретных фрагментов, составляющих дуплекс 523, под действием положительного напряжения, приложенного к нанопоре 500, например, +180 мВ. Если фрагмент 522 выбран таким образом, чтобы он соответствовал нуклеотиду лишь одного типа, то сигнал может позволить идентифицировать нуклеотид, на который воздействует полимераза 530. Следует отметить, что размер дуплекса 523, образованного фрагментом 515 и фрагментом 522, может быть достаточно велик, чтобы затруднять перемещение дуплекса через сужение. В одном из иллюстративных примеров "репортер" для каждого из различных нуклеотидов может включать основания, расположенные непосредственно вблизи дуплекса (например, сразу после последнего основания дуплекса, показанного на Фиг. 5В). Таким образом, в одном из неограничивающих примеров композиция может содержать четыре репортера для идентификации нуклеотидов. Она также может содержать пятый репортер, т.е. репортер 514, обозначенный на изображении кружком. Репортер 514 может быть применен для индикации конформационного состояния полимеразы 530, как показано на Фиг. 5С и 5D. Конформационное состояние полимеразы может зависеть от соответствия или несоответствия нуклеотида, удерживаемого полимеразой.
Например, как показано на Фиг. 5С, вследствие непрерывного приложения положительного напряжения, например, +180 мВ, дуплекс 523 может диссоциировать. Эта диссоциация может рассматриваться как "разрыв" дуплекса 523, образованного фрагментом 515 и фрагментом 522. В некоторых примерах осуществления фрагмент 515 может перемещаться через сужение и затем располагаться на второй стороне нанопоры 500. В части Фиг. 6, обозначенной "С" (мелкий пунктир), показан пример электрического тока или потока, проходящего через отверстие при положительном напряжении после отщепления фрагмента 515 от фрагмента 522. Состояние электрического тока или потока, обозначенное "С", соответствует расположению репортерной области (областей) 514 на участке, характеризующем закрытое состояние полимеразы 530, в котором подходящий (соответствующий) нуклеотид 520 связан с полимеразой, при приложении к нанопоре 500 положительного напряжения, например, +180 мВ.
В этом примере полимераза 530 встраивает нуклеотид 520 в секвенируемый полинуклеотид, отщепляет маркер от этого нуклеотида и затем связывает другой нуклеотид, который может быть комплементарен или некомплементарен следующему нуклеотиду в секвенируемом полинуклеотиде. Например, нуклеотид "Т", показанный на Фиг. 5С, комплементарен следующему нуклеотиду в секвенируемом полинуклеотиде, в то время как нуклеотид "Т", показанный на Фиг. 5D, некомплементарен следующему нуклеотиду в секвенируемом полинуклеотиде. В примере, показанном на Фиг. 5D, при приложении положительного напряжения, например, +180 мВ, полимераза 530 может переходить в уникальную конформацию, которую она принимает только тогда, когда нуклеотид, на который оказывается воздействие, не соответствует следующему нуклеотиду в секвенируемом полинуклеотиде. Это приводит к некоторому смещению репортерной области (областей) 514 в сужении нанопоры 500 относительно положения репортерной области (областей)) 514 в случае соответствия нуклеотида, например, показанном на Фиг. 5С. В части Фиг. 6, обозначенной "D" (мелкий пунктир) показан пример электрического тока или потока, проходящего через отверстие под действием положительного напряжения; при этом полимераза 530 переходит в конформацию, соответствующую несоответствующему нуклеотиду, под действием приложенного к нанопоре 500 положительного напряжения, например, +180 мВ. Следует отметить, что уровень сигнала, обозначенного мелким пунктиром на изображении "D", отличается от уровня сигнала, обозначенного простой пунктирной линией на изображении "С," что позволяет отличать соответствующие нуклеотиды от несоответствующих нуклеотидов. Кроме того, каждому несоответствующему основанию также может соответствовать уникальная конформация полимеразы, формирующая легко отличимые сигнальные состояния.
Следует отметить, что рассмотренные выше состояния не являются ограничивающими и приведены для примера. Могут встречаться другие, отличные от приведенных, доступные для обнаружения состояния. Например, может существовать множество доступных для обнаружения состояний полимеразы в случаях отсутствия нуклеотида, соответствующего таким конфигурациям, как открытая и закрытая, или даже множество состояний, в которых несоответствующий нуклеотид связан с полимеразой, находящейся в открытом или закрытом состоянии.
Следует понимать, что сигналы, соответствующие относительным положениям репортерной области (областей)) 514 и дуплекса 523, а также конкретных фрагментов, образующих дуплекс 523, могут быть доступны для обнаружения любыми подходящими средствами, например, такими как средства, рассмотренные в настоящем описании. Кроме того, следует понимать, что сигнал, указывающий на комплементарность или некомплементарность нуклеотида, на который оказывается воздействие, следующему нуклеотиду в последовательности полинуклеотида, подвергаемого секвенированию, не обязательно должен быть электрическим или оптическим, и на практике этот сигнал может быть сформирован любым подходящим образом.
Кроме того, следует отметить, что диссоциация дуплекса, который, например, может быть образован в результате взаимодействия между первым фрагментом удлиненного тела и вторым фрагментом удлиненного маркера, под действием приложенного напряжения может рассматриваться как первый путь реакции, имеющий две или более характеризующие его константы скорости. Кроме того, указание на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду в последовательности секвенируемого полинуклеотида, проявляющееся, например, в конформационном изменении полимеразы, высвобождении пирофосфата или высвобождении удлиненного маркера нуклеотида, может рассматриваться как второй путь реакции, имеющий свои характеризующие этот путь две или более константы скорости. Статистическое распределение сигналов, измеряемых (например, оптическими или электрическими средствами) при количественных исследованиях первого пути реакции или второго пути реакции, может быть основано на относительных величинах констант скорости соответствующего пути реакции. Например, если данная константа скорости первого пути реакции или второго пути реакции значительно превышает другие константы скорости этого пути реакции, то на кинетику этого пути реакции может главным образом оказывать влияние данная константа скорости, и полученное статистическое распределение сигналов может считаться экспоненциальной функцией. Для сравнения, две или более константы скорости первого пути реакции или второго пути реакции могут быть выбраны таким образом, чтобы их величины были одного порядка, или даже чтобы они по существу совпадали (например, отличались друг от друга множителем, составляющим пять или менее или четыре или менее, или три или менее, или два или менее), так, чтобы ни одна из констант скорости не оказывала преобладающего влияния на кинетику таких путей реакции, и полученное статистическое распределение сигналов может определяться гамма-функцией, в которой по существу равна нулю вероятность событий, происходящих в начальный момент времени, или очень кратковременных событий, которые по существу недоступны для наблюдения. Для сравнения: при экспоненциальном распределении имеется высокая вероятность кратковременных событий или событий, происходящих в начальный момент времени, которые по существу недоступны для наблюдения.
Одна или более констант скорости первого или второго пути реакции могут быть изменены любыми подходящими средствами таким образом, чтобы порядок их величин соответствовал одной или более другим константам скорости этого пути реакции, или даже чтобы их величины по существу равнялись величинам одной или более других констант скорости этого пути. Например, как указано выше, полимераза может быть модифицирована с целью обеспечения задержки высвобождения пирофосфата вследствие встраивания нуклеотида в первый нуклеотид, что приводит к модификации по меньшей мере одной из констант скорости этого пути реакции. В другом примере соединительная структура может дополнительно включать второй фрагмент, который гибридизуется с первым фрагментом с образованием шпилькообразной структуры. Первый и второй фрагменты соединительной структуры могут быть способны диссоциировать с разрушением гибридизации в соответствии с двухэтапным механизмом под действием напряжения, приложенного к нанопоре, что приводит к изменению по меньшей мере одной константы скорости этого пути реакции. Пример нуклеотида, модифицированного тетрафосфатом, содержащего метку и способного образовывать шпилькообразную структуру, представлен на Фиг. 12А. Как показано на Фиг. 12 В, после гибридизации с соединительной структурой образуется "шпилька" (структура в виде шпильки). Предполагается, что шпилька может иметь две константы скорости отрыва, k1 и k2, которые представлены на Фиг. 12В. Конструкция может быть создана таким образом, чтобы эти константы скорости имели близкие величины и при суммировании приводили к образованию гамма-распределения.
Как показано в настоящей работе, различные подходящие композиции могут быть включены в удлиненный маркер нуклеотида или удлиненное тело соединительной структуры или в обе этих конструкции. Такие композиции могут включать ДНК, ПНК, ЗНК, РНК, морфолиновые олигонуклеотиды, ПЭГ (полиэтиленгликоль) и подобные вещества и могут иметь любую подходящую длину. Олигонуклеотидная метка, содержащая подходящим образом модифицированный нуклеотид, может быть присоединена к различным композициям; например, для этой цели идеально подходят предшественники, совместимые со способами клик-химии. В одном из примеров нуклеотид помечен азидом, что облегчает применение меченных алкином олигонуклеотидов, которые могут быть легко синтезированы. Примеры молекул включают меченные тетрафосфатом нуклеотиды, такие как нуклеотиды, представленные ниже, в которых (А) означает азид-P4O13-дТТФ, и (В) означает алкин-P4O13-дТТФ. Эти нуклеотиды могут быть модифицированы любыми требуемыми маркерами с помощью средств стандартной клик-химии:
Ниже приведены публикации, посвященные получению и введению меток в нуклеотиды, содержащие тетрафосфат, содержания которых полностью включены в настоящее описание посредством ссылки:
Kumar, S., A. Sood, J. Wegener, P.J. Finn, S. Nampalli, J.R. Nelson, A. Sekher, P. Mitsis, J. Macklin, C.W. Fuller, "Terminal phosphate labeled nucleotides: synthesis, applications, and linker effect on incorporation by DNA polymerases" (Нуклеотиды с меченным терминальным фосфатом: синтез, применение и линкерный эффект при встраивании под действием ДНК-полимеразы), Nucleosides Nucleotides Nucleic Acids 24(5-7): 401-408 (2005);
Sood, A.,S. Kumar, S. Nampalli, J.R. Nelson, J. Macklin, C.W. Fuller, "Terminal phosphate-labeled nucleotides with improved substrate properties for homogeneous nucleic acid assays" (Нуклеотиды с меченным терминальным фосфатом с улучшенными свойствами подложки для однородных анализов нуклеиновых кислот), J. Am. Chrm. Soc. 127(8): 2394-2395 (2005);
Kumar, S., С. Tao, М. Chien, В. Hellner, A. Balijepalli, J.W. Robertson, Z. Li, J.J. Russo, J.E. Reiner, J.J. Kasianowicz, J. Ju, "PEG-labeled nucleotides and nanopore detection for single molecule DNA sequencing by synthesis" (Меченные ПЭГ нуклеотиды и определение единичной молекулы ДНК при секвенировании синтезом в нанопорах), Sci. Rep. 2: 684 (8 pages) (2012);
Bonnac, L., S.E. Lee, G.T. Giuffredi, L.M. Elphick, A.A. Anderson, E.S. Child, D.J. Mann, V. Gouverneur, "Synthesis and O-phosphorylation of 3,3,4,4-tetrafluoroaryl-C-nucleoside analogues" (Синтез и О-фосфорилирование 3,3,4,4-тетрафторарил-С-нкулеозидных аналогов), Org. Biomol. Слет. 8(6): 1445-1454 (2010); и
Lee, S.Е., L.М. Elphick, A.A. Anderson, L. Bonnac, Е.S. Child, D.J. Mann, V. Gouverneur, "Synthesis and reactivity of novel gamma-phosphate modified ATP analogues" (Синтез и реакционная способность новых аналогов АТФ, модифицированных гамма-фосфатом), Bioorg. Med. Chem. Lett. 19(14): 3804-3807 (2009).
Другие альтернативные примеры осуществления
В то время как выше рассмотрены различные иллюстративные примеры осуществления изобретения, специалистам в данной области техники должно быть понятно, что изобретение охватывает различные изменения и модификации, не выходящие за пределы объема изобретения. Например, несмотря на то, что некоторые композиции, системы и способы были рассмотрены выше на примерах секвенирования таких полинуклеотидов, как ДНК или РНК, следует понимать, что композиции, системы и способы согласно настоящему изобретению могут быть подходящим образом адаптированы для применения при обнаружении события любого типа, например, движения молекулы или ее части, которое может быть связано с присутствием или перемещением репортерной области вблизи сужения нанопоры. Прилагаемые пункты формулы изобретения включают все изменения и модификации, которые не противоречат характеру и объему настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ILLUMINA, INC.
ИЛЛЮМИНА, ИНК.
<120> КОМПОЗИЦИИ, СИСТЕМЫ И СПОСОБЫ СЕКВЕНИРОВАНИЯ ПОЛИНУКЛЕОТИДОВ
С ПРИМЕНЕНИЕМ СОЕДИНИТЕЛЬНЫХ СТРУКТУР, ПРИКРЕПЛЕННЫХ
К ПОЛИМЕРАЗАМ, РАСПОЛОЖЕННЫМ ВБЛИЗИ НАНОПОР
<130> 12957-180-28
<140>
<141>
<150> 62/170,563
<151> 2015-06-03
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 26
<212> DNA
<213> Искусственная последовательность
<220>
<221> source
<223> /note="Описание Искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> modified_base
<222> (12)..(12)
<223> a, c, t или g
<400> 1
tttttttttt tnttttttta tatggg 26
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОДАВЛЕНИЕ ОШИБОК В СЕКВЕНИРОВАННЫХ ФРАГМЕНТАХ ДНК ПОСРЕДСТВОМ ПРИМЕНЕНИЯ ИЗБЫТОЧНЫХ ПРОЧТЕНИЙ С УНИКАЛЬНЫМИ МОЛЕКУЛЯРНЫМИ ИНДЕКСАМИ (UMI) | 2016 |
|
RU2704286C2 |
| ОПОСРЕДОВАННАЯ НУКЛЕАЗОЙ СБОРКА ДНК | 2015 |
|
RU2707911C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717491C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2761432C2 |
| СПОСОБЫ И ПРИБОРЫ ДЛЯ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ ЗАКОДИРОВАННЫХ ГРАНУЛ И БИОЛОГИЧЕСКИХ МОЛЕКУЛ | 2007 |
|
RU2487169C2 |
| СЛОЖНЫЕ КОМПЛЕКСЫ СВЯЗАННОЙ НА ПОВЕРХНОСТИ ТРАНСПОСОМЫ | 2020 |
|
RU2790295C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ОПРЕДЕЛЕНИЯ ЛИГАНДОВ НА МАТРИЦАХ С ИСПОЛЬЗОВАНИЕМ ИНДЕКСОВ И ШТРИХКОДОВ | 2019 |
|
RU2816708C2 |
| ДЕТЕКЦИЯ НУКЛЕОТИДНОЙ ВАРИАЦИИ В НУКЛЕИНОВОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ-МИШЕНИ В АНАЛИЗЕ С РАСЩЕПЛЕНИЕМ И УДЛИНЕНИЕМ ЗОНДИРУЮЩЕГО И МЕТЯЩЕГО ОЛИГОНУКЛЕОТИДА (РТО) | 2013 |
|
RU2620955C2 |
| ДЕТЕКЦИЯ НУКЛЕИНОВОКИСЛОТНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ-МИШЕНЕЙ В АНАЛИЗЕ С РАСЩЕПЛЕНИЕМ И УДЛИНЕНИЕМ РТО | 2012 |
|
RU2566562C2 |
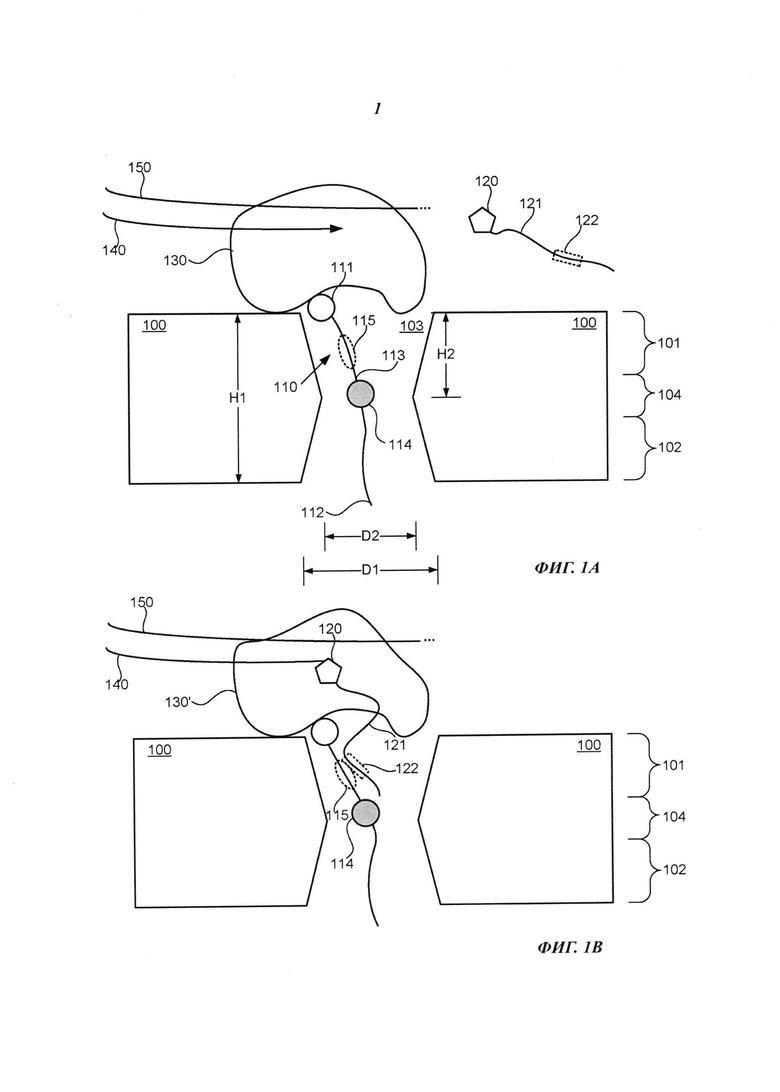
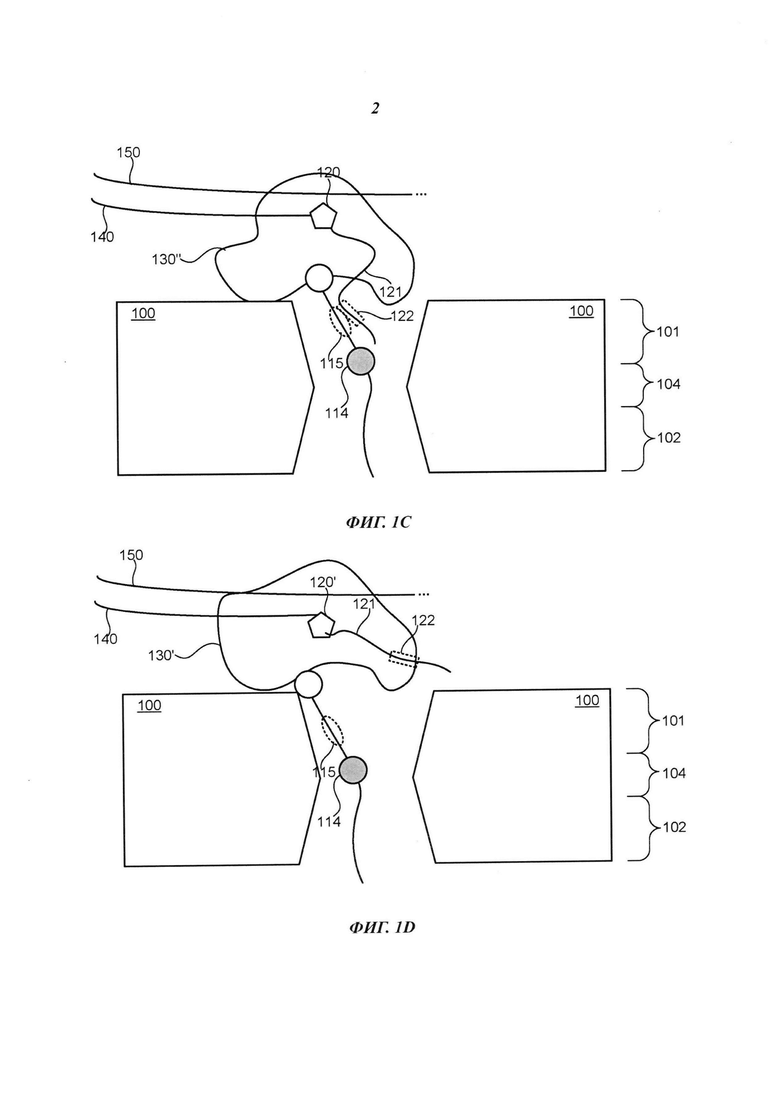
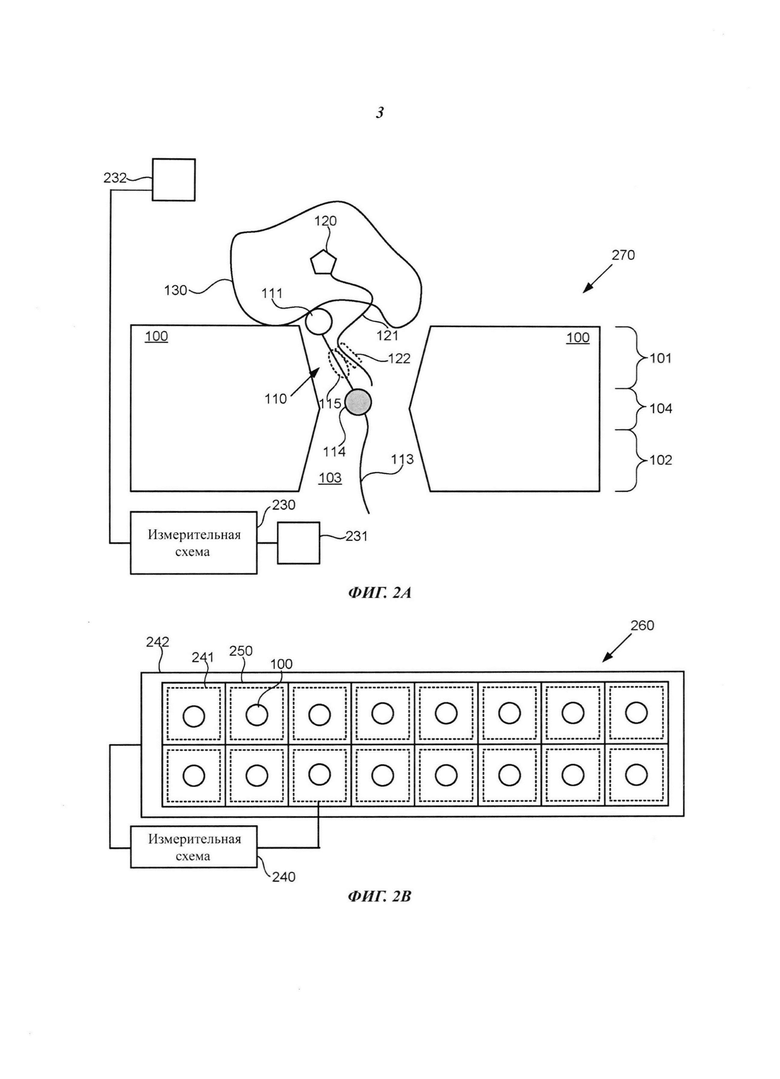
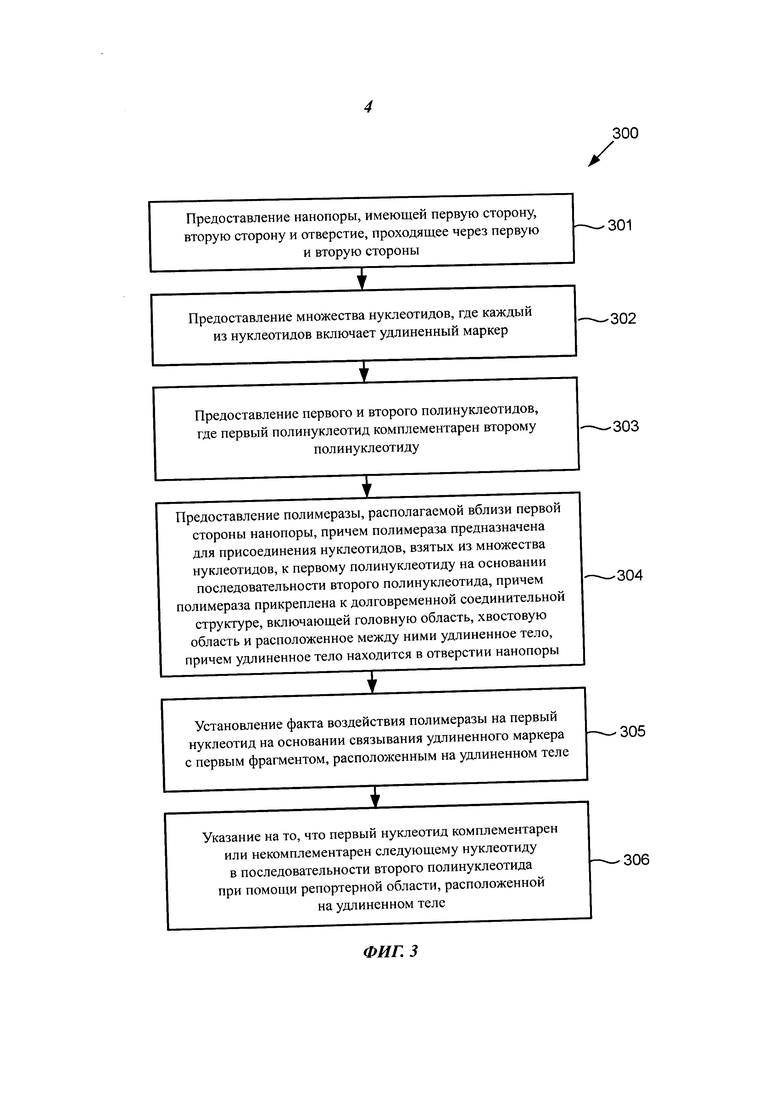
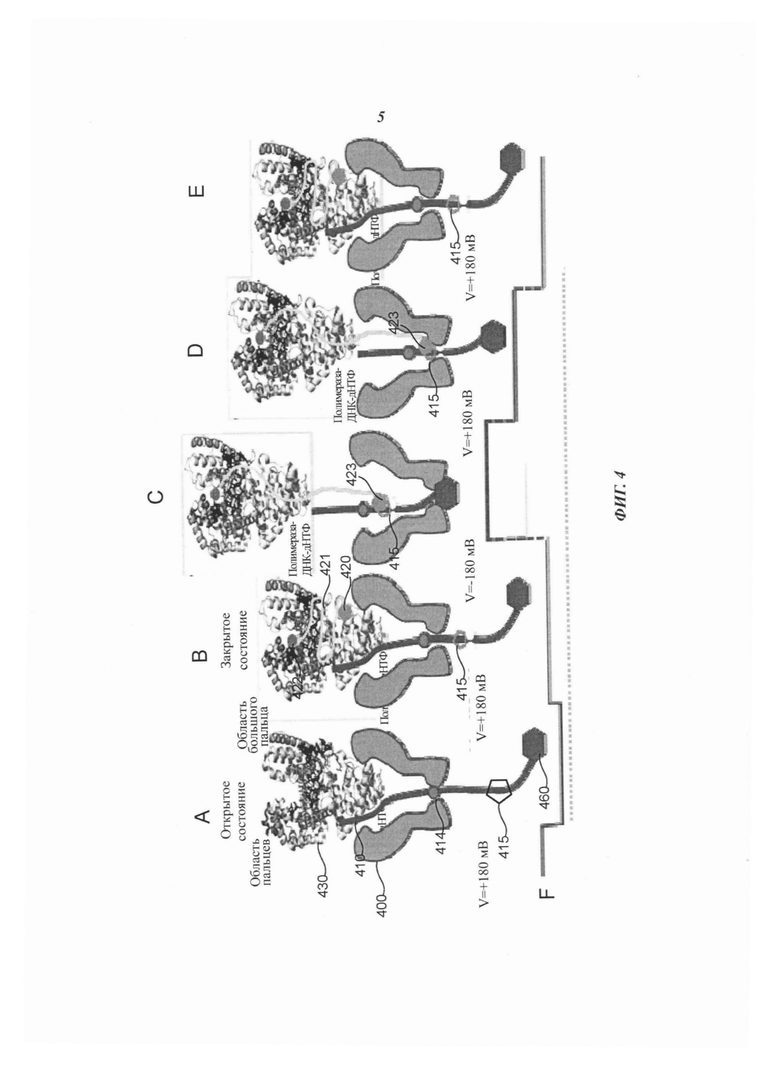
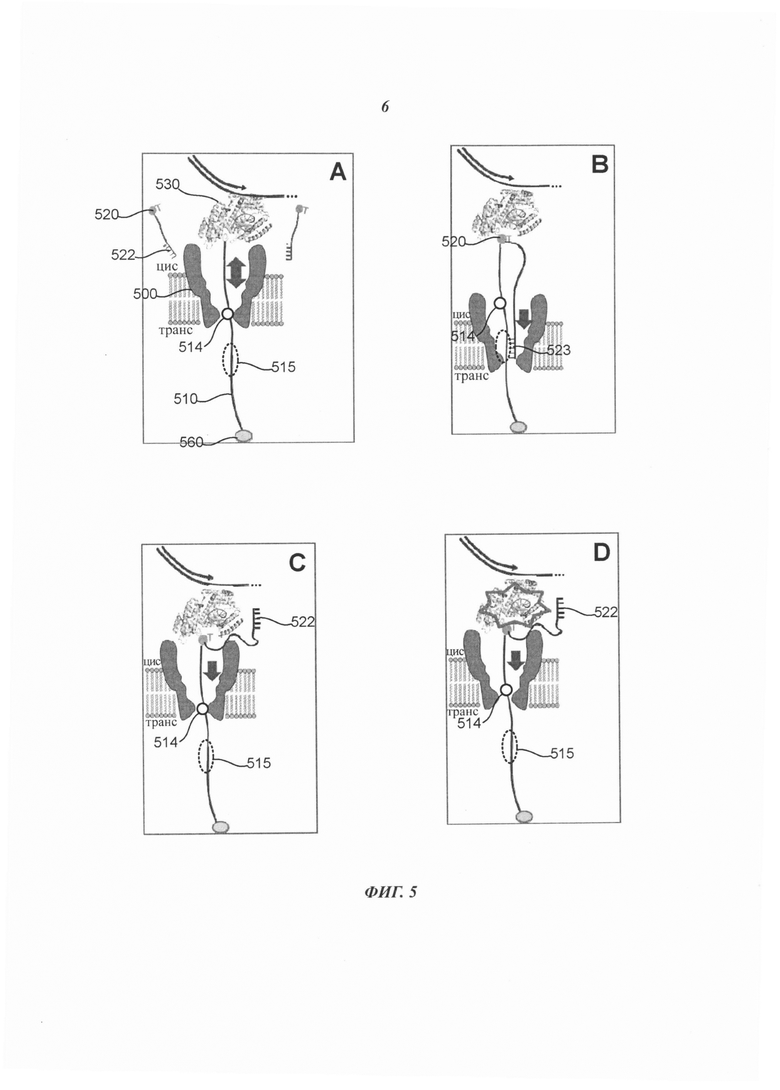
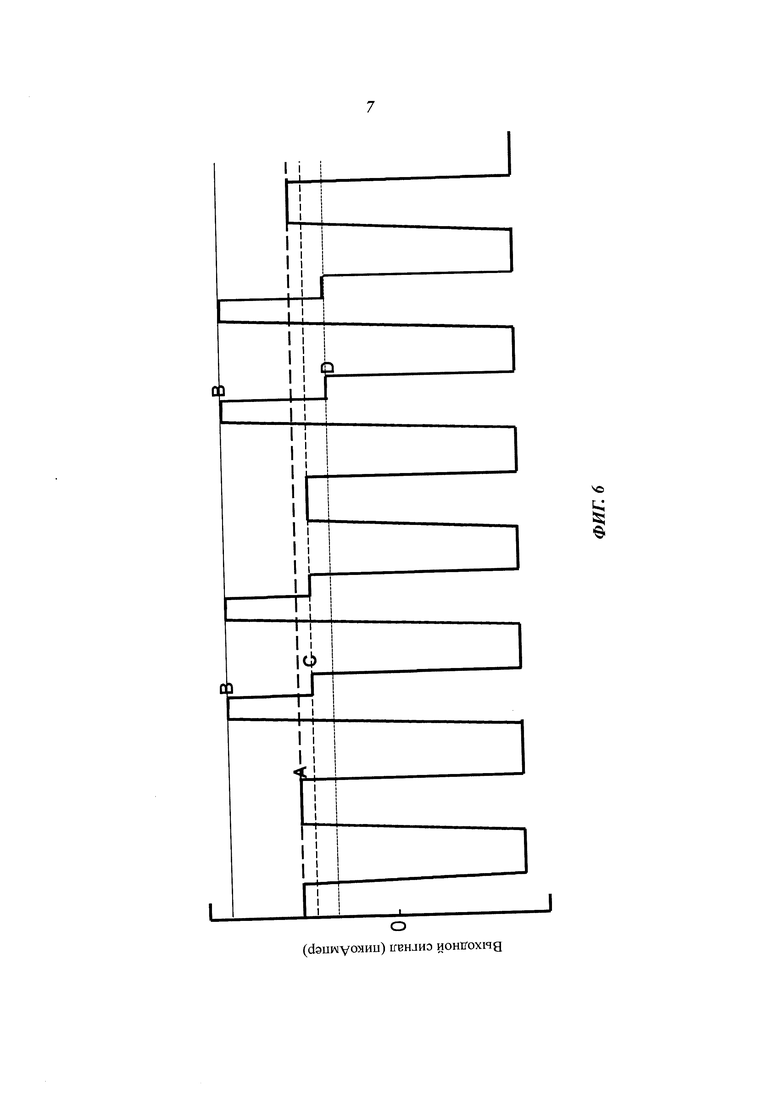
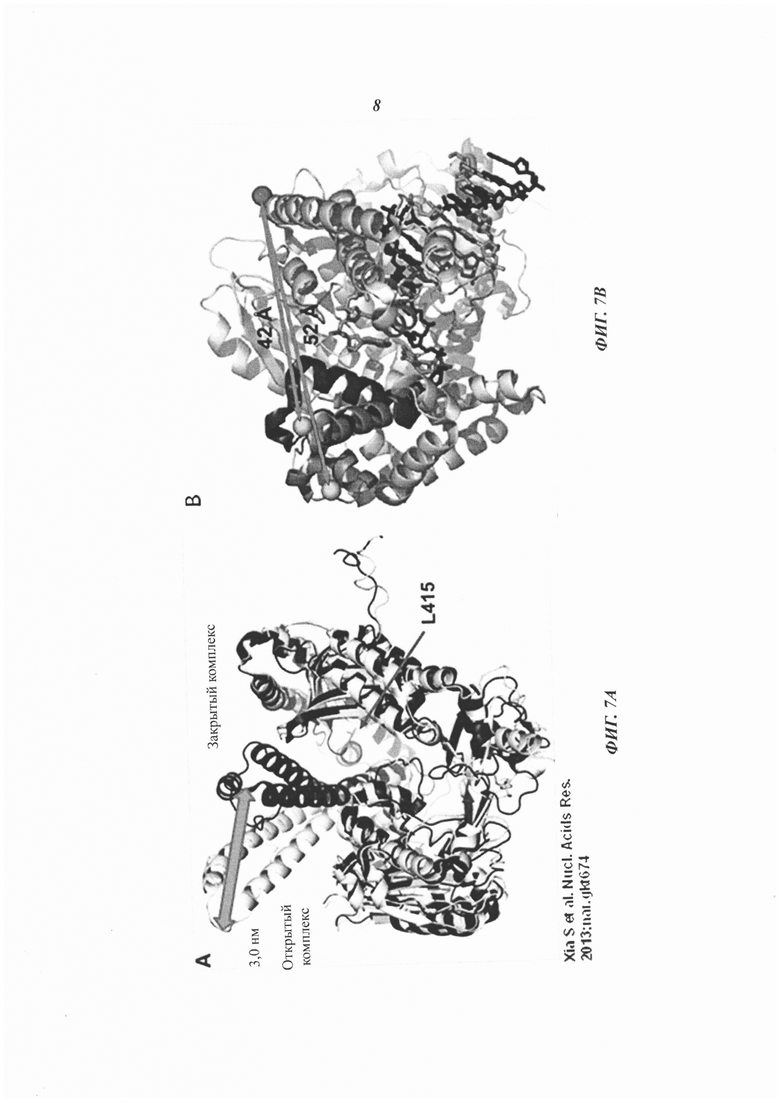
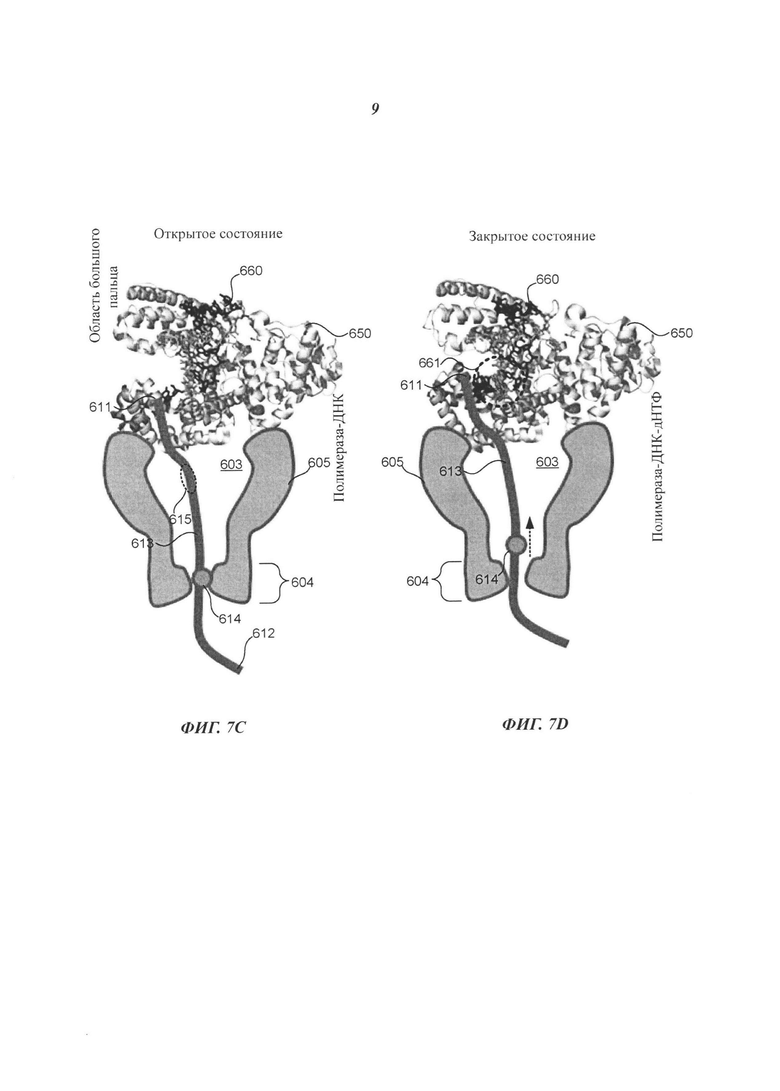
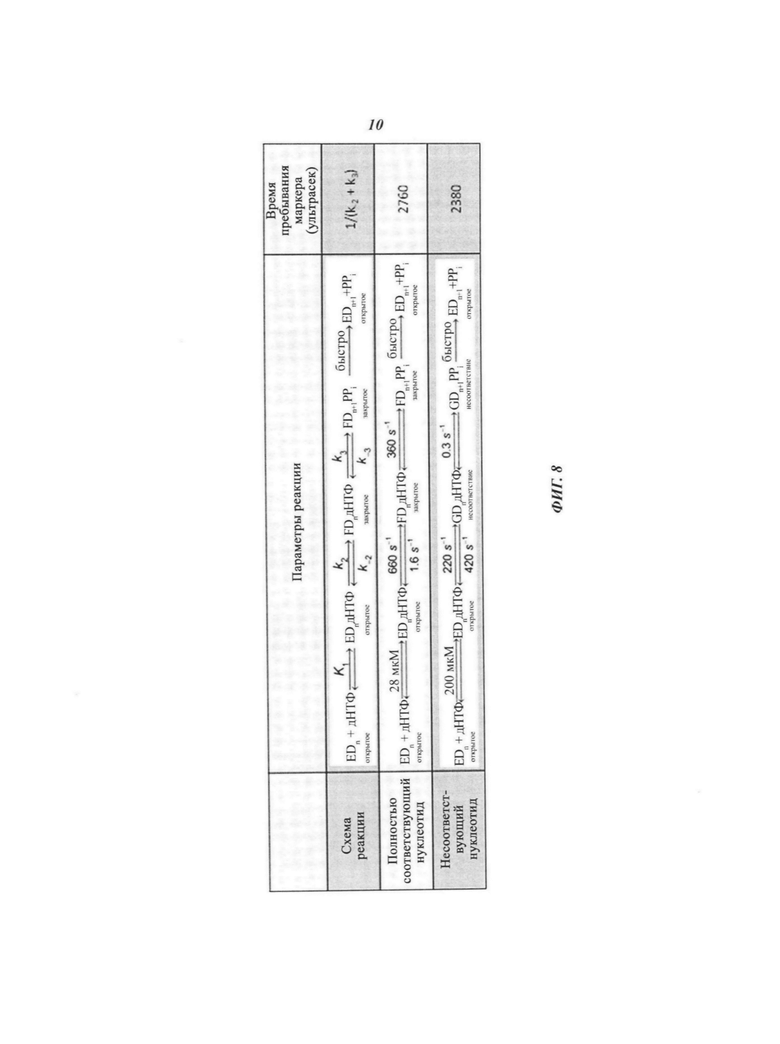
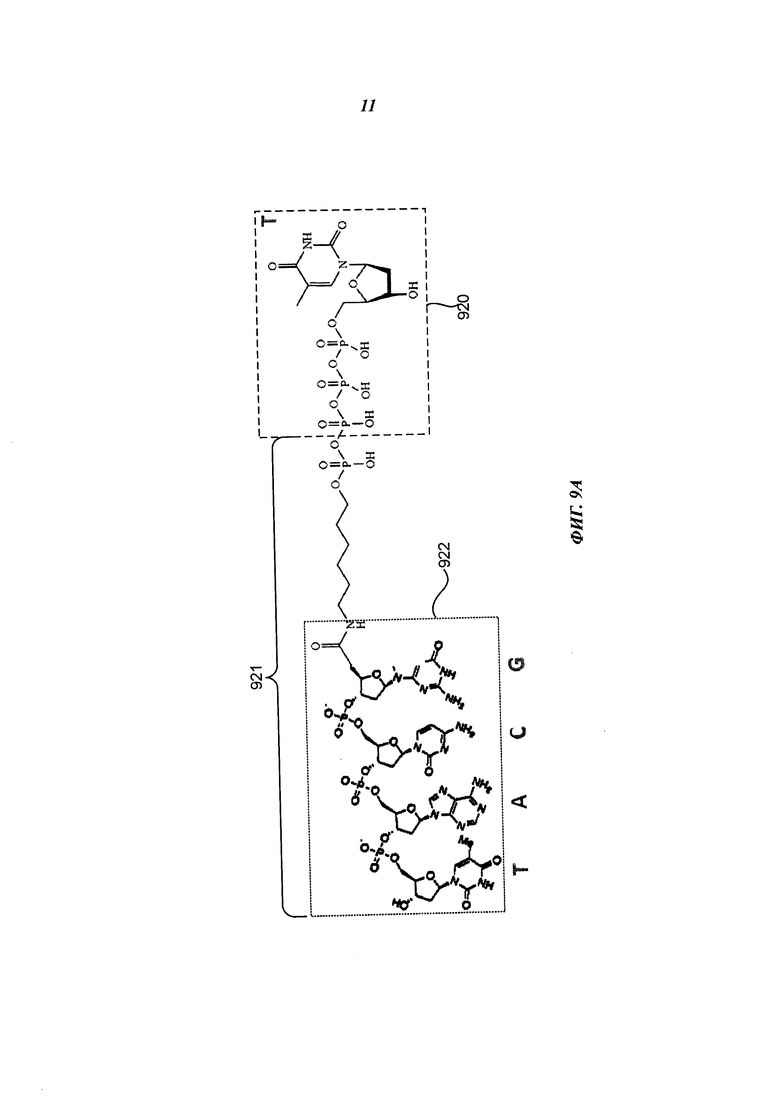
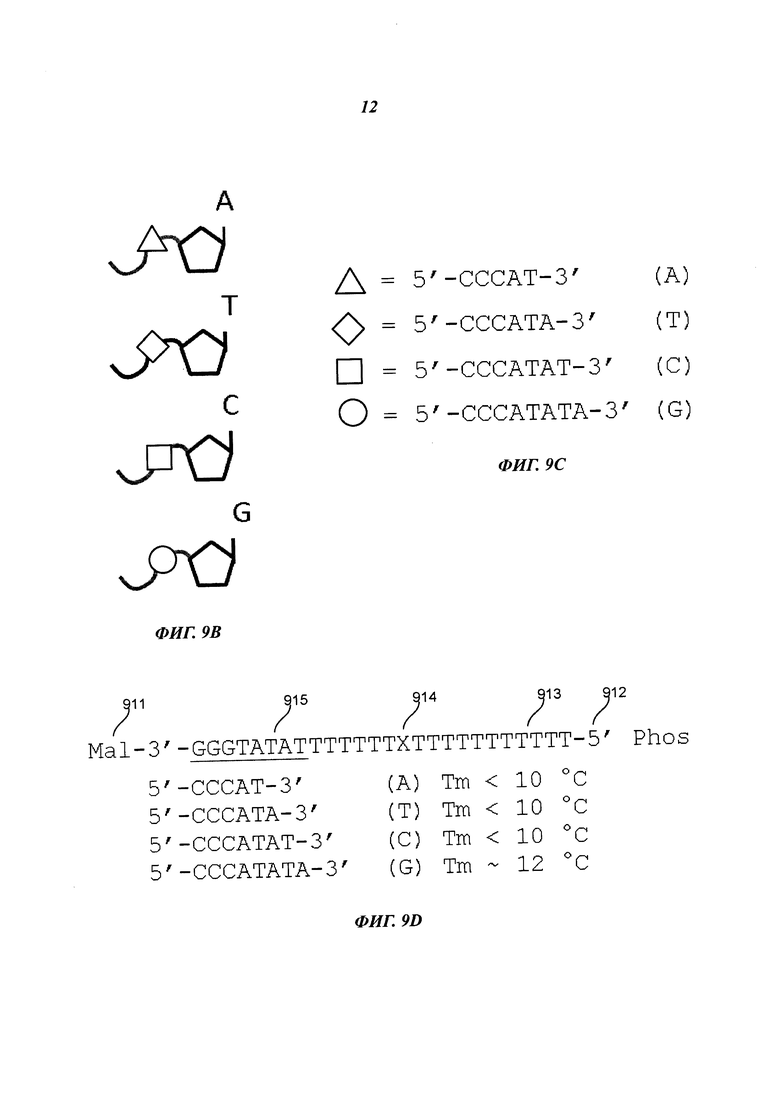
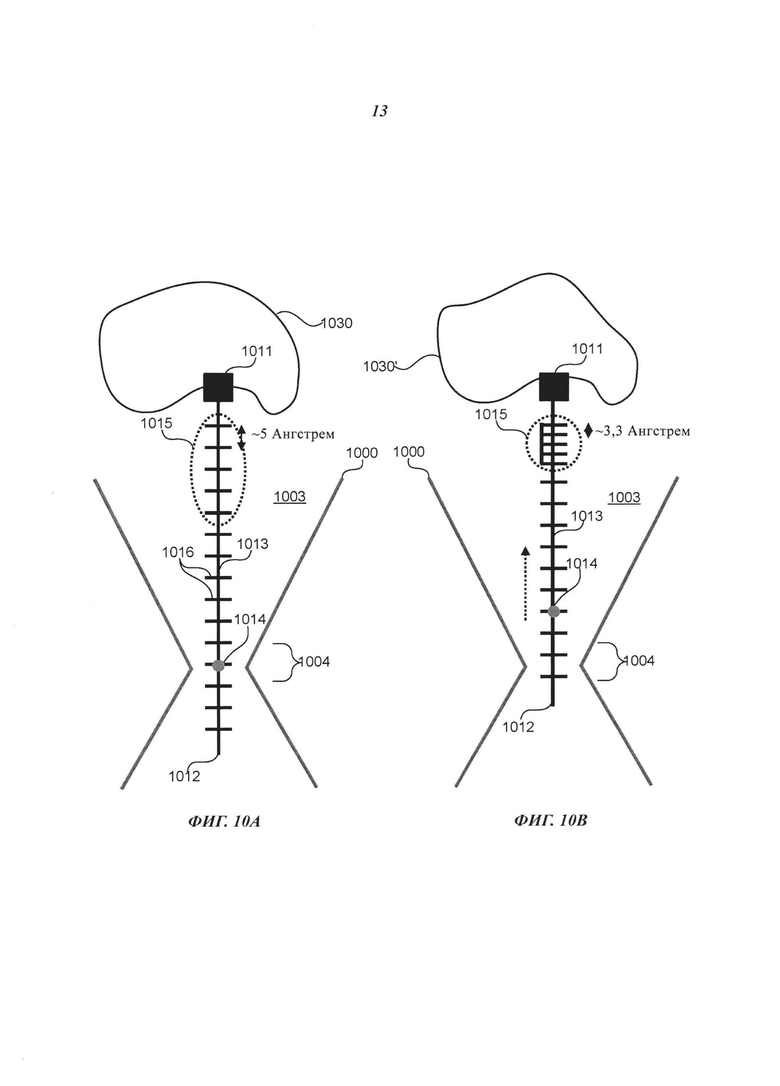
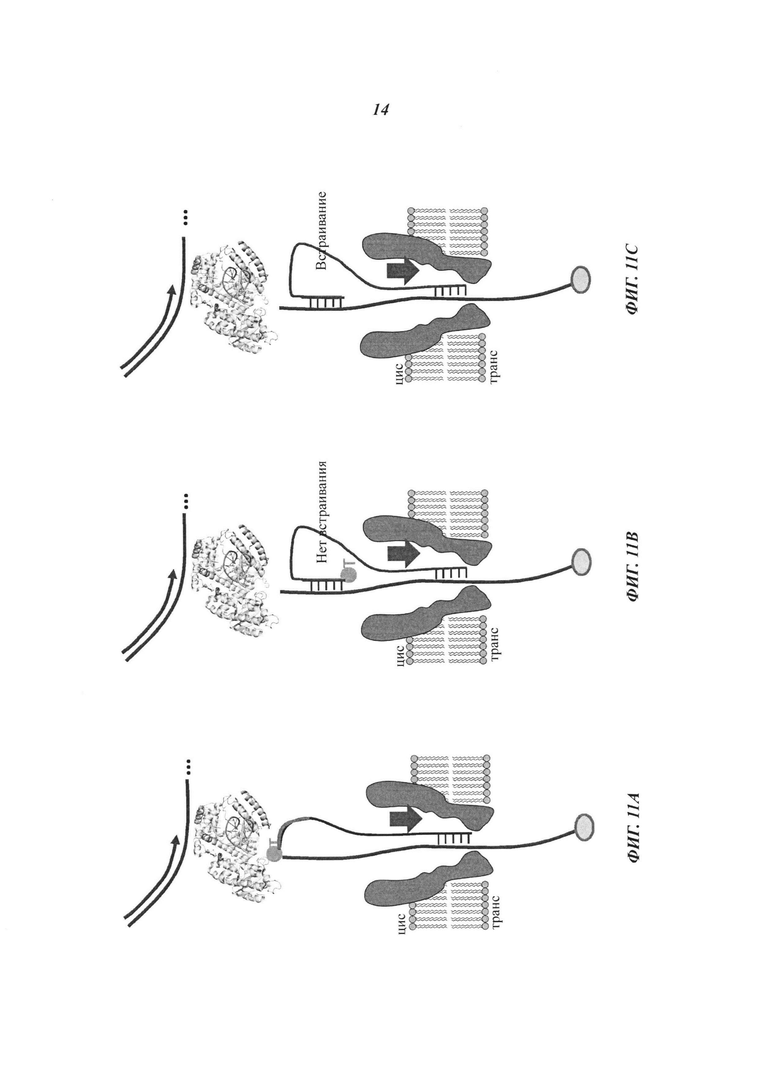
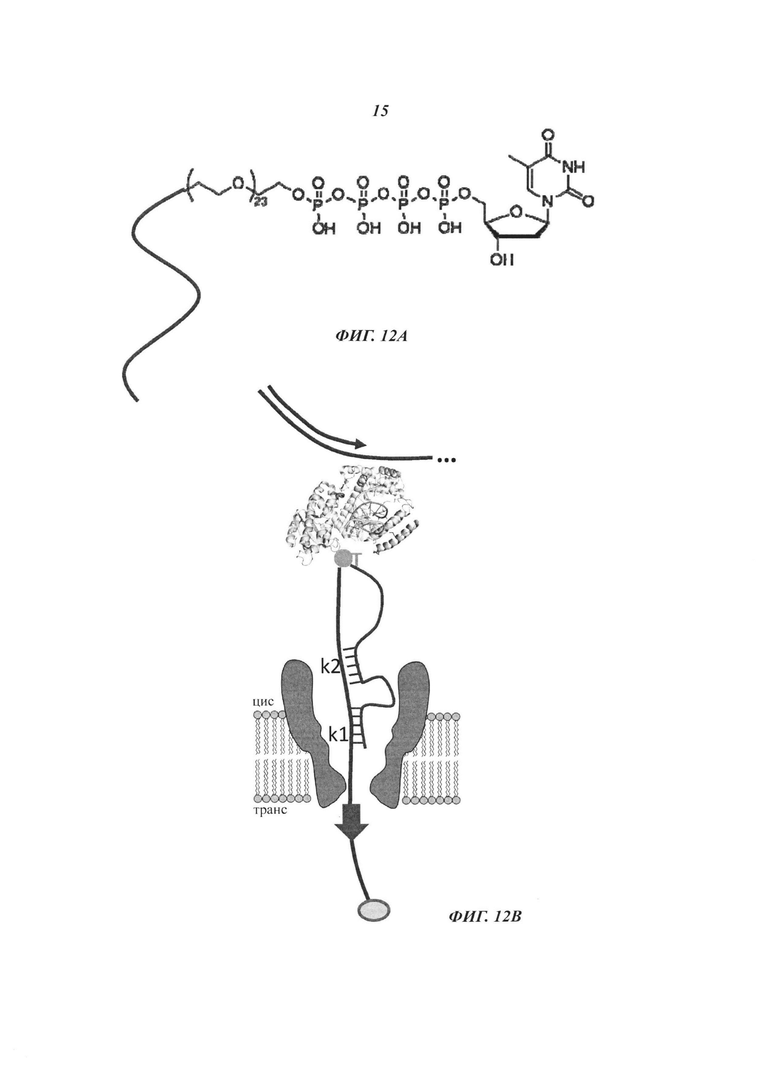
Группа изобретений относится к генетике и может быть использована для секвенирования полинуклеотидов. Для этого используется композиция для секвенирования полинуклеотида, включающая: нанопору; множество нуклеотидов; первый и второй полинуклеотиды; полимеразу; долговременную соединительную структуру; первый фрагмент, расположенный на удлиненном теле; репортерную область. Также используется система для секвенирования полинуклеотидов, включающая композицию, и сам способ секвенирования полинуклеотида. Данная группа изобретений является более надежной, воспроизводимой и чувствительной. 3 н. и 40 з.п. ф-лы, 1 табл., 12 ил.
1. Композиция для секвенирования полинуклеотида, включающая:
нанопору, имеющую первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны;
множество нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер, указывающий на идентичность нуклеотида, при этом удлиненный маркер имеет достаточную длину и достаточно малую ширину для размещения в по меньшей мере части отверстия нанопоры;
первый и второй полинуклеотиды, где первый полинуклеотид комплементарен второму полинуклеотиду, который должен быть секвенирован;
полимеразу, располагаемую вблизи первой стороны нанопоры, причем полимераза выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов, к первому полинуклеотиду на основании последовательности второго полинуклеотида;
долговременную соединительную структуру, включающую головную область, хвостовую область и расположенное между ними удлиненное тело, где головная область закреплена на полимеразе и удлиненное тело находится в отверстии нанопоры;
первый фрагмент, расположенный на удлиненном теле, где первый фрагмент выполнен с возможностью связывания с удлиненным маркером первого нуклеотида, на который воздействует полимераза при секвенировании второго полинуклеотида, при этом связывание первого фрагмента с удлиненным маркером первого нуклеотида указывает на идентичность первого нуклеотида; и
репортерную область, расположенную на удлиненном теле, где репортерная область способна указывать на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида при воздействии полимеразы на первый нуклеотид.
2. Композиция по п. 1, в которой первый фрагмент выполнен с возможностью формирования первого электрического или оптического сигнала в ответ на воздействие полимеразы на первый нуклеотид, который указывает на идентичность первого нуклеотида.
3. Композиция по п. 2, в которой воздействие полимеразы на первый нуклеотид включает связывание полимеразой первого нуклеотида.
4. Композиция по п. 2, в которой репортерная область выполнена с возможностью формирования второго электрического или оптического сигнала, который указывает на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду второго полинуклеотида.
5. Композиция по п. 4, в которой репортерная область выполнена с возможностью формирования второго электрического или оптического сигнала вследствие успешного встраивания первого нуклеотида в первый полинуклеотид под действием полимеразы.
6. Композиция по п. 5, в которой репортерная область выполнена с возможностью формирования второго электрического или оптического сигнала в ответ на высвобождение пирофосфата вследствие успешного встраивания первого нуклеотида в первый полинуклеотид под действием полимеразы.
7. Композиция по п. 6, в которой полимераза модифицирована для обеспечения задержки высвобождения пирофосфата вследствие встраивания первого нуклеотида в первый полинуклеотид.
8. Композиция по п. 7, в которой полимераза включает модифицированную рекомбинантную полимеразу Φ29, B103, GA-1, PZA, Φ15, BS32, M2Y, Nf, G1, Cp-1, PRD1, PZE, SF5, Cp-5, Cp-7, PR4, PR5, PR722 или L17.
9. Композиция по п. 7, в которой полимераза включает модифицированную рекомбинантную ДНК-полимеразу Φ29, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из: замещения аминокислоты в положении 484, замещения аминокислоты в положении 198 и замещения аминокислоты в положении 381.
10. Композиция по п. 7, в которой полимераза включает модифицированную рекомбинантную ДНК-полимеразу Φ29, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из E375Y, K512Y, T368F, A484E, A484Y, N387L, T372Q, T372L, K478Y, 1370W, F198W и L381A.
11. Композиция по п. 2, в которой репортерная область выполнена с возможностью формирования второго электрического или оптического сигнала в ответ на конформационное изменение полимеразы.
12. Композиция по п. 11, в которой величина или временная продолжительность конформационного изменения полимеразы чувствительна к комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду второго полинуклеотида и величина и/или временная продолжительность второго электрического или оптического сигнала зависит от конформационного изменения полимеразы.
13. Композиция по п. 1, в которой удлиненный маркер включает первую нуклеотидную последовательность, а первый фрагмент включает вторую нуклеотидную последовательность, которая комплементарна первой нуклеотидной последовательности.
14. Система для секвенирования полинуклеотида, включающая композицию по п. 13 и дополнительно включающая измерительную схему, выполненную с возможностью определения первого электрического сигнала на основании электрического тока или потока, проходящего через отверстие.
15. Система по п. 14, в которой первый электрический сигнал указывает на идентичность первого нуклеотида.
16. Система по п. 15, в которой измерительная схема дополнительно выполнена с возможностью определения второго электрического сигнала на основании электрического тока или потока, проходящего через отверстие.
17. Система по п. 16, в которой второй электрический сигнал зависит от положения репортерной области внутри отверстия и на основании второго электрического сигнала может быть определено комплементарен или не комплементарен первый нуклеотид следующему нуклеотиду во втором полинуклеотиде.
18. Композиция по п. 1, в которой первый фрагмент и второй фрагмент соединительной структуры способны гибридизоваться друг с другом с образованием шпилькообразной структуры.
19. Композиция по п. 18, дополнительно включающая источник напряжения, выполненный с возможностью создания напряжения между первой и второй сторонами.
20. Композиция по п. 19, в которой первый фрагмент и второй фрагмент соединительной структуры способны подвергаться дегибридизации с отщеплением друг от друга в ответ на воздействие напряжения.
21. Способ секвенирования полинуклеотида, включающий:
(a) предоставление нанопоры, имеющей первую сторону, вторую сторону и отверстие, проходящее через первую и вторую стороны;
(b) предоставление множества нуклеотидов, где каждый из нуклеотидов включает удлиненный маркер, указывающий на идентичность нуклеотида, при этом удлиненный маркер имеет достаточную длину и достаточно малую ширину для размещения в по меньшей мере части отверстия нанопоры;
(c) предоставление первого и второго полинуклеотидов, где первый полинуклеотид комплементарен второму полинуклеотиду, который должен быть секвенирован;
(d) предоставление полимеразы, располагаемой вблизи первой стороны нанопоры, причем полимераза выполнена с возможностью присоединения нуклеотидов, взятых из множества нуклеотидов, к первому полинуклеотиду на основании последовательности второго полинуклеотида и полимераза прикреплена к долговременной соединительной структуре, включающей головную область, хвостовую область и расположенное между ними удлиненное тело, причем удлиненное тело находится в отверстии нанопоры;
(e) определение идентичности первого нуклеотида, на который воздействует полимераза при секвенировании второго полинуклеотида, на основании связывания удлиненного маркера первого нуклеотида с первым фрагментом, расположенным на удлиненном теле; и
(f) с помощью репортерной области, расположенной на удлиненном теле, указание на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду в последовательности второго полинуклеотида при воздействии полимеразы на первый нуклеотид.
22. Способ по п. 21, в котором определение включает формирование первого электрического или оптического сигнала в ответ на воздействие полимеразы на первый нуклеотид, который указывает на идентичность первого нуклеотида.
23. Способ по п. 22, в котором воздействие полимеразы на первый нуклеотид включает связывание полимеразой первого нуклеотида.
24. Способ по п. 23, в котором указание включает формирование второго электрического или оптического сигнала, который указывает на комплементарность или некомплементарность первого нуклеотида следующему нуклеотиду второго полинуклеотида.
25. Способ по п. 24, включающий формирование второго электрического или оптического сигнала в ответ на встраивание первого нуклеотида в первый полинуклеотид под действием полимеразы.
26. Способ по п. 25, включающий формирование второго электрического или оптического сигнала вследствие высвобождения пирофосфата в ответ на встраивание первого нуклеотида в первый полинуклеотид под действием полимеразы.
27. Способ по п. 26, в котором полимераза модифицирована для обеспечения задержки высвобождения пирофосфата вследствие встраивания первого нуклеотида в первый полинуклеотид.
28. Способ по п. 27, в котором полимераза включает модифицированную рекомбинантную полимеразу Φ29, B103, GA-1, PZA, Φ15, BS32, M2Y, Nf, G1, Cp-1, PRD1, PZE, SF5, Cp-5, Cp-7, PR4, PR5, PR722 или L17.
29. Способ по п. 27, в котором полимераза включает модифицированную рекомбинантную ДНК-полимеразу Φ29, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из: замещения аминокислоты в положении 484, замещения аминокислоты в положении 198 и замещения аминокислоты в положении 381.
30. Способ по п. 29, в котором полимераза включает модифицированную рекомбинантную ДНК-полимеразу Φ29, имеющую по меньшей мере одно замещение аминокислоты или комбинацию замещений, выбранных из группы, состоящей из E375Y, K512Y, T368F, A484E, A484Y, N387L, T372Q, T372L, K478Y, 1370W, F198W и L381A.
31. Способ по п. 24, включающий формирование второго электрического или оптического сигнала в ответ на конформационное изменение полимеразы.
32. Способ по п. 31, в котором величина или временная продолжительность конформационного изменения полимеразы чувствительная к комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду полинуклеотида, причем величина и/или временная продолжительность второго электрического или оптического сигнала зависит от конформационного изменения полимеразы.
33. Способ по п. 21, в котором удлиненный маркер включает первую нуклеотидную последовательность, а первый фрагмент включает вторую нуклеотидную последовательность, которая комплементарна первой нуклеотидной последовательности.
34. Способ по п. 33, в котором определение дополнительно включает определение первого электрического сигнала на основании электрического тока или потока, проходящего через отверстие.
35. Способ по п. 34, в котором указанное определение дополнительно включает идентификацию первого нуклеотида на основании первого электрического сигнала.
36. Способ по п. 35, в котором указание включает перемещение репортерной области в отверстии в ответ на воздействие полимеразы на первый нуклеотид.
37. Способ по п. 36, в котором указание дополнительно включает определение второго электрического сигнала на основании электрического тока или потока, проходящего через отверстие.
38. Способ по п. 37, в котором второй электрический сигнал зависит от положения репортерной области внутри отверстия и указание дополнительно включает определение комплементарности или некомплементарности первого нуклеотида следующему нуклеотиду во втором полинуклеотиде на основании второго электрического сигнала.
39. Способ по п. 33, в котором первый фрагмент и второй фрагмент соединительной структуры гибридизуются друг с другом с образованием шпилькообразной структуры.
40. Способ по п. 39, дополнительно включающий создание напряжения между первой и второй стороной.
41. Способ по п. 40, в котором первый фрагмент и второй фрагмент соединительной структуры подвергаются дегибридизации с отщеплением друг от друга в ответ на воздействие напряжения.
42. Способ по п. 21, дополнительно включающий: (g) определение идентичности следующего нуклеотида, на который воздействует полимераза, на основании связывания удлиненного маркера с первым фрагментом, расположенным на удлиненном теле; и (h) с помощью репортерной области, расположенной на удлиненном теле следующего нуклеотида, указание на комплементарность или некомплементарность следующего нуклеотида нуклеотиду, который следует за следующим нуклеотидом в последовательности второго полинуклеотида.
43. Способ по п. 42, дополнительно включающий повторение этапов (g) и (h) при исследовании множества последующих нуклеотидов, которые комплементарны или некомплементарны множеству нуклеотидов, следующих за следующим нуклеотидом.
| US 2013240359 A1, 19.09.2013 | |||
| US 20140134616 A1, 15.05.2014 | |||
| HOWORKA S | |||
| et al | |||
| Sequence-specific detection of individual DNA strands using engineered nanopores //Nature biotechnology | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| С | |||
| СПОСОБ ЭЛЕКТРИЧЕСКОЙ ПЕРЕДАЧИ ИЗОБРАЖЕНИЙ ПРИ ПОМОЩИ СИСТЕМЫ ПАРАЛЛЕЛЬНЫХ ПРОВОДОВ | 1921 |
|
SU636A1 |
| US 20070196846 A1, 23.08.2007. | |||
Авторы
Даты
2020-02-05—Публикация
2016-06-02—Подача