ОБЛАСТЬ ТЕХНИКИ
Примеры осуществления настоящего изобретения относятся к способам и композиции для анализа клеточных компонентов. В некоторых примерах осуществления настоящее изобретение относится к способам и композиции для анализа компонентов единичной клетки. В некоторых примерах осуществления настоящее изобретение относится к способам и композиции для идентификации типа единичной клетки. В некоторых примерах осуществления способы и композиции относятся к секвенированию (определению последовательности) нуклеиновых кислот. Некоторые из приведенных примеров осуществления способов и композиций пригодны для определения составной структуры (англ. composite status) такой единичной клетки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Определение конкретных последовательностей нуклеиновых кислот, имеющихся в биологическом образце, применяют, например, в способе идентификации и классификации микроорганизмов, при диагностике инфекционных заболеваний, при обнаружении и характеристике генетических аномалий, при идентификации генетических изменений, связанных с раковыми заболеваниями, при исследовании генетической предрасположенности к развитию заболевания и для определения ответной реакции на различные типы терапии. Общей методикой определения конкретных последовательностей нуклеиновых кислот в биологическом образце является секвенирование нуклеиновых кислот.
Методика секвенирования нуклеиновых кислот была значительно усовершенствована по сравнению со способами химического разложения, которые применяли Maxam и Gilbert (Максам и Гилберт), и способами удлинения цепи, которые применял Sanger (Сенгер). В настоящее время используются несколько методик секвенирования, которые позволяют осуществлять параллельную обработку всех нуклеиновых кислот в одном прогоне секвенирования. При этом в одном прогоне секвенирования может быть получен огромный объем информации.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 схематично представлено четырехуровневое комбинаторное индексирование элемента, сохраняющего связность ДНК (англ. contiguity preserving element, сокращенно СЕ), полученного при включении содержимого единичной клетки в полимерную матрицу или при его прикреплении к грануле. На каждом этапе (уровне) комбинаторного объединения и перераспределения прикрепляют компартмент-специфичные индексы. В показанном примере в четырех уровнях получают четыре индекса, которые последовательно связаны друг с другом (посредством повторяющихся циклов лигирования (сшивания), полимеразного удлинения, тагментации и т.д.), что облегчает прочтение при секвенировании. В альтернативном варианте сохраняющий связность элемент, включающий ДНК, может быть создан компартментализованным разделением ДНК (т.е. отбором части исходного образца ДНК с разбавлением ДНК), которая была заключена в матрицу или иммобилизована на грануле. Такой тип разбавления удобен при проведении фазирования и сборки.
На Фиг. 2 представлен способ получения библиотек ДНК или кДНК единичной клетки с применением двухуровневой схемы комбинаторного индексирования, в которой индексы первого уровня присоединяют посредством тагментации (компартмент-специфичные индексы в транспозонах), и индексы второго уровня присоединяют посредством проведения ПЦР (компартмент-специфичные индексы на праймерах для ПЦР). Содержимое резервуара единичной клетки (т.е. геномная ДНК или кДНК) может необязательно участвовать в этапе амплификации целого генома (англ. whole genome amplification, сокращенно WGA) или в этапе амплификации целого транскриптома.
На Фиг. 3 представлен способ создания библиотеки кДНК из содержимого единичной клетки в таком СЕ, как капля. В представленном примере индексы используют для создания меток различных образцов.
На Фиг. 4 представлено репрезентативное содержимое единичной клетки, которое может быть проанализировано с помощью предложенной схемы комбинаторного индексирования.
На Фиг. 5А и 5В схематично представлены неограничивающие примеры осуществления, подходящие для создания элементов, сохраняющих связность (СЕ), после инкапсуляции и лизиса содержимого единичной клетки, захваченной в таком СЕ, как полимерная гранула. Клетка заключена, например, в полимерную гранулу. В грануле все компоненты единичной клетки удерживаются рядом друг с другом. Затем один или более компонентов могут быть подвергнуты амплификации, модификации (синтез кДНК) и затем помечены с помощью индексов или меток (тэгов). На Фиг. 5С схематично представлен неограничивающий пример осуществления, в котором индексирование образца может быть выполнено введением метки в кодирующие последовательности ДНК (такие как плазмиды) на стадии инкапсуляции, амплификации/кДНК или полимеризации. Каждый образец получают с различным набором кодирующих плазмид или комбинацией кодирующей плазмиды. В каждом СЕ, прошедшем комбинаторную индексацию, будут образованные соответствующим образом комбинаторно проиндексированные элементы библиотеки, кодирующие образец. Таким образом, для каждого элемента библиотеки может быть отслежен его путь от исходного СЕ и исходного образца.
На Фиг. 6 представлены схемы инкапсуляции содержимого единичной клетки в СЕ, таком как гранулы с полимерной матрицей.
На Фиг. 7 представлены схемы примеров высокоэффективного анализа клеточных компонентов с использованием непосредственного захвата (улавливания) на поверхности. Буквой "А" обозначен набор клеток. Буквой "В" обозначены связанные с поверхностью транспосомы. В этапе "С" клетки транспортируются течением по поверхности. В этапе "D" клетки подвергаются лизису, и компоненты клеток перемещаются за счет контролируемой диффузии в области участка (сайта), которым захвачена клетка. В этапе "Е" транспосомы захватывают нуклеиновые кислоты (происходит тагментация). В зависимости от того, происходит ли лизис клеточной мембраны или ядер, захватываются разные клеточные компоненты. Применение компонент-специфичных улавливающих частиц (т.е. антител, рецепторов, лигандов) позволяет улавливать (захватывать) различные клеточные компоненты. Анализ захваченных молекул может быть проведен непосредственно на улавливающей поверхности. В альтернативном варианте захваченные молекулы могут быть собраны и проанализированы на другой поверхности. В этом случае первая поверхность составлена из множества участков (т.е. блоков), и на каждый блок нанесены олигонуклеотиды, которые имеют идентичный штрих-код, в результате чего молекулы, захваченные на одном блоке, будут иметь одинаковый идентификационный штрих-код.
На Фиг. 8 представлены примеры схем анализа нуклеиновой кислоты с применением элементов, сохраняющих связность, на гранулах.
На Фиг. 9A-D представлен пример стратегии моделирования.
На Фиг. 10 представлен способ получения частиц, подходящих для создания элементов, обеспечивающих связность.
СВЕДЕНИЯ. ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Некоторые аспекты настоящего изобретения относятся к способам и композициям, относящимся к определению компонентов единичной клетки, сохраняемой, или включенной, или содержащейся в элементах, сохраняющих связность (СЕ).
Один из аспектов настоящего изобретения относится к способам анализа множества типов анализируемых веществ (аналитов), получаемых из единичной клетки. В некоторых примерах осуществления предоставлено множество элементов, сохраняющих связность (СЕ), где каждый из СЕ включает единичную клетку. Клетки подвергают лизису внутри СЕ таким образом, что множество анализируемых веществ, находящихся в единичной клетке, высвобождаются в СЕ. В некоторых примерах осуществления предоставлено множество типов репортерных групп, и при этом каждый тип репортерной группы специфичен для каждого типа анализируемого вещества. В некоторых примерах осуществления репортерная группа идентифицирует единичную клетку. Множество анализируемых веществ модифицируют таким образом, чтобы каждый тип анализируемого вещества включал репортерную группу, специфичную для этого типа анализируемого вещества. В некоторых примерах осуществления СЕ, включающие анализируемые вещества, содержащие такие репортерные группы, объединяют. В некоторых примерах осуществления объединенный СЕ, включающий анализируемые вещества, содержащие такие репортерные группы, подвергают компартментализации (разделению на компартменты). В некоторых примерах осуществления обеспечивают наличие дополнительных репортерных групп, которые комбинируют с анализируемыми веществами, включающими анализируемые вещества, таким образом, что анализируемые вещества включают две или более различные репортерные группы. Анализируемые вещества, включающие репортерные группы, анализируют, идентифицируя анализируемое вещество, и при этом репортерная группа идентифицирует источник анализируемого вещества, получаемого из единичной клетки.
В некоторых примерах осуществления примеры множества анализируемых веществ включают, без ограничений, ДНК, РНК, кДНК, белок, липиды, углеводы, клеточные органеллы (например, ядро, аппарат Гольджи, рибосомы, митохондрии, эндоплазматический ретикулюм, хлоропласт, клеточную мембрану и т.д.), продукты метаболизма клетки, срезы тканей, клетки, единичную клетку, содержимое клеток или единичной клетки, нуклеиновую кислоту, извлеченную из клеток или из единичной клетки, или нуклеиновую кислоту, извлеченную из клеток или из единичной клетки и дополнительно модифицированную, или бесклеточную ДНК (например, из плацентарной жидкости или плазмы крови). В некоторых примерах осуществления множество анализируемых веществ включает геномную ДНК и мРНК (информационную или матричную РНК). В некоторых примерах осуществления мРНК имеет "полиаденильный хвост". В некоторых примерах осуществления геномную ДНК и мРНК одновременно иммобилизуют на твердой подложке в СЕ. В некоторых примерах осуществления иммобилизацию геномной ДНК производят после иммобилизации мРНК на твердой подложке. В некоторых примерах осуществления геномную ДНК объединяют с транспосомными комплексами, концы транспозона иммобилизуют на твердой подложке, и мРНК иммобилизуют на твердом носителе посредством гибридизации олигонуклеотидных (dT) зондов, иммобилизованных на твердой подложке. В некоторых примерах осуществления геномную ДНК объединяют с транспосомными комплексами, и концы транспозона необязательно гибридизуют с комплементарными последовательностями, иммобилизованными на твердой подложке таким образом, что мРНК оказываются иммобилизованными на твердом носителе в результате гибридизации олигонуклеотидных (dT) зондов, иммобилизованных на твердой подложке. Для иммобилизации мРНК также могут быть применены другие способы. В некоторых примерах осуществления твердая подложка представляет собой гранулу. В некоторых примерах осуществления твердая подложка представляет собой поверхность проточной ячейки. В некоторых примерах осуществления твердая поверхность представляет собой стенку реакционной емкости.
В некоторых примерах осуществления способы включают секвенирование нуклеиновых кислот, сохраняемых или внедренных или содержащихся в СЕ. В частности, представленные в настоящем описании примеры осуществления способов и композиций относятся к получению матриц нуклеиновых кислот и получению из них данных о последовательностях. Рассмотренные в настоящем описании способы и композиции относятся к способам и композициям, представленным в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки. Некоторые примеры осуществления настоящего изобретения относятся к получению ДНК внутри СЕ для проведения фазирования и получения информации о сборке последовательности от целевой нуклеиновой кислоты (нуклеиновой кислоты-мишени), и для проведения фазирования и получения информации о сборке последовательности от таких матриц. Конкретные примеры осуществления, рассмотренные в настоящем описании, относятся к применению интеграз, например, транспозаз, для поддержания физически близкого расположения ассоциированных концов фрагментированных нуклеиновых кислот и к применению комбинаторного индексирования для создания индивидуальных библиотек для каждого СЕ. Получение гаплотипической информации из СЕ включает распознавание различных аллелей (например, SNP (от англ. Single Nucleotide Polymorphism, что означает однонуклеотидный полиморфизм), генетических аномалий и т.д.) в целевой нуклеиновой кислоте. Такие способы подходят для получения характеристик различных аллелей в целевой нуклеиновой кислоте и снижения вероятности ошибки в информации о последовательности.
В одном из примеров осуществления матричная нуклеиновая кислота может быть разбавлена с образованием таких СЕ, как капли. Необязательно может быть применена амплификация целого генома, и информация о последовательности может быть получена из такого количества матричной нуклеиновой кислоты, которое приблизительно эквивалентно гаплоидному эквиваленту целевой нуклеиновой кислоты.
В других примерах осуществления матричная нуклеиновая кислота может быть компартментализована таким образом, который позволяет создать множество копий хромосомы в одном и том же компартменте в результате проведения в компартменте двойного или множественного индексирования, и при этом может быть определен гаплотип. Другими словами, матричная нуклеиновая кислота может быть получена с использованием виртуальных компартментов. В таких примерах осуществления нуклеиновая кислота может быть распределена между несколькими первыми компартментами с присвоением первого индекса нуклеиновой кислоте каждого компартмента, объединением нуклеиновых кислот, распределением нуклеиновой кислоты между несколькими вторыми компартментами и присвоением второго индекс индекса нуклеиновой кислоте каждого компартмента. Предпочтительно, такое индексирование позволяет получать информацию о гаплотипе при более высоких концентрациях нуклеиновой кислоты по сравнению с простым разбавлением нуклеиновой кислоты в одном компартменте до количества, эквивалентного гаплотипу нуклеиновой кислоты.
Используемый в настоящем описании термин "компартмент" обозначает область или объем, который отделяет или изолирует объекты от других объектов. Примеры компартментов включают, без ограничений, флаконы, пробирки, лунки (планшетов), капли, болюсы, гранулы, емкости, элементы поверхности или области или объемы, отделенные с помощью физических сил, таких как течение жидкости (текучей среды), магнитные силы, электрический ток или подобные явления.
Пример способа получения компартментов представлен на Фиг. 10. Для вдавливания лунок в листе из гидрогеля может быть применен эталонный шаблон из кремнийорганического полимера, имеющий вертикальные колонки (лунки в гидрогеле оказываются обратными копиями вертикальных колонок). Полученные в гидрогеле лунки могут быть заполнены материалом, который образует частицы (например, гелем или полимером) совместно с целевым анализируемым веществом или другим реагентом. Затем лист из гидрогеля может быть растворен с помощью методики, при которой частицы не растворяются. Затем частицы могут быть собраны и обработаны способами, рассмотренными в настоящем описании.
В некоторых примерах осуществления, рассмотренных в настоящем описании, библиотеки матриц (шаблонов) получают с применением транспосом. В некоторых таких библиотеках целевая нуклеиновая кислота может быть фрагментированной. Соответственно, некоторые примеры осуществления, рассмотренные в настоящем описании, относятся к способам сохранения информации последовательности, относящейся к физической связности соседних фрагментов. Такие способы включают применение интеграз для сохранения связи между теми фрагментами матричной нуклеиновой кислоты, которые расположены друг рядом с другом в целевой нуклеиновой кислоте. Предпочтительно, такое применение интегразы для сохранения физически близкого расположения фрагментированных нуклеиновых кислот повышает вероятность того, что фрагментированные нуклеиновые кислоты, полученные из одной исходной молекулы, например, хромосомы, окажутся в одном и том же компартменте.
Другие примеры осуществления, рассмотренные в настоящем описании, относятся к получению информации о последовательности из каждой нити (также называемой цепью или цепочкой) нуклеиновой кислоты, которая может способствовать снижению вероятности ошибки в информации о секвенировании. Способы создания библиотек матричных нуклеиновых кислот для получения информации о последовательности из каждой нити нуклеиновой кислоты могут быть организованы таким образом, который позволяет проводить распознавание каждой нити, а также распознавание продуктов, полученных из каждой нити.
Некоторые из способов, рассмотренных в настоящем описании, включают способы анализа нуклеиновых кислот. Такие способы включают получение библиотеки матричных нуклеиновых кислот для целевой нуклеиновой кислоты, получение данных о последовательности из библиотеки матричных нуклеиновых кислот и сборку модели последовательности целевой нуклеиновой кислоты, исходя из таких данных о последовательности.
В общем, способы и композиции, рассмотренные в настоящем описании, относятся к способам и композициям, рассмотренным в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки. Способы, рассмотренные в настоящем описании, относятся к применению транспосом, подходящих для введения элементов в целевую нуклеиновую кислоту. Такие элементы включают участки фрагментации, участки связывания праймера, штрих-коды, аффинные метки, репортерные группы и т.д.
В способе, который может быть применен для создания примеров осуществления настоящего изобретения, библиотеку матричных нуклеиновых кислот создают из СЕ, включающего целевую нуклеиновую кислоту. Библиотеку получают введением или присоединением множества уникальных штрих-кодов по всей структуре целевой нуклеиновой кислоты. В некоторых примерах осуществления каждый штрих-код включает первую последовательность штрих-кода и вторую последовательность штрих-кода, между которыми расположен участок фрагментации. Первая последовательность штрих-кода и вторая последовательность штрих-кода могут быть идентифицированы или специально сконструированы для образования пары друг с другом. Образование пары может быть информативным, при котором первый штрих-код ассоциирован со вторым штрих-кодом. Предпочтительно, парные последовательности штрих-кодов могут быть использованы для сбора данных секвенирования из библиотеки матричных нуклеиновых кислот. Например, идентификация первой матричной нуклеиновой кислоты, включающей первую последовательность штрих-кода, и второй матричной нуклеиновой кислоты, включающей вторую последовательность штрих-кода, которая образует пару с первой последовательностью, указывает на то, что первая и вторая матричные нуклеиновые кислоты представляют последовательности, соседствующие друг с другом в модели последовательности целевой нуклеиновой кислоты. Такие способы могут быть применены для сборки модели последовательности целевой нуклеиновой кислоты заново без необходимости использования эталонного генома.
В некоторых примерах осуществления может быть применено множественное комбинаторное штрих-кодирование (баркодинг, от англ. barcoding), в результате которого целевая нуклеиновая кислота из каждой единичной клетки получает уникальный штрих-код (например, уникальную комбинацию штрих-кодов), с помощью которого ее можно легко отличить от другой целевой нуклеиновой кислоты из другой единичной клетки. В некоторых примерах осуществления СЕ может включать целевую нуклеиновую кислоту из единичной клетки. В некоторых примерах осуществления целевая нуклеиновая кислота, находящаяся в СЕ, будет иметь идентифицируемые уникальные штрих-коды, отличающиеся от кодов целевых нуклеиновых кислот, находящихся в других СЕ.
В некоторых примерах осуществления может быть применена комбинаторная схема множественного мечения находящихся в единичной клетке компонентов, отличных от нуклеиновых кислот, например, белков, органелл, липидов или клеточных мембран, и с помощью этой схемы компоненты, находящиеся в единичной клетке, можно отличать от компонентов, полученных из другой единичной клетки. В некоторых примерах осуществления СЕ может включать компоненты, содержащиеся в единичной клетке. В некоторых примерах осуществления компоненты единичной клетки, находящиеся в СЕ, имеют идентифицируемую уникальную метку (метки), которая отличается от метки компонентов единичной клетки, находящейся в другом СЕ.
В некоторых примерах осуществления могут быть совместно применены комбинаторные схемы множественного штрих-кодирования для мечения целевой нуклеиновой кислоты из единичной клетки и комбинаторные схемы множественного мечения компонентов единичной клетки. В некоторых примерах осуществления такое комбинаторное штрих-кодирование и комбинаторное мечение может быть выполнено в пределах СЕ, содержащего единичную клетку. В некоторых примерах осуществления такое комбинаторное штрих-кодирование и комбинаторное мечение могут быть параллельно выполнены для множества СЕ, включающих единичные клетки.
В некоторых примерах осуществления может быть произведено секвенирование белков, сохраняемых, заключенных, иммобилизованных или содержащихся в СЕ. В некоторых примерах осуществления таким белкам присваивают уникальные метки. В некоторых примерах осуществления белки, сохраняемые, заключенные, иммобилизованные или содержащиеся в СЕ, могут быть идентифицированы способами, известными в данной области техники. В некоторых примерах осуществления идентификация и или секвенирование белка может быть выполнено совместно со сбором информации о последовательностях нуклеиновых кислот.
Используемый в настоящем описании термин "нуклеиновая кислота" и/или "олигонуклеотид" и/или их грамматические эквиваленты могут означать по меньшей мере два нуклеотидных мономера, соединенных друг с другом. Обычно нуклеиновая кислота может содержать сложные фосфодиэфирные связи; однако, в некоторых примерах осуществления аналоги нуклеиновых кислот могут иметь основные цепочки других типов, включающие, например, фосфорамидные (Beaucage et al., Tetrahedron, 49:1925 (1993); Letsinger, J. Org. Chem., 35:3800 (1970); Sprinzl et al., Eur. J. Biochem., 81:579 (1977); Letsinger et al., Nucl. Acids Res., 14:3487 (1986); Sawai et al., Chem. Lett., 805 (1984), Letsinger et al., J. Am. Chem. Soc., 110:4470 (1988) и Pauwels et al., Chemica Scripta, 26:141 (1986)), фосфоротиоатные (Mag et al., Nucleic Acids Res., 19:1437 (1991) и патент US 5644048), фосфородитиоатные (Briu et al., J. Am. Chem. Soc., 111:2321 (1989), О-метилфосфороамидитные связи (см.: Eckstein, Oligonucleotides and Analogues: A Practical Approach, Oxford University Press), а также пептидные основные цепи и связи нуклеиновых кислот (см.: Egholm, J. Am. Chem. Soc., 114:1895 (1992); Meier et al., Chem. Int. Ed. Engl., 31:1008 (1992); Nielsen, Nature, 365:566 (1993); Carlsson et al., Nature, 380:207 (1996)). Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
Другие аналоги нуклеиновых кислот включают вещества с положительно заряженными основными цепями (Denpcy et al., Proc. Natl. Acad. Sci. USA, 92:6097 (1995)); неионными основными цепями (патенты US 5386023, US 5637684, US 5602240, US 5216141 и US 4469863; Kiedrowshi et al., Angew. Chem. Intl. Ed. English, 30:423 (1991); Letsinger et al., J. Am. Chem. Soc., 110:4470 (1988); Letsinger et al., Nucleosides & Nucleotides, 13:1597 (1994); Главы 2 и 3, ASC Symposium Series 580, "Carbohydrate Modifications in Antisense Research (Модификации углеводов в исследовании антисмысловых нуклеотидов)", под ред. Y.S. Sanghui и P. Dan Cook; Mesmaeker et al., Bioorganic & Medicinal Chem. Lett., 4:395 (1994); Jeffs et al., J. Biomolecular NMR, 34:17 (1994); Tetrahedron Lett., 37:743 (1996)) и нерибозными цепями (патенты US 5235033 и US 5034506 и Главы 6 и 7, ASC Symposium Series 580, "Carbohydrate Modifications in Antisense Research", под ред. Y.S. Sanghui и P. Dan Coo). Нуклеиновые кислоты также могут содержать один или более карбоциклических сахаров (см.: Jenkins et al., Chem. Soc. Rev., (1995) стр. 169-176). Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
Для облегчения присоединения дополнительных частиц, таких как метки, или для повышения стабильности таких молекул в определенных условиях, рибозо-фосфатная основная цепь может быть модифицирована. Кроме того, могут быть приготовлены смеси природных нуклеиновых кислот и аналогов. В альтернативном варианте могут быть приготовлены смеси различных аналогов нуклеиновых кислот и смеси природных нуклеиновых кислот и их аналогов. Нуклеиновые кислоты могут быть однонитевыми (одноцепочечными) или двухнитевыми (двухцепочечными), как указано, или могут содержать части и двухнитевой, и однонитевой последовательности. Нуклеиновая кислота может представлять собой ДНК, например, геномную или кДНК, РНК или гибридную молекулу, может быть получена из единичных клеток, множества клеток или от множества индивидуумов, как в случае метагеномных образцов, таких как образцы, полученные из окружающей среды, а также из смешанных образцов, например, смешанных образцов тканей или смешанных образцов различных индивидуумов одного вида, образцов больных тканей, таких как нуклеиновых кислот, связанных с раковым заболеванием, и подобных веществ. Нуклеиновая кислота может содержать любую комбинацию дезоксирибо- и рибо-нуклеотидов и любую комбинацию оснований, включающих урацил, аденин, тимин, цитозин, гуанин, инозин, ксантанин, гипоксантанин, изоцитозин, изогуанин, и аналогов, оснований, таких как нитропиррол (включая 3-нитропиррол) и нитроиндол (включая 5-нитроиндол) и т.д.
В некоторых примерах осуществления нуклеиновая кислота может включать по меньшей мере одно неизбирательное основание. Неизбирательные основания могут образовывать комплементарную пару оснований более чем с одним типом оснований. В некоторых примерах осуществления неизбирательное основание может образовывать комплементарную пару оснований с по меньшей мере двумя различными типами оснований и не более чем с тремя различными типами оснований. Пример неизбирательного основания включает инозин, который может образовывать пару с аденином, тимином или цитозином. Другие примеры включают гипоксантин, 5-нитроиндол, ацилированный 5-нитроиндол, 4-нитропиразол, 4-нитроимидазол и 3-нитропиррол (Loakes et al., Nucleic Acid Res. 22:4039 (1994); Van Aerschot et al., Nucleic Acid Res. 23:4363 (1995); Nichols et al., Nature 369:492 (1994); Bergstrom et al., Nucleic Acid Res. 25:1935 (1997); Loakes et al., Nucleic Acid Res. 23:2361 (1995); Loakes et al., J. Mol. Biol. 270:426 (1997), и Fotin et al., Nucleic Acid Res. 26:1515 (1998)). Также могут быть применены неизбирательные основания, которые могут образовывать пару оснований с по меньшей мере тремя, четырьмя или более типами оснований. Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
Используемый в настоящем описании термин "аналог нуклеотида" и/или его грамматические эквиваленты могут относиться к синтетическим аналогам, имеющим модифицированные фрагменты нуклеотидных оснований, модифицированные пентозные фрагменты и/или модифицированные фосфатные фрагменты, и в случае полинуклеотидов модифицированные межнуклеотидные связи; описание таких веществ имеется в литературе (например, Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Englisch, Angew. Chem. Int. Ed. Engl. 30:613-29, 1991; Agarwal, Protocols for Polynucleotides and Analogs, Humana Press, 1994; и S. Verma и F. Eckstein, Ann. Rev. Biochem. 67:99-134, 1998). Обычно модифицированные фосфатные фрагменты включают аналоги фосфата, в которых атом фосфора имеет степень окисления +5, и один или более атомов кислорода замещены некислородной частицей, например, серой. Примеры аналогов фосфата включают, без ограничений, фосфоротиоат, фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфоранилидат, фосфорамидат, борфосфаты, включающие ассоциированные противоионы, например, Н+, NH4+, Na+, если такие противоионы имеются. Примеры модифицированных фрагментов нуклеотидных оснований включают, без ограничений, 5-метилцитозин (5mC); С-5-пропинильные аналоги, включающие, без ограничений, С-5 пропинил-С и С-5 пропинил-U; 2, 6-диаминопурин, также известный как 2-аминоаденин или 2-амино-dA); гипоксантин, псевдоуридин, 2-тиопиримидин, изоцитозин (изоС), 5-метил-изоС и изогуанин (изоG; см., например, патент US 5432272). Примеры модифицированных пентозных фрагментов включают, без ограничений, аналоги запертых нуклеиновых кислот (англ. locked nucleic acid, сокращенно LNA), которые включают, без ограничений, Bz-A-LNA, 5-Me-Bz-C-LNA, dmf-G-LNA и T-LNA (см., например, The Glen Report, 16(2):5, 2003; Koshkin et al., Tetrahedron 54:3607-30, 1998), и 2'- или 3'-модификации, в которых в 2'- или 3'-положении находится водород, гидроксигруппа, алкоксигруппа (например, метокси-, этокси-, аллилокси-, изопропокси-, бутокси-, изобутокси- и феноксигруппа), азидо-, амино-, алкиламиногруппа, фтор, хлор или бром. Модифицированные межнуклеотидные связи включают аналоги фосфатов, аналоги, имеющие ахиральные и незаряженные связи между субъединицами (описанные, например, в публикации Sterchak, Е.P. et al., Organic Chem., 52:4202, 1987), и незаряженные полимеры на основе морфолина, имеющие ахиральные и незаряженные связи между субъединицами (см., например, патент US 5034506). Некоторые аналоги с межнуклеотидными связями включают гетероциклы, соединенные через морфолидат, ацеталь и полиамид. В одном из классов аналогов нуклеотидов, называемых пептидными нуклеиновыми кислотами, которые включают псевдокомплементарные пептидные нуклеиновые кислоты (англ. pseudo complementary peptide nucleic acid, сокращенно "PNA"), традиционная связь между сахаром и нуклеотидом была заменена полимером с основной цепью на основе 2-аминоэтилглицинамида (см., например, Nielsen et al., Science, 254:1497-1500, 1991; Egholm et al., J. Am. Chem. Soc., 114: 1895-1897 1992; Demidov et al., Proc. Natl. Acad. Sci. 99:5953-58, 2002; Peptide Nucleic Acids: Protocols and Applications, Nielsen, ed., Horizon Bioscience, 2004). Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
Используемый в настоящем описании термин "прочтение последовательности" и/или его грамматические эквиваленты может относиться к многократному повторению этапов физической или химической обработки, которые проводят для получения сигналов, указывающих на порядок расположения мономеров в полимере. Сигналы могут указывать на порядок мономеров при разрешении в один мономер или более низком разрешении. В конкретных примерах осуществления проведение этапов может начинаться с целевой нуклеиновой кислоты и продолжаться до получения сигналов, указывающих на порядок оснований в целевой нуклеиновой кислоте. Способ может быть проведен до его обычного завершения, которое обычно определяется точкой, в которой сигналы, получаемые в способе, уже не позволяют распознавать основания мишени с разумной степенью достоверности. При необходимости способ может быть завершен раньше, например, после получения требуемого объема информации о последовательности. Прочтение последовательности может быть проведено на единственной молекуле целевой нуклеиновой кислоты или одновременно на популяции молекул целевых нуклеиновых кислот, имеющих одинаковую последовательность, или одновременно на популяции целевых нуклеиновых кислот, имеющих разные последовательности. В некоторых примерах осуществления прочтение последовательности заканчивают, если сигналы уже не исходят от одной или более молекул целевых нуклеиновых кислот, с которых начался сбор сигналов. Например, может быть начато прочтение последовательности одной или более молекул целевых нуклеиновых кислот, которые находятся на твердофазной подложке, и окончено после удаления одной или более молекул целевых нуклеиновых кислот с подложки. В иных случаях секвенирование может быть окончено при прекращении обнаружения целевых нуклеиновых кислот, которые присутствовали на подложке после запуска секвенирования.
Используемый в настоящем описании термин "представление секвенирования" и/или его грамматические эквиваленты может относиться к информации, которая выражает порядок и тип мономерных единиц в полимере. Например, информация может указывать на порядок и тип нуклеотидов в нуклеиновой кислоте. Информация может находиться в любом из множества форматов, которые включают, например, описание, изображение, электронный носитель, серию символов, серию чисел, серию букв, серию цветов и т.д. Разрешение информации может быть на уровне одного мономера или ниже. Пример полимера представляет собой нуклеиновую кислоту, такую как ДНК или РНК, содержащую нуклеотидные единицы. Серия букв "А", "Т", "G" и "С" представляет собой хорошо известную модель последовательности ДНК, которая может быть сопоставлена на уровне разрешения, составляющем один нуклеотид, с реальной последовательностью молекулы ДНК. Другие примеры полимеров представляют собой белки, содержащие аминокислотные единицы, и полисахариды, содержащие сахаридные единицы.
Используемый в настоящем описании термин "по меньшей мере часть" и/или его грамматические эквиваленты может относиться к любой части от общего количества. Например, "по меньшей мере часть" может означать по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99%, 99,9% или 100% от общего количества.
Используемый в настоящем описании термин "обнаруживать" и/или его грамматические эквиваленты могут относиться к идентификации присутствия или существования анализируемого вещества, идентификации индивидуальных компонентов анализируемого вещества, например, информации о последовательности, и/или к определению количества такого анализируемого вещества.
Участки (сайты) фрагментации
В некоторых примерах осуществления, включающих петлеобразные транспосомы, линкер может включать участок (сайт) фрагментации. Участок фрагментации может быть использован для расщепления физической, но не информационной связи между первой последовательностью штрих-кода и второй последовательностью штрих-кода. Расщепление может быть произведено биохимическими, химическими или другими средствами. В некоторых примерах осуществления участок фрагментации может включать нуклеотид или нуклеотидную последовательность, которая может быть разбита на фрагменты различными способами. Например, участок фрагментации может включать участок распознавания рестрикционной эндонуклеазы; по меньшей мере один рибонуклеотид, способный расщепляться под действием РНКазы; аналоги нуклеотидов, способные расщепляться в присутствии определенного химического агента; диольную связь, способную расщепляться при обработке периодатом; дисульфидную группу, способную расщепляться под действием химического восстановителя; способный расщепляться фрагмент, который может подвергаться фотохимическому расщеплению, и пептид, способный расщепляться под действием фермента пептидазы или других подходящих средств. См., например, опубликованную патентную заявку US 2012/0208705, опубликованную патентную заявку US 2012/0208724 и опубликованную международную патентную заявку WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки.
Участки (сайты) связывания праймера
В некоторых примерах осуществления репортерные группы могут включать участки (сайты) связывания праймера, которые могут гибридизоваться с праймером. В некоторых примерах осуществления репортерная группа может включать по меньшей мере первый участок связывания праймера, подходящий для амплификации, секвенирования и подобных операций.
В некоторых примерах осуществления последовательность транспозона может включать "адаптор секвенирования" или "участок (сайт) адаптора секвенирования", то есть область, которая включает один или более участков, которые могут гибридизоваться с праймером. В некоторых примерах осуществления последовательность транспозона может включать по меньшей мере первый участок связывания праймера, подходящий для амплификации, секвенирования и подобных операций. В некоторых примерах осуществления, включающих петлеобразные транспосомы, линкер может включать адаптор секвенирования. В других примерах осуществления, включающих петлеобразные транспосомы, линкер включает по меньшей мере первый участок связывания праймера и второй участок связывания праймера. Ориентация участков связывания праймера в таких примерах осуществления может быть такой, при которой праймер, гибридизующийся с первым участком связывания праймера, и праймер, гибридизующийся со вторым участком связывания праймера, находятся в одной и той же ориентации или в разных ориентациях.
В некоторых примерах осуществления линкер может включать первый участок связывания праймера и второй участок связывания праймера, между которым расположен неамплифицируемый участок. Неамплифицируемый участок подходит для блокирования удлинения полинуклеотидной цепи между первым и вторым участками связывания праймера, там, где полинуклеотидная цепочка гибридизуется с одним из участков связывания праймера. Неамплифицируемый участок также может применяться для предотвращения образования конкатемеров. Примеры неамплифицируемых участков включают аналог нуклеотида, ненуклеотидную химическую частицу, аминокислоту, пептид и полипептид. В некоторых примерах осуществления неамплифицируемый участок включает аналог нуклеотида, который не связывается существенным образом в пару с А, С, G или Т. Некоторые примеры осуществления включают линкер, включающий первый участок связывания праймера и второй участок связывания праймера, между которыми расположен участок фрагментации. В других примерах осуществления может применяться вилкообразная или Y-образная конструкция адаптора, подходящая для направленного секвенирования, рассмотренная в патенте US 7741463, содержание которого полностью включено в настоящее описание посредством ссылки.
Примеры последовательностей участков связывания праймера включают, без ограничений AATGATACGGCGACCACCGAGATCTACAC (последовательность Р5) и CAAGCAGAAGACGGCATACGAGAT (последовательность Р7).
Репортерные группы
Используемый в настоящем описании термин "репортерная группа" и его грамматические эквиваленты может относиться к любому идентифицируемому тэгу, метке, индексам, штрих-кодам или группе, которая позволяет определять состав, идентификационные свойства и/или источник исследуемого анализируемого вещества.
Опытный специалист в данной области техники должен понимать, что в способах и композициях согласно изобретению может быть применено множество различных видов репортерных групп, как индивидуальных, так и в комбинации с одной или более другими репортерными группами. В некоторых примерах осуществления для одновременного исследования более одного анализируемого вещества может быть применено более одной из различных репортерных групп. В некоторых примерах осуществления для присвоения уникальной идентификации единичной клетке или компонентам единичной клетки одновременно может быть применено множество различных репортерных групп.
В определенных примерах осуществления репортерная группа может испускать сигнал. Примеры сигналов включают, без ограничений, флуоресцентный, хемилюминесцентный, биолюминесцентный, фосфоресцентный, радиоактивный, калориметрический, сигнал ионной активности, электронный или электрохемилюминесцентный сигналы. Примеры репортерных групп перечислены, например, в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки.
В некоторых примерах осуществления репортерная группа может представлять собой адаптор. В некоторых примерах осуществления композиций и способов, рассмотренных в настоящем описании, последовательность транспозона может включать репортерную группу. В некоторых примерах осуществления, включающих петлеобразные транспосомы, линкер или адаптор может включать репортерную группу.
В некоторых примерах осуществления репортерная группа может не выдавать сигнал. В некоторых примерах осуществления репортерная группа может представлять собой фрагмент нуклеиновой кислоты, такой как штрих-код, уникальный молекулярный индекс, плазмида. В некоторых примерах осуществления репортерная группа может включать антитело, которое специфично связывается с белком. В некоторых примерах осуществления антитело может включать пригодную для обнаружения метку. В некоторых примерах осуществления репортер может включать антитело или аффинный реагент, меченный тэгом нуклеиновой кислоты. Тэг нуклеиновой кислоты может быть подходящим для обнаружения, например, посредством способа близкого лигирования (англ. proximity ligation assay, сокращенно PLA) или способа близкого расширения (англ. proximity extension assay, сокращенно PEA).
В некоторых примерах осуществления может быть применен набор репортерных групп. В некоторых примерах осуществления набор репортерных групп может включать смесь субнаборов репортерных групп, в которой каждый субнабор репортерных групп специфичен для анализируемого вещества соответствующего типа, например, белков, нуклеиновых кислот, липидов, углеводов. В некоторых примерах осуществления набор репортерных групп может включать смесь субнаборов репортерных групп, в которой каждый субнабор репортерных групп отличается от других, но специфичен для того же типа анализируемого вещества.
Штрих-коды
Обычно штрих-код может включать одну или более нуклеотидных последовательностей, которые могут быть применены для идентификации одного или более из конкретных анализируемых веществ, таких как нуклеиновые кислоты, белки, метаболиты или другие анализируемые вещества, рассмотренные в настоящем описании или известные в данной области техники. Штрих-код может представлять собой искусственную последовательность или может представлять собой природную последовательность, полученную при транспозиции, такую как идентичные фланкирующие геномные ДНК последовательности (g-коды) на концах ранее размещенных друг возле друга фрагментов ДНК. Штрих-код может включать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более расположенных последовательно (один за другим) нуклеотидов. В некоторых примерах осуществления штрих-код включает по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70 80, 90, 100 или более расположенных последовательно нуклеотидов. В некоторых примерах осуществления по меньшей мере часть штрих-кодов в популяции нуклеиновых кислот, включающих штрих-коды, различны. В некоторых примерах осуществления по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% штрих-кодов различны. В других подобных примерах осуществления все штрих-коды различны. Множество разнообразных штрих-кодов в популяции нуклеиновых кислот, включающих штрих-коды, могут быть созданы случайным или неслучайным образом.
В некоторых примерах осуществления последовательность транспозона включает по меньшей мере один штрих-код. В некоторых примерах осуществления такие транспосомы включают две последовательности транспозона, не составляющие непрерывной последовательности, где первая последовательность транспозона включает первый штрих-код, а вторая последовательность транспозона включает второй штрих-код. В некоторых примерах осуществления, например, в петлеобразных транспосомах, последовательность транспозона включает штрих-код, включающий первую последовательность штрих-кода и вторую последовательность штрих-кода. В некоторых из указанных выше примеров осуществления первая последовательность штрих-кода может быть идентифицирована или предназначена для образования комплементарной пары (спаривания) со второй последовательностью штрих-кода. Например, то, что известная первая последовательность штрих-кода образует пару с известной второй последовательностью штрих-кода, может быть известно из справочных таблиц, включающих множество первых и вторых последовательностей штрих-кода, которые образуют пары друг с другом.
В другом примере первая последовательность штрих-кода может включать ту же самую последовательность, что и вторая последовательность штрих-кода. В другом примере первая последовательность штрих-кода может включать обратный комплемент ко второй последовательности штрих-кода. В некоторых примерах осуществления первая последовательность штрих-кода и вторая последовательность штрих-кода различны. Первая и вторая последовательности штрих-кода могут включать бинарный код (англ. bi-code).
В некоторых примерах осуществления композиций и способов, рассмотренных в настоящем описании, штрих-коды применяют при получении матричных нуклеиновых кислот. Следует понимать, что огромное количество доступных штрих-кодов позволяет каждой молекуле матричной нуклеиновой кислоты включать уникальную идентификацию. Уникальная идентификация каждой молекулы в смеси матричных нуклеиновых кислот может быть использована в нескольких вариантах применения. Например, молекулы с уникальной идентификацией могут быть применены для идентификации индивидуальных молекул нуклеиновых кислот, в образцах, содержащих множество хромосом, в геномах, в клетках, в клеточных типах, для состояния заболеваний клеток и для определения вида, например, при секвенировании гаплотипа, для распознавания родительских аллелей, при метагеномном секвенировании и при выборочном секвенировании генома. Примеры последовательностей штрих-кода включают, без ограничений, TATAGCCT, ATAGAGGC, ССТАТССТ, GGCTCTGA, AGGCGAAG, ТААТСТТА, CAGGACGT и GTACTGAC.
Линкеры
Некоторые примеры осуществления, включающие петлеобразные транспосомы, включают последовательности транспозона, включающие первую последовательность штрих-кода и вторую последовательность штрих-кода, между которыми расположен линкер. В других примерах осуществления линкер может отсутствовать или может представлять собой основную цепь, состоящую из сахара и фосфата, которая соединяет один нуклеотид с другим. Линкер может включать, например, один или более нуклеотидов, нуклеиновых кислот, ненуклеотидных химических фрагментов, аналогов нуклеотидов, аминокислот, пептидов, полипептидов или белков. В предпочтительных примерах осуществления линкер включает нуклеиновую кислоту. Линкер может включать по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более нуклеотидов. В некоторых примерах осуществления линкер может включать по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или более нуклеотидов.
В некоторых примерах осуществления линкер может подвергаться амплификации, например, ПЦР амплификации, амплификации по типу катящегося кольца, амплификации с замещением цепей и подобных методик. В других примерах осуществления линкер может включать неамплифицируемые фрагменты. Примеры неамплифицируемых линкеров включают органические химические линкеры, такие как алкил, пропил, ПЭГ; не встречающиеся в природе основания, такие как ИзоС (isoC), изоG (isoG); или любую группу, которая не амплифицируется согласно схемам амплификации на основе ДНК. Например, транспозоны, содержащие изоС, изоG пары, могут быть амплифицированы со смесями dNTP, не имеющими комплементарных изоG и изоС, что обеспечивает отсутствие амплификации по введенным транспозонам.
В некоторых примерах осуществления линкер включает однонитевую нуклеиновую кислоту. В некоторых примерах осуществления линкер соединяет последовательности транспозона в 5'-3' ориентации, 5'-5' ориентации или 3'-3' ориентации.
Аффинные метки
В некоторых примерах осуществления последовательность транспозона может включать аффинную метку. В некоторых примерах осуществления, включающих петлеобразные транспосомы, линкер может включать аффинную метку. Аффинные метки могут иметь ряд применений, например, объемное разделение целевых нуклеиновых кислот, гибридизованных с метками гибридизации. Дополнительные варианты применения включают, без ограничений, применение аффинных меток для очистки, например, комплексов транспозаза/транспозон и целевой ДНК с введенным транспозоном, целевой РНК или целевых белков. Используемый в настоящем описании термин "аффинная метка" и его грамматические эквиваленты может означать компонент многокомпонентного комплекса, в котором компоненты многокомпонентного комплекса специфично взаимодействуют или связываются друг с другом. Например, аффинная метка может включать биотин или поли-His, который может связывать стрептавидин или никель, соответственно. Другие примеры многокомпонентных комплексов аффинных меток перечислены, например, в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки.
Твердая подложка
Твердая подложка может быть двух- или трехмерной и может включать планарную (плоскую) поверхность (например, стеклянную пластину), или может иметь определенную форму. Твердая подложка может включать стекло (например, стекло с регулируемым размером пор (англ. controlled pore glass, сокращенно CPG)), кварц, полимер (такой как полистирол (полистирол с низкой плотностью поперечных связей и с высокой плотностью поперечных связей), поликарбонат, полипропилен и полиметилметакрилат), акриловый сополимер, полиамид, кремний, металл (например, алкантиолятное производное золота), целлюлозу, нейлон, латекс, декстран, матрицу из геля (например, силикагеля), полиакролеин или композиционные материалы.
Подходящие трехмерные твердые подложки включают, например, сферы, микрочастицы, гранулы, наночастицы, полимерные матрицы, такие как агароза, полиакриламид, альгинат, мембраны, пластинки, пластины, полученные микрообработкой чипы, трубки (например, капиллярные трубки), микролунки, микроструйные устройства, каналы, фильтры, проточные ячейки, структуры, подходящие для иммобилизации нуклеиновой кислоты, белков или клеток. Твердая подложка может включать планарные массивы или матрицы, которые могут иметь области, которые включают популяции матричных нуклеиновых кислот или праймеры. Примеры включают функционализированные нуклеозидами CPG и полистирольные пластинки; функционализированные магнитные пластинки; полистирол, привитый полиэтиленгликоль и подобные вещества.
В некоторых примерах осуществления твердая подложка включает микросферы или гранулы. В настоящем описании термины "микросферы" или "гранулы" или "частицы" или их грамматические эквиваленты означают мелкие дискретные частицы. Подходящие композиции гранул включают, без ограничений, полимеры, керамику, стекло, полистирол, метилстирол, акриловые полимеры, парамагнитные материалы, золь оксида тория, углеродный графит, диоксид титана, латекс или сшитые поперечными связями декстраны, такие как Сефароза (Sepharose), целлюлоза, нейлон, сшитые поперечными связями мицеллы и тефлон, а также любые другие материалы, которые в настоящем описании упомянуты в качестве пригодных для получения твердых подложек. Полезным пособием является "Microsphere Detection Guide" from Bangs Laboratories, Fishers Ind. В определенных примерах осуществления микросферы представляют собой магнитные микросферы или гранулы. В некоторых примерах осуществления гранулы могут иметь цветовой код. Например, могут быть применены микросферы MicroPlex®, поставляемые компанией Luminex, Austin, ТХ (Остин, Техас).
Гранулы не обязательно должны быть сферическими; могут применяться частицы неправильной формы. В альтернативном варианте или дополнительно гранулы могут быть пористыми. Размеры гранул составляют от нанометров, т.е. от 100 нм, до миллиметров, т.е. до 1 мм; предпочтительными являются размеры гранул, составляющие от приблизительно 0,2 микрон до приблизительно 200 микрон, и особенно предпочтительными являются размеры гранул, составляющие от приблизительно 0,5 до приблизительно 5 микрон, хотя в некоторых примерах осуществления могут быть применены гранулы меньшего или большего размеров. В некоторых примерах осуществления диаметр гранул может составлять приблизительно 1, 1,5, 2, 2,5, 2,8, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 10,5, 15 или 20 мкм.
В некоторых примерах осуществления гранулы могут включать антитела или другие аффинные зонды (типичные протоколы присоединения рассмотрены в публикации "Immobilized Biomolecules in Analysis. A Practical Approach. (Иммобилизованные биомолекулы в анализе. Практический подход)". Cass Т., Ligler F.S., изд. Oxford University Press, New York, 1998. стр. 1-14, которая включена в настоящее описание посредством ссылки). В некоторых примерах осуществления антитела могут быть моноклональными, и в других примерах осуществления антитела могут быть поликлональными. В некоторых примерах осуществления антитела могут быть специфичными для эпитопа (детерминанты) клеточной поверхности. В некоторых примерах осуществления антитела могут быть специфичными по отношению к белку, находящемуся внутри клетки.
В некоторых примерах осуществления матрица нуклеиновой кислоты, рассмотренная в настоящем описании, может быть присоединена к твердой подложке. Для присоединения, закрепления или иммобилизации нуклеиновых кислот на поверхности твердой подложки могут быть применены различные способы, хорошо известные в данной области техники.
Анализируемые вещества
Анализируемые вещества представляют собой биомолекулы, чьи функции, состав, идентификационные свойства и/или источники получения являются предметом исследования. Примеры анализируемых веществ включают, без ограничений, ДНК, РНК, кДНК, белки, липиды, углеводы, клеточные органеллы (например, ядра, аппарат Гольджи, рибосомы, митохондрии, эндоплазматический ретикулюм, хлоропласт, клеточная мембрана и т.д.), продукты метаболизма клетки, срезы ткани, клетки, единичную клетку, содержимое клеток или содержимое единичной клетки, нуклеиновую кислоту, выделенную из клеток или из единичной клетки, или нуклеиновую кислоту, выделенную из клеток или из единичной клетки и дополнительно модифицированную, или бесклеточную ДНК (например, из плацентарной жидкости или плазмы крови).
Целевые нуклеиновые кислоты
Целевая нуклеиновая кислота может включать любую интересующую нуклеиновую кислоту. В одном из примеров осуществления целевая нуклеиновая кислота может включать любую интересующую нуклеиновую кислоту, содержащуюся, захваченную, внедренную или иммобилизованную в СЕ, таком как матрица, капля, эмульсия, твердая подложка или компартмент, который поддерживает связность находящихся в нем нуклеиновых кислот, но предоставляет доступ к жидкостям и ферментативным реагентам. Целевые нуклеиновые кислоты могут включать ДНК, кДНК, продукты полногеномной амплификации (англ. whole genome amplification, сокращенно WGA), РНК, пептидную нуклеиновую кислоту, модифицированную морфолином нуклеиновую кислоту, запертую нуклеиновую кислоту, модифицированную гликолем нуклеиновую кислоту, модифицированную треозой нуклеиновую кислоту, смешанные образцы нуклеиновых кислот, полиплоидную ДНК (т.е. ДНК растения), смеси перечисленных веществ и их гибриды. В одном из предпочтительных примеров осуществления в качестве целевой нуклеиновой кислоты используют фрагменты геномной ДНК или ее амплифицированные копии. В другом предпочтительном примере осуществления используют кДНК, митохондриальную ДНК или ДНК хлоропласта.
Целевая нуклеиновая кислота может включать любую последовательность нуклеотидов. В некоторых примерах осуществления целевая нуклеиновая кислота включает последовательности гомополимеров. Целевая нуклеиновая кислота также может включать последовательности повторов. Последовательности повторов могут иметь различные длины и включать, например, 2, 5, 10, 20, 30, 40, 50, 100, 250, 500 или 1000 нуклеотидов или более. Последовательности повторов могут быть повторены, как непрерывно, так и не непрерывно, любое множество раз, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15 или 20 раз или более.
В некоторых примерах осуществления, рассмотренных в настоящем описании, может быть применена единственная целевая нуклеиновая кислота. В других примерах осуществления может быть применено множество целевых нуклеиновых кислот. В таких примерах осуществления множество целевых нуклеиновых кислот может включать множество одинаковых целевых нуклеиновых кислот, множество различных целевых нуклеиновых кислот, в котором некоторые целевые нуклеиновые кислоты одинаковы, или множество различных целевых нуклеиновых кислот, в котором все целевые нуклеиновые кислоты различны. Примеры осуществления, в которых применяют множество целевых нуклеиновых кислот, могут быть осуществлены в мультиплексных форматах, в которых реагенты доставляют к целевым нуклеиновым кислотам одновременно, например, в одну или более камер или на поверхность матрицы (массива). В некоторых примерах осуществления множество целевых нуклеиновых кислот может включать по существу весь геном конкретного организма. Множество целевых нуклеиновых кислот может включать по меньшей мере часть генома конкретного организма, включающую, например, по меньшей мере приблизительно 1%, 5%, 10%, 25%, 50%, 75%, 80%, 85%, 90%, 95% или 99% генома. В конкретных примерах осуществления верхний предел этой части может максимально составлять приблизительно 1%, 5%, 10%, 25%, 50%, 75%, 80%, 85%, 90%, 95% или 99% генома.
Целевые нуклеиновые кислоты могут быть получены из любого источника. Например, целевые нуклеиновые кислоты могут быть получены из молекул нуклеиновых кислот, полученных из одного организма, или из популяций молекул нуклеиновых кислот, полученных из природных источников, которые включают один или более организмов. Источники молекул нуклеиновых кислот включают, без ограничений, органеллы, клетки, ткани, органы или организмы. Клетки, которые могут быть применены в качестве источников молекул целевых нуклеиновых кислот, могут быть прокариотическими (клетки бактерий, например, видов Escherichia, Bacillus, Serratia, Salmonella, Staphylococcus, Streptococcus, Clostridium, Chlamydia, Neisseria, Treponema, Mycoplasma, Borrelia, Legionella, Pseudomonas, Mycobacterium, Helicobacter, Erwinia, Agrobacterium, Rhizobium и Streptomyces); архейскими, такими как кренархеоты, наноархеоты или эвриархеоты; или эукариотическими, такими как грибы (например, дрожжи), растения, простейшие и другие паразиты, и животные (включая насекомых (например, Drosophila spp.), нематоды (например, Caenorhabditis elegans), и млекопитающие (например, крысы, мыши, обезьяны, приматы, не относящиеся к человеку, и люди).
Целевые нуклеиновые кислоты и матричные нуклеиновые кислоты могут быть обогащены определенными представляющими интерес последовательностями с помощью различных способов, хорошо известных в данной области техники. Примеры таких способов представлены в опубликованной международной патентной заявке WO 2012/108864, содержание которой полностью включено в настоящее описание посредством ссылки. В некоторых примерах осуществления нуклеиновые кислоты могут быть дополнительно обогащены при проведении способов получения библиотек матриц (библиотек шаблонов). Например, нуклеиновые кислоты могут быть обогащены определенными последовательностями перед введением транспосом, после введения транспосом и/или после амплификации нуклеиновых кислот.
Кроме того, в некоторых примерах осуществления целевые нуклеиновые кислоты и/или матричные нуклеиновые кислоты могут быть очищены до высокой степени чистоты; например, перед применением в способах, рассмотренных в настоящем описании, нуклеиновые кислоты могут быть по меньшей мере на приблизительно 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или 100% очищены от загрязняющих веществ. В некоторых примерах осуществления целесообразно применять способы, известные в данной области техники, которые позволяют сохранять качество и размер целевой нуклеиновой кислоты; например, извлечение и/или прямая транспозиция целевой ДНК может быть выполнена на агарозных брикетах.
В некоторых примерах осуществления целевая нуклеиновая кислота может быть получена из биологического образца или образца, полученного из организма пациента. Используемый в настоящем описании термин "биологический образец" или "образец, полученный из организма пациента" включает такие образцы, как одна или более клеток, тканей или физиологических жидкостей. "Физиологические жидкости" могут включать, без ограничений, кровь, сыворотку, плазму крови, слюну, спинномозговую жидкость, плевральную жидкость, слезную жидкость, жидкость молочных протоков, лимфу, мокроту, мочу, околоплодную жидкость или семенную жидкость. Образец может включать "бесклеточную" физиологическую жидкость. "Бесклеточная физиологическая жидкость" включает менее приблизительно 1% (масс.) цельного клеточного материала. Плазма или сыворотка крови представляют собой примеры бесклеточных физиологических жидкостей. Образец может включать пробу природного или синтетического происхождения (т.е. клеточный образец, который был превращен в бесклеточный).
Используемый в настоящем описании термин "плазма крови" относится к бесклеточной жидкости, находящейся в крови. "Плазма" может быть получена из крови удалением из крови цельного клеточного материала способами, известными в данной области техники (например, центрифугированием, фильтрованием и подобными способами).
Некоторые способы получения матричных нуклеиновых кислот
Некоторые примеры осуществления включают способы получения матричных нуклеиновых кислот. Используемый в настоящем описании термин "матричная нуклеиновая кислота" может относиться к субстрату (веществу), подходящему для получения информации о последовательности. В некоторых примерах осуществления матричная нуклеиновая кислота может включать целевую нуклеиновую кислоту, ее фрагмент или любую ее копию, включающую по меньшей мере одну последовательность транспозона, ее фрагмент или любую ее копию. В некоторых примерах осуществления матричная нуклеиновая кислота может включать целевую нуклеиновую кислоту, включающую адаптор секвенирования, такой как участок связывания праймера, отвечающий за секвенирование (англ. sequencing primer site). В некоторых примерах осуществления СЕ может включать целевую нуклеиновую кислоту.
Некоторые способы получения матричных нуклеиновых кислот включают введение последовательности транспозона в целевую нуклеиновую кислоту и получение, таким образом, матричной нуклеиновой кислоты. Некоторые способы введения включают контакт последовательности транспозона, рассмотренной в настоящем описании, с целевой нуклеиновой кислотой в присутствии фермента, такого как транспозаза или интеграза, в условиях, подходящих для интеграции последовательности или последовательностей транспозона в целевую нуклеиновую кислоту. В некоторых примерах осуществления СЕ может включать такую целевую нуклеиновую кислоту.
В некоторых примерах осуществления введение последовательностей транспозона в целевую нуклеиновую кислоту может быть произведено не беспорядочным (неслучайным) образом. В некоторых примерах осуществления последовательности транспозона могут быть введены в контакт с целевыми нуклеиновыми кислотами, включающими белки, которые ингибируют интеграцию на определенных участках. Например, может быть произведено ингибирование интеграции последовательностей транспозона в геномную ДНК, включающую белки, геномную ДНК, включающую хроматин, геномную ДНК, включающую нуклеосомы, или геномную ДНК, включающую гистоны. В некоторых примерах осуществления для интеграции последовательности транспозона при определенной последовательности в целевой нуклеиновой кислоте, последовательности транспозона могут быть ассоциированы с аффинными метками. Например, последовательность транспозона может быть ассоциирована с белком, мишенью которого являются специфичные последовательности нуклеиновых кислот, например, гистоны, хроматин-связывающие белки, факторы транскрипции, факторы инициации и т.д. и антитела или фрагменты антител, которые связываются с определенными последовательность-специфичными белками, связывающими нуклеиновые кислоты. В одном из репрезентативных примеров осуществления последовательность транспозона ассоциирована с аффинной меткой, такой как биотин; аффинная метка может быть ассоциирована с белком, связывающим нуклеиновые кислоты. В некоторых примерах осуществления СЕ может включать такую целевую нуклеиновую кислоту.
Следует понимать, что при проведении интеграции некоторых последовательностей транспозона в целевую нуклеиновую кислоту, несколько последовательно расположенных нуклеотидов целевой нуклеиновой кислоты на участке интеграции в интегрированном продукте подвергаются дупликации. Таким образом, интегрированный продукт может включать дуплицированную последовательность на каждом из концов интегрированной последовательности в целевой нуклеиновой кислоте. Используемый в настоящем описании термин "метка хозяина" или "g-тэг" может относиться к целевой последовательности нуклеиновых кислот, которая дуплицирована по каждому концу интегрированной последовательности транспозона. Однонитевые (одноцепочечные) части нуклеиновых кислот, которые могут быть получены посредством введения последовательностей транспозона, могут быть подвергнуты репарации с помощью множества различных способов, хорошо известных в данной области техники, например, под действием лигаз, олигонуклеотидов и/или полимераз.
В некоторых примерах осуществления множество последовательностей транспозона, рассмотренных в настоящем описании, вводят в целевую нуклеиновую кислоту. Некоторые примеры осуществления включают выбор условий, подходящих для проведения интеграции множества последовательностей транспозона в целевую нуклеиновую кислоту таким образом, чтобы среднее расстояние между соседними интегрированными последовательностями транспозона включало определенное количество расположенных последовательно нуклеотидов целевой нуклеиновой кислоты.
Некоторые примеры осуществления включают выбор условий, подходящих для осуществления введения последовательности или последовательностей транспозона в целевую нуклеиновую кислоту, но не в другую последовательность или последовательности транспозона. Для снижения вероятности введения последовательности транспозона в другую последовательность транспозона может быть применено множество различных способов. Примеры таких способов, которые могут быть применены для воплощения примеров осуществления настоящего изобретения, приведены, например, в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки.
В некоторых примерах осуществления условия могут быть выбраны таким образом, чтобы среднее расстояние в целевой нуклеиновой кислоте между интегрированными последовательностями транспозона составляло по меньшей мере приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более последовательно расположенных нуклеотидов. В некоторых примерах осуществления среднее расстояние в целевой нуклеиновой кислоте между интегрированными последовательностями транспозона составляет по меньшей мере приблизительно 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000 или более последовательно расположенных нуклеотидов. В некоторых примерах осуществления среднее расстояние в целевой нуклеиновой кислоте между интегрированными последовательностями транспозона составляет по меньшей мере приблизительно 1 т.о. (что означает "тысяч оснований", от англ. kb, что означает kilobase), 2 т.о., 3 т.о., 4 т.о., 5 т.о., 6 т.о., 7 т.о., 8 т.о., 90 т.о., 100 т.о. или более последовательно расположенных нуклеотидов. В некоторых примерах осуществления среднее расстояние в целевой нуклеиновой кислоте между интегрированными последовательностями транспозона составляет по меньшей мере приблизительно 100 т.о., 200 т.о., 300 т.о., 400 т.о., 500 т.о., 600 т.о., 700 т.о., 800 т.о., 900 т.о., 1000 т.о. или более последовательно расположенных нуклеотидов. Следует понимать, что некоторые из условий, которые могут быть выбраны, включают контакт целевой нуклеиновой кислотой с определенным количеством последовательностей транспозона.
Некоторые примеры осуществления способов, рассмотренных в настоящем описании, включают выбор условий, подходящих для проведения интеграции по меньшей мере части последовательностей транспозона, которые различны, в целевую нуклеиновую кислоту. В предпочтительных примерах осуществления способов и композиций, рассмотренных в настоящем описании, каждая последовательность транспозона, интегрированная в целевую нуклеиновую кислоту, отличается от других. Некоторые из возможно выбранных условий осуществления интеграции определенной части последовательностей транспозона в различающиеся целевые последовательности включают выбор степени разнообразия популяции последовательностей транспозона. Следует понимать, что разнообразие последовательностей транспозона частично обусловлено разнообразием штрих-кодов таких последовательностей транспозона. Соответственно, некоторые примеры осуществления включают обеспечение наличия популяции последовательностей транспозона, в которой по меньшей мере часть штрих-кодов различны. В некоторых примерах осуществления по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99% или 100% штрих-кодов в популяции последовательностей транспозона различны. В некоторых примерах осуществления по меньшей мере часть последовательностей транспозона, интегрированных в целевую нуклеиновую кислоту, одинаковы.
Некоторые примеры осуществления получения матричной нуклеиновой кислоты могут включать копирование последовательностей, включающих целевую нуклеиновую кислоту. Например, некоторые примеры осуществления включают гибридизацию праймера с участком связывания праймера последовательности транспозона, интегрированной в целевую нуклеиновую кислоту. В некоторых таких примерах осуществления праймер может быть гибридизован с участком связывания праймера и удлинен. Скопированные последовательности могут включать по меньшей мере одну последовательность штрих-кода и по меньшей мере часть целевой нуклеиновой кислоты. В некоторых примерах осуществления скопированные последовательности могут включать первую последовательность штрих-кода, вторую последовательность штрих-кода и расположенную между ними по меньшей мере часть целевой нуклеиновой кислоты. В некоторых примерах осуществления по меньшей мере одна скопированная нуклеиновая кислота может включать по меньшей мере первую последовательность штрих-кода первой скопированной нуклеиновой кислоты, которая может быть идентифицирована или предназначена для образования пары со второй последовательностью штрих-кода второй скопированной нуклеиновой кислоты. В некоторых примерах осуществления праймер может включать праймер секвенирования. В некоторых примерах осуществления данные секвенирования получают с помощью праймера секвенирования. В других примерах осуществления адапторы, включающие участки связывания праймера, могут быть прикреплены к каждому из концов нуклеиновой кислоты, и нуклеиновая кислота амплифицирована, начиная с таких участков связывания праймера.
Некоторые примеры осуществления получения матричной нуклеиновой кислоты могут включать амплификацию последовательностей, включающих по меньшей мере часть одной или более последовательностей транспозона и по меньшей мере часть целевой нуклеиновой кислоты. В некоторых примерах осуществления по меньшей мере часть целевой нуклеиновой кислоты может быть амплифицирована с использованием праймеров, которые гибридизуются с участками связывания праймера интегрированных последовательностей транспозона, интегрированных в целевую нуклеиновую кислоту. В некоторых таких примерах осуществления амплифицированная нуклеиновая кислота может включать первую последовательность штрих-кода и вторую последовательность штрих-кода, между которыми расположена по меньшей мере часть целевой нуклеиновой кислоты. В некоторых примерах осуществления по меньшей мере одна амплифицированная нуклеиновая кислота может включать по меньшей мере первую последовательность штрих-кода первой амплифицированной нуклеиновой кислоты, которая может быть идентифицирована и соединена с образованием пары со второй последовательностью штрих-кода второй амплифицированной последовательности.
Некоторые способы получения матричных нуклеиновых кислот включают введение последовательностей транспозона, включающих одноцепочечные линкеры. В одном из примеров последовательности транспозона (МЕ-Р1-линкер-Р2-МЕ; мозаичный конец-участок связывания праймера 1-линкер-участок связывания праймера 2-мозаичный конец) вводят в целевую нуклеиновую кислоту. Целевая нуклеиновая кислота, в которую введены последовательности транспозона/линкера, может быть подвергнута операции удлинения и амплификации.
В одном из примеров осуществления композиций и способов, рассмотренных в настоящем описании, для создания фрагмента целевой нуклеиновой кислоты, имеющего метку (тэг) на конце (тагментированного фрагмента или тагмента), применяют транспосомы, которые имеют симметричные транспозируемые концевые последовательности. Таким образом, каждый тагментированный фрагмент содержит идентичные концы, не имеющие направленности. Затем для амплификации количества копий матрицы (шаблона), составляющего от 2n до 2n*2x, где х соответствует числу циклов ПЦР, может быть применена ПЦР с одним праймером с использованием транспозонных концевых последовательностей. В следующем этапе посредством проведения ПЦР с праймерами могут быть добавлены дополнительные последовательности, такие как последовательности адаптора секвенирования.
В некоторых примерах осуществления может быть предпочтительно, чтобы каждая матричная нуклеиновая кислота включала по меньшей мере один участок связывания универсального праймера. Например, матричная нуклеиновая кислота может включать первые концевые последовательности, которые включают первый участок связывания универсального праймера, и вторые концевые последовательности, которые включают второй участок связывания универсального праймера. Участки связывания универсального праймера могут иметь различные варианты применения, например, применяться в процессе амплификации, секвенирования и/или идентификации одной или более матричных нуклеиновых кислот. Первый и второй участки связывания универсального праймера могут быть идентичными, по существу сходными, сходными или различными. Участки связывания универсального праймера могут быть введены в нуклеиновые кислоты различными способами, хорошо известными в данной области техники, например, соединением (связыванием) участков связывания праймера с нуклеиновыми кислотами, амплификацией нуклеиновых кислот с применением так называемых «хвостатых» праймеров (англ. - tailed primers, т.е. праймеров, имеющих на конце дополнительные не комплементарные амплифицируемой последовательности участки) и введением последовательности транспозона, включающей участок связывания универсального праймера.
Транспосомы
"Транспосома" включает фермент интеграции, такой как интеграза или транспозаза, и нуклеиновую кислоту, включающую участок распознавания интеграции, такой как участок распознавания транспозазы. В примерах осуществления, рассмотренных в настоящем описании, транспозаза может образовывать функциональный комплекс с участком распознавания транспозазы, который способен катализировать реакцию транспозиции. Транспозаза может связываться с участком распознавания транспозазы и вводить участок распознавания транспозазы в целевую нуклеиновую кислоту, находящуюся в СЕ, при проведении процесса, иногда называемого "тагментацией". В некоторых случаях такого введения одна нить (цепочка) участка распознавания транспозазы может быть перенесена в целевую нуклеиновую кислоту. В одном из примеров транспосома включает димерную транспозазу, включающую две субъединицы и две не непрерывные последовательности транспозона. В другом примере транспозаза включает димерную транспозазу, включающую две субъединицы и непрерывную последовательность транспозона.
Некоторые примеры осуществления могут включать применение гиперактивной транспозазы Tn5 и участка распознавания транспозазы Tn5-типа (Goryshin, Reznikoff, J. Biol. Chem., 273:7367 (1998)) или MuA транспозазы и участка распознавания транспозазы Mu, включающего концевые последовательности R1 и R2 (Mizuuchi, K., Cell, 35: 785, 1983; Savilahti, Н. et al., EMBO J., 14: 4893, 1995). Также могут быть применены последовательности ME, оптимизированные специалистом в данной области техники. Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
Дополнительные примеры систем транспозиции, которые могут быть применены в определенных примерах осуществления композиций и способов, рассмотренных в настоящем описании, включают Tn552 Staphylococcus aureus (Colegio et al., J. Bacterid., 183: 2384-8, 2001; Kirby C. et al., Mol. Microbiol., 43: 173-86, 2002), Ty1 (Devine & Boeke, Nucleic Acids Res., 22: 3765-72, 1994 и международная патентная заявка WO 95/23875), Транспозон Tn7 (Craig, N.L., Science. 271: 1512, 1996; Craig, N.L., обзор в публикации: Curr. Top Microbiol. Immunol., 204:27-48, 1996), Tn/O и IS10 (Kleckner N. et al., Curr. Top Microbiol. Immunol., 204:49-82, 1996), транспозаза Mariner (Lampe D.J. et al., EMBO J., 15: 5470-9, 1996), Tc1 (Plasterk R.H., Curr. Topics Microbiol. Immunol., 204: 125-43, 1996), Элемент P (Gloor, G.В., Methods Mol. Biol., 260: 97-114, 2004), Tn3 (Ichikawa & Ohtsubo, J. Biol. Chem. 265:18829-32, 1990), последовательности бактериального введения (Ohtsubo & Sekine, Curr. Top Microbiol. Immunol. 204: 1-26, 1996), ретровирусы (Brown et al., Proc. Natl. Acad. Sci. USA, 86:2525-9, 1989) и ретротранспозон дрожжей (Boeke & Corces, Annu. Rev. Microbiol. 43:403-34, 1989). Другие примеры включают IS5, Tn10, Tn903, IS911 и сконструированные варианты ферментов семейства транспозаз (Zhang et al., (2009) PLoS Genet. 5:e1000689. Epub 2009 Oct. 16; Wilson C. et al. (2007) J. Microbiol. Methods 71:332-5). Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
Другие примеры интеграз, которые могут быть применены в способах и композициях, рассмотренных в настоящем описании, включают ретровирусные интегразы и последовательности распознавания интеграз для таких ретровирусных интеграз, такие как интегразы, полученные из ВИЧ-1, ВИЧ-2, SIV (simian immunodeficiency virus, т.е. вирус иммунодефицита обезьян), PFV-1 (prototypic foamy virus, т.е. прототипный пенящий вирус), RSV (respiratory syncytial virus, т.е. респираторно-синцитиальный вирус).
Последовательности транспозона
Некоторые примеры осуществления композиций и способов, рассмотренных в настоящем описании, включают применение последовательностей транспозона. В некоторых примерах осуществления последовательность транспозона включает по меньшей мере один участок распознавания транспозазы. В некоторых примерах осуществления последовательность транспозона включает по меньшей мере один участок распознавания транспозазы и по меньшей мере один штрих-код. Последовательности транспозона, которые могут быть применены в способах и композициях, рассмотренных в настоящем описании, приведены в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки. В некоторых примерах осуществления последовательность транспозона включает первый участок распознавания транспозазы и второй участок распознавания транспозазы, между которыми расположен штрих-код.
Транспосомы, включающие не непрерывно расположенные последовательности транспозона
Некоторые транспосомы, рассмотренные в настоящем описании, включают транспозазу, включающую две последовательности транспозона. В некоторых таких примерах осуществления две последовательности транспозона не связаны друг с другом, т.е., другими словами, последовательности транспозона расположены не непрерывно по отношению друг к другу. Примеры таких транспосом известны в данной области техники; см., например, опубликованную патентную заявку US 2010/0120098, содержание которой полностью включено в настоящее описание посредством ссылки.
Петлеобразные структуры
В некоторых примерах осуществления транспосома включает нуклеиновые кислоты последовательности транспозона, которая связывает две субъединицы транспозазы с образованием "петлеобразного комплекса" или "петлеобразной транспосомы". В одном из примеров транспосома включает димерную транспозазу и последовательность транспозона. Петлеобразные комплексы могут обеспечивать введение транспозонов в целевую ДНК, сохраняя при этом упорядочивающую информацию исходной целевой ДНК без фрагментации целевой ДНК. Как будет показано ниже, петлеобразные структуры могут вводить праймеры, штрих-коды, индексы и подобные частицы в целевую нуклеиновую кислоту, сохраняя при этом физическую связность целевой нуклеиновой кислоты. В некоторых примерах осуществления СЕ может включать целевую нуклеиновую кислоту. В некоторых примерах осуществления последовательность транспозона петлеобразной транспосомы может включать участок фрагментации, то есть последовательность транспозона может быть фрагментирована с образованием транспосомы, включающей две последовательности транспозона. Такие транспосомы подходят для обеспечения того, что соседние фрагменты целевой ДНК, в которые встраиваются транспозоны, получают комбинации кодов, которые могут быть однозначно собраны на более поздней стадии проведения анализа.
Некоторые способы получения последовательностей транспозона
Последовательности транспозона, рассмотренные в настоящем описании, могут быть получены множеством различных способов. Примеры способов включают прямой синтез и способы удлинения шпилечной структуры. В некоторых примерах осуществления последовательности транспозона могут быть получены прямым синтезом. Например, последовательность транспозона, включающая нуклеиновую кислоту, может быть получена способами, включающими химический синтез. Такие способы хорошо известны в данной области техники и включают, например, твердофазный синтез с применением фосфорамидитовых предшественников, таких как фосфорамидиты, полученные из защищенных 2'-дезоксинуклеозидов, рибонуклеозидов или аналогов нуклеозидов. Примеры способов получения последовательностей транспозонов имеются, например, в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки.
В некоторых примерах осуществления, включающих петлеобразные транспосомы, могут быть получены последовательности транспозона, включающие однонитевой (одноцепочечный) линкер. В некоторых примерах осуществления линкер соединяет последовательности транспозона транспосомы таким образом, что последовательность транспозона, включающая первую последовательность распознавания транспозазы, присоединяется ко второй последовательности транспозона, включающей вторую последовательность распознавания транспозазы, в ориентации 5' к 3'. В некоторых примерах осуществления линкер соединяет последовательность транспозона, включающую первую последовательность распознавания транспозазы, со второй последовательностью транспозона, включающей вторую последовательность распознавания транспозазы, в ориентации 5' к 5' или ориентации 3' к 3'. Соединение последовательностей транспозона транспосомы либо в ориентации 5' к 5', либо в ориентации 3' к 3', может способствовать предотвращению взаимодействия элементов распознавания транспозазы, в частности, мозаичных элементов (ME или М), друг с другом. Соединенные последовательности транспозона могут быть получены посредством синтеза последовательностей транспозона, включающих либо альдегидную группу, либо группу оксиамина. Альдегидные и оксиаминные группы могут взаимодействовать, образуя ковалентную связь и соединяя, таким образом, последовательности транспозона.
В некоторых примерах осуществления могут быть получены транспосомы, включающие комплементарные последовательности. В одном из примеров осуществления в транспозазу помещают последовательности транспозона, включающие комплементарные "хвосты". Хвосты гибридизуются с образованием соединенной последовательности транспозона. Для снижения вероятности гибридизации между транспосомами, гибридизация может быть проведена в разбавленной среде.
Направленное введение
В некоторых примерах осуществления способов и композиций, рассмотренных в настоящем описании, последовательности транспозона могут быть введены в конкретные являющиеся мишенями последовательности целевой нуклеиновой кислоты. Транспозиция в днДНК (двухнитевую ДНК, англ. double stranded DNA, сокращенно dsDNA) может быть более эффективной, чем транспозиция в мишени, которые представляют собой онДНК (однонитевую ДНК, англ. single-stranded DNA, сокращенно ssDNA). В некоторых примерах осуществления днДНК подвергают детанурации с образованием онДНК и подвергают ренатурации (соединению комплементарных нитей) в присутствии олигонуклеотидных зондов (20-200 оснований). Эти зонды образуют участки днДНК, которые могут быть эффективно применены в качестве участков интеграции с транспосомами, рассмотренными в настоящем описании. В некоторых примерах осуществления целенаправленное воздействие на днДНК может включать образование D-петли с участием олигозондов с покрытием из recA и последующее образование триплекса. В некоторых таких примерах осуществления D-петля представляет собой предпочтительный субстрат для транспосом, включающих транспозазу Tn4430. В других примерах осуществления целенаправленное воздействие на интересующие области днДНК может включать воздействие последовательность-специфичных белков, связывающих ДНК, таких как комплексы "цинковые пальцы" и другие аффинные лиганды к специфичным областям ДНК.
В некоторых примерах осуществления для целенаправленного введения в целевую нуклеиновую кислоту могут быть применены транспосомы, включающие транспозазу, предпочтительный субстрат которой в целевой нуклеиновой кислоте представляет собой ошибочно (вопреки принципу комплементарности) спаренные основания. Например, некоторые MuA транспозазы, такие как HYPERMU (Epicenter), имеют предпочтение к ошибочно спаренным мишеням. В некоторых таких примерах осуществления олигонуклеотидные зонды, включающие ошибочное спаривание, претерпевают ренатурацию с образованием однонитевой целевой нуклеиновой кислоты. Транспосомы, включающие MuA транспозазы, такие как HYPERMU, могут быть применены для оказания целенаправленного воздействия на ошибочно спаренные последовательности оснований в целевой нуклеиновой кислоте.
Элемент, сохраняющий связность (СЕ)
Элемент, сохраняющий связность (англ. contiguity preserving element, сокращенно СЕ), представляет собой физическую единицу, которая сохраняет близкое расположение (или связность) по меньшей мере двух или более или всех анализируемых веществ при проведении одного или более этапов анализа и обеспечивает доступ к аналитическим реагентам, а также может быть объединена и разделена множество раз без нарушения близкого расположения анализируемых веществ.
В некоторых примерах осуществления СЕ может представлять собой твердую подложку. В одном из примеров осуществления СЕ может представлять собой эмульсию или каплю. В некоторых примерах осуществления СЕ представляет собой гель, гидрогель, или гелевую гранулу. В некоторых примерах осуществления СЕ может включать твердую подложку, такую как гранулы. В некоторых примерах осуществления гранулы могут дополнительно включать антитела, олигонуклеотиды и/или штрих-коды. В другом примере осуществления СЕ может составлять наношар ДНК, полученный способом WGA, RCA (сокращенно от англ. rolling circle amplification, амплификация по типу катящегося кольца) или конденсацией любого реагента, включающего нуклеиновую кислоту.
В некоторых примерах осуществления СЕ может быть получен введением нуклеиновой кислоты, полученной из клеток или из единичной клетки, или продукта ее амплификации (способом WGA и т.д.) в полимерную матрицу, такую как агароза, полиакриламид, альгинат и т.д. В некоторых примерах осуществления связность содержимого клеток или единичной клетки внутри СЕ поддерживается за счет сохранения физически близкого расположения компонентов друг к другу посредством инкапсуляции (например, в полимерной матрице), иммобилизации на грануле или захватом, которые эффективно сохраняют связность информации в СЕ в процессе многократного повторения циклов объединения и перераспределения. Возможность независимого объединения и разделения набора СЕ, а также возможность реагирования с аналитическими реагентами, повторного объединения и разделения и т.д. при условии сохранения связности анализируемых веществ, составляющих индивидуальный СЕ, позволяет производить комбинаторное индексирование в различных этапах объединения и разделения.
В некоторых примерах осуществления анализируемые вещества, находящиеся в элементе, сохраняющем связность, доступны для аналитических реагентов, которые включают водные растворы, ферменты (например, фрагментазы, полимеразы, лигазы, транспозазы, киназы, рестрикционные эндонуклеазы, протеазы, фосфатазы, липазы), адапторы нуклеиновых кислот, штрих-коды нуклеиновых кислот, метки.
В некоторых примерах осуществления СЕ включает клетки или единичную клетку. В некоторых примерах осуществления СЕ включает нуклеиновую кислоту, получаемую из клеток или из единичной клетки, такую как ДНК, мРНК или кДНК; макромолекулы клеток или единичной клетки, включающие белки, полисахариды, липиды и нуклеиновые кислоты, а также небольшие молекулы, такие как первичные метаболиты, вторичные метаболиты и природные продукты, получаемые из клеток или из единичной клетки. В некоторых примерах осуществления перед созданием СЕ, включающего нуклеиновую кислоту, нуклеиновая кислота подвергается амплификации, например, посредством ПЦР или амплификации целого генома. В некоторых примерах осуществления анализ дНК и мРНК может быть осуществлен параллельно.
В некоторых примерах осуществления одно или более анализируемых веществ, находящихся в СЕ, подвергается мечению одной или более метками. Примеры меток включают, без ограничений, штрих-коды или индексы из ДНК, флуоресцентные метки, хемилюминесцентные метки, штрих-коды или индексы из РНК, радиоактивные метки, антитело, включающее метку, гранулы, включающие метку.
В некоторых примерах осуществления способ может включать следующие этапы: (а) компартментализацию СЕ, включающего целевую нуклеиновую кислоту, в результате чего получают множество первых емкостей; (b) предоставление первого индекса целевой нуклеиновой кислоте, находящейся в каждой первой емкости, что приводит к получению первой проиндексированной нуклеиновой кислоты; (с) объединение первых проиндексированных нуклеиновых кислот; (d) компартментализацию первых проиндексированных матричных нуклеиновых кислот, в результате чего получают множество вторых емкостей; (е) предоставление второго индекса первой проиндексированной матричной нуклеиновой кислоте, находящейся в каждой второй емкости, что приводит к получению второй проиндексированной нуклеиновой кислоты. Для создания дополнительных виртуальных компартментов выполнение этапов а-е может быть продолжено за счет добавления дополнительных циклов одного или более этапов а-е. Этот способ комбинаторного индексирования может быть применен для эффективного создания большого количества виртуальных компартментов из ограниченного количества физических компартментов.
В некоторых примерах осуществления способ может включать следующие этапы: (а) обеспечение наличия СЕ, включающего анализируемые вещества, не являющиеся нуклеиновыми кислотами (например, белки), к которым присоединены репортеры на основе нуклеиновой кислоты; (b) компартментализацию СЕ, в результате которой получают множество первых емкостей; (с) предоставление первого индекса целевым репортерам на основе нуклеиновой кислоты, находящимся в каждой первой емкости, что приводит к получению первого проиндексированного целевого репортера на основе нуклеиновой кислоты; (с) объединение первых проиндексированных репортеров на основе нуклеиновой кислоты; (d) компартментализацию первых проиндексированных СЕ, в результате которой получают множество вторых емкостей; (е) предоставление второго индекса первым проиндексированным репортерам на основе нуклеиновой кислоты, находящимся в каждой второй емкости, что приводит к получению второго проиндексированного репортера на основе нуклеиновой кислоты. Для создания дополнительных виртуальных компартментов выполнение этапов а-е может быть продолжено за счет добавления дополнительных циклов одного или более этапов а-е. Этап компартментализации может дополнительно включать амплификацию нуклеиновой кислоты или этап захвата, например, способами PLA, PEA или другими методиками захвата или амплификации нуклеиновых кислот.
В некоторых примерах осуществления ткани, зафиксированные в формалине и погруженные в парафин, могут быть разделены на срезы, и каждый срез добавлен в СЕ. Затем в каждом СЕ может быть произведен анализ содержимого или последовательности, и впоследствии может быть получена 2D или 3D карта содержимого каждого среза (пластинки).
В некоторых примерах осуществления нуклеиновая кислота или нуклеиновые кислоты могут быть погружены в матрицу, которая ограничивает нуклеиновые кислоты в определенном пространстве, но обеспечивает доступ реагентов для проведения этапов, которые включают, без ограничений, амплификацию (ПЦР, полногеномную амплификацию, случайное (неупорядоченное) удлинение праймера и т.д.), лигирование, транспозицию, гибридизацию, расщепление рестрикционным ферментом и мутагенез ДНК. Примеры мутагенеза включают, без ограничений, удлинение сниженной точности (с использованием ошибающейся полимеразы), алкилирование, бисульфитную конверсию, применение индуцированных активацией (цитидин) дезаминаз и т.д.
В некоторых примерах осуществления способы и композиции, в которых применяют СЕ, могут быть объединены с методиками мутагенной сборки, что существенно улучшает сборку информации о последовательности ДНК. Геномная ДНК может быть фрагментирована и разделена на множество СЕ, в котором каждый СЕ включает фракцию генома. Различные фракции генома получают различные штрих-коды, что позволяет независимо осуществлять сборку фракций генома. Одной из наиболее сложных задач является сборка повторов. Один из способов сборки повторов рассмотрен в публикации Levy, D.; Wigler, М. (2014) "Facilitated sequence counting and assembly by template mutagenesis (Упрощенный подсчет и сборка последовательности способом матричного мутагенеза)". Proc. of the Natl. Acad. Sci., 111 (43). E4632-E4637. ISSN 0027-8424. Способы сборки также рассмотрены в заявке US 20140024537, озаглавленной: "Methods and Systems for Determining Haplotypes and Phasing of Haplotypes (Способы и системы для определения гаплотипов и фазирования гаплотипов)", содержание которой полностью включено в настоящее описание посредством ссылки. Содержание цитируемых выше документов включено в настоящее описание посредством ссылки.
В способах, в которых распределение ДНК фрагментов объединено с мутагенезом или подобной методикой, распределение может быть проведено с применением СЕ, лунок, индексов, виртуальных индексов, физических компартментов, капель и т.д. Мутагенез может быть проведен множеством способов, которые включают, без ограничений, удлинение со сниженной точностью, алкилирование, бисульфитную конверсию, применение индуцированных активацией (цитидин) дезаминаз и т.д. Способ распределения нуклеиновой кислоты по СЕ и методика проведения мутагенеза могут быть полезны в тех случаях, когда сборка повторов или сложных областей традиционными способами становится затруднительной.
В некоторых примерах осуществления способы, рассмотренные в настоящем описании, могут быть применены для вариантного фазирования, сборки генома (заново), скрининга популяций клеток для определения неоднородности популяции и определения различий между клетками.
В некоторых примерах осуществления кДНК, получаемую из клеток или из единичной клетки, извлекают в емкости и превращают в СЕ, проиндексированные с помощью виртуальной компартментализации, рассмотренной выше. Это позволяет производить экспрессию гена и транскрипционный анализ 1000, 10000, 100000 и даже большего количества различных проиндексированных библиотек единичных клеток.
В некоторых примерах осуществления, из-за выборки с экспоненциальным распределением (пуассоновской выборки), количество единичных клеток, которое может быть проанализировано, приблизительно составляет 10% от общего количества виртуальных компартментов. Для четырехуровневой схемы индексирования с использованием 96-луночных компартментов в каждом этапе, в одном эксперименте может быть проанализировано общее количество единичных клеток, составляющее 10%×96×96×96×96 = более 8 миллионов при использовании общего количества физических компартментов, составляющего 4×96 = 384. В примере, представленном на Фиг. 3, для создания большого количества виртуальных компартментов (набор молекул или элементов библиотеки ДНК, содержащий уникальную комбинацию индексов) применяли четыре этапа комбинаторного разбавления и объединения. В этом примере непрерывный резервуар для ДНК создают инкапсуляцией содержимого единичной клетки в полимерной матрице (например, в РАМ, т.е. полиакриламиде, от англ. polyacrylamide). В одном из конкретных предпочтительных примеров осуществления геномного анализа содержимое геномной ДНК единичной клетки подвергают амплификации способом MDA (амплификация целого генома (WGA) с множественным замещением цепи, англ.: WGA multiple displacement amplification reaction). Этот продукт MDA единичной клетки составляет резервуар ДНК, которую обрабатывают в соответствии с комбинаторной схемой индексирования. Для экспрессии гена препарат кДНК единичной клетки может быть получен из резервуара единичной клетки, как описано в работе Picelli (Picelli, 2014). В предпочтительном примере осуществления исходные индексы прикрепляют к геномной ДНК или кДНК с помощью стандартных методик создания библиотек с использованием фрагментации (ферментативной) и адапторного лигирования или с помощью тагментации с использованием комплексов транспозазы. В предпочтительном примере осуществления последующие индексы прикрепляют к библиотекам посредством лигирования или ПЦР. Предпочтительным является лигирование, поскольку проиндексированные адапторы легко добавляются при последовательном присоединении. Окончательный этап может включать только индексированную ПЦР или лигирование и ПЦР.
В некоторых примерах осуществления целевая нуклеиновая кислота имеет гистонную/белковую защиту (см. публикацию Buenrostro et al. Nature Methods 10, 1213-1218 (2013) doi:10.1038/nmeth.2688, содержание которой включено в настоящее описание посредством ссылки). Варианты применения включают эпигеномный анализ и анализ открытого хроматина и ДНК-связывающих белков, а также положения нуклеосомы.
В некоторых примерах осуществления элементы, сохраняющие связность, могут включать единичную клетку, и нуклеиновая кислота клетки может быть подвергнута амплификации. Затем каждый элемент, сохраняющий связность, может быть уникальным образом проиндексирован с помощью комбинаторной схемы индексирования. Результаты прочтения коротких последовательностей могут быть сгруппированы на основании уникального индекса. Результаты секвенирования длинных синтетических последовательностей могут быть по отдельности собраны заново на основании уникального индекса (публикация: McCoy et al. Plosone 2014 (DOI: 10.1371/journal.pone.0106689) Illumina TruSeq Synthetic Long-Reads Empower De Novo Assembly and Resolve Complex, Highly-Repetitive Transposable Elements, содержание которой включено в настоящее описание посредством ссылки).
В некоторых примерах осуществления СЕ может включать содержимое клетки, например, белки, органеллы, РНК, ДНК, рибосомы, антитела, стероиды, специализированные структуры, гликаны, липиды, небольшие молекулы, молекулы, которые могут влиять на биологические пути, моно- и полисахариды, алкалоиды, первичные и вторичные метаболиты.
В некоторых примерах осуществления органеллы, находящиеся в СЕ, могут быть различным образом окрашены. Примеры реагентов, окрашивающих органеллы, представляют собой флуоресцентные белки, мишенью которых являются органеллы (Cellular Lights™), классические окрашивающие вещества для органелл или конъюгаты красителей, которые селективно или неселективно могут метить органеллы или клеточные структуры.
В некоторых примерах осуществления анализируемым веществом, представляющим интерес, которое содержится в СЕ, является белок. Белки могут быть мечеными штрих-кодами или альтернативными метками. Штрих-коды или метки могут быть считаны традиционными способами прочтения массивов или последовательностей. Для идентификации и определения содержания белков в каждой индивидуальной клетке, наряду с определением последовательностей штрих-кодов, могут быть применены способы близкого лигирования и индексации последовательности антителами для обнаружения белков (публикация Fredriksson et al., Nature Biotechnology 20, 473-477 (2002), содержание которой включено в настоящее описание посредством ссылки). Мечение белков может быть проведено различными способами (www.piercenet.com/cat/protein-antibody-labeling), известными специалисту в данной области техники, которые включают методики сайт-специфичного химического мечения in vivo и in vitro.
Способ близкого лигирования (Duo-link PLA, wwww.sigmaaldrich.com/life-science/molecular-biology/molecular-bioloqv-products.html?TablePage=112232138, Multiplexed proximity ligation assay (Мультиплексный способ близкого лигирования) ЕР 2714925 А1) представляет собой пример обнаружения белков, взаимодействий белок-белок и пост-трансляционных модификаций, который может быть адаптирован для работы с элементом, сохраняющим связность. Этот способ может быть применен для обнаружения и количественного определения определенного белка или белкового комплекса в элементе, сохраняющем связность. Один из примеров технологической методики состоит в следующем: (1) получение элемента или элементов, сохраняющих связность, (2) промывка и добавление пары или пар первичных антител, специфичных для интересующего белка, (3) промывка и окрашивание антителами, мечеными штрих-кодом. В каждую популяцию элементов, сохраняющих связность, находящихся в емкости, добавляют различные меченые штрих-кодами антитела. Способ близкого лигирования позволяет получать пару или пары первичных антител, амплифицируемые продукты, которые содержат штрих-код, уникальный для определенного белка. Один штрих-код может быть специфичным для белка, представляющего интерес, в то время как другие штрих-коды применяют для сопоставления белка с определенным элементом, сохраняющим связность, и/или клеткой. Фракции могут быть различным образом помечены при проведении одного или более этапов разделения и объединения. Таким образом, содержимое отдельных элементов, сохраняющих связность, может быть проанализировано без необходимости проведения индивидуальной обработки каждого элемента, сохраняющего связность, во множестве параллельных этапов. Таким образом, особенно удобно обрабатывать 10, 100, 1000, 10000, 100000, 1000000, 10000000, 100000000 и более элементов, сохраняющих связность. Стероиды и небольшие молекулы могут быть определены способом, аналогичным описанному для идентификации белков. Для стероидов могут быть созданы антитела, меченые штрих-кодом (Hum Reprod. 1988 Jan; 3(1):63-8. Antibodies against steroids (Антитела против стероидов).  P. et al.). Для альтернативных определений были описаны флуоресцентный краситель и радиоактивные конъюгаты (www.jenabioscience.com/cms/en/1/cataloq/2305 fluorescent hormones.html). Такие конъюгаты антител для определения стероидов могут быть обработаны так, как описано выше. Для обнаружения одного или более компонентов элемента, сохраняющего связность, могут быть применены различные способы. Один или более компонентов элемента, сохраняющего связность, может быть помечен хемолюминесцентными, флуоресцентными, радиоактивными зондами, ДНК-метками (тэгами), штрих-кодами и индексами. Для усиления сигнала могут быть применены методики амплификации. Например, амплификация по типу катящегося кольца (англ. сокр. RCA) может быть применена для обнаружения анализируемых веществ. Затем продукты RCA могут идентифицированы при помощи секвенирования, флуоресцентных декодеров (зондов). Дополнительно для прочтения могут быть применены микрочипы (микропанели), наборы белков, секвенирование, нанопоровое секвенирование, секвенирование следующего поколения, капиллярный электрофорез, массивы (наборы) гранул.
P. et al.). Для альтернативных определений были описаны флуоресцентный краситель и радиоактивные конъюгаты (www.jenabioscience.com/cms/en/1/cataloq/2305 fluorescent hormones.html). Такие конъюгаты антител для определения стероидов могут быть обработаны так, как описано выше. Для обнаружения одного или более компонентов элемента, сохраняющего связность, могут быть применены различные способы. Один или более компонентов элемента, сохраняющего связность, может быть помечен хемолюминесцентными, флуоресцентными, радиоактивными зондами, ДНК-метками (тэгами), штрих-кодами и индексами. Для усиления сигнала могут быть применены методики амплификации. Например, амплификация по типу катящегося кольца (англ. сокр. RCA) может быть применена для обнаружения анализируемых веществ. Затем продукты RCA могут идентифицированы при помощи секвенирования, флуоресцентных декодеров (зондов). Дополнительно для прочтения могут быть применены микрочипы (микропанели), наборы белков, секвенирование, нанопоровое секвенирование, секвенирование следующего поколения, капиллярный электрофорез, массивы (наборы) гранул.
Установление связности содержимого клетки
В некоторых примерах осуществления связность содержимого клеток или единичной клетки, примеры которого включают, без ограничений, ДНК, РНК, белок, органеллы, метаболиты, небольшие молекулы, может быть сохранено в элементе, сохраняющем связность (СЕ). СЕ может быть создан множеством способов, примеры которых включают, без ограничений, инкапсуляцию содержимого в капле, включение содержимого в полимерную матрицу (после инкапсуляции) и прикрепление содержимого к грануле. В предпочтительном примере осуществления СЕ проницаем для аналитических реагентов, таких как водные буферные растворы, ферменты (полимеразы, лигазы, транспозазы и т.д.), нуклеотиды, олигонуклеотидные адапторы, транспозоны и праймеры и т.д. Проиндексированные библиотеки получают из СЕ как описано выше. Повторные циклы разбавления с образованием физических компартментов, присоединение компартмент-специфических индексов, объединение и повторное разбавление с образованием дополнительных компартментов приводит к созданию экспоненциального количества виртуальных компартментов. При правильной организации способа, по окончании работы содержимому каждого СЕ будет виртуально присвоен уникальный штрих-код. Показанная в примере, изображенном на Фиг. 1, четырехуровневая схема индексирования позволяет получать большое количество виртуальных компартментов и индексов (>84 миллионов) при общем количестве физических компартментов, составляющем всего лишь 4×96=384. В предпочтительном примере осуществления компартмент-специфические индексы добавляют на каждом уровне компартментализации с помощью тагментации, лигирования или ПЦР. В предпочтительном примере осуществления каждый физический компартмент в каждом этапе имеет уникальный индекс. В последующей компартментализации могут быть использованы те же или другие индексы. Если в каждом последующем уровне компартментализации применяют одни и те же индексы, то положение индекса в цепочке конечной последовательности будет идентифицировать компартмент и уровень компартментализации.
Анализ клеточных компонентов с использованием капель
В одном из примеров осуществления СЕ может представлять собой эмульсию или каплю. В одном из примеров осуществления СЕ представляет собой каплю, находящуюся в контакте с маслом. В одном из примеров СЕ, включающий нуклеиновую кислоту, включает разбавление и разделение образца нуклеиновой кислоты на капли, компартменты или гранулы. В одном из примеров осуществления капля включает клетки или единичную клетку. В одном из примеров осуществления СЕ, включающий единичные клетки, включает разбавление и разделение единичной клетки на капли, компартменты или гранулы.
В некоторых примерах осуществления "капля" может представлять собой объем жидкости, находящийся в капельном манипуляторе (манипуляторе для работы с каплями), и этот объем по меньшей мере частично ограничен текучей заполняющей средой. Например, капля может быть полностью окружена текучей заполняющей средой, или она может быть ограничена текучей заполняющей средой и одной или более поверхностью капельного манипулятора. Капли могут иметь огромное множество различных форм, неограничивающие примеры которых обычно включают следующие формы: диска, пули, усеченной сферы, эллипсоида, сферы, частично сжатой сферы, полусферы, овоида, цилиндра и различные формы, образующиеся в результате операций с каплями, таким как сливание или расщепление, или образующиеся в результате контакта таких форм с одной или более поверхностями капельного манипулятора.
Капельные манипуляторы применяют для проведения множества различных операций с каплями. Капельный манипулятор обычно включает две подложки, разделенные пространством (зазором, англ. space). Подложки включают электроды для проведения операций с каплями. Пространство обычно заполняют текучей заполняющей средой, которая не смешиваема с текучей средой, с которой производят манипуляции на капельном манипуляторе. Поверхностям, обращенным внутрь пространства, обычно придают гидрофобные свойства. Анализ генетического материала (геномика) и его экспрессии (функциональная геномика), протеомика, комбинаторный анализ библиотек и другие мультиплексные биоаналитические способы могут быть осуществлены в каплях, а последующие операции могут быть выполнены на аналитическом капельном манипуляторе. Способы манипуляций с каплями при помощи капельного манипулятора рассмотрены в опубликованных патентных заявках US 20100130369 и US 20130203606 соответственно, содержание каждой из которых включено в настоящее описание посредством ссылки.
"Капельный манипулятор" означает устройство для манипуляций с каплями. Примеры капельных манипуляторов рассмотрены, например, в следующих публикациях: Pamula et al., патент US 6911132, озаглавленный "Apparatus for Manipulating Droplets by Electrowetting-Based Techniques (Устройство для манипуляций с каплями на основе методик электросмачивания)", выданный 28 июня 2005 г.; Pamula et al., опубликованная патентная заявка US 20060194331, озаглавленная "Apparatuses and Methods for Manipulating Droplets on a Printed Circuit Board (Устройства и способы манипуляций с каплями на печатной плате)", опубликованная 31 августа 2006 г.; Pollack et al., Международная патентная заявка WO/2007/120241, озаглавленная "Droplet-Based Biochemistry (Биохимия на основе капель)", опубликованная 25 октября 2007 г.; Shenderov, патент US 6773566, озаглавленный "Electrostatic Actuators for Microfluidics and Methods for Using Same (Электростатические манипуляторы для микроструйных устройств и способы их применения)", выданный 10 августа 2004 г.; Shenderov, патент US 6565727, озаглавленный "Actuators for Microfluidics Without Moving Part (Манипуляторы для микроструйных устройств, не имеющие движущихся деталей)", выданный 20 мая 2003 г.; Kim et al., опубликованная патентная заявка US 20030205632, озаглавленная "Electrowetting-driven Micropumping (Микроперекачивание, приводимое в движение электросмачиванием)", опубликованная 6 ноября 2003 г.; Kim et al., опубликованная патентная заявка US 20060164490, озаглавленная "Method and Apparatus for Promoting the Complete Transfer of Liquid Drops from a Nozzle (Способ и устройство для улучшения полного переноса капель жидкости из сопла)", опубликованная 27 июля 2006 г.; Kim et al., опубликованная патентная заявка US 20070023292, озаглавленная "Small Object Moving on Printed Circuit Board (Перемещение мелких объектов по печатной плате)", опубликованная 1 февраля 2007 г.; Shah et al., опубликованная патентная заявка US 20090283407, озаглавленная "Method for Using Magnetic Particles in Droplet Microfluidics (Способ применения магнитных частиц в капельном микроструйном устройстве)", опубликованная 19 ноября 2009 г.; Kim et al., опубликованная патентная заявка US 20100096266, озаглавленная "Method and Apparatus for Real-time Feedback Control of Electrical Manipulation of Droplets on Chip (Способ и устройство для контроля отклика в режиме реального времени при электрических манипуляциях с каплями на чипе)", опубликованная 22 апреля 2010 г.; Velev, патент US 7547380, озаглавленный " Droplet Transportation Devices and Methods Having a Fluid Surface (Устройства и способы для транспортировки капель, имеющие текучую поверхность)", выданный 16 июня 2009 г.; Sterling et al., патент US 7163612, озаглавленный "Method, Apparatus and Article for Microfluidic Control via Electrowetting, for Chemical, Biochemical and Biological Assays and the Like (Способ, устройство и изделие для управления микроструйным устройством посредством электросмачивания, для проведения химических, биохимических, биологических и подобных анализов)", выданный 16 января 2007 г.; Becker et al., патент US 7641779, озаглавленный "Method and Apparatus for Programmable Fluidic Processing (Способ и устройство для программируемой струйной обработки)", выданный 5 января 2010 г.; Becker et al., патент US 6977033, озаглавленный "Method and Apparatus for Programmable Fluidic Processing (Способ и устройство для программируемой струйной обработки)", выданный 20 декабря 2005 г.; Decre et al., патент US 7328979, озаглавленный "System for Manipulation of a Body of Fluid (Система для манипуляции объемом текучей среды)", выданный 12 февраля 2008 г.; Yamakawa et al., опубликованная патентная заявка US 20060039823, озаглавленная "Chemical Analysis Apparatus (Устройство для химического анализа)", опубликованная 23 февраля 2006 г.; Wu, опубликованная патентная заявка US 20110048951, озаглавленная "Digital Microfluidics Based Apparatus for Heat-exchanging Chemical Processes (Устройства на основе микроструйной методики для теплообменных химических способов)", опубликованная 3 марта 2011 г.; Fouillet et al., опубликованная патентная заявка US 20090192044, озаглавленная "Electrode Addressing Method (Способ адресации электрода)", опубликованная 30 июля 2009 г.; Fouillet et al., патент US 7052244, озаглавленный "Device for Displacement of Small Liquid Volumes Along a Micro-catenary Line by Electrostatic Forces (Устройство для вытеснения небольших объемов жидкости вдоль микроцепной линии под действием электростатических сил)", выданный 30 мая 2006 г.; Marchand et al., опубликованная патентная заявка US 20080124252, озаглавленная "Droplet Microreactor (Капельный микрореактор)", опубликованная 29 мая 2008 г.; Adachi et al., опубликованная патентная заявка US 20090321262, озаглавленная "Liquid Transfer Device (Устройство для переноса жидкости)", опубликованная 31 декабря 2009 г.; Roux et al., опубликованная патентная заявка US 20050179746, озаглавленная "Device for Controlling the Displacement of a Drop Between Two or Several Solid Substrates (Устройство для управления вытеснения капли между двумя или несколькими твердыми подложками)", опубликованная 18 августа 2005 г.; и Dhindsa et al., "Virtual Electrowetting Channels: Electronic Liquid Transport with Continuous Channel Functionality (Виртуальные канали электросмачивания: Электронный транспорт жидкости с непрерывной функциональностью каналов)", Lab Chip, 10:832-836 (2010), где содержание каждого из цитируемых документов полностью включено в настоящее описание посредством ссылки. Некоторые капельные манипуляторы могут включать одну или более подложек, между которыми расположен зазор для операций с каплями, и электроды, присоединенные (например, нанесенные в виде слоя, прикрепленные к и/или погруженные в) к одной или более подложкам и установленные для проведения одной или более операций с каплями. Например, некоторые капельные манипуляторы включают основную (или нижнюю) подложку, электроды для операций с каплями, соединенные с подложкой, один или более диэлектрических слоев поверх подложки и/или электродов и необязательно один или более гидрофобных слоев поверх подложки; при этом диэлектрические слои и/или электроды образуют поверхность для операций с каплями. Также может быть установлена верхняя подложка, которая отделяется от поверхности для операций с каплями зазором, обычно называемым зазором для операций с каплями. Различные варианты размещения электродов на верхней и/или нижней подложках рассмотрены в цитируемых выше патентах и патентных заявках, и некоторые новые варианты размещения электродов рассмотрены в настоящем описании. При проведении операций с каплями предпочтительно, чтобы капли оставались в постоянном контакте или находились в частом контакте с электродом заземления или электродом сравнения. В зазоре электрод заземления или сравнения может быть соединен с верхней подложкой, обращенной к зазору, нижней подложкой, обращенной к зазору. В тех случаях, когда электроды устанавливают на обеих подложках, электрические контакты для соединения электродов с капельным манипулятором для управления или мониторинга электродов, могут быть соединены с одной или обеими пластинами. В некоторых случаях электроды на одной подложке соединены электрическим соединением с другой подложкой таким образом, что только одна подложка находится в контакте с капельным манипулятором. В одном из примеров осуществления проводящий материал (например, эпоксид, такой как MASTER BOND™ Polymer System EP79, поставляемый Master Bond, Inc., Hackensack, NJ) обеспечивает электрическое соединение между электродами, находящимися на одной подложке, и электрическими путями (цепями), находящимися на других подложках; например, таким проводящим материалом может быть соединен электрод заземления, находящийся на верхней подложке, с электрической цепью, находящейся на нижней подложке. В тех случаях, когда применяют множество подложек, между подложками может быть установлен разделитель, определяющий высоту зазора между подложками и ограничивающий имеющиеся на манипуляторе дозирующие резервуары (англ. dispensing reservoirs). Высота разделителя может составлять, например, по меньшей мере приблизительно 5 мкм, 100 мкм, 200 мкм, 250 мкм, 275 мкм или более. В альтернативном варианте или дополнительно максимальная высота разделителя может составлять приблизительно 600 мкм, 400 мкм, 350 мкм, 300 мкм или менее. Разделитель может быть, например, образован слоем выступов, выступающих за пределы верхней или нижней подложки, и/или материалом, введенным между верхней и нижней подложками. В одной или более подложках могут быть образованы одно или более отверстий для создания канала для текучей среды, через который жидкость может быть направлена в зазор для операций с каплями. В некоторых случаях одно или более отверстий могут быть сопоставлены для взаимодействия с одним или более электродами, например, сопоставлены таким образом, чтобы жидкость, протекающая через отверстие, протекала достаточно близко к одному или более электродам для операций с каплями, что позволяет электродам для операций с каплями эффективно выполнять операции с каплями жидкости. В некоторых случаях основная (или нижняя) и верхняя подложки могут быть сформованы в виде одного целостного компонента. На основной (или нижней) и/или верхней подложках и/или в зазоре могут быть установлены один или более электродов сравнения. Примеры установки электродов сравнения приведены в цитируемых выше патентах и патентных заявках. В различных примерах осуществления манипуляции с каплями в капельном манипуляторе могут быть произведены при помощи электрода, например, за счет электросмачивания или диэлектрофореза или Кулоновских сил. Примеры других методик управления операциями с каплями, которые могут быть применены в капельных манипуляторах согласно изобретению, включают применение устройств, создающих гидродинамическое давление текучей среды, таких, как устройства, в основе действия которых лежат механические принципы (например, внешние шприцевые насосы, пневматические мембранные насосы, вибрационные мембранные насосы, вакуумные устройства, устройства с применением центробежных сил, пьезоэлектрические/ультразвуковые насосы и устройства с применением акустических воздействий); электрические или магнитные принципы (например, электроосмотическое течение, электрокинетические насосы, пробки из магнитной жидкости, электрогидродинамические насосы, применение магнитных сил притяжения или отталкивания и магнитогидродинамические насосы); термодинамические принцип (например, образование газовых пузырей/увеличение объема за счет фазового изменения); другие принципы поверхностного смачивания (например, электросмачивание и оптоэлектросмачивание, а также градиенты поверхностного натяжения, вызываемые химическим, температурным, структурным и радиоактивным взаимодействием); сила тяжести; поверхностное натяжение (например, капиллярное действие); электростатические силы (например, электроосмотическое течение); центробежное течение (подложка расположена на компакт-диске, который вращается); магнитные силы (например, течение, вызываемое осцилляцией ионов); магнитогидродинамические силы; и вакуум или разность давлений. В определенных примерах осуществления для проведения операции с каплей в капельном манипуляторе согласно настоящему изобретению могут быть применены комбинации двух или более указанных выше методик. Аналогично, одна или более указанных выше методик может быть применена для доставки жидкости в зазор для операций с каплями, например, из резервуара, находящегося в другом устройстве, или из внешнего резервуара капельного манипулятора (например, резервуара, связанного с подложкой капельного манипулятора и каналом течения из резервуара в зазор для операций с каплями). В некоторых капельных манипуляторах согласно настоящему изобретению поверхности для операций с каплями могут быть изготовлены из гидрофобных материалов, или на них могут быть нанесены покрытия, или они могут быть обработаны для придания им гидрофобности. Например, в некоторых случаях некоторая часть поверхностей или все поверхности для операций с каплями могут быть функционализированы материалами или химическим веществами с низкой поверхностной энергией, например, осаждением или синтезом in situ с использованием таких соединений, как поли- или перфорированные соединения в растворе или полимеризуемые мономеры. Примеры включают TEFLON® AF (поставляемый DuPont, Wilmington, DE), члены класса материалов Cytop, покрытия класса FLUOROPEL® гидрофобных и супергидрофобных покрытий (поставляемые Cytonix Corporation, Beltsville, MD), силановые покрытия, фторсилановые покрытия, гидрофобные производные фосфонатов (например, поставляемые Aculon, Inc) и электронные покрытия NOVEC™ (поставляемые 3М Company, St. Paul, MN), другие фторированные мономеры для плазмохимического осаждения из газовой фазы (англ. plasma enhanced chemical vapor deposition, сокращенно PECVD) и органосилоксан (например, SiOC) для PECVD. В некоторых случаях поверхность для операций с каплями может включать гидрофобное покрытие, толщина которого составляет от приблизительно 10 нм до приблизительно 1000 нм. Кроме того, в некоторых примерах осуществления верхняя подложка капельного манипулятора включает электропроводящий органический полимер, на который затем наносят гидрофобное покрытие или обрабатывают иным способом для придания гидрофобности поверхности для операций с каплями. Например, электропроводящий органический полимер, осаждаемый на полимерную подложку, может представлять собой поли-3,4-этилендиокситиофен/полистиролсульфонат (англ. poly(3,4-ethylenedioxythiophene) poly(styrenesulfonate), сокращенно PEDOT:PSS). Другие примеры электропроводящих органических полимеров и альтернативных проводящих слоев рассмотрены в публикации Pollack et al., Международная патентная заявка WO/2011/002957, озаглавленная "Droplet Actuator Devices and Methods (Капельные манипуляторы и способы)", опубликованной 6 января 2011 г., содержание которой полностью включено в настоящее описание посредством ссылки. Одна или обе подложки могут быть изготовлены с использованием в качестве подложки печатной платы (англ. printed circuit board, сокращенно РСВ), стекла, стекла с покрытием из оксида индия-олова (англ. indium tin oxide, сокращенно ITO) и/или полупроводниковых материалов. Если подложка представляет собой стекло с покрытием из ITO, то предпочтительно толщина покрытия из ITO составляет по меньшей мере приблизительно 20 нм, 50 нм, 75 нм, 100 нм или более. В альтернативном варианте или дополнительно его толщина может составлять не более приблизительно 200 нм, 150 нм, 125 нм или менее. В некоторых случаях верхняя и/или нижняя подложка включает подложку из РСВ, имеющую покрытие из диэлектрического материала, такого как полиимидный диэлектрический материал, который в некоторых случаях также может иметь покрытие или быть обработан иным способом для придания гидрофобности поверхности для операций с каплями. Если подложка включает РСВ, то примерами подходящих материалов являются следующие материалы: MITSUI™ BN-300 (поставляемый MITSUI Chemicals America, Inc., San Jose CA); ARLON™ 11N (поставляемый Arlon, Inc., Santa Ana, CA).; NELCO® N4000-6 и N5000-30/32 (поставляемые Park Electrochemical Corp., Melville, NY); ISOLA™ FR406 (поставляемый Isola Group, Chandler, AZ), в частности, IS620; класс фторполимеров (подходящих для флуоресцентного определения, поскольку они имеют низкий фоновый уровень флуоресценции); класс полиимидов; сложный полиэфир; полиэтиленнафталат; поликарбонат; простой полиэфирэфиркетон; жидкокристаллический полимер; циклоолефиновый сополимер (англ. cyclo-olefin copolymer, сокращенно СОС); циклоолефиновый полимер (англ. cyclo-olefin polymer, сокращенно СОР); арамид; нетканый арамидный армированный материал THERMOUNT® (поставляемый DuPont, Wilmington, DE); волокно марки NOMEX® (поставляемое DuPont, Wilmington, DE); и бумага. В качестве диэлектрического компонента подложки также подходят различные материалы. Их примеры включают: диэлектрики, нанесенные осаждением из газовой фазы, такие как PARYLENE™ С (в особенности, на стекло), PARYLENE™ N и PARYLENE™ НТ (для высокой температуры, ~300°С) (поставляемые Parylene Coating Services, Inc., Katy, TX); покрытия из TEFLON® AF; Cytop; паяльные маски, такие как жидкие фотопроявляемые паяльные маски (например, на РСВ), такие как материалы серий TAIYO™ PSR4000, TAIYO™ PSR и AUS (поставляемые Taiyo America, Inc. Carson City, NV) (хорошие термические характеристики для вариантов применения, включающих обеспечение температурного контроля), и PROBIMER™ 8165 (хорошие термические характеристики для вариантов применения, включающих обеспечение температурного контроля) (поставляемый Huntsman Advanced Materials Americas Inc., Los Angeles, CA); паяльная маска на основе сухой пленки, такие как паяльные маски на основе сухой пленки линии VACREL® (поставляемые DuPont, Wilmington, DE); пленочные диэлектрические материалы, такие как полиимидная пленка (например, полиимидная пленка KAPTON®, поставляемая DuPont, Wilmington, DE), полиэтилен и фторполимеры (например, фторэтиленовый полимер, англ. fluorethylene propylene, сокращенно FEP), политетрафторэтилен; сложный полиэфир; полиэтиленнафталат; циклоолефиновый сополимер (СОС); циклоолефиновый полимер (СОР); любые другие материалы подложек РСВ, перечисленные выше; полимеры для черненых матриц; полипропилен; и черные материалы для гибких цепей, такие как DuPont™ Pyralux® НХС и DuPont™ Kapton® МВС (поставляемые DuPont, Wilmington, DE). Напряжение и частота, применяемые для транспортировки капель, могут быть выбраны для обеспечения работы с реагентами, применяемыми в конкретных протоколах анализа. Конструкционные параметры могут быть различными, например: количество и местоположения размещаемых на манипуляторе резервуаров, количество независимых соединений электродов, размер (объем) различных резервуаров, местоположение зон промывки магнитов/гранул, размер электродов, межэлектродное пространство и высота зазора (между верхней и нижней подложками) могут варьироваться в зависимости от применения конкретных реагентов, протоколов, объемов капель и т.д. В некоторых случаях подложка согласно настоящему изобретению может быть функционализирована материалами или химическими веществами с низкой поверхностной энергией, например, посредством осаждения или синтеза in situ с использованием поли- или перфорированных соединений в растворе или полимеризуемых мономеров. Примеры включают покрытия из TEFLON® AF и покрытия из FLUOROPEL®, подходящие для нанесения покрытия погружением или распылением, другие фторированные мономеры для плазмохимического осаждения из газовой фазы (PECVD) и органосилоксан (например, SiOC) для PECVD. Дополнительно, в некоторых случаях на некоторую часть поверхности или всю поверхность для операций с каплями может быть нанесено покрытие из вещества, которое снижает фоновые сигналы, такие как фоновые сигналы флуоресценции от подложки РСВ. Например, покрытие, снижающее шумы, может включать полимеры для черненых матриц, такие как полимеры для черненых матриц, поставляемых Toray industries, Inc., Japan. Электродами капельного манипулятора обычно управляет контроллер или процессор, который сам представляет собой часть системы, которая может иметь функции обработки, а также хранить данные и программное обеспечение и принимать и выводить данные. Реагенты могут быть доставлены в капельный манипулятор в зазор для операций с каплями или в резервуар, соединенный соединением для текучей среды с зазором для операций с каплями. Реагенты могут находиться в жидком виде, например, в виде капель, или они могут быть доставлены в зазор для операций с каплями или в резервуар, соединенный соединением для текучей среды с зазором для операций с каплями, в восстанавливаемой форме. Для восстановления восстанавливаемые реагенты обычно объединяют с жидкостями. Один из примеров восстанавливаемых реагентов, подходящих для применения в способах и устройстве, рассмотренных в настоящем описании, включает реагенты, рассмотренные в патенте US 7727466, Meathrel et al., озаглавленном "Disintegratable Films for Diagnostic Devices (Разрушаемые пленки для диагностических устройств)", выданном 1 июня 2010 г., содержание которого полностью включено в настоящее описание посредством ссылки.
"Операция с каплей" означает любую манипуляцию с каплей, произведенную на капельном манипуляторе. Операция с каплей может, например, включать: помещение капли в капельный манипулятор; дозирование одной или более капель из источника капель; расщепление, разделение или разъединение капли с образованием двух или более капель; транспортировка капли с одного участка на другой в любом направлении; сливание или объединение двух или более капель в одну каплю; разбавление капли; перемешивание капли; взбалтывание капли; деформацию капли; сохранение исходного положения капли; инкубацию капли; нагревание капли; испарение капли; охлаждение капли; отбрасывание капли; транспортировка капли из капельного манипулятора; другие операции с каплями, рассмотренные в настоящем описании; и/или любую комбинацию перечисленных выше операций. Термины "сливаться", "слияние", "объединяться", "объединение" и подобные им термины используют для описания создания одной капли из двух или более капель. Следует понимать, что при употреблении этого термина в отношении двух или более капель может быть применена любая комбинация операций с каплями, которая достаточна для объединения двух или более капель в одну каплю. Например, осуществление "слияния капли А с каплей В" может включать транспортировку капли А до контакта со стационарной каплей В, транспортировку капли В до контакта со стационарной каплей А или транспортировку капель А и В до контакта друг с другом. Термины "расщепление", "разъединение" и "разделение" не предполагают какого-либо конкретного изменения объема полученных капель (т.е. объем полученных капель может быть исходным или иным) или количества полученных капель (количество полученных капель может составлять 2, 3, 4, 5 или более). Термин "перемешивание" означает операции с каплями, которые приводят к более гомогенному распределению одного или более компонентов внутри капли. Примеры "загрузочных" операций с каплями включают загрузку с помощью микродиализа, загрузку с приложением давления, роботизированную загрузку, пассивную загрузку и загрузку с помощью пипетки. Операции с каплями могут быть осуществлены под действием электродов. В некоторых случаях операции с каплями дополнительно облегчаются за счет использования гидрофильных и/или гидрофобных участков на поверхностях и/или физических препятствий. Примеры операций с каплями рассмотрены в патентах и патентных заявках, цитируемых выше при раскрытии определения "капельный манипулятор". Для определения или подтверждения результата операции с каплей в некоторых случаях могут быть применены методики измерения или визуализации полного сопротивления или емкости. Примеры таких методик рассмотрены в опубликованной патентной заявке US 20100194408, Sturmer et al., озаглавленной "Capacitance Detection in a Droplet Actuator (Определение емкости в капельном манипуляторе)", опубликованной 5 августа 2010 г., содержание которой полностью включено в настоящее описание посредством ссылки. Вообще говоря, методики измерения или визуализации могут быть применены для подтверждения присутствия или отсутствия капли на определенном электроде. Например, присутствие отмеренной капли на электроде назначения после проведения операции отмеривания капли подтверждает, что операция отмеривания капли прошла эффективно. Аналогично, присутствие капли на участке определения на соответствующем этапе протокола анализа может подтверждать, что в результате серии предыдущих операций с каплями была успешно создана капля для проведения определений. Транспортировка капли может быть достаточно быстрой. Например, в различных примерах осуществления транспортировка капли от одного электрода до другого может превышать приблизительно 1 секунду или приблизительно 0,1 секунды, или приблизительно 0,01 секунды или приблизительно 0,001 секунды. В одном из примеров осуществления электрод работает на переменном токе, но его переключают на постоянный ток для получения изображения. Удобно, если при проведении операций с каплями площадь, занимаемая каплей, приблизительно равна площади электросмачивания; другими словами, 1х-, 2х- и 3х-капли успешно контролируют, применяя 1, 2 и 3 электрода, соответственно. Если площадь, занимаемая каплей, превышает количество электродов, доступных для проведения операции с каплей в течение заданного времени, то разность между размером капли и количеством электродов обычно не должна превышать 1; другими словами, 2х-каплю успешно контролируют, применяя 1 электрод, и 3х-каплю успешно контролируют, применяя 2 электрода. Если капли включают гранулы, то удобно чтобы размер капли был равен количеству электродов, которые контролируют каплю, например, транспортируют каплю.
Согласно некоторым аспектам, библиотека нуклеиновых кислот может быть получена из клеток или единичной клетки с использованием капель в качестве СЕ. В некоторых примерах осуществления клетки могут быть суспендированы в буфере. В некоторых примерах осуществления в капельный манипулятор может быть помещена суспензия клеток. С помощью операций с каплями, проводимых посредством электродов, множество капель, включающих клеточную суспензию, может быть распределено таким образом, что каждая капля будет включать единичную клетку. С помощью операций с каплями, проводимых посредством электродов, может быть отмерено множество капель реагента, включающих буфер для лизиса клеток (капли буфера лизирования). Капли буфера лизирования и множество капель клеточной суспензии, включающих единичные клетки, могут быть объединены при помощи операций, проводимых посредством электродов, что приводит к образованию капли клеточного лизата, причем капли клеточного лизата включают компоненты единичных клеток. В капельный манипулятор могут быть введены реакционные реагенты, включающие уникальные штрих-коды нуклеиновых кислот, транспозоны и подходящие ферменты (например, фрагментазы, полимеразы, лигазы, транспозазы, обратные транскриптазы и т.д.). В некоторых примерах осуществления транспозоны и/или штрих-коды могут включать участки связывания праймера. В операциях с каплями, проводимых посредством электродов, множество капель реагента, включающих реакционные реагенты, может быть распределено таким образом, что каждая капля реагента включает уникальные штрих-коды нуклеиновых кислот и подходящие ферменты. Капли клеточного лизата и капли реагента могут быть объединены с помощью операций, проводимых посредством электродов, с образованием множества капель с первым штрих-кодом, в которых на нуклеиновую кислоту из единичной клетки воздействуют ферменты из капель реагента, в результате чего нуклеиновые кислоты приобретают штрих-код. В некоторых примерах осуществления после объединения капель клеточного лизата и капель реагента, мРНК, находящаяся в каплях клеточного лизата, может быть подвергнута обратной транскрипции, и кДНК может включать штрих-коды. В некоторых примерах осуществления штрих-коды могут включать участки связывания праймера и уникальные молекулярные индексы. С помощью операций, проводимых посредством электродов с каплями, капля с первым штрих-кодом может быть дополнительно объединена множество раз с каплями реагента с образованием множества капель, имеющих второй штрих-код, капель, имеющих третий штрих-код и т.д. В некоторых примерах осуществления в каждом цикле объединения штрих-коды различны. Таким образом, множество циклов объединения капель, имеющих штрих-коды, с каплями реагента приведет к осуществлению комбинаторного штрих-кодирования. По окончании, нуклеиновая кислота из различных капель может быть собрана, и может быть определена ее последовательность. Информация секвенирования может дать доступ к информации о последовательности нуклеиновой кислоты соответствующей клетки, а также необязательно позволить идентифицировать источник нуклеиновой кислоты (например, клетки или единичную клетку). Такая информация очень ценна, если нуклеиновая кислота включает мутацию, связанную с заболеванием, таким как врожденное генетическое заболевание или рак.
Согласно некоторым аспектам, способы согласно настоящему изобретению могут быть применены в протеомике. Множество гранул, содержащих капли, может быть получено введением суспензии гранул в капельный манипулятор, в котором производят распределение множества капель из суспензии гранул таким образом, что каждая капля множества капель включает одну гранулу (см. опубликованную патентную заявку US 20100130369, содержание которой включено в настоящее описание посредством ссылки). Гранулы могут включать антитела или другие аффинные зонды (типичные протоколы присоединения рассмотрены в публикации "Immobilized Biomolecules in Analysis. A Practical Approach. (Иммобилизованные биомолекулы в анализе. Практический подход)". Cass Т., Ligler F. S., изд. Oxford University Press, New York, 1998. стр. 1-14, включено в настоящее описание посредством ссылки). В некоторых примерах осуществления антитела могут быть специфичными для эпитопов клеточной поверхности. В некоторых примерах осуществления антитела могут быть моноклональными, и в других примерах осуществления антитела могут быть поликлональными. С помощью операций с каплями, проводимых посредством электродов, множество капель, содержащих суспензию гранул, может быть объединено с множеством капель, включающих единичные клетки, что приводит к получению множества капель, содержащих клетки, закрепленные на гранулах, поскольку находящиеся на гранулах антитела связываются с белками поверхности клетки. В некоторых примерах осуществления антитела могут быть специфичными для белка, находящегося внутри клетки. С помощью операций с каплями, проводимых посредством электродов, множество капель, содержащих суспензию гранул, может быть объединено с множеством капель, включающих лизаты единичных клеток, в результате чего находящиеся на гранулах антитела связываются с белками, находящими внутри клетки, с образованием множества капель, содержащих белок, зафиксированный на грануле. Необязательно, с помощью операций с каплями, проводимых посредством электродов, множество капель, содержащих гранулы с закрепленным белком, могут быть объединены с множеством капель реагента, включающих реагенты для мечения белка, что позволяет уникальным образом метить белки. Связанные белки могут быть обнаружены с помощью ассоциированных меток или другими средствами (электрофорезом на полиакриламидном геле в присутствии додецилсульфата натрия (англ. sodium dodecyl sulphate, сокращенно SDS), твердофазного иммуноферментного анализа (англ. enzyme-linked immunosorbent assay, сокращенно ELISA) и т.д.). Белок может быть идентифицирован, и может быть определен источник белка. В некоторых примерах осуществления протеомные данные могут быть сопоставлены сданными секвенирования.
В некоторых примерах осуществления антитела могут быть специфичными для других биомолекул, то есть их специфичность не ограничена белками. Такие биомолекулы могут включать, без ограничений, полисахариды или липиды. В некоторых примерах осуществления идентификация и источник таких биомолекул могут быть сопоставлены с полученными ранее данными о последовательности.
Клеточный анализ in situ
В некоторых примерах осуществления клетки и их компоненты могут быть проанализированы in situ. В некоторых примерах осуществления клетки могут быть пропущены через проточную ячейку.
Используемый в настоящем описании термин "проточная ячейка" означает камеру, имеющую поверхность, по которой могут течь один или более текучих реагентов. Обычно для организации течения текучей среды проточная ячейка имеет впускное отверстие и выпускное отверстие. Примеры проточных ячеек и соответствующих струйных систем и платформ для определения, которые могут быть применены в способах согласно настоящему изобретению, рассмотрены, например, в следующих публикациях: Bentley et al., Nature 456:53-59 (2008), WO 04/018497, US 7057026, WO 91/06678, WO 07/123744, US 7329492, US 7211414, US 7315019, US 7405281 и US 2008/0108082, содержание каждой из которых включено в настоящее описание посредством ссылки.
В некоторых примерах осуществления проточные ячейки могут вмещать массивы. Массивы, применяемые для секвенирования нуклеиновых кислот, часто включают произвольно выбранные пространственные диаграммы характеристик нуклеиновых кислот. Например, в платформах секвенирования HiSeq™ или MiSeq™, поставляемых Illumina Inc. (San Diego, CA), применяют проточные ячейки, на которых формируют массивы нуклеиновых кислот, производя произвольным образом посев и затем выполняя мостиковую амплификацию. Однако для секвенирования нуклеиновых кислот или других аналитических методик также могут быть применены структурированные (patterned) массивы. Примеры структурированных массивов, способов их получения и способов их применения рассмотрены в следующих публикациях: US 13/787396, US 13/783043, US 13/784368, опубликованная патентная заявка US 2013/0116153 А1 и опубликованная патентная заявка US 2012/0316086 А1, содержание каждой из которых включено в настоящее описание посредством ссылки. Характеристики таких структурированных массивов могут быть применены для захвата единственной молекулы матричной нуклеиновой кислоты и последующего размещения зародыша для создания однородной колонии, например, посредством мостиковой амплификации. Такие структурированные массивы особенно удобны для применения в секвенировании нуклеиновых кислот.
В некоторых примерах осуществления поверхность проточной ячейки может включать улавливающие частицы, такие как антитела, которые иммобилизуют клетки, пропускаемые через проточную ячейку, на поверхности ячейки. В некоторых примерах осуществления антитела, находящиеся на поверхности проточной ячейки, могут специфично связываться с белками клеточной поверхности. В некоторых примерах осуществления антитела могут специфично связываться с белками клеточной поверхности раковых клеток, что приводит к накоплению раковых клеток на поверхности проточной ячейки.
В некоторых примерах осуществления клетки мог быть рассортированы в соответствии с различными типами с помощью методики сортировки клеток, известной в данной области техники, после чего клетки направляют в проточную ячейку. Примеры методик сортировки клеток включают, без ограничений, сортировку клеток с активацией флуоресценции (англ. Fluorescence Activated Cell Sorting, сокращенно FACS), в которой применяют проточную цитометрию, сортировку клеток с магнитной активацией (англ. magnetic-activated cell sorting, сокращено MACS) (Miltenyi Biotec Inc., San Diego, CA) или методику разделения клеток без применения колонки, в которой пробирку с мечеными клетками помещают в магнитное поле. Клетки, прошедшие сортировку, остаются в пробирке, в то время как клетки, не прошедшие сортировку, оказываются в жидкой суспензии (STEMCELL Technologies Inc., Vancouver, ВС, Canada).
В некоторых примерах осуществления клетки, пропускаемые через проточную ячейку, могут быть подвергнуты лизису в проточной ячейке, в результате чего в проточную ячейку высвобождается нуклеиновая кислота клеток (ДНК и РНК). В некоторых примерах осуществления перед проведением лизиса клетки иммобилизуют в проточной ячейке. Способы лизиса клеток известны в данной области техники и включают, без ограничений, разрушение ультразвуком, обработку протеазой, осмотический шок, обработку высокими концентрациями соли. В некоторых примерах осуществления может быть произведена обратная транскрипция всей РНК. В некоторых примерах осуществления в нуклеиновую кислоту, полученную из клеток, например ДНК, РНК или кДНК, могут быть введены уникальные штрих-коды. Способы введения штрих-кодов в нуклеиновую кислоту рассмотрены выше и включают, без ограничений, тагментацию с помощью методики Nextera™, лигазы, полимераз. В некоторых примерах осуществления штрих-коды могут быть применены для идентификации источника получения клетки. В некоторых примерах осуществления штрих-коды могут иметь участки связывания праймера. В некоторых примерах осуществления в нуклеиновую кислоту может быть введено множество штрих-кодов. В некоторых примерах осуществления штрих-коды множества отличаются друг от друга. В некоторых примерах осуществления нуклеиновая кислота, содержащая штрих-коды, может диффундировать, может быть вновь собрана, и в нее могут быть введены дополнительные штрих-коды. В некоторых примерах осуществления после или во время введения штрих-кодов нуклеиновая кислота может быть подвергнута фрагментации. В некоторых примерах осуществления перед распределением (диффузией) в проточной ячейке фрагментированная нуклеиновая кислота может быть амплифицирована. В некоторых примерах осуществления фрагментированная нуклеиновая кислота, содержащая штрих-коды, может диффундировать в другую часть проточной ячейки, включающую зонды захвата, и может быть иммобилизована в проточной ячейке. В некоторых примерах осуществления иммобилизованная фрагментированная нуклеиновая кислота может быть подвергнута мостиковой амплификации.
В некоторых примерах осуществления рассмотренных выше аспектов клетка, пропускаемая через проточную ячейку, представляет собой единичную клетку. В некоторых примерах осуществления может быть проанализирован весь транскриптом. В некоторых примерах осуществления может быть одновременно проанализирована информация о последовательности ДНК и РНК клеток или единичной клетки. В некоторых примерах осуществления белки, поступающие из клеток или из единичной клетки, могут быть идентифицированы, и получена информация об их последовательности. В некоторых примерах осуществления могут быть исследованы другие анализируемые вещества, поступающие из клеток или из единичной клетки, такие каклипиды, углеводы, клеточные органеллы.
Фрагментация матричных нуклеиновых кислот
Некоторые примеры осуществления получения матричной нуклеиновой кислоты могут включать фрагментацию целевой нуклеиновой кислоты. В некоторых примерах осуществления к фрагментированной целевой нуклеиновой кислоте присоединяют адапторы, имеющие штрих-коды или индексы. Адапторы могут быть присоединены любыми способами, хорошо известными в данной области техники, таким как лигирование (ферментативное или химическое), тагментация, полимеразное удлинение и т.д. В некоторых примерах осуществления введение транспосом, включающих последовательности транспозона, не составляющие непрерывной последовательности, может приводить к фрагментации целевой нуклеиновой кислоты. В некоторых примерах осуществления, включающих петлеобразные транспосомы, целевая нуклеиновая кислота, включающая последовательности транспозона, может быть фрагментирована на участках фрагментации, находящихся в последовательностях транспозона. Дополнительные примеры способов, подходящих для фрагментации целевой нуклеиновой кислоты, которые могут быть применены в примерах осуществления, рассмотренных в настоящем описании, имеются, например, в опубликованной патентной заявке US 2012/0208705, опубликованной патентной заявке US 2012/0208724 и опубликованной международной патентной заявке WO 2012/061832, содержание каждой из которых полностью включено в настоящее описание посредством ссылки.
Введение тэга (метки) в одиночные молекулы
Настоящее изобретение относится к способам мечения (введения тэга, англ. tagging) молекул, которые позволяют отслеживать и идентифицировать индивидуальные молекулы. Затем может быть произведена деконволюция обобщенных данных, и данные могут быть конвертированы обратно к индивидуальной молекуле. Возможность распознавать индивидуальные молекулы и передавать информацию обратно к исходной молекуле особенно важна в тех случаях, когда изменения, превращающие исходную молекулу в конечный продукт, изменяют (стехиометрическое) представление исходной популяции. Например, амплификация приводит к дупликации (например, при ПЦР дупликации или несимметричной амплификации), которая может искажать исходное представление. Из-за неоднородной амплификации и/или сдвига амплификации может происходить изменение отклика статуса метилирования, количества копий, аллельного отношения. Идентификация индивидуальных молекул с помощью введения кода позволяет различать идентичные молекулы после обработки. Таким образом, дупликации и сдвиг амплификации могут быть отфильтрованы, что позволяет точно определять исходное представление молекулы или популяции молекул.
Преимуществом уникального мечения единичных молекул является то, что идентичные молекулы в исходном объединении молекул получают уникальную идентификацию посредством мечения. Такие уникально помеченные молекулы можно различать при проведении последующих анализов. Эта методика может быть применена в тех схемах анализа, в которых используют амплификацию. Например, известно, что амплификация искажает исходное представление смешанной популяции молекул. Если не применять уникальное мечение, то исходное представление (такое как количество копий или аллельное отношение) должно объяснять сдвиги (известные или неизвестные) для каждой молекулы в представлении. При наличии уникальных меток, представление может быть точно определено после удаления дуплицированных участков и подсчета исходного представления молекул, каждая из которых имеет уникальную метку (тэг). Таким образом, кДНК могут быть амплифицированы, и их последовательности могут быть распознаны без учета сдвига, поскольку данные могут быть отфильтрованы таким образом, что для дальнейшего анализа отбирают только аутентичные последовательности или последовательности, представляющие интерес. После согласования множества прочтений, имеющих одинаковый штрих-код, может быть достигнута высокая точность прочтения.
В некоторых примерах осуществления композиций и способов, рассмотренных в настоящем описании, предпочтительно производить мечение исходной популяции на ранних этапах анализа; тем не менее, мечение может быть произведено и на последующих стадиях, если на более ранних этапах не происходит сдвиг, или если эти этапы не важны. В любом из указанных случаев вариабельность последовательностей штрих-кода должна превышать количество индивидуальных молекул, подвергаемых мечению. При таком подходе различные целевые молекулы получают различные и уникальные метки. Таким образом, желательно получить пул (объединенное множество) произвольных олигонуклеотидов определенной длины (например, длиной 5, 10, 20, 30, 40, 50, 100 или 200 нуклеотидов). Произвольный пул меток имеет высокую вариабельность меток с кодовым пространством 4n, где n - количество нуклеотидов. На различных этапах могут быть введены дополнительные коды (как сконструированные, так и произвольные), которые служат для дополнительной проверки, такой как проверка четности для корректировки ошибок.
В одном из примеров осуществления композиций и способов, рассмотренных в настоящем описании, индивидуальные молекулы (такие как целевая ДНК) присоединяют к уникальным меткам, таким как уникальные последовательности олигонуклеотидов и/или штрих-коды. Присоединение меток может быть произведено лигированием, посредством присоединения химических веществ, адсорбцией, введением последовательностей транспозона и т.д. Другие способы включают амплификацию (например, с применением ПЦР, RCA или LC (сокр. от англ. ligase-chain reaction, т.е. лигазная цепная реакция)), копирование (например, присоединением полимеразы) и нековалентные взаимодействия.
Специальные способы включают введение штрих-кодов (например, сконструированных или произвольных последовательностей) в ПЦР праймеры таким образом, чтобы каждая матрица получила индивидуальный код в кодовом пространстве, в результате чего получают уникальные ампликоны, которые можно отличить от других ампликонов. Эта концепция может быть применена к любому способу, в котором проводят полимеразную амплификацию, такому как анализы GoldenGate™ и анализы, рассмотренные в патентах US 7582420, US 7955794 и US 8003354, содержание каждого из которых полностью включено в настоящее описание посредством ссылки. Целевые последовательности, меченные кодами, могут быть подвергнуты циркуляризации и амплификации таким способами, как амплификация по типу катящегося кольца, с образованием меченных кодами ампликонов. Аналогично, код также может быть добавлен к РНК.
Способ анализа матричных нуклеиновых кислот
Некоторые примеры осуществления методики, рассмотренной в настоящем описании, включают способы анализа матричных нуклеиновых кислот. В таких примерах осуществления из матричных нуклеиновых кислот может быть получена информация секвенирования, и эта информация может быть использована для создания модели последовательности одной или более целевых нуклеиновых кислот.
В некоторых примерах осуществления способов секвенирования, рассмотренных в настоящем описании, может быть применена методика ассоциированного прочтения (Linked Read). Методика ассоциированного прочтения может включать идентификацию данных секвенирования, которая связывает по меньшей мере два прочтения для установления последовательности. Например, первое прочтение последовательности может содержать первый маркер, и второе прочтение последовательности может содержать второй маркер. Первый и второй маркеры могут указывать на то, что данные секвенирования из каждого прочтения последовательности в модели последовательности целевой нуклеиновой кислоты соседствуют друг с другом. В некоторых примерах осуществления композиций и способов, рассмотренных в настоящем описании, маркеры могут включать первую последовательность штрих-кода и вторую последовательность штрих-кода, где первая последовательность штрих-кода может составлять пару (быть спарена) со второй последовательностью штрих-кода. В других примерах осуществления маркеры могут включать первую метку хозяина и вторую метку хозяина. В других примерах осуществления, маркеры могут включать первую последовательность штрих-кода с первой меткой хозяина и вторую последовательность штрих-кода со второй меткой хозяина.
Один из неограничивающих примеров осуществления способа секвенирования матричной нуклеиновой кислоты может включать следующие этапы: (а) секвенирование первой последовательности штрих-кода с использованием праймера секвенирования, гибридизующегося с первым участком связывания праймера; и (b) секвенирование второй последовательности штрих-кода с использованием праймера секвенирования, гибридизующегося со вторым праймером. В результате получают два прочтения последовательности, которые помогают связать матричную нуклеиновую кислоту с ее геномными соседями. Учитывая достаточно большую длину прочтений и достаточно малую длину фрагментов библиотеки, информация из этих двух прочтений может быть объединена с образованием одного длинного прочтения, которое перекрывает весь фрагмент. Использование прочтений последовательности штрих-кода и дуплицированной последовательности из 9 нуклеотидов, полученной при введении, позволяет связать прочтения с их геномными соседями, в результате чего получают "связанные прочтения" гораздо большей длины in silica
Следует понимать, что библиотека, включающая матричные нуклеиновые кислоты, может включать дупликатные фрагменты нуклеиновых кислот. Секвенирование дупликатных фрагментов нуклеиновых кислот удобно применять в способах, которые включают создание консенсусной последовательности для дупликатных фрагментов. Такие способы могут повышать точность получения консенсусной последовательности для матричной нуклеиновой кислоты и/или библиотеки матричных нуклеиновых кислот.
В некоторых примерах осуществления методики секвенирования, рассмотренной в настоящем описании, анализ последовательности выполняют в режиме реального времени. Например, секвенирование в режиме реального времени может быть проведено при одновременном наборе и анализе данных секвенирования. В некоторых примерах осуществления секвенирование с целью получения данных о порядке последовательности может быть прервано на различных этапах, включая этап после получения по меньшей мере части данных о целевой последовательности нуклеиновых кислот или до прочтения всей последовательности нуклеиновой кислоты. Примеры способов, систем и дополнительные примеры осуществления приведены в международной патентной заявке WO 2010/062913, содержание которой полностью включено в настоящее описание посредством ссылки.
В одном из неограничивающих примеров осуществления способа сборки коротких прочтений последовательности с помощью методики ассоциированного прочтения в геномную ДНК вводят последовательности транспозона, включающие штрих-коды, подготавливают библиотеку, и получают данные секвенирования для библиотеки матричных нуклеиновых кислот. Посредством идентификации парных штрих-кодов могут быть собраны блоки матриц, после чего могут быть собраны более крупные контиги. В одном из примеров осуществления собранные прочтения могут быть дополнительно собраны в более крупные контиги посредством спаривания кодов с использованием перекрывающихся прочтений.
Некоторые примеры осуществления методики секвенирования, рассмотренные в настоящем описании, включают определение ошибок и возможности для коррекции. Примеры ошибок могут включать ошибки в основных вызовах в процессе секвенирования и ошибки в сборке фрагментов в более крупные контиги. Следует понимать, что ошибочное определение может включать обнаружение присутствия или вероятности ошибок в данной выборке, и, как таковое, обнаружение местоположения ошибки или количества ошибок может не требоваться. Для исправления ошибки нужна информация о локализации ошибки и/или количества ошибок в данной выборке. Способы исправления ошибки хорошо известны в данной области техники. Их примеры включают применение меры расстояния Хэмминга и применение алгоритма контрольной суммы (см., например, опубликованную патентную заявку US 2010/0323348, патент US 7574305 и патент US 6654696, содержания которых полностью включены в настоящее описание посредством ссылки.
Вложенные библиотеки
Альтернативный способ включает описанные выше способы мечения стыков и создания вложенных библиотек секвенирования. Вложенные суббиблиотеки создают из ДНК фрагментов, меченных кодами. Это позволяет менее часто метить транспозоны по всему геному. Это также может создавать большее разнообразие прочтений (вложенных) последовательностей. Эти факторы способствуют достижению улучшенного перекрывания и точности.
В результате отбора дополнительных образцов и амплификации целого генома может быть создано множество копий определенной популяции исходных молекул. Затем с помощью транспозон-специфичной фрагментации получают фрагменты ДНК, причем каждый фрагмент получает код, который позволяет отследить связь фрагмента с его первоначальным соседом, имеющим подходящий код (идентичный, комплементарный или иным образом информационно связанный). Меченые фрагменты подвергают фрагментации по меньшей мере второй раз способами произвольной фрагментации или последовательность-специфичными способами, таким как ферментация, произвольное разрезание, разрезание с применением транспозона или другими способами, получая суббиблиотеки ДНК фрагментов, снабженных кодами. В полезной модификации рассмотренного выше способа снабженные кодами фрагменты могут быть избирательно выделены с помощью транспозонов, которые содержат биотин или другую аффинную функциональную группу, с целью последующего их концентрирования (обогащения). Последующее создание библиотеки превращает вложенные фрагменты ДНК в матрицы секвенирования. Секвенирование спаренных концов приводит к определению последовательности кодирующего маркера фрагментов ДНК и целевой ДНК. В результате создания вложенных библиотек для этого же кодирующего маркера, последовательности длинных фрагментов ДНК могут быть расшифрованы с помощью коротких прочтений.
Способы секвенирования
Способы и композиции, рассмотренные в настоящем описании, могут быть применены в комбинации с множеством различных методик секвенирования. В некоторых примерах осуществления способ определения нуклеотидной последовательности целевой нуклеиновой кислоты может представлять собой автоматизированный способ.
Некоторые примеры осуществления способов секвенирования, рассмотренных в настоящем описании, включают секвенирование синтезом (SBS), например, с применением методик пиросеквенирования. Пиросеквенирование основано на обнаружении высвобождения неорганического пирофосфата (PPi) по мере встраивания определенных нуклеотидов в растущую цепь (Ronaghi et al., Analytical Biochemistry 242(1): 84-9(1996); Ronaghi, M. Genome Res. 11(1):3-11 (2001); Ronaghi et al., Science 281(5375):363 (1998); патент US 6210891; патент US 6258568 и патент US 6274320; содержание каждого из цитируемых документов полностью включено в настоящее описание посредством ссылки).
В другом примере, включающем применение SBS, циклическое секвенирование производят поэтапным добавлением нуклеотидов обратимого терминатора, содержащих, например, способную расщепляться или способную к фотоотбеливанию метку на основе красителя, рассмотренную, например, в патенте US 742767, патенте US 74141163 и патенте US 7057026, содержание каждого из которых полностью включено в настоящее описание посредством ссылки. Этот подход, который в настоящее время вводит в коммерческое обращение Illumina Inc., также рассмотрен в международных патентных заявках WO 91/06678 и WO 07/123744, содержание каждой из которых полностью включено в настоящее описание посредством ссылки. Доступность флуоресцентно меченых терминаторов, в которых может быть обращена терминация и расщеплена флуоресцентная метка, упрощает проведение эффективного секвенирования посредством циклической обратной терминации (англ. cyclic reversible termination, сокращенно CRT). Из этих модифицированных нуклеотидов также могут быть соответствующим образом сконструированы полимеразы для эффективного введения и удлинения последовательности.
Дополнительные примеры систем и способов SBS, которые могут быть применены для осуществления способов и получения композиций, рассмотренных в настоящем описании, рассмотрены в опубликованной патентной заявке US 2007/0166705, опубликованной патентной заявке US 2006/0188901, патенте US 7057026, опубликованной патентной заявке US 2006/0240439, опубликованной патентной заявке US 2006/0281109, опубликованной патентной заявке WO 05/065814, опубликованной патентной заявке US 2005/0100900, опубликованной патентной заявке WO 06/064199 и опубликованной патентной заявке WO 07/010251; содержание каждого из цитируемых документов полностью включено в настоящее описание посредством ссылки.
В некоторых примерах осуществления методики секвенирования, рассмотренной в настоящем описании, может быть применено секвенирование посредством лигирования. В таких методиках применяют ДНК лигазу для встраивания нуклеотидов и обнаружения встраивания таких нуклеотидов. Примеры систем и способов SBS, которые могут быть применены для осуществления способов и получения композиций, рассмотренных в настоящем описании, рассмотрены в патенте US 6969488, патенте US 6172218 и патенте US 6306597, содержание каждого из которых полностью включено в настоящее описание посредством ссылки.
Предпочтительно, способы секвенирования, рассмотренные в настоящем описании, могут быть осуществлены в мультиплексных форматах, то есть при одновременном манипулировании со множеством различных целевых нуклеиновых кислот. В конкретных примерах осуществления различные целевые нуклеиновые кислоты могут быть обработаны в одной реакционной емкости или на поверхности соответствующей подложки (субстрата). Это обеспечивает удобное проведение доставки реагентов для секвенирования, удаления непрореагировавших реагентов и обнаружения событий встраивания (включения) мультиплексным образом. В тех примерах осуществления, в которых целевые нуклеиновые кислоты присоединены к поверхности, целевые нуклеиновые кислоты могут находиться в формате массива. Обычно в формате массива целевые нуклеиновые кислоты могут быть закреплены на поверхности пространственно различимым образом. Например, целевые нуклеиновые кислоты могут быть закреплены с помощью непосредственного ковалентного присоединения, присоединения к грануле или другой частице или связаны с полимеразой или другой молекулой, которая присоединена к поверхности. Массив может включать одну копию целевой нуклеиновой кислоты на каждом участке (сайте, site) (также называемом элементом (англ. feature)) или множество копий, имеющих одинаковые последовательности, могут присутствовать на каждом участке или элементе. Множество копий может быть получено способами амплификации, таким как мостиковая амплификация или ПЦР в эмульсии, которые более подробно рассмотрены ниже.
В способах, рассмотренных в настоящем описании, могут быть использованы массивы, имеющие элементы, плотность которых может составлять различные значения, включающие, например, по меньшей мере приблизительно 10 элементов/см2, 100 элементов/см2, 500 элементов/см2, 1000 элементов/см2, 5000 элементов/см2, 10000 элементов/см2, 50000 элементов/см2, 100000 элементов/см2, 1000000 элементов/см2, 5000000 элементов/см2, 107 элементов/см2, 5×107 элементов/см2, 108 элементов/см2, 5×108 элементов/см2, 109 элементов/см2, 5×109 элементов/см2 или более.
Способы снижения вероятности ошибок в данных секвенирования
Некоторые примеры осуществления способов и композиций, рассмотренных в настоящем описании, включают снижение вероятности ошибок в данных секвенирования. В некоторых таких примерах осуществления и смысловая, и антисмысловая нить (цепь) двухцепочечной целевой нуклеиновой кислоты связана с разными штрих-кодами. Каждую цепь подвергают амплификации, из множества копий амплифицированных цепей получают информацию о последовательности, и на основе подробной информации о последовательности создают консенсусную модель последовательности целевой нуклеиновой кислоты. Таким образом, из каждой цепи может быть извлечена и идентифицирована информация о последовательности. Соответственно, в тех случаях, когда информация о последовательности, получаемая от одной цепи последовательности, не согласуется с информацией о последовательности, получаемой от другой цепи, могут быть идентифицированы и исправлены ошибки в последовательности.
В некоторых примерах осуществления смысловая и антисмысловая цепи целевой нуклеиновой кислоты связаны с разными штрих-кодами. Штрих-коды могут быть соединены с целевой нуклеиновой кислотой множеством различных способов, которые включают лигирование адапторов и введение последовательностей транспозона. В некоторых таких примерах осуществления Y-адаптор может быть связан с по меньшей мере одним концом целевой нуклеиновой кислоты. Y-адаптор может включать двухцепочечную последовательность и некомплементарные цепи, где каждая цепь включает штрих-код, отличный от другого. Целевая нуклеиновая кислота, соединенная с Y-адаптором, может быть подвергнута амплификации и секвенировнию, в котором каждый штрих-код может быть применен для идентификации исходной смысловой или антисмысловой цепи. Аналогичный способ рассмотрен в публикации Kinde I. et al., (2011) PNAS 108:9530-9535, содержание которой полностью включено в настоящее описание посредством ссылки. В некоторых примерах осуществления смысловую и антисмысловую цепи целевой нуклеиновой кислоты соединяют с разными штрих-кодами посредством введения последовательностей транспозона, рассмотренных в настоящем описании. В некоторых таких примерах осуществления последовательности транспозона могут включать некомплементарные штрих-коды.
Некоторые примеры осуществления таких способов включают получение информации о последовательности из цепи целевой двухцепочечной нуклеиновой кислоты, которое включает: (а) получение данных о последовательности из матричной нуклеиновой кислоты, включающий первый адаптор секвенирования и второй адаптор секвенирования, между которыми расположена по меньшей мере часть двухцепочечной целевой нуклеиновой кислоты, где: (i) первый адаптор секвенирования включает двухцепочечный первый штрих-код, одноцепочечный первый участок связывания праймера и одноцепочечный второй участок связывания праймера, где первый и второй участки связывания праймера некомплементарны, и (ii) второй адаптор секвенирования включает двухцепочечный второй штрих-код, одноцепочечный третий участок связывания праймера и одноцепочечный четвертый участок связывания праймера, где третий и четвертый участки связывания праймера некомплементарны. В некоторых примерах осуществления первый участок связывания праймера смысловой цепи матричной нуклеиновой кислоты и третий участок связывания праймера антисмысловой смысловой цепи матричной нуклеиновой кислоты включают одну и ту же последовательность. В некоторых примерах осуществления каждый штрих-код отличается от других. В некоторых примерах осуществления первый адаптор секвенирования включает одноцепочечную шпилечную структуру, соединяющую первый участок связывания праймера и второй участок связывания праймера.
В другом примере осуществления каждый конец целевой нуклеиновой кислоты соединен с адаптором, имеющим отличный от других штрих-код, который, таким образом, позволяет отличать друг от друга продукты удлинения, получаемые из смысловой и антисмысловой цепей нуклеиновой кислоты. В некоторых примерах осуществления последовательности участков связывания праймера и штрих-коды выбраны таким образом, что удлинение праймера, присоединенного к смысловой цепи, приводит к образованию продуктов, которые можно отличать от продуктов удлинения праймера, присоединенного к антисмысловой цепи. В одном из примеров участок 3' связывания праймера смысловой цепи такой же, как и участок 3' связывания праймера антисмысловой цепи, но отличается как от участка 5' связывания праймера смысловой цепи, так и от участка 5' связывания праймера антисмысловой цепи. Удлинение (достройка) праймеров, присоединенных к участку 3' связывания праймера смысловой цепи и к участку 3' связывания праймера антисмысловой цепи приведет к следующим продуктам, получаемым из каждой цепи:
Смысловая цепь: (5') штрих-код 2 - [целевая последовательность] - штрих-код 1 (3') Антисмысловая цепь: (5') штрих-код 1 - [целевая последовательность] - штрих-код 2 (3')
Таким образом, продукты, получаемые при удлинении (достройке) смысловой и антисмысловой цепей нуклеиновой кислоты, можно отличать друг от друга. Пример способа представлен в работе Schmitt M.W. et al., PNAS (2012) 109:14508-13, содержание которой полностью включено в настоящее описание посредством ссылки. В некоторых таких способах штрих-коды и участки связывания праймера могут быть соединены с целевой нуклеиновой кислотой множеством различных способов, которые включают лигирование адапторов и введение последовательностей транспозона. В некоторых примерах осуществления могут быть сконструированы последовательности транспозона, обеспечивающие создание адапторов со шпилечными структурами. Шпилечные структуры обеспечивают возможность поддержания физической связности смысловой и антисмысловой цепей целевой нуклеиновой кислоты. Матричная нуклеиновая кислота, включающая шпилечные структуры, может быть получена при использовании последовательностей транспозона, включающих линкеры, рассмотренные в настоящем описании. Примеры линкеров включают одноцепочечные нуклеиновые кислоты.
Некоторые примеры осуществления, относящиеся к созданию библиотек матричных нуклеиновых кислот с целью получения информации о последовательности от каждой цепи целевой двухцепочечной нуклеиновой кислоты, включают (а) обеспечение наличия популяции транспосом, включающих транспозазу и первую последовательность транспозона, включающую: (i) первый участок распознавания транспозазы, первый участок связывания праймера и первый штрих-код, и (ii) вторую последовательность транспозона, включающую второй участок распознавания транспозазы, второй участок связывания праймера и второй штрих-код, где первая последовательность транспозона не составляет непрерывную последовательность со второй последовательностью транспозона; и (b) контакт транспосом с двухцепочечной нуклеиновой кислотой в таких условиях, при которых первая и вторая последовательности транспозона встраиваются в целевую двухцепочечную нуклеиновую кислоту, что приводит к получению библиотеки матричных нуклеиновых кислот для получения информации о последовательности от каждой цепи целевой двухцепочечной нуклеиновой кислоты. В некоторых примерах осуществления популяция транспосом дополнительно включает транспосомы, включающие транспозазу и последовательность транспозона, включающую третий участок распознавания транспозазы и четвертый участок распознавания транспозазы, между которыми расположена последовательность штрих-кода; при этом последовательность штрих-кода включает третий штрих-код и четвертый штрих-код, между которыми расположен адаптор секвенирования, и адаптор секвенирования включает третий участок связывания праймера и четвертый участок связывания праймера, между которыми расположен линкер. В некоторых примерах осуществления первый участок связывания праймера смысловой цепочки матричной нуклеиновой кислоты и третий участок связывания праймера антисмысловой смысловой цепочки матричной нуклеиновой кислоты включают одну и ту же последовательность. Некоторые примеры осуществления также включают этап (с) выбора матричных нуклеиновых кислот, включающих последовательности транспозона, в которых первая последовательность транспозона не образует непрерывной последовательности со второй последовательностью транспозона, и последовательности транспозона включают линкер. В некоторых примерах осуществления линкер включает аффинную метку, подходящую для связывания с зондом захвата. В некоторых примерах осуществления аффинная метка выбрана из группы, состоящей из His, биотина и стрептавидина. В некоторых примерах осуществления каждый штрих-код отличается от других. В некоторых примерах осуществления линкер включает одноцепочечную нуклеиновую кислоту. В некоторых примерах осуществления целевая нуклеиновая кислота включает геномную ДНК.
Способы получения гаплотипической информации
Некоторые примеры осуществления способов и композиций, рассмотренных в настоящем описании, включают способы получения гаплотипической информации (информации о гаплотипе) из целевой нуклеиновой кислоты. Гаплотипическая информация может включать определения наличия или отсутствия различных последовательностей в специфических локусах целевой нуклеиновой кислоты, таких как геном. Например, информация о последовательности может быть получена для материнских и отцовских копий аллеля. В полиплоидном организме информация о последовательности может быть получена для по меньшей мере одного гаплотипа. Такие способы также применяют для снижения вероятности появления ошибки при получении информации о последовательности из целевой нуклеиновой кислоты.
Обычно способы получения гаплотипической информации включают распределение нуклеиновой кислоты в одном или более компартментов таким образом, чтобы каждый компартмент включал количество нуклеиновой кислоты, приблизительно эквивалентное гаплотипу нуклеиновой кислоты, или приблизительно эквивалентное количеству, составляющему менее гаплотипа нуклеиновой кислоты. Затем из каждого компартмента может быть получена информация о последовательности, позволяющая получать гаплотипическую информацию. Распределение матричной нуклеиновой кислоты по множеству резервуаров повышает вероятность того, что один резервуар содержит одну копию аллеля или SNP (однонуклеотидного полиморфизма), или что консенсусная информация о последовательности, полученная из одного резервуара, отражает информацию о последовательности аллеля или SNP. Следует понимать, что в некоторых таких примерах осуществления перед распределением (компартментализацией) матричной нуклеиновой кислоты по множеству резервуаров матричная нуклеиновая кислота может быть разбавлена. Например, каждый резервуар может содержать количество целевых нуклеиновых кислот, приблизительно равное гаплотипическому эквиваленту целевой нуклеиновой кислоты. В некоторых примерах осуществления резервуар может содержать менее приблизительно одного гаплотипического эквивалента целевой нуклеиновой кислоты.
Способы определения гаплотипической информации, способ гаплотипирования с применением виртуальных компартментов, способы получения целевых нуклеиновых кислот для гаплотипирования рассмотрены в документе WO/2014/142850, содержание которого включено в настоящее описание посредством ссылки.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Сохранение связности матрицы
В этом примере рассмотрен способ сохранения информации о связности матричной нуклеиновой кислоты, находящейся в СЕ. Матричную нуклеиновую кислоту получают с использованием транспосом, включающих последовательности транспозона, не составляющие непрерывную последовательность, в которых после транспозиции транспозаза Tn5 остается связанной с матричной ДНК. Целевую нуклеиновую кислоту вводят в контакт с транспосомами, включающими транспозазу Tn5 и не составляющие непрерывную последовательность последовательности транспозона. Образцы, которые дополнительно обрабатывают SDS, могут выглядеть как пятна различных фрагментов матричной нуклеиновой кислоты; образцы, не обработанные SDS, могут удерживать предполагаемую высокомолекулярную матричную нуклеиновую кислоту. Таким образом, даже если нуклеиновая кислота фрагментирована, то соседние последовательности могут оставаться соединенными друг с другом через транспозазу.
В другом неограничивающем способе библиотеку матричных нуклеиновых кислот получают с применением транспосом, включающих, наряду с целевой нуклеиновой кислотой, включающей хромосому человека, последовательности транспозона, не составляющие непрерывной последовательности. СЕ включает целевую нуклеиновую кислоту. В тех образцах, в которых транспозаза удалена последующим разбавлением SDS, можно наблюдать гаплотипические блоки ДНК. Таким образом, способы, рассмотренные в настоящем описании, позволяют сохранять требуемую целостность целевых нуклеиновых кислот при транспозировании, разбавлении и превращении в библиотеки секвенирования.
Используемый в настоящем описании термин "включающий" является синонимом терминов "содержащий" или "характеризуемый", имеет неисключающее или неограничивающее значение и не исключает добавления дополнительных, не названных элементов или этапов способа.
Все числовые величины, выражающие количества ингредиентов, относящиеся к условиям реакции и т.д., приведенные в настоящем описании, должны рассматриваться как величины, во всех случаях модифицированные термином "приблизительно". Соответственно, если не указано иное, числовые параметры, рассмотренные в настоящем описании, представляют собой приблизительные величины, которые могут различаться в зависимости от требуемых свойств, которые должны быть получены. По меньшей мере и не в качестве попытки ограничить применение доктрины эквивалентов объемом, ограничиваемым любыми пунктами формулы изобретения любой патентной заявки, претендующей на приоритет настоящей патентной заявки, следует понимать, что каждый числовой параметр должен рассматриваться с учетом значащих цифр и обычных практик округления.
В приведенном выше описании раскрыты некоторые способы и материалы согласно настоящему изобретению. В способы и материалы согласно настоящему изобретению могут быть внесены изменения, а также изменения могут быть внесены в способы изготовления и оборудование. Такие изменения могут быть внесены специалистом в данной области техники после прочтения настоящего описания или воплощения практической части изобретения. Таким образом, изобретение не ограничено конкретными рассмотренными в настоящем описании примерами осуществления, но включает все модификации и альтернативы, соответствующие объему и букве изобретения.
Содержание всех документов, цитируемых в настоящем описании, которые включают, без ограничений, опубликованные и неопубликованные заявки, патенты и литературные источники, включено в настоящее описание посредством ссылки полностью и, таким образом, является частью настоящего описания. Если публикации и патенты или патентные заявки, включенные в настоящее описание посредством ссылки, в определенной степени противоречат содержанию настоящего описания, то в этом случае содержание настоящего описания заменяет и/или имеет преимущество перед любым противоречащим материалом.
Пример 2
Полное секвенирование транскриптома единичной клетки
В этом примере рассмотрен способ однородного штрих-кодирования по всей длине кДНК и применения штрих-кодов для определения информации о связности кДНК, а также идентификации клеточного источника, т.е. идентификации единичной клетки, связанной с мРНК.
В этом примере представлен способ секвенирования транскриптома единичной клетки. В этом примере для захвата транскриптома множества единичных клеток на индивидуальных гранулах для захвата применяют капельное микроструйное устройство, и затем для присвоения штрих-кода кДНК, полученной из транскриптома каждой единичной клетки, применяют транспозицию с сохранением связности и комбинаторное индексирование (англ. contiguity preserving transposition and combinatorial indexing, сокращенно CPT-seq). В одном из примеров осуществления для индексации кДНК единичной клетки в способе согласно изобретению применяют способ множественного штрих-кодирования, в котором первый штрих-код добавляют в реакции тагментации, и второй штрих-код добавляют при проведении ПЦР-амплификации.
В одном из примеров производят улавливание поли-А+ РНК из единичных клеток, и захваченную поли-А+ РНК обрабатывают целиком для создания мультиплексной библиотеки секвенирования.
Способ может включать следующие этапы. При выполнении этапа 1 РНК из единичной клетки фиксируют на иммобилизующей грануле. Например, множество единичных клеток (например, приблизительно 1000 единичных клеток) инкапсулируют в индивидуальных каплях (т.е. в среднем одна клетка и одна гранула на каплю), содержащих буфер лизиса и иммобилизующую гранулу. На поверхности иммобилизующей гранулы иммобилизовано множество зондов захвата, которые включают последовательность захвата поли-dT и последовательность ПЦР праймера. Композиция буфера лизиса, находящегося в капле, оказывает действие, приводящее к диссоциации цитоплазматической мембраны единичной клетки, что приводит к высвобождению цитоплазматической РНК. Высвобожденная поли-А+ РНК захватывается посредством гибридизации поли-А+ последовательностей, находящихся на РНК, с олиго-dT последовательностями захвата, иммобилизованными на поверхности совместно инкапсулированной иммобилизующей гранулы. После этого каждая иммобилизующая гранула включает поли-А+ РНК, полученную из транскриптома единичной клетки. Все поли-А+ РНК, полученные из единичной клетки, сохраняют близкое друг к другу расположение на иммобилизующей грануле.
При выполнении этапа 2 иммобилизующие гранулы, на которых иммобилизована поли-А+ РНК единичной клетки, собирают из множества капель (например, приблизительно 1000 иммобилизующих гранул), и выполняют синтез двухцепочечной кДНК. Например, иммобилизующие гранулы объединяют, промывают, и выполняют синтез первой цепи кДНК с использованием РНКазы Н - минус обратной транскриптазы, способной к переключению цепей. Праймер-переключатель цепи встраивается во время синтеза первой цепи кДНК, что позволяет помещать участок связывания универсального праймера на 3' конец кДНК. Затем, используя универсальный праймер и высокоточную ДНК полимеразу при проведении ПЦР (например, от 1 до 2 циклов ПЦР), синтезируют двухцепочечную кДНК. После этого каждая иммобилизующая гранула включает кДНК, обратно транскрибированную из поли-А+ РНК единичной клетки.
При выполнении этапа 3 иммобилизующие гранулы, на которых иммобилизованы двухцепочечные кДНК, распределяют по лункам 96-луночного планшета таким образом, чтобы в одной лунке оказалось приблизительно 10 иммобилизующих гранул.
При выполнении этапа 4 двухцепочечную кДНК, находящуюся в каждой лунке, подвергают тагментации с использованием 96 уникально проиндексированных транспосом. Тагментацию применяют для модификации кДНК адаптором и индексирующими последовательностями, но при этом сохраняется связность единичной клетки. Сборка из 96 уникально проиндексированных транспосомных комплексов, применяемая для проведения тагментации, более подробно рассмотрена ниже. При проведении реакции тагментации происходит добавление первой части двухчастного штрих-кода к каждому будущему фрагменту кДНК. После этого каждая иммобилизующая гранула включает тагментированную кДНК единичной клетки.
При выполнении этапа 5 иммобилизующие гранулы, находящиеся во всех лунках, собирают, объединяют, промывают и перераспределяют по лункам другого 96-луночного планшета так, чтобы в каждой лунке оказалось приблизительно 10 иммобилизующих гранул. мРНК/кДНК индивидуальной клетки остается на поверхности индивидуальной гранулы, транспозаза остается связанной с фрагментированной кДНК и препятствует диссоциации фрагментов.
При выполнении этапа 6 транспозаза и тагментированная кДНК высвобождаются из иммобилизующих гранул. Например, для высвобождения связанной транспозазы и тагментированной кДНК из иммобилизующих гранул в каждую лунку добавляют аликвоту раствора SDS (1% SDS).
При выполнении этапа 7 находящуюся в каждой лунке тагментированную кДНК подвергают амплификации с использованием праймеров ПЦР, которые включают последовательность Р5 или Р7 и уникальную последовательность штрих-кода. Например, в каждую лунку добавляют одну из 96 уникальных комбинаций ПЦР праймеров Р5 и Р7, снабженных штрих-кодами, и проводят амплификацию тагментированных кДНК фрагментов. В результате проведения ПЦР происходит добавление оставшейся части двухчастного штрих-кода к каждому фрагменту кДНК. После этого каждый фрагмент кДНК включает 4 последовательности штрих-кода: две последовательности, присоединенные при проведении реакции тагментации, и две последовательности, присоединенные при проведении ПЦР амплификации. Таким образом, мРНК/кДНК, получаемые из индивидуальной клетки, идентифицируют введением комбинации индекса тагментации и ПЦР индекса, добавляемого при проведении этапа амплификации.
При выполнении этапа 8 снабженные штрих-кодом фрагменты кДНК из каждой лунки объединяют и подвергают секвенированию.
В этом примере для штрих-кодирования приблизительно 1000 единичных клеток применяли комбинаторное индексирование 96×96; при этом шанс получения двумя клетками одинаковых штрих-кодов составляет приблизительно 5%. Производительность может быть легко увеличена посредством увеличения количества "компартментов". Например, применение комбинаторного штрих-кодирования 384×384 (приблизительно 147456 виртуальных компартментов) позволяет параллельно снабдить индивидуальными штрих-кодами приблизительно 10000 единичных клеток; при этом шанс получения двумя клетками одинаковых штрих-кодов составляет приблизительно 3%.
В этом примере также рассмотрен способ сборки 96 снабженных уникальными штрих-кодами транспосомных комплексов для добавления первой части двухчастного штрих-кода в соответствии с протоколом комбинаторного штрих-кодирования. Способ включает, без ограничений, представленные ниже этапы.
При проведении этапа А, 20 уникальным образом проиндексированных транспозонов получают соединением комплементарных нитей (ренатурацией) индивидуально проиндексированных олигонуклеотидов, каждый из которых содержит последовательность Tn5 мозаичного конца (МК) на конце 3', с универсальным 5' фосфорилированным комплементарным олигонуклеотидом МК (pMENTS). Например, проиндексированный олигонуклеотид 1110, который включает последовательности Р5, уникальную индексирующую последовательность из 8 оснований "i5", универсальную соединительную последовательность Универсальный коннектор А-С15: и МК последовательность, соединяют с МК комплементарной последовательностью 1115. МК комплементарная последовательность 1115 представляет собой универсальный фосфорилированный по 5' олигонуклеотид (pMENTS), комплементарный МК последовательностям в проиндексированном олигонуклеотиде 1110. Универсальную соединительную последовательность А-С15 затем используют для ренатурации специально созданного праймера секвенирования индекса 2.
Вторую группу реакций ренатурации (т.е. 12 индивидуальных реакций ренатурации) выполняют для создания второй группы, состоящей из 12 транспозонов, в которой каждый из них включает уникальную индексирующую последовательность "i7" из 8 оснований, соседствующую с последовательностью Р7. Например, проиндексированный олигонуклеотид 1120, который включает последовательности Р7, уникальную индексирующую последовательность i7 из 8 оснований, универсальную соединительную последовательность B-D15 и последовательность МК, соединяют в процессе ренатурации с МК комплементарной последовательностью 1115. Универсальную соединительную последовательность B-D15 затем используют для ренатурации специально созданного праймера секвенирования индекса 1.
При проведении этапа В подвергнутые ренатурации P5_i5 транспозоны 1125 (т.е. 8 P5_i5 транспозонов 1125, каждый из которых имеет уникальную индексирующую последовательность i5 из 8 оснований) и подвергнутые ренатурации P7_i7 транспозоны 1130 (т.е. 12 транспозонов 1130, каждый из которых имеет уникальную индексирующую последовательность i7 из 8 оснований) собирают в отдельных реакциях с Tn5 транспозазой с образованием транспосомных комплексов. Например, каждый подвергнутый ренатурации P5_i5 транспозон 1125 инкубируют с Tn5 транспозазой 1135 при приблизительно 37°С в течение приблизительно 1 часа, получая P5_i5 транспосомный комплекс 1140. Аналогично, каждый подвергнутый ренатурации P7_i7 транспозон 1130 инкубируют с Tn5 транспозазой 1135 при приблизительно 37°С в течение приблизительно 1 часа, получая P7_i7 транспосомный комплекс 1145.
При проведении этапа С объединением аликвот P5_i5 транспосомных комплексов 1140 с аликвотами P7_i7 транспосомных комплексов 1145 получают 96 уникальных транспосомных комплексов. Например, аликвоты P5_i5 транспосомных комплексов 1140 помещают в ряды А-Н 96-луночного планшета, а аликвоты P7_i7 транспосомных комплексов 1145 помещают в колонки 1-12 того же 96-луночного планшета. Комбинирование восьми P5_i5 транспосомных комплексов 1140 и двенадцати P7_i7 транспосомных комплексов 1145 приводит к получению 96 различных комбинаций индексов.
Для оценки собранных транспосомных комплексов, с помощью одной реакции тагментации и одной ПЦР была получена библиотека секвенирования из 10 единичных клеток. Были объединены десять иммобилизующих гранул, включающих кДНК из 10 единичных клеток, которые затем подвергали тагментации с использованием транспосомной смеси P5_i5_1 плюс P7_i7_1. Затем тагментированная кДНК была высвобождена из иммобилизующих гранул и подвергнута ПЦР амплификации с использованием снабженных штрих-кодом праймеров Р5 и Р7, в результате чего получали библиотеку секвенирования. Затем в библиотеке секвенирования с помощью биоанализатора проводили анализ распределения размеров фрагментов. В некоторых примерах осуществления после проведения ПЦР производили постобработку. В некоторых примерах осуществления после проведения первой постобработки SPRI (Solid Phase Reversible Immobilization beads, Гранул для обратимой твердофазной иммобилизации) выполняли вторую постобработку SPRI. В некоторых примерах осуществления перед проведением анализа в биоанализаторе образец разбавляли в 10 раз.
В другом примере для создания библиотеки секвенирования из 100 единичных клеток использовали две различных смеси транспосомных комплексов. В этом примере для оценки транспосомных комплексов применяли протокол разделения и объединения. Сто иммобилизующих гранул, включающих кДНК из 100 единичных клеток, распределяли по двум реакциям тагментациии, причем одну реакцию тагментации проводили с использованием смеси транспосом P5_i5_2 плюс P7_i7_2, а вторую реакцию тагментации проводили с использованием смеси транспосом P5_i5_3 плюс P7_i7_3. После проведения реакций тагментации, для создания двух библиотек секвенирования иммобилизующие гранулы из каждой реакции объединяли и перераспределяли для проведения ПЦР амплификации с использованием двух уникальных комбинаций снабженных штрих-кодом ПЦР праймеров Р5 и Р7 (т.е. первой комбинации ПЦР праймеров Р5 и Р7 и второй комбинации ПЦР праймеров Р5 и Р7). Затем в каждой библиотеке секвенирования с помощью биоанализатора проводили анализ распределения размеров фрагментов. Анализ библиотеки, снабженной штрих-кодами, проводили после однократного этапа очистки 0,7xSPRI.
Расшифровка сокращений, использованных в графических материалах:
РАМ - полиакриламид
гДНК - геномная ДНК
PCR - ПЦР - полимеразная цепная реакция
MDA - амплификация целого генома (WGA) с множественным замещением цепи (WGA Multiple Displacement Amplification)
WTA - амплификация целого транскриптома (от англ. whole transcriptome amplification).
WGA - амплификация целого генома (от англ. whole genome amplification)
СЕ - элемент, сохраняющий связность (от англ. contiguity preserving element)
TSO - template switching oligo - олигонуклеотид переключения матрицы
LNA - Locked Nucleic Acid - запертая нуклеиновая кислота
ISPCR -In Situ ПЦР (от англ. In Situ Polymerase Chain Reaction)
CPT - сохраняющее связность транспозиционное секвенирование (от англ. seq - contiguity preserving transposition sequencing)
TAT - транс-действующий активатор транскрипции (от англ. trans-activating transcriptional activator)
kb - 1000 оснований, "т.о." (от англ. kilobase)
bp - пар оснований (от англ. base pair)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ АНАЛИЗА КЛЕТОЧНЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717491C2 |
| СИСТЕМА АНАЛИЗА ДЛЯ ОРТОГОНАЛЬНОГО ДОСТУПА К БИОМОЛЕКУЛАМ И ИХ МЕЧЕНИЯ В КЛЕТОЧНЫХ КОМПАРТМЕНТАХ | 2017 |
|
RU2771892C2 |
| СПОСОБЫ ДИСКРЕТНОЙ АМПЛИФИКАЦИИ ПОЛНОГО ГЕНОМА | 2016 |
|
RU2736351C2 |
| АНАЛИЗ МНОЖЕСТВА АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ОДНОГО АНАЛИЗА | 2019 |
|
RU2824049C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2833615C2 |
| ТРАНСПОЗИЦИЯ С СОХРАНЕНИЕМ СЦЕПЛЕНИЯ ГЕНОВ | 2015 |
|
RU2736728C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838946C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ БИБЛИОТЕКИ ОДИНОЧНЫХ ЯДЕР И ОДИНОЧНЫХ КЛЕТОК И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2838545C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНОЕ СЕКВЕНИРОВАНИЕ ОДИНОЧНОЙ КЛЕТКИ СО СНИЖЕННОЙ ОШИБКОЙ АМПЛИФИКАЦИИ | 2019 |
|
RU2744175C1 |
| КРУПНОМАСШТАБНЫЕ МОНОКЛЕТОЧНЫЕ БИБЛИОТЕКИ ТРАНСКРИПТОМОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2773318C2 |

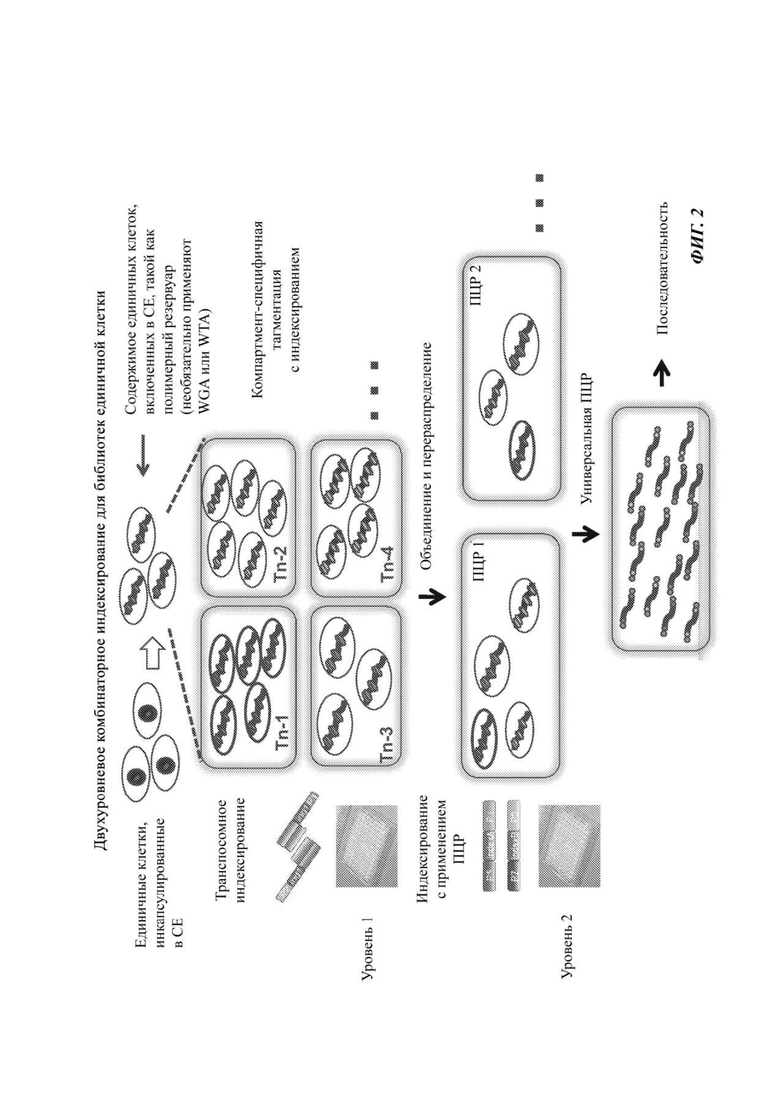
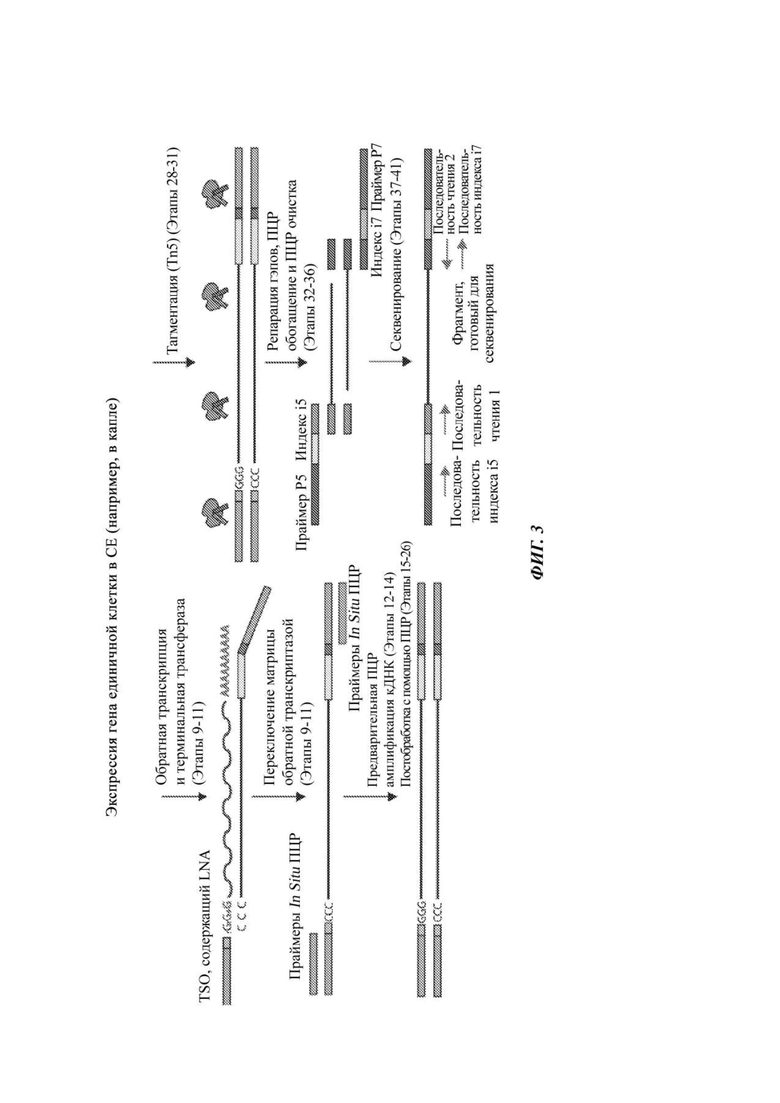
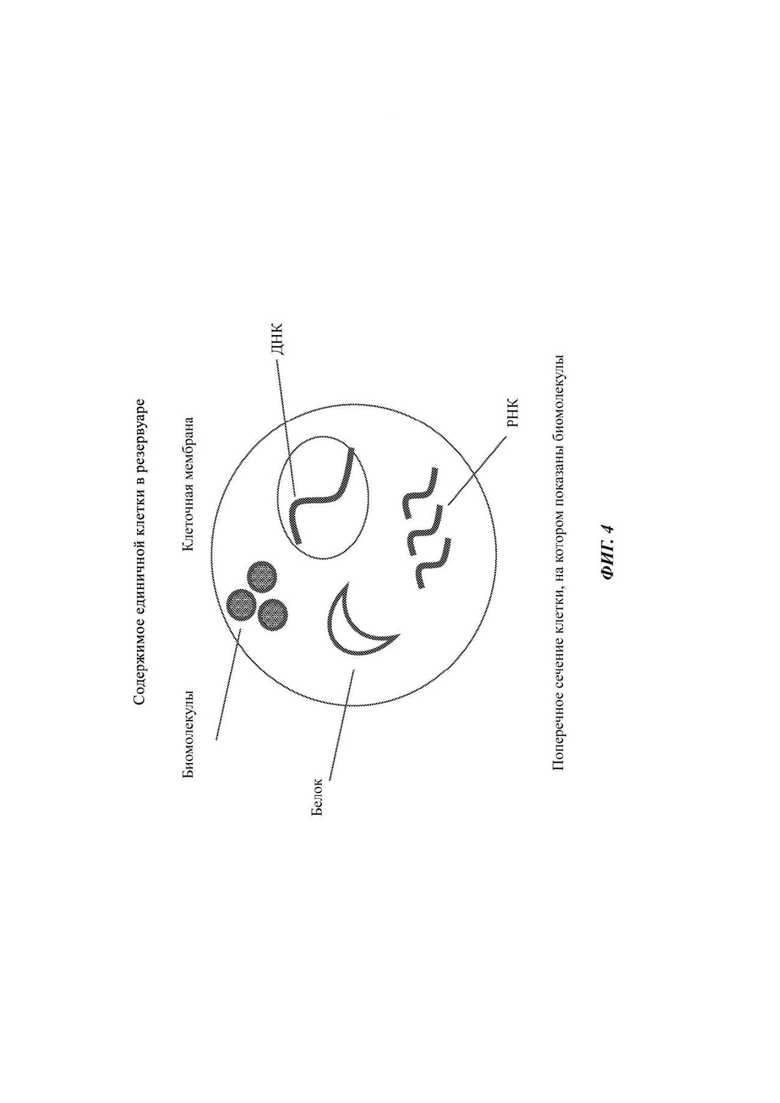
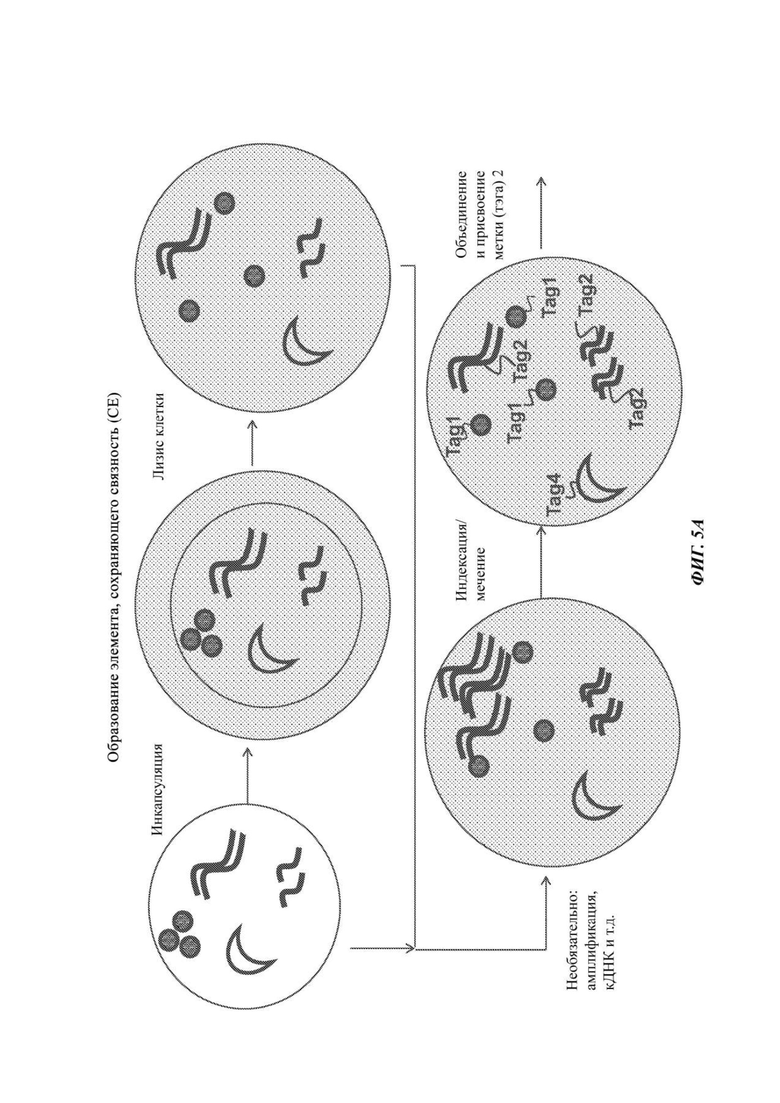
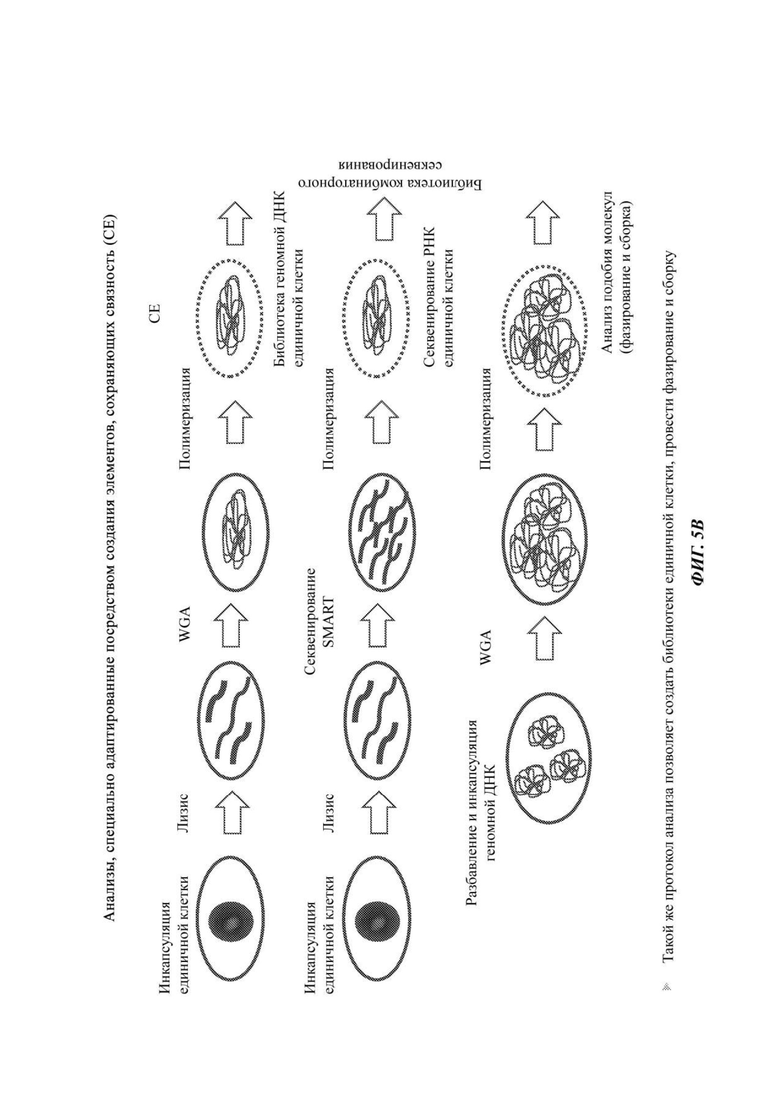



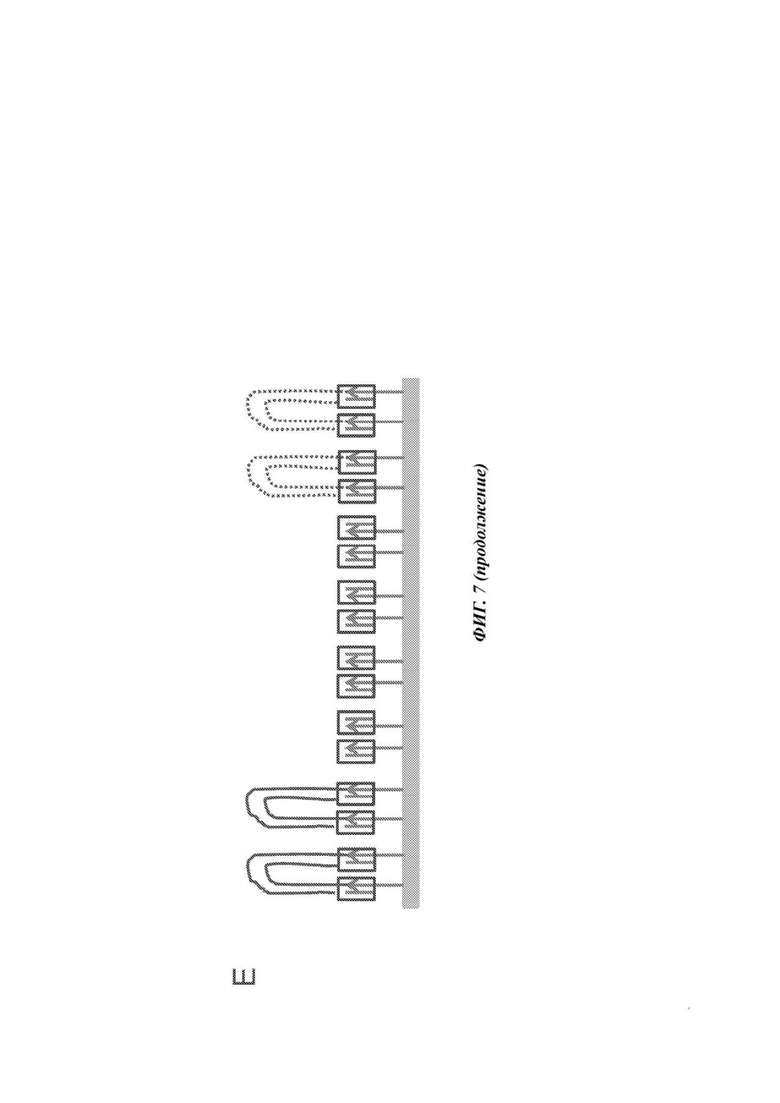
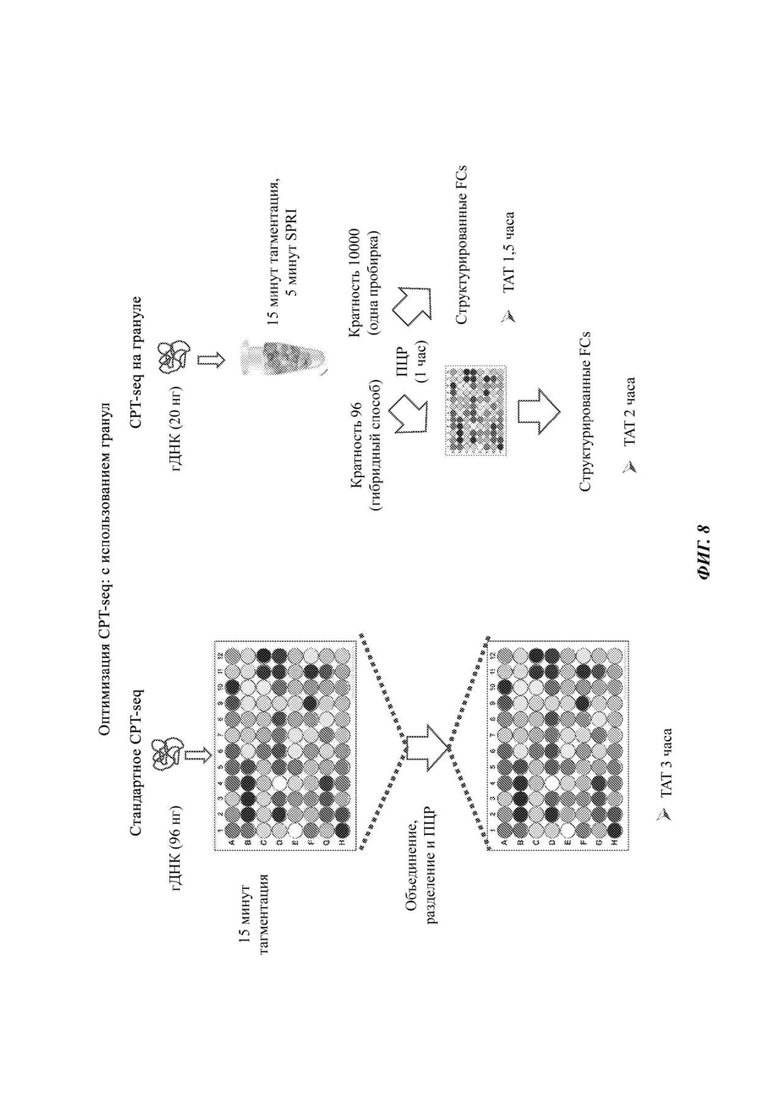




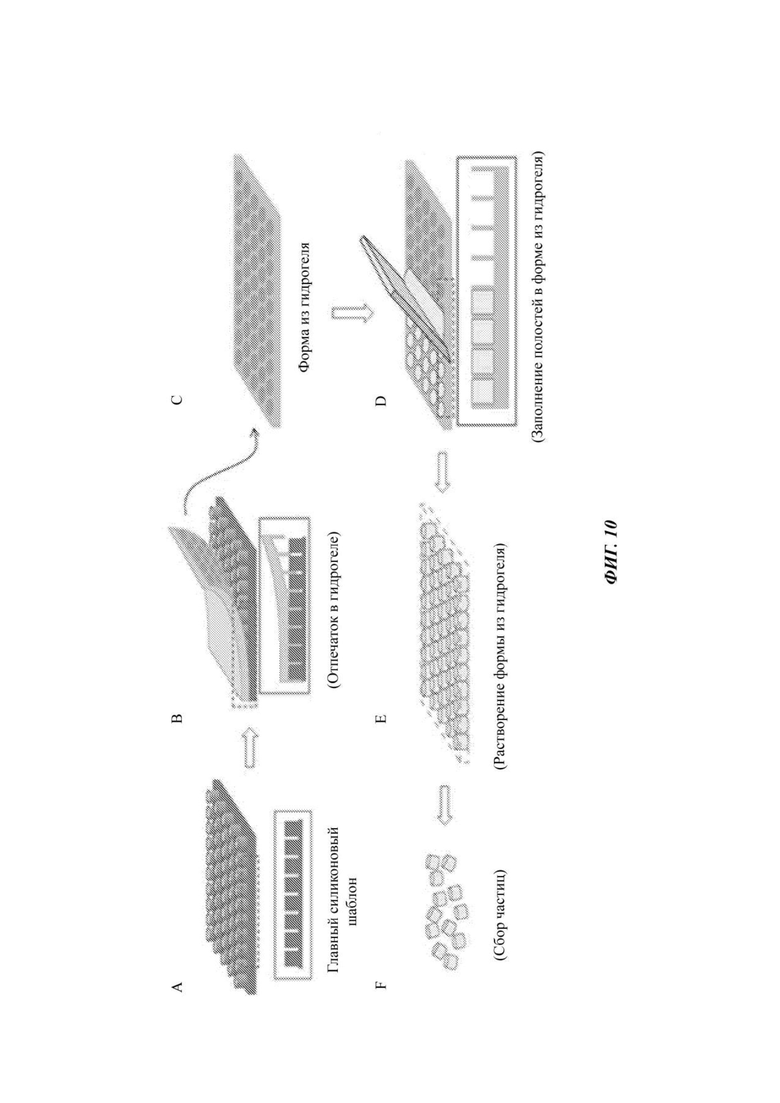
Группа изобретений относится к области биотехнологии. Предложен способ анализа клеточных компонентов (варианты). В первом варианте способ включает объединение капель буфера лизиса и капель клеточной суспензии, объединение капель лизата с каплями реагента, где реагент включает репортерную группу и ферменты, объединение включающих репортерную группу капель с каплями промывного раствора и получение информации о последовательности. Во втором и третьем вариантах способ включает нанесение клеток на твердые подложки, где каждая твердая подложка представляет собой сохраняющий связность (CE) элемент, проведение лизиса клеток с образованием множества СЕ, компартментализацию CE с образованием первых компартментов, обеспечение компартмента первой репортерной группы и модификацию нуклеиновой кислоты, объединение СЕ, компартментализацию CE с образованием вторых компартментов, обеспечение компартмента второй репортерной группы и модификацию нуклеиновой кислоты. Во втором варианте способ включает получение информации о последовательности из включающей первую репортерную группу нуклеиновой кислоты, а в третьем варианте способ включает анализ включающих одну или более первых репортерных групп и одну или более вторых репортерных групп веществ. Изобретения обеспечивают возможность различать идентичные молекулы после обработки и определять исходного представления молекул или популяции молекул. 3 н. и 39 з.п. ф-лы, 10 ил., 2 пр.
1. Способ анализа клеточных компонентов, включающий получение информации о последовательности из целевой нуклеиновой кислоты, содержащейся в единичной клетке, который включает:
a) введение клеточной суспензии в первый капельный манипулятор;
b) применение операций с каплями, проводимых посредством электродов, для такого дозирования множества капель, включающих клеточную суспензию, при котором каждая капля включает единичную клетку;
c) введение буфера лизиса клеток во второй капельный манипулятор;
c) применение операций с каплями, проводимых посредством электродов, для дозирования множества капель, включающих буфер лизиса клеток;
d) применение операций с каплями, проводимых посредством электродов, для объединения множества капель буфера лизиса клеток и множества капель клеточной суспензии, что приводит к получению множества капель лизата клеток;
e) введение раствора реагента, включающего первую репортерную группу и ферменты, в третий капельный манипулятор, где по меньшей мере один фермент обладает способностью вводить первую репортерную группу в целевую нуклеиновую кислоту, и при этом первая репортерная группа идентифицирует единичную клетку;
f) применение операций с каплями, проводимых посредством электродов, для дозирования множества капель, включающих раствор реагента;
g) применение операций с каплями, проводимых посредством электродов, для объединения множества капель лизата клеток с каплями реагента, которое приводит к образованию множества капель, включающих первую репортерную группу, в котором репортерные группы введены в нуклеиновые кислоты, содержащиеся в каплях клеточного лизата;
h) применение операций с каплями, проводимых посредством электродов, для дозирования множества капель, включающих промывной раствор;
i) применение операций с каплями, проводимых посредством электродов, для объединения множества капель, включающих первую репортерную группу, с каплями промывного раствора, что приводит к удалению фермента, остающегося после реакции, из нуклеиновой кислоты и образованию множества капель, включающих целевую нуклеиновую кислоту, причем целевая нуклеиновая кислота включает первую репортерную группу;
(j) по меньшей мере однократное повторение этапов (e)-(i), в котором последующие растворы реагентов включают репортерные группы, отличающиеся от первой репортерной группы, что приводит к образованию множества капель, включающих целевую нуклеиновую кислоту, включающую множество репортерных групп;
(k) получение информации о последовательности из целевой нуклеиновой кислоты, включающей одну или более репортерных групп, и сопоставление информации о последовательности с единичной клеткой.
2. Способ по п. 1, дополнительно включающий:
(l) введение в капельный манипулятор раствора реагента для мечения белка, включающего метки, специфичные для белков;
(m) применение операций с каплями, проводимых посредством электродов, для дозирования множества капель, включающих раствор реагента для мечения белка;
(n) применение операций с каплями, проводимых посредством электродов, для объединения множества растворов реагента для мечения белка с множеством капель, включающих целевую нуклеиновую кислоту, включающую множество репортерных групп, где по меньшей мере часть белков из единичной клетки включает метку, уникальную для единичной клетки, и идентификацию по меньшей мере части белков, включающих метки.
3. Способ по п. 2, в котором способ получения информации о последовательности из целевой нуклеиновой кислоты осуществляют одновременно с идентификацией по меньшей мере части белков, включающих метки.
4. Способ по любому из пп. 1-3, в котором целевая нуклеиновая кислота представляет собой РНК.
5. Способ по любому из пп. 1-3, в котором целевая нуклеиновая кислота представляет собой ДНК.
6. Способ по п. 5, в котором целевая нуклеиновая кислота представляет собой геномную ДНК.
7. Способ по любому из пп. 1-3, в котором целевая нуклеиновая кислота представляет собой и РНК, и ДНК.
8. Способ по любому из пп. 1-7, в котором первая репортерная группа введена в целевую нуклеиновую кислоту посредством лигирования.
9. Способ по любому из пп. 1-8, дополнительно включающий:
(i) введение раствора реагента, включающего репортерные группы, специфичные для продуктов метаболизма клетки, в капельный манипулятор;
(ii) применение операций с каплями, проводимых посредством электродов, для дозирования множества капель реагента, включающего репортерные группы, специфичные для продуктов метаболизма клетки;
(iii) применение операций с каплями, проводимых посредством электродов, для объединения множества капель реагента с множеством капель, включающих целевую нуклеиновую кислоту, включающую множество репортерных групп, где по меньшей мере часть продуктов метаболизма клетки, получаемых из единичной клетки, включает репортерную группу, уникальную для единичной клетки, и идентификацию по меньшей мере части продуктов метаболизма клетки.
10. Способ анализа клеточных компонентов, включающий получение информации о последовательности из клеточной нуклеиновой кислоты, который включает:
(a) нанесение одной или более клеток на множество твердых подложек, где каждая твердая подложка представляет собой элемент, сохраняющий связность (CE), причем твердые подложки включают группы, иммобилизующие клетки, и в результате такого нанесения одна клетка оказывается иммобилизованной на каждой из твердых подложек;
(b) проведение лизиса клеток, иммобилизованных на твердых подложках, с образованием множества СЕ, где каждый CE содержит клеточный лизат;
(c) компартментализацию CE с образованием множества первых компартментов;
(d) обеспечение каждого компартмента множества первых компартментов наличием первой репортерной группы для нуклеиновой кислоты, содержащейся в CE каждого компартмента, и модификацию нуклеиновой кислоты с образованием CE, содержащего нуклеиновые кислоты, включающие первую репортерную группу, причем первая репортерная группа, доставляемая к каждому из компартментов, отличается от первой репортерной группы каждого из других компартментов, так что первая репортерная группа идентифицирует СЕ каждого компартмента, где модификация включает мечение, удлинение, амплификацию или лигирование;
(e) объединение СЕ, включающего нуклеиновые кислоты, включающие первую репортерную группу;
(f) компартментализацию CE с образованием множества вторых компартментов;
(g) обеспечение каждого компартмента множества вторых компартментов наличием второй репортерной группы для нуклеиновых кислот, содержащихся в СЕ каждого компартмента, и модификацию нуклеиновой кислоты таким образом, чтобы по меньшей мере некоторые из нуклеиновых кислот содержали первую репортерную группу и вторую репортерную группу, где вторая репортерная группа, доставляемая к анализируемым веществам каждого компартмента, отличается от второй репортерной группы, доставляемой к анализируемому веществу каждого из других компартментов, и где второй набор репортерных групп идентифицирует СЕ каждого компартмента, причем модификация включает мечение, удлинение, амплификацию или лигирование;
(h) получение информации о последовательности из нуклеиновой кислоты, включающей первую репортерную группу.
11. Способ по п. 10, в котором нуклеиновая кислота представляет собой геномную ДНК.
12. Способ по п. 10, в котором нуклеиновая кислота представляет собой РНК.
13. Способ по п. 12, дополнительно включающий обратную транскрипцию РНК в кДНК.
14. Способ по любому из пп. 10-13, дополнительно включающий обеспечение наличия дополнительных репортерных групп для нуклеиновой кислоты этапа (d), включающей первую репортерную группу, и модификацию нуклеиновой кислоты этапа (c) с целью дополнительного включения одной или более дополнительных репортерных групп.
15. Способ по п. 14, в котором дополнительные репортерные группы отличаются от первой репортерной группы.
16. Способ по любому из пп. 10-15, в котором нуклеиновая кислота представляет собой нуклеиновую кислоту из единичной клетки.
17. Способ по любому из пп. 10-16, в котором нуклеиновая кислота представляет собой и РНК, и ДНК.
18. Способ по любому из пп. 10-17, в котором твердая подложка выбрана из группы, состоящей из проточных ячеек, гранул и микролунок.
19. Способ по любому из пп. 10-18, в котором группы, иммобилизующие клетки, представляют собой антитела, где антитела связываются с белками клеточной поверхности.
20. Способ по п. 19, в котором антитела представляют собой моноклональные антитела.
21. Способ по любому из пп. 19, 20, в котором антитела специфично связываются с белками клеточной поверхности, специфичными для раковых клеток.
22. Способ по любому из пп. 10-21, дополнительно включающий воздействие на клеточный лизат меток, специфичных для белков, где по меньшей мере часть белка клетки включает метку, уникальную для клетки, и идентификацию по меньшей мере части белков, включающих метки.
23. Способ по п. 22, в котором идентификация по меньшей мере части белков, включающих метки, и получение информации о последовательности из клеточной нуклеиновой кислоты производят одновременно.
24. Способ по любому из пп. 10-23, в котором одна или более репортерные группы включают по меньшей мере один штрих-код.
25. Способ по любому из пп. 10-26, в котором одна или более репортерные группы включают участок связывания праймера.
26. Способ по любому из пп. 10-25, в котором модификацию нуклеиновой кислоты, включающей первую репортерную группу, производят лигированием.
27. Способ по любому из пп. 10-24, в котором модификацию нуклеиновой кислоты, включающей одну или более дополнительных репортерных групп, производят лигированием.
28. Способ по любому из пп. 10-27, в котором модифицированную нуклеиновую кислоту, включающую первую репортерную группу, подвергают амплификации до получения информации о последовательности.
29. Способ по любому из пп. 10-28, в котором модифицированную нуклеиновую кислоту, включающую две или более репортерные группы, подвергают амплификации до получения информации о последовательности.
30. Способ по любому из пп. 10-28, в котором по меньшей мере часть клеток связана с заболеванием.
31. Способ по п. 30, в котором по меньшей мере часть клеток связана с раковым заболеванием.
32. Способ анализа клеточных компонентов, включающий:
(a) нанесение одной или более клеток на множество твердых подложек, где каждая твердая подложка представляет собой элемент, сохраняющий связность (CE), причем твердые подложки включают группы, иммобилизующие клетки, и в результате такого нанесения одна клетка оказывается иммобилизованной на каждой из твердых подложек;
(b) проведение лизиса клеток, иммобилизованных на твердой подложке, с образованием множества СЕ, содержащих клеточные лизаты;
(c) компартментализацию CE с образованием множества первых компартментов;
(d) включение в каждый компартмент множества первых компартментов одной или более первых репортерных групп в CE каждого компартмента, в результате чего одно или более анализируемых веществ, находящихся в CE, включает одну или более первых репортерных групп, с образованием CE, содержащего одну или более первых репортерных групп, и при этом одна или более первых репортерных групп уникальна для каждого компартмента, так что одна или более первых репортерных групп идентифицирует CE каждого компартмента;
(e) объединение СЕ, содержащего одну или более первых репортерных групп;
(f) компартментализацию CE с образованием множества вторых компартментов;
(g) обеспечение СЕ одной или более вторых репортерных групп, отличных от одной или более первых репортерных групп, так что одно или более анализируемых веществ в СЕ содержит одну или более первых репортерных групп и одну или более вторых репортерных групп, причем одна или более вторых репортерных групп уникальна для каждого компартмента, так что одна или более вторых репортерных групп идентифицирует СЕ каждого компартмента;
(h) анализ анализируемых веществ, включающих одну или более первых репортерных групп и одну или более вторых репортерных групп, причем такой анализ позволяет идентифицировать клетки и обнаруживать компоненты клетки.
33. Способ по п. 32, в котором единичные клетки иммобилизованы на твердой подложке.
34. Способ по любому из пп. 32, 33, в котором твердая подложка выбрана из группы, состоящей из проточных ячеек, гранул и микролунок.
35. Способ по любому из пп. 32-34, в котором группы, иммобилизующие клетки, представляют собой антитела, где антитела связываются с белками клеточной поверхности.
36. Способ по п. 35, в котором антитела представляют собой моноклональные антитела.
37. Способ по любому из пп. 35, 36, в котором антитела специфично связываются с белками клеточной поверхности, специфичными для раковых клеток.
38. Способ по п. 32, в котором анализируемые вещества выбраны из группы, состоящей из белка, нуклеиновой кислоты, органелл, липидов, углеводов, продуктов метаболизма клетки.
39. Способ по любому из пп. 32-38, в котором одна или более репортерные группы включают участок связывания праймера.
40. Способ по любому из пп. 32-38, в котором одно или более анализируемых веществ представляют собой нуклеиновые кислоты.
41. Способ по п. 40, в котором перед проведением анализа нуклеиновые кислоты, включающие репортерные группы, подвергают амплификации.
42. Способ по любому из пп. 40, 41, в котором анализ нуклеиновой кислоты производят секвенированием.
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| УСТРОЙСТВО ДЛЯ ИНТЕГРАЛЬНОГО АНАЛИЗА НУКЛЕИНОВЫХ КИСЛОТ В РЕАЛЬНОМ ВРЕМЕНИ И СПОСОБ ОПРЕДЕЛЕНИЯ ЦЕЛЕВОЙ НУКЛЕИНОВОЙ КИСЛОТЫ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2532853C2 |
Авторы
Даты
2021-12-08—Публикация
2016-02-10—Подача