Область техники
Настоящее изобретение относится к частицам, содержащим аморфный эмпаглифлозин и фармацевтически приемлемый полимер, а также к процессу их изготовления методом высушивания распылением.
Уровень техники
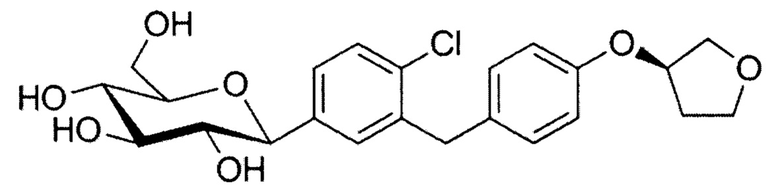
Эмпаглифлозин или (1S)-1,5-ангидро-1-(4-хлор-3-{4-[(3S)-тетрагидрофуран-3-илокси] бензил}фенил)-D-глюцитол представляет собой мощный ингибитор натрий-глюкозного контранспортера 2 типа (SGLT-2) и в связи с этим используется для лечения сахарного диабета 2 типа. В настоящее время он разрешен к применению для лечения сахарного диабета 2 типа и улучшения контроля содержания сахара в крови. Молекула эмпаглифлозина, который относится к глюкопиранозил-замещенным производным бензола, была впервые описана в Международной патентной заявке WO 2005/092877 и имеет следующую структурную формулу:
В зависимости от условий изготовления, эмпаглифлозин может принимать кристаллическую или аморфную форму. Аморфная форма очень неустойчива. Эти формы различаются по своим физическим свойствам, в частности - по растворимости и биодоступности. Кристаллическая форма эмпаглифлозина впервые упоминается в патентной заявке WO 2006/117359. Лекарственный препарат, содержащий кристаллическую форму эмпаглифлозина, был затем описан в патентной заявке WO 2010/092126. Оригинальный продукт, продающийся на рынке под торговым наименованием Джардинс (Jardiance), содержит кристаллический эмпаглифлозин и продается в лекарственной форме с общей дозировкой 10 или 25 мг действующего вещества, при рекомендуемой частоте приема один раз в день. Лекарственная форма представляет собой таблетку с немедленным высвобождением, покрытую оболочкой, где содержащиеся в таблетке частицы имеют размер D(0,9)≤200 мкм, при измерении методом динамического рассеяния света. Размер частиц является критическим фактором для скорости растворения эмпаглифлозина несмотря на то, что, в соответствии с биофармацевтической классификационной системой, эмпаглифлозин входит в III класс БКС, то есть относится к хорошо растворимым, но плохо всасывающимся веществам. Для специалиста в соответствующей области было бы логично предположить, что у таких веществ размер их частиц не оказывает значительного влияния на их биодоступность. Однако было неожиданно обнаружено, что растворимость (и как следствие, биодоступность) кристаллического эмпаглифлозина зависит от размера частиц, что описано в WO 2010/092126. Таким образом, при изготовлении лекарственных форм, содержащих кристаллический эмпаглифлозин, следует тщательно контролировать размер частиц, так как любое отклонение может оказать сильное влияние на свойства растворимости готового продукта.
Растворимость эмпаглифлозина можно также улучшить, используя аморфную форму вместо кристаллической. Однако аморфный эмпаглифлозин, сам по себе, очень неустойчив и практически сразу рекристаллизуется. В WO 2016/051368 описан способ стабилизации аморфного эмпаглифлозина посредством образования его комплекса с циклодекстрином. Этот процесс состоит из растворения кристаллического эмпаглифлозина в растворителе, добавления циклодекстрина и выделения твердой дисперсии эмпаглифлозина и циклодекстрина после испарения растворителя. В качестве растворителя использовали метанол при повышенной температуре 60°С. Этот процесс сопряжен со значительными рисками для безопасности, связанными с тем, что метанол представляет собой ядовитое и, кроме того, очень летучее вещество.
В чешской патентной заявке PV 2015-279 описывается изготовление аморфной формы эмпаглифлозина за счет испарения растворителя посредством ротационного вакуумного выпаривания или лиофилизации. Однако в результате такого процесса изготовления образуется тонкая пленка продукта, которую необходимо подвергать этапам дополнительной обработки - например, измельчению, и при этом полученная форма продукта все равно не обладает физическими свойствами, которые в полной мере подходили бы для изготовления твердых лекарственных форм. Кроме того, испарение растворителя занимает очень много времени, а образующаяся в результате пленка отличается неоднородностью.
В чешской патентной заявке PV 2017-152 описывается изготовление аморфной формы эмпаглифлозина с фармацевтически приемлемыми полимерами путем экструзии горячего расплава. Однако экструзия горячего расплава осуществляется при высоких температурах, что вызывает распад некоторой части используемого эмпаглифлозина и снижает выход готового продукта. Кроме того, эмпаглифлозин, изготовленный таким образом, не обладает физическими свойствами, подходящими в полной мере для изготовления твердых фармацевтических форм (см., в частности, необходимость применять антислеживатели в примерах лекарственных составов в PV 2017-152), и в итоге для него становится необходимым этап дробления.
Таким образом, в отрасли существует настоятельная потребность в простом, экономически выгодном процессе изготовления аморфного эмпаглифлозина, обладающего хорошей растворимостью и устойчивостью.
Описание изобретения
В рамках настоящего изобретения, авторами было обнаружено, что аморфный эмпаглифлозин в сочетании с фармацевтически приемлемым полимером может создавать высокоустойчивые твердые растворы путем высушивания распылением, где получаемые в результате частицы обладают превосходными физическими свойствами для изготовления твердых лекарственных форм.
По сравнению с экструзией горячего расплава, высушивание распылением проводят при более низких температурах, поэтому отсутствует риск распада эмпаглифлозина. Кроме того, полученный материал имеет форму сферических частиц с превосходной сыпучестью и может непосредственно смешиваться с другими вспомогательными веществами. Высушивание распылением приводит к получению сферических частиц с относительно узким распределением по размеру. На конкретный размер частиц часто влияют условия, существующие в процессе высушивания распылением, в том числе, в частности, температура сушильного газа, расход сушильного газа, расход высушенного материала и давление распыления форсунки. При обеспечении постоянных условий во время процесса, всегда получаются частицы примерно одинакового размера.
Сферическая форма частиц дополнительно обеспечивает улучшенную сыпучесть, в связи с чем из частиц может быть легко образован готовый продукт в виде таблетки или капсулы. Таким образом, в частности, отпадает необходимость в дроблении экструдата, который получался бы при использовании технологии экструзии горячего расплава, или в измельчении продукта, который получался бы при испарении растворителя. При дроблении, получаются частицы с широким диапазоном распределения по размеру, например, 1-200 мкм. Кроме того, при помоле невозможно обеспечить сферическую форму частиц, получаемых в результате измельчения.
В продукте, высушенном распылением, эмпаглифлозин заключен в полимерную матрицу в виде твердого раствора, что снижает его нежелательные адгезивные свойства. В то же время, также обеспечивается снижение запыленности и подверженности персонала действию эмпаглифлозина во время таблетирования, заполнения капсул или фасовки порошка. Это очень важно, так как речь идет о веществе, относимом к классу ОЕВ 3 (по диапазону концентрации в воздухе рабочей зоны). Эта классификация отражает диапазон значений концентрации в воздухе рабочей зоны, и для эмпаглифлозина предварительное значение установлено равным 20 μг/м3 (OEL, Предельное значение профессионального воздействия). Эмпаглифлозин в форме твердого раствора может легко образовывать со вспомогательными веществами лекарственный препарат. Изготовленный таким образом состав высокоустойчив, не подвержен последующей рекристаллизации или распаду эмпаглифлозина, в связи с чем не требуется особых условий хранения лекарственного средства.
Например, размер частиц можно измерить методом динамического рассеяния света и/или посредством визуального анализа изображений частиц. В настоящем документе для определения размера частиц применяли визуальный анализ изображений, полученных растровой электронной микроскопией.
Настоящее изобретение позволяет получить частицы (т.е., состав в виде частиц), содержащие аморфный эмпаглифлозин и фармацевтически приемлемый полимер, имеющие размер, определенный анализом изображений растровой электронной микроскопии с D(0.9), не более 100 мкм, предпочтительно - не более 50 мкм, в наиболее предпочтительном случае - не более 20 мкм.
D(0.9) - это 90-й квантиль размера частиц, где значение D(0.9) указывает на диапазон или предел размера частиц, которому соответствует 90% объемных процентов всех частиц в системе.
Кроме того, в рамках настоящего изобретения был получен стабилизированный аморфный эмпаглифлозин с узким распределением размера сферических частиц в пределах от 1 до 20 мкм. Такое распределение размера было достигнуто за счет высушивания распылением и за счет контроля условий высушивания распылением. Было обнаружено, что более высокий расход сушильного газа приводит к получению частиц меньшего размера, а менее высокий расход сушильного газа приводит к получению частиц большего размера. Еще одним параметром, который существенно влияет на получаемый размер частиц, является содержание твердых веществ, растворенных в растворе, который высушивается распылением. Более высокое содержание твердых веществ (т.е., более высокая концентрация раствора) приводит к образованию более крупных частиц. Сферические частицы с размером от 1 до 20 μмкм получают при расходе сушильного газа 5-7 л/мин, содержании растворенных твердых веществ 15-40 мг/мл, с использованием двухфазной форсунки диаметром 0,6-0,8 мм, при температуре сушильного газа на входе 90-110°С, температуре на выходе 60-65°С и скорости ввода распыляемого раствора 5-7 мл/мин. В предпочтительном случае, применяют следующие параметры высушивания распылением: расход сушильного газа 6 л/мин и содержание растворенных твердых веществ 30 мг/мл, двухфазная форсунка диаметром 0,7 мм, температура сушильного газа на входе 100°С, температура на выходе 62°С и скорость ввода распыляемого раствора 6 мл/мин. Такое узкое распределение является предпочтительным ввиду последующего смешивания частиц с другими вспомогательными веществами. Изменение в расходе сушильного газа до 8 л/мин и/или изменение в содержании растворенных твердых веществ до 6 мг/мл, при сохранении неизменными значений других параметров, приводило к получению частиц размером менее 1 мкм, которые в последующем считались несколько худшими с технологической точки зрения из-за возросшей клейкости материала и снижения сыпучести.
Для образования полимерной матрицы допускается использовать полимер, допущенный к применению в фармацевтическом производстве. Такие фармацевтически приемлемые полимеры хорошо известны из уровня техники. К факторам, влияющим на выбор полимера, относятся, в частности, химическая чистота действующего вещества, его растворимость в выбранном полимере, растворимость полимера в выбранном растворителе, гигроскопичность и т.п. Таким образом, выбор подходящего полимера или группы полимеров может быть различным в зависимости от конкретного случая.
К подходящим фармацевтически приемлемым полимерам, в частности, относятся, гомополимеры и сополимеры полиалкиленоксидов, таких как полиэтиленгликоль и полипропиленгликоль; гомополимеры и сополимеры N-виниллактамов, в частности N-винилпирролидона, таких как поливинилпирролидон (ПВП), винилацетатов, таких как Коллидон, и N-винилкапролактама; гомополимеры и сополимеры акриловых кислот и их производных; гомополимеры и сополимеры метакриловой кислоты и ее производных, в частности метилметакрилата; а также производные целлюлозы - такие, как метилцеллюлоза, этилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза (ГЭЦ), гидроксипропилцеллюлоза (ГПЦ), гидроксипропилметилцеллюлоза (ГПМЦ), карбоксиметилцеллюлоза, производные крахмала и т.п. В предпочтительном варианте осуществления изобретения, фармацевтически приемлемый полимер выбирают из группы, состоящей из Коллидона VA64, который в химическом отношении является сополимером винилпирролидона и винилацетата, и ПВП К3О, который является поливинилпирролидоном.
Весовое соотношение эмпаглифлозина и фармацевтически приемлемого полимера составляет в предпочтительном случае от 1:1 до 1:10, в более предпочтительном случае - от 1:2 до 1:5, в наиболее предпочтительном случае - 1:2.
Частицы могут изготавливаться посредством высушивания распылением для получения аморфного эмпаглифлозина в виде твердого раствора или твердой дисперсии с фармацевтически приемлемым полимером. Соответственно, изобретение также предусматривает процесс изготовления описанных выше частиц, где эмпаглифлозин или его фармацевтически приемлемую соль или сокристалл смешивают с фармацевтически приемлемым полимером и растворителем, и получаемый в результате раствор подвергают высушиванию распылением.
Принцип этого способа заключается в быстрой сушке распыляемого материала с использованием горячего газа, в предпочтительном случае - азота или воздуха. За счет того, что весь материал перед сушкой растворяют в растворителе, а также благодаря тому, что материал имеет форму раствора, может быть гарантированно получен продукт однородной плотности и формы. Высушивание распылением проводят на распылительной сушилке, которая состоит из распылителя, газораспределителя, сушильной камеры, циклонного сепаратора и сборного контейнера.
Исходный эмпаглифлозин может представлять собой любую форму эмпаглифлозина или его фармацевтически приемлемой соли либо сокристалла. Кристаллическая форма эмпаглифлозина и ее изготовление хорошо известны специалистам в соответствующей области.
Настоящее изобретение позволяет получить частицы, содержащие аморфный эмпаглифлозин, изготавливаемые методом высушивания распылением, предпочтительно, с размером частиц по D(0.9) не более 100 мкм. В одном из вариантов осуществления, эмпаглифлозин имеет форму твердого раствора в фармацевтически приемлемом полимере, в качестве которого в предпочтительном случае используют поливинилпирролидон, например, ПВП К30. В другом варианте осуществления, эмпаглифлозин имеет форму твердого раствора в фармацевтически приемлемом полимере, в качестве которого в предпочтительном случае используют коллидон, например, Коллидон VA64.
Аморфный эмпаглифлозин, изготавливаемый высушиванием распылением, подходит для лечения сахарного диабета 2 типа. Кроме того, он значительно снижает риск болезней сердца у больных сахарным диабетом 2 типа. Соответственно, еще одним предметом изобретения являются частицы аморфного эмпаглифлозина, описанные выше, для применения в лечении или профилактик сахарного диабета 2 типа.
Изобретение также позволяет получить лекарственный препарат, содержащий частицы, описанные выше. Содержание эмпаглифлозина в лекарственном препарате составляет от 1 до 100 мг, предпочтительно - от 5 до 50 мг, в еще более предпочтительном случае - от 10 до 25 мг, в самом предпочтительном случае - 10 или 25 мг. Содержание эмпаглифлозина в препарате составляет в предпочтительном случае от 1 до 40% от общей массы препарата.
Препарат может также содержать одно или более вспомогательных веществ, которые служат, в частности, в качестве наполнителей, связующих веществ, смазок, поверхностно-активных веществ, разрыхлителей, красителей, растворителей, противомикробных веществ, а также вкусовых и ароматических добавок. В предпочтительном случае, препарат содержит по меньшей мере одно вспомогательное вещество, выбираемое из группы, в состав которой входят микрокристаллическая целлюлоза, лактоза, гидроксипропилцеллюлоза, натрия кроскармеллоза, двуокись кремния и магния стеарат.
Лекарственный препарат может изготавливаться практически в любой твердой лекарственной форме, например, в виде таблеток, капсул, порошков, шариков или гранул. Предпочтительной лекарственной формой является капсула, таблетка или таблетка в оболочке. В предпочтительном случае, препарат может быть изготовлен посредством смешивания высушенного распылением материала, описанного выше, с фармацевтически приемлемыми вспомогательными веществами и его таблетирования, при желании - с последующим покрытием оболочкой.
Краткое описание чертежей
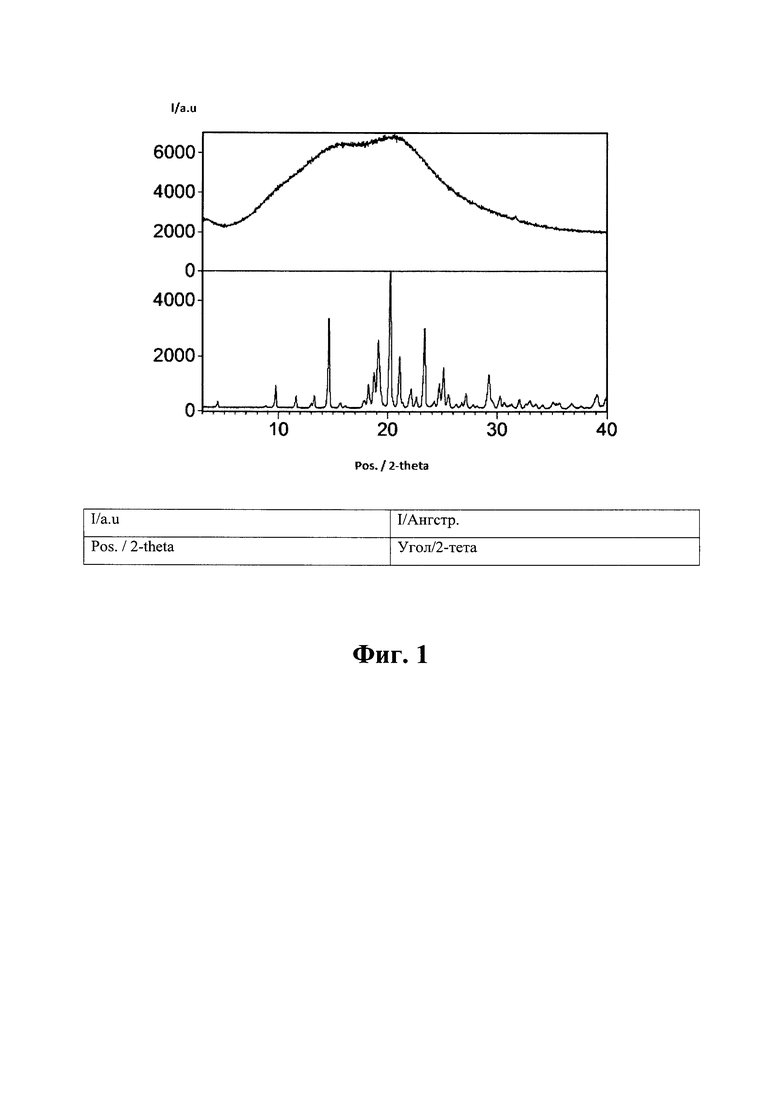
На Фиг. 1 показана характеристика ПРД а) кристаллического эмпаглифлозина, изготовленного в соответствии с WO 2006117359 (нижняя кривая), b) материала, изготовленного согласно описанному в Примере 1 (верхняя кривая).
На Фиг. 2 показана характеристика растровой электронной микроскопии (РЭМ) материала, изготовленного согласно Примеру 1.
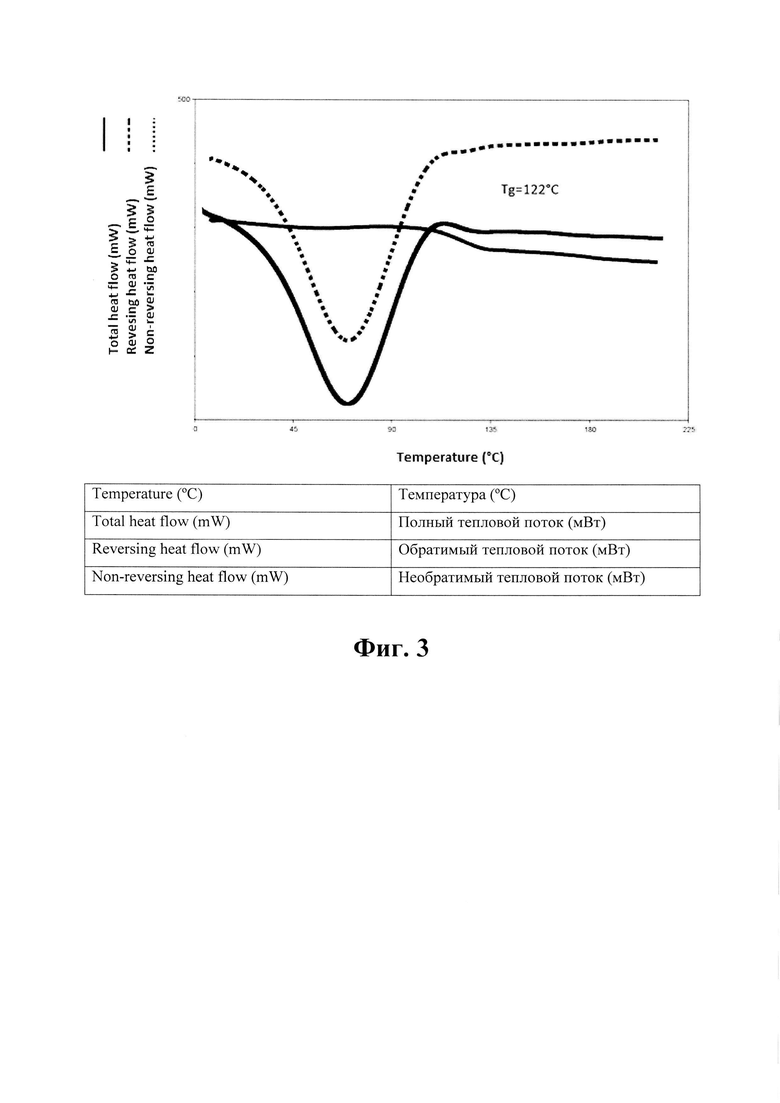
На Фиг. 3 показана характеристика дифференциальной сканирующей калориметрии (ДСК) материала, изготовленного посредством процесса по Примеру 1.
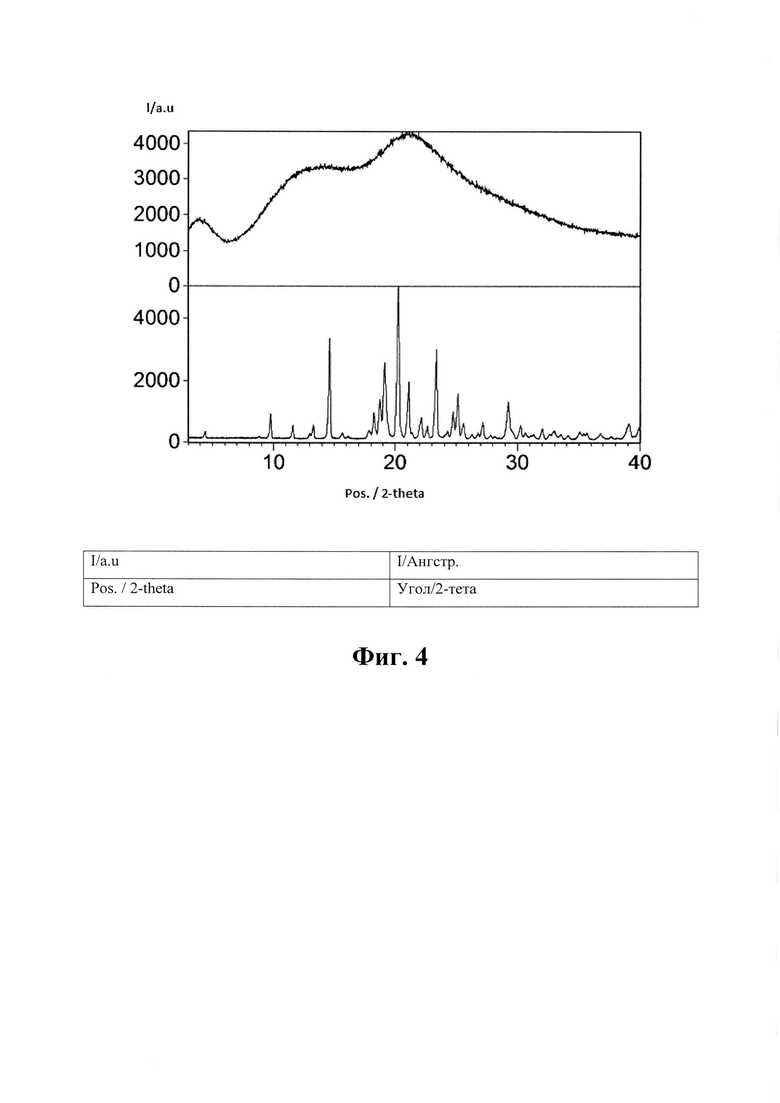
На Фиг. 4 показана характеристика ПРД а) кристаллического эмпаглифлозина, изготовленного в соответствии с WO 2006117359 (нижняя кривая), b) материала, изготовленного согласно описанному в Примере 2 (верхняя кривая).
На Фиг. 5 показана характеристика растровой электронной микроскопии (РЭМ) твердого раствора, изготовленного согласно Примеру 2.
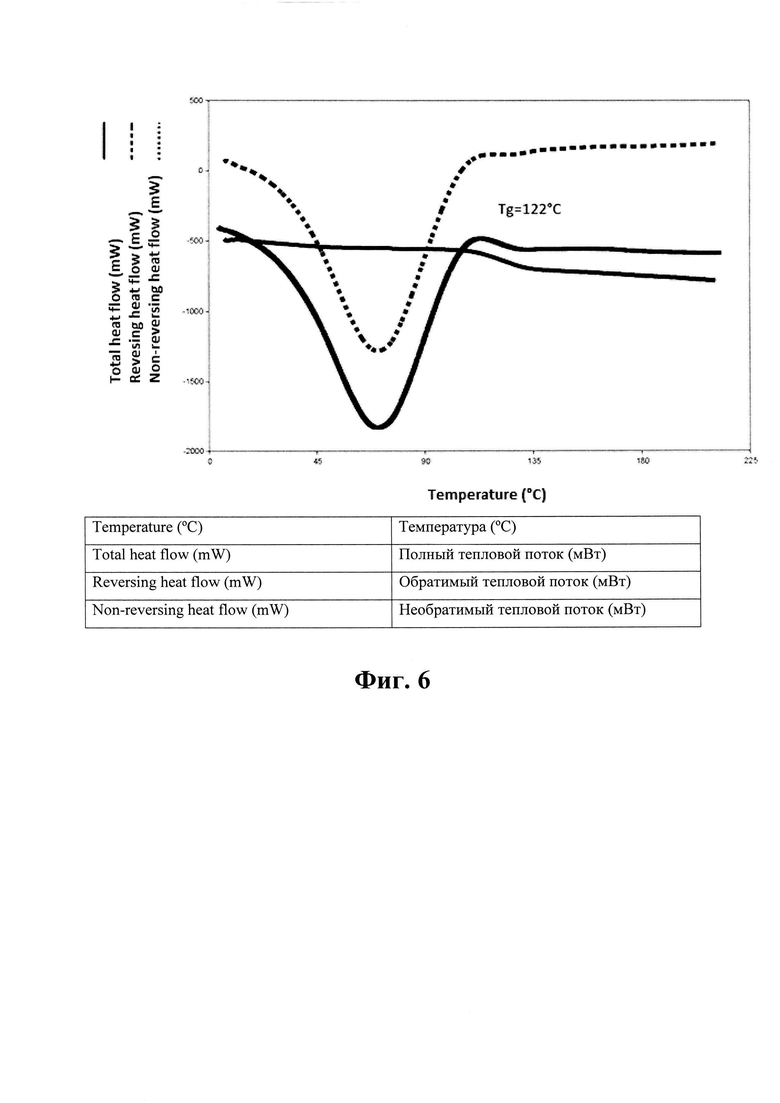
На Фиг. 6 показана характеристика дифференциальной сканирующей калориметрии (ДСК) материала, изготовленного посредством процесса по Примеру 2.
Примеры осуществления Изобретения
Приведенные ниже примеры предназначены для иллюстрации и дополнительного пояснения изобретения, и не должны истолковываться как ограничивающие объем правовой охраны, определяемый формулой изобретения.
Пример 1
10 г эмпаглифлозина в кристаллической форме растворяли в 1000 мл чистого этанола. К полученному раствору добавляли и растворяли в нем 20 г Коллидона VA64. Таким образом, полученный раствор имел содержание твердых веществ 30 мг/мл и высушивался распылением в распылительной сушилке Buchi Mini В-290, снабженной двухфазной форсункой диаметром 0,7 мм. В качестве сушильного газа использовали воздух, расход газа составлял 6 л/мин, температура газа на входе составляла 100°С, а температура на выходе 62°С. Скорость подачи раствора в распылительную сушилку составляла 6 мл/мин. Выход высушенного распылением материала составил 80% относительно количества твердых веществ, содержавшихся в исходном растворе. Такой выход считается очень хорошим для эксперимента малого масштаба с распылительной сушилкой.
Для изготовленного материала была получена характеристика порошковой рентгеновской дифрактометрии (ПРД), см. Фиг. 1. Результаты показывают, что это аморфный материал. Фиг. 2 представляет характеристику растровой электронной микроскопии, на которой показано, что полученный материал имеет форму сферических частиц со средним размером около 5 мкм и распределением размера от 1 до 10 мкм. Размер частиц определяли посредством визуального анализа изображений электронной микроскопии. Для того, чтобы определить, является ли продукт твердым раствором аморфного эмпаглифлозина с полимером или аморфной дисперсией эмпаглифлозина в полимере, применяли дифференциальную сканирующую калориметрию (ДСК) со скоростью нагрева 5°С/мин (амплитуда = 0,8°С, период = 60 с). Результаты, отраженные на Фиг. 3, показывают, что продукт имел температуру стеклования (Tg = 122°С). Таким образом, эмпаглифлозин имеет форму твердого раствора.
Пример 2
10 г эмпаглифлозина в кристаллической форме растворяли в 1000 мл чистого этанола. К полученному раствору добавляли и растворяли в нем 20 г ПВП К30. Таким образом, полученный раствор имел содержание твердых веществ 30 мг/мл и высушивался распылением в распылительной сушилке Buchi Mini В-290, снабженной двухфазной форсункой диаметром 0,7 мм. В качестве сушильного газа использовали воздух, расход газа составлял 6 л/мин, температура газа на входе составляла 100°С, а температура на выходе 62°С. Скорость подачи раствора в распылительную сушилку составляла 6 мл/мин. Выход высушенного распылением материала составил 80% относительно количества твердых веществ, содержавшихся в исходном растворе. Такой выход считается очень хорошим для эксперимента малого масштаба с распылительной сушилкой.
Для изготовленного материала была получена характеристика порошковой рентгеновской дифрактометрии (ПРД), см. Фиг. 4. Результаты показывают, что это аморфный материал. Фиг. 5 представляет характеристику растровой электронной микроскопии, на которой показано, что полученный материал имеет форму сферических частиц со средним размером около 10 мкм и распределением размера от 5 до 20 мкм. Размер частиц определяли посредством визуального анализа изображений электронной микроскопии. Для того, чтобы определить, является ли продукт твердым раствором аморфного эмпаглифлозина с полимером или аморфной дисперсией эмпаглифлозина в полимере, применяли дифференциальную сканирующую калориметрию (ДСК) со скоростью нагрева 5°С/мин (амплитуда = 0,8°С, период = 60 с). Результаты, отраженные на Фиг. 6, показывают, что продукт имел температуру стеклования (Tg = 122°С). Таким образом, эмпаглифлозин имеет форму твердого раствора.
Пример 3
10 г эмпаглифлозина в кристаллической форме растворяли в 1000 мл чистого этанола. К полученному раствору добавляли и растворяли в нем 20 г Коллидона VA64. Таким образом, полученный раствор имел содержание твердых веществ 30 мг/мл и высушивался распылением в распылительной сушилке Buchi Mini В-290, снабженной двухфазной форсункой диаметром 0,7 мм. В качестве сушильного газа использовали азот, расход газа составлял 6 л/мин, температура газа на входе составляла 100°С, а температура на выходе 62°С. Скорость подачи раствора в распылительную сушилку составляла 6 мл/мин. Выход высушенного распылением материала составил 80% относительно количества твердых веществ, содержавшихся в исходном растворе. Такой выход считается очень хорошим для эксперимента малого масштаба с распылительной сушилкой.
Для изготовленного таким образом материала была получена характеристика по методу порошковой рентгеновской дифрактометрии (ПРД). Результаты показывают, что продукт аморфен.
Пример 4
10 г эмпаглифлозина в кристаллической форме растворяли в 1000 мл чистого этанола. К полученному раствору добавляли и растворяли в нем 20 г ПВП К30. Таким образом, полученный раствор имел содержание твердых веществ 30 мг/мл и высушивался распылением в распылительной сушилке Buchi Mini В-290, снабженной двухфазной форсункой диаметром 0,7 мм. В качестве сушильного газа использовали азот, расход газа составлял 6 л/мин, температура газа на входе составляла 100°С, а температура на выходе 62°С. Скорость подачи раствора в распылительную сушилку составляла 6 мл/мин. Выход высушенного распылением материала составил 80% относительно количества твердых веществ, содержавшихся в исходном растворе. Такой выход считается очень хорошим для эксперимента малого масштаба с распылительной сушилкой.
Для изготовленного материала была получена характеристика по методу порошковой рентгеновской дифрактометрии (ПРД). Результаты показывают, что продукт аморфен.
Пример 5
Высушенные распылением частицы, изготовленные в Примере 2, смешивали с микрокристаллической целлюлозой, лактозой, гидроксипропилцеллюлозой (ГПЦ), натрия кроскармеллозой и магния стеаратом. Смесь гомогенизировали и таблетировали в виде таблеток, содержащих 10,0 мг или 25,0 мг эмпаглифлозина. Таблетки показали превосходные свойства - таблетируемость, активность и т.п. Состав отдельных таблеток показан в Таблицах 1 и 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 2018 |
|
RU2809144C2 |
| СПОСОБ СОЗДАНИЯ ОДНОРОДНЫХ ВЫСУШЕННЫХ РАСПЫЛЕНИЕМ ТВЕРДЫХ АМОРФНЫХ ЛЕКАРСТВЕННЫХ ДИСПЕРСНЫХ СИСТЕМ С ИСПОЛЬЗОВАНИЕМ РАСПЫЛЯЮЩИХ НАПОРНЫХ ФОРСУНОК (ВАРИАНТЫ) И ПРОДУКТ | 2003 |
|
RU2288703C2 |
| СТАБИЛЬНАЯ, СОСТОЯЩАЯ ИЗ ЧАСТИЦ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЛИФЕНАЦИН ИЛИ ЕГО СОЛЬ | 2005 |
|
RU2397767C2 |
| Фармацевтическая композиция, содержащая твердые дисперсии аморфного кладрибина и фармацевтически приемлемый водорастворимый носитель | 2020 |
|
RU2748311C1 |
| КОМПОЗИЦИЯ НЕНУКЛЕОЗИДНОГО ИНГИБИТОРА ОБРАТНОЙ ТРАНСКРИПТАЗЫ | 2014 |
|
RU2661399C1 |
| СПОСОБЫ РАСПЫЛИТЕЛЬНОЙ СУШКИ ДЛЯ ПОЛУЧЕНИЯ ТВЕРДОАМОРФНЫХ ДИСПЕРСИЙ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ПОЛИМЕРОВ | 2004 |
|
RU2318495C2 |
| ПРОТИВОГРИБКОВЫЕ СУХИЕ ПОРОШКИ | 2017 |
|
RU2766086C2 |
| НОВАЯ ФОРМА ИВЕРМЕКТИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2019 |
|
RU2810145C2 |
| ТВЕРДАЯ ДИСПЕРСИЯ | 2012 |
|
RU2648448C2 |
| ДЕАМОРФИЗАЦИЯ ВЫСУШЕННЫХ РАСПЫЛЕНИЕМ СОСТАВОВ ПОСРЕДСТВОМ СМЕШИВАНИЯ РАСПЫЛЕНИЕМ | 2014 |
|
RU2698331C2 |


Группа изобретений относится к фармацевтической промышленности, а именно: к частицам сферической формы; к способу их получения; к лекарственному препарату в твердой лекарственной форме для лечения или профилактики сахарного диабета 2 типа, содержащему указанные частицы и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество. Предложенные частицы имеют размер 1-100 мкм (определенный с D(0.9)), содержат аморфный эмпаглифлозин и фармацевтически приемлемый полимер, выбранный из гомополимера поливинилпирролидона и сополимера винилпирролидона и винилацетата, и получены посредством высушивания распылением в определенных условиях. Согласно предложенному способу эмпаглифлозин смешивают с полимером и растворителем, затем полученный раствор высушивают распылением при расходе сушильного газа 5-7 л/мин, содержании растворенных твердых веществ 15-40 мг/мл, с использованием двухфазной форсунки диаметром 0,6-0,8 мм, при температуре сушильного газа на входе 90-110°С, температуре на выходе 60-65°С и скорости ввода распыляемого раствора 5-7 мл/мин. Группа изобретений обеспечивает сферические частицы с узким распределением по размеру и превосходными физическими свойствами для изготовления твердых лекарственных форм (сыпучесть, таблетируемость). 3 н. и 8 з.п. ф-лы, 5 пр., 2 табл., 6 ил.
1. Частицы сферической формы, предназначенные для изготовления лекарственного препарата для лечения или профилактики сахарного диабета 2 типа, содержащие аморфный эмпаглифлозин и фармацевтически приемлемый полимер, выбранный из гомополимера поливинилпирролидона и сополимера винилпирролидона и винилацетата, где указанные частицы имеют размер, определенный с D(0.9), не менее 1 мкм и не более 100 мкм и получены посредством высушивания распылением при расходе сушильного газа 5-7 л/мин, содержании растворенных твердых веществ 15-40 мг/мл, с использованием двухфазной форсунки диаметром 0,6-0,8 мм, при температуре сушильного газа на входе 90-110°С, температуре на выходе 60-65°С и скорости ввода распыляемого раствора 5-7 мл/мин.
2. Частицы по п.1, характеризующиеся тем, что имеют размер, определенный с D(0.9), не менее 1 мкм и не более 50 мкм, или не менее 1 мкм и не более 20 мкм.
3. Частицы по п.1 или 2, характеризующиеся тем, что имеют распределение размера в пределах от 1 до 20 мкм.
4. Частицы по любому из предыдущих пунктов, характеризующиеся тем, что аморфный эмпаглифлозин и фармацевтически приемлемый полимер находятся в форме твердого раствора.
5. Частицы по любому из предыдущих пунктов, характеризующиеся тем, что весовое соотношение эмпаглифлозина и фармацевтически приемлемого полимера составляет от 1:1 до 1:10, или 1:2.
6. Способ получения частиц по любому из пп.1-5, характеризующийся тем, что эмпаглифлозин смешивают с фармацевтически приемлемым полимером и растворителем, далее получаемый в результате раствор подвергают высушиванию распылением, причем высушивание распылением осуществляют при расходе сушильного газа 5-7 л/мин, содержании растворенных твердых веществ 15-40 мг/мл, с использованием двухфазной форсунки диаметром 0,6-0,8 мм, при температуре сушильного газа на входе 90-110°С, температуре на выходе 60-65°С и скорости ввода распыляемого раствора 5-7 мл/мин.
7. Способ по п.6, характеризующийся тем, что высушивание распылением осуществляют при расходе сушильного газа 6 л/мин, содержании растворенных твердых веществ в растворе 30 мг/мл, с использованием двухфазной форсунки диаметром 0,7 мм, при температуре сушильного газа на входе 100°С, температуре на выходе 62°С и скорости ввода распыляемого раствора 6 мл/мин.
8. Лекарственный препарат в твердой лекарственной форме для лечения или профилактики сахарного диабета 2 типа, характеризующийся тем, что содержит частицы по любому из пп.1-5 и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
9. Лекарственный препарат по п.8, характеризующийся тем, что содержание эмпаглифлозина составляет от 1 до 100 мг, или от 10 до 25 мг, или 10 или 25 мг в однократной дозе.
10. Лекарственный препарат по любому из пп.8, 9, характеризующийся тем, что твердая лекарственная форма выбирается из капсулы, таблетки или таблетки в оболочке.
11. Лекарственный препарат по любому из пп.8-10, характеризующийся тем, что вспомогательное вещество выбирают из группы, включающей лактозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, натрия кроскармеллозу и магния стеарат.
| WO 2016169534 A1, 27.10.2016 | |||
| Чертежный прибор | 1929 |
|
SU25429A1 |
| US 20170319539 A1, 09.11.2017 | |||
| RU 2015128002 A, 16.01.2017 | |||
| WO 2016131431 A1, 25.08.2016. | |||
Авторы
Даты
2020-02-05—Публикация
2019-04-11—Подача