ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическому составу (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, а также к способу его получения, а также его медицинским применениям.
(S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол описан в виде Примера 136 в WO 2014/183850, как один из представителей семейства арилхиназолинов, которые, как было обнаружено, имеют ценные фармакологические свойства. Он является эффективным и селективным ингибитором активности ДНК-зависимой протеинкиназы (ДНК-ПК), что приводит к эффективному ингибированию ДНК-ПК аутофосфорилирования в линиях злокачественных клеток, которое было продемонстрировано как с помощью данных в условиях in vitro, так и в условиях in vivo. Следовательно, его можно использовать, в частности, для сенсибилизации раковых клеток к противораковым средствам и/или ионизирующему излучению.
Генетический материал человека в форме ДНК постоянно подвержен атакам активных форм кислорода (АФК), которые образуются главным образом в качестве побочных продуктов окислительного метаболизма. АФК способны вызывать повреждение ДНК в форме одноцепочечных разрывов. Двухцепочечные разрывы (ДЦР) могут возникать, если предшествующие одноцепочечные разрывы происходят в непосредственной близости. Дополнительно, одно- и двухцепочечные разрывы могут возникать, если ДНК репликативная вилка наталкивается на поврежденные структуры оснований. Кроме того, экзогенные влияния, такие как ионизирующее излучение (например, гамма или корпускулярное излучение), и определенные противораковые лекарственные средства (например, блеомицин) способны вызывать двухцепочечные разрывы ДНК. Кроме того, ДЦР могут встречаться в качестве промежуточных продуктов соматической рекомбинации, процесса, который является важным для образования функциональной иммунной системы всех позвоночных.
Если двухцепочечные разрывы ДНК не репарированы или репарированы неправильно, то могут происходить мутации и/или хромосомные аберрации, которые в результате могут привести к клеточной гибели. Для противодействия тяжелым повреждениям, возникающим вследствие двухцепочечных разрывов ДНК, эукариотические клетки разработали различные механизмы для их репарации. Высшие эукариоты используют главным образом так называемое негомологичное соединение концов, в котором ключевую роль выполняет ДНК-зависимая протеинкиназа (ДНК-ПК). ДНК-зависимая протеинкиназа (ДНК-ПК) представляет собой серин/треонин протеинкиназу, которая активируется в комплексе с ДНК. В биохимических исследованиях было показано, что ДНК-ПК наиболее эффективно активируется посредством случаев ДНК-ДЦР. Клеточные линии, у которых ДНК-ПК компоненты были мутированы и являются нефункциональными, оказываются чувствительными к действию радиации (Smith и Jackson, 1999). ДЦР рассматриваются как наиболее летальный тип повреждения ДНК, если они остаются нерепарированными.
(S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол имеет плохую растворимость в воде и искусственных желудочных соках. Также, в аморфной форме, соединение является объемным и электростатически заряженным и, таким образом, само плохо поддается дальнейшей переработке в твердый состав. Дополнительно, приготовление твердого состава энантиомерных фармацевтически активных компонентов всегда несет риск нежелательного превращения эутомера в дистомер.
Таким образом, задачей настоящего изобретения является обеспечение фармацевтической лекарственной формы (S)-[2-Хлор-4-фтор-5-(7-морфолин-4-ил-хиназолин-4-ил)-фенил]-(6-метокси-пиридазин-3-ил)метанола, которая будет обеспечивать достаточную биодоступность и энантиомерную стабильность и подходящий способ для ее приготовления.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиту, содержащему твердую дисперсию (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола или его фармацевтически приемлемую соль, в полимерном матриксе.
(S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол проиллюстрирован ниже:
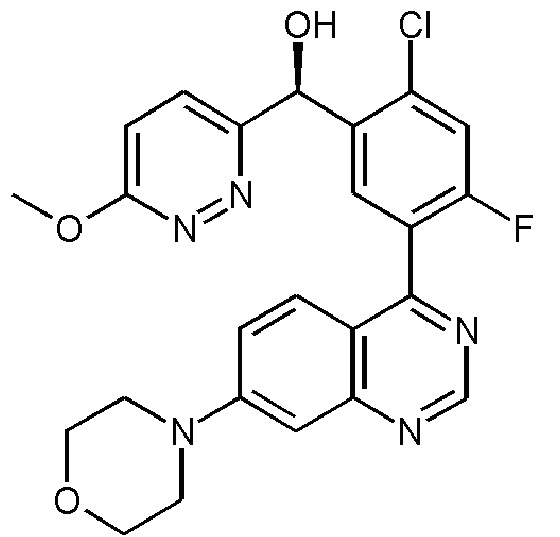
Несмотря на то, что в тексте настоящей заявки приведена ссылка на (S)-энантиомер соединения, подразумевается, что термин (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол в данном контексте следует рассматривать как допускающий возможность определенного процентного содержания дистомерной примеси, предпочтительно включающий самое большее 10 мас. %, более предпочтительно самое большее 5 мас. %, еще более предпочтительно самое большее 2 мас. %, и наиболее предпочтительно самое большее 1 мас. % или меньше дистомерной примеси. Любое количество или вес или процент по весу (S)-энантиомера, такое как в дисперсии или фармацевтическом составе, представленном в настоящей заявке, следовательно включают оба компонента, как (S)-энантиомер и любую постоянную примесь (R)-энантиомера. (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол, в любой форме, может просто обозначаться в настоящей заявке как "лекарственное вещество" в дальнейшем.
Степень энантиомерной примеси может быть оценен с использованием количественной хиральной ВЭЖХ, например, как описано в ПРИМЕРЕ 11.
Настоящее изобретение дополнительно охватывает фармацевтическую композицию, содержащую указанный композит, способы получения композита и способы получения фармацевтической композиции, а также применение композита, соответственно фармацевтической композиции для лечения злокачественного новообразования, либо отдельно или в комбинации с лучевой терапией и/или химиотерапией.
Как указано выше, в первом аспекте, настоящее изобретение обеспечивает композит, содержащий твердую дисперсию (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола или его фармацевтически приемлемую соль, в полимерном матриксе. В некоторых вариантах осуществления, композит может содержать твердую дисперсию, а также один или больше фармацевтически приемлемых наполнителей, например, выбранных из заполнителя (например, полисахарид, дисахарид, полиспирты), агента, вызывающего дезинтеграцию (например, поливинилполипирролидон), неионных и ионных поверхностно-активных веществ (например, полоксамер, стеарат магния, лаурилсульфат натрия), пластификаторов (например, полиалкиленгликоль) и неорганических абсорбентов (например, диоксид кремния).
Твердая дисперсия, как используется в настоящей заявке, относится к лекарственному веществу, которое диспергировано или распределено в дисперсионной среде, которая представляет собой полимерный матрикс в соответствии с настоящим изобретением. На основании возможных комбинаций физических состояний лекарственного вещества и полимера, лекарственное вещество может быть либо кристаллическим или аморфным и полимерный матрикс также может быть кристаллическим и аморфным, что приводит к четырем возможным комбинациям: кристаллическое лекарственное вещество - кристаллический полимер (твердая суспензия); аморфное лекарственное вещество - аморфный полимер; кристаллическое лекарственное вещество - аморфный полимер; и аморфное лекарственное вещество - кристаллический полимер. Типичные варианты осуществления согласно настоящей заявке относятся к аморфному лекарственному веществу в полимерном матриксе. Аморфное лекарственное вещество может быть диспергировано в форме аморфных (микро)частиц в аморфном полимерном матриксе, которое далее обозначается как аморфная суспензия, или оно может быть молекулярно диспергировано в (кристаллическом или аморфном) полимере или полимерном матриксе с образованием твердого раствора. "Твердый раствор" в контексте изобретения, будет также охватывать те варианты осуществления, где небольшая часть лекарственного вещества может не находиться в растворе или оставаться нерастворенной, при условии, что, например, по меньшей мере приблизительно 80%, более предпочтительно по меньшей мере приблизительно 90% и наиболее предпочтительно по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% лекарственного вещества (по объему) будет находится в молекулярно диспергированном состоянии. В таком твердом растворе, индивидуальные физические свойства лекарственного вещества уже больше не могут быть распознаны.
В предпочтительном варианте осуществления, композит в соответствии с настоящим изобретением состоит из твердой дисперсии (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола или его фармацевтически приемлемой соли, в полимерном матриксе. Несомненно, он в дальнейшем может просто обозначаться как твердая дисперсия.
Наиболее предпочтительно, твердая дисперсия представляет собой твердый раствор, то есть наиболее предпочтительно, лекарственное вещество молекулярно диспергировано в полимерном матриксе.
Как становится понятным из типичных вариантов осуществления, описанных в настоящей заявке, полученные твердые дисперсии являются аморфными.
Несмотря на то, что (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол он может присутствовать в любой подходящей солевой форме, но он наиболее предпочтительно присутствует в его свободной форме, на в форме соли.
Фармацевтически приемлемые соли включают те, которые указаны в раскрытии WO 2014/183850, которая полностью включена в настоящую заявку в качестве ссылки.
Любую ссылку на количества или вес или проценты по весу (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил) метанола или его фармацевтически приемлемых солей, следует рассматривать как относящуюся к безводной свободной форме (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола (включая дистомер, если это является приемлемым, как указано выше), если специально не указано иначе.
Для образования твердой дисперсии, полимер или полимеры, образующие полимерный матрикс, обычно представляют собой полимеры, которые способны заделывать лекарственное вещество, в частности, если нагреваются выше точки плавления, в особенности с способе гранулирования из расплава или экструзии расплава или при растворении в растворителе и атомизации, как, например, в способе высушивания распылением. Следовательно, полимер, образующий полимерный матрикс, предпочтительно проявляет термопластическое поведение. Любой полимер, способный таким способом заделывать лекарственное вещество, наиболее предпочтительно на молекулярном уровне, и усиливать его растворимость, может использоваться в контексте настоящего изобретения. Таким образом, гидрофильные полимеры являются предпочтительными.
В предпочтительном варианте осуществления, полимерный матрикс включает или состоит из гомополимера или сополимера поливинилпирролидона. Более предпочтительно, полимерный матрикс включает или состоит из сополимера поливинилпирролидона, и наиболее предпочтительно сополимера поливинилпирролидона и поливинилацетата. Наиболее предпочтительно, твердая дисперсия состоит из (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, наиболее предпочтительно в его свободной форме, в полимерном матриксе сополимера поливинилпирролидона и поливинилацетата. Как будет показано по отношению к типичным вариантам осуществления, этот вариант осуществления является особенно предпочтительным, потому что он может быть приготовлен только с минимальным превращением (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола в дистомер ((R)-энантиомер). Даже после длительного хранения, соотношение эутомер : дистомер является чрезвычайно удовлетворительным. Принимая во внимание то, что исходя из текущих оценок клинически эффективных доз, количество, принимаемое пациентом, и следовательно, необходимое для включения в фармацевтическую лекарственную форму, является существенным, оно представляет собой чрезвычайно важный фактор, который следует учитывать. Предпочтительно, твердую дисперсию получают путем экструзии горячего расплава.
Сополимер поливинилпирролидона и поливинилацетата также может относится к /охватывать сополимер винилпирролидон-винилацетат, коповидон (USP), кополивидон (JPE), PVP-VAc-Сополимер, или: этениловый эфир уксусной кислоты, полимер с 1-этенил-2-пирролидиноном (IUPAC). Любой из этих терминов может использоваться в дальнейшем, где коповидон является предпочтительным для простоты дальнейшего изложения материала. Регистрационным номером CAS сополимера является 25086-89-9. Примером подходящего коммерчески доступного коповидона является Kollidon® VA 64 (BASF). Согласно информации производителя, Kollidon® VA 64 классов изготавливают путем свободнорадикальной полимеризации частей N-винилпирролидона и 4 частей винилацетата в 2-пропаноле, в соответствии с указаниями cGMP, что приводит к получению водорастворимого полимера с цепочечной структурой. Также было описано (BASF), что он имеет K-значение в диапазоне 25,2-30,8 (номинально 28), при этом K-значение было определено в соответствии с Европейской фармакопеей, то есть рассчитано на основании относительной вязкости (кинематическое) 1% раствора в воде при 25°С. Температура перехода в стеклообразное состояние Kollidon® VA 64 зависит от содержания влаги и находится при 103°С для безводного Kollidon® VA 64.
В альтернативном предпочтительном варианте осуществления, полимерный матрикс включает или состоит из привитого сополимера поливинилкапролактам - поливинилацетат - полиэтиленгликоль. Подходящий коммерчески доступный полимер обозначается как Soluplus® (BASF). Согласно информации производителя, средняя молекулярная масса этого продукта, как измерено с помощью гельпроникающей хроматографии, типично находится в диапазоне от 90000 до 140000 г/моль. Регистрационным номером CAS сополимера является 402932-23-4.
В альтернативном варианте осуществления, полимерный матрикс включает или состоит из ацетат сукцинат гипромеллозы. Полимер также может обозначаться как ацетат сукцинат гидроксипропил метилцеллюлозы, или: Целлюлоза, 2-гидроксипропилметиловый эфир, ацетат, гидробутандиоат (IUPAC), или может быть сокращен как HPMCAS. Регистрационным номером CAS является 71138-97-1. Примером коммерчески доступного подходящего примера ацетат сукцинат гипромеллозы является Aqoat® (Shin-Etsu). Особенно предпочтительным в настоящей заявке для формования из расплава, в особенности экструзии горячего расплава, является микронизированный вариант, например, Aqoat® AS-LF, который, согласно информации производителя, включает 8% ацетильные группы и 15% сукцинильные группы, имеет средневесовую молекулярную массу 18000 (измеренную с помощью SEC-MALS) и средний размер частиц 5 мкм. Предпочтительным в настоящей заявке для других способов приготовления, в особенности высушивания распылением, является другой микронизированный вариант, например, Aqoat® AS-HF, который, согласно информации производителя, включает 12% ацетильные группы и 6% сукцинильные группы и имеет средний размер частиц 5 мкм.
Как будет понятно, в особенности из твердых дисперсий, полученных путем высушивания распылением, варианты осуществления изобретения, в которых полимерный матрикс включает или состоит из ацетат сукцинат гипромеллозы, являются в равной степени чрезвычайно благоприятными, и, следовательно, особенно предпочтительными.
В дальнейшем альтернативном варианте осуществления, полимерный матрикс включает или состоит из основного бутилированного метакрилатного сополимера (USP: аминометакрилатный полимер). Подходящим примером такого полимера является Eudragit®, например, (Регистрационный номер CAS 24938-16-7), такой как Eudragit® Е100 или Е РО. В соответствии с техническими указаниями производителя, Eudragit® E100 представляет собой катионный полимер на основании диметиламиноэтилметакрилата, бутилметакрилата и метилметакрилата при соотношении 2:1:1. Мономеры случайным образом распределены вдоль сополимерной цепи. На основании SEC метода, средневесовая молекулярная масса Eudragit® E100 или Е РО составляет приблизительно 47000 г/моль. Eudragit® Е РО имеет размер частиц, определенный с помощью дифракции лазерного излучения в соответствии с Европейской Фармакопеей 2.9.31/дифракция света измерение USP <429> для Dv50 < 50 мкм.
В дальнейшем типичном варианте осуществления, полимерный матрикс может содержать или состоять из НРМСР. НРМСР является сокращением для фталата гипромеллозы, которая представляет собой сложный эфир монофталевой кислоты гидроксипропилметилцеллюлозы. Он содержит метокси, гидроксипропокси и фталильные группы. НРМСР имеет регистрационный номер CAS 9050-31-1. Подходящими примерами являются НРМСР классы, доступные от Shin-Etsu
Другие полимеры известны в данной области техники, такие как макроголи, РЕО гомополимеры или сополимеры, полиакрилатные гомополимеры или сополимеры, простые эфиры целлюлозы и полисахариды являются дополнительными возможными полимерами, которые могут образовывать полимерный матрикс.
Полимерный матрикс в твердой дисперсии в соответствии с настоящим изобретением может содержать более одного полимера, образующего матрикс. Тем не менее, в предпочтительных вариантах осуществления, полимерный матрикс включает только один полимер. Дополнительно, полимерный матрикс может содержать или может не содержать один или больше аддитивов, таких как один или больше пластификаторов. Типичные пластификаторы, известные в данной области техники, включают полиалкиленгликоль, полиоксиэтилен-полиоксипропилен блок-сополимер (например, Kolliphor® Р188, Р338, Р407), полисорбат (например, Tween®), трибутилцитрат, триэтилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, моногидрат лимонной кислоты, триацетин, диоктилфталат, диэтилфталат, дибутилсебацат, касторовое масло и его производные, например, PEG-40 гидрогенизированное касторовое масло.
В некоторых типичных вариантах осуществления, дополнительные фармацевтически приемлемые наполнители уже обеспечиваются в смеси с полимером для образования полимерного матрикса. Тем не менее, "полимер", как используется в настоящей заявке, не подразумевается как смесь полимера с аддитивами, он будет относится к полимеру как таковому.
В предпочтительных вариантах осуществления, твердая дисперсия, более предпочтительно твердый раствор, состоит только из лекарственного вещества в полимерном матриксе, который образован одним полимером без каких-либо дополнительных аддитивов (2-х компонентная система).
Твердую дисперсию в соответствии с настоящим изобретением получают, например, путем экструзии горячего расплава или гранулирования из расплава Экструзия горячего расплава является особенно предпочтительной, так как было обнаружено, что она обеспечивает наиболее благоприятные свойства дисперсии, соответственно композиту. Следовательно, предпочтительно, твердая дисперсия представляет собой экструдат расплава.
В альтернативных типичных вариантах осуществления, твердую дисперсию в соответствии с настоящим изобретением получают с помощью методов на основании растворителей, наиболее предпочтительно и благоприятно высушивание распылением.
Совместное осаждение, лиофилизация или формование окунанием в раствор являются дополнительными способами, которые обычно пригодны для получения твердых дисперсий в соответствии с настоящим изобретением.
Предпочтительно, в композите в соответствии с изобретением, в особенности в самой твердой дисперсии, концентрация (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, который может присутствовать в свободной форме или в форме фармацевтически приемлемой соли, в полимерном матриксе находится в диапазоне от 4 до 60 процентов по весу, например, в диапазоне от 4 до 50 процентов по весу, предпочтительно в диапазоне от 10 до 40 процентов по весу, например, в диапазоне от 15 до 30 мас. %, или от 17,5 до 25 мас. %, на основе общего веса твердой дисперсии.
Во избежание неопределенности, следует принять во внимание, что процент по весу относится к безводной свободной форме, независимо от того, будет ли лекарственное вещество находится в свободной форме или в форме одной из его фармацевтически приемлемых солей.
Другими словами, твердая дисперсия, например, может содержать по меньшей мере 4 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, по меньшей мере 10 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, по меньшей мере 15 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола или по меньшей мере 17,5 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола. Повторно, как было указано выше, лекарственное вещество может присутствовать в свободной форме или солевой форме, где проценты по весу рассчитываются на основании безводной свободной формы.
В типичных вариантах осуществления, твердая дисперсия состоит из 15-35 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и 65-85 мас. % полимерного матрикса, предпочтительно приготовленного только с помощью одного полимера без каких-либо других аддитивов. В других типичных вариантах осуществления, твердая дисперсия состоит из 15-30 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и 70-85 мас. % полимерного матрикса, предпочтительно приготовленного только с помощью одного полимера без каких-либо других аддитивов.
В дальнейших типичных вариантах осуществления, твердая дисперсия состоит из 15-25 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и 75-85 мас. % полимерного матрикса, предпочтительно приготовленного только с помощью одного полимера без каких-либо других аддитивов.
В одном типичном варианте осуществления, твердая дисперсия состоит из 20 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и 80 мас. % полимерного матрикса, предпочтительно приготовленного только с помощью одного полимера без каких-либо других аддитивов.
В другом типичном варианте осуществления, твердая дисперсия состоит из 25 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и 75 мас. % полимерного матрикса, предпочтительно приготовленного только с помощью одного полимера без каких-либо других аддитивов.
В другом типичном варианте осуществления, твердая дисперсия состоит из 30 мас. % (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и 70 мас. % полимерного матрикса, предпочтительно приготовленного только с помощью одного полимера без каких-либо других аддитивов. Подводя итог описанному выше, и как будет понятно из примеров, твердые дисперсии в соответствии с настоящим изобретением обеспечивают хорошую биодоступность. Тогда как известно, что твердые дисперсии потенциально благосклонны к усилению биодоступности плохо растворимых активных компонентов, научное обоснование, лежащее в основе этой технологии, еще до конца непонятно и способы скрининга в небольших масштабах не обязательно обеспечивают хорошую корреляцию со способами получения в промышленным масштабах. Тем не менее, изобретатели настоящего изобретения были успешными в обеспечении твердых дисперсий, в особенности аморфных твердых дисперсий лекарственного вещества, которые обеспечивают лучшую биодоступность по сравнению с любой из известных до настоящего времени солей и полиморфных форм.
Было подтверждено, что коповидон является особенно пригодным в качестве/в полимерном матриксе в твердых дисперсиях, так как он может быть получен либо путем высушивания распылением или экструзии горячего расплава, с получением аморфных твердых дисперсий, которые характеризуются хорошей стабильностью, чрезвычайно низкими количествами дистомера и продуктов разложения, которые образуются, и чрезвычайно хорошей долгосрочной стабильностью. Такие преимущества обеспечивает молекулярная дисперсия лекарственного вещества в полимерном матриксе. Эти преимущества являются тем более неожиданными, поскольку попытки скрининга в небольших масштабах не обеспечивали какого-либо указания на эти результаты, а даже наоборот предполагали исключение этого полимера из дальнейшего рассмотрения.
Дальнейшим предпочтительным полимером, в особенности для твердых дисперсий, приготовленных путем высушивания распылением, является ацетат сукцинат гипромеллозы.
Композит в соответствии с настоящим изобретением, в особенности, когда получен путем формования из расплава, например, экструзией горячего расплава, может иметь размер частиц, который характеризуется d50 значением 1000 мкм или меньше, предпочтительно 500 мкм или меньше, более предпочтительно 400 мкм или меньше, 300 мкм или меньше, например, в интервале от 200 мкм до 300 мкм. Как правило, меньший размер частиц ассоциирован с более высокой площадью поверхности, которая может быть благоприятной в контексте растворения, но типично необходимо механическое снижение исходных частиц, что очень часто связано с выработкой тепла, и, следовательно, может оказывать неблагоприятное влияние на другие физические параметры частиц, такие как плотность, а также и на диспергирование лекарственного вещества в матриксе, и даже уровни примесей. Значения d50, на которые ссылаются в настоящей заявке, измерены путем лазерной дифракции на Malvern Mastersizer 2000 (сухой метод; микрообъемная кювета; количество образца 200 мг; дисперсионное давление воздуха 0,1 бар; скорость подачи 50%; время измерения 4 с; снижение чувствительности 1-5%; применение 66 дисперсионных стальных шариков 2 мм; измерения оценивали с помощью MIE теории). d50 значение, указанное в настоящей заявке, представляет собой размер в микронах, которое разделяет распределение на половину выше и половину ниже этого диаметра. d50 представляет собой срединное значения для объемного распределения и часто также обозначается как (или Dv0,5).
В тех вариантах осуществления, в которых композит, более предпочтительно дисперсию, получают путем высушивания распылением, размер частиц обычно находится в диапазоне, который характеризуется d50 значением от 1 мкм до 300 мкм, предпочтительно от 20 мкм до 200 мкм и более предпочтительно от 30 до 100 мкм. Таким образом, один вариант осуществления изобретения также относится к композиту, где композит имеет средний размер частиц, который характеризуется d50 значением меньше, чем 200 мкм, например, меньше, чем 100 мкм, например, в интервале от 1 мкм до 300 мкм, предпочтительно от 20 мкм до 200 мкм и более предпочтительно от 30 мкм до 100 мкм.
Если размер частиц является меньше желательного, например, поскольку маленький размер частиц может не быть идеальным в плане текучести или плотности для последующих стадий переработки в конечную композицию, то размер частиц может быть повышен с использованием подходящих техник, таких как грануляция или вальцевание. Такие методики используют для приготовления гранулятов, которые могут иметь размер частиц, который характеризуется d50 значением 1000 мкм или меньше, предпочтительно 500 мкм или меньше, более предпочтительно 400 мкм или меньше, 300 мкм или меньше, например, в интервале от 200 мкм до 300 мкм.
Таким образом, настоящее изобретение также относится к композиту в форме гранулята, где такой гранулят имеет размер частиц, который характеризуется d50 значением 1000 мкм или меньше, предпочтительно 500 мкм или меньше, более предпочтительно 400 мкм или меньше, 300 мкм или меньше, например, в интервале от 200 мкм до 300 мкм.
Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую композит в соответствии с изобретением. Наиболее предпочтительно, фармацевтическая композиция предназначена для перорального введения.
Еще более предпочтительно, фармацевтическая композиция представляет собой композицию с немедленным высвобождением. В типичных вариантах осуществления, фармацевтическая композиция, наиболее предпочтительно таблетка, характеризуется временем распадаемости 30 минут или меньше, например, 20 минут или меньше, предпочтительно 15 минут или меньше, и более предпочтительно 10 минут или меньше. Время распадаемости, указанное выше, измеряют в 0,01 н. HCl при 37°С в приборе для измерения распадаемости в соответствии с USP-NF <701> (USP39-NF34 стр. 537; Pharmacopeial Forum: том №34(1) стр. 155) Распадаемость: Прибор состоит из корзинного блока, 1000-мл, лабораторного низкого стакана для иммерсионной жидкости, термостатической конструкции для нагревания, и устройства для поднимания и опускания корзины в иммерсионную жидкость. Корзинный блок двигается вертикально вдоль его оси и состоит из шести прозрачных пробирок с открытыми концами; пробирки удерживаются в вертикальном положении с помощью двух пластинок. К нижней поверхности нижней пластинки присоединено тканое изделие из проволоки из нержавеющей стали. Каждая пробирка снабжена диском цилиндрической формы. Диск изготовлен из подходящего прозрачного пластикового материала. Помещают 1 дозированную единицу в каждую из шести пробирок корзины и добавляют диск. Эксплуатируют прибор, используя указанную среду в качестве иммерсионной жидкости, поддерживая при температуре 37°С±2°С. После окончания лимита по времени или через заранее установленные интервалы, корзину освобождают от жидкости, и наблюдают, распались ли полностью таблетки.
В одном варианте осуществления, фармацевтическая композиция в соответствии с настоящим изобретением представляет собой капсулу, содержащую заполнитель, включающий композит и необязательно по меньшей мере один фармацевтически приемлемый наполнитель. Сама капсула может представлять собой любую фармацевтически приемлемую капсулу, такую как твердая желатиновая капсула, но предпочтительно должна быть легко растворимой.
В иллюстративном варианте осуществления, фармацевтическая композиция представляет собой капсулу, которая содержит заполнитель, состоящий из от 40 до 100 мас. %, например, по меньшей мере 50 мас. %, более предпочтительно по меньшей мере 70, 80, 90, 95 или 99 мас. % композита в соответствии с настоящим изобретением; и от 0 до 60 мас. %, то есть остаток (разница от 100 мас. %) заполнителя, по меньшей мере одного фармацевтически приемлемого наполнителя, предпочтительно выбранного из заполнителя, агента, вызывающего дезинтеграцию, скользящего вещества, порообразователя и неорганической соли щелочного металла, на основе общего веса заполнителя. Другими словами, капсулу не учитывают при расчете процентов по весу, как указано в настоящей заявке.
Как будет показано в качестве примеров, капсульные составы могут содержать, например, 100, 99,5, 99, 90, 80, 75, 70, 60 или 50 мас. % композита, соответственно твердой дисперсии в тех вариантах осуществления, где композит состоит из твердой дисперсии, или любой диапазон, охватываемый любой комбинацией этих значений: от 50 до 100 мас. %, от 50 до 99,5 мас. %, от 50 до 99 мас. %, от 50 до 90 мас. %, от 50 до 80 мас. %, от 50 до 75 мас. %, от 50 до 70 мас. %, от 50 до 60 мас. %; 60 до 100 мас. %, от 60 до 99,5 мас. %, от 60 до 99 мас. %, от 60 до 90 мас. %, от 60 до 80 мас. %, от 60 до 75 мас. %, от 60 до 70 мас. %; 70 до 100 мас. %, от 70 до 99,5 мас. %, от 70 до 99 мас. %, от 70 до 90 мас. %, от 70 до 80 мас. %; 75 до 100 мас. %, от 75 до 99,5 мас. %, от 75 до 99 мас. %, от 75 до 90 мас. %, от 75 до 80 мас. %; 80 до 100 мас. %, от 80 до 99,5 мас. %, от 80 до 99 мас. %, от 80 до 90 мас. %; 90 до 100 мас. %, от 90 до 99,5 мас. %, от или 90 до 99 мас. %, Остаток заполнителя (разница от 100 мас. %) компенсирован по меньшей мере одним фармацевтически приемлемым наполнителем, как указано выше.
В иллюстративном варианте осуществления, фармацевтическая композиция представляет собой капсулу, содержащую заполнитель, включающий:
50-100 мас. % композита в соответствии с изобретением;
2,5-75 мас. % агента, вызывающего дезинтеграцию;
0-60 мас. % заполнителя;
0-5 мас. % скользящего вещества;
0-30 мас. % порообразователя;
0-20 мас. % неорганической соли щелочного металла; и
всего от 0 до 20 мас. % одного или больше дополнительных фармацевтически приемлемых наполнителей, на основе общего веса таблетки. Общий вес, несомненно, обозначает 100 мас. %.
Процент по весу агента, вызывающего дезинтеграцию в вышеуказанном иллюстративном варианте осуществления может находится в интервале от 5 до 60 мас. %, например, или, например, в интервале от 7,5 до 55 мас. %, или, например, в интервале от 7,5 до 25 мас. %.
Диапазон по весу скользящего вещества в вышеуказанном иллюстративном варианте осуществления может находится в интервале от 0,25 мас. % до 5 мас. %, или от 0,5 мас. % до 4 мас. %, или, например, от 0,5 мас. % до 2,5 мас. %.
Порообразователь, если он присутствует в вышеуказанном иллюстративном варианте осуществления, может содержаться в количестве, например, от 2,5 до 50 мас. %, или от 5 до 25 мас. %, или от 7,5 до 20 мас. %.
Заполнитель, если он присутствует, может быть представлен в вышеуказанном иллюстративном варианте осуществления, например, в диапазоне вплоть до 60 мас. %, таком как, от 5 до 60 мас. %, или, например, в интервале от 7,5 до 55 мас. %, или вплоть до 50 мас. %, или в диапазоне от 10 до 50 мас. %. Также было обнаружено, что выполнимы варианты осуществления капсул без заполнителя.
Неорганическая соль щелочного металла предпочтительно присутствует в вышеуказанном иллюстративном варианте осуществления, и может содержаться в количестве от 2,5 до 20 мас. %, или от 5 до 17,5 мас. %, например, или по меньшей мере 7,5 мас. %, например, приблизительно 10 или 15 мас. %.
Примеры подходящих фармацевтически приемлемых наполнителей вышеуказанных категорий включают:
Заполнители обычно служат для создания желательных объемных свойств, свойств текучести, и характеристик компрессии при приготовлении таблеток и заполнении капсул. Подходящие заполнители включают: целлюлозу, включая модифицированную целлюлозу, такую как микрокристаллическая целлюлоза, простые эфиры целлюлозы, такие как НРМС (гидроксипропилметилцеллюлоза), лактозу и декстрозу, этот перечень не является исчерпывающим. Особенно предпочтительной является микрокристаллическая целлюлоза.
Агенты, вызывающие дезинтеграцию, служат для дезинтеграции таблеток или гранул, и т.д., и, следовательно, усиливают растворение твердой дозированной формы при контактировании с жидкой растворяющей средой. Подходящие агенты, вызывающие дезинтеграцию, включают кросповидон (поперечно сшитый поливинил N-пирролидон), карбоксиметилцеллюлозу и ее соли и производные, такие как поперечно сшитые производные, например, кроскармеллоза натрия (поперечно сшитый полимер карбоксиметилцеллюлозы натрия) натрия карбоксиметил гликолят, натрия крахмала гликолят, каррагенан, агар и пектин. Особенно предпочтительными являются кросповидон и кроскармеллоза натрия.
Скользящие вещества служат для предотвращения прилипания компонентов друг к другу при заполнении капсул или в таблетировочных машинах. Даже несмотря на то, что они не являются полностью идентичными глидантам, которые служат для уменьшения межчастичного трения и, следовательно, усиления текучести смеси частиц при приготовлении таблеток или капсул, глиданты и скользящие вещества собирательно обозначаются в настоящей заявке как скользящие вещества. Скользящее вещество, которое можно использовать в контексте настоящего изобретения, выбирают из одного или нескольких следующих веществ: стеарат магния, стеариновая кислота, тальк, стеарин, диоксид кремния, такой как гидрофильный высокодисперсный диоксид кремния или коллоидный диоксид кремния, трисиликат магния, крахмал, карбонат магния, оксид магния, фосфат кальция (Са3(PO4)2), стеарат кальция, и стеарат алюминия. Особенно предпочтительным является стеарат магния.
В качестве порообразователей или создателей пор, могут быть упомянуты маннит, сахароза и ее сложные эфиры, трегалоза или циклодекстрины в качестве подходящих для применения в настоящем изобретении, где особенно предпочтительным является маннит.
Неорганические соли щелочных металлов, то есть соли, образованные из ионов щелочных металлов и анионов неорганических кислот, имеют относительно недавно обнаруженную полезность для усиления растворения и включают хлорид натрия, сульфат натрия, карбонат натрия, бикарбонат натрия, фосфат натрия, дигидрофосфат натрия, хлорид калия, карбонат калия и бикарбонат калия. Особенно предпочтительным является хлорид натрия.
В еще более предпочтительном варианте осуществления, фармацевтическую композицию выбирают из таблетки и гранулята, и, следовательно, она типично включает по меньшей мере один фармацевтически приемлемый наполнитель. По меньшей мере один фармацевтически приемлемый наполнитель предпочтительно выбирают из заполнителя, агента, вызывающего дезинтеграцию, скользящего вещества, порообразователя, неорганической соли щелочного металла или их комбинации.
В иллюстративном варианте осуществления, фармацевтическая композиция представляет собой таблетку, включающую:
25-95 мас. % композита в соответствии с изобретением
15-72,5 мас. % заполнителя;
2,5-40 мас. % агента, вызывающего дезинтеграцию;
0-5 мас. % скользящего вещества;
0-20 мас. % неорганической соли щелочного металла; и
всего от 0 до 20 мас. % одного или больше дополнительных фармацевтически приемлемых наполнителей, на основе общего веса таблетки.
Один или больше дополнительных фармацевтически приемлемых наполнителей может включать один или больше компонентов, выбранных из порообразователей, консервантов, антиоксидантов, подсластителей, ароматизаторов, красителей, поверхностно-активных веществ и агентов, способствующих впитыванию влаги.
Многие наполнители могут проявлять больше одной функции, в зависимости от других компонентов фармацевтической лекарственной формы. Во избежание неопределенности, в особенности, при расчете процентов по весу, каждый фармацевтически приемлемый наполнитель, используемый в фармацевтической композиции в соответствии с настоящим изобретением, предпочтительно ассоцирован только с одной функциональной характеристикой, то есть он либо рассматривается как агент, вызывающий дезинтеграцию или скользящее вещество.
В другом типичном варианте осуществления, фармацевтическая композиция представляет собой таблетку, включающую:
40-60 мас. % композита в соответствии с изобретением;
25-55 мас. % заполнителя;
5-30 мас. % агента, вызывающего дезинтеграцию;
0-5 мас. % скользящего вещества;
0-15 мас. % неорганической соли щелочного металла; и
всего от 0 до 10 мас. % одного или больше дополнительных фармацевтически приемлемых наполнителей, на основе общего веса таблетки.
В дальнейшем типичном варианте осуществления, фармацевтическая композиция представляет собой таблетку, включающую:
35-55 мас. % композита в соответствии с изобретением;
30-55 мас. % заполнителя;
5-20 мас. % агента, вызывающего дезинтеграцию;
0,25-2,5 мас. % скользящего вещества;
2,5-15 мас. % неорганической соли щелочного металла; и
всего от 0 до 10 мас. % одного или больше дополнительных фармацевтически приемлемых наполнителей, на основе общего веса таблетки.
Предпочтительно, в тех вариантах осуществления, заполнитель представляет собой микрокристаллическую целлюлозу и/или агент, вызывающий дезинтеграцию, выбирают из кросповидона, карбоксиметилцеллюлозы и ее солей и производных, таких как кроскармеллоза натрия, и/или неорганическая соль щелочного металла представляет собой неорганическую соль натрия, такую как хлорид натрия.
Предпочтительно, общее содержание одного или больше дополнительных фармацевтически приемлемых наполнителей составляет 0-10 мас. %, 0-7,5 мас. %, 0-5 мас. %, 0-2,5 мас. % или 0-1 мас. %, например, 0 мас. %.
Очевидно, таблетка может быть покрыта оболочкой, для улучшения вкуса и/или внешнего вида и/или для защиты таблетки от воздействия внешних факторов, таких как влага. Любая оболочка не должна учитываться для суммарного 100 мас. % фармацевтически активных компонентов и лекарственного вещества, образовывающего таблетки, как указано выше. Для покрытия пленочной оболочкой, можно использовать, например, макромолекулярные вещества, такие как модифицированные целлюлозы, включая гидроксипропилметилцеллюлоза (НРМС), полиметакрилаты и зеин. Толщина покрытия предпочтительно составляет меньше, чем 100 мкм.
В альтернативных вариантах осуществления, фармацевтическая композиция может представлять собой любую другую форму, подходящую для инкорпорации твердой дисперсии, соответственно композита, в соответствии с настоящим изобретением. Также может быть упомянуты пастилки, каплеты, лепешки.
Настоящее изобретение также обеспечивает первый способ приготовления композита, который включает или состоит из твердой дисперсии, представляющей собой предпочтительно твердый раствор, где способ включает экструзию горячего расплава или гранулирование из расплава. Было обнаружено, что экструзия горячего расплава обеспечивает наилучшие физические свойства для твердой дисперсии и, следовательно, является особенно предпочтительной согласно настоящему изобретению.
В иллюстративном варианте осуществления, способ включает:
смешивание и плавление (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, или его фармацевтически приемлемой соли, и полимера, образующего полимерный матрикс, и необязательно по меньшей мере одного фармацевтически приемлемого наполнителя,
экструдирование горячего расплава или влажное гранулирование смеси для образования композита,
и необязательно измельчение образованного композита.
Очевидно, смешивание и плавление может включать смешивание полимера и лекарственного вещества, с последующей стадией плавления, которая обязательно вовлекает дальнейшее смешивание, или единственную стадию смешивание и плавление. Смешивание и плавление, как известно в данной области техники, понимается в значении смешивания (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, или его фармацевтически приемлемой соли, и полимера, образующего полимерный матрикс, и необязательно по меньшей мере одного фармацевтически приемлемого наполнителя, в то время, как происходит плавление полимера. Таким образом, (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол, или его фармацевтически приемлемую соль, растворяют или диспергируют в расплаве, а не плавят так таковой.
Подходящие экструдеры для плавления полимеров известны в данной области техники. Подходящие экструдеры включают мелкомасштабные экструдеры, такие как HAAKE MiniLab II (Thermo Fisher Scientific) или крупномасштабные вращающиеся в одном направлении двухшнековые экструдеры, такие как PharmaLab 16 (Thermo Fisher Scientific, наружный диаметр шнека 16 мм), или ZSE 18 НР-РН (Leistritz, наружный диаметр шнека 18 мм), этот перечень не является исчерпывающими примерами.
Подходящие корректировки параметров процесса, таких как температура расплава, давление расплава, крутящий момент, и входные параметры экструзии, такие как температурный профиль, производительность, конструкция шнека и скорость вращения шнека, легко могут быть осуществлены с помощью общеизвестных экспериментов на основании обычных известных знаний квалифицированного специалиста в данной области техники.
Подходящие мельницы для необязательной стадии измельчения также известны в данной области техники. Подходяще, можно использовать молотковую мельницу (такую как FitzMill L1A by Fitzpatrick).
В альтернативном варианте осуществления, настоящее изобретение также обеспечивает второй способ приготовления композита, где композит включает или состоит из твердой дисперсии, представляющей собой предпочтительно твердый раствор, где способ включает
а) Растворение лекарственного вещества и полимера, который образует полимерный матрикс, и необязательно одного или больше фармацевтически приемлемых наполнителей, в растворителе с образованием раствора,
б) Высушивание распылением раствора с образованием композита,
в) Необязательно высушивание композита, предпочтительно при пониженном давлении.
Для лекарственного вещества и полимеров, используемых в соответствии с настоящим изобретением, подходящие растворители включают: дихлорметан, метанол и наиболее предпочтительно их смеси. Другие подходящие системы растворителей будут представлены самостоятельно квалифицированным специалистом в данной области техники, принимая во внимания растворимость лекарственного вещества, указание которого можно получить из ПРИМЕРА 1, и растворимость полимера, образующего полимерный матрикс, как указано в информации от производителя.
Несомненно, растворение может включать растворение лекарственного вещества и полимера в растворителе, которое может быть осуществлено последовательно сначала путем растворения лекарственного вещества с образованием раствора лекарственного вещества и затем добавления и растворения полимера к раствору лекарственного вещества или наоборот, то есть сначала путем растворения полимера в растворителе и затем добавления полимера. Альтернативно, растворы лекарственного вещества и полимера могут быть приготовлены раздельно и затем оба раствора объединяют в один раствор.
Подходящие техники высушивания распылением, которые можно использовать для приготовления частиц, хорошо известны и описаны, например, K. Masters в "Spray-drying Handbook", John Wiley & Sons, New York, 1984. В иллюстративном варианте осуществления, атомизацию раствора осуществляют с помощью форсунки. Примеры подходящих распылительных сушилок включают лабораторные распылительные сушилки, такие как Mini Spray Dryer 290 ( ) или 4M8-TriX (ProCepT); или MOBILE MINOR™, Pharma Spray Dryer PharmaSD® от GEA Niro.
) или 4M8-TriX (ProCepT); или MOBILE MINOR™, Pharma Spray Dryer PharmaSD® от GEA Niro.
Условия высушивания распылением оказывают решающие воздействие на свойства продукта, содержание растворителя, размер частиц, морфологию и степень разложения лекарственного вещества и полимера. Температура является наиболее важным параметром способа, поскольку воздействие высокой температуры на лекарственное вещество и полимер может вызывать разложение. Для распылительной сушилки, необходимо контролировать две температуры: температуру на входе и температуру на выходе. Формировка является независимым параметром способа и может быть установлена оператором, последний зависит, например, от скорости подачи жидкости, объемной скорости потока атомизирующего газа (если используется), объемной скорости потока сушильного газа, и выбранной температуры на входе. Параметры способа легко могут быть осуществлены с помощью общеизвестных экспериментов на основании обычных известных знаний квалифицированного специалиста в данной области техники.
Подходящие техники высушивания, которые можно использовать для необязательной стадии высушивания, включают общепринятые техники, известные в данной области техники, такие как, например, сушка в барабанной сушилке, сушка на ленточном конвейере и сушка на лотке. Такие методы могут быть осуществлены на воздухе или в атмосфере азота при нормальном или пониженном давлении, например, в вакууме. Предпочтительным является высушивание при пониженном давлении.
Подходящие аналитические методы для оценки аморфной природы, целостности лекарственного вещества и соотношение эутомер-дистомер описаны в ПРИМЕРЕ 11.
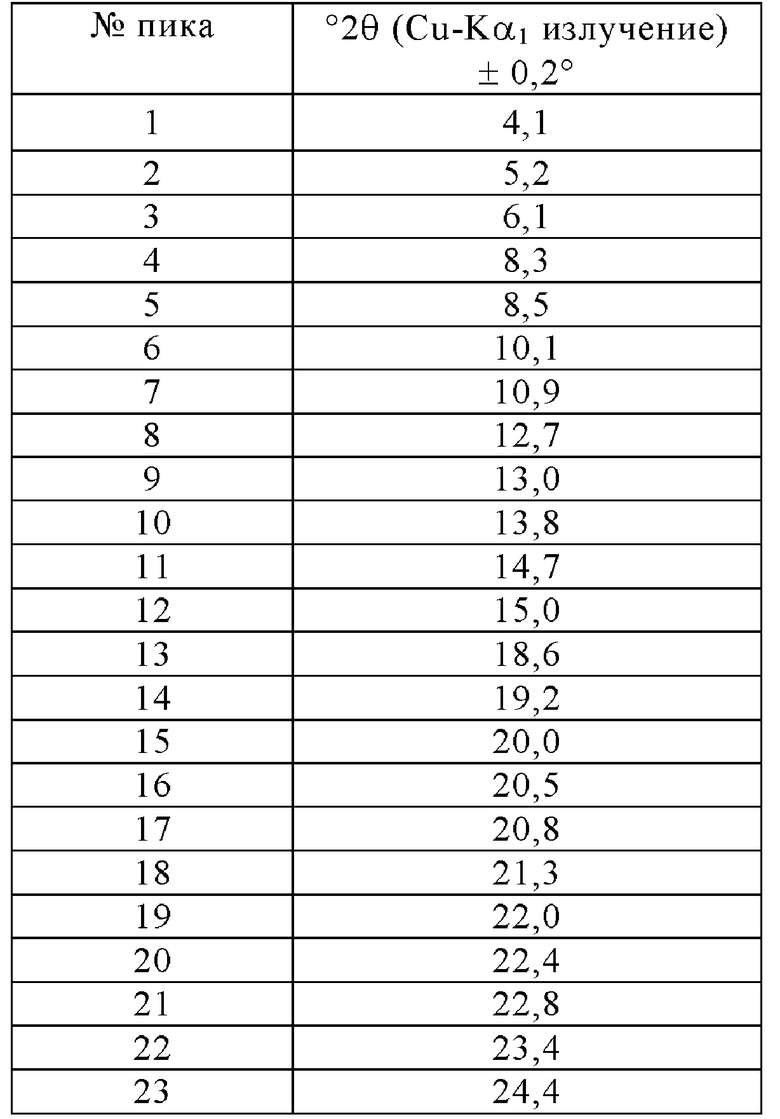
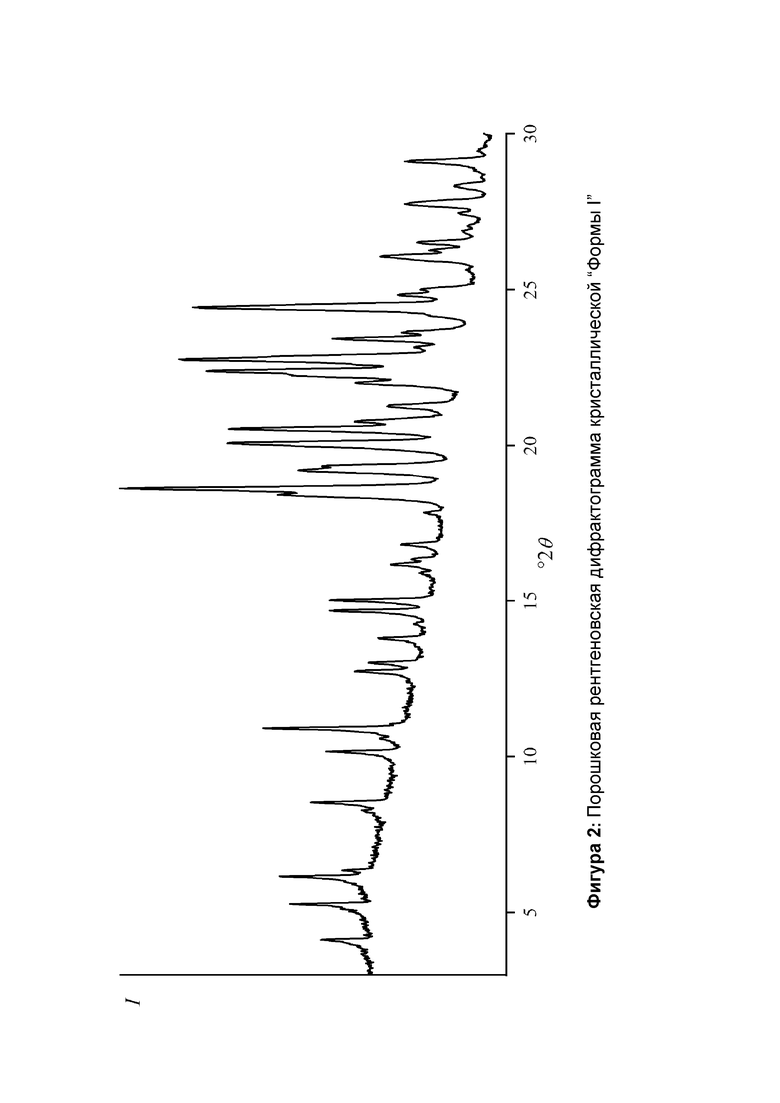
Предпочтительно, в качестве исходного вещества для способа экструзии горячего расплава или гранулирования из расплава, или высушивания распылением или совместного осаждения, используют кристаллическую форму лекарственного вещества. Наиболее предпочтительно, используют кристаллическую форму свободного лекарственного вещества, которая будет обозначаться в дальнейшем как Форма I, и которая характеризуется порошковой рентгеновской дифрактограммой, имеющей по меньшей мере два пика при градусах 2 тета (°2θ), выбранных из 4,1, 5,2, 6,1, 8,3, 8,5, 10,1, 10,9, 12,7, 13,0, 13,8, 14,7, 15,0, 18,6, 19,2, 20,0, 20,5, 20,8, 21,3, 22,0, 22,4, 22,8, 23,4, 24,4, каждый ± 0,2 градуса 2θ, где по меньшей мере один из по меньшей мере двух пиков выбирают из 4,1, 5,2, 8,3, 8,5, 10,1, 10,9, 12,7, 13,0 и 21,3 градусов 2θ (°2θ), каждый пик ± 0,2 градуса 2θ. Эту кристаллическую форму получают путем медленной кристаллизации из нагретого растворителя или смеси растворителей, таких как метанол, этанол, 1-пропанол, ацетон, метилэтилкетон, метилизобутилкетон, этилацетат, тетрагидрофуран, ацетонитрил, и смеси двух или больше из этих растворителей. Пример подходящего способа получения указанной кристаллической формы описан в ПРИМЕРЕ 1.
Кристаллическая форма I кристаллизуется в орторомбической пространственной группе P212121 с параметрами кристаллической решетки а=4,8 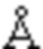 , b=27,5
, b=27,5 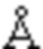 , с=33,3
, с=33,3  и α=β=γ=90°. Форма может быть дополнительно охарактеризована тем, что присутствует 8 формульных единиц на элементарную ячейку и объем элементарной ячейки составляет 4436
и α=β=γ=90°. Форма может быть дополнительно охарактеризована тем, что присутствует 8 формульных единиц на элементарную ячейку и объем элементарной ячейки составляет 4436  3. Кристаллическая форма дополнительно может быть описана с помощью расчетного значения плотности 1,44 г/см3. Эти данные были получены на основании данных рентгеновской структуры монокристалла с использованием дифрактометра Rigaku SuperNova, оборудованным детектором CCD, с использованием Cu-Kα излучения при 200 K. Форма I не проявляет термических событий до плавления / разложения выше 200°С.
3. Кристаллическая форма дополнительно может быть описана с помощью расчетного значения плотности 1,44 г/см3. Эти данные были получены на основании данных рентгеновской структуры монокристалла с использованием дифрактометра Rigaku SuperNova, оборудованным детектором CCD, с использованием Cu-Kα излучения при 200 K. Форма I не проявляет термических событий до плавления / разложения выше 200°С.
Таким образом, настоящее изобретение также относится к применению Формы I в способе приготовления композита в соответствии с настоящим изобретением.
Настоящее изобретение дополнительно обеспечивает способ приготовления фармацевтической композиции, включающей композит в соответствии с изобретением, где способ включает
способ для образования композита как указано выше;
смешивание композита и одного или больше фармацевтически приемлемых наполнителей;
необязательно гранулирование смеси композита и одного или больше фармацевтически приемлемых наполнителей,
и либо заполнение (необязательно гранулированной) смеси в капсулы или таблетирование смеси.
Подразумевается, что смешивание композита и наполнителей и гранулирование смеси может являться частью одной и той же стадии, то есть происходят одновременно.
Таблетирование, соответственно прессование в таблетки, можно осуществлять с помощью общепринятых эксцентричных прессов или вращательных прессов.
Как указано выше в вводном разделе, было обнаружено, что (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол проявляет чрезвычайно ценные свойства в качестве ДНК-ПК ингибитора, что нашло применение для лечения злокачественного новообразования. В настоящее время он проходит исследования в клинических испытаниях.
Таким образом, настоящее изобретение обеспечивает композит, соответственно фармацевтическую композицию, как описано выше, для применения для лечения злокачественного новообразования.
Необязательно лечение злокачественного новообразования дополнительно включает лучевую терапию. Подходящие лечения с применением лучевой терапии описаны в WO 2014/183850 и включены в настоящую заявку в качестве ссылки.
Необязательно, альтернативно или дополнительно к лучевой терапии, лечение злокачественного новообразования может включать химиотерапию. Подходящие фармацевтически активные компоненты, которые можно использовать в химиотерапии в комбинации с (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанолом, включают цисплатин и этопозид или их комбинацию, но только в качестве примера, а не ограничиваясь только ими.
Таким образом, настоящее изобретение также обеспечивает способ лечения злокачественного новообразования у пациента, который в этом нуждается, который включает введение пациенту фармацевтической композиции в соответствии с настоящим изобретением, необязательно в комбинации с лучевой терапией или химиотерапией или оба вида терапии. В иллюстративном варианте осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из рака ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов, у пациента, который в этом нуждается, который включает введение указанному пациенту (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола, или его фармацевтически приемлемой соли в композите или фармацевтической композиции в соответствии с настоящим изобретением, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата платины. В дальнейшем варианте осуществления, доксорубицин можно использовать в качестве компонента комбинации, либо отдельно или в комбинации с препаратом платины.
В дальнейшем, настоящее изобретение будет описано со ссылкой на его иллюстративные варианты осуществления, которые не следует рассматривать как ограничивающие изобретение.
Краткое описание фигур
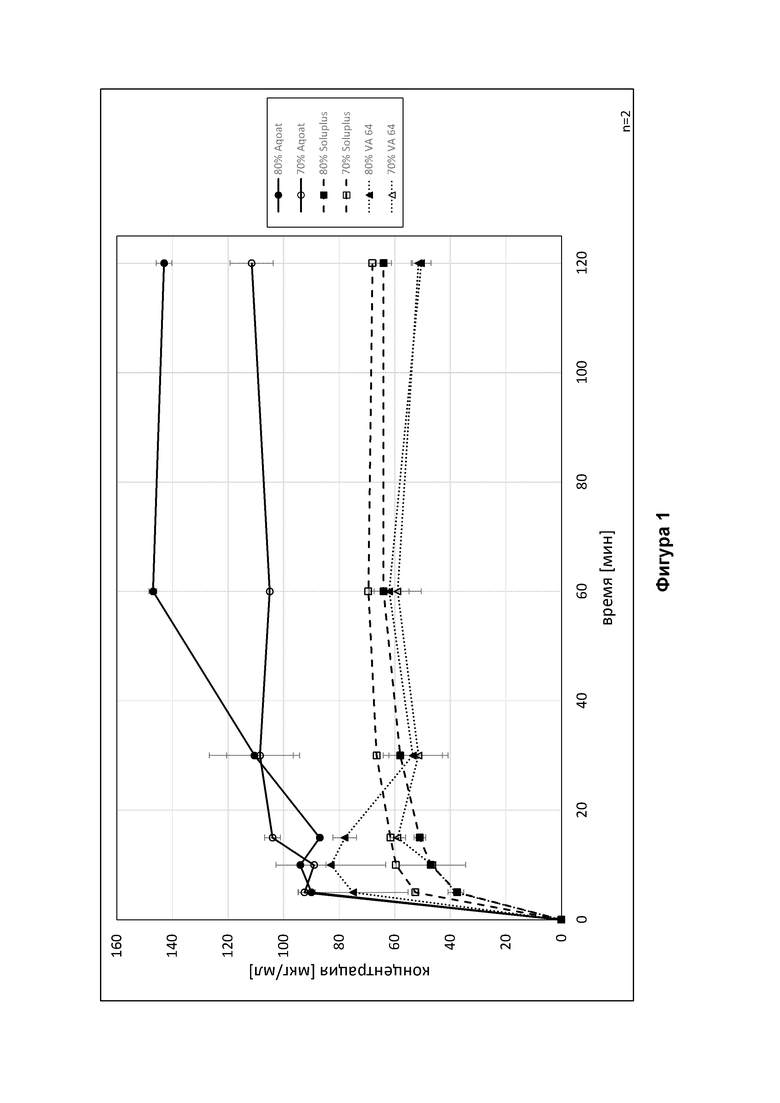
Фиг. 1 представлены кривые растворения для различных вариантов осуществления твердых дисперсий в соответствии с настоящим изобретением, полученных путем экструзии горячего расплава.
Фиг. 2 представлена порошковая рентгеновская дифрактограмма кристаллической формы I, которую предпочтительно используют в качестве исходного вещества в настоящем изобретении.
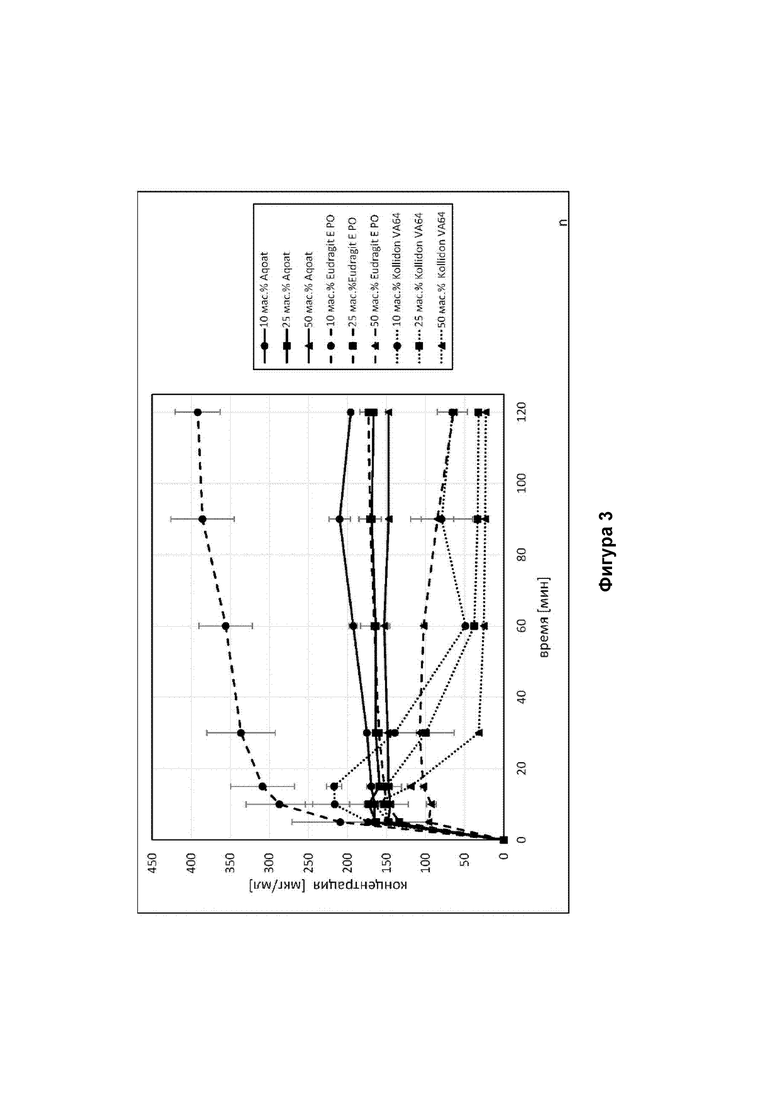
Фиг. 3 представлены кривые растворения для различных вариантов осуществления твердых дисперсий в соответствии с настоящим изобретением, полученных путем высушивания распылением.
Подробное описание изобретения
ПРИМЕР 1: Приготовление кристаллического безводного (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола для применения в качестве исходного вещества при экструзии горячего расплава или гранулирования из расплава или высушивания распылением или совместного осаждения
Прибл. 20 мг лекарственного вещества растворяли или суспендировали в нескольких растворителях (см. Таблицу 2 ниже) при 50°С. Растворы/суспензии фильтровали через шприцевые фильтры 0,2 мкм. Полученные прозрачные растворы охлаждали до 5°С со скоростью изменения температуры прибл. 0,05 K/мин. Во время охлаждения растворы перемешивали с помощью магнитной мешалки с якорями, покрытыми PTFE. Разделение твердых и жидких фаз полученных суспензий осуществляли путем центрифугирования и твердые материалы высушивали в течение ночи при комнатной температуре с потоком сухого азота. Растворители, используемые в этих экспериментах, обобщены в таблице ниже.

Порошковую рентгеновскую дифракцию (XRPD) получали с помощью стандартных методик, как описано в Европейской Фармакопее 7-ая редакция, раздел 2.9.33 (Cu-Kα1 излучение, λ=1,5406  , температура окружающей среды), и в частности: Измерение осуществляли в геометрии пропускания с Cu-Kα1 излучением на дифрактометре Stoe StadiP 611, оборудованном Mythen1K Si-ленточным детектором (PSD). Приблизительно 10-100 мг образца приготавливали между аморфными пленками. Измерение осуществляли путем установки следующих параметров:
, температура окружающей среды), и в частности: Измерение осуществляли в геометрии пропускания с Cu-Kα1 излучением на дифрактометре Stoe StadiP 611, оборудованном Mythen1K Si-ленточным детектором (PSD). Приблизительно 10-100 мг образца приготавливали между аморфными пленками. Измерение осуществляли путем установки следующих параметров:
Дифрактограмма проиллюстрирована на Фигуре 2 и проявляет следующие пики:
ПРИМЕР 2: Твердые дисперсии, приготовленные путем экструзии горячего расплава
Твердые дисперсии, содержащие либо 20 или 30 мас. % лекарственного вещества (используя в качестве исходной безводную кристаллическую форму I, описанную выше) и либо 80 или 70 мас. % полимерного матрикса, приготавливали путем экструзии горячего расплава, используя в качестве исходного 5 или 10 г материала, используя лабораторный экструдер (HAAKE MiniLab II (Thermo Fisher Scientific)). Используемыми полимерами являлись: Aqoat®, Soluplus® и Kollidon® VA 64, который более подробно был описан выше, при следующих условиях:
70 или 80 мас. % Kollidon® VA 64: Начальная температура экструзии: 160°С, повышение температуры 5-10°С, Температура экструзии: 200°С (80% VA 64) или 195°С (70% VA 64), Скорость экструзии: 100 об./мин (оборотов в минуту).
70 или 80 мас. % Aqoat®: Начальная температура экструзии: 160°С, повышение температуры 5°С (80 мас. % Aqoat®) или 5-10°С (70 мас. % Aqoat®), Температура экструзии: 175°С (80% Aqoat®) или 178°С (70% Aqoat®), Скорость экструзии: 100 об./мин (оборотов в минуту).
70 или 80 мас. % Soluplus®: Начальная температура экструзии: 130°С (80 мас. %) Soluplus®) или 188°С (70 мас. % Soluplus®), повышение температуры 5°С (80 мас. %) Soluplus®) или 2-5°С (70 мас. % Soluplus®), Температура экструзии: 188°С (80% Soluplus®) или 200°С (70% Soluplus®), Скорость экструзии: 100 об./мин (оборотов в минуту).
Экструдаты размалывали, используя Pulverisette 23 LabScale мельницу (Fritsch). Сразу, одну нить экструдата размалывали в течение 2 минут при 30 колебаниях/с, используя два размольных шара оксида циркония 10 мм.
Исследования растворения осуществляли для всех вышеописанных примеров, используя следующие условия проведения тестов: Приблизительно 30 мг размолотого экструдата диспергировали в 7 мл FaSSIF (состав см. ПРИМЕР 4) путем встряхивания при 37°С. В соответствующие моменты времени отбирали образцы объемом 1 мл, центрифугировали и анализировали, используя ВЭЖХ. Временные точки отбора образцов: 5, 10, 15, 30, 60 и 120 минут.
Полученные кривые растворения проиллюстрированы на Фигуре 1. Как становится очевидным из графика, твердые дисперсии лекарственного вещества в Aqoat® матриксе обеспечивало наилучшую растворимость для обоих дисперсий 20 и 30 мас. % лекарственного вещества. Kollidon® VA 64 обеспечивал лучшую растворимость при 80 мас. % полимерного матрикса по сравнению с составами на основании Soluplus®, но только приблизительно эквивалентную растворимость при 70 мас. % Kollidon® VA 64.
При этом, растворимость твердой дисперсии является предпоследним фактором, который следует принимать во внимание при оценке качества твердой дисперсии. Что касается соотношения эутомер: дистомер, то твердые дисперсии на основании Kollidon® VA 64 неожиданно продемонстрировали наилучшие результаты, принимая во внимание, что содержание эутомеров этих первых экспериментальных составов было выше 95% даже после хранения в течение 26 недель при 40°С и 75% относительной влажности. Что касается соотношения эутомер : дистомер, то твердые дисперсии на основании Soluplus® заметно являются не настолько благоприятными, как дисперсии на основании Kollidon® VA 64, но все еще значительно лучше, чем твердые дисперсии на основании Aqoat®.
Следовательно, особенно предпочтительными являются твердые дисперсии в полимерном матриксе Kollidon® VA 64, то есть коповидон, в особенности твердые дисперсии с приблизительно 20 мас. % лекарственного вещества в приблизительно 80 мас. % коповидона.
При рентгеновском дифрактометрическом анализе образцов было обнаружено только аморфный материал, в котором молекулярно диспергировано лекарственное вещество.
ПРИМЕР 3: Другой пример твердой дисперсии, приготовленной путем экструзии горячего расплава
Дальнейшие эксперименты экструзии осуществляли на предпочтительных твердых дисперсиях на основе Kollidon® VA 64 (80 мас. %) (то есть 20 мас. % лекарственного вещества, используя в качестве исходной безводную кристаллическую форму I, описанную выше)), используя крупномасштабный экструдер (PharmaLab 16; Thermo Fisher Scientific). Температурный профиль в экструдере находился в диапазоне от 60°С в зоне 2 до 150°С в зоне шнека. Конструкция шнека включает конвейерные элементы з двумя замешивающими блоками. Скорость вращения шнека устанавливали на 300 об./мин (оборотов в минуту) и производительность составляла 1,6 кг/ч. Температура расплава устанавливали приблизительно при 154°С и давление расплава приблизительно при 2 бар. Полученные твердые дисперсии включали меньше, чем 0,5 мас. % дистомера. Полученная дисперсия имела температуру перехода в стеклообразное состояние приблизительно 103°С и хорошо достигалась желательная насыщающая растворимость более, чем 25 мкг/мл. Молотковая мельница продуцировала частицы с подходящим распределением частиц по размеру, с наибольшей порцией частиц, имеющих размер в диапазоне 100-355 мкм.
Другой эксперимент экструзии осуществляли на предпочтительных твердых дисперсиях на основе Kollidon® VA 64, используя крупномасштабный экструдер с еще более высокой лекарственной нагрузкой: 30 мас. % лекарственного вещества (как указано выше) и 70 мас. % Kollidon® VA 64. Температурный профиль в экструдере находился в диапазоне от 60°С в зоне 2 до 160°С в зоне шнека. Конструкция шнека включает конвейерные элементы з двумя замешивающими блоками. Скорость вращения шнека устанавливали на 350 об./мин (оборотов в минуту) и производительность составляла 1,0 кг/ч. Температуру расплава устанавливали приблизительно при 160°С и давление расплава ниже 1 бар. Полученные твердые дисперсии включали меньше, чем 1,5 мас. % дистомера. Полученная дисперсия имела температуру перехода в стеклообразное состояние приблизительно 81-83°С. Молотковая мельница продуцировала частицы с подходящим распределением частиц по размеру, с наибольшей порцией частиц, имеющих размер в диапазоне 100-355 мкм.
Таким образом, экструзия горячего расплава обеспечивала однофазные аморфные твердые дисперсии, то есть твердые растворы с лекарственными веществами, молекулярно диспергированными в полимерном матриксе при благоприятно высокой лекарственной нагрузке, хорошей биодоступности и благоприятно высокому содержанию эутомера.
ПРИМЕР 4: Другой пример твердой дисперсии, приготовленной путем экструзии горячего расплава
Другой способ оптимизации, используя вращающийся в одном направлении двухшнековый экструдер (ZSE 18 НР-РН; Leistritz) и молотковую мельницу предоставлял возможность другого способа оптимизации, обеспечивая даже еще более благоприятные соотношения эутомер : дистомер (на уровне до 0,3 мас. % дистомера), температуру перехода в стеклообразное состояние 109°С, аморфный внешний вид и благоприятные свойства растворимости в твердых дисперсиях 80 мас. % Kollidon® VA 64 и 20 мас. % лекарственного вещества. Результаты измерений растворимости различных образцов, которые были получены при незначительно отличающихся условиях осуществления способа, каждый (скорость вращения шнека, способ температура, и скорость подачи) представлены в таблице ниже:

AUC90: Площадь под кривой при (через) 90 минут
С90: концентрация через 90 минут
Cmax90: максимум концентрация в течение 90 минут
Исследование растворимости осуществляли следующим образом: 50 мг активной таблетки добавляли в сосуд для определения растворимости объемом 100 мл. Среду для определения растворимости (FaSSIF рН 6,5) предварительно нагревали до 37°С. Лопасти вращались при 250 об./мин. Запускали таймер и в сосуд добавляли 100 мл среды для определения растворимости. Через 1 минуту, скорость лопастей снижали до 200 об./мин. За 3 минуты до временного точки отбора каждого образца, 1 мл образца удаляли с помощью шприца и канюли с фильтром 10 мкм, который снова заменяли на фильтр PTFE 0,45 мкм и образец фильтровали во флакон для ВЭЖХ. 50 мкл фильтрата переносили в новый флакон с 250 мкл разбавителя. Образцы отбирали во время 4, 10, 15, 20, 30, 40 и 90 минут.
FaSSIF: 3 мМ таурохолата натрия; 0,75 мМ лецитина; 105,9 мМ хлорида натрия; 28,4 мМ одноосновного фосфата натрия и 8,7 мМ гидроксида натрия, рН 6,5
ПРИМЕР 5: Типичные составы капсул
Твердые желатиновые капсулы обеспечивали заполнителем, включающим следующие ингредиенты при указанном проценте по весу заполнителя:

ПРИМЕР 6: Типичные составы таблеток (покрытие в/м)
Таблетки получали с составом, содержащим следующие ингредиенты при указанном весовом проценте по весу таблетки. Постулировали сопротивление на разрыв от 1,0-2,0 МРа.
ПРИМЕР 7: Терапевтическая эффективность
Терапевтическую релевантность ингибирования ДНК-ПК лекарственным веществом как таковым исследовали in vivo в комбинации с ионизирующей радиацией (ИИ)), клинически доказанным лечение, индуцирующим ДЦР. Лекарственное вещество тестировали для определения активности на шести моделях ксенотрансплантатов у мышей злокачественного новообразования человека. Модели выбирали из злокачественных новообразований различных показаний (ободочная кишка, легкие, голова и шея, поджелудочная железа), и гистологических подтипов (адено, сквамозный, крупноклеточный). Ионизирующее излучение вводили, используя фракционированную схему 2 Гр на день введения в течение пяти последовательных дней (суммарная доза облучения = 10 Гр). вводили перорально за 10 минут до каждой фракции облучения (ONC397-1-2AZ, ONC397-1-3AZ, ONC397-1-4AZ, ONC397-1-5AZ, ONC397-1-8AZ).
Во всех моделях, пероральное введение лекарственного вещества приводило к сильному усилению эффекта облучения. Усиливающий эффект лучевой терапии был количественно выражен для тестируемых моделей в помощью времени до достижения 400% исходного объема для 150 мг/кг исследуемых групп. Полученные графики Каплана-Майера сравнивали с помощью логарифмического рангового критерия. Было обнаружено, что коэффициент усиления в такой установленной схеме лечения находится в диапазоне 1,5 (А549, НСТ116), и 2,6 (NCI-H460).
ПРИМЕР 8: Твердые дисперсии, приготовленные путем высушивания распылением
Твердые дисперсии, содержащие либо 10, 25 или 50 мас. % лекарственного вещества (используя в качестве исходной безводную кристаллическую форму I, описанную выше) и либо 50, 75 или 90 мас. % полимерного матрикса приготавливали путем высушивания распылением используя в качестве исходного 1,5 г материала, используя лабораторную распылительную сушилку (4M8-TriX (ProCepT)). Используемыми полимерами были: Aqoat®, Eudragit® Е РО и Kollidon® VA 64, которые более подробно были описаны выше, при следующих условиях:
50, 75 или 90 мас. % Aqoat®: Распыляемый раствор: 1% (м/м твердых веществ в 90:10 дихлорметан : метанол, температура на входе: 80°С, воздушный поток: 0,3 м3/мин, атомизирующий воздух: 10 л/мин, размер форсунки: 1 мм, скорость подачи: 2 мл/мин.
50, 75 или 90 мас. % Kollidon® VA 64: Распыляемый раствор: 2% (м/м твердых веществ в 90:10 дихлорметан : метанол, температура на входе: 80°С, воздушный поток: 0,3 м3/мин, атомизирующий воздух: 10 л/мин, размер форсунки: 1 мм, скорость подачи: 2 мл/мин.
50, 75 или 90 мас. % Eudragit® Е РО: Распыляемый раствор: 2% (м/м твердых веществ в 90:10 дихлорметан : метанол, температура на входе: 50°С, воздушный поток: 0,3 м3/мин, атомизирующий воздух: 10 л/мин, размер форсунки: 1 мм, скорость подачи: 2 мл/мин.
Вторичное высушивание высушенного распылением материала осуществляли в эксикаторе при 200 мбар. Материал был полностью аморфным.
Исследования растворения осуществляли для всех вышеописанных примеров, используя следующие условия проведения тестов: Приблизительно 6,5 мг твердой дисперсии для 10 мас. % лекарственного вещества, 2,6 мг твердой дисперсии для 25 мас. % лекарственного вещества и 1,3 мг твердой дисперсии для 50 мас. % лекарственного вещества (нормирование всех тестируемых образцов к количеству лекарственного вещества 650 мкг) взвешивали в Eppendorf Сар объемом 1,5 мл. Среду для определения растворимости (FaSSIF рН 6,5) предварительно нагревали до 37°С. 1,3 мл предварительно нагретой среды для определения растворимости добавляли в Eppendorf Сар. Образец встряхивали в течение 1 минуты и после этого хранили при 37°С. За 2,5 минуты до временно точки отбора каждого образца, образец центрифугировали в течение 1 минуты при 10000 об./мин. 50 мкл супернатанта переносили во флакон для ВЭЖХ с 150 мкл разбавителя и анализировали с помощью ВЭЖХ. Оставшийся образец встряхивали в течение 25 секунд и хранили при 37°С до следующей временной точки, когда процедуру повторяли. Временные точки отбора образцов: 5, 10, 15, 30, 60, 90 и 120 минут.
Полученные кривые растворения проиллюстрированы на Фигуре 3.
- Твердая дисперсия лекарственного вещества в Eudragit® Е РО матриксе обеспечивала наилучшую растворимость для 10 мас. % дисперсии лекарственного вещества. Тем не менее, была обнаружена четкая зависимость поведения растворимости от количества лекарственного вещества в составе.
- Твердая дисперсия лекарственного вещества в Aqoat® матриксе обеспечивала четкое сверхнасыщение без осаждения. Было обнаружено только незначительное влияние количества лекарственного вещества в составе.
- Твердая дисперсия лекарственного вещества в Kollidon® VA64 матриксе обеспечивала четкое сверхнасыщение с последующим осаждением. Было обнаружено только незначительное влияние количества лекарственного вещества в составе. Дисперсии с 10 мас. % лекарственного вещества проявили наибольшее сверхнасыщение, в то время как дисперсии с 25 мас. % и 50 мас. % лекарственного вещества проявили почти такое же сверхнасыщение и осаждение.
Тем не менее, растворимость твердой дисперсии является предпоследним фактором, который следует учитывать при исследовании качества твердой дисперсии. Что касается стабильности:
- Твердая дисперсия лекарственного вещества в Aqoat® матриксе проявила только ничтожно малую потерю свойств растворимости. После хранения в течение 12 недель при 40°С и 75% относительной влажности при рентгеновском дифрактометрическом анализе образцов был обнаружен только аморфный материал. Было обнаружено только приемлемое повышение количества примесей.
- Твердая дисперсия лекарственного вещества в Kollidon® VA64 матриксе не проявила изменений свойств растворимости в динамике. После хранения в течение 12 недель при 25°С и 60% относительной влажности при рентгеновском дифрактометрическом анализе образцов был обнаружен только аморфный материал. Было обнаружено только очень незначительное повышение количества примесей (даже меньше, чем в Aqoat матриксе).
- В то время как твердые дисперсии лекарственного вещества в Eudragit® Е РО матриксе проявили наилучшую растворимость, то свойство растворимости и уровни примесей после хранения в течение 12 недель при 40°С и 75% относительной влажности были заметно ниже по сравнению с дисперсиями на матриксах Kollidon® VA64 и Aqoat®.
Следовательно, твердые дисперсии в полимерном матриксе HPMCAS, в настоящей заявке Aqoat®, приготовленные путем высушивания распылением являются одними из особенно предпочтительных вариантов осуществления, в особенности твердые дисперсии приблизительно 25 мас. % лекарственного вещества с приблизительно 75 мас. % HPMCAS.
ПРИМЕР 9: Другие примеры твердых дисперсий, приготовленных путем высушивания распылением
Другие эксперименты высушивания распылением осуществляли на твердых дисперсиях на основе Aqoat® (75 мас. %), используя изготовленную по специальному заказу лабораторную распылительную сушилку. Высушивание распылением осуществляли при следующих условиях:
Распыляемый раствор: 6 мас. % твердых веществ в 90:10 дихлорметан : метанол, температура: 96°С, интенсивность газового потока: 450 г/мин, давление атомизации: 120 фунтов на кв. дюйм, атомайзер: давление Swirl Schlick 2.0, скорость подачи: 27 г/мин.
Вторичное высушивание высушенного распылением материала осуществляли в конвекционной центробежной сушилке при 40°С в течение 22 часов.
При рентгеновском дифрактометрическом анализе образца обнаружили только аморфный материал.
Что касается соотношения эутомер: дистомер, то полученная твердая дисперсия на основе Aqoat® обеспечивает содержание эутомера выше 95%, даже после хранения в течение 26 недель при 40°С и 75% относительной влажности. Благоприятно, сумма общих продуктов разложения составляет меньше 2%.
ПРИМЕР 10: Твердые дисперсии, полученные путем совместного осаждения
Твердые дисперсии, содержащие либо 20 или 35 мас. % лекарственного вещества (используя безводную кристаллическую форму I, описанную выше в препарате) и либо 80 или 65 мас. % полимерного матрикса приготавливали путем скрининга совместного осаждения. Используемыми полимерами были: HPMCAS и НРМСР, которые более подробно были описаны выше.
Приготавливали прозрачный раствор соединения и полимера (приблизительно 20 или 35 мас. % соединения к полимеру) в DMA. 70 мкл прозрачного раствора DMA вливали по каплям с помощью многоканальной пипетки к вымороженному и интенсивно перемешанному антирастворителю (700 мкл HCl раствор, 0,01 н., рН 2) в стеклянных флаконах объемом 1 мл. Полученную суспензию фильтровали и полученный фильтрационный осадок промывали водой и высушивали в вакууме.
При рентгеновском дифрактометрическом анализе твердых дисперсий не обнаружилось признаков кристаллического материала для обоих концентраций лекарственных веществ в HMPCAS и НРМСР.
ПРИМЕР 11: Аналитические методы
Твердое состояние, и, в особенности, аморфная природа полученных твердых дисперсий, может быть оценена с помощью рентгеновских дифрактометрических измерений и/или с помощью ДСК измерений, при этом подходящие методы, применяемые для анализа вышеописанных примеров, представлены далее. Для квалифицированного специалиста в данной области техники будет понятным, что для определенных вариантов осуществления, может быть необходимо или благоприятно модифицировать аналитические методы. Такие модификации, например, адаптация скорости линейного изменения нагрева, легко могут быть идентифицированы квалифицированным специалистом в данной области техники.
XRD:
Измерения осуществляли в геометрии пропускания с Cu-Kα1 излучением на дифрактометре Stoe StadiP 611, оборудованном Mythen1K Si-ленточным детектором (PSD) путем установки следующих параметров:
• приготовление между аморфными пленками
ДСК:
ДСК исследования осуществляли на ДСК 1 (Mettler Toledo, Switzerland). 20 мг твердой дисперсии, например, измельченного экструдата, взвешивали в ДСК алюминиевом контейнере объемом 100 мкл и запечатывали крышкой, которую прокалывали вручную перед измерением. Осуществляли три цикла нагревания: 25-180°С при скорости изменения 5 K/мин, затем поддерживали при 180°С в течение 5 минут, и после этого охлаждали от 180°С до 25°С при - 5 K/мин. В течение четвертого цикла нагревания, осуществляли нагревание 25-180°С при скорости изменения только 10 K/мин. Определяли температуры перехода в стеклообразное состояние Tg во втором, третьем и четвертом циклах нагревания.
Единичная температура перехода в стеклообразное состояние свидетельствует об однофазной аморфной системе.
ВЭЖХ:
Целостность лекарственного вещества, в особенности для анализа возможных продуктов разложения, может быть определена с помощью ВЭЖХ, как подробно указано ниже:
Система: Agilent Technologies (USA) 1260 ВЭЖХ Система
Способ: вводили 10 мкл образца и количественно определяли с помощью детектора на диодной матрице, работающего при 298 нм. Используемыми элюентами были бинарные смеси 95:5 и 5:95 (об/об) MilliQ воды с 0,1% трифторуксусной кислотой и ACN. Линейный градиент прогоняли от 90% фазы А до 100% B в течение 13 мин. Использовали колонку YMC с обращенной фазой (4,6×50 мм с упаковкой 3 мкм), постоянно нагревали вплоть до 35°С.
Степень энантиомерной примеси может быть оценена с помощью количественной хиральной ВЭЖХ, как подробно описано ниже:
Система: Agilent Technologies (USA) 1260 ВЭЖХ Система
Способ: вводили 5 мкл образца и количественно определяли с помощью детектора на диодной матрице, работающего при 273 нм. Используемыми элюентами были н-Гексан с 0,1% муравьиной кислотой (фаза А) и Изопропанол с 0,1% муравьиной кислотой (фаза В). Изократический градиент с 80% фазой А и 20% фазой В прогоняли в течение 40 минут. Использовали колонку Lux Cellulose-1 (4,6×150 мм с упаковкой 5 мкм), постоянно нагревали вплоть до 20°С.
| название | год | авторы | номер документа |
|---|---|---|---|
| АРИЛХИНАЗОЛИНЫ | 2014 |
|
RU2701193C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ИНГИБИТОРА ТИРОЗИНКИНАЗЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2007 |
|
RU2468788C2 |
| ТВЕРДЫЕ, ПРИГОДНЫЕ ДЛЯ ОРАЛЬНОГО УПОТРЕБЛЕНИЯ ФАРМАЦЕВТИЧЕСКИЕ ФОРМЫ ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ РИВАРОКСАБАН С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ | 2005 |
|
RU2420290C2 |
| Пероральная твердая лекарственная форма с микофенольной кислотой или ее солью для использования в качестве иммунодепрессанта для лечения или предупреждения отторжения трансплантата органа или ткани и способ ее получения | 2016 |
|
RU2670447C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ АНТАГОНИСТОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА 5 (MGLU5) | 2011 |
|
RU2602955C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА | 2003 |
|
RU2296757C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЛИГАНДЫ СИГМА РЕЦЕПТОРА | 2010 |
|
RU2549882C2 |
| Экструдат с микофенолятом натрия для получения пероральной твердой лекарственной формы | 2018 |
|
RU2723255C2 |
| ТВЕРДЫЕ ДИСПЕРСИИ, СОДЕРЖАЩИЕ ИНГИБИТОРЫ КИНАЗ | 2011 |
|
RU2566716C2 |
| КОМПОЗИЦИЯ И ЛЕКАРСТВЕННАЯ ФОРМА, СОДЕРЖАЩИЕ ТВЕРДУЮ ИЛИ ПОЛУТВЕРДУЮ МАТРИЦУ | 2006 |
|
RU2423997C9 |
Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой твердую дисперсию (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола в полимерном матриксе, состоящем из сополимера поливинилпирролидона и поливинилацетата, для сенсибилизации раковых клеток к ионизирующему излучению. 2 объект – фармацевтическую композицию для сенсибилизации раковых клеток к ионизирующему излучению, которая представляет собой таблетку, включающую твердую дисперсию. 3 и 4 объекты – способы приготовления твердой дисперсии. 5 объект – способ приготовления фармацевтической композиции. Технический результат заключается в улучшенной биодоступности (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола. 5 н. и 8 з.п. ф-лы, 3 ил., 5 табл., 11 пр.
1. Твердая дисперсия (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола в полимерном матриксе, состоящем из сополимера поливинилпирролидона и поливинилацетата, для сенсибилизации раковых клеток к ионизирующему излучению, причем (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанол представлен в его свободной форме и количество (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола в полимерном матриксе составляет от 10 до 40 мас.%, на основе общего веса твердой дисперсии.
2. Твердая дисперсия по п. 1, которая представляет собой твердый раствор.
3. Твердая дисперсия по любому из пп. 1 или 2, где твердая дисперсия получена путем экструзии горячего расплава.
4. Твердая дисперсия по любому из предшествующих пунктов, где количество (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола в полимерном матриксе составляет от 10 до 30 мас.%, на основе общего веса твердой дисперсии.
5. Твердая дисперсия по любому из предшествующих пунктов, которая имеет размер частиц, характеризующийся d50 значением 1000 мкм или меньше, предпочтительно 400 мкм или меньше.
6. Фармацевтическая композиция для сенсибилизации раковых клеток к ионизирующему излучению, которая представляет собой таблетку, включающую:
I. 40-60 мас.% твердой дисперсии по любому из пп. 1-5;
II. 25-55 мас.% заполнителя;
III. 5-30 мас.% агента, вызывающего дезинтеграцию;
IV. до 5 мас.% скользящего вещества;
V. до 15 мас.% неорганической соли щелочного металла; и
VI. всего до 10 мас.% одного или больше дополнительных фармацевтически приемлемых наполнителей,
на основе общего веса таблетки.
7. Фармацевтическая композиция по п. 6, где заполнитель представляет собой микрокристаллическую целлюлозу и/или агент, вызывающий дезинтеграцию, выбранный из кросповидона, карбоксиметилцеллюлозы и ее солей и производных, и/или неорганическая соль щелочного металла представляет собой неорганическую соль натрия.
8. Способ приготовления твердой дисперсии по любому из пп. 1-5, который включает экструзию горячего расплава или гранулирование из расплава.
9. Способ приготовления твердой дисперсии по любому из пп. 1-5, который включает:
смешивание и плавление (S)-[2-хлор-4-фтор-5-(7-морфолин-4-илхиназолин-4-ил)фенил]-(6-метокси-пиридазин-3-ил)метанола и полимера, образующего полимерный матрикс,
экструдирование горячего расплава или гранулирование из расплава смеси для образования твердой дисперсии.
10. Способ по п. 9, дополнительно включающий измельчение образованной твердой дисперсии.
11. Способ по п. 10, в котором смешивание и плавление осуществляют в присутствии по меньшей мере одного фармацевтически приемлемого наполнителя.
12. Способ приготовления фармацевтической композиции по п. 6 или 7, включающий способ по п. 8 или 9 для образования твердой дисперсии;
смешивание твердой дисперсии и одного или больше фармацевтически приемлемых наполнителей; и
таблетирование смеси.
13. Способ по п. 12, дополнительно включающий гранулирование смеси твердой дисперсии и одного или больше фармацевтически приемлемых наполнителей.
| WO 2014183850 A1, 20.11.2014 | |||
| FLYNN E | |||
| Pharmacokinetic Parameters, Editor(s): S.J | |||
| Enna, David B | |||
| Bylund, xPharm: The Comprehensive Pharmacology Reference, Elsevier, 2007, P | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ПЕРЦЕВ И.М | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - Харьков: УкрФА | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Телефонная трансляция | 1922 |
|
SU464A1 |
| СУТЯГИН В.М | |||
| и соавт | |||
| Химия и физика полимеров: | |||
Авторы
Даты
2023-12-07—Публикация
2018-03-28—Подача