Предлагаемое изобретение относится к области медицинской микро-биологии и фармакологии и может быть использовано для сочетанной терапии злокачественных новообразований. Смертность от злокачественных новообразований занимает одно из первых мест в причинах смертности населения, как в РФ, так и за рубежом. В мире ежегодно регистрируют приблизительно 10 млн. случаев злокачественных новообразований, из них на развитые страны приходится около 48%, в связи с этим разработка новых противоопухолевых препаратов является актуальной задачей [Соухами Р., Тобайас Дж. Рак и его лечение //Пер. с англ. - М.: БИНОМ. Лаборатория знаний, 2009. - 437 с.].
Одним из вариантов увеличения эффективности терапии злокачественных новообразований является сочетанное применение различных препаратов, обладающих противоопухолевым действием (цитостатиков). В настоящее время список цитостатиков обширен и включает в себя несколько классов веществ с различным механизмом действия. Все имеющиеся на сегодняшний день протоколы комбинированной противоопухолевой терапии имеют свои ограничения и недостатки, связанные с токсичностью применяемых препаратов, возможностью возникновения опухолевой резистентности и др., поэтому разработка новых вариантов и схем совместного применения противоопухолевых препаратов также актуальна.
Среди биотехнологических препаратов, обладающих противоопухолевым действием, особое место занимает микотоксин Т-2. Микотоксин Т-2 в очищенном виде представляет собой бесцветные (белые или серые в зависимости от уровня очистки) кристаллы [Тутелян В.А. Микотоксины. Медицинские и биологические аспекты //АМН СССР. - М.: Медицина, 1985. - 320 с.].
Относится к низкомолекулярным соединениям - сесквитерпенам, исключительно устойчивым в физическом и химическом плане. Молекулярная масса Т-2 токсина равна 466 (химическая формула С24Н34О9), точка плавления 151°С. Хорошо хранится при комнатной температуре в течение нескольких лет, выдерживает воздействие температуры до 600°С, длительное УФ-облучение и действие других факторов внешней среды. Т-2 токсин хорошо растворяется в умеренно полярных растворителях (хлороформ, этилацетат), несколько меньше в более полярных растворителях (этанол), еще меньше - в воде.
Уровни токсических доз в зависимости от вида млекопитающего и места аппликации находятся в диапазоне 1,0-10,0 мг⋅кг-1 массы тела. Он проникает в организм через неповрежденные кожные покровы, слизистые, желудочно-кишечный тракт, органы дыхания (пути проникновения указаны в порядке снижения токсической дозы).
Исследования тонких механизмов действия Т-2 показали множественность мишеней его приложения на молекулярном, клеточном, органном, системном и организменном уровнях [Зайченко A.M. Макроциклические трихотеценовые микотоксины: биологическая активность // Современные проблемы токсикологии. - 2006. - №3. - С. 59-66]. Даже в наноколичествах он способен нарушать функции клеточных мембран, митохондрий, ингибировать синтез белка, ферментов, нуклеиновых кислот, оказывать заметное цитостатическое действие на быстроделящиеся клетки. Т-2 токсин является уникальным веществом, способным в субтоксичных дозах (1/10 ЛД50 и менее) потенцировать действие химических (разные токсиканты-цитостатики) и физических (ионизирующая радиация) факторов на организм и отдельные ткани животных, при этом сочетанное взаимодействие идет по выраженному синергидному типу, когда комбинированное действие двух веществ существенно превосходит простое суммирование действия каждого из факторов по отдельности [Кадиков И.Р. Сочетанное действие диоксидина и Т-2 токсина на организм животных и оценка эффективности лекарственных средств: дисс. канд. биол. наук. - Казань, 2008. - 108 с.].
Противоопухолевый эффект микотоксина Т-2 был отмечен еще в конце прошлого столетия, однако, ввиду высокой токсичности, данный препарат не нашел своего клинического применения. Попытки использовать микотоксин Т-2 в качестве противоопухолевого средства привели к созданию опытного целевого препарата на основе моноклональных антител и микотоксина. Такой конъюгат оказался токсичен в отношении клеток тимомы EL-4 [Anti-tumor activity of T-2 toxin-conjugated monoclonal antibody to murine thymoma / Ohtani K., Murakami H., Shibuya O. et al //Jpn. J. Exp. Med. - 1990. - Vol. 60, №2. - P. 57-65; Ohtani K., Ueno Y. Selective antitumor activity of T-2 toxin-antibody conjugates // Microbial Toxins in Foods and Feeds. - 1990. - P. 403-409].
На основании этого предлагается использовать известные противоопухолевые эффекты микотоксина Т-2 в комбинации с иными противоопухолевыми химиотерапевтическими препаратами, например цисплатином, что позволило бы за счет их синергидного действия повысить эффективность противоопухолевой терапии.
Противоопухолевое действие микотоксина Т-2 изучали на перевиваемой опухоли мышей меланомы В16, входящей в число обязательных моделей опухолей животных, которые используются при отборе новых противоопухолевых веществ [Методические указания по изучению противоопухолевой активности фармакологических веществ / Трещалина Е.М., Жукова О.С., Герасимова Г.К. и др. //Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - 2-изд., перераб. и доп. - М.: Медицина, 2005. - С. 637-651]. Опухолевый штамм был приобретен в Учреждении Российской академии медицинских наук «Российский онкологический научный центр имени Н.Н. Блохина РАМН» г. Москва. В качестве эталонного цитостатика использовали цисплатин - препарат алкилирующего ряда, действие которого основано на алкилировании цепей ДНК в пролиферирующих опухолевых клетках.
При получении микотоксина Т-2 использовали общепринятые методические подходы [Chemical interconversion of Т-2 and НТ-2 toxins and related com-pounds / Wei R.D., Strong F.M., Smalley E.B. et al. // Biochem. Biophys. Res. Commun. - 1971. - Vol. 45. - P. 396-4018; Smalley E.B., Caldwell R.W. New process for T-2 toxin production // Appl. Environ. Microbiol. - 1982. - Vol. 44, №2. - P. 371-375]. В опыте использовали мышей линии C57BL/6 обоего пола, массой 20-25 г. Животные были приобретены в питомнике лабораторных животных Учреждения Российской академии наук «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН» (ИБХ РАН), г. Пущине Опухоль трансплантировали путем подкожного введения в область передней конечности ближе к позвоночнику в объеме 0,2 мл (200 тыс. клеток) на мышь. Для оценки специфического противоопухолевого эффекта препарат микотоксина Т-2 вводили в двух дозировках трехкратно двумя курсами: 5 (1/10 ЛД50) мкг (группа 1) и 10 мкг (1/5 ЛД50) на одно животное (группа 2), трехкратно (через сутки), подкожно, через 48 часов после имплантации опухолевых клеток. Повторный курс введения препарата микотоксина Т-2 по той же схеме проводили через 14 суток.
Изучалась также возможность комбинированного применения микотоксина Т-2 и цисплатина. Препарат микотоксина Т-2 вводили по схеме, аналогичной монотерапии, в дозе 10 мкг (группа 3) и 5 мкг на одно животное (группа 4). Противоопухолевый препарат цисплатин вводили внутрибрюшинно однократно двумя курсами: через 48 часов и 14 суток после имплантации опухолевых клеток. У лабораторных животных в группе 3 препарат цисплатин использовали в дозе 50 мкг, в группе 4-25 мкг на одно животное.
Кроме того, противоопухолевый препарат цисплатин исследовался в качестве монотерапии (группа 5). Животным данной группы препарат вводился также двумя курсами (через 48 часов и 14 суток после имплантации опухолевых клеток), внутрибрюшинно однократно в дозе 50 мкг на мышь. В качестве контрольной группы (группа 6) использовали мышей той же линии без введения исследуемых препаратов.
Противоопухолевый эффект оценивали по следующим общепринятым показателям: торможению роста опухоли (ТРО), увеличению продолжительности жизни (УПЖ) и уровню метастазирования.
Расчет индекса торможения роста опухоли проводили следующим образом. Начиная с 12-14 суток с момента имплантации опухоли, проводили 3 измерения опухолевых узлов - через каждые 5-7 дней (в зависимости от интенсивности опухолевого роста). Для этого с помощью штангенциркуля определяли два размера (длину и ширину) опухолевых узлов. Объем (V, мм3) вычисляли по формуле (1):
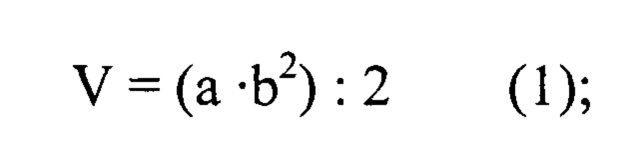
где:
а - длина опухолевого узла, мм,
b - ширина опухолевого узла, мм.
Индекс торможения роста опухоли (ТРО) рассчитывали по формуле (2):
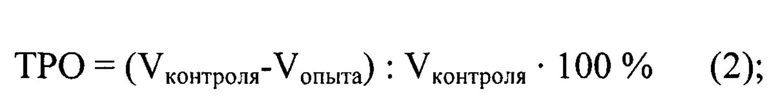
где:
ТРО - индекс торможения роста опухоли, %;
Vконтроля - средний объем опухоли в контрольной группе, мм3;
Vопыта - средний объем опухоли в опытной группе, мм3.
Примечание: эффект считали значимым при значении ТРО≥70%, УПЖ≥25%.
Индекс увеличения продолжительности жизни (УПЖ) рассчитывали по формуле (3):
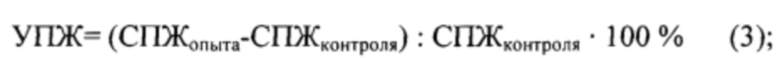
где:
СПЖопыта - средняя продолжительность жизни животных в опытной группе, дни;
СПЖконтроля - средняя продолжительность жизни животных в контрольной группе, дни.
Изучение влияния на метастатическую активность опухоли осуществляли путем оценки доли животных с метастазами в каждой группе. Результаты эксперимента приведены в таблице 1.
Как следует из представленных в таблице данных, во всех экспериментальных группах на все сроки наблюдения отмечается существенное торможение роста опухоли. Монотерапия цисплатином приводит к сокращению размеров опухолевого узла порядка 40%, в то время как в группе животных с монотерапией микотоксином Т-2 индекс ТРО находится в районе 50-70%. С учетом того, что применение микотоксина позволяет добиться увеличения продолжительности жизни лабораторных животных и снижает долю животных с метастазами, необходимо отметить, что эффективность монотерапии препаратом микотоксина Т-2 не только не уступает эффективности монотерапии цисплатином, но и превосходит ее.
Наибольшие значения индекса ТРО наблюдаются в группах сочетанного применения цисплатина и микотоксина Т-2: в зависимости от срока наблюдения он составляет от 78,2% до 87,4%. В данных группах также отмечены наибольшие показатели продолжительности жизни лабораторных животных и наименьшие показатели метастазирования.
Таким образом, применение микотоксина Т-2 как в монотерапии, так и в сочетании с цитостатиком цисплатином ведет к развитию клинически значимого эффекта в отношении опухолевых графтов меланомы В16, что выражается в уменьшении размеров опухолевых узлов, увеличении продолжительности жизни лабораторных животных и снижении метастазирования. Все это позволяет рассматривать микотоксин Т-2 в качестве противоопухолевого препарата и средства для потенцирования противоопухолевого эффекта цисплатина.
Пример 1. Взвесь клеток меланомы В16 в количестве 200 тыс. клеток была введена мыши C57BL/6 в объеме 0,2 мл физиологического раствора хлорида натрия в область правой лопатки. На 18 сутки после перевивки объем опухоли составил 4630 мм2, на 23 сутки - 9800 мм2, на 28 сутки мышь пала. При вскрытии обнаружены метастазы в легких в количестве 9 узлов.
Пример 2. Взвесь клеток меланомы В16 в количестве 200 тыс.клеток была введена мыши C57BL/6 в объеме 0,2 мл физиологического раствора хлорида натрия в область правой лопатки. Через 48 часов после перевивки опухоли мыши ввели 50 мкг цисплатина внутрибрюшинно. В течение 3 суток животное получало по 10 мкг препарата микотоксина Т-2, через 14 дней проведен повторный курс введения микотоксина. На 18 сутки после перевивки объем опухоли составил 792 мм2, на 23 сутки - 1014 мм2, на 28 сутки - 1098 мм2, при вскрытии на 25 сутки в легких обнаружены 3 метастатических узла.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПЕЦИФИЧЕСКАЯ СОЧЕТАННАЯ ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЦИТОСТАТИКОМ И ЕГО МОДИФИКАТОРОМ | 2015 |
|
RU2571551C1 |
| Пептид, обладающий противоопухолевой и антиметастатической активностью, и готовая лекарственная форма на его основе | 2018 |
|
RU2682039C1 |
| Фармацевтическая композиция на основе соединения палладия | 2015 |
|
RU2613305C2 |
| СПОСОБ СОЧЕТАННОГО КОНСЕРВАТИВНОГО ВОЗДЕЙСТВИЯ НА ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ | 2008 |
|
RU2392935C1 |
| СПОСОБ ДОСТИЖЕНИЯ АНТИМЕТАСТАТИЧЕСКОГО ЭФФЕКТА В ЭКСПЕРИМЕНТЕ | 2017 |
|
RU2661704C1 |
| СПОСОБ СОЧЕТАННОЙ ТЕРАПИИ СОЕДИНИТЕЛЬНОТКАННОЙ САРКОМЫ М-1 КРЫС С ИСПОЛЬЗОВАНИЕМ КОНЬЮГАТА ДИПРОПОКСИБАКТЕРИОПУРПУРИНА С ДОКСОРУБИЦИНОМ | 2023 |
|
RU2808909C1 |
| Комбинация дегидроксиметилэпоксихиномицина (DHMEQ) и цитостатиков для лечения рака яичника | 2018 |
|
RU2704020C1 |
| ИММУНОСТИМУЛИРУЮЩИЙ ПРЕПАРАТ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2597837C1 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1996 |
|
RU2114623C1 |
| Средство, обладающее противоопухолевым действием, для лечения онкологических заболеваний | 2018 |
|
RU2761429C2 |
Настоящее изобретение относится к медицине, а именно к онкологии, и касается потенцирования активности цитостатического препарата. В дополнение к цитостатическому препарату цисплатину вводят микотоксин Т-2 в субтоксических дозах. Такое сочетанное введение в условиях эксперимента обеспечивает торможение роста опухоли и снижение метастазирования за счет синергетического действия указанных препаратов. 2 пр., 1 таб.
Способ подавления опухолевого роста путем введения цисплатина, отличающийся тем, что дополнительно для потенцирования цитостатического эффекта вводят микотоксин Т-2 в субтоксических дозах.
| US 4233291 A,11.11.1980 | |||
| МИРОНОВА О.А | |||
| "Морфофункциональные особенности иммунной и сердечно-сосудистой систем у свиней при микотоксикозах" | |||
| Автореферат дис | |||
| к.б.н., 2009, найдено 29.07.2019 в Интернете: |
Авторы
Даты
2020-02-12—Публикация
2017-06-29—Подача