Изобретение относится к медицине, к экспериментальной хирургии и может быть использовано для лечение труднозаживающих гнойных, вялотекущих ран и длительно незаживающих ран.
Гнойные труднозаживающие раны остаются одной из основных проблем в хирургии. В структуре обращаемости к хирургу частота гнойных ран достигает 70%. Используемые методы и средства в лечении обширных гнойных ран не всегда обеспечивают желаемый результат.
В настоящее время существует множество способов лечения инфицированных длительно незаживающих ран, начиная от фармакологических препаратов антисептики, различные мази и заканчивая воздействием на ткань различными видами энергий (гелий-неоновый и углекислотный лазеры, магнитолазерная установка, ультразвуковое излучение, электро и криокоагуляция). Несмотря на изобилие способов лечения данных патологий, проблема лечении гнойных длительно незаживающих ран до сих пор остается актуальной, поскольку все имеющиеся методы лечения не влияют на весь процесс заживления и являются не всегда успешной.
В связи с этим важен поиск новых способов, комбинаций и средств местного лечения, обеспечивающих антимикробный, противовоспалительный и репаративный эффект.
Уровень техники. Известны способы лечения трофических язв с помощью ранозаживляющего препарата милиацил (просяное масло)[1]. Патент РФ №2198702 от 2003 г. авторы: Б.Г. Нузов и О.Б. Нузова [2]. Установлено, что лечебный эффект милиацила обусловлен наличием в нем ряда биологически активных соединений (ненасыщенные жирные кислоты, особенно линолевая и линоленовая, токоферолы и каротиноиды), обладающие антибиотическим действием, ускоряющими метаболические процессы. Применение милиацила при лечении трофических язв приводит к значительному снижению микробной обсемененности, быстрому завершению стадии воспаления, стимулирует репаративные процессы в тканях. Авторы, применявшие милиацил в комплексном лечении трофических язв, отмечают высокую эффективность препарата: сокращаются сроки лечения, сроки подготовки язв к аутодермопластике и конструктивным операциям на венах.
Известен способ с середины 80-х годов в России и в странах Западной Европы успешно применяется комбинированный антимикробный препарат «Банеоцин»[3], в состав которого входят два бактерицидных антибиотика - бацитрацин и неомицин с синергидным действием. Комбинированное воздействие двух местных антибиотиков обеспечивают широкий антимикробный спектр. Две формы выпуска «Банеоцина» позволяют применять его последовательно для лечения различных стадий раневого процесса. При применении «Банеоцина» раневая поверхность быстро очищается от фибрина и некротических тканей, которые размягчаются и приобретают гелеобразную консистенцию, легко удаляемую при туалете язвенной поверхности раны Патент РФ №2539383 от 2015 года[4].
Известны медикаментозные средства местного действия - это препарат «Ацербин» (Acerbine) [5]. «Ацербин» - раствор для наружного применения, в состав которого входят яблочная, бензойная и салициловая кислоты. Препарат обладает антисептическими, анальгетическими и ранозаживляющими свойствами, уменьшает образование экссудата и способствует формированию струпа, грануляций и эпителизации. Яблочная кислота улучшает метаболические процессы и баланс жидкости в области раны. Бензойная кислота имеет антибактериальный эффект. Благодаря своему Ph «Ацербин» предотвращает алкализацию раны, что препятствует инфицированию и стимулирует заживление. «Ацербин» успешно применяют для лечения ожогов, варикозных язв, нагноительных процессов и трофических язв. Лечебная эффективность препарата при трофических язвах обусловлена действием каждого его компонента на раневой процесс Патент РФ №2549459 от 2015 года[6].
Известны исследования роли пептидных факторов роста в лечении труднозаживающих ран, использования рекомбинантных факторов роста для стимуляции заживления трофических язв, резистентных к стандартному лечению. В рандомизированных клинических исследованиях был установлен терапевтический эффект ряда регуляторов, включая эпидермальный фактор роста (EGF)[7], фактор роста тромбоцитов (PDGF)[8] и фактор роста фибробластов 2 (FGF-2) при СДС[9].
Указанные факторы роста способны стимулировать заживление нейропатических язв при условии многократного введения и создания высоких локальных концентраций. Последнее обстоятельство объясняется тем, что при введении в организм пептидные факторы роста быстро разрушаются протеолитическими ферментами, в связи с чем возникла идея введения генов ростовых факторов в геном клеток, присутствующих в зоне язвы или ишемии, для обеспечения постоянной экспрессии и создания концентраций, близких к физиологическим. В качестве «проводников» (векторов) генов предложено использовать бактериальные плазмиды, вирусы, липосомы, наночастицы, метилцеллюлозные диски, коллагеновые гели и повязки[10].
Несмотря на положительные результаты, полученные в отдельных исследованиях, посвященных лечению облитерирующих заболеваний периферических артерий с помощью ангиогенных факторов роста, не выявлено достоверного влияния данного вида лечения на динамику заживления труднозаживающих ран.
Прототип
В восстановительной хирургии наиболее перспективными являются методы лечения аутодермопластикой. В качестве прототипа выбран способ лечения с использованием кожных трансплантантов самого больного. Аутодермопластика марочным методом по Яновичу - Чайскому - Девису. Для такой пересадки иглу вкалывают в кожу и, приподняв последнюю, срезают маленькие кусочки (размером 2-3×4-5 мм). Такие кусочки в центре содержат все слои кожи, а на периферии - только поверхностные. Кусочки кожи укладывают на гранулирующую поверхность в шахматном порядке на расстоянии 2,5-5 мм. Донорские участки накладывают по одному шву на каждый дефект. Схожесть прототипа заключается в том, что наложение фиксирующих повязок, как и в применении композита, укладывают на 5-7 суток. [11]
Недостатком наиболее близкого аналога является, что они зачастую не приводят к желаемым результатам, так как интеграция кожных трансплантатов составляет всего 36,4%. Кроме того, применение аутодермопластики для закрытия раневого дефекта создает дополнительный дефект тканей у больного в области донорской раны. В случае не приживления кожного лоскута в области реципиентной раны у пациента будут как минимум два дефекта мягких тканей, а это ухудшает прогноз лечения.
Новизна исследования заключается в том, что применяют гидроксиапатитколлагеновый композит «ЛитАр» для лечения труднозаживающих гнойных, вялотекущих ран и длительно незаживающих ран. Задачей изобретения является расширение арсенала для способов местного лечения, и композит может быть использован для закрытия обширных гнойных ран.
Раскрытие сущности изобретения
Сущностью изобретения является то, что производят удаления гноя, налетов фибрина и некротических тканей с 3-х по 10-е сутки, при этом используют марлевые повязки с водорастворимой мазью «Офломелид», перед имплантацией гидроксоапатитколлагеновый композит помещают в стерильную чашку Петри, фрагментируют на кусочки, насыщают стерильными раствором NaCl 0,9%, на 10-е сутки в раневое ложе имплантируют гидроксоапатитколлагеновый композит «ЛитАр» из соотношения 1:2 на рассчитываемую площадь раны и накладывают полупроницаемую адгезивную повязку на полимерной основе фирмы Silkofix PU-Ag, смена которых производиться 1 раз в 5 дней.
Осуществление изобретения
Решение задачи достигается способом лечения дефектов раневого ложа включающем следующие действия:
- Производилась хирургическая обработки раны (удаления гноя, налетов фибрина и некротических тканей) с 3-х по 10-е сутки (в первую фазу раневого процесса) использовались марлевые повязки с водорастворимой мазью «Офломелид» (Состав в 1 г мази: офлоксацин -10 мг, метилурацил - 40 мг, лидокаина гидрохлоид - 30 мг).
- После элиминации инфекции с раневой поверхности и очищения раны от некрозов на 10 сутки во вторую фазу раневого процесса выполнялась имплантация в раневой дефект биоразлагаемого гидроксоапатитколлагенового композита «ЛитАр».
Гидроксоапатитколлагеновый композит под названием «ЛитАр» представляет из себя смесь гидроксоапатита и ксеноколлагена с высоким уровнем взаимной структурной интеграции. Данный композит является цитоактивным наноразмерным материалом, предназначенным для восполнения дефектов тканей. Средние размеры кристаллов апатита в материале «ЛитАр» - 43-45 нм. На данный материал выдано регистрационное удостоверение 11 июня 2010 года №ФСР 2010/07994 и сертификат соответствия №9398-001-6493 8703 [12].
Перед имплантацией композит помещают в стерильную чашку Петри (из расчета: композит 10×10 мм на рассчитываемую площадь раневого ложа 20×20 мм, т.е. 1:2) фрагментирует на мелкие кусочки, насыщали стерильным раствором NaCl 0,9%. Содержимое имплантируют в раневое ложе и накладывается полупроницаемая адгезивная повязка на полимерной основе (фирмы Silkofix PU-Ag), смена которых производится 1 раз в 5 дней.
Основанием для предлагаемого способа являются результаты экспериментального исследования. С целью сравнения применения различных способов лечения труднозаживающих ран, были выполнены эксперименты на животных.
На 100 половозрелых крысах-самцах линии Wistar массой 180-200 гр. создавали модель кожно-мышечной гнойной раны путем иссечения по трафарету в межлопаточной области подкожно-жировой клетчатки прямоугольной формы с размерами сторон 20×20 мм (что составляло примерно 10% от всего кожного покрова крысы). Края раны и подлежащие мышцы раздавливались зажимами, рана инфицировалась микробной взвесью Staphylococcus aureus в концентрации 107, края раны фиксировались на дюралюминиевой рамке. Сверху рамки рана герметично закрывалась целлофановой пленкой и скотчем, для создания парникового эффекта.[13] Для инфицирования раны использовали штамм Staphylococcus aureus №251LEM, обладающий гемолитической, плазмокоагулазной, фибринолитической и лецитоветиллазной активностью, резистентный к пенициллину (минимальная подавляющая концентрация(МПК) 1,5 мг/л), чувствительный к оксациллину (МПК 1,0 мг/мл), клиндамицину (МПК 0,5 мг/л), офлоксацину (МПК 1,0 мг/л), левофлоксацину (МПК 1,0 мг/л), доксициклину (МПК 2,0 мг/л), кларитромицину (МПК 2,0 мг/л), фузидину (МПК 1 мг/мл), ванкомицину (МПК 1,0 мг/мл), гентамицину (МПК 4,0 мг/л), рифампицину (МПК 1,0 мг/л).
Экспериментальные животные были разделены на 4 группы (по 25 животных в каждой). Все операции выполнялись под эфирным наркозом, из опыта животные выводились передозировкой наркозных средств на 3, 7, 14, 21 и 28 сутки, (по 5 крыс на каждом сроке).
Местное лечение гнойных ран животных 2, 3, и 4 групп начинали на 3 сутки от момента нанесения раны и развития гнойного процесса.
Животные первой группы служили контролем, медикаментозного лечения не получали.
При лечении животных второй группы использовались только мазевые повязки («Офломелид» содержание в 1 г мази: офлоксацин - 10 мг, метилурацил - 40 мг, лидокаина гидрохлоид - 30 мг).
Животным третьей группы в период с 3-го по 10-е сутки проводили такое же лечение, как и у животных второй группы. Далее производилась аутодермопластика для сравнения со способом прототипа во II-ую фазу пролиферации на 10-е сутки эксперимента, так как рана полностью очищалась от некротической ткани, снижался воспалительный процесс, раневое ложе полностью выстилается грануляционной тканью и на начало второй недели эксперимента существенно снижается бактериальная обсемененность и накладывались фиксирующие повязки, смена которых выполнялась через 5-7 суток, затем каждые два дня. Участок донорского трансплантата брался в зоне бедра. В первые трое суток после аутодермопластики выполнялось парентеральное введение антибиотика (Офлоксацина 0,2% в дозировке 1,5 мл).
У животных 4-й группы после произведенной хирургической обработки раны (удаления гноя, налетов фибрина и некротических тканей) с 3-х по 10-е сутки в I фазу раневого процесса (фаза воспаления) использовались марлевые повязки с водорастворимой мазью «Офломелид».
После элиминации инфекции с раневой поверхности и очищения раны от некрозов на 10-е сутки животным производилась имплантация в раневой дефект биоразлогаемого гидрооксоапатитколлагенового композита «ЛитАр». Извлечение упакованного в полиэтилен материала производили после вскрытия пакета стерильным инструментом (пинцетом) непосредственно перед имплантацией. Композит фрагментировали на мелкие кусочки размером не более 2×2 мм, после помещали в стерильную чашку Петри, насыщали композит стерильным физиологическим раствором. «Лит-Ар» поглощает жидкость, расширяется в два раза и полностью заполняет раневой дефект. Рана закрывалась двойной повязкой на полимерной основе, смена которых производилась раз в 5-7 дней.
Полученные результаты свидетельствуют о следующем. При гистологическом исследовании выявлено, что инфицирование микробной взвесью Staphylococcus aureus в концентрации 107 приводит к возникновению гнойно-воспалительного процесса в коже и прилежащих мышцах у всех экспериментальных животных. Лейкоцитарная инфильтрация представлена в эти сроки в основном нейтрофилами.
У животных первой группы, которым лечение не проводилось, полная эпителизация кожного дефекта к 28 суткам эксперимента так и не произошла. В ране по результатам посева сохранялся воспалительный процесс вплоть до 21 суток, (из 25 животных этой группы погибло 6)
У животных второй группы при консервативном стандартном лечении мазью «Офломелид», на протяжении всего лечения наблюдалась умеренная лейкоцитарная инфильтрация на фоне отека и паранекротических изменений тканевых элементов. В результате умеренной синтетической активности фибробластов на 28 сутки после операции формируется грубая фиброзная ткань на месте раны при этом полной эпителизации раневой поверхности не отмечается, (из 25 животных этой группы погибло 2) На фоне процессов пролиферации, цитодифференецировки и синтетической активности фибробластов отмечается снижение лейкоцитарной инфильтрации, определялось большое количество фибробластов и макрофагов, количество нейтрофилов снижалось с 14 по 28 сутки (Рис. 1).
У животных третьей группы (которым проводили аутодермопластику), при выполнении аутодермопластики на 7-10-е сутки после трансплантации в пересаженном кожном лоскуте наблюдалась выраженная диффузная лейкоцитарная инфильтрация на фоне отека и паранекротических изменений всех тканевых элементов, на 21 сутки после операции формируется грубая фиброзная ткань, на месте рубца, (из 25 животных этой группы погибло 4) В третье группе отмечалось значительное количество деструктивных лейкоцитов, по сравнению с животными 4-й группе, где применялся композит. Морфологическая картина свидетельствовала о нарушении приживания трансплантированного фрагмента кожи (Рис. 2).
Среди животных 4-й группы не наблюдалось гибели. Начиная с 14-х суток эксперимента (10-е сутки с начала лечения) лейкоцитарная инфильтрация снижается, изменяется и ее качественная характеристика, к 21 суткам доля нейтрофилов снижается, при этом увеличивается содержание лимфоцитов. Композитный материал заполняет всю раневую поверхность. В результате пролиферации малодифференцированных фибробластов
количество клеток фибробластического дифферона в области раны возрастает. В результате цитодифференцировки и активной синтетической деятельности фибробластов в области раны повышается содержание компонентов межклеточного вещества соединительной ткани (коллагеновых волокон и основного аморфного вещества). Следует отметить, что наиболее выраженная синтетическая активность фибробластов наблюдается у животных 4-й группы, при лечении которых использовали гидроксиапатитколлагеновый композитный материал «ЛитАр» для закрытия остаточной полости. При этом наиболее активной синтетическая деятельность фибробластов отмечалась в период 2-й - 3-й недель эксперимента.
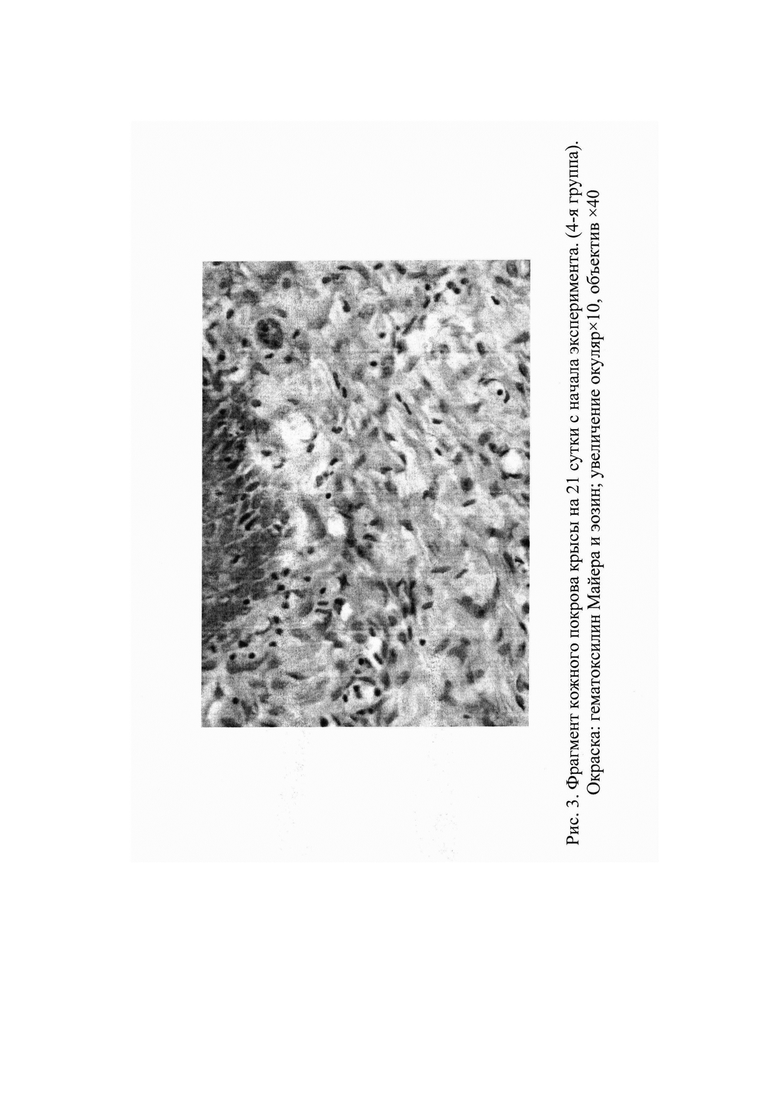
Во вновь образованной соединительной ткани в раневом ложе материала «ЛитАр» наблюдается новообразование кровеносных сосудов. Активизация пролиферации, цитодифференцировки и синтетической активности фибробластов, а также новообразование сосудов в зоне данного композитного материала может свидетельствовать о наличии у этого материала свойств индукции ангиогенеза и стимуляции гистиотипической репаративной регенерации. На фоне формирования новой соединительной ткани с 14 суток отмечается биодеградация композитного материала «ЛитАр», которая полностью завершается к концу первого месяца. На 21 сутки наблюдается практически полное закрытие раневого дефекта (Рис. 3).
Мы получили значительные морфологические отличия в динамике и характере раневого процесса у животных разных групп. Пролиферативная активность эпителия (на основе учета митотической активности и экспрессии белка Ki67) у животных четвертой группы была выше, чем у животных предыдущих групп. Подсчет лейкоцитов в формирующейся соединительной ткани показал, что при использовании биокомпозита «ЛитАр» содержание лейкоцитов в формирующейся соединительной ткани существенно снижено, в сравнении с экспериментом по лечению только мазями на водорастворимой основе и выполнения аутодермопластики.
При бактериологическом исследовании раневого отделяемого экспериментальных животных четвертой группы было установлено, что с 3 по 14 сутки эксперимента уровень бактериальной обсемененности S. aureus постепенно снижался от 106 до 102 КОЕ/мл. Наиболее длительный период снижения этого показателя был характерен для животных контрольной группы, не получавших лечения. У животных, получавших местную антибактериальную терапию, снижение уровня бактериальной обсемененности S. aureus до уровня ниже 105 КОЕ/мл, что значительно ниже, чем при активно протекающем гнойном процессе происходило быстрее (к седьмым суткам).
Технический результат. Полученные результаты свидетельствуют о том, что в сравнении со способами включающих антибактериальные препараты и способами хирургического лечения, использование композитного материала «ЛитАр» эффективно активирует процессы пролиферации и дифференцировки эпителия и малодифференцированных клеточных элементов фибробластического дифферона, что приводит к более быстрой и полной ликвидации раневого дефекта. При использовании гидроксиапатитколлагенового композитного материала отмечается более раннее формирование малодифференцированной соединительной ткани в области композитного материала и интенсивный ангиогенез, а также более полное эпителизация раны. Полученные результаты свидетельствуют об оптимизирующем воздействии гидроксоапатитколлагенового композита на репаративные процессы в эпителии и соединительной ткани кожи. Максимальный срок биодеградации «ЛитАра» составляет не более 20 сут, преимуществом композита является отсутствие опасности заражения ВИЧ и гепатитов, возможность инъекционного введения, он не поддерживает инфекционный процесс в ране из-за высокого содержания солевого компонента (80-85%), он не требует моделирования в ране, длительный срок годности (5 лет) и удобство хранения.
В данном методе необходимо использовать адгезивную повязку на полимерной основе, которая не позволяет высыхать композиту, а при смене повязки имплантат не смещается и не травмирует края раны. Таким образом, предложенный способ позволяет использовать композитный биодеградируемый материала «ЛитАр» для пластики кожного дефекта обширной гнойной раны стимулировать репарацию, ангиогенез, пролиферацию и цитодифференцировку клеточных элементов. Тем самым достигнуто укорочение сроков регенерации раневого дефекта труднозаживающей раны. Так же данный метод лечения позволяет отказаться от аутодермопластики и нанесения донорских кожных дефектов. В показанном способе лечения использовались только отечественные медицинские материалы и препараты, прошедшие необходимую регистрацию. Предложенный способ лечения комплаентен в использовании и возможно применять его в условиях дневного стационара и даже в амбулаторных условиях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ НЕЙРОПАТИЧЕСКИХ ТРОФИЧЕСКИХ ЯЗВ ПРИ СИНДРОМЕ ДИАБЕТИЧЕСКОЙ СТОПЫ | 2013 |
|
RU2549459C2 |
| СПОСОБ ПОДГОТОВКИ ТРОФИЧЕСКИХ ЯЗВ К АУТОДЕРМОПЛАСТИКЕ | 2001 |
|
RU2198702C1 |
| СПОСОБ ЛЕЧЕНИЯ ДЛИТЕЛЬНО НЕЗАЖИВАЮЩИХ РАН У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ | 2008 |
|
RU2358757C1 |
| СПОСОБ РАНЕВОГО ДИАЛИЗА ГНОЙНЫХ РАН ПРИ САХАРНОМ ДИАБЕТЕ 2 ТИПА | 2011 |
|
RU2454187C1 |
| Способ закрытия дефектов вялотекущих ран нижних конечностей при синдроме диабетической стопы | 2015 |
|
RU2608431C1 |
| ФЕРМЕНТНЫЙ РАНОЗАЖИВЛЯЮЩИЙ ПРЕПАРАТ | 2011 |
|
RU2484811C2 |
| СРЕДСТВО ДЛЯ ЗАМЕСТИТЕЛЬНОЙ КЛЕТОЧНОЙ ТЕРАПИИ | 2007 |
|
RU2342163C1 |
| СПОСОБ ЛЕЧЕНИЯ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ У БОЛЬНЫХ С СИНДРОМОМ ДИАБЕТИЧЕСКОЙ СТОПЫ | 2016 |
|
RU2619257C1 |
| СРЕДСТВО ДЛЯ ЗАЖИВЛЕНИЯ РАН "ЦЕЛЛЬГЕЛЬ", СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ РАН РАЗЛИЧНОЙ ЭТИОЛОГИИ ПОЛУЧЕННЫМ СРЕДСТВОМ | 2011 |
|
RU2481115C1 |
| СПОСОБ КОЖНОЙ ПЛАСТИКИ | 2006 |
|
RU2311878C1 |


Изобретение относится к медицинской технике, а именно к способу лечения труднозаживающих ран в эксперименте путем наложения противоспалительной повязки. В способе производят удаления гноя, налетов фибрина и некротических тканей с 3-х по 10-е сутки. Используют марлевые повязки с водорастворимой мазью «Офломелид». Перед имплантацией гидроксоапатитколлагеновый композит помещают в стерильную чашку Петри, фрагментируют на кусочки, насыщают стерильными раствором NaCl 0,9%. На 10-е сутки в раневое ложе имплантируют гидроксоапатитколлагеновый композит «ЛитАр» из соотношения 1:2 на рассчитываемую площадь раны и накладывают полупроницаемую адгезивную повязку на полимерной основе фирмы Silkofix PU-Ag, смена которой производится 1 раз в 5 дней. Техническим результатом является более раннее формирование малодифференцированной соединительной ткани в области композитного материала и интенсивный ангиогенез. 3 ил.
Способ лечения труднозаживающих ран в эксперименте путем наложения противоспалительной повязки, отличающийся тем, что производят удаления гноя, налетов фибрина и некротических тканей с 3-х по 10-е сутки, при этом используют марлевые повязки с водорастворимой мазью «Офломелид», перед имплантацией гидроксоапатитколлагеновый композит помещают в стерильную чашку Петри, фрагментируют на кусочки, насыщают стерильными раствором NaCl 0,9%, на 10-е сутки в раневое ложе имплантируют гидроксоапатитколлагеновый композит «ЛитАр» из соотношения 1:2 на рассчитываемую площадь раны и накладывают полупроницаемую адгезивную повязку на полимерной основе фирмы Silkofix PU-Ag, смена которой производиться 1 раз в 5 дней.
| "Использование композитного материала ЛитАр для коррекции остаточных полостей печени" Третьяков А.А | |||
| и др | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| СПОСОБ ПОДГОТОВКИ ОБШИРНЫХ ТРУДНОЗАЖИВАЮЩИХ РАН К ДЕРМОПЛАСТИКЕ | 2009 |
|
RU2404817C1 |
| RU 420237 C1, 10.06.2011 | |||
| СПОСОБ ЛЕЧЕНИЯ КИСТ МОЛОЧНЫХ ЗУБОВ | 2001 |
|
RU2204337C2 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
Авторы
Даты
2020-02-25—Публикация
2019-02-28—Подача