ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0001] Семейство транспортеров (переносчиков) растворенных веществ (сокращенно - SLC) включает более чем 300 генов, кодирующих мембранные транспортные белки, разбитое на десятки подсемейств. Подсемейство SLC1A включает транспортную систему ASC, которая служит посредником при натрий-зависимом переносе нейтральных аминокислот в клетках позвоночных. Аланин, серин и цистеин являются предпочтительными субстратами в системе ASC. Были идентифицированы два подтипа системы ASC - транспортер 1 ASC (ASCT1, также известный как SLC1A4) и транспортер 2 ASC (ASCT2, также известный как SLC1A5).
[0002] ASCT2 представляет собой 541-аминокислоту - многопроходный мембранный белок с восемью трансмембранными доменами. Молекулярная масса ASCT2 варьируется от 55-75 кД в зависимости от различных профилей гликозилирования. Дополнительно к переносу L-аланина, L-серина и L-цистеина ASCT2 также переносит L-треонин и L-глутамин. Помимо этого, ASCT2 действует в качестве рецептора клеточной поверхности, который совместно используется ретровирусом типа D обезьян и вирусами типа C.
[0003] О наблюдаемой сверхэкспрессии ASCT2 сообщалось при различных онкологических заболеваниях, включая рак ободочной и прямой кишки, плоскоклеточную карциному головы и шеи (HNSCC), рак простаты, рак легкого, рак поджелудочной железы и гемобластозы, такие как миелома и лимфома. Сверхэкспрессия ASCT2, которую оценивают по иммунногистохимическим анализам (IHC), говорит о плохом прогнозе при различных онкологических заболеваниях, включая рак ободочной и прямой кишки, рак простаты, рак легкого и рак поджелудочной железы (K. Kaira, et al. (2015) Histopathology; Shimizu, et al. (2014) BJC; D. Witte, et al. (2002) Anticancer Research; R. Li, et al. (2003) Anticancer Research). Сообщалось, что ASCT2 является одним из драйверов сигнального пути мишени для рапамицина у млекопитающих (mTOR) и, вследствие этого, роста опухоли (Nicklin P. et al. (2009) Cell).
[0004] Нагруженные лекарственным средством антитела (ADC) представляют собой новый перспективный подход в терапии для более эффективного лечения рака, уменьшая при этом обусловленное лекарственным средством токсическое действие за счет объединения специфичности антитела с действенностью цитотоксических малых молекул или токсинов. ADC может включать в себя цитотоксин, который может быть малой молекулой, химически модифицированной так, чтобы она содержала линкерную группу. Линкерная группа затем используется для присоединения (конъюгирования) цитотоксина к антителу или его антиген-связывающему фрагменту. Цитотоксичность проявляется, когда ADC связывается с поверхностью антигена целевой клетки-мишени, поглощается и переносится в лизосому, где токсин высвобождается в результате либо протеолиза расщепляемой линкерной группы (например, с помощью катепсина В, находящегося в лизосоме), или в результате протеолитического расщепления антитела, если для присоединения цитотоксина к антителу используется нерасщепляемая линкерная группа. Цитотоксин затем перемещается из лизосомы в цитозоль, где он может связываться со своей мишенью в зависимости от ее механизма действия. Обычно эти цитотоксины вызывают остановку клеточного цикла, что впоследствии приводит к апоптозу. Соответствующие конъюгаты, содержащие визуализирующие средства, также представляют собой новое перспективное направление для выявления раковых клеток in vivo или in vitro.
[0005] В данном раскрытии предложены молекулы, которые специфично связываются с ASCT2, и способы применения таких молекул, например, для определения ASCT2, доставки гетерологичного средства в клетку или для лечения болезни или расстройства, характеризующихся свехэкспрессией ASCT2, например, онкологического заболевания. В данном раскрытии предложены антитела к ASCT2, конъюгированные с цитотоксическим лекарственным средством, таким как производное тубулизина или пирролобензодиазепин (анти-ASCT2-ADC). Антитела данного изобретения полезны для лечения заболевания или расстройства, характеризующихся сверхэкспрессией ASCT2, например, онкологического заболевания. В качестве примера изобретателями было показано, что анти-ASCT2 ADC вызывают регрессию опухоли в ксеногенной мышиной модели человеческих рака ободочной и прямой кишки и рака головы и шеи.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] Некоторые из основных аспектов настоящего изобретения сформулированы ниже. Дополнительные аспекты описаны в разделах подробного описания изобретения, примеров, графических материалов и формулы изобретения этого раскрытия. Описание в каждом разделе этого раскрытия предназначено для рассмотрения совместно с другими разделами. Кроме того, различные варианты осуществления, описанные в каждом разделе этого раскрытия, могут быть объединены различными способами, и все такие комбинации предназначены входить в объем настоящего изобретения.
[0007] В данном раскрытии предложены ASCT2-связывающие молекулы, например, антитела к ASCT2 или их антиген-связывающие фрагменты, например, моноклональные антитела, способные связываться с ASCT2. В некоторых аспектах связывающая молекула конъюгирована со средством, таким как цитотоксин.
[0008] В некоторых случаях выделенная связывающая молекула или ее антиген-связывающий фрагмент, которые специфично связываются с эпитопом ASCT2, специфично связываются с тем же эпитопом ASCT2, что и антитело или его антиген-связывающий фрагмент, которые содержат вариабельный участок тяжелой цепи (VH) и вариабельный участок легкой цепи (VL) в 17c10 или 1e8.
[0009] В некоторых случаях VH в 17c10 содержит SEQ ID NO: 1 или SEQ ID NO: 5, а VL в 17c10 содержит SEQ ID NO: 2 или SEQ ID NO: 6.
[0010] В некоторых случаях VH в 1e8 содержит SEQ ID NO: 3 или SEQ ID NO: 7, а VL в 1e8 содержит SEQ ID NO: 4 или SEQ ID NO: 8.
[0011] В некоторых случаях выделенная связывающая молекула или ее антиген-связывающий фрагмент, которые специфично связываются с ASCT2, содержат VL антитела, где VL содержит аминокислотную последовательность по меньшей мере на 85%, 90%, 95% или 100% идентичную эталонной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 и SEQ ID NO: 8.
[0012] В некоторых случаях выделенная связывающая молекула или ее антиген-связывающий фрагмент, которые специфично связываются с ASCT2, содержат VН антитела, где VН содержит аминокислотную последовательность по меньшей мере на 85%, 90%, 95% или 100% идентичную эталонной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
[0013] В некоторых случаях выделенная связывающая молекула или ее антиген-связывающий фрагмент, которые специфично связываются с ASCT2, конъюгированы со средством, выбранным из группы, состоящей из противомикробного средства, терапевтического средства, пролекарства, пептида, белка, фермента, липида, модификатора биологического ответа, фармацевтического средства, лимфокина, гетерологичного антитела или его фрагмента, детектируемой метки, полиэтиленгликоля (PEG) и комбинации двух или более из любых указанных средств.
[0014] В некоторых случаях выделенная связывающая молекула или ее антиген-связывающий фрагмент, которые специфично связываются с ASCT2, конъюгированы с цитотоксином. В определенных вариантах осуществления цитотоксин выбирают из группы, состоящей из AZ1508, SG3249 и SG3315.
[0015] В некоторых случаях связывающая молекула или ее антиген-связывающий фрагмент включают в себя антитело или его антиген-связывающий фрагмент.
[0016] В некоторых случаях выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с ASCT2, содержат VH и VL, где VH и VL содержат, соответственно, аминокислотные последовательности по меньшей мере на 85%, 90%, 95% или 100% идентичные эталонным аминокислотным последовательностям, выбранным из группы, состоящей из SEQ ID NO: 1 и SEQ ID NO: 2; SEQ ID NO: 3 и SEQ ID NO: 4; SEQ ID NO: 5 и SEQ ID NO: 6; и SEQ ID NO: 7 и SEQ ID NO: 8. В некоторых случаях VH содержит аминокислотную последовательность SEQ ID NO: 5, а VL содержит аминокислотную последовательность SEQ ID NO: 6. В некоторых случаях VH содержит аминокислотную последовательность SEQ ID NO: 7, а VL содержит аминокислотную последовательность SEQ ID NO: 8.
[0017] В некоторых случаях антитело или его антиген-связывающий фрагмент содержат константный участок тяжелой цепи или его фрагмент. В некоторых случаях константный участок тяжелой цепи или его фрагмент представляют собой константный участок IgG. В некоторых случаях константный участок IgG содержит аминокислотную последовательность SEQ ID NO: 9. В некоторых случаях константный участок IgG представляет собой константный участок IgG1 человека.
[0018] В некоторых случаях антитело или его антиген-связывающий фрагмент содержат константный участок легкой цепи, выбранный из группы, состоящей из константного участка каппа-цепи человека и константного участка лямбда-цепи человека.
[0019] В некоторых случаях антитело или его антиген-связывающий фрагмент представляют собой мышиное антитело, гуманизированное антитело, химерное антитело, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, полиспецифичное антитело или их антиген-связывающий фрагмент. В некоторых случаях антиген-связывающий фрагмент представляет собой Fv, Fab, F(ab')2, Fab', dsFv, scFv и sc(Fv)2.
[0020] В некоторых случаях антитело или его антиген-связывающий фрагмент могут связываться с человеческим ASCT2 и ASCT2 макаки-крабоеда (cyno).
[0021] В некоторых случаях антитело или его антиген-связывающий фрагмент специфично не связываются с человеческим ASCT1.
[0022] В некоторых случаях антитело или его антиген-связывающий фрагмент конъюгированы со средством, выбранным из группы, состоящей из противомикробного средства, терапевтического средства, пролекарства, пептида, белка, фермента, липида, модификатора биологического ответа, фармацевтического средства, лимфокина, гетерологичного антитела или его фрагмента, детектируемой метки, PEG и комбинации двух или более из любых указанных средств.
[0023] В некоторых случаях антитело или его антиген-связывающий фрагмент конъюгированы с цитотоксином. В определенных вариантах осуществления цитотоксин выбирают из группы, состоящей из AZ1508, SG3249 и SG3315.
[0024] В некоторых случаях изобретение предоставляет изолированный полинуклеотид или комбинацию полинуклеотидов, которые содержат нуклеиновую кислоту, кодирующую связывающую молекулу или ее фрагмент, как описано в данном документе. В некоторых случаях изобретение предоставляет изолированный полинуклеотид или комбинацию полинуклеотидов, которые содержат нуклеиновую кислоту, кодирующую антитело или его антиген-связывающий фрагмент, как описано в данном документе.
[0025] В некоторых случаях изобретение предоставляет вектор, содержащий описанный в данном документе полинуклеотид. В некоторых случаях полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VH, и полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VL, содержатся в одном и том же векторе. В некоторых случаях полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VH, и полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VL, содержатся в разных векторах.
[0026] В некоторых случаях изобретение предоставляет композицию, содержащую (i) связывающую молекулу или ее фрагмент, как описано в данном документе, и (ii) носитель. В некоторых случаях изобретение предоставляет композицию, содержащую (i) антитело или его антиген-связывающий фрагмент, как описано в данном документе, и (ii) носитель. В некоторых случаях изобретение предоставляет композицию, содержащую (i) нуклеиновую кислоту, кодирующую антитело или его антиген-связывающий фрагмент, как описано в данном документе, и (ii) носитель. В некоторых случаях изобретение предоставляет композицию, содержащую (i) вектор, как описано в данном документе, и (ii) носитель. В некоторых аспектах носитель представляет собой фармацевтически приемлемый носитель.
[0027] В некоторых случаях изобретение предоставляет клетку-хозяина, содержащую полинуклеотид, как описано в данном документе, вектор, как описано в данном документе, или композицию, как описано в данном документе.
[0028] В некоторых случаях изобретение предоставляет способ получения связывающей молекулы или ее фрагмента, как описано в данном документе, при этом способ включает в себя (a) культивирование клетки-хозяина, как описано в данном документе; и (b) выделение связывающей молекулы или фрагмента. В некоторых случаях изобретение предоставляет способ получения антитела или антиген-связывающего фрагмента, как описано в данном документе, при этом способ включает в себя (a) культивирование клетки-хозяина, как описано в данном документе; и (b) выделение антитела или антиген-связывающего фрагмента.
[0029] В некоторых случаях изобретение предоставляет диагностический реагент или набор, включающий связывающую молекулу или ее фрагмент, как описано в данном документе, или антитело или его антиген-связывающий фрагмент, как описано в данном документе.
[0030] В некоторых случаях способ доставки средства к экспрессирующей ASCT2 клетке включает в себя приведение в контакт клетки со связывающей молекулой или фрагментом, конъюгированными со средством, как описано в данном документе, или антителом или его антиген-связывающим фрагментом, конъюгированными со средством, как описано в данном документе, при этом средство поглощается клеткой. В некоторых случаях средство можно выбрать из группы, состоящей из противомикробного средства, терапевтического средства, пролекарства, пептида, белка, фермента, липида, модификатора биологического ответа, фармацевтического средства, лимфокина, гетерологичного антитела или его фрагмента, детектируемой метки, PEG и комбинации двух или более из любых указанных средств. В некоторых случаях средство может представлять собой цитотоксин.
[0031] В некоторых случаях способ, вызывающий гибель экспрессирующей ASCT2 клетки, включает в себя приведение в контакт клетки со связывающей молекулой или фрагментом, конъюгированными с цитотоксином, как описано в данном документе, или антителом или его антиген-связывающим фрагментом, конъюгированными с цитотоксином, как описано в данном документе, при этом цитотоксин поглощается клеткой. В предпочтительном варианте осуществления цитотоксин выбирают из группы, состоящей из AZ1508, SG3249 и SG3315.
[0032] В некоторых случаях способ лечения заболевания или расстройства, характеризующихся сверхэкспрессией ASCT2, например, онкологического заболевания, у субъекта включает в себя введение субъекту, нуждающемуся в лечении, эффективного количества связывающей молекулы или фрагмента, как описано в данном документе, или антитела или его антиген-связывающего фрагмента, как описано в данном документе, или композиции, как описано в данном документе.
[0033] В некоторых случаях способ лечения заболевания или расстройства, характеризующихся сверхэкспрессией ASCT2, например, онкологического заболевания, включает широкий спектр онкологических заболеваний от солидных опухолей до гематологических онкологических заболеваний. Такой широкий спектр эффективного действия для способов лечения необычен и достаточно неожидан. Помимо широкого спектра действия, продемонстрированного для солидных опухолей и гематологических онкологических заболеваний, описанное в данном документе изобретение можно использовать в способах выявления наличия раковых стволовых клеток (CSC) и способах лечения, ассоциированных с CSC, что дополнительно подтверждает широту использования и неожиданный эффект от описанного в данном документе изобретения.
[0034] В некоторых случаях онкологическое заболевание выбрано из группы, состоящей из рака ободочной и прямой кишки, HNSCC, рака простаты, рака легкого, рака поджелудочной железы, меланомы, рака эндометрия и гемобластоза (острого миелоидного лейкоза (AML), множественной миеломы (MM), диффузной крупноклеточной B-клеточной лимфомы (DLBCL)). Кроме того, способы включают в себя лечение, основанное на целенаправленном воздействии на CSC. Предпочтительно, чтобы субъектом являлся субъект-человек.
[0035] В некоторых случаях способ определения уровня экспрессии ASCT2 в образце включает в себя (a) приведение в контакт указанного образца со связывающей молекулой или фрагментом, как описано в данном документе, или антителом или антиген-связывающим фрагментом, как описано в данном документе, или композицией, как описано в данном документе, и (b) обнаружение связывания связывающей молекулы или ее фрагмента или антитела или его антиген-связывающего фрагмента с ASCT2 в указанном образце. В некоторых случаях образец представляет собой клеточную культуру. В некоторых случаях образец представляет собой отдельную ткань. В некоторых случаях образец взят у субъекта, предпочтительно - субъекта-человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ/ФИГУР
[0036] На ФИГ. 1A приведены количественные данные анализов проточной цитометрии, которые демонстрируют высокий уровень экспрессии ASCT2 в костномозговых пунктатах из образцов AML и MM в сравнении с костным мозгом из образцов здоровой ткани.
[0037] На ФИГ. 1B показан высокий уровень экспрессии ASCT2 в популяции CD34+/CD38+ - сообщаемых маркерах, определяющих популяцию лейкемических стволовых клеток (LSC). Дополнительно уровни экспрессии ASCT2 оценивали во всех других подтипах, таких как популяции CD34+CD38-, CD34+CD38+ и CD34-CD38+.
[0038] На ФИГ. 1C показана экспрессия ASCT2 в клетках плазмы (PC; CD138+/CD19 ) и стволовых клетках (SC; CD138-/CD19+) из образцов MM.
[0039] На ФИГ. 1D показана экспрессия ASCT2, которую оценивали в клеточной популяции EpCAM+/CD24+/CD44+ - сообщаемых маркерах CSC поджелудочной железы. Результаты анализа проточной цитометрии указывают на высокий уровень экспрессии ASCT2 в CSC опухолей поджелудочной железы.
[0040] На ФИГ. 1E показано удаление популяции CSC (EpCAM+/CD24+/CD44+) в опухолях поджелудочной железы после обработки с использованием ASCT2-PBD ADC (антитело 17c10 конъюгировано с SG3249) in vivo.
[0041] На ФИГ. 2 приведен график, показывающий во сколько раз изменяется связывающая активность очищенных человеческих анти-ASCT2 IgG - 1e8, 3f7, 5a2, 9b3, 10c3, 16b8, 17c10 и 17a10 - по отношению к 293F клеткам, трансфицированным плазмидой, экспрессирующей человеческий ASCT2.
[0042] На ФИГ. 3A приведена гистограмма относительной жизнеспособности клеток 293F, экспрессирующих ASCT2, обработанных отрицательным контрольным веществом (необработанных); обработанных первичными антителами к ASCT2-1e8 и 17c10; обработанных антителом к ASCT2, конъюгированным с сапорином; или обработанных контрольным антителом, связанным с сапорином (hIgG-сапорин) по отношению к необработанным контрольным клеткам.
[0043] На ФИГ. 3B приведен график цитотоксичности анти-ASCT2 1 E8, анти-ASCT2 17C10 и изотипического контроля R347, классически конъюгированных с тубулизином AZ1508 в Sw48 клетках.
[0044] На ФИГ. 4 приведена гистограмма, показывающая связывание антител к ASCT2-17c10 и 1e8 - с клетками WiDr или клетками WiDr с нокдауном shРНК экспрессии ASCT2 согласно результатам проточной цитометрии.
[0045] На ФИГ. 5A приведена кинетика поглощения антитела к ASCT2 17c10 и изотипического контроля.
[0046] На ФИГ. 5B приведена кинетика поглощения ASCT2-ADC (антитела 17c10, конъюгированного с AZ1508), измеренная по уровню цитотоксического лизиса. Клетки импульсно обрабатывали, используя ASCT2-ADC (17c10-AZ1508), в течение соответствующих периодов времени. После этого содержащую ADC среду заменяли свежей средой и продолжали инкубировать в течение 4 дней. Жизнеспособность клеток измеряли, используя набор CTG Kit. Кривые зависимости эффекта от дозы строили в виде процентной доли от необработанных контрольных клеток.
[0047] На ФИГ. 6A-ФИГ. 6H приведены цитометрические кривые, полученные в результате связывания антител к ASCT2-17c10 и 1e8 - и изотипического контроля R347 с ASCT2-экспрессирующими клеточными линиями. ФИГ. 6A - клеточная линия Cal27 рака человека; ФИГ. 6B - клеточная линия FaDu рака человека; ФИГ. 6C - клеточная линия SSC15 рака человека; ФИГ. 6D - клеточная линия WiDr рака человека; ФИГ. 6E - клетки CHOK1, стабильно экспрессирующие ASCT2 человека; ФИГ. 6F - клетки CHOK1, стабильно экспрессирующие ASCT2 макаки-крабоеда; ФИГ. 6G - клеточная линия CynoMK1 рака макаки-крабоеда; и ФИГ. 6H ложно-трансфицированные клетки CHOK1.
[0048] На ФИГ. 7A показано, что связывание антитела к ASCT2-17c10 - с клетками SKMEL-2 не изменялось под действием ASCT1 shРНК, в то время как связывание значительно уменьшалось после ASCT2-специфичного нокдауна shРНК.
[0049] На ФИГ. 7B показано, что цитотоксический лизис под действием ADC антитела к ASCT2 (антитела 17c10, конъюгированного с AZ1508) не изменялся после нокдауна shРНК ASCT1, в то время как подавление экспрессии shРНК ASCT2 приводило к значительному снижению цитотоксического лизиса. Данные по всем группа с нокдауном shРНК нормализовали относительно необработанных контролей.
[0050] На ФИГ. 8A и ФИГ. 8B показан цитотоксический эффект антител к ASCT2-17c10 (ФИГ. 8A) и 1e8 (ФИГ. 8B), конъюгированных с тубулизином 1508, по отношению к стабильным клеточным линиям CHO-K1, экспрессирующим белки ASCT2 человека или макаки-крабоеда, или по отношению к случайному рецептору.
[0051] На ФИГ. 9A-ФИГ. 9D приведены цитометрические кривые связывания родительского антитела 17c10, антитела 17c10 зародышевого типа и антитела R347 изотипического контроля со стабильными клеточными линиями CHO-K1, экспрессирующими человеческие ASCT2 (ФИГ. 9A); стабильными клеточными линиями CHO-K1, экспрессирующими ASCT2 макаки-крабоеда (ФИГ. 9B); клетками WiDr рака ободочной и толстой кишки, экспрессирующими ASCT2 (ФИГ. 9C); и ложно-трансфицированными контрольными клетками (ФИГ. 9D).
[0052] На ФИГ. 10A-ФИГ. 10F приведена относительная жизнеспособность (%), нормализованная по жизнеспособности необработанных контрольных клеток, клеточных линий рака, обработанных антителом к ASCT2-17c10, конъюгированным с тубулизином AZ1508, и антителом R347 изотипического контроля, конъюгированным с тубулизином AZ1508, клеток рака поджелудочной железы (ФИГ. 10A), клеток рака прямой кишки (ФИГ. 10B), клеток рака легкого (ФИГ. 10C), клеток рака HNSCC (ФИГ. 10D), клеток рака простаты (ФИГ. 10E) и клеточных линий, не экспрессирующих ASCT2 (ФИГ. 10F).
[0053] На ФИГ. 11A приведена относительная жизнеспособность, нормализованная по жизнеспособности клеток, обработанных контрольным антителом, конъюгированным с SG3249, по сравнению с антителом к ASCT2-17c10, конъюгированным с SG3249.
[0054] На ФИГ. 11B приведена относительная жизнеспособность, нормализованная по жизнеспособности клеток, обработанных контрольным антителом, конъюгированным с SG3315, по сравнению с антителом к ASCT2-17c10, конъюгированным с SG3315.
[0055] На ФИГ. 12A, ФИГ. 12B и ФИГ. 12C приведена временная зависимость объема опухоли в ксенотрансплантатной модели рака WiDr прямой и ободочной кишок или первичного рака поджелудочной железы после обработки антителом к ASCT2-17c10, конъюгированным с тубулизином или ПБД. ФИГ. 12A - антитело 17c10, конъюгированное с тубулизином 1508; ФИГ. 12B - антитело к ASCT2-17c10, конъюгированное с SG 3315; ФИГ. 12C - антитело к ASCT2-17c10, конъюгированное с SG 3249.
[0056] На ФИГ. 13A показана противоопухолевая действенность ASCT2-ПБД ADC (антитело 17c10, конъюгированное с SG3249) в мышиной модели диссеминированного TF1 альфа AML. ADC и изотипический контроль вводили по схеме Q1Wx4. Тяжесть заболевания и смертность регистрировали ежедневно. При всех уровнях дозирования ADC (0,05, 0,1, 0,25 и 0,5 мг/кг) наблюдали значительное улучшение выживаемости по сравнению с необработанной контрольной группой. Данные представлены на кривых выживаемости Каплана-Мейера, которые демонстрируют течение болезни каждого животного в каждой группе.
[0057] На ФИГ. 13B показана противоопухолевая эффективность ASCT2-PBD ADC (антитела 17c10, конъюгированного с SG3249) в мышиной модели диссеминированной MM.1S ММ. Мышей обрабатывали, используя ADC или изотипический контроль, как описано на ФИГ. 13A. Тяжесть заболевания и смертность регистрировали ежедневно. При обоих уровнях дозы ADC (0,1 и 0,4 мг/кг) выживаемость значительно улучшалась (117 и 123,5 дня, соответственно) по сравнению с контрольной группой, не получавшей обработку (55,5 дня). Данные представлены на кривых выживаемости Каплана-Мейера, которые демонстрируют течение болезни каждого животного в каждой группе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0058] В настоящем изобретении предложены антитела и их антиген-связывающие фрагменты, которые специфично связываются с ASCT2. В некоторых вариантах осуществления антитело или антиген-связывающий фрагмент конъюгированы со средством, предпочтительно - цитотоксином. Также предложены полинуклеотиды, кодирующие антитела и их антиген-связывающие фрагменты, векторы, содержащие полинуклеотиды, и клетки-хозяева, экспрессирующие антитела. Также предложены композиции, содержащие антитела к ASCT2 или их антиген-связывающие фрагменты, и способы получения антител к ASCT2 и их антиген-связывающих фрагментов. Дополнительно предложены способы применения новых антител к ASCT2, такие как применения в диагностике или в способах лечения заболевания или расстройства, характеризующихся сверхэкспрессией ASCT2, например, онкологического заболевания.
[0059] Чтобы легче понять настоящее изобретение, сначала приведены определения конкретных терминов. Дополнительные определения изложены в контексте подробного описания.
I. Определения
[0060] Используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают определяемые объекты и во множественном числе, если из контекста явно не следует иное. Термины в единственном числе, а также "один или несколько" и "по меньшей мере один" можно использовать в данном документе взаимозаменяемо.
[0061] Кроме того, выражение "и/или" следует рассматривать как конкретное раскрытие каждого из двух указанных признаков или компонентов с другим или без другого. Таким образом, подразумевается, что термин "и/или", используемый в такой фразе, как "А и/или В", включает "А и В", "А или В", "А" (отдельно) и "В" (отдельно). Сходным образом подразумевается, что термин "и/или", используемый в такой фразе, как "А, B и/или C", включает "А, B и С", "А, B или C", "A или B", "A или C", "B или C", "A и B", "A и C", "B и C", "А" (отдельно), "В" (отдельно) и "C" (отдельно).
[0062] Если варианты осуществления описываются выражением "содержащий", то другие аналогичные варианты осуществления, описываемые терминами "состоящий из" и/или "состоящий главным образом из", также предусмотрены.
[0063] Если не определено иное, то все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой относится настоящее изобретение. Например, в The Dictionary of Cell and Molecular Biology (5th ed. J.M. Lackie ed., 2013), Oxford Dictionary of Biochemistry and Molecular Biology (2d ed. R. Cammack et al. eds., 2008) и The Concise Dictionary of Biomedicine and Molecular Biology, P-S. Juo, (2nd ed. 2002) специалист в данной области может найти общие определения некоторых терминов, используемых в данном документе.
[0064] Единицы измерения, префиксы и символы обозначены в их форме, принятой согласно Международной системе единиц (SI). Числовые диапазоны включают числа, определяющие диапазон. Если не указано иное, то аминокислотные последовательности записаны слева направо в направлении от амино- к карбокси-концу. Приведенные в данном документе заголовки не ограничивают различные аспекты или варианты осуществления настоящего изобретения, которые могут обеспечиваться ссылкой на описание в целом. Соответственно, термины, определяемые непосредственно ниже, более полно определены со ссылкой на описание во всей его полноте.
[0065] В данном документе аминокислоты обозначены с помощью их общеизвестных трехбуквенных символов или с помощью однобуквенных символов, рекомендованных Комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично нуклеотиды обозначены с помощью их общепринятых однобуквенных кодов.
[0066] Термин "ASCT2" относится к транспортному белку 2 системы переноса аминокислот ASC и/или его активным фрагментам. ASCT2 представляет собой трансмембранный белок, который способствует переносу малых нейтральных аминокислот, включая глутамин, аланин и серин, цистеин и треонин, Na+-зависимым образом. РНК, ДНК и аминокислотные последовательности ASCT2 известны специалистам в данной области и их можно найти во многих базах данных, например, в базах данных Национального центра биотехнологической информации (National Center for Biotechnology Information - NCBI). Примеры таких последовательностей, найденные в NCBI, представляют собой последовательности ASCT2 человека, имеющие в GenBank инвентарные номера NM_005628 и NP_005619; последовательности ASCT2 макака-крабоеда (Macaca fascicularis), имеющие в GenBank инвентарные номера NM_001284054 и NP-001270983.
[0067] Термины "ингибировать", "блокировать" и "подавлять" используются в данном документе взаимозаменяемо и относятся к любому статистически значимому уменьшению биологической активности, в том числе к полному блокированию активности. Например, "ингибирование" может относиться к уменьшению биологической активности или процесса на примерно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%.
[0068] Выражения "антитело" или "иммуноглобулин" в данном документе используются взаимозаменяемо. Типичное антитело содержит по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, связанные между собой дисульфидными связями. Каждая тяжелая цепь состоит из вариабельного участка тяжелой цепи (в данном документе сокращенно VH) и константного участка тяжелой цепи. Константный участок тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельного участка легкой цепи (в данном документе сокращенно VL) и константного участка легкой цепи. Константный участок легкой цепи состоит из одного домена CL. Участки VH и VL можно дополнительно подразделять на участки гипервариабельности, называемые определяющими комплементарность участками (CDR), которые чередуются с более консервативными участками, называемыми каркасными участками (FW). Каждый из VH и VL состоит из трех CDR и четырех FW, расположенных от амино-конца к карбокси-концу в следующем порядке: FW1, CDR1, FW2, CDR2, FW3, CDR3, FW4. Вариабельные участки тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные участки антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. Примерами антител настоящего раскрытия являются полученные с помощью гибридомной технологии мышиные моноклональные антитела 17c10 и 1e8, гуманизированные, с оптимизированным сродством (аффинностью), зародышевого типа, и/или другие варианты этих антител, и антитела к ASCT2 YTE (например, K44VHa-N56Q, K44VHa6-N56Q или K2Ha-N56Q) с оптимизированным периодом полувыведения из крови.
[0069] Термин "зародышевого типа" означает, что аминокислоты в конкретных положениях в антителе подвергнуты обратной мутации с получением свойственных зародышевой линии аминокислот.
[0070] Термин "антитело" может относиться к молекуле иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид или комбинации вышеуказанного, посредством по меньшей мере одного антиген-распознающего сайта вариабельного участка молекулы иммуноглобулина. Термин "антитело", используемый в данном документе, охватывает интактные поликлональные антитела, интактные моноклональные антитела, фрагменты антител (такие как Fab-, Fab'-, F(ab')2- и Fv-фрагменты), одноцепочечные мутантные формы Fv (scFv), полиспецифичные антитела, такие как биспецифичные антитела, полученные по меньшей мере из двух интактных антител, химерные антитела, гуманизированные антитела, человеческие антитела, белки слияния, содержащие антигенопределяющий участок антитела, а также любую другую модифицированную молекулу иммуноглобулина, содержащую антигенраспознающий сайт, при условии, что антитела проявляют требуемую биологическую активность. Антитело может относиться к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM или их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), исходя из идентичности их константных доменов тяжелой цепи, обозначаемых соответственно как альфа, дельта, эпсилон, гамма и мю. Разные классы иммуноглобулинов характеризуются разными и хорошо известными структурами субъединиц и пространственными конфигурациями. Антитела могут быть "голыми" или конъюгированными с другими молекулами, такими как токсины, радиоизотопы и т.д.
[0071] Термин "антитело к ASCT2", или "антитело, которое связывается с ASCT2", или "анти-ASCT2" относится к антителу, которое способно к связыванию ASCT2 с достаточным сродством (аффинностью), благодаря чему данное антитело пригодно в качестве терапевтического средства или диагностического реагента при целенаправленном воздействии на ASCT2. Степень связывания антитела к ASCT2 с неродственным белком, отличным от ASCT2, составляет менее чем примерно 10% от связывания антитела с ASCT2 согласно измерению, например, с помощью радиоиммунологического анализа (RIA), BIACORE® (с применением рекомбинантного ASCT2 в качестве аналита и антитела в качестве лиганда или наоборот), KINEXA® или других анализов связывания, известных из уровня техники. Согласно определенным вариантам осуществления антитело, которое связывается с ASCT2, характеризуется константой диссоциации (KD), составляющей ≤1 мкM, ≤100 нM, ≤10 нM, ≤1 нM, ≤0,1 нM, ≤10 пM, ≤1 пM или ≤0,1 пM.
[0072] Выражение "антиген-связывающий фрагмент" относится к части интактного антитела и относится к комплементарности, определяющей, вариабельные участки интактного антитела. Фрагменты полноразмерного антитела могут представлять собой антиген-связывающий фрагмент антитела. Примеры фрагментов антитела включают без ограничения Fab, Fab', F(ab')2 и Fv-фрагменты, линейные антитела, одноцепочечные антитела (например, ScFv) и полиспецифические антитела, образованные из фрагментов антитела.
[0073] "Моноклональное антитело" (mAb) относится к гомогенной популяции антител, участвующих в высокоспецифичном распознавании и связывании одной антигенной детерминанты или эпитопа. Этим они отличаются от поликлональных антител, которые, как правило, включают разные антитела, направленные против разных антигенных детерминант. Термин "моноклональное антитело" охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антитела (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (scFv) мутанты, составные белки, содержащие часть антитела, и любую другую модифицированную молекулу иммуноглобулина, содержащую сайт распознавания антигена. Кроме того, "моноклональное антитело" относится к таким антителам, которые получены любым путем, в том числе, без ограничения, гибридомной технологией, отбором с помощью фагового дисплея, рекомбинантной экспрессией и с применением трансгенных животных.
[0074] Термин "гуманизированное антитело" относится к антителу, происходящему из иммуноглобулина, отличного от иммуноглобулина человека (например, иммуноглобулина мыши), которое было сконструировано так, чтобы содержание последовательностей, отличных от последовательностей человека (например, последовательностей мыши), было минимальным. Как правило, гуманизированные антитела представляют собой иммуноглобулины человека, в которых остатки определяющего комплементарность участка (CDR) заменены остатками CDR видов, отличных от человека (например, мыши, крысы, кролика или хомяка), которые характеризуются требуемой специфичностью, сродством (аффинностью) и функциональной способностью (Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536). В некоторых случаях остатки каркасного участка (FW) Fv иммуноглобулина человека заменены соответствующими остатками антитела из отличных от человека видов, которые характеризуются необходимой специфичностью, аффинностью и функциональной способностью.
[0075] Гуманизированные антитела можно дополнительно модифицировать посредством замены дополнительных остатков в каркасной области Fv и/или в замененных, не относящихся к человеческим остатках для усовершенствования и оптимизации специфичности, сродства и/или функциональной способности антитела. Как правило, гуманизированные антитела будут включать практически все из по меньшей мере одного, и, как правило, двух или трех вариабельных доменов, содержащих все или практически все из CDR-участков, которые соответствуют таковым у иммуноглобулина, отличного от иммуноглобулина человека, тогда как все или практически все из FR-участков являются таковыми из консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело может также содержать по меньшей мере часть константного участка или домена (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Примеры способов, используемых для получения гуманизированных антител, описаны в патентах США №№ 5225539 или 5639641.
[0076] "Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый носитель включает в себя, но не ограничивается этим, буфер, вспомогательное вещество, стабилизатор или консервант. Выражение "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные средства и противогрибковые средства, изотонические средства и замедляющие всасывание/ресорбцию средства и т.п., которые должны быть физиологически совместимыми.
[0077] "Вариабельный участок" антитела относится к вариабельному участку легкой цепи антитела или вариабельному участку тяжелой цепи антитела как по отдельности, так и в комбинации. Каждый из вариабельных участков тяжелой и легкой цепей состоит из четырех каркасных участков (FW), соединенных тремя определяющими комплементарность участками (CDR), также известными как гипервариабельные участки. В каждой цепи CDR удерживаются в непосредственной близости с помощью FW-участков, и вместе с CDR из другой цепи участвуют в образовании антиген-связывающего cайта антител. Существует по меньшей мере две методики определения CDR: (1) подход, основанный на межвидовой вариабельности последовательностей (т.е. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273:927-948)). Кроме того, для определения CDR в данной области техники иногда используют комбинации этих двух подходов.
[0078] Систему нумерации по Kabat обычно используют при обозначении остатка в вариабельном домене (примерно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
[0079] Нумерация аминокислотных положений согласно Kabat относится к системе нумерации, применяемой к вариабельным доменам тяжелой цепи или вариабельным доменам легкой цепи антител в соответствии с собранными сведениями в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). При применении данной системы нумерации фактическая линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, соответствующие укорочению FW или CDR вариабельного домена или вставке в них. Например, вариабельный домен тяжелой цепи может содержать вставку из одной аминокислоты (остаток 52a согласно Kabat) после остатка 52 в H2 и вставленные остатки (например, остатки 82a, 82b и 82c и т.д. согласно Kabat) после остатка 82 FW тяжелой цепи.
[0080] Нумерацию остатков согласно Kabat можно определить для данного антитела с помощью выравнивания по гомологичным участкам последовательности антитела со «стандартной» последовательностью, пронумерованной согласно Kabat. В отличие от этого, Chothia обращается к расположению структурных петель (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Конец петли CDR-H1 согласно Chothia при нумерации с использованием правила нумерации согласно Kabat варьируется от H32 до H34 в зависимости от длины петли (это обусловлено тем, что согласно схеме нумерации Kabat вставки размещаются в H35A и H35B; при этом если не присутствуют ни 35A, ни 35B, то петля заканчивается на 32; если присутствует только 35A, то петля заканчивается на 33; если присутствуют обе 35A и 35B, то петля заканчивается на 34). Определение гипервариабельных участков согласно AbM представляет собой компромисс между определением CDR согласно Kabat и структурных петель согласно Chothia, и применяется в программном обеспечении для моделирования антител AbM от Oxford Molecular. В Таблице 1 ниже приведены положения аминокислот, составляющих вариабельные участки антител в каждой системе.
ТАБЛИЦА 1
ПОЛОЖЕНИЯ АМИНОКИСЛОТ В КАЖДОЙ СИСТЕМЕ
2Нумерация по Chothia.
[0081] ImMunoGeneTics (IMGT) предусматривает также систему нумерации для вариабельных участков иммуноглобулинов, в том числе CDR. См., например, Lefranc, M.P. et al., Dev. Comp. Immunol. 27: 55-77(2003). Система нумерации IMGT основана на выравнивании более 5000 последовательностей, данных о структуре и определении характеристик гипервариабельных петель, и она обеспечивает возможность легкого сравнения вариабельных и CDR-участков для всех видов. В соответствии со схемой нумерации IMGT VH-CDR1 находится в положениях 26-35, VH-CDR2 находится в положениях 51-57, VH-CDR3 находится в положениях 93-102, VL-CDR1 находится в положениях 27-32, VL-CDR2 находится в положениях 50-52 и VL-CDR3 находится в положениях 89-97.
[0082] Описанные последовательности VH CDR, используемые в настоящем описании, соответствуют местоположениям согласно классической нумерации по Kabat, а именно VH-CDR1 согласно Kabat находится в положениях 31-35, VH-CDR2 находится в положениях 50-65 и VH-CDR3 находится в положениях 95-102. VL-CDR1, VL-CDR2 и VL-CDR3 также соответствуют местоположениям согласно классической нумерации по Kabat, а именно положениям 24-34, 50-56 и 89-97 соответственно.
[0083] Термин "человеческое антитело" означает антитело, продуцируемое в организме человека, или антитело с аминокислотной последовательностью, соответствующей антителу, продуцируемому в организме человека, полученное с использованием любых методик, известных из уровня техники. Это определение человеческого антитела включает интактные или полноразмерные антитела, их фрагменты и/или антитела, содержащие по меньшей мере один полипептид тяжелой и/или легкой цепи человека, как, например, антитело, содержащее полипептиды легкой цепи мыши и тяжелой цепи человека.
[0084] Термин "химерные антитела" относится к антителам, в которых аминокислотная последовательность молекулы иммуноглобулина получена от двух или более видов. Как правило, вариабельный участок как легкой, так и тяжелой цепей соответствует вариабельному участку антител, полученных от одного вида млекопитающих (например, мыши, крысы, кролика и т.д.) с необходимой специфичностью, аффинностью и функциональной способностью, в то время как константные участки гомологичны с последовательностями антител, полученных от другого вида (обычно человека), во избежание вызывания иммунного ответа у этого вида.
[0085] Термины "YTE" или "YTE-мутант" относятся к мутации в Fc IgG1, которая приводит к усилению связывания с FcRn человека и улучшению в отношении периода полувыведения антитела с указанной мутацией из крови. УТЕ-мутант предусматривает комбинацию трех мутаций M252Y/S254T/T256E, (нумерация согласно EU-индексу по Kabat et al. (1991) Sequences of Proteins of Immunological Interest, U.S. Public Health Service, National Institutes of Health, Washington, D.C.), введенных в тяжелую цепь IgG1. См. патент США № 7658921, который включен в данный документ посредством ссылки. Было показано, что мутант YTE увеличивает время полувыведения антител из сыворотки примерно в четыре раза по сравнению с таковым для версий дикого типа того же антитела (Dall'Acqua et al., J. Biol. Chem. 281:23514-24 (2006); Robbie et al., (2013) Antimicrob. Agents Chemother. 57, 6147-6153). Также см. патент США № 7083784, который включен в данный документ с помощью ссылки во всей своей полноте.
[0086] «Аффинность связывания», в целом, относится к силе суммы всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антителом) и его партнером по связыванию (например, антигеном). Если не указано иное, "аффинность связывания", как используется в данном документе, относится к характерной, не измененной аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y в целом можно представить константой диссоциации (KD). Аффинность можно измерить с помощью способов, общеизвестных из уровня техники, в том числе описанных в данном документе. В основном антитела с низкой аффинностью связывают антиген медленно и склонны легко диссоциировать, тогда как антитела с высокой аффинностью обычно связывают антиген быстрее и склонны оставаться в связанном состоянии дольше. Из уровня техники известен ряд способов измерения аффинности связывания, любой из которых можно применять для целей настоящего изобретения.
[0087] Как правило, эффективность связывающей молекулы выражают в виде значения IC50 в нг/мл, если не указано иное. IC50 представляет собой медианную ингибирующую концентрацию молекулы антитела. В функциональных анализах IC50 представляет собой концентрацию, которая снижает биологический ответ на 50% от его максимума. В исследованиях по связыванию лиганда IC50 представляет собой концентрацию, которая снижает уровень связывания рецептора на 50% от максимального уровня специфичного связывания. IC50 можно рассчитать любым из множества способов, известных в данной области.
[0088] Кратность повышения эффективности антител или полипептидов данного изобретения по сравнению с эталонным антителом может быть по меньшей мере примерно 2-кратной, по меньшей мере примерно 4-кратной, по меньшей мере примерно 6-кратной, по меньшей мере примерно 8-кратной, по меньшей мере примерно 10-кратной, по меньшей мере примерно 20-кратной, по меньшей мере примерно 30-кратной, по меньшей мере примерно 40-кратной, по меньшей мере примерно 50-кратной, по меньшей мере примерно 60-кратной, по меньшей мере примерно 70-кратной, по меньшей мере примерно 80-кратной, по меньшей мере примерно 90-кратной, по меньшей мере примерно 100-кратной, по меньшей мере примерно 110-кратной, по меньшей мере примерно 120-кратной, по меньшей мере примерно 130-кратной, по меньшей мере примерно 140-кратной, по меньшей мере примерно 150-кратной, по меньшей мере примерно 160-кратной, по меньшей мере примерно 170-кратной или по меньшей мере примерно 180-кратной или больше.
[0089] Эффективность связывания антитела обычно выражают в виде значения ЕC50 в нМ или пМ, если не указано иное. EC50 - это концентрация лекарственного средства, которая индуцирует биологический ответ, соответствующий половине между ответом на исходном уровне и максимальным ответом, после определенного времени воздействия. ЕC50 можно рассчитать любым образом из известных в данной области техники.
[0090] "Терапевтическое антитело" - это такое антитело, которое можно вводить субъекту для лечения или предупреждения заболевания или состояния. "Субъект" - это любой индивидуум, в частности, млекопитающее, для которого необходимы диагностика, прогнозирование или терапия. Субъекты-млекопитающие включают в себя людей, домашних животных, сельскохозяйственных животных, используемых в спорте животных и животных в зоопарке, например, людей, обезьян, собак, кошек, морских свинок, кроликов, крыс, мышей, лошадей, крупный рогатый скот и т.д.
[0091] Термин "лечить" относится к терапевтическим мерам, с помощью которых излечивают, замедляют течение, ослабляют симптомы диагностированного патологического состояния или нарушения и/или останавливают их прогрессирование. Таким образом, нуждающиеся в лечении включают тех, которые уже страдают расстройством. В определенных вариантах осуществления субъект успешно "проходит лечение" в соответствии со способами, предусмотренными в данном документе, если у пациента наблюдается, например, полное, частичное или временное облегчение или устранение симптомов, связанных с заболеванием или расстройством.
[0092] Термины, такие как "предупреждать", относятся к профилактическим или превентивным мерам, с помощью которых предупреждают и/или замедляют развитие целевого патологического состояния или нарушения. Так, нуждающиеся в предупреждении включают тех, которые предрасположены или восприимчивы к данному расстройству. В определенных вариантах осуществления заболевание или расстройство успешно предупреждают в соответствии со способами, предложенными в данном документе, если у пациента, например, развивается на временной или постоянной основе меньше симптомов или симптомы с меньшей тяжестью, связанных с заболеванием или расстройством, или симптомы, связанные с заболеванием или расстройством, появляются позже по сравнению с пациентом, который не получал лечения в соответствии со способами данного изобретения.
[0093] Выражение "фармацевтическая композиция" относится к препарату, который находится в такой форме, которая не препятствует эффективному проявлению биологической активности активного ингредиента, и который не содержит дополнительных, неприемлемо токсичных компонентов для субъекта, которому будут вводить композицию. Такая композиция может быть стерильной и содержать фармацевтически приемлемый носитель, такой как физиологический солевой раствор. Пригодные фармацевтические композиции могут включать в себя один или несколько из следующего: буфер (например, ацетатный, фосфатный или цитратный буфер), поверхностно-активное вещество (например, полисорбат), стабилизатор (например, человеческий альбумин), консервант (например, бензиловый спирт) и вещество, способствующее впитыванию, для улучшения биодоступности, и/или другие обычные солюбилизирующие или диспергирующие средства.
[0094] "Эффективным количеством" антитела, раскрытого в данном документе, является количество, достаточное для осуществления определенно поставленной цели. "Эффективное количество" применительно к поставленной цели можно определить опытным путем и стандартным способом.
[0095] "Метка" относится к детектируемому соединению или композиции, которая конъюгирована прямо или опосредованно со связывающей молекулой или антителом с получением "меченой" связывающей молекулы или антитела. Метка может быть выявляемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментной метки, может катализировать химическое превращение субстратного соединения или композиции, которое является выявляемым.
[0096] Термины "полипептид", "пептид" и "белок" используются в данном документе взаимозаменяемо для обозначения полимеров из аминокислот любой длины. Полимер может быть линейным или разветвленным, может содержать модифицированные аминокислоты и его могут разделять не аминокислоты. Термины также охватывают полимер из аминокислот, который был модифицирован в природных условиях или посредством вмешательства; например, посредством образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгирование с метящим компонентом. В данное определение также включены, например, полипептиды, содержащие один или несколько аналогов аминокислоты (в том числе, например, не встречающиеся в природе аминокислоты и т.п.), а также другие модификации, известные из уровня техники. В некоторых вариантах осуществления полипептиды могут находиться в виде одиночных цепей или связанных цепей.
[0097] "Полинуклеотид" в данном контексте может включать одну или несколько "нуклеиновых кислот", "молекул нуклеиновой кислоты" или "последовательностей нуклеиновой кислоты", относится к полимеру из нуклеотидов любой длины и включает ДНК и РНК. Полинуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания, и/или их аналоги, или любой субстрат, который можно встроить в полимер с помощью ДНК- или РНК-полимеразы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Предыдущее описание применимо ко всем указанным в данном документе полинуклеотидам, в том числе РНК и ДНК.
[0098] Термин "вектор" означает конструкцию, способную доставлять в клетку-хозяина, и согласно некоторым вариантам осуществления экспрессировать в клетке-хозяине один или несколько представляющих интерес генов или последовательностей. Примеры векторов включают без ограничения вирусные векторы, векторы экспрессии "голой" ДНК или РНК, плазмиды, космиды или фаговые векторы, векторы экспрессии ДНК или РНК, ассоциированные с катионными конденсирующими средствами, векторы экспрессии ДНК или РНК, инкапсулированные в липосомы, а также определенные эукариотические клетки, такие как клетки-продуценты.
[0099] Полипептид, антитело, полинуклеотид, вектор, клетка или композиция в "выделенном" виде представляют собой полипептид, антитело, полинуклеотид, вектор, клетку или композицию, которые находятся в таком виде, который не встречается в природе. Выделенные полипептиды, антитела, полинуклеотиды, векторы, клетки или композиции включают таковые, которые были очищены до такой степени, что они больше не находятся в такой форме, в которой они встречаются в природе. В некоторых вариантах осуществления выделенные антитело, полинуклеотид, вектор, клетка или композиция являются практически чистыми.
[00100] Выражения "идентичный" или "идентичность", выраженная в процентах, при упоминании двух или более нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми, или которые характеризуются определенным процентным содержанием нуклеотидов или аминокислотных остатков, которые являются одинаковыми при сравнении и выравнивании (при необходимости, с введением разрывов) для максимального соответствия, без учета каких-либо консервативных аминокислотных замен как части идентичности последовательностей. Процентную идентичность можно измерять с применением программного обеспечения или алгоритмов для сравнения последовательностей или посредством визуальной проверки. Различные алгоритмы и программное обеспечение, которые можно применять для получения выравниваний аминокислотных или нуклеотидных последовательностей, известны из уровня техники.
[00101] Один из таких неограничивающих примеров алгоритма выравнивания последовательностей представляет собой алгоритм, описанный у Karlin et al., Proc. Natl. Acad. Sci. USA, 87:2264-2268 (1990), в качестве модификации у Karlin et al., Proc. Natl. Acad. Sci. USA, 90:5873-5877 (1993), и включенный в программы NBLAST и XBLAST (Altschul et al., Nucleic Acids Res. 25:3389-3402 (1991)). В определенных вариантах осуществления можно применять Gapped BLAST, описанную у Altschul et al., Nucleic Acids Res. 25:3389-3402 (1997). BLAST-2, WU-BLAST-2 (Altschul et al., Methods in Enzymol. 266:460-480 (1996)), ALIGN, ALIGN-2 (Genentech, Южный Сан Франциско, СА) или Megalign (DNASTAR) представляют собой дополнительные общедоступные программы системы программного обеспечения, которые можно применять для выравнивания последовательностей. В определенных вариантах осуществления процентную идентичность двух нуклеотидных последовательностей определяют с применением программы GAP в пакете программного обеспечения GCG (например, с применением матрицы NWSgapdna.CMP и штрафа за открытие разрыва 40, 50, 60, 70 или 90 и штрафа за продолжение разрыва 1, 2, 3, 4, 5 или 6). В некоторых альтернативных вариантах осуществления программу GAP в пакете программного обеспечения GCG, в которую включен алгоритм Нидлмана-Вунша (J. Mol. Biol. (48):444-453 (1970)), можно применять для определения процентной идентичности двух аминокислотных последовательностей (например, с применением либо матрицы BLOSUM 62, либо матрицы PAM250, и штрафа за открытие разрыва 16, 14, 12, 10, 8, 6 или 4 и штрафа за продолжение разрыва 1, 2, 3, 4, 5). Альтернативно, в определенных вариантах осуществления процентную идентичность нуклеотидных или аминокислотных последовательностей определяют с применением алгоритма Миллера-Майерса (CABIOS, 4:11-17 (1989)). Например, процентную идентичность можно определять с применением программы ALIGN (версия 2.0) и с применением PAM120 с таблицей замен остатков, штрафа за продление разрыва 12 и штрафа за открытие разрыва 4. Специалист в данной области может определить соответствующие параметры с целью максимального выравнивания с помощью конкретного программного обеспечения для выравнивания. В определенных вариантах осуществления применяют параметры по умолчанию программного обеспечения для выравнивания.
[00102] Согласно определенным вариантам осуществления процент идентичности "X" первой аминокислотной последовательности со второй аминокислотной последовательностью рассчитывают как 100 x (Y/Z), где Y представляет собой количество аминокислотных остатков, подсчитанных как идентичные совпадения при выравнивании первой и второй последовательностей (выравненные с помощью визуальной проверки или специальной программы выравнивания последовательностей), и Z представляет собой общее число остатков во второй последовательности. Если длина первой последовательности больше, чем второй последовательности, то процентная идентичность первой последовательности со второй последовательностью будет выше, чем процентная идентичность второй последовательности с первой последовательностью.
[00103] "Консервативная аминокислотная замена" представляет собой замену, при которой один аминокислотный остаток замещается другим аминокислотным остатком со схожей боковой цепью. Семейства аминокислотных остатков со сходными боковыми цепями определены в данной области техники и включают основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженные полярные боковые цепи (например, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Например, замена фенилаланина тирозином является консервативной заменой. В определенных вариантах осуществления консервативные замены в аминокислотных последовательностях связывающих молекул, антител и антиген-связывающих фрагментов данного изобретения не подавляют связывание связывающей молекулы, антитела или антиген-связывающего фрагмента, содержащих аминокислотную последовательность, с антигеном(ами), т.е. ASCT2, с которым(ми) связывается связывающая молекула, антитело или антиген-связывающий фрагмент. Способы выявления нуклеотидных и аминокислотных консервативных замен, которые не приводят к устранению связывания с антигенами, хорошо известны из уровня техники. См., например, Brummell et al., Biochem. 32: 1180-1 187 (1993); Kobayashi et al., Protein Eng. 12(10):879-884 (1999); Burks et al., Proc. Natl. Acad. Sci. USA 94:.412-417 (1997).
II. Антитела к ASCT2 и антиген-связывающие фрагменты
[00104] В настоящем изобретении предложены антитела к ASCT2 (анти-ASCT2) и их антиген-связывающие фрагменты, которые специфично связываются с ASCT2. Полноразмерные аминокислотные (aa) и нуклеотидные (nt) последовательности для ASCT2 человека и макака-крабоеда известны в области техники и их можно найти, по крайней мере, в базе данных Национального центра биотехнологической информации (NCBI). Базой данных NCBI можно пользоваться в режиме online. В некоторых вариантах осуществления антитела к ASCT2 и их антиген-связывающие фрагменты, предложенные в данном документе, представляют собой гуманизированные антитела или человеческие антитела. В некоторых вариантах осуществления антитела к ASCT2 конъюгированы с цитотоксином, в этом случае они обозначаются как анти-ASTC2 ADC.
[00105] В некоторых вариантах осуществления антитела к ASCT2 данного изобретения связываются с ASCT2 на поверхности клетки и поглощаются клеткой. В некоторых вариантах осуществления антитело к ASCT2 поглощается клетками, экспрессирующими ASCT2, при IC50 за 10 минут, равном от примерно 100 нг/мл до примерно 1 мкг/мл, от примерно 100 нг/мл до примерно 500 нг/мл, от примерно 100 нг/мл до примерно 250 нг/мл, от примерно 250 нг/мл до примерно 500 нг/мл, от примерно 350 нг/мл до примерно 450 нг/мл, от примерно 500 нг/мл до примерно 1 мкг/мл, от примерно 500 нг/мл до примерно 750 нг/мл, от примерно 750 нг/мл до примерно 850 нг/мл или от примерно 900 нг/мл до примерно 1 мкг/мл. В некоторых вариантах осуществления антитело к ASCT2 поглощается клетками, экспрессирующими ASCT2, при IC50 за 30 минут, равном от примерно 100 нг/мл до примерно 1 мкг/мл, от примерно 100 нг/мл до примерно 500 нг/мл, от примерно 100 нг/мл до примерно 250 нг/мл, от примерно 250 нг/мл до примерно 500 нг/мл, от примерно 250 нг/мл до примерно 350 нг/мл, от примерно 350 нг/мл до примерно 450 нг/мл, от примерно 500 нг/мл до примерно 1 мкг/мл, от примерно 500 нг/мл до примерно 750 нг/мл, от примерно 750 нг/мл до примерно 850 нг/мл или от примерно 900 нг/мл до примерно 1 мкг/мл. В некоторых вариантах осуществления антитело к ASCT2 поглощается клетками, экспрессирующими ASCT2, при IC50 за 120 минут, равном от примерно 50 нг/мл до примерно 500 нг/мл, от примерно 50 нг/мл до примерно 100 нг/мл, от примерно 100 нг/мл до примерно 200 нг/мл, от примерно 200 нг/мл до примерно 300 нг/мл, от примерно 300 нг/мл до примерно 400 нг/мл или от примерно 400 нг/мл до примерно 500 нг/мл. В некоторых вариантах осуществления антитело к ASCT2 поглощается клетками, экспрессирующими ASCT2, при IC50 за 8 часов, равном от примерно 5 нг/мл до примерно 250 нг/мл, от примерно 10 нг/мл до примерно 25 нг/мл, от примерно 25 нг/мл до примерно 50 нг/мл, от примерно 50 нг/мл до примерно 100 нг/мл, от примерно 100 нг/мл до примерно 150 нг/мл, от примерно 150 нг/мл до примерно 200 нг/мл или от примерно 200 нг/мл до примерно 250 нг/мл. В некоторых случаях антитело к ASCT2, конъюгированное с цитотоксином, представляет собой анти-ASCT2 ADC.
[00106] В некоторых аспектах данного раскрытия предложено антитело к ASCT2 или его антиген-связывающий фрагмент, содержащие три определяющих комплементарность участка тяжелой цепи (HCDR) и три определяющих комплементарность участка легкой цепи (LCDR). В определенных аспектах HCDR1 имеет аминокислотную последовательность, выбранную из SEQ ID NO: 10 и SEQ ID NO: 16; HCDR2 имеет аминокислотную последовательность, выбранную из SEQ ID NO: 22, SEQ ID NO: 11 и SEQ ID NO: 17; HCDR3 имеет аминокислотную последовательность, выбранную из SEQ ID NO: 23, SEQ ID NO: 12 и SEQ ID NO: 18; LCDR1 имеет аминокислотную последовательность, выбранную из SEQ ID NO: 13 и SEQ ID NO: 19; LCDR2 имеет аминокислотную последовательность, выбранную из SEQ ID NO: 14, SEQ ID NO: 20 и SEQ ID NO: 24; LCDR3 имеет аминокислотную последовательность, выбранную из SEQ ID NO: 15, SEQ ID NO: 21 и SEQ ID NO: 25. Как оговорено в данном документе, VH содержит аминокислотную последовательность, приведенную под SEQ ID NO: 1 или SEQ ID NO: 5; и VL содержит аминокислотную последовательность, приведенную под SEQ ID NO: 2 или SEQ ID NO: 6. В некоторых аспектах антитело к ASCT2 содержит VH с аминокислотной последовательностью, приведенной под SEQ ID NO: 5, и VL с аминокислотной последовательностью, приведенной под SEQ ID NO: 6. По выбору, антитело к ASCT2 содержит VH с аминокислотной последовательностью, приведенной под SEQ ID NO: 3 или SEQ ID NO: 7, и VL с аминокислотной последовательностью, приведенной под SEQ ID NO: 4 или SEQ ID NO: 8. В некоторых вариантах осуществления антитело к ASCT2 содержит VH с аминокислотной последовательностью, приведенной под SEQ ID NO: 7, и VL с аминокислотной последовательностью, приведенной под SEQ ID NO: 8.
[00107] Кроме того, в раскрытии предложено выделенное антитело или его антиген-связывающий фрагмент, которые специфично связываются с ASCT2, содержащим VH и VL, где VH и VL содержат, соответственно, аминокислотные последовательности по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичные эталонным аминокислотным последовательностям SEQ ID NO: 1 и SEQ ID NO: 2; SEQ ID NO: 3 и SEQ ID NO: 4; SEQ ID NO: 5 и SEQ ID NO: 6; или SEQ ID NO: 7 и SEQ ID NO: 8, соответственно.
[00108] В одном аспекте настоящего раскрытия предложено антитело к ASCT2 или его антиген-связывающий фрагмент, содержащие аминокислотную последовательность VH с SEQ ID NO: 5; и аминокислотную последовательность VL с SEQ ID NO: 6. В одном аспекте настоящего раскрытия предложено антитело к ASCT2 или его антиген-связывающий фрагмент, содержащие аминокислотную последовательность VH с SEQ ID NO: 7; и аминокислотную последовательность VL с SEQ ID NO: 8.
[00109] Антитело к ASCT2 или его антиген-связывающий фрагмент, описанные в данном документе, могут представлять собой, например, мышиное антитело, гуманизированное антитело, химерное антитело, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, полиспецифичное антитело или любую их комбинацию. Антиген-связывающий фрагмент антитела к ASCT2 может представлять собой Fv-фрагмент, Fab-фрагмент, F(ab')2-фрагмент, Fab'-фрагмент, dsFv-фрагмент, scFv-фрагмент или sc(Fv)2-фрагмент.
[00110] В одном аспекте настоящего раскрытия предложено антитело к ASCT2 или его антиген-связывающий фрагмент, которые могут связываться с молекулами ASCT2 у разных видов, например, антитело или фрагмент могут связываться с мышиным ASCT2, крысиным ASCT2, кроличьим ASCT2, человеческим ASCT2 и/или ASCT2 макака-крабоеда. Например, антитело или фрагмент могут связываться с человеческим ASCT2 и ASCT2 макака-крабоеда. В дополнительном примере антитело или фрагмент могут также связываться с мышиным ASCT2.
[00111] В некоторых вариантах осуществления, предложенных в данном документе, антитело к ASCT2 или его антиген-связывающий фрагмент могут специфично связываться с ASCT2, например, человеческим ASCT2 и ASCT2 макака-крабоеда, но не связываются специфически с человеческим ASCT1.
[0100] Антитело к ASCT2 или его антиген-связывающий фрагмент, описываемые в данном документе, могут включать, в дополнение к VH и VL, константный участок тяжелой цепи или его фрагмент. Согласно определенным аспектам константный участок тяжелой цепи представляет собой константный участок тяжелой цепи человека, например, константный участок IgG человека, например, константный участок IgG1 человека. В некоторых вариантах осуществления, особенно в тех случаях, когда антитело или его антиген-связывающий фрагмент конъюгированы со средством, таким как цитотоксическое средство, между аминокислотами S239 и V240 в CH2 участке IgG1 вставлен цистеиновый остаток. Этот цистеин обозначается как "239-вставка" или "239i."
[0101] В некоторых аспектах константный участок тяжелой цепи или его фрагмент, например, константный участок IgG человека или его фрагмент, могут включать одну или несколько аминокислотных замен по сравнению с константным доменом IgG дикого типа, где модифицированный IgG характеризуется увеличенным периодом полувыведения по сравнению с периодом полувыведения IgG с константным доменом IgG дикого типа. Например, константный домен IgG может содержать одну или несколько аминокислотных замен аминокислотных остатков по положениям 251-257, 285-290, 308-314, 385-389 и 428-436, где нумерация аминокислотных положений приведена согласно EU-индексу, как изложено у Kabat. В некоторых аспектах константный домен IgG может содержать одну или несколько замен аминокислоты по положению 252 согласно Kabat на тирозин (Y), фенилаланин (F), триптофан (W) или треонин (T), замену аминокислоты по положению 254 согласно Kabat на треонин (T), замену аминокислоты по положению 256 согласно Kabat на серин (S), аргинин (R), глутамин (Q), глутаминовую кислоту (E), аспарагиновую кислоту (D) или треонин (T), замену аминокислоты по положению 257 согласно Kabat на лейцин (L), замену аминокислоты по положению 309 согласно Kabat на пролин (P), замену аминокислоты по положению 311 согласно Kabat на серин (S), замену аминокислоты по положению 428 согласно Kabat на треонин (T), лейцин (L), фенилаланин (F) или серин (S), замену аминокислоты по положению 433 согласно Kabat на аргинин (R), серин (S), изолейцин (I), пролин (P) или глутамин (Q) или замену аминокислоты по положению 434 согласно Kabat на триптофан (W), метионин (M), серин (S), гистидин (H), фенилаланин (F) или тирозин. Более конкретно, константный домен IgG может содержать аминокислотные замены по сравнению с константным доменом дикого типа IgG человека, в том числе в виде замены аминокислоты по положению 252 согласно Kabat на тирозин (Y), замены аминокислоты по положению 254 согласно Kabat на треонин (T) и замены аминокислоты по положению 256 согласно Kabat на глутаминовую кислоту (E). В данном раскрытии предложено антитело к ASCT2 или его антиген-связывающий фрагмент, где тяжелая цепь представляет собой YTE мутант человеческого IgG1.
[0102] Антитело к ASCT2 или его антиген-связывающий фрагмент, предложенные в данном документе, например, как описаны выше, могут включать, в дополнение к VH и VL и, необязательно, константному участку тяжелой цепи или его фрагменту, константный участок легкой цепи или его фрагмент. Согласно определенным аспектам константный участок легкой цепи представляет собой константный участок легкой каппа- или лямбда-цепи, например, константный участок каппа-цепи человека или константный участок лямбда-цепи человека.
[0103] Как упоминалось выше, аминокислотная последовательность VH и/или VL может быть, например, на 85%, 90%, 95%, 96%, 97%, 98% или 99% сходной с последовательностью, приведенной выше, и/или содержать 1, 2, 3, 4, 5 или более замен, например, консервативных замен, по сравнению с последовательностью, приведенной в данном документе. Антитело к ASCT2, содержащее участки VH и VL с определенным процентом сходства с областью VH или областью VL или предусматривающее одну или несколько замен, например, консервативных замен, можно получить с помощью мутагенеза (например, сайт-направленного или ПЦР-опосредованного мутагенеза) молекул нуклеиновых кислот, кодирующих участки VH и/или VL, описанные в данном документе, с последующей проверкой кодируемого измененного антитела в отношении связывания с ASCT2 и, необязательно, проверкой в отношении сохранения функции с применением функциональных анализов, описанных в данном документе.
[0104] Сродство (аффинность) или авидность антитела к антигену можно определить экспериментально с помощью любого подходящего хорошо известного из уровня техники способа, например, проточной цитометрии, твердофазного иммуноферментного анализа (ELISA), или радиоиммунологического анализа (RIA) или кинетических анализов (например, анализа KINEXA® или BIACORE™). Можно без затруднения применять анализы в формате прямого связывания, а также анализы в формате конкурентного связывания. (См., например, Berzofsky et al., "Antibody-Antigen Interactions" в Fundamental Immunology, Paul, W. E., Ed., Raven Press: New York, N.Y. (1984); Kuby, Immunology, W. H. Freeman and Company: New York, N.Y. (1992) и описанные в данном документе способы.) Измеряемая аффинность конкретного взаимодействия антитело-антиген может варьироваться при измерении в различных условиях (например, концентрации солей, pH, температуре). Таким образом, измерения аффинности и других параметров связывания антигена (например, KD или Kd, Kon, Koff) проводят со стандартизированными растворами антитела и антигена, и стандартизированным буфером, известным из уровня техники.
[0105] В некоторых вариантах осуществления антитело к ASCT2 или его антиген-связывающий фрагмент могут связываться с ASCT2-экспрессирующими клетками при IC50 ниже чем примерно 500 нМ, ниже чем примерно 350 нМ, ниже чем примерно 250 нМ, ниже чем примерно 150 нМ, ниже чем примерно 100 нМ, ниже чем примерно 75 нМ, ниже чем примерно 60 нМ, ниже чем примерно 50 нМ, ниже чем примерно 40 нМ, ниже чем примерно 30 нМ, ниже чем примерно 20 нМ, ниже чем примерно 15 нМ, ниже чем примерно 10 нМ, ниже чем примерно 5 нМ, ниже чем примерно 1 нМ, ниже чем примерно 500 пМ, ниже чем примерно 350 пМ, ниже чем примерно 250 пМ, ниже чем примерно 150 пМ, ниже чем примерно 100 пМ, ниже чем примерно 75 пМ, ниже чем примерно 60 пМ, ниже чем примерно 50 пМ, ниже чем примерно 40 пМ, ниже чем примерно 30 пМ, ниже чем примерно 20 пМ, ниже чем примерно 15 пМ, ниже чем примерно 10 пМ или ниже чем примерно 5 пМ согласно измерениям с использованием проточной цитометрии.
III. Связывающие молекулы, которые связываются с тем же эпитопом, что и антитела к ASCT2 и их антиген-связывающие фрагменты
[0106] В некоторых вариантах осуществления в данном раскрытии предложено антитело к ASCT2, которое связывается с тем же эпитопом, что и антитела к ASCT2, описываемые в данном документе. Термин "эпитоп" относится к детерминанте белка-мишени, способной связываться с антителом данного изобретения. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или боковые цепи сахаров, и обычно обладают специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не с последними, утрачивается в присутствии денатурирующих растворителей. Такие антитела можно идентифицировать на основании их способности перекрестно конкурировать (например, конкурентно подавлять связывание на статистически значимом уровне) с такими антителами, как описываются в данном документе, в стандартных анализах связывания ASCT2 или анализах активности.
[0107] Соответственно, в одном варианте осуществления данного изобретения предложены антитела к ASCT2 и их антиген-связывающие фрагменты, например, моноклональные антитела, которые конкурируют при связывании с ASCT2 с другим антителом к ASCT2 или его антиген-связывающим фрагментом данного изобретения, таким как мышиные моноклональные антитела 17c10 или 1e8, или гуманизированными вариантами, как раскрыто в данном документе. Способность тестируемого антитела ингибировать связывание, например, антитела 17c10 или 1e8, демонстрирует, что тестируемое антитело может конкурировать с данным антителом за связывание с ASCT2; при этом такое антитело может, в соответствии с теорией, не имеющей ограничительного характера, связываться с тем же или родственным (например, структурно сходным или пространственно близким) эпитопом на ASCT2, что и антитело к ASCT2 или его антиген-связывающий фрагмент, с которыми оно конкурирует. В одном варианте осуществления предложено антитело к ASCT2 или его антиген-связывающий фрагмент, которые связываются с тем же эпитопом на ASCT2, что и, например, мышиные моноклональные антитела 17c10 или 1e8.
IV. Получение антител к ASCT2 и их антиген-связывающих фрагментов
[0108] Моноклональные антитела к ASCT2 можно получать с применением способов с использованием гибридомы, например, таковых, описанных Kohler and Milstein, Nature 256:495 (1975). При применении способа гибридомы мышь, хомячка или другое подходящее животное-хозяина иммунизируют, как описано выше, чтобы вызвать выработку лимфоцитами антител, которые будут специфически связываться с иммунизирующим антигеном. Лимфоциты также можно иммунизировать in vitro. После иммунизации лимфоциты выделяют и сливают с подходящей линией клеток миеломы, например, с применением полиэтиленгликоля, с образованием клеток гибридомы, которые затем можно выборочно отделить от не подвергшихся слиянию лимфоцитов и клеток миеломы. Гибридомы, которые вырабатывают моноклональные антитела, специфически направленные против выбранного антигена, как определяется с помощью иммунопреципитации, иммуноблоттинга или с использованием анализа связывания in vitro (например, радиоиммунологического анализа (RIA), твердофазного иммуноферментного анализа (ELISA), затем можно размножать либо в культуре in vitro с использованием стандартных способов (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986), либо in vivo в виде асцитных опухолей у животных. Затем моноклональные антитела можно очищать из культуральной среды или асцитной жидкости с применением известных способов.
[0109] Альтернативно, моноклональные антитела к ASCT2 также можно получать с применением способов рекомбинантной ДНК, как описано в патенте США № 4816567. Полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых В-клеток или клетки гибридомы, например, с помощью RT-PCR с использованием олигонуклеотидных праймеров, которые специфически амплифицируют гены, кодирующие тяжелую и легкую цепи антитела, и их последовательность определяют с помощью обычных процедур. Выделенные полинуклеотиды, кодирующие тяжелую и легкую цепи, затем клонируют в подходящие векторы экспрессии, которые при трансфекции в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в других случаях не вырабатывают белок, представляющий собой иммуноглобулин, обеспечивают выработку моноклональных антител клетками-хозяевами. Также рекомбинантные моноклональные антитела к ASCT2 или их антиген-связывающие фрагменты требуемых видов можно выделить с использованием библиотек фагового дисплея, экспрессирующих CDR требуемых видов, как описано (McCafferty et al., Nature 348:552-554 (1990); Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
[0110] Полинуклеотид(-ы), кодирующий(ие) антитело к ASCT2 или его антиген-связывающий фрагмент, можно дополнительно модифицировать с помощью целого ряда различных способов с применением технологии рекомбинантной ДНК для получения альтернативных антител. В некоторых вариантах осуществления константные домены легкой и тяжелой цепей, например, из мышиного моноклонального антитела, можно заменить 1) на такие участки, например, из человеческого антитела, с получением химерного антитела или 2) на отличный от иммуноглобулина полипептид с получением составного антитела. В некоторых вариантах осуществления константные участки подвергают усечению или делеции с получением требуемого фрагмента антитела из моноклонального антитела. Сайт-направленный мутагенез или мутагенез высокой плотности в отношении вариабельного участка можно применять для оптимизации специфичности, аффинности и т.д. моноклонального антитела.
[0111] В определенных вариантах осуществления антитело к ASCT2 или его антиген-связывающий фрагмент представляют собой антитело человека или его антиген-связывающий фрагмент. Человеческие антитела можно получать напрямую с помощью различных методик, известных из уровня техники. Можно получать иммортализованные B-лимфоциты человека, иммунизированные in vitro или выделенные у иммунизированного индивидуума, у которого вырабатываются антитела к антигену-мишени. См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., J. Immunol. 147 (1):86-95(1991); патент США № 5750373.
[0112] Также антитело человека к ASCT2 или его антиген-связывающий фрагмент могут быть отобраны из фаговой библиотеки, при этом в такой фаговой библиотеке экспрессируются антитела человека, как описано, например, у Vaughan et al., Nat. Biotech. 14:309-314 (1996); Sheets et al., Proc. Natl. Acad. Sci. USA 95:6157-6162 (1998); Hoogenboom and Winter, J. Mol. Biol. 227:381 (1991); и Marks et al., J. Mol. Biol. 222:581 (1991). Методики создания и применения фаговых библиотек антител также описаны в патентах США №№ 5969108, 6172197, 5885793, 6521404; 6544731; 6555313; 6582915; 6593081; 6300064; 6653068; 6706484 и 7264963, а также в Rothe et al., J. Molec. Biol., 376:1182-1200 (2008), каждый из которых включен посредством ссылки во всей своей полноте.
[0113] Стратегии созревания аффинности и стратегии перестановки цепей известны в данной области и могут использоваться для получения высокоаффинных антител человека или их антиген-связывающих фрагментов. См. Marks et al., BioTechnology 10:779-783 (1992), включенные ссылкой во всей своей полноте.
[0114] В некоторых вариантах осуществления моноклональное антитело к ASCT2 может представлять собой гуманизированное антитело. Также можно применять способы конструирования, гуманизации или изменения поверхности антител, не являющихся антителами человека, или антител человека, и они хорошо известны из уровня техники. Гуманизированное, с измененной поверхностью или подобным образом сконструированное антитело может иметь один или несколько аминокислотных остатков, отличных от таковых человеческого происхождения, например, без ограничения мыши, крысы, кролика, обезьяны или другого млекопитающего. Эти аминокислотные остатки, не являющиеся аминокислотными остатками человека, заменяют остатками, часто называемыми "импортированными" остатками, которые, как правило, взяты из "импортированного" вариабельного, константного или другого домена известной последовательности человека. Такие импортированные последовательности можно применять для снижения иммуногенности или снижения, повышения или модификации связывания, аффинности (сродства), скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полувыведения или любых других подходящих характеристик, известных из уровня техники. В целом, остатки CDR непосредственно и в наиболее значительной степени участвуют во влиянии на связывание ASCT2. Соответственно, сохраняются часть или все из последовательностей CDR, не относящихся или относящихся к человеку, тогда как последовательности вариабельных и константных областей, не относящихся к человеку, могут быть заменены на человеческие или другие аминокислотные последовательности.
[0115] Антитела также необязательно можно гуманизировать, изменять поверхность, конструировать, или антитела человека можно конструировать с сохранением высокой аффинности к антигену ASCT2 и других предпочтительных биологических свойств. Для достижения данной цели гуманизированные (или человеческие) или сконструированные антитела к ASCT2 и антитела с измененной поверхностью можно необязательно получать посредством способа с анализом исходных последовательностей и гуманизированных и сконструированных различными подходами продуктов с использованием трехмерных моделей исходных, сконструированных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известны специалистам в данной области техники. Существуют компьютерные программы, в которых иллюстрируются и отображаются возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулина-кандидата. Рассмотрение этих изображений позволяет проанализировать вероятную роль остатков в функционировании последовательности-кандидата иммуноглобулина, т.e. проанализировать остатки, которые влияют на способность иммуноглобулина-кандидата связывать его антиген, такой как ASCT2. Таким образом, остатки FW можно выбирать и комбинировать из консенсусной и импортированной последовательностей так, чтобы обеспечить требуемые характеристики антитела, такие как повышенная аффинность к антигену(ам)-мишени.
[0116] Гуманизацию, изменение поверхности или конструирование антител к ASCT2 или их антиген-связывающих фрагментов согласно настоящему изобретению можно осуществлять с применением любого известного способа, такого как, но не ограничиваясь им, описан у Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); Verhoeyen et al., Science 239:1534 (1988), Sims et al., J. Immunol. 151, 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987); Carter et al., Proc. Natl. Acad. Sci. USA 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993); в патентах США №№ 5639641, 5723323; 5976862; 5824514; 5817483; 5814476; 5763192; 5723323; 5766886; 5714352; 6204023; 6180370; 5693762; 5530101; 5585089; 5225539; 4816567, 7557189; 7538195 и 7342110; Международных заявках №№ PCT/US98/16280; PCT/US96/18978; PCT/US91/09630; PCT/US91/05939; PCT/US94/01234; PCT/GB89/01334; PCT/GB91/01134; PCT/GB92/01755; Международных заявках на патент №№ WO90/14443; WO90/14424; WO90/14430; и Европейских заявках на патент №№ EP 229246; каждый из этих документов в полном объеме включен в данный документ с помощью ссылки, включая цитируемые в них ссылки.
[0117] Гуманизированные антитела к ASCT2 и их антиген-связывающие фрагменты также можно получать с использованием трансгенных мышей, содержащих локусы иммуноглобулинов человека, которые способны после иммунизации вырабатывать полный спектр антител человека при отсутствии выработки эндогенных иммуноглобулинов. Этот подход описан в патентах США №№ 5545807; 5545806; 5569825; 5625126; 5633425 и 5661016.
[0118] В определенных вариантах осуществления предоставлен фрагмент антитела к ASCT2. Известны различные методики получения фрагментов антител. Традиционно эти фрагменты получают посредством протеолитического расщепления интактных антител, как описано, например, у Morimoto et al., J. Biochem. Biophys. Meth. 24:107-117 (1993) и Brennan et al., Science 229:81 (1985). Согласно определенным вариантам осуществления фрагменты антител к ASCT2 получают рекомбинантным путем. Все Fab-, Fv- и scFv-фрагменты антител могут экспрессироваться и секретироваться E. coli или другими клетками-хозяевами, что обеспечивает таким образом получение больших количеств этих фрагментов. Такие фрагменты антител к ASCT2 также можно выделять из фаговых библиотек антител, обсуждаемых выше. Фрагменты антител к ASCT2 также могут представлять собой линейные антитела, описанные в патенте США № 5641870. Другие методики получения фрагментов антител будут очевидны практикующему специалисту.
[0119] В соответствии с настоящим изобретением методики можно адаптировать для получения одноцепочечных антител, специфичных в отношении ASCT2. См., например, патент США № 4946778). Кроме того, способы можно адаптировать для создания экспрессионных библиотек Fab, что позволяет быстро и эффективно идентифицировать моноклональные Fab-фрагменты с требуемой специфичностью в отношении ASCT2 или их производных, фрагментов, аналогов или гомологов. См., например, Huse et al., Science 246:1275-1281 (1989). Фрагменты антител можно получать с помощью методик, известных из уровня техники, включая, но не ограничиваясь ими: F(ab')2-фрагмент, получаемый за счет расщепления молекулы антитела пепсином; Fab-фрагмент, получаемый за счет восстановления дисульфидных мостиков F(ab')2-фрагмента, Fab-фрагмент, получаемый за счет обработки молекулы антитела папаином и восстанавливающим средством; или Fv-фрагменты.
[0120] В определенных аспектах антитело к ASCT2 или его антиген-связывающий фрагмент можно модифицировать с целью увеличения его периода полувыведения из крови. Этого можно достичь, например, посредством введения эпитопа, связывающегося с рецептором реутилизации, в антитело или фрагмент антитела с помощью мутации соответствующей области в антителе или фрагменте антитела, или посредством введения эпитопа в пептидную метку, которую затем сливают с антителом или фрагментом антитела на любом из концов или в середине (например, с помощью синтеза ДНК или пептида), либо с помощью мутации YTE. Из уровня техники известны другие способы увеличения периода полувыведения антитела или его антиген-связывающего фрагмента из сыворотки крови, например, конъюгирование с гетерологичной молекулой, такой как PEG.
[0121] Модифицированные антитела к ASCT2 или их антиген-связывающие фрагменты, как предложено в данном документе, могут содержать вариабельный участок любого типа, который обеспечивает связывание антитела или полипептида с ASCT2. В связи с этим вариабельный участок может содержаться или может происходить от млекопитающего любого типа, у которого может быть вызван гуморальный ответ и выработка иммуноглобулинов против представляющего интерес антигена. Таким образом, вариабельный участок антитела к ASCT2 или его антиген-связывающего фрагмента может происходить, например, от человека, мыши, отличного от человека примата (например, макаков-крабоедов, макаков и т.д.) или представителя семейства волчьих. Согласно некоторым вариантам осуществления как вариабельные, так и константные участки модифицированных антител к ASCT2 или их антиген-связывающих фрагментов происходят от человека. Согласно другим вариантам осуществления вариабельные участки совместимых антител (обычно происходящие от источника, отличного от человека) можно сконструировать или специфически оптимизировать с целью улучшения свойств связывания или снижения иммуногенности молекулы. В связи с этим вариабельные участки, применимые в настоящем изобретении, могут быть гуманизированы или иным образом изменены посредством включения импортируемых аминокислотных последовательностей.
[0122] Согласно определенным вариантам осуществления вариабельные домены как тяжелых, так и легких цепей антитела к ASCT2 или его антиген-связывающего фрагмента изменены посредством по меньшей мере частичного замещения одного или нескольких CDR и/или посредством частичного замещения каркасного участка и изменения последовательности. Хотя CDR могут быть получены из антитела того же класса или даже подкласса, что и антитело, из которого получены каркасные участки, предусматривается, что CDR будут получены из антитела другого класса и согласно некоторым вариантам осуществления - из антитела от другого вида. Для передачи антиген-связывающей способности одного вариабельного домена другому замещение всех CDR полными CDR из донорного вариабельного участка не является необходимым. Напротив, необходимым является только перенос тех остатков, которые являются необходимыми для сохранения активности антиген-связывающего сайта. С учетом пояснений, изложенных в патентах США №№ 5585089, 5693761 и 5693762, получение функционального антитела со сниженной иммуногенностью путем обычного экспериментирования находится в пределах компетенции специалиста в данной области техники.
[0123] Безотносительно к изменениям в вариабельном участке, специалистам в данной области техники будет понятно, что модифицированные антитела к ASCT2 или их антиген-связывающие фрагменты данного изобретения будут включать в себя антитела (например, полноразмерные антитела или их антиген-связывающие фрагменты), в которых по меньшей мере часть одного или нескольких доменов константного участка были удалены или иным образом изменены с обеспечением требуемых биохимических характеристик, таких как усиленная локализация в опухоли или сокращенный период полувыведения из сыворотки крови, по сравнению с антителом примерно с такой же иммуногенностью, содержащим нативный или неизмененный константный участок. Согласно некоторым вариантам осуществления константный участок модифицированных антител будет содержать константный участок человеческого происхождения. Модификации константного участка, совместимые с этим изобретением, включают добавления, делеции или замены одной или нескольких аминокислот в одном или нескольких доменах. То есть раскрытые в данном документе модифицированные антитела могут содержать изменения или модификации одного или нескольких из трех константных доменов тяжелой цепи (CH1, CH2 или CH3) и/или константного домена легкой цепи (CL). Согласно некоторым вариантам осуществления предполагаются модифицированные константные участки, в которых частично или полностью удалены один или несколько доменов. Согласно некоторым вариантам осуществления модифицированные антитела будут содержать конструкции или варианты с удаленным доменом, в которых полный CH2-домен был удален (ΔCH2-конструкции). В некоторых вариантах осуществления исключенный домен константного участка может быть замещен коротким аминокислотным спейсером (например, из 10 остатков), что обеспечивает некоторую гибкость молекулы, которую обычно придает отсутствующий константный участок.
[0124] Помимо их конфигурации, из уровня техники известно, что константный участок опосредует некоторые эффекторные функции. Например, антитела связываются с клетками посредством Fc-участка, при этом сайт связывания Fc-рецептора на Fc-участке антитела связывается с Fc-рецептором (FcR) клетки. Существует ряд Fc-рецепторов, являющихся специфичными в отношении антител различных классов, включая IgG (гамма-рецепторы), IgE (эта-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc-рецепторами на поверхностях клеток запускает ряд важных и разнообразных биологических ответов, включая поглощение и разрушение нагруженных антителами частиц, клиренс иммунных комплексов, лизис нагруженных антителами клеток-мишеней клетками-киллерами (называемый антителозависимой клеточно-опосредованной цитотоксичностью или ADCC), высвобождение медиаторов воспаления, плацентарный перенос и регуляцию выработки иммуноглобулинов.
[0125] В некоторых вариантах осуществления антитело к ASCT2 или его антиген-связывающий фрагмент обеспечивают измененные эффекторные функции, которые в свою очередь влияют на биологические параметры введенного антитела или его антиген-связывающего фрагмента. Например, делеция или инактивация (с помощью точечных мутаций или других средств) домена константного участка может уменьшать степень связывания циркулирующего модифицированного антитела с Fc-рецепторами. В других случаях модификации константного участка, соответствующие настоящему изобретению, могут ослаблять связывание комплемента и таким образом сокращать период полувыведения из крови и уменьшать неспецифичную связь конъюгированного цитотоксина. Еще несколько модификаций константного участка можно применять для устранения дисульфидных связей или олигосахаридных фрагментов, что обеспечивает возможность усиления локализации в связи с повышенной специфичностью по отношению к антигену или гибкостью антитела. Аналогичным образом модификации константного участка в соответствии с данным изобретением можно легко осуществлять, применяя хорошо известные методики биохимической или молекулярной инженерии, которые находятся в пределах компетенции специалиста в данной области техники.
[0126] В определенных вариантах осуществления ASCT2-связывающая молекула, то есть антитело или его антиген-связывающий фрагмент, не обладает одной или несколькими эффекторными функциями. К примеру, в некоторых вариантах осуществления антитело или его антиген-связывающий фрагмент не обладают активностью в виде антителозависимой клеточной цитотоксичности (ADCC) и/или активностью в виде комплементзависимой цитотоксичности (CDC). В определенных вариантах осуществления антитело к ASCT2 или его антиген-связывающий фрагмент не связываются с Fc-рецептором и/или факторами комплемента. В определенных вариантах осуществления антитело или его антиген-связывающий фрагмент не обладают эффекторной функцией.
[0127] В определенных вариантах осуществления антитело к ASCT2 или его антиген-связывающий фрагмент можно конструировать для слияния СН3-домена непосредственно с шарнирным участком соответствующих модифицированных антител или их фрагментов. В других конструкциях можно вставить пептидный спейсер между шарнирным участком и модифицированными CH2 и/или CH3-доменами. Например, можно экспрессировать совместимые конструкции, в которых CH2-домен был удален и оставшийся CH3-домен (модифицированный или немодифицированный) соединяется с шарнирным участком с помощью спейсера из 5-20 аминокислот. Такой спейсер можно добавлять, к примеру, чтобы убедиться, что регуляторные элементы константного домена остаются свободными и доступными или сохраняется гибкость шарнирного участка. Аминокислотные спейсеры могут в некоторых случаях оказаться иммуногенными и вызывать нежелательный иммунный ответ в отношении конструкции. Соответственно, в некоторых вариантах осуществления любой спейсер, добавленный в конструкцию, может быть относительно неиммуногенным или вовсе не будет включен с целью сохранения требуемых биохимических свойств модифицированных антител.
[0128] Наряду с делецией целых доменов константного участка, антитела к ASCT2 или их антиген-связывающие фрагменты, предложенные в данном документе, можно модифицировать посредством частичной делеции или замены нескольких или даже одной аминокислоты в константном участке. Например, мутации одной аминокислоты в выбранных областях CH2-домена может быть достаточно, чтобы существенно ослабить связывание Fc и тем самым усилить локализацию в опухоли. Аналогичным образом, один или несколько доменов константных участков, которые регулируют эффекторную функцию (например, связывание C1Q комплемента), могут быть полностью или частично удалены. Такие частичные делеции константных участков могут улучшать выбранные характеристики антитела или его антиген-связывающего фрагмента (например, период полувыведения из крови), сохраняя при этом другие требуемые функции, ассоциированные с отсутствием изменения представляющего интерес домена константного участка. Кроме того, константные участки раскрываемых антител к ASCT2 и их антиген-связывающих фрагментов можно модифицировать посредством мутации или замены одной или нескольких аминокислот, что улучшает профиль полученной конструкции. В связи с этим можно блокировать активность, обеспечиваемую консервативным сайтом связывания (например, Fc-связывания), при этом существенно сохраняя конфигурацию и иммуногенный профиль модифицированного антитела или его антиген-связывающего фрагмента. Определенные варианты осуществления могут включать добавление одной или нескольких аминокислот к константному участку для улучшения требуемых характеристик, таких как ослабление или усиление эффекторной функции или обеспечение присоединения большего количества цитотоксинов или углеводов. В таких вариантах осуществления могут потребоваться вставка или повторение специфических последовательностей, полученных из выбранных доменов константных участков.
[0129] Настоящее изобретение дополнительно охватывает варианты и эквиваленты, которые практически гомологичны мышиным, химерным, гуманизированным и человеческим антителам к ASCT2 или их антиген-связывающим фрагментам, изложенным в данном документе. Они могут содержать, например, мутации в виде консервативных замен, т.е. замену одной или нескольких аминокислот на сходные аминокислоты. Например, консервативная замена относится к замене аминокислоты на другую из того же общего класса, как, например, одной кислой аминокислоты на другую кислую аминокислоту, одной основной аминокислоты на другую основную аминокислоту или одной нейтральной аминокислоты на другую нейтральную аминокислоту. Из уровня техники хорошо известно, что подразумевается под консервативной заменой аминокислоты.
[0130] Антитело к ASCT2 или его антиген-связывающий фрагмент можно дополнительно модифицировать, чтобы они содержали дополнительные химические фрагменты, не являющиеся в обычных условиях частью белка. Данные дериватизированные фрагменты могут улучшать растворимость, биологическое полувыведение или абсорбцию белка. Данные фрагменты могут также уменьшать или устранять любые требуемые побочные эффекты белков и т. п. Обзор таких фрагментов можно найти в Remington's Pharmaceutical Sciences, 22nd ed., Ed. Lloyd V. Allen, Jr. (2012).
V. Конъюгаты антитела к ASCT2
[0131] В данном раскрытии далее предложены антитело к ASCT2 или его фрагмент, как описывается выше, конъюгированные с гетерологичным средством. В контексте настоящего изобретения "конъюгированный" означает связанный посредством ковалентной или ионной связи. В некоторых аспектах средство может представлять собой противомикробное средство, терапевтическое средство, пролекарство, пептид, белок, фермент, липид, модификатор биологического ответа, фармацевтическое средство, лимфокин, гетерологичное антитело или его фрагмент, детектируемую метку, PEG или комбинацию двух или более из любых указанных средств. В некоторых вариантах осуществления такие ASCT2-связывающие молекулы представляют собой ASCT2-ADC.
[0132] Так, в настоящем изобретении также предложены ADC, содержащие антитело к ASCT2, раскрываемое в данном документе, дополнительно содержащие по меньшей мере одно цитотоксическое средство. В некоторых аспектах ADC дополнительно содержит по меньшей мере один необязательный спейсер. В некоторых аспектах по меньшей мере один спейсер представляет собой пептидный спейсер. В некоторых аспектах по меньшей мере один спейсер представляет собой непептидный спейсер.
[0133] Цитотоксическое средство или цитотоксин могут быть любой молекулой, известной в области техники, которая подавляет или препятствует выполнению функции клеток и/или вызывает разрушение клеток (гибель клеток), и/или оказывает противоопухолевые/антипролиферативные эффекты. Известно несколько классов цитотоксических средств, которые потенциально могут использоваться в молекулах ADC. Они включают, но не ограничиваются данным перечнем, аманитины, ауристатины, дауномицины, доксорубицины, дуокармицины, доластатины, ендиины, лекситропсины, таксаны, пуромицины, майтанзиноиды, алкалоиды барвинка, тубулизины и пирролобензодиазепины (ПБД или PBD). Примерами таких цитотоксических средств являются AFP, MMAF, MMAE, AEB, AEVB, ауристатин E, паклитаксел, доцетаксел, CC-1065, SN-38, топотекан, морфолино-доксорубицин, ризоксин, цианоморфолинодоксорубицин, доластатин-10, эхиномицин, комбретастатин, калихимицин, майтанзин, DM-1, винбластин, метотрексат и нетропсин, и их производные и аналоги. Дополнительные раскрытия, касающиеся цитотоксинов, пригодных для применения в ADC, можно найти, например, в опубликованных международных заявках на патент №№ WO 2015/155345 и WO 2015/157592, включенных в данный документ посредством ссылки во всей своей полноте.
[0134] В одном варианте осуществления цитотоксическое средство представляет собой тубулизин или производное тубулизина. Тубулизин А имеет следующую химическую структуру:
[0135] Тубулизины являются представителями класса природных веществ, выделенных из видов миксобактерий (Sasse et al., J. Antibiot. 53:879-885 (2000)). Как средства, взаимодействующие с цитоскелетом, тубулизины являются митотическими ядами, которые ингибируют полимеризацию тубулина и приводят к блокированию клеточного цикла и апоптозу (Steinmetz et al., Chem. Int. Ed. 43:4888-4892 (2004); Khalil et al., Chem. Biochem. 7:678-683 (2006); Kaur et al., Biochem. J. 396: 235-242 (2006)). Используемое в данном документе выражение "тубулизин" относится в целом и по отдельности к природным тубулизинам и к аналогам и производным тубулизинов. Иллюстративные примеры тубулизинов раскрыты, например, в WO2004005326A2, WO2012019123A1, WO2009134279A1, WO2009055562A1, WO2004005327A1, US7776841, US7754885, US20100240701, US7816377, US20110021568 и US20110263650, которые включены в данный документ посредством ссылки. Следует понимать, что такие производные включают в себя, например, пролекарства тубулизина, или тубулизин, который включает один или несколько видов защиты или защитных групп, один или несколько связывающих фрагментов.
[0136] В некоторых аспектах тубулизин представляет собой тубулизин 1508, также называемый здесь "AZ1508" и описываемый более подробно в WO 2015157594, включенной в данный документ посредством ссылки, причем он имеет следующую структуру:
[0137] В другом варианте осуществления цитотоксическое средство может представлять собой пирролобензодиазепин (РВD или ПБД) или производное ПБД. ПБД перемещается в ядро, где он сшивает ДНК, предотвращая репликацию в ходе деления ядра, повреждая ДНК за счет однонитевых разрывов, и впоследствии приводя к гибели клетки. Некоторые ПБД способны распознавать и связываться с определенными последовательностями ДНК; предпочтительной последовательностью является PuGPu. Общая структура для ПБД:
[0138] ПБД отличаются числом, типом и положением заместителей как в их ароматических А кольцах, так и в пиррольных С кольцах, а также степенью насыщения С колец. В B-кольце присутствуют либо имин (N=C), либо карбиноламин (NH-CH(OH)), либо метиловый эфир карбиноламина (NH-CH(OMe)) в положении N10-C11, которое является электрофильным центром, ответственным за алкилирование ДНК. Все известные природные продукты имеют (S)-конфигурацию в хиральном положении C11a, которая обеспечивает им правовращательный поворот, если смотреть от C-кольца в направлении A-кольца. Это придает им подходящую трехмерную форму для изомерной спиральности с малой бороздой ДНК B-формы, приводя к плотному прилеганию в сайте связывания (Kohn, In Antibiotics III. Springer-Verlag, New York, pp. 3-11 (1975); Hurley and Needham-VanDevanter, Acc. Chem. Res., 19, 230-237 (1986)). Их способность образовывать продукт присоединения в малой борозде позволяет им вмешиваться в преобразования ДНК, и поэтому они могут использоваться в качестве противоопухолевых средств.
[0139] Первый противоопухолевый ПБД антибиотик - антрамицин - был открыт в 1965 г. (Leimgruber et al., J. Am. Chem. Soc. 87:5793-5795 (1965); Leimgruber et al., J. Am. Chem. Soc. 87:5791-5793 (1965)). С тех пор был обнаружен ряд ПБД, встречающихся в природе, и было разработано более 10 путей синтеза для получения различных аналогов (Thurston et al., Chem. Rev. 1994:433-465 (1994); Antonow, D. и Thurston, D.E., Chem. Rev. 111:2815-2864 (2011)). Представители данного семейства включают аббемицин (Hochlowski et al., J. Antibiotics 40:145-148 (1987)), шикамицин (chicamycin) (Konishi et al., J. Antibiotics 37:200-206 (1984)), DC-81 (Japanese Patent 58-180 487; Thurston et al., Chem. Brit. 26:767-772 (1990); Bose et al., Tetrahedron 48:751-758 (1992)), мазетрамицин (Kuminoto et al., J. Antibiotics 33:665-667 (1980)), неотрамицины A и B (Takeuchi et al., J. Antibiotics 29:93-96 (1976)), поротрамицин (Tsunakawa et al., J. Antibiotics 41:1366-1373 (1988)), протракарцин (Shimizu et al., J. Antibiotics 29:2492-2503 (1982); Langley and Thurston, J. Org. Chem. 52:91-97 (1987)), сибаномицин (DC-102)(Hara et al., J. Antibiotics 41:702-704 (1988); Itoh et al., J. Antibiotics 41:1281-1284 (1988)), сибиромицин (Leber et al., J. Am. Chem. Soc. 110:2992-2993 (1988)) и томамицин (Arima et al., J. Antibiotics 25:437-444 (1972)). ПБД и содержащие их ADC также описаны в публикациях международных заявок на патент №№ WO 2015/155345 и WO 2015/157592, включенных посредством ссылки в данный патент во всей своей полноте.
[0140] В некоторых аспектах ПБД представляет собой ПБД 3249, также называемый здесь "SG3249" и описываемый более подробно в WO 2014/057074, включенной в данный документ посредством ссылки, причем он имеет следующую структуру:
[0141] В некоторых аспектах ПБД представляет собой ПБД 3315, также называемый здесь "SG3315" и описываемый более подробно в WO 2015/052322, включенной в данный документ посредством ссылки, причем он имеет следующую структуру:
[0142] Антитела к ASCT2 и их антиген-связывающие фрагменты, раскрываемые в данном документе, можно конъюгировать с гетерологичными средствами, используя сайт-специфические или несайт-специфические способы конъюгирования. В некоторых аспектах ADC содержит одну, две, три, четыре или более терапевтических частей. В некоторых аспектах все терапевтические части одинаковы.
[0143] Обычные стратегии конъюгирования антител или их антиген-связывающих фрагментов основаны на случайном конъюгировании полезной нагрузки с антителом или фрагментом по лизиновым или цистеиновым остаткам. Соответственно, в некоторых аспектах антитело или его антиген-связывающий фрагмент случайным образом конъюгированы со средством, например, путем частичного восстановления антитела или фрагмента, а затем реакцией с интересующим средством с присоединением линкерной группы или без нее. Антитело или фрагмент можно восстанавливать, используя дитиотреитол (DTT) или подобный восстановитель. Средство с присоединенной линкерной группой или без нее можно затем добавлять с молярным избытком к восстановленному антителу или фрагменту в присутствии ДМСО (DMSO). После конъюгирования можно вводить избыток свободного цистеина для гашения непрореагировавшего средства. Реакционную смесь можно затем очищать и производить замену буфера на PBS.
[0144] В других аспектах сайт-специфическое конъюгирование терапевтических частей с антителами с использованием реакционноспособных аминокислотных остатков в конкретных положениях дает однородные препараты ADC с одинаковой стехиометрией. Сайт-специфическое конъюгирование может происходить по цистеиновому остатку или не нейтральной аминокислоте. В одном варианте осуществления цитотоксическое или визуализирующее средство конъюгируют с антителом или его антиген-связывающим фрагментом по меньшей мере по одному цистеиновому остатку. В некоторых аспектах каждая терапевтическая часть химически конъюгирована с боковой цепью аминокислоты в определенном положении по Kabat в Fc-участке. В некоторых вариантах осуществления цитотоксическое или визуализирующее средство конъюгируют с антителом или его антиген-связывающим фрагментом путем замещения цистеина по меньшей мере в одном из положений 239, 248, 254, 273, 279, 282, 284, 286, 287, 289, 297, 298, 312, 324, 326, 330, 335, 337, 339, 350, 355, 356, 359, 360, 361, 375, 383, 384, 389, 398, 400, 413, 415, 418, 422, 440, 441, 442, 443 и 446, где нумерация соответствует EU индексу по Kabat. В некоторых аспектах конкретные положения согласно Kabat представляют собой 239, 442 или оба из них. В некоторых аспектах определенными положениями являются положение 442 согласно Kabat, аминокислотная вставка между положениями 239 и 240 согласно Kabat, или оба из них. В некоторых аспектах средство конъюгируют с антителом или его антиген-связывающим фрагментом по тиол-малеимидной связи. В некоторых аспектах боковая цепь аминокислоты представляет собой сульфгидрильную боковую цепь.
[0145] В одном варианте осуществления ASCT2-связывающая молекула, например, ASCT2-ADC, антитело к ASCT2 или их антиген-связывающий фрагмент, доставляет цитотоксическую полезную нагрузку в ASCT2-экспрессирующие клетки и ингибирует или подавляет пролиферацию по меньшей мере на 10%, или по меньшей мере на 20%, или по меньшей мере на 30%, или по меньшей мере на 40%, или по меньшей мере на 50%, или по меньшей мере на 60%, или по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90% или примерно на 100%. Клеточную пролиферацию можно анализировать с помощью известных в данной области методик, которые позволяют измерять скорость деления клеток и/или фракцию клеток в популяции клеток, проходящих деление, и/или скорость утраты клеток из популяции клеток в связи с терминальной дифференцировкой или гибелью клеток (например, включение тимидина).
VI. Полинуклеотиды, кодирующие ASCT2-связывающие молекулы, и их экспрессия
[0146] В настоящем раскрытии предложены полинуклеотиды, содержащие последовательности нуклеиновой кислоты, кодирующие полипептид, который специфично связывается с ASCT2, или его антиген-связывающий фрагмент. Например, изобретение предлагает полинуклеотид, содержащий последовательность нуклеиновой кислоты, которая кодирует антитело к ASCT2 или кодирует антиген-связывающий фрагмент такого антитела. Полинуклеотиды данного изобретения могут находиться в форме РНК или в форме ДНК. ДНК включает кДНК, геномную ДНК и синтетическую ДНК и может быть двунитевой или однонитевой, при этом если она однонитевая, то может представлять собой кодирующую нить или некодирующую (антисмысловую) нить.
[0147] В определенных вариантах осуществления полинуклеотид может быть выделенным. В определенных вариантах осуществления полинуклеотид может быть практически чистым. В определенных вариантах осуществления полинуклеотид может представлять собой кДНК или происходить от кДНК. В определенных вариантах осуществления полинуклеотид может быть получен рекомбинантным путем. В определенных вариантах осуществления полинуклеотид может содержать кодирующую последовательность для зрелого полипептида, слитую в той же самой рамке считывания с полинуклетидом, который способствует, например, экспрессии и секреции полипептида из клетки-хозяина (например, лидерную последовательность, которая функционирует как секреторная последовательность для контроля транспорта полипептида из клетки). Полипептид с лидерной последовательностью представляет собой белок-предшественник и может иметь лидерную последовательность, отщепляемую клеткой-хозяином с образованием зрелой формы полипептида. Полинуклеотиды также могут кодировать ASCT2-связывающий белок-предшественник, который представляет собой зрелый белок с дополнительными аминокислотными остатками на 5'-конце.
[0148] В настоящем раскрытии далее предложен выделенный полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VH антитела, где VH содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
[0149] Помимо этого, в раскрытии далее предложен выделенный полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VL антитела, где VL содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 и SEQ ID NO: 8.
[0150] В определенных вариантах осуществления в настоящем раскрытии предложен выделенный полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VН антитела, при этом VН содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 1, и нуклеиновую кислоту, кодирующую VL антитела, при этом VL содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 2. В определенных вариантах осуществления в настоящем раскрытии предложен выделенный полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VН антитела, при этом VН содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 3, и нуклеиновую кислоту, кодирующую VL антитела, при этом VL содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 4. В определенных вариантах осуществления в настоящем раскрытии предложен выделенный полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VН антитела, при этом VН содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 5, и нуклеиновую кислоту, кодирующую VL антитела, при этом VL содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 6. В определенных вариантах осуществления в настоящем раскрытии предложен выделенный полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VН антитела, при этом VН содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 7, и нуклеиновую кислоту, кодирующую VL антитела, при этом VL содержит аминокислотную последовательность, которая по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или 100% идентична эталонной аминокислотной последовательности SEQ ID NO: 8.
[0151] В определенных аспектах антитело или его антиген-связывающий фрагмент, содержащие VH или VL, кодируемые полинуклеотидом, как описано выше, могут специфично связываться с ASCT2, например, ASCT2 человека или макака-крабоеда. В определенных случаях такие антитело или его антиген-связывающий фрагмент могут специфично связываться с тем же эпитопом, что и антитело или его антиген-связывающий фрагмент, содержащие VH и VL в 17c10 или 1e8. В определенных аспектах в настоящем раскрытии предложен полинуклеотид или комбинация полинуклеотидов, кодирующих связывающую молекулу, например, антитело или его антиген-связывающий фрагмент, которые специфично связываются с ASCT2.
[0152] Дополнительно предложен вектор, содержащий полинуклеотид, описанный выше. Подходящие векторы описаны в данном документе и известны специалистам в данной области.
[0153] В определенных аспектах в настоящем раскрытии предложена композиция, например, фармацевтическая композиция, содержащая полинуклеотид или вектор, как описано выше, необязательно дополнительно содержащая один или несколько носителей, разбавителей, наполнителей или других добавок.
[0154] В композиции полинуклеотидов, как описано выше, полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VH, и полинуклеотид, содержащий нуклеиновую кислоту, кодирующую VL, могут находиться в одном векторе или могут находиться на отдельных векторах. Соответственно, в настоящем раскрытии предусмотрен один или несколько векторов, содержащих композицию полинуклеотидов, описанную выше.
[0155] В настоящем раскрытии дополнительно предусмотрена клетка-хозяин, содержащая полинуклеотид, композицию полинуклеотидов или вектор, предусматриваемые выше, где клетка-хозяин в некоторых случаях может экспрессировать антитело или его антиген-связывающий фрагмент, которые специфично связываются с ASCT2. Такую клетку-хозяина можно использовать в способе получения антитела или его антиген-связывающего фрагмента, предлагаемых в данном документе, при этом способ включает (a) культивирование клетки-хозяина и (b) выделение антитела или его антиген-связывающего фрагмента, экспрессируемых клеткой-хозяином.
[0156] В определенных вариантах осуществления полинуклеотиды содержат последовательность, кодирующую зрелый ASCT2-связывающий полипептид, например, антитело к ASCT2 или его антиген-связывающий фрагмент, слитую в той же рамке считывания с маркерной последовательностью, что делает возможной, например, очистку кодируемого полипептида. Например, маркерная последовательность может представлять собой гексагистидиновую метку, доставляемую вектором pQE-9, для обеспечения очистки слитого с маркером зрелого полипептида в случае хозяина-бактерии, или маркерная последовательность может представлять собой гемагглютининовую (HA) метку, полученную из белка гемагглютинина вируса гриппа, если используется хозяин-млекопитающее (например, клетки COS-7).
[0157] Также предложены варианты полинуклеотидов. Варианты полинуклеотидов могут содержать изменения в кодирующих участках, некодирующих участках или как в тех, так и в других. В некоторых вариантах осуществления варианты полинуклеотидов содержат изменения, которые приводят к "молчащим" заменам, добавлениям или делециям, но не меняют свойства или активность кодируемого полипептида. В некоторых вариантах осуществления варианты полинуклеотидов образуются в результате "молчащих" замен вследствие вырожденности генетического кода. Варианты полинуклеотидов можно получать в силу ряда причин, например, для оптимизации экспрессии кодонов для конкретного хозяина (замена кодонов в mРНК человека на кодоны, предпочтительные для хозяина-бактерии, такого как E. coli). Также преложены векторы и клетки, содержащие полинуклеотиды, описанные в данном документе.
[0158] В некоторых вариантах осуществления последовательность ДНК, кодирующая ASCT2-связывающую молекулу, может быть сконструирована при помощи химического синтеза с применением олигонуклеотидного синтезатора. Такие олигонуклеотиды можно конструировать на основе аминокислотной последовательности требуемого полипептида и отбирая те кодоны, которые являются предпочтительными для клетки-хозяина, в которой будут получать рекомбинантный полипептид, представляющий интерес. Для синтеза выделенной полинуклеотидной последовательности, кодирующей выделенный полипептид, представляющий интерес, можно применять стандартные способы. Например, полную аминокислотную последовательность можно применять для конструирования гена с возможной последовательностью, восстановленной по полипептиду. Затем можно синтезировать ДНК-олигомер, содержащий нуклеотидную последовательность, кодирующую конкретный выделенный полипептид. Например, можно синтезировать несколько небольших олигонуклеотидов, кодирующих части требуемого полипептида, а затем лигировать их. Отдельные олигонуклеотиды, как правило, содержат 5' или 3' "липкие" концы для комплементарной сборки.
[0159] Сразу после сборки (посредством синтеза, сайт-направленного мутагенеза или другого способа) полинуклеотидные последовательности, кодирующие конкретный выделенный полипептид, представляющий интерес, могут быть вставлены в вектор экспрессии и функционально связаны с контролирующей экспрессию последовательностью, соответствующей экспрессии белка в требуемом хозяине. Правильность сборки можно подтвердить, например, с помощью секвенирования нуклеотидов, рестрикционного картирования и/или экспрессии биологически активного полипептида в подходящем хозяине. Для получения высоких уровней экспрессии трансфицированного гена в хозяине ген можно функционально связать или ассоциировать с последовательностями контроля экспрессии на уровне транскрипции и трансляции, которые являются функциональными в выбранном хозяине для экспрессии.
[0160] В определенных вариантах осуществления рекомбинантные векторы экспрессии применяют для амплификации и экспрессии ДНК, кодирующей антитела к ASCT2 или их антиген-связывающие фрагменты. Рекомбинантные векторы экспрессии представляют собой реплицируемые ДНК-конструкции, которые имеют синтетические или полученные из кДНК фрагменты ДНК, кодирующие полипептидную цепь антитела к ASCT2 или/и его антиген-связывающий фрагмент, функционально связанные с подходящими элементами, регулирующими транскрипцию или трансляцию, полученными из генов млекопитающих, микроорганизмов, вирусов или насекомых. В основном транскрипционная единица содержит сборку из (1) генетического элемента или элементов, имеющих регуляторную роль в экспрессии генов, например, промоторы или энхансеры транскрипции, (2) структурной или кодирующей последовательности, которая транскрибируется в mРНК и транслируется в белок, и (3) соответствующих последовательностей начала и конца транскрипции и трансляции, подробно описанных в данном документе. Такие регуляторные элементы могут включать последовательность оператора для контроля транскрипции. Способность к репликации в хозяине обычно обеспечивается точкой начала репликации, при этом можно дополнительно встроить ген селекции для облегчения распознавания трансформантов. Участки ДНК являются функционально связанными, когда они функционально зависят друг от друга. Например, ДНК сигнального пептида (секреторная лидерная последовательность) функционально связана с ДНК полипептида, если она экспрессируется в виде предшественника, который участвует в секреции полипептида; промотор функционально связан с кодирующей последовательностью, если он контролирует транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы обеспечивать трансляцию. Структурные элементы, предназначенные для применения в дрожжевых системах экспрессии, включают лидерную последовательность, обеспечивающую секрецию из клетки транслируемого белка клеткой-хозяином. В качестве альтернативы, если рекомбинантный белок экспрессируется без лидерной или транспортной последовательности, белок может включать в себя N-концевой остаток метионина. Этот остаток может впоследствии быть необязательно отщеплен от экспрессируемого рекомбинантного белка с получением конечного продукта.
[0161] Выбор последовательности, контролирующей экспрессию, и вектора экспрессии будет зависеть от выбора хозяина. Можно использовать большое разнообразие комбинаций хозяин/вектор для экспрессии. Применимые векторы экспрессии для эукариотических хозяев включают в себя, например, векторы, содержащие последовательности, осуществляющие контроль экспрессии, из SV40, вируса папилломы крупного рогатого скота, аденовируса и цитомегаловируса. Применимые векторы экспрессии для хозяев-бактерий включают в себя известные бактериальные плазмиды, такие как плазмиды из E. coli, в том числе pCR1, pBR322, pMB9 и их производные, плазмиды для более широкого круга хозяев, такие как M13 и нитевидные фаги, содержащие однонитевую ДНК.
[0162] Подходящие клетки-хозяева для экспрессии ASCT2-связывающей молекулы включают клетки прокариотов, дрожжей, насекомых или высших эукариотов под контролем соответствующих промоторов. Прокариоты включают в себя грамотрицательные или грамположительные организмы, например, E. coli или бациллы. Клетки высших эукариотов включают в себя устойчивые линии клеток, происходящие от млекопитающих, описанные в данном документе. Можно также использовать бесклеточные системы трансляции. Дополнительную информацию касательно способов получения белка, в том числе получения антител, можно найти, например, в патентной публикации США № 2008/0187954, патентах США №№ 6413746 и 6660501, и международной патентной публикации № WO 04009823, каждая из которых включена тем самым в данный документ посредством ссылки во всей своей полноте.
[0163] Различные системы культур клеток млекопитающих или насекомых также можно преимущественно использовать для экспрессии рекомбинантных ASCT2-связывающих молекул. Экспрессию рекомбинантных белков можно осуществлять в клетках млекопитающих, поскольку такие белки в основном правильно свернуты, модифицированы соответствующим образом и полностью функциональны. Примеры подходящих линий клеток-хозяев млекопитающих включают HEK-293 и HEK-293T, линии клеток почки обезьяны COS-7, описанные Gluzman, (Cell 23:175 (1981), и другие линии клеток, в том числе, например, L-клетки, линии клеток C127, 3T3, яичника китайского хомячка (CHO), HeLa и BHK. Векторы экспрессии для млекопитающих могут содержать нетранскрибируемые элементы, такие как точка начала репликации, подходящий промотор и энхансер, связанные с геном, подлежащим экспрессии, и другие 5' и 3'-концевые фланкирующие нетранскрибируемые последовательности, а также 5'-концевые или 3'-концевые нетранслируемые последовательности, такие как необходимые сайты связывания рибосомы, сайт полиаденилирования, донорные и акцепторные сайты сплайсинга и последовательности терминации транскрипции. Бакуловирусные системы для получения гетерологичных белков в клетках насекомых рассматриваются в Luckow and Summers, BioTechnology 6:47 (1988).
[0164] ASCT2-связывающие молекулы, продуцируемые трансформированным хозяином, можно очистить согласно любому подходящему способу. Такие стандартные способы включают хроматографию (например, ионообменную, аффинную и эксклюзионную колоночную хроматографию), центрифугирование, очистку на основе различной растворимости или любую другую стандартную методику очистки белков. Аффинные метки, такие как гексагистидин, мальтозосвязывающий домен, последовательность белка оболочки вируса гриппа и глутатион-S-трансфераза, можно присоединять к белку для облегчения очистки путем пропускания через соответствующую аффинную колонку. Выделенные белки можно также характеризовать с физической точки зрения с применением таких методик, как протеолиз, ядерный магнитный резонанс и рентгеноструктурная кристаллография.
[0165] Например, надосадочные жидкости из систем, которые секретируют рекомбинантный белок в культуральную среду, можно вначале сконцентрировать с помощью коммерчески доступного фильтра для концентрирования белков, например, установки для ультрафильтрации Amicon или Pellicon от Millipore. После стадии концентрирования концентрат можно нанести на подходящую матрицу для очистки. В качестве альтернативы можно использовать анионообменную смолу, например, матрицу или субстрат, имеющие подвешенные диэтиламиноэтильные (DEAE) группы. Матрицы могут быть акриламидными, агарозными, декстрановыми, целлюлозными или относиться к другим типам, обычно используемым для очистки белков. В качестве альтернативы можно использовать стадию катионного обмена. Подходящие катионообменники включают в себя различные нерастворимые матрицы, содержащие сульфопропильные или карбоксиметильные группы. В конечном счете можно применять одну или несколько стадий обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC), в которых используют гидрофобные среды для RP-HPLC, например, силикагель с боковыми метильными или другими алифатическими группами, для дополнительной очистки ASCT2-связывающей молекулы. Некоторые или все из вышеизложенных стадий очистки в различных комбинациях можно также использовать для получения однородного рекомбинантного белка.
[0166] Рекомбинантную ASCT2-связывающую молекулу, продуцированную в бактериальной культуре, можно выделить, например, с помощью изначального экстрагирования из клеточных осадков, с последующей одной или несколькими стадиями концентрирования, высаливания, ионообменной или эксклюзионной хроматографии в водной среде. На конечных стадиях очистки можно использовать высокоэффективную жидкостную хроматографию (HPLC). Клетки микроорганизмов, используемые для экспрессии рекомбинантного белка, можно разрушать с помощью любого удобного способа, в том числе проведения циклов замораживания-размораживания, обработки ультразвуком, механического разрушения или применения средств для лизиса клеток.
[0167] Известные из уровня техники способы очистки антител и других белков также включают, например, способы, описанные в публикациях патентов США №№ 2008/0312425, 2008/0177048 и 2009/0187005, каждый из которых в полном объеме включен в данный документ ссылкой.
VII. Фармацевтические композиции и способы введения
[0168] Способы получения и введения предусмотренных в данном документе ASCT2-связывающих молекул нуждающемуся в этом субъекту хорошо известны специалистам в данной области или могут быть без труда определены ими. Путь введения ASCT2-связывающей молекулы, может быть, например, пероральным, парентеральным, ингаляционным или местным. Термин "парентеральный", используемый в данном документе, включает, например, внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. Хотя явно подразумевается, что все эти формы введения находятся в пределах объема данного изобретения, другим примером формы для введения будет раствор для инъекций, в частности, для внутривенной или внутриартериальной инъекции или капельного вливания. Как правило, подходящая фармацевтическая композиция может содержать буфер (например, ацетатный, фосфатный или цитратный буфер), поверхностно-активное вещество (например, полисорбат), необязательно стабилизатор (например, человеческий альбумин) и т.д. В других способах, совместимых с идеями данного документа, ASCT2-связывающие молекулы, предложенные в данном документе, можно доставлять непосредственно к месту локализации нежелательной клеточной популяции, увеличивая тем самым воздействие терапевтического средства на пораженную ткань. В одном варианте осуществления введение осуществляется непосредственно в дыхательные пути, например, посредством ингаляции или интраназального введения.
[0169] Как обсуждается в данном документе, ASCT2-связывающие молекулы, предложенные в данном документе, можно вводить в фармацевтически эффективном количестве в случае in vivo лечения болезней или расстройств, характеризующихся свехэкспрессией ASCT2, таких как рак ободочной и прямой кишки, HNSCC, рак простаты, рак легкого, рак поджелудочной железы, меланома, рак эндометрия, гемобластоз (AML, MM, DLBCL) и онкологические заболевания, включающие CSC. В этом отношении следует иметь в виду, что раскрываемые связывающие молекулы можно составлять таким образом, чтобы облегчать введение и способствовать стабильности активного средства. Фармацевтические композиции в соответствии с настоящим изобретением могут содержать фармацевтически приемлемый, нетоксичный, стерильный носитель, такой как физиологический солевой раствор, нетоксичные буферы, консерванты и т.д. Для целей настоящей заявки фармацевтически эффективное количество ASCT2-связывающей молекулы означает количество, достаточное для достижения эффективного связывания с мишенью и для достижения положительного эффекта, например, облегчения симптомов заболевания или состояния или для обнаружения вещества или клетки. Подходящие составы для применения в терапевтических способах, раскрытых в данном документе, описаны в Remington's Pharmaceutical Sciences 22nd ed., Ed. Lloyd V. Allen, Jr. (2012).
[0170] Определенные фармацевтические композиции, предусматриваемые в данном документе, можно вводить перорально в виде приемлемой лекарственной формы, включающей, например, капсулы, таблетки, водные суспензии или растворы. Определенные фармацевтические композиции также можно вводить с помощью назального аэрозоля или путем ингаляции. Такие композиции можно получать в виде растворов в солевом растворе с использованием бензилового спирта или других подходящих консервантов, стимуляторов всасывания для повышения биодоступности и/или других традиционных солюбилизирующих или диспергирующих средств.
[0171] Количество ASCT2-связывающей молекулы, которое может быть объединено с материалами-носителями для получения стандартной лекарственной формы, будет варьироваться в зависимости от получающего лечение субъекта и конкретного способа введения. Композицию можно вводить в виде однократной дозы, многократных доз или в течение установленного периода времени посредством инфузии. Схемы дозирования также можно подбирать для обеспечения оптимального требуемого ответа.
[0172] В соответствии с объемом настоящего раскрытия ASCT2-связывающие молекулы можно вводить человеку или другому животному в соответствии с вышеупомянутыми способами лечения в количестве, достаточном для получения терапевтического эффекта. ASCT2-связывающие молекулы, предложенные в данном документе, можно вводить такому человеку или другому животному в традиционной лекарственной форме, полученной при объединении ASCT2-связывающей молекулы по настоящему изобретению с традиционным фармацевтически приемлемым носителем или разбавителем в соответствии с известными методиками. Форма и свойство фармацевтически приемлемых носителя или разбавителя могут быть обусловлены количеством активного ингредиента, с которым они будут объединены, путями введения и другими хорошо известными переменными. Также можно использовать смесь, содержащую один или несколько видов ASCT2-связывающих молекул, например, ASCT2-ADC, антител к ASCT2 или их антиген-связывающих фрагментов, вариантов или производных по данному изобретению.
[0173] Под "терапевтически эффективной дозой или количеством" или "эффективным количеством" подразумевается количество ASCT2-связывающей молекулы, которое при введении вызывает положительный терапевтический ответ в отношении лечения пациента с заболеванием или состоянием, подлежащим лечению.
[0174] Терапевтически эффективные дозы композиций настоящего изобретения для лечения заболеваний или расстройств, при которых происходит сверхэкспрессия ASCT2, такие как определенные онкологические заболевания, изменяются в зависимости от ряда разных факторов, включая пути введения, целевой участок, физиологическое состояние пациента, является ли пациент человеком или животным и другие вводимые лекарственные препараты. Обычно пациентом является человек, однако также можно лечить млекопитающих, отличных от человека, в том числе трансгенных млекопитающих. Для оптимизации безопасности и эффективности дозировки для лечения можно подбирать с применением обычных способов, известных специалистам в данной области.
[0175] Количество по меньшей мере одной ASCT2-связывающей молекулы для введения может быть легко определено специалистом обычной квалификации в данной области без излишних экспериментов с учетом настоящего раскрытия. Факторы, влияющие на способ введения и соответствующее количество по меньшей мере одной ASCT2-связывающей молекулы, включают, но не ограничиваются этим перечнем, тяжесть заболевания, историю болезни и возраст, рост, вес, состояние здоровья и физическое состояние индивидуума, получающего терапевтическое лечение. Аналогичным образом, количество ASCT2-связывающей молекулы для введения будет зависеть от способа введения и от того, будет ли субъект получать одну дозу или несколько доз этого средства.
[0176] В этом раскрытии также предложено применение ASCT2-связывающей молекулы, например, ASCT2-ADC, антитела к ASCT2 или его антиген-связывающего фрагмента, варианта или производного, для применения в лечении заболевания или расстройства, характеризующегося свехэкспрессией ASCT2, такого как рак ободочной и прямой кишки, HNSCC, рак простаты, рак легкого, рак поджелудочной железы или гемобластоз.
[0177] В этом раскрытии также предложено применение ASCT2-связывающей молекулы, например, ASCT2-ADC, антитела к ASCT2 или его антиген-связывающего фрагмента, варианта или производного, для производства лекарственного средства для лечения заболевания или расстройства, характеризующегося свехэкспрессией ASCT2, такого как рак ободочной и прямой кишки, HNSCC, рак простаты, рак легкого, рак поджелудочной железы или гемобластоз.
VIII. Диагностика
[0178] В этом раскрытии далее предложен диагностический способ, применимый в ходе определения диагноза заболеваний, характеризующихся свехэкспрессией ASCT2, таких как определенные онкологические заболевания, который включает в себя измерение уровня экспрессии ASCT2 в клетках или ткани, полученных от индивидуума, и сравнение измеренного уровня экспрессии со стандартной экспрессией ASCT2 в нормальных клетках или ткани, в результате чего повышенный по сравнению со стандартным уровень экспрессии указывает на то, что расстройство может подвергаться лечению ASCT2-связывающей молекулой, предложенной в данном документе.
[0179] ASCT2-связывающие молекулы, предложенные в данном документе, можно применять для определения уровней ASCT2-белка в биологическом образце, используя классические иммуногистологические способы, известные специалистам в данной области. См. Jalkanen et al., J. Cell Biol. 105:3087-3096 (1987); Jalkanen, et al., J. Cell. Biol. 101:976-985 (1985). Другие способы на основе антител, пригодные для обнаружения экспрессии белка ASCT2, включают иммунологические анализы, такие как ELISA, иммунопреципитацию или вестерн-блоттинг.
[0180] Под "анализом уровня экспрессии полипептида ASCT2" подразумевается качественное или количественное измерение или оценка уровня полипептида ASCT2 в первом биологическом образце либо напрямую (например, путем определения или оценки абсолютного уровня белка), либо относительно (например, путем сравнения с уровнем ассоциированного с заболеванием полипептида во втором биологическом образце). Уровень экспрессии полипептида ASCT2 в первом биологическом образце можно измерить или оценить и сравнить со стандартным уровнем полипептида ASCT2, при этом стандарт берут из второго биологического образца, полученного от индивидуума, не имеющего нарушения, или определяют путем усреднения уровней от группы индивидуумов, не имеющих нарушения. Как будет понятно в данной области техники, после того как "стандартный" уровень полипептида ASCT2 становится известен, его можно применять многократно в качестве стандарта для сравнения.
[0181] Под "биологическим образцом" подразумевается любой биологический образец, полученный от индивидуума, линии клеток, культуры ткани или другого источника клеток, потенциально экспрессирующего ASCT2. Способы получения биоптатов тканей и жидкостей организма от млекопитающих хорошо известны в данной области техники.
IX. Наборы, содержащие ASCT2-связывающие молекулы
[0182] В этом раскрытии далее предложены наборы, которые содержат ASCT2-связывающую молекулу, описанную в данном документе, и которую можно применять для осуществления способов, описанных в данном документе. В определенных вариантах осуществления набор содержит по меньшей мере одно очищенное антитело к ASCT2 или его антиген-связывающий фрагмент в одном или нескольких контейнерах. В некоторых вариантах осуществления набор содержит по меньшей мере один очищенный ASCT2-ADC в одном или нескольких контейнерах. В некоторых вариантах осуществления наборы содержат все компоненты, необходимые и/или достаточные для выполнения анализа на обнаружение, в том числе все контрольные образцы, указания для выполнения анализов и любое необходимое программное обеспечение для анализа и представления результатов. Специалист в данной области техники без труда поймет, что раскрываемые ASCT2-связывающие молекулы могут быть легко включены в один из уже применяемых форматов набора, которые хорошо известны из уровня техники.
X. Иммунологические анализы
[0183] ASCT2-связывающие молекулы, предложенные в данном документе, можно применять в анализах для иммуноспецифичного связывания в любом способе, известном в области техники. Иммунологические анализы, которые можно применять, включают без ограничения системы конкурентного и неконкурентного анализа с использованием таких методик, как вестерн-блоттинг, радиоиммунологические анализы (RIA), ELISA, ELISPOT, иммунологические "сэндвич"-анализы, анализы иммунопреципитации, реакции преципитации, реакции диффузионной преципитации в геле, анализы иммунодиффузии, анализы агглютинации, анализы фиксации комплемента, иммунорадиометрические анализы, флуоресцентные иммунологические анализы и иммунологические анализы с белком A. Такие анализы являются стандартными и хорошо известны из уровня техники. См., например, Ausubel et al., eds, (1994) Current Protocols in Molecular Biology (John Wiley & Sons, Inc., NY) Vol. 1, который включен в данный документ посредством ссылки во всей своей полноте.
[0184] ASCT2-связывающие молекулы, предложенные в данном документе, можно использовать в гистологических анализах, например, на основе иммунофлуоресценции, иммуноэлектронной микроскопии или неиммунологических анализов, например, для обнаружения ASCT2 или его консервативных вариантов или пептидных фрагментов in situ. Обнаружение in situ можно выполнять путем взятия у пациента гистологического образца и нанесения на него меченой ASCT2-связывающей молекулы, например, нанесением поверх биологического образца меченой ASCT2-связывающей молекулы. Благодаря применению такой процедуры можно определить не только присутствие ASCT2 или его консервативных вариантов или пептидных фрагментов, но также и его распределение в исследуемой ткани. Используя настоящее изобретение, специалисты обычной квалификации в данной области техники без труда поймут, что любой из широкого ряда гистологических способов (таких как процедуры окрашивания) можно модифицировать для того, чтобы добиться такого обнаружения in situ.
[0185] Связывающую активность определенной партии ASCT2-связывающей молекулы можно определить согласно хорошо известным способам. Специалисты в данной области техники смогут определить рабочие и оптимальные условия анализа для каждого определения с использованием стандартных экспериментов.
[0186] Способы и реагенты, подходящие для определения характеристик связывания выделенной ASCT2-связывающей молекулы, известны из уровня техники и/или их можно приобрести. Оборудование и программное обеспечение, разработанное для таких кинетических анализов, можно приобрести (например, программное обеспечение BIAcore®, BIAevaluation® от GE Healthcare; программное обеспечение KINEXA® от Sapidyne Instruments).
[0187] При осуществлении настоящего изобретения на практике будут использоваться, если не указано иное, традиционные методики клеточной биологии, культивирования клеток, молекулярной биологии, биологии трансгенных организмов, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в пределах компетентности специалиста в данной области. Такие методики в полном объеме объясняются в литературе. См., например, Sambrook et al., ed. (1989) Molecular Cloning A Laboratory Manual (2nd ed.; Cold Spring Harbor Laboratory Press); Sambrook et al., ed. (1992) Molecular Cloning: A Laboratory Manual, (Cold Springs Harbor Laboratory, NY); D. N. Glover ed., (1985) DNA Cloning, Volumes I and II; Gait, ed. (1984) Oligonucleotide Synthesis; Mullis et al., патент США № 4683195; Hames and Higgins, eds. (1984) Nucleic Acid Hybridization; Hames and Higgins, eds. (1984) Transcription And Translation; Freshney (1987) Culture Of Animal Cells (Alan R. Liss, Inc.); Immobilized Cells And Enzymes (IRL Press) (1986); Perbal (1984) A Practical Guide To Molecular Cloning; the treatise, Methods In Enzymology (Academic Press, Inc., N.Y.); Miller and Calos eds. (1987) Gene Transfer Vectors For Mammalian Cells, (Cold Spring Harbor Laboratory); Wu et al., eds., Methods In Enzymology, Vols. 154 and 155; Mayer and Walker, eds. (1987) Immunochemical Methods In Cell And Molecular Biology (Academic Press, London); Weir and Blackwell, eds., (1986) Handbook Of Experimental Immunology, Volumes I-IV; Manipulating the Mouse Embryo, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1986); и в Ausubel et al. (1989) Current Protocols in Molecular Biology (John Wiley and Sons, Baltimore, Md.).
[0188] Общие принципы конструирования антител изложены в Borrebaeck, ed. (1995) Antibody Engineering (2nd ed.; Oxford Univ. Press). Общие принципы конструирования белков изложены в Rickwood et al., eds. (1995) Protein Engineering, A Practical Approach (IRL Press at Oxford Univ. Press, Oxford, Eng.). Общие принципы касательно антител и связывания антител с гаптенами изложены в: Nisonoff (1984) Molecular Immunology (2nd ed.; Sinauer Associates, Sunderland, Mass.); и Steward (1984) Antibodies, Their Structure and Function (Chapman and Hall, New York, N.Y.). Кроме того, стандартные способы, применяемые в иммунологии, известные из уровня техники и не описанные специально, как правило, соответствуют изложенным в Current Protocols in Immunology, John Wiley & Sons, New York; Stites et al., eds. (1994) Basic and Clinical Immunology (8th ed; Appleton & Lange, Norwalk, Conn.) и Mishell and Shiigi (eds) (1980) Selected Methods in Cellular Immunology (W.H. Freeman and Co., NY).
[0189] Авторитетные справочные издания, в которых изложены общие принципы иммунологии, включают Current Protocols in Immunology, John Wiley & Sons, New York; Klein (1982) J., Immunology: The Science of Self-Nonself Discrimination (John Wiley & Sons, NY); Kennett et al., eds. (1980) Monoclonal Antibodies, Hybridoma: A New Dimension in Biological Analyses (Plenum Press, NY); Campbell (1984) "Monoclonal Antibody Technology" в Laboratory Techniques in Biochemistry and Molecular Biology, ed. Burden et al., (Elsevere, Amsterdam); Goldsby et al., eds. (2000) Kuby Immunology (4th ed.; H. Freemand & Co.); Roitt et al. (2001) Immunology (6th ed.; London: Mosby); Abbas et al. (2005) Cellular and Molecular Immunology (5th ed.; Elsevier Health Sciences Division); Kontermann and Dubel (2001) Antibody Engineering (Springer Verlan); Sambrook and Russell (2001) Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Press); Lewin (2003) Genes VIII (Prentice Hall 2003); Harlow and Lane (1988) Antibodies: A Laboratory Manual (Cold Spring Harbor Press); Dieffenbach and Dveksler (2003) PCR Primer (Cold Spring Harbor Press).
[0190] Все цитируемые в данном раскрытии ссылки включены в данный документ посредством ссылки во всей своей полноте. Кроме того, любые инструкции или каталоги производителя для любых продуктов, приведенных или упомянутых здесь, включены путем ссылки. Документы, включенные посредством ссылки в этот текст, или любые входящие в них учения могут быть использованы в практическом осуществлении настоящего изобретения. Документы, включенные посредством ссылки в этот текст, не признаются в качестве уровня техники.
XI. Варианты осуществления
[0191] Вариант осуществления 1. Антитело или его антиген-связывающий фрагмент, которые специфично связываются с эпитопом транспортного белка 2 переноса нейтральных аминокислот (ASCT2), где антитело или его антиген-связывающий фрагмент специфично связываются с тем же эпитопом ASCT2, что и антитело или его антиген-связывающий фрагмент, содержащие три определяющих комплементарность участка тяжелой цепи (HCDR) вариабельного участка тяжелой цепи (VH) и три определяющих комплементарность участка легкой цепи (LCDR) вариабельного участка легкой цепи (VL); где аминокислотная последовательность HCDR1 изложена в SEQ ID NO: 10; аминокислотная последовательность HCDR2 изложена в SEQ ID NO: 22; аминокислотная последовательность HCDR3 изложена в SEQ ID NO: 23; аминокислотная последовательность LCDR1 изложена в SEQ ID NO: 13; аминокислотная последовательность LCDR2 изложена в SEQ ID NO: 24; и аминокислотная последовательность LCDR3 изложена в SEQ ID NO: 25.
[0192] Вариант осуществления 2. Антитело или антиген-связывающий фрагмент по варианту осуществления 1, где антитело или его антиген-связывающий фрагмент содержат HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 10 или SEQ ID NO: 16; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 11 или SEQ ID NO: 17; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 12 или SEQ ID NO: 18; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 13 или SEQ ID NO: 19; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 14 или SEQ ID NO: 20; и LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 15 или SEQ ID NO: 21.
[0193] Вариант осуществления 3. Антитело или антиген-связывающий фрагмент по любому из вариантов осуществления 1 или 2, где VH содержит аминокислотную последовательность, выбранную из SEQ ID NO: 1; SEQ ID NO: 3; SEQ ID NO: 5 и SEQ ID NO: 7; и где VL содержит аминокислотную последовательность, выбранную из SEQ ID NO: 2; SEQ ID NO: 4; SEQ ID NO: 6 и SEQ ID NO: 8.
[0194] Вариант осуществления 4. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-3, где VH содержит аминокислотную последовательность, приведенную в SEQ ID NO: 5, а VL содержит аминокислотную последовательность, приведенную в SEQ ID NO: 6.
[0195] Вариант осуществления 5. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-3, где VH содержит аминокислотную последовательность SEQ ID NO: 7, а VL содержит аминокислотную последовательность SEQ ID NO: 8.
[0196] Вариант осуществления 6. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-5, где константный участок IgG содержит вставку цистеина (C) между серином (S) в положении 239 и V в положении 240.
[0197] Вариант осуществления 7. Антитело или антиген-связывающий фрагмент по варианту осуществления 6, где антитело содержит тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 9.
[0198] Вариант осуществления 8. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-7, где при связывании антитела с ASCT2 на клеточной поверхности антитело поглощается клеткой.
[0199] Вариант осуществления 9. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-8, которые содержат константный участок легкой цепи, выбранный из группы, состоящей из константного участка каппа-цепи человека и константного участка лямбда-цепи человека.
[0200] Вариант осуществления 10. Антитело или антиген-связывающий фрагмент по варианту осуществления 9, где антитело содержит константный участок каппа-цепи человека, приведенный в SEQ ID NO: 26.
[0201] Вариант осуществления 11. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-10, дополнительно конъюгированные с цитотоксином, выбранным из группы, состоящей из противомикробного средства, терапевтического средства, пролекарства, пептида, белка, фермента, липида, модификатора биологического ответа, фармацевтического средства, лимфокина, гетерологичного антитела, фрагмента гетерологичного антитела, детектируемой метки, полиэтиленгликоля (PEG), радиоизотопа и комбинации двух или более из любых указанных цитотоксинов.
[0202] Вариант осуществления 12. Антитело или антиген-связывающий фрагмент по варианту осуществления 11, которые конъюгированы с цитотоксином.
[0203] Вариант осуществления 13. Антитело или антиген-связывающий фрагмент по варианту осуществления 12, где цитотоксин выбирают из производного тубулизина и пирролобензодиазепина.
[0204] Вариант осуществления 14. Антитело или антиген-связывающий фрагмент по варианту осуществления 13, где производное тубулизина представляет собой тубулизин AZ1508.
[0205] Вариант осуществления 15. Антитело или антиген-связывающий фрагмент по варианту осуществления 13, где пирролобензодиазепин выбирают из SG3315 и SG3249.
[0206] Вариант осуществления 16. Антитело или антиген-связывающий фрагмент по варианту осуществления 15, где пирролобензодиазепин представляет собой SG3315.
[0207] Вариант осуществления 16A. Антитело или антиген-связывающий фрагмент по варианту осуществления 15, где пирролобензодиазепин представляет собой SG3249.
[0208] Вариант осуществления 17. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-16, где антитело связывается с ASCT2 человека или ASCT2 макака-крабоеда.
[0209] Вариант осуществления 18. Антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-17, где антитело специфично не связывается с ASCT1 человека.
[0210] Вариант осуществления 19. Фармацевтическая композиция, содержащая антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-18 и фармацевтически приемлемый носитель.
[0211] Вариант осуществления 20. Полинуклеотид или комбинация полинуклеотидов, кодирующих антитело или его антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-19.
[0212] Вариант осуществления 21. Вектор, содержащий полинуклеотид или комбинацию полинуклеотидов согласно варианту осуществления 20.
[0213] Вариант осуществления 22. Клетка-хозяин, содержащая полинуклеотид или комбинацию полинуклеотидов согласно пункту 20 или вектор по варианту осуществления 21.
[0214] Вариант осуществления 23. Антитело или его антиген-связывающий фрагмент, где антитело или антиген-связывающий фрагмент содержат HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 10; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 22; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 23; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 13; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 24; и LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 23, и где антитело или антиген-связывающий фрагмент конъюгированы с цитотоксином.
[0215] Вариант осуществления 23A. Антитело или его антиген-связывающий фрагмент, где антитело или антиген-связывающий фрагмент содержат HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 10; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 22; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 23; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 13; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 24; и LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, и где антитело или антиген-связывающий фрагмент конъюгировано с цитотоксином.
[0216] Вариант осуществления 24. Антитело или его антиген-связывающий фрагмент по варианту осуществления 23, где антитело или антиген-связывающий фрагмент содержат VH-домен, содержащий аминокислотную последовательность SEQ ID NO: 7, и VL-домен, содержащий аминокислотную последовательность SEQ ID NO: 8.
[0217] Вариант осуществления 24A. Антитело или его антиген-связывающий фрагмент по варианту осуществления 23, где антитело или антиген-связывающий фрагмент содержат VH-домен, содержащий аминокислотную последовательность SEQ ID NO: 5, и VL-домен, содержащий аминокислотную последовательность SEQ ID NO: 6.
[0218] Вариант осуществления 25. Антитело или антиген-связывающий фрагмент по варианту осуществления 23 или варианту осуществления 24, где цитотоксин выбирают из группы, состоящей из противомикробного средства, терапевтического средства, пролекарства, пептида, белка, фермента, липида, модификатора биологического ответа, фармацевтического средства, лимфокина, гетерологичного антитела, фрагмента гетерологичного антитела, детектируемой метки, полиэтиленгликоля (PEG), радиоизотопа и комбинации двух или более из любых указанных цитотоксинов.
[0219] Вариант осуществления 26. Антитело или антиген-связывающий фрагмент по варианту осуществления 23 или варианту осуществления 24, где цитотоксин выбирают из производного тубулизина и пирролобензодиазепина.
[0220] Вариант осуществления 27. Антитело или антиген-связывающий фрагмент по варианту осуществления 26, где производное тубулизина представляет собой тубулизин AZ1508.
[0221] Вариант осуществления 28. Антитело или антиген-связывающий фрагмент по варианту осуществления 26, где пирролобензодиазепин выбирают из SG3315 и SG3249.
[0222] Вариант осуществления 29. Антитело или антиген-связывающий фрагмент по варианту осуществления 28, где пирролобензодиазепин представляет собой SG3315.
[0223] Вариант осуществления 29A. Антитело или антиген-связывающий фрагмент по варианту осуществления 28, где пирролобензодиазепин представляет собой SG3249.
[0224] Вариант осуществления 30. Фармацевтическая композиция, содержащая антитело или антиген-связывающий фрагмент по вариантам осуществления 23-29 и фармацевтически приемлемый носитель.
[0225] Вариант осуществления 31. Способ получения антитела или его антиген-связывающего фрагмента, причем способ включает в себя культивирование клетки-хозяина по варианту осуществления 22; и выделение антитела или антиген-связывающего фрагмента.
[0226] Вариант осуществления 32. Диагностический реагент, содержащий антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-18 или 23-29.
[0227] Вариант осуществления 33. Набор, содержащий антитело или антиген-связывающий фрагмент по любому одному из вариантов осуществления 1-18 или 23-29, или композицию по варианту осуществления 19 или 30.
[0228] Вариант осуществления 34. Способ доставки средства к экспрессирующей ASCT2 клетке, причем способ включает в себя приведение в контакт клетки с антителом или антиген-связывающим фрагментом по любому одному из вариантов осуществления 23-29, где средство поглощается клеткой.
[0229] Вариант осуществления 35. Способ, вызывающий гибель экспрессирующей ASCT2 клетки, причем способ включает в себя приведение в контакт клетки с антителом или антиген-связывающим фрагментом по любому одному из вариантов осуществления 23-29, где антитело, конъюгированное с цитотоксином, вызывает гибель экспрессирующей ASCT2 клетки.
[0230] Вариант осуществления 36. Способ лечения онкологического заболевания, характеризующегося сверхэкспрессией ASCT2 у субъекта, причем способ включает введение субъекту, нуждающемуся в лечении, эффективного количества антитела или антиген-связывающего фрагмента по любому одному из вариантов осуществления 1-18 или 23-29, или композиции по варианту осуществления 19 или варианту осуществления 30.
[0231] Вариант осуществления 37. Способ по варианту осуществления 36, где онкологическое заболевание выбирают из группы, состоящей из рака ободочной и прямой кишки, плоскоклеточной карциномы головы и шеи (HNSCC), рака простаты, рака легкого, рака поджелудочной железы, меланомы, рака эндометрия и гемобластозов (AML, MM, DLBCL).
[0232] Вариант осуществления 37A. Способ по варианту осуществления 36, где онкологическое заболевание включает CSC.
[0233] Вариант осуществления 38. Способ по варианту осуществления 37, где гемобластозы выбирают из острого лимфобластного лейкоза (ALL); острого миелогенного лейкоза (AML); хронического лимфоцитарного лейкоза (CLL); хронического миелогенного лейкоза (CML); острого миеломоноцитарного лейкоза (AMoL); лимфом ходжкина; неходжкинской лимфомы и множественной миеломы.
[0234] Вариант осуществления 39. Способ определения уровня экспрессии ASCT2 в образце, причем способ включает в себя: приведение образца в контакт с антителом или его антиген-связывающим фрагментом по любому одному из вариантов осуществления 1-18 или 23-29, или композицией по варианту осуществления 19 или варианту осуществления 30, и обнаружение связывания антитела или его антиген-связывающего фрагмента с ASCT2 в образце.
[0235] Вариант осуществления 40. Способ по варианту осуществления 39, где образец представляет собой клеточную культуру.
[0236] Вариант осуществления 41. Способ по варианту осуществления 39, где образец представляет собой выделенную ткань.
[0237] Вариант осуществления 42. Способ по варианту осуществления 39, где образец взят у человека.
[0238] Вариант осуществления 43. Конъюгат антитела к ASCT2 и лекарственного средства (ASCT2-ADC), содержащий антитело или его антиген-связывающий фрагмент, содержащие HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 10; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 11; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 12; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 13; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 14; LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 15, и тубулизин AZ1508.
[0239] Вариант осуществления 44. ASCT2-ADC, содержащий антитело или его антиген-связывающий фрагмент, содержащие HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 10; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 11; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 12; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 13; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 14; LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 15, и ПБД SG3249.
[0240] Вариант осуществления 45. ASCT2-ADC, содержащий антитело или его антиген-связывающий фрагмент, содержащие HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 10; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 11; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 12; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 13; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 14; LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 15, и тубулизин, и ПБД SG3315.
[0241] Вариант осуществления 46. ASCT2-ADC, содержащий антитело или его антиген-связывающий фрагмент, содержащие HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 16; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 17; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 18; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 19; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 20; и LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 21, и тубулизин AZ1508.
[0242] Вариант осуществления 47. ASCT2-ADC, содержащий антитело или его антиген-связывающий фрагмент, содержащие HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 16; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 17; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 18; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 19; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 20; и LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 21, и ПБД SG3249.
[0243] Вариант осуществления 48. ASCT2-ADC, содержащий антитело или его антиген-связывающий фрагмент, содержащие HCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 16; HCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 17; HCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 18; LCDR1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 19; LCDR2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 20; и LCDR3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 21, и ПБД SG3315.
ПРИМЕРЫ
[0244] Следующие Примеры предлагаются в качестве иллюстрации, но не в качестве ограничения.
[0245] Варианты осуществления настоящего раскрытия могут быть дополнительно определены с помощью ссылки на следующие неограничительные примеры, в которых подробно описывается получение определенных антител по настоящему раскрытию и способы применения антител по настоящему раскрытию. Специалистам в данной области техники будет очевидно, что многочисленные модификации как материалов, так и способов, можно осуществлять на практике без отступления от объема настоящего раскрытия.
Пример 1. Экспрессия ASCT2 в нормальных человеческих тканях и раковых тканях
Анализ экспрессии белка ASCT2 в нормальной и раковой ткани с помощью IHC
[0246] Для оценки экспрессии белка ASCT2 проводили IHC на срезах из нормальной ткани человека и опухолевой ткани человека, фиксированных формальдегидом. После обработки цитратным буфером (pH=6,0) для извлечения антигена, исследовали действие кроличьего поликлонального антитела к ASCT2 (EMD Millipore, Billerica, MA; Кат. № ABN73) на ткани, следуя инструкции производителя. Оптимизацию протокола по инструкции проводили, используя клеточную линию HT29 в качестве положительного контроля, и клетки первичных гепатоцитов человека в качестве отрицательного контроля.
[0247] В нормальных тканях печени, сердца, пневмоцитов, клубочков почек и мозга окрашивания, ассоциированного с ASCT2, не наблюдалось.
Экспрессия ASCT2 в опухолях человека
[0248] Экспрессию ASCT2 оценивали с помощью IHC в ряде различных раковых тканей. Сильную мембранную экспрессию ASCT2 наблюдали у солидных опухолей, включая ткани карциномы толстой кишки, плоскоклеточной карциномы легкого, рака головы и шеи и рака простаты и гемабластозы, такие как AML, MM и DLBCL. Кроме того, высокую экспрессию ASCT2 наблюдали в тканях рака эндометрия яичника и тканях меланомы. В Таблице 2 ниже сведены данные об экспрессии ASCT2 в человеческих раковых тканях.
Таблица 2
Экспрессия ASCT2 в опухолях человека
легкого
[0249] Экспрессию ASCT2 наблюдали в раковых стволовых клетках из AML и MM. ASCT2 в раковых стволовых клетках оценивали с помощью проточной цитометрии, используя антитело 17c10 к ASCT2, конъюгированное с флуорофором Alexa 647. Экспрессия ASCT2 у пациентов с AML и MM была значительно выше, чем в нормальном костном мозге, как показано на ФИГ. 1A. Путем использования проточной цитометрии для сортировки различных популяций, таких как CD38+, CD38-, CD34+; CD34-; CD38+ и CD34+; и CD38- и CD34-, клетки изолировали и дополнительно охарактеризовывали свойства их стволовых клеток путем проведения клоногенного анализа на каждой субпопуляции. Нами было обнаружено, что только CD38+, CD34+ клетки образовывали колонии, что дополнительно подтверждает описанные в литературных источниках наблюдения (Lapidot T. et al., Nature 1994; 367(6464):645-8; Bonnet D. et al. Nat Med 1997; 3(7):730-7.). Экспрессию ASCT2 оценивали во всех описываемых выше субпопуляциях. На ФИГ. 1B показана высокая экспрессия ASCT2 в популяции лейкемических стволовых клеток, а именно CD38+, CD34+ популяции в образцах, взятых у пациентов с AML. Сходным образом, экспрессия ASCT2 также является высокой в популяциях основной массы или нелейкемических стволовых клеток в случае AML, как показано на ФИГ. 1C. Кроме того, экспрессию ASCT2 также оценивали в CD138+, CD19- (клетки плазмы) и CD138-, CD19+ (стволовые клетки) клетках опухолей MM. Гистограммы на ФИГ. 1C позволяют предположить, что экспрессия ASCT2 в клетках плазмы сильнее, чем в стволовых клетках MM. Данные подтверждают, что экспрессия ASCT2 наблюдалась в костном мозге в образцах, взятых у пациентов с AML и MM, в отличие от костного мозга, взятого у здорового донора. Кроме того, ASCT2 сверхэкспрессируется в лейкемических стволовых клетках (LSC) (CD34+/CD38+) в образцах, взятых у пациентов с AML. Помимо этого, клетки CD138+, CD19-, которые также являются клетками плазмы MM, демонстрируют более высокую экспрессию ASCT2 по сравнению с популяцией стволовых клеток (CD138-, CD19+).
[0250] Экспрессию ASCT2 также наблюдали в раковых стволовых клетках из опухолей поджелудочной железы. Фрагменты солидных опухолей поджелудочной железы расщепляли коллагеном III и готовили одноклеточную суспензию. Диссоциировавшие клетки окрашивали антителом на фоне белков клеточной поверхности - EpCAM, CD44, CD24, и используя антитело к ASCT2, описанное выше. Отличительные черты клеточного поверхностного белка для раковых стволовых клеток поджелудочной железы хорошо охарактеризованы. Было определено, что клетки EpCAM+ CD44+ CD24+ являются раковыми стволовыми клетками в опухолях поджелудочной железы (Li, C et al. Cancer Res. 2007;67:1030-1037). Пример экспрессии ASCT2 в популяции CSC (EpCAM+, CD44+, CD24+) показан на ФИГ. 1D. Применяя ту же стратегию, оценивали экспрессию ASCT2 в популяциях раковых стволовых клеток опухолей поджелудочной железы после обработки одной дозой ASCT2-PBD ADC или изотипического ADC контроля. На ФИГ. 1E показано, что ASCT2-PBD ADC уничтожает популяции раковых стволовых клеток. Приведенные здесь данные показывают, что нацеливание на ASCT2 будет эффективно не только в солидных опухолях, но также и в гемобластозах и стволовых клетках рака.
Пример 2. Получение антител к ASCT2
Иммунизация и получение гибридомы
[0251] Антитела к ASCT2 создавали иммунизацией ДНК (Chowdhury et al., J. Immunol. Methods 249:147, 2001) плазмиды, содержащей человеческий ген ASCT2. Ген человеческого ASCT2 клонировали в экспрессионную плазмиду pcDNA3.1 (Invitrogen, Carlsbad, CA). Восьминедельным VelocImmune II мышам (Regeneron, Tarrytown, NY) внутрикожно у основания хвоста каждую вторую неделю вводили по 100 мкг экспрессионной плазмиды ASCT2 с концентрацией 1 мг/мл в PBS. Пробы крови брали с 2-недельными интервалами, начиная со дня 28 после первой инъекции и анализировали на специфичные к ASCT2 антитела, используя проточную цитометрию. Серийные разведения проб крови инкубировали с клетками 293F, экспрессирующими либо ASCT2, либо не относящийся к нему поверхностный белок. На день 56 и 70 мышей с наиболее высокими титрами умерщвляли. Лимфоциты из лимфоузлов и селезенки выделяли и сливали с клеточной линией миеломы P3x/63Ag8.653 в соотношении 1:1, следуя способу слияния с полиэтиленгликолем (Roche Diagnostics, Indianapolis, IN). Слитые клетки отбирали в гипоксантин-аминоптерин-тимидин (HAT)-содержащей гибридомной ростовой среде.
Скрининговый анализ с помощью проточной цитометрии
[0252] Надосадочные жидкости гибридом исследовали на связывание с HEK 293F клетками, экспрессирующими ASCT2. Надосадочные жидкости, которые, как обнаружилось, специфично связывались с ASCT2-экспрессирующими HEK 293F клетками согласно результатам проточной цитометрии, дополнительно исследовали с целью подтвердить специфичное связывание с ASCT2 с использованием окрашивания проточной цитометрией ряда ASCT2-экспрессирующих раковых клеточных линий. В завершение, подтвержденные надосадочные жидкости преобразовывали в человеческие IgG1 для дальнейшего испытания на связывание.
Клонирование и экспрессия человеческих IgG mAb и Fab к ASCT2
[0253] Гибридомы субклонировали, используя предельное разведение. Надосадочные жидкости с IgG субклонами после аффинной очистки с белком А подвергали скринингу на ASCT2-специфичные антитела с помощью проточной цитометрии, как описано выше для родительских гибридом. мРНК субклонированных гибридом выделяли, используя набор Dynabeads mRNA Direct Kit (Invitrogen). Первую нить кДНК синтезировали, используя обратную транскриптазу SuperScript III (Invitrogen) и случайные гексамерные праймеры. Гены человеческих Ig VL и VH амплифицировали с помощью ПЦР с набором вырожденных Ig-праймеров Novagen® (EMD Millipore, Кат. № 69830). ПЦР-амплифицированные продукты VL и VH клонировали в плазмиду pCR2.1-TOPO (Invitrogen) и секвенировали. Гены VH и VL из каждой гибридомы повторно амплифицировали с помощью ПЦР, вводили сайты ферментной рестрикции для клонирования в человеческий вектор IgG-каппа pOE, где VL клонировали по сайту BssHII/BsiWI, составленному с человеческим c-каппа, а VH клонировали по сайту BsrGI/SalI, составленному с человеческим константным участком тяжелой цепи IgG-1 (или CH1 участком для создания Fab). Полученные pOE плазмиды подтверждали секвенированием ДНК.
[0254] Антитела к ASCT2 временно экспрессировали либо в клетках Hek293F (Invitrogen), либо в CHO-G22. Для экспрессии в клетках Hek293F выполняли трансфекцию, используя 293fectin™ (Invitrogen; Кат. № 12347-019), согласно инструкциям производителя. Клетки культивировали в среде для экспрессии FreeStyle™ 293 (Invitrogen; Кат. № 12338-018), и объем культуры удваивали на третий и шестой день после трансфекции. Трансфицированные Hek293F клетки культивировали в общей сложности одиннадцать дней. Для экспрессии в клетках CHO-G22, клетки трансфицировали, используя 25 кДа линейный полиэтиленимин (Polysciences, Warrington, PA) и следуя инструкции производителя. Клетки культивировали в среде CD CHO (Invitrogen), подкармливая через день питательным кормом, используемым в данной компании. Трансфицированные CHO-G22 клетки культивировали в общей сложности двенадцать дней.
[0255] После выделения с применением хроматографии с белком A полноразмерных человеческих IgG, связывание снова анализировали с помощью проточной цитометрии. На ФИГ. 2 приведена гистограмма, показывающая кратность изменения связывания изолированного человеческого IgG 1e8, 3f7, 5a2, 9b3, 10c3, 16b8, 17c10 и 17a10 с клетками, экспрессирующими человеческий ASCT2, в отличие от ложно-трансфицированных клеток. Как видно из фигуры, было обнаружено, что несколько полноразмерных человеческих IgG сохранили активность связывания с ASCT2.
Пример 3. ASCT2-связывающие антитела в качестве конъюгатов антитело-лекарственное средство (ADC)
Испытание цитотоксичности ASCT2-связывающих антител, опосредованной ADC
[0256] Чтобы подтвердить поглощение родительских антител и для прогноза о возможности доставки ими цитотоксичной нагрузки, родительские антитела испытывали в анализе поглощения антител Hum-ZAP (Advanced Targeting Systems, San Diego, CA) в соответствии с инструкциями изготовителя. Вкратце, ASCT2-положительные WiDr клетки засевали в планшеты в среду для культивации с плотностью 1000 клеток на лунку обработанных культурой тканей 96-луночных планшетов и позволяли прикрепиться в течение ночи при 37°C/5% CO2. Для приготовления исследуемых экземпляров каждое родительское антитело инкубировали со вторичным антителом (антителом козы к IgG человека), конъюгированным с инактивирующим рибосому белком - сапорином - в течение 30 минут при комнатной температуре с образованием вторичного конъюгата. Затем готовили серийное разведение этого вторичного конъюгата и вносили в лунки, содержащие клетки.
[0257] После инкубирования при 37°C/5% CO2 в течение 72 часов, использовали люминесцентный анализ жизнеспособности CellTiter-Glo® (Promega, Madison, WI) для определения относительной цитотоксичности. Вкратце, CellTiter-Glo® реагент вносили в каждую лунку и инкубировали в течение 10 минут при комнатной температуре, слегка встряхивая. Поглощение каждым образцом считывали при 560 нМ, используя люминометр Perkin Elmer EnVision®. Относительную скорость пролиферации (%) клеток, обработанных родительским антителом 1E8 или 17C10, антителом к ASCT2, химически связанным с сапорином (hIgG-сапорин), или изотипическим контролем, химически связанным с сапорином, сравнивали с относительной выживаемостью необработанных контрольных клеток. Как видно из ФИГ. 3A, относительная скорость пролиферации была ниже у клеток, обработанных антителами к ASCT2, химически не связанными с сапорином, чем у клеток, обработанных антителами, конъюгированными с сапорином.
Испытание цитотоксичности, опосредованной ADC, классически конъюгированных антител к ASCT2, нагруженных тубулизином
[0258] С целью подтвердить ADC-опосредованный лизис, вызываемый конъюгированными антителами к ASCT2, нагруженными тубулизином, лидерные антитела 1E8 и 17C10 напрямую конъюгировали с токсинами класса тубулизина, и цитотоксический лизис под действием конъюгированных антител испытывали на ASCT2-положительных клетках рака прямой кишки. Вкратце, SW48 клетки засевали в планшеты в среду для культивации с плотностью 1000 клеток на лунку обработанных культурой тканей 96-луночных планшетов и позволяли прикрепиться в течение ночи при 37°C/5% CO2. Для приготовления исследуемых экземпляров каждое антитело (ASCT2 лидеры 1E8 и 17C10 и изотипический контроль), конъюгированное с нагрузкой тубулизином, подвергали серийному разведению и вносили в соответствующую лунку. После инкубирования при 37°C/5% CO2 в течение 72 часов, использовали люминесцентный анализ жизнеспособности CellTiter-Glo® для определения относительной цитотоксичности, как описано выше.
[0259] Процент жизнеспособности клеток рассчитывали по следующей формуле: (средняя люминесценция обработанных образцов/средняя люминесценция контрольных образцов) × 100. Значения IC50 определяли с использованием анализа методом логистической нелинейной регрессии с помощью программного обеспечения GraphPad Prism. На ФИГ. 3B приведен график цитотоксичности анти-ASCT2 1 E8, анти-ASCT2 17C10 и изотипического контроля R347, классически конъюгированных с тубулизином AZ1508. Из фигуры видно, что оба антитела к ASCT2 имеют схожую цитотоксичность. Рассчитанные значения IC50 показаны в Таблице 3 ниже.
Таблица 3
ADC-опосредованный цитотоксический лизис под действием лидирующих антител к ASCT2, классически конъюгированных с тубулизином
Клонирование цистеиновых мутаций для сайт-специфичного конъюгировавния
[0260] Стандартные способы ПЦР с перекрывающимися праймерами использовали для введения цистеинового остатка между аминокислотами S239 и V240 в CH2 участок антител к ASCT2 1E8 и 17C10. Этот цистеин, обозначенный как "239-вставка" или "239i", будет служить в качестве сайта конъюгации для цитотоксических лекарственных средств при получении антител к ASCT2 ADC. Аминокислотная последовательность остова тяжелой цепи, содержащего вставку Maia, показана в SEQ ID NO: 9. Антитела, содержащие введенный в них цистеин, конъюгировали с нагрузкой из тубулизина (тубулизин AZ1508), или с нагрузкой из пирролобензодиазепина (ПБД) (SG3249 или SG3315), в основном как описано ниже.
Конъюгирование малеимид-содержащих лекарственных средств
[0261] Все соединения, оцененные для нагрузок в ADC (AZ1508, SG3249, SG3315), содержат линкер и малеимидную группу, которая легко подвергается конъюгированию с тиолсодержащим остатком антитела, образуя связь между тиольной и малеимидной группами. Цитотоксины, содержащие малеимидную группу (например, тубулизин 1508), можно конъюгировать с конкретными цистеиновыми остатками, введенными с помощью генной инженерии в антитела к ASCT2 данного изобретения (например, 17c10, 1e8). В качестве альтернативы или по выбору можно применять классические способы конъюгирования для присоединения цитотоксического средства к описанным антителам. Способы конъюгирования цитотоксинов с нативными лизиновыми и цистеиновыми остатками на антителах хорошо известны в данной области техники. Показательные способы сайт-специфичного (по введенным с помощью генной инженерии цистеиновым остаткам) и классического конъюгирования (по нативным цистеиновым остаткам) представлены ниже.
[0262] Показательный способ сайт-специфической конъюгации антитела с лекарственным средством включает этапы (a) снятия защитных групп с боковых цепей дериватизируемых аминокислот (например, цистеинов), (b) окисления, (c) конъюгирования с нагрузкой (например, с цитотоксическим средством, таким как тубулизин 1508) и (d) тонкой очистки путем удаления реагентов для конъюгирования и непрореагировавшей нагрузки. Например, конъюгацию с введенным с помощью генной инженерии цистеином можно провести путем составления антитела в 1X PBS с 1 мM этилендиаминтетрауксусной кислоты (EDTA). Мягкое восстановление используется для формирования свободных тиольных групп путем добавления сорока эквивалентов гидрохлорида Tris-(2-карбоксиэтил)фосфина на антитело с инкубацией при 37°C в течение трех часов. Три последовательных диализа в 1X PBS с 1 мM EDTA использовали для удаления гидрохлорида трис-(2-карбоксиэтил)фосфина. В альтернативном случае можно использовать обессоливающие колонки для удаления гидрохлорида трис-(2-карбоксиэтил)фосфина. Межцепочечным дисульфидным связям антитела позволяли заново образовываться путем добавления примерно 20 эквивалентов дегидроабиетиновой кислоты (dhAA) и инкубации в течение примерно четырех часов при комнатной температуре.
[0263] В качестве подготовки к конъюгированию к антителу к ASCT2 добавляли диметилсульфоксид до десяти процентов об./об. Добавляли восемь или двенадцать эквивалентов нагрузки тубулизина 1508 (для 2T и 4T нагрузки лекарственным средством, соответственно) в диметилсульфоксиде и смесь инкубировали при комнатной температуре примерно 1 час. В альтернативном случае, инкубирование можно проводить при 4°C в течение примерно 16 часов. Реакцию гасили добавлением примерно 4 мольных эквивалентов N-ацетилцистеина (NAC) на нагрузку (т.е. 32 или 48). Несвязанную нагрузку удаляли из конъюгированного антитела при помощи керамического гидроксиапатита в соответствии с рекомендациями изготовителя. Если необходимо, конечный продукт можно подвергать замене буфера. Для подтверждения чистоты и конъюгирования с тяжелой цепью конъюгированные антитела можно анализировать любым способом, известным в области техники. В некоторых случаях можно использовать SDS-PAGE в невосстанавливающих и восстанавливающих условиях для подтверждения чистоты и конъюгирования с тяжелой цепью.
[0264] ADC с лекарственными средствами, случайным образом конъюгированными с нативными цистеиновыми остатками, получают путем частичного восстановления антитела с последующей реакцией с желаемым комплексом линкер-лекарственное средство. Антитело с концентрацией 5 мг/мл частично восстанавливают добавлением примерно 3 мольных эквивалентов DTT с pH 8,0, с последующим инкубированием при примерно 37°C в течение примерно 2 часов. Восстановленную реакционную смесь затем охлаждают на льду и избыток DTT удаляют, например, диафильтрацией. Затем добавляют комплекс линкер-лекарственное средство в молярном соотношении комплекс линкер-лекарственное средство/тиольная группа примерно 1:10. Реакцию конъюгирования проводят в присутствии ~10% об./об. DMSO. После конъюгирования избыток свободного цистеина (примерно 2-кратное молярное соотношение с комплексом линкер-лекарственное средство) добавляют для гашения непрореагировавшего комплекса линкер-лекарственное средство с получением продукта присоединения цистеин-линкер-лекарственное средство. Реакционную смесь очищали (например, посредством хроматографии гидрофобных взаимодействий) и подвергали замене буфера на PBS. Распределение нагрузки лекарственным средством определяли с использованием стандартных способов, таких как хроматография гидрофобных взаимодействий и восстановительная обращенно-фазовая хроматография.
Пример 4. Характеризация ASCT2-связывающих mAb и ADC
ASCT2-специфичное связывание антител с ASCT2 в раковых клетках ободочной и прямой кишки
[0265] Чтобы определить является ли связывающая способность определенных гибридомных клонов специфичной в отношении антигена ASCT2, связывание исследовали после нокдауна shРНК экспрессии ASCT2. Вкратце, клетки WiDr подвергали трансдукции лентивирусом, экспрессирующим shРНК ASCT2 или не являющуюся мишенью shРНК (NTshРНК). Связывание двух гибридомных клонов 17c10 и 1e8 к ASCT2 испытывали через 72 часа после инфицирования. Как видно на ФИГ. 4, нокдаун экспрессии ASCT2 в значительной степени исключил связывание соответствующих клонов, и дополнительно подтвердил антиген-специфичное связывание ASCT2 mAb 17c10 и 1e8.
Кинетика поглощения неконъюгированного антитела к ASCT2
[0266] Поглощение антитела при связывании с антигеном мишени является предварительным условием для достижения желаемого эффекта от ADC. В связи с этим исследовали характеристики поглощения антител к ASCT2. Клетки WiDr инкубировали с антителом 17c10 к ASCT2, конъюгированным с Alexa 488 (17c10-Alexa 488) в течение периодов разной продолжительности. Клетки затем промывали и инкубировали с антителом к Alexa 488 или без него в течение 45 минут на льду, чтобы погасить сигналы с клеточной поверхности. Интенсивность флуоресценции суммарного сигнала и гашеного сигнала (представляющего поглощенное антитело) измеряли с помощью проточной цитометрии. Как видно на ФИГ.5A, антитело 17c10 к ASCT2 показало повышенную способность к поглощению клеткой в зависимости от времени по сравнению с изотипическим контрольным антителом, которое не поглощалось клеткой.
Кинетика поглощения ASCT2-ADC (17c10AZ1508), измеренная по цитотоксическому лизису
[0267] Клетки импульсно обрабатывали, используя антитело к ASCT2, конъюгированное с тубулизином AZ1508 (17C10-AZ1508) в течение периодов различной продолжительности. После этого содержащую ADC среду заменяли свежей средой и клетки продолжали инкубировать в течение 4 дней. Жизнеспособность клеток измеряли, используя набор CTG Kit. Кривые зависимости ответа от дозы строили как процент от необработанных контрольных клеток и показательный график приведен на ФИГ. 5B. Значения IC50 рассчитывали, как описано выше, а результаты сведены в Таблицу 4 ниже.
Таблица 4
Кинетика поглощения ASCT2-ADC (17c10AZ1508)
Определение сродства (аффинности) (связывание 17c10 и 1e8 с клеточными линиями, экспрессирующими ASCT2)
[0268] Клеточные линии человека, макака-крабоеда и происходящие от CHO, экспрессирующие ASCT2, использовали для исследования сродства связывания и перекрестной реактивности ASCT2-специфичных антител. Видимое сродство измеряли титрованием меченых флуорофором антител. Показательные результаты сведены в Таблицу 6 ниже и приведены на ФИГ. 6.
[0269] На ФИГ. 6 приведены цитометрические кривые, полученные в результате связывания антител 17c10 и 1e8 к ASCT2 и изотипического контроля R347 с ASCT2-экспрессирующими клеточными линиями. Результаты для клеточных линий Cal27 рака человека показаны на ФИГ. 6A; результаты для клеточных линий FaDu рака человека показаны на ФИГ. 6B; результаты для клеточных линий SSC15 рака человека показаны на ФИГ. 6C; результаты для клеточных линий WiDr рака человека показаны на ФИГ. 6D; результаты для клеток CHOK1, стабильно экспрессирующих человеческий ASCT2, показаны на ФИГ. 6E; результаты для клеток CHOK1, стабильно экспрессирующих ASCT2 макака-крабоеда, показаны на ФИГ. 6F; результаты для клеточной линии CynoMK1 рака макака-крабоеда показаны на ФИГ. 6G; и результаты для ложно-трансфицированных клеток CHOK1 показаны на ФИГ. 6H. Значения EC50 при связывании 17c10 и 1e8 с ASCT2-экспрессирующими клеточными линиями указаны в Таблице 5 ниже.
Таблица 5
Значения EC50 при связывании 17c10 и 1e8 с ASCT2-экспрессирующими клеточными линиями
Специфичность антитела 17c10 по отношению к антигену ASCT2
[0270] Антитело 17c10 к ASCT2 не обладает сродством к ASCT1 (SLC1A4), являющемуся другим членом семейства SLC1A. Подавление экспрессии ASCT1 с использованием shРНК не исключает ASCT2-специфичного связывания 17c10 в SKMEL-2 клетках, как видно из графика, приведенного на ФИГ. 7A. Эффективность нокдауна с использованием shРНК дополнительно подтверждали с помощью вестерн-блоттинга. Кроме того, никакого изменения не наблюдали в профиле цитотоксичности клеток, в которых экспрессия ASCT1 была подавлена с помощью shРНК, как видно из графика, приведенного на ФИГ. 7B. Результаты сведены в таблице 6.
Таблица 6
ASCT2-специфическое связывание и цитотоксический лизис под действием 17c10-ADC
Перекрестная реактивность и цитотоксичность ASCT2-ADC антител по отношению к ASCT2 макака-крабоеда
[0271] ASCT2-связывающие клоты 17c10 и 1e8, конъюгированные с тубулизином AZ1508, исследовали на связывание с ASCT2 макака-крабоеда, стабильно экспрессированными в клетках CHOK1, ASCT2 человека, стабильно экспрессированными в клетках CHOK1, и контрольными молекулами, эспрессированными в клетках CHOK1. Антитело 17c10 к ASCT2 (ФИГ. 8A) и антитело 1e8 к ASCT2 (ФИГ. 8B) при конъюгировании с нагрузкой из тубулизина 1508 демонстрируют мощную цитотоксическую активность в клетках CHOK1, экспрессирующих ASCT2 человека и макака-крабоеда, но не в не прошедших трансфекцию CHOK1 или CHOK1-ABCB5. Эти результаты сведены в Таблицу 7 ниже.
Таблица 7
ASCT2-специфическое связывание и цитотоксический лизис под действием 17c10-ADC
Преобразование 17c10 в зародышевый тип
[0272] Аминокислотные последовательности VH- и VL-доменов для 17c10 выравнивали с известными последовательностями генов зародышевого типа человека из базы данных VBASE и самый близкий ген зародышевого типа идентифицировали при помощи анализа на сходство последовательностей. В случае VH-домена это был IgVh4-34*01; в случае VL-домена это был IgKv1-5*03. В случае 17c10, преобразование в зародышевый тип включало реверсию 1 остатка каркасного участка в VH-домене и 5 остатков в VL-домене. В VH-домене реверсную мутацию производили в положении 82а по Kabat, где треонин (T) заменили обратно на (S). В VL-домене мутации согласно нумерации Kabat были в положениях 13, 21, 39, 70 и 76, где в Kabat положении 13 треонин (T) заменили обратно на аланин (A); в Kabat положении 21 лейцин (L) заменили обратно на изолейцин (I); в Kabat положении 39 аспарагин (N) заменили обратно на лизин (K); в Kabat положении 70 аспартат (D) заменили обратно на глутамат (E), и в Kabat положении 76 треонин (T) заменили обратно на серин (S). Эти замены были сделаны путем синтеза VH- и VL-доменов с этими мутациями и замещения существующих VH и VL с использованием рестрикционного расщепления и лигирования. Оба 17c10 - зародышевого типа и исходный (не подвергнутый преобразованию в зародышевый тип) - экспрессировали как IgG и их сродство к различным ASCT2-экспрессирующим клеточным линиям исследовали с помощью проточной цитометрии. Как видно на ФИГ. 9A-ФИГ. 9D, разницы в связывании 17c10 зарордышевого типа или родительского 17c10 с клетками WiDr или с клетками CHO, экспрессирующими HuASCT2 или CyASCT2, не наблюдалось.
Пример 5. Цитотоксический лизис под действием ASCT2-ADC при различных онкологических заболеваниях
[0273] Антитело 17c10 конъюгировали с нагрузкой из ПБД (SG3315) или тубулизина (AZ1508) по сайт-специфичному сайту конъюгирования, как описано выше. Соотношение лекарственное средство-антитело (DAR) оценивали, как равное 2,0 для каждого вещества. Цитотоксический анализ выполняли, используя раковые клетки из различных опухолей, таких как рак поджелудочной железы, рак прямой кишки, рак легкого, плоскоклеточная карцинома головы и шеи (HNSCC), рак простаты и ASCT2-отрицательный рак легкого. Как показано на ФИГ. 10A-ФИГ. 10 F, 17c10 ADC антитело, конъюгированное с AZ1508, имело наиболее высокое цитотоксическое действие по сравнению с контрольным антителом, связанным с тубулизином. Антитело к ASCT2 17c10, конъюгированное с SG3249 или SG3315, также имело более высокую цитотоксическую активность, чем контрольные антитела, связанные с тубулизином AZ1508 или связанные с ПБД SG3249, или связанные с SG3315. Кривая, показывающая результаты цитотоксических анализов с использованием 17c10, конъюгированного с SG3249, показана на ФИГ. 11A, а кривая, показывающая результаты цитотоксических анализов с использованием 17c10, конъюгированного с SG3315, показана на ФИГ. 11B. Значения IC50 показаны в Таблице 8 ниже.
Таблица 8.
Подавление пролиферации раковых клеток под действием ASCT2-ADC
Пример 6. ASCT2-ADC подавляют рост опухолей in vivo
[0274] Все in vivo процедуры выполняли в соответствии с институциональными методическими указаниями для аккредитованной AAALAC лаборатории и были одобрены Институциональным комитетом MedImmune LLC по уходу за животными и их использованию. Для испытания способности антитела ASCT2-ADC вызывать лизис опухолевых клеток, WiDr (100 мкл/106 клеток/мышь) или первичные опухоли поджелудочной железы (PDX) вводили подкожно в правый бок 3-5-недельных самок бестимусных мышей (Charles River Laboratories, Wilmington, MA). Мышей выдерживали несколько недель, чтобы позволить развиться опухолям; когда опухоли достигали примерно 150-200 мм3, мышей произвольно распределяли в группы для обработки (10 мышей/группу). После этого мышам делали внутривенные инъекции различных доз анти-ASCT2 ADC (17c10-Az1508 или 17c10-SG3315 или 17c10-SG3249) или изотипического контроля конъюгированного с лекарственным средством антитела. За весом тела и объемом опухоли обрабатываемых ксенотрансплантированных мышей наблюдали в течение соответствующих периодов времени. Объем опухоли рассчитывали, используя следующую формулу: (самый короткий диаметр)2 x (самый длинный диаметр) x 0,5, и результаты приведены на ФИГ. 12A, ФИГ. 12B и ФИГ. 12C.
[0275] Кроме того, эффективность in vivo 17c10-SG3249 оценивали в ряде моделей гематологических злокачественных новообразований, представляющих разные субпопуляции, экспрессирующие ASCT2 на разных уровнях. ADC вводили еженедельно при дозе 0,4 мг/кг (или 0,5 мг/кг) и 0,1 мг/кг, в общей сложности четыре дозы, в ксенотрансплантированных моделях диссеминированных опухолей. Кривые Каплана - Мейера демонстрируют значительное увеличение выживаемости в 17c10-SG3249 когортах по сравнению с необработанными или изотипическими ADC контролями, как показано на ФИГ. 13A и ФИГ. 13B. Введение 17c10-SG3249 в нескольких AML ксенотрансплантированных моделях опухолей показали значительное повышение выживаемости по сравнению с другими когортами, такими как SOC, необработанной и изотипического ADC контроля. В моделях TF1a AML 17c10-SG3249 продемонстрировал исключительную активность (средняя выживаемость >205 дней) по сравнению с изотипическими ADC контролем (66 дней). Сходным образом, 17c10-SG3249 продемонстрировал устойчивое подавление роста опухоли и выживаемость в нескольких моделях MM1.S множественной миеломы (MM) (средняя выживаемость 123,5 дней по сравнению с 55,5 днями в не подвергнутом обработке контроле). Результаты для 17c10-SG3249 в различных гематологических новообразованиях сведены в Таблице 9 ниже.
Таблица 9: Гематологическая средняя выживаемость
Пример 7. Конъюгирование химических частей с антителами к ASCT2 с образованием ADC
[0276] Был разработан способ очистки mAb к ASCT2. Вкратце, собранная жидкость клеточной культуры подвергали стадии улавливания белка A, которую выполняли с использованием смолы MAbSelect Sure (GE Healthcare) для улавливания белка из надосадочной жидкости клеточной культуры и для удаления примесей, связанных с процессом и продуктом. Все стадии процесса выполняли с линейной скоростью потока, равной 300 см/ч. Смолу уравновешивали, используя 50 мM Tris с pH 7,4, и кондиционированную среду загружали в колонку до нагрузки, равной 30 г/л смолы. Колонку повторно уравновешивали, используя 50 мM Tris с pH 7,4, и затем проводили две стадии промывки, которые были оптимизированы с целью уменьшения содержания примесей и уменьшения избытка легких цепей, находящихся в кондиционированной среде. Первая стадия состояла из 50 мM Tris, 500 мM хлорида натрия при pH 7, а во второй промывке содержалось 50 мM ацетата натрия, 500 мM хлорида натрия при pH 5,0. Колонку затем повторно уравновешивали, используя 50 мM Tris с pH 7,4, и продукт элюировали, используя 25 мM ацетата натрия при pH 3,6. Продукт собирали от 0,5 OD на восходящей стороне пика элюирования до 0,5 OD на убывающей стороне. После каждого цикла очистки колонку десорбировали, используя 100 мM уксусную кислоту, затем повторно уравновешивали, используя 50 мM Tris с pH 7,4, обеззараживали, используя 0,1 н. гидроксида натрия, и хранили в 2% (об./об.) бензиловом спирте, 100 мM ацетате натрия при pH 5,0. Типичный выход на этой стадии составлял 70-75%.
[0277] Обработку при низком рН выполняли для вирусной инактивации. Вкратце, продукт, полученный с помощью MAbSelect Sure, приводили к целевому pH, равному 3,5, введением 1 M уксусной кислоты. После выдерживания в течение 60 минут раствор нейтрализовали добавлением 1 М Tris до требуемого рН, равного 7,4. Продукт затем фильтровали.
[0278] В качестве промежуточной стадии очистки выполняли хроматографию в смешанном режиме, используя смолу Capto Adhere (GE Healthcare). Колонка работала в проточном режиме: Колонку уравновешивали, используя 50 мM Tris с pH 7,4, и нейтрализованный раствор белка загружали в колонку. Примеси связывались смолой, в то время как продукт извлекали в потоке через пул. Типичный выход на этой стадии составлял 80-84%.
[0279] Стадию тонкой очистки выполняли, используя катионнообменную смолу HS 50 (POROS). Эту стадию выполняют в режиме связывания-элюирования и она служит для дальнейшего удаления связанных с процессом примесей. Колонку уравновешивали, используя 50 мM Tris с pH 7,4, и продукт, полученный на хроматографической со смешанным режимом стадии, загружали в колонку. Колонку затем промывали, используя 50 мM Tris с pH 7,4, затем - 50 мM Tris, 150 мM хлорида натрия при pH 7,4, и затем элюировали, используя 50 мM Tris, 400 мM хлорида натрия при pH 7,4. Продукт собирали от 0,5 OD на восходящей стороне пика элюирования до 0,5 OD на убывающей стороне. После каждого цикла очистки колонку десорбировали, используя 50 мM Tris, 500 мM хлорида натрия при pH 7,4, обеззараживали, используя 1 н. гидроксида натрия, и хранили в 0,1 н. NaOH. Типичный выход на этой стадии составлял 95-98%.
[0280] Очищенное промежуточное mAb концентрировали, используя мембрану Pellicon 3 Ultracel с границей отсечения по молекулярной массе (MWCO) 30 кДа и переносили в буфер для составления (20 мM гистидина, 240 мM сахарозы при pH 6,0) путем диафильтрации. Конечная концентрация белка составляла примерно 20 мг/мл. Если необходимо, белок хранили в замороженном виде при -80°C до проведения конъюгирования. В Таблице 10 ниже сведены данные о качестве продукта в ходе процесса очистки моноклонального антитела.
Таблица 10
Постадийная чистота в ходе процесса очистки антитела к ASCT2
Конъюгирование антитела к ASCT2 с тубулизином AZ1508
[0281] Конъюгат антитела с лекарственным средством готовили с помощью сайт-направленного конъюгирования тубулизина (AZ1508) с двумя свободными синтетическими цистеиновыми остатками путем малеимидного химического процесса.
[0282] Очищенное промежуточное mAb размораживали и доводили рН до рН 7,0 добавлением 1 М основания Tris. Раствор белка разбавляли до конечной концентрации 7,5 мг/мл, используя 20 мM гистидиновый буфер с pH 7,0, и добавляли EDTA до конечной концентрации 1 мM. Белок переносили в подходящий реакционный сосуд и температуру доводили до 37°C. Восстановитель трис(2-карбоксиэтил)фосфин (TCEP) добавляли из свежеприготовленного 50 мM исходного раствора при мольном соотношении TCEP:mAb=30:1. Раствор инкубировали при слабом перемешивании при 37°C в течение 3 часов. После этого периода инкубирования восстановитель удаляли диализом или диафильтрацией против 20 мM гистидина/1 мM EDTA буфера с pH 7,0. Извлеченный продукт фильтровали через 0,22 мкм фильтр. Для окисления раствор белка инкубировали с дегидроаскорбиновой кислотой (DHA) при мольном соотношении 10:1 (DHA:mAb). Инкубирование проводили при 22-25°C в течение 4 часов при слабом перемешивании (со скоростью перемешивания 50 об/мин). По окончании этого времени в качестве нагрузки добавляли тубулизин (AZ1508) из 10 мM исходного раствора в DMSO в мольном соотношении нагрузка:mAb 8:1. Дополнительное количество DMSO добавляли по каплям до достижения конечной концентрации 10% (об./об.). Смесь инкубировали 1 час при 22-25°C и слабом перемешивании, чтобы дать сформироваться конъюгату антитело-лекарственное средство. Реакцию затем гасили добавлением N-ацетилцистеина (NAC) из 100 мM исходного раствора при мольном соотношении NAC:тубулизин 5:1.
[0283] Для удаления фрагментов белков, агрегатов и избытка несвязанной тубулизиновой нагрузки, после конъюгирования проводили очистку, используя керамический гидроксиапатит (CHT) типа I (Biorad). Колонка работала в режиме связывания-элюирования при линейной скорости потока, равной 180 см/ч. К погашенной смеси конъюгата антитело-лекарственное средство добавляли фосфат натрия из 300 мМ исходного раствора до конечной концентрации 10 мМ. Колонку СНТ предварительно уравновешивали, используя 300 мM фосфат натрия с pH 6,5, и уравновешивали, используя 10 мM фосфат натрия с pH 6,5. Смесь конъюгата антитело-лекарственное средство нагружали до достижения нагрузки, равной 20 г/л и колонку повторно уравновешивали, используя 10 мM фосфат натрия с pH 6,5. Элюирование выполняли с линейным градиентом до 1 M хлорида натрия в 10 мM фосфате натрия с pH 6,5 за 10 объемов колонки. Пик элюирования разделяли на фракции, которые анализировали с помощью HP SEC (высокоэффективной гель-хроматографии). Фракции, которые содержали конъюгированный белок с чистотой мономера >95%, отбирали в пул. После каждого цикла очистки колонку десорбировали 300 мM фосфатом натрия при pH 6,5, обеззараживали, используя 1 н. гидроксид натрия, и хранили в 0,1 н. гидроксиде натрия.
[0284] Отобранный в пул конъюгат антитела и лекарственного средства (ADC) концентрировали и заменяли среду на буфер в конечном составе, используя проточную фильтрацию вдоль потока либо на регенерированной целлюлозе, либо на PES мембранах с отсекаемым молекулярным весом 30 кДа. Вносили во вспомогательное вещество PS80 из исходного 10% раствора. Конечная концентрация ADC составляли 5 мг/мл в 20 мM гистидине, 240 мМ сахарозе, 0,02% PS80 при pH 6,0. В этих условиях полученные ADC показали <12% неконъюгированной тяжелой цепи, 75-82% моноконъюгированной тяжелой цепи и соотношение лекарственного средства к антителу, равное 1,8-1,9.
Конъюгирование антитела к ASCT2 с пирролобензодиазепином (ПБД) SG3249
[0285] Конъюгат антитела с лекарственным средством готовили с помощью сайт-направленного конъюгирования ПБД (SG3249) с двумя свободными синтетическими цистеиновыми остатками путем малеимидного химического процесса. Последовательность процесса такая же, как обсуждается для конъгирования с тубулизином, приведенная выше, хотя точные условия отличаются.
[0286] Очищенное промежуточное mAb размораживали и доводили рН до рН 7,0 добавлением 1 М основания Tris. Стадии восстановления, окисления и конъюгирования для конъгата с ПБД выполняли при концентрации белка, равной 20 мг/мл в 20 мM гистидине, 1 мм EDTA, pH 7,0. Белок переносили в подходящий реакционный сосуд и температуру доводили до 37°C. Восстановитель дитиотреитол (DTT) добавляли из свежеприготовленного 50 мM исходного раствора при мольном соотношении DTT:mAb=30:1. Раствор инкубировали при слабом перемешивании при 37°C в течение 1 часа. После этого периода инкубирования восстановитель удаляли диализом или диафильтрацией против 20 мM гистидина/1 мM EDTA буфера с pH 7,0. Извлеченный продукт фильтровали через 0,22 мкм фильтр. Для окисления раствор белка инкубировали с дегидроаскорбиновой кислотой (DHA) при мольном соотношении 10:1 (DHA:mAb). Инкубирование проводили при 22-25°C в течение 1 часа при слабом перемешивании (со скоростью перемешивания 50 об/мин). По окончании этого времени в качестве нагрузки добавляли ПБД (SG3249) из 10 мM исходного раствора в DMSO в мольном соотношении нагрузка:mAb 8,5:1. Дополнительное добавление DMSO к данной реакционной смеси не производили, эффективная концентрация DMSO вследствие внесения DHA и нагрузки составляла примерно 11,4%. Смесь инкубировали 1 час при 22-25°C и слабом перемешивании, чтобы дать сформироваться конъюгату антитело-лекарственное средство. Реакцию гасили добавлением N-ацетилцистеина (NAC) из 100 мM исходного раствора при мольном соотношении NAC:ПБД 4:1.
[0287] Для удаления фрагментов белков, агрегатов и избытка несвязанной ПБД нагрузки, после конъюгирования проводили очистку, используя керамический гидроксиапатит (CHT) типа I (BioRad). Колонка работала в режиме связывания-элюирования при линейной скорости потока, равной 180 см/ч. рН погашенной реакционной смеси антитела и лекарственного средства доводили до рН 7,0 добавлением 1 М основания Tris. Колонку СНТ предварительно уравновешивали, используя 300 мM фосфат натрия с pH 6,5, и уравновешивали, используя 10 мM фосфат натрия с pH 6,5. Смесь конъюгата антитело-лекарственное средство нагружали до достижения нагрузки, равной 20 г/л и колонку повторно уравновешивали, используя 10 мM фосфат натрия с pH 6,5. Связанный белок затем промывали 10 мM фосфата натрия, 25 мM каприлата натрия при pH 6,5 для удаления избытка несвязанного лекарственного средства, а затем проводили повторное уравновешивание, используя 10 мM фосфат натрия с pH 6,5. Элюирование выполняли с линейным градиентом от 0,3 до 1 M хлорида натрия в 10 мM фосфате натрия с pH 6,5 за 10 объемов колонки. Пик элюирования разделяли на фракции, все из которых анализировали с помощью HP SEC. Фракции, которые содержали конъюгированный белок с чистотой мономера >95%, отбирали в пул. После каждого цикла очистки колонку десорбируют 2 M хлоридом натрия, обеззараживают, используя 1 н. гидроксид натрия, и хранят в 0,1 н. гидроксиде натрия.
[0288] ADC концентрировали и заменяли среду на буфер в конечном составе, используя проточную фильтрацию вдоль потока либо на регенерированной целлюлозе, либо на PES мембранах с отсекаемым молекулярным весом 30 кДа. Вносили во вспомогательное вещество PS80 из исходного 10% раствора. Конечная концентрация ADC составляла 5 мг/мл в 20 мM гистидине, 240 мМ сахарозе, 0,02% PS80 при pH 6,0.
АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ:
Исходная VH в 17c10; SEQ ID NO: 1
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWSWIRQPPGKGLEWIGEIHHSGGANYNPSLKSRVTISVDTSKNQFSLKLTSVTAADTAVYYCARGQGKNWHYDYFDYWGQGTLVTVSSA
Исходная VL в 17c10; SEQ ID NO: 2
DIQMTQSPSTLSTSVGDRVTLTCRASQSIRSWLAWYQQNPGKAPKLLIYKASILKIGVPSRFSGSGSGTDFTLTITSLQPDDFATYYCQQYYSYSRTFGQGTKVEIK
Исходная VH в 1e8; SEQ ID NO: 3
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWSWIPQPPGKGVEWIGEINHSGSTNYNPSLKSRVTISSDTSKNQFSLKLTSVTAADTAVYYCARGQGKNWNYDYFDYWGQGTLVTVSSA
Исходная VL в 1e8; SEQ ID NO: 4
DIQMTQSPSTLSASVGDRVTLTCRASQSIRSWLAWYQQKPGKAPKLLIYKASSLKSGVPSRFSGSGSGTDFTLTISSLQPDDFATYYCQQYYSFSRTFGQGTKVEIK
VH в 17c10 зародышевого типа; SEQ ID NO: 5
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWSWIRQPPGKGLEWIGEIHHSGGANYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARGQGKNWHYDYFDYWGQGTLVTVSSA
VL в 17c10 зародышевого типа; SEQ ID NO: 6
DIQMTQSPSTLSASVGDRVTITCRASQSIRSWLAWYQQKPGKAPKLLIYKASILKIGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYYSYSRTFGQGTKVEIK
VH в 1e8 зародышевого типа; SEQ ID NO: 7
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWSWIRQPPGKGLEWIGEIHHSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARGQGKNWNYDYFDYWGQGTLVTVSSA
VL в 1e8 зародышевого типа; SEQ ID NO: 8
DIQMTQSPSTLSASVGDRVTITCRASQSIRSWLAWYQQKPGKAPKLLIYKASSLKSGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYYSFSRTFGQGTKVEIK
Остов тяжелой цепи Maia (цистеиновая вставка приведена в рамке жирным шрифтом); SEQ ID NO: 9
STKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPS VFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREE
VFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREE
QYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
HCDR1 в 17c10 зародышевого типа (нумерация по Kabat) SEQ ID NO: 10
GYYWS
HCDR2 в 17c10 зародышевого типа (нумерация по Kabat); SEQ ID NO: 11
EIHHSGGANYNPSLKS
HCDR3 в 17c10 зародышевого типа (нумерация по Kabat); SEQ ID NO: 12
GQGKNWHYDYFDY
LCDR1 в 17c10 зародышевого типа (нумерация по Kabat); SEQ ID NO: 13
RASQSIRSWLA
LCDR2 в 17c10 зародышевого типа (нумерация по Kabat); SEQ ID NO: 14
KASILKI
LCDR3 в 17c10 зародышевого типа (нумерация по Kabat); SEQ ID NO: 15
QQYYSYSRT
HCDR1 в 1e8 зародышевого типа (нумерация по Kabat); SEQ ID NO: 16
GYYWS
HCDR2 в 1e8 зародышевого типа (нумерация по Kabat); SEQ ID NO: 17
EIHHSGSTNYNPSLKS
HCDR3 в 1e8 зародышевого типа (нумерация по Kabat); SEQ ID NO: 18
GQGKNWNYDYFDY
LCDR1 в 1e8 зародышевого типа (нумерация по Kabat); SEQ ID NO: 19
RASQSIRSWLA
LCDR2 в 1e8 зародышевого типа (нумерация по Kabat); SEQ ID NO: 20
KASSLKS
LCDR3 в 1e8 зародышевого типа (нумерация по Kabat); SEQ ID NO: 21
QQYYSFSRT
Консенсусная HCDR2; SEQ ID NO: 22
EIHHSGX1X2NYNPSLKS; где X1 представляет собой S или G, и X2 представляет собой A или T
Консенсусная HCDR3; SEQ ID NO: 23
GQGKNWX1YDYFDY; где X1 представляет собой H или N
Консенсусная LCDR2; SEQ ID NO: 24
KASX1LKX2; где X1 представляет собой I или S, и X2 представляет собой I или S
Консенсусная LCDR3; SEQ ID NO: 25
QQYYSX1SRT; где X1 представляет собой Y или F
Легкая каппа-цепь человека; SEQ ID NO: 26
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
[0289] Предшествующее описание конкретных вариантов осуществления настолько полно раскрывает общий характер настоящего изобретения, что другие, используя знания в данной области, могут легко модифицировать и/или адаптировать для различных применений такие конкретные варианты осуществления без излишнего экспериментирования, не отступая от общей концепции настоящего изобретения. Следовательно, предусматривается, что такие адаптации и модификации находятся в пределах содержания и диапазона эквивалентов раскрытых вариантов осуществления, основанных на идее и принципе, представленных в данном документе. Следует понимать, что формулировки или терминология в данном документе предназначены для целей описания, а не ограничения, вследствие этого терминологию или формулировки в настоящем описании квалифицированному специалисту следует интерпретировать в свете идей и принципов. Настоящее изобретение далее описано в следующей формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Терапевтические антитела и их применения | 2016 |
|
RU2722381C2 |
| АНТИТЕЛА ПРОТИВ KIT И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2681730C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ НЕКТИН-4, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2805252C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2019 |
|
RU2797268C2 |
| ANTI-CXCR4 АНТИТЕЛА И КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВО | 2014 |
|
RU2675516C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С PSL PSEUDOMONAS, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2708977C2 |
| Конъюгаты "антитело-лекарственное средство" | 2012 |
|
RU2624141C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АФУКОЗИЛИРОВАННОГО АНТИТЕЛА К CD20 В СОЧЕТАНИИ С КОНЪЮГАТОМ АНТИТЕЛО К CD79b-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2670971C9 |
| АНТИТЕЛА ПРОТИВ CD19 ЧЕЛОВЕКА, ОБЛАДАЮЩИЕ ВЫСОКОЙ АФФИННОСТЬЮ | 2016 |
|
RU2761077C1 |
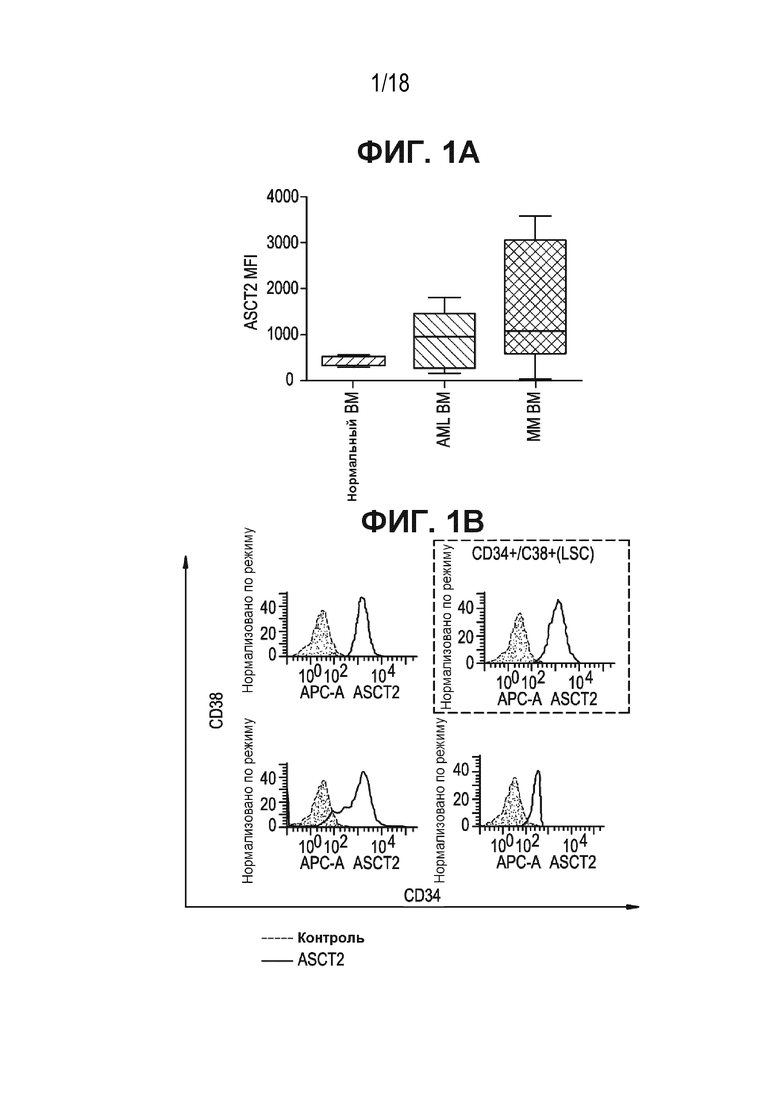
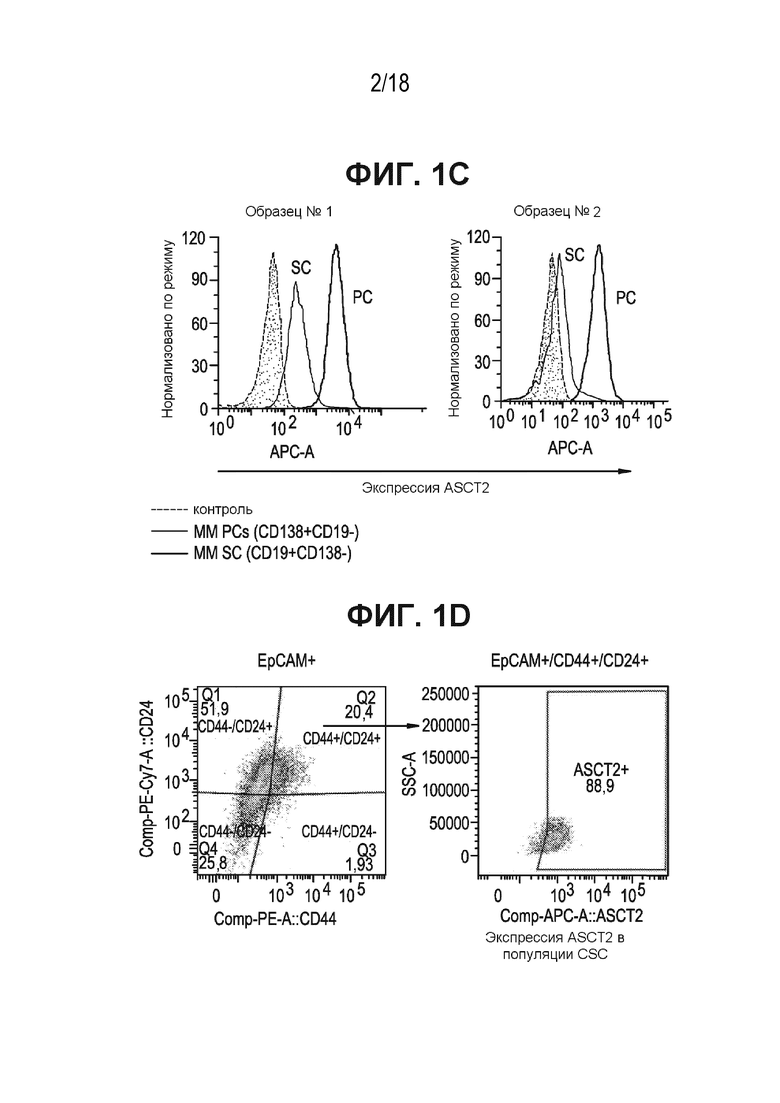
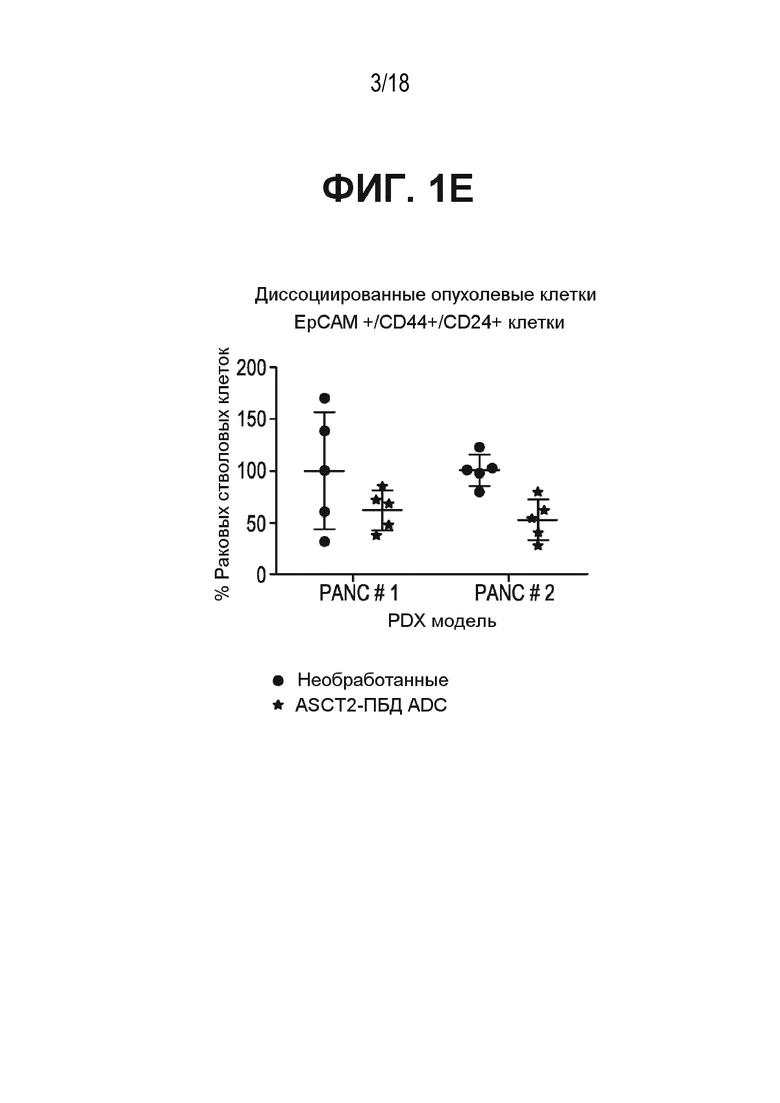
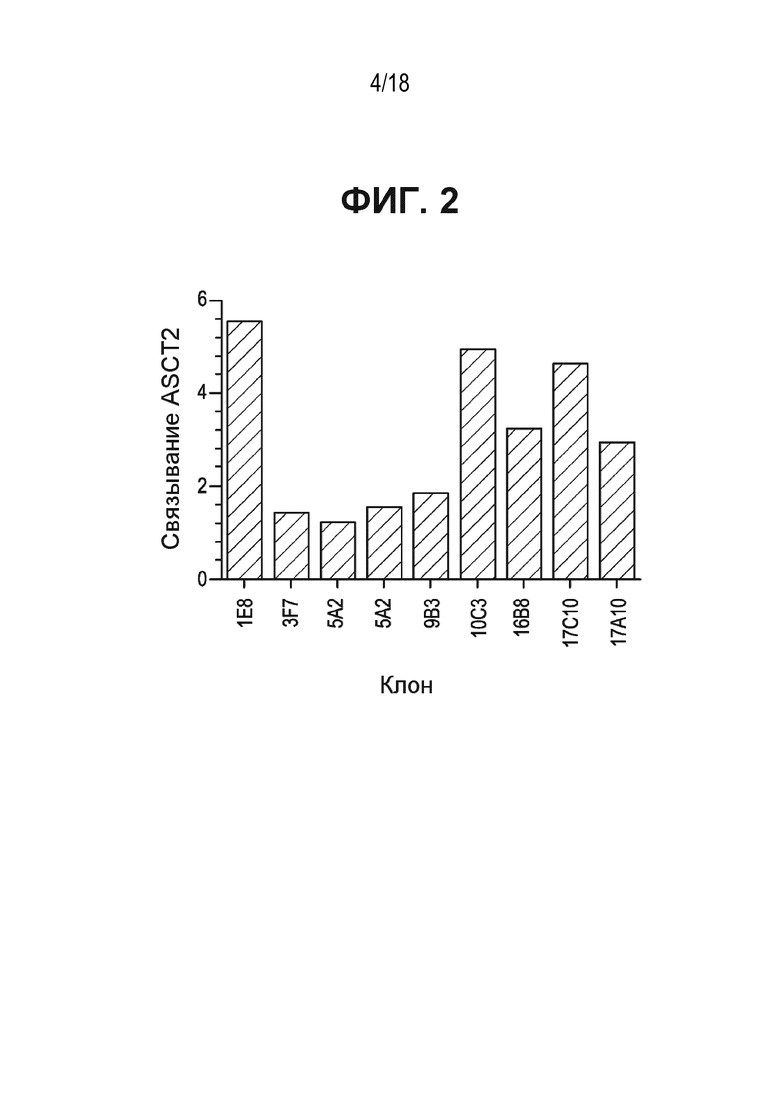
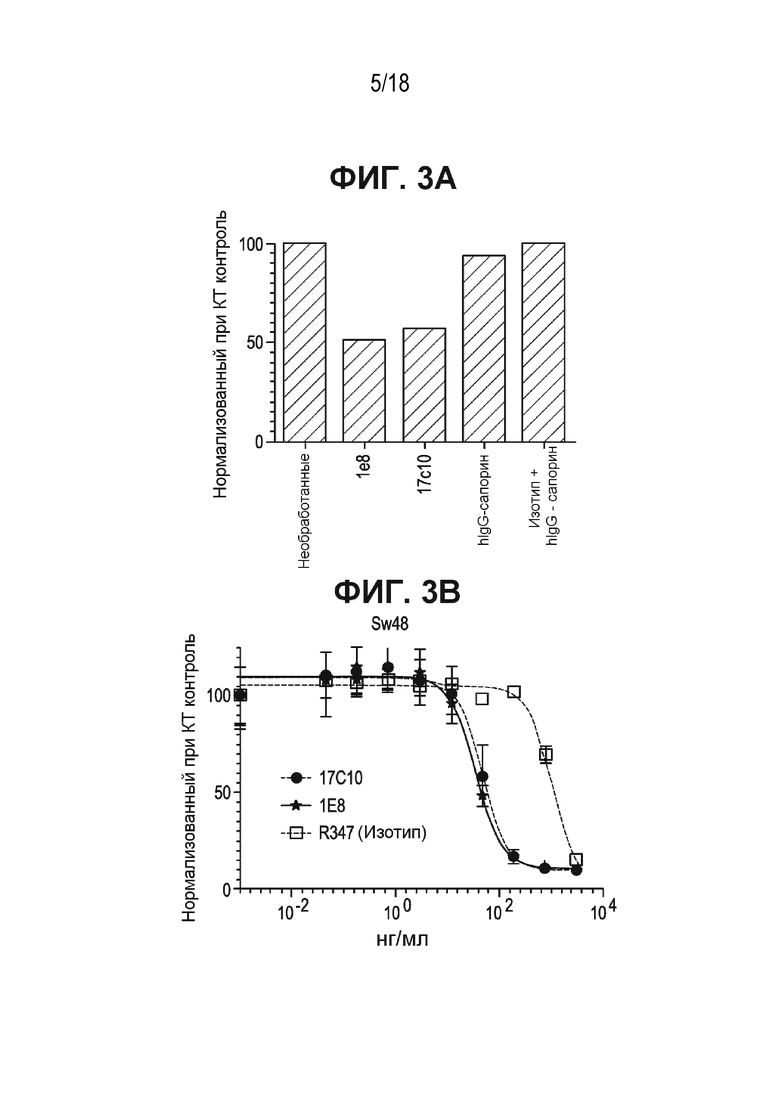
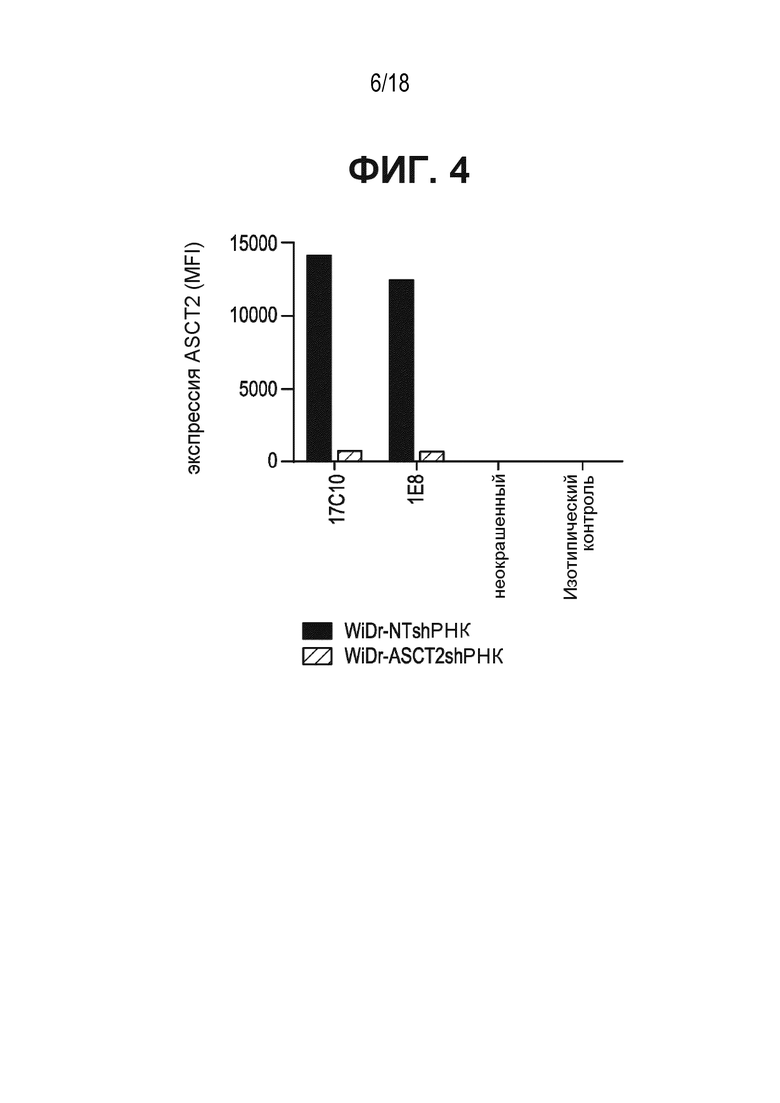
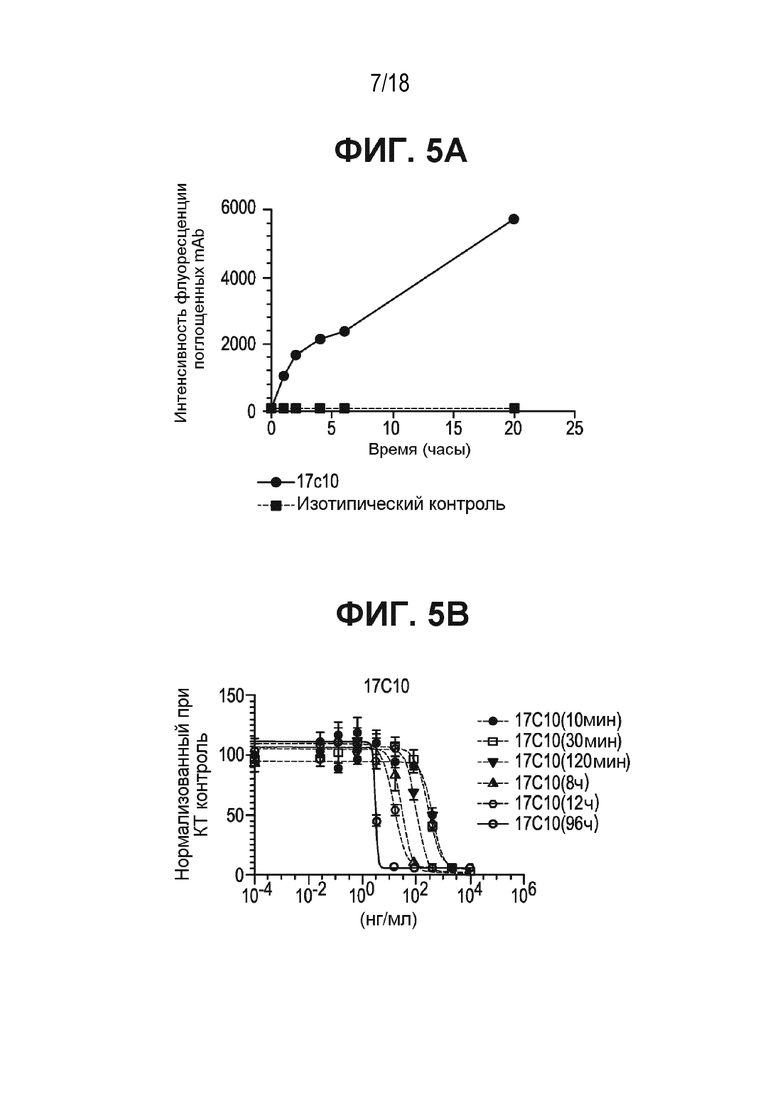
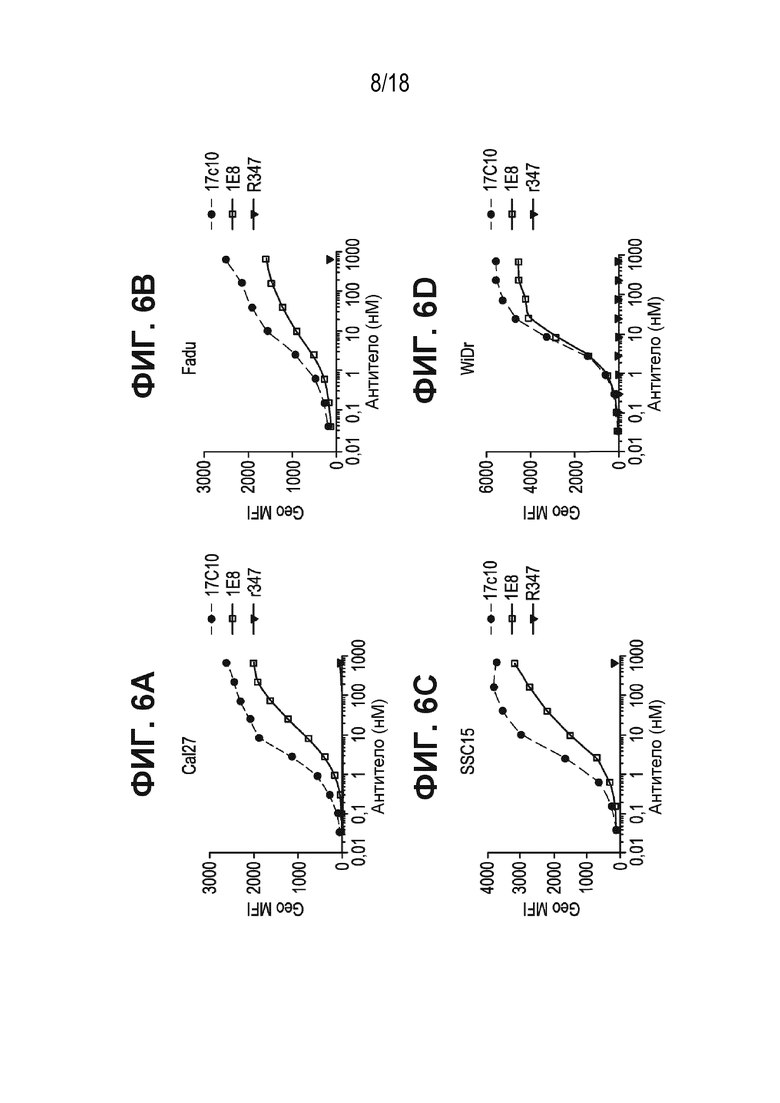
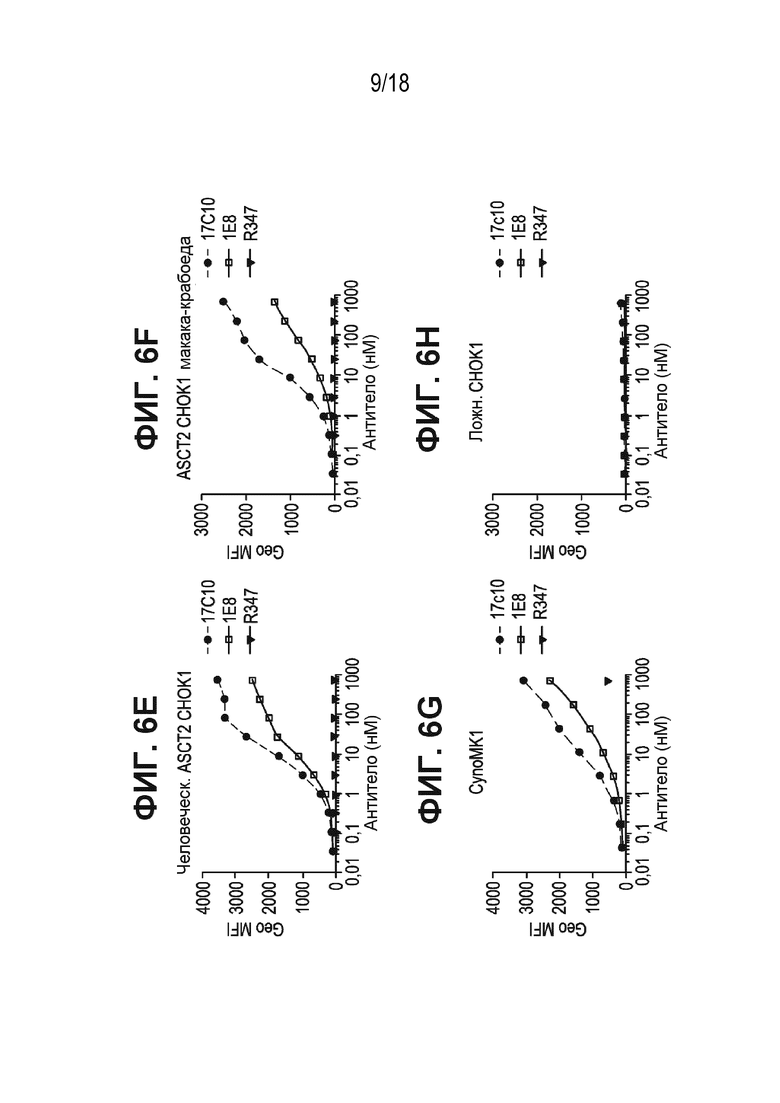
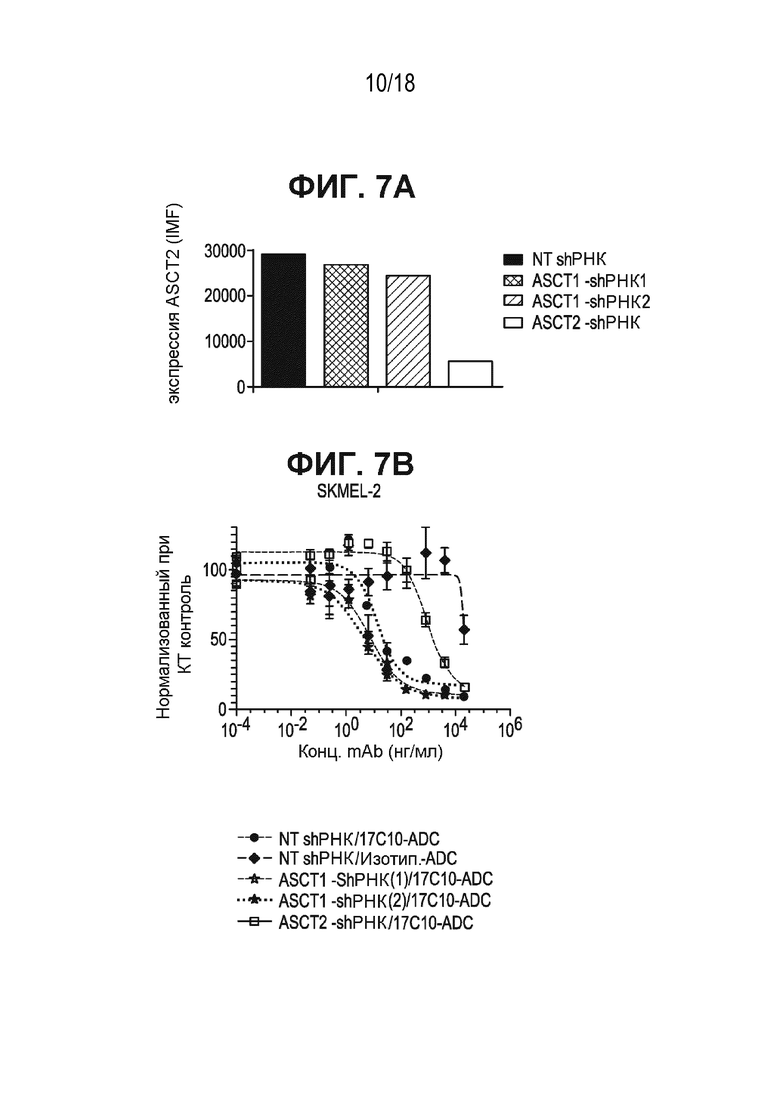
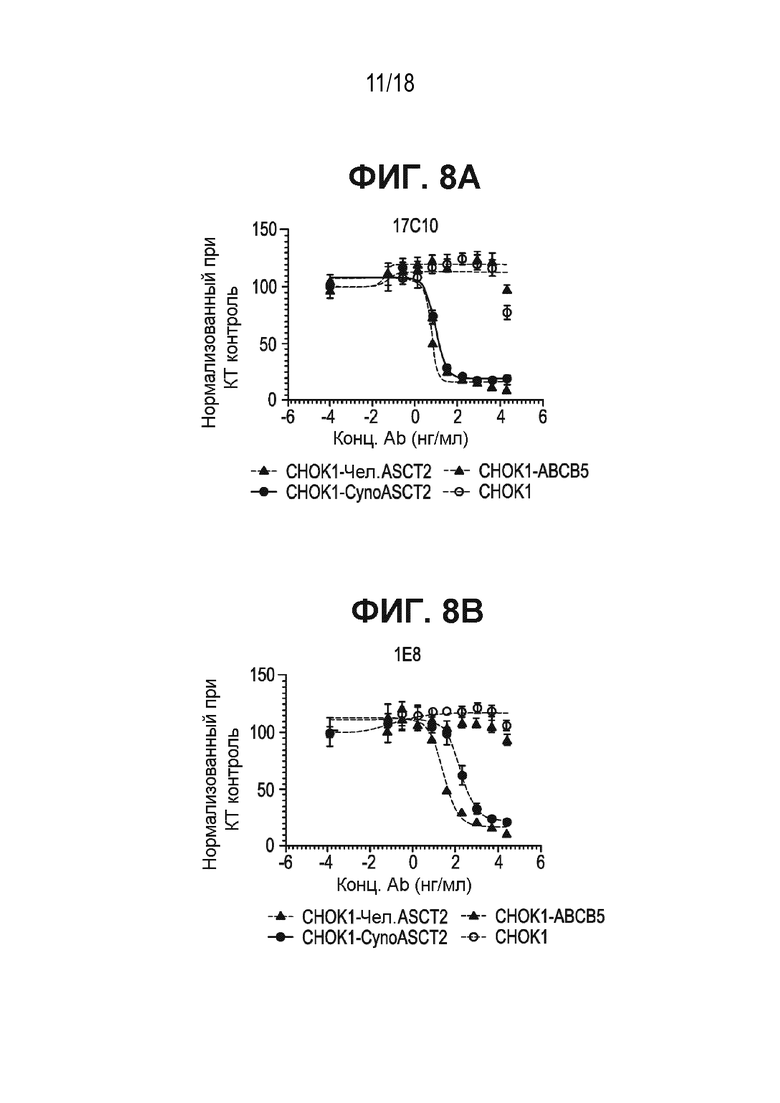
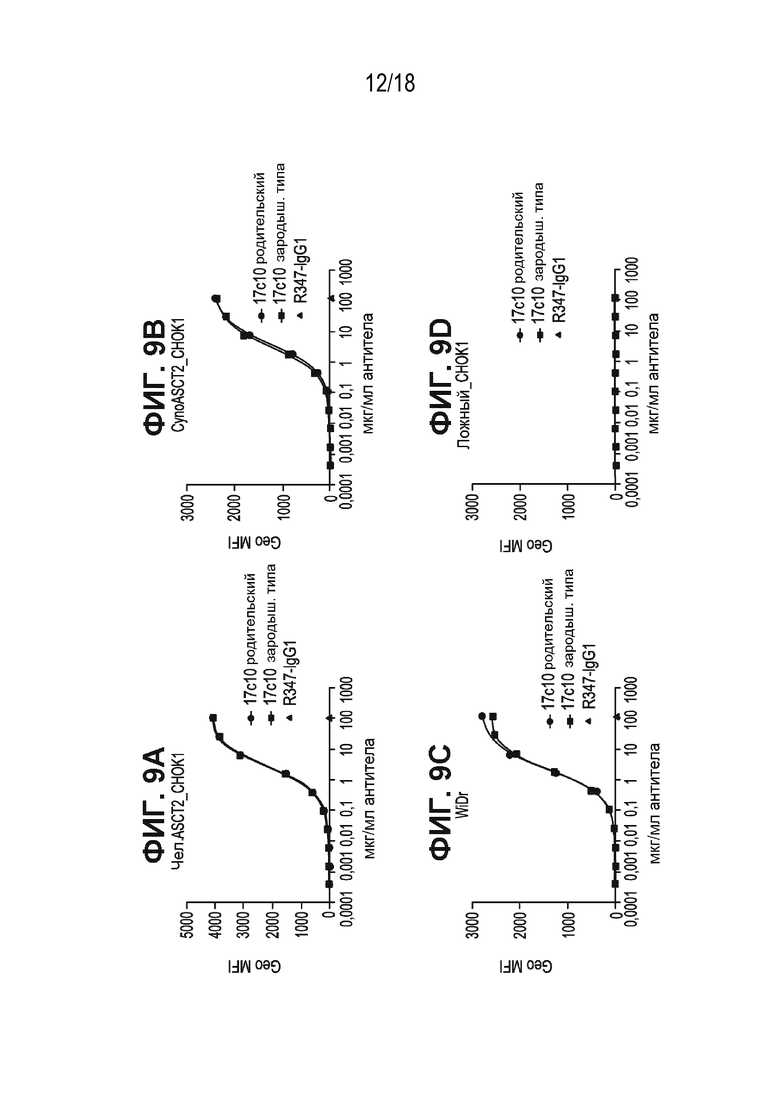
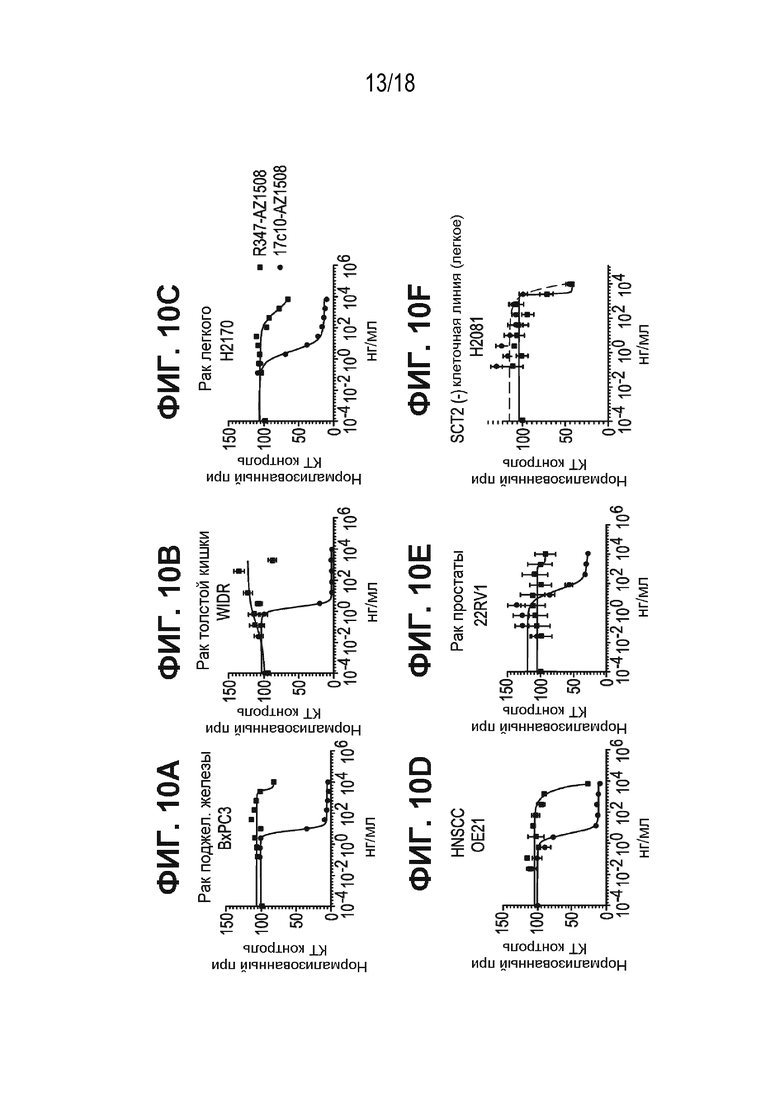
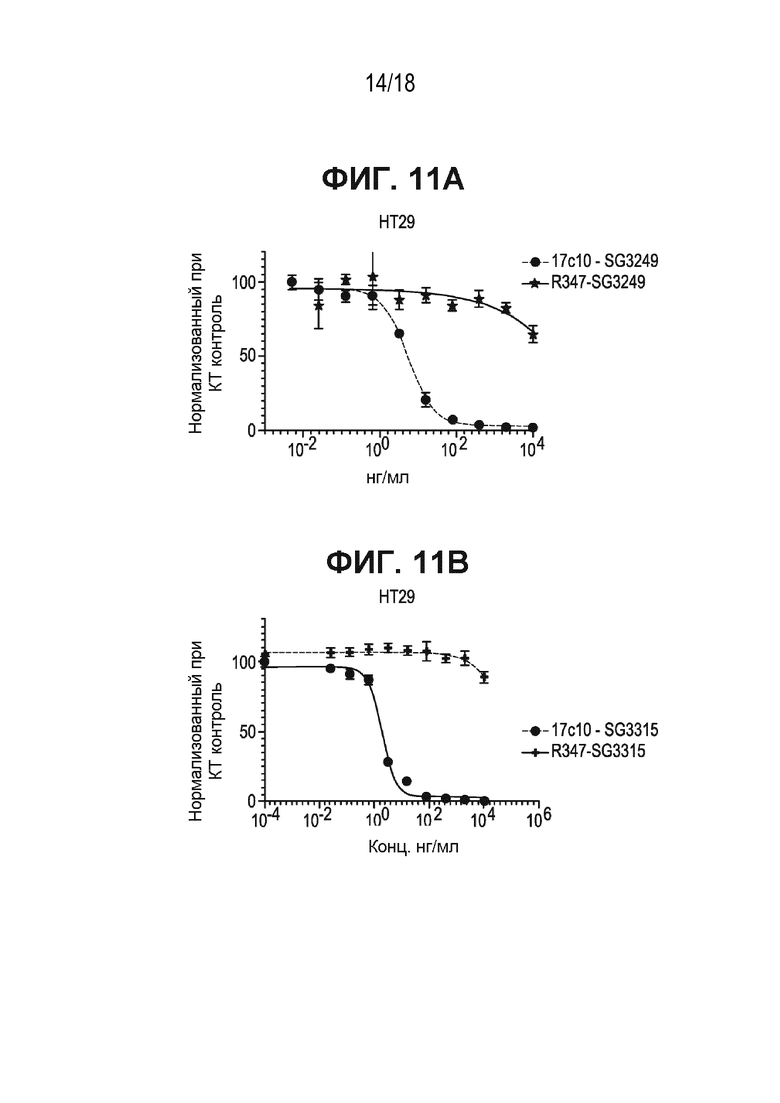
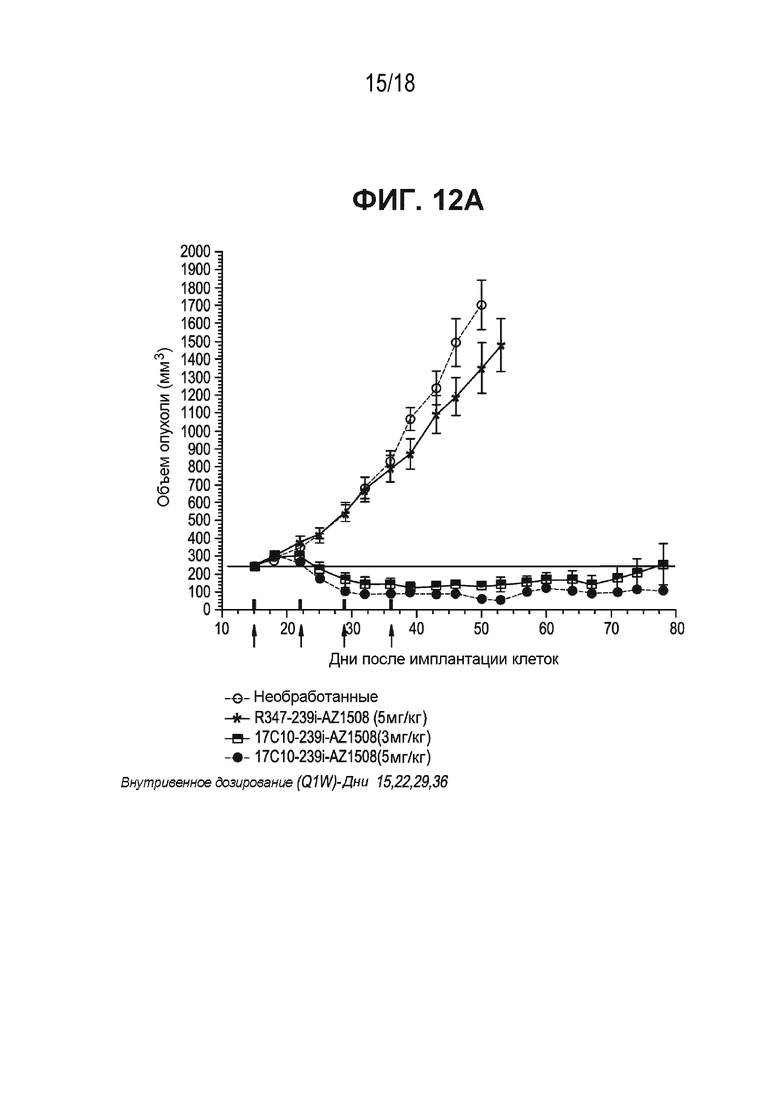
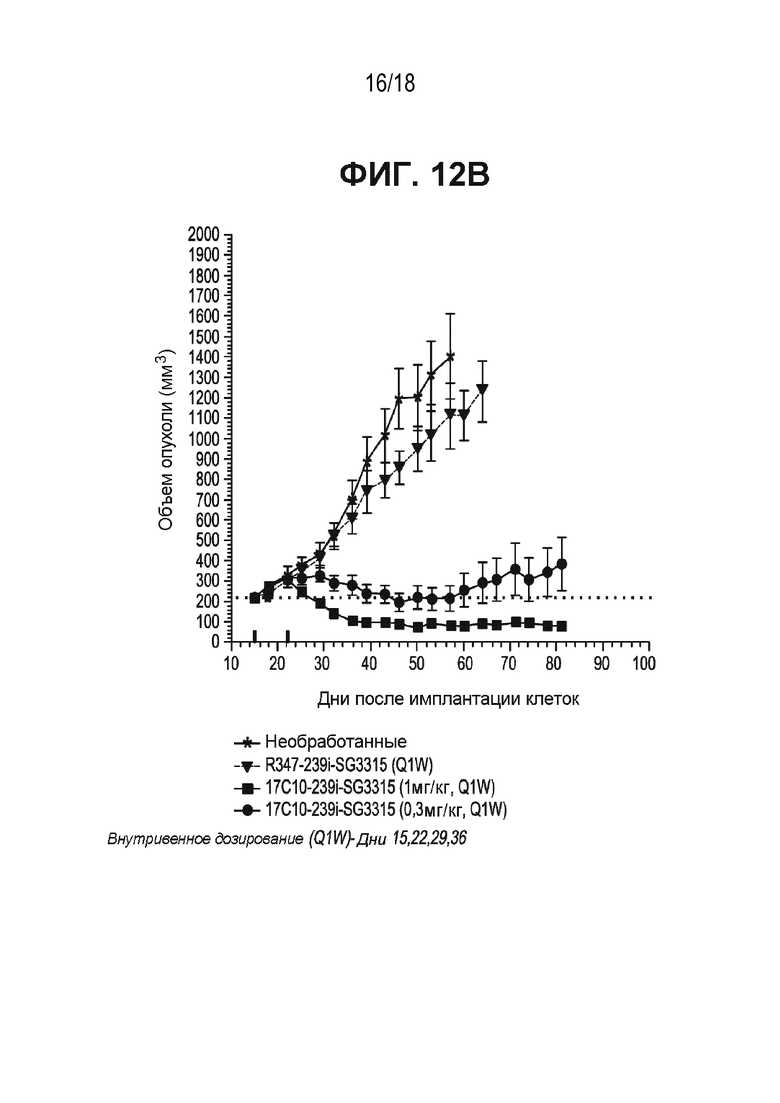
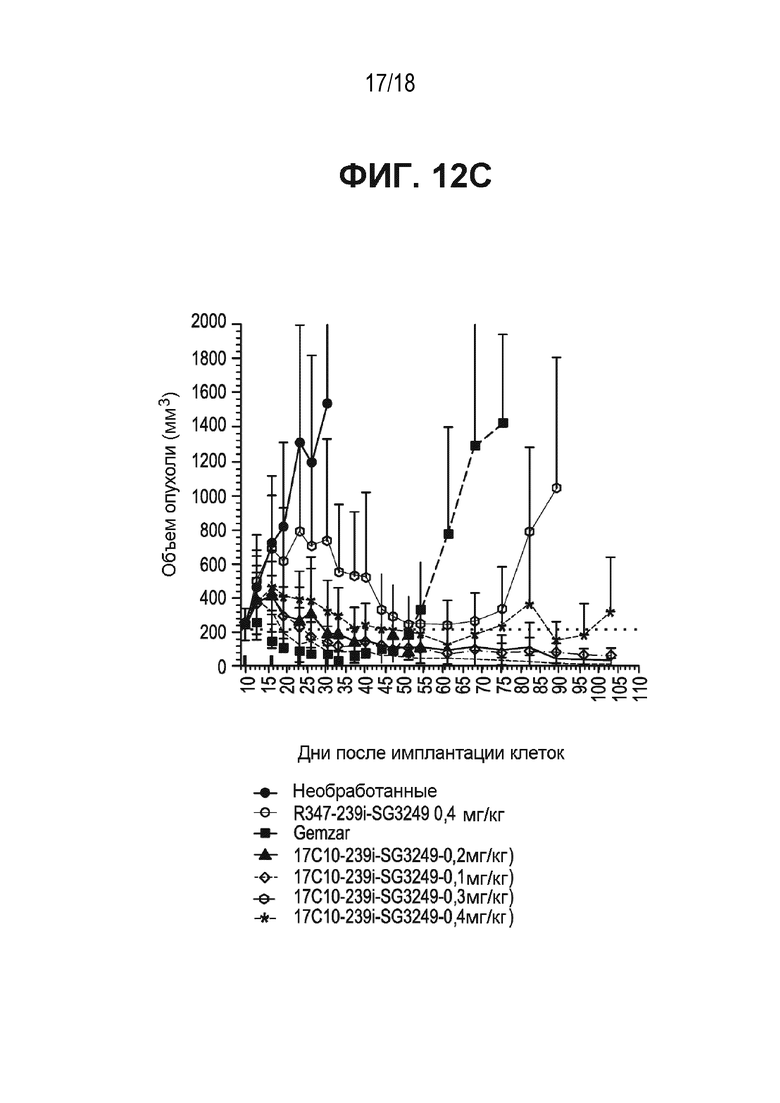
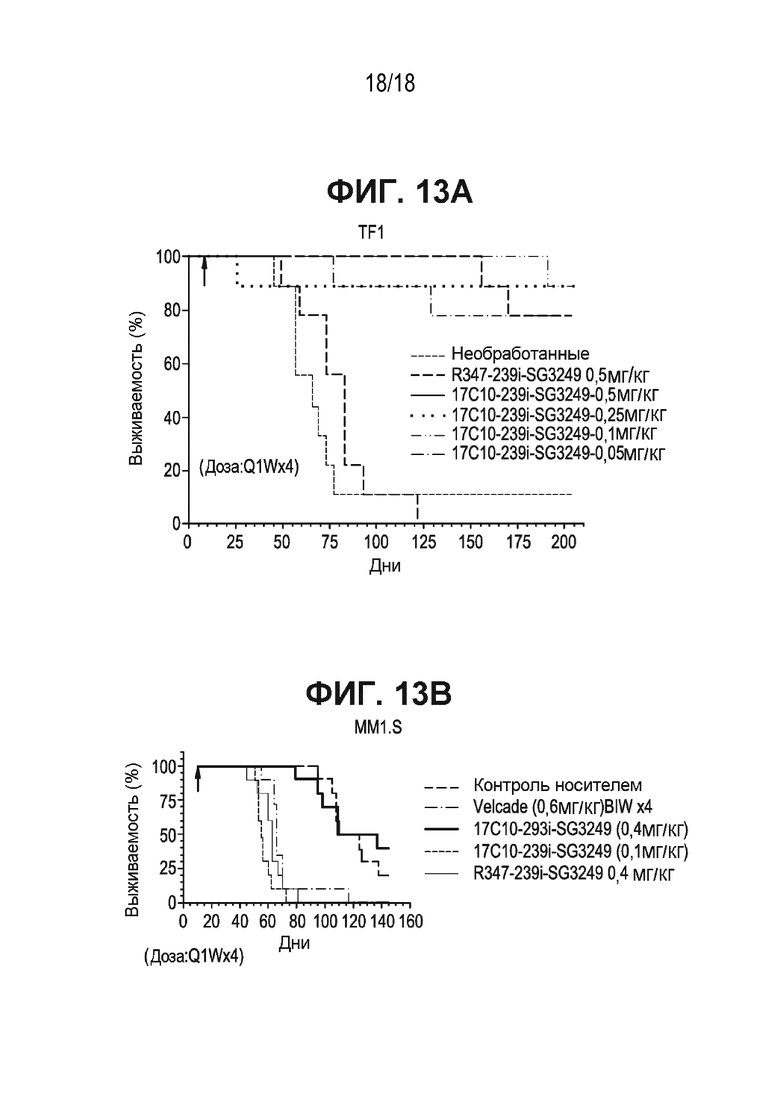
Изобретение относится к области биохимии, в частности к антителу, которое специфично связывается с эпитопом белка 2 транспортной системы для нейтральных аминокислот (ASCT2). Также раскрыты фармацевтическая композиция, содержащая указанное антитело; полинуклеотид, кодирующий указанное антитело; конъюгат, содержащий указанное антитело. Раскрыты способ получения указанного антитела, способ лечения с помощью указанного антитела. Изобретение обладает способностью эффективно лечить заболевания, ассоциированные с ASCT2. 8 н. и 22 з.п. ф-лы, 7 пр., 10 табл., 40 ил.
1. Антитело или его антиген-связывающий фрагмент, которое специфично связывается с эпитопом белка 2 транспортной системы для переноса нейтральных аминокислот (ASCT2) и содержит три определяющие комплементарность области тяжелой цепи (HCDR) вариабельной области тяжелой цепи (VH) и три определяющие комплементарность области легкой цепи (LCDR) вариабельной области легкой цепи (VL):
(a)
HCDR1 c аминокислотной последовательностью SEQ ID NO:10;
HCDR2 c аминокислотной последовательностью SEQ ID NO:11;
HCDR3 c аминокислотной последовательностью SEQ ID NO:12;
LCDR1 c аминокислотной последовательностью SEQ ID NO:13;
LCDR2 c аминокислотной последовательностью SEQ ID NO:14; и
LCDR3 c аминокислотной последовательностью SEQ ID NO:15;
или
(b)
HCDR1 c аминокислотной последовательностью SEQ ID NO:16;
HCDR2 c аминокислотной последовательностью SEQ ID NO:17;
HCDR3 c аминокислотной последовательностью SEQ ID NO:18;
LCDR1 c аминокислотной последовательностью SEQ ID NO:19;
LCDR2 c аминокислотной последовательностью SEQ ID NO:20;
и LCDR3 с аминокислотной последовательностью SEQ ID NO:21.
2. Антитело или его антиген-связывающий фрагмент по п.1, в котором:
(a)
VH содержит аминокислотную последовательность SEQ ID NO:1 и
VL содержит аминокислотную последовательность SEQ ID NO:2;
(b)
VH содержит аминокислотную последовательность SEQ ID NO:3 и
VL содержит аминокислотную последовательность SEQ ID NO:4;
(c)
VH содержит аминокислотную последовательность SEQ ID NO:5 и
VL содержит аминокислотную последовательность SEQ ID NO:6;
или
(d)
VH содержит аминокислотную последовательность SEQ ID NO:7 и
VL содержит аминокислотную последовательность SEQ ID NO:8.
3. Антитело или его антиген-связывающий фрагмент по любому из пп.1 или 2, в котором
VH содержит аминокислотную последовательность SEQ ID NO:5 и
VL содержит аминокислотную последовательность SEQ ID NO:6.
4. Антитело или его связывающий фрагмент по любому из пп.1 или 2, в котором
VH содержит аминокислотную последовательность SEQ ID NO:7 и
VL содержит аминокислотную последовательность SEQ ID NO:8.
5. Антитело или его антиген-связывающий фрагмент по любому из пп.1-4, которое содержит константную область IgG, содержащего тяжелую цепь с аминокислотной последовательностью SEQ ID NO:9.
6. Антитело или его антиген-связывающий фрагмент по любому из пп.1-5, где при связывании антитела или его антиген-связывающего фрагмента с ASCT2 на поверхности клетки, антитело или его антиген-связывающий фрагмент интернализуется в клетку.
7. Антитело или его антиген-связывающий фрагмент по любому из пп.1-6, которое содержит константную область легкой цепи, выбранную из группы, состоящей из константой области легкой цепи каппа человека и константной области легкой цепи лямбда человека.
8. Антитело или его антиген-связывающий фрагмент по п.7, которое содержит константную область каппа легкой цепи человека SEQ ID NO:26.
9. Антитело или его антиген-связывающий фрагмент по любому из пп.1-8, которое связывается с ASCT2 человека и ASCT2 макаки-крабоеда.
10. Антитело или его антиген-связывающий фрагмент по любому из пп.1-9, которое не связывается специфически с ASCT1 человека.
11. Фармацевтическая композиция для лечения заболевания или состояния, отличающегося повышенной экспрессией ASCT2, которая содержит эффективное количество антитела или его антиген-связывающего фрагмента по любому из пп.1-10 и фармацевтически приемлемый носитель.
12. Полинуклеотид, кодирующий антитело или его антиген-связывающий фрагмент по любому из пп.1-10.
13. Способ получения антитела или его антиген-связывающего фрагмента по любому из пп.1-10, включающий культивирование клетки-хозяина, содержащей полинуклеотид по п.12.
14. Способ лечения онкологического заболевания, отличающегося сверхэкспрессией ASCT2, у пациента, включающий
введение пациенту эффективного количества антитела или его антиген-связывающего фрагмента по любому из пп.1-10 или фармацевтической композиции по п.11.
15. Конъюгат «антитело-лекарственное средство» для онкологического заболевания, отличающегося сверхэкспрессией ASCT2, содержащее антитело или его антиген-связывающий фрагмент, которое специфически связывается с эпитопом белка 2 транспортной системы для переноса нейтральных аминокислот (ASCT2), конъюгированное с цитотоксином, и содержит три определяющие комплементарность области тяжелой цепи (HCDR) вариабельной области тяжелой цепи (VH) и три определяющие комплементарность области легкой цепи (LCDR) вариабельной области легкой цепи (VL):
(a)
HCDR1 c аминокислотной последовательностью SEQ ID NO:10;
HCDR2 c аминокислотной последовательностью SEQ ID NO:11;
HCDR3 c аминокислотной последовательностью SEQ ID NO:12;
LCDR1 c аминокислотной последовательностью SEQ ID NO:13;
LCDR2 c аминокислотной последовательностью SEQ ID NO:14; и
LCDR3 c аминокислотной последовательностью SEQ ID NO:15;
или
(b)
HCDR1 c аминокислотной последовательностью SEQ ID NO:16;
HCDR2 c аминокислотной последовательностью SEQ ID NO:17;
HCDR3 c аминокислотной последовательностью SEQ ID NO:18;
LCDR1 c аминокислотной последовательностью SEQ ID NO:19;
LCDR2 c аминокислотной последовательностью SEQ ID NO:20;
и LCDR3 с аминокислотной последовательностью SEQ ID NO:21.
16. Конъюгат «антитело-лекарственное средство» по п.15, в котором:
(a)
VH содержит аминокислотную последовательность SEQ ID NO:1 и
VL содержит аминокислотную последовательность SEQ ID NO:2;
(b)
VH содержит аминокислотную последовательность SEQ ID NO:3 и
VL содержит аминокислотную последовательность SEQ ID NO:4;
(c)
VH содержит аминокислотную последовательность SEQ ID NO:5 и
VL содержит аминокислотную последовательность SEQ ID NO:6;
или
(d)
VH содержит аминокислотную последовательность SEQ ID NO:7 и
VL содержит аминокислотную последовательность SEQ ID NO:8.
17. Конъюгат «антитело-лекарственное средство» по любому из пп.15 или 16, в котором
VH содержит аминокислотную последовательность SEQ ID NO:5 и
VL содержит аминокислотную последовательность SEQ ID NO:6.
18. Конъюгат «антитело-лекарственное средство» по любому из пп.1 или 2, в котором
VH содержит аминокислотную последовательность SEQ ID NO:7 и
VL содержит аминокислотную последовательность SEQ ID NO:8.
19. Конъюгат «антитело-лекарственное средство» по любому из пп.15-18, который содержит константную область IgG, содержащего тяжелую цепь с аминокислотной последовательностью SEQ ID NO:9.
20. Конъюгат «антитело-лекарственное средство» по любому из пп.15-19, где при связывании конъюгата «антитело-лекарственное средство», связывающегося ASCT2 на поверхности клетки, конъюгат «антитело-лекарственное средство» интернализуется в клетку.
21. Конъюгат «антитело-лекарственное средство» по любому из пп.15-20, которое содержит константную область легкой цепи, выбранную из группы, состоящей из константной области легкой цепи каппа человека и константной области легкой цепи лямбда человека.
22. Конъюгат «антитело-лекарственное средство» по п.21, который содержит константную область каппа легкой цепи человека SEQ ID NO:26.
23. Конъюгат «антитело-лекарственное средство» по любому из пп.15-22, в котором цитотоксин выбран из производного тубулизина и пирролобензодиазепина.
24. Конъюгат «антитело-лекарственное средство» по п.23, в котором производное тубулизина представляет собой тубулизин AZ1508.
25. Конъюгат «антитело-лекарственное средство» по п.23, в котором пирролобензодиазепин представляет собой SG3315.
26. Конъюгат «антитело-лекарственное средство» по п.23, в котором пирролобензодиазепин представляет собой SG3249.
27. Конъюгат «антитело-лекарственное средство» по любому из пп.15-26, который связывается с ASCT2 человека и ASCT2 макаки-крабоеда.
28. Конъюгат «антитело-лекарственное средство» по любому из пп.15-27, который не связывается специфически с ASCT1 человека.
29. Фармацевтическая композиция для лечения заболевания или состояния, отличающегося повышенной экспрессией ASCT2, которая содержит эффективное количество конъюгата «антитело-лекарственное средство» по любому из пп.15-28 и фармацевтически приемлемый носитель.
30. Способ лечения онкологического заболевания, отличающегося сверхэкспрессией ASCT2, у пациента, включающий
введение индивиду эффективного количества конъюгата «антитело-лекарственное средства» по любому из пп.15-28 или фармацевтической композиции по п.29.
| US 8673592 B2, 18.03.2014 | |||
| WO 2013176626 A1, 28.11.2013 | |||
| US 20100074894 A1, 25.03.2010 | |||
| АНТИТЕЛА К GDF8 И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2447084C2 |
Авторы
Даты
2019-12-24—Публикация
2016-11-10—Подача