ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка заявляет приоритет по предварительной заявке США № 62/572467, поданной 14 октября 2017 г., содержание которой полностью включено в данный документ посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] «Перечень последовательностей», представленный в электронном виде одновременно с данным документом в соответствии с §1.821 Раздела 37 Кодекса Федеральных Законов в машиночитаемой форме (CFR) через EFS-Web с именем файла «CYTM056001US_12OCT2018_FINAL_ST25.txt», включен в данный документ посредством ссылки. Электронная копия перечня последовательностей была создана 12 октября 2018 года, а размер диска составляет 96 килобайт.
ОБЛАСТЬ ТЕХНИКИ
[0003] Данное изобретение в целом относится к конъюгатам активируемого лекарственного средства с антителами (AADC - activatable antibody drug conjugates), которые связывают CD71 в активированном состоянии, и к способам получения и применения данных активируемых антител, конъюгированных с CD71, при различных терапевтических, диагностических и профилактических показаниях.
УРОВЕНЬ ТЕХНИКИ
[0004] Терапия на основе антител доказала свою эффективность для лечения нескольких заболеваний, но в некоторых случаях токсичность из-за широкой экспрессии мишени ограничивает их терапевтическую эффективность. Кроме того, основанные на антителах терапевтические средства продемонстрировали другие ограничения, такие как быстрое выведение из кровотока после введения.
[0005] В области низкомолекулярной терапии были разработаны стратегии для обеспечения пролекарств активного химического вещества. Такие пролекарства вводят в относительно неактивной (или значительно менее активной) форме. После введения пролекарство in vivo метаболизируется в активное соединение. Такие стратегии в отношении пролекарств могут обеспечить повышенную селективность лекарственного средства по отношению к его предполагаемой мишени и уменьшить побочные эффекты.
[0006] Соответственно, существует постоянная потребность, в области основанной на антителах терапии, в антителах, которые имитируют желательные характеристики низкомолекулярного пролекарства.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0007] Данное изобретение относится к конъюгированным активируемым антителам, которые специфически связываются с CD71, также известным как белок 1 рецептор трансферрина (TfR1).
[0008] В аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли:
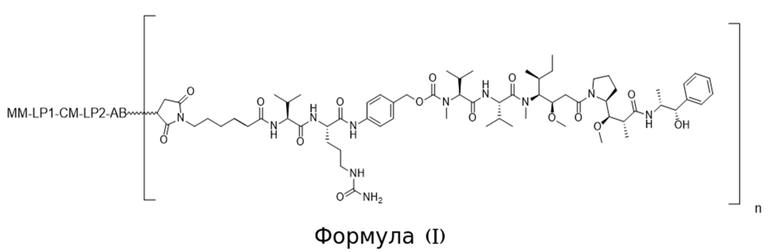
где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) LP1 представляет собой первый связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207; (iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (v) LP2 представляет собой второй связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и (b) при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), т.е. АВ содержит изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), т.е. АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0009] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5 и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) LP1 представляет собой первый связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207; (iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (v) LP2 представляет собой второй связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и (b) при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), т.е. АВ содержит изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), т.е. АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0010] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167 и легкую цепь, содержащую последовательность SEQ ID NO: 19; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) LP1 представляет собой первый связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207; (iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (v) LP2 представляет собой второй связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и (b) при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0011] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли, при этом указанный MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169, и при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0012] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли, при этом указанный MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170, при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0013] В связанном аспекте изобретения предложено в данном документе конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли:
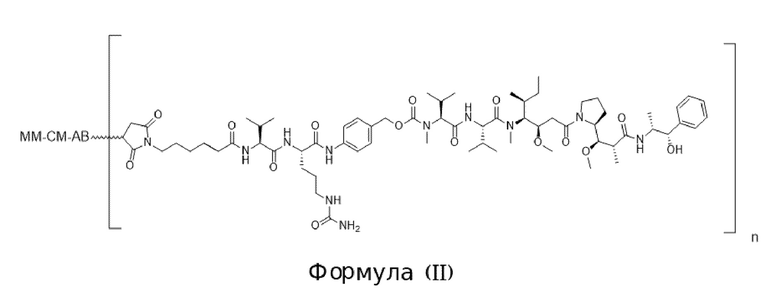
где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; и (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0014] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5 и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; и (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0015] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167 и легкую цепь, содержащую последовательность SEQ ID NO: 19; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; и (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0016] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли, где MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169, и при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0017] В связанном аспекте изобретения в данном документе предложено конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли, где MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170, и при этом «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0018] В другом аспекте изобретения в данном документе предложены способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (I) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) LP1 представляет собой первый связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207; (iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (v) LP2 представляет собой второй связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0019] В другом аспекте изобретения в данном документе предлагаются способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (I) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) LP1 представляет собой первый связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207; (iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (v) LP2 представляет собой второй связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0020] В другом аспекте изобретения в данном документе предлагаются способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (I) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167 и легкую цепь, содержащую последовательность SEQ ID NO: 19; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) LP1 представляет собой первый связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207; (iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (v) LP2 представляет собой второй связывающий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0021] В другом аспекте изобретения в данном документе предлагаются способы производства конъюгированного активируемого антитела, содержащего структуру Формулы (I) или ее соли, где MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0022] В другом аспекте изобретения в данном документе предложены способы получения конъюгированного активируемого антитела, включающего структуру Формулы (I) или ее соли, где MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0023] В другом аспекте изобретения в данном документе предлагаются способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (II) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0024] В другом аспекте изобретения в данном документе предлагаются способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (II) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0025] В другом аспекте изобретения в данном документе предлагаются способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (II) или ее соли, где (i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167 и легкую цепь, содержащую последовательность SEQ ID NO: 19; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM ингибирует связывание AB с CD71 человека, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0026] В другом аспекте изобретения в данном документе предложены способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (II) или ее соли, где MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0027] В другом аспекте изобретения в данном документе предложены способы получения конъюгированного активируемого антитела, содержащего структуру Формулы (II) или ее соли, где MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека, при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170; и (b) при этом «n» равно 2; способ, включающий (i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, восстановителем; и (ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0028] В другом аспекте изобретения в данном документе представлены фармацевтические композиции, содержащие конъюгированное активируемое антитело одной итерации Формулы (I) или Формулы (II). В некоторых вариантах осуществления фармацевтические композиции могут содержать фармацевтически приемлемый носитель.
[0029] В другом аспекте изобретения в данном документе предлагаются способы лечения, ослабления симптомов или задержки прогрессирования рака у субъекта, причем способ включает введение терапевтически эффективного количества конъюгированного активируемого антитела Формулы (I) или Формулы (II) или фармацевтическую композицию, содержащую конъюгированное активируемое антитело одной итерации Формулы (I) или Формулы (II) и, необязательно, фармацевтически приемлемый носитель субъекту, нуждающемуся в этом, для рака, выбранного из группы, состоящей из: рак желудка, рак яичника, рак пищевода, немелкоклеточного рака легких, ER+рака молочной железы, тройной негативный рак молочной железы, колоректальный рак, меланомы, рака простаты, множественной миеломы, диффузной крупноклеточной B-клеточной лимфомы, мелкоклеточной карциномы головы и шеи, рака поджелудочной железы, мезотелиомы, неходжкинской лимфомы, гепатоцеллюлярной карциномы и глиобластомы.
[0030] В другом аспекте изобретения в данном документе представлено конъюгированное активируемое антитело, содержащее (а) активируемое антитело (АА), содержащее в неразрезанном состоянии структурное расположение от N-конца к С-концу следующим образом: MM-CM-AB, где (i) АВ представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит последовательность вариабельной области тяжелой цепи из SEQ ID NO: 5 и последовательность вариабельной области легкой цепи из SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM, связанный с AB, ингибирует связывание AB с CD71, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, связанную с AB, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) монометилауристатин E (MMAE), при этом активируемое антитело конъюгировано с двумя эквивалентами MMAE. В некоторых вариантах осуществления конъюгированное активируемое антитело, содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело, содержит N-концевой глутамат либо на тяжелой цепи, либо на легкой цепи, который, необязательно, является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0031] В другом аспекте изобретения в данном документе представлено конъюгированное активируемое антитело, имеющее формулу AA- (AG) p, где (a) AA представляет собой активируемое антитело, содержащее в неразрезанном состоянии структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB, где (i) AB представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит последовательность вариабельной области тяжелой цепи из SEQ ID NO: 5 и последовательность вариабельной области легкой цепи из SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM, связанный с AB, ингибирует связывание AB с CD71, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, связанную с AB, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) AG представляет собой агент, конъюгированный с AA, при этом агент представляет собой MMAE и при этом p равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело, содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело, содержит N-концевой глутамат либо на тяжелой цепи, либо на легкой цепи, который, необязательно, является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0032] В другом аспекте изобретения в данном документе предложен способ получения конъюгированного активируемого антитела, включающий (а) конъюгирование по меньшей мере одного MMAE с активируемым антителом (AA), в результате чего получают композицию, содержащую AA- (MMAE) p, при этом p равно 1 до 8; и (b) обогащение композиции в отношении конъюгированных активируемых видов антител, у которых р равно 2, где АА в неразрезанном состоянии содержит структурное расположение от N-конца к С-концу следующим образом: MM-CM-AB, при этом AB представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит последовательность вариабельной области тяжелой цепи из SEQ ID NO: 5 и последовательность вариабельной области легкой цепи из SEQ ID NO: 7; (ii) MM представляет собой маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный MM, связанный с AB, ингибирует связывание AB с CD71, когда конъюгированное активируемое антитело находится в неразрезанном состоянии; (iii) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, связанную с AB, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и (b) AG представляет собой агент, конъюгированный с AA, при этом агент представляет собой MMAE и при этом p равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело, содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело, содержит N-концевой глутамат либо на тяжелой цепи, либо на легкой цепи, который, необязательно, является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0033] В другом аспекте изобретения в данном документе предложено любое конъюгированное активируемое антитело или фармацевтическая композиция, как описано в данном документе, для применения в качестве лекарственного средства.
[0034] В другом аспекте изобретения в данном документе предложено любое конъюгированное активируемое антитело или фармацевтическая композиция, как раскрыто в данном документе, для применения при лечении рака, необязательно при этом рак выбран из группы, состоящей из рака желудка, рака яичника, рак пищевода, немелкоклеточного рака легких, ER+рака молочной железы, тройной негативный рак молочной железы, колоректальный рак, меланомы, рака простаты, множественной миеломы, диффузной крупноклеточной B-клеточной лимфомы, мелкоклеточного рака головы и шеи, рака поджелудочной железы, мезотелиомы, неходжкинской лимфомы, гепатоцеллюлярной карциномы и глиобластомы.
[0035] В другом аспекте изобретения в данном документе представлен набор, содержащий по меньшей мере одно активируемое антитело, как описано в данном документе. Набор может дополнительно содержать один или несколько vcMMAE и/или восстановитель.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0036] Фиг. 1, как обсуждается в Примере 5, изображает типичные иммуногистохимические (ИГХ) анализы для определения уровней экспрессии CD71 в различных типах тканей первичного и метастатического рака. Иллюстративные результаты, продемонстрированные на данной фигуре и в примере, продемонстрировали, что CD71 экспрессируется на высоких уровнях в первичных опухолях различных видов рака человека.
[0037] Фиг. 2, как обсуждается в Примере 5, изображает иллюстративные исследования уровня экспрессии CD71 во множественных образцах метастатического рака, полученных от пациента. Иллюстративные результаты, продемонстрированные на данной фигуре и в примере, продемонстрировали, что CD71 экспрессируется на высоких уровнях в метастатических опухолях при различных видах рака человека.
[0038] На Фиг. 3А и 3В, как обсуждается в Примере 4, изображен иллюстративный анализ in vitro способности неконъюгированных и конъюгированных активируемых антител против CD71 по данному изобретению связывать рекомбинантный CD71 человека или яванского макака, когда активируемое антитело является интактным или протеолитически активированным (обозначается как «ACT»). Иллюстративные результаты, продемонстрированные на данных фигурах и в Примере, продемонстрировали, что анти-CD71-конъюгированное активируемое антитело связывалось с CD71 на уровнях, сравнимых с его неконъюгированным активируемым анти-CD71-антителом, а также оба связывали CD71 с эквивалентным повышенным сродством при активации протеазы.
[0039] На Фиг. 3C и 3D, как обсуждается в Примере 4, изображают иллюстративный анализ in vitro способности неконъюгированных и конъюгированных активируемых антител против CD71 по данному изобретению связывать CD71 человека или яванского макака на поверхности клетки, когда активируемое антитело является интактным или протеолитически активированным (обозначается как «ACT»). Иллюстративные результаты, продемонстрированные на данных фигурах и в Примере, продемонстрировали, что конъюгированное активируемое антитело против CD71 связывалось с CD71 на клеточной поверхности на уровнях, сравнимых с его активируемым антителом, не активируемым против CD71, а также с обоими связанными CD71 на поверхности клетки с эквивалентным повышенным сродством после активации протеазой.
[0040] На Фиг. 4A, 4B и 4C, как обсуждается в Примере 6, изображены иллюстративные исследования эффективности активируемых антител, конъюгированных с CD71 (AADC) по данному изобретению, на модели ксенотрансплантата мыши (анти-CD71 TF01-3011-MMAE против анти-CD71). TF02.13-2011-MMAE). Данные иллюстративные результаты продемонстрированы на данных фигурах и пример того, что AADC с маскирующим фрагментом с более низким сродством (TF02.13) продемонстрировал более высокую эффективность, чем AADC с маскирующим фрагментом с более высоким сродством (TF01).
[0041] Фиг. 5, как обсуждено в Примере 7, изображает иллюстративное исследование эффективности активируемых антител, конъюгированных с CD71 (AADC) по данному изобретению, на модели ксенотрансплантата мыши. Иллюстративные результаты, продемонстрированные на данной фигуре, и пример демонстрируют, что эффективность указанного AADC (анти-CD71 TF02.13-2011-vcMMAE) с менее разрезаемым субстратом по существу такая же, как эффективность AADC (анти-CD71 TF02). 13-3011-vcMMAE) с более разрезаемым субстратом, продемонстрированным на Фиг. 4В и 4С.
[0042] На Фиг. 6А, 6В, 6С и 6D, как обсуждается в Примере 8, изображены иллюстративные исследования эффективности конъюгированных активируемых антител против CD71 (AADC) с различными DAR (анти-CD71 TF02.13-2011-vcMMAE с DAR ~ 3 по сравнению с DAR ~ 3 против. анти-CD71 TF02.13-2011-vcMMAE E2 с DAR ~ 2) данного раскрытия в модели ксенотрансплантата мыши. Иллюстративные результаты, продемонстрированные на данных фигурах, и пример демонстрируют, что эффективность AADC с согласованной дозой (анти-CD71 TF02.13-2011-vcMMAE), имеющих различные DAR, продемонстрировала сопоставимую эффективность.
[0043] На Фиг.7А, 7В и 7С, как обсуждено в Примере 9, продемонстрированы иллюстративные схематические рабочие процессы для анализа продуктов метаболизма, возникающих в результате введения конъюгированных активируемых антител против CD71 (AADC) по данному изобретению.
[0044] На Фиг.8А, 8В, 9А, 9В, 10 и 11, как обсуждено в Примерах 11-14, изображены иллюстративные процессы появления со временем метаболических побочных продуктов после введения конъюгированных активируемых антител против CD71 (AADC) по данному изобретению на животной модели., Иллюстративные результаты, продемонстрированные на данных фигурах, и пример демонстрируют, что количество общего и неповрежденного AADC по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) сохраняется у животных в течение всего дозирования в пропорциональном дозе количестве, и количество MMAE, которое конъюгировано с активируемым антителом, существенно выше, чем количество неконъюгированного MMAE во время дозирования и на всех уровнях дозирования.
[0045] Фиг. 12, как обсуждается в Примере 17, изображает иллюстративное титрование указанных тестируемых изделий до фрагмента белка iC3b, представляющее их способность активировать каскад комплемента. Иллюстративные результаты, продемонстрированные на данной фигуре и примере, демонстрируют, что AADC по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) продемонстрировал более низкую способность к активации комплемента по сравнению с его неконъюгированным активируемым антителом.
[0046] Фиг. 13, как обсуждается в Примере 19, изображает иллюстративную эффективность AADC по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) в мышиной модели ксенотрансплантата с использованием колоректальных клеточных линий человека. Иллюстративные результаты, продемонстрированные на данной Фиг., и пример демонстрируют, что AADC по данному изобретению демонстрирует значительное ингибирование роста опухоли при всех дозировках с полной регрессией, наблюдаемой при самых высоких дозировках.
[0047] Фиг. 14, как обсуждено в Примере 20, изображает иллюстративную эффективность AADC по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) в модели ксенотрансплантата мыши с использованием опухолей, полученных от пациента (DLBCL). Иллюстративные результаты, продемонстрированные на данной Фиг. и в Примере, демонстрируют, что AADC по данному изобретению демонстрирует значительное ингибирование роста опухоли после однократного введения, причем полные ответы наблюдаются в некоторых случаях.
[0048] На Фиг. 15A, 15B и 15C, как обсуждено в Примере 21, изображает иллюстративную эффективность AADC по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) в мышиных моделях ксенотрансплантата, полученных от пациентов (PDX). Иллюстративные результаты, продемонстрированные на данных фигурах, и пример демонстрируют, что AADC по данному раскрытию продемонстрировал эффективность, включая полные ответы в некоторых случаях, в моделях PDX, полученных из множества типов рака человека.
[0049] Фиг. 16, как обсуждено в Примере 22, изображает иллюстративную эффективность AADC по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) в мышиной модели ксенотрансплантата, полученного от пациента. Иллюстративные результаты, продемонстрированные на данной Фиг. и Примере, демонстрируют, что AADC по данному изобретению продемонстрировал эффективность, включая полные ответы в некоторых случаях, на модель PDX рака поджелудочной железы.
[0050] Фиг. 17, как обсуждается в Примере 10, суммирует результаты, которые демонстрируют, что активируемые антитела против CD71 человека с конъюгированными токсинами (AADC) по данному изобретению (анти-CD71 TF02.13-2011-vcMMAE E2) хорошо переносятся и стабильны у яванского макака даже в более высоких относительных дозах по сравнению с соответствующим родительским конъюгатом антитела против CD71 лекарственного средства (ADC), AADC, имели субстрат с большей расщепляемостью, и AADC, имели более высокий DAR.
[0051] На Фиг. 18А, 18В и 18С, как обсуждено в Примере 27, продемонстрирован профиль HIC-разделенных видов, присутствующих в неочищенном анти-CD71-TF02.13-2011-vcMMAE и очищенном анти-CD71-TF02.13-2011-vcMMAE E2, а также их скорость очистки у мышей. Данные фигуры и пример демонстрируют, что анти-CD71-TF02.13-2011-vcMMAE E2 мигрирует как один вид конъюгата и имеет более низкую скорость клиренса.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0052] Данное изобретение относится к активируемым антителам, конъюгированным с CD71, которые специфически связывают CD71 в активированном состоянии. CD71 также известен как белок 1 рецептора трансферрина (TfR1). Как правило, настоящее раскрытие направлено на конъюгированное активируемое антитело против CD71, содержащее маскирующий фрагмент, разрезаемый фрагмент, линкер vc и токсин MMAE. Маскирующий фрагмент (MM) снижает способность сайта связывания антитела связываться с его антигеном-мишенью CD71, когда активируемое антитело находится в неразрезанном состоянии; разрезаемый фрагмент (CM) представляет собой активируемый протеазой субстрат, который разрезается в микроокружении опухоли, что приводит к удалению маскирующего фрагмента и сопутствующей активации CDR, нацеленных на анти-CD71. В частности, в данном раскрытии описывается выбор анти-CD71-конъюгированного активируемого моноклонального антитела, которое обладает превосходной эффективностью и переносимостью по отношению к другим анти-CD71-конъюгированным активируемым моноклональным антителам, известным в данной области техники, благодаря тому, что оно имеет уникальную комбинацию маскирующего фрагмента с низким сродством, менее разрезаемый фрагмент субстрата и низкую загрузку лекарственного средства - 2, что в совокупности приводит к значительному улучшению эффективности и переносимости на моделях опухолей у мышей. Кроме того, анти-CD71 конъюгированное активируемое моноклональное антитело также неожиданно лишено способности связываться с ингибирующим рецептором Fc RIIb, в отличие от других антител, содержащих Fc IgG1 дикого типа, что важно, поскольку известно, что связывание с такими рецепторами ингибирует кальций-зависимые процессы, такие как дегрануляция, фагоцитоз, антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC), высвобождение цитокинов и провоспалительная активация, и все это может привести к снижению эффективности, если активирован рецептор FcγRIIb.
[0053] CD71 представляет собой рецептор клеточной поверхности, который экспрессируется на делящихся клетках, включая раковые клетки. Он экспрессируется на высоком уровне в самых разных типах раковых клеток, и CD71 интернализуется, что делает его привлекательной мишенью для целевой терапии рака с использованием направляемых антителом конъюгированных токсинов. Маскирующие фрагменты (MM), имеющие более высокую и более низкую афинность, а также разрезаемые фрагменты (CM), имеющие меньшую или большую расщепляемость, были идентифицированы и использованы для конструирования множества активируемых антител, а затем антител, конъюгированных с vcMMAE (т.е. конъюгатов активируемого лекарственного средства с антителом или AADC), Иллюстративные исследования эффективности данных конъюгированных активируемых антител на мышиной модели ксенотрансплантата продемонстрировали, что AADC с маскирующими фрагментами более высокой аффинности (например, CD71-TF01-3011-vcMMAE), продемонстрировали более низкую эффективность, чем те, которые имеют маскирующие фрагменты с более низкой аффинностью (например, CD71-TF02.13-3011-vcMMAE). Более того, другие исследования эффективности с использованием AADC, имеющих те же маскирующие фрагменты с более низкой аффинностью, но с субстратами с различной расщепляемостью, продемонстрировали, что, хотя эффективность была одинаковой, у приматов, не являющихся человеком, AADC с менее разрезаемым субстратом (CD71-TF02.13-2011-vcMMAE) была лучше переносимой и с более низкими уровнями циркулирующего AADC в активированной форме по сравнению с AADC с более разрезаемым субстратом (CD71-TF02.13-3011-vcMMAE), таким образом обеспечивая более высокий терапевтический индекс. Дальнейшие исследования продемонстрировали, что AADC с более низким отношением лекарственное средство к активируемому антителу (например, CD71-TF02.13-3011-vcMMAE E2, где DAR равно 2) более переносимы при более высоких дозировках по сравнению с тем же конъюгированным активируемым антителом с болле высоким DAR (т.е. DAR ~ 3). Более того, CD71-TF02.13-3011-vcMMAE E2 продемонстрировал эквивалентную эффективность с дозами, подобранными по дозе, с более высокой DAR AADC в различных мышиных моделях CDX и PDX с раком человека. Наконец, CD71-TF02.13-3011-vcMMAE E2 продемонстрировал значительную переносимость по отношению к его немаскированному аналогу, который не переносился даже при низких дозах.
[0054] В некоторых вариантах осуществления конъюгированные активируемые моноклональные антитела интернализуются клетками, содержащими CD71. Использование термина «CD71» предназначено для охвата любого его варианта, такого как, в качестве неограничивающего примера, CD-71 и/или CD 71, и все варианты используются в данном документе взаимозаменяемо.
[0055] CD71 представляет собой трансмембранный гликопротеин, который в основном связывает трансферрин. CD71 необходим для гомеостаза клеток. CD71 непрерывно рециркулируется посредством лиганд-опосредованного эндоцитоза, при этом основным лигандом является трансферрин. Также известно, что CD71 повсеместно экспрессируется на делящихся клетках.
[0056] Аберрантная экспрессия и/или активность передачи сигналов, связанных с CD71 и CD71, вовлечены в патогенез многих заболеваний и расстройств, таких как рак. CD71 сверхэкспрессируется при многих раковых заболеваниях, включая солидный и гематологический рак. CD71 обладает широкой экспрессией на клеточной поверхности. CD71 в злокачественных клетках обеспечивает более высокое усвоение железа, необходимого для клеточного деления. CD71 также связан с плохим прогнозом при лейкозах. CD71 является желательной мишенью, потому что он распространен по множественным показаниям рака.
[0057] Данное раскрытие изобретения обеспечивает конъюгированные активируемые анти-CD71-антитела, которые пригодны для способов лечения, предотвращения, замедления прогрессирования, ослабления и/или облегчения симптомов заболевания или расстройства, связанного с аберрантной экспрессией и/или активностью CD71. Например, активируемые анти-CD71-антитела используются в способах лечения, предотвращения, замедления прогрессирования, ослабления и/или облегчения симптомов рака или другого неопластического состояния.
[0058] Данное раскрытие изобретения обеспечивает анти конъюгированные активируемые анти-CD71-антитела, которые пригодны для способов лечения, предотвращения, замедления прогрессирования, ослабления и/или облегчения симптомов заболевания или расстройства, связанного с клетками, экспрессирующими CD71. В некоторых вариантах осуществления клетки связаны с аберрантной экспрессией и/или активностью CD71. В некоторых вариантах осуществления клетки связаны с нормальной экспрессией и/или активностью CD71. Например, активируемые анти-CD71-антитела используются в способах лечения, предотвращения, замедления прогрессирования, ослабления и/или облегчения симптомов рака или другого неопластического состояния.
[0059] Данное раскрытие изобретения обеспечивает конъюгированные активируемые анти-CD71-антитела, которые пригодны для способов лечения, предотвращения, замедления прогрессирования, ослабления и/или облегчения симптомов заболевания или расстройства, при котором больные клетки экспрессируют CD71. В некоторых вариантах осуществления больные клетки связаны с аберрантной экспрессией и/или активностью CD71. В некоторых вариантах осуществления больные клетки связаны с нормальной экспрессией и/или активностью CD71. Например, активируемые анти-CD71-антитела используются в способах лечения, предотвращения, замедления прогрессирования, ослабления и/или облегчения симптомов рака или другого неопластического состояния.
[0060] Конъюгированные активируемые анти-CD71-антитела содержат антитело или его антигенсвязывающий фрагмент, который специфически связывает CD71, связанный с маскирующим фрагментом (ММ), так что связывание ММ снижает способность антитела или его антигенсвязывающего фрагмента связывать CD71. В некоторых вариантах осуществления MM связан через последовательность, которая содержит субстрат для протеазы, например протеазы, которая совместно локализована с CD71 в месторасположении лечения у субъекта.
[0061] Иллюстративные активируемые антитела против CD71 по данному изобретению включают, например, активируемые антитела, которые включают тяжелую цепь и легкую цепь, которые являются производными вариабельных последовательностей тяжелой цепи и легкой цепи или получены из них, как продемонстрировано ниже (последовательности CDR продемонстрированы в жирным шрифтом и подчеркиванием):
muM21 VH:
EVQLQESGTVLARPGASVKMSCKAS GYTFTSYWMH WVKQRPGQGLEWIG AIYPGNSETG YNQNFKGKAKLTAVTSASTAYMDLSSLTNEDSAVYYCTR ENWDPGFAF WGQGTLITVSA (SEQ ID NO 1):
muM21 VL:
DIVMTQTPAIMSASPGEKVTITC SASSSVYYMY WFQQKPGTSPKLWIY STSNLAS GVPVRFSGSGSGTSYSLTISRMEAEDAATYYC QQRRNYPYT FGGGTKLEIKRA (SEQ ID NO: 2)
вариабельная тяжелая цепь hu2vHa
QVQLVQSGAEVKKPGASVKVSCKAS GYTFTSYWMH WVRQAPGQGLEWMG AIYPGNSETG YAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCAR ENWDPGFAF WGQGTLVTVSS (SEQ ID 3):
вариабельная тяжелая цепь hu2vHb
QVQLVQSGAEVKKPGASVKMSCKAS GYTFTSYWMH WVRQAPGQGLEWIG AIYPGNSETG YAQKFQGRATLTADTSTSTAYMELSSLRSEDTAVYYCTR ENWDPGFAF WGQGTLVTVSS (SEQ ID NO: 4)
вариабельная тяжелая цепь hu2vHc
QVQLVQSGAEVKKPGASVKMSCKAS GYTFTSYWMH WVRQAPGQGLEWIG AIYPGNSETG YAQKFQGRATLTADTSTSTAYMELSSLRSEDTAVYYCTR ENWDPGFAF WGQGTLITVSS (SEQ ID NO: 5)
вариабельная легкая цепь hu21vKa
DIQMTQSPSSLSASVGDRVTITC SASSSVYYMY WYQQKPGKAPKLLIY STSNLAS GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC QQRRNYPYT FGQGTKLEIK (SEQ ID NO: 6)
вариабельная легкая цепь hu21vKb
DIQMTQSPSSLSASVGDRVTITC SASSSVYYMY WFQQKPGKAPKLWIY STSNLAS GVPSRFSGSGSGTDYTLTISSMQPEDFATYYC QQRRNYPYT FGQGTKLEIK (SEQ ID NO: 7)
вариабельная легкая цепь hu21vKc
DIQMTQSPSSLSASVGDRVTIT CRASSSVYYMY WFQQKPGKAPKLWIY STSNLAS GVPSRFSGSGSGTDYTLTISSMQPEDFATYYC QQRRNYPYT FGQGTKLEIK (SEQ ID NO: 8)
[0062] Иллюстративные активируемые анти-CD71-антитела по данному изобретению включают, например, активируемые антитела, которые содержат комбинацию последовательности области 1, определяющей комплементарность, вариабельной тяжелой цепи (VH CDR1, также называемой в данном документе CDRH1), последовательности области 2, определяющей комплементарность, вариабельной тяжелой цепи (VH CDR2, также называемой в данном документе CDRH2), последовательности области 3, определяющей комплементарность, вариабельной тяжелой цепи (VH CDR3, также называемой в данном документе CDRH3), последовательности области 1, определяющей комплементарность, вариабельной легкой цепи (VL CDR1, также называемой в данном документе CDRL1), последовательности области 2, определяющей комплементарность, вариабельной легкой цепи (VL CDR2, также называемой в данном документе CDRL2), и последовательности области 3, определяющей комплементарность, вариабельной легкой цепи (VL CDR3, также называемой в данном документе CDRL3), при этом по меньшей мере, одна последовательность CDR выбрана из группы, состоящей из последовательности VH CDR1, содержащей аминокислотную последовательность GYTFTSYWMH (SEQ ID NO: 9); последовательность VH CDR2, содержащей аминокислотную последовательность AIYPGNSETG (SEQ ID NO: 10); последовательности VH CDR3, содержащей аминокислотную последовательность ENWDPGFAF (SEQ ID NO: 11); последовательности CDR1 VL, содержащей аминокислотную последовательность SASSSVYYMY (SEQ ID NO: 12) или CRASSSVYYMY (SEQ ID NO: 13); последовательности CDR2 VL, содержащей аминокислотную последовательность STSNLAS (SEQ ID NO: 14); и последовательности CDR3 VL, содержащей аминокислотную последовательность QQRRNYPYT (SEQ ID NO: 15).
[0063] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит комбинацию последовательности VH CDR1, последовательности VH CDR2, последовательности VH CDR3, последовательности VL CDR1, последовательности VL CDR2, и последовательность CDR3 VL, при этом по меньшей мере одна последовательность CDR выбрана из группы, состоящей из последовательности VH CDR1, которая содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности VH CDR1, содержащей аминокислотную последовательность GYTFTSYWMH (SEQ ID NO: 9); последовательность VH CDR2, которая содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности VH CDR2, содержащей аминокислотную последовательность AIYPGNSETG (SEQ ID NO: 10); последовательность VH CDR3, которая содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности VH CDR3, содержащей аминокислотную последовательность ENWDPGFAF (SEQ ID NO: 11); последовательность VL CDR1, которая содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности VL CDR1, содержащей аминокислотную последовательность ASSSVYYMY (SEQ ID NO: 12) или CRASSSVYYMY (SEQ ID NO: 13); последовательность VL CDR2, которая содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности VL CDR2, содержащей аминокислотную последовательность STSNLAS (SEQ ID NO: 14); и последовательность VL CDR3, которая содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична последовательности VL CDR3, содержащей аминокислотную последовательность QQRRNYPYT (SEQ ID NO: 15).
[0064] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит комбинацию последовательности VH CDR1, последовательности VH CDR2, последовательности VH CDR3, последовательности VL CDR1, последовательности VL CDR2, и последовательность CDR3 VL, при этом последовательность VH CDR1 содержит аминокислотную последовательность GYTFTSYWMH (SEQ ID NO: 9); последовательность VH CDR2 содержит аминокислотную последовательность AIYPGNSETG (SEQ ID NO: 10); последовательность VH CDR3 содержит аминокислотную последовательность ENWDPGFAF (SEQ ID NO: 11); последовательность VL CDR1 содержит аминокислотную последовательность SASSSVYYMY (SEQ ID NO: 12) или CRASSSVYYMY (SEQ ID NO: 13); последовательность VL CDR2 содержит аминокислотную последовательность STSNLAS (SEQ ID NO: 14); и последовательность VL CDR3 содержит аминокислотную последовательность QQRRNYPYT (SEQ ID NO: 15).
[0065] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит комбинацию последовательности VH CDR1, последовательности VH CDR2, последовательности VH CDR3, последовательности VL CDR1, последовательности VL CDR2, и последовательность VL CDR3, при этом последовательность VH CDR1 содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична аминокислотной последовательности GYTFTSYWMH (SEQ ID NO: 9); последовательность VH CDR2 содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична аминокислотной последовательности AIYPGNSETG (SEQ ID NO: 10); последовательность VH CDR3 содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична аминокислотной последовательности ENWDPGFAF (SEQ ID NO: 11); последовательность VL CDR1 содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична аминокислотной последовательности SASSSVYYMY (SEQ ID NO: 12) или CRASSSVYYMY (SEQ ID NO: 13); последовательность VL CDR2 содержит последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична аминокислотной последовательности STSNLAS (SEQ ID NO: 14); и последовательность CDR3 VL, последовательность которой по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична аминокислотной последовательности QQRRNYPYT (SEQ ID NO: 15).
[0066] В некоторых вариантах осуществления антитело конъюгированного активируемого антитела по данному изобретению включает антитело, которое специфически связывает CD71. В некоторых вариантах осуществления конъюгированное активируемое антитело содержит моноклональное антитело, которое связывает CD71. В некоторых вариантах осуществления такое моноклональное антитело, которое связывает CD71, представляет собой гуманизированное или полностью человеческое моноклональное антитело.
[0067] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит аминокислотную последовательность вариабельной области тяжелой цепи, содержащую SEQ ID NO: 5. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит аминокислотную последовательность вариабельной области легкой цепи, содержащую SEQ ID NO: 7. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит аминокислотную последовательность вариабельной области тяжелой цепи, содержащую SEQ ID NO: 5, и аминокислотную последовательность вариабельной области легкой цепи или его антигенсвязывающий фрагмент, содержащий SEQ ID NO: 7.
[0068] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит аминокислотную последовательность вариабельной области тяжелой цепи, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, содержащей SEQ ID NO: 5. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит аминокислотную последовательность вариабельной области легкой цепи, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, содержащей SEQ ID NO: 7. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению содержит аминокислотную последовательность вариабельной области тяжелой цепи, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, содержащей SEQ ID NO: 1 и 3-5, и аминокислотную последовательность вариабельной области легкой цепи, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, содержащей SEQ ID NO: 7.
[0069] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность тяжелой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 5 В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность легкой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 7. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность тяжелой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 5, и последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность легкой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 7.
[0070] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность тяжелой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 5. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность легкой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 7. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность тяжелой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID NO: 5, и последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность легкой цепи, содержащую аминокислотную последовательность, содержащую SEQ ID №: 7.
[0071] Данное раскрытие также предоставляет способы получения активируемого антитела из конъюгированного активируемого антитела по данному изобретению путем культивирования клетки в условиях, которые приводят к экспрессии активируемого антитела, при этом клетка содержит молекулу нуклеиновой кислоты по данному изобретению или вектор по данному изобретению.,
[0072] Данное изобретение также относится к конъюгированным активируемым антителам, которые содержат антитело или его антигенсвязывающий фрагмент, который специфически связывает CD71, связанный с маскирующим фрагментом (ММ), так что связывание ММ уменьшает способность антитела или его антигенсвязывающего фрагмента связываться с CD71. В некоторых вариантах осуществления MM связан через последовательность, которая содержит субстрат для протеазы, например, протеазу, которая активна в пораженной ткани, и/или протеазу, которая локализована совместно с CD71 в месторасположении лечения у субъекта. Конъюгированные активируемые анти-CD71-антитела, представленные в данном документе, также упоминаемые в данном документе взаимозаменяемо как анти-CD71-конъюгируемые активируемые антитела или CD71-конъюгированные активируемые антитела, являются стабильными в кровообращении, активируются в предполагаемых участках терапии и/или диагностики, но не в нормальной, например, здоровой ткани или другой ткани, не предназначенной для лечения и/или диагностики, и при активации проявляют связывание с CD71, которое, по меньшей мере, сопоставимо с соответствующим немодифицированным антителом, также называемым в данном документе родительским антителом.
[0073] Данное изобретение также предлагает способы лечения, предотвращения и/или задержки начала или прогрессирования или облегчения симптомов, связанных с аберрантной экспрессией и/или активностью CD71, у субъекта с использованием конъюгированных активируемых антител, которые связывают CD71, в частности конъюгированных активируемых антител, которые связывают и нейтрализуют или иным образом ингибируют по меньшей мере одну биологическую активность CD71 и/или CD71-опосредованной передачи сигналов.
[0074] Данное изобретение также предлагает способы лечения, предотвращения и/или задержки появления или прогрессирования или облегчения симптомов, связанных с наличием, ростом, пролиферацией, метастазированием и/или активностью клеток, которые экспрессируют CD71 или аберрантно экспрессируют CD71 у субъекта, который использует конъюгированные активируемые антитела, которые связывают CD71, особенно активируемые антитела, которые связывают, нацелены, нейтрализуют, уничтожают или иным образом ингибируют по меньшей мере одну биологическую активность клеток, которые экспрессируют или аберрантно экспрессируют CD71.
[0075] Данное изобретение также предлагает способы лечения, предотвращения и/или задержки начала или прогрессирования или облегчения симптомов, связанных с присутствием, ростом, пролиферацией, метастазированием и/или активностью клеток, которые экспрессируют CD71, у субъекта с использованием конъюгированных активируемых антител, которые связывают CD71, особенно активируемых антител, которые связывают, нацеливают, нейтрализуют, уничтожают или иным образом ингибируют по меньшей мере одну биологическую активность клеток, которые экспрессируют CD71.
[0076] Данное изобретение также предлагает способы лечения, предотвращения и/или задержки начала или прогрессирования или облегчения симптомов, связанных с присутствием, ростом, пролиферацией, метастазированием и/или активностью клеток, которые аберрантно экспрессируют CD71 у субъекта с использованием конъюгированных активируемых антител, которые связывают CD71, в частности конъюгированных активируемых антител, которые связывают, нацеливают, нейтрализуют, уничтожают или иным образом ингибируют по меньшей мере одну биологическую активность клеток, которые аберрантно экспрессируют CD71.
[0077] Конъюгированные активируемые антитела в активированном состоянии связывают CD71 и содержат (i) антитело (AB), которое специфично связывается с CD71; (ii) маскирующий фрагмент (MM), который, когда активируемое антитело находится в неразрезанном состоянии, ингибирует связывание AB с CD71; и (c) разрезаемый фрагмент (СМ), связанный с АВ, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы.
[0078] В некоторых вариантах осуществления конъюгированное активируемое антитело в неразрезанном состоянии имеет структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM.
[0079] В некоторых вариантах осуществления конъюгированное активируемое антитело содержит линкерный пептид между MM и CM.
[0080] В некоторых вариантах осуществления конъюгированное активируемое антитело содержит линкерный пептид между CM и AB.
[0081] В некоторых вариантах осуществления конъюгированное активируемое антитело содержит первый линкерный пептид (LP1) и второй линкерный пептид (LP2), причем конъюгированное активируемое антитело в неразрезанном состоянии имеет структурное расположение от N-конца к C-концу следующим образом: MM-LP1-CM-LP2-AB или AB-LP2-CM-LP1-MM. В некоторых вариантах осуществления два линкерных пептида не обязательно должны быть идентичными друг другу.
[0082] В некоторых вариантах по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS)n, (GGS)n, (GSGGS)n (SEQ ID NO: 24) и (GGGS)n (SEQ ID NO: 25), где n является целым числом, по меньшей мере, один.
[0083] В некоторых вариантах по меньшей мере один из LP1 или LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из GGSG (SEQ ID NO: 26), GGSGG (SEQ ID NO: 27), GSGSG (SEQ ID NO: 28), GSGGG (SEQ ID NO: 29), GGGSG (SEQ ID NO: 30) и GSSSG (SEQ ID NO: 31).
[0084] В некоторых вариантах осуществления LP1 содержит аминокислотную последовательность GGGSSGGS (SEQ ID NO: 207), GSSGGSGGSGGSG (SEQ ID NO: 32), GSSGGSGGSGG (SEQ ID NO: 33), GSSGGSGGSGGS (SEQ ID NO: 34), GSSGSGSGSGSGSGSGSGSGSGSGSGSGSGSGSGSGSGSGGSGSGGSG SEQ ID NO: 35), GSSGGSGGSG (SEQ ID NO: 36), GSSGGSGGSGS (SEQ ID NO: 37).
[0085] В некоторых вариантах осуществления LP2 содержит аминокислотную последовательность GSS, GGS, GGGS (SEQ ID NO: 38), GSSGT (SEQ ID NO: 39) или GSSG (SEQ ID NO: 40).
[0086] В некоторых вариантах осуществления АВ имеет константу диссоциации около 100 нМ или менее для связывания с CD71 млекопитающих. В некоторых вариантах осуществления АВ имеет константу диссоциации около 10 нМ или менее для связывания с CD71 млекопитающих. В некоторых вариантах осуществления AB имеет константу диссоциации около 5 нМ или менее для связывания с CD71. В некоторых вариантах осуществления AB имеет константу диссоциации около 1 нМ или менее для связывания с CD71. В некоторых вариантах осуществления AB имеет константу диссоциации около 0,5 нМ или менее для связывания с CD71. В некоторых вариантах осуществления AB имеет константу диссоциации около 0,1 нМ или менее для связывания с CD71. В некоторых вариантах осуществления АВ имеет константу диссоциации от 0,01 до 100 нМ, от 0,01 до 10 нМ, от 0,01 до 5 нМ, от 0,01 до 1 нМ, от 0,01 до 0,5 нМ, от 0,01 до 0,1 нМ, от 0,01 до 0,05 нм. нМ, от 0,05 нМ до 100 нМ, от 0,05 нМ до 10 нМ, от 0,05 нМ до 5 нМ, от 0,05 нМ до 1 нМ, от 0,05 до 0,5 нМ, от 0,05 нМ до 0,1 нМ, от 0,1 нМ до 100 нМ, от 0,1 нМ до 10 нМ, 0,1 нМ до 5 нМ, от 0,1 нМ до 1 нМ, от 0,1 до 0,5 нМ, от 0,5 нМ до 100 нМ, от 0,5 нМ до 10 нМ, от 0,5 нМ до 5 нМ, от 0,5 нМ до 1 нМ, от 1 нМ до 100 нМ, от 1 нМ до 10 нМ, от 1 нМ до 5 нМ, от 5 нМ до 100 нМ, от 5 нМ до 10 нМ или от 10 нМ до 100 нМ для связывания с CD71 млекопитающих.
[0087] В некоторых вариантах осуществления конъюгированное активируемое антитело в неразрезанном состоянии специфично связывается с CD71 млекопитающих с константой диссоциации, меньшей или равной 1 нМ, меньшей или равной 5 нМ, меньшей или равной 10 нМ, меньшей или равной до 15 нМ, меньшей или равной 20 нМ, меньшей или равной 25 нМ, меньшей или равной 50 нМ, меньшей или равной 100 нМ, меньшей или равной 150 нМ, меньшей или равной 250 нМ, меньшей или равной 500 нМ, меньшей или равной 750 нМ, меньшей или равной 1000 нМ и/или меньшей или равной 2000 нМ.
[0088] В некоторых вариантах осуществления конъюгированное активируемое антитело в неразрезанном состоянии специфично связывается с CD71 млекопитающих с константой диссоциации в диапазоне от 1 нМ до 2000 нМ, от 1 нМ до 1000 нМ, от 1 нМ до 750 нМ, от 1 нМ до 500 нМ, От 1 нМ до 250 нМ, от 1 нМ до 150 нМ, от 1 нМ до 100 нМ, от 1 нМ до 50 нМ, от 1 нМ до 25 нМ, от 1 нМ до 15 нМ, от 1 нМ до 10 нМ, от 1 нМ до 5 нМ, 5 нМ до 2000 нМ, от 5 нМ до 1000 нМ, от 5 нМ до 750 нМ, от 5 нМ до 500 нМ, от 5 нМ до 250 нМ, от 5 нМ до 150 нМ, от 5 нМ до 100 нМ, от 5 нМ до 50 нМ, от 5 нМ до 25 нМ, от 5 нМ до 15 нМ, от 5 нМ до 10 нМ, от 10 нМ до 2000 нМ, от 10 нМ до 1000 нМ, от 10 нМ до 750 нМ, от 10 нМ до 500 нМ, от 10 нМ до 250 нМ, от 10 нМ до 150 нМ, От 10 нМ до 100 нМ, от 10 нМ до 50 нМ, от 10 нМ до 25 нМ, от 10 нМ до 15 нМ, от 15 нМ до 2000 нМ, от 15 нМ до 1000 нМ, от 15 нМ до 750 нМ, от 15 нМ до 500 нМ, 15 нМ до 250 нМ, от 15 нМ до 150 нМ, от 15 нМ до 100 нМ, от 15 нМ до 50 нМ, от 15 нМ до 25 нМ, от 25 нМ до 2000 нМ, от 25 нМ до 1000 нМ, от 25 нМ до 750 нМ, от 25 нМ до 500 нМ, от 25 нМ до 250 нМ, от 25 нМ до 150 нМ, от 25 нМ до 100 нМ, от 25 нМ до 50 нМ, от 50 нМ до 2000 нМ, от 50 нМ до 1000 нМ, от 50 нМ до 750 нМ, от 50 нМ до 500 нМ, от 50 нМ до 250 нМ, от 50 нМ до 150 нМ, от 50 нМ до 100 нМ, от 100 нМ до 2000 нМ, от 100 нМ до 1000 нМ, От 100 нМ до 750 нМ, от 100 нМ до 500 нМ, от 100 нМ до 250 нМ, от 100 нМ до 150 нМ, от 150 нМ до 2000 нМ, от 150 нМ до 1000 нМ, от 150 нМ до 750 нМ, от 150 нМ до 500 нМ, 150 нМ до 250 нМ, от 250 нМ до 2000 нМ, от 250 нМ до 1000 нМ, от 250 нМ до 750 нМ, от 250 нМ до 500 нМ, от 500 нМ до 2000 нМ, от 500 нМ до 1000 нМ, от 500 нМ до 750 нМ, от 500 нМ до 500 нМ, от 500 нМ до 250 нМ, от 500 нМ до 150 нМ, от 500 нМ до 100 нМ, от 500 нМ до 50 нМ, от 750 нМ до 2000 нМ, от 750 нМ до 1000 нМ или от 1000 нМ до 2000 нМ.
[0089] В некоторых вариантах осуществления конъюгированное активируемое антитело в активированном состоянии специфично связывается с CD71 млекопитающих с константой диссоциации, меньшей или равной 0,01 нМ, 0,05 нМ, 0,1 нМ, 0,5 нМ, 1 нМ, 5 нМ или 10 нМ.
[0090] В некоторых вариантах осуществления конъюгированное активируемое антитело в активированном состоянии специфично связывается с CD71 млекопитающих с константой диссоциации в диапазоне от 0,01 нМ до 100 нМ, от 0,01 нМ до 10 нМ, от 0,01 нМ до 5 нМ, от 0,01 нМ до 1 нМ, От 0,01 до 0,5 нМ, от 0,01 до 0,1 нМ, от 0,01 до 0,05 нМ, от 0,05 до 100 нМ, от 0,05 до 10 нМ, от 0,05 до 5 нМ, от 0,05 до 1 нМ, от 0,05 до 0,5 нМ, от 0,05 до 0,1 нМ. нМ, от 0,1 нМ до 100 нМ, от 0,1 нМ до 10 нМ, от 0,1 нМ до 5 нМ, от 0,1 нМ до 1 нМ, от 0,1 до 0,5 нМ, от 0,5 нМ до 100 нМ, от 0,5 нМ до 10 нМ, от 0,5 нМ до 5 нМ, 0,5 от 1 нМ до 1 нМ, от 1 нМ до 100 нМ, от 1 нМ до 10 нМ, от 1 нМ до 5 нМ, от 5 нМ до 100 нМ, от 5 нМ до 10 нМ или от 10 нМ до 100 нМ.
[0091] В некоторых вариантах осуществления CD71 млекопитающих выбирают из группы, состоящей из CD71 человека, CD71 мыши, CD71 крысы и CD71 обезьяны яванского макака. В некоторых вариантах осуществления AB специфично связывается с CD71 человека, CD71 мыши или CD71 обезьяны яванского макака с константой диссоциации менее 1 нМ. В некоторых вариантах осуществления CD71 млекопитающих представляет собой CD71 человека.
[0092] В некоторых вариантах осуществления AB имеет одну или несколько из следующих характеристик: (a) AB специфично связывается с CD71 человека; и (b) AB специфично связывается с CD71 человека и обезьяной Cynomolgus CD71.
[0093] В некоторых вариантах осуществления AB имеет одну или несколько из следующих характеристик: (a) AB специфически связывает CD71 человека и обезьяну яванского макака CD71; (b) АВ ингибирует связывание трансферрина с CD71 млекопитающих; (c) АВ ингибирует связывание человеческого трансферрина с человеческим CD71; и (d) AB ингибирует связывание трансферрина обезьяны яванского макака с CD71 обезьяны яванского макака.
[0094] В некоторых вариантах осуществления AB блокирует способность природного лиганда связываться с CD71 млекопитающих с EC50, меньшей или равной 5 нМ, меньшей или равной 10 нМ, меньшей или равной 50 нМ, меньшей или равной 100 нМ, меньшей или равной 500 нМ и/или меньшей или равной 1000 нМ. В некоторых вариантах осуществления AB блокирует способность трансферрина связываться с CD71 млекопитающих с EC50, меньшей или равной 5 нМ, меньшей или равной 10 нМ, меньшей или равной 50 нМ, меньшей или равной до 100 нМ, меньшей или равной 500 нМ и/или меньшей или равной 1000 нМ. В некоторых вариантах осуществления природный лиганд CD71 представляет собой трансферрин.
[0095] В некоторых вариантах осуществления AB блокирует способность природного лиганда связываться с CD71 млекопитающих с EC50 от 5 нМ до 1000 нМ, от 5 нМ до 500 нМ, от 5 нМ до 100 нМ, от 5 нМ до 50 нМ, от 5 нМ до 10 нМ, от 10 нМ до 1000 нМ, от 10 нМ до 500 нМ, от 10 нМ до 100 нМ от 10 нМ до 50 нМ, от 50 нМ до 1000 нМ, от 50 нМ до 500 нМ, от 50 нМ до 100 нМ, от 100 нМ до 1000 нМ, От 100 нМ до 500 нМ, от 500 нМ до 1000 нМ. В некоторых вариантах осуществления AB блокирует способность трансферрина связываться с CD71 млекопитающих с ЕС50 от 5 нМ до 1000 нМ, от 5 нМ до 500 нМ, от 5 нМ до 100 нМ от 5 нМ до 50 нМ, от 5 нМ до 10 нМ, от 10 нМ до 1000 нМ, от 10 нМ до 500 нМ, от 10 нМ до 100 нМ от 10 нМ до 50 нМ, от 50 нМ до 1000 нМ, от 50 нМ до 500 нМ, от 50 нМ до 100 нМ, от 100 нМ до 1000 нМ, 100 нМ до 500 нМ, от 500 нМ до 1000 нМ. В некоторых вариантах осуществления природный лиганд CD71 представляет собой трансферрин.
[0096] В некоторых вариантах осуществления AB по данному изобретению ингибирует или уменьшает рост, пролиферацию и/или метастазирование клеток, экспрессирующих CD71 млекопитающих. Без намерения быть связанными какой-либо теорией, AB по данному изобретению может ингибировать или уменьшать рост, пролиферацию и/или метастазирование клеток, экспрессирующих CD71 млекопитающих, посредством специфического связывания с CD71 и ингибирования, блокирования и/или предотвращения связывания природного лиганда CD71 млекопитающих. В некоторых вариантах осуществления природный лиганд CD71 млекопитающих представляет собой трансферрин.
[0097] В некоторых вариантах осуществления MM имеет константу диссоциации для связывания с AB, которая больше, чем константа диссоциации AB для CD71.
[0098] В некоторых вариантах осуществления MM имеет константу диссоциации для связывания с AB, которая не больше, чем константа диссоциации от AB до CD71.
[0099] В некоторых вариантах осуществления MM имеет константу диссоциации для связывания с AB, которая меньше, чем константа диссоциации AB для CD71.
[00100] В некоторых вариантах осуществления константа диссоциации (Kd) ММ по отношению к AB составляет не более чем в 2, 3, 4, 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 10000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более раз, или в между 1-5, 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000, или 100000-10000000 раз или более раз больше чем константа диссоциации AB к мишени.
[00101] В некоторых вариантах осуществления MM не вмешивается или не конкурирует с AB за связывание с CD71, когда активируемое антитело находится в разрезанном состоянии.
[00102] В некоторых вариантах осуществления MM представляет собой полипептид длиной от около 2 до 40 аминокислот. В некоторых вариантах осуществления MM представляет собой полипептид длиной до около 40 аминокислот.
[00103] В некоторых вариантах осуществления полипептидная последовательность MM отличается от последовательности CD71. В некоторых вариантах осуществления полипептидная последовательность MM не более чем на 50% идентична любому природному связывающему партнеру AB. В некоторых вариантах осуществления полипептидная последовательность MM отличается от последовательности CD71 и не более чем на 40, 30, 25, 20, 15 или 10% идентична любому природному связывающему партнеру АВ.
[00104] В некоторых вариантах осуществления соединение MM с AB снижает способность AB связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71, по меньшей мере в два раза больше, чем Kd. AB, не связанного с MM, по отношению к CD71.
[00105] В некоторых вариантах осуществления соединение ММ с АВ уменьшает способность АВ связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71 по меньшей мере в пять раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[00106] В некоторых вариантах осуществления соединение MM с AB уменьшает способность AB связывать CD71, так что константа диссоциации (Kd) AB, когда он соединен с MM по отношению к CD71, по меньшей мере в 10 раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[00107] В некоторых вариантах осуществления соединение ММ с АВ уменьшает способность АВ связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71 по меньшей мере в 20 раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[00108] В некоторых вариантах осуществления соединение ММ с АВ уменьшает способность АВ связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71 по меньшей мере в 40 раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[00109] В некоторых вариантах осуществления соединение ММ с АВ уменьшает способность АВ связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71 по меньшей мере в 100 раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[00110] В некоторых вариантах осуществления соединение MM с AB уменьшает способность AB связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71, по меньшей мере в 1000 раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[0100] В некоторых вариантах осуществления соединение ММ с АВ уменьшает способность АВ связывать CD71, так что константа диссоциации (Kd) AB, связанного с MM, по отношению к CD71 по меньшей мере в 10000 раз больше, чем Kd AB, не связанного с MM, по отношению к CD71.
[0101] В некоторых вариантах осуществления в присутствии CD71 MM снижает способность AB связывать CD71 по меньшей мере на 90%, когда CM не разрезан, по сравнению с тем, когда CM разрезается при анализе in vitro с использованием анализа смещения мишени, такого как как, например, анализ, описанный в публикации РСТ № WO 2010/081173, содержание которой полностью включено в данное описание посредством ссылки.
[0102] В некоторых вариантах MM содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16 или 18.
[0103] В некоторых вариантах осуществления протеаза, которая расщепляет CM, является активной, например, активированной или иным образом нерегулируемой, в пораженной ткани, и протеаза расщепляет CM в активируемом антителе, когда активируемое антитело подвергается воздействию протеазы.
[0104] В некоторых вариантах осуществления протеаза совместно локализована с CD71 в ткани, и протеаза расщепляет CM в конъюгированном активируемом антителе, когда активируемое антитело подвергается воздействию протеазы.
[0105] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в два раза больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии (т.е. когда конъюгированное активируемое антитело находится в разрезанном состоянии), AB связывается с CD71.
[0106] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в пять раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии (т.е. когда конъюгированное активируемое антитело находится в разрезанном состоянии), AB связывается с CD71.
[0107] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в 10 раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии (т.е. когда конъюгированное активируемое антитело находится в разрезанном состоянии), AB связывается с CD71.
[0108] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в 20 раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии (т.е. когда конъюгированное активируемое антитело находится в разрезанном состоянии), AB связывается с CD71.
[0109] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в 40 раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии AB связывается с CD71.
[0110] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в 50 раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии AB связывается с CD71.
[0111] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в 100 раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии AB связывается с CD71.
[0112] В некоторых вариантах осуществления CM расположен в конъюгированном активируемом антителе так, что, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, связывание конъюгированного активируемого антитела с CD71 уменьшается до проявления при константе диссоциации, которая по меньшей мере, в 200 раз больше, чем константа диссоциации немодифицированного AB, связывающегося с CD71, тогда как в разрезанном состоянии AB связывается с CD71.
[0113] В некоторых вариантах осуществления CM представляет собой полипептид длиной до 15 аминокислот.
[0114] В некоторых вариантах осуществления CM представляет собой полипептид, который содержит первый разрезаемый фрагмент (CM1), который представляет собой субстрат для по меньшей мере одной матриксной металлопротеазы (MMP), и второй разрезаемый фрагмент (CM2), который представляет собой субстрат для по меньшей мере одной сериновой протеазы (SP). В некоторых вариантах осуществления каждая из субстратной последовательности CM1 и субстратной последовательности CM2 субстрата CM1-CM2 независимо представляет собой полипептид длиной до 15 аминокислот.
[0115] В некоторых вариантах осуществления CM представляет собой субстрат для по меньшей мере одной протеазы, которая является или считается активированной или иным образом нерегулируемой при раке.
[0116] В некоторых вариантах осуществления CM представляет собой субстрат для по меньшей мере одной протеазы, выбранной из группы, состоящей из матриксной металлопротеазы (ММР), тромбина, нейтрофильной эластазы, цистеиновой протеазы, легумаина и сериновой протеазы, такой как матриптаза (MT- SP1) и урокиназа (УАП - uPA). Не будучи связанными теорией, считается, что эти протеазы активируются или иным образом не регулируются, по меньшей мере, в одном из случаев рака.
[0117] В некоторых вариантах осуществления CM выбран для применения со специфической протеазой, например протеазой, которая, как известно, совместно локализована с мишенью активируемого антитела.
[0118] В некоторых вариантах осуществления CM представляет собой субстрат для по меньшей мере одного MMP. В некоторых вариантах осуществления CM представляет собой субстрат для протеазы, выбранной из группы, состоящей из MMP 9, MMP14, MMP1, MMP3, MMP13, MMP17, MMP11 и MMP19. В некоторых вариантах осуществления CM представляет собой субстрат для MMP9. В некоторых вариантах осуществления CM представляет собой субстрат для MMP14.
[0119] В некоторых вариантах осуществления CM представляет собой субстрат, который содержит последовательность TGRGPSWV (SEQ ID NO: 41); SARGPSRW (SEQ ID NO: 42); TARGPSFK (SEQ ID NO: 43); LSGRSDNH (SEQ ID NO: 44); GGWHTGRN (SEQ ID NO: 45); HTGRSGAL (SEQ ID NO: 46); PLTGRSGG (SEQ ID NO: 47); AARGPAIH (SEQ ID NO: 48); RGPAFNPM (SEQ ID NO: 49); SSRGPAYL (SEQ ID NO: 50); RGPATPIM (SEQ ID NO: 51); RGPA (SEQ ID NO: 52); GGQPSGMWGW (SEQ ID NO: 53); FPRPLGITGL (SEQ ID NO: 54); VHMPLGFLGP (SEQ ID NO: 55); SPLTGRSG (SEQ ID NO: 56); SAGFSLPA (SEQ ID NO: 57); LAPLGLQRR (SEQ ID NO: 58); SGGPLGVR (SEQ ID NO: 59); PLGL (SEQ ID NO: 60); LSGRSGNH (SEQ ID NO: 175); SGRSANPRG (SEQ ID NO: 176); LSGRSDDH (SEQ ID NO: 177); LSGRSDIH (SEQ ID NO: 178); LSGRSDQH (SEQ ID NO: 179); LSGRSDTH (SEQ ID NO: 180); LSGRSDYH (SEQ ID NO: 181); LSGRSDNP (SEQ ID NO: 182); LSGRSANP (SEQ ID NO: 183); LSGRSANI (SEQ ID NO: 184); LSGRSDNI (SEQ ID NO: 185); МИАПВАЙР (SEQ ID NO: 186); RPSPMWAY (SEQ ID NO: 187); WATPRPMR (SEQ ID NO: 188); FRLLDWQW (SEQ ID NO: 189); ISSGL (SEQ ID NO: 190); ISSGLLS (SEQ ID NO: 191); и/или ISSGLL (SEQ ID NO: 192).
[0120] В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDNH (SEQ ID NO: 44). В некоторых вариантах осуществления CM содержит аминокислотную последовательность TGRGPSWV (SEQ ID NO: 41). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PLTGRSGG (SEQ ID NO: 47). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GGQPSGMWGW (SEQ ID NO: 53). В некоторых вариантах осуществления CM содержит аминокислотную последовательность FPRPLGITGL (SEQ ID NO: 54). В некоторых вариантах осуществления CM содержит аминокислотную последовательность VHMPLGFLGP (SEQ ID NO: 55). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PLGL (SEQ ID NO: 60). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SARGPSRW (SEQ ID NO: 42). В некоторых вариантах осуществления CM содержит аминокислотную последовательность TARGPSFK (SEQ ID NO: 43). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GGWHTGRN (SEQ ID NO: 45). В некоторых вариантах осуществления CM содержит аминокислотную последовательность HTGRSGAL (SEQ ID NO: 46). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AARGPAIH (SEQ ID NO: 48). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RGPAFNPM (SEQ ID NO: 49). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SSRGPAYL (SEQ ID NO: 50). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RGPATPIM (SEQ ID NO: 51). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RGPA (SEQ ID NO: 52). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSGNH (SEQ ID NO: 175). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SGRSANPRG (SEQ ID NO: 176). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDDH (SEQ ID NO: 177). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDIH (SEQ ID NO: 178). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDQH (SEQ ID NO: 179). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDTH (SEQ ID NO: 180). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDYH (SEQ ID NO: 181). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDNP (SEQ ID NO: 182). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSANP (SEQ ID NO: 183). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSANI (SEQ ID NO: 184). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LSGRSDNI (SEQ ID NO: 185). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MIAPVAYR (SEQ ID NO: 186). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RPSPMWAY (SEQ ID NO: 187). В некоторых вариантах осуществления CM содержит аминокислотную последовательность WATPRPMR (SEQ ID NO: 188). В некоторых вариантах осуществления CM содержит аминокислотную последовательность FRLLDWQW (SEQ ID NO: 189). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGL (SEQ ID NO: 190). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLLS (SEQ ID NO: 191). В некоторых вариантах осуществления CM содержит аминокислотную последовательность и/или ISSGLL (SEQ ID NO: 192).
[0121] В некоторых вариантах осуществления CM представляет собой субстрат для MMP и содержит последовательность ISSGLSS (SEQ ID NO: 61); QNQALRMA (SEQ ID NO: 62); AQNLLGMV (SEQ ID NO: 63); STFPFGMF (SEQ ID NO: 64); PVGYTSSL (SEQ ID NO: 65); DWLYWPGI (SEQ ID NO: 66), ISSGLLSS (SEQ ID NO: 67), LKAAPRWA (SEQ ID NO: 68); GPSHLVLT (SEQ ID NO: 69); LPGGLSPW (SEQ ID NO: 70); MGLFSEAG (SEQ ID NO: 71); SPLPLRVP (SEQ ID NO: 72); RMHLRSLG (SEQ ID NO: 73); LAAPLGLL (SEQ ID NO: 74); AVGLLAPP (SEQ ID NO: 75); LLAPSHRA (SEQ ID NO: 76); и/или PAGLWLDP (SEQ ID NO: 77).
[0122] В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLSS (SEQ ID NO: 61). В некоторых вариантах осуществления CM содержит аминокислотную последовательность QNQALRMA (SEQ ID NO: 62). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AQNLLGMV (SEQ ID NO: 63). В некоторых вариантах осуществления CM содержит аминокислотную последовательность STFPFGMF (SEQ ID NO: 64). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PVGYTSSL (SEQ ID NO: 65). В некоторых вариантах осуществления CM содержит аминокислотную последовательность DWLYWPGI (SEQ ID NO: 66). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ISSGLLSS (SEQ ID NO: 67). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LKAAPRWA (SEQ ID NO: 68). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GPSHLVLT (SEQ ID NO: 69). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LPGGLSPW (SEQ ID NO: 70). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MGLFSEAG (SEQ ID NO: 71). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SPLPLRVP (SEQ ID NO: 72). В некоторых вариантах осуществления CM содержит аминокислотную последовательность RMHLRSLG (SEQ ID NO: 73). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LAAPLGLL (SEQ ID NO: 74). В некоторых вариантах осуществления CM содержит аминокислотную последовательность AVGLLAPP (SEQ ID NO: 75). В некоторых вариантах осуществления CM содержит аминокислотную последовательность LLAPSHRA (SEQ ID NO: 76). В некоторых вариантах осуществления CM содержит аминокислотную последовательность PAGLWLDP (SEQ ID NO: 77).
[0123] В некоторых вариантах осуществления CM представляет собой субстрат для тромбина. В некоторых вариантах осуществления CM представляет собой субстрат для тромбина и содержит последовательность GPRSFGL (SEQ ID NO: 78) или GPRSFG (SEQ ID NO: 79). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GPRSFGL (SEQ ID NO: 78). В некоторых вариантах осуществления CM содержит аминокислотную последовательность GPRSFG (SEQ ID NO: 79).
[0124] В некоторых вариантах осуществления CM содержит аминокислотную последовательность, выбранную из группы, состоящей из NTLSGRSENHSG (SEQ ID NO: 80); NTLSGRSGNHGS (SEQ ID NO: 81); ЦТСГРСАНПРГ (SEQ ID NO: 82); TSGRSANP (SEQ ID NO: 83); VAGRSMRP (SEQ ID NO: 84); VVPEGRRS (SEQ ID NO: 85); ILPRSPAF (SEQ ID NO: 86); MVLGRSLL (SEQ ID NO: 87); QGRAITFI (SEQ ID NO: 88); SPRSIMLA (SEQ ID NO: 89); и SMLRSMPL (SEQ ID NO: 90).
[0125] В некоторых вариантах осуществления CM содержит аминокислотную последовательность NTLSGRSENHSG (SEQ ID NO: 80). В некоторых вариантах осуществления CM содержит аминокислотную последовательность NTLSGRSGNHGS (SEQ ID NO: 81). В некоторых вариантах осуществления CM содержит аминокислотную последовательность TSTSGRSANPRG (SEQ ID NO: 82). В некоторых вариантах осуществления CM содержит аминокислотную последовательность TSGRSANP (SEQ ID NO: 83). В некоторых вариантах осуществления CM содержит аминокислотную последовательность VAGRSMRP (SEQ ID NO: 84). В некоторых вариантах осуществления CM содержит аминокислотную последовательность VVPEGRRS (SEQ ID NO: 85). В некоторых вариантах осуществления CM содержит аминокислотную последовательность ILPRSPAF (SEQ ID NO: 86). В некоторых вариантах осуществления CM содержит аминокислотную последовательность MVLGRSLL (SEQ ID NO: 87). В некоторых вариантах осуществления CM содержит аминокислотную последовательность QGRAITFI (SEQ ID NO: 88). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SPRSIMLA (SEQ ID NO: 89). В некоторых вариантах осуществления CM содержит аминокислотную последовательность SMLRSMPL (SEQ ID NO: 90).
[0126] В некоторых вариантах осуществления CM представляет собой субстрат для нейтрофильной эластазы. В некоторых вариантах осуществления CM представляет собой субстрат для сериновой протеазы. В некоторых вариантах осуществления CM представляет собой субстрат для УАП. В некоторых вариантах осуществления CM представляет собой субстрат для легумаина. В некоторых вариантах осуществления CM представляет собой субстрат для матриптазы. В некоторых вариантах осуществления CM представляет собой субстрат для цистеиновой протеазы. В некоторых вариантах осуществления CM представляет собой субстрат для цистеиновой протеазы, такой как катепсин.
[0127] В некоторых вариантах осуществления CM представляет собой субстрат CM1-CM2 и содержит последовательность ISSGLLSGRSDNH (SEQ ID NO: 91); ISSGLLSSGGSGGSLSGRSDNH (SEQ ID NO: 92); AVGLLAPPGGTSTSGRSANPRG (SEQ ID NO: 93); TSTSGRSANPRGGGAVGLLAPP (SEQ ID NO: 94); VHMPLGFLGPGGTSTSGRSANPRG (SEQ ID NO: 95); TSTSGRSANPRGGGVHMPLGFLGP (SEQ ID NO: 96); AVGLLAPPGGLSGRSDNH (SEQ ID NO: 97); LSGRSDNHGGAVGLLAPP (SEQ ID NO: 98); VHMPLGFLGPGGLSGRSDNH (SEQ ID NO: 99); LSGRSDNHGGVHMPLGFLGP (SEQ ID NO: 100); LSGRSDNHGGSGGSISSGLLSS (SEQ ID NO: 101); LSGRSGNHGGSGGSISSGLLSS (SEQ ID NO: 102); ISSGLLSSGGSGGSLSGRSGNH (SEQ ID NO: 103); LSGRSDNHGGSGGSQNQALRMA (SEQ ID NO: 104); QNQALRMAGGSGGSLSGRSDNH (SEQ ID NO: 105); LSGRSGNHGGSGGSQNQALRMA (SEQ ID NO: 106); QNQALRMAGGSGGSLSGRSGNH (SEQ ID NO: 107); ISSGLLSGRSGNH (SEQ ID NO: 108); ISSGLLSGRSANPRG (SEQ ID NO: 148); AVGLLAPPTSGRSANPRG (SEQ ID NO: 149); AVGLLAPPSGRSANPRG (SEQ ID NO: 150); ISSGLLSGRSDDH (SEQ ID NO: 151); ISSGLLSGRSDIH (SEQ ID NO: 152); ISSGLLSGRSDQH (SEQ ID NO: 153); ISSGLLSGRSDTH (SEQ ID NO: 154); ISSGLLSGRSDYH (SEQ ID NO: 155); ISSGLLSGRSDNP (SEQ ID NO: 156); ISSGLLSGRSANP (SEQ ID NO: 157); ИССГЛЛСГРСАНИ (SEQ ID NO: 158); AVGLLAPPGGLSGRSDDH (SEQ ID NO: 159); AVGLLAPPGGLSGRSDIH (SEQ ID NO: 160); AVGLLAPPGGLSGRSDQH (SEQ ID NO: 161); AVGLLAPPGGLSGRSDTH (SEQ ID NO: 162); AVGLLAPPGGLSGRSDYH (SEQ ID NO: 163); AVGLLAPPGGLSGRSDNP (SEQ ID NO: 164); AVGLLAPPGGLSGRSANP (SEQ ID NO: 165); AVGLLAPPGGLSGRSANI (SEQ ID NO: 166), ISSGLLSGRSDNI (SEQ ID NO: 171); AVGLLAPPGGLSGRSDNI (SEQ ID NO: 172); GLSGRSDNHGGAVGLLAPP (SEQ ID NO: 193); и/или GLSGRSDNHGGVHMPLGFLGP (SEQ ID NO: 194).
[0128] В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDNH (SEQ ID NO: 91), которая также упоминается в данном документе как субстрат 2001. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSSGGSGGSLSGRSDNH (SEQ ID NO: 92), которая также упоминается в данном документе как субстрат 1001/LP`/0001, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления данного изобретения субстрат СМ1-СМ2 содержит последовательность AVGLLAPPGGTSTSGRSANPRG (SEQ ID NO: 93), которая также упоминается в данном описании в качестве субстрата 2015 и/или субстрата 1004/LP`/0003, при этом LP`, как используется в этом CM1-CM2 субстрате, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность TSTSGRSANPRGGGAVGLLAPP (SEQ ID NO: 94), которая также упоминается в данном документе как субстрат 0003/LP`/1004, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность VHMPLGFLGPGGTSTSGRSANPRG (SEQ ID NO: 95), которая также упоминается в данном документе как субстрат 1003/LP`000/0003, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность TSTSGRSANPRGGGVHMPLGFLGP (SEQ ID NO: 96), которая также упоминается в данном документе как субстрат 0003/LP`/1003, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDNH (SEQ ID NO: 97), которая также упоминается в данном документе как субстрат 3001 и/или субстрат 1004/LP`/0001, при этом LP`, как используется в этом CM1-CM2 субстрате представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность LSGRSDNHGGAVGLLAPP (SEQ ID NO: 98), которая также упоминается в данном документе как субстрат 0001/LP`/1004, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность VHMPLGFLGPGGLSGRSDNH (SEQ ID NO: 99), которая также упоминается в данном документе как субстрат 1003/LP '/ 0001, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность LSGRSDNHGGVHMPLGFLGP (SEQ ID NO: 100), которая также упоминается в данном документе как субстрат 0001/LP`/1003, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность LSGRSDNHGGSGGSISSGLLSS (SEQ ID NO: 101), которая также упоминается в данном документе как субстрат 0001/LP`/1001, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность LSGRSGNHGGSGGSISSGLLSS (SEQ ID NO: 102), которая также упоминается в данном документе как субстрат 0002/LP`/1001, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSSGGSGGSLSGRSGNH (SEQ ID NO: 103), которая также упоминается в данном документе как субстрат 1001/LP`/0002, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность LSGRSDNHGGSGGSQNQALRMA (SEQ ID NO: 104), которая также упоминается в данном документе как субстрат 0001/LP`/1002, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность QNQALRMAGGSGGSLSGRSDNH (SEQ ID NO: 105), которая также упоминается в данном документе как субстрат 1002/LP`/0001, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность LSGRSGNHGGSGGSQNQALRMA (SEQ ID NO: 106), которая также упоминается в данном документе как субстрат 0002/LP`/1002, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность QNQALRMAGGSGGSLSGRSGNH (SEQ ID NO: 107), которая также упоминается в данном документе как субстрат 1002/LP`/0002, при этом LP`, как используется в этом субстрате CM1-CM2, представляет собой аминокислотную последовательность GGSGGS (SEQ ID NO: 205). В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSGNH (SEQ ID NO: 108), которая также упоминается в данном документе как субстрат 2002. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSANPRG (SEQ ID NO: 148), которая также упоминается в данном документе как субстрат 2003. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPTSGRSANPRG (SEQ ID NO: 149), которая также упоминается в данном документе как субстрат 2004. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPSGRSANPRG (SEQ ID NO: 150), которая также упоминается в данном документе как субстрат 2005. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDDH (SEQ ID NO: 151), которая также упоминается в данном документе как субстрат 2006. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDIH (SEQ ID NO: 152), которая также упоминается в данном документе как субстрат 2007. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDQH (SEQ ID NO: 153), которая также упоминается в данном документе как субстрат 2008. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDTH (SEQ ID NO: 154), которая также упоминается в данном документе как субстрат 2009. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDYH (SEQ ID NO: 155), которая также упоминается в данном документе как субстрат 2010. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDNP (SEQ ID NO: 156), которая также упоминается в данном документе как субстрат 2011. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSANP (SEQ ID NO: 157), которая также упоминается в данном документе как субстрат 2012. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSANI (SEQ ID NO: 158), которая также упоминается в данном документе как субстрат 2013. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDDH (SEQ ID NO: 159), которая также упоминается в данном документе как субстрат 3006. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDIH (SEQ ID NO: 160), которая также упоминается в данном документе как субстрат 3007. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDQH (SEQ ID NO: 161), которая также упоминается в данном документе как субстрат 3008. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDTH (SEQ ID NO: 162), которая также упоминается в данном документе как субстрат 3009. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDYH (SEQ ID NO: 163), которая также упоминается в данном документе как субстрат 3010. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDNP (SEQ ID NO: 164), которая также упоминается в данном документе как субстрат 3011. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSANP (SEQ ID NO: 165), которая также упоминается в данном документе как субстрат 3012. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSANI (SEQ ID NO: 166), которая также упоминается в данном документе как субстрат 3013. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность ISSGLLSGRSDNI (SEQ ID NO: 171), которая также упоминается в данном документе как субстрат 2014. В некоторых вариантах осуществления субстрат CM1-CM2 содержит последовательность AVGLLAPPGGLSGRSDNI (SEQ ID NO: 172), которая также упоминается в данном документе как субстрат 3014. В некоторых вариантах осуществления данного изобретения субстрат СМ1-СМ2 содержит последовательность GLSGRSDNHGGAVGLLAPP (SEQ ID NO: 193), которая также упоминается в данном описании в качестве субстрата 0001/LP`/1004, при этом LP`, используемый в данном субстарте СМ1-СМ2 представляет собой аминокислотную последовательность GG. В некоторых вариантах осуществления данного изобретения субстрат СМ1-СМ2 содержит последовательность GLSGRSDNHGGVHMPLGFLGP (SEQ ID NO: 194), которая также упоминается в данном описании в качестве субстрата 0001/LP`/1003, при этом LP`, используемый в данном субстарте СМ1-СМ2 представляет собой аминокислотную последовательность GG.
[0129] В некоторых вариантах осуществления CM представляет собой субстрат для по меньшей мере двух протеаз. В некоторых вариантах осуществления CM представляет собой субстрат для по меньшей мере двух протеаз, выбранных из группы, состоящей из MMP, тромбина, нейтрофильной эластазы, цистеиновой протеазы, УАП, легумаина и матриптазы.
[0130] В некоторых вариантах осуществления конъюгированное активируемое антитело содержит, по меньшей мере, первый CM и второй CM. В некоторых вариантах осуществления первый CM и второй CM каждый представляют собой полипептид длиной не более 15 аминокислот. В некоторых вариантах осуществления первый CM и второй CM в конъюгированном активируемом антителе в неразрезанном состоянии имеют структурное расположение от N-конца к C-концу следующим образом: MM-CM1-CM2-AB или AB-CM2-CM1-MM, В некоторых вариантах по меньшей мере один из первого CM и второго CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы, выбранной из группы, состоящей из MMP, тромбина, нейтрофильной эластазы, цистеиновой протеазы, УАП, легумаина и матриптазы. В некоторых вариантах осуществления первый CM разрезается первым разрезающим агентом, выбранным из группы, состоящей из MMP, тромбина, нейтрофильной эластазы, цистеиновой протеазы, УАП, легумаина и матриптазы в ткани-мишени, а второй CM разрезается с помощью второго разрезающего агента в ткани-мишени. В некоторых вариантах осуществления другая протеаза выбрана из группы, состоящей из групп, продемонстрированных в Таблице (I). В некоторых вариантах осуществления первый разрезающий агент и второй разрезающий агент представляют собой одну и ту же протеазу, выбранную из группы, состоящей из MMP, тромбина, нейтрофильной эластазы, цистеиновой протеазы, УАП, легумаина и матриптазы, а также первой CM и второй CM являются разными субстратами для фермента. В некоторых вариантах осуществления первый разрезающий агент и второй разрезающий агент представляют собой одну и ту же протеазу, выбранную из группы, состоящей из групп, продемонстрированных в Таблице (I). В некоторых вариантах осуществления первый разрезающий агент и второй разрезающий агент представляют собой разные протеазы. В некоторых вариантах осуществления первый разрезающий агент и второй разрезающий агент совместно локализуются в ткани-мишени. В некоторых вариантах осуществления первый CM и второй CM разрезаются по меньшей мере одним разрезающим агентом в ткани-мишени.
[0131] В некоторых вариантах осуществления конъюгированное активируемое антитело подвергается воздействию и разрезается протеазой, так что в активированном или разрезанном состоянии конъюгированное активированное антитело содержит аминокислотную последовательность легкой цепи, которая содержит, по меньшей мере, часть последовательности LP2 и/или CM после того, как протеаза расщепила CM.
[0132] В некоторых вариантах осуществления активируемое антитело конъюгировано с одним или несколькими эквивалентами агента. В некоторых вариантах осуществления активируемое антитело конъюгировано с одним эквивалентом агента. В некоторых вариантах осуществления активируемое антитело конъюгировано с двумя, тремя или четырьмя эквивалентами агента. В некоторых вариантах осуществления активируемое антитело является частью смеси активируемых антител, имеющих гомогенное количество эквивалентов конъюгированных агентов. В некоторых вариантах осуществления активируемое антитело является частью смеси активируемых антител, имеющих гетерогенное количество эквивалентов конъюгированных агентов. В некоторых вариантах осуществления смесь активируемых антител является такой, что среднее число агентов, конъюгированных с каждым активируемым антителом, составляет от нуля до одного, от одного до двух, от двух до трех или от трех до четырех. В некоторых вариантах осуществления смесь активируемых антител является такой, что среднее количество агентов, конъюгированных с каждым активируемым антителом, составляет один, два, три или четыре.
[0133] В некоторых вариантах осуществления активируемое антитело содержит одну или несколько сайт-специфических модификаций аминокислотной последовательности, так что количество остатков лизина и/или цистеина увеличивается или уменьшается по сравнению с исходной аминокислотной последовательностью активируемого антитела, таким образом, в некоторых вариантах осуществления соответственно увеличивается или уменьшается количество агентов, которые могут быть конъюгированы с активируемым антителом, или в некоторых вариантах осуществления ограничивается конъюгации агентов с активируемым антителом сайт-специфическим образом. В некоторых вариантах осуществления модифицированное активируемое антитело модифицируют одной или несколькими неприродными аминокислотами сайт-специфическим образом, таким образом, в некоторых вариантах осуществления ограничивают конъюгацию агентов только сайтами неприродных аминокислот.
[0134] Конъюгированные активируемые антитела, раскрытые в данном документе, могут содержать молекулы лекарственного средства и фрагменты антител в различных стехиометрических молярных соотношениях в зависимости от конфигурации антитела и, по меньшей мере, частично, от способа, используемого для осуществления конъюгации.
[0135] Термин «лекарственная нагрузка» или «лекарственная загрузка» относится к молярному соотношению молекул лекарственного средства на антитело в отдельном конъюгированном активируемом антителе. В некоторых вариантах осуществления загрузка лекарственного средства может включать от 1-4 молекул лекарственного средства, от 2-4 молекул лекарственного средства, от 1-3 молекул лекарственного средства, от 2-3 молекул лекарственного средства или от 1 до 2 молекул лекарственного средства. В некоторых вариантах осуществления загрузка лекарственного средства может включать 1 молекулу лекарственного средства, 2 молекулы лекарственного средства, 3 молекулы лекарственного средства или 4 молекулы лекарственного средства.
[0136] Для целей данного изобретения специалист в данной области техники поймет, что «загрузка лекарственного средства» и «отношение лекарственное средство к антителу» (также называемое DAR) не являются одинаковыми. DAR относится к среднему молярному соотношению молекул лекарственного средства на антитело в популяции по меньшей мере двух конъюгированных активируемых молекул антител, тогда как загрузка лекарственного средства относится к молярному соотношению молекул лекарственного средства на антитело в отдельной конъюгированной активируемой молекуле антитела. Загрузка лекарственного средства, в первую очередь, имеет отношение к конструированию и проэктированию конъюгированного активируемого антитела, тогда как DAR, в первую очередь, имеет отношение к фармацевтической композиции терапевтически конъюгированного активируемого антитела, которая будет вводиться пациентам.
[0137] В некоторых вариантах осуществления активируемые антитела по данному изобретению могут быть конъюгированы для получения относительно гомогенных препаратов конъюгированных активируемых антител, имеющих узкое распределение DAR. В некоторых вариантах осуществления препарат конъюгированного активируемого антитела может быть по существу гомогенным в отношении его DAR распределения, что означает, что в препарате преобладает вид сайт-специфического ADC с конкретным DAR (например, DAR 2 и/или 4), В некоторых вариантах осуществления по существу гомогенный конъюгированный активируемый препарат антител также может быть однородным по отношению к сайтам нагрузки (т.е. по свободным цистеинам).
[0138] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет составлять около 2 и/или 4. В этом контексте термин «около» следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более 80% двух основных видов в совокупности, имеющих DAR, равный 2 и 4, с примерно равным распределением (например, более 40% каждый), а остальная часть состоит из других видов DAR.
[0139] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2. В этом контексте термин «около» следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более чем около 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% ±0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0140] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2, при этом термин "около" следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более чем около 94% ±0,1, 0,2, 0,3. 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0141] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2, при этом термин "около" следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более около 95% ±0,1, 0,2, 0,3. 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0142] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2, при этом термин "около" следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более около 96% ±0,1, 0,2, 0,3. 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0143] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2, при этом термин "около" следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более чем около 97% ±0,1, 0,2, 0,3. 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0144] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2, при этом термин "около" следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более чем около 98% ±0,1, 0,2, 0,3. 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0145] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет обогащен до около 2, при этом термин "около" следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более около 99% ±0,1, 0,2, 0,3. 0,4, 0,5, 0,6, 0,7, 0,8, 0,9%.
[0146] В некоторых вариантах осуществления DAR конъюгированных активируемых антител по данному изобретению будет составлять около 2 и/или 4. В этом контексте термин «около» следует понимать как означающий препарат конъюгированного активируемого антитела, содержащий более 80% двух основных видов в совокупности, имеющих DAR, равный 2 и 4, с примерно равным распределением (например, более 40% каждый), а остальная часть состоит из других видов DAR.
[0147] В некоторых вариантах осуществления можно достичь желаемой гомогенности путем применения сайт-специфических активируемых антител и/или селективного восстановления и конъюгации. В некоторых вариантах осуществления желаемая гомогенность может быть достигнута путем применения сайт-специфических конструкций в сочетании с селективным восстановлением. В некоторых вариантах осуществления препараты могут быть дополнительно очищены, например, с использованием способов аналитической или препаративной хроматографии. В данных вариантах гомогенность препарата конъюгированного активируемого антитела может быть проанализирована с использованием различных способов, известных в данной области, включая, но не ограничиваясь этим, масс-спектрометрию, ВЭЖХ (например, ВЭЖХ с исключением по размеру, ОФ-ВЭЖХ, ВЭЖХ-ВЭЖХ и т. д.) Или капиллярный электрофорез.
[0148] Что касается очистки препаратов конъюгированных активируемых антител, следует понимать, что стандартные фармацевтические препаративные способы могут быть использованы для получения желаемой чистоты. Как обсуждалось в данном документе, способы жидкостной хроматографии, такие как хроматография с обращенной фазой (RP) и хроматография гидрофобного взаимодействия (HIC), могут разделять соединения в смеси по величине загрузки лекарственного средства. В некоторых случаях ионообменная (IEC) или смешанная хроматография (ММС) также могут быть использованы для выделения видов с определенной нагрузкой лекарственного средства.
[0149] В некоторых вариантах осуществления препарат конъюгированного активируемого антитела по данному изобретению, имеющий заданный DAR с относительно высоким уровнем гомогенности лекарственной нагрузки, может фактически включать смесь конъюгатов с диапазоном или распределением лекарственных нагрузок, но где распределение лекарственных нагрузок в смесь сосредоточена вокруг (или имеет средневзвешенное значение) среднего значения DAR. Таким образом, в некоторых вариантах осуществления препараты конъюгированных активируемых антител будут включать смесь конъюгатов, в которой средний DAR смеси составляет около 1, 2 или 3, каждый +/- 0,5. Понятно, что диапазон или отклонение могут быть менее 0,4 в некоторых предпочтительных вариантах осуществления. Таким образом, в других вариантах осуществления композиции будут содержать средний DAR 1, 2 или 3, каждый +/- 0,3.
[0150] В некоторых вариантах осуществления распределение лекарственных средств на антитело в препаратах конъюгированных активируемых антител из реакций конъюгации можно охарактеризовать с помощью обычных средств, таких как спектрофотометрия UV-Vis, обращенно-фазовая ВЭЖХ, HIC, масс-спектроскопия, ИФА и электрофорез.
[0151] В некоторых вариантах осуществления смесь конъюгированных активируемых антител по данному изобретению, которая содержит смесь конъюгатов, имеющих различные лекарственные нагрузки, может быть очищена или обогащена для одного или нескольких видов конъюгата, имеющих конкретную лекарственную нагрузку. Например, смесь конъюгированных активируемых антител, которая содержит смесь AADC имеющего лекарственную нагрузку 0, 2, 4, 6 и 8, может быть обогащена или очищена для конъюгированных активируемых антител имеющего лекарственную нагрузку 2. В некоторых вариантах осуществления смесь может быть очищена или обогащена только для видов конъюгированных активируемых антител, имеющих лекарственную нагрузку 4. В некоторых вариантах осуществления смесь может быть очищена или обогащена только для видов конъюгированных активируемых антител, имеющих лекарственную нагрузку 2 и 4. Используемый в данном документе препарат или очистка или конъюгированное активируемое антитело, имеющее относительно гомогенный препарат видов видов конъюгатов, имеющих лекарственную нагрузку 2, обозначается как «E2», который имеет DAR около 2. Используемый в данном документе препарат или очистка или конъюгированное активируемое антитело, имеющее относительно гомогенный препарат видов конъюгатов, имеет лекарственную нагрузку 4, обозначается как «Е4». Используемый в данном документе препарат или средство для очистки или конъюгированное активируемое антитело, имеющее смесь видов конъюгатов, имеет лекарственную нагрузку 2 или 4, обозначается как «DE» (обогащенный DAR), имеет DAR около 3. В этом контексте термин «около» понимается как означающий +/- 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 от запрещенного количества.
[0152] В некоторых вариантах осуществления конъюгированное активируемое антитело по данному изобретению может быть представлено формулой:
AA-(AG)p
где AA представляет собой активируемое антитело, которое в неразветвленном состоянии имеет структурное расположение от N-конца к C-концу MM-CM-AB. АВ представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит последовательность вариабельной области тяжелой цепи из SEQ ID NO: 5 и последовательность вариабельной области легкой цепи из SEQ ID NO: 7. MM является маскирующим фрагментом, который содержит последовательность SEQ ID NO: 18, и MM связан с AB и ингибирует связывание AB с CD71, когда AA находится в неразрезанном состоянии. CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, CM связан с AB, и CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы. AG представляет собой агент, конъюгированный с AA, где AA- (AG)p. В некоторых вариантах осуществления p равно 0, 1, 2, 3, 4, 5, 6, 7 или 8. В некоторых вариантах осуществления композиция по данному изобретению включает смесь конъюгированных активируемых антител по данному изобретению, где каждое конъюгированное активируемое антитело представлено формулой AA-(AG)p, где p является целым числом от 0 до 8. В некоторых вариантах осуществления композиция включает смесь конъюгированных активируемых антител по данному изобретению, где, по меньшей мере, 50%, по меньшей мере, 75%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95% или, по меньшей мере, 98% видов конъюгированного активируемого антитела, при этом р равно 2.
[0153] В некоторых вариантах осуществления препарат конъюгированного активируемого антитела, которое очищается или обогащается для данного вида конъюгата с определенной лекарственной нагрузкой, содержит, по меньшей мере, определенный процент данных видов лекарственной нагрузки. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит, по меньшей мере, 50% препарата, конъюгированного активируемого антитела, имеющего лекарственную нагрузку 2. В некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит, по меньшей мере, 75% конъюгированного активируемого антитела, имеющего лекарственную нагрузку 2. В некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит, по меньшей мере, 85% конъюгированного активируемого антитела, имеющего лекарственную нагрузку 2. В некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит, по меньшей мере, 90% конъюгированного активируемого антитела, имеющего лекарственную нагрузку 2. В некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит, по меньшей мере, 95% конъюгированного активируемого антитела, имеющего лекарственную нагрузку 2. В некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит, по меньшей мере, 98% конъюгированного активируемого антитела, имеющего лекарственную нагрузку 2.
[0154] В некоторых вариантах осуществления препарат конъюгированного активируемого антитела, которое очищается или обогащается для данных видов лекарственной нагрузки, включает больше молярных эквивалентов данных видов лекарственной нагрузки, чем общие молярные эквиваленты всех других видов лекарственной нагрузки, вместе взятых. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела является таким, что объединенные эквиваленты каждого из видов конъюгированных активируемых антител композиции, в которой нагрузка лекарственным средством не составляет 2, меньше, чем эквиваленты конъюгированного активируемого антитела с лекарственной нагрузкой 2. В некоторых вариантах осуществления препарат конъюгированного активируемого антитела Е4 является таким, что объединенные эквиваленты каждого из видов конъюгированных активируемых антител композиции, в которой нагрузка лекарственным средством не равна 4, меньше, чем эквиваленты конъюгированного активируемого антитела с лекарственной нагрузкой 4 В некоторых вариантах осуществления препарат DE-конъюгированного активируемого антитела является таким, что объединенные эквиваленты каждого из видов конъюгированных активируемых антител композиции, в которой нагрузка лекарственным средством не составляет 2 или 4, меньше, чем эквиваленты конъюгированного активируемого антитела, которые имеют лекарственную нагрузку 2 или 4.
[0155] В некоторых вариантах осуществления препарат конъюгированного активируемого антитела, которое очищено или обогащено для данных видов DAR (например, E2 или E4, как описано в данном документе), содержит менее определенного процента конъюгированного активируемого антитела, которое не является данным видом лекарственной нагрузки. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит менее 50% конъюгированного активируемого антитела, которое не имеет лекарственную нагрузку 2 видов. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит менее 25% конъюгированного активируемого антитела, которое не имеет лекарственную нагрузку 2 видов. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит менее 15% конъюгированного активируемого антитела, которое не имеет лекарственную нагрузку 2 видов. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит менее 10% конъюгированного активируемого антитела, которое не имеет лекарственную нагрузку 2 видов. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит менее 5% конъюгированного активируемого антитела, которое не имеет лекарственную нагрузку 2 видов. Например, в некоторых вариантах осуществления препарат E2-конъюгированного активируемого антитела содержит менее 2% конъюгированного активируемого антитела, которое не имеет лекарственную нагрузку 2 видов. В некоторых других вариантах осуществления или обогащенные или очищенные препараты (например, E4 или DE) могут иметь менее 50%, менее 25%, менее 15%, менее 10%, менее 5% или менее 2%, того что является не соответствующими видами лекарственной нагрузки в обогащенной или очищенной конъюгированной активируемой композиции антител.
[0156] В некоторых вариантах агент представляет собой противовоспалительный агент.
[0157] В некоторых вариантах осуществления конъюгированное активируемое антитело также содержит детектируемый фрагмент. В некоторых вариантах осуществления детектируемый фрагмент представляет собой диагностический агент.
[0158] В некоторых вариантах осуществления конъюгированное активируемое антитело также содержит сигнальный пептид. В некоторых вариантах осуществления сигнальный пептид конъюгируется с активируемым антителом через спейсер. В некоторых вариантах осуществления спейсер конъюгирован с активируемым антителом в отсутствие сигнального пептида. В некоторых вариантах осуществления спейсер соединен непосредственно с ММ активируемого антитела. В некоторых вариантах осуществления спейсер соединен непосредственно с ММ активируемого антитела в структурном расположении от N-конца к С-концу спейсер-MM-CM-AB. Примером спейсера, соединенного непосредственно с N-концом ММ активируемого антитела, является QGQSGQ (SEQ ID NO: 109). Другие примеры спейсера, соединенного непосредственно с N-концом MM активируемого антитела, включают QGQSGQG (SEQ ID NO: 138), QGQSG (SEQ ID NO: 139), QGQS (SEQ ID NO: 140), QGQ, QG, и Q. Другие примеры спейсера, соединенного непосредственно с N-концом MM активируемого антитела, включают GQSGQG (SEQ ID NO: 143), QSGQG (SEQ ID NO: 144), SGQG (SEQ ID NO: 145), GQG и G. В некоторых вариантах осуществления спейсер не присоединен к N-концу MM. В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QGQSGQ (SEQ ID NO: 109). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QGQSGQG (SEQ ID NO: 138). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QGQSG (SEQ ID NO: 139). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QGQS (SEQ ID NO: 140). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QGQ. В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QG. В некоторых вариантах осуществления спейсер содержит по меньшей мере аминокислотный остаток Q. В некоторых вариантах осуществления спейсер содержит по меньшей мере аминокислотную последовательность GQSGQG (SEQ ID NO: 143). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность QSGQG (SEQ ID NO: 144). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность SGQG (SEQ ID NO: 145). В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность GQG. В некоторых вариантах осуществления спейсер содержит, по меньшей мере, аминокислотную последовательность G. В некоторых вариантах осуществления спейсер отсутствует.
[0159] В некоторых вариантах AB конъюгированного активируемого антитела, природно, содержит одну или несколько дисульфидных связей. В некоторых вариантах AB может быть сконструировано так, чтобы содержать одну или несколько дисульфидных связей.
[0160] В некоторых вариантах осуществления активируемое антитело конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность вариабельной области тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 5. В некоторых вариантах осуществления активируемое антитело конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность вариабельной области легкой цепи, выбранную из группы, состоящей из SEQ ID NO: 7. В некоторых вариантах осуществления активируемое антитело конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную последовательность вариабельной области тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 5, и последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность вариабельной области легкой цепи, выбранную из группы, состоящей из SEQ ID NO: 7.
[0161] В некоторых вариантах осуществления активируемое антитело конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность вариабельной области тяжелой цепи, выбранной из группы, состоящей из SEQ ID NO: 5. В некоторых вариантах осуществления активируемое антитело конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность вариабельной области легкой цепи, выбранной из группы, состоящей из SEQ ID NO: 7. В некоторых вариантах осуществления активируемое антитело конъюгированного активируемого антитела по данному изобретению кодируется последовательностью нуклеиновой кислоты, которая содержит последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность вариабельной области тяжелой цепи, выбранной из группы, состоящей из SEQ ID NO: 5, и последовательность нуклеиновой кислоты, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность вариабельной области легкой цепи, выбранной из группы, состоящей из SEQ ID NO: 7.
[0162] Данное раскрытие также предоставляет способы получения активируемого антитела по данному изобретению путем культивирования клетки в условиях, которые приводят к экспрессии активируемого антитела, при этом клетка содержит молекулу нуклеиновой кислоты по данному изобретению или вектор по данному изобретению.
[0163] Данное раскрытие также предоставляет способы получения активируемого антитела, которое в активированном состоянии связывает CD71, причем способ включает: (а) культивирование клетки, содержащей конструкцию нуклеиновой кислоты, которая кодирует активируемое антитело в условиях, которые приводят к экспрессии активируемого антитела при этом активируемое антитело содержит активируемое антитело по данному изобретению; и (b) восстановление активируемого антитела.
[0164] В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела длиннее, чем у соответствующего антитела; например, рК конъюгированного активируемого антитела длиннее, чем у соответствующего антитела. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела аналогичен периоду полужизни соответствующего антитела. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 15 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 12 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 11 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 10 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 9 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 8 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке конъюгированного активируемого антитела составляет по меньшей мере 7 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 6 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 5 дней при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 4 дня при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 3 дня при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 2 дня при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 24 часа при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 20 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 18 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 16 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 14 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 12 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 10 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 8 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 6 часов при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 4 часа при введении в организм. В некоторых вариантах осуществления период полужизни в сыворотке активируемого антитела составляет по меньшей мере 3 часа при введении в организм.
[0165] Данное раскрытие также обеспечивает способы получения анти-CD71-антитела и/или активируемого полипептида анти-CD71-антитела путем культивирования клетки в условиях, которые приводят к экспрессии полипептида, при этом клетка содержит изолированную молекулу нуклеиновой кислоты, кодирующую антитело, и/или активируемое антитело, описанное в данном документе, и/или векторы, которые содержат эти выделенные последовательности нуклеиновой кислоты. Данное раскрытие обеспечивает способы получения антитела и/или активируемого антитела путем культивирования клетки в условиях, которые приводят к экспрессии антитела и/или активируемого антитела, при этом клетка содержит выделенную молекулу нуклеиновой кислоты, кодирующую антитело и/или активируемое антитело, описанные в данном документе, и/или векторы, которые содержат эти выделенные последовательности нуклеиновых кислот.
[0166] Данное изобретение обеспечивает способы предотвращения, задержки прогрессирования, лечения, ослабления симптомов или иного ослабления заболевания, опосредованного CD71, у субъекта путем введения терапевтически эффективного количества конъюгированного активируемого антитела против CD71, описанного в данном документе, нуждающемуся в этом субъекту.
[0167] Данное изобретение также предлагает способы предотвращения, задержки прогрессирования, лечения, ослабления симптомов или иного ослабления рака у субъекта путем введения терапевтически эффективного количества конъюгированного активируемого анти-CD71-антитела, описанного в данном документе, субъекту, нуждающемуся в этом. Известно, что CD71 экспрессируется в различных формах рака, таких как, в качестве неограничивающего примера, аденокарцинома, рак желчных протоков, рак мочевого пузыря, рак молочной железы, например, тройной негативный рак молочной железы и Her2-отрицательный рак молочной железы; карциноидный рак; рак шейки матки; холангиокарцинома; колоректальный рак; рак эндометрия; глиомы; рак головы и шеи, например плоскоклеточный рак головы и шеи; лейкемия; рак печени; рак легких, например, NSCLC, SCLC; лимфома; меланома; рак носоглотки; рак яичников; панкреатический рак; рак предстательной железы, например метастатический кастрационно-устойчивый рак предстательной железы; рак почки; рак кожи; плоскоклеточный рак, рак желудка; рак яичка; рак щитовидной железы; и рак уротелия.
[0168] В некоторых вариантах осуществления рак связан с CD71-экспрессирующей опухолью. В некоторых вариантах осуществления рак обусловлен опухолью, экспрессирующей CD71.
[0169] Конъюгированное активируемое анти-CD71-антитело, используемое в любом из вариантов осуществления данных способов и применений, можно вводить на любой стадии заболевания. Например, такое конъюгированное активируемое антитело против CD71 можно вводить пациенту, страдающему раком любой стадии, от ранней до метастатической. Термины субъект и пациент используются в данном документе взаимозаменяемо.
[0170] В некоторых вариантах осуществления субъект представляет собой млекопитающее, такое как человек или примат, не являющийся человеком.
[0171] Конъюгированное активируемое антитело против CD71 и его терапевтические составы вводят субъекту, страдающему или подверженному заболеванию или расстройству, связанному с аберрантной экспрессией и/или активностью CD71. Субъект, страдающий или подверженный заболеванию или расстройству, связанному с аберрантной экспрессией и/или активностью CD71, идентифицируется с использованием любого из множества способов, известных в данной области. Например, субъекты, страдающие от рака или другого неопластического состояния, идентифицируются с использованием любого из множества клинических и/или лабораторных тестов, таких как физическое обследование и анализ крови, мочи и/или стула для оценки состояния здоровья. Например, субъекты, страдающие от воспаления и/или воспалительного расстройства, идентифицируются с использованием любого из множества клинических и/или лабораторных тестов, таких как физическое обследование и/или анализ жидкостей организма, например анализ крови, мочи и/или кала, для оценки состояния здоровья.
[0172] Введение конъюгированного активируемого анти-CD71-антитела пациенту, страдающему заболеванием или расстройством, связанным с аберрантной экспрессией и/или активностью CD71, считается успешным, если достигается любая из множества лабораторных или клинических целей. Например, введение конъюгированного активируемого антитела против CD71 пациенту, страдающему заболеванием или расстройством, связанным с аберрантной экспрессией и/или активностью CD71, считается успешным, если один или несколько симптомов, связанных с заболеванием или расстройством, ослаблены, уменьшены, ингибированы или не переходят в другое, т.е. в худшее состояние. Введение конъюгированного активируемого анти-CD71-антитела пациенту, страдающему заболеванием или расстройством, связанным с аберрантной экспрессией и/или активностью CD71, считается успешным, если заболевание или расстройство входит в ремиссию или не переходит в дальнейшее, т.е. в худшее состояние,
[0173] В некоторых вариантах осуществления конъюгированное активируемое антитело против CD71 и его терапевтические составы вводят субъекту, страдающему или подверженному заболеванию или расстройству, такому касубъекту, страдающему от рака или другого неопластического состояния, при котором больные клетки субъекта экспрессируют CD71. В некоторых вариантах осуществления больные клетки связаны с аберрантной экспрессией и/или активностью CD71. В некоторых вариантах осуществления больные клетки связаны с нормальной экспрессией и/или активностью CD71. Субъект, страдающий или подверженный заболеванию или расстройству, в котором больные клетки субъекта экспрессируют CD71, идентифицируется с использованием любого из множества способов, известных в данной области. Например, субъекты, страдающие от рака или другого неопластического состояния, идентифицируются с использованием любого из множества клинических и/или лабораторных тестов, таких как физическое обследование и анализ крови, мочи и/или стула для оценки состояния здоровья. Например, субъекты, страдающие от воспаления и/или воспалительного расстройства, идентифицируются с использованием любого из множества клинических и/или лабораторных тестов, таких как физическое обследование и/или анализ жидкостей организма, например анализ крови, мочи и/или кала, для оценки состояния здоровья.
[0174] В некоторых вариантах осуществления конъюгированное активируемое антитело против CD71 и его терапевтические составы вводят субъектам, страдающему или подверженному заболеванию или расстройству, связанному с клетками, экспрессирующими CD71, или наличию, росту, пролиферации, метастазированию и/или активности таких клеток, таким как субъекты, страдающие от рака или других опухолевых состояний. В некоторых вариантах осуществления клетки связаны с аберрантной экспрессией и/или активностью CD71. В некоторых вариантах осуществления клетки связаны с нормальной экспрессией и/или активностью CD71. Субъект, страдающий или подверженный заболеванию или расстройству, связанному с клетками, которые экспрессируют CD71, идентифицируется с использованием любого из множества способов, известных в данной области. Например, субъекты, страдающие от рака или другого неопластического состояния, идентифицируются с использованием любого из множества клинических и/или лабораторных тестов, таких как физическое обследование и анализ крови, мочи и/или стула для оценки состояния здоровья. Например, субъекты, страдающие от воспаления и/или воспалительного расстройства, идентифицируются с использованием любого из множества клинических и/или лабораторных тестов, таких как физическое обследование и/или анализ жидкостей организма, например анализ крови, мочи и/или кала, для оценки состояния здоровья.
[0175] Введение конъюгированного активируемого анти-CD71-антитела пациенту, страдающему заболеванием или расстройством, связанным с клетками, экспрессирующими CD71, считается успешным, если достигнута любая из множества лабораторных или клинических целей. Например, введение конъюгированного активируемого анти-CD71-антитела пациенту, страдающему заболеванием или расстройством, связанным с клетками, экспрессирующими CD71, считается успешным, если один или несколько симптомов, связанных с заболеванием или расстройством, смягчены, уменьшены, подавлены или не переходият к дальнейшему, т.е. к худшему, состоянию. Введение конъюгированного активируемого анти-CD71-антитела пациенту, страдающему заболеванием или расстройством, связанным с клетками, экспрессирующими CD71, считается успешным, если заболевание или расстройство входит в ремиссию или не переходит в дальнейшее, т.е. в худшее состояние.
[0176] Данное раскрытие также предоставляет способы лечения, облегчения симптомов или задержки прогрессирования расстройства или заболевания, при котором больные клетки экспрессируют CD71, включающие введение терапевтически эффективного количества конъюгированного антитела по данному изобретению или фармацевтической композиции, содержащей антитело по данному изобретению или фармацевтическую композицию, содержащую конъюгированное антитело по данному изобретению субъекту, нуждающемуся в этом. В некоторых вариантах осуществления расстройство или заболевание представляет собой рак.
[0177] Данное раскрытие также предоставляет способы лечения, облегчения симптомов или задержки прогрессирования расстройства или заболевания, связанного с клетками, экспрессирующими CD71, включающие введение терапевтически эффективного количества конъюгированного антитела по данному изобретению или фармацевтической композиции, содержащей фармацевтическую композицию, содержащую конъюгированное антитело по данному изобретению субъекту, нуждающемуся в этом. В некоторых вариантах осуществления расстройство или заболевание, связанное с клетками, экспрессирующими CD71, представляет собой рак. В некоторых вариантах осуществления рак представляет собой аденокарциному, рак желчных протоков (рак желчных путей), рак мочевого пузыря, рак кости, рак молочной железы, тройнй негативный рак молочной железы, Her2-негативный рак молочной железы, карциноидный рак, рак шейки матки, холангиокарциному, колоректальный рак, рак толстой кишки, рак эндометрия, глиому, рак головы и шеи, плоскоклеточный рак головы и шеи, лейкоз, рак печени, рак легких, немелкоклеточный рак легких, мелкоклеточный рак легких, лимфому, меланому, рак ротоглотки, рак яичников, рак поджелудочной железы, рак предстательной железы, метастатический, резистентный к кастрации, рак предстательной железы, рак почки, саркому, рак кожи, плоскоклеточный рак, рак желудка, рак яичка, рак щитовидной железы, рак мочеполовой системы или рак уротелия. В некоторых вариантах осуществления природный лиганд представляет собой трансферрин. В некоторых вариантах осуществления экспрессия и/или активность CD71 млекопитающих является аберрантной. В некоторых вариантах осуществления способ включает введение дополнительного агента. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0178] Данное раскрытие также предоставляет способы ингибирования или уменьшения роста, пролиферации или метастазирования клеток, экспрессирующих CD71 млекопитающих, включающие введение терапевтически эффективного количества антитела по данному изобретению или конъюгированного антитела по данному изобретению или фармацевтической композиции, содержащей антитело по данному изобретению или фармацевтическую композицию, содержащую конъюгированное антитело по данному изобретению для субъекту, который нуждается в этом. В некоторых вариантах осуществления природный лиганд представляет собой трансферрин. В некоторых вариантах осуществления экспрессия и/или активность CD71 млекопитающих является аберрантной. В некоторых вариантах осуществления способ включает введение дополнительного агента. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0179] Данное раскрытие также обеспечивает способы ингибирования, блокирования или предотвращения связывания природного лиганда с CD71 млекопитающих, включающие введение терапевтически эффективного количества антитела по данному изобретению или конъюгированного антитела по данному изобретению или фармацевтической композиции, содержащей антитело по данному изобретению или фармацевтическая композиция, содержащая конъюгированное антитело по данному изобретению субъекту, нуждающемуся в этом. В некоторых вариантах осуществления природный лиганд представляет собой трансферрин. В некоторых вариантах осуществления экспрессия и/или активность CD71 млекопитающих является аберрантной. В некоторых вариантах осуществления способ включает введение дополнительного агента. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0180] Данное раскрытие также предоставляет способы лечения, облегчения симптомов или задержки прогрессирования расстройства или заболевания, при котором больные клетки экспрессируют CD71, включающие введение терапевтически эффективного количества активируемого антитела по данному изобретению или конъюгированного активируемого антитела по данному изобретению или фармацевтической композиции, содержащей активируемое антитело по данному изобретению, или фармацевтической композиции, содержащей конъюгированное активируемое антитело по данному изобретению, субъекту, нуждающемуся в этом. В некоторых вариантах осуществления расстройство или заболевание представляет собой рак.
[0181] Данное раскрытие также предоставляет способы лечения, облегчения симптомов или задержки прогрессирования расстройства или заболевания, связанного с клетками, экспрессирующими CD71, включающие введение терапевтически эффективного количества конъюгированного активируемого антитела по данному изобретению или фармацевтической композиции, содержащей конъюгированное активируемое антитело по данному изобретению субъекту, нуждающемуся в этом. В некоторых вариантах осуществления расстройство или заболевание, связанное с клетками, экспрессирующими CD71, представляет собой рак. В некоторых вариантах осуществления рак представляет собой аденокарциному, рак желчных протоков (рак желчных путей), рак мочевого пузыря, рак кости, рак молочной железы, тройной негативный рак молочной железы, Her2-негативный рак молочной железы, карциноидный рак, рак шейки матки, холангиокарциному, колоректальный рак, рак толстой кишки, рак эндометрия, глиому, рак головы и шеи, плоскоклеточный рак головы и шеи, лейкоз, рак печени, рак легких, немелкоклеточный рак легких, мелкоклеточный рак легких, лимфома, меланома, рак ротоглотки, рак яичников, рак поджелудочной железы, рак предстательной железы, метастатический, резистентный к кастрации, рак предстательной железы, рак почки, саркому, рак кожи, плоскоклеточный рак, рак желудка, рак яичка, рак щитовидной железы, рак мочеполовой системы или рак уротелия. В некоторых вариантах осуществления природный лиганд представляет собой трансферрин. В некоторых вариантах осуществления экспрессия и/или активность CD71 млекопитающих является аберрантной. В некоторых вариантах осуществления способ включает введение дополнительного агента. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0182] Данное раскрытие также предоставляет способы ингибирования или уменьшения роста, пролиферации или метастазирования клеток, экспрессирующих CD71 млекопитающих, включающие введение терапевтически эффективного количества активируемого антитела по данному изобретению или конъюгированного активируемого антитела по данному изобретению или фармацевтической композиции, содержащей активируемое антитело по данному изобретению или фармацевтической композиции, содержащей конъюгированное активируемое антитело по данному изобретению субъекту, нуждающемуся в этом. В некоторых вариантах осуществления природный лиганд представляет собой трансферрин. В некоторых вариантах осуществления экспрессия и/или активность CD71 млекопитающих является аберрантной. В некоторых вариантах осуществления способ включает введение дополнительного агента. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0183] Данное раскрытие также обеспечивает способы ингибирования, блокирования или предотвращения связывания природного лиганда с CD71 млекопитающих, включающие введение терапевтически эффективного количества конъюгированного активируемого антитела по данному изобретению или фармацевтической композиции, содержащей конъюгированное активируемое антитело по данному изобретению субъекту, который нуждается в этом. В некоторых вариантах осуществления природный лиганд представляет собой трансферрин. В некоторых вариантах осуществления экспрессия и/или активность CD71 млекопитающих является аберрантной. В некоторых вариантах осуществления способ включает введение дополнительного агента. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0184] В некоторых вариантах осуществления данных способов и наборов анти-CD71 конъюгированное активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления данных способов и наборов детектируемая метка содержит визуализирующий агент, контрастирующий агент, фермент, флуоресцентную метку, хромофор, краситель, один или несколько ионов металлов или метку на основе лиганда. В некоторых вариантах осуществления данных способов и наборов визуализирующий агент содержит радиоизотоп. В некоторых вариантах осуществления данных способов и наборов радиоизотоп представляет собой индий или технеций. В некоторых вариантах осуществления данных способов и наборов контрастирующий агент содержит йод, гадолиний или оксид железа. В некоторых вариантах осуществления данных способов и наборов фермент содержит пероксидазу хрена, щелочную фосфатазу или β-галактозидазу. В некоторых вариантах осуществления данных способов и наборов флуоресцентная метка содержит желтый флуоресцентный белок (YFP), голубой флуоресцентный белок (CFP), зеленый флуоресцентный белок (GFP), модифицированный красный флуоресцентный белок (mRFP), красный флуоресцентный белок tdimer2 (RFP tdimer2), HCRED или производное европия. В некоторых вариантах осуществления данных способов и наборов люминесцентная метка содержит производное N-метилакридия. В некоторых вариантах осуществления данных способов, метка содержит метки Alexa Fluor®, такие как Alexa Fluor® 680 или Alexa Fluor® 750. В некоторых вариантах осуществления данных способов и наборов метка на основе лиганда содержит биотин, авидин, стрептавидин или один или несколько гаптенов.
[0185] В некоторых вариантах осуществления данных способов и наборов субъект является млекопитающим. В некоторых вариантах осуществления данных способов субъектом является человек. В некоторых вариантах осуществления субъект является млекопитающим, не являющимся человеком, таким как примат, не являющийся человеком, домашнее животное (например, кошка, собака, лошадь), сельскохозяйственное животное, рабочее животное или животное зоопарка. В некоторых вариантах субъект является грызуном.
[0186] В некоторых вариантах осуществления данных способов и наборов способ представляет собой способ in vivo. В некоторых вариантах осуществления данных способов способ представляет собой способ in situ. В некоторых вариантах осуществления данных способов способ представляет собой способ ex vivo. В некоторых вариантах осуществления данных способов способ представляет собой способ in vitro.
[0187] В некоторых вариантах осуществления способов и наборов способ используется для идентификации или иного уточнения популяции пациентов, подходящей для лечения конъюгированным активируемым антителом против CD71 по данному изобретению, с последующей обработкой путем введения данного конъюгированного активируемого антитела против CD71 субъекту, который нуждается в этом. Например, пациенты, которые дают положительный результат как на мишень (например, CD71), так и на протеазу, которая расщепляет субстрат в расщепляемой части (CM) активируемого антитела против CD71, тестируемого этими способами, идентифицируются как подходящие кандидаты для лечения таким активируемым антителом против CD71, содержащим такой CM, и пациенту затем вводят терапевтически эффективное количество активируемого антитела против CD71 и/или конъюгированного активируемого антитела против CD71, которое было протестировано. Аналог ично, пациенты, которые дают отрицательный результат на одну или обе мишень (например, CD71) и протеазу, которая расщепляет субстрат в CM в активируемом антителе, тестируемом с использованием данных способов, могут быть идентифицированы как подходящие кандидаты для другой формы терапии. В некоторых вариантах осуществления такие пациенты могут тестироваться с другими активируемыми антителами против CD71 до тех пор, пока не будет идентифицировано подходящее активируемое антитело против CD71 для лечения (например, активируемое антитело против CD71, содержащее СМ, который разрезается пациентом в сайте болезни). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество активируемого анти-CD71-антитела и/или конъюгированного, на которое пациент дал положительный результат. Подходящие AB, MM и/или CM включают любые из AB, MM и/или CM, раскрытые в данном документе.
[0188] Фармацевтические композиции по данному изобретению могут содержать антитело по данному изобретению и, необязательно, фармацевтически приемлемый носитель. Данные фармацевтические композиции могут быть включены в наборы, такие как, например, диагностические наборы.
[0189] В некоторых вариантах осуществления фармацевтическая композиция содержит конъюгированное активируемое антитело по данному изобретению и, необязательно, фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтическая композиция содержит дополнительный агент. В некоторых вариантах осуществления дополнительный агент представляет собой терапевтический агент.
[0190] Антитела против CD71 и AB в активируемых антителах по данному изобретению специфически связывают мишень CD71, такую как, например, CD71 млекопитающих и/или CD71 человека. Также в данное описание включены анти-CD71-антитела и AB, которые связываются с тем же эпитопом CD71, что и антитело по данному изобретению и/или активированное активируемое антитело, описанное в данном документе. Также в данное описание включены анти-CD71-антитела и AB, которые конкурируют с анти-CD71-антителом и/или активированным анти-CD71-активируемым антителом, описанным в данном документе, за связывание с мишенью CD71, например, человеческим CD71. Также в данное описание включены анти-CD71-антитела и AB, которые перекрестно конкурируют с анти-CD71-антителом и/или активированным анти-CD71-активируемым антителом, описанным в данном документе, за связывание с мишенью CD71, например, человеческим CD71.
[0191] Активируемые анти-CD71-антитела, представленные в данном документе, содержат маскирующий фрагмент. В некоторых вариантах осуществления маскирующий фрагмент представляет собой аминокислотную последовательность, которая спарована или иным образом присоединена к анти-CD71-антителу и расположена в активируемой конструкции анти-CD71-антитела таким образом, что маскирующий фрагмент снижает способность анти-CD71-антитела к специфическому связыванипю CD71. Подходящие маскирующие фрагменты идентифицируются с использованием любого из множества известных способов. Например, пептидные маскирующие фрагменты идентифицируют с использованием способов, описанных в публикации РСТ № WO 2009/025846 Daugherty et al., содержание которой полностью включено в данное описание посредством ссылки.
[0192] Активируемые антитела против CD71, представленные в данном документе, включают разрезаемый фрагмент. В некоторых вариантах осуществления разрезаемый фрагмент включает аминокислотную последовательность, которая представляет собой субстрат для протеазы, обычно для внеклеточной протеазы. Подходящие субстраты идентифицируются с использованием любого из множества известных способов. Например, пептидные субстраты идентифицируют с использованием способов, описанных в патенте США № 7666817, Daugherty et al .; в патенте США № 8563269, Stagliano et al .; и в публикации РСТ № WO 2014/026136 La Porte et al., содержание каждой из которых настоящим полностью включено в качестве ссылки. (См. также Boulware et al. “Evolutionary optimization of peptide substrates for proteases that exhibit rapid hydrolysis kinetics.” Biotechnol. Bioeng. 106,3 (2010): 339-46).
[0193] Иллюстративные субстраты включают, но не ограничиваются ими, субстраты, разрезаемые одним или несколькими из следующих ферментов или протеаз, перечисленных в Таблице (I).
[0194] Активируемые анти-CD71-антитела, описанные в данном документе, преодолевают ограничение терапевтических средств на антитела, в частности терапевтических антител, которые, как известно, являются токсичными по меньшей мере до некоторой степени in vivo. Целевая опосредованная токсичность представляет собой основное ограничение для разработки терапевтических антител. Активируемые анти-CD71-антитела, представленные в данном документе, предназначены для устранения токсичности, связанной с ингибированием мишени в нормальных тканях традиционными терапевтическими антителами. Данные активируемые анти-CD71-антитела остаются замаскированными до протеолитической активации в месторасположении патологии. Начиная с анти-CD71-антитела в качестве родительского терапевтического антитела, активируемые анти-CD71-антитела по данному изобретению были сконструированы путем связывания антитела с ингибирующим маскирующим фрагментом через линкер, который включает субстрат протеазы.
[0195] Когда AB модифицируется с помощью MM и находится в присутствии мишени, специфическое связывание AB с его мишенью уменьшается или ингибируется по сравнению со специфичным связыванием AB, не модифицированного MM, или специфичным связыванием родительский AB к мишени.
[0196] Kd AB, модифицированного ММ, к мишени, составляет не менее чем в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 100000, 100000, 500000, 1,000,000, 5000000, 10000000, 50000000 или более, или чем в между 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или в 100000-10000000 раз больше, чем Kd AB, не модифицированного MM, или родительского AB к мишени. И наоборот, аффинность связывания АВ, модифицированного ММ, к мишени составляет, по меньшей мере, в 2, 3, 4, 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более, или между 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100,000, 100-1,000,000, 100-10,000,000, 1,000-10,000, 1,000-100,000, 1000-1,000,000, 1000-10,000,000, 10,000-100,000, 10,000-1,000,000, 10,000-10,000,000, 100,000-1,000,000 или в 100,000-10,000,000 раз меньше чем аффинность связывания AB, не модифицированного MM, или родительского AB к мишени.
[0197] Константа диссоциации (Kd) ММ по отношению AB, как правило, больше, чем Kd AB по отношению к мишени. Kd MM по отношению к AB может быть как минимум в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 100000, 1000000 или даже в 10000000 раз больше, чем Kd AB к мишени. И наоборот, аффинность связывания ММ по отношению к АВ обычно ниже, чем аффинность связывания АВ по отношению к мишени. Аффинность связывания MM по отношению к AB может быть по меньшей мере в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 100000, 1000000 или даже в 10000000 раз ниже, чем аффинность связывания AB по отношению к мишени AB.
[0198] В некоторых вариантах осуществления константа диссоциации (Kd) ММ по отношению к АВ примерно равна Kd АВ по отношению к мишени. В некоторых вариантах осуществления константа диссоциации (Kd) ММ по отношению к АВ не превышает константу диссоциации АВ по отношению к мишени.
[0199] В некоторых вариантах осуществления константа диссоциации (Kd) ММ по отношению к АВ меньше, чем константа диссоциации АВ по отношению к мишени.
[0200] В некоторых вариантах осуществления константа диссоциации (Kd) ММ по отношению к АВ больше, чем константа диссоциации АВ по отношению к мишени.
[0201] В некоторых вариантах осуществления MM имеет Kd для связывания с AB, которая составляет не более Kd для связывания AB с мишенью.
[0202] В некоторых вариантах осуществления MM имеет Kd для связывания с AB, которая не меньше, чем Kd для связывания AB с мишенью.
[0203] В некоторых вариантах осуществления MM имеет Kd для связывания с AB, которая примерна равна Kd для связывания AB с мишенью.
[0204] В некоторых вариантах осуществления MM имеет значение Kd для связывания с AB, которое меньше, чем Kd для связывания AB с мишенью.
[0205] В некоторых вариантах осуществления MM имеет значение Kd для связывания с AB, которое больше, чем Kd для связывания AB с мишенью.
[0206] В некоторых вариантах осуществления MM имеет Kd для связывания с AB, который не более чем в 2, 3, 4, 5, 10, 25, 50, 100, 250, 500 или 1000 раз больше, чем Kd для связывания AB с мишенью. В некоторых вариантах осуществления MM имеет Kd для связывания с AB, который находится между в 1-5, 2-5, 2-10, 5-10, 5-20, 5-50, 5-100, 10-100, 10-1000, 20-100, 20-1000 или 100-1000 раз больше, чем Kd для связывания AB с мишенью.
[0207] В некоторых вариантах MM обладает афинностью связывания с AB, которая меньше, чем афинность связывания AB с мишенью.
[0208] В некоторых вариантах MM обладает афинностью связывания с AB, которая не превышает афинность связывания AB с мишенью.
[0209] В некоторых вариантах MM обладает афинностью связывания с AB, которая примерно равна афинности связывания AB с мишенью.
[0210] В некоторых вариантах MM обладает афинностью связывания с AB, которая не меньше, чем афинность связывания AB с мишенью.
[0211] В некоторых вариантах MM обладает афинностью связывания с AB, которая превышает афинность связывания AB с мишенью.
[0212] В некоторых вариантах MM обладает афинностью связывания с AB, которая на 2, 3, 4, 5, 10, 25, 50, 100, 250, 500 или 1000 меньше, чем афинность связывания AB с мишенью., В некоторых вариантах осуществления MM обладает афинностью связывания с AB, которая составляет в 1-5, 2-5, 2-10, 5-10, 5-20, 5-50, 5-100, 10-100, В 10-1000, 20-100, 20-1000 или 100-1000 раз меньше сродства связывания АВ с мишенью. В некоторых вариантах MM обладает афинностью связывания с AB, которая в 2-20 раз меньше, чем афинность связывания AB с мишенью. В некоторых вариантах осуществления MM нековалентно связан с AB и в эквимолярной концентрации с AB не ингибирует связывание AB с мишенью.
[0213] Когда AB модифицируется с помощью MM и находится в присутствии мишени, специфическое связывание AB с его мишенью уменьшается или ингибируется по сравнению со специфичным связыванием AB, не модифицированного MM, или специфичным связыванием родительского AB с мишенью. По сравнению со связыванием AB, не модифицированного MM, или связыванием родительского AB с мишенью, способность AB связываться с мишенью при модификации с помощью MM может быть уменьшена по меньшей мере на 50%, 60%, 70%, 80%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и даже 100% в течение по меньшей мере 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72, 84 или 96 часов, или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 дней, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или более при измерении в анализе in vivo или in vitro.
[0214] ММ ингибирует связывание AB с мишенью. ММ связывает антигенсвязывающий домен АВ и ингибирует связывание АВ с мишенью. ММ может стерически ингибировать связывание AB с мишенью. ММ может аллостерически ингибировать связывание AB с его мишенью. В данных вариантах осуществления, когда АВ модифицирован или спарован с ММ и в присутствии мишени отсутствует или практически отсутствует связывание АВ с мишенью, или присутствует не более 0,001%, 0,01%, 0,1%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40% или 50% связывания AB с мишенью, по сравнению со связыванием AB, не модифицированного MM, родительского AB или AB, не спарованного с MM с мишенью, по меньшей мере, на протяжении 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72, 84 или 96 часов, или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 дней, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше при измерении в анализе in vivo или in vitro.
[0215] Когда AB связан или изменен с помощью MM, MM «маскирует» или уменьшает или иным образом ингибирует специфическое связывание AB с мишенью. Когда AB связан или изменен с помощью MM, такое соединение или модификация могут вызвать структурное изменение, которое уменьшает или ограничивает способность AB специфически связывать свою мишень.
[0216] AB, связанный или модифицированный с помощью MM, может быть представлен следующими формулами (по порядку от амино (N) концевой области до карбоксильной (C) концевой области:
(ММ) - (АВ)
(АВ) - (ММ)
(ММ) -L- (АВ)
(АВ) -L- (ММ)
при этом указанный MM представляет собой маскирующий фрагмент, AB представляет собой антитело или его фрагмент, а L представляет собой линкер. Во многих вариантах осуществления может быть желательно вставить один или несколько линкеров, например гибких линкеров, в композицию, чтобы обеспечить гибкость.
[0217] В определенных вариантах осуществления MM не является естественным партнером по связыванию AB. В некоторых вариантах MM не содержит или практически не имеет гомологии с любым природным партнером по связыванию AB. В некоторых вариантах осуществления MM не более чем на около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% подобен любому природному связывающему партнеру АВ. В некоторых вариантах осуществления MM не более чем на около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% идентичны любому природному связывающему партнеру АВ. В некоторых вариантах осуществления MM не более чем на 25% идентичен любому природному связывающему партнеру AB. В некоторых вариантах осуществления MM не более чем на 50% идентичен любому природному связывающему партнеру AB. В некоторых вариантах осуществления MM не более чем на 20% идентичен любому природному связывающему партнеру AB. В некоторых вариантах осуществления MM не более чем на 10% идентичен любому природному связывающему партнеру AB.
[0218] В некоторых вариантах осуществления активируемые антитела включают АВ, которое модифицировано ММ, а также содержит одну или несколько разрезаемых фрагментов (СМ). Такие активируемые антитела проявляют активируемое/переключаемое связывание с мишенью АВ. Активируемые антитела обычно содержат антитело или фрагмент антитела (АВ), модифицированные или связанные с маскирующим фрагментом (ММ), и модифицируемым или разрезаемым фрагмент (СМ). В некоторых вариантах осуществления CM содержит аминокислотную последовательность, которая служит в качестве субстрата по меньшей мере для одной протеазы.
[0219] Элементы активируемых антител расположены таким образом, что ММ и СМ расположены таким образом, что в разрезанном (или относительно активном) состоянии и в присутствии мишени АВ связывает мишень, в то время как активируемое антитело находится в неразрезанном (или относительно неактивном) состоянии при наличии мишени, специфическое связывание AB с его мишенью снижается или ингибируется. Специфическое связывание AB с его мишенью может быть уменьшено из-за ингибирования или маскировки способности AB специфически связывать свою мишень с помощью ММ.
[0220] Kd AB, модифицированного ММ и СМ, по отношению к мишени, составляет не менее чем в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 10000, 100000, 500000, 1,000,000, 5000000, 10000000, 50000000 или более раз, или между 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100 -1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или в 100000-10000000 раз больше, чем Kd AB немодифицированного MM и CM или родительского AB по отношению к мишени. И наоборот, аффинность связывания АВ, модифицированной ММ и СМ, по отношению к мишени, составляет, по меньшей мере, в 5, 10, 25, 50, 100, 250, 500, 1000, 2500, 5000, 10000, 50000, 100000, 500000, 1000000, 5000000, 10000000, 50000000 или более раз, или в между 5-10, 10-100, 10-1000, 10-10000, 10-100000, 10-1000000, 10-10000000, 100-1000, 100-10000, 100-100000, 100-1000000, 100-10000000, 1000-10000, 1000-100000, 1000-1000000, 1000-10000000, 10000-100000, 10000-1000000, 10000-10000000, 100000-1000000 или в 100000-10000000 раз меньше, чем афинность связывания AB не модифицированного ММ и CM или родительского AB по отношению к мишени.
[0221] Когда AB модифицируется с помощью MM и CM и находится в присутствии мишени, но не в присутствии модифицирующего агента (например, по меньшей мере, одной протеазы), специфическое связывание AB с его мишенью уменьшается или ингибируется, по сравнению со специфичным связыванием AB, не модифицированного MM и CM, или родительского AB с мишенью. По сравнению со связыванием родительского AB или связыванием AB, не модифицированного MM и CM, к своей мишени, способность AB связывать мишень при модификации с помощью MM и CM может быть снижена как минимум на 50%, 60%, 70%, 80%, 90%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и даже 100% в течение по меньшей мере 2, 4, 6, 8, 12, 28, 24, 30, 36, 48, 60, 72, 84 или 96 часов или 5, 10, 15, 30, 45, 60, 90, 120, 150 или 180 дней, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше при измерении в анализе in vivo или in vitro.
[0222] Используемый в данном документе термин «разрезанное состояние» относится к состоянию активируемых антител после модификации CM по меньшей мере одной протеазой. Используемый в данном документе термин «неразрезанное состояние» относится к состоянию активируемых антител в отсутствие разрезания CM протеазой. Как обсуждалось выше, термин «активируемые антитела» используется в данном документе для обозначения активируемого антитела как в его неразрезанном (нативном) состоянии, так и в его разрезанном состоянии. Специалисту в данной области техники должно быть очевидно, что в некоторых вариантах осуществления разрезаемое активируемое антитело может не иметь MM из-за разрезания CM протеазой, что приводит к высвобождению по меньшей мере MM (например, когда MM не присоединен к активируемому антителу ковалентной связью (например, дисульфидной связью между остатками цистеина)).
[0223] Под активируемым или переключаемым подразумевается, что активируемое антитело демонстрирует первый уровень связывания с мишенью, когда активируемое антитело находится в ингибированном, замаскированном или неразрезанном состоянии (т.е. первой конформации), и второй уровень связывания с мишенью в неингибированом, немаскированом и/или разрезанном состоянии (т.е. второй конформации), где второй уровень связывания мишени больше первого уровня связывания. Обычно доступ мишени к AB активируемого антитела в присутствии разрезающего агента, способного расщеплять СМ, т.е. протеазы, больше, чем в отсутствие такого разрезающего агента. Таким образом, когда активируемое антитело находится в неразрезанном состоянии, AB ингибируется от связывания с мишенью и может маскироваться от связывания с мишенью (т.е. первая конформация такова, что AB не может связываться с мишенью), а в разрезанном состоянии AB не ингибируется или не маскируется для связывания с мишенью.
[0224] CM и AB активируемых антител выбираются таким образом, чтобы AB представлял связывающую группу для данной мишени, а CM представлял собой субстрат для протеазы. В некоторых вариантах осуществления протеаза локализуется совместно с мишенью в месторасположении лечения или в месторасположении диагностики у субъекта. Используемый в данном документе термин «локализованный» относится к тому же месту или относительно близко к нему. В некоторых вариантах осуществления протеаза расщепляет СМ с образованием активированного антитела, которое связывается с мишенью, расположенной рядом с сайтом разрезания. Активируемые антитела, раскрытые в данном документе, находят конкретное применение, когда, например, протеаза, способная расщеплять сайт в CM, т.е. протеазу, присутствует на относительно более высоких уровнях в ткани, содержащей мишень, в месторасположении лечения или в диагностическом сайте, чем в ткани участков не подлежащих лечению (например, в здоровых тканях). В некоторых вариантах осуществления данного изобретения CM по данному изобретению также разрезается одной или несколькими другими протеазами. В некоторых вариантах осуществления именно одна или несколько других протеаз совместно локализуются с мишенью и отвечают за разрезание CM in vivo.
[0225] В некоторых вариантах осуществления активируемые антитела обеспечивают сниженную токсичность и/или неблагоприятные побочные эффекты, которые в противном случае могли бы возникнуть в результате связывания АВ в сайтах не требующих лечения, если АВ не были замаскированы или иным образом ингибированы для связывания с мишенью.
[0226] В общем, активируемое антитело может быть сконструировано путем выбора интересующего АВ и конструирования остатка активируемого антитела таким образом, чтобы при конформационном ограничении ММ предусматривал маскирование АВ или уменьшение связывания АВ с его мишенью. Критерии структурного проектирования могут быть приняты во внимание, чтобы обеспечить данную функциональную особенность.
[0227] Предоставляются активируемые антитела, обладающие переключаемым фенотипом желаемого динамического диапазона для связывания мишени в ингибированной или неингибированной конформации. Динамический диапазон обычно относится к отношению (а) максимального обнаруженного уровня параметра при первом наборе условий к (b) минимальному обнаруженному значению данного параметра при втором наборе условий. Например, в контексте активируемого антитела динамический диапазон относится к отношению (а) максимального обнаруженного уровня связывания белка-мишени с активируемым антителом в присутствии по меньшей мере одной протеазы, способной расщеплять СМ активируемого антитела к (b) минимальному обнаруженному уровню связывания белка-мишени с активируемым антителом в отсутствие протеазы. Динамический диапазон активируемого антитела можно рассчитать как отношение константы диссоциации обработки разрезающим агентом активируемого антитела (например, фермента) к константе диссоциации обработки разрезающим агентом активируемых антител. Чем больше динамический диапазон активируемого антитела, тем лучше переключаемый фенотип активируемого антитела. Активируемые антитела, имеющие относительно более высокие значения динамического диапазона (например, более 1), демонстрируют более желательные фенотипы переключения, так что связывание белка-мишени активируемыми антителами происходит в большей степени (например, преимущественно происходит) в присутствии разрезающего агента (например, фермента) способного расщеплять CM активируемых антител, чем при отсутствии разрезающего агента.
[0228] Активируемые антитела могут быть предоставлены в различных структурных конфигурациях. Иллюстративные формулы для активируемых антител приведены ниже. Конкретно предполагается, что порядок от N- к C-концу AB, MM и CM может быть обращен в активируемом антителе. Также конкретно предполагается, что CM и MM могут перекрываться в аминокислотной последовательности, например, так, что CM содержится в MM.
[0229] Например, активируемые антитела могут быть представлены следующей формулой (по порядку от амино (N) концевой области до карбоксильной (С) концевой области:
(ММ) - (CM) - (AB)
(AB) - (CM) - (ММ)
при этом указанный MM представляет собой маскирующий фрагмент, CM представляет собой разрезаемый фрагмент, а AB представляет собой антитело или его фрагмент. Следует отметить, что хотя MM и CM указаны как отдельные компоненты в формулах выше, во всех иллюстративных вариантах осуществления (включая формулы), раскрытых в данном документе, предполагается, что аминокислотные последовательности MM и CM могут перекрываться, например, так, что CM полностью или частично содержится в MM. Кроме того, формулы, приведенные выше, предусматривают дополнительные аминокислотные последовательности, которые могут быть расположены на N-конце или C-конце относительно активируемых элементов антител.
[0230] В определенных вариантах осуществления MM не является естественным партнером по связыванию AB. В некоторых вариантах MM не содержит или практически не имеет гомологии с любым природным партнером по связыванию AB. В некоторых вариантах осуществления MM имеет не более чем 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% подобия любому природному связывающему партнеру АВ. В некоторых вариантах осуществления MM имеет не более чем 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или 80% идентичности любому природному связывающему партнеру АВ. В некоторых вариантах осуществления MM не более чем на 50% идентичен любому природному связывающему партнеру AB. В некоторых вариантах осуществления MM не более чем на 25% идентичен любому природному связывающему партнеру AB. В некоторых вариантах осуществления MM не более чем на 20% идентичен любому природному связывающему партнеру AB. В некоторых вариантах осуществления MM не более чем на 10% идентичен любому природному связывающему партнеру AB.
[0231] Во многих вариантах осуществления может быть желательно вставить один или несколько линкеров, например гибких линкеров, в активируемую конструкцию антитела, чтобы обеспечить гибкость в одном или нескольких из соединения MM-CM, соединения CM-AB или обоих. Например, AB, MM и/или CM могут не содержать достаточного количества остатков (например, Gly, Ser, Asp, Asn, особенно Gly и Ser, особенно Gly) для обеспечения желаемой гибкости. Как таковой, переключаемый фенотип таких активируемых конструкций антител может выиграть от введения одной или нескольких аминокислот для обеспечения гибкого линкера. Кроме того, как описано ниже, когда активируемое антитело предоставляется в виде конформационно-ограниченной конструкции, гибкий линкер может быть функционально вставлен для облегчения образования и поддержания циклической структуры в неразрезанном активируемом антителе.
[0232] Например, в некоторых вариантах осуществления активируемое антитело содержит одну из следующих формул (где приведенная ниже формула представляет аминокислотную последовательность либо от N- к C-концу, либо от C- к N-концу):
(ММ) -LP1- (CM) - (AB)
(ММ) - (CM) -LP2- (AB)
(ММ) -LP1- (СМ) -LP2- (АВ)
при этом указанный MM, CM и AB такие, как определено выше; при этом LP1 и LP2 каждый независимо и необязательно присутствуют или отсутствуют, представляют собой одинаковые или разные гибкие линкеры, которые содержат по меньшей мере 1 гибкую аминокислоту (например, Gly). Кроме того, формулы, приведенные выше, предусматривают дополнительные аминокислотные последовательности, которые могут быть расположены на N-конце или C-конце относительно активируемых элементов антител. Примеры включают, но не ограничиваются ими, нацеливающие фрагменты (например, лиганд для рецептора клетки, присутствующей в ткани-мишени) и фрагменты, увеличивающие период полужизни в сыворотке (например, полипептиды, которые связывают сывороточные белки, такие как иммуноглобулин (например, IgG) или сывороточный альбумин (например, человеческий сывороточный альбумин (HAS)).
[0233] CM специфически разрезается по меньшей мере одной протеазой со скоростью около 0,001-1500×104 М-1 с-1 или по меньшей мере 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1, 2,5, 5, 7,5, 10, 15, 20, 25, 50, 75, 100, 125, 150, 200, 250, 500, 750, 1000, 1250 или 1500×104 М-1 с-1. В некоторых вариантах осуществления CM специфически разрезается со скоростью около 100000 М-1 с-1. В некоторых вариантах осуществления CM специфически разрезается со скоростью от около 1×10Е2 до около 1×10Е6 М-1 с-1 (т.е. от около 1×10 2 до около 1×106 М-1 с-1).
[0234] Для специфического разрезания ферментом устанавливается контакт между ферментом и CM. Когда активируемое антитело, содержащее AB, связанный с MM и CM, находится в присутствии мишени и достаточной активности фермента, CM может быть разрезан. Достаточная активность фермента может относиться к способности фермента вступать в контакт с CM и влиять на разрезание. Можно легко предположить, что фермент может находиться вблизи CM, но не способен расщепляться из-за других клеточных факторов или белковой модификации фермента.
[0235] Линкеры, подходящие для применения в описанных в данном документе композициях, обычно представляют собой линкеры, которые обеспечивают гибкость модифицированного АВ или активируемых антител для облегчения ингибирования связывания АВ с мишенью. Такие линкеры обычно называют гибкими линкерами. Подходящие линкеры могут быть легко выбраны и могут быть любой подходящей различной длины, такой как от 1 аминокислоты (например, Gly) до 20 аминокислот, от 2 аминокислот до 15 аминокислот, от 3 аминокислот до 12 аминокислот, включая от 4 до 10 аминокислот, от 5 до 9 аминокислот, от 6 до 8 аминокислот или от 7 до 8 аминокислот и могут составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот в длину.
[0236] Иллюстративные гибкие линкеры включают глицин-полимеры (G) n, глицин-сериновые полимеры (включая, например, (GS) n, (GSGGS) n (SEQ ID NO: 24) и (GGGS) n (SEQ ID NO: 25), где n представляет собой целое число по меньшей мере один), глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры, известные в данной области. Глицин и глицин-сериновые полимеры являются относительно неструктурированными и, следовательно, могут быть в качестве нейтральной связи между компонентами. Глицин получает доступ к значительно большему количеству phi-psi-пространства, чем даже аланин, и гораздо менее ограничен, чем остатки с более длинными боковыми цепями (см. Scheraga, Rev. Computational Chem. 11173-142 (1992)). Иллюстративные гибкие линкеры включают, но не ограничиваются ими, Gly-Gly-Ser-Gly (SEQ ID NO: 26), Gly-Gly-Ser-Gly-Gly (SEQ ID NO: 27), Gly-Ser-Gly-Ser- Gly (SEQ ID NO: 28), Gly-Ser-Gly-Gly-Gly (SEQ ID NO: 29), Gly-Gly-Gly-Ser-Gly (SEQ ID NO: 30), Gly-Ser-Ser-Ser -Gly (SEQ ID NO: 31) и тому подобное. Специалист в данной области техники поймет, что конструкция активируемых антител может включать линкеры, которые являются полностью или частично гибкими, так что линкер может содержать гибкий линкер, а также одну или несколько частей, которые придают менее гибкую структуру для обеспечения структуры желаемых активируемых антител.
[0237] Данное раскрытие также предоставляет композиции и способы, которые содержат активируемое антитело против CD71, которое включает антитело или фрагмент антитела (AB), который специфически связывает CD71, при этом AB связан с маскирующим фрагментом (MM), который снижает способность AB к связыванию его мишени. В некоторых вариантах осуществления активируемое антитело против CD71 дополнительно включает разрезаемый фрагмент (CM), который представляет собой субстрат для протеазы. Композиции и способы, представленные в данном документе, обеспечивают возможность присоединения одного или нескольких агентов к одному или нескольким остаткам цистеина в AB без ущерба для активности (например, маскирующей, активирующей или связывающей активности) активируемого антитела против CD71. В некоторых вариантах осуществления композиции и способы, представленные в данном документе, обеспечивают возможность присоединения одного или нескольких агентов к одному или нескольким остаткам цистеина в AB без уменьшения или иного нарушения одной или нескольких дисульфидных связей в ММ. Композиции и способы, представленные в данном документе, продуцируют активируемое антитело против CD71, которое конъюгировано с одним или несколькими агентами, например, с любым из множества терапевтических, диагностических и/или профилактических агентов, например, в некоторых вариантах осуществления, без какого-либо агента (ов) конъюгированного с ММ активируемого антитела против CD71. Композиции и способы, представленные в данном документе, продуцируют конъюгированные активируемые антитела против CD71, в которых ММ сохраняет способность эффективно и действенно маскировать АВ активируемого антитела в неразрезанном состоянии. Композиции и способы, представленные в данном документе, продуцируют конъюгированные активируемые антитела против CD71, в которых активируемое антитело все еще активировано, т.е. расщеплено, в присутствии протеазы, которая может расщеплять CM.
[0238] Активируемые анти-CD71-антитела имеют по меньшей мере одну точку конъюгации для агента, но в представленных в данном документе способах и композициях для конъюгации с агентом доступно меньше всех возможных точек конъюгации. В некоторых вариантах осуществления одна или несколько точек коньюгации представляют собой атомы серы, участвующие в дисульфидных связях. В некоторых вариантах осуществления одна или несколько точек коньюгации представляют собой атомы серы, участвующие в межцепочечных дисульфидных связях. В некоторых вариантах осуществления одна или несколько точек коньюгации представляют собой атомы серы, участвующие в межцепочечных сульфидных связях, но не атомы серы, участвующие во внутрицепочечных дисульфидных связях. В некоторых вариантах осуществления одна или несколько точек коньюгации представляют собой атомы серы цистеина или другие аминокислотные остатки, содержащие атом серы. Такие остатки могут встречаться в природе в структуре антитела или могут быть включены в антитело путем сайт-направленного мутагенеза, химического превращения или намеренно неправильного включения неприродных аминокислот.
[0239] Также предоставлены способы получения конъюгата активируемого анти-CD71-антитела, имеющего одну или несколько межцепочечных дисульфидных связей в АВ и одну или несколько внутрицепочечных дисульфидных связей в ММ, и предоставляется лекарственное средство, реагирующее со свободными тиолами. Способ обычно включает частичное восстановление межцепочечных дисульфидных связей в активируемом антителе с помощью восстановителя, такого как, например, TCEP; и конъюгирование лекарственного средства со свободными тиолами в частично восстановленном активируемом антителе. Используемый в данном документе термин частичное восстановление относится к ситуациям, когда активируемое антитело против CD71 контактирует с восстановителем, и восстанавливаются меньше, чем все дисульфидные связи, например, меньше, чем все возможные сайты конъюгации. В некоторых вариантах осуществления менее чем 99%, 98%, 97%, 96%, 95%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55%, 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10% или менее 5% всех возможных участков конъюгации восстанавливается.
[0240] В еще других вариантах осуществления предложен способ восстановления и конъюгирования агента, например лекарственного средства, с активируемым антителом против CD71, что приводит к селективности при размещении агента. Способ обычно включает частичное восстановление активируемого анти-CD71-антитела восстанавливающим агентом, так что любые сайты конъюгации в маскирующем фрагменте или другой не-AB-части активируемого антитела не восстанавливаются, и конъюгирование агента с межцепочечными тиолами в AB. Сайт (ы) конъюгации выбирают так, чтобы обеспечить желаемое размещение агента, чтобы конъюгация происходила в желаемом сайте. Восстановителем является, например, TCEP. Условия реакции восстановления, такие как, например, отношение восстанавливающего агента к активируемому антителу, продолжительность инкубации, температура во время инкубации, pH восстановительного реакционного раствора и т. д., определяются путем определения условий, которые вызывают конъюгированное активируемое антитело, в котором ММ сохраняет способность эффективно и действенно маскировать AB активируемого антитела в неразрезанном состоянии. Отношение восстановителя к активируемому антителу против CD71 будет варьироваться в зависимости от активируемого антитела. В некоторых вариантах осуществления отношение восстановителя к активируемому анти-CD71-антителу будет находиться в диапазоне от около 20: 1 до 1: 1, от около 10: 1 до 1: 1, от около 9: 1 до 1: 1, от около 8: 1 до 1: 1, от около 7: 1 до 1: 1, от около 6: 1 до 1: 1, от около 5: 1 до 1: 1, от около 4: 1 до 1: 1, от около 3: 1 до 1: 1, от около 2: 1 до 1: 1, от около 20: 1 до 1: 1,5, от около 10: 1 до 1: 1,5, от около 9: 1 до 1: 1,5, от около 8: 1 до 1: 1,5, от около 7: 1 до 1: 1,5, от около 6: 1 до 1: 1,5, от около 5: 1 до 1: 1,5, от около 4: 1 до 1: 1,5, от около 3: 1 до 1: 1,5, от около 2: 1 до 1: 1,5, от около 1,5: 1 до 1: 1,5 или от около 1: 1 до 1: 1,5. В некоторых вариантах осуществления соотношение находится в диапазоне от около 5: 1 до 1: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 5: 1 до 1,5: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 4: 1 до 1: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 4: 1 до 1,5: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 8: 1 до около 1: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 2,5: 1 до 1: 1.
[0241] В некоторых вариантах осуществления данного изобретения способ уменьшения межцепочечных дисульфидных связей в АВ активируемого анти-CD71-антитела и конъюгирования агента, например, тиолсодержащего агента, такого как лекарственное средство, с получающимися в результате межцепочечными тиолами для селективного определения местоположения агента (ов) на AB предоставляется. Способ обычно включает частичное восстановление АВ восстановителем с образованием по меньшей мере двух межцепочечных тиолов без образования всех возможных межцепочечных тиолов в активируемом антителе; и конъюгирование агента с межцепочечными тиолами частично восстановленного AB. Например, AB активируемого антитела частично восстанавливается в течение около 1 часа при температуре около 37°C при желаемом соотношении восстановитель: активируемое антитело. В некоторых вариантах осуществления отношение восстановителя к активируемому антителу будет в диапазоне от около 20: 1 до 1: 1, от около 10: 1 до 1: 1, от около 9: 1 до 1: 1, от около 8: 1 до 1: 1, от около 7: 1 до 1: 1, от около 6: 1 до 1: 1, от около 5: 1 до 1: 1, от около 4: 1 до 1: 1, от около 3: 1 до 1: 1, от около 2: 1 до 1: 1, от около 20: 1 до 1: 1,5, от около 10: 1 до 1: 1,5, от около 9: 1 до 1: 1,5, от около 8: 1 до 1: 1,5, от около 7: 1 до 1: 1,5, от около 6: 1 до 1: 1,5, от около 5: 1 до 1: 1,5, от около 4: 1 до 1: 1,5, от около 3: 1 до 1: 1,5, от около 2: 1 до 1: 1,5, от около 1,5: 1 до 1: 1,5 или от около 1: 1 до 1: 1,5. В некоторых вариантах осуществления соотношение находится в диапазоне от около 5: 1 до 1: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 5: 1 до 1,5: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 4: 1 до 1: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 4: 1 до 1,5: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 8: 1 до около 1: 1. В некоторых вариантах осуществления соотношение находится в диапазоне от около 2,5: 1 до 1: 1.
[0242] Тиолсодержащим реагентом может быть, например, цистеин или N-ацетилцистеин. Восстановителем может быть, например, TCEP. В некоторых вариантах осуществления восстановленное активируемое антитело может быть очищено до конъюгации с использованием, например, колоночной хроматографии, диализа или диафильтрации. Альтернативно, восстановленное антитело не очищается после частичного восстановления и до конъюгации.
[0243] Данное изобретение также предлагает частично восстановленные активируемые анти-CD71-антитела, в которых по меньшей мере одна дисульфидная связь между цепями в активируемом антителе была восстановлена восстанавливающим агентом без нарушения каких-либо внутрицепочечных дисульфидных связей в активируемом антителе, при этом активируемое антитело содержит антитело или его антигенсвязывающий фрагмент (АВ), который специфично связывается с CD71, маскирующий фрагмент (ММ), который ингибирует связывание АВ активируемого антитела в неразрезанном состоянии с мишенью CD71, и разрезаемый фрагмент (СМ), связанный с АВ, в которой CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы. В некоторых вариантах осуществления MM соединяется с AB через CM. В некоторых вариантах осуществления одна или несколько внутрицепочечных дисульфидных связей активируемого антитела не нарушаются восстановителем. В некоторых вариантах осуществления одна или несколько внутрицепочечных дисульфидных связей ММ в активируемом антителе не нарушаются восстановителем. В некоторых вариантах осуществления активируемое антитело в неразрезанном состоянии имеет структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM. В некоторых вариантах осуществления восстановитель представляет собой TCEP.
[0244] В еще других вариантах осуществления способ восстановления и конъюгирования агента, например лекарственного средства, с активируемым антителом против CD71, приводящий к селективности в расположении агента, путем предоставления активируемого антитела против CD71 с определенным числом и положениями остатки лизина и/или цистеина. В некоторых вариантах осуществления определенное количество остатков лизина и/или цистеина выше или ниже числа соответствующих остатков в аминокислотной последовательности исходного антитела или активируемого антитела. В некоторых вариантах осуществления определенное количество остатков лизина и/или цистеина может привести к определенному количеству эквивалентов агентов, которые могут быть конъюгированы с антителом против CD71 или активируемым антителом против CD71. В некоторых вариантах осуществления определенное количество остатков лизина и/или цистеина может приводить к определенному количеству эквивалентов агентов, которые могут быть конъюгированы с антителом против CD71 или активируемым антителом против CD71 сайт-специфическим образом. В некоторых вариантах осуществления модифицированное активируемое антитело модифицируют одной или несколькими неприродными аминокислотами сайт-специфическим образом, таким образом, в некоторых вариантах осуществления ограничивают конъюгацию агентов только сайтами неприродных аминокислот. В некоторых вариантах осуществления анти-CD71-антитело или активируемое анти-CD71-антитело с определенным числом и положениями остатков лизина и/или цистеина могут быть частично восстановлены с помощью восстанавливающего агента, как обсуждено в данном документе, так что любые сайты конъюгации в маскирующем фрагменте или другой не-AB части активируемого антитела не восстанавливаются, и просходит конъюгация агента к межцепочечным тиолам в AB.
[0245] Данное раскрытие также обеспечивает частично восстановленные активируемые антитела, в которых по меньшей мере одна дисульфидная связь между цепями в активируемом антителе была восстановлена с помощью восстанавливающего агента без нарушения каких-либо внутрицепочечных дисульфидных связей в активируемом антителе, при этом активируемое антитело содержит антитело или антигенсвязывающий фрагмент его (AB), который специфично связывается с мишенью, например CD71, маскирующий фрагмент (MM), который ингибирует связывание AB активируемого антитела в неразрезанном состоянии с мишенью, и разрезаемый фрагмент (CM), связанный с AB, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата по меньшей мере для одной протеазы. В некоторых вариантах осуществления MM соединяется с AB через CM. В некоторых вариантах осуществления одна или несколько внутрицепочечных дисульфидных связей активируемого антитела не нарушаются восстановителем. В некоторых вариантах осуществления одна или несколько внутрицепочечных дисульфидных связей ММ в активируемом антителе не нарушаются восстановителем. В некоторых вариантах осуществления активируемое антитело в неразрезанном состоянии имеет структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM. В некоторых вариантах осуществления восстановитель представляет собой TCEP.
[0246] В некоторых вариантах осуществления активируемые антитела, описанные в данном документе, также включают агент, конъюгированный с активируемым антителом. В некоторых вариантах осуществления конъюгированный агент представляет собой терапевтический агент, такой как противовоспалительный и/или противоопухолевый агент. В таких вариантах осуществления агент конъюгирован с углеводным фрагментом активируемого антитела, например, в некоторых вариантах осуществления, в которых углеводный фрагмент расположен вне антигенсвязывающей области антитела или антигенсвязывающего фрагмента в активируемом антителе. В некоторых вариантах осуществления агент конъюгирован с сульфгидрильной группой антитела или антигенсвязывающим фрагментом в активируемом антителе.
[0247] В некоторых вариантах осуществления агент представляет собой цитотоксический агент, такой как токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или их фрагменты), или радиоактивный изотоп (т.е. радиоактивный конъюгат).
[0248] В некоторых вариантах осуществления агент представляет собой детектируемый фрагмент, такой как, например, метка или другой маркер. В некоторых вариантах осуществления детектируемый фрагмент представляет собой диагностический агент. Например, агент представляет собой или включает меченную радиоактивным изотопом аминокислоту, одну или несколько биотинильных групп, которые могут быть обнаружены с помощью меченого авидина (например, стрептавидин, содержащий флуоресцентный маркер или ферментативную активность, которая может быть обнаружена оптическими или калориметрическими способами), один или несколько радиоизотопов или радионуклидов, одну или несколько флуоресцентных меток, одну или несколько ферментных меток и/или один или несколько хемилюминесцентных агентов. В некоторых вариантах осуществления детектируемые фрагменты присоединяются спейсерными молекулами.
[0249] Данное раскрытие также относится к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим агентом, таким как токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты), или радиоактивный изотоп (т.е. радиоконъюгатом). Подходящие цитотоксические агенты включают, например, доластатины и их производные (например, ауристатин E, AFP, MMAF, MMAE, MMAD, DMAF, DMAE). Например, агент представляет собой монометилауристатин E (MMAE) или монометилауристатин D (MMAD). В некоторых вариантах агент представляет собой доластатин. В некоторых вариантах осуществления агент представляет собой ауристатин или его производное. В некоторых вариантах осуществления агент представляет собой ауристатин Е или его производное. В некоторых вариантах осуществления агент представляет собой монометилауристатин E (MMAE). В некоторых вариантах осуществления агент представляет собой монометилауристатин D (MMAD). В некоторых вариантах осуществления агент представляет собой мейтансиноид (maytansinoid) или производное мейтансиноида.
[0250] В некоторых вариантах осуществления линкер и токсин, конъюгированный с АВ, включают фрагмент SPDB-DM4, фрагмент vc-MMAD, фрагмент vc-MMAE, vc-дуокармицин или фрагмент PEG2-vc-MMAD. В некоторых вариантах осуществления линкер представляет собой разрезаемый линкер. В некоторых вариантах осуществления линкер представляет собой неразрезаемый линкер. В некоторых вариантах осуществления агент представляет собой детектируемый фрагмент.
[0251] В некоторых вариантах осуществления средство связывают с АВ с использованием малеимидного капроил-валин-цитруллинового линкера или малеимидного ПЭГ-валин-цитруллинового линкера. В некоторых вариантах осуществления, агент связывается с АВ с использованием малеимид капроил-валин-цитруллинового линкера. В некоторых вариантах осуществления агент представляет собой монометилауристатин E (MMAE), связанный с AB, используя малеимидный капроил-валин-цитруллиновый линкер, и эта полезная нагрузка конструкции линкера упоминается в данном документе как «vc-MMAE». В некоторых вариантах осуществления агент связан с АВ с использованием малеимидного ПЭГ-валин-цитруллинового линкера. В некоторых вариантах осуществления агент представляет собой монометилауристатин D (MMAD), связанный с АВ с использованием малеимидного тетра-ПЭГ-валин-цитруллин-пара-аминобензилоксикарбонильного линкера, и эта полезная нагрузка конструкции линкера упоминается в данном документе как «PEG4-vc-MMAD». » В некоторых вариантах осуществления агент представляет собой монометилауристатин E (MMAE), связанный с AB, используя малеимидный тетра-PEG-валин-цитруллин-пара-аминобензилоксикарбонильный линкер, и эта полезная нагрузка конструкции линкера упоминается в данном документе как «PEG4-vc-MMAE». » В некоторых вариантах осуществления, агент связывается с AB с помощью малеимида ПЭГ-валин-цитруллинового линкера. В некоторых вариантах осуществления агент представляет собой монометилауристатин D (MMAD) связан с АВ с использованием бис-малеимид ПЭГ-валин-цитрулин- пара -аминобензилоксикарбонильного линкера, и эта полезная нагрузка конструкции линкера упоминается в данном документе как «PEG2-vc-MMAD». Структуры PEG4-vc-MMAD, PEG4-vc-MMAE, PEG2-vc-MMAD и vc-MMAE продемонстрированы ниже:
[0252] Данное раскрытие также обеспечивает конъюгированные активируемые антитела, которые содержат активируемое антитело, связанное с vcMMAE, который представляет собой полезную нагрузку монометилауристатина E (MMAE) с линкером val-cit (vc), при этом активируемое антитело содержит антитело (AB), которое специфично связывается с мишенью, маскирующий фрагмент (MM), связанный с AB, который ингибирует связывание AB с мишенью, когда конъюгированное активируемое антитело в неразрезанном состоянии, и разрезаемый фрагмент (CM), связанный с AB, и CM представляет собой полипептид который функционирует как субстрат для протеазы. В некоторых вариантах осуществления конъюгированные активируемые антитела по данному изобретению имеют структуру Формулы (I) или ее соли:
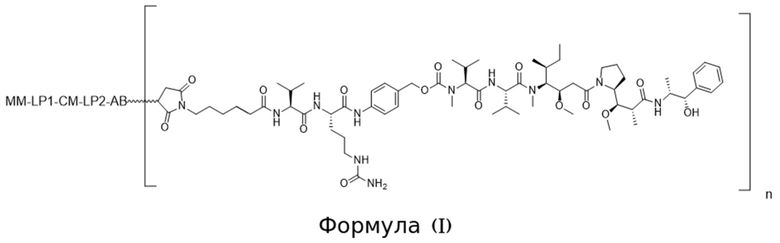
При этом AB представляет собой антитело, которое специфично связывается с мишенью и содержит вариабельную область тяжелой цепи, тяжелую цепь и/или одну или несколько областей CDR (CDRH) тяжелой цепи. AB также содержит вариабельную область легкой цепи, легкую цепь и/или одну или несколько областей CDR легкой цепи (CDRL). Конъюгированное активируемое антитело Формулы (I) также содержит маскирующий фрагмент (ММ), при этом ММ ингибирует связывание АВ с его мишенью, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, первый линкерный фрагмент (LP1), разрезаемый фрагмент (CM), в месторасположении CM, и второй линкерный фрагмент (LP2). В конкретном варианте осуществления Формулы (I) «n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0253] В некоторых вариантах осуществления конъюгированные активируемые антитела по данному изобретению имеют структуру Формулы (II) или ее соли:
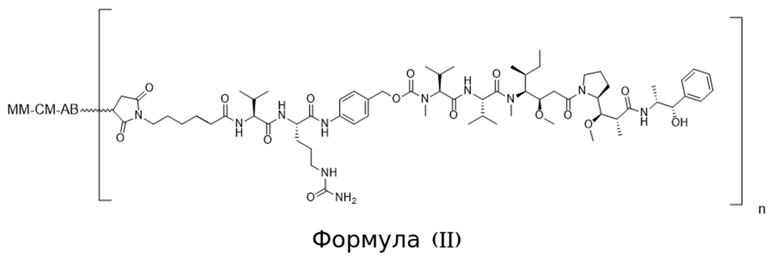
При этом AB представляет собой антитело, которое специфично связывается с мишенью и содержит вариабельную область тяжелой цепи, тяжелую цепь и/или одну или несколько областей CDR (CDRH) тяжелой цепи. AB также содержит вариабельную область легкой цепи, легкую цепь и/или одну или несколько областей CDR легкой цепи (CDRL). Конъюгированное активируемое антитело Формулы (I) также содержит маскирующий фрагмент (MM), при этом указанный MM ингибирует связывание АВ с его мишенью, когда конъюгированное активируемое антитело находится в неразрезанном состоянии, и разрезаемый фрагмент (CM), в месторасположении CM. В конкретном варианте осуществления Формулы (II)«n» равно 2. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ содержащее изотип IgG1. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит АВ, которое представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином. В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (II), содержит N-концевой глутамат на тяжелой цепи и/или легкой цепи и он необязательно является либо пироглутаматом, либо посттрансляционно модифицированным в пироглутамат.
[0254] В некоторых вариантах осуществления конъюгированных активируемых антител данного раскрытия Формул (I) или (II) мишенью является CD71 млекопитающих. В некоторых вариантах осуществления конъюгированных активируемых антител данного раскрытия Формул (I) или (II) мишенью является CD71 человека.
[0255] В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формул (I) или (II) AB содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащая SEQ ID NO: 11, и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15, MM, содержащий аминокислотную последовательность SEQ ID NO: 18, и CM, содержащий последовательность SEQ ID NO: 156, и «n» равен 2. В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формулы (I) AB содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11 и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15, MM, содержащий аминокислотную последовательность SEQ ID NO: 18, LP1, содержащий аминокислотную последовательность SEQ ID NO: 207, CM, содержащий последовательность SEQ ID NO: 156, и LP2, содержащий аминокислотную последовательность SEQ ID NO: 38, а «n» равно 2.
[0256] В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формул (I) или (II) AB содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7, MM, содержащий аминокислотную последовательность SEQ ID NO: 18, и CM, содержащий последовательность SEQ ID NO: 156, и «n» равен 2. В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формулы (I) AB содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7, a MM, содержит аминокислотную последовательность SEQ ID NO: 18, LP1, содержит аминокислотную последовательность SEQ ID NO: 207, CM, содержит последовательность SEQ ID NO: 156, и LP2, содержит аминокислотную последовательность SEQ ID NO: 38, а «n» равно 2.
[0257] В некоторых вариантах осуществления конъюгированных активируемых антител данного раскрытия Формул (I) или (II) AB содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 19, и MM, содержащий аминокислотную последовательность SEQ ID NO: 18, и CM, содержащий последовательность SEQ ID NO: 156, и «n» равен 2. В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формулы (I) AB содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 19, MM, содержащий амино кислотную последовательность SEQ ID NO: 18, LP1, содержащий аминокислотную последовательность SEQ ID NO: 207, CM, содержащий последовательность SEQ ID NO: 156, и LP2, содержащий аминокислотную последовательность SEQ ID NO: 38, и «n» равно 2.
[0258] В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формул (I) или (II) AB содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169, и «n» равно 2. В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формулы (I) AB содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169, и «n» равно 2. В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формул (I) или (II) AB содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 201, и «n» равно 2.
[0259] В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формул (I) или (II) AB содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7. В некоторых вариантах осуществления конъюгированных активируемых антител по данному изобретению Формул (I) или (II) AB содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7.
[0260] Данное раскрытие также предоставляет конъюгированные активируемые антитела, которые содержат активируемое антитело, связанное с полезной нагрузкой монометилауристатина D (MMAD), при этом активируемое антитело содержит антитело или его антигенсвязывающий фрагмент (AB), который специфично связывается с мишенью, маскирующий фрагмент (MM), который ингибирует связывание АВ активируемого антитела в неразрезанном состоянии с мишенью, и разрезаемый фрагмент (СМ), связанный с АВ, и СМ представляет собой полипептид, который функционирует в качестве субстрата по меньшей мере для одной ММР-протеазы.
[0261] В некоторых вариантах осуществления MMAD-конъюгированное активируемое антитело может быть конъюгировано с использованием любого из нескольких способов присоединения агентов к AB: (а) присоединение к углеводным фрагментам АВ или (b) присоединение к сульфгидрильным группам АВ, или (c) присоединение к аминогруппам AB или (d) присоединение к карбоксилатным группам AB.
В некоторых вариантах осуществления полезная нагрузка MMAD конъюгирована с AB через линкер. В некоторых вариантах осуществления полезная нагрузка MMAD конъюгирована с цистеином в AB через линкер. В некоторых вариантах осуществления полезная нагрузка MMAD конъюгирована с лизином в AB через линкер. В некоторых вариантах осуществления полезная нагрузка MMAD конъюгирована с другим остатком АВ через линкер, такой как те остатки, которые раскрыты в данном документе. В некоторых вариантах осуществления линкер представляет собой тиолсодержащий линкер. В некоторых вариантах осуществления линкер представляет собой разрезаемый линкер. В некоторых вариантах осуществления линкер представляет собой неразрезаемый линкер. В некоторых вариантах осуществления линкер выбран из группы, состоящей из линкеров, продемонстрированных в Таблицах (II) и (III). В некоторых вариантах осуществления активируемое антитело и полезная нагрузка MMAD связаны через малеимидный капроил-валин-цитруллиновый линкер. В некоторых вариантах осуществления активируемое антитело и полезная нагрузка MMAD связаны через малеимидный ПЭГ-валин-цитруллиновый линкер. В некоторых вариантах осуществления активируемое антитело и полезная нагрузка MMAD связаны через малеимидный капроил-валин-цитруллин-пара-аминобензилоксикарбонильный линкер. В некоторых вариантах осуществления активируемое антитело и полезная нагрузка MMAD связаны через малеимидный ПЭГ-валин-цитруллин-пара-аминобензилоксикарбонильный линкер. В некоторых вариантах осуществления полезная нагрузка MMAD конъюгирована с AB с использованием технологии частичного восстановления и конъюгирования, раскрытой в данном документе.
[0262] В некоторых вариантах осуществления компонент линкера - полиэтиленгликоль (ПЭГ) по данному изобретению образован из 2 мономеров этиленгликоля, 3 мономеров этиленгликоля, 4 мономеров этиленгликоля, 5 мономеров этиленгликоля, 6 мономеров этиленгликоля, 7 мономеров этиленгликоля 8 мономеров этиленгликоля, 9 мономеров этиленгликоля или по меньшей мере 10 мономеров этиленгликоля. В некоторых вариантах осуществления данного раскрытия компонент PEG представляет собой разветвленный полимер. В некоторых вариантах осуществления данного раскрытия компонент PEG представляет собой неразветвленный полимер. В некоторых вариантах осуществления полимерный компонент PEG функционализирован аминогруппой или ее производным, карбоксильной группой или ее производным или обеими аминогруппой или ее производным и карбоксильной группой или ее производным.
[0263] В некоторых вариантах осуществления PEG-компонент линкера по данному изобретению представляет собой амино-тетраэтиленгликолькарбоксильную группу или ее производное. В некоторых вариантах осуществления компонент PEG линкера по данному изобретению представляет собой амино-триэтиленгликолькарбоксильную группу или ее производное. В некоторых вариантах осуществления компонент PEG линкера по данному изобретению представляет собой амино-диэтиленгликолькарбоксильную группу или ее производное. В некоторых вариантах осуществления аминопроизводное представляет собой образование амидной связи между аминогруппой и карбоксильной группой, с которой оно конъюгировано. В некоторых вариантах осуществления карбоксильное производное представляет собой образование амидной связи между карбоксильной группой и аминогруппой, с которой оно конъюгировано. В некоторых вариантах осуществления карбоксильное производное представляет собой образование сложноэфирной связи между карбоксильной группой и гидроксильной группой, с которой оно конъюгировано.
[0264] Ферментативно активные токсины и их фрагменты, которые можно использовать, включают дифтерийную А-цепь, несвязывающие активные фрагменты дифтерийного токсина, экзотоксиновую А-цепь (из Pseudomonas aeruginosa), рицин А-цепь, абрин А-цепь, модецин А-цепь, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Разнообразные радионуклиды доступны для производства радиоконъюгированных антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re.
[0265] Конъюгаты антитела и цитотоксического агента получают с использованием различных бифункциональных белковых связующих агентов, таких как N-сукцинимидил-3- (2-пиридилдитиол) пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметил адипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис (п-азидобензоил) гександиамин), производные бис-диазония (такие как бис- (п-диазонийбензоил) - этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рицин-иммунотоксин может быть получен, как описано в Vitetta et al., Science 238: 1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типичный хелатирующий агент для конъюгации радионуклеотида с антителом. (См. WO94/11026).
[0266] Специалистам в данной области техники должно быть понятно, что большое количество возможных фрагментов может быть связано с полученными в результате антителами по данному изобретению. (См., например, "Conjugate Vaccines", Contributions to Microbiology and Immunology, J. M. Cruse and R. E. Lewis, Jr (eds), Carger Press, New York, (1989), полное содержание которой включено в данный документ посредством ссылки).
[0267] Связывание может быть осуществлено любой химической реакцией, которая будет связывать две молекулы, пока антитело и другая часть сохраняют свои соответствующие активности. Эта связь может включать в себя множество химических механизмов, например ковалентное связывание, аффинное связывание, интеркаляцию, координационное связывание и комплексообразование. В некоторых вариантах осуществления связывание представляет собой, тем не менее, ковалентное связывание. Ковалентное связывание может быть достигнуто либо путем прямой конденсации существующих боковых цепей, либо путем включения внешних мостиковых молекул. Многие двухвалентные или поливалентные связывающие агенты пригодны для связывания белковых молекул, таких как антитела по данному изобретению, с другими молекулами. Например, типичные связующие агенты могут включать органические соединения, такие как тиоэфиры, карбодиимиды, сложные эфиры сукцинимидов, диизоцианаты, глутаральдегид, диазобензолы и гексаметилендиамины. Данный список не предназначен для того, чтобы быть исчерпывающим для различных классов связующих агентов, известных в данной области, но скорее является примером более распространенных связующих агентов. (See Killen and Lindstrom, Jour. Immun. 133:1335-2549 (1984); Jansen et al., Immunological Reviews 62:185-216 (1982); and Vitetta et al., Science 238:1098 (1987).
[0268] В некоторых вариантах осуществления в дополнение к композициям и способам, представленным в данном документе, конъюгированное активируемое антитело также может быть модифицировано для сайт-специфического конъюгирования через модифицированные аминокислотные последовательности, вставленные или иным образом включенные в последовательность активируемого антитела. Данные модифицированные аминокислотные последовательности предназначены для обеспечения контролируемого размещения и/или дозировки конъюгированного агента в конъюгированном активируемом антителе. Например, активируемое антитело может быть сконструировано так, чтобы включать замены цистеина в положениях на легких и тяжелых цепях, которые обеспечивают реакционноспособные тиоловые группы и не оказывают отрицательного влияния на сворачивание и сборку белка, а также не влияют на связывание антигена. В некоторых вариантах осуществления активируемое антитело может быть сконструировано так, чтобы включать или иным образом вводить один или несколько неприродных аминокислотных остатков в активируемом антителе для обеспечения подходящих сайтов для конъюгации. В некоторых вариантах осуществления активируемое антитело может быть сконструировано так, чтобы включать или иным образом вводить энзиматически активируемые пептидные последовательности в активируемую последовательность антитела.
[0269] Подходящие линкеры описаны в литературе. (См., Ramakrishnan, S. et al., Cancer Res. 44:201-208 (1984) describing use of MBS (M-maleimidobenzoyl-N-hydroxysuccinimide ester). См. также патент США № 5030719, в котором описано использование галогенированного производного ацетилгидразида, связанного с антителом посредством олигопептидного линкера. В некоторых вариантах осуществления подходящие линкеры включают: (i) гидрохлорид EDC (1-этил-3- (3-диметиламино-пропил) карбодиимид), (ii) SMPT (4-сукцинимидилоксикарбонил-альфа-метил-альфа- (2-придил-дитио)) -толуол (Pierce Chem. Co., № по каталогу (21558G); (iii) SPDP (сукцинимидил-6 [3- (2-пиридилдитио) пропионамидо] гексаноат (Pierce Chem. Co., № по каталогу 21651G); (iv) сульфо-LC-SPDP (сульфосукцинимидил 6 [3- (2-пиридилдитио)) -пропианамид] гексаноат (Pierce Chem. Co. № по каталогу # 2165-G); и (v) сульфо-NHS (N-гидроксисульфосукцинимид: Pierce Chem. Co., № по каталогу 24510), конъюгированный с EDC. Дополнительные линкеры включают, но не ограничиваются ими, SMCC ((сукцинимидил 4- (N-малеимидометил) циклогексан-1-карбоксилат), сульфо-SMCC (сульфосукцинимидил 4- (N-малеимидометил) циклогексан-1-карбоксилат), SPDB (N -сукцинимидил-4- (2-пиридилдитио) бутаноат) или сульфо-SPDB (N-сукцинимидил-4- (2-пиридилдитио) -2-сульфобутаноат).
[0270] Описанные выше линкеры содержат компоненты, которые имеют различные атрибуты, что приводит к образованию конъюгатов с различными физико-химическими свойствами. Например, сульфо-NHS-эфиры алкилкарбоксилатов более стабильны, чем сульфо-NHS-эфиры ароматических карбоксилатов. Линкеры, содержащие сложные эфиры NHS, менее растворимы, чем сложные эфиры сульфо-NHS. Кроме того, линкер SMPT содержит стерически затрудненную дисульфидную связь и может образовывать конъюгаты с повышенной стабильностью. Дисульфидные связи, как правило, менее стабильны, чем другие связи, потому что дисульфидная связь разрезается in vitro, что приводит к уменьшению количества доступного конъюгата. В частности, сульфо-NHS может повысить стабильность карбодимидных соединений. Карбодимидные связи (такие как EDC) при использовании в сочетании с сульфо-NHS образуют сложные эфиры, которые более устойчивы к гидролизу, чем одна реакция карбодимидного связывания.
[0271] В некоторых вариантах осуществления линкеры являются разрезаемыми. В некоторых вариантах осуществления линкеры не разрезаются. В некоторых вариантах осуществления два или более линкера присутствуют. Два или более линкера являются одинаковыми, т.е. разрезаемыми или неразрезаемыми, или два или более линкера являются разными, т.е., по меньшей мере, один разрезаемый и, по меньшей мере, один неразрезаемый.
[0272] В данном раскрытии используются несколько способов присоединения агентов к АВ: (а) присоединение к углеводным фрагментам АВ или (b) присоединение к сульфгидрильным группам АВ, или (c) присоединение к аминогруппам АВ, или (d) присоединение к карбоксилатным группам АВ. Согласно раскрытию, AB могут быть ковалентно присоединены к агенту через промежуточный линкер, имеющий по меньшей мере две реакционноспособные группы: одну для взаимодействия с AB и одну для реакции с агентом. Линкер, который может включать любое совместимое органическое соединение, может быть выбран таким образом, чтобы реакция с AB (или агентом) не оказывала неблагоприятного влияния на реакционную способность и селективность AB. Кроме того, присоединение линкера к агенту может не разрушать активность агента. Подходящие линкеры для реакции с окисленными антителами или фрагментами окисленных антител включают те, которые содержат амин, выбранный из группы, состоящей из первичного амина, вторичного амина, гидразина, гидразида, гидроксиламина, фенилгидразина, семикарбазидной и тиосемикарбазидной групп. Такие реакционноспособные функциональные группы могут существовать как часть структуры линкера или могут быть введены путем подходящей химической модификации линкеров, не содержащих таких групп.
[0273] Согласно данному раскрытию подходящие линкеры для присоединения к восстановленным AB включают те, которые имеют определенные реакционноспособные группы, способные к реакции с сульфгидрильной группой восстановленного антитела или фрагмента. Такие реакционноспособные группы включают, но не ограничиваются ими: реакционноспособные галогеналкильные группы (включая, например, галоацетильные группы), п-меркурибензоатные группы и группы, способные к реакциям присоединения типа Михаэля (включая, например, малеимиды и группы типа описанного Mitra and Lawton, 1979, J. Amer. Chem. Soc. 101: 3097-3110).
[0274] Согласно данному раскрытию подходящие линкеры для присоединения ни к окисленным, ни к восстановленным Ab включают в себя те, которые имеют определенные функциональные группы, способные к реакции с первичными аминогруппами, присутствующими в немодифицированных остатках лизина в Ab. Такие реакционноспособные группы включают, но не ограничиваются ими, сложные эфиры карбоновых или угольных кислот NHS, сложные эфиры карбоновых или угольных кислот сульфо-NHS, сложные эфиры 4-нитрофенилкарбоновых или угольных кислот, сложные эфиры пентафторфенилкарбоновых или угольных кислот, ацилимидазолы, изоцианаты и изотиоцианаты.
[0275] Согласно данному раскрытию подходящие линкеры для присоединения ни к окисленному, ни к восстановленному Ab включают те, которые имеют определенные функциональные группы, способные вступать в реакцию с группами карбоновой кислоты, присутствующими в остатках аспартата или глутамата в Ab, которые были активированы подходящими реагентами. Подходящие активирующие реагенты включают EDC с добавлением или без добавления NHS или сульфо-NHS и другие дегидратирующие агенты, используемые для образования карбоксамида. В данных случаях функциональные группы, присутствующие в подходящих линкерах, включают первичные и вторичные амины, гидразины, гидроксиламины и гидразиды.
[0276] Агент может быть присоединен к компоновщику до или после присоединения компоновщика к AB. В определенных применениях может быть желательно сначала получить промежуточное соединение AB-линкера, в котором линкер не содержит ассоциированного агента. В зависимости от конкретного применения конкретный агент затем может быть ковалентно присоединен к линкеру. В некоторых вариантах осуществления AB сначала присоединяется к MM, CM и связанным линкерам, а затем присоединяется к линкеру в целях конъюгации.
[0277] Разветвленные линкеры. В конкретных вариантах осуществления используются разветвленные линкеры, которые имеют несколько сайтов для присоединения агентов. Для множественных линкеров сайтов одно ковалентное присоединение к AB приведет к промежуточному звену AB-линкера, способному связывать агент в ряде сайтов. Сайты могут быть альдегидными или сульфгидрильными группами или любым химическим сайтом, к которому могут быть присоединены агенты.
[0278] В некоторых вариантах осуществления более высокая удельная активность (или более высокое отношение агентов к AB) может быть достигнуто путем присоединения одного линкерного сайта к множеству сайтов на AB. Это множество сайтов может быть введено в AB любым из двух способов. Во-первых, можно создать несколько альдегидных групп и/или сульфгидрильных групп в одном и том же АВ. Во-вторых, к альдегиду или сульфгидрилу АВ можно присоединить «разветвленный линкер», имеющий несколько функциональных сайтов для последующего присоединения к линкерам. Функциональные сайты разветвленного линкера или линкера с множественными сайтами могут быть альдегидными или сульфгидрильными группами или могут быть любым химическим сайтом, к которому могут быть присоединены линкеры. Еще более высокие специфические активности могут быть получены путем объединения данных двух подходов, т.е. присоединения множество линкеров сайтов к нескольким сайтам в AB.
[0279] Разрезаемые линкеры: пептидные линкеры, которые чувствительны к разрезанию ферментами системы комплемента, такие как, но не ограничиваясь ими, активатор u-плазминогена, активатор тканевого плазминогена, трипсин, плазмин или другой фермент, обладающий протеолитической активностью, можно использовать в одном варианте осуществления данного раскрытия. Согласно одному способу данного изобретения агент присоединяется через линкер, чувствительный к разрезанию комплементом. Антитело выбрано из класса, который может активировать комплемент. Таким образом, конъюгат антитело-агент активирует каскад комплемента и высвобождает агент в целевом сайте. Согласно другому способу данного изобретения агент присоединяют через линкер, чувствительный к разрезанию ферментами, обладающими протеолитической активностью, такими как активатор u-плазминогена, активатор тканевого плазминогена, плазмин или трипсин.
[0280] Неограничивающие примеры разрезаемых линкерных последовательностей представлены в Таблице (II).
[0281] Кроме того, агенты могут быть присоединены через дисульфидные связи (например, дисульфидные связи на молекуле цистеина) к АВ. Поскольку многие опухоли естественным образом высвобождают высокие уровни глутатиона (восстановителя), это может привести к восстановлению дисульфидных связей с последующим высвобождением агента в месторасположении доставки. В некоторых вариантах осуществления восстановитель, который модифицирует CM, также модифицирует линкер конъюгированного активируемого антитела.
[0282] Спейсеры и разрезаемые элементы. В некоторых вариантах осуществления может быть необходимо сконструировать линкер таким образом, чтобы оптимизировать расстояние между агентом и АВ активируемого антитела. Это может быть достигнуто путем применения линкера общей структуры:
W-(CH2)n-Q
где
W представляет собой -NH-CH2 - или -CH2 -;
Q - аминокислота, пептид; и
n является целым числом от 0 до 20.
[0283] В некоторых вариантах осуществления линкер может содержать спейсерный элемент и разрезаемый элемент. Спейсерный элемент служит для размещения разрезаемого элемента вдали от ядра АВ, так что разрезаемый элемент более доступен для фермента, ответственного за разрезание. Некоторые из разветвленных линкеров, описанных выше, могут служить спейсерными элементами.
[0284] На протяжении всего данного обсуждения следует понимать, что присоединение линкера к агенту (или спейсерного элемента к разрезаемому элементу или разрезаемого элемента к агенту) не обязательно должно быть определенным способом присоединения или реакции. Любая реакция, обеспечивающая продукт подходящей стабильности и биологической совместимости, является приемлемой.
[0285] Сывороточный комплемент и отбор линкеров. Согласно одному способу данного изобретения, когда желательно высвобождение агента, используют AB, которое является антителом класса, который может активировать комплемент. Полученный конъюгат сохраняет способность связывать антиген и активировать каскад комплемента. Таким образом, согласно данному варианту осуществления данного раскрытия агент присоединяется к одному концу разрезаемого линкера или разрезаемого элемента, а другой конец группы линкера присоединяется к конкретному сайту на AB. Например, если агент имеет гидроксигруппу или аминогруппу, он может быть присоединен к карбоксиконцу пептида, аминокислоты или другого подходяще выбранного линкера через сложноэфирную или амидную связь соответственно. Например, такие агенты могут быть присоединены к линкерному пептиду посредством карбодимидной реакции. Если агент содержит функциональные группы, которые будут мешать прикреплению к компоновщику, эти мешающие функциональные группы могут быть заблокированы перед присоединением и разблокированы после создания сопряженного или промежуточного продукта. Противоположный или аминоконец линкера затем используют либо непосредственно, либо после дальнейшей модификации для связывания с АВ, который способен активировать комплемент.
[0286] Линкеры (или спейсерные элементы линкеров) могут иметь любую желаемую длину, один конец которой может быть ковалентно присоединен к конкретным сайтам на АВ активируемого антитела. Другой конец линкерного или спейсерного элемента может быть присоединен к аминокислотному или пептидному линкеру.
[0287] Таким образом, когда эти конъюгаты связываются с антигеном в присутствии комплемента, амидная или сложноэфирная связь, которая присоединяет агент к линкеру, будет расщеплена, что приведет к высвобождению агента в его активной форме. Данные конъюгаты при введении субъекту обеспечивают доставку и высвобождение агента в целевом сайте и являются особенно эффективными для доставки in vivo фармацевтических агентов, антибиотиков, антиметаболитов, антипролиферативных агентов и тому подобного.
[0288] Линкеры для высвобождения без активации комплемента. В еще одном применении целевой доставки высвобождение агента без активации комплемента является желательным, поскольку активация каскада комплемента в конечном счете лизирует клетку-мишень. Следовательно, данный подход полезен, когда доставка и высвобождение агента должны осуществляться без уничтожения клетки-мишени. Такой является задача, когда желательна доставка клеточных медиаторов, таких как гормоны, ферменты, кортикостероиды, нейротрансмиттеры, гены или ферменты, к клеткам-мишеням. Данные конъюгаты могут быть получены путем присоединения агента к АВ, который не способен активировать комплемент через линкер, который легко подвержен разрезанию сывороточными протеазами. Когда данный конъюгат вводят индивидууму, комплексы антиген-антитело будут образовываться быстро, тогда как разрезание агента будет происходить медленно, что приводит к высвобождению соединения в целевом сайте.
[0289] Биохимические сшиватели. В некоторых вариантах осуществления активируемое антитело может быть конъюгировано с одним или несколькими терапевтическими агентами с использованием определенных биохимических сшивателей. Сшивающие реагенты образуют молекулярные мостики, которые связывают функциональные группы двух разных молекул. Для поэтапного связывания двух разных белков можно использовать гетеробифункциональные сшиватели, которые устраняют нежелательное образование гомополимера.
[0290] Пептидильные линкеры, разрезаемые лизосомальными протеазами, также являются пригодными, например, Val-Cit, Val-Ala или другие дипептиды. Кроме того, могут быть использованы кислотолабильные линкеры, разрезаемые в среде лизосомы с низким pH, например, бис-сиалиловый эфир. Другие подходящие линкеры включают катепсин-лабильные субстраты, особенно те, которые демонстрируют оптимальную функцию при кислотном pH.
[0291] Иллюстративные гетеробифункциональные сшиватели приведены в Таблице (III).
[0292] Неразрезаемые линкеры или прямое присоединение. В некоторых вариантах осуществления данного изобретения конъюгат может быть сконструирован так, что агент доставляется к мишени, но не высвобождается. Это может быть достигнуто путем присоединения агента к AB либо напрямую, либо через неразрезаемый линкер.
[0293] Данные неразрезаемые линкеры могут содержать аминокислоты, пептиды, D-аминокислоты или другие органические соединения, которые могут быть модифицированы для включения функциональных групп, которые впоследствии могут быть использованы для присоединения к AB с помощью способов, описанных в данном документе. Общая формула для такого органического линкера может быть
W - (CH2)n - Q
где
W представляет собой -NH-CH2 - или -CH2-;
Q - аминокислота, пептид; и
n является целым числом от 0 до 20.
[0294] Неразрезаемые конъюгаты. В некоторых вариантах осуществления соединение может быть присоединено к AB, которые не активируют комплемент. При использовании AB, которые неспособны к активации комплемента, это присоединение может быть осуществлено с использованием линкеров, которые подвержены разрезанию активированным комплементом, или с использованием линкеров, которые не подвержены разрезанию активированным комплементом.
Определения
[0295] Если не указано иное, научные и технические термины, используемые в связи с данным раскрытием, должны иметь значения, которые обычно понимаются специалистами в данной области техники. Термин или «объект» относится к одному или нескольким объектам. Например, соединение относится к одному или нескольким соединениям. Как таковые, термины единственного числа, «один или несколько» и «по меньшей мере один» могут использоваться взаимозаменяемо. Кроме того, если иное не требуется в контексте, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число. Как правило, номенклатуры, используемые в связи с способами и технологиями клеточной и тканевой культуры, молекулярной биологии и химии и гибридизации белков и олиго- или полинуклеотидов, описанных в данном документе, являются хорошо известными и широко используемыми в данной области. Стандартные способы используются для рекомбинантной ДНК, синтеза олигонуклеотидов, а также для культуры и трансформации тканей (например, электропорация, липофекция). Ферментативные реакции и способы очистки выполняются в соответствии со спецификациями производителя, или как это обычно делается в данной области техники или как описано в данном документе. Вышеприведенные способы и процедуры обычно выполняются в соответствии с обычными способами, хорошо известными в данной области техники, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в данном описании. Смотри, например, Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Номенклатуры, используемые в связи с описанными в данном документе лабораторными процедурами и способами аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, хорошо известны и широко используются в данной области. Стандартные способы используются для химического синтеза, химического анализа, фармацевтической подготовки, составления и доставки и лечения пациентов.
[0296] Используемые в соответствии с данным раскрытием, следующие термины, если не указано иное, должны иметь следующие значения:
[0297] Используемый в данном документе термин «антитело» относится к молекулам иммуноглобулина и иммунологически активным частям молекул иммуноглобулина (Ig), т.е. молекулам, которые содержат сайт связывания антигена, который специфически связывает (иммунореагирует с) антиген. Под «специфичным связыванием» или «иммунореактивностью с» или «иммуноспецифичным связыванием» подразумевается, что антитело реагирует с одной или несколькими антигенными детерминантами желаемого антигена и не реагирует с другими полипептидами или связывается с ними с гораздо более низким сродством (Kd>10-6)
[0298] Известно, что структурная единица основного антитела содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну «легкую» (около 25 кДа) и одну «тяжелую» цепь (около 50-70 кДа). Аминоконцевая часть каждой цепи содержит вариабельную область от около 100 до 110 или более аминокислот, в первую очередь ответственную за распознавание антигена. Карбоксиконцевая часть каждой цепи определяет константную область, в первую очередь ответственную за эффекторную функцию. В общем, молекулы антител, полученные от людей, относятся к любому из классов IgG, IgM, IgA, IgE и IgD, которые отличаются друг от друга природой тяжелой цепи, присутствующей в молекуле. Некоторые классы также имеют подклассы, такие как IgG1, IgG2 и другие. Кроме того, у человека легкая цепь может представлять собой каппа-цепь или лямбда-цепь.
[0299] Используемый в данном документе термин «моноклональное антитело» (mAb) или «композиция моноклонального антитела» относится к популяции молекул антитела, которые содержат только один молекулярный вид молекулы антитела, состоящий из уникального продукта гена легкой цепи и уникального продукта гена тяжелой цепи. продукт. В частности, определяющие комплементарность области (CDR) моноклонального антитела идентичны во всех молекулах популяции. MAb содержат антигенсвязывающий сайт, способный иммунореагировать с конкретным эпитопом антигена, характеризующимся уникальной аффинностью связывания с ним.
[0300] Термин «антигенсвязывающий сайт» или «связывающая часть» относится к части молекулы иммуноглобулина, которая участвует в связывании антигена. Антигенсвязывающий сайт образован аминокислотными остатками N-концевых вариабельных («V») областей тяжелой («Н») и легкой («L») цепей. Три сильно расходящихся участка в V-областях тяжелой и легкой цепей, называемых «гипервариабельными областями», расположены между более консервативными фланкирующими участками, известными как «каркасные области» или «FR». Таким образом, термин «FR» относится к аминокислотным последовательностям, которые естественным образом находятся между гипервариабельными областями в иммуноглобулинах и рядом с ними. В молекуле антитела три гипервариабельных участка легкой цепи и три гипервариабельных участка тяжелой цепи расположены относительно друг друга в трехмерном пространстве, чтобы сформировать антигенсвязывающую поверхность. Антигенсвязывающая поверхность дополняет трехмерную поверхность связанного антигена, и три гипервариабельные области каждой из тяжелых и легких цепей называются «определяющими комплементарность областями» или «CDR». Присвоение аминокислот каждому домену соответствует определениям Kabat Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 and 1991)), or Chothia & Lesk J. Mol. Biol. 196:901-917 (1987), Chothia et al. Nature 342:878-883 (1989).
[0301] Используемый в данном документе термин «эпитоп» включает любую детерминанту белка, способную специфически связываться с иммуноглобулином, scFv или T-клеточным рецептором. Термин «эпитоп» включает любую белковую детерминанту, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как боковые цепи аминокислот или сахара, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Например, антитела могут быть получены против N-концевых или С-концевых пептидов полипептида. Считается, что антитело специфично связывается с антигеном, когда константа диссоциации составляет ≤1 мкМ; в некоторых вариантах осуществления ≤100 нМ, а в некоторых вариантах ≤10 нМ.
[0302] Используемые в данном документе термины «специфическое связывание», «иммунологическое связывание» и «свойства иммунологического связывания» относятся к нековалентным взаимодействиям того типа, которые происходят между молекулой иммуноглобулина и антигеном, для которого иммуноглобулин является специфическим. Сила или аффинность иммунологических связывающих взаимодействий может быть выражена через константу диссоциации (Kd) взаимодействия, где меньший Kd представляет большую аффинность. Иммунологические свойства связывания выбранных полипептидов могут быть определены количественно с использованием способов, хорошо известных в данной области. Один такой способ включает измерение скоростей образования и диссоциации антигенсвязывающего сайта/антигенного комплекса, причем эти скорости зависят от концентраций партнеров комплекса, аффинности взаимодействия и геометрических параметров, которые в равной степени влияют на скорость в обоих направлениях. Таким образом, как «константа скорость on» (Kon), так и «константа скорость off» (Koff) могут быть определены путем расчета концентраций и фактических скоростей ассоциации и диссоциации. (См. Nature 361: 186-87 (1993)). Отношение K off/Kon позволяет аннулировать все параметры, не связанные с аффинностью, и равно константе диссоциации Kd. (См., вцелом, Davies et al. (1990) Annual Rev Biochem 59: 439-473). Антитело данного раскрытия называется специфически связывающимся с мишенью, когда константа связывания (Kd) равна ≤1 μ M, в некоторых вариантах осуществления равна ≤100 нМ, в некоторых вариантах осуществления равна ≤10 нМ, а в некоторых вариантах осуществления равна ≤100-100 пМ, в измерениях с помощью таких анализов, как анализы связывания радиолиганда или аналогичных анализов, известных специалистам в данной области.
[0303] Используемый в данном документе термин «выделенный полинуклеотид» означает полинуклеотид геномного, кДНК или синтетического происхождения или некоторую их комбинацию, который в силу своего происхождения представляет собой «выделенный полинуклеотид» (1) не связанный со всем или частью полинуклеотида, в котором указанній «выделенный полинуклеотид» находится в природе, (2) функционально связан с полинуклеотидом, с которым он не связан в природе, или (3) не встречается в природе как часть большей последовательности. Полинуклеотиды в соответствии с данным изобретением содержат молекулы нуклеиновой кислоты, кодирующие молекулы иммуноглобулина тяжелой цепи, продемонстрированные в данном документе, и молекулы нуклеиновой кислоты, кодирующие молекулы иммуноглобулина легкой цепи, продемонстрированные в данном документе.
[0304] Термин «выделенный белок», упомянутый в данном документе, означает белок происходящий из кДНК, рекомбинантной РНК или синтетического происхождения или некоторую их комбинацию, который в силу своего происхождения или источника происхождения представляет собой «изолированный белок» (1) не связанный с белками, встречающимися в природе, (2) не содержит других белков из того же источника, например, не содержит мышиных белков, (3) экспрессируется клеткой другого вида или (4) не встречается в природе.
[0305] Термин «полипептид» используется в данном документе в качестве общего термина для обозначения нативного белка, фрагментов или аналогов полипептидной последовательности. Следовательно, нативные белковые фрагменты и аналоги являются видами рода полипептида. Полипептиды в соответствии с данным изобретением содержат молекулы иммуноглобулина тяжелой цепи, продемонстрированные в данном документе, и молекулы иммуноглобулина легкой цепи, продемонстрированные в данном документе, а также молекулы антитела, образованные комбинациями, содержащими молекулы иммуноглобулина тяжелой цепи с молекулами иммуноглобулина легкой цепи, такими как иммуноглобулин каппа легкой цепи молекулы, и наоборот, а также их фрагменты и аналоги.
[0306] Используемый в данном документе термин «встречающийся в природе» применительно к объекту относится к тому факту, что объект можно найти в природе. Например, полипептидная или полинуклеотидная последовательность, которая присутствует в организме (включая вирусы), которая может быть выделена из источника в природе и которая не была преднамеренно изменена человеком в лаборатории или иным образом встречается в природе.
[0307] Используемый в данном документе термин «функционально связанный» относится к положениям компонентов, которые, как описано, находятся в отношениях, позволяющих им функционировать по назначению. Контрольная последовательность, «функционально связанная» с кодирующей последовательностью, лигируется таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с контрольными последовательностями.
[0308] Используемый в данном документе термин «контрольная последовательность» относится к полинуклеотидным последовательностям, которые необходимы для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Природа таких контрольных последовательностей различается в зависимости от организма-хозяина у прокариот, такие контрольные последовательности обычно включают промотор, сайт связывания рибосом и последовательность терминации транскрипции у эукариот, как правило, такие контрольные последовательности включают промоторы и последовательность терминации транскрипции. Предполагается, что термин «контрольные последовательности» включает, как минимум, все компоненты, присутствие которых является существенным для экспрессии и обработки, и может также включать дополнительные компоненты, присутствие которых является преимущественным, например, лидерные последовательности и последовательности партнеров слияния. Термин «полинуклеотид» в контексте данного описания означает нуклеотиды длиной по меньшей мере 10 оснований, либо рибонуклеотиды, либо дезоксинуклеотиды, либо модифицированные формы нуклеотидов любого типа. Термин включает одноцепочечные и двухцепочечные формы ДНК.
[0309] Термин «олигонуклеотид», на который в данном документе ссылаются, включает встречающиеся в природе и модифицированные нуклеотиды, связанные вместе встречающимися в природе и не встречающимися в природе олигонуклеотидными связями. Олигонуклеотиды представляют собой полинуклеотидное подмножество, обычно содержащее длину 200 оснований или менее. В некоторых вариантах осуществления длина олигонуклеотидов составляет от 10 до 60 оснований, а в некоторых вариантах осуществления длина от 12, 13, 14, 15, 16, 17, 18, 19 или от 20 до 40 оснований. Олигонуклеотиды обычно являются одноцепочечными, например, для зондов, хотя олигонуклеотиды могут быть двухцепочечными, например, для применения в конструировании мутанта гена. Олигонуклеотиды по данному изобретению представляют собой смысловые или антисмысловые олигонуклеотиды.
[0310] Термин «встречающиеся в природе нуклеотиды», на который в данном документе ссылаются, включает дезоксирибонуклеотиды и рибонуклеотиды. Термин «модифицированные нуклеотиды», упоминаемый в данном документе, включает нуклеотиды с модифицированными или замещенными сахарными группами и тому подобное. Термин «олигонуклеотидные связи», на который в данном документе ссылаются, включает олигонуклеотидные связи, такие как фосфоротиоат, фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосхораниладат, фосфороамидат и тому подобное. См., например, LaPlanche et al. Nucl. Acids Res. 14:9081 (1986); Stec et al. J. Am. Chem. Soc. 106:6077 (1984), Stein et al. Nucl. Acids Res. 16:3209 (1988), Zon et al. Anti Cancer Drug Design 6:539 (1991); Zon et al. Oligonucleotides and Analogues: A Practical Approach, pp. 87-108 (F. Eckstein, Ed., Oxford University Press, Oxford England (1991)); Stec et al. патент США № 5151510; Uhlmann and Peyman Chemical Reviews 90:543 (1990). При желании олигонуклеотид может содержать метку для детекции.
[0311] Как в данном документе используется, двадцать обычных аминокислот и их аббревиатуры соответствуют традиционному применению. См. Immunology - A Synthesis (2nd Edition, E.S. Golub and D.R. Green, Eds., Sinauer Associates, Sunderland, Mass. (1991)). Стереоизомеры (например, D-аминокислоты) из двадцати обычных аминокислот, неприродные аминокислоты, такие как α-, α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие нетрадиционные аминокислоты, также могут быть подходящими компонентами для полипептидов по данному раскрытию. Примеры нетрадиционных аминокислот включают: 4-гидроксипролин, γ-карбоксиглутамат, ε-N, N, N-триметиллизин, ε -N-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, σN -N- σметиларгинин и другие подобные аминокислоты и иминокислоты (например, 4-гидроксипролин). В используемом в данном документе обозначении полипептида левое направление является аминоконцевым направлением, а правое направление является карбоксиконцевым направлением в соответствии со стандартным использованием и соглашением.
[0312] Аналогично, если не указано иное, левый конец одноцепочечных полинуклеотидных последовательностей является 5 'концом, и левый конец двухцепочечных полинуклеотидных последовательностей называется 5' направлением. Направление 5'-3' добавления возникающих РНК-транскриптов называется областями последовательности направления транскрипции на цепи ДНК, имеющими ту же последовательность, что и РНК, и которые находятся на 5' к 5' концу РНК-транскрипта называются «верхними последовательностями», области последовательности на цепи ДНК, имеющие ту же последовательность, что и РНК, и которые находятся 3' к 3' концу РНК-транскрипта, называются «последовательностями вниз по течению».
[0313] Применительно к полипептидам термин «существенная идентичность» означает, что две пептидные последовательности при оптимальном выравнивании, например, с помощью программ GAP или BESTFIT, использующих значимость промежутков по умолчанию, имеют общую, по меньшей мере, 80-процентную идентичность последовательности, в некоторых вариантах осуществления, по меньшей мере, 90 процентов идентичности последовательности, в некоторых вариантах осуществления, по меньшей мере, 95% идентичности последовательности, а в некоторых вариантах осуществления, по меньшей мере, 99% идентичности последовательности.
[0314] В некоторых вариантах осуществления положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами.
[0315] Как обсуждалось в данном документе, небольшие вариации в аминокислотных последовательностях антител или молекул иммуноглобулина рассматриваются как охватываемые данным раскрытием, при условии, что вариации в аминокислотной последовательности сохраняют, по меньшей мере, 75%, в некоторых вариантах осуществления, по меньшей мере, 80%, 90%, 95%, а в некоторых вариантах осуществления 99%. В частности, предусматриваются консервативные замены аминокислот. Консервативными заменами являются те, которые происходят в семействе аминокислот, которые родственны в их боковых цепях. Генетически кодируемые аминокислоты обычно делятся на семейства: (1) кислые аминокислоты представляют собой аспартат, глутамат; (2) основные аминокислоты представляют собой лизин, аргинин, гистидин; (3) неполярные аминокислоты представляют собой аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан, и (4) незаряженные полярные аминокислоты представляют собой глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Гидрофильные аминокислоты включают аргинин, аспарагин, аспартат, глутамин, глутамат, гистидин, лизин, серин и треонин. Гидрофобные аминокислоты включают аланин, цистеин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан, тирозин и валин. Другие семейства аминокислот включают (i) серин и треонин, которые являются алифатически-гидрокси-семейством; (ii) аспарагин и глутамин, которые являются амидсодержащим семейством; (iii) аланин, валин, лейцин и изолейцин, которые являются алифатическим семейством; и (iv) фенилаланин, триптофан и тирозин, которые являются ароматическим семейством. Например, разумно ожидать, что изолированная замена лейцина на изолейцин или валин, аспартат на глутамат, треонин на серин или аналогичная замена аминокислоты структурно родственной аминокислотой не будет иметь сильного влияния на связывание или свойства получаемой молекулы, особенно если замена не включает аминокислоту в каркасном сайте. То, приводит ли замена аминокислоты к функциональному пептиду, может быть легко определено путем анализа специфической активности производного полипептида. Анализы подробно описаны в данном документе. Фрагменты или аналоги антител или молекул иммуноглобулина могут быть легко получены специалистами в данной области. Подходящие амино- и карбоксиконцы фрагментов или аналогов встречаются вблизи границ функциональных доменов. Структурные и функциональные домены могут быть идентифицированы путем сравнения данных нуклеотидных и/или аминокислотных последовательностей с общедоступными или частными базами данных последовательностей. В некоторых вариантах осуществления компьютеризированные способы сравнения используются для идентификации мотивов последовательности или предсказанных доменов конформации белка, которые встречаются в других белках с известной структурой и/или функцией. Способы идентификации белковых последовательностей, которые складываются в известную трехмерную структуру, известны. Bowie et al. Science 253:164 (1991). Таким образом, вышеприведенные примеры демонстрируют, что специалисты в данной области техники могут распознавать мотивы последовательности и структурные конформации, которые можно использовать для определения структурных и функциональных доменов в соответствии с данным раскрытием.
[0316] Подходящими аминокислотными заменами являются такие, которые: (1) уменьшают восприимчивость к протеолизу, (2) уменьшают восприимчивость к окислению, (3) изменяют аффинность связывания для образования белковых комплексов, (4) изменяют аффинность связывания и (5) обеспечивают или модифицируют другие физико-химические или функциональные свойства таких аналогов. Аналоги могут включать различные мутации последовательности, отличной от встречающейся в природе пептидной последовательности. Например, одиночные или множественные аминокислотные замены (например, консервативные аминокислотные замены) могут быть сделаны в встречающейся в природе последовательности (например, в части полипептида вне домена (доменов), образующего межмолекулярные контакты. Консервативная аминокислотная замена не должна существенно изменять структурные характеристики родительской последовательности (например, замещающая аминокислота не должна стремиться разрушить спираль, которая встречается в родительской последовательности, или нарушить другие типы вторичной структуры, которая характеризует родительскую последовательность). Примеры известных в данной области полипептидных вторичных и третичных структур описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N.Y. (1991)); and Thornton et at. Nature 354: 105 (1991).
[0317] Используемый в данном документе термин «полипептидный фрагмент» относится к полипептиду, который имеет аминоконцевую и/или карбоксиконцевую делецию и/или одну или несколько внутренних делеций, но в котором оставшаяся аминокислотная последовательность идентична соответствующим позициям в встречающейся в природе последовательности, выведенной, например, из полной последовательности кДНК. Фрагменты обычно имеют длину, по меньшей мере, 5, 6, 8 или 10 аминокислот, в некоторых вариантах осуществления, длину, по меньшей мере, 14 аминокислот, в некоторых вариантах осуществления, длину, по меньшей мере, 20 аминокислот, обычно длину, по меньшей мере, 50 аминокислот, а в некоторых вариантах осуществления длину не менее 70 аминокислот. Используемый в данном документе термин «аналог» относится к полипептидам, которые состоят из сегмента, по меньшей мере, из 25 аминокислот, который имеет существенную идентичность части выведенной аминокислотной последовательности и который имеет специфическое связывание с мишенью в подходящих условиях связывания. Обычно полипептидные аналоги содержат консервативную аминокислотную замену (или добавление или делецию) по отношению к встречающейся в природе последовательности. Аналоги обычно имеют длину, по меньшей мере, 20 аминокислот, в некоторых вариантах осуществления, длиной, по меньшей мере, 50 аминокислот или более, и часто они могут быть такими же длинными, как и полноразмерный природный полипептид.
[0318] Термин «агент» используется в данном документе для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, изготовленного из биологических материалов.
[0319] Используемый в данном документе термин «метка» или «помеченный» относится к включению детектируемого маркера, например, путем включения радиоактивно меченной аминокислоты или присоединения к полипептиду биотинильных фрагментов, которые могут быть обнаружены с помощью маркированного авидина (например, стрептавидина, содержащего флуоресцентный маркер или ферментативную активность, которая может быть обнаружена оптическими или калориметрическими способами). В определенных ситуациях метка или маркер также могут быть терапевтическими. Различные способы мечения полипептидов и гликопротеинов известны в данной области и могут быть использованы. Примеры меток для полипептидов включают, но не ограничиваются ими, следующие: радиоизотопы или радионуклиды (например, 3H, 14C, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, FITC, родамин, лантаноидные люминофоры), ферментативные метки (например, пероксидаза хрена, п-галактозидаза, люцифераза, щелочная фосфатаза), хемилюминесцентные, биотинильные группы, заранее определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейцинового зиппера, сайты связывания для вторичных антител, домены, связывающие металлы, эпитопные тэги). В некоторых вариантах осуществления метки прикрепляются к распорным плечам различной длины, чтобы уменьшить потенциальное стерическое препятствие. Используемый в данном документе термин «фармацевтический агент или лекарственное средство» относится к химическому соединению или композиции, способным вызывать желаемый терапевтический эффект при правильном введении пациенту.
[0320] Другие химические термины в данном описании используются в соответствии с общепринятым применением в данной области техники, примером чего является The McGraw-Hill Dictionary of Chemical Terms (Parker, S., Ed., McGraw-Hill, San Francisco (1985)).
[0321] Используемый в данном документе термин «по существу чистый» означает, что необходимый вид является преобладающим присутствующим видом (т.е., в молярном отношении он является более распространенным, чем любой другой отдельный вид в композиции), и в некоторых вариантах осуществления по существу очищенная фракция представляет собой композицию, в которой необходимый вид содержит, по меньшей мере, около 50 процентов (в молярном отношении) всех присутствующих макромолекулярных видов.
[0322] Как правило, по существу чистая композиция будет содержать более чем около 80 процентов всех макромолекулярных частиц, присутствующих в композиции, в некоторых вариантах осуществления более чем около 85%, 90%, 95% и 99%. В некоторых вариантах осуществления необходимый вид очищают до существенной гомогенности (виды-загрязнители не могут быть обнаружены в композиции обычными способами детекции), при этом композиция состоит по существу из одного макромолекулярного вида.
[0323] Термин «пациент» включает людей и ветеринарных субъектов.
[0324] Антитела и/или активируемые антитела по данному изобретению специфически связывают данную мишень, например белок-мишень человека, такой как CD71 человека. Также в данное описание включены антитела и/или активируемые антитела, которые связываются с тем же эпитопом, что и антитела и/или активируемые антитела, описанные в данном документе. Также в данное описание включены антитела и/или активируемые антитела, которые конкурируют с антителом против CD71 и/или активируемым антителом против CD71, описанным в данном документе, за связывание с CD71, например, с человеческим CD71. Также в данное описание включены антитела и/или активируемые антитела, которые перекрестно конкурируют с антителом против CD71 и/или активируемым антителом против CD71, описанным в данном документе, за связывание с CD71, например, с человеческим CD71.
[0325] Специалистам в данной области техники будет понятно, что без чрезмерных экспериментов можно определить, обладает ли моноклональное антитело (например, мышиное моноклональное или гуманизированное антитело) той же специфичностью, что и моноклональное антитело, используемое в способах, описанных в данном документе, путем выяснения, предотвращает ли первое связывание последнего с мишенью. Если тестируемое моноклональное антитело конкурирует с моноклональным антителом по данному изобретению, как продемонстрировано уменьшением связывания моноклонального антитела по данному изобретению, тогда два моноклональных антитела связываются с одним или близким эпитопом. Альтернативный способ определения того, обладает ли моноклональное антитело специфичностью моноклонального антитела по данному изобретению, заключается в предварительной инкубации моноклонального антитела по данному изобретению с мишенью и затем добавлении тестируемого моноклонального антитела, чтобы определить, ингибируется ли тестируемое моноклональное антитело в отношении его способности связать мишень. Если тестируемое моноклональное антитело ингибируется, то, по всей вероятности, оно обладает такой же или функционально эквивалентной эпитопной специфичностью, что и моноклональное антитело по данному изобретению.
Применение конъюгированных активируемых антител
[0326] Понятно, что введение терапевтических модальностей в соответствии с данным изобретением будет осуществляться с подходящими фармацевтически приемлемыми носителями, наполнителями и другими агентами, которые включены в составы для обеспечения улучшенного переноса, доставки, переносимости и тому подобного.
[0327] Терапевтические составы по данному изобретению, которые содержат в качестве неограничивающего примера конъюгированное активируемое антитело, используются для предотвращения, лечения или иного облегчения заболевания или расстройства, связанных с аберрантной экспрессией и/или активностью мишени. Например, терапевтические препараты по данному изобретению, которые включают конъюгированное активируемое антитело, используются для лечения или иного облегчения рака или другого неопластического состояния, воспаления, воспалительного расстройства и/или аутоиммунного заболевания. В некоторых вариантах осуществления рак представляет собой солидную опухоль или гематологическое злокачественное образование, при котором мишень экспрессируется. В некоторых вариантах осуществления рак представляет собой солидную опухоль, в которой мишень экспрессируется. В некоторых вариантах осуществления рак представляет собой гематологическое злокачественное образование, при котором мишень экспрессируется. В некоторых вариантах осуществления мишень экспрессируется на паренхиме (например, при раке, части органа или ткани, которая часто выполняет функцию (функции) органа или ткани). В некоторых вариантах осуществления мишень экспрессируется на клетке, ткани или органе. В некоторых вариантах осуществления мишень экспрессируется на строме (т.е. на соединительной поддерживающей структуре клетки, ткани или органа). В некоторых вариантах осуществления мишень экспрессируется на остеобласте. В некоторых вариантах осуществления мишень экспрессируется на эндотелии (сосудистой сети). В некоторых вариантах осуществления мишень экспрессируется на раковой стволовой клетке. В некоторых вариантах осуществления агент, с которым конъюгировано антитело и/или активируемое антитело, представляет собой ингибитор микротрубочек. В некоторых вариантах осуществления агент, с которым конъюгировано антитело и/или активируемое антитело, представляет собой агент, повреждающий нуклеиновую кислоту.
[0328] Эффективность профилактики, улучшения или лечения определяется в сочетании с любым известным способом диагностики или лечения заболевания или расстройства, связанных с экспрессией и/или активностью мишени, таких как, например, аберрантная экспрессия и/или активность мишени. Продление выживания субъекта или иная задержка прогрессирования заболевания или расстройства, связанного с экспрессией и/или активностью мишени, например, аберрантной экспрессией и/или активностью мишени, у субъекта указывает на то, что антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело дает клиническое преимущество.
[0329] Антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело можно вводить в форме фармацевтических композиций. В некоторых вариантах осуществления, в которых используются фрагменты антител, выбирается наименьший фрагмент, который специфично связывается с доменом связывания белка-мишени. Например, на основе последовательностей вариабельной области антитела могут быть сконструированы пептидные молекулы, которые сохраняют способность связывать последовательность белка-мишени. Такие пептиды могут быть синтезированы химически и/или получены с помощью технологии рекомбинантных ДНК. (См., Например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)).
[0330] Составы, используемые для введения in vivo, должны быть стерильными. Это легко достигается путем фильтрации через стерильные фильтрующие мембраны.
[0331] В некоторых вариантах осуществления антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело содержит детектируемую метку. Используют интактное антитело или его фрагмент (например, Fab, scFv или F (ab)2). Термин «меченный» в отношении зонда или антитела предназначен для охвата прямого мечения зонда или антитела путем сшивки (т.е. физического связывания) детектируемого вещества с зондом или антителом, а также непрямого мечения зонда или антитела с помощью реактивности с другим реагентом, который прямо помечен. Примеры косвенного мечения включают детекцию первичного антитела с использованием флуоресцентно-меченного вторичного антитела и концевое мечение ДНК-зонда с биотином, так что его можно обнаружить с помощью флуоресцентно-меченного стрептавидина. Предполагается, что термин «биологический образец» включает ткани, клетки и биологические жидкости, выделенные от субъекта, а также ткани, клетки и жидкости, присутствующие в субъекте. Поэтому в термин «биологический образец» входит кровь и ее фракция или компонент, включая сыворотку крови, плазму крови или лимфу. Таким образом, способ детекции по данному изобретению можно использовать для детекции мРНК, белка или геномной ДНК аналита в биологическом образце как in vitro, так и in vivo. Например, способы детекции мРНК аналита in vitro включают Нозерн гибридизацию и гибридизацию in situ. Способы детекции белка-аналита in vitro включают иммуноферментные анализы (ИФА), вестерн-блоты, иммунопреципитацию, иммунохимическое окрашивание и иммунофлюоресценцию. Способы детекции геномной ДНК анализируемого вещества in vitro включают гибридизацию по Саузерну. Процедуры проведения иммуноанализа описаны, например, в “ELISA: Theory and Practice: Methods in Molecular Biology”, Vol. 42, J. R. Crowther (Ed.) Human Press, Totowa, NJ, 1995; “Immunoassay”, E. Diamandis and T. Christopoulus, Academic Press, Inc., San Diego, CA, 1996; и “Practice and Theory of Enzyme Immunoassays”, P. Tijssen, Elsevier Science Publishers, Amsterdam, 1985. Кроме того, способы in vivo для детекции белка аналита включают введение субъекту меченого антитела против белка аналита. Например, антитело может быть помечено радиоактивным маркером, присутствие и местоположение которого у субъекта можно обнаружить стандартными способами визуализации.
[0332] Антитела, конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по данному изобретению также пригодны в различных диагностических и профилактических составах. В одном варианте осуществления конъюгированное активируемое антитело вводят пациентам, которые подвергаются риску развития одного или нескольких из вышеупомянутых расстройств. Предрасположенность пациента или органа к одному или нескольким из вышеупомянутых нарушений может быть определена с использованием генотипических, серологических или биохимических маркеров.
[0333] В некоторых вариантах осуществления данного изобретения конъюгированное активируемое антитело вводят людям, у которых диагностировано клинический симптом, связанное с одним или несколькими из вышеупомянутых нарушений. После постановки диагноза вводят конъюгированное активируемое антитело, чтобы смягчить или обратить эффект клинических показаний.
[0334] Антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело по данному изобретению также применимы для детекции мишени в образцах пациентов и, соответственно, пригодны для диагностики. Например, антитела и/или активируемые антитела и их конъюгированные варианты по данному изобретению используются в анализах in vitro, например, ИФА, для определения уровней мишени в образце пациента.
[0335] В одном варианте осуществления антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело по данному изобретению иммобилизовано на твердой подложке (например, в лунке (-ах) микротитровального планшета). Иммобилизованное антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело служит захватывающим антителом для любой мишени, которая может присутствовать в тестируемом образце. Перед контактом иммобилизованного антитела и/или активируемого антитела и/или его конъюгированных версий с образцом пациента твердую подложку промывают и обрабатывают блокирующим агентом, таким как молочный белок или альбумин, для предотвращения неспецифической адсорбции аналита.
[0336] Затем лунки обрабатывают тестируемым образцом, предположительно содержащим антиген, или раствором, содержащим стандартное количество антигена. Такой образец представляет собой, например, образец сыворотки от субъекта, у которого подозреваются уровни циркулирующего антигена, который считается диагностическим признаком патологии. После промывания исследуемого образца или стандарта твердую подложку обрабатывают вторым антителом, которое можно детектируемо пометить. Меченое второе антитело служит детектирующим антителом. Измеряется уровень детектируемой метки, а концентрация антигена-мишени в тестируемом образце определяется путем сравнения со стандартной кривой, полученной из стандартных образцов.
[0337] Понятно, что на основании результатов, полученных с использованием антител и активируемых антител по данному изобретению и их конъюгированных версий, в диагностическом анализе in vitro, можно стадировать заболевание у субъекта на основании уровней экспрессии антигена-мишени. Для данного заболевания отбирают образцы крови у субъектов, у которых диагностированы различные стадии развития заболевания и/или различные этапы терапевтического лечения заболевания. Используя совокупность образцов, которая дает статистически значимые результаты для каждой стадии прогрессирования или терапии, обозначают диапазон концентраций антигена, который можно считать характерным для каждой стадии.
[0338] Антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело также можно использовать в способах диагностики и/или визуализации. В некоторых вариантах осуществления такие способы представляют собой способы in vitro. В некоторых вариантах осуществления такие способы представляют собой способы in vivo. В некоторых вариантах осуществления такие способы представляют собой способы in situ. В некоторых вариантах осуществления такие способы представляют собой способы ex vivo. Например, активируемые антитела, имеющие ферментативно разрезаемый СМ, могут быть использованы для детекции присутствия или отсутствия фермента, способного расщеплять СМ. Такие активируемые антитела можно использовать в диагностике, которая может включать в себя определение in vivo (например, качественное или количественное) ферментативной активности (или, в некоторых вариантах осуществления, среды с повышенным потенциалом восстановления, такой как среда, которая может обеспечить восстановление дисульфидной связи) путем измерения накопления активированных антител (т.е. антител, возникающих в результате разрезания активируемого антитела) в данной клетке или ткани данного организма-хозяина. Такое накопление активированных антител указывает не только на то, что ткань экспрессирует ферментативную активность (или повышенный потенциал восстановления в зависимости от природы CM), но также на то, что ткань экспрессирует мишень, с которой связывается активированное антитело.
[0339] Например, CM может быть выбран в качестве субстрата для по меньшей мере одной протеазы, обнаруженной в месторасположении опухоли, в месторасположении вирусной или бактериальной инфекции в биологически ограниченном пространстве (например, в виде абсцесса в органе и тому подобного) и тому подобном. AB может быть тем, который связывает целевой антиген. Используя способы, раскрытые в данном документе, или, когда это уместно, способы, знакомые специалисту в данной области, детектируемая метка (например, флуоресцентная метка или радиоактивная метка или радиотрейсер) может быть конъюгирована с AB или другим участком антитела и/или активируемого антитела. Подходящие детектируемые метки обсуждаются в контексте вышеупомянутых способов скрининга, и дополнительные конкретные примеры представлены ниже. При использовании АВ, специфичного к белку или пептиду патологического состояния, наряду с по меньшей мере одной протеазой, активность которой повышена в интересующей ткани заболевания, активируемые антитела будут проявлять повышенную скорость связывания с тканью заболевания по сравнению с тканями, в которых специфичный для CM фермент не присутствует на детектируемом уровне или присутствует на более низком уровне, чем в ткани заболевания, или неактивен (например, в форме зимогена или в комплексе с ингибитором). Поскольку мелкие белки и пептиды быстро выводятся из крови почечной фильтрационной системой, а также потому, что фермент, специфичный для CM, не присутствует на детектируемом уровне (или присутствует на более низких уровнях в тканях, не подверженных заболеваниям, или присутствует в неактивной конформации), накопление активированных антител в пораженных тканях увеличивается по сравнению с непораженными тканями.
[0340] В другом Примере активируемые антитела можно использовать для детекции присутствия или отсутствия разрезающего агента в образце. Например, когда активируемые антитела содержат CM, чувствительный к разрезанию ферментом, активируемые антитела можно использовать для детекции (качественно или количественно) присутствия фермента в образце. В другом Примере, где активируемые антитела содержат CM, чувствительный к разрезанию восстанавливающим агентом, активируемые антитела могут использоваться для детекции (качественно или количественно) наличия восстановительных условий в образце. Для облегчения анализа в данных способах активируемые антитела могут быть детектируемо помечены и могут быть связаны с подложкой (например, твердой подложкой, такой как предметное стекло или гранула). Детектируемая метка может быть размещена на части активируемого антитела, которая не высвобождается после разрезания, например, детектируемая метка может представлять собой погашенную флуоресцентную метку или другую метку, которая не детектируется до тех пор, пока не произойдет разрезание. Анализ может проводиться, например, контактированием иммобилизованных, детектируемых меченных активируемых антител с образцом, предположительно содержащим фермент и/или восстановитель, в течение времени, достаточного для того, чтобы произошло разрезание, затем промывкой для удаления избытка образца и загрязняющих веществ. Присутствие или отсутствие разрезающего агента (например, фермента или восстановителя) в образце затем оценивают по изменению детектируемого сигнала активируемых антител перед контактом с образцом, например, по наличию и/или увеличению детектируемого сигнала из-за разрезания активируемого антитела разрезающим агентом в образце.
[0341] Такие способы детекции могут быть адаптированы так, чтобы также обеспечивать обнаружение присутствия или отсутствия мишени, которая способна связывать AB активируемых антител при расщеплении. Таким образом, анализы могут быть адаптированы для оценки наличия или отсутствия разрезающего агента и наличия или отсутствия интересующей мишени. Присутствие или отсутствие разрезающего агента может быть детектировано по присутствию и/или увеличению детектируемой метки активируемых антител, как описано выше, и присутствие или отсутствие мишени может быть детектировано путем детекции комплекса мишень-AB, например, путем применения детектируемо меченого антитела против мишени.
[0342] Активируемые антитела также пригодны при визуализации in situ для подтверждения активации активируемых антител, например, путем разрезания протеазой и связывания с конкретной мишенью. Визуализация in situ - это способ, позволяющий локализовать протеолитическую активность и мишень в биологических образцах, таких как клеточные культуры или срезы тканей. Используя данную методику, можно подтвердить как связывание с данной мишенью, так и протеолитическую активность на основании наличия детектируемой метки (например, флуоресцентной метки).
[0343] Данные способы пригодны для любых замороженных клеток или тканей, полученных из места заболевания (например, опухолевой ткани) или здоровых тканей. Данные способы также пригодны для образцов свежих клеток или тканей.
[0344] В данных методах активируемое антитело помечается детектируемой меткой. Детектируемая метка может представлять собой флуоресцентный краситель (например, флуорофор, изотиоцианат флуоресцеина (FITC), изотиоцианат родамина (TRITC), метку Alexa Fluor®), краситель в ближней инфракрасной области (NIR) (например, нанокристаллы Qdot®), коллоидный металл, гаптен, радиоактивный маркер, биотин и амплифицирующий реагент, такой как стрептавидин, или фермент (например, пероксидаза хрена или щелочная фосфатаза).
[0345] Обнаружение метки в образце, который был инкубирован с меченым, активируемым антителом, указывает на то, что образец содержит мишень и содержит протеазу, которая специфична для CM активируемого антитела. В некоторых вариантах осуществления присутствие протеазы может быть подтверждено с использованием ингибиторов протеазы широкого спектра действия, таких как описанные в данном документе, и/или с использованием агента, который специфичен для протеазы, например, антитела, такого как A11, которое специфично для протеазы матриптазы и ингибирует протеолитическую активность матриптазы; см., например, международную публикацию № WO 2010/129609, опубликованную 11 ноября 2010 г. Тот же подход с использованием ингибиторов протеазы широкого спектра, таких как описанные в данном документе, и/или с использованием более селективного ингибирующего агента, может быть использован для идентификации протеазы, которая специфична для CM активируемого антитела. В некоторых вариантах осуществления присутствие мишени может быть подтверждено с использованием агента, специфичного для мишени, например другого антитела, или детектируемая метка может конкурировать с немеченой мишенью. В некоторых вариантах осуществления можно использовать немеченое активируемое антитело с обнаружением меченым вторичным антителом или более сложной системой детекции.
[0346] Подобные способы также пригодны для визуализации in vivo, где обнаружение флуоресцентного сигнала у субъекта, например млекопитающих, включая человека, указывает на то, что сайт заболевания содержит мишень и содержит протеазу, специфичную для CM активируемого антитела,
[0347] Данные способы также пригодны в наборах и/или в качестве реагентов для детекции, идентификации или характеризации протеазной активности в различных клетках, тканях и организмах на основе протеазоспецифичных CM в активируемом антителе.
[0348] Данное раскрытие обеспечивает способы применения антител и/или активируемых антител при различных диагностических и/или профилактических показаниях. Например, в описании раскрыты способы детекции присутствия или отсутствия разрезающего агента и представляющей интерес мишени у субъекта или в образце путем (i) контакта субъекта или образца с активируемым антителом, при этом активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, например протеазой, и антигенсвязывающим доменом или его фрагментом (AB), который специфически связывает интересующую мишень, при этом активируемое антитело в неразрезанном, неактивированном состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB и не является модифицированной формой партнера по естественному связыванию AB; и (b) где в неразрезанном неактивированном состоянии ММ препятствует специфическому связыванию AB с мишенью, а в разрезанном активированном состоянии ММ не вмешивается или не конкурирует со специфичным связыванием AB с мишенью; и (ii) измерение уровня активируемого антитела у субъекта или в образце, в котором детектируемый уровень активируемого антитела у субъекта или в образце указывает на то, что разрезающий агент и мишень присутствуют у субъекта или в образце и в котором не детектируемый уровень активируемого антитела у субъекта или в образце указывает на то, что разрезающий агент, мишень или как разрезающий агент, так и мишень отсутствуют и/или недостаточно присутствуют у субъекта или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0349] Данное раскрытие также обеспечивает способы детекции присутствия или отсутствия разрезающего агента у субъекта или в образце путем (i) контакта субъекта или образца с активируемым антителом в присутствии представляющей интерес мишени, например в присутствии мишени и при этом активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), разрезаемый разрезающим агентом, например протеазой, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывает интересующую мишень, при этом активируемое антитело в неразрезанном неактивированном состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB и не является модифицированной формой партнера по естественному связыванию AB; и (b) при этом в неразрезанном неактивированном состоянии ММ препятствует специфическому связыванию AB с мишенью, а в разрезанном активированном состоянии ММ не вмешивается или не конкурирует со специфичным связыванием AB с мишенью; и (ii) измерение уровня активированного активируемого антитела у субъекта или в образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в образце указывает на то, что разрезающий агент присутствует у субъекта или в образце и при этом не детектируемый уровень активируемого активированного активируемого антитела у субъекта или в образце указывает на то, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0350] Данное раскрытие также предоставляет наборы для применения в способах детекции присутствия или отсутствия разрезающего агента и мишени у субъекта или в образце, при этом наборы содержат, по меньшей мере, активируемое антитело, содержащее маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, например протеазой, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывает интересующую мишень, при этом активируемое антитело в неразрезанном неактивированном состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB и не является модифицированной формой партнера по естественному связыванию AB; и (b) где в неразрезанном неактивированном состоянии ММ препятствует специфическому связыванию AB с мишенью, а в разрезанном активированном состоянии ММ не вмешивается или не конкурирует со специфичным связыванием AB с мишенью; и (ii) измерение уровня активированного активируемого антитела у субъекта или в образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в образце указывает на то, что разрезающий агент присутствует у субъекта или в образце и где не детектируемый уровень активированного активируемого антитела у субъекта или в образце указывает на то, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0351] Данное раскрытие также предоставляет способы детекции присутствия или отсутствия разрезающего агента у субъекта или в образце путем (i) контакта субъекта или образца с активируемым антителом, при этом активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, например протеазой, антигенсвязывающий домен (AB), который специфически связывает мишень, и детектируемую метку, при этом активируемое антитело в неразрезанном неактивированном состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB и не является модифицированной формой естественного партнера по связыванию AB; при этом в неразрезанном неактивированном состоянии ММ препятствует специфическому связыванию AB с мишенью, а в разрезанном активированном состоянии ММ не вмешивается или не конкурирует со специфичным связыванием AB с мишенью; и при этом детектируемая метка расположена на части активируемого антитела, которое высвобождается после разрезания CM; и (ii) измерение уровня детектируемой метки у субъекта или в образце, в котором детектируемый уровень детектируемой метки у субъекта или в образце указывает на то, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в образце и при этом отсутствие детектируемого уровня детектируемой метки у субъекта или в образце указывает на то, что разрезающий агент присутствует у субъекта или в образце. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0352] Данное раскрытие также предоставляет наборы для применения в способах детекции присутствия или отсутствия разрезающего агента и мишени у субъекта или в образце, при этом наборы содержат, по меньшей мере, активируемое антитело и/или конъюгированное активируемое антитело (например, активируемое антитело к которому конъюгировано терапевтическое средство) описанное в данном документе, для применения для контактирования с субъектом или биологическим образцом и средство для определения уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у субъекта или в биологическом образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образец указывает на то, что разрезающий агент и мишень присутствуют у субъекта или в биологическом образце, и при этом не детектируемый уровень актирвируемого активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент, мишень или и агент разрезания, и мишень отсутствуют и/или недостаточно присутствуют у субъекта или в биологическом образце, так что связывание мишени и/или разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце.
[0353] Данное раскрытие также предоставляет способы детекции присутствия или отсутствия разрезающего агента у субъекта или в образце путем (i) контакта субъекта или биологического образца с активируемым антителом в присутствии мишени и (ii) измерения уровня активированного активируемого антитела у субъекта или в биологическом образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент присутствует у субъекта или в биологическом образце и где не детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в биологическом образце на детектируемом уровне, так что разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце. Такое активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, например протеазой, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывает мишень, при этом активируемое антитело в неразрезанном (т.е. неактивированном) состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB; и (b) при этом ММ активируемого антитела в неразрезанном состоянии мешает специфическому связыванию АВ с мишенью, и при этом ММ активируемого антитела в разрезанном (т.е. активированном) состоянии не мешает и не конкурирует со специфичным связыванием AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления детектируемая метка прикреплена к маскирующему фрагменту. В некоторых вариантах осуществления детектируемая метка прикрепляется к N-концу разрезаемого фрагмента к сайту разрезания протеазой. В некоторых вариантах осуществления один антигенсвязывающий сайт АВ маскируется. В некоторых вариантах осуществления, в которых антитело по данному изобретению имеет по меньшей мере два антигенсвязывающих сайта, по меньшей мере один антигенсвязывающий сайт маскируется и по меньшей мере один антигенсвязывающий сайт не маскируется. В некоторых вариантах осуществления все сайты связывания антигена маскируются. В некоторых вариантах осуществления этап измерения включает использование вторичного реагента, содержащего детектируемую метку.
[0354] Данное раскрытие также предоставляет наборы для применения в способах детекции присутствия или отсутствия разрезающего агента и мишени у субъекта или в образце, при этом наборы содержат, по меньшей мере, активируемое антитело и/или конъюгированное активируемое антитело, описанные в данном документе, для применения в контакте субъекта или биологического образца с активируемым антителом в присутствии мишени и измерение уровня активированного активируемого антитела у субъекта или в биологическом образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент присутствует у субъекта или в биологическом образце, и в котором не детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в биологическом образце на детектируемом уровне, так что разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце. Такое активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, например протеазой, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывает мишень, при этом активируемое антитело в неразрезанном (т.е. неактивированном) состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB; и (b) при этом ММ активируемого антитела в неразрезанном состоянии мешает специфическому связыванию АВ с мишенью, и при этом ММ активируемого антитела в разрезанном (т.е. активированном) состоянии не мешает и не конкурирует со специфичным связыванием AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления детектируемая метка прикреплена к маскирующему фрагменту. В некоторых вариантах осуществления детектируемая метка прикрепляется к N-концу разрезаемого фрагмента к сайту разрезания протеазой. В некоторых вариантах осуществления один антигенсвязывающий сайт АВ маскируется. В некоторых вариантах осуществления, в которых антитело по данному изобретению имеет по меньшей мере два антигенсвязывающих сайта, по меньшей мере один антигенсвязывающий сайт маскируется и по меньшей мере один антигенсвязывающий сайт не маскируется. В некоторых вариантах осуществления все сайты связывания антигена маскируются. В некоторых вариантах осуществления этап измерения включает использование вторичного реагента, содержащего детектируемую метку.
[0355] Данное раскрытие также предоставляет наборы для применения в способах детекции присутствия или отсутствия разрезающего агента у субъекта или в образце, при этом наборы содержат, по меньшей мере, активируемое антитело и/или конъюгированное активируемое антитело, описанные в данном документе, для применения при контакте с субъектом или биологическим образцом и средство для определения уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у субъекта или в биологическом образце, при этом активируемое антитело содержит детектируемую метку, которая расположена на части активируемого антитела, которая высвобождается после разрезания CM, при этом детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в биологическом образце, так что целевое связывание и/или разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце, и при этом не детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент присутствует у субъекта или в биологическом образце на детектируемом уровне.
[0356] Данное раскрытие изобретения предоставляет способы детекции присутствия или отсутствия разрезающего агента и мишени у субъекта или в образце путем (i) контакта субъекта или биологического образца с активируемым антителом, при этом активируемое антитело содержит детектируемую метку, которая расположена на части активируемого антитела, которая высвобождается после разрезания CM и (ii) измерения уровня активированного активируемого антитела у субъекта или в биологическом образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент мишень или разрезающий агент и мишень отсутствуют и/или недостаточно присутствуют у субъекта или в биологическом образце, так что связывание мишени и/или разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце, и при этом сниженный детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент и мишень присутствуют у субъекта или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение на около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95% и/или около 100%. Такое активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывает мишень, при этом активируемое антитело в неразрезанном (т.е. неактивированном) состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB; и (b) при этом ММ активируемого антитела в неразрезанном состоянии мешает специфическому связыванию АВ с мишенью, и при этом ММ активируемого антитела в разрезанном (т.е. активированном) состоянии не мешает и не конкурирует со специфичным связыванием AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0357] Данное раскрытие также предоставляет наборы для применения в способах детекции присутствия или отсутствия разрезающего агента и мишени у субъекта или в образце, при этом наборы содержат, по меньшей мере, активируемое антитело и/или конъюгированное активируемое антитело, описанные в данном документе, для применения для контакта с субъектом или биологическим образцом и средства для определения уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у субъекта или в биологическом образце, в котором детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент, мишень или и разрезающий агент, и мишень отсутствуют и/или недостаточно присутствуют у субъекта или в биологическом образце, так что связывание мишени и/или разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце, и при этом сниженный детектируемый уровень активированного активируемого антитела у субъекта или в биологическом образце указывает на то, что разрезающий агент и мишень присутствуют у субъекта или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение на около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95% и/или около 100%.
[0358] Данное раскрытие также предоставляет способы детекции присутствия или отсутствия разрезающего агента у субъекта или в образце путем (i) контакта субъекта или биологического образца с активируемым антителом, при этом активируемое антитело содержит детектируемую метку, которая расположена на части активируемого антитела, которая высвобождается после разрезания CM; и (ii) измерение уровня детектируемой метки у субъекта или в биологическом образце, в котором детектируемый уровень детектируемой метки у субъекта или в биологическом образце указывает на то, что разрезающий агент отсутствует и/или недостаточно присутствует у субъекта или в биологическом образце на детектируемом уровне, так что разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце, и при этом пониженный детектируемый уровень детектируемой метки у субъекта или в биологическом образце указывает на то, что разрезающий агент присутствует у субъекта или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение на около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95% и/или около 100%. Такое активируемое антитело содержит маскирующий фрагмент (MM), разрезаемый фрагмент (CM), который разрезается разрезающим агентом, и антигенсвязывающий домен или его фрагмент (AB), который специфически связывает мишень, при этом активируемое антитело в неразрезанном (т.е. неактивированном) состоянии содержит структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB или AB-CM-MM; (a) при этом указанный MM представляет собой пептид, который ингибирует связывание AB с мишенью, и при этом указанный MM не имеет аминокислотной последовательности встречающегося в природе партнера по связыванию AB; и (b) при этом ММ активируемого антитела в неразрезанном состоянии мешает специфическому связыванию АВ с мишенью, и при этом ММ активируемого антитела в разрезанном (т.е. активированном) состоянии не мешает и не конкурирует со специфичным связыванием AB с мишенью. В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0359] Данное раскрытие также предоставляет наборы для применения в способах детекции присутствия или отсутствия интересующего разрезающего агента у субъекта или в образце, при этом наборы содержат, по меньшей мере, активируемое антитело и/или конъюгированное активируемое антитело, описанные в данном документе, для применения при контакте с субъектом или биологическим образцом и средство для определения уровня активированного активируемого антитела и/или конъюгированного активируемого антитела у субъекта или в биологическом образце, при этом активируемое антитело содержит детектируемую метку, которая расположена на части активируемого антитела, которая высвобождается после разрезания CM, при этом детектируемый уровень детектируемой метки у субъекта или в биологическом образце указывает на то, что разрезающий агент, мишень или как разрезающий агент, так и мишень отсутствуют и/или недостаточно присутствуют у субъекта или в биологическом образце, например что целевое связывание и/или разрезание протеазой активируемого антитела не может быть детектировано у субъекта или в биологическом образце, и при этом пониженный детектируемый уровень детектируемой метки у субъекта или в биологическом образце указывает на то, что разрезающий агент и мишень присутствуют у субъекта или в биологическом образце. Пониженный уровень детектируемой метки представляет собой, например, снижение на около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95% и/или около 100%.
[0360] В некоторых вариантах осуществления данных способов и наборов активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления данных способов и наборов детектируемая метка содержит визуализирующий агент, контрастирующий агент, фермент, флуоресцентную метку, хромофор, краситель, один или несколько ионов металлов или метку на основе лиганда. В некоторых вариантах осуществления данных способов и наборов визуализирующий агент содержит радиоизотоп. В некоторых вариантах осуществления данных способов и наборов радиоизотоп представляет собой индий или технеций. В некоторых вариантах осуществления данных способов и наборов контрастирующий агент содержит йод, гадолиний или оксид железа. В некоторых вариантах осуществления данных способов и наборов фермент содержит пероксидазу хрена, щелочную фосфатазу или β-галактозидазу. В некоторых вариантах осуществления данных способов и наборов флуоресцентная метка содержит желтый флуоресцентный белок (YFP), голубой флуоресцентный белок (CFP), зеленый флуоресцентный белок (GFP), модифицированный красный флуоресцентный белок (mRFP), красный флуоресцентный белок tdimer2 (RFP tdimer2), HCRED или производное европия. В некоторых вариантах осуществления данных способов и наборов люминесцентная метка содержит производное N-метилакридия. В некоторых вариантах осуществления данных способов, метка содержит метки Alexa Fluor®, такие как Alexa Fluor® 680 или Alexa Fluor® 750. В некоторых вариантах осуществления данных способов и наборов метка на основе лиганда содержит биотин, авидин, стрептавидин или один или несколько гаптенов.
[0361] В некоторых вариантах осуществления данных способов и наборов субъект является млекопитающим. В некоторых вариантах осуществления данных способов и наборов субъектом является человек. В некоторых вариантах осуществления субъект является млекопитающим, не являющимся человеком, таким как примат, не являющийся человеком, домашнее животное (например, кошка, собака, лошадь), сельскохозяйственное животное, рабочее животное или животное зоопарка. В некоторых вариантах субъект является грызуном.
[0362] В некоторых вариантах осуществления данных способов способ представляет собой способ in vivo. В некоторых вариантах осуществления данных способов способ представляет собой способ in situ. В некоторых вариантах осуществления данных способов способ представляет собой способ ex vivo. В некоторых вариантах осуществления данных способов способ представляет собой способ in vitro.
[0363] В некоторых вариантах осуществления визуализация in situ и/или визуализация in vivo пригодны для способов идентификации пациентов, которых лечат. Например, при визуализации in situ активируемые антитела используются для скрининга образцов пациентов с мишенью идентификации тех пациентов, которые имеют подходящую протеазу(ы) и мишень(и) в соответствующем месторасположении, например в месторасположении опухоли.
[0364] В некоторых вариантах осуществления визуализация in situ используется для идентификации или иного уточнения популяции пациентов, подходящей для лечения активируемыми антителами по данному изобретению. Например, идентифицируют пациентов, которые дают положительный результат как для мишени (например, мишени), так и для протеазы, которая расщепляет субстрат в расщепляемой части (CM) тестируемого активируемого антитела (например, накапливают активированные антитела в месторасположении патологии) в качестве подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогичным образом, пациенты, которые дают отрицательный результат на одну или обе мишени (например, мишень) и протеазу, которая расщепляет субстрат в CM в активируемом антителе, тестируемом с использованием данных способов, могут быть идентифицированы как подходящие кандидаты для другой формы терапии. В некоторых вариантах осуществления такие пациенты, которые дают отрицательный результат в отношении первого активируемого антитела, могут тестироваться с другими активируемыми антителами, содержащими разные CM, до тех пор, пока не будет идентифицировано подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое разрезается пациентом в месторасположении патологии). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество активируемого антитела, для которого пациент дал положительный результат.
[0365] В некоторых вариантах осуществления визуализация in vivo используется для идентификации или иного уточнения популяции пациентов, подходящей для лечения активируемыми антителами по данному изобретению. Например, идентифицируют пациентов, которые дают положительный результат как для мишени (например, мишени), так и для протеазы, которая расщепляет субстрат в расщепляемой части (CM) тестируемого активируемого антитела (например, накапливают активированные антитела в месторасположении патологии) в качестве подходящих кандидатов для лечения таким активируемым антителом, содержащим такой CM. Аналогично, пациенты с отрицательным результатом теста могут быть определены как подходящие кандидаты для другой формы терапии. В некоторых вариантах осуществления такие пациенты, которые дают отрицательный результат в отношении первого активируемого антитела, могут тестироваться с другими активируемыми антителами, содержащими разные CM, до тех пор, пока не будет идентифицировано подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое разрезается пациентом в месторасположении патологии). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество активируемого антитела, для которого пациент дал положительный результат.
[0366] В некоторых вариантах осуществления способов и наборов способ или набор используются для идентификации или иного уточнения популяции пациентов, подходящей для лечения активируемыми антителами по данному изобретению. Например, пациенты, которые дают положительный результат как на мишень (например, на мишень), так и на протеазу, которая расщепляет субстрат в расщепляемом фрагменте (CM) активируемого антитела, тестируемого этими способами, идентифицируются как подходящие кандидаты для лечения таким активируемым антителом, содержащим такой CM. Аналогичным образом, пациенты, которые дают отрицательный результат для обеих мишеней (например, кокретной мишени) и протеазы, которая расщепляет субстрат CM в активируемом антителе, тестируемом с использованием данных способов, могут быть идентифицированы как подходящие кандидаты для другой формы терапии. В некоторых вариантах осуществления таких пациентов можно тестировать с другими активируемыми антителами до тех пор, пока не будет идентифицировано подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое разрезается пациентом в месторасположении патологии). В некоторых вариантах осуществления пациенты, которые дают отрицательный результат по любой из мишеней (например, кокретной мишени), идентифицируются как подходящие кандидаты для лечения таким активируемым антителом, содержащим такую CM. В некоторых вариантах осуществления пациенты, которые дают отрицательный результат по любой из мишеней (например, кокретной мишени), идентифицируются как не подходящие кандидаты для лечения таким активируемым антителом, содержащим такую CM. В некоторых вариантах осуществления таких пациентов можно тестировать с другими активируемыми антителами до тех пор, пока не будет идентифицировано подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое разрезается пациентом в месторасположении патологии). В некоторых вариантах осуществления активируемое антитело представляет собой активируемое антитело, с которым конъюгирован терапевтический агент. В некоторых вариантах осуществления активируемое антитело не конъюгировано с агентом. В некоторых вариантах осуществления активируемое антитело содержит детектируемую метку. В некоторых вариантах осуществления детектируемая метка расположена на АВ. В некоторых вариантах осуществления измерение уровня активируемого антитела у субъекта или в образце выполняется с использованием вторичного реагента, который специфично связывается с активированным антителом, при этом реагент содержит детектируемую метку. В некоторых вариантах осуществления вторичный реагент представляет собой антитело, содержащее детектируемую метку.
[0367] В некоторых вариантах осуществления способ или набор используют для идентификации или иного уточнения популяции пациентов, подходящей для лечения активируемым антителом против мишени и/или конъюгированным активируемым антителом (например, активируемым антителом, с которым конъюгирован терапевтический агент) данного раскрытия с последующим лечением путем введения данного активируемого антитела и/или конъюгированного активируемого антитела субъекту, нуждающемуся в этом. Например, пациенты, которые дают положительный результат как на мишени (например, на мишень), так и на протеазу, которая расщепляет субстрат в расщепляемой части (CM) активируемого антитела и/или конъюгированного активируемого антитела, тестируемого в данных способах, идентифицируются как подходящие кандидаты для лечения таким антителом и/или таким конъюгируемым активируемым антителом, содержащим такую CM, и пациенту затем вводят терапевтически эффективное количество активируемого антитела и/или конъюгированного активируемого антитела, которое было протестировано. Аналогичным образом, пациенты, которые дают отрицательный результат на одну или обе мишени (например, мишень) и протеазу, которая расщепляет субстрат в СМ в активируемом антителе, тестируемом с использованием данных способов, могут быть идентифицированы как подходящие кандидаты для другой формы терапии. В некоторых вариантах осуществления таких пациентов можно тестировать с другим антителом и/или конъюгированным активируемым антителом до тех пор, пока не будет идентифицировано подходящее антитело и/или конъюгированное активируемое антитело для лечения (например, активируемое антитело и/или конъюгированное активируемое антитело, содержащее СМ, который отщепляется пациентом на месторасположении заболевания). В некоторых вариантах осуществления пациенту затем вводят терапевтически эффективное количество активируемого антитела и/или конъюгированного активируемого антитела, в отношении которого пациент дал положительный результат.
[0368] В некоторых вариантах осуществления данных способов и наборов MM представляет собой пептид, имеющий длину от около 4 до 40 аминокислот. В некоторых вариантах осуществления данных способов и наборов активируемое антитело содержит линкерный пептид, при этом линкерный пептид расположен между MM и CM. В некоторых вариантах осуществления данных способов и наборов активируемое антитело содержит линкерный пептид, при этом линкерный пептид расположен между AB и CM. В некоторых вариантах осуществления данных способов и наборов активируемое антитело содержит первый линкерный пептид (LP1) и второй линкерный пептид (LP2), где первый линкерный пептид расположен между MM и CM, а второй линкерный пептид расположен между AB и CM. В некоторых вариантах осуществления данных способов и наборов каждый из LP1 и LP2 представляет собой пептид длиной от около 1 до 20 аминокислот, и при этом каждый из LP1 и LP2 не обязательно должен быть одним и тем же линкером. В некоторых вариантах осуществления данных способов и наборов один или оба из LP1 и LP2 содержат глицин-сериновый полимер. В некоторых вариантах осуществления данных способов и наборов, по меньшей мере, один из LP1 и LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из (GS) n, (GSGGS) n (SEQ ID NO: 24) и (GGGS) n (SEQ ID NO: 25), где n является целым числом, по меньшей мере, один. В некоторых вариантах осуществления данных способов и наборов, по меньшей мере, один из LP1 и LP2 содержит аминокислотную последовательность, имеющую формулу (GGS) n, где n представляет собой целое число, по меньшей мере, один. В некоторых вариантах осуществления данных способов и наборов, по меньшей мере, один из LP1 и LP2 содержит аминокислотную последовательность, выбранную из группы, состоящей из Gly-Gly-Ser-Gly (SEQ ID NO: 26), Gly-Gly-Ser-Gly- Gly (SEQ ID NO: 27), Gly-Ser-Gly-Ser-Gly (SEQ ID NO: 28), Gly-Ser-Gly-Gly-Gly (SEQ ID NO: 29), Gly-Gly-Gly-Ser -Gly (SEQ ID NO: 30) и Gly-Ser-Ser-Ser-Gly (SEQ ID NO: 31).
[0369] В некоторых вариантах осуществления данных способов и наборов АВ содержит антитело или последовательность фрагмента антитела, выбранную из представленных в данном документе последовательностей перекрестно-реактивных антител. В некоторых вариантах осуществления данных способов и наборов AB содержит фрагмент Fab, scFv или одноцепочечное антитело (scAb).
[0370] В некоторых вариантах осуществления данных способов и наборов разрезающий агент представляет собой протеазу, которая локализована у субъекта или в образце вместе с мишенью, и CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы, где протеаза расщепляет CM в активируемое антитело, когда активируемое антитело подвергается воздействию протеазы. В некоторых вариантах осуществления данных способов и наборов CM представляет собой полипептид длиной до 15 аминокислот. В некоторых вариантах осуществления данных способов и наборов CM соединен с N-концом AB. В некоторых вариантах осуществления данных способов и наборов CM соединен с C-концом AB. В некоторых вариантах осуществления данных способов и наборов CM связан с N-концом цепи VL AB.
[0371] N- и C-концы полипептидных цепей антител по данному изобретению могут отличаться от последовательностей, описанных в данном документе, из-за обычно наблюдаемых посттрансляционных модификаций. Например, С-концевые остатки лизина часто отсутствуют в тяжелых цепях антител. Dick et al. (2008) Biotechnol. Bioeng. 100: 1132. N-концевые остатки глютамина и в меньшей степени остатки глутамата часто превращаются в остатки пироглутамата как в легкой, так и в тяжелой цепях терапевтических антител. Dick et al. (2007) Biotechnol. Bioeng. 97:544; Liu et al. (2011) JBC 28611211; Liu et al. (2011) J. Biol. Chem. 286:11211. Соответственно, конъюгированное активируемое антитело Формулы (I) и/или Формулы (II)может иметь антитело (АВ), где на С-концевом остатке константной области тяжелой цепи отсутствует либо одна или несколько аминокислот на конце, но отсутствует С-концевой лизин имеет С-концевой лизин, удаленный вследствие посттрансляционной обработки, или С-концевой лизин представляет собой аминокислоту, отличную от лизина. Если С-концевой остаток константной области тяжелой цепи представляет собой аминокислоту, отличную от лизина, в одном варианте осуществления это аминокислота, обычно не поддающаяся образованию дисульфидной связи или иным образом не поддающаяся конъюгации с цитотоксическим агентом.
[0372] В некоторых вариантах осуществления конъюгированное активируемое антитело Формулы (I) и/или Формулы (II)может иметь антитело (AB), в котором N-концевой глутамат на тяжелой и/или легкой цепи необязательно представляет собой либо пироглутамат, либо пост-трансляционно модифицирован в пироглутамат.
[0373] В некоторых вариантах осуществления константная область тяжелой цепи конъюгированного активируемого антитела Формулы (I) и/или Формулы (II)содержит лизин или другую аминокислоту на С-конце, например, она содержит следующие последние аминокислоты: PGK для тяжелой цепи. В некоторых вариантах осуществления в константной области тяжелой цепи отсутствует одна или несколько аминокислот на С-конце, и она имеет, например, С-концевую последовательность PG или P.
[0374] В некоторых вариантах осуществления вариабельные области тяжелой цепи и/или легкой цепи конъюгированного активируемого антитела Формулы (I) и/или Формулы (II)содержат глутаматную или пироглутаматную аминокислоту на N-конце, например, она содержит следующее последние аминокислоты: pQGQ для легкой цепи и/или pQVQ для тяжелой цепи, где «pQ» представляет пироглутамат.
[0375] Антитела, конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по данному изобретению используются в диагностических и профилактических составах. В одном варианте осуществления активируемое антитело вводят пациентам, которые подвергаются риску развития одного или нескольких из вышеупомянутых воспалений, воспалительных расстройств, рака или других расстройств.
[0376] Предрасположенность пациента или органа к одному или нескольким из вышеупомянутых нарушений может быть определена с использованием генотипических, серологических или биохимических маркеров.
[0377] В некоторых вариантах осуществления данного изобретения антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело вводят людям, у которых диагностировано клинический симптом, связанный с одним или несколькими из вышеупомянутых расстройств. После постановки диагноза вводят антитело, конъюгированное антитело, активируемое антитело и/или конъюгированное активируемое антитело, чтобы смягчить или обратить вспять эффекты клинического симптома.
[0378] Антитела, конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по данному изобретению также пригодны при обнаружении мишени в образцах пациентов и, соответственно, пригодны в качестве диагностики. Например, антитела, конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по данному изобретению используются в анализах in vitro, например, ИФА, для определения уровней мишени в образце пациента.
[0379] В одном варианте осуществления антитело и/или активируемое антитело по данному изобретению иммобилизовано на твердой подложке (например, в лунке (ах) планшета для микротитрования). Иммобилизованное антитело и/или активируемое антитело служит захватывающим антителом для любой мишени, которая может присутствовать в тестируемом образце. Перед контактом иммобилизованного антитела и/или активируемого антитела с образцом пациента твердую подложку промывают и обрабатывают блокирующим агентом, таким как молочный белок или альбумин, для предотвращения неспецифической адсорбции аналита.
[0380] Затем лунки обрабатывают тестируемым образцом, предположительно содержащим антиген, или раствором, содержащим стандартное количество антигена. Такой образец представляет собой, например, образец сыворотки от субъекта, у которого подозреваются уровни циркулирующего антигена, который считается диагностическим признаком патологии. После промывания исследуемого образца или стандарта твердую подложку обрабатывают вторым антителом, которое можно детектируемо пометить. Меченое второе антитело служит детектирующим антителом. Измеряется уровень детектируемой метки, а концентрация антигена-мишени в тестируемом образце определяется путем сравнения со стандартной кривой, полученной из стандартных образцов.
[0381] Понятно, что на основании результатов, полученных с использованием антител и/или активируемых антител по данному изобретению в диагностическом анализе in vitro, возможно выявить заболевание у субъекта на основании уровней экспрессии антигена-мишени. Для данного заболевания отбирают образцы крови у субъектов, у которых диагностированы различные стадии развития заболевания и/или различные этапы терапевтического лечения заболевания. Используя совокупность образцов, которая дает статистически значимые результаты для каждой стадии прогрессирования или терапии, обозначают диапазон концентраций антигена, который можно считать характерным для каждой стадии.
[0382] Антитела, конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела также можно использовать в методах диагностики и/или визуализации. В некоторых вариантах осуществления такие способы представляют собой способы in vitro. В некоторых вариантах осуществления такие способы представляют собой способы in vivo. В некоторых вариантах осуществления такие способы представляют собой способы in situ. В некоторых вариантах осуществления такие способы представляют собой способы ex vivo. Например, активируемые антитела, имеющие ферментативно разрезаемый СМ, могут быть использованы для детекции присутствия или отсутствия фермента, способного расщеплять СМ. Такие активируемые антитела можно использовать в диагностике, которая может включать в себя определение in vivo (например, качественное или количественное) ферментативной активности (или, в некоторых вариантах осуществления, среды с повышенным потенциалом восстановления, такой как среда, которая может обеспечить восстановление дисульфидной связи) путем измерения накопления активированных антител (т.е. антител, возникающих в результате разрезания активируемого антитела) в данной клетке или ткани данного организма-хозяина. Такое накопление активированных антител указывает не только на то, что ткань экспрессирует ферментативную активность (или повышенный потенциал восстановления в зависимости от природы CM), но также на то, что ткань экспрессирует мишень, с которой связывается активированное антитело.
[0383] Например, СМ может быть выбран в качестве субстрата протеазы для протеазы, обнаруженной в месторасположении опухоли, в месторасположении вирусной или бактериальной инфекции в биологически ограниченном местоположении (например, в виде абсцесса в органе и тому подобного) и тому подобном. AB может быть тем, который связывает целевой антиген. Используя способы, знакомые специалисту в данной области, детектируемая метка (например, флуоресцентная метка или радиоактивная метка или радиотрекер) может быть конъюгирована с AB или другим участком активируемого антитела. Подходящие детектируемые метки обсуждаются в контексте вышеупомянутых способов скрининга, и дополнительные конкретные примеры представлены ниже. При использовании AB, специфичной к белку или пептиду патологического состояния, наряду с протеазой, активность которой повышена в интересующей ткани заболевания, активируемые антитела будут демонстрировать повышенную скорость связывания с тканью заболевания по сравнению с тканями, в которых специфический фермент CM не присутствует на детектируемом уровне или присутствует на более низком уровне, чем в ткани заболевания, или неактивен (например, в форме зимогена или в комплексе с ингибитором). Поскольку мелкие белки и пептиды быстро выводятся из крови почечной фильтрационной системой, а также потому, что фермент, специфичный для CM, не присутствует на детектируемом уровне (или присутствует на более низких уровнях в тканях, не подверженных заболеваниям, или присутствует в неактивной конформации), накопление активированных антител в пораженных тканях увеличивается по сравнению с нездоровыми тканями.
[0384] В другом Примере активируемые антитела можно использовать для детекции присутствия или отсутствия разрезающего агента в образце. Например, когда активируемые антитела содержат CM, чувствительный к разрезанию ферментом, активируемые антитела можно использовать для детекции (качественно или количественно) присутствия фермента в образце. В другом Примере, где активируемые антитела содержат CM, чувствительный к разрезанию восстанавливающим агентом, активируемые антитела могут использоваться для детекции (качественно или количественно) наличия восстановительных условий в образце. Для облегчения анализа в данных способах активируемые антитела могут быть детектируемо помечены и могут быть связаны с подложкой (например, твердой подложкой, такой как предметное стекло или гранула). Детектируемая метка может быть размещена на части активируемого антитела, которая не высвобождается после разрезания, например, детектируемая метка может представлять собой погашенную флуоресцентную метку или другую метку, которая не детектируется до тех пор, пока не произойдет разрезание. Анализ может проводиться, например, контактированием иммобилизованных, детектируемых меченных активируемых антител с образцом, предположительно содержащим фермент и/или восстановитель, в течение времени, достаточного для того, чтобы произошло разрезание, затем промывкой для удаления избытка образца и загрязняющих веществ. Присутствие или отсутствие разрезающего агента (например, фермента или восстановителя) в образце затем оценивают по изменению детектируемого сигнала активируемых антител перед контактом с образцом, например, по наличию и/или увеличению детектируемого сигнала из-за разрезания активируемого антитела разрезающим агентом в образце.
[0385] Такие способы детекции могут быть адаптированы так, чтобы также обеспечивать обнаружение присутствия или отсутствия мишени, которая способна связывать AB активируемых антител при расщеплении. Таким образом, анализы могут быть адаптированы для оценки наличия или отсутствия разрезающего агента и наличия или отсутствия интересующей мишени. Присутствие или отсутствие разрезающего агента может быть детектировано по присутствию и/или увеличению детектируемой метки активируемых антител, как описано выше, и присутствие или отсутствие мишени может быть детектировано путем детекции комплекса мишень-AB. например, путем применения детектируемо меченого антитела против мишени.
[0386] Активируемые антитела также пригодны при визуализации in situ для подтверждения активации активируемых антител, например, путем разрезания протеазой и связывания с конкретной мишенью. Визуализация in situ - это способ, позволяющий локализовать протеолитическую активность и мишень в биологических образцах, таких как клеточные культуры или срезы тканей. Используя данную методику, можно подтвердить как связывание с данной мишенью, так и протеолитическую активность на основании наличия детектируемой метки (например, флуоресцентной метки).
[0387] Данные способы пригодны для любых замороженных клеток или тканей, полученных из участка заболевания (например, опухолевой ткани) или здоровых тканей. Данные способы также пригодны для образцов свежих клеток или тканей.
[0388] В данных методах активируемое антитело помечается детектируемой меткой. Детектируемая метка может представлять собой флуоресцентный краситель (например, изотиоцианат флуоресцеина (FITC), изотиоцианат родамина (TRITC), краситель ближнего инфракрасного (NIR) диапазона (например, нанокристаллы Qdot®), коллоидный металл, гаптен, радиоактивный маркер, биотин и реагент для амплификации, такой как стрептавидин или фермент (например, пероксидаза хрена или щелочная фосфатаза).
[0389] Обнаружение метки в образце, который был инкубирован с меченым, активируемым антителом, указывает на то, что образец содержит мишень и содержит протеазу, которая специфична для CM активируемого антитела. В некоторых вариантах осуществления присутствие протеазы может быть подтверждено с использованием ингибиторов протеазы широкого спектра действия, таких как описанные в данном документе, и/или с использованием агента, который специфичен для протеазы, например, антитела, такого как A11, которое специфично для протеазы матриптазы и ингибирует протеолитическую активность матриптазы; см., например, международную публикацию № WO 2010/129609, опубликованную 11 ноября 2010 г. Тот же самый подход с использованием ингибиторов протеазы широкого спектра, таких как описанные в данном документе, и/или с использованием более селективного ингибиторного агента, может быть использован для идентификации протеазы или класса протеаз, специфичных для CM активируемого антитела. В некоторых вариантах осуществления присутствие мишени может быть подтверждено с использованием агента, специфичного для мишени, например другого антитела, или детектируемая метка может конкурировать с немеченой мишенью. В некоторых вариантах осуществления можно использовать немеченое активируемое антитело с обнаружением меченым вторичным антителом или более сложной системой детекции.
[0390] Подобные способы также пригодны для визуализации in vivo, где обнаружение флуоресцентного сигнала у субъекта, например млекопитающих, включая человека, указывает на то, что сайт заболевания содержит мишень и содержит протеазу, специфичную для CM активируемого антитела,
[0391] Данные способы также пригодны в наборах и/или в качестве реагентов для детекции, идентификации или характеризации протеазной активности в различных клетках, тканях и организмах на основе протеазоспецифичных CM в активируемом антителе.
[0392] В некоторых вариантах осуществления визуализация in situ и/или визуализация in vivo пригодны для способов идентификации пациентов, которых лечат. Например, при визуализации in situ активируемые антитела используются для скрининга образцов пациентов с мишенью и идентификации тех пациентов, которые имеют подходящую протеазу (ы) и мишень (и) в соответствующем месторасположении, например в месторасположении опухоли.
[0393] В некоторых вариантах осуществления визуализация in situ используется для идентификации или иного уточнения популяции пациентов, подходящей для лечения активируемыми антителами по данному изобретению. Например, пациенты, которые дают положительный результат как на мишень, так и на протеазу, которая расщепляет субстрат в расщепляемой части (CM) тестируемого активируемого антитела (например, накапливают активированные антитела в месторасположении патологии), идентифицируются как подходящие кандидаты для лечения таким активируемым антителом, содержащее такой CM. Аналогичным образом, пациенты, которые дают отрицательный результат на одну или обе мишени и протеазу, которая расщепляет субстрат в CM в активируемом антителе, тестируемом с использованием данных способов, идентифицируются как подходящие кандидаты для другой формы терапии (т.е. не подходят для лечения тестируемым активируемым антителом). В некоторых вариантах осуществления такие пациенты, которые дают отрицательный результат в отношении первого активируемого антитела, могут тестироваться с другими активируемыми антителами, содержащими разные CM, до тех пор, пока не будет идентифицировано подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое разрезается пациентом). в месторасположении патологии).
[0394] В некоторых вариантах осуществления визуализация in vivo используется для идентификации или иного уточнения популяции пациентов, подходящей для лечения активируемыми антителами по данному изобретению. Например, пациенты, которые дают положительный результат как на мишень, так и на протеазу, которая расщепляет субстрат в расщепляемой части (CM) тестируемого активируемого антитела (например, накапливают активированные антитела в месторасположении патологии), идентифицируются как подходящие кандидаты для лечения таким активируемым антителом, содержащее такой CM. Аналогичным образом, пациенты с отрицательным тестом идентифицируются как подходящие кандидаты для другой формы терапии (т.е. не подходят для лечения тестируемым активируемым антителом). В некоторых вариантах осуществления такие пациенты, которые дают отрицательный результат в отношении первого активируемого антитела, могут тестироваться с другими активируемыми антителами, содержащими разные CM, до тех пор, пока не будет идентифицировано подходящее активируемое антитело для лечения (например, активируемое антитело, содержащее CM, которое разрезается пациентом, в месторасположении патологии).
Фармацевтические композиции
[0395] Антитела, конъюгированные антитела, активируемые антитела и/или конъюгированные активируемые антитела по данному изобретению (также называемые в данном документе «активными соединениями») и их производные, фрагменты, аналоги и гомологи могут быть включены в фармацевтические композиции, подходящие для введения.
[0396] Особенно выгодно составлять оральные или парентеральные композиции в единичной дозированной форме для простоты введения и единообразия дозировки. Используемая в данном документе единичная лекарственная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для субъекта, которого лечат; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтически приемлемым носителем. Спецификация для единичных дозированных форм раскрытия изобретения продиктована и напрямую зависит от уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, а также ограничений, присущих уровню техники приготовления такого активного соединения для лечения физические лица.
[0397] Фармацевтические композиции могут быть включены в контейнер, упаковку или дозатор вместе с инструкциями для введения.
[0398] Данное изобретение будет дополнительно описано в следующих перечисленных вариантах осуществления и Примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
Перечисленные варианты осуществления
[0399] Данное изобретение может быть определено посредством ссылки на следующие перечисленные иллюстративные варианты осуществления.
Набор I
[0400] I-1. Конъюгированное активируемое антитело, содержащее:
(а) активируемое антитело (АА), содержащее в неразрезанном состоянии структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB, где:
(i) АВ представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит последовательность вариабельной области тяжелой цепи из SEQ ID NO: 5, и последовательность вариабельной области легкой цепи из SEQ ID NO: 7;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, отличающийся тем, что ММ в сочетании с AB ингибирует связывание AB к CD71, когда конъюгированное активируемое антитело в нерасщепленного состоянии;
(iii) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, соединенный с AB, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(b) монометилауристатин Е (MMAE), в котором активируемый антитело, конъюгированное с двумя эквивалентами MMAE.
[0401] I-2. Композиция, содержащая: конъюгированное активируемое антитело, имеющее формулу
AA- (AG) p, где
(a) AA представляет собой активируемое антитело, содержащее в неразрезанном состоянии структурное расположение от N-конца к C-концу следующим образом: MM-CM-AB, где:
(i) АВ представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит вариабельный участок тяжелой цепи последовательности SEQ ID NO: 5, и последовательность вариабельной области легкой цепи из SEQ ID NO: 7,
(ii) ММ маскирующий фрагмент, содержащий последовательность SEQ ID NO: 18, отличающийся тем, что ММ в сочетании с АВ ингибирует связывание АВ с CD71, когда конъюгированное активируемое антитело в нерасщепленного состоянии, и
(iii) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, соединенный с AB, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(b) AG представляет собой агент, конъюгированный с AA, при этом агент представляет собой MMAE и при этом p равно 2.
[0402] I-3. Способ получения сопряженного активируемое антитела, включающий: конъюгирование по меньшей мере одного MMAE к активируемому антителу (АА) с получением таким образом композиции, содержащей AA- (MMAE) р, где р равно от 1 до 8; и обогащение композиции в отношении конъюгированных активируемых видов антител, у которых р равно 2, где АА в неразрезанном состоянии содержит структурное расположение от N-конца к С-концу следующим образом: MM-CM-AB, где:
(i) АВ представляет собой антитело, которое специфично связывается с CD71 млекопитающих и содержит вариабельный участок тяжелой цепи последовательности SEQ ID NO: 5, и последовательность вариабельной области легкой цепи из SEQ ID NO: 7,
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, отличающийся тем, что ММ в сочетании с АВ, который ингибирует связывание AB к CD71, когда конъюгированное активируемое антитело в нерасщепленного состоянии, и
(iii) СМ представляют собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, соединенную с AB, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы.
[0403] I-4. Конъюгированное активируемое антитело по варианту осуществления I-1 или композиции по варианту осуществления I-2 или по варианту осуществления I-3, при этом AB содержит последовательность тяжелой цепи из SEQ ID NO: 20.
[0404] I-5. Конъюгированное активируемое антитело по варианту осуществления I-1 или композиции по варианту осуществления I-2 или по варианту осуществления I-3, при этом AB содержит последовательность тяжелой цепи из SEQ ID NO: 167.
[0405] I-6. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1, I-4 и I-5 или композиция по любому из вариантов осуществления I-2, I-4 и I-5 или способ по любому из вариантов осуществления I-3-I-5, в которых АВ содержит последовательность легкой цепи из SEQ ID NO: 19.
[0406] I-7. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-6 или композиция по любому из вариантов осуществления I-2 и I-4 - I-6 или способ по любому из вариантов осуществления I-3-6, в которых АА содержит линкерный пептид LP1 между АВ и ММ.
[0407] I-8. Конъюгированное активируемое антитело или композиция или способ по варианту осуществления I-7, при этом LP1 содержит аминокислотную последовательность GGGSSGGS (SEQ ID NO: 207).
[0408] I-9. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и 4-8, или композиция по любому из вариантов осуществления I-2 и I-4-I-8, или способ по любому из вариантов осуществления I-3-I- 8, в которых АА содержит линкерный пептид LP2 между AB и СМ.
[0409] I-10. Конъюгированное активируемое антитело или композиция или способ по варианту осуществления I-9, при этом LP2 содержит аминокислотную последовательность GGGS (SEQ ID NO: 38).
[0410] I-11. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-10, или композиция по любому из вариантов осуществления I-2 и I-4 - I-10, или способ по любому из вариантов осуществления I-3 - I-10, в которых AA содержит первый линкерный пептид (LP1) и второй линкерный пептид (LP2), и в которых AA в неразрезанном состоянии имеет структурное расположение от N-конца к C-концу следующим образом: MM -LP1-CM-LP2-AB.
[0411] I-12. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-11, или композиция по любому из вариантов осуществления I-2 и I-4 - I-11, или способ по любому из вариантов осуществления I- 3-11, в которых активируемое антитело содержит легкую цепь, содержащую спейсерную последовательность, выбранную из группы, состоящей из SEQ ID NO: 138 и 143-145 и GQG.
[0412] I-13. Конъюгированное активируемое антитело или композиция или способ по варианту осуществления I-12, в которых спейсерная последовательность является N-концевой по отношению к MM.
[0413] I-14. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-13, или композиция по любому из вариантов осуществления I-2 и I-4 - I-13, или способ по любому из вариантов осуществления I- 3-13, в которых активируемое антитело содержит последовательность вариабельной области легкой цепи из SEQ ID NO: 201.
[0414] I-15. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-13, или композиция по любому из вариантов осуществления I-2 и I-4 - I-13, или способ по любому из вариантов осуществления I- 3-13, в которых активируемое антитело содержит последовательность вариабельной области легкой цепи из SEQ ID NO: 202.
[0415] I-16. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-13, или композиция по любому из вариантов осуществления I-2 и I-4 - I-13, или способ по любому из вариантов осуществления I- 3-13, в которых активируемое антитело содержит последовательность легкой цепи из SEQ ID NO: 169.
[0416] I-17. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-13, или композиция по любому из вариантов осуществления I-2 и I-4 - I-13, или способ по любому из вариантов осуществления I- 3-13, в которых активируемое антитело содержит последовательность легкой цепи из SEQ ID NO: 170.
[0417] I-18. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-17, или композиция по любому из вариантов осуществления I-2 и I-4 - I-17, или способ по любому из вариантов осуществления I- 3-17, в которых АВ специфично связывает CD71 человека и CD71 обезьяны яванского макака.
[0418] I-19. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4-I-18, или композиция по любому из вариантов осуществления I-2 и 4-18, или способ по любому из вариантов осуществления I-3-I- 18, в которых ММ имеет константу диссоциации для связывания с AB, которая больше, чем константа диссоциации AB с CD71.
[0419] I-20. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-19, или композиция по любому из вариантов осуществления I-2 и I-4 - I-19, или способ по любому из вариантов осуществления I-3 - I-19, в которых ММ не вмешивается и не конкурирует с AB за связывание с CD71, когда активируемое антитело находится в разрезанном состоянии.
[0420] I-21. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-20, или композиция по любому из вариантов осуществления I-2 и I-4 - I-20, или способ по любому из вариантов осуществления I-3 - I-20, в которых ММ представляет собой полипептид длиной не более 40 аминокислот.
[0421] I-22. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-21, или композиция по любому из вариантов осуществления I-2 и I-4 - I-21, или способ по любому из вариантов осуществления I-3 - I-21, в которых CM представляет собой субстрат для протеазы, которая активна в пораженной ткани.
[0422] I-23. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-22, или композиция по любому из вариантов осуществления I-2 и I-4 - I-22, или способ по любому из вариантов осуществления I-3 - I-22, в которых агент конъюгирован с АВ через линкер.
[0423] I-24. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-23 или композиция по любому из вариантов осуществления I-2 и I-4 - I-23 или способ по любому из вариантов осуществления I-3 - I-23, в которых линкер, с которым агент конъюгирован с АВ, содержит валин-цитруллиновый фрагмент.
[0424] I-25. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-24, или композиция по любому из вариантов осуществления I-2 и I-4 - I-24, или способ по любому из вариантов осуществления I-3 - I-24, в которых линкер, с которым агент конъюгирован с АВ, содержит малеимидный капроил-валин-цитруллиновый фрагмент.
[0425] I-26. Конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-25 или композиция по любому из вариантов осуществления I-2 и I-4 - I-25 или способ по любому из вариантов осуществления I-3 - I-25, в которых линкер, с которым агент конъюгирован с АВ, содержит малеимидный капроил-валин-цитруллин-пара-аминобензилоксикарбонильный фрагмент.
[0426] I-27. Композиция по любому из вариантов осуществления I-2 и I-4 - I-26 или способ по любому из вариантов осуществления I-3 - I-26, в которых по меньшей мере 50% конъюгированного активируемого антитела композиции принадлежит виду, для которого р равен 2.
[0427] I-28. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых по меньшей мере 75% конъюгированного активируемого антитела композиции принадлежит виду, для которого р равен 2.
[0428] I-29. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых по меньшей мере 90% конъюгированного активируемого антитела композиции принадлежит виду, для которого р равен 2.
[0429] I-30. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых по меньшей мере 95% конъюгированного активируемого антитела композиции принадлежит виду, для которого р равен 2.
[0430] I-31. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых по меньшей мере 98% конъюгированного активируемого антитела композиции принадлежит виду, для которого р равен 2.
[0431] I-32. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых эквиваленты каждого из конъюгированных активируемых видов антител композиции в которых p равно 1 или 3-8 находятся в меньшем количестве, чем эквиваленты конъюгированных активируемых видов антител композиции, в которых p равно 2.
[0432] I-33. Композиция по любому из вариантов осуществления I-2 и I-4 - I-26 или способ по любому одному из вариантов осуществления I-3 - I-26, где конъюгированные активируемые виды антител композиции, в которой p равно 1 или 3-8 находятся в меньшем количестве, чем эквиваленты конъюгированных активируемых видов антител композиции, в которых р равно 2.
[0433] I-34. Композиция по любому из вариантов осуществления I-2 и I-4 - I-26 или способ по любому из вариантов осуществления I-3 - I-26, в которых менее 50% конъюгированных активируемых видов антител в композиции принадлежит видам, для которых р составляет 1 или от 3 до 8.
[0434] I-35. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых менее 25% конъюгированных активируемых видов антител в композиции принадлежит видам, для которых р составляет 1 или от 3 до 8.
[0435] I-36. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых менее 10% конъюгированных активируемых видов антител в композиции принадлежит видам, для которых р составляет 1 или от 3 до 8.
[0436] I-37. Композиция по любому из вариантов осуществления I-2 и I-4 - I-26 или способ по любому из вариантов осуществления I-3 по I-26, в которых менее 5% конъюгированных активируемых видов антител в композиции принадлежит видам, для которых р составляет 1 или от 3 до 8.
[0437] I-38. Композиция по любому из вариантов осуществления I-2 и I-4-I-26 или способ по любому из вариантов осуществления I-3-I-26, в которых менее 2% конъюгированных активируемых видов антител в композиции принадлежит видам, для которых р составляет 1 или от 3 до 8.
[0438] I-39. Фармацевтическая композиция, содержащая:
[0439] конъюгированное активируемое антитело по любому из вариантов осуществления I-1 и I-4 - I-26 или композицию по любому из вариантов осуществления I-2 и I-4 - I-38; и носитель.
[0440] I-40. Способ лечения, ослабления симптомов или задержки прогрессирования рака у субъекта, включающий введение терапевтически эффективного количества конъюгированного активируемого антитела по любому из вариантов осуществления I-1 и I-4-I- 26 или композиции по любому из вариантов осуществления I-2 и I-4-I-38 или фармацевтической композиции по варианту осуществления I-39 субъекту, нуждающемуся в этом.
[0441] I-41. Способ по варианту осуществления I-40, в котором рак представляет собой рак желудка.
[0442] I-42. Способ по варианту осуществления I-40, в котором рак представляет собой рак яичника.
[0443] I-43. Способ по варианту осуществления I-40, в котором рак представляет собой рак пищевода.
[0444] I-44. Способ по варианту осуществления I-40, в котором рак представляет собой немелкоклеточный рак легких.
[0445] I-45. Способ по варианту осуществления I-40, в котором рак представляет собой рак молочной железы.
[0446] I-46. Способ по варианту осуществления I-40, в котором рак представляет собой колоректальный рак.
[0447] I-47. Способ по варианту осуществления I-40, в котором рак представляет собой меланому.
[0448] I-48. Способ по варианту осуществления I-40, в котором рак представляет собой рак предстательной железы.
[0449] I-49. Способ по варианту осуществления I-40, в котором рак представляет собой мезотелиому.
Набор II
[0450] II-1. Конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли:
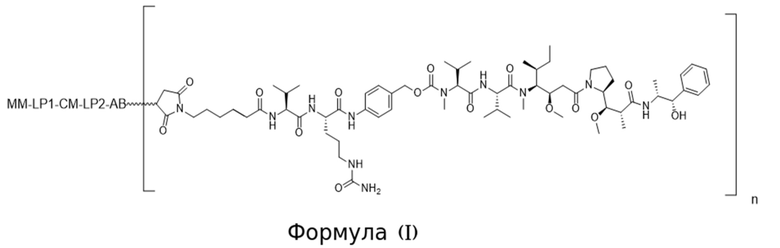
(а) где
(i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит
i. вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и
ii. вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащая SEQ ID NO: 15;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, в котором ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии;
(iii) LP1 представляет собой первый линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207;
(iv) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, в котором СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(v) LP2 представляет собой второй линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и
(b) при этом «n» равно 2.
[0451] II-2. Конъюгированное активируемое антитело по варианту осуществления II-1, в котором АВ содержит изотип IgG1.
[0452] II-3. Конъюгированное активируемое антитело по варианту осуществления II-1 или II-2, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0453] II-4. Конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли:
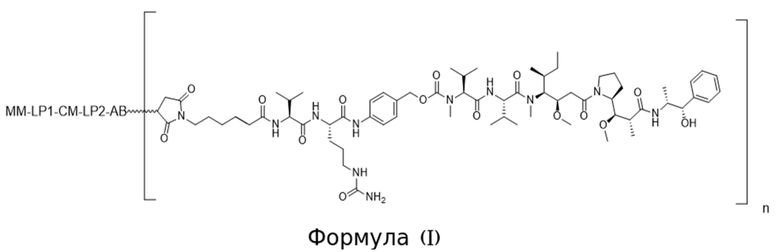
(а) где
(i) АВ представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии;
(iii) LP1 представляет собой первый линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207;
(iv) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(v) LP2 представляет собой второй линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и
(b) при этом «n» равно 2.
[0454] II-5. Конъюгированное активируемое антитело по варианту осуществления II-4, в котором АВ содержит изотип IgG1.
[0455] II-6. Конъюгированное активируемое антитело по варианту осуществления II-4 или II-5, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0456] II-7. Конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли:
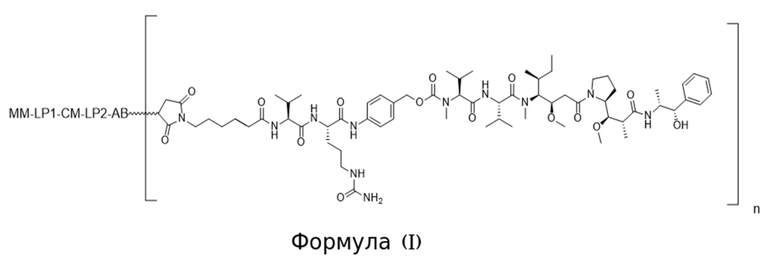
(а) где
(i) АВ представляет собой антитело, которое специфично связывается с CD71 человека и включает тяжелую цепь, содержащую последовательность SEQ ID NO: 167 и легкую цепь, содержащую последовательность SEQ ID NO: 19;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии;
(iii) LP1 представляет собой первый линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207;
(iv) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(v) LP2 представляет собой второй линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и
(b) при этом «n» равно 2.
[0457] II-8. Конъюгированное активируемое антитело по варианту осуществления II-7, в котором АВ содержит изотип IgG1.
[0458] II-9. Конъюгированное активируемое антитело по варианту осуществления II-7 или II-8, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0459] II-10. Конъюгированное активируемое антитело, содержащее структуру Формулы (I) или ее соли:
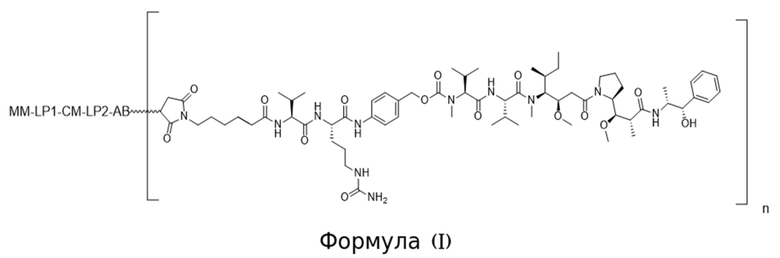
при этом указанный MM-LP1-CM-LP2-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека,
при этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170, и
при этом «n» равно 2.
[0460] II-11. Конъюгированное активируемое антитело по варианту осуществления II-10, в котором АВ содержит изотип IgG1.
[0461] II-12. Конъюгированное активируемое антитело по варианту осуществления II-10 или II-11, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0462] II-13. Конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли:
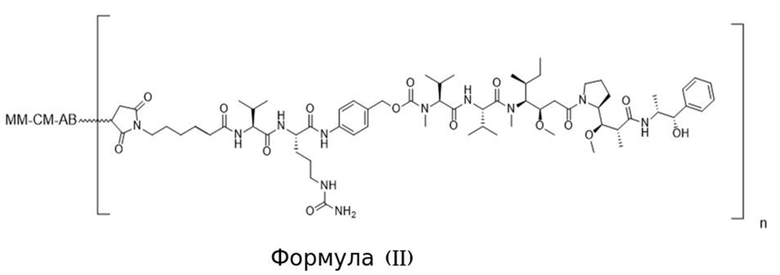
(а) где
(i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит
i. вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и
ii. вариабельная область легкой цепи, содержащая последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащая SEQ ID NO: 15;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии; и
(iii) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(b) при этом «n» равно 2.
[0463] II-14. Конъюгированное активируемое антитело по варианту осуществления II-13, в котором АВ содержит изотип IgG1.
[0464] II-15. Конъюгированное активируемое антитело по варианту осуществления II-13 или II-14, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0465] II-16. Конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли:
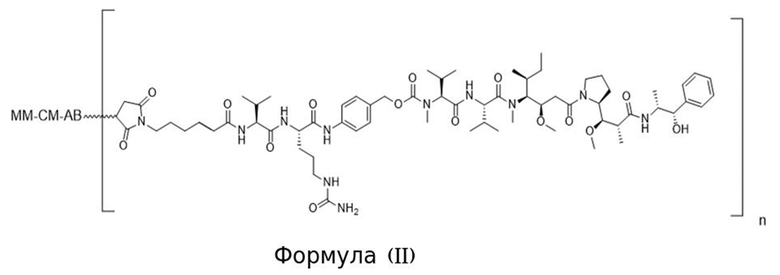
(а) где
(i) АВ представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 7;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии; и
(iii) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(b) при этом «n» равно 2.
[0466] II-17. Конъюгированное активируемое антитело по варианту осуществления II-16, в котором АВ содержит изотип IgG1.
[0467] II-18. Конъюгированное активируемое антитело по варианту осуществления II-16 или II-17, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0468] II-19. Конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли:
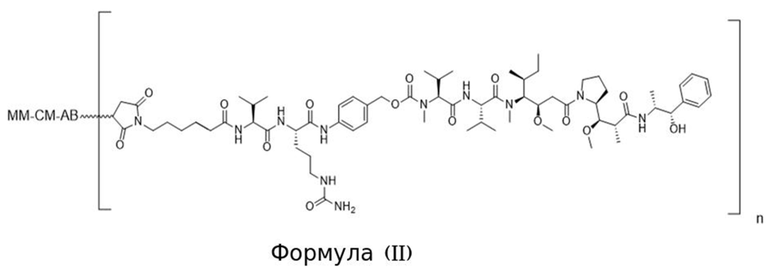
(а) где
(i) АВ представляет собой антитело, которое специфично связывается с CD71 человека и содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167 и легкую цепь, содержащую последовательность SEQ ID NO: 19;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии; и
(iii) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(b) при этом «n» равно 2.
[0469] II-20. Конъюгированное активируемое антитело по варианту осуществления II-19, в котором АВ содержит изотип IgG1.
[0470] II-21. Конъюгированное активируемое антитело по варианту осуществления II-19 или II-20, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0471] II-22. Конъюгированное активируемое антитело, содержащее структуру Формулы (II) или ее соли:
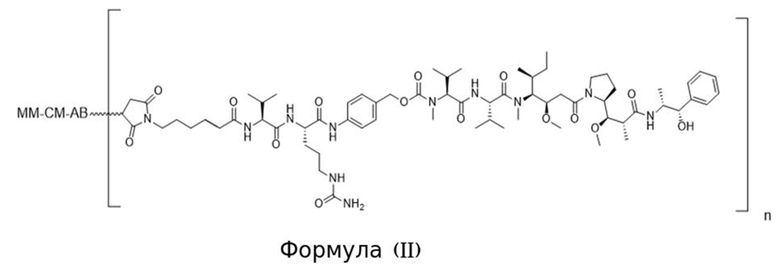
При этом MM-CM-AB представляет собой активируемое антитело, при этом AB представляет собой антитело, которое специфично связывается с CD71 человека,
При этом активируемое антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169, и
при этом «n» равно 2.
[0472] II-23. Конъюгированное активируемое антитело по варианту осуществления II-22, в котором АВ содержит изотип IgG1.
[0473] II-24. Конъюгированное активируемое антитело по варианту осуществления II-22 или II-23, в котором АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
[0474] II-25. Способ изготовления конъюгированного активируемое антитела, содержащего структуру Формулы (I) или ее соли:
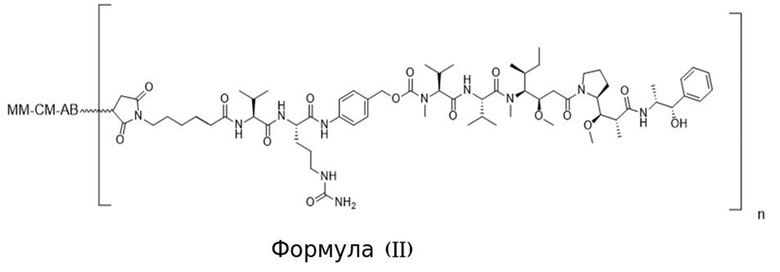
(а) где
(i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит
i. вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и
ii. вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащая SEQ ID NO: 15;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии;
(iii) LP1 представляет собой первый линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207;
(iv) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(v) LP2 представляет собой второй линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38;
и при этом «n» равно 2;
(b) способ, включающий
(i) восстановление активируемого антитела, содержащего MM-LP1-CM-LP2-AB, с восстановителем; и
(ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом.
[0475] II-26. Способ изготовления конъюгированного активируемого антитела, содержащего структуру Формулы (II) или ее соли:
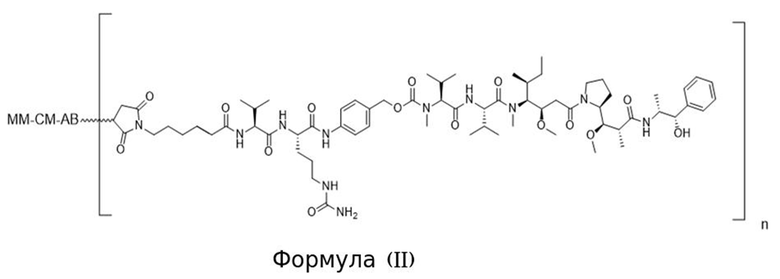
(а) где
(i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит
i. вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и
ii. вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащая SEQ ID NO: 15;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии;
(ii) СМ представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом СМ представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
и при этом «n» равно 2;
(b) способ, включающий
(i) восстановление активируемого антитела, содержащего MM-CM-AB, восстановителем; и
(ii) конъюгирование одного или нескольких vcMMAE с восстановленным активируемым антителом.
[0476] II-27. Фармацевтическая композиция, содержащая: конъюгированное активируемое антитело любому одному из вариантов II-1 до II-24; и, необязательно, фармацевтически приемлемый носитель.
[0477] II-28. Способ лечения, ослабления симптомов или задержки прогрессирования рака у субъекта, включающий введение терапевтически эффективного количества конъюгированного активируемого антитела по любому из вариантов осуществления II-1-II-24 или фармацевтического препарата, композицию воплощения II-27 субъекту, нуждающемуся в этом, для рака, выбранного из группы, состоящей из: рака желудка, рака яичника, рака пищевода, немелкоклеточного рака легкого, ER+рака молочной железы, тройного негативного рака молочной железы, колоректального рака, меланомы, рака предстательной железы, множественной миеломы, диффузной крупноклеточной В-лимфомы, мелкоклеточного рака головы и шеи, рака поджелудочной железы, мезотелиомы, неходжкинской лимфомы, гепатоцеллюлярной карциномы и глиобластомы.
[0478] II-29. Конъюгированное активируемое антитело по любому из вариантов осуществления II-1-II-24 или фармацевтическая композиция по варианту осуществления II-27 для применения в качестве лекарственного средства.
[0479] II-30. Конъюгированное активируемое антитело по любому из вариантов осуществления II-1-II-24 или фармацевтическая композиция по варианту осуществления II-27 для применения при лечении рака, при этом злокачественная опухоль выбрана из группы, состоящей из рака желудка, рака яичников, рака пищевода, немелкоклеточного рака легких, ER+рака молочной железы, тройного негативного рака молочной железы, колоректального рака, меланомы, рака простаты, множественной миеломы, диффузной крупноклеточной В-лимфомы, мелкоклеточного рака головы и шеи, рака поджелудочной железы, мезотелиомы, неходжкинской лимфомы, гепатоцеллюлярной карциномы и глиобластомы.
ПРИМЕРЫ
ПРИМЕР 1. Конъюгированные активируемые антитела против CD71 (AADC)
[0480] Представленные в данном документе исследования были предназначены для получения некоторых из активируемых антител против CD71 по данному изобретению.
[0481] Как описано в заявке на патент США № US 2016/0355599 A1, которая полностью включена в данное описание посредством ссылки, моноклональное антитело против CD71 M21 было получено с использованием технологии гибридомы мыши в соответствии с методиками, известными в данной области техники. Мышей иммунизировали внеклеточным доменом CD71 человека (ECD), и последующие гибридомы подвергали скринингу с использованием анализа цитотоксичности, и положительные по цитотоксичности клоны из данного анализа подтверждали с помощью ИФА для связывания полипептида ECD CD71 человека и подтверждали связывание клеточных поверхностей с помощью FACS. Моноклональное антитело против CD71 M21 содержит вариабельную область тяжелой цепи (VH) SEQ ID NO: 1 и вариабельную область легкой цепи (VL) SEQ ID NO: 2.
[0482] Следующие гуманизированные анти-CD71-антитела, которые были основаны на моноклональном антителе мыши M21 против CD71, также были протестированы: Ab21.10 LcB: HcA (VH SEQ ID NO: 3 и VL SEQ ID NO: 7), Ab21.11 LcB: HcB (VH SEQ ID NO: 4 и VL SEQ ID NO: 7), Ab21.12 LcB: HcC (VH SEQ ID NO: 5 и VL SEQ ID NO: 7) и M21 (VH SEQ ID NO: 1 и VL SEQ ID NO: 2). Способность различных анти-CD71-антител по данному изобретению связывать CD71 на клеточной поверхности была подтверждена FACS.
[0483] Все гуманизированные антитела против CD71 продемонстрировали связывание с CD71 человека и яванского макака, которое было сопоставимо со связыванием, продемонстрированным мышиным антителом CD71 М21. Связывание гуманизированных анти-CD71-антител было подтверждено на клеточной линии BxPC3 с помощью FACS. Вкратце, клетки BxPC3 метили мышиным моноклональным антителом Mab21 или huCD71 (Ab21.10, Ab21.11 и Ab21.12) в указанных концентрациях и затем детектировали с помощью меченного Alexa Fluor 647 козьего антимышиного или анти-человеческого IgG Alexa Fluor 647 соответственно.
[0484] В одном из иллюстративных исследований измеряли связывающую активность анти-CD71 Ab21.12 LcB: HcC (VH SEQ ID NO: 5 и VL SEQ ID NO: 7) с рекомбинантными CD71 (с помощью ИФА) и CD71-экспрессирующими клетками (с использованием проточной цитометрии) человека, обезьян яванских макак, мышей и крыс. Как продемонстрировано в приведенных в качестве примера результатах Таблицы 1, антитело против CD71 связывало рекомбинантный CD71 человека и обезьяны с эквивалентной аффинностью, измеренной с помощью ИФА, и которая была эквивалентна афинности человеческого холо-трансферрина к CD71 человечека. Антитело связывало CD71-экспрессирующие клеточные линии человека и обезьяны (клетки рака поджелудочной железы человека BxPC3 и первичные эпителиальные клетки почки обезьяны яванского макака соответственно) с эквивалентной аффинностью, измеренной методом проточной цитометрии. Не было измерено значительного связывания анти-CD71-антитела с клеточной линией экспрессирующей рекомбинантнй мышиный CD71 или крысиный CD71 (клетки гепатомы H-4-11-E скорости).
(ECD)
(клеточные линии)
ПРИМЕР 2. Поиск маскирующих фрагментов
[0485] Представленные в данном документе исследования были предназначены для идентификации и характеристики маскирующих фрагментов для применения в активируемых анти-CD71-антителах по данному изобретению.
[0486] Как описано в заявке на патент США № US 2016/0355599 A1, антитело против CD71 21.12, содержащее VH SEQ ID NO: 5 и VL SEQ ID NO: 7, использовали для скрининга случайной библиотеки пептидов X15 с общим разнообразием 6×1010, где Х - любая аминокислота, с использованием метода, аналогичного описанному в международной публикации РСТ № WO 2010/081173, опубликованной 15 июля 2010 г. Отбор состоял из одного раунда MACS и пяти раундов сортировки FACS. Первоначальную сортировку MACS проводили с использованием Dynabeads с белком-А (Invitrogen) и антитела против CD71 21.12 в концентрации 200 нМ. Для MACS было проведено скрининг около 1×1012 клеток и было собрано 1×107 клеток. Анти-CD71 21.12 конъюгировали с DyLight-488 (ThermoFisher), активность связывания CD71 была подтверждена, и анти-CD71 21.12-488 использовали в качестве флуоресцентного зонда для всех раундов FACS. Бактериальные клетки окрашивали и собирали положительные клоны следующим образом: 20 нМ анти-CD71 21.12-488 с 1×106 клеток, собранных в FACS 1-го раунда, 5 нМ анти-CD71 21.12-488 с 6,2×104 клеток, собранных в FACS 2-го раунда и 5 нМ анти-CD71 21.12-488 с 5×103 клетками и 1 нМ анти-CD71 21.12-488 с 5×102 клетками, собранными в FACS 3-го раунда, 1 нМ анти-CD71 21.12-488 с> 2×102 клетками, собранными в FACS 4-го и 5-го раунда. Было подтверждено, что положительная популяция из второго раунда FACS ингибирует связывание антитела против CD71 21.12-488 с рекомбинантным белком CD71. Индивидуальные пептидные клоны идентифицировали путем анализа последовательности из 5 нМ связующих из раунда 3 FACS и из 1 нМ связующего из раундов 3, 4 и 5 FACS.
[0487] Идентифицированные маскирующие фрагменты включают TF01 (QFCPWSYYLIGDCDI; SEQ ID NO: 16) и TF02 (NLCTEHSFALDCRSY; SEQ ID NO: 17). Маскирующие фрагменты TF01 и TF02 были обрезаны и отсканированы на аланин для получения семейств активируемых антител с различной эффективностью маскировки, включая маскирующий фрагмент TF02.13 (NLCTEHSAALDCRSY; SEQ ID NO: 18).
[0488] Данные маскирующие пептиды были использованы для генерирования активируемых антител против CD71 по данному изобретению. Последовательности некоторых из данных активируемых антител против CD71 продемонстрированы ниже в Таблице А. В некоторых вариантах осуществления эти активируемые антитела против CD71 включают разрезаемый фрагмент 2001 (ISSGLLSGRSDNH; SEQ ID NO: 91), разрезаемый фрагмент 3001 (AVGLLAPPGGLSGRSDNH; SEQ ID; NO: 97), разрезаемый фрагмент 2011 (ISSGLLSGRSDNP; SEQ ID NO: 156) или разрезаемый фрагмент 3011 (AVGLLAPPGGLSGRSDNP; SEQ ID NO: 164), как указано.
[0489] Хотя определенные последовательности, продемонстрированные ниже, содержат спейсерную последовательность SEQ ID NO: 138, специалисты в данной области техники оценят, что активируемые антитела против CD71 по данному изобретению могут включать любую подходящую спейсерную последовательность, такую как, например, спейсерная последовательность выбранная из группы, состоящей из QGQSGQG (SEQ ID NO: 138), QGQSGQ (SEQ ID NO: 109), QGQSG (SEQ ID NO: 139), QGQS (SEQ ID NO: 140), QGQ, QG, GQSGQG (SEQ ID NO: 143), QSGQG (SEQ ID NO: 144), SGQG (SEQ ID NO: 145), GQG, G или Q. В некоторых вариантах осуществления активируемые антитела против CD71 по данному изобретению могут не иметь спейсерной последовательности, присоединенной к его N-концу.
Таблица А Последовательности активируемых антител против CD71
Вариабельная область тяжелой цепи HuCD71_HcC
Аминокислотная последовательность
QVQLVQSGAEVKKPGASVKMSCKASGYTFTSYWMHWVRQAPGQGLEWIGAIYPGNS ETGYAQKFQGRATLTADTSTSTAYMELSSLRSEDTAVYYCTRENWDPGFAFWGQGTLITVSS (SEQ ID NO: 5)
Нуклеотидная последовательность
CAGGTGCAGCTGGTGCAGTCTGGCGCCGAAGTGAAGAAACCTGGCGCCTCCGTGA AGATGTCCTGCAAGGCCTCCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGCGAC AGGCTCCAGGCCAGGGCCTCGAATGGATCGGCGCCATCTACCCCGGCAACTCCGAGACAG GCTACGCCCAGAAGTTCCAGGGCAGAGCCACCCTGACCGCCGACACCTCCACCTCCACCG CCTACATGGAACTGTCCAGCCTGCGGAGCGAGGACACCGCCGTGTACTACTGCACCAGAG AGAACTGGGACCCCGGCTTCGCCTTCTGGGGCCAGGGCACCCTGATCACCGTGTCCTCC (SEQ ID NO: 206)
HuCD71_HcC-des тяжелая цепь
Аминокислотная последовательность
QVQLVQSGAEVKKPGASVKMSCKASGYTFTSYWMHWVRQAPGQGLEWIGAIYPGNS ETGYAQKFQGRATLTADTSTSTAYMELSSLRSEDTAVYYCTRENWDPGFAFWGQGTLITVSS ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLY SLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFP PKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSV LTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCL VKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHE ALHNHYTQKSLSLSPG (SEQ ID NO: 167)
Нуклеотидная последовательность
CAGGTGCAGCTGGTGCAGTCTGGCGCCGAAGTGAAGAAACCTGGCGCCTCCGTGA AGATGTCCTGCAAGGCCTCCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGCGAC AGGCTCCAGGCCAGGGCCTCGAATGGATCGGCGCCATCTACCCCGGCAACTCCGAGACAG GCTACGCCCAGAAGTTCCAGGGCAGAGCCACCCTGACCGCCGACACCTCCACCTCCACCG CCTACATGGAACTGTCCAGCCTGCGGAGCGAGGACACCGCCGTGTACTACTGCACCAGAG AGAACTGGGACCCCGGCTTCGCCTTCTGGGGCCAGGGCACCCTGATCACCGTGTCCTCCG CCAGCACCAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCCACCTCTGGCGG CACAGCTGCCCTGGGCTGCCTGGTGAAAGACTACTTCCCCGAGCCCGTGACCGTGTCCTG GAACTCTGGCGCCCTGACCAGCGGAGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGG CCTGTACTCCCTGTCCTCCGTGGTGACAGTGCCCTCCTCCAGCCTGGGCACCCAGACCTAC ATCTGCAACGTGAACCACAAGCCCTCCAACACCAAGGTGGACAAGAAGGTGGAACCCAA GTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCCCCTGAACTGCTGGGCGGACC TTCCGTGTTTCTGTTCCCCCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCCGAA GTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGACCCTGAAGTGAAGTTCAATTGGTAC GTGGACGGCGTGGAAGTGCACAACGCCAAGACCAAGCCCAGAGAGGAACAGTACAACTC CACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGA GTACAAGTGCAAGGTGTCCAACAAGGCCCTGCCTGCCCCCATCG AAAAGACCATCTCCAAGGCCAAGGGCCAGCCCCGCGAGCCCCAGGTGTACACACTGCCA CCTAGCCGGGAAGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAAGGCTTC TACCCCTCCGATATCGCCGTGGAATGGGAGAGCAACGGCCAGCCCGAGAACAACTACAA GACCACCCCACCTGTGCTGGACTCCGACGGCTCATTCTTCCTGTACTCCAAGCTGACCGTG GACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCAGCGTGATGCACGAGGCCCTG CACAACCACTACACCCAGAAGTCCCTGTCCCTGAGCCCCGGC (SEQ ID NO: 168)
HuCD71_HcC тяжелая цепь
Аминокислотная последовательность
QVQLVQSGAEVKKPGASVKMSCKASGYTFTSYWMHWVRQAPGQGLEWIGAIYPGNS ETGYAQKFQGRATLTADTSTSTAYMELSSLRSEDTAVYYCTRENWDPGFAFWGQGTLITVSS ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLY SLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFP PKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSV LTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCL VKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHE ALHNHYTQKSLSLSPGK (SEQ ID NO: 20)
Нуклеотидная последовательность
CAGGTGCAGCTGGTGCAGTCTGGCGCCGAAGTGAAGAAACCTGGCGCCTCCGTGA AGATGTCCTGCAAGGCCTCCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGCGAC AGGCTCCAGGCCAGGGCCTCGAATGGATCGGCGCCATCTACCCCGGCAACTCCGAGACAG GCTACGCCCAGAAGTTCCAGGGCAGAGCCACCCTGACCGCCGACACCTCCACCTCCACCG CCTACATGGAACTGTCCAGCCTGCGGAGCGAGGACACCGCCGTGTACTACTGCACCAGAG AGAACTGGGACCCCGGCTTCGCCTTCTGGGGCCAGGGCACCCTGATCACCGTGTCCTCCG CCAGCACCAAGGGCCCCTCCGTGTTCCCTCTGGCCCCTTCCAGCAAGTCCACCTCTGGCGG CACAGCTGCCCTGGGCTGCCTGGTGAAAGACTACTTCCCCGAGCCCGTGACCGTGTCCTG GAACTCTGGCGCCCTGACCAGCGGAGTGCACACCTTCCCTGCCGTGCTGCAGTCCTCCGG CCTGTACTCCCTGTCCTCCGTGGTGACAGTGCCCTCCTCCAGCCTGGGCACCCAGACCTAC ATCTGCAACGTGAACCACAAGCCCTCCAACACCAAGGTGGACAAGAAGGTGGAACCCAA GTCCTGCGACAAGACCCACACCTGTCCTCCCTGCCCTGCCCCTGAACTGCTGGGCGGACC TTCCGTGTTTCTGTTCCCCCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCCGAA GTGACCTGCGTGGTGGTGGACGTGTCCCACGAGGACCCTGAAGTGAAGTTCAATTGGTAC GTGGACGGCGTGGAAGTGCACAACGCCAAGACCAAGCCCAGAGAGGAACAGTACAACTC CACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAAGA GTACAAGTGCAAGGTGTCCAACAAGGCCCTGCCTGCCCCCATCG AAAAGACCATCTCCAAGGCCAAGGGCCAGCCCCGCGAGCCCCAGGTGTACACACTGCCA CCTAGCCGGGAAGAGATGACCAAGAACCAGGTGTCCCTGACCTGTCTGGTGAAAGGCTTC TACCCCTCCGATATCGCCGTGGAATGGGAGAGCAACGGCCAGCCCGAGAACAACTACAA GACCACCCCACCTGTGCTGGACTCCGACGGCTCATTCTTCCTGTACTCCAAGCTGACCGTG GACAAGTCCCGGTGGCAGCAGGGCAACGTGTTCTCCTGCAGCGTGATGCACGAGGCCCTG CACAACCACTACACCCAGAAGTCCCTGTCCCTGAGCCCCGGCAAG (SEQ ID NO: 21)
HuCD71_LcB
Аминокислотная последовательность
DIQMTQSPSSLSASVGDRVTITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVP SRFSGSGSGTDYTLTISSMQPEDFATYYCQQRRNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDE QLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKAD YEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 19)
HuCD71_LcB
Нуклеотидная последовательность
GACATCCAGATGACCCAGTCCCCATCCAGCCTGTCCGCCTCCGTGGGCGACAGAGT GACAATCACCTGTTCCGCCAGCTCCTCCGTGTACTACATGTACTGGTTCCAGCAGAAGCCC GGCAAGGCCCCCAAGCTGTGGATCTACTCCACCTCCAACCTGGCCTCCGGCGTGCCCTCC AGATTCTCCGGCTCTGGCTCCGGCACCGACTACACCCTGACCATCTCCAGCATGCAGCCC GAGGACTTCGCCACCTACTACTGCCAGCAGCGGCGGAACTACCCCTACACCTTCGGCCAG GGCACCAAGCTGGAAATCAAGCGGACCGTGGCCGCTCCCAGCGTGTTCATCTTCCCACCC TCCGACGAGCAGCTGAAGTCCGGCACCGCCAGCGTCGTGTGCCTGCTGAACAACTTCTAC CCCCGCGAGGCCAAGGTGCAGTGGAAGGTGGACAACGCCCTGCAGTCCGGCAACTCCCA GGAATCCGTCACCGAGCAGGACTCCAAGGACAGCACCTACTCCCTGTCCTCCACCCTGAC CCTGTCCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGCGAAGTGACCCACCAGG GCCTGTCCAGCCCCGTGACCAAGTCCTTCAACCGCGGCGAGTGC (SEQ ID NO: 208)
Активируемое антитело, легкая цепь анти-CD71-TF01-2001
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF01_2001 (SEQ ID NO: 141)]
Аминокислотная последовательность
[QGQSGQG] [QFCPWSYYLIGDCDIGGGSSGGSISSGLLSGRSDNHGGGSDIQMTQSPSSLSASVGDRVTITCS ASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDFATYYC QQRRNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVD NALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC ] (SEQ ID NO: 22)
Активируемое антитело, легкая цепь анти-CD71-TF02.13-2001
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF02.13_2001 (SEQ ID NO: 142)]
Аминокислотная последовательность
[QGQSGQG] [NLCTEHSAALDCRSYGGGSSGGSISSGLLSGRSDNHGGGSDIQMTQSPSSLSASVGDRVTITCS ASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDFATYYC QQRRNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVD NALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC ] (SEQ ID NO: 23)
Активируемое антитело, легкая цепь анти-CD71-TF02.13-3011
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF02.13_3011 (SEQ ID NO: 146)]
Аминокислотная последовательность
[QGQSGQG] [NLCTEHSAALDCRSYGGGSSGGSAVGLLAPPGGLSGRSDNPGGSDIQMTQSPSSLSASVGDR VTITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDF ATYYCQQRRNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKV QWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKS FNRGEC] (SEQ ID NO: 147)
Активируемое антитело, легкая цепь анти-CD71-TF02.13-2011
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF02.13_2011 (SEQ ID NO: 169)]
Аминокислотная последовательность
[QGQSGQG] [NLCTEHSAALDCRSYGGGSSGGSISSGLLSGRSDNPGGGSDIQMTQSPSSLSASVGDRVTITCS ASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDFATYYC QQRRNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVD NALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC ] (SEQ ID NO: 170)
Активируемое антитело, легкая цепь анти-CD71-TF01-3011
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF01_3011 (SEQ ID NO: 173)]
Аминокислотная последовательность
[QGQSGQG] [QFCPWSYYLIGDCDIGGGSSGGSAVGLLAPPGGLSGRSDNPGGSDIQMTQSPSSLSASVGDRV TITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDFA TYYCQQRRNYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQ WKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSF NRGEC] (SEQ ID NO: 174)
Вариабельная область легкой цепи активируемого антитела анти-CD71-TF02.13-2001
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF02.13_2001 домен VL (SEQ ID NO: 197)]
Аминокислотная последовательность
[QGQ SGQG] [NLCTEHSAALDCRSYGGGSSGGSISSGLLSGRSDNHGGGSDIQMTQSPSSLSASVGDRVTITCS ASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDFATYYC QQRRNYPYTFGQGTKLEIK] (SEQ ID NO: 198)
Вариабельная область легкой цепи активируемого антитела анти-CD71-TF02.13-3011
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF02.13_3011 домен VL (SEQ ID NO: 199)]
Аминокислотная последовательность
[QGQSGQG][NLCTEHSAALDCRSYGGGSSGGSAVGLLAPPGGLSGRSDNPGGSDIQMT QSPSSLSASVGDRVTITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGT DYTLTISSMQPEDFATYYCQQRRNYPYTFGQGTKLEIK] (SEQ ID NO: 200)
Вариабельная область легкой цепи активируемого антитела анти-CD71-TF02.13-2011
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF02.13_2011 домен VL (SEQ ID NO: 201)]
Аминокислотная последовательность
[QGQSGQG][NLCTEHSAALDCRSYGGGSSGGSISSGLLSGRSDNPGGGSDIQMTQSPSS LSASVGDRVTITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLT ISSMQPEDFATYYCQQRRNYPYTFGQGTKLEIK] (SEQ ID NO: 202)
Вариабельная область легкой цепи активируемого антитела анти-CD71-TF01-2001
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF01_2001 домен VL (SEQ ID NO: 195)]
Аминокислотная последовательность
[QGQSGQG][QFCPWSYYLIGDCDIGGGSSGGSISSGLLSGRSDNHGGGSDIQMTQSPSS LSASVGDRVTITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLT ISSMQPEDFATYYCQQRRNYPYTFGQGTKLEIK] (SEQ ID NO: 196)
Вариабельная область легкой цепи активируемого антитела анти-CD71-TF01-3011
[спейсер (SEQ ID NO: 138)] [huCD71Lc_TF01_3011 домен VL (SEQ ID NO: 203)]
Аминокислотная последовательность
[QGQ SGQG] [QFCPWSYYLIGDCDIGGGSSGGSAVGLLAPPGGLSGRSDNPGGSDIQMTQSPSSLSASVGDRV TITCSASSSVYYMYWFQQKPGKAPKLWIYSTSNLASGVPSRFSGSGSGTDYTLTISSMQPEDFA TYYCQQRRNYPYTFGQGTKLEIK] (SEQ ID NO: 204)
ПРИМЕР 3. Получение и характеризация активируемых анти-CD71-активируемых антител и анти-CD71-конъюгированных активируемых антител
[0490] Представленные в данном документе исследования были предназначены для генерирования некоторых активируемых антител против CD71 по данному изобретению.
[0491] Активируемые анти-CD71 антитела были получены с различной эффективностью маскировки (т.е. измерением способности ММ активируемого антитела блокировать связывание АВ активируемого антитела с его мишенью). Пептиды TF01 и TF02 мутировали путем укорочения и сканирования аланином, как описано в Примере 2, и эти варианты маскирующих пептидов использовали для создания семейств активируемых антител против CD71 по данному изобретению с диапазоном маскирующих эффективностей.
[0492] Связывание активируемых анти-CD71-антител по данному изобретению с клеточной линией NCI H292 (также называемой в данном документе H292) оценивали с использованием FACS. Вкратце, клетки метили антителом huCD71 или активируемым антителом в диапазоне концентраций и затем детектировали с помощью меченного Alexa Fluor 647 вторичного козьего антитела против человеческого IgG для определения кривой связывания. Как суммировано в приведенных ниже в качестве примера данных связывания в Таблице 2, активируемые анти-CD71-антитела данного изобретения демонстрируют диапазон маскирующих эффективностей по сравнению с родительским анти-CD71-антителом (huCD71 21.12 Ab).
[0493] Данные иллюстративные данные в Таблице 2 демонстрируют, что оба маскирующих фрагмента (TF01 и TF02.13) ингибируют связывание антитела против CD71 с CD71, когда активируемое антитело находится в интактном или неразрезанном состоянии. Данные иллюстративные данные также демонстрируют, что маскирующий фрагмент TF01 демонстрирует более высокую маскирующую эффективность, чем маскирующий фрагмент TF02.13.
ПРИМЕР 4. Характеризация связывающей активности активируемого антитела к CD71 и конъюгированного активируемого антитела к CD71
[0494] Данный пример демонстрирует, что активируемые анти-CD71 антитела и конъюгированные активируемые антитела против CD71 по данному изобретению демонстрируют более низкую аффинность связывания с рекомбинантным белком CD71 человека и яванского макака на клеточной поверхности, когда они находятся в интактной, нерасщепленной форме, по сравнению с их соответствующими расщепленными протеазой формами.,
[0495] Как продемонстрировано на Фиг. 3A и 3B, был использован твердофазный анализ связывания (ИФА) для демонстрации аффинности связывания активируемых антител против CD71 и конъюгированных активируемых антител против CD71, по данному изобретению с рекомбинантным CD71, как в их интактных, неразрезанных формах, так и в их активированных протеазой, разрезанных формах. В данных Примерах рекомбинантный белок яванского макака (Фиг. 3B) или человеческий CD71 (Фиг. 3A) (R&D Systems) наносили на планшеты для ИФА в концентрации 1 мкг/мл, а затем инкубировали с указанной концентрацией неповрежденного, неразрезанного анти-CD71 активируемого антитела (« анти - CD71- TF02.13-2011») по данному изобретению или интактного, неразрезанного Е2 (т.е. имеющий DAR от ~ 2) анти-CD71 конъюгированного активируемого антитела («анти - CD71 -TF02.13-2011-vc-MMAE E2 »данного раскрытия. Также анализировали были ли активируемое анти-CD71 антитело («анти - CD71- TF02.13-2011 (Акт)») или Е2 (т.е. имеющий DAR от ~ 2) анти-CD71 конъюгированное активируемое антитело, («анти - CD71-TF02.13-2011 (Акт)» по данному изобретению активны после обработки протеазой, которая расщепляет разрезаемый фрагмент активируемого компонента антитела.
[0496] Как обсуждено в данном документе, «Е2» относится к композиции данного конъюгированного активируемого антитела против CD71 по данному изобретению, которая содержит, по существу, только виды конъюгированного активируемого антитела, где лекарственная нагрузка составляет 2 молекулы лекарственного средства для каждой молекулы активируемого антитела, и по существу, не включает какие-либо или минимальные количества других возможных видов (т.е., когда нагрузка лекарством составляет 0, 1, 3, 4, 5, 6, 7, 8 и т. д.). Как обсуждено в данном документе, «DAR» относится к среднему соотношение между лекарственным средством (в данном случае MMAE) и активируемым антителом (т.е. CD71-TF02.13-2011) в популяции таких конъюгированных активируемых антител. Таким образом, в этом Примере, анти - CD71- TF02.13-2011-VC-ММАЕ Е2 относится к композиции, которая содержит только анти - CD71- TF02.13-2011 активируемое антитело, в котором каждое активируемое антитело имело загрузку лекарственного средства 2 эквивалентов vc-MMAE и DAR около 2, как описано в Примере 26.
[0497] Количество связанного антитела в каждом образце определяли путем инкубации и детекции козьим анти-человеческим антителом, конъюгированным с пероксидазой хрена, и обнаружением Ultra TMB (Thermo Fisher Scientific). Обобщенные данные по афинностям связывания продемонстрированы ниже:
Кd(app) нМ
Kd(app) нМ
(Активированное)
[0498] На Фиг. 3C и 3D демонстрируют в анализе FACS иллюстративные результаты, в которых активируемые антитела против CD71 по данному изобретению и конъюгированные активируемые антитела против CD71 по данному изобретению связывают клетки, экспрессирующие CD71 человека (Фиг. 3C) и CD71 яванского макака (Фиг. 3D) с более высокой константой диссоциации и более низкой аффинностью, чем у соответствующего активируемого протеазой анти-CD71-активируемого антитела или активируемой протеазой анти-CD71-конъюгированного активируемого антитела по данному изобретению. Данные иллюстративные результаты демонстрируют, что аффинность связывания разрезанных, активируемых протеазой анти-CD71-активируемых антител по данному изобретению и разрезанных активируемых протеазой анти-CD71-конъюгированных активируемых антител по данному изобретению связываются с клетками с аффинностью аналогично родительскому анти-CD71-антителу, демонстрируя, таким образом, эффект маскирующего фрагмента в ингибировании связывания анти-CD71 с его мишенью в интактном активируемом антителе или интактном конъюгированном активируемом антителе.
[0499] В иллюстративном исследовании, продемонстрированном на Фиг. 3C и 3D, связывание антител по данному изобретению с указанными клеточными линиями осуществляли с использованием стандартного метода мечения FACS. Вкратце, клетки метили указанными антителами или активируемыми антителами по данному изобретению: контрольное антитело (AB095), человеческое антитело против CD71 (Ab 21.12, имеющее VH SEQ ID NO: 5 и VL SEQ ID NO: 7), активируемое антитело против CD71 (анти-CD71 TF02.13-2011) или E2 (т.е. имеющее DAR ~ 2), активируемое антитело против CD71 (анти-CD71 TF02.13-2011-vcMMAE) E2). Кроме того, аффинность связывания активируемого антитела против CD71 (анти-CD71 TF02.13-2011 (Act)) и E2 (т.е. имеющего DAR ~ 2) активируемого антитела, конъюгированного с CD71 (анти-CD71 TF02). 13-2011-vcMMAE E2 (Act)) также анализировали после активации протеазы, которая расщепляла разрезаемый фрагмент в нем. Каждое тестируемую субстанцию наносили в указанных концентрациях и затем детектировали с использованием вторичного антитела козы против человеческого IgG, меченного Alexa Fluor 647.
[0500] Таблица 3В ниже демонстрирует значения ЕС50 на основе кривых связывания, изображенных на Фиг. 3C в 3D. Данные результаты демонстрируют, что интактное активируемое антитело и интактное конъюгированное активируемое антитело связываются с его мишенью с более низкой аффинностью, чем их активированные протеазой аналоги, и что активированные протеазой активируемые антитела связываются со сродством, которое было сходным с таковым у родительского антитела против CD71.
FACS EC50
FACS EC50
(Активированный)
[0501] В аналогичном иллюстративном исследовании анализы ИФА и проточной цитометрии использовали для демонстрации аффинности связывания анти-CD71-антител, анти-CD71-конъюгированных антител, анти-CD71-активируемых антител (интактная, нерасщепленная форма и активированная протеазой, разрезанная форма) и анти-CD71 конъюгированных активируемых антител (интактная, нерасщепленная форма и активированная протеазой, разрезанная форма) по данному изобретению с рекомбинантным CD71 с рекомбинантным CD71 человека и яванского макака и клеточными линиями, экспрессирующими CD71 человека и яванского макака. Тестируемыми субстанциями были антитело против CD71 Ab21.12 (VH с SEQ ID NO: 5 и VL с SEQ ID NO: 7), конъюгированное антитело против CD71 Ab21.12-vcMMAE E2 (т.е. имеющее DAR ~ 2) активируемое антитело анти-CD71-TF02.13-2011 и конъюгированное с DAR2 активируемое антитело анти-CD71-TF02.13-2011-vcMMAE E2 (т.е. имеющее DAR ~ 2).
[0502] В Примерах ИФА рекомбинантные ECD-белки яванского макака или CD71 человека наносили на планшеты для ИФА и затем инкубировали с одной из ряда концентраций тестируемых изделий по данному изобретению с последующим измерением количества связанного тестируемого изделия вторичным антитела. Тестируемые изделия, которые были активированы, инкубировали с ферментом протеазой матриптазой. Иллюстративные кажущиеся значения Kd для каждого испытуемого изделия продемонстрированы в Таблице 3C.
[0503] В иллюстративном исследовании, также продемонстрированном в Таблице 3C, связывание антител по данному изобретению с указанными клеточными линиями проводили с использованием стандартного метода мечения FACS. Результаты проточной цитометрии отражают среднее измеренное значение Kapp для четырех линий клеток человека (рак молочной железы человека HCC1806, колоректальный рак человека HT-29, рак легкого человека NCI-H292 и рак легкого человека NCI-H520) и одной линии клеток CHO-K1, экспрессирующих CD71 обезьяны яванского макака. Иллюстративные очевидные значения Kd для каждого испытуемого изделия продемонстрированы в Таблице 3C.
рчCD71
ряCD71
[0504] Данные иллюстративные результаты демонстрируют, что интактные активируемые антитела и интактные конъюгированные активируемые антитела демонстрируют более низкую видимую аффинность к CD71 по сравнению с их активированными аналогами или их родительскими антителами.
ПРИМЕР 5. Экспрессия CD71 в многих первичных и метастатических опухолях, полученных от пациента
[0505] В этом Примере продемонстрировано, что CD71 экспрессируется в большом разнообразии первичных и метастатических типов опухолей иммуногистохимическим (ИГХ) окрашиванием с использованием антитела против CD71.
[0506] Фиг. 1 и 2 демонстрируют, что CD71 экспрессируется на высоком уровне в большом количестве первичных и метастатических опухолевых образцов, с применением ИГХ окрашивания коммерческим анти-CD71 антителом многих первичных опухолей полученных от пациентов и микромассивов на тканях (TMA - tissue microarrays) метастазов, полученных от пациентов. На Фиг. 1 продемонстрировано окрашивание ИГХ CD71 при раке головы и шеи (1), раке шейки матки (2), раке молочной железы (3), неходжкинской лимфоме (НХЛ) в лимфатических узлах (4), раке легкого (5), раке мочевого пузыря (6), раке яичников (7) и раке пищевода (8). Фиг. 2 демонстрирует окрашивание ИГХ CD71 в тканевом микромассиве (TMA), состоящем из сердцевин метастатических опухолей, демонстрирует умеренный или высокий уровень экспрессии CD71 в большинстве сердцевин. Суммированные данные по экспрессии CD71 в образцах опухолей человека с помощью иммуногистохимии (ИГХ) продемонстрированы в Таблице 4А.
ПРИМЕР 6. Эффективность маскировки и эффективность активируемого анти-CD71-AADC in vivo в модели ксенотрансплантата CRC
[0507] Данный пример демонстрирует, что маскирующая эффективность активируемых антител против CD71 человека с конъюгированными токсинами (AADC) по данному изобретению является фактором его эффективности в модели ксенотрансплантата мыши с колоректальным раком (CRC) HT29.
[0508] В данных исследованиях опухоли ксенотрансплантата HT29 у мышей выращивали до среднего объема 150 мм3. Затем мышей рандомизировали в группы и в первый день дозировали по 3 мг/кг (или иным образом указано) каждого указанного испытуемой субстанции. Средний объем опухоли ± СОС наносили на график для каждой временной точки.
[0509] На Фиг.4А продемонстрировано, что иллюстративный анти-CD71 AADC по данному изобретению (анти-CD71 TF01-3011-vc-MMAE) с маскировочным фрагментом с более высокой аффинностью продемонстрировал некоторое ингибирование роста опухоли относительно контроля носителя после однократной дозы 3 мг/кг. Для сравнения, на Фиг.4B продемонстрирован типовой анти-CD71 AADC по данному изобретению (анти-CD71 TF02.13-3011-vc-MMAE) с маскировочным фрагментом с более низкой аффинностью, но с тем же разрезаемым субстратом, который по существу продемонстрировал полную регрессию ксенотрансплантата после однократного введения 3 мг/кг дозы. На Фиг.4C продемонстрирован иллюстративный анти-CD71 AADC по данному изобретению (анти-CD71 TF02.13-3011-vc-MMAE) с маскировочным фрагментом с более низкой аффинностью, но с тем же разрезаемым субстратом, который также продемонстрировал по существу полную регрессию ксенотрансплантата HT29 при обоих единичных дозировках 2 мг/кг или 3 мг/кг. Данные иллюстративные результаты демонстрируют, что AADC с маскирующим фрагментом более низкой аффинности, продемонстрировал более высокую эффективность, чем AADC с маскирующим фрагментом более высокой аффинности.
ПРИМЕР 7. Разрезаемые субстраты и эффективность активируемого анти-CD71-AADC in vivo в моделях ксенотрансплантата CRC
[0510] В данном Примере продемонстрировано влияние разрезаемого субстрата на эффективность типичных активируемых антител, конъюгированных с CD71 человека (AADC) по данному изобретению, в модели ксенотрансплантата мыши.
[0511] В данных исследованиях опухоли ксенотрансплантата НТ29 (колоректальный рак) у мышей выращивали до среднего объема 150 мм3. Затем мышей рандомизировали в группы и в первый день вводили дозу указанного количества указанной испытуемой субстанции. Средний объем опухоли ± СОС наносили на график для каждой временной точки.
[0512] Фиг. 5 демонстрирует, что иллюстративные анти-CD71 AADC по данному изобретению (CD71 TF02.13-2011-vc-MMAE) демонстрируют полную или почти полную регрессию в модели ксенотрансплантата мыши при двух разных дозировках. Данные иллюстративные данные демонстрируют, что эффективность указанного AADC (анти-CD71 TF02.13-2011-vc-MMAE) с менее разрезаемым субстратом по существу такая же, как эффективность AADC (анти-CD71 TF02.13-3011- vc-MMAE) с более разрезаемым субстратом, продемонстрированная на Фиг. 4В и 4С.
ПРИМЕР 8. Эффективность активируемого анти-CD71-AADC in vivo в моделях с множественными ксенотрансплантатами
[0513] В данном Примере продемонстрирована эффективность анти-CD71 TF02.13-2011-vc-MMAE AADC по данному изобретению при двух различных соотношениях лекарственное средство-антитело (DAR) в различных моделях мышиных ксенотрансплантатов.
[0514] В данных исследованиях опухоли ксенотрансплантата рака яичников (OV-90; Фиг. 6B), рака желудка (NCI-N87; Фиг. 6A), рака молочной железы ER + (BT474; Фиг. 6C) или тройного негативного рака молочной железы (HCC-70; Фигура 6D) у мышей выращивали до среднего объема 150 мм3. Затем мышей рандомизировали в группы и в первый день вводили дозу указанной испытуемой субстанции. Количество каждого AADC, которое вводили, подбирали в зависимости от количества токсина MMAE, так что анти-CD71 TF02.13-2011-vc-MMAE (имеющий средний DAR ~ 3) вводили в дозе 3 мг/кг и анти-CD71 TF02.13-2011-vc-MMAE E2 (со средним DAR ~ 2) вводили в дозе 4,3 мг/кг. Средний объем опухоли ± СОС наносили на график для каждой временной точки.
[0515] Фиг. 6А-6В демонстрируют, что иллюстративные анти-CD71 AADC по данному изобретению (анти-CD71 TF02.13-2011-vc-MMAE) демонстрируют полную или почти полную регрессию в модели ксенотрансплантата мыши с раком яичника и желудка. Анти-CD71 TF02.13-2011-vc-MMAE E2 (т.е. имеющий DAR ~ 2), который содержал очищенные AADC, каждый с двумя эквивалентами токсина MMAE, также продемонстрировал завершенные регрессии в тех же моделях. Во всех случаях, таких как продемонстрированные на Фиг. 6C и 6D, даже когда полная или почти полная регрессия не наблюдалась, активности E2 (т.е. имеющие DAR ~ 2) и AADC с более высоким DAR были эквивалентными или почти эквивалентными. Данные иллюстративные данные демонстрируют, что согласованная по дозе эффективность E2 (т.е. имеющего DAR ~ 2) AADC (анти-CD71 TF02.13-2011-vc-MMAE E2) сравнима с соответствующей более высокой DAR AADC.
[0516] Как продемонстрировано в Таблице 4В, эффективность AADC против CD71 TF02.13-2011-vc-MMAE E2, имеющего DAR ~ 2, была протестирована против различных клеточных линий (PDX) или раковых (CDX) клеток в мышиной модель ксенотрансплантата и получала дозу, меньшую или равную 6 мг/кг, один или два раза. Результаты, которые обобщены ниже, демонстрируют, что AADC продемонстрировал, по меньшей мере, некоторую эффективность, от регрессии до стазиса до ингибирования роста опухоли почти во всех тестируемых моделях.
ПРИМЕР 9. Биоаналитические анализы для определения уровней конъюгированного и свободного токсина, а также интактного и общего AADC в образцах от обработанных животных
[0517] В данном Примере продемонстрированы иллюстративные рабочие процессы для анализов для измерения уровней метаболитов в тестируемых образцах, включая уровни конъюгированного и свободного токсина, а также уровни интактных и общих конъюгированных активируемых антител.
[0518] На Фиг.7А, 7В и 7С продемонстрированы схематические рабочие процессы для типичных биоаналитических анализов для определения количества интактного и общего (т.е. объединенного интактного и расщепленного) активируемого антитела у обработанных обезьян, а также количества интактного AADC (с нерасщепленным токсином) и расщепленный токсин у обработанных обезьян. Используя иллюстративный протокол анализа, изображенный на Фиг. 7А, общее количество интактного и расщепленного активируемого антитела (например, анти-CD71 TF02.13-3001) в образце может быть захвачено магнитными шариками белка А и впоследствии денатурировано (RapiGest™), уменьшено с помощью дитиотреитола, алкилированного и трипсина. переваривается. Полученные пептидные фрагменты могут быть проанализированы с использованием обращенно-фазовой LC-MS/MS для идентификации и количественного определения характерных пептидных фрагментов из тяжелой и легкой цепей антитела. В данном конкретном анализе один или несколько пептидов, которые характерны для части антитела активируемого антитела или конъюгированного активируемого антитела, могут быть идентифицированы и количественно определены с использованием обращенно-фазовой LC-MS/MS для определения общего количества как интактного, так и расщепленного активируемого антитела, таким образом измерение количества общего интактного и расщепленного активируемого антитела в образце.
[0519] В том же анализе один или несколько пептидов, которые характерны для нерасщепляемого фрагмента (CM) и маскирующего фрагмента (MM) активируемого антитела (например, с N-конца легкой цепи анти-CD71-TF02.13- 2011) можно идентифицировать и количественно определить с помощью обращенно-фазовой LC-MS/MS для определения общего количества интактного активируемого антитела, таким образом измеряя количество интактного активируемого антитела в образце.
[0520] Используя иллюстративный протокол анализа, изображенный на Фиг. 7B, можно определить общее количество AADC (например, анти-CD71 TF02.13-3001-vc-MMAE), которое остается конъюгированным с его токсином (MMAE) в образце. В данном анализе общее количество активируемого антитела, как конъюгированного, так и неконъюгированного, захватывается белком А. MabSelect®. Эта фракция обрабатывается цистеиновой протеазой для разрезания линкер-токсина, таким образом высвобождая любой токсин, который остался конъюгированным с его активируемым антителом. Используя обращенно-фазовую LC-MS/MS для анализа расщепленной цистеиновой протеазой фракции, характерный токсин (например, MMAE), который оставался конъюгированным с захваченным активируемым антителом, может быть идентифицирован и количественно определен, таким образом, измеряя количество конъюгированного токсина в образце.
[0521] Используя иллюстративный протокол анализа, изображенный на Фиг. 7C, можно определить общее количество токсина в образце, которое включает токсины, отщепленные от AADC у животного. В данном иллюстративном анализе, изображенном на Фиг. 7C, общий белок из образца осаждается, оставляя свободный неконъюгированный токсин (MMAE) в супернатанте. Супернатант может быть проанализирован с использованием обращенно-фазовой LC-MS/MS для идентификации и количественного определения характеристического токсина (например, MMAE), который не связывался с осажденным белком, таким образом измеряя количество неконъюгированного токсина в образце. В эти анализы были включены внутренние стандарты (например, SILu ™ Mab, Sigma-Aldrich) для количественного анализа.
ПРИМЕР 10. Переносимость и стабильность АЦП анти-CD71-AADC и анти-CD71 у обезьян яванских макак
[0522] Данный пример демонстрирует, что активируемые против человеческого CD71 антитела с конъюгированными токсинами (AADC) по данному изобретению хорошо переносятся у обезьян яванского макака по сравнению с соответствующим родительским конъюгатом с антителом против CD71 (ADC) на основании одного или нескольких гематологических показателей и клинических данных. симптомы. Результаты суммированы ниже в Таблице 5 и суммированы на Фигуре 17.
[0523] В данном исследовании обезьян яванских макак лечили внутривенно указанным AADC или ADC с указанной дозировкой в дни 1 и 21. Только одна доза переносилась для анти-CD71-TF02.13-3011-vc-MMAE AADC и только одна доза вводилась для анти-CD71-vc-MMAE E2 (т.е. с DAR ~ 2) ADC. Стабильность активируемых антител (т.е. общее активируемое антитело против интактного активируемого антитела) в образцах, полученных от каждого животного, выполняли, как описано в Примере 9, с использованием обращенно-фазовой ЖХ/МС/МС)
сутки)
(на мкл)
Толерантность
(~ 3)
(~ 3)
Переносимый
(~ 2)
Переносимый
(~ 2)
[0524] Потеря массы тела определялась по наименьшей массе измерения после 1-й введенной дозы. Базовое количество нейтрофилов составляло не менее 1000 на мкл.
[0525] Как продемонстрировано в Таблице 5, немаскированный E2 (т.е. имеющий DAR ~ 2) ADC (E2 анти-CD71-vc-MMAE) продемонстрировал летальность в течение 8 дней после первой дозы.
[0526] Иллюстративные результаты, обобщенные в Таблице 5, также демонстрируют, что AADC с менее разрезаемым субстратом (т.е. анти-CD71 TF02.13-2011-vc-MMAE и анти-CD71 TF02.13-2011-vc-MMAE E2) лучше переносятся и демонстрируются более высокий уровень стабильности кровообращения у примата, не являющегося человеком, чем соответствующий AADC с более разрезаемым субстратом (т.е. анти-CD71 TF02.13-3011-vc-MMAE). Наконец, иллюстративные результаты демонстрируют, что AADC (анти-CD71 TF02.13-2011-vc-MMAE E2 (т.е. имеющий DAR ~ 2)) продемонстрировал заметно улучшенную переносимость у примата, не являющегося человеком, чем соответствующий более высокий DAR AADC (анти-CD71 TF02.13-2011-vc-MMAE).
ПРИМЕР 11. Стабильность и фармакокинетика анти-CD71-AADC у обезьян яванских макак
[0527] Данный пример демонстрирует стабильность и фармакокинетику активируемых антител против CD71 человека с конъюгированными токсинами (AADC) по данному изобретению у обезьян яванских макак. В данном исследовании,
[0528] В данном исследовании, результаты которого более подробно описаны в Примерах с 12 по 14, четыре группы обезьян яванских макак были обработаны внутривенно указанным E2 (т.е. имеющим DAR ~ 2) анти-CD71 TF02.13-2011- vc-MMAE или контроль транспортного средства с указанной дозировкой и графиком, показанным в Таблице 6. Образцы от каждого животного были получены в дни, указанные в Таблице 6, которые были проанализированы на общее и интактное активируемое антитело и конъюгированный и неконъюгированный токсин MMAE способом, описанным в Примере 9.
День 22: + 0,003, 0,17, 1, 2, 4, 7
День 22: + 0,003, 0,17, 1, 2, 4, 7
День 22: + 0,003, 0,17, 1, 2, 4, 7
[0529] Как продемонстрировано в Таблице 6, обезьянам яванским макакам вводили либо носитель, либо анти-CD71 TF02.13-2011-vc-MMAE E2 AADC медленным внутривенным болюсным введением при уровнях дозы и продемонстрированных графиках. Образцы крови для токсикокинетического анализа обрабатывали в плазму и хранили при -80°C до анализа. Образцы сыворотки крови получали для анализа на лекарство перед введением дозы и через 7 дней после второй дозы для групп 1-3 и через 22 дня после первой дозы для группы 4. Все группы содержали трех животных (2 самца и 1 самка).
ПРИМЕР 12. Стабильность анти-CD71-AADC у обезьян яванских макак
[0530] В данном Примере продемонстрирована стабильность активируемых антител против CD71 человека с конъюгированными токсинами (AADC) по данному изобретению у обезьян яванского макака.
[0531] Как продемонстрировано в иллюстративных результатах на Фиг. 8A и 8B, концентрации в плазме общего и интактного активируемого антитела (анти-CD71 TF02.13-2011) введенного AADC определяли способом, описанным в Примерах 9 и 11. Нижние пределы количественного определения (LLOQ) для интактного и общего активируемого антитела составляли 0,633 нМ, как указано. Данные иллюстративные результаты демонстрируют, что концентрация интактных активируемых антител в плазме обычно поддерживалась в течение 21-дневного интервала дозирования и на уровне, который был пропорционален первоначально введенной дозе. Даже через 7 дней после введения дозы около 80% конъюгированного активируемого антитела (анти-CD71-TF02.13-2011-vc-MMAE E2) в плазме находилось в неповрежденной пролекарственной форме.
[0532] Как продемонстрировано в иллюстративных результатах на Фиг. 9A и 9B, концентрации в плазме конъюгированного и неконъюгированного токсина MMAE определяли способом, описанным в Примерах 9 и 11. Нижний предел количественного определения (LLOQ) составлял 1,77 нМ для конъюгированного MMAE и 0,31 нМ для неконъюгированного MMAE, как указано. Данные иллюстративные результаты демонстрируют, что менее 1% от общего количества ММАЭ, измеренного в концентрации в плазме, находилось в неконъюгированной форме.
ПРИМЕР 13. Изменение соотношения лекарственного средства к активируемому антителу после введения анти-CD71-AADC обезьянам яванским макакам
[0533] В данном Примере продемонстрировано наблюдаемое отношение лекарственного средства (MMAE) к активируемому антителу (анти-CD71 TF02.13-2011) в плазме после дозирования обезьян яванских макак активируемыми антителами против CD71 человека с конъюгированными токсинами (AADC) по данному изобретению.
[0534] Концентрации в плазме общего и интактного активируемого антитела (анти-CD71 TF02.13-2011) определяли способом, описанным в Примерах 9 и 11. Как продемонстрировано на Фиг. 10 отношение лекарственное средство к активируемому антителу рассчитывали путем деления концентрации конъюгированного MMAE (см. Пример 12 и Фиг. 9A) на концентрацию общего активируемого антитела (см. Пример 11 и Фиг. 8A) в каждый указанный момент времени. Средние коэффициенты и стандартные отклонения для конкретных моментов времени продемонстрированы в Таблице 7. Данные иллюстративные результаты демонстрируют, что наблюдаемое отношение лекарственного средства ММАЕ к активируемому антителу изменялось со временем таким образом, который был согласован между каждой из трех (3) доз. В каждой дозе рассчитанный DAR интактного AADC начинался через ~ 2 сразу после и в течение 4 часов после введения, и что это соотношение снижалось до около 1 около через 96 часов (т.е. около 4 дней) после введения дозы.
Пример 14. Фармакокинетические параметры анти-CD71-AADC у обезьян яванских макак
[0535] В данном Примере продемонстрированы фармакокинетические параметры активируемых антител против CD71 человека с конъюгированными токсинами (AADC) по данному изобретению у обезьян яванского макака.
[0536] Концентрации в плазме общего и интактного активируемого антитела (анти-CD71 TF02.13-2011) определяли способом, описанным в Примерах 9 и 11. Как продемонстрировано в Таблице 8, средняя Cmax для данного аналита была основана на максимальной наблюдаемой концентрации в плазме. Среднее значение AUC0-7 основывалось на площади под кривой концентрация-время в плазме от 0 до 7 дней. Периоды полураспада для общего конъюгированного активируемого антитела, интактного конъюгированного активируемого антитела и конъюгата MMAE варьировались от 2,5 до 6,3 дня. Оценки периода полураспада не были получены для неконъюгированного MMAE.
Пример 15. Анализ антител против лекарственного средства
[0537] В данном Примере описано использование мостикового анализа для мониторинга образования антител против лекарств (ADA - anti-drug antibodies) у тестируемых животных.
[0538] Образцы плазмы для анализа ADA были собраны до исследования и через 7 дней после второй дозы. Антитела против лекарственного средства были обнаружены у 3 из 9 животных, получавших дозу в исследовании.
Пример 16. Цитотоксичность in vitro конъюгированного активируемого антитела против CD71
[0539] В данном Примере описаны анализы цитотоксичности in vitro на линиях клеток, полученных из опухолей человека, интактных и активированных анти-CD71-конъюгированных активируемых антител по данному изобретению по сравнению с ADC изотипического контроля.
[0540] Иллюстративная цитотоксическая активность in vitro конъюгированного активируемого антитела по данному изобретению анти-CD71-TF02.13-2011-vcMMAE E2 (HC SEQ ID NO: 167 и LC SEQ ID NO: 169) с предварительной обработкой матриптазой или без нее оценивали и сравнивали с контрольным конъюгированным антителом, не связывающимся с CD71, изотипа (AB095-vcMMAE с DAR 2, при этом AB095 специфичен для столбнячного токсина). Цитотоксичность тестируемых изделий тестировали на HT29 (клеточная линия колоректального рака человека), H292 (клеточная линия рака легкого человека), H520 (клеточная линия рака легкого человека) и HCC1806 (клеточная линия рака молочной железы человека) путем инкубации каждой тестируемой субстанции с каждой клеточной линией в течение 5 дней, а затем измерения жизнеспособности клеток в диапазоне концентраций каждой испытуемой субстанции, чтобы определить EC50 для каждого испытуемой субстанции. Результаты суммированы ниже в Таблице 9.
ЕС50 (нМ)
ЕС50 (нМ)
ЕС50 (нМ)
ЕС50 (нМ)
[0541] Данные иллюстративные результаты демонстрируют, что цитотоксичность in vitro интактного анти-CD71-конъюгированного активируемого антитела была сходной с таковой у изотипического контроля, но была существенно повышена при активации матриптазы.
ПРИМЕР 17. Связывание Fc и активация комплемента конъюгированным активируемым антителом против CD71
[0542] Данный пример продемонстрировал способность анти-CD71 конъюгированных активируемых антител по данному изобретению опосредовать механизмы, основанные на эффекторных функциях, такие как антителозависимая клеточно-опосредованная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC).
[0543] “Кристаллизуемый фрагмент” (Fc) часть антитела IgG может опосредовать множество функций, некоторые из которых происходят посредством связывания с рецепторами Fc и C1q. Данные функции включают индукцию цитокинов, антитело-зависимую клеточную цитотоксичность (ADCC), комплемент-зависимую цитотоксичность (CDC) через активацию классического пути системы комплемента, фагоцитоз и гомеостаз антител посредством рециркуляции IgG. (Ravetch et al ., Annu Rev Immunol., 2001; 19: 275-290; Roopenian et al ., Nat Rev Immunol. 2007; 7: 715-725).
[0544] Гомеостаз антител частично регулируется Fc-родственным неонатальным рецептором FcRn, который присутствует в эпителиальных клетках кишечника, эндотелиальных клетках сосудов и профессиональных антигенпрезентирующих клетках. Внутриклеточно FcRn присутствует в везикулах; в кислых эндосомах при низком pH он может связывать Fc-часть IgG, которая была поглощена пиноцитозом. Затем IgG высвобождается, когда эндосомы возвращаются на поверхность клетки в результате воздействия внеклеточного нейтрального рН. Данный процесс позволяет контролировать перенос IgG через однослойные эпителиальные барьеры и защищает молекулы IgG от катаболизма, продлевая период полураспада IgG в сыворотке. (Roopenian). Действительно, было продемонстрировано, что мутации, которые усиливают связывание FcRn при низком рН, но поддерживают низкое связывание при физиологическом рН, имеют более длительное время полужизни в сыворотке. (Hinton et al., J. Biol. Chem. 2004; 279: 6213-6216; Hinton et al., J. Immunol. 2006; 176: 346-356)
[0545] Система человеческого FcγR состоит из активирующих (FcγRI, FcγRIIa и FcγRIIIa) и ингибирующих (FcγRIIb) рецепторов. FcγRI, высокоаффинный рецептор IgG1, экспрессируется клетками моноцитарного происхождения. (Li et al., J. Immunol. 2008; 181: 1012-1018) FcγRIIa представляет собой более широко экспрессируемый низкоаффинный IgG-рецептор, который преимущественно связывает иммунные комплексы. (Littaua et al., J. Immunol., 1990; 144: 3183-3186). FcγRIIb в основном экспрессируется на моноцитарной линии и В-клетках и представляет собой низкоаффинный ингибитор IgG-рецептора. При связывании FcγRIIb с комплексами IgG кальций-зависимые процессы, такие как дегрануляция, фагоцитоз, ADCC, высвобождение цитокинов и провоспалительная активация, блокируются. (Clynes et al., Nat. Med ., 6: 446-446 (2000); Minard-Colin et al., Blood, 112: 1205-1213 (2008); и Hamaguchi et al., J. Exp. Med. 203: 743-753 (2006). FcγRIIIa является рецептором с низким сродством, ответственным за ADCC-активность NK-клеток. (Ravetch) Чтобы добавить к разнообразию рецепторов Fcγ, существуют полиморфные варианты FcγRIIa (H131 против R131) и FcγRIIIa (V158 против F158), которые имеют различия в сродстве к молекулам IgG. (Bruhns et al., Blood, 2008; 113: 3716-3725).
[0546] Способность антител опосредовать различные функции через эффекторные системы FcγR или комплемента обеспечивает возможность непреднамеренно преувеличенной фармакологии в инженерных биологических препаратах на основе IgG. Неизвестная перекрестная реактивность на лимфоцитах периферической крови способна вызывать перекрестное связывание рецепторов Fcγ. Поскольку перекрестные связи рецепторов Fcγ могут опосредовать различные функции, включая индукцию цитокинов, ADCC и фагоцитоз (Ravetch), важно определить способность терапевтических антител связывать непреднамеренные мишени в крови или тканях.
Способы - Анализ связывания поверхностного плазмонного резонанса FcγRIIa, FcγRIIb, FcγRIIIa и FcRn
[0547] Рекомбинантные человеческие FcγRII и FcγRIII были захвачены с помощью 6xHis-метки для оценки их связывания с анти-CD71 TF02.13-2011-vc-MMAE, анти-CD71 Ab21.12 (IgG1/κ), AB095-MMAE-E2 и AB095 (IgG1/κ) методом поверхностного плазмонного резонанса (Biacore). Мышиные анти-6xHis-антитела были непосредственно иммобилизованы на чипе СМ5 путем аминного связывания в соответствии с протоколом производителя до плотности 10000 RU. Человеческие FcγR затем захватывали на проточных ячейках 2, 3 и 4 для достижения уровня захвата FcγR в 250-500 RU. Проточная ячейка 1 была использована в качестве контрольной поверхности. В качестве рабочего буфера использовали буфер HBS-EP + (GE, Healthcare). Анти-CD71 TF02.13-2011-vc-MMAE E2, анти-CD71 Ab21.12 (IgG1/κ), AB095-MMAE-E2, AB095 (IgG1/κ) и трастузумаб (IgG1/κ) были инъецированы по всем проточные клетки со скоростью потока 50 мкл/мин в течение одной-двух минут (одна минута для FcγRIIb и FcγRIIa H131 и две минуты для FcγRIIIa F158 и FcγRIIIa V158) в концентрациях от 46,9 до 12000 нМ для FcγRII и от 7,8 до 4000 нМ для FcγRIII (2-кратное серийное разведение для обоих) с последующим временем диссоциации от одной до пяти минут (одна минута для FcγRIIb, FcγRIIa H131 и пять минут для FcγRIIIa F158 и FcγRIIIa V158). Поверхности чипа регенерировали инъекцией 100 мМ HCl при скорости потока 100 мкл/мин в течение двух секунд по всем четырем проточным элементам. Три эксперимента с использованием трех разных чипов CM5 были проведены для каждого образца (каждый в двух экземплярах), чтобы учесть все типы ошибок эксперимента (инструмент, поверхность и оператор). Результаты данных трех экспериментов были усреднены.
[0548] Для анализа связывания FcRn: анти-CD71 TF02.13-2011-vc-MMAE E2, анти-CD71 TF02.13-2011 (IgG1/κ без vc-MMAE), AB095-vcMMAE-E2 (неспецифическое моноклональное антитело человека против столбнячного анатоксина IgG1/κ, содержащее MMAE с обогащенным DAR=2), AB095 (неспецифическое моноклональное антитело человека против столбнячного анатоксина IgG1/κ) и трастузумаб (IgG1/κ) были непосредственно иммобилизованы на чипе CM5 с помощью аминной связи по протоколу производителя до плотности 500 RU. Hu FcRn вводили через все проточные ячейки при скорости потока 50 мкл/мин в течение одной минуты в концентрациях от 5,5 до 12000 нМ (3-кратное серийное разведение) с последующим двухминутным временем диссоциации. Поверхности регенерировали инъекцией 100 мМ HCl в течение двух секунд, а затем HBS-EP +, pH 7,4. Образцы готовили и использовали в двух действующих буферных системах: MES-EP+pH 6,0 и HBS-EP pH 7,4. Три эксперимента с использованием трех разных чипов CM5 были проведены для каждого образца (каждый в двух экземплярах), чтобы учесть ошибку прибора, поверхности и оператора. Результаты данных трех экспериментов были усреднены.
[0549] Все данные рекомбинантного человеческого FcγRIIIa V158 и данные FcγRIIIa F158 были адаптированы к модели подгонки связывания 1: 1 с фиксированным локальным Rmax для учета изменчивости уровней захвата. Данные по рекомбинантному связыванию человеческого FcγRIIb, FcγRIIa H131 и FcRn были сопоставлены с моделью аффинности в стационарном состоянии. Оценочное программное обеспечение Biacore T200 версии 2.0 использовалось для подбора всех данных.
Результаты
[0550] Анти-CD71 TF02.13-2011-vc-MMAE E2 содержит изотип Fc человеческого IgG1/κ. Ожидалось, что он будет связываться с FcγRI, FcγIIa, FcγIIb, FcγIII, в соответствии с другими антителами IgG1/κ дикого типа. Связывание анти-CD71 TF02.13-2011-vc-MMAE E2 с FcγR анализировали с помощью поверхностного плазмонного резонанса, конкурентного связывания FcγRI ИФА (результаты не продемонстрированы) и конкурентного связывания FcγRIII ИФА (результаты не продемонстрированы) и связывания анти-CD71 TF02.13-2011-vc-MMAE E2 для комплемента человека и яванского макака анализировали с помощью функциональных анализов активации (результаты не продемонстрированы). Данные анализы были сравнены с коммерческими и внутренними человеческими антителами. В качестве положительного контроля для анализов связывания FcγR использовали материал клинической чистоты анти-HER2, IgG1/κ, трастузумаб. Известно, что Fc-рецепторы и комплемент связывают антитела IgG1 дикого типа. (Ravetch; Roopenian; Burton et al., Nature. 1980; 288: 338-344; Hughes-Jones et al., Mol Immunol ., 1979; 16: 697-701; и Hezareh et al., J Virol. 2001; 75: 12161-12168). Изучение анти-CD71 TF02.13-2011-vc-MMAE выявило, что оно связывало FcγRI, FcγIIa H131, FcγRIII и FcRn, хотя при сравнении с положительным контролем трастузумаб наблюдалось умеренно пониженное связывание с FcγRIII (посредством SPR). Связывание анти-CD71 TF02.13-2011-vc-MMAE E2 с FcγRIIb было слишком слабым для определения, поскольку оно упало ниже предела детекции прибора Biacore при 1,0 e-05 KD. (см. Таблицы 10А и 10В).
[0551] Комплементзависимую цитотоксичность (CDC) оценивали, оценивая способность активируемого антитела, конъюгированного с CD71, активировать комплемент сыворотки человека и яванского макака путем захвата iC3b (человека) или C3 (яванского макака) методом ИФА для CDC.
[0552] Как продемонстрировано в иллюстративных результатах на Фиг.12, связывание указанных тестируемых изделий в указанных концентрациях с iC3b продемонстрировано в качестве анализа для активации человеческого комплемента. Анти-CD71-TF02.13-2011-vcMMAE E2 связывал iC3b в анализе активации комплемента как в сыворотке человека, так и в сыворотке Cynomolgus, но в меньшей степени, чем положительный контроль, антитело 7C6, которое использовали в анализе CDC. Антитело 7C6.7 с указанными мутациями использовали в качестве отрицательного контроля. Связывание iC3b анти-CD71-TF02.13-2011-vcMMAE E2 также было меньше, чем у его неконъюгированного активируемого аналога антитела (анти-CD71-TF02.13-2011).
ПРИМЕР 18. Высвобождение цитокинов в МКПК человека
[0553] Данный пример продемонстрировал, что хотя анти-CD71-TF02.13-2011-vcMMAE E2 не связывается с мононуклеарными клетками периферической крови человека (CBC) человека или яванского макака, антитела IgG1 способны перекрестно связывать Fcγ-рецепторы на лимфоцитах периферической крови, тем самым опосредуя различные функции, включая индукцию цитокинов.
[0554] Способность анти-CD71-TF02.13-2011-vcMMAE E2 или анти-CD71-TF02.13-2011 индуцировать высвобождение цитокинов in vitro в МКПК человека оценивали в растворимом или твердофазном (с пластинчатым) формате для следующие цитокины: интерлейкин (ИЛ) -1β, ИЛ 6, ИЛ 2, интерферон (IFN) γ и фактор некроза опухоли альфа (TNFα). Для твердофазного эксперимента МКПК от 8 здоровых человеческих доноров добавляли в полипропиленовые планшеты, предварительно покрытые 0,96 мкг тестируемого изделия, и отмывали через 1,5 часа. Супернатант собирали через 48 часов для анализа. В качестве отрицательного контроля использовали трастузумаб и контрольный ADC изотипа, не связывающийся, AB095-vcMMAE E2. Использовали три положительных контроля: антитела, стимулирующие Т-клетки, TGN1412 или висилизумаб и В-клетки, и липополисахарид, стимулирующий миелоидные клетки (LPS). У 1 из 8 протестированных доноров наблюдалось значительное высвобождение 3 из 5 измеренных цитокинов, ИЛ-1β, ИЛ-6 и TNFα, в ответ на оба анти-CD71-TF02.13-2011-vcMMAE E2 и AB095- vcMMAE-E2. Высвобождение ИЛ-6 и TNFα наблюдалось у дополнительных 2 из 8 доноров в ответ на анти-CD71-TF02.13-2011-vcMMAE E2 и AB095-vcMMAE E2. Три донора были протестированы в анализе растворимого представления, который представлял собой 24-часовой анализ представления с высокой плотностью клеток.
[0555] В данном исследовании высвобождение цитокинов из человеческих донорских МКПК измерялось после стимуляции предварительным покрытием 0,96 мкг/лунку с анти-CD71-TF02.13-2011-vcMMAE E2 и анти-CD71-TF02.13-2011 (IgG1κ). Трастузумаб использовали в качестве отрицательного контрольного антитела IgG1κ. AB095-vcMMAE-E2 и AB095 (IgG1κ) использовали в качестве антител для контроля изотипа. TGN1412, висилизумаб и липополисахарид (LPS) были добавлены в качестве положительных контролей для высвобождения цитокинов. Значения выделены жирным шрифтом и выделены в штучной упаковке в тестовом изделии, которое вызывало высвобождение цитокинов в 2 раза больше, чем высвобождение трастузумаба.
[0556] Как продемонстрировано в приведенных в качестве примера результатах в Таблице 11, анти-CD71-TF02.13-2011-vcMMAE E2 не вызывал выброса цитокинов выше уровня, индуцированного трастузумабом отрицательного контроля. Высвобождение цитокинов также оценивали у 3 доноров-обезьян яванских макак в твердофазном формате для следующих цитокинов: ИЛ-1β, ИЛ-6, ИЛ-2, IFNγ, ИЛ-8 и ИЛ-10. Анти-CD71-TF02. В токсикологических исследованиях не-GLP и GLP обезьян яванского макака для анти-CD71-TF02.13-2011-vcMMAE E2 острых клинических симптомов, характерных для высвобождения цитокинов, не наблюдалось ни на одном уровне дозы.
ПРИМЕР 19. Противоопухолевая эффективность AADC против CD71 в модели ксенотрансплантата мыши SW-48
[0557] Данный пример демонстрирует эффективность анти-CD71-конъюгированного активируемого антитела по данному изобретению на модели ксенотрансплантата опухоли мыши с использованием клетки SW-48 (колоректальный рак человека).
[0558] В данном иллюстративном исследовании однократные внутрибрюшинные инъекции анти-CD71-TF02.13-2011-vcMMAE E2 (AADC) в указанных дозировках вводили группам из 8 мышей, и средний объем опухоли наблюдали с течением времени. Как продемонстрировано на Фиг. 13 и в Таблице 12, диапазон общего ингибирования роста (TGI) через 23 дня по сравнению с контролем-носителем наблюдался во всех дозировках, при этом полная регрессия опухоли наблюдалась при дозировках 6 и 12 мг/кг.
ПРИМЕР 20. Противоопухолевая эффективность AADC против CD71 на мышиной модели DLBCL PDX
[0559] В данном Примере продемонстрирована эффективность анти-CD71-конъюгированного активированного антитела по данному изобретению на пяти (5) мышиных моделях ксенотрансплантата, полученных от пациента с опухолью (PDX), с использованием диффузной крупной В-клеточной лимфомы (DLBCL), полученной от пациента HuPrime, у женщин с SCID или Мыши NOG.
[0560] В данном типичном исследовании группы из 3 мышей были созданы с подкожными опухолями (100-200 мм3) и им вводили 6 мг/кг анти-CD71-TF02.13-2011-vcMMAE E2 (AADC) или контроль носителя в дни 0 и 7. Как продемонстрировано в иллюстративных результатах на Фиг. 14, испытательное изделие AADC достигло> 100% TGI в 4 из 5 моделей и 72% TFI в 1 модели по сравнению с контрольной группой транспортного средства. Полные ответы (т.е. отсутствие измеряемой опухоли в конце исследования) в моделях, которым вводили AADC, наблюдали у 2 из 3 мышей для LY2345, у 3 из 3 мышей для модели LY6933, у 2 из 3 мышей для модели LY6934 и у 2 или 3 мышки для модели LY2318. Полных ответов для модели LY3604 не наблюдалось. Данные иллюстративные результаты демонстрируют, что AADC по данному раскрытию продемонстрировал эффективность, вплоть до полного отклика в некоторых моделях.
ПРИМЕР 21. Противоопухолевая эффективность AADC против CD71 в мышиной модели TumorGraft PDX
[0561] В данном Примере продемонстрирована эффективность анти-CD71-конъюгированного активированного антитела по данному изобретению на девяти (9) мышиных моделях ксенотрансплантата, полученного у пациента с опухолью (PDX), с использованием рака молочной железы человека, полученного у пациента TumorGraft (CTG-0437, CTG-0869, CTG). -1059), немелкоклеточного рака легких (NSCLC) (CTG-1082, CTG-0860, CTG-0160, CTG-1012) и мелкоклеточного рака головы и шеи (HNSCC) (CTG-1140, CTG-1082) у голых (nude) мышей.
[0562] В данном иллюстративном исследовании группы из 3 мышей для каждой модели PDX были созданы с подкожными опухолями (150-300 мм3) и им вводили 6 мг/кг анти-CD71-TF02.13-2011-vcMMAE E2 (AADC) или контроль транспортного средства в дни 0 и 7. Как продемонстрировано в иллюстративных результатах на Фиг.15А, 15В и 15С, тестируемая субстанция AADC достигло >100% ингибирования роста опухоли (TGI) в 6 из 9 моделей по трем диагнозам рака. В данных 6 моделях, в которых наблюдалось >100% TGI, 6 из 18 мышей, получавших AADC, достигли полного ответа (т.е. отсутствия измеримой опухоли в конце исследования). В 2 дополнительных моделях 92% и 78% TGI наблюдались для HNSCC и NSCLC, соответственно. Одна модель NSCLC не ответила на AADC. Как продемонстрировано в данных иллюстративных результатах, AADC по данному раскрытию продемонстрировала эффективность, включая полные ответы в некоторых случаях, на модель PDX, полученную из множества типов рака человека.
ПРИМЕР 22. Противоопухолевая эффективность AADC против CD71 в мышиной модели поджелудочной железы PDX HuPrime
[0563] В данном Примере продемонстрирована эффективность конъюгированного активированного антитела против CD71 по данному изобретению на мышиной модели ксенотрансплантата (PDX), полученной от пациента, с использованием рака поджелудочной железы человека (PA6237), полученного от пациента HuPrime, у мышей SCID.
[0564] В данном иллюстративном исследовании была создана группа из 3 мышей с подкожными опухолями (100-200 мм3), которым вводили 3 или 6 мг/кг анти-CD71-TF02.13-2011-vcMMAE E2 (AADC) или носителя. контроль в дни 0 и 7. Как продемонстрировано в иллюстративных результатах на Фиг. 16, тестируемая субстанция AADC достигало> 100% ингибирования роста опухоли (TGI) при 3 и 6 мг/кг. В данной группе 6 мг/кг 3 из 3 полных ответов наблюдались до 59 дня, в то время как группа 3 мг/кг сохраняла полный ответ до 31 дня с последующим отрастанием опухоли.
Пример 23. Экспериментальные не-GLP исследования токсичности конъюгированного активируемого антитела против CD71
[0565] В данном Примере продемонстрирована относительная токсичность анти-CD71-конъюгированного активируемого антитела (AADC) анти-CD71-TF02.13-2011-vcMMAE E2 по данному изобретению при уровнях доз в диапазоне от 6 до 18 мг/кг по отношению к анти-CD71-конъюгированным антителам. (ADC) Ab21.12-vcMMAE E2 в дозах от 0,6 до 6 мг/кг у обезьян яванского макака (1-2 обезьяны на пол на группу) после внутривенной болюсной инъекции один раз каждые 3 недели (Q3W) или один раз каждые 2 недели (Q2W). Конечные вскрытия проводились на подопытных животных на 29 день (7 дней после последней дозы). Оценки во время исследования включали клинические признаки, массу тела, потребление пищи, клиническую патологию, анатомическую патологию, TK и иммуногенность. Резюме пилотного исследования токсичности продемонстрировано в Таблице 13.
самка
(нет 2-й дозы)
(нет 2-й дозы)
(нет 2-й дозы)
(нет 2-й дозы)
[0566] Тяжелая токсичность наблюдалась в виде сгорбленной позы, снижения активности и повышения температуры тела в группах, которые получали высокую дозу CD71-TF02.13-2011-vcMMAE E2 (18 мг/кг), частые дозы CD71-TF02.13 -2011-vcMMAE E2 (дозирование в дни 1 и 15) или немаскированный конъюгат родительского лекарственного средства против CD71-антитела (ADC) (Ab21.12-vcMMAE E2) в дозе 6 и 2 мг/кг. Когда можно было установить причину смерти, было установлено, что инфекция является вторичной по отношению к иммуносупрессии, связанной с наркотиками.
[0567] Результаты, связанные с испытуемой субстанцией, были сходными для CD71-TF02.13-2011-vcMMAE E2 и Ab21.12-vcMMAE E2 и состояли в основном из гематологической токсичности. Основные результаты включали (1) смертность, связанную с вторичной инфекцией, которая наблюдалась в группах, которые получали однократную дозу CD71-TF02.13-2011-vcMMAE E2 в 18 мг/кг, CD71-TF02.13-2011-vcMMAE E2 в дни 1 и 15 при 8 мг/кг или однократной дозе АЦП (Ab21.12-vcMMAE E2) при ≥2 мг/кг, (2) снижение массы тела через 2 недели после введения дозы, с восстановлением через 3 недели после введения дозы при ≥12 мг/кг CD71-TF02.13-2011-vcMMAE E2, (3) дозозависимое уменьшение массы эритроцитов и всех популяций лейкоцитов с частичным или полным выздоровлением, наблюдаемое через 3 недели после введения дозы, (4) временное увеличение тромбоцитов уровни через 2 недели после введения дозы, (5) легкое или умеренное увеличение фибриногена, снижение уровня альбумина и повышение уровня глобулина, (6) легкое или умеренное снижение клеточного костного мозга, селезенки и тимуса с соответствующим снижением веса в тимусе и селезенке. Снижение клеточности также наблюдалось в нескольких лимфоидных тканях.
[0568] В данном иллюстративном исследовании самые высокие переносимые дозы CD71-TF02.13-2011-vcMMAE E2 и Ab21.12-vcMMAE E2 (соответствующий ADC) в данных исследованиях составляли 12 мг/кг и 0,6 мг/кг соответственно, вводимые один раз каждые 3 недели по 2 дозы.
ПРИМЕР 24. GLP исследования токсичности конъюгированного активируемого антитела против CD71
[0569] В данном Примере продемонстрировано исследование токсичности повторной дозы GLP на обезьянах яванских макаках анти-CD71-конъюгированного активируемого антитела (AADC) анти-CD71-TF02.13-2011-vcMMAE E2 по данному изобретению при уровнях дозы 0, 2, 6 или 12 мг/кг в дни 1 и 22 с помощью внутривенного болюсного введения. Группы доз приведены в Таблице 14.
самка
(нет
2-й дозы)
[0570] В данном иллюстративном исследовании каждой группе из 6 самцов и 6 самок обезьян вводили анти-CD71-TF02.13-2011-vcMMAE E2 или носитель (IV болюс указанной дозы в дни 1 и 22), как продемонстрировано в Таблице 14. Конечные вскрытия проводились на 29 день, а восстановительные вскрытия - на 64 день. Оценки токсичности включали смертность, клинические признаки, изменения массы тела, потребление пищи, клиническую патологию, анатомическую патологию, исследования офтальмологии и оценки сердечно-сосудистой, дыхательной и центральной нервной системы. Исследование включало анализ ТЗ и оценку формирования ADA. Были сделаны следующие иллюстративные наблюдения. Сводка выбранных результатов исследования токсичности GLP для анти-CD71 TF02.13-2011-vcMMAE E2, имеющего DAR ~ 2, по сравнению с соответствующими исследованиями не-GLP немаскированного конъюгата с анти-CD71-антителом (ADC) Ab21.12-vcMMAE E2 (также имеющий DAR ~2) суммирован в Таблице 15.
[0571] Не было никаких связанных с AADC воздействий на вес тела, потребление пищи, частоту дыхания, параметры электрокардиографии, коагуляции и анализа мочи, а также не было никаких неврологических эффектов, глазных эффектов или общих патологических результатов.
[0572] Связанная с AADC смертность наблюдалась при дозах 12 мг/кг; 1 самка была найдена мертвой на 10 день, а 2 самки были умерщвлены на 11 день в ухудшающемся клиническом состоянии. Клиническая патология и результаты микроскопии у данных животных, связанные с AADC, были аналогичны тем, которые присутствовали у животных, переживших плановое вскрытие (день 29), за исключением микроскопических признаков бактериальной инфекции, которая считалась следствием иммуносупрессии, связанной с AADC.,
[0573] Как продемонстрировано в Таблице 15, анти-CD71-TF02.13-2011-vcMMAE E2 продемонстрировал превосходную переносимость по сравнению с Ab21.12-vcMMAE E2 без заметной потери массы тела. Как продемонстрировано, Ab21.12-vcMMAE E2 испытывал недостаток переносимости в течение 8 дней после однократного приема при 2 мпк, в то время как анти-CD71-TF02.13-2011-vcMMAE E2 обеспечивал ≥10-кратную защиту по сравнению с немаскированным Ab21.12- vcMMAE E2.
[0574] Связанные с AADC клинические признаки у животных, которым вводили дозу 12 мг/кг и которые выжили до запланированного аутопсии, представляли собой поражения кожи/раны, в соответствии с инфекцией, что коррелировало с уменьшением популяций лейкоцитов и признаками острой фазы ответа (снижение уровня альбумина и холестерина и повышение уровня глобулинов, общего билирубина и триглицеридов).
[0575] Изменения гематологических параметров при ≥6 мг/кг после первой дозы включали уменьшение массы эритроцитов, ретикулоцитов и всех подгрупп лейкоцитов, а также увеличение количества тромбоцитов. Гематологические изменения в дозе 2 мг/кг были ограничены умеренно увеличенными тромбоцитами после первой и второй дозы
[0576] Связанное с AADC изменение параметров клинической химии после первой дозы было наиболее заметным при дозе 12 мг/кг и состояло из острой фазы ответа (снижение уровня альбумина и холестерина и увеличение уровня глобулинов, триглицеридов [только для женщин], общего билирубина) и увеличивает содержание азота мочевины (только индивидуально) и креатинина и снижает содержание фосфора. Изменения клинической химии в дозе 6 мг/кг наблюдались только после первой дозы и были ограничены минимально повышенным билирубином и повышенным уровнем глобулинов у отдельных женщин.
[0577] Связанные с AADC результаты гематологической и клинической химии получались к концу фазы восстановления.
[0578] Результаты микроскопии, связанные с AADC, при терминальной эвтаназии присутствовали в тимусе, надпочечниках и костном мозге в дозе ≥6 мг/кг/дозу. Результаты в месторасположении инъекции наблюдались во всех группах и интерпретируются как связанные с процедурой введения, а не конкретно с AADC. Вес тимуса уменьшился у самцов обезьян, которым вводили 12 мг/кг, и самок обезьян, которым вводили 6 мг/кг, что коррелировало гистологически с уменьшением клеточности, особенно коры тимуса. Вес надпочечников был повышен у самцов обезьян, получавших дозу 12 мг/кг, и самок обезьян, получавших дозу 6 мг/кг, а гистологическим коррелятом была адренокортикальная гипертрофия. Снижение клеточности присутствовало в костном мозге, особенно в бедренной кости, у самцов обезьян, которым вводили дозу ≥6 мг/кг. После 6-недельного интервала без дозы сниженная клеточность тимуса и адренокортикальная гипертрофия отсутствовали, что соответствовало полному восстановлению данных изменений. Повышенная клеточность костного мозга сохранялась, но при сниженной степени тяжести, что соответствовало частичному выздоровлению.
ПРИМЕР 25. Конъюгирование MMAE с активируемым антителом CD71 и способы снижения DAR образовавшегося конъюгированного активируемого антитела CD71 до около DAR 3
[0579] В данном Примере описаны способы, которые были использованы для конъюгирования vc-MMAE с активируемым антителом против CD71, анти-CD71 TF02.13-2011, для создания анти-CD71 TF02.13-2011-vc-MMAE, содержащего лекарственную нагрузку 2 молекулы MMAE для каждой молекулы анти-CD71 TF02.13-2011, в дополнение к способам, используемым для обогащения DAR до около 3.
Метод конъюгации
[0580] E2-обогащенный анти-CD71 TF02.13-2011-vc-MMAE - К раствору анти-CD71 TF02.13-2011 (13,95 мг/мл), 39 г раствора, 544 мг, 3,5 нмоль) добавляли 0,5 М ЭДТА (0,39 мл) и TCEP (0,77 мл, 10 мМ в WFI, 7,7 нмоль, 2,2 эквивалента) при 2-8°C в течение ночи. Затем восстановленное антитело разбавляли ДМСО (2,29 мл), обработанного vcMMAE в ДМСО (1,89 мл 9,49 мМ vcMMAE в ДМСО, 17,9 нмоль, 5,1 эквивалента), при комнатной температуре в течение 1 часа. Конъюгированное антитело обрабатывали N-ацетилцистеином (0,29 мл, 100 мМ в WFI, 29 нмоль, 8,2 эквивалента), чтобы погасить избыток vcMMAE. Погашенный раствор анализировали с помощью HIC (хроматография гидрофобного взаимодействия) для видов DAR> E4 (более насыщенные виды DAR, 20,9% в вышеуказанном препарате).
Способ обогащения на снижное DAR
[0581] Реакцию конъюгирования суспендировали со смолой HIC, подобно тем, которые имеются в продаже у Tosoh Biosciences (в качестве примера Toyopearl алкил), порциями при комнатной температуре в течение 2 часов, чтобы снизить количество видов DAR до целевого уровня (обычно <2%). Обработанный раствор фильтровали и смолу последовательно промывали PBSE (125 мМ фосфат калия, 150 мМ NaCl, 6,3 мМ ЭДТА, pH 7,2, 22 г), а затем PBS (5 мМ фосфат калия, 200 мМ NaCl, pH 7, 35). грамм). Объединенные фильтрат и промывные растворы концентрировали и заменяли буфер с использованием отсекающего центрифужного фильтра с молекулярной массой 30 кД, затем разбавляли компонентами композиции для хранения.
[0582] Полученный продукт содержал 228 мг (A280 6,5 мг/мл) и, как было продемонстрировано, имел DAR около 2,9, как измерено из коммерчески доступной колонки HIC, и составлял следующие характеристики и виды DAR: SEC 98,7% мономер, 0,2% выше молекулярный масса, на 1,1% ниже молекулярная масса, эндотоксин <0,06 EU/мг, DAR-виды, большие, чем E4, были меньше, чем 2% площади; DAR E0 составлял около 6,2 пл.%, DAR E2 составлял около 40,7% площади и DAR E4 составлял около 46,8 пл.%).
[0583] В описанных в данном документе Примерах данный обогащенный продукт DAR упоминается как «анти-CD71 TF02.13-2011-vc-MMAE (имеющий среднее DAR ~ 3)»
ПРИМЕР 26. Конъюгирование MMAE с активируемым антителом CD71 и способы обогащения DAR образовавшегося конъюгированного активируемого антитела CD71 до около DAR 2 («E2»)
[0584] В данном Примере описаны способы, которые были использованы для конъюгирования vc-MMAE с активируемым антителом против CD71, анти-CD71 TF02.13-2011, для создания анти-CD71 TF02.13-2011-vc-MMAE, содержащего лекарственную нагрузку 2 молекулы MMAE для каждой молекулы анти-CD71 TF02.13-2011, в дополнение к способам, используемым для обогащения DAR до около 2.
Метод конъюгации
[0585] Анти-CD71 TF02.13-2011-vc-MMAE E2 - раствор анти-CD71 TF02.13-2011 (20,3 мг/мл) разбавляли 1457 г PBSE (125 мМ фосфат калия, 150 мМ NaCl, 6,3 мМ ЭДТА, рН 7,7) и охлаждают до 4°С. К охлажденному раствору добавляли TCEP (10 мМ в WFI, 30,2 мл, 0,30 ммоль, 1,5 эквивалента) и выдерживали при 4°C в течение 15 часов. К восстановленному антителу добавляли раствор vc-MMAE (1,056 г, 0,80 ммоль, 4 эквивалента) в ДМСО (300 г) при охлаждении с последующим промыванием ДМСО (65 г), после чего раствору давали нагреться до комнатной температуры. Через 3,5 часа добавляли N-ацетилцистеин (0,262 г, 1,60 ммоль, 8 эквивалентов), чтобы погасить избыток vc-MMAE, и реакционную смесь хранили при 2-8°C до очистки.
Способ обогащения на снижное DAR
[0586] Продукт очищали порциями на коммерчески доступных колонках для очистки HIC, таких как те, которые имеются в продаже от GE Life Sciences (алкилсефароза), используя градиент буферов сульфата/фосфата аммония при pH 7,1 с контролем при 280 нм с помощью УФ. В собранном пуле продуктов DAR 2 (около 9,5 г, выход 30%) заменяли буфером на буфер с pH 6,0 с помощью TFF, используя мембраны Pellicon 3 Ultracel 30 кД, затем разбавляли компонентами препарата для хранения.
[0587] Было продемонстрировано, что полученный продукт (A280 6,4 мг/мл) имеет DAR около 2 при измерении из коммерчески доступной колонки HIC и составляет следующие характеристики и виды DAR: SEC 99,6% мономер, 0,2% HMW, 0,2% LMW, Эндотоксин <0,06 EU/мг, и DAR E2 составлял около 99,0% площади, с вариабельностью между циклами от 94 до 99% DAR E2.
[0588] В Примерах, описанных в данном описании, данный обогащенный DAR 2 («Е2») продукт называют «анти-CD71-TF02.13-2011 vcMMAE E2».
ПРИМЕР 27. Оценка биофизических характеристик Е2 в сравнении с видами с более высоким DAR в доклинических мышиных моделях
[0589] Очищенный не-HIC конъюгированный продукт, полученный способом, описанным в Примере 25, пропускали через колонку HIC, используя стандартные буферы и процедуры, как описано в данном документе. Как продемонстрировано на Фиг. 18А, было выявлено несколько видов, имеющих лекарственную нагрузку от 0 до 8.
[0590] Очищенный продукт E2, полученный из примера 26, подвергали той же хроматографии HIC. Как продемонстрировано на Фиг. 18B, наблюдался только один вид, содержащий лекарственную нагрузку 2.
[0591] Неочищенные продукты и продукты Е2 радиоактивно метили и вводили мышам для оценки общего клиренса и токсичности каждого продукта. Как продемонстрировано на Фиг. 18C, очищенный продукт E2, как было продемонстрировано, имеет значительно более низкий клиренс по сравнению с неочищенным продуктом с высоким содержанием лекарственного средства.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[0592] Хотя данное изобретение было описано в сочетании с его подробным описанием, вышеприведенное описание предназначено для иллюстрации, а не для ограничения объема изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах объема следующей формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> AbbVie, Inc.
Singh, Shweta
Richardson, Jennifer Hope
Serwer, Laura Patterson
Terrett, Jonathan Alexander
Morgan-Lappe, Susan E.
Henriques, Tracy
Ralston, Sherry L.
Leanna, Marvin Robert
Badagnani, Ilaria
Bose, Sahana
<120> КОНЪЮГАТЫ АНТИ-CD71 АКТИВИРУЕМОЕ АНТИТЕЛО - ЛЕКАРСТВЕННОЕ СРЕДСТВО
И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> CYTM-056/001US 322001-2522
<150> US 62/572,467
<151> 2017-10-14
<160> 208
<170> PatentIn версия 3.5
<210> 1
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 1
Glu Val Gln Leu Gln Glu Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Asn Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Asn Trp Asp Pro Gly Phe Ala Phe Trp Gly Gln Gly Thr
100 105 110
Leu Ile Thr Val Ser Ala
115
<210> 2
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 2
Asp Ile Val Met Thr Gln Thr Pro Ala Ile Met Ser Ala Ser Pro Gly
1. 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met
20 25 30
Tyr Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala
100 105
<210> 3
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asn Trp Asp Pro Gly Phe Ala Phe Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 4
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Asn Trp Asp Pro Gly Phe Ala Phe Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 5
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Asn Trp Asp Pro Gly Phe Ala Phe Trp Gly Gln Gly Thr
100 105 110
Leu Ile Thr Val Ser Ser
115
<210> 6
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 7
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met
20 25 30
Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 8
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Ser Ser Val Tyr Tyr Met
20 25 30
Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 9
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 9
Gly Tyr Thr Phe Thr Ser Tyr Trp Met His
1. 5 10
<210> 10
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 10
Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly
1. 5 10
<210> 11
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 11
Glu Asn Trp Asp Pro Gly Phe Ala Phe
1. 5
<210> 12
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 12
Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
1. 5 10
<210> 13
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 13
Cys Arg Ala Ser Ser Ser Val Tyr Tyr Met Tyr
1. 5 10
<210> 14
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 14
Ser Thr Ser Asn Leu Ala Ser
1. 5
<210> 15
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 15
Gln Gln Arg Arg Asn Tyr Pro Tyr Thr
1. 5
<210> 16
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 16
Gln Phe Cys Pro Trp Ser Tyr Tyr Leu Ile Gly Asp Cys Asp Ile
1. 5 10 15
<210> 17
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 17
Asn Leu Cys Thr Glu His Ser Phe Ala Leu Asp Cys Arg Ser Tyr
1. 5 10 15
<210> 18
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 18
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr
1. 5 10 15
<210> 19
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met
20 25 30
Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 20
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Asn Trp Asp Pro Gly Phe Ala Phe Trp Gly Gln Gly Thr
100 105 110
Leu Ile Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 21
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 21
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac ctggcgcctc cgtgaagatg 60
tcctgcaagg cctccggcta caccttcacc agctactgga tgcactgggt gcgacaggct 120
ccaggccagg gcctcgaatg gatcggcgcc atctaccccg gcaactccga gacaggctac 180
gcccagaagt tccagggcag agccaccctg accgccgaca cctccacctc caccgcctac 240
atggaactgt ccagcctgcg gagcgaggac accgccgtgt actactgcac cagagagaac 300
tgggaccccg gcttcgcctt ctggggccag ggcaccctga tcaccgtgtc ctccgccagc 360
accaagggcc cctccgtgtt ccctctggcc ccttccagca agtccacctc tggcggcaca 420
gctgccctgg gctgcctggt gaaagactac ttccccgagc ccgtgaccgt gtcctggaac 480
tctggcgccc tgaccagcgg agtgcacacc ttccctgccg tgctgcagtc ctccggcctg 540
tactccctgt cctccgtggt gacagtgccc tcctccagcc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc ctccaacacc aaggtggaca agaaggtgga acccaagtcc 660
tgcgacaaga cccacacctg tcctccctgc cctgcccctg aactgctggg cggaccttcc 720
gtgtttctgt tccccccaaa gcccaaggac accctgatga tctcccggac ccccgaagtg 780
acctgcgtgg tggtggacgt gtcccacgag gaccctgaag tgaagttcaa ttggtacgtg 840
gacggcgtgg aagtgcacaa cgccaagacc aagcccagag aggaacagta caactccacc 900
taccgggtgg tgtccgtgct gaccgtgctg caccaggact ggctgaacgg caaagagtac 960
aagtgcaagg tgtccaacaa ggccctgcct gcccccatcg aaaagaccat ctccaaggcc 1020
aagggccagc cccgcgagcc ccaggtgtac acactgccac ctagccggga agagatgacc 1080
aagaaccagg tgtccctgac ctgtctggtg aaaggcttct acccctccga tatcgccgtg 1140
gaatgggaga gcaacggcca gcccgagaac aactacaaga ccaccccacc tgtgctggac 1200
tccgacggct cattcttcct gtactccaag ctgaccgtgg acaagtcccg gtggcagcag 1260
ggcaacgtgt tctcctgcag cgtgatgcac gaggccctgc acaaccacta cacccagaag 1320
tccctgtccc tgagccccgg caag 1344
<210> 22
<211> 260
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 22
Gln Gly Gln Ser Gly Gln Gly Gln Phe Cys Pro Trp Ser Tyr Tyr Leu
1. 5 10 15
Ile Gly Asp Cys Asp Ile Gly Gly Gly Ser Ser Gly Gly Ser Ile Ser
20 25 30
Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn His Gly Gly Gly Ser Asp
35 40 45
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
50 55 60
Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
65 70 75 80
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser
85 90 95
Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
100 105 110
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp
115 120 125
Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe
130 135 140
Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser
145 150 155 160
Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
165 170 175
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
180 185 190
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser
195 200 205
Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr
210 215 220
Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys
225 230 235 240
Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn
245 250 255
Arg Gly Glu Cys
260
<210> 23
<211> 260
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 23
Gln Gly Gln Ser Gly Gln Gly Asn Leu Cys Thr Glu His Ser Ala Ala
1. 5 10 15
Leu Asp Cys Arg Ser Tyr Gly Gly Gly Ser Ser Gly Gly Ser Ile Ser
20 25 30
Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn His Gly Gly Gly Ser Asp
35 40 45
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
50 55 60
Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
65 70 75 80
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser
85 90 95
Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
100 105 110
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp
115 120 125
Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe
130 135 140
Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser
145 150 155 160
Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
165 170 175
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
180 185 190
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser
195 200 205
Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr
210 215 220
Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys
225 230 235 240
Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn
245 250 255
Arg Gly Glu Cys
260
<210> 24
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 24
Gly Ser Gly Gly Ser
1. 5
<210> 25
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 25
Gly Gly Gly Ser
1
<210> 26
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 26
Gly Gly Ser Gly
1
<210> 27
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 27
Gly Gly Ser Gly Gly
1. 5
<210> 28
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 28
Gly Ser Gly Ser Gly
1. 5
<210> 29
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 29
Gly Ser Gly Gly Gly
1. 5
<210> 30
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 30
Gly Gly Gly Ser Gly
1. 5
<210> 31
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 31
Gly Ser Ser Ser Gly
1. 5
<210> 32
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 32
Gly Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
1. 5 10
<210> 33
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 33
Gly Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly
1. 5 10
<210> 34
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 34
Gly Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser
1. 5 10
<210> 35
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 35
Gly Ser Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Gly Ser
1. 5 10 15
<210> 36
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 36
Gly Ser Ser Gly Gly Ser Gly Gly Ser Gly
1. 5 10
<210> 37
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 37
Gly Ser Ser Gly Gly Ser Gly Gly Ser Gly Ser
1. 5 10
<210> 38
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 38
Gly Gly Gly Ser
1
<210> 39
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 39
Gly Ser Ser Gly Thr
1. 5
<210> 40
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 40
Gly Ser Ser Gly
1
<210> 41
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 41
Thr Gly Arg Gly Pro Ser Trp Val
1. 5
<210> 42
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 42
Ser Ala Arg Gly Pro Ser Arg Trp
1. 5
<210> 43
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 43
Thr Ala Arg Gly Pro Ser Phe Lys
1. 5
<210> 44
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 44
Leu Ser Gly Arg Ser Asp Asn His
1. 5
<210> 45
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 45
Gly Gly Trp His Thr Gly Arg Asn
1. 5
<210> 46
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 46
His Thr Gly Arg Ser Gly Ala Leu
1. 5
<210> 47
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 47
Pro Leu Thr Gly Arg Ser Gly Gly
1. 5
<210> 48
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 48
Ala Ala Arg Gly Pro Ala Ile His
1. 5
<210> 49
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 49
Arg Gly Pro Ala Phe Asn Pro Met
1. 5
<210> 50
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 50
Ser Ser Arg Gly Pro Ala Tyr Leu
1. 5
<210> 51
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 51
Arg Gly Pro Ala Thr Pro Ile Met
1. 5
<210> 52
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 52
Arg Gly Pro Ala
1
<210> 53
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 53
Gly Gly Gln Pro Ser Gly Met Trp Gly Trp
1. 5 10
<210> 54
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 54
Phe Pro Arg Pro Leu Gly Ile Thr Gly Leu
1. 5 10
<210> 55
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 55
Val His Met Pro Leu Gly Phe Leu Gly Pro
1. 5 10
<210> 56
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 56
Ser Pro Leu Thr Gly Arg Ser Gly
1. 5
<210> 57
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 57
Ser Ala Gly Phe Ser Leu Pro Ala
1. 5
<210> 58
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 58
Leu Ala Pro Leu Gly Leu Gln Arg Arg
1. 5
<210> 59
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 59
Ser Gly Gly Pro Leu Gly Val Arg
1. 5
<210> 60
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 60
Pro Leu Gly Leu
1
<210> 61
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 61
Ile Ser Ser Gly Leu Ser Ser
1. 5
<210> 62
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 62
Gln Asn Gln Ala Leu Arg Met Ala
1. 5
<210> 63
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 63
Ala Gln Asn Leu Leu Gly Met Val
1. 5
<210> 64
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 64
Ser Thr Phe Pro Phe Gly Met Phe
1. 5
<210> 65
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 65
Pro Val Gly Tyr Thr Ser Ser Leu
1. 5
<210> 66
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 66
Asp Trp Leu Tyr Trp Pro Gly Ile
1. 5
<210> 67
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 67
Ile Ser Ser Gly Leu Leu Ser Ser
1. 5
<210> 68
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 68
Leu Lys Ala Ala Pro Arg Trp Ala
1. 5
<210> 69
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 69
Gly Pro Ser His Leu Val Leu Thr
1. 5
<210> 70
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 70
Leu Pro Gly Gly Leu Ser Pro Trp
1. 5
<210> 71
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 71
Met Gly Leu Phe Ser Glu Ala Gly
1. 5
<210> 72
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 72
Ser Pro Leu Pro Leu Arg Val Pro
1. 5
<210> 73
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 73
Arg Met His Leu Arg Ser Leu Gly
1. 5
<210> 74
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 74
Leu Ala Ala Pro Leu Gly Leu Leu
1. 5
<210> 75
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 75
Ala Val Gly Leu Leu Ala Pro Pro
1. 5
<210> 76
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 76
Leu Leu Ala Pro Ser His Arg Ala
1. 5
<210> 77
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 77
Pro Ala Gly Leu Trp Leu Asp Pro
1. 5
<210> 78
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 78
Gly Pro Arg Ser Phe Gly Leu
1. 5
<210> 79
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 79
Gly Pro Arg Ser Phe Gly
1. 5
<210> 80
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 80
Asn Thr Leu Ser Gly Arg Ser Glu Asn His Ser Gly
1. 5 10
<210> 81
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 81
Asn Thr Leu Ser Gly Arg Ser Gly Asn His Gly Ser
1. 5 10
<210> 82
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 82
Thr Ser Thr Ser Gly Arg Ser Ala Asn Pro Arg Gly
1. 5 10
<210> 83
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 83
Thr Ser Gly Arg Ser Ala Asn Pro
1. 5
<210> 84
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 84
Val Ala Gly Arg Ser Met Arg Pro
1. 5
<210> 85
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 85
Val Val Pro Glu Gly Arg Arg Ser
1. 5
<210> 86
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 86
Ile Leu Pro Arg Ser Pro Ala Phe
1. 5
<210> 87
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 87
Met Val Leu Gly Arg Ser Leu Leu
1. 5
<210> 88
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 88
Gln Gly Arg Ala Ile Thr Phe Ile
1. 5
<210> 89
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 89
Ser Pro Arg Ser Ile Met Leu Ala
1. 5
<210> 90
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 90
Ser Met Leu Arg Ser Met Pro Leu
1. 5
<210> 91
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 91
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn His
1. 5 10
<210> 92
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 92
Ile Ser Ser Gly Leu Leu Ser Ser Gly Gly Ser Gly Gly Ser Leu Ser
1. 5 10 15
Gly Arg Ser Asp Asn His
20
<210> 93
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 93
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Thr Ser Thr Ser Gly Arg
1. 5 10 15
Ser Ala Asn Pro Arg Gly
20
<210> 94
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 94
Thr Ser Thr Ser Gly Arg Ser Ala Asn Pro Arg Gly Gly Gly Ala Val
1. 5 10 15
Gly Leu Leu Ala Pro Pro
20
<210> 95
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 95
Val His Met Pro Leu Gly Phe Leu Gly Pro Gly Gly Thr Ser Thr Ser
1. 5 10 15
Gly Arg Ser Ala Asn Pro Arg Gly
20
<210> 96
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 96
Thr Ser Thr Ser Gly Arg Ser Ala Asn Pro Arg Gly Gly Gly Val His
1. 5 10 15
Met Pro Leu Gly Phe Leu Gly Pro
20
<210> 97
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 97
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Asn His
<210> 98
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 98
Leu Ser Gly Arg Ser Asp Asn His Gly Gly Ala Val Gly Leu Leu Ala
1. 5 10 15
Pro Pro
<210> 99
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 99
Val His Met Pro Leu Gly Phe Leu Gly Pro Gly Gly Leu Ser Gly Arg
1. 5 10 15
Ser Asp Asn His
20
<210> 100
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 100
Leu Ser Gly Arg Ser Asp Asn His Gly Gly Val His Met Pro Leu Gly
1. 5 10 15
Phe Leu Gly Pro
20
<210> 101
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 101
Leu Ser Gly Arg Ser Asp Asn His Gly Gly Ser Gly Gly Ser Ile Ser
1. 5 10 15
Ser Gly Leu Leu Ser Ser
20
<210> 102
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 102
Leu Ser Gly Arg Ser Gly Asn His Gly Gly Ser Gly Gly Ser Ile Ser
1. 5 10 15
Ser Gly Leu Leu Ser Ser
20
<210> 103
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 103
Ile Ser Ser Gly Leu Leu Ser Ser Gly Gly Ser Gly Gly Ser Leu Ser
1. 5 10 15
Gly Arg Ser Gly Asn His
20
<210> 104
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 104
Leu Ser Gly Arg Ser Asp Asn His Gly Gly Ser Gly Gly Ser Gln Asn
1. 5 10 15
Gln Ala Leu Arg Met Ala
20
<210> 105
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 105
Gln Asn Gln Ala Leu Arg Met Ala Gly Gly Ser Gly Gly Ser Leu Ser
1. 5 10 15
Gly Arg Ser Asp Asn His
20
<210> 106
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 106
Leu Ser Gly Arg Ser Gly Asn His Gly Gly Ser Gly Gly Ser Gln Asn
1. 5 10 15
Gln Ala Leu Arg Met Ala
20
<210> 107
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 107
Gln Asn Gln Ala Leu Arg Met Ala Gly Gly Ser Gly Gly Ser Leu Ser
1. 5 10 15
Gly Arg Ser Gly Asn His
20
<210> 108
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 108
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Gly Asn His
1. 5 10
<210> 109
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 109
Gln Gly Gln Ser Gly Gln
1. 5
<210> 110
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 110
Pro Arg Phe Lys Ile Ile Gly Gly
1. 5
<210> 111
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 111
Pro Arg Phe Arg Ile Ile Gly Gly
1. 5
<210> 112
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 112
Ser Ser Arg His Arg Arg Ala Leu Asp
1. 5
<210> 113
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 113
Arg Lys Ser Ser Ile Ile Ile Arg Met Arg Asp Val Val Leu
1. 5 10
<210> 114
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 114
Ser Ser Ser Phe Asp Lys Gly Lys Tyr Lys Lys Gly Asp Asp Ala
1. 5 10 15
<210> 115
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 115
Ser Ser Ser Phe Asp Lys Gly Lys Tyr Lys Arg Gly Asp Asp Ala
1. 5 10 15
<210> 116
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 116
Ile Glu Gly Arg
1
<210> 117
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 117
Ile Asp Gly Arg
1
<210> 118
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 118
Gly Gly Ser Ile Asp Gly Arg
1. 5
<210> 119
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 119
Pro Leu Gly Leu Trp Ala
1. 5
<210> 120
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 120
Gly Pro Gln Gly Ile Ala Gly Gln
1. 5
<210> 121
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 121
Gly Pro Gln Gly Leu Leu Gly Ala
1. 5
<210> 122
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 122
Gly Ile Ala Gly Gln
1. 5
<210> 123
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 123
Gly Pro Leu Gly Ile Ala Gly Ile
1. 5
<210> 124
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 124
Gly Pro Glu Gly Leu Arg Val Gly
1. 5
<210> 125
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 125
Tyr Gly Ala Gly Leu Gly Val Val
1. 5
<210> 126
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 126
Ala Gly Leu Gly Val Val Glu Arg
1. 5
<210> 127
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 127
Ala Gly Leu Gly Ile Ser Ser Thr
1. 5
<210> 128
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 128
Glu Pro Gln Ala Leu Ala Met Ser
1. 5
<210> 129
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 129
Gln Ala Leu Ala Met Ser Ala Ile
1. 5
<210> 130
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 130
Ala Ala Tyr His Leu Val Ser Gln
1. 5
<210> 131
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 131
Met Asp Ala Phe Leu Glu Ser Ser
1. 5
<210> 132
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 132
Glu Ser Leu Pro Val Val Ala Val
1. 5
<210> 133
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 133
Ser Ala Pro Ala Val Glu Ser Glu
1. 5
<210> 134
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 134
Asp Val Ala Gln Phe Val Leu Thr
1. 5
<210> 135
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 135
Val Ala Gln Phe Val Leu Thr Glu
1. 5
<210> 136
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 136
Ala Gln Phe Val Leu Thr Glu Gly
1. 5
<210> 137
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 137
Pro Val Gln Pro Ile Gly Pro Gln
1. 5
<210> 138
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 138
Gln Gly Gln Ser Gly Gln Gly
1. 5
<210> 139
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 139
Gln Gly Gln Ser Gly
1. 5
<210> 140
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 140
Gln Gly Gln Ser
1
<210> 141
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 141
Gln Phe Cys Pro Trp Ser Tyr Tyr Leu Ile Gly Asp Cys Asp Ile Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ile Ser Ser Gly Leu Leu Ser Gly Arg
20 25 30
Ser Asp Asn His Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
35 40 45
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser
50 55 60
Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly
65 70 75 80
Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
85 90 95
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
100 105 110
Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
115 120 125
Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
130 135 140
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
145 150 155 160
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
165 170 175
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
180 185 190
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
195 200 205
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
210 215 220
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
225 230 235 240
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
245 250
<210> 142
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 142
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ile Ser Ser Gly Leu Leu Ser Gly Arg
20 25 30
Ser Asp Asn His Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
35 40 45
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser
50 55 60
Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly
65 70 75 80
Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
85 90 95
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
100 105 110
Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
115 120 125
Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
130 135 140
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
145 150 155 160
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
165 170 175
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
180 185 190
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
195 200 205
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
210 215 220
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
225 230 235 240
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
245 250
<210> 143
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 143
Gly Gln Ser Gly Gln Gly
1. 5
<210> 144
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 144
Gln Ser Gly Gln Gly
1. 5
<210> 145
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 145
Ser Gly Gln Gly
1
<210> 146
<211> 257
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 146
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ala Val Gly Leu Leu Ala Pro Pro Gly
20 25 30
Gly Leu Ser Gly Arg Ser Asp Asn Pro Gly Gly Ser Asp Ile Gln Met
35 40 45
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
50 55 60
Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln
65 70 75 80
Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn
85 90 95
Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
100 105 110
Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr
115 120 125
Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly
130 135 140
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile
145 150 155 160
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
165 170 175
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
180 185 190
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
195 200 205
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
210 215 220
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
225 230 235 240
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
245 250 255
Cys
<210> 147
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 147
Gln Gly Gln Ser Gly Gln Gly Asn Leu Cys Thr Glu His Ser Ala Ala
1. 5 10 15
Leu Asp Cys Arg Ser Tyr Gly Gly Gly Ser Ser Gly Gly Ser Ala Val
20 25 30
Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp Asn Pro
35 40 45
Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
50 55 60
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val
65 70 75 80
Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
85 90 95
Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe
100 105 110
Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met
115 120 125
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr
130 135 140
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val
145 150 155 160
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
165 170 175
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
180 185 190
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
195 200 205
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
210 215 220
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
225 230 235 240
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
245 250 255
Lys Ser Phe Asn Arg Gly Glu Cys
260
<210> 148
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 148
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Ala Asn Pro Arg Gly
1. 5 10 15
<210> 149
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 149
Ala Val Gly Leu Leu Ala Pro Pro Thr Ser Gly Arg Ser Ala Asn Pro
1. 5 10 15
Arg Gly
<210> 150
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 150
Ala Val Gly Leu Leu Ala Pro Pro Ser Gly Arg Ser Ala Asn Pro Arg
1. 5 10 15
Gly
<210> 151
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 151
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Asp His
1. 5 10
<210> 152
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 152
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Ile His
1. 5 10
<210> 153
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 153
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Gln His
1. 5 10
<210> 154
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 154
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Thr His
1. 5 10
<210> 155
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 155
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Tyr His
1. 5 10
<210> 156
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 156
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn Pro
1. 5 10
<210> 157
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 157
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Ala Asn Pro
1. 5 10
<210> 158
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 158
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Ala Asn Ile
1. 5 10
<210> 159
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 159
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Asp His
<210> 160
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 160
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Ile His
<210> 161
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 161
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Gln His
<210> 162
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 162
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Thr His
<210> 163
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 163
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Tyr His
<210> 164
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 164
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Asn Pro
<210> 165
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 165
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Ala
1. 5 10 15
Asn Pro
<210> 166
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 166
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Ala
1. 5 10 15
Asn Ile
<210> 167
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 167
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Ser Glu Thr Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Asn Trp Asp Pro Gly Phe Ala Phe Trp Gly Gln Gly Thr
100 105 110
Leu Ile Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 168
<211> 1341
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 168
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac ctggcgcctc cgtgaagatg 60
tcctgcaagg cctccggcta caccttcacc agctactgga tgcactgggt gcgacaggct 120
ccaggccagg gcctcgaatg gatcggcgcc atctaccccg gcaactccga gacaggctac 180
gcccagaagt tccagggcag agccaccctg accgccgaca cctccacctc caccgcctac 240
atggaactgt ccagcctgcg gagcgaggac accgccgtgt actactgcac cagagagaac 300
tgggaccccg gcttcgcctt ctggggccag ggcaccctga tcaccgtgtc ctccgccagc 360
accaagggcc cctccgtgtt ccctctggcc ccttccagca agtccacctc tggcggcaca 420
gctgccctgg gctgcctggt gaaagactac ttccccgagc ccgtgaccgt gtcctggaac 480
tctggcgccc tgaccagcgg agtgcacacc ttccctgccg tgctgcagtc ctccggcctg 540
tactccctgt cctccgtggt gacagtgccc tcctccagcc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc ctccaacacc aaggtggaca agaaggtgga acccaagtcc 660
tgcgacaaga cccacacctg tcctccctgc cctgcccctg aactgctggg cggaccttcc 720
gtgtttctgt tccccccaaa gcccaaggac accctgatga tctcccggac ccccgaagtg 780
acctgcgtgg tggtggacgt gtcccacgag gaccctgaag tgaagttcaa ttggtacgtg 840
gacggcgtgg aagtgcacaa cgccaagacc aagcccagag aggaacagta caactccacc 900
taccgggtgg tgtccgtgct gaccgtgctg caccaggact ggctgaacgg caaagagtac 960
aagtgcaagg tgtccaacaa ggccctgcct gcccccatcg aaaagaccat ctccaaggcc 1020
aagggccagc cccgcgagcc ccaggtgtac acactgccac ctagccggga agagatgacc 1080
aagaaccagg tgtccctgac ctgtctggtg aaaggcttct acccctccga tatcgccgtg 1140
gaatgggaga gcaacggcca gcccgagaac aactacaaga ccaccccacc tgtgctggac 1200
tccgacggct cattcttcct gtactccaag ctgaccgtgg acaagtcccg gtggcagcag 1260
ggcaacgtgt tctcctgcag cgtgatgcac gaggccctgc acaaccacta cacccagaag 1320
tccctgtccc tgagccccgg c 1341
<210> 169
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 169
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ile Ser Ser Gly Leu Leu Ser Gly Arg
20 25 30
Ser Asp Asn Pro Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
35 40 45
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser
50 55 60
Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly
65 70 75 80
Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
85 90 95
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
100 105 110
Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
115 120 125
Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
130 135 140
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
145 150 155 160
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
165 170 175
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
180 185 190
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
195 200 205
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
210 215 220
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
225 230 235 240
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
245 250
<210> 170
<211> 260
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 170
Gln Gly Gln Ser Gly Gln Gly Asn Leu Cys Thr Glu His Ser Ala Ala
1. 5 10 15
Leu Asp Cys Arg Ser Tyr Gly Gly Gly Ser Ser Gly Gly Ser Ile Ser
20 25 30
Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn Pro Gly Gly Gly Ser Asp
35 40 45
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
50 55 60
Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
65 70 75 80
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser
85 90 95
Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
100 105 110
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp
115 120 125
Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe
130 135 140
Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser
145 150 155 160
Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
165 170 175
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
180 185 190
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser
195 200 205
Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr
210 215 220
Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys
225 230 235 240
Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn
245 250 255
Arg Gly Glu Cys
260
<210> 171
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 171
Ile Ser Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn Ile
1. 5 10
<210> 172
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 172
Ala Val Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp
1. 5 10 15
Asn Ile
<210> 173
<211> 257
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 173
Gln Phe Cys Pro Trp Ser Tyr Tyr Leu Ile Gly Asp Cys Asp Ile Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ala Val Gly Leu Leu Ala Pro Pro Gly
20 25 30
Gly Leu Ser Gly Arg Ser Asp Asn Pro Gly Gly Ser Asp Ile Gln Met
35 40 45
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
50 55 60
Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln
65 70 75 80
Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn
85 90 95
Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
100 105 110
Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr
115 120 125
Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly
130 135 140
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile
145 150 155 160
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
165 170 175
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
180 185 190
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
195 200 205
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
210 215 220
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
225 230 235 240
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
245 250 255
Cys
<210> 174
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 174
Gln Gly Gln Ser Gly Gln Gly Gln Phe Cys Pro Trp Ser Tyr Tyr Leu
1. 5 10 15
Ile Gly Asp Cys Asp Ile Gly Gly Gly Ser Ser Gly Gly Ser Ala Val
20 25 30
Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp Asn Pro
35 40 45
Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
50 55 60
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val
65 70 75 80
Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
85 90 95
Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe
100 105 110
Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met
115 120 125
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr
130 135 140
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val
145 150 155 160
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
165 170 175
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
180 185 190
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
195 200 205
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
210 215 220
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
225 230 235 240
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
245 250 255
Lys Ser Phe Asn Arg Gly Glu Cys
260
<210> 175
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 175
Leu Ser Gly Arg Ser Gly Asn His
1. 5
<210> 176
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 176
Ser Gly Arg Ser Ala Asn Pro Arg Gly
1. 5
<210> 177
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 177
Leu Ser Gly Arg Ser Asp Asp His
1. 5
<210> 178
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 178
Leu Ser Gly Arg Ser Asp Ile His
1. 5
<210> 179
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 179
Leu Ser Gly Arg Ser Asp Gln His
1. 5
<210> 180
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 180
Leu Ser Gly Arg Ser Asp Thr His
1. 5
<210> 181
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 181
Leu Ser Gly Arg Ser Asp Tyr His
1. 5
<210> 182
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 182
Leu Ser Gly Arg Ser Asp Asn Pro
1. 5
<210> 183
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 183
Leu Ser Gly Arg Ser Ala Asn Pro
1. 5
<210> 184
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 184
Leu Ser Gly Arg Ser Ala Asn Ile
1. 5
<210> 185
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 185
Leu Ser Gly Arg Ser Asp Asn Ile
1. 5
<210> 186
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 186
Met Ile Ala Pro Val Ala Tyr Arg
1. 5
<210> 187
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 187
Arg Pro Ser Pro Met Trp Ala Tyr
1. 5
<210> 188
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 188
Trp Ala Thr Pro Arg Pro Met Arg
1. 5
<210> 189
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 189
Phe Arg Leu Leu Asp Trp Gln Trp
1. 5
<210> 190
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 190
Ile Ser Ser Gly Leu
1. 5
<210> 191
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 191
Ile Ser Ser Gly Leu Leu Ser
1. 5
<210> 192
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 192
Ile Ser Ser Gly Leu Leu
1. 5
<210> 193
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 193
Gly Leu Ser Gly Arg Ser Asp Asn His Gly Gly Ala Val Gly Leu Leu
1. 5 10 15
Ala Pro Pro
<210> 194
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 194
Gly Leu Ser Gly Arg Ser Asp Asn His Gly Gly Val His Met Pro Leu
1. 5 10 15
Gly Phe Leu Gly Pro
20
<210> 195
<211> 146
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 195
Gln Phe Cys Pro Trp Ser Tyr Tyr Leu Ile Gly Asp Cys Asp Ile Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ile Ser Ser Gly Leu Leu Ser Gly Arg
20 25 30
Ser Asp Asn His Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
35 40 45
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser
50 55 60
Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly
65 70 75 80
Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
85 90 95
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
100 105 110
Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
115 120 125
Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
130 135 140
Ile Lys
145
<210> 196
<211> 153
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 196
Gln Gly Gln Ser Gly Gln Gly Gln Phe Cys Pro Trp Ser Tyr Tyr Leu
1. 5 10 15
Ile Gly Asp Cys Asp Ile Gly Gly Gly Ser Ser Gly Gly Ser Ile Ser
20 25 30
Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn His Gly Gly Gly Ser Asp
35 40 45
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
50 55 60
Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
65 70 75 80
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser
85 90 95
Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
100 105 110
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp
115 120 125
Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe
130 135 140
Gly Gln Gly Thr Lys Leu Glu Ile Lys
145 150
<210> 197
<211> 146
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 197
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ile Ser Ser Gly Leu Leu Ser Gly Arg
20 25 30
Ser Asp Asn His Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
35 40 45
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser
50 55 60
Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly
65 70 75 80
Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
85 90 95
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
100 105 110
Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
115 120 125
Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
130 135 140
Ile Lys
145
<210> 198
<211> 153
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 198
Gln Gly Gln Ser Gly Gln Gly Asn Leu Cys Thr Glu His Ser Ala Ala
1. 5 10 15
Leu Asp Cys Arg Ser Tyr Gly Gly Gly Ser Ser Gly Gly Ser Ile Ser
20 25 30
Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn His Gly Gly Gly Ser Asp
35 40 45
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
50 55 60
Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
65 70 75 80
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser
85 90 95
Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
100 105 110
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp
115 120 125
Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe
130 135 140
Gly Gln Gly Thr Lys Leu Glu Ile Lys
145 150
<210> 199
<211> 150
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 199
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ala Val Gly Leu Leu Ala Pro Pro Gly
20 25 30
Gly Leu Ser Gly Arg Ser Asp Asn Pro Gly Gly Ser Asp Ile Gln Met
35 40 45
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
50 55 60
Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln
65 70 75 80
Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn
85 90 95
Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
100 105 110
Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr
115 120 125
Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly
130 135 140
Thr Lys Leu Glu Ile Lys
145 150
<210> 200
<211> 157
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 200
Gln Gly Gln Ser Gly Gln Gly Asn Leu Cys Thr Glu His Ser Ala Ala
1. 5 10 15
Leu Asp Cys Arg Ser Tyr Gly Gly Gly Ser Ser Gly Gly Ser Ala Val
20 25 30
Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp Asn Pro
35 40 45
Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
50 55 60
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val
65 70 75 80
Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
85 90 95
Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe
100 105 110
Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met
115 120 125
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr
130 135 140
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
145 150 155
<210> 201
<211> 146
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 201
Asn Leu Cys Thr Glu His Ser Ala Ala Leu Asp Cys Arg Ser Tyr Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ile Ser Ser Gly Leu Leu Ser Gly Arg
20 25 30
Ser Asp Asn Pro Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
35 40 45
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser
50 55 60
Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly
65 70 75 80
Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
85 90 95
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu
100 105 110
Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
115 120 125
Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu
130 135 140
Ile Lys
145
<210> 202
<211> 153
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 202
Gln Gly Gln Ser Gly Gln Gly Asn Leu Cys Thr Glu His Ser Ala Ala
1. 5 10 15
Leu Asp Cys Arg Ser Tyr Gly Gly Gly Ser Ser Gly Gly Ser Ile Ser
20 25 30
Ser Gly Leu Leu Ser Gly Arg Ser Asp Asn Pro Gly Gly Gly Ser Asp
35 40 45
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
50 55 60
Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr
65 70 75 80
Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser
85 90 95
Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
100 105 110
Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp
115 120 125
Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe
130 135 140
Gly Gln Gly Thr Lys Leu Glu Ile Lys
145 150
<210> 203
<211> 150
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 203
Gln Phe Cys Pro Trp Ser Tyr Tyr Leu Ile Gly Asp Cys Asp Ile Gly
1. 5 10 15
Gly Gly Ser Ser Gly Gly Ser Ala Val Gly Leu Leu Ala Pro Pro Gly
20 25 30
Gly Leu Ser Gly Arg Ser Asp Asn Pro Gly Gly Ser Asp Ile Gln Met
35 40 45
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
50 55 60
Ile Thr Cys Ser Ala Ser Ser Ser Val Tyr Tyr Met Tyr Trp Phe Gln
65 70 75 80
Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn
85 90 95
Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
100 105 110
Asp Tyr Thr Leu Thr Ile Ser Ser Met Gln Pro Glu Asp Phe Ala Thr
115 120 125
Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr Pro Tyr Thr Phe Gly Gln Gly
130 135 140
Thr Lys Leu Glu Ile Lys
145 150
<210> 204
<211> 157
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 204
Gln Gly Gln Ser Gly Gln Gly Gln Phe Cys Pro Trp Ser Tyr Tyr Leu
1. 5 10 15
Ile Gly Asp Cys Asp Ile Gly Gly Gly Ser Ser Gly Gly Ser Ala Val
20 25 30
Gly Leu Leu Ala Pro Pro Gly Gly Leu Ser Gly Arg Ser Asp Asn Pro
35 40 45
Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
50 55 60
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val
65 70 75 80
Tyr Tyr Met Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
85 90 95
Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe
100 105 110
Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Met
115 120 125
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Arg Asn Tyr
130 135 140
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
145 150 155
<210> 205
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 205
Gly Gly Ser Gly Gly Ser
1. 5
<210> 206
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 206
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac ctggcgcctc cgtgaagatg 60
tcctgcaagg cctccggcta caccttcacc agctactgga tgcactgggt gcgacaggct 120
ccaggccagg gcctcgaatg gatcggcgcc atctaccccg gcaactccga gacaggctac 180
gcccagaagt tccagggcag agccaccctg accgccgaca cctccacctc caccgcctac 240
atggaactgt ccagcctgcg gagcgaggac accgccgtgt actactgcac cagagagaac 300
tgggaccccg gcttcgcctt ctggggccag ggcaccctga tcaccgtgtc ctcc 354
<210> 207
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 207
Gly Gly Gly Ser Ser Gly Gly Ser
1. 5
<210> 208
<211> 639
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 208
gacatccaga tgacccagtc cccatccagc ctgtccgcct ccgtgggcga cagagtgaca 60
atcacctgtt ccgccagctc ctccgtgtac tacatgtact ggttccagca gaagcccggc 120
aaggccccca agctgtggat ctactccacc tccaacctgg cctccggcgt gccctccaga 180
ttctccggct ctggctccgg caccgactac accctgacca tctccagcat gcagcccgag 240
gacttcgcca cctactactg ccagcagcgg cggaactacc cctacacctt cggccagggc 300
accaagctgg aaatcaagcg gaccgtggcc gctcccagcg tgttcatctt cccaccctcc 360
gacgagcagc tgaagtccgg caccgccagc gtcgtgtgcc tgctgaacaa cttctacccc 420
cgcgaggcca aggtgcagtg gaaggtggac aacgccctgc agtccggcaa ctcccaggaa 480
tccgtcaccg agcaggactc caaggacagc acctactccc tgtcctccac cctgaccctg 540
tccaaggccg actacgagaa gcacaaggtg tacgcctgcg aagtgaccca ccagggcctg 600
tccagccccg tgaccaagtc cttcaaccgc ggcgagtgc 639
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2815683C2 |
| МУЛЬТСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, МУЛЬТСПЕЦИФИЧЕСКИЕ АКТИВИРУЕМЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2727836C2 |
| СУБСТРАТЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ И ДРУГИЕ РАСЩЕПЛЯЕМЫЕ ФРАГМЕНТЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2014 |
|
RU2832636C2 |
| КОМПОЗИЦИИ АНТИТЕЛ К ROR1 И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2017 |
|
RU2766190C2 |
| АНТИ-CEACAM1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2754876C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| МОНОСПЕЦИФИЧЕСКИЕ И БИСПЕЦИФИЧЕСКИЕ БЕЛКИ С РЕГУЛИРОВАНИЕМ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2793167C2 |
| ОХ40-СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2802070C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ, ОБЛАДАЮЩИЕ ОГРАНИЧЕННЫМ СВЯЗЫВАНИЕМ С СD3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2813816C2 |
| АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2017 |
|
RU2773355C2 |
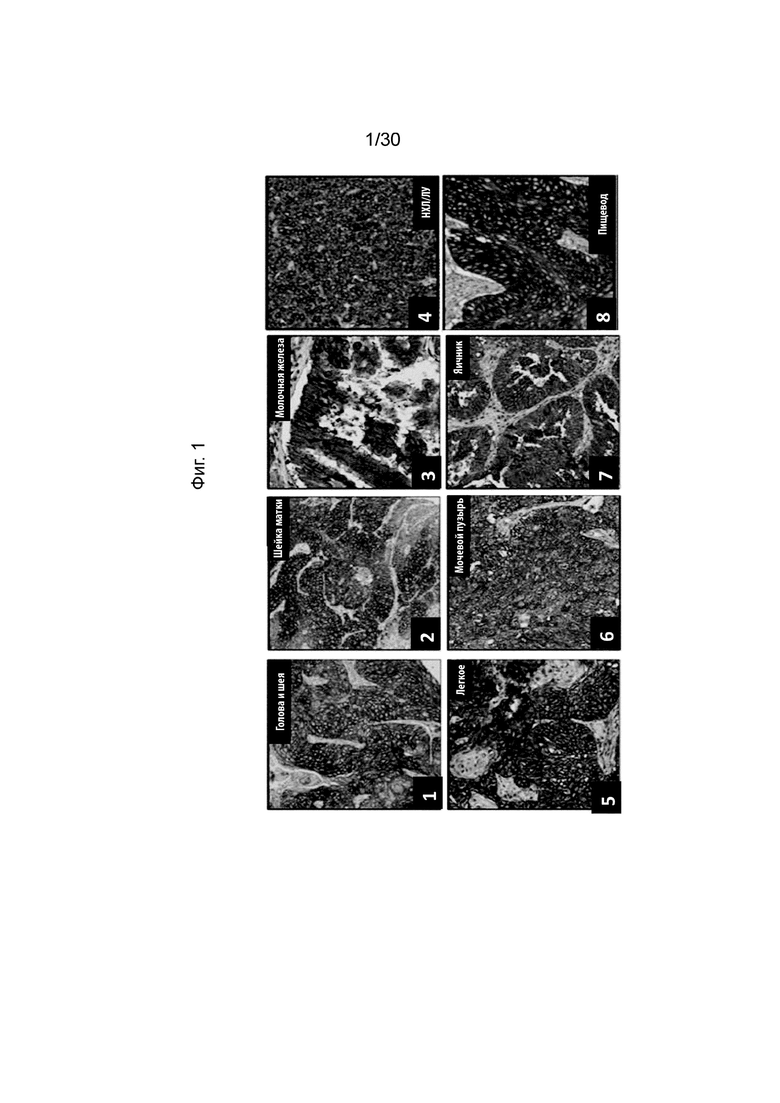
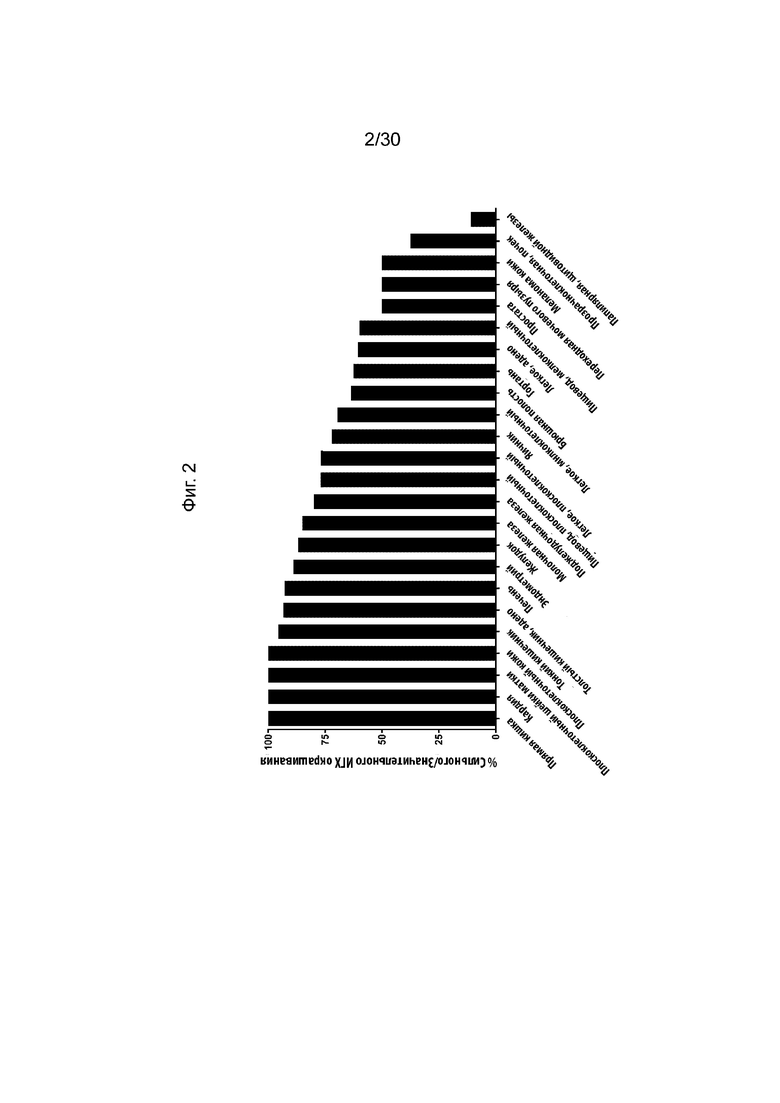
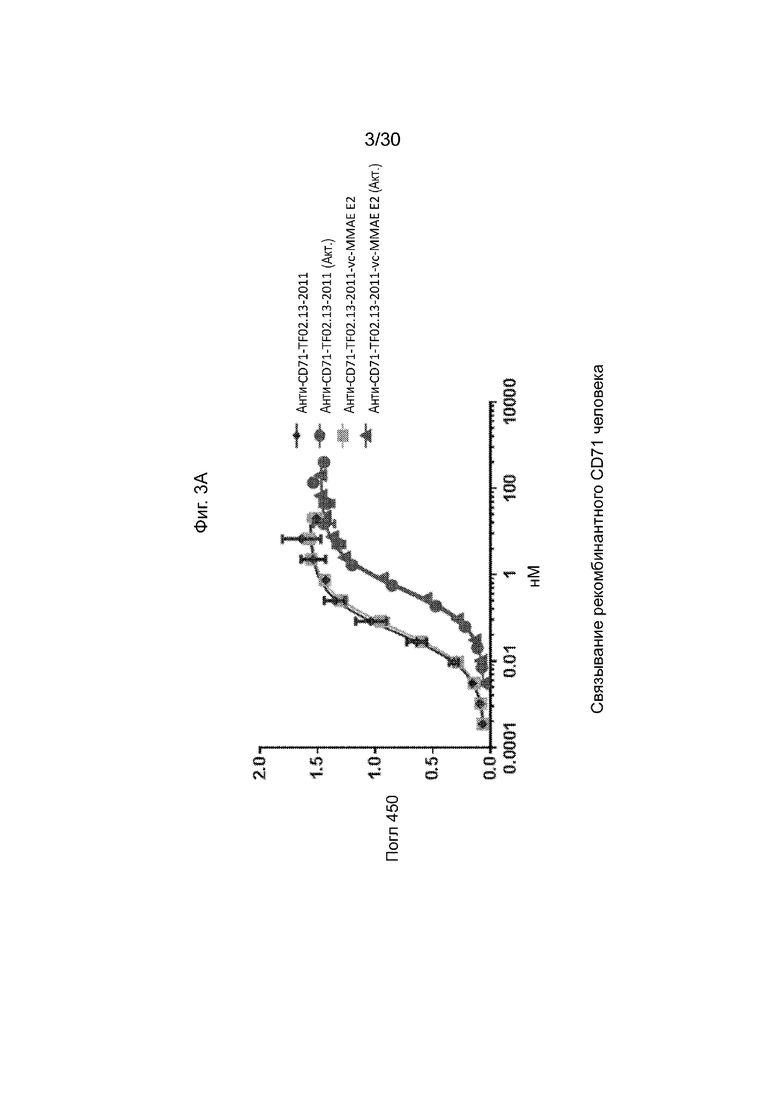
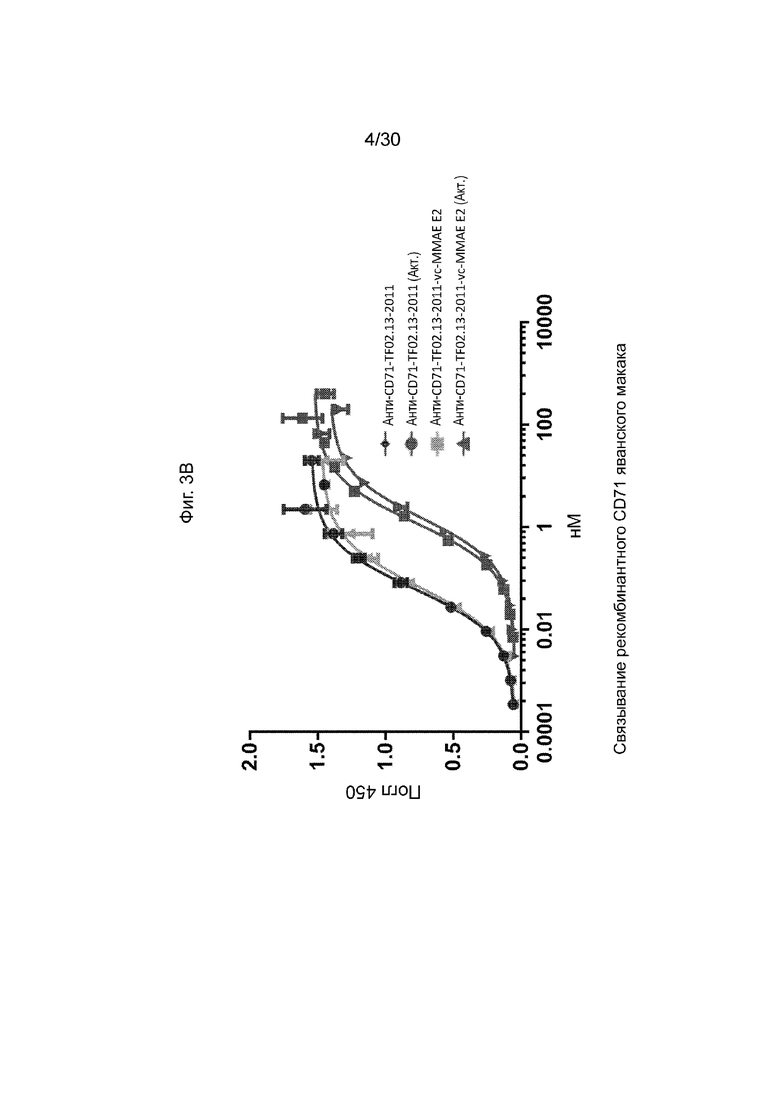
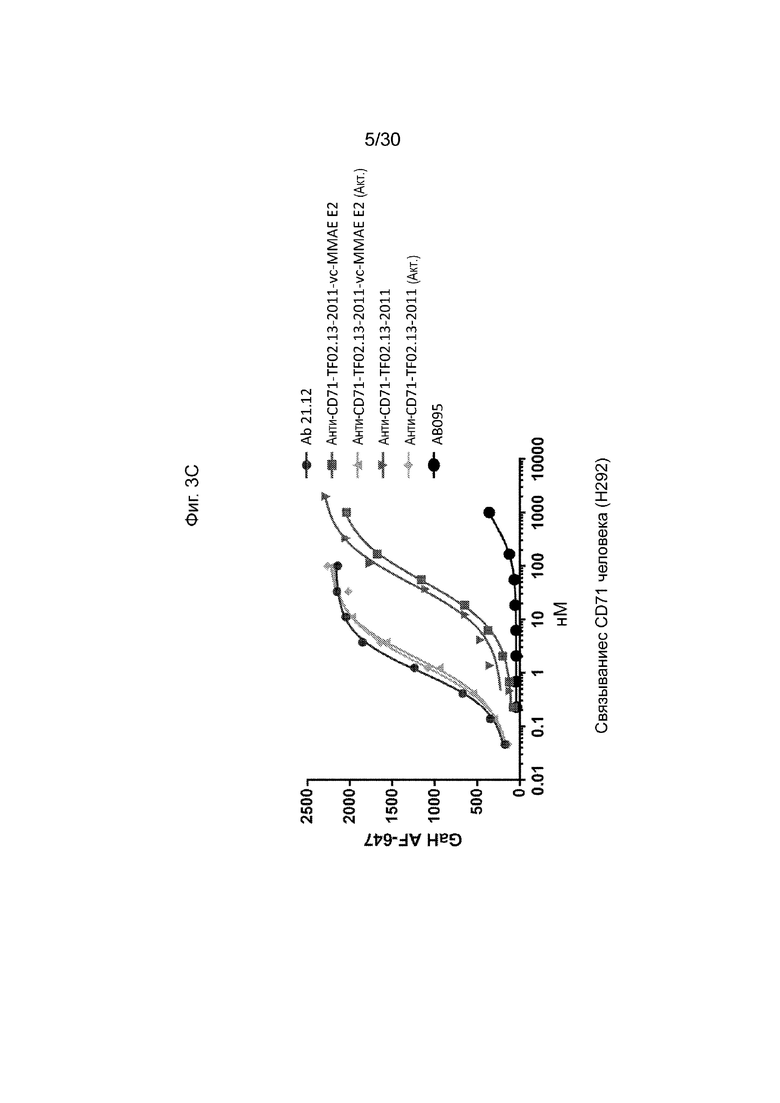
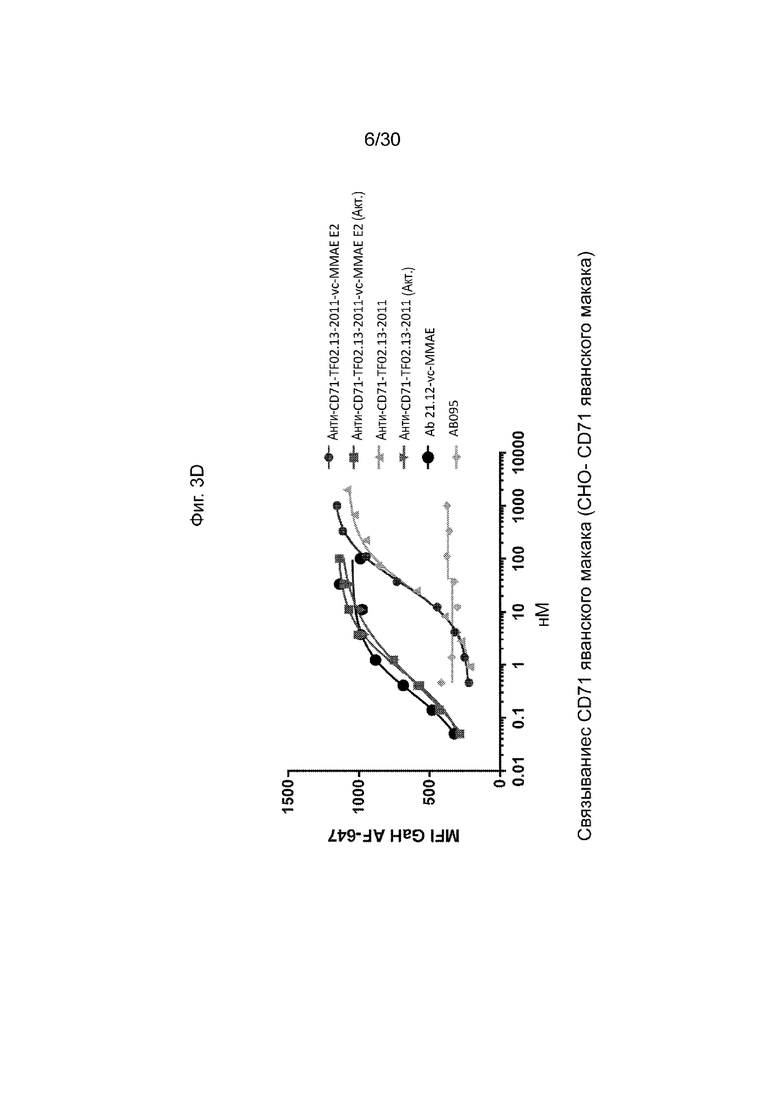
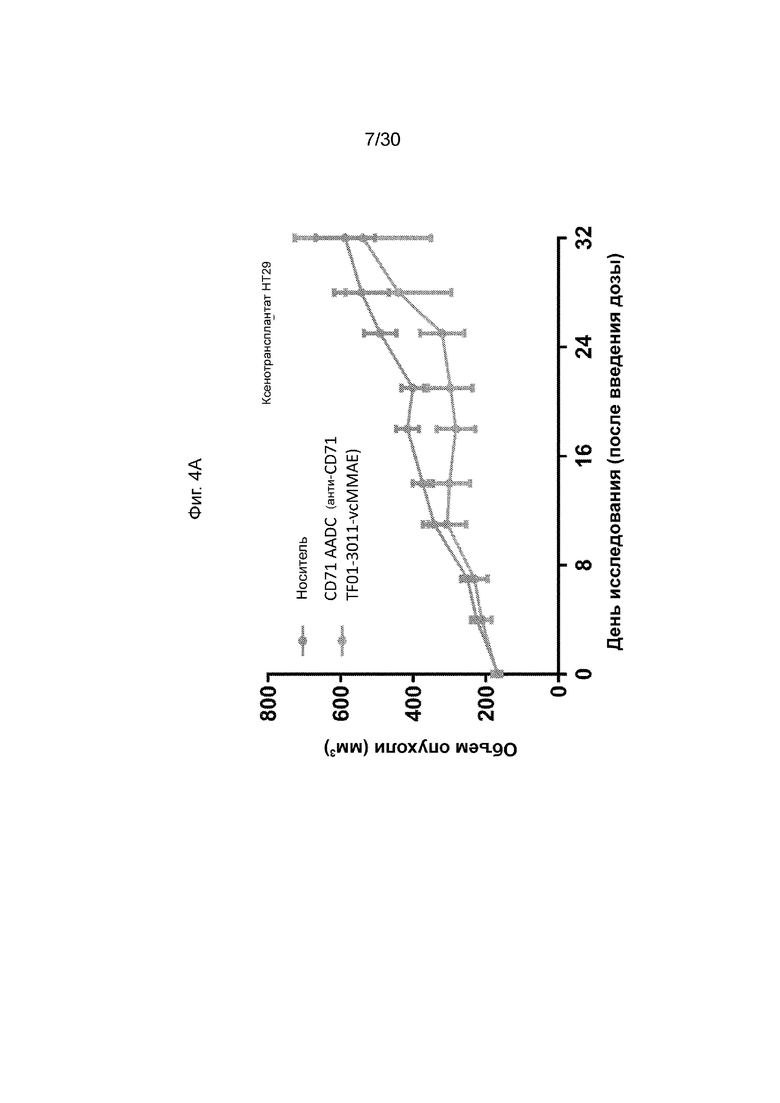
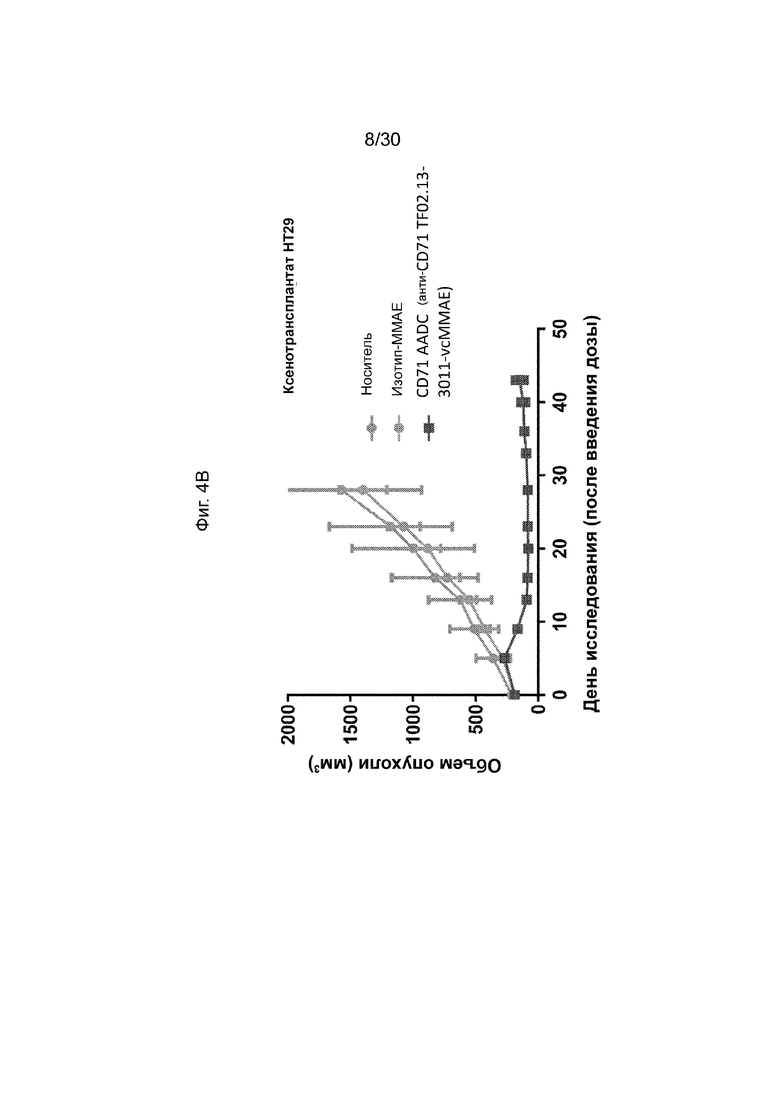

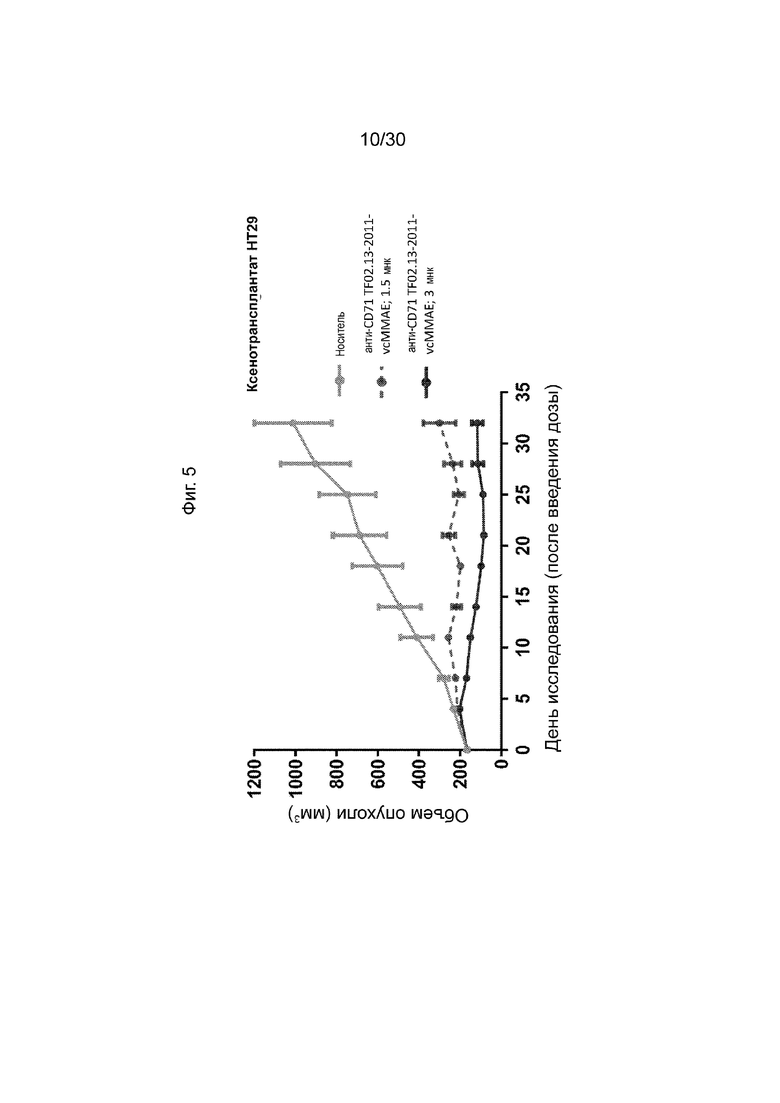
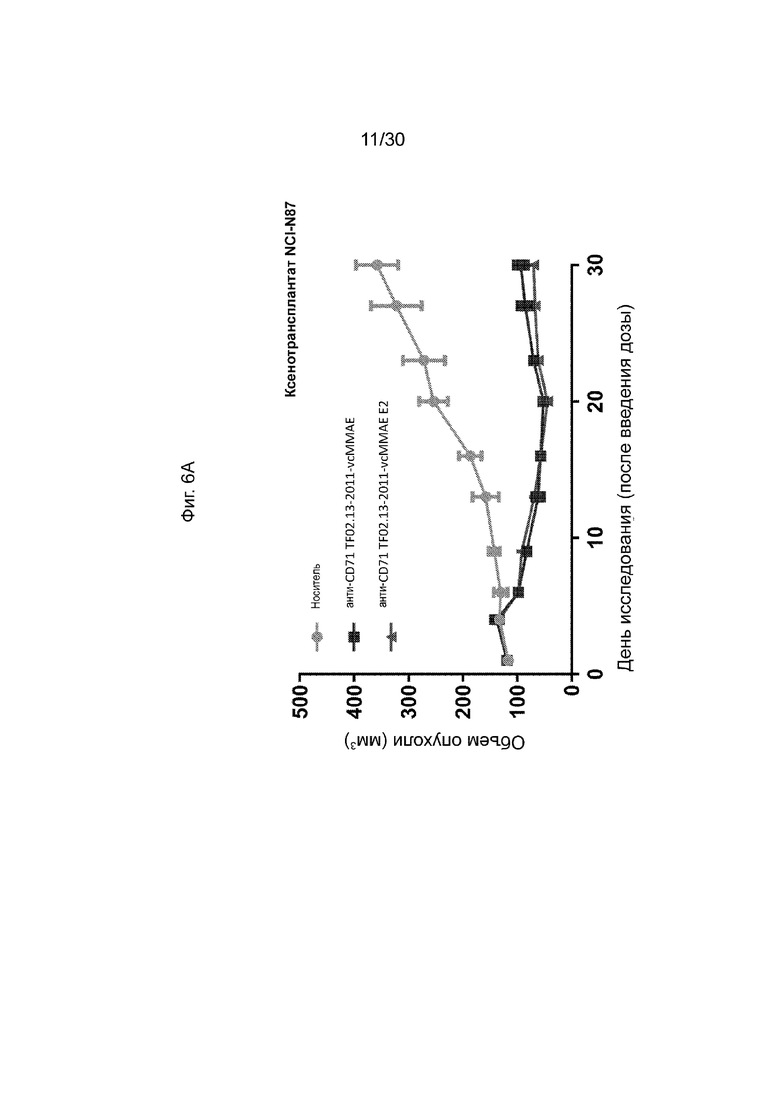
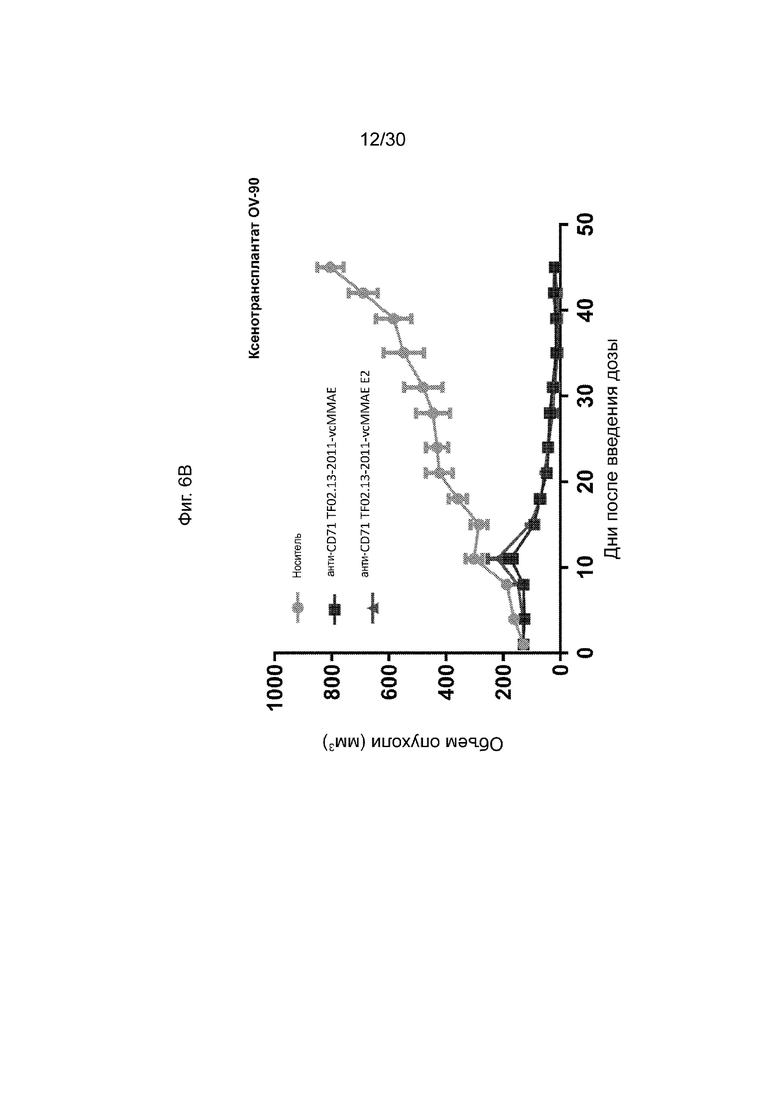
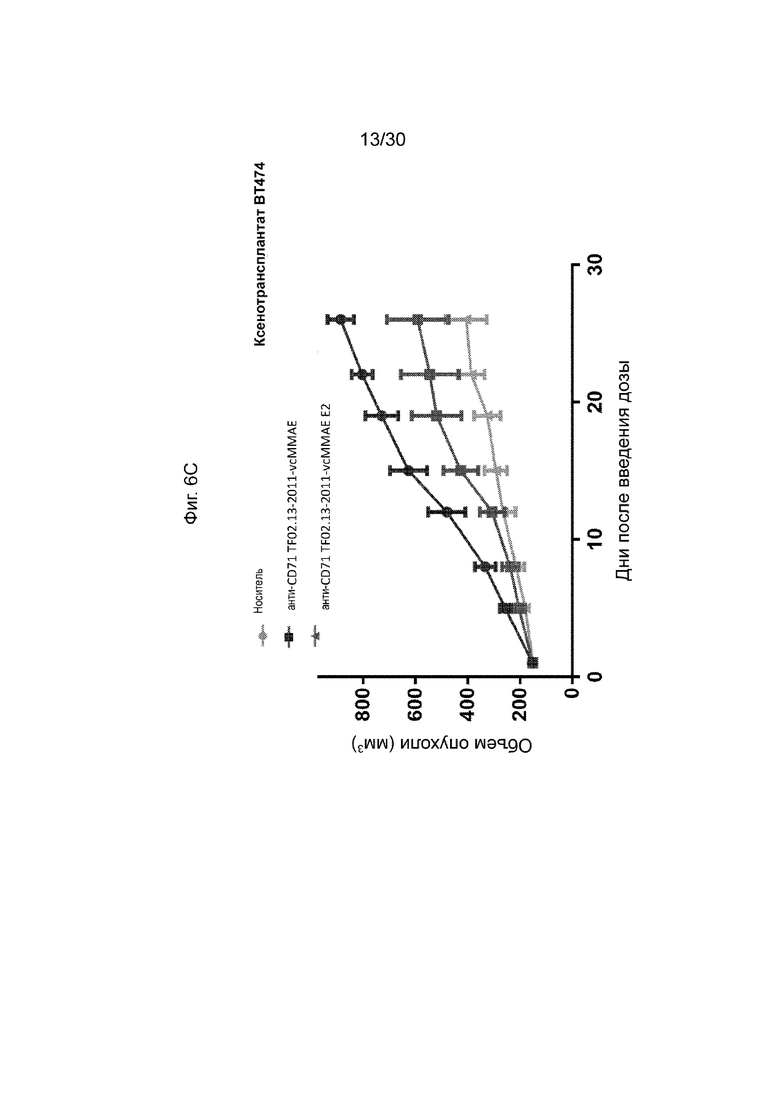
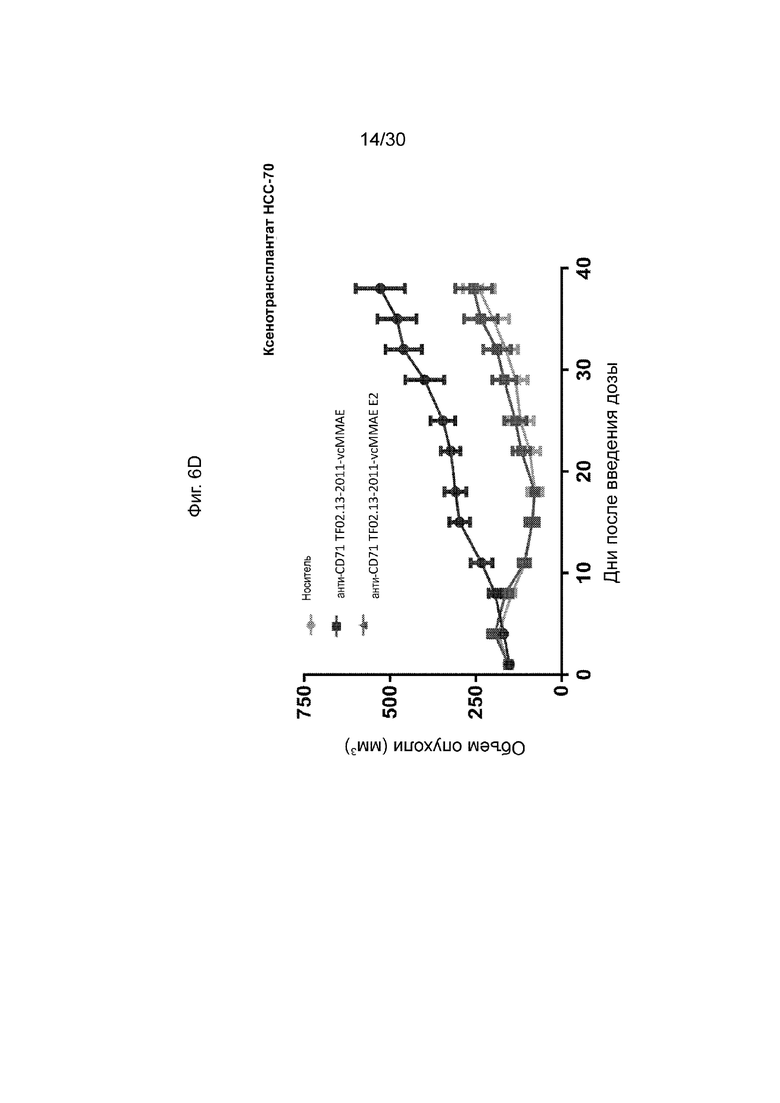


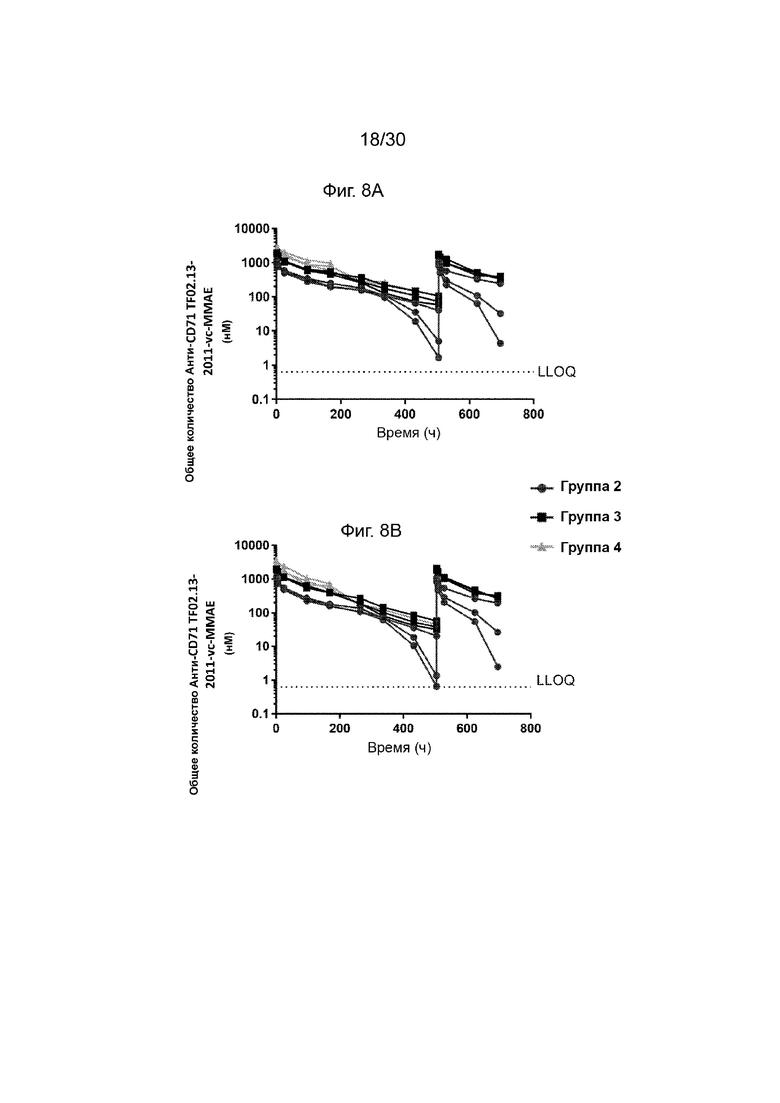
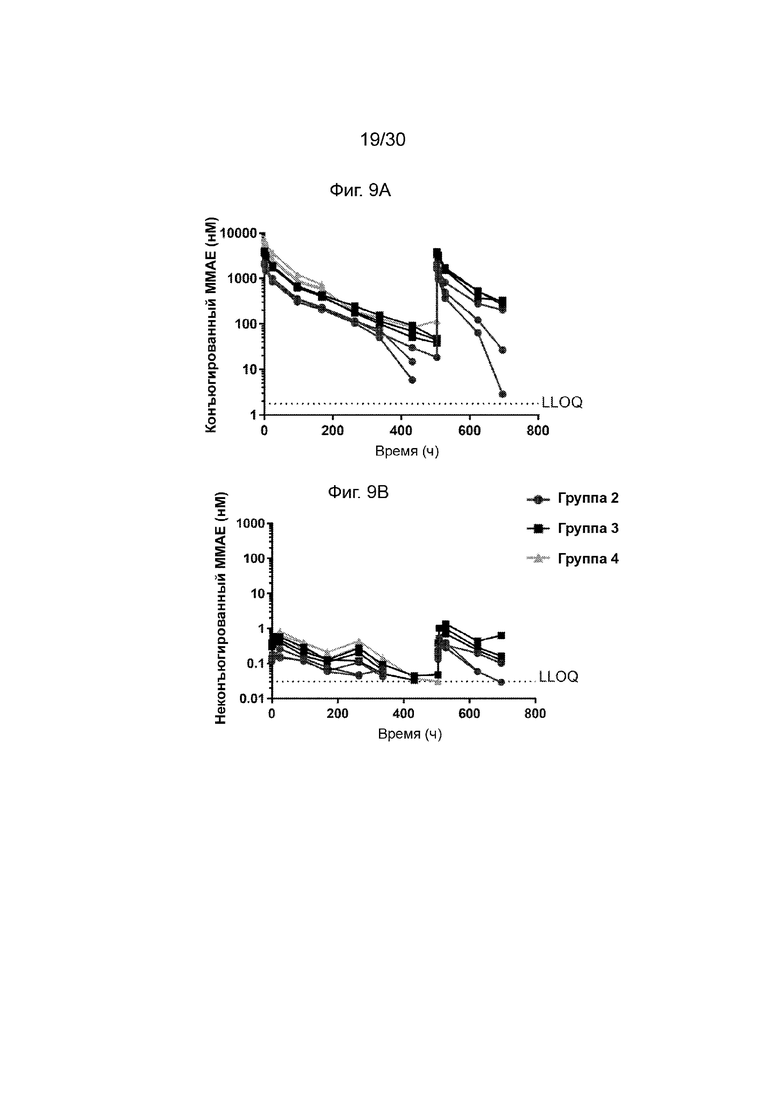
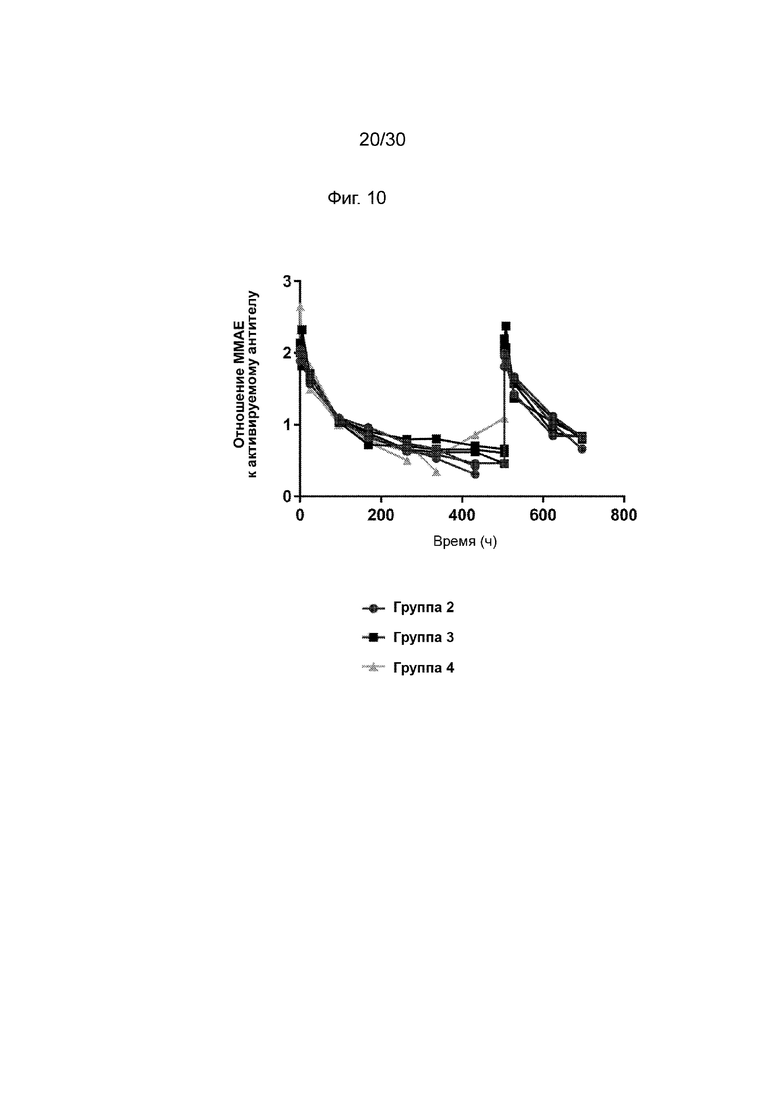
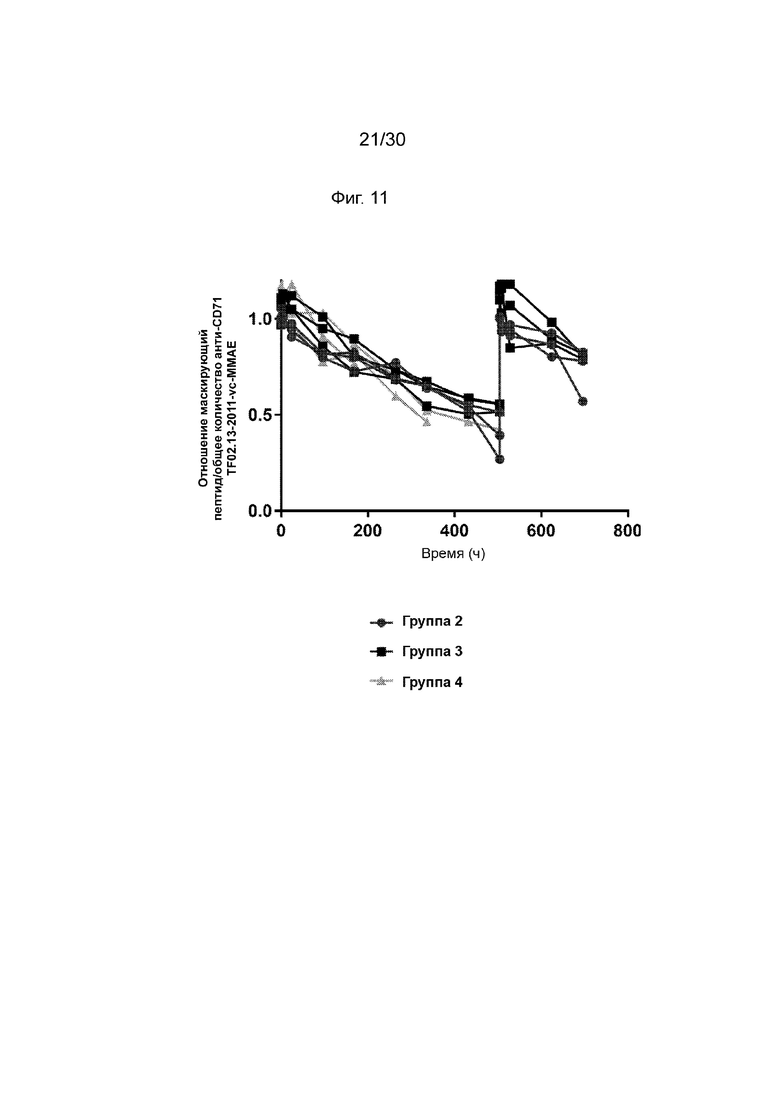
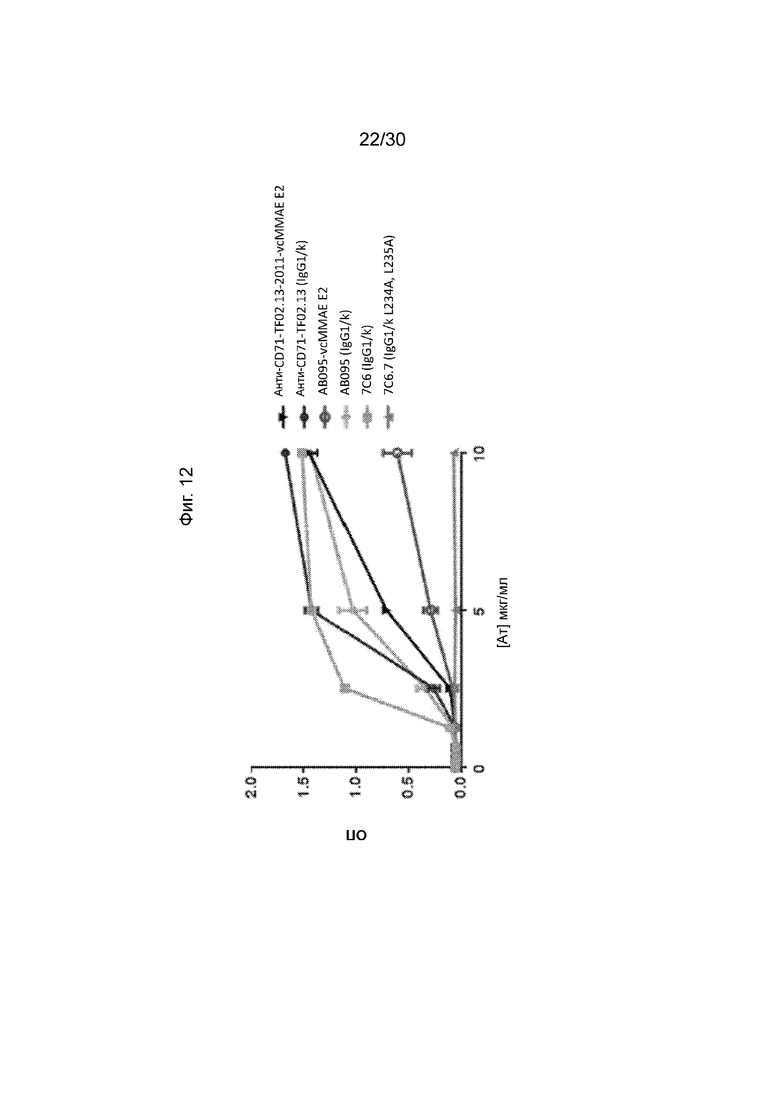

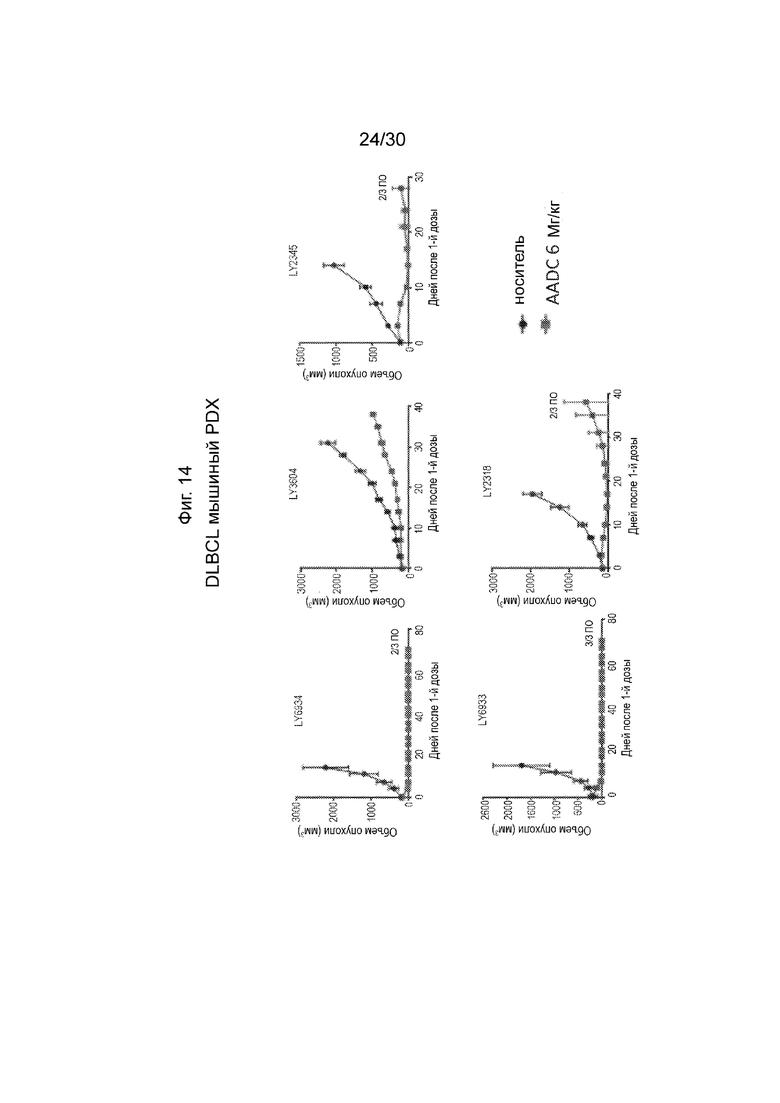
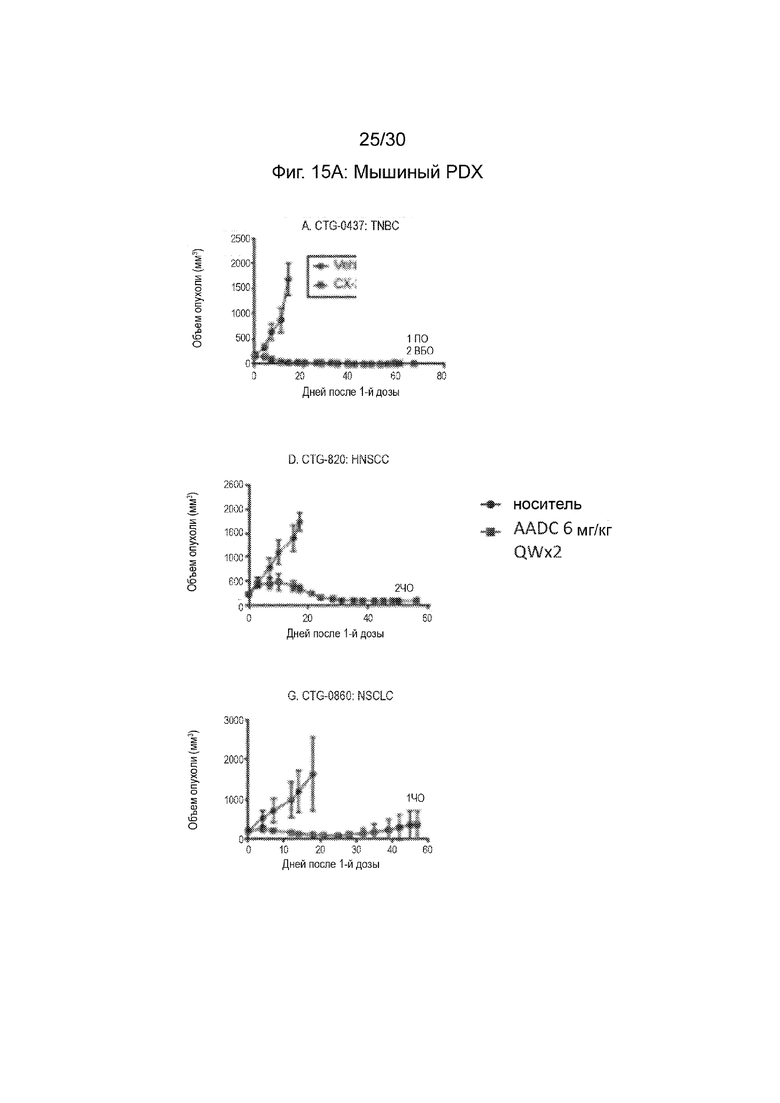
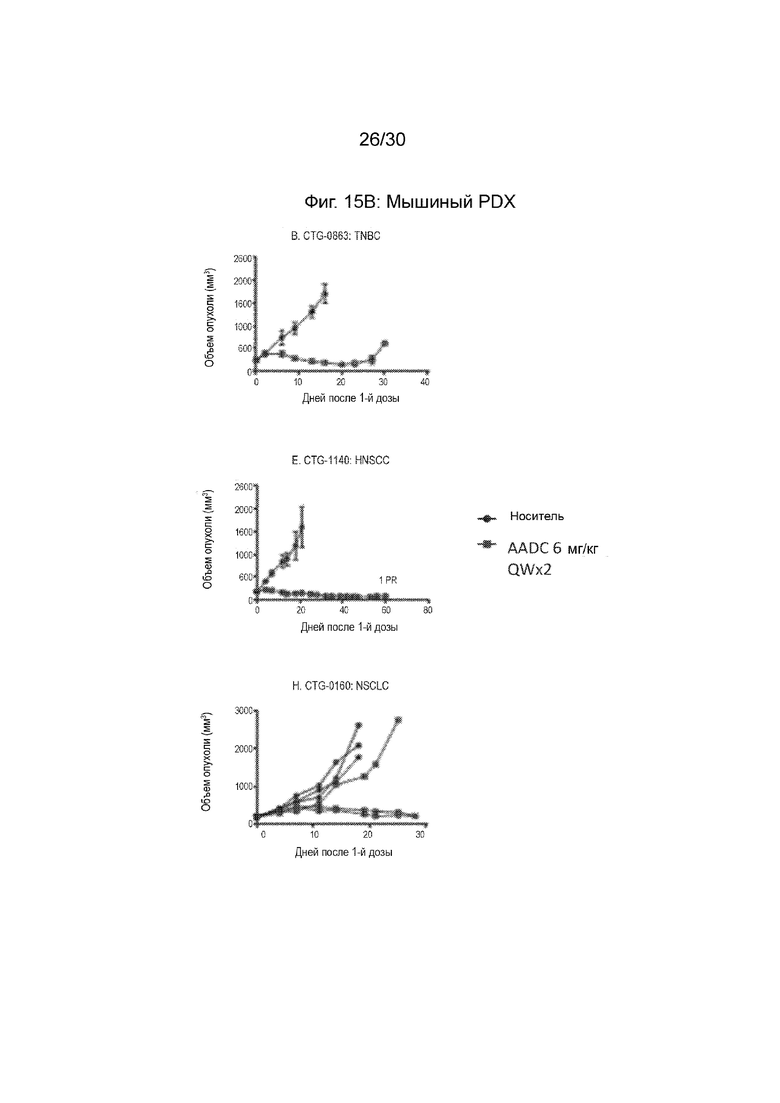
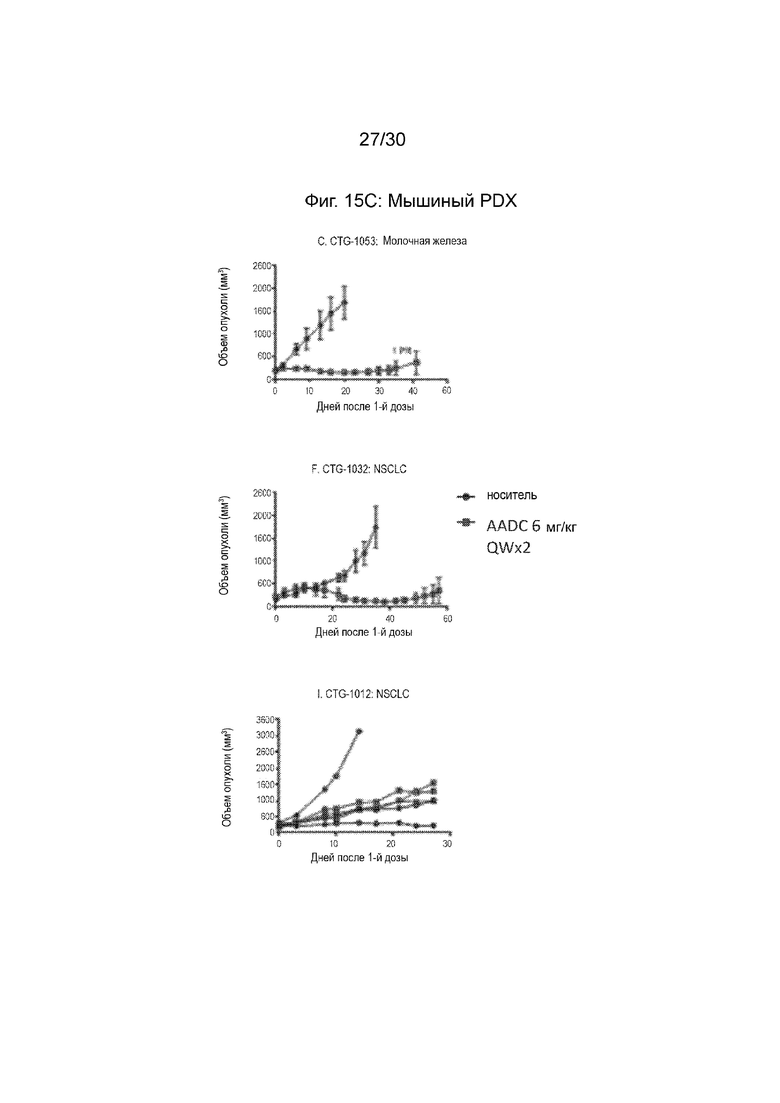
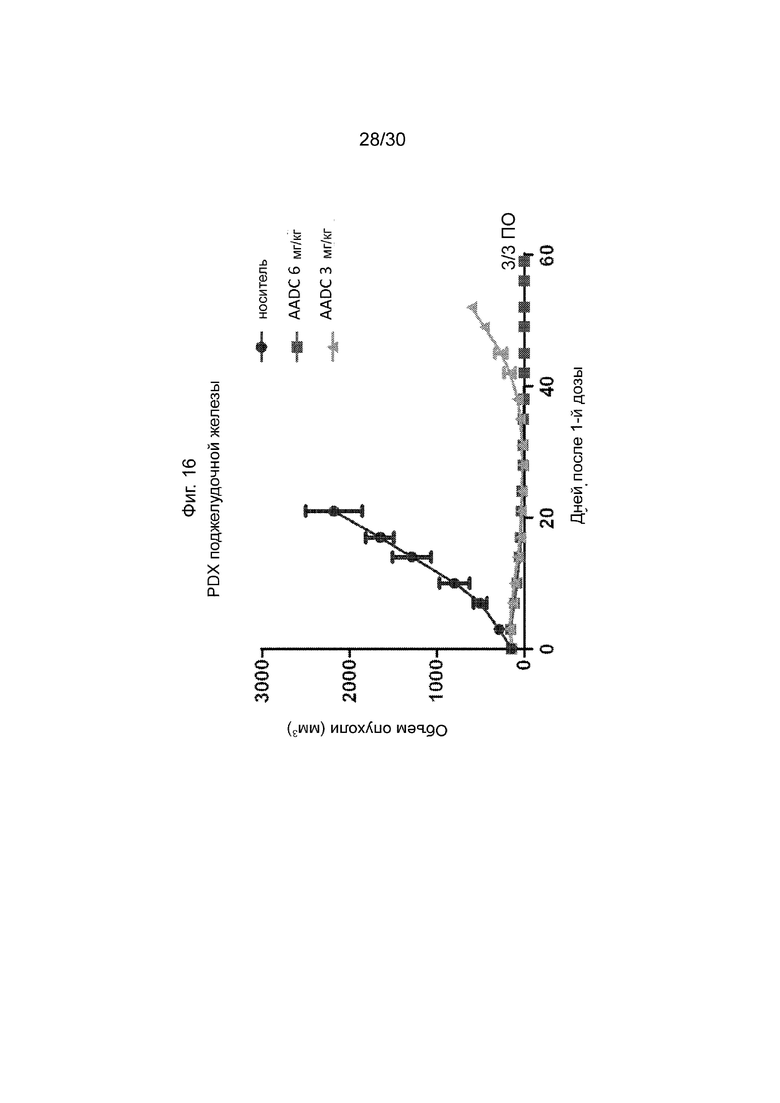
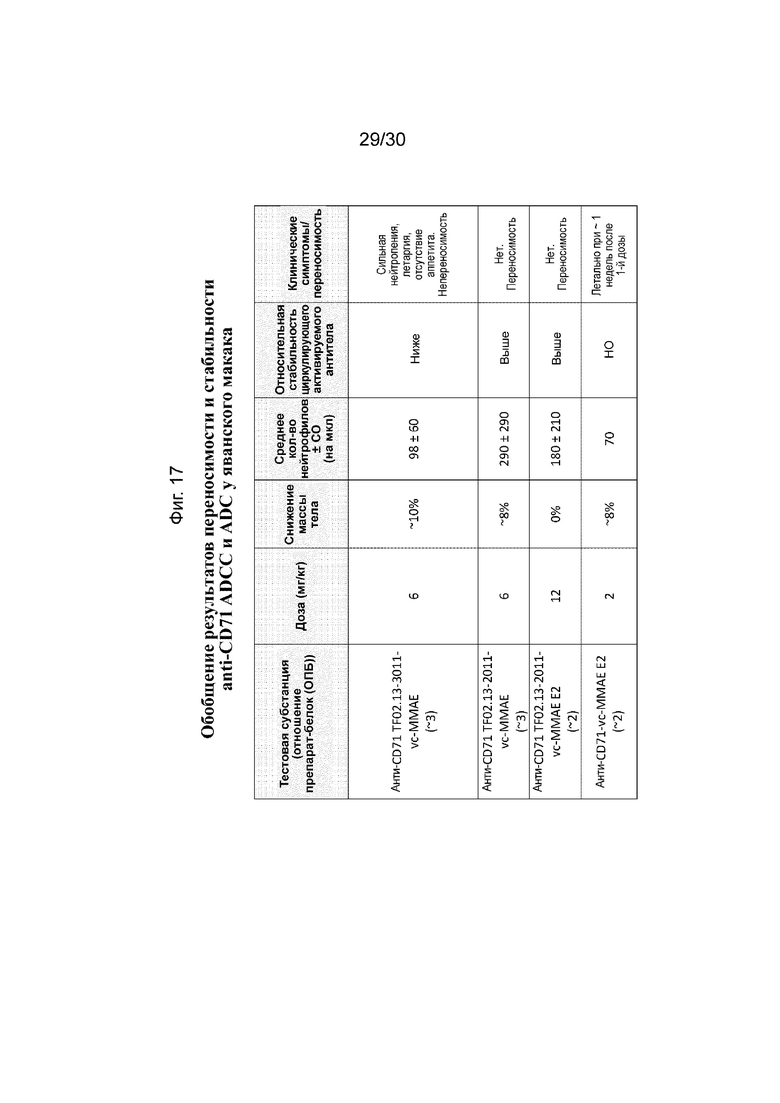
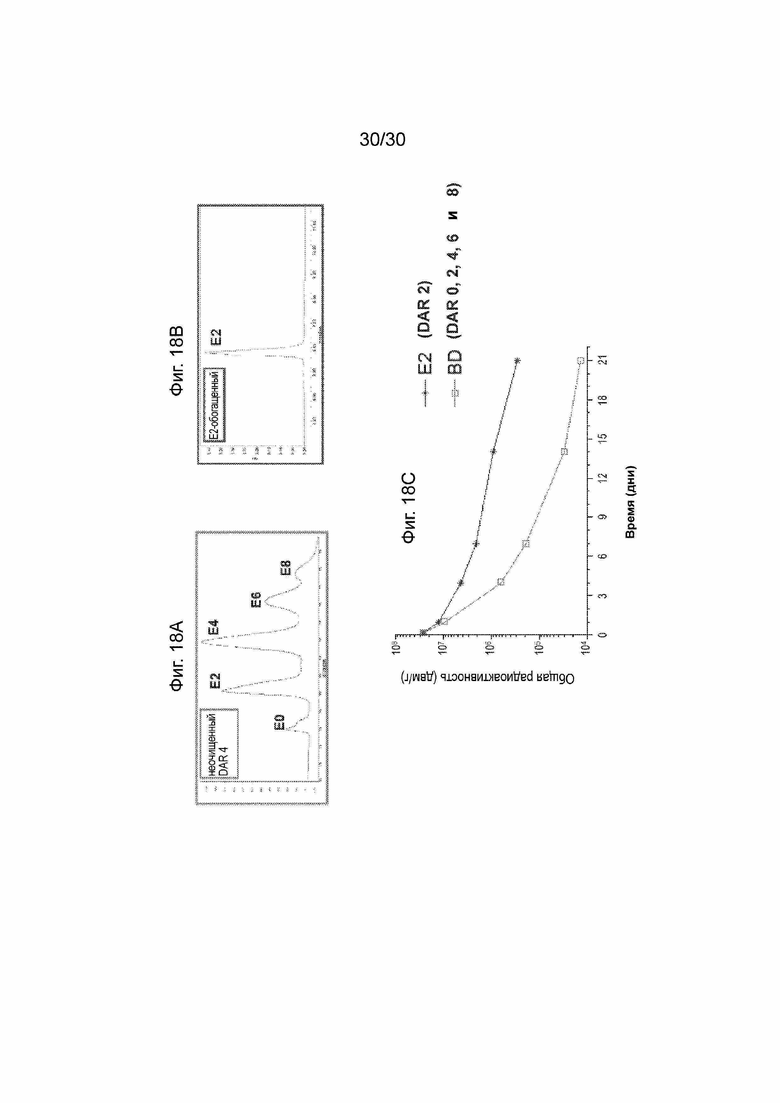
Изобретение относится к области биотехнологии. Описано конъюгированное активируемое антитело для лечения, облегчения симптомов или задержки прогрессирования рака у субъекта. Конъюгированное активируемое антитело представляет собой антитело, которое специфично связывается с CD71 человека и содержит вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15. Изобретение расширяет арсенал средств для лечения, облегчения симптомов или задержки прогрессирования рака у субъекта. 11 з.п. ф-лы, 34 ил., 15 табл., 27 пр.
1. Конъюгированное активируемое антитело для лечения, облегчения симптомов или задержки прогрессирования рака у субъекта, нуждающегося в этом,
где конъюгированное активируемое антитело содержит структуру Формулы (I) или ее соли:
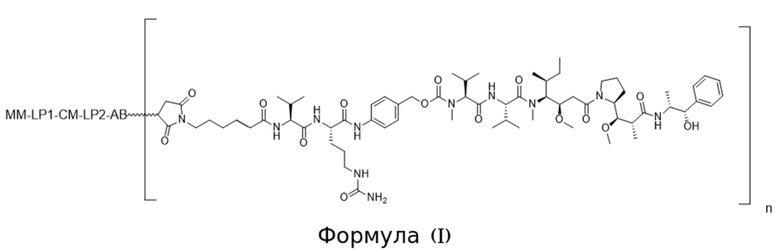
(а) где
(i) AB представляет собой антитело, которое специфично связывается с CD71 человека и содержит:
i. вариабельную область тяжелой цепи, содержащую последовательность CDRH1, содержащую SEQ ID NO: 9, последовательность CDRH2, содержащую SEQ ID NO: 10, и последовательность CDRH3, содержащую SEQ ID NO: 11; и
ii. вариабельную область легкой цепи, содержащую последовательность CDRL1, содержащую SEQ ID NO: 12 или SEQ ID NO: 13, последовательность CDRL2, содержащую SEQ ID NO: 14, и последовательность CDRL3, содержащую SEQ ID NO: 15;
(ii) ММ маскирующий фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 18, при этом указанный ММ ингибирует связывание AB с CD71 человека, когда коньюгированное активируемое антитело находится в неразрезанном состоянии;
(iii) LP1 представляет собой первый линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 207;
(iv) CM представляет собой разрезаемый фрагмент, содержащий последовательность SEQ ID NO: 156, при этом указанный CM представляет собой полипептид, который функционирует в качестве субстрата для протеазы; и
(v) LP2 представляет собой второй линкерный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 38; и
(b) где «n» равно 2.
2. Конъюгированное активируемое антитело по п. 1, где рак выбран из группы, состоящей из рака желудка, рака яичника, рака пищевода, немелкоклеточного рака легкого, ER+ рака молочной железы, тройного негативного рака молочной железы, колоректального рака, меланомы, рака простаты, множественной миеломы, диффузной крупноклеточной В-лимфомы, мелкоклеточного рака головы и шеи, рака поджелудочной железы, мезотелиомы, неходжкинской лимфомы, гепатоцеллюлярной карциномы и глиобластомы.
3. Конъюгированное активируемое антитело по п. 1 или 2, отличающееся тем, что АВ содержит изотип IgG1.
4. Конъюгированное активируемое антитело по любому из пп. 1-3, отличающееся тем, что АВ представляет собой антитело, имеющее константную область тяжелой цепи, и при этом С-концевой остаток константной области тяжелой цепи не является лизином.
5. Конъюгированное активируемое антитело по любому из пп. 1-4, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность SEQ ID NO: 5, и вариабельная область легкой цепи содержит последовательность SEQ ID NO: 7.
6. Конъюгированное активируемое антитело по любому из пп. 1-5, содержащее тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 19.
7. Конъюгированное активируемое антитело по любому из пп. 1-6, содержащее вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 201.
8. Конъюгированное активируемое антитело по п. 7, содержащее вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 202.
9. Конъюгированное активируемое антитело по п. 7, содержащее вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 202, где N-концевая аминокислота SEQ ID NO: 202 модифицирована в пироглутамат.
10. Конъюгированное активируемое антитело по любому из пп. 1-6, содержащее тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 169.
11. Конъюгированное активируемое антитело по п. 10, содержащее тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170.
12. Конъюгированное активируемое антитело по п. 10, содержащее тяжелую цепь, содержащую последовательность SEQ ID NO: 167, и легкую цепь, содержащую последовательность SEQ ID NO: 170, где N-концевая аминокислота SEQ ID NO: 170 модифицирована в пироглутамат.
| WO 2016179257 A2, 10.11.2016 | |||
| WO 2013115410 A2, 08.08.2013 | |||
| ТРАНСПОРТНЫЙ РОБОТ | 2010 |
|
RU2424891C1 |
| WO 2009061996 A2, 14.05.2009 | |||
| КОНЪЮГАТ АНТИ-TROP2 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2705367C2 |
Авторы
Даты
2022-04-29—Публикация
2018-10-12—Подача