Изобретение относится к гуманизированным антителам или фрагментам антител, которые связывают CD269 (BCMA), тем самым нарушая взаимодействие между CD269 и его нативными лигандами (BAFF и APRIL), и к их применению для лечения опосредуемых плазмацитами заболеваний, таких как множественная миелома и аутоиммунные заболевания.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
B-клеточный антиген созревания (BCMA) является представителем 17 суперсемейства рецептора фактора некроза опухоли (TNFRSF). Его нативными лигандами являются B-клеточный активирующий фактор (BAFF; также называемый BLyS или TALL-1, TNFSF13B) и индуцирующий пролиферацию лиганд (APRIL, TNFSF13, CD256), которые вовлечены (посредством взаимодействия с другими лигандами) в регуляцию различных аспектов гуморального иммунитета, развитие B-клеток и гомеостаз.
BCMA на высоком уровне экспрессируется на злокачественных плазмацитах, например, при множественной миеломе (MM), которая представляет собой B-клеточную неходжкинскую лимфому костного мозга, и плазмаклеточном лейкозе (PCL), который является более агрессивным, чем MM, и составляет приблизительно 4% от всех случаев плазмацитарных нарушений. В дополнение к MM и PCL, BCMA также обнаруживается на клетках Ходжкина и клетках Рид-Штернберга у пациентов, страдающих лимфомой Ходжкина (Chiu et al. (2007) Blood 109:729-739). Было показано, что аналогично функционированию на плазмацитах, связывание лиганда с BCMA модулирует рост и выживаемость клеток множественной миеломы, экспрессирующих BCMA (Novak et al. (2004) Blood 103:689-694). Передача сигнала BAFF и APRIL через BCMA считается факторами, способствующими выживанию, для злокачественных плазмацитов; таким образом, истощение BCMA-положительных опухолевых клеток и/или нарушение взаимодействия лиганд-рецептор должно улучшить терапевтический исход множественной миеломы и зависимых от аутоантител аутоиммунных заболеваний.
В настоящее время существуют различные доступные подходы для лечения множественной миеломы (Raab et al. (2009) Lancet 374:324-339). Химиотерапия обеспечивает у большинства индивидуумов только частичный контроль множественной миеломы; редко химиотерапия приводит к полной ремиссии. Таким образом, часто используют подходы комбинирования, вовлекающие дополнительное введение кортикостероидов, таких как дексаметазон или преднизон. Однако с кортикостероидами сопряжены побочные эффекты, такие как снижение плотности костей. Также была предложена трансплантация стволовых клеток с использованием собственных стволовых клеток индивидуума (аутологичные) или с использованием клеток от близкого родственника или совпадающего неродственного донора (аллогенные). При множественной миеломе большинство проводимых трансплантаций представляет собой трансплантации аутологичного типа. Было показано, что такие трансплантации, хотя и не являются излечивающими, продлевают жизнь отдельных пациентов (Suzuki (2013) Jpn J Clin Oncol 43:116-124). Альтернативно для лечения с недавних пор используют талидомид и его производные, однако они также ассоциированы с недостаточными показателями успеха и высокой стоимостью. Позднее ингибитор протеасом бортезомиб (PS-341) был одобрен для лечения рецидивирующей и рефрактерной MM, и его использовали в многочисленных клинических испытаниях отдельно или в комбинации с общепризнанными лекарственными средствами, что обеспечивало обнадеживающий клинический результат (Richardson et al. (2003) New Engl J Med 348:2609-2617; Kapoor et al. (2012) Semin Hematol 49:228-242). Стоимость комбинированного лечения, соответственно, является высокой, и показатели успеха, тем не менее, могли бы быть существенно лучшими. Комбинирование вариантов лечения также не является идеальным вследствие накопления побочных эффектов, если несколько лекарственных средств используют одновременно. Необходимы новые подходы для лечения плазмацитарных заболеваний, в частности, множественной миеломы.
Возможность специфического нацеливания на плазмациты также имеет высокое преимущество для лечения аутоиммунных заболеваний. Мягкие формы аутоиммунного заболевания сначала лечат нестероидными противовоспалительными лекарственными средствами (NSAID) или модифицирующими заболевание противоревматическими лекарственными средствами (DMARD). Более тяжелые формы системной красной волчанки (SLE), вовлекающие дисфункцию органов вследствие активного заболевания, обычно лечат стероидами совместно с сильнодействующими иммунодепрессивными средствами, такими как циклофосфамид - цитотоксическое средство, которое нацелено на делящиеся клетки. Только недавно белимумаб - антитело, нацеленное на цитокин BAFF, который обнаруживается на повышенных уровнях в сыворотке пациентов с аутоиммунными заболеваниями, получил одобрение Food and Drug Administration (FDA) для применения при SLE. Однако у человека BAFF необходим для выживания вновь образующихся B-клеток, в то время как B-клетки памяти и плазмациты являются менее чувствительными к селективному ингибированию BAFF (Jacobi et al. (2010) Arthritis Rheum 62:201-210). Для ревматоидного артрита (RA) ингибиторы TNF были первыми лицензированными биологическими средствами, за которыми последовали абатацепт, ритуксимаб и тоцилизумаб, и другие: они подавляют ключевые воспалительные каскады, вовлеченные в воспаление и разрушение суставов, что, однако, происходит за счет повышенного риска инфекции вследствие относительной иммуносупрессии (Chan et al. (2010) Nat Rev Immunol 10:301-316, Keyser (2011) Curr Rheumatol Rev 7:77-87). Несмотря на одобрение этих биологических средств, пациенты, страдающие RA и SLE, часто демонстрируют персистенцию аутоиммунных маркеров, которая, наиболее вероятно, связана с присутствием долгоживущих оседлых плазмацитов в костном мозге, которые являются устойчивыми, например, к опосредуемому CD20 уничтожению ритуксимабом, и глюкокортикоидам в высокой дозе, и терапии циклофосфамидом.
Антитела, которые связывают CD269 (BCMA), и их применение для лечения различных обусловленных B-клетками медицинских нарушений описаны в данной области. Ryan et al. (Molecular Cancer Therapeutics, 2007 6(11), 3009) описывают антитело против BCMA, полученное вакцинацией крыс с использованием пептида из аминокислот с 5 по 54 белка BCMA. В WO 2012/163805 описаны связывающие BCMA белки, такие как химерные и гуманизированные антитела, их применение для блокирования взаимодействия BAFF и/или APRIL с BCMA и их потенциальное применение для лечения плазмацитарных злокачественных опухолей, таких как множественная миелома. Антитело, описанное в настоящем описании, было получено посредством вакцинации мышей с использованием рекомбинантного пептида из аминокислот с 4 по 53 белка BCMA. В WO 2010/104949 также описаны различные антитела, которые предпочтительно связывают внеклеточный домен BCMA, и их применение для лечения опосредуемых B-клетками медицинских состояний и нарушений. В WO 2002/066516 и WO 2012/066058 описаны двухвалентные антитела, которые связывают как BCMA, так и дополнительные мишени, и их потенциальное применение для лечения обусловленных B-клетками медицинских нарушений. Детали, касающиеся связывающих свойств и конкретных эпитопов двухвалентных антител, не предоставлены ни в одном из описаний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Ввиду уровня техники, технической проблемой, лежащей в основе изобретения, было предоставление средства, пригодного для лечения заболеваний человека, ассоциированных с патогенными плазмацитами, таких как множественная миелома и аутоиммунные заболевания. Эта проблема решается с помощью признаков независимых пунктов формулы изобретения. Предпочтительные варианты осуществления настоящего изобретения предоставлены в зависимых пунктах формулы изобретения.
Таким образом, задачей изобретения является предоставление гуманизированного антитела или фрагмента антитела, которые связывают CD269 (BCMA), в частности, эпитоп внеклеточного домена CD269 (BCMA).
Антитела, описанные в настоящем описании, содержат гуманизированные последовательности, особенно гуманизированные последовательности предпочтительных связывающих областей VL и VH, которые сохраняют соответствующую аффинность к лиганду, как описано в отношении химерного антитела J22.9-xi.
В различных вариантах осуществления изобретения модификация аминокислотной последовательности для получения указанных гуманизированных последовательностей может быть проведена либо в областях CDR исходного химерного антитела J22.9-xi, либо в каркасных областях, где каркасную область следует понимать как область в вариабельном домене белка, принадлежащего суперсемейству иммуноглобулинов, которая является менее "вариабельной", чем CDR.
Было совершенно неожиданным, что конкретные гуманизированные последовательности, описанные в настоящем описании, предпочтительно области CDR областей VL и VH, вовлеченные в связывание, проявляют специфическое и высокое связывание, как продемонстрировано в экспериментальных примерах, и сохраняют характеристики связывания исходного химерного антитела J22.9-xi в такой степени, что сохраняется их желаемый терапевтический эффект.
Таким образом, изобретение относится к антителу или фрагменту антитела, содержащим VH-домен, который содержит последовательности CDR:
- RYWX1S (H-CDR1; SEQ ID NO: 15), где X1: I, F, L, V, Y. C, G, A, S, T);
- EINPX2X3STINYAPSLKDK (H-CDR2; SEQ ID NO: 16), где X2X3: SS, NS, TS, GS, KS, RS, SD, SN, DE; и/или
- SLYX4DYGDAX5DYW (H-CDR3; SEQ ID NO: 17), где X4: Y, L, A, V, F, I, W, и/или X5: Y, L, F, I, V, A, C,
где указанное антитело или его фрагмент специфически связывают эпитоп внеклеточного домена CD269 (BCMA).
В частности, было неожиданным, что гуманизированные антитела, описанные в настоящем описании, которые имеют изменения последовательности по сравнению с исходным химерным антителом, в частности, изменения последовательности в CDR указанного химерного антитела, сохраняют достаточные связывающие свойства в отношении их мишени для терапевтической эффективности.
Для квалифицированного специалиста является неожиданным, что характеристики связывания гуманизированных вариантов могут быть сходными с исходным химерным антителом или антителом мыши. Учитывая изменения последовательности в вариабельных доменах, в частности, в CDR, благоприятные характеристики связывания у гуманизированных последовательностей, продемонстрированные в настоящем описании, считаются неожиданным техническим эффектом. Сравнение характеристик связывания между частично и полностью гуманизированными антителами также демонстрирует улучшение полностью гуманизированных последовательностей. Это является полностью неожиданным результатом. Первоначальные модификации химеры (частично гуманизированные последовательности) привели к некоторой утрате аффинности связывания. Однако внесение дополнительной гуманизации впоследствии привело к усилению связывания, в результате чего "полностью гуманизированные" последовательности показывают свойства связывания, сходные с исходной химерой, тем самым демонстрируя неожиданный технический эффект после внесения таких значительных модификаций последовательности без существенного снижения аффинности связывания.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, отличаются тем, что домен VH содержит последовательность CDR RYWIS (SEQ ID NO: 18) или RYWFS (SEQ ID NO: 19).
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, отличаются тем, что указанный домен VH содержит последовательность CDR EINPNSSTINYAPSLKDK (SEQ ID NO: 20) или EINPSSSTINYAPSLKDK (SEQ ID NO: 21).
В следующих вариантах осуществления изобретения аминокислота 54 домена VH может относиться к любой указанной аминокислоте или модифицированной аминокислоте. Как показано в примерах ниже, потенциальное гликозилирование аминокислоты N в этом остатке не нарушает в значительной степени специфическое и высокое связывание антитела с его эпитопом-мишенью. Ввиду этой информации, изобретение относится к антителу или фрагменту антитела, содержащему последовательность CDR2, как описано в настоящем описании, где любая указанная аминокислота или модифицированная аминокислота может присутствовать в аминокислоте 54 домена VH последовательности CDR2.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, отличаются тем, что указанный домен VH содержит последовательность CDR SLYYDYGDAYDYW (SEQ ID NO: 22).
Кроме того, изобретение относится к антителу или фрагменту антитела, содержащим домен VL, который содержит последовательности CDR:
- KASQSVX1X2NVA (L-CDR1; SEQ ID NO: 23), где X1X2: ES, SS, TS, QS, HS, DH;
- SASLRFS (L-CDR2; SEQ ID NO: 24); и/или
- QQYNNYPLTFG (L-CDR3; SEQ ID NO: 25),
где указанное антитело или его фрагмент специфически связывают эпитоп внеклеточного домена CD269 (BCMA).
Также в отношении последовательности LC было неожиданным, что модифицированная последовательность CDR3 не имела выраженного неблагоприятного эффекта на связывание мишени BCMA.
Более того, антитела по настоящему изобретению также демонстрируют неожиданные и благоприятные характеристики стабильности, когда они находятся в растворе, как в выделенном или очищенном состоянии, или in vitro, так и in vivo после введения, которые нельзя было ожидать в результате изменений последовательности, проведенных в отношении исходного химерного антитела.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, отличаются тем, что VL-домен содержит последовательность CDR KASQSVDSNVA (SEQ ID NO: 26).
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, содержат домен VH, который содержит последовательность EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWX1SWVRQAPGKGLVWVGEINPX2X3STINYAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYX4DYGDAX5DYWGQGTLVTVSS (SEQ ID NO: 4), где X1: I, F, L, V, Y, C, G, A, S, T; X2X3: SS, NS, TS, GS, KS, RS, SD, SN, DE, предпочтительно SS; X4: Y, L, A, V, F, I, W; и X5: Y, L, F, I, V, A, C.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, отличаются тем, что антитело или фрагмент содержат домен VH, который содержит последовательность согласно SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, содержат домен VL, который содержит последовательность EIVMTQSPATLSVSPGERATLSCKASQSVX1X2NVAWYQQKPGQAPRALIYSASLRFSGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYNNYPLTFGAGTKLELKR (SEQ ID NO: 12), где X1X2: ES, SS, TS, QS, HS, DH.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, содержат домен VL, который содержит последовательность согласно SEQ ID NO: 14.
В предпочтительном варианте осуществления антитело или фрагмент антитела, как описано в настоящем описании, содержат домен VH, который сдержит последовательность согласно SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9, и домен VL, который содержит последовательность согласно SEQ ID NO: 14.
Кроме того, изобретение относится к антителу или фрагменту антитела, как описано в настоящем описании, содержащим домен VH, где указанный домен VH содержит последовательность согласно X1VQLX2X3SGGGLVQPGGSLX4LSCAASGX5X6FX7X8YWZ1SWVRX9APGKGLEWX10GEINPZ2SS TINYAPSLKX11X12FX13ISRDNAKNTLYLQMX14X15X16RX17EDTAX18YYCASLYYDYGDAZ3DY WGQGTX19VTVSS (SEQ ID NO: 41), где X1: Q, E; X2: Q, V; X3: Q, E; X4: K, R; X5: I, F; X6: D, T; X7: S, D; X8: R, D; X9: R, Q; X10: I, V; X11: D, G; X12: K, R; X13: I, T; X14: S, N; X15: K, S; X16: V, L; X17: S, A; X18: L, V; X19: S, L;
и где по меньшей мере один из Z1: I, F, L, V, Y, C, G, A, S, T, предпочтительно I или F; Z2: S, N, T, G, K, R, D, предпочтительно S и/или Z3: Y, L, F, I, V, A, C, предпочтительно Y;
и где указанное антитело или его фрагмент специфически связывают эпитоп внеклеточного домена CD269 (BCMA).
Этот вариант осуществления охватывает различные гуманизированные антитела, в частности, их последовательности VH, все варианты, определяемые преимущественной гуманизацией, проведенной в CDR, как описано в настоящем описании.
Кроме того, изобретение относится к антителу или фрагменту антитела, как описано в настоящем описании, содержащим VL-домен, где указанный VL-домен содержит последовательность согласно DIVMTQSX1X2X3X4X5X6SVGDX7VX8X9TCKASQSVESNVAWYQQKPX10QX11PKX12LIX13SX14X 15LRFSGVPARFX16GSGSGTDFTLTISX17LQSEDX18AX19YX20CQQYNNYPLTFGAGTKLELKR (SEQ ID NO: 42), где X1: Q, P; X2: R, A; X3: F, T; X4: M, L; X5: T, S; X6: T, V; X7: R, E; X8: S, T; X9: V, L; X10: R, G; X11: S, A; X12: A, L; X13: F, Y; X14: A, D; X15: S, D; X16: T, S; X17: N, S; X18: L, F; X19: E, V; X20: F, Y;
и где указанное антитело или его фрагмент специфически связывают эпитоп внеклеточного домена CD269 (BCMA). Этот вариант осуществления охватывает различные гуманизированные антитела, в частности, их последовательности VL, все варианты, определяемые преимущественной гуманизацией, проведенной в CDR, как описано в настоящем описании.
Предпочтительные варианты осуществления, касающиеся гуманизированных вариантов антител
Как подробно описано в настоящем описании, последовательность предпочтительных вариантов осуществления изобретения согласно J22.9-xi гуманизировали для предоставления более совместимого реагента для введения человеку. Были получены различные гуманизированные варианты последовательности J22.9-xi, и они были исследованы в отношении их аффинности связывания и специфичности в отношении CD269 как человека, так и яванского макака (BCMA). Результаты анализов связывания демонстрируют, что гуманизированные последовательности сохраняют желаемые свойства связывания химерного реагента J22.9-xi. В последовательностях ниже подчеркнутые области соответствуют CDR или предполагаемым CDR.
Предпочтительные варианты осуществления, касающиеся гуманизированных вариантов VH
Ниже предоставлена дополнительная информация, касающаяся последовательности гуманизированного антитела по настоящему изобретению.
Химерная последовательность:
HC мыши (SEQ ID NO: 1):
QVQLQQSGGGLVQPGGSLKLSCAASGIDFSRYWMSWVRRAPGKGLEWIGEINPDSSTIN YAPSLKDKFIISRDNAKNTLYLQMSKVRSEDTALYYCASLYYDYGDAMDYWGQGTSVTVSS
Последовательность HC мыши соответствует вариабельной области тяжелой цепи (VH), первоначально разработанной для химерного антитела J22.9-xi, которое содержит домены VL и VH, полученные из антитела мыши, способные связываться с эпитопом внеклеточного домена CD269 (BCMA), и в котором домены VL и VH слиты с доменами CL и CH человека, соответственно.
Частично гуманизированные последовательности:
Частично гуманизированная HC (SEQ ID NO: 2):
EVQLVESGGGLVQPGGSLRLSCAASGFTFDDYWMSWVRQAPGKGLEWVGEINPDSSTIN YAPSLKGRFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYYDYGDAMDYWGQGTLVTVSS
Частично гуманизированная последовательность HC представляет собой модифицированную аминокислотную последовательность (посредством аминокислотных замен) по сравнению с химерным антителом, описанным в настоящем описании, в которой связывающие области VL и VH модифицированы в отношении их последовательности, что делает их более пригодными для введения человеку.
Гуманизированная последовательность VH:
hHC01 (SEQ ID NO: 3)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWMSWVRQAPGKGLVWVGEINPDSSTIN YAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYYDYGDAMDYWGQGTLVTVSS
Гуманизированная последовательность VH с удалением мотивов посттрансляционной модификации:
hHC02 (SEQ ID NO: 4)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWX1SWVRQAPGKGLVWVGEINPX2X3ST INYAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYX4DYGDAX5DYWGQGTLVTVSS
где:
X1: I, F, L, V, Y. C, G, A, S, T, предпочтительно I или F;
X2X3: SS, NS, TS, GS, KS, RS, SD, SN, DE, предпочтительно SS;
X4: Y, L, A, V, F, I, W, предпочтительно Y; и/или
X5: Y, L, F, I, V, A, C, предпочтительно Y;
Гуманизированные последовательности "hHC01" и "hHC02" представляют собой новые аминокислотные последовательности, которые содержат изменения последовательности по сравнению как с исходной химерной последовательностью, так и с частично гуманизированными последовательностями, описанными в настоящем описании.
Мутации PTM предназначены для удаления потенциально вредоносных мотивов посттрансляционной модификации из указанных белков, при сохранении преимущественных свойств связывания. Положения 1, 5, 6, 19, 27, 28, 34, 39, 46, 48, 54, 69, 84, 85, 86, 88, 93, 107 и/или 115 hHC01 и hHC02 предпочтительно являются мутантными (замещенными) по сравнению с исходной химерной последовательностью. Важность замены обусловлена в основном конечной аминокислотой, а не исходной аминокислотой. Таким образом, замену также можно проводить с соответствующей исходной химерной аминокислоты или другого варианта, такого как частично гуманизированные последовательности.
Следующие замены являются новыми по сравнению с химерной (SEQ ID NO: 1) последовательностью:
- аминокислота M34 последовательности HC (VH) заменена любой аминокислотой, предпочтительно I, L, F, V, Y. C, G, A, S, T;
- аминокислота E46 последовательности HC (VH) заменена на V;
- аминокислоты D54 и S55 последовательности HC (VH) заменена любой комбинацией аминокислот, предпочтительно SS, TS, GS, KS, RS, SD, SN, DE;
- аминокислота Y101 последовательности HC (VH) заменена любой аминокислотой, предпочтительно L, A, V, F, I, W; и/или
- аминокислота M107 последовательности HC (VH) заменена любой аминокислотой, предпочтительно L, Y, F, I, V, A, C.
Последовательности, которые могут быть модифицированными в остатках, требуемых для прямого взаимодействия с BCMA:
hHC03 - модифицированные аминокислоты, вовлеченные во взаимодействие с BCMA (SEQ ID NO: 5):
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYX1MX2WVRQAPGKGLVX3VGX4INPDSST INYAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASX5X6X7DYGDX8MDYWGQGTLVTVS S
Где предпочтительными аминокислотами являются:
X1: W, F, Y, предпочтительно W;
X2: S, T, N, Q, D, E, предпочтительно S;
X3: W, F, Y, предпочтительно W;
X4: E, Q, предпочтительно E;
X5: L, I, V, G, A, предпочтительно L;
X6: Y, X, предпочтительно Y;
X7: Y, F, L, I, V, M, предпочтительно Y; и/или
X8: A, G, V, предпочтительно A.
Гуманизированная последовательность "hHC03" соответствует новым аминокислотным последовательностям, которые содержат замены аминокислотной последовательности по сравнению как с исходной химерной последовательностью, так и с частично гуманизированной последовательностью. Эти изменения последовательности отражают потенциальные изменения аминокислот, связывающих мишень BCMA, которые могут быть заменены при сохранении преимущественных свойств связывания. Важность замены обусловлена в основном конечной аминокислотой, а не исходной аминокислотой. Таким образом, изменение также можно проводить с соответствующей аминокислоты исходной химерной аминокислотной последовательности или другого варианта.
Например:
- аминокислота W33 последовательности HC (VH) представляет собой W, F, Y;
- аминокислота S35 последовательности HC (VH) представляет собой S, T, N, Q, D, E;
- аминокислота W47 последовательности HC (VH) представляет собой W, F, Y;
- аминокислота E50 последовательности HC (VH) представляет собой E, Q;
- аминокислота L99 последовательности HC (VH) представляет собой L, I, V, G, A;
- аминокислота Y100 последовательности HC (VH) представляет собой Y, X;
- аминокислота Y101 последовательности HC (VH) представляет собой Y, F, L, I, V, M; и/или
- аминокислота A106 последовательности HC (VH) представляет собой A, G, V.
Как правило, любое изменение области CDR, внесенное в процессе гуманизации, также можно считать признаком последовательности CDR при рассмотрении независимо от каркасной последовательности в целом. Такие модифицированные последовательности CDR можно считать определяющими признаками настоящего изобретения, либо в пределах, либо независимо от их контекста в целой каркасной области, описанной в настоящем описании. Например, последовательности CDR, обозначенные подчеркиванием в hHC01-hHC03, можно считать определяющим признаком изобретения независимо от окружающей каркасной последовательности.
Конкретные примеры гуманизированных последовательностей HC (VH):
hHC04 (SEQ ID NO: 6):
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWISWVRQAPGKGLVWVGEINPNSSTIN YAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYYDYGDAYDYWGQGTLVTVSS
hHC05 (SEQ ID NO: 7):
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWFSWVRQAPGKGLVWVGEINPNSSTIN YAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYYDYGDAYDYWGQGTLVTVSS
hHC06 (SEQ ID NO: 8):
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWISWVRQAPGKGLVWVGEINPSSSTIN YAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYYDYGDAYDYWGQGTLVTVSS
hHC07 (SEQ ID NO: 9):
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWFSWVRQAPGKGLVWVGEINPSSSTIN YAPSLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYYDYGDAYDYWGQGTLVTVSS
Выравнивание:
Множественное выравнивание последовательностей CLUSTAL W (1.83) различных замещенных положений в последовательности HC обеспечивает соответствующие сравнения последовательностей, приведенные на фиг.8. "Общая последовательность" представляет собой последовательность HC, в которой каждый X представляет собой потенциальную аминокислотную замену на любую данную аминокислоту. Предпочтительные аминокислотные замены представляют собой замены, описанные выше, для каждого из потенциально мутантных положений.
Предпочтительные варианты осуществления, касающиеся гуманизированных вариантов VL
Химерная последовательность:
LC мыши (SEQ ID NO: 43):
DIVMTQSQRFMTTSVGDRVSVTCKASQSVDSNVAWYQQKPRQSPKALIFSASLRFSGVPARFTGSGSGTDFTLTISNLQSEDLAEYFCQQYNNYPLTFGAGTKLELKR
Последовательность LC мыши представляет собой вариабельную область легкой цепи (VL), первоначально разработанную для химерного антитела J22.9-xi, которая содержит домены VL и VH, полученные из антитела мыши, способные связывать эпитоп внеклеточного домена CD269 (BCMA), и в которой домены VL и VH слиты с доменами CL и CH человека, соответственно.
Частично гуманизированные последовательности:
Частично гуманизированная LC (SEQ ID NO: 10):
DIVMTQSPATLSVSVGDEVTLTCKASQSVDSNVAWYQQKPGQAPKLLIYSDDLRFSGVPARFSGSGSGTDFTLTISSLQSEDFAVYYCQQYNNYPLTFGAGTKLELKR
Частично гуманизированная последовательность LC представляет собой модифицированную последовательность (посредством аминокислотных замен) по сравнению с химерным антителом, описанным в примерах настоящего изобретения, в котором последовательность связывающих областей VL и VH модифицирована так, чтобы они были более пригодными для введения человеку.
Гуманизированная последовательность VL:
hLC01 (SEQ ID NO: 11):
EIVMTQSPATLSVSPGERATLSCKASQSVDSNVAWYQQKPGQAPRALIYSASLRFSGIP ARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYNNYPLTFGAGTKLELKR
Гуманизированная последовательность VL с удалением мотивов посттрансляционной модификации:
hLC02 (SEQ ID NO: 12):
EIVMTQSPATLSVSPGERATLSCKASQSVX1X2NVAWYQQKPGQAPRALIYSASLRFSGI PARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYNNYPLTFGAGTKLELKR
где:
X1X2: ES, SS, TS, QS, HS, DH, предпочтительно ES.
Гуманизированные последовательности "hLC01" и "hLC02" представляют собой новые аминокислотные последовательности, которые содержат изменения аминокислотной последовательности по сравнению как с исходной химерной последовательностью, так и с частично гуманизированными последовательностями, описанными в настоящем описании.
Мутации PTM предназначены для удаления частично неблагоприятных мотивов посттрансляционной модификации из указанных белков при сохранении преимущественных свойств связывания. Положения 1, 8, 9, 10, 13, 15, 17, 19, 20, 21, 22, 30, 41, 43, 45, 49, 58, 63, 70, 77, 83, 85 и/или 87 hLC01 и hLC02 предпочтительно являются мутантными (заменены) по сравнению с исходной химерной последовательностью). Важность замены обусловлена в основном конечной аминокислотой, а не исходной аминокислотой. Таким образом, изменение можно проводить с соответствующей исходной химерной аминокислоты или другого варианта.
Следующие замены являются новыми относительно химерных и частично гуманизированных последовательностей:
- аминокислота D1 последовательности LC (VL) заменена на E;
- аминокислота V15 последовательности LC (VL) заменена на P;
- аминокислота D17 последовательности LC (VL) заменена на E;
- аминокислота V19 последовательности LC (VL) заменена на A;
- аминокислота T22 последовательности LC (VL) заменена на S;
- аминокислоты D30 и S31 последовательности LC (VL) заменены любой комбинацией аминокислот, предпочтительно ES, SS, TS, QS, HS, DH;
- аминокислота V58 последовательности LC (VL) заменена на I; и/или
- аминокислота D70 последовательности LC (VL) заменена на E.
Последовательности, которые могут быть модифицированы в их связывающих областях CDR в остатках, требуемых для взаимодействия BCMA:
hLC03 - модифицированные аминокислоты, вовлеченные во взаимодействие с BCMA (SEQ ID NO: 13):
EIVMTQSPATLSVSPGERATLSCKASQSVDX1X2VX3WX4QQKPGQAPRALIX5X6AX7X8R X9SGIPARFSGSX10X11GTEFTLTISSLQSEDFAVYYCX12QX13NNX14PX15TFGAGTKLELKR
где предпочтительными аминокислотами являются:
X1: S, H, T, N, D, Q;
X2: N, E, Q;
X3: A, G, V, S, T, L, I;
X4: Y, F, L, I, V, A, G;
X5: Y, F, L;
X6: S, T;
X7: S, T, D, N, H, E, Q;
X8: L, V, I, M;
X9: F, L, I, V, Y, M;
X10: G, X;
X11: S, X;
X12: Q, V, L, I, M;
X13: Y, F, L, I, Q;
X14: Y, F, R, Q, K; и/или
X15: L, I, V, F.
"Гуманизированная последовательность hLC03" соответствует новым аминокислотным последовательностям, которые содержат изменения аминокислотной последовательность по сравнению как с исходной химерной последовательностью, так и с частично гуманизированной последовательностью. Подразумевается, что эти изменения последовательности отражают потенциальные изменения аминокислот, связывающих мишень BCMA, которые могут быть заменены при сохранении преимущественных свойств связывания. Важность замены обусловлена в основном конечной аминокислотой, а не исходной аминокислотой. Таким образом, изменение также можно проводить с соответствующей исходной химерной аминокислоты или другого варианта.
Например:
- аминокислота S31 последовательности LC (VL) представляет собой S, H, T, N, D, Q;
- аминокислота N32 последовательности LC (VL) представляет собой N, E, Q;
- аминокислота A34 последовательности LC (VL) представляет собой A, G, V, S, T, L, I;
- аминокислота Y36 последовательности LC (VL) представляет собой Y, F, L, I, V, A, G;
- аминокислота Y49 последовательности LC (VL) представляет собой Y, F, L;
- аминокислота S50 последовательности LC (VL) представляет собой S, T;
- аминокислота S52 последовательности LC (VL) представляет собой S, T, D, N, H, E, Q;
- аминокислота L53 последовательности LC (VL) представляет собой L, V, I, M;
- аминокислота F55 последовательности LC (VL) представляет собой F, L, I, V, Y, M;
- аминокислота G66 последовательности LC (VL) представляет собой G, X;
- аминокислота S67 последовательности LC (VL) представляет собой S, X;
- аминокислота Q89 последовательности LC (VL) представляет собой Q, V, L, I, M;
- аминокислота Y91 последовательности LC (VL) представляет собой Y, F, L, I, Q;
- аминокислота Y94 последовательности LC (VL) представляет собой Y, F, R, Q, K; и/или
- аминокислота L96 последовательности LC (VL) представляет собой L, I, V, F.
Как правило, любое изменение области CDR также может считаться признаком последовательности CDR при рассмотрении независимо от каркасной последовательности в целом. Такие модифицированные последовательности CDR можно считать определяющими признаками настоящего изобретения, либо в пределах, либо независимо от их контекста в целой каркасной области, описанной в настоящем описании. Например, последовательности CDR, обозначенные подчеркиванием в hLC01-hLC03 могут - в их немодифицированной или замещенной форме - считаться определяющим признаком изобретения независимо окружающей каркасной последовательности.
Пример гуманизированной последовательности LC:
hLC04 (SEQ ID NO: 14):
EIVMTQSPATLSVSPGERATLSCKASQSVESNVAWYQQKPGQAPRALIYSASLRFSGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYNNYPLTFGAGTKLELKR
Выравнивание
Множественное выравнивание последовательностей CLUSTAL W (1.83) различных потенциально измененных участков в последовательности LC обеспечивает соответствующие сравнения последовательностей, представленные на фиг.9. "Общая последовательность" представляет собой последовательность LC, в которой каждый X представляет собой потенциальную аминокислотную замену. Предпочтительные аминокислотные замены представляют собой замены, описанные выше, для каждого из потенциально мутантных положений.
Таким образом, настоящее изобретение относится к гуманизированным последовательностям согласно hHC01, hHC02, hHC03, hHC04, hHC05, hHC06, hHC07, hLC01, hLC02, hLC03 и/или hLC04, или любой их указанной комбинации.
Настоящее изобретение охватывает все возможные комбинации потенциальных модификаций для любого данного потенциально вариантного остатка, предложенного в настоящем описании (как обозначено посредством X в "общей" последовательности). Путем комбинирования одной или нескольких из этих замен можно получать гуманизированные варианты, которые проявляют желаемые свойства связывания химерного антитела, первоначально разработанного и продемонстрированного в настоящем описании. Антитела или их части, описанные в настоящем описании, также охватывают последовательность по меньшей мере с 80%, предпочтительно 90%, идентичностью последовательности c гуманизированными последовательностями, описанными явным образом или описанными с помощью формулы последовательности.
Предпочтительные варианты осуществления, касающиеся эпитопа антитела
Таким образом, изобретение относится к выделенному антителу или фрагменту антитела, которые связывают CD269 (BCMA), где антитело связывает эпитоп, содержащий одну или несколько аминокислот в остатках с 13 по 32 CD269 (BCMA).
Аминокислотная последовательность в остатках с 13 по 32 CD269 представлена в SEQ ID NO: 40. N-концевая последовательность CD269 представлена в SEQ ID NO: 39. Внеклеточный домен CD269 представлен в качестве SEQ ID NO: 38.
Антиген, содержавший внеклеточный домен CD269 согласно SEQ ID NO: 38, использовали вакцинации для достижения специфичности связывания антитела мыши и химерного антитела, описанного в настоящем описании. Использование всего белка CD269 или его фрагментов, содержащих либо мембраносвязанный, либо внутриклеточный домен в качестве антигена в процессе получения антитела может обеспечить антитела, которые связывают скрытые или внутриклеточные домены CD269, что тем самым делает такие средства непригодными или неблагоприятными для терапевтического применения. Таким образом, антитела по настоящему изобретению определяются их связыванием с внеклеточной частью CD269. Определенный эпитоп во внеклеточном домене также представляет собой новый и неожиданный отличительный признак изобретения.
Fab-фрагменты, полученные из антител мыши или химерных антител, кристаллизовали в комплексе с очищенным внеклеточным доменом BCMA и определяли структуру комплекса. Структурный анализ продемонстрировал детальную информацию об эпитопе антитела по настоящему изобретению и его биологическое значение. Связывание эпитопа, содержащего одну или несколько аминокислот из остатков 13-32 CD269 (BCMA) внеклеточного домена, антителом по настоящему изобретению является преимущественным свойством, поскольку эта область демонстрирует значительное перекрывание с участками связывания BAFF и APRIL, двух природных лигандов CD269. Ни одно из антител против CD269, описанных в данной области на сегодняшний день, не продемонстрировало такого обширного перекрывания с участками связывания BAFF и APRIL.
В одном варианте осуществления выделенное антитело или фрагмент антитела по настоящему изобретению отличаются тем, что антитело связывает эпитоп, содержащий одну ли несколько из аминокислот 13, 15, 16, 17, 18, 19, 20, 22, 23, 26, 27 или 32 CD269 (BCMA). В другом варианте осуществления выделенное антитело или фрагмент антитела по настоящему изобретению отличаются тем, что антитело связывает эпитоп, состоящий из аминокислот 13, 15, 16, 17, 18, 19, 20, 22, 23, 26, 27 и 32 CD269 (BCMA). Эти остатки представляют собой аминокислоты, которые взаимодействуют непосредственно с антителом по настоящему изобретению, как идентифицировано с помощью данных о кристаллической структуре, представленных в настоящем описании. Нумерация этих остатков проведена относительно SEQ ID NO: 39, которая представляет собой N-концевую последовательность CD269.
В одном варианте осуществления изобретения выделенное антитело или фрагмент антитела отличаются тем, что связывание антитела с CD269 (BCMA) нарушает взаимодействие BAFF-CD269 и/или APRIL-CD269.
Связывание антител по настоящему изобретению с внеклеточным доменом CD269 нарушает взаимодействие BAFF-CD269. Вследствие того факта, что участки связывания APRIL и BAFF расположены в сходных участках с эпитопом антитела, связывание антитела с CD269 также блокирует взаимодействие APRIL-CD269.
Сравнение специфического эпитопа антитела по настоящему изобретению с участками связывания APRIL и BAFF, для которых была определена кристаллическая структура и были картированы их участки взаимодействия, показывает всестороннее перекрывание участков связывания природных лигандов и антитела, описанного в настоящем описании. Это представляет собой благоприятный и неожиданный аспект изобретения и обеспечивает надежное и эффективное нарушение взаимодействий BAFF-CD269 и/или APRIL-CD269.
Таким образом, изобретение относится к выделенному антителу или фрагменту антитела, как описано в настоящем описании, где антитело нарушает взаимодействие APRIL-CD269 путем связывания эпитопа, содержащего одну или несколько аминокислот из остатков 13, 15, 17, 18, 19, 22, 26, 27, 30, 31, 32, 33, 34, 35 CD269 (BCMA), в частности, состоящего из аминокислот 13, 15, 17, 18, 19, 22, 26, 27, 32. Эти аминокислоты соответствуют участку связывания APRIL на CD269 и перекрывающимся остаткам CD269, которые связываются как с антителом, как описано в настоящем описании, так и с APRIL, соответственно.
Таким образом, в другом варианте осуществления изобретение относится к выделенному антителу или фрагменту антитела, как описано в настоящем описании, где антитело нарушает взаимодействие BAFF-CD269 посредством связывания эпитопа, содержащего одну или несколько аминокислот из остатков 13, 15, 16, 17, 18, 19, 22, 25, 26, 27, 29, 30, 31, 32, 34, 35 CD269 (BCMA), в частности, эпитопа, состоящего из аминокислот 13, 15, 16, 17, 18, 19, 22, 26, 27, 32. Эти аминокислоты соответствуют участку связывания BAFF на CD269, и перекрывающимся остаткам CD269, которые связываются с антителом, как описано в настоящем описании, и с BAFF, соответственно.
Хотя в данной области описаны антитела, которые связывают CD269, которые также потенциально нарушают взаимодействия APRIL или BAFF с CD269, не предоставлено соответствующего описания, касающегося конкретного эпитопа таких антител. Нельзя предположить, что ранее описанные антитела также связывают эпитоп с таким широким перекрыванием, что и у антител по настоящему изобретению. Даже если бы было показано, что нарушаются взаимодействия APRIL или BAFF с CD269, это потенциально могло произойти вследствие связывания во многом отличающегося эпитопа и последующего пространственного препятствования связыванию APRIL или BAFF. Степень нарушения взаимодействий APRIL или BAFF с CD269, вызванного антителами уровня техники, ранее не была задокументирована.
Антитела по настоящему изобретению обеспечивают эффективное и надежное нарушение взаимодействия, которое потенциально представляет собой улучшенный технический эффект по сравнению с антителами, описанными на уровне техники. Для определения и сравнения нарушения взаимодействия с BAFF и/или APRIL можно проводить анализ блокирования in vitro, например, с внеклеточным доменом BCMA человека и рекомбинантным BAFF или APRIL.
В предпочтительном варианте осуществления эпитопная специфичность в комбинации с высокой аффинностью, демонстрируемой антителами, описанными в настоящем описании, представляет собой новый и неожиданный технический эффект. По существу, исключительно высокая аффинность антитела J22.9 и его гуманизированных вариантов обеспечивают не только "нарушение" или "блокирование" связывания природных лигандов; но также сверхвысокая аффинность антитела по изобретению обеспечивает исключение полностью или практически полностью связывания ими их мишени BCMA, когда антитело присутствует.
Как описано в разделе "Примеры" ниже, аффинность гуманизированных антител, как описано в настоящем описании, неожиданно является высокой и сравнительно лучшей, чем в сходных подходах, предпринятых на уровне техники. Kd в пМ-диапазоне (как показано ниже) обычно воспринимают как выдающуюся аффинность, не ожидаемую в обычной практике.
В другом аспекте гуманизированное антитело или фрагменты антител по изобретению связывают CD269 с высокой аффинностью, например, при измерении с использованием поверхностного плазмонного резонанса, такого как Biacore, антитело связывается с CD269 человека с высокой аффинностью 100 нМ, 90, 80, 70, 60, 50, 40, 30 нМ или менее, или 20 нМ или менее, или аффинностью 15 нМ или менее, или аффинностью 5 нМ или менее, или аффинностью 1000 пМ или менее, или аффинностью 500 пМ или менее, или аффинностью 100 пМ или менее, или 80 пМ или менее, или, например, приблизительно 50 пМ.
В следующем варианте осуществления антитело связывается с CD269 человека с аффинностью, измеряемой способом поверхностного плазмонного резонанса, таким как Biacore, от приблизительно 1 пМ до приблизительно 100 нМ, или от приблизительно 100 пМ до приблизительно 50 нМ, или от приблизительно 200 пМ до приблизительно 20 нМ.
Следующие предпочтительные варианты осуществления изобретения
В одном варианте осуществления изобретение относится к антителу или фрагменту антитела, содержащим аминокислотную последовательность, определяемую одной или несколькими аминокислотами, которые прямо взаимодействуют с мишенью CD269, и/или одной или несколькими аминокислотами, которые взаимодействуют через водные взаимодействия (см. таблицы 1-6). Большое количество водных взаимодействий, вовлеченных в связывание антитела, как описано в настоящем описании, с эпитопом, представляет собой необычный и неожиданный аспект связывания. В частности, высокая аффинность антитела, направленного на конкретный эпитоп, описанный в настоящем описании, в комбинации с большим количеством водных взаимодействий, вовлеченных в поверхность связывания между антителом и эпитопом, представляет собой удивительный и неожиданный аспект изобретения.
Таким образом, изобретение относится к антителу или фрагменту антитела, содержащим аминокислотную последовательность, как описано в настоящем описании, где последовательность характеризуется присутствием конкретных аминокислотных остатков, которые вовлечены в поверхность взаимодействия с эпитопом-мишенью через водяной мостик согласно таблице 5, выбранных из группы, содержащей Ser31, Asn32, Tyr36, Ser50, Ser52, Gly66, Gln89, Tyr91 и/или Tyr94 легкой цепи, и/или Trp33, Ser35, Trp47, Glu50, Leu99 и/или Tyr101 тяжелой цепи, относительно химеры, описанной в настоящем описании, или относительно соответствующего остатка гуманизированных вариантов последовательности, описанных в настоящем описании.
Хотя примеры в отношении образования водяных мостиков антитела проводили с химерой J22.9-xi, авторы изобретения установили, что этот технический эффект сохраняется в гуманизированных вариантах по настоящему изобретению вследствие сохранения характеристик связывания в гуманизированных вариантах по сравнению с исходным исследованным химерным антителом. В тяжелой цепи единственным мутантным остатком водяного мостика является Y101, однако его водное взаимодействие вовлекает атом основной цепи (т.е. остова), и, таким образом, можно обоснованно предположить, что оно не изменяется вследствие мутации боковой цепи; в легкой цепи отсутствуют мутации остатков, вовлеченных в водяные мостики.
Антитело по изобретению может далее характеризоваться аминокислотными остатками эпитопа, вовлеченными во взаимодействие через водяные мостики с антителом, как описано в настоящем описании. Соответствующие признаки представлены в таблице 5. Таким образом, например, в одном варианте осуществление изобретение отличается тем, что остаток Ser31 легкой цепи взаимодействует с Thr32 CD269 через молекулу воды. Такое описание свойств связывания антител по настоящему изобретению предусматривается для каждого взаимодействия, как показано в таблице 5.
Более того, варианты последовательности антител, описанных в настоящем описании, охватываются настоящем изобретением, в котором один или нескольких остатков, вовлеченных во взаимодействие по принципу образования "водяного мостика" модифицированы для "включения" прямого взаимодействия боковой цепи в последовательность за счет водяного "мостика". Например, в аминокислотную последовательность можно вносить мутацию или изменение, вытесняющие воду из поверхности взаимодействия, но по существу не влияющие на аффинность взаимодействия. Таким образом, изобретение относится к антителу или фрагменту антитела, содержащим аминокислотную последовательность, как описано в настоящем описании, где последовательность характеризуется варьированием последовательности в тех аминокислотных остатках, которые вовлечены в поверхность взаимодействия с эпитопом-мишенью через водяной мостик согласно таблице 5, выбранных из группы, содержащей Ser31, Ser31, Asn32, Tyr36, Ser50, Ser52, Gly66, Gln89, Tyr91 и/или Tyr94 легкой цепи и/или Trp33, Ser35, Trp47, Glu50, Leu99 и/или Tyr101 тяжелой цепи, относительно химеры, описанной в настоящем описании, или относительно соответствующего остатка гуманизированных вариантов последовательности, описанных в настоящем описании. Варьирование в соответствующих положениях гуманизированных антител, описанных в настоящем описании, может быть связано с любой данной аминокислотной заменой, предпочтительно аминокислотной заменой, которая эффективно вытесняла бы воду из взаимодействия, но сохраняла бы сходные свойства связывания с точки зрения аффинности и специфичности к эпитопу.
В одном варианте осуществления изобретения выделенное антитело или фрагмент антитела отличаются тем, что антитело является гликолизированным, предпочтительно содержащим N-связанную олигосахаридную цепь, предпочтительно на Asn297 тяжелой цепи.
Гликозилирование антитела относится к связыванию углеводов или гликанов с антителом. N-связанные гликаны связываются с азотом боковых цепей аспарагина или аргинина. Углеводные цепи, связанные с белками-мишенями, выполняют различные функции. Например, некоторые белки не сворачиваются правильно, если они не гликозилируются сначала. Также полисахариды, связанные с азотом амида аспарагина в белке, могут обеспечивать стабильность некоторых секретируемых гликопротеинов. Гликозилирование в этом случае не является строгим требованием для надлежащего сворачивания, однако негликозилированный белок может деградировать быстрее.
Как демонстрируют примеры настоящего изобретения дегликозилирование антитела, описанного в настоящем описании, приводит к уменьшению терапевтического эффекта по сравнению с гликозилированными формами антитела. Было неожиданным, что гликозилирование может играть значительную роль в поддержании активности антитела. Таким образом, гликозилирование представляет собой предпочтительный вариант осуществления изобретения, ассоциированный с неожиданными техническими преимуществами.
Как продемонстрировано в разделе "Примеры" настоящего описания, хотя общая опухолевая нагрузка у животных, которым вводили J22.9-xi-N-glycan (дегликозилированное), не отличалась значительно от опухолевой нагрузки у животных, которым вводили изотипическое контрольное антитело, продолжительность жизни этих мышей существенно возрастала по сравнению с группой, в которой вводили isoAb. Поскольку было показано, что J22.9-xi-N-glycan не способно индуцировать ADCC или CDC, этот результат указывает на то, что уже одно связывание J22.9-xi с BCMA препятствует росту опухоли. Можно обоснованно заключить, что это является следствием блокирования взаимодействия между рецептором и его нативными лигандами (APRIL и BAFF). Этот аспект изобретения и антител, описанных в настоящем описании, представляет собой неожиданный технический эффект, который не мог быть достигнут с помощью антител уровня техники. J22.9-xi-N-glycan (дегликозилированное) можно считать контрольным образцом в описанных экспериментах, который обеспечивает связывание антитела с его эпитопом-мишенью без последующих эффектов ADCC или CDC, для оценки потенциального терапевтического эффекта. Таким образом, антитела по изобретению, предпочтительно с гликозилированием, демонстрируют такое эффективное связывание эпитопа, которое обеспечивает предупреждение (или значительное нарушение) связывания природных лигандов, что приводит к клеточной токсичности. Эта характеристика антител, описанных в настоящем описании, не была описана для сходных антител, описанных в данной области.
Хотя примеры в отношении гликозилирования антитела проводили для химеры J22.9-xi, авторы изобретения установили, что этот технический эффект сохраняется в гуманизированных вариантах по настоящему изобретению вследствие сохранения характеристик связывания в гуманизированных вариантах по сравнению с исходным исследованным химерным антителом. Предпочтительное положение гликозилирования (Asn297 тяжелой цепи) не имеет прямой связи с каким-либо из мутантных остатков и находится в константной области полноразмерного IgG человека. Таким образом, является обоснованным предположение, что не существует отличий в профиле гликозилирования в любом из этих вариантов J22.9 по сравнению с химерным антителом.
Применение и функциональные аспекты изобретения
Антитела по настоящему изобретению способны связывать эпитопы, описанные в настоящем описании, блокировать взаимодействие природных лигандов этого эпитопа и индуцировать CDC и ADCC.
Антителозависимая клеточно-опосредуемая цитотоксичность (ADCC) является одним из факторов, индуцируемых антителом по настоящему изобретению, которые индуцируют желаемый терапевтический эффект. ADCC представляет собой механизм клеточно-опосредуемой иммунной защиты, в котором эффекторная клетка иммунной системы активно осуществляет лизис клетки-мишени, у которой антигены поверхности мембраны связаны специфическими антителами. После связывания экспрессирующих CD269 клеток антителами по настоящему изобретению может индуцироваться ADCC. Классическая ADCC опосредуется натуральными киллерами (NK); макрофаги, нейтрофилы и эозинофилы также могут опосредовать ADCC. ADCC является частью адаптивного иммунного ответа вследствие ее зависимости от предшествующего антительного ответа. Эксперименты на мышах могут указывать на то, что ADCC является важным механизмом действия терапевтических антител, как описано в настоящем описании.
Предпочтительный вариант осуществления изобретения относится к выделенному антителу или фрагменту антитела, как описано в настоящем описании, для применения в качестве лекарственного средства для лечения медицинского нарушения, ассоциированного с присутствием патогенных B-клеток.
В одном варианте осуществления изобретения медицинское нарушение представляет собой ассоциированное с CD269 нарушение, предпочтительно ассоциированное с патогенными B-клетками, которое предпочтительно представляет собой заболевание плазматических клеток и/или B-клеток памяти.
Заболевание плазматических клеток может представлять собой злокачественную опухоль плазматических клеток, например, множественную миелому, плазмацитому, макроглобулинемию Валденстрема или плазмаклеточный лейкоз. Заболевание плазматических клеток может представлять собой злокачественную опухоль B-лимфоцитов, такую как болезнь Ходжкина.
В одном варианте осуществления изобретения медицинское нарушение представляет собой аутоиммунное заболевание, ассоциированное с аутореактивными плазмацитами и/или аутореактивными B-клетками памяти, такое как воспалительное аутоиммунное заболевание, например, системная красная волчанка или ревматоидный артрит.
Таким образом, изобретение также относится к способу лечения медицинских нарушений, описанных в настоящем описании, предпочтительно включающему введение терапевтически эффективного количества антитела индивидууму, нуждающемуся в таком лечении.
Следующий аспект изобретения относится к конъюгату антитело-лекарственное средство (ADC), содержащему антитело или фрагменты антител, как описано в настоящем описании. Конъюгаты антитело против CD269-лекарственное средство "ADC против CD269" могут быть описаны как антитело против CD269 или его фрагмент, конъюгированные с лекарственным средством. В определенных вариантах осуществления ADC содержит антитело против CD269 (например, гуманизированный вариант J22.9-xi, как описано в настоящем описании).
ADC или производные ADC, как описано в настоящем описании, оказывают клинически полезные эффекты на экспрессирующие CD269 клетки при введении индивидууму с медицинским состоянием, ассоциированным с экспрессией CD269, таким как злокачественная опухоль или аутоиммунное нарушение. В одном варианте осуществления антитело против CD269 или его производное конъюгировано с цитотоксическим средством, так что конечный ADC или производное ADC оказывают цитотоксическое действие на экспрессирующую CD269 злокачественную клетку, предпочтительно при захвате и интернализации клеткой.
ADC против CD269 или производное ADC предпочтительно интернализуются и накаливаются в экспрессирующей CD269 клетке, где ADC или производное ADC проявляют терапевтический эффект (например, цитотоксический эффект). Особенно пригодными частями для конъюгации с антителами или производными антител являются химиотерапевтические средства, конвертирующие пролекарства ферменты, радиоактивные изотопы или соединения, или токсины. Например, антитело против CD269 или его производное можно конъюгировать с цитотоксическим средством, таким как химиотерапевтическое средство, или токсином (например, цитостатическое или цитоцидное средство).
Другой аспект изобретения относится предпочтительно к выделенной молекуле нуклеиновой кислоты, выбранной из группы, состоящей из:
a) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность
- которая кодирует выделенное антитело или фрагмент антитела согласно любому из предшествующих пунктов,
- которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из последовательностей согласно SEQ ID NO: 1-31 и 41-42,
- содержащую последовательность или фрагмент последовательности SEQ ID NO: 32-36,
b) молекулы нуклеиновой кислоты, которая комплементарна нуклеотидной последовательности согласно a);
c) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, обладающую достаточной идентичностью последовательности для того, чтобы быть функционально аналогичной/эквивалентной нуклеотидной последовательности согласно a) или b), предпочтительно обладающей идентичностью последовательности с нуклеотидной последовательностью согласно a) или b) по меньшей мере 80%, предпочтительно 90%, более предпочтительно 95%;
d) молекулы нуклеиновой кислоты, которая вследствие генетического кода является вырожденной в нуклеотидную последовательность согласно a)-c); и
e) молекулы нуклеиновой кислоты согласно нуклеотидной последовательности a)-d), которая модифицирована посредством делеций, вставок, замен, транслокаций, инверсий и/или инсерций и функционально аналогична/эквивалентна нуклеотидной последовательности согласно a)-d).
Следующий аспект изобретения относится к клетке-хозяину, такой как бактериальная клетка или клетка млекопитающего, предпочтительно гибридомная клетка или клеточная линия, способные продуцировать антитело или фрагменты антител, как описано в настоящем описании, и/или содержащие молекулу нуклеиновой кислоты, как описано в настоящем описании.
Следующий аспект изобретения относится к фармацевтической композиции, содержащей выделенное антитело или фрагмент антитела, как описано в настоящем описании, молекулу нуклеиновой кислоты, как описано в настоящем описании, или клетку-хозяина, как описано в настоящем описании, вместе с фармацевтически приемлемым носителем.
Дополнительным и неожиданным аспектом изобретения является повышение стабильности антитела, описанного в настоящем описании. Антитело можно без труда хранить в течение длительных периодов времени в подходящих условиях без какого-либо снижения аффинности. Были проведены соответствующие тесты, касающиеся поддержания активности после хранения либо при -80, либо при 4°C, которые продемонстрировали неожиданно высокую стабильность антитела и поддержание активности после хранения при обеих вышеупомянутых температурах (фиг.3c). Эта повышенная стабильность является очевидной для химерного антитела, а также неожиданно для его гуманизированных вариантов. Неожиданно, стабильность гуманизированных вариантов является повышенной относительно химеры при длительном хранении.
Следующим преимуществом антител, как описано в настоящем описании, является эффективное системное истощение клеток миеломы, как продемонстрировано в разделе "Примеры". Для антител, ранее описанных на уровне техники, не было продемонстрировано, что они проявляют желаемый эффект против плазмацитов системным образом. В исследованиях, проведенных для антител уровня техники, описана только подкожная инъекция клеток миеломы и последующая обработка выделенной клеточной массы. Настоящее изобретение относится к антителу, способному к системному истощению злокачественных клеток множественной миеломы после их в/в инъекции, как продемонстрировано в разделе "Примеры". Эффективное истощение клеток-мишени представляет собой технический эффект, который ранее не был продемонстрирован на уровне техники, в дополнение к полезному свойству антител по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как используют в рамках изобретения, "антитело", главным образом, относится к белку, состоящему из одного или нескольких полипептидов, по существу кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Когда используют термин "антитело", также подразумевается термин "фрагменты антител". Известные гены иммуноглобулинов включают гены константной области каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов вариабельных областей иммуноглобулинов. Легкие цепи классифицируют либо как каппа, либо как лямбда. Тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон, которые в свою очередь определяют классы иммуноглобулинов IgG, IgM, IgA, IgD и IgE, соответственно. Известно, что основной структурный элемент иммуноглобулина (антитела) представляет собой тетрамер или димер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая из которых имеет одну "легкую" (L) (приблизительно 25 кДа) и одну "тяжелую" (H) цепь (приблизительно 50-70 кДа). N-конец каждой цепи определяет вариабельную область из приблизительно от 100 до 110 или более аминокислот, в основном ответственных за распознавание антигена. Термины "вариабельная область легкой цепи" и "вариабельная область тяжелой цепи" относятся к этим вариабельным областям легкой и тяжелой цепей, соответственно. Необязательно, антитело или иммунологическую часть антитела можно химически конъюгировать или экспрессировать в качестве белка, слитого с другими белками.
Антитела по изобретению предназначены для связывания белковых мишеней млекопитающих, в частности, человека. Использование названий белков может соответствовать вариантам белка либо мыши, либо человека.
"Специфическое связывание" должно быть понятно специалисту в данной области, причем специалисту в данной области хорошо известны различные экспериментальные методики, которые можно использовать для исследования связывания и специфичности связывания. Некоторая перекрестная реакция или фоновое связывание могут быть неизбежными при многих белок-белковых взаимодействиях; это не преуменьшает "специфичности" связывания между антителом и эпитопом. Термин "направленный против" также применим при рассмотрении термина "специфичность" для понимания взаимодействия между антителом и эпитопом.
Антитела по изобретению включают, но не ограничиваются ими, поликлональные, моноклональные, биспецифические, человеческие, гуманизированные или химерные антитела, единичные вариабельные фрагменты (ssFv), однодоменные антитела (такие как фрагменты VHH из наноантител), одноцепочечные фрагменты (scFv), Fab-фрагменты, F(ab')2-фрагменты, фрагменты, продуцированные экспрессирующей Fab библиотекой, антиидиотипические антитела и связывающие эпитоп фрагменты или комбинации любого из вышеуказанных при условии, что они сохраняют исходные свойства связывания. Также в способе по изобретению можно использовать миниантитела и поливалентные антитела, такие как диантитела, триантитела, четырехвалентные антитела и пептаантитела. Молекулы иммуноглобулинов по изобретению могут принадлежать любому классу (т.е. IgG, IgE, IgM, IgD и IgA) или подклассу молекул иммуноглобулинов. Таким образом, термин "антитело", как используют в рамках изобретения, также включает антитела и фрагменты антител, либо продуцируемые посредством модификации целых антител, либо синтезированные de novo с использованием методологий рекомбинантных ДНК.
Гуманизированное антитело, содержащее одну или несколько CDR антител по изобретению или одну или несколько CDR, происходящих из указанных антител, можно получать с использованием любых способов, известных в данной области. Например, для гуманизации моноклонального антитела можно использовать четыре основных стадии. Они представляют собой: (1) определение нуклеотидной и спрогнозированной аминокислотной последовательности исходных вариабельных доменов легкой и тяжелой цепей, (2) моделирование гуманизированного антитела, т.е. определение того, какую каркасную область антитела использовать в процессе гуманизации, (3) фактические методологии/технологии гуманизации и (4) трансфекцию и экспрессию гуманизированного антитела. См., например, патенты США № 4816567; 5807715; 5866692; 6331415; 5530101; 5693761; 5693762; 5585089; 6180370; 5225539; 6548640.
Термин "гуманизированное антитело" означает, что по меньшей мере часть каркасных областей и необязательно часть областей CDR или других областей, вовлеченных в связывание иммуноглобулина, происходит из или скорректирована в направлении последовательностей имммуноглобулинов человека. Гуманизированные, химерные или частично гуманизированные версии моноклональных антител мыши можно получать, например, посредством технологии рекомбинантных ДНК, начиная с последовательностей геномной ДНК мыши и/или человека, кодирующих цепи H и L, или с клонов кДНК, кодирующих цепи H и L. Гуманизированные формы антител мыши можно получать путем связывания областей CDR не являющихся человеческими антител с константными областями человека способами рекомбинантных ДНК (Queen et al., 1989; WO 90/07861). Альтернативно моноклональные антитела, используемые в способе по изобретению, могут представлять собой моноклональные антитела человека. Антитела человека можно получать, например, с использованием способов фагового дисплея (WO 91/17271; WO 92/01047).
Как используют в рамках изобретения, гуманизированные антитела также относится к формам не являющихся человеческими антител (например, мыши, верблюда, ламы, акулы), которые представляют собой специфические химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из не являющегося человеческим иммуноглобулина.
Как используют в рамках изобретения, антитело человека или гуманизированное антитело означает антитело, имеющее аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого у человека и/или полученного с использованием любого из способов получения антител человека, известных в данной области или описанных в настоящем описании. Селекцию антител человека можно проводить посредством экспериментов с конкурентным связыванием или иным образом, чтобы эпитопная специфичность была такой же, как и у конкретного антитела мыши. Гуманизированные антитела по настоящему изобретению неожиданно в большой степени обладают теми же полезными функциональными свойствами, что и антитела мыши. Также можно предоставлять поликлональные антитела человека в форме сыворотки от человека, иммунизированного иммуногенным средством. Необязательно, такие поликлональные антитела можно концентрировать посредством аффинной очистки с использованием амилоидных фибриллярных и/или нефибриллярных полипептидов или их фрагментов в качестве аффинного реагента. Моноклональные антитела можно получать из сыворотки способом, описанным в WO 99/60846.
Кроме того, настоящее изобретение относится к применению антител или их фрагментов, как описано в настоящем описании, например, вариабельных областей, в молекулах распознавания или аффинных реагентах, которые пригодны для селективного связывания с мишенью. Аффинный реагент, антитело или его фрагмент согласно изобретению могут быть пегилированными, где пегилирование относится к ковалентному присоединению полимерных цепей полиэтиленгликоля (PEG) к антителу по изобретению. Пегилирование можно стандартным образом проводить путем инкубации реактивного производного PEG с молекулой-мишенью. Пегилирование с антителом может потенциально замаскировать средство от иммунной системы хозяина, что приводит к снижению иммуногенности и антигенности, или увеличить гидродинамический размер средства, что может продлить его время в кровотоке путем снижения почечного выведения.
Вариабельная область антитела относится к вариабельной области легкой цепи антитела или к вариабельной области тяжелой цепи антитела, либо отдельно, либо в комбинации. Каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вблизи посредством FR и вместе с CDR из другой цепи вносят вклад в образование антигенсвязывающего центра антител. Существует по меньшей мере два способа определения CDR: (1) подход на основе перекрестно-видовой вариабельности последовательностей (т.е. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)); и (2) подход на основе кристаллографических исследований комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273:927-948). Как используют в рамках изобретения, CDR может относиться к CDR, определяемым с помощью любого подходом или комбинации обоих подходов.
В некоторых вариантах осуществления изобретение относится к антителу, которое содержит по меньшей мере одну CDR, по меньшей мере две, по меньшей мере три или более CDR, которые являются по существу идентичными по меньшей мере одной CDR, по меньшей мере двум, по меньшей мере трем или более CDR антитела по изобретению. Другие варианты осуществления включают антитела, которые имеют по меньшей мере две, три, четыре, пять или шесть CDR, которые по существу идентичны по меньшей мере двум, трем, четырем, пяти или шести CDR антител по изобретению или происходят из антител по изобретению. В некоторых вариантах осуществления по меньшей мере одна, две, три, четыре, пять или шесть CDR по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 95%, 96%, 97%, 98% или 99% идентичны по меньшей мере одной, двум или трем CDR антитела по изобретению. Понятно, что для целей настоящего изобретения специфичность связывания и/или общая активность в основном сохраняются, хотя степень активности может варьироваться по сравнению с указанным антителом (может быть более высокой или менее высокой).
Время полужизни и цитотоксический потенциал антитела зависят в основном от взаимодействия Fc-домена с различными Fc-гамма рецепторами. В случае времени полужизни антитела, главную роль играет неонатальный Fc-рецептор (FcRn). Этот рецептор экспрессируется на нескольких типах клеток и тканей, таких как моноциты и сосудисто-эндотелиальные клетки, которые могут захватывать сывороточные белки в утилизирующие их эндосомы. В эндосомах значение pH снижено приблизительно до 6 и в этих условиях антитела способны связываться с FcRn. Это взаимодействие защищает антитела от деградации до тех пор, пока они вновь не высвобождаются в кровь, где физиологические значения pH нарушают связывание с рецептором (Roopenian and Akilesh (2007) Nat Rev Immunol 7:715-725). Чем более высокой является аффинность антитела к FcRn при pH 6, тем более высоким является время полужизни этого антитела. Мутации Fc-фрагмента, о которых известно, что они стабилизируют это взаимодействие, обобщенно представлены в Presta (2008, Curr Opin Immunol 20:460-470).
При связывании мишени терапевтические антитела могут действовать через несколько механизмов. Связывание само по себе может запускать передачу сигнала, которая может приводить к запрограммированной клеточной гибели (Chavez-Galan et al. (2009) Cell Mol Immunol 6:15-25). Также оно может блокировать взаимодействие рецептора с его лигандом путем связывания либо с рецептором, либо с лигандом. Это прерывание может вызывать апоптоз, если нарушаются сигналы, важные для выживания (Chiu et al. (2007) Blood 109:729-739). Что касается клеточного истощения, существует два основных эффекторных механизма. Первым является комплементзависимая цитотоксичность (CDC) в отношении клетки-мишени. Существует три известных каскада. Однако в случае антител, важным каскадом для CDC является классический каскад, который инициируется через связывание C1q с константной областью IgG или IgM (Wang and Weiner (2008) Expert Opin Biol Ther 8:759-768).
Второй механизм называется антителозависимой клеточной цитотоксичностью (ADCC). Эта эффекторная функция характеризуется привлечением иммунных клеток, которые экспрессируют Fc-рецепторы для соответствующего изотипа антител. ADCC по большей части опосредуется активацией Fc-гамма рецепторов (FcγR), которые способны связываться с IgG-молекулами, либо отдельно, либо в виде иммунных комплексов. Мыши имеют три (FcγRI, FcγRIII и FcγRIV), а люди имеют пять (FcγRI, FcγRIIA, FcγRIIC, FcγRIIIA и FcγRIIIB) активирующих Fcγ-рецепторов. Эти рецепторы экспрессируются на клетках врожденного иммунитета, таких как гранулоциты, моноциты, макрофаги, дендритные клетки и натуральные киллеры, и, таким образом, связывают врожденную иммунную систему с адаптивной. В зависимости от типа клеток существует несколько способов действия несущих FcgR клеток при распознавании маркированных антителом клеток-мишеней. Гранулоциты в основном высвобождают вазоактивные и цитотоксические вещества или хемоаттрактанты, но также способны к фагоцитозу. Моноциты и макрофаги отвечают фагоцитозом, окислительным взрывом, цитотоксичностью или высвобождением провоспалительных цитокинов, в то время как натуральные киллеры высвобождают гранзимы и перфорин, и также могут запускать клеточную смерть через взаимодействие с FAS на клетке-мишени и их Fas-лиганде (Nimmerjahn and Ravetch (2008) Nat Rev Immunol 8:34-47; Wang and Weiner (2008) Expert Opin Biol Ther 8:759-768; Chavez-Galan et al. (2009) Cell Mol Immunol 6:15-25).
Антителозависимая клеточная цитотоксичность (ADCC) также может быть усилена путем упрочнения связывания Fc-домена с активирующими Fc-гамма рецепторами (FcγR). Этого также можно достигать посредством мутаций в Fc-гамма домене, как обобщенно представлено в Presta (2008, Curr Opin Immunol 20:460-470).
Другим способом изменения ADCC является манипулирование сахарной частью, присутствующей в каждом IgG на Asn297. Известно, что дефукозилирование и удаление сиаловой кислоты с конца молекул сахаров повышает цитотоксический потенциал антитела (Anthony and Ravetch (2010) J Clin Immunol 30 Suppl 1: S9-14).
Также в объем изобретения входят варианты последовательностей заявленных нуклеиновых кислот, белков и антител, например, определяемые заявленной % идентичностью последовательностей, которые сохраняют указанные свойства по изобретению. Такие варианты, которые демонстрируют альтернативные последовательности, но сохраняют по существу те же свойства связывания, такие как специфичность к мишени, что и конкретные представленные последовательности, известны как функциональные аналоги или как функционально аналогичные последовательности. Идентичность последовательностей относится к проценту идентичных нуклеотидов или аминокислот при проведении выравнивания последовательностей.
Специалисту в данной области будет понятно, что в результате вырожденности генетического кода существует множество нуклеотидных последовательностей, которые кодируют полипептид, как описано в настоящем описании. Некоторые из этих полинуклеотидов имеют минимальную гомологию или идентичность последовательности с нуклеотидной последовательностью любого нативного гена. Тем не менее, настоящее изобретение конкретно предусматривает полинуклеотиды, которые варьируются вследствие отличий в использовании кодонов. Также изобретение охватывает делеции, замены и другие изменения последовательности, которые соответствуют описанной идентичности последовательностей.
Модификации белковой последовательности, которые могут быть осуществлены посредством замен, также входят в объем изобретения. Замены, как определяют в настоящем описании, представляют собой модификации, внесенные в аминокислотную последовательность белка, где одна или несколько аминокислот заменены тем же количеством (отличающихся) аминокислот, с образованием белка, который содержит аминокислотную последовательность, отличающуюся от первичного белка, предпочтительно без значительного изменения функции белка. Подобно вставкам, замены могут быть природными или искусственными. В данной области хорошо известно, что аминокислотные замены можно вносить без значительного изменения функции белка. Это является особенно справедливым, когда модификация относится к "консервативной" аминокислотной замене, которая представляет собой замену одной аминокислоты другой аминокислотой со сходными свойствами. Такие "консервативные" аминокислоты могут представлять собой природные или синтетические аминокислоты, которые, благодаря размеру, заряду, полярности и конформации, могут быть заменены без значительного влияния на структуру и функцию белка. Часто многие аминокислоты могут быть заменены консервативными аминокислотами без неблагоприятного влияния на функцию белка.
Как правило, неполярные аминокислоты Gly, Ala, Val, Ile и Leu; неполярные ароматические аминокислоты Phe, Trp и Tyr; нейтральные полярные аминокислоты Ser, Thr, Cys, Gln, Asn и Met; положительно заряженные аминокислоты Lys, Arg и His; отрицательно заряженные аминокислоты Asp и Glu, представляют собой группы консервативных аминокислот. Этот перечень не является исчерпывающим. Например, хорошо известно, что Ala, Gly, Ser и иногда Cys могут заменять друг друга, даже несмотря на то, что они принадлежат различным группам.
В вариантах с заменой имеют по меньшей мере один аминокислотный остаток в молекуле антитела удален, и на его место встроен другой остаток. Представляющие наибольший интерес участки для мутагенеза с заменами включают гипервариабельные области, однако также предусмотрены изменения FR. Если такие замены приводят к изменению биологической активности, тогда можно вносить более существенные изменения, обозначенные как "иллюстративные замены" в таблице, представленной ниже, или как дополнительно описано ниже в отношении классов аминокислот, и продукты можно подвергать скринингу.
Потенциальные аминокислотные замены:
Существенные модификации биологических свойств антитела проводят, выбирая замены, которые значительно отличаются по их эффекту на поддержание (a) структуры полипептидного остова в области замены, например, такой как конформация слоя или спирали, (b) заряда или гидрофобности молекулы в участке-мишени, или (c) объема боковой цепи.
Консервативные аминокислотные замены не ограничиваются встречающимися в природе аминокислотами, но также включают синтетические аминокислоты. Широко используемыми синтетическими аминокислотами являются омега-аминокислоты различной длины цепи и циклогексилаланин, которые являются нейтральными неполярными аналогами; цитруллин и метионинсульфоксид, которые являются нейтральными неполярными аналогами, фенилглицин, который представляет собой ароматический нейтральный аналог; цистеиновая кислота, которая представляет собой отрицательно заряженный аналог, и орнитин, который представляет собой положительно заряженный аналог аминокислоты. Подобно встречающимся в природе аминокислотам, этот перечень не является исчерпывающим, а является только иллюстрирующим замены, которые хорошо известны в данной области.
Антитела по настоящему изобретению можно получать путем трансфекции клетки-хозяина экспрессирующим вектором, содержащим кодирующую последовательность для антитела по изобретению. Экспрессирующий вектор или рекомбинантную плазмиду продуцируют, помещая эти кодирующие последовательности для антитела в функциональную связь с общепринятыми регуляторными последовательностями контроля, способными контролировать репликацию и экспрессию в клетке-хозяине и/или секрецию из нее. Регуляторные последовательности включают промоторные последовательности, например, промотор CMV, и сигнальные последовательности, которые могут происходить из других известных антител. Аналогично, может быть получен второй экспрессирующий вектор, имеющий последовательность ДНК, которая кодирует комплементарную легкую или тяжелую цепь антитела. В определенных вариантах осуществления этот второй экспрессирующий вектор идентичен первому, за исключением кодирующих последовательностей и селективных маркеров, чтобы гарантировать функциональную экспрессию каждой полипептидной цепи настолько, насколько это возможно. Альтернативно кодирующие последовательности тяжелой и легкой цепей для антитела могут находиться на одном векторе.
Выбранную клетку-хозяина сотрансфицируют общепринятыми способами как первым, так и вторым, векторами (или просто трансфицируют одним вектором) с получением трансфицированной клетки-хозяина по изобретению, содержащей как рекомбинантные, так и синтетические легкие и тяжелые цепи. Затем трансфицированную клетку культивируют общепринятыми способами с получением сконструированного антитела по изобретению. Скрининг антитела, которое включает ассоциацию как рекомбинантной тяжелой цепи, так и/или легкой цепи, проводят в культуре с использованием подходящего анализа, такого как ELISA или RIA. Для конструирования других антител можно использовать сходные общепринятые способы.
Подходящие векторы для стадий клонирования и субклонирования, используемых в способах, и конструирования композиций по настоящему изобретению может выбрать специалист в данной области. Например, можно использовать общепринятую серию клонирующих векторов pUC. Один вектор, pUC19, является коммерчески доступным. Компоненты таких векторов, например, репликоны, селективные гены, энхансеры, промоторы, сигнальные последовательности и т.п., можно получать из коммерческих или природных источников или можно синтезировать с использованием известных методик, применяемых для контроля экспрессии и/или секреции продукта рекомбинантной ДНК в выбранном хозяине. Для этой цели могут быть выбраны другие подходящие экспрессирующие векторы, многочисленные типы которых известны в данной области для экспрессии в клетках млекопитающих, бактерий, насекомых, дрожжей и грибов.
Также настоящее изобретение охватывает клеточную линию, трансфицированную рекомбинантной плазмидой, содержащей кодирующие последовательности антител по настоящему изобретению. Клетки-хозяева, пригодные для клонирования и других манипуляций этими клонирующими векторами, также являются общеизвестными.
Подходящие клетки-хозяева или клеточные линии для экспрессии антител по изобретению включают клетки млекопитающих, такие как NS0, Sp2/0, CHO (например, DG44), COS, HEK, фибробластную клетку (например, 3T3) и клетки миеломы, например, их можно экспрессировать в клетках CHO или клетках миеломы. Можно использовать клетки человека, таким образом, обеспечивая модификацию молекулы для характера гликозилирования человека. Альтернативно можно использовать другие линии прокариотических или эукариотических клеток. Выбор подходящих клеток-хозяев млекопитающих и способов трансформации, культивирования, амплификации, скрининга и продукции продукта известен в данной области.
В соответствии с настоящим изобретением предусматривается способ продуцирования антитела против CD269 по настоящему изобретению, которое связывает и нейтрализует активность CD269, который включает стадии: предоставления первого вектора, кодирующего тяжелую цепь антитела; предоставления второго вектора, кодирующего легкую цепь антитела; трансформации клетки-хозяина млекопитающего (например, CHO) указанными первым и вторым векторами; культивирования клетки-хозяина со стадии (c) в условиях, способствующих секреции антитела из указанной клетки-хозяина в указанную культуральную среду; выделения секретируемого антитела стадии (d). После экспрессии антитело можно оценивать в отношении желаемых свойств связывания с использованием способов, описанных в настоящем описании.
Изобретение охватывает иммуноконъюгаты (взаимозаменяемо обозначаемые как "конъюгаты антитело-лекарственное средство" или "ADC"), содержащие антитело согласно изобретению, как описано в настоящем описании, включая, но не ограничиваясь ими, антитело, конъюгированное с одним или несколькими цитотоксическими средствами, такими как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, белковый токсин, ферментативный токсин, происходящий из бактерий, грибов, растений или животных, или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). Способы конъюгации лекарственных средств с белками, и, в частности, с антителами, такими как конъюгаты антитело против CD269-лекарственное средство по настоящему изобретению, хорошо известны. (См., например, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", Monoclonal Antibodies And Cancer Therapy (Reisfeld et al. eds., Alan R. Liss, Inc., 1985); Hellstrom et al., "Antibodies For Drug Delivery", Controlled Drug Delivery (Robinson et al. eds., Marcel Dekker, Inc., 2nd ed. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", Monoclonal Antibodies '84: Biological And Clinical Applications (Pinchera et al. eds., 1985); "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody In Cancer Therapy", Monoclonal Antibodies For Cancer Detection And Therapy (Baldwin et al. eds., Academic Press, 1995); и Thorpe et al., 1982, Immunol. Rev. 62:119-58. Также см., например, публикацию PCT WO 89/12624.)
Как правило, ADC или производное ADC содержит линкерную область между лекарственным средством и антителом против CD269 или его производным. Как отмечалось выше, в типичных вариантах осуществления линкер является расщепляемым во внутриклеточных условиях, так что расщепление линкера освобождает лекарственное средство от антитела во внутриклеточной среде. Например, в некоторых вариантах осуществления линкер расщепляется расщепляющим средством, который присутствует во внутриклеточной среде (например, в лизосоме, или эндосоме, или кавеоле). Линкер может представлять собой, например, пептидильный линкер, который расщепляется внутриклеточным ферментом пептидазой или протеазой, включая, но не ограничиваясь ими, лизосомальную или эндосомальную протеазу. В других вариантах осуществления расщепляемый линкер является чувствительным к pH, т.е. чувствительным к гидролизу при определенных значениях pH. Как правило, pH-чувствительный линкер гидролизуется в кислых условиях. В других вариантах осуществления линкер расщепляется в восстанавливающих условиях (например, дисульфидный линкер). В данной области известно множество дисульфидных линкеров (См., например, Wawrzynczak et al., Immunoconjugates: Antibody Conjugates in Radioimagery and Therapy of Cancer (C. W. Vogel ed., Oxford U. Press, 1987. Также см. патент США № 4880935).
Как правило, линкер по существу не является чувствительным к внеклеточной среде. В других не являющихся взаимно исключающими вариантах осуществления линкер индуцирует клеточную интернализацию. В определенных вариантах осуществления линкер индуцирует клеточную интернализацию, когда он конъюгирован с лекарственным средством (т.е. в случае части линкер - лекарственное средство в ADC или производном ADC, как описано в настоящем описании). В других вариантах осуществления линкер индуцирует клеточную интернализацию, когда он конъюгирован как с лекарственным средством, так и с антителом против CD269 или его производным (т.е. в случае ADC или производного ADC, как описано в настоящем описании). Множество линкеров, которые можно использовать с композициями и способами по изобретению, описано в WO 2004010957 под названием "Drug Conjugates and Their Use for Treating Cancer, An Autoimmune Disease or an Infectious Disease", поданной 31 июля 2003 года, и временной заявке США № 60/400403, под названием "Drug Conjugates and their use for treating cancer, an autoimmune disease or an infectious disease", поданной 31 июля 2002 года (содержание которой включено в настоящее описание в качестве ссылки).
В определенных вариантах осуществления иммуноконъюгат содержит антитело, как описано в настоящем описании, включая, но не ограничиваясь ими, антитело и химиотерапевтическое средство или другой токсин. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают A-цепь дифтерийного токсина, не связывающие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII, и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Доступны различные радионуклиды для получения радиоконъюгатов антител.
Антитела или их фрагменты по настоящему изобретению также можно конъюгировать с одним или несколькими токсинами, включая, но не ограничиваясь ими, калихеамицин, майтанзиноиды, доластатины, ауростатины, трихотецен и CC1065, и производные этих токсинов, которые обладают токсической активностью. Подходящие цитотоксические средства включают, но не ограничиваются ими, ауристатин, включая довалин-валин-долаизолеунин-долапроин-фенилаланин (MMAF) и монометилауристатин E (MMAE), а также формы сложных эфиров MMAE, соединения, связывающиеся с малой бороздкой ДНК, средства, алкилирующие малую бороздку ДНК, энедиин, лекситропсин, дуокармицин, таксан, включая паклитаксел и доцетаксел, пуромицин, доластатин, майтанзиноид и алкалоид барвинка. Конкретные цитотоксические средства включают топотекан, морфолино-доксорубицин, ризоксин, цианоморфолино-доксорубицин, доластатин-10, эхиномицин, комбретатстатин, калихеамицин, майтанзин, DM-1, DM-4, нетропсин. Другие пригодные цитотоксические средства включают антитубулиновые средства, такие как ауристатин, алкалоид барвинка, подофиллотоксин, таксан, производное баккатина, криптофизин, майтанзиноид, комбретастатин или доластатин. Антитубулиновое средство включает диметилвалин-валин-долаизолеуин-долапроин-фенилаланин-п-фенилендиамин (AFP), MMAF, MMAE, ауристатин E, винкристин, винбластин, виндезин, винорелбин, VP-16, камптотецин, паклитаксел, доцетаксел, эпотилон A, эпотилон B, нокодазол, колхицины, колцимид, эстрамустин, цематодин, дискодермолид, майтанзин, DM-1, DM-4 или элеутеробин.
В некоторых вариантах осуществления иммуноконъюгат содержит антитело, конъюгированное с доластатинами или пептидными аналогами или производными долостатина ауристатинами (патенты США № 5635483; 5780588). Было показано что доластатины и ауристатины препятствуют динамике микротрубочек, гидролизу GTP и делению ядра и клеток (Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают активностью против злокачественной опухоли (патент США № 5663149) и противогрибковой активностью (Pettit et al. (1998) Antimicrob. Agents Chemother. 42:2961-2965). Лекарственные части доластатина или ауристатина (которые представляют собой пентапептидные производные доластатинов) могут быть связаны с антителом через N(амино)-конец или C(карбоксильный)-конец пептидной лекарственной части (WO 02/088172). Иллюстративные варианты осуществления ауристатина включают связанные с N-концом лекарственные части монометилауристатина DE и DF, описанные в "Monomethylvalin Compounds Capable of Conjugation to Ligands", патент США № 7498298. Как используют в рамках изобретения, сокращенное обозначение "MMAE" относится к монометилауристатину E. Как используют в рамках изобретения, сокращенное обозначение "MMAF" относится к довалин-валин-долаизолеуин-долапроин-фенилаланину.
Как правило, лекарственные части на основе пептидов можно получать путем формирования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, способом жидкофазного синтеза (см. E. Schroder and K. Lubke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов.
В качестве активного средства, связанного с антителом или его фрагментом согласно изобретению, можно использовать майтанзиноиды. Майтанзиноиды представляют собой ингибиторы митоза, которые действуют, ингибируя полимеризацию тубулина. Майтанзин впервые был выделен из восточноафриканского кустарника Maytenus serrata (патент США № 3896111). Затем было открыто, что определенные микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и C-3 сложные эфиры майтанзинола (патент США № 4151042). Высокоцитотоксические майтанзиноидные лекарственные средства можно получать из ансамитоциновых предшественников, продуцируемых посредством ферментации микроорганизмов, таких как Actinosynnema. Конъюгаты антитело-майтанзиноид получают путем химического связывания антитела с молекулой майтанзиноида без существенного уменьшения биологической активности как молекулы антитела, так и молекулы майтанзиноида. См., например, патент США № 5208020. В среднем 3-4 конъюгированных молекулы майтанзиноида на молекулу антитела продемонстрировали эффективность повышения цитотоксичности в отношении клеток-мишеней без отрицательного влияния на функцию или растворимость антитела, хотя можно ожидать, что даже одна молекула токсина/антитела будет усиливать цитотоксичность относительно применения простого антитела. Майтанзиноиды хорошо известны в данной области, и их можно синтезировать известными способами или выделять из природных источников.
В качестве активного средства, связанного с антителом или его фрагментом согласно изобретению, можно использовать отдельные примеры калихеамицинового семейства антибиотиков. Калихеамициновое семейство антибиотиков способно образовывать двухцепочечные разрывы ДНК в субпикомолярных концентрациях. Для получения конъюгатов семейства калихеамицинов, см. патенты США № 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296. Другое противоопухолевое лекарственное средство, с которым можно конъюгировать антитело, представляет собой QFA, представляющий собой антифолат. Как калихеамицин, так и QFA, имеют внутриклеточные участки действия и не легко проходят через плазматическую мембрану. Таким образом, клеточный захват этих средств через опосредуемую антителом интернализацию значительно усиливает их цитотоксические эффекты.
Другие противоопухолевые средства, которые можно конъюгировать с антителами, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство средств, в совокупности известных как комплекс LL-E33288, описанный в патентах США № 5053394, 5770710, а также эсперамицины (патент США № 5877296). Кроме того, настоящее изобретение относится к иммуноконъюгату, образованному между антителом и соединением с нуклеолитической активностью (например, рибонуклеаза или ДНК-эндонуклеаза, такая как дезоксирибонуклеаза; ДНК-аза). Для селективного разрушения опухоли антитело может содержать высокорадиоактивный атом.
Фармацевтически приемлемый носитель с точки зрения настоящего изобретения может представлять собой любой нетоксичный материал, который не оказывает значительного вредоносного влияния на эффективность биологической активности антител по настоящему изобретению. Очевидно, что характеристики носителя зависят от пути введения. Такая композиция может содержать, в дополнение к активному веществу и носителю, разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие материалы, известные в данной области. Составление фармацевтически приемлемых эксципиентов и растворов носителей хорошо известно специалистам в данной области, также как и разработка подходящих режимов дозирования и лечения для применения конкретных композиций, описанных в настоящем описании, в различных режимах лечения, включая, например, пероральное, парентеральное, внутривенное, интраназальное и внутримышечное введение и составление.
Лекарственное средство, также известное как фармацевтическая композиция, содержащее активный ингредиент (антитело или фрагменты антител) может быть в форме, подходящей для перорального применения, например, в форме таблеток, лепешек, пастилок, водных или маслянистых суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов или эликсиров. Композиции, предназначенные для перорального применения, можно получать любым способом производства фармацевтических композиций, известным в данной области, и такие композиции могут содержать одно или несколько средств, выбранных из группы, состоящей из подсластителей, вкусовых добавок, красителей и консервантов для обеспечения фармацевтически элегантных и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые пригодны для производства таблеток. Эти эксципиенты могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие вещества и разрыхлители, например, кукурузный крахмал или альгиновую кислоту, связующие вещества, например, крахмал, желатин и гуммиарабик, и смазывающие вещества, например, стеарат магния, стеариновую кислоту или тальк. Таблетки могут быть непокрытыми, или они могут быть покрыты известными способами, чтобы замедлить дезинтеграцию и всасывание в желудочно-кишечном тракте и тем самым обеспечить непрерывное воздействие в течение более длительного периода времени. Например, может быть использован такой материал с замедленным высвобождением, как глицерилмоностеарат или глицерилдистеарат. Также они могут быть покрытыми. Настоящее изобретение также относится к фармацевтической композиции для местного применения, перорального приема, ингаляции или кожной, подкожной или внутривенной инъекции. Специалисту в данной области известны носители и добавки, требуемые для конкретных форм применения.
Когда терапевтически эффективное количество активного вещества (антитело или фрагменты антител) по изобретению вводят посредством внутривенной, кожной или подкожной инъекции, активное вещество может иметь форму не содержащего пирогенов парентерально приемлемого водного раствора.
Также изобретение относится к введению терапевтически значимого количества антитела, как описано в настоящем описании, для лечения индивидуума, который имеет медицинские нарушения, как описано в настоящем описании. Как используют в рамках изобретения, термин "терапевтически эффективное количество" означает общее количество каждого активного компонента фармацевтической композиции или способа, которое является достаточным для того, чтобы продемонстрировать существенную пользу у пациента. Количество активного вещества в фармацевтической композиции по настоящему изобретению зависит от природы и тяжести состояния, подвергаемого лечению, и от природы предшествующих способов лечения, которым подвергался пациент. Можно вводить более высокие дозы до тех пор, пока не достигнут оптимального терапевтического эффекта для пациента, и в этот момент дозировку более не увеличивают.
Получение таких парентерально приемлемых растворов, имеющих требуемое значение pH, изотоничность, стабильность и т.п., входит в пределы квалификации специалиста в данной области. Предпочтительная фармацевтическая композиция для внутривенной, кожной или подкожной инъекции должна содержать в дополнение к активному веществу изотонический носитель, такой как хлорид натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций, лактатный раствор Рингера для инъекций или другой носитель, известный в данной области. Фармацевтическая композиция по настоящему изобретению также может содержать стабилизаторы, консерванты, буферы, антиоксиданты или другие добавки, известные специалистам в данной области.
Очевидно, что доза вводимого антитела зависит от многочисленных факторов, хорошо известных в данной области, например, таких как химическая природа и фармацевтический состав антитела, и масса тела, поверхность тела, возраст и пол пациента, а также время и путь введения. Для взрослого иллюстративная доза может составлять от 0,001 мкг до 1 г в сутки, предпочтительно от 0,1 мкг до 100 мг в сутки, более предпочтительно от 1 мкг до 100 мг в сутки, еще более предпочтительно от 5 мкг до 10 мг в сутки. В случае непрерывной инфузии иллюстративная доза может составлять от 0,01 мкг до 100 мг, предпочтительно от 1 мкг до 10 мг на килограмм массы тела в минуту.
В другом аспекте настоящего изобретения предусматривается антитело согласно изобретению, как описано в настоящем описании, для применения для лечения опосредуемого B-клетками или опосредуемого плазмацитами заболевания или опосредуемого антителом заболевания или нарушения, выбранного из множественной миеломы (MM), хронического лимфоцитарного лейкоза (CLL), несекреторной множественной миеломы, вялотекущей множественной миеломы, моноклональной гаммапатии неопределенной значимости (MGUS), изолированной плазмацитомы (костная, экстрамедуллярная), лимфоплазматической лимфомы (LPL), макроглобулинемии Вальденстрема, плазмаклеточного лейкоза, первичного амилоидоза (AL), болезни тяжелых цепей, системной красной волчанки (SLE), синдрома POEMS/остеосклеротической миеломы, криоглобулинемии типа I и II, болезни накопления легких цепей, синдрома Гудпасчера, идиопатической тромбоцитопенической пурпуры (ITP), острого гломерулонефрита, пемфигуса и пемфигоидных нарушений, и приобретенного буллезного эпидермолиза; или любого B-клеточного лейкоза по типу неходжскинской лимфомы или лимфомы Ходжкина (HL) с экспрессией BCMA или любых заболеваний, при которых у пациентов развиваются нейтрализующие антитела к заместительной терапии рекомбинантным белком, где указанный способ включает стадию введения указанному пациенту терапевтически эффективного количества антитела, как описано в настоящем описании.
B-клеточные нарушения можно подразделить на дефекты развития B-клеток/продукции иммуноглобулинов (иммунодефициты) и чрезмерную/неконтролируемую пролиферацию (лимфомы, лейкозы). Как используют в рамках изобретения, B-клеточное нарушение относится к обоим типам заболеваний, и предусматриваются способы лечения B-клеточных нарушений антителом.
В одном аспекте настоящего изобретения заболевание представляет собой множественную миелому.
Также предусматривается применение антитела, как описано в настоящем описании, для производства лекарственного средства для лечения заболеваний и нарушений, как описано в настоящем описании.
Например, в одном аспекте изобретения предусматривается применение антитела, как описано в настоящем описании, для лечения или профилактики заболеваний и нарушений, отвечающих на модулирование (такое как ингибирование или блокирование) взаимодействия между BCMA и лигандами BAFF и APRIL.
В одном варианте осуществления изобретения выделенное антитело или фрагмент антитела предназначены для лечения B-лимфоцитарных злокачественных опухолей, таких как лимфома Ходжкина.
В одном варианте осуществления изобретения выделенное антитело или фрагмент антитела предназначены для применения для лечения аутоиммунного заболевания, такого как медицинское нарушение, ассоциированное с воспалением, предпочтительно аутоиммунное заболевание с воспалительным компонентом, где аутоиммунное заболевание выбрано из артериита Такаясу, гигантоклеточного артериита, семейной средиземноморской лихорадки, болезни Кавасаки, узелкового полиартериита, кожного узелкового полиартериита, ассоциированного с гепатитом артериита, синдрома Бехчета, гранулематоза Вегенера, ANCA-васкулитов, синдрома Черджа-Стросс, микроскопического полиангиита, васкулита при заболеваниях соединительной ткани, пурпуры Геноха-Шенлейна, криоглобулинемического васкулита, кожного лейкоцитокластического ангиита, тропического аортита, саркоидоза, синдрома Когана, синдрома Вискотта-Олдрича, лепроматозного артериита, первичного ангиита ЦНС, облитерирующего тромбангита, паранеопластического артериита, крапивницы, болезни Дегоса, миелодиспластического синдрома, стойкой возвышающейся эритемы, синдрома гипериммуноглобулина D, аллергического ринита, бронхиальной астмы, хронического обструктивного заболевания легких, периодонтита, ревматоидного артрита, атеросклероза, амилоидоза, болезни Крона, язвенного колита, аутоиммунного миозита, сахарного диабета, рассеянного склероза, синдрома Гийена-Барре, гистиоцитоза, остеоартрита, атопического дерматита, периодонтита, хронического риносинусита, псориаза, псориатического артрита, микроскопического колита, фиброза легких, гломерулонефрита, болезни Уиппла, болезни Стилла, узловатой эритемы, отита, криоглобулинемии, синдрома Шегрена, красной волчанки, апластической анемии, остеомиелофиброза, хронической воспалительной демиелинизирующей полиневропатии, болезни Кимура, системной склеродермии, хронического периаортита, хронического простатита, идиопатического фиброза легких, хронического гранулематозного заболевания, идиопатической ахалазии, индуцируемого блеомицином воспаления легких, индуцируемого цитарабином воспаления легких, аутоиммунной тромбоцитопении, аутоиммунной нейтропении, аутоиммунной гемолитической анемии, аутоиммунной лимфоцитопении, болезни Чагаса, хронического аутоиммунного тиреоидита, аутоиммунного гепатита, тиреоидита Хашимото, атрофического тиреоидита, болезни Грэйвса, аутоиммунного полигландулярного синдрома, аутоиммунного синдрома Аддисона, пемфигуса обыкновенного, пемфигуса листовидного, герпетиформного дерматита, аутоиммунной алопеции, витилиго, антифосфолипидного синдрома, миастении, синдрома ригидности мышц, синдрома Гудпасчера, симпатической офтальмии, фолликулита, синдрома Шарпа и/или синдрома Эванса, в частности, сенной лихорадки, периодонтита, атеросклероза, ревматоидного артрита, предпочтительно ревматоидного артрита или рассеянного склероза.
ПОСЛЕДОВАТЕЛЬНОСТИ
Предпочтительные последовательности антител по изобретению:
где
X1: I, F, L, V, Y. C, G, A, S, T, предпочтительно I или F;
X2X3: SS, NS, TS, GS, KS, RS, SD, SN, DE, предпочтительно SS;
X4: Y, L, A, V, F, I, W, предпочтительно Y; и/или
X5: Y, L, F, I, V, A, C, предпочтительно Y
где
X1: W, F, Y, предпочтительно W;
X2: S, T, N, Q, D, E, предпочтительно S;
X3: W, F, Y, предпочтительно W;
X4: E, Q, предпочтительно E;
X5: L, I, V, G, A, предпочтительно L;
X6: Y, X, предпочтительно Y;
X7: Y, F, L, I, V, M, предпочтительно Y; и/или
X8: A, G, V, предпочтительно A
где:
X1X2: ES, SS, TS, QS, HS, DH, предпочтительно ES.
где:
X1: S, H, T, N, D, Q;
X2: N, E, Q;
X3: A, G, V, S, T, L, I;
X4: Y, F, L, I, V, A, G;
X5: Y, F, L;
X6: S, T;
X7: S, T, D, N, H, E, Q;
X8: L, V, I, M;
X9: F, L, I, V, Y, M;
X10: G, X;
X11: S, X;
X12: Q, V, L, I, M;
X13: Y, F, L, I, Q;
X14: Y, F, R, Q, K; и/или
X15: L, I, V, F
где:
X1: I, F, L, V, Y. C, G, A, S, T, предпочтительно I или F
где:
X2X3: SS, NS, TS, GS, KS, RS, SD, SN, DE, предпочтительно SS
где:
X4: Y, L, A, V, F, I, W, предпочтительно Y; и/или
X5: Y, L, F, I, V, A, C, предпочтительно Y
где:
X1X2: ES, SS, TS, QS, HS, DH, предпочтительно ES
Предпочтительные нуклеотидные последовательности
Предпочтительные последовательности по изобретению, относящиеся к CD269 (BCMA):
Предпочтительные обобщенные аминокислотные последовательности, содержащие модификации гуманизированной последовательности:
где X1: Q, E; X2: Q, V; X3: Q, E; X4: K, R; X5: I, F; X6: D, T; X7: S, D; X8: R, D; X9: R, Q; X10: I, V; X11: D, G; X12: K, R; X13: I, T; X14: S, N; X15: K, S; X16: V, L; X17: S, A; X18: L, V; X19: S, L; и где по меньшей мере один из Z1: I или F; Z2: S и/или Z3: Y.
где X1: Q, P; X2: R, A; X3: F, T; X4: M, L; X5: T, S; X6: T, V; X7: R, E; X8: S, T; X9: V, L; X10: R, G; X11: S, A; X12: A, L; X13: F, Y; X14: A, D; X15: S, D; X16: T, S; X17: N, S; X18: L, F; X19: E, V; X20: F, Y
ЧЕРТЕЖИ
Изобретение демонстрируется в качестве примера с помощью примеров и чертежей, описанных в настоящем описании. На чертежах, представленных в настоящем описании, показаны конкретные варианты осуществления изобретения, и они не предназначены для ограничения объема изобретения. Чертежи следует рассматривать как предоставление дополнительного описания возможных и потенциально предпочтительных вариантов осуществления, которые подкрепляют техническую поддержку одного или нескольких неограничивающих вариантов осуществления.
Краткое описание чертежей:
Фиг.1: Охарактеризация J22.9-xi in vitro.
Фиг.2: Структура CD269 (BCMA) и комплекса J22.9-xi Fab:CD269.
Фиг.3: Цитотоксичность J22.9-xi in vitro.
Фиг.4: Эффективность J22.9-xi у мышей NSG с ксенотрансплантатами.
Фиг.5: Лечение развившихся опухолей.
Фиг.6: Лечение опухоли на ранней фазе заболевания.
Фиг.7: Нестабильность гибридомы J22.9.
Фиг.8: Последовательности гуманизированных последовательностей HC по сравнению с J22.9-xi.
Фиг.9: Последовательности гуманизированных последовательностей LC по сравнению с J22.9-xi.
Фиг.10: Варианты J22.9-xi с оптимизированной последовательностью демонстрируют сходное связывание в ELISA.
Фиг.11: Варианты J22.9-xi с оптимизированной последовательностью демонстрируют сходное связывание при проточной цитометрии.
Фиг.12: Исходные данные SPR.
Фиг.13: Гель-электрофорез вариантов антител.
Подробное описание чертежей:
Фиг.1: Охарактеризация J22.9-xi in vitro. Зависимое от концентрации связывание J22.9-xi с BCMA в (a) ELISA и (b) проточной цитометрии с использованием CD269-положительных клеток MM.1S. (c) Аффинность связывания J22.9-xi с BCMA определяли из измерений способом поверхностного плазмонного резонанса с указанными концентрациями BCMA. (d) J22.9-xi блокирует взаимодействие между BAFF и BCMA, адсорбированным на микропланшетах для титрования.
Фиг.2: (a) Поверхность распознавания CD269 (BCMA). Три вида на внеклеточный домен CD269 (BCMA), демонстрирующие связывание остатков эпитопов BAFF/APRIL и J22.9-xi. Сверху представлен вид непосредственно на поверхность связывания CD269 (BCMA): светло-серое выделение цветом указывает на все остатки, составляющие связываемый эпитоп BAFF и APRIL, как идентифицировано из их кристаллических структур, черные остатки (показанные в качестве сфер) не контактируют ни с одним из BAFF, APRIL или J22.9-xi; подгруппа остатков эпитопов, вовлеченных в связывание J22.9-xi, показана в поверхностном представлении; остальные светло-серые остатки, показанные в виде сфер, являются частью эпитопов как BAFF, так и APRIL, однако не имеют прямых контактов с J22.9-xi. На средних и нижних панелях показано то же представление, что и на верхней панели, однако с вращением на 90° в направлении к и от зрителя, соответственно. (b) Два вида на комплекс J22.9-xi Fab:CD269. J22.9-xi показано в поверхностном представлении с тяжелой цепью, окрашенной светло-серым цветом, и легкой цепью, окрашенной темно-серым цветом. CD269 (BCMA) показан в ленточном представлении, связанный с антигенным карманом J22.9-xi. Слева представлен полный вид на комплекс Fab:CD269; справа представлен комплекс, наклоненный в сторону зрителя для демонстрации связывающего кармана.
Фиг.3: Цитотоксичность J22.9-xi in vitro. (a) CD269-положительные клетки MM.1S-Luc, смешанные с PBMC человека в соотношении эффектора и мишени 20:1, инкубировали с указанными концентрациями J22.9-xi в течение 4 часов. Незакрашенные символы указывают на цитотоксическую активность J22.9-xi без N-гликанов при инкубации с PBMC от доноров 1 и 2. Планки погрешности указывают на SEM. (b) Дегликозилирование не влияет на связывание J22.9-xi с клетками MM.1S. (c) Хранение J22.9-xi в течение 3 недель при 4°C или -80°C не влияет на цитотоксичность.
Фиг.4: Эффективность J22.9-xi у мышей NSG с ксенотрансплантатами. (a) Развитие опухоли с течением времени при введении 200 мкг J22.9-xi или контрольного антитела два раза в неделю, или у контрольных мышей без введения. (b) Общая опухолевая нагрузка между 6 и 41 сутками (площадь под кривой (AUC) (a)). на график нанесены средние значения с SEM (**P<0,01, ***P<0,001, t-критерий). (c) Общая выживаемость мышей, которым вводили J22.9-xi и изотипический контроль. Значение P вычисляли с использованием логарифмического рангового критерия (Мантеля-Кокса). (d-1) Выявление клеток MM.1S-Luc в указанных группах без введения терапевтического антитела. Числа (41, 41, 44, 40) ниже крайнего справа изображения указывают на количество суток после инъекции опухолевых клеток, на которые конкретная мышь погибла. (d-2) Выявление клеток MM.1S-Luc в указанных группах на 21 и 28 сутки. Вид сзади. (e) Взаимосвязь между концентрацией J22.9-xi и развитием опухоли. (f) Общая опухолевая нагрузка между 6 и 42 сутками (AUC для (e)). Средние величины с SEM (**P<0,01, ***P<0,001, t-критерий). (g) Обзор хронологии эксперимента.
Фиг.5: Лечение развившихся опухолей. (a) Развитие опухоли с течением времени при введении 200 мкг J22.9-xi или контрольного антитела два раза в неделю, или у контрольных мышей без введения. (b) Общая опухолевая нагрузка между сутками 8 и 48 (AUC для (a)). На график нанесены средние значения с SEM (*P<0,05, **P<0,01, t-критерий). (c) Общая выживаемость у мышей с J22.9-xi и мышей с изотипическим контролем. Значение P вычисляли с использованием логарифмического рангового критерия (Мантеля-Кокса). Обзор хронологии эксперимента представлен на фиг.5d.
Фиг.6: Лечение опухоли на ранней фазе заболевания. (a) Динамика роста опухоли при лечении 2 мкг, 20 мкг или 200 мкг J22.9-xi или 200 мкг либо изотипического контрольного антитела, либо J22.9-xi без N-гликанов, и без опухоли. (b) Общая опухолевая нагрузка в течение суток с 9 по 44 (AUC для (a)). Показаны средние значения с SEM (*P<0,05, **P<0,01, t-критерий). (c) Выживание мышей SCID-Beige с ксенотрансплантатом, которых лечили антителом, и контрольных мышей. Значения P вычисляли с использованием логарифмического рангового критерия (Мантеля-Кокса). Обзор хронологии эксперимента представлен на фиг.6d.
Фиг.7: Нестабильность гибридомы J22.9. Супернатант гибридомы J22.9 имел положительные результаты исследования на связывание с BCMA в ELISA на покрытых BCMA микропланшетах для титрования на 1 сутки. Последующий анализ в указанные моменты времени выявил снижение связывающей способности супернатанта. Среду заменяли на 7, 14 и 21 сутки.
Фиг.8: Обобщение последовательностей гуманизированных антител по сравнению с J22.9-xi. Сравнение последовательностей проводили с использованием стандартного программного обеспечения для выравнивания.
Фиг.9: Обобщение последовательностей гуманизированных антител по сравнению с J22.9-xi. Сравнения последовательностей проводили с использованием стандартного программного обеспечения для выравнивания.
Фиг.10: Связывание химерного J22.9-xi и гуманизированных вариантов исследовали посредством ELISA с использованием микропланшетов для титрования, покрытых BCMA человека (hBCMA) или BCMA яванского макака (cyBCMA) (J22.9-H соответствует гуманизированной последовательности SEQ ID NO: 27; J22.9-FSY соответствует гуманизированной и модифицированной в отношении PTM SEQ ID NO: 28; J22.9-ISY соответствует гуманизированной и модифицированной в отношении PTM SEQ ID NO: 29).
Фиг.11: Связывание химерного J22.9-xi и гуманизированных вариантов исследовали проточной цитометрией с использованием клеточной линии MM человека RPMI-8226 (J22.9-FSY соответствует гуманизированной и модифицированной в отношении PTM SEQ ID NO: 28; J22.9-ISY соответствует гуманизированной и модифицированной в отношении PTM SEQ ID NO: 29).
Фиг.12: Исходные данные SPR: аффинность связывания химерного J22.9-xi и гуманизированных вариантов с BCMA человека (фиг.12 A) и яванского макака (фиг.12 B) измеряли с использованием спектрометрии поверхностного плазмонного резонанса (SPR). IgG иммобилизовывали посредством химии аминов на сенсорном чипе Proteon GLH и связывание измеряли с использованием BCMA в подвижной фазе. Порядок кривых исходных данных на графике соответствует порядку образцов, приведенных на легенде фигуры.
Фиг.13: Гель-электрофорез вариантов антител. Варианты антител анализировали в невосстанавливающем SDS-PAGE и окрашивали для демонстрации миграции белков.
ПРИМЕРЫ
Изобретение демонстрируется с помощью примеров, описанных в настоящем описании. Примеры, предоставленные в настоящем описании, представляют собой только конкретные варианты осуществления изобретения и не предназначены для ограничения объема изобретения. Примеры следует считать обеспечивающими дополнительное описание возможных и потенциально предпочтительных вариантов осуществления, которые подкрепляют техническую поддержку одного или нескольких неограничивающих вариантов осуществления.
Хотя примеры в отношении кристаллизации комплекса антитело-эпитоп и противоопухолевого эффекта in vitro и in vivo были проведены с использованием исходного химерного антитела J22.9-xi, авторы изобретения показали, что эти технические эффекты сохраняются для гуманизированных вариантов по настоящему изобретению, вследствие сохранения характеристик связывания у гуманизированных вариантов по сравнению с исследованным исходным химерным антителом. Таким образом, данные, предоставленные для химерного антитела, таким образом, предоставлены в качестве справочного материала и для показания промышленной применимости и полезности заявленных человеческих вариантов. Предварительные биологические данные указывают на сравнимые эффекты между J22.9-xi и гуманизированными вариантами.
Характеристики связывания и блокирования взаимодействия J22.9-xi и BCMA
Новое химерное антитело (J22.9-xi) связывается с внеклеточным доменом CD269 человека (BCMA, TNFRSF17). Первоначально это было установлено посредством ELISA и проточной цитометрии на клеточной линии множественной миеломы человека MM.1S (фиг.1a.b). Аффинность J22.9-xi к BCMA определяли с использованием поверхностного плазмонного резонанса (SPR). Средняя Kd составляет 54 пМ, как показано на фиг.1c.
Известно, что BCMA запускает сигналы, важные для выживания клеток множественной миеломы и плазмацитов in vivo, посредством взаимодействия с его лигандами BAFF и/или APRIL (Mackay F et al. (2003) Annu Rev Immunol 21:231-264). Таким образом, проводили анализ блокирования in vitro с внеклеточным доменом BCMA человека и рекомбинантным BAFF. Связывание J22.9-xi с BCMA явно блокирует взаимодействие между рецептором и его лигандом BAFF. При использовании изотипического контрольного антитела вместо J22.9-xi связывание рекомбинантного BAFF с BCMA не изменялось (фиг.1d).
Кристаллическая структура комплекса J22.9-xi-Fab-BCMA демонстрирует широкую поверхность связывания с BCMA
Fab-фрагменты, полученные из J22.9-xi, кристаллизовали в комплексе с очищенным внеклеточным доменом BCMA из 46 аминокислотных остатков, и структуру комплекса определяли до разрешения 1,9 ангстрем. Электронную плотность высокого качества наблюдали для остатков 6-41 BCMA, и они демонстрируют обширное взаимодействие с J22.9-xi, в основном с легкой цепью антитела (фиг.2B). Эта поверхность контакта, которая охватывает 740,4 квадратных ангстрем и вовлекает одну треть остатков BCMA, охватывает 12 из 16 остатков идентичного эпитопа, наблюдаемых в кристаллических структурах комплексов BMCA с APRIL и sTALL1 (также известным как BAFF), включая консервативный мотив DxL (Gordon N C, et al. (2003), BAFF/BlysS receptor 3 comprises a minimal TNF receptor-like module that encodes a highly focused ligand-binding site. Biochemistry 42(20): 5977-83, и Patel D R, et al. (2004), Engineering an APRIL-specific B Cell Maturation Antigen. JBC 279(16): 16727-35), обеспечивая отчетливое обоснование блокирующего эффекта, наблюдаемого в анализах in vitro с BAFF (фиг.2A). Взаимодействие с J22.9-xi, кроме того, включает прямой контакт боковой цепи с Ala20 и Pro23 в BCMA, остатками, не являющихся частью связываемого эпитопа, охватываемого BAFF и APRIL, и несколько опосредуемых водой водородных связей. Общая конформация BCMA во всех трех структурах является в высокой степени сходной, с C-альфа rmsd 1,4 ангстрем для комплексов J22.9-xi и APRIL и 1,5 ангстрем для комплексов J22.9-xi и sTALL1; соответствующие C-альфа rmsd для связываемого J22.9-xi эпитопа BCMA (остатки 13-30) составляют 0,98 и 0,88 ангстрем. Несмотря на распознавание того же эпитопа BCMA, имеющего мотив DxL в его центре, участок связывания J22.9-xi в значительной степени отличается от участков связывания sTALL1 и APRIL, также как и совокупность взаимодействий, образующих поверхность контакта.
Как можно видеть на фиг.2B и в таблицах 1 и 2, 19 аминокислот из J22.9-xi (6 из тяжелой цепи (таблица 1), 13 из легкой цепи (таблица 2)) образуют прямые связи с 12 остатками из внеклеточного домена CD269.
Таблица 1: Перечень взаимодействий аминокислот между тяжелой цепью J22.9-xi и BCMA. Этот перечень взаимодействий был получен с использованием программного обеспечения PDBsum (Laskowski R A (2009)).
Таблица 2: Перечень взаимодействий аминокислот между легкой цепью J22.9-xi и BCMA. Этот перечень взаимодействий был получен с использованием программного обеспечения PDBsum (Laskowski R A (2009)).
Таблица 3: Перечень взаимодействий остатков, вовлеченных в связывание CD269:APRIL и CD269:BAFF (остатки, не контактирующие прямо с J22.9, подчеркнуты). Этот перечень взаимодействий был получен с использованием программного обеспечения PDBsum (Laskowski R A (2009)).
Таблица 4: Остатки мишени CD269, связываемые посредством прямых контактов J22.9, APRIL и/или BAFF. Остатки мишени CD269, прямо контактирующие только с J22.9, подчеркнуты (20, 23). Остатки мишени CD269, не контактирующие прямо с J22.9, выделены полужирным шрифтом (30, 31, 33, 34, 35 для APRIL; 25, 29, 30, 31, 34, 35 для BAFF).
J22.9: 13, 15, 16, 17, 18, 19, 20, 22, 23, 26, 27, 32
APRIL: 13, 15, 17, 18, 19, 22, 26, 27, 30, 31, 32, 33, 34, 35
BAFF: 13, 15, 16, 17, 18, 19, 22, 25, 26, 27, 29, 30, 31, 32, 34, 35
Таблица 5: Водные взаимодействия J22.9 (J22.9-xi:H2O:CD269). Данные, приведенные в таблице 5, были получены с использованием программного обеспечения LigPlot (Wallace and Laskowski, European Bioinformatics Institute). (sc=H-связь боковой цепи; mc=H-связь основной цепи)
Выраженная цитотоксическая эффективность J22.9-xi существенно снижается после дегликозилирования
Анализ цитотоксичности на основе люциферазы был разработан с использованием трансдуцированной люциферазой клеточной линии MM.1S-Luc. В этом анализе биолюминесценция обнаруживалась только в живых клетках, поскольку люцифераза, высвобождаемая погибшими клетками, не способна функционировать вследствие нехватки ATP в среде. PBMC от здоровых доноров выделяли и смешивали с клетками MM.1S-Luc в соотношении 20 к 1. Через 4 часа измеряли биолюминесценцию.
Посредством выбора 4 нестимулированных препаратов донорских PBMC определяли цитотоксичность J22.9-xi in vitro. Цитотоксический потенциал несколько варьируется между PBMC от здоровых доноров. После инкубации в течение 4 часов клеточный лизис достигал 18-35% при концентрации 125 нг/мл J22.9-xi. Увеличение концентрации J22.9-xi до 1 мкг/мл повышало клеточный лизис на вплоть до 56% (фиг.3a).
После дегликозилирования J22.9-xi (J22.9-xi-N-glycan) посредством PNG-азы F цитотоксическая активность снижалась до уровня ниже 8%, в то время как связывание J22.9-xi-N-glycan с положительными по BCMA клетками MM.1S оставалось неизмененным (фиг.3a,b).
J22.9-xi снижает опухолевую нагрузку у мышей с ксенотрансплантатами и продлевает выживаемость
Авторы настоящего изобретения использовали мышей с нокаутом общей гамма-цепи NOD scid (NSG), лишенных функциональных популяций B-, T- и NK-клеток. У этих мышей после инъекции 1×107 клеток MM.1S-Luc внутривенно развивается паралич задних конечностей в пределах 6 недель (фиг.4d-1). День, в который появляется первый симптом, определяют как день умерщвления.
После инъекции 1×107 MM.1S-Luc в хвостовую вену мышей случайным образом распределяли на 3 группы. В первой группе (n=2) лечение не проводили до конца эксперимента, в то время как во второй (n=5) и в третьей (n=6) группах проводили инъекции два раза в неделю 200 мкг изотипического контроля или антитела J22.9-xi, соответственно. Антитела вводили в течение 6 недель внутрибрюшинно (в/б), начиная в день инъекции опухолевых клеток. Мониторинг роста опухоли проводили один раз в неделю с использованием IVIS Spectrum. Измерение биолюминесценции проводили через 3 минуты после в/б инъекции люциферина.
Сходное течение развития опухоли наблюдали как в группе без введения, так и в группе, в которой вводили контрольное антитело, в то время как группа, в которой вводили J22.9-xi, продемонстрировала значительно меньшую опухолевую нагрузку, начиная уже с первого момента измерения на шестые сутки (фиг. 4a). Кроме того, эта группа продемонстрировала меньшую общую опухолевую нагрузку на протяжении всего периода мониторинга (фиг.4b). Животные, которым вводили изотипический контроль, имели среднюю выживаемость 46 суток после инъекции клеток. Мыши, которым вводили J22.9-xi, жили в среднем на 26 суток дольше. Это соответствует продлению выживаемости на 55% по сравнению с мышами, которым вводили контрольное антитело (фиг.4c). У мышей, которым не проводили введение, и мышей, которым вводили изотипическое контрольное антитело, на 28 сутки после инъекции клеток наблюдали массивные инфильтраты опухолевых клеток в позвоночник и паховые лимфатические узлы (фиг.4d-2).
Введение 200 мкг антитела мыши соответствует приблизительно 10 мг/кг массы тела. Для исследования эффективности J22.9-xi при более низких дозах авторы настоящего изобретения подразделили мышей с ксенотрансплантатом MM.1S-Luc на четыре группы. В первой группе (n=7) вводили 200 мкг контрольного антитела два раза в неделю, и в группах 2, 3 (в каждой n=3) и 4 (n=9) инъецировали 2 мкг, 20 мкг или 200 мкг два раза в неделю, соответственно. Инъекции и мониторинг проводили, как описано выше.
Хотя, как и ожидалось, в контрольной группе мышей развивались опухоли, значительно ограниченный рост опухоли наблюдали в группах, в которых вводили 20 мкг или 200 мкг J22.9-xi (фиг.4e,f). Обзор хронологии эксперимента представлен на фиг.4g.
Рост развившихся опухолей останавливается на 5 недель в ходе лечения J22.9-xi
Терапевтическое введение имитировали путем отсрочивания начала введения антитела на 5 суток после инъекции опухолевых клеток. Мышей с ксенотрансплантатами разделяли на 2 группы (n=6). Животным вводили 200 мкг на инъекцию либо изотипического контроля, либо антитела J22.9-xi, два раза в неделю. Первое измерение проводили через 8 суток после инъекции клеток. В то время как в группе, в которой вводили J22.9-xi (n=5), биолюминесценция опухоли не выявлялась вплоть до 35 суток, устойчивое увеличение опухолевой нагрузки наблюдали у животных, которым вводили изотипическое контрольное антитело (n=6) (фиг.5a,b). Мыши из группы изотипического контроля выживали в среднем 56 суток после инъекции клеток, в то время как все мыши, которым вводили J22.9-xi, все еще были живы на 77 сутки (фиг.5c). Обзор хронологии эксперимента представлен на фиг.5d.
Интенсивное лечение J22.9-xi на ранней фазе препятствует росту опухоли в течение 7 недель
Для дальнейшей оценки эффекта расписания лечения на рост опухоли различные антитела вводили в течение пяти последовательных суток, начиная с суток инъекции опухолевых клеток. После в/в инъекции клеток животных случайным образом разделяли на 5 групп. В группе 1 (n=5) вводили 200 мкг изотипического контрольного антитела на инъекцию (в/б), в то время как в группе 2 (n=6) вводили 200 мкг/инъекция антитела J22.9-xi-N-glycan. Мышам из группы 3 (n=4), группы 4 (n=5) и группы 5 (n=5) вводили 200 мкг, 20 мкг и 2 мкг на инъекцию антитела J22.9-xi, соответственно. Измерения биолюминесценции начинали на 9 сутки после инъекции клеток. Вплоть до 44 суток не наблюдали биолюминесценции опухоли ни водной из групп, в которых вводили интактное антитело J22.9-xi. Хотя рост опухоли у животных, которым вводили J22.9-xi-N-glycan, замедлялся, общая опухолевая нагрузка не отличалась значительно от опухолевой нагрузки у животных, которым вводили изотипическое контрольное антитело (фиг.6a,b). Хотя общая опухолевая нагрузка у животных, которым вводили J22.9-xi-N-glycan (дегликозилированное), не отличалось значительно (фиг.6b) от группы введения isoAb, продолжительность жизни этих была значительно увеличена (фиг.6c). Поскольку было показано, что J22.9-xi-N-glycan не способно индуцировать ADCC или CDC, этот результат показывает, что уже только связывание J22.9-xi с BCMA препятствует росту опухоли. Можно обоснованно заключить, что это является следствием блокирования взаимодействия между рецептором и его нативными лигандами (APRIL и BAFF). Обзор хронологии эксперимента представлен на фиг.6d.
Гуманизация J22.9-xi
Антитело J22.9-xi гуманизировали на основе выравнивания последовательностей и данных, полученных из кристаллической структуры. Последовательности вариабельных областей выравнивали с их соответствующими гомологами человека с использованием IgBLAST (NCBI) или Clustal (EBI). Каждую предложенную мутацию оценивали посредством визуального исследования структуры до изменения.
Связывание гуманизированных вариантов с мишенью BCMA
Связывание мутантов с BCMA исследовали с использованием проточной цитометрии, ELISA и SPR. Аффинность гуманизированных антител измеряли с использованием поверхностного плазмонного резонанса (ProteOn™ XPR36; Bio-Rad). Данные о связывании демонстрируют неожиданные результаты в отношении специфичности и аффинности гуманизированных вариантов антител в отношении того же эпитопа, который тестировали в отношении связывания J22.9-xi. Как показано в таблице ниже, было совершенно неожиданным, что гуманизированные антитела, как описано в настоящем описании, проявляли сравнимые характеристики связывания с исходным химерным антителом. Данные SPR показали, что аффинность гуманизированных вариантов является сходной с аффинностью химер, и она является достаточной для предположения об их клинической значимости ввиду данных, представленных в настоящем описании с исходным химерным антителом. Квалифицированный специалист не может ожидать, что посредством модификации CDR в процессе гуманизации химеры, характеристики связывания могут сохраниться до такой степени.
ELISA проводили, как описано в настоящем описании, с использованием покрытых BCMA микропланшетов для титрования (мкг/мл). Как наблюдали на фиг.10, связывание было сравнимым для всех гуманизированных вариантов по сравнению с J22.9-xi при использовании BCMA как человека, так и яванского макака.
Проточную цитометрию также проводили с использованием гуманизированных вариантов, описанных в настоящем описании, и было показано эквивалентное связывание с BCMA как человека, так и яванского макака, для всех исследованных гуманизированных вариантов (см. фиг.11).
Также проводили анализ SPR и измеряли аффинность для гуманизированных вариантов антител. Как можно наблюдать в таблице ниже (таблица 6), аффинность гуманизированных вариантов (J22.9-H соответствует гуманизированной последовательности SEQ ID NO: 27; J22.9-FSY соответствует гуманизированной и модифицированной в отношении PTM SEQ ID NO: 28; J22.9-ISY соответствует гуманизированной и модифицированной в отношении PTM SEQ ID NO: 29).
Таблица 6. Данные SPR
(n=3)
(n=2)
Аминокислота 54 в CDR2 тяжелой цепи J22.9:
Для удаления потенциального участка посттрансляционной модификации в гуманизированном J22.9 остаток D54 CDR2 тяжелой цепи заменяли на аспарагин (N), непреднамеренно создав новый потенциальный участок модификации посредством N-связанного гликозилирования. Мутантная тяжелая цепь, содержавшая N54, мигрировала медленней на гелях SDS (фиг.13), что указывает на больший размер и на то, что CDR была гликозилированной.
Тем не менее, соответствующий IgG, J22.9-FNY, связывал BCMA в FACS и ELISA, и кристаллизовался в комплекс с BCMA. Хотя и не полностью уточненная, структура с разрешением 2,7 ангстрем демонстрирует явную электронную плотность, исходящую из боковой цепи N54 - что согласуется с модификацией остатка сахаром. Неожиданно, такое большое удлинение боковой цепи не нарушило связывания BCMA, и, исходя из этих наблюдений, можно было ожидать, что в этом положении допустимо множество различных аминокислотных замен, а также потенциально дериватизаций, отличных от сахаров.
СПОСОБЫ
Клеточные линии и культура
Клеточную линию множественной миеломы человека MM.1S (Greenstein et al. (2003) Exp Hematol 31:271-282) получали от Prof. B. Dörken (MDC, Берлин, Германия). Для мониторинга роста клеток in vivo, люциферазу и GFP клонировали в вектор pFU лентивирусной векторной системы ViraPower (Invitrogen). Посредством экспрессии GFP трансдуцированными клетками выделяли моноклональные клеточные линии с использованием сортировки флуоресцентно активированных единичных клеток. Клеточные линии культивировали в среде RPMI-1640 без фенолового красного, содержавшей 10% эмбриональную телячью сыворотку, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина (все от PAA).
Клетки HEK293-6E, приобретенные от National Research Council of Canada, поддерживали в среде Freestyle F17 (Invitrogen), дополненной 7,5 мМ L-глутамином (PAA), 0,1% Pluronic F-68 (Invitrogen) и 25 мкг/мл G418 (Invitrogen). Клетки выращивали в колбах Эрленмейера (Corning) при 110 об./мин. и 37°C в атмосфере с 5% CO2.
Продукция и очистка антител
Для получения связывающего BCMA антитела использовали стандартный способ гибридом. 4 мыши BL/6 дикого типа иммунизировали 6 раз неполным адъювантом Фрейнда и 30 мкг внеклеточного домена BCMA человека, слитого на C-конце с глутатион S-трансферазой (GST). После слияния клеток с последующим периодом скрининга было показано, что гибридома J22.9 секретирует антитело против BCMA.
Вследствие нестабильности гибридом вариабельные области легкой и тяжелой цепей гибридомы J22.9 амплифицировали и клонировали выше генов каппа человека или константных доменов IgG1, соответственно. Химерное антитело J22.9-xi получали посредством временной сотрансфекции клеток 293-6E смесью 1:2 плазмидной ДНК, кодирующей легкую и тяжелую цепи, соответственно. В кратком изложении: клетки 293-6E ресуспендировали до 1,7×106 клеток/мл в бессывороточной середе Freestyle F17 и трансфицировали с использованием полиэтиленимина в конечной концентрации 1 мкг/мл культуры. Через двое суток после трансфекции клетки подпитывали 100% использованным для трансфекции объемом среды Freestyle F17, содержавшей 1% триптон N1 (Organo Technie). На 7 сутки клетки собирали центрифугированием и фильтрованную (0,45 мкм) культуральную среду пропускали через 3,5-мл колонку Protein A Sepharose (Bio-Rad). Колонку промывали 10 мл фосфатно-солевого буфера (PBS) и антитело элюировали добавлением 20 мМ ацетата натрия, 150 мМ NaCl, pH 3,5. Фракции объемом 2 мл собирали непосредственно в пробирки, содержавшие 100 мкл 1 M HEPES, pH 7,5, для нейтрализации. Конечный выход полноразмерного IgG составлял приблизительно 40 мг/л культуры.
Поскольку гибридома J22.9 утрачивала способность продуцировать/секретировать антитело против BCMA (фиг.8), вариабельные области тяжелой и легкой цепей амплифицировали с использованием ПЦР, а затем клонировали на 5ʹ-конце генов константной области IgG1 и легкой цепи K, соответственно. Посредством сотрансфекции клеток 293-6E этими двумя плазмидами получали химерное антитело J22.9-xi. Таким образом, продукция антитела по изобретению была в своей основе затруднена и не осуществлялась простыми стандартными способами.
Параллельно с антителом J22.9-xi продуцировали изотипическое контрольное антитело, состоявшее из тяжелой цепи J22.9-xi и случайной химерной легкой цепи каппа. Посредством ELISA и проточной цитометрии было показано, что это антитело было не способно связываться с BCMA.
N-связанные олигосахаридные цепи на Asn297 тяжелой цепи J22.9-xi удаляли ферментативно с использованием N-гликозидазы F (PNG-аза F) (NEB). 10 мг J22.9-xi инкубировали с 15000 единиц PNG-азы F в 500 мкл PBS (pH 7,4) в течение 36 часов при 37°C, а затем проводили замену буфера на стерильный PBS.
Определение способности J22.9-xi к связыванию и блокированию с использованием твердофазного иммуноферментного анализа (ELISA)
Микропланшеты для титрования покрывали 10 мкг/мл внеклеточного домена BCMA человека. Детекцию нанесенного BCMA проводили с использованием серийного разведения J22.9-xi и изотипического контроля в диапазоне от 1 до 1000 нг. Связывание J22.9-xi или изотипического контрольного антитела с нанесенным BCMA выявляли с использованием конъюгированного с пероксидазой хрена (HRP) вторичного антитела козы против антител человека (Jackson ImmunoResearch, 109-035-098, разведение 1:5000).
Микропланшеты для титрования покрывали 1 мкг/мл внеклеточного домена BCMA человека или яванского макака (hBCMA или cyBCMA, соответственно). Детекцию нанесенного BCMA проводили с использованием серийных разведений J22.9-xi, J22.9-H, J22.9-ISY и J22.9-FSY в диапазоне от 0,26 пМ до 500 нМ. Обнаружение связывания антител с нанесенным BCMA проводили с использованием конъюгированного с пероксидазой хрена (HRP) вторичного антитела козы против антител человека (Jackson ImmunoResearch, 109-035-098, разведение 1:5000).
Для эксперимента по блокированию 1 мг/мл рекомбинантного BAFF человека, слитого с His-меткой (Biomol), наносили после антител и промывания, и выявляли с использованием антитела мыши против His-метки (AbD Serotec, AD1.1.10, разведение 1:5000, конъюгированное с HRP). Во всех случаях ELISA проводили с использованием реагентов A и B BD OptEIA (BD Bioscience) и измерение проводили с использованием спектрофотометра для микропланшетов (BioTek) при 450 нм и 570 нм.
Проточно-цитометрический анализ
Для экспериментов по обнаружению антигенов клеточной поверхности использовали антитела собственного изготовления (J22.9-xi, J22.9-H, J22.9-ISY, J22.9-FSY и изотипический контроль) и коммерчески доступное антитело мыши против His-метки (AbD Serotec, AD1.1.10, разведение 1:100, конъюгированное с Alexa Fluor 488) и антитело козы против IgG1 человека (Jackson ImmunoResearch, 109-116-098, разведение 1:400, конъюгированное с PE) и рекомбинантный BAFF человека, слитый с His-меткой (Biomol). Эксперименты проводили на проточном цитометре FACSCalibur или FACSCanto II (BD Bioscience). Данные анализировали с использованием программного обеспечения Flowjo версии 7.6 (TreeStar Inc.).
Получение Fab и комплексов Fab:BCMA
(Fab)2-фрагменты получали из полноразмерного IgG J22.9-xi посредством инкубации с пепсином. J22.9-xi пропускали через колонку для замены буфера PD-10 в 50 мМ ацетате натрия, pH 3,5, и добавляли пепсин в количестве 30 мкг на миллиграмм J22.9-xi. Инкубация при 37°C в течение 2,5 часов была достаточной для полного расщепления области кристаллизующегося фрагмента (Fc), и пепсин инактивировали путем замены через колонку PD-10 на PBS (pH 7,2). Восстановление (Fab)2-фрагментов на индивидуальные Fab проводили в PBS посредством добавления 2-меркаптоэтиламина (50 мМ) в присутствии 5 мМ этилендиаминтетрауксусной кислоты (EDTA). После инкубации в течение 90 минут при 37°C, восстановленные остатки цистеина блокировали алкилированием с 500 мкМ йодацетамидом в течение 30 минут, а затем проводили замену буфера на свежий PBS. Fab-фрагменты комбинировали с 1,5 молярными эквивалентами очищенного BCMA и комплексы выделяли посредством эксклюзионной хроматографии на колонке Superdex 75 16/60. Фракции анализировали на 4-12% SDS-полиакриламидных гелях и фракции, содержавшие как Fab, так и BCMA, объединяли и концентрировали для испытаний по кристаллизации.
Кристаллизация комплексов Fab:BCMA
Концентрированные комплексы дополняли 0,5 молярных эквивалентов чистого BCMA, чтобы гарантировать насыщение, и подвергали скринингу посредством кристаллизации. Исходные условия кристаллизации Fab:BCMA идентифицировали посредством коммерческого скрининга (Qiagen) в 96-луночных планшетах в формате сидячей капли с использованием устройства для дозирования Gryphon (капли 200 нл), и оптимизировали в 24-ячеечных планшетах в висячих каплях (2-3 мкл). Комплекс концентрировали до 8 мг/мл и кристаллизовали в 21% PEG 3350, 0,1 M BisTris pH 6,5 и 5 мМ CuCl2 при 20°C. Кристаллы появлялись через трое суток в качестве кластеров тонких пластинок и достигали их конечного размера (0,2-0,3 мм) в пределах приблизительно 7 суток. Кластеры разделяли и индивидуальные пластинки быстро замораживали в жидком азоте в маточной жидкости с 20% глицерином в качестве криопротектора. Полные данные дифракции получали для отдельного кристалла на синхротроне BESSY от Helmoltz Zentrum Berlin. Структуру определяли до разрешения 1,9 ангстрем посредством молекулярного замещения с использованием экспериментальных фаз из структуры эфализумаба (3EO9) в качестве модели поиска. Обработку данных проводили с использованием пакета программ ccp4, уточнение структуры проводили с использованием Phenix (Adams P D, et al. (2010), Acta Cryst. D66: 213-221) и построение и оценку модели проводили с использованием Coot. (Emsley et al., Acta Crystallographica Section D - Biological Crystallography, 2010, 66:486-501). Изображения получали с использованием PyMOL (The PyMOL Molecular Graphics System, Version 1.5.0.4 Schrödinger, LLC).
Анализ цитотоксичности in vitro
В этом анализе определяли цитотоксический эффект J22.9-xi путем измерения люминесцении оставшихся живых клеток в устройстве для считывания биолюминесценции. В кратком изложении: вновь полученные лейкоцитарные пленки человека (FBC) подвергали обратной промывке под действием гравитации посредством 160 мл буфера для элюирования (PBS (pH 7,4), содержащий 5 мМ Na2-EDTA и 2,5 [мас./об.] сахарозы). Мононуклеарные клетки выделяли из элюированных клеток центрифугированием в градиенте Ficoll. Мононуклеарные клетки из интерфазы отбирали и промывали два раза буфером для элюирования. После лизиса эритроцитов PBMC вновь промывали, подсчитывали и доводили путем разведения в RPMI/10% FCS без фенолового красного до 1×107 клеток/мл. В микропланшеты для титрования высевали 5×104 клеток MM.1S-Luc в 50 мкл RPMI. За десять минут до добавления 100 мкл PBMC, клетки MM.1S-Luc инкубировали с серийными разведениями J22.9-xi или изотипического контрольного антитела в объеме образца 200 мкл. После добавления клеток-мишеней, антител и эффекторных клеток, микропланшеты для титрования центрифугировали (300×g) в течение 2 минут при комнатной температуре (к.т.) и хранили при 37°C с 5% CO2. Контрольные лунки обрабатывали 1% Triton X вместо антитела для завершения лизиса. После инкубации в течение 4 часов в каждую лунку добавляли 25 мкл PBS с люциферином (250 нг/мл), и биолюминесценцию живых клеток измеряли в устройстве для считывания биолюминесценции (Tecan). Удельную цитотоксичность вычисляли по следующей формуле:
100 - [величина (J22.9-xi) - величина (общий лизис)]/[величина (изотипический контроль) - величина (общий лизис)]×100.
Исследования in vivo
Использовали мышей NOD.Cg-Prkdcscid Il2rgtm1Wjl Tg(CSF2)2Ygy Tg(IL3)1Ygy Tg(KITLG)3YgyJGckRolyJ (NSG) из The Jackson Laboratory и мышей CB17.Cg-Prkdcscid Lystbg/Crl из Charles River Deutschland (Sulzfeld, Германия). Эксперименты проводили на мышах в возрасте 8-14 недель. Все исследования на животных проводили согласно руководствам учреждения и штата в специальных условиях без патогенов. В экспериментальных примерах, связанных с лечением развившихся опухолей и лечением опухоли на ранней фазе заболевания, использовали мышей CB17.Cg-Prkdcscid Lystbg/Crl. Фенотип двух линий мышей, упомянутых в настоящем описании, является в высокой степени сходным. Животные не имеют функциональных B-, T- и NK-клеток. Несколько более медленный рост опухоли наблюдали у мышей CB17.Cg, что указывает на еще более перспективный эффект терапевтического антитела по настоящему изобретению.
Модель множественной миеломы с ксенотрансплантатом индуцировали посредством внутривенной инъекции 1×107 клеток MM.1S-Luc в хвостовую вену на нулевые сутки. В этой модели у животных без лечения развивается паралич задних конечностей в пределах 6 недель. Возникновение этого симптома указывает на конечную точку эксперимента.
Для исследований эффективности антитела вводили внутрибрюшинно (в.б.) два раза в неделю или в течение 5 последовательных суток, начиная на нулевые сутки. Антитело J22.9-xi вводили в дозах 2 мкг, 20 мкг или 200 мкг на инъекцию; для изотипического контрольного антитела использовали 200 мкг/инъекция. Биолюминесценцию клеток MM.1S-Luc измеряли после в/б инъекции 150 мкг люциферина с использованием IVIS Spectrum (Caliper Life Sciences). Измерения проводили каждую неделю. В каждый момент времени 3 контрольным мышам без введения также вводили люциферин. Общие величины потока у этих животных либо вычитали из каждого результата измерения, либо они представлены на графиках.
Для лечения развившихся опухолей терапию антителом начинали через 5 суток после инъекции клеток MM.1S-Luc. 200 мкг J22.9-xi или изотипического контрольного антитела вводили два раза в неделю в течение периода 6 недель.
Гуманизация J22.9-xi
Последовательности вариабельных областей тяжелой и легкой цепей (мыши) выравнивали с соответствующими последовательностями вариабельных областей тяжелой и легкой цепей подтипов человека для определения того, какие изменения остатков требовались для получения полностью гуманизированного варианта последовательности. С использованием кристаллической структуры комплекса J22.9-xi:hBCMA каждую модификацию сначала оценивали in silico для идентификации мутаций, которые могли потенциально нарушить связывание антитела с BCMA. Синтезировали два полных гена вариабельной области J22.9 для каждой цепи, один с исходной последовательностью мыши и один с полностью гуманизированной последовательностью (т.е. содержащей все из необходимых гуманизирующих мутаций) с двумя добавленными участками ферментов рестрикции для разделения генов на три кассеты каждый. После маркировки потенциально проблематичных мутаций получали различные комбинации исходных кассет генов мыши и полностью гуманизированных кассет генов и их соответствующие IgG экспрессировали, очищали и подвергали FACS-анализу с положительными по BCMA клетками для оценки связывания. В маркированные проблематичные остатки вносили мутации индивидуально с использованием ПЦР для проверки их эффекта на аффинность BCMA, а затем конечные оптимизированные конструкции количественно оценивали в отношении связывания с BCMA как человека, так и яванского макака, посредством SPR.
SPR
SPR проводили на ProteonXPR36 с использованием фосфатно-солевого буфера, дополненного 0,005% Tween-20 (PBST). Целый IgG в концентрации 15 мкг/мл иммобилизовывали на сенсорном чипе Proteon GLH с использованием стандартной химии аминов согласно инструкциям изготовителя. Для экспериментов по связыванию в качестве подвижной фазы использовали BCMA человека или яванского макака в PBST. Аффинность связывания (Kd) вычисляли из констант ассоциации (kon) и диссоциации (koff), определенных параллельно, при множестве концентраций BCMA (в диапазоне от 0,4 до 800 нМ для hBCMA и от 2,7 нМ до 1 мкМ для cynoBCMA), что предполагает модель одного участка связывания.
Кроме того, дальнейшее экспериментирование демонстрирует, что предпочтительные варианты осуществления изобретения обеспечивают удивительные и неожиданные эффекты, тем самым решая проблему изобретения неочевидным образом.
Ссылки
Adams, P.D., Afonine, P.V., Bunkoczi, G., Chen, V.B., Davis, I.W., Echols, N., Headd, J.J., Hung, L.W., Kapral, G.J., Grosse-Kunstleve, R.W., et al. (2010). PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallogr D Biol Crystallogr 66, 213-221.
Al-Lazikani, B., Lesk, A.M., and Chothia, C. (1997). Standard conformations for the canonical structures of immunoglobulins. J Mol Biol 273, 927-948.
Anthony, R.M., and Ravetch, J.V. (2010). A novel role for the IgG Fc glycan: the anti-inflammatory activity of sialylated IgG Fcs. J Clin Immunol 30 Suppl 1, S9-14.
Chan et al. (2010) Nat Rev Immunol 10:301-316
Chavez-Galan, L., Arenas-Del Angel, M.C., Zenteno, E., Chavez, R., and Lascurain, R. (2009). Cell death mechanisms induced by cytotoxic lymphocytes. Cell Mol Immunol 6, 15-25.
Chiu, A., Xu, W., He, B., Dillon, S.R., Gross, J.A., Sievers, E., Qiao, X., Santini, P., Hyjek, E., Lee, J.W., et al. (2007). Hodgkin lymphoma cells express TACI and BCMA receptors and generate survival and proliferation signals in response to BAFF and APRIL. Blood 109, 729-739.
Gordon, N.C., Pan, B., Hymowitz, S.G., Yin, J., Kelley, R.F., Cochran, A.G., Yan, M., Dixit, V.M., Fairbrother, W.J., and Starovasnik, M.A. (2003). BAFF/BLyS receptor 3 comprises a minimal TNF receptor-like module that encodes a highly focused ligand-binding site. Biochemistry 42, 5977-5983.
Greenstein, S., Krett, N.L., Kurosawa, Y., Ma, C., Chauhan, D., Hideshima, T., Anderson, K.C., and Rosen, S.T. (2003). Characterization of the MM.1 human multiple myeloma (MM) cell lines: a model system to elucidate the characteristics, behavior, and signaling of steroid-sensitive and -resistant MM cells. Exp Hematol 31, 271-282.
Jacobi, A.M., Huang, W., Wang, T., Freimuth, W., Sanz, I., Furie, R., Mackay, M., Aranow, C., Diamond, B., and Davidson, A. (2010). Effect of long-term belimumab treatment on B cells in systemic lupus erythematosus: extension of a phase II, double-blind, placebo-controlled, dose-ranging study. Arthritis Rheum 62, 201-210.
Kapoor, P., Ramakrishnan, V., and Rajkumar, S.V. (2012). Bortezomib combination therapy in multiple myeloma. Semin Hematol 49, 228-242.
Keyser, F.D. (2011). Choice of Biologic Therapy for Patients with Rheumatoid Arthritis: The Infection Perspective. Curr Rheumatol Rev 7, 77-87.
Laskowski, R.A. (2009). PDBsum new things. Nucleic Acids Res 37, D355-359.
Mackay, F., Schneider, P., Rennert, P., and Browning, J. (2003). BAFF AND APRIL: a tutorial on B cell survival. Annu Rev Immunol 21, 231-264.
Nimmerjahn, F., and Ravetch, J.V. (2008). Fcgamma receptors as regulators of immune responses. Nat Rev Immunol 8, 34-47.
Novak, A.J., Darce, J.R., Arendt, B.K., Harder, B., Henderson, K., Kindsvogel, W., Gross, J.A., Greipp, P.R., and Jelinek, D.F. (2004). Expression of BCMA, TACI, and BAFF-R in multiple myeloma: a mechanism for growth and survival. Blood 103, 689-694.
Queen et al., 1989; WO 90/07861
Patel, D.R., Wallweber, H.J., Yin, J., Shriver, S.K., Marsters, S.A., Gordon, N.C., Starovasnik, M.A., and Kelley, R.F. (2004). Engineering an APRIL-specific B cell maturation antigen. J Biol Chem 279, 16727-16735.
Presta, L.G. (2008). Molecular engineering and design of therapeutic antibodies. Curr Opin Immunol 20, 460-470.
Raab, M.S., Podar, K., Breitkreutz, I., Richardson, P.G., and Anderson, K.C. (2009). Multiple myeloma. Lancet 374, 324-339.
Richardson et al. (2003) New Engl J Med 348:2609-2617.
Ryan et al (Molecular Cancer Therapeutics, 2007 6(11), 3009)
Roopenian, D.C., and Akilesh, S. (2007). FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 7, 715-725.
Suzuki, K. (2013). Current therapeutic strategy for multiple myeloma. Jpn J Clin Oncol 43, 116-124.
Thorpe et al., 1982, Immunol. Rev. 62:119-58
Wang, S.Y., and Weiner, G. (2008). Complement and cellular cytotoxicity in antibody therapy of cancer. Expert Opin Biol Ther 8, 759-768.
Woyke et al. (2001 ) Antimicrob. Agents and Chemother. 45(12):3580-3584.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MAX-DELBRUECK-CENTRUM
<120> ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ CD269 (BCMA)
<130> XII 2136/14WO
<160> 43
<170> PatentIn version 3.5
<210> 1
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 1
Gln Val Gln Leu Gln Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Ile Asp Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 2
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 3
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (34)..(34)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (54)..(55)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (101)..(101)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (107)..(107)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 4
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Xaa Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Xaa Xaa Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Xaa Asp Tyr Gly Asp Ala Xaa Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 5
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (33)..(33)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (35)..(35)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (47)..(47)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (50)..(50)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (99)..(101)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (106)..(106)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Xaa Met Xaa Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Xaa Val
35 40 45
Gly Xaa Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Xaa Xaa Xaa Asp Tyr Gly Asp Xaa Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 6
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 6
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Asn Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 7
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Phe Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Asn Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Ser Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Phe Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Ser Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 10
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 10
Asp Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Val Gly
1 5 10 15
Asp Glu Val Thr Leu Thr Cys Lys Ala Ser Gln Ser Val Asp Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Asp Asp Leu Arg Phe Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 11
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 11
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Leu Arg Phe Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 12
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (30)..(31)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 12
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Xaa Xaa Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Leu Arg Phe Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 13
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (31)..(32)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (34)..(34)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (36)..(36)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (49)..(50)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (52)..(53)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (66)..(67)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (89)..(89)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (91)..(91)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (94)..(94)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (96)..(96)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 13
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Xaa Xaa
20 25 30
Val Xaa Trp Xaa Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile
35 40 45
Xaa Xaa Ala Xaa Xaa Arg Xaa Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Xaa Xaa Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Xaa Gln Xaa Asn Asn Xaa Pro Xaa
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 14
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 14
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Glu Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Leu Arg Phe Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 15
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 15
Arg Tyr Trp Xaa Ser
1 5
<210> 16
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (5)..(6)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 16
Glu Ile Asn Pro Xaa Xaa Ser Thr Ile Asn Tyr Ala Pro Ser Leu Lys
1 5 10 15
Asp Lys
<210> 17
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (10)..(10)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 17
Ser Leu Tyr Xaa Asp Tyr Gly Asp Ala Xaa Asp Tyr Trp
1 5 10
<210> 18
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 18
Arg Tyr Trp Ile Ser
1 5
<210> 19
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 19
Arg Tyr Trp Phe Ser
1 5
<210> 20
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 20
Glu Ile Asn Pro Asn Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu Lys
1 5 10 15
Asp Lys
<210> 21
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 21
Glu Ile Asn Pro Ser Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu Lys
1 5 10 15
Asp Lys
<210> 22
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 22
Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp
1 5 10
<210> 23
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (7)..(8)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 23
Lys Ala Ser Gln Ser Val Xaa Xaa Asn Val Ala
1 5 10
<210> 24
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 24
Ser Ala Ser Leu Arg Phe Ser
1 5
<210> 25
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 25
Gln Gln Tyr Asn Asn Tyr Pro Leu Thr Phe Gly
1 5 10
<210> 26
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 26
Lys Ala Ser Gln Ser Val Asp Ser Asn Val Ala
1 5 10
<210> 27
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 28
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Phe Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Ser Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 29
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Gly Glu Ile Asn Pro Ser Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Asp Lys Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 30
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 30
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Leu Arg Phe Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 31
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 31
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Glu Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Leu Arg Phe Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 32
<211> 1450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кодирующая последовательность Ab
<400> 32
gaattccacc atgggatggt catgtatcat cctttttcta gtagcaactg caaccggtgt 60
ccacagtgaa gtgcagctgg tcgaatctgg aggaggcctg gttcagcctg gtggcagcct 120
taggctctct tgtgcagcct ctggctttac cttctcacgg tattggatga gctgggtgag 180
acaggctcca gggaaaggtc tggtgtgggt aggggagata aaccccgata gcagcacgat 240
caactatgct ccgtcactga aagacaagtt caccatttcc cgcgataatg ccaagaacac 300
tctctacttg cagatgaatt cccttcgagc cgaggataca gcggtgtact actgcgccag 360
tctgtactac gactatgggg acgcaatgga ctattgggga caaggcacac tggtgactgt 420
tagctccgcg tcgaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac 480
ctctgggggc acagcggccc tgggctgcct ggtcaaggac tacttccccg aacctgtgac 540
ggtctcgtgg aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca 600
gtcctcagga ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac 660
ccagacctac atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagagagt 720
tgagcccaaa tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct 780
ggggggaccg tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg 840
gacccctgag gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt 900
caactggtac gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca 960
gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa 1020
tggcaaggag tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac 1080
catctccaaa gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg 1140
ggaggagatg accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag 1200
cgacatcgcc gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc 1260
tcccgtgctg gactccgacg gctccttctt cctctatagc aagctcaccg tggacaagag 1320
caggtggcag caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca 1380
ctacacgcag aagagcctct ccctgtcccc gggtaaatga gtgcgacggc cgggcggcgg 1440
cggcggatcc 1450
<210> 33
<211> 1450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кодирующая последовательность Ab
<400> 33
gaattccacc atgggatggt catgtatcat cctttttcta gtagcaactg caaccggtgt 60
ccacagtgaa gtgcagctgg tcgaatctgg aggaggcctg gttcagcctg gtggcagcct 120
taggctctct tgtgcagcct ctggctttac cttctcacgg tattggttca gctgggtgag 180
acaggctcca gggaaaggtc tggtgtgggt aggggagata aaccccagca gcagcacgat 240
caactatgct ccgtcactga aagacaagtt caccatttcc cgcgataatg ccaagaacac 300
tctctacttg cagatgaatt cccttcgagc cgaggataca gcggtgtact actgcgccag 360
tctgtactac gactatgggg acgcatacga ctattgggga caaggcacac tggtgactgt 420
tagctccgcg tcgaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac 480
ctctgggggc acagcggccc tgggctgcct ggtcaaggac tacttccccg aacctgtgac 540
ggtctcgtgg aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca 600
gtcctcagga ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac 660
ccagacctac atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagagagt 720
tgagcccaaa tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct 780
ggggggaccg tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg 840
gacccctgag gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt 900
caactggtac gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca 960
gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa 1020
tggcaaggag tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac 1080
catctccaaa gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg 1140
ggaggagatg accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag 1200
cgacatcgcc gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc 1260
tcccgtgctg gactccgacg gctccttctt cctctatagc aagctcaccg tggacaagag 1320
caggtggcag caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca 1380
ctacacgcag aagagcctct ccctgtcccc gggtaaatga gtgcgacggc cgggcggcgg 1440
cggcggatcc 1450
<210> 34
<211> 1450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Кодирующая последовательность Ab
<400> 34
gaattccacc atgggatggt catgtatcat cctttttcta gtagcaactg caaccggtgt 60
ccacagtgaa gtgcagctgg tcgaatctgg aggaggcctg gttcagcctg gtggcagcct 120
taggctctct tgtgcagcct ctggctttac cttctcacgg tattggatca gctgggtgag 180
acaggctcca gggaaaggtc tggtgtgggt aggggagata aaccccagca gcagcacgat 240
caactatgct ccgtcactga aagacaagtt caccatttcc cgcgataatg ccaagaacac 300
tctctacttg cagatgaatt cccttcgagc cgaggataca gcggtgtact actgcgccag 360
tctgtactac gactatgggg acgcatacga ctattgggga caaggcacac tggtgactgt 420
tagctccgcg tcgaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac 480
ctctgggggc acagcggccc tgggctgcct ggtcaaggac tacttccccg aacctgtgac 540
ggtctcgtgg aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca 600
gtcctcagga ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac 660
ccagacctac atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagagagt 720
tgagcccaaa tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct 780
ggggggaccg tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg 840
gacccctgag gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt 900
caactggtac gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca 960
gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa 1020
tggcaaggag tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac 1080
catctccaaa gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg 1140
ggaggagatg accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag 1200
cgacatcgcc gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc 1260
tcccgtgctg gactccgacg gctccttctt cctctatagc aagctcaccg tggacaagag 1320
caggtggcag caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca 1380
ctacacgcag aagagcctct ccctgtcccc gggtaaatga gtgcgacggc cgggcggcgg 1440
cggcggatcc 1450
<210> 35
<211> 718
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 35
gaattccacc atgggatggt catgtatcat cctttttcta gtagcaactg caaccggtgt 60
acactccgag atcgtgatga cccagtctcc tgctaccctg agcgtttctc ccggtgaaag 120
ggccacactc agctgcaaag cctctcaaag cgtggacagc aatgtcgcct ggtatcagca 180
gaaacctggc caagctccga gagcactgat ctattccgcg tcattgcgct tttccggcat 240
accagcacgg tttagtggct cagggagtgg gactgagttc actctgacga ttagctccct 300
tcagtcagag gatttcgccg tgtactactg tcagcagtac aacaactatc ccctcacatt 360
cggagctgga accaagctgg aactgaagcg tacggtggct gcaccatctg tcttcatctt 420
cccgccatct gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc tgctgaataa 480
cttctatccc agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa 540
ctcccaggag agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac 600
cctgacgctg agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca 660
tcagggcctg agctcgcccg tcacaaagag cttcaacagg ggagagtgtt agggatcc 718
<210> 36
<211> 718
<212> ДНК
<213> Искусственная последовательность
<220>
<223> AB
<400> 36
gaattccacc atgggatggt catgtatcat cctttttcta gtagcaactg caaccggtgt 60
acactccgag atcgtgatga cccagtctcc tgctaccctg agcgtttctc ccggtgaaag 120
ggccacactc agctgcaaag cctctcaaag cgtggagagc aatgtcgcct ggtatcagca 180
gaaacctggc caagctccga gagcactgat ctattccgcg tcattgcgct tttccggcat 240
accagcacgg tttagtggct cagggagtgg gactgagttc actctgacga ttagctccct 300
tcagtcagag gatttcgccg tgtactactg tcagcagtac aacaactatc ccctcacatt 360
cggagctgga accaagctgg aactgaagcg tacggtggct gcaccatctg tcttcatctt 420
cccgccatct gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc tgctgaataa 480
cttctatccc agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa 540
ctcccaggag agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac 600
cctgacgctg agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca 660
tcagggcctg agctcgcccg tcacaaagag cttcaacagg ggagagtgtt agggatcc 718
<210> 37
<211> 285
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HIS-МЕТКА
<400> 37
Met Ser Pro Ile Leu Gly Tyr Trp Lys Ile Lys Gly Leu Val Gln Pro
1 5 10 15
Thr Arg Leu Leu Leu Glu Tyr Leu Glu Glu Lys Tyr Glu Glu His Leu
20 25 30
Tyr Glu Arg Asp Glu Gly Asp Lys Trp Arg Asn Lys Lys Phe Glu Leu
35 40 45
Gly Leu Glu Phe Pro Asn Leu Pro Tyr Tyr Ile Asp Gly Asp Val Lys
50 55 60
Leu Thr Gln Ser Met Ala Ile Ile Arg Tyr Ile Ala Asp Lys His Asn
65 70 75 80
Met Leu Gly Gly Cys Pro Lys Glu Arg Ala Glu Ile Ser Met Leu Glu
85 90 95
Gly Ala Val Leu Asp Ile Arg Tyr Gly Val Ser Arg Ile Ala Tyr Ser
100 105 110
Lys Asp Phe Glu Thr Leu Lys Val Asp Phe Leu Ser Lys Leu Pro Glu
115 120 125
Met Leu Lys Met Phe Glu Asp Arg Leu Cys His Lys Thr Tyr Leu Asn
130 135 140
Gly Asp His Val Thr His Pro Asp Phe Met Leu Tyr Asp Ala Leu Asp
145 150 155 160
Val Val Leu Tyr Met Asp Pro Met Cys Leu Asp Ala Phe Pro Lys Leu
165 170 175
Val Cys Phe Lys Lys Arg Ile Glu Ala Ile Pro Gln Ile Asp Lys Tyr
180 185 190
Leu Lys Ser Ser Lys Tyr Ile Ala Trp Pro Leu Gln Gly Trp Gln Ala
195 200 205
Thr Phe Gly Gly Gly Asp His Pro Pro Lys Ser Asp Leu Val Pro Arg
210 215 220
Gly Ser Met Ala Gly Gln Cys Ser Gln Asn Glu Tyr Phe Asp Ser Leu
225 230 235 240
Leu His Ala Cys Ile Pro Cys Gln Leu Arg Cys Ser Ser Asn Thr Pro
245 250 255
Pro Leu Thr Cys Gln Arg Tyr Cys Asn Ala Ser Val Thr Asn Ser Val
260 265 270
Lys Gly Thr Asn Ala Leu Glu His His His His His His
275 280 285
<210> 38
<211> 53
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> внеклеточный домен
<400> 38
Met Ala Gly Gln Cys Ser Gln Asn Glu Tyr Phe Asp Ser Leu Leu His
1 5 10 15
Ala Cys Ile Pro Cys Gln Leu Arg Cys Ser Ser Asn Thr Pro Pro Leu
20 25 30
Thr Cys Gln Arg Tyr Cys Asn Ala Ser Val Thr Asn Ser Val Lys Gly
35 40 45
Thr Asn Ala Leu Glu
50
<210> 39
<211> 56
<212> БЕЛОК
<213> Homo sapiens
<400> 39
Met Leu Gln Met Ala Gly Gln Cys Ser Gln Asn Glu Tyr Phe Asp Ser
1 5 10 15
Leu Leu His Ala Cys Ile Pro Cys Gln Leu Arg Cys Ser Ser Asn Thr
20 25 30
Pro Pro Leu Thr Cys Gln Arg Tyr Cys Asn Ala Ser Val Thr Asn Ser
35 40 45
Val Lys Gly Thr Asn Ala Leu Glu
50 55
<210> 40
<211> 20
<212> БЕЛОК
<213> Homo sapiens
<400> 40
Tyr Phe Asp Ser Leu Leu His Ala Cys Ile Pro Cys Gln Leu Arg Cys
1 5 10 15
Ser Ser Asn Thr
20
<210> 41
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (1)..(1)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (5)..(6)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (19)..(19)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (27)..(28)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (30)..(31)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (39)..(39)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (48)..(48)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (66)..(67)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (69)..(69)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (84)..(86)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (88)..(88)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (93)..(93)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (115)..(115)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 41
Xaa Val Gln Leu Xaa Xaa Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Xaa Leu Ser Cys Ala Ala Ser Gly Xaa Xaa Phe Xaa Xaa Tyr
20 25 30
Trp Glx Ser Trp Val Arg Xaa Ala Pro Gly Lys Gly Leu Glu Trp Xaa
35 40 45
Gly Glu Ile Asn Pro Glx Ser Ser Thr Ile Asn Tyr Ala Pro Ser Leu
50 55 60
Lys Xaa Xaa Phe Xaa Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Xaa Xaa Xaa Arg Xaa Glu Asp Thr Ala Xaa Tyr Tyr Cys
85 90 95
Ala Ser Leu Tyr Tyr Asp Tyr Gly Asp Ala Glx Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Xaa Val Thr Val Ser Ser
115 120
<210> 42
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<220>
<221> дополнительный признак
<222> (8)..(13)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (18)..(18)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (20)..(21)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (41)..(41)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (43)..(43)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (46)..(46)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (49)..(49)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (51)..(52)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (63)..(63)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (77)..(77)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (83)..(83)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (85)..(85)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (87)..(87)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 42
Asp Ile Val Met Thr Gln Ser Xaa Xaa Xaa Xaa Xaa Xaa Ser Val Gly
1 5 10 15
Asp Xaa Val Xaa Xaa Thr Cys Lys Ala Ser Gln Ser Val Glu Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Xaa Gln Xaa Pro Lys Xaa Leu Ile
35 40 45
Xaa Ser Xaa Xaa Leu Arg Phe Ser Gly Val Pro Ala Arg Phe Xaa Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Xaa Leu Gln Ser
65 70 75 80
Glu Asp Xaa Ala Xaa Tyr Xaa Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 43
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Ab
<400> 43
Asp Ile Val Met Thr Gln Ser Gln Arg Phe Met Thr Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Ser Val Asp Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Arg Gln Ser Pro Lys Ala Leu Ile
35 40 45
Phe Ser Ala Ser Leu Arg Phe Ser Gly Val Pro Ala Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Leu Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-T-КЛЕТКИ | 2020 |
|
RU2762942C1 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-NK-КЛЕТКИ | 2020 |
|
RU2795443C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ К BCMA | 2015 |
|
RU2747457C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ PSMA | 2019 |
|
RU2794450C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2019 |
|
RU2747735C2 |
| Антитело к BCMA, его антигенсвязывающий фрагмент и их медицинское применение | 2020 |
|
RU2819660C2 |
| АНТИ-HLA-A2 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2782276C2 |
| СПОСОБ ОЧИСТКИ ДЛЯ УДАЛЕНИЯ ВАРИАНТОВ АНТИТЕЛ С СУЛЬФАТИРОВАНИЕМ ТИРОЗИНА; ОЧИЩЕННЫЕ КОМПОЗИЦИИ | 2017 |
|
RU2793400C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2714232C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
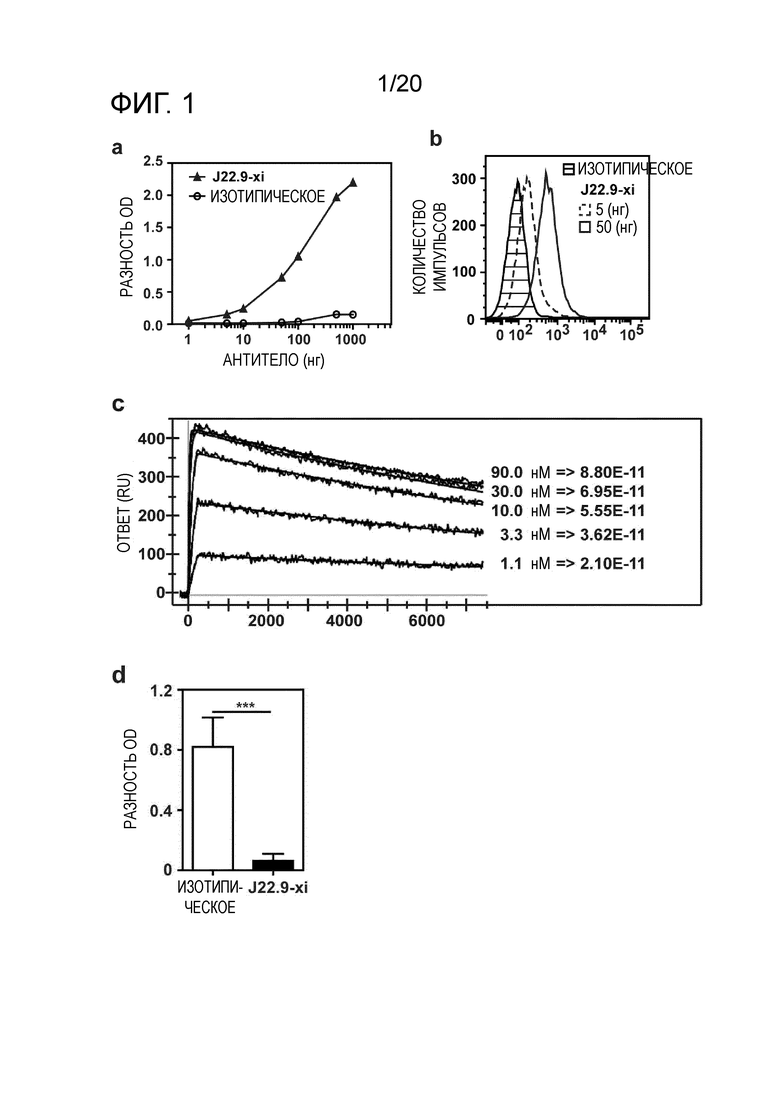
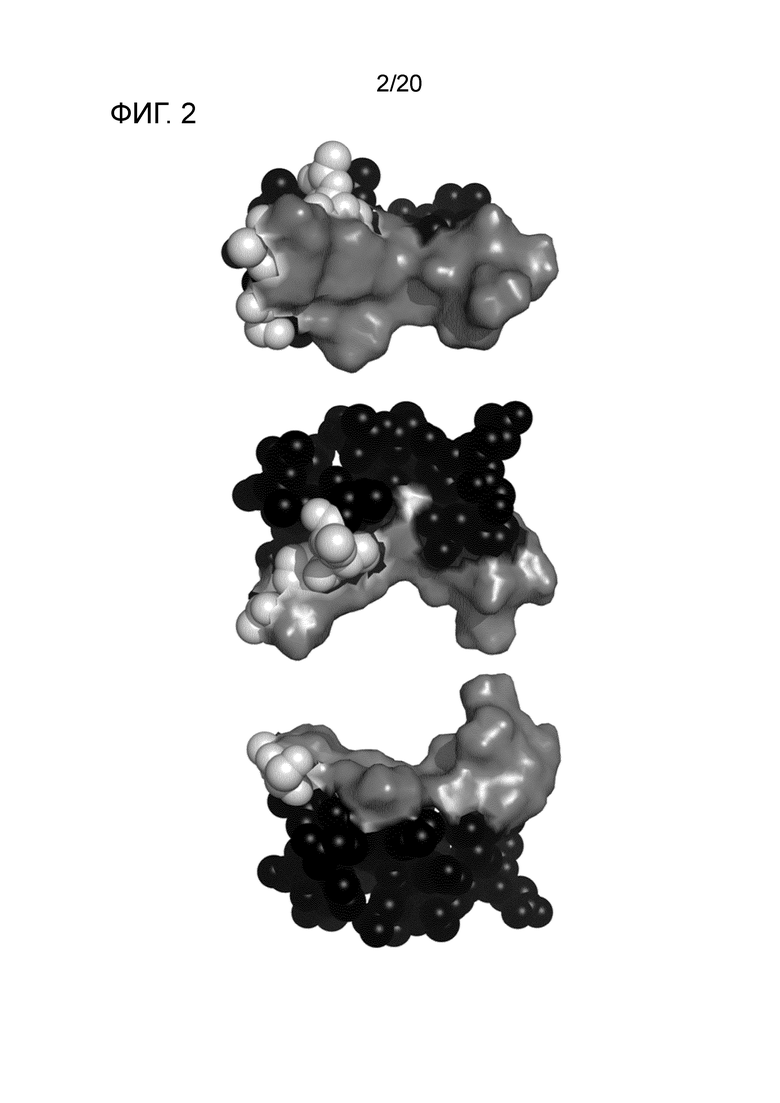

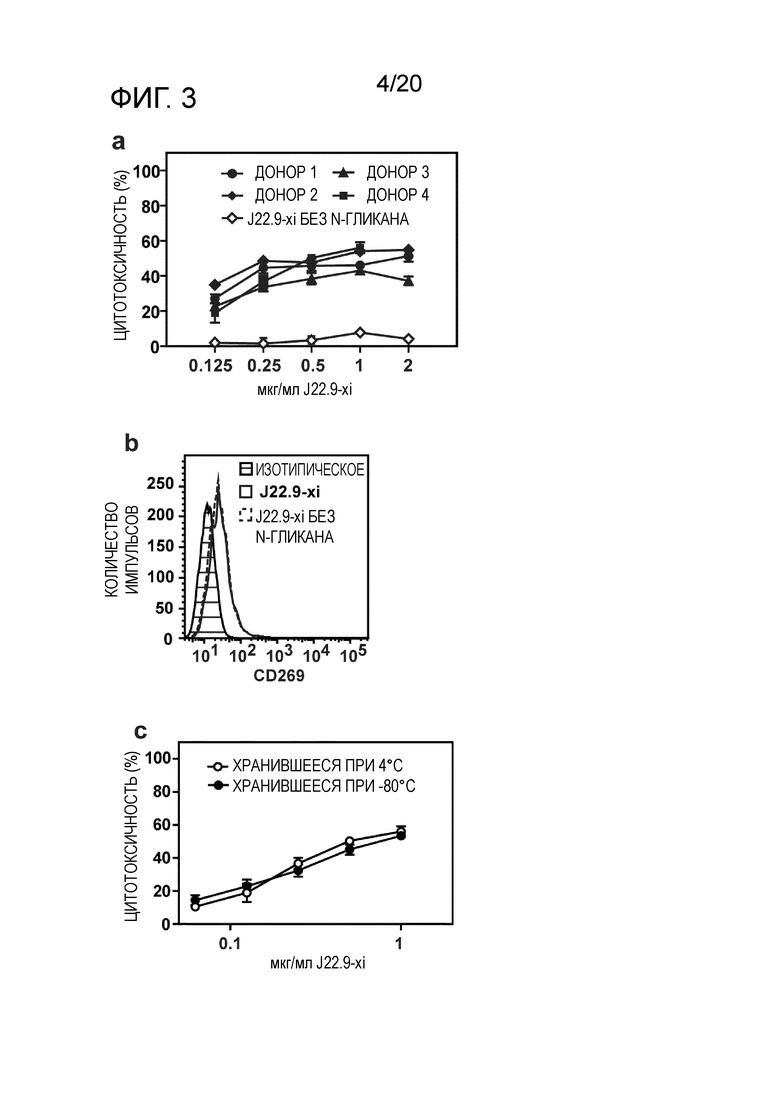
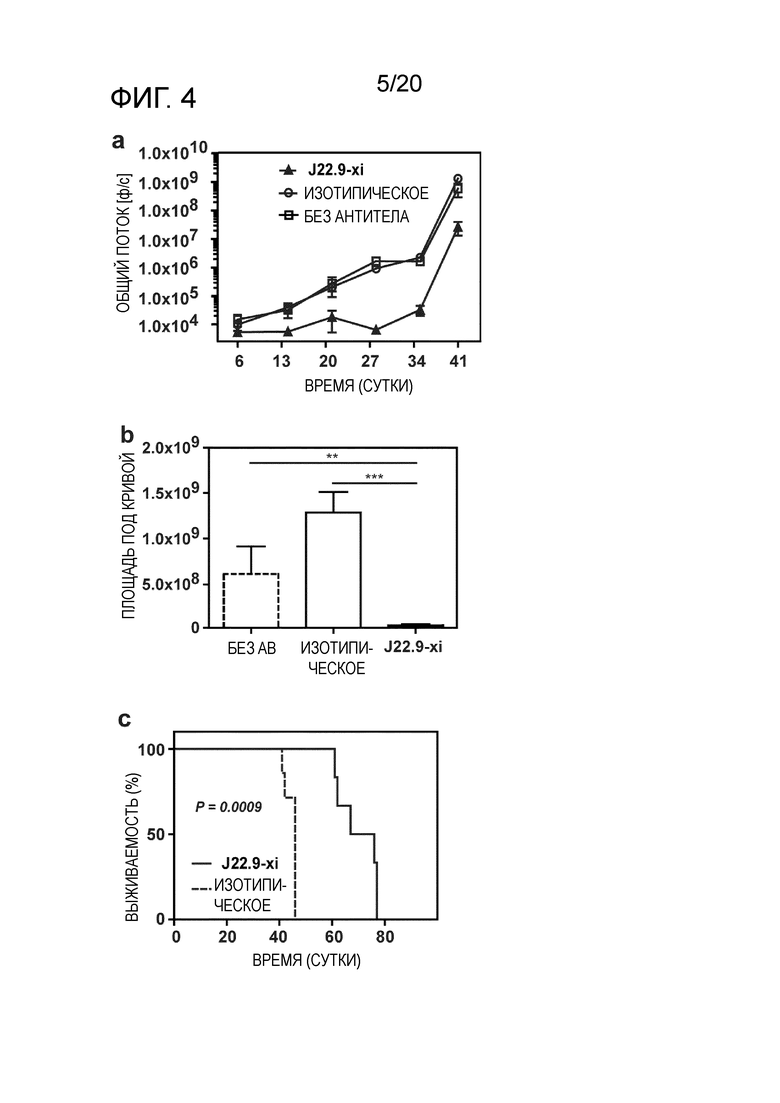
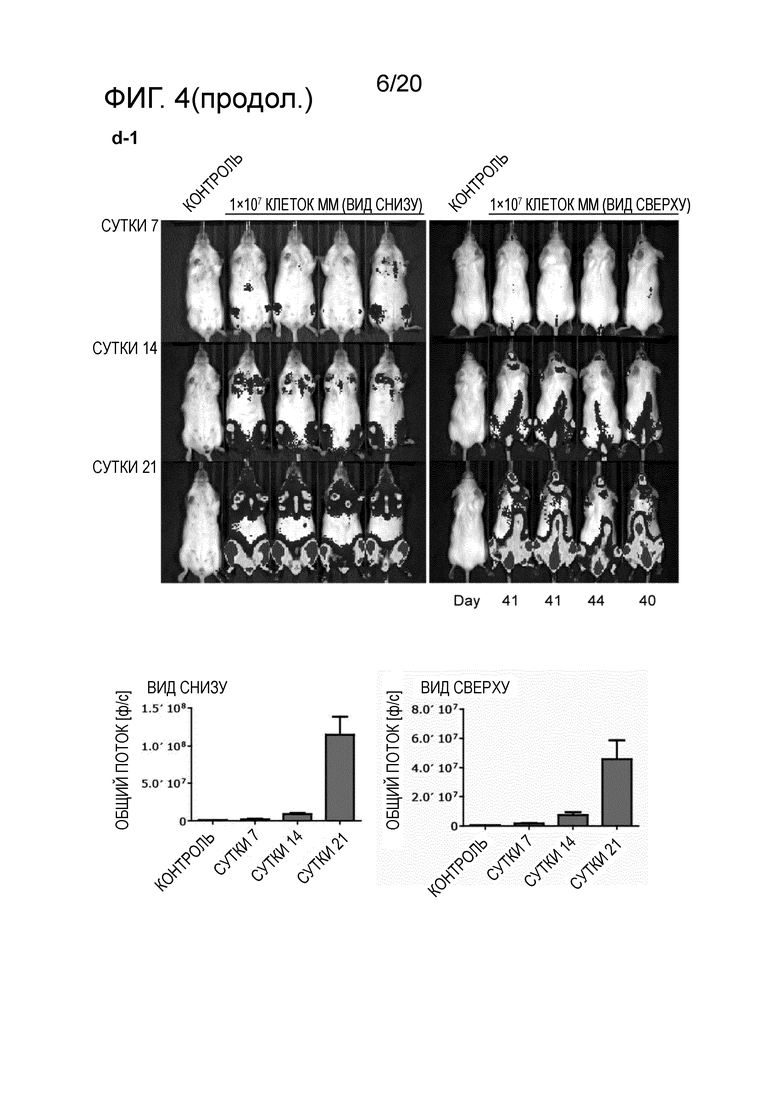
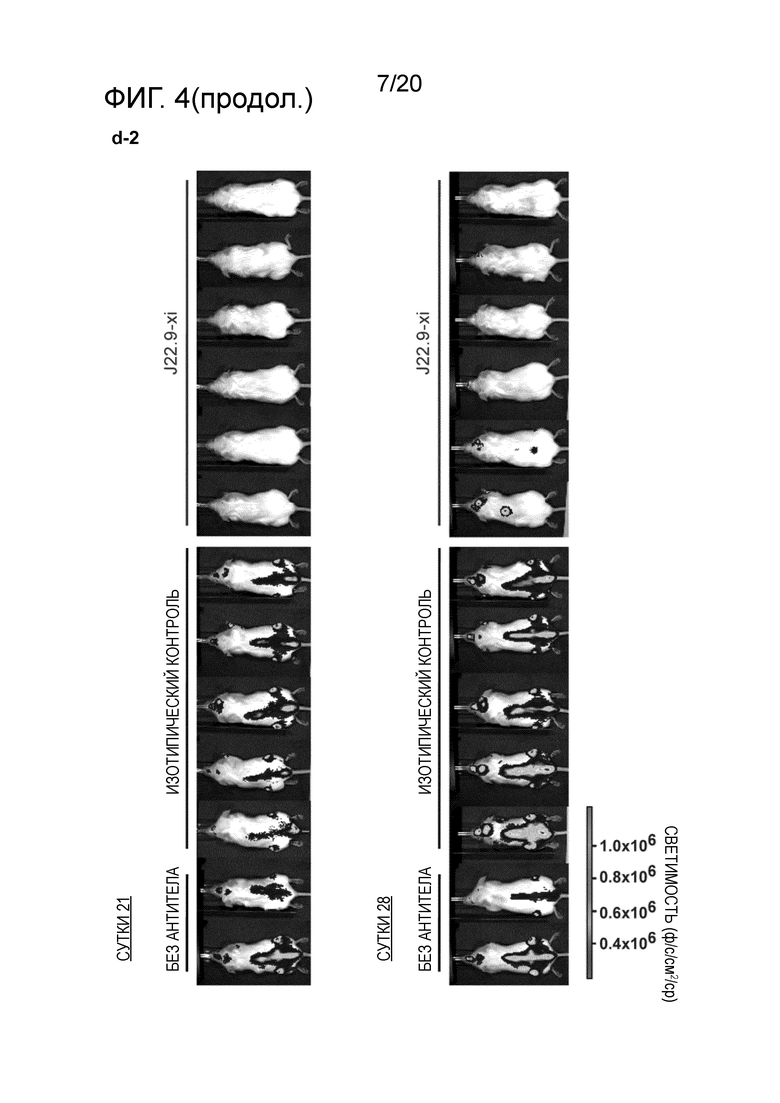
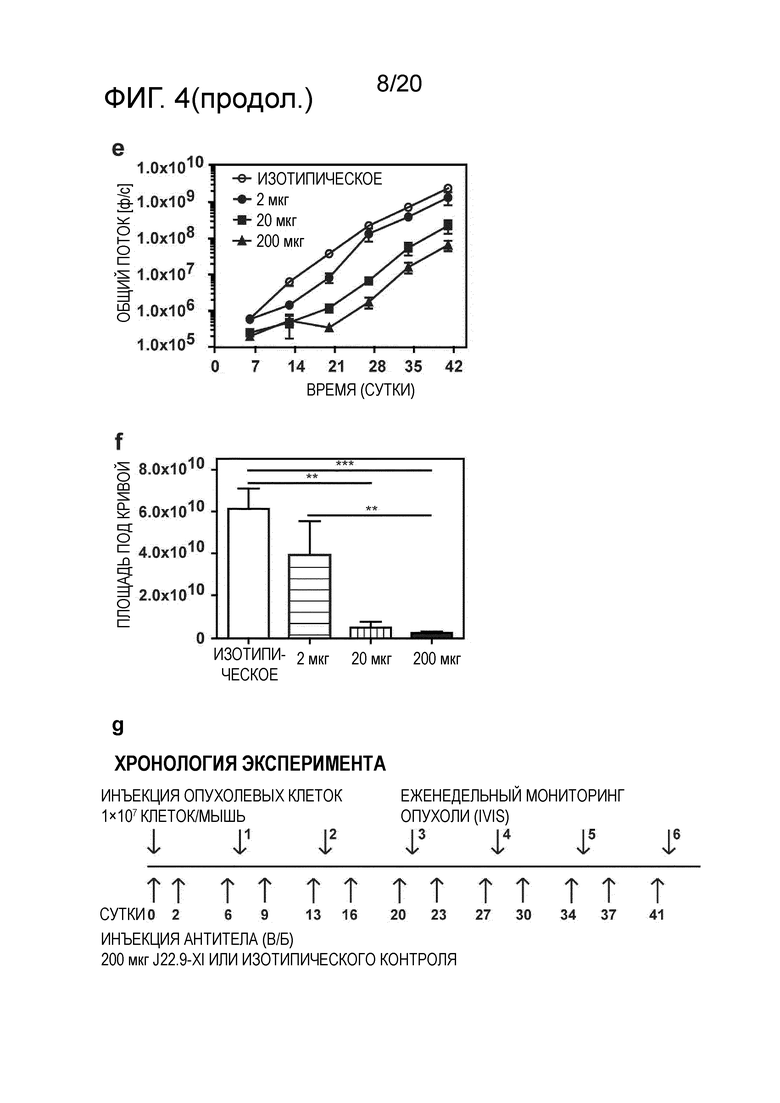
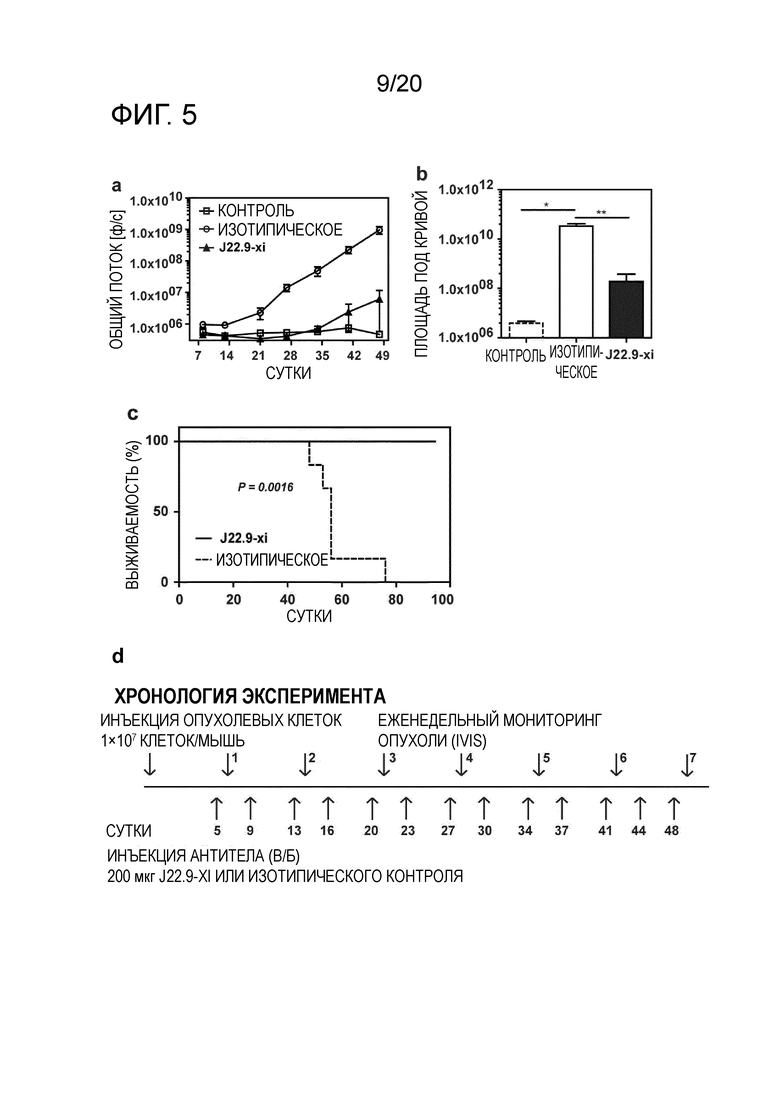



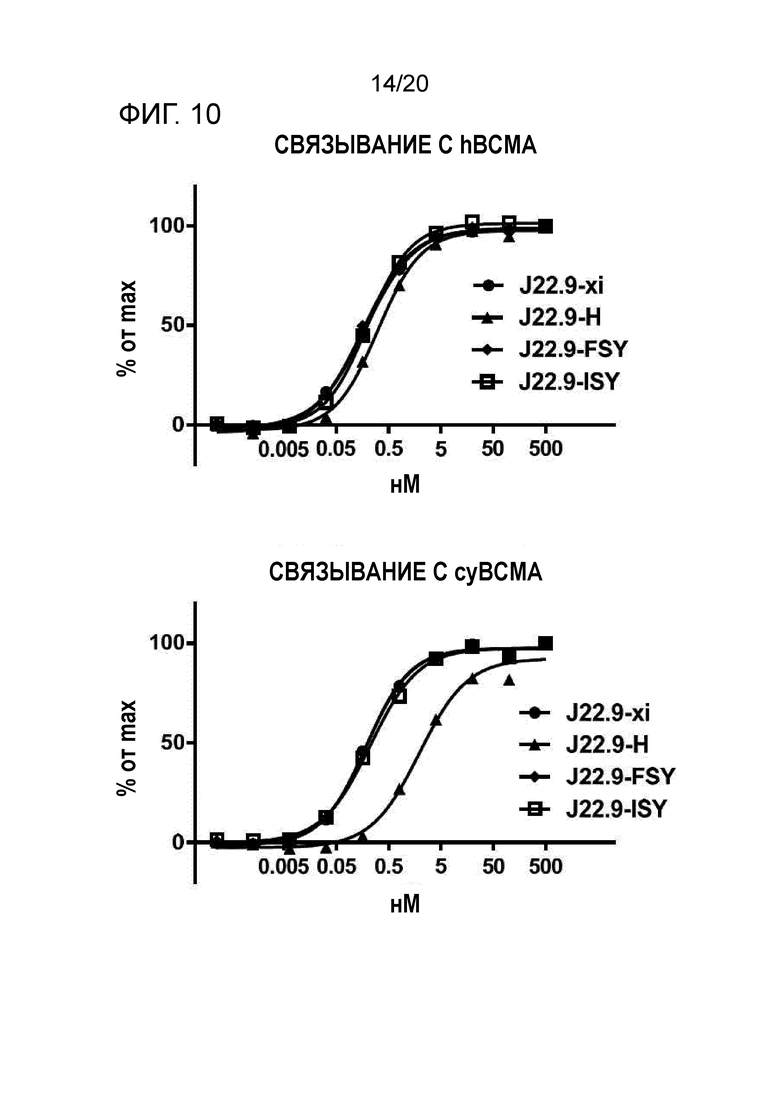
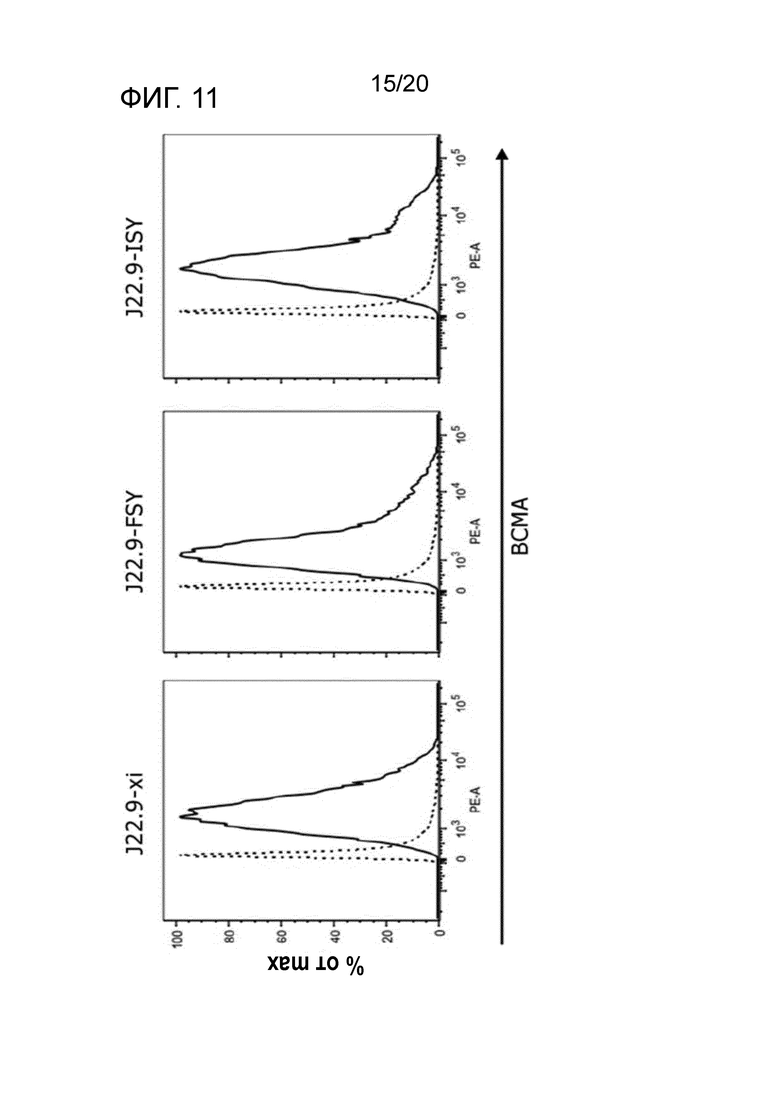
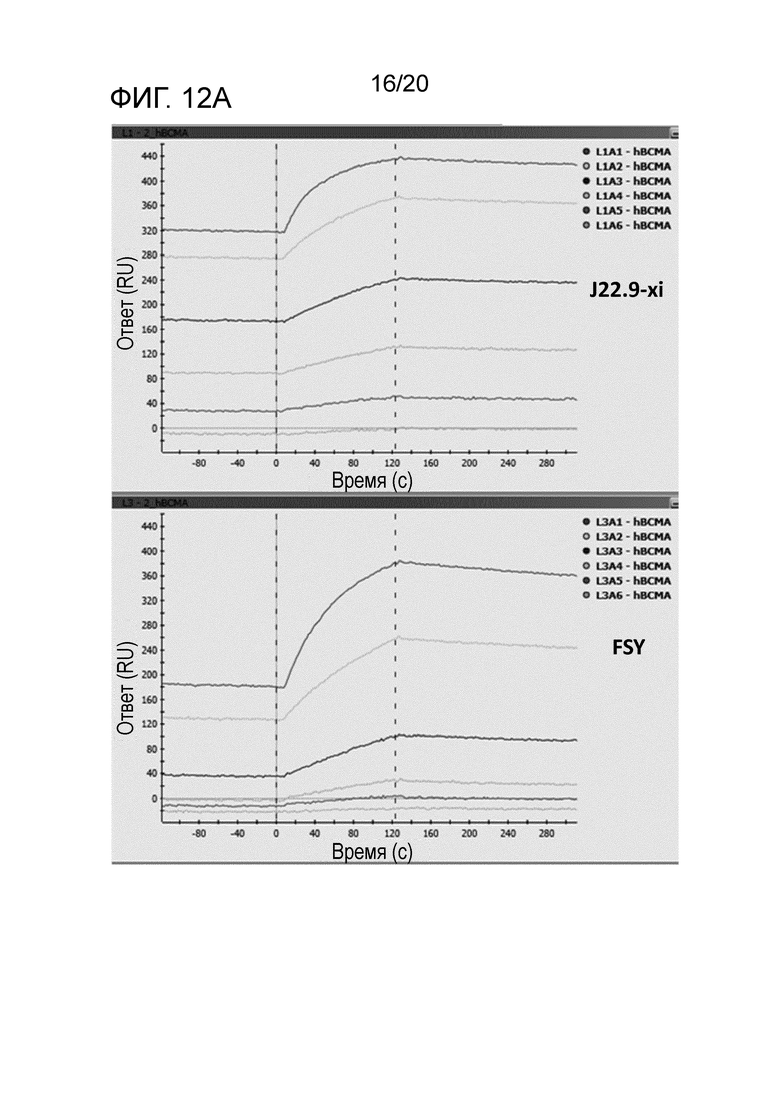
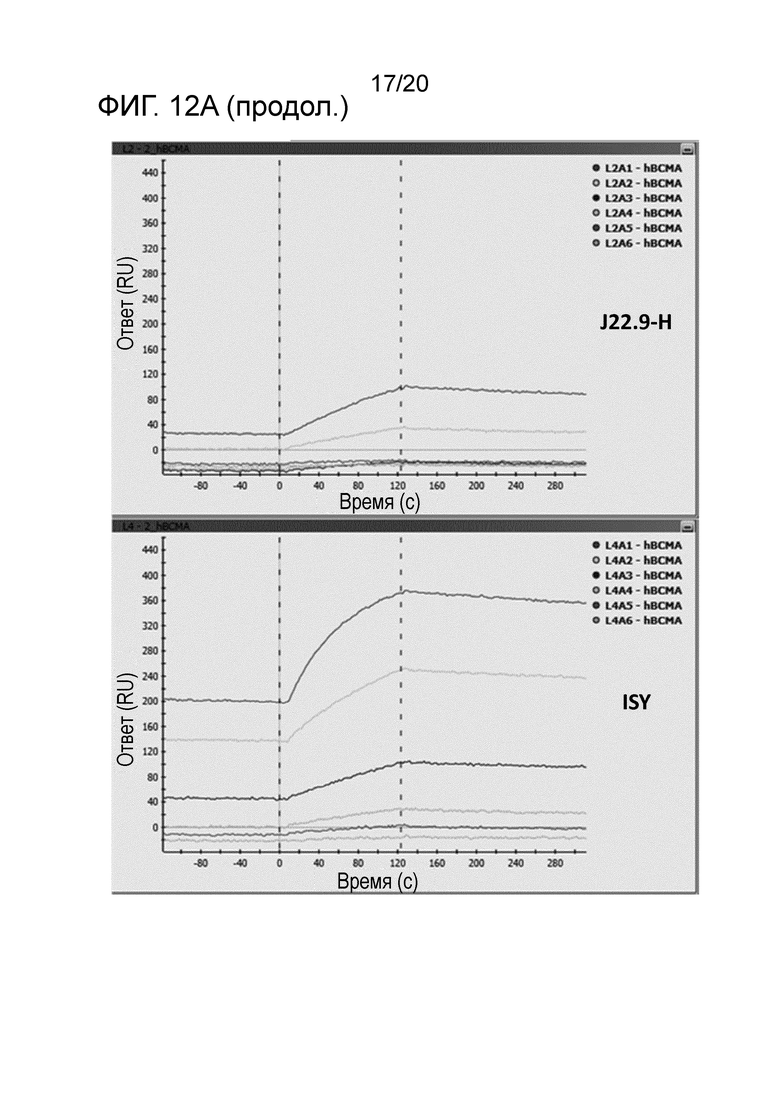

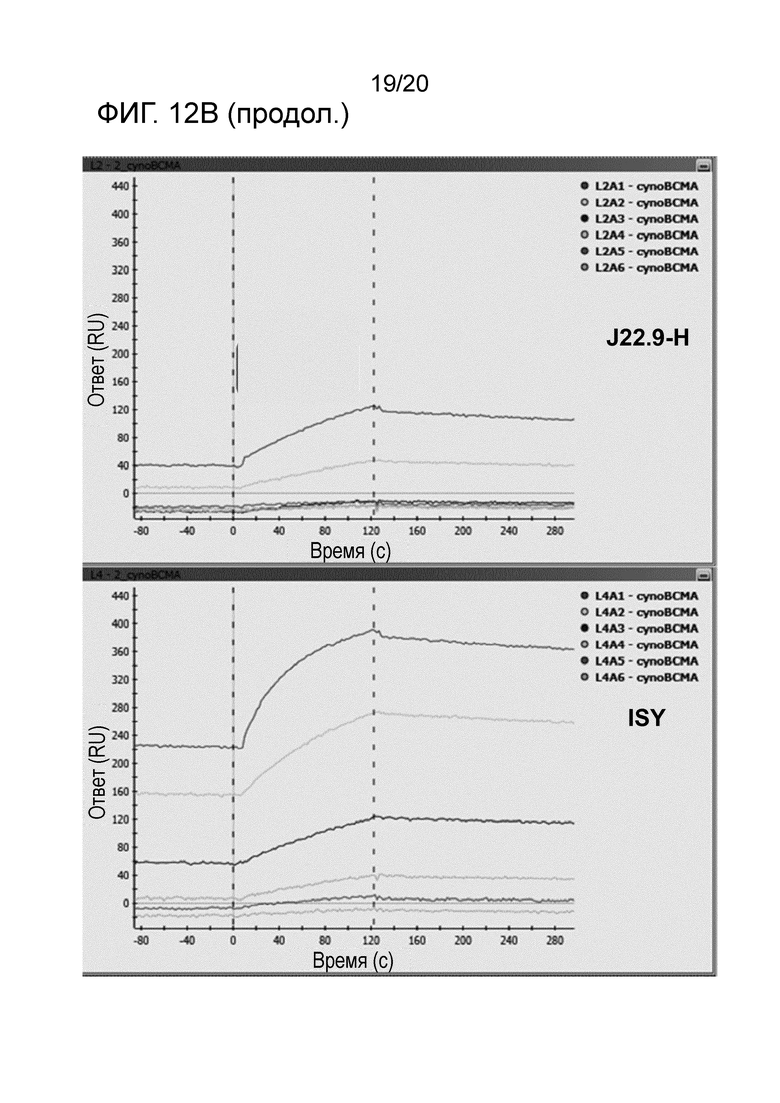

Изобретение относится к области биохимии, в частности к антителу или фрагменту антитела, специфически связывающемуся с эпитопом внеклеточного домена CD269, а также к содержащему его конъюгату и композиции. Также раскрыта молекула нуклеиновой кислоты, которая кодирует вышеуказанное антитело или его фрагмент, а также содержащая ее клетка. Изобретение эффективно в качестве лекарственного средства для лечения расстройства, связанного с наличием патогенных B-клеток. 6 н. и 17 з.п. ф-лы, 6 табл., 13 ил.
1. Антитело или фрагмент антитела, содержащий домен VH, который содержит:
- CDR1 с последовательностью RYWIS (SEQ ID NO:18) или RYWFS (SEQ ID NO:19);
- CDR2 c последовательностью EINPNSSTINYAPSLKDK (SEQ ID NO:20) или EINPSSSTINYAPSLKDK (SEQ ID NO:21); и
- CDR3 c последовательностью SLYYDYGDAYDYW (SEQ ID NO:22),
и содержащий домен VL, который содержит:
- CDR1 c последовательностью KASQSVESNVA;
- CDR2 с последовательностью SASLRFS (SEQ ID NO:24);
- CDR3 с последовательностью QQYNNYPLTFG (SEQ ID NO:25),
где указанное антитело или его фрагмент специфически связывается с эпитопом внеклеточного домена CD269 (BCMA).
2. Антитело или фрагмент антитела по п.1, содержащее домен VH, который содержит последовательность
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWX1SWVRQAPGKGLVWVGEINPX2X3STINYAP SLKDKFTISRDNAKNTLYLQMNSLRAEDTAVYYCASLYX4DYGDAX5DYWGQGTLVTVSS (SEQ ID NO:4),где X1: I или F; X2X3: SS или NS; X4: Y; и X5: Y,
и содержащее домен VL, который содержит последовательность
EIVMTQSPATLSVSPGERATLSCKASQSVX1X2NVAWYQQKPGQAPRALIYSASLRFSGIPARFS GSGSGTEFTLTISSLQSEDFAVYYCQQYNNYPLTFGAGTKLELKR (SEQ ID NO:12), где X1X2: ES.
3. Антитело или фрагмент антитела по п.1, содержащее домен VH, который содержит последовательность SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8 или SEQ ID NO:9.
4. Антитело или фрагмент антитела по п.1, содержащее домен VL, который содержит последовательность SEQ ID NO:14.
5. Антитело или фрагмент антитела по п.1, содержащее домен VH, который содержит последовательность SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8 или SEQ ID NO:9, и домен VL, который содержит последовательность SEQ ID NO:14.
6. Антитело или фрагмент антитела по п.1, содержащее домен VH, где указанный домен VH содержит последовательность
X1VQLX2X3SGGGLVQPGGSLX4LSCAASGX5X6FX7X8YWZ1SWVRX9APGKGLEWX10GEINPZ2SS TINYAPSLKX11X12FX13ISRDNAKNTLYLQMX14X15X16RX17EDTAX18YYCASLYYDYGDAZ3DY WGQGTX19VTVSS,
где X1: Q или E; X2X3: QQ, VQ или VE; X4: K или R; X5X6: ID или FT; X7: S или D; X8: R; X9: R или Q; X10: I или V; X11: D; X12: K; X13: I или T; X14X15X16: SKV или NSL; X17: S или A; X18: L или V; X19: S или L; X20: E или V; и где по меньшей мере один из Z1: I или F; Z2: N или S и/или Z3: Y; и
содержащий домен VL, где указанный домен VL содержит последовательность
X21IVMTQSX1X2X3X4X5X6SX22GX23X7X24X8X9X25CKASQSVESNVAWYQQKPX10QX11PX26X12 LIX13SX14X15LRFSGX27PARFX16GSGSGTX28FTLTISX17LQSEDX18AX19YX20CQQYNNYPLT FGAGTKLELKR,
где X1: Q или P; X2: R или A; X3: F или T; X4: M или L; X5: T или S; X6: T или V; X7: R или E; X8: S или T; X9: V или L; X10: R или G; X11: S или A; X12: A; X13: F или Y; X14: A; X15: S; X16: T или S; X17: N или S; X18: L или F; X19: E или V; X20: F или Y; X21: D или E; X22: P или V; X23: D или E; X24: V или A; X25: S или T; X26: R или K; X27: I или V; X28: E или D,
и где указанное антитело или его фрагмент специфически связывается с эпитопом внеклеточного домена CD269 (BCMA).
7. Антитело или фрагмент антитела по п.1, где домен VH содержит последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8 или SEQ ID NO:9, и домен VL содержит последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO:14.
8. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела связывается с эпитопом, состоящим из аминокислот 13, 15, 16, 17, 18, 19, 20, 22, 23, 26, 27 и 32 CD269 с последовательностью SEQ ID NO:39.
9. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело или фрагмент антитела связывается с CD269 (BCMA), нарушает взаимодействие BAFF-CD269 и/или APRIL-CD269.
10. Антитело или фрагмент антитела по любому из предшествующих пунктов, где антитело является гликозилированным.
11. Антитело или фрагмент антитела по п.10, где гликан представляет собой N-связанную олигосахаридную цепь в положении Asn297 тяжелой цепи.
12. Применение антитела или фрагмента антитела по любому из предшествующих пунктов в качестве лекарственного средства для лечения расстройства, связанного с наличием патогенных B-клеток.
13. Применение по п.12, где расстройство, связанное с наличием патогенных B-клеток, представляет собой заболевание плазматических клеток и/или B-клеток памяти.
14. Применение по п.12, где расстройство, связанное с наличием патогенных B-клеток, представляет собой злокачественную опухоль из плазматических клеток или злокачественную опухоль из B-лимфоцитов.
15. Применение по п.14, где злокачественная опухоль из плазматических клеток представляет собой множественную миелому, плазмацитому, макроглобулинемию Вальденстрема или плазмоклеточный лейкоз.
16. Применение по п.14, где злокачественная опухоль из B-лимфоцитов представляет собой болезнь Ходжкина.
17. Применение по п.12, где расстройство, связанное с наличием патогенных B-клеток, представляет собой аутоиммунное заболевание, связанное с аутореактивными плазмацитами и/или аутореактивными B-клетками памяти.
18. Применение по п.17, где аутоиммунное заболевание, связанное с аутореактивными плазмацитами и/или аутореактивными B-клетками памяти, представляет собой системную красную волчанку (SLE) или ревматоидный артрит.
19. Конъюгат анти-CD269 антитело-лекарственное средство (ADC) для лечения расстройства, связанного с экспрессирующими CD269 клетками, содержащий антитело или фрагмент антитела по любому из пп.1-11, конъюгированное с терапевтическим средством.
20. Молекула нуклеиновой кислоты, которая кодирует антитело или его фрагмент по любому из пп.1-11.
21. Клетка-хозяин для экспрессии антитела или фрагмента антитела по любому из пп.1-11, содержащая молекулу нуклеиновой кислоты по п.20.
22. Клетка-хозяин по п.21, где клетка продуцирует антитело или фрагмент антитела по любому из пп.1-11.
23. Фармацевтическая композиция для лечения расстройства, связанного с наличием патогенных B-клеток, содержащая антитело или фрагмент антитела по любому из пп.1-11, молекулу нуклеиновой кислоты по п.20, ADC по п.19 или клетку-хозяина по п.21 или 22, в терапевтически эффективном количестве, вместе с фармацевтически приемлемым носителем.
| Dissertation: Generation of an antibody targeting B cell maturation antigen for the treatment of multiple myeloma and autoimmune diseases, 16.12.2013, Berlin, p.p.49-69, 76-78 | |||
| WO2009070767 A2, 04.06.2009 | |||
| Прибор для определения вязкости жидкости | 1928 |
|
SU11449A1 |
Авторы
Даты
2021-06-03—Публикация
2015-04-30—Подача