[0001] По настоящей заявке потребуется приоритет в отношении предварительной заявки США 61/522624, поданной 11 августа 2011 года, содержимое которой включено сюда посредством ссылки во всей полноте.
УРОВЕНЬ ТЕХНИКИ
[0002] PI3K представляют собой уникальное и консервативное семейство внутриклеточных липидных киназ, фосфорилирующих 3'-OH группу фосфатидилинозитолов или фосфоинозитидов. Семейство PI3K включает 15 киназ с различными специфичностями к субстратам, паттернами экспрессии и режимами регуляции. PI3K класса I (p110α, р110β, p110δ и p110γ) обычно активируются тирозинкииазами или рецепторами, сопряженными с G-белком, образуя липидный продукт, называемый PIP3, который запускает нижележащие эффекторы, такие как лежащие на пути Akt/PDK1, mTOR, киназы семейства Tec и ГТФазы семейства Rho. PI3-K классов II и III играют ключевую роль во внутриклеточной транспортировке посредством синтеза PI(3)P и PI(3,4)P2.
[0003] mTOR является серин-треониновой киназой, родственной липидным киназам семейства PI3K. mTOR участвует в большом количестве биологических процессов, включая клеточный рост, клеточную пролиферацию, клеточную моторику и выживание. Нарушение регуляции пути mTOR отмечалось при различных видах онкологических заболеваний. mTOR является многофункциональной киназой, объединяющей фактор роста и сигналы питательных веществ для регулировки трансляции белков, захвата питательных веществ, аутофагии и функции митохондрий.
[0004] mTOR существует в двух комплексах: mTORC1 и mTORC2. mTORC1 содержит субъединицу раптор, а mTORC2 содержит риктор. Эти комплексы регулируются по-разному и обладают различной специфичностью к субстрату и чувствительностью к рапамицину. К примеру, mTORC1 фосфорилирует S6 киназу (S6K) и 4EBP1, способствуя повышению трансляции и биогенеза рибосом для облегчения клеточного роста и прогрессирования клеточного цикла. S6K также действует по обратному пути для ослабления активации PI3K/Akt. mTORC2, в общем, нечувствителен к рапамицину. mTORC2, как считается, модулирует сигнализацию фактора роста путем фосфорилирования C-терминального гидрофобного мотива ряда AGC-киназ, таких как Akt. Во множестве клеточных окружений mTORC2 необходим для фосфорилирования сайта S473 Akt.
[0005] За последнее десятилетие mTOR привлек существенное внимание по причине его участия в контроле клеточного роста и вовлеченности в заболевания человека. mTor участвует в большом количестве нарушений, включая, но не ограничиваясь перечисленным, онкологические заболевания, диабет, ожирение, сердечно-сосудистые заболевания и неврологические нарушения. Было показано, что mTOR модулирует множество фундаментальных биологических процессов, включая транскрипцию, трансляцию, аутофагию, организацию актина и биогенез рибосом путем интегрирования внутриклеточных и внеклеточных сигналов, таких как сигналы, опосредованные факторами роста, питательными веществами, уровнями энергии и клеточным стрессом.
[0006] По этой причине киназы, в частности, протеинкиназы, такие как mTor и Akt, а также липидные киназы, такие как PI3K, являются первичными целями для разработки лекарственных средств. Хотя соединения с ингибиторной активностью по отношению к подобным мишеням часто изначально исследуются на предмет активности в растворенном виде, характеристики твердой фазы, такие как полиморфизм, также важны. Полиморфные формы лекарственной субстанции, такой как ингибитор mTOR, могут иметь различные химические и физические свойства, включая точку плавления, химическую реакционную способность, удельную растворимость, скорость растворения, оптические и механические свойства, давление пара и плотность. Эти свойства могут обладать прямым влиянием на способность обрабатывать или производить лекарственную субстанцию и лекарственный продукт. Помимо этого, полиморфизм часто проходит контроль регулирующими органами при установлении тождественности лекарственных продуктов от различных производителей. К примеру, полиморфизм определялся для множества препаратов с рынком в несколько миллионов долларов и даже несколько миллиардов долларов, таких как варфарин-натрий, фамотидин и ранитидин. Полиморфизм может влиять на качество, безопасность и/или эффективность лекарственного средства, такого как ингибитор киназы.
[0007] Таким образом, все еще имеется необходимость в полиморфах ингибиторов mTor и/или Akt, так же как и липидных киназ, таких как PI3K. Это изобретение направлено на эту необходимость и обеспечивает связанные с этим преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
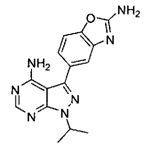
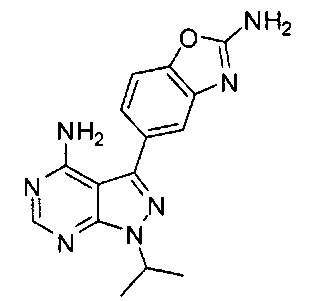
[0008] В одном варианте воплощения, изобретение направлено на способ получения полиморфной Формы C соединения Формулы I:
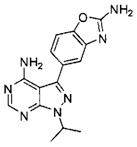 ,
,
причем способ включает (i) подвергание композиции, содержащей один или более полиморфов, отличных от Формы C соединения Формулы I, воздействию небезводных условий в течение периода времени, достаточного для превращения по меньшей мере приблизительно 50% от общего количества полиморфов, отличных от Формы C, в Форму C соединения Формулы I; и (ii) выделение указанной полиморфной Формы C. В различных вариантах воплощения небезводные условия включают воду в форме, выбранной из водяного пара и жидкой воды. Небезводные условия могут включать бинарную кристаллизационную систему, содержащую неводный растворитель и жидкую воду. В различных вариантах воплощения неводный растворитель представляет собой диоксан или ТГФ. К примеру, жидкая вода может присутствовать в количестве, выбранном из приблизительно 1%. приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95 и 100% от объема системы растворителей. В различных вариантах воплощения жидкая вода присутствует в количестве от приблизительно 10% до приблизительно 50% от объема системы растворителей.
[0009] Полиморфы, отличные от Формы C, могут быть выбраны из группы, состоящей из Формы A, Формы B, Формы D, Формы E, Формы F, аморфной формы и их смесей. К примеру, один или более полиморфов, отличных от Формы C, может содержать по меньшей мере 50% полиморфной Формы A по массе. В различных вариантах воплощения одну или более Форм, отличных от Формы C, получают из сырой или очищенной Формы C.
[0010] В одном варианте воплощения изобретение направлено на способ получения полиморфной Формы C соединения Формулы I:
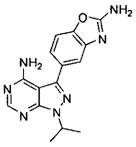 ,
,
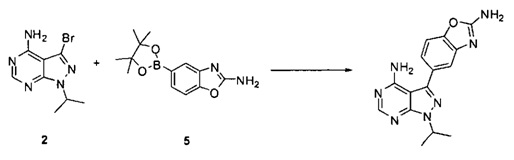
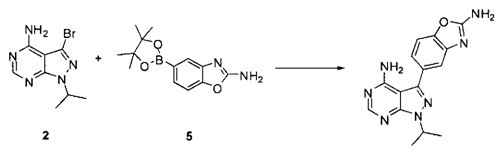
причем упомянутый способ включает (i) взаимодействие соединений 2 и 5:
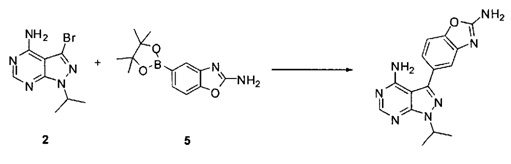 ,
,
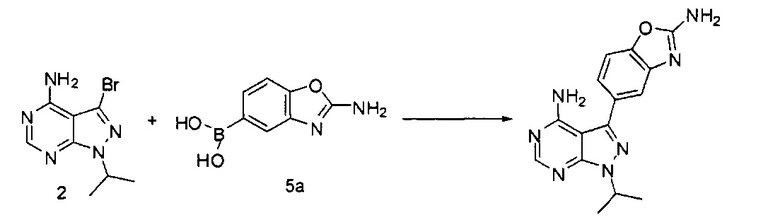
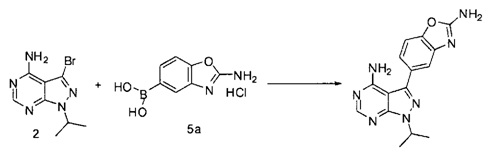
или взаимодействие соединений 2 и 5а:
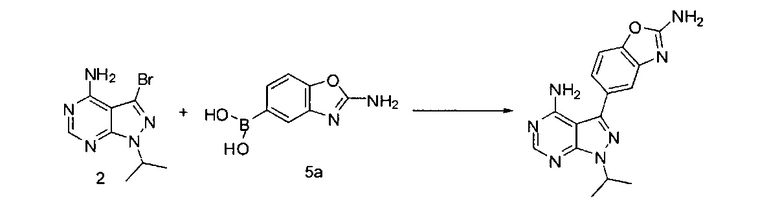
для получения соединения Формулы I; и (ii) выделение указанного соединения Формулы I в полиморфной Форме C; причем, по меньшей мере один из этапов (i) и (ii) происходит в небезводных условиях. К примеру, небезводные условия могут включать водяной пар и/или жидкую воду. Соединение 5а может быть солью, такой как гидрохлоридная соль, или внутренней солью, либо несолевой формой.
[0011] В различных вариантах воплощения, изобретение направлено на способ получения полиморфной Формы A соединения Формулы I:
 ,
,
причем упомянутый способ включает взаимодействие соединений 2 и 5:
 ,
,
или взаимодействие соединений 2 и 5а:
для получения соединения Формулы I; и (ii) выделение указанного соединения Формулы [в полиморфной Форме А. Соединение 5а может быть солью, такой как гидрохлоридная соль, или внутренней солью, либо несолевой формой. Этап (ii) может включать перекристаллизацию соединения Формулы I либо из системы, состоящей из одного растворителя, либо из системы множества растворителей. В различных вариантах воплощения изобретение включает этап растворения соединения Формулы I в растворителе или растворителях, удаления твердого остатка для получения жидкого раствора, активного охлаждения указанного жидкого раствора со скоростью, влияющей на кристаллизацию Формы А, и отделение Формы А от жидкого раствора. В различных вариантах воплощения соединение Формулы I обрабатывается для удаления палладия, к примеру, активированным углем в метаноле.
[0012] В различных вариантах воплощения изобретение направлено на фармацевтически приемлемую соль соединения Формулы I:
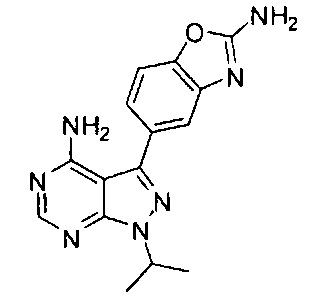
и/или ее сольват. В различных вариантах воплощения соль (одно- или двузамещенная) выбрана из L-винной кислоты, п-толуилсульфоновой кислоты, D-глюкуроновой кислоты, этан-1,2-дисульфоновой кислоты (ЭДСК), 2-нафталинсульфоновой кислоты (НСК), хлороводородной кислоты (HCl) (одно- и двузамещенная), бромоводородной кислоты (HBr), лимонной кислоты, нафталин-1,5-дисульфоновой кислоты (НДСК), DL-миндальной кислоты, фумаровой кислоты, серной кислоты, малеиновой кислоты, метансульфоновой кислоты (МСК), бензилсульфоновой кислоты (БСК), этансульфоновой кислоты (ЭСК), L-яблочной кислоты, фосфорной кислоты и аминоэтансульфоновой кислоты (таурина). Соединение может быть гидрохлоридной солью или бис-гидрохлоридной солью.
[0013] В различных вариантах воплощения изобретение направлено на композицию, содержащую соединение Формулы I:
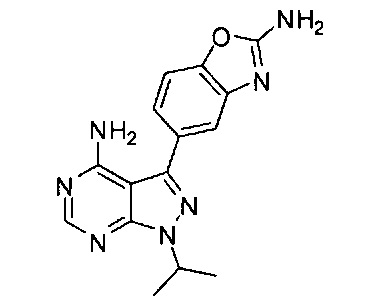
или его фармацевтически приемлемые соль и/или сольват, причем композиция содержит смесь полиморфной Формы C и одного или более полиморфов, отличных от C. К примеру, композиция может содержать полиморфную Форму C и полиморфную Форму A. В различных вариантах воплощения соотношение полиморфной Формы C к общему количеству отличных от С полиморфов выше чем приблизительно 1:1 или выше чем приблизительно 9:1. В различных вариантах воплощения композиция по меньшей мере на 98% по массе представляет собой соединение Формулы I.
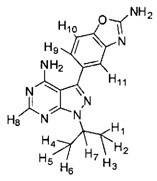
[0014] В различных вариантах воплощения соединение Формулы I модифицировано путем замещения одного или более атомов водорода на атомы дейтерия. В различных вариантах воплощения один или более замещаемых атомов водорода выбраны из атомов водорода, присоединенных к атому углерода, к примеру, обозначенных H1-H11 в следующей формуле:
 .
.
[0015] В различных вариантах воплощения изобретение направлено на композицию, содержащую терапевтически эффективное количество соединения Формулы I:
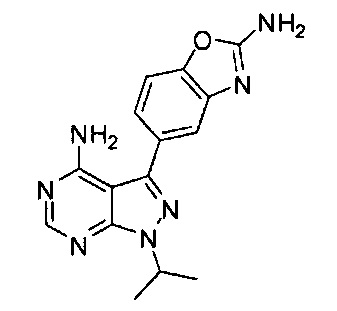
или его фармацевтически приемлемой соли и/или сольвата, и фармацевтически приемлемый носитель; причем композиция содержит полиморфную Форму C соединения Формулы I. Композиция может дополнительно содержать один или более полиморфов соединения Формулы I, отличных от С. В различных вариантах воплощения соотношение полиморфной Формы C к общему количеству отличных от С полиморфов выше чем приблизительно 1:1.
[0016] Композиции могут представлять собой твердую дозированную форму. В различных вариантах воплощения фармацевтическая композиция содержит соединения Формулы I и III,
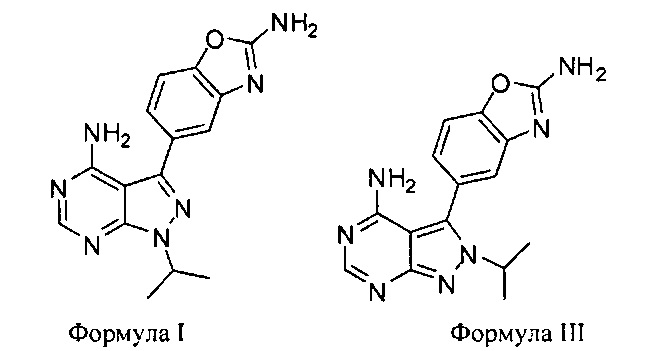
причем соединение Формулы III находится в количестве менее чем 50% по массе, менее чем 40% по массе, менее чем 30% по массе, менее чем 20% по массе, менее чем 10% по массе, менее чем 5% по массе, менее чем 4% по массе, менее чем 3% по массе, менее чем 2% по массе, менее чем 1% по массе, менее чем 0,1% по массе или менее чем 0,01% по массе, причем все количества указаны приблизительно и относительно количества Формулы I.
[0017] В различных вариантах воплощения изобретение направлено на композицию, содержащую терапевтически эффективное количество соединения Формулы I:
или его фармацвтически приемлемой соли и/или сольвата, и фармацевтически приемлемый носитель; причем композиция содержит сольват или гидрат соединения Формулы I. Композиция может содержать один или более полиморфов соединения Формулы I в гидратированной или сольватированной форме. В различных вариантах воплощения гидрат является гидратом Формы А. В различных вариантах воплощения сольват является сольватом Формы А. В различных вариантах воплощения сольват является диметилацетамидным (ДМА) сольватом.
[0018] Композиции по изобретению могут использоваться для лечения mTOR-ассоциированного нарушения, причем способ включает введение композиции индивидууму, нуждающемуся в этом.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[0019] Все публикации, патенты и патентные заявки, упомянутые в этой спецификации, включены сюда посредством ссылки до той же степени, как если бы для каждой отдельной публикации, патента или патентной заявки было конкретно и отдельно указано о включении посредством ссылки.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] Новые особенности изобретения в деталях представлены в прилагаемой формуле изобретения. Понимания особенностей и преимуществ настоящего изобретения можно достичь благодаря представленному ниже детальному описанию, в котором показаны типичные варианты воплощения, в которых используются принципы изобретения, а также сопроводительным чертежам, из которых:
[0021] На ФИГ.1 показана рентгеновская порошковая дифрактограмма высокого разрешения для полиморфной Формы A.
[0022] На ФИГ.2 показана рентгеновская порошковая дифрактограмма для полиморфной Формы A до и после хранения при 40°C/75% отн. вл. в течение 1 недели, 3 недель и 5 недель.
[0023) На ФИГ.3 показан ТГА-профиль для полиморфной Формы А.
[0024] На ФИГ.4 показан ДСК-профиль для полиморфной Формы А.
[0025] На ФИГ.5 показан ГСП-профиль для полиморфной Формы А.
[0026] На ФИГ.6 показаны рентгеновские порошковые дифракционные профили для полиморфной Формы B.
[0027] На ФИГ.7 показан ДСК-профиль для полиморфной Формы В.
[0028] На ФИГ.8 показаны рентгеновские порошковые дифракционные профили для полиморфных Формы C и Формы D.
[0029] На ФИГ.9 показан ТГА-профиль для полиморфной Формы C.
[0030] На ФИГ.10 показан ДСК-профиль для полиморфной Формы C.
[0031] На ФИГ.11 показан ДСК-профиль для полиморфной Формы D.
[0032] На ФИГ.12 показаны рентгеновские порошковые дифракционные профили для полиморфных Форм А, В, С и Е в крупномасштабном эксперименте.
[0033] На ФИГ.13 показан ТГА-профиль для полиморфной Формы Е.
[0034] На ФИГ.14 показан ГСП-профиль для полиморфной Формы C.
[0035] На ФИГ.15 показана рентгеновская порошковая дифрактограмма гидрата Формулы I.
[0036] На ФИГ.16 показаны ТГА-профиль и ДСК-профиль гидрата Формулы I.
[0037] На ФИГ.17 показана рентгеновская порошковая дифрактограмма диметилацетамидного (ДМА) сольвата Формулы I.
[0038] На ФИГ.18 показаны ТГА-профиль и ДСК-профиль ДМА-сольвата Формулы I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0039] Хотя предпочтительные варианты воплощения настоящего изобретения были показаны и описаны здесь, специалисту в данной области техники понятно, что такие варианты воплощения представлены исключительно в качестве примера. Множество вариаций, изменений и замещений, не отступающих от изобретения, очевидны специалисту в данной области техники. Следует понимать, что различные альтернативы вариантам воплощения изобретения, описанным здесь, могут применяться при практическом использовании изобретения. Подразумевается, что прилагаемая формула изобретения определяет объем изобретения, и что способы и структуры в пределах этой формулы изобретения и их эквиваленты покрываются ею.
I. ОПРЕДЕЛЕНИЯ
[0040] Если не указано иное, все технические и научные термины, используемые здесь, обладают таким же смыслом, как их обычно понимает специалист в области техники, к которой принадлежит изобретение.
[0041] Существительные в форме единственного числа при использовании в описании и формуле изобретения охватывают и формы множественного числа, если только из контекста не следует явным образом обратное.
[0042] При использовании здесь, «средство» или «биологически активный агент» обозначают биологическое, фармацевтическое или химическое соединение либо иную группу. Неограничивающие примеры включают простую или сложную органическую или неорганическую молекулу, пептид, белок, олигонуклеотид, антитело, производное антитела, фрагмент антитела, производное витамина, углевод, токсин или химиотерапевтическое соединение. Могут быть синтезированы различные соединения, к примеру, малые молекулы и олигомеры (например, олигопептиды и олигонуклеотиды), а также синтетические органические соединения, основывающиеся на различных структурах скелета. Помимо этого, из различных природных источников могут быть получены соединения для скрининга, такие как растительные или животные экстракты и т.п. Опытному специалисту понятно, что нет ограничений на структурную природу агентов по настоящему изобретению.
[0043] Термин «агонист» при использовании здесь обозначает соединение, обладающее способностью инициировать или усиливать биологическую функцию целевого белка, ингибируя активность или экспрессию целевого белка. Соответственно, термин «агонист» определяется в контексте биологической роли целевого полипептида. Хотя предпочтительные агонисты здесь специфически взаимодействуют с (например, связываются с) мишенью, соединения, которые инициируют или усиливают биологическую активность целевого полипептида путем взаимодействия с другими членами сигнального пути, к которому принадлежит целевой полипептид, также специфически включаются в это определение.
[0044] Термины «антагонист» и «ингибитор» используются взаимозаменяемо и обозначают соединение, обладающее способностью ингибировать биологическую функцию целевого белка, ингибируя активность или экспрессию целевого белка. Соответственно, термины «антагонист» и «ингибиторы» определяются в контексте биологической роли целевого белка. Хотя предпочтительные антагонисты здесь специфически взаимодействуют с (например, связываются с) мишенью, соединения, которые ингибируют биологическую активность целевого белка путем взаимодействия с другими членами сигнального пути, к которому принадлежит целевой белок, также специфически включаются в это определение. Предпочтительная биологическая активность, ингибируемая антагонистом, ассоциирована с развитием, ростом или распространением опухоли или нежелательного иммунного ответа, проявляющегося в виде аутоиммунного заболевания.
[0045] «Антибластомное средство», «противоопухолевое средство» или «химиотерапевтическое средство» обозначают любое средство, пригодное для лечения опухолевого состояния. Один класс антибластомных средств содержит химиотерапевтические средства. Под «химиотерапией» понимается введение одного или более химиотерапевтических лекарственных средств и/или других средств пациенту с онкологическим заболеванием посредством различных способов, включая внутривенный, пероральный, внутримышечный, внутрибрюшинный, внутрипузырный, подкожный, трансдермальный. буккальный, или ингаляционный, либо в виде суппозитория.
[0046] Термин «клеточная пролиферация» обозначает явление, при котором количество клеток изменяется вследствие деления. Этот термин также охватывает клеточный рост, при котором изменяется морфология клетки (например, происходит увеличение в размере) в соответствии с пролиферативным сигналом.
[0047] Термины «совместное введение», «введение в комбинации с» и их грамматические эквиваленты при использовании здесь охватывают введение двух или более средств животному таким образом, чтобы оба средства и/или их метаболиты присутствовали у животного одновременно. Совместное введение включает одновременное введение в раздельных композициях, введение в различное время в раздельных композициях или введение в композиции, содержащей оба средства.
[0048] Термин «эффективное количество» или «терапевтически эффективное количество» относится к такому количеству соединения, описанного здесь, которое достаточно для оказания предполагаемого воздействия, включая, но не ограничиваясь лечением заболевания, как указано ниже. Терапевтически эффективное количество может варьироваться в зависимости от предполагаемого применения (in vitro или in vivo), либо от подвергаемых лечению субъекта и болезненного состояния, например, от массы тела и возраста субъекта, тяжести болезненного состояния, пути введения и т.п., что может быть легко определено обычным специалистом в данной области техники. Этот термин также применяется по отношению к дозе, которая индуцирует особый ответ у клеток-мишеней, например, снижение адгезии тромбоцитов и/или клеточной миграции. Конкретная доза варьируется в зависимости от конкретных выбранных компонентов, от используемого режима дозирования, от того, осуществляется ли введение в комбинации с другими соединениями, времени введения, ткани, в которую она вводится и физической системы доставки, в которой она находится.
[0049] При использовании здесь, термины «лечение», «терапия», «облегчение» и «ослабление» используются взаимозаменяемо. Эти термины обозначают подход к получению полезных или желаемых результатов, включая, но не ограничиваясь терапевтической пользой и/или профилактической пользой. Под терапевтической пользой понимается устранение или ослабление основного заболевания, подвергаемого лечению. Помимо этого, терапевтическая польза достигается при устранении или ослаблении одного или более физиологических симптомов, ассоциируемых с основным заболеванием, например, при улучшении состояния пациента даже при сохранении основного заболевания у него. Для профилактической пользы композиции могут вводиться пациенту, имеющему риск развития конкретной болезни, или пациенту, у которого отмечается один или более из физиологических симптомов заболевания, даже если диагноз этого заболевания еще не был установлен.
[0050] «Терапевтический эффект», при использовании этого термина здесь, охватывает терапевтическую пользу и/или профилактическую пользу, как описано выше. Профилактический эффект включает задержку или устранение проявления заболевания или состояния, задержку или устранение начала симптомов заболевания или состояния, замедление, останов или обращение прогрессирования заболевания или состояния, или любую комбинацию перечисленного.
[0051] Термин «фармацевтически приемлемая соль» обозначает соли, происходящие из множества органических и неорганических противоионов, хорошо известных в данной области техники. Фармацевтически приемлемые кислые соли добавления могут быть образованы неорганическими кислотами и органическими кислотами. Неорганические кислоты, от которых могут происходить соли, включают, к примеру, хлороводородную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.д. Органические кислоты, от которых могут происходить соли, включают, к примеру, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуилсульфоновую кислоту, салициловую кислоту и т.п. Фармацевтически приемлемые основные соли добавления могут быть образованы неорганическими и органическими основаниями. Неорганические основания, от которых могут происходить соли, включают, к примеру, натрий, калий, литий, аммоний, тетраалкиламмоний, кальций, магний, железо, цинк, медь, марганец, алюминий и т.п. Органические основания, от которых могут происходить соли, включают, к примеру, первичные, вторичные и третичные амины, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины, щелочные ионообменные смолы и т.п., конкретно, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах воплощения фармацевтически приемлемая основная соль добавления выбрана из солей аммония, калия, натрия, кальция и магния. Двойные соли (т.е. с двумя противоионами), тройные соли и соли более высокой валентности охватываются понятием фармацевтически приемлемых солей.
[0052] «Фармацевтически приемлемый носитель» или «фармацевтически приемлемый вспомогательный компонент» включают все без исключения растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства для задержки абсорбции и т.д. Применение подобных сред и средств с фармацевтически активными веществами хорошо известно в данной области техники. За исключением случаев несовместимости любой обычной среды или средства с активным компонентом, предполагается их использование в терапевтических композициях по изобретению. Также в композиции могут быть введены вспомогательные активные компоненты.
[0053] «Субъект» обозначает животное, такое как млекопитающее, к примеру, человека. Способы, описанные здесь, могут быть полезны для лечения человека и в ветеринарии. В некоторых вариантах воплощения пациентом является млекопитающее, и в некоторых вариантах воплощения пациентом является человек.
[0054] Под «пролекарством» понимается соединение, которое в физиологических условиях или при сольволизе может превратиться в биологически активное соединение, описанное здесь. Таким образом, термин «пролекарство» обозначает прекурсор биологически активного соединения, который фармацевтически приемлем. Пролекарство может быть неактивным при введении субъекту, но превращается in vivo в активное соединение, к примеру, путем гидролиза. Пролекарственное соединение часто выгодно использовать благодаря его растворимости, тканевой совместимости или задерживания высвобождения в организме млекопитающего (см., к примеру, Bundgard, H., Design of Prodrugs (1985), pp.7-9, 21-24 (Elsevier, Амстердам). Обсуждение пролекарств представлено в Higuchi, Т., et al., "Pro-drugs as Novel Delivery Systems," A.C.S. Symposium Series, Vol.14, и в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, которые оба включены сюда в полном объеме посредством ссылки. Термин «пролекарство» также понимается как включающий любые ковалентно связанные носители, которые высвобождают активное соединение in vivo при введении такого пролекарства субъекту-млекопитающему. Пролекарства активного соединения, как описано здесь, могут быть получены модифицированием функциональных групп, присутствующих в активном соединении так, чтобы модифицированные участки расщеплялись, либо стандартным путем, либо in vivo, до исходного активного соединения. Пролекарства включают соединения, в которых гидрокси-, амино- или меркаптогруппа соединена с любой группой, которая, в случае если пролекарство активного соединения вводится субъекту-млекопитающему, расщепляется с образованием свободной гидрокси-, амино- или меркаптогруппы, соответственно. Примеры пролекарств включают, не ограничиваясь перечисленным, ацетатные, формиатные и бензоатные производные спиртового, ацетамидного, формамидного и бензамидного производного аминной функциональной группы в активном соединении и т.д.
[0055] Термин «in vivo» относится к событию, которое происходит в организме субъекта.
[0056] Термин «in vitro» относится к событию, которое происходит вне организма субъекта. К примеру, анализ in vitro охватывает любые анализы, отличные от анализов, выполняемых в субъекте. Анализы in vitro охватывают основанные на клетках анализы, в которых применяются живые или мертвые клетки. Анализы in vitro также охватывают бесклеточные анализы, в которых не используются неповрежденные клетки.
[0057] Термин «выделение» также охватывает очистку.
[0058] Если не указано обратное, структуры, описанные здесь, также предполагаются как содержащие соединения, которые отличаются только наличием одного или более изотопно обогащенных атомов. К примеру, соединения, обладающие представленными структурами, за исключением того, что водород замещен на дейтерий или тритий, либо углерод замещен на углерод, обогащенный 13C- или 14C, охватываются этим изобретением.
[0059] Соединения по настоящему изобретению также могут содержать неприродные пропорции изотопов атомов для одного или более атомов, входящих в состав этих соединений. К примеру, соединения могут содержать радиоактивную метку в виде радиоактивных изотопов, таких как тритий (3H), иод-125 (125I) или углерод-14 (14C). Все изотопные варианты соединений по настоящему изобретению, как радиоактивные, так и нет, находятся в пределах настоящего изобретения.
[0060] Если для указания физических свойств, таких как молекулярная масса, или химических свойств, таких как химические формулы, используются интервалы, то подразумевается, что включены все комбинации и подкомбинации интервалов и их конкретные варианты воплощения. Термин «приблизительно» при указании числа или интервала чисел обозначает, что указанное число или интервал чисел обозначает приближение с экспериментальной погрешностью (или со статистической экспериментальной ошибкой) и, таким образом, число или интервал чисел может варьироваться в пределах, к примеру, от 1% до 15% от указанного числа или интервала чисел. Термин «содержащий» (и родственные термины, такие как «содержать» или «содержит», или «имеющий», или «включающий») включает те варианты воплощения, к примеру, вариант воплощения любой композиции вещества, состава, способа, процесса и т.п., которые «состоят из» или «состоят преимущественно из» описанных черт. Фраза «состоит преимущественно из» исключает неуказанные компоненты, которые существенно изменяют материал или состав в значительных пропорциях и/или следовых количествах.
[0061] Термины «растворитель», «органический растворитель» или «инертный растворитель» каждый обозначает растворитель, инертный в условиях реакции, которая была описана в связи с этим, включая, к примеру, бензол, толуол, ацетонитрил, тетрагидрофуран («ТГФ»), диметилформамид («ДМФ»), хлороформ, метиленхлорид (или дихлорметан), диэтиловый эфир, метанол, N-метилпирролидон («NMP»), пиридин и так далее. Если не указано противоположное, растворители, используемые в реакциях, описанных здесь, являются инертными органическими растворителями. Если не указано противоположное, каждому грамму ограничивающего реактива соответствует один куб. см. (или мл) растворителя.
[0062] «Сольват» обозначает соединение (например, соединение, описанное здесь, или его фармацевтически приемлемую соль), находящееся в физической связи с одной или более молекул фармацевтически приемлемого растворителя.
[0063| «Кристаллическая форма», «полиморф» и «новая форма» могут использоваться здесь взаимозаменямо и, как предполагается, включают все кристаллические и аморфные формы соединения, включая, к примеру, полиморфы, псевдополиморфы, сольваты, гидраты, несольватированные полиморфы (включая ангидраты), конформационные полиморфы и аморфные формы, а также их смеси, если только не указана конкретная кристаллическая или аморфная форма. Соединения по настоящему изобретению включают кристаллические и аморфные формы этих соединений, включая, к примеру, полиморфы, псевдополиморфы, сольваты. гидраты, несольватированные полиморфы (включая ангидраты), конформационные полиморфы и аморфные формы соединений, а также их смеси.
[0064] Фармацевтически приемлемые формы соединений, указанных здесь, включают фармацевтически приемлемые соли, хелаты, нековалентные комплексы, пролекарства и их смеси. В определенных вариантах воплощения соединения, описанные здесь, находятся в форме фармацевтически приемлемых солей. Поэтому термины «химическое вещество» и «химические вещества» также охватывают фармацевтически приемлемые соли, хелаты, нековалентные комплексы, пролекарства и смеси.
[0065] Помимо этого, если соединение по изобретению получается в виде кислой соли добавления, то свободное основание может быть получено путем подщелачивания раствора кислой соли. С другой стороны, если продукт представляет собой свободное основание, соль добавления, в частности, фармацевтически приемлемую соль добавления, то он может быть получен путем растворения свободного основания в подходящем органическом растворителе с обработкой раствора кислотой, в соответствии с обычными процедурами изготовления кислых солей добавления из основных соединений. Специалистам в данной области техники понятны различные методики синтеза, которые могут использоваться для изготовления нетоксичных фармацевтически приемлемых солей добавления.
II. СОЕДИНЕНИЯ И СПОСОБЫ ИЗГОТОВЛЕНИЯ
[0066] Химические вещества, описанные здесь, в общем случае могут быть синтезированы по подходящей комбинации хорошо известных способов синтеза. Способы синтеза этих химических веществ понятны и доступны специалистам в соответствующей области техники, исходя из актуального раскрытия. Множество необязательно замещенных исходных соединений и других реактивов доступны в продаже, например, у Aldrich Chemical Company (Милуоки, Висконсин) или с легкостью могут быть получены специалистами в данной области техники по обычно применяемым способам синтеза.
[0067] Полиморфы, изготовленные по способам согласно изобретению, могут быть охарактеризованы по любой методологии в данной области техники. К примеру, полиморфы, изготовленные по способам согласно изобретению, могут быть охарактеризованы рентгеновской порошковой дифракцией (XRPD), дифференциальной сканирующей калориметрией (ДСК), термогравиметрическим анализом (ТГА), высокотемпературной микроскопией и спектроскопией (например, рамановской, твердотельным ядерным магнитным резонансом (ттЯМР) и инфракрасной (ИК)).
[0068] XRPD
[0069] Полиморфы согласно изобретению могут быть охарактеризованы по профилям рентгеновской порошковой дифракции (XRPD). Относительные интенсивности XRPD-пиков могут варьироваться, в зависимости от техники подготовки образца, процедуры установки образца и конкретного используемого прибора. Помимо этого, погрешность прибора и иные факторы могут повлиять на величины 2-θ. Поэтому положения XRPD-пиков могут отличаться на плюс-минус примерно 0,2 градуса.
[0070] ДСК
[0071] Полиморфы согласно изобретению также могут быть идентифицированы по характерным профилям дифференциального калориметрического сканирования (ДСК), таким как показаны на фигурах. Для ДСК известно, что наблюдаемые температуры зависят от скорости изменения температуры, а также способа изготовления образца и конкретного используемого оборудования. Поэтому величины, указанные здесь по отношению к ДСК-термограммам, могут отличаться в большую или меньшую сторону на приблизительно 4°C.
[0072] ТГА
[0073] Полиморфные формы по изобретению также могут обладать термическим поведением, отличающимся от поведения аморфного материала или иной полиморфной формы. Термическое поведение может быть измерено в лаборатории посредством термогравиметрического анализа (ТГА), который может использоваться для того, чтобы отличить некоторые полиморфные формы от других. В одном аспекте, полиморф может быть охарактеризован термогравиметрическим анализом.
[0074] Полиморфные формы по изобретению полезны для производства лекарственных препаратов и могут быть получены посредством способа кристаллизации для получения кристаллических и полукристаллических форм или способа отверждения с целью получения аморфной формы. В различных вариантах воплощения кристаллизацию выполняют либо получением соединения Формулы I в реакционной смеси с выделением желаемой полиморфной формы из реакционной смеси, либо растворением сырого соединения в растворителе, необязательно при нагревании с последующими кристаллизацией/отверждением продукта при охлаждении (включая активное охлаждение) и/или добавлением противорастворителя в течение определенного периода времени. После кристаллизации или отверждения может выполняться высушивание в контролируемых условиях до достижения желаемого содержания воды к концу получения полиморфной формы.
[0075] В одном аспекте по изобретению предлагаются способы получения одного или более полиморфов соединения Формулы I:
или его фармацевтически приемлемой соли и/или сольвата. Полиморфы по способам этого изобретения могут быть выбраны из Формы А, Формы В, Формы C, Формы D, Формы Е, аморфной формы и смесей более чем одной формы. Помимо этого, полиморфы, изготовленные по изобретению, могут включать сольваты. В различных вариантах воплощения полиморфы по изобретению изготавливаются в виде свободного основания, однозамещенной соли или двузамещенной соли, такой как гидрохлоридная соль или бис-гидрохлоридная соль соединения Формулы I.
[0076] В различных вариантах воплощения интермедиаты для синтеза Формулы I изготавливаются по следующим схемам.
[0077] Схема 1
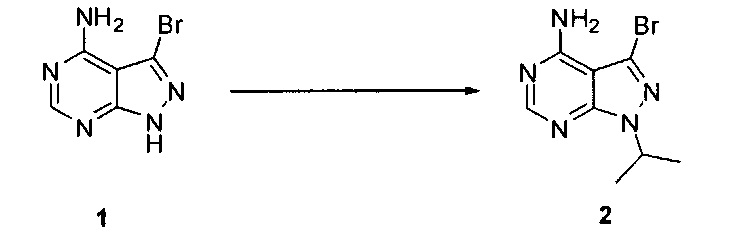
[0078] Превращение соединения 1 в соединение 2 может выполняться по любому способу, известному в данной области техники. В одном варианте воплощения соединение 1 обрабатывают изопропилбромидом и карбонатом калия в безводном ДМФ при температуре выше комнатной.
[0079] Схема 2
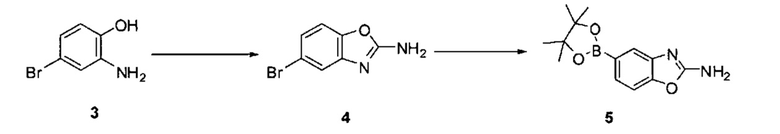
[0080] Превращение соединения 3 в соединение 5 может выполняться по любому способу, известному в данной области техники. В одном варианте воплощения соединение 3 обрабатывают бромцианидом в метаноле для получения соединения 4. Соединение 4 может быть превращено в соединение 5 путем катализируемой переходным металлом реакции перекрестного связывания с диборным агентом. В одном варианте воплощения соединение 4 обрабатывают бис(пинаколято)дибором, ацетатом калия и PdCl2(dppf) в 1,4-диоксане при 110°C для получения соединения 5. В одном варианте воплощения соединение 5 дополнительно обрабатывают кислотой, к примеру, 6Н HCl при повышенной температуре, например, 80°C, для получения соединения 5а, представляющего собой производное бороновой кислоты.
[0081] Схема 3
[0082] В одном варианте воплощения соединение Формулы I получают путем прямого связывания по следующей схеме:
 ,
,
[0083] Связывание соединения 2 с соединением 5 может выполняться в условиях стандартной реакции перекрестного связывания, катализируемой переходным металлом, которые известны в данной области техники. В одном варианте воплощения соединения 2 и 5 могут нагреваться в смеси 1,4-диоксана и воды в присутствии Pd(PPh3)4 и карбоната натрия при 110°C для получения соединения Формулы I. Для получения реакционного продукта можно проводить обработку активированным углем в MeOH, например, при обратном кипячении, чтобы удалить палладий.
[0084] Иначе, производное бороновой кислоты может использоваться по следующей схеме:
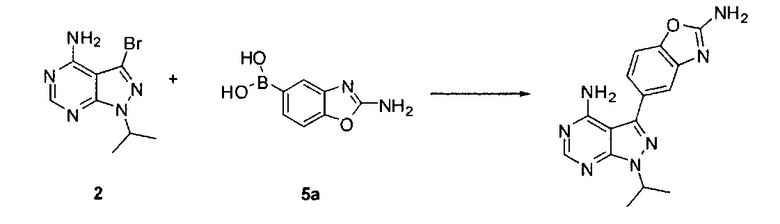
Связывание соединения 2 с соединением 5а может выполняться в условиях стандартной реакции перекрестного связывания, катализируемой переходным металлом, которые известны в данной области техники. Соединение 5а может быть солью, такой как гидрохлоридная соль, или внутренней солью, либо несолевой формой. В одном варианте воплощения соединения 2 и 5а могут нагреваться в смеси 1,4-диоксана и воды в присутствии Pd(PPh3)4 и карбоната натрия при 110°C для получения соединения Формулы I. Для получения реакционного продукта можно проводить обработку активированным углем в МеОН, например, при обратном кипячении, чтобы удалить палладий.
[0085] Полиморфы по изобретению не ограничены исходными материалами, используемыми для получения соединения Формулы I.
[0086] Выделение и очистка химических веществ и интермедиатов, описанных здесь, могут выполняться, при желании, посредством любой подходящей процедуры отделения или очистки, такой как, к примеру, фильтрация, экстракция, кристаллизация, колонная хроматография, тонкослойная хроматография или толстослойная хроматография, либо комбинацией этих процедур. Конкретные описания подходящих процедур выделения и очистки могут быть взяты из примеров ниже. Однако также могут использоваться другие эквивалентные процедуры выделения или очистки. До использования в качестве активного фармацевтического компонента в лекарственном продукте, соединение Формулы I может быть очищено до чистоты более чем 90%, чистоты более чем 91%, чистоты более чем 92%, чистоты более чем 93%, чистоты более чем 94%, чистоты более чем 95%, чистоты более чем 96%, чистоты более чем 97%, чистоты более чем 98%, чистоты более чем 99% и до чистоты, близкой к 100%.
[0087] В одном аспекте изобретение направлено на способы получения полиморфов соединения Формулы I:
или его фармацевтически приемлемой соли и/или сольвата посредством либо выделения желаемого полиморфа в виде первой твердой формы после синтеза соединения Формулы I, либо, иначе, путем выделения желаемого полиморфа в виде переходной формы из предыдущей твердой формы соединения Формулы I. Переходы из одной формы в другую охватываются изобретением, поскольку они могут быть альтернативным способом производства для получения формы, желаемой для получения лекарственных средств.
[0088] В одном варианте воплощения желаемым полиморфом является Форма A, а этап выделения включает перекристаллизацию сырого реакционного продукта из системы, состоящей из одного растворителя. В различных вариантах воплощения желаемым полиморфом является Форма A, а этап выделения включает перекристаллизацию сырого продукта из двойной, тройной или системы растворителей более высокого уровня, в совокупности называемой системой из многих растворителей. В различных вариантах воплощения желаемым полиморфом является Форма A, а этап выделения включает кристаллизацию из системы состоящей из одного или множества растворителей, причем кристаллизация включает активное охлаждение раствора, содержащего растворенное соединение Формулы I. В различных вариантах воплощения желаемым полиморфом является Форма A, а этап выделения включает кристаллизацию из системы, состоящей из одного или множества растворителей, причем кристаллизация включает добавление противорастворителя либо вместе с этапом активного охлаждения, либо без него, для того, чтобы твердая Форма A осадилась из раствора.
[0089] В различных вариантах воплощения желаемым полиморфом является Форма C, а этап выделения включает кристаллизацию сырого реакционного продукта из системы, состоящей из одного растворителя. В различных вариантах воплощения желаемым полиморфом является Форма C, а этап выделения включает перекристаллизацию сырого продукта из двойной, тройной или системы растворителей более высокого уровня, причем двойные, тройные или системы растворителей более высокого уровня в совокупности понимаются как системы из множества растворителей. В различных вариантах воплощения желаемым полиморфом является Форма C, а этап выделения включает кристаллизацию из системы, состоящей из одного или множества растворителей, причем кристаллизация включает активное охлаждение раствора, содержащего растворенное соединение Формулы I. В различных вариантах воплощения желаемым полиморфом является Форма C, а этап выделения включает кристаллизацию из системы, состоящей из одного или множества растворителей, причем кристаллизация включает добавление противорастворителя либо вместе с этапом активного охлаждения, либо без него, для того, чтобы твердая Форма C осадилась из раствора. В различных вариантах воплощения условия кристаллизации небезводны. Если условия небезводны, то вода может содержаться в следовых количествах или в количествах ниже 1% по объему растворителя. В различных вариантах воплощения вода может находиться в качестве ко-растворителя (или противорастворителя) в количестве от приблизительно 1% до приблизительно 50%. К примеру, вода может присутствовать в количестве приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%. приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45% и приблизительно 50% от объема растворителя. В различных вариантах воплощения вода может присутствовать в количествах, равных или превышающих приблизительно 50% по объему растворителя. К примеру, вода может присутствовать в количестве приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95% и до 100% от объема растворителя. В различных вариантах воплощения жидкая вода находится в системе из множества растворителей в количестве от приблизительно 10% до приблизительно 50% от объема системы растворителей. В различных вариантах воплощения вода может присутствовать в виде водяного пара или влажности окружающей среды.
[0090] В различных вариантах воплощения, изобретение направлено на способы получения полиморфа соединения Формулы I, отличающиеся тем, что по способу происходит превращение выделенного полиморфа или смеси полиморфов в желаемый полиморф. В определенных вариантах воплощения способы содержат воздействие на композицию, содержащую один или более полиморфов, условий, достаточных для того, чтобы превратить по меньшей мере приблизительно 50% от общего количества оригинального(ых) полиморфа(ов) в по меньшей мере приблизительно 50% желаемого полиморфа, а также выделение желаемого полиморфа при необходимости.
[0091] В различных вариантах воплощения исходная твердая форма соединения Формулы I содержит больше чем приблизительно 50% полиморфов, отличных от Формы C, а желаемым полиморфом является Форма C. Преобразование в Форму C может выполняться в условиях системы множества растворителей в течение периода времени, достаточного для превращения по меньшей мере приблизительно 50% от общего количества полиморфов, отличных от Формы C, в Форму C соединения Формулы I, при необходимости, с необязательным отделением Формы C от любых полиморфов, отличных от Формы C. Система из множества растворителей может включать воду. К примеру, условия, использующие систему из множества растворителей, могут включать растворение оригинальной композиции в смеси вода/органический растворитель при температуре выше 25°C и последующее охлаждение полученного раствора до 20°C или ниже.
[0092] В различных вариантах воплощения оригинальная композиция содержит одно или более из Формы А, Формы В, Формы D, Формы Е, Формы F, аморфной формы и их смесей. В различных вариантах воплощения оригинальная композиция представляет собой полиморфную Форму A более чем на 50% по массе.
[0093] В различных вариантах воплощения изобретение направлено на композиции, содержащие смесь более чем одного полиморфа соединения Формулы I. К примеру, в различных вариантах воплощения композиция содержит отношение Формы C к отличным от C полиморфам, которое выше чем 1:1 или выше чем 9:1 или выше чем 99:1. В различных вариантах воплощения композиция содержит и Форму C, и Форму A.
[0094] Форма A
[0095] На ФИГ.1 показана рентгеновская порошковая дифрактограмма полиморфа Формы А. На ФИГ.3 показан термогравиметрический анализ (ТГА) Формы А. На ФИГ.4 показан дифференциальный сканирующий калориметрический (ДСК) эндотермический анализ для Формы А. На ФИГ.5 показан ГСП-профиль для Формы А.
[0096] В различных вариантах воплощения Форма A может быть получена непосредственно при выполнении этапа синтеза соединения Формулы I, при котором отличные от A Формы не образуются или образуются в малых количествах. В различных вариантах воплощения Форма A может быть получена путем кристаллизации из одного растворителя, включая метанол и этилацетат, при быстром и медленном охлаждении. В различных вариантах воплощения Форма A может быть получена путем кристаллизации из двойной системы растворителей, содержащей метанол и этилацетат, а также при быстром и медленном охлаждении двойных систем растворителей с дихлорметаном или гексаном в качестве противорастворителя. Форма A может быть также получена из суспензий в метаноле, этилацетате, ДМФ, ДМСО, N-метилпирролидоне (NMP), уксусной кислоте, изопропиловом спирте, ацетонитриле и диметилацетамиде (ДМА). В различных вариантах воплощения Форму A получают ресуспендированием одной или более Форм, отличных от А. в безводном растворителе. К примеру. Форму A получают ресуспендированием одной или более Форм, отличных от A (такой как Форма C), в метаноле, хлороформе, дихлорметане, изопропиловом спирте, этаноле, ацетате, этаноле/ацетате или их смесях.
[0097] Форма C
[0098] В одном варианте воплощения полиморфом согласно изобретению является Форма C. На ФИГ.12 показана рентгеновская порошковая дифрактограмма Полиморфной Формы C. На ФИГ.9 показан термогравиметрический анализ (ТГА) Формы C. На ФИГ.10 показан ДСК-эндотермический анализ Формы C. Символом «exo» обозначена экзотерма. В некоторых вариантах воплощения Форма C характеризуется ДСК-профилем с пиком на приблизительно 100°C и пиком на 275°C.
[0099] В различных вариантах воплощения Форма C может быть получена в смеси с полиморфными формами, отличными от C. К примеру, в различных вариантах воплощения Форма C может находиться в виде композиции, дополнительно содержащей одну или более полиморфных форм, отличных от С. Количество полиморфных форм, отличных от С, может варьироваться. К примеру, в различных вариантах воплощения массовое отношение полиморфной Формы C к общему количеству одного или более отличных от C полиморфов выше чем приблизительно 7:1, выше чем приблизительно 8:1, выше чем приблизительно 9:1, выше чем приблизительно 9,5:1, или выше чем приблизительно 99:1. Аналогично, при составлении фармацевтических композиций, могут присутствовать различные количества полиморфных форм, отличных от С. В различных вариантах воплощения массовое отношение полиморфной Формы C к общему количеству одного или более отличных от С полиморфов в фармацевтической композиции может быть выше чем приблизительно 7:1, выше чем приблизительно 8:1, выше чем приблизительно 9:1, выше чем приблизительно 9,5:1, или выше чем приблизительно 99:1.
[00100] В различных вариантах воплощения Форма C может быть получена путем помещения Формы A в воду или в систему растворителей с водой. При воздействии воды или содержащей воду системы растворителей комбинация может образовать суспензию. Комбинация Формы A и воды или содержащей воду системы растворителей может перемешиваться, необязательно при нагревании, до тех пор, пока конверсия Формы C не произойдет в желательной степени. В различных вариантах воплощения система растворителей является водорастворимым спиртом с водой. В различных вариантах воплощения система растворителей является неспиртовым водорастворимым растворителем с водой. В различных вариантах воплощения система растворителей является обыкновенным органическим растворителем, содержащим ТГФ или 1,4-диоксан с водой. В различных вариантах воплощения Форму C получают путем быстрого или медленного охлаждения двойных систем растворителей, включая тетрагидрофуран или 1,4-диоксан в качестве основного растворителя и воду в качестве противорастворителя.
[00101] Если помимо воды используется растворитель, то соотношение растворителя к воде может варьироваться от приблизительно 100/1 до приблизительно 1/100. К примеру, отношение растворителя к воде может быть выбрано из приблизительно 100/1, приблизительно 90/1, приблизительно 80/1, приблизительно 70/1, приблизительно 60/1, приблизительно 50/1, приблизительно 40/1, приблизительно 30/1, приблизительно 20/1, приблизительно 10/1, приблизительно 9/1, приблизительно 8/1, приблизительно 7/1, приблизительно 6/1, приблизительно 5/1, приблизительно 4/1, приблизительно 3/1, приблизительно 2/1, приблизительно 1,5/1, приблизительно 1/1, приблизительно 1/1,5, приблизительно 1/2, приблизительно 1/3, приблизительно 1/4, приблизительно 1/5, приблизительно 1/6, приблизительно 1/7, приблизительно 1/8, приблизительно 1/9, приблизительно 1/10, приблизительно 1/20, приблизительно 1/30, приблизительно 1/40, приблизительно 1/50, приблизительно 1/60, приблизительно 1/70, приблизительно 1/80, приблизительно 1/90 и приблизительно 1/100. Общее количество растворителя или системы растворителей может быть выбрано из приблизительно 0,1 объемов (например, литров/кг), приблизительно 0,5 объемов, приблизительно 1 объема, приблизительно 2 объемов, приблизительно 3 объемов, приблизительно 4 объемов, приблизительно 5 объемов, приблизительно 6 объемов, приблизительно 7 объемов, приблизительно 8 объемов, приблизительно 9 объемов, приблизительно 10 объемов, приблизительно 11 объемов, приблизительно 12 объемов, приблизительно 13 объемов, приблизительно 14 объемов, приблизительно 15 объемов, приблизительно 16 объемов, приблизительно 17 объемов, приблизительно 18 объемов, приблизительно 19 объемов, приблизительно 20 объемов, приблизительно 30 объемов, приблизительно 40 объемов, приблизительно 50 объемов или большего количества. В различных вариантах воплощения система растворителей представляет собой ТГФ/воду. В различных вариантах воплощения система растворителей представляет собой диоксан/воду.
[00102] В различных вариантах воплощения Форму C получают перекристаллизацией Формы, отличной от С, включая полное растворение Формы, отличий от С, с последующим фильтрованием для удаления любых нерастворимых частиц с последующей кристаллизацией для получения Формы C. В различных вариантах воплощения не производится полного растворения и фильтрования, а образуется взвесь, которая превращается в Форму C без полного растворения одной или более Форм, отличных от С. В различных вариантах воплощения, Форма C является канальным гидратом.
[00103] В различных вариантах воплощения раскрыт способ получения полиморфной Формы А соединения Формулы I:
 ,
,
причем указанный способ включает
(i) взаимодействие соединений 2 и 5:
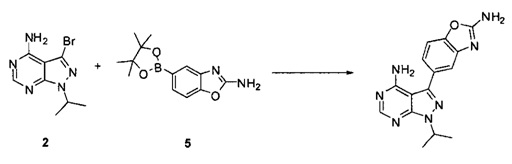 ,
,
или взаимодействие соединений 2 и 5а:
для получения соединения Формулы I; и (ii) выделение указанного соединения Формулы I в полиморфной Форме А, причем упомянутое выделение происходит в условиях для удаления палладия. К примеру, палладий удаляют обработкой соединения Формулы I активированным углем. В различных вариантах воплощения обработка соединения Формулы I включает кипячение в метаноле с обратным холодильником. После обработки для удаления палладия очищенная полиморфная Форма A содержит количество палладия, выбранное из менее чем приблизительно 1% по массе, менее чем приблизительно 0,5% по массе, менее чем приблизительно 0,1% по массе, менее чем приблизительно 0,05% по массе, менее чем приблизительно 0,01% по массе, менее чем приблизительно 0,001% по массе, и менее чем приблизительно 0,0001% по массе.
[00104] Солевые Формы
[00105] В различных вариантах воплощения соединение Формулы I представляет собой фармацевтически приемлемую соль. Фармацевтически приемлемые кислые соли добавления могут быть образованы неорганическими кислотами и органическими кислотами. Неорганические кислоты, от которых могут происходить соли, включают, к примеру, хлороводородную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.д. Органические кислоты, от которых могут происходить соли, включают, к примеру, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуилсульфоновую кислоту, бензилсульфоновую кислоту, салициловую кислоту, 1,2-этандисульфоновую кислоту и т.п. Фармацевтически приемлемые основные соли добавления могут быть образованы неорганическими и органическими основаниями. Неорганические основания, от которых могут происходить соли, включают, к примеру, натрий, калий, литий, аммоний, кальций, магний, железо, цинк, медь, марганец, алюминий и т.п. Органические основания, от которых могут происходить соли, включают, к примеру, первичные, вторичные и третичные амины, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины, щелочные ионообменные смолы и т.п., конкретно, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. В некоторых вариантах воплощения фармацевтически приемлемая основная соль добавления выбрана из солей аммония, калия, натрия, кальция и магния. Двойные соли (т.е. с двумя противоионами) и соли более высокой валентности охватываются понятием фармацевтически приемлемых солей.
[00106] В различных вариантах воплощения соли Формулы I могут быть образованы серной кислотой, п-толуилсульфоновой кислотой, D-глюкуроновой кислотой, этан-1,2-дисульфоновой кислотой (ЭДСК), 2-нафталинсульфоновой кислотой (НСК), хлороводородной кислотой (HCl) (одно- и двузамещенная), бромоводородной кислотой (HBr), щавелевой кислотой, нафталин-1,5-дисульфоновой кислотой (НДСК), DL-миндальной кислотой, фумаровой кислотой, серной кислотой, малеиновой кислотой, метансульфоновой кислотой (МСК), бензилсульфоновой кислотой (БСК), этансульфоновой кислотой (ЭСК), L-яблочной кислотой, фосфорной кислотой и аминоэтансульфоновой кислотой (таурином).
[00107] Атомы дейтерия
[00108] В различных вариантах воплощения соединение Формулы I модифицировано путем замещения одного или более атомов водорода на атомы дейтерия. В различных вариантах воплощения один или более замещаемых атомов водорода выбраны из атомов водорода, присоединенных к атому углерода, к примеру, обозначенных H1-H11 в следующей формуле:
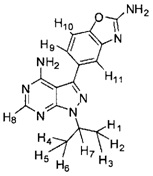 .
.
[00109] Атом(ы) водорода для замещения могут быть выбраны из одного или более из Н1-Н7, как указано в формуле выше. Количество атомов дейтерия для включения в соединение Формулы I может варьироваться от одного атома дейтерия до замены всех атомов водорода на атомы дейтерия. К примеру, в различных вариантах воплощения, от одного до шести атомов водорода, обозначенных H1-H6 в формуле выше, замещено на от одного до шести атомов дейтерия в любой комбинации. Таким образом, соединение Формулы I может содержать две группы CD3, по одной группе CD3 и группе CHD2, по одной группе CD3 и группе CH2D, по одной группе CD3 и группе СН3, две группы CHD2, по одной группе CHD2 и группе CH2D, по одной группе CHD2 и группе CH3, две группы CH2D, по одной группе CH2D и группе CH3 и так далее.
[00110] В различных вариантах воплощения соединения Формулы I, помеченные дейтерием, обладают повышенной метаболической стабильностью в сравнении с немечеными соединениями. Альтернативно, соединения, помеченные дейтерием, полезны при анализе соединения, например. ЯМР, либо при анализе путей метаболизма.
[00111] Формулы II и III
[00112] В различных вариантах воплощения синтезируются соединения Формул II и III:
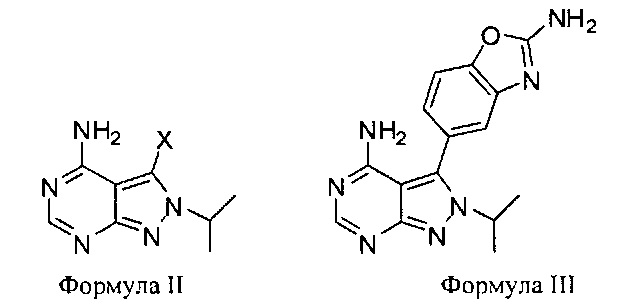
где X в Формуле II является галогеном. В различных вариантах воплощения X выбран из иода и брома.
[00113] В различных вариантах воплощения синтез соединения Формулы I также дает соединения Формул II и/или III. К примеру, если проводить синтез, раскрытый здесь по Схемам 1 и 3, то могут быть синтезированы соединения Формул II и III. В различных вариантах воплощения соединения Формулы II или III удаляются или отделяются от соединения Формулы I или его предшественников. К примеру, в Схеме 1 выше, в которой Соединение 2 находится в комбинации с соединением Формулы II, Соединение 2 очищают для снижения количества соединения Формулы II до менее чем 50% по массе, менее чем 40% по массе, менее чем 30% по массе, менее чем 20% по массе, менее чем 10% по массе, менее чем 5% по массе, менее чем 4% по массе, менее чем 3% по массе, менее чем 2% по массе, менее чем 1% по массе, менее чем 0,1% по массе или менее чем 0,01% по массе, причем все количества указаны приблизительно. По отношению к соединению Формулы I, если соединение Формулы I находится в комбинации с соединением Формулы III, то соединение Формулы I очищают для снижения количества соединения Формулы III до менее чем 50% по массе, менее чем 40% по массе, менее чем 30% по массе, менее чем 20% по массе, менее чем 10% по массе, менее чем 5% по массе, менее чем 4% по массе, менее чем 3% по массе, менее чем 2% по массе, менее чем 1% по массе, менее чем 0,1% по массе или менее чем 0,01% по массе, причем все количества указаны приблизительно.
III. КОМПОЗИЦИИ
[00114] Согласно изобретению предлагаются композиции, включая фармацевтические композиции, содержащие один или более полиморфов по настоящему изобретению.
[00115] В различных вариантах воплощения соотношение желаемого полиморфа, такого как Форма A или Форма C, ко всем другим полиморфам, может быть больше, чем приблизительно 5:1, 6:1, 7:1, 8:1, 9:1 или более.
[00116] Рассматриваемые фармацевтические композиции обычно составляются так, чтобы обеспечивалось терапевтически эффективное количество полиморфа по настоящему изобретению в качестве активного компонента, либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного. При потребности, фармацевтические композиции содержат фармацевтически приемлемую соль и/или ее координационный комплекс, а также один или более фармацевтически приемлемых вспомогательных компонентов, носителей, включая инертные твердые разбавители и наполнители, разбавители, включая стерильный водный раствор и различные органические растворители, усилители проникновения, солюбилизаторы и адъюванты.
[00117] Обсуждаемые фармацевтические композиции могут вводиться по отдельности или в комбинации с одним или более других средств, которые обычно также вводятся в форме фармацевтических композиций. При желании, рассматриваемые полиморфы и другой(ие) агент(ы) могут смешиваться с получением препарата, либо оба компонента могут быть составлены в виде отдельных препаратов для использования их в комбинации отдельно или одновременно.
[00118] В некоторых вариантах воплощения концентрация одного или более полиморфов в фармацевтических композициях по настоящему изобретению равна менее чем 100; 90; 80; 70; 60; 50; 40; 30; 20; 19; 18; 17; 16; 15; 14; 13; 12; 11; 10; 9; 8; 7; 6; 5; 4; 3; 2; 1; 0,5; 0,4; 0,3; 0,2; 0,1; 0,09; 0,08; 0,07; 0,06; 0,05; 0,04; 0,03; 0,02; 0,01; 0,009; 0,008; 0,007; 0,006; 0,005; 0,004; 0,003; 0,002; 0,001; 0,0009; 0,0008; 0,0007; 0,0006; 0,0005; 0,0004; 0,0003; 0,0002 или 0,0001% м/м, м/об или об/об.
[00119] В некоторых вариантах воплощения концентрация одного или более полиморфов по настоящему изобретению превышает 90; 80; 70; 60; 50; 40; 30; 20; 19,75; 19,50; 19,25; 19; 18,75; 18,50; 18,25; 18; 17,75; 17,50; 17,25; 17; 16,75; 16,50; 16,25; 16; 15,75; 15,50; 15,25; 15; 14,75; 14,50; 14,25; 14; 13,75; 13,50; 13,25; 13; 12,75; 12,50; 12,25; 12; 11,75; 11,50; 11,25; 11; 10,75; 10,50; 10,25; 10; 9,75; 9,50; 9,25; 9; 8,75; 8,50; 8,25; 8; 7,75; 7,50; 7,25; 7; 6,75; 6,50; 6,25; 6; 5,75; 5,50; 5,25; 5; 4,75; 4,50; 4,25; 4; 3,75; 3,50; 3,25; 3; 2,75; 2,50; 2,25; 2; 1,75; 1,50; 1,25; 1; 0,5; 0,4; 0,3; 0,2; 0,1; 0,09; 0,08; 0,07; 0,06; 0,05; 0,04; 0,03; 0,02; 0,01; 0,009; 0,008; 0,007; 0,006; 0,005; 0,004; 0,003; 0,002; 0,001; 0,0009; 0,0008; 0,0007; 0,0006; 0,0005; 0,0004; 0,0003; 0,0002 или 0,0001% м/м, м/об или об/об.
[00120] В некоторых вариантах воплощения концентрация одного или более полиморфов по настоящему изобретению лежит в пределах от приблизительно 0,0001% до приблизительно 50%, от приблизительно 0,001% до приблизительно 40%, от приблизительно 0,01% до приблизительно 30%, от приблизительно 0,02% до приблизительно 29%, от приблизительно 0,03% до приблизительно 28%, от приблизительно 0,04% до приблизительно 27%, от приблизительно 0,05% до приблизительно 26%, от приблизительно 0,06% до приблизительно 25%, от приблизительно 0,07% до приблизительно 24%, от приблизительно 0,08% до приблизительно 23%, от приблизительно 0,09% до приблизительно 22%, от приблизительно 0,1% до приблизительно 21%, от приблизительно 0,2% до приблизительно 20%, от приблизительно 0,3% до приблизительно 19%, от приблизительно 0,4% до приблизительно 18%, от приблизительно 0,5% до приблизительно 17%, от приблизительно 0,6% до приблизительно 16%, от приблизительно 0,7% до приблизительно 15%, от приблизительно 0,8% до приблизительно 14%, от приблизительно 0,9% до приблизительно 12%, от приблизительно 1% до приблизительно 10% м/м, м/об или об/об.
[00121] В некоторых вариантах воплощения концентрация одного или более полиморфов по настоящему изобретению лежит в пределах от приблизительно 0,001% до приблизительно 10%, от приблизительно 0,01% до приблизительно 5%, от приблизительно 0,02% до приблизительно 4,5%, от приблизительно 0,03% до приблизительно 4%, от приблизительно 0,04% до приблизительно 3,5%, от приблизительно 0,05% до приблизительно 3%, от приблизительно 0,06% до приблизительно 2.5%, от приблизительно 0,07% до приблизительно 2%, от приблизительно 0,08% до приблизительно 1,5%, от приблизительно 0,09% до приблизительно 1%, от приблизительно 0,1% до приблизительно 0,9% м/м, м/об или об/об.
[00122] В некоторых вариантах воплощения количество одного или более полиморфов по настоящему изобретению равно или менее чем 10; 9,5; 9,0; 8,5; 8,0; 7,5; 7,0; 6,5; 6,0; 5,5; 5,0; 4,5; 4,0; 3,5; 3,0; 2,5; 2,0; 1,5; 1,0; 0,95; 0,9; 0,85; 0,8; 0,75; 0,7; 0,6;, 0,6; 0,55; 0,5; 0,4;, 0,4; 0,35; 0,3; 0,25; 0,2; 0,15; 0,1; 0,09; 0,08; 0,07; 0,06; 0,05; 0,04; 0,03; 0,02; 0,01; 0,009; 0,008; 0,007; 0,006; 0,005; 0,004; 0,003; 0,002; 0,001; 0,0009; 0,0008; 0,0007; 0,0006; 0,0005; 0,0004; 0,0003; 0,0002 либо 0,0001 г.
[00123] В некоторых вариантах воплощения количество одного или более полиморфов по настоящему изобретению превышает 0,0001; 0,0002; 0,0003; 0,0004; 0,0005; 0,0006; 0,0007; 0,0008; 0,0009; 0,001; 0,0015;, 0,002; 0,0025; 0,003; 0,0035; 0,004; 0,0045; 0,005; 0,0055; 0,006; 0,0065; 0,007; 0,0075; 0,008; 0,0085; 0,009; 0,0095; 0,01; 0,015; 0,02; 0,025; 0,03; 0,035; 0,04; 0,045; 0,05; 0,055; 0,06; 0,065; 0,07; 0,075; 0,08, 0,085; 0,09; 0,095; 0,1; 0,15; 0,2; 0,25; 0,3; 0,35; 0,4; 0,45; 0,5; 0,55; 0,6; 0,65; 0,7; 0,75; 0,8; 0,85; 0,9; 0,95, 1; 1,5; 2; 2,5; 3;, 3,5; 4;, 4,5:, 5;, 5,5;, 6;, 6,5;, 7;, 7,5;, 8;, 8,5;, 9 9,5 или 10 г.
[00124] В некоторых вариантах воплощения количество одного или более полиморфов по настоящему изобретению лежит в пределах 0,0001-10 г, 0,0005-9 г, 0,001-8 г, 0,005-7 г, 0,01-6 г, 0,05-5 г, 0,1-4 г, 0,5-4 г или 1-3 г.
[00125] Полиморфы согласно изобретению эффективны в широком интервале дозировок. К примеру, при лечении взрослых людей примерами дозировок, которые могут использоваться, служат от 0,01 до 1000 мг, от 0,5 до 100 мг, от 1 до 50 мг в сутки и от 5 до 40 мг в сутки. Примерная дозировка составляет от 10 до 30 мг в сутки или в неделю. Точная дозировка будет зависеть от пути введения, формы введения полиморфов, подвергаемого терапии субъекта, массы тела подвергаемого терапии субъекта, а также от предпочтений и опыта лечащего врача.
[00126] В различных вариантах воплощения фармацевтические композиции по Формуле I также содержат определенное количество соединения Формулы III. К примеру, композиция Формулы I может содержать детектируемое количество соединения Формулы III. В различных вариантах воплощения количество соединения Формулы III составляет менее чем 50% по массе, менее чем 40% по массе, менее чем 30% по массе, менее чем 20% по массе, менее чем 10% по массе, менее чем 5% по массе, менее чем 4% по массе, менее чем 3% по массе, менее чем 2% по массе, менее чем 1% по массе, менее чем 0,1% по массе или менее чем 0,01% по массе, причем все количества указаны приблизительно и относительно количества Формулы I.
[00127] Ниже описаны неограничивающие примерные фармацевтические композиции и способы их изготовления.
[00128] Фармацевтические композиции для перорального приема: В некоторых вариантах воплощения по изобретению предлагается фармацевтическая композиция для перорального приема, содержащая полиморф по настоящему изобретению и фармацевтический вспомогательный компонент, пригодный для перорального приема.
[00129] В некоторых вариантах воплощения по изобретению предлагается твердая фармацевтическая композиция для перорального приема, содержащая: (i) эффективное количество соединения по настоящему изобретению; необязательно, (ii) эффективное количество второго средства; и (iii) один или более фармацевтических вспомогательных компонентов, пригодных для перорального приема. В некоторых вариантах воплощения композиция дополнительно содержит: (iv) эффективное количество третьего средства.
[00130] В некоторых вариантах воплощения фармацевтическая композиция может быть жидкой фармацевтической композицией, пригодной для употребления внутрь. Фармацевтические композиции по изобретению, пригодные для перорального введения, могут представлять собой дискретные дозированные формы, такие как капсулы, облатки, таблетки или жидкости либо аэрозольные спреи, каждая из которых содержит предустановленное количество активного компонента в виде порошка или гранул, раствора, суспензии в водной или неводной жидкости, эмульсии масло в воде или жидкой эмульсии вода в масле. Такие дозированные формы могут быть изготовлены по любому из способов фармации, но все способы содержат этап связывания активного компонента с носителем, который содержит один или более необходимых компонентов. В общем, композиции изготавливаются путем тщательного и равномерного перемешивания активного компонента с жидкими носителями или тонко измельченными твердыми носителями, либо с обоими этими видами носителей, а затем, при необходимости, приданием продукту желаемого вида. К примеру, таблетка может быть изготовлена путем сжатия или отливки, необязательно, с одним или более дополнительных компонентов. Сжатые таблетки могут быть изготовлены путем прессования в подходящем аппарате активного компонента, находящегося в сыпучем виде, таком как порошок или гранулы, необязательно, смешанного с вспомогательным компонентом, таким как, но не ограничиваясь перечисленным, связующее вещество, любрикант, инертный разбавитель и/или поверхностно-активное либо диспергирующее вещество. Литые таблетки могут быть изготовлены отливанием в подходящей установке смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
[00131] Это изобретение дополнительно охватывает безводные фармацевтические композиции и дозированные формы, содержащие активный компонент, поскольку вода может способствовать распаду некоторых соединений. К примеру, вода может добавляться (например, 5%) в области фармацевтики для симулирования долгосрочного хранения, чтобы определить такие характеристики как срок годности или стабильность составов во времени. Безводные фармацевтические композиции и дозированные формы по изобретению могут изготавливаться с использованием безводных компонентов или компонентов с низким содержанием влаги и в условиях низкой влажности. Фармацевтические композиции и дозированные формы по изобретению, которые содержат лактозу, могут быть сделаны безводными, если ожидается существенное контактирование с влагой и/или влажностью при производстве, упаковке и/или хранении. Безводная фармацевтическая композиция может изготавливаться и храниться так, чтобы поддерживалась ее безводная природа. Соответственно, безводные композиции могут упаковываться в материалы, противодействующие воздействию воды так, чтобы они могли быть включены в подходящие фармакологические наборы. Примеры подходящей упаковки включают, не ограничиваясь перечисленным, герметически запечатанные фольгу, пластик и т.д., единично-дозовые контейнеры, блистеры и стрипы.
[00132] Активный компонент может быть совмещен с фармацевтическим носителем при тщательном перемешивании согласно обычным фармацевтическим способам изготовления составов. Носитель может находиться в большом количестве форм в зависимости от формы препарата, желаемой для введения. При изготовлении композиций дозированных форм для перорального приема в качестве носителей могут использоваться любые из обыкновенных фармацевтических сред, например, вода, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т.д. в случае пероральных жидких препаратов (таких как суспензии, растворы и эликсиры) или аэрозолей; либо в случае пероральных твердых препаратов могут использоваться такие носители как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, любриканты, связующие вещества и средства для улучшения распадаемости, в некоторых вариантах воплощения без использования лактозы. К примеру, подходящие носители включают порошки, капсулы и таблетки с твердыми пероральными препаратами. При желании таблетки могут быть покрыты по стандартным водным или неводным методикам.
[00133] Связующие агенты, пригодные для использования в фармацевтических композициях и дозированных формах включают, не ограничиваясь перечисленным, кукурузный крахмал, картофельный крахмал и иные виды крахмала, желатин, природные и синтетические резины, такие как акация, альгинат натрия, альгиновую кислоту, другие альгинаты, порошкообразный трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, целлюлозы ацетат, карбоксиметилцеллюлозу кальция, натрия карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу. прежелатинизированный крахмал, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу и их смеси.
[00134] Примеры подходящих наполнителей для использования в фармацевтических композициях и дозированных формах, раскрытых здесь, включают, не ограничиваясь перечисленным, тальк, кальция карбонат (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, маннитол, кремниевую кислоту, сорбитол, крахмал, прежелатинизированный крахмал и их смеси.
[00135] Регуляторы распадаемости могут использоваться в композициях по изобретению для получения таблеток, распадающихся при попадании в водную среду. Слишком большое количество регулятора распадаемости может привести к тому, что таблетки будут разрушаться во флаконе. Слишком малое его количество может быть недостаточным для распада, вследствие чего может измениться скорость и степень выделения активного(ых) компонента(ов) из дозированной формы. Таким, образом, для получения дозированных форм полиморфов, раскрытых здесь, может использоваться достаточное количество регулятора распадаемости, которое ни слишком мало, ни слишком велико для излишнего изменения высвобождения активного(ых) компонента(ов). Количество используемого регулятора распадаемости может варьироваться в зависимости от типа состава и пути введения и может быть легко определено обыкновенным специалистом в данной области техники. В фармацевтической композиции может использоваться от приблизительно 0,5 до приблизительно 15 массовых процентов регулятора распадаемости или от приблизительно 1 до приблизительно 5 массовых процентов регулятора распадаемости. Регуляторы распадаемости, которые могут использоваться для составления фармацевтических композиций и дозированных форм по изобретению включают, не ограничиваясь перечисленным, агар-агар, альгиновую кислоту, кальция карбонат, микрокристаллическую целлюлозу, кросскармеллозу натрия, кроссповидон, полакрилин калия, натрия крахмалгликолят, крахмал картофеля или тапиоки, другие виды крахмала, прежелатинизированный крахмал, другие виды крахмала, глины, другие виды альгинатов, другие виды целлюлозы, камеди или их смеси.
[00136] Любриканты, которые могут использоваться для образования фармацевтических композиций и дозированных форм по изобретению включают, не ограничиваясь перечисленным, кальция стеарат, магния стеарат, минеральное масло, светлое минеральное масло, глицерин, сорбитол, маннитол, полиэтиленгликоль, другие гликоли, стеариновую кислоту, натрия лаурилсульфат, тальк, гидрогенизированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, сезамовое масло, оливковое масло, кукурузное масло и соевое масло), цинка стеарат, этилолеат, этиллауреат, агар или их смеси. Дополнительные любриканты включают, к примеру, силоидный силикагель, коагулированный аэрозоль синтетического оксида кремния или их смеси. Любрикант может, необязательно, добавляться в количестве менее чем приблизительно 1 процент по массе фармацевтической композиции.
[00137] В некоторых случаях коллоидные частицы включают по меньшей мере один катионный агент и по меньшей мере одно неионное поверхностно-активное вещество, такое как полоксамер, тилоксапол, полисорбат, полиоксиэтиленовое производное касторового масла, сорбитановый эфир или полиоксилстеарат. В некоторых случаях катионный агент является алкиламином, третичным алкиламином, четвертичным аммонийным соединением, катионным липидом, аминоспиртом, бигуанидиновой солью, катионным соединением или их смесью. В некоторых случаях катионный агент является бигуанидиновой солью, такой как хлоргексидин, полиаминопропилбигуанидин, фенформин, алкилбигуанидин, или их смесью. В некоторых случаях четвертичное аммонийное соединение является бензалкония галидом, лаурилалкония галидом, цетримидом, гексадецилтриметиламмония галидом, тетрадецилтриметиламмония галидом, додецилтриметиламмония галидом, цетримония галидом, бензетония галидом, бегеналкония галидом, цеталкония галидом, цететилдимония галидом, цетилпиридиния галидом, бензододециния галидом, хлораллилметенамина галидом, миристилалкония галидом, стеарилалкония галидом или смесью двух или более из перечисленного. В некоторых случаях катионный агент является бензалкония хлоридом, лаурилалкония хлоридом, бензододециния бромидом, бензетония хлоридом, гексадецилтриметиламмония бромидом, тетрадецилтриметиламмония бромидом, додецилтриметиламмония бромидом или смесью двух или более из перечисленного. В некоторых случаях масляная фаза представляет собой минеральное масло и светлое минеральное масло, триглецириды со средней длиной цепи (МСТ), кокосовое масло; гидрогенизированные масла, содержащие гидрогенизированное хлопковое масло, гидрогенизированное пальмовое масло, гидрогенизированное касторовое масло или гидрогенизированное соевое масло; полиоксиэтиленовые производные гидрогенизированного касторового масла, содержащие полиоксил-40 гидрогенизированное касторовое масло, полиоксил-60 гидрогенизированное касторовое масло или полиоксил-100 гидрогенизированное касторовое масло.
[00138] Если для перорального введения желательны водные суспензии и/или эликсиры, то их активный компонент может быть совмещен с различными подсластителями или вкусовыми добавками, красителями или подкрашивающими добавками и, при желании, эмульгаторами и/или суспендирующими средствами, вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин и их различные комбинации.
[00139] Таблетки могут не иметь оболочки или могут быть покрыты по известным способам, чтобы задержать дезинтеграцию и абсорбцию в желудочно-кишечном тракте и обеспечить длительное действие в течение более длительного периода времени. К примеру, может использоваться материал для задерживания времени, такой как глицерилмоностеарат или глицерилдистеарат. Составы для перорального использования также могут быть выполнены в виде твердых желатиновых капсул, в которых активный компонент смешан с инертным твердым разбавителем, к примеру, кальция карбонатом, кальция фосфатом или каолином, или в виде мягких желатиновых капсул, в которых активный компонент смешан с водой или масляной средой, к примеру, арахисовым маслом, жидким парафином или оливковым маслом.
[00140] Поверхностно-активные вещества, которые могут использоваться для составления фармацевтических композиций и дозированных форм по изобретению, включают, не ограничиваясь перечисленным, гидрофильные поверхностно-активные вещества, липофильные поверхностно-активные вещества и их смеси. Таким образом, может использоваться смесь гидрофильных поверхностно-активных веществ, смесь липофильных поверхностно-активных веществ или смесь из по меньшей мере одного гидрофильного поверхностно-активного вещества и по меньшей мере одного липофильного поверхностно-активного вещества.
[00141] Подходящее гидрофильное поверхностно-активное вещество может в общем случае иметь величину HLB по меньшей мере равную 10, а подходящие липофильные поверхностно-активные вещества могут в общем случае иметь величину HLB, равную или меньшую чем приблизительно 10. Эмпирическим параметром для описания относительных гидрофильности и гидрофобности неионных амфифильных соединений служит баланс гидрофильности-липофильности (величина «HLB»). Поверхностно-активные вещества с меньшими величинами HLB более липофильны или гидрофобны и более растворимы в жирах, а поверхностно-активные вещества с большими величинами HLB более гидрофильны и более растворимы в водных растворах. Гидрофильными поверхностно-активными веществами обычно считаются соединения с величиной HLB выше приблизительно 10, а также анионные, катионные или цвиттерионные соединения, к которым шкала HLB в общем не применима. Аналогичным образом, липофильными (т.е. гидрофобными) поверхностно-активными веществами являются соединения с величиной HLB, равной или меньшей приблизительно 10. Тем не менее, величина HLB поверхностно-активного вещества является довольно грубой оценкой, обыкновенно используемой для разработки промышленных, фармацевтических и косметических эмульсий.
[00142] Гидрофильные поверхностно-активные вещества могут быть ионными или неионными. Подходящие ионные поверхностно-активные вещества включают, не ограничиваясь перечисленным, соли алкиламмония; соли фузидиевой кислоты; жирнокислотные производные аминокислот, олигопептидов и полипептидов: глицеридные производные аминокислот, олигопептидов и полипептидов; лецитины и гидрогенизированные лецитины; лизолецитины и гидрогенизированные лизолецитины; фосфолипиды и их производные; лизофосфолипиды и их производные; соли жирнокислотных эфиров карнитина; соли алкилсульфатов; соли жирных кислот; натрия докузат; ацилактилаты; моно- и диацетилированные эфиры винной кислоты моно- и диглицеридов; сукцинилированные моно- и диглицериды; эфиры лимонной кислоты моно- и диглицеридов; и их смеси.
[00143] В группе выше ионные поверхностно-активные вещества включают, в качестве примера: лецитины, лизолецитин, фосфолипиды, лизофосфолипиды и их производные; соли жирнокислотных эфиров карнитина; соли алкилсульфатов: соли жирных кислот; натрия докузат; ацилактилаты; моно- и диацетилированные сложные эфиры винной кислоты моно- и диглицеридов; сукцинилированные моно- и диглицериды; сложные эфиры лимонной кислоты моно- и диглицеридов; и их смеси.
[00144] Ионные поверхностно-активные вещества могут представлять собой ионизированные формы лецитина, лизолецитина, фосфатидилхолина, фосфатидилэтаноламина, фосфатидилглицерина, фосфатидиновой кислоты, фосфатидилсерина, лизофосфатидилхолина, лизофосфатидилэтаноламина, лизофосфатидилглицерина, лизофосфатидиновой кислоты, лизофосфатидилсерина, ПЭГ-фосфатидилэтаноламина, ПВП-фосфатидилэтаноламина, лактатные сложные эфиры жирных кислот, стеароил-2-лактат, стеароиллактат, сукцинилированные моноглицериды, моно/диацетилированные сложные эфиры винной кислоты моно/диглицеридов, сложные эфиры лимонной кислоты моно/диглицеридов, холилсаркозин, капроат, каприлат, капрат, лаурат, миристат, пальмитат, олеат, рицинолеат, линолеат, линоленат, стеарат, лаурилсульфат, терацецилсульфат, докузат, лауроилкарнитины, пальмитоилкарнитины, миристоилкарнитины и их соли и смеси.
[00145] Гидрофильные неионные поверхностно-активные вещества могут включают, не ограничиваясь перечисленным, алкилгликозиды; алкилмальтозиды; алкилтиогликозиды; лаурилмакроголглицериды; полиоксиалкиленалкиловые простые эфиры, такие как полиэтиленгликольалкиловые простые эфиры; полиоксиалкиленалкилфенолы, такие как полиэтиленгликольалкилфенолы; сложные эфиры жирных кислот и полиоксиалкиленалкилфенолов, такие как сложные моноэфиры жирных кислот и полиэтиленгликоля и сложные диэфиры жирных кислот и полиэтиленгликоля; сложные эфиры жирных кислот и полиэтиленгликольглицерина; сложные эфиры жирных кислот и полиглицерина; сложные эфиры жирных кислот и полиоксиалкиленсорбитана, такие как сложные эфиры жирных кислот и полиэтиленгликольсорбитана; гидрофильные продукты трансэтерификации полиолов с по меньшей мере одним членом из группы, состоящей из глицеридов. растительных масел, гидрогенизированных растительных масел, жирных кислот и стеринов; полиоксиэтиленстерины, их производные и аналоги; полиоксиэтилированные витамины и их производные; полиоксиэтилен-полиоксипропилен блок-кополимеры; и их смеси; полиэтиленгликольсорбитановые сложные эфиры жирных кислот и гидрофильные продукты трансэтерификации полиолов с по меньшей мере одним членом из группы, состоящей из триглицеридов, растительных масел и гидрогенизированных растительных масел. Полиол может быть глицерином, этиленгликолем, полиэтиленгликолем, сорбитолом, пропиленгликолем, пентаэритритолом или сахаридом.
[00146] Другие гидрофильные неионные поверхностно-активные вещества включают, не ограничиваясь перечисленным, ПЭГ-10 лаурат, ПЭГ-12 лаурат, ПЭГ-20 лаурат, ПЭГ-32 лаурат, ПЭГ-32 дилаурат, ПЭГ-12 олеат, ПЭГ-15 олеат, ПЭГ-20 олеат, ПЭГ-20 диолеат, ПЭГ-32 олеат, ПЭГ-200 олеат, ПЭГ-400 олеат, ПЭГ-15 стеарат, ПЭГ-32 дистеарат, ПЭГ-40 стеарат, ПЭГ-100 стеарат, ПЭГ-20 дилаурат, ПЭГ-25 глицерил триолеат, ПЭГ-32 диолеат, ПЭГ-20 глицерил лаурат, ПЭГ-30 глицерил лаурат, ПЭГ-20 глицерил стеарат, ПЭГ-20 глицерил олеат, ПЭГ-30 глицерил олеат, ПЭГ-30 глицерил лаурат, ПЭГ-40 глицерил лаурат, ПЭГ-40 пальмоядровое масло, ПЭГ-50 гидрогенизированное касторовое масло, ПЭГ-40 касторовое масло, ПЭГ-35 касторовое масло, ПЭГ-60 касторовое масло, ПЭГ-40 гидрогенизированное касторовое масло, ПЭГ-60 гидрогенизированное касторовое масло, ПЭГ-60 кукурузное масло, ПЭГ-6 капринат/каприлатглицериды, ПЭГ-8 капринат/каприлатглицериды, полиглицерил-10 лаурат, ПЭГ-30 холестерин, ПЭГ-25 фитостерин, ПЭГ-30 соевый стерол, ПЭГ-20 триолеат, ПЭГ-40 сорбитан олеат, ПЭГ-80 сорбитан лаурат, полисорбат 20, полисорбат 80, РОЕ-9 лауриловый эфир, РОЕ-23 лауриловый эфир, РОЕ-10 олеиновый эфир, РОЕ-20 олеиновый эфир, РОЕ-20 стеариновый эфир, токоферил ПЭГ-100 сукцинат, ПЭГ-24 холестерин, полиглицерил-10 олеат, Твин 40, Твин 60, сахарозы моностеарат, сахарозы монопаурат, сахарозы монопальмитат, ПЭГ 10-100 нонилфеноловую серию, ПЭГ 15-100 октилфеноловую серию и полоксамеры.
[00147] Подходящие липофильные поверхностно-активные вещества включают, исключительно в качестве примера: жирные спирты; сложные эфиры жирных кислот и глицерина; ацетилированные сложные эфиры жирных кислот и глицерина; сложные эфиры жирных кислот и низших спиртов; сложные эфиры жирных кислот и пропиленгликоля; сложные эфиры жирных кислот и сорбитана; сложные эфиры жирных кислот и полиэтиленсорбитана; стеролы и производные стерола; полиоксиэтилированные стеролы и производные стерола; простые алкильные эфиры полиэтиленгликоля; сложные эфиры сахара; простые эфиры сахара; молочнокислые производные моно- и диглицеридов; гидрофобные продукты трансэтерификации полиолов с по меньшей мере одним членом из группы, состоящей из глицеридов, растительных масел, гидрогенизированных растительных масел, жирных кислот и стеролов; жирорастворимые витамины/производные витаминов; и их смеси. В пределах этой группы предпочтительные липофильные поверхностно-активные вещества включают сложные эфиры жирных кислот и глицерина, сложные эфиры жирных кислот и пропиленгликоля и их смеси, либо гидрофобные продукты трансэтерификации полиолов с по меньшей мере одним членом из группы, состоящей из растительных масел, гидрогенизированных растительных масел и триглицеридов.
[00148] В одном варианте воплощения композиция может включать солюбилизатор для обеспечения хорошей солюбилизации и/или растворения соединения по настоящему изобретению и для минимизации осаждения соединения по настоящему изобретению. Это может быть особенно важно для композиций для не-перорального применения, например, инъекционных композиций. Солюбилизатор также может добавляться для повышения растворимости гидрофильного лекарственного средства и/или других компонентов, таких как поверхностно-активные вещества, или для поддержания композиции в виде стабильного или гомогенного раствора или дисперсии.
[00149] Примеры подходящих солюбилизаторов включают, не ограничиваясь перечисленным, следующие: спирты и полиолы, такие как этанол, изопропиловый спирт, бутанол, бензиловый спирт, этиленгликоль. пропиленгликоль, бутандиолы и их изомеры, глицерин, пентаэритрит, сорбит, маннитол, транскутол, диметилизосорбид, полиэтиленгликоль, полипропиленгликоль, поливиниловый спирт, гидроксипропилметилцеллюлозу и другие производные целлюлозы, циклодекстрины и производные циклодекстрина; эфиры полиэтиленгликолей со средней молекулярной массой от приблизительно 200 до приблизительно 6000, такие как тетрагидрофурфурилового спирта ПЭГ-эфир (гликофурол) или метокси ПЭГ; амиды и другие азотсодержащие соединения, такие как 2-пирролидон, 2-пиперидон, ε-капролактам, N-алкилпирролидон, N-гидроксиалкилпирролидон, N-алкилпиперидон, N-алкилкапролактам, диметилацетамид и поливинилпирролидон; эфиры, такие как этилпропионат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилцитрат, этилолеат, этилкаприлат, этилбутират, триацетин, пропиленгликоля моноацетат, пропиленгликоля диацетат, ε-капролактон и его изомеры, δ-валеролактон и его изомеры, β-бутиролактон и его изомеры; и другие солюбилизаторы, известные в данной области техники, такие как диметилацетамид, диметилизосорбид, N-метилпирролидоны, монооктаноин, диэтиленгликоля моноэтиловый эфир, а также вода В различных вариантах воплощения в качестве солюбилизитора применяется солюбилизатор, содержащий полигликолевые моно- и диэфиры 12-гидроксистеариновой кислоты и приблизительно 30% свободного полиэтиленгликоля (доступен под названием Solutol HS 15).
[00150] Также могут использоваться смеси солюбилизаторов. Примеры включают, не ограничиваясь перечисленным, триацетин, триэтилцитрат, этилолеат, этилкаприлат, диметилацетамид, N-метилпирролидон, N-гидроксиэтилпирролидон, поливинилпирролидон, гидроксипропилметилцеллюлозу, гидроксипропилциклодекстрины, этанол, полиэтиленгликоль 200-100, гликофурол, транскутол, пропиленгликоль и диметилизосорбид. К особенно предпочтительным солюбилизаторам относятся сорбитол, глицерин, триацетин, этиловый спирт, ПЭГ-400, гликофурол и пропиленгликоль.
[00151] Количество солюбилизатора, которое может включаться, не ограничено конкретно. Количество данного солюбилизатора может быть ограничено до биодоступного количества, которое может быть легко определено специалистом в данной области техники. В некоторых случаях может быть выгодным включать солюбилизатор в количествах значительно выше уровня биодоступности, к примеру, чтобы максимизировать концентрацию лекарственного средства, а избыток солюбилизатора удалять до введения композиции субъекту по удобным способам, таким как дистилляция или испарение. Таким образом, если он присутствует, солюбилизатор может находиться в массовом отношении 10%, 25%, 50%, 100%, или до приблизительно 200% по массе, относительно обшей массы лекарственного средства и других вспомогательных компонентов. При желании, также могут использоваться очень малые количества солюбилизатора, такие как 5%, 2%, 1% и даже меньшие. Как правило, солюбилизатор может присутствовать в количестве от приблизительно 1% до приблизительно 100%, обычно от приблизительно 5% до приблизительно 25% по массе.
[00152] Композиция может дополнительно включать один или более фармацевтически приемлемых вспомогательных компонентов и добавок. Такие добавки и вспомогательные компоненты включают, не ограничиваясь перечисленным, средства для снижения липкости, пеногасители, буферные агенты полимеры, антиоксиданты, консерванты, хелатирующие средства, модуляторы вязкости, регуляторы тоничности, ароматизаторы, красители, вкусовые добавки, замутнители, суспендирующие средства, связующие агенты, наполнители, пластификаторы, любриканты и их смеси.
[00153] Помимо этого, для облегчения производства, повышения стабильности или по другим причинам, в композицию может вводиться кислота или основание. Примеры фармацевтически приемлемых оснований включают аминокислоты, эфиры аминокислот, аммония гидроксид, калия гидроксид, натрия гидроксид, натрия гидрокарбонат, алюминия гидроксид, кальция карбонат, магния гидроксид, магния-алюминия силикат, синтетический алюминия силикат, синтетический гидрокальцит, магния-алюминия гидроксид, диизопропилэтиламин, этаноламин, этилендиамин, триэтаноламин, триэтилмин, триизопропаноламин, триметиламин, трис(гидроксиметил)аминометан (ТРИС) и так далее. Также пригодны основания, являющиеся солями фармацевтически приемлемой кислоты, такой как уксусная кислота, акриловая кислота, адипиновая кислота, альгиновая кислота, алкансульфоновая кислота, аминокислоты, аскорбиновая кислота, бензойная кислота, борная кислота, масляная кислота, угольная кислота, лимонная кислота, жирные кислоты, муравьиная кислота, фумаровая кислота, глюконовая кислота, гидрохиносульфоновая кислота, изоаскорбиновая кислота, молочная кислота, малеиновая кислота, щавелевая кислота, пара-бромфенилсульфоновая кислота, пропионовая кислота, п-толуилсульфоновая кислота, салициловая кислота, стеариновая кислота, янтарная кислота, дубильная кислота, винная кислота, тиогликолевая кислота, толуилсульфоновая кислота, мочевая кислота и т.п. Также могут применяться соли полипротонных кислот, такие как натрия фосфат, натрия гидрофосфат и натрия дигидрофосфат. Если в качестве основания выступает соль, катионом может служить любой обыкновенный и фармацевтически приемлемый катион, такой как аммонийный, щелочных металлов, щелочноземельных металлов и т.д. Примеры могут включать, не ограничиваясь перечисленным, натрий, калий, литий, магний, кальций и аммоний.
[00154] Подходящие кислоты являются фармацевтически приемлемыми органическими или неорганическими кислотами. Примерами подходящих неорганических кислот служат хлороводородная кислота, бромоводородная кислота, иодоводородная кислота, серная кислота, азотная кислота, борная кислота, фосфорная кислота и т.д. Примеры подходящих органических кислот включают уксусную кислоту, акриловую кислоту, адипиновую кислоту, альгиновую кислоту, алкансульфоновые кислоты, аминокислоты, аскорбиновую кислоту, бензойную кислоту, борную кислоту, масляную кислоту, угольную кислоту, лимонную кислоту, жирные кислоты, муравьиную кислоту, фумаровую кислоту, глюконовую кислоту, гидрохиносульфоновую кислоту, изоаскорбиновую кислоту, молочную кислоту, малеиновую кислоту, метансульфоновую кислоту, щавелевую кислоту, пара-бромфенилсульфоновую кислоту, пропионовую кислоту, п-толуилсульфоновую кислоту, салициловую кислоту, стеариновую кислоту, янтарную кислоту, дубильную кислоту, винную кислоту, тиогликолевую кислоту, толуилсульфоновую кислоту, мочевую кислоту и т.п.
[00155] Фармацевтические композиции для инъекций. В некоторых вариантах воплощения по изобретению предлагается фармацевтическая композиция для инъекций, содержащая соединение по настоящему изобретению и фармацевтический вспомогательный компонент, пригодный для инъекций. Компоненты и количества средств в композициях соответствуют описанным здесь.
[00156] Формы, в которые могут включаться новые композиции по настоящему изобретению для инъекционного введения включают водные или масляные суспензии или эмульсии с сезамовым маслом, кукурузным маслом, хлопковым маслом или арахисовым маслом, а также эликсиры, маннитол, декстрозу или стерильный водный раствор, и аналогичные фармацевтические носители.
[00157] Также обычно для инъекций используются водные растворы в солевом растворе. Помимо этого, могут применяться этанол, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобное (и их подходящие смеси), производные циклодекстрина и растительные масла. Нужная текучесть может поддерживаться, к примеру, путем использования покрытий, таких как лецитин, для поддержания необходимого размера частиц при дисперсии и путем использования поверхностно-активных веществ. Воздействие микроорганизмов может быть предотвращено различными антибактериальными и противогрибковыми средствами, к примеру, парабенами, хлорбутанолом, фенолом, сорбиновой кислотой, тимеросалом и т.п.
[00158] Стерильные инъекционные растворы изготавливаются путем включения соединения по настоящему изобретению в необходимом количестве в подходящий растворитель с различными дополнительными компонентами, перечисленными выше, с последующей стерилизацией фильтрованием при необходимости. В общем, дисперсии изготавливаются путем включения различных стерильных активных компонентов в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые компоненты из вышеперечисленных. В случае стерильных порошков для приготовления стерильных инъекционных растворов, определенными желательными способами изготовления служат сушка под вакуумом и сушка при замораживании, которые дают порошок активного компонента с любым дополнительным желательным компонентом из ранее стерильно профильтрованного его раствора.
[00159] Фармацевтические композиции для местного (например, трансдермального) нанесения. В некоторых вариантах воплощения по изобретению предлагается фармацевтическая композиция для трансдермальной доставки, содержащая соединение по настоящему изобретению и по меньшей мере один фармацевтический вспомогательный компонент, пригодный для трансдермальной доставки.
[00160] Композиции по настоящему изобретению могут быть составлены в виде препаратов твердой, мягкой или жидкой форм, пригодных для местного или поверхностного нанесения, таких как гели, водорастворимые желе, крема, лосьоны, суспензии, пены, порошки, взвеси, мази, растворы, масла, пасты, суппозитории, спреи, эмульсии, солевые растворы, растворы на основе диметилсульфоксида (ДМСО). В общем, чтобы обеспечить область длительного воздействия активных компонентов, подходят носители с более высокой плотностью. Наоборот, формы в виде растворов могут обеспечивать немедленное воздействие активного компонента на выбранную область.
[00161] Фармацевтические композиции могут также содержать подходящие твердые или гелевые носители или вспомогательные компоненты, которые представляют собой соединения, повышающие проникновение или способствующие доставке терапевтических молекул через эпидермальный барьер проницаемости кожи. Специалистам известно множество молекул для усиления проницаемости, используемых в формах для местного использования. Примеры таких носителей и вспомогательных компонентов включают, не ограничиваясь перечисленным, увлажнители (например, мочевину), гликоли (например, пропиленгликоль), спирты (например, этанол), жирные кислоты (например, олеиновую кислоту), поверхностно-активные вещества (например, изопропилмиристат и натрия лаурилсульфат), пирролидоны, глицерина монолаурат, сульфоксиды, терпены (например, ментол), амины, амиды, алканы, алканолы, воду, кальция карбонат, кальция фосфат, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
[00162] Другая типичная форма для использования по способам согласно настоящему изобретению представляет собой устройства для трансдермальной доставки («пластыри»). Такие трансдермальные пластыри могут использоваться для обеспечения длительного или прерывного поступления соединения по настоящему изобретению в контролируемых количествах, с другим средством или без него. Конструкция и использование трансдермальных пластырей для доставки фармацевтических средств хорошо известны в данной области техники. См., к примеру, патенты США №5023252, 4992445 и 5001139. Подобные пластыри могут быть сделаны так, чтобы обеспечивать непрерывную, периодическую доставку или доставку фармацевтических средств по требованию.
[00163] Фармацевтические композиции для ингаляций. Композиции для ингаляций или вдувания включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях, а также порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые вспомогательные компоненты, как описано выше. Предпочтительно, чтобы композиции вводились в дыхательные пути через рот или нос для местного или системного эффекта. Композиции в предпочтительных фармацевтически приемлемых растворителях могут распыляться при помощи инертных газов. Распыленные растворы могут вдыхаться непосредственно из небулайзера или же небулайзер может быть соединен с лицевой маской или дыхательным аппаратом с чередующимся положительным давлением. Растворы, суспензии или порошковые композиции могут вводиться, предпочтительно, через рот или нос, из устройств, которые доставляют состав подходящим образом.
[00164] В некоторых вариантах воплощения по изобретению предлагается фармацевтическая композиция для лечения расстройств зрения. Композиция изготавливается для глазного введения и содержит эффективное количество одного или более полиморфов по настоящему изобретению и фармацевтический вспомогательный компонент, пригодный для глазного введения. Фармацевтические композиции по изобретению, пригодные для глазного введения, могут представлять собой дискретные дозированные формы, такие как капли или спреи, каждая из которых содержит предустановленное количество активного компонента в виде раствора или суспензии в водной или неводной жидкости, эмульсии масло в воде или жидкой эмульсии вода в масле. Глазные капли могут быть изготовлены путем растворения активного компонента в стерильном водном растворе, таком как физиологический солевой раствор, буферный раствор и т.д., или путем комбинирования порошковых композиций, растворяемых перед использованием. Могут быть выбраны другие носители, которые, как известно в данной области техники, включают, не ограничиваясь перечисленным, балансированный солевой раствор, солевой раствор, водорастворимые полиэфиры, такие как полиэтиленгликоль, поливинилы, такие как поливиниловый спирт и повидон, производные целлюлозы, такие как метилцеллюлоза и гидроксипропилметилцеллюлоза, производные нефти, такие как минеральное масло и белый вазелин, животные жиры, такие как ланолин, полимеры акриловой кислоты, такие как карбоксимполиметиленовый гель, растительные жиры, такие как арахисовое масло, и полисахариды, такие как декстраны, и гликозаминогликаны, такие как натрия гиалуронат. При желании, могут добавляться добавки, которые обычно используются в глазных каплях. Такие добавки включают изотонические средства (например, натрия хлорид и т.д.), буферный агент (например, борная кислота, натрия гидрофосфат, натрия дигидрофосфат и т.д.), консерванты (например, бензалкония хлорид, бензетония хлорид, хлорбутанол и т.д.), загустители (например, сахариды, такие как лактоза, маннитол, мальтоза и т.д.; например, гиалуроновая кислота или ее соль, такая как натрия гиалуронат, калия гиалуронат и т.д.; например, мукополисахарид, такой как хондроитинсульфат и т.д.; например, натрия полиакрилат, карбоксивиниловый полимер, перекрестно-связанный полиакрилат, поливиниловый спирт, поливинилпирролидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза или иные средства, известные специалистам в данной области техники).
[00165] Другие фармацевтические композиции. Фармацевтические композиции могут быть также изготовлены из композиций, описанных здесь и одного или более фармацевтически приемлемых вспомогательных компонентов. пригодных для сублингвального, буккального, ректального, внутрикостного, внутриглазного, интраназального, эпидурального или интраспинального введения. Изготовление таких фармацевтических композиций хорошо известно в данной области техники. См., к примеру, Anderson, Philip О.; Knoben, James Е.; Troutman, William G, eds., Handbook of Clinical Drug Data, Tenth Edition, McGraw-Hill, 2002; Pratt and Taylor, eds., Principles of Drug Action, Third Edition, Churchill Livingston, New York, 1990; Katzung, ed., Basic and Clinical Pharmacology, Ninth Edition, McGraw Hill, 20037ybg; Goodman and Gilman, eds., The Pharmacological Basis of Therapeutics, Tenth Edition, McGraw Hill, 2001; Remingtons Pharmaceutical Sciences, 20th Ed., Lippincott Williams & Wilkins., 2000; Martindale, The Extra Pharmacopoeia, Thirty-Second Edition (The Pharmaceutical Press, London, 1999); которые включены сюда посредством ссылки во всей полноте.
[00166] Введение полиморфов или фармацевтической композиции по настоящему изобретению может выполняться по любому из способов, обеспечивающих доставку полиморфов в место воздействия. Эти способы включают пероральные пути, интрадуоденальные пути, парентеральные инъекции (включая внутривенные, внутриартериальные, подкожные, внутримышечные, внутрисосудистые, внутрибрюшинные инъекции или переливания), местные (например, трансдермальное нанесение), ректальное введение, посредством местной доставки катетером, стентом или посредством ингаляции. Полиморфы также могут вводиться в жировую ткань или интратекально.
[00167] Количество вводимого соединения будет зависеть от подвергаемого лечению млекопитающего, тяжести нарушения или состояния, скорости введения, расположения соединения и суждения лечащего врача. Однако эффективная доза лежит в пределах от приблизительно 0,001 до приблизительно 100 мг на кг массы тела в сутки, предпочтительно от приблизительно 1 до приблизительно 35 мг/кг/сутки, однократно или в несколько приемов. Для человека массой 70 кг, это будет составлять от приблизительно 0,05 до 7 г/сутки, предпочтительно от приблизительно 0,05 до приблизительно 2,5 г/сутки. В некоторых случаях уровни дозировок ниже нижнего предела указанного интервала могут быть более чем достаточны, а в других случаях могут использоваться еще более высокие дозы без вредных побочных эффектов, например, при разделении таких более крупных доз на несколько малых доз для введения в течение суток.
[00168] В некоторых вариантах воплощения соединение по изобретению вводится единой дозой. Как правило, такое введение будет являться инъекционным, например, внутривенной инъекцией, чтобы ввести средство быстро. Тем не менее, при необходимости, могут использоваться и другие пути. Одна доза соединения по изобретению может также использоваться для лечения острого состояния.
[00169] В некоторых вариантах воплощения соединение по изобретению вводится множественными дозами. Дозирование может осуществляться приблизительно один, два, три раза, четыре раза, пять раз, шесть раз или более шести раз в сутки. Дозирование может осуществляться приблизительно один раз в месяц, один раз каждые две недели, один раз в неделю или раз в двое суток. В другом варианте воплощения соединение по изобретению и другое средство вводятся совместно от приблизительно одного раза в сутки до приблизительно 6 раз в сутки. В другом варианте воплощения введение соединения по изобретению и средства длится менее чем приблизительно 7 суток. В еще одном варианте воплощения введение продолжается более чем приблизительно 6, 10, 14, 28 суток, двух месяцев, шести месяцев или одного года. В некоторых случаях добиваются непрерывного дозирования, которое поддерживают так долго, как это необходимо. В различных вариантах воплощения введение выполняют раз в неделю.
[00170] Введение средств по изобретению может продолжаться так долго, как это необходимо. В некоторых вариантах воплощения средство по изобретению вводится в течение более чем 1, 2, 3, 4, 5, 6, 7, 14 или 28 суток. В некоторых вариантах воплощения средство по изобретению вводится в течение менее чем 28, 14, 7, 6, 5, 4, 3, 2 или 1 суток. В некоторых вариантах воплощения средство по изобретению вводится регулярно и длительно, например, для лечения хронических эффектов.
[00171] Эффективное количество соединения по изобретению может вводиться либо однократными, либо множественными дозами по любому приемлемому пути введения для средств со схожими целями применения, включая ректальный, буккальный, интраназальный и трансдермальный пути, посредством внутриартериальной инъекции, внутривенно, внутрибрюшинно, парентерально, внутримышечно, подкожно, перорально, местно или в виде ингалянта.
[00172] Композиции по изобретению также могут доставляться при помощи пропитанного устройства или устройства с покрытием, такого как, к примеру, стент, или артериальный цилиндрический полимер. Такой способ введения может способствовать, к примеру, профилактике или ослаблению рестеноза после таких процедур как баллонная ангиопластика. Не ограничиваясь теорией, полиморфы по изобретению могут замедлять или ингибировать миграцию и пролиферацию клеток гладкой мускулатуры в артериальной стенке, участвующих в рестенозе. Соединение по изобретению может вводиться, к примеру, путем местной доставки из распорок стента, из стент-графта, из имплантов или из покрытия или оболочки стента. В некоторых вариантах воплощения соединение по изобретению примешано к матриксу. Таким матриксом может быть полимерный матрикс, который может служить для удержания соединения в стенте. Полимерные матриксы, пригодные для применения, включают, к примеру, лактонные сложные полиэфиры или кополиэфиры, такие как полилактид, поликапролактогликолид, полиортоэфиры, полиангидриды, полиаминокислоты, полисахариды, полифосфазены, поли (простой эфир-сложный эфир) кополимеры (например, PEO-PLLA); полидиметилсилоксан, поли(этилен-винилацетат), полимеры или кополимеры на основе акрилата (например, полигидроксиэтил метилметакрилат, поливинилпирролидон), фторированные полимеры, такие как политетрафторэтилен, и сложные эфиры целлюлозы. Подходящие матриксы могут быть нераспадающимися или же могут распадаться со временем, высвобождая соединение или соединения. Полиморфы по изобретению могут наноситься на поверхность стента посредством различных способов, таких как покрывание обмакиванием/с центрифугированием, спреевое покрывание, покрывание обмакиванием и/или покрывание кистью. Полиморфы могут вноситься в растворитель, а растворитель при испарении будет образовывать слой соединения на стенте. Альтернативно, соединение может располагаться в корпусе стента или импланта, к примеру, в микроканалах или микропорах. При имплантации соединение диффундирует из корпуса стента и контактирует с артериальной стенкой. Такие стенты могут изготавливаться путем обмакивания стента, произведенного так, чтобы он содержал такие микропоры или микроканалы, в раствор соединения по изобретению в подходящем растворителе с последующим испарением растворителя. Избыток лекарственного средства на поверхности стента может быть удален путем дополнительной краткой промывки в растворителе. В других вариантах воплощения полиморфы по изобретению могут быть ковалентно связаны со стентом или имплантом. Может применяться ковалентный линкер, который распадается in vivo, высвобождая соединение по изобретению. Для этой цели может примяться любая биолабильная связь, например, сложноэфирная, амидная или ангидридная связи. Полиморфы по изобретению, помимо этого, могут вводиться интраваскулярно из баллона, используемого при ангиопластике. Также, для снижения рестеноза, может выполняться экстраваскулярное введение полиморфов в составах по изобретению в перикард или адвентициально.
[00173] Может использоваться множество стентирующих устройств как описано в раскрытии, к примеру, следующих ссылок, все из которых включены сюда посредством ссылки: патент США №5451233; патент США №5040548; патент США №5061273; патент США №5496346; патент США №5292331; патент США №5674278; патент США №3657744; патент США №4739762; патент США №5195984; патент США №5292331; патент США №5674278; патент США №5879382; патент США №6344053.
[00174] Полиморфы по изобретению могут вводиться дозирование В данной области техники известно, что вследствие вариабельности между субъектами в фармакокинетике соединения, для оптимальной терапии необходим индивидуальный подбор режима дозирования. Дозирование соединения по изобретению может проводиться рутинно непосредственно по раскрытию.
[00175] По изобретению также предлагаются наборы. Наборы включают соединение или полиморфы по настоящему изобретению, как описано здесь, в подходящей упаковке, а также печатный материал, который может содержать рекомендации по применению, обсуждение клинических исследований, перечень побочных эффектов и тому подобное. Такие наборы также могут содержать информацию, такую как научные литературные источники, вкладыши, результаты клинических исследований и/или их обзоры и т.д., обозревающую или устанавливающую действия и/или преимущества композиции, и/или в которой описывается дозирование, введение, побочные эффекты, лекарственное взаимодействие или иная информация, необходимая поставщику услуг здравоохранения. Такая информация может основываться на результатах различных исследований, к примеру, исследований на подопытных животных в моделях in vivo и клинических испытаний на людях. Набор может дополнительно содержать другой агент. В некоторых вариантах воплощения соединение по настоящему изобретению и средство поставляются в виде отдельных композиций в отдельных контейнерах набора. В некоторых вариантах воплощения соединение по настоящему изобретению и средство поставляются в виде единой композиции в одном контейнере набора. В набор могут включаться подходящая упаковка и дополнительные предметы для применения (например, мерная чашечка для жидких препаратов, обертка из фольги для минимизации воздействия воздуха и т.п.), известные в данной области техники. Наборы, описанные здесь, могут поставляться, продаваться и/или предоставляться поставщикам услуг здравоохранения, в том числе врачам, сестрам, фармацевтам, должностным лицам в области фармацевтики и т.д. В некоторых вариантах воплощения наборы могут также продаваться непосредственно потребителям.
[00176] Полиморфы, описанные здесь, могут использоваться вместе со средствами, раскрытыми здесь, или иными подходящими средствами, в зависимости от подвергаемого терапии состояния. Поэтому в некоторых вариантах воплощения полиморфы по изобретению будут вводиться совместно с другими средствами, как описано выше. При использовании в комбинированной терапии, полиморфы, описанные здесь, могут вводиться отдельно или одновременно со вторым средством. Комбинированное введение может включать одновременное введение двух средств в одной дозированной форме, одновременное введение в раздельных дозированных формах и отдельное введение. Таким образом, соединение, описанное здесь и любое из средств, описанных выше, могут быть составлены в одну дозированную форму для одновременного введения. Альтернативно, соединение по настоящему изобретению и любое из средств, описанных выше, могут одновременно вводиться, причем оба средства будут находиться в отдельных формах. Альтернативно, следом за соединением по настоящему изобретению может вводиться любое из средств, описанных выше, или наоборот. По протоколу раздельного введения соединение по настоящему изобретению и любое из средств, описанных выше, могут вводиться с интервалом в несколько минут, несколько часов или несколько дней.
IV. ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ
[00177] По изобретению также предлагаются способы использования соединений или фармацевтических композиций по настоящему изобретению для лечения болезненных состояний, включая, но не ограничиваясь перечисленным, заболевания, ассоциированные с нарушением функционирования mTOR или одного и более типов киназ PI3.
[00178] Терапевтические способы, представленные здесь, содержат введение субъекту терапевтически эффективного количества соединения по изобретению. В одном варианте воплощения по настоящему изобретению предлагается способ лечения воспалительного нарушения, включая аутоиммунные заболевания у млекопитающего. Способ включает введение упомянутому млекопитающему терапевтически эффективного количества соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного. Примеры аутоиммунных заболеваний включают, не ограничиваясь перечисленным, острый диссеминированный энцефаломиелит (ОДЭМ), болезнь Аддисона, синдром антифосфолипидных антител (САА), апластическую анемию, аутоиммунный гепатит, целиакию, болезнь Крона, сахарный диабет (типа 1), синдром Гудпасчера, болезнь Грейвса, Синдром Гийена-Барре (СГБ), болезнь Хашимото, красную волчанку, множественный склероз, миастению гравис, синдром опсоклонуса-миоклонуса (СОМ), неврит зрительного нерва, тиреоидит Орда, пузырчатку, полиартрит, первичный билиарный цирроз, псориаз, ревматоидный артрит, синдром Рейтера, артериит Такаясу, темпоральный артериит (также известный как «гигантскоклеточный артериит»), теплую аутоиммунную гемолитическую анемию, гранулематоз Вегенера, общую алопецию, болезнь Шагаса, синдром хронической усталости, дизавтономию, эндометриоз, гнойный гидраденит, интерстициальный цистит, нейромиотонию, саркоидоз, склеродерму, язвенный колит, витилиго и вульводинию. Другие расстройства включают расстройства резорбции костей и тромбоз.
[00179] В некоторых вариантах воплощения способ лечения воспалительных или аутоиммунных заболеваний включает введение субъекту (например, млекопитающему) терапевтически эффективного количества одного или более соединений по настоящему изобретению, которые селективно ингибируют mTOR относительно всех других типов киназ. Подобное селективное ингибирование может быть выгодным при лечении любого из заболеваний или состояний, описанных здесь. К примеру, селективное ингибирование может ингибировать воспалительные ответы, ассоциированные с воспалительными заболеваниями, аутоиммунным заболеванием или заболеваниями, связанными с нежелательным иммунным ответом, включая, но не ограничиваясь перечисленным, астму, эмфизему, аллергию, дерматит, ревматоидный артрит, псориаз, красную волчанку или реакцию трансплантата против хозяина. Селективное ингибирование mTOR может дополнительно обеспечивать снижение воспалительного или нежелательного иммунного ответа без сопутствующего снижения способности подавлять бактериальную, вирусную и/или грибковую инфекцию. Селективное ингибирование обоих mTOR С1/С2 может быть выгодно для ингибирования воспалительного ответа у субъекта до более высокой степени, чем та, которая была бы обеспечена ингибиторами, селективно ингибирующими mTOR С1 или mTOR С2 по отдельности. В одном аспекте, один или более из рассматриваемых способов эффективны для снижения продукции in vivo антигенспецифического антитела приблизительно в 2 раза, 3 раза, 4 раза, 5 раз, 7,5 раз, 10 раз, 25 раз, 50 раз, 100 раз, 250 раз, 500 раз, 750 раз или приблизительно в 1000 раз или более. В другом аспекте, один или более из рассматриваемых способов эффективен для снижения продукции in vivo антигенспецифического IgG3 и/или IgGM приблизительно в 2 раза, 3 раза, 4 раза, 5 раз, 7,5 раз, 10 раз, 25 раз, 50 раз, 100 раз, 250 раз, 500 раз, 750 раз или приблизительно в 1000 раз или более.
[00180] В одном аспекте, один или более из рассматриваемых способов эффективен для облегчения симптомов, связанных с ревматоидным артритом, включая, но не ограничиваясь перечисленным, снижение отекания суставов, снижение уровней антиколлагена в сыворотке и/или снижение суставной патологии, такой как резорбция кости, повреждение хряща, паннус и/или воспаление. В другом аспекте рассматриваемые способы эффективны для снижения воспаления голеностопного сустава на по меньшей мере приблизительно 2, 5, 10, 15, 20, 25, 30, 50, 60% или от приблизительно 75% до 90%. В другом аспекте рассматриваемые способы эффективны для снижения воспаления коленного сустава на по меньшей мере приблизительно 2, 5, 10, 15, 20, 25, 30, 50, 60% или от приблизительно 75% до 90% или более. В еще одном аспекте рассматриваемые способы эффективны для снижения уровней антиколлагена типа II в сыворотке на по меньшей мере приблизительно 10, 12, 15, 20, 24, 25, 30, 35, 50, 60, 75, 80, 86, 87%, или приблизительно 90% или более. В другом аспекте рассматриваемые способы эффективны для снижения гистопатологической оценки голеностопного сустава на приблизительно 5, 10, 15, 20, 25, 30, 40, 50, 60, 75, 80, 90% или более. В еще одном аспекте рассматриваемые способы эффективны для снижения гистопатологической оценки коленного сустава на приблизительно 5, 10, 15, 20, 25, 30, 40, 50, 60, 75, 80, 90% или более.
[00181] В других вариантах воплощения, по настоящему изобретению предлагаются способы использования соединений или фармацевтических композиций для лечения дыхательных заболеваний, включая, но не ограничиваясь перечисленным, заболевания, влияющие на доли легкого, плевральную полость, бронхи, трахею, верхние дыхательные пути или дыхательные нервы и мышцы. К примеру, предлагаются способы для лечения обструктивного заболевания легких. Хроническая обструктивная болезнь легких (ХОБЛ) - сборный термин для обозначения группы заболеваний дыхательных путей, характеризующихся обструкцией или ограничиванием воздушного потока. Состояния, которые включены в этот термин: хронический бронхит, эмфизема и бронхоэктатическая болезнь.
[00182] В другом варианте воплощения соединения, описанные здесь, используются для лечения астмы. Также, соединения или фармацевтические композиции, описанные здесь, могут использоваться для лечения эндотоксемии и сепсиса. В одном варианте воплощения соединения или фармацевтические композиции, описанные здесь, используются для лечения ревматоидного артрита (РА). В еще одном варианте воплощения соединения или фармацевтические композиции, описанные здесь, используются для лечения контактного или атопического дерматита. Контактный дерматит включает ирритантный дерматит, фототоксический дерматит, аллергический дерматит, фотоаллергический дерматит, контактную крапивницу, системный контактный дерматит и т.д. Ирритантный дерматит может возникнуть при избыточном воздействии вещества на кожу или при чувствительности кожи к конкретному веществу. Атопический дерматит, иногда называемый экземой, является видом дерматита, атопическим заболеванием кожи.
[00183] Изобретение также относится к способу лечения гиперпролиферативного нарушения у млекопитающего, включающему введение упомянутому млекопитающему терапевтически эффективного количества соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного. В некоторых вариантах воплощения упомянутый способ относится к лечению онкологического заболевания, такого как острый миелолейкоз, онкологические заболевания тимуса, мозга, легкого, сквамозных клеток, кожи, глаз, ретинобластома, интраокулярная меланома, онкологические заболевания ротовой полости и ротоглотки, мочевого пузыря, желудка, живота, поджелудочной железы, мочевого пузыря, молочной железы, цервикальный рак, головы, шеи, почки, почечный рак, печени, яичника, предстательной железы, колоректальный рак, пищевода, яичка, гинекологический рак, щитовидной железы, ЦНС, ПНС, обусловленное СПИДом (например, лимфома и саркома Капоши) или вирусами. В некоторых вариантах воплощения упомянутый способ относится к лечению небластомного гиперпролиферативного нарушения, такого как доброкачественная гиперплазия кожи (например, псориаз), рестеноз или предстательной железы (например, доброкачественная гипертрофия предстательной железы (ДГПЖ)).
[00184] Изобретение также относится к способу лечения заболеваний, связанных с васкулогенезом или ангиогенезом у млекопитающего, включающему введение упомянутому млекопитающему терапевтически эффективного количества соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного. В некоторых вариантах воплощения упомянутый способ предназначен для лечения заболевания, выбранного из группы, состоящей из опухолевого ангиогенеза, хронического воспалительного заболевания, такого как ревматоидный артрит, атеросклероза, воспалительной болезни кишечника, кожных болезней, таких как псориаз, экзема и склеродерма, диабета, диабетической ретинопатии, ретинопатии недоношенных, возрастной макулярной дегенерации, гемангиомы, глиомы, меланомы, саркомы Капоши и рака яичника, молочной железы, легкого, поджелудочной железы, предстательной железы, ободочной кишки и эпидермоидного рака.
[00185] Пациенты, которые могут получать лечение соединениями по настоящему изобретению или фармацевтически приемлемой солью, эфиром, пролекарством, сольватом, гидратом или производным упомянутых соединений, согласно способам настоящего изобретения включают, к примеру, пациентов, у которых были диагностированы псориаз; рестеноз; атеросклероз; ДГПЖ; рак молочной железы, такой как проточный рак в ткани протока молочной железы, медуллярный рак, коллоидный рак, тубулярный рак и воспалительный рак молочной железы; рак яичника, включая эпителиальные опухоли яичника, такие как аденокарцинома яичника и аденокарцинома, мигрировавшая из яичника в брюшную полость; рак матки; цервикальный рак, такой как аденокарцинома эпителия цервикального канала, включая сквамозноклеточную карциному и аденокарциномы; рак предстательной железы, такой как рак предстательной железы, выбранный из следующего: аденокарцинома или аденокарцинома, мигрировавшая в кость; рак поджелудочной железы, такой как эпителиальный рак ткани протока поджелудочной железы и аденокарцинома протока поджелудочной железы; рак мочевого пузыря, такой как карцинома переходных клеток мочевого пузыря, уротелиальные карциномы (карциномы переходных клеток), опухоли уротелиальных клеток, лежащие в мочевом пузыре, сквамозноклеточные карциномы, аденокарциномы и виды мелкоклеточного рака; лейкоз, такой как острый миелолейкоз (ОМЛ), острый лимфоцитный лейкоз, хронический лимфоцитный лейкоз, хронический миелолейкоз, волосатоклеточный лейкоз, миелодисплазия, миелопролиферативные нарушения, острый миелогенный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ), мастоцитоз, хронический лимфоцитный лейкоз (ХЛЛ), множественная миелома (ММ) и миелодиспластический синдром (МДС); рак костей; рак легкого, такой как немелкоклеточный рак легкого (НМРЛ), который подразделяется на сквамозноклеточные карциномы, аденокарциномы и крупноклеточные недифференцированные карциномы, и мелкоклеточный рак легкого; рак кожи, такой как базальноклеточная карцинома, меланома, сквамозноклеточная карцинома и лучевой кератоз, который представляет собой состояние кожи, которое иногда перерождается в сквамозноклеточную карциному, ретинобластома глаза; кожная или интраокулярная (глазная) меланома; первичный рак печени (рак, происходящий из печени); рак почки; рак щитовидной железы, такой как папиллярный, фолликулярный, медуллярный и анапластический; СПИД-обусловленная лимфома, такая как диффузная крупно-B-клеточная лифома, B-клеточная иммунобластная лимфома и мелкоклеточная нерасщепленная лимфома; Саркома Капоши; вызванные вирусами виды рака, включая вирус гепатита B (HBV), вирус гепатита C (HCV) и печеночноклеточную карциному; лимфотропный вирус человека типа 1 (HTLV-1) и T-клеточный лейкоз/лимфома; и вирус папилломы человека (ВПЧ) и цервикальный рак; опухоли центральной нервной системы (ЦНС), такие как первичная опухоль мозга, которая включает глиомы (астроцитому, анапластическую астроцитому или мультиформную глиобластому), олигодендроглиома, эпендимома, менингимома, лимфома, шваннома и медуллобластома; онкологические заболевания периферической нервной системы (ПНС), такие как невромы слухового нерва и злокачественная опухоль оболочек периферического нерва (MPNST), включая нейрофибромы и шванномы, злокачественную фиброзную цитому, злокачественную фиброзную гистиоцитому, злокачественную менингиому, злокачественную мезотелиому и злокачественную смешанную мюллеровскую опухоль; рак ротовой полости и ротоглотки, такой как гипофарингеальный рак, ларингеальный рак, назофарингеальный рак и орофарингеальный рак; онкологические заболевания брюшной полости, такие как лимфомы, желудочные стромальные опухоли и карциноидные опухоли; онкологические заболевания яичка такие как герминогенные опухоли (GCT), которые включают семиномы и несеминомы, а также гонадные стромальные опухоли, которые включают опухоли из клеток Лейдига и опухоли из клеток Сертоли; онкологические заболевания тимуса, такие как тимомы, карциномы тимуса, болезнь Ходжкина, неходжкинские лимфомные карциноиды или карциноидные опухоли; ректальный рак; и рак ободочной кишки.
[00186] Пациенты, которые могут получать лечение соединениями по настоящему изобретению или фармацевтически приемлемой солью, эфиром, пролекарством, сольватом, гидратом или производным упомянутых соединений, согласно способам настоящего изобретения включают, к примеру, пациентов, у которых были диагностированы, не ограничиваясь перечисленным, невринома слухового нерва, аденокарцинома, рак надпочечника, рак анального канала, ангиосаркома (например, лимфангиосаркома, лимфангиоэндотелиосаркома, гемангиосаркома), доброкачественная моноклональная гаммапатия, билиарный рак (например, холангиокарцинома), рак мочевого пузыря, рак молочной железы (например, аденокарцинома молочной железы, папиллярная карцинома молочной железы, рак тела молочной железы, медуллярная карцинома молочной железы), рак мозга (например, менингиома; глиома, в т.ч., астроцитома, олигодендроглиома; медуллобластома), рак бронхов, цервикальный рак (например, цервикальная аденокарцинома), хориокарцинома, хордома, краниофарингиома, колоректальный рак (в т.ч., рак ободочной кишки, рак прямой кишки, колоректальная аденокарцинома), эпителиальная карцинома, эпендимома, эндотелиосаркома (в т.ч. саркома Капоши, множественная идиопатическая геморрагическая саркома), рак эндометрия, рак пищевода (в т.ч., аденокарцинома пищевода, аденокарцинома Барретта), саркома Юинга, семейная гиперэозинофилия, рак желудка (например, аденокарцинома желудка), желудочно-кишечная стромальная опухоль (GIST), опухоль головы и шеи (например, сквамозноклеточная карцинома головы и шеи, рак в полости рта (например, сквамозноклеточная карцинома в полости рта (OSCC)), болезнь тяжелых цепей (например, болезнь альфа-цепей, болезнь гамма-цепей, болезнь мю-цепей), гемангиобластома, воспалительные миофибробластные опухоли, иммуноцитный амилоидоз, рак почек (например, нефробластома или опухоль Вильмса, почечноклеточная карцинома), рак печени (например, печеночноклеточный рак (НСС), злокачественная гепатома), рак легкого (например, бронхогенная карцинома, мелкоклеточный рак легкого (МРЛ), немелкоклеточный рак легкого (НМРЛ), аденокарцинома легкого), лейкоз (например, острый лимфолейкоз (ОЛЛ), который включает ОЛЛ В-линии и ОЛЛ Т-линии, хронический лимфолейкоз (ХЛЛ), пролимфоцитный лейкоз (ПЛЛ), волосатоклетчный лейкоз (ВКЛ) и макроглобулинемия Вальденстрема (MB); периферические T-клеточные лимфомы (ПТКЛ). T-клеточные лейкоз/лимфомы у взрослых (ATL), кожная Т-клеточная лимфома (CTCL), крупногранулярный лимфоцитный лейкоз (LGF), болезнь Ходжкина и болезнь Рида-Стемберга; острый миелоцитарный лейкоз (ОМЛ), хронический миелоцитарный лейкоз (ХМЛ), хронический лимфолейкоз (ХЛЛ)), лимфома (например, ходжкинская лимфома (ХЛ), неходжкинская лимфома (НХЛ), фолликулярная лимфома, диффузная В-крупноклеточная лимфома (DLBCL), лимфома клеток зоны мантии (MCL)), лейомиосаркома (ЛМС), мастоцитоз (например, системный мастоцитоз), множественная миелома (ММ), миелодиспластический синдром (МДС), мезотелиома, миелопролиферативное нарушение (МПН) (например, полицитемия вера (ПВ), эссенциальный тромбоз (ЭТ), идиопатическая миелоидная метаплазия (АММ), также называемая миелофиброзом (МФ), хронический идиопатический миелофиброз, хронический миелоцитарный лейкоз (ХМЛ), хронический нейтрофильный лейкоз (ХНЛ), гиперэозинофильный синдром (ГЭС)), нейробластома, нейрофиброма (например, нейрофиброматоз (НФ) типа 1 или типа 2, шванноматоз), нейроэндокринный рак (например, гастроэнтеропанкреатическая нейроэндокринная опухоль (ГЭП-НЭО), карциноидная опухоль), остеосаркома, рак яичника (например, цистаденокарцинома, эмбриональная карцинома яичника, аденокарцинома яичника), болезнь Педжета вульвы, болезнь Педжета полового члена, папиллярная аденокарцинома, рак поджелудочной железы (например, аденокарцинома поджелудочной железы, внутрипротоковая папиллярно-муцинозная опухоль (IPMN)), пинеалома, примитивная нейроэктодермальная опухоль (PNT), рак предстательной железы (например, аденокарцинома предстательной железы), рабдомиосаркома, ретинобластома, рак слюнной железы, рак кожи (например, сквамозноклеточная карцинома (СКК), кератоакантома (КА), меланома, базальноклеточная карцинома (БКК)), рак тонкого кишечника (например, рак аппендикса), саркома мягкой ткани (например, злокачественная фиброзная гистиоцитома (ЗФГ), липосаркома, злокачественная опухоль оболочек периферических нервов (MPNST), хондросаркома, фибросаркома, миксосаркома), карцинома сальной железы, карцинома потовой железы, синовиома, рак яичка (например, семинома, эмбриональная карцинома яичка), рак щитовидной железы (например, папиллярная карцинома щитовидной железы, (РТС), медуллярный рак щитовидной железы) и макроглобулинемия Вальденстрема.
[00187] Изобретение также относится к способу лечения диабета у млекопитающего, включающему введение упомянутому млекопитающему терапевтически эффективного количества соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного.
[00188] Помимо этого, соединения, описанные здесь, могут применяться для лечения акне.
[00189] Также соединения, описанные здесь, могут применяться для лечения артериосклероза, включая атеросклероз. Артериосклероз является общим термином, определяющим любое уплотнение средних или крупных артерий. Атеросклероз обозначает уплотнение артерии конкретно по причине атероматозных бляшек.
[00190] Помимо этого, соединения, описанные здесь, могут применяться для лечения гломерулонефрита. Гломерулонефрит является первичным или вторичным аутоиммунным заболеванием почек, для которого характерно воспаление клубочков. Он может протекать бессимптомно или с гематурией и/или протеинурией. Выделяют множество его типов, в том числе острый, подострый и хронический гломерулонефрит. Его причины имеют инфекционный (бактериальный, вирусный или паразитарный), аутоиммунный или паранеопластический характер.
[00191] Помимо этого, соединения, описанные здесь, могут применяться при лечении бурсита, волчанки, острого диссеминированного энцефаломиелита (ОДЭМ), болезни Аддисона, синдрома антифосфолипидных антител (САА), апластической анемии, аутоиммунного гепатита, целиакии, болезни Крона, сахарного диабета (типа 1), синдрома Гудпасчера, болезни Грейвса, синдрома Гийена-Барре (СГБ), болезни Хашимото, воспалительной болезни кишечника, красной волчанки, множественного склероза, миастении гравис, синдрома опсоклонуса-миоклонуса (СОМ), неврита зрительного нерва, тиреоидита Орда, остеоартрита, увеоретинита, пемфигуса, полиартрита, первичного билиарного цирроза, синдрома Рейтера, артериита Такаясу, темпорального артериита, теплой аутоиммунной гемолитической анемии, гранулематоза Вегенера, общей алопеции, болезни Шагаса, синдрома хронической усталости, дизавтономии, эндометриоза, гнойного гидраденита, интерстициального цистита, нейромиотонии, саркоидоза, склеродермы, язвенного колита, витилиго, вульводинии, аппендицита, артериита, артрита, блефарита, бронхиолита, бронхита, цервицита, холангита, холецистита, хориоамнионита, колита, конъюктивита, цистита, дакриоаденита, дерматомиозита, эндокардита, эндометрита, энтерита, энтероколита, эпикондилита, эпидидимита, фасциита, фиброзита, гастрита, гастроэнтерита, гингивита, гепатита, гидраденита, илеита, ирита, ларингита, мастита, менингита, миелита, миокардита, миозита, нефрита, омфалита, оофорита, орхита, остеита, отита, панкреатита, паротита, перикардита, перитонита, фарингита, плеврита, флебита, пневмонии, проктита, простатита, пиелонефрита, ринита, сальпингита, синусита, стоматита, синовиита, тендонита, тонзиллита, увеита, вагинита, васкулита или вульвита.
[00192] Помимо этого, соединения по изобретению могут использоваться для лечения круглогодического аллергического ринита, мезентерита, перитонита, акродерматита, ангиодерматита, атопического дерматита, контактного дерматита, экземы, мультиформной экземы, интертриго, синдрома Сгивенса-Джонсона, токсического некролиза эпидермиса, кожной аллергии, острой аллергической реакции/анафилаксии, аллергического гранулематоза, гранулематоза Вегенера, аллергического конъюктивита, хориоретинита, конъюктивита, инфекционного кератоконъюктивита, кератоконъюктивита, офтальмии новорожденых, трахомы, увеита, воспаления глаз, блефароконъюктивита, мастита, гингивита, перикоронарита, фарингита, ринофарингита, сиаладенита, воспаления скелетно-мышечной системы, болезни Стиллау взрослых, болезни Бехчета, Бурсита, Хондрокальциноза, Дактилита, синдрома Фелти, подагры, инфекционного артрита, болезни Лайма, воспалительного остеоартрита, периартрита, синдрома Рейтера, вирусной инфекции Росс Ривер, острого респираторного дистресс-синдрома, острого бронхита, острого синусита, аллергического ринита, астмы, тяжелой рефракторной астмы, фарингита, плеврита, ринофарингита, сезонного аллергического ринита, синусита, астматического статуса, трахеобронхита, ринита, серозита, менингита, нейромиелита зрительного нерва, полиовирусной инфекции, синдрома Альпорта, баланита, эпидидимита, эпидидимоорхита, фокально-сегментарного гломерулосклероза, гломерулонефрита, нефропатии IgA (болезни Бергера), орхита, параметрита, воспалительной болезни орагнов таза, простатита, пиелита, пиелоцистита, пиелонефрита, гранулематоза Вегенера, гиперурикемии, аортита, артериита, хилоперикардита, синдрома Дресслера, эндартериита, эндокардита, экстракраниального темпорального артериита, ВИЧ-ассоциированного артериита, интракраниального темпорального артериита, болезни Кавасаки, Лимфангиофлебита, болезни Мондора, периартериита или перикардита.
[00193] В других аспектах соединения по изобретению применяются для лечения аутоиммнного гепатита, еюнита, мезентерита, мукозита, неалкогольного стеатогепатита, невирусного гепатита, аутоиммунного панкреатита, перигепатита, перитонита, резервуарного илеита, проктита, псевдомембранозного колита, ректосигмоита, сальпингоперитонита, сигмоидита, стеатогепатита, язвенного колита, синдрома Черджа-Стросса, язвенного проктита, синдрома раздраженного кишечника, желудочно-кишечного воспаления, острого энтероколита, анусита, некроза Бальсера, холецистита, колита, болезни Крона, дивертикулита, энтерита, энтероколита, энтерогепатита, эозинофильного эзофагита, эзофагита, гастрита, геморрагического энтерита, гепатита, гепатовирусной инфекции, гепатохолангита, гипертрофического гастрита, илеита, воспаления подвздошной кишки, саркоидоза, воспалительной болезни кишечника, анкилозирующего спондилита, ревматоидного артрита, ювенильного ревматоидного артрита, псориаза, псориатического артрита, волчанки (кожной/системной/почечной), СПИДа, агаммаглобулинемии, комплекса, связанного со СПИДом, болезни Брутона, синдрома Чедиака-Хигаси, вариабельного неклассифицируемого иммунодефицита, синдрома Ди Георге, дисгаммаглобулинемии, дефицита иммуноглобулинов, синдрома Джоба, синдрома Незелофа, фагоцит-бактерицидного нарушения, синдрома Вискотта-Олдрича, асплении, слоновости, гиперсплении, болезни Кавасаки, лимфаденопатии, лимфедемы, лимфоцеле, синдрома Нонне-Милроя-Мейге, болезни селезенки, спленомегалии, тимомы, болезни тимуса, периваскулита, флебита, плевроперикардита, узелкового полиартериита, васкулита, артериита Такаясу, темпорального артериита, тромбоангита, облитерирующего тромбоангита, тромбоэндокардита, тромбофлебита или ХОБЛ.
[00194] Изобретение также относится к способу лечения сердечно-сосудистого заболевания у млекопитающего, включающему введение упомянутому млекопитающему терапевтически эффективного количества соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного. Примеры сердечно-сосудистых состояний включают, не ограничиваясь перечисленным, атеросклероз, рестеноз, васкулярную окклюзию и каротидную обструктивную болезнь.
[00195] В другом аспекте настоящего изобретения предлагаются способы нарушения функционирования лейкоцита или нарушения функционирования остеокласта. Способ включает контактирование лейкоцита или остеокласта с нарушающим функцию количеством соединения по изобретению.
[00196] В другом аспекте настоящего изобретения предлагаются способы лечения болезни глаз путем введения одного или более обсуждаемых соединений или фармацевтических композиций в глаз субъекта.
[00197] Дополнительно предлагаются способы для введения соединений по настоящему изобретению в виде глазных капель, внутриглазной инъекции, интравитреальной инъекции, местно или путем использования устройства для вымывания лекарственного средства, микрокапсулы, импланта или микрофлюидного устройства. В некоторых случаях соединения по настоящему изобретению вводятся совместно с носителем или вспомогательным компонентом, который повышает интраокулярную проникающую способность соединения, таким как масло и водная эмульсия с коллоидными частицами, обладающими масляным ядром, окруженным поверхностной пленкой.
[00198] По изобретению дополнительно предлагаются способы модулирования киназной активности путем контактирования киназы с количеством соединения по изобретению, достаточным для модулирования активности киназы. Модулирование может заключаться в ингибировании или активации киназной активности. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности путем контактирования киназы с количеством соединения по изобретению, достаточным для ингибирования активности киназы. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в растворе путем контактирования указанного раствора с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанном растворе. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в клетке путем контактирования указанной клетки с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанной клетке. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в ткани путем контактирования указанной ткани с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанной ткани. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в организме путем контактирования указанного организма с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанном организме. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в животном путем контактирования указанного животного с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанном животном. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в млекопитающем путем контактирования указанного млекопитающего с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанном млекопитающем. В некоторых вариантах воплощения по изобретению предлагаются способы ингибирования киназной активности в человеке путем контактирования указанного человека с количеством соединения по изобретению, достаточным для ингибирования активности киназы в указанном человеке. В некоторых вариантах воплощения % киназной активности после контактирования киназы с соединением по изобретению меньше, чем 1, 5, 10, 20, 30, 40, 50, 60, 70, 80 90, 95 или 99% киназной активности в отсутствие упомянутого этапа контактирования.
[00199] В некоторых вариантах воплощения одно или более соединений по изобретению селективно ингибируют активность обоих видов mTor с величиной IC50 приблизительно 100 нМ, 50 нМ, 10 нМ, 5 нМ, 100 пМ, 10 пМ или даже 1 пМ или ниже, судя по киназному анализу in vitro.
[00200] В некоторых вариантах воплощения одно или более соединений или полиморфов по изобретению ингибируют фосфорилирование Akt (S473) и Akt (Т308) более эффективно, нежели рапамицин при тестировании в сравнимой молярной концентрации в киназном анализе in vitro.
[00201] В некоторых вариантах воплощения одно или более соединений или полиморфов по изобретению конкурируют с АТФ за связывание с АТФ-связывающим сайтом mTorC1 и/или mTorC2.
V. КОМБИНИРОВАННАЯ ТЕРАПИЯ
[00202] По настоящему изобретению также предлагаются способы для комбинированной терапии, по которым средство, которое, как известно, модулирует другие пути, или иные компоненты того же пути, или даже перекрывающиеся наборы ферментов-мишеней, используются совместно с соединением по настоящему изобретению, или с его фармацевтически приемлемой солью, эфиром, пролекарством, сольватом или производным. В одном аспекте такая терапия включает, но не ограничивается комбинацией рассматриваемого соединения с химиотерапевтическими средствами, терапевтическими антителами и лучевой терапией, чтобы обеспечить синергический или аддитивный терапевтический эффект.
[00203] В одном аспекте соединения или фармацевтические композиции по настоящему изобретению могут проявлять синергическую или аддитивную эффективность при введении в комбинации со средствами, ингибирующими продуцирование или активность IgE. Такая комбинация может снизить нежелательный эффект высокого уровня IgE, обусловленного использованием одного или более ингибиторов, если подобный эффект возникает. Это может быть особенно полезно при лечении аутоиммунных и воспалительных заболеваний (AIID), таких как ревматоидный артрит. Помимо этого, введение ингибиторов по настоящему изобретению в комбинации с ингибиторами PI3Kα, PI3Kδ или PI3Kδ/γ может также проявлять синергичность в усиленном ингибировании пути PI3K.
[00204] Средства, ингибирующие продукцию IgE, известны в данной области техники и включают, не ограничиваясь перечисленным, одно или более из TEI-9874, 2-(4-(6-циклогексилокси-2-нафтилокси)фенилацетамид)бензойной кислоты, рапамицина, аналогов рапамицина (т.н. рапалоги), ингибиторов TORC1, ингибиторов TORC2 и любых других соединений, которые ингибируют mTORC1 и mTORC2. Средства, которые ингибируют активность IgE, включают, к примеру, антитела против IgE, такие как, к примеру, Омализумаб и TNX-901.
[00205] Для лечения аутоиммунных заболеваний рассматриваемые соединения или фармацевтические композиции могут использоваться в комбинации с обычно прописываемыми лекарственными средствами, включая, но не ограничиваясь перечисленным, Enbrel®, Remicade®, Humira®, Avonex® и Rebif®. Для лечения дыхательных заболеваний, рассматриваемые соединения или фармацевтические композиции могут вводиться в комбинации с обычно прописываемыми лекарственными средствами, включая, но не ограничиваясь перечисленным, Xolair®, Advair®, Singulair® и Spiriva®.
[00206] Соединения по изобретению могут быть составлены или могут вводиться вместе с другими средствами, которые действуют путем облегчения симптомов воспалительных состояний, таких как энцефаломиелит, астма и другие заболевания, описанные здесь. Эти средства включают нестероидные противовоспалительные препараты (НПВП), например, ацетилсалициловую кислоту; ибупрофен; напроксен; индометацин; набуметон; толметин; и т.д. Кортикостероиды используются для снижения воспаления и подавления активности иммунной системы. Наиболее часто назначаемым средством этого типа является Преднизон. Хлорохин (Арален) или гидроксихлорохин (Плаквенил) также могут быть очень полезны для некоторых пациентов с волчанкой. Чаще всего они назначаются при кожных и суставных симптомах волчанки. Азатиоприн (Имуран) и циклофосфамид (Цитоксан) подавляют воспаление и оказывают супрессию на иммунную систему. Другие средства, например, метотрексат и циклоспорин, используются для контролирования симптомов волчанки. Антикоагулянты применяются, чтобы предотвратить быстрое сгущение крови. К ним относятся аспирин в очень малых дозах, препятствующих агрегации тромбоцитов и гепарин/кумадин. Другие средства, используемые при лечении волчанки, включают белимумаб (Benlysta®).
[00207] В еще одном аспекте, это изобретение также относится к фармацевтической композиции для ингибирования аномального клеточного роста у млекопитающего, включающей определенное количество соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного в комбинации с определенным количеством противоопухолевого средства (например, биотерапевтического химиотерапевтического средства). В настоящее время в данной области техники известно множество химиотерапевтических средств, которые могут использоваться в комбинации с соединениями по изобретению. Совместно с соединениями по изобретению также могут использоваться и другие виды противоопухолевой терапии, которые включают, не ограничиваясь перечисленным, хирургию и хирургическое лечение, а также лучевую терапию.
[00208] В некоторых вариантах воплощения химиотерапевтический препарат выбран из группы, состоящей из ингибиторов митоза, алкилирующих средств, антиметаболитов, интеркаляционных антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, средств, модифицирующих биологический ответ, антигормонов, ингибиторов ангиогенеза и антиандрогенов. Неограничивающими примерами служат химиотерапевтичекие средства, цитотоксические средства и непептидные малые молекулы, такие как Gleevec (иматиниба мезилат), Velcade (бортезомиб), Casodex (бикалутамид), Iressa (гефитиниб), а также Адриамицин в качестве основного химиотерапевтичекого средства. Неограничивающие примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXANTM); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленамин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретамина оксида гидрохлорид, мелфалан, новембицин, фенестрин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, CasodexTM, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицин, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозотоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флурадабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антагонисты функции надпочечников, такие как аминоглютетимид, митотан, трилостан; антагонисты фолиевой кислоты, такие как фролиниевая кислота; ацеглатон; альдофосфамида гликозид; аминолевулановую кислоту; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфомитин; эллиптиния ацетат; этоглюцид; галлия нитрат; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK.RTM.; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозин («Ara-С»); циклофосфамид; тиотепа; таксаны, например, паклитаксел (TAXOLTM, Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси) и доцетаксел (TAXOTERETM, Rhone-Poulenc Rorer, Антони, Франция); ретиноевая кислота; эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного. Также к подходящим химиотерапевтическим препаратам, воздействующим на клетки, причисляют антигормональные средства, которые регулируют или ингибируют гормональное воздействие на опухоли, такие как антиэстрогены, включая, к примеру, тамоксифен (Нольвадекс ТМ), ралоксифен, ингибиторы ароматазы 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен (Фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; камптотецин-11 (СРТ-11); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДФМО). При необходимости, соединения или фармацевтическая композиция по настоящему изобретению может использоваться в комбинации с обыкновенно назначаемыми противоопухолевыми препаратами, такими как Herceptin®, Avastin®, Erbitux®, Rituxan®, Taxol®, Arimidex®, Taxotere® и Velcade®.
[00209] Другие химиотерапевтические средства включают, не ограничиваясь перечисленным, антиэстрогены (например, тамоксифен, ралоксифен и мегестрол), агонисты РФЛГ (например, гозерелин и леупролид), антиандрогены (например, флутамид и бикалутамид), средства для фотодинамической терапии (например, вертопорфин (BPD-MA), фталоцианин, фотосенсибилизатор Рс4 и диметокси-гипокреллин A (2BA-2-DMHA)), азотистые иприты (например, циклофосфамид, ифосфамид, трофосфамид, хлорамбуцил, эстрамустин и мелфалан), нитрозомочевины (например, кармустин (BCNU) и ломустин (CCNU)), алкилсульфонаты (например, бусульфан и треосульфан), триазины (например, дакарбазин, темозоломид), соединения платины (например, цисплатин, карбоплатин, оксалиплатин), алкалоиды барвинка (например, винкристин, винбластин, виндезин и винорелбин), таксоиды (например, паклитаксел или эквивалент паклитаксела, такой как наночастицы альбумин-связанного паклитаксела (Абраксан), паклитаксел, связанный с докозагексеновой кислотой (DHA-паклитаксел, Таксопрексин), паклитаксел, связанный с полиглутаматом (PG-паклитаксел, паклитаксел полиглюмекс, СТ-2103, XYOTAX), активируемое в опухоли пролекарство (TAP) ANG1005 (Ангиопеп-2, связанный с тремя молекулами паклитаксела), паклитаксел-EC-1 (паклитаксел, связанный с erbB2-распознающим пептидом EC-1), и конъюгированный с глюкозой паклитаксел, например, 2'-паклитаксела метил-2-гликопиранозилсукцинат; доцетаксел, таксол), эпиподофиллины (например, этопозид, этопозида фосфат, тенипозид, топотекан, 9-аминокамптотецин, камптоиринотекан, иринотекан, криснатол, митомицин С), антиметаболиты, ингибиторы ДГФР (например, метотрексат, дихлорметотрексат, триметрексат, эдатрексат), ингибиторы ИМФ дегидрогеназы (например, микофеноловая кислота, тиазофурин, рибавирин и EICAR), ингибиторы рибонуклеотидредуктазы (например, гидроксимочевина и дефероксамин), урациловые аналоги (например, 5-фторурацил (5-FU), флоксуридин, доксифлуридин, ратитрексед, тегафур-урацил, капецитабин), цитозиновые аналоги (например, цитарабин (ага C), цитозина арабинозид и флударабин), пуриновые аналоги (например, меркаптопурин и тиогуанан), аналоги Витамина D3 (например, EB 1089, CB 1093 и KH 1060), ингибиторы изопренилирования (например, ловастатин), дофаминергические нейротоксины (например, 1-метил-4-фенилпиридиния ион), ингибиторы клеточного цикла (например, ставроспорин), актиномицин (например, актиномицин D, дактиномицин), блеомицин (например, блеомицин A2, блеомицин B2, пепломицин), антрациклин (например, даунорубицин, доксорубицин, пегилированный липосомальный доксорубицин, идарубицин, эпирубицин, пирарубицин, зорубицин, митоксантрон), ингибиторы МЛУ (например, верапамил), ингибиторы Ca2+ АТФазы (например, тапсигаргин), иматиниб, талидомид, леналидомид, ингибиторы тирозинкиназ (например, акситиниб (AGO 13736), бозутиниб (SKI-606), цедираниб (RECENTINTM, AZD2171), дазатиниб (SPRYCEL®, BMS-354825), эрлотиниб (TARCEVA®), гефитиниб (IRESSA®), иматиниб (Gleevec®, CGP57148B, STI-571), лапатиниб (TYKERB®, TYVERB®), ластавртиниб (СЕР-701), нератиниб (HKI-272), нилотиниб (TASIGNA®), семаксаниб (семаксиниб, SU5416), сунитиниб (SUTENT®, SU11248), тоцераниб (PALLADIA®), вандетаниб (ZACTIMA®, ZD6474), ваталаниб (PTK787, PTK/ZK), трастузумаб (HERCEPTIN®), бевацизумаб (AVASTIN®), ритуксимаб (RITUXAN®), цетуксимаб (ERBITUX®), панитумумаб (VECTIBIX®), ранибизумаб (Lucentis®), нилотиниб (TASIGNA®), сорафениб (NEXAVAR®), эверолимус (AFINITOR®), алемтузумаб (САМРАТН®), гемтузумаб озогамицин (MYLOTARG®), темсиролимус (TORISEL®), ENMD-2076, PCI-32765, АС220, довитиниба лактат (TKI258, CHIR-258), BIBW 2992 (TOVOKTM), SGX523, PF-04217903, PF-02341066, PF-299804, BMS-777607, АВТ-869, МР470, BIBF 1120 (VARGATEF®), АР24534, JNJ-26483327, MGCD265, DCC-2036, BMS-690154, СЕР-11981, тивозаниб (AV-951), OSI-930, MM-121, XL-184, XL-647, и/или XL228), ингибиторы протеасом (например, бортезомиб (Velcade)), ингибиторы mTOR (например, рапамицин, темсиролимус (CCI-779), эверолимус (RAD-001), ридафоролимус, АР23573 (Ariad), AZD8055 (AstraZeneca), BEZ235 (Novartis), BGT226 (Norvartis), XL765 (Sanofi Aventis), PF-4691502 (Pfizer), GDC0980 (Genetech), SF1126 (Semafoe) и OSI-027 (OSI)), облимерсен, гемцитабин, карминомицин, лейковорин, пеметрексед, циклофосфамид, дакарбазин, прокарбизин, преднизолон, дексаметазон, камптотецин, пликамицин, аспарагиназа, аминоптерин, метоптерин, порфиромицин, мелфалан, лейрозидин, лейрозин, хлорамбуцил, трабектидин, прокарбазин, дискодермолид, карминомицин, аминоптерин и гексаметилмеламин.
[00210] Типичные биотерапевтические средства включают, не ограничиваясь перечисленным, интерфероны, цитокины (например, фактор некроза опухолей, интерферон α, интерферон γ), вакцины, гемопоэтические факторы роста, моноклональную серотерапию, иммуностимуляторы и/или иммуномодуляторные средства (например, IL-1, 2, 4, 6 или 12), факторы роста иммунных клеток (например, ГМ-КСФ) и антитела (например, Герцептин (трастузумаб), T-DM1, AVASTIN (бевацизумаб), ERBITUX (цетуксимаб), Vectibix (панитумумаб). Rituxan (ритуксимаб), Bexxar (тозитумомаб)).
[00211] Это изобретение дополнительно относится к способу использования соединений или фармацевтической композиции в комбинации с лучевой терапией для ингибирования аномального клеточного роста или лечения гиперпролиферативного нарушения у млекопитающего. Способы лучевой терапии известны в данной области техники, и эти способы могут использоваться в комбинированной терапии, описанной здесь. Введение соединения по изобретению в этой комбинированной терапии может быть определено, как описано здесь.
[00212] Лучевая терапия может осуществляться по одному из нескольких способов или комбинации способов, включая, без ограничения, наружную дистанционную терапию, внутреннюю лучевую терапию, облучение имплантатом, стереотактическую радиохирургию, системную лучевую терапию, лучевую терапию и постоянную или временную интерстициальную брахитерапию. Термин «брахитерапия» при использовании здесь обозначает лучевую терапию, осуществляемую ограниченным в пространстве радиоактивным материалом, вставленным в организм рядом с опухолью или в нее, либо рядом с другим участком пролиферативной ткани или в него. Термин, не ограничиваясь перечисленным, включает подвергание воздействию радиоактивных изотопов (например, At-211, I-131, I-125, Y-90, Re-186, Re-188, Sm-153, Bi-212, P-32 и радиоактивных изотопов Lu). Подходящие источники радиации для использования в качестве клеточных кондиционеров по настоящему изобретению включают твердые и жидкие вещества. В качестве неограничивающего примера, источник радиации может быть радионуклидом, таким как I-125, I-131, Yb-169, Ir-192 в качестве твердого источника, I-125 в качестве твердого источника, или другими радионуклидами, испускающими фотоны, бета-частицы, гамма-излучение или другие терапевтические лучи. Радиоактивный материал также может быть жидкостью, изготовленной из любого раствора радионуклида(ов), например, раствора I-125 или I-131, либо радиоактивная жидкость может быть получена с использованием взвеси, состоящей из подходящей жидкости, содержащей мале частицы твердых радионуклидов, таких как Au-198, Y-90. Помимо этого, радионуклид(ы) может быть внедрен в гель или радиоактивные микросферы.
[00213] Не ограничиваясь какой-либо теорией, соединения по настоящему изобретению могут сделать аномальные клетки более чувствительными к лучевой терапии, чтобы убить и/или ингибировать рост таких клеток. Соответственно, данное изобретение дополнительно относится к способу сенсибилизирования аномальных клеток у млекопитающего для лечения облучением, включающему введение млекопитающему количества соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного, такого количества, которое эффективно для сенсибилизации аномальных клеток к лечению облучением. Количество соединения, соли или сольвата в этом способе может быть определено по средним достаточным эффективным количествам таких соединений, описанных здесь.
[00214] Соединения или фармацевтические композиции по настоящему изобретению могут использоваться в комбинации с количеством одного или более веществ, выбранных из подавляющих ангиогенез средств, ингибиторов передачи сигнала и антипролиферативных средств.
[00215] Средства против ангиогенеза, такие как ингибиторы ММР-2 (матричная металлопротеаза 2), ингибиторы ММР-9 (матричная металлопротеаза 9) и ингибиторы ЦОГ-11 (циклооксигеназа 11), могут применяться вместе с соединением по настоящему изобретению и фармацевтическими композициями, описанными здесь. Примеры пригодных ингибиторов ЦОГ-II включают CELEBREXTM (алекоксиб), вальдекоксиб и рофекоксиб. Примеры пригодных ингибторов матричных металлопротеаз описаны в WO 96/33172 (опубликовано 24 октября 1996 г.), WO 96/27583 (опубликовано 7 марта 1996 г.), Европейской патентной заявке №97304971.1 (подано 8 июля 1997 г.), Европейской патентной заявке №99308617.2 (подано 29 октября 1999 г.), WO 98/07697 (опубликовано 26 февраля 1998 г.), WO 98/03516 (опубликовано 29 января 1998 г.), WO 98/34918 (опубликовано 13 августа 1998 г.), WO 98/34915 (опубликовано 13 августа 1998 г.), WO 98/33768 (опубликовано 6 августа 1998 г.), WO 98/30566 (опубликовано 16 июля 1998 г.), Европейской патентной заявке 606046 (опубликовано 13 июля 1994 г.), Европейской патентной заявке 931788 (опубликовано 28 июля 1999 г.), WO 90/05719 (опубликовано 31 мая 1990 г.), WO 99/52910 (опубликовано 21 октября 1999 г.), WO 99/52889 (опубликовано 21 октября 1999 г.), WO 99/29667 (опубликовано 17 июня 1999 г.), Международной патентной заявке № РСТ/IB98/01113 (подано 21 июля 1998 г.). Европейской патентной заявке №99302232.1 (подано 25 марта 1999 г.), патентной заявке Великобритании №9912961.1 (подано 3 июня 1999 г.), предварительной заявке США №60/148464 (подано 12 августа 1999 г.), патенте США 5863949 (выдан 26 января 1999 г.), патенте США 5861510 (выдан 19 января 1999 г.) и Европейской патентной публикации 780386 (опубликовано 25 июня 1997 г.), все из которых включены сюда во всей полноте посредством ссылки. Предпочтительными ингибиторами ММР-2 и ММР-9 являются те, которые не обладают ингибирующей активностью по отношению к ММР-1 или обладают слабой такой активностью. Более предпочтительными являются те, которые селективно ингибируют ММР-2 и/или АМР-9 относительно других матричных металлопротеаз (т.е. МАР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторые конкретные примеры ингибиторов ММР, пригодных для использования в настоящем изобретении: AG-3340, RO 32-3555 и RS 13-0830.
[00216] Изобретение также относится к способу и фармацевтической композиции для лечения сердечнососудистого заболевания у млекопитающего, включающему определенное количество соединения по настоящему изобретению либо его фармацевтически приемлемой соли, эфира, пролекарства, сольвата, гидрата или производного, либо изотопно помеченного его производного, и определенное количество одного или более терапевтических средств, используемых для лечения сердечно-сосудистых заболеваний.
[00217] Примерами для использования при сердечно-сосудистых заболеваниях служат антитромботические средства, например, простациклин и салицилаты, тромболитические средства, например, стрептокиназа, урокиназа, активатор тканевого плазминогена (ТРА) и анизоилированный активатор комплекса плазминоген-стрептокиназа (APSAC), средства против агрегации тромбоцитов, например, ацетилсалициловая кислота (ASA) и клопидогрел, вазодилатирующие средства, например, нитраты, блокаторы кальциевых каналов, антипролиферативные средства, например, колхицин и алкилирующие средства, интеркалирующие средства, факторы, модулирующие рост, такие как интерлейкины, фактор-бета трансформации роста и аналоги тромбоцитарного фактора роста, моноклональные антитела, направленные против факторов роста, противовоспалительные средства, как стероидные, так и нестероидные, а также другие средства, которые могут модулировать сосудистый тонус, функцию, атеросклероз и заживляющий ответ в сосуде или органе после повреждения в результате вмешательства. Также в комбинации или покрытия, охватываемые изобретением, могут быть включены антибиотики. Помимо этого, покрытие может использоваться для осуществления терапевтической доставки непосредственно в сосудистую стенку. При внедрении активного средства в набухающий полимер, активное средство будет высвобождаться при набухании полимера.
[00218] Соединения, описанные здесь, могут быть выполнены или вводиться вместе с жидкими или твердыми тканевыми барьерами, также известными как любриканты. Примеры тканевых барьеров включают, не ограничиваясь перечисленным, полисахариды, полигликаны, сепрафильм, интерсед и гиалуроновую кислоту.
[00219] Лекарственные средства, которые могут вводиться вместе с соединениями, описанными здесь, включают любые пригодные соединения, с пользой доставляемые путем ингалирования, например, анальгетики, в т.ч. кодеин, дигидроморфин, эрготамин, фентанил или морфин; антиангинальные препараты, например, дилтиазем; антиаллергические препараты, например, кромогликат, кетотифен или недокромил; противоинфекционные средства, например, цефалоспорины, пенициллины, стрептомицин, сульфаниламиды, тетрациклины или пентамидин; антигистаминные средства, например, метапирилен; противовоспалительные средства, например, беклометазон, флунизолид, будезонид, типредан, триацинолона ацетонид или флутиказон; противокашлевые средства, например, носкапин; бронходилататоры, например, эфедрин, адреналин, фенотерол, формотерол, изопреналин, метапротеренол, фенилэфрин, фенилпропаноламин, пирбутерол, репротерол, римитерол, сальбутамол, сальметерол, тербуталин, изоэтарин, тулобутерол, орципреналин или (-)-4-амино-3,5-дихлор-α-[[[6-[2-(2-пиридинил)этокси]гексил]-амино]метил]бензилметанол; диуретики, например, амилорид; антихолинергические средства, например, ипратропий, атропин или окситропий; гормоны, например, кортизон, гидрокортизон или преднизолон; ксантины, например, аминофиллин, холина теофиллинат, лизина теофиллинат или теофиллин; и терапевтические белки и пептиды, например, инсулин или глюкагон. Специалисту в данной области техники понятно, что при необходимости лекарственные средства могут применяться в форме солей (например, солей щелочных металлов или аминов, или кислых солей добавления), или эфиров (например, низших алкиловых эфиров), или сольватов (например, гидратов) с целью оптимизации активности и/или стабильности лекарственного средства.
[00220] Другие типичные терапевтические средства, пригодные для комбинированной терапии, включают, не ограничиваясь перечисленным, лучевую терапию, антагонисты гормонов, гормоны и их рилизинг-факторы, тиреоидные и антитиреоидные препараты, эстрогены и прогестины, андрогены, адренокортикотропный гормон; адренокортикальные стероиды и их синтетические аналоги; ингибиторы синтеза и действия адренокортикальных гормонов, инсулин, пероральные гипогликемические средства и фармакологические средства эндокринной части поджелудочной железы, средства, влияющие на кальцификацию и обновление костной ткани: кальций, фосфаты, паратгормон, витамин D, кальцитонин, витамины, такие как водорастворимые витамины, комплекс витаминов B, аскорбиновую кислоту, жирорастворимые витамины, витамины A, K и E, факторы роста, цитокины, хемокины, агонисты и антагонисты мускариновых рецепторов; антихолинэстеразные средства: средства, воздействующие на нейромышечное соединение и/или автономные ганглии; катехоламины, симпатомиметические препараты и агонисты или антагонисты адренергических рецепторов; а также агонисты и антагонисты рецептора 5-гидрокситриптамина (5-ГТ, серотонина).
[00221] Терапевтические средства также могут включать средства против боли и воспаления, такие как гистамин и антагонисты гистамина, брадикинин и антагонисты брадикинина, 5-гидрокситриптамин (серотонин), липидные вещества, которые получаются путем биотрансформации продуктов селективного гидролиза мембранных фосфолипидов, эйкозаноидов, простагландинов, тромбоксанов, лейкотриенов, аспирина, нестероидных противовоспалительных препаратов, анальгетических-антипиретических средств, средств, которые ингибируют синтез простагландинов и тромбоксанов, селективные ингибиторы индуцируемой циклооксигеназы, селективные ингибиторы индуцируемой циклооксигеназы-2, автакоиды, паракринные гормоны, соматостатин, гастрин, цитокины, которые опосредуют взаимодействия гуморального и клеточного иммунных ответов, производные от липидов автакоиды, эйкозаноиды, β-адренергические агонисты, ипратропий, глюкокортикоиды, метилксантины, блокаторы натриевых каналов, агонисты опиатных рецепторов, блокаторы кальциевых каналов, стабилизаторы мембраны и лейкотриеновые ингибиторы.
[00222] Дополнительные терапевтические средства, предлагаемые здесь, включают диуретики, вазопрессин, средства, влияющие на удерживание почками воды, ренин, ангиотензин, средства, полезные для лечения ишемии миокарда, антигипертензивные средства, ингибиторы ангиотензинконвертирующего фермента, антагонисты β-адренергического рецептора, средства для лечения гиперхолестеринемии и средства для лечения дислипидемии.
[00223] Другие предполагаемые терапевтические средства включают препараты, используемые для контролирования кислотности в желудке, средства для лечения пептических язв, средства для лечения гастроэзофагеальной рефлюксной болезни, прокинетики, антиэметики, средства, используемые при синдроме раздраженного кишечника, средства, используемые при диарее, средства против запора, средства, применяемые при воспалительной болезни кишечника, средства против билиарной болезни, средства, используемые против болезней поджелудочной железы. Терапевтические средства, используемые для лечения протозойных инфекций, лекарственные средства, которые применяются для лечения малярии, амебиаза, жиардиаза, трихомониаза, трипаносомиаза и/или лейшманиоза, и/или лекарственные средства, используемые в химиотерапии гельминтозов. Другие терапевтические средства включают антимикробные препараты, сульфаниламиды, триметоприм-сульфаметоксазолхинолоны и средства для лечения инфекций мочевых путей, пенициллины, цефалоспорины и другие бета-лактамные антибиотики, средство, содержащее аминогликозид, ингибиторы синтеза белка, средства, используемые в химиотерапии туберкулеза, заболевания комплекса mycobacterium avium и лепры, противогрибковые средства, антивирусные средства, включая неретровирусные препараты и антиретровирусные препараты.
[00224] Примеры терапевтических антител, которые можно совмещать с рассматриваемым соединением, включают, не ограничиваясь перечисленным, антитела против рецептора тирозинкиназы (цитуксимаб, панитумумаб, трастузумаб), антитела против CD20 (ритуксимаб, тозитумомаб) и другие антитела, такие как алемтузумаб, бевацизумаб и гемтузумаб.
[00225] Помимо этого, способами по изобретению подразумеваются терапевтические средства, используемые для иммуномодулирования, такие как иммуномодуляторы, иммуносупрессивные средства, толерогены и иммуностимуляторы. Помимо этого, терапевтические средства, воздействующие на кровь и кроветворные органы, гемопоэтические средства, факторы роста, минеральные вещества и витамины, антикоагулянты, тромболитические и антитромбоцитные средства.
[00226] Дополнительные терапевтические средства, которые можно комбинировать с рассматриваемым соединением, указаны в Goodman и Gilman, The Pharmacological Basis of Therapeutics, десятое издание, в редакции Hardman, Limbird и Gilman, или Physician's Desk Reference, оба из которых включены сюда посредством ссылки во всей полноте.
[00227] Соединения, описанные здесь, могут использоваться вместе со средствами, раскрытыми здесь, или иными подходящими средствами, в зависимости от подвергаемого терапии состояния. Поэтому в некоторых вариантах воплощения соединения по изобретению будут вводиться совместно с другими средствами, как описано выше. При использовании в комбинированной терапии, соединения, описанные здесь, могут вводиться отдельно или одновременно со вторым средством. Комбинированное введение может включать одновременное введение двух средств в одной дозированной форме, одновременное введение в раздельных дозированных формах и отдельное введение. Таким образом, соединение, описанное здесь, и любое из средств, описанных выше, могут быть составлены в одну дозированную форму для одновременного введения. Альтернативно, соединение по настоящему изобретению и любое из средств, описанных выше, могут одновременно вводиться, причем оба средства будут находиться в отдельных формах. Альтернативно, сразу же следом за соединением по настоящему изобретению может вводиться любое из средств, описанных выше, или наоборот. По протоколу раздельного введения соединение по настоящему изобретению и любое из средств, описанных выше, могут вводиться с интервалом в несколько минут, несколько часов или несколько дней.
ПРИМЕРЫ
[00228] Примеры и способы синтеза, представленные ниже, дополнительно иллюстрируют и описывают соединения по настоящему изобретению и способы изготовления таких соединений. Следует понимать, что пределы настоящего изобретения никоим образом не ограничивается объемом приведенных ниже примеров и способов синтеза. В представленных ниже примерах молекулы с одним хиральным центром, если не указано обратное, существуют в виде рацемической смеси. Молекулы с двумя или более хиральными центрами, если не указано обратное, существуют в виде рацемической смеси диастереомеров. Изолированные энантиомеры/диастереомеры могут быть получены по способам, известным специалистам в данной области техники.
[00229] Пример 1

[00230] 3-бром-1Н-пиразоло[3,4-d]пиримидин-4-амин (1) (21,4 г, 0,1 моль) и калия карбонат (27,64 г, 0,2 моль, 2 экв) были суспендированы в безводном ДМФ (110 мл) и перемешивались при 60°C в течение 0,5 ч. К этой смеси при той же температуре был добавлен изопропилбромид (9,9 мл, 0,105 моль, 1,05 экв). Полученную смесь перемешивали при 60°C еще 2,5 ч, а затем охлаждали до комнатной температуры. Затем смесь была профильтрована, осадок был промыт небольшим количеством изопропилацетата, а фильтрат был сконцентрирован под вакуумом. Остаток был распределен между водой и изопропилацетатом (100 мл/400 мл). Водный слой был экстрагирован изопропилацетатом (100 мл × 2). Комбинированные органические слои были промыты солевым раствором (100 мл), высушены над MgSO4, профильтрованы и смыты изопропилацетатом (50 мл × 3). Фильтрат был сконцентрирован под вакуумом для получения сырого продукта (23,4 г, выход 91,4%) в виде желтого твердого вещества. Полученный продукт был суспендирован в метаноле (25 мл), после чего его перемешивали 1 ч. Твердое вещество было отделено фильтрованием, промыто метанолом (4 мл) и высушено под вакуумом для получения желаемого продукта 2 (18,8 г, выход 73,4%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 8,23 (s, 1Н, пиримидин), 5,00 (m, 1Н, iPr), 1,44 (d, J=6,8 Гц, 6H, iPr); 13C ЯМР (100 МГц, ДМСО-d6): δ 157,3; 156,4; 152,9; 116,6; 99,4; 48,7; 21,6.
[00231] Пример 2
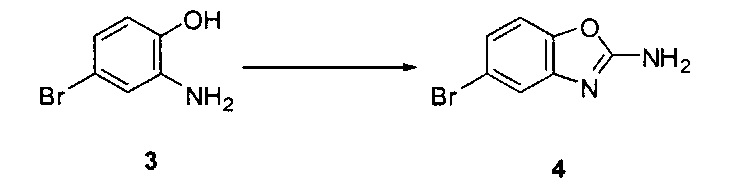
[00232) К перемешанному раствору 2-амино-4-бромфенола (3) (59,6 г, 0,317 моль) в метаноле (600 мл) при комнатной температуре был постепенно порциями добавлен твердый бромциан (40,3 г, 0,38 моль, 1,2 экв), полученную смесь перемешивали при 35°C в течение 6 ч. (Внимание: бромциан высокотоксичен, поэтому работать с реактивом и выполнять реакцию необходимо с осторожностью в вытяжном шкафу). Реакцию останавливали путем добавления насыщенного водного раствора Na2CO3 и величину pH доводили до 7-8. Затем смесь концентрировали под вакуумом для удаления метанола. Остаток растворяли в этилацетате (600 мл), промывали водой (100 мл × 2) и солевым раствором (100 мл), высушивали над MgSO4 и фильтровали. Фильтрат был сконцентрирован под вакуумом для получения желаемого продукта 4 (65,2 г, выход 96,5%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 7,62 (s, 2Н), 7,37 (d, J=1,9 Гц, 1Н), 7,30 (d, J=8,3 Гц, 1Н), 7,11 (dd, J=8.3, 2,1 Гц, 1Н); 13С ЯМР (100 МГц, ДМСО-d6): δ 163,7;, 147,1;, 145,7; 122,2; 117,7; 115,4; 110,0.
[00233] Пример 3
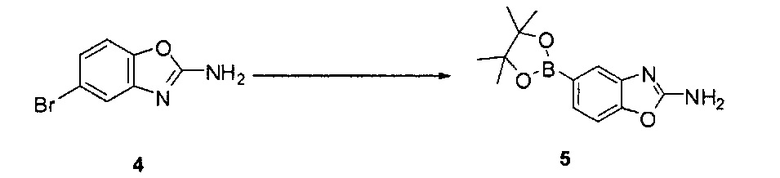
[00234] 5-бромбензол[d]оксазол-2-амин (4) (15,0 г, 70,4 ммоль) и бис(пинаколято)диборан (21,5 г, 84,5 ммоль, 1,2 экв) были растворены в 1,4-диоксане (150 мл). К этой смеси были последовательно добавлены PdCl2(dppf) (5,17 г, 6,3 ммоль, 0,09 экв) и калия ацетат (20,71 г, 211 ммоль, 3 экв). Полученная смесь была дегазирована и продута аргоном трижды, а затем ее кипятили с обратным холодильником при 110°C в течение 2 ч при перемешивании. Смесь охлаждали до комнатной температуры, фильтровали, осадок промывали этилацетатом (30 мл × 2). Фильтрат был перемешан с силикагелем (50 г) и затем сконцентрирован под вакуумом. Остаток помещали на пробку из силикагеля (60 г) и элюировали этилацетатом/гептаном (1:1, 1000 мл). Фильтрат концентрировали под вакуумом, осадок суспендировали в гептане (50 мл) и кипятили с обратным холодильником 30 мин при перемешивании. Суспензию охлаждали до комнатной температуры, затем твердое вещество было отделено фильтрованием, промыто небольшим количеством гептана для получения желаемого продукта 5 (15,66 г, выход 85,3%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 7,47 (s, 1Н), 7,43 (s, 2Н), 7,34 (s, 2Н), 1,30 (s, 12Н).
[00235] Пример 3a
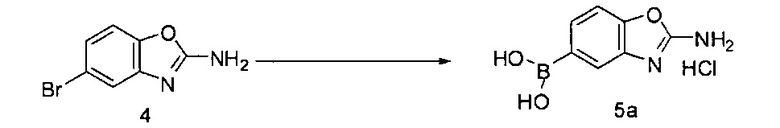
[00236] Соединение 4 (6,9 кг) при комнатной температуре было загружено в стеклянный реактор вместимостью 100 литров, после чего добавляли 9,9 кг бис(пинаколято)диборана и 69,0 кг 1,4-диоксана. Реакционную смесь перемешивали в атмосфере аргона, затем добавляли 2,4 кг 1,1'-бис(дифенилфосфино)ферроцена]дихлорпалладия(II) (комплекс с дихлорметаном 1:1) и 9,5 кг калия ацетата. Реакционная смесь была нагрета 3,5 часа при 100°C в атмосфере аргона до тех пор, пока внутрипроизводственный анализ ВЭЖХ не показал полноту протекания реакции. После охлаждения реакционной смеси до 25°C, она была загружена на пробку из 20,6 кг силикагеля и профильтрована. Осадок был промыт 230,0 кг этилацетата. Объединенные фильтраты были отогнаны под вакуумом до приблизительно 15 литров. Затем была добавлена смесь из 38,8 кг концентрированной соляной кислоты и 32,5 кг воды. Реакционная смесь была нагрета 2,5 часа при 80°C до тех пор, пока внутрипроизводственный анализ ВЭЖХ не показал полноту протекания реакции. Реакционная смесь была охлаждена до 20°C и профильтрована. Твердый продукт 5а был промыт смесью из 3,9 кг концентрированной соляной кислоты и 36,0 кг воды, затем 44,2 кг этилацетата, а затем высушен при 50°C в течение 90 часов под вакуумом с небольшой подпиткой азотом.
[00237] Пример 4: Синтез 5-(4-амино-1-изопропил-1Н-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-Амина (Формула I)
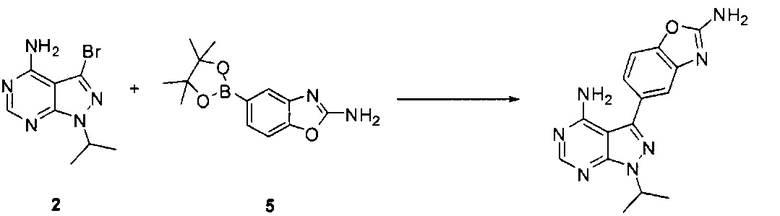
[00238] 3-бром-1-изопропил-1Н-пиразоло[3,4-d]пиримидин-4-амин (2) (20 г, 78,1 ммоль) и 5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)бензо[d]оксазол-2-амин (5) (26,4 г, 102 ммоль, 1,3 экв) были растворены в смеси 1,4-диоксана и воды (300 мл/100 мл). К этой смеси были последовательно добавлены Pd(PPh3)4 (7,21 г, 6,25 ммоль, 0,08 экв) и натрия карбонат (41,4 г, 391 ммоль, 5 экв). Полученная смесь была дегазирована и продута аргоном трижды, а затем ее кипятили с обратным холодильником при 110°C в течение 3 ч при перемешивании. Смесь охлаждали до комнатной температуры, фильтровали, осадок промывали этилацетатом (50 мл × 2). Объединенный фильтрат был сконцентрирован под вакуумом. Осадок был суспендирован в смеси воды и этилацетата (500 мл/100 мл) и перемешан в течение 30 минут. Твердый остаток был отделен фильтрованием, затем его промыли водой (50 мл) и этилацетатом (100 мл). Полученный таким образом сырой продукт был суспендирован в этилацетате (100 мл) и перемешан в течение 30 минут. Твердый остаток был отделен фильтрованием, затем его промыли этилацетатом (50 мл) и высушили под вакуумом, получив сырой продукт Формулы I (20 г, выход 83%). Полученный при этом продукт (20 г) был растворен в кипящем метаноле (1600 мл) с обратным холодильником, после чего был добавлен активированный уголь (6 г, 30% м/м). Эту смесь кипятили с обратным холодильником 30 мин, затем ее в горячем состоянии фильтровали через воронку Бюхнера. Осадок был промыт горячим метанолом (100 мл × 3). Объединенные фильтраты были сконцентрированы. Осадок был суспендирован в этилацетате (300 мл) и суспензию перемешивали при комнатной температуре в течение 30 минут. Твердый остаток был отделен фильтрованием, затем его промыли этилацетатом (50 мл × 2) и высушили под вакуумом, получив целевой продукт Формулы I в виде полиморфной Формы A (16,27 г, выход 67,3%). Точка плавления: 273,67°C (температура начала); 1H ЯМР (400 МГц, ДМСО-d6): δ 8,26 (s, 1Н, пиримидин), 7,56 (s, 2Н, оксазол-2-амин), 7,48 (d, J=8,1 Гц, 1Н, Ph), 7,45 (d, J=1,4 Гц, 1Н, Ph), 7,27 (dd, J=8,1, 1,6 Гц, 1H, Ph), 5,08 (m, 1H, iPr) и 1,52 (d, J=6,7 Гц, 6H, iPr); 13C ЯМР (100 МГц, ДМСО-d6): δ 163,4; 158,1; 155,4; 153,2; 148,3; 144,4; 143,7; 128,8; 120,5; 115,0; 108,8; 97,5; 48,0 и 21,8; анализ (% рассчетное, % определенный для C15H15N7O): С (58,24; 58,04), Н (4,87; 4,83), N (31,70; 31,49); чистота выше 99% по данным ЖХ-МС.
[00239] Пример 4а Синтез 5-(4-амино-1-изопропил-1Н-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-Амина (Формула I)
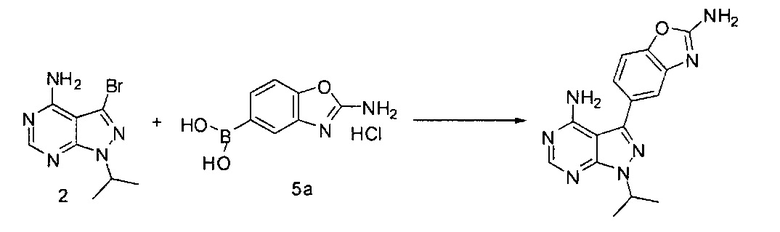
|00240] Соединение 2 (2,7 кг) и соединение 5а (2,8 кг) при комнатной температуре были загружены в стеклянный реактор вместимостью 100 литров. Реакционную смесь перемешивали в атмосфере азота, затем добавляли 43,4 кг 1,4-диоксана и 14,0 кг воды. Реакционную смесь перемешивали в атмосфере аргона, затем добавляли 1,0 кг тетракис(трифенилфосфино)палладия(0) и 5,7 кг натрия карбоната. Реакционная смесь нагревалась с кипячением при обратном холодильнике 7,5 часа при температуре кипения (88°C) в атмосфере аргона до тех пор, пока внутрипроизводственный анализ ВЭЖХ не показал полноту протекания реакции. После охлаждения до комнатной температуры, реакционная смесь была дистиллирована под вакуумом до приблизительно 10 л. К этой смеси были добавлены 60,0 кг воды и 11,0 кг этилацетата. Смесь перемешивали при 22°C 1 ч, затем фильтровали. Осадок во влажном состоянии был перенесен в стеклянный реактор вместимостью 100 литров, смешан с 60,0 кг воды и 11,0 кг этилацетата и перемешан при 22°C в течение 30 минут. Смесь была профильтрована. Влажный осадок был промыт 8,0 кг воды и 8,5 кг этилацетата. После промывания осадок во влажном состоянии был перенесен в стеклянный реактор вместимостью 100 литров, смешан с 12,6 кг этилацетата и перемешан при 22°C в течение 30 минут. Смесь была повторно профильтрована и промыта 5,7 кг этилацетата. После высушивания сырого продукта при 54°C под вакуумом с небольшой подпиткой азотом, его (2,36 кг) загрузили в дистиллятор GLCS на 200 галлонов. Дистиллятор был продут азотом, после чего добавили 200,0 кг метанола. Смесь была нагрета до 60°C. К этой смеси была добавлена суспензия из 1,0 кг активированного углерода в 14,5 кг метанола. Полученную смесь нагревали в течение 1 ч при 60°C. Горячую смесь фильтровали через предварительно разогретый (60°C) стеклянный нутч-фильтр. Затем осадок был промыт 70,0 кг горячего метанола. Объединенные фильтраты были отогнаны под вакуумом до приблизительно 10 литров. Было добавлено 28,4 кг этилацетата. Смесь перемешивали при 25°C 30 минут, затем фильтровали. Влажный осадок был промыт 12,7 кг этилацетата. Желаемый продукт Формулы I был высушен при 50°C под вакуумом с небольшой подпиткой азота до тех пор, пока потеря в массе при высушивании не стала ниже 1,0%.
[00241] Пример 5
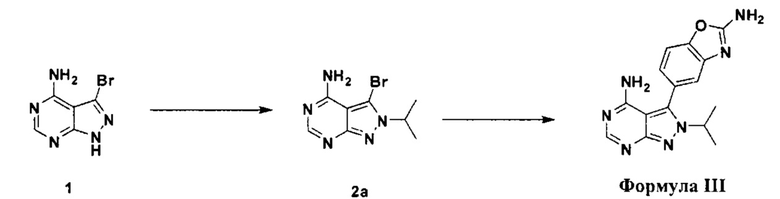
[00242] 3-бром-1Н-пиразоло[3,4-d]пиримидин-4-амин (1) (21,4 г, 0,1 моль) и калия карбонат (27,64 г, 0,2 моль, 2 экв) были суспендированы в безводном ДМФ (210 мл) и перемешивались при 80°C в течение 0,5 ч. К этой смеси при той же температуре был добавлен изопропилбромид (9,9 мл, 0,105 моль, 1,05 экв). Полученную смесь перемешивали при 80°C еще 2,5 ч, а затем охлаждали до комнатной температуры. Смесь была сконцентрирована под вакуумом и осадок был очищен хроматографией в испарительной колонне на силикагеле (МеОН/ДХМ: от 1:80 до 1:10), был получен желаемый продукт 3-бром-2-изопропил-2Н-пиразоло[3,4-d]пиримидин-4-амин (2а) (800 мг, 3,1%) в виде твердого вещества.
[00243] 3-бром-2-изопропил-2Н-пиразоло[3,4-d]пиримидин-4-амин 2а (500 мг, 1,95 ммоль, 1,0 экв), 5-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)бензо[d]оксазол-2-амин (1 г, 3,9 ммоль, 2,0 экв), Pd(OAc)2 (131 мг, 0,59 ммоль, 0,3 экв), PPh3 (308 мг, 1,17 ммоль, 0,6 экв) и Na2CO3 (1,03 г, 9,75 ммоль, 5,0 экв) были растворены в ДМФ/EtOH/H2O (30 мл/10 мл/10 мл). Полученная смесь была дегазирована и продута аргоном трижды, а затем ее перемешивали при 80-90°C в течение 1,5 ч в атмосфере аргона. Полноту реакции определяли по ТСХ анализу. Смесь была сконцентрирована под вакуумом и осадок был очищен хроматографией в испарительной колонне на силикагеле (МеОН/ДХМ от 1:100 до 1:10), был получен желаемый продукт 5-(4-амино-2-изопропил-2Н-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин (Формула III) (300 мг, 52%) в виде твердого вещества.
[00244] Пример 6
[00245] Порошковые рентгеновские дифрактограммы (XRPD) Формы A были сняты на дифрактометре Siemens D5000 с излучением Cu Kα (40 кВ, 40 мА), гониометром θ-θ, расходимостью V20 и входными щелями, вторичным графитовым монохроматором и сцинтилляционным счетчиком. Инструмент был прокалиброван с помощью сертифицированного Корундового стандарта (NIST 1976). Для сбора данных использовалось ПО Diffrac Plus XRD Commander v2.3.1, данные анализировались и оформлялись при помощи Diffrac Plus EVA v 11.0.0.2 или v 13.0.0.2.
[00246] Образец изготавливался в виде плоских образцов в форме тарелки с использованием полученного порошка. Приблизительно 35 мг образца осторожно помещали в полость, вырезанную в полированном силиконовом диске с нулевым фоном (510). При анализе образец вращался в своей плоскости. Сведения об условиях съемки:
- Интервал углов: 2-42.2θ
- Шаг: 0,05.2θ
- Время съемки: 4 с.шаг-1
[00247] XRPD-профили других форм были сняты на дифрактометре Bruker AXS C2 GADDS с излучением Cu Kα (40 кВ, 40 мА), автоматической шкалой XYZ, лазерным видеомикроскопом для автоматического позиционирования образца и двухмерным зональным детектором Hi Star. Рентгеновская оптика состояла из одного многослойного зеркала Гебеля и коллиматора с отверстием 0,3 мм.
[00248] Расходимость потока, т.е. эффективный размер рентгеновского потока на образце, составляла приблизительно 4 мм. Использовался непрерывный режим сканирования θ-θ с расстоянием образец - детектор в 20 см, что дает эффективный интервал 2θ в 3,2°-29,7°. Как правило, образец подвергали воздействию рентгеновского потока в течение 120 секунд. Для сбора данных использовалось ПО GADDS для WNT 4.1.16, данные анализировались и оформлялись при помощи Diffrac Plus EVA v 9.0.0.2 или v 13.0.0.2.
[00249] Образцы изготавливались в виде плоских образцов в форме тарелки с использованием полученного порошка без перетирания. Примерно по 1-2 мг образца слегка вдавливались в силиконовый диск для получения плоской поверхности.
[00250] Пример 7: Исследования Формы A
[00251] Рентгеновская порошковая дифракция
(00252] Рентгеновская порошковая дифрактограмма полиморфа Формы A высокого разрешения представлена на ФИГ.1.
[00253] Проверка стабильности при 40°C/75% отн. вл.
[00254] Образец J00439 хранился при 40°C/75% отн. вл. При повторном рентгеновском анализе спустя 7 суток, 21 сутки и 35 суток был получен неизменный профиль A (ФИГ.2). Таким образом, эта твердая форма (обозначаемая как Форма A), была стабильна в условиях ускоренной проверки стабильности. Следует отметить, что с течением времени наблюдались небольшие изменения интенсивностей дифракционных пиков.
[0255] Дифференциальная сканирующая калориметрия (ДСК) и термогравиметрический анализ (ТГА)
[0256] ТГА-съемка Формы A (ФИГ.3) показала лишь малую потерю массы между 25°C и 250°C. Потеря в массе, равная 9,7%, между 250°C и 350°C, вероятно, связана с некоторым разложением. ДСК-съемка Формы A (ФИГ.4) выявила резкую эндотерму плавления с началом на 274°C.
[00257] Гравиметрическая сорбция пара (ГСП)
[00258] Данные, полученные в ГСП-исследовании Формы A показали очень малое изменение массы в течение всего эксперимента (0,1%). Гистерезиса не наблюдалось. Материал негигроскопичен. На кинетическом графике (ФИГ.5) наблюдалось быстрое установление равновесия при каждом уровне относительной влажности. Материал после ГСП-исследования был повторно проанализирован рентгеновской дифракцией, профиль соответствовал профилю A. Таким образом, эта форма устойчива по отношению к условиям ГСП.
[00259] Определение воды по Карлу Фишеру.
[00260] Содержание воды в J00439 составляло 2,4% по данным титрования по Карлу Фишеру.
[00261] Пример 8: Скрининг полиморфов
[00262] Эксперименты проводились для скрининга различных полиморфов. Результаты показаны в Таблицах 1-3. Конкретно, в Таблице 1 показаны результаты обработки раствора Формы A противорастворителем. В Таблице 2 растворы Формы A во множестве одинарных растворителей охлаждались до 5°C со скоростью 0,5°C/мин. В Таблице 3 растворы Формы A во множестве смесей воды/органического растворителя охлаждались до 5°C со скоростью 0,5°C/мин. Полученные осадки дополнительно анализировались с помощью способа порошковой рентгеновской дифракции (XRPD), как описано в Примере 6. Все эксперименты в Таблицах 2 и 3 проводились с количеством в 20 мг.
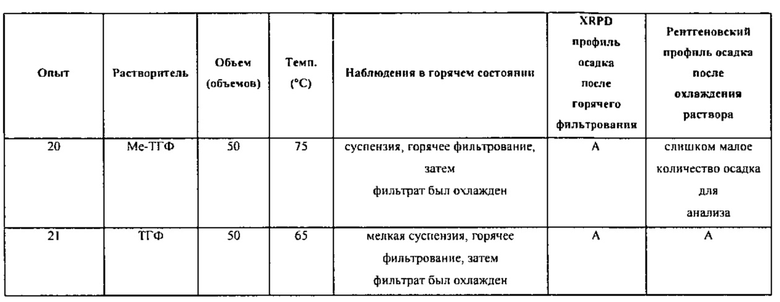
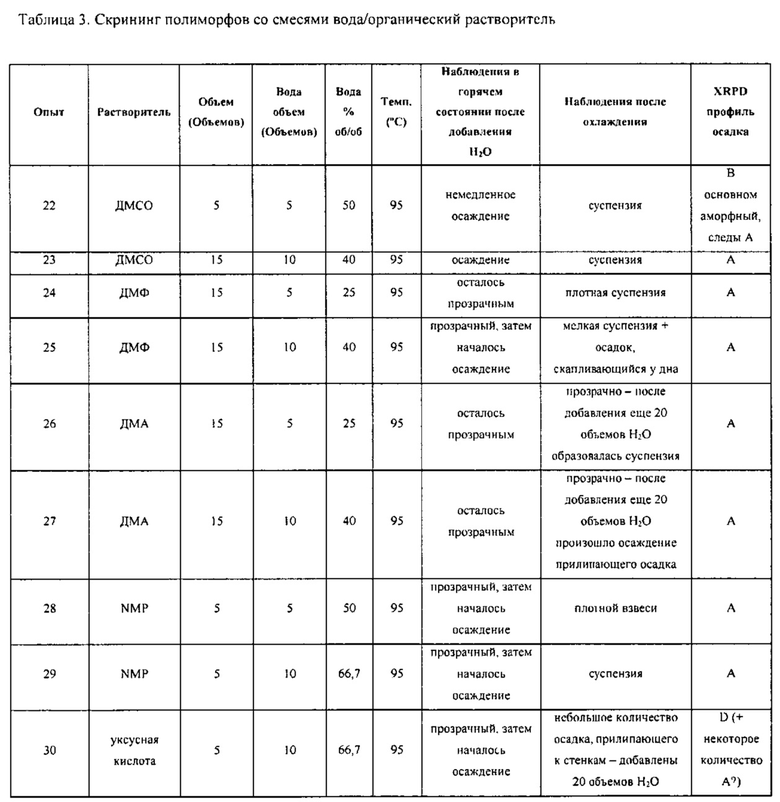
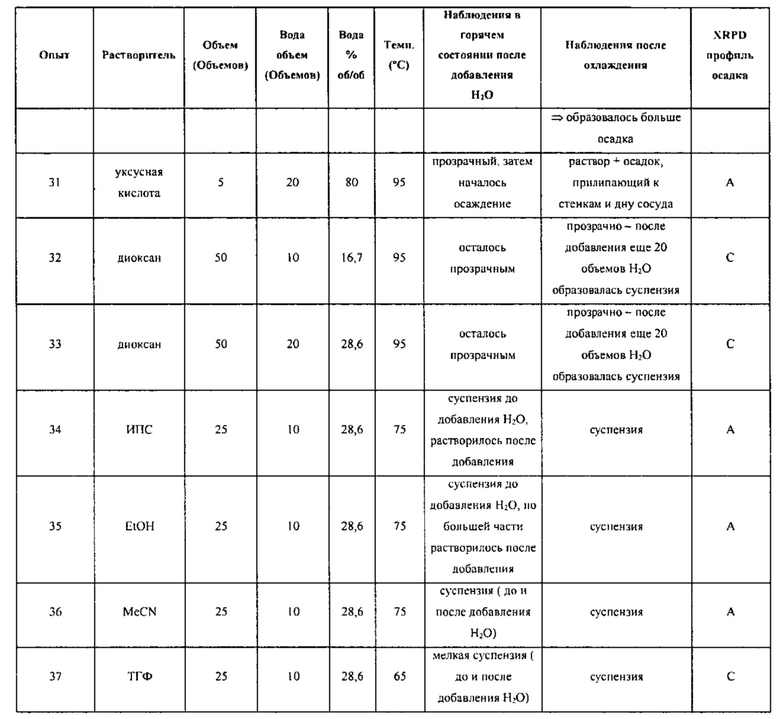
[00263] Пример 9: Эксперименты более крупного масштаба по скринингу и определению характеристик полиморфов.
[00264] Эксперименты, в которых получались твердые вещества с различными рентгеновскими дифракционными профилями, выполнялись повторно на количестве 80-100 мг. Детальные сведения представлены в Таблице 4. Все осадки были отфильтрованы, высушены на воздухе в течение нескольких минут непосредственно на фильтре, а затем высушены в течение 1 ч в вакуумной печи (25°C) перед анализом. Опыт 38 являлся повторением маломасштабного эксперимента из Таблицы 2 (опыт 9), в котором получилась ожидаемая смесь профилей. Но в этом более крупномасштабном исследовании, при охлаждении раствора в ДМФ образовалась новая Форма Е. Помимо этого, в опыте 40, в AcOH/вода, в котором ожидалось образование Формы D, в этом случае образовалась Форма A исходного материала. Другие эксперименты привели к ожидаемым Формам B и C.
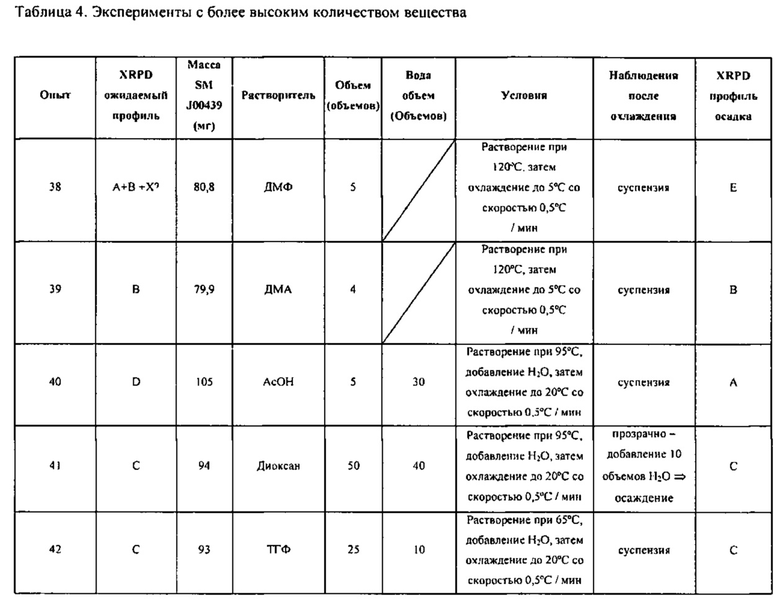
[00265] Помимо рентгеновского дифракционного анализа, полученные осадки были подвергнуты дополнительным анализам. Результаты показаны в Таблице 5.
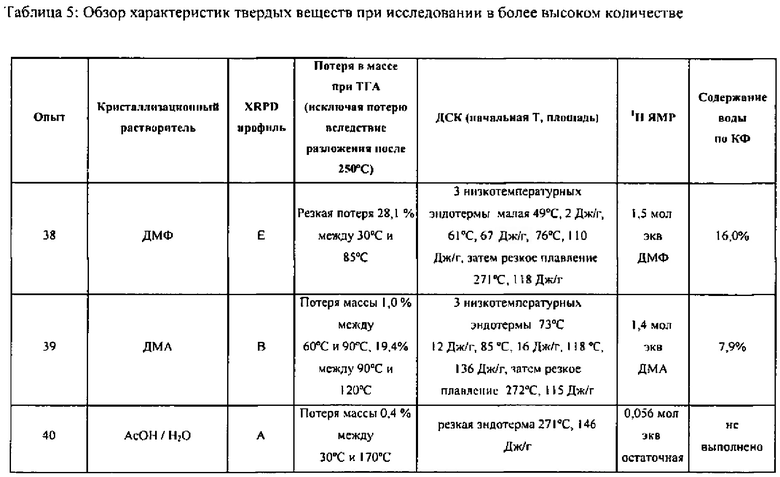
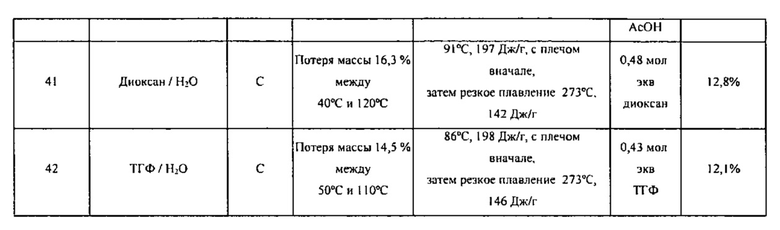
Термический анализ
При ТГА для твердой формы E (опыт 38, Таблица 5) наблюдался резкий скачок около 60°C (ФИГ.13), при котором утрачивалось 28% массы. При ДСК наблюдалось множество низкотемпературных эндотерм, после чего наблюдалось резкое плавление, характерное для Формы A при 271°C.
Аналогичное термальное поведение наблюдалось для обоих образцов твердой фазы Формы C, с ТГА скачком при около 80°C и низкотемпературной эндотермой ДСК (ФИГ.9).
Для твердой фазы формы B (опыт 39, Таблица 5) также наблюдался скачок на кривой ТГА, который состоял из двух последовательных скачков на около 70°C и 100°C. ДСК-профиль включал сложную последовательность низкотемпературных эндотерм. Возможно, что часть этих низкотемпературных потерь соответствовала остаточному несвязанному растворителю.
Резкие скачки при ТГА типичны для десольвации связанного растворителя, и ДСК показывает, что десольвация приводит к Форме А.
[00266] 1H ЯМР
[00267] Как показано в Таблице 11, 1H ЯМР свидетельствовал о наличии растворителя в твердой фазе Форм B, C и E. Примечательно, что количества диоксана или ТГФ в твердых фазах Формы C аналогичны тем, которые наблюдались в экспериментах меньшего масштаба. Твердая фаза Формы E содержала 1,5 моль экв ДМФ, что соответствовало примерно 25,5% по массе. Это было немного меньше ТГА-скачка, составлявшего 28%, поэтому в эту потерю массы может также входить некоторое количество воды. Твердая фаза Формы B содержала 1,4 моль экв ДМА (28,3% по массе). Некоторое количество ДМА было несвязанным остаточным растворителем.
[00268] Титрование по Карлу Фишеру для определения содержания воды
[00269| Содержание воды в твердых фазах по данным титрования по Карлу Фишеру представлено в Таблице 5. Все твердые фазы содержали значительное количество воды и поэтому могли представлять собой гидраты. В частности, твердые фазы Формы C (опыты 41 и 42, Таблица 5) характеризовались схожим содержанием воды, которое соответствовало примерно 2,5 моль экв (12,5% масс).
[00270] Высушивание твердых фаз
[00271] Образец каждой твердой фазы был высушен в вакуумной печи при 40°C в течение ночи, затем образцы были повторно проанализированы с помощью способов рентгеновской порошковой дифракции и 1H ЯМР. Результаты показаны в Таблице 6 ниже.
[00272] Форма E при высушивании десольватировалась в Форму A, а Форма B только частично десольватировалась, теряя примерно 0,4 моль экв. ДМА и проявляя новый профиль рентгеновской порошковой дифракции (Форму F). Обе твердые фазы Формы C (опыты 41 и 42, Таблица 6) были стабильны при высушивании и не утрачивали растворителя. Это было особенно интересным ввиду того, что у ТГФ относительно низкая температура кипения, что указывает на то, что органический растворитель был связан в структуре.
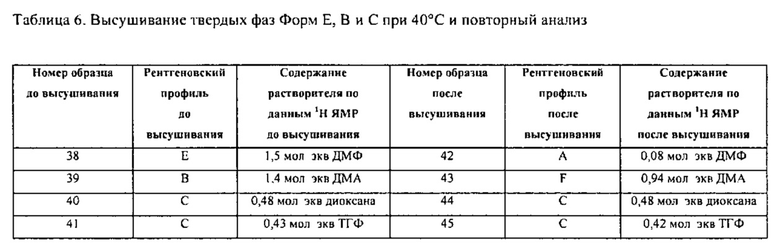
[00273] Анализ ГСП
[00274] Форма E теряла 28% массы при первом цикле сорбции (от 40 до 90% отн. вл.), при последующих десорбции и втором цикле сорбции она не теряла и не приобретала массы. Повторный рентгеновский порошковый дифракционный анализ твердой фазы после ГСП показал, что она перешла в Форму A. Это согласуется с десольватированием Формы E до Формы A в эксперименте ГСП.
[00275] Аналогичным образом, Форма B десольватировалась до Формы A, теряя, в совокупности, 28% на различных этапах первого цикла сорбции.
[00276] У Формы C наблюдалось другое поведение при ГСП. Она не десольватировалась и согласно рентгеновскому порошковому дифракционному анализу, после ГСП оставалась Формой С. Образец был негигроскопичен, привес при первом цикле сорбции составил лишь 0,16%. Она не дегидрировалась и не десольватировалась также и при десорбции (потеря между 90 и 0% отн. вл составила 0,38%). Гистерезиса не наблюдалось, кинетический график показал быстрое установление равновесия при каждом уровне относительной влажности.
[00277] Исследование стабильности
[00278] Образцы с опытов 38, 39, 41 и 42 хранились при 40°C/75% отн. вл. При повторном рентгеновском дифракционном порошковом анализе через 7 дней выяснилось, что Формы E и B перешли в Форму A, а обе твердые фазы Формы C все еще принадлежали к Форме С.
[00279] Одна из твердых фаз Формы C (опыт 45, Таблица 6) также была повторно проанализирована посредством 1H ЯМР, чтобы проверить уровень растворителя (ТГФ), оставшегося после хранения при высокой влажности. При интегральном измерении было обнаружено 0,37 моль экв ТГФ, что соответствовало небольшому понижению уровня растворителя. Это вновь свидетельствует о том, что ТГФ довольно прочно связан со структурой, поскольку высокая влажность зачастую позволяет удалить растворитель (как это наблюдалось для сольватов Форм Е и В).
[00280] В итоге, были идентифицированы различные сольваты формулы I. Форма B и Форма E, судя по всему, представляли собой сольваты ДМФ и ДМА, соответственно. Также, они могут представлять собой смешанный гидрат/сольват (содержащий и воду, и органический растворитель), поскольку для них отмечалось высокое содержание воды по Карлу Фишеру (однако содержание воды само по себе не может объяснить скачок, наблюдаемый на кривой ТГА). Обе формы, Форма B и Форма Е, легко десольватировались до Формы А при ГСП и в условиях ускоренного испытания стабильности (40°C/75% отн. вл.). Форма E также превращалась в Форму A при высушивании, а Форма В частично десольватировалась, переходя в новую Форму F.
[00281] Форма C была стабильна при высушивании и при условиях высокой влажности (и при ГСП, и при испытании стабильности). Судя по всему, она представляла собой гидрат приблизительно с 2,5 моль экв. воды. Также, судя по всему, она содержала примерно 0,4-0,5 моль экв. ТГФ или диоксана. Таким образом, она может представлять собой смешанный гидрат/сольват. Также, возможно, что Форма C представляла собой тригидрат с частичным заполнением решетки органическим растворителем.
[00282] Пример 10: Скрининговые исследования солей
[00283] Соли Формы А были образованы п-толуилсульфоновой кислотой, этан-1,2-дисульфоновой кислотой (ЭДСК), хлороводородной кислотой (HCl) (одно- и двузамещенная), серной кислотой, малеиновой кислотой, метансульфоновой кислотой (МСК), бензилсульфоновой кислотой (БСК), этансульфоновой кислотой (ЭСК), фосфорной кислотой, изетионовой кислотой и щавелевой кислотой. Различные соли были испытаны относительно различных растворителей на предмет образования кристаллических осадков, как показано в Таблице 7. Форма A, как наблюдалось, образует кристаллические моно-соли с соляной кислотой и фосфорной кислотой, и полукристаллические или кристаллические двойные соли с серной кислотой, хлороводородной кислотой, 1,2-этандисульфоновой кислотой, п-толуилсульфоновой кислотой, метансульфоновой кислотой, этансульфоновой кислотой и малеиновой кислотой.
[00284] Таблица 7: Обзор результатов скрининга солей
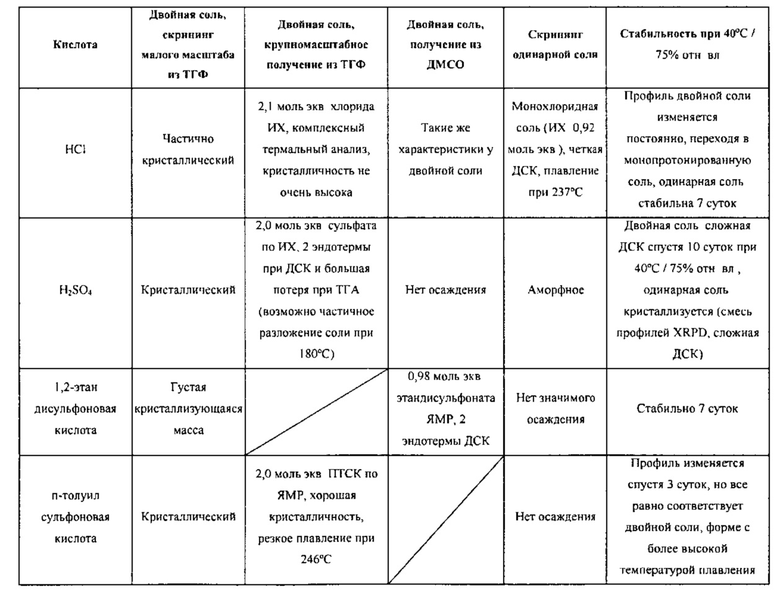
[00285] Пример 11: Дополнительный скрининг сольватов.
[00286| Приблизительно 20 мг соединения Формулы I (Форма A) было развешено во флаконы, после чего было добавлено по 150 мкл сольвентной системы. В течение 4-5 суток флаконы взбалтывались при 50°C, 5°C или проходили циклы изменения температуры от комнатной до 50°C. Твердая фаза была отделена фильтрованием, после чего проанализирована рентгеновским порошковым дифракционным анализом и термальным анализом. Из ацетона/5% воды при 5°C был выделен гидрат (см. Фигуры 15 и 16). Гидрат превращался в форму A после сушки под вакуумом, анализа ГСП, 8 суток хранения при 40°C/75% относительной влажности или 25°C/97% относительной влажности, или нагревания до приблизительно 100°C. Из диметилацетамида (ДМА) при циклировании между комнатной температурой и 50°C в течение 5 суток был выделен сольват (см. Фигуры 17 и 18). ДМА-сольват превращался в форму A после 8 суток хранения при 40°C/75% относительной влажности или 25°C/97% относительной влажности, или нагревания до приблизительно 100°C. При добавлении к ДМА 10% воды или более образование ДМА-сольвата предотвращалось.
[00287] Хотя предпочтительные варианты воплощения настоящего изобретения были показаны и описаны здесь, специалисту в данной области техники понятно, что такие варианты воплощения представлены исключительно в качестве примера. Множество вариаций, изменений и замещений, не отступающих от изобретения, очевидны специалисту в данной области техники. Следует понимать, что различные альтернативы вариантам воплощения изобретения, описанным здесь, могут применяться при практическом использовании изобретения. Подразумевается, что следующая ниже формула изобретения охватывает изобретение, и что способы и структуры в пределах этой формулы изобретения и их эквиваленты покрываются ею.
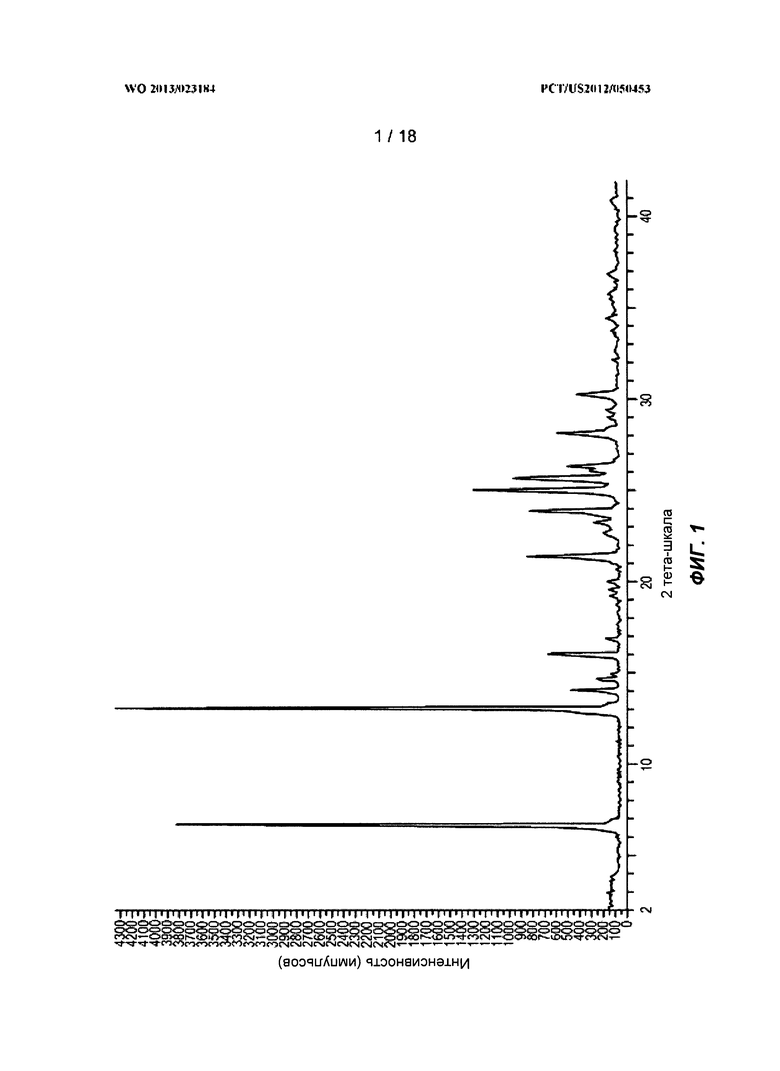
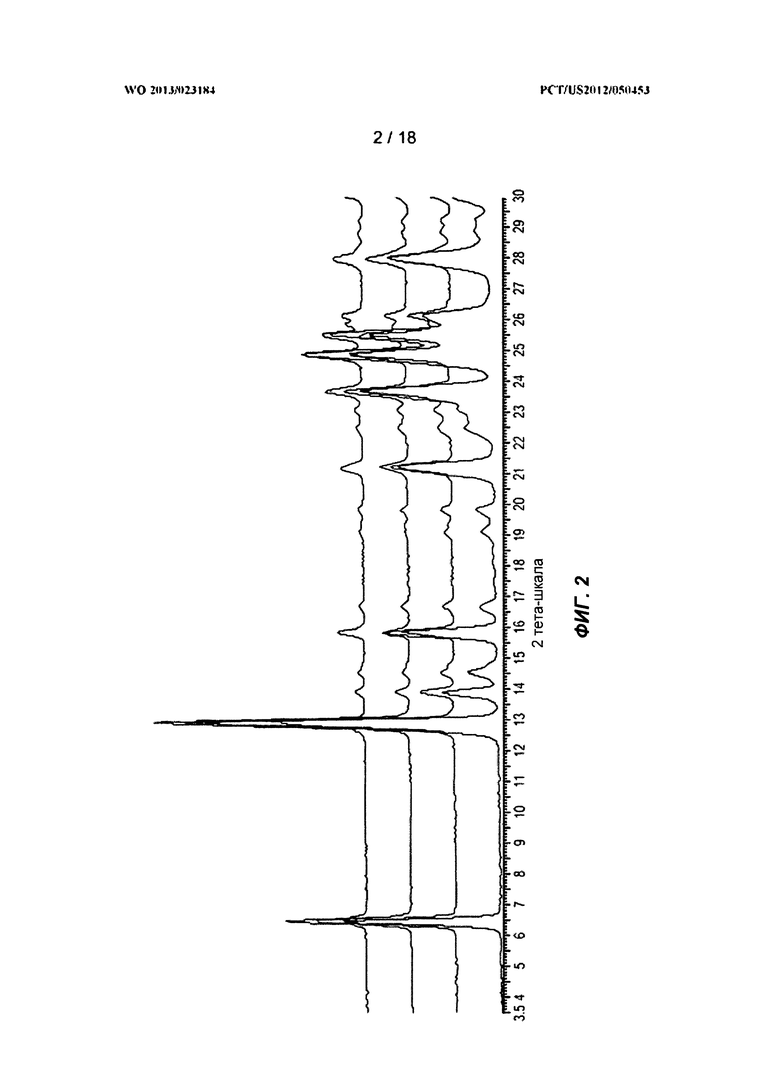
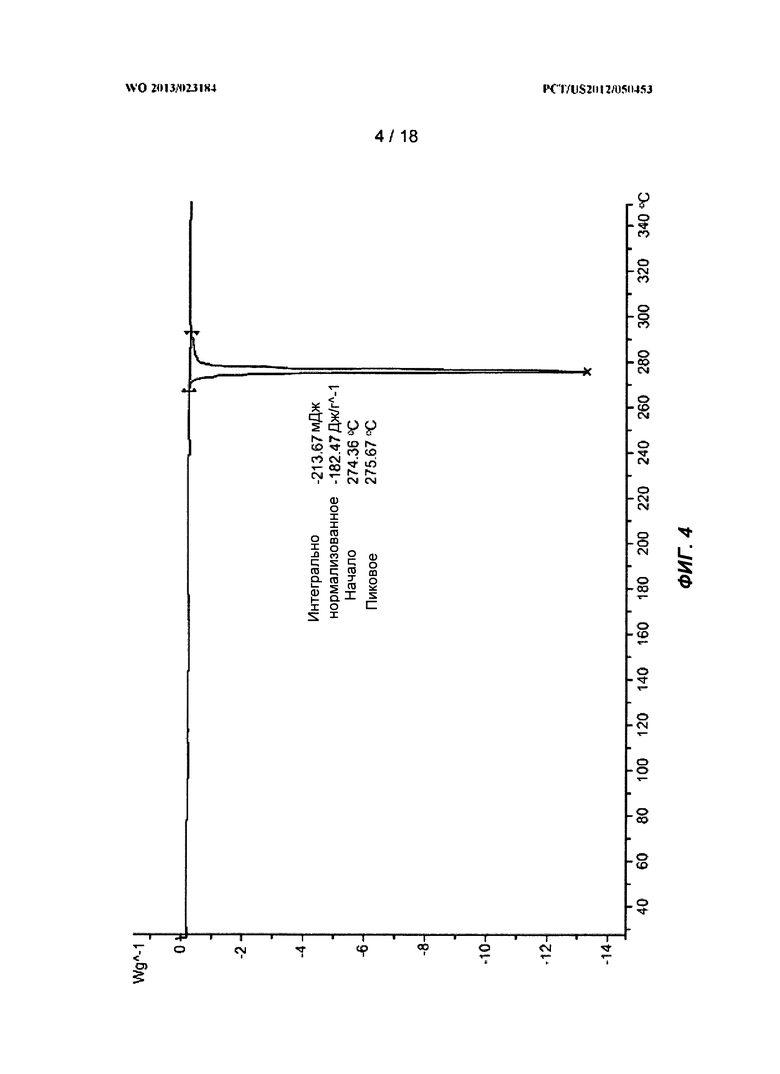
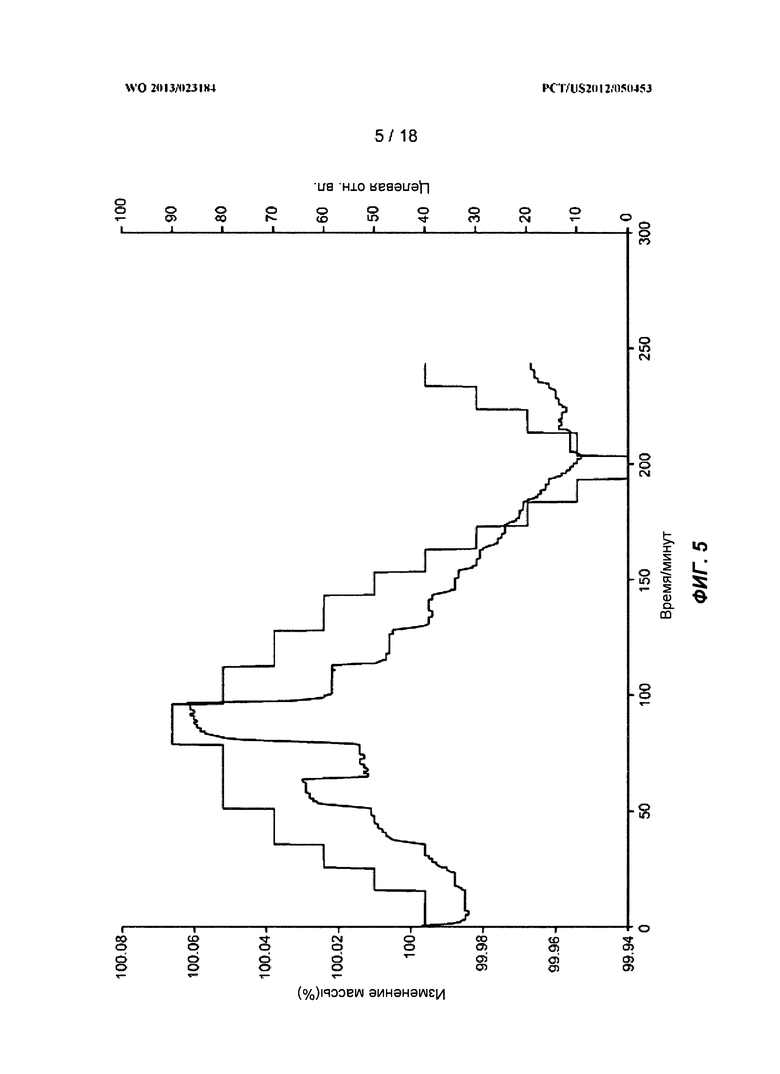
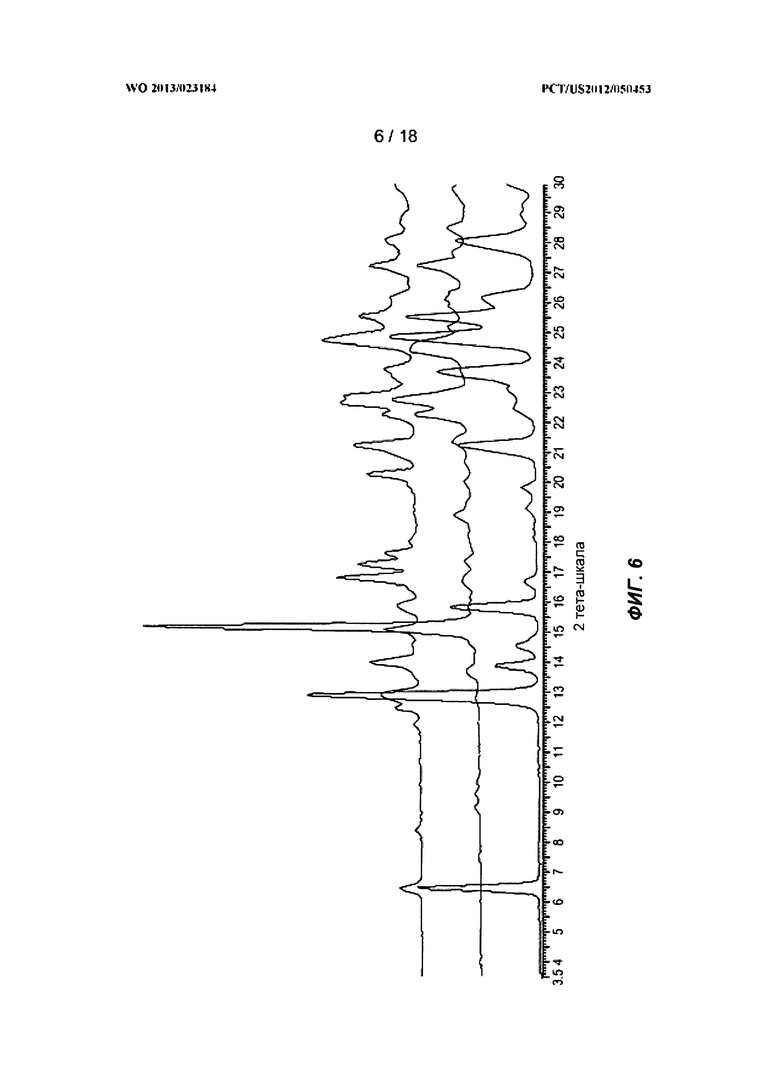
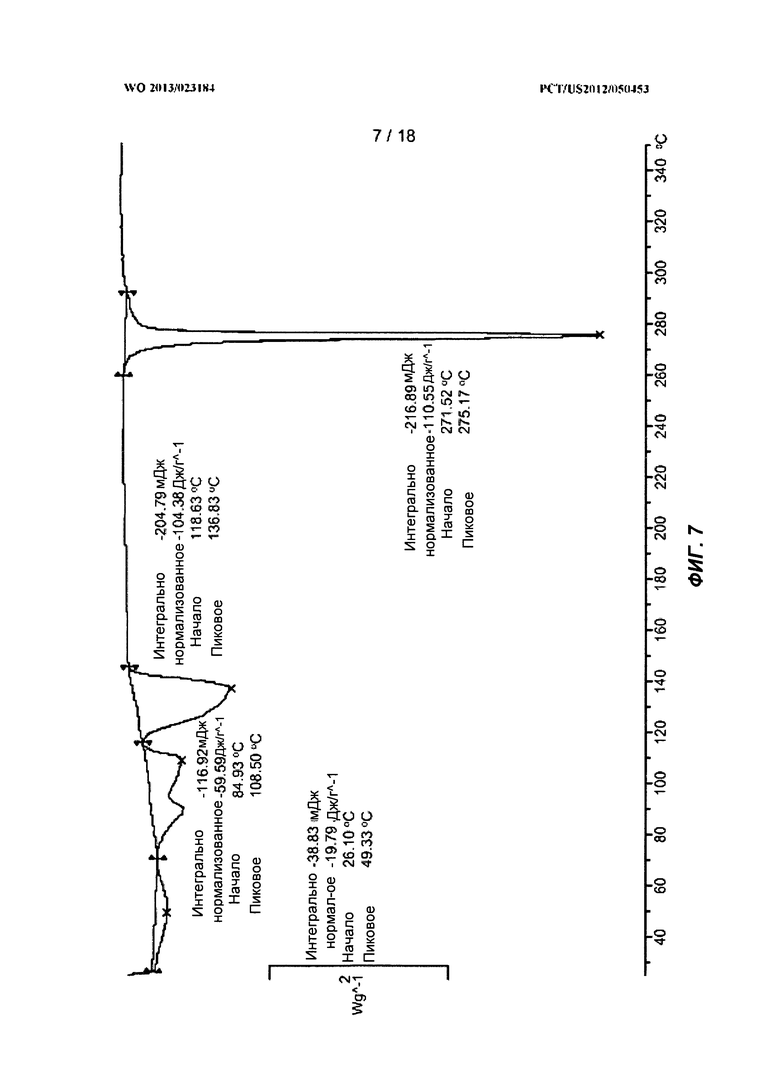
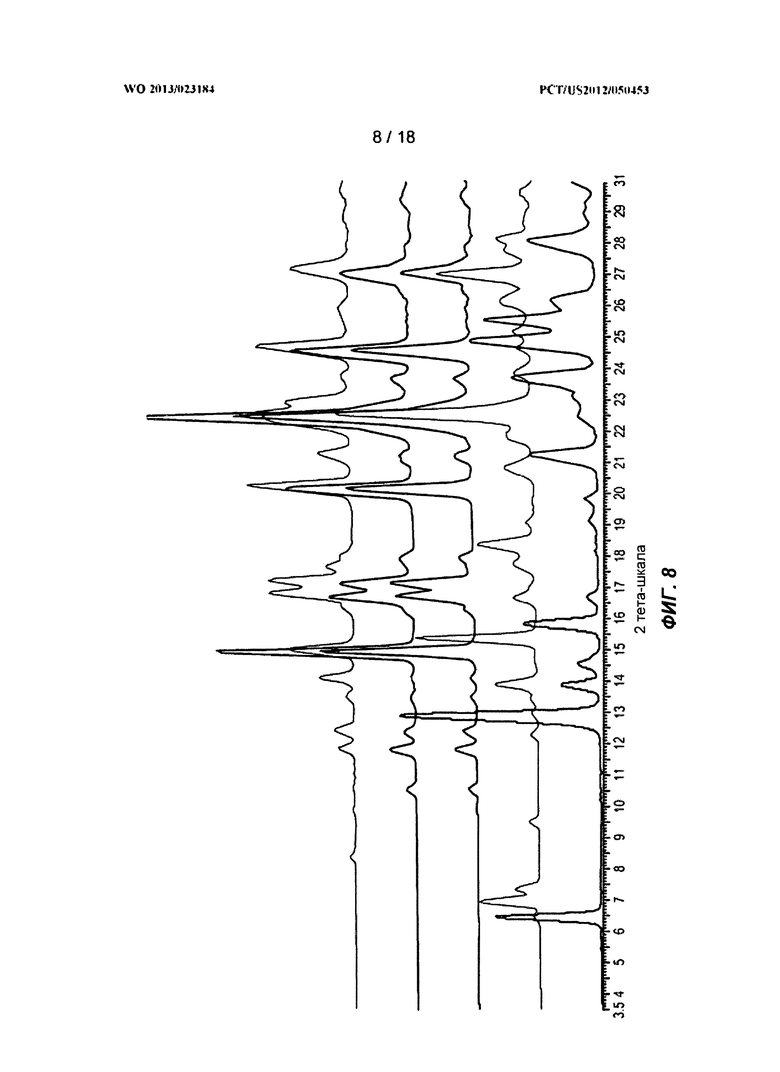
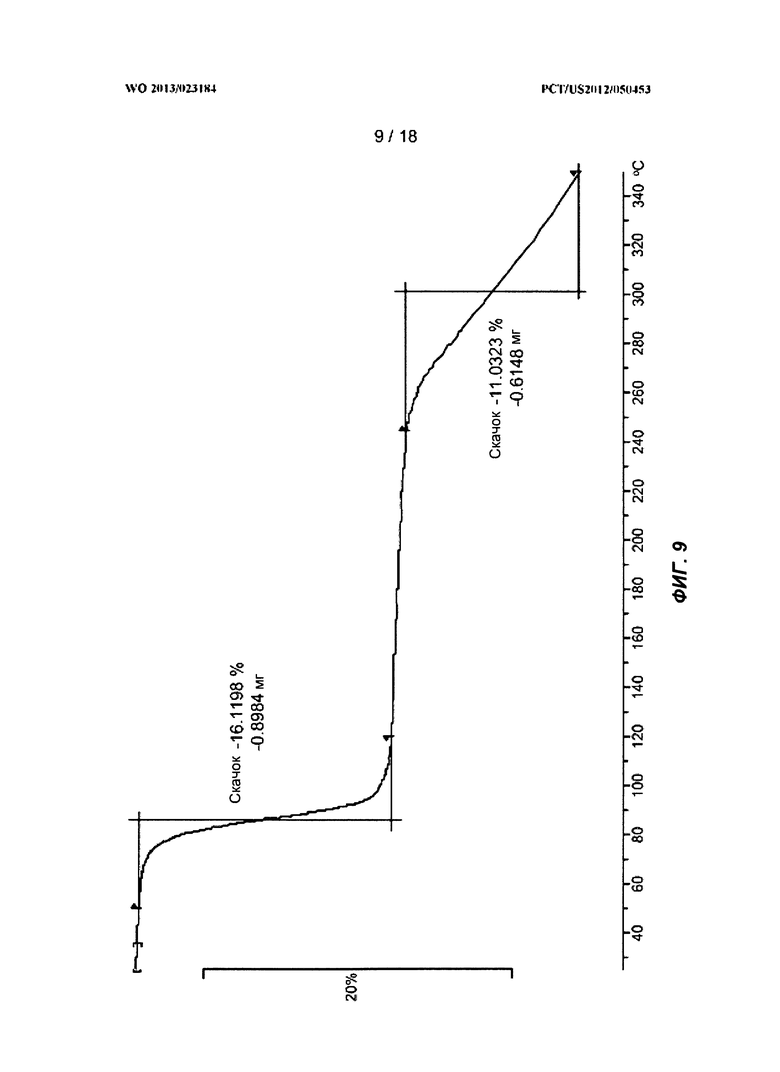
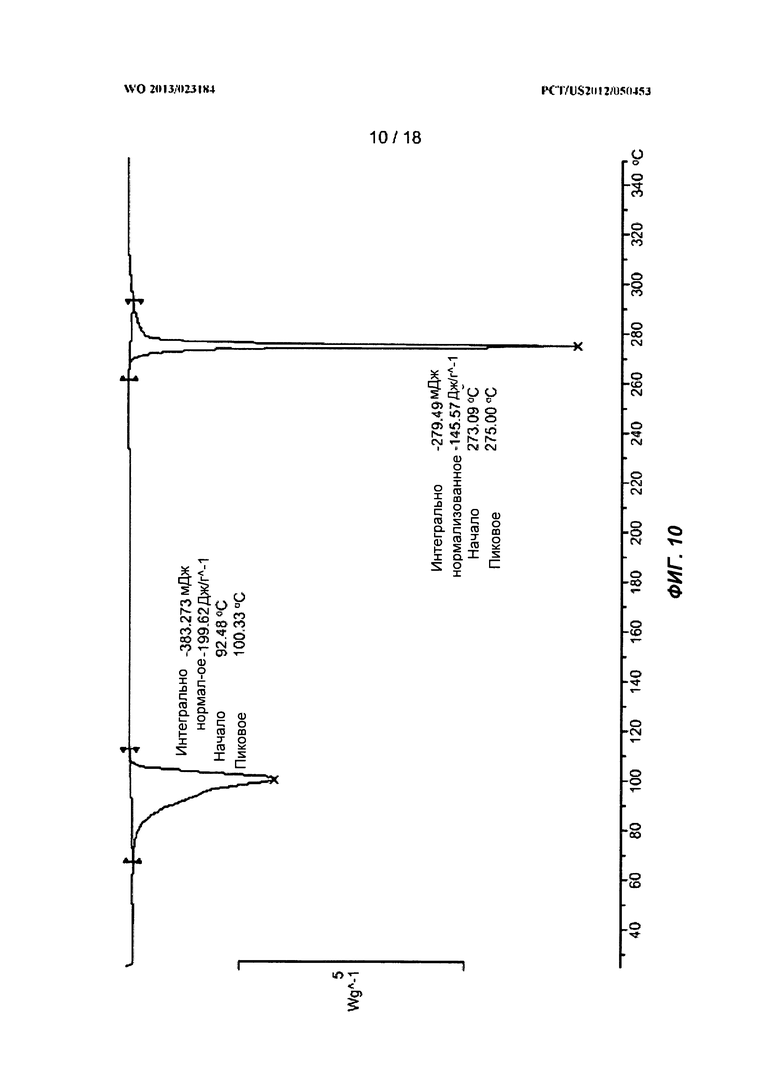
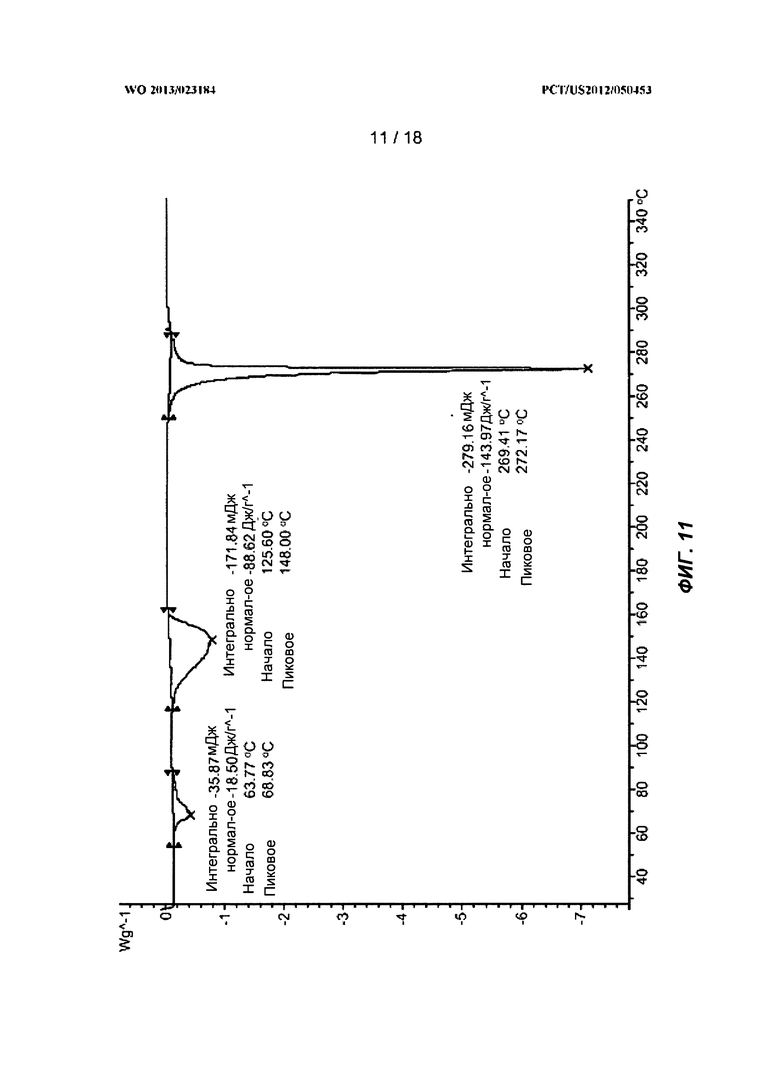
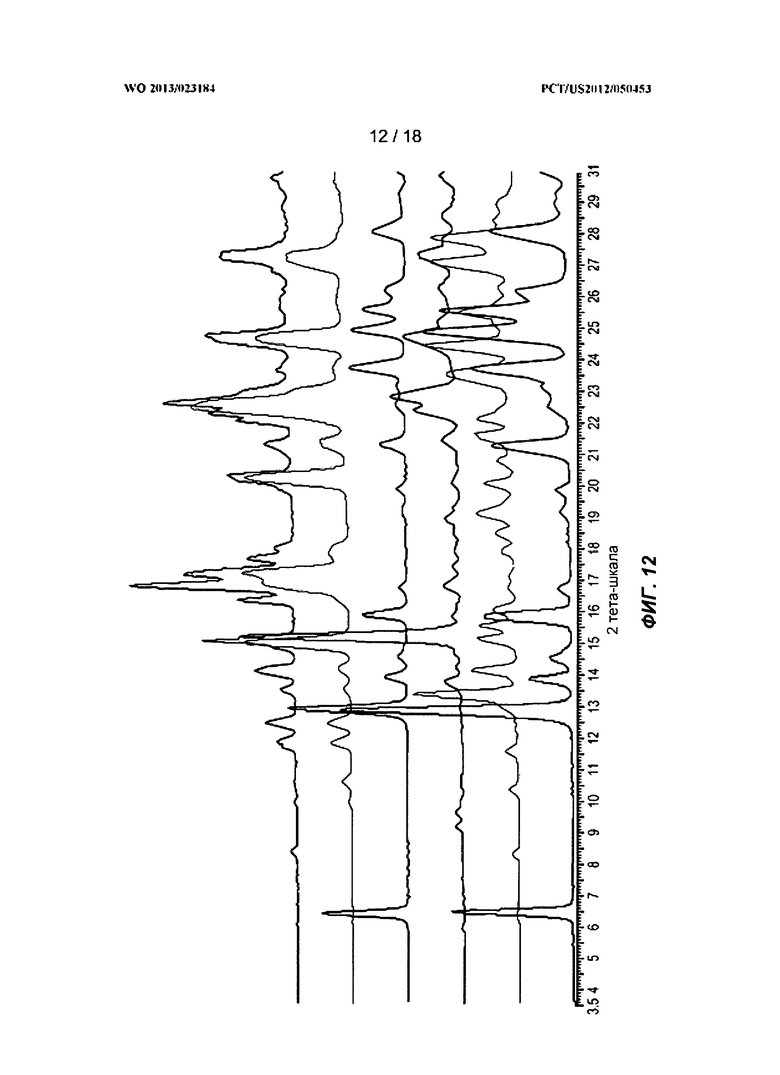
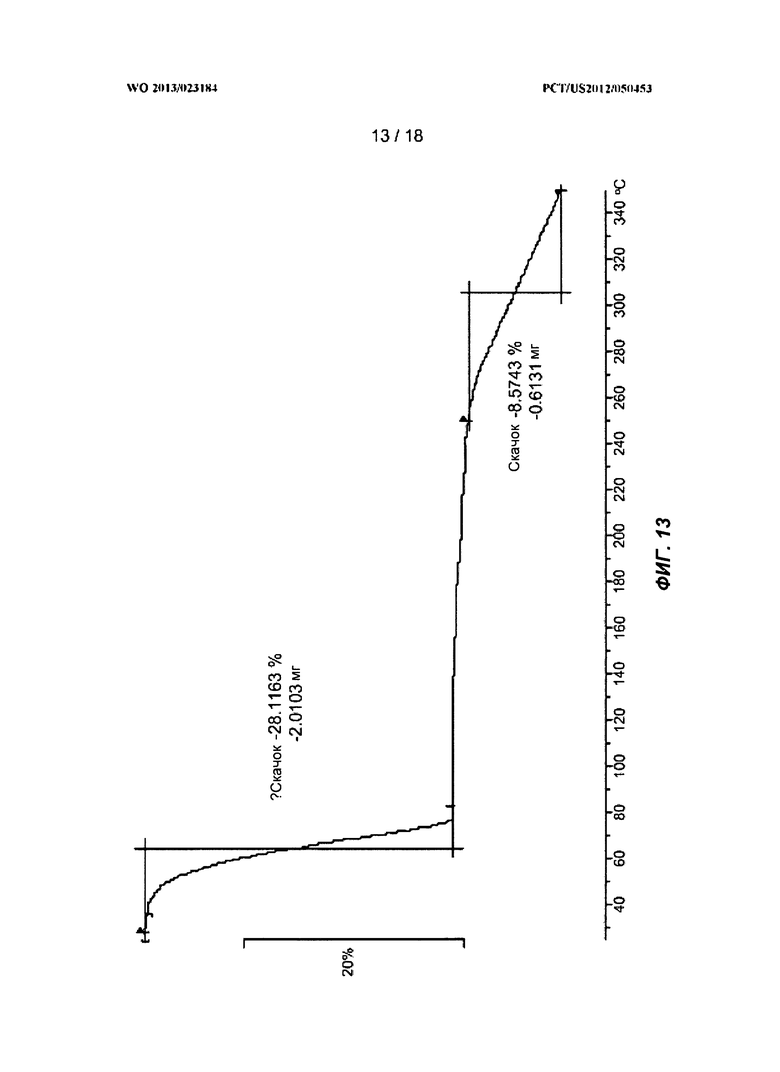
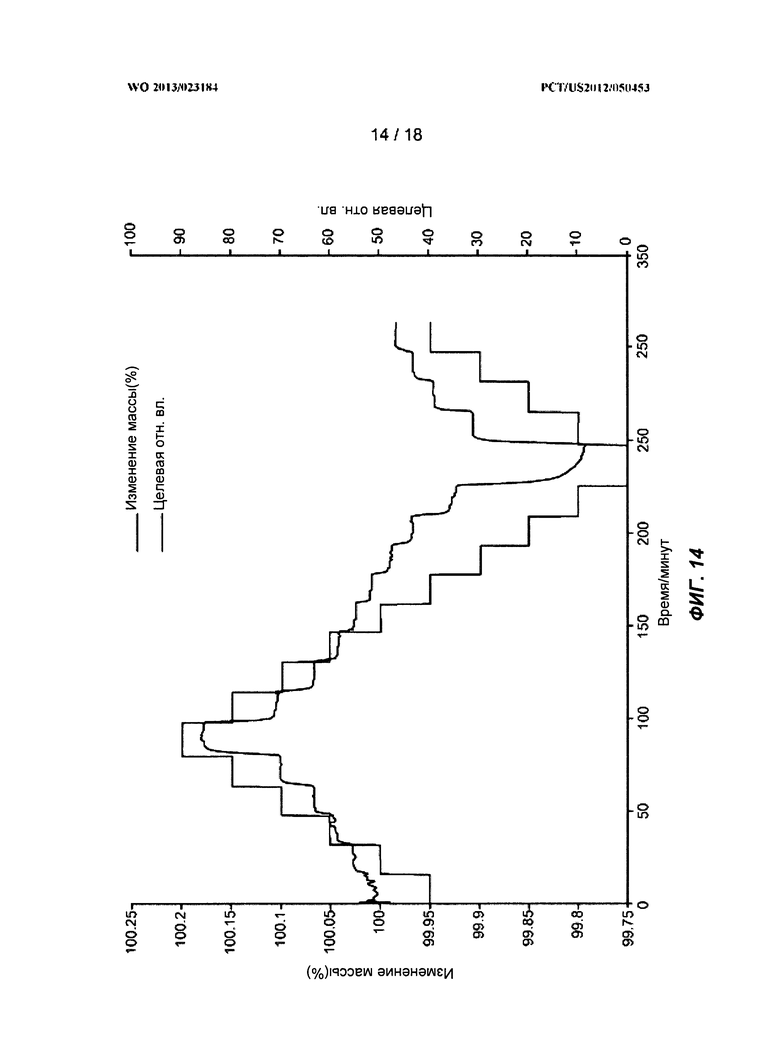
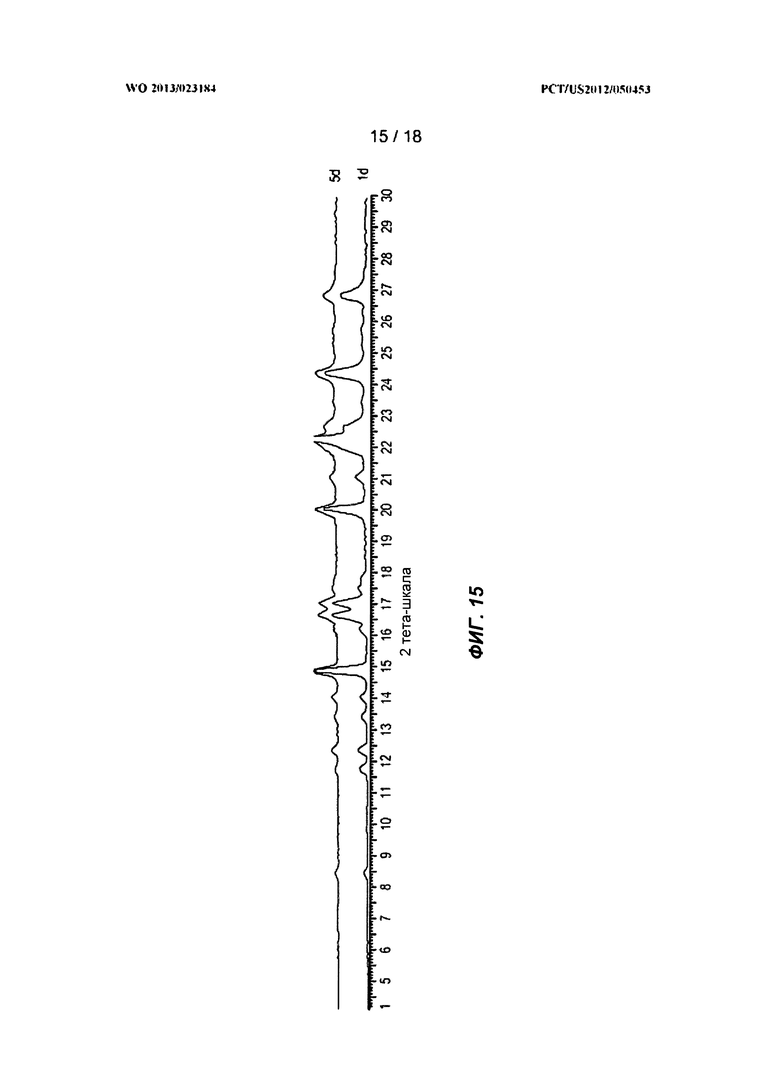
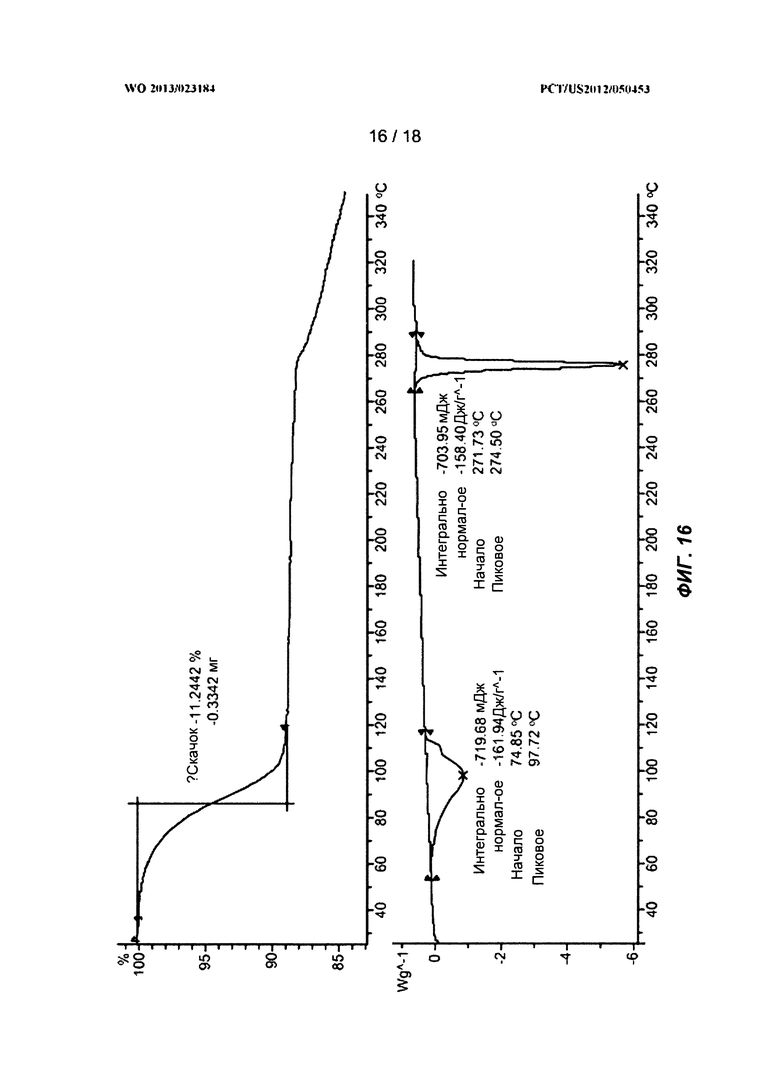
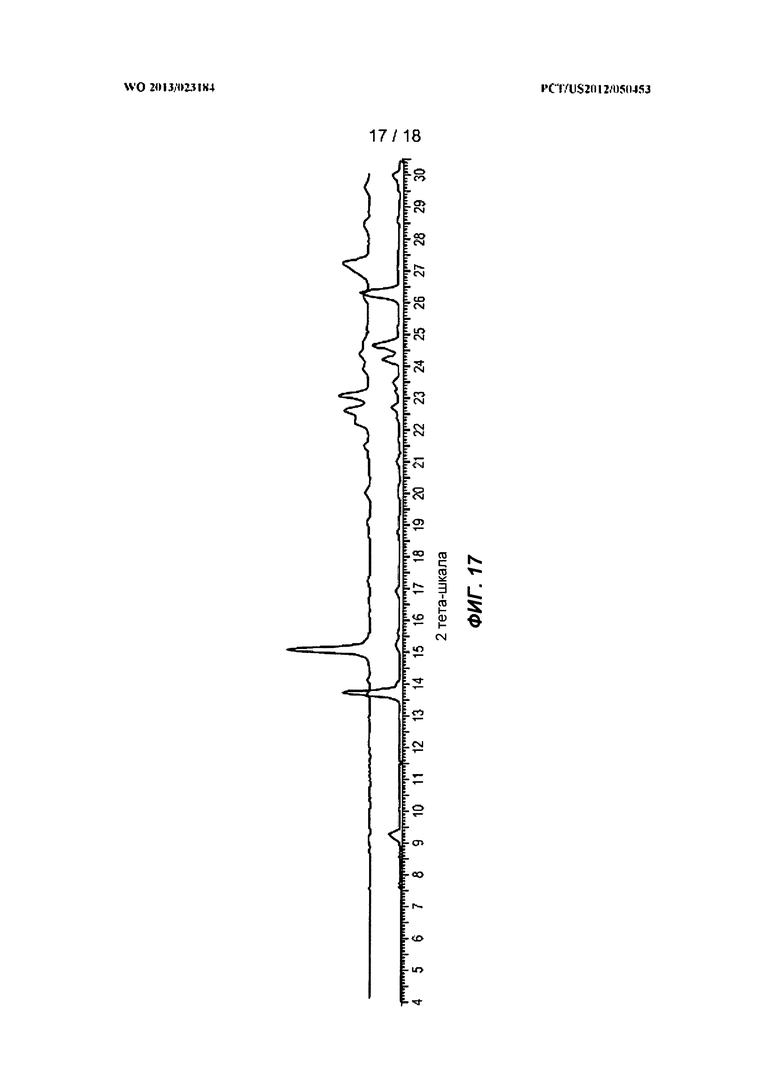
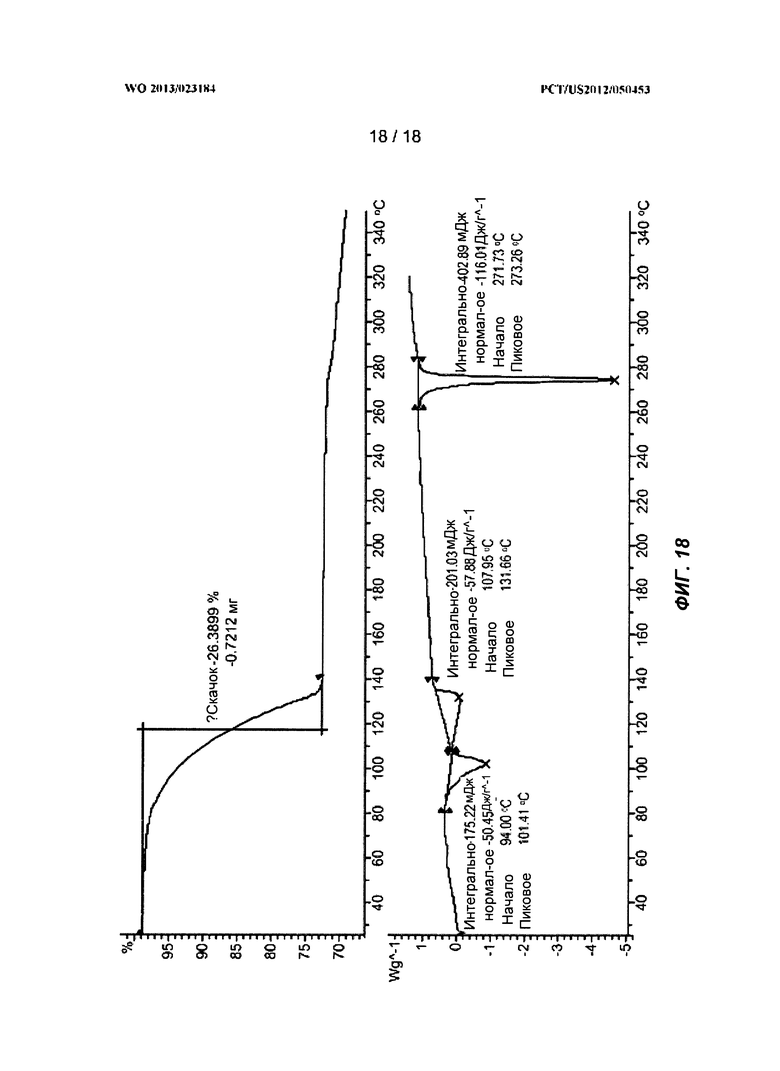
Изобретение относится к области органической химии, а именно к полиморфной форме А соединения формулы I. Технический результат: получена новая полиморфная форма соединения I, имеющая улучшенные свойства, например такие, как стабильность, гигроскопичность, полезная при лечении mTOR-ассоциированного нарушения. 18 ил., 7 табл., 13 пр.
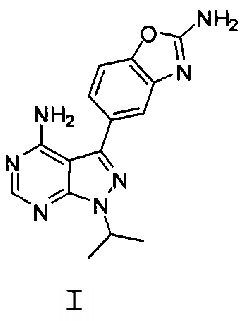
Полиморфная форма А соединения формулы I
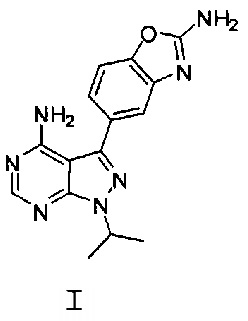
отличающаяся тем, что форма А характеризуется основными пиками на рентгеновской порошковой дифрактограмме, представленной на фиг. 1.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ПИРАЗОЛОПИРИМИДИНЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2124016C1 |
Авторы
Даты
2017-11-24—Публикация
2012-08-10—Подача