Изобретение относится к области биотехнологии и медицины, а именно к области ДНК аптамеров, способных специфично и с высоким сродством связываться с сердечным тропонином I человека. Основными областями применения ДНК-аптамеров к сердечному тропонину I являются клинические исследования, медицинская диагностика инфаркта миокарда, в том числе создание высокочувствительных и высокоэффективных систем для детекции сердечного тропонина I.
Инфаркт миокарда одна из ведущих причин смерти в развитых странах. Несмотря на то, что современная медицина обладает немалым арсеналом средств для диагностики этого заболевания, актуальность проблемы не исчерпана. Значительные усилия исследователи предпринимают для поиска новых эффективных (быстрых и чувствительных) аналитических систем для выявления кардиомаркеров, а также для поиска наиболее специфичных биомаркеров. Одними из общепризнанных высокочувствительных и специфичных маркеров инфаркта миокарда являются сердечные тропонины.
Сердечный тропонин I - это белок сердечной мышцы с молекулярной массой 23,9 кДа, состоящий из 209 аминокислотных остатков [Rajappa М. Biomarkers of Cardiac Injury: An Update / M. Rajappa, A. Sharma // Angiology. - 2005. - V. 56. P. 677-691]. В сердце он находится в белковом комплексе вместе с тропонинами Т и С. Вследствие разрушения миокарда белковый комплекс распадается, и тропонины попадают в кровяное русло, а через 4-8 часов уровень тропонина I в сыворотке крови становится диагностируемым. К настоящему времени создано много методов определения кардиомаркеров, включая электрохимическую и электрогенерирующую хемилюминесценцию, флюоресцентную иммунохроматографию и иммуноанализ [Qureshi A. Biosensors for cardiac biomarkers detection: a review / A. Qureshi, V. Gurbuz, J.H. Niazi // Sensors and Actuators B: Chemical. - 2012. - V. 171-172. P. 62-76]. При этом все существующие на сегодняшний момент диагностикумы основаны на биоспецифичном взаимодействии антиген-антитело. К недостаткам антител можно отнести их низкую стабильность, высокую стоимость и длительное время инкубации при анализе. В качестве отличной альтернативы антителам сейчас рассматривают аптамеры. Это синтетические одноцепочечные олигонуклеотиды с уникальной третичной структурой, способные специфично узнавать молекулу-мишень и присоединяться к ней. По сродству к мишеням аптамеры сравнимы с моноклональными антителами и обладают при этом рядом дополнительных преимуществ, таких как: возможность отбора методом молекулярной селекции «в пробирке» без использования иммунизации животных, восстановление активности после термической денатурации/ренатурации, высокая стабильность аптамеров в жестких условиях, а также возможность их химического синтеза в препаративных количествах и введения в их состав разнообразных химических модификаций. Перечисленные выше достоинства аптамеров обусловили растущий интерес к их использованию в биоаналитических целях. В последнее десятилетие активно развивается такое направление, как создание биосенсоров на основе аптамеров (аптасенсоров), в которых в качестве узнающего элемента используются аптамеры, а для передачи сигнала используются оптические, электрохимические или масс-чувствительные методы детекции. Разнообразие химических подходов и способов детекции позволяет конструировать аптасенсоры для высокочувствительного и специфичного определения самых разнообразных аналитов: от ионов металлов до одноклеточных микроорганизмов. В последние годы все больше появляется работ по созданию аптасенсоров на различные биомаркеры, в том числе и на маркеры заболеваний сердца: С-реактивный белок, натрийуретический пептид, миоглобин, тропонин I.
Известен ДНК аптамер к тропонину I, состоящий из 79 нуклеотидов (TnIApt18: 5'-GCCTGTTGTGAGCCTCCTAACTACATGTTCTCAGGGTTGAGGCTGGATGGCGATGGTGGCATGCTTATTCTTGTCTCCC-3') [Dorraj G.S. Selection of DNA aptamers against Human Cardiac Troponin I for colorimetric sensor based dot blot application / G.S. Dorraj, M.J. Rassaee, A.M. Latifi, B. Pishgoo, M. Tavallaei // Journal of Biotechnology. - 2015. - V. 208. - P. 80-86]. По данным флюоресцентного твердофазного анализа аптамер обладает аффинностью 9 нМ. С использованием данного аптамера были созданы электрохимический аптасенсор, позволяющий определять тропонин I в диапазоне 10 pg/μL - 1 ng/μL и пределом обнаружения 24 pg/ml, а также аптасенсор с детекцией сигнала посредством флюоресцентного резонансного переноса энергии. Предел обнаружения такого аптасенсора составляет 14.4 pg/ml тропонина I.
Недостатком этого аптамера является то, что он был получен к рекомбинантному тропонину I.
Наиболее близкими аналогами, принятыми за прототип, являются аптамеры к тропонину I, состоящие из 40 нуклеотидов (Tro4: 5'-CGTGCAGTACGCCAACCTTTCTCATGCGCTGCCCCTCTTA-3' и Tro6: 5'-CGCATGCCAAACGTTGCCTCATAGTTCCCTCCCCGTGTCC-3') [Jo Н. Electrochemical Aptasensor of Cardiac Troponin I for the Early Diagnosis of Acute Myocardial Infarction / H Jo, H. Gu, W. Jeon, H. Youn, J. Her, S.K. Kim, J. Lee, J.H. Shin, C. Ban // Analytical Chemistry. - 2015. - V. 87. - №19. - P. 9869-9875]. По данным SPR, аптамеры обладают высокой аффинностью - 270 рМ (Tro4) и 317 рМ (Tro6). Известны изобретения, в которых описаны способы выявления тропонина I с помощью данных аптамеров. Например, электрохимические аптасенсоры с пределами обнаружения тропонина I в диапазоне от 1 pg/ml до 24 pg/ml, также аптасенсоры с электрохемилюминесцентным детекцией сигнала (предел обнаружения 0.3 pg/ml) или флюоресцентной детекцией сигнала (предел обнаружения 70 pg/ml и 7.2 fg/ml).
Недостатком является то, что аптамеры были получены к рекомбинантному тропонину I, кроме этого, использование разработанных на их основе аптасенсоров продемонстрировано только на искусственных сыворотках, также с использованием рекомбинантного тропонина I. Поскольку конформации рекомбинантных и нативных белков могут различаться, специфичность выявления тропонина I в крови человека с помощью таких аптамеров может быть недостаточно высока.
Задачей настоящего изобретения является создание ДНК аптамеров, способных специфично и высокоафинно связываться с нативным человеческим сердечным тропонином I.
Техническим результатом данного изобретения является получение новых ДНК аптамеров, обладающих способностью специфично и высокоафинно связываться с человеческим сердечным тропонином I, а также расширяется их ассортимент.
Технический результат достигается тем, что ДНК аптамеры, связывающие сердечный тропонин I человека, представлены одноцепочечными ДНК, обладают высокой специфичностью связывания в отношении сердечного тропонина I человека, новым является то, что:
ДНК аптамер TnAp2 длиной 80 нуклеотидов, молекулярной массой 25 кДа, константой диссоциации 42 нМ, имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACAGGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGTTGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB;
ДНК аптамер TnAp2t1 длиной 54 нуклеотида, молекулярной массой 17 кДа, константой диссоциации 25 нМ, имеет первичную последовательность 5'-AGACAAGACAGGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGTTGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp2t2 длиной 40 нуклеотидов, молекулярной массой 12,6 кДа, константой диссоциации 39 нМ, имеет первичную последовательность 5'-GGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp2t3 длиной 27 нуклеотидов, молекулярной массой 8,5 кДа, константой диссоциации 31 нМ, имеет первичную последовательность 5'-GCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp12 длиной 80 нуклеотидов, молекулярной массой 25 кДа, константой диссоциации 24 нМ, имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACATCGGGAGGGAGGGAGGGCAGTCTAGTCTCATGTGTTTCCATGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB.
Сопоставительный анализ с прототипом позволяет сделать вывод о том, что заявляемое изобретение отличается от известного тем, что:
ДНК аптамер TnAp2 длиной 80 нуклеотидов, молекулярной массой 25 кДа, константой диссоциации 42 нМ, имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACAGGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGTTGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB;
ДНК аптамер TnAp2t1 длиной 54 нуклеотида, молекулярной массой 17 кДа, константой диссоциации 25 нМ, имеет первичную последовательность 5'-AGACAAGACAGGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGTTGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp2t2 длиной 40 нуклеотидов, молекулярной массой 12,6 кДа, константой диссоциации 39 нМ, имеет первичную последовательность 5'-GGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp2t3 длиной 27 нуклеотидов, молекулярной массой 8,5 кДа, константой диссоциации 31 нМ, имеет первичную последовательность 5'-GCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp12 длиной 80 нуклеотидов, молекулярной массой 25 кДа, константой диссоциации 24 нМ, имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACATCGGGAGGGAGGGAGGGCAGTCTAGTCTCATGTGTTTCCATGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB.
Признаки, отличающие заявляемое решение от прототипа, обеспечивают заявляемому техническому решению соответствие критерию «новизна».
Признаки, отличающие заявляемое решение от прототипа не выявлены при изучении других известных технических решений в данной области техники и, следовательно, обеспечивают ему соответствие критерию «изобретательский уровень».
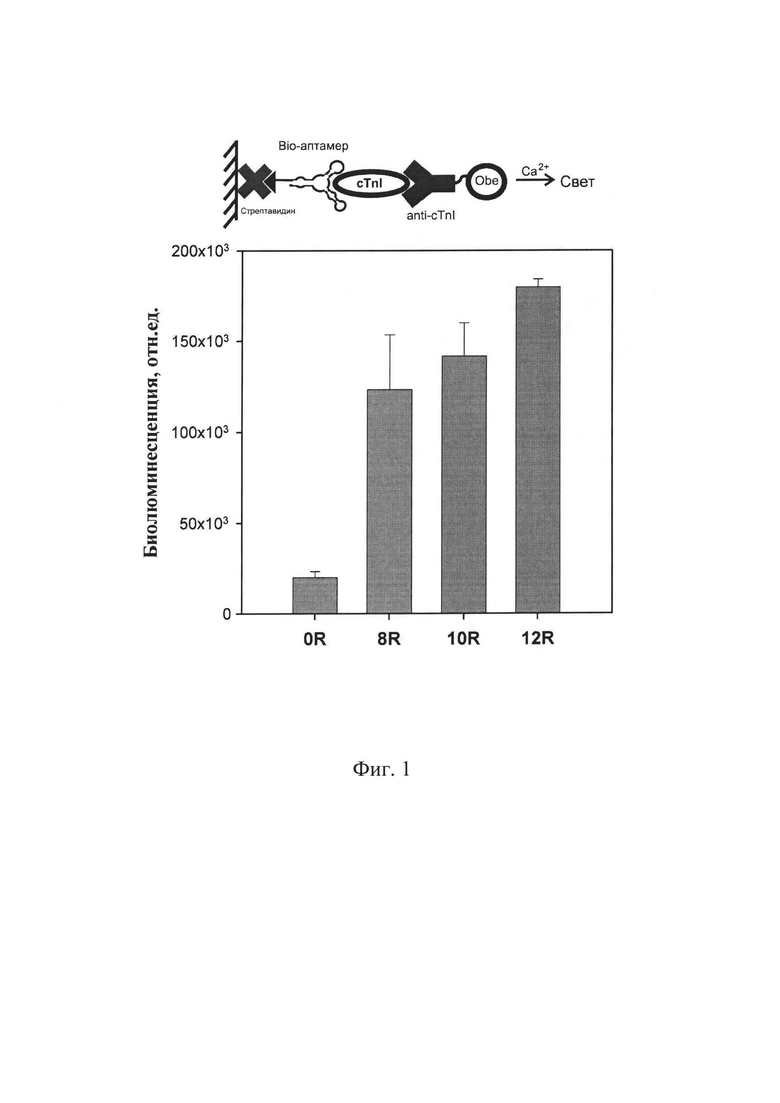
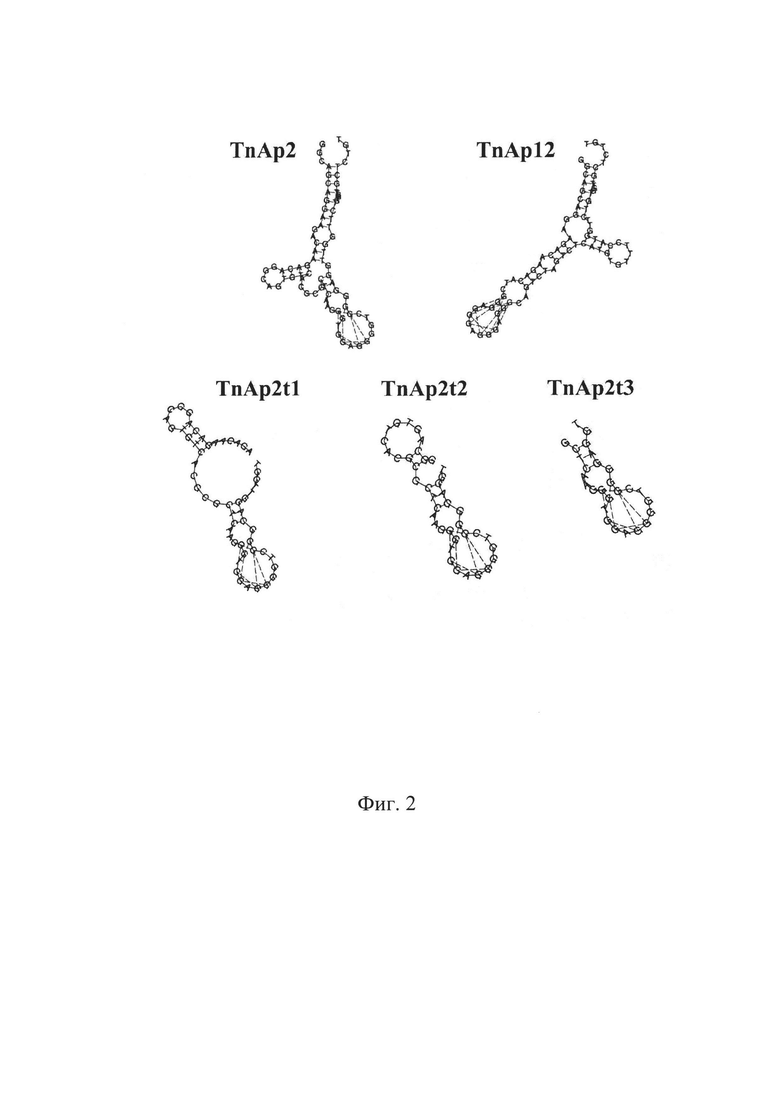
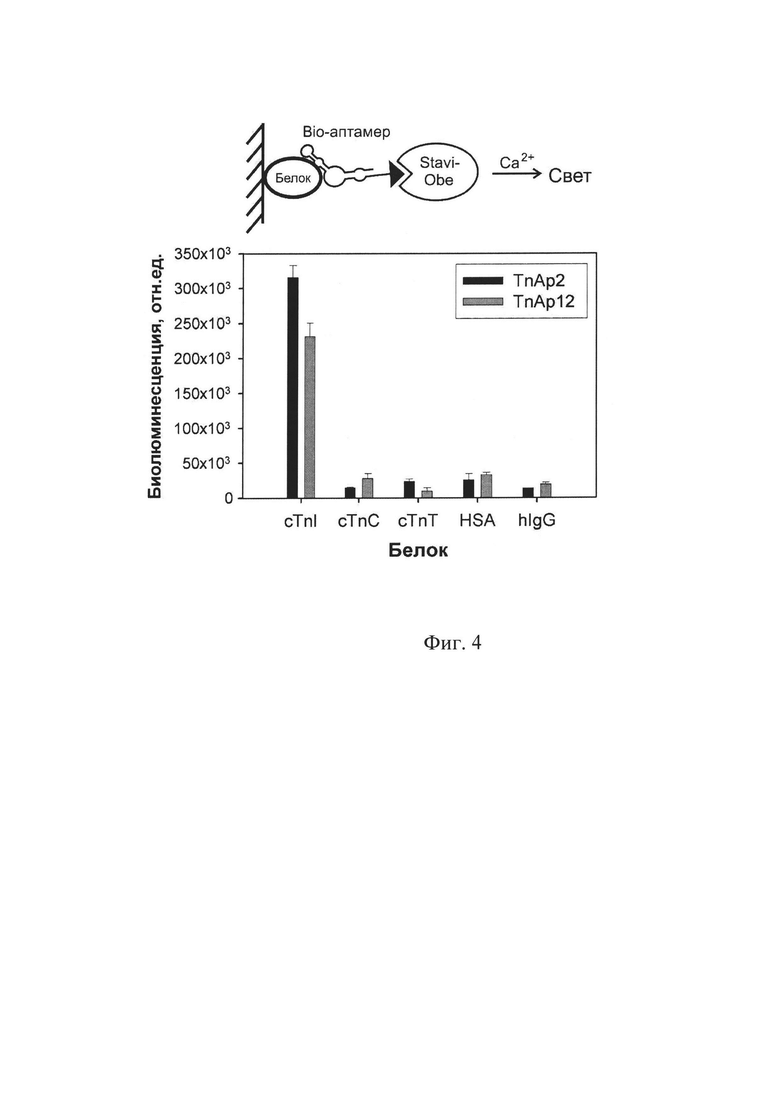
Изобретение поясняется графическими материалами. На фиг. 1 приведены схема и результаты твердофазного биолюминесцентного анализа исходной (0R) и обогащенной ДНК библиотеки после 8 (8R), 10 (10R) и 12 (12R) раундов селекции (n=3); на фиг. 2 приведены вторичные структуры аптамера TnAp2, TnAp12 и укороченных вариантов аптамера TnAp2: TnAp2t1, TnAp2t2 и TnAp2t3, предсказанные с помощью RNAfold веб-сервера; на фиг. 3 приведены схема твердофазного биолюминесцентного анализа и полученные кривые связывания тропонина I с аптамерами TnAp2 ( ) и TnAp12 (-Δ-), (n=3); на фиг. 4 приведены схема и результаты биолюминесцентного твердофазного анализа специфичности аптамеров TnAp2 и TnAp12.
) и TnAp12 (-Δ-), (n=3); на фиг. 4 приведены схема и результаты биолюминесцентного твердофазного анализа специфичности аптамеров TnAp2 и TnAp12.
Сущность изобретения заключается в следующем: с помощью разработанной схемы селекции аптамеров к тропонину I, с использованием нативного сердечного тропонина I человека в качестве мишени, отбираются аптамеры с высокой специфичностью к мишени; применением раундов негативной селекции библиотеки ДНК-олигонуклеотидов против человеческого сывороточного альбумина, тропонина Т, тропонина С, миоглобина, креатинкиназы MB и бычьего сывороточного альбумина, что позволяет удалить из селектируемого пула неспецифичные последовательности ДНК; путем определения первичной структуры последовательностей аптамеров с помощью NGS секвенирования обогащенной библиотеки и проверки индивидуальных последовательностей ДНК на связывание с тропонином I при помощи биолюминесцентного твердофазного анализа; минимизация нуклеотидной последовательности аптамера и проверка укороченных вариантов аптамера на связывание с тропонином I при помощи биолюминесцентного твердофазного анализа.
Изобретение осуществляют следующим образом.
1. Отбор ДНК аптамеров к сердечному тропонину I.
Отбор высокоаффинных и специфичных ДНК аптамеров к сердечному тропонину I (cTnI) проводят методом систематической эволюции лигандов при экспоненциальном обогащении (SELEX). Используемая ДНК-библиотека представляет собой набор одноцепочечных ДНК (5'-const1-N40-const2-3'), каждая из которых фланкирована стандартными последовательностями для связывания праймеров при амплификации (const1 и const2), а центральные 40 нуклеотидов рандомизированы. Перед каждым раундом селекции оцДНК-библиотеку или ее обогащенный в предыдущем раунде вариант (в PBS рН 7,0, 1 мМ MgCl2) денатурируют в течение 5 мин при 95°С, после чего ренатурируют при комнатной температуре в течение 10 мин. В ходе отбора проводят 12 раундов селекции, включающих 1) инкубацию исходной библиотеки аптамеров в первом раунде селекции (или ее обогащенный в предыдущем раунде вариант) с cTnI, адсорбированным на поверхность лунки стрипового планшета (10 мкг/мл, PBS в течение ночи, 4°С); 2) удаление несвязавшихся аптамеров с помощью отмывок (PBS рН 7,0, 1 мМ MgCl2, 0,1% Твин 20); 3) трехкратную экстракцию связанных с cTnI аптамеров денатурацией в ТЕ буфере при 95°С в течение 10 мин; 4) амплификацию обогащенной библиотеки аптамеров с помощью симметричной и ассиметричной ПЦР. Симметричную ПЦР проводят следующим образом: 5 мкл раствора аптамеров (5-15 нг) в ТЕ буфере и 45 мкл реакционной смеси, содержащей 1X Taq-буфер, 200 мкМ dNTPs, 300 нМ прямого праймера (5'-GGCAGCAGGAAGACAAGACA-3'), 300 нМ обратного праймера (Bio-5'-ACAGAGCAACCACAGAACCA-3'), HotStart DNA-полимеразу 0,05 ед/мкл. Ассимитричную ПЦР проводят следующим образом: 5 мкл симметричного ПЦР продукта и 45 мкл реакционной смеси: 1X Taq-буфер, 200 мкМ dNTPs, 1 мкМ прямого праймера, 50 нМ обратного праймера, HotStart DNA-полимераза 0,05 ед/мкл. ПЦР проводят по следующей программе: предварительная денатурация матрицы - 2 мин при 95°С, далее 15 циклов: 30 сек при 95°С, 15 сек при 56°С, 15 сек при 72°С. Продукты ПЦР анализируют с помощью электрофореза в 2% агарозном геле при окрашивании бромистым этидием (3,8-диамино-5-этил-6-фенил-фенантридиум бромид). Для дальнейшего использования аптамеры очищают с помощью центрифужной фильтрационной ячейки для концентрирования Amicon. Концентрацию оцДНК-аптамеров определяют спектрофотометрически.
Для увеличения специфичности отбираемых аптамеров проводят негативную селекцию на следующие мишени: человеческий сывороточный альбумин, HSA (KS1 и KS7), сердечные тропонин Т, cTnT (KS2 и KS9) и тропонин С, cTnC (KS6 и KS10), миоглобин человека, Myo (KS4) и креатинкиназа MB, CKMB (KS5), а также бычий сывороточный альбумин, BSA (KS3). Для увеличения аффинности отбираемых аптамеров в ходе отбора уменьшают время инкубации и увеличивают количество промывок для удаления не связавшихся аптамеров. В результате отбора происходит постепенное обогащение библиотеки последовательностями, обладающими повышенным сродством к cTnI.
2. Анализ обогащения ДНК библиотеки с помощью биолюминесцентного твердофазного анализа.
Для анализа обогащения ДНК библиотеки последовательностями, аффинными к cTnI, библиотеку после 8, 10 и 12 раундов селекции амплифицируют симметричной и ассиметричной ПЦР с использованием биотинилированного прямого праймера (Bio-5'-GGCAGCAGGAAGACAAGACA-3'). Полученные биотин-содержащие последовательности вносят по 50 мкл (50 нМ в буфере для связывания: PBS рН 7,0, 1 мМ MgCl2) в лунки микропланшета, активированного стрептавидином (10 мкг/мл, в PBS рН 7,5, ночь при 4°С), инкубируют 1 час при комнатной температуре и лунки промывают (четырежды, промывочным буфером: PBS рН 7,0, 1 мМ MgCl2, 0,1% Твин20). Затем в лунки вносят по 50 мкл раствора cTnI (1,25 μM - 0,08 нМ в буфере для связывания), инкубируют 1 час при комнатной температуре и лунки промывают. Далее в лунки вносят по 50 мкл раствора репортера, представляющего собой Са2+-регулируемый фотопротеин обелин, химически конъюгированный с моноклональным антителом к cTnI (0,1 мкг/мл в буфере для связывания, содержащий 0,1% БСА) и инкубируют 40 мин. После промывки лунок, биолюминесценцию обелина инициируют добавлением 0,1 М CaCl2 в 0,1 М Трис-HCl рН 8,8 и измеряют с помощью планшетного люминометра в течение 5 секунд.
3. Определение первичной последовательности ДНК аптамеров к тропонину I и моделирование их вторичной структуры.
Для определения первичной последовательности индивидуальных ДНК аптамеров используют метод высокопроизводительного ДНК-секвенирования. Библиотеку после 12 раунда селекции секвенируют на платформе Miseq (Illumina). После первичной биоинформатической обработки результатов получают выборки уникальных последовательностей и рассчитывают частоту их встречаемости в обогащенной библиотеке.
В ходе анализа последовательностей проводят предсказание вторичной структуры аптамеров при помощи веб-серверов Mfold и RNAfold. RNAfold используют для получения вторичных структур аптамеров с учетом G-квадруплексов.
4. Скрининг индивидуальных последовательностей аптамеров на связывание с тропонином I биолюминесцентным твердофазным анализом.
Для скрининга аффинности индивидуальных аптамеров к cTnI биолюминесцентным твердофазным анализом синтезируют биотинилированные производные индивидуальных аптамеров, которые затем иммобилизуют (50 нМ в буфере для связывания: PBS рН 7,0, 1 мМ MgCl2) на поверхность микропланшет, активированную стрептавидином (10 мкг/мл, в PBS рН 7,5, ночь при 4°С), инкубируют 1 час при комнатной температуре и лунки микропланшета промывают (четырежды, промывочным буфером: PBS рН 7,0, 1 мМ MgCl2, 0,1% Твин20). Затем в лунки вносят по 50 мкл раствора cTnI (1,25 μМ - 0,08 нМ в буфере для связывания), инкубируют 1 час при комнатной температуре и лунки промывают. Далее в лунки вносят по 50 мкл раствора репортера, представляющего собой Са2+-регулируемый фотопротеин обелин, химически конъюгированный с моноклональным антителом к cTnI (0,1 мкг/мл в буфере для связывания, содержащий 0,1% БСА) и инкубируют 40 мин при комнатной температуре. После промывки лунок, биолюминесценцию обелина инициируют добавлением 0,1 М CaCl2 в 0,1 М Трис-HCl рН 8,8 и измеряют с помощью планшетного люминометра в течение 5 секунд.
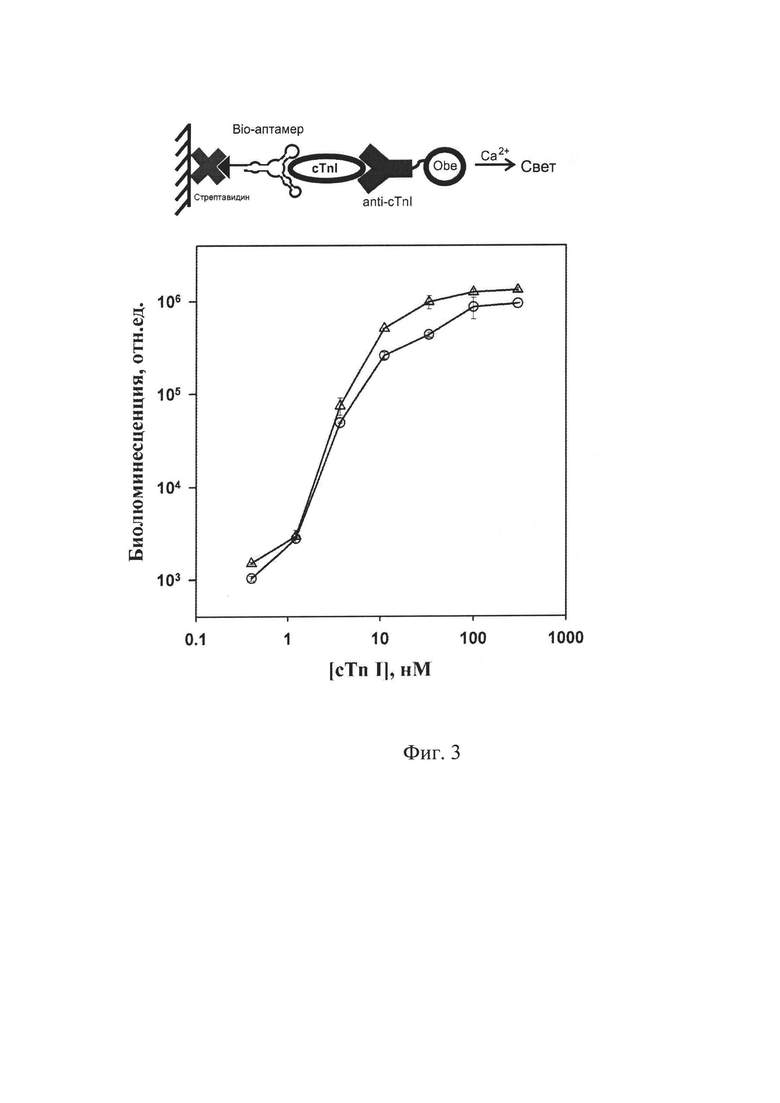
Полученные в результате биолюминесцентного анализа кривые связывания используют для расчета константы диссоциации комплексов аптамер - cTnI. Расчет проводят нелинейной регрессией экспериментальных данных, используя зависимость:
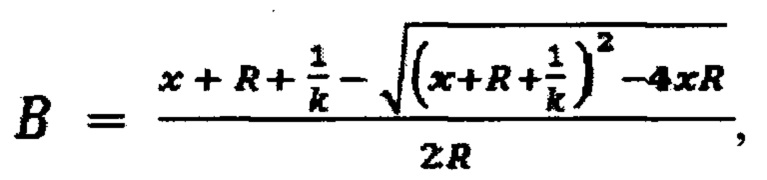
где В=L/Lmax; отношение пика интенсивности сигнала от образца (L) к сигналу от образца с насыщающей концентрацией cTnI (Lmax); R - концентрация индивидуального аптамера; х - концентрация cTnI в образцах, вносимых в лунки; k - константа аффинности.
5. Определение специфичности ДНК аптамеров к тропонину I биолюминесцентным твердофазным анализом.
В качестве неспецифических белков используют белки плазмы крови: HSA и человеческие иммуноглобулины G, а также белки тропонинового комплекса (cTnT и cTnC), которые адсорбируют на поверхность микропланшет (50 мкл, 10 мкг/мл, PBS, ночь при 4°С). После процедуры промывки (четырежды, промывочным буфером: PBS рН 7,0, 1 мМ MgCl2, 0,1% Твин20) инкубируют с 100 нМ раствором биотинилированного аптамера (50 мкл в буфере для связывания PBS рН 7,0, 1 мМ MgCl2) 1 час при комнатной температуре и лунки снова промывают. Затем в лунки добавляют по 50 мкл гибридного белка стрептавидин-обелин (50 нг/мл в буфере для связывания), полученного как описано в [Bashmakova Е.Е. Hybrid minimal core streptavidin-obelin as a versatile reporter for bioluminescence-based bioassay / E.E. Bashmakova, V.V. Krasitskaya, A.N. Kudryavtsev, V.G. Grigorenko, L.A. Frank // Photochemistry and Photobiology. - 2017. - V. 93. - №2. - P. 548-552], инкубируют 40 мин при комнатной температуре. После промывки лунок, биолюминесценцию обелина инициируют добавлением 0,1 М CaCl2 в 0,1 М Трис-HCl рН 8,8 и измеряют с помощью планшетного люминометра в течение 5 секунд.
Таким образом, предлагаемые ДНК аптамеры обладают высоким сродством и специфичностью связывания с сердечным тропонином I и могут быть использованы для создания аптасенсора для чувствительного определения уровня тропонина I в сыворотке/плазме крови человека при диагностике инфаркта миокарда, третичная структура предлагаемых ДНК аптамеров содержит G-квадруплекс, что предполагает большую стабильность по сравнению со структурой прототипа, не содержащей G-квадруплекс.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления мишеней, ассоциированных с определенным диагнозом, в крови пациентов на основе ДНК-аптамеров | 2017 |
|
RU2685936C2 |
| ДНК-аптамер, специфично связывающийся с белком Dickkopf-1 человека | 2023 |
|
RU2814580C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯСЯ С ПРОТЕОЛИТИЧЕСКОЙ СУБЪЕДИНИЦЕЙ НЕЙРОТОКСИНА ТИПА A CLOSTRIDIUM BOTULINUM | 2014 |
|
RU2571210C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯСЯ С БАКТЕРИЯМИ Escherichia coli O157:H7 | 2014 |
|
RU2566551C1 |
| Способ направленного истощения олигонуклеотидных библиотек для снижения неспецифической адсорбции при твердофазной селекции аптамеров на основе нуклеиновых кислот | 2015 |
|
RU2618872C1 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |
| СПОСОБ СЕЛЕКЦИИ АПТАМЕРОВ К ЗАДАННЫМ БЕЛКОВЫМ МИШЕНЯМ НА ПОВЕРХНОСТИ КЛЕТОК | 2012 |
|
RU2518368C1 |
| Способ выявления опухолеспецифичных мишеней в гистологических срезах тканей больных раком легкого человека | 2015 |
|
RU2639238C2 |
| СВЯЗЫВАЮЩИЕ КОМПЛЕМЕНТ АПТАМЕРЫ И СРЕДСТВА ПРОТИВ С5, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2007 |
|
RU2477137C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯ ШИГА-ТОКСИН ТИПА 2 | 2014 |
|
RU2566552C1 |
Изобретение относится к области биотехнологии и медицины, а именно к области ДНК аптамеров, способных специфично и с высоким сродством связываться с сердечным тропонином I человека. Основными областями применения ДНК-аптамеров к сердечному тропонину I являются клинические исследования, медицинская диагностика инфаркта миокарда, в том числе создание высокочувствительных и высокоэффективных систем для детекции сердечного тропонина I. ДНК аптамеры, связывающие сердечный тропонин I человека, представлены одноцепочечными ДНК. ДНК аптамер ТnАр2 имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACAGGCAGTGT CACGCGCTCAAGGGTGGAGGGGTCGGGG AGGTTGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB; ДНК аптамер TnAp2t1 имеет первичную последовательность 5'-AGACAAGACAGGCAGTGTCA CGCGCTCAAGGGTGGAGG GGTCGGGGAGGTTGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера ТnАр2; ДНК аптамер TnAp2t2 имеет первичную последовательность 5'-GGCAGTGTCACGCGCTCAAGG GTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера ТnАр2; ДНК аптамер TnAp2t3 имеет первичную последовательность 5'-GCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера ТnАр2; ДНК аптамер ТnАр12 имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACATCGGGAGGGAG GGAGGGCAGTCTAGTCTCATGTG TTTCCATGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB. Полученные ДНК аптамеры обладают способностью специфично и высокоафинно связываться с человеческим сердечным тропонином I, а также расширяется их ассортимент. 4 ил.
ДНК аптамер, связывающий сердечный тропонин I человека, представленный одноцепочечной ДНК, обладающий высокой специфичностью связывания в отношении сердечного тропонина I человека, выбранный из группы:
ДНК аптамер TnAp2 длиной 80 нуклеотидов, молекулярной массой 25 кДа, константой диссоциации 42 нМ, имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACAGGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCG GGGAGGTTGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB;
ДНК аптамер TnAp2t1 длиной 54 нуклеотида, молекулярной массой 17 кДа, константой диссоциации 25 нМ, имеет первичную последовательность 5'-AGACAAGACAGGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGTTGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp2t2 длиной 40 нуклеотидов, молекулярной массой 12,6 кДа, константой диссоциации 39 нМ, имеет первичную последовательность 5'-GGCAGTGTCACGCGCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp2t3 длиной 27 нуклеотидов, молекулярной массой 8,5 кДа, константой диссоциации 31 нМ, имеет первичную последовательность 5'-GCTCAAGGGTGGAGGGGTCGGGGAGGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB и оптимизации последовательности аптамера TnAp2;
ДНК аптамер TnAp12 длиной 80 нуклеотидов, молекулярной массой 25 кДа, константой диссоциации 24 нМ, имеет первичную последовательность 5'-GGCAGCAGGAAGACAAGACATCGGGAGGGAGGGAGGGCAGTCTAGTCTCATGTGTTTCCATGGTTCTGTGGTTGCTCTGT-3', отобран в результате позитивной селекции против нативного сердечного тропонина I человека и негативной селекции против человеческих сывороточного альбумина, сердечных тропонинов С и Т, миоглобина и креатинкиназы MB.
| CHAMAR SOLTAN DORRAJ et al | |||
| Selection of DNA aptamers against Human cardiac troponin I for colorimetric sensor based dot blot application, Journal of biotechnology, 208, 2015, с.80-86 | |||
| ДАВЫДОВА А.С | |||
| и др | |||
| Новые РНК-аптамеры к фотопротеину обелину как универсальная платформа для создания аптасенсоров, Всероссийская конференция с международным |
Авторы
Даты
2020-03-11—Публикация
2019-07-02—Подача