Изобретение относится к медицине, а именно к средствам терапевтического воздействия, основным компонентом которого является хлорид лития (LiCl). Изобретение может быть использовано для дальнейшей разработки медикаментозных средств и способов лечения больных с патологическими состояниями, при которых наблюдается воспалительная гиперактивация нейтрофилов: синдром системного воспалительного ответа (ССВО) после операций на сердце и сосудах, тяжелая сочетанная травма, тяжелый сепсис и септический шок, синдром ишемии-реперфузии тканей при инсульте и инфаркте миокарда, отек легкого и острый респираторный дистресс-синдром (ОРДС), ожоговая болезнь.
Уровень техники
Неразрешаемое воспаление, сопровождаемое гибелью множества клеток и развитием полиорганной недостаточности, несовершенные иммунные реакции и повышенная восприимчивость к инфекционным возбудителям являются основными причинами, лежащими в основе высокого риска смерти, характерного для критических состояний.
В настоящее время известно несколько терапевтических средств и способов, направленных на решение указанной задачи путем устранения избыточной воспалительной активации нейтрофилов.
Известно терапевтическое средство и метод лечения ССВО и других заболеваний, сопровождаемых активацией нейтрофилов (US 2016146835). Из описания указанного патента известно, что богатый гистидином гликопротеин (HRG) может выступать в роли регулятора активации нейтрофилов и приводить к меньшей выраженности ССВО. Его уровень в крови пациентов может быть предиктором неблагоприятного исхода при сепсисе.
Кроме того, известно, что использование пептидов от 10 до 19 аминокислот от NH2 конца белка СТАР-III может выступать в роли регулятора активации нейтрофилов и приводить к меньшей выраженности ССВО (WO 9205796).
Известно также, что использование пептидов LALF31-52 может выступать в роли регулятора активации нейтрофилов и приводить к меньшей выраженности ССВО. Цитопротекторная фармацевтическая комбинация, содержащая указанные пептиды может быть использована в профилактике и лечении ССВО (СА 2635342).
Из описания патента TW 201534322 (FPR1 antagonist derivatives and use thereof) известно, что дипептидные деривативы (dipeptide derivatives) могут выступать в роли антагонистов рецепторов FPR1 на поверхности нейтрофилов и блокировать активацию нейтрофилов, что приводит к уменьшению выраженности ССВО. Однако, указанный способ предполагает блокаду только воспалительного ответа на формил-пептиды, в отличие от заявляемого способа, который предполагает блокаду воспалительного ответа не только на формил-пептиды цитозоля бактериальной клетки, но и блокаду воспалительного ответа на компоненты стенки грамм-отрицательной бактерии (LPS) липополисахарида.
Из анализа представленных аналогов очевидно, что поиск средств для уменьшения воспалительной активации нейтрофилов и меньшей выраженности ССВО чрезвычайно актуален для молекулярной биологии и медицины, но известные препараты представляют собой пептиды или белки, что предполагает достаточную дороговизну и сложность белкового синтеза, а также возможные аллергические и пирогенные реакции на белок в условиях целостного организма.
Наиболее близким к заявляемому способу по совокупности существенных признаков является способ предотвращения воспалительной активации нейтрофилов, раскрытый в патенте TW 201825113 (Neutrophil activation regulator). Принят в качестве прототипа.
Способ-прототип относится к применению тромбин-подобного фермента (батроксобин) в качестве регулятора активации нейтрофилов путем инактивации интегрина Мас-1 на поверхности нейтрофилов, который ответственен за связывание с молекулами клеточной адгезии ICAM-1 и приводит к угнетению трансэндотелиальной миграции нейтрофилов, что уменьшает инфильтрацию нейтрофилами тканей органов и может быть использовано в клинической практике для лечения сепсиса, ССВО при панкреатите и ОРДС.
Заявляемый способ основан на ином молекулярном механизме действия, который состоит в том, что хлорид лития фосфорилирует (инактивирует) ГСК-3 бета и вызывает не только инактивацию интегрина CD-11b, также ответственного за связывание с молекулами клеточной адгезии ICAM-1, но и инактивацию CD-66b, который регулирует выход из цитозоля на поверхность нейтрофилов гранул с протеолитическими ферментами, которые могут повреждать ткани при воспалении.
Из уровня техники неизвестно примеров использования ионов лития в качестве средства для лечения критических состояний, ассоциированных с воспалительной активацией нейтрофилов.
Раскрытие изобретения
Заявляемое изобретение направлено на решение задачи подавления воспалительной гиперактиваци нейтрофилов.
Активация нейтрофилов - обязательный этап и чувствительный маркер ССВО - состояния, с развитием которого связывается последующее возникновение полиорганной недостаточности - основного показания для пребывания пациентов в отделении реанимации. Поиск препаратов, способных предотвратить развитие ССВО и снизить летальность, остается актуальность задачей анестезиологии-реаниматологии.
ССВО - состояние, возникающее в ответ на различные повреждающие воздействия, как инфекционного (бактериальные возбудители), так и неинфекционного (травмы, ожоги, оперативные вмешательства большого объема) характера и проявляющееся в гиперпродукции так называемых провоспалительных цитокинов, их проникновении через гистогематические барьеры с последующей инфильтрацией лейкоцитами и цитокинами тканей органов-мишеней (Alexander JJ, Jacob A, Cunningham Р, Hensley L, Quigg RJ. TNF is a key mediator of septic encephalopathy acting through its receptor, TNF receptor-1. Neurochem Int. 2008; 52: 447-56. doi: 10.1016/j.neuint.2007.08.00). Последнее приводит к развитию полиорганной недостаточности, являющейся основной причиной гибели пациентов в палатах интенсивной терапии.
Важнейшую роль в развитии, регуляции и разрешении воспаления играют нейтрофилы - клетки врожденного иммунитета. Иммунный ответ на повреждение тканей или инфекцию начинается с секреции нейтрофилами провоспалительных и антивоспалительных цитокинов, что направлено на удаление повреждающего агента и восстановление гомеостаза.
Чувствительными маркерами системного воспалительного ответа являются молекулы CD11b и CD66b, которые находятся во внутриклеточных гранулах нейтрофилов. При действии воспалительных стимулов внутриклеточные гранулы сливаются с цитоплазматической мембраной и эти молекулы (CD11b и CD66b) экспонируются на поверхности клеток. Происходит процесс дегрануляции. CD11b взаимодействует с рецепторами ICAM-1 на эндотелиальных клетках, что обеспечивает адгезию нейтрофилов и последующую их миграцию через эндотелиальный барьер к очагу воспаления, в то время как CD66b связан с агрегацией нейтрофилов и выходом из цитозоля на поверхность нейтрофилов гранул с протеолитическими ферментами, которые могут повреждать ткани при воспалении.
Количественный анализ молекул CD11b и CD66b широко используется в клинической диагностике: известно, что их уровень значительно повышен у пациентов с различными видами бактериальных инфекций (Lilius Е.М. Nuutila J. Bacterial infections, DNA virus infections, and RNA virus infections manifest differently in neutrophil receptor expression. ScientificWorldJournal. 2012; 2012: 527347. doi: 10.1100/2012/5273478) и сепсисе, поскольку имеются многочисленные данные о том, что экспрессия CD11b и CD66b значительно увеличивается при сепсисе и ССВО (Muller Kobold A, Tulleken J Е, Zijlstra J G, Sluiter W, Hermans J. Leukocyte activation in sepsis; correlations with disease state and mortality. Intensive Care Med. 2000 Jul; 26 (7): 883-92).
Однако при определенных условиях возникает избыточный иммунный ответ, сопровождающийся гиперактивацией нейтрофилов и других клеток иммунной системы, нарушением их миграции, избыточным количеством провоспалительных цитокинов в крови, так называемой «цитокиновой бурей», последующим «иммунным параличом», что и приводит к увеличению числа осложнений и повышению летальности у пациентов. (Alexander JJ, Jacob A, Cunningham Р, Hensley L, Quigg RJ. TNF is a key mediator of septic encephalopathy acting through its receptor, TNF receptor-1. Neurochem Int. 2008; 52: 447-56. doi: 10.1016/j.neuint.2007.08.00).
Известные к настоящему времени средства, используемые для уменьшения воспалительной активации нейтрофилов и меньшей выраженности ССВО, представляют собой пептиды или белки, что предполагает достаточную дороговизну и сложность белкового синтеза, а также возможные аллергические и пирогенные реакции на белок в условиях целостного организма.
В частности, дипептидные деривативы (dipeptide derivatives) могут выступать в роли антагонистов рецепторов FPR1 на поверхности нейтрофилов и блокировать активацию нейтрофилов, что приводит к уменьшению выраженности ССВО. Однако, результатом воздействия указанных соединений является блокада воспалительного ответа только на формил-пептиды, в отличие от заявляемого способа, который предполагает блокаду воспалительного ответа не только на формил-пептиды цитозоля бактериальной клетки, но и блокаду воспалительного ответа на компоненты стенки грамм-отрицательной бактерии (LPS) липополисахарида.
В случае применения тромбин-подобного фермента (батроксобина) в качестве регулятора активации нейтрофилов путем инактивации интегрина Мас-1 на поверхности нейтрофилов, который ответственен за связывание с молекулами клеточной адгезии ICAM-1, происходит угнетение трансэндотелиальной миграции нейтрофилов, что уменьшает инфильтрацию нейтрофилами тканей органов и может быть использовано в клинической практике для лечения сепсиса, ССВО при панкреатите и ОРДС.
Заявляемый способ основан на ином молекулярном механизме действия, который состоит в том, что хлорид лития фосфорилирует (инактивирует) ГСК-3 бета и вызывает не только инактивацию интегрина CD-11b, также ответственного за связывание с молекулами клеточной адгезии ICAM-1, но и инактивацию CD-66b, который регулирует выход из цитозоля на поверхность нейтрофилов гранул с протеолитическими ферментами, которые могут повреждать ткани при воспалении.
Препарат, содержащий лития хлорид, принадлежит к веществам, обладающим выраженными цитопротективными свойствами вследствие способности фосфорилировать Сер9 молекулы киназы 3-бета гликогенсинтетазы (GSK3beta), приводящей к ингибиции активности фермента (Klein, P.S., and Melton, D.A. (1996) A molecular mechanism for the effect of lithium on development, Proc. Natl. Acad. Sci. USA, 93, 8455-8459).
Авторами заявляемого способа показано, что лития хлорид оказывает противовоспалительное действие на нейтрофилы человека. Такое защитное действие ограничивает гиперпродукцию провоспалительных цитокинов, их проникновение через гистогематические барьеры с последующей инфильтрацией лейкоцитами и цитокинами тканей органов-мишеней, которое приводит к развитию полиорганной недостаточности при критических состояниях, включающих, но не ограничивающихся ССВО после операций на сердце и сосудах, ССВО при тяжелой сочетанной травме сепсисом, отеком легкого и ОРДС и тяжелыми ожогами.
В описанных ниже экспериментах показано, что лития хлорид снижает уровень активации нейтрофилов, оказывая противоспалительный эффект на предварительно активированные компонентами бактерий (ЛПС, fMLP) нейтрофилы и способствует снижению уровня экспрессии молекул CD11b и CD66b на поверхности интактных нейтрофилов, ингибируя процесс активации и дегрануляции.
Проведенное изучение влияния бактериальных компонентов и лития хлорида на фосфорилирование ГСК-3бета в нейтрофилах методом вестерн-блоттинга показало, что лития хлорид модулирует воспалительную активацию нейтрофилов бактериальными компонентами через фосфорилирование ГСК-3бета в нейтрофилах.
Использование заявляемого способа позволяет достичь нескольких технических и экономических результатов:
• устранение избыточной воспалительной активации нейтрофилов, уменьшение проницаемости эндотелия;
• уменьшение инфильтрации тканей органов-мишеней и как следствие модулирование воспалительного ответа организма как на инфекционные, так и неинфекционные повреждающие агенты;
• повышение терапевтического эффекта за счет применения препарата, который воздействует на два независимых механизма активации;
• снижение себестоимости фармацевтических препаратов, изготовленных на основе солей лития, по сравнению с препаратами, содержащими пептиды или белки, для которых общеизвестны их дороговизна и сложность белкового синтеза, а также возможные аллергические и пирогенные реакции на белок в условиях целостного организма.
Указанные технические и экономические результаты при осуществлении изобретения достигаются за счет того, что также как в известном способе регулирование активации нейтрофилов осуществляют путем ингибирования трансэндотелиальной миграции нейтрофилов.
Особенность заявляемого способа заключается в том, что в качестве регулятора активации нейтрофилов использован лития хлорид.
Краткое описание чертежей
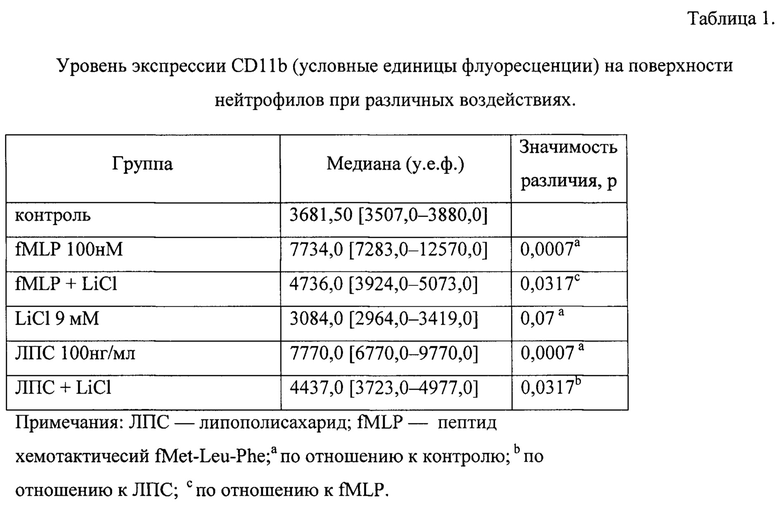
На Фиг. 1 представлена диаграмма, отражающая понижение экспрессии маркеров дегрануляции CD11b и CD66b под воздействием хлорида лития 9 мМ в предактивированных fMLP 100 нМ нейтрофилах человека.
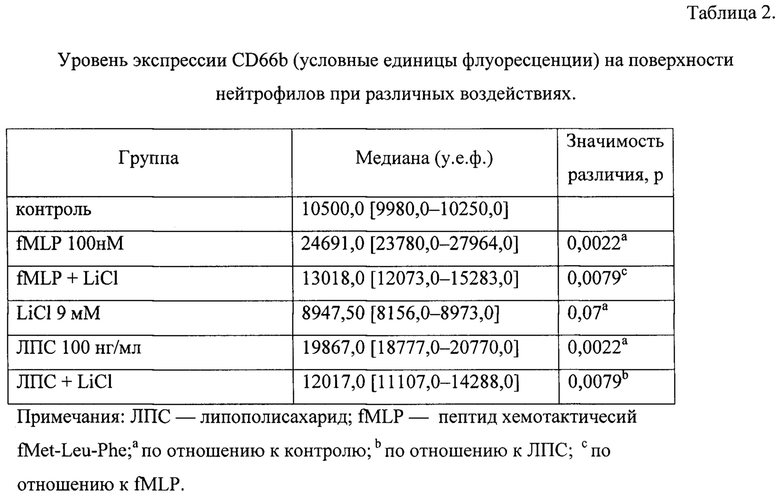
На Фиг. 2 представлена диаграмма, отражающая понижение экспрессии маркеров дегрануляции CD11b и CD66b под воздействием хлорида лития 9 мМ в предактивированных ЛПС 100 нг/мл нейтрофилах человека
Описание процедуры эксперимента
Исследование было проведено с использованием нейтрофилов, выделенных из крови пяти здоровых доноров, часть из которых активировали с помощью 100 mkM fMLP и 100 нг/мл ЛПС и затем оценивали их активность с помощью флуоресцентных антител к маркерам дегрануляции CD11b и CD66b. Интактные и активированные нейтрофилы обрабатывали раствором лития хлорида в концентрации 9 ммоль.
Выделение нейтрофилов
Гепаринизированную венозную кровь 5-ти здоровых доноров смешивали раствором декстрана Т-500 (Pharmacosmos, Дания) до конечной концентрации декстрана 1%) и оставляли при комнатной температуре на 30 минут для осаждения эритроцитов. Верхний слой плазмы (обогащенный лейкоцитами и лишенный эритроцитов) наслаивали на Фиколл (ПанЭко, Россия) с плотностью 1,077 г/мл и центрифугировали при комнатной температуре при 300 g, 30' в центрифуге с отключенным тормозом. Затем удаляли супернатант и все дальнейшие процедуры проводили на льду и с использованием охлажденных растворов. Удаление примесных эритроцитов проводили с помощью ресуспендирования осадка в 2 мл деионизованной стерильной воды в течение 45 сек, а затем добавляли 2 мл 2-х кратного PBS для восстановления онкотического давления. Центрифугировали при 200 g, +4°С, 10'. Осажденные нейтрофилы промывали PBS и ресуспендировали в культуральной среде (RPMI-1640 (ПанЭко, Россия) + 10% FBS с низким содержанием эндотоксинов).
Активация нейтрофилов
Активацию (дегрануляцию) нейтрофилов измеряли с помощью антител, конъюгированных с флуоресцентными красителями (CD11b-FITC и CD66b-AlexaFluor647 (BD Biosciences, USA) согласно протоколу производителя.
Для определения активации нейтрофилов были использованы антитела к молекулам CD11b (β2-интегрин) и CD66b. В качестве индукторов воспаления были применены липополисахарид (ЛПС), основной компонент клеточной стенки грамотрицательных бактерий, а также fMLP, который бактерии используют при биосинтезе белка.
К нейтрофилам в концентрации 4 млн/мл добавляли 100 mkM fMLP и лития хлорид в концентрациях 9 ммоль и инкубировали 30 мин при 37°С. Затем добавляли антитела и инкубировали 30 мин во льду, после чего измеряли уровень флуоресценции (единицы флуоресценции) на проточном цитофлуориметре Beckman-Coulter FC 500.
К нейтрофилам в концентрации 4 млн/мл добавляли 100 нг/мл ЛПС и хлорид лития в концентрациях 9 ммоль и инкубировали 30 мин при 37°С. Затем добавляли антитела и инкубировали 30 мин во льду, после чего измеряли уровень флуоресценции (условные единицы флуоресценции) на проточном цитофлуориметре Beckman-Coulter FC 500.
Исследование фермента ГСК-3-бета методом иммуноблотинга.
Определение концентрации белка.
Определение концентрации белка в нейтрофилах во всех опытах выполнялось по методу, описанному Р.K. Smith [Measurement of protein using bicinchoninic acid / P.K. Smith, R.I. Krohn, G.T. Hermanson [et al.] // Anal. Biochem. - 1985. - Vol. 150, №1. - P. 76-85] и основанному на колориметрической реакции бицинхониновой кислоты с белками. Для определения использовали раствор следующего состава: натриевая соль бицинхониновой кислоты (Sigma Chemical Co., США), Na виннокислый (Sigma Chemical Co., США), NaHCO3 0,95% (реагент А) и CuSO4 × 5H2O 4% (реагент В). Раствор для определения готовили непосредственно перед измерением концентрации белка, смешивая исходные реагенты А и B в соотношении 50:1. К аликвоте 50 мкл анализируемого образца добавляли 1 мл раствора для определения, перемешивали и инкубировали 30 мин при 37°С, после чего определяли оптическую плотность раствора при 562 нм в акриловой кювете на спектрофотометре Hitachi-557 (Hitachi Ltd., Япония).
Концентрацию белка в анализируемом образце определяли по калибровочной кривой с помощью программного обеспечения SigmaPlot 2000. В качестве стандарта для построения калибровочной кривой использовали коммерческий препарат бычьего сывороточного альбумина («Fermentas») с концентрацией 2 мг/мл.
Вестерн-блоттинг
Электрофорез белков проводили в 12,5% полиакриламидном геле в денатурирующих условиях по U.K. Laemmli [Laemmli, U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 / U.K. Laemmli // Nature. - 1970. - Vol. 227, №5259. - P. 680-685.]. Образцы растворяли в буфере, содержащем 0,125 М Трис-HCl (рН 6,8), 4% додецилсульфата натрия (Sigma Chemical Co., США), 20% глицерина, 0,005% бромфенола синего (Sigma Chemical Co., США) и 10% 2β-меркаптоэтанола (Merck, Германия). Образцы кипятили 2 мин на водяной бане и вносили в лунки геля. Для приготовления разделяющего геля использовали 30% смесь акриламида (Sigma Chemical Co., США) и бис-акриламида (Sigma Chemical Co., США) (37,5:1) которую разводили до 12,5%) 1,5 М Трис-HCl буфером (рН=8,8) и водой до конечной концентрации Трис-HCl 375 мМ. В смесь также добавляли додецилсульфат натрия до 0,1%, персульфат аммония (Sigma Chemical Co., США) до 0,1% и ТЕМЕД (N,N,N',N'-тетраметилэтилендиамин, Acros, Бельгия) до 0,1%. Для приготовления концентрирующего геля 30% смесь акриламида и бис-акриламида разводили до 5% 1 М Трис-HCl буфером (рН=6,8) и водой до конечной концентрации Трис-HCl 125 мМ. В смесь также добавляли 0,1% додецилсульфата натрия, 0,1% персульфат аммония и 0,1% ТЕМЕД. В работе использовали стекла 8×10 см со спейсерами толщиной 1 мм. Для проведения электрофореза использовали Трис-глициновый электродный буфер, содержащий 25 мМ Трис-HCl, 192 мМ глицин, 0,1% додецилсульфата натрия, рН=8,3. Электрофорез проводили при постоянном токе 10 мА в режиме концентрирования и 15 мА в режиме разделения. По окончании электрофореза переносили белки на PVDF мембрану (Amersham Pharmacia Biotech, Объединенное Королевство). Перенос проводили полусухим методом в течение 2 ч при 200 мА, 20 V. Качество переноса оценивали окрашиванием части геля и окрашиванием мембраны 2% раствором Ponceau (Sigma Chemical Co., США). Мембраны блокировали 12 ч при +4°С в трис-буферной среде (Sigma Chemical Co., США), содержащем 5% обезжиренного сухого молока. Затем мембраны промывали трис-буферной средой 3 раза по 10 мин и инкубировали 2 час. при комнатной температуре с первичными антителами (против гликоген-синтетазы-киназы типа 3 бета или фосфорилированной формы гликоген-синтетазы-киназы типа 3 бета) в разведении 1:1000 в трис-буферной среде, содержащем 0,5% бычьего сывороточного альбумина («Calbiochem») и 0,01% Tween-20 («Sigma Chemical Со.»). Мембраны три раза по 15 мин промывали в TBS, содержащем 0,01% Tween-20 и инкубировали 1 час. с вторичными антителами, конъюгированными с пероксидазой хрена, в разведении 1:10000 в трис-буферной среде, содержащем 0,01% Tween-20. После финальной отмывки от несвязанных антител, полосы детектировали с помощью хемилюминесцентного субстрата пероксидазы хрена ECL (Enhanced chemiluminescence system, Amersham Pharmacia Biotech, Бельгия). Хемилюминесценция детектировалась на фотопленку Kodak Professional Т-МАХ Р3200 TMZ 135-36 (Kodak, США). Изображение оцифровывали на сканере Epson Perfection V750 Pro (Seiko Epson Corp., Япония) и анализировали с помощью программы Image J.
Содержание фосфорилированной формы гликоген-синтетазы-киназы типа 3 бета выражали в условных единицах хемилюминесценции (у.е.л.).
Статистический анализ
Для расчетов использовались программы Statistica 10.0 (StatSoft, Inc.) и MedCalc 12.5.0.0 (MedCalc Software bvba). Средние значения представлены медианой с межквартильным интервалом. Межгрупповые различия показателей оценивались при помощи U-критерия Уитни-Манна и принимались статистически значимыми при уровне р<0,05.
Результаты.
Как видно из табл. 1, 2 уровень экспрессии CD11b на поверхности интактных нейтрофилов составляет 3681,50 [3507,0-3880,0] условных единиц флуоресценции (у.е.ф.). Установлено, что присутствие лития хлорида в концентрации 9 мМ способствует снижению уровня экспрессии молекул CD11b на поверхности интактных нейтрофилов на 16% (р=0.07), a fMLP в дозе 100 нМ, увеличивает экспрессию тех же молекул на в 2,6 раза (р=0,0007). Добавление раствора лития хлорида в концентрации 9 мМ к нейтрофилам, активированным fMLP, уменьшает экспрессию молекул CD11b (р=0,0317), практически возвращая уровень их экспрессии к контрольному уровню. ЛПС добавленный в дозе 100 нг/мл к интактным нейтрофилам в 2,1 раза (р=0,0007) увеличивает экспрессию молекул CD11b на поверхности нейтрофилов по отношению к контролю, добавление лития хлорида в концентрации 9 мМ к активированным ЛПС нейтрофилам (р=0,0317).
Проведенное изучение влияния бактериальных компонентов и хлорида лития на фосфорилирование ГСК-3бета в нейтрофилах методом вестерн-блоттинга показало, что fMLP - пептид хемотактичесий fMet-Leu-Phe приводит к дефосфорилированию ГСК-3бета на 47% (р<0.05), а хлорид лития в концентрации 9 мМ увеличивает фосфорилирилирование ГСК-3 бета на 387% (р<0.05). Добавление хлорида лития к активированным fMLP нейтрофилам восстанавливает уровень фосфорилирилирования ГСК-3 бета на 277% относительно контрольного уровня в интактных нейтрофилах (р<0.05).
Таким образом, установлено, что реализация противовоспалительных свойств солей лития, как на инфекционные, так и неинфекционные повреждающие агенты осуществляется через фосфорилирование ГСК-3бета в нейтрофилах, что приводит к снижению экспрессии на их поверхности маркеров дегрануляции CD11b и CD66b.
Эти данные показывают перспективы применения лития хлорида для профилактики и лечения ССВО при тяжелой сочетанной травме, операциях на сердце с использованием аппарата искусственного кровообращения, а также при инфаркте миокарда и ишемическом инсульте.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ подавления избыточной активации нейтрофилов в модели ex vivo | 2022 |
|
RU2794568C1 |
| Способ снижения воспалительной гиперактивации нейтрофилов | 2020 |
|
RU2758536C1 |
| РЕГУЛЯТОР АКТИВАЦИИ НЕЙТРОФИЛОВ | 2018 |
|
RU2742417C1 |
| СПОСОБЫ ОСЛАБЛЕНИЯ ВЫСВОБОЖДЕНИЯ МЕДИАТОРОВ ВОСПАЛЕНИЯ И ПЕПТИДЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ЭТОЙ ЦЕЛИ | 2007 |
|
RU2423376C2 |
| Применение пептида для лечения сердечно-сосудистых заболеваний | 2013 |
|
RU2672341C2 |
| СПОСОБЫ РЕГУЛЯЦИИ МЕДИАТОРОВ ВОСПАЛЕНИЯ И ПЕПТИДЫ, ИСПОЛЬЗУЕМЫЕ В НИХ | 2007 |
|
RU2429004C2 |
| КЛЕТОЧНАЯ СИСТЕМА НАПРАВЛЕННОЙ ДОСТАВКИ ФАРМАЦЕВТИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА ИЛИ МЕТКИ | 2016 |
|
RU2771323C2 |
| ПРИМЕНЕНИЕ ГЕПАРИНСВЯЗЫВАЮЩИХ АНТАГОНИСТОВ В ИНГИБИРОВАНИИ ВЫСВОБОЖДЕНИЯ БРАДИКИНИНА | 2000 |
|
RU2251433C2 |
| СПОСОБ ДИАГНОСТИКИ С ИСПОЛЬЗОВАНИЕМ HNL | 2015 |
|
RU2758608C2 |
| ХИМЕРНЫЙ ПОЛИПЕПТИД, СЕЛЕКТИВНО ВЗАИМОДЕЙСТВУЮЩИЙ С РОДСТВЕННЫМ ЕМУ РЕЦЕПТОРОМ ХЕМОКИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ ХИМЕРНОГО ПОЛИПЕПТИДА (ВАРИАНТЫ) | 2005 |
|
RU2430113C2 |
Изобретение относится к медицине и может быть использовано для регуляции активации нейтрофилов путем применения лития хлорида. Это позволяет снизить уровень активации нейтрофилов за счет снижения уровня экспрессии молекул CD11b и CD66b. 2 табл., 2 ил.
Применение лития хлорида в качестве регулятора активации нейтрофилов путем ингибирования трансэндотелиальной миграции нейтрофилов.
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И/ИЛИ УЛУЧШЕНИЯ СОСТОЯНИЯ ПРИ ДИССЕМИНИРОВАННОМ ВНУТРИСОСУДИСТОМ СВЕРТЫВАНИИ | 2007 |
|
RU2433829C2 |
| TW 201825113 A, 16.07.2018 | |||
| CIAMBELLUCA M.S | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| КАРПОВ О.И | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-03-12—Публикация
2019-05-14—Подача