Изобретение относится к медицине, а именно к средствам терапевтического воздействия на дыхательную систему пациента основным компонентом которого является летучий анестетик севофлуран. Изобретение может быть использовано для лечения больных с патологическими состояниями, при которых наблюдается синдром системного воспалительного ответа (ССВО) после обширных операций, оперативных вмешательств с использованием аппарата искусственного кровообращения, сочетанной травмы, тяжелого сепсиса и септического шока, синдрома ишемии-реперфузии тканей при инсульте и инфаркте миокарда, при сахарном диабете, метастазировании опухолей, отеке легкого и остром респираторном дистресс-синдроме, ожоговой болезни и др. Способ позволяет снизить активность нейтрофилов, уменьшить воспалительные процессы, профилактировать или уменьшить степень выраженности полиорганной недостаточности, сократить сроки лечения и увеличить выживаемость больных при критических состояниях.
Уровень техники
Воспаление представляет собой типовой патологический процесс, направленный на защиту организма от инфекции. Тем не менее, у пациентов в критическом состоянии воспаление может быть также ключевым патогенетическим фактором повреждения тканей и прогрессирования мультиорганной дисфункции. Нейтрофилы являются одними из основных участников воспалительного процесса, в связи с чем их дисфункция может иметь большое значение в патогенезе критических состояний. Так, в ряде исследований была продемонстрирована роль нейтрофилов в их прогрессировании за счет дополнительного повреждения тканей при сепсисе, остром респираторном дистресс-синдроме (ОРДС), коагулопатиях и других патологических процессах и состояниях. Таким образом, терапия, направленная на нормализацию функции нейтрофилов, может быть целесообразной у таких пациентов.
В настоящее время известно большое количество нейтрофильных факторов, влияющих на возбудителей инфекции, компоненты иммунной системы, ткани организма. Известен ряд терапевтических методов, воздействующих на те или иные звенья функционирования нейтрофилов: воздействие на образование нейтрофилов, их выход их костного мозга, рекрутинг и миграцию, хемотаксис, активацию, а также на основные ферменты нейтрофилов [Bartaula-Brevik S, Lindstad Brattas М.К., Tvedt Т.Н.A. et al. Splenic tyrosine kinase (SYK) inhibitors and their possible use in acute myeloid leukemia. Expert Opin Investig Drugs. 2018;27(4):377-387. doi:10.1080/13543784.2018.1459562; Westhovens R., Taylor P.C., Alten R. et al. Filgotinib (GLPG0634/GS-6034), an oral JAK1 selective inhibitor, is effective in combination with methotrexate (MTX) in patients with active rheumatoid arthritis and insufficient response to MTX: results from a randomised, dose-finding study (DARWIN 1). Ann Rheum Dis. 2017;76(6):998-1008. doi: 10.1136/annrheumdis-2016-210104].
Тем не менее, большая часть таргетных препаратов характеризуется теми или иными недостатками: недостаточная избирательность действия, нейтропения и иммуносупрессия ввиду избыточного подавления функции нейтрофилов и другие [Jonsson Н., Allen P., Peng S.L. Inflammatory arthritis requires Foxo3a to prevent Fas ligand-induced neutrophil apoptosis. Nat Med. 2005;11(6):666-671. doi:10.1038/nml248, Serhan C.N., Levy B.D. Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators. J Clin Invest. 2018;128(7):2657-2669. doi:10.1172/JCI97943].
Известно также несколько терапевтических средств и способов, направленных на решение задачи устранения избыточной воспалительной активации нейтрофилов.
В частности, известен регулятор активации нейтрофилов, включающий батроксобин в качестве активного ингредиента: для ингибирования дегрануляции нейтрофилов, для ингибирования экспрессии Мас-1 нейтрофилами, для ингибирования образования NETs нейтрофилами, для ингибирования трансэндотелиальной миграции нейтрофилов, а также для лечения заболеваний, вызванных активацией нейтрофилов, которые выбраны из группы, состоящей из сепсиса, ОРДС, острого панкреатита и острого легочного расстройства (RU 2742417). Данный способ предполагает введение батроксобина - препарата с фибринолитическими свойствами. Противопоказаниями к его введению являются: органная дисфункция, коагулопатия, пожилой возраст.Использование известного способа не дает технических результатов заявляемого способа, поскольку синдром избыточного воспаления при различных патологических состояниях, как правило, сопровождается органной дисфункцией и коагулопатией.
Известен также способ регулирования активации нейтрофилов в модели in vitro путем применения лития хлорида (LiCl), позволяющий снизить уровень активации нейтрофилов за счет снижения уровня экспрессии молекул CD11b и CD66b (RU 2716492). Известный способ основан на молекулярном механизме действия, который состоит в том, что LiCl фосфорилирует (инактивирует) ГСК-3 бета и вызывает не только инактивацию интегрина CD-11b, также ответственного за связывание с молекулами клеточной адгезии ICAM-1, но и инактивацию CD-66b, который регулирует выход из цитозоля на поверхность нейтрофилов гранул с протеолитическими ферментами, которые могут повреждать ткани при воспалении.
Препарат, содержащий LiCl, принадлежит к веществам, обладающим выраженными цитопротективными свойствами вследствие способности фосфорилировать Сер9 молекулы киназы 3-бета гликогенсинтетазы (GSK3beta), приводящей к ингибиции активности фермента [Klein, P.S., and Melton, D.A. (1996) A molecular mechanism for the effect of lithium on development, Proc. Natl. Acad. Sci. USA, 93, 8455-8459].
Авторами известного способа показано, что LiCl оказывает противовоспалительное действие на нейтрофилы человека. Такое защитное действие ограничивает гиперпродукцию провоспалительных цитокинов, их проникновение через гистогематические барьеры с последующей инфильтрацией лейкоцитами и цитокинами тканей органов-мишеней, которое приводит к развитию полиорганной недостаточности при критических состояниях, включающих, но не ограничивающихся ССВО после операций на сердце и сосудах, ССВО при тяжелой сочетанной травме, сепсисом, отеком легкого и ОРДС и тяжелыми ожогами. Использование известного способа регулирования активации нейтрофилов путем применения LiCl, не дает технических результатов заявляемого способа, поскольку на сегодняшний день не разработана фармакологическая субстанция соли LiCl для внутривенного введения, и клиническое применение солей лития при критических состояниях представляется маловероятным, учитывая его токсические эффекты на центральную нервную систему, почки и печень.
Наиболее близким к заявляемому способу по совокупности совпадающих существенных признаков является способ снижения воспалительной гиперактивации нейтрофилов, включающий ингаляцию газовой смесью: ксенон 30 об.%, кислород не более 40 об.%, остальное - азот, по закрытому контуру длительностью 60 мин (RU 2758536). Способ обеспечивает снижение активности нейтрофилов, уменьшение воспалительных процессов, предупреждает или уменьшает степень выраженности полиорганной недостаточности, а также сокращает сроки лечения и увеличивает выживаемость больных при критических состояниях. Принят в качестве прототипа.
Использование известного способа регулирования активации нейтрофилов, включающий ингаляцию газовой смесью: ксенон 30 об.%, не дает технических результатов заявляемого способа, поскольку на сегодняшний день не разработан способ клинического применения ксенона при критических состояниях, сопровождающихся развитием гипервоспалительного ответа. Ксенон применяется только интраоперационно, как средство для наркоза, в то время как воспалительная реакция развивается в послеоперационном периоде.
Заявляемое изобретение направлено на решение задачи расширения арсенала технических средств подавления избыточной активации нейтрофилов, а именно: возможности применения севофлурана с целью коррекции воспалительного процесса у пациентов, находящихся в критическом состоянии, а также определения оптимальных концентраций севофлурана в процессе активации нейтрофилов человека в модели ex vivo.
Задача расширения арсенала технических средств подавления избыточной активации нейтрофилов достигается за счет того, что также, как в известном способе снижение воспалительной гиперактивации нейтрофилов достигают путем воздействия газовой смесью.
Особенность заявляемого способа заключается в том, что снижение воспалительной гиперактивации нейтрофилов достигают путем воздействия севофлурана в дозе 3,0 об.%, что соответствует 1,5 минимальной альвеолярной концентрации (МАК), которая широко используется в клинической практике и не имеет токсических эффектов. 1 МАК - это концентрация анестетика в объемных процентах, которая предотвращает двигательную реакцию пациента на кожный разрез, для севофлурана=2 об.%. [Ингаляционная индукция и поддержание анестезии / В.В. Лихванцев, К.Ю. Борисов, М.В. Габитов и др.; Под редакцией профессора В.В. Лихванцева. - Москва: Издательство "Медицинское информационное агентство", 2013. - 320 с. - ISBN 978-5-9986-0107-1. - EDN RTMISB. https://www.elibrary.ru/item.asp?id=23431414].
Раскрытие сущности изобретения;
Ввиду важной роли нейтрофилов в регуляции воспаления при инфекционных и неинфекционных заболеваниях актуальным вопросом является поиск оптимальных методов определения активации нейтрофилов. Известно использование в качестве маркеров активации нейтрофилов белков CD11b и CD66b [Гребенчиков О. А., Касаткина И.С., Каданцева К.К., Мешков М.А., Баева А.А. Влияние LiCl на активацию нейтрофилов под действием сыворотки пациентов с септическим шоком. Общая реаниматология. 2020; 16(5):45-55. https://doi.org/10.15360/1813-9779-2020-5-45-55]. Указанные белки представляют собой интегрины, которые быстро экспрессируются на цитоплазматической мембране нейтрофилов при их активации, что было продемонстрировано в ряде исследований [Nicholson G.C., Tennant R.C., Carpenter D.C. et al. A novel flow cytometric assay of human whole blood neutrophil and monocyte CD11b levels: Upregulation by chemokines is related to receptor expression, comparison with neutrophil shape change, and effects of a chemokine receptor (CXCR2) antagonist. Pulm Pharmacol Ther. 2007; 20(1):52-59. doi:10.1016/j.pupt.2005.11.009, Schmidt Т., Brodesser A., Schnitzler N. et al. CD66b Overexpression and Loss of C5a Receptors as Surface Markers for Staphylococcus aureus-Induced Neutrophil Dysfunction. Akiyama T, ed. PLOS ONE. 2015; 10(7):e0132703. doi: 10.137l/journal.pone.0132703 и др.].
Среди других маркеров активации нейтрофилов можно отметить фосфорилированную киназу гликогенсинтазы-3β (фосфо-ГСК-3β). ГСК-3 представляет собой сериновую протеазу, которая участвует в регуляции различных клеточных процессов, причем данный фермент регулирует не только синтез гликогена, но также продемонстрирована его роль в регуляции клеточного цикла (деления клеток) и большом количестве различных сигнальных путей. Обе изоформы данного фермента, ГСК-3α и ГСК-3β, обнаружены в нейтрофилах, однако их функции в данных клетках недостаточно изучены. Тем не менее, показано, что фосфорилирование обоих изоферментов является важным регуляторным механизмом нейтрофилов. Таким образом, количество фосфо-ГСК-3β в нейтрофилах может отражать их активность [Остроумова О.Д., Кочетков А.И., Павлеева Е.Е., Кравченко Е.В. Лекарственно-индуцированные нейтропения и агранулоцитоз. Безопасность и риск фармакотерапии. 2020;8(3): 109-122. https://doi.org/10.30895/2312- 7821-2020-8-3-109-122, Borgquist J.D., Quinn М.Т., Swain S.D. Adhesion to extracellular matrix proteins modulates bovine neutrophil responses to inflammatory mediators. J Leukoc Biol. 2002;71(5):764-774.].
Севофлуран представляет собой ингаляционный анестетик, положительное влияние которого на функцию нейтрофилов в критических состояниях продемонстрировано в ряде экспериментов in vitro и in vivo [Beck-Schimmer В., Baumann L., Restin T. et al. Sevoflurane attenuates systemic inflammation compared with propofol, but does not modulate neuro-inflammation: A laboratory rat study. Eur J Anaesthesiol. 2017; 34(11):764-775. doi: 10.1097/EJA.0000000000000668, Koutsogiannaki S., Hou L., Babazada H. et al. The volatile anesthetic sevoflurane reduces neutrophil apoptosis via Fas death domain-Fas-associated death domain interaction. FASEB J. 2019; 33(11): 12668-12679. doi:10.1096/fj.201901360R,  R., Baluja A., Veiras Del Rio S. et al. Effects of sevoflurane postconditioning on cell death, inflammation and TLR expression in human endothelial cells exposed to LPS. J Transl Med. 2013; 11(1):87. doi: 10.1186/1479-5876-11-87].
R., Baluja A., Veiras Del Rio S. et al. Effects of sevoflurane postconditioning on cell death, inflammation and TLR expression in human endothelial cells exposed to LPS. J Transl Med. 2013; 11(1):87. doi: 10.1186/1479-5876-11-87].
Известно также снижение выраженности воспалительного процесса и оксидативного стресса у пациентов после оперативных вмешательств при использовании севофлурана в качестве средства для наркоза [De Conno Е., Steurer М.Р., Wittlinger М. et al. Anesthetic-induced Improvement of the Inflammatory Response to One-lung Ventilation. Anesthesiology.2009; 110(6): 1316-1326. oi:10.1097/ALN.0b013e3181al0731, Schilling Т., Kozian A., Senturk M. et al. Effects of Volatile and Intravenous Anesthesia on the Alveolar and Systemic Inflammatory Response in Thoracic Surgical Patients. Anest].
В настоящее время в доступных авторам БД не обнаружено результатов исследований по применению севофлурана с целью коррекции воспалительного процесса у пациентов, находящихся в критическом состоянии.
Описание процедуры эксперимента
Исследование проведено на клеточной культуре нейтрофилов, выделенных из венозной крови 5 здоровых мужчин в возрасте 25-34 лет.В гепаринизированной венозной крови осаждали эритроциты, а плазму наслаивали на фиколл (ПанЭко, Россия) с плотностью 1.077 г/мл и центрифугировали при комнатной температуре при 400g 30 минут.Затем удаляли супернатант и все дальнейшие процедуры проводили на льду с использованием охлажденных растворов. Примесные эритроциты удаляли с помощью ресуспендирования осадка в 2 мл деионизованной стерильной воды в течение 45 сек, а далее добавлялось 2 мл 2-кратного PBS для восстановления тоничности и затем центрифугировали при 200g, +4°С в течение 10 минут.Осажденные нейтрофилы промывали PBS и ресуспендировали в культуральной среде (RPMI-1640+10% FBS). Затем выделенные нейтрофилы на 30 мин помещали в инкубатор, куда подавали воздушную смесь комнатной температуры, содержавшую различные концентрации севофлурана в воздухе: 0,5 МАК (1 об.%), 1,0 МАК (2,0 об.%), 1,5 МАК (3,0 об.%).
После этого клетки помещали в увлажненный СО2-инкубатор (37°С, 5% СО2) на 30 мин, после чего проводили дальнейшие манипуляции. После инкубации с активатором (LPS) нейтрофилы в концентрации 5 млн/мл лизировали в горячем буфере (62,5 мМ Tris-НС1, рН 6,8; 2% SDS; 10% глицерина; 50 мМ ДТТ, 0,01% бромфенолового синего) в течение 4 мин при 94°С.Белки разделяли в 12% полиакриламидном геле и переносили на PVDF-мембраны (Amersham, США). Далее 5% БСА в буфере ТБСТ (25 мМ Tris рН 7,4,0,15М NaCl, 0,1% Tween20) блокировали сайты неспецифического связывания. Затем мембраны инкубировали в течение ночи при температуре 4°С с антителами в 5% растворе БСА в ТБСТ (антитела против фосфо-р38 (T180/Y182), Cell Signaling, США). Со вторыми антителами (против мышиных иммуноглобулинов, конъюгированных с пероксидазой хрена и разведенных в 5% растворе БСА/ТБСТ) мембраны инкубировали в течение 1 часа. Визуализацию проводили набором SuperSignal West Pico (ThermoFisher, США) с помощью гель-документирующей системы Bio-Rad ChemiDocTM Touch.
Апоптоз нейтрофилов оценивали с помощью проточной цитофлуориметрии. Нейтрофилы инкубировали с липополисахаридами (ЛПС) и fMLP в течение 22 часов при 37°С в увлажненном СО2-инкубаторе. Затем клетки центрифугировали при 400 g в течение 5 мин и ресуспендировали осадок в 70 мкл буфера (10 мМ HEPES, 120 мМ NaCl, 2,5 мМ СаСЬ, рН=7,4). К каждой пробе добавляли 2,5 мкл аннексина V, конъюгированного с флуоресцентным красителем FITC (ThermoFisher, США), и оставляли на 25 мин при 37°С. Далее добавляли PI до конечной концентрации 10 мкг/мл, инкубировали еще 5 мин, после чего анализировали 50 тысяч клеток с помощью проточного цитофлуориметра Beckman Coulter CytoFLEX. Апоптотическими считали аннексии V-положительные и PI-отрицательные клетки.
Иммуноферментный анализ (ИФА) осуществляли с помощью реагентов для иммуноферментного определения концентрации анализируемых цитокинов в среде культивации нейтрофилов (Вектор-Бест, Россия), согласно протоколу производителя. Образцы сывороток крови, содержавшие осадок, очищали центрифугированием при 400 g в течение 5 мин при комнатной температуре. Для проведения анализа во все лунки стрипов используемых планшетов вносили по 100 мкл раствора для разведения образцов (РРО). Далее вносили в соответствующие лунки в дублях по 100 мкл каждого калибровочного образца и по 100 мкл контрольного образца, а в остальные лунки вносили в дублях по 100 мкл анализируемых образцов сывороток крови. Планшеты заклеивали пленкой и инкубировали 2 часа при встряхивании на шейкере при 37°С и 700 об/мин. После удаления пленки для промывки и удаления остатков жидкости во все лунки вносили по 100 мкл конъюгата №1. После повторной инкубации и промывки во все лунки вносили по 100 мкл конъюгата №2. После третьей инкубации и промывки во все лунки вносили по 100 мкл ТМБ и инкубировали в защищенном от света месте в течение 25 мин при комнатной температуре, после чего во все лунки внесли по 100 мкл стоп-реагента.
Оптическую плотность (OD) растворов в лунках стрипов измеряли на спектрофотометре вертикального сканирования «BioRad iMark» при основной длине волны 450 нм и длине волны сравнения в диапазоне 620-655 нм. Для каждой пары лунок вычисляли среднее арифметическое значение OD, после чего в линейных координатах строили калибровочный график зависимости среднего арифметического значения OD от концентрации цитокина в калибровочных образцах (пг/мл). Далее по калибровочному графику определяли концентрацию цитокинов в контрольных и анализируемых образцах.
Для определения уровня активации нейтрофилов оценивали их дегрануляцию по увеличению на поверхности клеток молекул CD11b (компонент мембран специфических, желатинозных и четвертичных гранул) и CD66b (компонент мембран специфических гранул) с помощью проточной цитофлуориметрии. Образцы клеток инкубировали с LPS в течение 30 мин при 37°С, затем добавляли 2,5 мкл антител к CD11b, конъюгированных с флуоресцентным красителем FITC (ThermoFisher, США), и 0,5 мкл антител к CD66b, конъюгированных с флуоресцентным красителем AlexaFluor647 (ThermoFisher, США), и 30 минут инкубировали на льду. Затем анализировали 50 тысяч клеток с помощью проточного цитофлуориметра Beckman Coulter CytoFLEX.
Для статистического анализа использовали программу Statistica 10.0 (StatSoft, Inc.) и MedCalc 12.5.0.0 (MedCalc Software bvba). Результаты представлены медианой с межквартильным интервалом. Межгрупповые различия показателей оценивали при помощи теста для связанных выборок «W-критерий Вилкоксона» и принимали статистически значимыми при уровне р<0,05.
При изучении провоспалительной активации нейтрофилов установлено, что уровни экспрессии CD11b и CD66b на поверхности интактных нейтрофилов составляли 3898,0 [3340,0-4200,0] и 8786,0 [8112,0-10100,0] условных единиц флуоресценции соответственно. Инкубация нейтрофилов с ЛПС и fMLP статистически значимо повышала экспрессию данных молекул:
- при обработке ЛПС в дозе 200 нг/мл экспрессия CD11b и CD66b увеличилась в 2,3 и 2,2 раза (р=0,002 и р=0,001 соответственно);
- при обработке fMLP в дозе 100 нМ экспрессия CD11b и CD66b увеличилась в 1,7 и 2,0 раза (р=0,025 и р=0,03 соответственно).
Эти результаты согласуются с данными литературы о повышении экспрессии CD11b и CD66b при активации нейтрофилов под воздействием различных факторов, инициирующих воспаление.
При инкубации нейтрофилов с такой же концентрацией ЛПС после воздействия севофлурана в течение 30 минут в дозе 1 об.% (0,5 МАК) и дозе 2 об.% (1 МАК) уровень экспрессии CD11b также значимо увеличился по сравнению с интактными нейтрофилами (таблица 1). Таким образом, установлено, что воздействие севофлурана в течение 30 минут в дозе 0,5-1,0 МАК в условиях ex vivo не влияет на провоспалительную активацию нейтрофилов.
При инкубации нейтрофилов с такой же концентрацией ЛПС после воздействия в течение 30 минут севофлурана в дозе 1,5 МАК уровень экспрессии CD11b и CD66b увеличился по сравнению с интактными нейтрофилами. Изменение экспрессии CD11b в данном эксперименте было статистически не значимым (р=0,055), изменение экспрессии CD66b - статистически значимо (р=0,007). Таким образом, установлено, что воздействие севофлурана в дозе 1,5 МАК снижает провоспалительную активацию нейтрофилов под действием ЛПС.
Аналогичные данные получены при инкубации нейтрофилов с fMLP и воздействии в течение 30 минут севофлураном: применение севофлурана в дозе 0,5 МАК и 1 МАК не влияло на провоспалительную активацию нейтрофилов. Увеличение экспрессии CD11b и CD66b под действием fMLP было статистически значимым и существенно не отличалось от такового без воздействия севофлурана. При инкубации нейтрофилов с такой же концентрацией fMLP после воздействия в течение 30 минут севофлурана в дозе 1,5 МАК уровень экспрессии CD11b и CD66b увеличился по сравнению с интактными нейтрофилами в 1,2 раза и 1,4 раза. Изменение экспрессии CD11b и CD66b в данном эксперименте было статистически не значимым. Таким образом, снижение провоспалительной активации нейтрофилов под воздействием севофлурана в концентрации 1,5 МАК отмечается также при активации, вызванной fMLP в дозе 100 нМ.
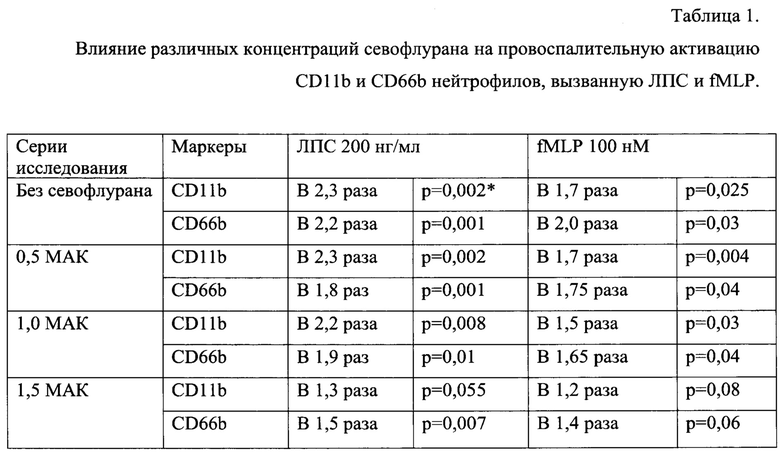

Выявленное снижение экспрессии CD11b и CD66b при воздействии севофлураном в дозе 1,5 МАК подтверждает возможность подавления избыточной активации нейтрофилов под действием этого анестетика.
Для изучения влияния севофлурана на уровень апоптоза и некроза нейтрофилов человека через 22 часа после их выделения использовали аннексии V и йодистый пропидий. Установили, что уровень спонтанного некроза и апоптоза нейтрофилов через 22 часа инкубации составил 57,0 [56,8-57,9] %, а воздействие севофлурана 0,5 и 1,5 МАК не влияли на способность нейтрофилов к спонтанному апоптозу: уровень апоптоза составил 52,9 [50,1-54,5] %, (р>0,05) для 0,5 МАК; 53[51,5-54,7] %, (р>0,05) для 1,0 МАК и 57,3[53,0-58,8] %, (р>0,05) для 1,5 МАК. Следовательно, севофлуран в указанных концентрациях не влиял на уровень апоптоза нейтрофилов.
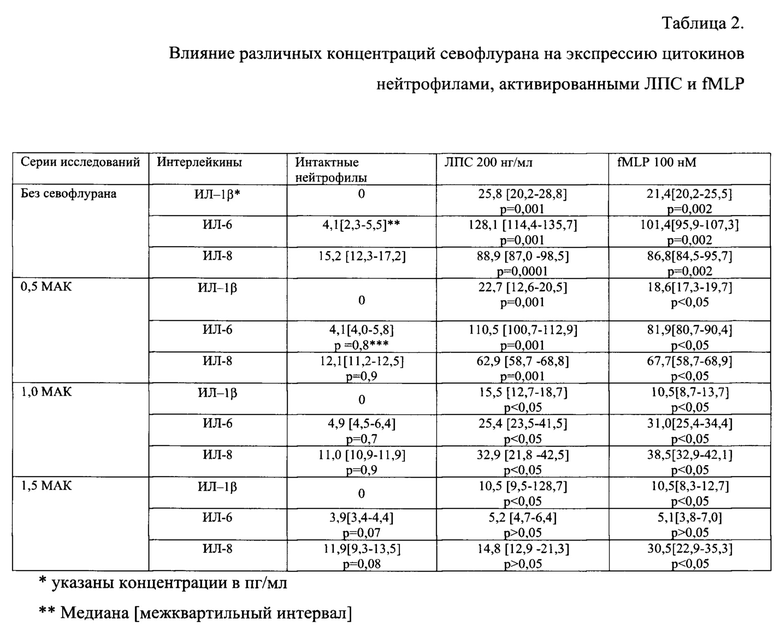
Авторами заявляемого способа произведена оценка влияния севофлурана на изменение экспрессии провоспалительных цитокинов ИЛ-1 р, ИЛ-6 и ИЛ-8 нейтрофилами под действием ЛПС и fMLP. В интактных нейтрофилах был определен уровень ИЛ-6 и ИЛ-8 (таблица 2). Установлено, что воздействие севофлурана в концентрации 0,5 МАК и 1,0 МАК на интактные нейтрофилы не влияла на уровень экспрессии данных цитокинов. При воздействии севофлурана в концентрации 1,5 МАК была отмечена тенденция к снижению уровня экспрессии данных цитокинов интактными нейтрофилами (таблица 2).
Добавление в среду инкубации ЛПС в дозе (200 нг/мл) статистически значимо увеличивало уровень провоспалительных цитокинов в нейтрофилах. Аналогично, добавление в среду инкубации fMLP в дозе 100 нМ также статистически значимо увеличивало уровень провоспалительных цитокинов в нейтрофилах.
Воздействие севофлурана в концентрации 1,5 МАК в течение 30 мин, отменяло активацию ИЛ-6 и ИЛ-8 под влиянием ЛПС, но значимо увеличивало уровень провоспалительного цитокина ИЛ-ip в нейтрофилах (таблица 2).
В аналогичном эксперименте, проведенном с активацией нейтрофилов 100 нМ fMLP, воздействие севофлурана в концентрации 0,5-1,0 МАК также не препятствовала увеличению экспрессии провоспалительных цитокинов. При этом при воздействии севофлурана в концентрации 1,5 МАК добавление в среду инкубации fMLP в дозе 100 нМ значимо увеличивало уровень экспрессии ИЛ-6 нейтрофилами, активированными ЛПС или fMLP и экспрессии ИЛ-8 нейтрофилами, активированными ЛПС.
Заключительным этапом исследования стало изучение влияния севофлурана на уровень фосфорилирования ГСК-3β в нейтрофилах после воздействия ЛПС.Оказалось, что стимуляция ЛПС приводит к дефосфорилированию киназы GSK-3P в нейтрофилах, статистически значимо снижая уровень фосфорилированной формы по сравнению с базальным. Воздействие 0,5 МАК севофлурана не влияло на уровень фосфорилирования GSK-3βP в стимулированных нейтрофилах. При воздействии 1,0 МАК севофлурана отмечали тенденцию к увеличению уровня фосфорилирования GSK-3β в стимулированных нейтрофилах (р=0,06). При этом воздействие 1,5 МАК севофлурана статистически значимо увеличивало уровень фосфорилирования GSK-3β в стимулированных нейтрофилах (р=0,008) (таблица 3).
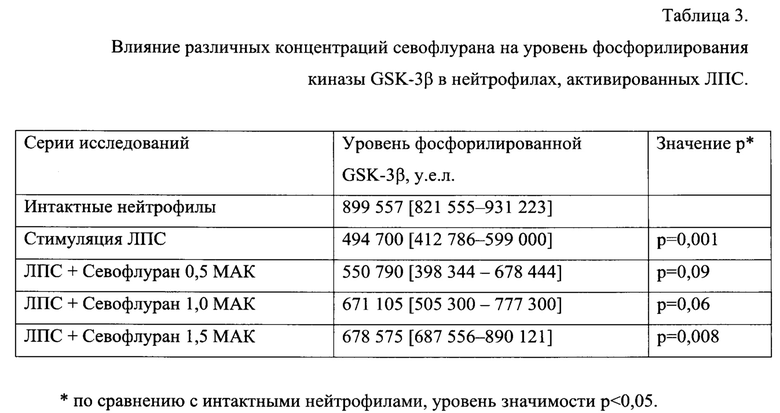
Полученные результаты позволяют констатировать влияние севофлурана в дозе 1,5 МАК на фосфорилирование GSK-3P в нейтрофилах, стимулированных ЛПС.
Таким образом, обнаруженное снижение активации нейтрофилов под действием ЛПС и fMLP, выразившееся в уровне экспрессии CD11b и CD66b, при воздействии севофлураном в дозе 1,5 МАК подтверждает возможность подавления избыточной активации нейтрофилов человека при воспалении под действием севофлурана. Установлено, что севофлуран обладает выраженным противовоспалительным действием, обусловленным подавлением гиперактивации нейтрофилов, что было продемонстрировано на нейтрофилах человека в модели ex vivo.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ регулирования активации нейтрофилов в модели in vitro | 2019 |
|
RU2716492C1 |
| Способ снижения воспалительной гиперактивации нейтрофилов | 2020 |
|
RU2758536C1 |
| РЕГУЛЯТОР АКТИВАЦИИ НЕЙТРОФИЛОВ | 2018 |
|
RU2742417C1 |
| Способ применения композиции, включающей действующее вещество энисамия йодид | 2023 |
|
RU2827811C1 |
| Применение композиции, включающей действующее вещество энисамия йодид | 2022 |
|
RU2815779C1 |
| Способ оценки врожденного иммунитета у пациентов с рецидивирующим экссудативным средним отитом | 2020 |
|
RU2739686C1 |
| Способ определения функциональной активности системы комплемента человека для прогноза тяжести течения системной воспалительной реакции | 2021 |
|
RU2756764C1 |
| Лекарственное средство, обладающее противовоспалительной активностью | 2016 |
|
RU2617123C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРИТОНИТА | 2000 |
|
RU2169570C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ | 2019 |
|
RU2816868C2 |
Изобретение относится к медицине, а именно к средствам терапевтического воздействия на дыхательную систему пациента, основным компонентом которых является летучий анестетик севофлуран, и может быть использовано для подавления избыточной активации нейтрофилов. Способ включает воздействие газовой смесью, при этом снижение воспалительной гиперактивации нейтрофилов в модели ex vivo достигают путем воздействия севофлурана в концентрации 3 об.%, что соответствует 1,5 МАК, в течение 30 мин. Изобретение может быть использовано для лечения больных с патологическими состояниями, при которых наблюдается синдром системного воспалительного ответа (ССВО) после обширных операций, оперативных вмешательств с использованием аппарата искусственного кровообращения, сочетанной травмы, тяжелого сепсиса и септического шока, синдрома ишемии-реперфузии тканей при инсульте и инфаркте миокарда, при сахарном диабете, метастазировании опухолей, отеке легкого и остром респираторном дистресс-синдроме, ожоговой болезни и др. Способ позволяет снизить активность нейтрофилов, уменьшить воспалительные процессы, профилактировать или уменьшить степень выраженности полиорганной недостаточности, сократить сроки лечения и увеличить выживаемость больных при критических состояниях. 3 табл.
Способ подавления избыточной активации нейтрофилов, включающий воздействие газовой смесью, отличающийся тем, что снижение воспалительной гиперактивации нейтрофилов в модели ex vivo достигают путем воздействия севофлурана в концентрации 3 об.%, что соответствует 1,5 МАК, в течение 30 мин.
| Способ снижения воспалительной гиперактивации нейтрофилов | 2020 |
|
RU2758536C1 |
| СПОСОБ ДИАГНОСТИКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ НЕЙТРОФИЛОВ ЧЕЛОВЕКА | 2001 |
|
RU2218567C2 |
| US 8097605 В2, 17.01.2012 | |||
| US 2021121549 A1, 29.04.2021 | |||
| Н.Г | |||
| Плехова и др | |||
| ДЕЙСТВИЕ АНТИГИСТАМИННЫХ ПРЕПАРАТОВ НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ НЕЙТРОФИЛОВ | |||
| Гены & Клетки, том XVI, N1, 2021, с | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Sophia Koutsogiannaki et al | |||
| The volatile anesthetic sevoflurane reduces neutrophil apoptosis | |||
Авторы
Даты
2023-04-21—Публикация
2022-03-25—Подача