Изобретение относится к биотехнологии, в частности, к получению антител к эритропоэтину человека. Изобретение может быть использовано для выделения и/или очистки рекомбинантного эритропоэтина человека из культуральной жидкости методом иммуноаффинной хроматографии.
Продукция красных кровяных клеток, эритроцитов, необходимых для транспорта кислорода, постоянно происходит в клетках костного мозга и регулируется специфическим гормоном - эритропоэтином. Эритропоэтин представляет собой кислый гликопротеин с молекулярным весом около 34000 Да, синтезируемый в почках. Функцией эритропоэтина является стимулирование пролиферации и дифференцировки клеток-предшественников эритроцитарного ряда [Кетлинский С.А., Симбирцев А.С. Цитокины, С-Пб, 2008].
В обычных условиях, когда ткани здорового организма получают достаточное количество кислорода, эритропоэтин содержится в плазме крови в очень низких концентрациях (10-15 мМЕ/мл). Эта низкая концентрация достаточна для поддержания воспроизводства красных кровяных телец взамен выбывающих в процессе старения.
Однако концентрация эритропоэтина в крови многократно возрастает в условиях гипоксии, когда снижается перенос кислорода кровяными клетками. Гипоксия может быть вызвана, например, потерей большого количества крови при кровотечениях, разрушением эритроцитов вследствие радиоактивного облучения, снижением потребления кислорода при нахождении в высоких слоях атмосферы, а также при анемиях [Симбирцев А.С. Цитокины в патогенезе и лечении заболеваний человека С-Пб, 2018].
В медицинской практике рекомбинантный эритропоэтин, полученный с использованием генно-инженерных технологий, применяют при анемиях, патологиях почек, кровопотерях и на поздних стадиях онкологических заболеваний. Рекомбинантный эритропоэтин получают путем культивирования клеток-продуцентов эритропоэтина с его последующей очисткой. Очистка эритропоэтина производится хроматографическими методами, которые могут включать стадию иммуноаффинной хроматографии с применением иммобилизованных моноклональных антител к эритропоэтину.
Известны моноклональные антитела к эритропоэтину (US 4558005 А, 10.12.1985; ЕР 0116446 В1, 22.08.1990; RU 2151184 С1, 20.06.2000; RU 2145610 С1, 20.02.2000, RU 2451071 С1, 02.05.2012). Описанные антитела могут применяться при очистке эритропоэтина, однако все они являются мышиными. Применение для очистки эритропоэтина мышиных моноклональных антител нежелательно из-за возможности развития иммунного ответа на мышиные антитела или их фрагменты, которые могут контаминировать препарат эритропоэтина вследствие протеолиза используемых для его очистки иммобилизованных антител.
Этого недостатка в значительной степени можно избежать за счет использования для очистки эритропоэтина химерного (мышь-человек) антитела к эритропоэтину, в котором константные области тяжелой и легкой цепей моноклонального антитела мыши заменены на аналогичные области антитела человека.
Из патента RU 2513689 известно химерное антитело 6-4A3him. В примере 4 упомянутого патента представлено конструирование последовательностей ДНК (генов), кодирующих тяжелую и легкую цепи химерного антитела 6-4A3him, вставка полученных генов в экспрессионные векторы, трансфекция данными векторами клеток СНО линии DG-44, культивирование трансфицированных клеток в течение 7 дней с очисткой и определением свойств полученного химерного антитела. Известно, что в течение 1-2 недель трансфицированные плазмидными ДНК клетки продуцируют рекомбинантные белки, но данная продукция в дальнейшем многократно снижается вследствие генетической нестабильности трансфицированных клеток и так называемого «замолкания» промотора [Jia J., Hou C., Hughes В.S., Smede M., Leung K.M., Levine K., Rigby S., Gray P.P., Munro T.P. High-throughput ClonePix FL analysis of mAb-expressing clones using the UCOE expression system // New Biotechnology, 2014, 31(3): 214-220]. Однако внедрение химерного антитела в производственную практику требует создания штамма клеток - стабильных продуцентов такого антитела. В RU 2513689 такая задача не была решена.
Для выделения из пулов первично трансфицированных клеток стабильных штаммов-продуцентов применяют генетические и селекционные методы [там же; Nair A.R., Xie Jinger X., Hermiston Т.W. Effect of different UCOE-promoter combinations in creation of engineered cell lines for the production of Factor VIII // BMC Research Notes, 2011, 4:178].
Для удовлетворения растущих потребностей медицины в препаратах эритропоэтина существует необходимость в совершенствовании технологии его получения, в том числе в создании штамма клеток - стабильных продуцентов химерного антитела к эритропоэтину.
Задачей настоящего изобретения является создание штамма культивируемых клеток - стабильных продуцентов химерного антитела к эритропоэтину.
Поставленная задача решается тем, что предложен штамм культивируемых клеток яичников китайского хомячка CHO-SE-9/4 - продуцент химерного антитела SE-9/4 к эритропоэтину человека.
Штамм характеризуется следующими признаками.
Штамм клеток яичников китайского хомячка Cricetulus griseus (авторское наименование штамма - CHO-SE-9/4) - продуцент рекомбинантного химерного антитела против эритропоэтина человека.
Родословная штамма: Родительская клеточная линия CHOdhfr-. Котрансфекция плазмидами pTVK4g/hybEpo-H и pTVK4d/hybEpo-L с последовательным отбором стабильного высокопродуктивного клона на среде без гипоксантина/тимидина с метотрексатом и на среде с генетицином. Плазмида pTVK4g/hybEpo-H несет последовательность ДНК, кодирующую тяжелую цепь химерного антитела против эритропоэтина человека, ген устойчивости к генетицину и служебные последовательности, обеспечивающие транскрипцию мРНК тяжелой цепи химерного антитела к эритропоэтину и интеграцию плазмиды в транскрипционно активные участки хроматина. Плазмида pTVK4d/hybEpo-L несет последовательность ДНК, кодирующую легкую цепь химерного антитела против эритропоэтина человека, ген устойчивости к метотрексату и служебные последовательности, обеспечивающие транскрипцию мРНК легкой цепи химерного антитела против эритропоэтина человека и интеграцию плазмиды в транскрипционно активные участки хроматина.
Культуральные свойства: Суспензионное культивирование в пробирках, колбах или 6-луночных планшетах на орбитальном шейкере с частотой вращения 130-180 об/мин, либо в биореакторе (ферментере). Посевная доза 0,3⋅106-0,5⋅106 клеток/мл, пересев каждые 3-4 суток. Время удвоения 24-26 часов. Устойчив к 5 мкг/мл метотрексата и к 0,2 мг/мл генетицина.
Стандартные условия выращивания: Среда CDM4 СНО (HyClone) без гипоксантина/тимидина с 6 мМ глутамина, 5 нМ метотрексата, 37°С, 5% CO2.
Характеристика культивирования в организме животного: культивирование в организме животного не применяется.
Характеристики полезного вещества, продуцируемого штаммом: Рекомбинантное химерное (мышь-человек) антитело (изотип IgG1, каппа) к эритропоэтину человека (оценка с помощью иммуноферментного анализа, вестерн-блота).
Характеристика биосинтеза полезных продуктов: Рекомбинантное химерное антитело к эритропоэтину человека, секретируется в культуральную среду в количестве не менее 20 пг на клетку в сутки. Стабильность продукции антитела сохраняется после 30 пассажей в неселективных условиях.
Способ криоконсервирования: 45% свежей среды CDM4 СНО, 45% кондиционной среды, 10% DMSO, 3⋅106-5⋅106 клеток/мл, заморозка до -70°C со скоростью 1°C/мин, далее помещение в жидкий азот, жизнеспособность после размораживания и отмывки от криоконсерванта составила 90% (с трипановым синим).
Продуцируемое химерное антитело характеризуется наличием следующих отличительных признаков:
а) аминокислотная последовательность тяжелой цепи по SEQ ID NO: 12;
б) аминокислотная последовательность легкой цепи по SEQ ID NO: 14;
в) аминокислотные последовательности участков, определяющих комплементарность антитела:
CDRH-1 по SEQ ID NO: 5, CDRH-2 по SEQ ID NO: 6, CDRH-3 по SEQ ID NO: 7;
CDRL-1 по SEQ ID NO: 8, CDRL-2 no SEQ ID NO: 9, CDRL-3 по SEQ ID NO: 10;
г) константа диссоциации с рекомбинантным эритропоэтином Kd=6,3-10-8 M;
д) изоэлектрическая точка в диапазоне pI от 7,86 до 8,53;
е) молекулярный вес 160 кД.
Изобретение иллюстрируются следующими графическими материалами.
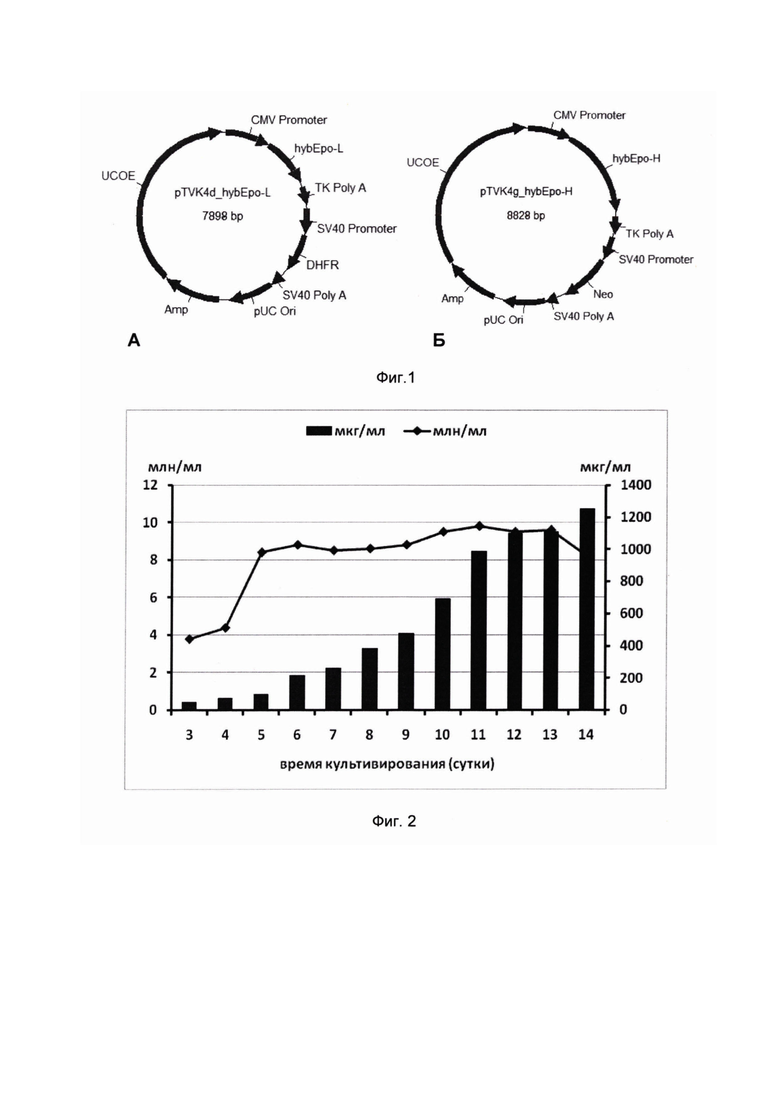
На Фиг. 1 представлены схемы плазмид pTVK4d/hybEpo-L (А) и pTVK4g/hybEpo-H (Б), где
CMV Promoter - промотор предранних белков цитомегаловируса;
hybEpo-L - последовательность ДНК, кодирующая легкую цепь химерного антитела к эритропоэтину человека (SEQ ID NO: 13);
hybEpo-H - последовательность ДНК, кодирующая тяжелую цепь химерного антитела к эритропоэтину человека (SEQ ID NO: 11);
TKpolyA - сайт полиаденилирования РНК из гена тимидинкиназы;
SV40 Promoter - промотор ранних белков вируса SV40;
DHFR - ген дигидрофолатредуктазы;
Neo - ген устойчивости к неомицину;
SV40 PolyA - сайт полиаденилирования ранних белков вируса SV40;
pUC Ori - точка начала репликации;
Amp - ген бактериального фермента β-лактамазы;
UCOE - регуляторный элемент, усиливающий экспрессию целевого гена.
На Фиг. 2 представлена динамика накопления химерного антитела SE-9/4 (мкг/мл) и числа жизнеспособных клеток (млн/мл) штамма-продуцента CHO-SE-9/4.
На Фиг. 3 представлены результаты электрофореза антитела SE-9/4 в 4-20% полиакриламидном геле с ДДС натрия в восстанавливающих и невосстанавливающих условиях. 1 - восстанавливающие условия, 2 - маркеры молекулярной массы, 3 - невосстанавливающие условия.
На Фиг. 4 представлено изофокусирование антитела SE-9/4. Фракция в - pI 8,53; фракция г - pI 8,49; фракция д - pI 8,37; фракция е - pI 8,17; фракция ж - pI 8,00; фракция з - pI 7,91 и фракция и - pI 7,86.
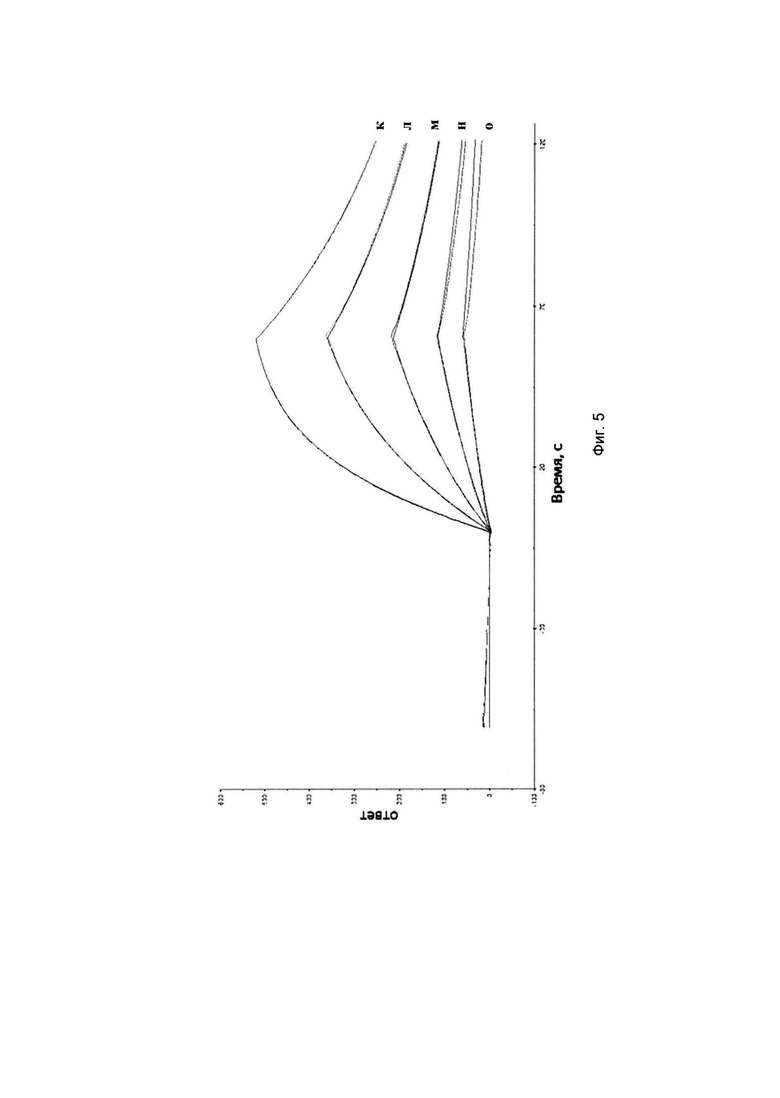
На Фиг. 5 представлен анализ связывания антитела SE-9/4 с эритропоэтином методом поверхностного плазмонного резонанса. Концентрация эритропоэтина: к - 200 нМ, л - 100 нМ, м - 50 нМ, н - 25 нМ, о - 12,5 нМ.
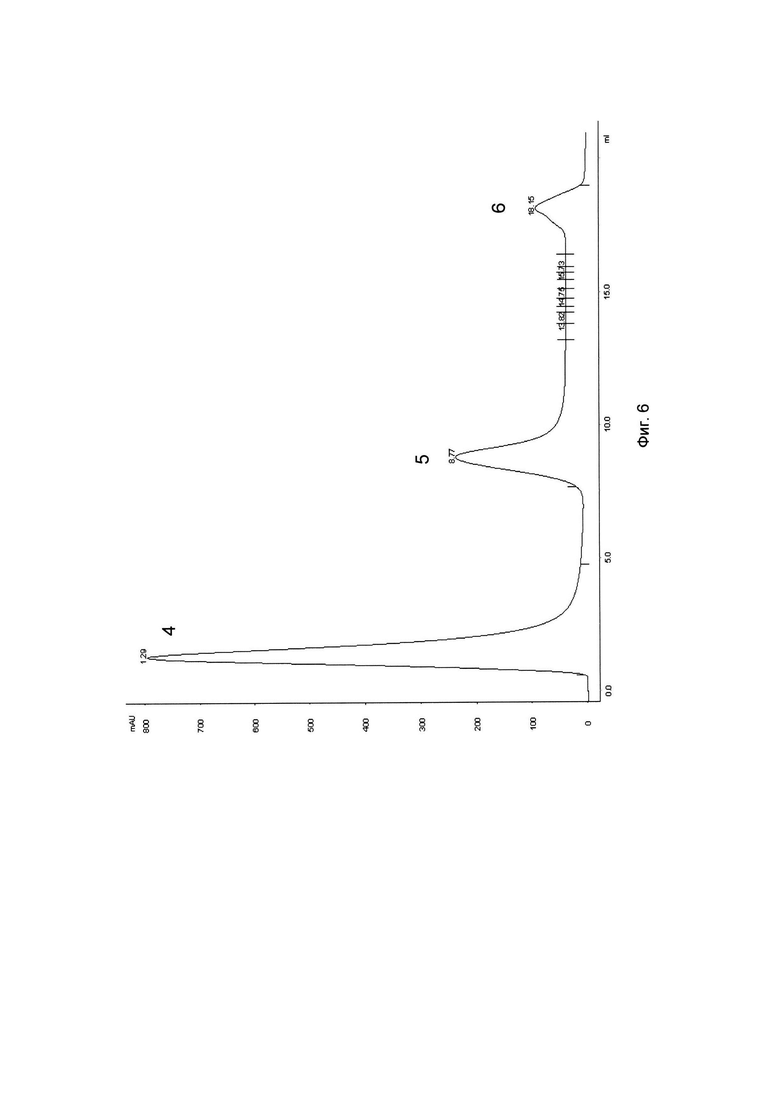
На Фиг. 6 представлены результаты аффинной хроматографии рекомбинантного эритропоэтина человека на колонке с иммобилизованным антителом SE-9/4. 4 - элюция посторонних белков 1 М раствором NaCl, 5 - элюция рекомбинантного эритропоэтина человека 0,1 М раствором лимонной кислоты, 6 - очистка колонки от загрязнений.
Подробное описание изобретения
Для создания химерного антитела против эритропоэтина человека первоначально была получена мышиная гибридома, секретирующая моноклональное антитело к эритропоэтину человека. Из клеток данной гибридомы была выделена РНК, на матрице которой была синтезирована кДНК, которая, в свою очередь, была использована в качестве матрицы для синтеза ДНК, кодирующих вариабельные области легкой и тяжелой цепей мышиного моноклонального антитела. Данные ДНК были слиты с последовательностями, кодирующими, соответственно, константные области легкой и тяжелой цепей иммуноглобулина G человека с получением генов тяжелой и легкой цепей химерного (мышь-человек) антитела SE-9/4. Было показано, что экспрессия химерных цепей антитела в клетках СНО приводит к секреции антитела, эффективно связывающего эритропоэтин человека. Рекомбинантное антитело по настоящему изобретению имеет аффинность к эритропоэтину с константой диссоциации Кd=6,3⋅10-8 М, вычисленной по результатам связывания SE-9/4 с эритропоэтином, установленным методом поверхностного плазмонного резонанса, и может быть использовано для аффинной хроматографии эритропоэтина.
На основе химерного антитела SE-9/4 могут быть также получены одноцепочечные и гуманизированные антитела к эритропоэтину человека.
Изобретение поясняется следующими примерами:
Пример 1. Получение гибридомы мыши, продуцирующей моноклональное антитело против эритропоэтина человека.
Мышей линии Balb/c иммунизировали рекомбинантным эритропоэтином человека в полном адъюванте Фрейнда в концентрации 10 мкг/мышь в апоневроз задних конечностей. На 28 день мышам повторно вводили антиген в неполном адъюванте Фрейнда в дозе 5 мкг/мышь. Еще через 21 день мышей иммунизировали в дозе 10 мкг/мышь внутривенно. Далее проводили выделение клеток селезенки и их слияние с клетками миеломы SP2/0 по стандартной процедуре [Pandey S. Hybridoma Technology For Production Of Monoclonal Antibodies // International Journal of Pharmaceutical Sciences Review and Research, 2010, 1(2): 017]. После отбора на селективной НАТ-среде в образцах культуральной жидкости определяли наличие антител к эритропоэтину методом твердофазного иммуноферментного анализа. Позитивные клоны подвергали дальнейшему клонированию и скринингу. В результате был отобран клон гибридных клеток, стабильно продуцирующих моноклональное антитело к эритропоэтину человека. С помощью иммуноферментного набора ISO-2 kit 072K4849 (Sigma, США) был установлен изотип тяжелой цепи продуцируемого антитела (G1) и легкой цепи (каппа). С помощью иммуноферментного анализа было установлено, что данное антитело не связывается с белками сыворотки крови и селезенки мышей, а также с белками сыворотки крови человека и растворимыми белками гомогената культивируемых клеток яичников китайского хомячка (СНО).
Пример 2. Выделение кДНК и секвенирование вариабельных областей легкой и тяжелой цепей.
Из клеток полученной гибридомы была выделена тотальная РНК. 100 нг полученной РНК подвергали обратной транскрипции с набором случайных гексануклеотидных праймеров.
На матрице полученной кДНК с помощью наборов синтетических праймеров были амплифицированы фрагменты генов, кодирующие вариабельные области тяжелой (VH) и легкой (VL) цепей антитела. Полученные фрагменты генов были вставлены в вектор pAL-TA (Евроген, Москва) и секвенированы со стандартных праймеров M13F и M13R. Последовательности ДНК, кодирующие VH и VL, представлены в SEQ ID NO: 1 и SEQ ID NO: 2, вычисленные аминокислотные последовательности VH и VL представлены в SEQ ID NO: 3 и SEQ ID NO: 4. Анализ последовательностей аминокислот вариабельных областей тяжелой и легкой цепей моноклонального антитела производили с помощью программы IMGTACQUEST (Immunogenetics Information System, http://www.imgt.org). Это позволило выделить участки мышиного моноклонального антитела, определяющие комплементарность к антигену для тяжелой цепи: CDR-H1, CDR-Н2 и CDR-H3, представленные в SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7 соответственно, и легкой цепи: CDRL-1, CDRL-2 и CDRL-3, представленные в SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10 соответственно.
Пример 3. Конструирование химерного антитела SE-9/4 к эритропоэтину.
С помощью полимеразной цепной реакции последовательности ДНК, кодирующие вариабельные области тяжелой и легкой цепей моноклонального антитела, были состыкованы с последовательностями ДНК, кодирующими константную область тяжелой цепи IgG1 человека и константную область легкой каппа цепи иммуноглобулина G человека соответственно.
Полученная последовательность нуклеотидов, кодирующая тяжелую цепь химерного (мышь-человек) антитела, представлена в SEQ ID NO: 11, последовательность аминокислот тяжелой цепи химерного антитела - в SEQ ID NO: 12.
Полученная последовательность нуклеотидов, кодирующая легкую цепь химерного антитела, представлена в SEQ ID NO: 13, последовательность аминокислот легкой цепи химерного антитела - в SEQ ID NO: 14. Сконструированное химерное антитело получило название SE-9/4.
Пример 4. Создание штамма-продуцента химерного антитела SE-9/4 против эритропоэтина человека.
Полученные в примере 3 ДНК, кодирующие тяжелую и легкую цепи химерного антитела, удлиняли путем постановки ПЦР с праймерами, содержавшими сайты рестрикции XbaI и NotI, обрабатывали данными рестриктазами и лигировали с рестрицированными XbaI и NotI плазмидными векторами серии pTVK4. В результате были получены плазмиды pTVK4g/hybEpo-H (Фиг. 1Б) и pTVK4d/hybEpo-L (Фиг. 1А). Плазмида pTVK4g/hybEpo-H несет последовательность ДНК, кодирующую тяжелую цепь химерного антитела против эритропоэтина человека, промотор цитомегаловируса, сайт полиаденилирования, ген устойчивости к генетицину и элемент UCOE из генома мыши, длиной 2990 нуклеотидов, обеспечивающий преимущественную интеграцию вектора в транскрипционно активные участки хроматина [Jia J. Hou C., Hughes В.S., Smede M., Leung K.M., Levine K., Rigby S., Gray P.P., Munro T.P. High-throughput ClonePix FL analysis of mAb-expressing clones using the UCOE expression system // New Biotechnology, 2014, 31(3): 214-220; Nair A. R., Xie Jinger X., Hermiston T.W. Effect of different UCOE-promoter combinations in creation of engineered cell lines for the production of Factor VIII // BMC Research Notes, 2011, 4:178]. Плазмида pTVK4d/hybEpo-L несет последовательность ДНК, кодирующую легкую цепь химерного антитела против эритропоэтина человека, промотор цитомегаловируса, сайт полиаденилирования, ген дигидрофолатредуктазы, обеспечивающий устойчивость к метотрексату, и элемент UCOE из 5'-нетранслируемой области гена RPS3 мыши, длиной 2990 нуклеотидов.
Для постоянной трансфекции использовали клетки линии яичников китайского хомячка, дефицитные по гену дигидрофолатредуктазы (CHOdhfr-), ранее адаптированные к суспензионному росту в бессывороточных условиях (Biaggio R.T., Abreu-Neto M.S., Covas D.T., Swiech K. Serum-free suspension culturing of human cells: adaptation, growth, and cryo-preservation // Bioprocess Biosyst Eng., 2015, 38(8): 1495-1507).
Клетки культивировали в среде CDM4CHO (HyClone, США) с добавлением 4 мМ аланилглутамина, 0,1 мМ гипоксантина, 0,016 мМ тимидина и 0,1% Pluronic F-68 (Sigma, США) в микробиореакторах типа TubeSpin 50 (ТРР, Швейцария) на орбитальном шейкере Sanyo MIR-S100C (200 об/мин), который был помещен в СО2-инкубатор, обеспечивающий содержание в воздухе 5% СО2 и температуру 37°С.
Трансфекцию проводили с помощью липосомального реагента «Free-style» (Life Technologies, США) по инструкции производителя, используя смесь из 3,6 мкг плазмиды pTVK4g/hybEpo-H и 2,4 мкг плазмиды pTVK4d/hybEpo-L на 5-106 клеток. Через 48 часов после трансфекции клетки переводили на среду без гипоксантина/тимидина с добавлением 5 мкг/мл метотрексата. В последующие дни среду меняли с интервалом 3 суток. Выросшие клетки затем пересевали на среду, содержавшую 0,2 мг/мл генетицина. Через 15 суток клетки переносили в колбы Эрленмейера в культуральную среду для последующего наращивания, после чего производили клонирование путем высева клеток в плотности одна клетка на лунку 96-луночного планшета. Таким образом было засеяно 20 планшетов по 96 лунок в каждом. Через 12 суток визуально отбирали лунки, содержащие единственный клон. Всего было идентифицировано 500 клонов. Через 3 суток культивирования с помощью иммуноферментного анализа (ИФА) оценивали содержание иммуноглобулинов человека в образцах культуральной среды индивидуальных клонов.
Для дальнейшей работы было отобрано 18 клонов, обеспечивших накопление иммуноглобулинов человека в концентрации более 1200 нг/мл. Отобранные клоны были целиком перенесены в 48-луночные планшеты. Через 48 часов культивирования был проведен повторный анализ концентрации иммуноглобулинов в образцах культуральной среды. По результатам второго анализа было отобрано 9 клонов с максимальной волюметрической продукцией рекомбинантных антител, концентрация иммуноглобулинов в культуральной среде которых была более 6000 нг/мл. Далее клетки каждого клона высевали в 12-луночные планшеты по 0,5⋅106 клеток на лунку в 2 мл среды и культивировали в тех же условиях. Продукцию антител оценивали на 5 сутки после посева. В результате были отобраны 7 клонов с максимальной продукцией антитела на 5 сутки.
Полученные клоны культивировали на шейкере в микробиореакторах типа TubeSpin 50 в 5 мл культуральной среды. Начальная плотность культуры составляла 0,5⋅106 клеток/мл, пересев проводили с интервалом 3 суток. После третьего пассажа клетки высевали в плотности 0,5⋅106 клеток/мл в 5 мл среды без метотрексата и генетицина и анализировали продукцию антител и динамику роста клеток. На основании полученных данных рассчитывали удельную продуктивность клеток клонов, которая оказалась наилучшей у клона 41.
Далее клетки клона 41 последовательно адаптировали к росту на среде с 5 нМ метотрексата (МТХ). После 7 пассажей в среде с МТХ клетки субклонировали в 96-луночные планшеты в среде с 5 нМ МТХ, при этом был получен 61 субклон. В результате анализа их продуктивности было показано, что субклон 9/4 обладает наилучшими ростовыми характеристиками и продуктивностью: на 6 сутки культивирования плотность жизнеспособных клеток составила 4,3⋅106 клеток/мл при жизнеспособности 90%, а максимальная волюметрическая продукция рекомбинантных антител - 20 мкг/мл. Субклон 9/4 был помещен в клеточный банк ФГУП «ГосНИИ ОЧБ» под названием CHO-SE-9/4.
Клетки штамма-продуцента CHO-SE-9/4 рассевали в мини-биореакторы, содержавшие по 5 мл среды CDM4CHO (HyClone, США), в которую добавляли 4 мМ аланил-глутамина (Applichem, Германия), 0,1% Plutonic F-68 (Sigma, США) и 5% EX-CELL® CD Hydrolysate Fusion (HyClone, США). Исходная концентрация клеток составляла 0,6⋅106 клеток/мл. Культивирование проводили на шейкере-инкубаторе LT-X (Kuhner, Швейцария), со скоростью вращения 200 об/мин и амплитудой 50 мм при 5% СО2. В первые трое суток культивирования поддерживали температуру 37 С, затем ее понижали до 32 С. Дальнейшее культивирование проводили при 32 С. Начиная с четвертых суток, в мини-биореакторы ежедневно добавляли питательные добавки Cell Boost 7а и Cell Boost 7b (HyClone, США) по 2% и 0,2% от первоначального объема культуры соответственно. Культивирование продолжали до 14 суток, достигнув максимальной плотности клеток более 9⋅106/мл и концентрации химерного антитела 1200 мкг/мл (Фиг. 2). Удельная продукция целевого антитела, рассчитанная по методике, описанной в статье Chusainow J., Yuan Sheng Yang Y.S., J.H.M. Yeo, Toh C.P., Asvadi P., Wong N.S.C, Yap M.S.G. A Study of Monoclonal Antibody-Producing CHO Cell Lines: What Makes a Stable High Producer? // Biotechnol. Bioeng., 2009, 102:1182-1196, составила 20 пг антитела SE-9/4 на клетку в сутки. Для оценки стабильности продукции химерного антитела клетки штамма CHO-SE-9/4 последовательно культивировали в 5 мл среды CDM4CHO без добавления метотрексата и генетицина в течение 3 суток, после чего пересевали в 5 мл аналогичной среды. Данную процедуру повторяли 30 раз, после чего вновь культивировали клетки в мини-биореакторе с добавлением питательных добавок и понижением температуры до 32°С на 4-е сутки культивирования. Концентрация химерного антитела в культуральной среде на 14 сутки культивирования составила 1150±100 мкг/мл. Таким образом, клетки штамма-продуцента CHO-SE-9/4 сохранили первоначальную продуктивность после 30 пассажей в неселективных условиях культивирования, что говорит о стабильности полученного штамма-продуцента.
Пример 5. Очистка химерного антитела SE9/4 и определение его свойств.
Клетки штамма-продуцента CHO-SE-9/4 культивировали в 5 колбах Эрленмейера емкостью 1 л, заполненных 50 мл среды. Состав среды, питательные добавки и режим культивирования использовали, как в примере 4. Накопление в среде культивирования химерного моноклонального антитела SE-9/4 определяли методом иммуноферментного анализа. В результате на 12 сутки культивирования было получено 200 мл культуральной среды, которую наносили на колонку, содержавшую 5 мл сефарозы с иммобилизованным белком A (GE Healthcare Life Sciences, США), промывку колонки и элюирование антитела проводили по инструкции изготовителя. В результате был получен лабораторный образец очищенного рекомбинантного химерного антитела SE-9/4 против эритропоэтина человека в количестве 80 мг.
Анализ химерного антитела SE-9/4 методом электрофореза в 4-20% полиакриламидном геле с ДДС натрия показал, что оно имеет молекулярный вес примерно 160 кД в невосстанавливающих условиях, в восстанавливающих условиях антитело диссоциирует на белки с молекулярной массой 49 и 24 кДа, что соответствует ожидаемым показателям для тяжелой и легкой цепей иммуноглобулина (Фиг. 3). Изоэлектрическое фокусирование антитела SE-9/4 в мочевине при 20 С проводили с помощью системы капиллярного электрофореза «Капель-105М» (Люмэкс, Россия), в нейтральном капилляре длиной 45 см и внутренним диаметром 50 мкм, используя амфолиты «Pharmalyte 3-10» (GE, США) и пептидные маркеры с известными изоэлектрическими точками («Beckman Coulter», США). Результаты регистрировали по светопоглощению при длине волны 280 нм с последующей обработкой в программе «Эльфоран» (Фиг. 4). Антитело SE-9/4 имеет изоэлектрические точки в диапазоне pI от 7,86 до 8,53, что может быть связано с гетерологичным гликозилированием. Основная фракция (фракция е), содержащая 74,89% материала, соответствует изоточке с pI=8,17, кроме того, наблюдаются другие фракции: фракция в имеет pI 8,53; фракция г - pI 8,49; фракция д - pI 8,37; фракция ж - pI 8,00; фракция з - pI 7,91 и фракция и - pI 7,86. (Фиг. 4).
Для определения аффинности антитела SE-9/4 к рекомбинантному эритропоэтину человека был использован метод поверхностного плазмонного резонанса с использованием прибора «Biacore X100» с двойной проточной ячейкой (GE-Healthcare, США). После иммобилизации антитела против IgG человека (Abeam, США) в ячейке прибора (4,9 нг на 1 мм2 поверхности ячейки) в ячейку добавляли раствор антитела SE-9/4 (50 нМ), промывали от несвязавшегося антитела, вводили раствор эритропоэтина человека в концентрации от 12,5 нМ до 200 нМ, после чего диссоциацию комплекса антиген-антитело проводили путем промывки ячейки буферным раствором (Фиг. 5). Равновесная константа диссоциации Kd комплекса SE-9/4-эритропоэтин была определена по зависимости установившегося значения ответа (RU) от концентраций эритропоэтина (ЕРО), при этом полученные данные соответствовали уравнению Ленгмюра для модели одноцентрового связывания:
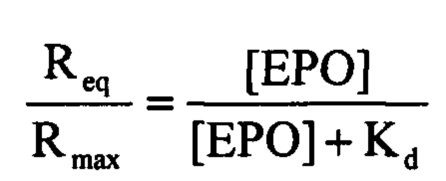
где Req - ответ (RU) при достижении равновесия, Rmax - ответ (RU) при насыщении поверхности антителом SE-9/4. Kd - равновесная константа диссоциации комплекса антитела SE-9/4 с эритропоэтином, [ЕРО] -концентрация эритропоэтина. Было получено значение Kd=63 нМ.
Пример 6. Применение химерного антитела SE-9/4 для очистки рекомбинантного эритропоэтина человека.
Химерное антитело SE-9/4 очищали из среды культивирования с помощью хроматографии на белок А-сефарозе. Выделенное антитело в количестве 5 мг иммобилизовывали на 2 мл CNBr-активированной матрицы Sepharose FF (GE Healthcare, США) по методике изготовителя и помещали в хроматографическую колонку. На колонку, предварительно уравновешенную фосфатным буфером, наносили 20 мл кондиционной культуральной среды, содержащей рекомбинантный эритропоэтин человека (Фиг. 6). После промывки колонки фосфатным буфером, содержащим 1 М хлористого натрия и 0,02% неионного детергента (пик 4 на Фиг. 6), сорбированный эритропоэтин человека элюировали 0,1 М раствором лимонной кислоты (пик 5 на Фиг. 6). рН полученного раствора эритропоэтина человека доводили до значения 7,5 дробным добавлением 0,1 М раствора NaOH, после чего анализировали свойства эритропоэтина. По данным электрофореза в полиакриламидном геле чистота эритропоэтина, очищенного с помощью иммобилизованного антитела SE-9/4, составила 95%, выход не менее 80%. Биологическая активность полученного эритропоэтина, определяемая по приросту ретикулоцитов в крови мышей после подкожного введения, составила 1,2⋅105 МЕ/мг белка.
Штамм-продуцент CHO-SE-9/4 был помещен на хранение в музей ФГУП «Гос. НИИ ОЧБ» ФМБА России. Удельная продуктивность клеток штамма CHO-SE-9/4 составляет не менее 20 пг антитела SE-9/4 на клетку в сутки, время удвоения от 24 до 26 часов.
Заявитель просит рассмотреть представленные материалы заявки «Штамм клеток CHO-SE-9/4 - продуцент химерного антитела против эритропоэтина человека и химерное антитело, продуцируемое данным штаммом» на предмет выдачи патента РФ на изобретение.
--->
Перечень последовательностей нуклеотидов
<110> Федеральное государственное унитарное предприятие «Государственный научно-исследовательский институт особо чистых биопрепаратов» Федерального медико-биологического агентства
Federal State Unitary Enterprise «State Research Institute of Ultra Pure Biologicals» of the Federal Medical and Biological Agency
<120> Штамм клеток СНО SE-9/4 — продуцент химерного антитела против эритропоэтина человека и химерное антитело, продуцируемое данным штаммом
<130>
<160> 14
<210> 1
<211> 358
<212> ДНК
<213> Mus musculus
<220>
<223> ДНК, кодирующая вариабельную область тяжелой цепи моноклонального антитела мыши к эритропоэтину человека
<400> 1
<210> 2
<211> 336
<212> ДНК
<213> Mus musculus
<220>
<222> (1)…(336)
<223> ДНК, кодирующая вариабельную область легкой цепи моноклонального антитела мыши к эритропоэтину человека
<400> 2
<210> 3
<211> 119
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(119)
<223> Последовательность аминокислот вариабельной области тяжелой цепи моноклонального антитела к эритропоэтину человека
<400> 3
<210> 4
<211> 112
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(112)
<223> Последовательность аминокислот вариабельной области легкой цепи моноклонального антитела к эритропоэтину человека
<400> 4
<210> 5
<211> 8
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(8)
<223> Последовательность аминокислот участка CDRH-1 моноклонального антитела к эритропоэтину человека
<400> 5
<210> 6
<211> 8
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(8)
<223> Последовательность аминокислот участка CDRH-2 моноклонального антитела к эритропоэтину человека
<400> 6
<210> 7
<211> 12
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(12)
<223> Последовательность аминокислот участка CDRH-3 моноклонального антитела к эритропоэтину человека
<400> 7
<210> 8
<211> 11
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(11)
<223> Последовательность аминокислот участка CDRL-1 моноклонального антитела к эритропоэтину человека
<400> 8
<210> 9
<211> 3
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(3)
<223> Последовательность аминокислот участка CDRL-2 моноклонального антитела к эритропоэтину человека
<400> 9
<210> 10
<211> 9
<212> Белок
<213> Mus musculus
<220>
<222> (1)…(9)
<223> Последовательность аминокислот участка CDRL-3 моноклонального антитела к эритропоэтину человека
<400> 10
<210> 11
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<222> (1)…(1347)
<223> ДНК, кодирующая тяжелую цепь химерного антитела SE-9/4
<400> 11
<210> 12
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<222> (1)…(449)
<223> Последовательность аминокислот тяжелой цепи химерного антитела SE-9/4
<400> 12
<210> 13
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<222> (1)…(660)
<223> ДНК, кодирующая легкую цепь химерного антитела SE-9/4
<400> 13
<210> 14
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<222> (1)…(219)
<223> Последовательность аминокислот легкой цепи химерного антитела SE-9/4
<400> 14
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитела против белка р17 ВИЧ-1 субтипа А | 2019 |
|
RU2727673C1 |
| Антитело моноклональное мышиное 1Е10 и антитело рекомбинантное химерное (мышь-человек) xi1E10, нейтрализующие летальный токсин Bacillus anthracis, и штамм гибридных культивируемых клеток животных Mus musculus 1E10 | 2020 |
|
RU2745116C1 |
| УНИВЕРСАЛЬНЫЙ АНТИТЕЛООПОСРЕДОВАННЫЙ БИОСЕНСОР | 2016 |
|
RU2746486C2 |
| АНТИТЕЛО ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2781148C2 |
| АНТИТЕЛО К CD73 ЧЕЛОВЕКА | 2017 |
|
RU2754058C2 |
| АНТИТЕЛА, ИНДУЦИРУЮЩИЕ ИММУННУЮ ТОЛЕРАНТНОСТЬ, ИНДУЦИРОВАННЫЕ ЛИМФОЦИТЫ И ТЕРАПЕВТИЧЕСКИЙ АГЕНТ/СПОСОБ КЛЕТОЧНОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ИНДУЦИРОВАННЫХ ЛИМФОЦИТОВ | 2019 |
|
RU2816592C2 |
| БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ БЫСТРОГО ОБНАРУЖЕНИЯ ОПРЕДЕЛЯЕМЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717658C2 |
| Антитела против анафилатоксина C5a человека | 2019 |
|
RU2731516C1 |
| Химерные белки на основе утрофина и дистрофина человека и их применение для лечения миодистрофии Дюшенна | 2021 |
|
RU2767335C1 |
| АНТИТЕЛО ПРОТИВ Fn14 ЧЕЛОВЕКА | 2019 |
|
RU2787044C2 |

Настоящее изобретение относится к области иммунологии. Предложено антитело, способное специфически связываться с эритропоэтином человека. Также рассмотрен штамм-продуцент такого антитела. Данное изобретение может найти дальнейшее применение в выделении и/или очистке рекомбинантного эритропоэтина человека методом иммуноаффинной хроматографии. 2 н.п. ф-лы, 6 ил., 6 пр.
1. Антитело, способное специфически связываться с эритропоэтином человека, имеющее последовательность вариабельной области тяжелой цепи по SEQ ID NO: 12 и последовательность вариабельной области легкой цепи по SEQ ID NO: 14.
2. Штамм - продуцент антитела по п. 1, представляющий собой культивируемые клетки Cricetulus griseus линии CHO-SE-9/4, трансформированные плазмидой pTVK4g/hybEpo-H, несущей последовательность ДНК SEQ ID NO: 11, ген устойчивости к генетицину и служебные последовательности, обеспечивающие транскрипцию мРНК тяжелой цепи химерного антитела к эритропоэтину и интеграцию плазмиды в транскрипционно активные участки хроматина, и плазмидой pTVK4d/hybEpo-L, несущей последовательность ДНК SEQ ID NO: 13, ген устойчивости к метотрексату и служебные последовательности, обеспечивающие транскрипцию мРНК легкой цепи химерного антитела против эритропоэтина человека и интеграцию плазмиды в транскрипционно активные участки хроматина.
| АНТИТЕЛО К ЭРИТРОПОЭТИНУ ЧЕЛОВЕКА (ВАРИАНТЫ) И ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К ЭРИТРОПОЭТИНУ ШТАММ ГИБРИДОМЫ | 2012 |
|
RU2513689C1 |
| Способ приготовления сернистого красителя защитного цвета | 1921 |
|
SU84A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К РЕКОМБИНАНТНОМУ ЭРИТРОПОЭТИНУ ЧЕЛОВЕКА (ВАРИАНТЫ) | 2010 |
|
RU2451071C1 |
| ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА СНО-ЕРО 4А9 - ПРОДУЦЕНТ ВЫСОКОСИАЛИРОВАННОГО ЭРИТРОПОЭТИНА | 2016 |
|
RU2652884C1 |
Авторы
Даты
2020-03-17—Публикация
2019-01-29—Подача