[0001] Перечень последовательностей в электронном формате (текстовый файл ASCII) подан с данной заявкой и включен в настоящий документ посредством ссылки. Имя ASCII текстового файла - «2016_0324A_ST25.txt»; файл был создан 11 марта 2016 года; размер файла составляет 74 КБ.
УРОВЕНЬ ТЕХНИКИ
[0002] В области безопасности пищевых продуктов, здравоохранения, сельскохозяйственных испытаний и биологической защиты существует возрастающая потребность в доступных и высокочувствительных видах анализа, позволяющих быстро и точно определять наличие факторов окружающей среды и патогенных агентов, в том числе токсинов, антигенов, бактерий и вирусов в исследуемых образцах. С этой целью коммерчески разрабатывают и выпускают различные биосенсорные продукты.
[0003] Конкретным примером биосенсорной платформы, используемой в настоящее время, является биосенсорная технология CANARY® PathSensors, Inc. Эта платформа, основанная на работе Rider et al. [1], обеспечивает надежную идентификацию специфических патогенов, распространяющихся по воздуху и с жидкостями. Биологический остов биосенсора CANARY® содержит генетически сконструированную В-клетку, экспрессирующую внеклеточно связанное антиген-специфическое антитело, которое может связывать свой распознанный антиген или патогенный агент. В этой системе при взаимодействии антиген-содержащего образца с антителом на внеклеточной поверхности биосенсора активируется внутриклеточный сигнальный каскад, что приводит к высвобождению Са2+ в В-клетках. В системе CANARY® В-клетки экспрессируют экворин, Са2+-чувствительный фотобелок, что приводит к люминесценции клеток в присутствии повышенных уровней внутриклеточного Са2+. Таким образом, люминесценцию можно использовать для индикации связывания антигена.
[0004] Систему CANARY® можно применять для эффективного выявления ряда специфических антигенов, в том числе бактериальных, вирусных антигенов и токсинов. В то же время расширение тестового репертуара антигенов является сложной и затратной процедурой. Необходимо сконструировать различные антиген- или патоген-специфичные биосенсоры для распознавания всевозможных выбранных антигенов, что требует ряда этапов, включающих получение гибридомных клеточных линий, клонирование нуклеотидных последовательностей, кодирующих антитела и экспрессию клонированных антител в качестве трансмембранных белков на поверхности генетически сконструированной линии В-клеток, люминесцирующих после связывания распознанного антигена (например, патогена) антителом.
[0005] Таким образом, сохраняется необходимость в разработке универсального биосенсора, который может быть адаптирован для использования на множестве исследовательских площадок по всему широкому диапазону факторов окружающей среды и патогенных агентов. Настоящее изобретение относится к данной и другим важным целям.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
[0006] В настоящем документе предложены универсальные антитело-опосредованные биосенсоры, которые могут быть использованы для выявления и количественной оценки агентов мишени в образце, а также способы применения биосенсоров для скрининга образцов, полученных из выбранного агента мишени.
[0007] Биосенсоры по настоящему изобретению обычно содержат клеточную линию, стабильно экспрессирующую новый химерный гибридный белок. Гибридный белок содержит антитело-связывающий домен (например, внеклеточный домен Fcγ-рецептора (FcγR)), гибридизированный сигнальным доменом (таким как, внутриклеточный домен активации альфа-иммуноглобулина (Igα)). N-концевой внеклеточный антитело-связывающий домен может связываться к Fc-областью антитела, в то время как С-концевой, внутриклеточный сигнальный домен может активировать клеточные процессы, такие как, высвобождение Са2+. Такая активация возникает, если антитела, связанные с антитело-связывающим доменом, перекрестно сшиты посредством их распознанного антигена.
[0008] Поскольку антитело-связывающий домен химерного гибридного белка связывает Fc-область антитела, антитело, которое может быть связано гибридным белком, не ограничено антигенной специфичностью антитела. Таким образом, химерный гибридный белок обладает способностью связывать любое имеющееся антитело, которое распознает и связывает выбранную мишень (например, антиген или патогенный агент).
[0009] Биосенсор по настоящему изобретению обеспечивает быстрое и экономичное средство тестирования наличия широкого спектра различных агентов мишени используя одинаковую платформу, не требуя производства отдельных химерных гибридных белков для каждого выбранного агента мишени. Этот универсальный биосенсор может быть использован в сочетании с коммерчески доступными антителами, а также с антителами, произведенными специально для использования сданным биосенсором.
Гибридные белки
[0010] В первом варианте воплощения настоящее изобретение относится к химерным гибридным белкам, содержащим антитело-связывающий домен Fcγ-рецептора (FcγR), трансмембранный домен и сигнальный домен. Гибридные белки обладают способностью распознавать и связывать Fc-область антитела за счет своего антитело-связывающего домена. Гибридные белки также обладают способностью активировать внутриклеточный сигнальный каскад в клетке, экспрессирующей гибридный белок. В некоторых аспектах внутриклеточный сигнальный каскад приводит к высвобождению Са2+ в клетке.
[0011] В некоторых аспектах настоящего варианта воплощения антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRI, определяемый SEQ ID NO: 1 или 3, или вариантом их последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 1 или 3. В некоторых других аспектах настоящего варианта воплощения антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRIII, определяемый SEQ ID NO: 2 или 4, или вариантом их последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 2 или 4. Варианты последовательности сохраняют антитело-связывающую активность антитело-связывающего домена, на котором они основаны.
[0012] В некоторых аспектах настоящего варианта воплощения сигнальным доменом является сигнальный домен альфа-иммуноглобулина (Igα), определяемый SEQ ID NO: 5, или вариантом его последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 5. В некоторых других аспектах настоящего варианта воплощения сигнальным доменом является частично мембранный Ig, определяемый SEQ ID NO: 6, или вариантом его последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 6. Варианты последовательности сохраняют сигнальную активность сигнального домена, на котором они основаны.
[0013] В отдельных аспектах гибридным белком является гибридный белок FcγRI/Igα определяемый SEQ ID NO: 8, гибридный белок FcγRIII/Igα определяемый SEQ ID NO: 10, гибридный белок FcγRI/мембранный Ig, определяемый SEQ ID NO: 22, или гибридный белок FcγRIII/мембранный Ig, определяемый SEQ ID NO: 23, или вариантом последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 8, 10, 22, или 23.
[0014] Настоящее изобретение включает полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие каждый из гибридных белков, предусмотренных в различных вариантах воплощения и аспектах, указанных в настоящем документе, а также их комплементарные цепи. Настоящее изобретение также включает клонирующие векторы, содержащие полинуклеотиды, и клетки-хозяева, содержащие полинуклеотиды или экспрессирующие векторы. Такие клетки-хозяева могут быть клетками млекопитающих или организмов, не являющихся млекопитающими. Кроме того, настоящее изобретение включает способы получения гибридных белков, указанных в настоящем документе, содержащих при этом культивирование клеток-хозяев в условиях, способствующих экспрессии гибридных белков, кодируемых полинуклеотидами и экспрессирующими векторами, и выделение гибридных белков из клеток или клеточных культур.
Клетки биосенсора
[0015] Во втором варианте воплощения настоящее изобретение относится к клеткам биосенсора, стабильно экспрессирующим химерный гибридный белок, причем указанный химерный гибридный белок содержит антитело-связывающий домен Fcγ-рецептора (FcγR), трансмембранный домен и сигнальный домен. Гибридные белки характеризуются способностью распознавать и связывать Fc-область антитела за счет своего антитело-связывающего домена. Гибридные белки характеризуются способностью активировать внутриклеточный сигнальный каскад в клетке, экспрессирующей гибридный белок. В некоторых аспектах внутриклеточный сигнальный каскад приводит к высвобождению Са2+ в клетке. Химерный гибридный белок стабильно экспрессируют на поверхность клетки в качестве интегрального мембранного белка.
[0016] В некоторых аспектах настоящего варианта воплощения клеткой биосенсора является В-клетка, Т-клетка, моноцит, макрофаг, клетка НЕК293, клетка СНО, Р815, К562, или клетка Cos-1, каждая из которых стабильно экспрессирует химерный гибридный белок.
[0017] В некоторых аспектах настоящего варианта воплощения антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRI, определяемый SEQ ID NO: 1 или 3, или вариантом их последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 1 или 3. В некоторых других аспектах настоящего варианта воплощения антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRIII, определяемый SEQ ID NO: 2 или 4, или вариантом их последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 2 или 4. Варианты последовательности сохраняют антитело-связывающую активность антитело-связывающего домена, на котором они основаны.
[0018] В некоторых аспектах настоящего варианта воплощения сигнальным доменом является сигнальный домен альфа-иммуноглобулина (Igα), определяемый SEQ ID NO: 5, или вариантом его последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 5. В некоторых других аспектах настоящего варианта воплощения сигнальным доменом является частично мембранный Ig, определяемый SEQ ID NO: 6, или вариантом его последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 6. Варианты последовательности сохраняют сигнальную активность сигнального домена, на котором они основаны.
Способы выявления агента
[0019] В третьем варианте воплощения настоящее изобретение относится к способам выявления агента-мишени в образце. Конкретный способ предусматривает (а) приведение в контакт образца с антителом, характеризующимся специфичностью связывания по отношению к агенту-мишени, и с клеткой биосенсора, и (b) тестирование клетки биосенсора на предмет клеточной активации, причем клетка биосенсора стабильно экспрессирует химерный гибридный белок, и при этом химерный гибридный белок содержит антитело-связывающий домен Fcγ-рецептора (FcγR), трансмембранный домен и сигнальный домен.
[0020] Гибридные белки характеризуются способностью распознавать и связывать Fc-область антитела за счет своего антитело-связывающего домена. Гибридные белки характеризуются способностью активировать внутриклеточный сигнальный каскад в клетке, экспрессирующей гибридный белок. В некоторых аспектах внутриклеточный сигнальный каскад приводит к высвобождению Са2+ в клетке. Химерный гибридный белок стабильно экспрессируют на поверхность клетки в качестве интегрального мембранного белка.
[0021] В некоторых аспектах настоящего варианта воплощения образцом является образец воздуха, образец жидкости, образец сухого вещества, образец растительного происхождения или биологический образец. В предпочтительных аспектах, если образцом является образец воздуха, его выбирают из группы, состоящей из аэрозоля, образца атмосферного воздуха, воздуха, нагнетаемого вентилятором, и выхлопных газов двигателя. В предпочтительных аспектах, если образцом является образец жидкости, его выбирают из группы, состоящей из продукта питания, напитка, образца воды, образца лекарственной формы и товара для личной гигиены. В предпочтительных аспектах, если образцом является образец сухого вещества, его выбирают из группы, состоящей из продукта питания, почвы, образца лекарственной формы, солюбилизированных мазковых проб и товара для личной гигиены. В предпочтительных аспектах, если образцом является образец растительного происхождения, его выбирают из группы, состоящей из листьев, фруктов, орехов, семян, цветков и растительной ткани. В предпочтительных аспектах, если образцом является биологический образец, его выбирают из группы, состоящей из крови, сыворотки, пота, мочи, спинномозговой жидкости, слизи, спермы, кала, смыва бронхоальвеолярного лаважа и ткани.
[0022] В некоторых аспектах настоящего варианта воплощения агентом является экологически нежелательный токсин, загрязнитель, медикамент или биологический агент. В предпочтительных аспектах, если образцом является биологический образец, его выбирают из группы, состоящей из агента биологического оружия, аллергена, паразитарного антигена, грибкового антигена, вирусного антигена, бактериального антигена, клеточного антигена и антитела.
[0023] В некоторых аспектах настоящего варианта воплощения клеткой биосенсора является В-клетка, Т-клетка, моноцит, макрофаг, клетка НЕК293, клетка СНО, Р815, К562, или Cos-1, каждая из которых стабильно экспрессирует химерный гибридный белок.
[0024] В некоторых аспектах настоящего варианта воплощения клеточная активация представляет собой увеличение внутриклеточных уровней Са2+.
[0025] В некоторых аспектах настоящего варианта воплощения антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRI, определяемый SEQ ID NO: 1 или 3, или вариантом их последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 1 или 3. В некоторых других аспектах настоящего варианта воплощения антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRIII, определяемый SEQ ID NO: 2 или 4, или вариантом их последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 2 или 4. Варианты последовательности сохраняют антитело-связывающую активность антитело-связывающего домена, на котором они основаны.
[0026] В некоторых аспектах настоящего варианта воплощения сигнальным доменом является сигнальный домен альфа-иммуноглобулина (Igα), определяемый SEQ ID NO: 5, или вариантом его последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 5. В некоторых других аспектах настоящего варианта воплощения сигнальным доменом является частично мембранный Ig, определяемый SEQ ID NO: 6, или вариантом его последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 6. Варианты последовательности сохраняют сигнальную активность сигнального домена, на котором они основаны.
[0027] Вышеизложенное достаточно широко обрисовывает признаки и технические преимущества настоящего изобретения с целью лучшего понимания последующего подробного описания изобретения. Дополнительные признаки и преимущества настоящего изобретения будут описаны в настоящем документе, что составляет предмет формулы изобретения. Специалисты в данной области техники должны принимать во внимание, что любая концепция и конкретный вариант воплощения, описанные в настоящем документе могут быть легко использованы в качестве основы для модификации или проектирования других структур для выполнения тех же задач настоящего изобретения. Специалисты в данной области техники также должны понимать, что такие эквивалентные конструкции не выходят за пределы сущности и объема настоящего изобретения, по прилагаемым пунктам формулы изобретения. Новые признаки, которые считаются отличительными признаками настоящего изобретения как с точки зрения его организации, так и способа действия, наряду с дальнейшими целями и преимуществами, будут лучше поняты из следующего описания, рассматриваемого в связи с прилагаемыми фигурами. В то же время, следует ясно понимать, что любое описание, фигура, пример и т.д. представлены только с целью иллюстрации и описания и никоим образом не предназначены для определения пределов изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0028] Фигура 1. Схематическое представление конструктов, кодирующих гибридные белки по настоящему изобретению. Конструкт А кодирует гибридный белок FcγRI/Igα, а конструкт В кодирует гибридный белок FcγRIII/Igα. Эти гибридные белки идентичны, за исключением того, что гибридный белок FcγRI/Igα характеризуется антитело-связывающим и трансмембранным доменами FcγRI, тогда как гибридный белок FcγRIII/Igα характеризуется антитело-связывающим и трансмембранным доменами FcγRIII. Конструкт С кодирует гибридный белок FcγRI/мембранный Ig, а конструкт D кодирует гибридный белок FcγRIII/мембранный Ig. Эти гибридные белки идентичны, за исключением того, что гибридный белок FcγRI/мембранный Ig характеризуется антитело-связывающим доменом FcγRI, тогда как гибридный белок FcγRIII/мембранный Ig характеризуется антитело-связывающий домен FcγRIII. Фрагмент этих гибридных белков, относящийся к мембранному Ig, содержит шарнирные-СН2-СН3-трансмембранные-внутриклеточные домены мембрано-ассоциированного антитела. Конструкты Е и F также кодируют гибридные белки FcγRI/Igα и FcγRIII/Igα, соответственно, но эти конструкты к тому же кодируют пептид 2А и FcRγ-цепь.
[0029] Фигура 2. Последовательность FcγRI мыши (SEQ ID NO: 15). Внеклеточная антитело-связывающая область находится на N-конце; закрашенная последовательность является предсказанной трансмембранной областью; внутриклеточная область находится на С-конце.
[0030] Фигура 3. Последовательность FcγRIII мыши (SEQ ID NO: 16). Внеклеточная антитело-связывающая область находится на N-конце; закрашенная последовательность является предсказанной трансмембранной областью; внутриклеточная область находится на С-конце.
[0031] Фигура 4. Последовательность альфа-иммуноглобулина мыши (Igα; CD79A; SEQ ID NO: 17). Внеклеточная область находится на N-конце; закрашенная последовательность является предсказанной трансмембранной областью; внутриклеточная область находится на С-конце.
[0032] Фигура 5. Последовательность гибридного белка FcγRI/Igα (гибридный белок А; SEQ ID NO: 7 и 8). Антитело-связывающий домен и трансмембранный домен (закрашенная последовательность) FcγRI гибридизированы сигнальным доменом Igα (подчеркнуто) в направлении от 5' к 3'.
[0033] Фигура 6. Последовательность гибридного белка FcγRIII/Igα (гибридный белок В; SEQ ID NO: 9 и 10). Антитело-связывающий домен и трансмембранный домен (закрашенная последовательность) FcγRIII гибридизированы сигнальным доменом Igα (подчеркнуто) в направлении от 5' к 3'.
[0034] Фигура 7. Частичная последовательность мембранного IgG2 человека (SEQ ID NO: 18). Область шарнира, затем домен СН2 (подчеркнуто), домен СН3 (двойное подчеркивание), трансмембранный домен и внутриклеточный домен (подчеркнуто) в направлении от 5' к 3'.
[0035] Фигура 8. Последовательность гибридного белка FcγRI/мембранный Ig (гибридный белок С; SEQ ID NO: 22). Антитело-связывающий домен FcγRI гибридизирован доменом частичной последовательности мембранного IgG2 человека (подчеркнуто) в направлении от 5' к 3'.
[0036] Фигура 9. Последовательность гибридного белка FcγRIII/мембранный Ig (гибридный белок D; SEQ ID NO: 23). Антитело-связывающий домен FcγRIII гибридизирован доменом частичного мембранного IgG2 человека (подчеркнуто) в направлении от 5' к 3'.
[0037] Фигура 10. Последовательность 2А пептида (SEQ ID NO: 24).
[0038] Фигура 11. Последовательность FcRγ-цепи (SEQ ID NO: 25).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
[0039] Если не указано иное, технические термины используются по своему обычному применению. Определения общепринятых в молекулярной биологии терминов, можно найти, например, в источниках Benjamin Lewin, Genes VII, опубликованном в Oxford University Press, 2000 (ISBN 019879276X); Kendrew et al. (eds.); The Encyclopedia of Molecular Biology, опубликованном в Blackwell Publishers, 1994 (ISBN 0632021829); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, опубликованном в Wiley, John & Sons, Inc., 1995 (ISBN 0471186341); и других соответствующих технических справочниках.
[0040] В контексте настоящего документа формы единственного числа могут означать один или несколько. В контексте настоящего документа при использовании в сочетании со словом «включая» формы единственного числа могут означать один или больше, чем один. В контексте настоящего документа термин «еще один» может означать по меньшей мере второй или более. Кроме того, если контекстом настоящего документа не требуется иное, то употребление терминов в единственном числе включает множественное число, а употребление терминов во множественном числе включает единственное число.
[0041] В настоящем документе слово «приблизительно» относится к численному значению, включая, например, целые числа, дроби и проценты, указанные явным или не явным образом. Термин «приблизительно», в общем случае, относится к диапазону численных значений (например, +/- 5-10% от приведенного значения), который любой средний специалист в данной области техники счел бы эквивалентным приведенному значению (например, характеризующимся тем же действием или результатом). В отдельных случаях термин «приблизительно» может включать численные значения, округленные до значащей цифры десятых.
II. Настоящее изобретение
[0042] По краткой сводной информации, приведенной выше, настоящее изобретение относится к универсальному антитело-опосредованному биосенсору, содержащему клеточную линию, стабильно экспрессирующую новый химерный гибридный белок на свою поверхность. Гибридные белки могут связывать антитела без учета специфичности связывания их антигенов, а клетки, экспрессирующие гибридные белки на свою поверхность, могут быть активированы в результате перекрестного сшивания связанных антител с помощью их распознанного антигена. Поскольку гибридные белки связывают Fc-область любого антитела, они могут служить универсальным звеном между внеклеточной сигнализацией и внутриклеточной активацией. Биосенсор может быть использован для выявления выбранных антигенов в образце посредством приведения образца в контакт с (i) клетками биосенсора и (ii) антителами, характеризующимися специфичностью связывания по отношению к данному антигену. Сразу после добавления антитела связываются химерными гибридными белками посредством связывания Fc-области антитела с помощью антитело-связывающего домена гибридных белков. Распознавание антигена и связывание посредством антител приводит к перекрестному сшиванию антител, что распространяется как сигнал, через гибридный белок в клетку биосенсора, где внутриклеточный сигнальный домен гибридного белка запускает клеточную активацию. Такая активация затем может быть проанализирована и, при желании, количественно оценена. На основании уровня клеточной активации, можно сделать выводы о наличии антигена в образце. В очень широком смысле, при возникновении клеточной активации с использованием клеток биосенсора по настоящему изобретению, квалифицируют наличие антигена в образце.
[0043] Хотя универсальный антитело-опосредованной биосенсор по настоящему изобретению содержит клеточную линию, стабильно экспрессирующую новый химерный гибридный белок в виде интегрального мембранного белка, отдельные элементы клеток биосенсора включают (i) внеклеточный антитело-связывающий домен гибридного белка, (ii) трансмембранный домен гибридного белка, (iii) внутриклеточный сигнальный домен гибридного белка, и (iv) клеточную линию, которая стабильно экспрессирует гибридный белок на свою поверхность в виде интегрального мембранного белка. Эти элементы обсуждаются в следующих абзацах.
Антитело-связывающий домен
[0044] Химерный гибридный белок по настоящему изобретению содержит внеклеточный антитело-связывающий домен на своем N-конце. Типичные антитело-связывающие домены включают антитело-связывающий домен Fcγ-рецептора (FcγR), такой как, FcγRI или FcγRIII, но не ограничиваются ими. Поскольку различные подтипы FcγR отличаются в их аффинности относительно различных изотипов антител (константных областей), биосенсоры по настоящему изобретению могут различаться в зависимости от идентификации антитело-связывающего домена в гибридном белке. Например, антитело-связывающий домен FcγRI мыши характеризуется высокой аффинностью относительно константных областей IgG2a мыши, а также иммуноглобулина IgG1, IgG3 и IgG4 человека. Антитело-связывающий домен FcγRI мыши связывает изотип IgG2a мыши с очень высокой аффинностью (>108 М-1) [2]. Исследования межвидового связывания продемонстрировали, что FcγRI человека может связывать коммерчески доступные мАт человека, причем связывание IgG1 и IgG3 является более сильным, чем IgG4 [3]. Антитело-связывающий домен FcγRIII мыши характеризуется пониженной аффинностью (3×104-6×105 М-1) относительно константных областей иммуноглобулина IgG1, IgG2a, IgG2b мыши и IgG1, IgG2 и IgG4 человека [3], однако также может быть использован в гибридных белках по настоящему изобретению. Между рецепторами FcγRI и FcγRIII все Ig мыши и человека (за исключением IgG3 мыши) могут связываться с одним из двух Fc-рецепторов. Кроме того, поликлональные антитела могут связываться с этими FcγR рецепторами [4].
[0045] Таким образом, специалисты должны понимать, что в зависимости от конкретного тестируемого агента и конкретных экспериментальных условий, антитело-связывающие домены различных Fcγ-рецепторов будут предпочтительны в различных условиях. Таким образом, настоящее изобретение в целом относится к новым химерным гибридным белкам, содержащим антитело-связывающие домены Fcγ-рецепторов, указанные в настоящем документе, а также к клеточным линиям, стабильно экспрессирующим эти гибридные белки.
[0046] В первом аспекте антитело-связывающий домен Fcγ-рецептора, используемый в химерных гибридных белках, содержит как антитело-связывающий домен, так и трансмембранный домен Fcγ-рецептора. Подходящие антитело-связывающие/трансмембранные домены Fcγ-рецептора включают антитело-связывающий/трансмембранный домен FcγRI мыши, определяемый SEQ ID NO: 1 (где аминокислоты 287-319 соответствуют расчетному трансмембранному домену) и антитело-связывающий/трансмембранный домен FcγRIII мыши, определяемый SEQ ID NO: 2 (где аминокислоты 208-233 соответствуют расчетному трансмембранному домену), но не ограничиваются ими.
[0047] Во втором аспекте антитело-связывающий домен Fcγ-рецептора, используемый в химерных гибридных белках, не содержит трансмембранного домена, например, там где трансмембранный домен гибридного белка получен из альтернативного источника. Подходящие антитело-связывающие домены Fcγ-рецептора, не содержащие трансмембранный домен, которые могут быть использованы в химерных гибридных белках, включают антитело-связывающий домен FcγRI мыши, определяемый SEQ ID NO: 3, и антитело-связывающий домен FcγRIII мыши, определяемый SEQ ID NO: 4, но не ограничиваются ими.
Сигнальный домен
[0048] Химерные гибридные белки по настоящему изобретению содержат внутриклеточный сигнальный домен на своем карбоксильном конце. Подходящие сигнальные домены включают в себя те, которые, как известно, индуцируют клеточную активацию в других контекстах. Например, В-клетки природно трансдуцируют связывание антигена В-клеточным рецептором (BCR) посредством образования комплекса с трансмембранным белком CD79. CD79 состоит из двух отдельных цепей, альфа-иммуноглобулина (Igα) и бета-иммуноглобулина (Igβ), которые образуют гетеродимер на поверхности В-клеток. Igα и Igβ характеризуются внеклеточным доменом, единственный трансмембранный домен и цитоплазматический сигнальный домен. Продемонстрировано, что гибридные белки с внеклеточной и трансмембранной областями белка CD8, гибридизированные внутриклеточными сигнальными областями или Igα или Igβ, характеризуются сигнальной способностью [5]. Другие исследования демонстрируют, что протеинкиназы являются более мощными активаторами гибридного белка CD8/Igα. В этом же исследовании дополнительно продемонстрировано, что при использовании гибридного белка CD8/Igα после перекрестного сшивания CD8 можно наблюдать Са2+-сигнальную активность. На основании указанных исследований в одном аспекте гибридные белки по настоящему изобретению содержат антитело-связывающий домен, гибиридизированный цитоплазматическим сигнальным доменом Igα [6]
[0049] Таким образом, в первом аспекте сигнальные домены, которые могут быть использованы в химерных гибридных белках настоящего изобретения, включают сигнальный домен Igα мыши, определяемый SEQ ID NO: 5, но не ограничиваются им.
[0050] Поскольку аффинность связывания может сильно различаться между гибридным белком и антителами в зависимости от идентификации антитело-связывающего домена, используемого в гибридном белке, и антител, важно иметь альтернативные сигнальные домены, способные обеспечить дополнительные нюансы авидности гибридных белков относительно антител. Например, сигнальные домены могут способствовать перекрестному сшиванию и димеризации. Считается, что расположение двух антитело-связывающих доменов в непосредственной близости увеличивает вероятность максимального перекрестного сшивания. Если антитело-связывающий домен сшит с модифицированной мембрано-ассоциированной молекулой IgG, как и сигнальный домен, может быть достигнута непосредственная близость двух антитело-связывающих доменов. Таким образом, и во втором аспекте, сигнальным доменом является частично мембранный Ig-пептид, содержащий шарнирную область сопровождаемую СН2, СН3, трансмембранной и внутриклеточной областями антитела IgG (см. гибридные белки С и D на Фигуре 1). В конкретном примере такой сигнальный домен определяется SEQ ID NO: 6. Поскольку этот сигнальный домен включает трансмембранную область, он может быть использован в совокупности с антитело-связывающими доменами, не содержащими трансмембранный домен, такими как антитело-связывающий доменом FcγRI, определяемый SEQ ID NO: 3, или антитело-связывающий домен Fcγ RIII, определяемый SEQ ID NO: 4.
Химерные гибридные белки
[0051] При использовании различных комбинаций антитело-связывающих доменов и сигнальных доменов должно быть очевидно, что можно корректировать аффинность гибридных белков относительно конкретного антитела и контролировать уровень клеточной активации. Конкретные примеры химерных гибридных белков, входящих в область изобретения, включают белки, представленные в таблице 1. На фигуре 1 показано схематическое представление каждого из шести гибридных белков.
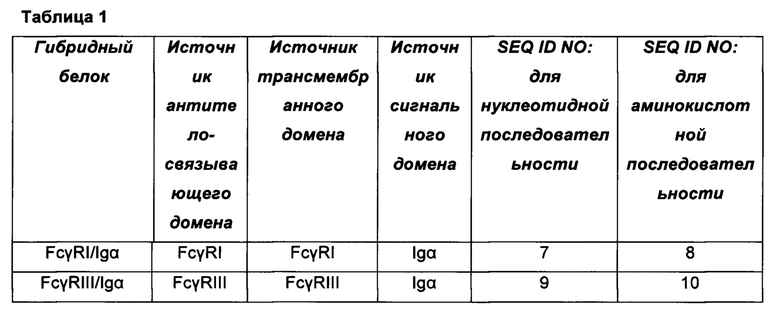
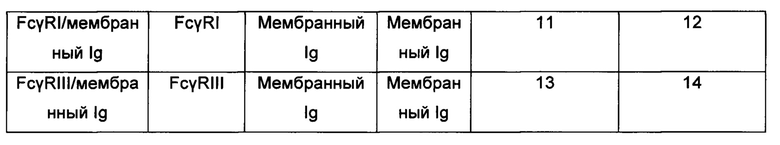
[0052] Таким образом, настоящее изобретение включает гибридный белок FcγRI/Igα, определяемый SEQ ID NO: 8, гибридный белок FcγRIII/Igα, определяемый SEQ ID NO: 10, гибридный белок FcγRI/мембранный Ig, определяемый SEQ ID NO: 22, и гибридный белок FcγRIII/мембранный Ig, определяемый SEQ ID NO: 23.
[0053] Поскольку разные антитело-связывающие домены могут быть сопоставлены с различными сигнальными доменами, следует понимать, что настоящее изобретение также включает гибридные белки, содержащие антитело-связывающий домен FcγRI, определяемый SEQ ID NO: 1 или 3, и гибридные белки, содержащие антитело-связывающий домен FcγRIII, определяемый SEQ ID NO: 2 или 4. Аналогично, настоящее изобретение включает гибридные белки, содержащие сигнальный домен Igα, определяемый SEQ ID NO: 5, и гибридные белки, содержащие сигнальный домен мембранного Ig, определяемый SEQ ID NO:6.
[0054] Специалисту должно быть понятно, что в аминокислотную последовательность гибридных белков по настоящему изобретению могут быть внесены незначительные изменения, не влияющие на связывающую или сигнальную активность белков. Например, незначительные изменения могут быть внесены в антитело-связывающий домен гибридных белков, при соблюдении связывающей активности гибридных белков. Аналогичным образом, незначительные изменения могут быть внесены в сигнальный домен гибридных белков, при соблюдении сигнальной активности гибридных белков. Кроме того, незначительные изменения могут быть внесены как в антитело-связывающий, так и в сигнальный домены гибридных белков, при соблюдении связывающей и сигнальной активности гибридных белков. Такие незначительные изменения могут быть использованы для изменения аффинности антитело-связывающего домена относительно антител, а именно, в некоторых случаях может быть предпочтительна конкретная аффинность связывания (например, низкая, средняя или высокая). Аналогичным образом, такие незначительные изменения могут быть использованы для изменения сигнальной активности сигнального домена в клетке, а именно, в некоторых случаях может быть предпочтителен конкретный вид или уровень активации клеток (например, низкий, средний или высокий).
[0055] Таким образом, настоящее изобретение включает варианты последовательности гибридных белков, раскрытых в настоящем документе, характеризующихся одной или более аминокислотными вставками, делециями и/или заменами, что также сохраняет связывающую и сигнальную активность гибридного белка, на котором они основаны. В частности, настоящее изобретение включает варианты последовательности, характеризующиеся по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичностью последовательности относительно всей протяженности аминокислотной последовательности, определяемой SEQ ID NO: 8, 10, 22 или 23.
[0056] Настоящее изобретение также включает варианты последовательности, содержащие антитело-связывающий домен FcγRI, причем указанный домен характеризуется по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичностью последовательности относительно всей протяженности аминокислотной последовательности SEQ ID NO: 1 или 3.
[0057] Настоящее изобретение также включает варианты последовательности, содержащие антитело-связывающий домен FcγRIII, причем указанный домен характеризуется по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичностью последовательности относительно всей протяженности аминокислотной последовательности SEQ ID NO: 2 или 4.
[0058] Настоящее изобретение дополнительно включает варианты последовательности, содержащие сигнальный домен Igα, причем упомянутый домен характеризуется по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичностью последовательности SEQ ID NO: 5 относительно всей протяженности аминокислотной последовательности.
[0059] Настоящее изобретение дополнительно включает варианты последовательности, содержащие сигнальный домен мембранного Ig, причем упомянутый домен характеризуется по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичностью последовательности SEQ ID NO: 6 относительно всей протяженности аминокислотной последовательности.
Полинуклеотид
[0060] Настоящее изобретение включает полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие каждый из гибридных белков, приводимых в настоящем документе, а также их комплементарные цепи. Настоящее изобретение также включает клонирующие векторы, содержащие полинуклеотиды, и клетки-хозяева, содержащие или полинуклеотиды или экспрессирующие векторы. Такие клетки-хозяева могут являться клетками млекопитающих или организмов, не являющихся млекопитающими, включая Е. coli и клетки насекомых, но не ограничиваются ими. Кроме того, настоящее изобретение включает способы получения гибридных белков, описанные в настоящем документе, содержащие культивирование клеток-хозяев в условиях, способствующих экспрессии гибридных белков, кодированных полинуклеотидами и экспрессирующими векторами, и выделение гибридных белков из клеток или клеточных культур.
Конструкты, кодирующие гибридные белки
[0061] Выполнено клонирование и подтверждение последовательностей относительно мышиных FcγRI (SEQ ID NO: 15) и FcγRIII (SEQ ID NO: 16). Нуклеотидные конструкты, кодирующие химерные гибридные белки, могут быть получены путем экспрессии гибридных белков посредством сконструированной последовательности, кодирующей антитело-связывающий, трансмембранный и сигнальный домены в экспрессирующий вектор. Например, антитело-связывающий и трансмембранный домены FcγR-рецепторов могут быть гибридизированы в рамке считывания последовательности, кодирующей сигнальный домен, например, посредством "SOEing" с помощью ПЦР [15]. Для укомлектования конструкта в случаях, когда требуется FcR-γ цепь (рассматривается ниже), С-конец сигнального домена и N-конец FcR-γ цепи могут быть присоединены посредством ПЦР к последовательности, кодирующей пептид 2А. Для конструирования FcγR-мембранный Ig конструктов могут быть использованы сайты рестрикции на С-конце последовательности FcγR для связывания с константными областями Ig, содержащими совместимые сайты рестрикции на N-конце.
[0062] Полинуклеотидные конструкты, кодирующие гибридные белки по настоящему изобретению, могут быть транзиентно или стабильно экспрессированы в выбранную клеточную линию. Конструкты могут быть трансфицированы в выбранную клеточную линию с помощью методик, хорошо известных квалифицированным специалистам, включая стандартные наборы для трансфекции (например, системы электропорации Fugene® или Neon™) или способы ретровирусной трансдукции, но не ограничиваются ими.
[0063] Экспрессию гибридного белка на поверхности клетки также можно подтвердить с помощью стандартных методик, хорошо известных квалифицированным специалистам, включая окрашивание антителами относительно или FcγRI или FcγRIII с флуоресцентной меткой и с помощью проточно-цитометрического анализа.
[0064] Подходящие экспрессирующие векторы включают плазмиды pcDNA 3.1 + или - (гигромицин), pcDNA 3.1 + или - (неомицин), pdisplay (Puro), pIRES (неомицин), pIRES Puro2, pQCXIP (puro), pQCXIN (неомицин) и pQCXIH (гигромицин), но не ограничиваются ими.
[0065] Поскольку экспрессирующие векторы могут совместно кодировать гибридные белки и FcRγ-цепь в одной непрерывной последовательности, кодирующая последовательность может находиться под контролем одного промотора. В качестве альтернативы, экспрессирующие векторы могут кодировать гибридные белки и FcRγ-цепь под контролем отдельных промоторов.
Клетки
[0066] Клеточные линии, которые могут быть использованы для экспрессии гибридных белков по настоящему изобретению, и, таким образом, выступать в качестве клеток биосенсора по настоящему изобретению, ограничены только тем, что они могут стабильно экспрессировать гибридные белки на поверхности клетки в виде интегрального мембранного белка и что активация сигнального домена может быть обнаружена. Подходящие клеточные линии включают лимфоциты и нелимфоидные клетки, но не ограничиваются ими.
[0067] Таким образом, настоящее изобретение включает клетки, стабильно экспрессирующие на своей поверхности один или более гибридный белок из указанных в настоящем документе. В некоторых случаях в настоящем документе эти клетки обозначены термином «клетки биосенсора». В конкретных вариантах воплощения настоящее изобретение включает клетки биосенсора, стабильно экспрессирующие на своей поверхности один или более гибридный белок FcγRI/Igα, определяемый SEQ ID NO: 8, гибридный белок FcγRIII/Igα определяемый SEQ ID NO: 10, гибридный белок FcγRI/мембранный Ig, определяемый SEQ ID NO: 22, гибридный белок FcγRIII/мембранный Ig, определяемый SEQ ID NO: 23, и вариантом последовательности, характеризующимся по меньшей мере 95% идентичностью последовательности относительно всей протяженности SEQ ID NO: 8, 10, 22, или 23. Клетками, используемыми для получения клеток биосенсора, могут быть любые клетки, указанные в настоящем документе.
Лимфоциты
[0068] Лимфоциты, экспрессирующие гибридный белок CD8/Igα, были использованы для демонстрации того, что перекрестное сшивание с антителом анти-CD8 стимулирует высвобождение внутриклеточного Са2+ и фосфорилирование Igα как в В-, так и в Т-клетках [5, 6, 10]. В-клеточные линии мыши и человека, обычно характеризующиеся сигнальной активностью за счет эндогенного Igα/Igβ пути, особенно полезны при экспрессии гибридных белков, описанных в настоящем документе. Подходящие В-клеточные линии, которые можно использовать при получении клеток биосенсора, включают клеточные линии Ramos, Raji, IIAI.6 и С604, но не ограничиваются ими. Другие подходящие В-клеточные линии включают А20 и LK 35.2.
[0069] Надлежащую экспрессию конструктов, кодирующих любой из гибридных белков по настоящему изобретению, можно подтвердить с помощью антител с флуоресцентной меткой и проточной цитометрии. Клетки могут быть клонированы с использованием ограничивающего разбавления и выбраны для последующего изучения на основании их проточно-цитометрических профилей экспрессии.
[0070] Некоторые В-клеточные линии экспрессируют ингибиторный рецептор FcγIIb, в то время как другие, например, клетки Ramos и IIA1.6 В клетки, не экспрессируют белок на свои поверхности клеток [11, 12]. Если ингибиторная активность рецептора FcγIIb создает проблемы для конкретной клеточной линии, могут быть использованы конструкты миРНК для стабильного ингибирования экспрессии FcγRIIb в клетках [13] или технология CRISPR/Cas9 для нокаута гена FcγRIIb в этих клеточных линиях [14].
[0071] Т-клетки, экспрессирующие CD8, гибридизированный сигнальным доменом Igα, высвобождают Са2+ после перекрестного сшивания с антителами анти-CD8 [5], что указывает, что сигнальный механизм в Т-клетках также может функционировать посредством Igα. Таким образом, гибридные белки по настоящему изобретению, также могут быть экспрессированы в Т-клетках мыши или человека. Подходящие Т-клеточные линии, которые могут быть использованы при получении клеток биосенсора, включают клеточные линии Jurkat, DO-11.10 и BW5147, но не ограничиваются ими. Моноциты (например, U937 клеточная линия), макрофаги, миобласты (например, KG! клеточная линия) и эритробласты (например, К562 клеточная линия), экспрессирующие гибридные белки, также могут быть использованы в качестве клеток биосенсора. Поскольку эти клетки не экспрессируют FcγR природным способом, ингибирование, вызванное ингибиторным FcγRIIb, должно отсутствовать. Надлежащая экспрессия также может быть определена с использованием флуоресцентно меченной мАт относительно FcγR с помощью проточной цитометрии.
Нелимфоидные клетки
[0072] Существует большое количество разработанных и хорошо изученных нелимфоидных клеточных линий, широко используемых в испытаниях, связанных с экспрессией на поверхности клеток выбранных белков, таких как НЕК293, СНО, Р815, К562 и Cos-1. Эти клеточные линии обычно используются для экспрессии чужеродных белков, поскольку в этих клетках легко установить стабильную экспрессию, и их характеристики роста хорошо определены. Однако нелимфоидные клетки не в состоянии экспрессировать гамма-цепь FcR (FcRγ-цепь), которая является вторичным белком, эксперссированным в Fcγ рецептор экспрессирующих клеток. FcRγ-цепь требуется для сигнализации Fcγ-рецептора [7]. Хотя нелимфоидные клетки не экспрессируют FcRγ-цепь, такие клетки все же могут служить превосходными кандидатами для экспрессии гибридного белка и использования в качестве клеток биосенсоров по настоящему изобретению, если они сконструированы для совместной экспрессии FcRγ-цепи.
[0073] Нелимфоидные клетки можно сконструировать для экспрессии FcRγ-цепи с помощью методик, хорошо известных квалифицированным специалистам. Одна из подходящих методик состоит во включении гена, кодирующего FcRγ-цепь в конструкты, кодирующие гибридные белки по настоящему изобретению, в которых две кодирующие последовательности находятся под контролем одних и тех же или отдельных промоторов. Другая походящая методика заключается в экспрессии гибридного белка и FcRγ-цепи под контролем одного и того же промотора. В частности, в конструкты, кодирующие гибридные белки, могут быть добавлены два дополнительных элемента. Первый элемент является самой FcRγ-цепью (SEQ ID NO: 25). Поскольку FcRγ-цепь должна принимать правильную конформацию в клеточной мембране, она не может быть частью гибридного белка. Второй элемент решает эту проблему, поскольку он является сконструированным пептидом 2А, легко расщепляемым пептидом, впервые описанным в составе вируса ящура [8]. В тешовирусе свиней обнаружен вариант исходного пептида 2А, более эффективно расщепляемый в целом ряде протестированных клеток [9], используемых в настоящем документе (SEQ ID NO: 24). Таким образом, FcRγ-цепь может быть получена в нелимфоидных клетках с использованием сконструированных конструктов, кодирующих гибридные белки по настоящему изобретению и содержащих последовательность пептида 2А после С-конца сигнального домена и после FcRγ-цепи (см. конструкты Е и F на Фиг. 1).
[0074] Нелимфоидные клеточные линии, которые могут быть использованы при продуцировании клеток биосенсора по настоящему изобретению, включают клеточные линии НЕК293, СНО, Р815, К562 и Cos-1, но не ограничиваются ими.
Антитела
[0075] Как очевидно из обсуждения в настоящем документе, идентификация антитела, которое может быть использовано с клетками биосенсора по настоящему изобретению при выявлении агентов-мишеней, ограничиваются только тем, что (I) антитело может быть связано гибридными белками по настоящему изобретению и (II) антитело может связываться с агентом-мишенью. После выбора конкретного агента-мишени для выявления легко определить, доступно ли для приобретения антитело, обладающее специфичностью связывания относительно этого агента. Если это не так, антитело с необходимой специфичностью связывания можно получить с использованием стандартных способов.
[0076] Очевидно, что антитела могут быть моноклональными или поликлональными. Антитела могут быть рекомбинантными. Подходящие антитела также включают фрагменты, сохраняющие специфичность связывания антитела, из которого они получены, такие как, Fab-фрагменты, F(ab')2-фрагменты и одноцепочечные Fv (ScFv) антитела, но не ограничиваются ими.
[0077] Антитела могут быть конъюгированы с детектируемыми метками, включающими фермент (например, пероксидазу, щелочную фосфатазу, глюкозоооксидазу), металл (например, золото, применяемое в электронной микроскопии), флуоресцентный маркер (например, применяемый в иммунофлуоресценции и проточной цитометрии, включая CYE-красители, флуоресцеинизотиоцианат, родамин, фикоэритрин, фикоцианин, аллофикоцианин, о-фталевый альдегид и флуорескамин), флуоресцентные металлы (например, 152Eu), радиоактивный маркер (например, радиоизотопы для диагностических целей, в том числе 3Н, 131I, 35S, 14С и 125I), хемилюминесцентный маркер (например, люминол, люциферин, изолюминол, тероматический сложный эфир акридиния, имидазол, соли акридиния и сложный эфир оксалата), и белковый маркер (например, биотин, фикобилипротеин, с-Мус, НА, VSV-G, HSV, FLAG, V5 или HIS/), но не ограничиваются ими.
[0078] Антитела могут также быть конъюгированы или покрыты фрагментами, которые могут быть использованы для изоляции/отделения антител от образца после воздействия на них агента-мишени. Такие фрагменты включают магнитные гранулы, гранулы агарозы и полистироловые гранулы различного диаметра, но не ограничиваются ими.
Образцы
[0079] Образцы, которые могут быть подвергнуты скринингу на наличие агента-мишени, ограничены аналогичным образом только тем, что они позволяют антителу связывать агент-мишень, присутствующий в образце. Подходящие образцы включают образцы воздуха, образцы жидкости, образцы сухого вещества, образцы растительного происхождения и биологические образцы, но не ограничиваются ими. Подходящие образцы воздуха включают аэрозоль, образец атмосферного воздуха, воздух, нагнетаемый вентилятором, и выхлопные газы, но не ограничиваются ими. Подходящие образцы жидкости включают продукты питания, напиток, образец воды, образец лекарственной формы и продукт для личной гигиены, но не ограничиваются ими. Подходящие образцы сухого вещества включают продукты питания, почву, образец лекарственной формы, образцы солюбилизированных мазковых проб и продукт для личной гигиены, но не ограничиваются ими. Подходящие образцы растительного происхождения включают листья, фрукты, орехи, семена, цветки и ткани растений, но не ограничиваются ими. Подходящие биологические образцы включают кровь, сыворотку, пот, мочу, спинномозговую жидкость, слизь, сперму, кал, смыв бронхоальвеолярный лаважа и ткань, но не ограничиваются ими.
Агенты
[0080] Биосенсоры по настоящему изобретению могут быть использованы для выявления широкого спектра различных агентов-мишеней. Для квалифицированного специалиста очевидно, что единственным ограничением касательно агента-мишени является возможность связывания агента антителом. Агенты-мишени включают агенты биологического происхождения, такие как, агенты биологического оружия, аллергены, паразитарные антигены, грибковые антигены, вирусные антигены, бактериальные антигены, клеточные антигены и антитела, но не ограничиваются ими. Типичные агенты биологического оружия включают рицин, споры сибирской язвы, ботулинический токсин, токсин Clostridium perfringens, сакситоксин и трихотеценовые микотоксины, но не ограничиваются ими. Типичные аллергены включают лесные орехи, арахис и перхоть животных, но не ограничиваются ими. Типичные клеточные антигены включают антигены, ассоциированные с заболеванием или состоянием субъекта, например, человека, примата или другого млекопитающего, например, скота или домашнего животного, например, собаки или кошки, но не ограничиваются ими. Агенты-мишени также включают агенты растительного происхождения и агенты, полученные из сельскохозяйственных культур, водных патогенов или болезнетворных агентов, медикаментов и других химических соединений, и молекулы, присутствующие в окружающей среды, например, токсины и загрязняющие вещества, но не ограничиваются ими.
Выявление клеточной активации
[0081] Клетки биосенсора по настоящему изобретению могут быть использованы в тестировании на выявление и, в некоторых случаях, количественной оценки агента-мишени в образце. Как описано выше, в результате связывания агента антителами и связывания антитела гибридными белками, экспрессируемыми клетками биосенсора, на поверхности клетки происходит перекрестное сшивание, и сигнальный домен гибридного белка транслирует данное связывание как сигнал активации внутри клетки. В качестве примера, взаимодействие антиген-содержащего образца с антителом на внеклеточной поверхности биосенсора приводит к активации внутриклеточного сигнального каскада.
[0082] In vivo рецепторы антигена (мембраносвязанного Ig) В-клетки нековалентно ассоциированы с дисульфидно-связанным трансмембранным гетеродимером белков Igα и Igβ [16]. После перекрестного сшивания рецептора В-клетки в результате связывания антигена некоторые белки, включая Igα и Igβ, фосфорилируются на остатках тирозина посредством протеинкиназы [17, 18]. Одним из первых событий после фосфорилирования является высвобождение Са2+ из внутриклеточных хранилищ, за которым следует притоком экзогенного Са2+ через Са2+-каналы в мембрану клетки [19]. Такое изменение уровней внутриклеточного кальция является одним из видов клеточной активации, рассматриваемых в настоящем документе, который может быть протестирован. Изменения уровня внутриклеточного Са2+ легко выявлено в клетках с помощью различных флуоресцентных химических соединений, которые могут быть эффективно введены в клетки.
[0083] Ввиду важности Са2+ в биологии, разработаны многочисленные методики анализа клеточной активности Са2+, которые могут быть использованы при тестировании клеточной активации в клетках биосенсора по настоящему изобретению. Популярным способом является использование флуоресцентных химических индикаторных зондов Сa2+, поскольку их сигнал достаточно велик для изменения концентрации внутриклеточного Сa2+ по сравнению с индикаторами другого типа [20]. Например, клеточная активация может быть отслежена и протестирована в клетках биосенсора по настоящему изобретению, посредством наполнения клеток биосенсора Fluo-4AM метиловым эфиром Fluo-4, которое является чувствительным нерациометрическим соединением, используемым для измерения концентрации Са2+ в живых клетках [21]. Мембрана непроницаема для большинства химических флуоресцентных индикаторов. Однако метиловые сложноэфирные формы Fluo-4 могут пассивно диффундировать через плазматическую мембрану, и после их проникновения в клетку внутриклеточные эстеразы отщепляют метиловую сложноэфирную группу от зонда, что приводит к образованию зонда, неспособного к проникновению в мембрану. Еще одним альтернативным зондом для применения с клетками по настоящему изобретению является Fura 2, который представляет собой индикатор Сa2+ с УФ-возбуждением, обеспечивающий рациометрическое измерение Сa2+. После связывания агента-мишени антителами сигнал передается сигнальному домену клеток биосенсора, что запускает указанные изменения в уровнях Сa2+, что, в свою очередь, может быть протестировано и/или количественно оценено с помощью спектрометра, для измерения изменений в клеточной флуоресценции.
[0084] Кроме того, Сa2+-связывающие фотолюминисцентные белки могут генерировать биолюминесценцию, которая продуцирует свет за счет биологических процессов. Некоторые Сa2+-связывающие фотолюминисцентные белки (например, экворин, обелин, митрокомин и клитин) использовались для измерения внутриклеточной концентрации Сa2+ [24], и каждый из них может быть использован с клетками биосенсора по настоящему изобретению для оценки изменений клеточной активации. Люминесценция этих фотолюминисцентных белков в результате связывания Сa2+ возникает в видимой области спектра, что обеспечивает простоту с точки зрения аппаратуры или выявления, и не зависит от фотообесцвечивания.
[0085] Следует отметить, что хотя связывание агента-мишени (т.е. клеточная активация), основана на определении изменений в уровнях Сa2+ в клетках, соответствует примерам в настоящем документе для оценки изменений при связывании агента-мишени могут быть использованы другие средства, включая люминесценцию с использованием фотолюминисцентных белков.
III. Примеры
Пример 1: Продукция и экспрессия конструктов, кодирующих гибридные белки
[0086] Получены доступные для приобретения кДНК FcγRI и Igα мыши. ПЦР-праймеры, обеспечивающие перекрытия последовательностей этих двух генов, используют для сшивания этих двух последовательностей с образованием гибрида FcγRI/Igα в рамке считывания, что подтверждено с помощью анализа последовательности. В качестве альтернативы, антитело-связывающий и/или трансмембранный домены FcγRI амплифицируют с использованием праймеров из кДНК, кодирующей рецептор, а внутриклеточный сигнальный домен Iga амплифицируют аналогичным образом.
[0087] Амплифицированные фрагменты очищают в геле. Продукты амплификации (например, FcγRI и Igα) смешивают и денатурируют посредством кипячения в течение 5 минут и размещают при комнатной температуре на 30 минут до амплификации для получения последовательности, кодирующей полноразмерные гибридные белки. Эти последовательности очищают в геле и клонируют в экспрессионный вектор, содержащий подходящий промотор (например, плазмида для экспрессии кДНК в клетках млекопитающих), трансфицируют в выбранные клеточные линии с использованием липофектамина LX или другого подходящего трансфекционного реагента, и селектируют с использованием подходящего селективного маркера. Отдельные клоны секвенируют для подтверждения того, что надлежащий гибридный белок был экспрессирован. Надлежащую поверхностную экспрессию гибридных белков определяют с помощью меченых антител к Fc-рецептору (например, посредством окрашивания антителом к CD64) и проточной цитометрии. Типичный конструкт, кодирующий гибридный белок FcγRI-Igα, представляет собой конструкт, кодирующий антитело-связывающий и трансмембранный домены FcγRI (SEQ ID NO: 19) и последовательность, кодирующую сигнальный домен Igα (SEQ ID NO: 21) в направлении от 5' к 3'.
[0088] Еще один типичный конструкт, кодирующий гибридный белок FcγRIII-Igα, представляет собой конструкт, кодирующим антитело-связывающий и трансмембранный домены FcγRIII (SEQ ID NO: 20) и последовательность, кодирующую внутриклеточный сигнальный домен Igα (SEQ ID NO: 21) в направлении от 5' к 3'. Коммерчески полученные ПЦР-праймеры кДНК FcγRIII и кДНК Igα мыши, обеспечивающие перекрытия этих двух генов, были использованы для сшивания этих двух последовательностей. Полученный продукт является гибридом FcγRIII/Igα в рамке считывания, что было подтверждено анализом последовательности.
[0089] Альтернативный подход был использован для комбинирования рецепторов FcγR с пептидом 2А и FcRγ-цепью для получения конструктов, показанных в виде конструктов Е и F на Фиг. 1. ПЦР-амплификацию с удлинением перекрытия используют для гибридизации последовательности 2А с FcRγ-цепью; и сайты рестрикции размещают на концах кДНК 2А и FcRγ-цепи. Используя ПЦР амплифицировали как кДНК FcγRI, так и FcγRIII с праймерами, содержащими на своих концах сайты рестрикции, которые могут быть использованы для связывания FcγR с сайтом 2А и для последующего клонирования в экспрессирующий вектор. ДНК расщеплен рестрикционной эндонуклеазой, продукты элюируют от геля. Фрагменты лигируют и клонируют в экспрессирующий вектор и секвенируют.
[0090] В следующих примерах представлены некоторые из случаев, в которых клетки универсального биосенсора по настоящему изобретению могут быть применены на практике. Эти примеры лишь небольшая подгруппа возможных путей, при которых данный биосенсор может быть использован. Биосенсор легко адаптировать для одно- или многолуночных форматов тестирования. Следует отметить, что комбинацию клеточной линии, конструкта и индикатора Са2+ можно изменять в зависимости от исследуемого агента, антигена или патогена и доступности изотипов антитела; может потребоваться эмпирическое определение данной комбинации.
Пример 2: Выявление вируса растения в образцах листьев или корней
[0091] Возбудители вирусных или бактериальных заболеваний растений вызывают большую озабоченность так как инфекции и как следствие потери продовольственных и кормовых культур, влияют на экономику и продовольственную безопасность. Поэтому важно наличие реально действующих тестов, способных выявить как обычные, а также возникающие патогены растений для содействия в управлении растениеводческими хозяйствами и мониторинге импортированных сельскохозяйственных культур. Описан анализ культурных растений на сельскохозяйственной ферме.
[0092] Выполнен сбор листьев или корней исследуемого растения. Образцы тщательно измельчают для высвобождения вирусных частиц, содержащихся в образце. Затем с матрицей образца смешивают магнитные гранулы, покрытые доступными для приобретения вирус-специфическим антителом, для забора вирусных частиц (например, агентов-мишеней). Гранулы могут быть магнитносепарируемыми от образца растения, тщательно промыты и инкубированы с клетками универсального биосенсора по настоящему изобретению.
[0093] Например, можно использовать клетки Ramos В, экспрессирующие или FcγRI/Igα или FcγRIII/Igα гибридный белок из конструкта, также кодирующего FcRγ-цепь (т.е. конструктов Е и F на Фиг. 1). Выбранные клетки биосенсора выращивают до высокой плотности (приблизительно 106 клеток/мл) и с замещением среды роста осмотически сбалансированным солевым раствором (т.е. HBSS, PBS), не содержащим фенолового красного. Клетки загружают приблизительно на 30-60 минут в раствор Fluo-4 AM (приблизительно 2-9 мкМ) в присутствии пробенецида (приблизительно 1-2,5 мМ). Пробенецид используют для минимизации утечки индикатора из клеток. Клетки тщательно промывают для удаления остаточного индикатора Са2+. Приблизительно 1-5×106 Fluo-4 AM загруженных клеток в небольшом объеме HBSS с пробенецидом переносят в множество лунок 96-луночного планшета с темными боковыми сторонами. Затем планшет с клетками вставляют в флуоресцентный планшет-ридер.
[0094] Несколько лунок, содержащих загруженные клетки, оптически измеряют при длине волны 535 нм в течение короткого периода времени, чтобы установить уровень исходной фоновой флуоресценции. Чтобы убедиться, что клетки загружены с Fluo-4 AM, в эти лунки добавляют фармакологические соединения (т.е. АТФ в концентрации приблизительно 100-200 мкМ, карбахол в концентрации приблизительно 30-60 мкМ или иономицин в концентрации приблизительно 0,1-2 мкМ), чтобы стимулировать увеличения внутриклеточных уровней Сa2+. Другие контроли, такие как использование антител FcγR с перекрестно сшивающим вторичным антителом с тем же успехом используют для подтверждения индикатора загрузки.
[0095] После подтверждения загрузки Fluo-4 лунки, содержащие загруженные клетки, инкубируют с доступным для приобретения вирус-специфическим антителом (изотипа, совместимого с используемым конструктом, и предпочтительно отличающегося от используемого для забора гранул) приблизительно в течение 30-60 минут. Затем к клеткам добавляют серию разведений покрытых вирусом гранул для забора, и измеряют изменения флуоресценции в течение нескольких минут. Для гарантии специфичности сигнала клетки также тестируют как с применением положительных (добавление заданного вирус-содержащего раствора) контролей, так и отрицательных контролей (добавление аналогичного раствора без вируса, или добавление раствора нерелевантного антигена, не способного вступать в перекрестную реакцию). Увеличение клеточной флуоресценции указывает на наличие выбранного вируса в образце. В некоторых случаях величина изменения клеточной флуоресценции коррелирует с количеством выбранного вируса, присутствующего в образце, что обеспечивает количественную оценку вируса в образце.
Пример 3: Выявление Salmonella в образцах смывов
[0096] Salmonella spp. является одним из наиболее распространенных пищевых патогенов и может вызывать серьезное заболевание сальмонеллезом, иногда со смертельным исходом, у детей младшего возраста, пожилых людей и других пациентов с ослабленной иммунной системой. Поскольку заражение Salmonella возникает при контакте с зараженными фекалиями животных или человека, заражению может подвергаться широкий спектр продуктов - от яиц и мясных продуктов до плодоовощных продуктов и воды. Современные способы выявления Salmonella включают ПЦР или использование бактериальных культур, которые требуют значительного времени и специальных знаний. Поэтому для контроля качества продуктов питания в целях предотвращения вспышек и отзывов продуктов желателен анализ, обеспечивающий простое, быстрое выявление. Описано тестирование Salmonella на предприятии по переработке куриных яиц.
[0097] Образцы мазковых проб получают с рабочих поверхностей в пределах предприятия и внешней скорлупы яиц. Затем мазки замачивают в биосовместимом растворе для выделения Salmonella в матрицу образца, который может быть непосредственно протестирован с помощью универсального биосенсора. В данном примере клетки С604 В, экспрессирующие гибридные белки FcγRI/мембранного Ig или FcγRIII/мембранного Ig (см. конструкты С и D на фиг. 1), используют в качестве клеток биосенсора по настоящему изобретению. Клетки С604, являющиеся В-клетками, будут характеризоваться эндогенным Igα и Igβ для обеспечения сигнальных возможностей.
[0098] Клетки С604 выращивают до высокой плотности (приблизительно 106 клеток/мл) и заменяют среду на HBSS, не содержащий феноловый красный. Клетки погружают приблизительно на 30-60 минут в раствор Fluo-4 AM (приблизительно 1-5 мкМ) в присутствии пробенецида (приблизительно 1-2,5 мМ). Клетки тщательно промывают для удаления остаточного индикатора Са2+. 1-5×106 клеток с Fluo-4 в небольшом объеме HBSS с пробенецидом переносят в множество лунок 96-луночного планшета. Планшет вводят в флуоресцентный планшет-ридер и устанавливают уровень исходной фоновой флуоресценции. В подгруппу лунок, содержащих клетки, добавляют анти IgM мыши (в концентрации приблизительно 5-7 нг/мкл), чтобы стимулировать отклик Сa2+ в качестве положительного контроля. Другие контроли используют для подтверждения загрузки а именно, использование антител анти-FcγRI с вторичным перекрестно сшивающим агентом антитела.
[0099] Доступное для приобретения антитело анти-Salmonella (изотипа, совместимого с FcγRI или FcγRIII) инкубируют с клетками в течение 30-60 минут. Затем к клеткам добавляют серию разбавлений Salmonella содержащего образца, и измеряют изменения уровня флуоресценции в течение 1-2 минут. Чтобы убедиться в специфичности сигнала, клетки также тестируют как с применением как положительных контролей, так и отрицательных контролей. Увеличение уровня клеточной флуоресценции указывает на наличие Salmonella в образце. В некоторых случаях величина изменения в клеточной флуоресценции коррелирует с количеством Salmonella, присутствующим в образце, что обеспечивает количественную оценку Salmonella в образце.
Пример 4: Выявление Listeria в образцах продуктов питания
[00100] Listeria (т.е. L. monocytogenes) является пищевым патогеном, вызывающим листериоз - серьезное бактериальное заболевание с приблизительно 20% смертностью, и наиболее опасно для беременных женщин, младенцев и лиц с ослабленной иммунной системой. Listeria может заражать продукты из сырого мяса, плодоовощные и молочные продукты, а также готовые пищевые продукты. Таким образом, в целях предотвращения вспышек возбудителя и отзывов продуктов желательно иметь возможность выявления этих бактерий и отслеживания их присутствия. Описано использование клеток универсального биосенсора для выявления Listeria на мясоперерабатывающих заводах, производящих готовые продукты питания (т.е. гастрономические мясные продукты и хот-доги).
[00101] Как аналогичным образом описано в примере 3, с целью отслеживания потенциального заражения продуктов и для оценки эффективности обеззараживающих процедур мазки с рабочих поверхностей и оборудования на заводе получают до, во время и после переработки мяса. Кроме того, образцы переработанного мяса могут быть протестированы. Образцы гомогенизируют в PBS и смешивают с микроскопическими магнитными гранулами, покрытыми доступным для приобретения Listeria-специфическим антителом. Гранулы связывают любые Listeria, присутствующие в образце; их магнитносепарируют от образца, тщательно промывают и добавляют к полученным универсальным биосенсорам.
[00102] Клетки COS-1, стабильно экспрессирующие гибридные белки или FcγRI/Igα или FcγRIII/Igα вместе с FcR-γ-цепью и биолюминесцентным фотолюминесцентным белком экворином используют в качестве клеток биосенсора и выращивают до высокой плотности (приблизительно 106 клеток/мл). Клетки инкубируют с приблизительно 2-8 мкМ коэлентеразина (обязательный субстрат экворина) на период 5-16 часов. После тщательной промывки с целью удаления избытка коэлентеразина клетки помещают во множество лунок 96-луночного планшета. Затем клетки инкубируют с доступным для приобретения Listeria-спецефическим антителом (изотипа, совместимого с используемым конструктом, и предпочтительно отличающегося от антитела, использованного в гранулах для забора) в течение 30-60 минут. Планшет вводят в люминесцентный планшет-ридер и измеряют уровень исходной фоновой люминесценции. Подтверждение успешной загрузки коэлентеразина и реактивность Сa2+ получают путем добавления 0.15-100 мкМ АТФ. После этого гранулы для забора, покрытые Listeria, добавляют к клеткам в различной степени разбавления и регистрируют изменения сигнала люминесценции в течение 1-2 минут. Увеличение уровня люминесценции указывает на наличие Listeria в образце. В некоторых случаях величина изменения уровня люминесценции коррелирует с количеством Listeria, присутствующим в образце, что обеспечивает количественную оценку Listeria в образце.
Пример 5: Выявление спор В. anthracis в образцах воздуха
[00103] Сибирская язва это быстро развивающееся смертельное заболевание, вызванное спорами бактерии Bacillus anthracis. Бактерия естественной почвы, может передаваться через контакт с зараженным мясом животных, содержавшихся на выгонах, а также с необработанными шкурами и шерстью животных. В последнее время разработаны способы применения В. anthracis в качестве оружия для использования в бактериологической войне и для террористических актов. В связи с этим важное значение имеет надежное и быстрое обнаружение спор В. anthracis. Тестовые образцы могут быть получены путем взятием мазков в зонах подозреваемых на заражение или посредством суспендирования подозрительных порошков непосредственно в PBS для анализа в растворе. Альтернативно, образцы аэрозоля могут быть собраны в зонах подозреваемых на заражение и частицы могут быть сконцентрированы на поверхности и подвергнуты взаимодействию с клетками универсального биосенсора. Подходящее устройство отбора проб аэрозолей (BioFlash Е) выпускает компания PathSensors, Inc.
[00104] В данном примере в качестве клеток биосенсора используют клетки Jurkat, Т-клеточную линию человека, экспрессирующие гибридные белки FcγRI/Igα или FcγRIII/Igα и FcRγ-цепь. В клетки вводят индикатор Са2+ Indo-1 (приблизительно 1-5 мкМ) на период 30-60 минут. После тщательной промывки клетки инкубируют с доступными для приобретения В. Anthracis-специфическими антителами (изотипа, совместимого с используемым конструктом) и загружают в камеру внутри аппарата для пробоотбора аэрозоля. Устанавливают уровень исходной фоновой флуоресценции при длине волны 405 нм. Подтверждение успешной загрузки индикатора Сa2+ получают путем добавления приблизительно 1-5 мкг/мл иономицина. Затем воздух из контролируемой зоны пропускают через аппарат и твердые частицы концентрируются на внутренней поверхности. Затем на тестируемую поверхность выводят биосенсоры для связывания любых спор в. anthracis, которые могут быть в наличии. Изменения сигнала флуоресценции при длине волны 405 нм регистрируют в течение 1-2 минут. Увеличение клеточной флуоресценции указывает на наличие сибирской язвы в образце. В некоторых случаях величина изменения в клеточной флуоресценции коррелирует с количеством спор сибирской язвы, присутствующих в образце, что обеспечивает количественную оценку сибирской язвы в образце.
[00105] Несмотря на то, что настоящее изобретение описано со ссылкой на некоторые конкретные варианты его воплощения, специалистам в данной области техники должно быть понятно, что различные изменения могут быть внесены без отступления от существа и объема настоящего изобретения. Сущность прилагаемой формулы изобретения не должна быть ограничена конкретными описанными вариантами воплощения.
ССЫЛКИ
[00106] Все патенты и публикации, упомянутые в настоящем описании изобретения, указывают на уровень специалистов в той области, к которой относится настоящее изобретение. Каждый процитированный патент и публикация полностью включены в настоящий документ посредством ссылки. Все нижеследующие источники цитируются в настоящей заявке:
1. Rider, TH, Petrovick, MS, Nargi FE, et al., (2003) А В Cell-Based Sensor for Rapid Identification of Pathogens Science 301:213-215.
2. Unkless JC, Eisen HN,. 1975. Binding of monomeric immunoglobulin to Fc receptors of mouse macrophages. J Exp Med 142:1520-1533.
3. RavetchJV, Kinet J. Fc receptors. (1991) Ann Rev. Immunol 9:457-492.
4. Antonsson, A and Hugo PJ. (2001) Binding of human and animal immunoglobulins to the IgG Fc receptor induced by human cytomegalovirus J. Gen Virol 82:1137-1145.
5. Taddie, JA, Hurley, TR, Hardwick, BS, Sefton, BM. (1994) Activation of B- and T-cells by the cytoplasmic domains of the B-cell antigen receptor proteins Ig-α and Ig-β. J Biol. Chem. 269:13529-13535.
6. Kim, KM, Alber G, Weiser P, Reth M. (1993) Differential signaling through the Ig-alpha and Ig-beta components of the В cell antigen receptor. Eur. J. Immunol. 23:911.
7. Gibbins JM, Okuma M, Farndale R, Barnes, M, Watson, SP. (1997) Glycoprotein VI is the collagen receptor in platelets which underlies tyrosine phosphorylation of the Fc receptor γ-chain. FEBS Lett. 413, 255-259.
8. Ryan, MD, King, AM, Thomas, GP. (1991) cleavage of the foot -and mouth- disease virus polyoprotein is mediated by residues within a 19 amino acid sequence. J. Gen Virol 72:2727-2732.
9. Kim, J-H, Lee, S-R, Li, L-H, Park, H-J et al. (2011) High cleavage efficiency of a 2A peptide derived from porcine Teschovirus in human cell lines, zebrafish and mice. PLoSONE 6:1:8.
10. Faswinkel, H and Reth M. (1994) Dual fole of the tyrosine activation motif of the Igaprotein during signal transduction via the В cell antigen receptor. EMBO J 13:83-89.
11 Walshe CA, Beers SA, French RR, et al. (2008) Induction of cytosolic calcium flux by CD20 is dependent upon В Cell antigen receptor signaling. J Biol Chem:28316971-16984.
12 Jones B, Tite JP, Janeway Jr CA (1986) Different phenotypic variants of the mouse В cell tumor A20/2J are selected by antigen and mitogen-triggered cytotoxicity of LST4-positive, IA-Restricted T cell clones. J. Immunol 136:348.
13. Hamilton A, Baulcombe D (1999). A species of small antisense RNA in posttranscriptional gene silencing in plants. Science 286: 950-952.
14. Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (2007). CRISPR provides acquired resistance against viruses in prokaryotes. Science 315:1709-1712.
15. Horton RM, Cai, ZL, Ho SN and Pease LR (1990) Gene splicing by overlap extension: tailor-made genes using the polymerase chain reaction. Biotechniques 8:528-535.
16. Reth M (1992) Antigen receptors on В cells. Ann Rev. Immunol 10:97-121
17. Campbell MA and Sefton BM (1990) Protein tyrosine phosphorylation is induced in murine В lymphocytes in response to stimulation with anti-immunoglobulin EMBO J 9:2125-2132.
18. Gold, MR, Matsuuchi L, Kelly RB, DeFranco AL (1991) Tyrosine phosphorylation of components of the B-cell antigen receptors following receptor crosslinking. Proc. Natl, Acad Aci 883436-3440.
19 Premack BA, Gardner P (1992) Signal transduction by T cell receptors:mobilization by Ca and regulation of calcium dependent effector molecules. Am J. Physiol 263:C1119-1140.
20. Tsien RY, (1980) New calcium indicators and buffers with high selectivity against magnesium and protons: design, synthesis, and properties of prototype structures. Biochemistry 19:2396-2404.
21. Gee KR, Brown KA, Chen WN, Bishop-Stewart J, Gray D, Johnson I (2000). Chemical and physiological characterization of fluo-4 Ca(2+)-indicator dyes Cell Calcium 27:97-106.
22. Beeker PL, Fay FS (1987) Photobleaching of fura-2 and its effect on determination of calcium concentrations. Am. J. Physiol. 25:C613-C618.
23. Tsuji F, Ohmiya Y, Fagan TF, Toh H, Inouye S (1995) Molecular evolution of the Ca2+-binding photoproteins of the hydrozoa. Photochem. Photobiol. 62:657-661.
24. Akiyuki Takahashi, Patricia Camacho, James D. Lechleiter, Brian Herman (1999). Measurement of intracellular calcium. Physiological Reviews 79:1089-1125.
SEQUENCE LISTING
<110> Schulze, Dan
<120> UNIVERSAL ANTIBODY-MEDIATED BIOSENSOR
<130> 2016-0324A
<150> US 62/132,729
<151> 2015-03-13
<160> 25
<170> PatentIn version 3.5
<210> 1
<211> 320
<212> PRT
<213> Mus musculus
<400> 1
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
Val Leu Gly Pro Gln Ser Ser Ala Pro Val Trp Phe His Ile Leu Phe
290 295 300
Tyr Leu Ser Val Gly Ile Met Phe Ser Leu Asn Thr Val Leu Tyr Val
305 310 315 320
<210> 2
<211> 233
<212> PRT
<213> Mus musculus
<400> 2
Met Thr Leu Asp Thr Gln Met Phe Gln Asn Ala His Ser Gly Ser Gln
1 5 10 15
Trp Leu Leu Pro Pro Leu Thr Ile Leu Leu Leu Phe Ala Phe Ala Asp
20 25 30
Arg Gln Ser Ala Ala Leu Pro Lys Ala Val Val Lys Leu Asp Pro Pro
35 40 45
Trp Ile Gln Val Leu Lys Glu Asp Met Val Thr Leu Met Cys Glu Gly
50 55 60
Thr His Asn Pro Gly Asn Ser Ser Thr Gln Trp Phe His Asn Trp Ser
65 70 75 80
Ser Ile Arg Ser Gln Val Gln Ser Ser Tyr Thr Phe Lys Ala Thr Val
85 90 95
Asn Asp Ser Gly Glu Tyr Arg Cys Gln Met Glu Gln Thr Arg Leu Ser
100 105 110
Asp Pro Val Asp Leu Gly Val Ile Ser Asp Trp Leu Leu Leu Gln Thr
115 120 125
Pro Gln Arg Val Phe Leu Glu Gly Glu Thr Ile Thr Leu Arg Cys Pro
130 135 140
Ser Trp Arg Asn Lys Leu Leu Asn Arg Ile Ser Phe Phe His Asn Glu
145 150 155 160
Lys Ser Val Arg Tyr His His Tyr Lys Ser Asn Phe Ser Ile Pro Lys
165 170 175
Ala Asn His Ser His Ser Gly Asp Tyr Tyr Cys Lys Gly Ser Leu Gly
180 185 190
Ser Thr Gln His Gln Ser Lys Pro Val Thr Ile Thr Val Gln Asp Pro
195 200 205
Ala Thr Thr Ser Ser Ile Ser Leu Val Trp His His Thr Ala Phe Ser
210 215 220
Leu Val Met Cys Leu Leu Phe Ala Val
225 230
<210> 3
<211> 286
<212> PRT
<213> Mus musculus
<400> 3
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu
275 280 285
<210> 4
<211> 207
<212> PRT
<213> Mus musculus
<400> 4
Met Thr Leu Asp Thr Gln Met Phe Gln Asn Ala His Ser Gly Ser Gln
1 5 10 15
Trp Leu Leu Pro Pro Leu Thr Ile Leu Leu Leu Phe Ala Phe Ala Asp
20 25 30
Arg Gln Ser Ala Ala Leu Pro Lys Ala Val Val Lys Leu Asp Pro Pro
35 40 45
Trp Ile Gln Val Leu Lys Glu Asp Met Val Thr Leu Met Cys Glu Gly
50 55 60
Thr His Asn Pro Gly Asn Ser Ser Thr Gln Trp Phe His Asn Trp Ser
65 70 75 80
Ser Ile Arg Ser Gln Val Gln Ser Ser Tyr Thr Phe Lys Ala Thr Val
85 90 95
Asn Asp Ser Gly Glu Tyr Arg Cys Gln Met Glu Gln Thr Arg Leu Ser
100 105 110
Asp Pro Val Asp Leu Gly Val Ile Ser Asp Trp Leu Leu Leu Gln Thr
115 120 125
Pro Gln Arg Val Phe Leu Glu Gly Glu Thr Ile Thr Leu Arg Cys Pro
130 135 140
Ser Trp Arg Asn Lys Leu Leu Asn Arg Ile Ser Phe Phe His Asn Glu
145 150 155 160
Lys Ser Val Arg Tyr His His Tyr Lys Ser Asn Phe Ser Ile Pro Lys
165 170 175
Ala Asn His Ser His Ser Gly Asp Tyr Tyr Cys Lys Gly Ser Leu Gly
180 185 190
Ser Thr Gln His Gln Ser Lys Pro Val Thr Ile Thr Val Gln Asp
195 200 205
<210> 5
<211> 62
<212> PRT
<213> Mus musculus
<400> 5
Phe Arg Lys Arg Trp Gln Asn Glu Lys Phe Gly Val Asp Met Pro Asp
1 5 10 15
Asp Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys
20 25 30
Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr Gln Asp
35 40 45
Val Gly Asn Leu His Ile Gly Asp Ala Gln Leu Glu Lys Pro
50 55 60
<210> 6
<211> 297
<212> PRT
<213> Homo sapiens
<400> 6
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
1 5 10 15
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Met Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro
100 105 110
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Pro Glu Leu Gln Leu Glu Glu Ser Cys Ala Glu Ala Gln Asp Gly
225 230 235 240
Glu Leu Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Thr Leu Phe
245 250 255
Leu Leu Ser Val Cys Tyr Ser Ala Thr Ile Thr Phe Phe Lys Val Lys
260 265 270
Trp Ile Phe Ser Ser Val Val Asp Leu Lys Gln Thr Ile Val Pro Asp
275 280 285
Tyr Arg Asn Met Ile Arg Gln Gly Ala
290 295
<210> 7
<211> 1149
<212> DNA
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRI and Ig
alpha
<400> 7
atgattctta ccagctttgg agatgacatg tggcttctaa caactctgct actttgggtt 60
ccagtcggtg gggaagtggt taatgccacc aaggctgtga tcaccttgca gcctccatgg 120
gtcagtattt tccagaagga aaatgtcact ttatggtgtg aggggcctca cctgcctgga 180
gacagttcca cacaatggtt tatcaacgga acagccgttc agatctccac gcctagttat 240
agcatcccag aggccagttt tcaggacagt ggcgaataca ggtgtcagat aggttcctca 300
atgccaagtg accctgtgca gttgcaaatc cacaatgatt ggctgctact ccaggcctcc 360
cgcagagtcc tcacagaagg agaacccctg gccttgaggt gtcacggatg gaagaataaa 420
ctggtgtaca atgtggtttt ctatagaaat ggaaaatcct ttcagttttc ttcagattcg 480
gaggtcgcca ttctgaaaac caacctgagt cacagcggca tctaccactg ctcaggcacg 540
ggaagacacc gctacacatc tgcaggagtg tccatcacgg tgaaagagct gtttaccacg 600
ccagtgctga gagcatccgt gtcatctccc ttcccggagg ggagtctggt caccctgaac 660
tgtgagacga atttgctcct gcagagaccc ggcttacagc ttcacttctc cttctacgtg 720
ggcagcaaga tcctggagta caggaacaca tcctcagagt accatatagc aagggcggaa 780
agagaagatg ctggattcta ctggtgtgag gtagccacgg aggacagcag tgtccttaag 840
cgcagccctg agttggagct ccaagtgctt ggtccccagt catcagctcc tgtctggttt 900
cacatcctgt tttatctgtc agtgggaata atgttttcgt tgaacacggt tctctatgtg 960
ttcaggaaac ggtggcaaaa tgagaagttt ggggtggaca tgccagatga ctatgaagat 1020
gaaaatctct atgagggcct gaaccttgat gactgttcta tgtatgagga catctccagg 1080
ggactccagg gcacctacca ggatgtgggc aacctccaca ttggagatgc ccagctggaa 1140
aagccatga 1149
<210> 8
<211> 382
<212> PRT
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRI and Ig
alpha
<400> 8
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
Val Leu Gly Pro Gln Ser Ser Ala Pro Val Trp Phe His Ile Leu Phe
290 295 300
Tyr Leu Ser Val Gly Ile Met Phe Ser Leu Asn Thr Val Leu Tyr Val
305 310 315 320
Phe Arg Lys Arg Trp Gln Asn Glu Lys Phe Gly Val Asp Met Pro Asp
325 330 335
Asp Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys
340 345 350
Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr Gln Asp
355 360 365
Val Gly Asn Leu His Ile Gly Asp Ala Gln Leu Glu Lys Pro
370 375 380
<210> 9
<211> 888
<212> DNA
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRIII and Ig
alpha
<400> 9
atgactttgg acacccagat gtttcagaat gcacactctg gaagccaatg gctacttcca 60
ccactgacaa ttctgctgct gtttgctttt gcagacaggc agagtgcagc tcttccgaag 120
gctgtggtga aactggaccc cccatggatc caggtgctca aggaagacat ggtgacactg 180
atgtgcgaag ggacccacaa ccctgggaac tcttctactc agtggttcca caactggagt 240
tccatccgga gccaggtcca atccagctac acgtttaagg ccacagtcaa tgacagtgga 300
gaatatcggt gtcaaatgga gcagacccgc ctcagcgacc ctgtagatct gggagtgatt 360
tctgactggc tgctgctcca gacccctcag cgggtgtttc tggaagggga aaccatcacg 420
ctaaggtgcc ctagctggag gaacaaacta ctgaacagga tctcgttctt ccataatgaa 480
aaatccgtga ggtatcatca ctacaaaagt aatttctcta tcccaaaagc caaccacagt 540
cacagtgggg actactactg caaaggaagt ctaggaagta cacagcacca gtccaagcct 600
gtcaccatca ctgtccaaga cccagcaact acatcctcca tctctctagt ctggcaccac 660
actgctttct ccctagtgat gtgcctcctg tttgcagtgt tcaggaaacg gtggcaaaat 720
gagaagtttg gggtggacat gccagatgac tatgaagatg aaaatctcta tgagggcctg 780
aaccttgatg actgttctat gtatgaggac atctccaggg gactccaggg cacctaccag 840
gatgtgggca acctccacat tggagatgcc cagctggaaa agccatga 888
<210> 10
<211> 295
<212> PRT
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRIII and Ig
alpha
<400> 10
Met Thr Leu Asp Thr Gln Met Phe Gln Asn Ala His Ser Gly Ser Gln
1 5 10 15
Trp Leu Leu Pro Pro Leu Thr Ile Leu Leu Leu Phe Ala Phe Ala Asp
20 25 30
Arg Gln Ser Ala Ala Leu Pro Lys Ala Val Val Lys Leu Asp Pro Pro
35 40 45
Trp Ile Gln Val Leu Lys Glu Asp Met Val Thr Leu Met Cys Glu Gly
50 55 60
Thr His Asn Pro Gly Asn Ser Ser Thr Gln Trp Phe His Asn Trp Ser
65 70 75 80
Ser Ile Arg Ser Gln Val Gln Ser Ser Tyr Thr Phe Lys Ala Thr Val
85 90 95
Asn Asp Ser Gly Glu Tyr Arg Cys Gln Met Glu Gln Thr Arg Leu Ser
100 105 110
Asp Pro Val Asp Leu Gly Val Ile Ser Asp Trp Leu Leu Leu Gln Thr
115 120 125
Pro Gln Arg Val Phe Leu Glu Gly Glu Thr Ile Thr Leu Arg Cys Pro
130 135 140
Ser Trp Arg Asn Lys Leu Leu Asn Arg Ile Ser Phe Phe His Asn Glu
145 150 155 160
Lys Ser Val Arg Tyr His His Tyr Lys Ser Asn Phe Ser Ile Pro Lys
165 170 175
Ala Asn His Ser His Ser Gly Asp Tyr Tyr Cys Lys Gly Ser Leu Gly
180 185 190
Ser Thr Gln His Gln Ser Lys Pro Val Thr Ile Thr Val Gln Asp Pro
195 200 205
Ala Thr Thr Ser Ser Ile Ser Leu Val Trp His His Thr Ala Phe Ser
210 215 220
Leu Val Met Cys Leu Leu Phe Ala Val Phe Arg Lys Arg Trp Gln Asn
225 230 235 240
Glu Lys Phe Gly Val Asp Met Pro Asp Asp Tyr Glu Asp Glu Asn Leu
245 250 255
Tyr Glu Gly Leu Asn Leu Asp Asp Cys Ser Met Tyr Glu Asp Ile Ser
260 265 270
Arg Gly Leu Gln Gly Thr Tyr Gln Asp Val Gly Asn Leu His Ile Gly
275 280 285
Asp Ala Gln Leu Glu Lys Pro
290 295
<210> 11
<211> 1752
<212> DNA
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRI and
membrane Ig
<400> 11
atgattctta ccagctttgg agatgacatg tggcttctaa caactctgct actttgggtt 60
ccagtcggtg gggaagtggt taatgccacc aaggctgtga tcaccttgca gcctccatgg 120
gtcagtattt tccagaagga aaatgtcact ttatggtgtg aggggcctca cctgcctgga 180
gacagttcca cacaatggtt tatcaacgga acagccgttc agatctccac gcctagttat 240
agcatcccag aggccagttt tcaggacagt ggcgaataca ggtgtcagat aggttcctca 300
atgccaagtg accctgtgca gttgcaaatc cacaatgatt ggctgctact ccaggcctcc 360
cgcagagtcc tcacagaagg agaacccctg gccttgaggt gtcacggatg gaagaataaa 420
ctggtgtaca atgtggtttt ctatagaaat ggaaaatcct ttcagttttc ttcagattcg 480
gaggtcgcca ttctgaaaac caacctgagt cacagcggca tctaccactg ctcaggcacg 540
ggaagacacc gctacacatc tgcaggagtg tccatcacgg tgaaagagct gtttaccacg 600
ccagtgctga gagcatccgt gtcatctccc ttcccggagg ggagtctggt caccctgaac 660
tgtgagacga atttgctcct gcagagaccc ggcttacagc ttcacttctc cttctacgtg 720
ggcagcaaga tcctggagta caggaacaca tcctcagagt accatatagc aagggcggaa 780
agagaagatg ctggattcta ctggtgtgag gtagccacgg aggacagcag tgtccttaag 840
cgcagccctg agttggagga gcgcaaatgt tgtgtcgagt gcccaccgtg cccagcacca 900
cctgtggcag gaccgtcagt cttcctcttc cccccaaaac ccaaggacac cctcatgatc 960
tcccggaccc ctgaggtcac gtgcgtggtg gtggacgtga gccacgaaga ccccgaggtc 1020
cagttcaact ggtacgtgga cggcatggag gtgcataatg ccaagacaaa gccacgggag 1080
gagcagttca acagcacgtt ccgtgtggtc agcgtcctca ccgtcgtgca ccaggactgg 1140
ctgaacggca aggagtacaa gtgcaaggtc tccaacaaag gcctcccagc ccccatcgag 1200
aaaaccatct ccaaaaccaa agggcagccc cgagaaccac aggtgtacac cctgccccca 1260
tcccgggagg agatgaccaa gaaccaggtc agcctgacct gcctggtcaa aggcttctac 1320
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1380
acacctccca tgctggactc cgacggctcc ttcttcctct acagcaagct caccgtggac 1440
aagagcaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1500
aaccactaca cacagaagag cctctccctg tctccggagc tgcaactgga ggagagctgt 1560
gcggaggcgc aggacgggga gctggacggg ctgtggacga ccatcaccat cttcatcaca 1620
ctcttcctgc taagcgtgtg ctacagtgcc accatcacct tcttcaaggt gaagtggatc 1680
ttctcctcag tggtggacct gaagcagacc atcgtccccg actacaggaa catgatcagg 1740
cagggggcct ag 1752
<210> 12
<211> 583
<212> PRT
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRI and
membrane Ig
<400> 12
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Glu Arg
275 280 285
Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly
290 295 300
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
305 310 315 320
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
325 330 335
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Met Glu Val His
340 345 350
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg
355 360 365
Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys
370 375 380
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu
385 390 395 400
Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
405 410 415
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
420 425 430
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
435 440 445
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met
450 455 460
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
465 470 475 480
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
485 490 495
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
500 505 510
Glu Leu Gln Leu Glu Glu Ser Cys Ala Glu Ala Gln Asp Gly Glu Leu
515 520 525
Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Thr Leu Phe Leu Leu
530 535 540
Ser Val Cys Tyr Ser Ala Thr Ile Thr Phe Phe Lys Val Lys Trp Ile
545 550 555 560
Phe Ser Ser Val Val Asp Leu Lys Gln Thr Ile Val Pro Asp Tyr Arg
565 570 575
Asn Met Ile Arg Gln Gly Ala
580
<210> 13
<211> 1515
<212> DNA
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRIII and
membrane Ig
<400> 13
atgactttgg acacccagat gtttcagaat gcacactctg gaagccaatg gctacttcca 60
ccactgacaa ttctgctgct gtttgctttt gcagacaggc agagtgcagc tcttccgaag 120
gctgtggtga aactggaccc cccatggatc caggtgctca aggaagacat ggtgacactg 180
atgtgcgaag ggacccacaa ccctgggaac tcttctactc agtggttcca caactggagt 240
tccatccgga gccaggtcca atccagctac acgtttaagg ccacagtcaa tgacagtgga 300
gaatatcggt gtcaaatgga gcagacccgc ctcagcgacc ctgtagatct gggagtgatt 360
tctgactggc tgctgctcca gacccctcag cgggtgtttc tggaagggga aaccatcacg 420
ctaaggtgcc ctagctggag gaacaaacta ctgaacagga tctcgttctt ccataatgaa 480
aaatccgtga ggtatcatca ctacaaaagt aatttctcta tcccaaaagc caaccacagt 540
cacagtgggg actactactg caaaggaagt ctaggaagta cacagcacca gtccaagcct 600
gtcaccatca ctgtccaaga cgagcgcaaa tgttgtgtcg agtgcccacc gtgcccagca 660
ccacctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 720
atctcccgga cccctgaggt cacgtgcgtg gtggtggacg tgagccacga agaccccgag 780
gtccagttca actggtacgt ggacggcatg gaggtgcata atgccaagac aaagccacgg 840
gaggagcagt tcaacagcac gttccgtgtg gtcagcgtcc tcaccgtcgt gcaccaggac 900
tggctgaacg gcaaggagta caagtgcaag gtctccaaca aaggcctccc agcccccatc 960
gagaaaacca tctccaaaac caaagggcag ccccgagaac cacaggtgta caccctgccc 1020
ccatcccggg aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 1080
taccccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1140
accacacctc ccatgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1200
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1260
cacaaccact acacacagaa gagcctctcc ctgtctccgg agctgcaact ggaggagagc 1320
tgtgcggagg cgcaggacgg ggagctggac gggctgtgga cgaccatcac catcttcatc 1380
acactcttcc tgctaagcgt gtgctacagt gccaccatca ccttcttcaa ggtgaagtgg 1440
atcttctcct cagtggtgga cctgaagcag accatcgtcc ccgactacag gaacatgatc 1500
aggcaggggg cctag 1515
<210> 14
<211> 504
<212> PRT
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRIII and
membrane Ig
<400> 14
Met Thr Leu Asp Thr Gln Met Phe Gln Asn Ala His Ser Gly Ser Gln
1 5 10 15
Trp Leu Leu Pro Pro Leu Thr Ile Leu Leu Leu Phe Ala Phe Ala Asp
20 25 30
Arg Gln Ser Ala Ala Leu Pro Lys Ala Val Val Lys Leu Asp Pro Pro
35 40 45
Trp Ile Gln Val Leu Lys Glu Asp Met Val Thr Leu Met Cys Glu Gly
50 55 60
Thr His Asn Pro Gly Asn Ser Ser Thr Gln Trp Phe His Asn Trp Ser
65 70 75 80
Ser Ile Arg Ser Gln Val Gln Ser Ser Tyr Thr Phe Lys Ala Thr Val
85 90 95
Asn Asp Ser Gly Glu Tyr Arg Cys Gln Met Glu Gln Thr Arg Leu Ser
100 105 110
Asp Pro Val Asp Leu Gly Val Ile Ser Asp Trp Leu Leu Leu Gln Thr
115 120 125
Pro Gln Arg Val Phe Leu Glu Gly Glu Thr Ile Thr Leu Arg Cys Pro
130 135 140
Ser Trp Arg Asn Lys Leu Leu Asn Arg Ile Ser Phe Phe His Asn Glu
145 150 155 160
Lys Ser Val Arg Tyr His His Tyr Lys Ser Asn Phe Ser Ile Pro Lys
165 170 175
Ala Asn His Ser His Ser Gly Asp Tyr Tyr Cys Lys Gly Ser Leu Gly
180 185 190
Ser Thr Gln His Gln Ser Lys Pro Val Thr Ile Thr Val Gln Asp Glu
195 200 205
Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala
210 215 220
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
225 230 235 240
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
245 250 255
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Met Glu Val
260 265 270
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val
325 330 335
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
340 345 350
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
355 360 365
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
370 375 380
Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
385 390 395 400
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
405 410 415
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
420 425 430
Pro Glu Leu Gln Leu Glu Glu Ser Cys Ala Glu Ala Gln Asp Gly Glu
435 440 445
Leu Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Thr Leu Phe Leu
450 455 460
Leu Ser Val Cys Tyr Ser Ala Thr Ile Thr Phe Phe Lys Val Lys Trp
465 470 475 480
Ile Phe Ser Ser Val Val Asp Leu Lys Gln Thr Ile Val Pro Asp Tyr
485 490 495
Arg Asn Met Ile Arg Gln Gly Ala
500
<210> 15
<211> 1215
<212> DNA
<213> Mus musculus
<220>
<221> exon
<222> (1)..(1212)
<400> 15
atg att ctt acc agc ttt gga gat gac atg tgg ctt cta aca act ctg 48
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
cta ctt tgg gtt cca gtc ggt ggg gaa gtg gtt aat gcc acc aag gct 96
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
gtg atc acc ttg cag cct cca tgg gtc agt att ttc cag aag gaa aat 144
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
gtc act tta tgg tgt gag ggg cct cac ctg cct gga gac agt tcc aca 192
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
caa tgg ttt atc aac gga aca gcc gtt cag atc tcc acg cct agt tat 240
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
agc atc cca gag gcc agt ttt cag gac agt ggc gaa tac agg tgt cag 288
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
ata ggt tcc tca atg cca agt gac cct gtg cag ttg caa atc cac aat 336
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
gat tgg ctg cta ctc cag gcc tcc cgc aga gtc ctc aca gaa gga gaa 384
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
ccc ctg gcc ttg agg tgt cac gga tgg aag aat aaa ctg gtg tac aat 432
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
gtg gtt ttc tat aga aat gga aaa tcc ttt cag ttt tct tca gat tcg 480
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
gag gtc gcc att ctg aaa acc aac ctg agt cac agc ggc atc tac cac 528
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
tgc tca ggc acg gga aga cac cgc tac aca tct gca gga gtg tcc atc 576
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
acg gtg aaa gag ctg ttt acc acg cca gtg ctg aga gca tcc gtg tca 624
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
tct ccc ttc ccg gag ggg agt ctg gtc acc ctg aac tgt gag acg aat 672
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
ttg ctc ctg cag aga ccc ggc tta cag ctt cac ttc tcc ttc tac gtg 720
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
ggc agc aag atc ctg gag tac agg aac aca tcc tca gag tac cat ata 768
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
gca agg gcg gaa aga gaa gat gct gga ttc tac tgg tgt gag gta gcc 816
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
acg gag gac agc agt gtc ctt aag cgc agc cct gag ttg gag ctc caa 864
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
gtg ctt ggt ccc cag tca tca gct cct gtc tgg ttt cac atc ctg ttt 912
Val Leu Gly Pro Gln Ser Ser Ala Pro Val Trp Phe His Ile Leu Phe
290 295 300
tat ctg tca gtg gga ata atg ttt tcg ttg aac acg gtt ctc tat gtg 960
Tyr Leu Ser Val Gly Ile Met Phe Ser Leu Asn Thr Val Leu Tyr Val
305 310 315 320
aaa ata cac agg ctg cag aga gag aag aaa tac aac tta gaa gtc cct 1008
Lys Ile His Arg Leu Gln Arg Glu Lys Lys Tyr Asn Leu Glu Val Pro
325 330 335
ttg gtt tct gag cag gga aag aaa gca aat tcc ttt cag caa gtt aga 1056
Leu Val Ser Glu Gln Gly Lys Lys Ala Asn Ser Phe Gln Gln Val Arg
340 345 350
agc gat ggc gtg tat gaa gaa gta aca gcc act gcg agc cag acc aca 1104
Ser Asp Gly Val Tyr Glu Glu Val Thr Ala Thr Ala Ser Gln Thr Thr
355 360 365
cca aaa gaa gcg ccc gat gga cct cga agc tca gtg ggt gac tgt gga 1152
Pro Lys Glu Ala Pro Asp Gly Pro Arg Ser Ser Val Gly Asp Cys Gly
370 375 380
ccc gag cag cct gaa ccc ctt cct ccc agt gac agt act ggg gca caa 1200
Pro Glu Gln Pro Glu Pro Leu Pro Pro Ser Asp Ser Thr Gly Ala Gln
385 390 395 400
act tcc caa agt tga 1215
Thr Ser Gln Ser
<210> 16
<211> 804
<212> DNA
<213> Mus musculus
<220>
<221> exon
<222> (1)..(801)
<400> 16
atg act ttg gac acc cag atg ttt cag aat gca cac tct gga agc caa 48
Met Thr Leu Asp Thr Gln Met Phe Gln Asn Ala His Ser Gly Ser Gln
1 5 10 15
tgg cta ctt cca cca ctg aca att ctg ctg ctg ttt gct ttt gca gac 96
Trp Leu Leu Pro Pro Leu Thr Ile Leu Leu Leu Phe Ala Phe Ala Asp
20 25 30
agg cag agt gca gct ctt ccg aag gct gtg gtg aaa ctg gac ccc cca 144
Arg Gln Ser Ala Ala Leu Pro Lys Ala Val Val Lys Leu Asp Pro Pro
35 40 45
tgg atc cag gtg ctc aag gaa gac atg gtg aca ctg atg tgc gaa ggg 192
Trp Ile Gln Val Leu Lys Glu Asp Met Val Thr Leu Met Cys Glu Gly
50 55 60
acc cac aac cct ggg aac tct tct act cag tgg ttc cac aac tgg agt 240
Thr His Asn Pro Gly Asn Ser Ser Thr Gln Trp Phe His Asn Trp Ser
65 70 75 80
tcc atc cgg agc cag gtc caa tcc agc tac acg ttt aag gcc aca gtc 288
Ser Ile Arg Ser Gln Val Gln Ser Ser Tyr Thr Phe Lys Ala Thr Val
85 90 95
aat gac agt gga gaa tat cgg tgt caa atg gag cag acc cgc ctc agc 336
Asn Asp Ser Gly Glu Tyr Arg Cys Gln Met Glu Gln Thr Arg Leu Ser
100 105 110
gac cct gta gat ctg gga gtg att tct gac tgg ctg ctg ctc cag acc 384
Asp Pro Val Asp Leu Gly Val Ile Ser Asp Trp Leu Leu Leu Gln Thr
115 120 125
cct cag cgg gtg ttt ctg gaa ggg gaa acc atc acg cta agg tgc cct 432
Pro Gln Arg Val Phe Leu Glu Gly Glu Thr Ile Thr Leu Arg Cys Pro
130 135 140
agc tgg agg aac aaa cta ctg aac agg atc tcg ttc ttc cat aat gaa 480
Ser Trp Arg Asn Lys Leu Leu Asn Arg Ile Ser Phe Phe His Asn Glu
145 150 155 160
aaa tcc gtg agg tat cat cac tac aaa agt aat ttc tct atc cca aaa 528
Lys Ser Val Arg Tyr His His Tyr Lys Ser Asn Phe Ser Ile Pro Lys
165 170 175
gcc aac cac agt cac agt ggg gac tac tac tgc aaa gga agt cta gga 576
Ala Asn His Ser His Ser Gly Asp Tyr Tyr Cys Lys Gly Ser Leu Gly
180 185 190
agt aca cag cac cag tcc aag cct gtc acc atc act gtc caa gac cca 624
Ser Thr Gln His Gln Ser Lys Pro Val Thr Ile Thr Val Gln Asp Pro
195 200 205
gca act aca tcc tcc atc tct cta gtc tgg cac cac act gct ttc tcc 672
Ala Thr Thr Ser Ser Ile Ser Leu Val Trp His His Thr Ala Phe Ser
210 215 220
cta gtg atg tgc ctc ctg ttt gca gtg gac acg ggc ctt tat ttc tat 720
Leu Val Met Cys Leu Leu Phe Ala Val Asp Thr Gly Leu Tyr Phe Tyr
225 230 235 240
gta cgg aga aat ctt caa acc ccg agg gat tac tgg agg aag tcc ctg 768
Val Arg Arg Asn Leu Gln Thr Pro Arg Asp Tyr Trp Arg Lys Ser Leu
245 250 255
tca atc aga aag cac cag gct cct caa gac aag tga 804
Ser Ile Arg Lys His Gln Ala Pro Gln Asp Lys
260 265
<210> 17
<211> 663
<212> DNA
<213> Mus musculus
<220>
<221> exon
<222> (1)..(660)
<400> 17
atg cca ggg ggt cta gaa gcc ctc aga gcc ctg cct ctc ctc ctc ttc 48
Met Pro Gly Gly Leu Glu Ala Leu Arg Ala Leu Pro Leu Leu Leu Phe
1 5 10 15
ttg tca tac gcc tgt ttg ggt ccc gga tgc cag gcc ctg cgg gta gaa 96
Leu Ser Tyr Ala Cys Leu Gly Pro Gly Cys Gln Ala Leu Arg Val Glu
20 25 30
ggg ggt cca cca tcc ctg acg gtg aac ttg ggc gag gag gcc cgc ctc 144
Gly Gly Pro Pro Ser Leu Thr Val Asn Leu Gly Glu Glu Ala Arg Leu
35 40 45
acc tgt gaa aac aat ggc agg aac cct aat atc aca tgg tgg ttc agc 192
Thr Cys Glu Asn Asn Gly Arg Asn Pro Asn Ile Thr Trp Trp Phe Ser
50 55 60
ctt cag tct aac atc aca tgg ccc cca gtg cca ctg ggt cct ggc cag 240
Leu Gln Ser Asn Ile Thr Trp Pro Pro Val Pro Leu Gly Pro Gly Gln
65 70 75 80
ggt acc aca ggc cag ctg ttc ttc ccc gaa gta aac aag aac cac agg 288
Gly Thr Thr Gly Gln Leu Phe Phe Pro Glu Val Asn Lys Asn His Arg
85 90 95
ggc ttg tac tgg tgc caa gtg ata gaa aac aac ata tta aaa cgc tcc 336
Gly Leu Tyr Trp Cys Gln Val Ile Glu Asn Asn Ile Leu Lys Arg Ser
100 105 110
tgt ggt act tac ctc cgc gtg cgc aat cca gtc cct agg ccc ttc ctg 384
Cys Gly Thr Tyr Leu Arg Val Arg Asn Pro Val Pro Arg Pro Phe Leu
115 120 125
gac atg ggg gaa ggt acc aag aac cgc atc atc aca gca gaa ggg atc 432
Asp Met Gly Glu Gly Thr Lys Asn Arg Ile Ile Thr Ala Glu Gly Ile
130 135 140
atc ttg ctg ttc tgt gca gtg gtg cca ggg acg ctg ctg cta ttc agg 480
Ile Leu Leu Phe Cys Ala Val Val Pro Gly Thr Leu Leu Leu Phe Arg
145 150 155 160
aaa cgg tgg caa aat gag aag ttt ggg gtg gac atg cca gat gac tat 528
Lys Arg Trp Gln Asn Glu Lys Phe Gly Val Asp Met Pro Asp Asp Tyr
165 170 175
gaa gat gaa aat ctc tat gag ggc ctg aac ctt gat gac tgt tct atg 576
Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys Ser Met
180 185 190
tat gag gac atc tcc agg gga ctc cag ggc acc tac cag gat gtg ggc 624
Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr Gln Asp Val Gly
195 200 205
aac ctc cac att gga gat gcc cag ctg gaa aag cca tga 663
Asn Leu His Ile Gly Asp Ala Gln Leu Glu Lys Pro
210 215 220
<210> 18
<211> 894
<212> DNA
<213> Homo sapiens
<220>
<221> exon
<222> (1)..(891)
<400> 18
gag cgc aaa tgt tgt gtc gag tgc cca ccg tgc cca gca cca cct gtg 48
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
1 5 10 15
gca gga ccg tca gtc ttc ctc ttc ccc cca aaa ccc aag gac acc ctc 96
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
atg atc tcc cgg acc cct gag gtc acg tgc gtg gtg gtg gac gtg agc 144
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
cac gaa gac ccc gag gtc cag ttc aac tgg tac gtg gac ggc atg gag 192
His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Met Glu
50 55 60
gtg cat aat gcc aag aca aag cca cgg gag gag cag ttc aac agc acg 240
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
ttc cgt gtg gtc agc gtc ctc acc gtc gtg cac cag gac tgg ctg aac 288
Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn
85 90 95
ggc aag gag tac aag tgc aag gtc tcc aac aaa ggc ctc cca gcc ccc 336
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro
100 105 110
atc gag aaa acc atc tcc aaa acc aaa ggg cag ccc cga gaa cca cag 384
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln
115 120 125
gtg tac acc ctg ccc cca tcc cgg gag gag atg acc aag aac cag gtc 432
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
130 135 140
agc ctg acc tgc ctg gtc aaa ggc ttc tac ccc agc gac atc gcc gtg 480
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
145 150 155 160
gag tgg gag agc aat ggg cag ccg gag aac aac tac aag acc aca cct 528
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
ccc atg ctg gac tcc gac ggc tcc ttc ttc ctc tac agc aag ctc acc 576
Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
180 185 190
gtg gac aag agc agg tgg cag cag ggg aac gtc ttc tca tgc tcc gtg 624
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
195 200 205
atg cat gag gct ctg cac aac cac tac aca cag aag agc ctc tcc ctg 672
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
tct ccg gag ctg caa ctg gag gag agc tgt gcg gag gcg cag gac ggg 720
Ser Pro Glu Leu Gln Leu Glu Glu Ser Cys Ala Glu Ala Gln Asp Gly
225 230 235 240
gag ctg gac ggg ctg tgg acg acc atc acc atc ttc atc aca ctc ttc 768
Glu Leu Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Thr Leu Phe
245 250 255
ctg cta agc gtg tgc tac agt gcc acc atc acc ttc ttc aag gtg aag 816
Leu Leu Ser Val Cys Tyr Ser Ala Thr Ile Thr Phe Phe Lys Val Lys
260 265 270
tgg atc ttc tcc tca gtg gtg gac ctg aag cag acc atc gtc ccc gac 864
Trp Ile Phe Ser Ser Val Val Asp Leu Lys Gln Thr Ile Val Pro Asp
275 280 285
tac agg aac atg atc agg cag ggg gcc tag 894
Tyr Arg Asn Met Ile Arg Gln Gly Ala
290 295
<210> 19
<211> 960
<212> DNA
<213> Mus musculus
<400> 19
atgattctta ccagctttgg agatgacatg tggcttctaa caactctgct actttgggtt 60
ccagtcggtg gggaagtggt taatgccacc aaggctgtga tcaccttgca gcctccatgg 120
gtcagtattt tccagaagga aaatgtcact ttatggtgtg aggggcctca cctgcctgga 180
gacagttcca cacaatggtt tatcaacgga acagccgttc agatctccac gcctagttat 240
agcatcccag aggccagttt tcaggacagt ggcgaataca ggtgtcagat aggttcctca 300
atgccaagtg accctgtgca gttgcaaatc cacaatgatt ggctgctact ccaggcctcc 360
cgcagagtcc tcacagaagg agaacccctg gccttgaggt gtcacggatg gaagaataaa 420
ctggtgtaca atgtggtttt ctatagaaat ggaaaatcct ttcagttttc ttcagattcg 480
gaggtcgcca ttctgaaaac caacctgagt cacagcggca tctaccactg ctcaggcacg 540
ggaagacacc gctacacatc tgcaggagtg tccatcacgg tgaaagagct gtttaccacg 600
ccagtgctga gagcatccgt gtcatctccc ttcccggagg ggagtctggt caccctgaac 660
tgtgagacga atttgctcct gcagagaccc ggcttacagc ttcacttctc cttctacgtg 720
ggcagcaaga tcctggagta caggaacaca tcctcagagt accatatagc aagggcggaa 780
agagaagatg ctggattcta ctggtgtgag gtagccacgg aggacagcag tgtccttaag 840
cgcagccctg agttggagct ccaagtgctt ggtccccagt catcagctcc tgtctggttt 900
cacatcctgt tttatctgtc agtgggaata atgttttcgt tgaacacggt tctctatgtg 960
<210> 20
<211> 699
<212> DNA
<213> Mus musculus
<400> 20
atgactttgg acacccagat gtttcagaat gcacactctg gaagccaatg gctacttcca 60
ccactgacaa ttctgctgct gtttgctttt gcagacaggc agagtgcagc tcttccgaag 120
gctgtggtga aactggaccc cccatggatc caggtgctca aggaagacat ggtgacactg 180
atgtgcgaag ggacccacaa ccctgggaac tcttctactc agtggttcca caactggagt 240
tccatccgga gccaggtcca atccagctac acgtttaagg ccacagtcaa tgacagtgga 300
gaatatcggt gtcaaatgga gcagacccgc ctcagcgacc ctgtagatct gggagtgatt 360
tctgactggc tgctgctcca gacccctcag cgggtgtttc tggaagggga aaccatcacg 420
ctaaggtgcc ctagctggag gaacaaacta ctgaacagga tctcgttctt ccataatgaa 480
aaatccgtga ggtatcatca ctacaaaagt aatttctcta tcccaaaagc caaccacagt 540
cacagtgggg actactactg caaaggaagt ctaggaagta cacagcacca gtccaagcct 600
gtcaccatca ctgtccaaga cccagcaact acatcctcca tctctctagt ctggcaccac 660
actgctttct ccctagtgat gtgcctcctg tttgcagtg 699
<210> 21
<211> 189
<212> DNA
<213> Mus musculus
<400> 21
ttcaggaaac ggtggcaaaa tgagaagttt ggggtggaca tgccagatga ctatgaagat 60
gaaaatctct atgagggcct gaaccttgat gactgttcta tgtatgagga catctccagg 120
ggactccagg gcacctacca ggatgtgggc aacctccaca ttggagatgc ccagctggaa 180
aagccatga 189
<210> 22
<211> 1752
<212> DNA
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRI and
membrane Ig
<220>
<221> exon
<222> (1)..(1749)
<400> 22
atg att ctt acc agc ttt gga gat gac atg tgg ctt cta aca act ctg 48
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
cta ctt tgg gtt cca gtc ggt ggg gaa gtg gtt aat gcc acc aag gct 96
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
gtg atc acc ttg cag cct cca tgg gtc agt att ttc cag aag gaa aat 144
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
gtc act tta tgg tgt gag ggg cct cac ctg cct gga gac agt tcc aca 192
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
caa tgg ttt atc aac gga aca gcc gtt cag atc tcc acg cct agt tat 240
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
agc atc cca gag gcc agt ttt cag gac agt ggc gaa tac agg tgt cag 288
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
ata ggt tcc tca atg cca agt gac cct gtg cag ttg caa atc cac aat 336
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
gat tgg ctg cta ctc cag gcc tcc cgc aga gtc ctc aca gaa gga gaa 384
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
ccc ctg gcc ttg agg tgt cac gga tgg aag aat aaa ctg gtg tac aat 432
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
gtg gtt ttc tat aga aat gga aaa tcc ttt cag ttt tct tca gat tcg 480
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
gag gtc gcc att ctg aaa acc aac ctg agt cac agc ggc atc tac cac 528
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
tgc tca ggc acg gga aga cac cgc tac aca tct gca gga gtg tcc atc 576
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
acg gtg aaa gag ctg ttt acc acg cca gtg ctg aga gca tcc gtg tca 624
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
tct ccc ttc ccg gag ggg agt ctg gtc acc ctg aac tgt gag acg aat 672
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
ttg ctc ctg cag aga ccc ggc tta cag ctt cac ttc tcc ttc tac gtg 720
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
ggc agc aag atc ctg gag tac agg aac aca tcc tca gag tac cat ata 768
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
gca agg gcg gaa aga gaa gat gct gga ttc tac tgg tgt gag gta gcc 816
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
acg gag gac agc agt gtc ctt aag cgc agc cct gag ttg gag gag cgc 864
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Glu Arg
275 280 285
aaa tgt tgt gtc gag tgc cca ccg tgc cca gca cca cct gtg gca gga 912
Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly
290 295 300
ccg tca gtc ttc ctc ttc ccc cca aaa ccc aag gac acc ctc atg atc 960
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
305 310 315 320
tcc cgg acc cct gag gtc acg tgc gtg gtg gtg gac gtg agc cac gaa 1008
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
325 330 335
gac ccc gag gtc cag ttc aac tgg tac gtg gac ggc atg gag gtg cat 1056
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Met Glu Val His
340 345 350
aat gcc aag aca aag cca cgg gag gag cag ttc aac agc acg ttc cgt 1104
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg
355 360 365
gtg gtc agc gtc ctc acc gtc gtg cac cag gac tgg ctg aac ggc aag 1152
Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys
370 375 380
gag tac aag tgc aag gtc tcc aac aaa ggc ctc cca gcc ccc atc gag 1200
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu
385 390 395 400
aaa acc atc tcc aaa acc aaa ggg cag ccc cga gaa cca cag gtg tac 1248
Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
405 410 415
acc ctg ccc cca tcc cgg gag gag atg acc aag aac cag gtc agc ctg 1296
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
420 425 430
acc tgc ctg gtc aaa ggc ttc tac ccc agc gac atc gcc gtg gag tgg 1344
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
435 440 445
gag agc aat ggg cag ccg gag aac aac tac aag acc aca cct ccc atg 1392
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met
450 455 460
ctg gac tcc gac ggc tcc ttc ttc ctc tac agc aag ctc acc gtg gac 1440
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
465 470 475 480
aag agc agg tgg cag cag ggg aac gtc ttc tca tgc tcc gtg atg cat 1488
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
485 490 495
gag gct ctg cac aac cac tac aca cag aag agc ctc tcc ctg tct ccg 1536
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
500 505 510
gag ctg caa ctg gag gag agc tgt gcg gag gcg cag gac ggg gag ctg 1584
Glu Leu Gln Leu Glu Glu Ser Cys Ala Glu Ala Gln Asp Gly Glu Leu
515 520 525
gac ggg ctg tgg acg acc atc acc atc ttc atc aca ctc ttc ctg cta 1632
Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Thr Leu Phe Leu Leu
530 535 540
agc gtg tgc tac agt gcc acc atc acc ttc ttc aag gtg aag tgg atc 1680
Ser Val Cys Tyr Ser Ala Thr Ile Thr Phe Phe Lys Val Lys Trp Ile
545 550 555 560
ttc tcc tca gtg gtg gac ctg aag cag acc atc gtc ccc gac tac agg 1728
Phe Ser Ser Val Val Asp Leu Lys Gln Thr Ile Val Pro Asp Tyr Arg
565 570 575
aac atg atc agg cag ggg gcc tag 1752
Asn Met Ile Arg Gln Gly Ala
580
<210> 23
<211> 1515
<212> DNA
<213> Artificial Sequence
<220>
<223> Chimeric fusion protein construct comprising Fc-gammaRIII and
membrane Ig
<220>
<221> exon
<222> (1)..(1512)
<400> 23
atg act ttg gac acc cag atg ttt cag aat gca cac tct gga agc caa 48
Met Thr Leu Asp Thr Gln Met Phe Gln Asn Ala His Ser Gly Ser Gln
1 5 10 15
tgg cta ctt cca cca ctg aca att ctg ctg ctg ttt gct ttt gca gac 96
Trp Leu Leu Pro Pro Leu Thr Ile Leu Leu Leu Phe Ala Phe Ala Asp
20 25 30
agg cag agt gca gct ctt ccg aag gct gtg gtg aaa ctg gac ccc cca 144
Arg Gln Ser Ala Ala Leu Pro Lys Ala Val Val Lys Leu Asp Pro Pro
35 40 45
tgg atc cag gtg ctc aag gaa gac atg gtg aca ctg atg tgc gaa ggg 192
Trp Ile Gln Val Leu Lys Glu Asp Met Val Thr Leu Met Cys Glu Gly
50 55 60
acc cac aac cct ggg aac tct tct act cag tgg ttc cac aac tgg agt 240
Thr His Asn Pro Gly Asn Ser Ser Thr Gln Trp Phe His Asn Trp Ser
65 70 75 80
tcc atc cgg agc cag gtc caa tcc agc tac acg ttt aag gcc aca gtc 288
Ser Ile Arg Ser Gln Val Gln Ser Ser Tyr Thr Phe Lys Ala Thr Val
85 90 95
aat gac agt gga gaa tat cgg tgt caa atg gag cag acc cgc ctc agc 336
Asn Asp Ser Gly Glu Tyr Arg Cys Gln Met Glu Gln Thr Arg Leu Ser
100 105 110
gac cct gta gat ctg gga gtg att tct gac tgg ctg ctg ctc cag acc 384
Asp Pro Val Asp Leu Gly Val Ile Ser Asp Trp Leu Leu Leu Gln Thr
115 120 125
cct cag cgg gtg ttt ctg gaa ggg gaa acc atc acg cta agg tgc cct 432
Pro Gln Arg Val Phe Leu Glu Gly Glu Thr Ile Thr Leu Arg Cys Pro
130 135 140
agc tgg agg aac aaa cta ctg aac agg atc tcg ttc ttc cat aat gaa 480
Ser Trp Arg Asn Lys Leu Leu Asn Arg Ile Ser Phe Phe His Asn Glu
145 150 155 160
aaa tcc gtg agg tat cat cac tac aaa agt aat ttc tct atc cca aaa 528
Lys Ser Val Arg Tyr His His Tyr Lys Ser Asn Phe Ser Ile Pro Lys
165 170 175
gcc aac cac agt cac agt ggg gac tac tac tgc aaa gga agt cta gga 576
Ala Asn His Ser His Ser Gly Asp Tyr Tyr Cys Lys Gly Ser Leu Gly
180 185 190
agt aca cag cac cag tcc aag cct gtc acc atc act gtc caa gac gag 624
Ser Thr Gln His Gln Ser Lys Pro Val Thr Ile Thr Val Gln Asp Glu
195 200 205
cgc aaa tgt tgt gtc gag tgc cca ccg tgc cca gca cca cct gtg gca 672
Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala
210 215 220
gga ccg tca gtc ttc ctc ttc ccc cca aaa ccc aag gac acc ctc atg 720
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
225 230 235 240
atc tcc cgg acc cct gag gtc acg tgc gtg gtg gtg gac gtg agc cac 768
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
245 250 255
gaa gac ccc gag gtc cag ttc aac tgg tac gtg gac ggc atg gag gtg 816
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Met Glu Val
260 265 270
cat aat gcc aag aca aag cca cgg gag gag cag ttc aac agc acg ttc 864
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
cgt gtg gtc agc gtc ctc acc gtc gtg cac cag gac tgg ctg aac ggc 912
Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly
290 295 300
aag gag tac aag tgc aag gtc tcc aac aaa ggc ctc cca gcc ccc atc 960
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile
305 310 315 320
gag aaa acc atc tcc aaa acc aaa ggg cag ccc cga gaa cca cag gtg 1008
Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val
325 330 335
tac acc ctg ccc cca tcc cgg gag gag atg acc aag aac cag gtc agc 1056
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
340 345 350
ctg acc tgc ctg gtc aaa ggc ttc tac ccc agc gac atc gcc gtg gag 1104
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
355 360 365
tgg gag agc aat ggg cag ccg gag aac aac tac aag acc aca cct ccc 1152
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
370 375 380
atg ctg gac tcc gac ggc tcc ttc ttc ctc tac agc aag ctc acc gtg 1200
Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
385 390 395 400
gac aag agc agg tgg cag cag ggg aac gtc ttc tca tgc tcc gtg atg 1248
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
405 410 415
cat gag gct ctg cac aac cac tac aca cag aag agc ctc tcc ctg tct 1296
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
420 425 430
ccg gag ctg caa ctg gag gag agc tgt gcg gag gcg cag gac ggg gag 1344
Pro Glu Leu Gln Leu Glu Glu Ser Cys Ala Glu Ala Gln Asp Gly Glu
435 440 445
ctg gac ggg ctg tgg acg acc atc acc atc ttc atc aca ctc ttc ctg 1392
Leu Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Thr Leu Phe Leu
450 455 460
cta agc gtg tgc tac agt gcc acc atc acc ttc ttc aag gtg aag tgg 1440
Leu Ser Val Cys Tyr Ser Ala Thr Ile Thr Phe Phe Lys Val Lys Trp
465 470 475 480
atc ttc tcc tca gtg gtg gac ctg aag cag acc atc gtc ccc gac tac 1488
Ile Phe Ser Ser Val Val Asp Leu Lys Gln Thr Ile Val Pro Asp Tyr
485 490 495
agg aac atg atc agg cag ggg gcc tag 1515
Arg Asn Met Ile Arg Gln Gly Ala
500
<210> 24
<211> 63
<212> DNA
<213> Artificial Sequence
<220>
<223> 2A peptide sequence
<220>
<221> exon
<222> (1)..(63)
<400> 24
gga agc gga gct act aac ttc agc ctg ctg aag cag gcg gag acg gga 48
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Glu Thr Gly
1 5 10 15
gga gaa ccc tgg acc 63
Gly Glu Pro Trp Thr
20
<210> 25
<211> 261
<212> DNA
<213> Mus musculus
<220>
<221> exon
<222> (1)..(258)
<400> 25
atg atc tca gcc gtg atc ttg ttc ttg ctc ctt ttg gtg gaa caa gca 48
Met Ile Ser Ala Val Ile Leu Phe Leu Leu Leu Leu Val Glu Gln Ala
1 5 10 15
gcc gcc ctg gga gag ccg cag ctc tgc tat atc ctg gat gct gtc ctg 96
Ala Ala Leu Gly Glu Pro Gln Leu Cys Tyr Ile Leu Asp Ala Val Leu
20 25 30
ttt ttg tat ggt att gtc ctt acc cta ctc tac tgt cga ctc aag atc 144
Phe Leu Tyr Gly Ile Val Leu Thr Leu Leu Tyr Cys Arg Leu Lys Ile
35 40 45
cag gtc cga aag gca gct ata gcc agc cgt gag aaa gca gat gct gtc 192
Gln Val Arg Lys Ala Ala Ile Ala Ser Arg Glu Lys Ala Asp Ala Val
50 55 60
tac acg ggc ctg aac acc cgg agc cag gag aca tat gag act ctg aag 240
Tyr Thr Gly Leu Asn Thr Arg Ser Gln Glu Thr Tyr Glu Thr Leu Lys
65 70 75 80
cat gag aaa cca ccc cag tag 261
His Glu Lys Pro Pro Gln
85
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитело моноклональное мышиное 1Е10 и антитело рекомбинантное химерное (мышь-человек) xi1E10, нейтрализующие летальный токсин Bacillus anthracis, и штамм гибридных культивируемых клеток животных Mus musculus 1E10 | 2020 |
|
RU2745116C1 |
| Антитела против белка р17 ВИЧ-1 субтипа А | 2019 |
|
RU2727673C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2714205C2 |
| БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ БЫСТРОГО ОБНАРУЖЕНИЯ ОПРЕДЕЛЯЕМЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717658C2 |
| СПОСОБ ПРОДУЦИРОВАНИЯ ПОЧЕЧНЫХ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ | 2016 |
|
RU2730861C2 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2019 |
|
RU2781542C2 |
| ШТАММ КЛЕТОК CHO-SE-9/4 - ПРОДУЦЕНТ ХИМЕРНОГО АНТИТЕЛА ПРОТИВ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА И ХИМЕРНОЕ АНТИТЕЛО, ПРОДУЦИРУЕМОЕ ДАННЫМ ШТАММОМ | 2019 |
|
RU2717038C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2766586C2 |
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2020 |
|
RU2811752C2 |












Изобретение относится к области биотехнологии, конкретно к антитело-опосредованному биосенсору, содержащему клетку, экспрессирующую химерный гибридный белок, который содержит антитело-связывающий домен Fcγ-рецептора, трансмембранный домен и сигнальный домен альфа-иммуноглобулина, и может быть использовано в медицине. Полученный биосенсор может быть использован для эффективного определения агента-мишени в образце. 6 н. и 17 з.п. ф-лы, 11 ил., 1 табл., 5 пр.
1. Способ обнаружения агента-мишени в образце, содержащий
(а) приведение образца к контакту с антителом, характеризующимся специфичностью связывания относительно агента-мишени, и с клеткой биосенсора, и
(b) анализ клетки биосенсора относительно клеточной активации, при этом клетка биосенсора стабильно экспрессирует химерный гибридный белок, и при этом химерный гибридный белок содержит антитело-связывающий домен Fcγ-рецептора (FcγR), трансмембранный домен и сигнальный домен, где сигнальным доменом является сигнальный домен альфа-иммуноглобулина (Igα), представленный в SEQ ID NO:5, или функционально активный вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:5, или где трансмембранным доменом вместе с сигнальным доменом является мембранный Ig, представленный в SEQ ID NO:6, или функционально активный вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:6, и при этом клетка биосенсора не является человеческим эмбрионом или клеткой зародышевой линии.
2. Способ по п. 1, в котором образцом является образец воздуха, образец жидкости, образец растительного происхождения или образец сухого вещества.
3. Способ по п. 1, в котором образцом является биологический образец, выбранный из группы, состоящей из крови, сыворотки, пота, мочи, спинномозговой жидкости, слизи, спермы, кала, смыва бронхоальвеолярного лаважа и ткани.
4. Способ по п. 1, в котором агентом является токсин окружающей среды, загрязняющее вещество или медикамент.
5. Способ по п. 1, в котором агентом является биологический агент, выбранный из группы, состоящей из агента биологического оружия, аллергена, паразитарного антигена, грибкового антигена, вирусного антигена, бактериального антигена, клеточного антигена и антитела.
6. Способ по п. 1, в котором клеткой биосенсора является В-клетка, Т-клетка, моноцит, макрофаг, клетка НЕК293, клетка СНО, Р815, К562 или клетка Cos-1, стабильно экспрессирующая химерный гибридный белок.
7. Способ по п. 1, в котором клеточная активация представляет собой увеличение внутриклеточных уровней Ca2+.
8. Способ по любому из пп. 1-7, в котором антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRI, представленный в SEQ ID NO:1 или 3, или вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:1 или 3.
9. Способ по любому из пп. 1-7, в котором антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRIII, представленный в SEQ ID NO:2 или 4, или вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:2 или 4.
10. Клетка биосенсора, за исключением человеческого эмбриона или клетки зародышевой линии, стабильно экспрессирующая химерный гибридный белок, при этом химерный гибридный белок содержит антитело-связывающий домен Fcγ-рецептора (FcγR), трансмембранный домен и сигнальный домен, где сигнальным доменом является сигнальный домен альфа-иммуноглобулина (Igα), представленный в SEQ ID NO:5, или функционально активный вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:5, или где трансмембранным доменом вместе с сигнальным доменом является мембранный Ig, представленный в SEQ ID NO:6, или функционально активный вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:6.
11. Клетка биосенсора по п. 10, в которой клеткой биосенсора является В-клетка, Т-клетка, моноцит, макрофаг, клетка НЕК293, клетка СНО, Р815, К562 или клетка Cos-1, стабильно экспрессирующая химерный гибридный белок.
12. Клетка биосенсора по п. 10, в которой антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRI, представленный в SEQ ID NO:1 или 3, или вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:1 или 3.
13. Клетка биосенсора по п. 10, в которой антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRIII, представленный в SEQ ID NO:2 или 4, или вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:2 или 4.
14. Химерный гибридный белок для обнаружения агента-мишени в образце, который содержит антитело-связывающий домен Fcγ-рецептора (FcγR), трансмембранный домен и сигнальный домен, где сигнальным доменом является сигнальный домен альфа-иммуноглобулина (Igα), представленный в SEQ ID NO:5, или функционально активный вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:5, или где трансмембранным доменом вместе с сигнальным доменом является мембранный Ig, представленный в SEQ ID NO:6, или функционально активный вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:6.
15. Химерный гибридный белок по п. 14, в котором антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRI, представленный в SEQ ID NO:1 или 3, или вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:1 или 3.
16. Химерный гибридный белок по п. 14, в котором антитело-связывающим доменом FcγR является антитело-связывающий домен FcγRIII, представленный в SEQ ID NO:2 или 4, или вариант его последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:2 или 4.
17. Химерный гибридный белок по п. 14, в котором гибридным белком является гибридный белок FcγRI/Igα, представленный в SEQ ID NO:8, или вариант последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:8.
18. Химерный гибридный белок по п. 14, в котором гибридным белком является гибридный белок FcγRIII/Igα, представленный в SEQ ID NO:10, или вариант последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:10.
19. Химерный гибридный белок по п. 14, в котором гибридным белком является гибридный белок FcγRI/мембранный Ig, представленный в SEQ ID NO:22, или вариант последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:22.
20. Химерный гибридный белок по п. 14, в котором гибридным белком является гибридный белок FcγRIII/мембранный Ig, представленный в SEQ ID NO:23, или вариант последовательности, характеризующийся по меньшей мере 95% идентичностью последовательности относительно всей длины SEQ ID NO:23.
21. Полинуклеотид, кодирующий химерный гибридный белок по любому из пп. 14-20.
22. Клонирующий вектор, содержащий полинуклеотид по п. 21.
23. Способ получения химерного гибридного белка по любому из пп. 14-20, содержащий культивирование клетки по п. 10 в условиях, способствующих экспрессии гибридного белка, и выделение гибридного белка из клетки или культуры клеток.
| WO 2010105817, 23.09.2010 | |||
| WO 2011115583, 22.09.2011 | |||
| RIDER T | |||
| H | |||
| et al., AB cell-based sensor for rapid identification of pathogens, Science, 2003, V | |||
| Прибор для исправления снимков рельефа местности | 1921 |
|
SU301A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ РАЗЪЕДИНЕНИЯ КАМНЕЛОВУШКИ ОТ СВЕКЛОМОЙКИ | 1926 |
|
SU5630A1 |
| MELLMAN I | |||
| R | |||
| A | |||
| et al., Structure and function of Fc receptors on macrophages and lymphocytes, J | |||
| Cell Sci | |||
| Suppl, 1988, V | |||
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| WINES B | |||
| D | |||
| et al., The IgG | |||
Авторы
Даты
2021-04-14—Публикация
2016-03-11—Подача