ОБЛАСТЬ ТЕХНИКИ К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к новой технологии, связанной с иммунной толерантностью. Более конкретно, настоящее изобретение относится к антителу, которое индуцирует иммунную толерантность, индуцированным лимфоцитам или терапевтическому агенту/способу клеточной терапии с использованием индуцированных лимфоцитов.
УРОВЕНЬ ТЕХНИКИ
[0002]
Трансплантация печени широко используется в качестве финального лечения пациентов с печеночной недостаточностью в терминальной стадии. Ежегодно за границей проводят 20000 и более трансплантаций печени, а в Японии - более 500.
[0003]
Трансплантация является одним из основных методов лечения органной недостаточности почек, сердца, печени, поджелудочной железы и т.п. в терминальной стадии заболевания. Несмотря на то, что в последние годы достигнут значительный прогресс в лечении отторжения трансплантата, большинство трансплантатов в конечном итоге отторгаются в отсутствие иммуносупрессивного режима. Современный медикаментозный режим иммуносупрессии, который зависит от непрерывной медикаментозной терапии, подавляет не только ответы, которые явно направлены на трансплантированные органы, но также и все иммунные ответы, вследствие чего пациенты с трансплантированными органами становятся более уязвимыми из-за повышенной чувствительности к инфекциям и раку.
[0004]
Хотя методы регенеративной медицины привлекают все большее внимание, иммунное отторжение в конечном итоге возможно и без участия аутологичных клеток, даже если используются индуцированные плюрипотентные стволовые клетки (iPS-клетки) или что-то подобное. Таким образом, внимание привлекли методы, обеспечивающие иммунную толерантность.
[0005]
Такие методы индуцирования иммунной толерантности включают индукцию антиген-специфического неиммунного ответа (анергии) Т-клеток. Имеются сообщения о конкретных методах, включая метод непосредственного введения пациенту после трансплантации органа антитела, которое ингибирует взаимодействия между CD80/CD86 на антигенпрезентирующих клетках и CD28 на неактивированных (наивных) Т-клетках, вызывая в организме донорную антиген-специфическую анергию (Патентная литература 1), и метод совместного культивирования реципиентных клеток и облученных радиацией донорных клеток в присутствии одного и того же антитела для индукции донорных антиген-специфических анергических клеток ex vivo и возвращения указанных клеток реципиенту (Патентная литература 2, Патентная литература 3 и непатентная литература 1-3),
Литература
Патентная литература
[0006]
[PTL 1] Выложенная публикация PCT на национальной фазе в Японии №2002-504120
[PTL 2] Выложенная публикация PCT на национальной фазе в Японии №2007-131598
[PTL 3] Выложенная публикация PCT на национальной фазе в Японии №2016-520081
Непатентная литература
[0007]
[NPL 1] Satoru Todo et al. Hepatorogy, 64 (vol. 2), 632-643 (2016)
[NPL 2] Teraoka S, Koyama I, Bashuda H, Uchida K, Tonsho M, et al. (2017) J Transplant Res 2(1) p1-8
[NPL 3] Bashuda H et al., J. Clin. Invest. 115: 1896-1902 (2005).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Решение проблемы
[0008]
Авторы изобретения попытались вызвать неиммунный ответ (анергию), используя антитело со специфической человеческой Fc-областью, которое ингибирует взаимодействие между CD80/CD86 и CD28, в результате чего было обнаружено, что связывание с клеткой, участвующей в иммунной системе, такой как макрофаг, нейтрофилы или естественные клетки-киллеры (NK), активирует эту клетку и индуцирует высвобождение гуморального фактора, такого как интерлейкин или интерферон (IFN), который отвечает за иммунные ответы. Авторы изобретения также обнаружили, что высвобождение этих гуморальных факторов вызывает неблагоприятную активацию иммунной системы, которая является противоположностью иммунной толерантности, следовательно, эффект иммунной толерантности может быть улучшен или ослабление эффекта иммунной толерантности может быть подавлено путем регулирования индукции неиммунных ответов (анергии) с помощью антитела с человеческой Fc-областью, которое не связывается с этими клетками. Таким образом, настоящее изобретение относится к антителу со структурой, позволяющей улучшать или не ослаблять эффект иммунной толерантности.
[0009]
Следовательно, предоставляется следующее:
(1) Антитело или его вариант, которое ингибируют взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности клетки, и CD28, экспрессируемым на поверхности другой клетки, при этом антитело или его вариант по существу не индуцирует продуцирование цитокина путем иммуностимуляции.
(2) Антитело или его вариант по предшествующему пункту, где цитокин включает интерферон γ.
(3) Антитело или его вариант по любому из предшествующих пунктов, которое является химерным антителом.
(4) Антитело или его вариант по любому из предшествующих пунктов, где антитело относится к подклассу IgG1.
(5) Антитело или его вариант по любому из предшествующих пунктов, имеющее тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 38 или 42, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 40 или 44.
(6) Антитело или его вариант по любому из предшествующих пунктов, содержащее:
(a) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 53, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 54, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 55, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 56, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 57, и CDRL3, приведенную в SEQ ID NO: 58; или
(b) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 59, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 60, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 61, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 62, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 63, и CDRL3, приведенную в SEQ ID NO: 64.
(7) Антитело или его вариант по любому из предшествующих пунктов, содержащее:
(а) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 46, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 48, или ее вариантную последовательность; или
(b) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 50, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 52, или ее вариантную последовательность.
(8) Антитело или его вариант по любому из предшествующих пунктов, в котором Fc-фрагмент антитела представляет собой фрагмент, который по существу не индуцирует продуцирование цитокина путем иммуностимуляции.
(9) Антитело или его вариант по любому из предшествующих пунктов, где антитело относится к подклассу IgG2 или IgG4.
(10) Антитело или его вариант по любому из предшествующих пунктов, где антитело относится к подклассу IgG4.
(11) Антитело или его вариант по любому из предшествующих пунктов, где вариант антитела представляет собой вариант, в котором отсутствует Fc-фрагмент антитела.
(12) Антитело или его вариант по любому из предшествующих пунктов, где вариант антитела представляет собой Fab антитело, F(ab')2 антитело, Fab' антитело, Fv антитело или scFv антитело.
(13) Антитело или его вариант по любого из предыдущих пунктов, обладающие способностью вызывать иммунную толерантность.
(14) Антитело или его вариант по любому из предшествующих пунктов, где клетка, экспрессирующая CD80 и/или CD86, представляет собой антигенпрезентирующую клетку, а другая клетка, экспрессирующая CD28, представляет собой Т-клетку.
(15) Антитело по любому из предшествующих пунктов, где антитело или его вариант представляет собой антагонистическое антитело к CD80, антагонистическое антитело к CD86, антагонистическое антитело к CD28 или биспецифическое антагонистическое антитело к CD80 и CD86, или его вариант.
(16) Антитело или его вариант по любому из предшествующих пунктов, которое представляет собой гуманизированное антитело, или человеческое антитело, или его вариант.
(17) Антитело или его вариант по любому из предшествующих пунктов, содержащее Fc-фрагмент IgG2 или IgG4 человеческого антитела.
(18) Антитело или его вариант по любому из предшествующих пунктов, содержащее Fc-фрагмент IgG4 человеческого антитела.
(19) Антитело или его вариант по любому из предшествующих пунктов, содержащее:
(a) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 26, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 28, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 29, и CDRL3, приведенную в SEQ ID NO: 30; или
(b) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 31, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 32, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 33, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 34, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 35, и CDRL3, приведенную в SEQ ID NO: 36.
(20) Антитело или его вариант по любому из предшествующих пунктов, содержащее:
(а) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 18, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 20, или ее вариантную последовательность; или
(b) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 22, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 24, или ее вариантную последовательность.
(21) Молекула нуклеиновой кислоты, кодирующая аминокислотную последовательность или ее часть антитела или его варианта по любому из предшествующих пунктов.
(22) Молекула нуклеиновой кислоты по любому из предшествующих пунктов, содержащая:
(a) полинуклеотид, кодирующий VH, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 17 или SEQ ID NO: 45, и полинуклеотид, кодирующий VL, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 19 или SEQ ID NO: 47; или
(b) полинуклеотид, кодирующий VH, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 21 или SEQ ID NO: 49, и полинуклеотид, кодирующий VL, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 23 или SEQ ID NO: 51.
(23) Вектор, содержащий молекулу нуклеиновой кислоты по любому из предшествующих пунктов.
(24) Клетка, содержащая молекулу нуклеиновой кислоты по любому из предшествующих пунктов или вектор по пункту 23.
(25) Способ получения антитела или его варианта по любому из предшествующих пунктов, включающий культивирование клетки по любому из предшествующих пунктов.
(26) Клетка с иммунной толерантностью, индуцированной антителом или его вариантом по любому из предшествующих пунктов.
(27) Клетка по любому из предшествующих пунктов, в которой иммунная толерантность индуцируется путем смешивания антитела или его варианта, клетки, происходящей от индивида, и антигена, который не происходит от индивида, или материала, содержащего этот антиген.
(28) Композиция для получения клетки с индуцированной иммунной толерантностью, содержащая по меньшей мере одно из антитела или его варианта по любому из предшествующих пунктов.
(29) Композиция по любому из предшествующих пунктов, содержащая антагонистическое антитело к CD80, антагонистическое антитело к CD86, антагонистическое антитело к CD28 или биспецифическое антагонистическое антитело к CD80 и CD86 или их вариант, или любую их комбинацию.
(30) Способ получения клетки для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, который не происходит от индивида, включающий смешивание антитела или его варианта по любому из предшествующих пунктов, клетки, полученной от индивида, и антигена, который не происходит от индивида, или материала, содержащего этот антиген.
(31) Способ по любому из предшествующих пунктов, в котором заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки или ES клетки и клетки, ткани или органа, полученного из указанных клеток.
(32) Способ по любому из предшествующих пунктов, в котором материал, содержащий антиген, представляет собой клетку.
(33) Клетка, полученная по любому из предшествующих пунктов.
(34) Клетка по любому из предшествующих пунктов, содержащая Т-клетку.
(35) Агент клеточной терапии, содержащий клетку с иммунной толерантностью, индуцированной антителом или его вариантом по любому из предшествующих пунктов, клетку, произведенную способом по любому из предшествующих пунктов, или клетку по любому из предшествующих пунктов.
(36) Композиция для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, чужеродным индивиду, содержащая клетку с иммунной толерантностью, индуцированной антителом или его вариантом по любому из предшествующих пунктов, клетку, произведенную способом по любому из предшествующих пунктов, или клетку по любому из предшествующих пунктов.
(37) Композиция по любому из предшествующих пунктов, где заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(38) Композиция по любому из предшествующих пунктов, где отторжение отличается тем, что трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстый кишечник, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
(39) Способ лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, который не происходит от индивида, у указанного индивида, включающий введение этому индивиду эффективного количества клетки с иммунной толерантностью, индуцированной антителом или его вариантом по любому из предшествующих пунктов, клетки, произведенной способом по любому из предшествующих пунктов, или клетки по любому из предшествующих пунктов.
(40) Способ по любому из предшествующих пунктов, в котором заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(41) Способ по любому из предшествующих пунктов, где отторжение отличается тем, что трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстый кишечник, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
(39A) Применение клетки с иммунной толерантностью, индуцированной антителом или его вариантом по любому из предшествующих пунктов, клетки, произведенной способом по любому из предшествующих пунктов, или клетки по любому из предшествующих пунктов, для производства лекарственного средства для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, который не происходит от индивида, у указанного индивида.
(40A) Применение по любому из предшествующих пунктов, где заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(41A) Применение по любому из предшествующих пунктов, где отторжение отличается тем, что трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстый кишечник, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
(39B) Клетка с иммунной толерантностью, индуцированной антителом или его вариантом по любому из предшествующих пунктов, клетка, полученная способом по любому из предшествующих пунктов, или клетка по любому из предшествующих пунктов для производства лекарственного средства для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, который не происходит от индивида, у указанного индивида.
(40B) Клетка по любому из предшествующих пунктов, где заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(41B) Клетка по любому из предшествующих пунктов, где отторжение отличается тем, что трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстый кишечник, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
Предлагается также следующее.
(A1) Антитело, которое ингибирует взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности клетки, и CD28, экспрессируемым на поверхности другой клетки, при этом антитело по существу не индуцирует продуцирование цитокина путем иммуностимуляции.
(A2) Антитело по п. (A1), где цитокин включает интерферон γ.
(A3) Антитело по п. (A1) или п. (A2), где Fc-фрагмент антитела представляет собой фрагмент, который по существу не индуцирует продуцирование цитокина путем иммуностимуляции.
(A4) Антитело по любому из пп. (A1)-(A3), где антитело относится к подклассу IgG2 или IgG4.
(A5) Антитело по п. (A4), где антитело относится к подклассу IgG4.
(A6) Антитело по п. (A1) или п. (A2), в котором отсутствует Fc-фрагмент.
(A7) Антитело по п. (A6), которое представляет собой Fab антитело, F(ab')2 антитело, Fab' антитело, Fv антитело или scFv антитело.
(A8) Антитело по любому из пп. (A1)-(A7), способное вызывать иммунную толерантность.
(A9) Антитело по любому из пп. (A1)-(A8), где клетка, экспрессирующая CD80 и/или CD86, представляет собой антигенпрезентирующую клетку, а другая клетка, экспрессирующая CD28, представляет собой Т-клетку.
(A10) Антитело по любому из пп. (A1)-(A9), представляющее собой антагонистическое антитело к CD80, антагонистическое антитело к CD86, антагонистическое антитело к CD28 или биспецифическое антагонистическое антитело к CD80 и CD86.
(A11) Антитело по любому из пп. (A1)-(A10), которое представляет собой химерное антитело, гуманизированное антитело или человеческое антитело.
(A12) Антитело по любому из пп. (A1)-(A11), содержащее Fc-фрагмент IgG2 или IgG4 человеческого антитела.
(A13) Антитело по любому из пп. (A1)-(A12), содержащее Fc-фрагмент IgG4 человеческого антитела.
(A14) Антитело по любому из пп. (A1)-(A13), содержащее:
(a) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 26, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 28, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 29, и CDRL3, приведенную в SEQ ID NO: 30; или
(b) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 31, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 32, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 33, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 34, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 35, и CDRL3, приведенную в SEQ ID NO: 36.
(A15) Антитело по п. (A14), содержащее:
(а) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 18, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 20, или ее вариантную последовательность; или
(b) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 22, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 24, или ее вариантную последовательность.
(A16) Молекула нуклеиновой кислоты, кодирующая аминокислотную последовательность или ее часть антитела по любому из пп. (A1)-(A15).
(A17) Молекула нуклеиновой кислоты по п. (A16), содержащая:
(а) полинуклеотид, кодирующий VH, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 17, и полинуклеотид, кодирующий VL, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 19; или
(b) полинуклеотид, кодирующий VH, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 21, и полинуклеотид, кодирующий VL, с нуклеотидной последовательностью, приведенной в SEQ ID NO: 23.
(A18) Вектор, содержащий молекулу нуклеиновой кислоты по п. (A16) или п. (A17).
(A19) Клетка, содержащая молекулу нуклеиновой кислоты по п. (A16) или п. (A17) или вектор по п. (A18).
(A20) Способ получения антитела по любому из пп. (A1)-(A15), включающий культивирование клетки по п. (A19).
(A21) Клетка с иммунной толерантностью, индуцированной антителом по любому из пп. (A1)-(A15).
(A22) Клетка по п. (A21), иммунная толерантность которой индуцируется смешиванием антитела, клетки, полученной от индивида, и антигена, который не происходит от индивида, или материала, содержащего этот антиген.
(A23) Композиция для получения клетки с индуцированной иммунной толерантностью, содержащая по меньшей мере одно из антител по любому из пп. (A1)-(A15).
(A24) Композиция по п. (A23), содержащая антагонистическое антитело к CD80, антагонистическое антитело к CD86, антагонистическое антитело к CD28 или биспецифическое антагонистическое антитело к CD80 и CD86, или любую их комбинацию.
(A25) Способ получения клетки для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, чужеродным индивиду, включающий смешивание антитела по любому из пп. (A1)-(A15), клетки полученной от индивида, и антигена, который не происходит от индивида, или материала, содержащего этот антиген.
(A26) Способ по п. (A25), где заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(A27) Способ по п. (A25) или п. (A26), где материал, содержащий антиген, представляет собой клетку.
(A28) Клетка, полученная способом по любому из пп. (A25)-(A27).
(A29) Клетка по п. (A28), содержащая Т-клетку.
(A30) Агент клеточной терапии, содержащий клетку с иммунной толерантностью, индуцированной антителом по любому из пп. (A1)-(A15), клетку, произведенную способом по п. (A25) или п. (A26), или клетку по пп. (A21), (A22), (A28) или (A29).
(A31) Композиция для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, чужеродным индивиду, содержащая клетку с иммунной толерантностью, индуцированной антителом по любому из пп. (A1)-(A15), клетку, произведенную способом по п. (A25) или п. (A26), или клетку по пп. (A21), (A22), (A28) или (A29).
(A32) Композиция по п. (A31), где заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(A33) Композиция по п. (A32), где отторжение характеризуется тем, что трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, большой кишечник, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
(A34) Способ лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, который не происходит от индивида, у указанного индивиде, включающий введение индивиду эффективного количества клетки с иммунной толерантностью, индуцированной антителом по любому из пп. (A1)-(A15), клетки, произведенной способом по п. (A23) или п. (A24), или клетки по пп. (A21), (A22), (A28) или (A29).
(A35) Способ по п. (A34), где заболевание, расстройство или состояние выбирают из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, болезни трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
(A36) Способ по п. (A35), в котором отторжение отличается тем, что трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, большой кишечник, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
[0010]
Дополнительно предоставляется следующее.
(B1) Антитело, имеющее Fc-область человека, где антитело может ингибировать взаимодействие между CD80 или CD86, экспрессируемым на клеточной поверхности, и CD28, экспрессируемым на другой клеточной поверхности, и не способствует продуцированию цитокинов человеческими PBMC.
(B2) Антитело по п. (B1), которое может ингибировать взаимодействие между CD80 или CD86, экспрессируемым на поверхности антигенпрезентирующих клеток, и CD28, экспрессируемым на поверхности Т-клеток.
(B3) Антитело по п. (B1) или п. (B2), которое может индуцировать иммунную толерантность к антигену путем контактирования антитела с PBMC вместе с антигеном или клеткой, несущей антигеном на своей поверхности.
(B4) Антитело по любому из пп. (B1)-(B3), где цитокин представляет собой IFNγ.
(B5) Антитело к любому из пп. (B1)-(B4), которое представляет собой анти-CD80 антитело или анти-CD86 антитело.
(B6) Антитело по любому из пп. (B1)-(B5), которое представляет собой химерное антитело, гуманизированное антитело или человеческое антитело.
(B7) Антитело по любому из пп. (B1)-(B6), которое является моноклональным антителом.
(B8) Антитело по любому из пп. (B1)-(B7), которое относится к подклассу IgG2 или IgG4.
(B8A) Антитело по любому из пп. (B1)-(B7), которое относится к подклассу IgG1.
(B8B) Антитело по п. (B8A), имеющее тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO. выбранной из SEQ ID NO: 38 и 42.
(B8C) Антитело по п. (B8B), имеющее:
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 38, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 40, или
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 42, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 44.
(B8D) Антитело по любому из пп. (B1)-(B7) и (B8A)-(B8C), имеющее CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 55 или 61.
(B8E) Антитело (B8D), которое представляет собой:
(Bi) антитело, имеющее CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 53, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 54, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 55, или
(Bii) антитело, имеющее CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 59, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 60, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 61.
(B8F) Антитело (Bi) по п. (B8E), имеющее CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 56, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 57, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 58, или
антитело (Bii) по п. (B8E), имеющее CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 62, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 63, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 64.
(B8G) Антитело по п. (B8D), имеющее вариабельную область тяжелой цепи (VH) с аминокислотной последовательностью, приведенной в SEQ ID NO: 46 или 50.
(B8H) Антитело по п. (B8G), имеющее VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 46, и вариабельную область легкой цепи (VL) с аминокислотной последовательностью, приведенной в SEQ ID NO: 48, или имеющее VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 50, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 52.
(B8I) Антитело по п. (B8G), имеющее тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO., выбранной из SEQ ID NO: 38 и 42.
(B8J) Антитело по п. (B8I), имеющее:
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 38, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 40, или
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 42, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 44.
(B9) Антитело по любому из пп. (B1)-(B8), имеющее CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO 27 или 33.
(B10) Антитело (B9), которое представляет собой:
(Bi) антитело, имеющее CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 26, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27, или
(Bii) антитело, имеющее CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 31, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 32, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 33.
(B11) Антитело (Bi) по п. (B10), имеющее CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 28, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 29, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 30, или
антитело (Bii) по п. (B10), имеющее CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 34, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 35, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 36.
(B12) Антитело по п. (B9), имеющее вариабельную область тяжелой цепи (VH) с аминокислотной последовательностью, приведенной в SEQ ID NO: 18 или 22.
(B13) Антитело по п. (B12), имеющее VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 18, и вариабельную область легкой цепи (VL) с аминокислотной последовательностью, приведенной в SEQ ID NO: 20, или имеющее VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 22, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 24.
(B14) Антитело по п. (B12), имеющее тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO., выбранной из SEQ ID NO: 2, 6, 10 и 14.
(B15) Антитело по п. (B14), имеющее:
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 2, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 4;
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 6, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 8;
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 10, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 12; или
тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 14, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 16.
(B16) Медицинская композиция, содержащая антитело по любому из пп. (B1)-(B15).
(B17) Медицинская композиция по п. (B16), содержащая анти-CD80 антитело и анти-CD86 антитело.
(B18) Медицинский композиция по п. (B16) или п. (B17), используемая для индукции иммунной толерантности.
(B19) Медицинская композиция по п. (B18), используемая для индукции иммунной толерантности в клетке, полученной от пациента, получающего трансплантацию органа.
(B20) Медицинская композиция по п. (B19) или п. (B20), в которой орган, подлежащий трансплантации, представляет собой сердце, почку или печень.
(B21) Медицинская композиция по п. (B18), используемая для индукции иммунной толерантности у пациента с аутоиммунным заболеванием или аллергическим заболеванием.
(B22) Молекула нуклеиновой кислоты, кодирующая аминокислотную последовательность антитела по любому из пп. (B12)-(B15).
(B23) Молекула нуклеиновой кислоты по п. (B22), содержащая полинуклеотид, кодирующий VH, с нуклеотидной последовательностью, выбранной из: SEQ ID NO: 1, 5, 9 и 13, и полинуклеотид, кодирующий VL, с нуклеотидной последовательностью, выбранной из: SEQ ID NO: 3, 7, 11 и 15.
(B24) Вектор, содержащий молекулу нуклеиновой кислоты по п. (B22) или п. (B23).
(B25) Клетка-хозяин, имеющая вектор по п. (B24).
(B26) Способ получения антитела по любому из пп. (B1)-(B15), включающий культивирование клетки-хозяина по п. (B25).
(B27) Способ индукции иммунной толерантности к антигену PBMC, включающий контактирование антитела по любому из пп. (B1)-(B15), с антигеном, к которому должна быть индуцирована иммунная толерантность, или клеткой, несущей антигеном на своей поверхности, и PBMC.
(B28) Метод индукции по п. (B27), который осуществляют ex vivo.
(B29) Способ по п. (B27) или п. (B28), где PBMC представляет собой клетку, полученную от пациента, получающего трансплантацию органа.
(B30) Способ по п. (B27) или п. (B28), где PBMC представляет собой клетку, полученную от пациента с аутоиммунным заболеванием или аллергическим заболеванием.
(B31) PBMC с иммунной толерантностью, индуцированной способом по любому из пп. (B27)-(B30).
(B32) Агент клеточной терапии, содержащий PBMC по п. (B30) в качестве активного ингредиента.
(B33) Агент клеточной терапии по п. (B32) для подавления отторжения при трансплантации органов.
(B34) Агент клеточной терапии по п. (B33), где трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстую кишку, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
(B35) Агент клеточной терапии по п. (B32) для лечения аутоиммунного заболевания или аллергического заболевания.
(B36) Способ подавления отторжения при трансплантации органа, включающий введение антитела по любому из пп. (B1)-(B15) пациенту, получающего трансплантацию органа.
(B37) Способ по п. (B36), где трансплантированный орган представляет собой почку, печень, сердце, кожу, легкое, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстую кишку, нерв, кровь, клетку крови, включая клетку иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко или костный мозг.
(B37) Способ лечения аутоиммунного заболевания или аллергического заболевания, включающий введение антитела по любому из пп. (B1)-(B15) пациенту с аутоиммунным заболеванием или аллергическим заболеванием.
(B38) Способ подавления отторжения при трансплантации органа, включающий введение агента клеточной терапии по любому из пп. (B32)-(B34) пациенту, получающего трансплантацию органа.
(B39) Способ лечения аутоиммунного заболевания или аллергического заболевания, включающий введение агента клеточной терапии по п. (B32) или п. (B35) пациенту с аутоиммунным заболеванием или аллергическим заболеванием.
(B40) Способ по любому из пп. (B27)-(B30), дополнительно включающий введение пациенту PBMC с индуцированной иммунной толерантностью.
(B41) Способ по п. (B40), включающий введение пациенту, получающему трансплантацию органа, PBMC, полученную от пациента с индуцированной иммунной толерантностью к органу, подлежащему трансплантации.
(B42) Способ по п. (B40), включающий введение пациенту с аутоиммунным заболеванием или аллергическим заболеванием PBMC, полученную от пациента с иммунной толерантностью к антигену, который является причиной аутоиммунного заболевания или индуцированного аллергического заболевания.
[0011]
Настоящее описание следует рассматривать как раскрывающее один или более описанных выше признаков не только в виде комбинаций, раскрытых в явном виде, но также и в виде других комбинаций этих признаков. Дополнительные варианты осуществления и преимущества настоящего изобретения станут очевидны специалистам в данной области техники после прочтения и осмысления приведенного ниже подробного описания, при необходимости.
[Преимущество настоящего изобретения]
[0012]
Антитело по настоящему изобретению подавляет продуцирование IFNγ, сохраняя при этом способность индуцировать иммунную толерантность. В частности, использование антител подкласса IgG2 или IgG4 по настоящему изобретению позволяет получить клетку с индуцированной иммунной толерантностью, не продуцирующую IFNγ.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0013]
[Фиг. 1] На фиг. 1 показаны результаты реакции смешанной культуры лимфоцитов (включение 3H-тимидина) в присутствии антител к человеческому CD80 и анти-CD86 антител (IgG1).  ; без добавления донора, без добавления антитела, Allo; добавлен донор, без добавления антитела. Концентрации каждого добавленного антитела равны 10, 1 и 0,1 (мкг/мл). По вертикальной оси отложена величина включения 3H-тимидина, исходя из отсутствия добавленных антител (Allo).
; без добавления донора, без добавления антитела, Allo; добавлен донор, без добавления антитела. Концентрации каждого добавленного антитела равны 10, 1 и 0,1 (мкг/мл). По вертикальной оси отложена величина включения 3H-тимидина, исходя из отсутствия добавленных антител (Allo).
[Фиг. 2] На фиг. 2 показаны результаты реакции смешанной культуры лимфоцитов (продуцирование IFNγ) в присутствии антител к человеческому CD80 и анти-CD86 антител (IgG1). По вертикальной оси отложена концентрация в среде (пг/мл).
[Фиг. 3] На фиг. 3 показаны результаты реакции смешанной культуры лимфоцитов (включение 3H-тимидина) в присутствии антител к человеческому CD80 и анти-CD86 антител (IgG1). По вертикальной оси отложена величина включения 3H-тимидина, исходя из отсутствия добавленных антител (Allo).
[Фиг. 4] На фиг. 4 показаны результаты реакции смешанной культуры лимфоцитов (продуцирование IFNγ) в присутствии антител к человеческому CD80 и анти-CD86 антител (IgG1). Верхний ряд: со стимуляцией донором, нижний ряд: без стимуляции донором. * представляет 50000 пг/мл или больше. По вертикальной оси отложена концентрация в среде (пг/мл).
[Фиг. 5] На фиг. 5 показаны результаты смешанной реакции лимфоцитов (включение 3H-тимидина) в присутствии анти-CD80 и анти-CD86 антител (IgG2, IgG4). По вертикальной оси отложена величина включения 3H-тимидина, исходя из отсутствия добавленных антител (Allo). Концентрации каждого добавленного антитела равна 10, 3 и 1 (мкг/мл).
[Фиг. 6] На фиг. 6 показаны результаты реакции смешанной культуры лимфоцитов (продуцирование IFNγ) в присутствии анти-CD80 и анти-CD86 антител (IgG1, IgG2, IgG4). По вертикальной оси отложена концентрация в среде (пг/мл).
[Фиг. 7] На фиг. 7 показаны результаты реакции смешанной культуры лимфоцитов (включение 3H-тимидина) при добавлении клетки, полученной в присутствии анти-CD80 и анти-CD86 антител (IgG1, IgG2, IgG4). По вертикальной оси отложена величина включения 3H-тимидина, исходя из отсутствия добавленных антител (Allo). 1/2, 1/4 и 1/8 представляют собой отношения смеси клеток, полученных в присутствии анти-CD80 и анти-CD86 антител (IgG1, IgG2, IgG4), к наивным клеткам-респондерам.
[Фиг. 8] На фиг. 8 показаны результаты реакции смешанной культуры лимфоцитов (продуцирование IFNγ) в присутствии химерных анти-CD80 антител и химерных анти-CD86 антител. По вертикальной оси отложена концентрация в среде (пг/мл).
[Фиг. 9] На фиг. 9 показаны результаты реакции смешанной культуры лимфоцитов (включение 3H-тимидина) при добавлении клетки, полученной в присутствии химерных анти-CD80 и химерных анти-CD86 антител. По вертикальной оси отложена величина включения 3H-тимидина, исходя из отсутствия добавленных антител (Allo). 1/2, 1/4, 1/8 и 1/16 представляют собой отношения смеси клеток, полученных в присутствии химерных анти-CD80 и химерных анти-CD86 антител, к наивным клеткам-респондерам.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0014]
Термины, используемые в настоящем описании, следует понимать в том значении, в котором они обычно используются в данной области техники, если специально не указано иное. Следовательно, если не указано иное, все термины и научно-технические термины, которые используются в настоящем описании, имеют такое же значение, как их обычно понимают специалисты в области техники, к которой относится настоящее изобретение. В случае противоречия настоящее описание (включая определения) имеет приоритет.
[0015]
Определение терминов
В контексте настоящего описания термин «примерно» относится к диапазону ±10% следующего за ним числового значения.
[0016]
В контексте настоящего описания «иммунная толерантность» относится к состоянию, при котором специфический иммунный ответ на конкретный антиген не проявляется или специфический иммунный ответ подавлен. Иммунная толерантность также может относиться к любому или обоим состояниям из: состояния, при которых иммунная клетка (в частности, Т-клетка) не демонстрирует специфический иммунный ответ на конкретный антиген или специфический иммунный ответ подавлен, и состояния, при котором у человека не наблюдается специфический иммунный ответ на определенный антиген или специфический иммунный ответ подавлен. Иммунная толерантность привлекает внимание, поскольку создание иммунной толерантности позволяет лечить иммунное отторжение или аллергию. В контексте настоящего описания термин «анергия» относится к состоянию, при котором при презентации антигена антигенпрезентирующей клеткой не возникает костимуляция, в результате чего клетка в последующий раз не сможет ответить стимуляцию в условиях костимуляции. Используемый в настоящем описании термин «PBMC (или T-клетка) с индуцированной иммунной толерантностью» является синонимом термину «анергическая PBMC (или T-клетка)».
[0017]
В контексте настоящего описания «индивид» включает домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и нечеловеческих приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В конкретном варианте осуществления индивидом является человек.
[0018]
В контексте настоящего описания «иммуностимуляция» относится к стимуляции, применяемой к клеткам иммунной системы (например, макрофагам, нейтрофилам, естественным киллерам (NK), Т-клеткам, В-клеткам и т.д.), или пролиферации клеток в иммунной системе. Продуцирование цитокинов (например, INF) или цитотоксическая активность индуцируются путем стимуляции клеток иммунной системы.
[0019]
В контексте настоящего описания термин «по существу не индуцирует продуцирование цитокина путем иммуностимуляции» относится к индукции продуцирования цитокинов, составляющего примерно 20% или менее от количества цитокинов, продуцируемых клетками (например, макрофагами, нейтрофилами, естественными киллерными (NK) клетками, Т-клетками, В-клетками и т.д.), полученными от индивида в присутствии антигена и в отсутствие антитела по настоящему изобретению.
[0020]
В контексте настоящего описания термин «антитело» в широком смысле относится к молекуле или группе молекул, которая может специфически связываться со специфическим эпитопом на антигене. В контексте настоящего описания «антитело» может быть полноразмерным антителом (т.е. антителом с Fc-фрагментом) или антителом, не содержащим Fc-фрагмента. Антитело, лишенное Fc-фрагмента, должно быть способно связываться только с представляющим интерес антигеном. Примеры такого антитела включают, без ограничения, Fab антитела, F(ab')2 антитела, Fab' антитела, Fv антитела и scFv антитела и т.п. Антитела также включают модифицированные и немодифицированные антитела. Что касается модифицированных антител, антитело может быть связано с различными молекулами, такими как полиэтиленгликоль. Модифицированное антитело может быть получено в результате химической модификации антитела с помощью известного метода.
[0021]
В контексте настоящего описания термин «антитело» в узком смысле относится к иммуноглобулину или его группе, который может специфически связываться со специфическим эпитопом антигена. Его вариантная форма называется «вариантом антитела». В контексте настоящего описания термин «антитело», в узком смысле, может представлять собой полноразмерное антитело (т.е. антитело с Fc-фрагментом). В настоящем описании «вариант антитела» может представлять собой вариант, в котором отсутствует Fc-фрагмент описанного выше антитела. Следовательно, в контексте настоящего описания антитело в узком смысле также может называться полноразмерным антителом, а вариант антитела также может называться вариантом полноразмерного антитела. Вариант, не содержащий Fc-фрагмент, должен быть способен связываться только с представляющим интерес антигеном. Примеры такого варианта включают, без ограничения, Fab антитела, F(ab')2 антитела, Fab' антитела, Fv антитела и scFv антитела и т.п. Варианты антитела также включают модифицированные антитела и немодифицированные антитела. Что касается модифицированных антител, антитело может быть связано с различными молекулами, такими как полиэтиленгликоль. Модифицированное антитело может быть получено в результате химической модификации антитела с помощью известного метода.
[0022]
В одном из вариантов настоящего описания «поликлональное антитело» может быть получено, например, путем введения иммуногена, содержащего представляющий интерес антиген, млекопитающему (например, крысе, мыши, кролику, корове, обезьяне или т.п.), птицам или т.п., чтобы индуцировать продуцирование поликлонального антитела, специфичного к антигену. Иммуноген можно вводить с помощью одного или более иммунологических агентов и инфузии адъюванта, при необходимости. Адъювант может использоваться для усиления иммунных ответов и может включать адъювант Фрейнда (полный или неполный), минеральный гель (гидроксид алюминия или т.п.), поверхностно-активное вещество (лизолецитин или т.п.) или т.п. Протокол иммунизации известен в данной области и может быть выполнен любым способом, который индуцирует иммунный ответ в соответствии с выбранным организмом-хозяином («Tanpakushitsu Jikken Handobukku [Protein experiment handbook], Yodosha (2003): 86-91»).
[0023]
В одном из вариантов осуществления настоящего изобретения «моноклональное антитело» включает отдельные антитела, составляющие популяцию, которые являются идентичными антителами, соответствующими, по существу, одному эпитопу, за исключением антител, содержащих мутацию, которая может возникать естественным образом в небольших количествах. Кроме того, отдельные антитела, составляющие популяцию, могут быть антителами, которые по существу одинаковы, за исключением антител, имеющих мутацию, которая может естественным образом в небольших количествах. Моноклональные антитела имеют высокую специфичность и отличаются от обычных поликлональных антител, которые обычно включают разные антитела, соответствующие разным эпитопам, и/или разные антитела, соответствующие одному и тому же эпитопу. В дополнение к специфичности моноклональные антитела полезны в том смысле, что они могут быть синтезированы из культуры гибридомы, которая не загрязнена другими иммуноглобулинами. Описание «моноклональное» может указывать на то, что антитело получено из по существу гомогенной популяции антител. Однако такое описание не означает, что антитела должны быть получены конкретным способом. Например, моноклональные антитела могут быть получены методом, аналогичным методу гибридомы, описанному в «Kohler G, Milstein C., Nature. 1975 Aug 7; 256(5517): 495-497». Альтернативно, моноклональные антитела могут быть получены методом, аналогичным рекомбинантному методу, описанному в патенте США №4816567. Моноклональные антитела также могут быть выделены из фаговой библиотеки антител с помощью метода, аналогичного описанному в «Clackson et al., Nature. 1991 Aug 15; 352(6336): 624-628» или «Marks et al., J Mol Biol. 1991 Dec 5; 222(3): 581-597». Моноклональные антитела также можно получить способом, описанным в «Tanpakushitsu Jikken Handobukku [Protein experiment handbook], Yodosha (2003): 92-96».
[0024]
В одном из вариантов осуществления настоящего изобретения «химерное антитело» представляет собой, например, вариабельную область антитела, связанную с константной областью антитела между ксеногенными организмами, и может быть сконструировано с помощью методов генной инженерии. Мышиное-человеческое химерное антитело можно получить, например, способом, описанным в "Roguska et al., Proc Natl Acad Sci USA. 1994 Feb 1; 91(3): 969-973". Например, в основном способе получения мышиного-человеческого химерного антитела мышиную лидерную последовательность и последовательность вариабельной области в клонированной кДНК связывают с последовательностью, кодирующей константную область человеческого антитела, уже присутствующую в векторе экспрессии клетки млекопитающего. После связывания мышиной лидерной последовательности и последовательности вариабельной области в клонированной кДНК с последовательностью, кодирующей константную область человеческого антитела, полученная последовательность может быть связана с вектором экспрессии клеток млекопитающих. Фрагмент константной области человеческого антитела может происходить из любой константной области H-цепи человеческого антитела и константной области L-цепи человеческого антитела. Примеры фрагмента человеческой H-цепи включают Cγ1, Cγ2, Cγ3 или Cγ4, а примеры фрагмента L-цепи включают Cλ или Cκ.
[0025]
В одном из вариантов осуществления изобретения «гуманизированное антитело» представляет собой, например, антитело, которое имеет одну или более CDR, полученные из нечеловеческих видов, каркасную область (FR), полученную из человеческого иммуноглобулина, и константную область, полученную из человеческого иммуноглобулина, причем указанное антитело связывается с требуемым антигеном. Антитела можно гуманизировать с помощью различных подходов, известных в данной области (Almagro et al., Front Biosci. 2008 Jan 1; 13: 1619-1633). Примеры включают прививку CDR (Ozaki et al., Blood. 1999 Jun 1; 93(11): 3922-3930), повторное покрытие (Roguska et al., Proc Natl Acad Sci US A. 1994 Feb 1; 91(3): 969-973.), FR перетасовку (Damschroder et al., Mol Immunol. 2007 Apr; 44(11): 3049-3060. Epub 2007 Jan 22.) и т.п. Аминокислотный остаток FR-области человека может быть заменен соответствующим остатком из CDR-донорного антитела с целью изменения (предпочтительно, улучшения) связывания антигена. Замена FR может быть осуществлена способом, хорошо известным в данной области (Riechmann et al., Nature. 1988 Mar 24; 332 (6162): 323-327). Например, остаток FR, который важен для связывания антигена может быть идентифицирован путем моделирования взаимодействия между CDR и остатком FR. Кроме того, аномальный остаток FR в конкретном положении может быть идентифицирован путем сравнения последовательностей.
[0026]
В одном из вариантов осуществления изобретения «человеческое антитело» представляет собой, например, антитело, в котором область, содержащая вариабельную область и константную область тяжелой цепи и вариабельную область и константную область легкой цепи, составляющие антитело, происходит из гена, кодирующего человеческий иммуноглобулин. Примеры основных способов получения включают метод, в котором для получения человеческих антител используются трансгенные мыши, метод фагового дисплея и т.п. Способ, в котором для получения человеческих антител используются трансгенные мыши, дает вместо мышиных антител человеческие антитела, различающиеся по антиген-связывающей способности, если функциональный ген человеческого Ig введен мыши с нокаутом по эндогенному Ig. Кроме того, эту мышь можно иммунизировать для получения человеческих моноклональных антител обычным методом гибридом. Их можно получить, например, способом, описанным в «Lonberg et al., Int Rev Immunol. 1995; 13(1): 65-93». Метод фагового дисплея представляет собой систему, которая обычно экспрессирует экзогенный ген в виде слитого белка, при этом инфекционность фага не теряется на N-конце белка оболочки (g3p, g10p и т.п.) волокнистого фага, такого как вирус М13 или Т7 E coli. Антитела можно получить, например, способом, описанным в «Vaughan et al., Nat Biotechnol. 1996 Mar; 14(3): 309-314».
[0027]
В контексте настоящего описания «вариантная последовательность», в случае аминокислотной последовательности, относится к последовательности с изменением (заменой, добавлением или делецией) по меньшей мере одного аминокислотного остатка относительно исходной последовательности и, в случае последовательности нуклеиновой кислоты, относится к изменению (замене, добавлению или делеции) по меньшей мере одного основания, которое не приведет к сдвигу рамки считывания. Вариантная последовательность имеет функцию, аналогичную исходной последовательности, которая, например, на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентична исходной последовательности. Если исходная последовательность представляет собой антитело, вариантная последовательность предпочтительно не имеет изменений в пределах CDR, но может иметь одно или более изменений, предпочтительно 3 или менее изменений, более предпочтительно 2 или менее изменений и наиболее предпочтительно одно изменение, при условии сохранения связывающей способности или функции исходного антитела. Когда изменение вводится в CDR, специалисты в данной области могут выбрать подходящее изменение, позволяющее сохранить связывающую способность или функцию исходного антитела.
[0028]
В контексте настоящего описания термин «клетка, полученная от индивида» относится к клетке, полученной от индивида, которому вводят композицию по настоящему изобретению, или к клетке, полученной из клетки, которая получена от индивида. В контексте настоящего описания «антиген, происходящий от индивида» относится к антигену, продуцируемому в организме самого индивида, который индуцирует иммунный ответ, такой как антиген, продуцируемый в организме индивида, который вызывает аутоиммунное заболевание у индивида с аутоиммунным заболеванием. В контексте настоящего изобретения термин «антиген, не происходящий от индивида» относится к экзогенному антигену, который может вызывать иммунный ответ. Используемый в настоящем описании термин «антиген-содержащий материал, который не происходит от индивида» относится к любому веществу или набору веществ, содержащих антиген, не происходящий от индивида. Примеры этого включают клетку, популяцию клеток, ткань и т.п., экспрессирующие антиген, не происходящий от индивида.
[0029]
В контексте настоящего описания термин «отторжение трансплантата» относится к иммунной системе индивида, атакующей, повреждающей или разрушающей трансплантированный орган, ткань или клетку у индивида, получающего трансплантацию орган, ткань или клетка.
[0030]
В контексте настоящего описания термин «аллергия» относится к гиперактивному иммунному ответу на антиген, не происходящий от индивида. Антиген, не происходящий от индивида, вызывающий аллергию, также называется аллергеном. Его примеры включают, без ограничения, клещевой антиген, антиген яичного белка, молочный антиген, пшеничный антиген, арахисовый антиген, соевый антиген, гречишный антиген, кунжутный антиген, рисовый антиген, антиген ракообразных, антиген киви, яблочный антиген, банановый антиген, антиген персика, антиген томата, антиген тунца, антиген лосося, антиген скумбрии, антиген говядины, антиген куриного мяса, антиген свинины, антиген перхоти кошки, антиген насекомых, антиген пыльцы, антиген перхоти собаки, грибковый антиген, бактериальный антиген, латекс, гаптен, металл и т.п.
[0031]
В контексте настоящего описания термин «аутоиммунное заболевание» относится к любому заболеванию, при котором иммунная система вызывает нежелательный иммунный ответ на свою собственную клетку, ткань или орган. Примеры аутоиммунного заболевания включают, без ограничения, ревматоидный артрит, рассеянный склероз, диабет 1 типа, воспалительное заболевание кишечника (например, болезнь Крона или язвенный колит), системную красную волчанку, псориаз, склеродермию, аутоиммунное заболевание щитовидной железы, очаговую алопецию, болезнь Грейвса, синдром Гийена-Барре, целиакию, синдром Шегрена, ревматическую лихорадку, гастрит, аутоиммунный атрофический гастрит, аутоиммунный гепатит, панкреатит, отит, орхит, увеит, индуцированный линзами увеит, миастению гравис, первичную гемолитическую микседему, пернициозную анемию, аутоиммунную гемолитическую анемию, болезнь Аддисона, склеродермию, синдром Гудпасчера, нефрит (например, гломерулонефрит), псориаз, вульгарную пузырчатку, пемфигоид, симпатическую офтальмию, идиопатическую тромбоцитопеническую пурпуру, идиопатическую лейкопению, гранулематоз Вегенера, гранулему и полимиозит/дерматомиулезит.
[0032]
В контексте настоящего описания термин «трансплантат против хозяина» относится к трансплантированному органу, ткани или клетке, атакующей, повреждающей или разрушающей в результате иммунного ответа клетку, ткань или орган индивида, которому была проведена трансплантация.
[0033]
В контексте настоящего описания термин «иммунное отторжение, вызванное трансплантацией iPS-клетки или ES-клетки, или клетки, ткани или органа, полученного из указанных клеток» относится к иммунному отторжению, вызванному антигеном iPS-клетки или ES-клетки, или антигеном клетки, ткани или органа, полученного из iPS-клетки или ES-клетки.
[0034]
(Предпочтительные варианты)
Ниже описаны предпочтительные варианты осуществления. Понятно, что варианты осуществления являются примерами настоящего изобретения, следовательно, объем настоящего изобретения не ограничен такими предпочтительными вариантами осуществления. Понятно, что специалисты в данной области техники могут обратиться к приведенным ниже предпочтительным вариантам осуществления, для внесения модификации или изменения в пределах объема настоящего изобретения. Любые из этих вариантов осуществления могут быть объединены специалистами в данной области техники соответствующим образом.
[0035]
В результате попытки индуцировать неиммунный ответ (анергию) с помощью антитела, имеющего человеческую Fc-область, которое ингибирует взаимодействие между CD80 и/или CD86 и CD28, авторы изобретения обнаружили, что подобные попытки приводят к активации клетки, являющейся компонентом иммунной системы, такой как макрофаг, нейтрофил или естественная киллерная (NK) клетка, и вызывают высвобождение гуморального фактора, такого как интерлейкин или интерферон (IFN), которые ответственны за иммунные ответы. Авторы изобретения также обнаружили, что индукция неиммунного ответа (анергии) с помощью антитела, имеющего человеческую Fc-область, связана с проблемой ослабления эффекта иммунной толерантности, поскольку высвобождение этих гуморальных факторов вызывает нежелательную активацию иммунной системы, которая является противоположной иммунной толерантности, и было обнаружено, что эффект иммунной толерантности можно улучшить путем подбора человеческой Fc-области.
[0036]
В частности, было получено химерное антитело, которое ингибирует взаимодействие между CD80 и/или CD86 и CD28 и индуцирует иммунную толерантность, путем иммунизации мышей Balb/c слитым белком рекомбинантный/человеческий CD80/CD86-Fc с последующим выделением мРНК из селезенки мышей, синтеза кДНК, отбора Fab антитела с высокой аффинностью к CD80/CD86, идентифицированного с помощью библиотеки фагового дисплея, созданной с помощью гена, амплифицированного методом ОТ-ПЦР, с последующим введением человеческой Fc-области методом генной инженерии.
[0037]
Чтобы минимизировать вероятность отторжения антитела, используемого для индукции иммунной толерантности, химерное антитело было гуманизировано с помощью метода прививки CDR, разработанного Xoma, с получением гуманизированного антитела (подкласс; IgG1). Полученные гуманизированные анти-CD80 антитела и анти-CD86 антитела (подкласс; IgG1) добавляли в реакцию смешанной культуры лимфоцитов с РВМС (мононуклеарными клетками периферической крови), полученными от двух добровольцев, в качестве донора или реципиента, для оценки супрессорной функции при стимуляции индуцированных клеток одним и тем же антигеном. В частности, у одного добровольца собирали PBMC, облучали излучением в дозе 30 Гр и совместно культивированы в течение 7 дней с PBMC, полученными от другого добровольца, в присутствии гуманизированного анти-CD80/CD86 антитела для индукции анергической клетки, специфической к донорному антигену. Индуцированные клетки добавляли в определенном соотношении к культуре смешанных лимфоцитов, полученных от тех же реципиента и донора, и по уровню включения меченного тритием тимидина измеряли способность подавлять деление и пролиферацию клеток с помощью стимуляции антигеном. В результате было подтверждено, что гуманизированные анти-CD80 антитела и анти-CD86 антитела значительно подавляют включение тимидина, и клетки, индуцированные такими антителами, вновь приобретали супрессорную функцию.
[0038]
Однако при измерении количества IFNγ в супернатанте через 7 дней культивирования IFNγ продуцировался при добавлении антитела, даже без стимуляции антигеном. Также было обнаружено, что IFNγ, обычно продуцируемый при стимуляции аллоантигеном в результате добавления облученных радиацией РВМС, после добавления антитела находится в супернатанте практически в том же количестве.
[0039]
В этом отношении, в результате тщательного исследования, направленного на получение антитела, которое не индуцирует продуцирование IFNγ, но при этом сохраняет способность вызывать иммунную толерантность, авторы изобретения обнаружили, что клетки, индуцирующие иммунную толерантность, без продуцирования IFNγ, могут быть получены с помощью гуманизированных анти-CD80/CD86 антител подкласса IgG2 или IgG4.
[0040]
(Антитела)
В одном из вариантов осуществления настоящее изобретение относится к антителу, которое ингибирует взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности клетки, и CD28, экспрессируемым на поверхности другой клетки, при этом антитело по существу не индуцирует продуцирование цитокина путем иммуностимуляции. Антитело по настоящему изобретению может представлять собой анти-CD80 антитело и/или анти-CD86 антитело, биспецифическое антитело к CD80 и CD86, анти-CD28 антитело или их смесь. В некоторых вариантах осуществления Fc-фрагмент антитела может быть фрагментом, который по существу не индуцирует продуцирование цитокина путем иммуностимуляции. В конкретном варианте осуществления антитело по настоящему изобретению относится к подклассу IgG2 или IgG4. Неожиданно было обнаружено, что антитело по настоящему изобретению, которое относится к подклассу IgG2 или IgG4, не индуцирует продуцирование цитокинов клеткой иммунной системы. Поскольку антитело, используемое в настоящем изобретении, может приводить к нежелательному эффекту за счет активации рецептора, предпочтительным является антагонистическое антитело.
[0041]
В некоторых вариантах осуществления антитело, которое по существу не индуцирует продуцирование цитокина посредством иммуностимуляции, может индуцировать продуцирование цитокинов, составляющее примерно 20% или менее, предпочтительно примерно 10% или менее, более предпочтительно примерно 5% или менее и наиболее предпочтительно примерно 0% от количества цитокинов, продуцируемых клеткой, полученной от индивида (например, макрофагом, нейтрофилом, клеткой-естественным киллером (NK), Т-клеткой, В-клеткой и т.п.) в отсутствие антитела по настоящему изобретению.
[0042]
В контексте настоящего описания термин «антагонистическое (антитело)» синонимично антагонисту (антитела), ингибированию (антитела), блокированию (антитела) или т.п., что (представляет собой антитело в случае антител) имеет функцию ингибирования целевой функции или сигнальной функции с целью ослабления или инактивации действия живого организма.
[0043]
Как было неожиданно обнаружено, индукция продуцирования цитокинов может быть подавлена путем изменения подкласса антитела с IgG1 на IgG2 или IgG4, как описано выше. Не желая ограничиваться какой-либо теорией, следует отметить, что индукция продуцирования цитокинов обусловлена Fc-фрагментом антитела IgG1, поскольку функция, опосредованная Fc-фрагментом, различается среди подклассов IgG. Таким образом, в другом варианте осуществления антитело по настоящему изобретению может быть антителом, лишенным Fc-фрагмента. Примеры такого антитела включают, без ограничения, Fab антитело, F(ab')2 антитело, Fab' антитело, Fv антитело, scFv антитело и т.п.
[0044]
В некоторых вариантах осуществления клетка, экспрессирующая CD80 и/или CD86, может быть антигенпрезентирующей клеткой, а другая клетка, экспрессирующая CD28, может быть Т-клеткой.
[0045]
В другом аспекте настоящего изобретения антитело по изобретению может ингибировать взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности клетки, и CD28, экспрессируемым на поверхности другой клетки. Возможность подавлять взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности одной клетки, с CD28, экспрессируемым на поверхности другой клетки, можно определить, например, с помощью коиммунопреципитации. В частности, эти белки связывают, и затем иммунопреципитируют с использованием антитела, которое связывается с одним из белков (приманка), и измеряют другой иммунопреципитированный белок (жертву). Если жертва, содержащаяся в реакции иммунопреципитации, уменьшается при добавлении антитела-кандидата по сравнению с контролем без антитела-кандидата, антитело-кандидат определяют как ингибирующее связывание между белками. Жертву, содержащуюся в реакции иммунопреципитации, можно измерить, пометив ее или что-то подобное по мере необходимости. Количество жертвы, связанной с носителем, можно сравнить путем связывания одного из белков (приманку) с носителем с помощью анализа методом «выталкивания» и контактирования с другим белком (жертвой) в присутствии/отсутствии антитела-кандидата.
[0046]
Предпочтительно, антитело по настоящему изобретению может ингибировать взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности антигенпрезентирующей клетки, и CD28, экспрессируемым на поверхности Т-клетки. Способность антитела-кандидата ингибировать взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности антигенпрезентирующей клетки, и CD28, экспрессируемым на поверхности Т-клетки, можно определить путем приведения в контакт антигенпрезентирующей клетки, экспрессирующей CD80 и/или CD86, с Т-клеткой, экспрессирующей CD28, в присутствие антитела-кандидата и определения того, что взаимодействие между CD80 и/или CD86, экспрессируемым на поверхности антигенпрезентирующей клетки, и CD28, экспрессируемым на поверхности Т-клетки, ингибируется, если Т-клетка не активирована.
[0047]
Кроме того, антитело по настоящему изобретению характеризуется тем, что оно не индуцирует продуцирование цитокинов человеческими PBMC. Способность антитела-кандидата индуцировать продуцирование цитокинов человеческими PBMC можно определить путем приведения в контакт антитела-кандидата с человеческими PBMC в среде и измерения количества цитокинов, высвобождаемых в среду. Антитело-кандидат, приводящее к меньшему/большему количеством цитокинов, высвобождаемых в присутствии этого антитела-кандидата, по сравнению с количеством цитокинов, высвобождаемых человеческими PBMC в отсутствие антитела, определяют как не стимулирующее/стимулирующее продуцирование цитокинов человеческими PBMC. Примеры цитокинов включают интерлейкины, такие как IL-1β, IL-2, IL-4, IL-5, IL-6, IL-8, IL-9, IL-14, IL-15, IL-17 и IL-18; хемокины, такие как CC, CXC, CX3C и C; интерфероны, такие как IFNα, IFNβ и IFNγ; и цитотоксические агенты, такие как TNFα. Цитокины предпочтительно представляют собой воспалительные цитокины и более предпочтительно IFNγ. Цитокины можно измерить с помощью коммерчески доступного набора. Например, IFNγ можно измерить с помощью Biolegend's Human IFNγ ELISA MAX TM Deluxe.
[0048]
Предпочтительно, антитело по настоящему изобретению может контактировать с PBMC вместе с антигеном или клеткой, несущей этот антиген на своей поверхности, для индукции иммунной толерантности к антигену. Способность антитела-кандидата индуцировать иммунную толерантность к антигену при контактирования антитела с PBMC вместе с антигеном или клеткой, несущей этот антиген на своей поверхности, может быть определена путем контактирования антигена или клетки, несущей этот антиген на своей поверхности, с PBMC в течение от нескольких до 7 дней в присутствии антитела-кандидата, затем добавления 3H-тимидина и удаления 3H-тимидина из культуры через 16-20 часов после его добавления, и затем измерения уровня включения 3H-тимидина в PBMC. Если уровень включения 3H-тимидина в PBMC является низким при добавлении антитела-кандидата по сравнению с контролем без применения антитела-кандидата, антитело может быть определено как способное индуцировать иммунную толерантность к антителу путем контактирования антитела с PBMC вместе с антигеном или клеткой, несущей антиген на своей поверхности.
[0049]
В контексте настоящего описания термин «иммунная толерантность» означает состояние, при котором специфический иммунный ответ на конкретный антиген не проявляется или специфический иммунный ответ подавлен. Иммунная толерантность может означать одно или оба состояния из: состояния, при котором иммунная клетка (в частности, Т-клетка) не проявляет специфический иммунный ответ на конкретный антиген или специфический иммунный ответ подавлен, и состояния, при котором у человека не проявляется специфический иммунный ответ на специфический антиген или специфический иммунный ответ подавлен. Используемый в настоящем описании термин «анергия» относится к Т-клетке, которая больше не сможет реагировать даже при последующей стимуляции в условиях костимуляции из-за отсутствия костимуляции при презентации антигена антигенпрезентирующей клеткой. В контексте настоящего описания термины «PBMC (или Т-клетка) с индуцированной иммунной толерантностью» и «анергическая PBMC (или Т-клетка)» являются синонимами.
[0050]
Предпочтительно, настоящее описание относится к анти-CD80 антителу и анти-CD86 антителу. Согласно настоящему описанию анти-CD80 антитело и анти-CD86 антитело специфически связывается с CD80 и CD86, соответственно. В контексте настоящего описания термин «специфическое» связывание антитела относится к связыванию антитела с представляющим интерес белком (CD80 или CD86) с существенно более высоким сродством по сравнению со сродством к другим белкам или пептидам. В этом отношении «связывание с существенно более высоким сродством» относится к более высокому сродству, позволяющему четко идентифицировать конкретный представляющий интерес белок или пептид от других белков или пептидов с помощью соответствующего измерительного устройства или метода измерения. Например, существенно более высокое сродство может означать примерно 3-кратное или более, примерно 4-кратное или более, примерно 5-кратное или более, примерно 6-кратное или более, примерно 7-кратное или более, примерно 8-кратное или более, примерно 9-кратное или более, примерно 10-кратное или более, примерно 20-кратное или более, примерно 30-кратное или более, примерно 40-кратное или более, примерно 50-кратное или более, или примерно 100-кратное или более высокое сродство, согласно интенсивности (например, интенсивности флуоресценции), определенной с помощью ELISA или EIA.
[0051]
Примеры константы скорости ассоциации (Ka1) при связывании антитела по настоящему изобретению с CD80, CD86 или CD28 включают примерно 1×104 Мс-1 или более, примерно 1×105 Мс-1 или более и примерно 5×105 Мс-1 или более. Примеры константы скорости диссоциации (Kd1) при связывании антитела по настоящему изобретению с CD80, CD86 или CD28 включают примерно 1×10-3 Мс-1 или менее и примерно 1×10-4 Мс-1 или менее. Примеры константы ассоциации (KD) при связывании антитела по настоящему изобретению с CD80, CD86 или CD28 включают примерно 1×10-8 (М) или менее, примерно 5×10-8 (М) или менее, примерно 1×10-9 (M) или менее и примерно 5×10-9 (M) или менее. Для измерения константы скорости ассоциации (Ka1), константы скорости диссоциации (Kd1) и константы ассоциации (KD) антитела в настоящем описании можно использовать BIACORE (GE Healthcare Bio-Sciences KK, BIACORE-X100) в соответствии с руководством, предоставленным производителем, путем иммобилизации биотинилированного CD80, CD86 или CD28 или экспрессирующей их клетки на чипе SA, затем обеспечения потока тестируемого антитела для измерения константы скорости ассоциации Ka1 и константы скорости диссоциации Kd1, и константы ассоциации KD, используя для измерения аппроксимацию двухзначной функции.
[0052]
Антитело по настоящему изобретению может быть поликлональным антителом или моноклональным антителом, но предпочтительно является моноклональным антителом. В настоящем описании «моноклональные антитела» представляют собой антитела с однородной структурой, реагирующие на одну антигенную детерминанту. Кроме того, антитело по настоящему изобретению включает антитело, имеющее аминокислотную последовательность антитела животного, не являющегося человеком, и аминокислотную последовательность антитела, полученного от человека и человеческого антитела. Примеры антител животного, не являющегося человеком, включают антитела мыши, крысы, хомяка, морской свинки, кролика, собаки, обезьяны, овцы, козы, верблюда, курицы, утки и т.п., предпочтительно антитела животного, которое можно использовать для получения гибридомы, и более предпочтительно антитела мыши, крысы или кролика. Примеры антител с аминокислотной последовательностью антитела животного, не являющегося человеком, и аминокислотной последовательностью антитела, полученного от человека, включают химерные антитела человеческого типа и гуманизированные антитела. «Химерное антитело», описанное выше, представляет собой антитело животного, отличного от человека, измененное с помощью генной инженерии, таким образом, что константная область антитела, специфически связывающаяся с представляющим интерес антигеном (CD80, CD86 или CD28), является такой же константной областью, как у человеческого антитела. Химерное антитело предпочтительно представляет собой человеческое/мышиное химерное антитело (см. публикацию заявки на патент ЕР №0125023). «Гуманизированное антитело» представляет собой антитело животного, отличного от человека, измененное с помощью генной инженерии, таким образом что первичная структура, отличная от определяющих комплементарность областей (CDR) Н-цепи и L-цепи антитела, специфически связывающегося с CD80, CD86 или CD28, является первичной структурой, соответствующей человеческому антителу. В этом случае CDR может быть определен согласно одному из следующих определений: Kabat et al. («Sequences of Proteins of Immunological Interest», Kabat, E. et al., U.S. Department of Health and Human Services, 1983), or Chothia et al. (Chothia & Lesk (1987) J. Mol. Biol., 196: 901-917). «Человеческое антитело» представляет собой человеческое антитело, которое является продуктом экспрессии гена полностью человеческого антитела. Их примеры включают моноклональные антитела, полученные с использованием трансгенного животного, которому введен ген, используемый для получения человеческого антитела (публикация патентной заявки ЕР №0546073), и т.п. Когда, например, антитело по настоящему изобретению используется для лечения, профилактики или диагностики путем введения этого антитела в организм, антитело по настоящему изобретению предпочтительно представляет собой химерное антитело человека/животного, не являющегося человеком, гуманизированное антитело, или человеческое антитело.
[0053]
Предпочтительно, класс иммуноглобулинов антитела по настоящему изобретению представляет собой IgG. Подклассом антитела по настоящему изобретению предпочтительно является IgG2 или IgG4. Более предпочтительно подклассом антитела по настоящему изобретению является IgG4. Альтернативно подклассом антитела по настоящему изобретению предпочтительно является IgG2. Антитело по настоящему изобретению может быть моноспецифическим, биспецифическим (биспецифическое антитело), триспецифическим (триспецифическое антитело) (например, WO 1991/003493), тетраспецифическим (тетраспецифическое антитело) или полиспецифическим (полиантигенспецифическим).
[0054]
В одном из вариантов осуществления антитело по настоящему изобретению имеет CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27 или SEQ ID NO: 33. Предпочтительно антитело по настоящему изобретению имеет CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 26, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27, или CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 31, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 32, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 33. Более предпочтительно, антитело по настоящему изобретению имеет CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 26, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27, и CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 28, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 29, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 30, или CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 31, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 32, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 33, и CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 34, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 35, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 36.
[0055]
В одном из вариантов осуществления антитело по настоящему изобретению может представлять собой антитело или его вариант, имеющий тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 38 или 42, или ее вариантной последовательностью, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 40 или 44, или ее вариантной последовательностью. Предпочтительно, антитело по настоящему изобретению может представлять собой антитело или его вариант, содержащий (а) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 53, или ее вариантную последовательность, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 54, или ее вариантную последовательность, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 55, или ее вариантную последовательность, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 56, или ее вариантную последовательность, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 57, или ее вариантную последовательность, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 58, или ее вариантную последовательность; или (b) VH, содержащую CDRH1 с аминокислотной последовательностью приведенной в SEQ ID NO: 59, или ее вариантную последовательность, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 60, или ее вариантную последовательность, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 61, или ее вариантную последовательность, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 62, или ее вариантную последовательность, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 63, или ее вариантную последовательность, и CDRL3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 64, или ее вариантную последовательность. В конкретном варианте осуществления антитело может представлять собой антитело или его вариант, содержащий (а) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 46, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 48, или ее вариантную последовательность, или (b) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 50, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 52 или ее вариантную последовательность. Вариантная последовательность предпочтительно не содержит изменение (аминокислотную замену, добавление или делецию) в CDR, но может содержать несколько изменений (3 или менее, 2 или менее, предпочтительно 1 или менее) в каждой CDR, при условии сохранения способности антитела связываться и/или функционировать таким же образом, как до изменения. Предпочтительно вариантная последовательность может иметь по меньшей мере 90% идентичности с исходной последовательностью.
[0056]
В другом аспекте антитело по настоящему изобретению относится к антителу, имеющему VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 18 или SEQ ID NO: 22. Предпочтительно, антитело по настоящему изобретению имеет VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 18, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 20, или VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 22, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 24.
[0057]
Кроме того, настоящее изобретение относится к антителу, имеющему VH с аминокислотной последовательностью, кодируемой последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях с последовательностью нуклеиновой кислоты, кодирующей аминокислотную последовательность SEQ ID NO: 18 или SEQ ID NO: 22. Предпочтительно, настоящее изобретение относится к антителу, имеющему VH с аминокислотной последовательностью, кодируемой последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях с последовательностью нуклеиновой кислоты, кодирующей аминокислотную последовательность SEQ ID NO: 18, и VL с аминокислотной последовательностью, кодируемой последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях с последовательностью нуклеиновой кислоты, кодирующей аминокислотную последовательность SEQ ID NO: 20, или антителом, имеющим VH с аминокислотной последовательностью, кодируемой последовательностью нуклеиновой кислоты, которая гибридизуется, в жестких условиях, с последовательностью нуклеиновой кислоты, кодирующей аминокислотную последовательность SEQ ID NO: 22, и VL с аминокислотной последовательностью, кодируемой последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях с последовательностью нуклеиновой кислоты, кодирующей аминокислотную последовательность SEQ ID NO: 24. В контексте настоящего описания гибридизация в жестких условиях означает гибридизацию в условиях гибридизации, которые обычно используются специалистами в данной области. Гибридизацию последовательности можно определить с помощью метода, описанного, например, в Molecular Cloning, a Laboratory Manual, Fourth Edition, Cold Spring Harbor Laboratory Press (2012), Current Protocols in Molecular Biology, Wiley Online Library и т.п. Например, условием гибридизации может быть условие гибридизации при 42°C в 6×SSC (0,9М NaCl, 0,09М тринатрийцитрат) или 6×SSPE (3М NaCl, 0,2М NaH2PO4, 20 мМ ЭДТА⋅2Na, pH 7,4), и затем промывка при 42°C в 0,5×SSC.
[0058]
Настоящее изобретение также относится к антителу, имеющему VH с аминокислотной последовательностью, имеющей 80% или более идентичности с аминокислотной последовательностью SEQ ID NO: 18 или SEQ ID NO: 22. Предпочтительно, антитело по настоящему изобретению имеет VH с аминокислотной последовательностью, имеющей 80% или более идентичности с аминокислотной последовательностью SEQ ID NO: 18, и VL с аминокислотной последовательностью, имеющей 80% или более идентичности с аминокислотной последовательностью SEQ ID NO: 20, или VH, имеющей 80% или более идентичности с аминокислотной последовательностью SEQ ID NO: 22, и VL с аминокислотной последовательностью, имеющей 80% или более идентичности с аминокислотной последовательностью SEQ ID NO: 24. Идентичность аминокислотных последовательностей относится к соотношению (%) количества аминокислот одного и того же типа между двумя типами белков в пределах аминокислотных последовательностей, предназначенных для сравнения, и может быть определена с помощью известной программы, такой как BLAST или FASTA. Описанная выше идентичность может представлять собой идентичность, которая превышает 80% или более, например идентичность 85% или более, 90% или более, 95% или более, 98% или более, 99% или более.
[0059]
Антитело, имеющее описанную выше VH с аминокислотной последовательностью, кодируемой последовательностью нуклеиновой кислоты, которая гибридизуется в жестких условиях, или антитело, имеющее аминокислотную последовательность с 80% или более идентичностью, предпочтительно имеет последовательность CDR, описанную выше.
[0060]
В качестве более конкретного примера настоящее изобретение относится к антителу, имеющему тяжелую цепь с аминокислотной последовательностью, приведенной в одной из SEQ ID NO, выбранной из SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 10 и SEQ ID NO: 14. Предпочтительным является антитело по настоящему изобретению, имеющее тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 2, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 4, тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 6, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 8, тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 10, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 12, или тяжелую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 14, и легкую цепь с аминокислотной последовательностью, приведенной в SEQ ID NO: 16.
[0061]
В предпочтительном варианте осуществления антитело может содержать (а) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 25, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 26, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 27, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 28, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 29, и CDRL3, приведенную в SEQ ID NO: 30, или (b) VH, содержащую CDRH1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 31, CDRH2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 32, и CDRH3 с аминокислотной последовательностью, приведенной в SEQ ID NO: 33, и VL, содержащую CDRL1 с аминокислотной последовательностью, приведенной в SEQ ID NO: 34, CDRL2 с аминокислотной последовательностью, приведенной в SEQ ID NO: 35, и CDRL3, приведенную в SEQ ID. NO: 36. В другом предпочтительном варианте осуществления антитело может содержать (а) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 18, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 20, или ее вариантную последовательность, или (b) VH с аминокислотной последовательностью, приведенной в SEQ ID NO: 22, или ее вариантную последовательность, и VL с аминокислотной последовательностью, приведенной в SEQ ID NO: 24, или ее вариантную последовательность. Вариантная последовательность предпочтительно не содержит изменения (аминокислотную замену, добавление или делецию) в CDR, но может содержать несколько изменений (3 или менее, 2 или менее, предпочтительно 1 или менее) в каждом CDR, при условии сохранения способности связываться и/или функционировать с антителом также, как до изменения. Предпочтительно вариантная последовательность может иметь по меньшей мере 90% идентичности с исходной последовательностью.
[0062]
Антитело по настоящему изобретению может быть получено путем иммунизации животного, не являющегося человеком, с иммунным ответом, предпочтительно иммунизации животного, не являющегося человеком (например, мыши MRL/lpr) с аутоиммунным ответом (аутоантитело) з-за гипериммунизации, белком CD80, CD86 или CD28 или его внеклеточным доменом или клеткой, экспрессирующей CD80, CD86 или CD28, в качестве иммуногена, вместе с иммуностимулятором (например, минеральное масло или преципитат алюминия и нагретые мертвые бактерии или липополисахарид, полный адъювант Фрейнда, неполный адъювант Фрейнда или т.п.), при необходимости. На иммунизируемое животное отсутствуют особые ограничения, при условии, что оно является животным, которое можно использовать для получения гибридом, такое как мышь, крыса, хомяк, морская свинка, кролик, собака, обезьяна, овца, коза, курица или утка, но предпочтительно представляет собой мышь или крысу, более предпочтительно мышь и наиболее предпочтительно мышь MRL/lpr. Иммуноген можно вводить животному путем подкожной инъекции, внутрибрюшинной инъекции, внутривенной инъекции, внутрикожной инъекции, внутримышечной инъекции или инъекции в подошву стопы в количестве 1×106 клеток один или несколько раз с подходящим интервалом (обычно одна иммунизация каждые 1-6 недель в общей сложности от 2 до 10 раз). Через 1-2 недели после последней иммунизации берут оббразцы крови из глазной впадины или хвостовой вены иммунизированного животного для измерения титра антител с использованием его сыворотки. Антитело по настоящему изобретению можно получить путем очистки из сыворотки животного с достаточным титром антитела.
[0063]
Моноклональное антитело может быть получено путем культивирования гибридомы, полученной путем слияния клетки, продуцирующей антитело, полученной от иммунизированного животного, которое было иммунизировано описанным выше способом, с клеткой миеломы. Примеры метода слияния включают метод, описанный Milstein et al. (Galfre, G. & Milstein, C. (1981) Methods Enzymol., 73: 3-46). Клетки, продуцирующие антитела, предназначенные для использования, могут быть получены из селезенки, поджелудочной железы, лимфатического узла или периферической крови мыши или крысы, иммунизированной описанным выше способом и имеющей сыворотку с достаточным титром антител. На клетку миеломы, предназначенную для использования, отсутствуют особые ограничения при условии, что это клетка, происходит от млекопитающего, такого как мышь, крыса, морская свинка, хомяк, кролик или человек, и может пролиферировать in vitro. Примеры такой клетки включают P3-X63Ag8 (X63) (Nature, 256, 495, 1975), P3/NS1/1-Ag4-1 (NS1) (Eur. J. Immunol., 6, 292, 1976), P3X63Ag8U1 (P3U1) (Curr. Top. Microbiol. Immunol., 81, 1, 1978), P3X63Ag8.653 (653) (J. Immunol., 123, 1548, 1979), Sp2/0-Ag14 (Sp2/O) (Nature, 276, 269, 1978), Sp2/O/FO-2 (FO-2) (J. Immunol. Methods, 35, 1, 1980), SP2ab и т.п. Клетка предпочтительно представляет собой клетку, полученную от животного того же вида, что и клетка-продуцент антитела, и более предпочтительно клетку, полученную от животного того же филогенного дерева, что и клетка-продуцент антитела.
[0064]
После культивирования собирают культуральный супернатант и с помощью ELISA отбирают клоны, которые связываются с CD80, CD86 или CD28, используя белок CD80, CD86 или CD28 или его внеклеточного домен, или клетку, экспрессирующую CD80, CD86 или CD28. Моноклональное антитело, продуцирующее клетки, может быть получено путем повторения серийных разведений от 1 до 5 раз в выбранном клоне для получения одной клетки.
[0065]
Альтернативно, антитело, связывающееся с CD80, CD86 или CD28, может быть получено, например, с использованием фаговой библиотеки антител (Tomizuka et al., Nature Genet., 15, 146-156 (1997)). При использовании фаговой библиотеки антител требуемый клон может быть получен, например, путем иммобилизации белка CD80, CD86 или CD28 или его внеклеточного домена или клетки, экспрессирующей CD80, CD86 или CD28, на твердой фазе, реакции его с фаговой библиотекой, промывкой и удалением несвязанного фага, а затем сбора связанного фага (пэннинг).
[0066]
Альтернативно, оно может быть получено путем скрининга антитела с высокой специфичностью к CD80, CD86 или CD28 в соответствии с описанным выше методом из антител, полученных путем конструирования аминокислотной последовательности представляющего интерес антитела или его иммунночувствительного фрагмента, со ссылкой на аминокислотную последовательность, представленную в настоящем описании, получения ДНК, кодирующей созданную аминокислотную последовательность, включения ДНК в вектор экспрессии, и введения и экспрессии указанного вектора в подходящей клетке-хозяине.
[0067]
Когда антитело по настоящему изобретению представляет собой химерное антитело человеческого типа, это антитело может быть получено путем получения ДНК, кодирующей VH и VL моноклонального антитела животного, не являющегося человеком, связывания ее с кДНК константной области человеческого иммуноглобулина и интеграции в вектор экспрессии, и введения и экспрессии вектора в подходящей клетке-хозяине (Morrison, SL et al., Proc. Natl. Acad. Sci. USA, 81, 6851-6855, 1984).
[0068]
Когда антитело по настоящему изобретению представляет собой гуманизированное антитело, антитело можно получить путем конструирования ДНК, кодирующей V-область, полученную путем трансплантации аминокислотной последовательности, кодирующей CDR VH и VL моноклонального антитела животного, не являющегося человеком, в каркасную область (FR) VH и VL человеческого антитела, связывание сконструированной ДНК с кДНК константной области человеческого иммуноглобулина и интеграции ее в вектор экспрессии, и введения и экспрессии вектора в подходящей клетке-хозяине (см. L. Rieohmann et al., Nature, 332, 323, 1988: Kettleborough, CA et al., Protein Eng., 4, 773-783, 1991; Clark M., Immunol. Today., 21, 397-402, 2000). CDR моноклонального антитела животного, не являющегося человеком, может быть получена путем сравнения аминокислотной последовательности, предсказанной на основе последовательности ДНК, кодирующей VH и VL моноклонального антитела животного, не являющегося человеком, полученной описанным выше способом, с полноразмерными аминокислотными последовательностями VH и VL известного антитела. Аминокислотные последовательности известного антитела можно получить из аминокислотных последовательностей антител, которые зарегистрированы в базе данных, такой как банк данных белков. FR гуманизированного антитела не имеет особых ограничений при условии, что антитело после трансплантации должно обеспечивать эффекта, раскрытый в настоящем описании, и предпочтительно представляет собой FR человеческого антитела с трехмерной структурой, где вариабельная область (далее обозначенная как «V-область») гуманизированного антитела аналогична V-области моноклонального антитела животного, не являющегося человеком, из которого происходит CDR, или FR человеческого антитела с высокой гомологией с аминокислотной последовательностью FR предназначенного для использования моноклонального антитела животного, не являющегося человеком. Некоторые из аминокислот, составляющих FR, полученную из человеческого антитела (в частности, аминокислоты, расположенные рядом с CDR в трехмерном пространстве), могут быть заменены последовательностью FR моноклонального антитела животного, не являющегося человеком, из которого, при необходимости, получают CDR гуманизированного антитела (см. Queen et al., патент США №5585089). Последовательность ДНК, кодирующую V-область гуманизированного антитела, предназначенную для использования, конструируют как последовательность ДНК, соответствующую аминокислотной последовательности, полученной путем связывания аминокислотной последовательности CDR моноклонального антитела животного, не являющегося человеком, с аминокислотной последовательностью FR человеческого антитела. ДНК, кодирующая V-область гуманизированного антитела, может быть получена способом, хорошо известным специалистам в данной области, на основе сконструированной последовательности ДНК.
[0069]
Например, человеческое антитело можно получить, используя фаговую библиотеку человеческих антител или трансгенную мышь, продуцирующую человеческие антитела (Tomizuka et al., Nature Genet., 15, 146-156 (1997)). При использовании фаговой библиотеки человеческих антител требуемый клон может быть получен, например, путем связывания белка CD80, CD86 или CD28 или его внеклеточного домена, или клетки, экспрессирующей CD80, CD86 или CD28, с твердой фазой, с последующим взаимодействием с фаговой библиотекой, промывкой и удалением несвязанного фага, а затем сбора связанного фага (пэннинг). Трансгенная мышь, продуцирующая человеческое антитело, представляет собой мышь, которая получена путем введения гена Ig человеческого антитела в мышь с нокаутом по гену эндогенного иммуноглобулина (Ig). Человеческое антитело, которое специфически распознает CD80, CD86 или CD28, может быть получено путем иммунизации антигенным белком в соответствии со способом получения антител по настоящему изобретению, описанному выше, при использовании трансгенной мыши, продуцирующей человеческое антитело, в качестве иммунизированного животного.
[0070]
(Молекула нуклеиновой кислоты/вектор/клетка-хозяин)
В другом аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей полинуклеотид, кодирующий антитело по настоящему изобретению, описанное выше. Например, молекула нуклеиновой кислоты по настоящему изобретению включает нуклеотидную последовательность, приведенную в SEQ ID NO: 17 или SEQ ID NO: 21, в качестве VH. В другом аспекте молекула нуклеиновой кислоты по настоящему изобретению содержит нуклеотидную последовательность, приведенную в SEQ ID NO: 19 или SEQ ID NO: 23, в качестве VL. В качестве более конкретного примера, молекула нуклеиновой кислоты по настоящему изобретению содержит полинуклеотид, кодирующий VH, с нуклеотидной последовательностью, приведенной в любой из SEQ ID NO: 1, 5, 9 и 13, и полинуклеотид, кодирующий VL, с нуклеотидной последовательностью, приведенной в любой из SEQ ID NO: 3, 7, 11 и 15. Молекула нуклеиновой кислоты по настоящему изобретению может иметь последовательность нуклеиновой кислоты, которая гибридизуется с описанной выше SEQ ID NO в жестких условиях. Кроме того, настоящее изобретение включает вектор, содержащий указанную молекулу нуклеиновой кислоты. На такой вектор отсутствуют особые ограничения при условии, что он является вектором, который можно использовать для экспрессии антитела. Подходящий вирусный вектор, плазмидный вектор и т.п. можно выбрать в соответствии с используемым хозяином. В другом аспекте настоящее изобретение относится к клетке-хозяину, содержащей указанный вектор. На клетку-хозяина отсутствуют особые ограничения при условии, что она является клеткой-хозяином, которую можно использовать для экспрессии антитела. Примеры таких клеток включают клетки млекопитающих (клетки мыши, клетки крысы, клетки кролика, клетки человека и т.п.), дрожжи и микроорганизмы (E.coli и т.п.). Настоящее изобретение относится к способу производства антитела по настоящему изобретению, включающему культивирование описанной выше клетки-хозяина. Специалисты в данной области могут определить соответствующий используемой клетке-хозяину способ культивирования среды с помощью хорошо известных средств.
[0071]
Нуклеиновая кислота по настоящему изобретению может быть получена путем клонирования из гибридомы, продуцирующей полученное выше антитело, или путем конструирования соответствующей последовательности нуклеиновой кислоты на основе аминокислотной последовательности полученного выше антитела или его иммунночувствительного фрагмента. Вектор по настоящему изобретению может быть получен путем включения соответствующим образом полученной нуклеиновой кислоты в подходящий для экспрессии вектор. Вектор по настоящему изобретению может содержать, дополнительно к нуклеиновой кислоте по настоящему изобретению, область, которая необходима для экспрессии (промотор, энхансер, терминатор и т.п.). Клетка-хозяин по настоящему изобретению может быть получена путем введения вектора по настоящему изобретению в подходящую линию клеток (например, клетку животного, клетку насекомого, клетку растения, дрожжевую клетку или микроорганизм, такой как E.coli).
[0072]
(Композиция)
В одном из вариантов осуществления настоящее изобретение относится к композиции для получения клетки с индуцированной иммунной толерантностью, которая содержит по меньшей мере одно из представленных в настоящем описании антител. В одном из вариантов осуществления настоящего изобретения композиция может содержать анти-CD80 антитело, анти-CD86 антитело, анти-CD28 антитело, биспецифическое антитело к CD80 и CD86 или любую их комбинацию. Отторжение в связи с трансплантацией органа может быть уменьшено, например, введением индивиду, получающему трансплантацию органа, клетки с индуцированной иммунной толерантностью. Клетка с индуцированной иммунной толерантностью может быть клеткой, полученной от индивида (реципиента) или донора, или смесью таких клеток. Неожиданно было обнаружено, что композиция по настоящему изобретению по существу не вызывает высвобождения цитокинов клетками, продуцирующими цитокины (например, макрофагами, нейтрофилами или клетками-естественными киллерами (NK)). Поскольку цитокины ослабляют иммунную толерантность, предпочтительно, чтобы высвобождение цитокинов не индуцировалось.
[0073]
В другом аспекте настоящее изобретение относится к медицинской композиции, содержащей представленное в настоящем описании антитело. В одном из примеров медицинская композиция по настоящему изобретению содержит анти-CD80 антитело, анти-CD86 антитело, анти-CD28 антитело или биспецифическое антитело к CD80 и CD86. Медицинская композиция по настоящему изобретению может использоваться для индуцирования иммунной толерантности. Во всем описании термин «индуцирование иммунной толерантности» включает случаи применения, например, для индуцирования иммунной толерантности к трансплантированному органу, т.е. для подавления чрезмерных иммунных ответов на возбудитель, который у пациента с аутоиммунным заболеванием или аллергическим заболеванием становится иммуногеном, для облегчения или лечения симптомов таких заболеваний с целью подавления отторжения при трансплантации органов. В другом варианте осуществления фармацевтическую композицию по настоящему изобретению используют для получения клетки с индуцированной иммунной толерантностью.
[0074]
В контексте настоящего описания термин «орган», подлежащий трансплантации, при «трансплантации органа» не имеет особых ограничений. Примеры такого органа включают сердце, почки, легкие, поджелудочную железу, пищевод, желудок, тонкий кишечник, толстый кишечник, кожу, нерв, кровь, клетки крови, включая клетки иммунной системы, кость, хрящ, кровеносный сосуд, роговицу, глазное яблоко, костный мозг и печень. В контексте настоящего описания термин «орган» включает часть органа и клетки, составляющие этот орган, в дополнение к целому или массе органа. Например, трансплантированные органы также включают клетки миокарда, клетки роговицы и т.п. Трансплантация органа также включает трансплантацию пациенту органа, полученного с использованием гетерологичных стволовых клеток в регенеративной медицине и т.п., в дополнение к трансплантации пациенту органа другого человека.
[0075]
Антитело по настоящему изобретению можно использовать в качестве медицинской композиции путем очистки, а затем при необходимости приготовления состава в соответствии с обычным методом. Настоящее изобретение также включает применение антитела по настоящему изобретению для производства медицинской композиции для индуцирования иммунной толерантности. Альтернативно, настоящее изобретение относится к применению антитела по настоящему изобретению для индуцирования иммунной толерантности. Кроме того, настоящее изобретение относится к способу индуцирования иммунной толерантности, включающему добавление или введение антитела по настоящему изобретению. Например, настоящее изобретение относится к способу подавления отторжения при трансплантации органов, включающему введение антитела по настоящему изобретению пациенту, получающему трансплантацию органа; способу лечения аутоиммунного заболевания или аллергического заболевания, включающему введение антитела по настоящему изобретению пациенту с аутоиммунным заболеванием или аллергическим заболеванием; и способу подавления отторжения при трансплантации iPS-клетки или ES-клетки или клетки, ткани или органа, полученного (дифференцированного) из такой клетки, включающему введение антитела по настоящему изобретению пациенту, получающему трансплантацию iPS-клетки или ES-клетки или клетки, ткани или органа, полученного (дифференцированного) из такой клетки.
[0076]
Примеры клеток, ткани или органа, полученных (дифференцированных) из iPS-клеток или ES-клеток, включают, помимо прочего, нервные клетки или ткань, клетки или ткань роговицы, клетки или ткань миокарда, клетки или ткань печени, клетки или ткань хряща, клетки или ткань кожи, клетки или ткань почек и т.п. В предпочтительном варианте осуществления клетки, ткань или орган, полученные (дифференцированные) из iPS-клеток или ES-клеток, включают нервные клетки или ткань, клетки или ткань миокарда, клетки или ткань хряща и клетки или ткань кожи.
[0077]
Медицинская композиция по настоящему изобретению может быть использована путем непосредственного введения пациенту или путем контактирования композиции с PBMC, полученной от пациента, у которой должна быть индуцирована иммунная толерантность, вместе с представляющим интерес антигеном, индуцирующим иммунную толерантность ex vivo, для получения анергической к антигену иммунной клетки.
[0078]
Когда медицинскую композицию по настоящему изобретению вводят непосредственно пациенту, можно использовать любой пероральный или парентеральный состав. Примеры композиции для парентерального введения включают глазные капли, инъекции, капли для носа, суппозитории, пластыри, мази и т.п. Композиция предпочтительно представляет собой инъекцию. Примеры лекарственных форм медицинской композиции по настоящему изобретению включают жидкий агент и лиофилизированный состав. Когда медицинская композиция по настоящему изобретению используется в качестве инъекции, при необходимости может быть использован дополнительный агент, например, солюбилизирующий агент, такой как пропиленгликоль или этилендиамин, буфер, такой как фосфат, агент регулирования тоничности, такой как хлорид натрия или глицерин, стабилизатор, такой как сульфит, консервант, такой как фенол, или анальгетик, такой как лидокаин, (см. «Japanese Pharmaceutical Excipients Directory», Yakuji Nippo, Limited, «Handbook of Pharmaceutical Excipients Fifth Edition», APhA). Когда медицинская композиция по настоящему изобретению используется в качестве инъекции, примеры контейнера для хранения включают ампулу, флакон, предварительно заполненный шприц, картридж для инъекций в форме ручки, мешок для внутривенных инфузий и т.п.
[0079]
Например, медицинская композиция по настоящему изобретению (терапевтическое лекарственное средство или профилактическое лекарственное средство) может использоваться в виде инъекции. Его дозированная форма включает внутривенную инъекцию, подкожную инъекцию, внутрикожную инъекцию, внутримышечную инъекцию, интравитреальную инъекцию, внутривенную капельную инъекцию и т.п. Такие инъекции могут быть приготовлены в соответствии с известным способом, например, путем растворения, суспендирования или эмульгирования описанного выше антитела в асептическом водном или масляном растворе, который обычно используется для инъекций. Например, в качестве водного раствора для инъекций можно использовать тонизирующий раствор, содержащий физиологический раствор, глюкозу, сахарозу, маннит или другой адъювант или т.п., или такой водный раствор можно использовать в сочетании с подходящим солюбилизирующим агентом, таким как спирт (например, этанол), многоатомный спирт (например, пропиленгликоль или полиэтиленгликоль), анионное поверхностно-активное вещество [например, полисорбат 80, полисорбат 20, HCO-50 (полиоксиэтиленовый (50 моль) аддукт гидрогенизированного касторового масла)] или т.п. Например, кунжутное масло, соевое масло и т.п. можно использовать в виде масляного раствора, который можно применять одновременно с бензилбензоатом, бензиловым спиртом или т.п. в качестве солюбилизирующего агента. Приготовленную инъекцию обычно наливают в подходящую ампулу, флакон или шприц. К антителу по настоящему изобретению или его иммунночувствительному фрагменту необязательно может быть добавлен подходящий наполнитель для получения лиофилизированного состава в виде раствора для инъекций, который растворяют в воде для инъекций, физиологическом растворе или т.п. Хотя обычно считается, что пероральная инъекция белка, такого как антитело, сопряжена с трудностями, связанными с разложением этого белка в органах пищеварения, пероральное введение также является возможным благодаря творческому подходу и изобретательности при изготовлении дозированной формы, содержащей, такой фрагмент антитела или модифицированный фрагмент антитела. Примеры составов для перорального введения включают капсулы, таблетки, сироп, гранулы и т.п.
[0080]
Медицинскую композицию по настоящему изобретению готовят соответствующим образом в виде дозированной формы с единицей дозирования, которая соответствует дозе активного ингредиента. Типичная лекарственная форма в виде единицы дозирования включает инъекцию (ампулу, флакон или предварительно заполненный шприц). Лекарственная форма в виде единицы дозирования обычно может содержать от 5 до 500 мг, от 5 до 100 мг или от 10 до 250 мг антитела по настоящему изобретению или его иммунночувствительного фрагмента.
[0081]
Введение медицинской композиции по настоящему изобретению может быть местным или системным. На способ введения отсутствуют особые ограничения. Композиция вводится парентерально или перорально, как описано выше. Примеры парентеральных путей введения включают внутриглазный, подкожный, внутрибрюшинный, в кровь (внутривенно или внутриартериально) или путем инъекции в спинномозговую жидкость, в виде капель и т.п., и предпочтительно вводят в кровь. Медицинская композиция по настоящему изобретению (терапевтическое лекарственное средство или профилактическое лекарственное средство) может вводиться временно, непрерывно или периодически. Например, введение может быть непрерывным и длиться от 1 минуты до 2 недель.
[0082]
Доза медицинской композиции по настоящему изобретению не имеет особых ограничений, если она представляет собой дозу, обеспечивающую требуемый терапевтический или профилактический эффект. Доза может быть определена соответствующим образом в зависимости от симптома, пола, возраста и т.п. Доза медицинской композиции по настоящему изобретению может быть определена, например, по степени индукции иммунной толерантности, используемой в качестве индикатора. Например, в качестве однократной дозы активного ингредиента медицинской композиции по настоящему изобретению обычно предпочтительно вводить примерно от 0,01 до 20 мг/кг веса тела, предпочтительно примерно от 0,1 до 10 мг/кг веса тела и более предпочтительно примерно от 0,1 до 5 мг/кг веса тела примерно от 1 до 10 раз в месяц и предпочтительно примерно от 1 до 5 раз в месяц путем внутривенной инъекции. Соответствующее этому количество можно вводить другим, парентеральным или пероральным, способом введения. В случае очень серьезного симптома дозу или количество введений можно увеличить в зависимости от тяжести симптома.
[0083]
Когда медицинская композиция по настоящему изобретению контактирует с PBMC, полученным от пациента, у которого должна быть индуцирована иммунная толерантность, композиция вместе с представляющим интерес антигеном, индуцирующим иммунную толерантность ex vivo, для получения анергической к антигену иммунной клетки, может быть приготовлена в такой форме, как жидкость, порошок, таблетка, гель или гранулы, в соответствии с описанной выше композицией для введения.
[0084]
(Клетки с индуцированной иммунной толерантностью)
В другом аспекте настоящее изобретение относится к клетке с иммунной толерантностью, индуцированной представленным в настоящем описании антителом. Иммунная толерантность может быть индуцирована путем смешивания клетки, полученной от индивида, с антигеном, который не происходит от индивида, или с материалом, содержащим этот антиген. В другом аспекте настоящее изобретение относится к способу производства клетки для лечения или профилактики заболевания, расстройства или состояния, вызванного антигеном, чужеродным индивиду, включающему смешивание представленного в настоящем описании антитела, клетки, полученной от индивида, и антигена, не происходящего от индивида, или материала, содержащего этот антиген (например, клетки). Заболевание, расстройство или состояние могут быть выбраны из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, реакции трансплантат против хозяина и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток.
[0085]
В варианте осуществления, в котором заболевание или т.п., на которое направлено настоящее изобретение, представляет собой отторжение трансплантата, анергическая клетка может быть индуцирована путем смешивания описанного выше антитела с клеткой, полученной от реципиента (PBMC или спленоцита), и антигеном, полученным от донора, или материалом, содержащим полученный от донора антиген. Материал, содержащий полученный от донора антиген, может представлять собой PBMC, спленоцит или клетку, полученную из органа, подлежащего трансплантации.
[0086]
В варианте осуществления, в котором заболевание, на которое направлено настоящее изобретение, или т.п., представляет собой аллергию, анергическая клетка может быть индуцирована путем смешивания описанного выше антитела с клеткой, полученной от индивида (PBMC или спленоцитом), и антигеном, вызывающим аллергию, чужеродным индивиду.
[0087]
В варианте осуществления, в котором заболевание, на которое направлено настоящее изобретение, или т.п., представляет собой аутоиммунное заболевание, анергическая клетка может быть индуцирована путем смешивания описанного выше антитела с клеткой, полученной от индивида (PBMC или спленоцитом), и полученным от индивида антигеном, который является причиной аутоиммунного заболевания.
[0088]
В варианте осуществления, в котором заболевание, на которое нацелено настоящее раскрытие, или т.п., представляет собой болезнь трансплантат против хозяина, анергическая клетка может быть индуцирована путем смешивания описанного выше антитела с PBMC или спленоцитом донора, обеспечивающего трансплантат, и антигеном, полученным от реципиента, или материалом, содержащим этот антиген. Материал, содержащий антиген, полученный от реципиента, может представлять собой PBMC, спленоцит, клетку из участка, расположенного рядом с местом трансплантации органа, или полученную из него клетку.
[0089]
В варианте осуществления, в котором заболевание, на которое нацелено настоящее раскрытие, или т.п., представляет собой иммунное отторжение, вызванное трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученного из указанных клеток, анергическая клетка может быть индуцирована путем смешивания описанного выше антитела с клеткой, полученной из индивида (PBMC или спленоцитом), и клеткой, дифференцированной из iPS-клетки или ES-клетки, используемой при трансплантации.
[0090]
Терапевтические примеры заболевания или т.п. в соответствии с настоящим раскрытием приведены ниже, но изобретение ими не ограничено.
[0091]
(Аллергия и аутоиммунные заболевания)
При аллергии и аутоиммунных заболеваниях макрофаг, полученный из периферической крови пациента, дифференцируют в дендритную клетку (дендритную клетку, полученную из макрофагов) с высокой антигенпрезентирующей способностью обычным способом. После облучения радиацией (γ-лучами) в клетку вводят антиген, который является причиной гиперреакции при аллергии или аутоиммунном заболевании, и культивируют совместно в течение 1-2 недель с группой Т-клеток, полученной из периферической крови того же пациента, в присутствии анти-CD80 антитела и/или анти-CD86 антитела для получения анергической клетки, специфичной к антигену, вызывающему аллергию или аутоиммунное заболевание. Анергическую клетку вводят пациенту для индукции иммунной толерантности, специфичной к антигену, вызывающему аллергию или аутоиммунное заболевание, для применения в профилактике или лечении аллергии и аутоиммунного заболевания. Может быть введено несколько доз в зависимости от того, применяется ли доза для профилактического лечения или терапевтического лечения, а также в зависимости от различных состояний, таких как тяжесть симптомов.
[0092]
(Болезнь трансплантат против хозяина)
При болезни трансплантат против хозяина, в отличие от лечения отторжения трансплантата, клетку, которая может быть причиной болезни трансплантат против хозяина, такую как PBMC или Т-клетку донора, предоставившего трансплантат, культивируют вместе с PBMC, полученной от хозяина и облученной радиацией (γ-лучами), или другими клетками в присутствии анти-CD80 антитела и/или анти-CD86 антитела в течение от 1 до 2 недель, чтобы получить анергическую клетку, специфичную для хозяина. Введение такой анергической клетки хозяину для профилактики или лечения болезни «трансплантат против хозяина» подавляет реакции у хозяина на трансплантат, вызывающие болезнь «трансплантат против хозяина» (и индуцирует иммунную толерантность). Может быть введено несколько доз в зависимости от того, вводится ли доза для профилактического лечения или терапевтического лечения, а также в зависимости от различных состояний, таких как ткань, подлежащая трансплантации, ее размер или тяжесть симптомов.
[0093]
(Иммунное отторжение, вызванное трансплантацией iPS-клетки или ES-клетки и клетки, ткани или органа, полученных из указанных клеток)
В случае применения для лечения, когда используется iPS-клетка или ES-клетка, дендритную клетку или клетку, используемую при трансплантации, дифференцированную из iPS-клетки или ES-клетки, облучают радиацией (γ-лучами), и эту клетку культивируют совместно с группой PBMC или Т-клеток пациента, получающего трансплантацию, в присутствии анти-CD80 антитела и/или анти-CD86 антитела в течение 1-2 недель с получением анергической клетки, которая специфична к клетке, дифференцированной из iPS-клетки или ES-клетки. Введение такой анергической клетки хозяину индуцирует иммунную толерантность, специфичную к iPS-клетке или трансплантированным клеткам, тканям и органам, полученным из ES-клеток, и обкспечивает профилактику и лечение отторжения этих клеток. Может быть введено несколько доз в зависимости от того, вводится ли доза для профилактического лечения или терапевтического лечения, а также от различных состояний, таких как ткань, подлежащая трансплантации, ее размер или тяжесть симптомов.
[0094]
В конкретном варианте осуществления настоящее изобретение относится к способу индукции анергии у PBMC пациента к антигену, включающему контактирование описанного выше антитела (включая композицию, содержащую описанное выше антитело; то же самое применимо и в дальнейшем) с антигеном, к которому должна быть индуцирована иммунная толерантность, или клеткой, несущей указанный антиген на своей поверхности, и PBMC. Способ индукции иммунной толерантности по настоящему изобретению осуществляют ex vivo. Если, например, при трансплантации органа предполагается подавление отторжения трансплантированного органа пациента, получающего трансплантацию, PBMC представляет собой клетку, полученную от пациента, получающего трансплантацию органа. Если PBMC предназначен для лечения или улучшения аутоиммунного заболевания или аллергического заболевания, PBMC представляет собой клетку, полученную от пациента.
[0095]
Например, иммунная толерантность для подавления отторжения трансплантированного органа может быть индуцирована следующим способом. Готовят PBMC пациента (реципиента), получающего трансплантацию органа, и PBMC индивида (донора), предоставляющего орган, и донорные PBMC облучают излучением в дозе 30 Гр. Донорные РВМС смешивают с реципиентными РВМС в соотношении 1:1 и добавляют антитело по настоящему изобретению (предпочтительно комбинацию человеческого анти-CD80 антитела и человеческого анти-CD86 антитела). Реципиентные РВМС, анергические по отношению к донору, могут быть получены путем культивирования в течение 3-7 дней в инкубаторе при 37°C и 5% CO2 в среде для РВМС.
[0096]
Например, иммунная толерантность для лечения или улучшения аутоиммунного заболевания или аллергического заболевания также может быть индуцирована следующим способом. Готовят PBMC пациента и смешивают с антигеном, вызывающим аутоиммунное заболевание или аллергическое заболевание, и добавляют антитело по настоящему изобретению (предпочтительно комбинацию человеческого анти-CD80 антитела и человеческого анти-CD86 антитела). Реципиентные РВМС, анергические по отношению к антигену, могут быть получены путем культивирования в течение 3-7 дней в инкубаторе при 37°С и 5% CO2 в среде для РВМС.
[0097]
Настоящее изобретение относится к клетке (например, PBMC) с анергией, индуцированной описанным выше способом. Клетка с индуцированной анергией (например, PBMC), может индуцировать иммунную толерантность у пациента путем введения пациенту с тем, чтобы клетка с индуцированной анергией (например, PBMC) могла быть использована в качестве агента клеточной терапии. Соответственно, настоящее изобретение относится к агенту клеточной терапии, содержащему в качестве активного ингредиента клетку (например, PBMC) с анергией, индуцированной описанным выше способом, предпочтительно изобретение относится к агенту клеточной терапии для подавления отторжения при трансплантации органов, содержащему в качестве активного ингредиента клетку (например, PBMC) пациента, получающего трансплантацию, с индуцированной анергией к трансплантированному органу, или к агенту клеточной терапии для лечения аутоиммунного заболевания или аллергического заболевания, содержащему в качестве активного ингредиента клетку (например, PBMC) с индуцированной анергией к антигену, вызывающему аутоиммунное заболевание или аллергическое заболевание, вызванное гиперактивным иммунным ответом, или к агенту клеточной терапии для подавления отторжения при трансплантации iPS-клетки или ES-клетки и клетки, ткани или органа, происходящих из указанных клеток. Пример отторжения включает болезнь «трансплантат против хозяина».
[0098]
Агент клеточной терапии по настоящему изобретению может вызывать иммунную толерантность у пациента путем введения пациенту. Например, настоящее изобретение включает способ подавления отторжения при трансплантации органов, включающий введение пациенту, получающему трансплантацию органа, агента клеточной терапии для подавления отторжения при трансплантации органа, содержащего в качестве активного ингредиента клетку (например, PBMC) пациента, получающего трансплантацию, с индуцированной анергией к трансплантированному органу. Настоящее изобретение также включает способ лечения аутоиммунного заболевания или аллергического заболевания, включающий введение пациенту с аутоиммунным заболеванием или аллергическим заболеванием агента клеточной терапии для лечения аутоиммунного заболевания или аллергического заболевания, содержащего в качестве активного ингредиента клетку (например, PBMC) с индуцированной анергией к антигену, вызывающему аутоиммунное заболевание или аллергическое заболевание, вызванное гиперактивным иммунным ответом. Настоящее раскрытие также включает способ подавления отторжения при трансплантации iPS-клетки или ES-клетки или клетки, ткани или органа, полученных из указанных клеток, включающий введение пациенту, получающему трансплантацию органа, агента клеточной терапии для подавления отторжения при трансплантации iPS-клетки или ES-клетки или клетки, ткани или органа, происходящего из указанных клеток, включающего в качестве активного ингредиента клетку (например, PBMC) пациента, получающего трансплантацию, с анергией к предназначенной для трансплантации iPS-клетке или ES-клетке, или клетке, ткани или органу, полученному из указанных клеток.
[0099]
Агент клеточной терапии по настоящему изобретению содержит PBMC в сыворотке, содержащей/не содержащей среду или физиологический раствор, который можно вводить человеку. Когда клетки адсорбированы, клетки можно содержать и хранить на съемной подложке и использовать путем отсоединения клеток перед применением. Например, можно использовать субстрат, от которого клетки можно отделять путем изменения температуры (RepCell, CellSeed Inc., Japan) или т.п.
[0100]
Настоящее изобретение может представлять собой способ индукции иммунной толерантности у пациента, включающий контактирование описанного выше антитела с антигеном, к которому должна быть индуцирована иммунная толерантность, или клеткой, несущей антиген на своей поверхности, и клеткой (например, PBMC) для индукции анергии к антигену клетки (например, PBMC) пациента и введение пациенту клетки с индуцированной анергией (например, PBMC). Например, настоящее изобретение относится к способу подавления отторжения при трансплантации органа, включающему приготовление клетки (например, PBMC), полученной от пациента, с иммунной толерантностью к трансплантированному органу, индуцированной путем индукции анергии к трансплантированному органу, в клетке (например, PBMC) пациента путем контактирования клетки, полученной от донора, с клеткой (например, PBMC) пациента и введения полученной клетки (например, PBMC) пациенту, получающему трансплантацию органа. Настоящее изобретение также может представлять собой способ лечения или облегчения аутоиммунного заболевания или аллергического заболевания, включающий приготовление клетки (например, PBMC), полученной от пациента, с иммунной толерантностью к антигену, вызывающему аутоиммунное заболевание или аллергическое заболевание, индуцированной путем индукции анергии к антигену, в клетке (например, PBMC) пациента путем контактирования антигена, вызывающего аутоиммунное заболевание или аллергическое заболевание, с клеткой (например, PBMC) пациента и введения полученной клетки (например, PBMC) пациенту с аутоиммунным заболеванием или аллергическим заболеванием. Настоящее изобретение также включает способ подавления отторжения при трансплантации iPS-клетки или ES-клетки, или клетки, ткани или органа, полученных из указанных клеток, включающий приготовление клетки (например, PBMC), полученной от пациента, с иммунной толерантностью к предназначенной для трансплантации iPS-клетке или ES-клетке, или клетке, ткани или органу, полученному из указанных клеток, индуцированной путем индукции анергии к iPS-клетке или ES-клетке, или клетке, ткани или органу, полученному из указанных клеток, в клетке (например, PBMC) пациента путем контактирования iPS-клетки или ES-клетки или клетки, ткани или органа, полученного из указанных клеток, с клеткой (например, PBMC) пациента и введения полученной клетки (например, PBMC) пациенту, получающему трансплантацию iPS-клетки или ES-клетки, или клетки, ткани или органа, полученного из указанных клеток.
[0101]
Введение агента клеточной терапии (клетки с индуцированной анергией, такой как PBMC) не имеет особых ограничений в настоящем описании при условии, что доза обеспечивает требуемый терапевтический или профилактический эффект и может быть соответствующим образом определена в зависимости от симптома, пола, возраста или т.п. Доза агента клеточной терапии по настоящему изобретению может быть определена, например, по степени индукции иммунной толерантности, используемой в качестве индикатора. Например, однократную дозу PBMC с индуцированной анергией агента клеточной терапии по настоящему изобретению преимущественно вводят путем внутривенной инъекции примерно от 1 до 10 раз в месяц и предпочтительно от 1 до 5 раз в месяц, и она составляет от примерно 1,0 до 3,7×107 клеток/кг веса тела, предпочтительно от примерно 2,0 до 5,0×107 клеток/кг веса тела и более предпочтительно от примерно 3,0 до 5,0×107 клеток/кг веса тела. Если эффект подавления иммунитета не наблюдается, дозу или количество введений можно увеличить в зависимости от симптома.
[0102]
(Примечание)
В контексте настоящего описания «или» используется, когда можно использовать «по меньшей мере один или более» из перечисленного в предложении. При явном указании в настоящем описании диапазона, например, «в диапазона, ограниченном двумя значениями», указанный диапазон также включает указанные два значения.
[0103]
Документы, указанные в виде ссылки, такие как научная литература, патенты и заявки на патенты, процитированные в настоящем описании, включены в настоящее описание посредством ссылки, как если бы каждый из этих документов был конкретно описан.
[0104]
Для облегчения понимания настоящего изобретения в настоящем описании продемонстрированы предпочтительные варианты осуществления. Хотя настоящее описание раскрыто ниже на основе примеров, приведенное выше описание и примеры ниже предоставлены только с целью иллюстрации, а не ограничения настоящего изобретения. Таким образом, объем настоящего изобретения не ограничен вариантами осуществления и примерами, которые в частности представлены в настоящем описании, и ограничен только объемом формулы изобретения.
[Примеры]
[0105]
Настоящее изобретение более конкретно описано ниже на основе примеров. Однако настоящее изобретение не ограничено примерами. На протяжении всей заявки все процитированные ссылки непосредственно включены в настоящее описание посредством ссылки.
[0106]
Примеры описаны ниже. Микроорганизмы, используемые в приведенных ниже примерах, были использованы в соответствии с руководящими принципами, установленными Университетом Джунтендо (Juntendo) и регулирующими органами. Эксперименты на животных выполняли в соответствии с Правилами контроля над экспериментами на животных Университета Джунтендо, которые приняты на основании «Act on Welfare and Management of Animals», «Guideline for Raising and Keeping of Laboratory Animals» (2006 Ministry of the Environment Notification No. 88) и «Fundamental guidelines for proper conduct of animal experiment and related activities in Academic research institutions» (2006 Ministry of Education, Culture, Sports, Science and Technology Notification No. 71). Эксперименты планировали на основе так называемого 3R. План был одобрен и принят после его представления и рассмотрения комитетом по экспериментам на животных Университета Джунтендо. Использование генно-инженерных мышей было одобрено после проверки университетским комитетом по безопасности плана экспериментов по использованию животных-продуцентов рекомбинантной ДНК. Для экспериментов с рекомбинантной ДНК план был одобрен и принят после его представления и рассмотрения комитетом по безопасности ДНК в Университете Джунтендо; исследования проводились в соответствии с соответствующими положениями, такими как «Law Concerning the Conservation and Sustainable Use of Biological Diversity through Regulations on the Use of Living Modified Organisms». Эксперимент с использованием периферической крови человека (PBMC) основан на принципе объективного обзора и раскрытия информации и одобрен комитетом по этике Университета Джунтендо как подходящий. Исследования выполняли при строгой защите личной информации и сохранении анонимности после получения информационного согласия относительно целей/плана/метода исследований от поставщиков образцов. Эксперименты проводили в соответствии с этическими принципами, установленными комитетами по этике Медицинской школы Университета Джунтендо и Национальной больницей Сагамихара (Sagamihara), и «руководящими принципами клинических исследований», установленными Министерством здравоохранения, труда и социального обеспечения. В качестве реагентов использовали конкретные продукты, описанные в примерах. Однако реагенты могут быть заменены эквивалентным продуктом другого производителя (Sigma-Aldrich, Wako Pure Chemical, Nacalai Tesque, R&D Systems, USCN Life Science INC, BD bioscience, BioLegend и т.п.).
[0107]
(Пример 1) Реакция смешанной культуры лимфоцитов (MLR) в присутствии человеческих анти-CD80 антител и анти-CD86 антител (подкласс IgG1)
(Материалы и методы)
Мононуклеарные клетки (PBMC) выделяли из периферической крови трех добровольцев-людей (один был обозначен как донор (донор C), а двое были обозначены как реципиенты (реципиент A и реципиент B)) с использованием среды для разделения лимфоцитов Promo cell (кат. No. C 44010) и доводили концентрацию до 4×106 клеток/мл в среду ALyS505N-0, содержащей 2% сыворотку человека AB типа (пул), компании Biowest, (Cell Science & Technology Institute (CSTI) 1020P10). Донорные PBMC облучали излучением (γ-лучи) в дозе 30 Гр.
[0108]
Донорные РВМС и реципиентные РВМС распределяли по 4 лункам 96-луночного планшета (Corning, Cat. No. 3799) по 100 мкл/лунку с соотношением 1:1 (итоговое общее количество 200 мкл/лунку). К ним добавляли комбинацию гуманизированных антител к человеческому CD80 (v2 (подкласс IgG1)) и человеческому CD86 (v5 (подкласс IgG1)) или комбинацию мышиного антитела eBioscience к человеческому CD80 (кат. №16-0809-85) (подкласс IgG1) и мышиного антитела к человеческому CD86 (кат. №16-0869-85) (подкласс IgG2) в количестве 10 мкл так, чтобы концентрация каждого антитела после добавления составляла 0,1, 1 или 10 мкг/мл, и начинали культивирование в инкубаторе при 5% CO2 при 37°C. На 4-й день от начала культивирования добавляли 3H-тимидин (10 мкл). На 5 день от начала культивирования (через 16-20 часов после добавления 3H-тимидина) культивированные клетки собирали с помощью харвестера клеток (Molecular Devices). Величину включения 3H-тимидина измеряли сцинтилляционным счетчиком.
[0109]
Для продуцирования IFNγ смесь PBMC, которая была смешана описанным выше способом с добавлением каждого антитела, как указано выше, вносили в 3 лунки 48-луночного планшета (Corning, Кат. №3548) по 500 мкл/лунку, и начинали культивирование в инкубаторе при 5% CO2 при 37°C. На 6 день культивирования собирали супернатант. Собранный образец разбавляли в 10-25 раз, и затем выполняли измерение с помощью Biolegend's Human IFNγ ELISA MAX TM Deluxe, Cat. 430104.
[0110]
(Полученные результаты)
В результате, как показано на фиг. 1, комбинация гуманизированного антитела к человеческому CD80 (v2 (подкласс IgG1)) и гуманизированного антитела к человеческому CD86 (v5 (подкласс IgG1)) имела низкий уровень включения 3H-тимидина, почти на том же уровне, что и комбинация мышиного антитела к человеческому CD80 от eBioscience и мышиного антитела к человеческому CD86, т.е. наблюдалась подавленная активация иммунных клеток. Между тем, как показано на фиг. 2, оценка продуцирования IFNγ показала низкий уровень продуцирования в присутствии мышиных антител eBioscience к человеческим CD80 и CD86, тогда как в присутствии гуманизированных антител к человеческим CD80 и CD86 (подкласс IgG1) наблюдали продуцирование IFNγ, которое зависимоеело от количества добавленных антител. При 10 мкг/мл, наблюдаемый уровень продуцирования, был равен или превышал уровень продуцирования отсутствие антител (фиг. 2: Allo). Не желая быть связанным какой-либо теорией, понятно, что низкий уровень продуцирования IFNγ в присутствии антител eBioscience обусловлен тем, что эти антитела являются мышиными и имеют низкую реактивность.
[0111]
(Пример 2) Реакция смешанной культуры лимфоцитов (MLR) в присутствии антител к человеческим CD80 и CD86 (подкласс IgG1)
(Материалы и методы)
3H-тимидина добавляли к комбинации гуманизированных антител к человеческому CD80 (v2 (подкласс IgG1)) и человеческому CD86 (v5 или v9 (подкласс IgG1)) или к комбинации мышиного антитела eBioscience к человеческому CD80 (кат. №16-0809-85) и мышиного антитела к человеческому CD86 (кат. №16-0869-85) до достижения концентрации каждого антитела после добавления 10 мкг/мл, как в примере 1. Из трех добровольцев один был обозначен как донор (донор F), а двое были обозначены как реципиенты (реципиент D и реципиент E).
[0112]
Кроме того, продуцирование IFNγ оценивали для комбинации гуманизированного антитела к человеческому CD80 (v2 (подкласс IgG1)) и гуманизированного антитела к человеческому CD86 (v9 (подкласс IgG1)) и для комбинации мышиного антитела eBioscience к человеческому CD80 и антитела к человеческому CD86. В дополнение к методу, описанному в примере 1, продуцирование IFNγ также оценивали для комбинации гуманизированного антитела к человеческому CD80 (v2 (подкласс IgG1)) и антитела к человеческому CD86 (v9 (подкласс IgG1)) без добавления облученных радиацией донорных PBMC.
[0113]
(Полученные результаты)
В результате, как показано на фиг. 3, комбинация гуманизированных антител к человеческому CD80 и человеческому CD86 показала более сильное подавление включения 3H-тимидина, чем комбинация мышиного антитела к человеческому CD80 и антитела к человеческому CD86. Между тем, как показано на фиг. 4, продуцирование IFNγ в присутствии мышиных антител eBioscience к человеческому CD80 и CD86 было таким же низким, как в Примере 1. Для гуманизированных антител к человеческим CD80 и CD86 наблюдали такой же или более высокий уровень продуцирования, чем при моделировании донора в отсутствие антитела. Кроме того, такое же продуцирование IFNγ наблюдали при добавлении гуманизированных антител к человеческому CD80 и человеческому CD86, даже без добавления облученных радиацией донорных РВМС.
[0114]
(Пример 3) Реакция смешанной культуры лимфоцитов (MLR) в присутствии антител к человеческому CD80 и антител к CD86 (подклассы IgG1, IgG2 и IgG4)
В Примере 2 продуцирование IFNγ наблюдали даже без добавления облученных радиацией донорных РВМС. Таким образом, меняли классы гуманизированных антител к человеческому CD80 и человеческому CD86, и оценивали включение 3H-тимидина при добавлении комбинации гуманизированных антител к человеческому CD80 (v2 (подкласс IgG2 или IgG4)) и человеческому CD86 (v9 (подкласс IgG2 или IgG4)) того же подкласса, а также комбинации мышиного антитела eBioscience к человеческому CD80 (кат. №16-0809-85) и антитела к человеческому CD86 (кат. №16-0869-85) до достижения концентрации каждого антитела после добавления, равной 1, 3 или 10 мкг/мл, а также оценивали уровень продуцирования IFNγ при добавлении антител с конечной концентрацией каждого антитела после добавления, равного 10 мкг/мл. Из трех добровольцев один был назначен донором (донор I), а двое - реципиентами (реципиент G и реципиент H). Ниже приводится подробное описание эксперимента.
[0115]
[Включение 3H-тимидина (концентрация каждого антитела: 1, 3 и 10 мкг/мл) (фиг. 5)
- без добавления антитела (Allo), с добавлением облученных радиацией донорных РВМС
- мышиные антитела eBioscience's к человеческому CD80 и мышиные антитела к человеческому CD86
- гуманизированное антитело к человеческому CD80 (v2 (IgG2)) и гуманизированное антитело к человеческому CD86 (v9 (IgG2))
- гуманизированное антитело к человеческому CD80 (v2 (IgG4)) и гуманизированное антитело к человеческому CD86 (v9 (IgG4))
[0116]
[Продуцирование IFNγ (концентрация каждого антитела: 10 мкг/мл) (фиг.6)
С добавлением облученных радиацией донорных РВМС (Allo)
- без добавления антител
- eBioscience's мышиные антитела к человеческому CD80 и антитела к человеческому CD86
- гуманизированное антитело к человеческому CD80 (v2 (IgG2)) и гуманизированное антитело к человеческому CD86 (v9 (IgG2))
- гуманизированное антитело к человеческому CD80 (v2 (IgG4)) и гуманизированное антитело к человеческому CD86 (v9 (IgG4))
Без добавления облученных радиацией донорных РВМС (Naïve)
- без добавления антител (Allo)
- антитела eBioscience к мышиным CD80 и антитела к CD86
- гуманизированное анти-CD80 антитело (v2 (IgG1)) и гуманизированное антитело к человеческому CD86 (v9 (IgG1))
- гуманизированное анти-CD80 антитело (v2 (IgG2)) и гуманизированное антитело к человеческому CD86 (v9 (IgG2))
- гуманизированное анти-CD80 антитело (v2 (IgG4)) и гуманизированное антитело к человеческому CD86 (v9 (IgG4))
[0117]
(Результаты)
В результате, как показано на фиг. 5, подклассы IgG2 и IgG4 продемонстрировали подавление включения 3H-тимидина, аналогичное наблюдаемому в примерах 1 и 2. Между тем, как показано на фиг. 6, продуцирование IFNγ наблюдали в подклассе IgG1, но неожиданно было обнаружено, что в подклассах IgG2 и IgG4 продуцирование IFNγ вообще отсутствует.
[0118]
(Пример 4) Реакция смешанной культуры лимфоцитов (MLR) с добавлением клеток, полученных в результате культивирования в присутствии антител к человеческому CD80 и антител к человеческому CD86 (подкласс IgG1, IgG2 или IgG4)
(Материалы и методы)
Культивирование продолжали в течение 14 дней способом, описанным в примере 1, в присутствии комбинации гуманизированного антитела к человеческому CD80 (v2) и антитела к человеческому CD86 (v9) подклассов IgG1, IgG2 и IgG4. Гуманизированное антитело к человеческому CD80 (v2) подкласса IgG2 состояло из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 2 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 4. Гуманизированное антитело к человеческому CD80 (v2) подкласса IgG4 состояло из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 6 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 8. Антитело к человекческому CD86 (v9) подкласса IgG2 состояло из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 10 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 12. Антитело к человеческому CD86 (v9) подкласса IgG4 состояло из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 14 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 16. После культивирования полученные анергические клетки, реципиентные PBMC (R-PBMC) и облученные радиацией донорные PBMC (D-PBMC) смешивали в соответствии с приведенной ниже таблицей, и затем оценивали включение 3H-тимидина после смешивания методом, описанным в Примере 1.
[0119]
[Таблица 1]
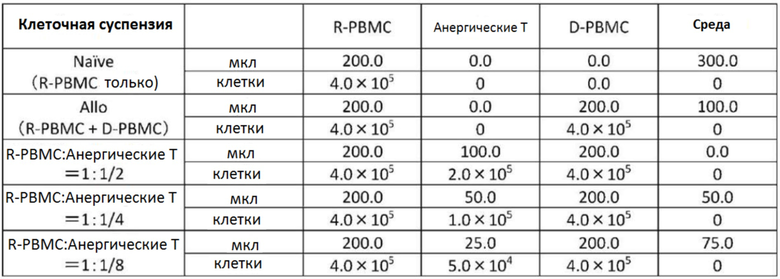
[0120]
(Результаты)
В результате, как показано на фиг. 7, клетки, полученные в присутствии антител любого подкласса, одинаково подавляли включение 3H-тимидина.
[0121]
(Пример 5) Индукция иммунной толерантности у пациента, получающего трансплантацию органа.
Тесты выполняли методом, аналогичным описанному в Satoru Todo et al. Hepatorogy, 64 (vol. 2), 632-643 (2016). Вкратце, анергические Т-клетки, специфические к донорному антигену, индуцировали совместным культивированием лимфоцитов, собранных из селезенки или периферической крови реципиента, лимфоцитов полученных от донора, облученных радиацией в дозе 30 Гр, и гуманизированных антител к CD80 и CD86 подкласса IgG4, использованных в примере 4. Анергические Т-клетки вводили реципиенту, которому была проведена трансплантация печени, на 13 день после операции. Затем отслеживали статус.
[0122]
(Пример 6) Химерные антитела к человеческому CD80 и химерные антитела к человеческому CD86 (подкласс IgG1)
Препарат антител
Авторы изобретения попытались улучшить антитела к человеческому CD80 и антитела к человеческому CD86 для использования в клеточной терапии. В частности, на основе мышиного антитела eBioscience к человеческому CD80 и мышиного антитела к человеческому CD86 получали химерные антитела. Полученное химерное антитело к человеческому CD80 (подкласс IgG1) состояло из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 38 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 40. Полученное химерное антитело к человеческому CD86 (подкласс IgG1) состояло из тяжелой цепи с аминокислотной последовательностью SEQ ID NO: 42 и легкой цепи с аминокислотной последовательностью SEQ ID NO: 44. Плазмиду, кодирующую их, заказывали у третьей стороны (TPG Biologics, Inc. Taiwan) и экспрессировали в клетках CHO, и антитела продуцировали/очищали.
[0123]
Реакция смешанной культуры лимфоцитов (MLR) в присутствии химерных антител к человеческому CD80 и химерных антител к CD86 (подкласс IgG1)
Продуцирование IFNγ
Практически таким же образом, как и в методе, описанном в примере 1, выделяли мононуклеарные клетки (PBMC) из человеческой периферической крови двух добровольцев (один был обозначен как донор, а другой - как реципиент), используя среду для лимфоцитов Promo cell (кат. № C - 44010), и концентрацию клеток доводили до 2×106 клеток/мл в среде ALyS505N-0, содержащей 2% человеческой сыворотки типа AB (пул), компании Biowest, (Cell Science & Technology Institute (CSTI) 1020P10). Донорные PBMC облучали излучением (γ-лучи) в дозе 30 Гр.
[0124]
Экспериментальная система была следующей.
1. «naïve»: PBMC реципиента, 1×106 клеток.
2. «allo»: PBMC реципиента, 1×106 клеток, и донорные PBMC, 1×106 клеток.
3. «Химерные анти-CD80»: PBMC реципиента, 1×106 клеток, и химерное антитело к человеческому CD80, 4 мкг.
4. «Химерные анти-CD86»: PBMC реципиента, 1×106 клеток, и химерное антитело к человеческому CD86, 4 мкг.
Системы 1-4 помещали в каждую лунку 96-луночного планшета (Corning, кат. №3799) с конечным реакционным объемом 200 мкл (конечная концентрация антител составляла примерно 20 мкг/мл), и культивировали в инкубаторе при 5% CO2 при 37°C. В дни 5 и 6 от начала культивирования супернатант собирали. Собранный образец разбавляли в 20-25 раз, и затем выполняли измерение с использованием Biolegend's Human IFNγ ELISA MAX TM Deluxe, кат. №430104.
[0125]
Полученные результаты
Как показано на фиг. 8, ни химерное антитело к человеческому CD80, ни химерное антитело к человеческому CD86 не продемонстрировало детектируемого продуцирования IFNγ.
[0126]
Измерение количества включенного 3H-тимидина
Эксперименты в основном проводили в соответствии со способами, описанными в примерах 1 и 4. Использовали реципиентные PBMC и донорные PBMC, свежевыделенные из периферической крови человека или замороженные при -80°C, которые быстро размораживали и использовали. Эти клетки доводили до концентрации 4×106 клеток/мл в среду ALyS505N-0, содержащей 2% человеческой сыворотки типа AB (пул), компании Biowest, (Cell Science & Technology Institute (CSTI) 1020P10). Донорные РВМС облучили в дозе 20 Гр. Донорные РВМС и реципиентные РВМС смешивали в соотношении 1:1, и к смеси добавляли химерное антитело к человеческому CD80 и химерное антитело к человеческому CD86 до конечной концентрации каждого антитела 10 мкг/мл. Клетки культивировали в течение 7 дней в инкубаторе при 5% CO2 при 37°C в чашке Петри диаметром 6 до 10 см (объем культуры от 6 до 18 мл).
[0127]
В день 7 от начала культивирования культивированные реципиентные PBMC собирали центрифугированием и доводили до концентрации 4×106 клеток/мл в описанной выше среде. К культивированным реципиентным РВМС добавляли свежеприготовленные и облученные донорные РВМС так, чтобы соотношение количества клеток составляло 2:1, и добавляли химерное антитело к человеческому CD80 и химерное антитело к человеческому CD86 до конечной концентрации каждого из антител 5 мкг/мл. Клетки культивировали в течение 7 дней в тех же условиях, как описано выше (плотность клеток: 4×106 клеток/мл).
[0128]
В день 14 после начала культивирования индуцированные клетки собирали центрифугированием. Каждую клетку смешивали в следующем соотношении:
1. «naïve»: реципиентные PBMC, 4×105 клеток
2. «allo»: реципиентные PBMC, 4×105 клеток, и донорные PBMC, 4×105 клеток.
3. «1:1/2»: реципиентные PBMC, 4×105 клеток, донорные PBMC, 4×105 клеток, и индуцированные клетки, 2×105 клеток.
4. «1:1/4»: реципиентные PBMC, 4×105 клеток, донорные PBMC, 4×105 клеток, и индуцированные клетки, 1×105 клеток.
5. «1:1/8»: реципиентные PBMC, 4×105 клеток, донорные PBMC, 4×105 клеток, и индуцированные клетки, 5×104 клеток.
6. «1:1/16»: PBMC реципиента, 4×105 клеток, донорные PBMC, 4×105 клеток, и индуцированные клетки, 2,5×104 клеток.
Каждую из систем 1-6 вносили в 4 лунки 96-луночного планшета (Corning, кат. №3799) и совместно культивировали в инкубаторе при 5% CO2 при 37°C. В день 4 после начала совместного культивирования добавляли 3H-тимидин (10 мкл). В день 5 от начала совместного культивирования (через 16-20 часов после добавления 3H-тимидина) 3H-тимидин из культуры удаляли для измерения количества включенного 3H-тимидина.
[0129]
Результаты
Как показано на фиг. 9, индуцированные клетки снижали количество включенного 3H-тимидина дозозависимым образом (т.е. подавлялась активация иммунных клеток). Таким образом, было продемонстрировано, что химерные антитела к человеческому CD80 и химерные антитела к человеческому CD86 являются антителами, подходящими для клеточной терапии, и могут индуцировать анергические Т-клетки, не вызывая вредного продуцирования IFNγ.
[0130]
[Примечание]
Согласно вышеописанному, настоящее изобретение проиллюстрировано использованием его предпочтительных вариантов осуществления. Однако следует понимать, что объем настоящего раскрытия следует интерпретировать исключительно на основе формулы изобретения. Также понятно, что любой патент, любая патентная заявка и любые другие ссылки, процитированные в настоящем описании, включены в настоящее описание посредством ссылки таким же образом, как если бы их содержание было раскрыто в настоящем описании. По настоящей заявке испрашивается приоритет по заявке на патент Японии №2018-118996 (поданной 22 июня 2018 г.). Понятно, что ее содержание (может быть весь документ) включено в настоящее описание посредством ссылки. Кроме того, часть или все содержание заявки на патент Японии №2018-119001 и заявки на патент Японии №2018-1190031 (обе поданы 22 июня 2018 г.) и международных заявок, по которым испрашивается приоритет, включены в настоящее описание посредством ссылки.
[Промышленная применимость]
[0131]
В настоящем описании предложено антитело со структурой, способной улучшать эффект иммунной толерантности или не ослаблять эффект иммунной толерантности. Предлагается технология, которая может быть использована в отраслях (фармацевтики), связанных с приготовлением составов и т.п., на основе такой технологии.
[Свободный текст списка последовательностей]
[0132]
SEQ ID NO: 1: последовательность нуклеиновой кислоты тяжелой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 2: аминокислотная последовательность тяжелой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 3: последовательность нуклеиновой кислоты легкой цепи анти CD80 антитела (IgG2).
SEQ ID NO: 4: аминокислотная последовательность легкой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 5: последовательность нуклеиновой кислоты тяжелой цепи анти-CD80 антитела (IgG4).
SEQ ID NO: 6: аминокислотная последовательность тяжелой цепи анти-CD80 антитела (IgG4).
SEQ ID NO: 7: последовательность нуклеиновой кислоты легкой цепи антитела к CD80 (IgG4).
SEQ ID NO: 8: аминокислотная последовательность легкой цепи антитела к CD80 (IgG4).
SEQ ID NO: 9: последовательность нуклеиновой кислоты тяжелой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 10: аминокислотная последовательность тяжелой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 11: последовательность нуклеиновой кислоты легкой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 12: аминокислотная последовательность легкой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 13: последовательность нуклеиновой кислоты тяжелой цепи анти-CD86 антитела (IgG4).
SEQ ID NO: 14: аминокислотная последовательность тяжелой цепи анти-CD86 антитела (IgG4).
SEQ ID NO: 15: последовательность нуклеиновой кислоты легкой цепи анти-CD86 антитела (IgG4).
SEQ ID NO: 16: аминокислотная последовательность легкой цепи анти-CD86 антитела (IgG4).
SEQ ID NO: 17: последовательность нуклеиновой кислоты вариабельной области тяжелой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 18: аминокислотная последовательность вариабельной области тяжелой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 19: последовательность нуклеиновой кислоты вариабельной области легкой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 20: аминокислотная последовательность вариабельной области легкой цепи анти-CD80 антитела (IgG2).
SEQ ID NO: 21: последовательность нуклеиновой кислоты вариабельной области тяжелой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 22: аминокислотная последовательность вариабельной области тяжелой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 23: последовательность нуклеиновой кислоты вариабельной области легкой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 24: аминокислотная последовательность вариабельной области легкой цепи анти-CD86 антитела (IgG2).
SEQ ID NO: 25: аминокислотная последовательность CDRH1 антитела анти-CD80 против (IgG2).
SEQ ID NO: 26: аминокислотная последовательность CDRH2 анти-CD80 антитела (IgG2).
SEQ ID NO: 27: аминокислотная последовательность CDRH3 анти-CD80 антитела (IgG2).
SEQ ID NO: 28: аминокислотная последовательность CDRL1 анти-CD80 антитела (IgG2).
SEQ ID NO: 29: аминокислотная последовательность CDRL2 анти-CD80 антитела (IgG2).
SEQ ID NO: 30: аминокислотная последовательность CDRL3 анти-CD80 антитела (IgG2).
SEQ ID NO: 31: аминокислотная последовательность CDRH1 анти-CD86 антитела (IgG2).
SEQ ID NO: 32: аминокислотная последовательность CDRH2 анти-CD86 антитела (IgG2).
SEQ ID NO: 33: аминокислотная последовательность CDRH3 анти-CD86 антитела (IgG2).
SEQ ID NO: 34: аминокислотная последовательность CDRL1 анти-CD86 антитела (IgG2).
SEQ ID NO: 35: аминокислотная последовательность CDRL2 анти-CD86 антитела (IgG2).
SEQ ID NO: 36: аминокислотная последовательность CDRL3 анти-CD86 антитела (IgG2).
SEQ ID NO: 37: последовательность нуклеиновой кислоты тяжелой цепи химерного анти-CD80 антитела.
SEQ ID NO: 38: аминокислотная последовательность тяжелой цепи химерного анти-CD80 антитела.
SEQ ID NO: 39: последовательность нуклеиновой кислоты легкой цепи химерного анти-CD80 антитела.
SEQ ID NO: 40: аминокислотная последовательность легкой цепи химерного анти-CD80 антитела.
SEQ ID NO: 41: последовательность нуклеиновой кислоты тяжелой цепи химерного анти-CD86 антитела.
SEQ ID NO: 42: аминокислотная последовательность тяжелой цепи химерного анти-CD86 антитела.
SEQ ID NO: 43: последовательность нуклеиновой кислоты легкой цепи химерного анти-CD86 антитела.
SEQ ID NO: 44: аминокислотная последовательность легкой цепи химерного анти-CD86 антитела.
SEQ ID NO: 45: последовательность нуклеиновой кислоты вариабельной области тяжелой цепи химерного анти-CD80 антитела.
SEQ ID NO: 46: аминокислотная последовательность вариабельной области тяжелой цепи химерного анти-CD80 антитела.
SEQ ID NO: 47: последовательность нуклеиновой кислоты вариабельной области легкой цепи химерного анти-CD80 антитела.
SEQ ID NO: 48: аминокислотная последовательность вариабельной области легкой цепи химерного анти-CD80 антитела.
SEQ ID NO: 49: последовательность нуклеиновой кислоты вариабельной области тяжелой цепи химерного анти-CD86 антитела.
SEQ ID NO: 50: аминокислотная последовательность вариабельной области тяжелой цепи химерного анти-CD86 антитела.
SEQ ID NO: 51: последовательность нуклеиновой кислоты вариабельной области легкой цепи химерного анти-CD86 антитела.
SEQ ID NO: 52: аминокислотная последовательность вариабельной области легкой цепи химерного анти-CD86 антитела.
SEQ ID NO: 53: аминокислотная последовательность CDRH1 химерного анти-CD80 антитела.
SEQ ID NO: 54: аминокислотная последовательность CDRH2 химерного анти-CD80 антитела.
SEQ ID NO: 55: аминокислотная последовательность CDRH3 химерного анти-CD80 антитела.
SEQ ID NO: 56: аминокислотная последовательность CDRL1 химерного анти-CD80 антитела.
SEQ ID NO: 57: аминокислотная последовательность CDRL2 химерного анти-CD80 антитела.
SEQ ID NO: 58: аминокислотная последовательность CDRL3 химерного анти-CD80 антитела.
SEQ ID NO: 59: аминокислотная последовательность CDRH1 химерного анти-CD86 антитела.
SEQ ID NO: 60: аминокислотная последовательность CDRH2 химерного анти-CD86 антитела.
SEQ ID NO: 61: аминокислотная последовательность CDRH3 химерного анти-CD86 антитела.
SEQ ID NO: 62: аминокислотная последовательность CDRL1 химерного анти-CD86 антитела.
SEQ ID NO: 63: аминокислотная последовательность CDRL2 химерного анти-CD86 антитела.
SEQ ID NO: 64: аминокислотная последовательность CDRL3 химерного анти-CD86 антитела.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗУНТЕН БИО КО., ЛТД.
<120> Антитела, индуцирующие иммунную толерантность, индуцированные
лимфоциты, и терапевтический агент/способ клеточной терапии с
использованием индуцированных лимфоцитов
<130> JB002PCT
<150> JP 2018-118996
<151> 2018-06-22
<160> 64
<170> PatentIn version 3.5
<210> 1
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(1347)
<400> 1
gag gtg cag ttg gtt gaa tct ggc gga gga ctg gtt cag cct ggc gga
48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tct ctg aga ctg tct tgt gcc gcc tct ggc ttc gtg ttc agc tcc gac
96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
gat atg tcc tgg gtc cga cag gct cct ggc aaa gga ttg gag tgg gtc
144
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
gcc tac atc tct tct ggc ggc gac tac acc tac tat ccc gac acc gtg
192
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
aag ggc aga ttc acc atc tcc aga gac aac gcc aag aac tcc ctg tac
240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
ctg cag atg aac agc ctg aga gcc gag gac acc gcc gtg tac tac tgt
288
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc aga cac ctg tac ggc tcc tcc agc tac tac gtg atg gac tat tgg
336
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
ggc cag ggc acc ctg gtc aca gtg tcc tct gct tcc acc aag gga ccc
384
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
agc gtt ttc cct ctg gct cct tgc tcc aga tcc acc tcc gag tct aca
432
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
gct gct ctg ggc tgc ctg gtc aag gac tac ttt cct gag cct gtg acc
480
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
gtg tcc tgg aac tct ggc gct ctg aca tct ggc gtg cac acc ttt cca
528
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
gct gtg ctg cag tcc tct ggc ctg tac tct ctg tcc tcc gtc gtg acc
576
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
gtg cct tcc tct aac ttt ggc acc cag acc tac acc tgt aat gtg gac
624
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
cac aag cct tcc aac acc aag gtg gac aag acc gtg gaa cgg aag tgc
672
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
tgc gtg gaa tgc cct cct tgt cct gct cct cct gtg gct ggc cct tcc
720
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
gtg ttt ctg ttc cct cca aag cct aag gac acc ctg atg atc tct cgg
768
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
acc cct gaa gtg acc tgc gtg gtg gtg gat gtg tct cac gag gat ccc
816
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
gaa gtg cag ttc aat tgg tac gtg gac ggc gtg gaa gtg cac aac gcc
864
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
aag acc aag cct aga gag gaa cag ttc aac tcc acc ttc aga gtg gtg
912
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
tcc gtg ctg acc gtg gtg cat cag gat tgg ctg aac ggc aaa gag tac
960
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
aag tgc aag gtg tcc aac aag ggc ctg cct gct cct atc gaa aag acc
1008
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
atc tct aag acc aag ggg cag ccc cgg gaa cct cag gtt tac aca ctg
1056
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
cct cca agc cgg gaa gag atg acc aag aac cag gtg tcc ctg acc tgc
1104
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
ctc gtg aag ggc ttc tac cct tcc gat atc gcc gtg gaa tgg gag agc
1152
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
aat ggc cag cct gag aac aac tac aag acc aca cct cct atg ctg gac
1200
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
tcc gac ggc tca ttc ttc ctg tac tcc aag ctg aca gtg gac aag tcc
1248
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
aga tgg cag cag ggc aac gtg ttc tcc tgc tcc gtg atg cac gag gcc
1296
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
ctg cac aat cac tac acc cag aag tcc ctg tct ctg tcc cct ggc aaa
1344
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
tga
1347
<210> 2
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 3
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(645)
<400> 3
gac atc cag atg acc cag tct cca tcc tct ctg tct gcc agc ctg ggc
48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
gac aga atc acc atc acc tgt cac gcc agc cag aac atc aac gtg tgg
96
Asp Arg Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
ctg tcc tgg tat cag cag aag ccc ggc aag atc ccc aag ctg ctg gtg
144
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Val
35 40 45
tac aag gcc tcc aat ctg cac acc ggc gtg ccc tct aga ttc tcc gga
192
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
tct ggc tct ggc acc gac ttt acc ctg aca atc tcc agc ctg cag cct
240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gag gac ttc gcc acc tac tat tgt cag cag ggc cag agc tac cct ctg
288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
acc ttt ggc gct ggc acc aag ctg gaa atc aag cgg aca gtg gcc gct
336
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
cct tcc gtg ttc atc ttc cca cct tcc gac gag cag ctg aag tcc ggc
384
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
aca gct tct gtc gtg tgc ctg ctg aac aac ttc tac cct cgg gaa gcc
432
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
aag gtg cag tgg aag gtg gac aat gcc ctg cag tcc ggc aac tcc caa
480
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
gag tct gtg acc gag cag gac tcc aag gac agc acc tac agc ctg tcc
528
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
tcc aca ctg acc ctg tcc aag gcc gac tac gag aag cac aag gtg tac
576
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
gcc tgc gaa gtg acc cat cag ggc ctg tct agc cct gtg acc aag tct
624
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
ttc aac cgg ggc gag tgc tga
645
Phe Asn Arg Gly Glu Cys
210
<210> 4
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Val
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 5
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(1350)
<400> 5
gag gtg cag ttg gtt gaa tct ggc gga gga ctg gtt cag cct ggc gga
48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tct ctg aga ctg tct tgt gcc gcc tct ggc ttc gtg ttc agc tcc gac
96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
gat atg tcc tgg gtc cga cag gct cct ggc aaa gga ttg gag tgg gtc
144
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
gcc tac atc tct tct ggc ggc gac tac acc tac tat ccc gac acc gtg
192
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
aag ggc aga ttc acc atc tcc aga gac aac gcc aag aac tcc ctg tac
240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
ctg cag atg aac agc ctg aga gcc gag gac acc gcc gtg tac tac tgt
288
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc aga cac ctg tac ggc tcc tcc agc tac tac gtg atg gac tat tgg
336
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
ggc cag ggc acc ctg gtc aca gtg tcc tct gct tct acc aag ggc ccc
384
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
tcc gtg ttc cct ctg gcc cct tgc tcc aga tcc acc tcc gag tct acc
432
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
gcc gct ctg ggc tgc ctc gtg aag gac tac ttc ccc gag ccc gtg aca
480
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
gtg tcc tgg aac tct ggc gct ctg acc tcc ggc gtg cac acc ttt cca
528
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
gca gtg ctg cag tcc tcc ggc ctg tac tcc ctg tcc tcc gtc gtg act
576
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
gtg ccc tcc agc tct ctg ggc acc aag acc tac acc tgt aac gtg gac
624
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
cac aag ccc tcc aac acc aag gtg gac aag aga gtg gaa tct aag tac
672
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
ggc cct ccc tgc ccc cct tgt cct gcc cct gaa ttt ctg ggc gga ccc
720
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
agc gtg ttc ctg ttc ccc cca aag ccc aag gac acc ctg atg atc tcc
768
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
cgg acc ccc gaa gtg acc tgc gtg gtg gtg gat gtg tcc cag gaa gat
816
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
ccc gag gtg cag ttc aat tgg tac gtg gac ggc gtg gaa gtg cac aac
864
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
gcc aag acc aag cct aga gag gaa cag ttc aac tcc acc tac cgg gtg
912
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
gtg tcc gtg ctg acc gtg ctg cac cag gat tgg ctg aac ggc aaa gag
960
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
tac aag tgc aag gtg tcc aac aag ggc ctg ccc agc tcc atc gaa aag
1008
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
acc atc tcc aag gcc aag ggc cag ccc cgg gaa ccc cag gtg tac aca
1056
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
ctg cct cca agc cag gaa gag atg acc aag aac cag gtg tcc ctg acc
1104
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
tgt ctc gtg aaa ggc ttc tac ccc tcc gat atc gcc gtg gaa tgg gag
1152
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
tcc aac ggc cag cct gag aac aac tac aag acc acc ccc cct gtg ctg
1200
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
gac tcc gac ggc tcc ttc ttc ctg tac tct cgc ctg acc gtg gac aag
1248
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
tcc cgg tgg cag gaa ggc aac gtg ttc tcc tgc tcc gtg atg cac gag
1296
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
gcc ctg cac aac cac tac acc cag aag tcc ctg tct ctg tcc ctg ggc
1344
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
aag tga
1350
Lys
<210> 6
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 7
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(645)
<400> 7
gac atc cag atg acc cag tct cca tcc tct ctg tct gcc agc ctg ggc
48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
gac aga atc acc atc acc tgt cac gcc agc cag aac atc aac gtg tgg
96
Asp Arg Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
ctg tcc tgg tat cag cag aag ccc ggc aag atc ccc aag ctg ctg gtg
144
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Val
35 40 45
tac aag gcc tcc aat ctg cac acc ggc gtg ccc tct aga ttc tcc gga
192
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
tct ggc tct ggc acc gac ttt acc ctg aca atc tcc agc ctg cag cct
240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gag gac ttc gcc acc tac tat tgt cag cag ggc cag agc tac cct ctg
288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
acc ttt ggc gct ggc acc aag ctg gaa atc aag cgg aca gtg gcc gct
336
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
cct tcc gtg ttc atc ttc cca cct tcc gac gag cag ctg aag tcc ggc
384
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
aca gct tct gtc gtg tgc ctg ctg aac aac ttc tac cct cgg gaa gcc
432
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
aag gtg cag tgg aag gtg gac aat gcc ctg cag tcc ggc aac tcc caa
480
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
gag tct gtg acc gag cag gac tcc aag gac agc acc tac agc ctg tcc
528
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
tcc aca ctg acc ctg tcc aag gcc gac tac gag aag cac aag gtg tac
576
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
gcc tgc gaa gtg acc cat cag ggc ctg tct agc cct gtg acc aag tct
624
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
ttc aac cgg ggc gag tgc tga
645
Phe Asn Arg Gly Glu Cys
210
<210> 8
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Val
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 9
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(1347)
<400> 9
cag gtg cag ttg gtt cag tct ggc gcc gaa gtg aag aaa cct ggc gcc
48
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
tct gtg aag gtg tcc tgc aag gct tcc ggc tac acc ttt acc agc tac
96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
gtg atc cac tgg gtc cga cag gct cca gga caa ggc ttg gag tgg atg
144
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
ggc tac atc aac ccc tac cac gac gtg acc aag tac aac gag aag ttc
192
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
cag ggc aga gtg acc atg acc aga gac acc tcc acc agc acc gtg tac
240
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
atg gaa ctg tcc agc ctg aga tcc gag gac acc gcc gtg tac tac tgc
288
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc aga cag ggc gac cct tac tcc ggc aac tac cag ttt acc tac tgg
336
Ala Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
ggc cag ggc acc ctg gtc aca gtt tct tcc gct tcc acc aag gga ccc
384
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
agc gtt ttc cct ctg gct cct tgc tcc aga tcc acc tcc gag tct aca
432
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
gct gct ctg ggc tgc ctg gtc aag gac tac ttt cct gag cct gtg acc
480
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
gtg tcc tgg aac tct ggc gct ctg aca tct ggc gtg cac acc ttt cca
528
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
gct gtg ctg cag tcc tct ggc ctg tac tct ctg tcc tcc gtc gtg acc
576
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
gtg cct tcc tct aac ttt ggc acc cag acc tac acc tgt aat gtg gac
624
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
cac aag cct tcc aac acc aag gtg gac aag acc gtg gaa cgg aag tgc
672
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
tgc gtg gaa tgc cct cct tgt cct gct cct cct gtg gct ggc cct tcc
720
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
gtg ttt ctg ttc cct cca aag cct aag gac acc ctg atg atc tct cgg
768
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
acc cct gaa gtg acc tgc gtg gtg gtg gat gtg tct cac gag gat ccc
816
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
gaa gtg cag ttc aat tgg tac gtg gac ggc gtg gaa gtg cac aac gcc
864
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
aag acc aag cct aga gag gaa cag ttc aac tcc acc ttc aga gtg gtg
912
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
tcc gtg ctg acc gtg gtg cat cag gat tgg ctg aac ggc aaa gag tac
960
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
aag tgc aag gtg tcc aac aag ggc ctg cct gct cct atc gaa aag acc
1008
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
atc tct aag acc aag ggg cag ccc cgg gaa cct cag gtt tac aca ctg
1056
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
cct cca agc cgg gaa gag atg acc aag aac cag gtg tcc ctg acc tgc
1104
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
ctc gtg aag ggc ttc tac cct tcc gat atc gcc gtg gaa tgg gag agc
1152
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
aat ggc cag cct gag aac aac tac aag acc aca cct cct atg ctg gac
1200
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
tcc gac ggc tca ttc ttc ctg tac tcc aag ctg aca gtg gac aag tcc
1248
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
aga tgg cag cag ggc aac gtg ttc tcc tgc tcc gtg atg cac gag gcc
1296
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
ctg cac aat cac tac acc cag aag tcc ctg tct ctg tcc cct ggc aaa
1344
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
tga
1347
<210> 10
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 11
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(645)
<400> 11
gac atc cag atg acc cag tct cca tcc tct ctg tcc gcc tct gtg ggc
48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
gac aga gtg acc atc acc tgt aga gcc tct cag gac gtg tcc acc gag
96
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
gtc gtg tgg tat cag cag aag cct ggc aag gcc cct aag ctg ctg atc
144
Val Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
tac tcc gcc tcc tac cgg tac tct ggc gtg ccc tct aga ttc tcc ggc
192
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
tct ggc tct ggc acc gac ttt acc ctg aca atc tcc agc ctg cag cct
240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gag gac ttc gcc acc tac tac tgc cag cag cac tac agc acc cct tac
288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
acc ttt ggc cag ggc acc aag ctg gaa atc aag cgg aca gtg gcc gct
336
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
cct tcc gtg ttc atc ttc cca cct tcc gac gag cag ctg aag tcc ggc
384
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
aca gct tct gtc gtg tgc ctg ctg aac aac ttc tac cct cgg gaa gcc
432
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
aag gtg cag tgg aag gtg gac aat gcc ctg cag tcc ggc aac tcc caa
480
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
gag tct gtg acc gag cag gac tcc aag gac agc acc tac agc ctg tcc
528
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
tcc aca ctg acc ctg tcc aag gcc gac tac gag aag cac aag gtg tac
576
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
gcc tgc gaa gtg acc cat cag ggc ctg tct agc cct gtg acc aag tct
624
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
ttc aac cgg ggc gag tgc tga
645
Phe Asn Arg Gly Glu Cys
210
<210> 12
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
Val Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 13
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(1350)
<400> 13
cag gtg cag ttg gtt cag tct ggc gcc gaa gtg aag aaa cct ggc gcc
48
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
tct gtg aag gtg tcc tgc aag gct tcc ggc tac acc ttt acc agc tac
96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
gtg atc cac tgg gtc cga cag gct cca gga caa ggc ttg gag tgg atg
144
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
ggc tac atc aac ccc tac cac gac gtg acc aag tac aac gag aag ttc
192
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
cag ggc aga gtg acc atg acc aga gac acc tcc acc agc acc gtg tac
240
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
atg gaa ctg tcc agc ctg aga tcc gag gac acc gcc gtg tac tac tgc
288
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc aga cag ggc gac cct tac tcc ggc aac tac cag ttt acc tac tgg
336
Ala Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
ggc cag ggc acc ctg gtc aca gtt tct tcc gct tct acc aag ggc ccc
384
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
tcc gtg ttc cct ctg gcc cct tgc tcc aga tcc acc tcc gag tct acc
432
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
gcc gct ctg ggc tgc ctc gtg aag gac tac ttc ccc gag ccc gtg aca
480
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
gtg tcc tgg aac tct ggc gct ctg acc tcc ggc gtg cac acc ttt cca
528
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
gca gtg ctg cag tcc tcc ggc ctg tac tcc ctg tcc tcc gtc gtg act
576
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
gtg ccc tcc agc tct ctg ggc acc aag acc tac acc tgt aac gtg gac
624
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
cac aag ccc tcc aac acc aag gtg gac aag aga gtg gaa tct aag tac
672
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
ggc cct ccc tgc ccc cct tgt cct gcc cct gaa ttt ctg ggc gga ccc
720
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
agc gtg ttc ctg ttc ccc cca aag ccc aag gac acc ctg atg atc tcc
768
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
cgg acc ccc gaa gtg acc tgc gtg gtg gtg gat gtg tcc cag gaa gat
816
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
ccc gag gtg cag ttc aat tgg tac gtg gac ggc gtg gaa gtg cac aac
864
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
gcc aag acc aag cct aga gag gaa cag ttc aac tcc acc tac cgg gtg
912
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
gtg tcc gtg ctg acc gtg ctg cac cag gat tgg ctg aac ggc aaa gag
960
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
tac aag tgc aag gtg tcc aac aag ggc ctg ccc agc tcc atc gaa aag
1008
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
acc atc tcc aag gcc aag ggc cag ccc cgg gaa ccc cag gtg tac aca
1056
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
ctg cct cca agc cag gaa gag atg acc aag aac cag gtg tcc ctg acc
1104
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
tgt ctc gtg aaa ggc ttc tac ccc tcc gat atc gcc gtg gaa tgg gag
1152
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
tcc aac ggc cag cct gag aac aac tac aag acc acc ccc cct gtg ctg
1200
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
gac tcc gac ggc tcc ttc ttc ctg tac tct cgc ctg acc gtg gac aag
1248
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
tcc cgg tgg cag gaa ggc aac gtg ttc tcc tgc tcc gtg atg cac gag
1296
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
gcc ctg cac aac cac tac acc cag aag tcc ctg tct ctg tcc ctg ggc
1344
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
aag tga
1350
Lys
<210> 14
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 15
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> антитело
<220>
<221> CDS
<222> (1)..(645)
<400> 15
gac atc cag atg acc cag tct cca tcc tct ctg tcc gcc tct gtg ggc
48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
gac aga gtg acc atc acc tgt aga gcc tct cag gac gtg tcc acc gag
96
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
gtc gtg tgg tat cag cag aag cct ggc aag gcc cct aag ctg ctg atc
144
Val Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
tac tcc gcc tcc tac cgg tac tct ggc gtg ccc tct aga ttc tcc ggc
192
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
tct ggc tct ggc acc gac ttt acc ctg aca atc tcc agc ctg cag cct
240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gag gac ttc gcc acc tac tac tgc cag cag cac tac agc acc cct tac
288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
acc ttt ggc cag ggc acc aag ctg gaa atc aag cgg aca gtg gcc gct
336
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
cct tcc gtg ttc atc ttc cca cct tcc gac gag cag ctg aag tcc ggc
384
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
aca gct tct gtc gtg tgc ctg ctg aac aac ttc tac cct cgg gaa gcc
432
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
aag gtg cag tgg aag gtg gac aat gcc ctg cag tcc ggc aac tcc caa
480
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
gag tct gtg acc gag cag gac tcc aag gac agc acc tac agc ctg tcc
528
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
tcc aca ctg acc ctg tcc aag gcc gac tac gag aag cac aag gtg tac
576
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
gcc tgc gaa gtg acc cat cag ggc ctg tct agc cct gtg acc aag tct
624
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
ttc aac cgg ggc gag tgc tga
645
Phe Asn Arg Gly Glu Cys
210
<210> 16
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
Val Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 17
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область антитела
<220>
<221> CDS
<222> (1)..(366)
<400> 17
gag gtg cag ttg gtt gaa tct ggc gga gga ctg gtt cag cct ggc gga
48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tct ctg aga ctg tct tgt gcc gcc tct ggc ttc gtg ttc agc tcc gac
96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
gat atg tcc tgg gtc cga cag gct cct ggc aaa gga ttg gag tgg gtc
144
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
gcc tac atc tct tct ggc ggc gac tac acc tac tat ccc gac acc gtg
192
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
aag ggc aga ttc acc atc tcc aga gac aac gcc aag aac tcc ctg tac
240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
ctg cag atg aac agc ctg aga gcc gag gac acc gcc gtg tac tac tgt
288
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc aga cac ctg tac ggc tcc tcc agc tac tac gtg atg gac tat tgg
336
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
ggc cag ggc acc ctg gtc aca gtg tcc tct
366
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 18
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 19
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область антитела
<220>
<221> CDS
<222> (1)..(321)
<400> 19
gac atc cag atg acc cag tct cca tcc tct ctg tct gcc agc ctg ggc
48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
gac aga atc acc atc acc tgt cac gcc agc cag aac atc aac gtg tgg
96
Asp Arg Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
ctg tcc tgg tat cag cag aag ccc ggc aag atc ccc aag ctg ctg gtg
144
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Val
35 40 45
tac aag gcc tcc aat ctg cac acc ggc gtg ccc tct aga ttc tcc gga
192
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
tct ggc tct ggc acc gac ttt acc ctg aca atc tcc agc ctg cag cct
240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gag gac ttc gcc acc tac tat tgt cag cag ggc cag agc tac cct ctg
288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
acc ttt ggc gct ggc acc aag ctg gaa atc aag
321
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 20
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Val
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 21
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область антитела
<220>
<221> CDS
<222> (1)..(366)
<400> 21
cag gtg cag ttg gtt cag tct ggc gcc gaa gtg aag aaa cct ggc gcc
48
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
tct gtg aag gtg tcc tgc aag gct tcc ggc tac acc ttt acc agc tac
96
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
gtg atc cac tgg gtc cga cag gct cca gga caa ggc ttg gag tgg atg
144
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
ggc tac atc aac ccc tac cac gac gtg acc aag tac aac gag aag ttc
192
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
cag ggc aga gtg acc atg acc aga gac acc tcc acc agc acc gtg tac
240
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
atg gaa ctg tcc agc ctg aga tcc gag gac acc gcc gtg tac tac tgc
288
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc aga cag ggc gac cct tac tcc ggc aac tac cag ttt acc tac tgg
336
Ala Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
ggc cag ggc acc ctg gtc aca gtt tct tcc
366
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 23
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область антитела
<220>
<221> CDS
<222> (1)..(321)
<400> 23
gac atc cag atg acc cag tct cca tcc tct ctg tcc gcc tct gtg ggc
48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
gac aga gtg acc atc acc tgt aga gcc tct cag gac gtg tcc acc gag
96
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
gtc gtg tgg tat cag cag aag cct ggc aag gcc cct aag ctg ctg atc
144
Val Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
tac tcc gcc tcc tac cgg tac tct ggc gtg ccc tct aga ttc tcc ggc
192
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
tct ggc tct ggc acc gac ttt acc ctg aca atc tcc agc ctg cag cct
240
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
gag gac ttc gcc acc tac tac tgc cag cag cac tac agc acc cct tac
288
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
acc ttt ggc cag ggc acc aag ctg gaa atc aag
321
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 24
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
Val Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 25
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 25
Ser Asp Asp Met Ser
1 5
<210> 26
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 26
Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val Lys
1 5 10 15
Gly
<210> 27
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 27
His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr
1 5 10
<210> 28
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 28
His Ala Ser Gln Asn Ile Asn Val Trp Leu Ser
1 5 10
<210> 29
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 29
Lys Ala Ser Asn Leu His Thr
1 5
<210> 30
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 30
Gln Gln Gly Gln Ser Tyr Pro Leu Thr
1 5
<210> 31
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 31
Ser Tyr Val Ile His
1 5
<210> 32
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 32
Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe Gln
1 5 10 15
Gly
<210> 33
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 33
Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr
1 5 10
<210> 34
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 34
Arg Ala Ser Gln Asp Val Ser Thr Glu Val Val
1 5 10
<210> 35
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 35
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 36
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR
<400> 36
Gln Gln His Tyr Ser Thr Pro Tyr Thr
1 5
<210> 37
<211> 1359
<212> ДНК
<213> Искусственная последовательность
<220>
<223> тяжелая цепь химерного анти-CD80 антитела
<400> 37
gaagtgaagc tgttggagtc tggcggcgga ctggttaagc ctggcggatc tctgaagctg
60
tcttgtgccg cctctggctt cgtgttcagc tccgacgata tgtcctgggt ccgacagtct
120
cctgagaagc ggcttgagtg ggtcgcctac atctcttccg gcggagacta cacctactat
180
cccgacaccg tgaagggcag attcaccatc tccagagaca acgccaagaa caccctgtac
240
ctgcagatgt ccagcctgaa gtctgaggac accgccatgt actactgcgc cagacacctg
300
tacggctcct ccagctacta cgtgatggac tattggggcc agggcacctc tgtcacagtg
360
tcctctgctt ccaccaaggg acccagcgtg ttccctctgg ctccttccag caagtctacc
420
tctggcggaa cagctgctct gggctgcctg gtcaaggact actttcctga gcctgtgacc
480
gtgtcctgga actctggcgc tctgacatct ggcgtgcaca cattccctgc tgtgctgcag
540
tcctccggcc tgtactctct gtcctctgtc gtgaccgtgc cttccagctc tctgggaacc
600
cagacctaca tctgcaatgt gaaccacaag ccttccaaca ccaaggtgga caagaaggtg
660
gaacccaagt cctgcgacaa gacccacacc tgtcctccat gtcctgctcc agaactgctc
720
ggcggacctt ccgtgttcct gtttcctcca aagcctaagg acaccctgat gatctctcgg
780
acccctgaag tgacctgcgt ggtggtggat gtgtcccacg aggacccaga agtgaagttc
840
aattggtacg tggacggcgt ggaagtgcac aacgccaaga ccaagcctag agaggaacag
900
tacaactcca cctacagagt ggtgtccgtg ctgaccgtgc tgcaccagga ttggctgaac
960
ggcaaagagt acaagtgcaa ggtgtccaac aaggccctgc ctgctcctat cgaaaagacc
1020
atctccaagg ccaagggcca gcctcgagaa ccccaggttt acaccttgcc tccatctcgg
1080
gacgagctga ccaagaacca ggtgtccctg acctgtctcg tgaagggctt ctacccctcc
1140
gacattgccg tggaatggga gtctaatggc cagccagaga acaactacaa gacaacccct
1200
cctgtgctgg actccgacgg ctcattcttc ctgtactcca agctgacagt ggacaagtcc
1260
agatggcagc agggcaacgt gttctcctgc tccgtgatgc acgaggccct gcacaatcac
1320
tacacacaga agtccctgtc tctgagcccc ggcaaatga
1359
<210> 38
<211> 452
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь химерного анти-CD80 антитела
<400> 38
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
Asp Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 39
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> легкая цепь химерного анти-CD80 антитела
<400> 39
gacatccaga tgacccagtc tccatcctct ctgtctgcca gcctgggcga caccatcacc
60
atcacatgtc acgccagcca gaacatcaac gtgtggctgt cctggtatca gcagaagccc
120
ggcaacatcc ccaagctgct ggtgtacaag gcctccaatc tgcacaccgg cgtgccctct
180
agattctccg gatctggctc tggcaccggc tttaccctga caatcagctc cttgcagccc
240
gaggacattg ccacctacta ctgtcagcag ggccagagct accctctgac ctttggcgct
300
ggcaccaagc tggaactgaa gcggacagtg gccgctcctt ccgtgttcat cttcccacct
360
tccgacgagc agctgaagtc cggcacagct tctgtcgtgt gcctgctgaa caacttctac
420
cctcgggaag ccaaggtgca gtggaaggtg gacaatgccc tgcagtccgg caactcccaa
480
gagtctgtga ccgagcagga ctccaaggac agcacctaca gcctgtcctc cacactgacc
540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccatcagggc
600
ctgtctagcc ctgtgaccaa gtctttcaac cggggcgagt gctga
645
<210> 40
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь химерного анти-CD80 антитела
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Val
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 41
<211> 1359
<212> ДНК
<213> Искусственная последовательность
<220>
<223> тяжелая цепь химерного анти-CD86 антитела
<400> 41
gaggttcagt tgcagcagtc tggacccgag ctggtcaagc ctggcacctc cgtgaagatg
60
tcctgcaagg cctccggcta caccttcacc agctacgtga tccactgggt caaagagaag
120
ccaggccagg gccttgagtg gatcggctac atcaacccct accacgacgt gaccaagtac
180
aacgagaagt tcaagggcag agctaccctg acctccgaca agtcctcttc caccgcctac
240
atggaactgt ccagcctgac ctctgaggac tccgccgtgt actactgctc tagacagggc
300
gacccttact ccggcaacta ccagtttacc tactggggcc agggcaccct ggtcacagtt
360
tctgccgctt ccaccaaggg acccagcgtg ttccctctgg ctccttccag caagtctacc
420
tctggcggaa cagctgctct gggctgcctg gtcaaggact actttcctga gcctgtgacc
480
gtgtcctgga actctggcgc tctgacatct ggcgtgcaca cattccctgc tgtgctgcag
540
tcctccggcc tgtactctct gtcctctgtc gtgaccgtgc cttccagctc tctgggaacc
600
cagacctaca tctgcaatgt gaaccacaag ccttccaaca ccaaggtgga caagaaggtg
660
gaacccaagt cctgcgacaa gacccacacc tgtcctccat gtcctgctcc agaactgctc
720
ggcggacctt ccgtgttcct gtttcctcca aagcctaagg acaccctgat gatctctcgg
780
acccctgaag tgacctgcgt ggtggtggat gtgtcccacg aggacccaga agtgaagttc
840
aattggtacg tggacggcgt ggaagtgcac aacgccaaga ccaagcctag agaggaacag
900
tacaactcca cctacagagt ggtgtccgtg ctgaccgtgc tgcaccagga ttggctgaac
960
ggcaaagagt acaagtgcaa ggtgtccaac aaggccctgc ctgctcctat cgaaaagacc
1020
atctccaagg ccaagggcca gcctcgagaa ccccaggttt acaccttgcc tccatctcgg
1080
gacgagctga ccaagaacca ggtgtccctg acctgtctcg tgaagggctt ctacccctcc
1140
gacattgccg tggaatggga gtctaatggc cagccagaga acaactacaa gacaacccct
1200
cctgtgctgg actccgacgg ctcattcttc ctgtactcca agctgacagt ggacaagtcc
1260
agatggcagc agggcaacgt gttctcctgc tccgtgatgc acgaggccct gcacaatcac
1320
tacacacaga agtccctgtc tctgagcccc ggcaaatga
1359
<210> 42
<211> 452
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь химерного анти-CD86 антитела
<400> 42
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Lys Glu Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 43
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> легкая цепь химерного анти-CD86 антитела
<400> 43
gacatcgtga tgtcccagag ccacaagttc atgtccacct ccgtgggcga cagagtgtct
60
atcgcctgca aggcctctca ggacgtgtcc acagaggtcg tgtggttcca gcagaagcct
120
ggccagtctc ctaagctgct gatctactcc gcctcctaca gatacaccgg cgtgcccgat
180
agattcaccg gctctggctc tggcaccgac tttaccttca ccatcagctc cgtgcaggcc
240
gaggatctgg ccgtgtacta ctgtcagcag cactacagca ccccttacac ctttggcgga
300
ggcaccaagc tggaaatcaa gcggacagtg gccgctcctt ccgtgttcat cttcccacct
360
tccgacgagc agctgaagtc cggcacagct tctgtcgtgt gcctgctgaa caacttctac
420
cctcgggaag ccaaggtgca gtggaaggtg gacaatgccc tgcagtccgg caactcccaa
480
gagtctgtga ccgagcagga ctccaaggac agcacctaca gcctgtcctc cacactgacc
540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccatcagggc
600
ctgtctagcc ctgtgaccaa gtctttcaac cggggcgagt gctga
645
<210> 44
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь химерного анти-CD86 антитела
<400> 44
Asp Ile Val Met Ser Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Ala Cys Lys Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
Val Val Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 45
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи химерного анти-CD80 антитела
<400> 45
gaagtgaagc tgttggagtc tggcggcgga ctggttaagc ctggcggatc tctgaagctg
60
tcttgtgccg cctctggctt cgtgttcagc tccgacgata tgtcctgggt ccgacagtct
120
cctgagaagc ggcttgagtg ggtcgcctac atctcttccg gcggagacta cacctactat
180
cccgacaccg tgaagggcag attcaccatc tccagagaca acgccaagaa caccctgtac
240
ctgcagatgt ccagcctgaa gtctgaggac accgccatgt actactgcgc cagacacctg
300
tacggctcct ccagctacta cgtgatggac tattggggcc agggcacctc tgtcacagtg
360
tcctct
366
<210> 46
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи химерного анти-CD80 антитела
<400> 46
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Val Phe Ser Ser Asp
20 25 30
Asp Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 47
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи химерного анти-CD80 антитела
<400> 47
gacatccaga tgacccagtc tccatcctct ctgtctgcca gcctgggcga caccatcacc
60
atcacatgtc acgccagcca gaacatcaac gtgtggctgt cctggtatca gcagaagccc
120
ggcaacatcc ccaagctgct ggtgtacaag gcctccaatc tgcacaccgg cgtgccctct
180
agattctccg gatctggctc tggcaccggc tttaccctga caatcagctc cttgcagccc
240
gaggacattg ccacctacta ctgtcagcag ggccagagct accctctgac ctttggcgct
300
ggcaccaagc tggaactgaa g
321
<210> 48
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи химерного анти-CD80 антитела
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Val
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 49
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи химерного анти-CD86 антитела
<400> 49
gaggttcagt tgcagcagtc tggacccgag ctggtcaagc ctggcacctc cgtgaagatg
60
tcctgcaagg cctccggcta caccttcacc agctacgtga tccactgggt caaagagaag
120
ccaggccagg gccttgagtg gatcggctac atcaacccct accacgacgt gaccaagtac
180
aacgagaagt tcaagggcag agctaccctg acctccgaca agtcctcttc caccgcctac
240
atggaactgt ccagcctgac ctctgaggac tccgccgtgt actactgctc tagacagggc
300
gacccttact ccggcaacta ccagtttacc tactggggcc agggcaccct ggtcacagtt
360
tctgcc
366
<210> 50
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи химерного анти-CD86 антитела
<400> 50
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Lys Glu Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 51
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи химерного анти-CD86 антитела
<400> 51
gacatcgtga tgtcccagag ccacaagttc atgtccacct ccgtgggcga cagagtgtct
60
atcgcctgca aggcctctca ggacgtgtcc acagaggtcg tgtggttcca gcagaagcct
120
ggccagtctc ctaagctgct gatctactcc gcctcctaca gatacaccgg cgtgcccgat
180
agattcaccg gctctggctc tggcaccgac tttaccttca ccatcagctc cgtgcaggcc
240
gaggatctgg ccgtgtacta ctgtcagcag cactacagca ccccttacac ctttggcgga
300
ggcaccaagc tggaaatcaa g
321
<210> 52
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи химерного анти-CD86 антитела
<400> 52
Asp Ile Val Met Ser Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Ala Cys Lys Ala Ser Gln Asp Val Ser Thr Glu
20 25 30
Val Val Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 53
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 химерного анти-CD80 антитела
<400> 53
Ser Asp Asp Met Ser
1 5
<210> 54
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 химерного анти-CD80 антитела
<400> 54
Tyr Ile Ser Ser Gly Gly Asp Tyr Thr Tyr Tyr Pro Asp Thr Val Lys
1 5 10 15
Gly
<210> 55
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 химерного анти-CD80 антитела
<400> 55
His Leu Tyr Gly Ser Ser Ser Tyr Tyr Val Met Asp Tyr
1 5 10
<210> 56
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1 химерного анти-CD80 антитела
<400> 56
His Ala Ser Gln Asn Ile Asn Val Trp Leu Ser
1 5 10
<210> 57
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 химерного анти-CD80 антитела
<400> 57
Lys Ala Ser Asn Leu His Thr
1 5
<210> 58
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 химерного анти-CD80 антитела
<400> 58
Gln Gln Gly Gln Ser Tyr Pro Leu Thr
1 5
<210> 59
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 химерного анти-CD86 антитела
<400> 59
Ser Tyr Val Ile His
1 5
<210> 60
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 химерного анти-CD86 антитела
<400> 60
Tyr Ile Asn Pro Tyr His Asp Val Thr Lys Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 61
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 химерного анти-CD86 антитела
<400> 61
Gln Gly Asp Pro Tyr Ser Gly Asn Tyr Gln Phe Thr Tyr
1 5 10
<210> 62
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1 химерного анти-CD86 антитела
<400> 62
Lys Ala Ser Gln Asp Val Ser Thr Glu Val Val
1 5 10
<210> 63
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 химерного анти-CD86 антитела
<400> 63
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 64
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 химерного анти-CD86 антитела
<400> 64
Gln Gln His Tyr Ser Thr Pro Tyr Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |
| АНТИТЕЛО К CD73 ЧЕЛОВЕКА | 2017 |
|
RU2754058C2 |
| АНТИТЕЛО ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2781148C2 |
| АНТИТЕЛО ПРОТИВ Fn14 ЧЕЛОВЕКА | 2019 |
|
RU2787044C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2714205C2 |
| KLK5-ИНГИБИРУЮЩИЙ ПЕПТИД | 2019 |
|
RU2826422C2 |
| ШТАММ КЛЕТОК CHO-SE-9/4 - ПРОДУЦЕНТ ХИМЕРНОГО АНТИТЕЛА ПРОТИВ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА И ХИМЕРНОЕ АНТИТЕЛО, ПРОДУЦИРУЕМОЕ ДАННЫМ ШТАММОМ | 2019 |
|
RU2717038C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2019 |
|
RU2781542C2 |
| УНИВЕРСАЛЬНЫЙ АНТИТЕЛООПОСРЕДОВАННЫЙ БИОСЕНСОР | 2016 |
|
RU2746486C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2766586C2 |
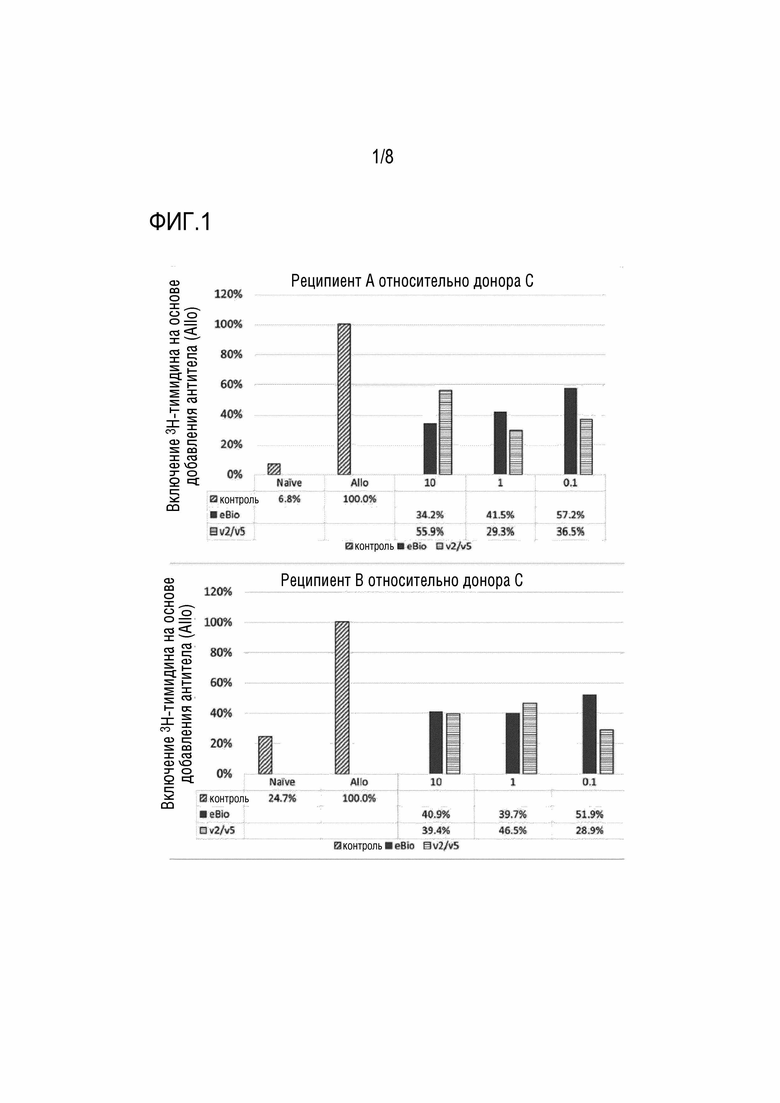
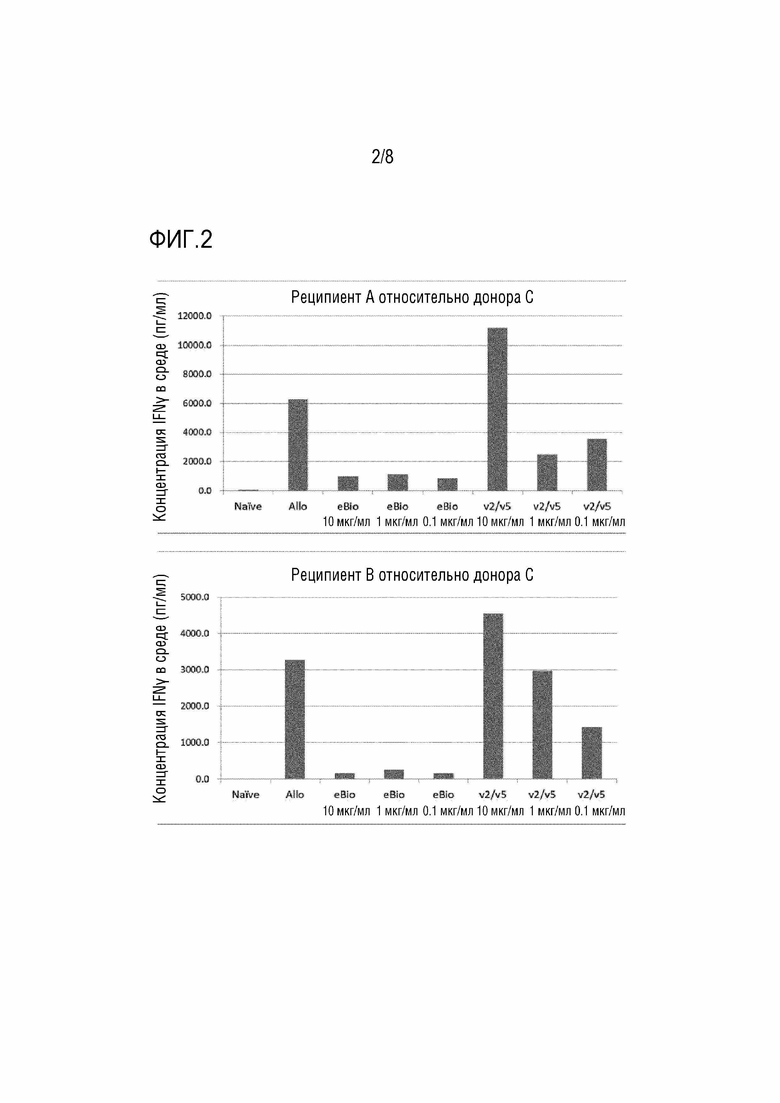
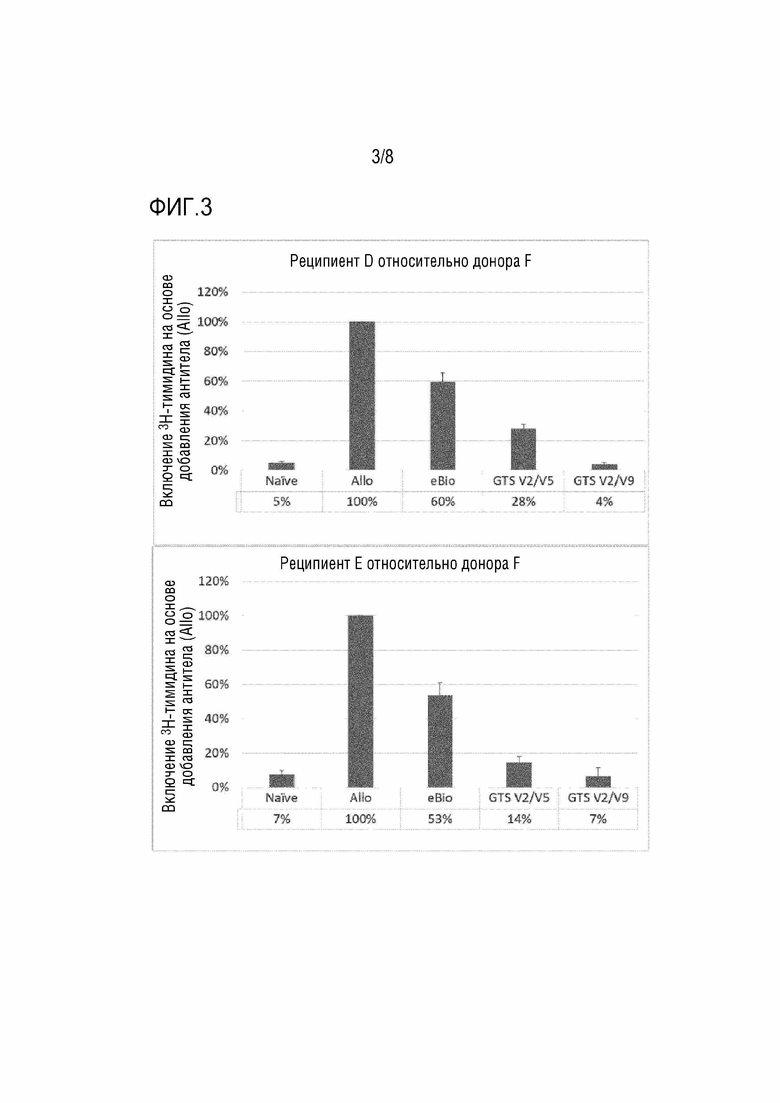

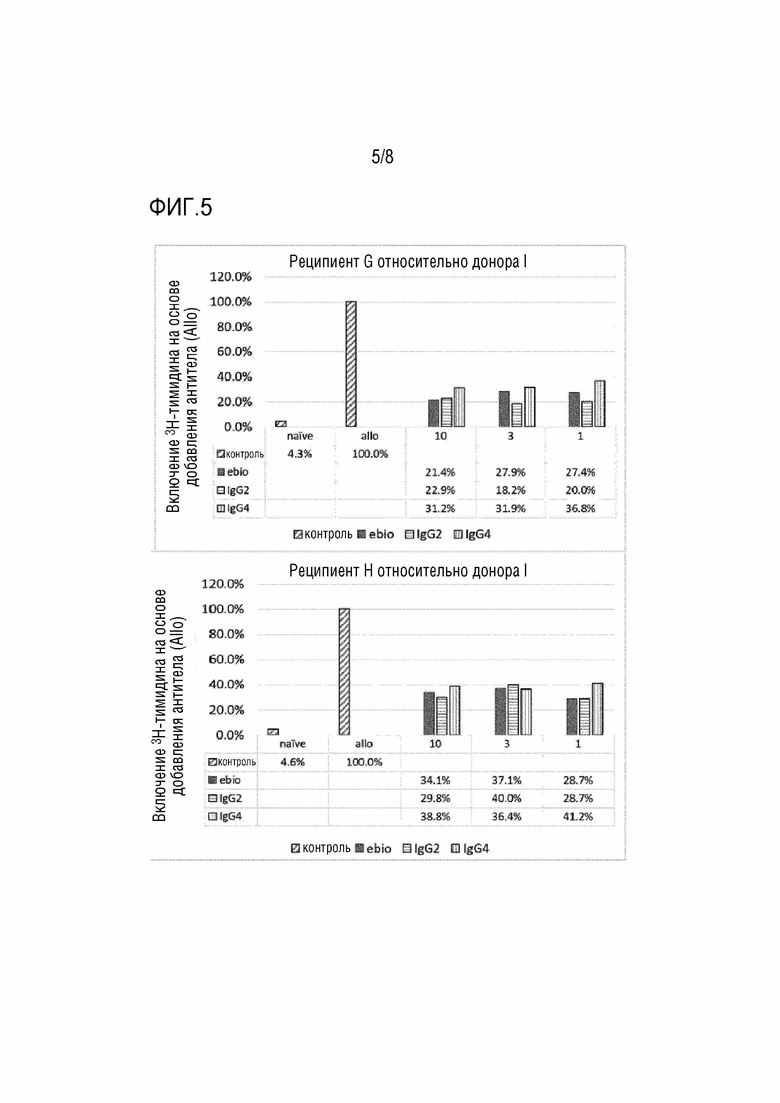
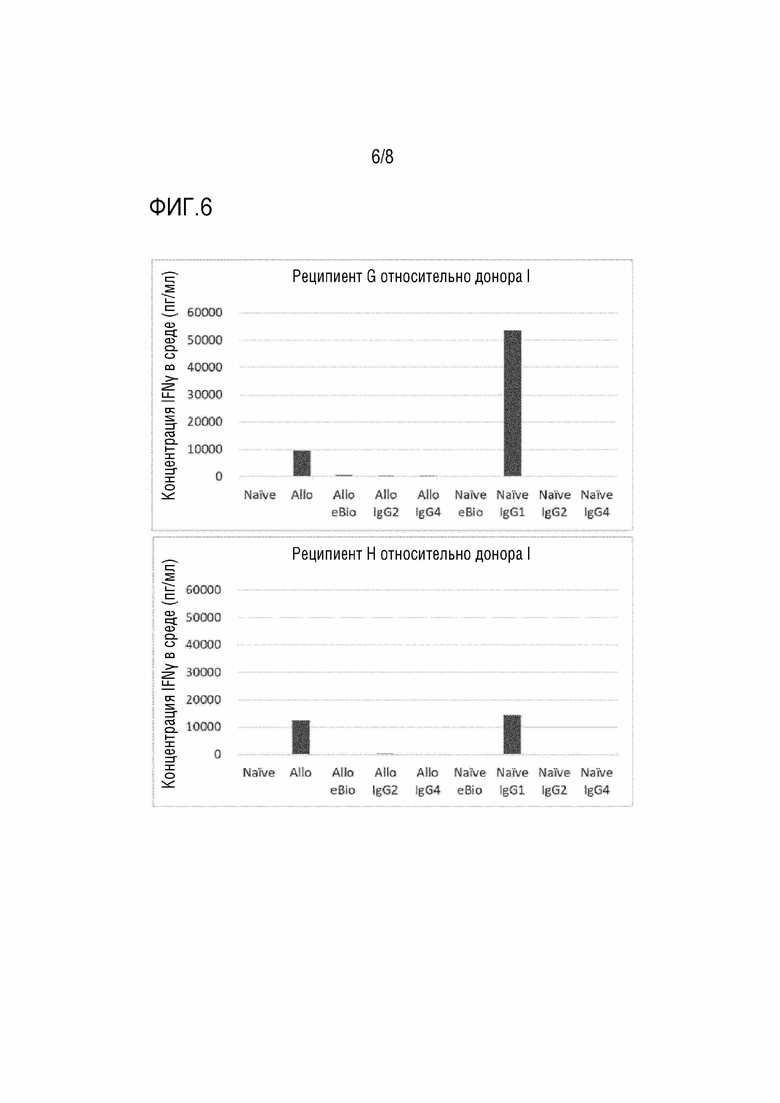
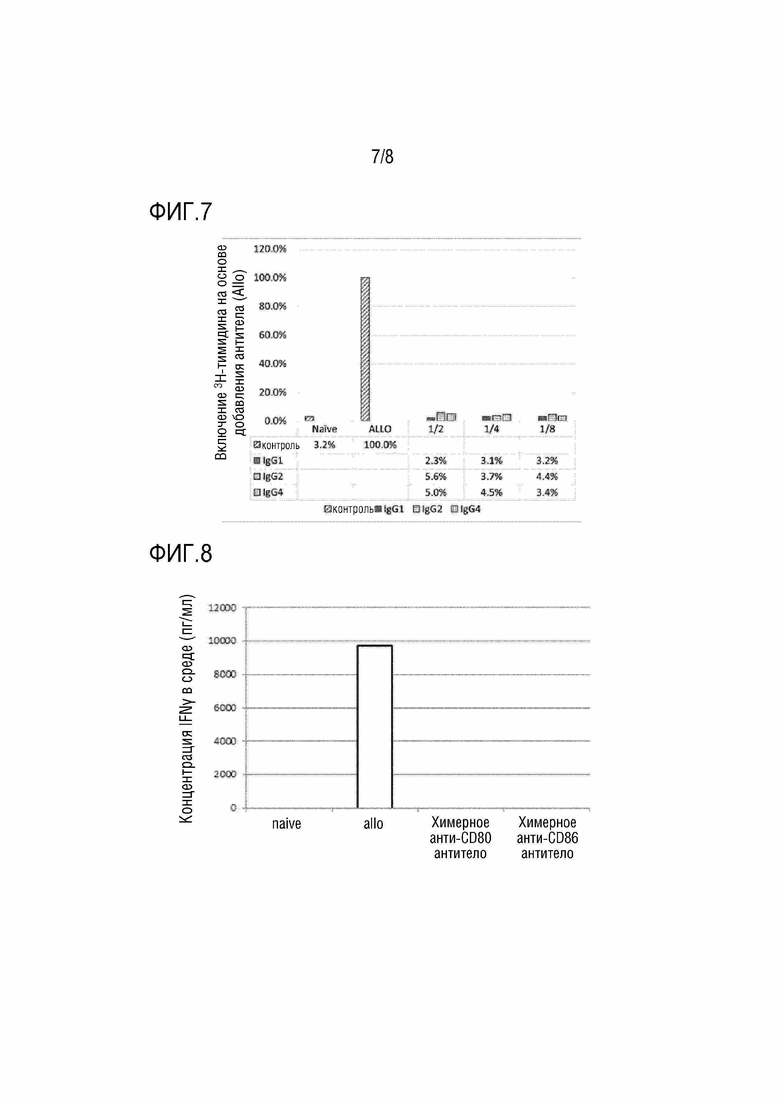
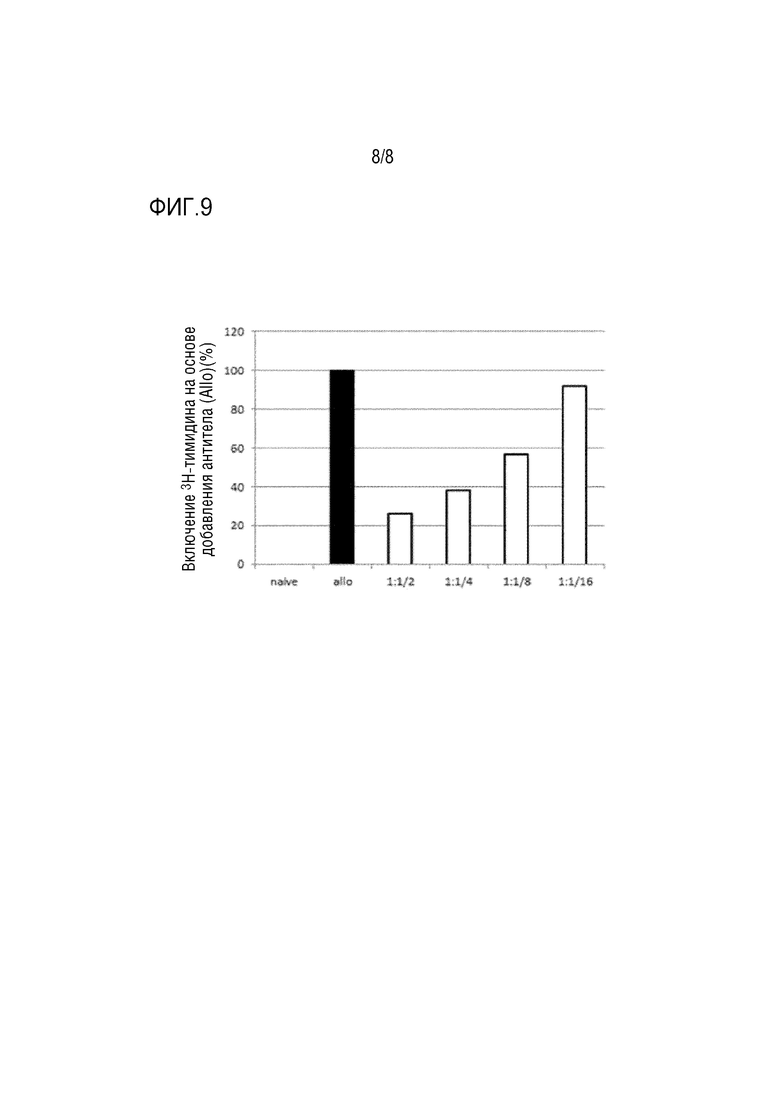
Изобретение относится к области биотехнологии, а именно к комбинации антител для индукции иммунной толерантности к клетке, полученной у индивида, содержащей анти-CD86 антитело и анти-CD80 антитело. Также раскрыты молекула нуклеиновой кислоты, кодирующая анти-CD80 антитело или его вариант, молекула нуклеиновой кислоты, кодирующая анти-CD86 антитело или его вариант, а также вектор и клетка, их содержащие. Изобретение также относится к способу получения клетки, включающему применение вышеуказанной комбинации. Изобретение эффективно для индукции иммунной толерантности к клетке, полученной у индивида. 7 н. и 2 з.п. ф-лы, 9 ил., 1 табл., 6 пр.
1. Комбинация антител для индукции иммунной толерантности к клетке, полученной у индивида, где комбинация антител содержит анти-CD86 антитело и анти-CD80 антитело, или их варианты,
где анти-CD86 антитело имеет тяжелую цепь с аминокислотной последовательностью SEQ ID NO:42 и легкую цепь с аминокислотной последовательностью SEQ ID NO:44,
где вариант антитело представляет собой Fab-антитело, антитело F(ab')2, антитело Fab', антитело Fv или антитело scFv,
где комбинация антител по существу не индуцирует продукцию цитокина путем иммуностимуляции и снижает обратный захват 3H-тимидина в клетке, полученной у индивида, по сравнению с клеткой, у которой не была индуцирована иммунная толерантность.
2. Комбинация по п.1, где
анти-CD86 антитело содержит:
VH, содержащую
CDRH1 с аминокислотной последовательностью SEQ ID NO:59,
CDRH2 с аминокислотной последовательностью SEQ ID NO:60, и
CDRH3 с аминокислотной последовательностью SEQ ID NO:61, и
VL, содержащую
CDRL1 с аминокислотной последовательностью SEQ ID NO:62,
CDRL2 с аминокислотной последовательностью SEQ ID NO:63, и
CDRL3 с аминокислотной последовательностью SEQ ID NO:64 и
анти-CD80 антитело содержит:
VH, содержащую
CDRH1 с аминокислотной последовательностью SEQ ID NO:53,
CDRH2 с аминокислотной последовательностью SEQ ID NO:54, и
CDRH3 с аминокислотной последовательностью SEQ ID NO:55, и
VL, содержащую
CDRL1 с аминокислотной последовательностью SEQ ID NO:56,
CDRL2 с аминокислотной последовательностью SEQ ID NO:57, и
CDRL3 с аминокислотной последовательностью SEQ ID NO:58.
3. Антитело или его вариант по п.1 или 2, где химерное антитело представляет собой химерное антитело мышь-человек.
4. Молекула нуклеиновой кислоты, кодирующая анти-CD86 антитело или его вариант по п.1 или 2.
5. Молекула нуклеиновой кислоты, кодирующая анти-CD80 антитело или его вариант по п.1 или 2, содержащая
полинуклеотид, кодирующий VH, с нуклеотидной последовательностью SEQ ID NO:45, и
полинуклеотид, кодирующий VL, с нуклеотидной последовательностью SEQ ID NO:47.
6. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по пп.4 и 5.
7. Клетка для получения комбинации по п.1 или 2, содержащая вектор по п.6.
8. Способ получения комбинации по п.1 или 2, включающий культивирование клетки по п.7.
9. Способ получения клетки для лечения или профилактики заболевания, расстройства или состояния, включающий
смешивание комбинации по п.1 или 2, Т-клетки, полученной от индивида, и CD80 и CD86 антигенов, чужеродных индивиду, или материала, содержащего эти антигены,
где заболевание, нарушение или состояние выбрано из группы, состоящей из отторжения трансплантата, аллергии, аутоиммунного заболевания, реакции «трансплантат против хозяина» и иммунного отторжения, вызванного трансплантацией iPS-клетки или ES-клетки и клетки, ткани, или органа, полученных из указанной iPS-клетки или указанной ES-клетки.
| WO 2014186193 А1, 20.11.2014 | |||
| BLAZEVIC V | |||
| et al | |||
| Analysis of the Costimulatory Requirements for Generating Human Virus-Specific in Vitro T Helper and Effector Responses | |||
| JOURNAL OF CLINICAL IMMUNOLOGY, 2001, v.21, n.4, p.293-302 | |||
| WATANABE T | |||
| Treatment strategies for nodal and gastrointestinal follicular lymphoma: Current status and future |
Авторы
Даты
2024-04-02—Публикация
2019-06-21—Подача