ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая патентная заявка испрашивает приоритет Предварительной заявки на патент США серийный номер 62/140920, поданной 31 марта 2015 года, под названием «Система быстрого обнаружения определяемых компонентов» и Предварительной патентной заявки США серийный номер 62/245595, поданной 23 октября 2015 года, под названием «Системы и устройства для быстрого обнаружения определяемых компонентов», раскрытие которых включено в настоящее описание посредством ссылки в полном объеме и является частью настоящей заявки на выдачу патента США на изобретение для всех целей.
УРОВЕНЬ ТЕХНИКИ
[002] В общем, описанное изобретение относится к системам, устройствам и способам обнаружения различных определяемых компонентов в биологических образцах или других типах образцов, а более конкретно, к системе на основе биосенсора для обнаружения и идентификации представляющих интерес определяемых компонентов в реальном времени на основе испускания обнаружимого сигнала при реакции биосенсора с представляющим интерес определяемым компонентом в исследуемом образце.
[003] В общих терминах биосенсор представляет собой систему или устройство для обнаружения определяемого компонента, которое объединяет чувствительный биологический компонент с физико-химическим детекторным компонентом. Компоненты типичной биосенсорной системы включают в себя биологический элемент, преобразователь или детекторный элемент, а также связанные электронные или сигнальные процессоры, которые отображают результаты испытаний значимым и полезным способом. Биологический элемент обычно содержит биологический материал, такой как ткань, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты и т.п., которые могут быть созданы известными методами биологической инженерии. Механизм действия преобразователя или детекторного элемента является физико-химическим (например, оптическим, пьезоэлектрическим и/или электрохимическим) и состоит в преобразовании сигнала, полученного в результате взаимодействия определяемого компонента с биологическим элементом, в другой сигнал, который можно с большей легкостью измерить и определить количественно. Биосенсоры возникли в результате интеграции молекулярной биологии и информационных технологий (например, микросхем, оптических волокон и т.д.) для идентификации или количественного определения взаимодействия биомолекулы-определяемого компонента, такого как взаимодействие антитела-антигена. Учитывая, что существует большой спрос на быстрые, чувствительные, простые в обращении и эффективные с точки зрения затрат инструменты для обнаружения инфекционных агентов, патогенов и/или токсинов в пище (см., например, Mead et al., Food Related Illness and Death in the United States, Emerging Infectious Diseases; Vol. 5, No. 5, September-October 1999 (607-625), включенную в настоящее описание посредством ссылки в полном объеме), существует настоятельная потребность в применении биосенсоров в переносных устройствах и приборах для обнаружения и идентификации инфекционных агентов, патогенных микроорганизмов, токсинов и других загрязняющих веществ в пищевых продуктах и многих других предметах в реальном времени.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[004] Ниже приведено краткое описание некоторых типичных вариантов реализации настоящего изобретения. Это резюме не является обширным обзором и не предназначено для определения ключевых или критических аспектов или элементов настоящего изобретения или для определения его объема.
[005] В соответствии с одним аспектом настоящего изобретения предлагается первая система для быстрого обнаружения определяемых компонентов. Примерный вариант реализации указанной первой системы содержит живую генно-модифицированную клетку биосенсора, которая получена из клеточного компонента иммунной системы млекопитающего; репортерный белок, который встроен внутрь и вырабатывается живой генно-модифицированной биосенсорной клеткой и который испускает поддающийся обнаружению сигнал в ответ на определенные, заранее заданные изменения в цитозоле живой генно-модифицированной биосенсорной клетки; путь передачи сигнала, встроенный или естественным образом присутствующий в живой генно-модифицированной биосенсорной клетке, который контролирует биологический процесс в цитозоле живой генно-модифицированной биосенсорной клетки, причем биологический процесс, когда он происходит, заставляет репортерный белок испускать поддающийся обнаружению сигнал; по меньшей мере один тип детекторной молекулы, и при этом каждая детекторная молекула адаптирована для связывания с конкретным определяемым компонентом; по меньшей мере один определяемый компонент, который связывается с детекторной молекулой специфичным для этого определяемого компонента образом; множество трансмембранных, элементов, не являющихся антителами, эксрессируемых живой генно-модифицированной биосенсорной клеткой, причем каждый элемент, передающий сигнал, адаптирован для восприятия детекторной молекулы; и, при этом, при связывании достаточного количества определяемых компонентов с достаточным количеством детекторных молекул, которые в свою очередь связаны с трансмембранными элементами, передающими сигнал, не являющимися антителами, на поверхности биосенсорной клетки происходит агрегация передающих сигнал элементов, активируется путь передачи сигнала, происходит биологический процесс, и репортерный белок испускает поддающийся обнаружению сигнал.
[006] В соответствии с другим аспектом настоящего изобретения предлагается вторая система для быстрого обнаружения определяемых компонентов. Примерный вариант реализации указанной второй системы содержит живую, генно-модифицированную биосенсорную клетку, причем живая генно-модифицированная биосенсорная клетка получена из клеточного компонента иммунной системы млекопитающего и, при этом, живая генно-модифицированная биосенсорная клетка экспрессирует множество рецепторных молекул по меньшей мере одного, заранее заданного типа на своей поверхности; репортерный белок, и при этом репортерный белок встроен внутрь и экспрессируется живой генно-модифицированной биосенсорной клеткой, причем репортерный белок испускает поддающийся обнаружению сигнал в ответ на определенные, заранее заданные изменения в цитозоле живой генно-модифицированной клетки; путь передачи сигнала, генно-модифицированный или естественным образом присутствующий в живой генно-модифицированной биосенсорной клетке, и при этом путь передачи сигнала контролирует биологический процесс внутри цитозоля живой генно-модифицированной биосенсорной клетки, и. при этом, биологический процесс, когда это происходит, вызывает испускание репортерным белком поддающегося обнаружению сигнала; по меньшей мере один тип детекторной молекулы, причем каждая детекторная молекула адаптирована для связывания с конкретным определяемым компонентом; по меньшей мере, один определяемый компонент, и, при этом, по меньшей мере один определяемый компонент связывается с детекторной молекулой, которая является специфичной для этого определяемых компонентов; множество растворимых элементов, не являющихся антителами, передающих сигнал, причем каждый растворимый элемент, передающий сигнал, адаптирован для связывания с молекулой-рецептором и детекторной молекулой; и, при этом, при связывании достаточного количества определяемого компонента с достаточным количеством детекторных молекул с достаточным количеством элементов, не являющихся антителами, передающих сигнал, которые непосредственно связаны с рецепторными молекулами на клеточной поверхности, происходит агрегация рецепторных молекул, активируется путь передачи сигнала, происходит биологический процесс, и репортерный белок испускает поддающийся обнаружению сигнал.
[007] В соответствии с еще одним аспектом настоящего изобретения предлагается биосенсор для быстрого обнаружения определяемых компонентов в образце. Указанный биосенсор содержит живую генно-модифицированную клетку, причем живая генно-модифицированная клетка получена из клеточного компонента иммунной системы млекопитающего (т.е. иммуноцита); репортерный белок, и при этом репортерный белок встроен внутрь и экспрессируется живой генно-модифицированной клеткой, и при этом репортерный белок испускает поддающийся обнаружению сигнал в ответ на определенные заранее заданные изменения в цитозоле живой генно-модифицированной клетки; канал передачи сигнала, генно-модифицированный или естественным образом присутствующий в живой генно-модифицированной клетке, причем путь передачи сигнала контролирует биологический процесс внутри цитозоля живой генно-модифицированной биосенсорной клетки, и при этом биологический процесс, когда он происходит, вызывает испускание репортерным белком поддающегося обнаружению сигнала; и множество элементов, не являющихся антителами, передающих сигнал, которые прямо или опосредованно связываются с определяемым компонентом в анализируемом образце, и при этом связанные элементы, не являющиеся антителами, передающие сигнал, далее взаимодействуют с биосенсорной клеткой, чтобы прямо или косвенно активировать путь передачи сигнала.
[008] Дополнительные признаки и аспекты настоящего изобретения станут очевидными для специалистов в данной области техники после прочтения и понимания нижеследующего подробного описания типичных вариантов реализации изобретения. Как будет понятно специалисту в данной области техники, возможны дополнительные варианты реализации изобретения без выхода за пределы изобретения. Соответственно, графические материалы и сопутствующее описание необходимо рассматривать как иллюстративные, но не ограничивающие.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[009] Сопроводительные графические материалы, которые включены в описание и составляют его часть, схематически иллюстрируют один или несколько иллюстративных вариантов реализации изобретения и вместе с общим описанием, приведенным выше, и подробным описанием, приведенным ниже, служат целям объяснения принципов изобретения, причем:
[0010] Фиг. 1а-b иллюстрируют первый биосенсор в соответствии с типичным вариантом реализации настоящего изобретения, в котором Т-клетки Jurkat были модифицированы для выработки экворина и для экспрессии трансмембранного, неантителообразующего элемент IgGbp-CD3ζ, передающего сигнал;
[0011] Фиг. 2а-b иллюстрируют второй биосенсор в соответствии с типичным вариантом реализации настоящего изобретения, в котором тучные клетки МС/9 были модифицированы для выработки экворина, причем клетки МС/9 экспрессируют нативный рецептор FcεRI, который связывается с растворимым неантителообразующим элементом IgGbp-IgE, передающим сигнал;
[0012] Фиг. 3а-b иллюстрируют третий биосенсор в соответствии с типичным вариантом реализации настоящего изобретения, в котором тучные клетки МС-9 модифицированы для выработки экворина, причем клетки МС/9 экспрессируют нативный рецептор FcεRI, который связывается с растворимым неантителообразующим элементом IgGbp-IgE, передающим сигнал, выделенным тучными клетками МС/9;
[0013] Фиг. 4 иллюстрирует четвертый биосенсор в соответствии с типичным вариантом реализации настоящего изобретения, в котором биосенсорные клетки модифицированы для выработки экворина и для экспрессии трансмембранного элемента mSA-CD3ζ, передающего сигнал, который связывается с биотинилированным детекторным элементом; а также
[0014] Фиг. 5 иллюстрирует пятый биосенсора в соответствии с типичным вариантом реализации настоящего изобретения, в котором биосенсорные клетки модифицированы для получения экворина и для экспрессии трансмембранного неантителообразующего элемента mSA-CD3ζ, передающего сигнал, который связывается с биотинилированным детекторным элементом.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0015] Иллюстративные варианты реализации настоящего изобретения в дальнейшем описаны со ссылкой на графические материалы. Хотя нижеследующее подробное описание в целях иллюстрации содержит множество признаков, специалисту в данной области техники будет понятно, что множество вариантов и модификаций следующих деталей находится в пределах изобретения. Соответственно, следующие варианты реализации изобретения излагаются без какой-либо потери общности и без ограничения заявленного изобретения.
[0016] Настоящее изобретение в общем относится к системам, устройствам и способам обнаружения различных определяемых компонентов в биологических образцах или других образцах, а более конкретно к системе на основе биосенсора для обнаружения и идентификации в реальном времени представляющих интерес определяемых компонентов на основе испускания поддающегося обнаружению сигнала при реакции биосенсора с представляющим интерес определяемым компонентом в исследуемом образце. Генно-модифицированные клетки по настоящему изобретению представляют собой в высокой степени чувствительные и эффективные биосенсори, и поскольку указанные биосенсорные клетки обладают внутренней способностью обнаружения, они обеспечивают универсальную систему, которая может быть легко адаптирована для обнаружения широкого спектра различных инфекционных агентов или других мишеней путем простого выбора альтернативных растворимых детекторных молекул (например, антитела), обладающих специфичностью в отношении конкретного возбудителя или другой интересующей мишени. Кроме того, система по настоящему изобретению может быть легко сконфигурирована для мультиплексного обнаружения нескольких инфекционных агентов или других определяемых компонентов в одном анализе, что обеспечивает высокую степень гибкости и применимости. Универсальность настоящего изобретения является результатом уникальной комбинации элементов и, в частности, комбинации универсальной биосенсорной клетки с конкретным растворимым детектором (например, антителом). Универсальная биосенсорная клетка способна реагировать на присутствие практически любой молекулы-мишени, которая может быть распознана детекторной молекулой. Поскольку в некоторых вариантах реализации детектор или детекторное антитело добавляют в систему в качестве растворимого фактора, система может быть сконфигурирована для обнаружения альтернативной мишени путем простого выбора соответствующего альтернативного детектора или детекторного антитела. Специфичность раскрытой системы определяется детекторной молекулой, которая выбирается, исходя из ее специфичности и сродства к молекуле-мишени, характерной для инфекционного агента или другого целевого определяемого компонента. Кроме того, комбинация указанной универсальной биосенсорной клетки и растворимого детектора позволяет создавать мультиплексные анализы путем простого введения множества детекторных молекул (например, антител) в тест-систему, причем целевые молекулы отбирают в зависимости от их специфичности в отношении альтернативных инфекционных агентов или других определяемых компонентов.
[0017] Генетическое манипулирование и модификация типов биосенсорных клеток, применяемых в соответствии с настоящим изобретением, обычно включают применение надлежащим образом отобранных носителей для введения генов, которые содержат генетические элементы, эффективно функционирующие в выбранном типе клеток. Например, подходящим будет применение промоторного элемента, который направляет экспрессию высокого уровня введенных трансгенов в конкретно выбранной биосенсорной клетке. В типичном варианте реализации настоящего изобретения такой промоторный элемент может быть получен непосредственно из самой биосенсорной клетки, а затем применен для экспрессии целевого трансгена. В другом варианте реализации настоящего изобретения подходящий элемент может быть определен эмпирически путем сравнения функции альтернативных промоторных элементов в контексте альтернативных носителей для введения генов с целью определения эффективных промоторных, трансгенных, векторных комбинаций для выбранного типа клеток. Трансгены, такие как ген, кодирующий люминесцентный репортерный белок, могут быть введены в биосенсорную клетку с применением стандартных методов, таких как электропорация или химические реагенты для трансфекции, такие как, например, липофектамин. Другие методы генной инженерии, известные специалистам в данной области техники, также совместимы с настоящим изобретением.
[0018] В общем варианте реализации настоящего изобретения предлагается система и способ для быстрого обнаружения определяемых компонентов, которые содержат следующие компоненты: (i) живую, генно-модифицированную биосенсорную клетку, причем живая инженерная биосенсорная клетка является компонентом иммунной системы млекопитающих; (ii) репортерный белок, причем репортерный белок экспрессируется живой генно-модифицированной биосенсорной клеткой, и при этом репортерный белок испускает поддающийся обнаружению сигнал в ответ на определенные, заранее заданные изменения в цитозоле живой генно-модифицированной клетки; (iii) путь передачи сигнала, экспрессируемый живой генно-модифицированной биосенсорной клеткой, причем путь передачи сигнала контролирует биологический или биохимический процесс внутри цитозоля живой генно-модифицированной биосенсорной клетки, и при этом биологический или биохимический процесс, когда он происходит, вызывает испускание поддающегося обнаружению сигнала репортерным белком; (iv) по меньшей мере один тип детекторной молекулы, причем каждая детекторная молекула адаптирована для связывания с конкретным определяемым компонентом; (v) по меньшей мере один определяемый компонент, причем по меньшей мере один определяемый компонент связывается с детекторной молекулой, которая является специфичной в отношении этого определяемого компонента; (vi) множество элементов, передающих сигнал, не являющихся антителами, экспрессируемые живой генно-модифицированной биосенсорной клеткой или активно связываются с рецептором или рецепторным компонентом, экспрессируемым живой генно-модифицированной биосенсорной клеткой, причем каждый элемент, передающий сигнал, адаптирован для восприятия детекторной молекулы. При связывании достаточного количества определяемых компонентов с достаточным количеством детекторных молекул, которые сами по себе связаны с элементами, передающими сигнал, не являющимися антителами, на поверхности клетки происходит агрегация элементов, передающих сигнал, активируется путь передачи сигнала, происходит биохимический процесс, и репортерный белок испускает обнаруживаемый сигнал. Указанная система может дополнительно содержать устройство для смешивания живых клеток с растворимыми компонентами и образец, содержащий целевое определяемый компонент или инфекционный агент, при этом сохраняя жизнеспособность и функциональность живой биосенсорной клетки, и детектор для обнаружения сигнала, испускаемого биосенсорной клеткой.
Живая, генно-модифицированная биосенсорная клетка
[0019] Типичные варианты реализации настоящего изобретения включают живую, генно-модифицированную биосенсорную клетку, которая обычно является компонентом иммунной системы млекопитающего, например иммуноцитом. В некоторых вариантах реализации настоящего изобретения биосенсорная клетка представляет собой В-клетку человека или мыши. В-клетки или В-лимфоциты, представляют собой тип лейкоцитов подтипа лимфоцитов, которые функционируют в компоненте гуморального иммунитета адаптивной иммунной системы путем секреции антител. В других вариантах реализации настоящего изобретения биосенсорная клетка является Т-клеткой человека или мыши. Т-клетки или Т-лимфоциты представляют собой другой тип лимфоцитов, которые играют центральную роль в клеточно-опосредованном иммунитете как часть адаптивной иммунной системы. Т-клетки отличаются от других лимфоцитов присутствием Т-клеточного рецептора на поверхности клетки. В других вариантах реализации настоящего изобретения биосенсорная клетка представляет собой тучную клетку. Тучная клетка также представляет собой тип лейкоцитов, известный как гранулоцит, который образуется из миелоидной стволовой клетки, являющейся частью иммунной и нейроиммунной систем. С настоящим изобретением совместимы другие типы клеток, включая базофилы, которые представляют собой другой тип лейкоцитов и которые по внешнему виду и функциям сходны с тучными клетками.
Репортерный белок
[0020] Иллюстративные варианты реализации настоящего изобретения включают репортерный элемент, такой как репортерный белок или фермент, который вырабатывается или экспрессируется живой генно-модифицированной биосенсорной клеткой. Репортерный белок испускает поддающийся обнаружению сигнал в ответ на определенные, заранее заданные изменения в цитозоле живой генно-модифицированной биосенсорной клетки. В некоторых вариантах реализации настоящего изобретения репортерный белок представляет собой биолюминесцентный фотобелок, такой как экворин, который получен из гидроида Aequorea Victoria. Экворин ранее применялся для создания живых биосенсорных клеток с целью получения световых сигналов в ответ на активацию широкого спектра путей передачи сигналов; таким образом, специалистам в данной области техники хорошо известны различные способы манипулирования выработкой экворина в живых клетках. В частности, квалифицированный специалист может выбрать и применить любой подходящий носитель для введения гена, такой как, например, бактериальные плазмидные векторы или вирусные векторы, для введения соответствующего генетического материала в биосенсорную клетку. Выработка репортерного белка в биосенсорной клетке будет контролироваться экспрессией введенного генетического материала. Кроме того, обычному специалисту в данной области техники будет понятно, что другие фотобелки или другие типы репортерных белков, ферментов и молекул могут быть включены и применены с различными альтернативными вариантами реализации настоящего изобретения.
Путь передачи сигнала
[0021] Иллюстративные варианты реализации настоящего изобретения включают в себя путь передачи сигнала, экспрессируемый живой генно-модифицированной биосенсорной клеткой. Путь передачи сигнала контролирует, по меньшей мере, один биологический процесс внутри цитозоля живой генно-модифицированной клетки, и по меньшей мере один биологический процесс, когда он возникает, вызывает испусканием репортерным белком поддающегося обнаружению сигнала. В некоторых вариантах реализации настоящего изобретения путь передачи сигнала представляет собой любой биохимический путь, в котором вызывается повышение внутриклеточной концентрации Са2+ в ответ на активацию передающей сигнал молекулы на поверхности клетки, такой как рецепторный белок. Биосенсорные клетки, применяемые в настоящем изобретении, могут быть выбраны из множества живых клеток, способных индуцировать цитоплазматический Са2+ в ответ на активацию передающей сигнал молекулы на поверхности клетки. Например, В-клетки, Т-клетки и тучные клетки обладают способностью индуцировать увеличение концентрации Са2+ в ответ на активацию передающих сигнал молекул на поверхности клетки, таких как В-клеточный рецептор, Т-клеточный рецептор и рецептор Fc эпсилон (тучные клетки), соответственно.
[0022] Поскольку клетки млекопитающих, растущие в культуре, обычно генерируют популяции клеток, в которых отдельные индивидуальные клетки могут иметь различную способность к индукции повышения концентрации Са2+, полезно выбрать или провести скрининг субпопуляции клеток или клональных клеточных линий, которые обладают надежной способностью к генерации сигнала Са2+. Это может быть достигнуто путем анализа индукции, например, индуцированной экворином вспышки. В частности, трансфектанты, созданные путем введения трансгенов в клетку, представляют собой смешанную популяцию клеток, полученную в результате большого количества независимых событий введения генов. Таким образом, при создании биосенсорной клетки полезно провести скрининг или выбрать определенные подмножества клеток или клональные клеточные линии, которые обладают эффективными возможностями передачи сигнала наряду с подходящими уровнями экспрессии введенных трансгенов. Особенно полезно применять технологию сортировки клеток с активированной флуоресценцией (СКАФ) для выбора субпопуляций клеток с высокой экспрессией или для создания клональных клеточных линий для этой цели.
[0023] Как было указано ранее, экворин до этого применялся для генно-модифицированных живых биосенсорных клеток с целью получения световых сигналов в ответ на активацию широкого спектра путей передачи сигнала, особенно в тех случаях, когда такие пути передачи сигнала приводят к повышению уровня цитоплазматических ионов Са2+ в пределах живой клетки. В некоторых вариантах реализации настоящего изобретения биосенсорные клетки, которые вырабатывают экворин в качестве репортерного белка, нагружают коэлентеразином (КТЗ) перед их применением в анализе обнаружения. На этой стадии нагрузки экворин ковалентно связывается с гидрофобной простетической группой (например, КТЗ), и при связывании с кальцием (Са2+), КТЗ вступает в необратимую реакцию, которая включает конформационное изменение, и испускает синий свет (при 469 нм).
Детекторная молекула
[0024] Иллюстративные варианты реализации настоящего изобретения содержат, по меньшей мере, один тип детектора, такого как детекторная молекула, причем каждая детекторная молекула адаптирована для связывания с конкретным целевым определяемым компонентом. Детекторная молекула может быть растворимым антителом, которое никоим образом не экспрессируется биосенсорными клетками. Конкретную детекторную молекулу, применяемую в соответствии с настоящим изобретением, выбирают, исходя из ее способности однозначно идентифицировать целевое определяемый компонент. В иллюстративном варианте реализации детекторная молекула представляет собой растворимое антитело, такое как коммерчески доступный IgG, специфичный в отношении конкретного определяемого компонента, такого как инфекционный агент. В другом иллюстративном варианте реализации детекторная молекула представляет собой биотинилированную молекулу (или молекулу на основе стрептавидина), которая является специфичной в отношении заданного определяемого компонента, такую как, например, биотинилированная молекула аутоантигена, которая является специфичной в отношении анти-аутоантигенового антитела. Детекторная или целевая молекула в соответствии с настоящим изобретением может включать аутоантиген или аутоантител, связанные с аутоиммунным заболеванием. Типичные аутоиммунные заболевания или расстройства включают ревматоидный артрит (РА), ювенильный РА (ЮРА), сахарный диабет 1 типа, системную красную волчанку, тиреоидит Хашимото, болезнь Грейвса, склеродермию, целиакию, болезнь Крона, язвенный колит, синдром Шегрена, рассеянный склероз, синдром Гудпасчуре, болезнь Аддисона, гранулематоз Вегенера, первичный билиарный цирроз, склерозирующий холангит, аутоиммунный гепатит, полимиалгию ревматическую, височный артериит / гигантскоклеточный артериит и синдром Гийена-Барре. Кроме того, детекторные или целевые молекулы могут содержать опухолеспецифичное или связанные с опухолью антигены или антитела к таким антигенам; или биологически активные молекулы, такие как EGF, пептидные гормоны, включая инсулин и гормон роста, цитокины, интерлейкины, интерфероны, TNF и т.д. или антитела к таким биологически активным молекулам.
Анализируемое вещество и исследуемый образец
[0025] Целевое применение настоящего изобретения заключается в обнаружении различных определяемых компонентов, которые присутствуют или могут присутствовать в образцах, подлежащих анализу. В типичном варианте реализации настоящего изобретения анализируемый объект, который должен быть обнаружен, будет связываться с детекторной молекулой, такой как растворимое антитело, которое является специфичным в отношении этого определяемого компонента. Образец, подлежащий анализу, может быть получен из большого количества источников пищи, включая: (i) мясо, такое как говядина, свинина, баранина, бизон, птица и морепродукты; и (ii) растения и овощи. Кроме того, образец, подлежащий анализу, может быть получен из многих других источников, таких как вода, бытовые жидкости, жидкости с консервантами и биологические жидкости, такие как кровь. Анализы, которые могут быть проведены, включают в себя практически все, в которых будет происходить специфичное связывание с детектором или детекторной молекулой, например, анализы на химические вещества, токсины и инфекционные агенты, такие как вирусы, бактерии и другие биологические материалы или агенты. В иллюстративном варианте реализации настоящего изобретения конкретным инфекционным агентом является Escherichia coli, хотя другие инфекционные агенты (такие как Salmonella, Listeria и Campylobacter) и загрязняющие вещества могут быть обнаружены в соответствии с настоящим изобретением. Escherichia coli O157 Н7, O26, O45, O103, O111, O121 и O145, как в анализах отдельных веществ, так и в мультиплексированных анализах, могут быть потенциально обнаружены с применением настоящего изобретения.
[0026] Настоящее изобретение позволяет обнаруживать множество различных определяемых компонентов, включая патогены мяса, и те, которые содержатся на шпинате, листьях салата и других овощах и пищевых продуктах. Анализируемое вещество может содержать один или несколько эпитопов антигена или аллергена, включая как линейные, так и конформационные эпитопы; кроме того, оно может содержать один или несколько лигандов или рецепторов, распознаваемых реципрокными рецепторами или лигандами. Примеры определяемых компонентов включают бактерию, такую как Bacillus (например, В. anthracis), Enterobacteriaceae (например, Salmonella, Escherichia coli, Yersinia pestis, Klebsiella и Shigella), Yersinia (например, Y. pestis или Y. enterocolitica), Staphylococcus (например, S. aureus), Streptococcus, Gonorrheae, Enterococcus (например, E. faecalis), Listeria (например, L. monocytogenes), Brucella (например, В. abortus, В. melitensis или В. suis), Vibrio (например, V. cholerae), Corynebacterium diphdieria, Pseudomonas (например, P. pseudomallei или P. aeruginosa), Burkholderia (например, В. mallei или В. pseudomallei), Shigella (например, S. dysenteriae), Rickettsia (например, R. Rickettsii, R. prowazekii или R. typhi), Francisella tularensis, Chlamydia psittaci, Coxiella burnetii, Mycoplasma (например, M. mycoides) и т.д.; аллергены, такие как арахисовая пыль, микотоксины, споры плесени или бактериальные споры, такие как Clostridium botulinum и C. perfringens; токсины, такие как рицин, микотоксин, тетродотоксин, токсин сибирской язвы, ботулинический токсин, стафилококковый энтетоксин В или сакситоксин; вирус, такой как Adenoviridae (например, аденовирус), Arenaviridae (например, вирус Мачупо), Bunyaviridae (например, хантавирус или вирус лихорадки долины Рифт), Coronaviridae, Orthomyxoviridae (например, вирусы гриппа), Filoviridae (например, вирус Эболы и вирус Марбург), Flaviviridae (например, вирус японского энцефалита или вирус желтой лихорадки), Hepadnaviridae (вируса гепатита В), Herpesviridae (например, вирусы простого герпеса), Papovaviridae (например, вирусы папилломы), Paramyxoviridae (например, респираторно-синцитиальный вирус, вирус кори, вирус эпидемического паротита или вирус парагриппа), Parvoviridae, Picornaviridae (например, полиовирусы), Poxviridae (например, вирусы натуральной оспы), Reoviridae (например, ротавирусы), Retroviridae (например, лимфотропные вирусы Т-клеток человека (ЛВТЧ) и вирусы иммунодефицита человека (ВИЧ)), Rhabdoviridae (например, вирус бешенства) и Togagihdae (например, вирусы энцефалита, вирус желтой лихорадки и вирус краснухи); простейшие, такие как Cryptosporidium parvum, Encephalitozoa, Plasmodium, Toxoplasma gondii, Acanthamoeba, Entamoeba histolytica, Giardia lamblia, Trichomonas vaginalis, Leishmania или Trypanosoma (например, Т. brucei и Т. Cruzi); гельминт, такой как цестоды (ленточные черви), трематоды (сосальщики) или нематоды (круглые черви, например, Ascaris lumbricoides, Trichuris trichiura, Necator americanus или Ancylostoma duodenale); паразит (например, любые простейшие или гельминты, описанные в настоящем документе); гриб, такой как Aspergilli, Candidae, Coccidioides immitis и Cryptococci; загрязнитель окружающей среды; добавка к воде; сельскохозяйственный маркер; нуклеиновая кислота (например, олигонуклеотиды, полинуклеотиды, нуклеотиды, нуклеозиды, молекулы ДНК или молекулы РНК, включая хромосому, плазмиду, вирусный геном, праймер или ген); белок (например, гликопротеин, металлопротеин, фермент, прион или иммуноглобулин); метаболит; сахар; липид; липополисахарид; соль; или ион. Кроме того, мишени включают пищевые патогены, такие как сальмонелла (например, Salmonella typhimurium), патогенные штаммы Е. coli (например, O157:Н7), Bacillus (например, В. cereus), Clostridium botulinum, Listeria monocytogenes, Yersinia (например, Y. enterocolitica), норовирус (например, вирус Норуолк), Shigella, Staphylococcus aureus, Toxoplasma gondii, Vibrio (например, V. vulnificus, V. cholera, V. parahaemolyticus), Campylobacter jejuni и Clostridium perfringens; и растительные патогены, такие как Bacillus anthracis, Yersinia pestis, Francisella tularensis, Brucella (например, В. suis), Burkholderia mallei, Burkholderia pseudomallei, Shigella, Clostridium botulinum, Variola (например, V. major), Filoviridae (например, вирус Эболы и вирус Марбург), Arenaviridae (например, вирус Ласса и вирус Мачупо), Clostridium perfringens, любой пищевой патоген (например, виды сальмонеллы, Escherichia coli O157:Н7 или Shigella), Chlamydia psittaci, Coxiella burnetii, Staphylococcal aureus, Rickettsia (например, R. prowazekii или R. rickettsii), альфавирус (например, вирус венесуэльского конского энцефалита, вирус восточного конского энцефалита или вирус западного конского энцефалита), Vibrio cholerae, Cryptosporidium parvum, хенипавирус (например, вирус Нипа), Bunyaviridae (например, хантавирус или вирус лихорадки долины Рифт), Flaviviridae (например, вирус японского энцефалита и вирус желтой лихорадки) и виды Coccidioides.
[0027] Эпитопы, которые могут быть обнаружены в виде определяемых компонентов или частей определяемого компонента, обычно представляют собой антигендетерминирующие сайты на антигене, с которыми может специфично связываться иммуноглобулин (или его антигенсвязывающий фрагмент). Эпитопы могут быть образованы как смежными аминокислотами, так и несмежными аминокислотами, которые сближаются в результате свертывания белка в третичную структуру. Эпитопы можно найти на Fab (вариабельной) области иммуноглобулинов (называются «идиотипическими детерминантами»), причем они определяют «идиотип» иммуноглобулина. Эпитоп и антиген могут иметь природное происхождение или могут быть получены искусственным путем. В зависимости от природы эпитопа или антигена они могут быть выделены или очищены от матрикса или субстанции происхождения, синтезированы или получены, например, рекомбинантным способом. Эпитопы и антигены, пригодные в качестве определяемых компонентов, могут быть получены из организма человека или животного, растения, бактерий, простейших, паразита, вируса и т.д. В некоторых вариантах реализации изобретения определяемый компонент представляет собой полипептид, молекулу нуклеиновой кислоты, углевод, гликопротеин, липид, липопротеин, гликолипид или молекулу небольшого размера. В некоторых вариантах реализации изобретения определяемый компонент выбирают из ракового антигена, аутоантигена, аллергена, эндогенного антигена, антигена инфекционного агента, антигена лекарственного средства (молекулы небольшого размера), токсина, яда, биологического антигена, экологического антигена, трансплантационного антигена и имплантационного антигена.
[0028] Определяемый компонент может содержать эпитоп ракового антигена. В некоторых вариантах реализации изобретения определяемый компонент является связанным с опухолью антигеном. В некоторых вариантах реализации изобретения определяемый компонент является опухолеспецифичном антигеном. В некоторых вариантах реализации изобретения определяемый компонент представляет собой связанный с опухолью антиген (TAA), а ТАА представляет собой углеводный антиген, содержащий одну или несколько посттрансляционных модификаций, которые отличаются от белка дикого типа, содержит область слияния белка в результате слияния гена, который присутствует в злокачественных клетках, но отсутствует в незлокачественных клетках, и/или если ТАА содержит рецепторную тирозинкиназу (РТК), которая дерегулирована и/или дисфункциональна в опухолевых клетках из-за аутокринной активации, хромосомной транслокации, повышенной экспрессии РТК или мутации с усилением функции в гене РТК или белке. В некоторых вариантах реализации изобретения определяемый компонент представляет собой иммуноглобулин, экспрессируемый злокачественным новообразованием В-клеток. Примеры злокачественных новообразований В-клеток включают, но не ограничиваясь этим, неходжкинскую лимфому, лимфому Ходжкина, хронический лимфоцитарный лейкоз, лимфому мантийных клеток и множественную миелому. Примеры В-клеточных злокачественных новообразований включают, например, В-клеточной полиморфоцитарный лейкоз, лимфоплазмоцитарный лейкоз, лимфому маргинальной зоны селезенки, лимфому маргинальной зоны (внеузловую и узловую), новообразования плазматических клеток (например, миелома плазматических клеток, плазмацитома, заболевания с отложением моноклональных иммуноглобулинов, болезни тяжелой цепи) и фолликулярную лимфому (например, классы I, П, III или IV).
[0029] В некоторых вариантах реализации определяемый компонент представляет собой связанный с опухолью антиген, полученный из опухолевых клеток, которые получены от субъекта. В некоторых вариантах реализации связанный с опухолью антиген представляет собой один или несколько антигенов, выбранных из 17-1А, 707-АР, AFP, аннексина П, ART-4, BAGE, BAGE-1, .бета.-катенина, BCG, bcr/abl, Bcr/abl e14a2 химерного соединения, bcr-abl (b3a2), bcr-abl (b3a2), bcr-abl p190 (e1a2), bcr-abl p210 (b2a2), bcr-abl p210 (b3a2), bcr-abl p210 (b3a2), антигена буллезного пемфигоида-1, CA19-9, CA125, CA215, CAG-3, CAMEL, антигена рака яичка, каспазы-8, CCL3, CCL4, CD16, CD20, CD3, CD30, CD55, CD63, CDC27, CDK-4, CDR3, CEA, кластера 5, кластера-5А, циклинзависимой киназы-4, Сур-В, DAM-10, DAM-6, деккаина, Е7, EGFR, EGFRvIII, EGP40, ELF2 М, EpCAM, FucGMl, G250, GA733, GAGE, GAGE-1-8, связанного с раком гастринового антигена, GD2, GD3, globoH, гликофорина, GM1, GM2, GM3, GnTV, Gn-TV, gplOO, Her-2/neu, HERV-K-ME, высокомолекулярного антигена, высокомолекулярного протеогликана (ВМПГ), HPV-16 E6, HPV-16 E7, HPVE6, HSP70-2M, HST-2, hTERT, человеческого хорионического гонадотропина (ЧХГ), глобулы молочного жира человека (ГМЖЧ), iCE, KIAA0205, KK-LC-1, KM-HN-1, L6, LAGE-1, Lcose4Cer, LDLR/FUT, Lewis A, Lewis v/b, М-белка, MAGE-1, MVC, MAGE-A1-12, MAGE-C2, MAHGE-3, MART-1/Melan-A, MC1R, ME491, MUC1, MUC2, муцина, MUM-1, MUM-2, MUM-3, мутантного p53, миозина, MZ2-E, N9 нейраминидазы, NA88, NA88-A, антигена назофарингеальной карциномы, NGA, NK1/c-3, новых bcr/ablk химерных BCR-экзонов 1, 13, 14 с экзонами ABL 4, NY-ESO-1/LAGE-2, NY-ESO-lb, OC125, связанного с остеосаркомой антигена-1, Р15, pl90 минорного bcr-abl (ela2), р53, Pm1/RARa, полисиаловой кислоты, PRAME, PSA, PSM, RU1, RU2, SAGE, SART-1, SART-2, SART-3, сиалил LeA, Spl7, SSX-2, SSX-4, поверхностный иммуноглобулин, TAG-1, TAG-2, TEL/AML1, TPI, TRAG-3, TRP-1 (gp75), TRP-2, TRP2-INT2, HTRT, связанного с опухолью гликопротеина-72 (TAG-72), тирозиназы, u-PA, WT1 и XAGE-lb, или иммуногенного фрагмента любого из вышеуказанных антигенов. В некоторых вариантах реализации связанный с опухолью антиген идентифицируют методом SEREX (серологический анализ рекомбинантной библиотеки экспрессии кДНК) или на основе серологического скрининга библиотеки экспрессии кДНК, генерируемой из опухолевых тканей различного происхождения или линий раковых клеток, и идентификации иммуногенных опухолевых белков на основе их способности реагировать с аутологичными сыворотками пациентов. В некоторых вариантах реализации изобретения определяемый компонент представляет собой связанный с опухолью антиген, который представляет собой безуглеводный антиген, содержащий одну или несколько посттрансляционных модификаций, которые отличаются от белка дикого типа. В некоторых вариантах реализации изобретения связанный с опухолью антиген содержит химерную область белка, являющуюся результатом слияния генов, которая присутствует в злокачественных клетках, но отсутствует в незлокачественных клетках. В некоторых вариантах реализации изобретения связанный с опухолью антиген содержит рецепторную тирозинкиназу, регуляция которой нарушена и/или которая является дисфункциональной в опухолевых клетках из-за аутокринной активации, хромосомных транслокаций, чрезмерной экспрессии РТК или мутаций с усилением функции гена или белка РТК.
[0030] Определяемый компонент может содержать эпитоп антигена инфекционного или неинфекционного агента, который может быть патогенным или непатогенным для субъекта. Определяемый компонент может быть получен из мутуалистических, паразитных или условно-патогенных микроорганизмов, включая любые микроорганизмы в биоме животного или растительного происхождения, такие как пробиотические или условно-патогенные микроорганизмы в пищеварительном тракте человека, на поверхностях слизистых оболочек или эпителии. В некоторых вариантах реализации изобретения бактериальный патоген выбран из Acinetobacter baumannii (ранее Acinetobacter calcoaceticus), Actinobacillus, Actinomyces pyogenes (ранее Corynebacterium pyogenes), Actinomyces israelii, Nocardia asteroids, N. brasiliensis, Aeromonas hydrophila, Amycolata autotrophica, Archanobacterium haemolyticum (ранее Corynebacterium haemolyticum), Arizona hinshawii все серотипы, Bacillus anthracis, Bacteroides fragilis, Bartonella henselae, B. quintana, B. vinsonii, Bordetella включая В. pertussis, Borrelia recurrentis, B. burgdorferi, Burkholderia (ранее Pseudomonas species), за исключением перечисленных в BSL III), Campylobacter coli, C. fetus, C. jejuni, Chlamydia psittaci, C. trachomatis, C. pneumonia, Clostridium botulinum (вырабатывающий нейротоксин вид), нейротоксинов Clostridium botulinum, Cl. chauvoei, Cl. haemolyticum, Cl. histolyticum, Cl. novyi, Cl. septicum, Cl. Tetani, эпсило-токсина Cl. perfirngens, Corynebacterium diphtheriae, C. pseudotuberculosis, C. renale, Dermatophilus congolensis, Edwardsiella tarda, Erysipelothrix rhusiopathiae, Escherichia coli - всех энтеропатогенных, энтеротоксигенных, энтероинвазивных штаммов и штаммов, несущих антиген K1, включая Е. coli O157:H7, Haemophilus ducreyi, Н. influenzae, Helicobacter pylori, Klebsiella - всех видов. За исключением K. oxytoca (RG1), Legionella включая L. pneumophila, Leptospira interrogans - всех серотипов, Listeria, Moraxella, Mycobacterium (за исключением перечисленных в BSL III), включая М. avium complex, М. asiaticum, штамма вакцины БЦЖ М. bovis, М. chelonei, М. fortuitum, М. kansasii, М. leprae, М. malmoense, М. marinum, М. paratuberculosis, М. scrofulaceum, М. simiae, М. szulgai, М. ulcerans, М. xenopi, Mycoplasma, Neisseria gonorrhoeae, N. meningitides, Nocardia asteroides, N. brasiliensis, N. otitidiscaviarum, N. transvalensis, Proteus mirabilis, P. vulgaris, Rhodococcus equi, Salmonella, включая S. arizonae, S. cholerasuis, S. enteritidis, S. gallinarum-pullorum, S. meleagridis, S. paratyphi, А, В, C, S. typhi, S. typhimurium, Shigella, включая S. boydii, S. dysenteriae, тип 1, S.flexneri, S. sonnei, Sphaerophorus necrophorus, Staphylococcus aureus, Streptobacillus moniliformis, Streptococcus, включая S. pneumoniae, S. pyogenes, Treponema pallidum, T. carateum, Vibrio cholerae, V. parahemolyticus, V. vulnificus, Yersinia enterocolitica, Bartonella, Brucella, включая В. abortus, В. canis, В. suis, В. melitensis, Burkholderia (Pseudomonas) mallei, B. pseudomallei, Coxiella burnetii, Francisella tularensis, Mycobacterium bovis (за исключением штамма БЦЖ, BSL II - бактериальные агенты, включая Chlamydia), М. tuberculosis, нетуберкулезных микобактерий (НТМБ), Pasteurella multocida тип В - «буффало» и других вариантных штаммов, Rickettsia akari, R. australis, R. canada, R. conorii, R. prowazekii, R. rickettsii, R, siberica, R. tsutsugamushi, R. typhi (R. mooseri), Yersinia pestis.
[0031] Определяемый компонент может происходить из вирусного патогена. Например, в некоторых вариантах реализации изобретения определяемый компонент получают из вирусного патогена, выбранного из числа аденовирусов человека - всех типов, альфавирусов (тогавирусов), вируса восточного конского энцефалита, вируса восточного конского энцефаломиелита, штамма вакцины против венесуэльского конского энцефаломиелита ТС-83, вируса западного конского энцефаломиелита, аренавирусов, вируса лимфоцитарного хориоменингита (не-нейротропные штаммы), комплекса вируса Такарибе, буньявирусов, вируса Буньямвера, штамма вируса лихорадки долины Рифт MP-12, кальцивирусов, коронавирусов, флавивирусов (тогавирусов) - группа В арбовирусов, серотипов вируса денге 1, 2, 3 и 4, штамма вируса 17D вируса желтой лихорадки, вирусов гепатита А, В, С, D и Е, цитомегаловируса, вируса Эпштейна-Барр, вирусов простого герпеса типа 1 и 2, вируса опоясывающего лишая, вирусов герпеса 6 и 7, вирусов гриппа типа А, В и С, паповавирусов, вирусов папилломы, вируса болезни Ньюкасла, вируса кори, вируса паротита, вирусов парагриппа 1, 2, 3 и 4, полиомавирусов (вирус JC, вирус BK), респираторного синцитиального вируса, парвовируса человека (В 19), вирусов Коксаки типа А и В, эховирусов, полиовирусов, риновирусов, аластрима (вирус белой оспы), оспы (вирус натуральной оспы), реовирусов белой оспы, колтивируса, ротавируса и орбивируса человека (вирус колорадской лихорадки), вируса бешенства, вируса везикулярного стоматита, рубивируса (краснуха), вируса леса Семлики, вируса энцефалита Сент-Луиса, вируса венесуэльского конского энцефалита, вируса венесуэльского конского энцефаломиелита, аренавирусов (также вирус южно-американской геморрагической лихорадки), Флексал, вируса лимфоцитарного хориоменингита (ЛХМ) (нейротропные штаммы), хантавирусов, включая вирус Хантаан, вируса лихорадки долины Рифт, вируса японского энцефалита, вируса желтой лихорадки, вируса обезьяньей оспы, вируса иммунодефицита человека (ВИЧ) типа 1 и 2, лимфотропного вируса Т-клеток человека (ЛВТЧ) типа 1 и 2, вируса иммунодефицита обезьян (ВИО), вируса везикулярного стоматита, вируса Гуанарито, вируса лихорадки Ласса, вируса Джунин, вируса Мачупо, вируса Сабиа, конго-крымской геморрагической лихорадки, вирусов Эбола, вируса Марбурга, комплекса вируса клещевого энцефалита (флавивируса), включая центрально-европейский клещевой эндефалит, дальневосточный клещевой энцефалит, Ханзалова, Хипр, Kumlinge, болезнь Кьясанурского леса, омскую геморрагическую лихорадку и вирусы российского весенне-летнего энцефалита, Herpesvirus simiae (герпес В или обезьяний вирус В), герпесвируса мартышковых 1 (вирус герпеса В), конского морбилливируса (вирус Хендра и Хендра-подобный вирус), вируса Нипа, вируса натуральной оспы (вирус оспы), вируса белой оспы (аластрим) вируса африканской чумы свиней, вируса болезни лошадей, вирус Акабане, вируса птичьего гриппа (высокопатогенный), вируса африканской катаральной лихорадки, вируса верблюжьей оспы, вируса классической чумы свиней, Cowdria ruminantium (коудриоз), вируса ящура, вируса козьей оспы, вируса японского энцефалита, вируса нодулярного дерматоза, вируса злокачественной катаральной лихорадки, вируса Менангле, вируса болезни Ньюкасла (ВБН), вируса чумы мелких жвачных животных, вируса жвачных животных, вируса овечьей оспы, вируса везикулярной болезни свиней, вируса везикулярного стоматита (экзотический).
[0032] Определяемый компонент может происходить из организма паразита. Например, в некоторых вариантах реализации изобретения определяемый компонент получают из организма паразита, выбранного из возбудителей анкилостомоза человека, включая A. duodenale, A. ceylanicum, Ascaris, включая Ascaris lumbricoides suum, Babesia, включая В. divergens, В. microti, червя Brugia filaria, включая В. malayi, В. timori, кокцидий, криптоспоридий, включая С. parvum, Cysticercus cellulosae (гидатидная киста, личинка Т. solium), Echinococcus, включая E. granulosis, Е. multiocularis, Е. vogeli, Entamoeba histolytica, Enterobius, Fasciola, включая F Gigantica, F. hepatica, Giardia, включая G. lamblia, Heterophyes, Hymenolepis, включая H. diminuta, H. nana, Isospora, Leishmania, включая L. braziliensis, L. donovani, L. etbiopia, L. major, L. mexicana, L. peruvania, L. tropica, филярии Лоа-лоа, Microsporidium, Naegleria fowleri, возбудителей анкилостомоза человека Necator, включая N. americanus, червей Onchocerca filaria, включая О. volvulus, Plasmodium cynomologi, P. falciparum, P. malariae, P. ovale, P. vivax, Sarcocyst, включая S. sui hominis, Schistosoma, включая S. haematobium, S. intercalatum, S. japonicum, S. mansoni, S. mekongi, Strongyloides, включая S. stercoralis, Taenia solium, Toxocara, включая Т. canis, Toxoplasma, включая Т. gondii, Trichinella spiralis, Trypanosoma, включая Т. brucei brucei, T. brucei gambiense, T. brucei rhodesiense, T. cruzi или филярий Wuchereria bancrofti.
[0033] Определяемый компонент может быть грибковым патогеном. Например, в некоторых вариантах реализации изобретения определяемый компонент получают из грибкового патогена, выбранного из Aspergillus fumigates, Blastomyces dermatitidis, Cladosporium bantianum, Candida albicans, С. (Xylohypha) trichoides, Cryptococcus neoformans, Dactylaria galopava (Ochroconis gallopavum), Epidermophyton, Exophiala (Wangiella) dermatitidis, Fonsecaea pedrosoi, Microsporum, Paracoccidioides braziliensis, Penicillium marneffei, Pneumocystis carinii, Sporothrix schenckii, Trichophyton, Coccidioides immitis, Coccidioides posadasii, Histoplasma capsulatum, H. capsulatum подвид duboisii.
[0034] Определяемый компонент может быть токсином. В некоторых вариантах реализации изобретения определяемый компонент представляет собой токсин, выбранный из абринов, нейротоксинов ботулина, эпсилон-токсина Clostridium perfringens, конотоксинов, диацетоксисирпенола, рицина, сакситоксина, сигалоподобных рибосомных инактивирующих белков, сигатоксина, стафилококковых энтеротоксинов, токсина Т-2 и тетродотоксина.
[0035] В некоторых вариантах реализации изобретения определяемый компонент выбран из поверхностного антигена гепатита В (HBsAg), В. burgdorferi OspA, HPV LI, белка RSV F, гемагглютинина гриппа, области «петля-на-стебле» вируса гриппа, М2 гриппа, поверхностного белка 1-10 мерозоита P. falciparum, GLURP, SERA, S-антигена, семейства 6-цис, АМА1, ЕВА175, 140, 181, MTRAP, PTRAMP, ASP, Rh1, 2a, 2b, 4, 5, RAP1, 2, 3, RAMA, RHOPH1, 2, 3, белка спорозоита P. vivax, поверхностного белка спорозоита 2, SSP2/TRAP, CSP-N, CSP-R, CSP-C, MSP-1, MSP-9, DBPRIII, AMA-1, Pvs25, Pvs28, капсулярного полисахарида S. aureus, поли-N-ацетилглюкозамина, HIV gp120, gp41 и консервативных участков вируса денге.
[0036] В другом варианте реализации изобретения определяемый компонент содержит по меньшей мере один эпитоп аллергена. Аллергены могут быть природными или искусственными, такими как аллергены, содержащиеся в аллергологических вакцинах. Примеры аллергенов включают, но не ограничиваясь этим, продукты животного происхождения (например, Feld1, меховая перхоть, чашечки тараканов, шерсть, экскременты пылевых клещей), лекарственные средства (например, пенициллин, сульфонамиды, салицилаты, местные анестетики), продукты питания (например, листовой и корневой сельдерей, кукуруза, яйца (например, альбумин), фрукты, бобовые (например, фасоль, горох, арахис, соя), молоко, морепродукты (например, моллюски), кунжут, соя, древесные орехи (например, орехи пекан, миндаль), пшеница, яд насекомых (например, огненные муравьи, яд жала пчелы, яд жала осы), латекс, металл, растительная пыльца (например, трава (например, плевел, тимофеевка, сорняки (например, амброзия, подорожник, крапива, Artemisia vulgaris, Chenopodium album, щавель) и деревья (например, береза, ольха, орешник, граб, каштан, ива, тополь, платан, липа, олива, можжевельник).
[0037] В некоторых вариантах реализации изобретения определяемый компонент представляет собой аллерген, полученный из латексного белка, например необработанного латексного сока, неочищенного латекса, содержащего аммиак, или готового латексного продукта, в котором белки подвергаются воздействию химических веществ и высоких температур. В некоторых вариантах реализации изобретения аллерген представляет собой аллерген клеща, например Dermatophagoides farinae, Dermatophagoides pteronyssinus, Acarus siro, Blomia tropicalis, Chortoglyphus arcuatas, Euroglyphus cannei, Lepidoglyphus destructor, Tyrophagus putrescentiae или Glyphagus demesticus. В некоторых вариантах реализации изобретения аллерген получен из яда, например, видов Bombus, Vespa crabro, Apis mellifera, видов Dolichovespula, видов Polistes, видов Vespula, Dolichovespula maculata или Dolichovespula arenaria. В некоторых вариантах реализации изобретения определяемый компонент представляет собой аллерген из организма насекомого, например, Camponotus pennsylvanicus, Solenopsis invicta, Solenopsis richteri, Periplaneta americana, Blattella germanica, Blatta orientails, видов Tebanus, Musca domestica, видов Ephemeroptera, вида Culicidae или вида Heterocera.
[0038] В некоторых вариантах реализации изобретения определяемый аллерген представляет собой эпителий, перхоть или волосы организма, например, Serinus canaria, Felis catus (domesticus), Bos taurus, Gallus gallus (domesticus), Canis familiaris, Arias platyrhynchos, Meriones unguiculatus, Capra hircus, Anser domesticus, Cavia porcellus (cobaya), Mesocrietus auratus, Sus scrofa, Equus caballus, Mus musculus, Psittacidae, Columba fasciata, Oryctolagus cuniculus, Rattus norvegicus или Ovis aries.
[0039] В некоторых вариантах реализации изобретения источником определяемых аллергенов являются грибы, например, Cephalosporium acremonium, Alternaria tenuis, Aspergillus glaucus, Aspergillus flavus, Aspergillus fumigatus, Aspergillus nidulans, Aspergillus niger, Aspergillus terreus, Aspergillus versicolor, Aureobasidium pullulan (Pullularia pullulans), Drechslera sorokiniana, Helminthosporium sativum, Botrytis cinerea, Candida albicans, Chaetomium globosum, Cladosporium herbarum, Cladosporium sphaerospennum (Homodendrum hordei), Drechslera spicifera (Curvularia spicifera), Epicoccum nigrum (Epicoccum purpurascens), Epidermophyton floccosum, Fusarium moniliforme, Fusarium solani, Geotrichum candidum, Gliocladium viride, Helminthosporium solani, Microsporum canis, Mucor circinelloidesf circinelloides, Mucor circinelloidesf lusitanicus, Mucor plumbous, Mycogone perniciosa, Neurospora intermedia, Nigrospora oryzae, Paecilomyces variotii, Penicillum brevicompactum, Penicillum camembertii, Penicillum chrysogenum, Penicillum digitatum, Penicillum expansum, Penicillum notatum, Penicillum roquefortii, Phoma betae, Phoma herbarum, Rhizopus oryzae, Rhizopus stolonifer, Rhodotorula mucilaginosa, Saccharomyces cerevisiae, Scopulariopsis brevicaulis, Serpula lacrymans, Setosphaeria rostrata, Stemphylium botryosum, Stemphylium solani, Trichoderma harzianum, Trichophyton mentagrophytes, Trichophyton rubrum или Trichothecium roseum. В некоторых вариантах реализации изобретения источником аллергена является головневый гриба, например, Ustilago nuda, Ustilago cynodontis, Ustilago candis, Sporisorium cruentum, Ustilago avenae или Ustilago tritici.
[0040] В некоторых вариантах реализации источником определяемого аллергена является трава, например, Paspalum notatum, Cynodon dactylon, Poa compressa, Bromus inennis, Phalaris arundinacea, Zea cans, Elytrigia repens (Agropyron repens), Sorghum haelpense, Poa pratensis, Festuca Pratensis (elatior), Avena sativa, Dactylis glomerata, Agrostis gigantea (alba), Secale cereale, Leymus (Elymus) condensatus, Lolium perenne подвид Multiflorum, Lolium perenne, Anthoxanthum odoratum, Phleum pratense, Holcus lanatus, Triticum aestivum или Elymus (Agropyron) smithii.
[0041] В некоторых вариантах реализации источником определяемого аллергена является сорняк, например, Atriplex polycarpa, Baccharis halimifolia, Baccharis sarothroides, Hymenoclea salsola, Amaranthus hybridus, Xanthium strumarium (commune), Rumex crispus, Eupathium capillifolium, виды Solidago, Amaranthus tuberculatus (Acnida tamariscina), Allenrolfea occidentalis, Chenopodium botrys, Kochia scoparia, Chenopodium album, Iva xanthifolia, Iva angustifolia, Chenopodium ambrosioides, Artemisia vulgaris, Artemisia ludoviciana, Urtica dioica, Amaranthus spinosus, Plantago lanceolata, Iva axillaris, Atriplex lentiformis, Ambrosia dumosa, Ambrosia acanthicarpa, Ambrosia trifida, Ambrosia artemisiifolia, Ambrosia confertiflora, Ambrosia bidentata, Ambrosia psilostachya, Salsola kali (pestifer), Artemisia californica, Artemisiafrigida, Artemisia tridentata, Atriplex wrightii, Atriplex confertifolia или Artemisia annua.
[0042] В некоторых вариантах реализации источником определяемого аллергена является дерево, например, виды Acasia, Alnus glutinosa, Alnus rubra, Alnus incana подвид rugosa, Alnus rhombifolia, Fraxinus velutina, Fraxinus pennsylvanica, Fraxinus latifolia, Fraxinus americana, Populus tremuloides, Myrica cerifera, Fagus grandifolia (americana), Casuarina equisetifolia, Betula lenta, Betula pendula, Betula nigra, Betula occudentalis (fontinalis), Betula populifolia, Acer negundo, Cryptomeria japonica, Juniperus ashei (sabinoides), Juniperus virginiana, Tamarix gallica, Populus balsamifera подвид trichocarpa, Populus deltoides, Populusfremontii, Populus wislizeni, Populus monilifera (sargentii), Cupressus arizonoca, Taxodium distichum, Cupressus sempervirens, Ulmus americana, Ulmus crassifolia, Ulmus pumila, Eucalyptus globulus, Celtis occidentalis, Corylus americana, Corylus avellana, Carya ovata, Carya laciniosa, Carya alba, Juniferus monosperma, Juniperus princhotii, Juniperus scopulorum, Juniperus occidentalis, Robinia pseudoacacia, Mangifera indica, Acer macrophyllum, Acer rubrum, Acer saccharum, Melaleuca quinquenervia (левкодендрон), Prosopis glandulosa (juliflora), Broussonetia papyrifera, Morus rubra, Morums alba, Quercus gambelii, Quercus velutina, Quercus macrocarpa, Quercus kelloggii, Quercus agrifolia, Quercus lobata, Quercus ilex, Quercus stellata, Quercus rubra, Quercus dumosa, Quercus virginiana, Quercus nigra, Quercus garryana, Quercus alba, Olea europaea, Elaegnus angustifolia, Citrus sinensis, Arecastrum romanzoffianum (Cocos plumosa), Carya illnoensis, Schinus molle, Schinus terebinthifolius, Pinus taeda, Pinus strobus, Pinus palustris, Pinus ponderosa, Pinus elliottii, Pinus virginiana, Pinus monticola, Pinus echinata, Populus nigra, Populus alba, Ligustrum vulgare, Liquidambar styraciflua, Platanus occidentalis, Platanus orientalis, Platanus racemosa, Platanus acerifolia, Juglans nigra, Juglans californica, Juglans regia, Salix lasiolepsis, Salix nigra или Salix discolor. В некоторых вариантах реализации изобретения источником аллергена является цветок, например, Chrysanthemum leucanthemum, Taraxacum officinale или Helianthus annuus. В некоторых вариантах реализации изобретения источником аллергена является сельскохозяйственное растение, например, Medicago sativa, Ricinus communis, Trifolium pratense, виды Brassica или Beta vulgaris.
[0043] В некоторых вариантах реализации источником определяемого аллергена является растительный пищевой продукт (съедобное растение), например, Prunus dulcis, Malus pumila, Prunus armeniaca, Musa paradisiaca (sapientum), Hordeum vulgare, Phaseolus lanatus, Phaseolus vulgaris, вид Phaseolus, вид Phaseolus, Phaseolus vulgaris, Rubus allegheniensis, вид Vaccinium, Brassica oleracea сорт botrytis, Fagopyrum esculentum, Brassica oleracea сорт capitata, Theobroma cacao, Cucumis melo, Daucus carota, Brassica oleracea сорт botrytis, Apium graveolens сорт dulce, вид Prunus, Cinnamomum verum, Coffea arabic, Zea cans, Vaccinium macrocarpon, Cucumis sativus, Allium sativum, Zingiber officinale, вид Vitis, Citrus paradisi, Humulus lupulus, Citrus limon, Lactuca sativa, Agaricus campestris, вид Brassica, Myristica fragrans, Avena sativa, Olea europaea, Allium сера сорт сера, Citrus sinensis, Vigna unguiculata, Pisum sativum, Prunus persica, Pyrus communis, Piper nigrum, Capsicum annuum сорт annuum, Ananas comosus, Ipomoea batatas, Solanum tuberosum, Rubus idaeus сорт idaeus, Oryza sativa, Secale cereale, Sesamum orientate (indicum), Glycine max, Spinacia oleracea, Cucurbita pepo сорт melopepo, Fragaria chiloensis, Lycopersicon esculentum (lycopersicum), Brassica rapa сорт rapa, Vanilla planifolia, Citrullus lanatus сорт lanatus или Triticun aestivum.
[0044] В некоторых вариантах реализации источником определяемого аллергена являются рыба или моллюски, например, вид Micropterus, Ictalurus punctatus, Mercenaria mercenaria, Gadus morhua, Callinectes sapidus, вид Platichthys, вид Hippoglossus, Homarus americanus, Scomber scombrus, Crassostrea virginica, Sebastes marinus, Salmo salar, Clupeiformes, Pecten magellanicus, вид Penaeus, вид Salvelinus или вид Thunnus. В некоторых вариантах реализации изобретения источником аллергена является пищевой продукт животного происхождения, например, полученный от Bos taurus, Ovis aries или Sus scrofa. В некоторых вариантах реализации аллерген представляет собой продукт из птицы, например, продукты из курицы (Gallus gallus) или индейки (Meleagris gallopavo). В некоторых вариантах реализации источником аллергена является молочный продукт, например, казеин жвачных животных или коровье молоко. В некоторых вариантах реализации изобретения аллергеном является орех, например, Bertholletia excelsa, Anacardium oceidentale, Cocos nucifera, Corylus americana, Arachis hypogaea, Carya illinoensis, Juglans nigra или Juglans regia. В некоторых вариантах реализации аллергеном является пыль, например пыль зерна ячменя, пыль зерна кукурузы, домашняя пыль, пыль матраца, пыль зерна овса, пыль зерна пшеницы, пыль обивки или латексная пыль.
[0045] В некоторых вариантах реализации определяемый антигенный компонент представляет собой аутоантиген, связанный с аутоиммунным расстройством. В некоторых вариантах аутоиммунное расстройство представляет собой клеточно- или органоспецифическое аутоиммунное расстройство, определяемый аутоантигенный компонент выбирают из: ацетилхолинового рецептора (миастения), актина (хронический активный гепатит, первичный билиарный цирроз), аденин-нуклеотидного транслокатора (АНТ) (дилатационная кардиомиопатия, миокардит), бета-адренорецептора (дилатационная кардиомиопатия), декарбоксилазы ароматических L-аминокислот (аутоиммунный полиэндокринный синдром типа I (АПС-1)), асиалогликопротеинового рецептора (аутоиммунный гепатит), бактерицидного / повышающего проницаемость белка (Bpi) (муковисцидозные васкулиты), рецептор чувствительности к кальцию (приобретенный гипопаратиреоз), фермента расщепления боковой цепи холестерина (CYPIIa) (АПС-1), альфа-цепи коллагена IV типа (синдром Гудпасчуре), цитохром Р450 2D6 (CYP2D6) (аутоиммунный гепатит), десмина (болезнь Крона, заболевание коронарных артерий), десмоглеина 1 (эксфолиативная пузырчатка), десмоглеина 3 (обыкновенная пузырчатка), F-актина (аутоиммунный гепатит), GM ганглиозида (синдром Гийена-Барре), глутаматдекарбоксилазы (GAD65) (диабет 1 типа, синдром мышечной скованности), глутаматного рецептора (GLUR) (энцефалит Расмуссена), H/K АТФазу (аутоиммунный гастрит), 17-альфа-гидроксилазу (CYP17) (АПС-1), 21-гидроксилазу (CYP21) (болезнь Аддисона), IA-2 (ICA512) (диабет 1 типа), инсулина (диабет 1 типа, инсулин-гипогликемический синдром (болезнь Хирата), резистентность к инсулину типа В, акантоз, системная красная волчанка (СКВ)), внутреннего фактора типа 1 (пернициозная анемия), лейкоцитарного функционально-связанного антигена (LFA-1) (резистентный к лечению артрит Лайма), миелин-ассоциированного гликопротеина (МАГ) (полиневропатия), основного белка миелина (рассеянный склероз, демиелинизирующее заболевание), миелин-олигодендроцитарного гликопротеина (МОГ) (рассеянный склероз), миозина (ревматическая лихорадка), р-80-коилина (атопический дерматит), комплекса пирувадегидрогеназы-Е2 (КПД Е2) (первичный билиарный цирроз), симпортера йодида натрия (СЙН) (болезнь Грейвса, аутоиммунный гипотиреоз), SOX-10 (витилиго), общего для щитовидной железы и глазных белка (аутоиммунный тиреоидит), пероксидазы щитовидной железы (аутоиммунный тиреоидит Хашимото), тиреотропинового рецептора (болезнь Грейвса), тканевой трансглутаминазы (целиакия), коактиватора транскрипции р75 (атопический дерматит), триптофангидроксилазы (АПС-1), тирозиназы (витилиго, метастатическая меланома) и тирозингидроксилазы (АПС-1), причем связанное(ые) аутоиммунное(ые) нарушение(я) перечислены в скобках сразу после каждого определяемого аутоантитела.
[0046] В некоторых вариантах реализации аутоиммунное нарушение представляет собой системное аутоиммунное расстройство, а определяемый аутоантигенный компонент выбран из: АКТГ (дефицит АКТГ), аминоацил-тРНК-гистидилсинтетазы (полимиозит, дерматомиозит), аминоацил-тРНК-синтетазы (полимиозит, дерматомиозит), кардиолипина (СКВ), карбоангидразы П (СКВ, синдром Шегрена, системный склероз), коллагена (ревматоидный артрит (РА), СКВ, прогрессирующий системный склероз), центромер-ассоциированного белка (системный склероз), фибронектина (СКВ, РА, очаговая склеродермия), глюкозо-6-фосфатизомеразы (РА), бета2-гликопротеина I (Бета2-ГПI) (первичный антифосфолипидный синдром), голгина (95, 97, 160 и/или 180) (синдром Шегрена, СКВ, РА), белка теплового шока (различные нарушения иммунной системы), гемидесмосомального белка 180 (пузырчатка, герпес беременных, рубцевой пемфигоид, гистон Н2А-Н2В-ДНК (СКВ), рецептор IgE (хроническая идиопатическая крапивница), кератин (РА), Ку-ДНК-протеинкиназа (СКВ), Ку-нуклеопротеин (синдромы соединительной ткани) La фосфопротеин (La 55-В) (синдром Шегрена), миелопероксидаза (некротизирующий и цесцентический гломерулонефрит (НЦГН), системный васкулит), протеиназы 3 (PR3) (гранулематоз Вегенера, синдром Чёрга-Страусс), РНК-полимеразы I-ПI (РНП) (системный склероз, СКВ), белка распознавания сигналов (SRP54) (полимиозит), топоизомеразы-1 (Scl-70) (склеродермия, синдром Рейно), тубулина (хроническое заболевание печени, висцеральный лейшманиоз) и виментина (системное аутоиммунное заболевание), связанное(ые) аутоиммунное(ые) нарушение(я) перечислены в скобках сразу после каждого аутоантигена.
[0047] В некоторых вариантах реализации изобретения аутоиммунное нарушение представляет собой аутоиммунное расстройство белков плазмы или аутоиммунное расстройство цитокинов, а определяемый аутоантигенный компонент выбран из: ингибитора C1 (аутоиммунный дефицит C1), Clq (СКВ, мембранозно-пролиферативный гломерулонефрит (МПГН)), цитокина (например, IL-1 альфа, IL-1 бета, IL-, IL-10, LIF) (РА, системный склероз), фактора II (пролонгированное время коагуляции), фактора V (пролонгированное время коагуляции), фактора VII (пролонгированное время коагуляции), фактора VIII (пролонгированное время коагуляции), фактора IX (пролонгированное время коагуляции), фактора X (пролонгированное время коагуляции), фактора XI (пролонгированное время коагуляции), фактора ХП (пролонгированное время коагуляции), тромбина (пролонгированное время коагуляции), VWF (пролонгированное время коагуляции), гликопротеина IIb/IIIg и Ib/IX (аутоиммунная тромбоцитопения пурпура), IgA (иммунодефицит) и окисленного ЛПНП (ОксЛПНП) (атеросклероз), причем связанное(ые) аутоиммунное(ые) нарушение(я) перечислены в скобках сразу после каждого аутоантигена.
[0048] В некоторых вариантах реализации аутоиммунное расстройство представляет собой рак или паранеопластическое аутоиммунное расстройство, а аутоантигенный определяемый компонент выбран из: амфифизина (нейропатии, мелкоклеточный рак легкого), циклина В 1 (гепатоцеллюлярная карцинома), ДНК топоизомеразы П (рак печени), десмоплакина (псориазиформный акрокератоз), гефирина (паранеопластический синдром мышечной скованности), белка Hu (паранеопластический энцефаломиелит), нейронный никотиновый рецептор ацетилхолина (подострая автономная нейропатия, рак), р53 (рак, СКВ), р62 (белок, связывающийся с мРНК IGF-II), рековерина (связанная с раком ретинопатия), белка R1 (паранеопластическая опсоклонусно-миоклонусная атаксия), бета IV спектрина (синдром альфа мотонейрона спинного мозга), синаптотагмина (миастенический синдром Ламберт-Итона), открываемых потенциалом кальциевых каналов (миастенический синдром Ламберта-Итона) и белка Yo (паранеопластическая мозжечковая дегенерация).
[0049] В некоторых вариантах реализации определяемый антигенный компонент представляет собой эндогенный антиген, который является аберрантно экспрессируемым полипептидом. Примеры таких эндогенных антигенов включают, но не ограничиваясь этим, амилоид бета (А-бета или А.бета.), альфа-синуклеин, цистатин С, тау, ABri, ADan, супероксиддисмутазу (СОД), мутантный Хантингтон, PrP.sup.sc или фрагмент любого из вышеперечисленных.
[0050] В некоторых вариантах реализации изобретения определяемый компонент содержит, по меньшей мере, один эпитоп импланта, который должен быть введен пациенту, продукты метаболизма или разложения материала импланта или вещества, которые специфично связываются с эпитопом материала импланта, такие как антитела к материалу импланта или продукты его разложения. Такие импланты могут включать, например, импланты с электроприводом (например, искусственные кардиостимуляторы), биоимпланты (биоматериал, хирургически имплантированный в организм пациента для замены поврежденной ткани (например, ортопедический реконструктивный протез), сердечные протезы (искусственные клапаны), кожа и роговица), контрацептивные импланты, зубные импланты, ортопедические импланты и устройства для предотвращения адгезии. Примеры материалов имплантов, которые могут содержать эпитопы, включают латекс; силикон; металлы, такие как сплавы на основе кобальта (Со-Cr), титан и титановые сплавы; полимеры, такие как сверхвысокомолекулярный полиэтилен (СВМПЭ) и полиметилметакрилатный цемент (ПММА); и биокерамику, такую как гидроксиапатит и биостекло.
Элемент, не являющийся антителом, передающий сигнал
[0051] Типичные варианты реализации настоящего изобретения включают в себя различные элементы, не являющиеся антителами, передающие сигнал. Каждый элемент, передающий сигнал, адаптирован для приема, т.е. связывания детекторной молекулы, которая сама по себе адаптирована для приема, т.е. связывания конкретного целевого определяемого компонента. В одном варианте реализации изобретения элемент, передающий сигнал, представляет собой трансмембранный химерный слитый белок, который встроен внутрь и экспрессируется на поверхности биосенсорной клетки, и который адаптирован для активации пути передачи сигнала, что в конечном итоге приводит к испусканию репортерным белком поддающегося обнаружению сигнала. В другом варианте реализации изобретения элемент, передающий сигнал, представляет собой растворимый химерный слитый белок, который адаптирован для связывания с элементом, передающим сигнал, на поверхности клетки, таким как нативный рецептор или белок-рецептор, который адаптирован для активации пути передачи сигнала, что в конечном итоге приводит к испусканию репортерным белком поддающегося обнаружению сигнала. В еще одном варианте реализации изобретения элемент, передающий сигнал, представляет собой растворимый химерный слитый белок, который встроен внутрь и экспрессируется биосенсорной клеткой. Затем растворимый химерный слитый белок секретируется/выводится во внеклеточное пространство, где он связывается с элементом, передающим сигнал, на поверхности клетки, таким как нативный рецептор или рецепторный белок, который адаптирован для активации пути передачи сигнала, что в конечном итоге приводит к испусканию репортерным белком поддающегося обнаружению сигнала.
[0052] Химерные слитые белки по настоящему изобретению могут содержать: (i) компонент белка, который адаптирован для связывания, по меньшей мере, с одним типом детекторной молекулы (например, растворимым антителом); и (ii) компонент рецепторного комплекса, обычно экспрессируемого живой генно-модифицированной
биосенсорной клеткой. В некоторых вариантах реализации изобретения компонент белка, который адаптирован для связывания с детекторной молекулой по меньшей мере одного типа, может быть получен из бактериального связывающегося белка (т.е. белка, связывающегося с антителом, который получен из бактерий), такого как, например, домен связывания с антителом IgG белка strep G (в настоящем документе обозначен как IgGbp или Igbp на Фигурах). Тандемные повторы этого домена связывания IgG могут быть включены для увеличения сродства связывающегося белка к растворимому антителу. В альтернативном варианте реализации изобретения компонент химерного слитого белка, который адаптирован для связывания с детекторной молекулой по меньшей мере одного типа, представляет собой домен связывания с антителом, полученный из рецепторного белка, такого как, например, мышиный рецептор Fc гамма RI (FcγRI). В различных типичных вариантах реализации изобретения компонент рецепторного комплекса, обычно экспрессируемый живой генно-модифицированной биосенсорной клеткой, представляет собой IgM (для биосенсоров В-клеток); IgGoα/β (для биосенсорных В-клеток); IgE (для биосенсорных тучных клеток); CD19 (для биосенсорных В-клеток), CD3дзета (для биосенсорных Т-клеток) или FcεRI (для биосенсорных тучных клеток).
[0053] Элементы, не являющиеся антителами, передающие сигнал, по настоящему изобретению, могут включать полноразмерные последовательности белка или генно-модифицированные фрагменты белка, такие как выбранные белковые домены, полученные из более крупных молекул белка. Специалисту в данной области техники будет понятно, что фрагменты более крупных молекул могут быть созданы с применением стандартных методов генной инженерии, таких как синтетическая генная технология. Если фрагменты более крупных белков применяются для разработки мотивов связывания антител как аспектов химерных слитых белков, важно сконструировать генно-модифицированные белки для обеспечения надлежащего конформационного свертывания выбранных фрагментов белка. Таким образом, полезно включать (в слитые белки) короткие спейсерные или линкерные элементы, которые с трудом образуют белковые вторичные структуры. Например, короткие комбинации аминокислот, таких как глицин, серии и аланин, могут применяться в указанных спейсерных или линкерных элементах. В типичном варианте реализации изобретения аминокислотная последовательность глицина (G), серии (S), аланин (А), серии (S), глицин (G), серии (S), глицин (G) применяется для отделения домена связывания с антителом от компонента рецепторного комплекса в генно-модифицированной белковой молекуле (см. SEQ ID NO: 19). Что касается пептидного линкера или спейсера, применяемого для соединения детектора с элементом, передающим сигнал, или для соединения разных сегментов элемента, передающего сигнал: линкер обычно соединяет карбоксильный конец одного элемента с аминоконцом другого. Длина пептидных линкеров может варьировать от 0 до 25 аминокислот или любого промежуточного целочисленного значение и обычно, но не всегда, содержат гидрофильные аминокислоты, такие как глицин (G) и серии (S).
[0054] Как указано выше, каждый элемент, передающий сигнал, связывается с детекторной молекулой, которая связывается с конкретным определяемым компонентом, представляющим интерес. Детекторная молекула, связанная с определяемым компонентом, будет (i) связываться с трансмембранным элементом, передающим сигнал,; или (ii) с элементом, передающим сигнал, который сам будет связываться с преобразователем сигнала на поверхности клетки (например, нативным рецептором). В первой ситуации при связывании достаточного количества определяемого компонента с достаточным количеством детекторных молекул, которые сами по себе связаны с трансмембранными элементами, передающими сигнал, не являющимися антителами, на поверхности биосенсорных клеток происходит агрегация элементов, передающих сигнал, активируется путь передачи сигнала, происходит биологический процесс, и репортерный белок испускает обнаруживаемый сигнал. Во втором случае при связывании достаточного количества определяемого компонента с достаточным количеством детекторных молекул и с достаточным количеством элементов, передающих сигнал, которые сами по себе связаны с соответствующим нативным рецептором, происходит агрегация рецепторов на клеточной поверхности, активируется путь передачи сигнала, происходит повышение уровня внутриклеточного кальция, и репортерный белок испускает обнаруживаемый свет.
[0055] Первый элемент, не являющийся антителом, передающий сигнал, в соответствии с типичным вариантом реализации настоящего изобретения содержит бактериальный связывающий белок (IgGbp), слитый с константным доменом тяжелой цепи IgM (В-клетка) с помощью линкера GSASGSG. В SEQ ID NO: 1 приведена последовательность ДНК для элемента IgGbp-IgM, передающего сигнал, а в SEQ ID NO: 2 приведена последовательность белка для элемента IgGbp-IgM, передающего сигнал.
[0056] Второй элемент, не являющийся антителом, передающий сигнал, в соответствии с типичным вариантом реализации настоящего изобретения содержит бактериальный связывающий белок (IgGbp), слитый с Igα/β-компонентом рецептора В-клеток с помощью линкера GSASGSG. В SEQ ID NO: 3 приведена последовательность ДНК для элемента IgGbp-Igα/β, передающего сигнал, а в SEQ ID NO: 4 приведена последовательность белка для элемента IgGbp-Igα/β, передающего сигнал.
[0057] Третий элемент, не являющийся антителом, передающий сигнал, в соответствии с типичным вариантом реализации настоящего изобретения содержит бактериальный связывающий белок (IgGbp), слитый с дзета-цепью CD3 рецептора Т-клеток с помощью линкера GSASGSG. В SEQ ID NO: 5 приведена последовательность ДНК для элемента IgGbp-С3ζ, передающего сигнал, а в SEQ ID NO: 6 приведена последовательность белка для элемента IgGbp-CD3ζ, передающего сигнал.
[0058] Четвертый элемент, не являющийся антителом, передающий сигнал, в соответствии с типичным вариантом реализации настоящего изобретения содержит домен связывания с антителом FcyRI, слитый с константным доменом тяжелой цепи IgM (В-клетка) с помощью линкера GSASGSG. В SEQ ID NO: 7 приведена последовательность ДНК для элемента FcyRI-IgM, передающего сигнал, а в SEQ ID NO: 8 приведена последовательность белка для элемента FcyRI-IgM, передающего сигнал.
[0059] Пятый элемент, не являющийся антителом, передающий сигнал, в соответствии с типичным вариантом реализации настоящего изобретения, содержит домен связывания с антителом FcyRI, слитый с Igα/β-компонентом В-клеточного рецептора с помощью линкера GSASGSG. В SEQ ID NO: 9 приведена последовательность ДНК для элемента FcyRI-Igα/β, передающего сигнал, а в SEQ ID NO: 10 приведена последовательность белка для элемента FcyRI-Igα/β, передающего сигнал.
[0060] Шестой элемент, не являющийся антителом, передающий сигнал, в соответствии с типичным вариантом реализации настоящего изобретения, содержит домен связывания с антителом FcyRI, слитый с дзета-цепью CD3 рецептора Т-клеток с помощью линкера GSASGSG. В SEQ ID NO: 11 приведена последовательность ДНК для элемента FcyRI-CD3ζ, передающего сигнал, а в SEQ ID NO: 12 приведена последовательность белка для элемента FcyRI-CD3ζ, передающего сигнал.
[0061] Седьмой типичный элемент, не являющийся антителом, передающий сигнал, в соответствии с настоящим изобретением содержит бактериальный связывающий белок (IgGbp), слитый с константным доменом IgE (В-клетка) с помощью линкера GSASGSG. В SEQ ID NO: 13 приведена последовательность ДНК для элемента IgGbp-IgE, передающего сигнал, а в SEQ ID NO: 14 приведена последовательность белка для элемента IgGbp-IgE, передающего сигнал.
[0062] Восьмой типичный элемент, не являющийся антителом, передающий сигнал, в соответствии с настоящим изобретением содержит домен связывания с антителом FcγRI, слитый с константным доменом IgE (В-клетка) с помощью линкера GSASGSG. В SEQ ID NO: 15 приведена последовательность ДНК для элемента, передающего сигнал, FcγRI-IgE, а в SEQ ID NO: 16 приведена последовательность белка для элемента, передающего сигнал, FcγRI-IgE.
[0063] Девятый типичный элемент, не являющийся антителом, передающий сигнал, в соответствии с настоящим изобретением содержит мономерный стрептавидин, слитый с дзета-цепью CD3 рецептора Т-клеток с помощью линкера GSASGSG. В SEQ ID NO: 17 приведена последовательность ДНК для элемента mSA-CD3ζ, передающего сигнал, а в SEQ ID NO: 18 приведена последовательность белка для элемента mSA-CD3ζ, передающего сигнал. Мономерный стрептавидин представляет собой рекомбинантную форму стрептавидина, которая содержит мутации для разрушения тетрамера стрептавидина с образованием мономера и повышения растворимости образовавшейся изолированной субъединицы.
Пример биосенсора I
[0064] Как проиллюстрировано на Фиг. 1a-b, первый биосенсор 100 в соответствии с типичным вариантом реализации настоящего изобретения содержит Т-клетки Jurkat 102, которые были модифицированы для выработки экворина 104 и которые были нагружены КТЗ 106 для получения экворина/КТЗ, как описано выше. Данный конкретный биосенсор дополнительно был сконструирован для экспрессии трансмембранного не-антителообразующего элемента 108, передающего сигнал, который представляет собой IgGbp-CD3ζ (SEQ ID NO: 5-6), хотя трансмембранный элемент, не являющийся антителом, передающий сигнал FcγRI-CD3ζ (SEQ ID NO: 11-12) также можно применять с биосенсором 100. Кроме того, биосенсорная клетка 102 содержит по меньшей мере один путь передачи сигнала 110, активизация которого приводит к повышению внутриклеточного уровня Са2+ 112. Как проиллюстрировано на Фиг. 1b, при связывании достаточного количества детекторных молекул 114 (например, растворимых антител), с которыми связан целевой определяемый компонент 116 (например, Е. coli O157), связывается с трансмембранными элементами 108, не являющимися антителами, передающими сигнал, активируется путь передачи сигнала 110, повышается внутриклеточный уровень Са2 +112, комплекс экворин/КТЗ претерпевает конформационное изменение и испускает сигнал (фотон) света 118, который обнаруживается с помощью фотоумножителя 120, а пик 122 графически отображается на тестовом устройстве (см. описание ниже), указывая на присутствие целевого определяемого компонента 116 в исследуемом образце. В отношении целевого определяемого компонента 116 отображение может быть как качественным, так и количественным.
Пример биосенсора II
[0065] Со ссылкой на Фиг. 2а-b, второй биосенсор 200 в соответствии с типичным вариантом реализации настоящего изобретения содержит тучные клетки 202 МС/9 (АТСС® CRL-8306™), которые были модифицированы для выработки экворина 204 и были нагружены КТЗ 206 для получения комплекса экворина/КТЗ, как описано выше. Данный конкретный биосенсор экспрессирует нативный Fc-эпсилон-рецептор (т.е. FcεRI) 207, который связывается с растворимым неантителообразующим элементом 208, передающим сигнал, который представляет собой IgGbp-IgE (SEQ ED NO: 13-14), хотя не-антителообразующий элемент FcγRI-IgE, передающий сигнал (SEQ ID NO: 15-16) также может применяться с биосенсором 200. Как проиллюстрировано на Фиг. 2b, если достаточное количество детекторных молекул 214 (например, растворимых антител), с которыми связан целевой определяемый компонент 216 (например, Е. coli O157), связывается с элементами 208, не являющимися антителами, передающими сигнал, которые ранее были связаны с нативными Fc-эпсилон-рецепторами 207, то активируется путь передачи сигнала 210, повышается внутриклеточный уровень Са2+ 212, комплекс экворин/КТЗ претерпевает конформационное изменение и испускает сигнал (фотон) света 218, который обнаруживается с помощью фотоумножителя 220, а пик 222 графически отображается на тестовом устройстве (см. описание ниже), указывая на присутствие целевого определяемого компонента 216 в исследуемом образце. В отношении целевого определяемого компонента 216 отображение может быть как качественным, так и количественным.
Пример биосенсора III
[0066] Со ссылкой на Фиг. 3а-b, третий биосенсор 300 в соответствии с типичным вариантом реализации настоящего изобретения содержит тучные клетки МС-9 302 (АТСС® CRL-8306™), которые были модифицированы для получения экворина 304 и были нагружены КТЗ 306 с для получения комплекса экворина/КТЗ, как описано выше. Данный конкретный биосенсор экспрессирует нативный Fc-эпсилон-рецептор (т.е. FcεRI) 307, который связывается с элементом 308 трансдукции сигнала, не являющимся антителом, который представляет собой IgGbp-IgE (SEQ ID NO: 13-14), хотя не-антителообразующий элемент FcγRI-IgE, передающий сигнал (SEQ ID NO: 15-16) также можно применять с биосенсором 300. В данном конкретном варианте реализации изобретения биосенсорные клетки 302 были дополнительно модифицированы для экспрессии IgGbp-IgE и выведения этого не-антителообразующего элемента, передающего сигнал, во внеклеточное пространство, где он связывается с нативным FcεRI, экспрессирующимся на поверхности клетки. Как проиллюстрировано на Фиг. 3b, если достаточное количество детекторных молекул 314 (например, растворимых антител), с которыми связан целевой определяемый компонент 316 (например, Е. coli O157), связывается с элементами, передающими сигнал, не являющимися антителами, 308, которые ранее были связаны с нативными Fc-эпсилон-рецепторами 307, то активируется путь передачи сигнала 310, повышается внутриклеточный уровень Са2+312, комплекс экворин/КТЗ претерпевает конформационное изменение и испускает сигнал (фотон) света 318, который обнаруживается с помощью фотоумножителя 320, а пик 322 графически отображается на тестовом устройстве (см. описание ниже), указывая на присутствие целевого определяемого компонента 316 в исследуемом образце. В отношении целевого определяемого компонента 316 отображение может быть как качественным, так и количественным.
Пример биосенсора IV
[0067] Со ссылкой на Фиг. 4, четвертый биосенсор 400 в соответствии с типичным вариантом реализации настоящего изобретения содержит биосенсорные клетки 402, которые были модифицированы для выработки экворина и экспрессируют трансмембранный не-антитело образующий элемент 408, передающий сигнал, который представляет собой mSA-CD3ζ (SEQ ID NO: 17-18). He-антитело образующий элемент mSA-CD3ζ, передающий сигнал (мономер стрептавидина-CD3ζ связывается с биотинилированной детекторной молекулой 414, которая специфично связывается с молекулой-мишенью 416, такой как, например, эпидермальный фактор роста (EGF). Молекулярное антитело 417 против мишени, такое как, например, анти-EGF, создает целевые мультимеры, кластеризующие несколько элементов, передающих сигнал, и индуцирует передачу сигнала, как описано выше. В других вариантах реализации мономерный стрептавидиновый компонент заменен биотинилированным компонентом, и могут применяться альтернативные средства образования связи.
Пример биосенсора V
[0068] Со ссылкой на Фиг. 5, пятый биосенсор 500 в соответствии с типичным вариантом реализации настоящего изобретения содержит биосенсорные клетки 502, которые были модифицированы для выработки экворина и экспрессируют трансмембранный не-антитело образующий элемент 508, передающий сигнал, который представляет собой mSA-CD3ζ (SEQ ED NO: 17-18). Неантител ообразующий элемент mSA-CD3ζ, передающий сигнал (мономерный стрептавидин-CD3ζ) связывается с биотинилированной детекторной молекулой 514, которая в некоторых вариантах реализации изобретения представляет собой молекулу аутоантигена. Биотинилированная детекторная молекула 514 специфично связывается с молекулой-мишенью 516, которая в некоторых вариантах реализации изобретения представляет собой молекулу против аутоантигена. Аутоантитела в образце сыворотки создают целевые мультимеры, которые объединяют несколько элементом, передающих сигнал, и индуцируют передачу сигнала, как описано ранее. В других вариантах реализации изобретения мономерный стрептавидиновый компонент заменен биотинилированным компонентом, и могут применяться альтернативные средства образования связи.
[0069] Аминокислотные последовательности передающего сигнал полипептида, применяемые для получения химерных белков по изобретению, могут обладать по меньшей мере 70%, 75%, 80%, 85%, 87,5%, 90%, 92,5%, 95% 97,5%, 98%, 99% идентичностью или сходством последовательности с белками или доменами, идентифицированными следующими регистрационными номерами или в них: тяжелая цепь IgM (GenBank: САС20458.1), Ig-альфа (P11912.2, GI:547896), Ig-бета (P40259.1 GI.728994), CD19 (AAA69966.1 GI:901823), CD3zeta (P20963.2, GI: 23830999), IgE альфа (1F2Q_A, GI:9257150) и Fc-эпсилонR1 субъединица альфа (P12319.1, GI: 119865).
[0070] Белок A Staphylococcus aureus (Р02976.3, GI: 110283003) кодируется геном spa Staphylococcus aureus, и его структура, включая его сегменты связывания с Ig, а также иммуноглобулинсвязывающие свойства хорошо известны и включены посредством ссылки на Graille, et al., Proc Natl Acad Sci USA. 2000 May 9; 97(10): 5399.404; и Roben, et al. J Immunol. 1995 Jun 15; 154(12): 6437-45. Варианты Белка A или его иммуноглобулинсвязывающих сегментов, обладающие по меньшей мере 70%, 75%, 80%, 85%, 87,5%, 90%, 92,5%, 95%, 97,5%, 98%, 99% идентичностью последовательности или сходством с известными аминокислотными последовательностями Белка А, а также способностью связываться с иммуноглобулином или другим определяемым компонентом, таким как описаны Graille, et al. и Roben, et al., могут быть получены с помощью методов молекулярной биологии, хорошо известных в данной области техники, включая прямой синтез нуклеиновой кислоты, кодирующей иммуноглобулинсвязывающую аминокислотную последовательность.
[0071] Другие иммуноглобулинсвязывающие белки, такие как Белок G Streptococcus и модифицированные варианты таких белков, известны и включены посредством ссылки на Bailey, et al., J Immunol Methods. 2014 Dec 15; 415: 24-30 (doi: 10.1016/j.jim.2014.10.003) (Epub 2014 Oct 22); и на Watanabe, et al., J Biol Chem. 2009 May 1; 284(18):12373-8 (doi: 10.1074/jbc.M809236200)(Epub 2009 Mar 6). Варианты Белка G или его иммуноглобулинсвязывающих сегментов, обладающих по меньшей мере 70%, 75%, 80%, 85%, 87,5%, 90%, 92,5%, 95%, 97,5%, 98%, 99% идентичностью или сходством последовательности с известными аминокислотными последовательностями Белка G и способность связываться с иммуноглобулином или другим определяемым компонентом, таким как описан Bailey, et al. and Watanabe, et al., могут быть получены с помощью методов молекулярной биологии, хорошо известных в данной области техники, включая прямой синтез нуклеиновой кислоты, кодирующей иммуноглобулинсвязывающую аминокислотную последовательность.
[0072] Fc-рецепторы (FcR) связываются с Fc-частью иммуноглобулина, и многие типы таких Fc-рецепторов известны, включая FcγRI и FcεRI. Структурные и функциональные характеристики связывания этих FcR включены посредством ссылки на Fridman, FASEB J. 1991 Sep; 5(12): 2684-90. Варианты FcR или их иммуноглобулинсвязывающих сегментов, обладающие по меньшей мере 70%, 75%, 80%, 85%, 87,5%, 90%, 92,5%, 95%, 97,5%, 98%, 99% идентичностью или сходством последовательности с известной аминокислотной последовательностью FcR, такой как последовательность, описанная Фридманом, может быть получена с помощью методов молекулярной биологии, хорошо известных в данной области техники, включая прямой синтез нуклеиновой кислоты, кодирующей иммуноглобулинсвязывающую аминокислотную последовательность.
[0073] Белок, передающий сигнал, в соответствии с изобретением, может обладать по меньшей мере 70% 75%, 80%, 85%, 87,5%, 90%, 92,5%, 95%, 97,5%, 98%, 99% идентичностью или сходством последовательности с раскрытыми белками, передающими химерный сигнал, описанными в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16 и 18, а также обладает способностью связываться с определяемым компонентом, таким как иммуноглобулин, и затем передавать сигнал в генно-модифицированную биосенсорную клетку. Такие варианты реализации изобретения могут быть сконструированы методами, хорошо известными из уровня техники в обрасти молекулярной биологии или химическим синтезом полинуклеотидов, кодирующих варианты химерных репортерных белков, введением кодирующих последовательностей в вектор и трансформацией или трансфекцией вектором компетентной клетки.
Сортировка и клонирование клеток
[0074] Дизайн и конструирование биосенсоров по настоящему изобретению давали смешанную популяцию биосенсорных клеток при культивировании. Некоторые клетки не экспрессировали модифицированные факторы, а другие экспрессировали факторы с разными уровнями. После успешной электропорации и введения генов биосенсорные клетки культивировали и тестировали на предмет биологического ответа (сигнал вспышки) в виде смешанных популяций. Сортировку отдельных клеток проводили с применением проточного цитометра. Клетки выделяли и затем размножали для анализа, с целью отбора экспрессирующих высокие уровни желаемых белков. Для этого процесса применяли флуоресцентно меченые антитела для нацеливания на различные рецепторы на биосенсорных клетках, тем самым обеспечивая процесс сортировки. Был проведен скрининг отдельных клонов на предмет проведения сигнала, и были выбраны лучшие клоны. В результате этого процесса были идентифицированы и выделены наиболее подходящие клоны. Сортировку клеток с активированной флуоресценцией (СКАФ) и окрашивание живых клеток на предмет внеклеточного белка проводили, как описано ниже.
[0075] Генно-модифицированные биосенсорные клетки подсчитывали, осторожно центрифугировали и повторно суспендировали в промывочном буфере (ССРХ + 2% БСА) до конечной концентрации 1×107-1×108 клеток/мл. В каждом эксперименте использовали полноразмерное антитело с Fc-областью или F(ab)2. При использовании полноразмерного антитела в каждую пустую пробирку 12×15 мм, которая должна была принимать клетки, помещали 1-0,5 мкг антитела, блокирующего Fc-рецептор. В каждую из этих пробирок добавляли 100 мкг клеток (1×106-1×107 клеток) поверх Fc-блокирующего антитела. Клетки осторожно перемешивали и инкубировали в течение 15 минут при 4°C или комнатной температуре. При использовании F(ab)2 предыдущую стадию блокировки Fc опускали. Добавляли в общей сложности 1 мкг первичного антитела (против рецептора выбора), и клетки затем осторожно перемешивали перед инкубацией в течение 20-40 минут на льду (или при 4°C). Эта температура препятствовала интернализации рецептора. Клетки осторожно перемешивали (вихревым перемешиванием) с перерывами, чтобы способствовать прикреплению метки. К клеткам добавляли 2 мл холодного промывочного буфера, затем клетки центрифугировали при 4°C, и супернатант отбрасывали. Стадию промывания повторяли перед повторным суспендированием клеток в 100 мкл буфера для промывания/сортировки. Вторичное ФИТЦ-меченое антитело добавляли (0,5-1 мкг) к клеткам и перемешивали перед инкубацией на льду (или при 4°C) в течение 20-40 минут. Клетки были защищены от действия света в течение всего процесса. Добавляли 2 мл холодного промывочного буфера, затем центрифугировали, и супернатант отбрасывали. Стадию промывания повторяли, и клетки повторно суспендировали в 0,5-1 мл промывочного буфера. Клетки инкубировали на льду до сортировки. Сортировку проводили как можно скорее (по крайней мере, в тот же день). Клонирование и культивирование клеток после однократной сортировки клеток проводили, как описано ниже.
[0076] Биосенсорные клетки сортировали на 96-луночных планшетах, каждая лунка которых содержала одну клетку и 100-200 мкл питательной среды для клеток. Планшеты сканировали/контролировали в течение следующих 10-14 дней, чтобы определить скорость роста и момент переноса на 24-луночный планшет. Во время сканирования использовали разную маркировку для разных условий. Некоторые лунки маркировали, если они содержали живые клетки, но не были готовы к переноса, а также маркировали загрязненные лунки. Клетки переносили на 24-луночный планшет, содержащий 1,0 мл соответствующих сред в каждой лунке. В случае загрязненных клеток промывание проводили путем переноса всей суспензии клеток из лунки в 5 мл стерильного 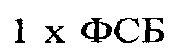 в конической пробирке 15 мл. Далее клетки центрифугировали с фактором разделения 170 в течение 10 минут, и супернатант отбрасывали. Осадок повторно суспендировали в 1,0 мл свежей среды на 24-луночном планшете для культивирования. После возобновления роста клетки переносили на 12-луночный планшет, содержащий 1,5 мл свежей среды на лунку.
в конической пробирке 15 мл. Далее клетки центрифугировали с фактором разделения 170 в течение 10 минут, и супернатант отбрасывали. Осадок повторно суспендировали в 1,0 мл свежей среды на 24-луночном планшете для культивирования. После возобновления роста клетки переносили на 12-луночный планшет, содержащий 1,5 мл свежей среды на лунку.
[0077] Для скрининга клона после роста на 12-луночном планшете подсчитывали клетки, чтобы определить, готовы ли они к нагрузке и тестированию вспышки. Во время тестирования вспышки в одной итерации участвовало 25000 клеток. Для тестирования выращивали достаточное количество клеток, а также оставляли некоторые для продолжения роста. Эта стадия отмечала первый раунд скрининга клонов. Выбранные клоны выращивали дополнительно и подвергали последующим испытаниям в зависимости от желаемых свойств. Например, для биологического ответа проводили скрининг клонов Jurkat-FcγRI-CD3ζ с помощью анти-CD3ε антител (положительный контроль) и моноклональных антител против бактерий с соответствующими бактериями, в то время как дигитонин применяли для теста на химический ответ. Скрининг клонов МС/9-Aeq проводили с применением антител против FcεRI (биологический ответ) и дигитонина (химический ответ).
[0078] Таким образом, сортировку клеток с активированной флуоресценцией (СКАФ) проводили с применением меток флуоресцентных антител для отбора и выделения клеток, которые экспрессировали высокие уровни желаемых белков, которые в этом случае были генно-модифицированными рецепторами. В результате этого процесса получали популяцию биосенсорных клеток с высокими уровнями экспрессии, что было дополнительно подтверждено тестированием вспышки с применением ФУ в тестовом устройстве. В течение всего процесса клетки подсчитывали с применением автоматического счетчика клеток, чтобы устранить ошибку, вызванную человеческим фактором, и повысить систематичность и эффективность. Различные клоны Jurkat-FcγRI-CD3ζ давали разные уровни биологического ответа при тестировании с помощью mAb против Е. coli O111 и бактерий Е. coli O111. Многие клоны были протестированы в одинаковых условиях, и дающие самый высокий ответ были сохранены в банке клонов. Аналогичным образом, результаты химического ответа, полученные при тестировании различных клонов МС/9-Aeq с применением химического вещества дигитонина, показали, что разные клоны дают разные уровни химического ответа, в зависимости от уровня экспрессии экворина. Клоны с самым высоким сигналом были сохранены в банке клонов.
Культивирование биосенсорных клеток
[0079] Различные рецептуры питательной среды применяли для различных клеточных линий с целью обеспечения оптимальных условий роста. Тучные клетки МС/9 культивировали в полной среде для тучных клеток (МДСИ - Sigma, кат. № D5796,  , 10% ФТС, 10% добавки T-Stim, 50 мкМ β-меркаптоэтанола). Т-клетки Jurkat культивировали в полных средах RPMI (RPMI-ThermoFisher, 10% ФТС,
, 10% ФТС, 10% добавки T-Stim, 50 мкМ β-меркаптоэтанола). Т-клетки Jurkat культивировали в полных средах RPMI (RPMI-ThermoFisher, 10% ФТС,  ). В .зависимости от характеристик электропорированных конструкций для селекции в клеточной культуре применяли разные антибиотики. Соответствующие антибиотики добавляли в питательную среду через 2-3 дня после электропорации для отбора клеток, которые успешно интегрировали линеаризованные конструкции ДНК. Концентрацию клеток поддерживали в диапазоне от 4,0×105 до 1,0×106 клеток/мл для оптимального роста клеток. Различные клеточные линии и клоны обрабатывали для длительного хранения, а запасы замораживали в жидком азоте следующим образом: (i) клетки центрифугировали при 150°C в течение 10 минут, и супернатант отбрасывали; (ii) осадок клеток повторно суспендировали в среде для замораживания (RPMI, 50% ФТС, 10% ДМСО) в концентрации 5,0×105 клеток/мл; и (iii) аликвоты по 1 мл помещали в криофлаконы Nunc емкостью 2 мл и замораживали при -80°C в течение 24 часов перед переносом в жидкий азот для длительного хранения.
). В .зависимости от характеристик электропорированных конструкций для селекции в клеточной культуре применяли разные антибиотики. Соответствующие антибиотики добавляли в питательную среду через 2-3 дня после электропорации для отбора клеток, которые успешно интегрировали линеаризованные конструкции ДНК. Концентрацию клеток поддерживали в диапазоне от 4,0×105 до 1,0×106 клеток/мл для оптимального роста клеток. Различные клеточные линии и клоны обрабатывали для длительного хранения, а запасы замораживали в жидком азоте следующим образом: (i) клетки центрифугировали при 150°C в течение 10 минут, и супернатант отбрасывали; (ii) осадок клеток повторно суспендировали в среде для замораживания (RPMI, 50% ФТС, 10% ДМСО) в концентрации 5,0×105 клеток/мл; и (iii) аликвоты по 1 мл помещали в криофлаконы Nunc емкостью 2 мл и замораживали при -80°C в течение 24 часов перед переносом в жидкий азот для длительного хранения.
Нагрузка биосенсорных клеток
[0080] Биосенсорные клетки по настоящему изобретению центрифугировали в конических пробирках емкостью 50 мл с фактором разделения 150 в течение 10 минут.Супернатант отбрасывали, и осадок повторно суспендировали в нагрузочной среде (RPMI, 10% обедненного антителами ФТС,  , 0,1% Pluronic F68 и 1,5 мМ коэлентеразина) при концентрации 25000 клеток / 180 мкл. Кроме того, клетки нагружали в различных концентрациях, таких как, например, 100000 клеток / 180 мкл и 400000 клеток / 180 мкл. Клетки нагружали при комнатной температуре с осторожным встряхиванием / покачиванием в течение 24-26 часов. Перед применением коммерчески доступная ФТС, обедненная антителами, может быть дополнительно очищена с применением других систем истощения антител.
, 0,1% Pluronic F68 и 1,5 мМ коэлентеразина) при концентрации 25000 клеток / 180 мкл. Кроме того, клетки нагружали в различных концентрациях, таких как, например, 100000 клеток / 180 мкл и 400000 клеток / 180 мкл. Клетки нагружали при комнатной температуре с осторожным встряхиванием / покачиванием в течение 24-26 часов. Перед применением коммерчески доступная ФТС, обедненная антителами, может быть дополнительно очищена с применением других систем истощения антител.
Повышение концентрации клеток
[0081] Было продемонстрировано, что биосенсорные клетки по настоящему изобретению более эффективно нагружаются при более низких концентрациях, а не при более высоких концентрациях. Например, было показано, что нагружающие клетки с плотностью 25000 клеток / 180 мкл против 400000 клеток / 180 мкл дают двукратное усиление обнаруживаемого сигнала. Клетки Jurkat-FcγRI-CD3ζ клона P5G7 нагружали как при концентрации 400000 клеток / 180 мкл, так и 25000 клеток / 180 мкл, и затем тестировали при концентрации 400000 клеток / 180 мкл в каждой реакции. Применяли ночную культуру бактерий Е. coli O111 с 23 нМ mAb против Е. coli O111. Биосенсорные клетки, нагруженные при более низкой концентрации, давали более высокий сигнал при том же количестве тестируемых бактериальных клеток. Плотность биосенсорных клеток в основном изменяется путем повышения концентрации клеток после нагрузки, чтобы обеспечить оптимальное обнаружение патогенов. Различные концентрации применялись для обнаружения патогенов в зависимости от целевого патогена и качества антитела, если детекторная молекула является растворимым антителом. Биосенсорные клетки концентрируют центрифугированием при 150°C в течение 10 минут, и осадок клеток повторно суспендируют в желаемом объеме тестируемой среды. Среда нагрузки дополнительно может служить тестовой средой. В некоторых случаях добавление нормальной ФТС к среде вызывало биологический ответ, приводящий к сигналу биосенсора (вспышка) из-за высокой концентрации антител в нормальной ФТС. Поэтому в процессе нагрузки использовали коммерчески доступной ФТС, обедненной антителами, который уменьшал сигнал, инициированный антителом, не устраняя его полностью. Дополнительные способы применялись для дальнейшего истощения следовых количеств антител в коммерчески доступной ФТС, обедненной антителами.
Биоанализ
[0082] В иллюстративных вариантах реализации настоящего изобретения формат биоанализа определяемого компонента устанавливается с помощью биосенсорной клетки и растворимого моноклонального антитела (mAb), которое является специфичным для этого определяемого компонента (например, патогена). В этих вариантах реализации изобретения специфичность биоанализа непосредственно связана с селективным связыванием растворимого антитела с анализируемой мишенью, а специфичность и чувствительность биосенсора определяются путем обнаружения и измерения биолюминесценции. В этом процессе биосенсорные клетки первоначально нагружают с применением светоизлучающей молекулы, коэлентеразина (КТЗ). Затем добавляют растворимое антитело по выбору и анализируемый образец. Если в образце присутствует целевой патоген, он взаимодействует с растворимым антителом, которое связывается со слитым белком, экспрессируемым биосенсорной клеткой, в конечном счете вызывая каскад сигнала, который приводит к световому испусканию из биосенсорной клетки. Испускаемый свет обнаруживается с помощью фотоумножителя (ФУ) в тестовом устройстве, а сигнал, испускаемый клеткой биосенсора, отображается как количество фотонов в секунду. Как описано ниже, были разработаны различные методы для обнаружения патогенов на основе растворимого антитела и целевого патогена. Три таких метода, подробно описанные ниже, включают: (i) мгновенное добавление детекторных молекул (например, антител); (ii) покрытие биосенсорных клеток с помощью детекторных молекул (например, антител); и (iii) покрытие определяемых компонентов (например, бактерий) антителами.
Тестовая установка
[0083] Аспект биоанализа согласно настоящему изобретению может быть выполнен в тестовом блоке или тестовом картридже, предназначенном для применения с настольной или переносной системой тестирования и устройством, описанным в заявке на выдачу патента США №13/711296 (патент США №9023640), которая включена в настоящее описание посредством качестве ссылки в полном объеме. Тестовый картридж, который может быть одноразовым изделием, принимает как образец, так и биосенсор и вводит биосенсор в тестовый картридж, смешивая образец и биосенсор предсказуемым и контролируемым образом. Тестовый картридж дополнительно содержит реакционную камеру для приема испытуемого образца и биосенсора, причем реакционная камера имеет заданную внутреннюю геометрию и дополнительно адаптирована для минимизации или устранения фоновых шумов с целью улучшения общего соотношения сигнал/шум. По меньшей мере один стабилизатор может быть расположен в реакционной камере для минимизации повреждения испытуемому образца и биосенсора силой сдвига во время процесса смешивания.
[0084] В иллюстративном варианте реализации изобретения реакционная камера и каналы для жидкости, которые ведут к реакционной камере внутри тестового картриджа, предназначены для достижения нескольких целей. Входной канал для жидкости, поступающий в реакционную камеру, включает трубчатую форму, причем диаметр трубки относительно небольшой и сужается, чтобы стать еще меньше на входе в реакционную камеру. Это увеличивает скорость поступления жидкости в реакционную камеру и способствует более интенсивному и гомогенному перемешиванию в результате объемного движения реагентов внутри реакционной камеры. Желательно смешивать реагенты и образец таким образом, чтобы способствовать смешению за пределами молекулярной диффузии и свести к минимуму продолжительность теста, при этом гарантируя, что любой инфекционный агент, присутствующий в образце, быстро встречается с биосенсором. Входной канал может быть смещен от центральной оси реакционной камеры, чтобы способствовать вращению реагентов по часовой стрелке или против часовой стрелки вокруг центральной оси тестовой камеры, поскольку текучие среды смешивают, чтобы повысить однородность смеси. Кроме того, входной канал расположен приблизительно по касательной к внутренней поверхности реакционной камеры, чтобы позволить входящей жидкости проходить от входного канала к реакционной камере, оставаясь при этом в контакте с боковой поверхностью реакционной камеры, что обеспечивает минимально турбулентный поток и минимальное попадание воздушных пузырьков в смешанные жидкости. Пузырьки нежелательны из-за непредсказуемого преломления света, которое они вызывают, когда свет, испускаемый реагентами, проходит через пузырьки внутри смешанных реагентов или на поверхности смешанных реагентов. Ось входного канала может быть наклонена выше горизонтали (например, около 30 градусов), чтобы обеспечить частично направленное вниз направление потока текучей среды и гарантировать, что реагент смешается с жидкостью, находящейся на дне реакционной камеры. Альтернативно, реагенты могут быть введены в тестовую камеру с использованием альтернативных средств доставки жидкости, таких как вертикальный канал для доставки реагентов на дно реакционной камеры или подача жидкости непосредственно на центральную ось тестовой камеры с целью создания столбика реагента, протекающего в тестовую камеру и тем самым содействия перемешиванию путем захвата.
[0085] Форма (т.е., заданная геометрия) реакционной камеры может представлять собой вращающуюся секцию, облегчающую движение смешивающихся жидкостей по часовой стрелке или против часовой стрелки вокруг центральной оси реакционной камеры. Альтернативно, при желании, может быть применена форма реакционной камеры, отличная от вращающейся секции, такая как прямоугольная или неправильная форма. В одном варианте реализации изобретения вращающаяся секция, применяемая для образования реакционной камеры, представляет собой часть эллипса для облегчения сбора рассеянного света, испускаемого реагентами и отражающего этот свет в направлении поверхности детектора, который может представлять собой фотоумножитель (ФУ) (Hamamatsu). Поверхность реакционной камеры может быть отражающей, чтобы улучшить способность эллиптической формы собирать свет. В некоторых вариантах реализации изобретения максимальный диаметр поверхности ФУ ограничен для достижения максимального соотношения сигнал/шум на выходе системы. Диаметр реакционной камеры может быть спроектирован таким образом, чтобы приблизительно соответствовать диаметру ФУ, что влияет на эллиптическую форму, которая может быть достигнута в реакционной камере, предназначенной для удерживания определенного объема текучих сред. Из-за ограниченной эллиптической формы цвет поверхности реакционной камеры может быть частично рассеивающим белым в целях дополнительного сбора света, который возникает, когда свет, который иначе не отражался бы непосредственно на поверхности ФУ, частично рассеивается белой поверхностью, и часть его направляется к поверхности ФУ. В качестве альтернативы можно использовать другие поверхности и материалы, такие как зеркальный полированный алюминий или прозрачный материал. Кроме того, желательно, чтобы материал реакционной камеры был минимально фосфоресцирующим, чтобы предотвратить испускание света из самой реакционной камеры, затмевающего испускаемый реагентами свет и препятствующее обнаружению. Было выявлено, что белые полимерные материалы, такие как акрилонитрилбутадиенстирол или другие подобные полимерные материалы, обладают низким уровнем фосфоресценции, было обнаружено, поэтому дополнительный сбор света, обеспечиваемый комбинацией отражения и диффузии света, является преимуществом с точки зрения соотношения сигнала к шуму на выходе светочувствительного контура.
[0086] В типичном варианте реализации изобретения тестовый блок представляет собой систему для применения в анализе образца. Система содержит биосенсорный реагент, причем биосенсорный реагент содержит живые биологические клетки; карту резервуара с длинной петлевой частью и короткой петлей, в которой карта резервуара хранит биосенсорный реагент; и основание тестового картриджа, и при этом основание тестового картриджа сконфигурировано для приема карты резервуара. Основание тестового картриджа дополнительно содержит: (i) реакционную камеру, имеющую центральную ось, причем реакционная камера имеет форму вращающегося полуэллипса; и (ii) входной канал, соединенный с реакционной камерой, причем входной канал расположен над реакционной камерой под углом 15-60 градусов выше горизонтали, и, при этом, входной канал смещен от центральной оси реакционной камеры, причем после введения образца, подлежащего анализу, в основание тестового картриджа через входной канал образец гомогенно смешивается с биосенсорный реагентом, сводя к минимуму повреждение живых биологических клеток.
[0087] В другом типичном варианте реализации изобретения тестовый блок обеспечивает систему для быстрого обнаружения присутствия определяемого компонента в биологическом образце. Эта система содержит биосенсорный реагент, содержащий по меньшей мере одно антитело, специфичное в отношении заданного определяемого компонента и биолюминесцентного агента, причем по меньшей мере одно антитело экспрессируется на поверхности живых генно-модифицированных лимфоцитов, и при этом биолюминесцентный агент экспрессируется живыми генно-модифицированными лимфоцитами, и, при этом биосенсорный реагент осуществляет: (i) обнаружение присутствия конкретного определяемого компонента в тестируемом образце и (ii) испускание обнаруживаемого светового сигнала, когда биосенсорный реагент реагирует с образцом и обнаруживает присутствие конкретного определяемого компонента в образце. Дополнительно включен тестовый картридж. Тестовый картридж дополнительно содержит: (i) карту резервуара, причем карта резервуара дополнительно содержит биосенсорный реагент; и (ii) основание тестового картриджа, и при этом основание тестового картриджа сконфигурировано для приема карты резервуара. Основание тестового картриджа дополнительно содержит: а) реакционную камеру, имеющую центральную ось, причем реакционная камера имеет форму вращающегося полуэллипса; b) входной канал, соединенный с реакционной камерой, причем входной канал расположен над реакционной камерой под углом 15-60 градусов выше горизонтали, и при этом входной канал смещен от центральной оси реакционной камеры; и с) при введении образца в основание тестового картриджа через входной канал образец гомогенно смешивается с биосенсорным реагентом, одновременно минимизируя повреждение живых, генно-модифицированных лимфоцитов и минимизируя любое барботирование смешанного биосенсорного реагента и образца в реакционной камере. Дополнительно включен тестовый блок, предназначенный для приема тестового картриджа. Тестовый блок содержит датчик для обнаружения обнаруживаемого светового сигнала, испускаемого биосенсорным реагентом при взаимодействии с образцом, причем обнаружение испускаемого обнаруживаемого светового сигнала указывает на присутствие определяемого компонента в образце, причем обнаружение конкретного определяемого компонента в образце происходит в реальном времени.
Пример биоанализа 1; мгновенное добавление антител
[0088] В иллюстративном варианте реализации биоанализа по настоящему изобретению, в котором детекторная молекула представляет собой растворимое антитело, растворимое антитело и исследуемый образец смешивают вместе непосредственно перед введением биосенсорных клеток в исследуемый образец. В этом варианте реализации изобретения нагруженные биосенсорные клетки центрифугируют и концентрируют, обычно до 400000 клеток / 180 мкл (подходит для однократной реакции) в нагружающей среде. Затем аликвоту нагруженных биосенсорных клеток 180 мкл (около 400000 клеток) загружают в длинную петлю карты резервуара. Для положительного контроля 30 мкл анти-CD3ε-антитела в средах RPMI загружают в короткую петлевую часть карты резервуара. Затем карту резервуар фиксируют в основании тестового картриджа. Аликвоту 2 мкл антитела (0,5 мг/мл) против целевого патогена, например, против Е. coli O111 (если целевым патогеном является Е. coli O111), смешивают с 28 мкл образца, подлежащего анализу, в смесительной камере для картриджа. Основание тестового картриджа вставляют в тестовое устройство, а нагруженные биосенсорные клетки вводят в реакционную камеру, чтобы инициировать реакцию. Результирующий сигнал регистрируют в течение 4-8 минут, и в конце периода анализа 30 мкл анти-CD3ε-антитела вводят из короткой петли резервуара в реакционную камеру в качестве положительного контроля реакции, которая регистрируется в течение 2 минут. В качестве альтернативного положительного контроля можно применять 30 мкл 0,61 мМ дигитонина, а не анти-CD3ε-антитело. Отрицательный контрольный опыт может быть выполнен с применением предварительно определенного патогена, который не является специфичным для применяемого антитела.
Пример биоанализа 2; Покрытие биосенсорных клеток антителами
[0089] В другом типичном варианте реализации биоанализа по настоящему изобретению, в котором детекторная молекула является растворимым антителом, биосенсорные клетки покрывают растворимым антителом в течение определенного периода времени перед смешиванием с образцом, который подлежит анализу с применением биосенсорных клеток. В этом варианте реализации нагруженные биосенсорные клетки центрифугируют и концентрируют, обычно до 400000 клеток / 180 мкл (подходит для однократной реакции) в нагружающей среде. Далее аликвоту 180 мкл биосенсорных клеток (около 400000 клеток) смешивают с 2 мкл антитела (0,5 мг/мл) против целевого патогена, такого как против Е. coli O111 (если целевым патогеном является Е. coli O111) в пробирке Эппендорфа. Биосенсорные клетки, смешанные с антителом, инкубируют при комнатной температуре в течение 10 минут, а затем загружают в длинную петлю карты резервуара. Для положительного контроля 30 мкл анти-CD3ε-антитела в среде RPMI загружают в часть короткой петли карты резервуара. Затем карту резервуар фиксируют в основании тестового картриджа. В реакционную камеру добавляют 30 мкл объема исследуемого образца. Основание тестового картриджа вставляют в тестовое устройство, а биосенсорные клетки инжектируют в тестовое устройство, чтобы инициировать реакцию. Результирующий сигнал регистрируют в течение 4-8 минут, и в конце тестового периода 30 мкл анти-CD3ε-антитела вводят из короткой петли резервуара в реакционную камеру в качестве положительного контроля реакции, которая регистрируется в течение 2 минут. В качестве альтернативного положительного контроля можно применять 30 мкл 0,61 мМ дигитонина, а не анти-CD3ε-антитело. Отрицательный контрольный опыт может быть выполнен с применением заранее определенного патогена, который не является специфичным для применяемого антитела.
Пример биоанализа 3; Покрытие определяемого компонента антителами
[0090] В другом типичном варианте реализации биоанализа по настоящему изобретению, в котором детекторная молекула представляет собой растворимое антитело, определяемый компонент (например, патогенные бактерии) в течение определенного периода времени покрывают растворимым антителом до смешивания с образцом, подлежащим анализу с помощью биосенсора. В этом варианте реализации изобретения нагруженные биосенсорные клетки центрифугируют и концентрируют, обычно до 400000 клеток /180 мкл (подходит для одной реакции) в нагружающей среде. Аликвоты биосенсорных клеток по 180 мкл (около 400000 клеток) загружают в длинную петлю карты резервуара. Для положительного контроля 30 мкл анти-CD3ε-антитела в среде RPMI загружают в часть короткой петли карты резервуара. Затем карту резервуара резервуара фиксируют в основании картриджа. Аликвоту 2 мкл антитела (0,5 мг/мл) против целевого патогена, такого как против Е. coli O111 (если целевым патогеном является Е. coli O111), смешивают с 28 мкл образца, подлежащего анализу, в пробирке Эппендорфа. Образец инкубируют при комнатной температуре в течение 10 минут, затем помещают в камеру для смешивания картриджа. Картридж вставляются в ФУ, и биосенсорные клетки вводят в смесительную камеру, чтобы инициировать реакцию. Результирующий сигнал регистрируют в течение 4-8 минут, и в конце тестового периода 30 мкл анти-CD3ε-антитела вводят из короткой петли резервуара в реакционную камеру в качестве реакции положительного контроля, которую регистрируются в течение 2 минут. В качестве альтернативного положительного контроля можно использовать 30 мкл 0,61 мМ дигитонина, а не анти-CD3ε-антитело. Отрицательный контрольный тест может быть выполнен с применением предварительно определенного патогена, который не является специфичным для применяемого антитела.
[0091] Иллюстративные биоанализы, описанные в настоящем документе, могут включать в себя другие добавки, которые уменьшают фоновый шум и усиливают сигнал. Было показано, что применение анти-CD3ε-антитела в качестве положительного контроля позволяет обнаружить менее 10 нагруженных биосенсорных клеток в смеси из 50000 ненагруженных биосенсорных клеток. Было продемонстрировано, что биосенсор сам по себе обнаруживает 230 КОЕ бактерий в образце 30 мкл. В описанных выше биоанализах патентованное моноклональное антитело (1F11) против бактерий Е. coli O111 применялось для обнаружения бактерий Е. coli O111, причем E.coli O157 использовали в качестве отрицательного контроля. Показано, что Е. coli O157 дают отрицательные результаты, тем самым доказывая специфичность системы. Дополнительно, многочисленные коммерчески доступные антитела могут применяться в описанном биоанализе. Что касается патентованного моноклонального антитела (1F11), то анализ антител и выбор моноклонального антитела осуществляли, как описано ниже.
[0092] Выработку антител определяли с помощью ТИФА, проводимого на 96-луночных планшетах. Каждую лунку покрывали различными ЛС (Е. coli O157, Е. coli O127, Е. coli O111, Е. coli O26, Klebsiella pnuemoniae, Salmonella enterioa и наивные сыворотки) или бактериальными клетками (Е. coli O157, Е. coli O111, Е. coli 26 и Е. coli DH5α). В лунки добавляли супернатант гибридомы от разных клонов mAb O157 или mAb O111. Для обнаружения применяли конъюгированный с пероксидазой хрена (ПХ) козий анти-мышиный IgG (Приложение ПI.A.3). Два клона гибридомы (1В10 и 6G1) Е. coli O157 распознают исключительно ЛПС Е. coli O157 и Е. coli O157. Девять гибридомных клонов Е. coli O111 специфично распознают ЛПС Е. coli O111 и Е. coli O111. Клоны с показателями максимальной оптической плотности (OD) были выбраны для валидации, которую выполняли, как описано ниже.
[0093] Гранулы клеток гибридомы собирали и хранили при -80°С перед экстракцией РНК. Выделенную РНК использовали в качестве матрицы для обратной транскрипции кДНК с последующей вложенной ПЦР-амплификацией. Все положительные продукты ПЦР были клонированы в векторы клонирования ТА и отправлены на секвенирование. После анализа последовательностей определяли вариабельные области легкой цепи и тяжелой цепи. Четыре одноцепочечных антитела (scFv) О157 (1В10) (индивидуальный mAb, продуцируемый ПСР) и АТСС НВ 10452, а также два одноцепочечных антитела 0111, продуцируемых ПСП (1F11 и 1F2), рекомбинантно экспрессировали и очищали аффинной хроматографией с иммобилизированными ионами металлов (АХИМ). Последовательность scFv была построена следующим образом: сигнал секреции pel В + аминокислота Аланин + Гистидиновая метка + аминокислоты Глицин-Серин-Серин-Глицин + сайт расщепления ВГТ + аминокислоты Глицин-Серин-Серин-Глицин + вариабельный участок тяжелой цепи + линкерный участок Серин-Аланин-Аспарагиновая кислота-Аспарагиновая кислота-Аланин-Лизин-Лизин-Аспарагиновая кислота-Аланин-Аланин-Лизин-Лизин-Аспарагиновая кислота-Аспарагиновая кислота-Аланин-Лизин-Лизин-Аспарагиновая кислота-Аспарагиновая кислота + вариабельный участок легкой цепи. Очищенные scFv анализировали с применением многослойных планшетов, покрытых ЛПС O157 или O111.
[0094] Целью настоящего исследования было изучить взаимодействие моноклинального антитела (mAb) с цельными бактериальными клетками (Е. coli O157 или Е. coli O111) и оценить кинетическую константу (KD) взаимодействия антитело-бактерия. В этих анализах применяли козье поликлональное антитело против Е. coli O157, козье поликлональное антитело против Е. coli O111, три моноклональных антитела (1022, 1024 и 1061) против Е. coli O157 и одно моноклональное антитело против Е. coli O111. Кроме того, применяли сенсорный чип СМ5 и набор для аминного сочетания. Все анализы проводили на приборе Biacore X100. В протоколе одно поликлональное антитело (против выбранных бактерий) было иммобилизировано на сенсорном чипе СМ5. Затем осуществляли связывание с выбранными бактериями, с последующей инъекцией моноклонального антитела против тех же бактерий в непрерывном потоке буферного раствора. Мониторинг взаимодействия осуществляли в режиме реального времени. Относительное связывание антитела с каждой бактерией регистрировали в резонансных единицах (РЕ). Результаты анализа методом BIAcore связывания специфичного антитела против Е. coli O157 (mAb FF754) с Е. coli O157 и Е. coli O111 продемонстрировали, что mAb O157 специфично в отношении своего целевого антигена.
[0095] Хотя настоящее изобретение было проиллюстрировано путем описания типичных вариантов его реализации, и хотя варианты реализации изобретения были описаны с определенной степенью детальности, они не предназначены для ограничения каким-либо образом объема прилагаемой формулы изобретения указанными деталями. Специалистам в данной области техники будут доступны дополнительные преимущества и модификации. Следовательно, изобретение в его более широких аспектах не ограничивается какими-либо конкретными деталями, типичными устройствами и способами и/или иллюстративными примерами, показанными и описанными. Соответственно, отклонения от таких деталей могут быть сделаны без выхода за пределы общей концепции изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Fundamental Solutions Corporation
Zupancic, Thomas J.
Zeng, Lingchun
Vedamoorthy, Srikanth
Lwande, Joel S.
Joseph, Kittle D.
<120> Биосенсорная система для быстрого обнаружения определяемых компонентов
<130> 35044-0006
<160> 19
<170> PatentIn версия 3.5
<210> 1
<211> 1929
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: BBP-IgM
<220>
<221> КДП
<222> (1)..(1929)
<400> 1
atg gtg ctg cag acg caa gtg ttt atc tcc ctg ctg ctc tgg atc agc 48
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
gga gcg tac ggc act tac aag ctg gtg atc aac ggt aaa acc ttg aag 96
Gly Ala Tyr Gly Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu Lys
20 25 30
ggt gag acc acc act gag gca gtc gac gcc gcc act gcc gag aag gtc 144
Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys Val
35 40 45
ttt aaa cag tat gcc aat gat aac ggc gtg gac ggc gag tgg acc tac 192
Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr Tyr
50 55 60
gat gac gcc act aag aca ttc act gtg act gaa aag ccc gag gtg att 240
Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val Ile
65 70 75 80
gac gcg tcc gaa ttg aca cct gcg gtg acc acc tac aaa ctg gtt atc 288
Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val Ile
85 90 95
aac ggc aag act ctg aag ggc gag acc acc aca gag gca gtc gat gcc 336
Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala
100 105 110
gcc acc gcc gag aag gtc ttc aag caa tat gcc aac gac aac ggg gtg 384
Ala Thr Ala Glu Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val
115 120 125
gac ggg gag tgg acc tac gat gat gcc acc aag acc ttc acc gtg acc 432
Asp Gly Glu Trp Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr
130 135 140
gag aag ccc gaa gtg atc gat gcg agt gaa ctg act ccc gcc gtg aca 480
Glu Lys Pro Glu Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr
145 150 155 160
ggt tct gct tct ggt tct ggt ggt tca gca tca gca cca act ttg ttt 528
Gly Ser Ala Ser Gly Ser Gly Gly Ser Ala Ser Ala Pro Thr Leu Phe
165 170 175
cca ctt gtc tca tgt gag aac tcg cca tcg gat acc tcg agc gta gcg 576
Pro Leu Val Ser Cys Glu Asn Ser Pro Ser Asp Thr Ser Ser Val Ala
180 185 190
gtc gga tgt ctc gct caa gac ttt ctt ccg gac agc atc acg ttt tca 624
Val Gly Cys Leu Ala Gln Asp Phe Leu Pro Asp Ser Ile Thr Phe Ser
195 200 205
tgg aag tat aag aac aat tcg gat att tcg agc acg cga gga ttt ccc 672
Trp Lys Tyr Lys Asn Asn Ser Asp Ile Ser Ser Thr Arg Gly Phe Pro
210 215 220
agc gta ttg aga ggg gga aag tac gcg gca aca agc cag gtg ctg ctc 720
Ser Val Leu Arg Gly Gly Lys Tyr Ala Ala Thr Ser Gln Val Leu Leu
225 230 235 240
cca agc aag gat gtg atg cag ggc act gac gag cat gta gta tgc aag 768
Pro Ser Lys Asp Val Met Gln Gly Thr Asp Glu His Val Val Cys Lys
245 250 255
gta cag cac ccc aat gga aac aag gaa aag aat gtc cct ctg cct gta 816
Val Gln His Pro Asn Gly Asn Lys Glu Lys Asn Val Pro Leu Pro Val
260 265 270
att gcc gag ctc cct cct aaa gtg tca gtg ttc gtg ccg ccc aga gat 864
Ile Ala Glu Leu Pro Pro Lys Val Ser Val Phe Val Pro Pro Arg Asp
275 280 285
ggg ttc ttt gga aac ccg cga tcg aag tcg aaa ctg atc tgc cag gcc 912
Gly Phe Phe Gly Asn Pro Arg Ser Lys Ser Lys Leu Ile Cys Gln Ala
290 295 300
acg gga ttc agc cct cgg cag att caa gtg tcg tgg ttg cgg gag gga 960
Thr Gly Phe Ser Pro Arg Gln Ile Gln Val Ser Trp Leu Arg Glu Gly
305 310 315 320
aaa cag gtg gga tcg ggg gtg acc aca gac cag gtg cag gcg gag gct 1008
Lys Gln Val Gly Ser Gly Val Thr Thr Asp Gln Val Gln Ala Glu Ala
325 330 335
aaa gaa agc ggt ccc acc aca tat aag gtc act tcc acc ctt act att 1056
Lys Glu Ser Gly Pro Thr Thr Tyr Lys Val Thr Ser Thr Leu Thr Ile
340 345 350
aag gaa tcg gat tgg ttg tca cag tcg atg ttc aca tgt aga gtc gat 1104
Lys Glu Ser Asp Trp Leu Ser Gln Ser Met Phe Thr Cys Arg Val Asp
355 360 365
cat cgc gga ctc acg ttt caa cag aac gcg tca tca atg tgt gta ccc 1152
His Arg Gly Leu Thr Phe Gln Gln Asn Ala Ser Ser Met Cys Val Pro
370 375 380
gat caa gat acg gcg atc aga gta ttc gcc att ccg cct agc ttc gca 1200
Asp Gln Asp Thr Ala Ile Arg Val Phe Ala Ile Pro Pro Ser Phe Ala
385 390 395 400
tcc att ttt ctc acc aaa agc aca aag ctg aca tgt ctt gtg aca gac 1248
Ser Ile Phe Leu Thr Lys Ser Thr Lys Leu Thr Cys Leu Val Thr Asp
405 410 415
ctc aca acg tac gat tca gtc aca att tca tgg acc agg cag aat ggg 1296
Leu Thr Thr Tyr Asp Ser Val Thr Ile Ser Trp Thr Arg Gln Asn Gly
420 425 430
gag gcg gta aag acg cac acc aac att tcg gaa agc cat ccc aac gcc 1344
Glu Ala Val Lys Thr His Thr Asn Ile Ser Glu Ser His Pro Asn Ala
435 440 445
acg ttt tcg gcg gtc ggg gag gca tcg att tgt gag gac gat tgg aat 1392
Thr Phe Ser Ala Val Gly Glu Ala Ser Ile Cys Glu Asp Asp Trp Asn
450 455 460
tca ggg gag cgc ttc aca tgc acg gtc act cac acg gat ctc cca tcc 1440
Ser Gly Glu Arg Phe Thr Cys Thr Val Thr His Thr Asp Leu Pro Ser
465 470 475 480
ccg ttg aag cag aca atc tcg cga ccc aaa ggt gtc gca ctg cac agg 1488
Pro Leu Lys Gln Thr Ile Ser Arg Pro Lys Gly Val Ala Leu His Arg
485 490 495
ccc gac gtc tac ctc ctg cct cct gcc agg gaa cag ctc aac ctc cgg 1536
Pro Asp Val Tyr Leu Leu Pro Pro Ala Arg Glu Gln Leu Asn Leu Arg
500 505 510
gaa tca gca acg atc acg tgt ctt gta acc ggg ttt tca ccg gct gac 1584
Glu Ser Ala Thr Ile Thr Cys Leu Val Thr Gly Phe Ser Pro Ala Asp
515 520 525
gtc ttt gtc caa tgg atg cag cgg gga caa ccc ttg tca cca gag aag 1632
Val Phe Val Gln Trp Met Gln Arg Gly Gln Pro Leu Ser Pro Glu Lys
530 535 540
tat gtg aca tca gcg ccc atg ccc gag cca cag gct ccg ggt agg tat 1680
Tyr Val Thr Ser Ala Pro Met Pro Glu Pro Gln Ala Pro Gly Arg Tyr
545 550 555 560
ttt gcc cat tcc atc ctc act gtg tcc gag gaa gag tgg aac acc ggc 1728
Phe Ala His Ser Ile Leu Thr Val Ser Glu Glu Glu Trp Asn Thr Gly
565 570 575
gaa acg tac acg tgc gtc gta gca cac gaa gcg ttg ccc aat aga gtg 1776
Glu Thr Tyr Thr Cys Val Val Ala His Glu Ala Leu Pro Asn Arg Val
580 585 590
act gag aga act gta gat aag tcc act gag ggc gaa gta agc gcg gat 1824
Thr Glu Arg Thr Val Asp Lys Ser Thr Glu Gly Glu Val Ser Ala Asp
595 600 605
gaa gaa ggt ttc gaa aac ttg tgg gct aca gcg agc acg ttt atc gtg 1872
Glu Glu Gly Phe Glu Asn Leu Trp Ala Thr Ala Ser Thr Phe Ile Val
610 615 620
ttg ttc ttg ctt tca ctc ttc tac tcc aca act gta acc ctg ttc aag 1920
Leu Phe Leu Leu Ser Leu Phe Tyr Ser Thr Thr Val Thr Leu Phe Lys
625 630 635 640
gtc aag tag 1929
Val Lys
<210> 2
<211> 642
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu Lys
20 25 30
Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys Val
35 40 45
Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr Tyr
50 55 60
Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val Ile
65 70 75 80
Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val Ile
85 90 95
Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala
100 105 110
Ala Thr Ala Glu Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val
115 120 125
Asp Gly Glu Trp Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr
130 135 140
Glu Lys Pro Glu Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr
145 150 155 160
Gly Ser Ala Ser Gly Ser Gly Gly Ser Ala Ser Ala Pro Thr Leu Phe
165 170 175
Pro Leu Val Ser Cys Glu Asn Ser Pro Ser Asp Thr Ser Ser Val Ala
180 185 190
Val Gly Cys Leu Ala Gln Asp Phe Leu Pro Asp Ser Ile Thr Phe Ser
195 200 205
Trp Lys Tyr Lys Asn Asn Ser Asp Ile Ser Ser Thr Arg Gly Phe Pro
210 215 220
Ser Val Leu Arg Gly Gly Lys Tyr Ala Ala Thr Ser Gln Val Leu Leu
225 230 235 240
Pro Ser Lys Asp Val Met Gln Gly Thr Asp Glu His Val Val Cys Lys
245 250 255
Val Gln His Pro Asn Gly Asn Lys Glu Lys Asn Val Pro Leu Pro Val
260 265 270
Ile Ala Glu Leu Pro Pro Lys Val Ser Val Phe Val Pro Pro Arg Asp
275 280 285
Gly Phe Phe Gly Asn Pro Arg Ser Lys Ser Lys Leu Ile Cys Gln Ala
290 295 300
Thr Gly Phe Ser Pro Arg Gln Ile Gln Val Ser Trp Leu Arg Glu Gly
305 310 315 320
Lys Gln Val Gly Ser Gly Val Thr Thr Asp Gln Val Gln Ala Glu Ala
325 330 335
Lys Glu Ser Gly Pro Thr Thr Tyr Lys Val Thr Ser Thr Leu Thr Ile
340 345 350
Lys Glu Ser Asp Trp Leu Ser Gln Ser Met Phe Thr Cys Arg Val Asp
355 360 365
His Arg Gly Leu Thr Phe Gln Gln Asn Ala Ser Ser Met Cys Val Pro
370 375 380
Asp Gln Asp Thr Ala Ile Arg Val Phe Ala Ile Pro Pro Ser Phe Ala
385 390 395 400
Ser Ile Phe Leu Thr Lys Ser Thr Lys Leu Thr Cys Leu Val Thr Asp
405 410 415
Leu Thr Thr Tyr Asp Ser Val Thr Ile Ser Trp Thr Arg Gln Asn Gly
420 425 430
Glu Ala Val Lys Thr His Thr Asn Ile Ser Glu Ser His Pro Asn Ala
435 440 445
Thr Phe Ser Ala Val Gly Glu Ala Ser Ile Cys Glu Asp Asp Trp Asn
450 455 460
Ser Gly Glu Arg Phe Thr Cys Thr Val Thr His Thr Asp Leu Pro Ser
465 470 475 480
Pro Leu Lys Gln Thr Ile Ser Arg Pro Lys Gly Val Ala Leu His Arg
485 490 495
Pro Asp Val Tyr Leu Leu Pro Pro Ala Arg Glu Gln Leu Asn Leu Arg
500 505 510
Glu Ser Ala Thr Ile Thr Cys Leu Val Thr Gly Phe Ser Pro Ala Asp
515 520 525
Val Phe Val Gln Trp Met Gln Arg Gly Gln Pro Leu Ser Pro Glu Lys
530 535 540
Tyr Val Thr Ser Ala Pro Met Pro Glu Pro Gln Ala Pro Gly Arg Tyr
545 550 555 560
Phe Ala His Ser Ile Leu Thr Val Ser Glu Glu Glu Trp Asn Thr Gly
565 570 575
Glu Thr Tyr Thr Cys Val Val Ala His Glu Ala Leu Pro Asn Arg Val
580 585 590
Thr Glu Arg Thr Val Asp Lys Ser Thr Glu Gly Glu Val Ser Ala Asp
595 600 605
Glu Glu Gly Phe Glu Asn Leu Trp Ala Thr Ala Ser Thr Phe Ile Val
610 615 620
Leu Phe Leu Leu Ser Leu Phe Tyr Ser Thr Thr Val Thr Leu Phe Lys
625 630 635 640
Val Lys
<210> 3
<211> 1884
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: BBP-IgAB
<220>
<221> КДП
<222> (1)..(1884)
<400> 3
atg ccg ggt gga ccc gga gtg ctc cag gca ttg cct gca acc atc ttc 48
Met Pro Gly Gly Pro Gly Val Leu Gln Ala Leu Pro Ala Thr Ile Phe
1 5 10 15
ctg ctg ttc ttg ttg tcc gcc gtc tac ctt gga cct ggt tgc cag gca 96
Leu Leu Phe Leu Leu Ser Ala Val Tyr Leu Gly Pro Gly Cys Gln Ala
20 25 30
act tac aag ctg gtg atc aac ggt aaa acc ttg aag ggt gag acc acc 144
Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr
35 40 45
act gag gca gtc gac gcc gcc act gcc gag aag gtc ttt aaa cag tat 192
Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys Val Phe Lys Gln Tyr
50 55 60
gcc aat gat aac ggc gtg gac ggc gag tgg acc tac gat gac gcc act 240
Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr Tyr Asp Asp Ala Thr
65 70 75 80
aag aca ttc act gtg act gaa aag ccc gag gtg att gac gcg tcc gaa 288
Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val Ile Asp Ala Ser Glu
85 90 95
ttg aca cct gcg gtg acc acc tac aaa ctg gtt atc aac ggc aag act 336
Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr
100 105 110
ctg aag ggc gag acc acc aca gag gca gtc gat gcc gcc acc gcc gag 384
Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu
115 120 125
aag gtc ttc aag caa tat gcc aac gac aac ggg gtg gac ggg gag tgg 432
Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp
130 135 140
acc tac gat gat gcc acc aag acc ttc acc gtg acc gag aag ccc gaa 480
Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu
145 150 155 160
gtg atc gat gcg agt gaa ctg act ccc gcc gtg aca ggt tct gct tcg 528
Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Gly Ser Ala Ser
165 170 175
ggc tca gga ctg tgg atg cat aag gtg cct gca tcg ctc atg gtg agc 576
Gly Ser Gly Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser
180 185 190
ctg ggc gaa gat gca cat ttt cag tgt ccc cat aac agc tcc aac aac 624
Leu Gly Glu Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn Asn
195 200 205
gcg aac gtg acc tgg tgg cgg gtg ctc cat ggc aat tac acc tgg ccg 672
Ala Asn Val Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp Pro
210 215 220
cct gaa ttt ctc gga ccg gga gag gac ccg aat ggg acc ctt atc atc 720
Pro Glu Phe Leu Gly Pro Gly Glu Asp Pro Asn Gly Thr Leu Ile Ile
225 230 235 240
cag aac gtg aat aag tcc cac gga gga atc tac gtc tgc cgc gtg caa 768
Gln Asn Val Asn Lys Ser His Gly Gly Ile Tyr Val Cys Arg Val Gln
245 250 255
gag gga aat gag agc tac caa cag tca tgc gga acg tac ctc cgc gtc 816
Glu Gly Asn Glu Ser Tyr Gln Gln Ser Cys Gly Thr Tyr Leu Arg Val
260 265 270
cgg cag cca cca ccg agg ccg ttc ctc gat atg gga gag gga act aag 864
Arg Gln Pro Pro Pro Arg Pro Phe Leu Asp Met Gly Glu Gly Thr Lys
275 280 285
aac cgg atc att acc gcc gaa ggc atc atc ctc ctc ttc tgc gcc gtc 912
Asn Arg Ile Ile Thr Ala Glu Gly Ile Ile Leu Leu Phe Cys Ala Val
290 295 300
gtg ccg ggg act ctg ctt ctg ttc cgg aaa agg tgg caa aac gaa aag 960
Val Pro Gly Thr Leu Leu Leu Phe Arg Lys Arg Trp Gln Asn Glu Lys
305 310 315 320
ctg ggt ctg gac gct ggg gac gaa tac gag gat gaa aac ttg tac gag 1008
Leu Gly Leu Asp Ala Gly Asp Glu Tyr Glu Asp Glu Asn Leu Tyr Glu
325 330 335
ggc ctg aat ctg gac gat tgc tcg atg tat gag gac att agc aga gga 1056
Gly Leu Asn Leu Asp Asp Cys Ser Met Tyr Glu Asp Ile Ser Arg Gly
340 345 350
ctg cag ggt acc tac caa gac gtg gga agc ctg aac atc ggg gat gtg 1104
Leu Gln Gly Thr Tyr Gln Asp Val Gly Ser Leu Asn Ile Gly Asp Val
355 360 365
cag ctc gag aaa cca agg aaa aga aga gct agc gaa gga cgc gga tca 1152
Gln Leu Glu Lys Pro Arg Lys Arg Arg Ala Ser Glu Gly Arg Gly Ser
370 375 380
ctg ctt act tgc ggc gat gtc gaa gaa aat ccc gga cca atg gcc aga 1200
Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Met Ala Arg
385 390 395 400
ttg gcg ctg tcg ccg gtc cct tcg cac tgg atg gtg gcc ctg ctg ctc 1248
Leu Ala Leu Ser Pro Val Pro Ser His Trp Met Val Ala Leu Leu Leu
405 410 415
ttg ctt tcg gcg gct gag ccg gtg cca gcg gct aga tcg gag gac cgc 1296
Leu Leu Ser Ala Ala Glu Pro Val Pro Ala Ala Arg Ser Glu Asp Arg
420 425 430
tac aga aat ccg aag ggt tcc gct tgc tca cgc atc tgg caa tca cca 1344
Tyr Arg Asn Pro Lys Gly Ser Ala Cys Ser Arg Ile Trp Gln Ser Pro
435 440 445
cgc ttc atc gcg cgc aaa cgc ggc ttc act gtc aag atg cac tgc tat 1392
Arg Phe Ile Ala Arg Lys Arg Gly Phe Thr Val Lys Met His Cys Tyr
450 455 460
atg aac tcg gcc agc ggg aat gtg tcg tgg ctg tgg aag cag gaa atg 1440
Met Asn Ser Ala Ser Gly Asn Val Ser Trp Leu Trp Lys Gln Glu Met
465 470 475 480
gac gag aat ccg cag caa ctg aaa ctg gag aag ggc cgg atg gaa gaa 1488
Asp Glu Asn Pro Gln Gln Leu Lys Leu Glu Lys Gly Arg Met Glu Glu
485 490 495
tcc cag aat gag tcg ctg gcc acc ctt act atc caa ggt atc cgg ttt 1536
Ser Gln Asn Glu Ser Leu Ala Thr Leu Thr Ile Gln Gly Ile Arg Phe
500 505 510
gaa gat aac ggg atc tac ttc tgt caa cag aag tgt aac aac act tca 1584
Glu Asp Asn Gly Ile Tyr Phe Cys Gln Gln Lys Cys Asn Asn Thr Ser
515 520 525
gag gtg tac cag gga tgc ggc acc gaa ctc cgc gtc atg gga ttc tcc 1632
Glu Val Tyr Gln Gly Cys Gly Thr Glu Leu Arg Val Met Gly Phe Ser
530 535 540
acc ctc gcc caa ctg aag cag cgc aac acg ctg aag gac ggc atc att 1680
Thr Leu Ala Gln Leu Lys Gln Arg Asn Thr Leu Lys Asp Gly Ile Ile
545 550 555 560
atg atc cag acc ctg ctg atc atc ctg ttc atc att gtg ccg atc ttt 1728
Met Ile Gln Thr Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe
565 570 575
ctg ctc ttg gat aag gac gac tcg aaa gcc gga atg gaa gag gac cac 1776
Leu Leu Leu Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp His
580 585 590
acg tac gaa ggt ctg gac atc gac caa act gcg act tac gag gac att 1824
Thr Tyr Glu Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile
595 600 605
gtg acc ctc cgg act ggc gaa gtc aag tgg tcc gtg ggt gaa cac cct 1872
Val Thr Leu Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His Pro
610 615 620
gga cag gaa tag 1884
Gly Gln Glu
625
<210> 4
<211> 627
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Met Pro Gly Gly Pro Gly Val Leu Gln Ala Leu Pro Ala Thr Ile Phe
1 5 10 15
Leu Leu Phe Leu Leu Ser Ala Val Tyr Leu Gly Pro Gly Cys Gln Ala
20 25 30
Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr
35 40 45
Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys Val Phe Lys Gln Tyr
50 55 60
Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr Tyr Asp Asp Ala Thr
65 70 75 80
Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val Ile Asp Ala Ser Glu
85 90 95
Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr
100 105 110
Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu
115 120 125
Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp
130 135 140
Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu
145 150 155 160
Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Gly Ser Ala Ser
165 170 175
Gly Ser Gly Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser
180 185 190
Leu Gly Glu Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn Asn
195 200 205
Ala Asn Val Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp Pro
210 215 220
Pro Glu Phe Leu Gly Pro Gly Glu Asp Pro Asn Gly Thr Leu Ile Ile
225 230 235 240
Gln Asn Val Asn Lys Ser His Gly Gly Ile Tyr Val Cys Arg Val Gln
245 250 255
Glu Gly Asn Glu Ser Tyr Gln Gln Ser Cys Gly Thr Tyr Leu Arg Val
260 265 270
Arg Gln Pro Pro Pro Arg Pro Phe Leu Asp Met Gly Glu Gly Thr Lys
275 280 285
Asn Arg Ile Ile Thr Ala Glu Gly Ile Ile Leu Leu Phe Cys Ala Val
290 295 300
Val Pro Gly Thr Leu Leu Leu Phe Arg Lys Arg Trp Gln Asn Glu Lys
305 310 315 320
Leu Gly Leu Asp Ala Gly Asp Glu Tyr Glu Asp Glu Asn Leu Tyr Glu
325 330 335
Gly Leu Asn Leu Asp Asp Cys Ser Met Tyr Glu Asp Ile Ser Arg Gly
340 345 350
Leu Gln Gly Thr Tyr Gln Asp Val Gly Ser Leu Asn Ile Gly Asp Val
355 360 365
Gln Leu Glu Lys Pro Arg Lys Arg Arg Ala Ser Glu Gly Arg Gly Ser
370 375 380
Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Met Ala Arg
385 390 395 400
Leu Ala Leu Ser Pro Val Pro Ser His Trp Met Val Ala Leu Leu Leu
405 410 415
Leu Leu Ser Ala Ala Glu Pro Val Pro Ala Ala Arg Ser Glu Asp Arg
420 425 430
Tyr Arg Asn Pro Lys Gly Ser Ala Cys Ser Arg Ile Trp Gln Ser Pro
435 440 445
Arg Phe Ile Ala Arg Lys Arg Gly Phe Thr Val Lys Met His Cys Tyr
450 455 460
Met Asn Ser Ala Ser Gly Asn Val Ser Trp Leu Trp Lys Gln Glu Met
465 470 475 480
Asp Glu Asn Pro Gln Gln Leu Lys Leu Glu Lys Gly Arg Met Glu Glu
485 490 495
Ser Gln Asn Glu Ser Leu Ala Thr Leu Thr Ile Gln Gly Ile Arg Phe
500 505 510
Glu Asp Asn Gly Ile Tyr Phe Cys Gln Gln Lys Cys Asn Asn Thr Ser
515 520 525
Glu Val Tyr Gln Gly Cys Gly Thr Glu Leu Arg Val Met Gly Phe Ser
530 535 540
Thr Leu Ala Gln Leu Lys Gln Arg Asn Thr Leu Lys Asp Gly Ile Ile
545 550 555 560
Met Ile Gln Thr Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe
565 570 575
Leu Leu Leu Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp His
580 585 590
Thr Tyr Glu Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile
595 600 605
Val Thr Leu Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His Pro
610 615 620
Gly Gln Glu
625
<210> 5
<211> 936
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: BBP-CD3Z
<220>
<221> КДП
<222> (1)..(936)
<400> 5
atg aag tgg aag gcg ctt ttc acc gcg gcc atc ctg cag gca cag ttg 48
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
ccg att aca gag gca act tac aag ctg gtg atc aac ggt aaa acc ttg 96
Pro Ile Thr Glu Ala Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu
20 25 30
aag ggt gag acc acc act gag gca gtc gac gcc gcc act gcc gag aag 144
Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys
35 40 45
gtc ttt aaa cag tat gcc aat gat aac ggc gtg gac ggc gag tgg acc 192
Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr
50 55 60
tac gat gac gcc act aag aca ttc act gtg act gaa aag ccc gag gtg 240
Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val
65 70 75 80
att gac gcg tcc gaa ttg aca cct gcg gtg acc acc tac aaa ctg gtt 288
Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val
85 90 95
atc aac ggc aag act ctg aag ggc gag acc acc aca gag gca gtc gat 336
Ile Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp
100 105 110
gcc gcc acc gcc gag aag gtc ttc aag caa tat gcc aac gac aac ggg 384
Ala Ala Thr Ala Glu Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly
115 120 125
gtg gac ggg gag tgg acc tac gat gat gcc acc aag acc ttc acc gtg 432
Val Asp Gly Glu Trp Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val
130 135 140
acc gag aag ccc gaa gtg atc gat gcg agt gaa ctg act ccc gcc gtg 480
Thr Glu Lys Pro Glu Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val
145 150 155 160
aca ggt tct gct tct ggt tct ggt cag agc ttt ggc ctg ctg gat ccc 528
Thr Gly Ser Ala Ser Gly Ser Gly Gln Ser Phe Gly Leu Leu Asp Pro
165 170 175
aaa ctc tgc tac ctg ctg gat gga atc ctc ttc atc tat ggt gtc att 576
Lys Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile
180 185 190
ctc act gcc ttg ttc ctg aga gtg aag ttc agc agg agc gca gac gcc 624
Leu Thr Ala Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
195 200 205
ccc gcg tac cag cag ggc cag aac cag ctc tat aac gag ctc aat cta 672
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
210 215 220
gga cga aga gag gag tac gat gtt ttg gac aag aga cgt ggc cgg gac 720
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
225 230 235 240
cct gag atg ggg gga aag ccg cag aga agg aag aac cct cag gaa ggc 768
Pro Glu Met Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly
245 250 255
ctg tac aat gaa ctg cag aaa gat aag atg gcg gag gcc tac agt gag 816
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
260 265 270
att ggg atg aaa ggc gag cgc cgg agg ggc aag ggg cac gat ggc ctt 864
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
275 280 285
tac cag ggt ctc agt aca gcc acc aag gac acc tac gac gcc ctt cac 912
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
290 295 300
atg cag gcc ctg ccc cct cgc taa 936
Met Gln Ala Leu Pro Pro Arg
305 310
<210> 6
<211> 311
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu
20 25 30
Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys
35 40 45
Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr
50 55 60
Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val
65 70 75 80
Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val
85 90 95
Ile Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp
100 105 110
Ala Ala Thr Ala Glu Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly
115 120 125
Val Asp Gly Glu Trp Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val
130 135 140
Thr Glu Lys Pro Glu Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val
145 150 155 160
Thr Gly Ser Ala Ser Gly Ser Gly Gln Ser Phe Gly Leu Leu Asp Pro
165 170 175
Lys Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile
180 185 190
Leu Thr Ala Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
195 200 205
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
210 215 220
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
225 230 235 240
Pro Glu Met Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly
245 250 255
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
260 265 270
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
275 280 285
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
290 295 300
Met Gln Ala Leu Pro Pro Arg
305 310
<210> 7
<211> 2340
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: FcгаммаR1-IgM
<220>
<221> КДП
<222> (1)..(2340)
<400> 7
atg att ctt acc agc ttt gga gat gac atg tgg ctt cta aca act ctg 48
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
cta ctt tgg gtt cca gtc ggt ggg gaa gtg gtt aat gcc acc aag gct 96
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
gtg atc acc ttg cag cct cca tgg gtc agt att ttc cag aag gaa aat 144
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
gtc act tta tgg tgt gag ggg cct cac ctg cct gga gac agt tcc aca 192
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
caa tgg ttt atc aac gga aca gcc gtt cag atc tcc acg cct agt tat 240
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
agc atc cca gag gcc agt ttt cag gac agt ggc gaa tac agg tgt cag 288
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
ata ggt tcc tca atg cca agt gac cct gtg cag ttg caa atc cac aat 336
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
gat tgg ctg cta ctc cag gcc tcc cgc aga gtc ctc aca gaa gga gaa 384
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
ccc ctg gcc ttg agg tgt cac gga tgg aag aat aaa ctg gtg tac aat 432
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
gtg gtt ttc tat aga aat gga aaa tcc ttt cag ttt tct tca gat tcg 480
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
gag gtc gcc att ctg aaa acc aac ctg agt cac agc ggc atc tac cac 528
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
tgc tca ggc acg gga aga cac cgc tac aca tct gca gga gtg tcc atc 576
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
acg gtg aaa gag ctg ttt acc acg cca gtg ctg aga gca tcc gtg tca 624
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
tct ccc ttc ccg gag ggg agt ctg gtc acc ctg aac tgt gag acg aat 672
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
ttg ctc ctg cag aga ccc ggc tta cag ctt cac ttc tcc ttc tac gtg 720
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
ggc agc aag atc ctg gag tac agg aac aca tcc tca gag tac cat ata 768
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
gca agg gcg gaa aga gaa gat gct gga ttc tac tgg tgt gag gta gcc 816
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
acg gag gac agc agt gtc ctt aag cgc agc cct gag ttg gag ctc caa 864
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
gtg ctt ggt ccc cag tca tca gct cct ggt tct gct tct ggt tct ggt 912
Val Leu Gly Pro Gln Ser Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly
290 295 300
ggt tca gca tca gca cca act ttg ttt cca ctt gtc tca tgt gag aac 960
Gly Ser Ala Ser Ala Pro Thr Leu Phe Pro Leu Val Ser Cys Glu Asn
305 310 315 320
tcg cca tcg gat acc tcg agc gta gcg gtc gga tgt ctc gct caa gac 1008
Ser Pro Ser Asp Thr Ser Ser Val Ala Val Gly Cys Leu Ala Gln Asp
325 330 335
ttt ctt ccg gac agc atc acg ttt tca tgg aag tat aag aac aat tcg 1056
Phe Leu Pro Asp Ser Ile Thr Phe Ser Trp Lys Tyr Lys Asn Asn Ser
340 345 350
gat att tcg agc acg cga gga ttt ccc agc gta ttg aga ggg gga aag 1104
Asp Ile Ser Ser Thr Arg Gly Phe Pro Ser Val Leu Arg Gly Gly Lys
355 360 365
tac gcg gca aca agc cag gtg ctg ctc cca agc aag gat gtg atg cag 1152
Tyr Ala Ala Thr Ser Gln Val Leu Leu Pro Ser Lys Asp Val Met Gln
370 375 380
ggc act gac gag cat gta gta tgc aag gta cag cac ccc aat gga aac 1200
Gly Thr Asp Glu His Val Val Cys Lys Val Gln His Pro Asn Gly Asn
385 390 395 400
aag gaa aag aat gtc cct ctg cct gta att gcc gag ctc cct cct aaa 1248
Lys Glu Lys Asn Val Pro Leu Pro Val Ile Ala Glu Leu Pro Pro Lys
405 410 415
gtg tca gtg ttc gtg ccg ccc aga gat ggg ttc ttt gga aac ccg cga 1296
Val Ser Val Phe Val Pro Pro Arg Asp Gly Phe Phe Gly Asn Pro Arg
420 425 430
tcg aag tcg aaa ctg atc tgc cag gcc acg gga ttc agc cct cgg cag 1344
Ser Lys Ser Lys Leu Ile Cys Gln Ala Thr Gly Phe Ser Pro Arg Gln
435 440 445
att caa gtg tcg tgg ttg cgg gag gga aaa cag gtg gga tcg ggg gtg 1392
Ile Gln Val Ser Trp Leu Arg Glu Gly Lys Gln Val Gly Ser Gly Val
450 455 460
acc aca gac cag gtg cag gcg gag gct aaa gaa agc ggt ccc acc aca 1440
Thr Thr Asp Gln Val Gln Ala Glu Ala Lys Glu Ser Gly Pro Thr Thr
465 470 475 480
tat aag gtc act tcc acc ctt act att aag gaa tcg gat tgg ttg tca 1488
Tyr Lys Val Thr Ser Thr Leu Thr Ile Lys Glu Ser Asp Trp Leu Ser
485 490 495
cag tcg atg ttc aca tgt aga gtc gat cat cgc gga ctc acg ttt caa 1536
Gln Ser Met Phe Thr Cys Arg Val Asp His Arg Gly Leu Thr Phe Gln
500 505 510
cag aac gcg tca tca atg tgt gta ccc gat caa gat acg gcg atc aga 1584
Gln Asn Ala Ser Ser Met Cys Val Pro Asp Gln Asp Thr Ala Ile Arg
515 520 525
gta ttc gcc att ccg cct agc ttc gca tcc att ttt ctc acc aaa agc 1632
Val Phe Ala Ile Pro Pro Ser Phe Ala Ser Ile Phe Leu Thr Lys Ser
530 535 540
aca aag ctg aca tgt ctt gtg aca gac ctc aca acg tac gat tca gtc 1680
Thr Lys Leu Thr Cys Leu Val Thr Asp Leu Thr Thr Tyr Asp Ser Val
545 550 555 560
aca att tca tgg acc agg cag aat ggg gag gcg gta aag acg cac acc 1728
Thr Ile Ser Trp Thr Arg Gln Asn Gly Glu Ala Val Lys Thr His Thr
565 570 575
aac att tcg gaa agc cat ccc aac gcc acg ttt tcg gcg gtc ggg gag 1776
Asn Ile Ser Glu Ser His Pro Asn Ala Thr Phe Ser Ala Val Gly Glu
580 585 590
gca tcg att tgt gag gac gat tgg aat tca ggg gag cgc ttc aca tgc 1824
Ala Ser Ile Cys Glu Asp Asp Trp Asn Ser Gly Glu Arg Phe Thr Cys
595 600 605
acg gtc act cac acg gat ctc cca tcc ccg ttg aag cag aca atc tcg 1872
Thr Val Thr His Thr Asp Leu Pro Ser Pro Leu Lys Gln Thr Ile Ser
610 615 620
cga ccc aaa ggt gtc gca ctg cac agg ccc gac gtc tac ctc ctg cct 1920
Arg Pro Lys Gly Val Ala Leu His Arg Pro Asp Val Tyr Leu Leu Pro
625 630 635 640
cct gcc agg gaa cag ctc aac ctc cgg gaa tca gca acg atc acg tgt 1968
Pro Ala Arg Glu Gln Leu Asn Leu Arg Glu Ser Ala Thr Ile Thr Cys
645 650 655
ctt gta acc ggg ttt tca ccg gct gac gtc ttt gtc caa tgg atg cag 2016
Leu Val Thr Gly Phe Ser Pro Ala Asp Val Phe Val Gln Trp Met Gln
660 665 670
cgg gga caa ccc ttg tca cca gag aag tat gtg aca tca gcg ccc atg 2064
Arg Gly Gln Pro Leu Ser Pro Glu Lys Tyr Val Thr Ser Ala Pro Met
675 680 685
ccc gag cca cag gct ccg ggt agg tat ttt gcc cat tcc atc ctc act 2112
Pro Glu Pro Gln Ala Pro Gly Arg Tyr Phe Ala His Ser Ile Leu Thr
690 695 700
gtg tcc gag gaa gag tgg aac acc ggc gaa acg tac acg tgc gtc gta 2160
Val Ser Glu Glu Glu Trp Asn Thr Gly Glu Thr Tyr Thr Cys Val Val
705 710 715 720
gca cac gaa gcg ttg ccc aat aga gtg act gag aga act gta gat aag 2208
Ala His Glu Ala Leu Pro Asn Arg Val Thr Glu Arg Thr Val Asp Lys
725 730 735
tcc act gag ggc gaa gta agc gcg gat gaa gaa ggt ttc gaa aac ttg 2256
Ser Thr Glu Gly Glu Val Ser Ala Asp Glu Glu Gly Phe Glu Asn Leu
740 745 750
tgg gct aca gcg agc acg ttt atc gtg ttg ttc ttg ctt tca ctc ttc 2304
Trp Ala Thr Ala Ser Thr Phe Ile Val Leu Phe Leu Leu Ser Leu Phe
755 760 765
tac tcc aca act gta acc ctg ttc aag gtc aag tag 2340
Tyr Ser Thr Thr Val Thr Leu Phe Lys Val Lys
770 775
<210> 8
<211> 779
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
Val Leu Gly Pro Gln Ser Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly
290 295 300
Gly Ser Ala Ser Ala Pro Thr Leu Phe Pro Leu Val Ser Cys Glu Asn
305 310 315 320
Ser Pro Ser Asp Thr Ser Ser Val Ala Val Gly Cys Leu Ala Gln Asp
325 330 335
Phe Leu Pro Asp Ser Ile Thr Phe Ser Trp Lys Tyr Lys Asn Asn Ser
340 345 350
Asp Ile Ser Ser Thr Arg Gly Phe Pro Ser Val Leu Arg Gly Gly Lys
355 360 365
Tyr Ala Ala Thr Ser Gln Val Leu Leu Pro Ser Lys Asp Val Met Gln
370 375 380
Gly Thr Asp Glu His Val Val Cys Lys Val Gln His Pro Asn Gly Asn
385 390 395 400
Lys Glu Lys Asn Val Pro Leu Pro Val Ile Ala Glu Leu Pro Pro Lys
405 410 415
Val Ser Val Phe Val Pro Pro Arg Asp Gly Phe Phe Gly Asn Pro Arg
420 425 430
Ser Lys Ser Lys Leu Ile Cys Gln Ala Thr Gly Phe Ser Pro Arg Gln
435 440 445
Ile Gln Val Ser Trp Leu Arg Glu Gly Lys Gln Val Gly Ser Gly Val
450 455 460
Thr Thr Asp Gln Val Gln Ala Glu Ala Lys Glu Ser Gly Pro Thr Thr
465 470 475 480
Tyr Lys Val Thr Ser Thr Leu Thr Ile Lys Glu Ser Asp Trp Leu Ser
485 490 495
Gln Ser Met Phe Thr Cys Arg Val Asp His Arg Gly Leu Thr Phe Gln
500 505 510
Gln Asn Ala Ser Ser Met Cys Val Pro Asp Gln Asp Thr Ala Ile Arg
515 520 525
Val Phe Ala Ile Pro Pro Ser Phe Ala Ser Ile Phe Leu Thr Lys Ser
530 535 540
Thr Lys Leu Thr Cys Leu Val Thr Asp Leu Thr Thr Tyr Asp Ser Val
545 550 555 560
Thr Ile Ser Trp Thr Arg Gln Asn Gly Glu Ala Val Lys Thr His Thr
565 570 575
Asn Ile Ser Glu Ser His Pro Asn Ala Thr Phe Ser Ala Val Gly Glu
580 585 590
Ala Ser Ile Cys Glu Asp Asp Trp Asn Ser Gly Glu Arg Phe Thr Cys
595 600 605
Thr Val Thr His Thr Asp Leu Pro Ser Pro Leu Lys Gln Thr Ile Ser
610 615 620
Arg Pro Lys Gly Val Ala Leu His Arg Pro Asp Val Tyr Leu Leu Pro
625 630 635 640
Pro Ala Arg Glu Gln Leu Asn Leu Arg Glu Ser Ala Thr Ile Thr Cys
645 650 655
Leu Val Thr Gly Phe Ser Pro Ala Asp Val Phe Val Gln Trp Met Gln
660 665 670
Arg Gly Gln Pro Leu Ser Pro Glu Lys Tyr Val Thr Ser Ala Pro Met
675 680 685
Pro Glu Pro Gln Ala Pro Gly Arg Tyr Phe Ala His Ser Ile Leu Thr
690 695 700
Val Ser Glu Glu Glu Trp Asn Thr Gly Glu Thr Tyr Thr Cys Val Val
705 710 715 720
Ala His Glu Ala Leu Pro Asn Arg Val Thr Glu Arg Thr Val Asp Lys
725 730 735
Ser Thr Glu Gly Glu Val Ser Ala Asp Glu Glu Gly Phe Glu Asn Leu
740 745 750
Trp Ala Thr Ala Ser Thr Phe Ile Val Leu Phe Leu Leu Ser Leu Phe
755 760 765
Tyr Ser Thr Thr Val Thr Leu Phe Lys Val Lys
770 775
<210> 9
<211> 2259
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: FcгаммаR1-IgAB
<220>
<221> КДП
<222> (1)..(2259)
<400> 9
atg att ctt acc agc ttt gga gat gac atg tgg ctt cta aca act ctg 48
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
cta ctt tgg gtt cca gtc ggt ggg gaa gtg gtt aat gcc acc aag gct 96
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
gtg atc acc ttg cag cct cca tgg gtc agt att ttc cag aag gaa aat 144
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
gtc act tta tgg tgt gag ggg cct cac ctg cct gga gac agt tcc aca 192
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
caa tgg ttt atc aac gga aca gcc gtt cag atc tcc acg cct agt tat 240
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
agc atc cca gag gcc agt ttt cag gac agt ggc gaa tac agg tgt cag 288
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
ata ggt tcc tca atg cca agt gac cct gtg cag ttg caa atc cac aat 336
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
gat tgg ctg cta ctc cag gcc tcc cgc aga gtc ctc aca gaa gga gaa 384
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
ccc ctg gcc ttg agg tgt cac gga tgg aag aat aaa ctg gtg tac aat 432
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
gtg gtt ttc tat aga aat gga aaa tcc ttt cag ttt tct tca gat tcg 480
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
gag gtc gcc att ctg aaa acc aac ctg agt cac agc ggc atc tac cac 528
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
tgc tca ggc acg gga aga cac cgc tac aca tct gca gga gtg tcc atc 576
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
acg gtg aaa gag ctg ttt acc acg cca gtg ctg aga gca tcc gtg tca 624
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
tct ccc ttc ccg gag ggg agt ctg gtc acc ctg aac tgt gag acg aat 672
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
ttg ctc ctg cag aga ccc ggc tta cag ctt cac ttc tcc ttc tac gtg 720
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
ggc agc aag atc ctg gag tac agg aac aca tcc tca gag tac cat ata 768
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
gca agg gcg gaa aga gaa gat gct gga ttc tac tgg tgt gag gta gcc 816
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
acg gag gac agc agt gtc ctt aag cgc agc cct gag ttg gag ctc caa 864
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
gtg ctt ggt ccc cag tca tca gct cct ggt tct gct tcg ggc tca gga 912
Val Leu Gly Pro Gln Ser Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly
290 295 300
ctg tgg atg cat aag gtg cct gca tcg ctc atg gtg agc ctg ggc gaa 960
Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser Leu Gly Glu
305 310 315 320
gat gca cat ttt cag tgt ccc cat aac agc tcc aac aac gcg aac gtg 1008
Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn Asn Ala Asn Val
325 330 335
acc tgg tgg cgg gtg ctc cat ggc aat tac acc tgg ccg cct gaa ttt 1056
Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp Pro Pro Glu Phe
340 345 350
ctc gga ccg gga gag gac ccg aat ggg acc ctt atc atc cag aac gtg 1104
Leu Gly Pro Gly Glu Asp Pro Asn Gly Thr Leu Ile Ile Gln Asn Val
355 360 365
aat aag tcc cac gga gga atc tac gtc tgc cgc gtg caa gag gga aat 1152
Asn Lys Ser His Gly Gly Ile Tyr Val Cys Arg Val Gln Glu Gly Asn
370 375 380
gag agc tac caa cag tca tgc gga acg tac ctc cgc gtc cgg cag cca 1200
Glu Ser Tyr Gln Gln Ser Cys Gly Thr Tyr Leu Arg Val Arg Gln Pro
385 390 395 400
cca ccg agg ccg ttc ctc gat atg gga gag gga act aag aac cgg atc 1248
Pro Pro Arg Pro Phe Leu Asp Met Gly Glu Gly Thr Lys Asn Arg Ile
405 410 415
att acc gcc gaa ggc atc atc ctc ctc ttc tgc gcc gtc gtg ccg ggg 1296
Ile Thr Ala Glu Gly Ile Ile Leu Leu Phe Cys Ala Val Val Pro Gly
420 425 430
act ctg ctt ctg ttc cgg aaa agg tgg caa aac gaa aag ctg ggt ctg 1344
Thr Leu Leu Leu Phe Arg Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu
435 440 445
gac gct ggg gac gaa tac gag gat gaa aac ttg tac gag ggc ctg aat 1392
Asp Ala Gly Asp Glu Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn
450 455 460
ctg gac gat tgc tcg atg tat gag gac att agc aga gga ctg cag ggt 1440
Leu Asp Asp Cys Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly
465 470 475 480
acc tac caa gac gtg gga agc ctg aac atc ggg gat gtg cag ctc gag 1488
Thr Tyr Gln Asp Val Gly Ser Leu Asn Ile Gly Asp Val Gln Leu Glu
485 490 495
aaa cca agg aaa aga aga gct agc gaa gga cgc gga tca ctg ctt act 1536
Lys Pro Arg Lys Arg Arg Ala Ser Glu Gly Arg Gly Ser Leu Leu Thr
500 505 510
tgc ggc gat gtc gaa gaa aat ccc gga cca atg gcc aga ttg gcg ctg 1584
Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Met Ala Arg Leu Ala Leu
515 520 525
tcg ccg gtc cct tcg cac tgg atg gtg gcc ctg ctg ctc ttg ctt tcg 1632
Ser Pro Val Pro Ser His Trp Met Val Ala Leu Leu Leu Leu Leu Ser
530 535 540
gcg gct gag ccg gtg cca gcg gct aga tcg gag gac cgc tac aga aat 1680
Ala Ala Glu Pro Val Pro Ala Ala Arg Ser Glu Asp Arg Tyr Arg Asn
545 550 555 560
ccg aag ggt tcc gct tgc tca cgc atc tgg caa tca cca cgc ttc atc 1728
Pro Lys Gly Ser Ala Cys Ser Arg Ile Trp Gln Ser Pro Arg Phe Ile
565 570 575
gcg cgc aaa cgc ggc ttc act gtc aag atg cac tgc tat atg aac tcg 1776
Ala Arg Lys Arg Gly Phe Thr Val Lys Met His Cys Tyr Met Asn Ser
580 585 590
gcc agc ggg aat gtg tcg tgg ctg tgg aag cag gaa atg gac gag aat 1824
Ala Ser Gly Asn Val Ser Trp Leu Trp Lys Gln Glu Met Asp Glu Asn
595 600 605
ccg cag caa ctg aaa ctg gag aag ggc cgg atg gaa gaa tcc cag aat 1872
Pro Gln Gln Leu Lys Leu Glu Lys Gly Arg Met Glu Glu Ser Gln Asn
610 615 620
gag tcg ctg gcc acc ctt act atc caa ggt atc cgg ttt gaa gat aac 1920
Glu Ser Leu Ala Thr Leu Thr Ile Gln Gly Ile Arg Phe Glu Asp Asn
625 630 635 640
ggg atc tac ttc tgt caa cag aag tgt aac aac act tca gag gtg tac 1968
Gly Ile Tyr Phe Cys Gln Gln Lys Cys Asn Asn Thr Ser Glu Val Tyr
645 650 655
cag gga tgc ggc acc gaa ctc cgc gtc atg gga ttc tcc acc ctc gcc 2016
Gln Gly Cys Gly Thr Glu Leu Arg Val Met Gly Phe Ser Thr Leu Ala
660 665 670
caa ctg aag cag cgc aac acg ctg aag gac ggc atc att atg atc cag 2064
Gln Leu Lys Gln Arg Asn Thr Leu Lys Asp Gly Ile Ile Met Ile Gln
675 680 685
acc ctg ctg atc atc ctg ttc atc att gtg ccg atc ttt ctg ctc ttg 2112
Thr Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe Leu Leu Leu
690 695 700
gat aag gac gac tcg aaa gcc gga atg gaa gag gac cac acg tac gaa 2160
Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp His Thr Tyr Glu
705 710 715 720
ggt ctg gac atc gac caa act gcg act tac gag gac att gtg acc ctc 2208
Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile Val Thr Leu
725 730 735
cgg act ggc gaa gtc aag tgg tcc gtg ggt gaa cac cct gga cag gaa 2256
Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His Pro Gly Gln Glu
740 745 750
tag 2259
<210> 10
<211> 752
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Met Ile Leu Thr Ser Phe Gly Asp Asp Met Trp Leu Leu Thr Thr Leu
1 5 10 15
Leu Leu Trp Val Pro Val Gly Gly Glu Val Val Asn Ala Thr Lys Ala
20 25 30
Val Ile Thr Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn
35 40 45
Val Thr Leu Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr
50 55 60
Gln Trp Phe Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr
65 70 75 80
Ser Ile Pro Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln
85 90 95
Ile Gly Ser Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn
100 105 110
Asp Trp Leu Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu
115 120 125
Pro Leu Ala Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn
130 135 140
Val Val Phe Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser
145 150 155 160
Glu Val Ala Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His
165 170 175
Cys Ser Gly Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile
180 185 190
Thr Val Lys Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser
195 200 205
Ser Pro Phe Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn
210 215 220
Leu Leu Leu Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val
225 230 235 240
Gly Ser Lys Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile
245 250 255
Ala Arg Ala Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala
260 265 270
Thr Glu Asp Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln
275 280 285
Val Leu Gly Pro Gln Ser Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly
290 295 300
Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser Leu Gly Glu
305 310 315 320
Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn Asn Ala Asn Val
325 330 335
Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp Pro Pro Glu Phe
340 345 350
Leu Gly Pro Gly Glu Asp Pro Asn Gly Thr Leu Ile Ile Gln Asn Val
355 360 365
Asn Lys Ser His Gly Gly Ile Tyr Val Cys Arg Val Gln Glu Gly Asn
370 375 380
Glu Ser Tyr Gln Gln Ser Cys Gly Thr Tyr Leu Arg Val Arg Gln Pro
385 390 395 400
Pro Pro Arg Pro Phe Leu Asp Met Gly Glu Gly Thr Lys Asn Arg Ile
405 410 415
Ile Thr Ala Glu Gly Ile Ile Leu Leu Phe Cys Ala Val Val Pro Gly
420 425 430
Thr Leu Leu Leu Phe Arg Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu
435 440 445
Asp Ala Gly Asp Glu Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn
450 455 460
Leu Asp Asp Cys Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly
465 470 475 480
Thr Tyr Gln Asp Val Gly Ser Leu Asn Ile Gly Asp Val Gln Leu Glu
485 490 495
Lys Pro Arg Lys Arg Arg Ala Ser Glu Gly Arg Gly Ser Leu Leu Thr
500 505 510
Cys Gly Asp Val Glu Glu Asn Pro Gly Pro Met Ala Arg Leu Ala Leu
515 520 525
Ser Pro Val Pro Ser His Trp Met Val Ala Leu Leu Leu Leu Leu Ser
530 535 540
Ala Ala Glu Pro Val Pro Ala Ala Arg Ser Glu Asp Arg Tyr Arg Asn
545 550 555 560
Pro Lys Gly Ser Ala Cys Ser Arg Ile Trp Gln Ser Pro Arg Phe Ile
565 570 575
Ala Arg Lys Arg Gly Phe Thr Val Lys Met His Cys Tyr Met Asn Ser
580 585 590
Ala Ser Gly Asn Val Ser Trp Leu Trp Lys Gln Glu Met Asp Glu Asn
595 600 605
Pro Gln Gln Leu Lys Leu Glu Lys Gly Arg Met Glu Glu Ser Gln Asn
610 615 620
Glu Ser Leu Ala Thr Leu Thr Ile Gln Gly Ile Arg Phe Glu Asp Asn
625 630 635 640
Gly Ile Tyr Phe Cys Gln Gln Lys Cys Asn Asn Thr Ser Glu Val Tyr
645 650 655
Gln Gly Cys Gly Thr Glu Leu Arg Val Met Gly Phe Ser Thr Leu Ala
660 665 670
Gln Leu Lys Gln Arg Asn Thr Leu Lys Asp Gly Ile Ile Met Ile Gln
675 680 685
Thr Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe Leu Leu Leu
690 695 700
Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp His Thr Tyr Glu
705 710 715 720
Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile Val Thr Leu
725 730 735
Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His Pro Gly Gln Glu
740 745 750
<210> 11
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: FcгаммаR1-CD3Z
<220>
<221> КДП
<222> (1)..(1335)
<400> 11
atg aag tgg aag gcg ctt ttc acc gcg gcc atc ctg cag gca cag ttg 48
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
ccg att aca gag gca gaa gtg gtt aat gcc acc aag gct gtg atc acc 96
Pro Ile Thr Glu Ala Glu Val Val Asn Ala Thr Lys Ala Val Ile Thr
20 25 30
ttg cag cct cca tgg gtc agt att ttc cag aag gaa aat gtc act tta 144
Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn Val Thr Leu
35 40 45
tgg tgt gag ggg cct cac ctg cct gga gac agt tcc aca caa tgg ttt 192
Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr Gln Trp Phe
50 55 60
atc aac gga aca gcc gtt cag atc tcc acg cct agt tat agc atc cca 240
Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr Ser Ile Pro
65 70 75 80
gag gcc agt ttt cag gac agt ggc gaa tac agg tgt cag ata ggt tcc 288
Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln Ile Gly Ser
85 90 95
tca atg cca agt gac cct gtg cag ttg caa atc cac aat gat tgg ctg 336
Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn Asp Trp Leu
100 105 110
cta ctc cag gcc tcc cgc aga gtc ctc aca gaa gga gaa ccc ctg gcc 384
Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu Pro Leu Ala
115 120 125
ttg agg tgt cac gga tgg aag aat aaa ctg gtg tac aat gtg gtt ttc 432
Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn Val Val Phe
130 135 140
tat aga aat gga aaa tcc ttt cag ttt tct tca gat tcg gag gtc gcc 480
Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser Glu Val Ala
145 150 155 160
att ctg aaa acc aac ctg agt cac agc ggc atc tac cac tgc tca ggc 528
Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His Cys Ser Gly
165 170 175
acg gga aga cac cgc tac aca tct gca gga gtg tcc atc acg gtg aaa 576
Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile Thr Val Lys
180 185 190
gag ctg ttt acc acg cca gtg ctg aga gca tcc gtg tca tct ccc ttc 624
Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser Ser Pro Phe
195 200 205
ccg gag ggg agt ctg gtc acc ctg aac tgt gag acg aat ttg ctc ctg 672
Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn Leu Leu Leu
210 215 220
cag aga ccc ggc tta cag ctt cac ttc tcc ttc tac gtg ggc agc aag 720
Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val Gly Ser Lys
225 230 235 240
atc ctg gag tac agg aac aca tcc tca gag tac cat ata gca agg gcg 768
Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile Ala Arg Ala
245 250 255
gaa aga gaa gat gct gga ttc tac tgg tgt gag gta gcc acg gag gac 816
Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala Thr Glu Asp
260 265 270
agc agt gtc ctt aag cgc agc cct gag ttg gag ctc caa gtg ctt ggt 864
Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln Val Leu Gly
275 280 285
ccc cag tca tca gct cct ggt tct gct tct ggt tct ggt cag agc ttt 912
Pro Gln Ser Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly Gln Ser Phe
290 295 300
ggc ctg ctg gat ccc aaa ctc tgc tac ctg ctg gat gga atc ctc ttc 960
Gly Leu Leu Asp Pro Lys Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe
305 310 315 320
atc tat ggt gtc att ctc act gcc ttg ttc ctg aga gtg aag ttc agc 1008
Ile Tyr Gly Val Ile Leu Thr Ala Leu Phe Leu Arg Val Lys Phe Ser
325 330 335
agg agc gca gac gcc ccc gcg tac cag cag ggc cag aac cag ctc tat 1056
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
340 345 350
aac gag ctc aat cta gga cga aga gag gag tac gat gtt ttg gac aag 1104
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
355 360 365
aga cgt ggc cgg gac cct gag atg ggg gga aag ccg cag aga agg aag 1152
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln Arg Arg Lys
370 375 380
aac cct cag gaa ggc ctg tac aat gaa ctg cag aaa gat aag atg gcg 1200
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
385 390 395 400
gag gcc tac agt gag att ggg atg aaa ggc gag cgc cgg agg ggc aag 1248
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
405 410 415
ggg cac gat ggc ctt tac cag ggt ctc agt aca gcc acc aag gac acc 1296
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
420 425 430
tac gac gcc ctt cac atg cag gcc ctg ccc cct cgc taa 1335
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
435 440
<210> 12
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Glu Val Val Asn Ala Thr Lys Ala Val Ile Thr
20 25 30
Leu Gln Pro Pro Trp Val Ser Ile Phe Gln Lys Glu Asn Val Thr Leu
35 40 45
Trp Cys Glu Gly Pro His Leu Pro Gly Asp Ser Ser Thr Gln Trp Phe
50 55 60
Ile Asn Gly Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr Ser Ile Pro
65 70 75 80
Glu Ala Ser Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln Ile Gly Ser
85 90 95
Ser Met Pro Ser Asp Pro Val Gln Leu Gln Ile His Asn Asp Trp Leu
100 105 110
Leu Leu Gln Ala Ser Arg Arg Val Leu Thr Glu Gly Glu Pro Leu Ala
115 120 125
Leu Arg Cys His Gly Trp Lys Asn Lys Leu Val Tyr Asn Val Val Phe
130 135 140
Tyr Arg Asn Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser Glu Val Ala
145 150 155 160
Ile Leu Lys Thr Asn Leu Ser His Ser Gly Ile Tyr His Cys Ser Gly
165 170 175
Thr Gly Arg His Arg Tyr Thr Ser Ala Gly Val Ser Ile Thr Val Lys
180 185 190
Glu Leu Phe Thr Thr Pro Val Leu Arg Ala Ser Val Ser Ser Pro Phe
195 200 205
Pro Glu Gly Ser Leu Val Thr Leu Asn Cys Glu Thr Asn Leu Leu Leu
210 215 220
Gln Arg Pro Gly Leu Gln Leu His Phe Ser Phe Tyr Val Gly Ser Lys
225 230 235 240
Ile Leu Glu Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile Ala Arg Ala
245 250 255
Glu Arg Glu Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala Thr Glu Asp
260 265 270
Ser Ser Val Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln Val Leu Gly
275 280 285
Pro Gln Ser Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly Gln Ser Phe
290 295 300
Gly Leu Leu Asp Pro Lys Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe
305 310 315 320
Ile Tyr Gly Val Ile Leu Thr Ala Leu Phe Leu Arg Val Lys Phe Ser
325 330 335
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
340 345 350
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
355 360 365
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln Arg Arg Lys
370 375 380
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
385 390 395 400
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
405 410 415
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
420 425 430
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
435 440
<210> 13
<211> 1848
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: FcгаммаR1-IgE
<220>
<221> КДП
<222> (1)..(1848)
<400> 13
cat atg gaa gtg gtt aat gcc acc aag gct gtg atc acc ttg cag cct 48
His Met Glu Val Val Asn Ala Thr Lys Ala Val Ile Thr Leu Gln Pro
1 5 10 15
cca tgg gtc agt att ttc cag aag gaa aat gtc act tta tgg tgt gag 96
Pro Trp Val Ser Ile Phe Gln Lys Glu Asn Val Thr Leu Trp Cys Glu
20 25 30
ggg cct cac ctg cct gga gac agt tcc aca caa tgg ttt atc aac gga 144
Gly Pro His Leu Pro Gly Asp Ser Ser Thr Gln Trp Phe Ile Asn Gly
35 40 45
aca gcc gtt cag atc tcc acg cct agt tat agc atc cca gag gcc agt 192
Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr Ser Ile Pro Glu Ala Ser
50 55 60
ttt cag gac agt ggc gaa tac agg tgt cag ata ggt tcc tca atg cca 240
Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln Ile Gly Ser Ser Met Pro
65 70 75 80
agt gac cct gtg cag ttg caa atc cac aat gat tgg ctg cta ctc cag 288
Ser Asp Pro Val Gln Leu Gln Ile His Asn Asp Trp Leu Leu Leu Gln
85 90 95
gcc tcc cgc aga gtc ctc aca gaa gga gaa ccc ctg gcc ttg agg tgt 336
Ala Ser Arg Arg Val Leu Thr Glu Gly Glu Pro Leu Ala Leu Arg Cys
100 105 110
cac gga tgg aag aat aaa ctg gtg tac aat gtg gtt ttc tat aga aat 384
His Gly Trp Lys Asn Lys Leu Val Tyr Asn Val Val Phe Tyr Arg Asn
115 120 125
gga aaa tcc ttt cag ttt tct tca gat tcg gag gtc gcc att ctg aaa 432
Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser Glu Val Ala Ile Leu Lys
130 135 140
acc aac ctg agt cac agc ggc atc tac cac tgc tca ggc acg gga aga 480
Thr Asn Leu Ser His Ser Gly Ile Tyr His Cys Ser Gly Thr Gly Arg
145 150 155 160
cac cgc tac aca tct gca gga gtg tcc atc acg gtg aaa gag ctg ttt 528
His Arg Tyr Thr Ser Ala Gly Val Ser Ile Thr Val Lys Glu Leu Phe
165 170 175
acc acg cca gtg ctg aga gca tcc gtg tca tct ccc ttc ccg gag ggg 576
Thr Thr Pro Val Leu Arg Ala Ser Val Ser Ser Pro Phe Pro Glu Gly
180 185 190
agt ctg gtc acc ctg aac tgt gag acg aat ttg ctc ctg cag aga ccc 624
Ser Leu Val Thr Leu Asn Cys Glu Thr Asn Leu Leu Leu Gln Arg Pro
195 200 205
ggc tta cag ctt cac ttc tcc ttc tac gtg ggc agc aag atc ctg gag 672
Gly Leu Gln Leu His Phe Ser Phe Tyr Val Gly Ser Lys Ile Leu Glu
210 215 220
tac agg aac aca tcc tca gag tac cat ata gca agg gcg gaa aga gaa 720
Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile Ala Arg Ala Glu Arg Glu
225 230 235 240
gat gct gga ttc tac tgg tgt gag gta gcc acg gag gac agc agt gtc 768
Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala Thr Glu Asp Ser Ser Val
245 250 255
ctt aag cgc agc cct gag ttg gag ctc caa gtg ctt ggt ccc cag tca 816
Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln Val Leu Gly Pro Gln Ser
260 265 270
tca gct cct ggt tct gct tct ggt tct ggt gtt cga cca gtt aac atc 864
Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly Val Arg Pro Val Asn Ile
275 280 285
acc gag ccc aca ctg gaa ctg ctg cac agc agc tgc gac ccc aac gcc 912
Thr Glu Pro Thr Leu Glu Leu Leu His Ser Ser Cys Asp Pro Asn Ala
290 295 300
ttc cac agc acc atc cag ctg tat tgc ttc atc tac ggc cac atc ctg 960
Phe His Ser Thr Ile Gln Leu Tyr Cys Phe Ile Tyr Gly His Ile Leu
305 310 315 320
aac gac gtg tcc gtg tcc tgg ctg atg gac gac aga gag atc acc gac 1008
Asn Asp Val Ser Val Ser Trp Leu Met Asp Asp Arg Glu Ile Thr Asp
325 330 335
acc ctg gcc cag acc gtg ctg atc aaa gag gaa ggc aag ctg gcc tct 1056
Thr Leu Ala Gln Thr Val Leu Ile Lys Glu Glu Gly Lys Leu Ala Ser
340 345 350
acc tgc agc aag ctg aat atc aca gag cag cag tgg atg agc gag agc 1104
Thr Cys Ser Lys Leu Asn Ile Thr Glu Gln Gln Trp Met Ser Glu Ser
355 360 365
acc ttc acc tgt aaa gtg acc tcc cag ggc gtg gac tac ctg gcc cac 1152
Thr Phe Thr Cys Lys Val Thr Ser Gln Gly Val Asp Tyr Leu Ala His
370 375 380
acc aga aga tgc ccc gac cac gaa ccc aga ggc gtg atc acc tac ctg 1200
Thr Arg Arg Cys Pro Asp His Glu Pro Arg Gly Val Ile Thr Tyr Leu
385 390 395 400
atc ccc cct agc ccc ctg gac ctg tac cag aac ggc gct cct aag ctg 1248
Ile Pro Pro Ser Pro Leu Asp Leu Tyr Gln Asn Gly Ala Pro Lys Leu
405 410 415
acc tgc ctg gtg gtg gac ctg gaa agc gag aag aac gtg aac gtg aca 1296
Thr Cys Leu Val Val Asp Leu Glu Ser Glu Lys Asn Val Asn Val Thr
420 425 430
tgg aac cag gaa aag aaa acc agc gtg tcc gcc agc cag tgg tac acc 1344
Trp Asn Gln Glu Lys Lys Thr Ser Val Ser Ala Ser Gln Trp Tyr Thr
435 440 445
aag cac cac aac aac gcc acc acc tcc atc acc agc atc ctg ccc gtg 1392
Lys His His Asn Asn Ala Thr Thr Ser Ile Thr Ser Ile Leu Pro Val
450 455 460
gtg gcc aag gac tgg atc gag ggc tac ggc tac cag tgc atc gtg gac 1440
Val Ala Lys Asp Trp Ile Glu Gly Tyr Gly Tyr Gln Cys Ile Val Asp
465 470 475 480
cac ccc gac ttc cct aag ccc atc gtg cgg agc atc acc aag acc cct 1488
His Pro Asp Phe Pro Lys Pro Ile Val Arg Ser Ile Thr Lys Thr Pro
485 490 495
ggc cag aga tct gcc ccc gag gtg tac gtg ttc ccc cca cct gag gaa 1536
Gly Gln Arg Ser Ala Pro Glu Val Tyr Val Phe Pro Pro Pro Glu Glu
500 505 510
gag tcc gag gac aag aga acc ctg acc tgt ctg atc cag aac ttc ttc 1584
Glu Ser Glu Asp Lys Arg Thr Leu Thr Cys Leu Ile Gln Asn Phe Phe
515 520 525
cca gag gac atc agc gtg cag tgg ctg ggc gac ggc aag ctg atc tcc 1632
Pro Glu Asp Ile Ser Val Gln Trp Leu Gly Asp Gly Lys Leu Ile Ser
530 535 540
aac agc cag cac agc aca acc acc cct ctg aag tcc aac ggc agc aac 1680
Asn Ser Gln His Ser Thr Thr Thr Pro Leu Lys Ser Asn Gly Ser Asn
545 550 555 560
cag ggc ttc ttc atc ttc agc aga ctg gaa gtg gcc aag acc ctg tgg 1728
Gln Gly Phe Phe Ile Phe Ser Arg Leu Glu Val Ala Lys Thr Leu Trp
565 570 575
acc cag aga aag cag ttt aca tgc caa gtg atc cat gag gcc ctg cag 1776
Thr Gln Arg Lys Gln Phe Thr Cys Gln Val Ile His Glu Ala Leu Gln
580 585 590
aag ccc aga aag ctg gaa aag acc atc agc acc agc ctg ggc aac acc 1824
Lys Pro Arg Lys Leu Glu Lys Thr Ile Ser Thr Ser Leu Gly Asn Thr
595 600 605
tcc ctg cgc cct agt tag ctc gag 1848
Ser Leu Arg Pro Ser Leu Glu
610 615
<210> 14
<211> 613
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
His Met Glu Val Val Asn Ala Thr Lys Ala Val Ile Thr Leu Gln Pro
1 5 10 15
Pro Trp Val Ser Ile Phe Gln Lys Glu Asn Val Thr Leu Trp Cys Glu
20 25 30
Gly Pro His Leu Pro Gly Asp Ser Ser Thr Gln Trp Phe Ile Asn Gly
35 40 45
Thr Ala Val Gln Ile Ser Thr Pro Ser Tyr Ser Ile Pro Glu Ala Ser
50 55 60
Phe Gln Asp Ser Gly Glu Tyr Arg Cys Gln Ile Gly Ser Ser Met Pro
65 70 75 80
Ser Asp Pro Val Gln Leu Gln Ile His Asn Asp Trp Leu Leu Leu Gln
85 90 95
Ala Ser Arg Arg Val Leu Thr Glu Gly Glu Pro Leu Ala Leu Arg Cys
100 105 110
His Gly Trp Lys Asn Lys Leu Val Tyr Asn Val Val Phe Tyr Arg Asn
115 120 125
Gly Lys Ser Phe Gln Phe Ser Ser Asp Ser Glu Val Ala Ile Leu Lys
130 135 140
Thr Asn Leu Ser His Ser Gly Ile Tyr His Cys Ser Gly Thr Gly Arg
145 150 155 160
His Arg Tyr Thr Ser Ala Gly Val Ser Ile Thr Val Lys Glu Leu Phe
165 170 175
Thr Thr Pro Val Leu Arg Ala Ser Val Ser Ser Pro Phe Pro Glu Gly
180 185 190
Ser Leu Val Thr Leu Asn Cys Glu Thr Asn Leu Leu Leu Gln Arg Pro
195 200 205
Gly Leu Gln Leu His Phe Ser Phe Tyr Val Gly Ser Lys Ile Leu Glu
210 215 220
Tyr Arg Asn Thr Ser Ser Glu Tyr His Ile Ala Arg Ala Glu Arg Glu
225 230 235 240
Asp Ala Gly Phe Tyr Trp Cys Glu Val Ala Thr Glu Asp Ser Ser Val
245 250 255
Leu Lys Arg Ser Pro Glu Leu Glu Leu Gln Val Leu Gly Pro Gln Ser
260 265 270
Ser Ala Pro Gly Ser Ala Ser Gly Ser Gly Val Arg Pro Val Asn Ile
275 280 285
Thr Glu Pro Thr Leu Glu Leu Leu His Ser Ser Cys Asp Pro Asn Ala
290 295 300
Phe His Ser Thr Ile Gln Leu Tyr Cys Phe Ile Tyr Gly His Ile Leu
305 310 315 320
Asn Asp Val Ser Val Ser Trp Leu Met Asp Asp Arg Glu Ile Thr Asp
325 330 335
Thr Leu Ala Gln Thr Val Leu Ile Lys Glu Glu Gly Lys Leu Ala Ser
340 345 350
Thr Cys Ser Lys Leu Asn Ile Thr Glu Gln Gln Trp Met Ser Glu Ser
355 360 365
Thr Phe Thr Cys Lys Val Thr Ser Gln Gly Val Asp Tyr Leu Ala His
370 375 380
Thr Arg Arg Cys Pro Asp His Glu Pro Arg Gly Val Ile Thr Tyr Leu
385 390 395 400
Ile Pro Pro Ser Pro Leu Asp Leu Tyr Gln Asn Gly Ala Pro Lys Leu
405 410 415
Thr Cys Leu Val Val Asp Leu Glu Ser Glu Lys Asn Val Asn Val Thr
420 425 430
Trp Asn Gln Glu Lys Lys Thr Ser Val Ser Ala Ser Gln Trp Tyr Thr
435 440 445
Lys His His Asn Asn Ala Thr Thr Ser Ile Thr Ser Ile Leu Pro Val
450 455 460
Val Ala Lys Asp Trp Ile Glu Gly Tyr Gly Tyr Gln Cys Ile Val Asp
465 470 475 480
His Pro Asp Phe Pro Lys Pro Ile Val Arg Ser Ile Thr Lys Thr Pro
485 490 495
Gly Gln Arg Ser Ala Pro Glu Val Tyr Val Phe Pro Pro Pro Glu Glu
500 505 510
Glu Ser Glu Asp Lys Arg Thr Leu Thr Cys Leu Ile Gln Asn Phe Phe
515 520 525
Pro Glu Asp Ile Ser Val Gln Trp Leu Gly Asp Gly Lys Leu Ile Ser
530 535 540
Asn Ser Gln His Ser Thr Thr Thr Pro Leu Lys Ser Asn Gly Ser Asn
545 550 555 560
Gln Gly Phe Phe Ile Phe Ser Arg Leu Glu Val Ala Lys Thr Leu Trp
565 570 575
Thr Gln Arg Lys Gln Phe Thr Cys Gln Val Ile His Glu Ala Leu Gln
580 585 590
Lys Pro Arg Lys Leu Glu Lys Thr Ile Ser Thr Ser Leu Gly Asn Thr
595 600 605
Ser Leu Arg Pro Ser
610
<210> 15
<211> 1449
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: BBP-IgE
<220>
<221> КДП
<222> (1)..(1449)
<400> 15
cat atg act tac aag ctg gtg atc aac ggt aaa acc ttg aag ggt gag 48
His Met Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu Lys Gly Glu
1 5 10 15
acc acc act gag gca gtc gac gcc gcc act gcc gag aag gtc ttt aaa 96
Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys Val Phe Lys
20 25 30
cag tat gcc aat gat aac ggc gtg gac ggc gag tgg acc tac gat gac 144
Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr Tyr Asp Asp
35 40 45
gcc act aag aca ttc act gtg act gaa aag ccc gag gtg att gac gcg 192
Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val Ile Asp Ala
50 55 60
tcc gaa ttg aca cct gcg gtg acc acc tac aaa ctg gtt atc aac ggc 240
Ser Glu Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val Ile Asn Gly
65 70 75 80
aag act ctg aag ggc gag acc acc aca gag gca gtc gat gcc gcc acc 288
Lys Thr Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr
85 90 95
gcc gag aag gtc ttc aag caa tat gcc aac gac aac ggg gtg gac ggg 336
Ala Glu Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly
100 105 110
gag tgg acc tac gat gat gcc acc aag acc ttc acc gtg acc gag aag 384
Glu Trp Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys
115 120 125
ccc gaa gtg atc gat gcg agt gaa ctg act ccc gcc gtg aca ggt tct 432
Pro Glu Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Gly Ser
130 135 140
gct tct ggt tct ggt gtt cga cca gtt aac atc acc gag ccc aca ctg 480
Ala Ser Gly Ser Gly Val Arg Pro Val Asn Ile Thr Glu Pro Thr Leu
145 150 155 160
gaa ctg ctg cac agc agc tgc gac ccc aac gcc ttc cac agc acc atc 528
Glu Leu Leu His Ser Ser Cys Asp Pro Asn Ala Phe His Ser Thr Ile
165 170 175
cag ctg tat tgc ttc atc tac ggc cac atc ctg aac gac gtg tcc gtg 576
Gln Leu Tyr Cys Phe Ile Tyr Gly His Ile Leu Asn Asp Val Ser Val
180 185 190
tcc tgg ctg atg gac gac aga gag atc acc gac acc ctg gcc cag acc 624
Ser Trp Leu Met Asp Asp Arg Glu Ile Thr Asp Thr Leu Ala Gln Thr
195 200 205
gtg ctg atc aaa gag gaa ggc aag ctg gcc tct acc tgc agc aag ctg 672
Val Leu Ile Lys Glu Glu Gly Lys Leu Ala Ser Thr Cys Ser Lys Leu
210 215 220
aat atc aca gag cag cag tgg atg agc gag agc acc ttc acc tgt aaa 720
Asn Ile Thr Glu Gln Gln Trp Met Ser Glu Ser Thr Phe Thr Cys Lys
225 230 235 240
gtg acc tcc cag ggc gtg gac tac ctg gcc cac acc aga aga tgc ccc 768
Val Thr Ser Gln Gly Val Asp Tyr Leu Ala His Thr Arg Arg Cys Pro
245 250 255
gac cac gaa ccc aga ggc gtg atc acc tac ctg atc ccc cct agc ccc 816
Asp His Glu Pro Arg Gly Val Ile Thr Tyr Leu Ile Pro Pro Ser Pro
260 265 270
ctg gac ctg tac cag aac ggc gct cct aag ctg acc tgc ctg gtg gtg 864
Leu Asp Leu Tyr Gln Asn Gly Ala Pro Lys Leu Thr Cys Leu Val Val
275 280 285
gac ctg gaa agc gag aag aac gtg aac gtg aca tgg aac cag gaa aag 912
Asp Leu Glu Ser Glu Lys Asn Val Asn Val Thr Trp Asn Gln Glu Lys
290 295 300
aaa acc agc gtg tcc gcc agc cag tgg tac acc aag cac cac aac aac 960
Lys Thr Ser Val Ser Ala Ser Gln Trp Tyr Thr Lys His His Asn Asn
305 310 315 320
gcc acc acc tcc atc acc agc atc ctg ccc gtg gtg gcc aag gac tgg 1008
Ala Thr Thr Ser Ile Thr Ser Ile Leu Pro Val Val Ala Lys Asp Trp
325 330 335
atc gag ggc tac ggc tac cag tgc atc gtg gac cac ccc gac ttc cct 1056
Ile Glu Gly Tyr Gly Tyr Gln Cys Ile Val Asp His Pro Asp Phe Pro
340 345 350
aag ccc atc gtg cgg agc atc acc aag acc cct ggc cag aga tct gcc 1104
Lys Pro Ile Val Arg Ser Ile Thr Lys Thr Pro Gly Gln Arg Ser Ala
355 360 365
ccc gag gtg tac gtg ttc ccc cca cct gag gaa gag tcc gag gac aag 1152
Pro Glu Val Tyr Val Phe Pro Pro Pro Glu Glu Glu Ser Glu Asp Lys
370 375 380
aga acc ctg acc tgt ctg atc cag aac ttc ttc cca gag gac atc agc 1200
Arg Thr Leu Thr Cys Leu Ile Gln Asn Phe Phe Pro Glu Asp Ile Ser
385 390 395 400
gtg cag tgg ctg ggc gac ggc aag ctg atc tcc aac agc cag cac agc 1248
Val Gln Trp Leu Gly Asp Gly Lys Leu Ile Ser Asn Ser Gln His Ser
405 410 415
aca acc acc cct ctg aag tcc aac ggc agc aac cag ggc ttc ttc atc 1296
Thr Thr Thr Pro Leu Lys Ser Asn Gly Ser Asn Gln Gly Phe Phe Ile
420 425 430
ttc agc aga ctg gaa gtg gcc aag acc ctg tgg acc cag aga aag cag 1344
Phe Ser Arg Leu Glu Val Ala Lys Thr Leu Trp Thr Gln Arg Lys Gln
435 440 445
ttt aca tgc caa gtg atc cat gag gcc ctg cag aag ccc aga aag ctg 1392
Phe Thr Cys Gln Val Ile His Glu Ala Leu Gln Lys Pro Arg Lys Leu
450 455 460
gaa aag acc atc agc acc agc ctg ggc aac acc tcc ctg cgc cct agt 1440
Glu Lys Thr Ile Ser Thr Ser Leu Gly Asn Thr Ser Leu Arg Pro Ser
465 470 475 480
tag ctc gag 1449
Leu Glu
<210> 16
<211> 480
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
His Met Thr Tyr Lys Leu Val Ile Asn Gly Lys Thr Leu Lys Gly Glu
1 5 10 15
Thr Thr Thr Glu Ala Val Asp Ala Ala Thr Ala Glu Lys Val Phe Lys
20 25 30
Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly Glu Trp Thr Tyr Asp Asp
35 40 45
Ala Thr Lys Thr Phe Thr Val Thr Glu Lys Pro Glu Val Ile Asp Ala
50 55 60
Ser Glu Leu Thr Pro Ala Val Thr Thr Tyr Lys Leu Val Ile Asn Gly
65 70 75 80
Lys Thr Leu Lys Gly Glu Thr Thr Thr Glu Ala Val Asp Ala Ala Thr
85 90 95
Ala Glu Lys Val Phe Lys Gln Tyr Ala Asn Asp Asn Gly Val Asp Gly
100 105 110
Glu Trp Thr Tyr Asp Asp Ala Thr Lys Thr Phe Thr Val Thr Glu Lys
115 120 125
Pro Glu Val Ile Asp Ala Ser Glu Leu Thr Pro Ala Val Thr Gly Ser
130 135 140
Ala Ser Gly Ser Gly Val Arg Pro Val Asn Ile Thr Glu Pro Thr Leu
145 150 155 160
Glu Leu Leu His Ser Ser Cys Asp Pro Asn Ala Phe His Ser Thr Ile
165 170 175
Gln Leu Tyr Cys Phe Ile Tyr Gly His Ile Leu Asn Asp Val Ser Val
180 185 190
Ser Trp Leu Met Asp Asp Arg Glu Ile Thr Asp Thr Leu Ala Gln Thr
195 200 205
Val Leu Ile Lys Glu Glu Gly Lys Leu Ala Ser Thr Cys Ser Lys Leu
210 215 220
Asn Ile Thr Glu Gln Gln Trp Met Ser Glu Ser Thr Phe Thr Cys Lys
225 230 235 240
Val Thr Ser Gln Gly Val Asp Tyr Leu Ala His Thr Arg Arg Cys Pro
245 250 255
Asp His Glu Pro Arg Gly Val Ile Thr Tyr Leu Ile Pro Pro Ser Pro
260 265 270
Leu Asp Leu Tyr Gln Asn Gly Ala Pro Lys Leu Thr Cys Leu Val Val
275 280 285
Asp Leu Glu Ser Glu Lys Asn Val Asn Val Thr Trp Asn Gln Glu Lys
290 295 300
Lys Thr Ser Val Ser Ala Ser Gln Trp Tyr Thr Lys His His Asn Asn
305 310 315 320
Ala Thr Thr Ser Ile Thr Ser Ile Leu Pro Val Val Ala Lys Asp Trp
325 330 335
Ile Glu Gly Tyr Gly Tyr Gln Cys Ile Val Asp His Pro Asp Phe Pro
340 345 350
Lys Pro Ile Val Arg Ser Ile Thr Lys Thr Pro Gly Gln Arg Ser Ala
355 360 365
Pro Glu Val Tyr Val Phe Pro Pro Pro Glu Glu Glu Ser Glu Asp Lys
370 375 380
Arg Thr Leu Thr Cys Leu Ile Gln Asn Phe Phe Pro Glu Asp Ile Ser
385 390 395 400
Val Gln Trp Leu Gly Asp Gly Lys Leu Ile Ser Asn Ser Gln His Ser
405 410 415
Thr Thr Thr Pro Leu Lys Ser Asn Gly Ser Asn Gln Gly Phe Phe Ile
420 425 430
Phe Ser Arg Leu Glu Val Ala Lys Thr Leu Trp Thr Gln Arg Lys Gln
435 440 445
Phe Thr Cys Gln Val Ile His Glu Ala Leu Gln Lys Pro Arg Lys Leu
450 455 460
Glu Lys Thr Ile Ser Thr Ser Leu Gly Asn Thr Ser Leu Arg Pro Ser
465 470 475 480
<210> 17
<211> 864
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Химерный белок: mSa-CD3Z
<220>
<221> КДП
<222> (1)..(864)
<400> 17
atg aag tgg aaa gcc ctt ttt acc gcc gcc att ctg caa gcg caa ttg 48
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
ccg atc act gaa gcc gca tcg gcc gag gcc ggt atc act gga acc tgg 96
Pro Ile Thr Glu Ala Ala Ser Ala Glu Ala Gly Ile Thr Gly Thr Trp
20 25 30
tac aac cag cac gga tcc aca ttc acc gtg acc gcc ggt gct gac gga 144
Tyr Asn Gln His Gly Ser Thr Phe Thr Val Thr Ala Gly Ala Asp Gly
35 40 45
aat ctg acc gga cag tac gag aat cgg gct cag ggc acc ggt tgt cag 192
Asn Leu Thr Gly Gln Tyr Glu Asn Arg Ala Gln Gly Thr Gly Cys Gln
50 55 60
aac tcc cct tac acc ctc act ggg aga tac aac ggc acc aag ctg gaa 240
Asn Ser Pro Tyr Thr Leu Thr Gly Arg Tyr Asn Gly Thr Lys Leu Glu
65 70 75 80
tgg agg gtg gaa tgg aac aac tcc acc gaa aac tgc cat tcc cgc act 288
Trp Arg Val Glu Trp Asn Asn Ser Thr Glu Asn Cys His Ser Arg Thr
85 90 95
gag tgg cgc gga cag tat cag ggg gga gcc gaa gcg cgg atc aac acc 336
Glu Trp Arg Gly Gln Tyr Gln Gly Gly Ala Glu Ala Arg Ile Asn Thr
100 105 110
caa tgg aac ctg acc tac gag ggc ggg agc gga ccc gcg act gag cag 384
Gln Trp Asn Leu Thr Tyr Glu Gly Gly Ser Gly Pro Ala Thr Glu Gln
115 120 125
ggc cag gat acg ttc act aag gtc aag ggc agc gca tca ggc tcg gga 432
Gly Gln Asp Thr Phe Thr Lys Val Lys Gly Ser Ala Ser Gly Ser Gly
130 135 140
cag agc ttt ggc ctg ctg gat ccc aaa ctc tgc tac ctg ctg gat gga 480
Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys Tyr Leu Leu Asp Gly
145 150 155 160
atc ctc ttc atc tat ggt gtc att ctc act gcc ttg ttc ctg aga gtg 528
Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala Leu Phe Leu Arg Val
165 170 175
aag ttc agc agg agc gca gac gcc ccc gcg tac cag cag ggc cag aac 576
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
180 185 190
cag ctc tat aac gag ctc aat cta gga cga aga gag gag tac gat gtt 624
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
195 200 205
ttg gac aag aga cgt ggc cgg gac cct gag atg ggg gga aag ccg cag 672
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln
210 215 220
aga agg aag aac cct cag gaa ggc ctg tac aat gaa ctg cag aaa gat 720
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
225 230 235 240
aag atg gcg gag gcc tac agt gag att ggg atg aaa ggc gag cgc cgg 768
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
245 250 255
agg ggc aag ggg cac gat ggc ctt tac cag ggt ctc agt aca gcc acc 816
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
260 265 270
aag gac acc tac gac gcc ctt cac atg cag gcc ctg ccc cct cgc taa 864
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
275 280 285
<210> 18
<211> 287
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Ala Ser Ala Glu Ala Gly Ile Thr Gly Thr Trp
20 25 30
Tyr Asn Gln His Gly Ser Thr Phe Thr Val Thr Ala Gly Ala Asp Gly
35 40 45
Asn Leu Thr Gly Gln Tyr Glu Asn Arg Ala Gln Gly Thr Gly Cys Gln
50 55 60
Asn Ser Pro Tyr Thr Leu Thr Gly Arg Tyr Asn Gly Thr Lys Leu Glu
65 70 75 80
Trp Arg Val Glu Trp Asn Asn Ser Thr Glu Asn Cys His Ser Arg Thr
85 90 95
Glu Trp Arg Gly Gln Tyr Gln Gly Gly Ala Glu Ala Arg Ile Asn Thr
100 105 110
Gln Trp Asn Leu Thr Tyr Glu Gly Gly Ser Gly Pro Ala Thr Glu Gln
115 120 125
Gly Gln Asp Thr Phe Thr Lys Val Lys Gly Ser Ala Ser Gly Ser Gly
130 135 140
Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys Tyr Leu Leu Asp Gly
145 150 155 160
Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala Leu Phe Leu Arg Val
165 170 175
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
180 185 190
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
195 200 205
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln
210 215 220
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
225 230 235 240
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
245 250 255
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
260 265 270
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
275 280 285
<210> 19
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Линкер
<400> 19
Gly Ser Ala Ser Gly Ser Gly
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ПОМОЩЬЮ КОРИНЕБАКТЕРИЙ С ПРИМЕНЕНИЕМ СИСТЕМЫ РАСЩЕПЛЕНИЯ ГЛИЦИНА | 2015 |
|
RU2713298C2 |
| Химерные белки на основе утрофина и дистрофина человека и их применение для лечения миодистрофии Дюшенна | 2021 |
|
RU2767335C1 |
| СПОСОБ УПРАВЛЕНИЯ РИТМОМ СЕРДЦА И СОКРАЩЕНИЕМ ОТДЕЛЬНЫХ КАРДИОМИОЦИТОВ ПРИ ПОМОЩИ ТЕРМОГЕНЕТИКИ | 2022 |
|
RU2802995C1 |
| КОНСТРУКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ И ВЕКТОРЫ ДЛЯ ГЕНОТЕРАПИИ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА И ДРУГИХ СОСТОЯНИЙ | 2015 |
|
RU2745567C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ БИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ ЛАКТАТА ИЗ С1-СОЕДИНЕНИЙ С ПРИМЕНЕНИЕМ ТРАНСФОРМАНТОВ ЛАКТАТ ДЕГИДРОГЕНАЗЫ | 2014 |
|
RU2710714C2 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| СПОСОБ ПРОДУЦИРОВАНИЯ ПОЧЕЧНЫХ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ | 2016 |
|
RU2730861C2 |
| Антитела против белка р17 ВИЧ-1 субтипа А | 2019 |
|
RU2727673C1 |
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2714205C2 |
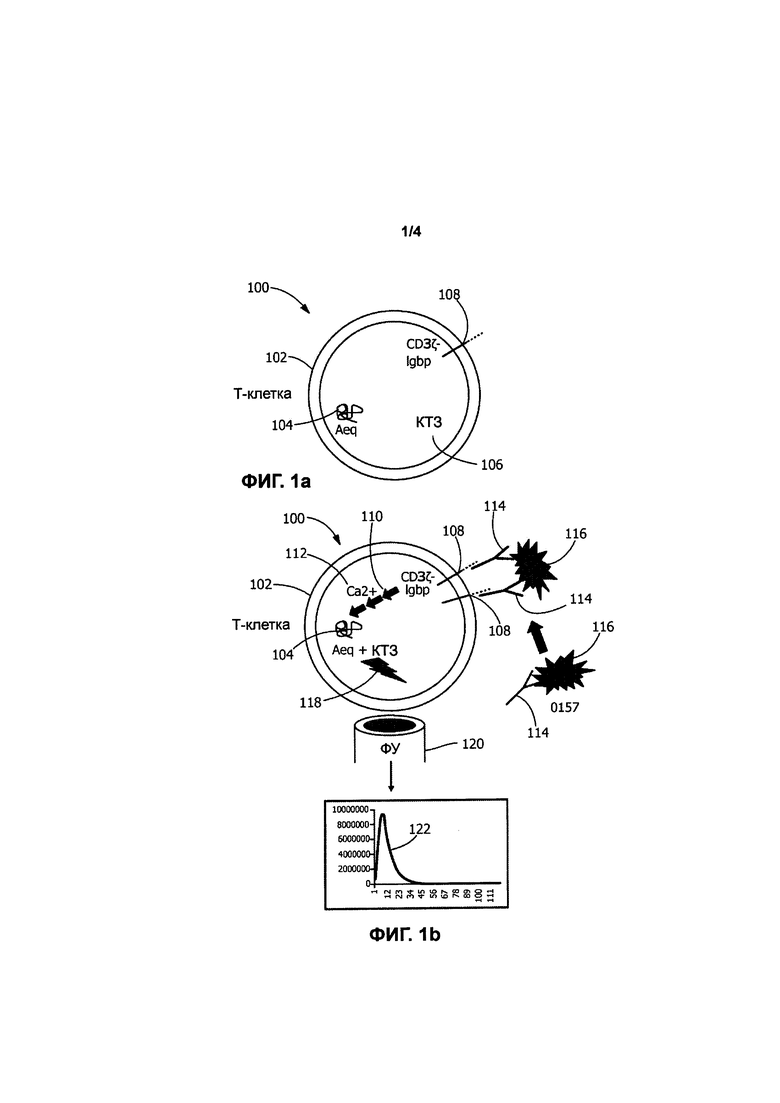
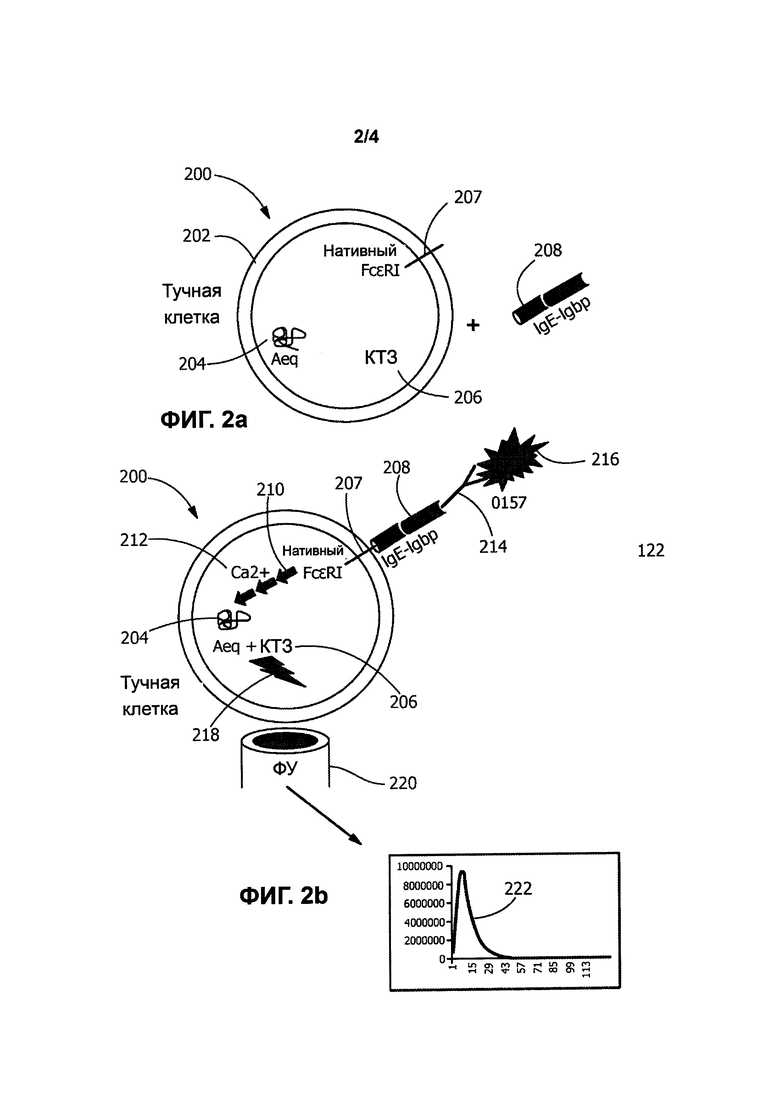
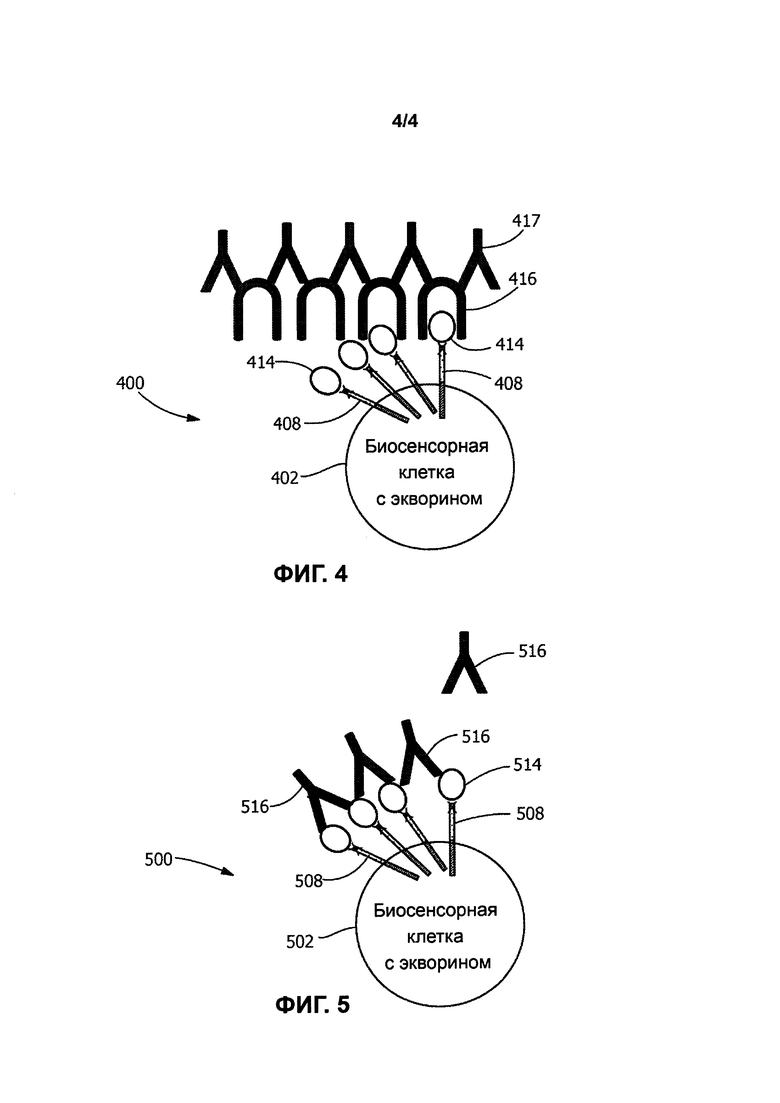
Группа изобретений относится к области биотехнологии. Предложен биосенсор и система для быстрого обнаружения определяемых компонентов, а также способ получения указанной системы и способ обнаружения определяемого компонента. Биосенсор и система содержат полученную из клеточного компонента иммунной системы млекопитающих живую генно-модифицированную биосенсорную клетку, встроенный внутрь и экспрессируемый указанной клеткой репортерный белок, путь передачи сигнала и множество не являющихся антителами и передающих сигнал элементов. Система дополнительно включает по меньшей мере один тип детекторной молекулы, по меньшей мере один определяемый компонент. Способ получения указанной системы включает трансфекцию или трансформацию иммуноцита одним или несколькими кодирующими репортерный белок, путь передачи сигнала и множество трансмембранных элементов полинуклеотидами вышеуказанной системы. Способ обнаружения определяемого компонента включает приведение содержащего определяемый компонент образца в контакт с вышеуказанной системой и обнаружение определяемого компонента при испускании сигнала репортерным белком. Изобретения обеспечивают обнаружение и идентификацию инфекционных агентов, патогенных микроорганизмов, токсинов и других загрязняющих веществ в реальном времени. 4 н. и 36 з.п. ф-лы, 8 ил.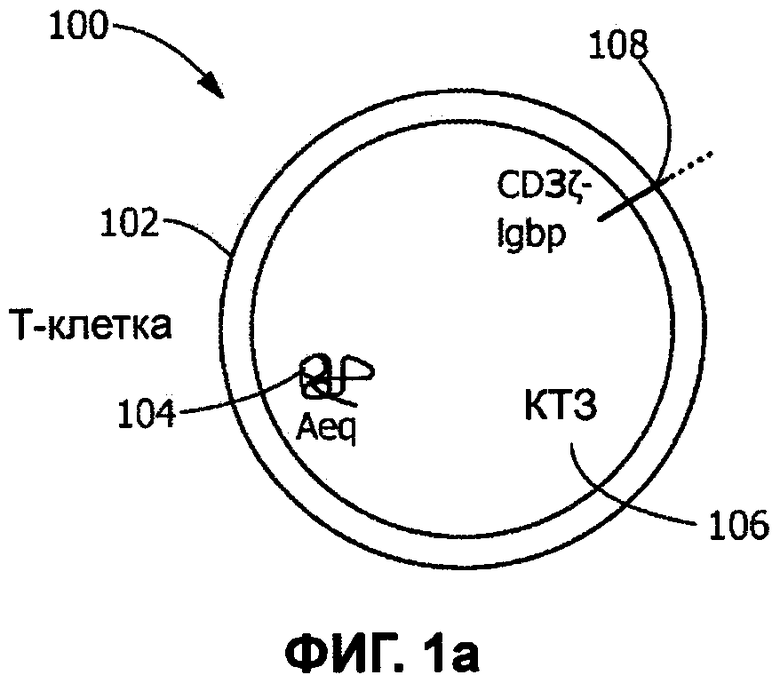
1. Система быстрого обнаружения определяемых компонентов, содержащая:
(a) живую генно-модифицированную биосенсорную клетку, причем живая генно-модифицированная биосенсорная клетка получена из клеточного компонента иммунной системы млекопитающих;
(b) репортерный белок, причем репортерный белок встроен внутрь и экспрессируется живой генно-модифицированной биосенсорной клеткой и при этом репортерный белок испускает поддающийся обнаружению сигнал в ответ на определенные, заранее заданные цитозольные изменения в живой генно-модифицированной биосенсорной клетке;
(c) путь передачи сигнала, встроенный или естественным образом присутствующий в живой генно-модифицированной биосенсорной клетке, причем путь передачи сигнала контролирует биологический процесс внутри цитозоля живой генно-модифицированной биосенсорной клетки и при этом биологический процесс, когда он происходит, вызывает испускание репортерным белком поддающегося обнаружению сигнала;
(d) по меньшей мере один тип детекторной молекулы, причем каждая детекторная молекула адаптирована для связывания с конкретным определяемым компонентом;
(e) по меньшей мере один определяемый компонент, причем этот по меньшей мере один определяемый компонент связывается с детекторной молекулой, которая является специфичной в отношении этого определяемого компонента;
(f) множество трансмембранных элементов, передающих сигнал, не являющихся антителами, экспрессируемых живой генно-модифицированной биосенсорной клеткой, причем каждый элемент, передающий сигнал, адаптирован для восприятия детекторной молекулы; и
(g) при этом при связывании достаточного количества определяемых компонентов с достаточным количеством детекторных молекул, которые сами по себе связаны с трансмембранными элементами, передающими сигнал, не являющимися антителами, на поверхности биосенсорной клетки происходит агрегация элементов, передающих сигнал, путь передачи сигнала активируется, происходит биологический процесс и репортерный белок испускает обнаруживаемый сигнал.
2. Система по п. 1, отличающаяся тем, что живая генно-модифицированная клетка получена из В-клетки или Т-клетки, репортерный белок является экворином, путь передачи сигнала включает повышение уровня внутриклеточного кальция, детекторная молекула представляет собой антитело, которое связывается с пищевым патогеном, определяемый компонент является пищевым патогеном, а множество элементов, передающих сигнал, адаптировано для восприятия антитела посредством связывания с участком бактериального белка, связывающегося с IgG.
3. Система по п. 1, отличающаяся тем, что биосенсорная клетка получена из В-клетки или Т-клетки.
4. Система по п. 1, отличающаяся тем, что репортерный белок является экворином, а поддающийся обнаружению сигнал представляет собой вспышку синего света.
5. Система по п. 1, отличающаяся тем, что биологический процесс, контролируемый путем передачи сигнала, дополнительно включает повышение уровня внутриклеточного кальция.
6. Система по п. 1, отличающаяся тем, что элемент, не являющийся антителом, передающий сигнал, является химерным слитым белком, экспрессируемым биосенсорной клеткой, причем этот химерный белок дополнительно содержит:
(а) по меньшей мере один компонент белка, который адаптирован для связывания с по меньшей мере одним типом детекторной молекулы; а также
(b) по меньшей мере один компонент рецепторного комплекса, обычно экспрессируемого на поверхности того типа иммуноцитов, из которого была получена биосенсорная клетка.
7. Система по п. 6, отличающаяся тем, что по меньшей мере один компонент белка, который адаптирован для связывания с по меньшей мере одним типом детекторной молекулы, получен из бактериального белка, связывающегося с антителом.
8. Система по п. 6, отличающаяся тем, что по меньшей мере один компонент белка, который адаптирован для связывания с детекторной молекулой по меньшей мере одного типа, представляет собой домен связывания с антителом, полученный из рецепторного белка FcR или другого рецепторного белка.
9. Система по п. 6, отличающаяся тем, что по меньшей мере один компонент рецепторного комплекса, обычно экспрессируемый на поверхности иммуноцита, представляет собой IgM; Igα/β; IgE; CD19; CD3ζ или их комбинации.
10. Система по п. 1, отличающаяся тем, что элемент, не являющийся антителом, передающий сигнал, кодируется последовательностью ДНК, обладающей по меньшей мере 95 % идентичностью с последовательностью ДНК, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11 и 17.
11. Система по п. 1, отличающаяся тем, что элемент, не являющийся антителом, передающий сигнал, является химерным слитым белком, аминокислотная последовательность которого выбрана из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12 и 18.
12. Система по п. 1, отличающаяся тем, что по меньшей мере одна детекторная молекула представляет собой растворимое антитело.
13. Система по п. 1, отличающаяся тем, что по меньшей мере одна детекторная молекула представляет собой растворимый IgG.
14. Система по п. 1, отличающаяся тем, что определяемый компонент является пищевым инфекционным агентом.
15. Система по п. 1, отличающаяся тем, что определяемый компонент представляет собой бактерию или вирус.
16. Система по п. 15, отличающаяся тем, что биосенсорная клетка получена из тучной клетки.
17. Способ обнаружения определяемого компонента, включающий приведение образца, содержащего определяемый компонент, в контакт с системой по п. 1 и обнаружение определяемого компонента при испускании сигнала репортерным белком.
18. Способ получения системы по п. 1, включающий трансфекцию или трансформацию иммуноцита одним или несколькими полинуклеотидами, кодирующими элементы (b), (с) и (f) системы.
19. Биосенсор для быстрого обнаружения определяемых компонентов, содержащий:
(а) живую генно-модифицированную клетку, причем живая генно-модифицированная клетка получена из иммуноцита;
(b) репортерный белок, причем репортерный белок встроен внутрь и экспрессируется иммуноцитом и при этом репортерный белок испускает поддающийся обнаружению сигнал в ответ на определенные, заранее заданные цитозольные изменения в иммуноците;
(c) путь передачи сигнала, встроенный или естественным образом присутствующий внутри иммуноцита, причем путь передачи сигнала контролирует биологический процесс в цитозоле иммуноцита, и при этом биологический процесс, когда он происходит, вызывает испускание репортерным белком поддающегося обнаружению сигнала; а также
(d) множество элементов, не являющихся антителами, передающих сигнал, которые непосредственно связываются с определяемым компонентом в анализируемом образце или которые опосредованно связываются с определяемым компонентом в анализируемом образце через комплекс определяемого компонента и по меньшей мере одного антитела или другой детекторной молекулы, причем связанные элементы, не являющиеся антителами, передающие сигналы, в дальнейшем взаимодействуют с биосенсорной клеткой, чтобы прямо или косвенно активировать путь передачи сигнала.
20. Биосенсор по п. 19, отличающийся тем, что дополнительно содержит множество рецепторных молекул по меньшей мере одного определенного типа, экспрессируемых на поверхности генно-модифицированной клетки, причем по меньшей мере один заранее определенный тип рецепторной молекулы взаимодействует с путем передачи сигнала и при этом по меньшей мере один заранее определенный тип рецепторной молекулы связывается с элементами, не являющимися антителами, передающими сигнал.
21. Биосенсор по п. 20, отличающийся тем, что по меньшей мере один заранее определенный тип рецепторных молекул, экспрессируемый на поверхности генно-модифицированной клетки, представляет собой FcεRI.
22. Биосенсор по п. 19, дополнительно содержащий по меньшей мере одно экзогенное антитело или другую детекторную молекулу, адаптированную для взаимодействия с элементами, передающими сигнал, не являющимися антителами, причем по меньшей мере одно экзогенное антитело или другая детекторная молекула также адаптированы для связывания с конкретным определяемым компонентом.
23. Биосенсор по п. 22, отличающийся тем, что по меньшей мере одно экзогенное антитело является растворимым IgG.
24. Биосенсор по п. 19, отличающийся тем, что иммуноцит является В-клеткой, Т-клеткой или тучной клеткой.
25. Биосенсор по п. 19, отличающийся тем, что элементы, не являющиеся антителами, передающие сигнал, экспрессируются генно-модифицированной клеткой в виде трансмембранных химерных слитых белков.
26. Биосенсор по п. 19, отличающийся тем, что элементы, не являющиеся антителами, передающие сигнал, вырабатываются генно-модифицированной клеткой, а затем выводятся из генно-модифицированной клетки в виде растворимых слитых белков.
27. Биосенсор по п. 19, отличающийся тем, что репортерный белок является экворином, а поддающийся обнаружению сигнал представляет собой вспышку синего света.
28. Биосенсор по п. 19, отличающийся тем, что биологический процесс, контролируемый путем передачи сигнала, дополнительно включает повышение уровня внутриклеточного кальция.
29. Биосенсор по п. 19, отличающийся тем, что элемент, не являющийся антителом, передающий сигнал, представляет собой химерный слитый белок, который содержит:
(а) по меньшей мере один белковый компонент, который адаптирован для связывания с по меньшей мере одним типом детекторной молекулы; и
(b) по меньшей мере один компонент рецепторного комплекса, обычно экспрессируемого на поверхности того типа иммуноцитов, из которого получена живая генно-модифицированная клетка.
30. Биосенсор по п. 29, отличающийся тем, что по меньшей мере один белковый компонент, который адаптирован для связывания с детекторной молекулой по меньшей мере одного типа, получен из бактериального белка, связывающегося с антителом.
31. Биосенсор по п. 29, отличающийся тем, что по меньшей мере один компонент белка, который адаптирован для связывания с детекторной молекулой по меньшей мере одного типа, представляет собой домен связывания с антителом, полученный из рецепторного белка FcR или другого рецепторного белка.
32. Биосенсор по п. 29, отличающийся тем, что по меньшей мере один компонент рецепторного комплекса, обычно экспрессируемый на поверхности живой генно-модифицированной клетки, представляет собой IgM; Igα/β; IgE; CD19; CD3ζ или их комбинации.
33. Биосенсор по п. 19, отличающийся тем, что элемент, не являющийся антителом, передающий сигнал, кодируется последовательностью ДНК, обладающей по меньшей мере 95 % идентичностью последовательности ДНК, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11 и 17.
34. Биосенсор по п. 19, отличающийся тем, что элемент, не являющийся антителом, передающий сигнал, является химерным слитым белком, аминокислотная последовательность которого выбрана из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12 и 18.
35. Биосенсор по п. 19, отличающийся тем, что каждый элемент, не являющийся антителом, передающий сигнал, представляет собой растворимый химерный слитый белок, который содержит бактериальный домен связывания с IgG, слитый с константным доменом IgE с помощью линкера GSASGSG (SEQ ID NO: 19).
36. Биосенсор по п. 19, отличающийся тем, что каждый элемент, не являющийся антителом, передающий сигнал, представляет собой растворимый химерный слитый белок, который содержит домен связывания с антителом FcγRI, слитый с константным доменом IgE с помощью линкера GSASGSG (SEQ ID NO: 19).
37. Биосенсор по п. 19, отличающийся тем, что элемент, не являющийся антителом, передающий сигнал, кодируется последовательностью ДНК, обладающей по меньшей мере 95 % идентичностью последовательности ДНК, выбранной из группы, состоящей из SEQ ID NO: 13 и 15.
38. Биосенсор по п. 19, отличающийся тем, что элемент, не являющийся антителом, передающий сигнал, является химерным слитым белком, аминокислотная последовательность которого выбрана из группы, состоящей из SEQ ID NO: 14 и 16.
39. Биосенсор по п. 19, отличающийся тем, что определяемый компонент является пищевым инфекционным агентом.
40. Биосенсор по п. 19, отличающийся тем, что определяемый компонент представляет собой бактерию или вирус.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| СИСТЕМА И СПОСОБ ОБНАРУЖЕНИЯ ТОЧЕЧНОГО ИСТОЧНИКА БИОЛОГИЧЕСКОГО АГЕНТА | 2003 |
|
RU2316748C2 |
| УСТРОЙСТВО ДЛЯ АНАЛИЗА | 2002 |
|
RU2282196C2 |
Авторы
Даты
2020-03-24—Публикация
2016-03-31—Подача