Изобретение относится к области добычи нефти, в частности к увеличению степени извлечения нефти из выработанных месторождений.
Известны многие способы повышения отдачи нефти при различных методах термогазохимической обработки. Так в способе стимулирования процесса добычи нефти предлагается использовать бинарные смеси реагентов, содержащих нитрат аммония, нитрит натрия и гидриды щелочных металлов. (Патент RU 2546694). Основными недостатками данного метода являются:
1. Высокая опасность процесса, т.к. гидриды щелочных металлов легко самовоспламеняются на воздухе, особенно влажной атмосфере;
2. Работа с гидридами щелочных металлов должна проводиться в специально оборудованных помещениях, что невыполнимо в полевых условиях;
3. Низкая экономичность процесса, т.к. стоимость гидридов или алюмогидридов очень высокая; крупнотоннажное производство этих продуктов отстутствует;
4. Реакции нитрата аммония с нитритом натрия образуют соли, в частности нитрат натрия, значительно менее растворимы, чем исходный нитрат аммония:
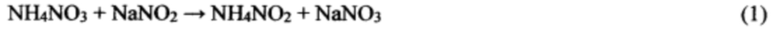
Растворимость нитрата натрия в воде при 20°С составляет 41% по сравнению с 65% нитрата аммония. Менее растворимые соли могут кристаллизоваться в трещинах и капиллярах нефтеносного пласта, особенно с учетом испарения воды в температурной области выше 100°С. Закупорка капилляров и трещин будет затруднять выход нефти из нефтеносного пласта;
В способе термического воздействия на нефтесодержащие и/или керогеносодержащие пласты, включающий образование рабочего агента и подачу его под давлением в нефтесодержащие и/или керогеносодержащие в качестве источника тепла для разогрева нефтеносного пласта используется реактор, содержащий в качестве катализатора наноразмерные частицы благородных металлов или оксиды металлов из группы, включающей золото, платину, палладий, серебро, рутений и т.п. в качестве жидкой топливной смеси используют раствор, содержащий 50% воды, 35% метанола и 15% перекиси водорода. (Патент RU 2447276). Жидкая топливная смесь поступает в реактор, заполненный платиновым или палладиевым катализатором, нанесенным на алюмосиликатный носитель. Продукты окисления метанола смешиваются с газообразной «обогатительной» смесью, состоящей преимущественно из азота (70%), углекислого газа (30%) и катализатора в виде наноразмерных частиц. Основными недостатками этого процесса являются:
1 Высокая опасность, т.к. продукты на выходе из реактора имеют температуру 800-1200°С, что может вызвать загорание углеводородов, содержащихся в пласте;
2 Сложность необходимого оборудования получения инертных газов (азот 70%, углекислый газ (30%)) на нефтепромысле;
3 Высокий расход благородных металлов в качестве катализатора.
В способе добычи вязкой нефти предполагается использовать перекись водорода, как основной источник энергии для разогрева нефтеносного пласта. (Патент RU 2522690). При этом в качестве основного приема, обеспечивающего разделение реакций разложения перекиси водорода и процесса нагрева нефти, содержащейся в удаленной зоне пласта, является создание катализаторной подушки в призабойной зоне.
С этой целью закачивают буровой шлам, содержащий кроме глинистых частиц, обладающих каталитической активностью на разложение перекиси водорода, еще и частиц песка, обеспечивающих проницаемость катализаторной подушки для воды, газов и раствора перекиси водорода.
Основным недостатком предлагаемого способа является повышенная опасность, связанная с образованием взрывоопасных смесей, содержащих кислород, как основной продукт реакции разложения перекиси водорода с газообразными углеводородами (метан, этан, пропан и др.), всегда присутствующими в нефтеносных пластах.
Так же известен способ добычи вязкой нефти. (Патент RU 2534870).
Однако использование в способе предлагаемых газовых смесей является взрыво- и пожароопасным. В таблицах 2-4 показано, что при всех режимах разложения 20-30%-ый перекиси водорода в газообразных продуктах содержится 7-91% кислорода и 9-29 двуокиси углерода (таблица 2); 12,28-8,19% кислорода, 38,5-65,3% аммиака и 24,9-14,1% двуокиси углерода (таблица 3); 78,7-55,2% кислорода, 15,3-37,6% аммиака, 13,6-10% двуокиси углерода (таблица 4). Взрыво- и пожароопасность подобных газовых смесей очень подробно изучена в связи с промышленным производством мочевины отмечается, что все смеси газов подобного состава обладают высокой способностью к воспламенению. («Справочник азотчика», стр. 440, Москва, Химия, 1987 г.) В промышленных условиях, когда строго контролируется состав газовой смеси, обеспечиваются условия безопасности. В полевых условиях, когда нет возможности контролировать состав и управлять составом газов не предоставляется возможность обеспечивать безопасность по рекомендациям патента.
Вторым очень важным недостатком способа является тепловые эффекты разложения бикарбонатов натрия или аммония. Эти реакции изучены очень подробно в связи с разработкой технологии производства мочевины по методу А.Базарова.
Термодинамика производства мочевины основывается на реакциях:
2NH3Г+CO2Г=NH2COONH4Ж+125,6 кДж/моль (30,05 ккал/моль)
H2NCOONH4Ж=CO(NH2)n+Н2ОЖ - 15,49 кДж/моль (3,705 ккал/моль)
В системе газов NH3-CO2-H2O экзотермичным является только образование карбамата и карбоната аммония. При этом тепловыделение в реакции аммиака и углекислоты составляет 30,05 ккал/моль («Справочник азотчика», стр. 255, Москва, Химия 1987 г.).
Обратная реакция распада карбоната или бикарбоната аммония идет с поглощением тепла, а не с выделением. Абсолютная величина имеет то же самое значение, но с обратным знаком. Поэтому нет никаких оснований, что диссоциация бикарбоната и карбоната аммония может пройти количественно. Побочным продуктом синтеза мочевины являются высокоплавкие, трудно растворимые в воде продукты: биурет (Тпл=190°С) и циануровая кислота. Температура плавления самой мочевины (132,7°С) также высокая, таким образом, она может закупоривать капилляры и трещины нефтеносного пласта.
Так же в способе невысокое использование энергетического потенциала перекиси водорода. Теплота реакции разложения перекиси водорода составляет всего:
2H2O2→2Н2О+О2+23,47 ккал/ моль
При этом окислительный потенциал молекулярного кислорода не используется. Более того после образования и выхода в парогазовое пространство молекулярный кислород, смешиваясь с газообразными углеводородами (метан, этан, пропан и т.п.) создает взрывоопасные смеси, что приводит к аварийным ситуациям на нефтепромыслах.
В качестве наиболее близкого аналога выбран способ, раскрытый в патенте №2249684. Данный способ принят нами за протопит.
В заявленном прототипе совпадают признаки заявленного способа, а именно закачивание в призабойную зону скважин состава, включающего перекись водорода, формальдегид, катализатор в виде водного раствора солей металлов переменной валентности.
Целью предлагаемого изобретения является разработка способа термогазохимической обработки нефтеносных пластов, обеспечивающих безопасность процесса и повышение эффективности использования энергетического потенциала всех химических реагентов, применяемых с этой целью.
Поставленная цель достигается тем, что в способе термогазохимической и ударно-волновой обработки нефтеносных пластов, включающем закачивание в призабойную зону скважин восстановительный состав, содержащий нитрат аммония, формальдегид, катализатор окисления простейших алифатических спиртов или метанол, или этанол, или изопропанол и перекись водорода, содержащую ингибитор разложения, согласно изобретению, в призабойную зону закачивают восстановительный состав, содержащий 40-66% нитрат аммония, формальдегид, алифатические спирты, катализатор окисления водные растворы солей металлов с переменной валентностью: FeCl3, Fe(NO3)3, K2CrO4, KMnO4, ингибитор разложения перекиси водорода щавелевую кислоту, добавляемую в 40-60%-ную перекись водорода в количестве 0,5-5,0%, продукты окисления содержат только газообразные азот или углекислый газ и воду, для обеспечения ударно-волнового воздействия на нефтеносный пласт осуществляют частичную нейтрализацию восстановительного раствора содой или аммиачной водой до рН=5,0-7,0, с образованием мощного взрывчатого вещества гексаметилентрипероксиддиамин, который разлагается в нефтеносном пласте, образуя трещины и капилляры, по которым нефть поступает в зону углеводородов и повышает эффективность использования энергетического потенциала применяемых реагентов, при этом восстановительный состав готовят растворением нитрата аммония в 37-40%-ном растворе формальдегида и перед добавлением перекиси водорода выдерживают не менее 2 часов, а катализатор окисления содержит соли металлов с переменной валентностью с концентрацией 3-6%.
Принципиальным в предлагаемом способе является гарантированная безопасность на всех ступенях технологического процесса. Наряду с гарантией безопасности предполагаемый способ в 3÷4 раза увеличивает эффективность использования энергетического потенциала используемых реагентов.
В призабойную зону закачивают восстановительный состав, содержащий 40÷66%-ый нитрат аммония, формальдегид, алифатические спирты, катализатор окисления и 40÷60%-ную перекись водорода. Раствор нитрата аммония в 37÷40%-ом растворе формальдегида выдерживают перед добавлением перекиси водорода не менее 2 часов, добавляют спирт (метанол, изопропанол) либо муравьиную кислоту и ингибитор разложения перекиси водорода, в качестве которого используют щавелевую кислоту с концентрацией 0,5÷5%. Муравьиная кислота также обнаруживается при окислении формальдегида или метанола перекисью водорода восстанавливает нитрат аммония до нитрита аммония, который в свою очередь разлагается на азот и воду.
Для обеспечения ударно волнового воздействия восстановительный состав обрабатывают 15÷25%-ой аммиачной водой или раствором соды, повышая рН среды до 5-7 с образованием мощного взрывчатого вещества гексаметилентрипероксиддиамин, который взрывообразно разлагается в нефтеносном пласте, увеличивая трещины и капилляры, по которым нефть поступает в зону углеводородов.
Газы, образующиеся при восстановлении нитрата аммония и последующем разложении содержат 16% азота и 24% углекислого газа и не содержат кислорода, что исключает образование взрывоопасных смесей с углеводородами, присутствующими в парогазовой фазе нефтеносного пласта.
Наиболее активным восстановителем нитрата аммония является муравьиная кислота, восстанавливающая нитрат аммония в нитрит аммония. Окислительно-восстановительные реакции с использованием формальдегида, нитрата аммония, алифатических спиртов и перекиси водорода повышает тепловой эффект реакции в 4-5 раз по сравнению с тепловым эффектом реакции разложения перекиси водорода. Ингибитором разложения перекиси водорода под действием ржавчины, содержащейся на стенках труб НКТ, является щавелевая кислота.
В предлагаемом способе используются окислительно-восстановительные реакции с простейшими органическими продуктами, обладающие восстановительными свойствами. В качестве малоактивного окислителя используют нитрат аммония. В качестве высокоактивного окислителя применяют перекись водорода, которая окисляет восстановители метанол, или формальдегид, или изопропанол с образованием муравьиной кислоты. Катализатором являются соли металлов с переменной валентностью FeCl3, Fe(NO3)3, K2CrO4, KMnO4 и т.д Основу использования реакций составляет способность нитрата аммония взаимодействовать с муравьиной кислотой по схеме:
NH4NO3+НСООН→CO2+NH4NO2+H2O
NH4NO2→H2O+NH2NO
NH2NO→N2+H2O
Сумма реакций:
NH4NO3+НСООН→CO2+N2+3H2O+121,69 ккал/моль
Окисление простейших органических восстановителей метанола, или формальдегида или изопропанола перекисью водорода дает муравьиную кислоту, которая реагирует с нитратом аммония, обеспечивая глубокую конверсию, как восстановителей, так и окислителей. кат.
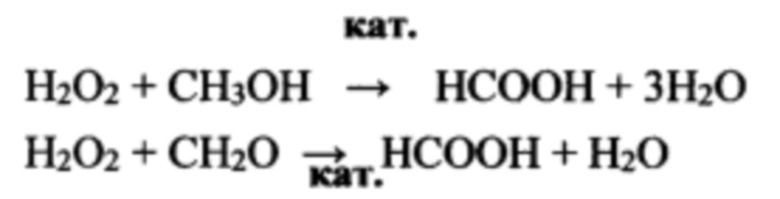
Окисление формальдегида и метанола требует присутствия катализаторов, которыми являются соли тяжелых металлов FeCl3, Fe(NO3)3, K2CrO4, KMnO4 и др.
Каталитическое окисление метанола или формальдегида может протекать частично и глубже, чем с образованием муравьиной кислоты.
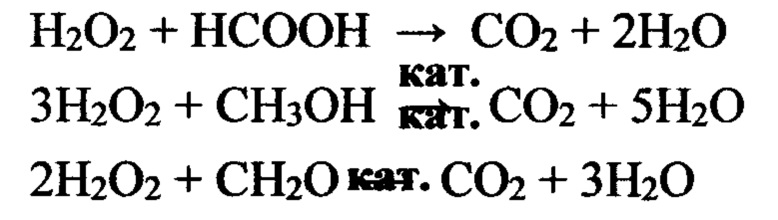
Конечными продуктами для всех реакций являются газы N2 и CO2 и вода, что исключает возможность закупорки капилляров и трещин высокоплавкими продуктами - мочевина, биурет, циануровая кислота.
Расчеты тепловых эффектов реакций перекиси водорода и нитрата аммония приведены в таблице 1. Из этих данных видно, что каталитическое разложение перекиси водорода дает всего 659 ккал/кг перекиси. Более глубокое использование энергетического потенциала перекиси с окислением метанола или формальдегида до муравьиной кислоты или углекислого газа может дать 2523÷2814 ккал/кг перекиси, что в 3,8-4,27 раза больше, чем для простого каталитического разложения перекиси.
Наибольший уровень использования энергетического потенциала достигается при использовании двух реакций, а именно при совместном применении перекиси водорода и нитрата аммония в качестве окислителей (реакции 8-10 таблицы 1). Использование формальдегида в качестве восстановителя для перекиси водорода и нитрата аммония дает наиболее высокий тепловой эффект: 2594 ккал/кг нитрата аммония. Для сравнения с максимально возможным тепловым эффектом в таблице 1 приведен расчет теплового эффекта для бинарного состава на основе реакции нитрата аммония и нитрита натрия (реакция 12): 1139 ккал/кг нитрата аммония, что в 2,3 раза меньше, чем для реакции 10 с использованием перекиси водорода и формальдегида.
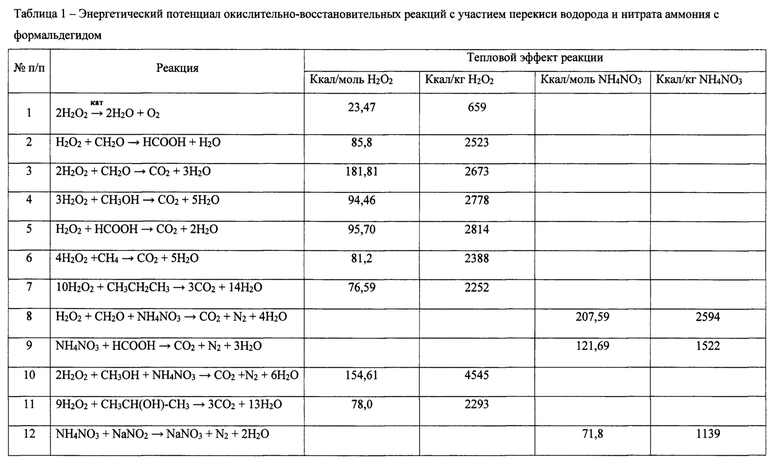
Предлагаемый нами способ не ограничивается только простейшими восстановителями метанол, формальдегид, муравьиная кислота. Применение изопропанола (реакция 11) позволяет получить тепловой эффект 2293 ккал/кг перекиси. Существует возможность участия углеводородов в аналогичной реакции. Примером окисления метана является реакция 6, но ввиду низкой растворимости метана в реакционном растворе вклад реакции 6 в суммарный тепловой эффект незначителен. Кроме реакции окисления формальдегида или метанола перекисью водорода, реальный вклад в образование муравьиной кислоты и соответственно в суммарный тепловой эффект может иметь реакция Плехля, открытая в 1888 году. Наиболее подробно эта реакция изучена на примере взаимодействия хлорида аммония и формальдегида.
2CH2O+NH4Cl→СНООН+CH3NH3Cl
P. Knudson установил, что в растворах формалина образование муравьиной кислоты начинается уже при 40°С (P. Knudsen, Chem.Ber., 1914, 47, 2694).
Н. Emde и Т. Hornemann показали, что в температурной области 75-80°С эта реакция обладает значительным тепловым эффектом с одновременным образованием углекислого газа:
3СН2О+2NH4Cl→2CH3NH3Cl+СО2
Для нитрата аммония реакция Плехля может быть представлена уравнениями:
2CH2O+NH4NO3→НСООН+CH3NH3NO3
НСООН+CH3NH3NO3→CO2+CH3NH3NO2+H2O
CH3NH3NO2→CH3-NH-NO+H2O
CH3NH-NO→N2+СН3ОН
Брутто уравнение:
2CH2O+NH4NO3→CO2+N2+СН3ОН+2H2O
В суммарном итоге реакция Плехля дает только газообразные продукты и метанол также, как и окисление простейших восстановителей перекисью водорода
Экспериментальное исследование реакций простейших восстановителей с перекисью водорода, протекающих в водном растворе, показало, что во всех случаях реакция протекает в жидкой фазе с быстрым повышением температуры до точки кипения (90-100°С).
Добавление нитрата аммония к реакционному раствору увеличивает интенсивность реакции, и температура повышается до 110-130°С в зависимости от содержания воды. При недостаточном количестве воды реакционная смесь бурно кипит с выделением бесцветных газов (СО2 и N2), и содержимое реакционного сосуда выбрасывается наружу.
Для сопоставления тепловых эффектов часть экспериментов проводили с искусственно завышенным содержанием воды. В таких случаях удавалось осуществить реакцию без выброса и замерить убыль массы за счет газовыделений и испарений воды. Такие эксперименты позволяют сравнить реальную убыль массы (сумма газообразных продуктов и испаренной воды) с теоретическим количеством кислорода, которое могло бы быть получено только за счет реакции разложения перекиси водорода. Результаты представлены в таблицах 2-4.
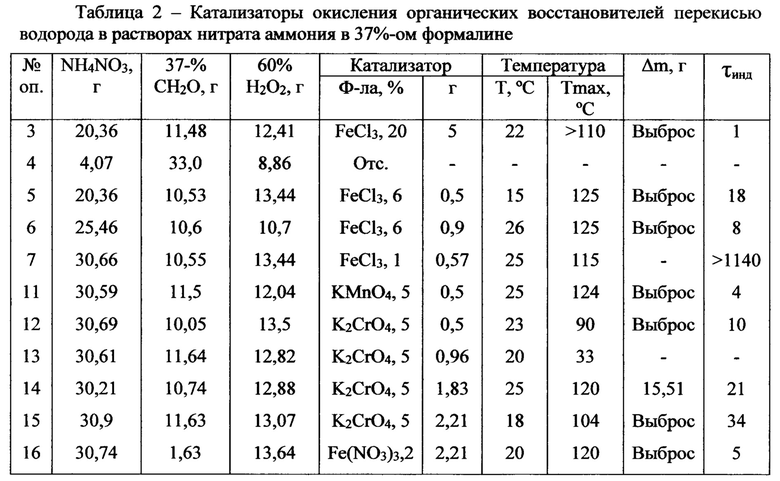
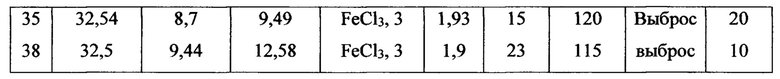
В таблице 2 приведены экспериментальные данные по использованию различных катализаторов для инициирования реакции окисления перекисью водорода. Использования перманганата калия и нитрата трехвалентного железа малопригодно для практического использования из-за очень энергичной реакции. Наиболее удобным оказалось применение 3%-го раствора хлорида железа, который можно добавлять к раствору применяемого формалина или к раствору нитрата аммония в формальдегиде
Для выяснения влияния природы аниона в реакции восстановления в некоторых экспериментах использовали нитрат натрия вместо нитрата аммония. В этом случае реакция описывается уравнением:
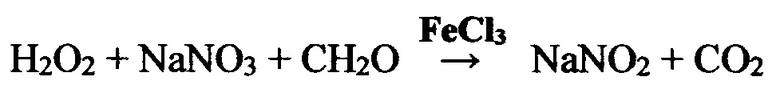
Температура быстро повышается до 100-107°С и происходит выброс. Уменьшая количество взятой перекиси водорода (оп. 76, таблица 3) можно сделать реакцию более спокойной и не допустить выброса. Убыль массы в этом эксперименте составила 1,78 г при теоретическом количестве кислорода 1,51 г за счет разложения перекиси водорода.
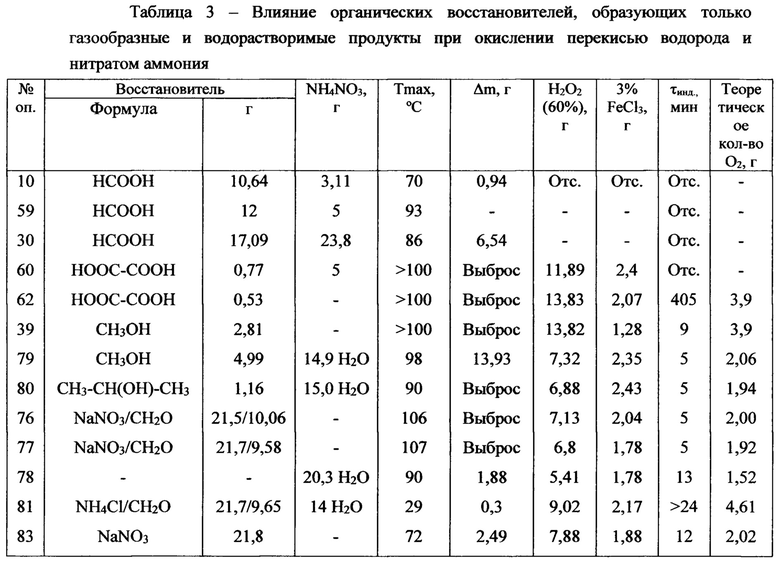
Использование хлорида аммония вместо натриевой или аммиачной селитры в присутствии формальдегида не обнаруживает тепло- или газовыделения в течение 240 минут (оп. 81, таблица 3).
Применение изопропилового спирта в качестве восстановителя (оп. 80, таблица 3) показывает высокую активность в данной реакции. Все опыты, кроме оп. 10, 30 и 59, проводились с применением 3%-го раствора FeCl3. Газы, выделяющиеся в оп. 59 таблицы 3, анализировали на газовом хроматографе. Состав газов, выделяющихся в реакции муравьиной кислоты: азот (76%), двуокись углерода (24%), кислород не обнаружен.
Образование воды и инертных газов в продуктах реакции исключает возможность образования взрывоопасных смесей с газообразными углеводородами, всегда присутствующими в нефтеносных пластах.
Использование кислорода, содержащегося в молекуле перекиси для глубокого окисления органических восстановителей не только повышает коэффициент использования энергетического потенциала применяемых реагентов, но одновременно принципиально повышает безопасность термогазохимической обработки нефтеносного пласта.
Еще одним важным параметром, обеспечивающим безопасность процесса является индукционный период от смешения катализатора окисления с перекисью водорода до начала энергичной реакции тепло- и газовыделения. В таблицах 2-4 показано, что некоторые сочетания восстановителей и перекиси водорода обнаруживают индукционный период 5-10 минут, что недостаточно для завершения операции закачки растворов в нефтеносный пласт. Влияние различных параметров на величину индукционного периода наиболее энергетичной системы Н2О2 - СН2О - NH4NO3 - 3% раствор FeCl3 приведены в таблице 4. Из этих данных видно, что основной параметр, определяющий величину индукционного эффекта, является время взаимодействия раствора нитрата аммония с формальдегидом перед добавлением к этому раствору 60%-ой перекиси водорода.
Известно, что конденсация нитрата аммония при низких температурах приводит к образованию солей гексаминия. Структуру оснований Кнудсена установили английские химики (М.Е. Foss и соавторы, J. Chem. Soc 1950, 624 - 628, 1691 - 1695). В основе этих соединений лежит ядро уротропина, связанное с метилольными или метиловыми группами. Реакция образования описывается схемой:
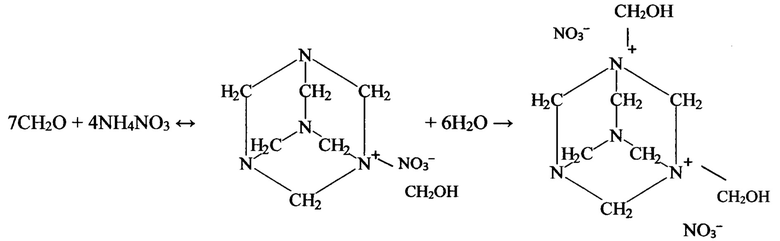
Когда время конденсации недостаточно для завершения вышеприведенной реакции в свободном состоянии остается большое количество формальдегида, который очень быстро реагирует с перекисью.
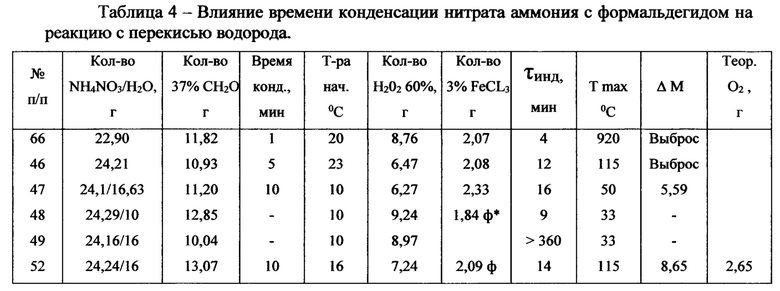
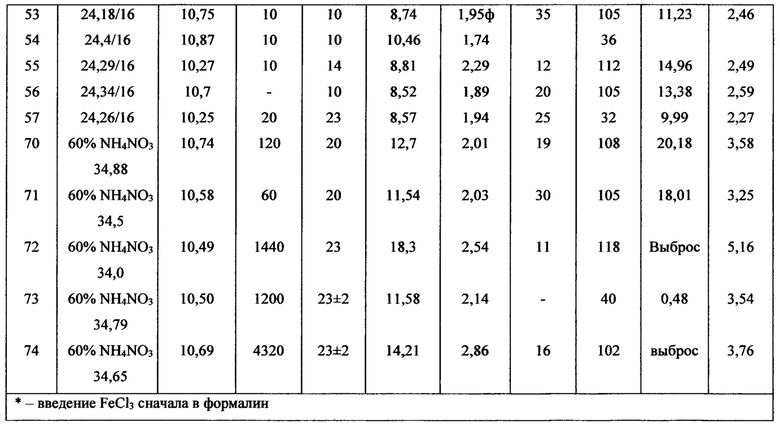
Время конденсации формальдегида с нитратом аммония около 1 мин сопровождается очень коротким 4 мин индукционным периодом. Увеличение времени конденсации до 30 и до 60 мин увеличивает индукционный период до 24 и до 60 мин соответственно, а при времени конденсации 120 мин инициировать реакцию окисления добавлением 2,0±0,1 - 3%-ного FeCl3 вообще не удается. Такое поведение можно объяснить сильным смещения обратимых реакций образования солей гексаминия вправо. В этих случаях инициировать окислительный процесс легко удается увеличением количества добавляемой 60%-ной перекиси водорода на 10÷15% и соответственно и 3%-ного FeCl3. Увеличение времени конденсации до 3 суток (оп. 74, таблица 4) при комнатной температуре инициируется увеличением количества перекиси водорода на 20%, с индукционным периодом 16 мин. Эти данные приведены в таблице 4.
Существенное значение имеет чистота труб НКТ, по которым осуществляется закачивание реагентов в нефтяносный пласт. Ржавчина на стенках труб катализирует разложение перекиси водорода, как было установлено нами на стендовой установке. Дезактивировать нежелательное влияние ржавчины можно добавлением различных комплексообразователей к перекиси водорода. Весьма удобным стабилизатором оказалась щавелевая кислота. Добавление 1,6% щавелевой кислоты к 13,83 г 60%-ной перекиси водорода и последующее добавление 2,0 г 3%-ного раствора FeCl3 увеличивает индукционный период до 405 мин. Добавление 6,4% щавелевой кислоты увеличивает индукционный период на более чем 8 часов. Стабилизирующее действие щавелевой кислоты на каталитическое разложение перекиси водорода очевидно связано с образованием стабильного комплекса 3-х валентного железа. Константа не стойкости Fe(Ox)3-3 при 25 равна 6,3*10-21 (Справочник химика, т. III, стр. 153, Химия, 1964).
Тепловые эффекты разложения перекиси водорода, нитрата аммония и формальдегида обеспечивают повышение температуры реакционной смеси до 200-300°С с одновременным повышением давления до 200-250 атм, что ускоряет выделение углеводородов из нефтеносного пласта. Энергетический потенциал компонентов восстановительной смеси при этом растянут во времени от 10 до 60 минут. Мы нашли, что выделение тепла и газов в вышеприведенных реакциях можно многократоно ускорить за счет ударно волнового воздействия на инертную породу пласта. Это достигается за счет превращения первичных продуктов конденсации перекиси водорода с формальдегидом и нитратом аммония с образованием гексаметилентрипероксиддиамина - мощного взрывчатого вещества, имеющего строение:
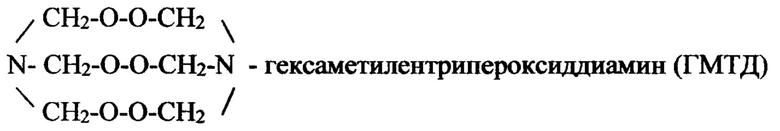
Первичные реакции, протекающие после смешения компонентов восстановительного раствора можно представить следующими уравнениями:
Образование моно-, ди- и триметилоламинов
NH4NO3+СН2О→HOCH2NH3+NO3 (нитрат монометилоламина)
HOCH2NH3+NO3+СН2О→(НОСН2)2NH2+NO3 (нитрат диметилоламина)
(HOCH2)2NH2+NO3+СН2О→(HOCH2)3NH+NO3- (нитрат триметилоамина)
Пероксид производные формальдегида и метилольных производных нитрата аммония представляют собой сложную смесь метилольных производных, хорошо растворимую в воде. Восстановительный раствор остается гомогенным в течение 2-3 суток, при этом рН на уровне 0-1. При нейтрализации такого гомогенного раствора содой или аммиачной водой с повышением рН до 5-6,5 наблюдается образование белого кристаллического продукта - гексаметилентрипероксиддиамина ГМТДА.
Физические и взрывчатые свойства ГМТДА идентичны описанным в монографии Л.И. Багал «Химия и технология инициирующих взрывчатых веществ» (Москва, «Машиностроение, стр. 410, 1975 г). Температура вспышки зависит от скорости нагревания и составляет 200°С при секундной задержке, 139°С при скорости нагревания 20 град. в мин. Скорость детонации при плотности 0,88 г/см3 4511 м/с, при плотности 1,10 г/см3 5100 м/с.
Уравнение взрывчатого разложения:
C6H12N2O6→0,35СО2+3,88СО+0.03С2Н2+0.55CH4+244Н2+1,42H2O+0,47N2+0,58HCN+0,58С
Ниже приведены примеры, иллюстрирующие сущность предлагаемого изобретения, демонстрируя значительное увеличение теплового эффекта за счет добавления к раствору нитрата аммония в перекиси водорода. Оценку теплового эффекта по конечной температуре реакции и по убыли веса, которая состоит из двух слагаемых: газообразные продукты и воды испаряющейся за счет теплового эффекта.
Пример 1
Взаимодействие муравьиной кислоты с нитратом аммония в отсутствии перекиси водорода и катализатора окисления.
а) с 85%-ной муравьиной кислотой
В коническую колбу засыпали 23,8 г сухого нитрат аммония и приливали 15 мл 85%-ной муравьиной кислоты при температуре 22°С. Через 10 минут температура за счет экзотермической реакции окисления муравьиной кислоты повышалась до 42°С и весь нитрат аммония растворился через 60 минут температура повышалась до 92°С и наблюдалось бурное выделение газов и температура постепенно снизилась до 28°С. Убыль веса составила 6,54 г. Хроматографический анализ газов показал, что образующиеся газы содержат 76% азота и 24% двуокиси углерода.
б) Реакция нитрата аммония с 90% муравьиной кислотой.
Реакция с использованием 11,8 г 90%-ной муравьиной кислоты вместо 85%-ной протекает аналогичным образом с единственным отличием в том, что снимаемая температура за 1 минуту повысилась до 90°С с бурным выделением бесцветных газов и последующим выбросом содержимого колбы при температуре 106°С.
Анализ газов в вышеприведенных примерах доказывает, что муравьиная кислота окисляется до образования двуокиси углерода, при этом восстанавливая нитрат аммония до нитрита аммония, который в свою очередь экзотермически разлагается на азот и воду.
Пример 2
Реакция 60%-ной перекиси водорода с метанолом.
К 13,87 г 60%-ной перекиси водорода при 25°С добавляли 2,81 г чистого метанола. Температура повышалась до 28°С через 5 минут, а затем постепенно понижалась до комнатной, 26°С. За 18 часов реакции при комнатной температуре убыль веса составила 0,02, что соответствует разложению 0,5% от исходного количества перекиси водорода. После 18 часов реакции без катализатора к раствору было добавлено 1 мл 3%-ного раствора хлорида железа FeCL3, через 9 минут экзотермической реакции температура повысилась до 100°С и содержимое колбы выбросило наружу.
Пример 3
Реакция перекиси водорода с формальдегидом в присутствии нитрата аммония.
К 12,65 г 60%-ной перекиси водорода присыпали 20,2 г нитрата аммония. Температура при этом понижалась до 8°С, что указывает на поглощение тепла при растворении селитры аналогично процессу реакции растворения в воде. При хранении этого раствора (содержание нитрата аммония 61,49%) сопровождается повышением температуры до комнатной, 26°С. Дальнейшее хранение раствора при комнатной температуре полученного эквимолярного раствора Н2О2 : NH4NO3 при 25-27°С в течении 24 часов не наблюдается уменьшение веса, что свидетельствует об уменьшении скорости разложения перекиси водорода. После суточного хранения к полученному раствору прилили 10 мл 37%-ного формальдегида (13,2 г/4,90 г/0,16 моль CH2O). При стоянии полученного раствора температура в течении 1,5 часов медленно повышалась до 43,5°С, без уменьшения веса. рН этого раствора понизилось до 1,0. Дальнейшее хранение раствора при комнатной температуре продолжалось в течении 4х суток. Температура в течении 2х часов снизилась до 26,5°С, через 4 суток общего времени реакции после добавления формальдегида убыль массы составила ~0,6 г, что связано с небольшим испарением воды. К раствору после 5 суток общего времени реакции добавили 0,5 мл 20%-ного раствора хлорида железа через 5 минут температура повысилась до 32°С, а через 8 минут до 105°С и произошел выброс.
Аналогичный опыт с использованием в качестве катализатора 5 мл 2%-ного раствора хлорида железа закончился подъемом температуры выше 105°С с выбросом.
Пример 4
Реакция нитрата аммония и перекиси водорода с изопропанолом.
К 15 мл воды добавили 21,5 г нитрата аммония, 1,5 мл (1,16 г) изопропанола и 2,4 г 3%-ного раствора хлорида железа при 25°С. К полученному раствору прилили 6,88 г 60%-ной перекиси водорода. Температура повысилась с 25°С до 32°С и затем в течении 5 минут температура повысилась до 90°С и произошел выброс.
Пример 5
Реакция нитрата натрия с формальдегидом и перекисью водорода.
К суспензии 21,85 г нитрата натрия в 24 мл воды добавили 10 мл 37%-ного формальдегида и 2,3 мл (1,88 г) хлорида железа. При 8°С к полученному раствору добавили 7,88 г 60%-ной перекиси водорода. Образуется раствор коричневого цвета который за 12 минут за счет тепла реакции повышает температуру до 72°С. Наблюдается интенсивное выделение бесцветных газов. После 2 часов реакции температура снижается до 28°С и прекращается газовыделение. Суммарная убыль веса составляет 2,49 г. Теоретическое количество кислорода при разложении 7,78 г перекиси составляет 2,12 г. Убыль массы за счет испарения воды таким образом составляет 0,37 г.
Пример 6
Реакция хлорида аммония с перекисью водорода в присутствии хлорида железа.
К суспензии 21,73 г хлорида аммония в 14 мл воды добавили 2,17 г 3%-ного раствора хлорида железа и 10 мл 37%-ного формальдегида. Затем добавили 9,02 г 60% -ной перекиси водорода, образовалась ярко желтая суспензия. В течении 1 часа температура постепенно повышается до 29°С. Убыль массы при этом составляет 0,1 г. После 2 часовой реакции убыль массы 0,2 г при 26°С, после 4 часов реакции убыль массы 0,3 г.
Таким образом, катион аммония и анион хлора, являются инертными. По отношению к перекиси водорода они не принимают участия в реакциях сопровождающихся тепловыделением.
Пример 7
Реакция разложения перекиси водорода в присутствии хлорида железа в разбавленном растворе.
К 5 мл (5,41 г) 60%-ной перекиси водорода добавили 20,33 г воды и 1,78 г 3%-ного раствора хлорида железа. Температура повышалась с 22 до 29°С. Образовался гомогенный коричневый раствор, через 5 минут температура повысилась до 34°С, через 8 минут до 48°С и через 10 минут до 90°С и затем стала снижаться. Через 2 часа температура достигла комнатной. Суммарная убыль массы 1,88 г. Теоретическое количество кислорода при разложении 3,24 г Н2О2 составляет 1,52 г, т.е. на долю испарения воды приходится 0,36 г.
Пример 8
Получение ГМТД
а) с использованием карбоната натрия (соды)
К 24.19 г нитрата аммония приливали 11,6 г 60%-ой перекиси водорода, температура при этом понизилась до 4°С. Через 10 минут добавили 25 мл 37%-го формальдегида. Температура постепенно повышается до 35°С и затем постепенно уменьшается до 22°С. После выдержки в течение суток к гомогенному раствору, имеющему рН=0, добавляется карбонат натрия (5 г порциями по 0,5 г) После достижения рН 5,5 начинается кристаллизация белого продукта, который отфильтровывали, промывали водой и сушили на воздухе до постоянного веса. Выход 4,44 г (96%). Продукт ярко вспыхивает от пламени спички.
б) с использованием аммиачной воды
По методике аналогичной вышеприведенной для нейтрализации восстановительного раствора 20%-ой аммиачной водой вместо соды получали ГМТД с выходом 69%.
Ниже приведен пример осуществления предлагаемого способа.
Коническую колбу последовательно наполняют 12,65 г 60%-ной перекисью водорода затем насыпают 20,2 г нитрата аммония. Температура при этом понижалась до 8°С, что указывает на поглощение тепла при растворении селитры аналогично процессу реакции растворения в воде. Через 24 часа хранения к полученному раствору приливают 10 мл 37%-ного формальдегида (13,2 г/4,90 г/0,16 моль СН2О). Температура полученного раствора в течении 1,5 часов медленно повышалась до 43,5°С, без уменьшения веса, рН этого раствора понизилось до 1,0. Далее к раствору добавляют 10 мл спирта метанрола и хранят раствор при комнатной температуре в течение 2х часов. Температура в течении 2х часов снизилась до 26,5°С, наблюдалась небольшое газообразование, за счет разложения нитрита аммония. Затем к раствору добавляют 0,5 мл 20%-ного раствора хлорида железа и через 3 минуты температура повысилась до 41°С, а через 6 минут до 105°С и произошел выброс.
Выделение тепла и газов в вышеприведенной реакции можно многократно ускорить за счет ударно волнового воздействия на инертную породу пласта. Для этого восстановительный состав обрабатывают 15÷25%-ой раствором соды, повышая рН среды до 5-7 и наблюдают образование кристаллического белого продукта гексаметилентрипероксиддиамина - мощного взрывчатого вещества. Его отфильтровывают, промывают водой и высушивают на воздухе до постоянного веса.
| название | год | авторы | номер документа |
|---|---|---|---|
| Термогазохимический бинарный состав и способ применения для обработки призабойной и удаленной зон нефтегазоносного пласта | 2015 |
|
RU2637259C2 |
| Способ термокислотной обработки нефтегазоносных пластов (варианты) | 2017 |
|
RU2675617C1 |
| СПОСОБ РАЗРАБОТКИ НЕФТЯНОГО МЕСТОРОЖДЕНИЯ | 2005 |
|
RU2283949C1 |
| ЭНЕРГОГАЗООБРАЗУЮЩИЙ СОСТАВ И ТЕХНОЛОГИЯ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПРОДУКТИВНОГО ПЛАСТА | 2014 |
|
RU2615543C2 |
| СПОСОБ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА | 2009 |
|
RU2440490C2 |
| СПОСОБ ЭПОКСИДИРОВАНИЯ ОЛЕФИНА | 1995 |
|
RU2154641C2 |
| ТЕРМОГАЗОХИМИЧЕСКИЙ СОСТАВ И СПОСОБ ПРИМЕНЕНИЯ ДЛЯ ОБРАБОТКИ ПРИЗАБОЙНОЙ И УДАЛЕННОЙ ЗОНЫ ПРОДУКТИВНОГО ПЛАСТА | 2012 |
|
RU2525386C2 |
| СОСТАВ ДЛЯ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА С ТРУДНОИЗВЛЕКАЕМЫМИ ЗАПАСАМИ НЕФТИ | 2003 |
|
RU2249684C1 |
| СПОСОБ ЭПОКСИДИРОВАНИЯ ОЛЕФИНА | 1996 |
|
RU2140415C1 |
| СПОСОБ ТЕРМОХИМИЧЕСКОГО РАЗРЫВА ПЛАСТА | 2012 |
|
RU2527437C2 |
Изобретение относится к области нефтедобывающей промышленности, в частности к увеличению степени извлечения нефти из выработанных месторождений. Способ включает закачивание в призабойную зону скважин восстановительного состава, содержащего нитрат аммония, формальдегид, катализатор окисления простейших алифатических спиртов метанол, или этанол, или изопропанол и перекись водорода, содержащую ингибитор разложения. Продукты окисления содержат только газообразные азот или углекислый газ и воду. В качестве инициатора окисления алифатических спиртов метанола, или этанола, или изопропапола используют водные растворы солей металлов с переменной валентностью: FeCl3, Fe(NO3)3, K2CrO4, KMnO4. В качестве ингибитора разложения перекиси водорода используют щавелевую кислоту, добавляемую в восстановительный состав, или 40-60%-ную перекись водорода в количестве 0,5-5,0%. Содержание нитрата аммония в восстановительном составе 40-66%. Используется перекись водорода с концентрацией 20-60%. Восстановительный состав готовят растворением нитрата аммония в 37-40%-ном формалине, перед добавлением перекиси водорода выдерживают не менее 2 часов. Инициатор окисления органических спиртов содержит соли металлов с переменной валентностью с концентрацией 3-6%. Для обеспечения ударно-волнового воздействия на нефтеносный пласт осуществляют частичную нейтрализацию восстановительного раствора содой или аммиачной водой до рН=5,0-7,0. Обеспечивается безопасность процесса, повышается эффективность использования энергетического потенциала всех химических реагентов. 2 з.п. ф-лы, 3 табл., 8 пр.
1. Способ термогазохимической и ударно-волновой обработки нефтеносных пластов, включающий закачивание в призабойную зону скважин восстановительного состава, содержащего нитрат аммония, формальдегид, катализатор окисления простейших алифатических спиртов или метанол, или этанол, или изопропанол и перекись водорода, содержащую ингибитор разложения, отличающийся тем, что в призабойную зону закачивают восстановительный состав, содержащий 40-66%-ый нитрат аммония, формальдегид, алифатические спирты, катализатор окисления спиртов водные растворы солей металлов с переменной валентностью: FeCl3, Fe(NO3)3, K2CrO4, KMnO4, ингибитор разложения перекиси водорода щавелевую кислоту, добавляемую в 40-60%-ную перекись водорода в количестве 0,5-5,0%, продукты окисления содержат только газообразные азот или углекислый газ и воду, для обеспечения ударно-волнового воздействия на нефтеносный пласт осуществляют частичную нейтрализацию восстановительного раствора содой или аммиачной водой до рН=5,0-7,0, с образованием мощного взрывчатого вещества гексаметилентрипероксиддиамин, который разлагается в нефтеносном пласте, образуя трещины и капилляры, по которым нефть поступает в зону углеводородов и повышает эффективность использования энергетического потенциала применяемых реагентов.
2. Способ по п. 1, отличающийся тем, что восстановительный состав готовят растворением нитрата аммония в 37-40%-ном растворе формальдегида и перед добавлением перекиси водорода выдерживают не менее 2 часов.
3. Способ по п. 1, отличающийся тем, что катализатор окисления содержит соли металлов с переменной валентностью с концентрацией 3-6%.
| СОСТАВ ДЛЯ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА С ТРУДНОИЗВЛЕКАЕМЫМИ ЗАПАСАМИ НЕФТИ | 2003 |
|
RU2249684C1 |
| ЭНЕРГОГАЗООБРАЗУЮЩИЙ СОСТАВ И ТЕХНОЛОГИЯ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПРОДУКТИВНОГО ПЛАСТА | 2014 |
|
RU2615543C2 |
| СПОСОБ ДОБЫЧИ ВЯЗКОЙ НЕФТИ | 2013 |
|
RU2534870C2 |
| СОСТАВ ДЛЯ ТЕРМОГАЗОХИМИЧЕСКОЙ ОБРАБОТКИ СКВАЖИН | 1988 |
|
RU2100583C1 |
| СПОСОБ РАЗРАБОТКИ НЕФТЯНОГО МЕСТОРОЖДЕНИЯ | 2005 |
|
RU2278250C1 |
| US 2016244659 A1, 02.02.2016. | |||
Авторы
Даты
2020-03-18—Публикация
2018-12-19—Подача