Область техники, к которой относится изобретение
Настоящее изобретение касается гетероарильных производных или их фармацевтически приемлемой соли, способа их получения и фармацевтической композиции, содержащей указанные соединения в качестве действующего вещества, для профилактики или лечения заболеваний, связанных с PI3 киназами.
Предшествующий уровень техники
По представлениям модели жидкой мозаики, мембрана эукариотических клеток неровная, и она может свободно двигаться или укрепляться, формируя особый участок, называемый липидный рафт. Этот липидный рафт богат холестерином, чтобы не допустить лизиса мембраны детергентом. Некоторые белки предпочитают липидное прикрепление, а не гидрофобное трансмембранное закрепление. Фосфатидилинозитол представляет собой внутриклеточный белок, найденный в липидном рафте на клеточной мембране, который присоединен к клеточной мембране жирной кислотой или пренильной связью. Липидный рафт очень динамичен и может коагулировать белки, переводя их в очень активное состояние.
Фосфорилирование белков, осуществляемое при посредстве киназ, является важным путем регуляции физиологической активности в клетке. Активность многих ферментов регулируется фосфорилированием, осуществляемым при посредстве киназ. Другая важная роль опосредуемого киназами фосфорилирования является создание сайта связывания с белком. То есть, другие белки собираются в сайте связывания в фосфорилированной области и связываются в нем без изменения индивидуальных особенностей фосфорилированного белка. Многие киназы, участвующие в передаче сигнала, находятся в липидном рафте на внутриклеточной поверхности клеточной мембраны. Когда мембраносвязанный белок фосфорилируется при активации рецептора на поверхности клетки, фосфорилированный участок становится сайтом связывания белка для свободноплавающих белков. Эти целевые белки неактивны, когда они свободно плавают неприкрепленными в цитоплазме, но становятся фосфорилированными и активными, когда они собираются в сайте связывания, увеличивая свою концентрацию.
Фосфатидилинозитол 3-киназа (PI3 киназа; PI3K) представляет собой липидкиназу, ответственную за фосфорилирование липидной молекулы вместо белка, что играет важную роль в выживании клетки, передаче сигнала и контроле переноса через мембрану. При появлении проблем в любом из перечисленных путей регуляции, развиваются заболевания, такие как рак, воспалительное заболевание и аутоиммунное заболевание.
Передача сигнала в клетке через 3'-фосфорилированный фосфоинозитид связана с различными клеточными процессами, такими как злокачественное преобразование, передача сигнала фактора роста, воспаление и иммунитет. PI3 киназа, участвующая в генерации фосфорилированного продукта при передаче сигнала, впервые была идентифицирована в ходе исследования взаимодействия между вирусным онкогенным белком, который вызывал фосфорилирование фосфатидилинозитола (PI), и его фосфорилированным производным по 3-ОН группе инозитольного кольца и тирозинкиназой рецептора фактора роста.
Концентрация фосфатидилинозитол-3,4,5-трифосфата (PIP3), первичного продукта активации PI3 киназы, повышается при обработке клетки различными стимулами, примерами которых являются фактор роста и воспалительные стимулы, гормоны, нейротрансмиттеры и передача сигнала, опосредованная антигенным рецептором, и т.д. Таким образом, активация PI3 киназы, хотя она и не является доминирующей, является одним из механизмов передачи сигналов у млекопитающих, связанных с активацией рецепторов на поверхности клетки. Поэтому считают, что активация PI3 киназы задействована в различных типах клеточного ответа, включая рост клетки, миграцию, дифференциацию и апоптоз.
PI3 киназа представляет собой фермент для фосфорилирования 3-го положения (3-OH) инозитольного кольца фосфатидилинозитола с помощью АТФ (аденозинтрифосфата). А именно, PI3 киназа фосфорилирует 3'-OH группу инозитольного кольца фосфатидилинозитола, превращая PIP2 в PIP3. PIP3 затем работает как сайт связывания для протеинкиназ, имеющих плекстрин-гомологичный домен. Эти протеинкиназы регулируют важные клеточные функции. Среди PIP3-связываемых протеинкиназ наиболее важной является серинтреонинкиназа AKT или PKB (протеинкиназа B), которая регулирует рост клетки, выживание клетки и деление клетки, посредством находящихся далее в пути передачи сигнала mTOR, GSK3β, Foxo 3a, p70S6K и NF-κB.
Первичной очисткой и молекулярным клонированием PI3 киназы было подтверждено, что PI3 киназа представляет собой гетеродимер, состоящий из субъединиц p85 и p110. По гомологии последовательностей и субстратной специфичности, она принадлежит к классу I, а класс I также делится на класс IA и класс IB.
Класс IA включает PI3Kα, PI3Kβ и PI3Kδ, и класс IA располагается ниже RTK (рецепторной тирозинкиназы) в пути регуляции. Класс IB представляет PI3Kγ, и он располагается ниже сопряженного с G-белком рецептора. Каждый класс построен из каталитической субъединицы весом 110 кДа и контролирующей субъединицы.
Более конкретно, три каталитические субъединицы, p110α, p110β и p110δ, содержат АТФ-связывающий домен и равно взаимодействуют с контролирующей субъединицей p85, а также активируются рецепторной тирозинкиназой. Между тем, PI3Kγ взаимодействует с другой контролирующей субъединицей p101 и активируется гетеротримерным G-белком. Контролирующий домен включает домен для прикрепления к рецептору на поверхности клетки.
Когда связывание с АТФ ингибируется, то подавляется фосфорилирование PIP2, и поэтому не образуется PIP3. В результате, у важного регулирующего белка, такого как AKT, не работает функция закрепления на клеточной мембране. Таким образом, важной целью для разработки лекарственных средств является ингибирование такой каталитической субъединицы и ее АТФ-связывающего сайта.
Как разъяснено ниже в настоящем тексте, профиль экспрессии каждой PI3K в клетках и тканях человека различается. PI3Kα и PI3Kβ демонстрируют широкое распространение в тканях, в то время как PI3Kγ находится главным образом в белых кровяных тельцах, а также в скелетных мышцах, печени, поджелудочной железе и сердце. PI3Kδ экспрессируется только в селезенке, вилочковой железе и лимфоцитах периферийной крови. Описанные выше профили экспрессии показывают, что PI3Kα и PI3Kβ активно участвуют в развитии рака, в то время как PI3Kγ и PI3Kδ скорее связаны с нарушениями адаптивной иммунной системы, такими как ревматоидный артрит (RA), системная красная волчанка (SLE) и злокачественные новообразования в крови.
В частности, мутации p110α были обнаружены в некоторых солидных опухолях. Например, было подтверждено, что α-амплификация связана с 50% рака яичников, рака шейки матки, рака легких и рака груди; и было подтверждено, что гиперактивация связана по меньшей мере с 50% случаев рака толстого кишечника и по меньшей мере с 25% случаев рака груди. Было подтверждено, что P110β участвует в тромбоцитопоэзе, и были разработаны p110γ-связанные соединения в качестве иммунодепрессантов для аутоиммунного заболевания. Аутоиммунное заболевание в настоящем контексте включает ревматоидный артрит и системную красную волчанку.
P110δ играет ключевую роль в активации B и T клеток. Кроме того, δ частично участвует в миграции нейтрофилов и внезапном учащении дыхания. Также подтверждено, что δ может частично нарушать опосредованную антигеном-IgE дегрануляцию тучных клеток. P110δ привлекает наше внимание как важный медиатор не только для аутоиммунного заболевания и аллергической реакции, но также для нескольких важных воспалительных реакций, включая патологические воспалительные заболевания. Данные по определению мишеней для p110δ были собраны из исследований с применением генетических инструментов и фармакологических агонистов, что подтверждает приведенное выше утверждение. Ингибирование δ приводит к значительному улучшению при воспалительных и родственных им заболеваниях, что подтверждено в мышиной воспалительной модели астмы дыхательных путей, вызванной овальбумином. Ритуксимаб и белимумаб, PI3Kδ моноклональные антитела, эффективны при RA и SLE.
Недавно было также открыто, что PI3 участвует в воспалении в легких и ушах. Механизм действия еще не полностью понятен, но повышенная экспрессия пути p110δ-AKT-mTOR усиливает аэробный гликолиз, при этом уменьшая работу и выживание лимфоцитов, что приводит к снижению иммунного ответа.
Хроническое воспаление не уникально при аутоиммунном заболевании, но концентрация PI3Kδ и фосфорилированной AKT характеристично повышается при хроническом обструктивном заболевании легких (ХОЗЛ). Повышенная экспрессия PI3Kδ и фосфорилированной AKT связана не только с иммунным заболеванием, но связана также с воспалением.
Поэтому предполагают, что ингибирование PI3Kδ может быть эффективным не только при лечении аутоиммунного заболевания, такого как ревматоидный артрит (RA) и системная красная волчанка (SLE), но также при лечении хронического не-аутоиммунного заболевания, такого как хроническое обструктивное заболевание легких (ХОЗЛ).
Недавно сообщалось, что было разработано новое соединение с новой структурой для селективного ингибирования PI3 киназы. А именно, в патентной публикации 1 описано соединение, которое может применяться для лечения рака, обладающее активностью в плане ингибирования фермента PI3K. В патентной публикации 2 описано, что 4-морфолино-замещенное бициклическое гетероарильное соединение оказывает ингибирующее действие на активность PI3K.
Таким образом, авторы настоящего изобретения пытались разработать новое соединение, имеющее новую структуру, которое эффективно и селективно ингибирует PI3 киназу. В ходе настоящего исследования авторы настоящего изобретения подтвердили, что разработанное гетероарильное производное со специфической структурой обладает активностью в плане селективного ингибирования PI3K α, β, δ и γ, и в частности обладает большей активностью в ингибировании PI3K δ и γ. Таким образом, авторы настоящего изобретения подтвердили, что разработанное гетероарильное производное можно эффективно применять как фармацевтическую композицию для профилактики и лечения заболеваний, связанных с PI3 киназой, что позволило успешно завершить работу над настоящим изобретением.
Литературные публикации из предшествующего уровня техники
Патентные публикации
(Патентная публикация 1) Международная патентная публикация № 2004/048365.
(Патентная публикация 2) Европейский патент № 1,277,738.
Краткое описание изобретения
Целью настоящего изобретения является разработка гетероарильного производного, его оптического изомера или фармацевтически приемлемой соли.
Другой целью настоящего изобретения является разработка способа получения указанного гетероарильного производного, его оптического изомера или фармацевтически приемлемой соли.
Целью настоящего изобретения является также разработка фармацевтической композиции для профилактики или лечения заболеваний, связанных с PI3 киназой, которая содержит указанное гетероарильное производное, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества.
Другой целью настоящего изобретения является разработка композиции здорового питания для профилактики или облегчения заболеваний, связанных с PI3 киназой, которая содержит указанное гетероарильное производное, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества.
Для достижения перечисленных выше целей, в настоящем изобретении описано соединение, имеющее формулу 1, его оптический изомер или его фармацевтически приемлемая соль:
Формула 1

В формуле 1,
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой атом водорода (Н), -NH2 или C1-5 линейную или разветвленную алкилтио-группу;
R2 представляет собой H, -CN, C1-5 линейный или разветвленный алкил, незамещенный C3-7 циклоалкил или атом галогена;
R3 и R4 независимо представляют собой H или C1-5 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5 ~ 7 членный незамещенный гетероциклоалкил, содержащий один или больше гетероатомов N, вместе с атомами, сопряженными с ними; и
R5 представляет собой


где n представляет собой целое число в диапазоне 0 ~ 3,
R6 представляет собой незамещенный или замещенный C6-10 арил или незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S. В указанном замещенном ариле и замещенном гетероариле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена, C1-5 линейного или разветвленного алкила, и C1-5 линейного или разветвленного алкилсульфонила,
R7 и R8 независимо представляют собой H, атом галогена, -CN, -OH, незамещенный или замещенный C6-10 арил, незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S, C1-5 линейный или разветвленный алкил, C1-5 линейную или разветвленную алкокси-группу, C1-5 линейный или разветвленный алкилоксиалкил, C1-5 линейный или разветвленный алкилсульфонил, C1-5 линейную или разветвленную алкилтио-группу, или -NR9R10, где R9 и R10 независимо представляют собой H, C1-5 линейный или разветвленный алкил, C1-5 линейную или разветвленную алкиламино-группу, незамещенный или замещенный C6-10 арил, незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S, или незамещенный или замещенный 3 ~ 8 членный гетероциклоалкил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S. В указанном замещенном C6-10 ариле, замещенном 5 ~ 10 членном гетероариле и замещенном 3 ~ 8 членном гетероциклоалкиле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена и C1-5 линейного или разветвленного алкила.
В настоящем изобретении также описан способ получения соединения, имеющего формулу 1, включающий описанные далее стадии, показанные ниже на схеме реакции 1:
получение соединения, имеющего формулу 2A, посредством реакции соединения, имеющего формулу 2 и соединения, имеющего формулу 3 (стадия 1);
получение соединения, имеющего формулу 5, посредством реакции соединения, имеющего формулу 2A, полученного на стадии 1, и соединения, имеющего формулу 4 (стадия 2);
получение соединения, имеющего формулу 7, посредством реакции соединения, имеющего формулу 5, полученного на стадии 2, и соединения, имеющего формулу 6 (стадия 3);
получение соединения, имеющего формулу 8, посредством реакции соединения, имеющего формулу 7, полученного на стадии 3, и соединения, имеющего формулу 2B, в щелочных условиях (стадия 4);
получение соединения, имеющего формулу 10, посредством реакции соединения, имеющего формулу 8, полученного на стадии 4, и соединения, имеющего формулу 9 (стадия 5);
получение соединения, имеющего формулу 11, посредством реакции соединения, имеющего формулу 10, полученного на стадии 5, в кислых условиях (стадия 6);
получение соединения, имеющего формулу 12, посредством реакции соединения, имеющего формулу 11, полученного на стадии 6, и соединения, имеющего формулу 2C (стадия 7); и
получение соединения, имеющего формулу 1a, путем удаления амин-защитной группы из соединения, имеющего формулу 12, полученного на стадии 7, в кислых условиях (стадия 8):
Схема реакции 1

В схеме реакции 1,
PG представляет собой амин-защитную группу;
соединение, имеющее формулу 1a, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом углерода, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом углерода, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
В настоящем изобретении также описан способ получения соединения, имеющего формулу 1, включающий описанные далее стадии, показанные ниже на схеме реакции 2:
получение соединения, имеющего формулу 15, посредством реакции соединения, имеющего формулу 2A, и соединения, имеющего формулу 14 (стадия 1);
получение соединения, имеющего формулу 17, посредством реакции соединения, имеющего формулу 15, полученного на стадии 1, и соединения, имеющего формулу 16 (стадия 2);
получение соединения, имеющего формулу 18, посредством реакции соединения, имеющего формулу 17, полученного на стадии 2, и соединения, имеющего формулу 2B (стадия 3);
получение соединения, имеющего формулу 20, посредством реакции соединения, имеющего формулу 18, полученного на стадии 3, и соединения, имеющего формулу 19 (стадия 4);
получение соединения, имеющего формулу 21, посредством реакции соединения, имеющего формулу 20, полученного на стадии 4, и соединения, имеющего формулу 2C, в щелочных условиях (стадия 5); и
получение соединения, имеющего формулу 1b, путем удаления амин-защитной группы из соединения, имеющего формулу 21, полученного на стадии 5, в кислых условиях (стадия 6):
Схема реакции 2
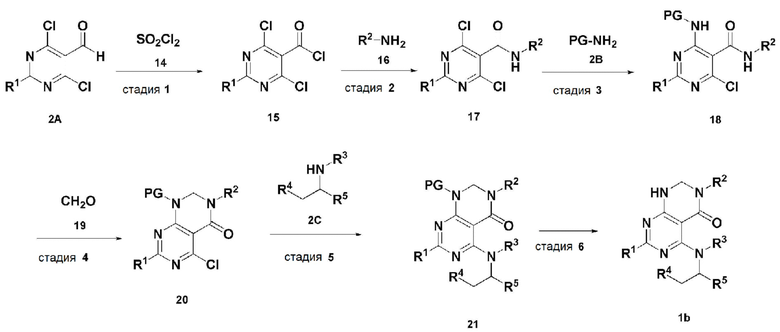
В схеме реакции 2,
PG представляет собой амин-защитную группу;
соединение, имеющее формулу 1b, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой простую связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой простую связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
В настоящем изобретении также описан способ получения соединения, имеющего формулу 1, включающий описанные далее стадии, показанные ниже на схеме реакции 3:
получение соединения, имеющего формулу 15, посредством реакции соединения, имеющего формулу 2A, и соединения, имеющего формулу 14 (стадия 1);
получение соединения, имеющего формулу 23, посредством реакции соединения, имеющего формулу 15, полученного на стадии 1, и соединения, имеющего формулу 22 (стадия 2); и
получение соединения, имеющего формулу 1c, посредством реакции соединения, имеющего формулу 23, полученного на стадии 2, и соединения, имеющего формулу 2C, в щелочных условиях (стадия 3):
Схема реакции 3
В схеме реакции 3,
PG представляет собой амин-защитную группу;
соединение, имеющее формулу 1c, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
В настоящем изобретении также описана фармацевтическая композиция для профилактики или лечения заболеваний, связанных с PI3 киназой, которая содержит указанное гетероарильное производное, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества.
Кроме того, в настоящем изобретении описана композиция здорового питания для профилактики или облегчения заболеваний, связанных с PI3 киназой, которая содержит указанное гетероарильное производное, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества.
Достигаемый положительный эффект
Гетероарильное производное по настоящему изобретению прекрасно селективно ингибирует PI3 киназу, поэтому его можно эффективно применять для профилактики или лечения заболеваний, связанных с PI3 киназой, включая раковые заболевания, такие как злокачественные новообразования в крови, рак яичников, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстого кишечника, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга; аутоиммунное заболевание, такое как ревматоидный артрит, системная красная волчанка, рассеянный склероз, диабет 1 типа, гиперфункция щитовидной железы, миастения, болезнь Крона, анкилоизирующий спондилит, псориаз, аутоиммунный атрофический гастрит и синдром Сёгрена; и респираторное заболевание, такое как хроническое обструктивное заболевание легких (ХОЗЛ), ринит, астма, хронический бронхит, хроническое воспалительное заболевание легких, силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, эмфизема, пневмония и бронхоэктаз.
Описание предпочтительных вариантов осуществления
Далее настоящее изобретение описано более подробно.
В настоящем изобретении описано соединение, имеющее формулу 1, его оптический изомер или его фармацевтически приемлемая соль:
Формула 1

В формуле 1,
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой атом водорода (Н), -NH2 или C1-5 линейную или разветвленную алкилтио-группу;
R2 представляет собой H, -CN, C1-5 линейный или разветвленный алкил, незамещенный C3-7 циклоалкил или атом галогена;
когда  представляет собой двойную связь, A представляет собой N, R2 отсутствует,
представляет собой двойную связь, A представляет собой N, R2 отсутствует,
R3 и R4 независимо представляют собой H или C1-5 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5 ~ 7 членный незамещенный гетероциклоалкил, содержащий один или больше гетероатомов N, вместе с атомами, сопряженными с ними; и
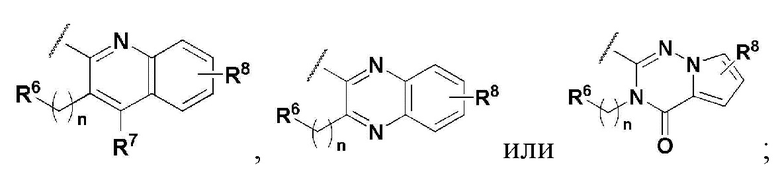
R5 представляет собой
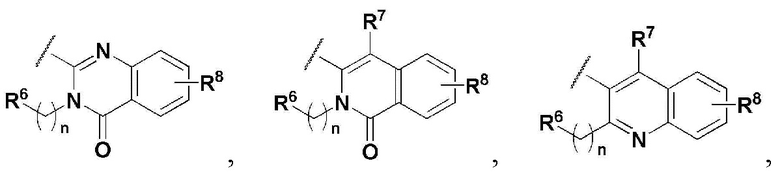

где n представляет собой целое число в диапазоне 0 ~ 3,
R6 представляет собой незамещенный или замещенный C6-10 арил или незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S. В указанном замещенном ариле и замещенном гетероариле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена, C1-5 линейного или разветвленного алкила, и C1-5 линейного или разветвленного алкилсульфонила,
R7 и R8 независимо представляют собой H, атом галогена, -CN, -OH, незамещенный или замещенный C6-10 арил, незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S, C1-5 линейный или разветвленный алкил, C1-5 линейную или разветвленную алкокси-группу, C1-5 линейный или разветвленный алкилоксиалкил, C1-5 линейный или разветвленный алкилсульфонил, C1-5 линейную или разветвленную алкилтио-группу, или -NR9R10, где R9 и R10 независимо представляют собой H, C1-5 линейный или разветвленный алкил, C1-5 линейную или разветвленную алкиламино-группу, незамещенный или замещенный C6-10 арил, незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S, или незамещенный или замещенный 3 ~ 8 членный гетероциклоалкил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S. В указанном замещенном C6-10 ариле, замещенном 5 ~ 10 членном гетероариле и замещенном 3 ~ 8 членном гетероциклоалкиле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена и C1-5 линейного или разветвленного алкила.
Предпочтительно,
В формуле 1,
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой H, -NH2 или метилтио-группу;
R2 представляет собой H, -CN, C1-3 линейный или разветвленный алкил, незамещенный C3-5 циклоалкил или атом галогена;
R3 и R4 независимо представляют собой H или C1-5 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5 ~ 7 членный незамещенный гетероциклоалкил, содержащий один или больше гетероатомов N, вместе с атомами, сопряженными с ними; и
R5 представляет собой

где n представляет собой целое число в диапазоне от 0 до 1,
R6 представляет собой незамещенный или замещенный C6-10 арил или незамещенный или замещенный 5 ~ 10 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S. В указанном замещенном ариле и замещенном гетероариле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена и C1-5 линейного или разветвленного алкила,
R7 представляет собой H, атом галогена, незамещенный или замещенный C6-10 арил, или незамещенный или замещенный 5 ~ 7 членный гетероарил, содержащий один или больше гетероатомов, выбранных из группы, состоящей из N, O и S. В указанном замещенном ариле и замещенном гетероариле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена и C1-5 линейного или разветвленного алкила, и
R8 представляет собой H, атом галогена, C1-3 линейный или разветвленный алкил, или C1-3 линейную или разветвленную алкокси-группу.
Более предпочтительно,
В формуле 1,
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой H, -NH2 или метилтио-группу;
R2 представляет собой H, -CN, C1-3 линейный или разветвленный алкил, незамещенный C3-5 циклоалкил или атом галогена;
R3 представляет собой H;
R4 представляет собой H или C1-3 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5 ~ 7 членный незамещенный гетероциклоалкил, содержащий один атом N, вместе с атомами, сопряженными с ними; и
R5 представляет собой


где n представляет собой целое число в диапазоне от 0 до 1,
R6 представляет собой незамещенный или замещенный фенил или пиридинил,
в указанном замещенном фениле и пиридиниле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена и C1-3 линейного или разветвленного алкила;
R7 представляет собой H, атом галогена или незамещенный или замещенный 5 ~ 7 членный гетероарил, содержащий один или больше гетероатомов N. В указанном замещенном ариле и замещенном гетероариле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из атома галогена и C1-3 линейного или разветвленного алкила, и
R8 представляет собой H, атом галогена или C1-3 линейный или разветвленный алкил.
Более предпочтительно,
В формуле 1,
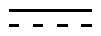 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой H или -NH2;
R2 представляет собой H, -F, -Cl, -CN, метил, этил, пропил, изопропил, циклопропил, или циклопентил;
R3 представляет собой H;
R4 представляет собой H или метил; или
R3 и R4 могут формировать пирролидин вместе с атомами, сопряженными с ними; и
R5 представляет собой

где n представляет собой целое число в диапазоне от 0 до 1,
R6 представляет собой незамещенный или замещенный фенил или пиридинил,
в указанном замещенном фениле и пиридиниле могут присутствовать один или больше заместителей, выбранных из группы, состоящей из -F, -Cl и метила;
R7 представляет собой H, -F, -Cl или пиридинил; и
R8 представляет собой H, -F или -Cl.
Соединение, имеющее формулу 1, в настоящем тексте может представлять собой соединение, имеющее формулу 1A, его оптический изомер или его фармацевтически приемлемую соль.
Формула 1A

В формуле 1A,
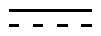 , A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
, A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
В соединении, имеющем формулу 1 по настоящему изобретению, предпочтительными примерами кольца, содержащего A и R2, являются

и предпочтительными примерами R5 являются
Примерами соединения, имеющего формулу 1 по настоящему изобретению, могут являться следующие соединения:
<1> 4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<2> 4-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<3> 4-((1-(5-хлор-4-оксо-3-(пиридин-2-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<4> 4-((1-(5-хлор-3-(3,5-дифторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<5> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<6> 4-((1-(2-фенилхинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<7> 4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<8> 4-((1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<9> 4-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этиламино)пиридо[2,3-d]пиримидин-5(8H)-он;
<10> 4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<11> 4-((1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<12> 4-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<13> 4-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<14> 4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<15> 2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<16> 2-амино-4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<17> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<18> 2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<19> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-5-оксо-5,8-дигидропиридо[2,3-d]пиримидин-6-карбонитрил;
<20> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<21> 4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<22> 6-хлор-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<23> 6-хлор-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<24> 6-хлор-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<25> 2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<26> 4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<27> 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<28> 4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<29> 4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<30> 4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<31> 4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<32> 4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<33> 4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<34> 4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<35> 5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<36> 5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<37> 5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<38> 5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<39> 5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<40> 3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<41> 3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<42> 5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<43> 5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<44> 5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<45> 5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<46> 5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<47> 5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<48> 5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<49> 5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<50> 7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<51> 7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<52> 7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<53> 7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<54> 7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<55> 7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<56> 7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<57> 7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<58> 7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<59> 7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<60> 7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<61> 7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<62> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<63> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<64> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<65> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<66> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<67> 5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<68> 5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<69> 5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<70> 5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<71> 5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<72> 5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<73> 5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<74> 5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<75> 5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<76> 5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<77> 5-(2-(8-хлор-1-оксо-2-(пиридин-3-ил)-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<78> 5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<79> 5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<80> 5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<81> 5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<82> 5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<83> 7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<84> 7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<85> 7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<86> 7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<87> 7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<88> 7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<89> 7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<90> 7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<91> 7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<92> 7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<93> 7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<94> 7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<95> 7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<96> 7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<97> 7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<98> 7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<99> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он;
<100> 4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он.
Предпочтительными примерами соединения, имеющего формулу 1 по настоящему изобретению, являются следующие оптически активные соединения:
<1> (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<2> (S)-4-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<3> (S)-4-((1-(5-хлор-4-оксо-3-(пиридин-2-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<4> (S)-4-((1-(5-хлор-3-(3,5-дифторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<5> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<6> (S)-4-((1-(2-фенилхинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<7> (S)-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<8> (S)-4-((1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<9> (S)-4-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этиламино)пиридо[2,3-d]пиримидин-5(8H)-он;
<10> (S)-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<11> (S)-4-((1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<12> (S)-4-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<13> (S)-4-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<14> (S)-4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<15> (S)-2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<16> (S)-2-амино-4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<17> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<18> (S)-2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<19> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-5-оксо-5,8-дигидропиридо[2,3-d]пиримидин-6-карбонитрил;
<20> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<21> (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<22> (S)-6-хлор-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<23> (S)-6-хлор-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<24> (S)-6-хлор-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<25> (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<26> (S)-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<27> (S)-4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<28> (S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<29> (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<30> (S)-4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<31> (S)-4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<32> (S)-4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<33> (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<34> (S)-4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<35> (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<36> (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<37> (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<38> (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<39> (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<40> (S)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<41> (S)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<42> (S)-5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<43> (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<44> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<45> (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<46> (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<47> (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<48> (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<49> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<50> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<51> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<52> (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<53> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<54> (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<55> (S)-7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<56> (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<57> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<58> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<59> (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<60> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<61> (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<62> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<63> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<64> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<65> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<66> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<67> (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<68> (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<69> (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<70> (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<71> (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<72> (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<73> (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<74> (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<75> (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<76> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<77> (S)-5-(2-(8-хлор-1-оксо-2-(пиридин-3-ил)-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<78> (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<79> (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<80> (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<81> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<82> (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<83> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<84> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<85> (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<86> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<87> (S)-7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<88> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<89> (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<90> (S)-7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<91> (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<92> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<93> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<94> (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<95> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<96> (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<97> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<98> (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<99> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он;
<100> (S)-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он.
В настоящем изобретении также описано промежуточное соединение, имеющее формулу 1B, для соединения, имеющего формулу 1, или его оптический изомер.
Формула 1B

В формуле 1B,
 , A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1; и
, A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1; и
PG представляет собой амин-защитную группу, выбранную из группы, состоящей из т-бутилоксикарбонила (Boc), карбобензилокси-группы (Cbz), 9-флуоренилметилоксикарбонила (Fmoc), ацетила (Ac), бензоила (Bz), бензила (Bn), п-метоксибензила (PMB), 3,4-диметоксибензила (DMPM), п-метоксифенила (PMP), тозила (Ts), 2,2,2-трихлопентоксикарбонила (Troc), 2-триметилсилилэтоксикарбонила (Teoc) и арилоксикарбонила (Alloc).
Соединение, имеющее формулу 1B, представляет собой интермедиат соединения, имеющего формулу 1, которое можно получить удалением амин-защитной группы PG.
Соединение, имеющее формулу 1 по настоящему изобретению, можно применять в форме фармацевтически приемлемой соли, которая предпочтительно представляет собой кислотно-аддитивную соль, образованную с фармацевтически приемлемыми свободными кислотами. Кислотно-аддитивную соль, в контексте настоящего изобретения, можно получить с неорганическими кислотами, такими как хлористоводородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, иодистоводородная кислота, азотистая кислота и фосфорная кислота; нетоксичными органическими кислотами, получая алифатический моно/дикарбоксилат, фенил-замещенный алканоат, гидроксиалканоат, алкандиоат, с ароматическими кислотами и алифатическими/ароматическими сульфокислотами; или с органическими кислотами, такими как уксусная кислота, бензойная кислота, лимонная кислота, молочная кислота, малеиновая кислота, глюконовая кислота, метансульфокислота, 4-толуолсульфокислота, винная кислота и фумаровая кислота. Примерами фармацевтически приемлемых нетоксичных солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, фторид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутилат, капрат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексан-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, бензолсульфонат, толуолсульфонат, хлорбензолсульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутилат, цитрат, лактат, гидроксибутилат, гликолят, малат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат и манделат.
Кислотно-аддитивную соль, в контексте настоящего изобретения, можно получить обычно применяемым способом, известным в данной области. Например, соединение, имеющее формулу 1, растворяют в органическом растворителе, таком как метанол, этанол, ацетон, метиленхлорид или ацетонитрил, в который затем добавляют органическую кислоту или неорганическую кислоту, что приводит к выпадению осадка. Затем образовавшийся осадок отфильтровывают и сушат, получая соль, или растворитель и избыточное количество кислоты отгоняют при пониженном давлении и сушат, получая соль, или осадок кристаллизуют в органическом растворителе, получая соль.
Фармацевтически приемлемую соль металла можно получить при использовании основания. Соль щелочного металла или щелочноземельного металла получают следующим способом: растворяя соединение в избытке раствора гидроксида щелочного металла или раствора гидроксида щелочноземельного металла; отфильтровывая нерастворимую соль соединения; упаривая оставшийся раствор и высушивая соль. На данной стадии соль металла предпочтительно получают в фармацевтически приемлемой форме соли натрия, калия или кальция. И соответствующую соль серебра получают реакцией соли щелочного или щелочноземельного металла с подходящей солью серебра (например, нитратом серебра).
Настоящее изобретение включает не только соединение, имеющее формулу 1, но также и его фармацевтически приемлемую соль, сольват, оптический изомер или гидрат.
В настоящем изобретении также описан способ получения соединения, имеющего формулу 1, включающий описанные далее стадии, показанные ниже на схеме реакции 1:
получение соединения, имеющего формулу 2A, посредством реакции соединения, имеющего формулу 2, и соединения, имеющего формулу 3 (стадия 1);
получение соединения, имеющего формулу 5, посредством реакции соединения, имеющего формулу 2A, полученного на стадии 1, и соединения, имеющего формулу 4 (стадия 2);
получение соединения, имеющего формулу 7, посредством реакции соединения, имеющего формулу 5, полученного на стадии 2, и соединения, имеющего формулу 6 (стадия 3);
получение соединения, имеющего формулу 8, посредством реакции соединения, имеющего формулу 7, полученного на стадии 3, и соединения, имеющего формулу 2B, в щелочных условиях (стадия 4);
получение соединения, имеющего формулу 10, посредством реакции соединения, имеющего формулу 8, полученного на стадии 4, и соединения, имеющего формулу 9 (стадия 5);
получение соединения, имеющего формулу 11, посредством реакции соединения, имеющего формулу 10, полученного на стадии 5, в кислых условиях (стадия 6);
получение соединения, имеющего формулу 12, посредством реакции соединения, имеющего формулу 11, полученного на стадии 6, и соединения, имеющего формулу 2C (стадия 7); и
получение соединения, имеющего формулу 1a, путем удаления амин-защитной группы из соединения, имеющего формулу 12, полученного на стадии 7, в кислых условиях (стадия 8):
Схема реакции 1
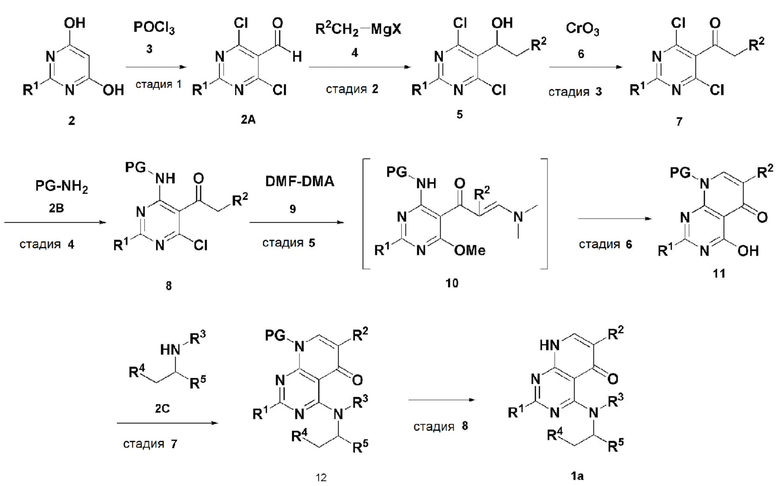
В схеме реакции 1,
PG представляет собой амин-защитную группу;
соединение, имеющее формулу 1a, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом углерода, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом углерода, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
Далее в настоящем тексте более подробно описан способ получения соединения, имеющего формулу 1 по настоящему изобретению.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 1 заключается в получении соединения, имеющего формулу 2A, посредством реакции соединения, имеющего формулу 2, с соединением, имеющим формулу 3.
На этой стадии, примерами соединения, имеющего формулу 3, являются ZnCl2, SnCl2, SnCl4, FeCl2, FeCl3 и POCl3, которые можно применять в эквивалентном количестве или в избытке. Среди перечисленных, POCl3 является более предпочтительным.
На стадии 1 применяют соединение, способное предоставить атом углерода для образования альдегидного соединения, имеющего формулу 2A. Соединение, способное предоставить атом углерода, не ограничивается в настоящем тексте, но предпочтительным является диметилформамид.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 2 заключается в получении соединения, имеющего формулу 5, посредством реакции соединения, имеющего формулу 2, полученного на стадии 1, с соединением, имеющим формулу 4, реагентом Гриньяра.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 3 заключается в получении соединения, имеющего формулу 7, посредством реакции соединения, имеющего формулу 5, полученного на стадии 2, с соединением, имеющим формулу 6.
В частности, стадия 3 заключается в получении альдегидного соединения, имеющего формулу 7, посредством реакции спиртового соединения, имеющего формулу 5, с окислителем, имеющим формулу 6. На данной стадии, примерами окислителя, имеющего формулу 6, являются PCC (пиридиния хлорхромат), PDC (пиридиния дихромат) и CrO3, которые можно применять в эквивалентном количестве или в избытке. Среди перечисленных, CrO3 является более предпочтительным.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 4 заключается в получении соединения, имеющего формулу 8, посредством реакции соединения, имеющего формулу 7, полученного на стадии 3, с соединением, имеющим формулу 2B.
На данной стадии, PG в соединении, имеющем формулу 2B, представляет собой амин-защитную группу, и примерами данной амин-защитной группы являются т-бутилоксикарбонил (Boc), карбобензилокси-группа (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), ацетил (Ac), бензоил (Bz), бензил (Bn), п-метоксибензил (PMB), 3,4-диметоксибензил (DMPM), п-метоксифенил (PMP), тозил (Ts), 2,2,2-трихлопентоксикарбонил (Troc), 2-триметилсилилэтоксикарбонил (Teoc) или арилоксикарбонил (Alloc), а п-метоксибензил (PMB) является более предпочтительным.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 5 заключается в получении соединения, имеющего формулу 10, посредством реакции соединения, имеющего формулу 8, полученного на стадии 4, с DMF-DMA (диметилформамид-диметилацеталь), соединением, имеющим формулу 9.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 6 заключается в получении соединения, имеющего формулу 11, посредством реакции соединения, имеющего формулу 10, полученного на стадии 5, в кислых условиях.
На данной стадии, примерами кислоты являются HCl, H2SO4, бромистоводородная кислота и уксусная кислота, которые можно применять в эквивалентном количестве или в избытке. Среди перечисленных, уксусная кислота является более предпочтительным.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 7 заключается в получении соединения, имеющего формулу 12, посредством реакции соединения, имеющего формулу 11, полученного на стадии 6, с соединением, имеющим формулу 2C.
В частности, стадия 3 заключается в получении соединения, имеющего формулу 1, посредством дегидратации-конденсации соединения, имеющего формулу 11, и соединения, имеющего формулу 2C, в присутствии (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфата (BOP) и основания.
На данной стадии, примерами указанного основания является органическое основание, такое как пиридин, триэтиламин, N,N-диизопропилэтиламин (DIPEA) и 1,8-диазабицикло[5.4.0]-7-ундецен (DBU) или неорганическое основание, такое как гидроксид натрия, карбонат натрия, карбонат калия, карбонат цезия, и гидрид натрия, которые можно применять в эквивалентном количестве или в избытке, по отдельности или в смеси. Среди перечисленных, 1,8-диазабицикло[5.4.0]-7-ундецен (DBU) является более предпочтительным.
Стерео-конфигурация соединения, имеющего формулу 1, определяется стерео-конфигурацией соединения, имеющего формулу 2C, применяющегося на стадии 7. Так, оптический изомер соединения, имеющего формулу 1, можно получить, используя оптический изомер соединения, имеющего формулу 2C.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, стадия 8 заключается в получении соединения, имеющего формулу 1a, путем удаления амин-защитной группы из соединения, имеющего формулу 12, полученного на стадии 7, в кислых условиях.
На данной стадии, примерами кислоты являются HCl, H2SO4, уксусная кислота и трифторуксусная кислота, которые можно применять в эквивалентном количестве или в избытке. Среди перечисленных, трифторуксусная кислота является более предпочтительной.
В способе получения соединения, имеющего формулу 1 по настоящему изобретению, каждую стадию в схеме реакции 1 можно проводить обычным образом, известным в данной области, и примерами основания, которое можно применять на данной стадии, являются такие органические основания, как пиридин, триэтиламин, N,N-диизопропилэтиламин (DIPEA) и 1,8-диазабицикло[5.4.0]-7-ундецен (DBU); или такие неорганические основания, как гидроксид натрия, карбонат натрия, карбонат калия, карбонат цезия и гидрид натрия, которые можно применять в эквивалентном количестве или в избытке, по отдельности или в смеси. Примерами приемлемых растворителей для данной реакции являются тетрагидрофуран (ТГФ); диоксан; простые эфиры, такие как этиловый эфир и 1,2-диметоксиэтан; низшие спирты, такие как метанол, этанол, пропанол, и бутанол; диметилформамид (ДМФА), диметилсульфоксид (ДМСО), дихлорметан (ДХМ), дихлорэтан, вода, бензолсульфонат, толуолсульфонат, хлорбензолсульфонат, ксилолсульфонат, этилацетат, фенилацетат, фенилпропионат, фенилбутилат, цитрат, лактат, гидроксибутилат, гликолят, малат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат и манделат. Растворитель в реакции может быть индивидуальным веществом или применяться в виде смеси растворителей.
Как описано выше, способ получения по настоящему изобретению, представленный на схеме реакции 1, не только является новым способом легкого получения соединения, имеющего формулу 11, одного из интермедиатов для получения соединения, имеющего формулу 1, но также представляет собой способ получения различных пиридо-пиримидиновых производных из соединения, имеющего формулу 1, посредством реакции соединения, имеющего формулу 11, с соединением, реагирующим по гидроксильной группе (-OH), являющейся заместителем в соединении, имеющем формулу 11.
В способе получения по настоящему изобретению, представленном на схеме реакции 1, соединение, имеющее формулу 1a, можно получить способом, включающим следующие стадии, изображенные на схеме реакции 1-a:
получение соединения, имеющего формулу 13, посредством реакции соединения, имеющего формулу 8, полученного на стадии 4, в схеме реакции 1, и соединения, имеющего формулу 2C (стадия 1);
получение соединения, имеющего формулу 12, посредством реакции соединения, имеющего формулу 13, полученного на стадии 1, и соединения, имеющего формулу 9 (стадия 2); и
получение соединения, имеющего формулу 1a, путем удаления амин-защитной группы из соединения, имеющего формулу 12, полученного на стадии 2, в кислых условиях (стадия 3):
Схема реакции 1-a

В схеме реакции 1-a,
соединение, имеющее формулу 1a, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом углерода, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом углерода, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
Кроме того, в способе получения, представленном на схеме реакции 1, к описанному способу могут быть добавлены перечисленные ниже стадии, с целью получения соединения, имеющего заместитель R1 (-SCH3 → -NH2), как показано на схеме реакции 1-b:
получение соединения, имеющего формулу 1a", посредством реакции соединения, имеющего формулу 1a', с mCPBA (3-хлорбензойной кислотой) (стадия 1); и
получение соединения, имеющего формулу 1a, где R1 представляет собой -NH2, посредством реакции соединения, имеющего формулу 1a", полученного на стадии 1, в присутствии NH4OH (стадия 2):
Схема реакции 1-b
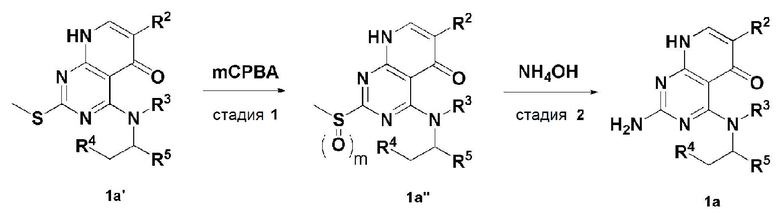
В схеме реакции 1-b,
соединение, имеющее формулу 1a, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом углерода, и R2, R3, R4 и R5 имеют значения, указанные для формулы 1. m равно 1 или 2.
представляет собой двойную связь, A представляет собой атом углерода, и R2, R3, R4 и R5 имеют значения, указанные для формулы 1. m равно 1 или 2.
В настоящем изобретении также описан способ получения соединения, имеющего формулу 1, включающий описанные далее стадии, показанные ниже на схеме реакции 2:
получение соединения, имеющего формулу 15, посредством реакции соединения, имеющего формулу 2A, и соединения, имеющего формулу 14 (стадия 1);
получение соединения, имеющего формулу 17, посредством реакции соединения, имеющего формулу 15, полученного на стадии 1, и соединения, имеющего формулу 16 (стадия 2);
получение соединения, имеющего формулу 18, посредством реакции соединения, имеющего формулу 17, полученного на стадии 2, и соединения, имеющего формулу 2B (стадия 3);
получение соединения, имеющего формулу 20, посредством реакции соединения, имеющего формулу 18, полученного на стадии 3, и соединения, имеющего формулу 19 (стадия 4);
получение соединения, имеющего формулу 21, посредством реакции соединения, имеющего формулу 20, полученного на стадии 4, и соединения, имеющего формулу 2C, в щелочных условиях (стадия 5); и
получение соединения, имеющего формулу 1b, путем удаления амин-защитной группы из соединения, имеющего формулу 21, полученного на стадии 5, в кислых условиях (стадия 6):
Схема реакции 2
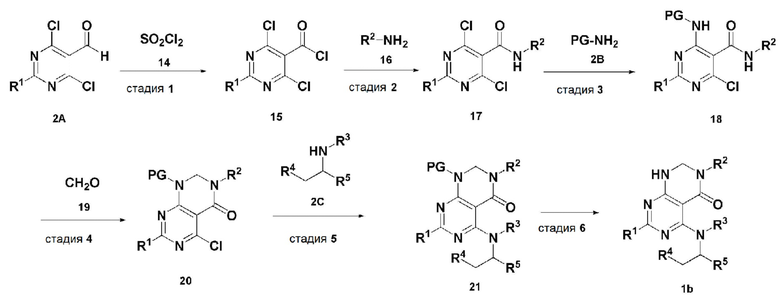
В схеме реакции 2, PG представляет собой амин-защитную группу;
соединение, имеющее формулу 1b, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой простую связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой простую связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
Каждую стадию в способе получения, представленном на схеме реакции 2, проводят так же или аналогично методу на приведенной выше схеме реакции 1, или обычно применяемым способом, известным в данной области.
Таким образом, способ получения по настоящему изобретению, представленный на схеме реакции 2, является не только является не только новым способом легкого получения соединения, имеющего формулу 20, одного из интермедиатов для соединения, имеющего формулу 1, но также и полезным способом получения различных дигидро-пиримидо-пиримидиновых производных из соединения, имеющего формулу 1, посредством реакции соединения, имеющего формулу 20, с соединением, реагирующим по хлоридному (-Cl) заместителю в указанном соединении.
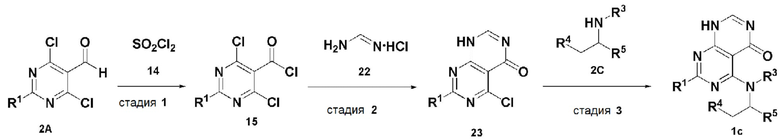
В настоящем изобретении также описан способ получения соединения, имеющего формулу 1, включающий описанные далее стадии, показанные ниже на схеме реакции 3:
получение соединения, имеющего формулу 15, посредством реакции соединения, имеющего формулу 2A, и соединения, имеющего формулу 14 (стадия 1);
получение соединения, имеющего формулу 23, посредством реакции соединения, имеющего формулу 15, полученного на стадии 1, и соединения, имеющего формулу 22 (стадия 2); и
получение соединения, имеющего формулу 1c, посредством реакции соединения, имеющего формулу 23, полученного на стадии 2, и соединения, имеющего формулу 2C, в щелочных условиях (стадия 3):
Схема реакции 3
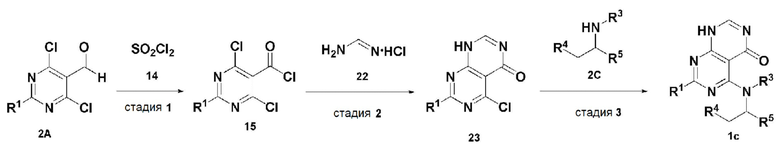
В схеме реакции 3, соединение, имеющее формулу 1c, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
Каждую стадию в способе получения, представленном на схеме реакции 3, проводят так же или аналогично методу, приведенному выше на схеме реакции 1, или обычно применяемым способом, известным в данной области.
Таким образом, способ получения по настоящему изобретению, представленный на схеме реакции 3, является не только новым способом легкого получения соединения, имеющего формулу 23, одного из интермедиатов для соединения, имеющего формулу 1, но также и полезным способом получения различных пиримидо-пиримидиновых производных из соединения, имеющего формулу 1, посредством реакции соединения, имеющего формулу 23, с соединением, реагирующим по хлоридному (-Cl) заместителю в указанном соединении.
В способе получения, представленном на схеме реакции 3, соединение, имеющее формулу 1c, можно получить способом, включающим следующие стадии, изображенные на схеме реакции 3-a:
получение соединения, имеющего формулу 25, посредством реакции соединения, имеющего формулу 15, полученного на стадии 1, в схеме реакции 3, и соединения, имеющего формулу 24 (стадия 1);
получение соединения, имеющего формулу 26, посредством реакции соединения, имеющего формулу 25, полученного на стадии 1, и соединения, имеющего формулу 2B (стадия 2);
получение соединения, имеющего формулу 29, посредством реакции соединения, имеющего формулу 26, полученного на стадии 2, и соединения, имеющего формулу 27 (стадия 3);
получение соединения, имеющего формулу 30, посредством реакции соединения, имеющего формулу 29, полученного на стадии 3, и соединения, имеющего формулу 2C (стадия 4); и
получение соединения, имеющего формулу 1b, путем удаления амин-защитной группы из соединения, имеющего формулу 30, полученного на стадии 4, в кислых условиях (стадия 5):
Схема реакции 3-a
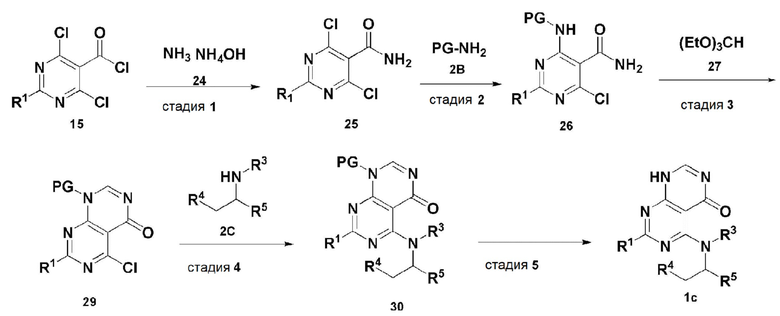
В схеме реакции 3-a,
PG представляет собой амин-защитную группу;
соединение, имеющее формулу 1c, представляет собой производное соединения, имеющего формулу 1, в котором  представляет собой двойную связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом азота, и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
В настоящем изобретении также описана фармацевтическая композиция для профилактики или лечения заболеваний, связанных с PI3 киназой, которая содержит указанное гетероарильное производное, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества.
Гетероарильное производное, его оптический изомер, или его фармацевтически приемлемая соль по настоящему изобретению отличаются селективным ингибированием PI3 киназы, выбранной из группы, состоящей из PI3Kα, PI3Kβ, PI3Kδ и PI3Kγ.
В частности, заболевание, связанное с PI3 киназой, включает рак, аутоиммунное заболевание и респираторное заболевание.
Примерами рака в настоящем тексте являются злокачественные новообразования крови, такие как миелоидная метаплазия, хронический миеломоноцитарный лейкоз, острый лимфобластный лейкоз, острый эритроидный лейкоз, ходжкинская/неходжкинская лимфома, В-клеточная лимфома, острый Т-клеточный лейкоз, миелодиспластический синдром, дисфункция плазматических клеток, лейкоз ворсистых клеток, саркома и лимфома Капоши, рак яичника, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстой кишки, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга.
Аутоиммунное заболевание в настоящем контексте включает ревматоидный артрит, системную красную волчанку, рассеянный склероз, диабет 1 типа, гиперфункцию щитовидной железы, миастению, болезнь Крона, анкилоизирующий спондилит, псориаз, аутоиммунный атрофический гастрит и синдром Сёгрена.
Респираторное заболевание в настоящем контексте включает хроническое обструктивное заболевание легких (ХОЗЛ), ринит, астму, хронический бронхит, хроническое воспалительное заболевание легких, силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, эмфизему, пневмонию и бронхоэктаз.
Авторы настоящего изобретения исследовали ингибирующее действие соединения, имеющего формулу 1 по настоящему изобретению, на PI3K α, β, γ и δ. В результате было подтверждено, что соединение по настоящему изобретению прекрасно ингибирует PI3K α, β, γ и δ. В частности, ингибирующее действие на PI3 киназу γ или δ было выражено даже при низкой концентрации (см. Экспериментальные примеры 1 ~ 4).
Таким образом, соединение по настоящему изобретению играет роль ингибитора PI3 киназы, поэтому оно может эффективно применяться для профилактики или лечения заболеваний, связанных с PI3 киназой, включая раковые заболевания, такие как злокачественные новообразования в крови, рак яичника, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстой кишки, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга; аутоиммунное заболевание, такое как ревматоидный артрит, системная красная волчанка, рассеянный склероз, диабет 1 типа, гиперфункция щитовидной железы, миастения, болезнь Крона, анкилоизирующий спондилит, псориаз, аутоиммунный атрофический гастрит и синдром Сёгрена; и респираторное заболевание, такое как хроническое обструктивное заболевание легких (ХОЗЛ), ринит, астма, хронический бронхит, хроническое воспалительное заболевание легких, силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, эмфизема, пневмония и бронхоэктаз.
Соединение, имеющее формулу 1, его оптический изомер или его фармацевтически приемлемую соль по настоящему изобретению может быть приготовлено для перорального или парентерального введения путем смешивания с обычно применяющимися разбавителями или вспомогательными веществами, такими как наполнители, удешевляющие добавки, связующие агенты, смачивающие средства, разрыхлители и поверхностно-активные вещества.
Примерами составов для перорального применения являются таблетки, пилюли, твердые/мягкие капсулы, растворы, суспензии, эмульсии, сиропы, гранулы, настойки и т.д. Помимо действующего вещества, эти составы могут включать разбавители (например, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин) и любриканты (например, силикагель, тальк, стеарат и его магниевую или кальциевую соль, и/или полиэтиленгликоль). Таблетки могут содержать связующие средства, такие как силикат магния-алюминия, крахмальную пасту, желатин, метилцеллюлозу, натрия карбоксиметилцеллюлозу и/или поливинилпирролидон, и при необходимости в состав можно включать разрыхлители, такие как крахмал, агароза, альгиновая кислота или ее натриевая соль, или азеотропные смеси и/или адсорбенты, красители, ароматизаторы и подсластители.
Фармацевтическая композиция, содержащая соединение, имеющее формулу 1, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества, может вводиться парентерально, и парентеральное введение включает подкожные инъекции, внутривенные инъекции, внутримышечные инъекции или интраторакальные инъекции.
Для приготовления композиции в форме состава для парентерального введения, соединение, имеющее формулу 1, или его фармацевтически приемлемую соль смешивают со стабилизатором или буферным агентом в воде, получая раствор или суспензию, которые заливают в ампулы или виалы. Композиция по настоящему изобретению может быть стерилизована и дополнительно содержать консерванты, стабилизаторы, смачиваемые порошки или эмульгаторы, соли и/или буферные вещества для регулировки осмотического давления, а также другие терапевтически применяемые вещества, и композицию можно превращать в готовый состав общеизвестными методами смешивания, гранулирования или нанесения покрытий.
Эффективную дозировку фармацевтической композиции, содержащей соединение, имеющее формулу 1, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества по настоящему изобретению, можно определить в соответствии с возрастом, весом, полом, способом введения, состоянием здоровья и степенью тяжести заболевания. Дозировка составляет 0.1 ~ 1000 мг/день для взрослого пациента (70 кг), предпочтительно 1 ~ 500 мг/день, которые можно вводить несколько раз в сутки или, предпочтительно, один раз в сутки или два раза в сутки.
Фармацевтическая композиция, содержащая соединение, имеющее формулу 1, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества по настоящему изобретению, можно вводить в отдельности или комбинировать с хирургической операцией, гормональной терапией, химиотерапией и биорегуляторами.
Кроме того, в настоящем изобретении описана композиция здорового питания для профилактики или облегчения заболеваний, связанных с PI3 киназой, которая содержит указанное гетероарильное производное, его оптический изомер или его фармацевтически приемлемую соль в качестве действующего вещества.
Заболевание, связанное с PI3 киназой, в настоящем тексте включает раковые заболевания, такие как злокачественные новообразования в крови, рак яичника, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстой кишки, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга, аутоиммунное заболевание, такое как ревматоидный артрит, системная красная волчанка, рассеянный склероз, диабет 1 типа, гиперфункция щитовидной железы, миастения, болезнь Крона, анкилоизирующий спондилит, псориаз, аутоиммунный атрофический гастрит и синдром Сёгрена, и респираторное заболевание, такое как хроническое обструктивное заболевание легких (ХОЗЛ), ринит, астма, хронический бронхит, хроническое воспалительное заболевание легких, силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, эмфизема, пневмония и бронхоэктаз.
Соединение, имеющее формулу 1 по настоящему изобретению, работает как ингибитор PI3 киназы, так что ее можно добавлять в добавки для поддержания функционального здоровья, включая продукты питания и напитки, как композицию здорового питания для профилактики или облегчения заболеваний, связанных с PI3 киназой.
Соединение, имеющее формулу 1 по настоящему изобретению, можно применять как пищевую добавку. В этом случае, соединение по настоящему изобретению можно добавлять как таковое или в смеси с другими пищевыми компонентами, согласно общеизвестному способу. Пропорции смешивания действующих веществ можно регулировать в соответствии с целью использования (профилактика или улучшение состояния). В общем, для приготовления здорового питания или напитков, соединение по настоящему изобретению добавляют предпочтительно в количестве 0.1 ~ 90 весовых частей. Однако, если требуется долговременный прием для здоровья и гигиены или регулирования состояния здоровья, содержание может быть ниже указанного выше, но приемлемым является и более высокое содержание, поскольку было подтверждено, что соединение по настоящему изобретению характеризуется высокой степенью безопасности.
Композиция для здоровых напитков по настоящему изобретению может дополнительно содержать различные ароматизаторы или натуральные углеводы и т.д., как и другие напитки. Упомянутые выше натуральные углеводы могут представлять собой один из моносахаридов, таких как глюкоза и фруктоза, дисахаридов, таких как мальтоза и сахароза, полисахаридов, таких как декстрин и циклодекстрин, и глюкозных спиртов, таких как ксилит, сорбит и эритрит. Кроме того, в качестве подсластителей можно вводить в состав натуральные подсластители (тауматин, экстракт стевии, например, ребаудиозид А, глицирризин и т.д.) и синтетические подсластители (сахарин, аспартам и т.д.). Содержание натурального углевода предпочтительно составляет 1 ~ 20 г, и более предпочтительно – 5 ~ 12 г в 100 г композиции.
В дополнение к упомянутым выше ингредиентам, соединение, имеющее формулу 1 по настоящему изобретению, можно комбинировать с широким рядом питательных веществ, витаминов, минеральных веществ (электролитов), ароматизаторов, включая натуральные ароматизаторы и синтетические ароматизаторы, красителей и удешевляющих агентов (сыр, шоколад и т.д.), пектиновой кислотой и ее солями, альгиновой кислотой и ее солями, органическими кислотами, защитными коллоидными загустителями, рН регуляторами, стабилизаторами, антисептиками, глицерином, спиртами, карбонизаторами, которые добавляют в газированные напитки, и т.д.. Соединение, имеющее формулу 1 по настоящему изобретению, может также включать мякоть фруктов, добавляемую в натуральный фруктовый сок, фруктовые напитки и овощные напитки.
Практические и предпочтительные в настоящий момент варианты осуществления настоящего изобретения проиллюстрированы в приведенных ниже примерах.
Однако, следует понимать, что квалифицированный специалист в данной области при изучении настоящего описания может осуществлять модификации и улучшения в рамках сути и объема настоящего изобретения.
Препаративный пример 1: Получение (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она

Стадия 1: Получение 2-амино-6-хлорбензойной кислоты
Реакционную смесь, состоящую из 5 г 2-амино-6-хлорбензонитрила (32.77 ммоль), 30%-ного раствора гидроксида калия (50 мл) и 30%-ного водного раствора перекиси водорода (3 мл) кипятили 12 часов, затем охлаждали до комнатной температуры. Водный слой отделяли с помощью диэтилового эфира и подкисляли добавлением 12н. HCl (pH: 3-4) для отделения органического слоя. Органический слой промывали насыщенным раствором хлорида натрия и затем отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. В результате получали 5.31 г целевого соединения 2-амино-6-хлорбензойной кислоты в виде желтого твердого вещества (30.95 ммоль, выход: 94%).
1H ЯМР (300 МГц, ДМСО-d6) δ 8.24 (с, 2H), 7.00-7.06 (т, J = 7.5 Гц, 1H), 6.64 (д, J = 8.4 Гц, 1H), 6.56 (д, J = 7.8 Гц, 1H).
Стадия 2: Получение трет-бутил (S)-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)карбамата
1.00 г (5.89 ммоль) 2-амино-6-хлорбензойной кислоты, полученной на описанной выше стадии 1, смешивали с N-Boc-L-аланином (1 экв.), трифенилфосфитом (1.2 экв.) и безводным пиридином (5 мл). Реакционную смесь перемешивали при 55℃ в течение 12 часов, после чего добавляли анилин (1 экв.). Полученную смесь нагревали в течение 6 часов, затем охлаждали до комнатной температуры. Полученную смесь упаривали при пониженном давлении, после чего подкисляли 1н. HCl (pH: 5-6). Реакционную смесь экстрагировали этилацетатом для отделения органического слоя. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 1/1), получая 1.63 г целевого соединения трет-бутил (S)-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)карбамата в виде желтого твердого вещества (4.09 ммоль, выход: 69%).
1H ЯМР (300 МГц, CDCl3) δ 7.61-7.63 (м, 2H), 7.46-7.57 (м, 4H), 7.36-7.39 (м, 1H), 7.29 (с, 1H), 5.59 (с, 1H), 4.50 (с, 1H), 1.37-1.46 (м, 9H), 1.25 (д, J = 6.5 Гц, 3H).
Стадия 3: Получение (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она
1.634 г (4.09 ммоль) трет-бутил (S)-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)карбамата, полученного на стадии 2, растворяли в дихлорметане (15 мл), затем добавляли трифторуксусную кислоту (ТФУК, 5 мл). После кипячения при 40ºС в течение 3 часов, смесь охлаждали при комнатной температуре, и медленно добавляли насыщенный водный раствор NaHCO3 для нейтрализации смеси. Органический слой экстрагировали этилацетатом, промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 20/1 -> дихлорметан/метанол, 5/1), получая 1.046 г целевого соединения (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она в виде белого твердого вещества (3.49 ммоль, выход: 85%).
1H ЯМР (300 МГц, CDCl3) δ 7.60-7.64 (м, 2H), 7.51-7.59 (м, 3H), 7.44-7.48 (м, 1H), 7.27-7.29 (м, 2H), 3.63-3.70 (м, 1H), 1.83 (с, 2H), 1.27 (д, J = 6.5 Гц, 3H).
Препаративный пример 2: Получение (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-она

Стадия 1: Получение трет-бутил (S)-2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата
5.51 г трет-бутил (S)-2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата получали в виде бежевого твердого вещества при использовании 3.76 г (17.47 ммоль) (трет-бутоксикарбонил)-L-пролина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (12.94 ммоль, выход: 74%).
1H ЯМР (300 МГц, CDCl3) δ 7.42-7.61 (м, 6H), 7.32-7.34 (м, 1H), 7.20-7.24 (м, 1H), 4.40-4.43 (м, 1H), 3.41-3.52 (м, 2H), 1.86-2.06 (м, 3H), 1.70-1.76 (м, 1H), 1.30 (с, 9H).
Стадия 2: Получение (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-она
3.3 г (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-она получали в виде бежевого твердого вещества при использовании 5.53 г (12.99 ммоль) трет-бутил (S)-2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (10.13 ммоль, выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ 7.60-7.62 (м, 2H), 7.47-7.54 (м, 4H), 7.27-7.29 (м, 2H), 3.75-3.79 (м, 1H), 3.22-3.26 (м, 1H), 3.73-3.76 (м, 1H), 1.69-1.77 (м, 4H).
Препаративный пример 3: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-она

Стадия 1: Получение трет-бутил (S)-(1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)карбамата
4.06 г трет-бутил (S)-(1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)карбамата получали в виде твердого вещества цвета слоновой кости при использовании 1.59 г (16.90 ммоль) 3-аминопиридина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (10.14 ммоль, выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ 8.77 (с, 1H), 8.57 (с, 1H), 7.45-7.82 (м, 5H), 5.47 (с, 1H), 4.35-4.38 (м, 1H), 1.41 (с, 9H), 1.26-1.31 (м, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-она
2.6 г (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 4.08 г (10.18 ммоль) трет-бутил (S)-(1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)карбамата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (8.65 ммоль, выход: 85%).
1H ЯМР (300 МГц, CDCl3) δ 8.78 (с, 1H), 8.58 (с, 1H), 7.65-7.71 (м, 3H), 7.52-7.56 (м, 2H), 3.57-3.64 (м, 1H), 1.29 (дд, J = 22.7, 5.9 Гц, 3H).
Препаративный пример 4: Получение (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-она

Стадия 1: Получение трет-бутил (S)-2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата
3.82 г трет-бутил (S)-2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата получали в виде белого твердого вещества при использовании 1.65 г (17.55 ммоль) 3-аминопиридина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (8.95 ммоль, выход: 51%).
1H ЯМР (300 МГц, CDCl3) δ 8.74-8.77 (м, 1H), 8.51 (с, 1H), 7.45-7.70 (м, 5H), 4.27-4.41 (м, 1H), 3.70-3.83 (м, 1H), 3.45-3.60 (м, 1H), 1.92-1.99 (м, 2H), 1.77-1.87 (м, 2H), 1.31 (д, J = 11.3 Гц, 9H).
Стадия 2: Получение (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-она
2.6 г (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 3.83 г (8.97 ммоль) трет-бутил (S)-2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (7.80 ммоль, выход: 87%).
1H ЯМР (300 МГц, CDCl3) δ 8.75 (с, 1H), 8.55-8.59 (д, J = 12.2 Гц, 1H), 7.63-7.70 (м, 3H), 7.50-7.52 (м, 2H), 3.63-3.81 (м, 1H), 3.20-3.27 (м, 1H), 2.74-2.79 (м, 1H), 1.65-1.78 (м, 4H).
Препаративный пример 5: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(м-толил)хиназолин-4(3H)-она
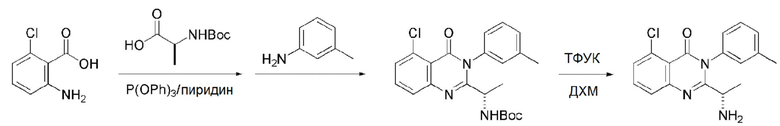
Стадия 1: Получение трет-бутил (S)-(1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)карбамата
5.1 г трет-бутил (S)-(1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)карбамата получали в виде белого твердого вещества при использовании 1.88 г (17.56 ммоль) м-толуидина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (12.29 ммоль, выход: 70%).
1H ЯМР (300 МГц, CDCl3) δ 7.62 (с, 2H), 7.39-7.47 (м, 2H), 7.31-7.33 (м, 1H), 7.15 (с, 1H), 7.08 (с, 1H), 5.61 (с, 1H), 4.50-4.53 (м, 1H), 2.42 (с, 3H), 1.42 (с, 9H), 1.27 (с, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(м-толил)хиназолин-4(3H)-она
3.0 г (S)-2-(1-аминоэтил)-5-хлор-3-(м-толил)хиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 5.0 г (12.10 ммоль) трет-бутил (S)-(1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)карбамата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (9.56 ммоль, выход: 79%).
1H ЯМР (300 МГц, CDCl3) δ 7.61-7.63 (м, 2H), 7.41-7.48 (м, 2H), 7.30-7.33 (д, J = 7.7 Гц, 1H), 7.05-7.08 (м, 2H), 3.66-3.73 (кв, J = 13.0, 6.5 Гц, 1H), 2.42 (с, 3H), 1.27-1.29 (д, J = 6.5 Гц, 3H).
Препаративный пример 6: Получение (S)-5-хлор-2-(пирролидин-2-ил)-3-(м-толил)хиназолин-4(3H)-она

Стадия 1: Получение (S)-трет-бутил 2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата
5.67 г трет-бутил (S)-2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата получали в виде желтого твердого вещества при использовании 1.87 г (17.41 ммоль) м-толуидина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (12.88 ммоль, выход: 74%).
1H ЯМР (300 МГц, CDCl3) δ 7.53-7.58 (м, 2H), 7.45-7.51 (м, 2H), 7.30-7.33 (м, 1H), 7.14 (с, 1H), 7.02 (с, 1H), 4.43-4.51 (м, 1H), 3.63-3.74 (м, 1H), 3.42-3.50 (м, 1H), 2.42 (с, 3H), 1.93-2.04 (м, 3H), 1.73-1.79 (м, 1H), 1.23-1.37 (м, 9H).
Стадия 2: Получение (S)-5-хлор-2-(пирролидин-2-ил)-3-(м-толил)хиназолин-4(3H)-она
4.0 г (S)-5-хлор-2-(пирролидин-2-ил)-3-(м-толил)хиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 5.69 г (12.93 ммоль) трет-бутил (S)-2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (11.77 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 7.42-7.58 (м, 4H), 7.35 (д, J = 8.1 Гц, 1H), 7.20-7.24 (м, 1H), 7.05 (с, 1H), 4.44-4.51 (м, 1H), 3.42-3.50 (м, 1H), 3.18-3.24 (м, 1H), 2.44 (д, J = 11.7 Гц, 3H), 1.76-1.93 (м, 4H).
Препаративный пример 7: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-она
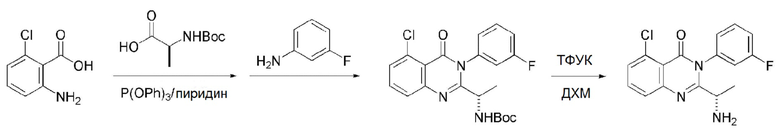
Стадия 1: Получение трет-бутил (S)-(1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)карбамата
4.88 г трет-бутил (S)-(1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)карбамата получали в виде желтого твердого вещества при использовании 1.94 г (17.43 ммоль) 3-фторанилина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (11.68 ммоль, выход: 67%).
1H ЯМР (300 МГц, CDCl3) δ 7.42-7.63 (м, 4H), 7.14-7.23 (м, 1H), 7.03-7.17 (м, 2H), 5.44-5.55 (м, 1H), 4.48-4.52 (м, 1H), 1.42 (с, 9H), 1.18-1.31 (м, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-она
2.4 г (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 4.88 г (11.80 ммоль) трет-бутил (S)-(1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)карбамата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (7.55 ммоль, выход: 64%).
1H ЯМР (300 МГц, CDCl3) δ 1.64 (с, 1H), 7.63 (д, J = 1.5 Гц, 1H), 7.46-7.60 (м, 2H), 7.22-7.25 (м, 1H), 7.04-7.10 (м, 2H), 3.65-3.71 (м, 1H), 1.31 (дд, J = 6.5, 1.3 Гц, 3H).
Препаративный пример 8: Получение (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)хиназолин-4(3H)-она

Стадия 1: Получение трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата
6.33 г трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата получали в виде желтого твердого вещества при использовании 1.93 г (17.39 ммоль) 3-фторанилина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (14.26 ммоль, выход: 82%).
1H ЯМР (300 МГц, CDCl3) δ 7.52-7.65 (м, 3H), 7.34-7.49 (м, 2H), 6.97-7.23 (м, 2H), 4.42-4.51 (м, 1H), 3.65-3.77 (м, 1H), 3.42-3.54 (м, 1H), 1.91-2.11 (м, 3H), 1.79-1.88 (м, 1H), 1.26-1.37 (м, 9H).
Стадия 2: Получение (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)хиназолин-4(3H)-она
3.82 г (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)хиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 6.49 г (14.62 ммоль) трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (11.11 ммоль, выход: 76%).
1H ЯМР (300 МГц, CDCl3) δ 7.62 (с, 1H), 7.61 (с, 1H), 7.44-7.58 (м, 2H), 7.20-7.25 (м, 1H), 7.02-7.12 (м, 2H), 3.78-3.81 (м, 1H), 3.24-3.28 (м, 1H), 3.00 (с, 1H), 2.77-2.80 (м, 1H), 1.72-1.82 (м, 4H).
Препаративный пример 9: Получение (S)-2-(1-аминопропил)-5-фтор-3-фенилхиназолин-4(3H)-она
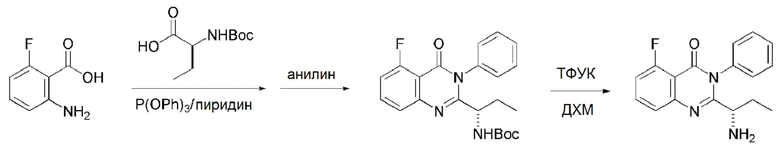
Стадия 1: Получение трет-бутил (S)-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)карбамата
4.42 г трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата получали в виде белого твердого вещества при использовании 2.97 г (14.61 ммоль) (S)-2-((трет-бутоксикарбонил)амино)бутановой кислоты согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1 (11.11 ммоль, выход: 76%).
1H ЯМР (300 МГц, ДМСО-d6) δ 7.39-7.43 (м, 1H), 7.07-7.19 (м, 3H), 6.99-7.02 (м, 2H), 6.72-6.88 (м, 2H), 3.51-3.56 (м, 1H), 2.92 (с, 1H), 1.26-1.31 (м, 1H), 1.10-1.17 (м, 1H), 0.92 (с, 9H), 0.21 (т, J = 6.7 Гц, 3H).
Стадия 2: Получение (S)-2-(1-аминопропил)-5-фтор-3-фенилхиназолин-4(3H)-она
32.43 г (S)-2-(1-аминопропил)-5-фтор-3-фенилхиназолин-4(3H)-она получали в виде белого твердого вещества при использовании 4.16 г (10.47 ммоль) трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-карбоксилата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (8.17 ммоль, выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ 7.66-7.73 (м, 1H), 7.50-7.56 (м, 4H), 7.27-7.28 (м, 3H), 7.11 (т, J = 5.1 Гц, 1H), 3.40-3.44 (м, 1H), 1.75-1.84 (м, 1H), 1.46-1.55 (м, 1H), 0.79 (т, J = 7.4 Гц, 3H).
Препаративный пример 10: Получение (S)-3-(1-аминоэтил)-4,8-дихлор-2-фенилизохинолин-1(2H)-она
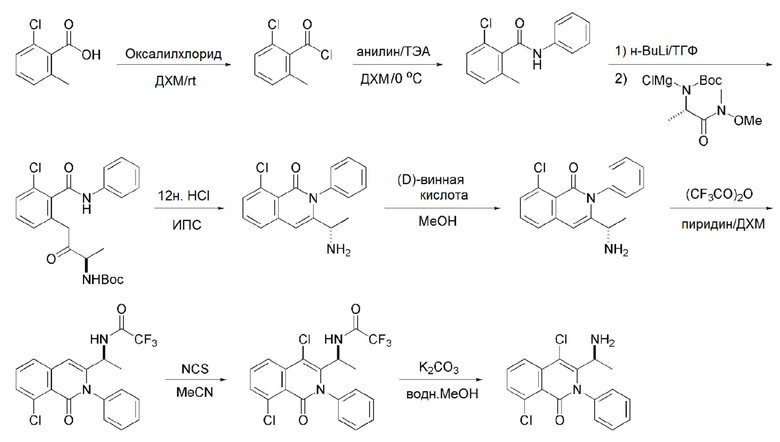
Стадия 1: Получение 2-хлор-6-метилбензоилхлорида
10.073 г (59.04 ммоль) 2-хлор-6-метилбензойной кислоты смешивали с безводным дихлорметаном (150 мл), затем добавляли 10.3 мл (118.09 ммоль, 2 экв.) оксалилхлорида. Добавляли 1-2 капли диметилформамида, и полученную смесь перемешивали при комнатной температуре в течение 4 часов. Полученную смесь упаривали при пониженном давлении. В результате получали 11.479 г целевого соединения 2-хлор-6-метилбензоилхлорида в виде коричневой жидкости (59.04 ммоль, выход: 100%).
Стадия 2: Получение 2-хлор-6-метил-N-фенилбензамида
5.8 мл (63.76 ммоль, 1.05 экв.) анилина и 14.8 мл (106.26 ммоль, 1.75 экв.) триэтиламина растворяли в безводном дихлорметане (150 мл), в который потом медленно прикапывали 11.48 г (60.7 ммоль, 1.0 экв.) 2-хлор-6-метилбензоилхлорида, полученного на стадии 1, растворенного в безводном дихлорметане (20 мл) при 0ºС в течение 10 минут, после чего перемешивали 5 часов. Затем смесь промывали последовательно 1н. HCl, водой и насыщенным раствором бикарбоната натрия. Органический слой отделяли, сушили (Na2SO4), фильтровали и перегоняли при пониженном давлении. Полученное твердое вещество перекристаллизовывали из смеси гексан/этилацетат, получая 13.0 г целевого соединения 2-хлор-6-метил-N-фенилбензамида в виде белого твердого вещества (52.9 ммоль, выход: 87%).
1H ЯМР (300 МГц, ДМСО-d6) δ 10.56 (с, 1H), 7.69-7.72 (д, J = 7.7 Гц, 2H), 7.27-7.37 (м, 5H), 7.10 (т, J = 7.3 Гц, 1H), 2.31 (с, 3H).
Стадия 3: Получение трет-бутил (S)-(4-(3-хлор-2-(фенилкарбамоил)фенил)-3-оксобутан-2-ил)карбамата
6 г (24.42 ммоль) 2-хлор-6-метил-N-фенилбензамида, полученного на стадии 2, растворяли в безводном ТГФ (50 мл), в который затем медленно добавляли 24.42 мл (61.05 ммоль, 2.5 экв.) н-BuLi при -30ºС. Полученную смесь перемешивали 1 час. 8.5 г (36.63 ммоль, 1.5 экв.) трет-бутил (S)-(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамата растворяли в безводном ТГФ (50 мл), в который затем медленно добавляли 56.35 мл (73.26 ммоль, 3.0 экв.) изопропил магнийхлорида при -30ºС. Реакционную смесь перемешивали 1 час и медленно добавляли в описанную выше смесь с помощью канюли, затем перемешивали при -15ºС в течение 2 часов. Поддерживали температуру равной -15ºС ~ -10ºС, порциями добавляя в реакционную смесь воду и 1н. HCl. рH реакционной смеси доводили до 5, и полученную смесь нагревали до комнатной температуры. Органический слой экстрагировали этилацетатом, промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: CH2Cl2/MeOH, 30/1 -> CH2Cl2/MeOH, 10/1), получая 8.8 г целевого соединения трет-бутил (S)-(4-(3-хлор-2-(фенилкарбамоил)фенил)-3-оксобутан-2-ил)карбамата в виде белого твердого вещества (21.11 ммоль, выход: 86%).
1H ЯМР (300 МГц, CDCl3) δ 7.90 (с, 1H), 7.59 (д, J = 7.6 Гц, 2H), 7.29-7.35 (м, 4H), 7.13-7.18 (м, 2H), 5.01 (с, 1H), 4.33-4.37 (м, 1H), 3.91-4.06 (м, 2H), 1.40 (с, 9H), 1.24 (д, J = 7.3 Гц, 3H).
Стадия 4: Получение (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она
8.8 г (21.11 ммоль) трет-бутил (S)-(4-(3-хлор-2-(фенилкарбамоил)фенил)-3-оксобутан-2-ил)карбамата, полученного на стадии 3, растворяли в смеси ИПС/12н. HCl (5/3, 160 мл) и перемешивали при 65ºС в течение 2 часов. Полученную смесь упаривали при пониженном давлении, затем добавляли насыщенный водный раствор карбоната натрия. Органический слой экстрагировали дихлорметаном, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: CH2Cl2/MeOH, 10/1 -> CH2Cl2/MeOH, 5/1), получая 4.871 г целевого соединения (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она в виде белого твердого вещества (16.30 ммоль, выход: 77%).
Стадия 5: Получение (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она
4.871 г (16.30 ммоль) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она, полученного на стадии 4, растворяли в метаноле (100 мл), в который затем добавляли 2.45 г (16.30 ммоль, 1.0 экв.) (D)-винной кислоты. Полученную смесь перемешивали при комнатной температуре в течение 30 минут, после чего кипятили 90 минут. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и отфильтровывали выпавший белый осадок. Добавляли к белому осадку воду и доводили значение рН до 8 насыщенным водным раствором карбоната натрия, затем перемешивали при комнатной температуре 30 минут. Белый твердый осадок отфильтровывали и сушили. В результате получали 3.74 г целевого соединения (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она в виде белого твердого вещества (12.50 ммоль, выход: 77%).
1H ЯМР (300 МГц, CDCl3) δ 7.41-7.56 (м, 7H), 7.28 (с, 1H), 6.71 (с, 1H), 3.68-3.74 (кв, J = 6.5 Гц, 1H), 1.31 (с, 2H), 1.25 (д, J = 6.5 Гц, 3H).
Стадия 6: Получение (S)-N-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида
2.99 г (10.00 ммоль) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она, полученного на стадии 5, и безводный пиридин (3 экв.) добавляли в безводный CH2Cl2 (15 мл), в который затем добавляли трифторуксусный ангидрид [(CF3CO)2O, 1.2 экв.] при 0ºС. Через 30 минут реакционную смесь нагревали до комнатной температуры, затем перемешивали 2 часа. Органический слой экстрагировали водой и этилацетатом, затем промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 2/1), получая 3.83 г целевого соединения (S)-N-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида в виде белого твердого вещества (9.70 ммоль, выход: 97%).
1H ЯМР (300 МГц, CDCl3) δ 7.20-7.60 (м, 8H), 6.52 (с, 1H), 6.38 (ушир.д, 1H), 4.64-4.74 (м, 1H), 1.43 (д, J = 6.9 Гц, 3H).
Стадия 7: Получение (S)-N-(1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида
Смешивали 3.55 г (9.00 ммоль) (S)-N-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида, полученного на стадии 6, N-хлорсукцинимид (NCS, 1.2 экв.) и безводный ацетонитрил (25 мл). Реакционную смесь кипятили в течение 4 часов, затем охлаждали до комнатной температуры. Добавляли насыщенный раствор тиосульфата натрия (Na2S2O3) (2 мл) и воду, после чего экстрагировали этилацетатом. Органический слой отделяли и промывали насыщенным раствором хлорида натрия. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 3.79 г целевого соединения (S)-N-(1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида в виде белого твердого вещества (8.82 ммоль, выход: 98%).
1H ЯМР (300 МГц, CDCl3) δ 7.98 (м, 1H), 7.51-7.69 (м, 6H), 7.15-7.20 (м, 1H), 7.03 (ушир.с, 1H), 4.85-5.00 (м, 1H), 1.58 (д, J = 7.2 Гц, 3H).
Стадия 8: Получение (S)-3-(1-аминоэтил)-4,8-дихлор-2-фенилизохинолин-1(2H)-она
Смешивали 3.78 г (8.8 ммоль) (S)-N-(1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида, полученного на стадии 7, K2CO3 (5 экв.) и MeOH/H2O (10/1, 20 мл), и реакционную смесь кипятили в течение 12 часов. Полученную смесь охлаждали до комнатной температуры. Растворитель удаляли при пониженном давлении. Добавляли воду и этилацетат, после чего проводили экстракцию. Органический слой отделяли и промывали насыщенным раствором хлорида натрия. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: CH2Cl2/MeOH, 20/1 -> гексан CH2Cl2/MeOH, 10/1), получая 2.90 г целевого соединения (S)-3-(1-аминоэтил)-4,8-дихлор-2-фенилизохинолин-1(2H)-она в виде белого твердого вещества (8.7 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 7.98-8.03 (м, 1H), 7.45-7.65 (м, 5H), 7.17-7.30 (м, 2H), 3.87-4.00 (м, 1H), 1.80 (ушир.с, 2H), 1.46 (д, J = 7.1 Гц, 3H).
Препаративный пример 11: Получение (S)-8-хлор-2-фенил-3-(пирролидин-2-ил)изохинолин-1(2H)-она

Стадия 1: Получение трет-бутил (S)-2-(2-(3-хлор-2-(фенилкарбамоил)фенил) ацетил)пирролидин-1-карбоксилата
6 г (24.42 ммоль) 2-хлор-6-метил-N-фенилбензамида, полученного на стадии 2, в Препаративном примере 13, растворяли в безводном ТГФ (50 мл). Медленно добавляли 24.42 мл (61.05 ммоль, 2.5 экв.) н-BuLi при -30ºС, затем перемешивали 1 час. 9.46 г (36.63 ммоль, 1.5 экв.) трет-бутил (S)-2-(метокси(метил)карбамоил)пирролидин-1-карбоксилата растворяли в безводном ТГФ (50 мл) и медленно добавляли в описанную выше реакционную смесь. После этого получали 5.05 г целевого соединения трет-бутил (S)-2-(2-(3-хлор-2-(фенилкарбамоил)фенил)ацетил)пирролидин-1-карбоксилата в виде белого твердого вещества по методике, аналогичной описанной для стадии 3 в Препаративном примере 10 (11.41 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 8.03 (с, 1H), 7.60 (д, J = 6.9 Гц, 2H), 7.32-7.38 (м, 3H), 7.16 (д, J = 8.6 Гц, 2H), 7.05 (д, J = 4.1 Гц, 1H), 4.28-4.39 (м, 1H), 3.98 (с, 1H), 3.41-3.52 (м, 2H), 1.69-1.78 (м, 4H), 1.38 (д, J = 12.1 Гц, 9H).
Стадия 2: Получение (S)-8-хлор-2-фенил-3-(пирролидин-2-ил)изохинолин-1(2H)-она
2.3 г (S)-8-хлор-2-фенил-3-(пирролидин-2-ил)изохинолин-1(2H)-она получали в виде белого твердого вещества при использовании 3.34г (7.53 ммоль) трет-бутил (S)-2-(2-(3-хлор-2-(фенилкарбамоил)фенил)ацетил)пирролидин-1-карбоксилата, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 4 в Препаративном примере 10 (7.08 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 7.40-7.54 (м, 6H), 7.27-7.30 (м, 1H), 7.21-7.23 (м, 1H), 6.87 (с, 1H), 3.78 (т, J = 7.0 Гц, 1H), 3.05-3.12 (м, 1H), 2.82-2.90 (м, 1H), 1.75-1.84 (м, 1H), 1.75 (с, 1H), 1.54-1.66 (м, 3H).
Препаративный пример 12: Получение (S)-1-(2-фенилхинолин-3-ил)этанамина

Стадия 1: Получение 2-фенилхинолин-3-карбальдегида
10 г (52.19 ммоль, 1.0 экв.) 2-хлор-3-хинолинкарбальдегида растворяли в смеси толуол/вода (4/1, 150 мл), и медленно добавляли порциями 7 г (57.41 ммоль, 1.1 экв.) фенилбороновой кислоты, 12.17 г (114.82 ммоль, 2.2 экв.) Na2CO3, 1.5 г (1.30 ммоль, 2.5 мол.%) Pd(PPh3)4, и 7 ~ 8 капель Aliquat 336. Полученную смесь кипятили в течение 12 часов в атмосфере аргона. Полученную смесь затем охлаждали до комнатной температуры. Добавляли воду, после чего экстрагировали этилацетатом. Органический слой отделяли, сушили (N2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/дихлорметан, 10/1 -> гексан/дихлорметан, 3/1), получая 12.156 г целевого соединения 2-фенилхинолин-3-карбальдегида в виде белого твердого вещества (52.11 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 10.19 (с, 1H), 8.86 (с, 1H), 8.22 (д, J = 8.4 Гц, 1H), 8.03 (д, J = 7.9 Гц, 1H), 7.88 (т, J = 7.7 Гц, 1H), 7.64-7.71 (м, 3H), 7.55-7.61 (м, 3H).
Стадия 2: Получение (с,E)-2-метил-N-((2-фенилхинолин-3-ил)метилен)пропан-2-сульфинамида
3 г (12.89 ммоль, 1.1 экв.) 2-фенилхинолин-3-карбальдегида, полученного на стадии 1, растворяли в ТГФ (100 мл), в который затем добавляли 5 мл (23.43 ммоль, 2 экв.) Ti(OEt)4 и 1.42 г (11.72 ммоль, 1.0 экв.) (R)-(+)-2-метил-2-пропансульфинамида, после чего кипятили 12 часов. Реакционную смесь охлаждали до комнатной температуры, затем добавляли насыщенный водный раствор карбоната натрия, перемешивали 1 час. Полученную смесь фильтровали через слой целита, после чего экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1 -> гексан/этилацетат, 1/1), получая 3.96 г целевого соединения (с,E)-2-метил-N-((2-фенилхинолин-3-ил)метилен)пропан-2-сульфинамида в виде желтого твердого вещества (11.77 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 8.90 (с, 1H), 8.80 (с, 1H), 8.19 (д, J = 8.2 Гц, 1H), 7.97 (д, J = 7.8 Гц, 1H), 7.81 (с, 1H), 7.50-7.61 (м, 6H), 1.31 (с, 9H).
Стадия 3: Получение (R)-2-метил-N-((S)-1-(2-фенилхинолин-3-ил)этил)пропан-2-сульфинамида
3.96 г (11.76 ммоль, 1.0 экв.) (с,E)-2-метил-N-((2-фенилхинолин-3-ил)метилен)пропан-2-сульфинамида, полученного на стадии 2, растворяли в безводном дихлорметане (70 мл), в который затем медленно добавляли 11.76 мл (23.53 ммоль, 3 экв.) 2M раствора MeMgBr при -78ºС, и перемешивали 3 часа. Полученную смесь перемешивали далее при комнатной температуре 12 часов, затем добавляли насыщенный водный раствор NH4Cl. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1 -> гексан/этилацетат, 1/2), получая 2.52 г целевого соединения (R)-2-метил-N-((S)-1-(2-фенилхинолин-3-ил)этил)пропан-2-сульфинамида в виде белого твердого вещества (7.15 ммоль, выход: 61%).
1H ЯМР (300 МГц, CDCl3) δ 8.32 (с, 1H), 8.16 (д, J = 8.5 Гц, 1H), 7.84 (д, J = 8.2 Гц, 1H), 7.71 (т, J = 7.6 Гц, 1H), 7.41-7.58 (м, 6H), 4.90-4.98 (м, 1H), 3.42 (д, J = 3.1 Гц, 1H), 1.47 (д, J = 6.6 Гц, 3H), 1.20 (с, 9H).
Стадия 4: Получение (S)-1-(2-фенилхинолин-3-ил)этан-1-амина
2.42 г (7.15 ммоль, 1.0 экв.) (R)-2-метил-N-((S)-1-(2-фенилхинолин-3-ил)этил)пропан-2-сульфинамида, полученного на стадии 3, растворяли в метаноле (50 мл), в который затем добавляли 4M раствор HCl в диоксане (15 мл) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный раствор карбоната натрия, после чего экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 20/1 -> дихлорметан/метанол, 5/1), получая 1.65 г целевого соединения (S)-1-(2-фенилхинолин-3-ил)этан-1-амина в виде светло-желтого вещества (6.64 ммоль, выход: 93%).
1H ЯМР (300 МГц, CDCl3) δ 8.43 (с, 1H), 8.13 (д, J = 8.4 Гц, 1H), 7.86 (д, J = 8.1 Гц, 1H), 7.68 (т, J = 7.6 Гц, 1H), 7.44-7.55 (м, 6H), 4.42-4.48 (кв, J = 6.5 Гц, 1H), 1.58 (с, 2H), 1.34 (д, J = 6.5 Гц, 3H).
Препаративный пример 13: Получение трет-бутил (S)-(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамата

10 г (52.85 ммоль, 1.0 экв.) (S)-2-((трет-бутоксикарбонил)амино)пропановой кислоты растворяли в безводном дихлорметане (250 мл), в который затем добавляли 29.5 мл (211.40 ммоль, 4.0 экв.) триэтиламина и 7.14 г (52.85 ммоль, 1.0 экв.) гидроксибензотриазола (HOBt) при 0ºС. Добавляли 20.3 г (105.70 ммоль, 2.0 экв.) EDCI·HCl, затем перемешивали при комнатной температуре 30 минут. Добавляли 5.7 г (58.14 ммоль, 1.1 экв.) N,O-диметилгидроксиламина, и перемешивали при комнатной температуре 12 часов. Добавляли в реакционную смесь воду, после чего экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Полученное твердое вещество перекристаллизовывали из смеси гексан/этилацетат, получая 11.7 г целевого соединения трет-бутил (S)-(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамата в виде белого твердого вещества (50.37 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 5.23 (с, 1H), 4.68-4.70 (м, 1H), 3.77 (с, 3H), 3.12 (с, 3H), 1.44 (с, 9H), 1.31 (д, J = 3.5 Гц, 3H).
Препаративный пример 14: Получение 2-((трет-бутоксикарбонил)амино)бутановой кислоты

10 г (96.97 ммоль, 1.0 экв.) 2-аминобутановой кислоты растворяли в 65 мл метанола, в который затем добавляли 97 мл 1M раствора гидроксида натрия (NaOH) и 25.4 г (116.37 ммоль, 1.2 экв.) ди-трет-бутил дикарбоната (Boc2O) при 0ºС. Полученную смесь перемешивали при комнатной температуре в течение 48 часов, затем упаривали при пониженном давлении. Реакционную смесь подкисляли добавлением 1н. HCl (pH 2-3), после чего экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 18.5 г целевого соединения 2-((трет-бутоксикарбонил)амино)бутановой кислоты в виде бесцветного масла (91.02 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 6.24 (с, 1H), 5.00-5.03 (д, J = 7.6 Гц, 1H), 4.27-4.29 (м, 1H), 1.87-1.94 (м, 1H), 1.66-1.78 (м, 1H), 1.45 (с, 9H), 0.96-1.01 (т, J = 7.3 Гц, 3H).
Препаративный пример 15: Получение пирроло[2,1-f][1,2,4]триазин-4(3H)-онового производного

Стадии 1 и 2: Получение метил 3-хлор-1H-пиррол-2-карбоксилата (3)
5-метил-3,4-дигидро-2H-пиррол (1) (4 г, 0.05 моль) растворяли в ТГФ (120 мл), затем медленно добавляли N-хлорсукцинимид (51.4 г, 0.39 моль) при 0℃. Полученную смесь перемешивали 15 минут, после чего кипятили 2.5 часа. ТГФ удаляли при пониженном давлении. Проводили экстракцию дихлорметаном. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (безводным MgSO4), фильтровали и упаривали при пониженном давлении. Полученное соединение 4,4-дихлор-5-(трихлорметил)-3,4-дигидро-2H-пиррол (2) использовали в следующей реакции без очистки. 4,4-дихлор-5-(трихлорметил)-3,4-дигидро-2H-пиррол (2) (12 г, 0.05 моль) растворяли в метаноле (100 мл), затем медленно добавляли метоксид натрия (NaOMe) (28 вес.% раствор в метаноле) (16 г, 0.29 моль) при 0ºС, и перемешивали при комнатной температуре 2 часа. Проводили экстракцию этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1), получая 6.5 г целевого соединения метил 3-хлор-1H-пиррол-2-карбоксилата (3) в виде коричневого твердого вещества (0.04 ммоль, выход: 77%).
1H ЯМР (300 МГц, CDCl3) δ 9.11 (ушир.с, 1H, NH), 6.87 (т, J = 2.7 Гц, 1H), 6.26 (т, J = 2.7 Гц, 1H), 3.90 (с, 3H).
Стадия 3: Получение 3-хлор-1H-пиррол-2-карбоновой кислоты (4)
Метил 3-хлор-1H-пиррол-2-карбоксилат (3) (5 г, 0.03 моль) растворяли в смеси метанол/вода (2/1) (30 мл), в которую затем добавляли LiOH·H2O (5.3 г, 0.13 моль), после чего кипятили при комнатной температуре 1.5 часа. Медленно добавляли 12н. HCl (13 мл) при 0ºС. Реакционную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором хлорида натрия, отделяли, сушили (безводным Na2SO4), фильтровали и упаривали при пониженном давлении. Полученное твердое вещество промывали гексаном, получая целевое соединение 3-хлор-1H-пиррол-2-карбоновую кислоту (4).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.58 (ушир.с, 1H), 11.92 (ушир.с, 1H), 6.94 (т, J = 2.7 Гц, 1H), 6.19 (т, J = 2.7 Гц, 1H).
Стадия 4-1: Получение 3-хлор-N-фенил-1H-пиррол-2-карбоксамида (5a)
3-хлор-1H-пиррол-2-карбоновую кислоту (4) (1 г, 6.87 ммоль) растворяли в безводном дихлорметане (25 мл), в который затем медленно добавляли оксалил хлорид (1.3 г, 10.31 ммоль) и диметилформамид (2 капель) при комнатной температуре. Реакционную смесь кипятили 1 час, затем упаривали при пониженном давлении. Полученное твердое вещество растворяли в безводном 1,4-диоксане (8 мл), в который затем медленно добавляли анилин (0.8 г, 8.25 ммоль) и N,N-диизопропилэтиламин (DIPEA) (2.7 г, 20.61 ммоль) при 0ºС. Полученную смесь перемешивали при 60℃ в течение 1 часа, затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором хлорида натрия, отделяли, сушили (безводным Na2SO4), фильтровали и упаривали при пониженном давлении. Полученное твердое вещество промывали гексаном, получая целевое соединение 3-хлор-N-фенил-1H-пиррол-2-карбоксамид (5a) в виде темно-коричневого твердого вещества.
1H ЯМР (300 МГц, CDCl3) δ 10.35 (ушир.с, 1H), 8.60 (ушир.с, 1H), 7.64 (д, J = 7.2 Гц, 2H), 7.37 (т, J = 7.8 Гц, 2H), 7.15 (т, J = 7.2 Гц, 1H), 6.91 (с, 1H), 6.27 (с, 1H).
Стадия 4-2: Получение 3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (5b)
2.6 г 3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (5b) получали в виде светло-коричневого твердого вещества при использовании 3-хлор-1H-пиррол-2-карбоновой кислоты (4) (2 г, 13.75 ммоль) и 3-фторанилина (1.9 г, 17.19 ммоль) по той же методике, которая описана для получения соединения 5a (10.85 ммоль, выход: 67%).
1H ЯМР (300 МГц, CDCl3) δ 9.81 (ушир.с, 1H), 8.61 (ушир.с, 1H), 7.61 (д, J = 11.1 Гц, 1H), 7.34-7.21 (м, 2H), 6.93 (т, J = 3.0 Гц, 1H), 6.81-6.87 (м, 1H), 6.29 (т, J = 3.0 Гц, 1H).
Стадия 5-1: Получение 1-амино-3-хлор-N-фенил-1H-пиррол-2-карбоксамида (6a)
NH4Cl (2.1 г, 39 ммоль), водный раствор NaOH (28 вес.%) (5.2 г, 130 ммоль), NH4OH (гидроксид аммония) (28 вес.%) (2.3 г, 65 ммоль) и Aliquat 336 (0.3 г, 0.65 ммоль) перемешивали с получением раствора. 3-хлор-N-фенил-1H-пиррол-2-карбоксамид (5a) (1.4 г, 6.50 ммоль) растворяли в смеси т-бутилметиловый эфир/диэтиловый эфир (1:1) (80 мл), и медленно добавляли в перемешиваемый раствор при 0ºС. Водный раствор NaOCl (гипохлорит натрия) (10 вес.%) медленно добавляли при той же температуре, затем перемешивали при комнатной температуре в течение 4 часов. Проводили экстракцию этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1), получая 1.1 г целевого соединения 1-амино-3-хлор-N-фенил-1H-пиррол-2-карбоксамида (6a) в виде белого твердого вещества (4.56 ммоль, выход: 70%).
1H ЯМР (300 МГц, CDCl3) δ 8.53 (ушир.с, 1H), 7.59 (д, J = 8.4 Гц, 2H), 7.37 (т, J = 7.8 Гц, 2H), 7.16 (т, J = 7.5 Гц, 1H), 6.91 (д, J = 2.7 Гц, 1H), 6.08 (д, J = 3.0 Гц, 1H), 5.91 (с, 2H).
Стадия 5-2: Получение 1-амино-3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (6b)
1.7 г 1-амино-3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (6b) получали в виде белого твердого вещества при использовании 3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (5b) (3.9 г, 0.02 моль) по той же методике, которая описана для получения соединения 6a (6.78 ммоль, выход: 63%).
1H ЯМР (300 МГц, ДМСО-d6) δ 11.03 (ушир.с, 1H), 7.68 (д, J = 12 Гц, 1H), 7.36 (с, 2H), 6.98 (д, J = 2.7 Гц, 1H), 6.90-6.94 (м, 1H), 6.54 (с, 2H), 6.12 (д, J = 3.0 Гц, 1H).
Стадия 6-1-1: Получение трет-бутил (S)-2-((3-хлор-2-(фенилкарбамоил)-1H-пиррол-1-ил)карбамоил)пирролидин-1-карбоксилата (7a)
1-амино-3-хлор-N-фенил-1H-пиррол-2-карбоксамид (6a) (150 мг, 0.64 ммоль), N-(трет-бутоксикарбонил)-L-пролин (192 мг, 0.89 ммоль) и EDC·HCl (171 мг, 0.89 ммоль) растворяли в безводном ТГФ (1 мл), затем перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1), получая 193 мг целевого соединения трет-бутил (S)-2-((3-хлор-2-(фенилкарбамоил)-1H-пиррол-1-ил)карбамоил)пирролидин-1-карбоксилата (7a) в виде белого твердого вещества (0.45 ммоль, выход: 70%).
1H ЯМР (300 МГц, CDCl3) δ 10.61 (ушир.с, 1H), 8.32 (ушир.с, 1H), 7.57 (д, J = 7.8 Гц, 2H), 7.34 (т, J = 7.8 Гц, 2H), 7.01-7.15 (м, 2H), 6.20 (с, 1H), 4.30-4.56 (м, 1H), 3.30-3.70 (м, 2H), 2.14-2.44 (м, 2H), 1.82-2.08 (м, 2H), 1.49 (с, 9H).
Стадия 6-1-2: Получение трет-бутил (S)-2-((3-хлор-2-((3-фторфенил)карбамоил)-1H-пиррол-1-ил)карбамоил)пирролидин-1-карбоксилата (7b)
Трет-бутил (S)-2-((3-хлор-2-((3-фторфенил)карбамоил)-1H-пиррол-1-ил)карбамоил) пирролидин-1-карбоксилат (7b) получали при использовании 1-амино-3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (6b) (0.7 г, 2.76 ммоль) по той же методике, которая описана для получения соединения 7a.
1H ЯМР (300 МГц, CDCl3) δ 10.61 (ушир.с, 1H), 8.38 (ушир.с, 1H), 7.64 (ушир.с, 1H), 7.23-7.31 (м, 2H,), 7.13 (ушир.с, 1H), 6.99 (ушир.с, 1H), 6.79-6.85 (м, 1H), 6.21 (с, 1H), 4.50 (ушир.с, 1H), 3.51 (ушир.с, 1H), 3.42 (ушир.с, 1H), 1.84-2.39 (м, 4H), 1.50 (с, 9H).
Стадия 6-2-1: Получение трет-бутил (S)-(1-((3-хлор-2-(фенилкарбамоил)-1H-пиррол-1-ил)амино)-1-оксопропан- 2-ил)карбамата (7a')
3.5 г трет-бутил (S)-(1-((3-хлор-2-(фенилкарбамоил)-1H-пиррол-1-ил)амино)-1-оксопропан-2-ил)карбамата (7a') получали в виде белого твердого вещества при использовании 1-амино-3-хлор-N-фенил-1H-пиррол-2-карбоксамида (6a) (2.3 г, 9.76 ммоль) и N-(трет-бутоксикарбонил)-L-анилина (2.6 г, 13.66 ммоль) по той же методике, которая описана для получения соединения 7a (8.56 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 10.25 (с, 1H), 8.37 (с, 1H), 7.56 (д, J = 8.1 Гц, 2H), 7.34 (т, J = 7.8 Гц, 2H), 7.14 (т, J = 7.5 Гц, 1H), 7.03 (д, J = 2.7 Гц, 1H), 6.21 (д, J = 2.7 Гц, 1H), 5.06 (д, J = 7.2 Гц, 1H), 4.40 (ушир.с, 1H), 1.47 (с, 9H), 1.44 (д, J = 7.5 Гц, 3H).
Стадия 6-2-2: Получение трет-бутил (S)-(1-((3-хлор-2-((3-фторфенил)карбамоил)-1H-пиррол-1-ил)амино)-1-оксопропан- 2-ил)карбамата (7b')
Трет-бутил (S)-(1-((3-хлор-2-((3-фторфенил)карбамоил)-1H-пиррол-1-ил)амино)-1-оксопропан-2-ил)карбамат (7b') получали в виде белого твердого вещества при использовании 1-амино-3-хлор-N-(3-фторфенил)-1H-пиррол-2-карбоксамида (6b) (3.1 г, 12.26 ммоль) и N-(трет-бутоксикарбонил)-L-аланина (3.3 г, 17.16 ммоль) по той же методике, которая описана для получения соединения 7a (8.56 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 10.16 (с, 1H), 8.42 (с, 1H), 7.61 (д, J = 11.1 Гц, 1H), 7.24-7.31 (м, 2H), 7.14-7.11 (м, 1H), 7.02 (д, J = 3.3 Гц, 1H), 6.86-6.80 (м, 1H), 6.22 (д, J = 3.3 Гц, 1H), 5.00 (д, J = 7.8 Гц, 1H) 4.35-4.42 (м, 1H), 1.48 (с, 9H), 1.44 (д, J = 7.2 Гц, 3H).
Стадия 7-1-1: Получение трет-бутил (S)-2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин- 1-карбоксилата (8a)
Трифенилфосфин (303 мг, 1.16 ммоль) растворяли в дихлорметане (1 мл), в который затем медленно добавляли Br2 (184 мг, 1.16 ммоль) при 0ºС, затем перемешивали при комнатной температуре 10 минут. Трет-бутил (S)-2-((3-хлор-2-(фенилкарбамоил)-1H-пиррол-1-ил)карбамоил)пирролидин-1-карбоксилат (7a) (250 мг, 0.58 ммоль) растворяли в дихлорметане (1 мл), и медленно добавляли в описанную выше смесь при 0ºС. Триэтиламин (146 мг, 1.44 ммоль) также добавляли при той же температуре. Реакционную смесь перемешивали при 0ºС в течение 10 минут, затем экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1), получая 82 мг целевого соединения трет-бутил (S)-2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-карбоксилата (8a) в виде белого твердого вещества (0.20 ммоль, выход: 34%).
1H ЯМР (300 МГц, CDCl3) δ 7.29-7.36 (м, 2H), 7.05-7.13 (м, 3H), 6.36-6.40 (м, 1H), 4.46-4.51 (м, 0.5H), 4.36-4.40 (м, 0.5H), 3.09-3.41 (м, 2H), 2.12-2.25 (м, 1H), 1.86-2.00 (м, 1H), 1.71-1.79 (м, 2H), 1.45 (с, 5H), 1.35 (с, 4H).
Стадия 7-1-2: Получение трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин- 1-карбоксилата (8b)
45 мг трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-карбоксилата (8b) получали в виде белого твердого вещества при использовании трет-бутил (S)-2-((3-хлор-2-((3-фторфенил)карбамоил)-1H-пиррол-1-ил)карбамоил)пирролидин-1-карбоксилата (7b) (100 мг, 0.22 ммоль) по той же методике, которая описана для получения соединения 8a (0.10 ммоль, выход: 47%).
1H ЯМР (300 МГц, CDCl3) δ 7.43-7.57 (м, 1H), 7.18-7.37 (м, 2H), 6.99-7.13 (м, 1H), 6.48 (дд, 1H, J = 2.7 Гц, J = 12.9 Гц), 4.46-4.53 (м, 0.5H), 4.41 (ушир.с, 0.5H), 3.32-3.70 (м, 2H), 1.80-2.11 (м, 4H), 1.45 (с, 4H), 1.38 (с, 5H).
Стадия 7-2-1: Получение трет-бутил (S)-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин- 2-ил)этил)карбамата (8a')
105 мг трет-бутил (S)-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)карбамата (8a') получали в виде белого твердого вещества при использовании трет-бутил (S)-(1-((3-хлор-2-(фенилкарбамоил)-1H-пиррол-1-ил)амино)-1-оксопропан-2-ил)карбамата (7a') (500 мг, 1.23 ммоль) по той же методике, которая описана для получения соединения 8a (0.27 ммоль, выход: 22%).
1H ЯМР (300 МГц, CDCl3) δ 7.48-7.60 (м, 3H), 7.39-7.41 (м, 1H), 7.28 (ушир.с, 2H), 6.50 (д, J = 2.1 Гц, 1H), 5.09 (ушир.с, 1H), 4.48 (ушир.с, 1H), 1.42 (с, 9H), 1.26 (д, J = 6.3 Гц, 3H).
Стадия 7-2-2: Получение трет-бутил (S)-(1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин- 2-ил)этил)карбамата (8b')
140 мг трет-бутил (S)-(1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)карбамата (8b') получали в виде белого твердого вещества при использовании трет-бутил (S)-(1-((3-хлор-2-((3-фторфенил)карбамоил)-1H-пиррол-1-ил)амино)-1-оксопропан-2-ил)карбамата (7b') (500 мг, 1.18 ммоль) по той же методике, которая описана для получения соединения 8a (0.34 ммоль, выход: 29%).
1H ЯМР (300 МГц, CDCl3) δ 7.47-7.58 (м, 1H), 7.15-7.30 (м, 3H), 7.02-7.09 (м, 1H), 6.51 (д, J = 2.1 Гц, 1H), 4.99-5.10 (м, 1H), 4.48 (ушир.с, 1H), 1.41 (с, 9H), 1.24-1.31 (м, 3H).
Стадия 8-1-1: Получение (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она (9a)
Трет-бутил (S)-2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-карбоксилат (8a) (130 мг, 0.31 ммоль) растворяли в трифторуксусной кислоте (50 вес.% в дихлорметане) (2 мл) при 0ºС, затем перемешивали при комнатной температуре 30 минут. Реакционную смесь нейтрализовывали добавлением NaHCO3 при 0ºС, затем экстрагировали дихлорметаном. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. В результате получали 96 мг целевого соединения (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она (9a) в виде белого твердого вещества (0.30 ммоль, выход: 97%).
1H ЯМР (300 МГц, CDCl3) δ 7.47-7.55 (м, 3H), 7.26-7.30 (м, 3H), 6.49 (д, J = 2.7 Гц, 1H), 3.81 (т, J = 5.7 Гц, 1H), 3.12-3.19 (м, 1H), 2.74-2.81 (м, 1H), 2.02 (ушир.с, 1H), 1.77-1.82 (м, 2H), 1.61-1.73 (м, 2H).
Стадия 8-1-2: Получение (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она HCl соли (9b)
Конц. HCl (15 вес.% в метаноле) (10 мл) добавляли к трет-бутил (S)-2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-карбоксилату (8b) (40 мг, 0.09 ммоль) при 0ºС, затем перемешивали 1 час. Растворитель удаляли из реакционной смеси при пониженном давлении. В результате получали целевое соединение (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она гидрохлорид (9b) в виде белого твердого вещества.
1H ЯМР (300 МГц, ДМСО-d6) δ 9.86 (ушир.с, 1H), 9.08 (ушир.с, 1H), 7.63-7.69 (м, 2H), 7.40-7.54 (м, 3H), 6.78 (с, 1H), 4.23 (ушир.с, 1H), 3.17 (ушир.с, 1H), 2.09-2.14 (м, 1H), 1.90-1.98 (м, 1H), 1.69-1.87 (м, 2H).
Стадия 8-2-1: Получение (S)-2-(1-аминоэтил)-5-хлор-3-фенилпирроло[2,1-f][1,2,4]триазин-4(3H)-она (9a')
69 мг (S)-2-(1-аминоэтил)-5-хлор-3-фенилпирроло[2,1-f][1,2,4]триазин-4(3H)-она (9a') получали в виде белого твердого вещества при использовании трет-бутил (S)-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)карбамата (8a') (105 мг, 0.27 ммоль) по той же методике, которая описана для получения соединения 9a (0.24 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 7.48-7.57 (м, 3H), 7.26-7.30 (м, 3H), 6.50 (д, J = 2.4 Гц, 1H), 3.66 (кв, J = 6.6 Гц, J = 13.2 Гц, 1H), 1.29 (д, J = 6.6 Гц, 3H).
Стадия 8-2-2: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она (9b')
103 мг (S)-2-(1-аминоэтил)-5-хлор-3-(3- фторфенил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она (9b') получали в виде белого твердого вещества при использовании трет-бутил (S)-(1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]-триазин-2-ил)этил)карбамата (8b') (140 мг, 0.34 ммоль) по той же методике, которая описана для получения соединения 9a (0.33 ммоль, выход: 97%).
1H ЯМР (300 МГц, CDCl3) δ 7.48-7.56 (м, 1H), 7.22-7.29 (м, 2H), 7.02-7.14 (м, 2H), 6.50 (д, J = 2.7 Гц, 1H), 3.76 (кв, J = 6.3 Гц, J = 12.8 Гц, 1H), 2.22 (ушир.с, 2H), 1.34 (д, J = 6.6 Гц, 3H).
Препаративный пример 16: Получение (S)-1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этан-1-амина

Стадия 1: Получение 7-фтор-2-(3-фторфенил)хинолин-3-карбальдегида
2.48 г 7-фтор-2-(3-фторфенил)хинолин-3-карбальдегида получали в виде светло-желтого вещества при использовании 2.10 г (10.0 ммоль) 2-хлор-7-фторхинолин-3-карбальдегида по методике, аналогичной описанной для стадии 1 в Препаративном примере 12 (9.2 ммоль, выход: 92%).
MS [m/z; (M + 1)+]: 270.
Стадия 2: Получение (R,E)-N-((7-фтор-2-(3-фторфенил)хинолин-3-ил)метилен)-2-метилпропан-2-сульфинамида
1.3 г (R,E)-N-((7-фтор-2-(3-фторфенил)хинолин-3-ил)метилен)-2-метилпропан-2-сульфинамида получали в виде желтого твердого вещества при использовании 1.0 г (3.71 ммоль, 1.0 экв.) 7-фтор-2-(3-фторфенил)хинолин-3-карбальдегида, полученного на стадии 1, по методике, аналогичной описанной для стадии 2 в Препаративном примере 12 (3.49 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 1.31 (с, 9H), 7.18-7.54 (м, 5H), 7.79-7.83 (м, 1H), 7.98-8.03 (м, 1H), 8.76 (с, 1H), 8.91 (с, 1H).
Стадия 3: Получение (R)-N-((S)-1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)-2-метилпропан-2-сульфинамида
1.30 г (R)-N-((S)-1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)-2-метилпропан-2-сульфинамида получали в виде светло-желтого вещества при использовании 1.3 г (3.49 ммоль) (R,E)-N-((7-фтор-2-(3-фторфенил)хинолин-3-ил)метилен)-2-метилпропан-2-сульфинамида, полученного на стадии 2, по методике, аналогичной описанной для стадии 3 в Препаративном примере 12 (3.35 ммоль, выход: 96%)
1H ЯМР (500 МГц, CDCl3) δ 1.23 (с, 9H), 1.51-1.53 (д, J = 10.0, 3H), 3.38-3.39 (д, J = 5.0, 1H), 4.92-4.94 (м, 1H), 7.17-7.21 (м, 1H), 7.29-7.32 (м, 1H), 7.38-7.41 (м, 2H), 7.49-7.53 (м, 1H), 7.78-7.80 (м, 1H), 7.85-7.88 (м, 1H), 8.35 (с, 1H).
Стадия 4: Получение (S)-1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этан-1-амина
0.37 г (S)-1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этан-1-амина получали в виде светло-желтого вещества при использовании 0.52 г (1.34 ммоль) (R)-N-((S)-1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)-2-метилпропан-2-сульфинамида, полученного на стадии 3, по методике, аналогичной описанной для стадии 4 в Препаративном примере 12 (1.30 ммоль, выход: 97%)
1H ЯМР (300 МГц, CDCl3) δ 1.35 (д, J = 9.0 Гц, 3H), 1.53 (ушир.с, 2H), 4.43 (т, J = 6.0, 1H), 4.92-4.94 (м, 1H), 7.16 (т, J = 9.0, 1H), 7309-7.36 (м, 3H), 7.42-7.49 (м, 1H), 7.73 (д, J = 12.0, 1H), 7.82-7.87 (м, 1H), 8.47 (с, 1H).
Препаративный пример 17: Получение (S)-1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этан-1-амина
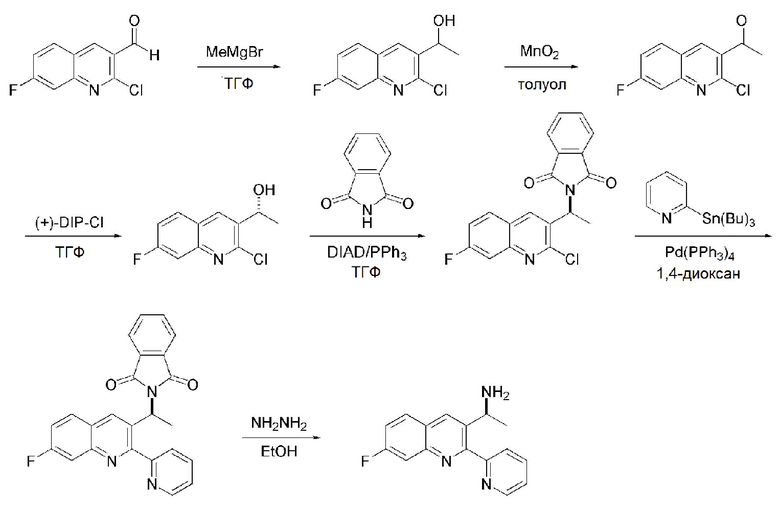
Стадия 1: Получение 1-(2-хлор-7-фторхинолин-3-ил)этан-1-ола
2.5 г (11.927 ммоль) 2-хлор-7-фторхинолин-3-карбальдегида растворяли в безводном ТГФ (30 мл), в который затем добавляли 4.77 мл (14.312 ммоль) 3M раствора MeMgBr (Et2O) при -78ºС, затем перемешивали при -78ºС ~ -10ºС в течение 2 часов. Температуру устанавливали равной -20ºС. После добавления насыщенного водного раствора NH4Cl, реакционную смесь нагревали при комнатной температуре, после чего экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1), получая 2.4 г целевого соединения 1-(2-хлор-7-фторхинолин-3-ил)этан-1-ола в виде желтого твердого вещества (10.636 ммоль, выход: 89%).
1H ЯМР (300 МГц, CDCl3) δ 8.38 (с, 1H), 7.79~7.87 (м, 1H), 7.63 (дд, J = 9.6, 2.2 Гц, 1H), 7.35 (тд, J = 8.6, 2.4 Гц, 1H), 5.32~5.41 (м, 1H), 2.31 (д, J = 2.9 Гц, 1H), 1.61 (д, J = 7.1 Гц, 3H).
Стадия 2: Получение 1-(2-хлор-7-фторхинолин-3-ил)этан-1-она
2.4 г (10.636 ммоль) 1-(2-хлор-7-фторхинолин-3-ил)этан-1-ола, полученного на стадии 1, растворяли в 30 мл безводного толуола, в который затем добавляли 9.2 г (106.36 ммоль) диоксида марганца (MnO2), после чего кипятили 10 часов. Реакционную смесь охлаждали при комнатной температуре, фильтровали через слой целита, упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1), получая 1.8 г целевого соединения 1-(2-хлор-7-фторхинолин-3-ил)этан-1-она в виде желтого твердого вещества (8.049 ммоль, выход: 76%).
1H ЯМР (300 МГц, CDCl3) δ 8.42 (с, 1H), 7.88~7.95 (м, 1H), 7.68 (дд, J = 9.8, 2.2 Гц, 1H), 7.41 (тд, J = 8.4, 2.4 Гц, 1H), 2.79 (с, 3H).
Стадия 3: Получение (R)-1-(2-хлор-7-фторхинолин-3-ил)этан-1-ола
5 г (15.588 ммоль) B-хлордиизопинокамфеолборана ((+)DIP-Cl) растворяли в безводном ТГФ (10 мл), который был заморожен до -47ºС. 1.8 г (8.049 ммоль) 1-(2-хлор-7-фторхинолин-3-ил)этан-1-она, полученного на стадии 2, растворяли в безводном ТГФ (20 мл), и добавляли в описанную выше смесь, затем перемешивали при комнатной температуре 12 часов. Реакционную смесь охлаждали до 0ºС, добавляли 1 мл ацетона и 1 мл 10%-ного раствора Na2CO3, затем перемешивали при комнатной температуре 1 час. Этилацетат и воду добавляли в реакционную смесь. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1), получая 1.4 г целевого соединения (R)-1-(2-хлор-7-фторхинолин-3-ил)этан-1-ола в виде белого твердого вещества (6.204 ммоль, выход: 77%).
1H ЯМР (300 МГц, CDCl3) δ 8.39 (с, 1H), 7.81~7.88 (м, 1H), 7.65 (дд, J = 9.9, 2.6 Гц, 1H), 7.36 (тд, J = 8.9, 2.8 Гц, 1H), 5.31~5.41 (м, 1H), 2.15 (д, J = 3.8 Гц, 1H), 1.61 (д, J = 6.4 Гц, 3H).
Стадия 4: Получение (S)-2-(1-(2-хлор-7-фторхинолин-3-ил)этил)изоиндолин-1,3-диона
1.4 г (6.204 ммоль) (R)-1-(2-хлор-7-фторхинолин-3-ил)этан-1-ола, полученного на стадии 3, растворяли в безводном ТГФ (30 мл), в который затем добавляли 1.95 г (7.445 ммоль) трифенилфосфин (PPh3) и 1.1 г (7.445 ммоль) фталимида. Полученную смесь охлаждали при 0ºС, добавляли 1.47 мл (7.445 ммоль) диизопропил азодикарбоксилата (DIAD), затем перемешивали при комнатной температуре 15 часов. В реакционную смесь добавляли воду и этилацетат, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1), получая 2 г целевого соединения (S)-2-(1-(2-хлор-7-фторхинолин-3-ил)этил)изоиндолин-1,3-диона в виде белого твердого вещества (5.637 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 8.56 (с, 1H), 7.87~7.94 (м, 1H), 7.77~7.83 (м, 2H), 7.68~7.74 (м, 2H), 7.61 (дд, J = 9.7, 2.2 Гц, 1H), 7.37 (тд, J = 8.4, 2.4 Гц, 1H), 5.95 (кв, J = 7.1, 6.9 Гц, 1H), 1.97 (д, J = 7.1 Гц, 3H).
Стадия 5: Получение (S)-2-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этил)изоиндолин-1,3-диона
1 г (2.819 ммоль) (S)-2-(1-(2-хлор-7-фторхинолин-3-ил)этил)изоиндолин-1,3-диона, полученного на стадии 4, растворяли в 1,4-диоксане (5 мл), в который затем добавляли 163 мг (0.141 ммоль) Pd(PPh3)4 и 1.25 г (3.383 ммоль) 2-(трибутилстаннил)-пиридина, после чего кипятили при 100ºС в течение 3 дней в атмосфере аргона. В реакционную смесь добавляли воду и этилацетат, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1), получая 500 мг целевого соединения (S)-2-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этил)изоиндолин-1,3-диона в виде белого твердого вещества (1.258 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 8.69 (с, 1H), 8.65 (д, J = 5.0 Гц, 1H), 7.90~7.97 (м, 1H), 7.60~7.76 (м, 7H), 7.28~7.42 (м, 2H), 6.31 (кв, J = 7.4, 7.1 Гц, 1H), 1.98 (д, J = 7.5 Гц, 3H).
Стадия 6: Получение (S)-1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этан-1-амина
500 мг (1.258 ммоль) (S)-2-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этил)изоиндолин-1,3-диона, полученного на стадии 5, растворяли в этаноле (20 мл), в который затем добавляли 612 мкл (12.58 ммоль) гидразин гидрата, и кипятили в течение 2 часов. Реакционную смесь охлаждали при комнатной температуре и фильтровали. Фильтрат разбавляли этилацетатом и водой, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 20/1 -> дихлорметан/метанол, 10/1), получая 312 мг целевого соединения (S)-1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этан-1-амина в виде желтой жидкости (1.167 ммоль, выход: 93%).
1H ЯМР (300 МГц, CDCl3) δ 8.70 (д, J = 4.6 Гц, 1H), 8.43 (с, 1H), 7.82~7.95 (м, 3H), 7.75 (дд, J = 9.7, 2.4 Гц, 1H), 7.31~7.41 (м, 2H), 4.63 (кв, J = 6.7, 6.7 Гц, 1H), 2.01(ушир.с, 2H), 1.43 (д, J = 6.8 Гц, 3H).
Препаративный пример 18: Получение 1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина

Стадия 1: Получение трет-бутил (S)-(3-оксо-4-(пиридин-2-ил)бутан-2-ил)карбамата
5 г (21.526 ммоль) трет-бутил (S)-(1-(метокси(метил)амино)-1-оксопропан-2-ил)карбамата растворяли в безводном ТГФ (40 мл), в который затем добавляли 16.6 мл (21.526 ммоль) раствора изопропилмагний хлорида/лития хлорида при -40ºС, затем перемешивали при -30ºС в течение 30 минут. Реакционную смесь охлаждали до -40ºС. 2.6 г (27.984 ммоль) 2-пиколина растворяли в безводном ТГФ (20 мл), в который затем добавляли 11 мл (27.984 ммоль) 2.5M раствора н-BuLi при -40ºС, перемешивали при -20ºС в течение 1 часа. Полученный раствор добавляли в описанную выше реакционную смесь, затем перемешивали при -20ºС ~ -10ºС в течение 3 часов. Реакционную смесь замораживали при -78ºС, в который затем добавляли насыщенный водный раствор хлорида аммония. Добавляли этилацетат и воду, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1), получая 5 г целевого соединения трет-бутил (S)-(3-оксо-4-(пиридин-2-ил)бутан-2-ил)карбамата в виде желтой жидкости (18.916 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.55 (д, J = 4.0 Гц, 1H), 7.66 (тд, J = 7.8, 1.8 Гц, 1H), 7.16~7.24 (м, 2H), 5.37 (ушир.с, 1H), 4.39~4.49 (м, 1H), 3.95~4.11 (м, 2H), 1.45 (с, 9H), 1.37 (д, J = 7.2 Гц, 3H).
Стадия 2: Получение трет-бутил(1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)карбамата
254 мг (0.916 ммоль) трет-бутил (S)-(3-оксо-4-(пиридин-2-ил)бутан-2-ил)карбамата, полученного на стадии 1, 134 мг (0.961ммоль) 2-амино-5-фторбензальдегида, и 398 мг (2.883 ммоль) карбоната калия (K2CO3) растворяли в этаноле (3 мл), затем перемешивали при 90ºС в течение 2 часов. Реакционную смесь разбавляли этилацетатом и водой, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1), получая 250 мг целевого соединения трет-бутил(1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)карбамата в виде желтого твердого вещества (0.680 ммоль, выход: 71%).
1H ЯМР (300 МГц, CDCl3) δ 8.76 (д, J = 4.5 Гц, 1H), 8.08~8.15 (м, 2H), 7.84 (тд, J = 7.9, 1.9 Гц, 1H), 7.41~7.60 (м, 3H), 7.35 (т, J = 4.5 Гц, 1H), 6.34 (д, J = 7.6 Гц, 1H), 5.37~5.48 (м, 1H), 1.45 (с, 9H), 1.33 (д, J = 6.3 Гц, 3H).
Стадия 3: Получение 1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина
250 мг (0.680 ммоль) трет-бутил(1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)карбамата, полученного на стадии 2, растворяли в дихлорметане (3 мл), в который затем добавляли 1 мл ТФУК, перемешивали при комнатной температуре 3 часов. Реакционную смесь фильтровали при пониженном давлении и нейтрализовывали добавлением водного раствора NaHCO3. Реакционную смесь разбавляли дихлорметаном и водой, затем экстрагировали. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1), получая 120 мг целевого соединения 1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина в виде желтого масла (0.449 ммоль, выход: 66%).
1H ЯМР (500 МГц, CDCl3) δ 8.75 (д, J = 4.1 Гц, 1H), 8.01~8.15 (м, 2H), 7.84 (тд, J = 7.8, 1.5 Гц, 1H), 7.40~7.50 (м, 3H), 7.33~7.39 (м, 1H), 4.49 (ушир.с, 1H), 2.11(ушир.с, 2H), 1.39 (д, J = 5.6 Гц, 3H).
Препаративный пример 19: Получение (S)-3-(1-аминоэтил)-8-хлор-4-фтор-2-фенилизохинолин-1(2H)-она
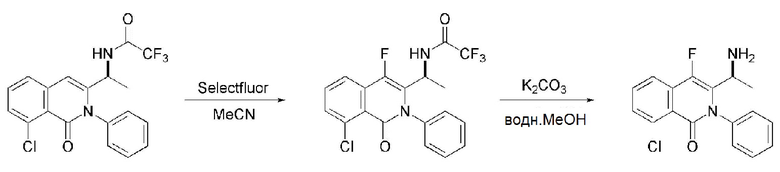
Стадия 1: Получение (S)-N-(1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида
1.97 г (5.0 ммоль, 1 экв.) (S)-N-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида, полученного на стадии 6 в Препаративном примере 10, Selectfluor (1.5 экв.) и безводный CH3CN (30 мл) смешивали и кипятили в течение 12 часов. Реакционную смесь охлаждали при комнатной температуре. Добавляли воду и этилацетат, затем экстрагировали. Органический слой промывали насыщенным водным раствором NaHCO3, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 1.61 г целевого соединения (S)-N-(1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида в виде белого твердого вещества (3.9 ммоль, выход: 78%).
1H ЯМР (500 МГц, CDCl3) δ 10.99 (ушир.д, J = 5.4 Гц, 1H), 7.77-7.85 (м, 2H), 7.64-7.71 (м, 1H), 7.50-7.61 (м, 3H), 7.42-7.46 (м, 2H), 4.17-4.24 (м, 1H), 1.47 (д, J = 7.1 Гц, 3H).
Стадия 2: Получение (S)-3-(1-аминоэтил)-8-хлор-4-фтор-2-фенилизохинолин-1(2H)-она
1.20 г (S)-3-(1-аминоэтил)-8-хлор-4-фтор-2-фенилизохинолин-1(2H)-она получали в виде белого твердого вещества при использовании 1.65 г (4.0 ммоль) (S)-N-(1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)-2,2,2-трифторацетамида, полученного на стадии 1, по методике, аналогичной описанной для стадии 8 в Препаративном примере 10 (3.8 ммоль, выход: 95%).
1H ЯМР (500 МГц, CDCl3) δ 7.74 (д, J = 8.0 Гц, 1H), 7.64 (т, J = 7.9 Гц, 1H), 7.54-7.60 (м, 3H), 7.47-7.53 (м, 1H), 7.32-7.35 (м, 1H), 7.22-7.25 (м, 1H), 3.57-3.64 (м, 1H), 1.85 (ушир.с, 2H), 1.46 (д, J = 6.9 Гц, 3H).
Препаративный пример 20: Получение 4-хлор-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она

Стадия 1: Получение 1-(4,6-дихлорпиримидин-5-ил)пропен-2-ен-1-ола
200 мг (2.8 ммоль) 4,6-дихлорпиримидин-5-карбальдегида растворяли в безводном толуоле (15 мл), в который затем 2.1 мл (1.2 экв.) медленно добавляли винилмагний хлорида (1.6 M раствор в ТГФ) при -20ºС, затем перемешивали 1 час. Добавляли насыщенный водный раствор NH4Cl (10 мл). Реакционную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1), получая 475 мг целевого соединения 1-(4,6-дихлорпиримидин-5-ил)пропен-2-ен-1-ола в виде желтого масла (2.3 ммоль, выход: 82%).
1H ЯМР (300 МГц, CDCl3) δ 8.72 (с, 1H), 6.23-6.12 (м, 1H), 5.90 (с, -OH), 5.43-5.34 (м, 2H).
Стадия 2: Получение 1-(4,6-дихлорпиримидин-5-ил)пропен-2-ен-1-она
323 мг 1-(4,6-дихлорпиримидин-5-ил)пропен-2-ен-1-она получали в виде бесцветного масла при использовании 394 мг (1.9 ммоль) 1-(4,6-дихлорпиримидин-5-ил)пропен-2-ен-1-ола, полученного на стадии 1, по методике, аналогичной описанной для стадии 3 в Примере 1 (1.57 ммоль, выход: 83%).
1H ЯМР (300 МГц, CDCl3) δ 8.87 (с, 1H), 6.69-6.59 (м, 1H), 6.31 (д, J = 10.6 Гц, 1H), 6.08 (д, J = 17.9 Гц, 1H).
Стадия 3: Получение 4-хлор-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она
4-метоксибензиламин (1.1 экв.) растворяли в безводном CH2CL2 (5 мл), и полученный раствор медленно добавляли в реакционную смесь, содержащую 300 мг (1.48 ммоль) 1-(4,6-дихлорпиримидин-5-ил)пропен-2-ен-1-она, полученного на стадии 2, DIPEA (1.1 экв.) и безводного CH2CL2 (15 мл) при 0℃. Полученную смесь нагревали до комнатной температуры и перемешивали 1 час. В реакционную смесь добавляли 1н. раствор HCl (5 мл), затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором NaHCO3, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 2/1), получая 413 мг целевого соединения 4-хлор-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она в виде светло-желтого вещества (1.36 ммоль, выход: 92%).
1H ЯМР (300 МГц, CDCl3) δ 8.40 (с, 1H), 7.22 (д, J = 8.5 Гц, 2H), 6.87 (д, J = 8.5 Гц, 2H), 4.92 (с, 2H), 3.80 (с, 3H), 3.56 (м, 2H), 2.96 (м, 2H).
Препаративный пример 21: Получение (S)-1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина
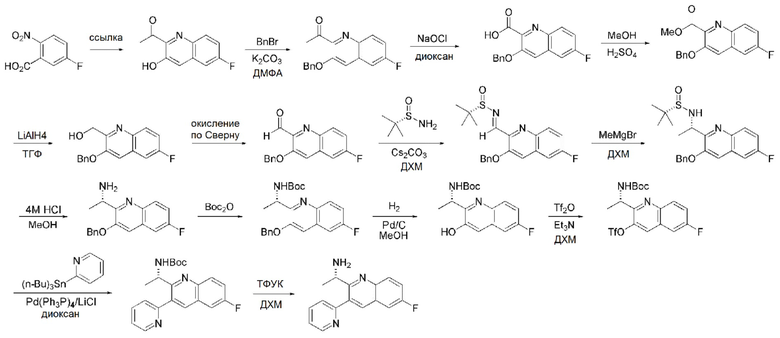
Стадия 1: Получение 1-(3-(бензилокси)-6-фторхинолин-2-ил)этан-1-она
20.52 г (100.0 ммоль) 1-(6-фтор-3-гидроксихинолин-2-ил)этан-1-он [ссылка: WO 2010-151740], BnBr (1.1 экв.) и K2CO3 (3 экв.) растворяли в безводном ДМФА (150 мл), затем перемешивали при комнатной температуре 6 часов. Растворитель удаляли при пониженном давлении. В реакционную смесь добавляли воду и этилацетат, затем экстрагировали. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 29.53 г целевого соединения 1-(3-(бензилокси)-6-фторхинолин-2-ил)этан-1-она в виде светло-коричневого масла (100.0 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.00-8.10 (м, 1H), 7.28-7.57 (м, 8H), 5.26 (с, 2H), 2.76 (с, 3H).
Стадия 2: Получение 3-(бензилокси)-6-фторхинолин-2-карбоновой кислоты
28.06 г (95.0 ммоль) 1-(3-(бензилокси)-6-фторхинолин-2-ил)этан-1-она, полученного на стадии 1, растворяли в смеси диоксан/H2O (4/1, 300 мл), затем медленно добавляли водный раствор NaOCl (12%, 5 экв.) при комнатной температуре в течение 30 минут, затем перемешивали 5 часов. рH реакционной смеси регулировали (pH=4) добавлением насыщенного раствора 2н. HCl. Реакционную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 1/1 -> этилацетат), получая 27.96 г целевого соединения 3-(бензилокси)-6-фторхинолин-2-карбоновой кислоты в виде светло-желтого масла (94.1 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.05-8.12 (м, 1H), 7.67 (с, 1H), 7.28-7.60 (м, 7H), 5.37 (с, 2H).
Стадия 3: Получение метил 3-(бензилокси)-6-фторхинолин-2-карбоксилата
26.76 г (90.0 ммоль) 3-(бензилокси)-6-фторхинолин-2-карбоновой кислоты, полученной на стадии 2, безводный MeOH (200 мл), CH(OMe)3 (50 мл) и конц. H2SO4 (2 мл) смешивали и нагревали при 45ºС в течение 12 часов. Реакционную смесь медленно добавляли в холодный насыщенный водный раствор NaHCO3, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 27.46 г целевого соединения метил 3-(бензилокси)-6-фторхинолин-2-карбоксилата в виде светло-желтого вещества (88.2 ммоль, выход: 98%).
1H ЯМР (300 МГц, CDCl3) δ 8.07-8.14 (м, 1H), 7.50 (с, 1H), 7.28-7.49 (м, 7H), 5.28 (с, 2H), 4.04 (с, 3H).
Стадия 4: Получение (3-(бензилокси)-6-фторхинолин-2-ил)метанола
14.17 г (50.0 ммоль) метил 3-(бензилокси)-6-фторхинолин-2-карбоксилата, полученного на стадии 3, растворяли в безводном ТГФ (200 мл). Реакционную смесь охлаждали до 0ºС, медленно добавляли LiAlH4 (1 экв.) в течение 10 минут, затем перемешивали 1 час. Реакционную смесь нагревали при комнатной температуре, затем перемешивали 5 часов. В реакционную смесь медленно добавляли диэтиловый эфир (200 мл) и дистиллированную воду (10 мл) для разложения LiAlH4, затем перемешивали 1 час. В полученную смесь добавляли безводный MgSO4, сушили, фильтровали и упаривали. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 1/1), получая 12.04 г целевого соединения (3-(бензилокси)-6-фторхинолин-2-ил)метанола в виде светло-желтого вещества (42.5 ммоль, выход: 85%).
1H ЯМР (300 МГц, CDCl3) δ 7.97-8.05 (м, 1H), 7.27-7.46 (м, 8H), 5.22 (с, 2H), 4.93 (д, J = 4.6 Гц, 2H), 4.54 (т, J = 4.6 Гц, 1H, OH).
Стадия 5: Получение 3-(бензилокси)-6-фторхинолин-2-карбальдегида
11.91 г 3-(бензилокси)-6-фторхинолин-2-карбальдегида получали в виде светло-желтого вещества окислением по Сверну, используя 12.00 г (42.4 ммоль) (3-(бензилокси)-6-фторхинолин-2-ил)метанола, полученного на стадии 4, (42.3 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 10.53 (с, 1H), 8.20 (м, 1H), 7.59 (с, 1H), 7.25-7.58 (м, 7H), 5.32 (с, 2H).
Стадия 6: Получение (S)-(E)-((3-(бензилокси)-6-фторхинолин-2-ил)метилен)-2-метилпропан-2-сульфинамида
5.63 г (20.00 ммоль) 3-(бензилокси)-6-фторхинолин-2-карбальдегида, полученного на стадии 5, (S)-(-)-2-метил-2-пропансульфинамида (1.1 экв.) и Cs2CO3 (1.2 экв.) растворяли в безводном CH2Cl2 (30 мл), затем перемешивали при комнатной температуре 12 часов. Реакционную смесь фильтровали и упаривали. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 7/1 -> гексан/этилацетат, 3/1), получая 7.30 г целевого соединения (S)-(E)-((3-(бензилокси)-6-фторхинолин-2-ил)метилен)-2-метилпропан-2-сульфинамида в виде светло-желтого вещества (18.99 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 9.22 (с, 1H), 8.14-8.20 (м, 1H), 7.53 (с, 1H), 7.28-7.50 (м, 7H), 5.30 (с, 2H), 1.28 (с, 9H).
Стадия 7: Получение (S)-N-((S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этил)-2-метилпропан-2-сульфинамида
3.85 г (10.00 ммоль) (S)-(E)-((3-(бензилокси)-6-фторхинолин-2-ил)метилен)-2-метилпропан-2-сульфинамида, полученного на стадии 6, растворяли в безводном CH2Cl2 (50 мл), замороженном до -78ºС. Медленно добавляли MeMgBr (3M раствор в диэтиловом эфире, 3 экв.) в течение 10 минут. Через 2 часа реакционную смесь медленно нагревали до -20ºС, затем перемешивали 1 час. Добавляли насыщенный водный раствор NH4Cl (50 мл). Реакционную смесь нагревали при комнатной температуре, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1 -> гексан/этилацетат, 1/2), получая 3.00 г целевого соединения (S)-N-((S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этил)-2-метилпропан-2-сульфинамида в виде светло-желтого вещества (7.40 ммоль, выход: 74%).
1H ЯМР (500 МГц, CDCl3) δ 7.97-8.01 (м, 1H), 7.45-7.52 (м, 4H), 7.38-7.44 (м, 2H), 7.28-7.33 (м, 2H), 5.60 (д, J = 6.5 Гц, 1H), 5.24 (с, 2H), 5.08-5.13 (м, 1H), 1.53 (д, J = 6.7 Гц, 3H), 1.32 (с, 9H).
Стадия 8: Получение (S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этан)-1-амина
2.81 г (7.02 ммоль) (S)-N-((S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этил)-2-метилпропан-2-сульфинамида, полученного на стадии 7, растворяли в безводном MeOH (10 мл), в который затем добавляли 4M HCl (раствор в диоксане) при комнатной температуре, затем перемешивали 1 час. Растворитель удаляли при пониженном давлении. В полученную смесь добавляли насыщенный водный раствор NaHCO3, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: MeOH/CH2Cl2, 1/20 -> MeOH/CH2Cl2, 1/10), получая 2.00 г целевого соединения (S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этан)-1-амина в виде не совсем белого твердого вещества (6.75 ммоль, выход: 96%).
1H ЯМР (300 МГц, CDCl3) δ 7.96-8.02 (м, 1H), 7.25-7.50 (м, 8H), 5.21 (с, 2H), 4.60-4.70 (м, 1H), 2.04 (ушир.с, 2H), 1.47 (д, J = 6.6 Гц, 3H).
Стадия 9: Получение трет-бутил (S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этил)карбамата
1.90 г (6.41 ммоль) (S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этан)-1-амина, полученного на стадии 8, растворяли в безводном CH2Cl2 (15 мл), затем добавляли Boc2O (1.3 экв.) при комнатной температуре и перемешивали 2 часа. Реакционную смесь упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 2.52 г целевого соединения трет-бутил (S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этил)карбамата в виде белого твердого вещества (6.36 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.00-8.04 (м, 1H), 7.30-7.52 (м, 8H), 6.44 (ушир.д, J = 7.6 Гц, 1H), 5.38-5.45 (м, 1H), 5.20-5.27 (м, 2H), 1.47-1.56 (м, 12H).
Стадия 10: Получение трет-бутил (S)-(1-(6-фтор-3-гидроксихинолин-2-ил)этил)карбамата
1.98 г (4.99 ммоль) трет-бутил (S)-1-(3-(бензилокси)-6-фторхинолин-2-ил)этил)карбамата, полученного на стадии 9, растворяли в MeOH (20 мл), затем добавляли 200 мг 10% Pd/C и гидрировали при комнатной температуре 1 час при 1 атм. H2. Реакционную смесь фильтровали через слой целита и упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1 -> гексан/этилацетат, 1/1), получая 1.53 г целевого соединения трет-бутил (S)-(1-(6-фтор-3-гидроксихинолин-2-ил)этил)карбамата в виде белого твердого вещества (4.99 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 9.47 (ушир.с, 1H), 7.87-7.90 (м, 1H), 7.18-7.23 (м, 1H), 7.00-7.04 (м, 1H), 6.84-6.89 (м, 1H), 5.52 (ушир.с, 1H), 5.29-5.36 (м, 1H), 1.62 (д, J = 6.8 Гц, 3H), 1.53 (с, 9H).
Стадия 11: Получение (S)-2-(1-((трет-бутоксикарбонил)амино)этил)-6-фторхинолин-3-ил трифторметансульфоната
1.50 г (4.90 ммоль) трет-бутил (S)-(1-(6-фтор-3-гидроксихинолин-2-ил)этил)карбамата, полученного на стадии 10, и безводный Et3N (3 экв.) растворяли в безводном CH2Cl2 (15 мл), затем медленно добавляли Tf2O (1.2 экв.) при 0ºС в течение 5 минут и перемешивали 2 часа. Растворитель удаляли при пониженном давлении. В реакционную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 5/1), получая 2.15 г целевого соединения (S)-2-(1-((трет-бутоксикарбонил)амино)этил)-6-фторхинолин-3-ил трифторметансульфоната в виде бесцветного масла (4.90 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.11-8.17 (м, 1H), 8.08 (с, 1H), 7.53-7.62 (м, 1H), 7.47-7.52 (м, 1H), 7.98 (ушир.с, 1H), 5.30-5.40 (м, 1H), 1.54 (д, J = 6.7 Гц, 3H), 1.48 (с, 9H).
Стадия 12: Получение трет-бутил (S)-(1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)карбамата
438 мг (1.00 ммоль) (S)-2-(1-((трет-бутоксикарбонил)амино)этил)-6-фторхинолин-3-ил трифторметансульфоната, полученного на стадии 11, 2-(трибутилстаннил)пиридина (2.0 экв.), LiCl (3 экв.), Pd(Ph3P)4 (0.1 экв.) и безводный диоксан (13 мл) смешивали, нагревали при 100ºС в течение 24 часов в атмосфере аргона. Реакционную смесь охлаждали при комнатной температуре и фильтровали через слой целита. В фильтрат добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4) и упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 286 мг целевого соединения трет-бутил (S)-(1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)карбамата в виде светло-желтого вещества (0.78 ммоль, выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ 8.76 (д, J = 4.5 Гц, 1H), 8.08-8.15 (м, 2H), 7.84 (тд, J = 7.9, 1.9 Гц, 1H), 7.41-7.60 (м, 3H), 7.35 (т, J = 4.5 Гц, 1H), 6.34 (д, J = 7.6 Гц, 1H), 5.37-5.48 (м, 1H), 1.45 (с, 9H), 1.33 (д, J = 6.3 Гц, 3H).
Стадия 13: Получение (S)-1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина
(S)-1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амин получали при использовании трет-бутил (S)-(1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)карбамата, полученного на стадии 12, по методике, аналогичной описанной для стадии 3 в Препаративном примере 18.
Препаративный пример 22: Получение 1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этан-1-амина

Стадия 1: Получение (5-фтор-2-нитрофенил)(пиридин-2-ил)метанола
1.90 г (12.0 ммоль) 2-бромпиридина растворяли в безводном ТГФ (20 мл) и охлаждали до 0ºС. Медленно добавляли раствор комплекса изопропилмагний хлорида и хлорида лития (1.3M раствор в ТГФ, 1.2 экв.) в течение 5 минут, затем перемешивали 1 час. 1.69 г (10.0 ммоль) 3-фтор-6-нитробензальдегид растворяли в безводном ТГФ (10 мл) и медленно добавляли в описанную выше смесь в течение 10 минут, затем перемешивали 1 час. Реакционную смесь нагревали до комнатной температуры, затем перемешивали 2 часа. Добавляли насыщенный раствор NH4Cl (20 мл) и затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4) и упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 5/1), получая 1.61 г целевого соединения (5-фтор-2-нитрофенил)(пиридин-2-ил)метанола в виде светло-желтого вещества (6.5 ммоль, выход: 65%).
1H ЯМР (300 МГц, CDCl3) δ 8.56-8.60 (м, 1H), 8.01-8.06 (м, 1H), 7.65-7.72 (м, 1H), 7.32-7.41 (м, 2H), 7.23-7.30 (м, 1H), 7.05-7.13 (м, 1H), 6.51 (с, 1H), 5.44(ушир.с, 1H).
Стадия 2: Получение (5-фтор-2-нитрофенил)(пиридин-2-ил)метанона
1.50 г (6.04 ммоль) (5-фтор-2-нитрофенил)(пиридин-2-ил)метанола, полученного на стадии 1, растворяли в безводном CH2Cl2 (30 мл), в который затем добавляли MnO2 (6 экв.) и перемешивали при комнатной температуре 5 часов. Реакционную смесь фильтровали через слой целита и упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 4/1), получая 1.48 г целевого соединения (5-фтор-2-нитрофенил)(пиридин-2-ил)метанона в виде светло-коричневого твердого вещества (6.01 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.49-8.52 (м, 1H), 8.22-8.29 (м, 2H), 7.88-7.96 (м, 1H), 7.43-7.48 (м, 1H), 7.23-7.36 (м, 2H).
Стадия 3: Получение (2-амино-5-фторфенил)(пиридин-2-ил)метанона
1.40 г (5.69 ммоль) (5-фтор-2-нитрофенил)(пиридин-2-ил)метанона и Fe (5 экв.) растворяли в EtOH/H2O (4/1, 30 мл), в который затем добавляли 2~3 капли конц. HCl. Реакционную смесь нагревали при 85ºС в течение 30 минут и охлаждали до комнатной температуры. Реакционную смесь фильтровали через слой целита, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученное соединение отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 4/1), получая 1.23 г целевого соединения (2-амино-5-фторфенил)(пиридин-2-ил)метанона в виде светло-желтого вещества (5.69 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.71 (д, J = 4.7 Гц, 1H), 7.92-7.80 (м, 2H), 7.52-7.43 (м, 2H), 7.12-7.05 (м, 1H), 6.66-6.72 (м, 1H), 6.13 (ушир.с, 2H).
Стадия 4: Получение трет-бутил (1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)карбамата
1.08 г (5.0 ммоль) (2-амино-5-фторфенил)(пиридин-2-ил)метанона, полученного на стадии 3, трет-бутил (S)-3-оксо-4-(пиридин-2-ил)карбамата (1.0 экв.) и InCl3 (0.2 экв.) добавляли в безводный CH3CN (10 мл), нагревали при 80℃ в течение 15 минут и охлаждали до комнатной температуры. Реакционную смесь фильтровали через слой целита, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 2.22 г целевого соединения трет-бутил (1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)карбамата в виде белого твердого вещества (4.99 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.60-8.67 (м, 2H), 8.15-8.21 (м, 1H), 7.45-7.55 (м, 3H), 7.10-7.21 (м, 3H), 7.05 (ушир.т, J = 6.8 Гц, 2H), 6.35 (ушир.с, 1H), 5.03 (ушир.с, 1H), 1.44 (с, 9H).
Стадия 5: Получение 1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этан-1-амина
133 мг (0.3 ммоль) трет-бутил (1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)карбамата, полученного на стадии 4, растворяли в CH2Cl2 (10 мл), в который затем добавляли ТФУК (1.0 мл) и перемешивали при комнатной температуре 1 час. В реакционную смесь добавляли насыщенный водный раствор NaHCO3 (25 мл), затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: MeOH/CH2Cl2, 1/20 -> MeOH/CH2Cl2, 1/10), получая 117 мг целевого соединения 1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этан-1-амина в виде белого твердого вещества (0.3 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.66 (дд, J = 12.0, 4.1 Гц, 2H), 8.11 (дд, J = 9.0, 5.5 Гц, 1H), 7.61-7.46 (м, 3H), 7.24-7.16 (м, 3H), 7.04-6.95 (м, 2H), 4.78 (ушир.с, 1H), 2.54 (ушир.с, 2H), 1.51 (д, J = 6.1 Гц, 3H).
Препаративный пример 23: Получение (S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этан-1-амина

Стадия 1: Получение 1,1-диэтокси-3-фенилпропан-2-она
5.29 г (30.0 ммоль) этил диэтоксиацетат растворяли в безводном ТГФ (50 мл), замороженном до -78ºС. PhMgCl (2M раствор в ТГФ, 1.5 экв.) медленно добавляли в течение 5 минут, затем перемешивали 12 часов. При охлаждении реакционной смеси ледяной водой медленно добавляли насыщенный водный раствор NH4Cl (50 мл). Реакционную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 20/1 -> гексан/этилацетат, 5/1), получая 6.21 г целевого соединения 1,1-диэтокси-3-фенилпропан-2-она в виде бесцветного масла (27.9 ммоль, выход: 93%).
1H ЯМР (300 МГц, CDCl3) δ 7.18-7.35 (м, 5H), 4.63 (с, 1H), 3.89 (с, 2H), 3.63-3.71 (м, 2H), 3.47-3.61 (м, 2H), 1.19-1.27 (м, 6H).
Стадия 2: Получение 2-(диэтоксиметил)-6-фтор-3-фенил-4-(пиридин-2-ил)хинолина
3.33 г (15.0 ммоль) 1,1-диэтокси-3-фенилпропан-2-она, полученного на стадии 1, 1.62 г (7.49 ммоль) (2-амино-5-фторфенил)(пиридин-2-ил)метанона и Cs2CO3 (30.0 ммоль) добавляли в EtOH (40 мл), после чего кипятили 12 часов. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь разбавляли водой, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 3.02 г целевого соединения 2-(диэтоксиметил)-6-фтор-3-фенил-4-(пиридин-2-ил)хинолина в виде белого твердого вещества (7.50 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.64-8.67 (м, 1H), 8.32-8.38 (м, 1H), 7.44-7.54 (м, 2H), 7.14-7.26 (м, 6H), 7.03-7.08 (м, 1H), 6.93-6.97 (м, 1H), 5.37 (с, 1H), 3.55-3.80 (м, 2H), 3.39-3.46 (м, 2H), 1.17 (т, J = 7.0 Гц, 6H).
Стадия 3: Получение 6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-карбальдегида
2.01 г (4.99 ммоль) 2-(диэтоксиметил)-6-фтор-3-фенил-4-(пиридин-2-ил)хинолина, полученного на стадии 2, растворяли в ТГФ (20 мл), в который затем добавляли 2н. водный раствор HCl (20 мл) и перемешивали при комнатной температуре 3 часа. Медленно добавляли насыщенный водный раствор NaHCO3, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 10/1 -> гексан/этилацетат, 3/1), получая 1.64 г целевого соединения 6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-карбальдегида в виде светло-желтого вещества (4.99 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 10.14 (с, 1H), 8.69-8.72 (м, 1H), 8.38-8.44 (м, 1H), 7.53-7.64 (м, 2H), 7.11-7.27 (м, 7H), 6.96-7.00 (м, 1H).
Стадия 4: Получение (с,E)-N-((6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)метилен)-2-метилпропан-2-сульфинамида
328 мг (1.0 ммоль) 6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-карбальдегида, полученного на стадии 3, вводили в реакцию по методике, аналогичной описанной для стадии 6 в Препаративном примере 21. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1 -> гексан/этилацетат, 1/1), получая 418 мг целевого соединения (с,E)-N-((6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)метилен)-2-метилпропан-2-сульфинамида в виде светло-желтого вещества (0.97 ммоль, выход: 97%).
1H ЯМР (500 МГц, CDCl3) δ 8.70-8.72 (м, 2H), 8.38-8.40 (м, 1H), 7.56-7.58 (м, 2H), 6.95-7.28 (м, 8H), 1.18 (с, 9H).
Стадия 5: Получение (S)-N-((S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)-2-метилпропан-2-сульфинамида
388 мг (0.90 ммоль) (с,E)-N-((6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)метилен)-2-метилпропан-2-сульфинамида, полученного на стадии 4, вводили в реакцию по методике, аналогичной описанной для стадии 7 в Препаративном примере 21. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: CH2Cl2/этилацетат, 4/1 -> CH2Cl2/этилацетат, 1/1), получая 306 мг целевого соединения (S)-N-((S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)-2-метилпропан-2-сульфинамида в виде не совсем белого твердого вещества (0.68 ммоль, выход: 76%).
1H ЯМР (300 МГц, CDCl3) δ 8.62-8.67 (м, 1H), 8.08-8.15 (м, 1H), 7.35-7.56 (м, 4H), 7.11-7.25 (м, 3H), 7.01-7.07 (м, 1H), 6.90-7.00 (м, 2H), 5.61-5.92 (м, 1H), 4.66-4.80 (м, 1H), 1.29 (с, 9H), 1.20 (д, J = 6.6 Гц, 3H).
Стадия 6: Получение (S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этан-1-амина
224 мг (0.5 ммоль) (S)-N-((S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)-2-метилпропан-2-сульфинамида, полученного на стадии 5, вводили в реакцию по методике, аналогичной описанной для стадии 8 в Препаративном примере 21. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: MeOH/CH2Cl2, 1/20 -> MeOH/CH2Cl2, 1/10), получая 163 мг целевого соединения (S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этан-1-амина в виде желтого масла (0.47 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 8.62-8.67 (м, 1H), 8.10-8.17 (м, 1H), 7.41-7.55 (м, 2H), 6.91-7.32 (м, 8H), 4.40-4.50 (м, 1H), 3.50 (ушир.с, 2H), 1.23-1.30 (м, 3H).
Препаративный пример 24: Получение (S)-2-(1-аминоэтил)-6-фтор-3-(пиридин-3-ил)хиназолин-4(3H)-она

Стадия 1: Получение трет-бутил (S)-(1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)карбамата
Трет-бутил (S)-(1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)карбамат получали при использовании 2-амино-5-фторбензойной кислоты и 3-аминопиридина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 8.79 (т, J = 3.2 Гц, 2H), 7.92-7.72 (м, 2H), 7.60-7.48 (м, 2H), 5.46 (д, J = 8.3 Гц, 2H), 4.45-4.37 (м, 1H), 1.41 (м, 9H), 1.28 (т, J = 6.8 Гц, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-6-фтор-3-(пиридин-3-ил)хиназолин-4(3H)-она
(S)-2-(1-аминоэтил)-6-фтор-3-(пиридин-3-ил)хиназолин-4(3H)-он получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 8.79 (д, J = 4.0 Гц, 1H), 7.90 (д, J = 8.1 Гц, 1H), 7.74 (д, J =6.5 Гц, 1H), 7.53 (д, J = 7.7 Гц, 2H), 7.31-7.11 (м, 2H), 3.80-3.73 (м, 1H), 2.80 (с, 2H), 1.32 (дд, J = 21, 6.3 Гц, 3H).
Препаративный пример 25: Получение (S)-2-(1-аминоэтил)-6-фтор-3-фенилхиназолин-4(3H)-она

Стадия 1: Получение трет-бутил (S)-(1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)карбамата
Целевое соединение получали при использовании 2-амино-5-фторбензойной кислоты и анилина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 7.88 (д, J = 8.0 Гц, 1H), 7.70-7.74 (м, 1H), 7.60-7.39 (м, 3H), 7.28 (д, J = 6.8 Гц, 1H), 5.66 (д, J = 6.7 Гц, 1H), 4.54 (т, J = 6.3 Гц, 1H), 1.41 (с, 9H), 1.26 (д, J = 6.3 Гц, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-6-фтор-3-фенилхиназолин-4(3H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 7.87 (д, J = 7.6 Гц, 1H), 7.66 (дд, J = 8.5, 5.0 Гц, 1H), 7.57-7.29 (м, 2H), 4.03-4.09 (м, 1H), 1.36 (д, J = 6.4 Гц, 3H).
Препаративный пример 26: Получение (S)-2-(1-аминоэтил)-6-фтор-3-(3-фторфенил)хиназолин-4(3H)-она
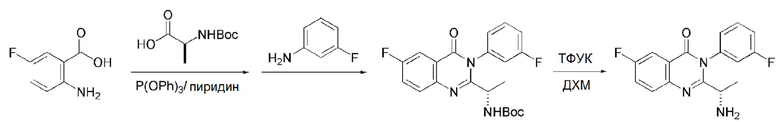
Стадия 1: Получение трет-бутил (S)-(1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)карбамата
Целевое соединение получали при использовании 2-амино-5-фторбензойной кислоты и 3-фторанилина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 7.88 (д, J = 8.0 Гц, 1H), 7.73 (дд, J = 8.4, 4.6 Гц, 1H), 7.62-7.47 (м, 2H), 7.28-7.03 (м, 3H), 5.55-5.50 (м, 1H), 4.56-4.49 (м, 1H), 1.41 (с, 9H). 1.30 (т, J = 4.4 Гц, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-6-фтор-3-(3-фторфенил)хиназолин-4(3H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 7.89 (д, J = 8.3 Гц, 1H), 7.74 (дд, J = 8.5, 4.4 Гц, 1H), 7.59-7.48 (м, 2H), 7.29-7.24 (м, 1H), 7.12-7.03 (м, 2H), 3.75-3.67 (м, 1H), 1.85 (с, 2H), 1.31 (д, J = 6.4 Гц, 3H).
Препаративный пример 27: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(2-хлорбензил)хиназолин-4(3H)-она
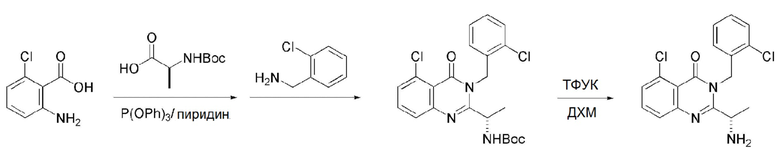
Стадия 1: Получение трет-бутил (S)-(1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)карбамата
Целевое соединение получали при использовании 2-амино-6-хлорбензойной кислоты и 2-хлорбензиламина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1.
1H ЯМР (500 МГц, CDCl3) δ 7.60-7.67 (м, 2H), 7.48-7.54 (м, 1H), 7.42-7.46 (м, 1H), 7.14-7.27 (м, 2H), 6.82 (д, J = 7.3 Гц, 1H), 5.63 (с, 2H), 5.39-5.44 (м, 1H), 4.82-4.85 (м, 1H), 1.49 (с, 9H), 1.37 (д, J = 6.6 Гц, 3H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-5-хлор-3-(2-хлорбензил)хиназолин-4(3H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 7.57-7.65 (м, 2H), 7.39-7.52 (м, 2H), 7.13-7.26 (м, 2H), 6.75-6.85 (м, 1H), 5.75 (д, J = 17.1 Гц, 1H), 5.27 (д, J = 17.1 Гц, 1H), 3.83-3.91 (м, 1H), 1.40 (д, J = 6.5 Гц, 3H).
Препаративный пример 28: Получение (S)-2-(1-аминоэтил)-6-фтор-3-(пиридин-2-илметил)хиназолин-4(3H)-она
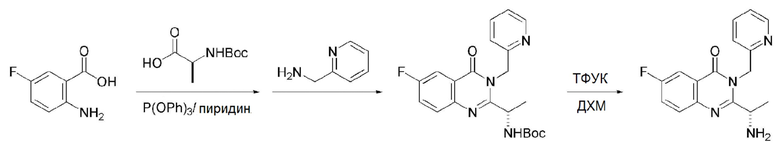
Стадия 1: Получение трет-бутил (S)-(1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)карбамата
Целевое соединение получали при использовании 2-амино-6-фторбензойной кислоты и пиридин-2-илметанамина согласно методике, аналогичной описанной для стадии 2 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 8.48 (д, J = 4.0 Гц, 1H), 7.89 (дд, J = 8.5, 3.0 Гц, 1H), 7.71-7.62 (м, 2H), 7.46 (тд, J = 8.6, 2.9 Гц, 1H), 7.19-7.15 (м, 2H), 5.61 (с, 2H), 5.22-5.13 (м, 1H), 1.44 (с, 3H), 1.41 (с, 9H).
Стадия 2: Получение (S)-2-(1-аминоэтил)-6-фтор-3-(пиридин-2-илметил)хиназолин-4(3H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1.
1H ЯМР (300 МГц, CDCl3) δ 8.48 (д, J = 4.5 Гц, 1H), 7.83 (дд, J = 8.4, 2.9 Гц, 1H), 7.71-7.63 (м, 2H), 7.42-7.33 (м, 2H), 7.19 (дд, J = 7.1, 5.1 Гц, 1H), 8.48 (д, J = 4.5 Гц, 1H), 5.73 (д, J = 15.8 Гц, 1H), 5.21 (д, J = 15.8 Гц, 1H), 4.72 (кв, J = 6.5 Гц, 1H), 4.45 (с, 2H), 1.53 (д, J = 6.6 Гц, 3H)
Препаративный пример 29: Получение 1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина

Стадия 1: Получение (2-амино-6-хлорфенил)метанола
3.43 г (20.0 ммоль) 2-амино-6-хлорбензойной кислоты растворяли в безводном ТГФ 30 мл), в который затем медленно добавляли LiAlH4 (1.5 экв.) при комнатной температуре в течение 10 минут и перемешивали 12 часов. Добавляли диэтиловый эфир (40 мл) и воду (5 мл). Реакционную смесь сушили (MgSO4) и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: CH2Cl2/этилацетат, 5/1 -> CH2Cl2/этилацетат, 2/1), получая 2.36 г целевого соединения (2-амино-6-хлорфенил)метанола в виде светло-желтого вещества (15.0 ммоль, выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ 7.01 (т, J = 8.0 Гц, 1H), 6.76 (д, J = 7.9 Гц, 1H), 6.58 (д, J = 8.0 Гц, 1H), 4.89 (с, 2H), 4.30 (ушир.с, 2H), 1.66 (ушир.с, 1H).
Стадия 2: Получение 2-амино-6-хлорбензальдегида
2.30 г (14.6 ммоль) (2-амино-6-хлорфенил)метанола, полученного на стадии 1, MnO2 (10 экв.) и диэтиловый эфир (50 мл) смешивали и перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь фильтровали через слой целита и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/CH2Cl2, 5/1 -> CH2Cl2), получая 2.27 г целевого соединения 2-амино-6-хлорбензальдегида в виде желтого твердого вещества (14.6 ммоль, выход: 10%).
1H ЯМР (300 МГц, CDCl3) δ 10.48 (с, 1H), 7.17 (т, J = 8.2 Гц, 1H), 6.67 (д, J = 7.7 Гц, 1H), 6.54 (д, J = 8.4 Гц, 1H), 6.48 (ушир.с, 2H).
Стадия 3: Получение трет-бутил (1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этилкарбамата
793 мг (3.0 ммоль) 2-амино-6-хлорбензальдегида (1.2 экв.), полученного на стадии 2, трет-бутил (S)-(3-оксо-4-(пиридин-2-ил)бутан-2-ил)карбамат, K2CO3 (3 экв.) и этанол (15 мл) смешивали и кипятили в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, отделяли, сушили (Na2SO4), и упаривали при пониженном давлении. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 8/1 -> гексан/этилацетат, 3/1), получая 1.16 г целевого соединения трет-бутил (1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этилкарбамата в виде белого твердого вещества (3.0 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.77 (ушир.д, J = 4.1 Гц, 1H), 8.53 (с, 1H), 8.05 (д, J = 8.6 Гц, 1H), 7.83-7.89 (м, 1H), 7.59-7.68 (м, 3H), 7.34-7.39 (м, 1H), 6.33 (ушир.д, J = 6.6 Гц, 1H), 5.43-5.52 (м, 1H), 1.45 (с, 9H), 1.34 (д, J = 6.5 Гц, 3H).
Стадия 4: Получение 1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина
739 мг 1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина получали при использовании 1.0 г (2.60 ммоль) трет-бутил (1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этилкарбамата, полученного на стадии 3, согласно методике, аналогичной описанной для стадии 3 в Препаративном примере 1 (2.60 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 8.64 (д, J = 2.7 Гц, 1H), 8.60 (с, 1H), 8.05-7.99 (м, 1H), 8.05-7.99 (м, 1H), 7.88 (тд, J = 7.7, 1.3 Гц, 1H), 7.70-7.63 (м, 3H), 7.36-7.32 (м, 1H), 5.18-5.24 (м, 1H), 1.58 (д, J = 6.6 Гц, 3H).
Приведенные далее Примеры 1 ~ 33 получали способом, представленным на схеме реакции 1A.
Схема реакции 1A
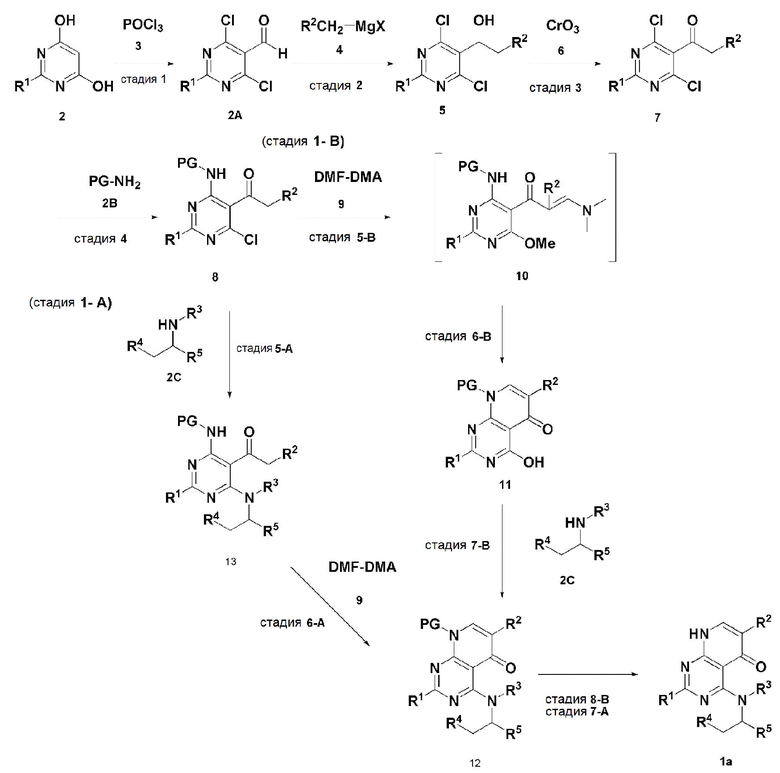
Пример 1: Получение (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
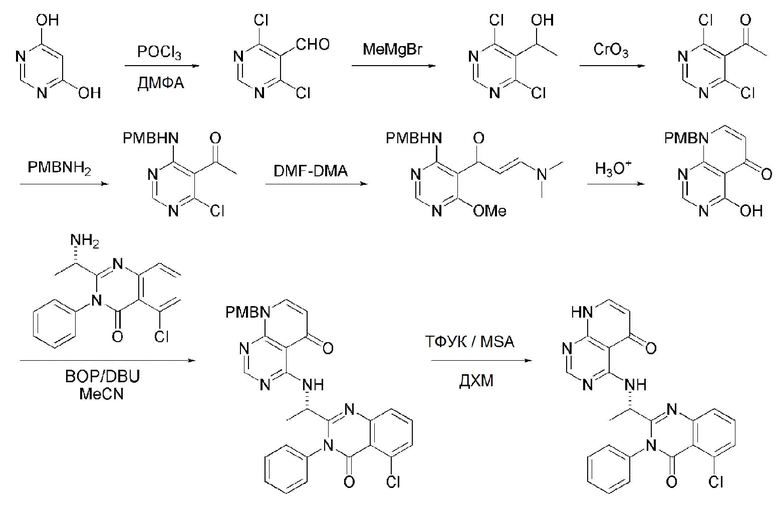
Стадия 1: Получение 4,6-дихлорпиримидин-5-карбальдегида
30 мл фосфорилхлорида (POCl3) охлаждали до 0ºС, затем медленно добавляли 9.6 мл безводного диметилформамида (ДМФА). Через 1 час добавляли 7.85 г (70.0 ммоль) 4,6-дигидроксипиримидина. Реакционную смесь нагревали при комнатной температуре, затем перемешивали при комнатной температуре 30 минут. Реакционную смесь кипятили в течение 3 часов. Смесь охлаждали до комнатной температуры. Реакционную смесь медленно добавляли в ледяную воду, затем экстрагировали этилацетатом. Отделяли органический слой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Полученное твердое вещество промывали смесью гексан/диэтиловый эфир (5/1, об/об), получая 10.5 г 4,6-дихлорпиримидин-5-карбальдегида в виде белого твердого вещества (5.95 ммоль, выход: 85%).
1H ЯМР (300 МГц, CDCl3) δ 10.47 (с, 1H), 8.90 (с, 1H).
Стадия 2: получение 1-(4,6-дихлорпиримидин-5-ил)этан-1-ола
1.2 г (6.8 ммоль) 4,6-дихлорпиримидин-5-карбальдегида растворяли в ТГФ (25 мл), в который затем медленно добавляли 8.14 мл (8.14 ммоль, 1.2 экв.) метилмагний бромида (18% в ТГФ) при 0ºС. Насыщенный водный раствор хлорида аммония (10 мл) медленно добавляли, затем экстрагировали этилацетатом. Отделяли органический слой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1), получая 1.1 г целевого соединения 1-(4,6-дихлорпиримидин-5-ил)этан-1-ола в виде белого твердого вещества (5.7 ммоль, выход: 80%).
1H ЯМР (300 МГц, CDCl3) δ 8.69 (с, 1H), 5.57-5.47 (м, 1H), 2.64 (д, J = 9.3 Гц, 1H), 1.68 (д, J = 6.8 Гц, 3H).
Стадия 3: Получение 1-(4,6-дихлорпиримидин-5-ил)этан-1-она
980 мг (5.08 ммоль) 1-(4,6-дихлорпиримидин-5-ил)этан-1-ола, полученного на стадии 2, растворяли в 30 мл ацетона, затем медленно добавляли 1.0 г (10.2 ммоль, 2.0 экв.) триоксида хрома и перемешивали при комнатной температуре 2 часа. Добавляли 2 мл изопропилового спирта и перемешивали 10 минут. Добавляли в реакционную смесь 20 мл насыщенного водного раствора карбоната натрия, затем экстрагировали этилацетатом. Отделяли органический слой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 6/1), получая 823 мг целевого соединения 1-(4,6-дихлорпиримидин-5-ил)этан-1-она в виде белого твердого вещества (4.3 ммоль, выход: 85%).
1H ЯМР (300 МГц, CDCl3) δ 8.84 (с, 1H), 2.63 (с, 3H).
Стадия 4: Получение 1-(4-хлор-6-((4-метоксибензил)амино)пиримидин-5-ил)этан-1-она
3.82 г (20.0 ммоль) 1-(4,6-дихлорпиримидин-5-ил)этан-1-она растворяли в 30 мл дихлорметана, который охлаждали до 0ºС, затем добавляли порциями 3.88 г (30.0 ммоль) диизопропилэтиламина и 3.29 г (24.0 ммоль) п-метоксибензиламина (PMBNH2). Через 1 час реакционную смесь нагревали до комнатной температуры, перемешивали при комнатной температуре 6 часов. В реакционную смесь добавляли воду и этилацетат, затем экстрагировали. Отделяли органический слой, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1), получая 5.54 г целевого соединения 1-(4-хлор-6-((4-метоксибензил)амино)пиримидин-5-ил)этан-1-она в виде белого твердого вещества (19.0 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 9.07 (ушир.с, 1H, NH), 8.38 (с, 1H), 7.25 (д, J = 8.1 Гц, 2H), 6.88 (д, J = 8.1 Гц, 2H), 4.67 (д, J = 4.8 Гц, 2H), 3.81 (с, 3H), 2.74 (с, 3H).
Стадии 5 и 6: Получение 4-гидрокси-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
5.83 г (20.0 ммоль) 1-(4-хлор-6-((4-метоксибензил)амино)пиримидин-5-ил)этан-1-она, полученного на стадии 4, и 3.57 г (30.0 ммоль) N,N-диметилформамид диметилацеталя (DMF-DMA) растворяли в 30 мл безводного толуола и нагревали при 100℃ в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры. Растворитель и DMF-DMA удаляли при пониженном давлении. В полученное промежуточное соединение добавляли 100 мл уксусной кислоты и 20 мл воды, после чего кипятили 4 дня. Реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли при пониженном давлении. Полученный желтый продукт промывали смесью вода/изопропанол (ИПС) (1/1), получая 4.53 г целевого соединения 4-гидрокси-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она в виде белого твердого вещества (16.0 ммоль, выход: 80%).
1H ЯМР (300 МГц, ДМСО-d6) δ 8.78 (ушир.с, 1H, NH), 7.76 (д, J = 4.7 Гц, 1H), 7.28 (д, J = 5.2 Гц, 2H), 6.93 (д, J = 5.2 Гц, 2H), 6.47 (д, J = 4.7 Гц, 1H), 5.48 (с, 3H), 3.83 (с, 3H).
Стадия 7: Получение (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
50 мг (0.176 ммоль) 4-гидрокси-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 5 и стадии 6, растворяли в 2 мл безводного ацетонитрила, в который затем добавляли 101 мг (0.229 ммоль) (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфата (BOP) и 39 мкл (0.264 ммоль) 1,8-диазабицикло[5.4.0]-7-ундецена (DBU) и перемешивали 30 минут. 58 мг (0.194 ммоль) (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она добавляли и перемешивали при 60℃ в течение 12 часов. Реакционную смесь фильтровали при пониженном давлении. Добавляли этилацетат и воду, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 6/1 -> гексан/этилацетат, 1/1), получая 72 мг целевого соединения (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она в виде желтого твердого вещества (0.127 ммоль, выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ 11.02 (д, J = 7.7 Гц, 1H), 8.28 (с, 1H), 7.7.71 (д, J = 8.1 Гц, 1H), 7.54-7.62 (м, 2H), 7.40-7.53 (м, 5H), 7.33 (д, J = 7.9 Гц, 1H), 7.20 (д, J = 8.6 Гц, 2H), 6.85 (д, J = 8.6 Гц, 2H), 6.30 (д, J = 7.9 Гц, 1H), 5.33 (с, 2H), 5.01 (кв, J = 6.9 Гц, 6.9 Гц, 1H), 3.78 (с, 3H), 1.49 (д, J = 6.7 Гц, 3H).
Стадия 8: Получение (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
72 мг (0.127 ммоль) (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 7, растворяли в 1 мл дихлорметана, в который затем добавляли 1 мл трифторуксусной кислоты (ТФУК) и 0.5 мл метансульфокислоты и перемешивали при 70℃ в течение 10 часов. Добавляли насыщенный водный раствор карбоната натрия, затем нейтрализовывали смесь. Добавляли дихлорметан и воду, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 30/1), получая 51 мг целевого соединения (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она в виде светло-желтого вещества (0.115 ммоль, выход: 90%).
1H ЯМР (500 МГц, CDCl3) δ 11.06 (д, J = 7.0 Гц, 1H), 8.24 (с, 1H), 7.73 (д, J = 8.2 Гц, 1H), 7.58-7.64 (м, 2H), 7.51-7.57 (м, 3H), 7.46-7.51 (м, 2H), 7.37 (д, J = 7.6 Гц, 1H), 6.38 (д, J = 7.6 Гц, 1H), 5.12 (кв, J = 6.8 Гц, 6.8 Гц, 1H), 1.53 (д, J = 6.4 Гц, 3H).
Стадия 6: Получение (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
4 мг (0.013 ммоль) 4-хлор-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 5, и 4 мг (0.014 ммоль) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она растворяли в 1 мл безводного диметилсульфоксида (ДМСО), в который затем добавляли 6.6 мкл (0.039 ммоль) диизопропилэтиламина (DIPEA) и перемешивали при 70ºС в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли этилацетат и воду, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1 -> гексан/этилацетат, 1/1), получая 6 мг целевого соединения (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она в виде светло-желтого вещества (0.010 ммоль, выход: 82%).
1H ЯМР (300 МГц, CDCl3) δ 10.53 (д, J = 6.6 Гц, 1H), 8.31 (с, 1H), 7.61 (д, J = 6.9 Гц, 1H), 7.47-7.57 (м, 2H), 7.30-7.47 (м, 6H), 7.22 (д, J = 8.2 Гц, 2H), 7.88 (д, J = 8.2 Гц, 2H), 6.58 (с, 1H), 5.38 (с, 2H), 4.95 (кв, J = 4.2 Гц, 5.2 Гц, 1H), 3.79 (с, 3H), 1.46 (д, J = 6.9 Гц, 3H).
Стадия 7: Получение (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-она
3 мг (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-она получали в виде светло-желтого вещества при использовании 6 мг (0.010 ммоль) (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 6, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.006 ммоль, выход: 63%).
1H ЯМР (500 МГц, CD3OD) δ 8.19 (с, 1H), 8.07 (д, J = 6.5 Гц, 1H), 7.62 (т, J = 4.7 Гц, 2H), 7.53-7.60 (м, 2H), 7.39-7.45 (м, 3H), 7.34 (т, J = 7.9 Гц, 1H), 6.90 (с, 1H), 4.99-5.05 (м, 1H), 1.56 (д, J = 6.6 Гц, 3H).
Пример 21: Получение (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-она
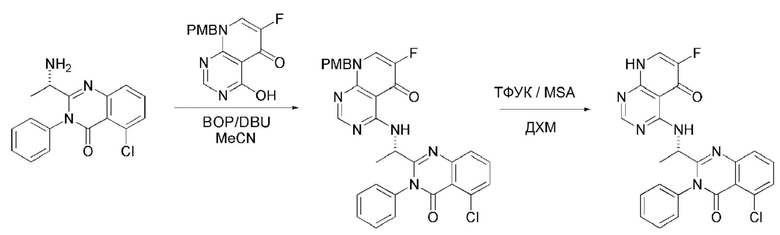
Стадия 1: Получение (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
50 мг (0.166 ммоль) 6-фтор-4-гидрокси-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она растворяли в 2 мл безводного диметилформамида, в который затем добавляли 95 мг (0.216 ммоль) (бензотриазол-1-илокси)трис(диметиламино) фосфония гексафторфосфата (BOP) и 81 мг (0.249 ммоль) карбоната цезия (Cs2CO3), и перемешивали при комнатной температуре 30 минут. Добавляли 55 мг (0.183 ммоль) (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она и перемешивали при 60 ~ 80℃ в течение 2 часов. В реакционную смесь добавляли этилацетат и воду, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 5/1 -> гексан/этилацетат, 1/1), получая 10 мг целевого соединения (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она в виде светло-желтого вещества (0.017 ммоль, выход: 10%).
1H ЯМР (300 МГц, CDCl3) δ 10.87 (д, J = 7.0 Гц, 1H), 8.29 (с, 1H), 7.72 (д, J = 7.8 Гц, 1H), 7.44-7.62 (м, 7H), 7.33 (д, J = 7.3 Гц, 1H), 7.21 (д, J = 8.6 Гц, 2H), 6.87 (д, J = 8.6 Гц, 2H), 5.32 (с, 2H), 5.11 (кв, J = 5.4 Гц, 6.8 Гц, 1H), 3.79 (с, 3H), 1.50 (д, J = 7.1 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-она
6 мг (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-она получали в виде светло-желтого вещества при использовании 10 мг (0.017 ммоль) (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фтор-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.013 ммоль, выход: 76%).
1H ЯМР (300 МГц, CDCl3) δ 10.84 (д, J = 8.1 Гц, 1H), 8.22 (с, 1H), 7.72 (д, J = 7.9 Гц, 1H), 7.52-7.64 (м, 6H), 7.42-7.49 (м, 2H), 7.35 (д, J = 7.3 Гц, 1H), 5.12 (кв, J = 5.5 Гц, 6.7 Гц, 1H), 1.51 (д, J = 6.7 Гц, 3H).
Пример 22: Получение (S)-6-хлор-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
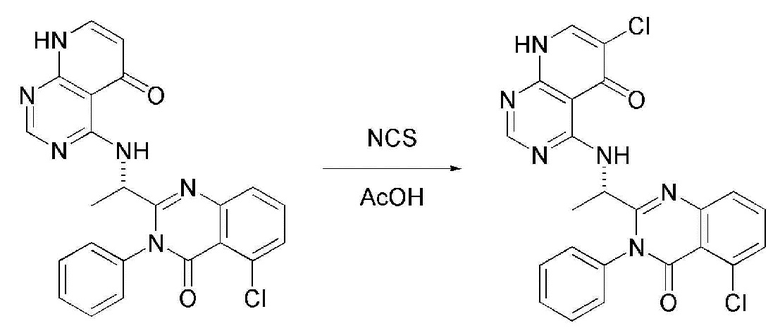
10 мг (0.022 ммоль) (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она, полученного в Примере 1, растворяли в 1 мл уксусной кислоты, затем добавляли 3.3 мг (0.025 ммоль) N-хлорсукцинимида (NCS) и перемешивали при 50 ~ 60ºС в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали при пониженном давлении. Добавляли насыщенный водный раствор карбоната натрия, после чего проводили нейтрализацию. Добавляли воду и дихлорметан, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 50/1 -> дихлорметан/метанол, 20/1), получая 3 мг целевого соединения (S)-6-хлор-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она в виде светло-желтого вещества (0.006 ммоль, выход: 28%).
1H ЯМР (300 МГц, CDCl3) δ 9.62 (д, J = 8.1 Гц, 1H), 8.07 (с, 1H), 7.74 (д, J = 7.3 Гц, 1H), 7.46-7.67 (м, 6H), 7.29-7.40 (м, 2H), 5.08-5.18 (м, 1H), 1.45 (д, J = 5.7 Гц, 3H).
Пример 23: Получение (S)-6-хлор-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
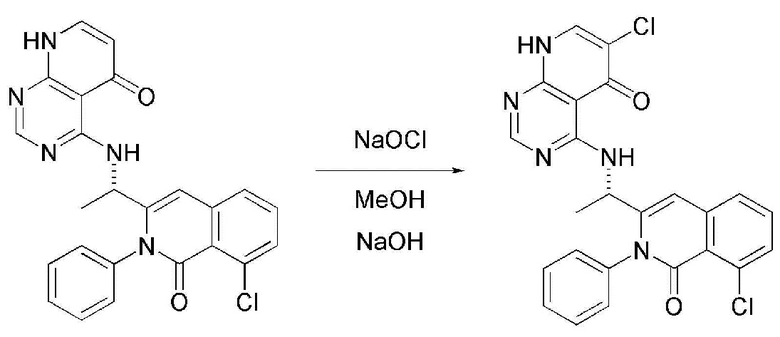
10 мг (0.023 ммоль) (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она, полученного в Примере 5, растворяли в 2 мл смеси метанол:вода (1:1), затем добавляли 34 мкл (0.068 ммоль) 2н. раствора гидроксида натрия и 34 мкл 12%-ного раствора гипохлорита натрия при 0℃, и перемешивали при комнатной температуре 1 час. Реакционную смесь фильтровали при пониженном давлении, после чего проводили нейтрализацию добавлением 1н. HCl. Добавляли воду и дихлорметан, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 50/1 -> дихлорметан/метанол, 20/1), получая 2 мг целевого соединения (S)-6-хлор-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она в виде желтого твердого вещества (0.004 ммоль, выход: 19%).
1H ЯМР (300 МГц, CDCl3) δ 10.53 (д, J = 5.6 Гц, 1H), 8.25 (с, 1H), 7.84 (с, 1H), 7.49-7.57 (м, 2H), 7.40-7.47 (м, 4H), 7.30-7.39 (м, 2H), 6.58 (с, 1H), 4.95 (т, J = 6.7 Гц, 1H), 1.47 (д, J = 6.6 Гц, 3H).
Пример 24: Получение (S)-6-хлор-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-о

50 мг (0.113 ммоль) (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он, полученного в Примере 5, растворяли в 2 мл уксусной кислоты, затем добавляли 17 мг (0.124 ммоль) N-хлорсукцинимид (NCS) и перемешивали при 50ºС в течение 15 часов. Реакционную смесь фильтровали при пониженном давлении. Добавляли насыщенный водный раствор карбоната натрия, после чего проводили нейтрализацию. Добавляли воду и дихлорметан, затем экстрагировали. Отделяли органический слой, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 50/1 -> дихлорметан/метанол, 20/1), получая 17 мг целевого соединения (S)-6-хлор-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она в виде светло-желтого вещества (0.036 ммоль, выход: 29%).
1H ЯМР (300 МГц, CDCl3) δ 10.92 (д, J = 4.4 Гц, 1H), 8.28 (с, 1H), 7.91-7.98 (м, 1H), 7.70-7.79 (м, 2H), 7.48-7.64 (м, 5H), 7.20 (д, J = 6.2 Гц, 1H), 5.04 (т, J = 7.12 Гц, 1H), 1.68 (д, J = 7.1 Гц, 3H).
Пример 25: Получение (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
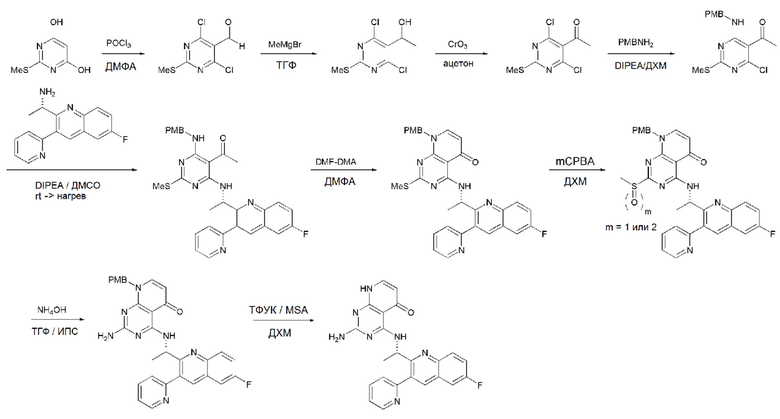
Стадия 1: Получение 4,6-дихлор-2-метилмеркаптопиримидин-5-карбальдегида
8.36 г 4,6-дихлор-2-метилмеркаптопиримидин-5-карбальдегида получали в виде белого твердого вещества при использовании 7.91г (50.0 ммоль) 4,6-дигидрокси-2-метилмеркаптопиримидина согласно методике, аналогичной описанной для стадии 1 в Примере 1 (37.5 ммоль, выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ 10.38 (с, 1H), 2.64 (с, 3H).
Стадия 2: Получение 1-(4,6-дихлор-2-метилмеркаптопиримидин-5-ил)этан-1-ола
2.27 г 1-(4,6-дихлор-2-метилмеркаптопиримидин-5-ил)этан-1-ола получали в виде белого твердого вещества при использовании 2.23 г (10.0 ммоль) 4,6-дихлор-2-метилмеркаптопиримидин-5-карбальдегида, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 2 в Примере 1 (9.5 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 5.40-5.47 (м, 1H), 2.57 (с, 3H), 2.52 (д, J = 9.2 Гц, 1H), 1.64 (д, J = 6.8 Гц, 3H).
Стадия 3: Получение 1-(4,6-дихлор-2-метилмеркаптопиримидин-5-ил)этан-1-она
1.09 г 1-(4,6-дихлор-2-метилмеркаптопиримидин-5-ил)этан-1-она получали в виде белого твердого вещества при использовании 1.20 г (5.0 ммоль) 1-(4,6-дихлор-2-метилмеркаптопиримидин-5-ил)этан-1-ола, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 3 в Примере 1 (4.6 ммоль, выход: 92%).
1H ЯМР (300 МГц, CDCl3) δ 2.62 (с, 3H), 2.61 (с, 3H).
Стадия 4: Получение 1-(4-хлор-2-метилмеркапто-6-((4-метоксибензил)амино) пиримидин-5-ил)этан-1-она
1.014 г 1-(4-хлор-2-метилмеркапто-6-((4-метоксибензил)амино)пиримидин-5-ил)этан-1-она получали в виде бесцветного масла при использовании 712 мг (3.0 ммоль) 1-(4,6-дихлор-2-метилмеркаптопиримидин-5-ил)этан-1-она, полученного на стадии 3, согласно методике, аналогичной описанной для стадии 4 в Примере 1 (3.0 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 9.53 (ушир.с, 1H, NH), 7.25 (д, J = 8.7 Гц, 2H), 6.87 (д, J = 8.7 Гц, 2H), 4.66 (д, J = 5.6 Гц, 2H), 3.80 (с, 3H), 2.71 (с, 3H), 2.50 (с, 3H).
Стадия 5: Получение (S)-1-(4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил) амино)-6-((4-метоксибензил)амино)-2-(метилмеркапто)пиримидин-5-ил)этан-1-она
376 мг (S)-1-(4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-6-((4-метоксибензил)амино)-2-(метилмеркапто)пиримидин-5-ил)этан-1-она получали в виде бесцветного масла при использовании 338 мг (1.0 ммоль) 1-(4-хлор-2-метилмеркапто-6-((4-метоксибензил)амино)пиримидин-5-ил)этан-1-она, полученного на стадии 4, и 267 мг (1.0 ммоль) (S)-1-(6-фтор-3-(пиридин-2-ил)этан-1-амина согласно методике, аналогичной описанной для стадии 1 в Примере 5 (0.66 ммоль, выход: 66%).
1H ЯМР (300 МГц, CDCl3) δ 9.71 (ушир.т, J = 5.4 Гц, 1H, NH), 7.79 (д, J = 4.7 Гц, 1H), 8.16 (с, 1H), 8.04 (м, 1H), 7.86-7.93 (м, 2H), 7.61-7.64 (м, 1H), 7.30-7.60 (м, 3H), 7.24 (м, 2H), 6.84 (м, 2H), 6.28 (м, 1H), 4.64 (д, J = 5.4 Гц, 2H), 3.78 (с, 3H), 2.77 (с, 3H), 2.37 (с, 3H), 1.27 (д, J = 7.2 Гц, 3H).
Стадия 6: Получение (S)-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)-2-(метилмеркапто)пиридо[2,3-d]пиримидин-5(8H)-она
168 мг (S)-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)-2-(метилмеркапто)пиридо[2,3-d]пиримидин-5(8H)-она получали в виде белого твердого вещества при использовании 285 мг (0.5 ммоль) (S)-1-(4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-6-((4-метоксибензил)амино)-2-(метилмеркапто) пиримидин-5-ил)этан-1-она, полученного на стадии 5, согласно методике, аналогичной описанной для стадии 2 в Примере 5 (0.29 ммоль, выход: 58%).
1H ЯМР (300 МГц, CDCl3) δ 11.42 (ушир.д, J = 7.6 Гц, 1H, NH), 8.77 (ушир.д, J = 4.8 Гц, 1H), 8.27 (м, 1H), 8.11 (с, 1H), 7.82 (м, 1H), 7.61 (д, J = 7.8 Гц, 1H), 7.20-7.60 (м, 4H), 7.18 (д, J = 8.6 Гц, 2H), 6.84 (д, J = 8.6 Гц, 2H), 6.21 (д, J = 7.9 Гц, 1H), 6.14 (м, 1H), 5.26 (с, 2H), 3.78 (с, 3H), 2.36 (с, 3H), 1.56 (д, J = 6.6 Гц, 3H).
Стадии 7 и 8: Получение (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
145 мг (0.25 ммоль) (S)-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)-2-(метилмеркапто)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 6, растворяли в 5 мл дихлорметана, затем добавляли 3-хлорпероксибензойную кислоту (mCPBA) (2 экв.), и перемешивали при комнатной температуре 30 минут. Добавляли в реакционную смесь воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором бикарбоната натрия, отделяли, сушили (Na2SO4), и упаривали. Полученное соединение растворяли в 5 мл смеси тетрагидрофуран: изопропанол (1:1), затем добавляли 2 мл 28%-ного раствора аммиака в воде, и перемешивали при 50ºС в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли воду, затем экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), и упаривали. Полученный продукт разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 2/1 -> этилацетат), получая 78 мг целевого соединения (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она в виде белого твердого вещества (0.14 ммоль, выход: 57%).
1H ЯМР (300 МГц, CDCl3) δ 11.20 (ушир.д, J = 7.2 Гц, 1H, NH), 8.79 (м, 1H), 8.25 (м, 1H), 8.08 (с, 1H), 7.80 (м, 1H), 7.30-7.55 (м, 4H), 7.10-7.26 (м, 3H), 6.83 (м, 2H), 6.08 (д, J = 7.9 Гц, 1H), 5.85 (м, 1H), 5.16 (с, 2H), 4.84 (с, 2H), 3.77 (с, 3H), 1.62 (д, J = 6.6 Гц, 3H).
Стадия 9: Получение (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
54 мг (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино) пиридо[2,3-d]пиримидин-5(8H)-она получали в виде белого твердого вещества при использовании 70 мг (0.128 ммоль) (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 8, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.126 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 11.39 (с, 1H), 8.77 (д, J = 4.5 Гц, 1H), 8.22 (дд, J = 9.0, 5.5 Гц, 1H), 8.03 (с, 1H), 7.86 (тд, J = 1.5, 7.6 Гц, 1H), 7.54-7.36 (м, 4H), 7.19 (д, J = 7.6 Гц, 1H), 6.08 (д, J = 7.6 Гц, 1H), 5.93-5.84 (м, 1H), 5.59 (ушир.с, 2H), 1.55 (д, J = 6.5 Гц, 3H).
Пример 26: Получение 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она

Стадия 1: Получение 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил) амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
99 мг 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она получали в виде бежевого твердого вещества при использовании 100 мг (0.29 ммоль) 1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этан-1-амина, полученного в Препаративном примере 22, согласно методике, аналогичной описанной для стадии 7 в Примере 1 (0.16 ммоль, выход: 56%).
1H ЯМР (300 МГц, CDCl3) δ 8.69 (с, 2H), 8.39-8.34 (м, 2H), 7.65-7.42 (м, 4H), 7.24-7.19 (м, 3H), 7.13-7.05 (м, 2H), 6.91-6.84 (м, 2H), 6.32 (с, 1H), 5.61 (с, 1H), 5.34 (с, 2H), 3.77 (с, 3H), 3.57-3.50 (м, 1H), 3.46 (с, 1H), 1.59 (д, J = 2.1 Гц, 3H).
Стадия 2: Получение 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил) амино)пиридо[2,3-d]пиримидин-5(8H)-она
54 мг 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она получали в виде бежевого твердого вещества при использовании 90 мг (0.15 ммоль) 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.11 ммоль, выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ 11.48 (ушир.с, 1H), 10.69 (с, 1H), 8.67 (т, J = 5.7 Гц, 2H), 8.67 (т, J = 5.7 Гц, 2H), 8.37 (дд, J = 9.2, 5.6 Гц, 1H), 8.17 (с, 2H), 7.54-7.44 (м, 3H), 7.34 (д, J = 7.7 Гц, 1H), 7.21-7.13 (м, 3H), 7.08-7.02 (м, 2H), 6.29 (д, J = 7.6 Гц, 1H), 5.70 (ушир.с, 1H), 1.54 (д, J = 2.3 Гц, 3H).
Пример 27: Получение (S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она

Стадия 1: Получение (S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
(S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она получали в виде бледно-бежевого твердого вещества при использовании 120 мг (0.35 ммоль) (S)-1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этан-1-амина, полученного в Препаративном примере 23, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 8.64 (ушир.д, J = 4.9 Гц, 1H), 8.29-8.35 (м, 2H), 7.42-7.55 (м, 3H), 7.13-7.34 (м, 7H), 6.91-7.09 (м, 3H), 6.82-6.89 (м, 2H), 6.30-6.32 (м, 1H), 5.65-5.69 (м, 1H), 5.30 (с, 2H), 3.78 (с, 3H), 1.47 (д, J = 6.3 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
(S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он получали в виде бледно-бежевого твердого вещества при использовании 95 мг (0.16 ммоль) (S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.58 (ушир.с, 1H), 11.32 (ушир.с, 1H), 8.65 (ушир.д, J = 4.2 Гц, 1H), 8.32-8.38 (м, 1H), 8.23 (с, 1H), 7.43-7.54 (м, 3H), 7.13-7.36 (м, 6H), 6.94-7.10 (м, 3H), 6.36 (д, J = 7.6 Гц, 1H), 5.65-6.75 (м, 1H), 1.45 (д, J = 6.3 Гц, 3H).
Пример 28: Получение (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она

Стадия 1: Получение (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного в Препаративном примере 24, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 10.91 (с, 1H), 8.75-8.62 (м, 1H), 8.37-8.26 (м, 1H), 7.89-7.71 (м, 2H), 7.89-7.71 (м, 2H), 7.57-7.40 (м, 3H), 7.21 (д, J = 7.2 Гц, 2H), 6.31 (д, J = 7.7 Гц, 2H), 5.41-5.26 (м, 2H), 5.13-4.99 (м, 1H), 3.78 (с, 3H), 1.53 (дд, J = 11.3, 6.7 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 10.89 (д, J = 6.7 Гц, 1H), 8.77 (с, 1H), 8.68 (д, J = 7.4 Гц, 1H), 8.17 (д, J = 3.2 Гц, 1H), 7.90-7.73 (м, 3H), 7.59-7.47 (м, 3H), 6.35 (т, J = 4.9 Гц, 2H), 5.13-5.03 (м, 1H), 1.55 (т, J = 8.0 Гц, 3H).
Пример 29: Получение (S)-4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
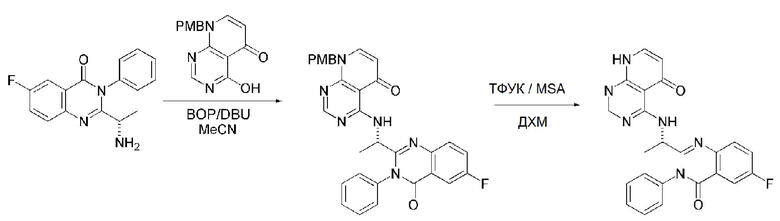
Стадия 1: Получение (S)-4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного в Препаративном примере 25, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.01 (д, J = 6.8 Гц, 1H), 8.27 (с, 1H), 7.90-7.88 (м, 2H), 7.90-7.88 (м, 2H), 7.58-7.44 (м, 6H), 7.33 (д, J = 6.8 Гц, 1H), 7.20 (д, J = 7.8 Гц, 1H), 6.85 (д, J = 8.0 Гц, 2H), 6.32 (д, J = 7.8 Гц, 1H), 5.34 (с, 1H), 5.18-5.09 (м, 1H), 3.78 (с, 3H), 1.50 (д, J = 6.5 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.05 (д, J = 6.9 Гц, 1H), 8.17 (с, 1H), 7.90 (д, J = 8.3 Гц, 1H), 7.85-7.80 (м, 1H), 7.60-7.41 (м, 6H), 6.36 (д, J = 7.6 Гц, 1H), 5.20-5.11 (м, 1H), 1.51 (д, J = 6.4 Гц, 3H).
Пример 30: Получение (S)-4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
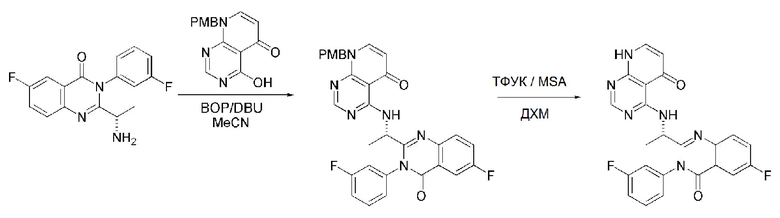
Стадия 1: Получение (S)-4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного в Препаративном примере 26, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 10.97-10.91 (м, 1H), 8.28 (с, 1H), 7.90-7.72 (м, 3H), 7.59- 7.50 (м, 4H), 7.24-7.20 (м, 3H), 6.86 (д, J = 7.8 Гц, 2H), 6.32 (д, J = 7.8 Гц, 1H), 5.35 (с, 2H), 5.17-5.10 (м, 1H), 3.78 (с, 3H), 1.53 (д, J = 6.5 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 10.84-10.78 (м, 1H), 8.20 (д, J = 5.4 Гц, 1H), 7.91-7.77 (м, 2H), 7.59-7.46 (м, 3H), 7.22-7.08 (м, 2H), 6.34 (д, J = 7.4 Гц, 1H), 5.18-5.09 (м, 1H), 1.53 (д, J = 6.5 Гц, 3H).
Пример 31: Получение (S)-4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она

Стадия 1: Получение (S)-4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного в Препаративном примере 27, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 10.84 (д, J = 7.8 Гц, 1H), 8.32 (с, 1H), 7.71-7.58 (м, 2H), 7.47 (т, J = 8.3 Гц, 2H), 7.26-7.18 (м, 3H), 7.01 (с, 2H), 6.87 (д, J = 7.7 Гц, 2H), 6.79 (д, J = 5.2 Гц, 1H), 6.23 (д, J = 7.8 Гц, 1H), 5.79-5.73 (м, 1H), 5.63-5.54 (м, 1H), 5.46-5.36 (м, 3H), 3.80 (с, 3H), 1.56 (д, J = 6.2 Гц, 3H).
Стадия 2: Получение ((S)-4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 10.84 (д, J = 7.9 Гц, 1H), 8.22 (с, 1H), 7.72 (дд, J = 7.9, 0.8 Гц, 1H), 7.62 (т, J = 7.8 Гц, 2H), 7.51-7.46 (м, 2H), 7.33-7.30 (м, 1H), 7.13-7.04 (м, 2H), 6.83-6.80 (м, 1H), 6.29 (д, J = 7.7 Гц, 1H), 5.78 (д, J = 17.1 Гц, 1H), 5.61-5.52 (м, 1H), 5.49-5.41 (м, 1H), 1.57 (д, J = 6.6 Гц, 1H). (м, 1H), 5.46-5.36 (м, 3H), 3.80 (с, 3H), 1.56 (д, J = 6.2 Гц, 3H).
Пример 32: Получение (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
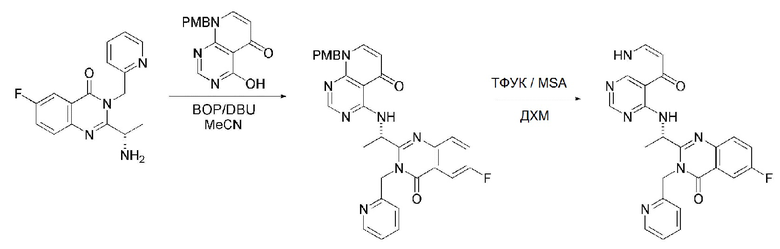
Стадия 1: Получение (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного в Препаративном примере 28, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.02 (д, J = 7.7 Гц, 1H), 8.41 (д, J = 4.4 Гц, 1H), 8.40 (с, 1H), 7.89 (дд, J = 8.5, 2.9 Гц, 1H), 7.78 (дд, J = 9.0, 4.9 Гц, 1H), 7.81-7.39 (м, 2H), 7.21 (д, J = 8.6 Гц, 2H), 7.09 (дд, J = 7.0, 5.3 Гц, 1H), 6.86 (д, J = 8.6 Гц, 2H), 6.29 (д, J = 7.9 Гц, 1H), 5.89-5.80 (м, 2H), 5.59 (д, J = 16.2 Гц, 1H), 5.33 (дд, J = 14.6, 16.1 Гц, 2H), 3.78 (с, 3H), 1.59 (д, J = 6.5 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-она
Целевое соединение получали при использовании соединения, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.19 (д, J = 7.6 Гц, 1H), 8.46 (д, J = 4.3 Гц, 1H), 8.23 (с, 1H), 7.90 (дд, J = 8.5, 3.0 Гц, 1H), 7.81 (дд, J = 9.0, 4.9 Гц, 1H), 7.63 (тд, J = 1.7, 7.7 Гц, 1H), 7.51-7.43 (м, 2H), 7.31 (д, J = 7.9 Гц, 1H), 7.15 (дд, J = 7.0, 5.0 Гц, 1H), 6.34 (д, J = 7.7 Гц, 1H), 5.95-5.81 (м, 2H), 5.54 (д, J = 16.1 Гц, 1H), 1.61 (д, J = 6.5 Гц, 3H).
Пример 33: Получение 4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино) пиридо[2,3-d]пиримидин-5(8H)-она
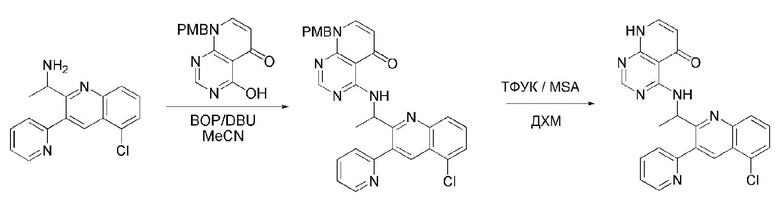
Стадия 1: Получение 4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она
4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил) пиридо[2,3-d]пиримидин-5(8H)-он получали в виде светло-желтого вещества при использовании 1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этан-1-амина, полученного в Препаративном примере 29, согласно методике, аналогичной описанной для стадии 7 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.6 (д, J = 7.4 Гц, 1H), 8.81 (д, J = 4.8 Гц, 1H), 8.51 (с, 1H), 8.32 (с, 1H), 8.81 (д, J = 4.8 Гц, 1H), 8.23 (д, J = 8.0 Гц, 1H), 7.87-7.82 (м, 1H), 7.67-7.60 (м, 3H), 7.44 (д, J = 7.9 Гц, 1H), 7.40-7.35 (м, 1H), 7.19 (д, J = 8.6 Гц, 2H), 6.85 (д, J = 8.6 Гц, 2H), 6.31 (д, J = 7.9 Гц, 1H), 6.16-6.07 (м, 1H), 5.33 (с, 2H), 3.78 (с, 3H), 1.56 (д, J = 6.6 Гц, 2H).
Стадия 2: Получение 4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино) пиридо[2,3-d]пиримидин-5(8H)-она
4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он получали в виде белого твердого вещества при использовании 4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)-8-(4-метоксибензил)пиридо[2,3-d]пиримидин-5(8H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1.
1H ЯМР (300 МГц, CDCl3) δ 11.54 (д, J = 7.1 Гц, 1H), 10.86 (с, 1H), 8.83 (д, J = 4.7 Гц, 1H), 8.54 (с, 1H), 8.26 (с, 1H), 8.24 (с, 1H), 7.87 (т, J = 7.7 Гц, 1H), 7.69-7.61 (м, 3H), 7.44-7.37 (м, 2H), 6.32 (д, J = 6.8 Гц, 1H), 6.20-6.12 (м, 1H), 1.57 (д, J = 6.3 Гц, 3H).
Представленные далее Примеры 34 ~ 65 были получены способом, изображенным на схеме реакции 2.
Схема реакции 2

Пример 34: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
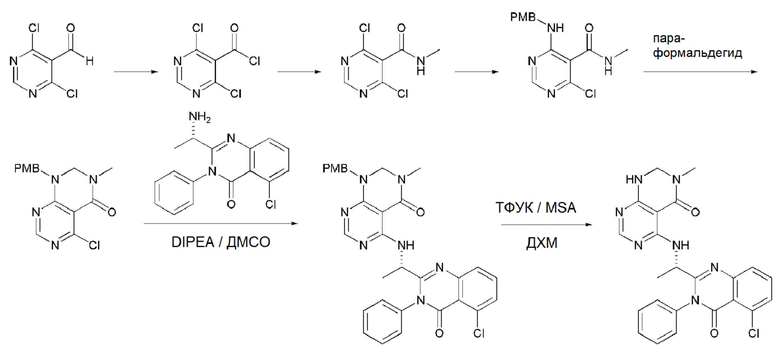
Стадии 1 и 2: Получение 4,6-дихлор-N-метилпиримидин-5-карбоксамида
1.00 г (5.65 ммоль) 4,6-дихлорпиримидин-5-карбоксальдегида растворяли в 15 мл CCl4, затем добавляли 0.78 мл (9.61 ммоль) сульфурилхлорида и 46 мг (0.28 ммоль) 2-2-азобис(2-метил пропионитрила), и перемешивали при 80ºС в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали при пониженном давлении. Добавляли 5 мл безводного толуол, затем фильтровали при пониженном давлении. Полученный продукт растворяли в 15 мл безводного тетрагидрофурана, затем добавляли 4.73 мл 2.0M раствора метиламина в тетрагидрофуране при -20ºС, и перемешивали при -20ºС в течение 2 часов. Реакционную смесь разбавляли 1н. раствором HCl и фильтровали при пониженном давлении. Добавляли этилацетат и воду, затем экстрагировали. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 20/1), получая 0.8 г целевого соединения 4,6-дихлор-N-метилпиримидин-5-карбоксамида в виде светло-желтого вещества (3.88 ммоль, выход: 69%).
1H ЯМР (300 МГц, CDCl3) δ 8.81 (с, 1H), 5.87(ушир.с, 1H), 3.08 (д, J = 2.6 Гц, 3H).
Стадия 3: Получение 4-хлор-6-((4-метоксибензил)амино)-N-метилпиримидин-5-карбоксамида
3.0 г (14.5 ммоль) 4,6-дихлор-N-метилпиримидин-5-карбоксамида, полученного на стадии 1 и стадии 2, растворяли в 80 мл безводного тетрагидрофурана, затем добавляли 1.8 мл (15.2 ммоль, 1.05 экв.) п-метоксибензиламина и 2.8 мл (16.0 ммоль, 1.1 экв.) диизопропилэтиламина (DIPEA), и перемешивали 6 часов. Реакционную смесь перегоняли при пониженном давлении. Добавляли воду, затем экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1), получая 3.73 г целевого соединения 4-хлор-6-((4-метоксибензил)амино)-N-метилпиримидин-5-карбоксамида в виде прозрачного масла (12.1 ммоль, выход: 84%).
1H ЯМР (300 МГц, CDCl3) δ 8.31 (с, 1H), 8.24 (с, 1H), 7.25 (д, J = 8.9 Гц, 2H), 6.86 (д, J = 8.5 Гц, 2H), 6.70 (с, 1H), 4.62 (д, J = 5.4 Гц, 2H), 3.79 (с, 3H), 2.97 (д, J = 4.7 Гц, 2H).
Стадия 4: Получение 5-хлор-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
3.7 г (12 ммоль) 4-хлор-6-((4-метоксибензил)амино)-N-метил-пиримидин-5-карбоксамида, полученного на стадии 3, 3.6 г (120 ммоль, >10 экв.) параформальдегида и 228 мг (1.2 ммоль, 0.1 экв.) п-толуолсульфокислоты растворяли в 100 мл толуола, перемешивали при 130ºС в течение 12 часов с насадкой Дина-Старка. Реакционную смесь охлаждали до комнатной температуры, и растворитель отгоняли при пониженном давлении. Полученный продукт отделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 3/1), получая 3.0 г целевого соединения в виде белого твердого вещества (9.4 ммоль, выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ 8.43 (с, 1H), 7.22 (д, J = 8.9 Гц, 2H), 6.88 (д, J = 8.4 Гц, 2H), 4.86 (с, 2H), 4.55 (с, 2H), 3.81 (с, 3H), 2.98 (с, 3H).
Стадия 5: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
50 мг (0.16 ммоль) 5-хлор-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 4, растворяли в 2 мл безводного диметилсульфоксида (ДМСО), затем добавляли 57 мг (0.19 ммоль, 1.2 экв.) (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она и 0.06 мл (0.35 ммоль, 2.2 экв.) диизопропилэтиламина (DIPEA), и перемешивали при 70ºС в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли воду, затем экстрагировали этилацетатом. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 2/1), получая 88 мг целевого соединения (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она в виде белого твердого вещества (0.15 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 9.49 (д, J = 7.0 Гц, -NH), 8.03 (с, 1H), 7.70-7.68 (м, 1H), 7.61-7.44 (м, 7H), 7.31-7.28 (м, 1H), 7.21 (д, J = 8.6 Гц, 2H), 6.86 (д, J = 8.6 Гц, 2H), 5.06-5.02 (м, 1H), 4.74 (с, 2H), 4.45 (с, 2H), 3.79 (с, 3H), 2.89 (с, 3H), 1.44 (д, J = 6.6 Гц, 3H).
Стадия 6: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
57 мг (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 70 мг (0.13 ммоль) (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидро-хиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она, полученного на стадии 5, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.43 (д, J = 7.9 Гц, -1H), 7.88 (с, 1H), 7.69-7.67 (м, 1H), 7.61-7.43 (м, 6H), 7.32-7.29 (м, 1H), 6.97 (с, -NH), 5.02-4.97 (м, 1H), 4.69 (с, 2H), 2.97 (с, 3H), 1.43 (д, J = 5.9 Гц, 3H).
Пример 35: Получение (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
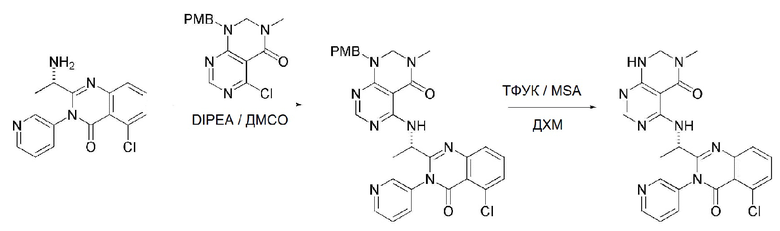
Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
83 мг (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил) амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-он (0.14 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 9.39-9.35 (м, 1H), 8.76-8.71 (м, 1H), 8.03 (д, J = 8.1 Гц, 2H), 7.70-7.46 (м, 3H), 7.20 (д, J = 8.6 Гц, 2H), 6.86 (д, J = 8.6 Гц, 2H), 5.02-4.89 (м, 1H), 4.8-4.65 (м, 2H), 4.46 (с, 2H), 3.79 (с, 3H), 2.90 (с, 3H), 1.50-1.44 (м, 3H).
Стадия 2: Получение (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
56 мг (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил) амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.30-9.25 (м, 1H), 8.74-8.71 (м, 1H), 8.57 (с, 1H), 7.91 (д, J = 8.9 Гц, 2H), 7.91 (д, J = 7.2 Гц, 1H), 7.70-7.59 (м, 2H), 7.53-7.44 (м, 2H), 5.88 (с, 1H), 5.73 (с, 1H), 5.00-4.86 (м, 1H), 4.72 (с, 2H), 2.99 (с, 3H), 1.50-1.43 (м, 3H).
Пример 36: Получение (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
87 мг (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил) амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-он (0.14 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 9.45-9.36 (м, 1H), 7.62-7.50 (м, 4H), 7.42-7.39 (м, 1H), 7.27-7.14 (м, 4H), 7.07-6.99 (м, 1H), 6.84 (д, J = 8.0 Гц, 2H), 4.84-4.69 (м, 3H), 4.73 (с, 2H), 3.89-3.80 (м, 1H), 3.79 (с, 3H), 3.57-3.48 (м, 1H), 2.90 (с, 3H), 2.33-2.24 (м, 1H), 2.13-2.06 (м, 2H), 1.50-1.44 (м, 3H).
Стадия 2: Получение (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
61 мг (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил) амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.40-9.31 (м, 1H), 7.89 (д, J = 4.65 Гц, 1H), 7.69-7.44 (м, 4H), 7.25-7.04 (м, 2H), 6.89-6.80 (м, 1H), 5.04-4.95 (м, 1H), 4.71 (с, 2H), 2.98 (м, 2H), 1.46 (м, J = 5.98, 3H).
Пример 37: Получение (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
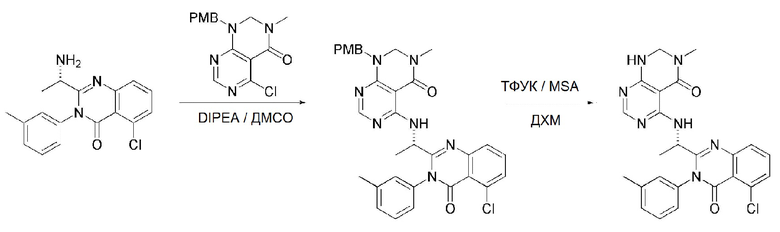
Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
85 мг (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-м-толилхиназолин-4(3H)-он (0.14 ммоль, выход: 89%).
1H ЯМР (300 МГц, CDCl3) δ 9.52-9.43 (м, 1H), 8.03 (с, 1H), 7.70-7.67 (м, 2H), 7.60-54 (м, 1H), 7.44-7.40 (м, 2H), 7.29-7.18 (м, 3H), 7.10 (с, 1H), 6.84 (д, J = 8.8 Гц, 2H), 5.10-04 (м, 1H), 4.73 (с, 2H), 4.44 (с, 2H), 3.78 (с, 3H), 2.89 (с, 3H), 2.35 (с, 3H), 1.47-1.43 (м, 3H).
Стадия 2: Получение (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
57 мг (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.44-9.36 (м, 1H), 7.90 (д, J = 4.9 Гц, 1H), 7.69 (д, J = 6.8 Гц, 1H), 7.61-7.56 (м, 1H), 7.46-7.37 (м, 2H), 7.31-7.28 (м, 1H), 7.23 (с, 1H), 7.07 (с, 1H), 6.11 (м, 1H), 5.08-5.02 (м, 1H), 4.70 (с, 2H), 2.99 (с, 3H), 2.35 (с, 3H), 1.45-1.43 (м, 3H).
Пример 38: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
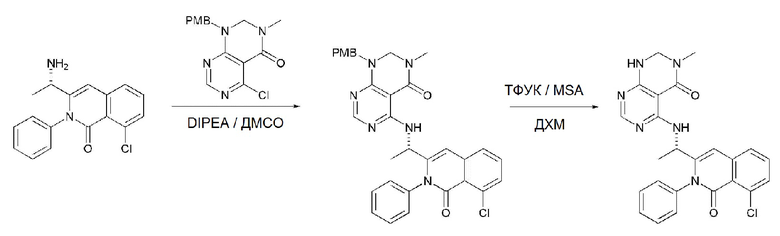
Стадия 1: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
30 мг (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде светло-желтого вещества при использовании 20 мг (0.063 ммоль) 5-хлор-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 4 в Примере 34, и 19 мг (0.063 ммоль) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.052 ммоль, выход: 82%).
1H ЯМР (300 МГц, CDCl3) δ 9.16 (д, J =7.8 Гц, 1H), 8.06 (с, 1H), 7.43-7.54 (м, 8H), 7.32 (д, J =8.6 Гц, 2H), 7.22 (д, J =8.4 Гц, 2H) 6.56 (с, 1H), 4.87 (т, J =7.1 Гц, 1H), 4.75 (с, 2H), 4.47 (с, 2H), 3.80 (с, 3H), 2.91 (с, 3H), 1.38 (д, J =6.8 Гц, 3H).
Стадия 2: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
22 мг (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 30 мг (0.052 ммоль) (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.048 ммоль, выход: 92%).
1H ЯМР (300 МГц, CDCl3) δ 9.07 (д, J =6.4 Гц, 1H), 7.92 (с, 1H), 7.36-7.51 (м, 7H), 7.29-7.32 (м, 1H), 6.55 (с, 1H), 6.11 (ушир.с, 1H), 4.85 (т, J =7.9 Гц, 1H), 4.73 (с, 2H), 2.99 (с, 3H), 1.38 (д, J =7.2 Гц, 3H).
Пример 39: Получение 3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение 1-(4-метоксибензил)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
10 мг 1-(4-метоксибензил)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 8 мг (0.025 ммоль) 5-хлор-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 4 в Примере 34, и 7.5 мг (0.030 ммоль) 1-(2-фенилхинолин-3-ил)этан-1-амина, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.019 ммоль, выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ 9.39 (д, J =7.2 Гц, 1H), 8.25 (с, 1H), 8.15 (д, J =9.3 Гц, 1H), 8.01 (с, 1H), 7.83 (д, J =8.6 Гц, 1H), 7.76 (д, J =7.2 Гц, 2H), 7.68-7.70 (м, 1H), 7.47-7.54 (м, 5H), 7.22 (д, J =8.6 Гц, 1H), 6.85 (д, J =8.6 Гц, 2H) 6.64 (т, J =7.2 Гц, 1H), 4.75 (д, J =6.5 Гц, 2H), 4.47 (с, 2H), 3.79 (с, 3H), 2.93 (с, 3H), 1.47 (м, 3H).
Стадия 2: Получение 3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
6 мг 3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 10 мг (0.019 ммоль) 1-(4-метоксибензил)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил) амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.015 ммоль, выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ 9.52 (д, J =6.1 Гц, 1H), 8.21 (с, 1H), 8.14 (д, J =8.8 Гц, 1H), 7.92 (ушир.с, 1H), 7.83 (д, J =7.5 Гц, 1H), 7.69 (д, J =8.1 Гц, 3H), 7.48-7.59 (м, 5H), 5.65 (т, J =6.8 Гц, 1H), 4.78 (ушир.с, 2H) 2.99 (с, 3H), 1.44 (д, J =6.8 Гц, 3H).
Пример 39-1: Получение (S)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
84 мг (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-1-(2-фенилхинолин-3-ил)этанамин (0.15 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.39 (д, J = 7.8 Гц, 1H), 8.23 (с, 1H), 8.44 (д, J = 8.1 Гц, 1H), 8.08 (с, 1H), 7.82 (д, J = 7.8 Гц, 1H), 7.75 (д, J = 7.8 Гц, 2H), 7.69-7.64 (м, 1H), 7.53-7.43 (м, 4H), 7.21 (д, J = 8.4 Гц, 1H), 6.85 (д, J = 9.0 Гц, 2H), 5.67-5.62 (м, 1H), 4.74 (д, J = 8.4 Гц, 2H), 4.47 (с, 2H), 3.79 (с, 3H), 2.92 (с, 3H), 1.40 (д, J = 6.5 Гц, 3H).
Стадия 2: Получение (S)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
52 мг (S)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.31 (д, J = 6.9 Гц, -1H), 8.22 (с, 1H), 8.13 (д, J = 7.7 Гц, -1H), 7.93 (с, 1H), 7.82 (д, J = 7.7 Гц, -1H), 7.75-7.64 (м, 3H), 7.53-7.43 (м, 4H), 6.71 (с, -NH), 5.66-5.56 (м, 1H), 4.69 (с, 2H), 2.98 (с, 3H), 1.41 (д, J = 7.4 Гц, 3H).
Пример 40: Получение (S)-5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(4,8-дихлор-1-оксо-2-фенилхинолин-3-ил)этил) амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
(S)-5-((1-(4,8-дихлор-1-оксо-2-фенилхинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он получали согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-3-(1-аминоэтил)-4,8-дигидро-2-фенилизохинолин-1(2H)-он.
1H ЯМР (300 МГц, CDCl3) δ 9.54 (ушир.д, J = 6.6 Гц, 1H), 8.09 (с, 1H), 7.97 (дд, J = 7.7, 1.5 Гц, 1H), 7.75 (ушир.д, J = 7.7 Гц, 1H), 7.46-7.61 (м, 6H), 7.15-7.21 (м, 3H), 6.80-6.87 (м, 2H), 4.97-5.05 (м, 1H), 4.72 (с, 2H), 4.39-4.47 (м, 2H), 3.78 (с, 3H), 2.88 (с, 3H), 1.60 (д, J = 7.2 Гц, 3H).
Стадия 2: Получение (S)-5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
(S)-5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он получали согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-((1-(4,8-дихлор-1-оксо-2-фенилхинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он.
1H ЯМР (500 МГц, CDCl3) δ 9.48 (ушир.с, 1H), 7.98 (дд, J = 8.1, 0.9 Гц, 1H), 7.96 (с, 1H), 7.74 (д, J = 7.8 Гц, 1H), 7.49-7.61 (м, 5H), 7.18-7.21 (м, 1H), 6.70 (ушир.с, 1H), 4.96-4.50 (м, 1H), 4.67-4.72 (м, 2H), 2.98 (с, 3H), 1.62 (д, J = 7.2 Гц, 3H).
Пример 41: Получение (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
91 мг (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминопропил)-5-фтор-3-фенилхиназолин-4(3H)-он (0.15 ммоль, выход: 98%).
1H ЯМР (300 МГц, CDCl3) δ 9.43 (д, J = 9.4 Гц, 1H), 8.02 (с, 1H), 7.66-7.45 (м, 6H), 7.31-7.28 (м, 1H), 7.21 (д, J = 7.4 Гц, 2H), 7.11-7.05 (м, 1H), 5.01-4.96 (м, 1H), 4.74 (с, 2H), 4.45 (с, 2H), 3.79 (с, 3H), 2.91 (с, 3H), 1.93-1.75 (м, 2H), 0.86-0.82 (м, 3H).
Стадия 2: Получение (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
55 мг (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.35 (д, J = 8.2 Гц, 1H), 7.88 (с, 1H), 7.69-7.62 (м, 1H), 7.57-7.50 (м, 4H), 7.44-7.41 (м, 1H), 7.30-7.28 (м, 1H), 7.11-7.05 (м, 1H), 6.28 (с, 1H), 4.83-4.91 (м, 1H), 4.70 (с, 2H), 2.98 (с, 3H), 1.92-1.75 (м, 2H), 0.87-0.82 (м, 3H).
Пример 42: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
102 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.16 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.03 (с, 1H), 7.75-7.73 (м, 1H), 7.60-7.50 (м, 5H), 7.41-7.38 (м, 1H), 7.16 (д, J = 7.6 Гц, 2H), 6.84 (д, J = 8.6 Гц, 2H), 4.90-4.64 (м, 1H), 3.79 (с, 3H), 3.72-3.65 (м, 1H), 2.89 (с, 3H), 2.38-2.28 (м, 1H), 1.86-1.76 (м, 4H).
Стадия 2: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
58 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 7.91 (с, 1H), 7.71-7.69 (м, 1H), 7.58-7.48 (м, 5H), 7.40 (д, J = 7.5 Гц, 2H), 7.25-7.23 (м, 1H), 4.72-4.68 (м, 1H), 4.56 (с, 2H), 3.90-3.81 (м, 1H), 3.62-3.53 (м, 1H), 3.32-3.25 (м, 2H), 3.05 (с, 3H), 2.31-2.24 (м, 1H), 2.10-2.09 (м, 2H), 1.84-1.75 (м, 1H).
Пример 43: Получение (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
106 мг (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.17 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.04 (с, 1H), 8.76 (д, J = 3.5 Гц, 1H), 8.54 (с, 1H), 8.12-8.00 (м, 3H), 7.61-7.40 (м, 7H), 7.17-7.14 (м, 2H), 6.84 (д, J = 8.5 Гц, 2H), 4.90-4.64 (м, 1H), 3.87-3.83 (м, 1H), 3.78 (с, 5H), 3.60-3.53 (м, 1H), 2.89 (с, 3H), 2.37-2.30 (м, 2H), 1.87-1.79 (м, 2H).
Стадия 2: Получение (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
59 мг (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.04 (с, 1H), 8.77-8.74 (м, 2H), 8.53 (с, 1H), 8.12-8.06 (м, 2H), 8.00 (с, 1H), 7.63-7.50 (м, 7H), 7.46-7.40 (м, 2H), 7.19-7.12 (м, 2H), 6.84 (д, J = 8.5 Гц, 2H), 4.87-4.67 (м, 2H), 4.36 (с, 2H), 3.60-3.53 (м, 1H), 2.89 (с, 3H), 2.39-2.27 (м, 2H), 1.87-1.79 (м, 2H).
Пример 44: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
102 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.16 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.06-8.03 (м, 1H), 7.61-7.40 (м, 4H), 7.42-7.39 (м, 1H), 7.27-7.14 (м, 3H), 7.07-6.98 (м, 1H), 6.84 (д, J = 8.4 Гц, 2H), 4.85-4.69 (м, 2H), 4.37 (с, 2H), 3.87-3.83 (м, 1H), 3.78 (с, 3H), 3.56-3.48 (м, 1H), 2.90 (с, 3H), 2.32-2.24 (м, 1H), 2.12-2.07 (м, 1H), 1.87-1.76 (м, 2H).
Стадия 2: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
60 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 7.95-7.91 (м, 1H), 7.57-7.38 (м, 5H), 7.24-7.19 (м, 1H), 7.07-6.98 (м, 1H), 6.13-6.10 (м, 1H), 6.02-6.00 (м, 1H), 4.79-4.37 (м, 1H), 4.66-4.53 (м, 2H), 3.79-3.70 (м, 1H), 3.07 (с, 3H), 2.38-2.32 (м, 1H), 2.13-2.01 (м, 2H), 1.95-1.82 (м, 2H).
Пример 45: Получение (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
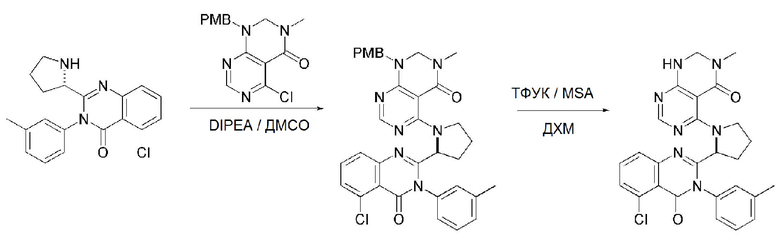
Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
95 мг (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-2-(пирролидин-2-ил)-3-м-толилхиназолин-4(3H)-он (0.15 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 8.04 (д, J = 6.3 Гц, 1H), 7.56-7.44 (м, 4H), 7.41-7.38 (м, 2H), 7.30 (д, J = 7.6 Гц, 1H), 7.16 (д, J = 8.5 Гц, 2H), 7.04-7.02 (м, 1H), 6.84 (д, J = 8.5 Гц, 2H), 4.81-4.71 (м, 3H), 4.37 (с, 2H), 3.86-3.81 (м, 1H), 3.78 (с, 3H), 3.56-3.51 (м, 1H), 2.89 (с, 3H), 2.76-2.72 (м, 1H), 2.42 (с, 3H), 2.33-2.26 (м, 1H), 2.13-2.07 (м, 2H), 1.84-1.76 (м, 1H).
Стадия 2: Получение (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
60 мг (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 7.88 (с, 1H), 7.49-7.44 (м, 4H), 7.41-7.37 (м, 2H), 7.30-7.27 (м, 1H), 7.03-7.01 (м, 1H), 4.78-4.75 (м, 1H), 4.61-4.53 (м, 2H), 3.73 (с, 2H), 3.05 (с, 3H), 2.41 (с, 3H), 2.35-2.31 (м, 1H), 1.88-1.81 (м, 2H).
Пример 46: Получение (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
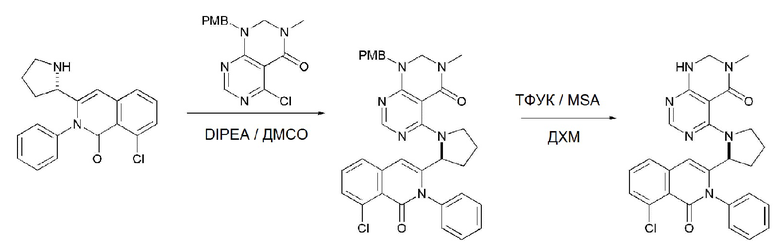
Стадия 1: Получение (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
97 мг (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-8-хлор-2-фенил-3-(пирролидин-2-ил)изохинолин-1(2H)-он (0.16 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.16 (с, 1H), 7.70-7.47 (м, 6H), 7.38 (с, 2H), 7.33-7.30 (м, 2H), 7.19 (д, J = 8.6 Гц, 2H), 6.86 (д, J = 8.6 Гц, 2H), 6.72 (с, 2H), 5.03-4.91 (м, 2H), 4.72-4.53 (м, 2H), 4.25-4.12 (м, 2H), 3.79 (с, 3H), 3.12-3.04 (м, 1H), 2.96 (с, 3H), 2.05-1.95 (м, 2H), 1.87-1.79 (м, 1H).
Стадия 2: Получение (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
58 мг (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 6 в Примере 34, за исключением того, что в синтезе использовали (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 8.05 (с, 1H), 7.65-7.46 (м, 4H), 7.37-7.29 (м, 4H), 6.65 (с, 1H), 6.03 (с, 1H), 5.01-4.98 (м, 1H), 4.77-4.73 (м, 1H), 4.48-4.44 (м, 1H), 4.20-4.10 (м, 1H), 3.10 (с, 3H), 2.05-1.96 (м, 2H), 83-1.60 (м, 2H).
Пример 47: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
35 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 20 мг (0.064 ммоль) 5-хлор-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии в Примере 34, и 20 мг (0.064 ммоль) (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.059 ммоль, выход: 93%).
1H ЯМР (500 МГц, CDCl3) δ 8.14 (с, 1H), 7.74 (д, J = 7.7 Гц, 1H), 7.49-7.61 (м, 3H), 7.17-7.28 (м, 4H), 6.87 (д, J = 8.5 Гц, 2H), 6.44 (д, J = 2.8 Гц, 1H), 4.73-4.91 (м, 3H), 4.35-4.44 (м, 2H), 3.82 (с, 3H), 3.72 (ушир.с, 1H), 3.58 (ушир.с, 1H), 2.90 (с, 3H), 2.26 (ушир.с, 1H), 2.09 (с, 1H), 2.02-2.08 (м, 1H), 1.79-1.87 (м, 1H).
Стадия 2: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
11 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 35 мг (0.059 ммоль) (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она согласно методике, аналогичной описанной для стадии 6 в Примере 34 (0.023 ммоль, выход: 39%).
1H ЯМР (500 МГц, CDCl3) δ 8.03 (с, 1H), 7.70 (д, J = 7.2 Гц, 1H), 7.48-7.60 (м, 3H), 7.25-7.27 (м, 1H), 7.20 (д, J = 2.6 Гц, 1H), 6.43 (д, J = 3.0 Гц, 1H), 6.16 (ушир.с, 1H), 4.76-4.81 (м, 1H), 4.58-4.67 (м, 2H), 3.64-3.76 (м, 2H), 3.09 (с, 3H), 2.27 (ушир.с, 1H), 2.01-2.11 (м, 2H), 1.83-1.90 (м, 2H).
Пример 48: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
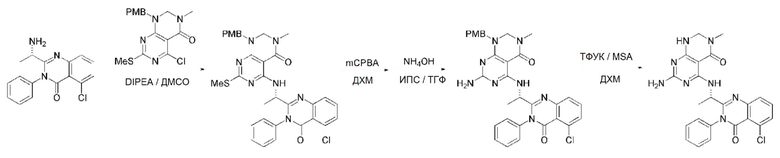
Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
65 мг (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 40 мг (0.11 ммоль, 1.0 экв.) 5-хлор-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d] пиримидин-4(1H)-она и 40 мг (0.13 ммоль, 1.2 экв.) (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.10 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 9.44-9.47 (д, J = 4.5 Гц, 1H), 7.69-7.72 (д, J = 8.0 Гц, 1H), 7.55-7.61 (м, 5H), 7.46 (с, 1H), 7.27-7.31 (м, 1H), 7.19-7.22 (д, J = 4.5 Гц, 2H), 6.84-6.87 (д, J = 8.6 Гц, 2H), 5.07-5.12 (м, 1H), 4.74 (с, 2H), 4.41 (с, 2H), 3.79 (с, 3H), 2.89 (с, 3H), 2.29 (с, 3H), 1.39-1.42 (д, J = 6.7 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
52 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил) амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 65 мг (0.10 ммоль) (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 4 в Примере 15 (0.09 ммоль, выход: 73%).
1H ЯМР (300 МГц, CDCl3) δ 9.46-9.48 (д, J = 7.4 Гц, 1H), 7.70-7.72 (д, J = 8.2 Гц, 1H), 7.42-7.61 (м, 5H), 7.29-7.31 (д, J = 7.8 Гц, 1H), 7.18-7.21 (д, J = 8.1 Гц, 2H), 6.83-6.86 (д, J = 7.8 Гц, 2H), 5.05-5.10 (м, 1H), 4.66 (с, 2H), 4.61 (с, 2H), 4.33 (с, 3H), 3.79 (с, 3H), 2.86 (с, 3H), 1.40-1.42 (д, J = 6.3 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
25 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил) амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 52 мг (0.09 ммоль) (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.05 ммоль, выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ 9.41-9.43 (д, J = 7.9 Гц, 1H), 7.70-7.73 (д, J = 7.9 Гц, 1H), 7.44-7.62 (м, 5H), 7.29-7.36 (м, 2H), 5.01-5.06 (м, 1H), 4.74 (с, 2H), 4.60 (с, 2H), 2.94 (с, 3H), 1.40-1.42 (д, J = 6.6 Гц, 3H).
Пример 49: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
77 мг (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-он (0.12 ммоль, выход: 90%).
1H ЯМР (300 МГц, CDCl3) δ 9.32-9.34 (м, 1H), 8.72-8.74 (м, 1H), 7.98-8.01 (д, J = 4.5 Гц, 1H), 7.59-7.68 (м, 3H), 7.46-7.52 (м, 2H), 7.19-7.22 (д, J = 7.4 Гц, 2H), 6.84-6.87 (д, J = 7.9 Гц, 2H), 4.92-4.98 (м, 1H), 4.74 (с, 2H), 4.42 (с, 2H), 3.79 (с, 3H), 2.88 (с, 3H), 2.35 (с, 3H), 1.45-1.48 (д, J = 6.4 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
47 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.08 ммоль, выход: 64%).
1H ЯМР (300 МГц, CDCl3) δ 9.40-9.43 (д, J = 8.8 Гц, 1H), 8.75-8.77 (м, 1H), 7.58-7.72 (м, 3H), 6.45-7.55 (м, 2H), 7.18-7.21 (д, J = 2.6 Гц, 2H), 6.83-6.87 (т, J = 6.8 Гц, 3H), 4.93-5.15 (м, 2H), 4.61-4.73 (м, 2H), 4.33 (с, 2H), 3.79 (с, 3H), 2.86 (с, 3H), 1.41-1.49 (дд, J = 17.4, 6.5 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
19 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.04 ммоль, выход: 51%).
1H ЯМР (300 МГц, ДМСО-d6) δ 9.19-9.27 (м, 1H), 8.70-8.77 (м, 1H), 8.05-8.10 (м, 1H), 7.75-7.80 (м, 1H), 7.57-7.67 (м, 3H), 7.20-7.21 (д, J = 5.0 Гц, 1H), 6.14 (с, 2H), 4.61-4.65 (м, 1H), 4.44 (с, 2H), 2.78 (с, 3H), 1.28-1.31 (д, J = 6.4 Гц, 3H).
Пример 50: Получение (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
75 мг (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил) амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d] пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-он (0.12 ммоль, выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 9.43-9.30 (м, 1H), 7.68-7.70 (д, J = 7.2 Гц, 1H), 7.44-7.62 (м, 4H), 7.30-7.38 (м, 1H), 7.19-7.21 (д, J = 8.0 Гц, 2H), 7.03-7.10 (м, 1H), 6.84-6.87 (д, J = 7.8 Гц, 2H), 5.06-5.13 (м, 1H), 4.74 (с, 2H), 4.41 (с, 3H), 3.79 (с, 3H), 2.88 (с, 3H), 2.32 (с, 3H), 1.43-1.45 (д, J = 6.1 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
56 мг (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.09 ммоль, выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ 9.39-9.46 (м, 1H), 7.70-7.72 (д, J = 7.3 Гц, 1H), 7.58-7.62 (м, 2H), 7.44-7.47 (м, 2H), 7.07-7.21 (м, 4H), 6.84-6.86 (д, J = 8.5 Гц, 2H), 5.07-5.14 (м, 1H), 4.63-4.76 (м, 4H), 4.34 (с, 2H), 3.79 (с, 3H), 2.86 (с, 3H), 1.42-1.44 (д, J = 3.0 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
26 мг (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.05 ммоль, выход: 58%).
1H ЯМР (300 МГц, CDCl3) δ 9.30-9.37 (т, J = 9.1 Гц, 1H), 7.69-7.72 (м, 1H), 7.40-7.62 (м, 3H), 7.04-7.23 (м, 3H), 5.50 (с, 1H), 5.00-5.11 (м, 1H), 4.62-4.75 (д, J = 22.7 Гц, 2H), 4.60 (с, 2H), 2.94 (с, 3H), 1.40-1.45 (т, J = 7.0 Гц, 3H).
Пример 51: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d] пиримидин-4(1H)-она
80 мг (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-м-толилхиназолин-4(3H)-он (0.12 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 9.38-9.46 (м, 1H), 7.69-7.71 (м, 1H), 7.55-7.60 (т, J = 7.5 Гц, 1H), 7.42-7.46 (м, 2H), 7.27-7.31 (м, 2H), 7.19-7.22 (д, J = 7.9 Гц, 2H), 7.06-7.09 (м, 1H), 6.84-6.86 (д, J = 7.8 Гц, 2H), 5.10-5.16 (м, 1H), 4.74 (с, 2H), 4.40 (с, 2H), 3.79 (с, 3H), 2.89 (с, 3H), 2.39-2.43 (д, J = 11.3 Гц, 3H), 2.29 (с, 3H), 1.65 (с, 4H), 1.41-1.44 (д, J = 7.9 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
49 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил) этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.12 ммоль, выход: 64%).
1H ЯМР (300 МГц, CDCl3) δ 9.42-9.48 (м, 1H), 7.69-7.72 (м, 1H), 7.58-7.60 (м, 1H), 7.42-7.46 (м, 2H), 7.27-7.32 (м, 2H), 7.18-7.20 (м, 2H), 7.09-7.11 (м, 1H), 6.84-6.87 (м, 2H), 5.08-5.12 (м, 1H), 4.62-4.67 (м, 3H), 4.34 (с, 3H), 3.79 (с, 3H), 2.86 (с, 3H), 2.34-2.44 (д, J = 30.0 Гц, 3H), 1.42-1.44 (с, J = 3.0 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
22 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.04 ммоль, выход: 56%).
1H ЯМР (300 МГц, CDCl3) δ 9.34-9.44 (дд, J = 20.1, 8.4 Гц, 1H), 7.70-7.72 (д, J = 7.2 Гц, 1H), 7.56-7.62 (т, J = 7.9 Гц, 1H), 7.37-7.43 (м, 2H), 7.29-7.31 (м, 1H), 7.08-7.16 (м, 2H), 5.77 (с, 3H), 5.04-5.16 (м, 1H), 4.72-4.75 (д, J = 10.0 Гц, 1H), 4.60 (с, 2H), 2.94 (с, 3H), 2.35-2.44 (д, J = 28.7 Гц, 3H), 1.40-1.43 (дд, J = 6.3, 3.3 Гц, 3H).
Пример 52 Получение (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d] пиримидин-4(1H)-она
66 мг (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-он (0.10 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 9.17-9.19 (д, J = 4.6 Гц, 1H), 7.59-7.62 (м, 1H), 7.40-7.50 (м, 6H), 7.30-7.32 (м, 1H), 7.21-7.23 (д, J = 5.7 Гц, 2H), 6.85-6.87 (д, J = 5.1 Гц, 2H), 6.56 (с, 1H), 4.85-4.91 (м, 1H), 4.70-4.81 (м, 2H), 4.44 (с, 2H), 3.80 (с, 3H), 2.89 (с, 3H), 2.37 (с, 3H), 1.35-1.36 (д, J = 3.8 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
51 мг (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил) амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.09 ммоль, выход: 83%).
1H ЯМР (300 МГц, CDCl3) δ 9.22-9.24 (д, J = 7.8 Гц, 1H), 7.31-7.53 (м, 8H), 7.19-7.22 (д, J = 7.8 Гц, 2H), 6.84-6.87 (д, J = 8.3 Гц, 2H), 6.58 (с, 1H), 4.79-4.83 (м, 1H), 4.67 (с, 2H), 4.36 (с, 2H), 3.79 (с, 3H), 2.87 (с, 3H), 1.32-1.34 (д, J = 6.5 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
26 мг (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил) амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.05 ммоль, выход: 64%).
1H ЯМР (300 МГц, ДМСО-d6) δ 9.07-9.10 (д, J = 6.7 Гц, 1H), 7.39-7.61 (м, 8H), 7.22 (с, 1H), 6.58 (с, 1H), 6.18 (с, 2H), 4.47-4.53 (м, 3H), 2.80 (с, 3H), 1.20-1.22 (д, J = 3.0 Гц, 3H).
Пример 53: Получение (S)-7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
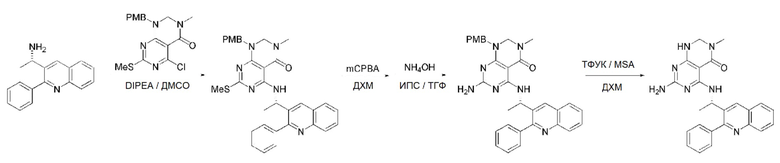
Стадия 1: Получение (S)-1-(4-метоксибензил)-3-метил-7-(метилтио)-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
60 мг (S)-1-(4-метоксибензил)-3-метил-7-(метилтио)-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-1-(2-фенилхинолин-3-ил)этанамин (0.10 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 9.44-9.46 (д, J = 6.7 Гц, 1H), 8.24 (с, 1H), 8.81-8.84 (д, J = 8.1 Гц, 1H), 7.75-8.77 (д, J = 7.9 Гц, 2H), 7.64-8.69 (т, J = 6.8 Гц, 1H), 7.44-7.53 (м, 4H), 7.20-7.22 (д, J = 8.0 Гц, 2H), 6.83-6.86 (д, J = 8.6 Гц, 2H), 5.67-5.71 (м, 1H), 4.67-4.80 (кв, J = 15.3, 10.8 Гц, 2H), 4.42 (с, 2H), 3.79 (с, 3H), 2.91 (с, 3H), 2.29 (с, 3H), 1.38-1.40 (д, J = 6.7 Гц, 3H).
Стадия 2: Получение (S)-7-амино-1-(4-метоксибензил)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
47 мг (S)-7-амино-1-(4-метоксибензил)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил) амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-1-(4-метоксибензил)-3-метил-7-(метилтио)-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.09 ммоль, выход: 83%).
1H ЯМР (300 МГц, CDCl3) δ 9.44-9.46 (д, J = 8.4 Гц, 1H), 8.27 (с, 1H),8.11-8.14 (д, J = 7.9 Гц, 1H), 7.82-7.84 (д, J = 7.8 Гц, 1H), 7.75-7.78 (д, J = 7.2 Гц, 2H), 7.63-7.68 (т, J = 5.7 Гц, 1H), 7.47-7.54 (м, 4H), 7.18-7.20 (д, J = 7.4 Гц, 2H), 6.82-6.85 (д, J = 8.1 Гц, 2H), 5.56-5.62 (м, 1H), 4.57-4.72 (м, 4H), 4.34 (с, 2H), 3.78 (с, 3H), 2.88 (с, 3H), 1.42-1.44 (д, J = 6.2 Гц, 3H).
Стадия 3: Получение (S)-7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил) амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
18 мг (S)-7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-1-(4-метоксибензил)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.04 ммоль, выход: 49%).
1H ЯМР (300 МГц, ДМСО-d6) δ 9.27-9.29 (д, J = 6.3 Гц, 1H), 8.30 (с, 1H), 7.97-7.80 (д, J = 7.8 Гц, 2H), 7.69-7.75 (м, 2H), 7.50-7.60 (м, 4H), 7.20 (с, 1H), 6.06 (с, 2H), 5.40-5.44 (м, 1H), 4.47 (с, 2H), 2.80 (с, 3H), 1.25-1.27 (д, J = 6.7 Гц, 1H).
Пример 54: Получение (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
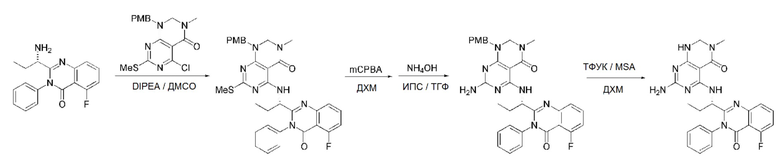
Стадия 1: Получение (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
64 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-2-(1-аминопропил)-5-фтор-3-фенилхиназолин-4(3H)-он (0.10 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 9.43-9.46 (д, J = 8.5 Гц, 1H), 7.47-7.69 (м, 6H), 7.27-7.31 (м, 1H), 7.19-7.22 (д, J = 8.3 Гц, 2H), 7.05-7.11 (м, 1H), 6.84-6.87 (д, J = 8.2 Гц, 2H), 5.01-5.08 (м, 1H), 4.73 (с, 2H), 4.41 (с, 2H), 3.79 (с, 3H), 2.89 (с, 3H), 2.26 (с, 3H), 1.73-1.81 (м, 2H), 0.80-0.85 (т, J = 7.2 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
43 мг (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил) пропил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.07 ммоль, выход: 71%).
1H ЯМР (300 МГц, CDCl3) δ 9.39-9.41 (д, J = 8.5 Гц, 1H), 7.52-7.64 (м, 5H), 7.37-7.39 (м, 1H), 7.28-7.31 (м, 1H), 7.19-7.21 (д, J = 7.5 Гц, 2H), 7.05-7.11 (т, J = 8.5 Гц, 1H), 6.84-6.86 (д, J = 7.0 Гц, 2), 4.99-5.01 (м, 1H), 4.66 (с, 2H), 4.57 (с, 2H), 4.33 (с, 2H), 3.79 (с, 3H), 2.86 (с, 3H), 1.77-1.79 (м, 2H), 0.82-0.87 (т, J = 7.5 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
16 мг (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил) пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.03 ммоль, выход: 47%).
1H ЯМР (300 МГц, ДМСО-d6) δ 9.22-9.25 (д, J = 5.4 Гц, 1H), 7.79-7.81 (м, 1H), 7.45-7.61 (м, 5H), 7.24-7.30 (т, J = 4.5 Гц, 1H), 7.18 (с, 1H), 6.06 (с, 2H), 4.54-4.61 (м, 1H), 4.45 (с, 2H), 2.79 (с, 3H), 1.49-1.53 (м, 2H), 0.65-0.70 (т, J = 7.9 Гц, 3H).
Пример 55: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
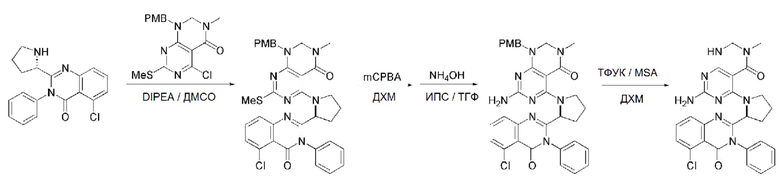
Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
82 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.13 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 8.04-8.07 (д, J = 4.5 Гц, 1H), 7.62-7.65 (м, 2H), 7.49-7.54 (м, 3H), 7.39-7.41 (м, 1H), 7.15-7.22 (м, 3H), 6.83-6.86 (д, J = 8.5 Гц, 2H), 4.77-4.80 (д, J = 7.7 Гц, 2H), 4.66-4.72 (м, 1H), 4.30-4.40 (кв, J = 6.0, 9.2 Гц, 2H), 3.91-3.97 (м, 1H), 3.79 (с, 3H), 3.42-3.47 (м, 1H), 2.90 (с, 3H), 2.38 (с, H), 2.15-2.23 (м, 2H), 1.63-1.75 (м, 2H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
55 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.09 ммоль, выход: 71%).
1H ЯМР (300 МГц, CDCl3) δ 7.48-7.64 (м, 6H), 7.37-7.39 (д, J = 7.6 Гц, 1H), 7.20-7.23 (д, J = 6.9 Гц, 1H), 7.11.7.14 (д, J = 7.7 Гц, 2H), 6.81-6.84 (д, J = 7.9 Гц, 2H), 4.66-4.70 (м, 2H), 4.23-4.29 (м, 2H), 3.84-3.90 (м, 1H), 3.78 (с, 3H), 3.50-3.53 (м, 1H), 2.85 (с, 3H), 2.06-2.13 (м, 1H), 1.98-2.01 (м, 2H), 1.68-1.71 (м, 1H).
Стадия 3: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
33 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.07 ммоль, выход: 74%).
1H ЯМР (300 МГц, ДМСО-d6) δ 7.87 (с, 1H), 7.65-7.70 (м, 1H), 7.40-7.54 (м, 7H), 5.94 (с, 2H), 4.79 (с, 1H), 4.35 (с, 2H), 3.57 (с, 1H), 2.86 (с, 3H), 1.98-2.04 (м, 2H), 1.78-1.83 (м, 1H), 1.63-1.69 (м, 1H).
Пример 56: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
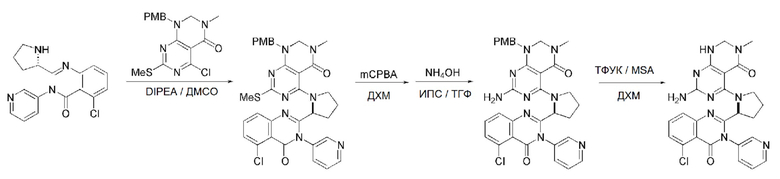
Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
79 мг (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.12 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 8.74-8.76 (д, J = 5.9 Гц, 1H), 8.47-8.50 (м, 1H), 7.58-7.66 (м, 3H), 7.42-7.44 (д, J = 7.6 Гц, 2H), 7.15-7.18 (д, J = 8.4 Гц, 2H), 6.83-6.86 (д, J = 8.0 Гц, 2H), 4.78-4.79 (д, J = 4.4 Гц, 2H), 4.31-4.37 (м, 2H), 3.85-4.04 (м, 1H), 3.79 (с, 3H), 3.55-3.35 (м, 1H), 2.90 (с, 3H), 2.39 (с, 3H), 2.08-2.13 (м, 2H), 1.60-1.83 (м, 2H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
49 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.08 ммоль, выход: 65%).
1H ЯМР (300 МГц, CDCl3) δ 8.75 (с, 7H), 7.61-7.65 (м, 2H), 7.52-7.57 (м, 3H), 7.40-7.43 (д, J = 6.8 Гц, 1H), 7.13-7.17 (м, 2H), 6.81-6.84 (д, J = 8.4 Гц, 2H), 4.81 (с, 2H), 4.61-4.76 (м, 2H), 4.19-4.33 (м, 2H), 3.94-4.05 (м, 1H), 3.78 (с, 3H), 3.47-3.57 (м, 1H), 2.86 (с, 3H), 2.15-2.24 (м, 1H), 1.96-2.09 (м, 2H), 1.72-1.79 (м, 1H).
Стадия 3: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
29 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.06 ммоль, выход: 73%).
1H ЯМР (300 МГц, ДМСО-d6O) δ 8.72 (с, 2H), 8.00-8.03 (д, J = 9.0 Гц, 1H), 7.61-7.73 (м, 2H), 7.43-7.52 (м, 2H), 6.04 (с, 1H), 5.31-5.43 (м, 1H), 4.56-4.65 (м, 1H), 4.36 (с, 2H), 3.97-4.05 (м, 1H), 2.86 (с, 3H), 1.95-2.04 (м, 2H), 1.63-1.82 (м, 2H).
Пример 57: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
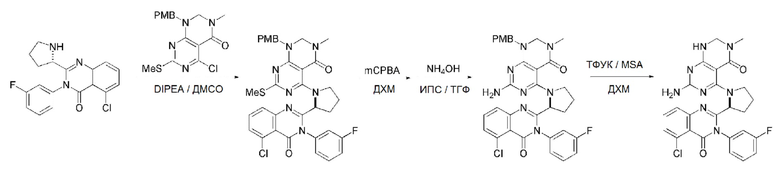
Стадия 1: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он
84 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d] пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.13 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 7.89-7.91 (д, J = 6.1 Гц, 1H), 7.50-7.66 (м, J = 38.5, 9.8 Гц, 3H), 7.40-7.43 (м, 1H), 7.11-7.24 (м, 3H), 6.91-7.06 (м, 1H), 6.83-6.86 (д, J = 7.4 Гц, 2H), 4.73-4.78 (д, J = 4.9 Гц, 1H), 4.62-4.72 (м, 1H), 4.30-3.41 (м, 2H), 3.86-4.03 (м, 1H), 3.79 (с, 3H), 3.35-3.42 (м, 1H), 2.90 (с, 3H), 2.38 (с, 3H), 2.05-2.22 (м, 3H), 1.72-1.82 (м, 1H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
54 мг (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.08 ммоль, выход: 67%).
1H ЯМР (300 МГц, CDCl3) δ 7.64-7.66 (м, 1H), 7.38-7.58 (м, 4H), 6.98-7.15 (м, 4H), 6.81-6.84 (д, J = 8.0 Гц, 2H), 4.62-4.74 (м, 3H), 4.25-4.30 (м, 2H), 3.84-3.96 (м, 1H), 3.78 (с, 3H), 3.48-3.56 (м, 1H), 2.86 (с, 3H), 2.14-2.18 (м, 1H), 2.02-2.05 (м, 2H), 1.72-1.79 (м, 1H).
Стадия 3: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
30 мг (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.06 ммоль, выход: 68%).
1H ЯМР (300 МГц, ДМСО-d6) δ 7.85 (с, 1H), 7.63-7.71 (м, 2H), 7.36-7.51 (м, 5H), 5.97-6.05 (сс, 2H), 4.49-4.61 (м, 1H), 4.35 (с, 2H), 3.52-3.59 (м, 1H), 2.86 (с, 3H), 1.98-2.06 (м, 2H), 1.81-1.85 (м, 1H), 1.66-1.70 (м, 1H).
Пример 58: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
76 мг (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-5-хлор-2-(пирролидин-2-ил)-3-м-толилхиназолин-4(3H)-он (0.11 ммоль, выход: 96%).
1H ЯМР (300 МГц, CDCl3) δ 7.83-7.88 (м, 1H), 7.60-7.63 (м, 1H), 7.38-7.58 (м, 3H), 7.29-7.31 (м, 1H), 7.16-7.19 (д, J = 7.4 Гц, 2H), 6.99-7.02 (м, 1H), 6.84-6.86 (д, J = 5.7 Гц, 2H), 4.73-4.81 (м, 3H), 4.35 (с, 2H),3.85-3.98 (м, 1H), 3.79 (с, 3H), 3.47-3.58 (м, 1H), 2.89 (с, 3H), 2.41-2.47 (д, J = 9.0 Гц, 3H), 2.30-2.41 (м, 3H), 2.15 (с, 3H), 1.70-1.77 (м, 1H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
57 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.09 ммоль, выход: 79%).
1H ЯМР (300 МГц, CDCl3) δ 7.62-7.65 (м, 1H), 7.41-7.55 (м, 4H), 7.29-7.32 (м, 1H), 7.13-7.16 (д, J = 6.0 Гц, 2H), 7.03 (с, 1H), 6.82-6.85 (д, J = 8.9 Гц, 2H), 4.68-4.76 (м, 3H), 4.59 (с, 2H), 4.27 (с, 2H), 3.85-3.91 (м, 1H), 3.78 (с, 3H), 3.52-3.59 (м, 1H), 2.85 (с, 3H), 2.43 (с, 3H), 2.14-2.22 (м, 1H), 2.00-2.04 (м, 2H), 1.72-1.77 (м, 1H).
Стадия 3: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
31 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.06 ммоль, выход: 67%).
1H ЯМР (300 МГц, CDCl3) δ 7.63-7.65 (м, 1H), 7.51-7.56 (т, J = 7.7 Гц, 1H), 7.39-7.45 (м, 3H), 7.30-7.32 (д, J = 7.4 Гц, 1H), 7.01-7.03 (м, 1H), 6.56 (с, 9H), 4.71-4.76 (м, 2H), 4.42-4.58 (м, 1H), 4.94-4.00 (м, 1H), 3.79-3.85 (м, 2H), 3.52-3.60 (м, 1H), 3.02 (с, 3H), 2.42 (с, 3H), 2.12-2.25 (м, 1H), 1.98-2.06 (м, 2H), 1.69-1.76 (м, 1H).
Пример 59: Получение (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
81 мг (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 1 в Примере 48, за исключением того, что в синтезе использовали (S)-8-хлор-2-фенил-3-(пирролидин-2-ил)изохинолин-1(2H)-он (0.12 ммоль, выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ 7.76-7.78 (д, J = 5.8 Гц, 1H), 7.59-7.64 (т, J = 6.4 Гц, 1H), 7.42-7.52 (м, 2H), 7.36-7.41 (м, 3H), 7.30-7.32 (д, J = 6.4 Гц, 1H), 7.18-7.20 (м, 1H), 6.84-6.86 (д, J = 8.1 Гц, 2H), 6.77 (с, 1H), 5.05-5.09 (т, J = 6.1 Гц, 1H), 4.89-4.94 (д, J = 15.3 Гц, 1H), 4.69-4.74 (д, J = 15.0 Гц, 1H), 4.52-4.56 (д, J = 10.5 Гц, 1H), 4.18-4.22 (д, J = 10.9 Гц, 1H), 4.11-4.16 (м, 1H), 3.79 (с, 3H), 3.07-3.13 (м, 1H), 2.94 (с, 3H), 2.44 (с, 3H), 1.93-1.99 (м, 2H), 1.61-1.81 (м, 2H).
Стадия 2: Получение (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
38 мг (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 48, за исключением того, что в синтезе использовали (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-7-(метилтио)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.06 ммоль, выход: 49%).
1H ЯМР (300 МГц, CDCl3) δ 7.48-7.55 (м, 4H), 7.31-7.38 (м, 4H), 7.16-7.18 (д, J = 7.9 Гц, 2H), 6.83-6.86 (м, 3H), 5.01-5.07 (м, 1H), 4.84-4.89 (д, J = 15.4 Гц, 1H), 4.69 (с, 2H), 4.48-4.59 (м, 2H), 4.10-4.13 (д, J = 10.3 Гц, 2H), 3.78 (с, 3H), 3.11-3.19 (м, 1H), 2.91 (с, 3H), 1.89-1.93 (м, 2H), 1.73-1.79 (м, 1H), 1.55-1.62 (м, 1H).
Стадия 3: Получение (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
13 мг (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 8 в Примере 1, за исключением того, что в синтезе использовали (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-1-(4-метоксибензил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он (0.03 ммоль, выход: 42%).
1H ЯМР (300 МГц, ДМСО-d6) δ 7.49-7.63 (м, 7H), 7.23-7.33 (м, 1H), 6.82 (с, 1H), 6.19 (с, 2H), 6.12 (с, 1H), 5.47-5.58 (м, 1H), 4.42 (с, 2H), 3.98-4.04 (м, 1H), 3.06-3.09 (м, 1H), 2.76 (с, 3H), 1.90-1.98 (м, 2H), 1.46-1.57 (м, 2H).
Пример 60: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
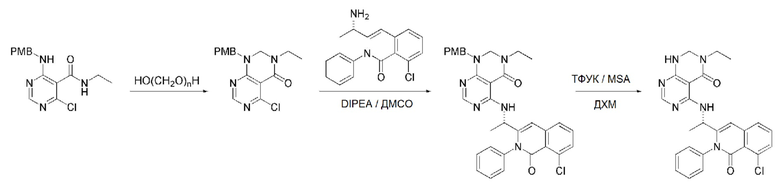
Стадия 1: Получение 5-хлор-3-этил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
400 мг 5-хлор-3-этил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 600 мг 1.87 ммоль) 4-хлор-N-этил-6-(4-метоксибензиламино)пиримидин-5-карбоксамида согласно методике, аналогичной описанной для стадии 4 в Примере 34 (1.2 ммоль, выход: 64%).
1H ЯМР (300 МГц, CDCl3) δ 8.44 (с, 1H), 7.22 (д, J = 8.4 Гц, 2H), 6.89 (д, J = 8.6 Гц, 2H), 4.85 (с, 2H), 4.54 (с, 2H), 3.82 (с, 3H), 3.46 (кв, J = 7.2 Гц, 2H), 1.08 (т, J = 7.2 Гц, 3H).
Стадия 2: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) этиламино)-3-этил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
60 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 40 мг (0.12 ммоль) 5-хлор-3-этил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.1 ммоль, выход: 84%).
1H ЯМР (300 МГц, CDCl3) δ 9.15 (с, -NH), 7.99 (с, 1H), 7.51-7.30 (м, 8H), 7.23 (д, J = 8.7 Гц, 2H), 6.87 (д, J = 8.1 Гц, 2H), 6.58 (с, 1H), 4.86 (с, 1H), 4.75 (с, 2H), 4.47 (с, 2H), 3.80 (с, 3H), 3.44-3.39 (м, 2H), 1.39 (д, J = 6.8 Гц, 3H), 1.11 (т, J = 7.2 Гц, 3H).
Стадия 3: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
47 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 60 мг (0.1 ммоль) (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидро-изохинолин-3-ил)этил)амино)-3-этил-1-(4-метоксибензил)-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.1 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.06 (д, J = 6.9 Гц, -NH), 7.94 (с, 1H), 7.49-7.39 (м, 8H), 6.56 (с, 1H), 5.80 (с, 1H), 4.87-4.82 (м, 1H), 4.74 (с, 2H), 3.52-3.45 (м, 2H), 1.39 (д, J = 6.7 Гц, 3H), 1.23 (т, J = 7.2 Гц, 3H).
Пример 61: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение 5-хлор-1-(4-метоксибензил)-3-пропил-2,3-дигидропиримидо [4,5-d]пиримидин-4(1H)-она
289 мг 5-хлор-1-(4-метоксибензил)-3-пропил-2,3-дигидропиримидо[4,5-d] пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 653 мг (1.95 ммоль) 4-хлор-6-(4-метоксибензиламино)-N-пропилпиримидин-5-карбоксамида согласно методике, аналогичной описанной для стадии 4 в Примере 34 (1.12 ммоль, выход: 57%).
1H ЯМР (300 МГц, CDCl3) δ 8.44 (с, 1H), 7.22 (д, J = 8.5 Гц, 2H), 6.89 (д, J = 8.5 Гц, 2H), 4.85 (с, 2H), 4.52 (с, 2H), 3.82 (с, 3H), 3.37 (т, J = 7.4 Гц, 2H), 1.52-1.45 (м, 2H), 0.86 (т, J = 7.4 Гц, 3H).
Стадия 2: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) этиламино)-1-(4-метоксибензил)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
56 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-1-(4-метоксибензил)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 41 мг (0.12 ммоль) 5-хлор-1-(4-метоксибензил)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.09 ммоль, выход: 73%).
1H ЯМР (300 МГц, CDCl3) δ 9.17-9.15 (м, -NH), 7.99 (с, 1H), 7.51-7.29 (м, 8H), 7.21-7.07 (м, 1H), 6.87 (д, J = 8.0 Гц, 2H), 6.52 (с, 1H), 4.96-4.87 (с, 1H), 4.75 (с, 2H), 4.47 (с, 2H), 3.80 (с, 3H), 3.44-3.39 (м, 2H), 1.68-1.63 (м, 2H), 1.39 (д, J = 6.9 Гц, 3H), 1.01-0.96 (м, 3H).
Стадия 3: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
45 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 56 мг (0.09 ммоль) (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-1-(4-метоксибензил)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.09 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.04 (с, -NH), 7.95 (с, 1H), 7.50-7.31 (м, 8H), 6.57 (с, 1H), 5.28 (с, 1H), 4.91-4.84 (м, 1H), 4.73 (с, 2H), 3.41-3.36 (м, 2H), 1.68-1.63 (м, 2H), 1.39 (д, J = 6.9 Гц, 3H), 1.01-0.96 (м, 3H).
Пример 62: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
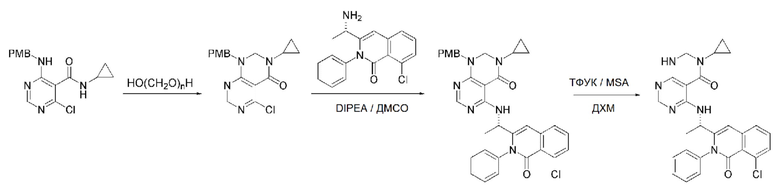
Стадия 1: Получение 5-хлор-3-циклопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
224 мг 5-хлор-3-циклопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 360 мг (1.08 ммоль) 4-хлор-N-циклопропил-6-(4-метоксибензиламино)пиримидин-5-карбоксамида согласно методике, аналогичной описанной для стадии 4 в Примере 34 (0.65 ммоль, выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ 8.43 (с, 1H), 7.21 (д, J = 7.8 Гц, 2H), 6.90 (д, J = 8.5 Гц, 2H), 4.84 (с, 2H), 4.52 (с, 2H), 3.82 (с, 3H), 2.60-2.56 (м, 1H), 0.84-0.82 (м, 2H), 0.52-0.50 (м, 2H).
Стадия 2: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) этиламино)-3-циклопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
43 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 40 мг (0.12 ммоль) 5-хлор-3-циклопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.07 ммоль, выход: 59%).
1H ЯМР (300 МГц, CDCl3) δ 9.19-9.15 (м, -NH), 8.05 (с, 1H), 7.53-7.32 (м, 4H), 7.23-7.18 (м, 1H), 6.87 (д, J = 9.4 Гц, 2H), 6.56 (с, 1H), 4.84 (с, 1H), 4.43 (с, 1H), 3.79 (с, 2H), 2.03 (с, 1H), 1.38 (д, J = 6.2 Гц, 3H), 0.86-0.80 (м, 2H), 0.56-0.52 (м, 2H).
Стадия 3: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
34 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 43 мг (0.07 ммоль) (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.07 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.09 (д, J = 6.8 Гц, 1H), 7.94 (с, 1H), 7.51-7.32 (м, 8H), 6.56 (с, 1H), 5.66 (с, 1H), 4.88-4.84 (м, 1H), 4.71 (с, 2H), 2.59-2.53 (м, 1H), 1.39 (д, J = 6.7 Гц, 3H), 0.95-0.92 (м, 2H), 0.75-0.73 (м, 2H).
Пример 63: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
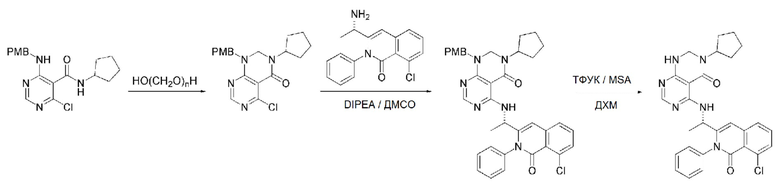
Стадия 1: Получение 5-хлор-3-циклопентил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
405 мг 5-хлор-3-циклопентил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 620 мг (1.72 ммоль) 4-хлор-N-циклопентил-6-(4-метоксибензиламино)пиримидин-5-карбоксамида согласно методике, аналогичной описанной для стадии 4 в Примере 34 (1.08 ммоль, выход: 63%).
1H ЯМР (300 МГц, CDCl3) δ 8.44 (с, 1H), 7.22 (д, J = 8.6 Гц, 2H), 6.90 (д, J = 8.7 Гц, 2H), 5.31 (с, 2H), 4.97-4.88 (м, 1H), 4.83 (с, 2H), 4.41 (с, 2H), 3.82 (с, 3H), 1.86-1.77 (м, 2H), 1.57-1.53 (м, 2H), 1.26-1.16 (м, 2H).
Стадия 2: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) этиламино)-3-циклопентил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
45 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде желтого твердого вещества при использовании 40 мг (0.1 ммоль) 5-хлор-3-циклопентил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.07 ммоль, выход: 70%).
1H ЯМР (300 МГц, CDCl3) δ 9.20 (д, J = 6.8 Гц, 1H), 8.06 (с, 1H), 7.56-7.30 (м, 8H), 7.23 (д, J = 8.4 Гц, 2H), 6.87 (д, J = 8.4 Гц, 2H), 6.59 (с, 1H), 4.91-4.82 (м, 2H), 4.74 (с, 2H), 4.36 (д, J = 2.3 Гц, 1H), 1.86-1.74 (м, 2H), 1.38 (д, J = 6.8 Гц, 3H).
Стадия 3: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
37 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 45 мг (0.07 ммоль) (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.07 ммоль, выход: 99%).
1H ЯМР (300 МГц, CDCl3) δ 9.11 (д, J = 6.7 Гц, 1H), 7.96 (с, 1H), 7.51-7.32 (м, 8H), 6.57 (с, 1H), 5.56 (с, 1H), 4.95-4.65 (м, 2H), 4.65 (с, 2H), 1.99-1.94 (м, 2H), 1.75-1.65 (м, 4H), 1.57-1.49 (м, 2H), 1.38 (д, J = 6.6 Гц, 3H).
Пример 64: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
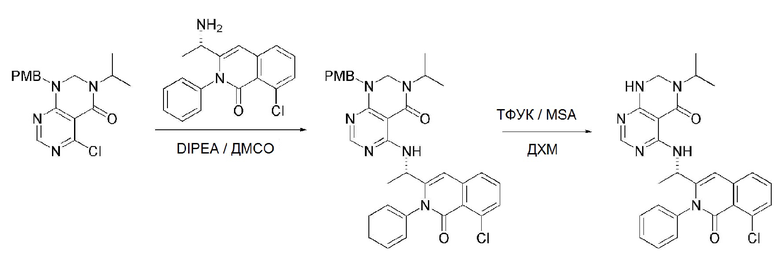
Стадия 1: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) этиламино)-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
Количественный выход (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 69 мг (0.20 ммоль) 5-хлор-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34.
1H ЯМР (300 МГц, CDCl3) δ 1.02-1.08 (м, 6H), 1.37-1.40 (д, J = 9.0, 3H), 3.80 (с, 3H), 4.32-4.40 (м, 2H), 4.76-4.89 (м, 4H), 6.59 (с, 1H), 6.85-6.88 (м, 2H), 7.21-7.53 (м, 10H), 8.05 (с, 1H), 9.17-9.19 (д, J = 6.0, 1H).
Стадия 2: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
14 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 25 мг 0.041 ммоль) (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она согласно методике, аналогичной описанной для стадии 8 в Примере 1 (выход: 70%).
1H ЯМР (300МГц, CDCl3) δ 1.19-1.25 (м, 6H), 1.37-1.40 (д, J = 9.0, 3H), 4.61-4.68 (м, 2H), 4.80-4.87 (м, 2H), 5.73 (ушир.с, 1H), 6.57 (с, 1H), 7.26-7.50 (м, 8H), 7.94 (с, 1H), 9.10-9.13 (д, J = 9.0,1H).
Пример 65: Получение (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил) пропиламино)-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
97 мг (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали 69 мг (0.20 ммоль) 5-хлор-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она и (S)-2-(1-аминопропил)-5-фтор-3-фенилхиназолин-4(3H)-он (1.1 экв.) (0.20 ммоль, выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ 0.84-0.88 (т, J = 6.0, 3H), 1.02-1.04 (д, J = 6.0, 6H), 1.74-1.94 (м, 2H), 3.79 (с, 3H), 4.34 (с, 2H), 4.73 (с, 2H), 4.79-4.86 (м, 1H), 4.96-5.03 (м, 1H), 6.84-6.87 (м, 2H), 7.05-7.30 (м, 4H), 7.45-7.69 (м, 6H), 8.02 (с, 1H), 9.44-9.46 (д, J = 6.0, 1H).
Стадия 2: Получение (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она
14 мг (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 30 мг (0.049 ммоль, 1.0 экв.) (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-1-(4-метоксибензил)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ 0.83-0.87 (т, J = 6.0, 3H), 1.19-1.21 (д, J = 6.0, 6H), 1.73-1.95 (м, 2H), 4.61 (с, 2H), 4.84-4.99 (м, 2H), 6.33 (ушир.с, 1H), 7.05-7.12 (м, 1H), 7.26-7.30 (м, 1H), 7.44-7.69 (м, 6H), 7.90 (с, 1H), 9.39-9.41 (д, J = 6.0, 1H).
Приведенные далее Примеры 66 ~ 98 были получены способом, изображенным на схеме реакции 3A.
Схема реакции 3A
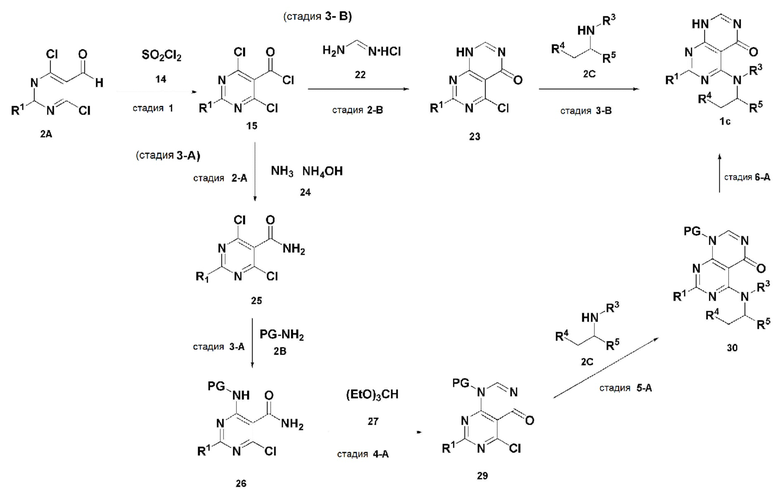
Пример 66: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение 4,6-дихлорпиримидин-5-карбонилхлорида
1 г (5.65 ммоль) 4,6-дихлорпиримидин-5-карбоксальдегида растворяли в 15 мл CCl4, затем добавляли 0.78 мл (9.61 ммоль) сульфурилхлорида и 46 мг (0.28 ммоль) 2-2-азобис(2-метил пропионитрила) и перемешивали при 80ºС в течение 3 часов. Реакционную смесь фильтровали при пониженном давлении. Добавляли 5 мл безводного толуола, затем фильтровали при пониженном давлении. В результате получали 4,6-дихлорпиримидин-5-карбонилхлорид.
Стадия 2: Получение 5-хлорпиримидо[4,5-d]пиримидин-4(1H)-она
4,6-дихлорпиримидин-5-карбонилхлорид (1.0 экв.) полученного на стадии 1, растворяли в толуоле, затем добавляли избыток тионилхлорида (SOCl2) и перемешивали при 115℃ в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры. Растворитель упаривали при пониженном давлении, и остаток сушили, получая хлорид. Формамидина гидрохлорид (1.1 экв.) растворяли в тетрагидрофуране при 0ºС, затем добавляли триэтиламин (4.0 экв.). Полученный хлорангидрид растворяли в 5.0 мл безводного тетрагидрофуране, который медленно добавляли в описанную выше смесь. Реакционную смесь нагревали при комнатной температуре и перемешивали 4 часа. Добавляли воду, затем экстрагировали диэтиловым эфиром. Водный слой экстрагировали смесью этилацетат:тетрагидрофуран (1:1). Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: дихлорметан/метанол, 15/1 -> дихлорметан/метанол, 10/1), получая целевое соединение 5-хлорпиримидо[4,5-d]пиримидин-4(1H)-он.
Стадия 3: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
25 мг (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино) пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 15 мг (0.08 ммоль, 1.0 экв.) 5-хлорпиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, и 30 мг (0.10 ммоль, 1.2 экв.) (S)-2-(1-аминоэтил)-5-хлор-3-фенилхиназолин-4(3H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.06 ммоль, выход: 68%).
1H ЯМР (300 МГц, CDCl3) δ 9.77 (с, 1H), 8.82 (с, 1H), 8.67 (с, 1H), 7.49-7.58 (м, 7H), 7.37 (с, 1H), 5.11-5.16 (м, 1H), 1.51-1.53 (д, J = 3.0 Гц, 3H).
Пример 67: Получение (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она

18.8 мг (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил) амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 3 в Примере 66, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-он (0.04 ммоль, выход: 77%).
1H ЯМР (300 МГц, ДМСО-d6) δ 9.69 (с, 1H), 8.66-8.69 (м, 2H), 8.40 (с, 1H), 8.31 (с, 1H), 8.00-8.11 (м, 1H), 7.74-7.78 (м, 1H), 7.56-7.65 (м, 3H), 4.82-4.86 (м, 1H), 1.34-1.39 (м, 3H).
Пример 68: Получение (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
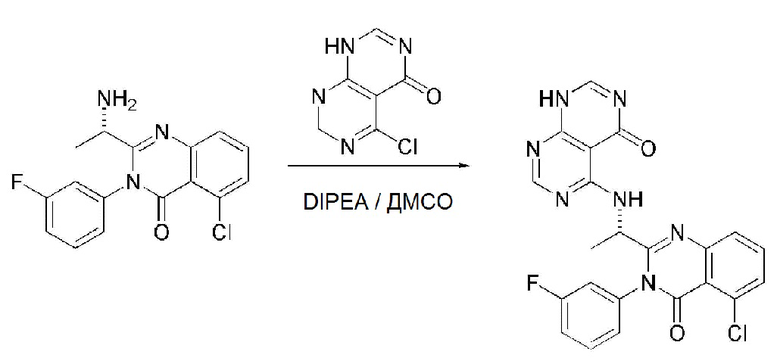
13.8 мг (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил) амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 3 в Примере 66, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-он (0.03 ммоль, выход: 55%).
1H ЯМР (300 МГц, CDCl3) δ 9.53-9.62 (м, 1H), 8.63-8.65 (д, J = 3.0 Гц1H), 8.43-8.44 (м, 1H), 7.63-7.69 (м, 3H), 7.58-7.62 (м, 2H), 7.50-7.55 (м, 1H), 7.28-7.29 (м, 1H), 7.12-7.19 (м, 1H), 5.12-5.18 (м, 1H), 1.47-1.56 (м, 3H).
Пример 69: Получение (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
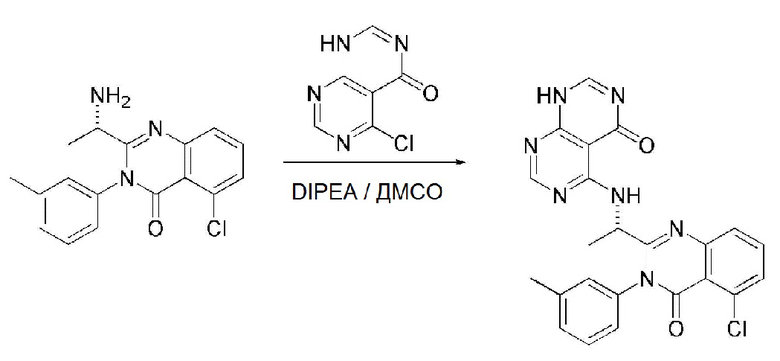
10.5 мг (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил) амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 3 в Примере 66, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(м-толил)хиназолин-4(3H)-он (0.02 ммоль, выход: 42%).
1H ЯМР (300 МГц, CDCl3) δ 9.79-9.81 (д, J = 4.5 Гц, 1H), 8.77-8.79 (д, J = 3.0 Гц, 1H), 8.66-8.68 (д, J = 3.0 Гц, 1H), 7.61-7.68 (м, 2H), 7.46-7.51 (м, 3H), 7.35-7.38 (м, 1H), 7.17-7.18 (м, 1H), 5.18-5.22 (м, 1H), 2.41-2.49 (д, J = 12.0 Гц, 3H), 1.53-1.55 (м, 3H).
Пример 70: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение 5-хлор-1-(4-метоксибензил)пиримидо[4,5-d]пиримидин-4(1H)-она
50 мг (0.171 ммоль) 4-хлор-6-((4-метоксибензил)амино)пиримидин-5-карбоксамида, 1 мл триэтилортоформиата и 10 мкл метансульфокислоты перемешивали при 50℃ в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли этилацетат и воду, затем экстрагировали. Органический слой отделяли, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток разделяли методом колоночной хроматографии (SiO2, элюент: гексан/этилацетат, 4/1 -> гексан/этилацетат, 1/1), получая 10 мг целевого соединения 5-хлор-1-(4-метоксибензил)пиримидо[4,5-d]пиримидин-4(1H)-она в виде бледно-желтой жидкости (0.033 ммоль, выход: 19%).
1H ЯМР (300 МГц, CDCl3) δ 8.96 (с, 1H), 8.44 (с, 1H), 7.29 (д, J = 8.9 Гц, 2H), 6.89 (д, J = 8.9 Гц, 2H), 5.37 (с, 2H), 3.80 (с, 3H).
Стадия 2: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)пиримидо[4,5-d]пиримидин-4(1H)-она
18 мг (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде светло-желтого вещества при использовании 10 мг (0.033 ммоль) 5-хлор-1-(4-метоксибензил) пиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, и 9 мг (0.036 ммоль) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.032 ммоль, выход: 96%).
1H ЯМР (300 МГц, CDCl3) δ 9.89 (д, J = 7.1 Гц, 1H), 8.36 (д, J = 9.4 Гц, 2H), 7.38-7.54 (м, 5H), 7.29-7.37 (м, 5H), 6.87 (д, J = 8.6 Гц, 2H), 6.56 (с, 1H), 5.29 (с, 2H), 4.95 (т, J = 6.3 Гц, 1H), 3.77 (с, 3H), 1.44 (д, J = 6.3 Гц, 3H).
Стадия 3: Получение (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
13 мг (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино) пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде светло-желтого вещества в круглодонной колбе объемом 25 мл при использовании 18 мг (0.032 ммоль) (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-1-(4-метоксибензил) пиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.029 ммоль, выход: 92%).
1H ЯМР (300 МГц, CDCl3) δ 9.24 (д, J =5.5 Гц, 1H), 8.57 (с, 1H), 7.47-7.52 (м, 5H), 7.32-7.38 (м, 4H), 6.60 (с, 1H), 5.03 (т, J =7.0 Гц, 1H), 1.50 (д, J =6.5 Гц, 3H).
Пример 71: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
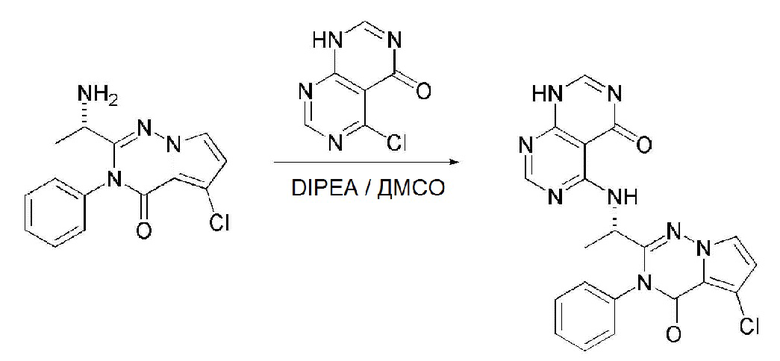
20 мг (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 15 мг (0.08 ммоль, 1.0 экв.) 5-хлорпиримидо[4,5-d]пиримидин-4(1H)-она и 28 мг (0.10 ммоль, 1.2 экв.) (S)-2-(1-аминоэтил)-5-хлор-3-фенилпирроло[2,1-f][1,2,4]триазин-4(3H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.05 ммоль, выход: 58%).
1H ЯМР (300 МГц, CDCl3) δ 9.44 (с, 1H), 8.81 (с, 1H), 8.64 (с, 1H), 7.49-7.56 (м, 5H), 7.27-7.36 (м, 2H), 7.50 (с, 1H), 5.10-5.14 (м, 1H), 1.51-1.53 (д, J = 3.2 Гц, 3H).
Пример 72: Получение (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
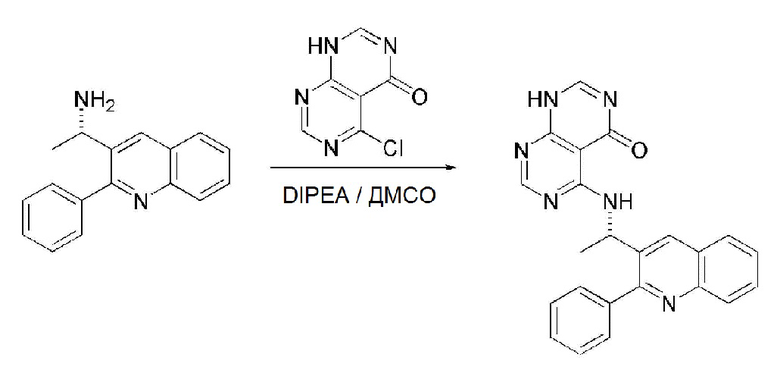
6 мг (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-1-(2-фенилхинолин-3-ил)этанамин (0.015 ммоль, выход: 28%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.86 (с, 1H), 9.42-9.44 (м, 1H), 8.46 (с, 1H), 8.39 (с, 1H), 8.31 (с, 1H), 9.58-7.74 (м, 5H), 7.42-7.45 (м, 3H), 5.48-5.52 (м, 1H), 1.46-1.48 (д, J = 3.0 Гц, 3H).
Пример 73: Получение (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она

10.7 мг (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил) амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминопропил)-5-фтор-3-(фенилхиназолин-4(3H)-он (0.02 ммоль, выход: 44%).
1H ЯМР (300 МГц, CDCl3) δ 9.69-9.72 (д, J = 4.5 Гц, 1H), 8.84 (с, 1H), 8.68 (с, 1H), 7.51-7.69 (м, 7H), 7.34-7.36 (м, 1H), 7.09-7.15 (т, J = 9.1 Гц, 1H), 5.07-5.11 (м, 1H), 1.86-1.96 (м, 2H), 0.87-0.92 (т, J = 7.1 Гц, 6H).
Пример 74: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

24.7 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.05 ммоль, выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ 9.56 (с, 1H), 8.53 (с, 1H), 7.74-7.61 (м, 1H), 7.42-7.63 (м, 6H), 7.29 (с, 1H), 4.84-4.88 (м, 1H), 4.00-4.02 (м, 1H), 3.70-3.74 (м, 1H), 2.04-2.29 (м, 2H), 1.83-1.87 (м, 2H).
Пример 75: Получение (S)-5-(2-(8-хлор-1-оксо-2-(пиридин-3-ил)-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

10.6 мг (S)-5-(2-(8-хлор-1-оксо-2-(пиридин-3-ил)-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-8-хлор-2-(пиридин-3-ил)-3-(пирролидин-2-ил)изохинолин-1(2H)-он (0.02 ммоль, выход: 41%).
1H ЯМР (300 МГц, ДМСО-d6) δ 8.49 (с, 1H), 8.25 (с, 1H), 7.48-7.61 (м, 6H), 7.35-7.41 (м, 3H), 6.46 (с, 1H), 4.67-4.71 (м, 1H), 4.09-4.15 (м, 1H), 3.09-3.16 (м, 1H), 1.88-1.97 (м, 3H), 1.49-1.53 (м, 1H).
Пример 76: Получение (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

15.8 мг (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.03 ммоль, выход: 61%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.41 (с, 1H), 8.44 (с, 1H), 8.01-8.22 (м, 3H), 7.39-7.63 (м, 4H), 4.41-4.47 (м, 1H), 3.77-3.83 (м, 1H), 3.45-3.52 (м, 1H), 1.99-2.15 (м, 3H), 1.69-1.75 (м, 1H).
Пример 77: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

4.1 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)изохинолин-4(3H)-он (0.01 ммоль, выход: 15%).
1H ЯМР (300 МГц, CDCl3) δ 9.56 (с, 1H), 8.54 (с, 1H), 7.52-7.64 (м, 4H), 7.44-7.47 (м, 2H), 7.07-7.14 (м, 1H), 4.86-4.90 (кв, J = 3.0, 1.5 Гц, 1H), 4.03-4.08 (м, 1H), 3.74-3.76 (м, 1H), 2.32-2.37 (м, 1H), 2.11-2.23 (м, 2H), 1.87-1.91 (м, 1H).
Пример 78: Получение (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
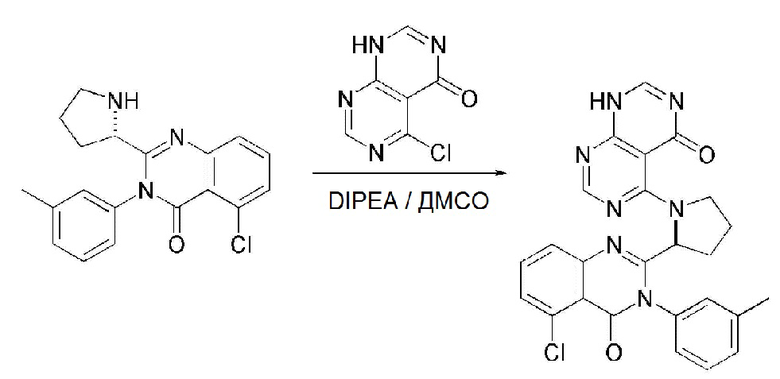
10.7 мг (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-2-(пирролидин-2-ил)-3-м-толилхиназолин-4(3H)-он (0.02 ммоль, выход: 40%).
1H ЯМР (300 МГц, CDCl3) δ 8.53 (с, 1H), 8.47-8.48 (д, J = 1.5 Гц, 1H), 7.42-7.57 (м, 6H), 7.35-7.36 (м, 1H), 7.09-7.11 (м, 1H), 4.86-4.92 (м, 1H), 4.04-4.07 (м, 1H), 3.68-3.72 (м, 1H), 2.46-2.49 (д, J = 4.5 Гц, 3H), 2.31-2.34 (м, 1H), 2.15-2.19 (м, 3H).
Пример 79: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

10 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 13 мг (0.07 ммоль, 1.0 экв.) 5-хлорпиримидо[4,5-d]пиримидин-4(1H)-она и 30 мг (0.09 ммоль, 1.3 экв.) (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.02 ммоль, выход: 31%).
1H ЯМР (300 МГц, ДМСО-d6) δ 8.55 (с, 1H), 8.27 (с, 1H), 7.72-7.77 (м, 1H), 7.50-7.62 (м, 5H), 6.61 (с, 1H), 4.52 (с, 1H), 3.78-3.83 (м, 1H), 3.40-3.46 (м, 1H), 1.96-2.15 (м, 3H), 1.70-1.76 (м, 1H).
Пример 80: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

20 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 16 мг (0.09 ммоль, 1.0 экв.) 5-хлорпиримидо[4,5-d]пиримидин-4(1H)-она и 30 мг (0.09 ммоль, 1.2 экв.) (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)пирроло[2,1-f][1,2,4]триазин-4(3H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.04 ммоль, выход: 47%).
1H ЯМР (300 МГц, CDCl3) δ 8.56-8.63 (м, 2H), 7.51-7.60 (м, 2H), 7.28-7.31 (м, 1H), 7.03-7.14 (м, 2H), 6.42 (с, 1H), 4.87 (с, 1H), 3.94-4.02 (м, 1H), 3.65-3.75 (м, 1H), 3.26-3.33 (м, 1H), 1.86-2.28 (м, 4H).
Пример 81: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
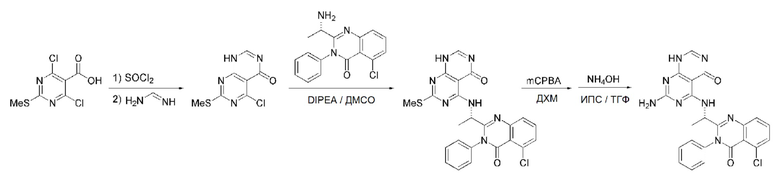
Стадия 1: Получение 5-хлор-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
3.0 г (12.55 ммоль, 1.0 экв.) 4,6-дихлор-2-(метилтио)пиримидин-5-карбоновой кислоты растворяли в 40 мл безводного толуола, затем добавляли 15 мл тионилхлорида (SOCl2) и перемешивали при 115ºС в течение 12 часов. Растворитель упаривали при пониженном давлении, и остаток сушили, получая ацилхлорид. Затем получали 1.6 г 5-хлор-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 2 в Примере 66 (2 стадия выход: 56%).
1H ЯМР (300 МГц, ДМСО-d6) δ 2.56-2.58 (д, J = 6.0, 3H), 8.42-8.44 (д, J = 6.0, 1H), 12.88 (ушир.с, 1H).
Стадия 2: Получение (S)-5-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этиламино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
22 мг (S)-5-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этиламино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 10 мг (0.055 ммоль) 5-хлор-7-(метилтио)пиримидо[4,5-d]пиримидин- 4(1H)-она, полученного на стадии 1, и 20 мг (0.066 ммоль, 1.2 экв.) (S)-2-(1-аминоэтил)-5-хлор-2-фенилхиназолин-4(3H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.044 ммоль, выход: 80%).
1H ЯМР (300 МГц, CDCl3) δ 9.42 (с, 1H), 8.21 (с, 1H), 7.64-7.33 (м, 7H), 7.36-7.33 (м, 1H), 5.19-5.13 (м, 1H), 2.43 (с, 3H), 1.47 (д, J = 6.5 Гц, 3H).
Стадия 3: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
16 мг (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил) амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 19.6 мг (0.04 ммоль) (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 4 в Примере 15 (0.034 ммоль, выход: 85%).
1H ЯМР (300 МГц, ДМСО-d6) δ 9.61-9.58 (м, -NH), 8.06 (с, 1H), 7.77-7.72 (м, 1H), 7.61-7.54 (м, 6H), 4.77-4.72 (м, 1H), 1.31 (д, J = 6.5 Гц, 3H).
Пример 82: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
30 мг (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил) амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(пиридин-3-ил)хиназолин-4(3H)-он (0.06 ммоль, выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ 11.77 (с, 1H), 11.32 (с, 1H), 9.28-9.20 (м, 1H), 8.89 (с, 1H), 8.81-8.79 (м, 1H), 8.72-8.70 (м, 1H), 8.63-8.62 (м, 1H), 8.24 (с, 1H), 8.10-8.05 (м, 1H), 7.77-7.75 (м, 1H), 7.66-7.48 (м, 5H), 5.18-5.13 (м, 1H), 4.95-4.90 (м, 1H), 2.49 (д, J = 11.7 Гц, 3H), 1.56-1.52 (м, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
11 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде светло-желтого вещества при использовании 24 мг (0.049 ммоль) (S)-5-(1-(5-хлор-4-оксо-3-фенил-3,4-дигидроизохинолин-2-ил)этиламино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 4 в Примере 15 (0.024 ммоль, выход: 49%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.14 (ушир.с, 1H), 9.40 (ушир.с, 1H), 8.74-8.81 (м, 1H), 8.64-8.73 (м, 1H), 8.03-8.14 (м, 2H), 7.72-7.84 (м, 1H), 7.52-7.67 (м, 3H), 6.80 (ушир.с, 2H), 4.62-4.75 (м, 1H), 1.33 (д, J = 6.6 Гц, 3H).
Пример 83: Получение (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
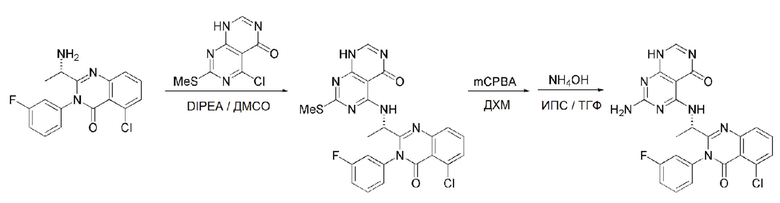
Стадия 1: Получение (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
38 мг (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил) амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-(3-фторфенил)хиназолин-4(3H)-он (0.075 ммоль, выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ 9.40 (с, -NH), 8.26 (с, 1H), 7.65-7.47 (м, 5H), 7.37-7.29 (м, 1H), 7.16-7.09 (м, 1H), 5.19-5.12 (м, 1H), 4.09-4.02 (м, 1H), 2.46 (с, 3H), 1.50 (д, J = 6.5 Гц, 1H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
27 мг (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он (0.056 ммоль, выход: 81%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.13 (с, -NH), 9.46 (с, -NH), 8.06 (с, 1H), 7.78-7.73 (м, 1H), 7.62-7.31 (м, 6H), 6.87 (с, -NH), 6.64 (с, -NH), 4.80-4.72 (м, 1H), 1.35-1.33 (м, 3H).
Пример 84: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
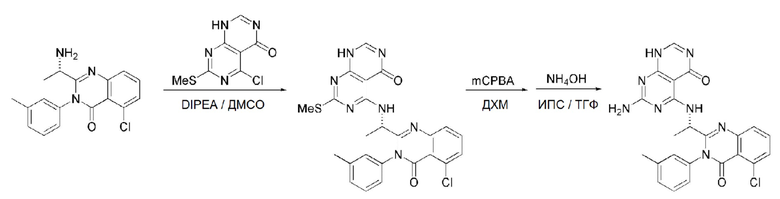
Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
45 мг (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминоэтил)-5-хлор-3-м-толилхиназолин-4(3H)-он (0.089 ммоль, выход: 89%).
1H ЯМР (300 МГц, CDCl3) δ 9.46 (с, 1H), 8.23 (с, 1H), 7.65-7.56 (м, 2H), 7.47-7.41 (м, 2H), 7.30-7.27 (м, 1H), 7.14 (с, 1H), 5.22-5.15 (м, 1H), 2.46-2.39 (м, 6H), 2.48-47 (м, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он
35 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил) этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он (0.073 ммоль, выход: 82%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.13 (с, -NH), 9.60-9.48 (с, -NH), 8.06 (с, 1H), 7.78-7.72 (м, 1H), 7.63-7.53 (м, 2H), 7.45-7.27 (м, 4H), 6.80-6.71 (м, -NH2), 4.84-4.77 (м, 1H), 2.47 (с, 3H), 1.35-1.30 (м, 3H).
Пример 85: Получение (S)-7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
35 мг (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 17 мг (0.0743 ммоль, 1.0 экв.) 5-хлор-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 1 в Примере 81, и 27 мг (0.0892 ммоль, 1.2 экв.) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (выход: 96%).
1H ЯМР (300 МГц, ДМСО-d6) δ 1.40-1.42 (д, J = 6.0, 3H), 2.34 (с, 3H), 4.75-4.80 (м, 1H), 6.82 (с, 1H), 7.27-7.36 (м, 3H), 7.42-7.44 (м, 1H), 7.49-7.54 (м, 2H), 7.60-7.67 (м, 2H), 8.28 (с, 1H), 9.13-9.15 (д, J = 6.0, 1H), 12.78 (ушир.с, 1H).
Стадия 2: Получение (S)-7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)пиримидо[4,5-d]пиримидин-4(1H)-она
60 мг (S)-7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил) этиламино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 170 мг (0.346 ммоль) (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она, полученного на стадии 2, согласно методике, аналогичной описанной для стадии 4 в Примере 15 (выход: 38%).
1H ЯМР (300 МГц, ДМСО-d6) δ 1.29-1.31 (д, J = 6.0, 3H), 4.58-4.62 (м, 1H), 6.57-6.94 (м, 3H), 7.42-7.64 (м, 8H), 8.08 (с, 1H), 9.05-9.06 (д, J = 3.0, 1H), 12.24 (с, 1H).
Пример 86: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
102 мг (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 58 мг (0.20 ммоль) (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)-7-(метилтио) пиримидо[4,5-d]пиримидин-4(1H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (выход: 94%).
1H ЯМР (300 МГц, CDCl3) δ 9.15 (ушир.с, 1H), 8.32 (с, 1H), 7.30-7.65 (м, 7H), 6.52 (с, 1H), 5.10-5.25 (м, 1H), 2.47 (с, 3H), 1.50 (д, J = 6.4 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
14 мг (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 43 мг (0.089 ммоль) (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)-7-(метилтио) пиримидо[4,5-d]пиримидин-4(1H)-она согласно методике, аналогичной описанной для стадии 4 в Примере 15 (0.031 ммоль, выход: 35%).
1H ЯМР (500 МГц, ДМСО-d6) δ 12.18 (ушир.с, 1H), 9.11 (ушир.с, 1H), 8.10 (с, 1H), 7.70-7.73 (м, 1H), 7.54-7.62 (м, 1H), 7.42-7.52 (м, 2H), 7.24-7.35 (м, 1H), 6.93 (ушир.с, 1H), 6.70 (дд, J = 1.0 Гц, J = 3.1 Гц, 1H), 6.62 (ушир.с, 1H), 4.75-4.83 (м, 1H), 1.35-1.41 (м, 3H).
Пример 87: Получение (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
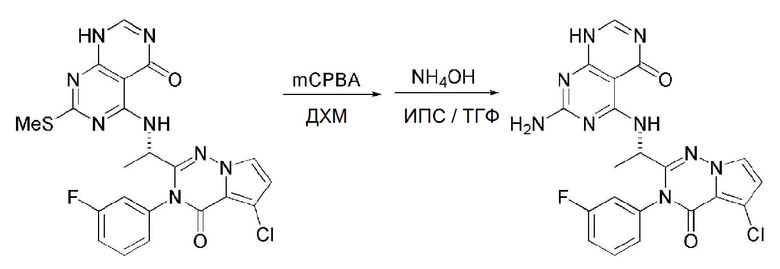
20 мг (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества при использовании 86 мг (0.172 ммоль) (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)этил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она согласно методике, аналогичной описанной для стадии 4 в Примере 15 (0.043 ммоль, выход: 25%).
1H ЯМР (500 МГц, ДМСО-d6) δ 9.19 (ушир.с, 1H), 8.09 (с, 1H), 7.68 (с, 1H), 7.53-7.63 (м, 3H), 7.48 (с, 2H), 6.95 (ушир.с, 1H), 6.68 (с, 1H), 6.60 (ушир.с, 1H), 7.71-7.78 (м, 1H), 1.32-1.38 (м, 3H).
Пример 88: Получение (S)-7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино) пиримидо[4,5-d]пиримидин-4(1H)-она
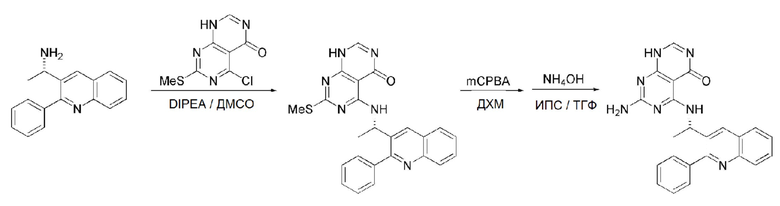
Стадия 1: Получение (S)-7-(метилтио)-5-((1-(2-фенилхинолин-3-ил)этил) амино)пиримидо[4,5-d]пиримидин-4(1H)-она
23 мг (S)-7-(метилтио)-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-1-(2-фенилхинолин-3-ил)этанамин (0.052 ммоль, выход: 52%).
1H ЯМР (300 МГц, CDCl3) δ 12.32 (с, -NH), 9.31-9.29 (м, 1H), 8.26 (с, 1H), 8.20 (д, J = 8.5 Гц, 1H), 8.04 (с, 1H), 7.83 (д, J = 8.2 Гц, 1H), 7.74-7.68 (м, 3H), 7.57-7.43 (м, 4H), 5.78-5.68 (м, 1H), 1.51 (д, J = 6.6 Гц, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино) пиримидо[4,5-d]пиримидин-4(1H)-она
16 мг (S)-7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-7-(метилтио)-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d] пиримидин-4(1H)-он (0.039 ммоль, выход: 81%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.16 (с, -NH), 9.36 (с, -NH), 8.36 (с, 1H), 8.07 (с, 1H), 8.01-7.96 (м, 2H), 7.75-7.44 (м, 7H), 7.63-7.53 (м, 2H), 7.45-7.27 (м, 4H), 6.86 (м, -NH), 6.75 (м, -NH), 5.48-5.44 (м, 1H), 1.33 (д, J = 6.1 Гц, 3H).
Пример 89: Получение (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
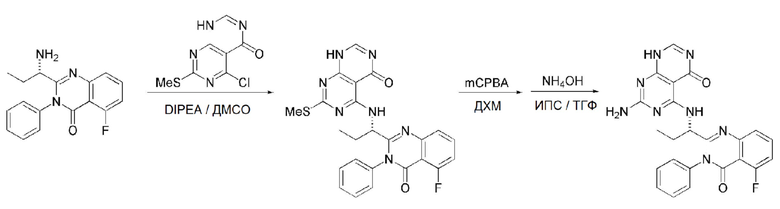
Стадия 1: Получение (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
45 мг (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-2-(1-аминопропил)-5-фтор-3-(пиридин-3-ил)хиназолин-4(3H)-он (0.089 ммоль, выход: 89%).
1H ЯМР (300 МГц, CDCl3) δ 9.49-9.45 (м, 1H), 8.21 (с, 1H), 7.72-7.47 (м, 5H), 7.35-7.31 (м, 1H), 7.15-7.08 (м, 1H), 5.13-5.06 (м, 1H), 2.38 (с, 3H), 1.98-1.76 (м, 2H), 0.87-0.78 (м, 3H).
Стадия 2: Получение (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она
34 мг (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил) пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он (0.075 ммоль, выход: 88%).
1H ЯМР (300 МГц, ДМСО-d6) δ 12.14 (с, -NH), 9.45 (с, -NH), 8.06 (с, 1H), 7.82-7.74 (м, 1H), 7.61-7.51 (м, 5H), 7.46-7.43 (м, 1H), 7.30-7.23 (м, 1H), 6.85 (с, -NH), 6.50 (с, -NH), 4.67 (с, 1H), 1.90-1.82 (м, 1H), 1.60-1.50 (м, 1H), 0.71-0.66 (м, 3H).
Пример 90: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-4--оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
23 мг (S)-5-(2-(5-хлор-4--оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.044 ммоль, выход: 80%).
1H ЯМР (300 МГц, CDCl3) δ 8.17 (с, 1H), 8.03-8.00 (м, 1H), 7.69-7.40 (м, 8H), 4.85-4.80 (м, 1H), 4.06-4.00 (м, 1H), 3.68-3.60 (м, 1H), 2.53 (с, 3H), 2.29-2.10 (2H), 1.83-1.76 (м, 2H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
20 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4--оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он (0.043 ммоль, выход: 86%).
1H ЯМР (300 МГц, CDCl3) δ 11.77 (с, 1H), 9.10 (с, 1H), 8.72-8.70 (м, 2H), 8.37 (с, 1H), 8.00 (с, 1H), 7.69-7.47 (м, 4H), 4.83-4.80 (м, 1H), 4.49-4.41 (м, 1H), 3.87-3.73 (м, 2H), 1.28-1.24 (м, 4H).
Пример 91: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
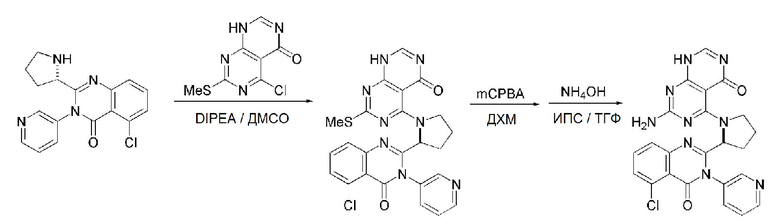
Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
30 мг (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(пиридин-3-ил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.057 ммоль, выход: 57%).
1H ЯМР (300 МГц, CDCl3) δ 10.96 (с, 1H), 9.31 (с, 1H), 8.82-8.78 (м, 1H), 8.56 (с, 1H), 8.45-8.42 (м, 1H), 8.24 (с, 1H), 7.56-7.43 (м, 4H), 4.83-4.80 (м, 1H), 4.69-4.64 (м, 1H), 3.71-3.60 (м, 1H), 2.53 (с, 3H), 1.28-1.24 (м, 1H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
20 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он (0.043 ммоль, выход: 86%).
1H ЯМР (300 МГц, CDCl3) δ 11.77 (с, 1H), 9.10 (с, 1H), 8.72-8.70 (м, 2H), 8.37 (с, 1H), 8.00 (с, 1H), 7.69-7.47 (м, 4H), 4.83-4.80 (м, 1H), 4.49-4.41 (м, 1H), 3.87-3.73 (м, 2H), 1.28-1.24 (м, 4H).
Пример 92: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
38 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)хиназолин-4(3H)-он (0.071 ммоль, выход: 71%).
1H ЯМР (300 МГц, CDCl3) δ δ 11.62 (с, -NH), 8.29 (с, 1H), 7.86-8.72 (м, 1H), 7.68-7.41 (м, 5H), 7.29-7.24 (м, 1H), 7.09-7.02 (м, 1H), 4.84-4.78 (м, 1H), 4.09-4.02 (м, 1H), 3.65-3.60 (м, 1H), 2.52 (с, 3H), 2.25-2.08 (м, 4H), 1.84-1.77 (м, 1H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
(S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он получали согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он.
1H ЯМР (300 МГц, ДМСО-d6) δ 11.76 (ушир.с, 1H), 8.00 (с, 1H), 7.95-7.30 (м, 8H), 6.62 (ушир.с, 2H), 4.60-4.40 (м, 1H), 3.90-3.70 (м, 1H), 3.65-1.77 (м, 6H).
Пример 93: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
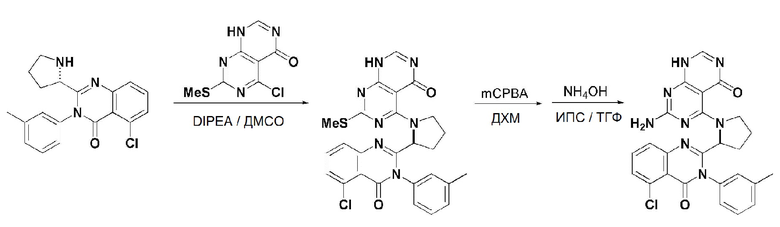
Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
45 мг (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-2-(пирролидин-2-ил)-3-м-толилхиназолин-4(3H)-он (0.085 ммоль, выход: 85%).
1H ЯМР (300 МГц, CDCl3) δ 11.72 (s -NH), 8.26 (с, 1H), 7.84 (с, 1H), 7.55-7.41 (м, 5H), 7.07 (с, 1H), 4.87-4.81 (м, 1H), 4.13-4.07 (м, 1H), 3.58-3.51 (м, 1H), 2.50 (с, 3H), 2.20-2.04 (м, 4H), 1.79-1.73 (м, 2H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
31 мг (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он (0.061 ммоль, выход: 77%).
1H ЯМР (300 МГц, ДМСО-d6) δ 11.75 (ушир.с, 1H), 8.00 (с, 1H), 7.80-7.20 (м, 7H), 6.53 (ушир.с, 2H), 4.63-4.53 (м, 1H), 3.84-3.74 (м, 1H), 3.60-3.40 (м, 1H), 2.37 (с, 3H), 2.10-1.27 (м, 4H).
Пример 94: Получение (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
42 мг (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин3-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-8-хлор-2-фенил-3-(пирролидин-2-ил)изохинолин-4(3H)-он (0.081 ммоль, выход: 81%).
1H ЯМР (300 МГц, CDCl3) δ 11.55 (с, -NH), 8.08 (с, 1H), 7.85-7.83 (м, 1H), 7.69-7.64 (м, 1H), 7.69-7.33 (м, 7H), 6.63 (с, 1H), 5.02-4.96 (м, 1H), 4.40-4.31 (м, 1H), 3.18-3.12 (м, 1H), 2.57 (с, 3H), 2.12-1.98 (м, 2H), 1.87-1.81 (м, 1H), 1.64-1.55 (м, 1H).
Стадия 2: Получение (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
(S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он получали согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он.
1H ЯМР (300 МГц, ДМСО-d6) δ 11.86 (ушир.с, 1H), 8.04 (с, 1H), 7.85-7.83 (м, 1H), 7.69-7.33 (м, 8H), 6.65 (ушир.с, 2H), 6.48 (с, 1H), 4.96-4.80 (м, 1H), 4.20-4.00 (м, 1H), 3.18-3.00 (м, 1H), 1.90-1.30 (м, 4H).
Пример 95: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
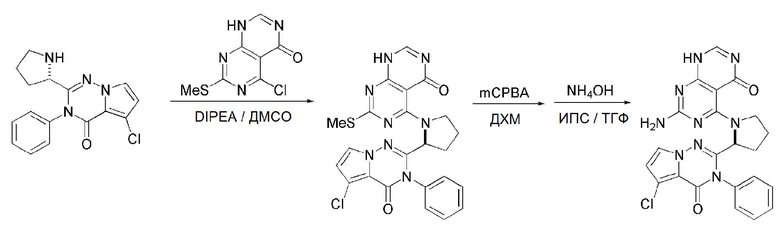
Стадия 1: Получение (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
30 мг (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-фенил-2-(пирролидин-2-ил)пирроло[1,2-f][1,2,4]триазин-4(3H)-он гидрохлорид (0.06 ммоль, выход: 66%).
1H ЯМР (300 МГц, CDCl3) δ 8.10 (с, 1H), 7.96-7.93 (м, 1H), 7.65-7.61 (м, 1H), 7.55-7.53 (м, 2H), 7.35 (с, 1H), 7.35-7.34 (м, 1H), 7.28-7.26 (м, 1H), 6.45-6.44 (м, 1H), 4.85-4.81 (м, 1H), 4.16-4.09 (м, 1H), 4.03-3.93 (м, 1H), 2.56 (с, 3H), 2.21-2.12 (м, 1H), 2.08-2.05 (м, 2H), 1.82-1.72 (с, 1H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло [1,2-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
(S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[1,2-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он получали согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он.
1H ЯМР (300 МГц, CDCl3) δ 8.45 (с, 1H), 7.60-7.05 (м, 7H), 6.43 (с, 1H), 4.85-4.81 (м, 1H), 4.16-4.09 (м, 1H), 3.80-3.60 (м, 1H), 2.45-1.65 (м, 4H).
Пример 96: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она

Стадия 1: Получение (S)-5-(2-(5-хлор-3-(3-фторфенил)4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она
60 мг (S)-5-(2-(5-хлор-3-(3-фторфенил)4-оксо-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-она получали в виде белого твердого вещества согласно методике, аналогичной описанной для стадии 5 в Примере 34, за исключением того, что в синтезе использовали (S)-5-хлор-3-(3-фторфенил)-2-(пирролидин-2-ил)пирроло[1,2-f][1,2,4]триазин-4(3H)-он гидрохлорид (0.011 ммоль, выход: 79%).
1H ЯМР (300 МГц, CDCl3) δ 9.94 (с, -NH), 8.16 (s 1H), 7.81-7.74 (м, 1H), 7.62-7.48 (м, 2H), 7.14 (с, 1H), 7.09-7.01 (м, 1H), 6.43 (с, 1H), 4.84 (с, 1H), 4.02-3.96 (м, 1H), 3.69-3.58 (м, 1H), 2.58 (с, 3H), 2.21-2.04 (м, 2H), 1.85-1.77 (м, 2H).
Стадия 2: Получение (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-она
(S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидропирроло[2,1-f] [1,2,4]триазин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он получали согласно методике, аналогичной описанной для стадии 4 в Примере 15, за исключением того, что в синтезе использовали (S)-5-(2-(5-хлор-3-(3-фторфенил)4-оксо-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-7-(метилтио)пиримидо[4,5-d]пиримидин-4(1H)-он.
1H ЯМР (300 МГц, CDCl3) δ 8.58 (ушир.с, 1H), 7.65-6.80 (м, 6H), 6.44 (с, 1H), 6.10 (с, 1H), 4.90 (с, 1H), 4.25-4.10 (м, 1H), 3.75-3.50 (м, 1H), 2.25-1.10 (м, 4H).
Пример 97: Получение (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она
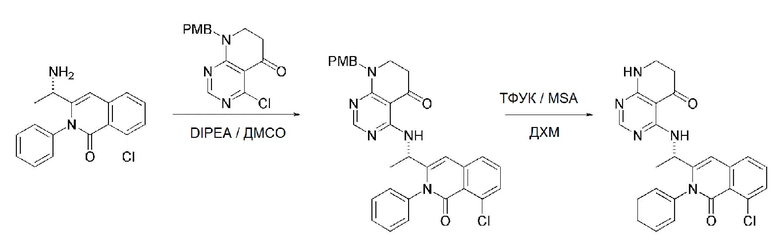
Стадия 1: Получение (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она
326 мг (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она получали в виде белого твердого вещества при использовании 200 мг (0.658 ммоль) 4-хлор-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она и 136 мг (0.790 ммоль) (S)-3-(1-аминоэтил)-8-хлор-2-фенилизохинолин-1(2H)-она согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.576 ммоль, выход: 87%).
1H ЯМР (300 МГц, CDCl3) δ 9.52 (д, J = 6.4 Гц, 1H), 8.04 (с, 1H), 7.35-7.56 (м, 7H), 7.31 (д, J = 6.4 Гц, 1H), 7.21 (д, J = 8.3 Гц, 2H), 6.86 (д, J = 8.3 Гц, 2H), 6.52 (с, 1H), 4.93 (т, J = 7.4 Гц, 1H), 4.83 (с, 2H), 3.79 (с, 3H), 3.45 (т, J = 6.4 Гц, 2H), 2.58-2.67 (м, 2H), 1.40 (д, J = 6.4 Гц, 3H).
Стадия 2: Получение (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она
36 мг (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она получали в виде белого твердого вещества при использовании 50 мг (0.088 ммоль) (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d] пиримидин-5(6H)-она согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.081 ммоль, выход: 91%).
1H ЯМР (300 МГц, CDCl3) δ 9.35 (д, J = 7.2 Гц, 1H), 7.93 (с, 1H), 7.34-7.55 (м, 7H), 7.30 (д, J = 8.4 Гц, 1H), 6.51 (с, 1H), 6.11 (ушир.с, 1H). 4.91 (т, J = 6.1 Гц, 1H), 3.58-3.67 (м, 2H), 2.67-2.75 (м, 2H), 1.40 (д, J = 6.9 Гц, 3H).
Пример 98: Получение (S)-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она

Стадия 1: Получение (S)-4-((4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она
150 мг (S)-4-((4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил) амино)-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она получали в виде белого твердого вещества при использовании 100 мг (0.30 ммоль) (S)-3-(1-аминоэтил)-4,8-дихлор-2-фенилизохинолин-1(2H)-она, полученного на стадии 8 в Препаративном примере 10, согласно методике, аналогичной описанной для стадии 5 в Примере 34 (0.25 ммоль, выход: 83%).
1H ЯМР (300 МГц, CDCl3) δ 9.97 (ушир.с, 1H), 8.11 (с, 1H), 8.00 (д, J = 8.2 Гц, 1H), 7.76 (д, J = 7.7 Гц, 1H), 7.51-7.64 (м, 5H), 7.19-7.24 (м, 3H), 6.86 (д, J = 8.6 Гц, 2H), 5.07-5.11 (м, 1H), 4.80-4.87 (м, 2H), 3.81 (с, 3H), 3.42-3.46 (м, 2H), 2.59-2.63 (м, 2H), 1.64 (д, J = 7.2 Гц, 3H).
Стадия 2: Получение (S)-4-((4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она
78 мг (S)-4-((4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она получали в виде белого твердого вещества при использовании 100 мг (0.17 ммоль) (S)-4-((4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-8-(4-метоксибензил)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-она, полученного на стадии 1, согласно методике, аналогичной описанной для стадии 8 в Примере 1 (0.16 ммоль, выход: 98%).
1H ЯМР (300 МГц, CDCl3) δ 9.82 (ушир.с, 1H), 7.99 (д, J = 6.7 Гц, 1H), 7.98 (с, 1H), 7.68-7.73 (м, 1H), 9.48-7.63 (м, 5H), 7.19-7.21 (м, 1H), 5.80 (с, 1H), 5.03-5.11 (м, 2H), 3.58-3.65 (м, 2H), 2.65-2.72 (м, 2H), 1.64 (д, J = 7.2 Гц, 3H).
Формулы соединений, полученных в Примерах 1 ~ 98, приведены в таблице 1 и таблице 2.
Таблица 1



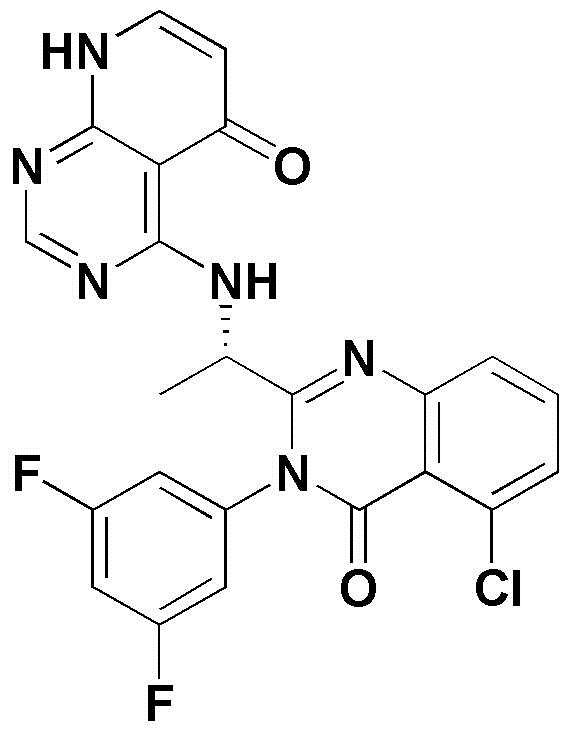
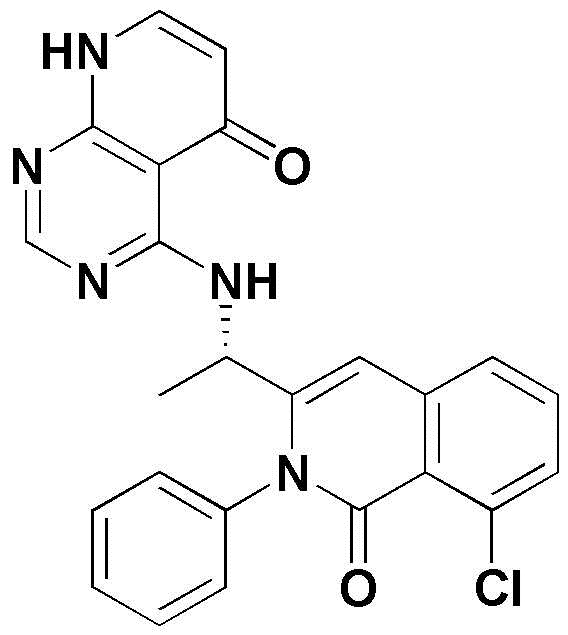
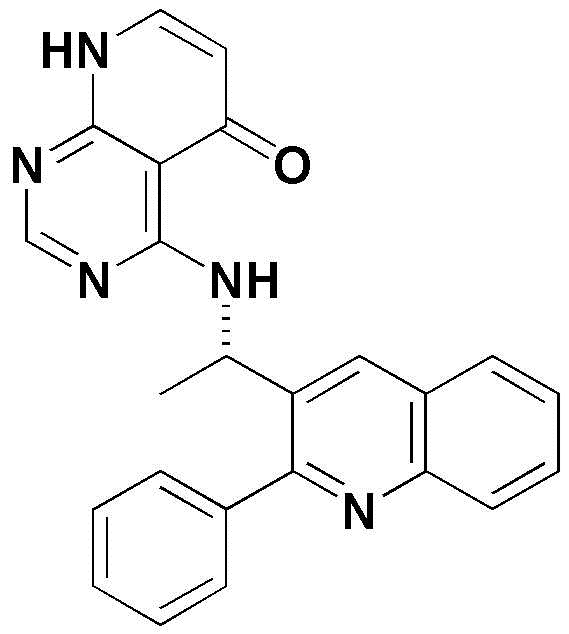

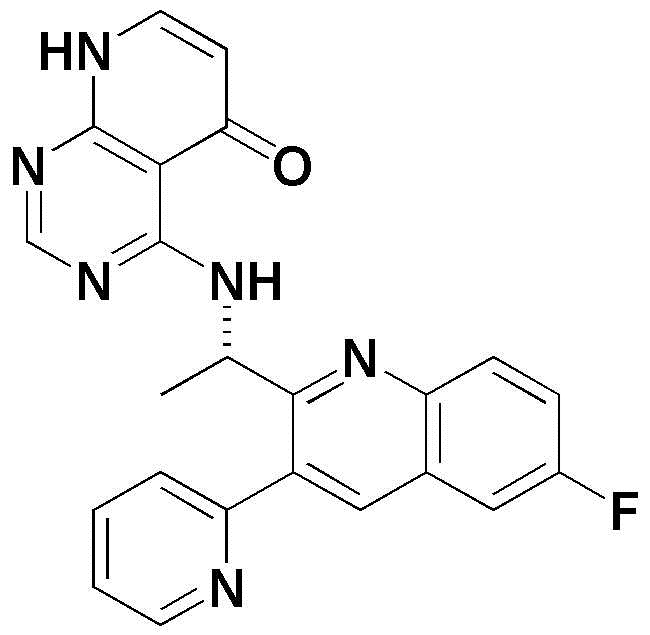
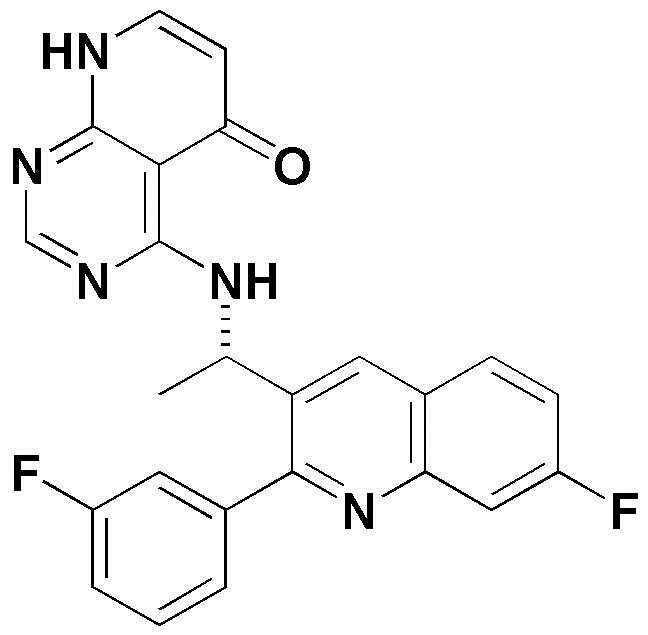
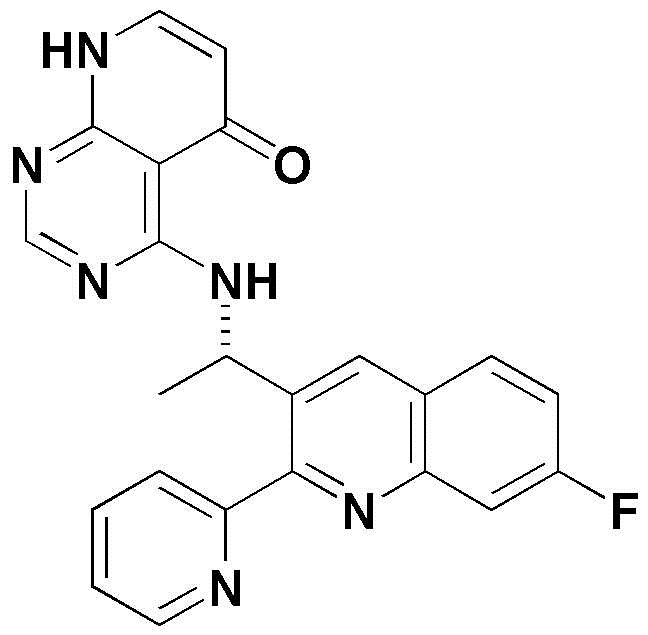
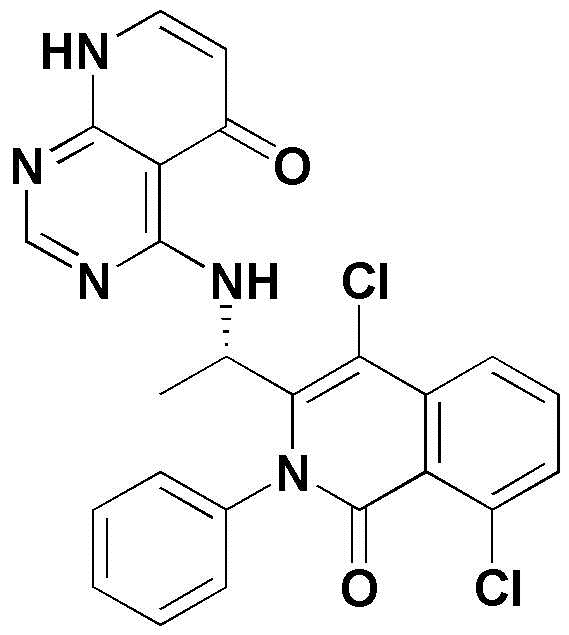
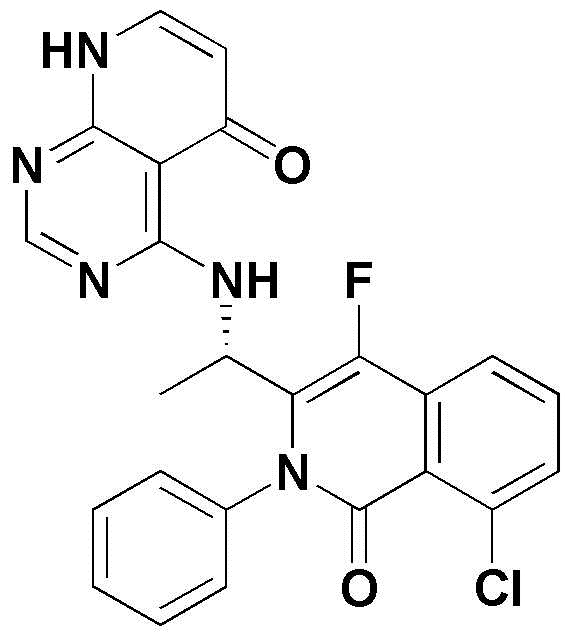
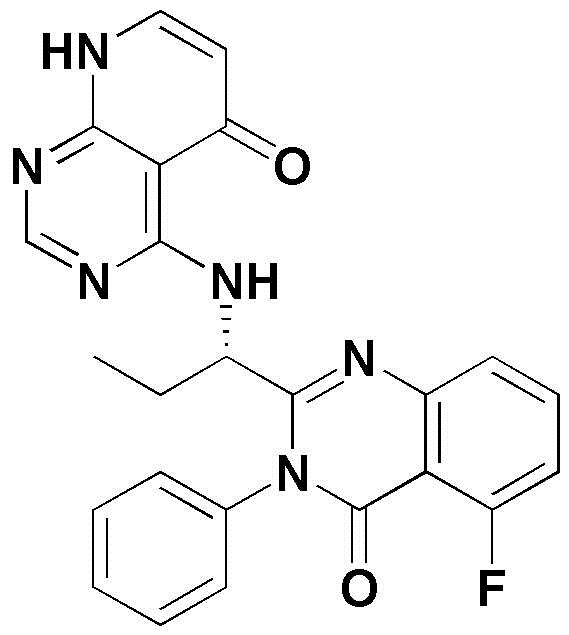
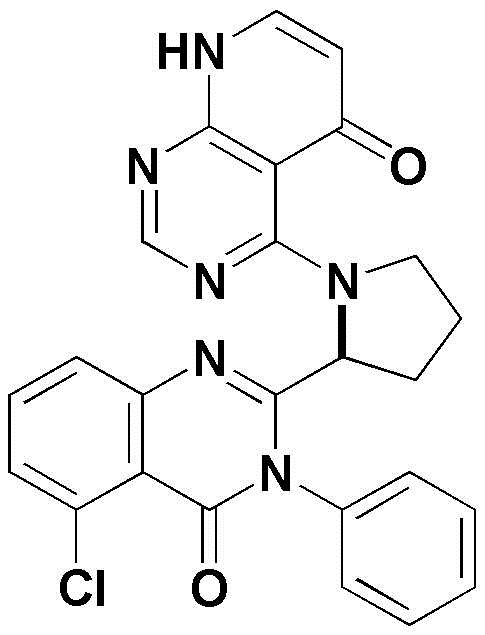
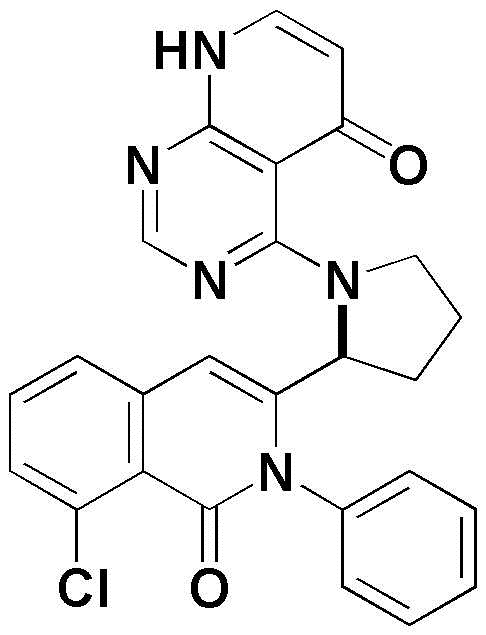

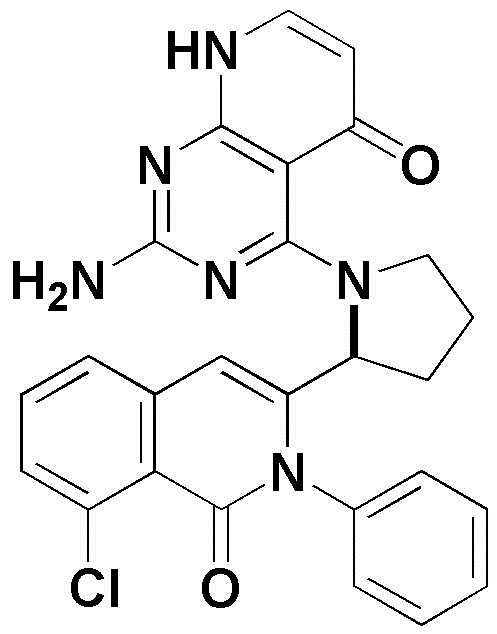


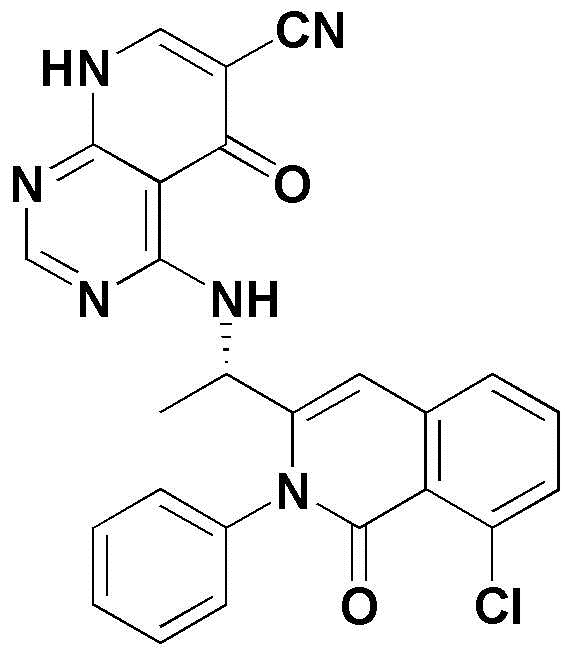
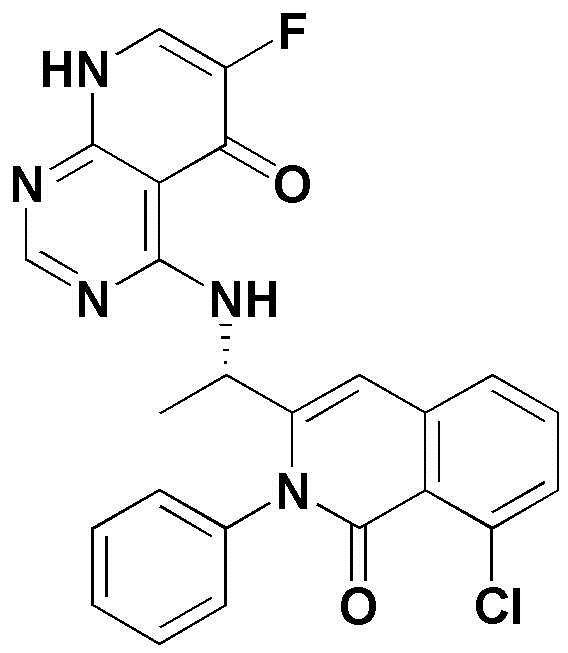
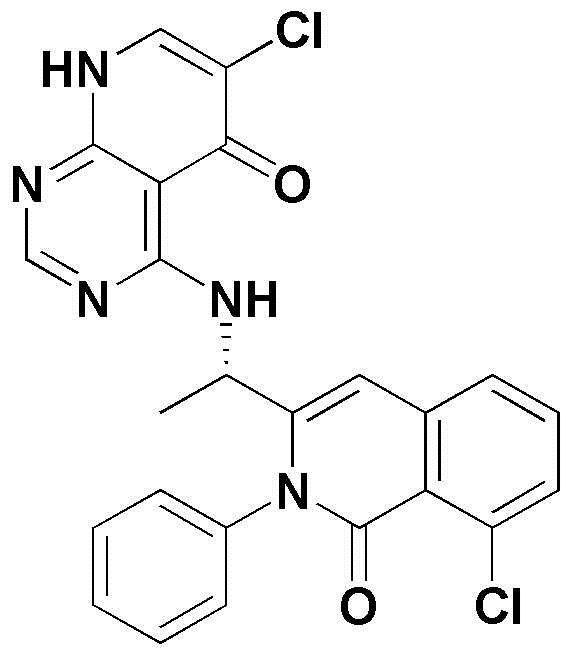


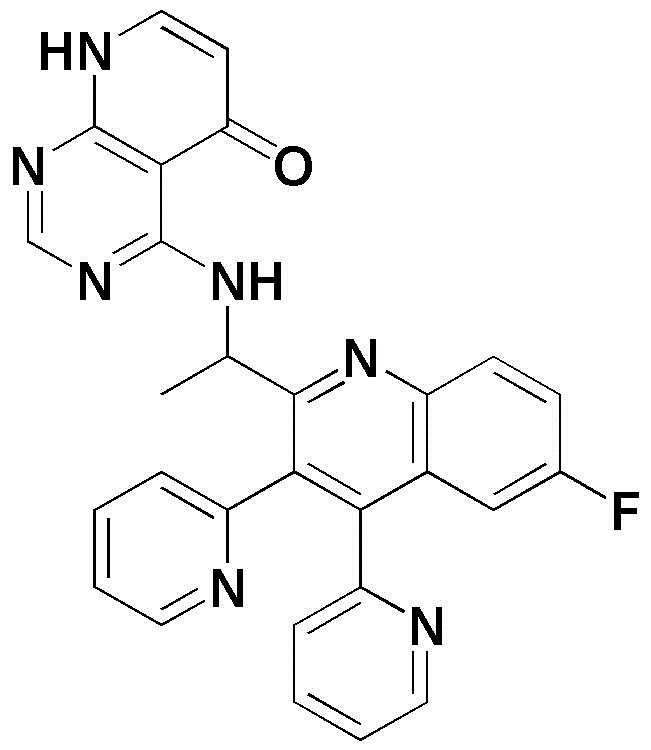
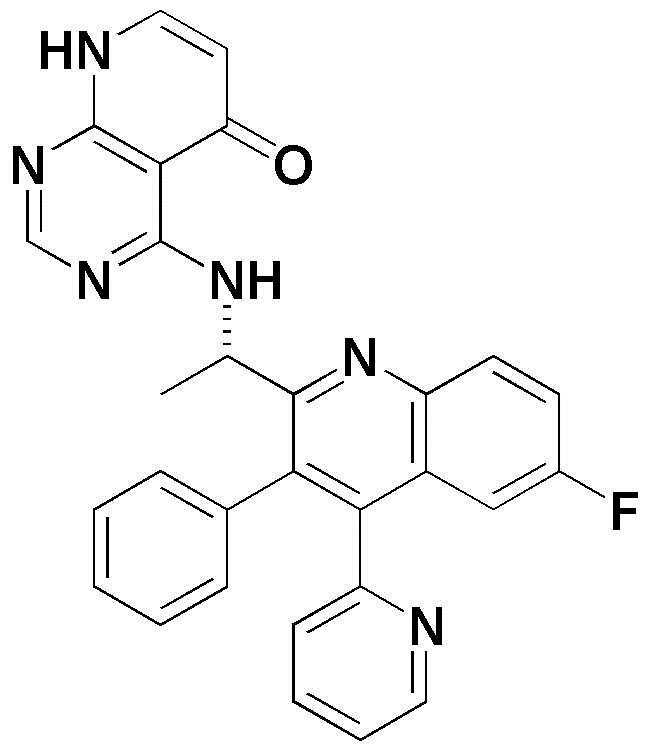

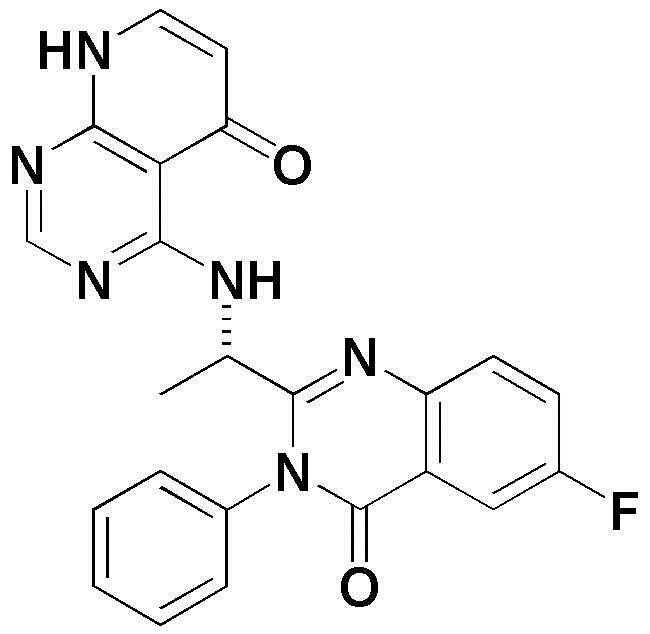
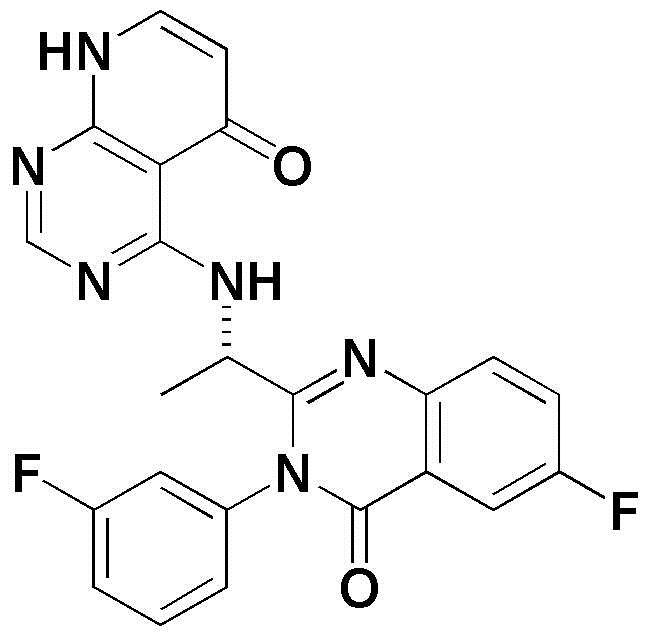


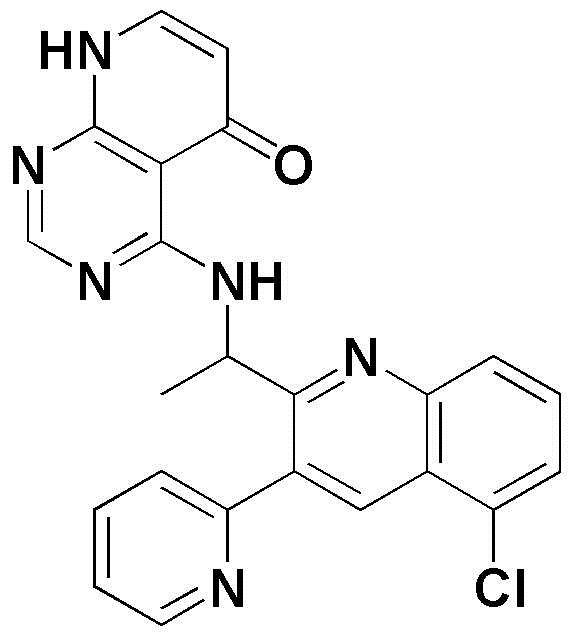

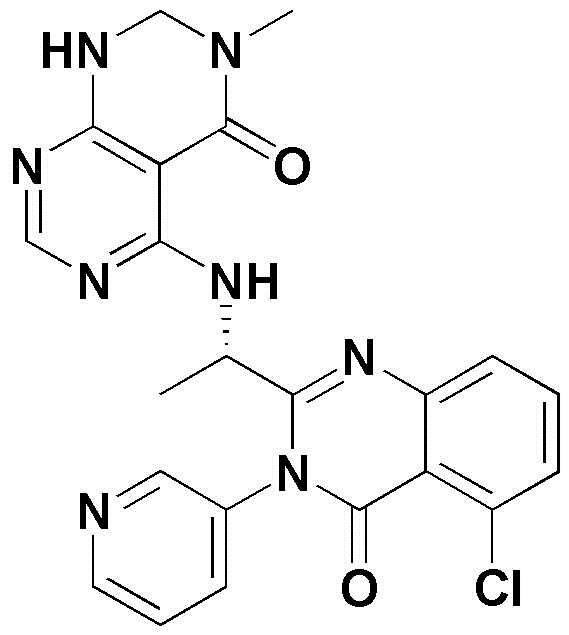


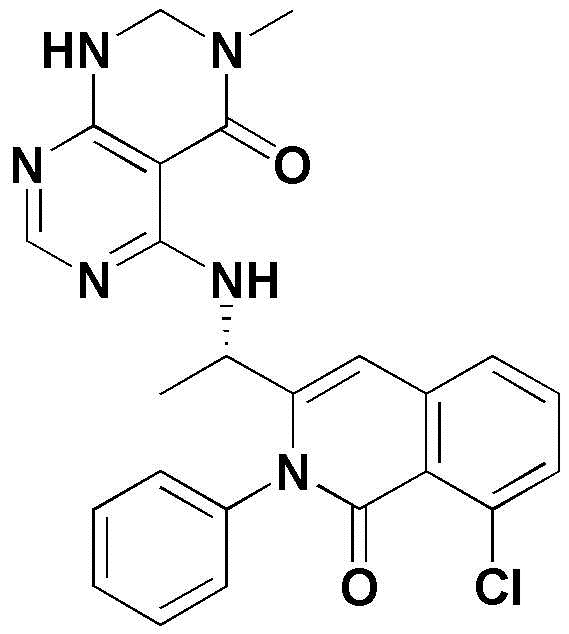
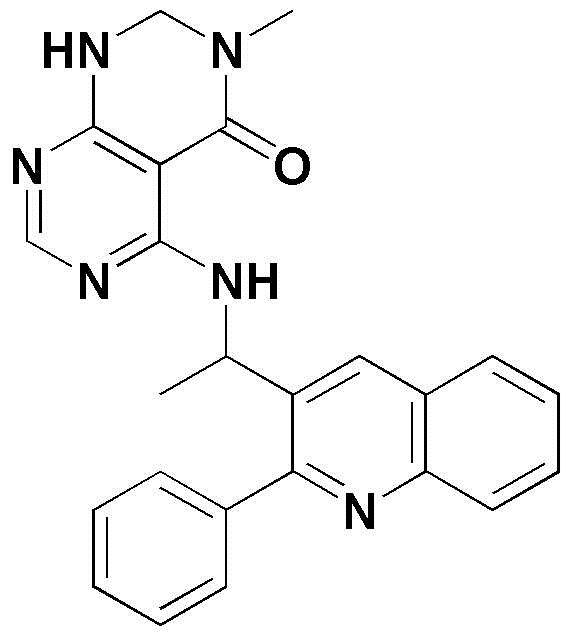

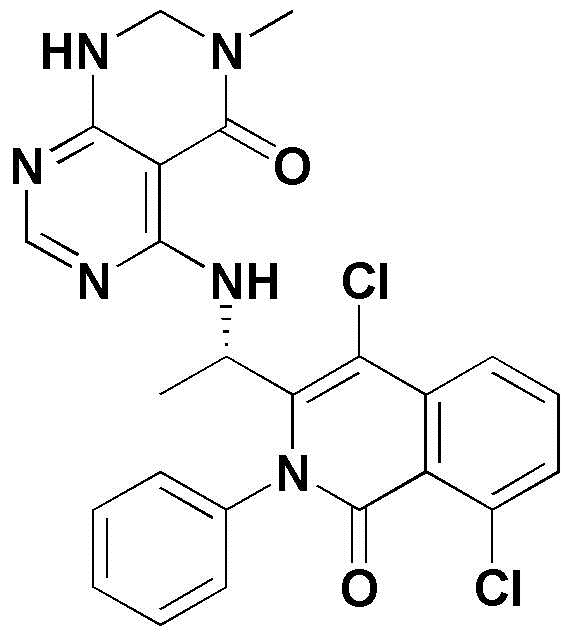

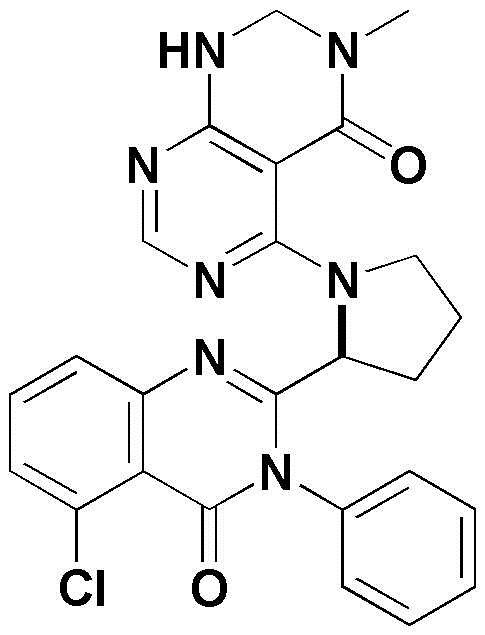

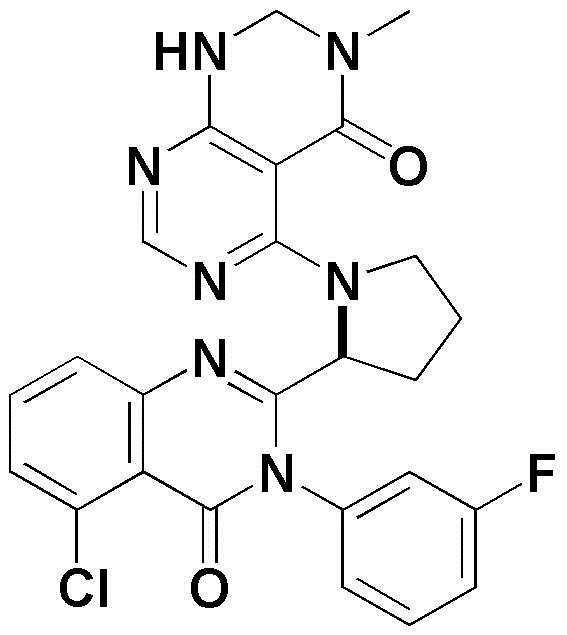

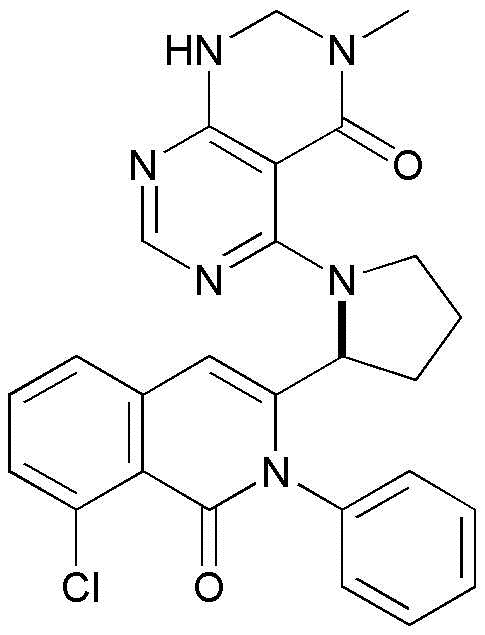

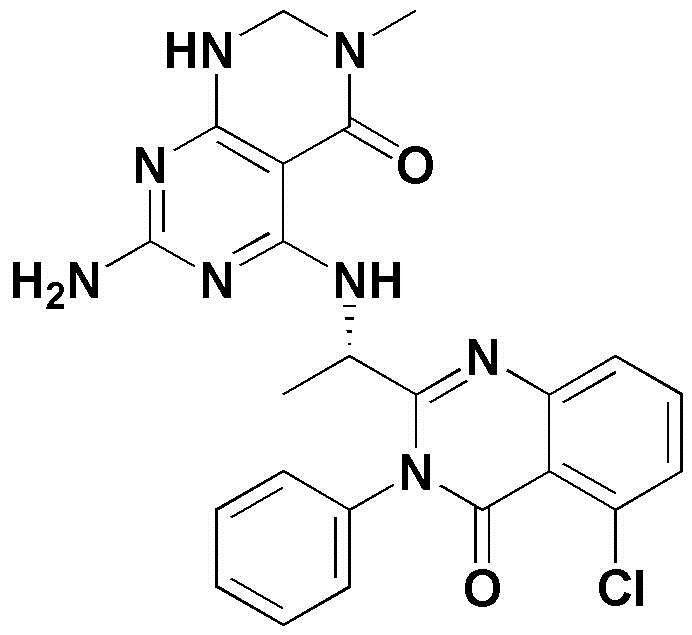
Таблица 2
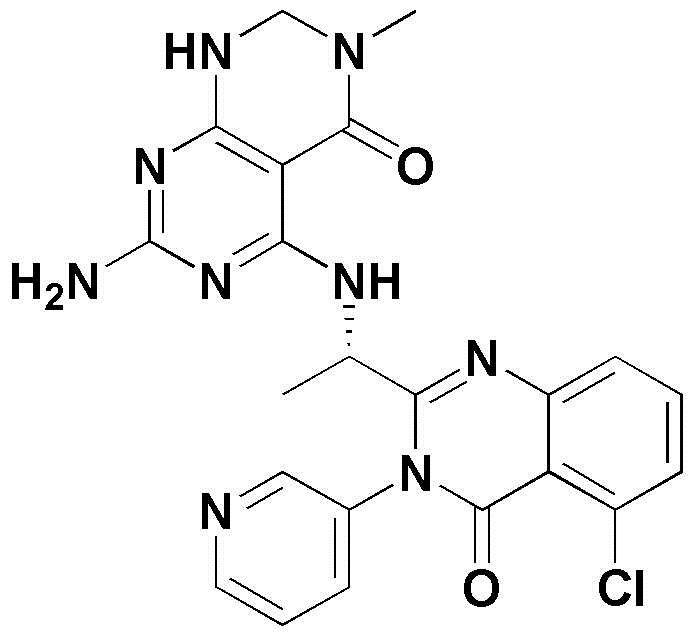
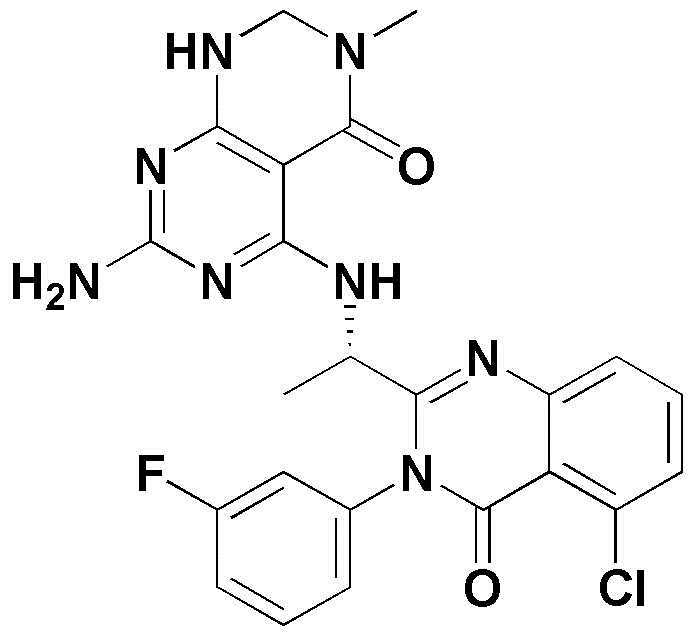
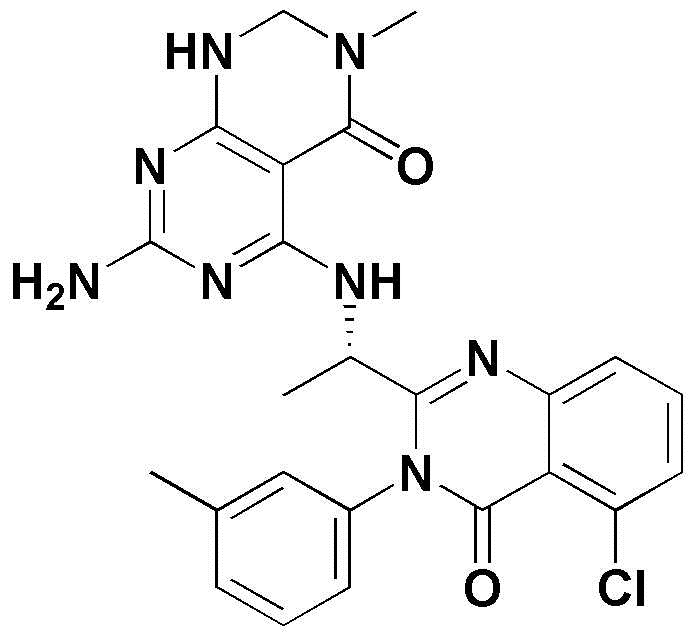

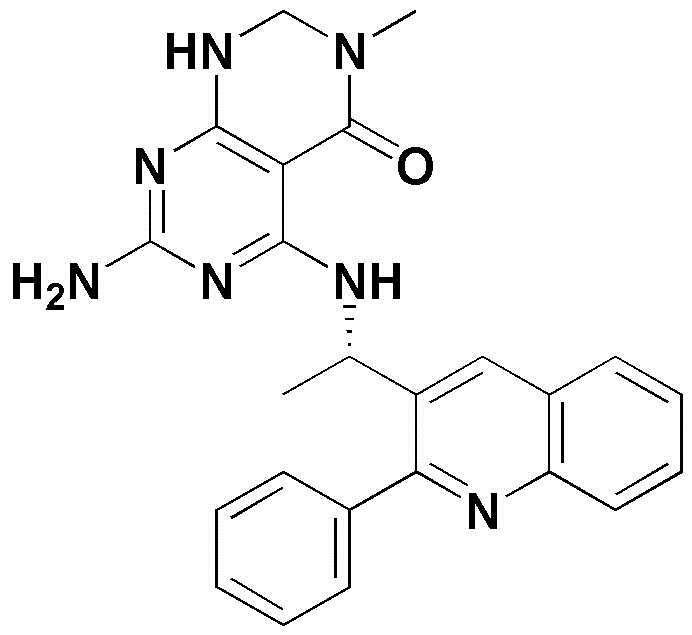

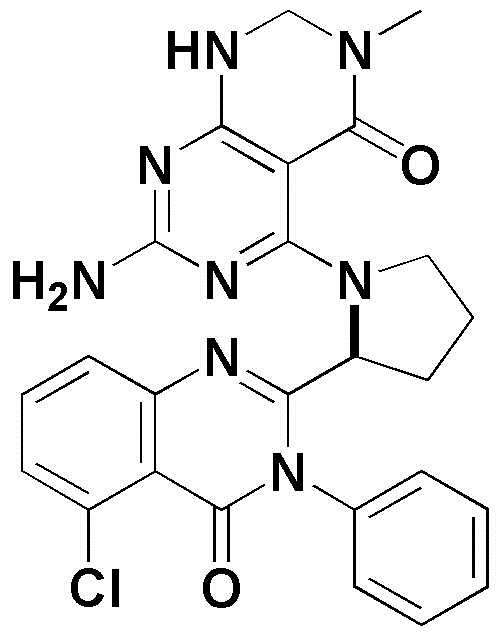

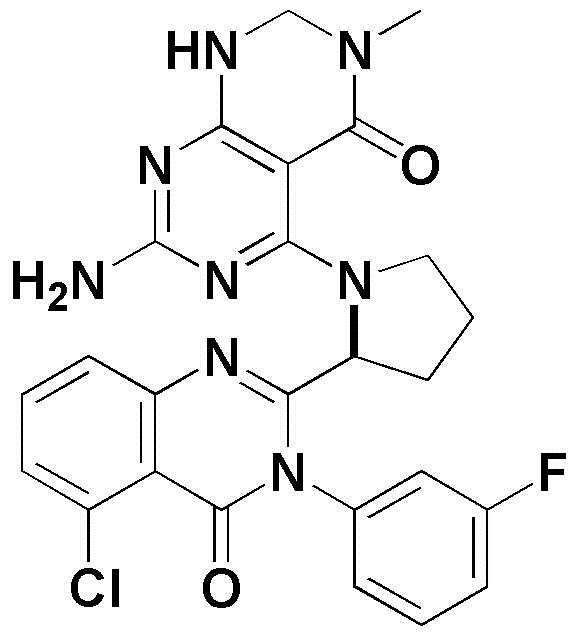

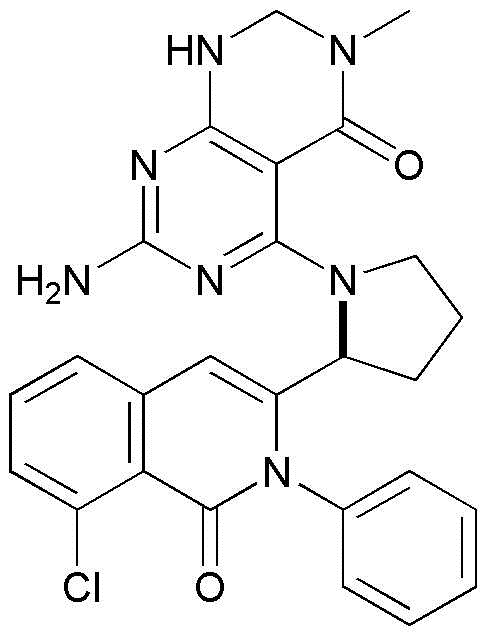

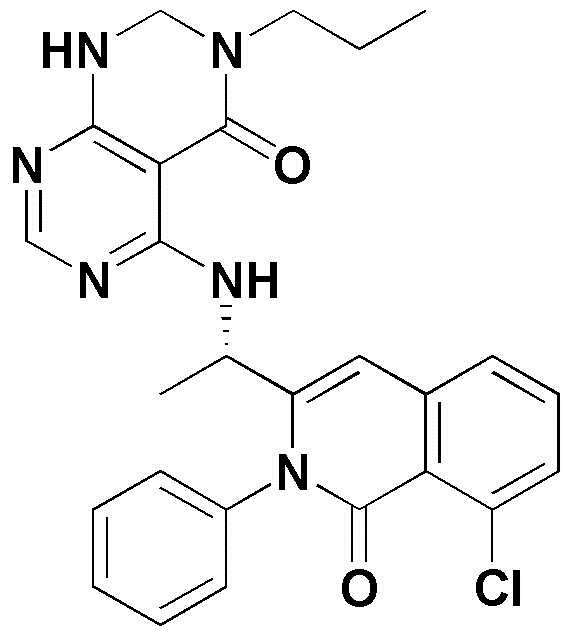
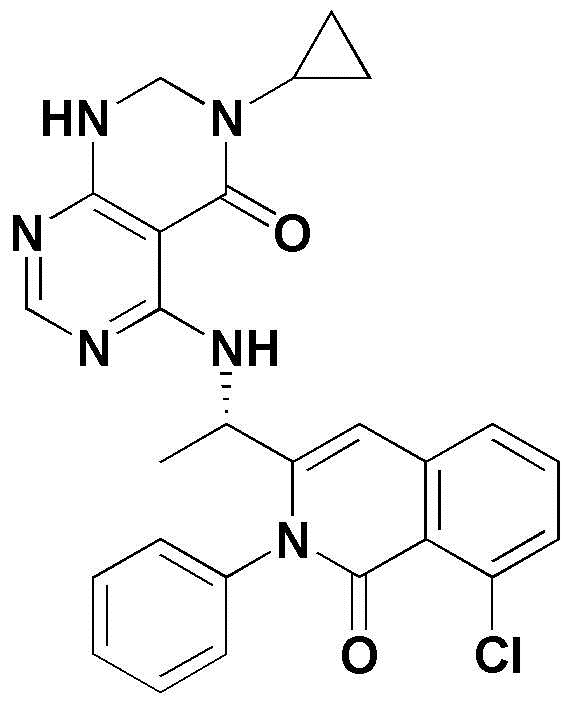
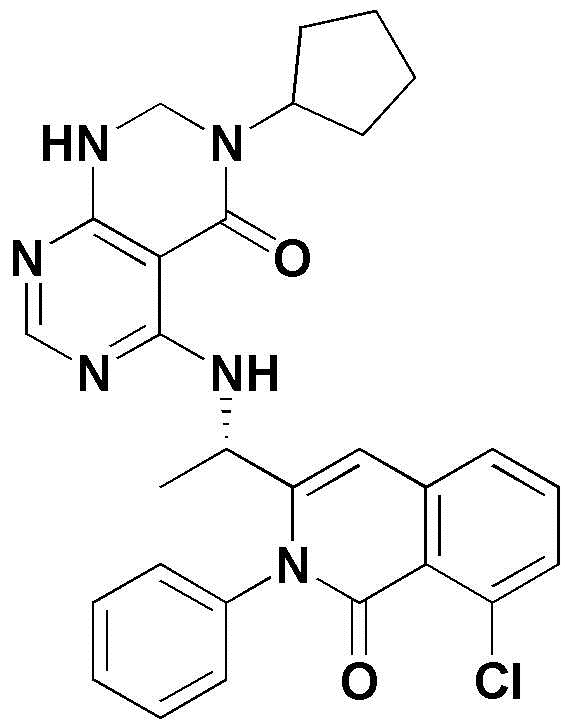
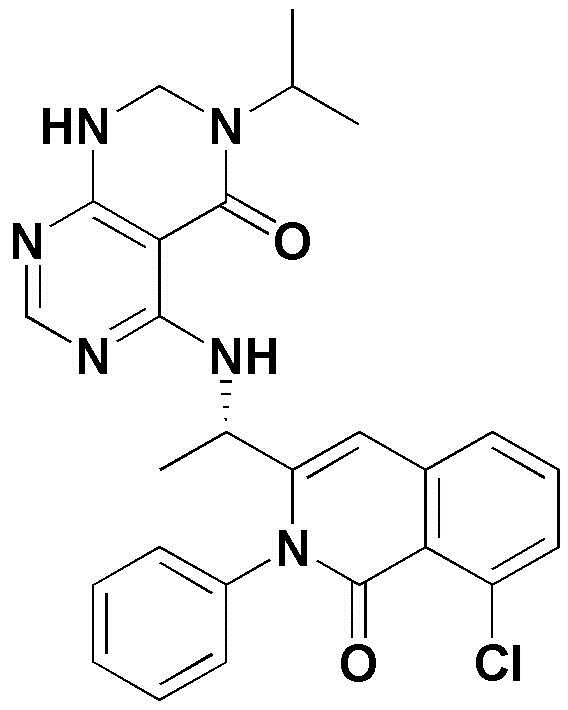
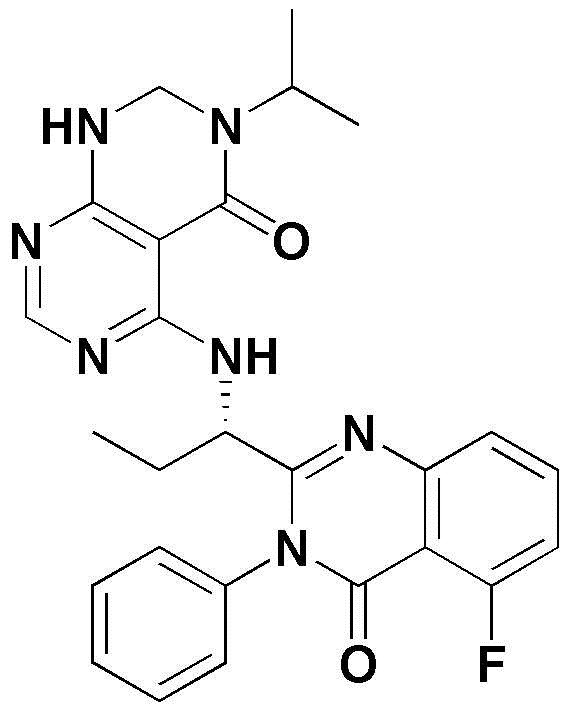

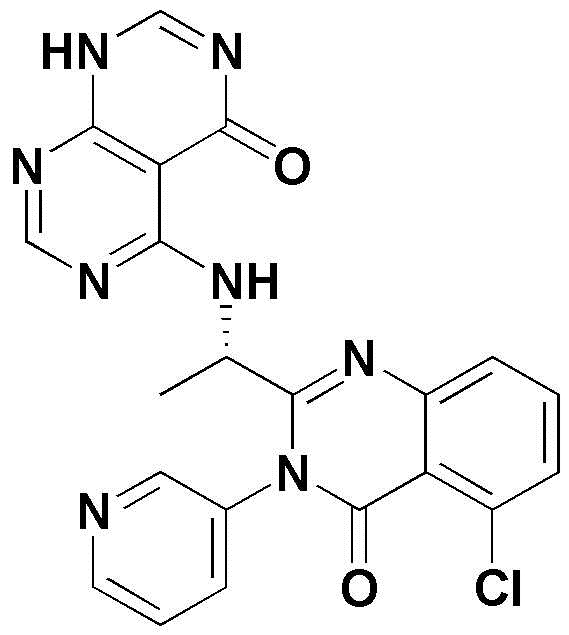
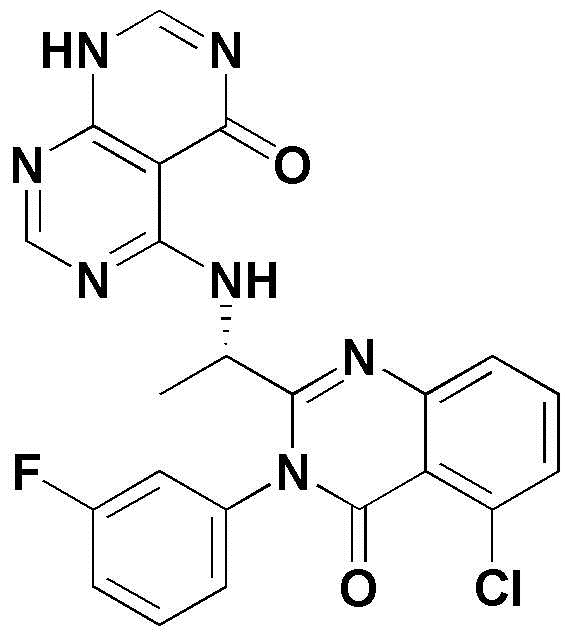
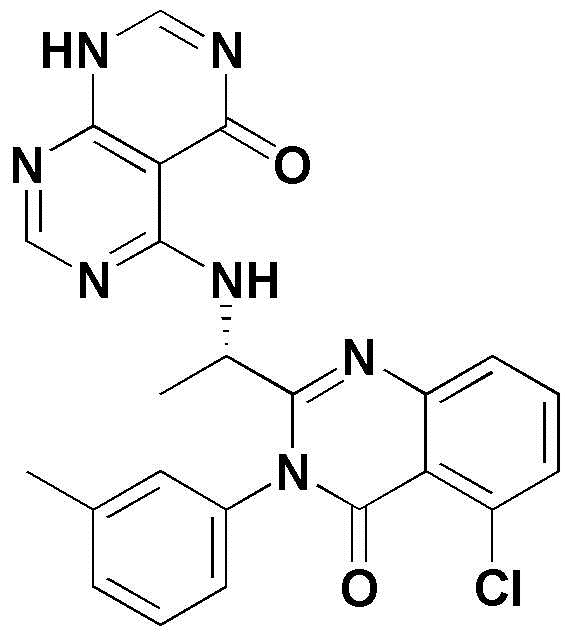


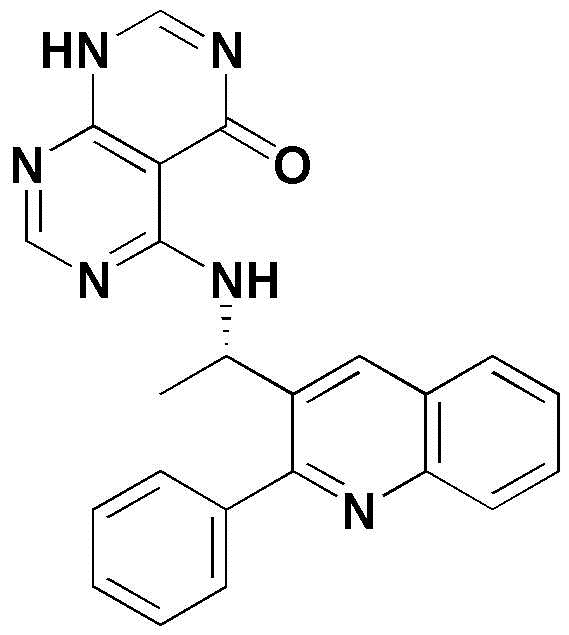
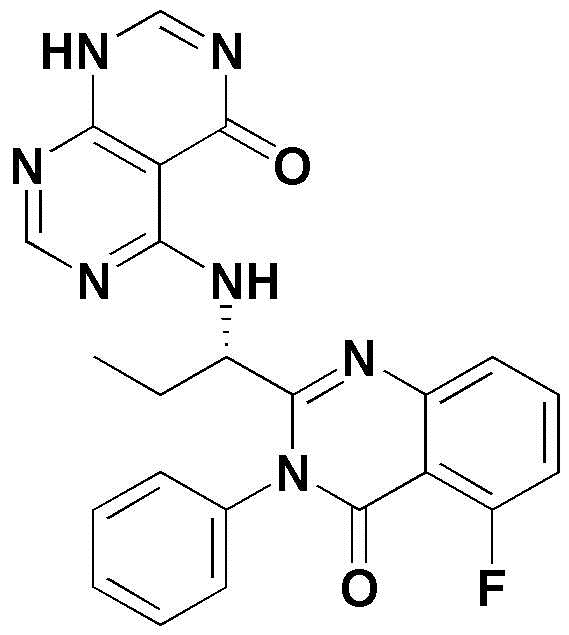
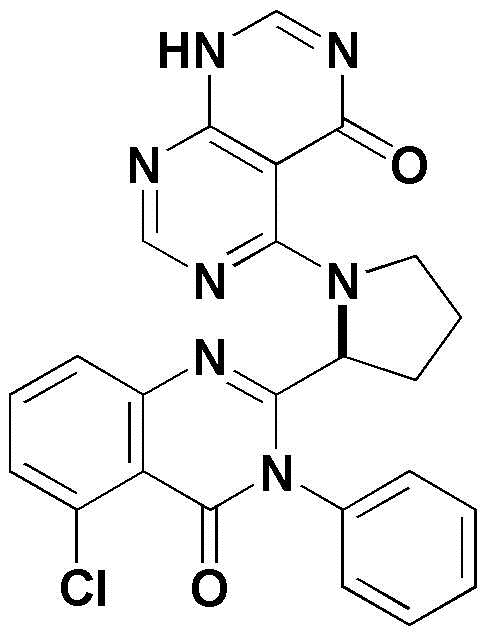

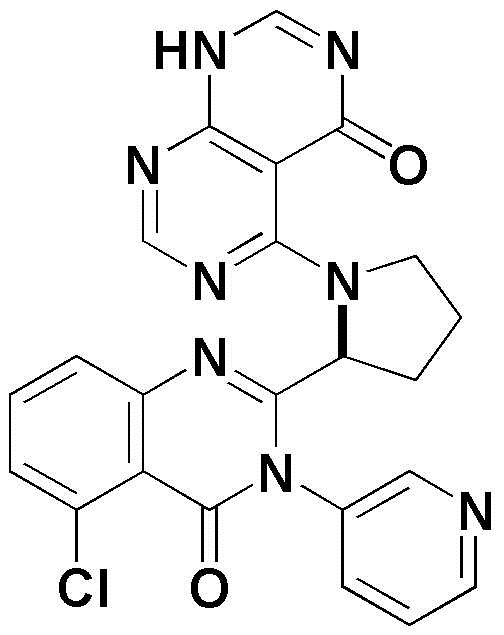
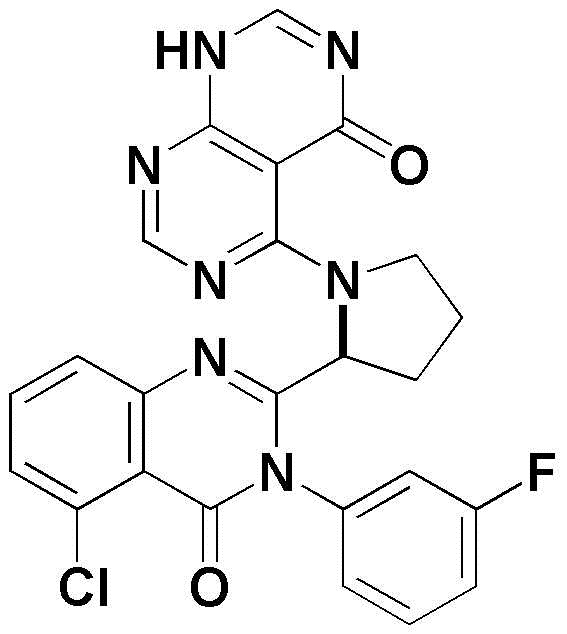
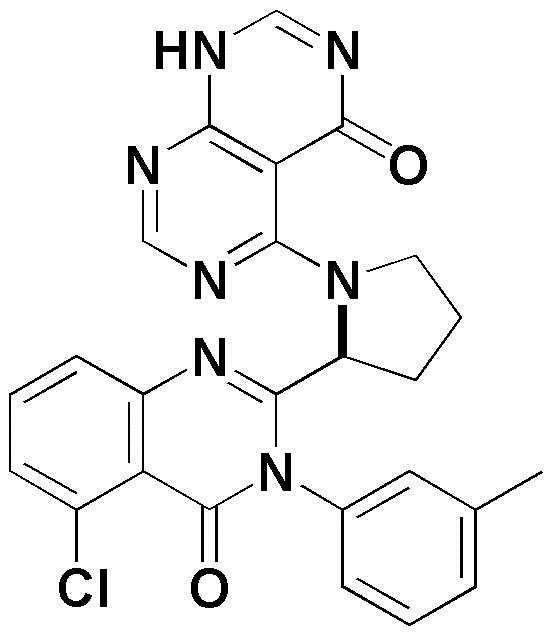


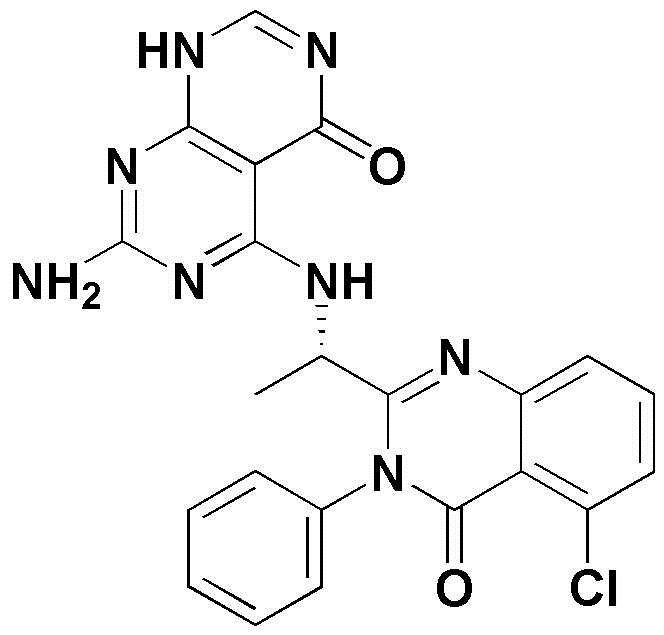


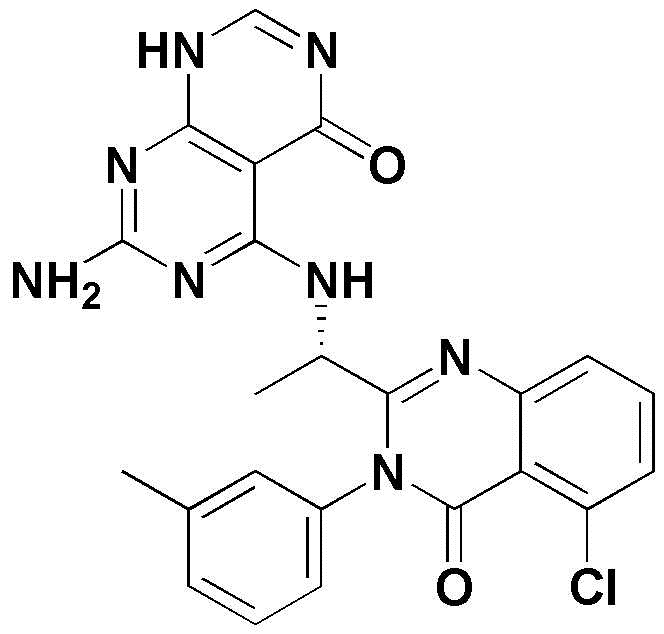
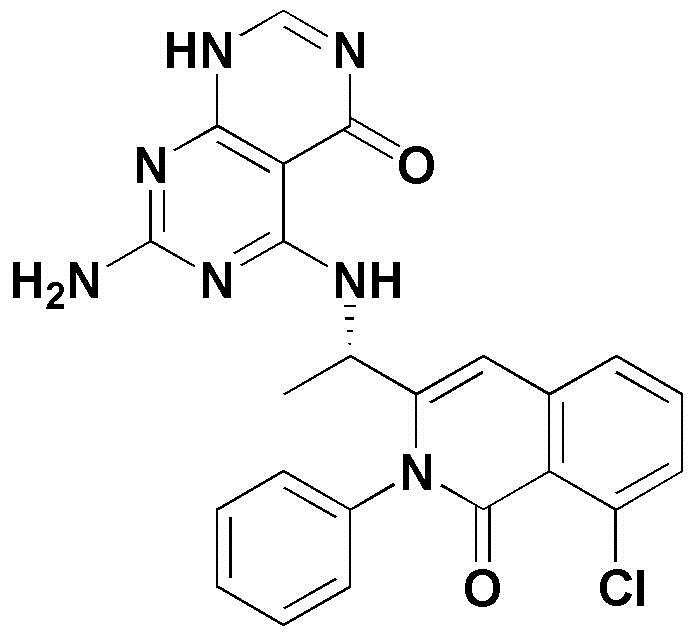



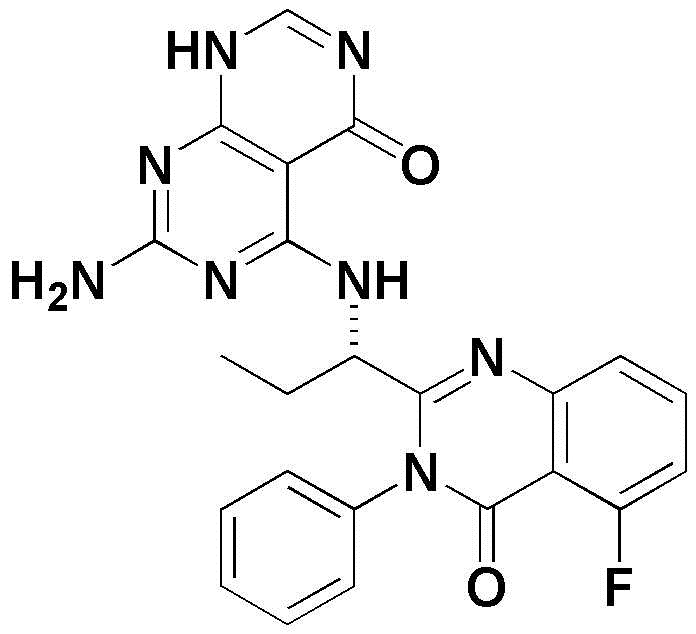


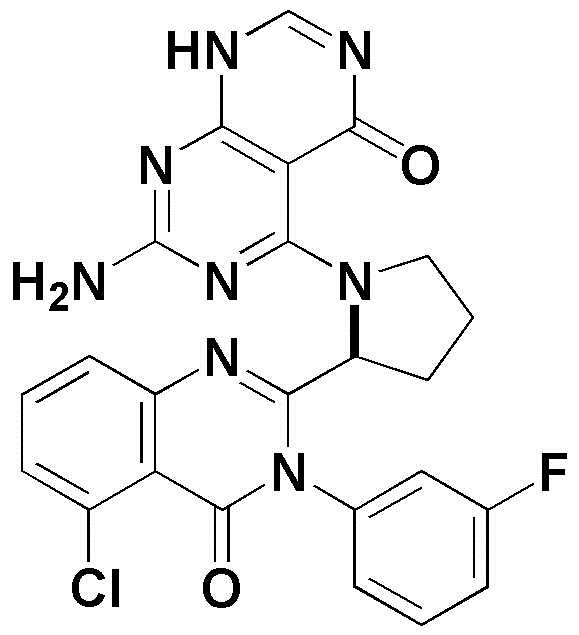

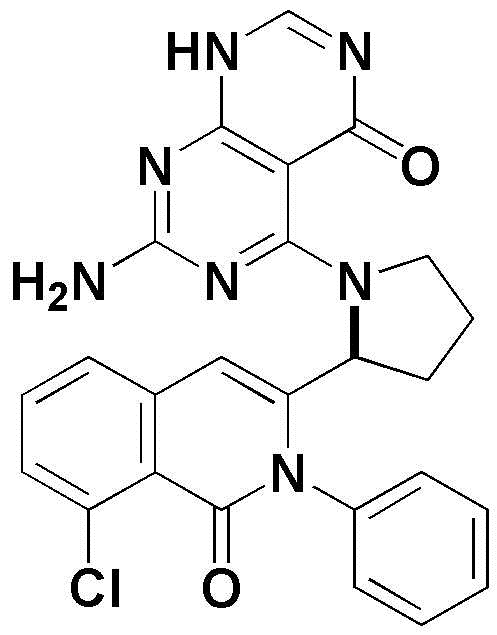
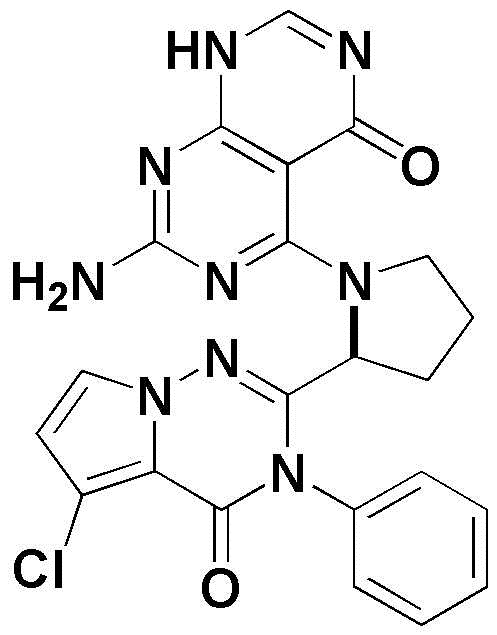
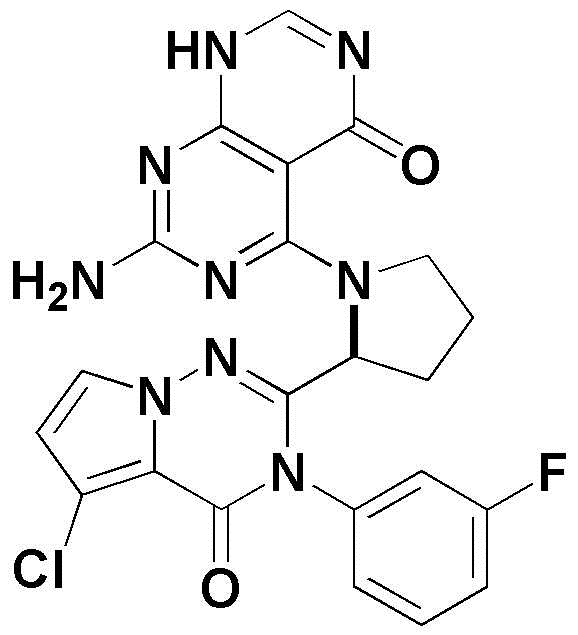
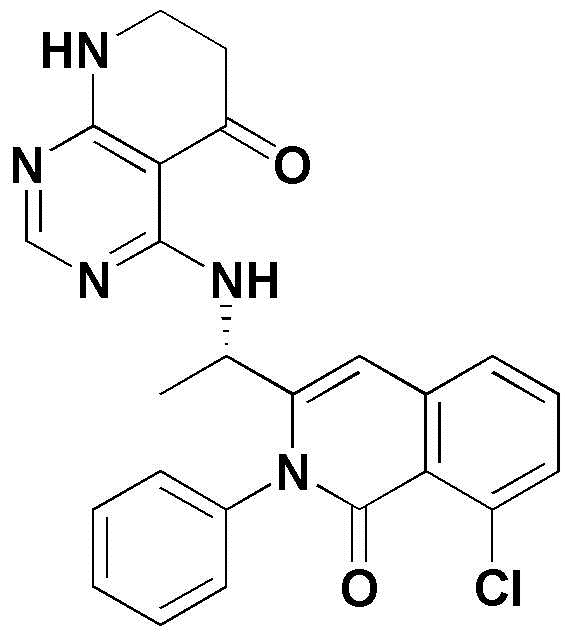
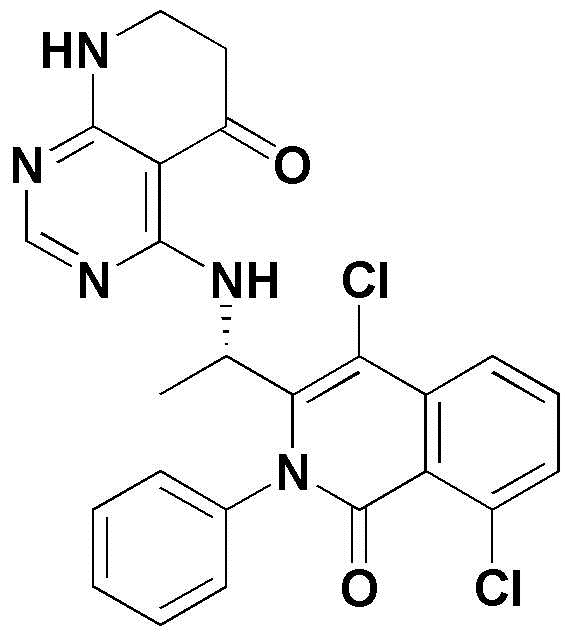
Экспериментальный Пример 1: Ингибирование фосфатидилинозитол 3-киназы альфа (PI3K α)
Ингибирование фосфатидилинозитол 3-киназы альфа (PI3K α) соединениями, полученными в Примерах 1 ~ 98, изучали в ходе описанного ниже эксперимента. Ингибирующую активность каждого соединения замеряли при следующих условиях: АТФ = 10 мкМ, и концентрация образца = 100 нМ.
Стадия 1: Клетки рака груди человека (MDA-MB-453), выращенные в DMEM (модифицированная по способу Дульбекко среда Игла, Hyclon, SH30243.01), в которую было добавлено 10% фетальной бычьей сыворотки (Hyclon, USA), распределяли в 12-луночный планшет с плотностью 1000000 клеток на лунку. Клетки стабилизировали при 37℃ CO2 в течение 24 часов, и затем добавляли каждое соединение на 1.5 часа. Клетки обрабатывали 10 нг/мл ЭФР (Эпидермальный фактор роста, 10 мкг/мл; R&D, 2150-C5) для повышения внутриклеточной активности PI3K альфа. Через 5 минут среду удаляли, и клетки промывали холодным PBS (фосфатно-солевой буферный раствор, Gibco, 14190-250). Затем PBS полностью удаляли пипеткой. Проводили исследование методом вестерн-блоттинга, описанное на стадии 2, для оценки внутриклеточной активности PI3K альфа.
Стадия 2: Вестерн-блоттинг
Простимулированные клетки переносили в пробирку объемом 1.5 мл, затем центрифугировали при 3000 об/мин в течение 1 минуты. Добавляли 100 мкл буферного раствора RIPA (буферный раствор для проведения радиоиммунологического анализа, 50 мM Tris-HCl, 5 мM ЭДТА, 150 мM NaCl, 1% NP-40, 1 мM PMSF (фенилметилсульфонил фторид, pH 8.0; ELPIS, Корея), выдерживали в холодильнике при 4ºС в течение 12 часов. Проводили центрифугирование при 4ºС и 14000 об/мин в течение 20 минут. Надосадочный раствор переносили в новую пробирку объемом 1.5 мл. Количественно определяли содержание белка методом с применением BCA (бицинхониновая кислота) и готовили образцы. Состав образцов был следующим: буфер для образца (ELPIS, EBA-1052) 5X, белок 10 мкг, и 1X буфер для образца до общего объема 20 мкл. Образец нагревали при 100℃ в течение 5 минут. Испаряющиеся пары воды конденсировались в холодильнике. Капли жидкости на стенках сгоняли вниз, центрифугируя в течение нескольких секунд. Образец переносили в 10% SDS (додецилсульфат натрия) акриламидный гель для разделения. Выделенный белок переносили на ПВДФ (поливинилдифторидную) мембрану и перемешивали с pAkt (фосфопротеинкиназа B) антителом (Ser473 или Thr308; Cell signaling, 9271s или 13038s) 12 часов при 4ºС. Мембрану промывали раствором TBST (Tris-забуференный солевой раствор с Tween 20, 10 мM Tris-HCl, pH 7.5, 150 мM NaCl, 0.1% Tween-20) три раза по 5 минут, затем добавляли вторичные антитела (антитела кролика, Santacruz,sc-2004) и перемешивали при комнатной температуре 2 часа. Мембрану промывали раствором TBST три раза по 10 минут, затем опрыскивали раствором ECL (усилитель хемилюминесценции, Thermo, NCI34095KR). Исследовали полосы с помощью LAS-3000.
Экспериментальный Пример 2: Ингибирование фосфатидилинозитол 3-киназы бета (PI3K β)
Ингибирование фосфатидилинозитол 3-киназы бета (PI3K β) соединениями, полученными в Примерах 1 ~ 98, изучали в ходе описанного ниже эксперимента. Ингибирующую активность каждого соединения замеряли при следующих условиях: АТФ = 10 мкМ, и концентрация образца = 100 нМ.
Клетки рака предстательной железы человека (PC3 клетки), выращенные в DMEM (модифицированная по способу Дульбекко среда Игла, Hyclon, SH30243.01), в которую было добавлено 10% фетальной бычьей сыворотки (Hyclon, USA), распределяли в 12-луночный планшет с плотностью 1000000 клеток на лунку. Клетки стабилизировали при 37℃ CO2 в течение 24 часов, и затем добавляли каждое соединение на 1.5 часа. Клетки обрабатывали 10 нг/мл LPA (лизофосфатидная кислота, 10 мкг/мл; R&D, 2150-C5) для повышения внутриклеточной активности PI3K бета. Через 5 минут среду удаляли, и клетки промывали холодным PBS (фосфатно-солевой буферный раствор, Gibco, 14190-250). Затем PBS полностью удаляли пипеткой. Проводили исследование методом вестерн-блоттинга согласно методике, аналогичной описанной для стадии 2 в Экспериментальном Примере 1, для оценки внутриклеточной активности PI3K бета.
Экспериментальный Пример 3: Ингибирование фосфатидилинозитол 3-киназы гамма (PI3K γ)
Ингибирование фосфатидилинозитол 3-киназы гамма (PI3K γ) соединениями, полученными в Примерах 1 ~ 98, изучали в ходе описанного ниже эксперимента. Ингибирующую активность каждого соединения замеряли при следующих условиях: АТФ = 10 мкМ, и концентрация образца = 100 нМ.
Макрофаги (RAW264.7), выращенные в DMEM (модифицированная по способу Дульбекко среда Игла, Hyclon, SH30243.01), в которую было добавлено 10% фетальной бычьей сыворотки (Hyclon, USA), распределяли в 12-луночный планшет с плотностью 1000000 клеток на лунку. Клетки стабилизировали при 37℃ CO2 в течение 24 часов, и затем добавляли каждое соединение на 1.5 часа. Клетки обрабатывали 10 нг/мл C5a (компонент комплемента 5a, 10 мкг/мл; R&D, 2150-C5) для повышения внутриклеточной активности PI3K гамма. Через 5 минут среду удаляли, и клетки промывали холодным PBS (фосфатно-солевой буферный раствор, Gibco, 14190-250). Затем PBS полностью удаляли пипеткой. Проводили исследование методом вестерн-блоттинга согласно методике, аналогичной описанной для стадии 2 в Экспериментальном Примере 1, для оценки внутриклеточной активности PI3K гамма.
Экспериментальный Пример 4: Ингибирование фосфатидилинозитол 3-киназы дельта (PI3K δ)
Ингибирование фосфатидилинозитол 3-киназы дельта (PI3K δ) соединениями, полученными в Примерах 1 ~ 98, изучали в ходе описанного ниже эксперимента. Ингибирующую активность каждого соединения замеряли при следующих условиях: АТФ = 10 мкМ, и концентрация образца = 100 нМ.
Клетки Раджи, выращенные в RPMI1640 (Hyclone, SH30027.02) с добавлением 10% фетальной бычьей сыворотки (Hyclon, USA) распределяли в 12-луночный планшет с плотностью 1000000 клеток на лунку. Клетки стабилизировали при 37℃ CO2 в течение 24 часов, и затем добавляли каждое соединение на 1.5 часа. Клетки обрабатывали 0.25 мкг/мл IgM (иммуноглобулин M, Southern Biotech, США) для повышения внутриклеточной активности PI3K дельта. Через 30 минут среду удаляли, и клетки промывали холодным PBS (фосфатно-солевой буферный раствор, Gibco, 14190-250). Затем PBS полностью удаляли пипеткой. Проводили исследование методом вестерн-блоттинга согласно методике, аналогичной описанной для стадии 2 в Экспериментальном Примере 1, для оценки внутриклеточной активности PI3K дельта.
Исследовали ингибирование фосфатидилинозитол 3-киназы альфа, бета, гамма и дельта (PI3K α, β, γ и δ) соединениями, полученными в Примерах 1 ~ 98, и результаты, полученные в Экспериментальных примерах 1 ~ 4, приведены в таблице 3.
Таблица 3
(p110α/p85α)(h)
(p110β/p86α)(h)
(p120γ)(h)
(p110δ/p85α)(h)
В таблице 3:
+ означает “больше 500 нM”;
++ означает “больше 10 нM ~ меньше 500 нM”; и
+++ означает “меньше 10 нM”.
Как показано в таблице 3, в результате исследования ингибирования PI3K α, β, γ и δ соединениями, имеющими формулу 1 по настоящему изобретению, соединения по настоящему изобретению показали прекрасную активность в ингибировании PI3K α, β, γ и δ. В частности, данные соединения ингибировали активность PI3 киназы γ или δ даже в очень низких концентрациях.
Таким образом, соединения по настоящему изобретению могут работать как ингибиторы PI3 киназы, и их можно эффективно применять для профилактики или лечения заболеваний, связанных с PI3 киназой, включая раковые заболевания, такие как злокачественные новообразования в крови, рак яичника, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстой кишки, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга; аутоиммунное заболевание, такое как ревматоидный артрит, системная красная волчанка, рассеянный склероз, диабет 1 типа, гиперфункция щитовидной железы, миастения, болезнь Крона, анкилоизирующий спондилит, псориаз, аутоиммунный атрофический гастрит и синдром Сёгрена; и респираторное заболевание, такое как хроническое обструктивное заболевание легких (ХОЗЛ), ринит, астма, хронический бронхит, хроническое воспалительное заболевание легких, силикоз, легочный саркоидоз, плеврит, альвеолит, васкулит, эмфизема, пневмония и бронхоэктаз.
Способы получения по настоящему изобретению, представленные схемами реакций 1 ~ 3, являются новыми способами, которые не только облегчают получение соединений, имеющих формулы 11, 20 и 23, которые являются промежуточными соединениями в синтезе соединения, имеющего формулу 1, но также включают различные стадии получения соединения, имеющего формулу 1, посредством реакции промежуточных соединений, имеющих формулы 11, 20 и 23, с соединением, которое может реагировать с заместителями в указанных соединениях.
Пример изготовления 1: Приготовление порошков
Соединение, имеющее формулу 1 - 2 г
Лактоза - 1 г
Порошки готовили, смешивая все перечисленные выше компоненты и заполняя смесью воздухонепроницаемые пакеты, согласно общеизвестным способам приготовления порошков.
Пример изготовления 2: Приготовление таблеток
Соединение, имеющее формулу 1 - 100 мг
Кукурузный крахмал - 100 мг
Лактоза - 100 мг
Стеарат магния - 2 мг
Таблетки готовили, смешивая все перечисленные выше компоненты согласно общеизвестным способам приготовления таблеток.
Пример изготовления 3: Приготовление капсул
Соединение, имеющее формулу 1 - 100 мг
Кукурузный крахмал - 100 мг
Лактоза - 100 мг
Стеарат магния - 2 мг
Капсулы готовили, смешивая все перечисленные выше компоненты и заполняя смесью желатиновые капсулы, согласно общеизвестным способам приготовления капсул.
Пример изготовления 4: Приготовление раствора для инъекций
Соединение, имеющее формулу 1 - 100 мг
Маннит - 180 мг
Na2HPO4ㆍ2H2O - 26 мг
Дистиллированная вода - 2974 мг
Растворы для инъекций готовили, смешивая все перечисленные выше компоненты, согласно общеизвестным способам приготовления растворов для инъекций.
Пример изготовления 5: Приготовление здоровой пищи
Соединение, имеющее формулу 1 - 100 нг
Витамин A ацетат - 70 мг
Витамин E - 1.0 мг
Витамин B1 - 0.13 мг
Витамин B2 - 0.15 мг
Витамин B6 - 0.5 мг
Витамин B12 - 0.2 мкг
Витамин C - 10 мг
Биотин - 10 мкг
Никотинамид - 1.7 мг
Фолиевая кислота - 50 мкг
Кальция пантотенат - 0.5 мг
Минеральные вещества - достаточное количество
Сульфат железа - 1.75 мг
Оксид цинка - 0.82 мг
Карбонат магния - 25.3 мг
Гидрофосфат калия - 15 мг
Дигидрофосфат калия - 55 мг
Цитрат калия - 90 мг
Карбонат кальция - 100 мг
Хлорид магния - 24.8 мг
Витамины и минеральные вещества смешивали в соответствии с предпочтительными соотношениями для композиций здорового питания. Однако состав композиции можно изменять. Компоненты смешивали согласно общеизвестным способам приготовления здорового питания, и затем готовили композицию здорового питания стандартным способом.
Квалифицированным специалистам в данной области будет понятно, что концепции и частные варианты осуществления, указанные в приведенном выше описании, можно легко использовать в качестве основы для модифицирования или создания других вариантов осуществления для достижения тех же целей по настоящему изобретению. Квалифицированным специалистам в данной области будет понятно, что такие эквивалентные варианты осуществления не выходят за рамки сути и объема настоящего изобретения, указанных в Формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННЫЕ СОЕДИНЕНИЯ | 2014 |
|
RU2691105C1 |
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНИЛА И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2021 |
|
RU2839891C1 |
| СОЕДИНЕНИЯ 2,3-ДИГИДРОХИНАЗОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NaV1.8 | 2020 |
|
RU2833870C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРА КИНАЗЫ | 2017 |
|
RU2714206C1 |
| ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2019 |
|
RU2812128C2 |
| ПРОИЗВОДНЫЕ 2-ОКСОХИНАЗОЛИНА КАК ИНГИБИТОРЫ МЕТИОНИН АДЕНОЗИЛТРАНСФЕРАЗЫ 2A | 2019 |
|
RU2830169C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788148C2 |
| НОВЫЕ СОЕДИНЕНИЯ ЗАМЕЩЕННОГО N-(3-ФТОРПРОПИЛ)ПИРРОЛИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2742278C2 |
| НОВОЕ ПИРРОЛОПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕЕ, В ЧАСТНОСТИ, АГЕНТ ДЛЯ ПРЕДОТВРАЩЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ОПУХОЛЕЙ, И ТОМУ ПОДОБНОЕ, НА ОСНОВЕ ИНГИБИТОРНОГО ВОЗДЕЙСТВИЯ НА NAE | 2015 |
|
RU2658008C2 |
| ХИНАЗОЛИНОНЫ КАК ИНГИБИТОРЫ ПРОЛИЛГИДРОКСИЛАЗЫ | 2010 |
|
RU2528412C2 |
Изобретение относится к новому соединению формулы 1, его (S) изомеру или его фармацевтически приемлемой соли и к вариантам способа его получения. Соединения характеризуются селективным ингибированием PI3 киназы, выбранной из группы, состоящей из PI3Kα, PI3Kβ, PI3Kδ и PI3Kγ, и могут быть использованы для профилактики или лечения заболевания, выбранного из группы, состоящей из рака, выбранного из следующей группы: злокачественные новообразования в крови, рак яичника, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстой кишки, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга; аутоиммунного заболевания, выбранного из группы, состоящей из ревматоидного артрита, системной красной волчанки, рассеянного склероза, диабета 1 типа, гиперфункции щитовидной железы, миастении, болезни Крона, анкилоизирующего спондилита, псориаза, аутоиммунного атрофического гастрита и синдрома Сегрена; респираторного заболевания, выбранного из группы, состоящей из хронического обструктивного заболевания легких (ХОЗЛ), ринита, астмы, хронического бронхита, хронического воспалительного заболевания легких, силикоза, легочного саркоидоза, плеврита, альвеолита, васкулита, эмфиземы, пневмонии и бронхоэктаза. Соединения также могут быть использованы для здорового функционального питания для профилактики или облегчения заболевания, связанного с PI3 киназой. В соединении формулы 1

 представляет собой простую связь или двойную связь; A представляет собой атом углерода (С) или азота (N); R1 представляет собой атом водорода (Н) или -NH2; R2 представляет собой H, -CN, C1-5 линейный или разветвленный алкил, незамещенный C3-7 циклоалкил или атом галогена; R3 представляет собой H; R4 представляет собой Н или C1-5 линейный или разветвленный алкил; или R3 и R4 могут формировать 5-членный незамещенный гетероциклоалкил, содержащий один гетероатом N, вместе с атомами, сопряженными с ними; и R5 представляет собой
представляет собой простую связь или двойную связь; A представляет собой атом углерода (С) или азота (N); R1 представляет собой атом водорода (Н) или -NH2; R2 представляет собой H, -CN, C1-5 линейный или разветвленный алкил, незамещенный C3-7 циклоалкил или атом галогена; R3 представляет собой H; R4 представляет собой Н или C1-5 линейный или разветвленный алкил; или R3 и R4 могут формировать 5-членный незамещенный гетероциклоалкил, содержащий один гетероатом N, вместе с атомами, сопряженными с ними; и R5 представляет собой
 ,
,  ,
,  или
или  ,
,
где n представляет собой целое число в диапазоне 0 ~ 3, R6 представляет собой незамещенный или замещенный фенил или незамещенный или замещенный 6-членный гетероарил, содержащий один гетероатом N, указанный замещенный фенил и замещенный гетероарил содержат один или два заместителя, выбранных из группы, состоящей из атома галогена, C1-2 линейного или разветвленного алкила, R7 представляет собой H, атом галогена или незамещенный 6-членный гетероарил, содержащий один гетероатом N, и R8 представляет собой Н или галоген. 7 н. и 13 з.п. ф-лы, 3 табл., 103 пр.
1. Соединение формулы 1, его (S) изомер или фармацевтически приемлемая соль:
Формула 1
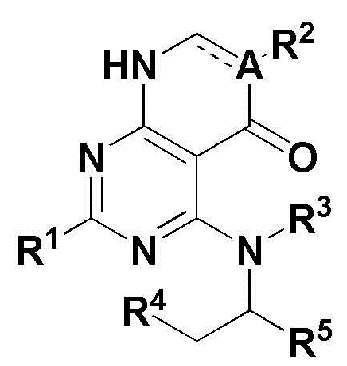
в формуле 1
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой атом водорода (Н) или -NH2;
R2 представляет собой H, -CN, C1-5 линейный или разветвленный алкил, незамещенный C3-7 циклоалкил или атом галогена;
R3 представляет собой H;
R4 представляет собой Н или C1-5 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5-членный незамещенный гетероциклоалкил, содержащий один гетероатом N, вместе с атомами, сопряженными с ними; и
R5 представляет собой
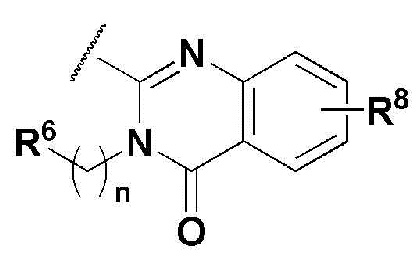 ,
, 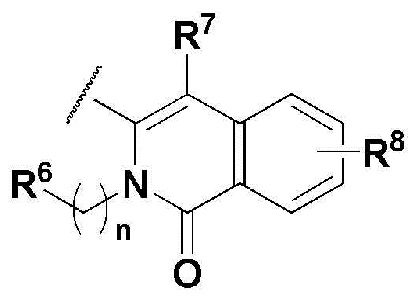 ,
,  или
или 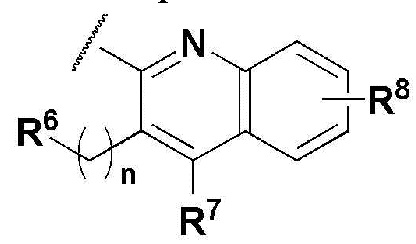 ,
,
где n представляет собой целое число в диапазоне 0 ~ 3,
R6 представляет собой незамещенный или замещенный фенил или незамещенный или замещенный 6-членный гетероарил, содержащий один гетероатом N, указанный замещенный фенил и замещенный гетероарил содержат один или два заместителя, выбранных из группы, состоящей из атома галогена, C1-2 линейного или разветвленного алкила,
R7 представляет собой H, атом галогена или незамещенный 6-членный гетероарил, содержащий один гетероатом N, и
R8 представляет собой Н или галоген.
2. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, где
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой H или -NH2;
R2 представляет собой H, -CN, C1-3 линейный или разветвленный алкил, незамещенный C3-5 циклоалкил или атом галогена;
R3 представляет собой H;
R4 представляет собой Н или C1-5 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5-членный незамещенный гетероциклоалкил, содержащий один гетероатом N, вместе с атомами, сопряженными с ними; и
R5 представляет собой
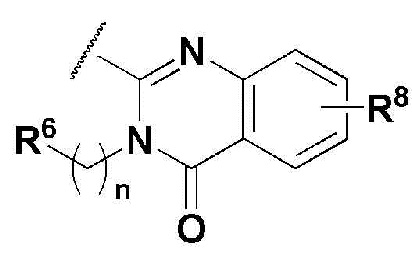 ,
,  ,
, 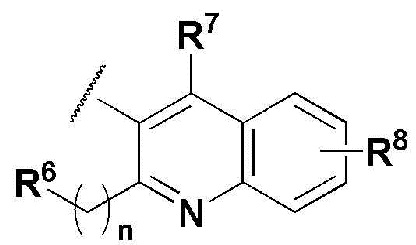 или
или 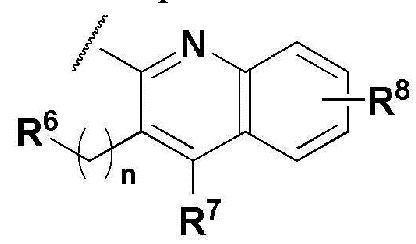 ,
,
где n представляет собой целое число в диапазоне от 0 до 1,
R6 представляет собой фенил или незамещенный или замещенный 6-членный гетероарил, содержащий один гетероатом N, указанный замещенный фенил и замещенный гетероарил содержат один или два заместителя, выбранных из группы, состоящей из атома галогена и C1-2 линейного или разветвленного алкила,
R7 представляет собой H, атом галогена или незамещенный 6-членный гетероарил, содержащий один гетероатом N, и
R8 представляет собой H или атом галогена.
3. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, где
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой H или -NH2;
R2 представляет собой H, -CN, C1-3 линейный или разветвленный алкил, незамещенный C3-5 циклоалкил или атом галогена;
R3 представляет собой H;
R4 представляет собой H или C1-3 линейный или разветвленный алкил; или
R3 и R4 могут формировать 5-членный незамещенный гетероциклоалкил, содержащий один атом N, вместе с атомами, сопряженными с ними; и
R5 представляет собой
 ,
,  ,
,  или
или  ,
,
где n представляет собой целое число в диапазоне от 0 до 1,
R6 представляет собой незамещенный или замещенный фенил или пиридинил,
указанный замещенный фенил и пиридинил содержат один или два заместителя, выбранных из группы, состоящей из атома галогена и C1-2 линейного или разветвленного алкила;
R7 представляет собой H, атом галогена или незамещенный 6-членный гетероарил, содержащий один гетероатом N, и
R8 представляет собой H или атом галогена.
4. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, где
 представляет собой простую связь или двойную связь;
представляет собой простую связь или двойную связь;
A представляет собой атом углерода (С) или азота (N);
R1 представляет собой H или -NH2;
R2 представляет собой H, -F, -Cl, -CN, метил, этил, пропил, изопропил, циклопропил или циклопентил;
R3 представляет собой H;
R4 представляет собой H или метил; или
R3 и R4 могут формировать пирролидин вместе с атомами, сопряженными с ними; и
R5 представляет собой
 ,
,  ,
,  или
или  ,
,
где n представляет собой целое число в диапазоне от 0 до 1,
R6 представляет собой незамещенный или замещенный фенил или пиридинил,
указанный замещенный фенил и пиридинил содержат один или два заместителя, выбранных из группы, состоящей из -F, -Cl и метила;
R7 представляет собой H, -F, -Cl или пиридинил; и
R8 представляет собой H, -F или -Cl.
5. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, где кольцом, содержащим A и R2, являются

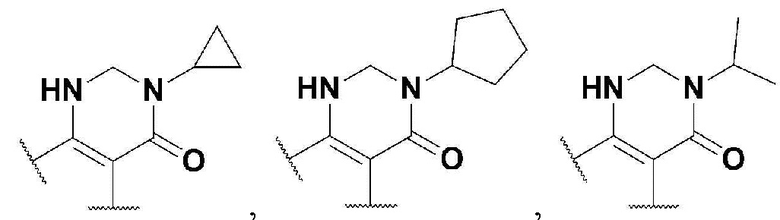 или
или 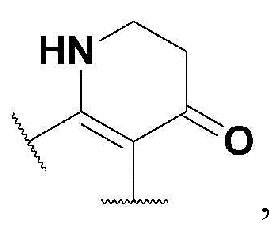
и R5 представляет собой
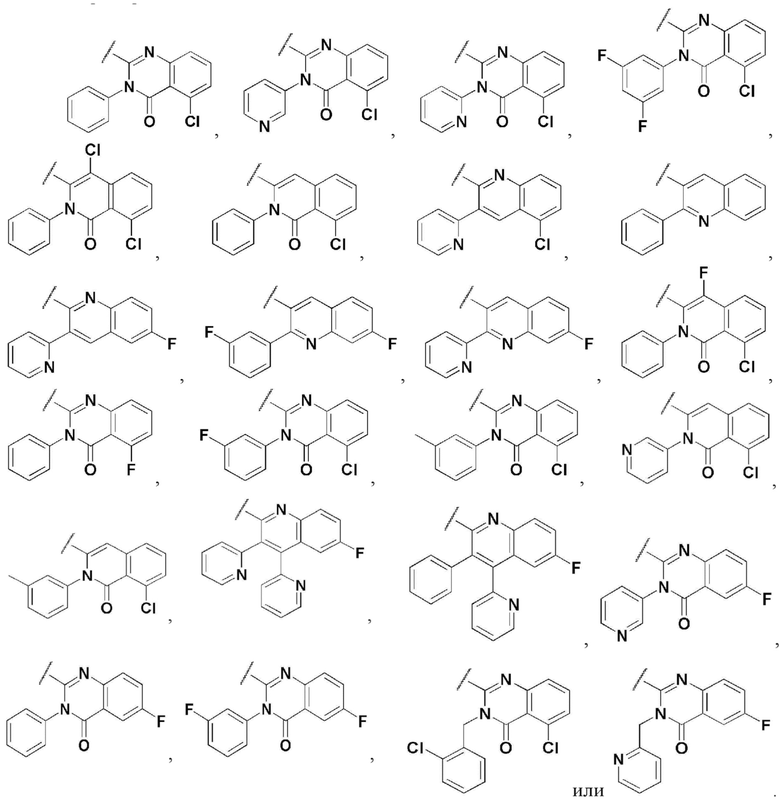
6. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, которое представляет собой соединение формулы 1A
Формула 1A
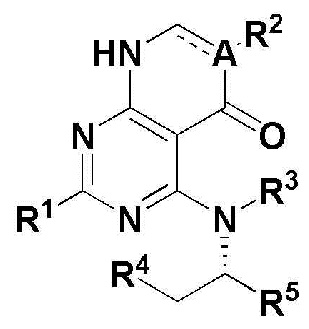
в формуле 1A
 , A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
, A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
7. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, которое выбрано из группы, состоящей из следующих соединений:
<1> 4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<2> 4-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<3> 4-((1-(5-хлор-4-оксо-3-(пиридин-2-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<4> 4-((1-(5-хлор-3-(3,5-дифторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<5> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<6> 4-((1-(2-фенилхинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<7> 4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<8> 4-((1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<9> 4-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этиламино)пиридо[2,3-d]пиримидин-5(8H)-он;
<10> 4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<11> 4-((1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<12> 4-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<13> 4-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<14> 4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<15> 2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<16> 2-амино-4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<17> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<18> 2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<19> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-5-оксо-5,8-дигидропиридо[2,3-d]пиримидин-6-карбонитрил;
<20> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<21> 4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<22> 6-хлор-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<23> 6-хлор-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<24> 6-хлор-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<25> 2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<26> 4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<27> 4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<28> 4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<29> 4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<30> 4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<31> 4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<32> 4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<33> 4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<34> 5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<35> 5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<36> 5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<37> 5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<38> 5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<39> 3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<40> 5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<41> 5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<42> 5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<43> 5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<44> 5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<45> 5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<46> 5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<48> 7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<49> 7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<50> 7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<51> 7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<52> 7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<53> 7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<54> 7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<55> 7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<56> 7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<57> 7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<58> 7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<59> 7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<60> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<61> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<62> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<63> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<64> 5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<65> 5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<66> 5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<67> 5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<68> 5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<69> 5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<70> 5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<72> 5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<73> 5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<74> 5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<75> 5-(2-(8-хлор-1-оксо-2-(пиридин-3-ил)-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<76> 5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<77> 5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<78> 5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<81> 7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<82> 7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<83> 7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<84> 7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<85> 7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<88> 7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<89> 7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<90> 7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<91> 7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<92> 7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<93> 7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<94> 7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<97> 4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он; и
<98> 4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он.
8. Соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль по п. 1, которое выбрано из группы, состоящей из следующих соединений:
<1> (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<2> (S)-4-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<3> (S)-4-((1-(5-хлор-4-оксо-3-(пиридин-2-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<4> (S)-4-((1-(5-хлор-3-(3,5-дифторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<5> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<6> (S)-4-((1-(2-фенилхинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<7> (S)-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<8> (S)-4-((1-(7-фтор-2-(3-фторфенил)хинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<9> (S)-4-(1-(7-фтор-2-(пиридин-2-ил)хинолин-3-ил)этиламино)пиридо[2,3-d]пиримидин-5(8H)-он;
<10> (S)-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<11> (S)-4-((1-(8-хлор-4-фтор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<12> (S)-4-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<13> (S)-4-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<14> (S)-4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<15> (S)-2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<16> (S)-2-амино-4-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиридо[2,3-d]пиримидин-5(8H)-он;
<17> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<18> (S)-2-амино-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-метилпиридо[2,3-d]пиримидин-5(8H)-он;
<19> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-5-оксо-5,8-дигидропиридо[2,3-d]пиримидин-6-карбонитрил;
<20> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<21> (S)-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-6-фторпиридо[2,3-d]пиримидин-5(8H)-он;
<22> (S)-6-хлор-4-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<23> (S)-6-хлор-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<24> (S)-6-хлор-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<25> (S)-2-амино-4-((1-(6-фтор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<26> (S)-4-((1-(6-фтор-3,4-ди(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<27> (S)-4-((1-(6-фтор-3-фенил-4-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<28> (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<29> (S)-4-((1-(6-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<30> (S)-4-((1-(6-фтор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<31> (S)-4-((1-(5-хлор-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<32> (S)-4-((1-(6-фтор-4-оксо-3-(пиридин-2-илметил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<33> (S)-4-((1-(5-хлор-3-(пиридин-2-ил)хинолин-2-ил)этил)амино)пиридо[2,3-d]пиримидин-5(8H)-он;
<34> (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<35> (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<36> (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<37> (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<38> (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<39> (S)-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<40> (S)-5-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<41> (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<42> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<43> (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<44> (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<45> (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<46> (S)-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<47> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<48> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<49> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<50> (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<51> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<52> (S)-7-амино-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<53> (S)-7-амино-3-метил-5-((1-(2-фенилхинолин-3-ил)этил)амино)-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<54> (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<55> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<56> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<57> (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<58> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<59> (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)-3-метил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<60> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-этил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<61> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-пропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<62> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<63> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-циклопентил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<64> (S)-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<65> (S)-5-(1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропиламино)-3-изопропил-2,3-дигидропиримидо[4,5-d]пиримидин-4(1H)-он;
<66> (S)-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<67> (S)-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<68> (S)-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<69> (S)-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<70> (S)-5-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<72> (S)-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<73> (S)-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<74> (S)-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<75> (S)-5-(2-(8-хлор-1-оксо-2-(пиридин-3-ил)-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<76> (S)-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<77> (S)-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<78> (S)-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<81> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<82> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<83> (S)-7-амино-5-((1-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<84> (S)-7-амино-5-((1-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<85> (S)-7-амино-5-(1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этиламино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<88> (S)-7-амино-5-((1-(2-фенилхинолин-3-ил)этил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<89> (S)-7-амино-5-((1-(5-фтор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пропил)амино)пиримидо[4,5-d]пиримидин-4(1H)-он;
<90> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-фенил-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<91> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(пиридин-3-ил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<92> (S)-7-амино-5-(2-(5-хлор-3-(3-фторфенил)-4-оксо-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<93> (S)-7-амино-5-(2-(5-хлор-4-оксо-3-(м-толил)-3,4-дигидрохиназолин-2-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<94> (S)-7-амино-5-(2-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)пирролидин-1-ил)пиримидо[4,5-d]пиримидин-4(1H)-он;
<97> (S)-4-((1-(8-хлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он; и
<98> (S)-4-((1-(4,8-дихлор-1-оксо-2-фенил-1,2-дигидроизохинолин-3-ил)этил)амино)-7,8-дигидропиридо[2,3-d]пиримидин-5(6H)-он.
9. Промежуточное соединение для соединения по п. 1 изображенной ниже формулы 1B или его (S) изомер:
Формула 1B
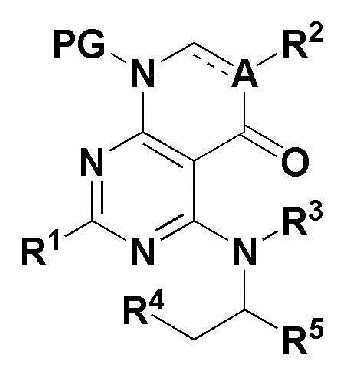
в формуле 1B
 , A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1; и
, A, R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1; и
PG представляет собой амино-защитную группу, выбранную из группы, состоящей из т-бутилоксикарбонила (Boc) и п-метоксибензила (PMB).
10. Способ получения соединения формулы 1, включающий описанные далее стадии, изображенные ниже на схеме реакции 1:
получение соединения формулы 2A посредством реакции соединения формулы 2 и соединения формулы 3 (стадия 1);
получение соединения формулы 5 посредством реакции соединения формулы 2A, полученного на стадии 1, и соединения формулы 4 (стадия 2);
получение соединения формулы 7 посредством реакции соединения формулы 5, полученного на стадии 2, и соединения формулы 6 (стадия 3);
получение соединения формулы 8 посредством реакции соединения формулы 7, полученного на стадии 3, и соединения формулы 2B, в щелочных условиях (стадия 4);
получение соединения формулы 10 посредством реакции соединения формулы 8, полученного на стадии 4, и соединения формулы 9 (стадия 5);
получение соединения формулы 11 посредством реакции соединения формулы 10, полученного на стадии 5, в кислых условиях (стадия 6);
получение соединения формулы 12 посредством реакции соединения формулы 11, полученного на стадии 6, и соединения формулы 2C (стадия 7); и
получение соединения формулы 1a путем удаления амино-защитной группы из соединения формулы 12, полученного на стадии 7, в кислых условиях (стадия 8):
Схема реакции 1
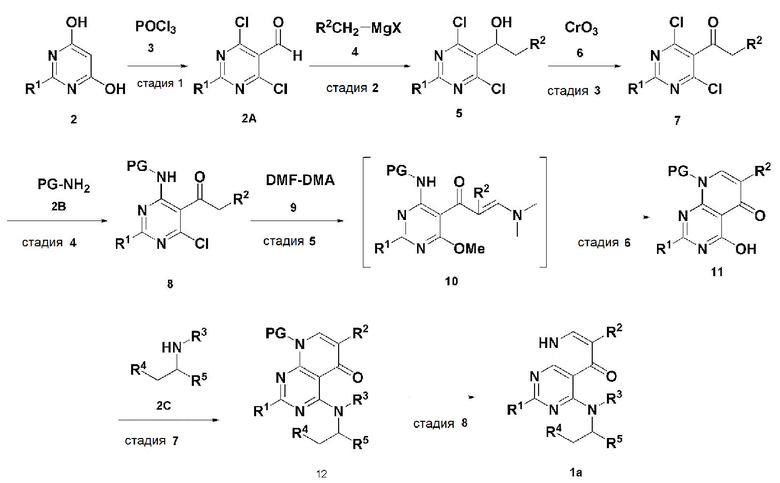
в схеме реакции 1
PG представляет собой т-бутилоксикарбонил (Boc) или п-метоксибензил (PMB);
соединение формулы 1a представляет собой производное соединения формулы 1, в котором  представляет собой двойную связь, A представляет собой атом углерода и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом углерода и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
11. Способ получения соединения формулы 1, включающий описанные далее стадии, изображенные ниже на схеме реакции 2:
получение соединения формулы 15 посредством реакции соединения формулы 2A и соединения формулы 14 (стадия 1);
получение соединения формулы 17 посредством реакции соединения формулы 15, полученного на стадии 1, и соединения формулы 16 (стадия 2);
получение соединения формулы 18 посредством реакции соединения формулы 17, полученного на стадии 2, и соединения формулы 2B (стадия 3);
получение соединения формулы 20 посредством реакции соединения формулы 18, полученного на стадии 3, и соединения формулы 19 (стадия 4);
получение соединения формулы 21 посредством реакции соединения формулы 20, полученного на стадии 4, и соединения формулы 2C, в щелочных условиях (стадия 5); и
получение соединения формулы 1b путем удаления амино-защитной группы из соединения формулы 21, полученного на стадии 5, в кислых условиях (стадия 6):
Схема реакции 2
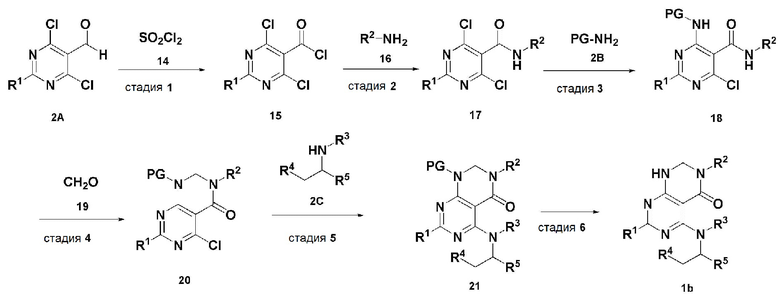
в схеме реакции 2
PG представляет собой т-бутилоксикарбонил (Boc) или п-метоксибензил (PMB);
соединение формулы 1b представляет собой производное соединения формулы 1, в котором  представляет собой простую связь, A представляет собой атом азота и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой простую связь, A представляет собой атом азота и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
12. Способ получения соединения формулы 1, включающий описанные далее стадии, изображенные ниже на схеме реакции 3:
получение соединения формулы 15 посредством реакции соединения формулы 2A и соединения формулы 14 (стадия 1);
получение соединения формулы 23 посредством реакции соединения формулы 15, полученного на стадии 1, и соединения формулы 22 (стадия 2); и
получение соединения формулы 1C посредством реакции соединения формулы 23, полученного на стадии 2, и соединения формулы 2C, в щелочных условиях (стадия 3):
Схема реакции 3
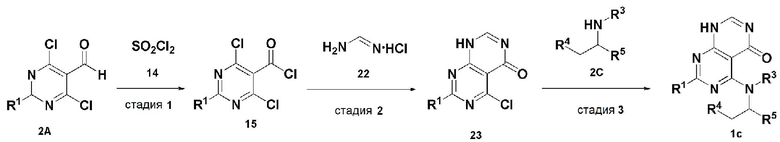
в схеме реакции 3
соединение формулы 1C представляет собой производное соединения формулы 1, в котором  представляет собой двойную связь, A представляет собой атом азота и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
представляет собой двойную связь, A представляет собой атом азота и R1, R2, R3, R4 и R5 имеют значения, указанные для формулы 1.
13. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с PI3 киназой, которая содержит соединение формулы 1, его (S) изомер или его фармацевтически приемлемую соль по п. 1 в качестве действующего вещества.
14. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с PI3 киназой, по п. 13, где соединение формулы 1, его (S) изомер или его фармацевтически приемлемая соль характеризуется селективным ингибированием PI3 киназы, выбранной из группы, состоящей из PI3Kα, PI3Kβ, PI3Kδ и PI3Kγ.
15. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с PI3 киназой, по п. 13, где заболевание, связанное с PI3 киназой, выбрано из группы, состоящей из рака, аутоиммунного заболевания и респираторного заболевания.
16. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с PI3 киназой, по п. 15, где рак выбран из группы, состоящей из следующих заболеваний: злокачественные новообразования в крови, рак яичника, рак шейки матки, рак груди, рак толстой и прямой кишки, рак печени, рак желудка, рак поджелудочной железы, рак толстой кишки, метастазы в брюшину, рак кожи, рак мочевого пузыря, рак предстательной железы, рак щитовидной железы, рак легких, остеосаркома, фиброзная опухоль и опухоль мозга.
17. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с PI3 киназой, по п. 15, где аутоиммунное заболевание выбрано из группы, состоящей из ревматоидного артрита, системной красной волчанки, рассеянного склероза, диабета 1 типа, гиперфункции щитовидной железы, миастении, болезни Крона, анкилоизирующего спондилита, псориаза, аутоиммунного атрофического гастрита и синдрома Сегрена.
18. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с PI3 киназой, по п. 15, где респираторное заболевание выбрано из группы, состоящей из хронического обструктивного заболевания легких (ХОЗЛ), ринита, астмы, хронического бронхита, хронического воспалительного заболевания легких, силикоза, легочного саркоидоза, плеврита, альвеолита, васкулита, эмфиземы, пневмонии и бронхоэктаза.
19. Композиция здорового функционального питания для профилактики или облегчения заболевания, связанного с PI3 киназой, которая содержит соединение формулы 1, его (S) изомер или его фармацевтически приемлемую соль по п. 1 в качестве действующего вещества.
20. Композиция здорового функционального питания для профилактики или облегчения заболевания, связанного с PI3 киназой, по п. 19, где заболевание, связанное с PI3 киназой выбрано из группы, состоящей из рака, аутоиммунного заболевания и респираторного заболевания.
| WO 2014015675 A1, 30.01.2014 & EA 201590281 A1, 30.07.2015 | |||
| WO 2009099801 A1, 13.08.2009 & EA 201001238 A1, 29.04.2011 | |||
| WO 2011053861 A1, 05.05.2011 & EA 029273 B1, 30.03.2018 | |||
| WO 2014167347 A1, 16.10.2014 & RU 2656342 C2, 05.06.2018 | |||
| CN 104151311 A, 19.11.2014. |
Авторы
Даты
2020-04-17—Публикация
2016-06-01—Подача