ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к соединениям, обладающим двунаправленной фармакологической активностью в отношении как рецептора сигма (σ), так и μ-опиоидного рецептора (MOR или мю-опиоида), и, более конкретно, к соединениям диазаспироундекановых производных, обладающим данной фармакологической активностью, к способам получения таких соединений, к фармацевтическим композициям, содержащим их, и к их применению в терапии, в частности, для лечения боли.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Достаточный контроль боли представляет собой важную задачу, поскольку доступные на данный момент методы лечения во многих случаях предусматривают только незначительные улучшения, не освобождающие многих пациентов от боли [Turk DC, Wilson HD, Cahana A. Treatment of chronic non-cancer pain. Lancet 377, 2226-2235 (2011)]. От боли страдает огромная часть населения с предположительной частотой случаев около 20% и ее распространенность, в частности, в случае хронической боли, возрастает со старением людей. Кроме того, боль, несомненно, связана с сопутствующими заболеваниями, такими как депрессия, тревожность и бессонница, что приводит к существенным потерям продуктивности и социально-экономической нагрузке [Goldberg DS, McGee SJ. Pain as a global public health priority. BMC Public Health. 11, 770 (2011)]. Существующие обезболивающие препараты включают нестероидные противовоспалительные лекарственные средства (NSAID), агонисты опиоидов, блокаторы кальциевых каналов и антидепрессанты, но они являются не совсем оптимальными вследствие своего коэффициента безопасности. Все из них демонстрируют ограниченную эффективность и ряд вторичных эффектов, которые мешают их применению, в особенности, в хронических условиях.
Как упомянуто выше, существует мало доступных терапевтических классов для лечения боли, и среди них наиболее эффективными являются опиоиды, в особенности, что касается состояний сильной боли. Они действуют посредством трех различных типов опиоидных рецепторов (мю, каппа и гамма), которые представляют собой трансмембранные сопряженные с G-белком рецепторы (GPCR). По-прежнему, главное аналгезирующее действие объясняется активацией μ-опиоидного рецептора (MOR). Однако, общее введение агонистов MOR ограничено вследствие их существенных побочных эффектов, таких как запор, дыхательная недостаточность, толерантность, рвота и физическая зависимость [Meldrum, M.L. (Ed.). Opioids and Pain Relief: A Historical Perspective. Progress in Pain Research and Management, Vol 25. IASP Press, Seattle, 2003]. Кроме того, агонисты MOR не являются оптимальными для лечения хронической боли, на что указывает уменьшенная эффективность морфина против состояний хронической боли. В особенности, это доказано для состояний хронической боли нейропатического или воспалительного происхождения в сравнении с его высокой активностью против острой боли. Сведения о том, что хроническая боль может привести к снижению экспрессии MOR, могут обеспечить молекулярную подоплеку для относительного недостатка эффективности морфина в условиях длительного лечения [Dickenson, A.H., Suzuki, R. Opioids in neuropathic pain: Clues from animal studies. Eur J Pain 9, 113-6 (2005)]. Более того, длительное лечение с помощью морфина может привести в результате к толерантности к его аналгезирующим эффектам, более вероятно вследствие индуцированного лечением снижения экспрессии MOR, интернализации и других регуляторных механизмов. Как следствие, длительное лечение может привести в результате к существенному увеличению в дозировании для поддержания клинически удовлетворительного облегчения боли, но узкое терапевтическое окно агонистов MOR в конце концов приводит в результате к неприемлемым побочным эффектам и неточному соблюдению пациентом режима и схемы лечения.
Рецептор сигма-1 (σ1) открыли 35 лет назад и изначально определили как новый подтип опиоидного семейства, но впоследствии и на основании исследований энантиомеров SKF-10,047 установили его независимую природу. Первую связь σ1-рецептора с аналгезией установили Chien и Pasternak [Chien CC, Pasternak GW. Sigma antagonists potentiate opioid analgesia in rats. Neurosci. Lett. 190, 137-9 (1995)], которые описали ее как эндогенную антиопиоидную систему на основании сведений о том, что агонисты σ1-рецепторов противодействовали опосредованной опиоидным рецептором аналгезии, тогда как антагонисты σ1-рецепторов, такие как галоперидол, стимулировали ее.
Многие дополнительные доклинические свидетельства указывают на четкую роль σ1-рецептора в лечении боли [Zamanillo D, Romero L, Merlos M, Vela JM. Sigma 1 receptor: A new therapeutic target for pain. Eur. J. Pharmacol, 716, 78-93 (2013)]. Создание нокаутных мышей по σ1-рецептору, которые не демонстрируют очевидный фенотип и нормально различают сенсорные стимулы, является ключевым моментом в данном направлении. В физиологических условиях было обнаружено, что реакции нокаутных мышей по σ1-рецептору на механические и тепловые стимулы являются неотличимыми от реакций мышей WT, но было показано, что они обладают более высокой устойчивостью к развитию болевого поведения, чем мыши WT, когда гиперчувствительность вступает в действие. Следовательно, у нокаутных мышей по σ1-рецептору капсаицин не вызывал механической гиперчувствительности, обе фазы индуцированной формалином боли были снижены, и гиперчувствительность к холоду и механическая гиперчувствительность были сильно ослаблены после частичного лигирования седалищного нерва или после лечения с помощью паклитаксела, что представляет собой модели нейропатической боли. Многие из данных действий были подтверждены путем применения антагонистов σ1-рецепторов и привели к переходу одного соединения, S1RA, на клинические испытания лечения различных состояний боли. Соединение S1RA вызывало существенное снижение нейропатической боли и состояния ангедонии после повреждения нерва (т. е. состояния нейропатической боли) и, как показано в оперантной модели самостоятельного введения, мыши с повреждением нерва, но не ложнооперированные мыши, приобретали оперантное поведение для его получения (в основном для облегчения боли), демонстрируя то, что антагонизм σ1-рецептора облегчает нейропатическую боль, а также влияет на некоторые из сопутствующих заболеваний (т. е. ангедонию, главный симптом в депрессии), связанные с состояниями боли.
Боль является мультимодальной по своей природе, поскольку практически во всех состояниях боли задействованы несколько медиаторов, сигнальных путей и молекулярных механизмов. Следовательно, мономодальные препараты не могут обеспечить полное облегчение боли. В настоящее время объединение существующих препаратов является обычной клинической практикой, и многие усилия направлены на определение лучшей комбинации доступных лекарственных средств в клинических исследованиях [Mao J, Gold MS, Backonja M. Combination drug therapy for chronic pain: a call for more clinical studies. J. Pain 12, 157-166 (2011)]. Следовательно, существует острая необходимость в инновационных терапевтических средствах для устранения данной неудовлетворенной медицинской потребности.
Как упомянуто выше, опиоиды являются одними из самых действенных аналгетиков, но они также отвечают за различные побочные эффекты, которые серьезно ограничивают их применение.
Соответственно, все еще существует необходимость поиска соединений, которые обладают альтернативной или улучшенной фармакологической активностью в лечении боли, являющихся как эффективными, так и демонстрирующими необходимую избирательность, и обладающих хорошими свойствами ʺприменимости в качестве лекарственных средствʺ, т. е. хорошими фармацевтическими свойствами, связанными с введением, распределением, метаболизмом и выведением.
Таким образом, следовательно, техническая проблема может быть выражена как поиск соединений, которые обладают альтернативной или улучшенной фармакологической активностью в лечении боли.
Принимая во внимание существующие результаты доступных на данный момент препаратов и клинических практик, в настоящем изобретении предлагают решение путем объединения в одно соединение, связывающееся с двумя различными рецепторами, относящимися к лечению боли. Этого в основном достигли путем обеспечения соединений согласно настоящему изобретению, которые связываются как с μ-опиоидным рецептором, так и с σ1-рецептором.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении было идентифицировано семейство структурно различных диазаспироундекановых производных, которые обладают двунаправленной фармакологической активностью в отношении как рецептора сигма (σ), так и μ-опиоидного рецептора с решением, таким образом, вышеуказанной проблемы идентификации альтернативных или улучшенных методов лечения боли посредством предоставления таких соединений двойного действия.
В одном аспекте настоящее изобретение направлено на соединение, обладающее двунаправленной активностью, связывающееся с σ1-рецептором и μ-опиоидным рецептором, для применения в лечении боли.
Поскольку настоящее изобретение направлено на обеспечение соединения или родственного с точки зрения химии ряда соединений, которые выполняют функцию лигандов двойного действия σ1-рецептора и μ-опиоидного рецептора, особенно предпочтительным вариантом осуществления является тот, где соединение характеризуется сродством, выраженным в виде Ki, которое составляет предпочтительно <1000 нМ для обоих рецепторов, более предпочтительно <500 нМ, еще более предпочтительно <100 нМ.
В основном аспекте настоящее изобретение направлено на соединение общей формулы (I),
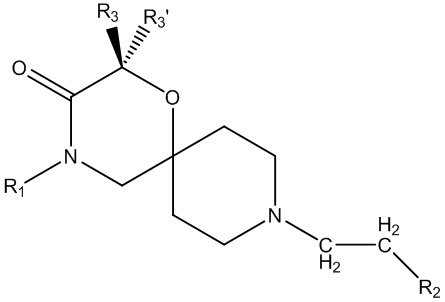
(I),
где R1, R2, R3, R3ʹ определены далее в подробном описании.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на семейство структурно различных диазаспироундекановых производных, которые обладают двунаправленной фармакологической активностью в отношении как рецептора сигма (σ), так и μ-опиоидного рецептора, которое было идентифицировано с решением, таким образом, вышеуказанной проблемы идентификации альтернативных или улучшенных методов лечения боли посредством предоставления таких соединений двойного действия.
В одном аспекте настоящее изобретение направлено на соединение, обладающее двунаправленной активностью, связывающееся с σ1-рецептором и μ-опиоидным рецептором, для применения в лечении боли.
Поскольку настоящее изобретение направлено на обеспечение соединения или родственного с точки зрения химии ряда соединений, которые выполняют функцию лигандов двойного действия σ1-рецептора и μ-опиоидного рецептора, очень предпочтительным вариантом осуществления является тот, где соединение характеризуется сродством, выраженным в виде Ki, которое составляет предпочтительно <1000 нМ для обоих рецепторов, более предпочтительно <500 нМ, еще более предпочтительно <100 нМ.
Заявитель неожиданно обнаружил, что проблема, на которой основано настоящее изобретение, может быть решена путем применения мультимодального сбалансированного аналгетического подхода, объединяющего две различные синергические активности в одном лекарственном средстве (т. е. лиганды двойного действия, которые являются бифункциональными и связываются с MOR и σ1-рецептором), тем самым улучшая опиоидную аналгезию посредством σ1-активации без увеличения нежелательных побочных эффектов. Это поддерживает терапевтическую ценность соединения двойного действия MOR/σ1-рецептора, где компонент связывания σ1-рецептора выполняет функцию естественного вспомогательного средства компонента связывания MOR.
Данное решение обеспечило преимущество, заключающееся в том, что два механизма взаимодополняют друг друга для лечения боли и хронической боли с использованием более низких и лучше переносимых необходимых доз на основании усиления действия аналгезии, но избегая побочных эффектов агонистов μ-опиоидных рецепторов.
Соединение двойного действия, которое характеризуется связыванием как с μ-опиоидным рецептором, так и с σ1-рецептором, демонстрирует чрезвычайно значимый терапевтический потенциал посредством достижения исключительной аналгезии (усиленной в отношении активности опиоидного компонента самого по себе) со сниженным профилем побочных эффектов (предел безопасности увеличен в сравнении с пределом опиоидного компонента самого по себе) в сравнении с существующими опиоидными препаратами.
Преимущественно соединения двойного действия согласно настоящему изобретению, кроме того, будут демонстрировать одну или несколько из следующих функциональных групп: отвечающую за антагонизм σ1-рецептора и отвечающую за агонизм MOR. Хотя следует отметить, что обе функциональные группы ʺантагонизмʺ и ʺагонизмʺ также подразделены из-за их эффекта на функциональные подгруппы, такие как частичный агонизм или обратный агонизм. Соответственно, функциональные группы соединения двойного действия следует рассматривать в пределах относительно широкого диапазона.
Антагонист на одном из названных рецепторов блокирует или ослабляет опосредованные агонистом реакции. Известные функциональные подгруппы представляют собой нейтральные антагонисты или обратные агонисты.
Агонист на одном из названных рецепторов увеличивает активность рецептора выше его исходного уровня. Известные функциональные подгруппы представляют собой полные агонисты или частичные агонисты.
Кроме того, два механизма взаимодополняют друг друга, поскольку агонисты MOR являются лишь незначительно эффективными в лечении нейропатической боли, тогда как антагонисты σ1-рецептора демонстрируют исключительные эффекты в доклинических моделях нейропатической боли. Таким образом, компонент σ1-рецептора добавляет уникальные аналгезирующие эффекты в отношении устойчивой к опиоидам боли. В конце концов, двунаправленный подход имеет четкие преимущества над агонистами MOR в лечении хронической боли, поскольку будут необходимы более низкие и лучше переносимые дозы на основании усилении действия аналгезии, но без побочных эффектов агонистов MOR.
Дополнительным преимуществом использования нескольких сконструированных лигандов является низкий риск взаимодействия лекарственное средство-лекарственное средство в сравнении со смесями лекарственных средств или многокомпонентными лекарственными средствами, тем самым обеспечивается более простая фармакокинетика и меньшая вариабельность среди пациентов. Кроме того, данный подход может улучшить соблюдение пациентом режима и схемы лечения и расширить терапевтическое применение в отношении лекарственных средств с одним механизмом действия путем обращения к более сложным этиологиям. Его также рассматривают в качестве пути улучшения выхода R&D, полученного с использованием подхода ʺодно лекарственное средство-одна мишеньʺ, который подвергается сомнению на протяжении нескольких последних лет [Bornot A, Bauer U, Brown A, Firth M, Hellawell C, Engkvist O. Systematic Exploration of Dual-Acting Modulators from a Combined Medicinal Chemistry and Biology Perspective. J. Med. Chem, 56, 1197-1210 (2013)].
Также было неожиданно обнаружено, что аффинность для μ-опиоидного рецептора 1-окса-4,9-диазаспиро[5.5]ундекановых производных, описанных в данном документе, зависит существенным образом от определенной природы заместителей в положении R3 формулы (I) и от их конкретной пространственной конфигурации.
Было неожиданно обнаружено, что аффинность связывания для μ-опиоидного рецептора свойственна главным образом заместителю R3 (отличному от водорода), занимающему пространственную конфигурацию, как показано в формуле (I), независимо от того, являются ли R3 и R3ʹ одними и теми же заместителями, отличающимися заместителями (что обеспечивает хиральный центр) или образующими циклоалкильную группу. Если R3 представляет собой водород, то связывание с μ-опиоидным рецептором намного слабее.
Аффинность по отношению к σ1-рецептору в основном поддерживали благодаря меньшему влиянию пространственной конфигурации радикалов в положении R3 или R3ʹ.
Оптические изомеры были получены посредством подходящих энантиоселективных способов или посредством разделения с помощью хиральной HPLC или фракционной кристаллизации диастереомерных солей соответствующих рацемических смесей.
В конкретном аспекте настоящее изобретение направлено на соединения общей формулы (I),

(I),
где
R1 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил;
R2 представляет собой замещенный или незамещенный моноциклический арил или замещенный или незамещенный моноциклический гетероциклил;
R3 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил, замещенный или незамещенный C4-7алкиларил, замещенный или незамещенный C3-6арил, замещенный или незамещенный C3-6гетероциклил или замещенный или незамещенный C4-7алкилгетероциклил;
R3ʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил или незамещенный C2-6алкинил,
в качестве альтернативы, R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), могут образовывать замещенный или незамещенный C3-6циклоалкил;
R4, R4ʹ и R4ʹʹ независимо выбраны из водорода или замещенного или незамещенного C1-6алкила, замещенного или незамещенного C2-6алкенила или замещенного или незамещенного C2-6алкинила, замещенного или незамещенного C3-6циклоалкила;
R4ʹʹʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил или -Boc;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или их соответствующую соль, или их соответствующий сольват.
Обратите внимание, что ʺили их соответствующая сольʺ также означает ʺили их соответствующая фармацевтически приемлемая сольʺ. Это касается всех нижеописанных вариантов осуществления и применений ʺсолиʺ, таким образом, эквивалентной ʺфармацевтически приемлемой солиʺ.
В конкретном варианте осуществления исключено одно или несколько из следующих соединений:
2,4-диметил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, и/или
2-этил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, и/или
2-изопропил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, и/или
2-бутил-4-этил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он,
 , и/или
, и/или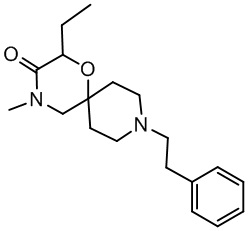 ,и/или
,и/или 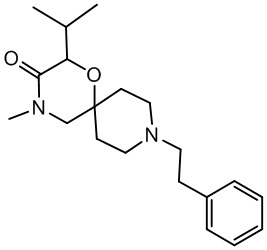 , и/или
, и/или  .
.
В конкретном варианте осуществления данное исключение относится только к соответствующей рацемической форме данного или данных вышеуказанного/вышеуказанных соединения/соединений.
В конкретном варианте осуществления все 4 данных вышеуказанных соединения исключены.
В конкретном варианте осуществления данное исключение также включает все соли с HCl данных вышеуказанных соединений или их фармацевтически приемлемые соли присоединения кислоты.
Некоторые соединения из уровня техники (US 4353900A) были идентифицированы как не являющиеся частью настоящего изобретения, поскольку в качестве рацемических соединений для них отсутствует информация о пространственной конформации группы, соответствующей R3 в формуле (I). Данные соединения соответствуют следующим названиям и формулам:
2,4-диметил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он,
2-этил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он,
2-изопропил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он,
2-бутил-4-этил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он.




В другом конкретном варианте осуществления условие/ограничение касается, в особенности, соединения согласно формуле I, где, если R2 представляет собой незамещенный фенил, R3ʹ представляет собой водород, и R3 представляет собой C1-4-алкил, то R1 может не представлять собой C1-2-алкил.
В контексте настоящего изобретения ʺалкилʺ следует понимать как означающий насыщенные, линейные или разветвленные углеводороды, которые могут быть незамещенными или замещенными один или несколько раз. Он охватывает, например, -CH3 и -CH2-CH3. В данных радикалах C1-2-алкил представляет собой C1- или C2-алкил, C1-3-алкил представляет собой C1-, C2- или C3-алкил, C1-4-алкил представляет собой C1-, C2-, C3- или C4-алкил, C1-5-алкил представляет собой C1-, C2-, C3-, C4- или C5-алкил, C1-6-алкил представляет собой C1-, C2-, C3-, C4-, C5- или C6-алкил, C1-7-алкил представляет собой C1-, C2-, C3-, C4-, C5-, C6- или C7-алкил, C1-8-алкил представляет собой C1-, C2-, C3-, C4-, C5-, C6-, C7- или C8-алкил, C1-10-алкил представляет собой C1-, C2-, C3-, C4-, C5-, C6-, C7-, C8-, C9- или C10-алкил и C1-18-алкил представляет собой C1-, C2-, C3-, C4-, C5-, C6-, C7-, C8-, C9-, C10-, C11-, C12-, C13-, C14-, C15-, C16-, C17- или C18-алкил. Алкильные радикалы предпочтительно представляют собой метил, этил, пропил, метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, гексил, 1-метилпентил, если замещенный - также CHF2, CF3 или CH2OH и т. д. Предпочтительно ʺалкилʺ следует понимать в контексте настоящего изобретения как C1-8алкил, такой как метил, этил, пропил, бутил, пентил, гексил, гептил или октил; предпочтительно ʺалкилʺ представляет собой C1-6алкил, такой как метил, этил, пропил, бутил, пентил или гексил; более предпочтительно представляет собой C1-4алкил, такой как метил, этил, пропил или бутил.
ʺАлкенилʺ следует понимать как означающий ненасыщенные, линейные или разветвленные углеводороды, которые могут быть незамещенными или замещенными один или несколько раз. Он охватывает группы, такие как, например, -CH=CH-CH3. Алкенильные радикалы предпочтительно представляют собой винил (этенил), аллил (2-пропенил). Предпочтительно в контексте настоящего изобретения алкенил представляет собой C2-10-алкенил или C2-8-алкенил, такой как этилен, пропилен, бутилен, пентилен, гексилен, гептилен или октилен; или представляет собой C2-6-алкенил, такой как этилен, пропилен, бутилен, пентилен или гексилен; или представляет собой C2-4-алкенил, такой как этилен, пропилен или бутилены.
ʺАлкинилʺ следует понимать как означающий ненасыщенные, линейные или разветвленные углеводороды, которые могут быть незамещенными или замещенными один или несколько раз. Он охватывает группы, такие как, например, -C=C-CH3 (1-пропинил). Предпочтительно алкинил в контексте настоящего изобретения представляет собой C2-10-алкинил или C2-8-алкинил, такой как этин, пропин, бутин, пентин, гексин, гептин или октин; или представляет собой C2-6-алкинил, такой как этин, пропин, бутин, пентин или гексин; или представляет собой C2-4-алкинил, такой как этин, пропин, бутин, пентин или гексин.
В контексте настоящего изобретения ʺциклоалкилʺ следует понимать как означающий насыщенные и ненасыщенные (но не ароматические) циклические углеводороды (без гетероатома в кольце), которые могут быть незамещенными или замещенными один или несколько раз. Более того, C3-4-циклоалкил представляет собой C3- или C4-циклоалкил, C3-5-циклоалкил представляет собой C3-, C4- или C5-циклоалкил, C3-6циклоалкил представляет собой C3-, C4-, C5- или C6-циклоалкил, C3-7-циклоалкил представляет собой C3-, C4-, C5-, C6- или C7-циклоалкил, C3-8-циклоалкил представляет собой C3-, C4-, C5-, C6-, C7- или C8-циклоалкил, C4-5-циклоалкил представляет собой C4- или C5-циклоалкил, C4-6-циклоалкил представляет собой C4-, C5- или C6-циклоалкил, C4-7-циклоалкил представляет собой C4-, C5-, C6- или C7-циклоалкил, C5-6-циклоалкил представляет собой C5- или C6-циклоалкил и C5-7-циклоалкил представляет собой C5-, C6- или C7-циклоалкил. Примерами являются циклопропил, 2-метилциклопропил, циклопропилметил, циклобутил, циклопентил, циклопентилметил, циклогексил, циклогептил, циклооктил, а также адамантил. Предпочтительно в контексте настоящего изобретения циклоалкил представляет собой C3-8циклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил; или представляет собой C3-7циклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; или представляет собой C3-6циклоалкил, такой как циклопропил, циклобутил, циклопентил или циклогексил, в особенности, циклопентил или циклогексил.
По отношению к алкилу, алкенилу, алкинилу и O-алкилу, если не указано иное, термин ʺзамещенныйʺ в контексте настоящего изобретения следует понимать как означающий замену по меньшей мере одного радикала-водорода при атоме углерода галогеном (F, Cl, I, Br), NR4R4ʹʹʹ, SR4, -S(O)R4, -S(O)2R4, -OR4, -C(O)OR4, -CN, галогеналкилом, галогеналкокси или -OC1-4алкилом, незамещенным или замещенным одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными. Возможной является более чем одна замена на одной и той же молекуле, а также при одном и том же атоме углерода одними и теми же или различными заместителями. Это включает, например, 3 атома водорода, замещенные при одном и том же атоме C, как в случае CF3, или по различным положениям одной и той же молекулы, как в случае, например, -CH(OH)-CH=CH-CHCl2. Если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Предпочтительно по отношению к алкилу, алкенилу, алкинилу или O-алкилу ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой алкил, алкенил, алкинил или O-алкил, который является замещенным, замещен одним или несколькими из галогена (F, Cl, I, Br), -OR4, -CN, галогеналкила или -OC1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Предпочтительно по отношению к алкилу, алкенилу, алкинилу или O-алкилу, ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой алкил, алкенил, алкинил или O-алкил, который является замещенным, замещен одним или несколькими из галогена (F, Cl, I, Br), -OR4, -CN или галогеналкила, причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Более предпочтительно по отношению к алкилу, алкенилу, алкинилу или O-алкилу ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой алкил, алкенил, алкинил или O-алкил, который является замещенным, замещен одним или несколькими из галогена (F, Cl, I, Br), -CN или галогеналкила.
Возможной является более чем одна замена на одной и той же молекуле, а также при одном и том же атоме углерода одними и теми же или различными заместителями. Это включает, например, 3 атома водорода, замещенные при одном и том же атоме C, как в случае CF3, или по различным положениям одной и той же молекулы, как в случае, например, -CH(OH)-CH=CH-CHCl2.
В контексте настоящего изобретения ʺгалогеналкилʺ следует понимать как означающий алкил, замещенный один или несколько раз галогеном (выбранным из F, Cl, Br, I). Он охватывает, например, -CH2Cl, -CH2F, -CHCl2, -CHF2, -CCl3, -CF3 и -CH2-CHCI2. Предпочтительно ʺгалогеналкилʺ следует понимать в контексте настоящего изобретения как галоген-замещенный C1-4алкил, представляющий собой галоген-замещенный C1-, C2-, C3- или C4-алкил. Таким образом, галоген-замещенные алкильные радикалы предпочтительно представляют собой метил, этил, пропил и бутил. Предпочтительные примеры включают -CH2Cl, -CH2F, -CHCl2, -CHF2 и -CF3.
В контексте настоящего изобретения ʺгалогеналкоксиʺ следует понимать как означающий -O-алкил, замещенный один или несколько раз галогеном (выбранным из F, Cl, Br, I). Он охватывает, например, -OCH2Cl, -OCH2F, -OCHCl2, -OCHF2, -OCCl3, -OCF3 и -OCH2-CHCI2. Предпочтительно ʺгалогеналкилʺ следует понимать в контексте настоящего изобретения как галоген-замещенный -OC1-4-алкил, представляющий собой галоген-замещенный C1-, C2-, C3- или C4-алкокси. Таким образом, галоген-замещенные алкильные радикалы предпочтительно представляют собой O-метил, O-этил, O-пропил и O-бутил. Предпочтительные примеры включают -OCH2Cl, -OCH2F, -OCHCl2, -OCHF2 и -OCF3.
ʺАрилʺ следует понимать как означающий кольцевые системы по меньшей мере с одним ароматическим кольцом, но без гетероатомов даже исключительно в одном из колец. Примерами являются фенил, нафтил, флуорантенил, флуоренил, тетралинил или инданил, в частности, 9H-флуоренил или радикалы антраценила, которые могут быть незамещенными или замещенными один или несколько раз. Наиболее предпочтительно ʺарилʺ следует понимать в контексте настоящего изобретения как фенил, нафтил или антраценил, предпочтительно ʺарилʺ представляет собой фенил.
В контексте настоящего изобретения ʺалкил-арилʺ следует понимать как означающий арильную группу (см. выше), соединенную с другим атомом посредством 1-4 групп (-CH2-). Наиболее предпочтительно алкил-арил представляет собой бензил. Таким образом, например, C4-7алкиларил означает, что суммарное число C-атомов в арильной группе и в 1-4 группах (-CH2-), посредством которых арил соединен с другим атомом, составляет 4-7.
В контексте настоящего изобретения ʺалкилгетероциклилʺ следует понимать как означающий гетероциклильную группу (см. ниже), соединенную с другим атомом посредством 1-4 групп (-CH2-). Наиболее предпочтительно алкилгетероциклил представляет собой -CH2-пиридин. Таким образом, например, C4-7алкилгетероциклил означает, что суммарное число C-атомов в гетероциклильной группе и в 1-4 группах (-CH2-), посредством которых гетероциклил соединен с другим атомом, составляет 4-7.
В контексте настоящего изобретения ʺалкилциклоалкилʺ следует понимать как означающий циклоалкильную группу (см. выше), соединенную с другим атомом посредством 1-4 групп (-CH2-). Наиболее предпочтительно алкилциклоалкил представляет собой -CH2-циклопропил. Таким образом, например, C4-7алкилциклоалкил означает, что суммарное число C-атомов в циклоалкильной группе и в 1-4 группах (-CH2-), посредством которых циклоалкил соединен с другим атомом, составляет 4-7.
В более общем смысле ʺгетероциклильный радикал или группаʺ следует понимать как означающий гетероциклические кольцевые системы по меньшей мере с одним насыщенным или ненасыщенным кольцом, которое содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы. Гетероциклическая группа также может быть замещена один или несколько раз. Примеры включают гетероарилы, такие как фуран, бензофуран, тиофен, бензотиофен, пиррол, пиридин, пиримидин, пиразин, хинолин, изохинолин, фталазин, бензо-1,2,5-тиадиазол, бензотиазол, индол, бензотриазол, бензодиоксолан, бензодиоксан, карбазол и хиназолин. Предпочтительно в контексте настоящего изобретения ʺгетероциклилʺ определен как гетероциклическая кольцевая система с одним или несколькими насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы. Предпочтительно он представляет собой гетероциклическую кольцевую систему с одним или двумя насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы. Предпочтительные примеры включают имидазол, оксадиазол, тетразол, пиридин, пиримидин, пиперидин, пиперазин, инден, 2,3-дигидроинден, бензофуран, бензимидазол, индазол, бензотиазол, бензодиазол, тиазол, бензотиазол, тетрагидропиран, морфолин, индолин, фуран, триазол, изоксазол, пиразол, тиофен, бензотиофен, пиррол, пиразин, пирроло[2,3b]пиридин, хинолин, изохинолин, фталазин, бензо-1,2,5-тиадиазол, индол, бензотриазол, бензоксазол, оксопирролидин, пиримидин, бензодиоксолан, бензодиоксан, карбазол и хиназолин, в особенности пиридин, пиразин, индазол, бензодиоксан, тиазол, бензотиазол, морфолин, тетрагидропиран, пиразол, имидазол, пиперидин, пиразол, тиофен, индол, бензимидазол, пирроло[2,3b]пиридин, бензоксазол, оксопирролидин, пиримидин.
В более конкретном смысле ʺгетероциклильный радикал или группаʺ (также называемый далее ʺгетероциклилʺ) следует понимать как означающий гетероциклические кольцевые системы по меньшей мере с одним насыщенным или ненасыщенным кольцом, которое содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы. Гетероциклическая группа также может быть замещена один или несколько раз.
Примеры включают неароматические гетероциклилы, такие как тетрагидропиран, оксазепан, морфолин, пиперидин, пирролидин, а также гетероарилы, такие как фуран, бензофуран, тиофен, бензотиофен, пиррол, пиридин, пиримидин, пиразин, хинолин, изохинолин, фталазин, тиазол, бензотиазол, индол, бензотриазол, карбазол и хиназолин.
Подгруппы внутри гетероциклилов, как следует понимать в данном документе, включают гетероарилы и неароматические гетероциклилы:
- гетероарил (эквивалентный гетероароматическим радикалам или ароматическим гетероциклилам) представляет собой ароматическую гетероциклическую кольцевую систему с одним или несколькими кольцами, из которых по меньшей мере одно ароматическое кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; предпочтительно представляет собой ароматическую гетероциклическую кольцевую систему с одним или двумя кольцами, из которых по меньшей мере одно ароматическое кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы, более предпочтительно выбран из фурана, бензофурана, тиофена, бензотиофена, пиррола, пиридина, пиримидина, пиразина, хинолина, изохинолина, фталазина, бензотиазола, индола, бензотриазола, карбазола, хиназолина, тиазола, имидазола, пиразола, оксазола, тиофена и бензимидазола;
- неароматический гетероциклил представляет собой гетероциклическую кольцевую систему с одним или несколькими кольцами, из которых по меньшей мере одно кольцо - при этом данное (или данные) кольцо (кольца) не является (являются) в этом случае ароматическим(и) - содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; предпочтительно представляет собой гетероциклическую кольцевую систему с одним или двумя кольцами, из которых одно или оба кольца - при этом данные одно или два кольца не являются в этом случае ароматическими - содержит/содержат один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы, более предпочтительно выбран из оксазепама, пирролидина, пиперидина, пиперазина, тетрагидропирана, морфолина, индолина, оксопирролидина, бензодиоксана, в особенности бензодиоксана, морфолина, тетрагидропирана, пиперидина, оксопирролидина и пирролидина.
Предпочтительно в контексте настоящего изобретения ʺгетероциклилʺ определен как гетероциклическая кольцевая система с одним или несколькими насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы. Предпочтительно он представляет собой гетероциклическую кольцевую систему с одним или двумя насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы.
Предпочтительные примеры гетероциклилов включают оксазепан, пирролидин, имидазол, оксадиазол, тетразол, пиридин, пиримидин, пиперидин, пиперазин, бензофуран, бензимидазол, индазол, бензодиазол, тиазол, бензотиазол, тетрагидропиран, морфолин, индолин, фуран, триазол, изоксазол, пиразол, тиофен, бензотиофен, пиррол, пиразин, пирроло[2,3b]пиридин, хинолин, изохинолин, фталазин, бензо-1,2,5-тиадиазол, индол, бензотриазол, бензоксазол, оксопирролидин, пиримидин, бензодиоксолан, бензодиоксан, карбазол и хиназолин, в особенности пиридин, пиразин, индазол, бензодиоксан, тиазол, бензотиазол, морфолин, тетрагидропиран, пиразол, имидазол, пиперидин, тиофен, индол, бензимидазол, пирроло[2,3b]пиридин, бензоксазол, оксопирролидин, пиримидин, оксазепан и пирролидин.
В контексте настоящего изобретения оксопирролидин следует понимать как означающий пирролидин-2-он.
По отношению к ароматическим гетероциклилам (гетероарилам), неароматическим гетероциклилам, арилам и циклоалкилам, когда кольцевая система одновременно находится в пределах двух или более из вышеуказанных определений цикла, то кольцевую систему определяют вначале как ароматический гетероциклил (гетероарил), если по меньшей мере одно ароматическое кольцо содержит гетероатом. Если отсутствует ароматическое кольцо, содержащее гетероатом, то кольцевую систему определяют как неароматический гетероциклил, если по меньшей мере одно неароматическое кольцо содержит гетероатом. Если отсутствует неароматическое кольцо, содержащее гетероатом, то кольцевую систему определяют как арил, если она содержит по меньшей мере один арильный цикл. Если отсутствует арил, то кольцевую систему определяют как циклоалкил, если присутствует по меньшей мере один неароматический циклический углеводород.
Предпочтительно арил представляет собой моноциклический арил.
Предпочтительно гетероарил представляет собой моноциклический гетероарил.
Предпочтительно неароматический гетероциклил представляет собой моноциклический неароматический гетероциклил.
Предпочтительно циклоалкил представляет собой моноциклический циклоалкил.
По отношению к арилу (включая алкил-арил), циклоалкилу (включая алкил-циклоалкил) или гетероциклилу (включая алкил-гетероциклил) ʺзамещенныйʺ следует понимать, если не указано иное, как означающий замещение кольцевой системы арила или алкил-арила, циклоалкила или алкил-циклоалкила; гетероциклила или алкил-гетероциклила посредством -R4, -OR4, галогена, =O, -OCH2CH2OH, -SR4, -S(O)R4, -S(O)2R4, -CN, галогеналкила, -галогеналкокси, -NR4R4ʹʹʹ, -NO2, -NR4C(O)R4ʹ, -NR4SO2R4ʹ, -C(O)OR4, -C(O)NR4R4ʹ, -NR4C(O)NR4ʹR4ʹʹ, -S(O)2NR4R4ʹ, -NR4S(O)2NR4ʹR4ʹʹ; NRxRy, при этом Rx и Ry независимо представляют собой либо H, либо насыщенный или ненасыщенный, линейный или разветвленный, замещенный или незамещенный C1-6-алкил; насыщенный или ненасыщенный, линейный или разветвленный, замещенный или незамещенный C1-6-алкил; насыщенный или ненасыщенный, линейный или разветвленный, замещенный или незамещенный -O-C1-6-алкил (алкокси); насыщенный или ненасыщенный, линейный или разветвленный, замещенный или незамещенный -S-C1-6-алкил; насыщенную или ненасыщенную, линейную или разветвленную, замещенную или незамещенную -C(O)-C1-6-алкильную группу; насыщенную или ненасыщенную, линейную или разветвленную, замещенную или незамещенную -C(O)-O-C1-6-алкильную группу; замещенный или незамещенный арил или алкил-арил; замещенный или незамещенный циклоалкил или алкил-циклоалкил; замещенный или незамещенный гетероциклил или алкил-гетероциклил, причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Предпочтительно по отношению к арилу (включая алкил-арил), циклоалкилу (включая алкил-циклоалкил) или гетероциклилу (включая алкил-гетероциклил) ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой арил, циклоалкил и гетероциклил, который является замещенным, замещен одним или несколькими из -OR4, галогена, -CN, галогеналкила, -галогеналкокси, -NR4R4ʹʹʹ, -NO2, -NR4C(O)R4ʹ, -C(O)OR4, -C(O)NR4R4ʹ, -NR4C(O)NR4ʹR4ʹʹ, -S(O)2NR4R4ʹ, -OC1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), -CN, или -C1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Наиболее предпочтительно по отношению к арилу (включая алкил-арил), циклоалкилу (включая алкил-циклоалкил) или гетероциклилу (включая алкил-гетероциклил) ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой арил, циклоалкил и гетероциклил, который является замещенным, замещен одним или несколькими из -OR4, галогена, -CN, галогеналкила, -галогеналкокси, -NR4R4ʹʹʹ, -NO2, -NR4C(O)R4ʹ, -C(O)NR4R4ʹ, -NR4C(O)NR4ʹR4ʹʹ, -S(O)2NR4R4ʹ, -OC1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), -CN, или -C1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Наиболее предпочтительно по отношению к арилу (включая алкил-арил), циклоалкилу (включая алкил-циклоалкил) или гетероциклилу (включая алкил-гетероциклил) ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой арил, циклоалкил и гетероциклил, который является замещенным, замещен одним или несколькими из -R4ʹʹʹ, -OR4ʹʹʹ, галогена, =O, -OCH2CH2OH, -SR4ʹʹʹ, -S(O)R4ʹʹʹ, -S(O)2R4ʹʹʹ, -CN, галогеналкила, -галогеналкокси, -NR4ʹʹʹR4ʹʹʹ, -NO2, -NR4ʹʹʹC(O)R4ʹʹʹ, -NR4ʹʹʹSO2R4ʹʹʹ, -C(O)OR4ʹʹʹ, -C(O)NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹC(O)NR4ʹʹʹR4ʹʹʹ, -S(O)2NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹS(O)2NR4ʹʹʹR4ʹʹʹ, -OC1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), -CN, или -C1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Наиболее предпочтительно по отношению к арилу (включая алкил-арил), циклоалкилу (включая алкил-циклоалкил) или гетероциклилу (включая алкил-гетероциклил) ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой арил, циклоалкил и гетероциклил, который является замещенным, замещен одним или несколькими из -R4ʹʹʹ, галогена, -SR4ʹʹʹ, -CN, галогеналкила, -NR4ʹʹʹR4ʹʹʹ, -OC1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), -CN, или -C1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
Наиболее предпочтительно по отношению к арилу (включая алкил-арил), циклоалкилу (включая алкил-циклоалкил) или гетероциклилу (включая алкил-гетероциклил) ʺзамещенныйʺ следует понимать в контексте настоящего изобретения как такой, где любой арил, циклоалкил и гетероциклил, который является замещенным, замещен одним или несколькими из -OR4ʹʹʹ, галогена, -CN, галогеналкила, -галогеналкокси, -OC1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), -CN, или -C1-4алкила, незамещенного или замещенного одним или несколькими из OH или галогена (F, Cl, I, Br), причем R4, R4ʹ, R4ʹʹ и R4ʹʹʹ определены выше, и при этом, если различные радикалы R1 - R4ʹʹʹʹ одновременно присутствуют в формулах I - Iʹʹ, они могут быть идентичными или различными.
В дополнение к вышеупомянутым замещениям по отношению к циклоалкилу или гетероциклилу, а именно - неароматическому гетероциклилу, ʺзамещенныйʺ также следует понимать, если не указано иное, как означающий замещение кольцевой системы циклоалкила или неароматического гетероциклила посредством  или =O.
или =O.
Термин ʺуходящая группаʺ означает молекулярный фрагмент, который удаляется с парой электронов при гетеролитическом расщеплении связи. Уходящие группы могут представлять собой анионы или нейтральные молекулы. Обычные анионные уходящие группы представляют собой галогениды, такие как Cl-, Br- и I-, и сложные эфиры сульфокислот, такие как тозилат (TsO-) или мезилат.
Термин ʺсольʺ следует понимать как означающий любую форму активного соединения, применяемого согласно настоящему изобретению, в которой оно принимает ионную форму, или является заряженным и сопряженным с противоионом (катионом или анионом), или находится в растворе. Под этим также следует понимать комплексы активного соединения с другими молекулами и ионами, в частности комплексы, образованные посредством ионных взаимодействий.
Термин ʺфизиологически приемлемая сольʺ означает в контексте настоящего изобретения любую соль, которая является физиологически переносимой (подразумевается, что большую часть времени она не является токсичной, в особенности, не вызывается противоионом), при использовании должным образом для лечения, в особенности, в применении для людей и/или млекопитающих или введении им.
Данные физиологически приемлемые соли могут быть образованы с помощью катионов или оснований, и в контексте настоящего изобретения их следует понимать как означающие соли по меньшей мере одного из соединений, применяемых согласно настоящему изобретению - обычно (депротонированной) кислоты - в качестве аниона по меньшей мере с одним, предпочтительно неорганическим, катионом, который является физиологически переносимым, в особенности, в применении для людей и/или млекопитающих. Соли щелочных металлов и щелочноземельных металлов являются особенно предпочтительными, а также соли с NH4, а в частности - соли (моно)- или (ди)натрия, (моно)- или (ди)калия, магния или кальция.
Физиологически приемлемые соли также могут быть образованы с помощью анионов или кислот, и в контексте настоящего изобретения их следует понимать как означающие соли по меньшей мере одного из соединений, применяемых согласно настоящему изобретению в качестве катиона, по меньшей мере с одним анионом, который является физиологически переносимым, в особенности, в применении для людей и/или млекопитающих. Под этим следует понимать, в частности, в контексте настоящего изобретения, соль, образованную с помощью физиологически переносимой кислоты, то есть соли особенно активного соединения с неорганическими или органическими кислотами, которые являются физиологически переносимыми, в особенности, в применении для людей и/или млекопитающих. Примерами физиологически переносимых солей конкретных кислот являются соли хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, метансульфоновой кислоты, муравьиной кислоты, уксусной кислоты, щавелевой кислоты, янтарной кислоты, яблочной кислоты, винной кислоты, миндальной кислоты, фумаровой кислоты, молочной кислоты или лимонной кислоты.
Соединения согласно настоящему изобретению могут быть представлены в кристаллической форме или в виде свободных соединений, таких как свободное основание или кислота.
Любое соединение, которое представляет собой сольват соединения согласно настоящему изобретению, такое как соединение согласно общей формуле I, определенной выше, следует понимать как такое, которое также охвачено объемом настоящего изобретения. Способы сольватации в общем известны из уровня техники. Подходящие сольваты представляют собой фармацевтически приемлемые сольваты. Термин ʺсольватʺ согласно настоящему изобретению следует понимать как означающий любую форму активного соединения согласно настоящему изобретению, в которой данное соединение было присоединено посредством нековалентного связывания с другой молекулой (как правило, полярного растворителя). Особенно предпочтительные примеры включают гидраты и алкоголяты, такие как метанолаты или этанолаты.
Любое соединение, которое представляет собой пролекарство соединения согласно настоящему изобретению, такое как соединение согласно общей формуле I, определенной выше, следует понимать как такое, которое также охвачено объемом настоящего изобретения. Термин ʺпролекарствоʺ применяется в своем самом широком смысле и охватывает такие производные, которые превращаются in vivo в соединения согласно настоящему изобретению. Такие производные будут очевидны специалистам в данной области и включают в зависимости от функциональных групп, присутствующих в молекуле, и без ограничения следующие производные соединений согласно настоящему изобретению: сложные эфиры, сложные эфиры аминокислот, сложные эфиры фосфорной кислоты, соли металлов и сложных эфиров сульфокислот, карбаматы и амиды. Примеры хорошо известных способов получения пролекарства определенного действующего соединения известны специалистам в данной области и могут быть найдены, например, в Krogsgaard-Larsen et al. ʺTextbook of Drug design and Discoveryʺ Taylor & Francis (April 2002).
Если не указано иное, подразумевают, что соединения согласно настоящему изобретению также включают соединения, которые отличаются лишь присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие данные структуры, за исключением замещения атома водорода дейтерием или тритием или замещения атома углерода углеродом, обогащенным 13C или 14C, или атома азота азотом, обогащенным 15N, находятся в пределах объема настоящего изобретения.
Соединения формулы (I), а также их соли, или сольваты соединений находятся предпочтительно в фармацевтически приемлемой или практически чистой форме. Под фармацевтически приемлемой подразумевают, среди прочего, форму, имеющую фармацевтически приемлемый уровень чистоты без учета обычных фармацевтических добавок, таких как разбавители и носители, и не содержащую веществ, которые считаются токсичными при обычных уровнях дозировки. Уровни чистоты для лекарственного вещества составляют предпочтительно выше 50%, более предпочтительно выше 70%, наиболее предпочтительно выше 90%. В предпочтительном варианте осуществления у соединения формулы (I) или его солей он составляет выше 95%. Это касается также его сольватов или пролекарств.
В предпочтительном варианте осуществления соединение согласно настоящему изобретению согласно общей формуле I представляет собой соединение формулы Iʹ,

(Iʹ),
где q равняется 1, 2, 3 или 4,
R1 и R2 определены выше для соединения формулы (I);
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединение согласно настоящему изобретению общей формулы I представляет собой соединение формулы Iʹʹ,

(Iʹʹ),
где R1, R2 и R3 определены выше для соединения формулы (I);
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В конкретном варианте осуществления исключены одно или несколько из следующих соединений:
2,4-диметил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, и/или
2-этил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, и/или
2-изопропил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, и/или
2-бутил-4-этил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он,
 , и/или
, и/или ,и/или
,и/или  , и/или
, и/или  .
.
В конкретном варианте осуществления данное исключение относится только к соответствующей рацемической форме данного или данных вышеуказанного/вышеуказанных соединения/соединений.
В конкретном варианте осуществления все 4 данных вышеуказанных соединения исключены.
В другом конкретном варианте осуществления условие/ограничение касается соединения согласно формуле Iʹʹ, где, если R2 представляет собой незамещенный фенил, и R3 представляет собой C1-4-алкил, то R1 может не представлять собой C1-2-алкил.
В предпочтительном варианте осуществления соединение согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ представляет собой соединение, где
R1 представляет собой незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил, незамещенный C3-6циклоалкил, незамещенный C4-7алкилциклоалкил;
R2 представляет собой замещенный или незамещенный моноциклический арил или замещенный или незамещенный моноциклический гетероциклил;
R3 - для формулы I или Iʹʹ - представляет собой незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил, незамещенный C3-6циклоалкил, незамещенный C4-7алкилциклоалкил, незамещенный C4-7алкиларил, незамещенный C3-6арил, незамещенный C3-6гетероциклил или незамещенный C4-7алкилгетероциклил;
R3ʹ - для формулы I - представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил или незамещенный C2-6алкинил,
в качестве альтернативы, R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), могут образовывать незамещенный C3-6циклоалкил;
R4, R4ʹ и R4ʹʹ независимо выбраны из водорода или незамещенного C1-6алкила, незамещенного C2-6алкенила или незамещенного C2-6алкинила, незамещенного C3-6циклоалкила;
и
R4ʹʹʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил или -Boc;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединение согласно настоящему изобретению согласно общей формуле I представляет собой соединение формулы Iʹ,
где q равняется 1;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R1 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R2 представляет собой замещенный или незамещенный моноциклический арил или замещенный или незамещенный моноциклический гетероциклил,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
R3 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил, замещенный или незамещенный C4-7алкиларил, замещенный или незамещенный C3-6арил, замещенный или незамещенный C3-6гетероциклил или замещенный или незамещенный C4-7алкилгетероциклил;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
R3ʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил или незамещенный C2-6алкинил,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), могут образовывать замещенный или незамещенный C3-6циклоалкил;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R4, R4ʹ и R4ʹʹ независимо выбраны из водорода или замещенного или незамещенного C1-6алкила, замещенного или незамещенного C2-6алкенила или замещенного или незамещенного C2-6алкинила, замещенного или незамещенного C3-6циклоалкила;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R4ʹʹʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил или -Boc;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R1 представляет собой незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил, незамещенный C3-6циклоалкил, незамещенный C4-7алкилциклоалкил,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R2 представляет собой замещенный или незамещенный моноциклический арил или замещенный или незамещенный моноциклический гетероциклил,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
R3 представляет собой незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил, незамещенный C3-6циклоалкил, незамещенный C4-7алкилциклоалкил, незамещенный C4-7алкиларил, незамещенный C3-6арил, незамещенный C3-6гетероциклил или незамещенный C4-7алкилгетероциклил;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
R3ʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил или незамещенный C2-6алкинил,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), могут образовывать незамещенный C3-6циклоалкил;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R4, R4ʹ и R4ʹʹ независимо выбраны из водорода или незамещенного C1-6алкила, незамещенного C2-6алкенила или незамещенного C2-6алкинила, незамещенного C3-6циклоалкила;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R4ʹʹʹ представляет собой водород или незамещенный C1-6алкил, незамещенный C2-6алкенил, незамещенный C2-6алкинил или -Boc;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле Iʹ соединение представляет собой соединение, где
q равняется 1, 2, 3 или 4,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
в R1, как определено в любом из вышеуказанных вариантов осуществления,
алкил представляет собой C1-4алкил, такой как метил, этил, пропил или бутил;
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил, этил, изопропил;
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
и/или
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила; предпочтительно C3-6циклоалкил представляет собой циклопропил;
и/или
в R2, как определено в любом из вышеуказанных вариантов осуществления,
арил представляет собой фенил;
и/или
гетероциклил представляет собой гетероциклическую кольцевую систему с одним насыщенным или ненасыщенным кольцом, которое содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; более предпочтительно выбран из имидазола, оксадиазола, тетразола, пиридина, пиримидина, пиперидина, пиперазина, тиазола, тетрагидропирана, морфолина, фурана, триазола, изоксазола, пиразола, тиофена, пиррола, пиразина, оксопирролидина, пиримидина, предпочтительно гетероциклил представляет собой пиридин или тиазол;
и/или
в R3 - для формулы I или Iʹʹ, как определено в любом из вышеуказанных вариантов осуществления,
алкил представляет собой C1-4алкил, такой как метил, этил, пропил или бутил;
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил, этил, изопропил,
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6алкинил, такой как этин, пропин, бутин, пентин или гексин, предпочтительно пропин;
и/или
арил представляет собой фенил;
и/или
гетероциклил представляет собой гетероциклическую кольцевую систему с одним или несколькими насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; предпочтительно представляет собой гетероциклическую кольцевую систему с одним или двумя насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; более предпочтительно выбран из имидазола, оксадиазола, тетразола, пиридина, пиримидина, пиперидина, пиперазина, бензофурана, бензимидазола, индазола, бензотиазола, бензодиазола, тиазола, бензотиазола, тетрагидропирана, морфолина, индолина, фурана, триазола, изоксазола, пиразола, тиофена, бензотиофена, пиррола, пиразина, пирроло[2,3b]пиридина, хинолина, изохинолина, фталазина, бензо-1,2,5-тиадиазола, индола, бензотриазола, бензоксазола, оксопирролидина, пиримидина, бензодиоксолана, бензодиоксана, карбазола и хиназолина;
и/или
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила;
и/или
в R3ʹ - для формулы I, как определено в любом из вышеуказанных вариантов осуществления,
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил или этил;
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
и/или
в R3 и R3ʹ - для формулы I - взятых вместе (с соединяющим C-атомом), и образующих циклоалкил, как определено в любом из вышеуказанных вариантов осуществления,
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила, предпочтительно C3-6циклоалкил представляет собой циклопропил или циклопентил;
и/или
в R4, R4ʹ и R4ʹʹ, как определено в любом из вышеуказанных вариантов осуществления,
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил;
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
и/или
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила;
и/или
в R4ʹʹʹ, как определено в любом из вышеуказанных вариантов осуществления,
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила,
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
в R1, как определено в любом из вышеуказанных вариантов осуществления,
алкил представляет собой C1-4алкил, такой как метил, этил, пропил или бутил;
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил, этил, изопропил;
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
и/или
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила; предпочтительно C3-6циклоалкил представляет собой циклопропил;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
в R2, как определено в любом из вышеуказанных вариантов осуществления,
арил представляет собой фенил;
и/или
гетероциклил представляет собой гетероциклическую кольцевую систему с одним насыщенным или ненасыщенным кольцом, которое содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; более предпочтительно выбран из имидазола, оксадиазола, тетразола, пиридина, пиримидина, пиперидина, пиперазина, тиазола, тетрагидропирана, морфолина, фурана, триазола, изоксазола, пиразола, тиофена, пиррола, пиразина, оксопирролидина, пиримидина, предпочтительно гетероциклил представляет собой пиридин или тиазол;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
в R3, как определено в любом из вышеуказанных вариантов осуществления,
алкил представляет собой C1-4алкил, такой как метил, этил, пропил или бутил;
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил, этил, изопропил,
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина, предпочтительно пропина;
и/или
арил представляет собой фенил;
и/или
гетероциклил представляет собой гетероциклическую кольцевую систему c одним или несколькими насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; предпочтительно представляет собой гетероциклическую кольцевую систему с одним или двумя насыщенными или ненасыщенными кольцами, из которых по меньшей мере одно кольцо содержит один или несколько гетероатомов в кольце из группы, состоящей из азота, кислорода и/или серы; более предпочтительно выбран из имидазола, оксадиазола, тетразола, пиридина, пиримидина, пиперидина, пиперазина, бензофурана, бензимидазола, индазола, бензотиазола, бензодиазола, тиазола, бензотиазола, тетрагидропирана, морфолина, индолина, фурана, триазола, изоксазола, пиразола, тиофена, бензотиофена, пиррола, пиразина, пирроло[2,3b]пиридина, хинолина, изохинолина, фталазина, бензо-1,2,5-тиадиазола, индола, бензотриазола, бензоксазола, оксопирролидина, пиримидина, бензодиоксолана, бензодиоксана, карбазола и хиназолина,
и/или
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
в R3ʹ, как определено в любом из вышеуказанных вариантов осуществления,
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил или этил;
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
в R3 и R3ʹ, взятых вместе (с соединяющим C-атомом) и образующих циклоалкил, как определено в любом из вышеуказанных вариантов осуществления,
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила, предпочтительно C3-6циклоалкил представляет собой циклопропил или циклопентил;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
в R4, R4ʹ и R4ʹʹ, как определено в любом из вышеуказанных вариантов осуществления,
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила, предпочтительно C1-6алкил представляет собой метил;
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
и/или
C3-6циклоалкил предпочтительно выбран из циклопропила, циклобутила, циклопентила или циклогексила;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
в R4ʹʹʹ, как определено в любом из вышеуказанных вариантов осуществления,
C1-6алкил предпочтительно выбран из метила, этила, пропила, бутила, пентила, гексила, изопропила или 2-метилпропила,
и/или
C2-6-алкенил предпочтительно выбран из этилена, пропилена, бутилена, пентилена или гексилена;
и/или
C2-6-алкинил предпочтительно выбран из этина, пропина, бутина, пентина или гексина;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль, или его соответствующий сольват.
В предпочтительном варианте осуществления
R1 представляет собой замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный изопропил или замещенный или незамещенный циклопропил, предпочтительно R1 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил или незамещенный циклопропил.
В другом предпочтительном варианте осуществления R2 представляет собой замещенный или незамещенный фенил, замещенный или незамещенный пиридин или замещенный или незамещенный тиазол.
В наиболее предпочтительном варианте осуществления
R3 представляет собой замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный изопропил, замещенный или незамещенный пропин, замещенный или незамещенный бензил или -CH2CH2OH, предпочтительно R3 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил, незамещенный пропин, незамещенный бензил или -CH2CH2OH.
В предпочтительном варианте осуществления
R3ʹ представляет собой водород, замещенный или незамещенный метил или замещенный или незамещенный этил, предпочтительно R3ʹ представляет собой водород, незамещенный метил или незамещенный этил.
В другом предпочтительном варианте осуществления
R3 представляет собой замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный изопропил, замещенный или незамещенный пропин, замещенный или незамещенный бензил или -CH2CH2OH, при этом R3ʹ представляет собой водород, замещенный или незамещенный метил или замещенный или незамещенный этил.
В другом предпочтительном варианте осуществления
R3 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил, незамещенный пропин, незамещенный бензил или -CH2CH2OH, при этом R3ʹ представляет собой водород, незамещенный метил или незамещенный этил.
В предпочтительном варианте осуществления
R3 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил, незамещенный бензил, незамещенный пропин или -CH2CH2OH, при этом R3ʹ представляет собой водород.
В другом предпочтительном варианте осуществления
R3 представляет собой замещенный или незамещенный метил, при этом R3ʹ представляет собой замещенный или незамещенный метил, предпочтительно R3 представляет собой незамещенный метил, при этом R3ʹ представляет собой незамещенный метил.
В другом предпочтительном варианте осуществления
R3 представляет собой замещенный или незамещенный этил, при этом R3ʹ представляет собой замещенный или незамещенный этил, предпочтительно R3 представляет собой незамещенный этил, при этом R3ʹ представляет собой незамещенный этил.
В другом предпочтительном варианте осуществления
R3 представляет собой замещенный или незамещенный пропин, при этом R3ʹ представляет собой водород, предпочтительно R3 представляет собой незамещенный пропин, при этом R3ʹ представляет собой водород.
В другом предпочтительном варианте осуществления
R3 представляет собой замещенный или незамещенный бензил, при этом R3ʹ представляет собой водород, предпочтительно R3 представляет собой незамещенный бензил, при этом R3ʹ представляет собой водород.
В другом предпочтительном варианте осуществления
R3 представляет собой -CH2CH2OH, при этом R3ʹ представляет собой водород.
В другом предпочтительном варианте осуществления
R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), представляют собой замещенный или незамещенный циклопропил или замещенный или незамещенный циклопентил, предпочтительно R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), представляют собой незамещенный циклопропил или незамещенный циклопентил.
В предпочтительном варианте осуществления
R4, R4ʹ и R4ʹʹ представляют собой водород или замещенный или незамещенный метил.
В предпочтительном варианте осуществления
R4, R4ʹ и R4ʹʹ представляют собой водород или незамещенный метил.
В другом предпочтительном варианте осуществления
R4ʹʹʹ представляет собой водород или -Boc.
В другом предпочтительном варианте осуществления
R4ʹʹʹ представляет собой незамещенный метил.
В конкретном предпочтительном варианте осуществления
R4, R4ʹ и R4ʹʹ представляют собой водород или замещенный или незамещенный метил, при этом R4ʹʹʹ представляет собой водород или -Boc.
В конкретном предпочтительном варианте осуществления
R4, R4ʹ и R4ʹʹ представляют собой водород или незамещенный метил, при этом R4ʹʹʹ представляет собой водород или -Boc.
В другом конкретном предпочтительном варианте осуществления
q равняется 1.
В одном варианте осуществления настоящего изобретения в соединении общих формул I, Iʹ и Iʹʹ
галоген представляет собой фтор, хлор, иод или бром.
В наиболее предпочтительном варианте осуществления в соединении согласно общим формулам I, Iʹ и Iʹʹ
галоген представляет собой фтор или хлор.
В одном варианте осуществления настоящего изобретения в соединении общих формул I, Iʹ и Iʹʹ
галогеналкил представляет собой -CF3.
В другом варианте осуществления настоящего изобретения в соединении общих формул I, Iʹ и Iʹʹ
галогеналкокси представляет собой -OCF3.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R1 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил,
где циклоалкил в R1 при замещении (также в алкилциклоалкиле) замещен заместителями, выбранными из -R4ʹʹʹ, галогена, -SR4ʹʹʹ, -CN, галогеналкила, -NR4ʹʹʹR4ʹʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R1 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил,
при этом алкил, алкенил и алкинил в R1 при замещении замещены заместителями, выбранными из галогена, -CN, галогеналкила;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R2 представляет собой замещенный или незамещенный моноциклический арил или замещенный или незамещенный моноциклический гетероциклил,
где арил или гетероциклил в R2 при замещении замещен заместителями, выбранными из -R4, -OR4, галогена, =O, -OCH2CH2OH, -SR4, -S(O)R4, -S(O)2R4, -CN, галогеналкила, -галогеналкокси, -NR4R4ʹʹʹ, -NO2, -NR4C(O)R4ʹ, -NR4SO2R4ʹ, -C(O)OR4, -C(O)NR4R4ʹ, -NR4C(O)NR4ʹR4ʹʹ, -S(O)2NR4R4ʹ, -NR4S(O)2NR4ʹR4ʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R2 представляет собой замещенный или незамещенный моноциклический арил или замещенный или незамещенный моноциклический гетероциклил,
где арил или гетероциклил в R2 при замещении замещен заместителями, выбранными из -R4ʹʹʹ, -OR4ʹʹʹ, галогена, =O, -OCH2CH2OH, -SR4ʹʹʹ, -S(O)R4ʹʹʹ, -S(O)2R4ʹʹʹ, -CN, галогеналкила, -галогеналкокси, -NR4ʹʹʹR4ʹʹʹ, -NO2, -NR4ʹʹʹC(O)R4ʹʹʹ, -NR4ʹʹʹS(O)2R4ʹʹʹ, -C(O)OR4ʹʹʹ, -C(O)NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹC(O)NR4ʹʹʹR4ʹʹʹ, -S(O)2NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹS(O)2NR4ʹʹʹR4ʹʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
R3 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил, замещенный или незамещенный C4-7алкиларил, замещенный или незамещенный C3-6арил, замещенный или незамещенный C3-6гетероциклил или замещенный или незамещенный C4-7алкилгетероциклил;
где арил, гетероциклил или циклоалкил в R3 при замещении (также в алкилариле, алкилциклоалкиле или алкилгетероциклиле) замещен заместителями, выбранными из -R4, -OR4, галогена, =O, -OCH2CH2OH, -SR4, -S(O)R4, -S(O)2R4, -CN, галогеналкила, -галогеналкокси, -NR4R4ʹʹʹ, -NO2, -NR4C(O)R4ʹ, -NR4S(O)2R4ʹ, -C(O)OR4, -C(O)NR4R4ʹ, -NR4C(O)NR4ʹR4ʹʹ, -S(O)2NR4R4ʹ, -NR4S(O)2NR4ʹR4ʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
R3 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил, замещенный или незамещенный C4-7алкиларил, замещенный или незамещенный C3-6арил, замещенный или незамещенный C3-6гетероциклил или замещенный или незамещенный C4-7алкилгетероциклил;
где арил, гетероциклил или циклоалкил в R3 при замещении (также в алкилариле, алкилциклоалкиле или алкилгетероциклиле) замещен заместителями, выбранными из -R4ʹʹʹ, -OR4ʹʹʹ, галогена, =O, -OCH2CH2OH, -SR4ʹʹʹ, -S(O)R4ʹʹʹ, -S(O)2R4ʹʹʹ, -CN, галогеналкила, -галогеналкокси, -NR4ʹʹʹR4ʹʹʹ, -NO2, -NR4ʹʹʹC(O)R4ʹʹʹ, -NR4ʹʹʹS(O)2R4ʹʹʹ, -C(O)OR4ʹʹʹ, -C(O)NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹC(O)NR4ʹʹʹR4ʹʹʹ, -S(O)2NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹS(O)2NR4ʹʹʹR4ʹʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
R3 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил, замещенный или незамещенный C4-7алкиларил, замещенный или незамещенный C3-6арил, замещенный или незамещенный C3-6гетероциклил или замещенный или незамещенный C4-7алкилгетероциклил;
и где алкил, алкенил и алкинил в R3 при замещении замещены заместителями, выбранными из -OR4, галогена, -CN, галогеналкила,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I или Iʹʹ соединение представляет собой соединение, где
R3 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6циклоалкил, замещенный или незамещенный C4-7алкилциклоалкил, замещенный или незамещенный C4-7алкиларил, замещенный или незамещенный C3-6арил, замещенный или незамещенный C3-6гетероциклил или замещенный или незамещенный C4-7алкилгетероциклил;
и где алкил, алкенил и алкинил в R3 при замещении замещены заместителями, выбранными из -OR4ʹʹʹ, галогена, -CN, галогеналкила,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), могут образовывать замещенный или незамещенный C3-6циклоалкил;
где циклоалкил для R3 и R3ʹ, взятых вместе, при замещении замещен заместителями, выбранными из -R4, -OR4, галогена, =O, -OCH2CH2OH, -SR4, -S(O)R4, -S(O)2R4, -CN, галогеналкила, -галогеналкокси, -NR4R4ʹʹʹ, -NO2, -NR4C(O)R4ʹ, -NR4S(O)2R4ʹ, -C(O)OR4, -C(O)NR4R4ʹ, -NR4C(O)NR4ʹR4ʹʹ, -S(O)2NR4R4ʹ, -NR4S(O)2NR4ʹR4ʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле I соединение представляет собой соединение, где
R3 и R3ʹ, взятые вместе (с соединяющим C-атомом), могут образовывать замещенный или незамещенный C3-6циклоалкил;
где циклоалкил для R3 и R3ʹ, взятых вместе, при замещении замещен заместителями, выбранными из -R4ʹʹʹ, -OR4ʹʹʹ, галогена, =O, -OCH2CH2OH, -SR4ʹʹʹ, -S(O)R4ʹʹʹ, -S(O)2R4ʹʹʹ, -CN, галогеналкила, -галогеналкокси, -NR4ʹʹʹR4ʹʹʹ, -NO2, -NR4ʹʹʹC(O)R4ʹʹʹ, -NR4ʹʹʹS(O)2R4ʹʹʹ, -C(O)OR4ʹʹʹ, -C(O)NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹC(O)NR4ʹʹʹR4ʹʹʹ, -S(O)2NR4ʹʹʹR4ʹʹʹ, -NR4ʹʹʹS(O)2NR4ʹʹʹR4ʹʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R4, R4ʹ и R4ʹʹ независимо выбраны из водорода или замещенного или незамещенного C1-6алкила, замещенного или незамещенного C2-6алкенила или замещенного или незамещенного C2-6алкинила, замещенного или незамещенного C3-6циклоалкила;
где циклоалкил в R4, R4ʹ или R4ʹʹ при замещении замещен заместителями, выбранными из -R4ʹʹʹ, галогена, -SR4ʹʹʹ, -CN, галогеналкила,-NR4ʹʹʹR4ʹʹʹ,
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общим формулам I, Iʹ или Iʹʹ соединение представляет собой соединение, где
R4, R4ʹ и R4ʹʹ независимо выбраны из водорода или замещенного или незамещенного C1-6алкила, замещенного или незамещенного C2-6алкенила или замещенного или незамещенного C2-6алкинила, замещенного или незамещенного C3-6циклоалкила;
при этом алкил, алкенил и алкинил в R4, R4ʹ или R4ʹʹ при замещении замещены заместителями, выбранными из галогена, -CN, галогеналкила;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующую соль.
В одном предпочтительном дополнительном варианте осуществления соединения общей формулы I выбраны из следующего.
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или их соответствующая соль.
В другом предпочтительном дополнительном варианте осуществления соединения общей формулы I выбраны из следующего.
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или их соответствующая соль.
В другом особенно предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле Iʹ соединение выбрано из примеров 1-10, 12-17, 19-30, 43 и 55-63 необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или их соответствующей соли.
В другом особенно предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле Iʹ соединение выбрано из примеров 1-10, 12-17, 19-30, 43, 55-63, 66, 67 и 71-73 необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или их соответствующей соли.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле Iʹʹ соединение выбрано из примеров 11, 18, 31-42 и 44-53 необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или соответствующей соли.
В другом предпочтительном варианте осуществления соединения согласно настоящему изобретению согласно общей формуле Iʹʹ соединение выбрано из примеров 11, 18, 31-42, 44-53, 70, 74-77, 80, 81, 87, 91-94 необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или соответствующей соли.
Поскольку настоящее изобретение направлено на обеспечение соединения или родственного с точки зрения химии ряда соединений, которые выполняют функцию лигандов двойного действия σ1-рецептора и μ-опиоидного рецептора особенно предпочтительным вариантом осуществления является тот, в котором выбраны соединения, которые выполняют функцию лигандов двойного действия σ1-рецептора и μ-опиоидного рецептора, и, в особенности, соединения, которые характеризуются сродством, выраженным в виде Ki, которое составляет предпочтительно <1000 нМ для обоих рецепторов, более предпочтительно <500 нМ, еще более предпочтительно <100 нМ.
Далее применяют фразу ʺсоединение согласно настоящему изобретениюʺ. Его следует понимать как любое соединение согласно настоящему изобретению, как описано выше, согласно общим формулам I, Iʹ или Iʹʹ.
Соединения согласно настоящему изобретению, представленные вышеописанной формулой (I), могут включать энантиомеры, в зависимости от присутствия хиральных центров, или изомеры, в зависимости от присутствия нескольких связей (например, Z, E). Отдельные изомеры, энантиомеры или диастереоизомеры и их смеси попадают в объем настоящего изобретения.
В общем, в экспериментальной части ниже описаны способы. Исходные материалы являются коммерчески доступными или могут быть получены традиционными способами.
В качестве дополнительного общего замечания, использование слов ʺвключающийʺ и ʺвключаетʺ, применяемых в данном документе, в особенности, при определении стадий способа, следует понимать как раскрывающее также выражения соответственно ʺсостоящий изʺ и ʺсостоит изʺ и т. д. Таким образом, это также включает то, что стадии соответствующего способа далее также следует понимать как ограниченные стадиями с предшествующими словами ʺвключающийʺ или ʺвключаетʺ и т. д.
Предпочтительный аспект настоящего изобретения также представляет собой способ получения соединения согласно формуле I,
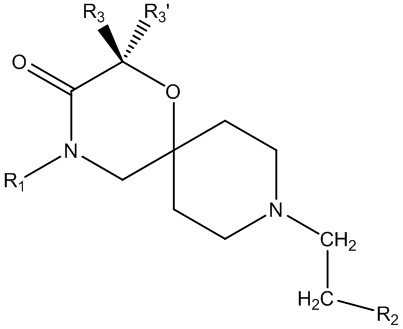
(I),
где R1, R2, R3 и R3ʹ уже определены в описании,
где соединение формулы VIIIH или его приемлемую соль, такую как гидрохлорид,

(VIIIH),
где R1, R3 и R3ʹ уже определены выше в описании, вводят в реакцию с соединением согласно формуле IX, X или XI,
 или
или 
(IX), (X) (XI),
где R2 уже определен выше в описании, и где LG представляет собой уходящую группу, что приводит к соединению согласно формуле (I).
Конкретный вариант осуществления представляет собой способ получения соединения общей формулы I,

(I),
где
R1, R2, R3 и R3ʹ уже определены в описании;
который включает стадии:
(a) введения в реакцию соединения формулы V,
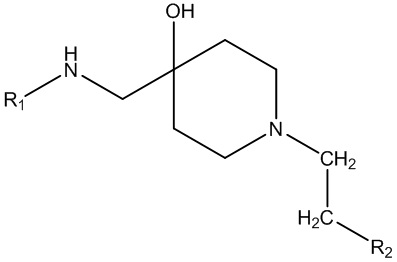
(V),
с соединением формулы VI,

(VI),
где W и LG представляют собой уходящие группы, R3 и R3ʹ уже определены в описании;
с получением соединения формулы VII,
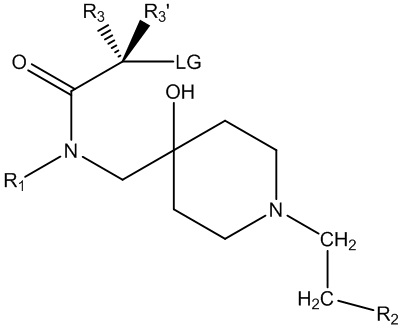
(VII),
где LG представляет собой уходящую группу, R3 и R3ʹ уже определены в описании;
и
(b) осуществления циклизации полученного соединения в подходящем растворителе в присутствии сильного основания и при температуре, находящейся в диапазоне от -78°C до температуры флегмы.
Другой конкретный вариант осуществления настоящего изобретения представляет собой способ получения
соединения общей формулы Iʹ,

(Iʹ),
где
q равняется 1, 2, 3 или 4, и R1 и R2 определены в описании;
который включает стадии:
(a) введения в реакцию соединения формулы V,

(V),
где R1 и R2 определены в описании;
с соединением формулы XX,

(XX),
где W и LG представляют собой уходящие группы, q определен в описании;
с получением соединения формулы XXI,

(XXI),
где W и LG представляют собой уходящие группы, R2 и q определены в описании;
(b) осуществления циклизации полученного соединения в подходящем растворителе в присутствии сильного основания и при температуре, находящейся в диапазоне от -78°C до температуры флегмы; что приводит к соединению формулы XXII,

(XXII),
(c) и обработки сильным основанием, таким как диизопропиламид лития или трет-бутоксид калия, в апротонном растворителе, таком как тетрагидрофуран, при подходящей температуре, предпочтительно при охлаждении.
Получение соли с HCl. К раствору полученного свободного основания в подходящем растворителе, предпочтительно в безводном диэтиловом эфире, добавляли HCl и смесь перемешивали, предпочтительно при комнатной температуре, предпочтительно в течение 1 ч. Растворитель выпаривали, предпочтительно под вакуумом, с получением соответствующей соли с HCl.
При необходимости, полученные продукты реакции можно очищать с помощью традиционных способов, таких как кристаллизация и хроматография. Если вышеописанные способы получения соединений согласно настоящему изобретению способствуют получению смесей стереоизомеров, данные изомеры можно разделять с помощью традиционных методик, таких как препаративная хроматография. Если присутствуют хиральные центры, соединения могут быть получены в рацемической форме, или отдельные энантиомеры могут быть получены либо посредством энантиоспецифичного синтеза, либо путем разделения.
Одна предпочтительная фармацевтически приемлемая форма соединения согласно настоящему изобретению представляет собой кристаллическую форму, в том числе такую форму в фармацевтической композиции. В случае солей, а также сольватов соединений согласно настоящему изобретению дополнительные ионные фрагменты и фрагменты, представляющие собой растворитель, также должны быть нетоксичными. Соединения согласно настоящему изобретению могут присутствовать в различных полиморфных формах, предполагается, что настоящее изобретение охватывает все такие формы.
Другой аспект настоящего изобретения относится к фармацевтической композиции, которая содержит соединение согласно настоящему изобретению, описанному выше согласно общим формулам I, Iʹ или Iʹʹ, или его фармацевтически приемлемую соль или стереоизомер и фармацевтически приемлемые носитель, вспомогательное средство или среду-носитель. Таким образом, в настоящем изобретении предусматривают фармацевтические композиции, содержащие соединение по настоящему изобретению или его фармацевтически приемлемую соль или стереоизомеры вместе с фармацевтически приемлемым носителем, вспомогательным средством или средой-носителем, для введения пациенту.
В качестве общего замечания, использование слов ʺсодержащийʺ и ʺсодержитʺ, применяемых в данном документе, в особенности, при определении содержимого лекарственного препарата или фармацевтического состава, следует понимать как раскрывающие также выражения соответственно ʺсостоящий изʺ и ʺсостоит изʺ и т. д. Таким образом, это также включает то, что содержимое соответствующего лекарственного препарата или фармацевтического состава далее также следует понимать как строго ограниченное содержимым с предшествующим словами ʺсодержащийʺ или ʺсодержитʺ и т. д.
Примеры фармацевтических композиций включают любую твердую (таблетки, пилюли, капсулы, гранулы и т. д.) или жидкую (растворы, суспензии или эмульсии) композицию для перорального, местного или парентерального введения.
В предпочтительном варианте осуществления фармацевтические композиции представлены в пероральной форме, либо твердой, либо жидкой. Подходящие дозировочные формы для перорального введения могут представлять собой таблетки, капсулы, сиропы или растворы и могут содержать традиционные наполнители, известные из уровня техники, такие как связующие средства, например, сироп, аравийская камедь, желатин, сорбит, трагакант или поливинилпирролидон; заполнители, например, лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающие вещества для таблетирования, например, стеарат магния; разрыхлители, например, крахмал, поливинилпирролидон, натрия крахмала гликолят или микрокристаллическую целлюлозу; или фармацевтически приемлемые смачивающие средства, такие как лаурилсульфат натрия.
Твердые композиции для перорального применения могут быть получены с помощью традиционных способов смешивания, заполнения или таблетирования. Повторяемые операции смешивания можно применять для распределения активного средства по данным композициям с использованием больших количеств заполнителей. Такие операции являются традиционными в уровне техники. Например, таблетки можно получать посредством влажного или сухого гранулирования и необязательно покрывать согласно способам, хорошо известным в обычной фармацевтической практике, в частности, энтеросолюбильным покрытием.
Фармацевтические композиции также могут быть приспособлены для парентерального введения, как, например, стерильные растворы, суспензии или лиофилизированные продукты в приемлемой стандартной лекарственной форме. Могут быть использованы приемлемые наполнители, такие как объемообразующие средства, буферные средства или поверхностно-активные средства.
Упомянутые составы будут получены с применением стандартных способов, таких как способы, описанные или относящиеся к фармакопеям Испании и США и подобным ссылочным источникам.
Введение соединений или композиций согласно настоящему изобретению можно осуществлять любым подходящим способом, таким как внутривенная инфузия, прием лекарственных препаратов для перорального применения, а также внутрибрюшинное и внутривенное введение. Пероральное введение является предпочтительным вследствие удобства для пациента и хронического характера заболеваний, подлежащих лечению.
Как правило, эффективное вводимое количество соединения согласно настоящему изобретению будет зависеть от относительной эффективности выбранного соединения, тяжести нарушения, подлежащего лечению, и веса больного. Однако, активные соединения, как правило, будут вводить один или несколько раз в сутки, например, 1, 2, 3 или 4 раза в сутки, с типичными суммарными суточными дозами в диапазоне от 0,1 до 1000 мг/кг/сутки.
Соединения и композиции согласно настоящему изобретению можно применять с другими лекарственными средствами для обеспечения комбинированной терапии. Другие лекарственные средства могут составлять часть одной и той же композиции или быть представлены в виде отдельной композиции для введения в одно и то же время или в разное время.
Другой аспект настоящего изобретения относится к применению соединения согласно настоящему изобретению или его фармацевтически приемлемой соли или изомера в производстве лекарственного препарата.
Другой аспект настоящего изобретения относится к соединению согласно настоящему изобретению в соответствии с описанными выше общими формулами I, Iʹ или Iʹʹ или его фармацевтически приемлемой соли или изомеру для применения в качестве лекарственного препарата для лечения боли. Предпочтительно боль представляет собой боль от средней до сильной, висцеральную боль, хроническую боль, боль при раке, мигрень, боль при воспалении, острую боль или нейропатическую боль, аллодинию или гипералгезию. Она может включать механическую аллодинию или термическую гипералгезию.
Другой аспект настоящего изобретения относится к применению соединения согласно настоящему изобретению в производстве лекарственного препарата для лечения или профилактики боли.
В предпочтительном варианте осуществления боль выбрана из боли от средней до сильной, висцеральной боли, хронической боли, боли при раке, мигрени, боли при воспалении, острой боли или нейропатической боли, аллодинии или гипералгезии, также предпочтительно включающих механическую аллодинию или термическую гипералгезию.
Другой аспект настоящего изобретения относится к способу лечения или предупреждения боли, при этом способ включает введение нуждающемуся в таком лечении пациенту терапевтически эффективного количества определенного выше соединения или фармацевтической композиции на его основе. Среди болевых синдромов, которые можно лечить, представлены боль от средней до сильной, висцеральная боль, хроническая боль, боль при раке, мигрень, боль при воспалении, острая боль или нейропатическая боль, аллодиния или гипералгезия, при этом в этом случае также могут включаться механическая аллодиния или термическая гипералгезия.
Настоящее изобретение проиллюстрировано ниже с помощью примеров. Данные иллюстрации приведены только в качестве примера и не ограничивают общую суть настоящего изобретения.
ПРИМЕРЫ
Общая экспериментальная часть (способы и оборудование для синтеза и анализа)
Схема 1
Описан 4-стадийный способ получения соединений общей формулы (I), начиная с кетона формулы II, как показано на следующей схеме.
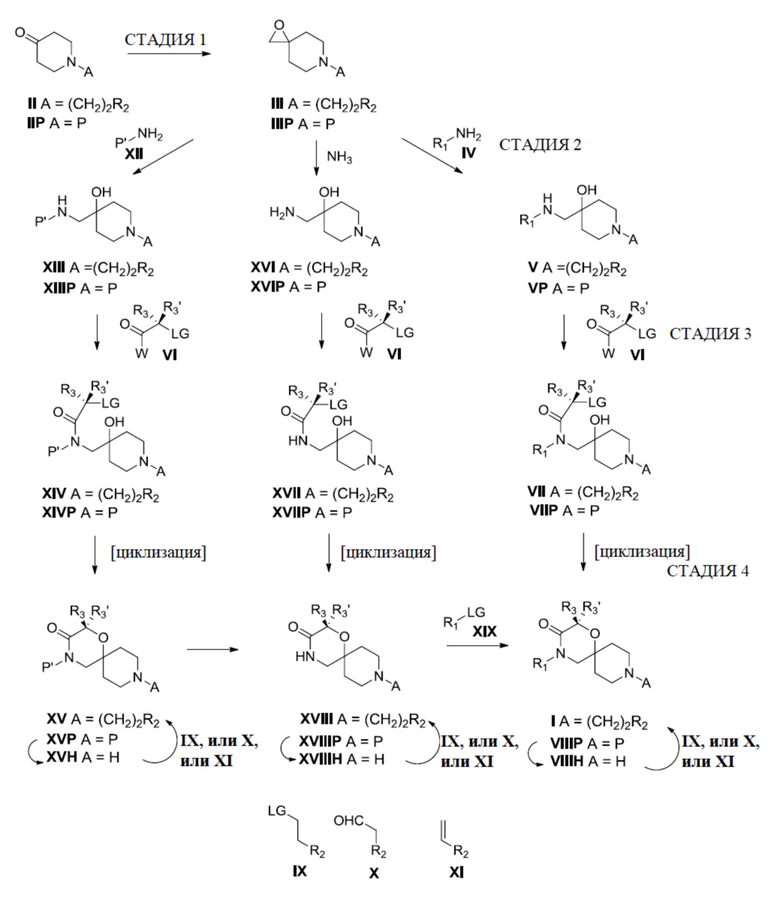
Схема 1
где R1, R2, R3 и R3ʹ имеют значения, определенные выше для соединения формулы (I), W представляет собой уходящую группу, такую как хлор или бром, LG представляет собой другую уходящую группу, такую как галоген, мезилат, тозилат или трифлат, P представляет собой подходящую защитную группу (предпочтительно Boc), и Pʹ представляет собой другую подходящую защитную группу (предпочтительно 4-метоксибензил).
4-стадийный способ осуществляли, как описано далее.
Стадия 1. Соединение формулы III получали путем обработки соединения формулы II подходящим метил-переносящим реагентом, таким как иодид триметилсульфоксония или иодид триметилсульфония, в подходящем апротонном растворителе, таком как диметилсульфоксид, и в присутствии сильного основания, такого как гидрид натрия или трет-бутоксид калия, при подходящей температуре, предпочтительно находящейся в диапазоне от комнатной температуры до 60°C.
Стадия 2. Соединение формулы V получали путем введения соединения формулы III в реакцию с амином формулы IV в подходящем растворителе, таком как спирт, предпочтительно смеси этанол-вода, при подходящей температуре, находящейся в диапазоне от комнатной температуры до температуры флегмы, предпочтительно при комнатной температуре.
Стадия 3. Соединение формулы VII получали путем введения соединения формулы V в реакцию с ацилирующим средством формулы VI. Реакцию ацилирования осуществляли в подходящем растворителе, таком как дихлорметан или смеси этилацетат-вода; в присутствии органического основания, такого как триэтиламин или диизопропилэтиламин, или неорганического основания, такого как K2CO3; и при подходящей температуре, предпочтительно находящейся в диапазоне от -78°C до комнатной температуры.
Стадия 4. Путем внутримолекулярной циклизации соединения формулы VII получали соединение формулы (I). Реакцию циклизации осуществляли в подходящем растворителе, таком как тетрагидрофуран; в присутствии сильного основания, такого как трет-бутоксид калия или гидрид натрия; и при подходящей температуре, находящейся в диапазоне от -78°C до комнатной температуры, предпочтительно при охлаждении.
В качестве альтернативы, в последнюю стадию синтеза может быть включена группа CH2CH2R2 путем осуществления реакции соединения формулы VIIIH с соединением формулы IX, X или XI, как показано на схеме 1. Соединение формулы VIIIH получали путем снятия защиты с соединения формулы VIIIP, где P представляет подходящую защитную группу, предпочтительно Boc (трет-бутоксикарбонил). Если защитная группа представляет собой Boc, снятие защиты можно проводить путем добавления раствора сильной кислоты, такой как HCl, в подходящем растворителе, таком как диэтиловый эфир, 1,4-диоксан или метанол, или с помощью трифторуксусной кислоты в дихлорметане. Соединение формулы VIIIP получали из соединения формулы IIP согласно такой же последовательности, описанной для синтеза соединений формулы (I).
Реакцию алкилирования между соединением формулы VIIIH (или подходящей солью, такой как трифторацетат или гидрохлорид) и соединением формулы IX осуществляли в подходящем растворителе, таком как ацетонитрил, дихлорметан, 1,4-диоксан или диметилформамид, предпочтительно в ацетонитриле; в присутствии неорганического основания, такого как K2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин, предпочтительно K2CO3; при подходящей температуре, находящейся в диапазоне от комнатной температуры до температуры флегмы, предпочтительно при нагревании, или, в качестве альтернативы, реакции можно осуществлять в микроволновом реакторе. Кроме того, можно использовать активирующее средство, такое как NaI.
Реакцию восстановительного аминирования между соединением формулы VIIIH и соединением формулы X осуществляли в присутствии восстанавливающего реагента, предпочтительно триацетоксиборгидрида натрия, в апротонном растворителе, предпочтительно в тетрагидрофуране или дихлорэтане, необязательно в присутствии кислоты, предпочтительно уксусной кислоты.
Реакцию конденсации между соединением общей формулы VIIIH и соединением формулы XI предпочтительно осуществляли в подходящем растворителе, таком как изопропанол, н-бутанол или 2-метоксиэтанол, необязательно в присутствии органического основания, такого как триэтиламин или диизопропилэтиламин, при подходящей температуре, находящейся в диапазоне от комнатной температуры до температуры флегмы, предпочтительно при нагревании, или, в качестве альтернативы, реакции можно осуществлять в микроволновом реакторе.
В другом альтернативном подходе заместитель R1 можно включать позже в последовательность путем введения соединения формулы XVIII в реакцию с соединением формулы XIX. Реакцию алкилирования осуществляли в апротонном растворителе, предпочтительно диметилформамиде, в присутствии неорганического основания, такого как NaH, при подходящей температуре, предпочтительно от комнатной температуры до 60°C.
Соединение формулы XVIII синтезировали согласно аналогичной последовательности, описанной для синтеза соединений формулы I, но в осуществлении стадии 2 применяли аммиак вместо амина. В качестве альтернативы, соединение формулы XVIII можно получать путем введения соединения формулы XVIIIH (полученного из соединения формулы XVIIIP, где P представляет собой подходящую защитную группу) в реакцию с соединением формулы IX, X или XI, как описано выше.
Кроме того, соединение формулы XVIII можно получать из соединения формулы XV, где Pʹ представляет собой подходящую защитную группу, предпочтительно 4-метоксибензильную группу. Реакцию снятия защиты осуществляли с помощью нитрата аммония церия в подходящем растворителе, таком как смеси ацетонитрил-вода, или путем нагревания в трифторуксусной кислоте или хлористоводородной кислоте.
Соединение формулы XV синтезировали из соединения формулы III и амина формулы XII согласно аналогичной последовательности, описанной для синтеза соединений формулы (I). В качестве альтернативы, соединение формулы XV можно получать путем введения соединения формулы XVH (полученного из соединения формулы XVP, где P представляет собой подходящую защитную группу) в реакцию с соединением формулы IX, X или XI, как описано выше.
В качестве альтернативы, соединение формулы I можно получать путем разделения рацемической смеси либо путем хиральной препаративной HPLC, либо путем кристаллизации диастереомерной соли или сокристалла. Рацемическое соединение можно получать согласно таким же последовательностям синтеза, описанным для получения соединения формулы I. Кроме того, стадию разделения можно осуществлять на предыдущем этапе с использованием любого подходящего промежуточного соединения.
Соединения общей формулы II, IIP, IV, VI, IX, X, XI, XII и XIX, где R1, R2, R3, R3ʹ, LG, V, W, P и Pʹ имеют значения, определенные выше, являются коммерчески доступными, или их можно получать традиционными способами, описанными в литературе.
СХЕМА 2
Соединения общей формулы (I), где R3 и R3ʹ, взятые вместе, образуют (с соединяющим C-атомом) C3-6циклоалкильную группу (соединения формулы Ia), или R3 и R3ʹ являются одинаковыми (соединения формулы Ib), можно, в качестве альтернативы, получать, как описано на следующей схеме.
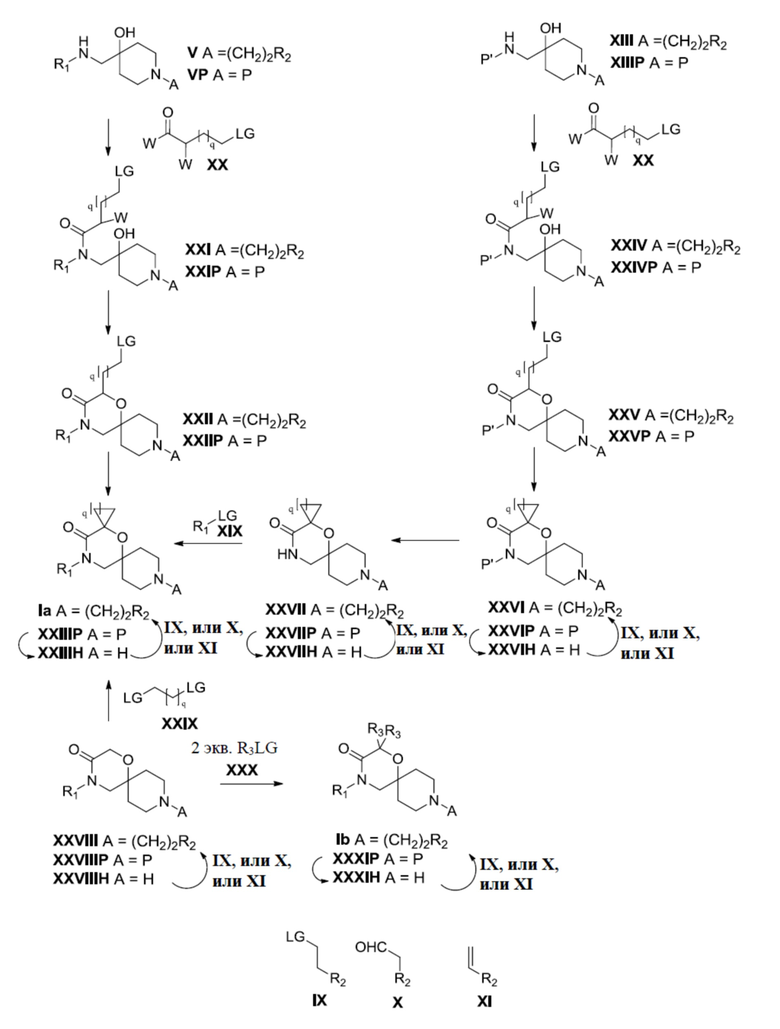
Схема 2
где R1, R2 и R3 имеют значения, определенные выше для соединения формулы (I), q равняется 1, 2, 3 или 4, LG представляет собой уходящую группу, такую как галоген, мезилат, тозилат или трифлат, W представляет собой другую уходящую группу, такую как хлор или бром, P представляет собой подходящую защитную группу (предпочтительно Boc), и Pʹ представляет собой другую подходящую защитную группу (предпочтительно 4-метоксибензил).
Соединение формулы Ia можно получать из соединения формулы XXII путем обработки сильным основанием, таким как диизопропиламид лития или трет-бутоксид калия, в апротонном растворителе, таком как тетрагидрофуран, при подходящей температуре, предпочтительно при охлаждении. Соединение формулы XXII можно синтезировать из соединения формулы V и соединения формулы XX в соответствии с условиями реакции, описанными на схеме 1.
В качестве альтернативы, соединение формулы Ia можно получать из соединения формулы XXVII и соединения формулы XIX в соответствии с условиями реакции, описанными на схеме 1. Соединение формулы XXVII можно синтезировать из соединения формулы XIII и соединения формулы XX в соответствии с условиями реакции, описанными на схеме 1.
Соединение формулы Ib можно получать из соединения формулы XXVIII путем введения соединения формулы XXVIII в реакцию с 2 эквивалентами алкилирующего средства формулы XXX. Аналогичный процесс двойного алкилирования можно использовать для альтернативного получения соединений формулы Ia путем введения соединения формулы XXVIII в реакцию с алкилирующим средством формулы XXIX. Реакции алкилирования осуществляли в присутствии сильного основания, такого как диизопропиламид лития или трет-бутоксид калия, в апротонном растворителе, таком как тетрагидрофуран, при подходящей температуре, предпочтительно находящейся в диапазоне от -78°C до комнатной температуры. Соединения формулы XXVIII можно получать из соединений формулы V и хлорацетилхлорида (или подходящего аналога) в качестве ацилирующего средства в соответствии с условиями реакции, описанными на схеме 1.
Кроме того, группу CH2CH2R2 можно включать на различных этапах синтеза для получения соединений формулы Ia и Ib из подходящих предшественников и соединений формулы IX, X и XI в соответствии с подобными условиями реакции, как описано на схеме 1 для получения соединений формулы (I).
Соединения общей формулы IX, X, XI, XIX, XX, XXIX и XXX, где R1, R2, R3, q, LG, W, P и Pʹ имеют значения, определенные выше, являются коммерчески доступными, или их можно получать традиционными способами, описанными в литературе.
Более того, конкретные соединения согласно настоящему изобретению можно также получать, начиная с других соединений формулы I посредством соответствующих реакций превращения функциональных групп на одной или нескольких стадиях с применением хорошо известных в органической химии реакций при стандартных экспериментальных условиях. В качестве примера, некоторые из данных превращений включают деметилирование метоксигруппы с получением гидроксигруппы, восстановление нитрогруппы с получением аминогруппы, ацилирование аминогруппы с получением ациламиногруппы, превращение аминогруппы в уреидогруппу и превращение сложного эфира в амид.
Примеры
Все растворители, применяемые для синтеза, являлись чистыми для анализа.
В примерах использовали следующие сокращения.
ACN: ацетонитрил
Boc: трет-бутоксикарбонил
CAN: нитрат аммония церия
DCM: дихлорметан
DEA: диэтиламин
DMF: диметилформамид
DMSO: диметилсульфоксид
EtOH: этанол
Пр.: пример
ч.: час/часы
HPLC: высокоэффективная жидкостная хроматография
пром. соед.: промежуточное соединение
IPA: изопропанол
LDA: диизопропиламид лития
MeOH: метанол
MS: масс-спектрометрия
мин.: минуты
колич.: количественный
удерж.: удерживание
к. т.: комнатная температура
нас.: насыщенный
и. м.: исходный материал
TFA: трифторуксусная кислота
THF: тетрагидрофуран
вес: вес
Для определения спектров HPLC-MS применяли следующий способ:
колонка: Xbridge C18 XP 30×4,6 мм, 2,5 мкм;
температура: 40°C;
поток: 2,0 мл/мин.;
градиент: NH4HCO3 pH 8: ACN (95:5)---0,5 мин.---(95:5)---6,5 мин.---(0:100)---1 мин.---(0:100);
образец, растворенный прибл. 1 мг/ мл в NH4HCO3 pH 8/ ACN.
В качестве альтернативы, в некоторых случаях применяли способ B.
Способ B:
колонка: Gemini-NX 30×4,6 мм, 3 мкм;
температура: 40°C;
поток: 2,0 мл/мин.;
градиент: NH4HCO3 pH 8: ACN (95:5)---0,5 мин.---(95:5)---6,5 мин.---(0:100)---1 мин.---(0:100);
образец, растворенный прибл. 1 мг/ мл в NH4HCO3 pH 8/ ACN.
Синтез промежуточных соединений
Промежуточное соединение 1A. Трет-бутил-1-окса-6-азаспиро[2.5]октан-6-карбоксилат
К суспензии иодида триметилсульфоксония (24,3 г, 110 ммоль) и NaH (4,4 г, 60 вес.% в минеральном масле, 110 ммоль) в DMSO (140 мл) каплями добавляли раствор трет-бутил-4-оксопиперидин-1-карбоксилата (20,0 г, 100 ммоль) в DMSO (140 мл). Реакционную смесь перемешивали при к. т. в течение 30 мин, затем нагревали при 50°C в течение 1 ч. После охлаждения до к. т. медленно добавляли лед и реакционную смесь экстрагировали три раза с помощью этилацетата. Органические фазы объединяли, промывали водой, сушили над MgSO4 и концентрировали под вакуумом с получением указанного в заголовке соединения (17,6 г, 82% выход) в виде белого твердого вещества. Время удерживания HPLC: 3,31 мин.; MS: 158 (M+H -56).
Данный способ применяли для получения промежуточного соединения 1B с использованием подходящих исходных материалов.
(мин.)
(M+H)

Промежуточное соединение 2A. Трет-бутил-4-(аминометил)-4-гидроксипиперидин-1-карбоксилат

Смесь промежуточного соединения 1A (10,0 г, 46,9 ммоль) и раствора аммиака (201 мл, 7 M раствора в метаноле, 1,4 моль) перемешивали при к. т. в течение ночи. Растворитель удаляли под вакуумом и остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (7,4 г, 69% выход) в виде белого твердого вещества. Время удерживания HPLC: 2,15 мин.; MS: 131 (M+H-100).
Промежуточное соединение 2B. Трет-бутил-4-гидрокси-4-((метиламино)метил)пиперидин-1-карбоксилат

К раствору промежуточного соединения 1A (0,50 г, 2,34 ммоль) в смеси этанол-вода 5,5:1 (14 мл) добавляли метиламин (4,1 мл, 40% раствор в воде, 47 ммоль). Реакционную смесь перемешивали при к. т. в течение ночи в герметизированной пробирке. Растворитель удаляли под вакуумом с получением указанного в заголовке соединения (0,534 г, 93% выход) в виде белого твердого вещества. Время удерживания HPLC: 2,28 мин.; MS: 189 (M+H-56).
Данный способ применяли для получения промежуточных соединений 2C-2G с использованием подходящих исходных материалов.
(мин.)
(M+H)

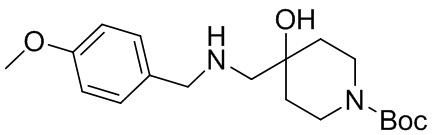
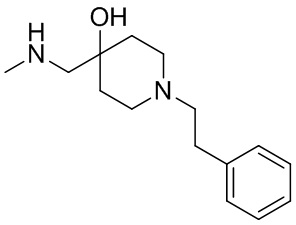
Промежуточное соединение 3A. Трет-бутил-2-(2-хлорэтил)-4-изопропил-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат

Стадия 1. Трет-бутил-4-((2-бром-4-хлор-N-изопропилбутанамидо)метил)-4-гидроксипиперидин-1-карбоксилат. К раствору промежуточного соединения 2D (0,500 г, 1,84 ммоль) и триэтиламина (0,613 мл, 4,41 ммоль) в дихлорметане (95 мл) каплями добавляли раствор 2-бром-4-хлорбутаноилхлорида (полученного, как описано в US 6114541A1(2000), пр. 1) (0,605 г, 2,75 ммоль) в дихлорметане (95 мл) при 0°C. Реакционную смесь перемешивали при к. т. в течение 4 ч., добавляли нас. раствор NaHCO3 и водную фазу экстрагировали дихлорметаном. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (0,243 г, 29%). Время удерживания HPLC: 4,75 мин.; MS: 357 (M+H-100).
Стадия 2. Указанное в заголовке соединение. К раствору неочищенного продукта, полученного на стадии 1 в THF (5 мл), каплями добавляли раствор трет-бутоксида калия (1,05 мл, 1 M в THF, 1,05 ммоль). Реакционную смесь перемешивали при к. т. в течение ночи. Затем добавляли воду, фазы разделяли и водную фазу экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (89 мг, 45% выход). Время удерживания HPLC: 4,48 мин.; MS: 375 (M+H).
Данный способ применяли для получения промежуточного соединения 3B с использованием подходящих исходных материалов.
(мин.)
(M+H)

Промежуточное соединение 3C. (R)-трет-бутил-2,4-диметил-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат
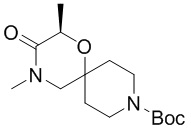
Стадия 1. (S)-трет-бутил-4-((2-хлор-N-метилпропанамидо)метил)-4-гидроксипиперидин-1-карбоксилат. К раствору промежуточного соединения 2B (0,521 г, 2,13 ммоль) в этилацетате (10 мл) добавляли раствор K2CO3 (0,825 г, 5,97 ммоль) в воде (7 мл). После охлаждения до 0°C каплями добавляли раствор (S)-2-хлорпропаноилхлорида (0,368 г, 2,90 ммоль) в этилацетате (2 мл). Реакционную смесь перемешивали при 0°C в течение 30 мин., слои разделяли и водную фазу экстрагировали этилацетатом. Органические фазы объединяли, промывали с помощью 0,5 M водного раствора HCl, а затем нас. раствора NaHCO3, сушили над MgSO4, фильтровали и концентрировали досуха с получением указанного в заголовке соединения (0,594 г). Время удерживания HPLC: 3,48 мин.; MS: 235 (M+H-100).
Стадия 2. Указанное в заголовке соединение. Раствор неочищенного продукта, полученного на стадии 1 в THF (30 мл), охлаждали до -78°C с использованием бани на сухом льду/ацетоне. После добавления раствора трет-бутоксида калия (1,95 мл, 1 M в THF, 1,95 ммоль) реакционную смесь перемешивали при -78°C в течение 30 мин. Затем добавляли нас. раствор NH4Cl и водную фазу экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток кристаллизовали из горячего изопропилацетата с получением указанного в заголовке соединения (0,320 г, 60% выход). Время удерживания HPLC: 3,32 мин.; MS: 299 (M+H). Оптическая чистота: 98,9% э. и., определенная с помощью хиральной HPLC: колонка: Chiralpak ADH 250×4,6 мм, 5 мкм; температура: 25°C; поток: 0,5 мл/мин.; элюент: гептан/(этанол+0,2% DEA) 85:15.
Данный способ применяли для получения промежуточных соединений 3D-3O с использованием подходящих исходных материалов.
(мин.)
(M+H)


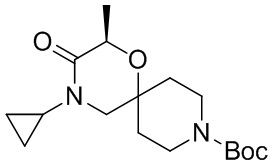

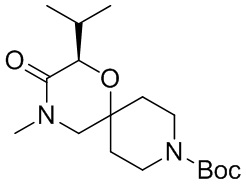



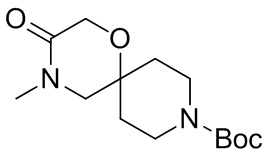
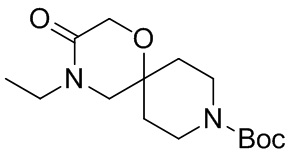
(способ B)
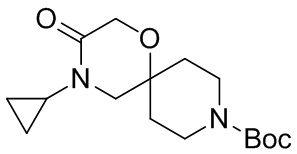
(способ B)
(1*) На стадии 2 через 15 мин. при -78°C, реакционную смесь перемешивали при -30°C в течение 2 ч., а затем ее гасили и обрабатывали, как обычно.
Промежуточное соединение 4A. Трет-бутил-12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-карбоксилат
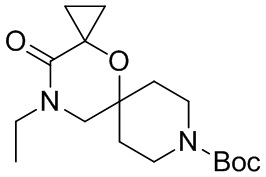
Раствор промежуточного соединения 3B (2,77 г, 7,68 ммоль) в THF (75 мл) охлаждали до 0°C. После добавления раствора LDA (11,5 мл, 2 M в смеси THF/н-гептан/этилбензол, 23,0 ммоль) реакционную смесь перемешивали при 0°C в течение 3 ч. Затем добавляли нас. раствор NH4Cl и водную фазу экстрагировали дихлорметаном. Органическую фазу сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (1,53 г, 61% выход). Время удерживания HPLC: 3,85 мин.; MS: 325 (M+H).
Данный способ применяли для получения промежуточного соединения 4B с использованием подходящих исходных материалов.
(мин.)
(M+H)
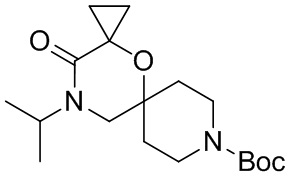
Промежуточное соединение 4B, в качестве альтернативы, получали с помощью способа алкилирования, описанного для получения промежуточного соединения 4F (с использованием 2-бромпропана вместо иодметана в качестве алкилирующего средства).
Промежуточное соединение 4C. Трет-бутил-12-(4-метоксибензил)-13-оксо-4-окса-8,12-диазадиспиро-[2.1.5.3]тридекан-8-карбоксилат
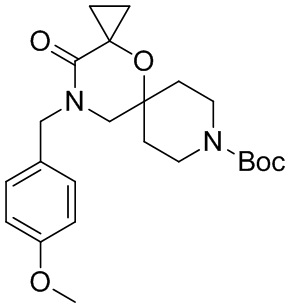
Стадия 1. Трет-бутил-4-((2-бром-4-хлор-N-(4-метоксибензил)бутанамидо)метил)-4-гидроксипиперидин-1-карбоксилат. К раствору промежуточного соединения 2F (9,94 г, 28,4 ммоль) и триэтиламина (9,5 мл, 68,1 ммоль) в дихлорметане (500 мл) каплями добавляли раствор 2-бром-4-хлорбутаноилхлорида (полученного, как описано в US 6114541A1(2000), пр. 1) (9,35 г, 20,2 ммоль) в дихлорметане (200 мл) при 0°C. Реакционную смесь перемешивали при 0°C в течение 3 ч. Добавляли дихлорметан и водный нас. раствор NaHCO3 и фазы разделяли. Водную фазу экстрагировали дихлорметаном и органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха с получением указанного в заголовке соединения (17,6 г, неочищенный продукт). Время удерживания HPLC: 4,82 мин.; MS: 435 (M+H-100).
Стадия 2. Указанное в заголовке соединение. Раствор неочищенного продукта, полученного на стадии 1 (14,8 г, 27,7 ммоль), в THF (185 мл) охлаждали в атмосфере азота до 0°C. После добавления раствора трет-бутоксида калия (111 мл, 1 M в THF, 111 ммоль) реакционную смесь перемешивали при 0°C в течение 2 ч. Затем добавляли нас. раствор NH4Cl и водную фазу экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (5,51 г, 48% выход для 2 стадий). Время удерживания HPLC: 4,46 мин.; MS: 417 (M+H).
Промежуточное соединение 4D. 8-Фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он

Стадия 1. 12-(4-Метоксибензил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она трифторацетат. К раствору промежуточного соединения 4C (1,50 г, 3,6 ммоль) в дихлорметане (36 мл) добавляли трифторуксусную кислоту (2,8 мл, 36,0 ммоль) и реакционную смесь перемешивали при к. т. в течение 4 ч. Растворитель выпаривали досуха с получением указанного в заголовке соединения в виде неочищенного продукта (2,30 г, 67 вес.%, колич. выход), которое использовали на следующей стадии без дополнительной очистки. Время удерживания HPLC: 2,43 мин.; MS: 317 (M+H).
Стадия 2. 12-(4-Метоксибензил)-8-фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он. Смесь неочищенного продукта, полученного на стадии 1 (2,30 г, 67 вес.%, 3,6 ммоль), (2-бромэтил)бензола (0,802 г, 4,3 ммоль) и K2CO3 (2,49 г, 18,1 ммоль) в ацетонитриле (36 мл) нагревали при 80°C в герметизированной пробирке в течение ночи. Добавляли воду и реакционную смесь экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (1,17 г, 77% выход). Время удерживания HPLC: 4,55 мин.; MS: 421 (M+H).
Стадия 3. Указанное в заголовке соединение. Смесь неочищенного продукта, полученного на стадии 2 (0,170 г, 0,404 ммоль), и CAN (0,568 г, 1,21 ммоль), ацетонитрила (2,5 мл) и воды (2,5 мл) перемешивали при к. т. в течение 7 ч. Нас. раствор Na2CO3 добавляли к реакционной смеси и ее экстрагировали этилацетатом. Органические фазы объединяли, промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали путем элюирования через картридж с кислотной ионообменной смолой (SCX) с получением указанного в заголовке соединения (106 мг, 88% выход). Время удерживания HPLC: 3,31 мин.; MS: 301 (M+H).
Промежуточное соединение 4E. Трет-бутил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-карбоксилат

Стадия 1. 4-Окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она трифторацетат. Раствор промежуточного соединения 4C (1,78 г, 4,26 ммоль) в TFA (20 мл) перемешивали в герметизированной пробирке при 80°C в течение 4 суток. Реакционную смесь концентрировали досуха и к остатку добавляли воду. Кислотную водную фазу промывали этиловым эфиром, который удаляли. Водный слой выпаривали досуха с получением указанного в заголовке соединения (1,17 г). Время удерживания HPLC: 0,33 мин.; MS: 197 (M+H).
Стадия 2. Указанное в заголовке соединение. Смесь неочищенного продукта, полученного на стадии 1, ди-трет-бутилдикарбоната (1,40 г, 6,40 ммоль), 1,4-диоксана (40 мл) и 1 M водного раствора NaOH (10 мл) перемешивали при к. т. в течение ночи. Добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (0,872 г, 69% выход для 2 стадий). Время удерживания HPLC: 3,29 мин.; MS: 297 (M+H).
Промежуточное соединение 4F. Трет-бутил-12-метил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-карбоксилат

К раствору промежуточного соединения 4E (0,190 г, 0,641 ммоль) в сухом DMF (5 мл) добавляли NaH (51 мг, 60 вес.% в минеральном масле, 1,28 ммоль) при к. т. Реакционную смесь перемешивали при к. т. в течение 30 мин., затем добавляли иодметан (0,040 мл, 0,641 ммоль) и полученную в результате смесь перемешивали при к. т. в течение ночи. К реакционной смеси добавляли воду и ее экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (166 мг, 83% выход). Время удерживания HPLC: 3,57 мин.; MS: 311 (M+H).
Промежуточное соединение 5A. Трет-бутил-2,2-диэтил-4-метил-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат
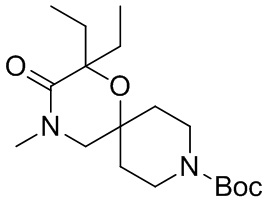
Раствор промежуточного соединения 3L (0,200 г, 0,70 ммоль) в сухом THF (1 мл) охлаждали до 0°C. После медленного добавления раствора LDA (1,41 мл, 2 M в смеси THF/н-гептан/этилбензол, 2,81 ммоль) реакционную смесь перемешивали при 0°C в течение 30 мин. Затем добавляли иодэтан (0,28 мл, 3,52 ммоль) и реакционную смесь перемешивали при 0-5°C в течение дополнительных 90 мин. Затем добавляли нас. раствор NH4Cl и водную фазу экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (186 мг, 78% выход). Время удерживания HPLC: 4,29 мин.; MS: 341 (M+H).
Данный способ применяли для получения промежуточных соединений 5B-5D с использованием подходящих исходных материалов.
(мин.)
(M+H)
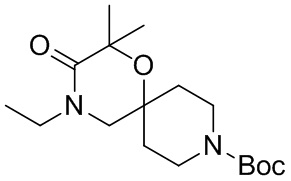
(способ B)
(способ B)
(способ B)
Промежуточное соединение 5E. Трет-бутил-4-метил-3-оксо-2-(проп-2-ин-1-ил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат

Раствор промежуточного соединения 3L (0,500 г, 1,76 ммоль) в сухом THF (2,5 мл) охлаждали до 0°C. После медленного добавления раствора LDA (1,05 мл, 2 M в смеси THF/н-гептан/этилбензол, 2,11 ммоль) реакционную смесь перемешивали при 0°C в течение 30 мин. Затем добавляли раствор пропаргилбромида (0,24 мл, 80 вес.% в толуоле, 2,11 ммоль) и реакционную смесь перемешивали при 0-5°C в течение дополнительных 2 ч. Добавляли нас. раствор NH4Cl и водную фазу экстрагировали три раза дихлорметаном. Объединенные органические фазы сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (327 мг, 58% выход). Время удерживания HPLC: 3,45 мин.; MS: 323 (M+H).
Промежуточное соединение 5F. Трет-бутил-14-метил-15-оксо-6-окса-10,14-диазадиспиро[4.1.5.3]пентадекан-10-карбоксилат
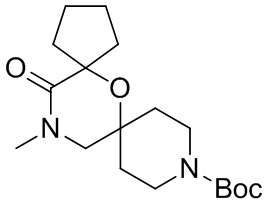
Стадия 1. Трет-бутил-2-(4-бромбутил)-4-метил-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат. Раствор промежуточного соединения 3L (0,400 г, 1,41 ммоль) в сухом THF (20 мл) охлаждали до -50°C. После медленного добавления раствора LDA (2,11 мл, 2 M в смеси THF/н-гептан/этилбензол, 4,22 ммоль) реакционную смесь перемешивали при -50°C в течение 30 мин. Затем добавляли 1,4-дибромбутан (0,25 мл, 2,11 ммоль) и реакционную смесь перемешивали при -50°C в течение дополнительных 90 мин., а затем обеспечивали достижение комнатной температуры и перемешивали в течение дополнительного часа. Добавляли нас. раствор NH4Cl и водную фазу экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения в виде неочищенного продукта, который применяли как таковой без дополнительной очистки. Время удерживания HPLC: 4,39 мин.; MS: 421 (M+H).
Стадия 2. Указанное в заголовке соединение. Раствор продукта, полученного на стадии 1 (1,41 ммоль), в сухом THF (30 мл) охлаждали до -50°C. После медленного добавления раствора LDA (2,11 мл, 2 M в смеси THF/н-гептан/этилбензол, 4,22 ммоль) реакционную смесь перемешивали при 0°C в течение 1 ч., а затем дополнительно перемешивали при комнатной температуре в течение 1 ч. Добавляли нас. раствор NH4Cl и водную фазу экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (199 мг, 42% выход для двух стадий). Время удерживания HPLC: 4,09 мин.; MS: 339 (M+H).
Промежуточное соединение 6. Трет-бутил-2-(2-гидроксиэтил)-4-метил-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат

Раствор промежуточного соединения 3K (0,200 г, 0,58 ммоль) в THF (1 мл) и 1 M растворе NaOH (1 мл) нагревали до температуры образования флегмы в герметизированной пробирке в течение ночи. Затем его концентрировали досуха и к остатку добавляли воду и этилацетат. Фазы разделяли и водную фазу экстрагировали три раза этилацетатом. Объединенные органические фазы сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (66 мг, 35% выход). Время удерживания HPLC: 2,96 мин.; MS: 329 (M+H).
Синтез примеров
Пример 1. 12-Этил-8-{2-[3-(трифторметил)пиридин-2-ил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он гидрохлорид
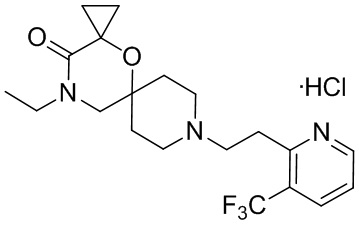
Стадия 1. 12-Этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она трифторацетат. К раствору промежуточного соединения 4A (1,50 г, 4,65 ммоль) в дихлорметане (46 мл) добавляли трифторуксусную кислоту (3,6 мл, 46,5 ммоль) и реакционную смесь перемешивали при к. т. в течение 3 ч. Растворитель выпаривали досуха с получением указанного в заголовке соединения в виде неочищенного продукта (3,02 г, 52 вес.%, колич. выход), который использовали на следующей стадии без дополнительной очистки. Время удерживания HPLC: 0,83 мин.; MS: 225 (M+H).
Стадия 2. 12-Этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он. Неочищенный продукт, полученный на стадии 1 (208 мг, 52 вес.%, 0,331 ммоль), растворяли в дихлорметане и дважды промывали 1 M водным раствором NaOH. Объединенные водные фазы экстрагировали дихлорметаном и органические фазы объединяли, промывали водой, сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения в виде неочищенного продукта (0,056 г, 78%). Время удерживания HPLC: 0,75 мин.; MS: 225 (M+H).
Стадия 3. 12-Этил-8-{2-[3-(трифторметил)пиридин-2-ил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он. Раствор неочищенного продукта, полученного на стадии 2 (0,056 г, 0,249 ммоль), и 3-трифторметил-2-винилпиридина (полученного так же, как описано в Angew. Chem. Int. Ed., 2013, 52, 9755) (0,068 г, 0,393 ммоль) в 2-метоксиэтаноле (0,6 мл) нагревали при 120°C в герметизированной пробирке в атмосфере аргона в течение 1 суток. Обеспечивали охлаждение реакционной смеси до к. т. и растворитель выпаривали. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения в виде его свободного основания (45 мг, 45% выход). Время удерживания HPLC: 3,49 мин.; MS: 398,0 (M+H).
Стадия 4. Указанное в заголовке соединение. К раствору свободного основания, полученного на стадии 3 (45 мг, 0,113 ммоль) в безводном диэтиловом эфире (2 мл), добавляли HCl (2 M раствор в диэтиловом эфире, 0,056 мл, 0,113 ммоль) и смесь перемешивали при к. т. в течение 1 ч. Растворитель выпаривали под вакуумом с получением соответствующей соли HCl (45 мг, 92% выход). Время удерживания HPLC: 3,62 мин.; MS: 398,0 (M+H).
Данный способ применяли для получения примеров 2-6 с использованием подходящих исходных материалов.
(мин.)
(M+H)
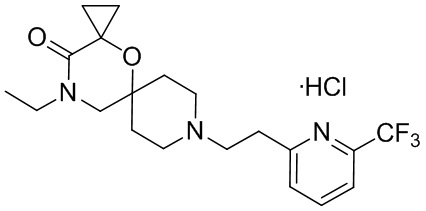

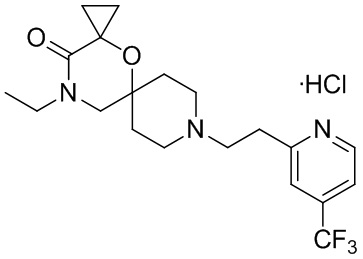


Где указано, гидрохлоридные соли получали, как описано в примере 1.
Пример 7. Гидрохлорид 12-этил-8-фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она
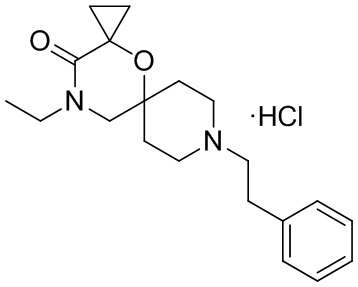
Смесь неочищенного продукта, полученного на стадии 1 примера 1 (0,044 г, 0,129 ммоль), (2-бромэтил)бензола (0,021 мл, 0,155 ммоль), иодида натрия (0,012 г, 0,078 ммоль) и K2CO3 (0,143 г, 1,04 ммоль) в ацетонитриле (2 мл) нагревали при 80°C в герметизированной пробирке в течение ночи. Добавляли воду и реакционную смесь экстрагировали этилацетатом. Органические фазы объединяли, промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения в виде его свободного основания (12 мг, 28% выход).
Предыдущее соединение превращали в его гидрохлоридную соль, как описано в примере 1. Время удерживания HPLC: 3,74 мин.; MS: 329,1 (M+H).
Данный способ применяли для получения примеров 8-53 с использованием подходящих исходных материалов.
(мин.)
(M+H)
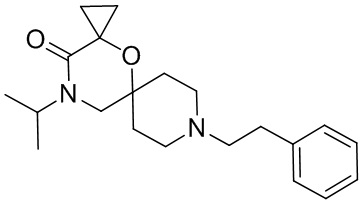
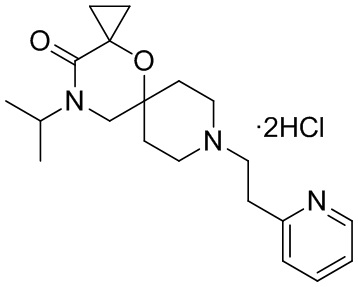
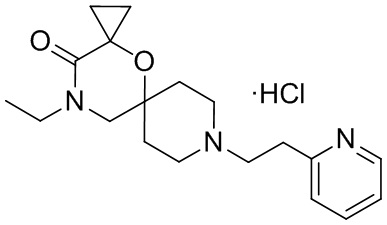



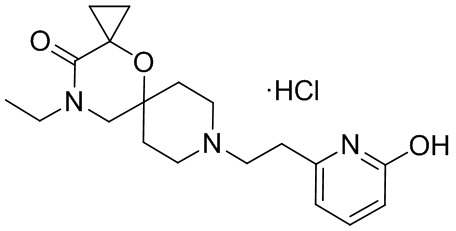
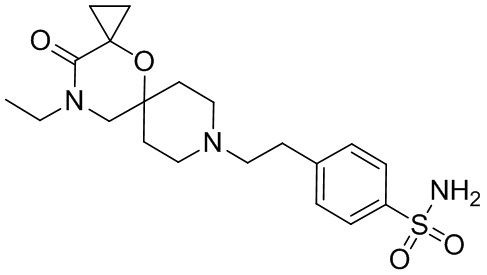

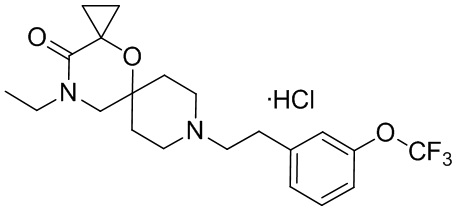
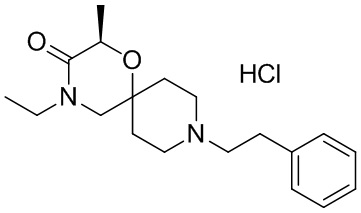



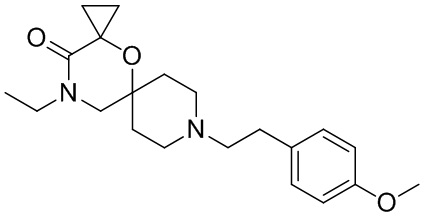
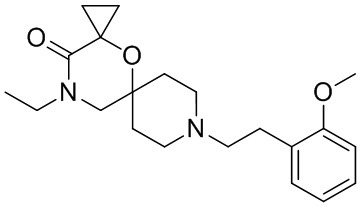

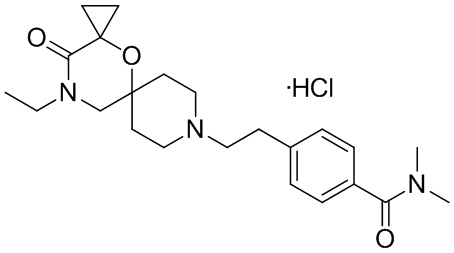
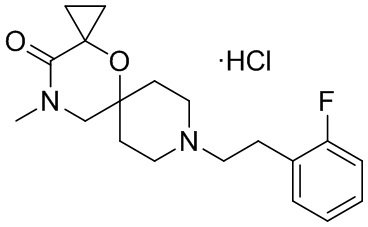




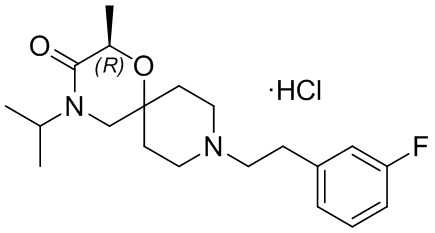
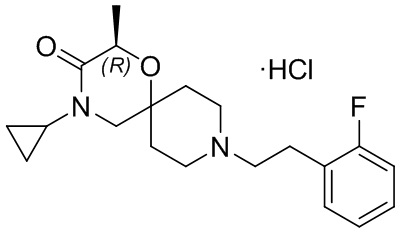

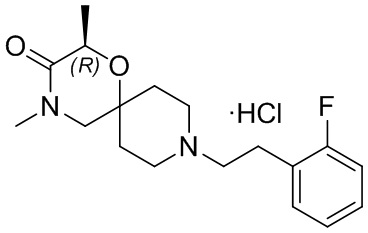


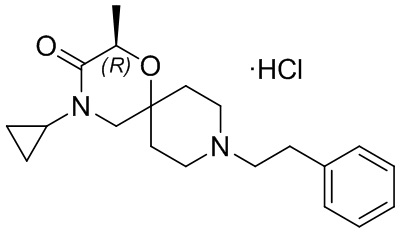

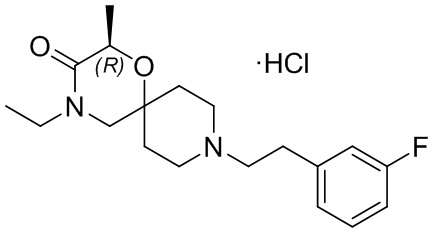





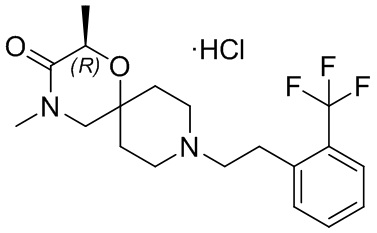



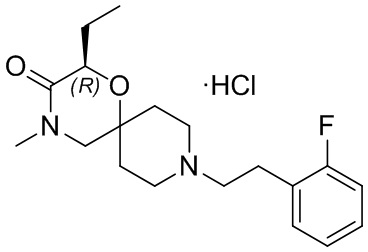
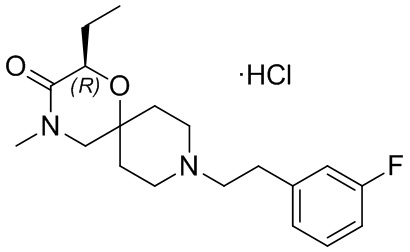
Где указано, гидрохлоридные соли получали, как описано в примере 1.
1*. Альтернативно получали посредством разделения с помощью хиральной препаративной HPLC рацемического соединения. Условия: колонка: OJ; температура: окружающей среды; поток: 0,8 мл/мин.; подвижная фаза: н-гептан/IPA 95/5 об./об.
2*. Альтернативно получали посредством разделения с помощью хиральной препаративной HPLC рацемического соединения. Условия: колонка: OJ; температура: окружающей среды; поток: 0,8 мл/мин.; подвижная фаза: н-гептан/EtOH 95/5 об./об.
3*. Альтернативно получали посредством разделения с помощью хиральной препаративной HPLC рацемического соединения. Условия: колонка: Chiralpak IA; температура: окружающей среды; поток: 0,4 мл/мин.; подвижная фаза: н-гептан/EtOH 98/2 об./об.
4*. Соединение, полученное в качестве побочного продукта предыдущего примера.
Альтернативный способ синтеза примера 11

Стадия 1. ((S)-2-хлор-N-((4-гидрокси-1-фенетилпиперидин-4-ил)метил)-N-метилпропанамид. К раствору промежуточного соединения 2G (0,500 г, 79 вес.%, 1,59 ммоль) в этилацетате (8 мл) добавляли раствор K2CO3 (0,779 г, 5,64 ммоль) в воде (7 мл). После охлаждения до 0°C каплями добавляли раствор (S)-2-хлорпропаноилхлорида (0,31 г, 2,42 ммоль) в этилацетате (1 мл) и реакционную смесь перемешивали при 0°C в течение 30 мин. Затем добавляли нас. раствор NaHCO3, слои разделяли и водную фазу экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха с получением указанного в заголовке соединения (0,500 г, 91% выход). Время удерживания HPLC: 3,13 мин.; MS: 339 (M+H).
Стадия 2. Указанное в заголовке соединение. Раствор неочищенного продукта, полученного на стадии 1 в THF (15 мл), охлаждали до -78°C с использованием бани на сухом льду/ацетоне. После добавления раствора трет-бутоксида калия (1,62 мл, 1 M в THF, 1,62 ммоль) реакционную смесь перемешивали при -78°C в течение 30 мин. Затем добавляли нас. раствор NH4Cl и водную фазу экстрагировали этилацетатом. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом с получением указанного в заголовке соединения (0,400 г, 90% выход). Время удерживания HPLC: 3,30 мин.; MS: 303 (M+H). Оптическая чистота: 93,5% э. и., определенная с помощью хиральной HPLC: колонка: OJ 250×4,6 мм, 10 мкм; температура: 25°C; поток: 0,5 мл/мин.; элюент: гептан/этанол 90:10.
Предыдущее соединение превращали в его гидрохлоридную соль, как описано в примере 1.
Данный способ применяли для получения примера 54 с использованием подходящих исходных материалов:
(мин.)
(M+H)
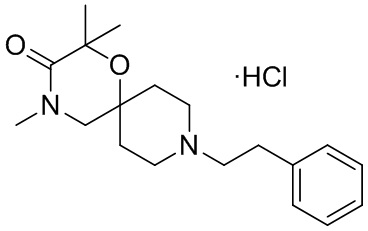
Пример 55. Гидрохлорид 12-метил-8-фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она
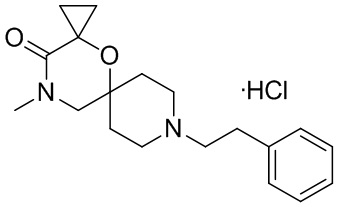
К раствору промежуточного соединения 4D (0,106 г, 0,353 ммоль) в сухом DMF (3,5 мл) добавляли NaH (16 мг, 60 вес.% в минеральном масле, 0,233 ммоль). Реакционную смесь перемешивали при к. т. в течение 30 мин., затем добавляли иодметан (0,024 мл, 0,388 ммоль) и полученную в результате смесь перемешивали при к. т. в течение ночи. К реакционной смеси добавляли воду и ее экстрагировали дихлорметаном. Органические фазы объединяли, промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения в виде его свободного основания (25 мг, 23% выход).
Предыдущее соединение превращали в его гидрохлоридную соль, как описано в примере 1.
Время удерживания HPLC: 3,53 мин.; MS: 315,1 (M+H).
Пример 56. 8-(3-Аминофенетил)-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он
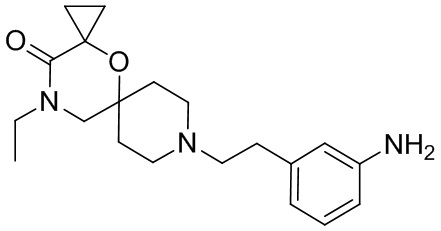
Смесь примера 19 (0,139 г, 0,372 ммоль) и палладия (14 мг, 10 вес.% на угле) в метаноле (3 мл) перемешивали при к. т. при 4 барах H2 в течение ночи. Затем твердые вещества отфильтровывали и растворитель удаляли под вакуумом с получением указанного в заголовке соединения (0,129 г, колич. выход). Время удерживания HPLC: 2,98 мин.; MS: 344,1 (M+H).
Пример 57. N-[3-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)фенил]ацетамид

К раствору примера 56 (0,060 г, 0,175 ммоль) и триэтиламина (0,036 мл, 0,262 ммоль) в дихлорметане (1,8 мл) каплями добавляли ацетилхлорид (0,014 мл, 0,192 ммоль) при 0°C. Реакционную смесь перемешивали при к. т. в течение ночи. Добавляли воду и водную фазу промывали дихлорметаном, повышали основность с помощью 1 M водного раствора NaOH и экстрагировали дихлорметаном. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали путем элюирования через картридж с кислотной ионообменной смолой (SCX) с получением указанного в заголовке соединения (0,048 г, 72% выход). Время удерживания HPLC: 3,00 мин.; MS: 386,1 (M+H).
Пример 58. [3-(2-{12-Этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)фенил]мочевина

К раствору примера 56 (0,060 г, 0,175 ммоль) в смеси уксусная кислота:вода 1:1,5 (1 мл) добавляли цианат калия (0,021 г, 0,262 ммоль) и реакционную смесь перемешивали при к. т. в течение ночи. Добавляли водный нас. раствор NaHCO3 и водную фазу промывали дихлорметаном, повышали основность с помощью 1 M водного раствора NaOH и экстрагировали дихлорметаном. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом. Остаток очищали путем элюирования через картридж с кислотной ионообменной смолой (SCX) с получением указанного в заголовке соединения (0,031 г, 46% выход). Время удерживания HPLC: 2,79 мин.; MS: 387,1 (M+H).
Пример 59. Гидрохлорид 4-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)-N-метилбензамида
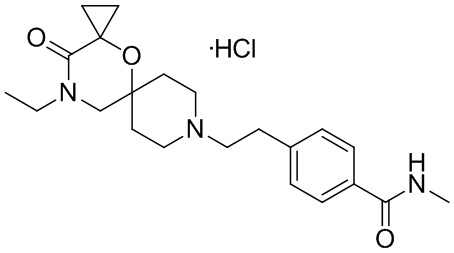
Смесь примера 22 (0,054 г, 0,140 ммоль) и раствора метиламина (1 мл, 33% в этаноле, 8,1 ммоль) нагревали при 100°C в герметизированной пробирке в течение ночи. Затем ее концентрировали досуха и остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения в виде его свободного основания (0,021 г, 39% выход).
Предыдущее соединение превращали в его гидрохлоридную соль, как описано в примере 1.
Время удерживания HPLC: 2,81 мин.; MS: 386,2 (M+H).
Пример 60. 12-Этил-8-(2-гидроксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он

К раствору примера 26 (0,078 г, 0,217 ммоль) в дихлорметане (2 мл) каплями добавляли раствор трибромида бора (0,65 мл, 1 M в дихлорметане, 0,65 ммоль) при -78°C. Обеспечивали нагревание реакционной смеси до к. т. в течение периода 2 ч. Затем добавляли 1 M водный раствор NaOH до pH 8-9 и его экстрагировали дихлорметаном. Органические фазы объединяли, промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, силикагеля, градиента дихлорметана к смеси метанол:дихлорметан (1:4) с получением указанного в заголовке соединения (0,032 г, 43% выход). Время удерживания HPLC: 3,71 мин.; MS: 345,2 (M+H).
Данный способ применяли для получения примеров 61-62, исходя из соответствующих примеров, описанных выше.
(мин.)
(M+H)
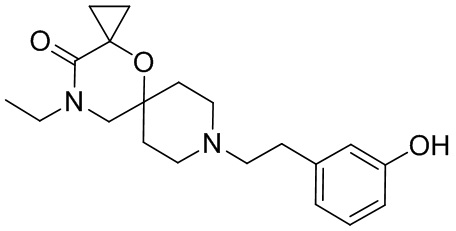
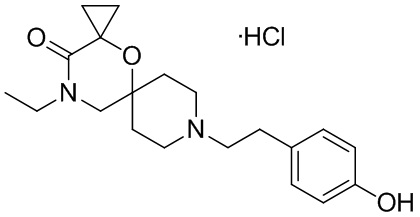
Где указано, гидрохлоридные соли получали, как описано в примере 1.
Пример 63. 8-[2-(2-Аминотиазол-4-ил)этил]-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-он
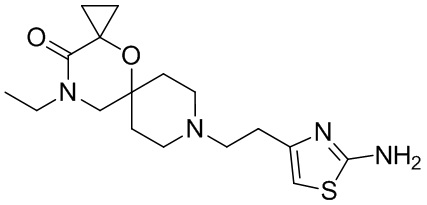
К раствору примера 21 (0,070 г, 0,155 ммоль) в дихлорметане (2,2 мл) добавляли трифторуксусную кислоту (0,60 мл, 7,78 ммоль). Реакционную смесь перемешивали при к. т. в течение ночи. Затем добавляли нас. раствор NaHCO3. Органическую фазу отделяли и ее промывали водой. Объединенные водные фазы обратно экстрагировали дихлорметаном. Органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии, C18, градиента водного NH4HCO3 (pH 8) к ацетонитрилу с получением указанного в заголовке соединения (0,015 г, 28% выход). Время удерживания HPLC: 2,60 мин.; MS: 351,2 (M+H).
Примеры 64-94 получали в соответствии с процедурой, описанной в примере 7, с использованием подходящих исходных материалов:


(способ B)

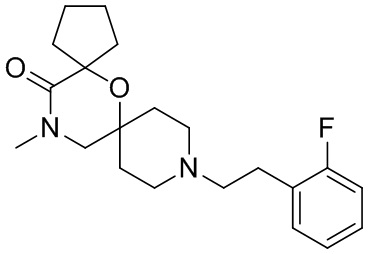
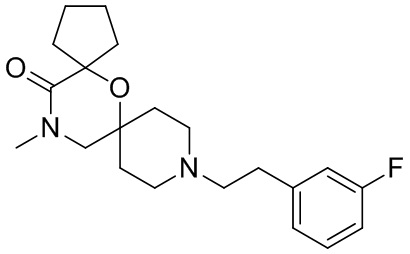

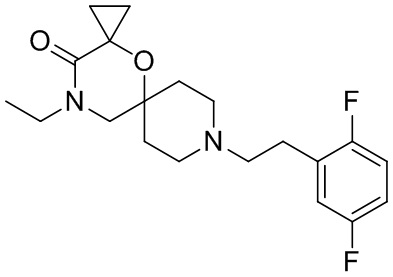



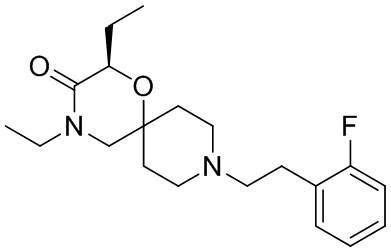
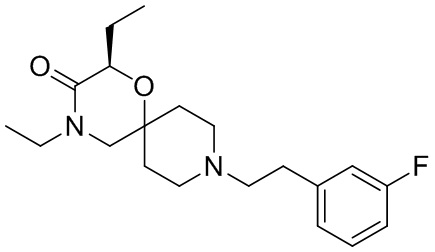
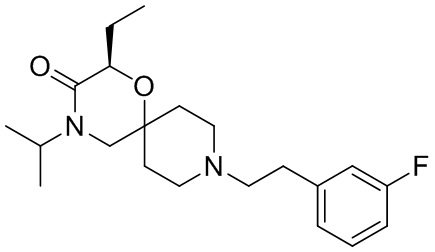


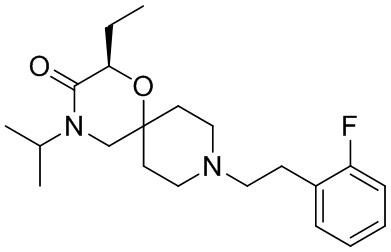


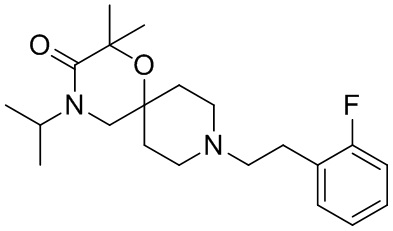
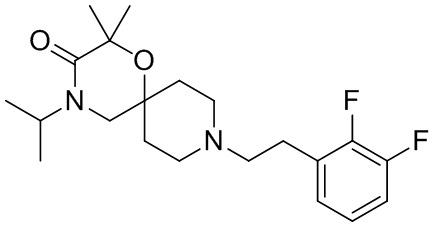
(способ B)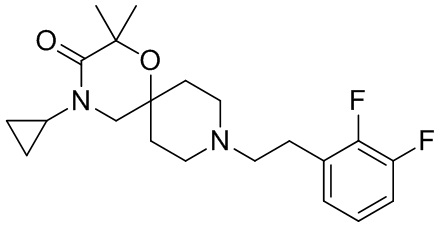
(способ B)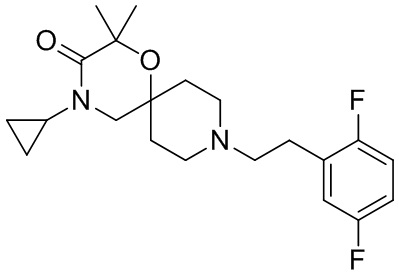
(способ B)
(способ B)
(способ B)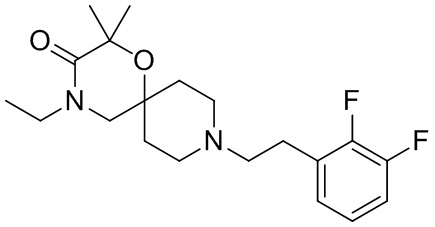
(способ B)
(способ B)
(способ B)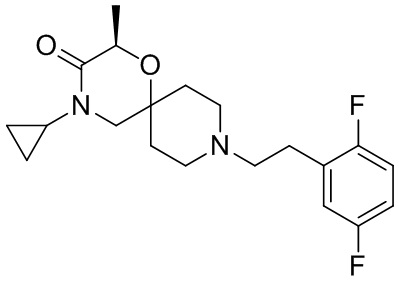
(способ B)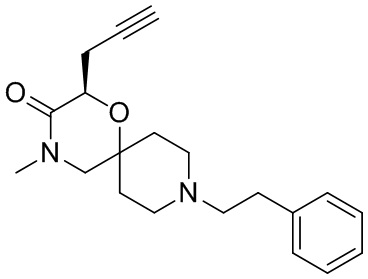
(1*)
(2*)
1*. Полученный посредством разделения с помощью хиральной препаративной HPLC рацемического соединения. Условия: колонка: AS-H; температура: окружающей среды; поток: 15 мл/мин.; подвижная фаза: н-гептан/(EtOH+0,33% DEA) 85/15 об./об.
2*. Полученный посредством разделения с помощью хиральной препаративной HPLC рацемического соединения. Условия: колонка: AS-H; температура: окружающей среды; поток: 10 мл/мин.; подвижная фаза: н-гептан/(IPA+0,33% DEA) 70/30 об./об.
Пример 95. (R)-2-бензил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он
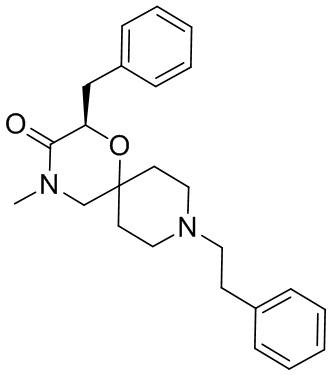
Альтернативный способ, описанный для синтеза примера 11, применяли с некоторыми небольшими модификациями для получения рацемического предшественника. На стадии 1 циннамоилхлорид применяли в качестве ацилирующего средства, и на стадии 2 реакционную смесь нагревали до 80°C вместо выдерживания при - 78°C для достижения циклизации. Указанное в заголовке соединение получали после разделения с помощью хиральной препаративной HPLC. Условия: колонка: OJ; температура: окружающей среды; поток: 15 мл/мин.; подвижная фаза: н-гептан/(EtOH+0,33% DEA) 70/30 об./об.
Время удерживания HPLC: 4,36 мин.; MS: 379,2 (M+H).
Таблица примеров, характеризующая сродство к μ-опиоидному рецептору и σ1-рецептору
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Фармакологическое исследование
Анализ с применением радиолиганда по отношению к σ1-рецептору человека
Для исследования свойств связывания тестовых соединений с σ1-рецептором человека в качестве радиолиганда применяли трансфицированные мембраны HEK-293 и [3H](+)-пентазоцин (Perkin Elmer, NET-1056). Анализ осуществляли с помощью 7 мкг суспензии мембран, 5 нМ [3H](+)-пентазоцина либо в отсутствие, либо в присутствии или буфера, или 10 мкМ галоперидола соответственно для общего и неспецифического связывания. Буфер для связывания содержал 50 мМ Tris-HCl при pH 8. Планшеты инкубировали при 37°C в течение 120 минут. После периода инкубации реакционную смесь далее помещали на MultiScreen HTS, планшеты FC (Millipore), фильтровали и планшеты промывали 3 раза ледяным 10 мМ Tris-HCl (pH 7,4). Фильтры сушили и проводили расчет при приблизительно 40% эффективности в сцинтилляционном счетчике MicroBeta (Perkin-Elmer) с использованием жидкой сцинтилляционной смеси EcoScint.
Анализ с применением радиолиганда по отношению к μ-опиоидному рецептору человека
Для исследования свойств связывания тестовых соединений с μ-опиоидным рецептором человека в качестве радиолиганда применяли трансфицированные клеточные мембраны CHO-K1 и [3H]-DAMGO (Perkin Elmer, ES-542-C). Анализ осуществляли с помощью 20 мкг суспензии мембран, 1 нМ [3H]-DAMGO либо в отсутствие, либо в присутствии или буфера, или 10 мкМ налоксона соответственно для общего и неспецифического связывания. Буфер для связывания содержал 50 мМ Tris-HCl, 5 мМ MgCl2 при pH 7,4. Планшеты инкубировали при 27°C в течение 60 минут. После периода инкубации реакционную смесь далее помещали на MultiScreen HTS, планшеты FC (Millipore), фильтровали и планшеты промывали 3 раза ледяным 10 мМ Tris-HCl (pH 7,4). Фильтры сушили и проводили расчет при приблизительно 40% эффективности в сцинтилляционном счетчике MicroBeta (Perkin-Elmer) с использованием жидкой сцинтилляционной смеси EcoScint.
Результаты
Поскольку настоящее изобретение направлено на обеспечение соединения или родственного с точки зрения химии ряда соединений, которые выполняют функцию лигандов двойного действия σ1-рецептора и μ-опиоидного рецептора, особенно предпочтительным вариантом осуществления является тот, в котором выбраны соединения, которые выполняют функцию лигандов двойного действия σ1-рецептора и μ-опиоидного рецептора, и, в особенности, соединения, которые характеризуются сродством, выраженным в виде Ki, которое составляет предпочтительно <1000 нМ для обоих рецепторов, более предпочтительно <500 нМ, еще более предпочтительно <100 нМ.
Была выбрана следующая шкала для представления сродства к σ1-рецептору и μ-опиоидному рецептору, выраженного в виде Ki.
+ как Ki-μ, так и Ki-σ1 >=500 нМ
++ один Ki <500 нМ, при этом другой Ki составляет >=500 нМ
+++ как Ki-μ, так и Ki-σ1 <500 нМ
++++ как Ki-μ, так и Ki-σ1 <100 нМ
Все соединения, полученные в соответствии с настоящей заявкой, проявляют сродство к σ1-рецептору и μ-опиоидному рецептору, в частности, продемонстрированы следующие результаты связывания.
Изобретение относится к области органической химии, а именно к гетероциклическому соединению формулы (I), необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или к его соответствующей фармацевтически приемлемой соли, где R1 представляет собой незамещенный C1-3алкил или незамещенный C3-6циклоалкил; R2 представляет собой замещенный или незамещенный фенил или замещенный или незамещенный моноциклический гетероциклил, выбранный из пиридина и тиазола, где фенил в R2 при замещении замещен одним или двумя заместителями, выбранными из -OR4, галогена, -CN, галоген-С1алкила, -галоген-ОС1алкила, -NR4R4''', -NO2, -NR4C(O)R4', -C(O)OR4, -C(O)NR4R4', -NR4C(O)NR4'R4'' и -S(O)2NR4R4'; где гетероцикл в R2 при замещении замещен одним заместителем, выбранным из -OR4, галогена, галоген-С1алкила и -NR4R4''; R3 представляет собой замещенный или незамещенный C1-3алкил, незамещенный C2-3алкенил, незамещенный C2-3алкинил, или незамещенный фенил, присоединенный к другому атому через одну группу (-CH2-), где алкил, как определено в R3, при замещении замещен заместителем, выбранным из OH; R3' представляет собой водород или незамещенный C1-3алкил, в качестве альтернативы, R3 и R3', взятые вместе с соединяющим C-атомом, могут образовывать незамещенный C3-5циклоалкил; R4, R4' и R4'' независимо выбраны из водорода или незамещенного метила; R4''' представляет собой водород или –Boc. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I) и его применению для получения лекарственного средства. Технический результат: получено новое гетероциклическое соединение формулы (I), полезное для лечения боли, опосредованной двойной активностью связывания с сигма-1 рецептором и μ-опиоидным рецептором. 4 н. и 8 з.п. ф-лы, 95 пр.
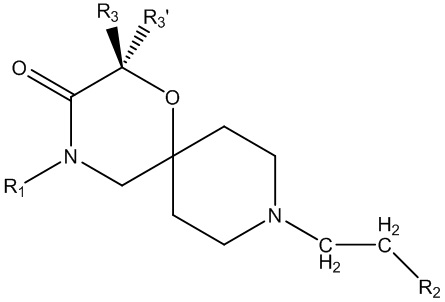
(I),
1. Соединение формулы I,

(I),
где
R1 представляет собой незамещенный C1-3алкил или незамещенный C3-6циклоалкил;
R2 представляет собой замещенный или незамещенный фенил или замещенный или незамещенный моноциклический гетероциклил, выбранный из пиридина и тиазола,
где фенил в R2 при замещении замещен одним или двумя заместителями, выбранными из -OR4, галогена, -CN, галоген-С1алкила, -галоген-ОС1алкила, -NR4R4''', -NO2, -NR4C(O)R4', -C(O)OR4, -C(O)NR4R4', -NR4C(O)NR4'R4'' и -S(O)2NR4R4';
где гетероцикл в R2 при замещении замещен одним заместителем, выбранным из -OR4, галогена, галоген-С1алкила и -NR4R4'';
R3 представляет собой замещенный или незамещенный C1-3алкил, незамещенный C2-3алкенил, незамещенный C2-3алкинил или незамещенный фенил, присоединенный к другому атому через одну группу (-CH2-),
где алкил, как определено в R3, при замещении замещен заместителем, выбранным из OH;
R3' представляет собой водород или незамещенный C1-3алкил,
в качестве альтернативы, R3 и R3', взятые вместе с соединяющим C-атомом, могут образовывать незамещенный C3-5циклоалкил;
R4, R4' и R4'' независимо выбраны из водорода или незамещенного метила;
R4''' представляет собой водород или -Boc;
необязательно в форме одного из стереоизомеров, предпочтительно энантиомеров или диастереомеров, рацемата или в форме смеси по меньшей мере из двух стереоизомеров, предпочтительно энантиомеров и/или диастереомеров, в любом соотношении, или его соответствующая фармацевтически приемлемая соль.
2. Соединение по п.1, где соединение формулы I представляет собой соединение формулы I',
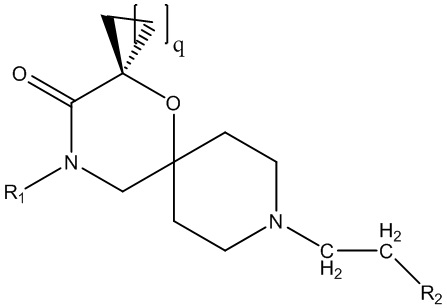
(I'),
где q равняется 1, 2 или 3,
R1 и R2 определены в предыдущих пунктах для соединения формулы (I).
3. Соединение по п.2, где q равняется 1.
4. Соединение по п.1, где соединение формулы I представляет собой соединение формулы I'',
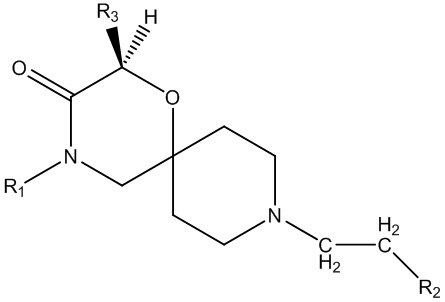
(I''),
где R1, R2 и R3 определены в предыдущих пунктах для соединения формулы (I).
5. Соединение по п.1, где
R3 представляет собой замещенный или незамещенный метил, замещенный или незамещенный этил, замещенный или незамещенный изопропил, незамещенный пропин или незамещенный бензил;
R3' представляет собой водород, незамещенный метил или незамещенный этил;
более предпочтительно R3 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил, незамещенный пропин, незамещенный бензил или -CH2CH2OH, при этом R3' представляет собой незамещенный метил или незамещенный этил;
еще более предпочтительно R3 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил, незамещенный бензил, незамещенный пропин или -CH2CH2OH, при этом R3' представляет собой водород;
или R3 и R3', взятые вместе с соединяющим C-атомом, могут образовывать незамещенный циклопропил.
6. Соединение по любому из пп. 1-5, где в соединении формулы I
R1 представляет собой незамещенный метил, незамещенный этил, незамещенный изопропил или незамещенный циклопропил;
и/или
R2 представляет собой замещенный или незамещенный фенил, замещенный или незамещенный пиридин или замещенный или незамещенный тиазол.
7. Соединение по п.1, где соединение выбрано из
12-этил-8-{2-[3-(трифторметил)пиридин-2-ил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-{2-[6-(трифторметил)пиридин-2-ил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-[2-(3-фторпиридин-2-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-{2-[4-(трифторметил)пиридин-2-ил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
8-[2-(3-хлорпиридин-2-ил)этил]-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
8-[2-(6-аминопиридин-2-ил)этил]-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-изопропил-8-фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
дигидрохлорида 12-изопропил-8-[2-(пиридин-2-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-[2-(пиридин-2-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
(R)-2,4-диметил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
12-этил-8-{2-[6-(трифторметил)пиридин-3-ил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-[2-(6-метоксипиридин-2-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-[2-(6-гидроксипиридин-2-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
4-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)бензол-1-сульфонамида,
4-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)-N-метилбензол-1-сульфонамида,
12-этил-8-{2-[3-(трифторметокси)фенил]этил}-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
(R)-4-этил-2-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
12-этил-8-(3-нитрофенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-(3-метоксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
трет-бутил-(4-(2-(12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил)этил)тиазол-2-ил)карбамата,
метил-4-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)бензоата,
12-этил-8-[2-(пиридин-4-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-[2-(пиридин-3-ил)этил]-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-(4-метоксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-(2-метоксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
3-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)бензонитрила,
4-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)-N,N-диметилбензамида,
8-[2-фторфенетил]-12-метил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
8-[2-фторфенетил]-12-изопропил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
(R)-2-изопропил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-этил-9-(2-фторфенетил)-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2-этил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(3-фторфенетил)-4-изопропил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-циклопропил-9-(2-фторфенетил)-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-изопропил-2-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2-фторфенетил)-2,4-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(3-фторфенетил)-2,4-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2-фторфенетил)-4-изопропил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-циклопропил-2-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-циклопропил-9-(3-фторфенетил)-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-этил-9-(3-фторфенетил)-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
гидрохлорида 8-(3-фторфенетил)-12-изопропил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
(R)-2,4-диметил-9-(3-(трифторметил)фенетил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2,4-диметил-9-(2-(трифторметокси)фенетил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2-фторфенетил)-2-изопропил-4-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(3-фторфенетил)-2-изопропил-4-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2,4-диметил-9-(2-(трифторметил)фенетил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2,6-дифторфенетил)-4-изопропил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2,5-дифторфенетил)-4-изопропил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2,3-дифторфенетил)-4-изопропил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2-этил-9-(2-фторфенетил)-4-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2-этил-9-(3-фторфенетил)-4-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
2,2,4-триметил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
12-метил-8-фенетил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
8-(3-аминофенетил)-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
N-[3-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)фенил]ацетамида,
[3-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)фенил]мочевины,
4-(2-{12-этил-13-оксо-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-8-ил}этил)-N-метилбензамида,
12-этил-8-(2-гидроксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-(3-гидроксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
гидрохлорида 12-этил-8-(4-гидроксифенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
8-[2-(2-аминотиазол-4-ил)этил]-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
2,2-диэтил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
4-циклопропил-9-(2-фторфенетил)-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
8-(2,5-дифторфенетил)-12-изопропил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
8-(2,3-дифторфенетил)-12-изопропил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
10-(2-фторфенетил)-14-метил-6-окса-10,14-диазадиспиро[4.1.5.3]пентадекан-15-она,
10-(3-фторфенетил)-14-метил-6-окса-10,14-диазадиспиро[4.1.5.3]пентадекан-15-она,
(R)-9-(2,5-дифторфенетил)-4-этил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
8-(2,5-дифторфенетил)-12-этил-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-(3-фторфенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
12-этил-8-(2-фторфенетил)-4-окса-8,12-диазадиспиро[2.1.5.3]тридекан-13-она,
(R)-9-(2,3-дифторфенетил)-2,4-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2,4-диэтил-9-(2-фторфенетил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2,4-диэтил-9-(3-фторфенетил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2-этил-9-(3-фторфенетил)-4-изопропил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
4-этил-9-(3-фторфенетил)-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
4-этил-9-(2-фторфенетил)-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2-этил-9-(2-фторфенетил)-4-изопропил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2,5-дифторфенетил)-2,4-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
9-(3-фторфенетил)-4-изопропил-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
9-(2-фторфенетил)-4-изопропил-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
9-(2,3-дифторфенетил)-4-изопропил-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
4-циклопропил-9-(2,3-дифторфенетил)-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
4-циклопропил-9-(2,5-дифторфенетил)-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-9-(2,3-дифторфенетил)-4-этил-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
9-(2,5-дифторфенетил)-4-этил-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
9-(2,3-дифторфенетил)-4-этил-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
9-(2,5-дифторфенетил)-4-изопропил-2,2-диметил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-циклопропил-9-(2,3-дифторфенетил)-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-циклопропил-9-(2,5-дифторфенетил)-2-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-4-метил-9-фенетил-2-(проп-2-ин-1-ил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-она,
(R)-2-(2-гидроксиэтил)-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она или
(R)-2-бензил-4-метил-9-фенетил-1-окса-4,9-диазаспиро[5.5]ундекан-3-она.
8. Фармацевтическая композиция для применения в качестве лекарственного препарата для лечения боли, опосредованной двойной активностью связывания с сигма-1 рецептором и μ-опиоидным рецептором, которая содержит терапевтическое эффективное количество соединения по любому из пп. 1-7 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, вспомогательное средство или среду-носитель.
9. Соединение по любому из пп. 1-7 для применения в качестве лекарственного препарата при лечении боли, опосредованной двойной активностью связывания с сигма-1 рецептором и μ-опиоидным рецептором.
10. Применение соединения по любому из пп. 1-6 для получения лекарственного препарата для лечения боли, опосредованной двойной активностью связывания с сигма-1 рецептором и μ-опиоидным рецептором.
11. Соединение по любому из пп. 1-7 для применения в качестве лекарственного препарата для лечения боли, опосредованной двойной активностью связывания с сигма-1 рецептором и μ-опиоидным рецептором, где указанная боль выбрана из боли от средней до сильной, висцеральной боли, хронической боли, боли при раке, мигрени, боли при воспалении, острой боли или нейропатической боли, аллодинии или гипералгезии.
12. Применение соединения по любому из пп. 1-7 для получения лекарственного препарата для лечения боли, опосредованной двойной активностью связывания с сигма-1 рецептором и μ-опиоидным рецептором, где указанная боль выбрана из боли от средней до сильной, висцеральной боли, хронической боли, боли при раке, мигрени, боли при воспалении, острой боли или нейропатической боли, аллодинии или гипералгезии.
| US 4353900 A, 12.10.1982 | |||
| Способ получения производных аминофенилкетона или их солей | 1972 |
|
SU515451A3 |
| Стиральная машина | 1929 |
|
SU18711A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Прибор для испытания хлебопекарных свойств муки | 1939 |
|
SU61333A1 |
Авторы
Даты
2020-04-29—Публикация
2015-06-02—Подача