ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к ингибиторам GATA-3 для применения в лечении Th2-индуцированной астмы, в частности к ДНКзимам, направленным на GATA-3, для применения в лечении пациента, страдающего аллергической астмой, при этом пациент характеризуется тем, что (i) количество эозинофилов в крови составляет 3% или более, в частности 4% или более, в частности 5% или более; и/или (ii) количество эозинофилов в крови составляет 350⋅106/л или более, конкретно 450⋅106/л или более; и/или (iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Хронические воспаления считаются возрастающей медицинской проблемой высокого социально-экономического значения. Они включают, в частности, следующие группы заболеваний: аутоиммунные заболевания и заболевания из области ревматических заболеваний (проявления, среди прочих, на коже, легких, почках, сосудистой системе, нервной системе, соединительной ткани, опорно-двигательном аппарате, эндокринной системе), аллергические реакции немедленного типа и астму, хроническую обструктивную болезнь легких (ХОБЛ), артериосклероз, псориаз и контактную экзему и реакции хронического отторжения после трансплантации органов и костного мозга. Распространение многих из указанных заболеваний в последние десятилетия увеличивается не только в индустриальных странах, но иногда и во всем мире. Например, в Европе, Северной Америке, Японии и Австралии более 20% населения страдает аллергическими заболеваниями и астмой. Хроническая обструктивная болезнь легких в настоящее время является пятой по частоте причиной смерти во всем мире, и согласно расчетам ВОЗ она будет представлять третью наиболее частую причину смерти в 2020 году. Артериосклероз и вторичные заболевания, такие как инфаркт миокарда, инсульт и заболевание периферических артерий, лидирует в мировой статистике заболеваемости и смертности. Совместно с нейродермитом, псориаз и контактная экзема в целом являются наиболее частыми хроническими воспалительными заболеваниями кожи.
Астма является распространенным хроническим воспалительным заболеванием дыхательных путей, включающим переменную обструкцию дыхательных путей, гиперсекрецию слизи, воспаление дыхательных путей и повышенную чувствительность дыхательных путей. Считается, что дисрегуляция врожденных и адаптивных иммунных ответов играет ключевую роль в развитии заболевания. Среди разных групп пациентов выявлен высокий уровень межиндивидуальной гетерогенности, что приводит к определению нескольких клинических фенотипов и патофизиологических эндотипов1. Наиболее изученным патофизиологическим астматическим состоянием является (аллергический) ответ, индуцированный Т-хелпером (Th)-22,3, который также называют «молекулярным эндотипом Th2»4,5.
Примерно у половины пациентов с астмой, независимо от тяжести заболевания, обнаруживают данный эндотип Th2, который характеризуется преобладающей активацией Th2-клеток, продуцирующих цитокины, такие как IL-4 (интерлейкин-4), IL-5 и IL-13. Экспрессия и продуцирование всех указанных Th2 цитокинов решающим образом контролируется фактором транскрипции GATA-3 с доменом «цинковый палец», который необходим для дифференциации и активации Th2-клеток и считается основным фактором транскрипции пути иммунной активации 2-го типа (Th2)6. GATA-3 в первую очередь отвечает за дифференциацию интактных CD4+ Т-клеток в Th2-клетки. В этом процессе дифференциация Th2-клеток в основном контролируется двумя путями передачи сигнала, путем Т-клеточного рецептора (TZR) и путем рецептора IL-4: Сигналы, направляемые из TZR, активируют специфичные для Th2-клеток факторы транскрипции cMaf и GATA-3, а также факторы транскрипции NFAT (ядерный фактор активированных Т-клеток) и АР-1 (белок-активатор 1). Активация рецептора IL-4 приводит к связыванию STAT6 (переносчика сигнала и активатора транскрипции 6) с цитоплазматическим доменом рецептора IL-4, где он фосфорилируется Jak1 и Jak3-киназами. Фосфорилирование со своей стороны приводит к димеризации и транслокации STAT6 в ядро, где STAT6 активирует транскрипцию GATA-3 и других генов. GATA-3 представляет собой фактор транскрипции с доменом «цинковый палец», который экспрессируется исключительно в зрелых Th2-клетках, а не в Th1-клетках. Повышенная экспрессия GATA-3 наблюдалась в образцах бронхоальвеолярного лаважа и биопсий легких у пациентов с тяжелой астмой, несмотря на оптимальную терапию в соответствии с рекомендациями Глобальной инициативы по борьбе с бронхиальной астмой GINA7. Поэтому эта иммунная сеть является многообещающей терапевтической мишенью. В дополнение к уже одобренным анти-IgE-моноклональным антителам в разработке находится несколько новых терапевтических средств, нацеленных на отдельные компоненты, расположенные ниже фактора транскрипции GATA-38.
Альтернативный подход непосредственно нацелен на стратегический фактор транскрипции GATA-3, чтобы одновременно препятствовать всем расположенным ниже молекулам/цитокинам. Экспрессия GATA-3 была проанализирована с целью определения молекулярного фенотипа пациентов, страдающих хроническими воспалительными заболеваниями, а также для разделения пациентов на подгруппы с «высоким Th2» и с «низким Th2», и было предложено лечить пациентов с «высоким Th2» с помощью GATA-3 специфических инактиваторов (WO 2014/040891). Поскольку GATA-3 экспрессируется только внутри клетки, были разработаны инактиваторы GATA-3 на основе нуклеиновой кислоты, такие как GATA-3-специфические ДНКзимы, с возможностью проникновения в клетки in vivo (WO 2005/033314).
При хронических воспалительных расстройствах, таких как аллергическая астма, проблема идентификации подходящей схемы лечения является при этом более сложной. Известно, что при аллергических реакциях количество эозинофилов увеличивается, что приводит к эозинофилии у некоторых пациентов. Однако, как известно, эозинофилы также экспрессируют GATA-3 (Zon et al., Blood 81 (1993) 3234-3241), поскольку экспрессия GATA-3 не ограничивается Т-клетками, а также стало возможным подтвердить экспрессию GATA-3 в базофилах, тучных клетках и эпителиальных клетках. GATA-3 играет ключевую роль в иммунопатогенезе хронических воспалительных заболеваний, в частности аллергической астмы. Было показано, что острая сенсибилизация и провокация аллергеном приводит к высокой степени накопления эозинофилов в дыхательных путях с минимальным накоплением лимфоцитов (Paul Justice et al., Am J Physiol Lung Cell Mol Physiol 282 (2002) L302-L309), и что провокация аллергеном вызывает экспрессию GATA-3 и GATA-3-чувствительных генов в легочных эозинофилах. В целом, было высказано предположение, что эозинофилы могут обеспечивать положительную обратную связь для воспалительного ответа. Напротив, было показано, что при хронических аллергических воспалениях дыхательных путей, например при аллергической астме, 60-90% GATA-3-положительных клеток в ткани легкого человека представляли собой CD3-положительные Т-клетки, и только менее 15% клеток были идентифицированы как эозинофилы (Nakamura et al., J Allergy Clin Immunol 103 (1999) 215-222). Поэтому был сделан вывод о том, что при астме у человека экспрессия GATA-3-чувствительных генов в эозинофилах, вероятно, не является основным источником провоспалительных цитокинов, приводящих к воспалению дыхательных путей, но может просто обеспечивать дополнительный источник Th2 цитокинов для поддержания хронического воспалительного процесса (Paul Justice et al., loc. cit.).
Таким образом, хотя GATA-3 в Th2-клетках является привлекательной мишенью для терапевтического вмешательства в случае аллергических расстройств, таких как аллергическая астма, было абсолютно неизвестно, какое влияние на успех такого подхода к лечению, если таковое имеется, может иметь одновременное присутствие эозинофилов, которые также экспрессируют GATA-3. Кроме того, возможность идентификации определенных групп пациентов, для которых такой подход особенно благоприятен, была совершенно непредсказуемой.
Таким образом, по-прежнему существует большая неудовлетворенная потребность в разработке новых и эффективных методов лечения пациентов с аллергической астмой. Решение, представленное в настоящей заявке, которое основано на идентификации определенных групп пациентов, для которых введение определенных ингибиторов GATA-3 является особенно благоприятным, до настоящего момента не было известно и не ожидалось обычными специалистами в данной области техники.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ингибиторам GATA-3 для применения в лечении ТН2-индуцированной астмы, в частности к ДНКзимам, направленным на GATA-3, для применения в лечении определенных подгрупп пациентов, страдающих от аллергической астмы.
Таким образом, в первом аспекте настоящее изобретение относится к инактиватору GATA-3 на основе нуклеиновой кислоты, в частности к ДНКзиму, направленному на GATA-3, для применения в лечении пациента, страдающего аллергической астмой, при этом пациент характеризуется тем, что (i) количество эозинофилов в крови составляет 3% или более, конкретно 4% или более, более конкретно 5% или более; и/или (ii) количество эозинофилов в крови составляет 350⋅106/л или более, в частности 450⋅106/л или более; и/или (iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более.
Во втором аспекте настоящее изобретение относится к способу лечения пациента, страдающего ТН2-индуцированной астмой, в частности аллергической астмой, при этом пациент характеризуется тем, что (i) количество эозинофилов в крови составляет 3% или более, в частности 4% или 5% или более, соответственно; и/или (ii) количество эозинофилов в крови составляет 350⋅106/л или более, в частности 450⋅106/л или более; и/или (iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более, при этом указанный способ включает стадию введения указанному пациенту инактиватора GATA-3 на основе нуклеиновой кислоты, в частности ДНКзима, направленного на GATA-3.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 представлен план исследования и структурная схема. На части А представлен обзор плана исследования и основных процедур исследования. На части В обобщено количество пациентов, зарегистрированных в исследовании и включенных в анализы. Двадцать один пациент в группе SB010 завершил все исследования, один пациент не был допущен к оценке из-за введения другой дозы аллергена при провокации аллергеном до и после лечения. В группе плацебо два пациента не были допущены к оценке (1 пациент нуждался в SABA (бета-2-агонисты кратковременного действия) во время провокации аллергеном, 1 пациенту вводили другую дозу аллергена при провокации аллергеном до и после лечения). Таким образом, 21 пациент, подлежащий оценке, в группе SB010 и 19 пациентов, подлежащих оценке, в группе плацебо завершили исследование"*": в группе плацебо данные LAR (поздней фазы ответа) для 1 пациента отсутствуют, так как последовательная спирометрия была непреднамеренно остановлена через 4 часа после провокации аллергеном.
На фигуре 2 представлены изменения функции легких после провокации аллергеном до и после 4 недель лечения. Фигура 2А: уровни ОФВ1 представлены в процентах от исходного ОФВ1 после провокации аллергеном. Провокации аллергеном осуществляли до периода лечения () и после завершения 4-недельного периода лечения (). Функцию легких регистрировали в течение семи часов после провокации аллергеном. Для каждой группы лечения представлены средние значения плюс/минус SEM (стандартная ошибка среднего значения). Лечение посредством SB010 ( ) значительно ослабляло раннюю фазу астматического ответа (Р равно 0,04, критерий суммы рангов Уилкоксона), а также позднюю фазу астматического ответа (Р равно 0,02, ANCOVA (ковариационный анализ)) в сравнении с плацебо (
) значительно ослабляло раннюю фазу астматического ответа (Р равно 0,04, критерий суммы рангов Уилкоксона), а также позднюю фазу астматического ответа (Р равно 0,02, ANCOVA (ковариационный анализ)) в сравнении с плацебо ( ). Результаты для исследуемой группы в целом представлены на части А; для предварительно распределенных подгрупп с количеством эозинофилов в крови, составляющим 4% или более (часть В), и FeNO, составляющим 40 млрд-1 или более (часть С). Количество эозинофилов и уровни FeNO определяли перед рандомизацией. Обе подгруппы состоят из 12 SB010/12 плацебо пациентов, 9 пациентов в группе SB010 и 11 пациентов в группе плацебо присутствуют в обеих подгруппах. EAR (ранняя фаза ответа) и LAR значительно улучшились в подгруппе с количеством эозинофилов в крови, составляющим 4% или более (Р равно 0,02 и Р равно 0,05, соответственно), и в подгруппе с FeNO, составляющим 40 млрд-1 или более (Р равно 0,02 и Р равно 0,05, соответственно). Следует обратить внимание: разброс по оси x в течение первого часа после провокации аллергеном увеличивается. Фигура 2В: Функция легких выражена в процентах от исходного ОФВ1 с течением времени. Представлены отдельные кривые до и после лечения для SB010 и плацебо для трех подгрупп с количеством эозинофилов в крови 3% или более, 4% или более и 5% или более, соответственно. Показаны средние значения для каждой группы лечения плюс/минус SEM. Во вставленных полях указаны % улучшения площади под кривой ОФВ1 (AUC) в группе лечения SB010 по сравнению с плацебо для ранней фазы ответа (левое поле) и поздней фазы ответа (правое поле). Статистический анализ посредством ANCOVA. Следует обратить внимание: Ось X изображена в разном масштабе в течение первого часа после провокации аллергеном. Непрерывное улучшение функции легких на основе исходного количества эозинофилов в крови. Фигура 2С: В настоящем документе ответы на провокации аллергеном после лечения посредством SB010 в течение 28 суток показаны в комбинации для всех трех подгрупп, разделенных по исходному количеству эозинофилов в крови. Для сравнения представлен ответ после лечения плацебо для подгруппы с количеством эозинофилов в крови 3% или более, который существенно не отличается от ответов после лечения плацебо в двух других подгруппах. Для дополнительных подробностей см. подпись к фигуре 2.
). Результаты для исследуемой группы в целом представлены на части А; для предварительно распределенных подгрупп с количеством эозинофилов в крови, составляющим 4% или более (часть В), и FeNO, составляющим 40 млрд-1 или более (часть С). Количество эозинофилов и уровни FeNO определяли перед рандомизацией. Обе подгруппы состоят из 12 SB010/12 плацебо пациентов, 9 пациентов в группе SB010 и 11 пациентов в группе плацебо присутствуют в обеих подгруппах. EAR (ранняя фаза ответа) и LAR значительно улучшились в подгруппе с количеством эозинофилов в крови, составляющим 4% или более (Р равно 0,02 и Р равно 0,05, соответственно), и в подгруппе с FeNO, составляющим 40 млрд-1 или более (Р равно 0,02 и Р равно 0,05, соответственно). Следует обратить внимание: разброс по оси x в течение первого часа после провокации аллергеном увеличивается. Фигура 2В: Функция легких выражена в процентах от исходного ОФВ1 с течением времени. Представлены отдельные кривые до и после лечения для SB010 и плацебо для трех подгрупп с количеством эозинофилов в крови 3% или более, 4% или более и 5% или более, соответственно. Показаны средние значения для каждой группы лечения плюс/минус SEM. Во вставленных полях указаны % улучшения площади под кривой ОФВ1 (AUC) в группе лечения SB010 по сравнению с плацебо для ранней фазы ответа (левое поле) и поздней фазы ответа (правое поле). Статистический анализ посредством ANCOVA. Следует обратить внимание: Ось X изображена в разном масштабе в течение первого часа после провокации аллергеном. Непрерывное улучшение функции легких на основе исходного количества эозинофилов в крови. Фигура 2С: В настоящем документе ответы на провокации аллергеном после лечения посредством SB010 в течение 28 суток показаны в комбинации для всех трех подгрупп, разделенных по исходному количеству эозинофилов в крови. Для сравнения представлен ответ после лечения плацебо для подгруппы с количеством эозинофилов в крови 3% или более, который существенно не отличается от ответов после лечения плацебо в двух других подгруппах. Для дополнительных подробностей см. подпись к фигуре 2.
На фигуре 3 представлено индивидуальное абсолютное изменение площади под кривой (AUC) во время поздних астматических ответов (LAR). Для каждого пациента в группе лечения SB010 (n равно 21) и в группе плацебо (n равно 18) рассчитано и изображено абсолютное изменение величины AUC в течение поздней фазы ответа (LAR). Линия представляет собой среднее значение; черные точки: пациенты с количеством эозинофилов в крови 4% или более на исходном уровне; круги: пациенты с количеством эозинофилов в крови меньше 4% на исходном уровне. Ответы LAR у указанных двух подгрупп существенно не различаются. Для всей группы лечение SB010 значительно ослабляло позднюю фазу астматического ответа (Р равно 0,02, фигура 2). Отдельные результаты см. в таблицах S4A и S4B дополнительного приложения.
На фигуре 4 представлены изменения уровней IL-5 в плазме после провокации аллергеном до и после лечения SB010 и плацебо. Представлены средние значения ±SEM абсолютных изменений концентраций IL-5 в плазме пациентов, у которых обнаружены определяемые уровни IL-5 в плазме в ответ на провокацию аллергеном до лечения, которые составили 4,21±1,51 пг/мл в группе SB010 (13 пациентов) и 4,03±0,92 пг/мл в группе плацебо (12 пациентов), соответственно. Различие является статистически значимым при Р равно 0,05 (*).
На фигуре 5 (фигура S1 дополнительного приложения) показана ключевая роль ТН2-клеток и GATA-3 в патогенезе аллергической астмы и механизм действия SB010, как описано в дополнительном приложении.
На фигуре 6 (фигура S2 дополнительного приложения) представлена активность расщепления мРНК и ДНКзима GATA-3, как описано в дополнительном приложении. Расщепляющая активность GATA-специфичного ДНКзима hgd40 in vitro для GATA-3 копии (к)РНК. Транскрибированную in vitro полную открытую рамку считывания кРНК инкубировали в течение различных временных интервалов (кинетика - А) или с увеличением дозы (зависимость от дозы - В) hgd40, и полученные продукты расщепления разделяли и окрашивали бромидом этидия на агарозных гелях. Аналогичным образом, кРНК GATA-3 инкубировали с неспецифичными ДНКзимами либо с скремблированными связывающими доменами, но с интактной каталитической последовательностью (скремблированные ДНКзимы 1-6), или с ДНКзимами, направленными против другой последовательности фактора транскрипции (Т-бокс транскрипционный фактор Tbet, Tbet ДНКзимы 1-3) для демонстрации специфичности последовательности подхода ДНКзима (С).
На фигуре 7 (фигура S3 дополнительного приложения) представлена биоактивность hgd40 - активного компонента SB010, и действие лечения посредством hgd40 на первичные Т-клетки человека и эксплантаты назальной ткани. А - Снижение экспрессии белка GATA-3 путем трансфекции hgd40 поляризованных ТН2-клеток человека. В - Снижение секреции IL-13 путем трансфекции hgd40 поляризованных ТН2-клеток человека. Данные на фигурах S2A и S2B представляют внутриклеточное окрашивание FAM (азидопроизводное флуоресцеина)-положительных трансфицированных клеток, и представлены как среднее значение плюс SEM для n равно 8-10 на группу. С и D - поглощение флуоресцентно меченого hgd40 (красный цвет) посредством CD3+ Т-клеток (зеленый цвет), присутствующих в эксплантатах ткани полипа носа человека, полученной от пациентов, страдающих хроническим риносинуситом и полипами носа (CRSwNP). Результаты были получены с помощью конфокальной лазерной сканирующей микроскопии и представлены в виде наложения обоих цветов для необработанных (фигура С) и обработанных посредством hgd40 клеток (фигура D). Е - Экспрессия мРНК GATA-3 в эксплантатах ткани полипа носа человека, полученной от пациентов, страдающих CRSwNP, в анализе ткани ex vivo. Данные выражены в форме нормированных относительных единиц экспрессии и представлены как среднее значение плюс SEM для n равно 6 на группу. F - Высвобождение белка IL-5 из полипов носа человека в анализе ткани ex vivo. Данные представлены как среднее значение плюс SEM для n равно 16 на группу. Значение было рассчитано с критерием Стьюдента с применением GraphPad Prism 5; (*) Р менее 0,05; (**) Р менее 0,01. Для получения технических подробностей см. дополнительное приложение, раздел разделе «Материалы и способы».
На фигуре 8 (фигура S4 дополнительного приложения) представлена средняя разница между лечением во всей ITT-популяции (пациенты, включенные в лечение) и в предварительно распределенных подгруппах. Она является визуализацией групповых различий, отражающих дельту относительных изменений между группой лечения SB010 и плацебо. Значения для всей исследуемой группы представлены в таблице S2, значения для предварительно распределенной подгруппы пациентов с количеством эозинофилов крови, составляющим 4% или более, представлены в таблице S3a, а значения для предварительно распределенной подгруппы пациентов с FeNO, составляющим 40 млрд-1 или более, находятся в таблице S3B. Вверху: процентное изменение функции легких между значениями до и после лечения выражено как площадь под кривой (AUC). Внизу: процентные изменения функции легких выражены как максимальное снижение ОФВ1. EAR: ранняя фаза астматического ответа; LAR: поздняя фаза астматического ответа.
На фигуре 9 (фигура S5 дополнительного приложения) представлено действие лечения SB010 и плацебо на эозинофилы мокроты (в процентах). Измерения проводили на образцах индуцированной мокроты до и после ингаляции аллергенами, как описано в разделе «Материалы и способы». Ингаляцию аллергенами проводили до и после 28 суток лечения SB010 ( ) и плацебо (
) и плацебо ( ). Для каждого момента времени и группы лечения представлены медианные значения и 25-й и 75-й процентильные диапазоны. Левая часть: группа в целом; средняя часть: предварительно распределенная подгруппа, количество эозинофилов в крови, составляющее 4% или более; правая часть: предварительно распределенная подгруппа, FeNO, составляющий 40 млрд-1 или более. В группе в целом абсолютное изменение эозинофилов в процентах после провокации показывает статистически незначимую тенденцию (Р равно 0,06) между группами лечения, которая становится значимой в подгруппе с эозинофилами (Р равно 0,009) и в подгруппе FeNO (Р равно 0,02). Данное снижение эозинофилов мокроты в процентах не было обусловлено увеличением притока нейтрофилов, как показано в таблице S8 в дополнительном приложении.
). Для каждого момента времени и группы лечения представлены медианные значения и 25-й и 75-й процентильные диапазоны. Левая часть: группа в целом; средняя часть: предварительно распределенная подгруппа, количество эозинофилов в крови, составляющее 4% или более; правая часть: предварительно распределенная подгруппа, FeNO, составляющий 40 млрд-1 или более. В группе в целом абсолютное изменение эозинофилов в процентах после провокации показывает статистически незначимую тенденцию (Р равно 0,06) между группами лечения, которая становится значимой в подгруппе с эозинофилами (Р равно 0,009) и в подгруппе FeNO (Р равно 0,02). Данное снижение эозинофилов мокроты в процентах не было обусловлено увеличением притока нейтрофилов, как показано в таблице S8 в дополнительном приложении.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к инактиваторам на основе нуклеиновой кислоты, в частности ДНКзимам, для применения в лечении ТН2-индуцированной астмы, в частности к инактиваторам на основе нуклеиновой кислоты, в частности ДНКзимам, направленным на GATA-3, для применения в лечении определенных подгрупп пациентов.
Таким образом, в первом аспекте настоящее изобретение относится к инактиватору GATA-3 на основе нуклеиновой кислоты, в частности к ДНКзиму, направленному на GATA-3, для применения в лечении пациента, страдающего аллергической астмой, при этом пациент характеризуется тем, что (i) количество эозинофилов в крови составляет 3% или более, конкретно 4% или более, более конкретно 5% или более; и/или (ii) количество эозинофилов в крови составляет 350⋅106/л или более, в частности 450⋅106/л или более; и/или (iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более.
Во втором аспекте настоящее изобретение относится к способу лечения пациента, страдающего ТН2-индуцированной астмой, в частности аллергической астмой, при этом пациент характеризуется тем, что (i) количество эозинофилов в крови составляет 3% или более, конкретно 4% или 5% или более, соответственно; и/или (ii) количество эозинофилов в крови составляет 350⋅106/л или более, в частности 450⋅106/л или более; и/или (iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более, при этом указанный способ включает стадию введения указанному пациенту инактиватора GATA-3 на основе нуклеиновой кислоты, в частности ДНКзима, направленного на GATA-3.
В контексте настоящего изобретения термин «инактиватор на основе нуклеиновой кислоты» относится к веществам на основе нуклеиновой кислоты, которые по меньшей мере частично комплементарны последовательности гена-мишени и которые инактивируют активность гена-мишени, например блокируя ауторепликацию, транскрипцию или трансляцию, или путем расщепления последовательности-мишени. Инактиватор на основе нуклеиновой кислоты может состоять из рибонуклеотидов, дезоксирибонуклеотидов, нуклеотидов, не встречающихся в природе, и их смесей, и может представлять собой одноцепочечную последовательность, двухцепочечную последовательность или их смесь. Инактиваторы на основе нуклеиновой кислоты по настоящему изобретению включают молекулы малых интерферирующих РНК, молекулы малых образующих шпильки РНК и ДНКзимы.
В контексте настоящего изобретения термин «ДНКзимы» относится к каталитически активным одноцепочечным синтетическим молекулам ДНК, которые не встречаются в природе. ДНКзимы семейства 10-23 представляют собой новый класс антисмысловых молекул, которые были обнаружены в 1990-х годах, но только недавно нашли клиническое применение9.
В контексте настоящего изобретения термин «семейство 10-23» относится к общей модели ДНКзима (Sontoro & Joyce, Proc. Natl. Acad. Sci. U.S.A., 94 (1997) 4262-4266). ДНКзимы модели 10-23, также называемые как «10-23 ДНКзимы», содержат каталитический домен из 15 дезоксирибонуклеотидов, которые примыкают к двум субстрат-связывающим доменам (см. WO 2005/033314). Потенциальные преимущества ДНКзимов включают относительно высокую стабильность и отсутствие зависимости от внутриклеточных ферментов.
В конкретном варианте реализации каталитический домен имеет последовательность 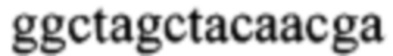 (SEQ ID No.: 1). Длина субстрат-связывающих доменов является переменной: они имеют или одинаковую или разную длину. В конкретных вариантах реализации субстрат-связывающие домены состоят из от 6 до 14 нуклеотидов, более конкретно в каждом случае по меньшей мере из девяти нуклеотидов. Такие ДНКзимы включают общую последовательность
(SEQ ID No.: 1). Длина субстрат-связывающих доменов является переменной: они имеют или одинаковую или разную длину. В конкретных вариантах реализации субстрат-связывающие домены состоят из от 6 до 14 нуклеотидов, более конкретно в каждом случае по меньшей мере из девяти нуклеотидов. Такие ДНКзимы включают общую последовательность 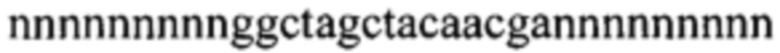 (SEQ ID NO 2). В конкретных вариантах реализации настоящего изобретения субстрат-связывающие домены связывают мРНК, кодирующую белок GATA-3.
(SEQ ID NO 2). В конкретных вариантах реализации настоящего изобретения субстрат-связывающие домены связывают мРНК, кодирующую белок GATA-3.
Указанный центральный каталитический домен ggctagctacaacga представляет собой только лишь конкретный вариант реализации. Специалисту в данной области техники известен факт, что могут быть получены «10-23 ДНКзимы» с сопоставимой биологической активностью с модифицированным каталитическим доменом.
В одном конкретном варианте реализации субстрат-связывающие домены являются полностью комплементарными областям, которые окружают участок расщепления. Однако для связывания РНК-мишени и ее расщепления ДНКзим необязательно должен быть полностью комплементарным. ДНКзимы типа 10-23 расщепляют мРНК-мишень на пурин-пиримидиновые последовательности. В пределах объема настоящего изобретения ДНКзимы предпочтительно включают ДНКзимы, активные in vivo против GATA-3, в соответствии с WO 2005/033314, содержание которой включено в настоящую заявку посредством ссылки, насколько это возможно, в соответствии с любым применимым патентным законодательством.
В конкретных вариантах реализации настоящего изобретения количество эозинофилов в крови пациента составляет 4% или более.
В конкретных вариантах реализации количество эозинофилов в крови пациента составляет 5% или более.
В конкретных вариантах реализации настоящего изобретения количество эозинофилов в крови пациента составляет 350⋅106/л или более.
В конкретных вариантах реализации количество эозинофилов в крови пациента составляет 450⋅106/л или более.
В конкретных вариантах реализации настоящего изобретения количество эозинофилов в крови определяют посредством (i) традиционного автоматизированного дифференциального анализа крови (например, с применением технологии Coulter или технологии Sysmex или других технологий) или (ii) ручной микроскопической дифференциации клеток с применением традиционных мазков крови.
В конкретных вариантах реализации настоящего изобретения фракционный выдыхаемый оксид азота пациента составляет 40 млрд-1 или более.
В конкретных вариантах реализации настоящего изобретения фракционный выдыхаемый оксид азота определяют с применением портативного устройства NIOX MINO®.
В конкретных вариантах реализации настоящего изобретения ДНКзим, направленный на GATA-3, выбран из последовательностей от hgd1 до hgd70 WO 2005/033314 (см. фигуру 3 WO 2005/033314), в частности выбран из последовательностей hgd11, hgd13, hgd17 и hgd40, более конкретно последовательности hgd40 (5'-GTGGATGGAggctagctacaacgaGTCTTGGAG; SEQ ID NO: 3).
В контексте настоящего изобретения термин «hgd40» относится к ДНКзиму, направленному на GATA-3, который состоит из 34 оснований с последовательностью 5'-GTGGATGGAggctagctacaacgaGTCTTGGAG. Девять оснований как в 3'-, так и в 5'-области образуют два связывающих домена, которые с высокой специфичностью связываются с мРНК-мишенью GATA-3. Центральное ядро молекулы представляет собой каталитический домен, который обеспечивает расщепление мишени после связывания hgd40 с GATA-3 мРНК10 (см. фигуры 5 и 6). Лекарственное вещество hgd40 характеризуется высокой биологической активностью и биодоступностью на участке доставки лекарственного средства посредством ингаляции12.
В конкретных вариантах реализации настоящего изобретения hgd40 включен в состав, который можно вводить пациенту перорально, ректально, парентерально, внутривенно, внутримышечно, подкожно, интрацистернально, интравагинально, интраперитонеально, интратекально, интраваскулярно, местно (порошок, мазь или капли) или в форме спрея или препарата для ингаляции. Активный компонент в стерильных условиях смешивают с физиологически приемлемым эксципиентом и возможными консервантами, буферами или пропеллентами в зависимости от требований.
В конкретных вариантах реализации настоящего изобретения hgd40 включен в состав для ингаляции.
В конкретных вариантах реализации настоящего изобретения указанный hgd40 растворен в PBS (фосфатно-солевой буфер).
Тип дозирования и схему дозирования определяет лечащий врач в соответствии с клиническими факторами. Специалисту в данной области известно, что тип дозирования и схема дозирования зависит от различных факторов, таких как, например, размер тела, масса, поверхность тела, возраст, пол или общее состояние здоровья пациента, но также зависит от вводимого агента, продолжительности и типа введения и от других лекарственных средств, которые могут вводиться параллельно. В этом процессе, согласно особенно предпочтительному варианту реализации, количество активного ингредиента лекарственного средства может быть подобрано в соответствии с измеренным уровнем экспрессии. Таким образом, в случае распределения в подгруппу с «высоким ТН2» и установленной очень высокой экспрессией гена GATA-3 можно вводить увеличенную дозу активного ингредиента, в частности ДНКзима, специфичного к GATA-3. Соответственно, в случае распределения в подгруппу с «высоким ТН1» и установленной очень высокой экспрессией гена Tbet можно вводить увеличенную дозу активного ингредиента, в частности ДНКзима, специфичного к Tbet.
В конкретных вариантах реализации настоящего изобретения дозировка составляет от 5 до 50 мг hgd40, конкретно от 5 до 20 мг hgd40, конкретно 10 мг hgd40. В конкретных вариантах реализации дозировку растворяют в 2 мл PBS. В конкретных вариантах реализации указанные дозировки представляют собой дозировки в суточном количестве.
В конкретных вариантах реализации настоящего изобретения указанный инактиватор GATA-3 на основе нуклеиновой кислоты вводят один раз в сутки, два раза в сутки или три раза в сутки, в частности один раз в сутки.
В конкретных вариантах реализации настоящего изобретения указанный ДНКзим, направленный на GATA-3, вводят один раз в сутки в течение 28 суток подряд при непрерывной терапии, в частности при поддерживающей терапии.
В конкретных вариантах реализации настоящего изобретения указанный инактиватор GATA-3 на основе нуклеиновой кислоты применяют в качестве дополнительной терапии для одного или более ингаляционных или пероральных терапевтических средств для лечения астмы, выбранных из списка: кортикостероиды, бета-агонисты длительного действия (LABA), антагонисты мускариновых рецепторов длительного действия (LAMA), антилейкотриены, бета-агонисты кратковременного действия (SABA), антихолинергические средства и моноклональные антитела.
Дополнительные признаки, детали и преимущества изобретения исходят из содержания формулы изобретения, а также из последующего описания иллюстративных вариантов реализации с привлечением чертежей.
ПРИМЕРЫ
Пример 1: Клиническое исследование «Ослабление аллерген-индуцированных астматических ответов посредством ингаляции GATA-3-специфическим ДНКзимом»
Реферат
Описание исследования
Наиболее превалирующий фенотип астмы характеризуется Th2-индуцированным воспалением с преобладанием эозинофилов. Терапевтическое направленное воздействие на GATA-3, основной фактор транскрипции пути Th2, может быть благоприятным. Авторы оценили безопасность и эффективность нового ДНКзима, специфически направленного против мРНК GATA-3 (SB010).
Способы
В данном рандомизированном двойном слепом плацебо-контролируемом многоцентровом клиническом исследовании пациентам с аллергической астмой с эозинофилией в мокроте, проявляющим двухфазовый ранний и поздний астматический ответ (EAR и LAR) после провокации аллергеном, назначали 10 мг SB010 (21 оцениваемый пациент) или плацебо (19 оцениваемых пациентов) посредством ингаляции один раз в сутки в течение нескольких суток. Провокацию аллергеном выполняли до и после лечения. Первичный конечный критерий оценки представлял собой изменение площади под кривой ОФВ1 (объем форсированного выдоха за 1 секунду) (AUC) при LAR.
Результаты
Через 28 суток лечения SB010 среднее значение AUC при LAR снизилось на 34% по сравнению со значением до лечения, тогда как в группе плацебо (Р равно 0,02) наблюдалось увеличение AUC при LAR на 1%, AUC при EAR снизилась на 11% посредством SB010 по сравнению с увеличением на 10% после плацебо (Р равно 0,03). Данные эффекты были более выраженными в предварительно распределенных подгруппах пациентов с количеством эозинофилов в крови 4% или более (улучшение LAR 41,7%, Р равно 0,05, улучшение EAR 28,3%, Р равно 0,02) или FeNO 40 млрд-1 или более. Ингибирование LAR посредством SB010 было связано со снижением количества эозинофилов в мокроте, индуцированной аллергеном (Р равно 0,06 для целой группы, Р равно 0,009 для подгруппы с эозинофилией, Р равно 0,02 для подгруппы FeNO), понижением триптазы в мокроте (Р равно 0,05) и уровней IL-5 в плазме (Р равно 0,05). Лечение не влияло на уровни FeNO, индуцированные аллергеном, а также гиперчувствительность дыхательных путей к метахолину.
Выводы
Лечение SB010 значительно снижало как LAR, так и EAR при аллергической астме после провокации аллергеном. Анализ биомаркеров подтвердил выраженное действие на Th2-регулируемые воспалительные ответы (Клинические исследования - гос. номер, NCT 01743768).
Введение
Центральное ядро активного лекарственного продукта SB010 представляет собой каталитический домен, который обеспечивает расщепление мишени после связывания hgd40 с GATA-3 мРНК10 (см. фигуры S1 и S2 в дополнительном приложении). Sel et al.11 сообщили о разработке ДНКзимов, способных расщеплять мРНК GATA-3 и продемонстрировали их эффективность в доклинических моделях аллергического воспаления дыхательных путей. Лекарственное вещество hgd40 характеризуется высокой биологической активностью и биодоступностью на участке доставки лекарственного средства посредством ингаляции12 и, таким образом, было выбрано для дальнейшего клинического исследования; hgd40 значительно снижает содержание мРНК и белка GATA-3, а также впоследствии продуцирование Th2 цитокинов в Т-клетках и эксплантатах ткани человека (фигура S3, дополнительное приложение). Нежелательные нецелевые эффекты были исключены13, и никакие серьезные факторы опасности в широкомасштабной токсикологической программе выявлены не были14. Соответствующий лекарственный продукт SB010 был исследован в трех недавно завершенных рандомизированных плацебо-контролируемых исследованиях фазы I с эскалацией дозы (рукописи находятся в редакции). Многообещающие результаты оправдали исследования фазы IIa для оценки эффективности SB010. Данное исследование представляет собой первое исследование фазы IIa ингаляционного ДНКзима на сегодняшний день.
Способы
План исследования и контроль
Указанное рандомизированное двойное слепое плацебо-контролируемое исследование проводили в 7 исследовательских центрах, специализирующихся на респираторных исследованиях в Германии, в период с января (первый зарегистрированный пациент) по октябрь 2013 года (последний визит последнего пациента). После скрининга и оценки исходного состояния участников рандомизировали с применением созданного в централизованном порядке списка рандомизации (Inamed GmbH, Мюнхен, Германия) без стратификации до 4-недельного периода лечения активным препаратом или плацебо. Три провокации аллергеном посредством ингаляции выполняли при скрининге (приемлемость) до рандомизации (до лечения) и на 28-ые сутки (после лечения). Исследование было одобрено регулирующим агентством Германии "Bundesinstitut  Arzneimittel und Medizinprodukte (BfArM)" и центральными и местными комитетами по этике в каждом участвующем центре до начала исследования. Исследование проводили в соответствии с принципами надлежащей клинической практики и Хельсинкской декларации. Все участники дали свое информированное согласие в письменной форме до выполнения каких-либо конкретных процедур. Данные собирали в каждом исследовательском центре и вводили в базу данных INAMED GmbH (Гаутинг, Германия). Статистический анализ был независимо выполнен FGK Clinical Research GmbH (Мюнхен, Германия). Первый проект рукописи был подготовлен первым и последним авторами, которые также приняли решение представить рукопись для публикации. Профессиональный автор медицинских текстов, финансируемый спонсором, оказал поддержку при написании и редактировании. Первый и последний авторы, а также авторы, являющиеся сотрудниками спонсора, отвечали за точность и полноту данных, статистический анализ и правильность проведения испытания до итогового протокола.
Arzneimittel und Medizinprodukte (BfArM)" и центральными и местными комитетами по этике в каждом участвующем центре до начала исследования. Исследование проводили в соответствии с принципами надлежащей клинической практики и Хельсинкской декларации. Все участники дали свое информированное согласие в письменной форме до выполнения каких-либо конкретных процедур. Данные собирали в каждом исследовательском центре и вводили в базу данных INAMED GmbH (Гаутинг, Германия). Статистический анализ был независимо выполнен FGK Clinical Research GmbH (Мюнхен, Германия). Первый проект рукописи был подготовлен первым и последним авторами, которые также приняли решение представить рукопись для публикации. Профессиональный автор медицинских текстов, финансируемый спонсором, оказал поддержку при написании и редактировании. Первый и последний авторы, а также авторы, являющиеся сотрудниками спонсора, отвечали за точность и полноту данных, статистический анализ и правильность проведения испытания до итогового протокола.
Пациенты
Авторы привлекли пациентов мужского пола европеоидной расы в возрасте от 18 до 64 лет, у которых была диагностирована астма легкой степени согласно рекомендациям GINA15 по меньшей мере за 6 месяцев до скрининга, и которые не получали никаких лекарственных средств от астмы, кроме ингаляционных бронхолитиков кратковременного действия. При скрининге ОФВ1 должен быть равен 70% или более от прогнозируемой нормы через по меньшей мере 6 часов после приема любых бронхолитиков кратковременного действия. Аллергический характер их астмы было необходимо продемонстрировать с помощью положительной кожной инъекционной пробы на общие аэроаллергены и положительной аллерген-индуцированной ранней и поздней фазы ответа (снижение ОФВ1 составляет 20% или более и составляет 15% или более, соответственно). Присутствие эозинофилов в мокроте было необходимо продемонстрировать до или после скрининга при провокации аллергеном. Полную информацию о критериях включения и исключения можно найти в дополнительном приложении. Лечение в рамках исследования
Лекарственный продукт SB010 представляет собой 10 мг GATA-3-специфичного ДНКзима человека hgd40 (произведенного BioSpring GmbH, Франкфурт, Германия) в 2 мл фосфатно-солевого буфера (или подходящее плацебо). Конечный лекарственный продукт получали централизованно (BAG Health Care GmbH, Lich, Германия) с идентичной упаковкой, чтобы обеспечить слепое исследование. Лекарственный продукт или плацебо вводили один раз в сутки утром с помощью ингаляции с контролируемым потоком и объемом длительностью приблизительно 3-8 минут в течение 28 последовательных суток с применением небулайзера AKITA2 APIXNEB (Activaero GmbH,  , Германия), чтобы обеспечить оптимальное осаждение лекарственного средства16. До включения в исследование пациентов обязательно обучали применению устройства. При каждом визите в течение периода лечения лечение активным препаратом или плацебо проводили в исследовательском центре под наблюдением персонала исследовательского центра. Остальные дозы вводились самостоятельно, а соблюдение режима лечения проверяли с применением смарт-карты устройства.
, Германия), чтобы обеспечить оптимальное осаждение лекарственного средства16. До включения в исследование пациентов обязательно обучали применению устройства. При каждом визите в течение периода лечения лечение активным препаратом или плацебо проводили в исследовательском центре под наблюдением персонала исследовательского центра. Остальные дозы вводились самостоятельно, а соблюдение режима лечения проверяли с применением смарт-карты устройства.
Процедуры исследования
Обзор основных процедур исследования и вмешательств показан на фигуре 1А (полное описание процедур исследования можно найти в дополнительном приложении).
- Провокация аллергеном и тестирование функции легких
Соответствующий аллерген для осуществления провокации аллергеном идентифицировали с помощью кожной инъекционной пробы при первом визите для скрининга (подробности см. в таблице S1 в дополнительном приложении). Последующую кожную инъекционную пробу со снижением концентрации аллергена при втором визите для скрининга (по меньшей мере через 1 неделю после первого) в сочетании с чувствительностью дыхательных путей (с помощью провокации метахолином) применяли для определения безопасной начальной концентрации для скрининга при провокации аллергеном7. Увеличенные концентрации ингаляционного аэроаллергена вводили до достижения 20% или более снижения ОФВ118. Последние три стадии концентрации ингаляционного аэроаллергена, которые приводили к 20% снижению ОФВ1, вводили перед рандомизацией (перед лечением) и после 28-суточного периода лечения (после лечения) идентичным образом19. Последовательные спирометрические измерения выполняли в двух повторах от 10 до 180 минут (ранняя фаза астматического ответа, EAR) и через 7 часов (поздняя фаза астматического ответа, LAR) после провокации аллергеном в соответствии с последними рекомендациями20. Для обеспечения возврата уровней ОФВ1 и FeNO к исходным значениям для всех пациентов до проведения дополнительных провокаций выдерживали соответствующие времена «отмывки» между провокациями.
- Тестирование с провокацией метахолином
Чувствительность дыхательных путей оценивали в моменты, указанные на фигуре 1А, как концентрация метахолина (Provocholine, Metapharm Inc., Брантфорд, Онтарио, Канада), приводящая к снижению ОФВ1, составляющему 20% или более (концентрация РС20), в соответствии с рекомендациями Американского торакального общества ATS21.
- Определение выдыхаемого оксида азота
Уровни фракционного выдыхаемого оксида азота (FeNO) определяли в моменты, указанные на фигуре 1А, с применением портативного устройства NIOX MINO® (Aerocrine, Сольна, Швеция) в соответствии с рекомендациями ATS/ERS (Европейского респираторного общества)22 согласно инструкциям производителя.
- Индукция мокроты
Индуцированные образцы мокроты отбирали в пяти временных точках (фиг. 1А): при скрининге, до (до двух недель) и через 24 часа после провокации до лечения и до (24-48 ч) и через 24 ч после лечения. Распределение клеток и анализ медиаторов в супернатанте оценивали в центральной лаборатории.
Измерение иммунологических параметров
Цитокины и хемокины TNF-α, IL-1β, IL-8 МСР-1, МСР-4, MIP-1β, MDC, IP10 и IL-4, IL-5 и IL-13 и IFN-γ определяли в супернатантах плазмы и/или мокроты с помощью мультиплексного анализа содержания Th1/Th2 и хемокинов (Meso Scale Discovery, Роквилл, США) согласно инструкции производителя. Эозинофильный катионный белок (ЕСР) и триптазу в супернатантах мокроты определяли с применением коммерчески доступного ELISA (ЕСР and tryptase: Cloud-Clone, Хьюстон, США) согласно инструкциям производителя.
Оценка безопасности
Нежелательные явления и сопутствующие лекарственные препараты оценивали при каждом визите. Лабораторные анализы безопасности (включая гематологию, клиническую химию и анализ мочи) проводили до первого введения и с двухнедельными интервалами во время лечения (подробности см. в дополнительном приложении). Кроме того, до и после лечения определяли антинуклеарные антитела (иммунофлуоресцентный скрининг-тест) и ревматоидную серологию (IgM), чтобы исключить развитие (ауто-)антител вследствие лечения лекарственным средством на основе ДНКзима. Определение результатов исследования
Первичным критерием эффективности является влияние множественных доз ингаляционного SB010 на площадь под кривой ОФВ1 (AUC), выраженное в процентах от исходных значений ОФВ1 при LAR (через 4 часа после провокации аллергеном). AUC рассчитывали с применением правила трапеций. Эмпирические конечные критерии оценки включали влияние SB010 на площадь под кривой ОФВ1 при EAR (0-3 часа), аллерген-индуцированные изменения чувствительности дыхательных путей (РС20 метахолин), уровни FeNO и биомаркеры в плазме и мокроте.
Размер образца и статистический анализ
Потребовалось по меньшей мере 38 оцениваемых субъектов при условии вероятности ошибки I типа, составляющей 10%, при различии в величине эффекта между группами лечения, составляющем 8%, и статистической мощности исследования, составляющей по меньшей мере 80%. Исходя из прогнозируемой частоты исключения из исследования, составляющей 15%, 43 субъекта были рандомизированы и подвергнуты лечению исследуемым препаратом или плацебо. Эффективность и фармакодинамические результаты проанализированы у всех оцениваемых пациентов (группа, начавшая лечение), как показано на фигуре 1.
Первичный критерий эффективности (AUC при LAR) сравнивали между группами лечения с применением модели ANCOVA с исходными AUC при LAR в качестве ковариаты. Четыре пациента в группе SB010 и три пациента в группе плацебо продемонстрировали LAR только при первой провокации аллергеном перед лечением. Для этих пациентов данные функции легких после указанной провокации аллергеном применяли в качестве значения перед лечением. Другие конечные критерии оценки также анализировали с применением той же модели или с применением критериев суммы рангов Уилкоксона для сравнения процентных изменений групп, как определено в плане статистического анализа. Результаты оценки безопасности были указаны пациентом, а также рассчитана описательная статистика. Более подробную информацию о статистических методах можно найти в дополнительном приложении.
Результаты
Пациенты
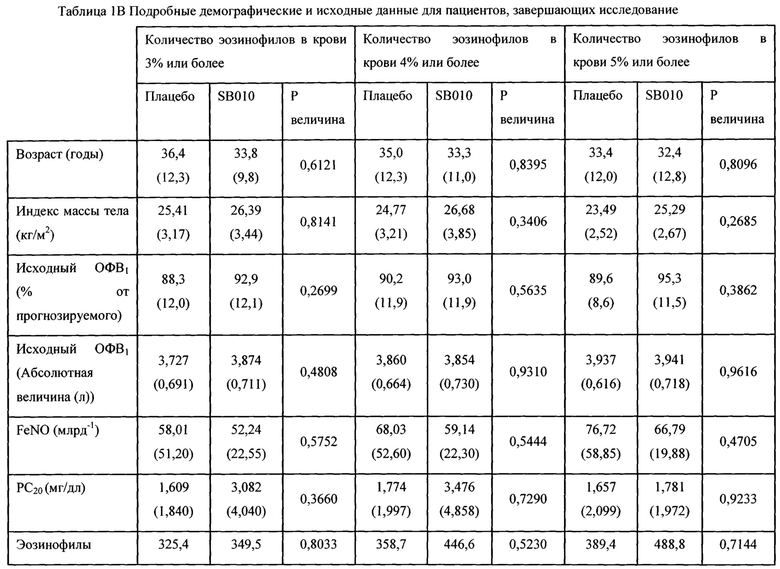
Двадцать один пациент завершил все оценки согласно исследованию в группе SB010, и 18 и 19 пациентов соответственно завершили оценки LAR и EAR в группе плацебо (фигура 1В). Демографические и исходные данные для указанных пациентов представлены в таблице 1А и таблице 1В.
Ранняя и поздняя фаза астматического ответа
Как показано на фигуре 2А (таблица S2 дополнительного приложения), наблюдалось снижение LAR после лечения SB010 со значительным увеличением средней площади под кривой (AUC) на 33,7% (Р равно 0,02) и увеличением максимального снижения ОФВ1 на 31,6% (Р равно 0,09). Также наблюдалось значительное снижение EAR при увеличении средней AUC на 11,3% (Р равно 0,04) и увеличении максимального снижения ОФВ1 на 21,5% (Р равно 0,04).
Ранняя и поздняя фаза астматического ответа в предварительно распределенных подгруппах
В предварительно распределенных подгруппах пациенты с относительным количеством эозинофилов в крови 4% или более в качестве исходной величины показали большее увеличение AUC при LAR и выраженный эффект на EAR после лечения SB010 (фигуры 2В и дополнительное приложение S3 А). Уменьшение AUC при LAR в группе SB010 было снижено на 41,7% (Р равно 0,05) (таблица S3A). Это сопровождалось снижением при EAR на 28,3% (Р равно 0,02). Индивидуальные изменения AUC после лечения SB010 и плацебо показаны на фигуре 3 (и таблицах S4A и S4B дополнительного приложения). Аналогичные наблюдения были зарегистрированы для подгруппы с FeNO 40 млрд-1 или более в качестве исходной величины (фигура 2С, таблица S3B дополнительного приложения). Показатели гетерогенности между стратами подгрупп были незначительными.
Взаимодействие с маркерами Th2-индуцированного воспаления
Через 28 суток после лечения SB010 по сравнению с плацебо наблюдали снижение индуцированной аллергеном эозинофилии в мокроте, хотя это различие не попадает в статистическую значимость во всей исследуемой группе (Р равно 0,06), но стало значимым в предварительно распределенных подгруппах, имеющих эозинофилы в крови в количестве 4% или более (Р равно 0,009), и имеющих FeNO больше или равный 40 млрд-1 (Р равно 0,02). Изменения эозинофилии в мокроте сопровождались значительным различием (Р равно 0,05) в уровнях IL-5 в крови (фигура 4). Увеличение уровней IL-5 после лечения, наблюдаемое в группе плацебо, отсутствовало после лечения SB010. В конце 28-суточного курса лечения уровни триптазы в мокроте были значительно (Р равно 0,05) ниже в группе лечения SB010 (медианное значение 6,39 IQR 2,03-13,88 нг/мл) по сравнению с плацебо (медианное значение 13,10 IQR 6,05-22,77 нг/мл). Уровни FeNO, индуцированные аллергеном, и гиперчувствительность дыхательных путей к метахолину в течение 24 часов после провокации оставались неизменными при исследуемом лечении (таблица S5 дополнительного приложения).
Безопасность и переносимость
Никаких примечательных различий в нежелательных явлениях, возникающих при лечении (ТЕАЕ), у пациентов, получавших SB010 или плацебо, не наблюдалось. В группе плацебо у 8 пациентов наблюдались ТЕАЕ по сравнению с 6 пациентами в группе SB010 (таблица 3). Никаких серьезных ТЕАЕ, вероятно или безусловно связанных с SB010 ТЕАЕ, выявлено не было. Два ТЕАЕ (тошнота и зуд) у двух пациентов возможно были связаны с SB010. Серьезных ТЕАЕ выявлено не было. Другие переменные безопасности не выявили каких-либо факторов опасности, включая все конечные критерии оценки безопасности, перечисленные в дополнительном приложении. Измерения TNF-α, IL-1β, IL-8, МСР-1, МСР-4, MIP-1β, MDC и IP-10 до и после лечения не выявили существенных различий между исследуемыми группами (таблица S7 дополнительного приложения); значительного увеличения ревматоидной серологии и антиуклеарных антител обнаружено не было, что в целом указывает на отсутствие врожденной иммунной активации и отсутствие нецелевых эффектов.
Обсуждение
Провокация аллергеном при бронхиальной ингаляции является широко распространенной in vivo моделью аллергического воспаления и бронхоконстрикции18, а терапевтическое ингибирование LAR в клинических исследованиях ранней фазы является достаточно хорошим прогнозирующим параметром клинической эффективности на более поздних стадиях программы разработки лекарственного средства24. Примеры включают пути нацеливания Th2 цитокинов, таких как IL-425,26,27, IL-528,29,30, IL-1331,32 и TSLP33 (тимусный стромальный лимфопоэтин). В данном исследовании лечение SB010 значительно улучшало функцию легких во время EAR и LAR после ингаляции аллергеном. Поскольку SB010 специфически и селективно нацелен на фактор транскрипции GATA-3, эти данные значительным образом подтверждают важность GATA-3-зависимых и регулируемых путей при астматическом ответе после ингаляции аллергеном у пациентов с Th2-индуцированным астматическим фенотипом6, и свидетельствуют о том, что SB010 может представлять собой перспективное лечение аллергической астмы.
Пациенты имели легкую форму аллергической астмы с типичным Th2-индуцированным эндотипом, что показано увеличением количества эозинофилов в крови и мокроте, а также увеличением уровней FeNO34,35. Указанный эндотип типа 2 не только присутствует в прототипной атопической и аллергической астме, но также недавно наблюдался и в других клинических фенотипах астмы, включая гиперэозинофильную астму с поздним началом, стойкую и тяжелую астму и аспирин-чувствительную астму5,36,37. Критерии включения определяли для охвата более широкого спектра пациентов с указанным эндотипом (например, только «присутствие эозинофилов в мокроте»), а данные о функции легких показывают, что SB010 оказал значительный эффект на указанную исследуемую группу в целом. Однако в анализе предварительно распределенных подгрупп для пациентов с более выраженным Th2-индуцированным фенотипом (уровни эозинофилов в крови, составляющие по меньшей мере 4%, или уровни FeNO, составляющие по меньшей мере 40 млрд-1), как оказалось, особенно благоприятно лечение SB010. В дополнение к более выраженному терапевтическому эффекту на LAR, также обнаружили значительное ослабление EAR. Такое двойное действие в обеих фазах астматического ответа не сообщалось для какого-либо потенциального биологического лекарственного средства со времен анти-IgE38 и недавно - анти-TSLP33. Является ли лечение SB010 особенно эффективным для пациентов, подверженных серьезным обострениям, необходимо изучить в предстоящих клинических исследованиях36. Центральная роль GATA-3 в регулировании ответа Th2 хорошо установлена. И развитие и поддержание эффекторных функций Th2 четко зависит от GATA-339. Совсем недавно во врожденных лимфоидных клетках типа 2 идентифицировали важнейшую функцию GATA-340. Однако указанные факторы транскрипции также выполняют важные функции далеко за пределами подмножества Th2-клеток. GATA-3 также экспрессируется в тучных клетках39, эозинофилах41 и эпителиальных клетках дыхательных путей, где он контролирует важные функции и эффекторные механизмы, связанные с аллерген-индуцированным аллергическим ответом42,43. После провокации аллергеном EAR зависит от дегрануляции тучных клеток, тогда как полагают, что LAR преимущественно зависит от Т-клеток и сопровождается заметным притоком эозинофилов в дыхательные пути и просвет дыхательных путей. Триптаза тучных клеток представляет собой надежный и устойчивый маркер, отражающий активацию тучных клеток и дегрануляцию тучных клеток. Данные результаты показывают, что лечение SB010 прямо или косвенно влияет на указанные эффекторные клетки астматического ответа. Вероятно SB010 выполняет эту ингибирующую и модуляторную функцию параллельно, как путем модуляции Th2-клеток и, таким образом, лишения эффекторных клеток факторов выживания и активации, а также путем прямого взаимодействия с мРНК GATA-3 в эозинофилах и тучных клетках в местной воспаленной ткани, однако необходимы дополнительные исследования механизма действия, чтобы полностью осветить все биологические эффекты лечения ДНКзимом GATA-3.
Пациенты, вовлеченные в данное исследование, в сочетании с индивидуумами, вовлеченными во время программы фазы I, составляют базу данных о безопасности для более 1200 применений у более чем 120 индивидуумов, у 39 из которых была зарегистрирована астма. Во время клинического исследования до настоящего момента не было обнаружено никаких опасных показателей наряду с результатами обширной доклинической программы. В заключение, это исследование для подтверждения концепции свидетельствует об эффективности лечения ДНКзимом SB010 посредством ингаляции, что значительно ослабляет как раннюю, так и позднюю фазы астматического ответа после провокации аллергеном. Дальнейшие клинические исследования позволяют исследовать, переходят ли указанные эффекты в клиническую пользу для устойчивых симптоматических астматиков с преобладающим фенотипом Th2.
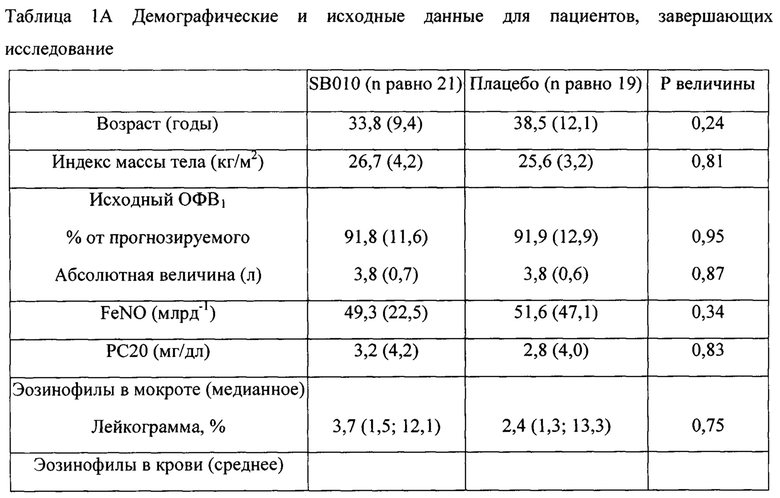

Все данные выражены как средние значения (SD), за исключением эозинофилов в мокроте (медианное, 1-й и 3-й квартили). Перед рандомизацией определяли фракционный выдыхаемый оксид азота (FeNO), гиперреактивность дыхательных путей (РС20), эозинофилы в крови и эозинофилы в индуцированной мокроте. Количество эозинофилов в мокроте рассчитаны для n равно 20 для SB010 и n равно 17 для группы плацебо, соответственно. Р величины в соответствии с критерием суммы рангов Уилкоксона (см. Материалы и способы).
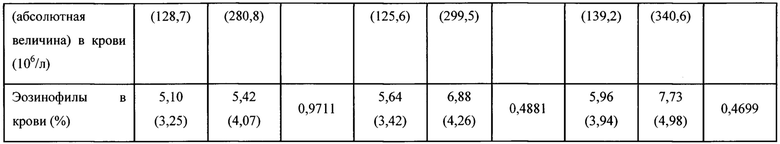
Все данные выражены как средние значения (SD). Перед рандомизацией определяли фракционный выдыхаемый оксид азота (FeNO), гиперреактивность дыхательных путей (РС20), эозинофилы в крови и эозинофилы в индуцированной мокроте. Р величины в соответствии с критерием суммы рангов Уилкоксона (см. Материалы и способы).
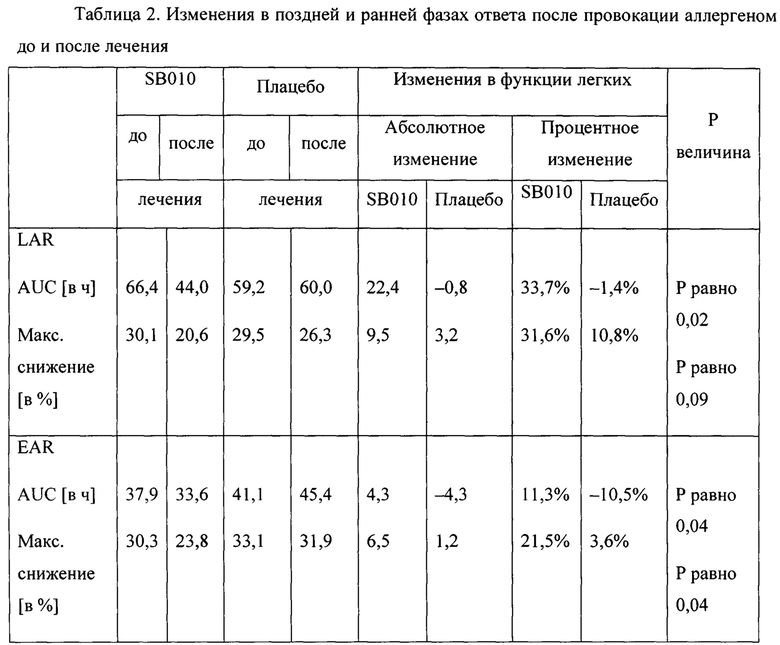
Представлены средние значения для площади под кривой (AUC) для позднего астматического ответа (LAR) и раннего астматического ответа (EAR). Уменьшение значений AUC в интервале от до лечения до после лечения отражает улучшение функции легких. Приведены значения AUC до и после лечения, а затем изменения функции легких для SB010 и группы плацебо, соответственно. Данные изменения представлены как значения AUC до-после и как процентное изменение между значениями до и после лечения. Положительные значения отражают улучшение функции легких, отрицательные значения соответствуют большей площади под кривой при провокации после лечения по сравнению с провокацией до лечения. Полный ряд данных см. в таблице S2 в дополнительном приложении.
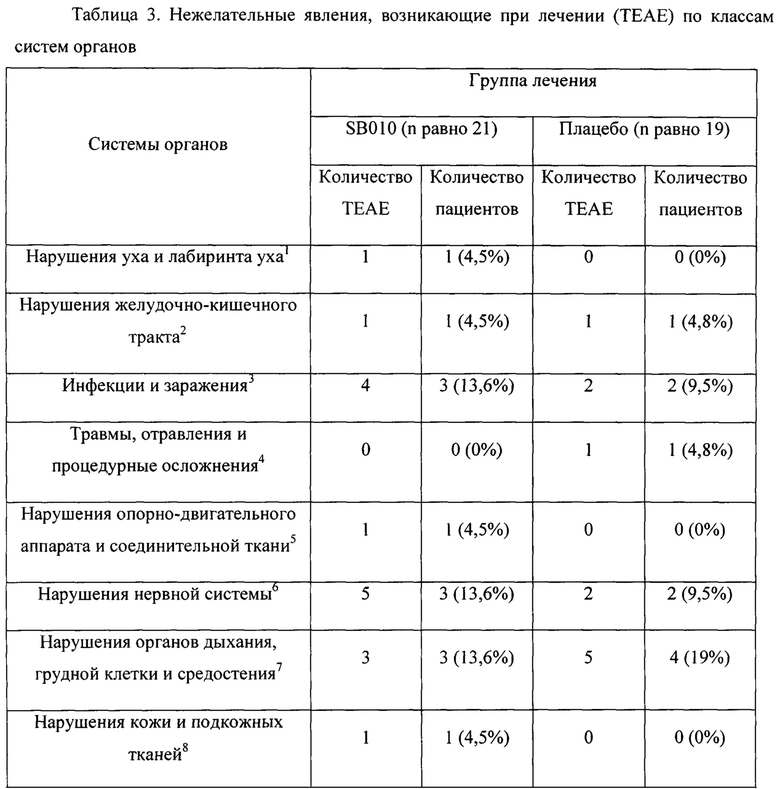
1головокружение; 2диарея, тошнота; 3простои герпес, назофарингит; 4порез; 5миалгия; 6головная боль, невралгия седалищного нерва; 7астма, бронхиальная обструкция, отдышка, повышенная секреция верхних дыхательных путей, орофарингеальная боль, синдром кашля верхних дыхательных путей; 8зуд.
Дополнительное приложение: Ослабление аллерген-индуцированных астматических реакций посредством ингаляции GATA-3-специфическим ДНКзимом
Материалы и способы
Критерии включения и исключения
Критерии включения
1. Взрослые пациенты мужского пола европеоидной расы в возрасте 18 лет или более и 60 лет или менее,
2. Клинический диагноз легкой астмы (согласно рекомендациям GINA 2008) в течение по меньшей мере 6 месяцев до скрининга. Отсутствие сопутствующего лечения астмы, за исключением ингаляционных бронходилататоров кратковременного действия,
3. Значение ОФВ1 по скринингу ОФВ1, которое составляет 70% или более от прогнозируемого нормального значения (ECSC) после вымывания в течение по меньшей мере 6 часов для ингаляционных бронходилататоров кратковременного действия,
4. Пациент должен демонстрировать достаточное продуцирование индуцированной мокроты,
5. Положительная кожная инъекционная проба (чувствительность кожи) на общие аэроаллергены (например, эпителий животных, пылевой клещ),
6. Пациент должен демонстрировать положительную раннюю и позднюю фазы аллерген-индуцированной бронхоконстрикции дыхательных путей,
7. Во все моменты времени до АС (провокации аллергеном) и MCh (провокации метахолином) пациенты должны показывать ОФВ1не ниже 65%.
8. Наличие эозинофилов в мокроте до или после скрининга при провокации аллергеном (первая или вторая индуцированная мокрота),
9. Пациент был проинформирован как в устной, так и в письменной форме о целях клинического исследования, способах, предполагаемых преимуществах и потенциальных рисках и дискомфорте, которым он может быть подвергнут, и дал письменное согласие на участие в указанном исследовании до начала исследования и любой процедуры, связанной с исследованием,
10. Пациент способен понять и дать письменное информированное согласие, и подписал письменную форму информированного согласия, одобренную Исследовательской комиссией по этике исследований,
11. Некурящие или ранее курящие, прекратившие курить по меньшей мере за 1 год до начала клинического исследования, имеющие менее 10 условных лет курения,
12. Способность проводить ингаляцию соответствующим образом (пациенты будут обучены ингаляции с помощью устройства AKITA2 APIXNEB® препаратом плацебо во время визита для скрининга).
13. Только мужчины, которые не желают заводить детей в течение шести месяцев после последней дозы SB010, будут включены в указанное исследование.
Критерии исключения
1. Наличие клинически значимых заболеваний, отличных от астмы (сердечнососудистых, заболеваний почек, печени, желудочно-кишечного тракта, гематологических, неврологических, мочеполовых, аутоиммунных, эндокринных, метаболических и т.д.), которые, по мнению исследователя, могут подвергать риску пациента вследствие участия в исследовании, или заболеваний, которые могут повлиять на результаты исследования или способность пациента участвовать в нем,
2. Наличие соответствующих легочных заболеваний или торакальной хирургии в анамнезе, таких как:
Известный активный туберкулез,
Интерстициальая легочная или тромбоэмболическая легочная болезни в анамнезе, Резекции легкого в течение последних 12 месяцев, Астматический статус в анамнезе,
Бронхоэктаз, вторичный по отношению к респираторным заболеваниям (например, кистозный фиброз, синдром Картагенера и т.д.) в анамнезе,
Хронический бронхит, эмфизема, аллергический бронхолегочный аспергиллез или респираторная инфекция в течение 4 недель перед первым приемом IMP (исследуемого препарата) в анамнезе,
3. Пациенты, получающие сопутствующее лечение, за исключением ингаляционных бронходилататоров кратковременного действия, по решению исследователя,
4. Применение β2-агонистов кратковременного действия за 6 часов до предусмотренных исследованием визитов 2, 3, 4, 5, 11 и 12,
5. Госпитализация или лечение в отделении неотложной помощи при острой астме за 6 месяцев до скрининга, между скринингом и началом периода лечения,
6. Интубирование (когда-либо) или госпитализация в течение более 24 часов для лечения обострения астмы в течение 6 месяцев до визита для скрининга,
7. Наличие в анамнезе или текущие проявления клинически значимой аллергии или идиосинкразии к лекарствам,
8. Наличие в анамнезе аллергических реакций на любые активные или неактивные ингредиенты раствора небулайзера,
9. Нарушения ЭКГ клинической значимости,
10. Субъекты с частотой сердечных сокращений меньше 45 уд/мин, систолическим артериальным давлением меньше 100 мм рт.ст., диастолическим артериальным давлением меньше 60 мм рт.ст.,
11. Предрасположенность к ортостатической дисрегуляции, обмороки или потемнение в глазах,
12. Злокачественные новообразования в анамнезе за последние 5 лет, за исключением иссеченных базалиом,
13. Клинически значимые отклонения клинических химических, гематологических или любых других лабораторных переменных по мнению исследователя,
14. Клинически значимые острые инфекции за последние 4 недели, предшествующие АС,
15. Клинически значимые хронические инфекции,
16. Положительные результаты в любом из вирусологических тестов острой или хронической инфекции вируса иммунодефицита человека (ВИЧ) и вирусных инфекций гепатитов В/С,
17. Положительный тест на употребление наркотических веществ,
18. Злоупотребление алкоголем или наркотическими веществами,
19. Положительный тест на котинин,
20. Лечение любыми известными ферментами, индуцирующими или ингибирующими агентами (зверобой (Johanniskraut), барбитураты, фенотиазины, циметидин, кетоконазол и т.Д.) в течение 30 суток до первого приема исследуемого лекарственного средства или в течение периода лечения,
21. Применение любых запрещенных сопутствующих лекарственных средств за 2 недели (для биопрепаратов: за 6 месяцев или 10-кратный период полувыведения соответствующего лекарственного средства) до начала приема первого исследуемого лекарственного средства или за менее чем 10 кратный период полувыведения лекарственного средства или в течение продолжительности фармакодинамического эффекта, независимо от того, который является более длительным, или ожидаемое сопутствующее лечение в течение периода лечения,
22. Употребление любых пищевых продуктов или напитков, индуцирующих или ингибирующих ферменты (например, брокколи, брюссельская капуста, грейпфрут, грейпфрутовый сок, карамбола и т.д.) в течение 14 суток до первого приема исследуемого лекарственного средства и в течение периода лечения согласно исследованию,
23. Употребление любого продукта, содержащего кофеин, за 6 часов до первой процедуры при каждом предусмотренным исследованием визите,
24. Хирургия желудочно-кишечного тракта, которая может препятствовать абсорбции лекарственного средства проглоченной фракции (Примечание: это не распространяется на небольшие абдоминальные операции, такие как аппендэктомия или герниотомия),
25. Донорство крови в течение последних 30 суток до скрининга,
26. Планируемое донорство зародышевых клеток, крови, органов или костного мозга в ходе исследования или в течение 6 месяцев после этого,
27. Участие в другом клиническом исследовании экспериментального лекарственного средства или устройства в течение последнего месяца или в течение 10-кратного периода полувыведения соответствующего лекарственного средства. Для биопрепаратов минимальный период составляет по меньшей мере 6 месяцев или время продолжительности фармакодинамического эффекта или 10-кратный период полувыведения соответствующего лекарственного средства до включения в указанное исследование,
28. Отсутствие способности или готовности дать информированное согласие или неспособность к адекватному сотрудничеству,
29. Предполагаемое отсутствие доступности для визитов/процедур согласно исследованию,
30. Уязвимые субъекты (например, лица, содержащиеся под стражей),
31. Сотрудник исследовательского центра, родственник или супруг исследователя.
Эксперименты in vitro
Эксперименты in vitro проводят для демонстрации активности и специфичности расщепления GATA-3 ДНКзима. Биоактивность и механизм действия оценивают в экспериментах с клеточной культурой с применением Т-клеток периферической крови и фрагментов синоназальной ткани в качестве модели ткани слизистой оболочки дыхательных путей.
Анализ расщепления (фигура S2 дополнительного приложения)
Анализ каталитической активности ДНКзимов по расщеплению РНК проводят с применением анализа расщепления in vitro, как описано ранее (Sel et al. JACI 2008). Вкратце, 2 мкл транскрибированных in vitro GATA-3 копий (к)РНК (250 нг/мкл) добавляли к смеси 4 мкл воды, не содержащей РНК-азу, 1 мкл 1 М NaCl, 1 мкл 10 мМ MgCl2 и 1 мкл 500 мМ Tris рН 7,4. Добавляли один мкл соответствующего ДНКзима (hgd40, скремблированные ДНКзимы 1-6 со скремблированными связывающими областями, но интактной каталитической последовательностью, специфические к фактору транскрипции Tbet ДНКзимы 1-3) или воду (отрицательный контроль), и смесь инкубировали при 37°C. Если не указано иное, ДНКзимы вносили при концентрации 10 мкМ, а стандартное время инкубации составляло 60 мин. Впоследствии реакционные смеси электрофоретически разделяли с применением агарозных гелей и визуализировали с помощью окрашивания бромидом этидия с применением стандартных методик.
Пациенты и сбор образцов (фигура S3, С - F дополнительного приложения) Субъекты исследования были отобраны на основе документированной истории болезни хронического риносинусита с носовыми полипами (CRSwNP), патологической носовой эндоскопии и КТ-сканирования пазух. Образцы из пазух решетчатой кости были собраны у n равно 16 пациентов (в возрасте 16-72 лет со средним возрастом 44 года, 11 мужчин, 5 женщин, 8 атопиков и 10 астматиков) во время функциональных процедур эндоскопической хирургии пазух (FESS) независимо от данного исследования, в отделении оториноларингологии в университетской больнице Гента, Бельгия, согласно действующим европейским и американским принципам. Все пациенты дали информированное согласие до их участия, и исследование было одобрено местным комитетом по этике. Применение любого перорального или местного лекарственного средства с возможным воздействием на измерения медиаторов было прекращено у всех пациентов по крайней мере за 4 недели до операции.
Получение и обработка фрагментов синоназальной ткани (фигура S3, С и D дополнительного приложения)
Сразу после хирургического удаления назальных полипов у пациентов, фрагменты ткани размером примерно 0,9 мм3 препарировали путем разрезания синоназальных эксплантатов. Фрагменты ткани суспендировали в среде RPMI-1640 и инкубировали либо только с тканевой культуральной средой (ТСМ), либо с 4 мг/мл ДНКзима hgd40 в течение 6 (РНК) и 24 часов (белок). Затем фрагменты ткани и супернатанты замораживали и хранили при -20°С/-80°С до анализа белка и мРНК. Для исследования поглощения ДНКзима hgd40 фрагменты ткани инкубировали только с ТСМ или с 4 мг/мл hgd40, меченого родамином 6G, в присутствии реагента для трансфекции липофекктамина в течение 24 часов. Затем фрагменты ткани заливали, немедленно замораживали и разрезали на 5 мкм срезы. Срезы окрашивали на CD3 маркер в соответствии с рекомендацией производителя. Впоследствии срезы оценивпли с применением конфокальной лазерной сканирующей микроскопии.
Генерация и трансфекция поляризованных Th2-клеток (Фигура S3, А и В дополнительного приложения)
Интактные CD4+ клетки человека выделяли из цельной крови или лейкоцитарной пленки градиентным центрифугированием фиколла и последующим обогащением с применением набора для выделения интактных CD4 Т-клеток (Miltenyi) в соответствии с инструкцией производителя. Выделенные клетки поляризовали до Th2-клеток путем стимуляции анти-CD3 и анти-CD28 в присутствии IL-2 (20 нг/мл), IL-4 (20 нг/мл) и анти-IFNγ (1 мкг/мл) в течение 10 суток, как описано ранее. После поляризации Th2-клетки трансфицирровали либо FAM-меченым человеческим GATA-3 - специфическим ДНКзимом hgd40, либо FAM-меченым скремблированным контрольным ДНКзимом ODNg3 путем электропорации с применением системы Amaxa. Трансфицированные клетки реплицировали и инкубировали в течение 22 часов.
Анализ экспрессии GATA-3 в поляризованных Th2 клетках (Фигура S3A дополнительного приложения)
После периода инкубирования трансфицированные клетки собирали и анализировали на экспрессию белка GATA-3 методом флуоресцентной проточной цитометрии (FACS). Вследствие этого клетки внутриклеточно окрашивали на белок GATA-3 с помощью мышиных анти-GATA антител, меченых Alexa Fluor 647 (Clone L50-823, BD Pharmingen) с применением набора «Буферный окрашивающий набор для фактора транскрипции» (eBioscience) в соответствии с инструкциями производителя. В анализе оценивали положительно трансфицированные клетки, а уровни экспрессии GATA-3 в указанных клетках определяли как средние геометрические уровни. Сравнивали средние геометрические уровни экспрессии белка GATA-3 в трансфицированных клетках, контролируемых как FAM-положительные, между трансфицированными hgd40 и контрольными трансфицированными клетками.
Экспрессия гена GATA-3 во фрагментах синоназальной ткани (Фигура S3E дополнительного приложения)
После инкубирования в течение 6 часов общую РНК экстрагировали с применением набора Aurum Total RNA Mini Kit (Bio-Rad Laboratories), и кДНК синтезировали с помощью набора для синтеза кДНК iScript (Bio-Rad Laboratories). ПЦР-амплификацию в реальном времени проводили в следующих условиях: 95°С в течение 10 минут, а затем 45 циклов по 30 секунд при 95°С, 30 секунд при 60°С и 10 секунд при 72°С и анализ кривой диссоциации от 60°С до 95°С. В качестве эндогенного стандарта для нормализации использовали β-актин (АСТВ), гипоксантинфосфорибозилтрансферазу 1 и фактор удлинения 1.
Определение белка IL-5 (Фигура S3F дополнительного приложения)
После инкубационного периода в течение 24 ч супернатанты собирали, и концентрацию IL-5 измеряли с помощью технологии Luminex хМАР с применением коммерчески доступных наборов Fluorokine MAP Kits (R&D Systems Europe Ltd,) в соответствии с рекомендациями производителя и измерениями на Bio-Plex 200 Platform (Bio-Rad Laboratories). Предел обнаружения составлял 1,5 пг/мл.
Анализ секреции IL-13 (Фигура S3B дополнительного приложения)
Для анализа высвобождения IL-13 трансфицированные клетки стимулировали посредством 1 мкг/мл энтеротоксина В Staphylococcus aureus (SEB) в течение 22 часов. Секрецию IL-13 определяли с помощью анализа FACS с применением набора для определения секреции IL-13 (Miltenyi) в соответствии с инструкцией производителя. В анализе оценивали положительно трансфицированные клетки, а уровни экспрессии IL-13 в указанных клетках определяли как средние геометрические уровни (GeoMean). Сравнивали средние геометрические уровни экспрессии белка IL13 в трансфицированных клетках, определяемых как FAM-положительные, в hgd40 трансфицированных и контрольных трансфицированных клетках.
Конечные критерии оценки безопасности
Оценивали следующие клинические химические параметры: креатинин, щелочную фосфатазу, общий билирубин, аланинаминотрансферазу, аспартатаминотрансферазу, гамма-глутамилтранспептидазу, общий белок, мочевую кислоту, мочевину, натрий, калий, кальций, хлорид, глюкозу (на голодный желудок), лактатдегидрогеназу и креатинфосфокиназу. Гематологические параметры: гемоглобин, гематокрит, средний объем эритроцитов, средний эритроцитарный гемоглобин, средняя концентрация эритроцитарного гемоглобина, количество эритроцитов, количество лейкоцитов с дифференцированным подсчетом (нейтрофилы, эозинофилы, базофилы, лимфоциты, моноциты) и количество тромбоцитов, активированное частичное тромбопластиновое время, протромбиновое время, международное нормализованное отношение (MHO), фибриноген. Оценивали следующие параметры мочи: лейкоциты, нитрит, рН, белок, глюкозу, кетон, уробилиноген, билирубин, кровь (гемоглобин и эритроциты). Регистрировали следующие параметры ЭКГ: ЭКГ в 12 отведениях регистрировали после 5-минутного отдыха в положении лежа на спине, с применением отведений по Эйнтховену и Голдбергеру, а также 6 прекардиальных отведений по Уилсону.
Статистический анализ
Статистический анализ проводили с применением программного обеспечения SAS (версия 9.3) от FGK Clinical Research GmbH (Мюнхен, Германия). Фигуру S2 подготовили с применением программного обеспечения GraphPad Prism (версия 5.0).
Обсуждение фигуры S1:
После воздействия аллергена дендритные клетки дыхательных путей направляют аллерген к Th0-клеткам, которые дифференцируются в Th2-клетки под влиянием эпителиальных цитокинов, таких как TSLP, IL-25 и IL-33 и исходный IL-4 (например, продуцируемые врожденными лимфоцитами типа 2 [ILC2]). GATA-3 представляет собой основной фактор транскрипции для дифференциации и активации Th2 и является незаменимым для продуцирования Th2 цитокинов, например IL-4, IL-5, IL-13. При высвобождении указанных цитокинов Th2-клетки вовлекают несколько эффекторных механизмов, таких как продуцирование IgE В-клетками с последующим связыванием с тучными клетками, рекрутинг и активация эозинофилов и развитие гиперплазии бокаловидных клеток. Медиаторы, высвобождаемые указанными эффекторными клетками, дополнительно способствуют воспалению, приводят к сокращению гладкой мускулатуры и образованию слизи с последующим сужением дыхательных путей и пропотеванием жидкости через сосуды. SB010 в значительной степени вмешивается в восходящие стадии этого процесса путем специфического расщепления матричной РНК для GATA-3 в Th2-клетках. В результате образуется меньше белка GATA-3, который затем не может в достаточной степени трансактивировать транскрипцию Th2 цитокинов с последующим ингибированием всех нисходящих процессов. Аналогично указанному действию в Th2-клетках, SB010 также может подавлять продукцию GATA-3 в других клетках, экспрессирующих GATA-3, таких как ILC2, тучные клетки и эозинофилы, с нисходящим ингибированием высвобождения цитокинов типа 2, а также продуцированием эффекторных молекул в тучных клетках и эозинофилах. На фигуре S1 также показана биологическая активность hgd40 - активного соединения SB010. Имеются ясные доказательства прямых и специфических эффектов hgd40, GATA-3-активного ДНКзима в SB010, на экспрессию GATA-3 и нисходящие биологические эффекты. Ряд экспериментов in vitro и in situ ясно демонстрирует механизм действия SB010, результаты которого включены на фигуры S2 и S3 (технические подробности см. в дополнительном приложении). Первоначально специфическая активность hgd40, GATA-3-активного ДНКзима в SB010, была продемонстрирована с применением анализа расщепления (дополнительная фигура S2), представляющего собой высокоспецифический способ in vitro для определения каталитической активности 10-23 ДНКзимов. Для этого in vitro транскрибируемую копию РНК (кРНК) - в данном случае кДНК GATA-3 человека - инкубируют с ДНКзимом. В течение указанной инкубации активные ДНКзимы каталитически расщепляют кРНК-мишень на два продукта расщепления, которые можно продемонстрировать с помощью электрофореза в агарозном геле. На основе серии анализов расщепления определено, что hgd40, который является активным компонентом в SB010, является самым активным ДНКзимом в отношении активности расщепления кРНК GATA-3. Было показано, что hgd40 расщепляет кРНК GATA-3 с зависимостью от дозы и времени (фигуры S2A и S2B). Расщепление является высокоспецифическим по отношению к последовательности, о чем свидетельствует анализ эффективности ДНКзимов, не специфических к GATA-3, на кРНК GATA-3 (фигура S2C). Было также продемонстрировано, что hgd40 специфически расщепляет одноцепочечную РНК даже при низких концентрациях (0,5 мкМ hgd40) и не расщепляет двухцепочечную ДНК, даже при невысоких концентрациях (20 мкМ hgd40). Более того, нежелательные нецелевые эффекты, такие как активация врожденных иммунных клеток или клеток, связанных с аллергическими эффекторными механизмами, ранее исключали (Dicke Т et al. Nucleic Acid Therapeutics 2012; 22(2):117-26). Впоследствии авторы продемонстрировали биологическую активность указанной молекулы в клетке человека и тканевом материале (дополнительная фигура S3). Трансфекция поляризованных CD4+ Th2-клеток человека посредством hgd40 значительно подавляла экспрессию белка GATA-3 и последующую продукцию IL-13 по сравнению с клетками, трансфицированными скремблированным контрольным ДНКзимом ODNg3 (фигуры S3A, S3B). Затем эксплантаты назальной ткани, полученные у атопических астматиков, инкубировали с ДНКзимом hgd40. Как показано на фигурах 3С и 3D, hgd40 поглощался CD3+ и CD3- клетками эксплантата и значительно снижал уровни мРНК GATA-3 в течение 6 часов (фигура S3E), что сопровождалось значительным снижением продуцирования IL-5 в течение 24 часов (фигура S3F).
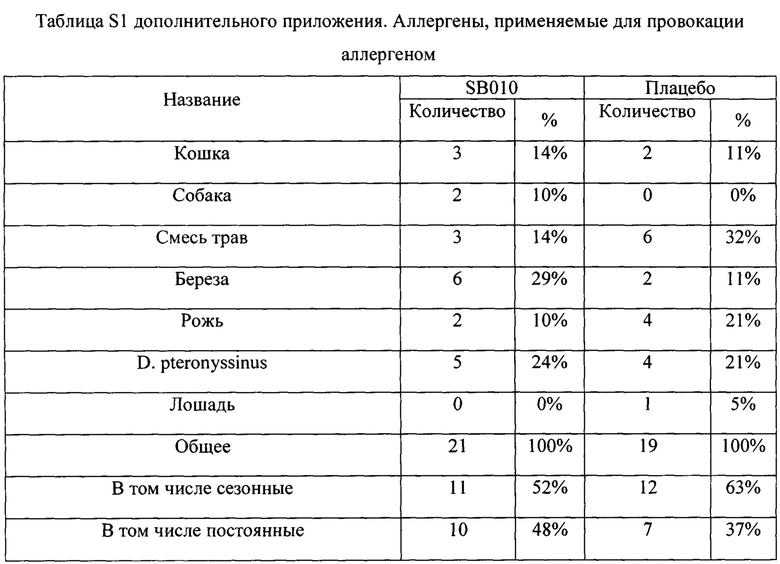
Аллергены были предоставлены  Arzneimittel GmbH, Германия, или Allergopharma Joachim Ganzer KG, Германия, в случае Alternaria tenuis.
Arzneimittel GmbH, Германия, или Allergopharma Joachim Ganzer KG, Германия, в случае Alternaria tenuis.
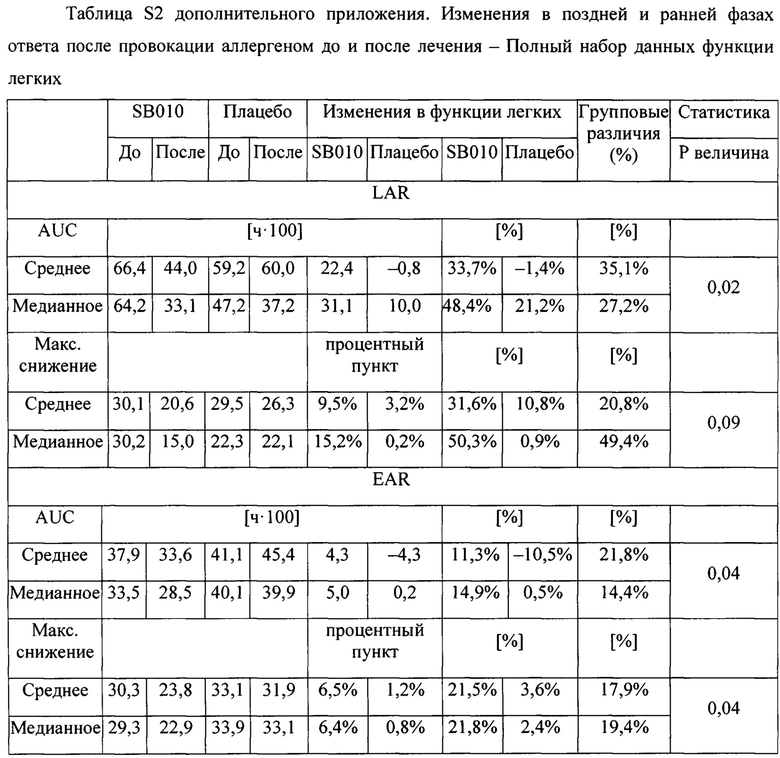
Подпись к таблице S2: Изменения в поздней и ранней фазах ответа после провокации аллергеном до и после лечения - Полный набор данных функции легких
Провокации аллергеном проводили до и после 28 суток лечения SB010 или плацебо. Представлены средние значения для площади под кривой (AUC) для позднего астматического ответа (LAR) и раннего астматического ответа (EAR). Уменьшение значений AUC до и после лечения отражает улучшение функции легких. Приведены значения AUC до и после лечения, а затем изменения функции легких для групп SB010 и плацебо, соответственно. Данные изменения представлены как значения AUC до-после и как процентное изменение между значениями до и после лечения. Положительные значения отражают улучшение функции легких, отрицательные значения соответствуют большей площади под кривой при провокации после лечения по сравнению с провокацией до лечения. Групповое различие показывает дельту относительных изменений между группой лечения SB010 и плацебо. Р величины для AUC при LAR и максимального снижения ОФВ1 при LAR и EAR рассчитаны по модели ANCOVA; Р величина для AUC при EAR рассчитана по критерию суммы рангов Уилкоксона.
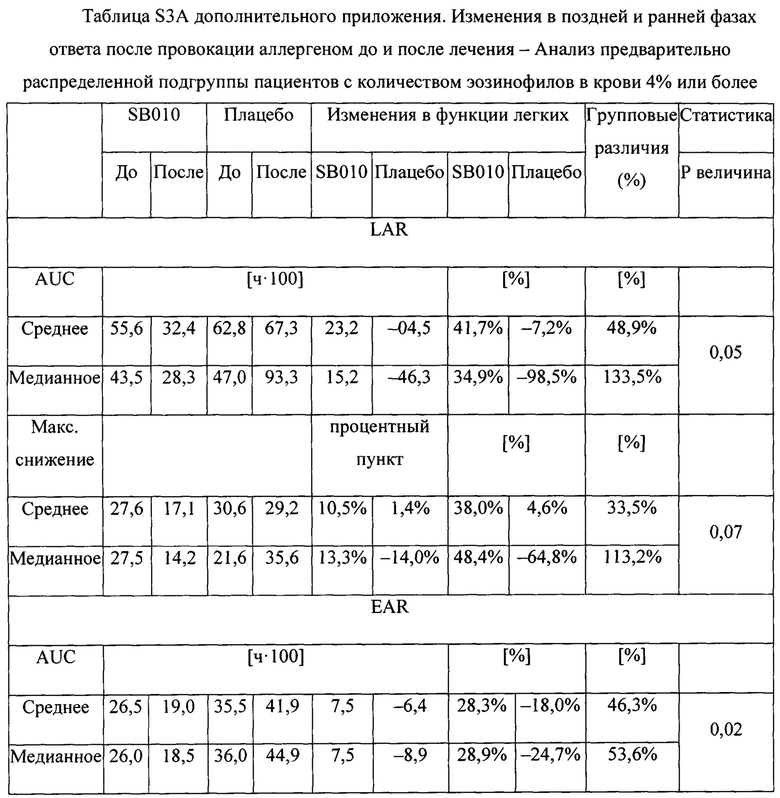
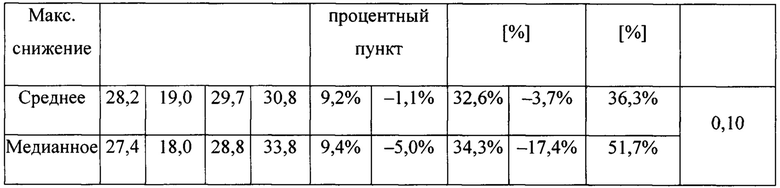
Подпись к таблице S3 А: Изменения в поздней и ранней фазах ответа после провокации аллергеном до и после лечения - Анализ предварительно распределенной подгруппы пациентов с количеством эозинофилов в крови 4% или более
Провокации аллергеном проводили до и после 28 суток лечения SB010 или плацебо. Представлены средние значения для площади под кривой (AUC) для позднего астматического ответа (LAR) и раннего астматического ответа (EAR). Уменьшение значений AUC до и после лечения отражает улучшение функции легких. Приведены значения AUC до и после лечения, а затем изменения функции легких для групп SB010 и плацебо, соответственно. Данные изменения представлены как значения AUC до-после и как процентное изменение между значениями до и после лечения. Положительные значения отражают улучшение функции легких, отрицательные значения соответствуют большей площади под кривой при провокации после лечения по сравнению с провокацией до лечения. Групповое различие показывает разницу относительных изменений между группами лечения SB010 и плацебо. Р величина для AUC при LAR рассчитана по модели ANCOVA; Р величины для AUC при EAR и максимального снижения ОФВ1 при LAR и EAR рассчитаны по критерию суммы рангов Уилкоксона.

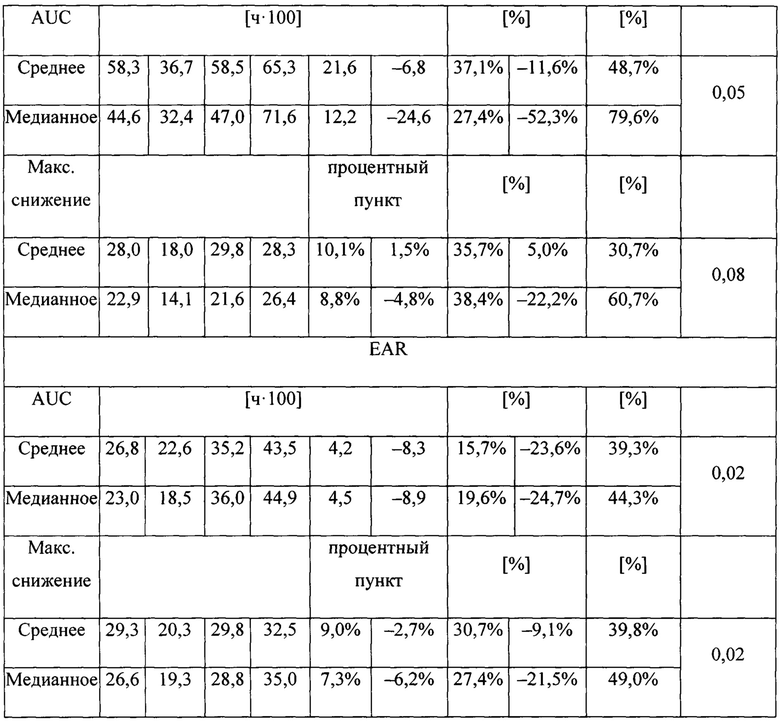
Подпись к таблице S3B: Изменения в поздней и ранней фазах ответа после провокации аллергеном до и после лечения - Анализ предварительно распределенной подгруппы пациентов с FeNO, равным 40 млрд-1 или более
Провокации аллергеном проводили до и после 28 суток лечения SB010 или плацебо. Представлены средние значения для площади под кривой (AUC) для позднего астматического ответа (LAR) и раннего астматического ответа (EAR). Уменьшение значений AUC до и после лечения отражает улучшение функции легких. Приведены значения AUC до и после лечения, а затем изменения функции легких для групп SB010 и плацебо, соответственно. Данные изменения представлены как значения AUC до-после и как процентное изменение между значениями до и после лечения. Положительные значения отражают улучшение функции легких, отрицательные значения соответствуют большей площади под кривой при провокации после лечения по сравнению с провокацией до лечения. Групповое различие показывает разницу относительных изменений между группами лечения SB010 и плацебо. Р величина для AUC при LAR и максимального снижения ОФВ1 при LAR и EAR рассчитаны по модели ANCOVA; Р величина для AUC при EAR рассчитана по критерию суммы рангов Уилкоксона.
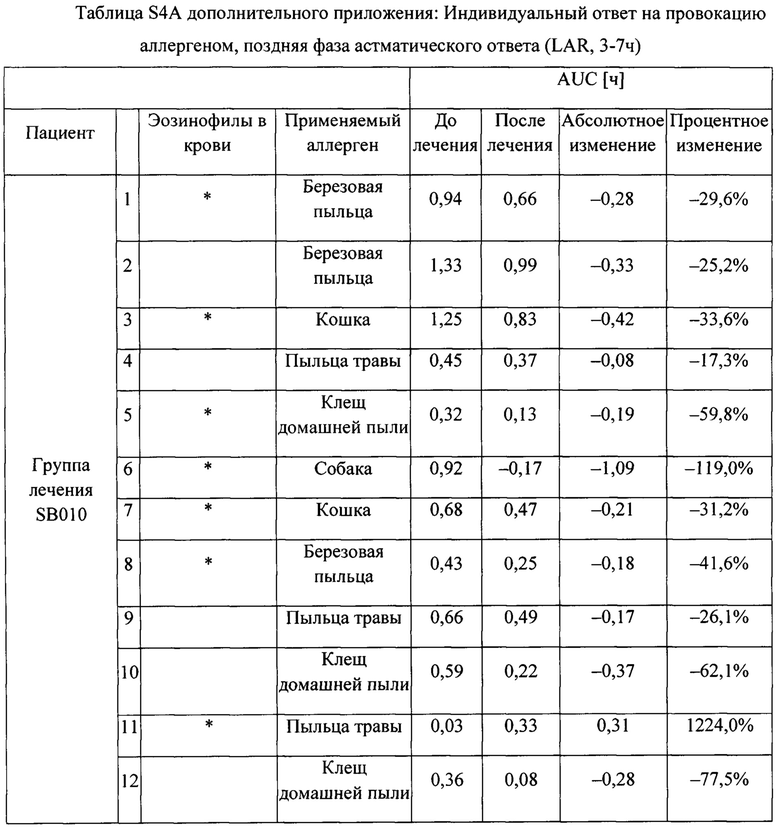
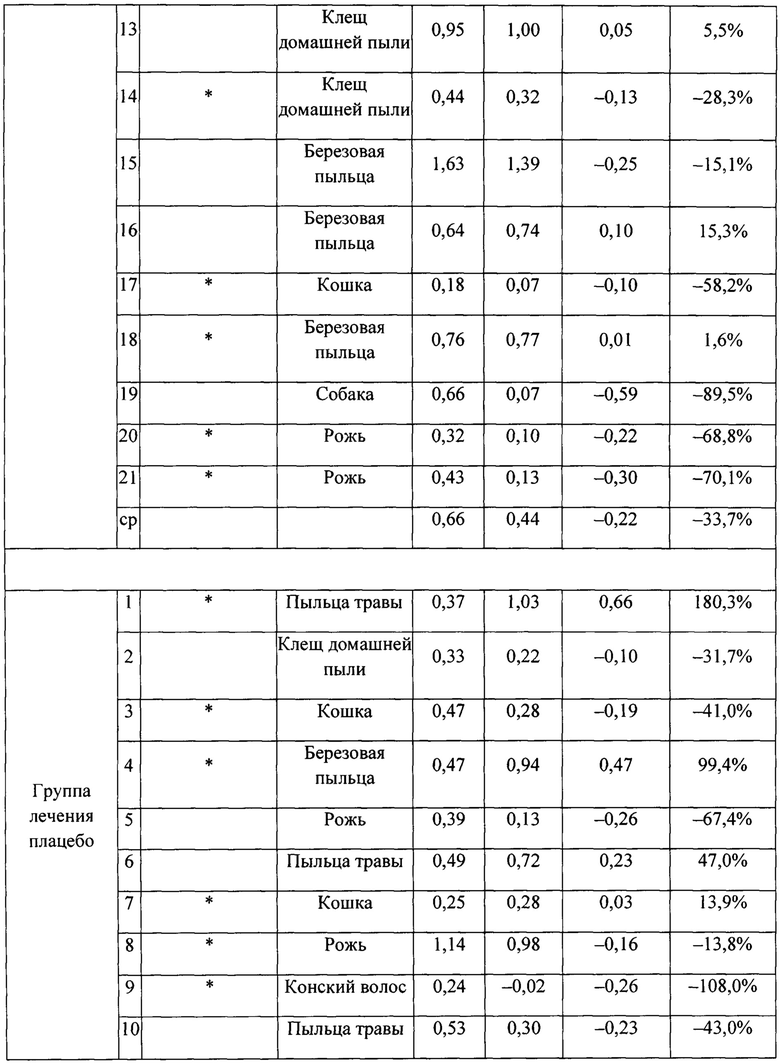
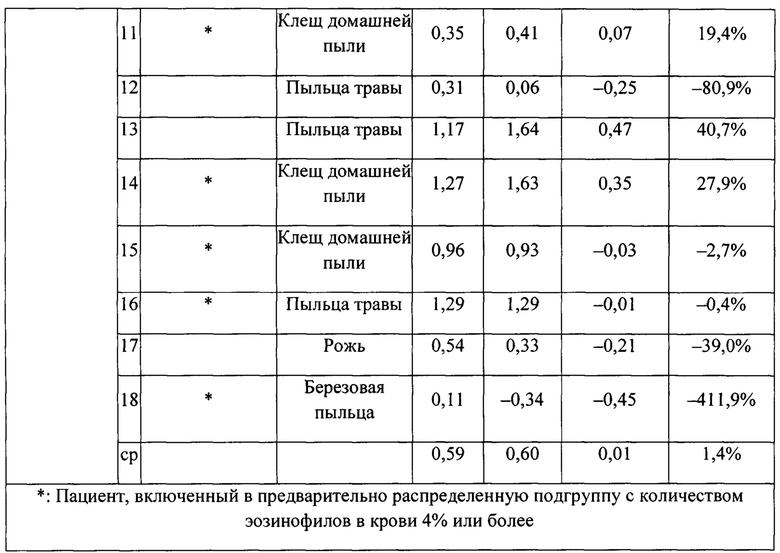
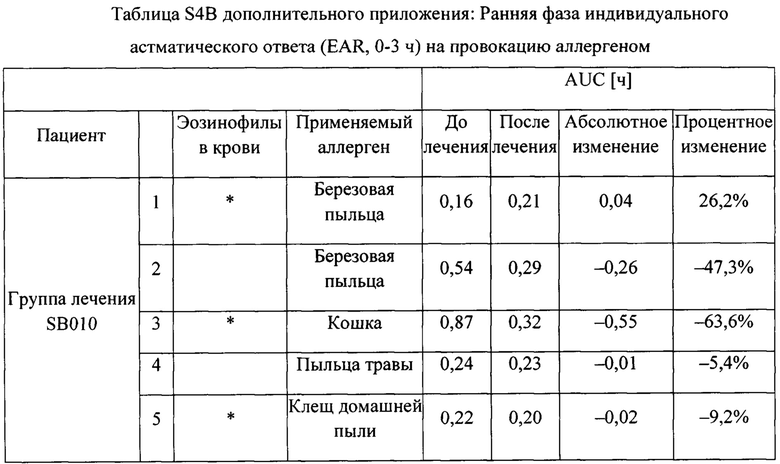
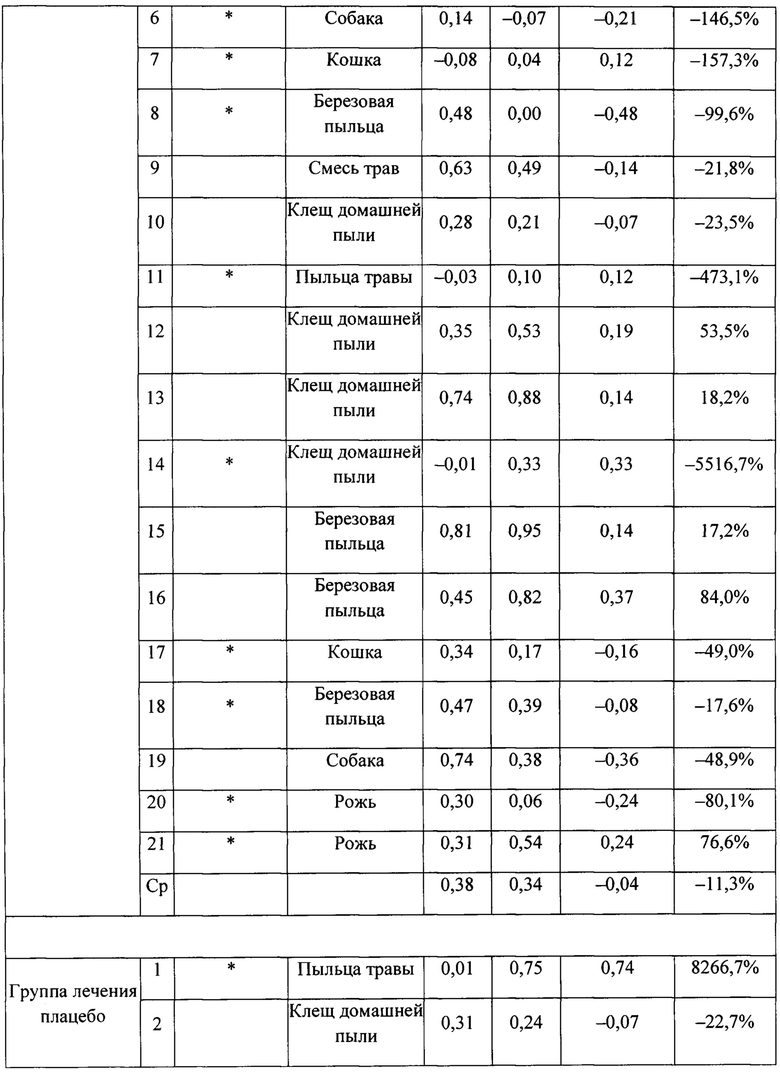
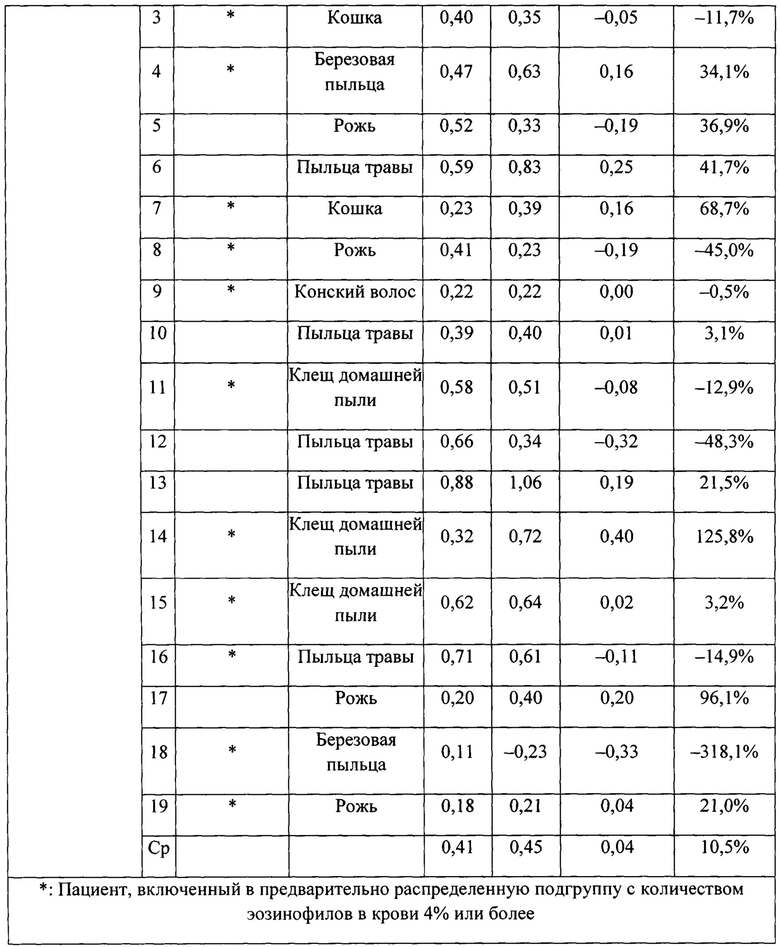

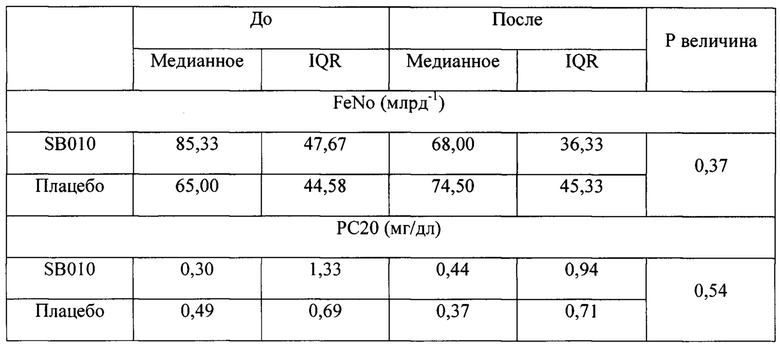
Подпись к таблице S5: Действие 28 суток лечения SB010 или плацебо на уровни FeNO и РС20 после провокации
Действие 28 суток лечения SB010 или плацебо на уровни FeNO и РС20. Определение уровней FeNO и оценку гиперчувствительности дыхательных путей (РС20) проводили после провокации аллергеном до и после 28-суточного курса лечения SB010 или плацебо. Уровни FeNO выражены в млрд-1, РС20 выражены в мг метахолина/дл. Р величина рассчитана с помощью критерия суммы рангов Уилкоксона.
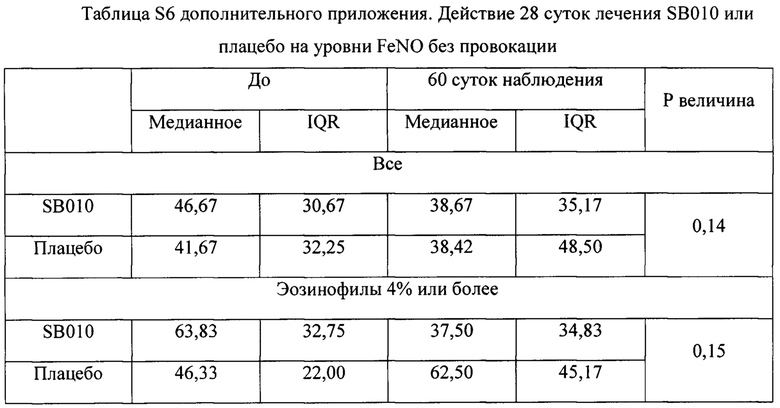
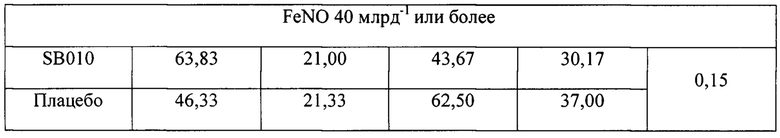
Подпись к таблице S6: Действие 28 суток лечения SB010 или плацебо на уровни FeNO без провокации
FeNO определяли при исходном состоянии перед провокацией аллергеном и перед лечением, после чего измерения производили на 88 сутки по окончанию 60-суточного периода наблюдения. Представлены медианные значения и межквартильные диапазоны (IQR) для ITT-популяции, а также для предварительно распределенных подгрупп с количеством эозинофилов в крови, составляющим 4% или более, и исходным FeNO, составляющим 40 млрд-1 или более. Р величины рассчитаны с помощью критерия суммы рангов Уилкоксона.
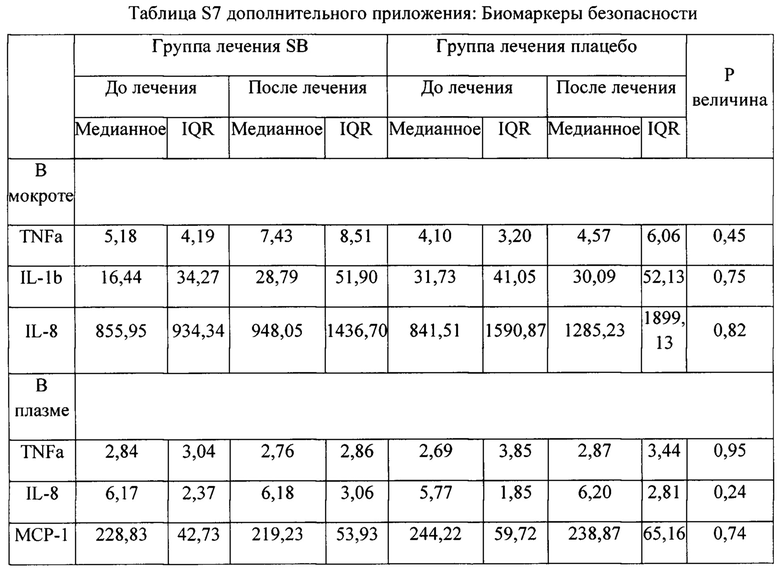
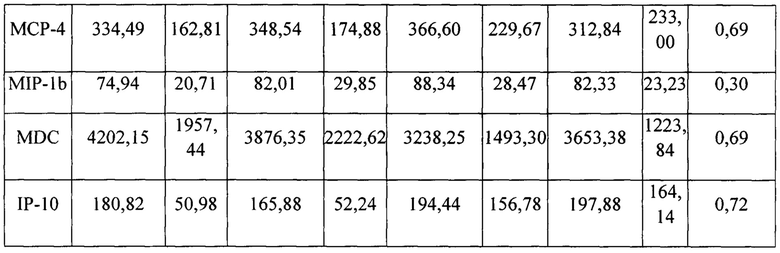
IL-4, IL-13 и IFN-γ в крови: большинство значений является ниже нижнего предела количественной оценки; IL-5 - см. фигуру S6 дополнительного приложения.
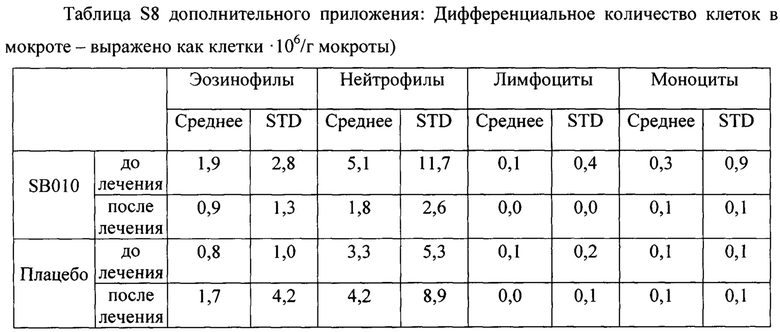
В таблице представлены средние значения плюс стандартное отклонение / после провокации аллергеном до и после лечения, соответственно.

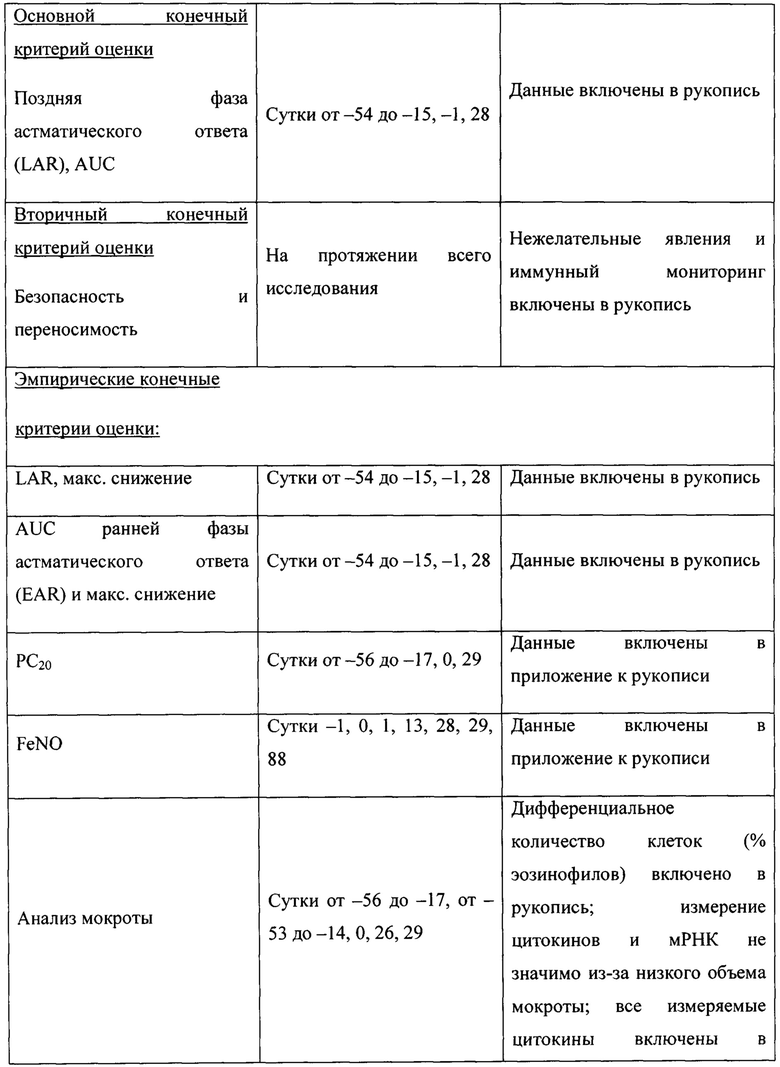
Ссылочные материалы
1. Global Strategy for Asthma Management and Prevention. From the Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA) 2014. www.ginathma.org; http://www.ginasthma.org/local/uploads/files/GINA_Report_2014.pdf
2. Bhakta NR, Woodruff PG. Human asthma phenotypes: from the clinic, to cytokines, and back again. Immunol Rev 201l; 242(1):220-232.
3. Woodruff PG, Modrek B, Choy DF et al. T-helper type 2-driven inflammation defines major subphenotypes of asthma. Am J Respir Crit Care Med 2009; 180(5):388-395.
4. Holgate ST. Innate and adaptive immune responses in asthma. Nat Med 2012; 18(5):673-683.
5. Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012; 18(5):716-725.
6. Ray A, Cohn L. Th2 cells and GATA-3 in asthma: new insights into the regulation of airway inflammation. J Clin Invest 1999; 104(8):985-993.
7. Bergqvist A, Andersson CK, Hoffmann HJ et al. Marked epithelial cell pathology and leukocyte paucity in persistently symptomatic severe asthma. Am J Respir Crit Care Med 2013; 188(12):1475-1477.
8. Holgate ST. Trials and tribulations in identifying new biologic treatments for asthma. Trends Immunol 2012; 33(5):238-246.
9. Cho EA, Moloney FJ, Cai H et al. Safety and tolerability of an intratumorally injected DNAzyme, Dz13, in patients with nodular basal-cell carcinoma: a phase first-in-human trial (DISCOVER). Lancet 2013; 381(9880):1835-1843.
10. Santiago FS, Khachigian LM. Nucleic acid based strategies as potential therapeutic tools: mechanistic considerations and implications to restenosis. J Mol Med (Berl) 2001; 79(12):695-706.
11. Sel S, Wegmann M, Dicke T et al. Effective preventionand therapy of experimental allergic asthma using a GATA-3-specific DNAzyme. J Allergy Clin Immunol 2008; 121 (4):910-916.
12. Turowska A, Librizzi D, Baumgartl N et al. Biodistribution of the GATA-3-specific DNAzyme hgd40 after inhalative exposure in mice, rats and dogs. Toxicol Appl Pharmacol 2013; 272(2):365-372.
13. Dicke T, Pali-Scholl I, Kaufmann A, Bauer S, Renz H, Garn H. Absence of unspecific innate immune cell activation by GATA-3-specific DNAzymes. Nucleic Acid Ther 2012; 22(2):117-126.
14. Fuhst R, Runge F, Buschmann J et al. Toxicity profile of the GATA-3-specific DNAzyme hgd40 after inhalation exposure. Pulm Pharmacol Ther 2013; 26(2):281-289.
15. Global Initiative for Asthma (GINA): Global strategy for asthma management and prevention. 2008. www.ginasthma.org. Eur Respir J 2008; 31:143-178.
16. Brand P, Beckmann H, Maas EM et al. Peripheral deposition of alpha 1-protease inhibitor using commercial inhalation devices. Eur Respir J 2003; 22(2):263-267.
17. Cockcroft DW, Murdock KY, Kirby J, Hargreave F. Prediction of airway responsiveness to allergen from skin sensitivity to allergen and airway responsiveness to histamine. Am Rev Respir Dis 1987; 135(1):264-267.
18. Diamant Z, Gauvreau GM, Cockcroft DW et al. Inhaled allergen bronchoprovocation tests. J Allergy Clin Immunol 2013; 132(5):1045-1055.
19. Gauvreau GM, Watson RM, Rerecich TJ, Baswick E, Inman MD, O'Byrne PM. Repeatability of allergen-induced airway inflammation. J Allergy Clin Immunol 1999; 104(1):66-71.
20. Miller MR, Hankinson J, Brusasco V et al. Standardisation of spirometry. Eur Respir J 2005; 26(2):319-338.
21. Crapo RO, Casaburi R, Coates AL et al. Guidelines for methacholine and exercise challenge testing-1999. This official statement of the American Thoracic Society was adopted by the ATS Board of Directors, July 1999. Am J Respir Crit Care Med 2000; 161(1):309-329.
22. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. Am J Respir Crit Care Med 2005; 171(8):912-930.
23. Janssen O, Schaumann F, Holz О et al. Low-dose endotoxin inhalation in healthy volunteers-a challenge model for early clinical drug development. BMC Pulm Med 2013; 13:19.
24. O'Byrne PM. Allergen-induced airway inflammation and its therapeutic intervention. Allergy Asthma Immunol Res 2009; 1(1):3-9.
25. Wenzel S, Wilbraham D, Fuller R, Getz EB, Longphre M. Effect of an interleukin-4 variant on late phase asthmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies. Lancet 2007; 370(9596):1422-1431.
26. Wenzel S, Ford L, Pearlman D et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med 2013; 368(26):2455-2466.
27. Corren J, Busse W, Meltzer EO et al. A randomized, controlled, phase 2 study of AMG 317, an IL-4Ralpha antagonist, in patients with asthma. Am J Respir Crit Care Med 2010; 181(8):788-796.
28. Haldar P, Brightling CE, Hargadon В et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009; 360(10):973-984.
29. Nair P, Pizzichini MM, Kjarsgaard M et al. Mepolizumab for prednisone 113 dependent asthma with sputum eosinophilia. N Engl J Med 2009; 360(10):985-993.
30. Pavord ID, Korn S, Howarth P et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet 2012; 380(9842):651-659.
31. Corren J, Lemanske RF, Hanania NA et al. Lebrikizumab treatment in adults with asthma. N Engl J Med 2011; 365(12):1088-1098.
32. Ingram JL, Kraft M. IL-13 in asthma and allergic disease: asthma phenotypes and targeted therapies. J Allergy Clin Immunol 2012; 130(4):829-842.
33. Gauvreau GM, O'Byrne PM, Boulet LP et al. Effects of an Anti-TSLP Antibody on Allergen-Induced Asthmatic Responses. N Engl J Med 2014.
34. Petsky HL, Cates CJ, Lasserson TJ et al. A systematic review and meta-analysis: tailoring asthma treatment on eosinophilic markers (exhaled nitric oxide or sputum eosinophils). Thorax 2012; 67(3):199-208.
35. Vijverberg SJ, Hilvering B, Raaijmakers JA, Lammers JW, Maitland-van der Zee AH, Koenderman L. Clinical utility of asthma biomarkers: from bench to bedside. Biologies 2013; 7:199-210.
36. Wenzel S. Severe asthma: from characteristics to phenotypes to endotypes. Clin Exp Allergy 2012; 42(5):650-658.
37. Brusselle GG, Maes T, Bracke KR. Eosinophils in the spotlight: Eosinophilic airway inflammation in nonallergic asthma. Nat Med 2013; 19(8):977-979.
38. Fahy JV, Fleming HE, Wong HH et al. The effect of an anti-IgE monoclonal antibody on the early- and late-phase responses to allergen inhalation in asthmatic subjects. Am J Respir Crit Care Med 1997; 155(6): 1828-1834.
39. Winandy S, Brown M. No DL1 Notch ligand? GATA be a mast-cell. Nat Immunol 2007; 8(8):796-798.
40. Mjosberg J, Bernink J, Golebski K et al. The transcription factor GATA3 is essential for the function of human type 2 innate lymphoid cells. Immunity 2012; 37(4):649-659.
41. Sadat MA, Kumatori A, Suzuki S, Yamaguchi Y, Tsuji Y, Nakamura M. GATA-3 represses gp91phox gene expression in eosinophil-committed HL-60-C15 cells. FEBS Lett 1998; 436(3):390-394.
42. Gauvreau GM, Boulet LP, Postma DS et al. Effect of low-dose ciclesonide on allergen-induced responses in subjects with mild allergic asthma. J Allergy Clin Immunol 2005; 116(2):285-291.
43. Kent SE, Boyce M, Diamant Z et al. The 5-lipoxygenase-activating protein inhibitor, GSK2190915, attenuates the early and late responses to inhaled allergen in mild asthma. Clin Exp Allergy 2013; 43(2):177-186.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2011 |
|
RU2578468C2 |
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ ТН2 | 2011 |
|
RU2737245C2 |
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2020 |
|
RU2832013C2 |
| СПОСОБ ДИАГНОСТИКИ МОЛЕКУЛЯРНОГО ФЕНОТИПА ПАЦИЕНТА, СТРАДАЮЩЕГО ЗАБОЛЕВАНИЕМ, СОПРОВОЖДАЮЩИМСЯ ХРОНИЧЕСКИМИ ВОСПАЛЕНИЯМИ | 2013 |
|
RU2672595C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2020 |
|
RU2832774C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ АСТМЫ | 2009 |
|
RU2607569C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2013 |
|
RU2690675C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2018 |
|
RU2793745C2 |
| Способ лечения аллергической бронхиальной астмы, основанный на подавлении экспрессии генов цитокинов IL-4 и IL-13 с использованием молекул миРНК | 2016 |
|
RU2615463C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО СИНУСИТА С ПОЛИПАМИ НОСА ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2734490C2 |
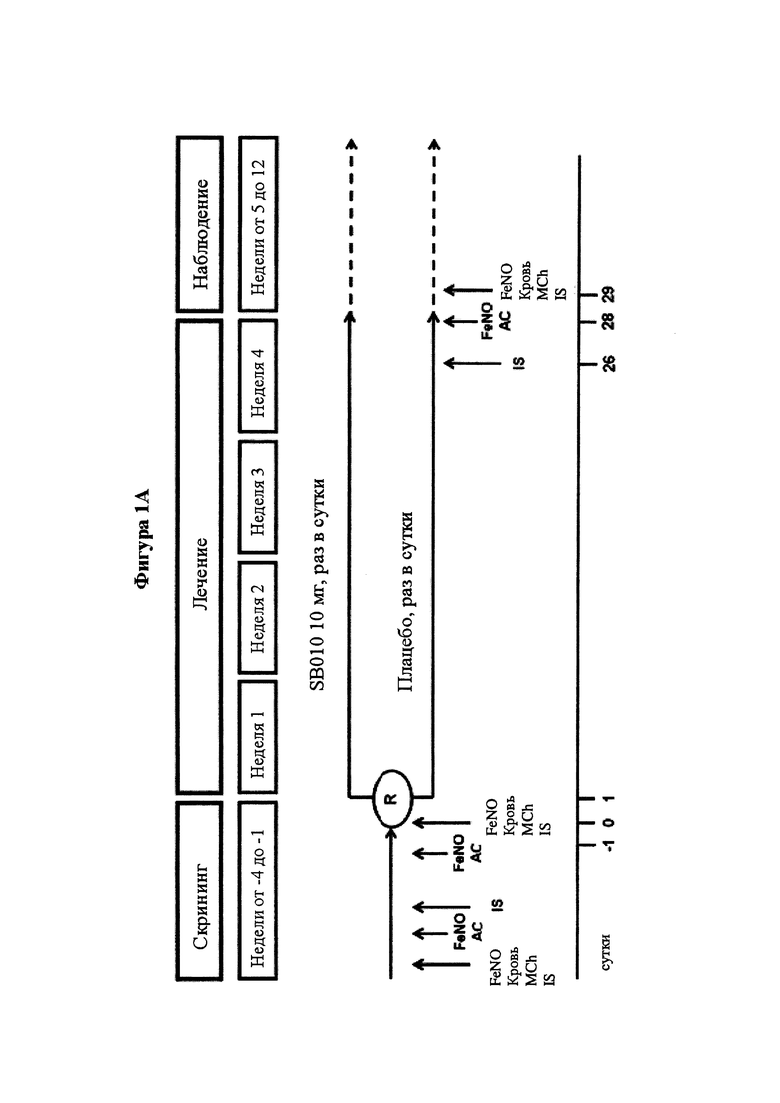
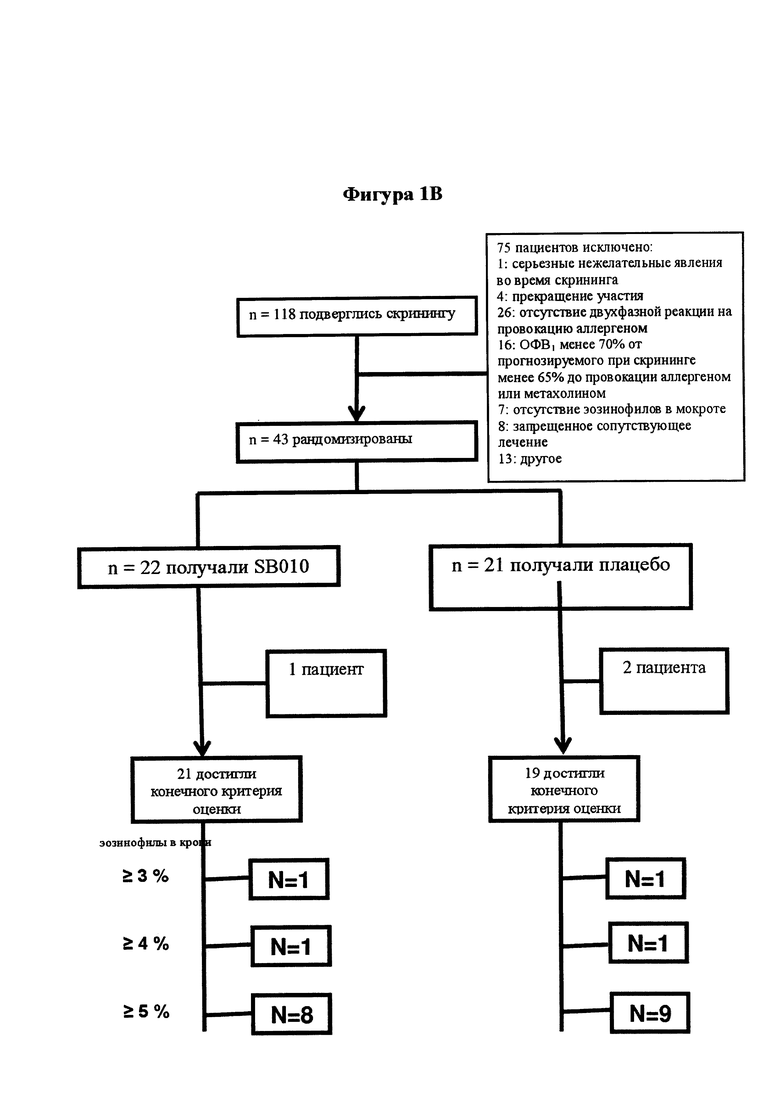
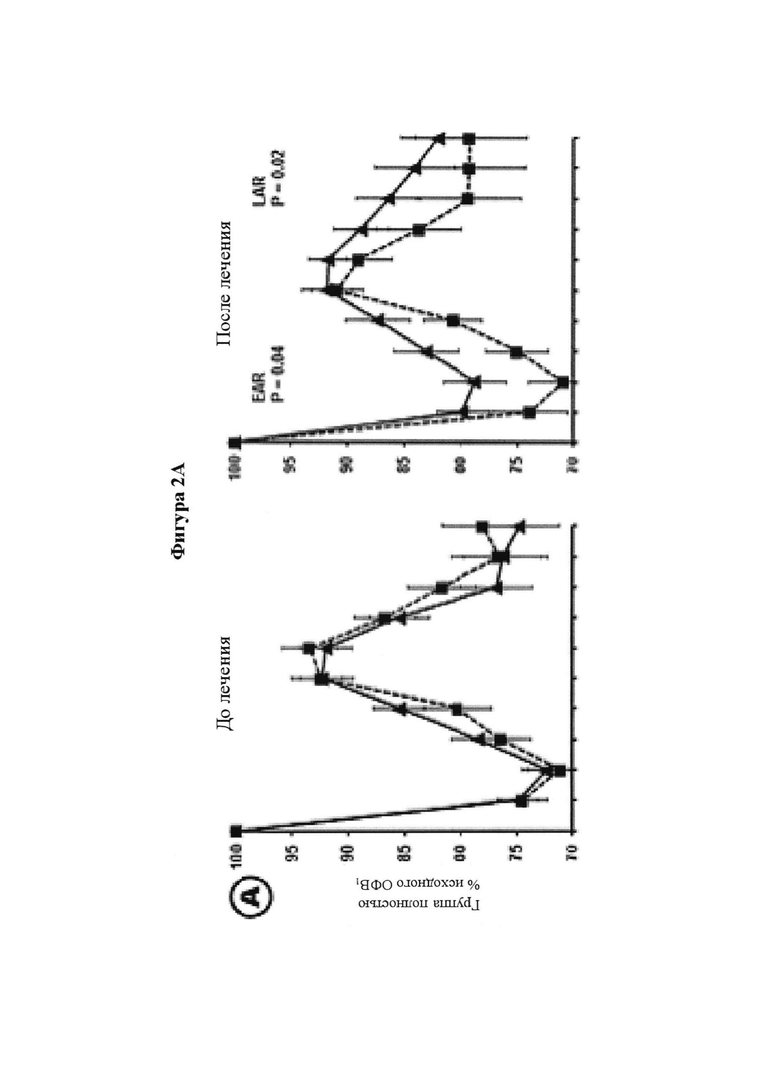
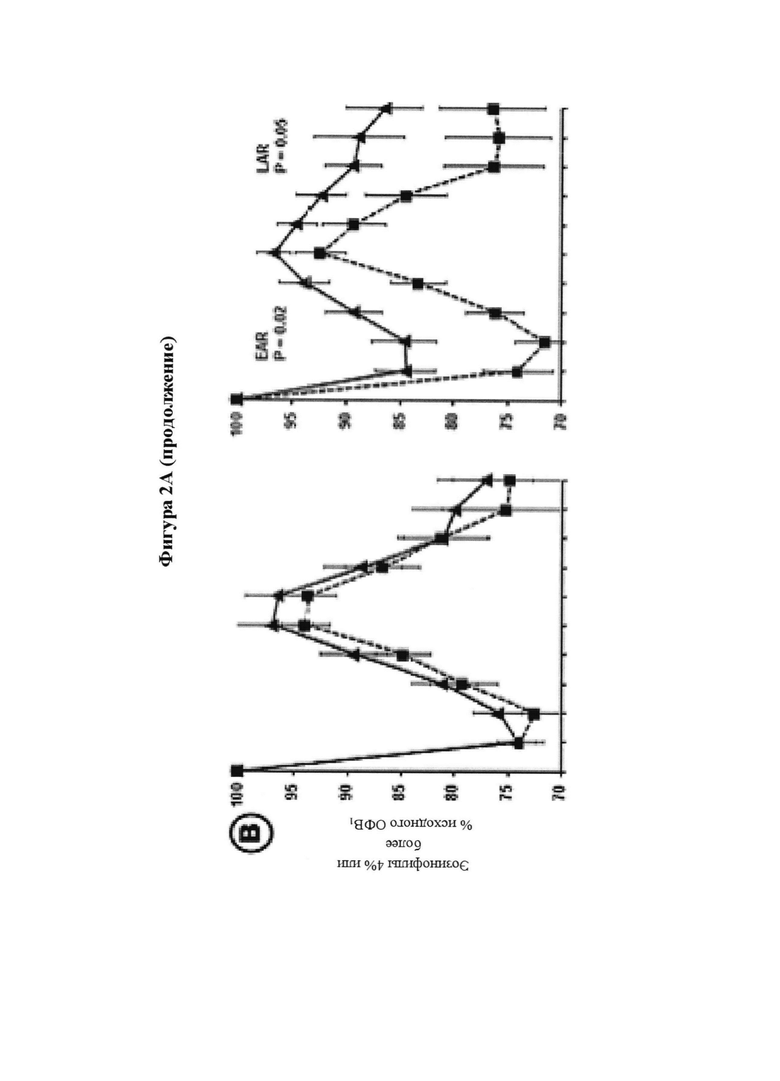
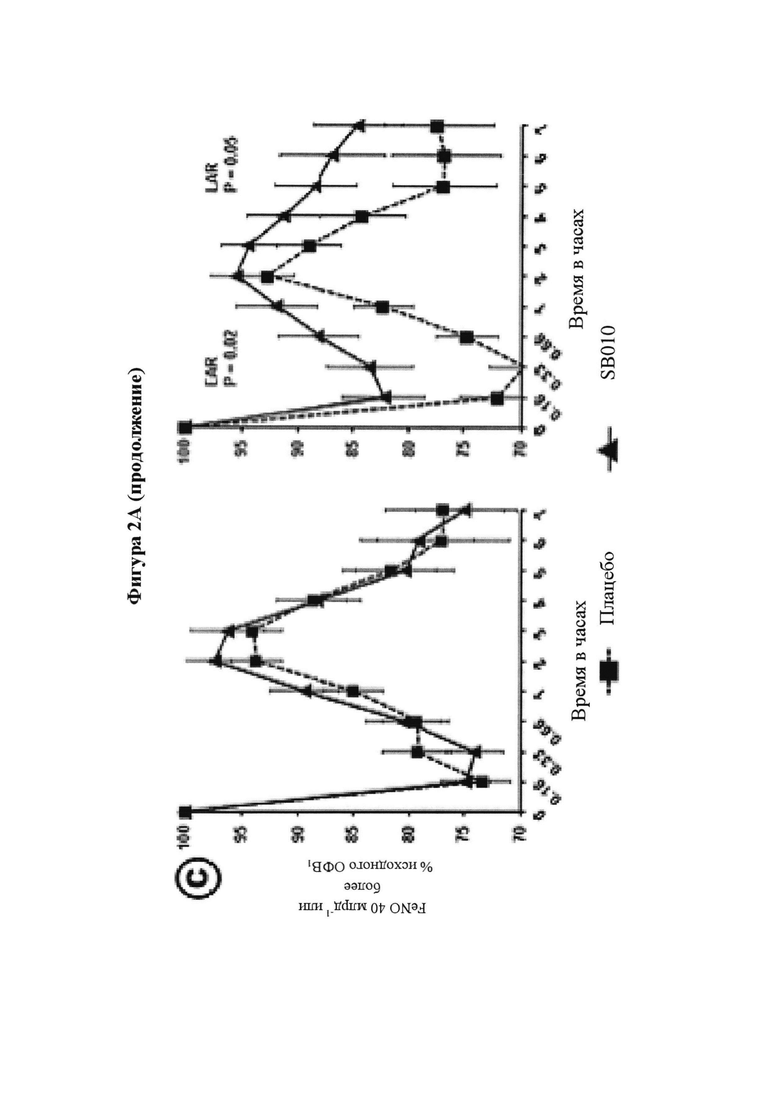
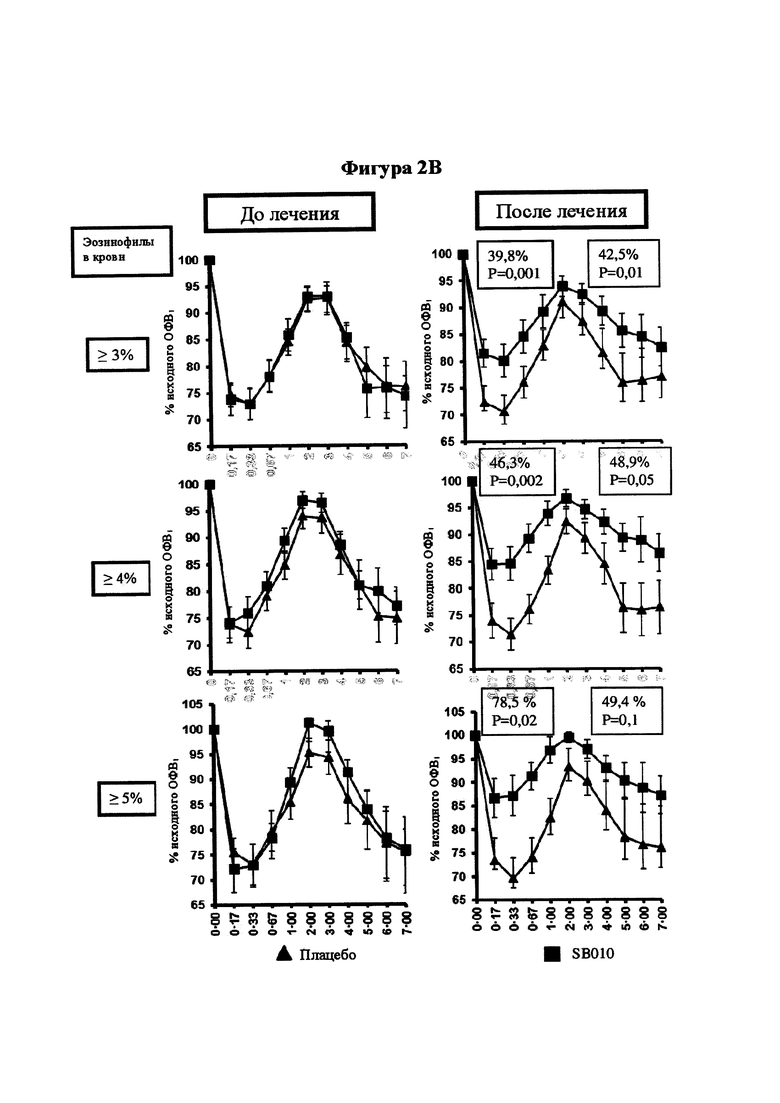
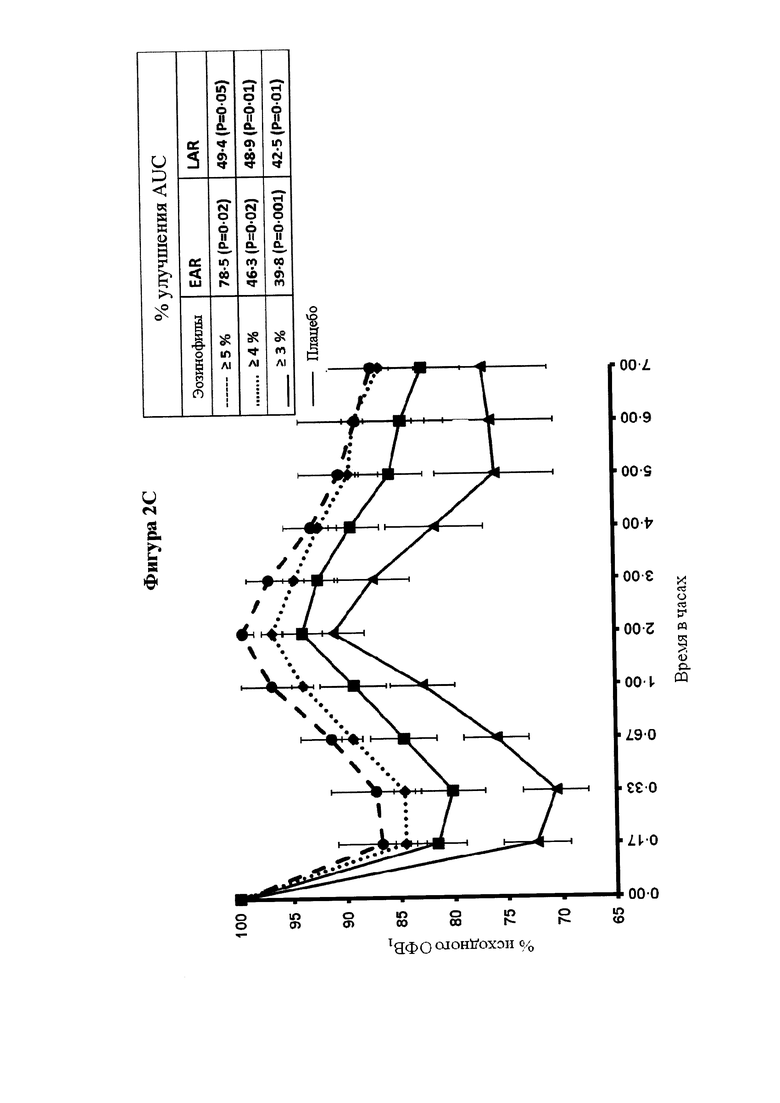
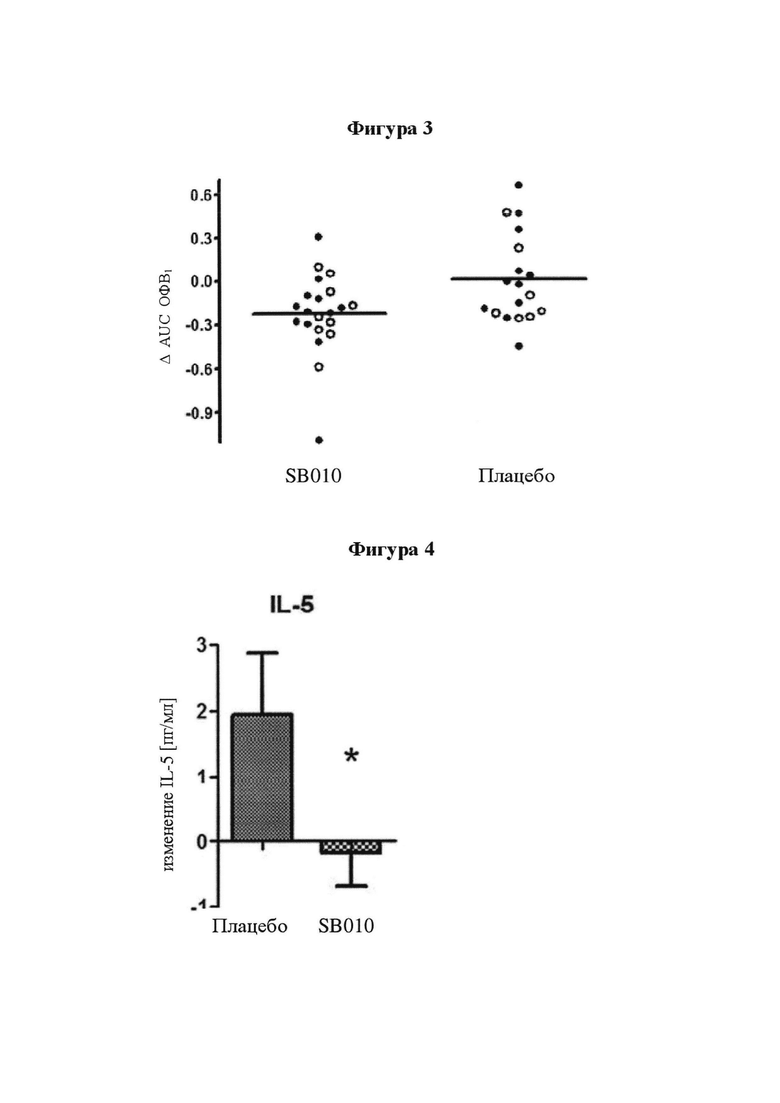
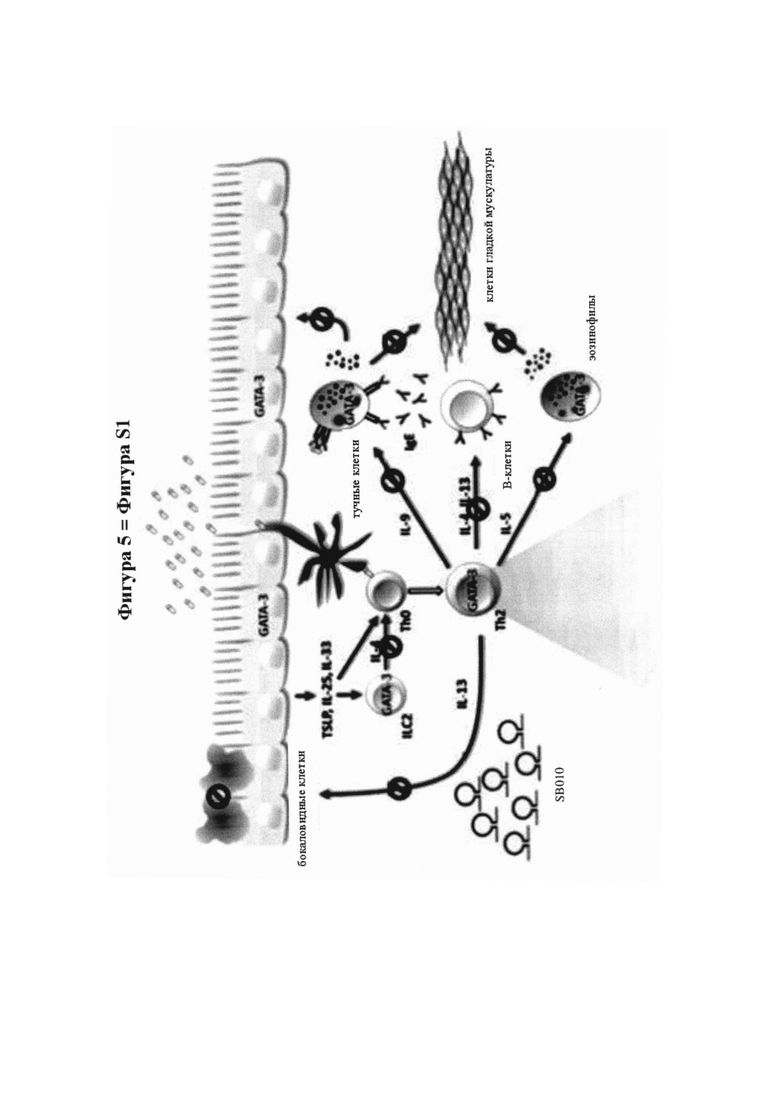
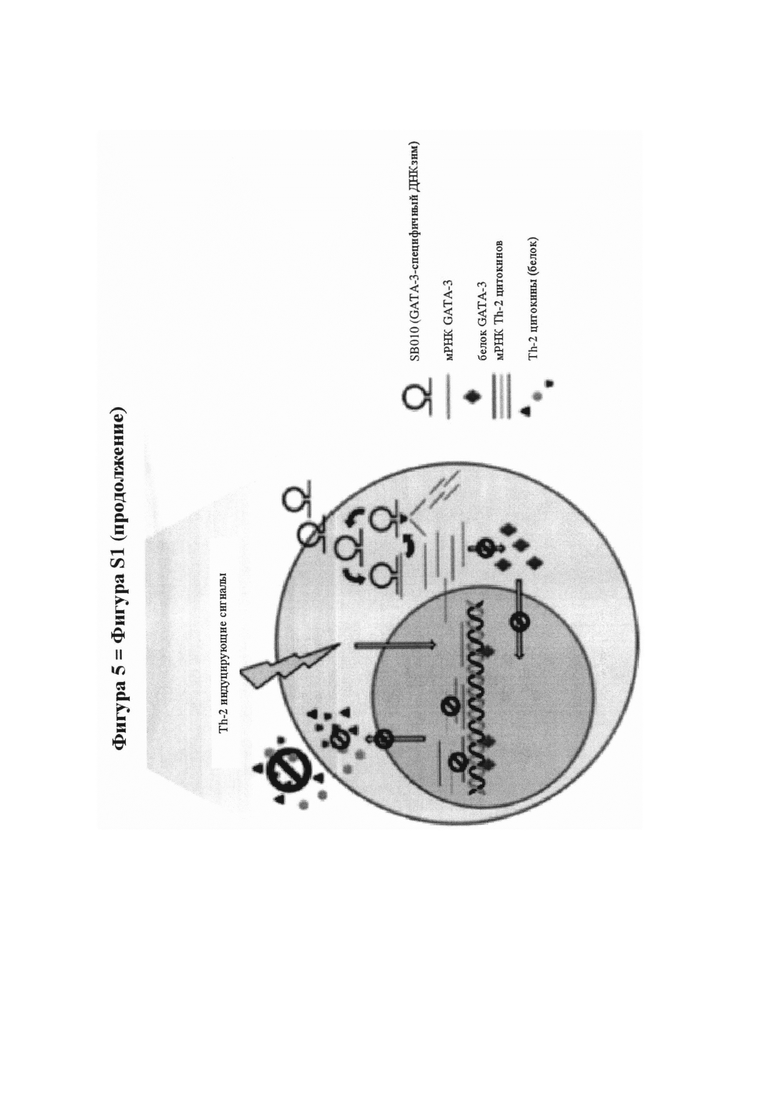
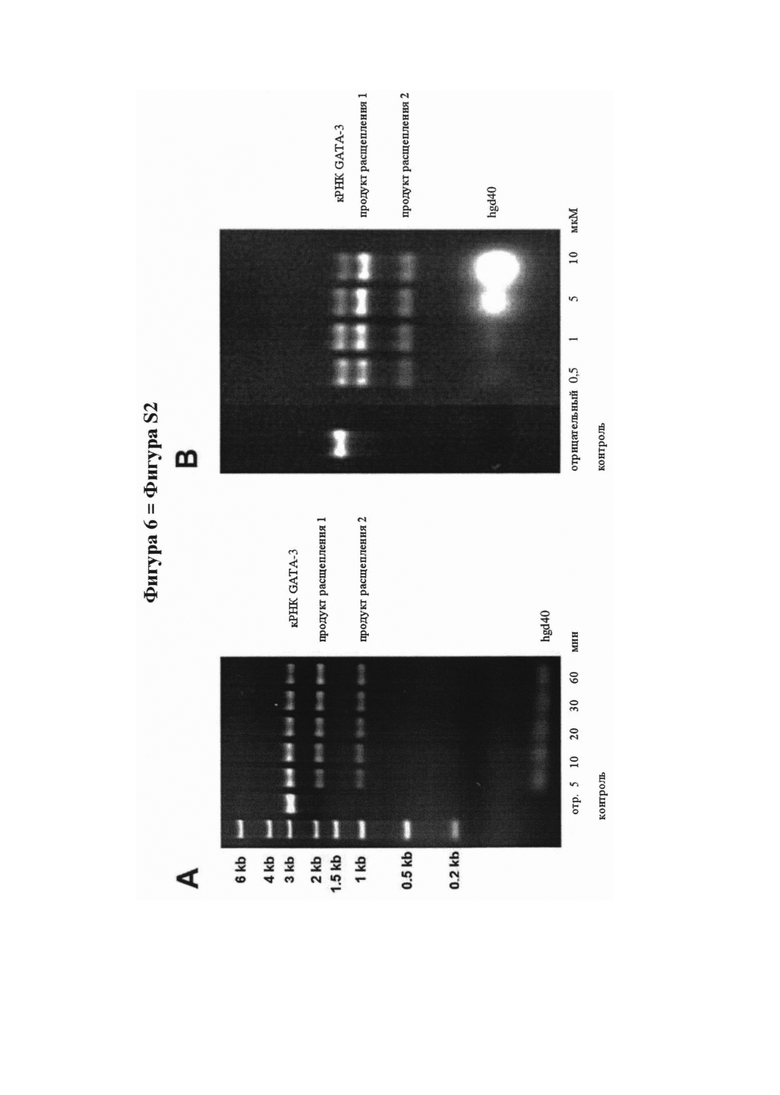
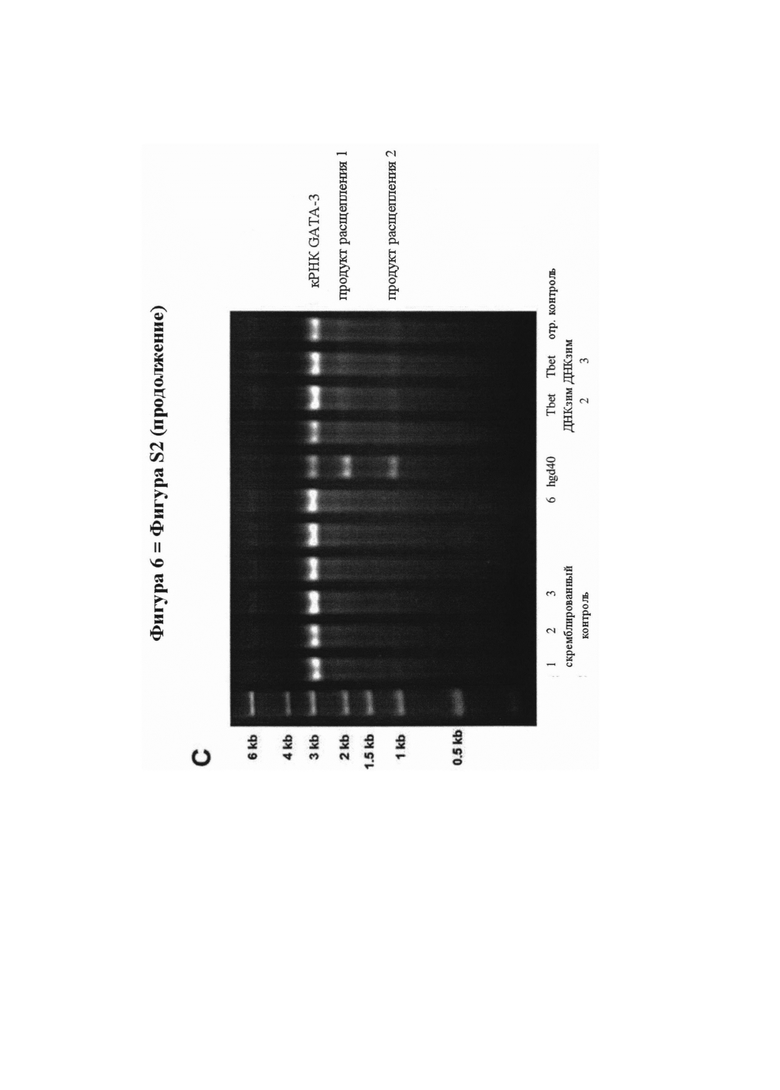
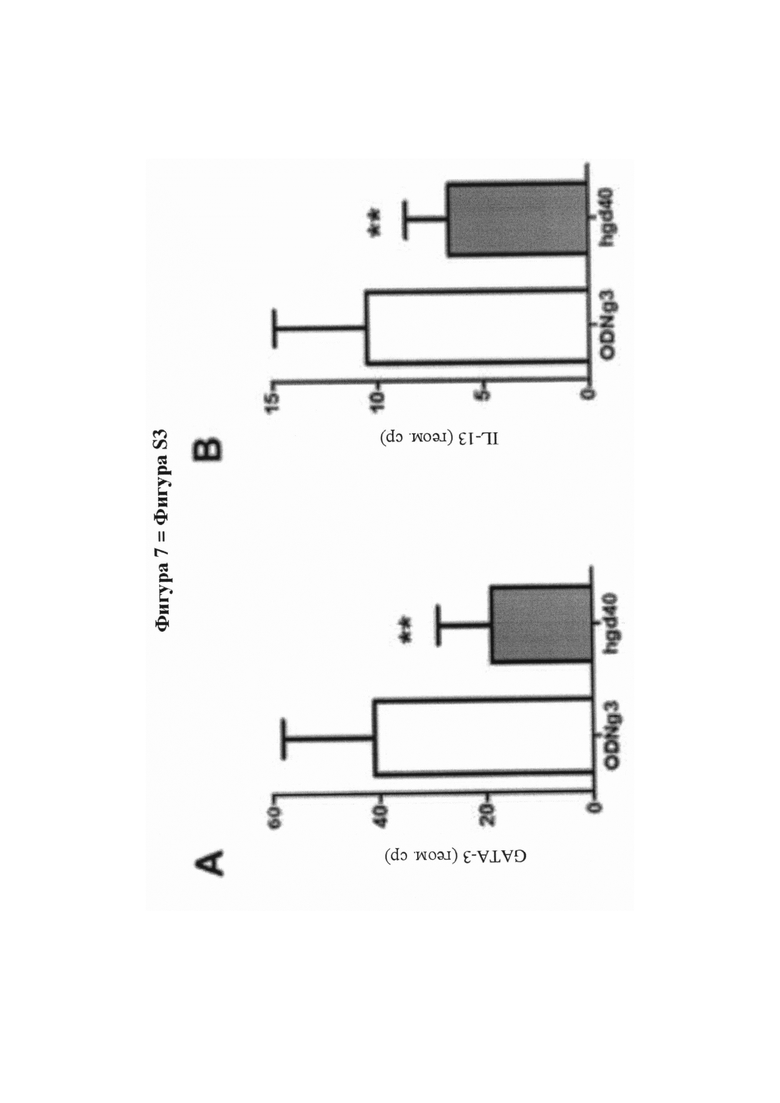
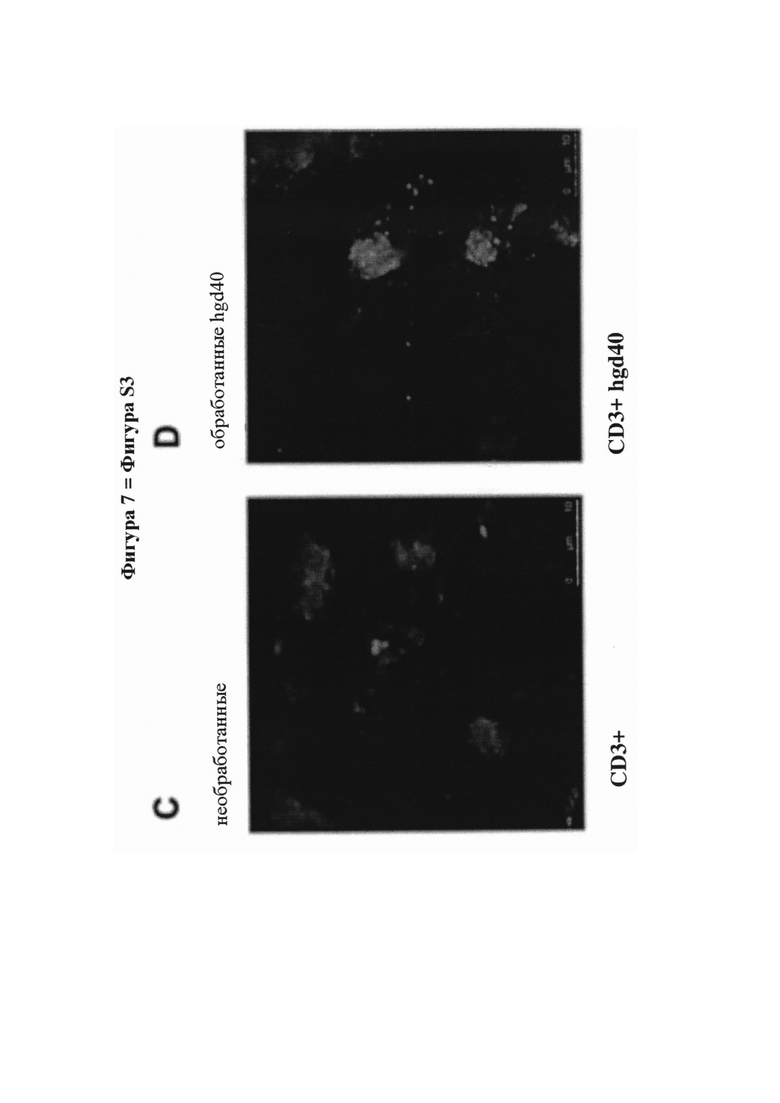
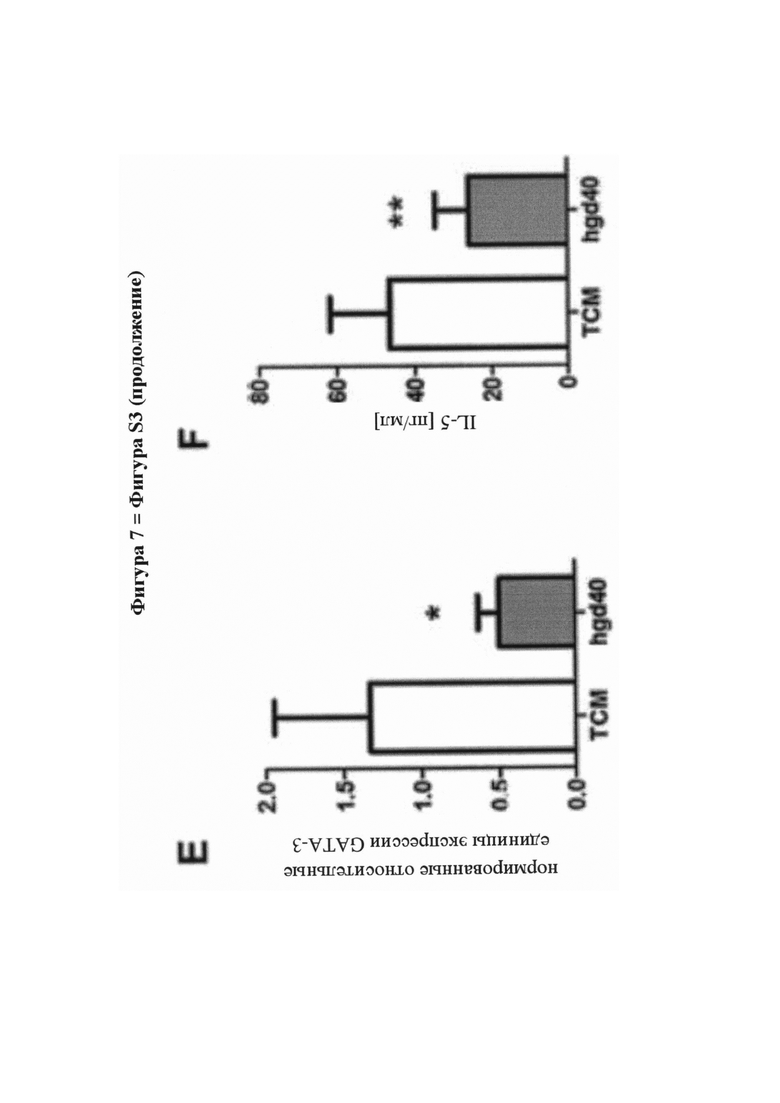
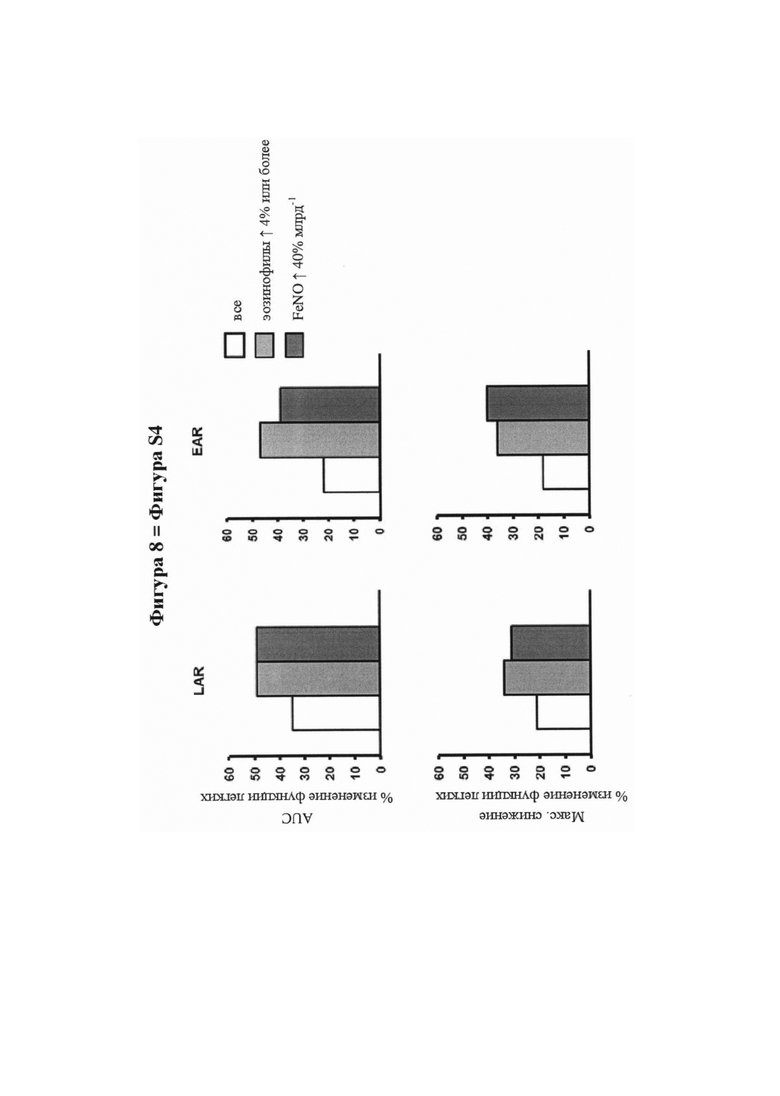
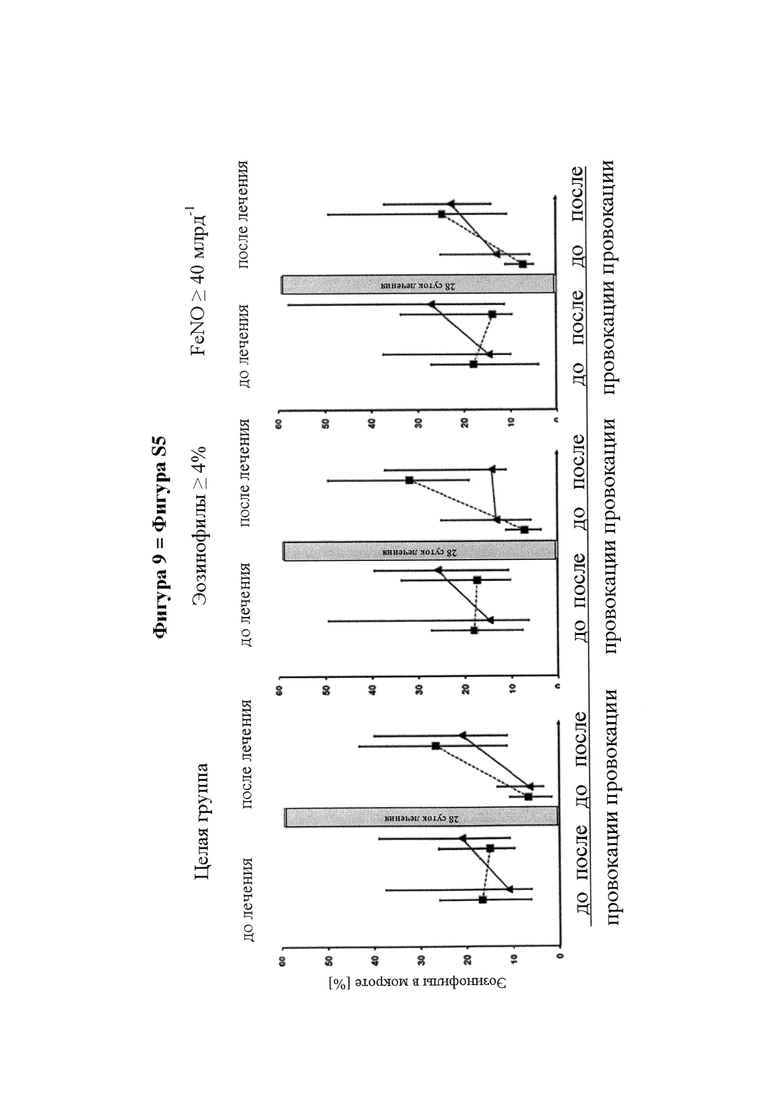
Настоящее изобретение относится к медицине. Предложено применение инактиватора GATA-3 на основе нуклеиновой кислоты для лечения пациента, страдающего Th2-индуцированной астмой, при этом у пациента (i) количество эозинофилов в крови составляет 3% или более, и/или (ii) количество эозинофилов в крови составляет 350⋅106/л или более, и/или (iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более. Технический результат: более выраженный терапевтический эффект на обе фазы (и раннюю, и позднюю аллергическую реакцию) астматического ответа после провокации аллергеном пациентов с заявленными показателями. 13 з.п. ф-лы, 9 ил., 7 табл.
1. Способ лечения пациента, страдающего Th2-индуцированной астмой, при этом пациент характеризуется тем, что
(i) количество эозинофилов в крови составляет 3% или более, в частности 4% или более, в частности 5% или более; и/или
(ii) количество эозинофилов в крови составляет 350·106/л или более, в частности 450·106/л или более; и/или
(iii) фракционный выдыхаемый оксид азота составляет 40 млрд-1 или более,
включающий введение указанному пациенту эффективного количества инактиватора GATA-3 на основе нуклеиновой кислоты.
2. Способ по п. 1, где указанный инактиватор на основе нуклеиновой кислоты представляет собой ДНКзим, направленный на GATA-3.
3. Способ по п. 1 или 2, где количество эозинофилов в крови у указанного пациента составляет 4% или более, в частности 5% или более.
4. Способ по любому из пп. 1-3, где количество эозинофилов в крови у указанного пациента составляет 350·106/л или более, в частности 450·106/л или более.
5. Способ по п. 3 или 4, где указанное количество эозинофилов в крови определяют с помощью (i) автоматизированного дифференциального анализа крови или (ii) ручной микроскопической дифференцировки клеток с применением традиционных мазков крови.
6. Способ по любому из пп. 1-5, где фракционный выдыхаемый оксид азота у указанного пациента составляет 40 млрд-1 или более.
7. Способ по п. 6, где указанный фракционный выдыхаемый оксид азота определяют с помощью портативного устройства NIOX MINO®.
8. Способ по любому из пп. 1-7, где указанный инактиватор GATA-3 на основе нуклеиновой кислоты представляет собой ДНКзим hgd40 (SEQ ID NO: 3).
9. Способ по п. 8, где указанный hgd40 содержится в составе для ингаляции.
10. Способ по п. 9, где указанный hgd40 растворен в PBS.
11. Способ по п. 10, где в 2 мл PBS растворено от 5 до 50 мг hgd40, в частности от 5 до 20 мг hgd40, в частности 10 мг hgd40.
12. Способ по любому из пп. 1-11, где указанный инактиватор GATA-3 на основе нуклеиновой кислоты вводят один раз в сутки, два раза в сутки или три раза в сутки, в частности один раз в сутки.
13. Способ по п. 12, где указанный инактиватор GATA-3 на основе нуклеиновой кислоты вводят один раз в сутки при непрерывной терапии, в частности при поддерживающей терапии.
14. Способ по любому из пп. 1-13, где указанный инактиватор на основе нуклеиновой кислоты используют в качестве дополнительной терапии для одного или более ингаляционных или пероральных терапевтических средств для лечения астмы, выбранных из списка: кортикостероиды, бета-агонисты длительного действия (LABA), антагонисты мускариновых рецепторов длительного действия (LAMA), антилейкотриены, бета-агонисты кратковременного действия (SABA), антихолинергические средства и моноклональные антитела.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| US 8119789 B2, 21.02.2012 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| FUHST R | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Pulmonary Pharmacology & Therapeutics | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| ОБЩАЯ ВРАЧЕБНАЯ ПРАКТИКА: ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ | |||
| Под | |||
Авторы
Даты
2020-05-15—Публикация
2016-05-12—Подача