Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 61/691625, поданной 21 августа 2012 года; предварительной заявки на патент США 61/758097, поданной 29 января 2013 года; предварительной заявки на патент США 61/761279, поданной 6 февраля 2013 года; предварительной заявки на патент США 61/783796, поданной 14 марта 2013 года; предварительной заявки на патент США 61/805797, поданной 27 марта 2013 года; и заявки на патент Франции 1356994, поданной 16 июля 2013 года. Содержание каждой из вышеуказанных заявок полностью включено в настоящую заявку посредством отсылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к лечению и/или предотвращению астмы и связанных состояний. Более конкретно, изобретение относится к введению антагониста рецептора интерлейкина 4 (IL-4R) с целью лечения или предотвращения астмы у пациента, нуждающегося в этом.
Уровень техники
Астма - хроническое воспалительное заболевание дыхательных путей, характеризующееся гиперчувствительностью дыхательных путей, острой и хронической бронхоконстрикцией, отеком дыхательных путей и их закупоркой слизью. Воспалительный компонент астмы, как полагают, включает несколько типов клеток, в том числе тучные клетки, эозинофилы, T-лимфоциты, нейтрофилы и эпителиальные клетки, а также их биологические продукты. У пациентов с астмой чаще всего проявляются такие симптомы, как хрипы, одышка, кашель и сдавленность в груди. Для большинства пациентов с астмой схема контролирующей терапии и бронхолитической терапии обеспечивает надлежащий длительный контроль приступов. Ингаляционные кортикостероиды (ИКС) считаются "золотым стандартом" в контроле симптомов астмы, при этом ингаляционные бета2-агонисты являются наиболее эффективными из доступных в настоящее время бронхолитических средств. Исследования показали, что комбинированная терапия ИКС в сочетании с ингаляционным бета2-агонистом длительного действия (БАДД) обеспечивает более эффективный контроль астмы, нежели высокие дозы одного ИКС. Следовательно, комбинированная терапия была рекомендованной терапией для тех больных, у которых применение одного ИКС в низких дозах не купировало симптомы астмы.
Тем не менее, по некоторым оценкам от 5% до 10% популяции с астмой имеют симптоматическую болезнь, несмотря на максимальную рекомендованную терапию с применением комбинаций противовоспалительных и бронхолитических средств. Кроме того, на эту группу с тяжелой астмой приходится до 50% от общих медицинских затрат на лечение в стационарах, использование экстренной помощи и незапланированные посещения врача. Существует неудовлетворенная потребность в новой терапии в этой группе с тяжелой астмой, так как многие из таких пациентов плохо поддаются лечению с применением ИКС вследствие множества клеточных и молекулярных механизмов. Кроме того, длительные нежелательные воздействия системных и ингаляционных кортикостероидов на метаболизм костной ткани, функции надпочечников и рост детей приводят к попыткам минимизировать используемое количество кортикостероида. Хотя у большой части больных астмой заболевание достаточно хорошо контролируется при использовании современных методов лечения, больным с тяжелой, невосприимчивой к кортикостероидам астмой доступно крайне мало вариантов терапевтического лечения, которые могут обеспечить надлежащий контроль болезни. Следствием резистентности к терапии или недостаточное соблюдение режима терапии является потеря контроля астмы и, в конечном счете, обострение астмы.
Одной из причин низкой восприимчивости к лечению у некоторых пациентов с тяжелой астмой может являться гетерогенность заболевания. К пониманию таких различных фенотипов растет интерес, поскольку направленная терапия с более высокой вероятностью будет успешна у пациентов с подобными, лежащими в основе болезни, патобиологическими особенностями. Недавние терапевтические подходы в области лечения астмы сосредоточились на попытке контроля ответа T-хэлперных клеток 2-го типа. Апрегуляция интерлейкина 4 (IL-4) и интерлейкина 13 (IL-13) была задействована как важный воспалительный компонент прогрессии астмы.
Таким образом, в уровне техники существует потребность в новых способах направленной терапии для лечения и/или предотвращения астмы.
Сущность изобретения
Согласно одному из аспектов настоящего изобретения, предложены способы уменьшения частоты обострений астмы у субъекта, нуждающегося в этом. В связанном аспекте предложены способы улучшения одного или более связанных с астмой параметров у субъекта, нуждающегося в этом. В еще одном аспекте настоящего изобретения предложены способы лечения астмы, например, от умеренной до тяжелой эозинофильной астмы, у субъекта, нуждающегося в этом.
Способы, представленные в настоящем изобретении, включают введение субъекту терапевтически эффективного количества фармацевтической композиции, включающей антагонист рецептора интерлейкина 4 (IL-4R). Согласно некоторым вариантам осуществления, антагонист IL-4R является антителом или его антигенсвязывающим фрагментом, которые специфично связывают IL-4R. Примеры антител против IL-4R, которые могут использоваться в рамках способов настоящего изобретения, описаны в других местах в настоящей заявке, включая рабочий Пример 1. Например, в одном варианте осуществления антагонист IL-4R является антителом или его антигенсвязывающим фрагментом, которые специфично связываются с IL-4R, и включает CDR (область, определяющая комплементарность) последовательности тяжелой цепи и легкой цепи из вариабельной области тяжелой цепи (HCVR) и вариабельной области легкой цепи (LCVR) - SEQ ID NO: 162 и 164, соответственно.
В одном варианте осуществления предложен способ уменьшения частоты одного или более обострений астмы у субъекта, нуждающегося в этом, посредством введения антитела или его антигенсвязывающего фрагмента, которые специфично связывают IL-4R. Обострение астмы может быть одним или более из следующего: (a) 30%-ое или более сильно уменьшение относительно базового уровня утренней пиковой скорости выдоха (ПСВ) в течение двух последовательных дней; (b) шесть или более дополнительных вдохов аэрозоля альбутерола или левалбутерола для облегчения дыхания за 24-часовой период (по сравнению с базовым уровнем) в течение двух последовательных дней; и (c) ухудшение астмы, требующее: (i) системной (пероральной и/или парентеральной) терапии стероидами, или (ii) увеличения приема ингаляционных кортикостероидов по меньшей мере до 4 раз, причем последнюю дозу принимают перед прерыванием приема или госпитализацией.
В различных вариантах осуществления способы улучшения одного или более связанных с астмой параметров включают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества антагониста IL-4R, где улучшение связанного с астмой параметра определяется как одно из следующего: увеличение ОФВ1 относительно базового уровня; увеличение ПСВу относительно базового уровня; увеличение ПСВв относительно базового уровня; уменьшение использования альбутерола/левалбутерола относительно базового уровня; уменьшение пробуждений в ночное время относительно базового уровня и/или уменьшение оценки по шкале SNOT-22 относительно базового уровня. Примеры связанных с астмой параметров включают: (a) объем форсированного выдоха за 1 секунду (ОФВ1); (b) пиковую скорость выдоха (ПСВ), включая ПСВ утром (ПСВу) и ПСВ вечером (ПСВв); (c) использование ингаляционного бронхолитика, такого как альбутерол или левалбутерол; (d) оценку по Опроснику контроля астмы, из пяти пунктов (Asthma Control Questionnaire, ACQ5); (d) пробуждения в ночное время; и (e) оценку в Тесте на исход болезней носа и околоносовых пазух, из 22 пунктов (Sino-Nasal Outcome Test, SNOT-22). В одном варианте осуществления улучшением связанного с астмой параметра является увеличение ОФВ1 по меньшей мере на 0,10 л относительно базового уровня. В одном варианте осуществления улучшением связанного с астмой параметра является увеличение ПСВ по меньшей мере на 10,0 л/мин относительно базового уровня. В одном варианте осуществления улучшением связанного с астмой параметра является увеличение ПСВв по меньшей мере на 1,0 л/мин относительно базового уровня. В одном варианте осуществления улучшением связанного с астмой параметра является уменьшение использования альбутерола/левалбутерола по меньшей мере на 1 вдох аэрозоля в день относительно базового уровня. В одном варианте осуществления улучшением связанного с астмой параметра является уменьшение по меньшей мере на 0,5 балла оценки ACQ5 относительно базового уровня. В одном варианте осуществления улучшением связанного с астмой параметра является уменьшение пробуждений в ночное время по меньшей мере в 0,2 раза за ночь относительно базового уровня. В одном варианте осуществления улучшением связанного с астмой параметра является уменьшение по меньшей мере на 5 баллов оценки SNOT-22 относительно базового уровня.
В изобретении также предложены способы уменьшения частоты возникновения обострений астмы или улучшения одного или более связанных с астмой параметров у субъекта, нуждающегося в этом, где способы включают последовательное введение субъекту, нуждающемуся в этом, разовой начальной дозы фармацевтической композиции, включающей антагонист IL-4R (например, антитело против IL-4R или его антигенсвязывающий фрагмент), а затем одной или более последующих доз фармацевтической композиции, включающей антагонист IL-4R. Фармацевтическую композицию, включающую антагонист IL-4R, можно вводить подкожно, интраназально или внутривенно субъекту, нуждающемуся в этом.
Согласно некоторым вариантам осуществления в изобретении предложены способы уменьшения частоты возникновения обострений астмы или улучшения одного или более связанных с астмой параметров у субъекта, нуждающегося в этом, где способы включают введение субъекту от приблизительно 75 до приблизительно 300 мг фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, которые специфично связывают IL-4R. Согласно этому аспекту фармацевтическую композицию можно вводить субъекту с частотой, например, один раз в неделю.
Изобретение также включает способы лечения астмы (например, эозинофильной астмы, от умеренной до тяжелой эозинофильной астмы и т.д.) путем отбора субъекта, у которого проявляется один или более симптомов или признаков астмы, и введения пациенту фармацевтической композиции, включающей антагонист IL-4R (например, антитело против IL-4R или его антигенсвязывающий фрагмент), где у субъекта проявляются один или более следующих симптомов или признаков астмы: (1) субъект проходил лечение с использованием постоянной дозы комбинации флутиказона/салметерола (250/50 мкг два раза в день или 500/50 мкг два раза в день) или комбинации будесонида/формотерола (160/9 мкг два раза в день или 320/9 мкг два раза в день) в течение по меньшей мере 3 месяцев до обследования; (2) субъект имеет уровень эозинофилов в крови больше или равный 300 клеткам/мкл.; (3) субъект имеет уровень эозинофилов в мокроте больше или равный 3%; (4) субъект имеет повышенные уровни IgE, тимусом и активацией регулируемого хемокина (TARC), эотаксина-3, раково-эмбрионального антигена (РЭА), YKL-40 или периостина; (5) субъект имеет повышенный уровень фракционного выдыхаемого оксида азота (ФВОА); и/или (6) субъект имеет оценку по Опроснику контроля астмы (ACQ5) больше или равную 1,0.
Варианты осуществления, представленные в изобретении, направлены на способы лечения, как описано выше, и дополнительно включают введение второго терапевтического средства в комбинации с антагонистом IL-4R. Второе терапевтическое средство можно вводить субъекту, нуждающемуся в этом, до, после или параллельно с введением антагониста IL-4R. Примеры вторых терапевтических средств включают, без ограничения перечисленными, один или больше из следующего в комбинации: ингибиторы IL-1, ингибиторы IL-5, ингибиторы IL-8, ингибиторы IgE, ингибиторы фактора некроза опухоли (ФНО), кортикостероиды, бета2-агонисты длительного действия и ингибиторы лейкотриена.
В другом аспекте изобретения предложены способы уменьшения или устранения зависимости пациента с астмой от базисной терапии астмы, включающие отбор пациента, имеющего от умеренной до тяжелой астмы, которая не контролируется или частично контролируется базисной терапией астмы; введение пациенту определенной дозы антагониста IL-4R с сохранением базисной терапии пациента; и постепенное уменьшение дозировки одного или более компонентов базисной терапии в последующий период лечения с продолжением введения антагониста IL-4R. В некоторых вариантах осуществления базисная терапия включает ингаляционные кортикостероиды (ИКС), бета-агонист длительного действия (БАДД), или комбинацию ИКС и БАДД. В некоторых вариантах осуществления базисную терапию постепенно сокращают или отменяют в течение 2 - 8 недель. В некоторых вариантах осуществления один компонент базисной терапии исключают после начального периода лечения. В одном варианте осуществления базисную терапию постепенно сокращают в течение последующего периода лечения.
В еще одном аспекте изобретения предложен способ идентификации пациента и лечения от умеренной до тяжелой астмы путем отбора пациента с повышенным уровнем такого биомаркера, как тимусом и активацией регулируемый хемокин (TARC), IgE, эотаксин-3, периостин, раково-эмбриональный антиген (РЭА) или YKL-40, или имеющего повышенный уровень фракционного выдыхаемого оксида азота (ФВОА); и введения пациенту терапевтически эффективного количества антагониста IL-4R.
В другом аспекте изобретения представлен способ мониторинга эффективности лечения от умеренной до тяжелой астмы у субъекта, например, посредством: (a) определения уровня экспрессии биомаркера, такого как TARC и/или эотаксин-3, или общего уровня IgE сыворотки в биологическом образце, полученном от субъекта до лечения с применением антагониста IL-4R; (b) определения уровня экспрессии биомаркера в биологическом образце, полученном от субъекта после лечения с применением антагониста IL-4R; (c) сравнения уровня экспрессии, определенного на этапе (a), с уровнем на этапе (b), и (d) заключения, что лечение является эффективным, если уровень, определенный на этапе (b), ниже, чем уровень, определенный на этапе (a), или заключения, что лечение является неэффективным, если уровень, определенный на этапе (b), является таким же или превышает уровень, определенный на этапе (a).
В одном варианте осуществления биомаркером является ФВОА, и если уровни ФВОА уменьшаются после введения антагониста, то лечение антагонистом IL-4R определяется как эффективное.
Уровень экспрессии биомаркера можно определить, например, через 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель или более после введения антагониста IL-4R, и сравнить с уровнем экспрессии до введения антагониста. Доза или схема введения антагониста IL-4R (например, антитела против IL-4R) может быть скорректирована после определения. Например, если экспрессия биомаркера не снижается в течение 1 недели, 2 недель, 3 недель, 4 недель, 5 недель или более после введения антагониста, то лечение антагонистом может быть приостановлено, или может быть увеличена доза антагониста. Если экспрессия биомаркера после введения антагониста снижается, дозировка антагониста может быть сохранена или уменьшена, например, для определения минимальной эффективной дозы. В некоторых вариантах осуществления лечение поддерживают на уровне минимальной эффективной дозы.
В другом аспекте изобретения представлен способ мониторинга ответа субъекта на лечение антагонистом IL-4R, где субъект имеет от умеренной до тяжелой астмы, например, посредством получения информации относительно уровня экспрессии биомаркера, такого как TARC и/или эотаксин-3, или общего уровня IgE сыворотки в биологическом образце субъекта после введения антагониста IL-4R субъекту, и получения показания, согласно которому лечение нужно продолжить, если уровень экспрессии биомаркера уменьшился по сравнению с уровнем до лечения антагонистом IL-4R. В одном варианте осуществления биомаркером является ФВОА, и если было определено, что уровни ФВОА снизились после введения антитела, то получают показание к продолжению лечения антагонистом IL-4R.
Изобретение также включает антагонист IL-4R, раскрытый в настоящем описании, для применения в производстве лекарственного средства для лечения и/или предотвращения астмы (например, эозинофильной астмы, от умеренной до тяжелой эозинофильной астмы и т.д.) или для лечения любого из других показаний или состояний, раскрытых в настоящем описании.
Изобретение также включает антагонист IL-4R, раскрытый в настоящем описании, для применения в лечении и/или предотвращении астмы (например, эозинофильной астмы, от умеренной до тяжелой эозинофильной астмы и т.д.) или для лечении и/или предотвращения любого из других показаний или состояний, раскрытых в настоящем описании.
Изобретение включает фармацевтическую композицию, включающую антагонистическое антитело против IL-4R или его антигенсвязывающий фрагмент для применения в лечении и/или предотвращении астмы и сопутствующих состояний.
Изобретение также включает фармацевтическую композицию, включающую антагонистическое антитело против IL-4R или его антигенсвязывающий фрагмент для применения в снижении частоты возникновения одного или более обострений астмы у субъекта, нуждающегося в этом.
Кроме того, изобретение включает фармацевтическую композицию, включающую антагонистическое антитело против IL-4R или его антигенсвязывающий фрагмент для применения в улучшении одного или более связанных с астмой параметров у субъекта, нуждающегося в этом.
Изобретение включает фармацевтическую композицию, включающую антагонистическое антитело против IL-4R или его антигенсвязывающий фрагмент для применения в лечении астмы и сопутствующих состояний у пациента, имеющего повышенный уровень биомаркера, выбранного из группы, состоящей из тимусом и активацией регулируемого хемокина (TARC), IgE, эотаксина-3, периостина, раково-эмбрионального антигена (РЭА), YKL-40 и фракционного выдыхаемого оксида азота (ФВОА).
Изобретение дополнительно включает фармацевтическую композицию, включающую антагонистическое антитело против IL-4R или его антигенсвязывающий фрагмент для применения в лечении астмы или от умеренной до тяжелой эозинофильной астмы у субъекта, нуждающегося в этом, где лечение включает тестирование пациента на присутствие уровня эозинофилов в крови по меньшей мере 300 клеток в микролитре и/или уровня эозинофилов в мокроте по меньшей мере 3%, и начало/продолжение введения фармацевтической композиции, если обнаружен такой уровень эозинофилов в крови и/или уровень эозинофилов в мокроте.
Другие варианты осуществления изобретения станут очевидными при просмотре следующего подробного описания.
Краткое описание фигур
Фигура 1 - диаграмма, на которой показан график Каплана-Мейера динамики обострения астмы у пациентов, получавших плацебо (незакрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (звездочки). Эффект лечения антителом mAb1 против IL-4R сохранялся в течение длительного времени, в том числе через 8 недель, когда пациенты подвергались более высокому риску развития обострений вследствие отмены стероидов. Ломанные вертикальные линии указывают отмену БАДД.
Фигура 2 - диаграмма, на которой показано среднее изменение объема форсированного выдоха через 1 секунду (ОФВ1) относительно базового уровня в литрах у пациентов, получавших плацебо (незакрашенные треугольники), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные кружки). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 3 - диаграмма, на которой показано среднее изменение пиковой скорости выдоха утром (ПСВу) в литрах в минуту относительно базового уровня у пациентов, получавших плацебо (открытые треугольники), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные кружки).
Фигура 4 - диаграмма, на которой показано среднее изменение пиковой скорости выдоха вечером (ПСВв) в литрах в минуту относительно базового уровня у пациентов, получавших плацебо (незакрашенные треугольники), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные кружки).
Фигура 5 - диаграмма, на которой показано среднее изменение количества ингаляций в день при использовании альбутерола относительно базового уровня у пациентов, получавших плацебо (незакрашенные треугольники), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные кружки). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 6 - диаграмма, на которой показано среднее изменение оценки по Опроснику контроля астмы из пяти пунктов (ACQ5) относительно базового уровня у пациентов, получавших плацебо (незакрашенные треугольники), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные кружки). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 7 - диаграмма, на которой показано среднее изменение количества пробуждений в ночное время относительно базового уровня у пациентов, получавших плацебо (незакрашенные треугольники), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные кружки). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 8 - диаграмма, на которой показано среднее процентное изменение TARC относительно базового уровня при посещении в неделю 0, 1, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 9 - диаграмма, на которой показано среднее процентное изменение эотаксина-3 относительно базового уровня при посещении в неделю 0, 1, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 10 - диаграмма, на которой показано среднее процентное изменение общего IgE относительно базового уровня при посещении в неделю 0, 1, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты). Сломанные вертикальные линии указывают отмену БАДД.
Фигура 11 - диаграмма, на которой показано среднее процентное изменение периостина относительно базового уровня при посещении в неделю 0, 1, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты).
Фигура 12 - диаграмма, на которой показано среднее процентное изменение раково-эмбрионального антигена (РЭА) относительно базового уровня при посещении в неделю 0, 1, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты).
Фигура 13 - диаграмма, на которой показано среднее процентное изменение YKL-40 относительно базового уровня при посещении в неделю 0, 1, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты).
Фигура 14 - диаграмма, на которой показано среднее процентное изменение эозинофилов в крови относительно базового уровня при посещении в неделю 0, 1, 2, 4, 6, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты).
Фигура 15 - диаграмма, на которой показано среднее процентное изменение уровня фракционного выдыхаемого оксида азота (NO) относительно базового уровня при посещении в неделю 0, 4, 8 и 12 в группе mITT, получавшей плацебо (закрашенные кружки), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (закрашенные квадраты). Ломанные вертикальные линии указывают отмену БАДД.
Фигура 16 - диаграмма рассеяния изменения ОФВ1 (л) относительно базового уровня в неделю 12 в сравнении с базовой фракцией выдыхаемого оксида азота (ФВОА) (млрд.д.) в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 17 - диаграмма рассеяния изменения ПСВу (л/мин) относительно базового уровня в неделю 12 в сравнении с базовой ФВОА (млрд.д.) в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 18 - диаграмма рассеяния изменения ПСВв (л/мин) относительно базового уровня в неделю 12 в сравнении с базовой ФВОА (млрд.д.) в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 19 - диаграмма рассеяния изменения ОФВ1 относительно базового уровня в неделю 12 (л) в сравнении с количеством эозинофилов в крови (109/л) в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 20 - диаграмма рассеяния изменения балла ACQ относительно базового уровня в неделю 12 в сравнении с количеством эозинофилов в крови (109/л) в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 21 - диаграмма рассеяния изменения при использовании альбутерола/левалбутерола в день относительно базового уровня в неделю 12 в сравнении с количеством эозинофилов в крови (109/л) в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 22 - диаграмма рассеяния изменения балла ACQ относительно базового уровня в неделю 12 в сравнении с базовым уровнем периостина в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 23 - диаграмма рассеяния изменения балла ACQ относительно базового уровня в неделю 12 в сравнении YKL-40 в группе mITT, получавшей плацебо (незакрашенные кружки и сплошная линия), по сравнению с пациентами, получавшими антитело mAb1 против IL-4R (знак плюс и пунктирная линия).
Фигура 24 - схематическое представление режима выбора времени введения и дозы для лечения больных астмой.
Фигура 25 - диаграмма, описывающая распределение пациентов в рандомизированном, плацебо-контролируемом, двойном слепом исследовании в параллельных группах, проводимом с подкожным введением раз в неделю 300 мг mAb1 или плацебо в течение 12 недель пациентам с персистирующей эозинофильной астмой, от умеренной до тяжелой, которую частично контролировали/неконтролировали посредством терапии ингаляционным кортикостероидом (ИКС) и бета2-агонистом длительного действия (БАДД).
Фигура 26A и 26B - диаграммы рассеяния симптомов астмы утром (A) и вечером (B), измеряемых в течение 12 недель после введения плацебо (незакрашенные треугольники) или mAb1 (закрашенные кружки).
Фигура 27 - диаграмма, на которой показаны уровни IgE сыворотки у гуманизированных IL-4/IL-4R мышей (IL-4hu/huIL-4Rαhu/hu) после провокации аллергенами пылевого клеща (HDM) и введения либо антитела против IL-4R, либо рецептора-ловушки IL-13Ra2-Fc, либо после имитации терапии. Измерения производили на образцах, полученных в День 40 (за 24 часа до введения первой дозы терапии) и в конце эксперимента, в День 85.
Фигура 28 - диаграмма, на которой показаны уровни IgE сыворотки у мышей дикого типа (Balb/c) после провокации аллергенами пылевого клеща (HDM) и введения либо контрольного изотипа, антитела против IL-4R, либо рецептора-ловушки IL-13Ra2-Fc, либо после имитации терапии.
Фигура 29 - диаграмма, на которой показано содержание коллагена (выраженное в мкг/долю) в легких гуманизированных IL-4/IL-4R мышей после провокации HDM и назначенной терапии.
Фигура 30 - диаграмма, на которой показано содержание коллагена (выраженное в мкг/долю) в легких мышей дикого типа после провокации HDM и назначенной терапии.
Фигура 31A - диаграмма, на которой показаны уровни эозинофилов и нейтрофилов у гуманизированных IL-4/IL-4R мышей после провокации HDM и назначенной терапии, и Фигура 31B - диаграмма, на которой показаны уровни резидентных дендритных клеток и воспалительных дендритных клеток у гуманизированных IL-4/IL-4R мышей после провокации HDM и назначенной терапии.
Подробное описание
Прежде чем будет описано настоящее изобретение, следует понимать, что это изобретение не ограничивается конкретными способами и описанными экспериментальными условиями, так как способы и условия могут изменяться. Также следует понимать, что терминология, используемая в настоящем описании, служит исключительно в целях описания конкретных вариантов осуществления, и не должна быть ограничивающей, поскольку объем настоящего изобретения будет ограничен лишь в соответствии с прилагаемой формулой изобретения.
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, под которым их обычно понимают средние специалисты в данной области техники, к которой относится настоящее изобретение.
При использовании в настоящем описании, термин "приблизительно", в случае его использования в отношении конкретного указанного числового значения, означает, что значение может отклоняться от указанного значения не более чем на 1%. Например, при использовании в настоящем описании, выражение "приблизительно 100" включает 99 и 101 и все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
При использовании в настоящем описании, термины "лечить", "лечение" или подобные означают облегчение симптомов, устранение этиологии симптомов на временной или постоянной основе, или предотвращение или замедление возникновения симптомов названного нарушения или состояния.
Хотя любые способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке, могут использоваться в практическом осуществлении настоящего изобретения, далее будут описаны предпочтительные способы и материалы. Все публикации, указанные в настоящей заявке, включены в настоящее описание посредством отсылки в полном объеме.
Способы уменьшения частоты возникновения обострений астмы
Изобретение включает способы уменьшения частоты возникновения обострений астмы у субъекта, нуждающегося в этом, включающие введение фармацевтической композиции, включающей антагонист рецептора интерлейкина 4 (IL-4R), субъекту. При использовании в настоящем описании, выражение "обострение астмы" означает увеличение тяжести и/или частоты, и/или продолжительности одного или более симптомов или признаков астмы. "Обострение астмы" также включает любое ухудшение здоровья дыхательных путей субъекта, которое требует и/или поддается лечению с терапевтическим вмешательством по поводу астмы (например, терапии стероидами, терапии ингаляционными кортикостероидами, госпитализации и т.д.). Согласно некоторым вариантам осуществления изобретения, обострение астмы определяется как одно или более из следующего: (a) 30%-ое или большее уменьшение пиковой скорости выдоха утром ("ПСВу", как определено в другом месте настоящего описания) относительно базового уровня за два последовательных дня; (b) шесть или более дополнительных вдохов аэрозоля альбутерола или левалбутерола для облегчения дыхания за 24-часовой период (по сравнению с базовым уровнем) в течение двух последовательных дней; и (c) ухудшение астмы, требующее: (i) системной (пероральной и/или парентеральной) терапии стероидами, или (ii) увеличения приема ингаляционных кортикостероидов по меньшей мере до 4 раз по сравнению с базовым уровнем, или (iii) госпитализации.
В некоторых случаях, обострение астмы можно отнести к категории "тяжелого обострения астмы". Тяжелое обострение астмы означает инцидент, требующий непосредственного вмешательства в форме лечения либо системными кортикостероидами, либо ингаляционными кортикостероидами в дозе, которая в четыре или более раз превышает дозу, применяемую до инцидента. Общее выражение "обострение астмы", таким образом, включает и охватывает более специализированную подкатегорию "тяжелых обострений астмы". Соответственно, изобретение включает способы уменьшения частоты возникновения тяжелых обострений астмы у пациента, нуждающегося в этом.
"Уменьшение частоты возникновения" обострений астмы означает, что субъект, который уже получил фармацевтическую композицию настоящего изобретения, испытывает меньше обострений астмы (то есть меньше по меньшей мере на одно обострение) после лечения, чем до лечения, или не испытывает никаких обострений астмы в течение по меньшей мере 4 недель (например, 4, 6, 8, 12, 14 или более недель) после начала лечения с применением фармацевтической композиции настоящего изобретения. "Уменьшение частоты возникновения" обострений астмы альтернативно означает, что после введения фармацевтической композиции настоящего изобретения, вероятность того, что субъект будет испытывать обострение астмы, уменьшается по меньшей мере на 10% (например, на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или больше) по сравнению с субъектом, который не получал фармацевтической композиции настоящего изобретения.
Способы улучшения связанных с астмой параметров
Изобретение также включает способы улучшения одного или более связанных с астмой параметров у субъекта, нуждающегося в этом, где способы включают введение фармацевтической композиции, включающей антагонист рецептора интерлейкина 4 (IL-4R) субъекту. В рамках изобретения уменьшение частоты возникновения обострений астмы (как описано выше) может коррелировать с улучшением одного или более связанных с астмой параметров, впрочем, такая корреляция не должна обязательно наблюдаться во всех случаях.
Примеры "связанных с астмой параметров" включают: (a) объем форсированного выдоха за 1 секунду (ОФВ1); (b) пиковую скорость выдоха (ПСВ), включая ПСВ утром (ПСВу) и ПСВ вечером (ПСВв); (c) использование ингаляционного бронхолитика, такого как альбутерол или левалбутерол; (d) оценку по Опроснику контроля астмы, из пяти пунктов (ACQ5); (d) пробуждения в ночное время; и (e) оценку в Тесте на исход болезней носа и околоносовых пазух, из 22 пунктов (SNOT-22). "Улучшение связанного с астмой параметра" означает увеличение относительно базового уровня одного или более из ОФВ1, ПСВу или ПСВв, и/или уменьшение относительно базового уровня одного или более из ежедневного применения альбутерола/левалбутерола, оценки ACQ5, среднего количества пробуждений в ночное время или оценки SNOT-22. При использовании в настоящем описании, термин "базовый уровень", в отношении связанного с астмой параметра, означает числовое значение связанного с астмой параметра у пациента до или во время введения фармацевтической композиции настоящего изобретения.
Для определения, улучшился ли связанный с астмой параметр, параметр оценивают количественно на базовом уровне и в момент после введения фармацевтической композиции настоящего изобретения. Например, связанный с астмой параметр может быть измерен в день 1, день 2, день 3, день 4, день 5, день 6, день 7, день 8, день 9, день 10, день 11, день 12, день 14 или в неделю 3, неделю 4, неделю 5, неделю 6, неделю 7, неделю 8, неделю 9, неделю 10, неделю 11, неделю 12, неделю 13, неделю 14, неделю 15, неделю 16, неделю 17, неделю 18, неделю 19, неделю 20, неделю 21, неделю 22, неделю 23, неделю 24 или позже, после начальной терапии с применением фармацевтической композиции настоящего изобретения. Различие между значением параметра в конкретной точке времени после начала лечения и значением параметра на базовом уровне используется для определения, было ли "улучшение" связанного с астмой параметра (например, увеличение или уменьшение, при соответствующих обстоятельствах, в зависимости от конкретного измеряемого параметра).
Термины "получать" или "получение", при использовании в настоящем описании, относятся к приобретению физического объекта или значения, например, числового значения, посредством "прямого получения" или "косвенного получения" физического объекта или значения, например, связанного с астмой параметра. "Прямое получение" означает выполнение процесса (например, выполнение метода синтеза или анализа) с получением физического объекта или значения. "Косвенное получение" относится к получению физического объекта или значения от другой стороны или из источника (например, от сторонней лаборатории, в которой непосредственно получили физический объект или значение). Прямое получение физического объекта включает выполнение процесса, который включает физическое изменение физического вещества, например, исходного вещества. Примеры изменений включают создание физического объекта из двух или более исходных веществ, резку или измельчение вещества, разделение или очистку вещества, объединение двух или более отдельных объектов в смесь, проведение химической реакции, которая включает разрыв или образование ковалентной или нековалентной связи. Прямое получение значения включает выполнение процесса, который включает физическое изменение образца или другого вещества, например, выполнение аналитического процесса, который включает физическое изменение вещества, например, образца, аналита или реагента (иногда именуемого в настоящем описании как "физический анализ").
Информацию, которую получают косвенно, можно представить в форме сообщения, например, в бумажной или электронной форме, такой как из электронной базы данных или в виде приложения ("App"). Сообщение или информация могут бы предоставлены, например, медицинским учреждением, таким как больница или клиника, или лицом, предоставляющим медицинские услуги, таким как врач или медсестра.
Объем форсированного выдоха за 1 секунду (ОФВ1). Согласно некоторым вариантам осуществления изобретения введение антагониста IL-4R пациенту приводит к увеличению относительно базового уровня объема форсированного выдоха за 1 секунду (ОФВ1). Методы измерения ОФВ1 известны в уровне техники. Например, для измерения ОФВ1 у пациента может использоваться спирометр, который соответствует рекомендациям 2005 Американского торакального общества (ATS)/Европейского респираторного общества (ERS). Стандартизация спирометрии ATS/ERS может использоваться в качестве руководства. Спирометрию обычно проводят между 6:00 и 10:00, по меньшей мере через 6 часов после приостановки приема альбутерола. Тесты легочной функции обычно проводят в положении сидя и при этом регистрируют максимальное значение ОФВ1 (в литрах).
Изобретение включает терапевтические способы, которые приводят к увеличению ОФВ1 относительно базового уровня по меньшей мере на 0,05 л в неделю 12 после начала терапии с применением фармацевтической композиции, включающей антагонист против IL-4R. Например, согласно изобретению введение антагониста IL-4R субъекту, нуждающемуся в этом, вызывает увеличение ОФВ1 относительно базового уровня приблизительно на 0,05 л, 0,10 л, 0,12 л, 0,14 л, 0,16 л, 0,18 л, 0,20 л, 0,22 л, 0,24 л, 0,26 л, 0,28 л, 0,30 л, 0,32 л, 0,34 л, 0,36 л, 0,38 л, 0,40 л, 0,42 л, 0,44 л, 0,46 л, 0,48 л, 0,50 л или больше в неделю 12.
Пиковая скорость выдоха утром и вечером (ПСВу и ПСВв). Согласно некоторым вариантам осуществления изобретения введение антагониста IL-4R пациенту приводит к увеличению пиковой скорости выдоха утром и/или вечером (ПСВу и/или ПСВв) относительно базового уровня. Методы измерения ПСВ известны в уровне техники. Например, согласно одному методу измерения ПСВ пациентам выдают электронный измеритель ПСВ для регистрации ПСВ утром (ПСВу) и вечером (ПСВв) (а также ежедневного применения альбутерола, оценок утренних и вечерних симптомов астмы и числа пробуждений в ночное время вследствие проявления симптомов астмы, которые требуют применения препаратов для неотложной помощи). Пациенты проходят инструктаж по применению устройства и получают письменные инструкции по использованию электронного измерителя ПСВ. Кроме того, медицинский работник может инструктировать пациентов о том, как регистрировать соответствующие измеряемые значения на электронном измерителе ПСВ. Измерение ПСВу обычно проводят в течение 15 минут после подъема (от 6:00 до 10:00) до приема альбутерола. Измерение ПСВв обычно проводят вечером (от 18:00 до 22:00) до приема альбутерола. Субъекты должны попытаться приостановить применение альбутерола в течение по меньшей мере 6 часов до измерения их ПСВ. Пациент делает три попытки измерения ПСВ и регистрирует все 3 значения на электронном измерителе ПСВ. Обычно для оценки используется максимальное значение. Базовое значение ПСВу можно вычислить как среднее измерение, выполняемое утром, зарегистрированное в течение 7 дней до введения первой дозы фармацевтической композиции, включающей антагонист IL-4R, и базовое значение ПСВв можно вычислить как среднее измерение, выполняемое вечером, зарегистрированное в течение 7 дней до введения первой дозы фармацевтической композиции, включающей антагонист IL-4R.
Изобретение включает терапевтические способы, которые приводят к увеличению ПСВу и/или ПСВв относительно базового уровня по меньшей мере на 1,0 л/мин в неделю 12 после начала лечения с применением фармацевтической композицией, включающей антагонист против IL-4R. Например, согласно изобретению, введение антагониста IL-4R субъекту, нуждающемуся в этом, вызывает увеличение ПСВ относительно базового уровня приблизительно на 0,5 л/мин, 1,0 л/мин, 1,5 л/мин, 2,0 л/мин, 2,5 л/мин, 3,0 л/мин, 3,5 л/мин, 4,0 л/мин, 4,5 л/мин, 5,0 л/мин, 5,5 л/мин, 6,0 л/мин, 6,5 л/мин, 7,0 л/мин, 7,5 л/мин, 8,0 л/мин, 8,5 л/мин, 9,0 л/мин, 9,5 л/мин, 10,0 л/мин, 10,5 л/мин, 11,0 л/мин, 12,0 л/мин, 15 л/мин, 20 л/мин или больше в неделю 12.
Применение альбутерола/левалбутерола. Согласно некоторым вариантам осуществления изобретения введение антагониста IL-4R пациенту приводит к уменьшению ежедневного применения альбутерола или левалбутерола относительно базового уровня. Число ингаляций альбутерола/левалбутерола может регистрироваться пациентами ежедневно в дневнике, на измерителе ПСВ или другом регистрирующем устройстве. В процессе лечения фармацевтической композицией изобретения, применение альбутерола/левалбутерола обычно можно осуществлять по мере необходимости в случае проявления симптомов, на нерегулярной основе или профилактически. Базовое количество ингаляций альбутерола/левалбутерола в день может быть вычислено исходя из среднего значения за 7 дней перед введением первой дозы фармацевтической композиции, включающей антагонист IL-4R.
Изобретение включает терапевтические способы, которые приводят к уменьшению применения альбутерола/левалбутерола относительно базового уровня по меньшей мере на 0,25 вдохов аэрозоля за день в неделю 12 после начала лечения фармацевтической композицией, включающей антагонист против IL-4R. Например, согласно изобретению, введение антагониста IL-4R субъекту, нуждающемуся в этом, вызывает уменьшение применения альбутерола/левалбутерола относительно базового уровня приблизительно на 0,25 вдохов аэрозоля в день, 0,50 вдохов аэрозоля в день, 0,75 вдохов аэрозоля в день, 1,00 вдохов аэрозоля в день, 1,25 вдохов аэрозоля в день, 1,5 вдохов аэрозоля в день, 1,75 вдохов аэрозоля в день, 2,00 вдохов аэрозоля в день, 2,25 вдохов аэрозоля в день, 2,5 вдохов аэрозоля в день, 2,75 вдохов аэрозоля в день, 3,00 вдохов аэрозоля в день или больше в неделю 12.
Оценка по Опроснику контроля астмы из пяти пунктов (ACQ). Согласно некоторым вариантам осуществления изобретения введение антагониста IL-4R пациенту приводит к уменьшению оценки по Опроснику контроля астмы из пяти пунктов (ACQ5) по сравнению с базовым уровнем. ACQ5 представляет собой утвержденный Опросник для оценки контроля астмы.
Изобретение включает терапевтические способы, которые приводят к уменьшению оценки ACQ5 относительно базового уровня по меньшей мере на 0,10 пункта в неделю 12 после начала лечения фармацевтической композицией, включающей антагонист против IL-4R. Например, согласно изобретению, введение антагониста IL-4R субъекту, нуждающемуся в этом, вызывает уменьшение балла ACQ по сравнению с базовым уровнем приблизительно на 0,10 пункта, 0,15 пункта, 0,20 пункта, 0,25 пункта, 0,30 пункта, 0,35 пункта, 0,40 пункта, 0,45 пункта, 0,50 пункта, 0,55 пункта, 0,60 пункта, 0,65 пункта, 0,70 пункта, 0,75 пункта, 0,80 пункта, 0,85 пункта или больше в неделю 12.
Пробуждения в ночное время. Согласно некоторым вариантам осуществления изобретения введение антагониста IL-4R пациенту приводит к уменьшению среднего количества пробуждений в ночное время относительно базового уровня.
Изобретение включает терапевтические способы, которые приводят к уменьшению среднего количества пробуждений в ночное время по сравнению с базовым уровнем по меньшей мере приблизительно на 0,10 раза в ночь в неделю 12 после начала лечения фармацевтической композицией, включающей антагонист против IL-4R. Например, согласно изобретению, введение антагониста IL-4R субъекту, нуждающемуся в этом, вызывает уменьшение среднего количества пробуждений в ночное время по сравнению с базовым уровнем приблизительно на 0,10 раза в ночь, 0,15 раза в ночь, 0,20 раза в ночь, 0,25 раза в ночь, 0,30 раза в ночь, 0,35 раза в ночь, 0,40 раза в ночь, 0,45 раза в ночь, 0,50 раза в ночь, 0,55 раза в ночь, 0,60 раза в ночь, 0,65 раза в ночь, 0,70 раза в ночь, 0,75 раза в ночь, 0,80 раза в ночь, 0,85 раза в ночь, 0,90 раза в ночь, 0,95 раза в ночь, 1,0 раза в ночь, 2,0 раза в ночь или больше в неделю 12.
Оценка в Тесте на исход болезней носа и околоносовых пазух из 22 пунктов (SNOT-22). Согласно некоторым вариантам осуществления изобретения введение антагониста IL-4R пациенту приводит к уменьшению оценки в Тесте на исход болезней носа и околоносовых пазух из 22 пунктов (SNOT-22) относительно базового уровня. SNOT-22 представляет собой утвержденный опросник для оценки влияния хронического риносинусита на качество жизни (Hopkins et al., 2009, Clin. Otolaryngol., 34:447-454).
Изобретение включает терапевтические способы, которые приводят к уменьшению оценки SNOT-22 относительно базового уровня по меньшей мере на 1 пункт в неделю 12 после начала лечения фармацевтической композицией, включающей антагонист против IL-4R. Например, согласно изобретению, введение антагониста IL-4R субъекту, нуждающемуся в этом, вызывает уменьшение оценки SNOT-22 относительно базового уровня приблизительно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 пунктов или больше в неделю 12.
Способы лечения астмы
В изобретении, согласно некоторым вариантам осуществления, предложены способы лечения астмы, включая, например, эозинофильную астму, у субъекта, нуждающегося в этом, где способы включают введение субъекту фармацевтической композиции, включающей антагонист рецептора интерлейкина 4 (IL-4R). В некоторых вариантах осуществления способы изобретения могут применяться для лечения от умеренной до тяжелой эозинофильной астмы у субъекта (например, персистирующей, от умеренной до тяжелой эозинофильной астмы).
Согласно изобретению, субъекта идентифицируют как имеющего от умеренной до тяжелой эозинофильной астмы, если субъект демонстрирует уровень эозинофилов крови по меньшей мере 300 клеток в микролитре и/или уровень эозинофилов в мокроте по меньшей мере 3%. Любые известные и доступные из уровня техники способы измерения уровня эозинофилов в крови и/или мокроте могут использоваться в рамках изобретения для идентификации субъекта, имеющего от умеренной до тяжелой эозинофильной астмы, который, таким образом, становится подходящим субъектом для применения терапевтических способов изобретения.
Согласно соответствующему аспекту изобретения предложены способы лечения астмы, включающие: (a) отбор пациента, который демонстрирует уровень эозинофилов в крови по меньшей мере 300 клеток в микролитре и/или уровень эозинофилов в мокроте по меньшей мере 3%; и (b) введение пациенту фармацевтической композиции, включающей антагонист IL-4R.
В другом аспекте предложены способы уменьшения или устранения зависимости пациента с астмой от применения ингаляционных кортикостероидов (ИКС) и/или бета-агонистов длительного действия (БАДД) в процессе лечения от умеренной до тяжелой астмы. В некоторых вариантах осуществления способы включают: отбор пациента, имеющего от умеренной до тяжелой астмы, которая не контролируется или частично контролируется базисной терапией; введение пациенту определенной дозы антагониста IL-4R, предпочтительно антитела против IL-4R, в течение начального периода лечения, с сохранением базисной терапии пациента в течение начального периода лечения; и постепенное уменьшение дозировки одного или более компонентов базисной терапии в течение последующего периода лечения, с продолжением введения антагониста IL-4R. Термин "базисная терапия" относится к стандартным или обычным терапевтическим средствам, известным в уровне техники, которые применяются для лечения астмы. В некоторых вариантах осуществления базисная терапия включает ИКС, БАДД или комбинацию обоих. В некоторых вариантах осуществления дозу ИКС и/или БАДД исключают или отменяют сразу после начального периода лечения. Например, БАДД, такой как салметерол или формотерол, вводят в начальный период лечения и полностью прекращают или отменяют его введение в последующий период лечения.
Пример схемы лечения пациента с умеренной - тяжелой астмой показан на Фигуре 24, где антагонист IL-4R вводят пациенту с умеренной - тяжелой астмой. В течение начального периода лечения (также называемого "стабильной фазой"), БАДД и ИКС вводят пациенту в качестве базисной терапии. В течение последующего периода лечения (также называемого "фазой отмены") введение БАДД приостанавливают, то есть БАДД отменяют или исключают. Дозу ИКС постепенно снижают в течение последующего периода лечения, до полного исключения.
В соответствующем аспекте предложены способы лечения астмы, включающие дополнительную терапию к базисной терапии с систематической отменой базисной терапии. В некоторых вариантах осуществления антагонист IL-4R вводят в качестве дополнительной терапии больному астмой, который находится на базисной терапии в течение некоторого периода времени (например, 1 недели, 2 недель, 3 недель, 1 месяца, 2 месяцев, 5 месяцев, 12 месяцев, 18 месяцев, 24 месяцев или дольше) (также называемого "стабильной фазой"). В некоторых вариантах осуществления базисная терапия включает ИКС и/или БАДД. Стабильная фаза сопровождается фазой отмены базисной терапии, где один или более компонентов, входящих в базисную терапию, отменяют или снижают, или исключают, тогда как дополнительную терапию продолжают. В некоторых вариантах осуществления базисная терапия может быть снижена приблизительно на 5%, приблизительно на 10%, приблизительно на 20%, приблизительно на 30%, приблизительно на 40%, приблизительно на 50% или больше в течение фазы отмены. Фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше. В предпочтительном варианте осуществления базисная терапия может быть уменьшена приблизительно на 5% в течение фазы отмены, при этом фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше. В предпочтительном варианте осуществления базисная терапия может быть уменьшена приблизительно на 10% в течение фазы отмены, при этом фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше. В предпочтительном варианте осуществления базисная терапия может быть уменьшена приблизительно на 20% в течение фазы отмены, при этом фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше. В предпочтительном варианте осуществления базисная терапия может быть уменьшена приблизительно на 30% в течение фазы отмены, при этом фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше. В предпочтительном варианте осуществления базисная терапия может быть уменьшена приблизительно на 40% в течение фазы отмены, при этом фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше. В предпочтительном варианте осуществления базисная терапия может быть уменьшена приблизительно на 50% или больше в течение фазы отмены, при этом фаза отмены может длиться 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель или больше.
В некоторых других вариантах осуществления изобретение охватывает способы лечения или уменьшения тяжести состояний или осложнений, связанных с астмой, таких как хронический риносинусит, аллергический ринит, аллергический грибковый риносинусит, аллергический бронхолегочный аспергиллез, болезнь объединенных дыхательных путей, синдром Черджа-Стросс, васкулит, хроническая обструктивная болезнь легких (ХОБЛ) и бронхоспазм, вызванный физической нагрузкой.
Изобретение также включает способы лечения персистирующей астмы. При использовании в настоящем описании, термин "персистирующая астма" означает, что у субъекта симптомы проявляются по меньшей мере один раз в неделю, днем и/или ночью, при этом симптомы длятся от нескольких часов до нескольких дней. В некоторых альтернативных вариантах осуществления, персистирующая астма является "слабо персистирующей" (например, более двух раз в неделю, но не ежедневно, причем симптомы достаточно тяжелы, чтобы нарушать повседневную деятельность или сон, и/или где легочная функция является нормальной или может быть возвращена к номе с помощью ингаляции бронхолитика), "умеренно персистирующей" (например, симптомы проявляются ежедневно, при этом сон прерывается по меньшей мере раз в неделю и/или легочная функция умеренно нарушена), или "сильно персистирующей" (например, постоянные симптомы, несмотря на правильное применение одобренных препаратов и/или где легочная функция сильно нарушена).
Антагонисты рецепторов интерлейкина-4
Способы изобретения включают введение субъекту, нуждающемуся в этом, терапевтической композиции, включающей антагонист рецептора интерлейкина 4 (IL-4R). При использовании в настоящем описании, "антагонист IL-4R" является любым средством, которое связывается или взаимодействует с IL-4R и ингибирует нормальную биологическую функцию сигнализации IL-4R в случае экспрессии IL-4R на клетке in vitro или in vivo. Неограничивающие примеры классов антагонистов IL-4R включают низкомолекулярные антагонисты IL-4R, аптамеры против IL-4R, антагонисты IL-4R на основе пептидов (например, молекулы "peptibody" или пептитела), а также антитела или антигенсвязывающие фрагменты антител, которые специфично связывают IL-4R человека.
Термин "IL-4R человека" (hIL-4R) относится к человеческому цитокиновому рецептору, который специфично связывается с интерлейкином 4 (IL-4), такому как IL-4Rα (SEQ ID NO: 274).
Термин "антитело" относится к молекулам иммуноглобулина, содержащим четыре полипептидных цепи, две тяжелых (H) цепи и две легких (L) цепи, которые связаны дисульфидными связями, а также к их мультимерам (например, IgM). Каждая тяжелая цепь включает вариабельную область тяжелой цепи (сокращенно HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи включает три домена: CH1, CH2 и CH3. Каждая легкая цепь включает вариабельную область легкой цепи (сокращенно LCVR или VL) и константную область легкой цепи. Константная область легкой цепи включает один домен - (CL1). Области VH и VL можно дополнительно поделить на гипервариабельные области, называемые областями, определяющими комплементарность (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца до C-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В различных вариантах осуществления FR области антитела против IL-4R (или их антигенсвязывающая часть) могут быть идентичны человеческим зародышевым последовательностям, или могут быть природно или искусственно модифицированы. Консенсусная аминокислотная последовательность может быть определена на основе анализа с выравниванием двух или более CDR.
Термин "антитело" также включает антигенсвязывающие фрагменты полноразмерных молекул антител. Термины "антигенсвязывающая часть" антитела, "антигенсвязывающий фрагмент" антитела и т.п., при использовании в настоящем описании, включают любой природный, получаемый при обработке ферментами, синтетический или полученный генно-инженерными методами полипептид или гликопротеин, который специфично связывается с антигеном, формируя комплекс. Антигенсвязывающие фрагменты антитела могут быть получены, например, из полноразмерных молекул антител, при использовании любых подходящих стандартных методов, таких как протеолитическое расщепление или рекомбинантных методов генной инженерии, включающих манипуляцию и экспрессию ДНК, кодирующей вариабельные и, необязательно константные домены антитела. Такая ДНК известна и/или может быть легко получена, например, из коммерческих источников, библиотек ДНК (в том числе, например, фаговых библиотек антител), или может быть синтезирована. ДНК можно секвенировать и подвергать манипуляциям с использованием химических методов или методов молекулярной биологии, например, размещать один или более вариабельных и/или константных доменов в нужной конфигурации или вводить кодоны, создавать цистеиновые остатки, модифицировать, добавлять или удалять аминокислоты и т.д.
Неограничивающие примеры антигенсвязывающих фрагментов включают: (i) Fab фрагменты; (ii) F(ab')2 фрагменты; (iii) Fd фрагменты; (iv) Fv фрагменты; (v) одноцепочечные Fv (scFv) молекулы; (vi) dAb фрагменты; и (vii) минимальные распознающие единицы, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область антитела (например, выделенная определяющая комплементарность область (CDR), такая как пептид CDR3), или конформационно ограниченный пептид FR3-CDR3-FR4. Другие сконструированные молекулы, такие как домен-специфичные антитела, однодоменные антитела, антитела с удаленными доменами, химерные антитела, CDR-привитые антитела, диатела, триатела, тетратела, минитела, нанотела (например, моновалентные нанотела, бивалентные нанотела и т.д.), малые модульные иммунофармацевтические средства (SMIP) и вариабельные домены IgNAR иммуноглобулинов акул, также охвачены выражением "антигенсвязывающий фрагмент".
Антигенсвязывающий фрагмент антитела обычно включает по меньшей мере один вариабельный домен. Вариабельный домен может иметь любой размер или аминокислотный состав и обычно включает по меньшей мере одну CDR, которая примыкает или находится в рамке считывания с одной или более каркасными последовательностями. В антигенсвязывающих фрагментах, в которых VH домен соединен с VL доменом, VH и VL домены могут быть расположены относительно друг друга в любой подходящей конфигурации. Например, вариабельная область может быть димерной и содержать VH-VH, VH-VL или VL-VL димеры. В альтернативе антигенсвязывающий фрагмент антитела может содержать мономерный VH или VL домен.
В некоторых вариантах осуществления антигенсвязывающий фрагмент антитела может содержать по меньшей мере один вариабельный домен, ковалентно связанный по меньшей мере с одним константным доменом. Неограничивающие, примерные конфигурации вариабельных и константных доменов, которые могут присутствовать в антигенсвязывающем фрагменте антитела настоящего изобретения, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (V) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; и (xiv) VL-CL. В любой конфигурации вариабельных и константных доменов, включая любую из указанных выше примерных конфигураций, вариабельные и константные домены могут быть либо связаны друг с другом непосредственно, либо могут быть связаны через полноразмерную или неполную шарнирную или линкерную область. Шарнирная область может состоять по меньшей мере из 2 (например, 5, 10, 15, 20, 40, 60 или больше) аминокислот, что дает гибкую или полугибкую связь между сопряженными вариабельными и/или константными доменами в одной полипептидной молекуле, предпочтительно шарнирная область может состоять из 2-60 аминокислот, предпочтительно 5-50 или предпочтительно 10-40 аминокислот. Кроме того, антигенсвязывающий фрагмент антитела настоящего изобретения может включать гомодимер или гетеродимер (или другие мультимеры) с любой из конфигураций вариабельных и константных доменов, указанных выше, в нековалентной ассоциации друг с другом и/или с одним или более мономерными VH или VL доменами (например, через дисульфидную связь (связи)).
Как и в случае с полноразмерными молекулами антител, антигенсвязывающие фрагменты могут быть моноспецифичными или мультиспецифичными (например, биспецифичными). Мультиспецифичный антигенсвязывающий фрагмент антитела обычно включает по меньшей мере два различных вариабельных домена, где каждый вариабельный домен способен специфично связываться с отдельным антигеном или с определенным эпитопом на одном антигене. Любой мультиспецифичный формат антитела может быть адаптирован для применения в рамках антигенсвязывающего фрагмента антитела изобретения при использовании стандартных способов, доступных в уровне техники.
Константная область антитела важна по отношению к способности антитела связывать комплемент и опосредовать клеточно-зависимую цитотоксичность. Таким образом, изотип антитела может быть выбран на основе того, желательно ли, чтобы антитело опосредовало цитотоксичность.
Термин "антитело человека" включает антитела, имеющие вариабельные и константные области, которые получены из человеческих зародышевых иммуноглобулиновых последовательностей. Антитела человека, представленные в изобретении, могут, тем не менее, включать аминокислотные остатки, не кодируемые человеческими зародышевыми иммуноглобулиновыми последовательностями (например, мутации, введенные с помощью случайного или сайт-специфического мутагенеза in vitro или соматической мутации in vivo), например, в CDR и, в частности, CDR3. Впрочем, термин "антитело человека" не включает антитела, в которых последовательности CDR, полученные из зародышевой линии млекопитающего другого вида, например, мыши, были привиты на человеческие каркасные последовательности.
Термин "рекомбинантное антитело человека" включает все человеческие антитела, которые получены, экспрессированы, созданы или выделены с помощью рекомбинантных средств, например, антитела, экспрессированные при использовании рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина (дополнительно описанные ниже), антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител (дополнительно описанные ниже), антитела, выделенные из животного (например, мыши), которое является трансгенным по человеческим генам иммуноглобулина (см. например, Taylor et al., (1992) Nucl. Acids Res. 20:6287-6295), или антитела полученные, экспрессированные, созданные или выделенные любым другим способом, который включает объединение последовательностей генов иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела содержат вариабельные и константные области, которые получены из человеческих зародышевых иммуноглобулиновых последовательностей. Впрочем, в некоторых вариантах осуществления такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, в случае использования животного, трансгенного по последовательностям Ig человека, in vivo соматическому мутагенезу), и, таким образом, аминокислотные последовательности VH и VL областей рекомбинантных антител являются последовательностями, которые хотя и были получены из последовательностей человеческих зародышевых VH и VL и связаны с ними, могут не существовать в репертуаре человеческих зародышевых антител in vivo.
Человеческие антитела могут существовать в двух формах, которые связаны с гетерогенностью шарнирной области. В одной из форм молекула иммуноглобулина включает стабильную четырехцепочечную конструкцию массой приблизительно 150-160 кДа, в которой димеры удерживаются вместе дисульфидной связью между тяжелыми цепями. Во второй форме димеры не связаны межцепочечными дисульфидными связями, при этом образуется молекула массой приблизительно 75-80 кДа, состоящая из ковалентно связанных легкой и тяжелой цепей (полуантитело). Такие формы было чрезвычайно сложно разделить, даже после аффинной очистки.
Частота образования второй формы в различных интактных изотипах IgG обусловлена, без ограничения, структурными различиями, связанными с шарнирной областью изотипа антитела. Единственная аминокислотная замена в шарнирной области человеческого IgG4 может значительно уменьшить образование второй формы (Angal et al. (1993) Molecular Immunology 30:105) до уровней, обычно наблюдаемых при использовании шарнира IgG1 человека. Настоящее изобретение охватывает антитела, имеющие одну или более мутаций в шарнирной, CH2 или CH3 области, которая может быть желательной, например, при получении, для повышения выхода требуемой формы антитела.
"Выделенное антитело" означает антитело, которое было идентифицировано и отделено и/или изолировано по меньшей мере от одного компонента его естественного окружения. Например, антитело, которое было отделено или удалено по меньшей мере от одного компонента организма, или из ткани или клетки, в которой антитело существует или вырабатывается в естественных условиях, является "выделенным антителом" в рамках настоящего изобретения. Выделенное антитело также включает антитело in situ в рекомбинантной клетке. Выделенные антитела являются антителами, которые были подвергнуты по меньшей мере одной стадии очистки или выделения. Согласно некоторым вариантам осуществления, выделенное антитело может по существу не содержать другого клеточного материала и/или химических соединений.
Термин "специфично связывает" или подобный означает, что антитело или его антигенсвязывающий фрагмент образуют комплекс с антигеном, который является относительно устойчивым в физиологических условиях. Методы определения, связывается ли антитело с антигеном специфично, известны в уровне техники и включают, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Например, антитело, которое "специфично связывает" IL-4R, при использовании в рамках настоящего изобретения, включает антитела, которые связывают IL-4R или его часть с KD меньше чем приблизительно 1000 нМ, меньше чем приблизительно 500 нМ, меньше чем приблизительно 300 нМ, меньше чем приблизительно 200 нМ, меньше чем приблизительно 100 нМ, меньше чем приблизительно 90 нМ, меньше чем приблизительно 80 нМ, меньше чем приблизительно 70 нМ, меньше чем приблизительно 60 нМ, меньше чем приблизительно 50 нМ, меньше чем приблизительно 40 нМ, меньше чем приблизительно 30 нМ, меньше чем приблизительно 20 нМ, меньше чем приблизительно 10 нМ, меньше чем приблизительно 5 нМ, меньше чем приблизительно 4 нМ, меньше чем приблизительно 3 нМ, меньше чем приблизительно 2 нМ, меньше чем приблизительно 1 нМ или меньше чем приблизительно 0,5 нМ, при измерении с помощью анализа на основе поверхностного плазмонного резонанса. Выделенное антитело, которое специфично связывает человеческий IL-4R, может, впрочем, обладать перекрестной реактивностью по отношению к другим антигенам, таким как молекулы IL-4R из других биологических видов (кроме человека).
Антитела против IL-4R, применимые в способах изобретения, могут включать одну или более аминокислотных замен, вставок и/или делеций (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 замен и/или 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 вставок и/или 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 делеций) в каркасных и/или CDR областях вариабельных доменов тяжелой и легкой цепи по сравнению с соответствующими зародышевыми последовательностями, из которых были получены антитела. Такие мутации могут быть с легкостью выявлены при сравнении аминокислотных последовательностей, раскрытых в настоящем описании, с зародышевыми последовательностями, доступными, например, в общих базах данных последовательностей антител. Изобретение включает способы, включающие применение антител и их антигенсвязывающих фрагментов, которые получены из любой аминокислотной последовательности, раскрытой в настоящем описании, где одна или более аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) в одной или более каркасных и/или одной или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 в отношении тетрамерного антитела или 1, 2, 3, 4, 5 или 6 в отношении HCVR и LCVR антитела) CDR областей подвергнуты мутации с заменой на соответствующий остаток(и) зародышевой последовательности, из которой антитело было получено, или на соответствующий остаток(и) другой человеческой зародышевой последовательности, или подвергнуты консервативной аминокислотной замене на соответствующий зародышевый остаток(и) (такие изменения последовательности совокупно указаны в настоящей заявке как "зародышевые мутации"). Средний специалист в данной области, начиная с последовательностей вариабельных областей тяжелых и легких цепей, раскрытых в настоящей заявке, может легко получить многочисленные антитела и антигенсвязывающие фрагменты, которые включают одну или более индивидуальных зародышевых мутаций или их комбинации. В некоторых вариантах осуществления все каркасные и/или CDR остатки в VH и/или VL доменах подвергнуты мутации с обратной заменой на остатки, присутствующие в исходной зародышевой последовательности, из которой было получено антитело. В других вариантах осуществления лишь некоторые остатки подвергнуты мутации с обратной заменой на остатки из исходной зародышевой последовательности, например, только мутированные остатки, присутствующие в пределах первых 8 аминокислот FR1 или в пределах последних 8 аминокислот FR4, или только мутированные остатки, присутствующие в CDR1, CDR2 или CDR3. В других вариантах осуществления один или более каркасных и/или CDR остатков подвергнуты мутации с заменой на соответствующий остаток(и) другой зародышевой последовательности (то есть зародышевой последовательности, которая отличается от зародышевый последовательности, из которой было первоначально получено антитело). Кроме того, антитела настоящего изобретения могут содержать любую комбинацию двух или более зародышевых мутаций в каркасных и/или CDR областях, например, где определенные индивидуальные остатки подвергнуты мутации с заменой на соответствующий остаток конкретной зародышевой последовательности, тогда как некоторые другие остатки, которые отличаются от исходной зародышевой последовательности, сохранены или подвергнуты мутации с заменой на соответствующий остаток другой зародышевой последовательности. После получения, антитела и антигенсвязывающие фрагменты, которые содержат одну или более зародышевых мутаций, могут быть легко проверены на наличие одного или более требуемых свойств, таких как повышенная специфичность связывания, увеличенная аффинность связывания, повышенные или улучшенные антагонистические или агонистические биологические свойства (в зависимости от обстоятельств), пониженная иммуногенность и т.д. Применение антител и антигенсвязывающих фрагментов, полученных таким общим способом, входит в объем настоящего изобретения.
Изобретение также включает способы, включающие применение антител против IL-4R, включающих варианты любой из аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрытых в настоящей заявке, которые содержат одну или более консервативных замен. Например, изобретение включает применение антител против IL-4R, имеющих аминокислотные последовательности HCVR, LCVR и/или CDR, например, с 10 или меньше, 8 или меньше, 6 или меньше, 4 или меньше и т.д. консервативными аминокислотными заменами в сравнении с любой из раскрытых в настоящей заявке аминокислотных последовательностей HCVR, LCVR и/или CDR.
Термин "поверхностный плазмонный резонанс" относится к оптическому явлению, которое позволяет проводить анализ взаимодействий в реальном времени при обнаружении изменений концентраций белка в матрице биосенсора, например, при использовании системы BIAcore™ (Biacore Life Sciences, подразделение GE Healthcare, Piscataway, NJ).
Термин "KD" относится к равновесной константе диссоциации конкретного взаимодействия антигена-антитела.
Термин "эпитоп" относится к антигенной детерминанте, которая взаимодействует со специфическим антигенсвязывающим сайтом в вариабельной области молекулы антитела, который известен как паратоп. Один антиген может иметь больше одного эпитопа. Таким образом, различные антитела могут связываться с различными областями на антигене и могут производить различные биологические эффекты. Эпитопы могут быть конформационными или линейными. Конформационный эпитоп образуют пространственно сближенные аминокислоты из различных сегментов линейной полипептидной цепи. Линейный эпитоп формируют смежные аминокислотные остатки в полипептидной цепи. При некоторых обстоятельствах эпитоп на антигене может включать сахаридные группы, фосфорильные группы или сульфонильные группы.
Получение антител человека
Методы получения человеческих антител в трансгенных мышах известны из уровня техники. Любые подобные известные методы могут применяться в рамках изобретения для получения человеческих антител, которые специфично связываются с человеческим IL-4R.
С применением технологии VELOCIMMUNE™ (см., например, US 6596541, Regeneron Pharmaceuticals) или любого другого известного метода получения моноклональных антител, первоначально выделяют высокоаффинные химерные антитела к IL-4R, которые имеют человеческую вариабельную область и мышиную константную область. Технология VELOCIMMUNE® включает создание трансгенной мыши, геном которой включает вариабельные области тяжелой и легкой цепей человека, функционально связанные с эндогенными локусами константных областей мыши таким образом, что в ответ на стимуляцию антигеном мышь вырабатывает антитело, содержащее человеческую вариабельную область и мышиную константную область. ДНК, кодирующую вариабельные области тяжелой и легкой цепей антитела, выделяют, и функционально связывают с ДНК, кодирующей константные области тяжелой и легкой цепей человека. Затем ДНК экспрессируется в клетке, способной экспрессировать полностью человеческое антитело.
Как правило, мышь VELOCIMMUNE® стимулируют целевым антигеном, после чего у мышей выделяют лимфатические клетки (такие как B-клетки), которые экспрессируют антитела. Лимфатические клетки могут быть слиты с линией клеток миеломы для получения иммортализованных линий клеток гибридом, после чего такие линии клеток гибридом подвергают скринингу и отбору с целью идентификации линий клеток гибридом, которые продуцируют антитела, специфичные к целевому антигену. ДНК, кодирующая вариабельные области тяжелой цепи и легкой цепи, может быть выделена и связана с требуемыми изотипическими константными областями тяжелой цепи и легкой цепи. Такой белок антитела может продуцироваться в клетке, такой как клетка CHO. В альтернативе, ДНК, кодирующая антиген-специфичные химерные антитела или вариабельные домены легкой и тяжелой цепей, может быть выделена непосредственно из антиген-специфичных лимфоцитов.
Первоначально выделяют высокоаффинные химерные антитела, имеющие человеческую вариабельную область и мышиную константную область. Антитела анализируют и отбирают по требуемым свойствам, включающим аффинность, селективность, эпитоп и т.д., используя стандартные методики, известные специалистам. Мышиные константные области заменяют требуемой человеческой константной областью, получая полностью человеческое антитело, представленное в изобретении, например, IgG1 или IgG4 дикого типа или модифицированный. Хотя выбранная константная область может быть различной в зависимости от конкретного применения, такие характеристики, как высокоаффинное связывание антигена и специфичность к мишени, присущи вариабельной области.
Как правило, антитела, которые могут применяться в способах изобретения, обладают высокими аффинностями, как описано выше, при измерении посредством связывания с антигеном, который либо иммобилизован на твердой фазе, либо находится в фазе раствора. Мышиные константные области заменяют требуемыми человеческими константными областями с получением полностью человеческих антител, представленных в изобретении. Хотя выбранная константная область может быть различной в зависимости от конкретного применения, такие характеристики, как высокоаффинное связывание антигена и специфичность к мишени, присущи вариабельной области.
Определенные примеры человеческих антител или антигенсвязывающих фрагментов антител, которые специфично связывают IL-4R, которые могут применяться в рамках способов настоящего изобретения, включают любое антитело или антигенсвязывающий фрагмент, которые включают три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в вариабельной области тяжелой цепи (HCVR), имеющей аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 2, 18, 22, 26, 42, 46, 50, 66, 70, 74, 90, 94, 98, 114, 118, 122, 138, 142, 146, 162, 166, 170, 186, 190, 194, 210, 214, 218, 234, 238, 242, 258 и 262. Антитело или антигенсвязывающий фрагмент могут включать три CDR легкой цепи (LCVR1, LCVR2, LCVR3), содержащиеся в вариабельной области легкой цепи (LCVR), имеющей аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 10, 20, 24, 34, 44, 48, 58, 68, 72, 82, 92, 96, 106, 116, 120, 130, 140, 144, 154, 164, 168, 178, 188, 192, 202, 212, 216, 226, 236, 240, 250, 260 и 264. Способы и методики идентификации CDR в аминокислотных последовательностях HCVR и LCVR известны в уровне техники и могут использоваться для идентификации CDR в указанных аминокислотных последовательностях HCVR и/или LCVR, раскрытых в настоящей заявке. Примерные правила, которые могут использоваться для установления границ CDR, включают, например, определение Кэбата, определение Чотиа и определение AbM. В общих виде, определение Кэбата основано на вариабельности последовательности, определение Чотиа основано на местоположении областей структурных петель, и определение AbM является компромиссом между подходами Кэбата и Чотиа. См., например, Kabat, "Sequences of Proteins of Immunological Interest," National Institutes of Health, Bethesda, Md. (1991); Al-Lazikani et al., J. Mol. Biol. 273:927-948 (1997); и Martin et al., Proc. Natl. Acad. Sci. USA 86:9268-9272 (1989). Также доступны общие базы данных для идентификации последовательностей CDR в антителе.
В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент включают шесть CDR (HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3) из пар аминокислотных последовательностей вариабельных областей тяжелой и легкой цепей (HCVR/LCVR), выбранных из группы, состоящей из SEQ ID NO: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260 и 262/264.
В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент включают шесть CDR (HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3), имеющих аминокислотные последовательности, которые выбраны из группы, состоящей из SEQ ID NO: 4/6/8/12/14/16; 28/30/32/36/38/40; 52/54/56/60/62/64; 76/78/80/84/86/88; 100/102/104/108/110/112; 124/126/128/132/134/136; 148/150/152/156/158/160; 172/174/176/180/182/184; 196/198/200/204/206/208; 220/222/224/228/230/232; и 244/246/248/252/254/256.
В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент включают пары аминокислотных последовательностей HCVR/LCVR, выбранные из группы, состоящей из SEQ ID NO: 2/10, 18/20, 22/24, 26/34, 42/44, 46/48, 50/58, 66/68, 70/72, 74/82, 90/92, 94/96, 98/106, 114/116, 118/120, 122/130, 138/140, 142/144, 146/154, 162/164, 166/168, 170/178, 186/188, 190/192, 194/202, 210/212, 214/216, 218/226, 234/236, 238/240, 242/250, 258/260 и 262/264.
Фармацевтические композиции
Изобретение включает способы, которые включают введение антагониста IL-4R пациенту, где антагонист IL-4R содержится в фармацевтической композиции. Фармацевтические композиции, представленные в изобретении, изготавливают с подходящими носителями, вспомогательными веществами и другими средствами, которые обеспечивают подходящий перенос, доставку, переносимость и т.п. Множество подходящих составов можно найти в справочнике, известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Эти составы включают, например, порошки, пасты, мази, желе, воска, масла, липиды, содержащие липид (катионный или анионный) везикулы (такие как LIPOFECTIN™), ДНК-конъюгаты, безводные абсорбирующие пасты, эмульсии "масло в воде" и "вода в масле", эмульсии карбовакс (полиэтиленгликоли с различной молекулярной массой), полутвердые гели и полутвердые смеси, содержащие карбовакс. См. также Powell et al., "Compendium of excipients for parenteral formulations", PDA (1998) J. Pharm. Sci. Technol., 52:238-311.
Доза антитела, которое вводят пациенту согласно способам изобретения, может изменяться в зависимости от возраста и веса пациента, симптомов, состояний, пути введения и т.п. Предпочтительную дозу обычно вычисляют в соответствии с массой тела или площадью поверхности тела. В зависимости от тяжести состояния может быть скорректирована частота и продолжительность терапии. Эффективные дозы и схемы введения фармацевтических композиций, включающих антитела против IL-4R, могут быть определены опытным путем; например, изменение состояния пациента можно отслеживать при периодическом обследовании и в зависимости от этого корректировать дозу. Кроме того, межвидовой перевод дозировок может быть выполнен при использовании известных методов (например, Mordenti et al., 1991, Pharmaceut. Res. 8:1351).
Различные системы доставки известны и могут использоваться для введения фармацевтических композиций, представленных в изобретении, например, включение в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, рецептор-опосредованный эндоцитоз (см., например, Wu et al., 1987, J. Biol. Chem. 262:4429-4432). Способы введения включают, без ограничения перечисленными, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, внутритрахеальный, перидуральный и пероральный пути. Композицию можно вводить любым удобным путем, например, инфузией или болюсной инъекцией, посредством абсорбции через эпителиальные или слизисто-кожные выстилки (например, слизистую оболочку ротовой полости, слизистую оболочку прямой кишки и кишечника и т.д.), и можно вводить вместе с другими биологически активными средствами.
Фармацевтическую композицию изобретения можно доставлять подкожно или внутривенно при помощи стандартной иглы и шприца. Кроме того, в отношении подкожной доставки, шприц-ручка может легко применяться при доставке фармацевтической композиции изобретения. Такая шприц-ручка может быть многоразового или одноразового применения. В шприц-ручке многоразового применения обычно используется сменный картридж, который содержит фармацевтическую композицию. После полного введения всей фармацевтической композиции в картридже, пустой картридж можно выбросить и заменить новым картриджем, который содержит фармацевтическую композицию. Шприц-ручку можно затем многократно использовать. В одноразовой шприц-ручке сменный картридж отсутствует. Вместо этого одноразовая шприц-ручка поставляется предварительно заполненной фармацевтической композицией, которая содержится в резервуаре внутри шприц-ручки. После того как фармацевтическая композиция в резервуаре кончается, все устройство выбрасывают.
Множество ручек многоразового применения и автоинъекторных устройств могут применяться при подкожной доставке фармацевтической композиции изобретения. Примеры включают, без ограничения, AUTOPEN™ (Owen Mumford, Inc., Woodstock, UK), ручку DISETRONIC™ (Disetronic Medical Systems, Bergdorf, Switzerland), ручку HUMALOG MIX 75/25™, ручку HUMALOG™, ручку HUMALIN 70/30™ (Eli Lilly and Co., Indianapolis, IN), NOVOPEN™ I, II и III (Novo Nordisk, Copenhagen, Denmark), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Denmark), ручку BD™ (Becton Dickinson, Franklin Lakes, NJ), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (sanofi-aventis, Frankfurt, Germany), и это лишь немногие из них. Примеры одноразовых шприц-ручек, которые могут применяться при подкожной доставке фармацевтической композиции настоящего изобретения, включают, без ограничения, ручку SOLOSTAR™ (Sanofi-Aventis), FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (Eli Lilly), автоинъектор SURECLICK™ (Amgen, Thousand Oaks, CA), PENLET™ (Haselmeier, Stuttgart, Germany), EPIPEN (Dey, L.P.) и ручку HUMIRA™ (Abbott Labs, Abbott Park IL), и это также лишь немногие из них.
В случае прямого введения в пазухи, фармацевтические композиции изобретения можно вводить при использовании, например, микрокатетера (например, эндоскопа и микрокатетера), аэрозольного генератора, дозатора порошка, небулайзера или ингалятора. Способы включают введение антагониста IL-4R субъекту, нуждающемуся в этом, в аэрозольной форме. Например, антителами к IL-4R в форме аэрозоля можно вводить для лечения астмы у пациента. Антитела в форме аэрозоля могут быть изготовлены, как описано, например, US 8178098, который полностью включен в настоящее описание.
В некоторых ситуациях фармацевтическую композицию можно доставлять в системе с контролируемым высвобождением. В одном варианте осуществления может использоваться насос (см. Langer, выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:201). В другом варианте осуществления могут использоваться полимерные материалы; см., Medical Applications of Controlled Release, Langer and Wise (eds.), 1974, CRC Pres., Boca Raton, Florida. В еще одном варианте осуществления система с контролируемым высвобождением может быть помещена вблизи от мишени композиции, что требует введения лишь некоторой части системной дозы (см., например, Goodson, 1984, в Medical Applications of Controlled Release, выше, том 2, стр. 115-138). Другие системы с контролируемым высвобождением обсуждаются в обзоре Langer, 1990, Science 249:1527-1533.
Препараты для инъекций могут включать лекарственные формы для внутривенных, подкожных, внутрикожных и внутримышечных инъекций, капельного вливания и т.д. Эти препараты для инъекций могут быть изготовлены известными методами. Например, препараты для инъекций могут быть изготовлены, например, посредством растворения, суспендирования или эмульгирования антитела или его соли, описанных выше, в стерильной водной среде или масляной среде, стандартно используемых для инъекций. В качестве водной среды для инъекций применяют, например, физиологический солевой раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные вещества, и т.д., который может использоваться в комбинации с соответствующим солюбилизатором, таким как спирт (например, этанол), полиспирт (например, пропиленгликоль, полиэтиленгликоль), неионное поверхностно-активное вещество [например, полисорбат 80, HCO-50 (аддукт полиоксиэтилена (50 моль) с гидрогенизированным касторовым маслом)] и т.д. В качестве масляной среды используют, например, кунжутное масло, соевое масло и т.д., которое может использоваться в комбинации с солюбилизатором, таким как бензилбензоат, бензиловый спирт и т.д. Препаратом для инъекций, изготовленным таким образом, предпочтительно заполняют подходящую ампулу.
Предпочтительно фармацевтические композиции для перорального или парентерального применения, описанные выше, изготавливают в виде лекарственных форм с единичной дозой, подходящих для регулирования дозы активных компонентов. Такие лекарственные формы с единичной дозой включают, например, таблетки, пилюли, капсулы, препараты для инъекций (ампулы), суппозитории и т.д.
Примеры фармацевтических композиций, включающих антитело против IL-4R, которые могут применяться в рамках изобретения, раскрыты, например, в публикации заявки на патент США 2012/0097565.
Дозировка
Количество антагониста IL-4R (например, антитела против IL-4R), вводимое субъекту согласно способам изобретения, является, как правило, терапевтически эффективным количеством. При использовании в настоящем описании, фраза "терапевтически эффективное количество" означает количество антагониста IL-4R, которое приводит к одному или более из следующего: (a) уменьшение частоты возникновения обострений астмы; (b) улучшение одного или более связанных с астмой параметров (как определено в другом месте в настоящем описании); и/или (c) обнаружимое улучшение одного или более симптомов или признаков воспалительного заболевания верхних дыхательных путей. "Терапевтически эффективное количество" также включает такое количество антагониста IL-4R, которое ингибирует, предотвращает, уменьшает или задерживает прогрессию астмы у субъекта.
В случае антитела против IL-4R, терапевтически эффективное количество может составлять от приблизительно 0,05 мг до приблизительно 600 мг, например, приблизительно 0,05 мг, приблизительно 0.1 мг, приблизительно 1,0 мг, приблизительно 1,5 мг, приблизительно 2,0 мг, приблизительно 3,0 мг, приблизительно 5,0 мг, приблизительно 7,0 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 460 мг, приблизительно 470 мг, приблизительно 480 мг, приблизительно 490 мг, приблизительно 500 мг, приблизительно 510 мг, приблизительно 520 мг, приблизительно 530 мг, приблизительно 540 мг, приблизительно 550 мг, приблизительно 560 мг, приблизительно 570 мг, приблизительно 580 мг, приблизительно 590 мг или приблизительно 600 мг антитела против IL-4R. В некоторых вариантах осуществления вводят 300 мг антитела против IL-4R.
Количество антагониста IL-4R, содержащегося в индивидуальных дозах, может быть выражено в миллиграммах антитела на килограмм массы тела пациента (то есть мг/кг). Например, антагонист IL-4R можно вводить пациенту в дозе от приблизительно 0,0001 до приблизительно 10 мг/кг массы тела пациента.
Комбинированные терапии
Способы изобретения, согласно некоторым вариантам осуществления, включают введение субъекту одного или более дополнительных терапевтических средств в комбинации с антагонистом IL-4R. При использовании в настоящем описании, выражение "в комбинации с" означает, что дополнительные терапевтические средства вводят до, после или параллельно с фармацевтической композицией, включающей антагонист IL-4R. В некоторых вариантах осуществления термин "в комбинации с" включает последовательное или параллельное введение антагониста IL-4R и второго терапевтического средства. Настоящее изобретение включает способы лечения астмы или связанного состояния, или осложнения, или уменьшения по меньшей мере одного обострения, включающие введение антагониста IL-4R в комбинации со вторым терапевтическим средством для аддитивной или синергической активностью.
Например, при введении "до" фармацевтической композиции, включающей антагонист IL-4R, дополнительное терапевтическое средство можно вводить за приблизительно 72 часа, приблизительно 60 часов, приблизительно 48 часов, приблизительно 36 часов, приблизительно 24 часа, приблизительно 12 часов, приблизительно 10 часов, приблизительно 8 часов, приблизительно 6 часов, приблизительно 4 часа, приблизительно 2 часа, приблизительно 1 час, приблизительно 30 минут, приблизительно 15 минут или за приблизительно 10 минут до введения фармацевтической композиции, включающей антагонист IL-4R. При введении "после" фармацевтической композиции, включающей антагонист IL-4R, дополнительное терапевтическое средство можно вводить через приблизительно 10 минут, приблизительно 15 минут, приблизительно 30 минут, приблизительно 1 час, приблизительно 2 часа, приблизительно 4 часа, приблизительно 6 часов, приблизительно 8 часов, приблизительно 10 часов, приблизительно 12 часов, приблизительно 24 часа, приблизительно 36 часов, приблизительно 48 часов, приблизительно 60 часов или через приблизительно 72 часа после введения фармацевтической композиции, включающей антагонист IL-4R. Введение "параллельно" с фармацевтической композицией, включающей антагонист IL-4R, подразумевает, что дополнительное терапевтическое средство вводят субъекту в отдельной лекарственной форме в пределах менее чем 5 минут (до, после или в то же время) от введения фармацевтической композиции, включающей антагонист IL-4R, или вводят субъекту в виде одной комбинированной лекарственной формы, включающей и дополнительное терапевтическое средство, и антагонист IL-4R.
Дополнительное терапевтическое средство может быть, например, другим антагонистом IL-4R, антагонистом IL-1 (включая, например, антагонист IL-1, как изложено в патенте США 6,927,044), антагонистом IL-6, антагонистом IL-6R (включая, например, антитело против IL-6Р, как изложено в патенте США 7,582,298), антагонистом ФНО, антагонистом IL-8, антагонистом IL-9, антагонистом IL-17, антагонистом IL-5, антагонистом IgE, антагонистом CD48, ингибитором лейкотриена, противогрибковым средством, НПВС, бета2-агонистом длительного действия (например, салметеролом или формотеролом), ингаляционным кортикостероидом (например, флутиказоном или будесонидом), системным кортикостероидом (например, пероральным или внутривенным), метилксантином, недокромилом натрия, кромолином натрия или их комбинациями. Например, в некоторых вариантах осуществления фармацевтическую композицию, включающую антагонист IL-4R, вводят в комбинации с комбинацией, включающей бета2-агонист длительного действия и ингаляционный кортикостероид (например, флутиказон + салметерол [например, Адваир® (GlaxoSmithKline)]; или будесонид + формотерол [например, Симбикорт® (Astra Zeneca))]).
Схемы введения
Согласно некоторым вариантам осуществления изобретения, многократные дозы антагониста IL-4R можно вводить субъекту в течение определенного периода времени. Такие способы включают последовательное введение субъекту многократных доз антагониста IL-4R. При использовании в настоящем описании, "последовательное введение" означает, что каждую дозу антагониста IL-4R вводят субъекту в различные моменты времени, например, в различные дни, разделенные заданным интервалом (например, часами, днями, неделями или месяцами). Настоящее изобретение включает способы, которые включают последовательное введение пациенту одну начальную дозу антагониста IL-4R с последующим введением одной или более вторичных доз антагониста IL-4R и, необязательно, с последующим введением одной или более третичных доз антагониста IL-4R.
Изобретение включает способы, включающие введение субъекту фармацевтической композиции, включающей антагонист IL-4R, с частотой введения приблизительно четыре раза в неделю, два раза в неделю, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в восемь недель, один раз в двенадцать недель или реже, пока не будет достигнут терапевтический ответ. В некоторых вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в неделю дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в две недели дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в три недели дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в четыре недели дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в пять недель дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в шесть недель дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в восемь недель дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. В других вариантах осуществления, включающих введение фармацевтической композиции, включающей антитело против IL-4R, может использоваться введение один раз в двенадцать недель дозы в количестве приблизительно 75 мг, 150 мг или 300 мг. Предпочтительный путь введения является подкожным.
Термин "неделя" или "недели" относится к периоду (n×7 дней) ± 2 дня, предпочтительно (n×7 дней)±1 день, более предпочтительно (n×7 дней), где "n" определяет число недель, например, 1, 2, 3, 4, 5, 6, 8, 12 или больше.
Термины "начальная доза", "вторичная доза" и "третичная доза" относятся к временной последовательности введения антагониста IL-4R. Таким образом, "начальная доза" является дозой, которую вводят в начале схемы лечения (также ее называют "исходной дозой"); "вторичные дозы" являются дозами, которые вводят после начальной дозы; и "третичные дозы" являются дозами, которые вводят после вторичных доз. Начальные, вторичные и третичные дозы могут содержать одинаковое количество антагониста IL-4R, но обычно могут отличаться друг от друга по частоте введения. Впрочем, в некоторых вариантах осуществления, количество антагониста IL-4R, содержащегося в начальной, вторичной и/или третичной дозах, различается (например, его увеличивают или снижают, при необходимости) в ходе лечения. В некоторых вариантах осуществления, две или более (например, 2, 3, 4 или 5) доз вводят в начале схемы лечения в качестве "насыщающих доз", сопровождаемых последующими дозами, которые вводят с меньшей частотой (например, "поддерживающие дозы"). В одном варианте осуществления поддерживающая доза может быть меньше насыщающей дозы. Например, можно вводить одну или более 600 мг насыщающих доз антагониста IL-4R с последующим введением поддерживающих дозами от приблизительно 75 мг до приблизительно 300 мг.
В одном примере осуществления изобретения каждую вторичную и/или третичную дозу вводят через 1-14 (например, через 1, 1½, 2, 2½, 3, 3½, 4, 4½, 5, 5½, 6, 6½, 7, 7½, 8, 8½, 9, 9½, 10, 10½, 1 1, 11½, 12, 12½, 13, 13½, 14, 14½ или больше) недель после непосредственно предшествующей дозы. Фраза "непосредственно предшествующая доза" означает, в последовательности многократных введения, дозу антагониста IL-4R, которую вводят пациенту до введения ближайшей последующей дозы в последовательности, без введения промежуточных доз.
Способы могут включать введение пациенту любого количества вторичных и/или третичных доз антагониста IL-4R. Например, в некоторых вариантах осуществления пациенту вводят только одну вторичную дозу. В других вариантах осуществления пациенту вводят две или более (например, 2, 3, 4, 5, 6, 7, 8 или больше) вторичных доз. Аналогично, в некоторых вариантах осуществления пациенту вводят только одну третичную дозу. В других вариантах осуществления пациенту вводят две или более (например, 2, 3, 4, 5, 6, 7, 8 или больше) третичных доз.
В вариантах осуществления, включающих многократные вторичные дозы, каждую вторичную дозу можно вводить с такой же частотой, что и другие вторичные дозы. Например, каждую вторичную дозу можно вводить пациенту через 1-2 недели после непосредственно предшествующей дозы. Аналогичным образом, в вариантах осуществления, включающих многократные третичные дозы, каждую третичную дозу можно вводить с такой же частотой, что и другие третичные дозы. Например, каждую третичную дозу можно вводить пациенту через 2-4 недели после непосредственно предшествующей дозы. В альтернативе, частота, с которой пациенту вводят вторичные и/или третичные дозы, в ходе лечения может изменяться. Частоту введения в ходе лечения также может корректировать врач в зависимости от потребностей индивидуального пациента после клинического обследования.
Изобретение включает способы, включающие последовательное введение антагониста IL-4R и второго терапевтического средства пациенту для лечения астмы или связанного состояния. В некоторых вариантах осуществления способы включают введение одной или более доз антагониста IL-4R с последующим введением одной или более доз (например, 2, 3, 4, 5, 6, 7, 8 или больше) второго терапевтического средства. Например, можно вводить одну или более доз от приблизительно 75 мг до приблизительно 300 мг антагониста IL-4R, после чего можно вводить одну или более доз (например, 2, 3, 4, 5, 6, 7, 8 или больше) второго терапевтического средства (например, ингаляционного кортикостероида или бета2-агониста, или любого другого терапевтического средства, как описано в другом месте в настоящей заявке) для лечения, частичного снятия, облегчения или уменьшения интенсивности одного или более симптомов астмы. В некоторых вариантах осуществления антагонист IL-4R вводят в одной или более дозах (например, 2, 3, 4, 5, 6, 7, 8 или больше), что приводит к улучшению одного или более связанных с астмой параметров, с последующим введением второго терапевтического средства для предотвращения рецидива по меньшей мере одного симптома астмы. Альтернативные варианты осуществления относятся к параллельному введению антагониста IL-4R и второго терапевтического средства. Например, вводят одну или более доз (например, 2, 3, 4, 5, 6, 7, 8 или больше) антагониста IL-4R, после чего второе терапевтическое средство вводят в отдельной дозе, с такой же или другой частотой по сравнению с антагонистом IL-4R. В некоторых вариантах осуществления второе терапевтическое средство вводят до, после или одновременно с антагонистом IL-4R.
Группы лечения
Способы изобретения включают введение субъекту, нуждающемуся в этом, терапевтической композиции, включающей антагонист IL-4R. Выражение "субъект, нуждающийся в этом" означает человека или не относящееся к человеку животное, у которых проявляется один или более симптомов или признаков астмы (например, эозинофильной астмы, включая умеренную - тяжелую эозинофильную астму), или у которых диагностировали астму. Например, "субъект, нуждающийся в этом" может включать, например, субъектов, которые до лечения демонстрируют (или демонстрировали) один или более связанных с астмой параметров, таких как, например, нарушенный ОФВ1 (например, меньше 2,0 л), нарушенный ПСВу (например, меньше 400 л/мин), нарушенный ПСВв (например, меньше 400 л/мин), оценка ACQ5 по меньшей мере 2,5, по меньшей мере 1 пробуждение за ночь, и/или оценка SNOT-22 по меньшей мере 20. В различных вариантах осуществления могут применяться способы лечения умеренной, умеренной - тяжелой и тяжелой астмы у пациентов, нуждающихся в этом.
В связанном варианте осуществления "субъект, нуждающийся в этом" может быть субъектом, которому до приема антагониста IL-4R был предписан прием, или который в настоящее время принимает, комбинацию ингаляционного кортикостероида (ИКС)/бета2-адренергического антагониста длительного действия (БАДД). Примеры терапии ИКС/БАДД включают комбинированную терапию флутиказоном/салметеролом и комбинированную терапию будесонидом/формотеролом. Например, изобретение включает способы, которые включают введение антагониста IL-4R пациенту, который проходил регулярный курс ИКС/БАДД в течение двух или более недель, непосредственно предшествующих введению антагониста IL-4R (такие предшествующие терапии именуются в настоящем описании как "базисные лечения"). Изобретение включает терапевтические способы, в которых базисные лечения приостанавливают во время или непосредственно перед (например, за 1 день - 2 недели перед) первым введением антагониста IL-4R. В альтернативе базисные лечения могут быть продолжены в комбинации с введением антагониста IL-4R. В других вариантах осуществления количество компонента ИКС, компонента БАДД или обоих компонентов постепенно уменьшают до или после начала введения антагониста IL-4R. В некоторых вариантах осуществления изобретение включает способы лечения пациентов с персистирующей астмой в течение по меньшей мере ≥12 месяцев. В одном варианте осуществления пациент с персистирующей астмой может быть резистентен к лечению таким терапевтическим средством, как кортикостероид, и при этом ему могут вводить антагонист IL-4R согласно настоящим способам.
В некоторых вариантах осуществления "субъект, нуждающийся в этом" может быть субъектом с повышенными уровнями связанного с астмой биомаркера. Примеры связанных с астмой биомаркеров включают, без ограничения перечисленными, IgE, тимусом и активацией регулируемый хемокин (TARC), эотаксин-3, РЭА, YKL-40 и периостин. В некоторых вариантах осуществления "субъект, нуждающийся в этом" может быть субъектом с уровнем эозинофилов в крови ≥300/мкл или с уровнем эозинофилов в мокроте ≥3%. В одном варианте осуществления "субъект, нуждающийся в этом" может быть субъектом с повышенным уровнем воспаления бронхов или дыхательных путей, согласно измерению фракционного выдыхаемого оксида азота (ФВОА).
В рамках изобретения нормальный уровень IgE у здоровых субъектов составляет меньше чем приблизительно 100 кЕд/л (например, при измерении с использованием теста ImmunoCAP® [Phadia, Inc. Portage, MI]). Таким образом, изобретение включает способы, включающие отбор субъекта, который демонстрирует повышенный уровень IgE сыворотки, который является уровнем IgE сыворотки больше чем приблизительно 100 кЕд/л, больше чем приблизительно 150 кЕд/л, больше чем приблизительно 500 кЕд/л, больше чем приблизительно 1000 кЕд/л, больше чем приблизительно 1500 кЕд/л, больше чем приблизительно 2000 кЕд/л, больше чем приблизительно 2500 кЕд/л, больше чем приблизительно 3000 кЕд/л, больше чем приблизительно 3500 кЕд/л, больше чем приблизительно 4000 кЕд/л, больше чем приблизительно 4500 кЕд/л или больше чем приблизительно 5000 кЕд/л, и введение субъекту фармацевтической композиции, включающей терапевтически эффективное количество антагониста IL-4R.
Уровни TARC у здоровых субъектов находятся в пределах от 106 нг/л до 431 нг/л, со средним значением приблизительно 239 нг/л (примером системы анализа для измерения уровня TARC является набор для количественного определения TARC методом ELISA, предоставляемый под номером DDN00 по каталогу R&D Systems, Minneapolis, MN). Таким образом, изобретение включает способы, включающие отбор субъекта, который демонстрирует повышенный уровень TARC, который является уровнем TARC в сыворотке больше чем приблизительно 431 нг/л, больше чем приблизительно 500 нг/л, больше чем приблизительно 1000 нг/л, больше чем приблизительно 1500 нг/л, больше чем приблизительно 2000 нг/л, больше чем приблизительно 2500 нг/л, больше чем приблизительно 3000 нг/л, больше чем приблизительно 3500 нг/л, больше чем приблизительно 4000 нг/л, больше чем приблизительно 4500 нг/л или больше чем приблизительно 5000 нг/л, и введение субъекту фармацевтической композиции, включающей терапевтически эффективное количество антагониста IL-4R.
Эотаксин-3 относится к группе хемокинов, секретируемых эпителиальными клетками дыхательных путей, и регулируется Th2 цитокинами IL-4 и IL-13 (Lilly et al., 1999, J. Allergy Clin. Immunol., 104:786-790). Изобретение включает способы, включающие введение антагониста IL-4R для лечения пациентов с повышенными уровнями эотаксина-3, например, больше чем приблизительно 100 пг/мл, больше чем приблизительно 150 пг/мл, больше чем приблизительно 200 пг/мл, больше чем приблизительно 300 пг/мл или больше чем приблизительно 350 пг/мл. Уровни эотаксин-3 в сыворотке можно измерить, например, с помощью ELISA.
Периостин является белком внеклеточного матрикса, участвующим в Th2-опосредованных воспалительных процессах. Уровни периостина, как было установлено, повышены у пациентов с астмой (Jia et al., 2012 J. Allergy Clin. Immunol., 130:647-654.e10. doi: 10.1016/j.jaci.2012.06.025. Epub 2012 Aug 1). Настоящее изобретение включает способы, включающие введение антагониста IL-4R для лечения пациентов с повышенными уровнями периостина.
Фракционный выдыхаемый NO (ФВОА) является биомаркером воспаления бронхов или дыхательных путей. ФВОА вырабатывается эпителиальными клетками дыхательных путей в ответ на воспалительные цитокины, включающие IL-4 и IL-13 (Alwing et al., 1993, Eur. Respir. J., 6:1368-1370). Уровни ФВОА у здоровых взрослых изменяются в пределах 2-30 миллиардных долей (млрд.д.). Примером анализа для измерения ФВОА является анализ с использованием аппарата NIOX (Aerocrine AB, Solna, Sweden). Оценку можно проводить до спирометрии и после воздержания от приема пищи, по меньшей мере в течение часа. Изобретение включает способы, включающие введение антагониста IL-4R пациентам с повышенными уровнями выдыхаемый NO (ФВОА), например, больше чем приблизительно 30 млрд.д., больше чем приблизительно 31 млрд.д., больше чем приблизительно 32 млрд.д., больше чем приблизительно 33 млрд.д., больше чем приблизительно 34 млрд.д. или больше чем приблизительно 35 млрд.д.
Раково-эмбриональный антиген (РЭА) является онкомаркером, который, как было установлено, коррелировал с не связанными с новообразованиями болезнями легких (Marechal et al 1988, Anticancer Res. 8: 677-680). Уровни РЭА в сыворотке могут быть измерены с помощью ELISA. Изобретение включает способы, включающие введение антагониста IL-4R пациентам с повышенными уровнями РЭА, например, больше чем приблизительно 1,0 нг/мл, больше чем приблизительно 1,5 нг/мл, больше чем приблизительно 2,0 нг/мл, больше чем приблизительно 2,5 нг/мл, больше чем приблизительно 3,0 нг/мл, больше чем приблизительно 4,0 нг/мл или больше чем приблизительно 5,0 нг/мл.
YKL-40 [названный по его N-концевым аминокислотам: тирозину (Y), лизину (K) и лейцину (L), и его молекулярной массе 40 кДа] представляет собой хитиназа-подобный белок, повышение уровня которого, как было обнаружено, коррелировало с обострением астмы, IgE и эозинофилами (Tang et al., 2010, Eur. Respir. J., 35:757-760). Уровни YKL-40 в сыворотке измеряют, например, с помощью ELISA. Изобретение включает способы, включающие введение антагониста IL-4R пациентам с повышенными уровнями YKL-40, например, больше чем приблизительно 40 нг/мл, больше чем приблизительно 50 нг/мл, больше чем приблизительно 100 нг/мл, больше чем приблизительно 150 нг/мл, больше чем приблизительно 200 нг/мл или больше чем приблизительно 250 нг/мл.
Эозинофилы и нейтрофилы в индуцированной мокроте являются известными прямыми маркерами воспаления дыхательных путей (Djukanovic et al., 2002, Eur. Respire. J., 37: 1S-2S). Отделение мокроты вызывают путем ингаляции над гипертоническим раствором хлорида натрия, а затем в мокроте подсчитывают клетки в соответствии с известными методами, например, согласно методическим указаниям Европейского Респираторного Общества. Изобретение включает способы, включающие введение антагониста IL-4R пациентам с повышенными уровнями эозинофилов в мокроте, например, больше чем приблизительно 2,5% или больше чем приблизительно 3%.
Способы оценки связанных с астмой фармакодинамических параметров
Изобретение также включает способы оценки одного или более связанных с астмой фармакодинамических параметров у субъекта, нуждающегося в этом, вызванных введением фармацевтической композиции, включающей антагонист рецептора интерлейкина 4 (IL-4R). Уменьшение частоты возникновения обострения астмы (как описано выше) или улучшения одного или более связанных с астмой параметров (как описано выше) может коррелировать с улучшением одного или более связанных с астмой фармакодинамических параметров, однако такая корреляция не должна обязательно соблюдаться во всех случаях.
Примеры "связанных с астмой фармакодинамических параметров" включают, например, следующее: (a) уровни экспрессии биомаркеров; (b) анализ белка сыворотки и РНК; (c) уровни эозинофилов и нейтрофилов в индуцированной мокроте; (d) выдыхаемый оксид азота (ФВОА); и (e) содержание эозинофилов в крови. "Улучшение связанного с астмой фармакодинамического параметра" означает, например, уменьшение относительно базового уровня одного или более биомаркеров, таких как TARC, эотаксин-3 или IgE, уменьшение эозинофилов или нейтрофилов в мокроте, ФВОА, или содержания эозинофилов крови. При использовании в настоящем описании, термин "базовый уровень", в отношении связанного с астмой фармакодинамического параметра, означает числовое значение связанного с астмой фармакодинамического параметра у пациента до или во время введения фармацевтической композиции, представленной в изобретении.
Для оценки связанного с астмой фармакодинамического параметра, параметр определяют количественно на базовом уровне и в момент времени после введения фармацевтической композиции настоящего изобретения. Например, связанный с астмой фармакодинамический параметр может быть измерен в день 1, день 2, день 3, день 4, день 5, день 6, день 7, день 8, день 9, день 10, день 11, день 12, день 14 или в неделю 3, неделю 4, неделю 5, неделю 6, неделю 7, неделю 8, неделю 9, неделю 10, неделю 1 1, неделю 12, неделю 13, неделю 14, неделю 15, неделю 16, неделю 17, неделю 18, неделю 19, неделю 20, неделю 21, неделю 22, неделю 23, неделю 24 или больше, после первоначального применения в лечении фармацевтической композиции настоящего изобретения. Различие между значением параметра в конкретной точке времени после начала лечения и значением параметра на базовом уровне используют для определения, имело ли место изменение, такое как "улучшение", связанного с астмой фармакодинамического параметра (например, увеличение или уменьшение, в зависимости от обстоятельств, в зависимости от определенного измеряемого параметра).
В некоторых вариантах осуществления введение антагониста IL-4R пациенту вызывает изменение, такое как уменьшение или увеличение, экспрессии конкретного биомаркера. Связанные с астмой биомаркеры включают следующее: (a) общий IgE; (b) тимусом и активацией регулируемый хемокин (TARC); (c) YKL-40 и (d) раково-эмбриональный антиген (РЭА (CEA), также известный как CEA молекула клеточной адгезии 5 [CEACAM5]) в сыворотке и (e) эотаксин-3 в плазме. Например, введение антагониста IL-4R пациенту с астмой может вызвать одно или более из уменьшения уровней TARC или эотаксина-3, или уменьшения уровней общего IgE сыворотки. Уменьшение может быть обнаружено в неделю 1, неделю 2, неделю 3, неделю 4, неделю 5 или более после введения антагониста IL-4R. Экспрессия биомаркера может быть проанализирована с помощью методов, известных в уровне техники. Например, уровни белка могут быть измерены с помощью ELISA (твердофазного иммуноферментного анализа), или уровни РНК могут быть измерены при помощи полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Экспрессия биомаркера, как обсуждается выше, может быть проанализирована посредством обнаружения белка или РНК в сыворотке. Образцы сыворотки также могут использоваться для контроля дополнительных белковых или РНК биомаркеров, связанных с ответом на терапию антагонистом IL-4R, IL-4/IL-13 сигнализацией, астмой, атопическими или эозинофильными заболеваниями (например, посредством измерения растворимого IL-4Rα, IL-4, IL-13, периостина). В некоторых вариантах осуществления образцы РНК используются для определения уровней РНК (негенетический анализ), например, уровней РНК биомаркеров; а в других вариантах осуществления образцы РНК используются для секвенирования транскриптомов (например, генетического анализа).
ПРИМЕРЫ
Следующие примеры предложены для предоставления средним специалистам полного раскрытия и описания того, как можно осуществить и применить способы и композиции, представленные в изобретении, и не должны ограничивать объем того, что авторы настоящего изобретения рассматривают в качестве своего изобретения. Были предприняты усилия по обеспечению точности в отношении используемых чисел (например, величин, температуры и т.д.), однако следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, части являются частями по весу, молекулярная масса является средней молекулярной массой, температура указана в градусах Цельсия, а давление равно или приблизительно равно атмосферному.
Пример 1. Создание человеческих антител к человеческому IL-4R
Антитела человека против hIL-4R были созданы, как описано в патенте США 7608693. В Таблице 1 приведены идентификаторы последовательностей для пар аминокислотных последовательностей вариабельных областей тяжелой и легкой цепей, а также аминокислотных последовательностей CDR, выбранных антител против IL-4R и обозначения соответствующих им антител.
Примером антагониста IL-4R, используемого в следующих Примерах, является человеческое антитело против IL-4R, обозначенное в Таблице 1 как H1H098-b (также именуется в настоящей заявке как "mAb1").
Пример 2: Клиническое исследование вводимого подкожно антитела против IL-4R (mAb1) У больных персистирующей умеренной - тяжелой эозинофильной астмой, включая больных астмой с хроническим гиперпластическим эозинофильным синуситом
A. Цели и краткий обзор исследования
Рандомизированное, плацебо-контролируемое, двойное слепое исследование в параллельных группах проводили с подкожным введением один раз в неделю либо 300 мг mAb1, либо плацебо, в течение 12 недель, пациентам с персистирующей умеренной - тяжелой эозинофильной астмой, которая являлась частично контролируемой/неконтролируемой посредством терапии ингаляционными кортикостероидами (ИКС) и бета2-агонистами длительного действия (БАДД). Основная цель исследования состояла в изучении эффектов mAb1, которое вводили подкожно, раз в неделю, в течение 12 недель, по сравнению с плацебо в отношении снижения частоты развития обострений астмы у пациентов с персистирующей умеренной - тяжелой эозинофильной астмой. Дополнительные цели исследования состояли в оценке безопасности и переносимости mAb1, которое вводили подкожно, раз в неделю, в течение 12 недель, у пациентов с персистирующей умеренной - тяжелой эозинофильной астмой, и в оценке концентрации mAb1 в сыворотке после подкожного введения, раз в неделю, в течение 12 недель, у пациентов с персистирующей умеренной - тяжелой эозинофильной астмой.
Перед скринингом пациенты должны были постоянно принимать любую из следующих доз и композиций комбинированной терапии ИКС/БАДД (также называемой "базисной терапией") в течение по меньшей мере 1 месяца:
Комбинированная терапия флутиказоном/салметеролом
- Advair® Diskus - ингалятор сухого порошка (DPI): 250/50 мкг два раза в день или 500/50 мкг два раза в день; или
- Advair® HFA - дозирующий ингалятор (MDI): 230/42 мкг два раза в день или 460/42 мкг два раза в день; или
Комбинированная терапия будесонидом/формотеролом (Симбикорт® 160/9 мкг два раза в день или 320/9 мкг два раза в день); или
Комбинированная терапия мометазоном/формотеролом (Дулера® 200/10 мкг два раза в день или 400/10 мкг два раза в день).
Пациентов, принимавших будесонид/формотерол или мометазон/формотерол, переводили на эквивалентную дозу флутиказона/салметерола при рандомизации (День 1), а пациентов, которые принимали флутиказон/салметерол, продолжали принимать тоже в качестве базисной терапии.
Пациентов, которые удовлетворяли критериям включения и исключения (см. ниже), рандомизировали в группу с одной из следующих терапий: 300 мг mAb1, которое вводили подкожно, раз в неделю, в течение 12 недель; или плацебо, которое вводили подкожно, раз в неделю, в течение 12 недель.
Исследование включало 2-недельный период скрининга, 12-недельный период лечения, включающий стабильную фазу 4-недельной базисной терапии, и 8-недельную базисную терапию фазы отмены после рандомизации, сопровождаемую 8-недельным периодом наблюдения после лечения.
Алгоритм отмены базисной терапии (ИКС/БАДД):
Пациенты продолжали курс базисной терапии флутиказоном/салметеролом, два раза в день, в течение 4 недель после начальной дополнительной терапии или лечения с 300 мг mAb1 (или плацебо). Через 4 недели после рандомизации, пациентов переводили с комбинированной терапии флутиказоном/салметеролом два раза в день на эквивалентную дозу монотерапии флутиказоном ИКС (включающей либо Flovent® Diskus - DPI композицию, 250 мкг или 500 мкг два раза в день; или Flovent® HFA - MDI композицию, 220 мкг или 440 мкг два раза в день). Компонент БАДД (то есть салметерол) отменяли. При последующих посещениях, начиная с недели 6, дозу флутиказона понижали приблизительно на 50%, при условии, что пациент не соответствовал ни одному из критериев обострения астмы (как определено ниже). Если обострения астмы не возникали, отмену ИКС проводили согласно следующей схеме приема:
После завершения 12 недель лечения с применением исследуемого продукта (или после преждевременного прекращения), пациентов переводили на их исходную дозу флутиказона/салметерола, будесонида/формотерола или мометазона/формотерола (доза на начало участия в исследовании) и альбутерола или левалбутерола, при необходимости контроля их симптомов в течение еще 8 недель приема лекарственных препаратов в исследовании перед заключительной оценкой безопасности.
Взрослых пациентов включали в исследование исходя из следующих критериев: (1) поставленный врачом диагноз персистирующей астмы на протяжении по меньшей мере ≥12 месяцев, основанный на руководстве Глобальной инициативы по бронхиальной астме (GINA) 2009, с вероятным эозинофильным воспалением дыхательных путей; и (2) астма поддается частичному контролю или не поддается контролю с применением комбинированной терапии ингаляционными кортикостероидами/бета-агонистами длительного действия в соответствии со следующими критериями: (i) постоянная доза либо комбинированной терапии флутиказоном/салметеролом (DPI композиция: 250/50 мкг два раза в день или 500/50 мкг два раза в день, или MDI композиция: 230/42 мкг два раза в день или 460/42 мкг два раза в день), либо комбинированной терапии будесонидом/формотеролом (160/9 мкг два раза в день или 320/9 мкг два раза в день), либо комбинированной терапии мометазоном/формотеролом (200/10 мкг два раза в день или 400/10 мкг два раза в день) в течение по меньшей мере 1 месяца до скрининга; (ii) эозинофилы крови ≥ 300 клеток/мкл или эозинофилы мокроты ≥3% в ходе фазы скрининга; (iii) оценка по Опроснику контроля астмы (вариант с 5 вопросами, ACQ, Juniper) ≥1,5 и ≤3,0 при скрининге; (iv) ОФВ1 ≥50% от расчетного нормального значения в ходе фазы скрининга (максимум 3 попытки) и в день рандомизации до приема первой дозы (максимум 3 попытки); (v) имел в течение 2 лет до скрининга или лечения одним или более системными (пероральными и/или парентеральными) стероидами приступы с ухудшением астмы или помещение в стационар, или приход работников скорой медицинской помощи в связи с ухудшением астмы; и (vi) зарегистрированный случай обратимости в течение 12 месяцев после скрининга, который удовлетворяет критерию - по меньшей мере 12% и 200 мл в ОФВ1 после приема от 200 мкг до 400 мкг (2-4 ингаляции) альбутерола в ходе фазы скрининга (максимум 3 попытки), или зарегистрированный случай положительной провокации метахолином (PD20 метахолина ≤8 мг) в течение 12 месяцев до скрининга. Пациенты с умеренной - тяжелой астмой, которая поддается частичному контролю или не поддается контролю умеренными - высокими дозами комбинированной терапии ингаляционными кортикостероидами и бета-агонистами длительного действия (Адваир®, Симбикорт® или Дулера®) и с содержанием эозинофилов в крови, больше или равным 300 клеток в микролитре, или эозинофилов в мокроте, больше или равным 3% в ходе фазы скрининга, были включены в исследование.
Пациенты, которые удовлетворяли всем критериям включения, участвовали в скрининге по следующим критериям исключения: (1) пациенты младше 18 лет или старше 65 лет; (2) клинически значимые отклонения от нормы в результатах лабораторных анализов, которые могут указывать на неизвестную болезнь и требуют дополнительной оценки; (3) хроническая обструктивная болезнь легких (ХОБЛ) и/или другие болезни легких, нарушающие результат тестов функции легких; (4) пациенты, нуждающиеся в блокаторах бета-адренергических рецепторов по какой-либо причине; (5) курение или отказ от курения в течение 6 месяцев до скрининга; (6) курение в прошлом с анамнезом курения >10 пачек сигарет-лет; (7) госпитализация в стационаре или приход работников скорой помощи из-за обострения астмы за последние 2 месяца до скрининга; (8) планы по началу аллерговакцинации в течение исследования; (9) воздействие другого экспериментального антитела в течение периода времени до скрининга продолжительностью меньше 5 полупериодов существования антитела, но не меньше 30 дней, или, если полупериод существования антитела не известен, то в течение периода времени до скрининга, которое составляет по меньшей мере 6 месяцев; (10) предыдущая регистрация в текущем исследовании; (11) пациент был исследователем, члены его семьи, или служащим в исследовательском центре; (12) известное или подозреваемое несоблюдение режима, употребление алкоголя или наркотическая зависимость; (13) неспособность выполнять процедуры исследования (например, вследствие языковых трудностей или психологических нарушений); (14) измененный режим сна (например, рабочий ночной смены); (15) лечение лекарственными средствами, удлиняющими интервал QTc; (16) сопутствующее тяжелое заболевание(я), при котором противопоказано применение ИКС (например, активный или неактивный туберкулез легких) или БАДД (например, диабет, сердечно-сосудистые заболевания, гипертония, гипертиреоз, тиреотоксикоз и т.д.); (17) применение инъекционных глюкокортикостероидов или пероральных системных глюкокортикостероидов в течение 2 месяцев до скрининга или больше чем 3 курса в течение 6 месяцев до скрининга; (18) предварительное лечение переменными дозами ИКС, отдельно или в комбинации с нестероидным препаратом базисной терапии (кроме комбинированной терапии флутиказоном/салметеролом, комбинированной терапии будесонидом/формотеролом или комбинированной терапии мометазоном/формотеролом); (19) прием запрещенных сопутствующих лекарственных препаратов (перечисленных ниже); (20) известная аллергия на доксициклин или родственные соединения; (21) беременность или планируемая беременность в течение исследования, кормление грудью или нежелание использовать эффективный метод контрацепции; и (22) недавний случай паразитарной инфекции или путешествие в эндемическую область распространения паразитов в течение 6 месяцев до скрининга.
Пациенты оставались на постоянной дозе базисной терапии астмы в течение первых четырех недель исследования, после чего дозу базисной терапии постепенно понижали. Сначала в неделю 4 отменили бета-агонист длительного действия - компонент базисной терапии, а затем дозу ингаляционного кортикостероида понижали наполовину каждые 2 недели до недели 12. Пациенты продолжали лечение в исследовании до конца исследования или пока они не выбывали вследствие обострения астмы или по какой-либо другой причине.
B. Лечение в исследовании
Исследуемый продукт: Стерильный раствор mAb1 150 мг/мл для п/к инъекций, в стеклянном флаконе объемом 5 мл. Каждый флакон содержал отбираемый объем 2 мл. Дозу 300 мг вводили подкожно в исследовательском центре, раз в неделю, утром, в течение 12 недель.
Плацебо: Стерильное плацебо для п/к инъекций было предоставлено в одинаково подобранном стеклянном флаконе объемом 5 мл. Каждый флакон содержал отбираемый объем 2 мл. Плацебо вводили подкожно в исследовательском центре, раз в неделю, утром, в течение 12 недель.
В течение всего исследования не разрешался прием следующих сопутствующих лекарственных препаратов: любой другой ингаляционный стероид кроме комбинированной терапии флутиказоном/салметеролом или флутиказона, который вводят в протоколе (или будесонид/формотерол, или мометазон/формотерол в течение периода скрининга); системные или глазные стероиды; другие БАДД кроме салметерола, компонента комбинированной терапии флутиказоном/салметеролом, которую вводят в протоколе; любые другие комбинированные продукты ИКС/БАДД кроме приведенных выше; любые ингаляционные антихолинергические средства (например, бромид ипратропия или тиотропий); метилксантины (теофиллин, аминофиллины); кромоны; анти-IgE терапия; ингибиторы липоксигеназы; и антагонисты рецепторов лейкотриенов или ингибиторы синтеза лейкотриенов.
C. Эффективность лечения
Основным конечным показателем данного исследования являлось возникновение обострения астмы, определяемое любым из следующего: (1) 30%-ое или большее уменьшение относительно базового уровня пиковой скорости выдоха утром (ПСВ) за два последовательных дня; или (2) шесть или более дополнительных вдохов аэрозоля альбутерола или левалбутерола для облегчения дыхания в течение 24 часов (по сравнению с базовым уровнем) за 2 последовательных дня; или (3) ухудшение астмы, определяемое исследователем, требующее: (a) системной (пероральной и/или парентеральной) терапии стероидами, или (b) увеличения последней дозы ИКС, полученной до прекращения участия в исследовании, в ≥4 раза, или (c) госпитализации.
Дополнительные конечные показатели исследования включали средние изменения относительно базового уровня следующих параметров: (1) Объем форсированного выдоха за 1 секунду (ОФВ1) в литрах, измеряемый при каждом посещении; (2) Пиковая скорость выдоха утром и вечером (ПСВу и ПСВв) в литрах/минуту, измеряемые ежедневно; (3) Ежедневное использование альбутерола/левалбутерола в ингаляциях/день; (4) Оценка по Опроснику контроля над астмой, из пяти пунктов (ACQ5), при каждом посещении; (5) Пробуждения в ночное время (раз за ночь), измеряемые ежедневно; и (6) Оценка в Тесте на исход болезней носа и околоносовых пазух, из 22 пунктов (SNOT-22), на базовом уровне и в конце лечения (в Неделю 12), для оценки симптомов в верхних дыхательных путях. Дополнительные конечные показатели также включали процент больных со смешанным случаем астмы, определяемым по 30% или большему снижению относительно базового уровня ПСВ утром за два последовательных дня в сочетании с ≥6 дополнительными вдохами аэрозоля альбутерола или левалбутерола для облегчения дыхания в течение 24-часового периода по сравнению с базовым уровнем за 2 последовательных дня. ПСВ, ACQ5, оценки симптомов астмы, пробуждения ночью и использование препаратов для облегчения дыхания фиксировали в электронном ежедневнике. Среднее количество пробуждений в ночное время, в пределах от 0-10, усредняли за предыдущие 7 дней. Утренние и вечерние оценки симптомов астмы состояли из неподтверждаемого, сообщаемого пациентом результата, оцениваемого по лайкертовской шкале из 5 пунктов, где более высокая оценка соответствовала более плохому исходу (Таблица 2). Пациенты регистрировали общие оценки симптомов два раза в день до измерения ПСВ. Данные описаны как среднее значение за 7 дней до указанного момента (см., например, Фигуры 26A и 26B).
Оценка симптомов астмы
D. Контроль нежелательных явлений
Безопасность в ходе исследования оценивали посредством мониторинга Нежелательных явлений и Тяжелых нежелательных явлений.
Нежелательное явление (AE) представляет собой любой нежелательный медицинский случай у субъекта или субъекта клинического исследования, которому ввели фармацевтический продукт. Таким образом AE может быть любым нежелательным и непредусмотренным признаком (включая отклоняющиеся от нормы данные лабораторного анализа), симптомом или заболеванием, связанными по времени с применением лекарственного средства, независимо от того, считают ли его связанным с лекарственным (исследуемым) средством. AE также включают: любое ухудшение (то есть любое клинически значимое изменение частоты и/или интенсивности) существовавшего ранее состояния, которое связано по времени с применением исследуемого препарата; отклоняющиеся от нормы данные лабораторного анализа, которые исследователь считает клинически значимыми; и любое нежелательный медицинский случай.
Тяжелое нежелательное явление (SAE) представляет собой любое нежелательный медицинский случай, который при любой дозе приводит к смерти; является опасным для жизни; требует госпитализации в стационаре или продления текущей госпитализации; приводит к постоянной или существенной потере дееспособности или к инвалидности; является врожденной аномалией/врожденным пороком; или является важным медицинским явлением.
E. Статистические методы
Для первичного анализа доли пациентов, испытывающих обострение астмы, модель логистической регрессии использовали для сравнения группы SAR с плацебо. Модель включала сроки лечения и фактор стратификации (предыдущая доза комбинированной терапии ИКС/БАДД). Первичный анализ проводили на основе модифицированной группы с назначенным лечением (mITT), которая включала всех рандомизированных пациентов, которые получали по меньшей мере одну дозу исследуемого лекарственного средства (ИЛС). Стратифицированный критерий хи-квадрат также использовали для подтверждения первичного анализа.
Что касается дополнительных конечных критериев эффективности, за исключением SNOT-22, изменение относительно базового уровня анализировали при использовании модели смешанного эффекта с методом многократных измерений (MMRM). Модель включала изменение относительно базовых значений до недели 12 в качестве переменных реакции, а также факторы (фиксированные эффекты) лечения, фактор стратификации, посещения, зависимость лечения от посещения, базовое значение и зависимость базового значение от посещения. Статистические выводы при сравнении лечения по изменению относительно базового уровня в неделю 12 были получены из модели смешанного эффекта. Изменение в SNOT-22 относительно базового уровня анализировали при использовании ковариационного анализа (ANCOVA), с использованием измерений в конце лечения для замены недостающих данных. Фармакодинамические эффекты оценивали, используя модель MMRM в апостериорном методе. Поправки на множественность не вводили, поскольку присутствовал только один основной конечный параметр и анализ. Переменные безопасности, включая AE, лабораторные показатели, жизненные признаки, кардиограмму, клинические лабораторные наблюдения и объективное обследование обобщали при использовании описательной статистики.
Демографические и клинические показатели обобщали, используя описательные характеристики. Диаграммы дополнительных и фармакодинамических переменных представлены как среднее изменение относительно базовых значений с течением времени со стандартной ошибкой. Сравнение эффектов лечения из MMRM анализа основано на среднем изменении наименьших квадратов (95% доверительный интервал [CI]) относительно базового уровня в Неделю 12.
F. Результаты
Результаты, наблюдаемые у всех 104 рандомизированных пациентов (из 491, прошедших скрининг), которые завершили или досрочно приостановили фазу лечения в исследовании, представлены ниже. Все рандомизированные пациенты проходили лечение в исследовании и были включены в группу mITT. Базовые показатели были аналогичными между группами. Демографические и клинические показатели также были аналогичными между этими двумя группами (Таблица 3). Как отмечено выше, пациенты проходили лечение либо mAb1, 300 мг подкожно, один раз в неделю, либо получали плацебо. Период лечения в исследовании был завершен на 86,5% и 67,3% у пациентов, получавших mAb1 и плацебо, соответственно (Фигура 25). Наиболее распространенной причиной досрочного прекращения являлась недостаточная эффективность, что было более частым в случае плацебо (21,2%), нежели mAb1 (1,9%).
Базовые демографические и клинические показатели групп лечения*
(N=52)
(N=52)
(i) Основной конечный критерий эффективности
Частота обострений астмы в группах лечения плацебо и mAb1 представлена в Таблице 4.
Частота обострений астмы в группе mITT
В течение периода лечения было в общей сложности 26 обострений астмы, при этом ни одного пациента по поводу обострений астмы не госпитализировали. В группе плацебо обострение астмы было у 23 пациентов (44,2%), тогда как в группе лечения mAb1 обострение астмы испытали только 3 пациента (5,8%). Отношение несогласия составило 0,077 (p<0,0001), и относительное снижение риска - приблизительно 87%.
Из 26 обострений астмы, которые пациенты испытали в ходе данного исследования, 9 считались тяжелыми, что проявлялось в потребности немедленного вмешательства в форме лечения либо системными кортикостероидами, либо ингаляционными кортикостероидами в 4 или больше раз более высокой дозе, чем принимали до последнего случая. Сводка частоты тяжелых обострений астмы представлена в Таблице 5.
Частота тяжелых обострений астмы в группе mITT
Как показано в Таблице 5, восемь тяжелых обострений астмы наблюдали в группе плацебо, и только 1 тяжелое обострение астмы наблюдали в группе лечения mAb1. Остальные 15 обострений астмы в группе плацебо и 2 в группе mAb1 соответствовали определению протокола обострения, основанного на пониженном ПСВ утром и/или повышенном применении альбутерола/левалбутерола. Как показано в Таблице 6, в группы активного лечения длительное улучшение в сравнении с базовым уровнем в ходе исследования наблюдали по всем параметрам, несмотря на отмену стероидов.
Случаи обострений
(N=52)
(N=52)
В случае mAb1, период времени до обострения был более продолжительным (Фигура 1), причем риск обострения был ниже по сравнению с плацебо (отношение опасности 0,10; 95% CI 0,03, 0,34; P<0,001). Анализ времени до обострения астмы с помощью графика Каплана-Мейера показал, что эффект от лечения mAb1 сохранялся в течение длительного времени, в том числе через 8 недель, когда пациенты были подвержены более высокому риску развития обострений вследствие отмены стероидов (Фигура 1).
Лишь 1 пациент из группы плацебо имел смешанный случай астмы. Смешанный случай астмы определен как 30% или большее снижение относительно базового уровня ПСВ утром за 2 последовательных дня в сочетании с ≥6 дополнительными вдохами аэрозоля альбутерола или левалбутерола в течение 24-часового периода (по сравнению с базовым уровнем) за 2 последовательных дня.
(ii) Другие конечные критерии эффективности
Параметры функции легких (ОФВ1, ПСВу и ПСВв), основанные на симптомах астмы конечные показатели (оценка ACQ, пробуждения ночью) и применение альбутерола оценивали у каждого пациента при каждом посещении. Результаты, наблюдаемые для этих параметров (еженедельно изменение относительно базового уровня), представлены на Фигурах 2-7, соответственно. Кроме того, оценку SNOT-22 получали на базовом уровне и в конце лечения. Для всех параметров, средние базовые значения и средние значения в неделю 12 (LOCF), а также среднее различие между группами лечения (модель ANOVA для SNOT-22) приведены в Таблице 7. В Таблице 7 колонка, обозначенная "Различие с плацебо", отражает скорректированное по плацебо значение относительно базового уровня, которое учитывает изменения, которые наблюдали в отношении значения параметра, в сравнении с изменениями, которые наблюдали для того же параметра в группе, получавшей плацебо.
Дополнительные параметры функции легких и оценки симптомов
(SD)
‡ 50 пациентов по меньшей мере с 1 оценкой после базового уровня.
Лечение mAb1 привело к существенному изменению относительно базового уровня значений ОФВ1 в Неделю 1, который сохранялся в течение Недели 12 (Фигура 2) несмотря на отмену БАДД и ИКС, с небольшим уменьшением ОФВ1 в Неделю 5, совпавшим с отменой БАДД. Подобные улучшения наблюдали в отношении ПСВу и, но уже в меньшей степени, ПСВв (Фигуры 3 и 4). Среднеквадратическое (LS) изменение относительно базового уровня до недели 12 значения ОФВ1 составило -0,22 л для плацебо и 0,05 л для группы mAb1. (p=0,0009).
Оценка ACQ5 улучшилась в обеих группах лечения в Неделю 1 (Фигура 6). Однако, несмотря на большее улучшение ACQ5 в группе mAb1 между Неделями 1 и 4, эффект плацебо стабилизировался с сохранением различия вплоть до Недели 12.
Утренние оценки симптомов увеличивались относительно базового уровня до Недели 12 в группе плацебо. В случае mAb1, наблюдали первоначальное уменьшение, которое оставалось ниже базового уровня вплоть до Недели 12 (Фигура 26A). Подобный профиль (с большей вариабельностью) наблюдали в отношении вечерних оценок симптомов астмы (Фигура 26B).
Пробуждения ночью были стабильными в группе плацебо в течение Недели 6, затем возрастали с Недели 6 до 12. Напротив, пробуждения ночью уменьшались в группе mAb1 с Недели 1 и оставались улучшенными относительно базового уровня в течение Недели 12 (Фигура 7).
Изменения в использовании альбутерола/левалбутерола (Фигура 5) соответствовали другим дополнительным конечным показателям: начальное уменьшение с последующим возвращением на базовый уровень с плацебо. В случае mAb1 начальное уменьшение сохранялось с течением времени.
Наблюдалось незначительное различие на базовом уровне между значениями SNOT-22, со средней оценкой для плацебо 26,24 и средней оценкой для mAb1 39,02. В неделю 12, среднее LS изменение было небольшим увеличением в 0,23 пунктов для группы плацебо и средним уменьшением (улучшением) в 8,26 пунктов для группы mAb1. Это соответствовало величине улучшения в 8,49 пунктов для группы mAb1 (p=0,0027).
Дополнительные конечные показатели
(N=52)
(N=52)
(95% CI)**
(31,8, 60,2)
(0,0, 2,1)
(0,03 - 0,34)
(-0,9 - -0,4)
(-0,9 - -0,4)
Изменение Относительно базового уровня в Неделю 12 оценки SNOT-22, соответствующей заболеванию верхних дыхательных путей
(N=52)
(N=52)
В отношении всех дополнительных конечных показателей, измерения на Неделе 12 говорили в пользу лечения mAb1 и были значимыми, за исключением ПСВ вечером и пробуждений ночью (Таблица 7 и 8). Существенные улучшения с mAb1 также наблюдали для трех пунктов SNOT-22, соответствующих заболеванию верхних дыхательных путей (Таблица 9).
(iii) Безопасность
В целом mAb1 было безопасным и хорошо переносилось. О нежелательных явлениях, возникших в процессе лечения (TEAE), сообщили так же 40 (76,9%) пациентов, получавших плацебо, и 42 (80,8%) пациента, проходящих лечение mAb1 (Таблица 10). Явления TEAE были неспецифическими, обычно от слабой до умеренной интенсивности, при этом в большинстве они проявлялись в конце исследования. Увеличение сообщений последующих TEAE наблюдали для mAb1 по сравнению с плацебо: о реакциях на участке инъекции сообщали 15 (28,8%) пациентов mAb1 и 5 пациентов плацебо (9,6%); о назофарингите сообщали 7 (13,5%) пациентов mAb1 и 2 пациента плацебо (3,8%); о головной боли сообщали 6 (11,5%) пациентов mAb1 и 3 (5,85%) пациента плацебо, и о тошноте сообщали 4 (7,7%) пациента mAb1 и 1 (1,9%) пациент плацебо.
Нежелательные явления
† реакция на участке инъекции включает следующие явления: боль на участке инъекции, реакция на участке инъекции, покраснение на участке инъекции, сыпь на участке инъекции, гематома на участке инъекции, крапивница на участке инъекции, дерматит на участке инъекции, воспаление на участке инъекции, узелок на участке инъекции, зуд на участке инъекции и припухлость участка инъекции.
В течение исследования не было зарегистрировано ни одного смертельного случая. Из 4 сообщенных тяжелых нежелательных явлений, возникших в процессе лечения (SAE): 1 пациент mAb1 страдал биполярным расстройством, и 3 пациента плацебо испытывали явления SAE, типичные для астмы, вследствие пневмонии, огнестрельного ранения с левосторонним пневмотораксом и перелома правой лодыжки. Ни один из этих SAE не считали связанными с IMP и все, кроме недавнего перелома лодыжки, выздоровели к концу исследования. Не было ни одного смертельного случая.
В общей сложности 6 пациентов прервали участие в исследовании из-за TEAE: 3 пациента в группе mAb1 (биполярное расстройство, астма с хрипами и ангионевротический отек) и 3 пациента в группе плацебо (инфекция верхних дыхательных путей, псориаз и астма). TEAE ангионевротический отек возник у 42-летней афроамериканки после девятой дозы лечения в исследовании и проявился в виде зудящей, папулезной сыпи, наблюдаемой на участке инъекции и на некотором удалении от него. Отек сохранялся в течение одной недели и прошел после прекращения лечения в исследовании и терапии преднизоном и дифенгидрамином. Это явление посчитали связанным с лечением. Это НЯ возникало после появления легкой сыпи на участке инъекции после первой и шестой доз лечения в исследовании.
Среди наиболее частых НЯ, наблюдаемых у ≥3 пациентов в любой группе лечения (Таблица 10), реакции на участке инъекции, назофарингит, тошнота и головная боль возникали чаще в случае mAb1, чем плацебо. Ни о каких клинически значимых изменениях показателей жизненно важных функций, объективного осмотра, данных клинических лабораторных анализов или ЭКГ не сообщали ни в одной группе.
G. Заключение
Наблюдали существенные улучшения функции легких и других параметров контроля астмы. Эффективность наблюдалась с ранних этапов и сохранялась, несмотря на отмену базисной терапии. Относительное снижение приблизительно на 87% (p<0,0001) по основному конечному показателю частоты возникновения обострений астмы у пациентов с персистирующей, умеренной - тяжелой астмой с эозинофилией наблюдали после 12-недельного лечения 300 мг mAb1 раз в неделю (5,8%) по сравнению с плацебо (44,2%). Как показано в Таблице 7, клинически и статистически значимые (без поправки на множественность) улучшения при лечении по сравнению с плацебо наблюдали в отношении показателей функции легких (ОФВ1, ПСВу), оценок симптомов астмы (ACQ) и применения альбутерола. Положительные тенденции наблюдали для ПСВв (p=0,0567) и пробуждений в ночное время (p=0,0518). Статистически значимое (без поправки на множественность) улучшение также наблюдали для оценки SNOT-22. В основной группе лечения длительное улучшение относительно базового уровня в течение исследования наблюдали для всех показателей, несмотря на отмену ИКС и БАДД. В целом mAb1 было безопасным и хорошо переносилось.
Пример 3: Биомаркерные исследования
Биомаркерный анализ проводили на пробах, полученных от субъектов, которые участвовали в клинических испытаниях mAb1 (см. Пример 2, выше). В частности, биомаркеры сыворотки/плазмы, связанные с TH2 воспалением, такие как тимусом и активацией регулируемый хемокин (TARC; CCL17), иммуноглобулин E (IgE), эотаксин-3, периостин, раково-эмбриональный антиген (РЭА), YKL-40 и эозинофилы крови, измеряли в пробах пациентов на базовом уровне и в различные точки времени после начала лечения в исследовании. Базовые уровни этих биомаркеров оценивали по потенциальному прогностическому значению для реакции на лечение. Кроме того, фракцию выдыхаемого NO (ФВОА) и эозинофилы и нейтрофилы в индуцированной мокроте измеряли в качестве биомаркерой бронхиального воспаления. Оценку выдыхаемого оксида азота проводили до спирометрии и после воздержания от приема пищи в течение по меньшей мере 1 часа, используя прибор NIOX (Aerocrine AB, Solna, Sweden). Биомаркеры анализировали, используя смешанную модель, ниже приведены средние значения, полученные методом наименьших квадратов на основе данной модели.
Субъектам с астмой (N=104) подкожно вводили либо mAb1 (300 мг), либо плацебо, в дни 1, 8, 15, 22, 29, 36, 43, 50, 57, 64, 71 и 78 исследования (то есть 12 еженедельных доз) (см. Пример 2). Пробы для биомаркерного анализа забирали у субъектов, получавших антитело и плацебо, в неделю 0, 1, 4, 8 и 12. Антигенспецифичный IgE детектировали, используя тест Phadiatop®.
TARC, эотаксин-3 и IgE оставались неизменными в ответ на плацебо (Фигуры 8, 9 и 10). Напротив, быстрое снижение TARC (среднее % изменение -22,7% в сравнении с +0,3%; p=0,0003) (Фигура 8) и эотаксина-3 (среднее % изменение -39,62% в сравнении с 12,69%; p<0,0001) (Фигура 9) наблюдалось в течение одной недели у пациентов, получавших mAb1, и сохранялось до недели 12: TARC: -26,0% в сравнении с +7,6% плацебо (p=0,0005); Эотаксин-3: -45,67% в сравнении с +5,13% плацебо (p<0,0001).
Уровни TARC изменялись в течение недели в ответ на воздействие mAb1, которое вводили подкожно в дозе 300 мг. Уровни TARC выходили на плато приблизительно при 50% от базового уровня у получавших mAb1 субъектов, несмотря на отмену ИКС. Данные позволяют предположить, что экспрессия TARC более непосредственно связана с сигнализацией IL-4R, нежели с изменениями ОФВ1 (который понижается параллельно с отменой ИКС [после Недели 4]), и что блокирование IL-4R вызывает изменение сигнатуры TH1, как наблюдали, например, при введении ИФН-гамма. Можно было бы титровать дозу mAb1, используя TARC (и, например, CXCL10), в особенности у пациентов, требующих длительного лечения и подверженных риску развития иммунных заболеваний TH1-типа.
Общий IgE сыворотки также снизился после лечения mAb1. Ответ общего IgE сыворотки был более гетерогенным и отсроченным по сравнению с ответом TARC. Средние (SD) базовые уровни IgE составляли 694,68 МЕ/л (1837,82) для группы плацебо (n=52) и 657,66 (1482,25) для группы mAb1 (n=52), тогда как медианное значение составляло 169,95 для группы плацебо и 206,15 для группы mAb1. Несмотря на такую гетерогенность, наблюдали тенденцию к уменьшению IgE у пациентов, получавших mAb1, по сравнению с плацебо, однако только начиная с недели 4. IgE сыворотки значительно снизился в группе mAb1 по сравнению с плацебо (среднее % изменение -10,1% в сравнении с +13,5%; p=0,0325), начиная с недели 4, и продолжал снижаться до недели 12 (среднее % изменение -36,8% для REGN668/SAR231893 в сравнении с -5,5% для плацебо; p<0,0001) (Фигура 10).
Все изменения относительно базового уровня и плацебо в Неделю 12 для ФВОА, TARC, эотаксин-3 и IgE говорили в пользу mAb1 (все P<0,001) (Таблица 11). Никакие различия относительно базового уровня или между группами лечения не наблюдали для YKL-40 или РЭА.
Процентное изменение относительно базового уровня в Неделю 12 по фармакодинамическим конечным показателям
(N=52)
(N=52)
Наблюдалось транзиентное уменьшение уровней периостина, сопровождаемое повышением при отмене БАДД/ИКС (Фигура 11). Введение mAb1 задерживало повышение, но не предотвращало повышение выше базового уровня. Никакого согласуемого эффекта лечения не наблюдали в случае РЭА (Фигура 12) и YKL-40 (Фигура 13). Содержание эозинофилов в крови оставалось неизменным в течение Недели 6, но затем повышалось в Недели 8 и 12 (Фигура 14). Содержание эозинофилов в периферической крови не изменялось на плацебо в течение всего лечения. Различие между лечением не было значимым, с пограничным увеличением, которое было вызвано более существенным повышением эозинофилов в крови лишь у нескольких пациентов, получавших mAb1. У большинства пациентов наблюдали слабое повышение или же таковое отсутствовало (Таблица 12).
Процент пациентов, достигших пороговых значений изменений уровней эозинофилов в крови
Поскольку только 3 пациента mAb1 испытывали обострение астмы в ходе исследования, невозможно сделать вывод относительно связи между базовыми уровнями биомаркеров и обострениями астмы.
Лечение mAb1 также было связано с существенным уменьшением относительно базового уровня значений ФВОА в Неделю 4, при этом ФВОА оставался ниже базового уровня вплоть до Недели 12, независимо от отмены ИКС (среднее % изменение в неделю 12: -28,7 для mAb1 и 35,0 для плацебо; p<0,0001) (Фигура 15). Напротив, значения ФВОА в группе плацебо оставались стабильными до Недели 8, с последовавшим увеличением в Неделю 12, совпавший с отменой ИКС.
Улучшение объема форсированного выдоха за 1 секунду (ОФВ1) значимо коррелировало со снижением ФВОА (r=-0,408, p=0,009) в неделю 12 (Фигура 16). Аналогично улучшения ПСВу и ПСВв коррелировали со снижением ФВОА (Фигуры 17 и 18). Другие корреляции с ФВОА не были значимыми. См. Таблицу 13.
Корреляция между ОФВ1 и PD конечными показателями
Анализ диаграммы рассеяния базовых уровней эозинофилов в сравнении с изменением ОФВ1 относительно базового уровня в неделю 12, как оказалось, не позволил связать базовые уровни эозинофилов и эффект лечения, измеряемый по изменению ОФВ1 относительно базового уровня в неделю 12 в группе исследования (базовый уровень эозинофилов ≥0,3×109/л) (Фигура 19). Базовый уровень эозинофилов коррелировал с уменьшением ACQ (Фигура 20) и уменьшением применения альбутерола/левалбутерола (Фигура 21). Периостин и YKL-40 на базовом уровне коррелировали с уменьшением ACQ (Фигуры 22 и 23).
Изменение ОФВ1 относительно базового уровня в неделю 12 сочеталось с отменой ИКС (начиная с недели 4). Подобные исследования не позволили связать базовые уровни TARC или IgE и изменение ОФВ1 относительно базового уровня в неделю 12 в группе исследования (базовый уровень эозинофилов ≥0,3×109/л).
Выводы
Эти результаты показывают, что mAb1 вызывало значительное уменьшение биомаркеров сыворотки, связанных с Th2 воспалением (TARC, эотаксин-3 и IgE) и бронхиальным воспалением (ФВОА) у взрослых пациентов с астмой. Корреляция между снижением ФВОА и улучшением ОФВ1 указывает на взаимосвязь между IL-4/IL-13 опосредованной противовоспалительной активностью и улучшением легочной функции при умеренной - тяжелой, неконтролируемой астме.
Объем настоящего изобретения не должен ограничиваться конкретными вариантами осуществления, описанными в настоящей заявке. Более того, различные модификации, в дополнение к описанным в настоящей заявке, станут очевидны специалистам в данной области из предыдущего описания и сопровождающих фигур. Такие модификации должны быть включены в объем прилагаемой формулы изобретения.
Пример 4: Блокада сигнального пути IL-4/IL-13 ингибирует выработку IgE и ремоделирование дыхательных путей в модели на мышах эозинофильной астмы, индуцированной аллергенами пылевых клещей
ВВЕДЕНИЕ
Было показано, что аллерген пылевого клеща (HDM) вызывает Th2 иммунный ответ, включая приток Th2-клеток в легкие, и IL-4-индуцированную транс-эндотелиальную миграцию эозинофилов в легкие. Эозинофилы, или эозинофильные гранулоциты, являются основными эффекторными клетками в аллергических реакциях, при этом высвобождение содержимого гранул (содержащих IL-4) из эозинофилов способствует развитию воспаления. У астматиков, Th2-регулируемая выработка IL-4 способствует миграции эозинофилов из крови в легкие при посредстве эотаксина, мощного хемоатрактанта эозинофилов (Mochizuki et al., J. Immunol., 1998, 160(1):60-68). Кроме того, при локализации на участке воспаления, эозинофилы вырабатывают и секретируют IL-4, способствуя, таким образом, продолжению Th2-регулируемого воспаления (Bjerke et al., Respir. Med., 1996, 90(5):271-277). У пациентов с аллергической астмой индукция HDM повышала уровень IgE и цитокинов Th2 в сыворотке в течение 5 недель после индукции аллергеном (van de Pol et al., Allergy, 2012, 67(7):67-73).
В данном Примере модель HDM-индуцированной хронической астмы использовали для оценки фармакодинамических эффектов антител против IL-4R в отношении маркеров воспаления дыхательных путей у мышей. Кроме того, в этой модели оценивали влияние антител против IL-4R на отложение коллагена в дыхательных путях, так как отложение коллагена коррелирует со степенью ремоделирования дыхательных путей.
МАТЕРИАЛЫ И МЕТОДЫ
в экспериментах данного Примера использовали два различных антитела против IL-4Rα: "mAb1", полностью человеческое моноклональное антитело, специфичное к человеческому IL-4Rα (то есть антитело против IL-4R, используемое в других рабочих примерах, представленных в настоящей заявке); и "anti-mIL-4Rα", мышиное моноклональное антитело, специфичное к мышиному белку IL-4Rα. mAb1 не обладает перекрестной реактивностью с мышиным IL-4Rα; поэтому mAb1 оценивали в гуманизированных мышах, в которых ввели сконструированный человеческий IL-4 и эктодомен IL-4Rα с целью замены ими соответствующих мышиных последовательностей у мышей (IL-4hu/huIL-4Rαhu/hu). Мышиное антитело против мышиного IL-4Rα "anti-mIL-4Rα", с другой стороны, тестировали на мышах дикого типа (Balb/c). Также в этих экспериментах тестировали мышиный IL-13Rα2-mFc слитый белок, который действует как рецептор-ловушка, блокируя сигнализацию IL-13 в результате выключения цитокина IL-13.
В отношении модели HDM-индуцированной астмы, мышей сенсибилизировали посредством ежедневной интраназальной аппликации HDM (50 мкг на мышь в 20 мкл PBS) в течение 10 дней, с последующим перерывом (период разрешения 2 недели). Аллерген с вводили путем интраназальной аппликации HDM (50 мкг на мышь в 20 мкл PBS) три раза в неделю в течение 8 недель. Для каждого введения HDM, в течение периода сенсибилизации или провокации, мышам делали легкую анестезию изофлураном.
Мышей оставляли для акклиматизации в экспериментальной лаборатории минимум в течение 5 дней перед началом экспериментальной процедуры. В течение всей продолжительности эксперимента животные оставались в экспериментальной лаборатории в стандартных условиях при 12-часовом цикле дня/ночи со свободным доступом к корму и воде. Число мышей в клетке было ограничено максимум 5 мышами.
В общей сложности в двух экспериментах использовали 48 гуманизированных мышей, в которых человеческий IL-4 лиганд и человеческий эктодомен IL-4Rα были генно-инженерно введены с целью замены ими соответствующих мышиных последовательностей (IL-4hu/huIL-4Rαhu/hu). Мыши IL-4hu/huIL-4Rαhu/hu имели смешанный фон C57BI/6NTac(75%)/129S6SvEvTac(25%). Кроме того, в одном из трех экспериментов использовали 20 однопометных мышей дикого типа с идентичным смешанным фоном. В каждом эксперименте мышей сенсибилизировали HDM (или PBS в контрольной группе) ежедневно, в течение десяти дней, с последующим периодом разрешения со дня 11 до дня 29. Со дня 30, животных стимулировали HDM три раза в неделю, в течение 8 недель, до дня 81, а затем усыпляли в день 85 для анализа. Мышей делили на шесть экспериментальных групп следующим образом:
(1) Несенсибилизированные, не подвергавшиеся лечению: PBS вводили интраназально в течение периодов сенсибилизации и провокации. Мышам не вводили антитела (IL-4hu/huIL-4Rαhu/hu мыши n=9, однопометные особи дикого типа n=5).
(2) HDM-сенсибилизированные, не подвергавшиеся лечению: HDM вводили интраназально в течение периодов сенсибилизации и провокации. Мышам не вводили антитела (IL-4hu/huIL-4Rαhu/hu мыши n=7; однопометные особи дикого типа n=5);
(3) HDM-сенсибилизированные, подвергнутые лечению anti-mIL-4Rα: HDM вводили интраназально в течение периодов сенсибилизации и провокации. Мышам в/б вводили anti-mIL-4Rα в дозе 50 мг/кг, два раза в неделю, с недели 7 до недели 12, в общей сложности в количестве 12 доз, в течение периода 6 недель (однопометные особи дикого типа n=5);
(4) HDM-сенсибилизированные, подвергнутые лечению антителом mAb1 против IL-4R человека: HDM вводили интраназально в течение периодов сенсибилизации и провокации. Мышам в/б вводили mAb1 в дозе 50 мг/кг, два раза в неделю, с недели 7 до недели 12, в общей сложности в количестве 12 доз, в течение периода 6 недель (IL-4hu/huIL-4Rαhu/hu мыши n=12).
(5) HDM-сенсибилизированные, подвергнутые лечению мышиным IL-13Rα2-mFc слитым белком: HDM вводили интраназально в течение периодов сенсибилизации и провокации. Мышам в/б вводили IL-13Rα2-mFc в дозе 25 мг/кг, два раза в неделю, с недели 7 до недели 12, в общем количестве 12 доз, в течение периода 6 недель (IL-4hu/huIL-4Rαhu/hu мыши n=7; однопометные особи дикого типа n=5);
(6) HDM-сенсибилизированные, подвергнутые введению антитела контрольного изотипа: HDM вводили интраназально в течение периодов сенсибилизации и провокации. Мышам в/б вводили изотипическое контрольное АТ в дозе 50 мг/кг, два раза в неделю, с недели 7 до недели 12, в общем количестве 12 доз в течение периода 6 недель (IL-4hu/huIL-4Rαhu/hu мыши n=7).
Мышей усыпляли в день 85, забирали кровь для анализа уровня иммуноглобулина сыворотки, после чего легкое (одну долю) использовали для получения одного из следующего: i) жидкости бронхоальвеолярного лаважа (BAL), ii) ферментативно обработанного образца суспензии отдельных клеток для проточного цитометрического анализа, iii) фиксированного формалином образца для окрашивания и гистологического анализа, или iv) образца для анализа с использованием набора для анализа коллагена Sircol™™ с целью определения количества коллагена, содержащегося в доле легкого.
Жидкость BAL получали из усыпленных животных, открыв сначала трахею и введя 23G лаважную трубку через небольшой разрез в стенке трахеи. Затем в легкое вводили стерильный PBS (1 мл) и отбирали жидкость BAL через лаважную трубку, используя шприц. 100 мкл BAL наносили на колонку Cytospin, которую центрифугировали в течение 5 минут при 500 об/мин для выделения клеток и их нанесения на предметные стекла. Препараты сушили и окрашивали гематоксилин-эозином (ГЭ) для визуализации эозинофилов.
Уровень IgE сыворотки определяли количественно, используя коммерческий набор ELISA. Коротко, последовательно разведенные образцы сыворотки инкубировали с захватывающим антителом против IgE в 96-луночных планшетах и детектировали IgE биотинилированным вторичным антителом против мышиного IgE. Очищенный мышиный IgE, меченный HRP, использовали в качестве стандарта.
Уровни HDM-специфичного IgG1 в сыворотке количественно определяли с помощью ELISA. Коротко, покрытые HDM планшеты инкубировали с последовательно разведенными образцами сыворотки, после чего инкубировали с HRP-конъюгированным антителом против мышиного IgG1. Относительные уровни IgG1 в сыворотке были представлены как единицы титра (OD450 умножали на коэффициент разведения, требуемый для достижения OD450≤0,5). Забранные доли легкого мгновенно замораживали в жидком азоте и хранили при -80°C до стадии выделения. Для выделения коллагена, легкое гомогенизировали в охлаждаемом льдом растворе NaCl/NaHCO3 и центрифугировали при 9000×g в течение 10 мин. Эту стадию повторяли три раза, после чего полученный осадок обрабатывали пепсином в уксусной кислоте в течение 18 часов при 4°C.
Образцы центрифугировали, супернатант отбирали и смешивали с реактивом Sircol Dye Reagent для окрашивания содержащегося в образцах коллагена. Образцы промывали реактивом Acid-Salt Wash для удаления несвязанного красителя Sircol Dye, а затем смешивали с реактивом Alkali. 200 мкл каждого образца переносили в 96-луночный планшет и измеряли OD при 555 нм. Коллагеновый стандарт использовали для конечного количественного определения коллагена, содержащегося в каждом образце.
Легкие забирали у усыпленных мышей и выдерживали в полной среде DMEM на льду до обработки смесью коллагеназы и ДНКазы в буфере HBSS в течение 20 минут при 37°C. Коллагеназную активность нейтрализовали добавлением 0,5М ЭДТА, образцы центрифугировали и эритроциты лизировали буфером ACK. Суспензии клеток, полученные для каждого образца, разделяли на три отдельных пула и окрашивали смесью антител 1 (anti-CD11c-APC, anti-SiglecF-PE, anti-F4/80-FITC, anti-CD45-PerCp-Cy5.5) или смесью антител 2 (anti-CD11c-APC, anti-CD11b-PerCp-Cy5.5, anti-CD103-FITC, anti-MHCII-PE), или смесью антител 3 (anti-CD19-PE, anti-Ly6G-APC, anti-CD3-FITC, anti-CD11b-PerCp-Cy5.5) в течение 25 минут при 4°C. Окрашенные клетки фиксировали в растворе Cytofix/Cytoperm в течение 30 минут при 4°C и хранили в PBS до проточного цитометрического анализа на FACSCanto (BD Biosciences).
В модели HDM-индуцированной хронической эозинофильной астмы (ЭА), левые доли легкого забирали у 4 мышей из каждой группы для микроматричного анализа экспрессии генов с использованием технологии GeneChip®. Уровни экспрессии генов у мышей, которых сенсибилизировали и провоцировали HDM, а затем обрабатывали АТ контрольного изотипа, сравнивали с уровнями экспрессии генов у мышей, которых ложно (PBS) сенсибилизировали и провоцировали, и не подвергали обработке антителом. Порог изменения экспрессии генов устанавливали >1,5-кратного. Выборку генов, идентифицированных как дифференциально экспрессируемые у мышей, которых сенсибилизировали и провоцировали HDM, затем также анализировали в группе, в которой вводили anti-IL-4Rα, в сравнении с группой, в которой вводили изотипический контроль. Порог изменения экспрессии генов в группе, обработанной anti-IL-4Rα, в сравнении с группой, в которой вводили изотипический контроль, устанавливали >2-кратного.
РЕЗУЛЬТАТЫ
Сенсибилизация и провокация HDM привели к повышению уровней IgE и HDM-специфичного IgG1. Повышение IgE было полностью заблокировано обоими АТ против IL-4Rα, но не обработкой IL-13Rα2-Fc (Фигуры 27A и 27B); на уровни HDM-специфичного IgG1 не повлияла ни одна обработка (данные не показаны).
Сенсибилизация и провокация HDM также вызвали увеличение коллагена, содержащегося в легких мышей. Содержание коллагена в легких мышей, которым вводили АТ к IL-4Rα и белок IL-13Rα2-Fc, снижалось до уровней, наблюдаемых у ложно сенсибилизированных и провоцированных мышей (Фигуры 28A и 28B).
Кроме того, обработка mAb1 предотвращала приток эозинофилов, нейтрофилов и воспалительных дендритных клеток в легкое (Фигура 29, панели A и B).
Микроматричный анализ мРНК, выделенной из ткани легкого HDM-индуцированных IL-4hu/huIL-4Rαhu/hu мышей, которым вводили антитело контрольного изотипа, выявил дифференциальную экспрессию 1468 генов (826 генов апрегулированы и 642 - даунрегулированы) по сравнению с ложно сенсибилизированными и провоцированными мышами. Обработка mAb1 HDM-индуцированных IL-4hu/huIL-4Rαhu/hu мышей привела к изменениям экспрессии только 521 гена (по сравнению с ложно сенсибилизированными/провоцированными мышами), обеспечивая эффективное блокирование приблизительно 65% генов, затронутых HDM сенсибилизацией/провокацией (>1,5-кратное изменение, p<0,05). Особый интерес представляет тот факт, что mAb1 опосредовало даунрегуляцию экспрессии генов нескольких представителей семейства цитокина IL-1, в частности IL-1α (2,9-кратную), IL-33 (2,6-кратную) и IL-18 связывающего белка (1,5-кратную). Экспрессия гена IL-1β не была увеличена в HDM-индуцированной группе, обработанной контрольным изотипом (по сравнению с ложно сенсибилизированными/провоцированными мышами), но была уменьшена (1,5-кратно) в группе, обработанной mAb1. Экспрессия гена Th1 воспалительных цитокинов, IL-12β и IFN-γ, была также даунрегулирована при введении mAb1 по сравнению с группой, обработанной контрольным изотипом. В частности, восемь генов, кодирующих хемокины-лиганды, вовлеченные в хоуминг и направленную миграцию клеток, были даунрегулированы в группе, обработанной mAb1, по сравнению с группой, обработанной контрольным изотипом: Ccl11 (~9-кратное снижение), Ccl8 и Cxcl2 (оба ~5-кратное снижение), Cxcl1, Ccl7, Ccl6 (все ~3-кратное снижение), Ccl2 и Ccl9 (примерно 2-кратное снижение).
ВЫВОДЫ
В данном Примере показано, что блокада IL-4 сигнализации через рецепторы I типа и II типа антителами против IL-4Rα подавляет воспалительные и фиброзные изменения в легких HDM-провоцированных мышей, а также изменения сигнатуры генов, которые вызывает HDM. Другие варианты осуществления представлены в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ПОЛИПОЗА НОСА ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2014 |
|
RU2674680C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2013 |
|
RU2801531C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2713406C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО СИНУСИТА С ПОЛИПАМИ НОСА ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2734490C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2018 |
|
RU2793745C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2020 |
|
RU2832774C2 |
| СПОСОБ ЛЕЧЕНИЯ КОЖНОЙ ИНФЕКЦИИ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2704999C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-33 | 2020 |
|
RU2838119C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ АНТАГОНИСТА IL-4R | 2013 |
|
RU2666630C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ АНТАГОНИСТА IL-4R | 2013 |
|
RU2698907C2 |











































































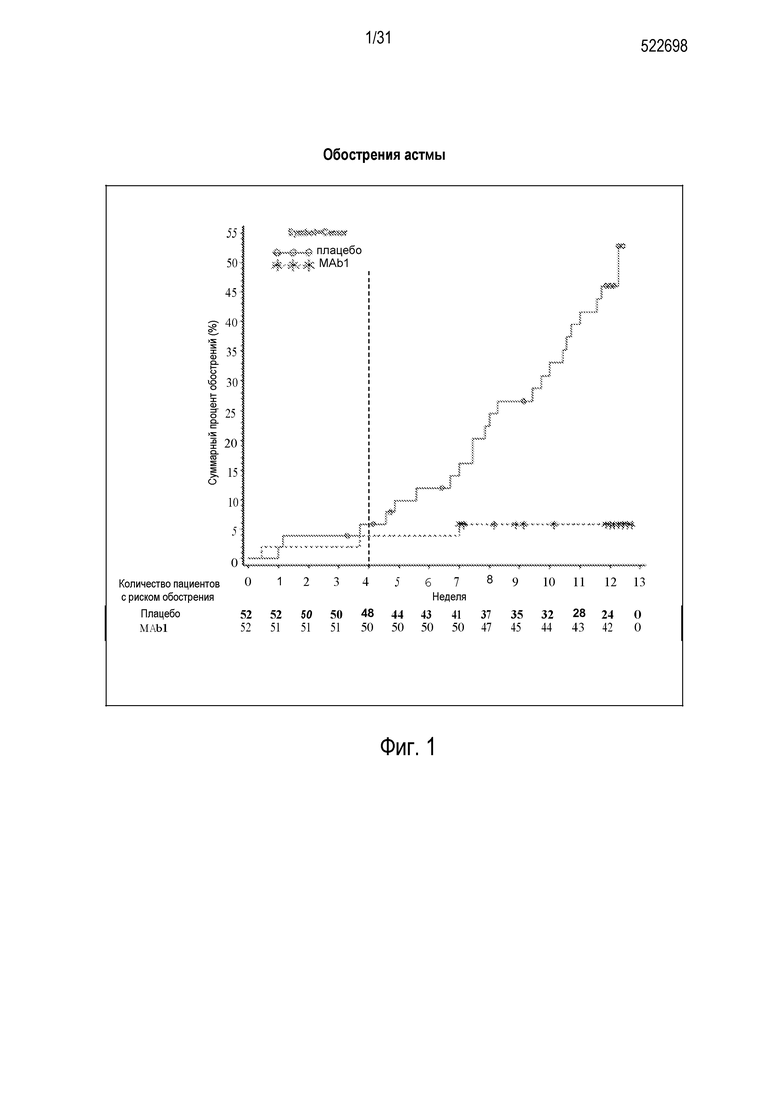

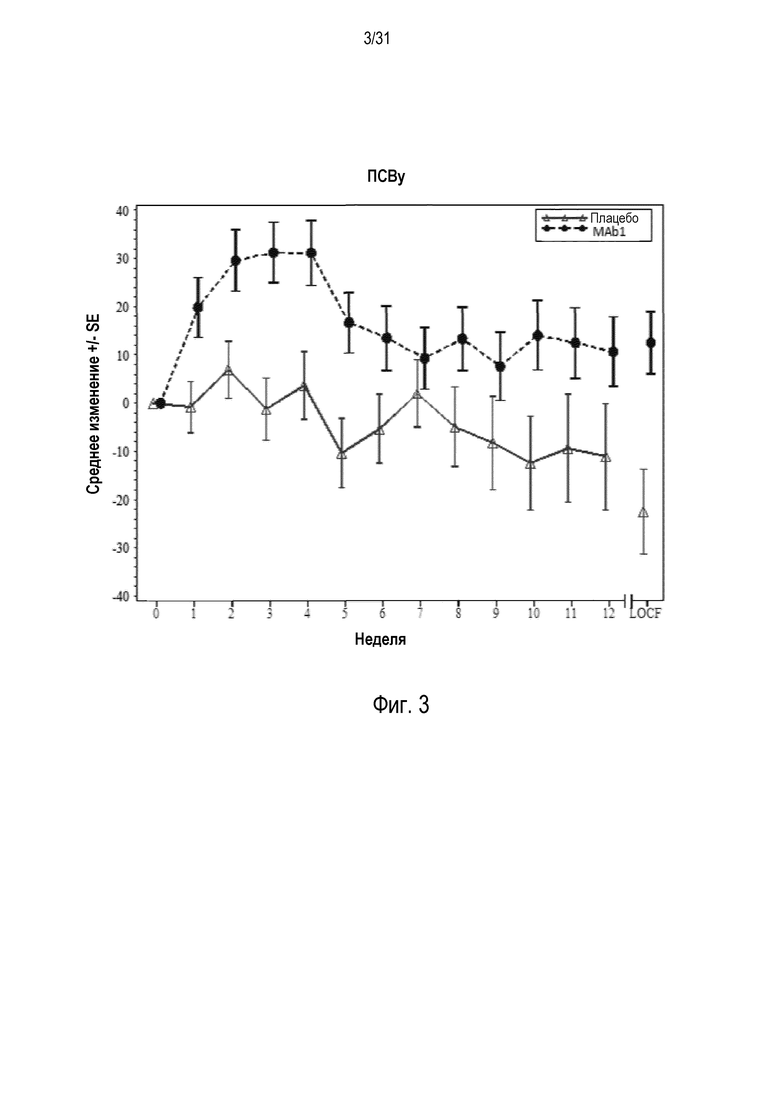




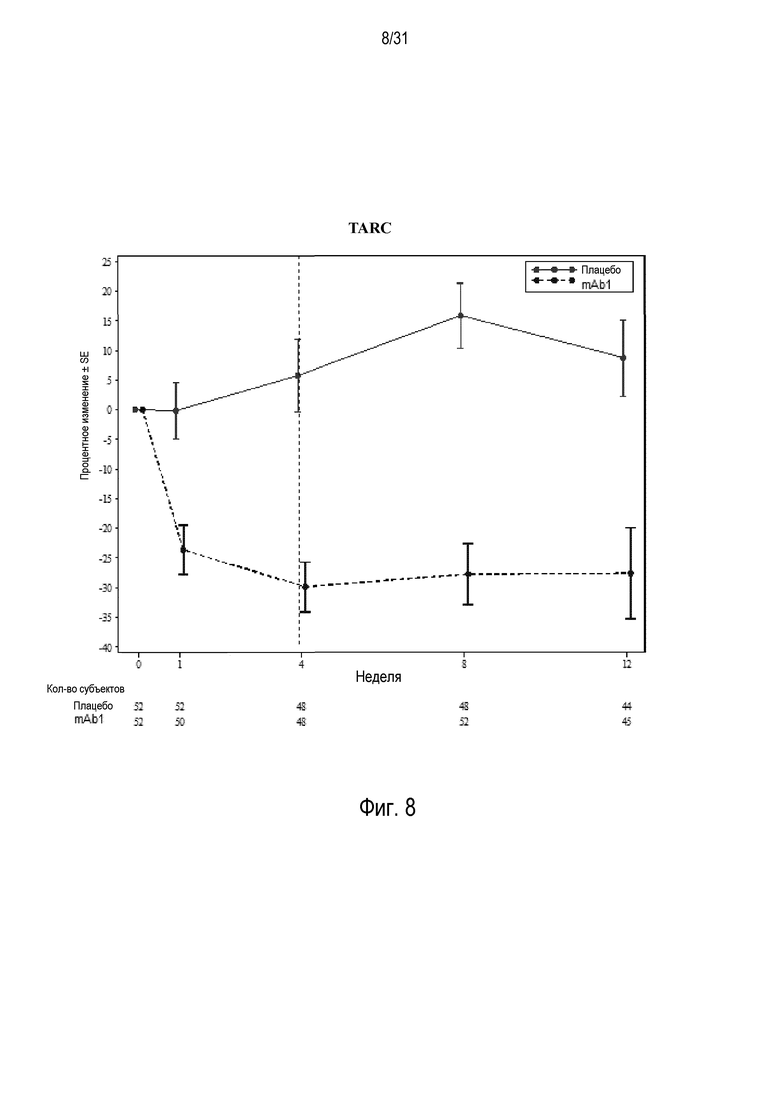
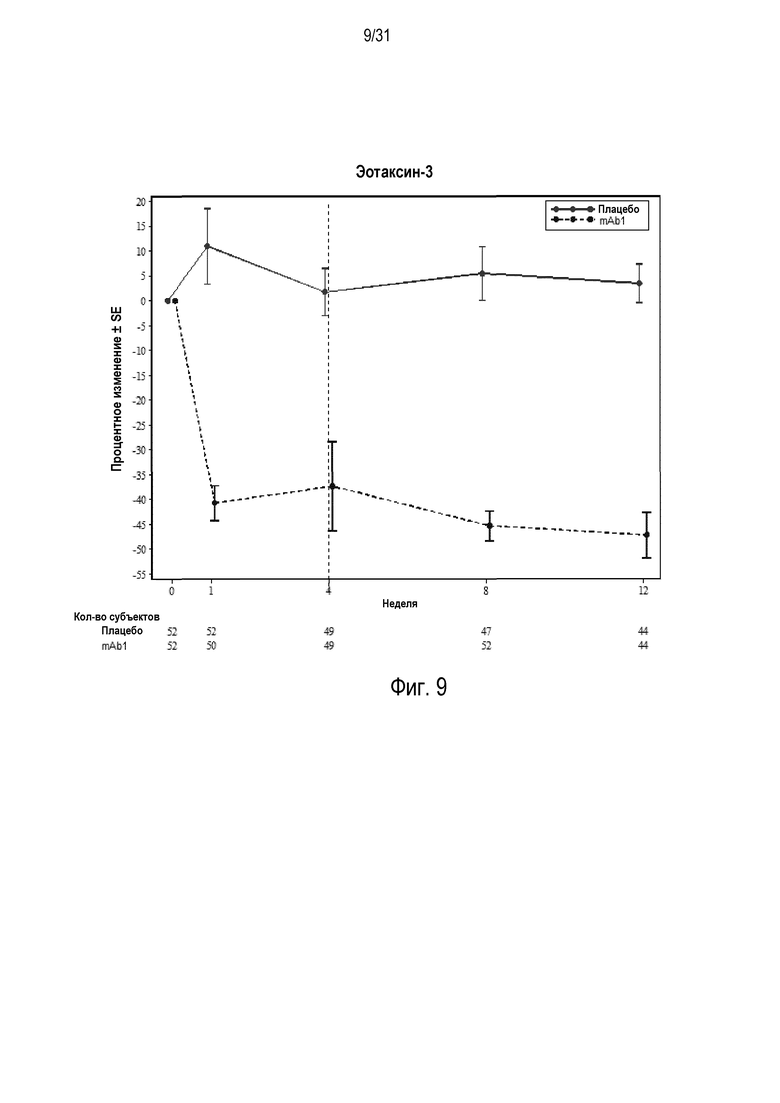
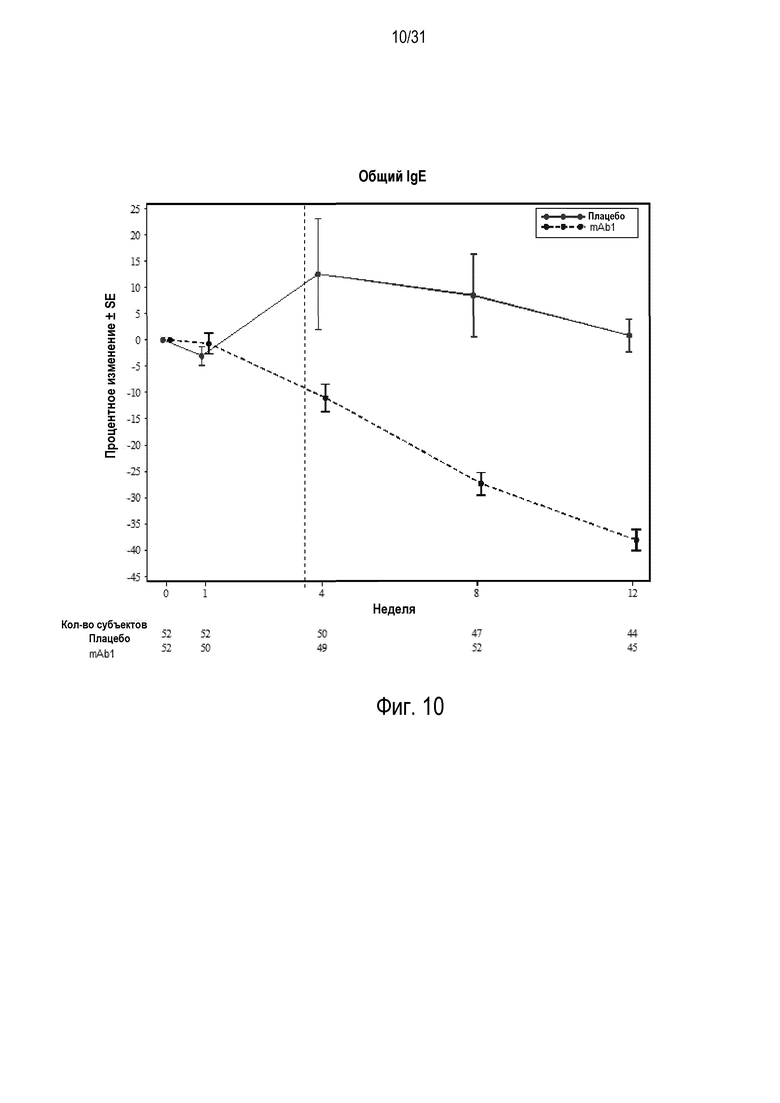







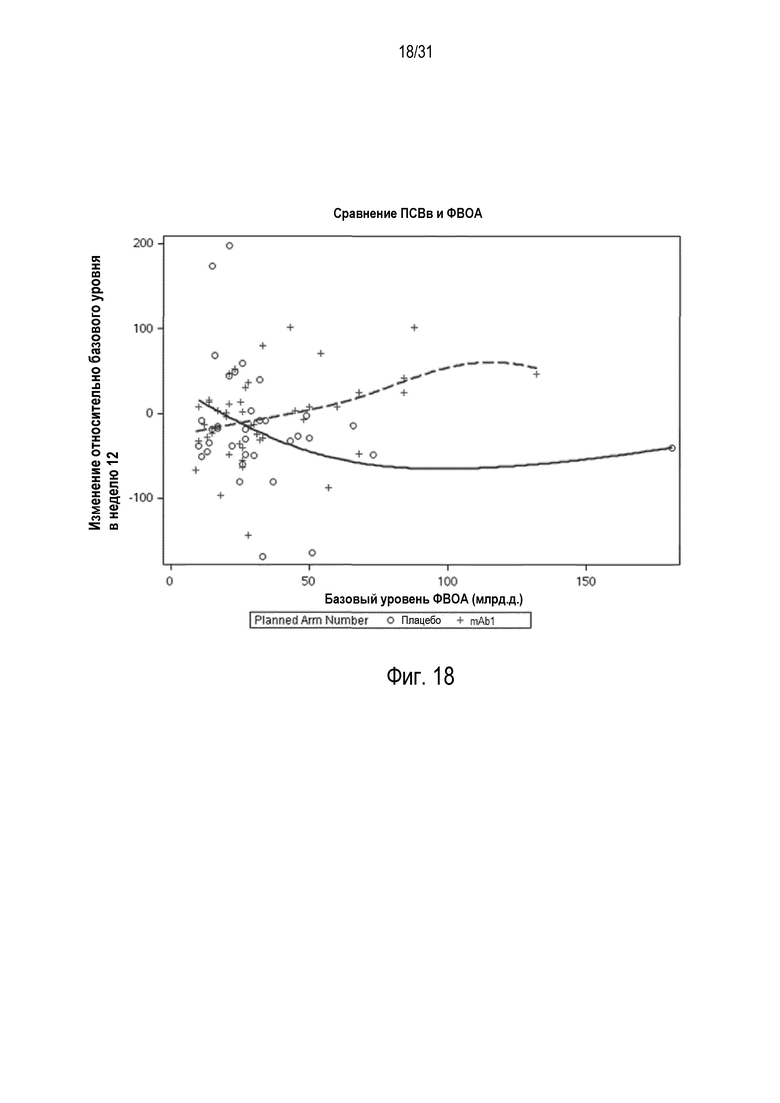









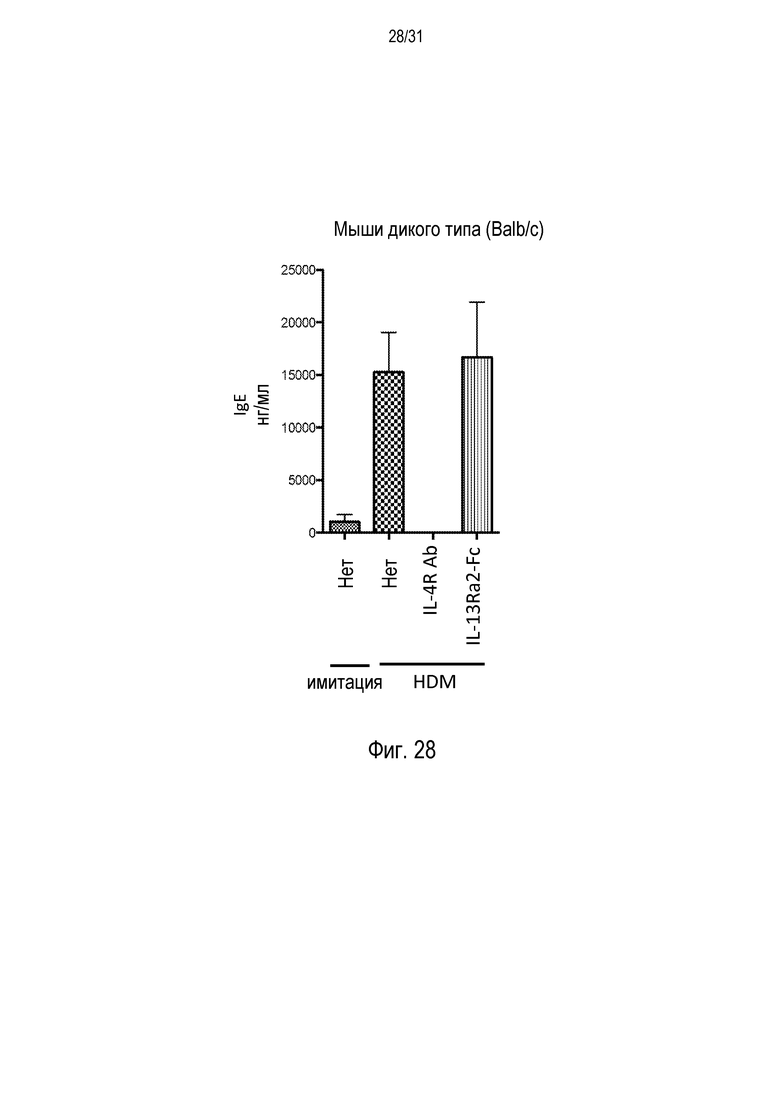


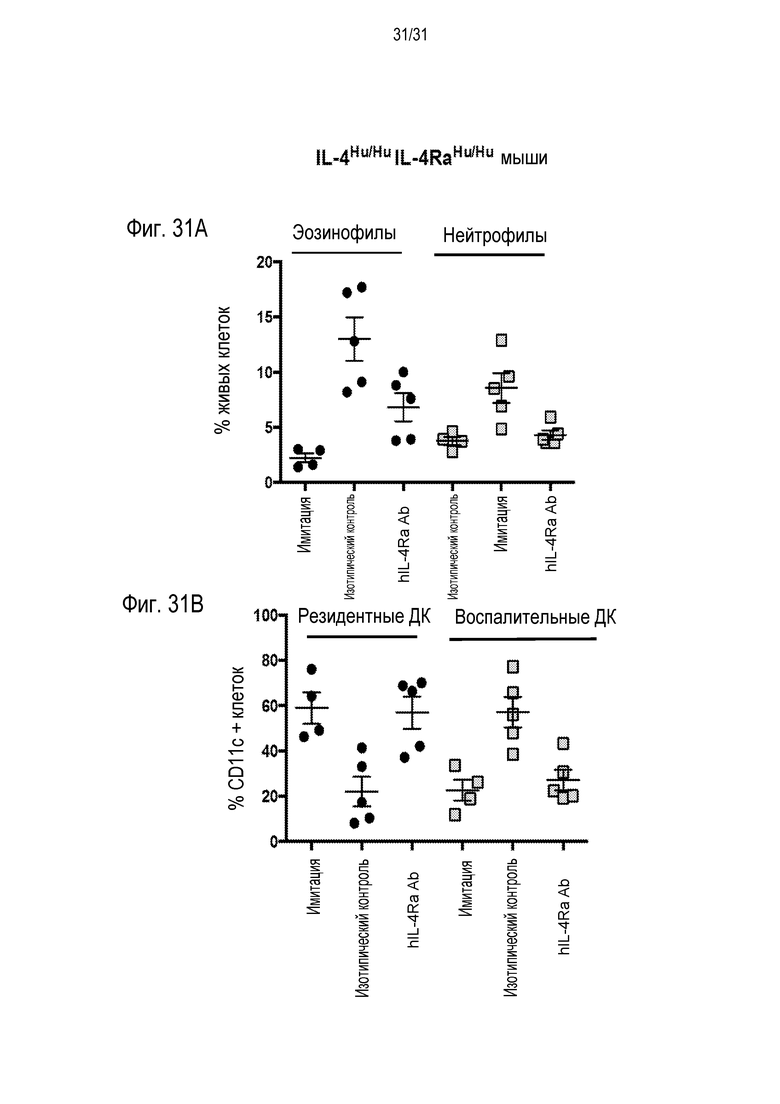
Настоящая группа изобретений относится к медицине, а именно к терапии, и касается лечения астмы. Для этого вводят эффективное количество фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R). При этом указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164. Это обеспечивает уменьшение частоты обострений умеренно-тяжелой астмы и снижение зависимости пациента от ингаляционных кортикостероидов и/или бета-агонистов длительного действия. 6 н. и 42 з.п. ф-лы, 13 табл., 4 пр., 31 ил.
1. Способ лечения умеренной-тяжелой астмы, который уменьшает частоту возникновения обострений астмы и улучшает один или более связанных с астмой параметров, у субъекта с умеренной-тяжелой астмой, нуждающегося в этом, включающий последовательно введение субъекту единичной начальной дозы фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R), и где за введением единичной начальной дозы следует введение одной или более дополнительных доз указанной фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164.
2. Способ по п.1, где антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую последовательности областей, определяющих комплементарность (HCDR), тяжелой цепи, включающие SEQ ID NO: 148, 150, 152 соответственно, и последовательности областей, определяющих комплементарность (LCDR), легкой цепи, включающие SEQ ID NO: 156, 158 и 160 соответственно.
3. Способ по п.1, где каждая из начальной дозы и дополнительных доз включают от 75 мг до 600 мг указанных антитела или его антигенсвязывающего фрагмента.
4. Способ по п.1, где фармацевтическую композицию вводят субъекту системно, подкожно, внутривенно или интраназально.
5. Способ по п.1, где указанная фармацевтическая композиция, включающая антитело или его антигенсвязывающий фрагмент, представляет собой дополнительное лечение к умеренно-высокой дозе ингаляционного кортикостероида (ИКС) и второго контролирующего лекарственного средства.
6. Способ по п.1, где второе контролирующее лекарственное средство выбрано из группы, состоящей из: ингибитора фактора некроза опухоли (ФНО), ингибитора интерлейкина-1 (IL-1), ингибитора интерлейкина-5 (IL-5), ингибитора интерлейкина-8 (IL-8), ингибитора интерлейкина Е (IgE), ингибитора лейкотриена, кортикостероида, метилксантина, нестероидного противовоспалительного лекарственного средства (НПВС), недокромила натрия, кромолина натрия, бета2-агониств длительного действия (БАДД), противогрибкового средства и их комбинации.
7. Способ по п.1, где каждую дополнительную дозу вводят через 1-8 недель после введения непосредственно предшествующей дозы.
8. Способ по п.1, где субъекту вводят по меньшей мере 8 дополнительных доз антитела или его антигенсвязывающего фрагмента, которые специфично связывают рецептор интерлейкина 4 (IL-4R), и где каждую дополнительную дозу вводят через 1 неделю после непосредственно предшествующей дозы.
9. Способ по п.1, где уровень экспрессии одного или более генных продуктов, выбранных из группы, состоящей из тимуса и активацией регулируемого хемокина (TARC), IgE, эотаксина-3, периостина, раково-эмбрионального антигена (РЭА) и YKL-40, снижается у субъекта относительно базового уровня.
10. Способ дополнительного поддерживающего лечения умеренной-тяжелой астмы, который снижает или устраняет зависимость пациента с астмой от ингаляционных кортикостероидов (ИКС) и/или бета-агонистов длительного действия (БАДД) для лечения одного или более обострений астмы, включающий:
(a) отбор пациента, который имеет умеренную-тяжелую астму, которая поддается частичному контролю или не поддается контролю с применением базисной терапии астмы, включающей ИКС, БАДД или их комбинацию;
(b) введение пациенту дозы антитела или его антигенсвязывающего фрагмента, которые специфично связывают рецептор интерлейкина 4 (IL-4R), с определенной частотой в течение начального периода лечения, с сохранением базисной терапии астмы у пациента в течение начального периода лечения; и
(c) постепенное снижение или отмену дозы ИКС и/или БАДД, вводимых пациенту, в течение последующего периода лечения с продолжением введения указанных антитела или его антигенсвязывающего фрагмента в течение начального периода лечения, где указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164.
11. Способ по п.10, где ИКС представляет собой флутиказон, будесонид или мометазон.
12. Способ по п.10, где БАДД представляет собой салметерол или формотерол.
13. Способ по п.10, где комбинация ИКС/БАДД представляет собой флутиказон/салметерол, будесонид/формотерол или мометазон/формотерол.
14. Способ по п.10, где дозу БАДД отменяют в конце начального периода лечения.
15. Способ по п.10, где дозу БАДД и/или ИКС постепенно снижают или отменяют в течение 2-8 недель.
16. Способ по п.10, где антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую последовательности областей, определяющих комплементарность (HCDR), тяжелой цепи, включающие SEQ ID NO: 148, 150, 152 соответственно, и последовательности областей, определяющих комплементарность (LCDR), легкой цепи, включающие SEQ ID NO: 156, 158 и 160 соответственно.
17. Способ по п.10, где каждая из начальной дозы и дополнительных доз включает от 75 мг до 600 мг указанных антитела или его антигенсвязывающего фрагмента.
18. Способ по п.10, где фармацевтическую композицию вводят субъекту системно, подкожно, внутривенно или интраназально.
19. Способ по п.10, где уровень экспрессии одного или более генных продуктов, выбранных из группы, состоящей из тимуса и активацией регулируемого хемокина (TARC), IgE, эотаксина-3, периостина, раково-эмбрионального антигена (РЭА) и YKL-40, снижается у субъекта относительно базового уровня.
20. Способ лечения умеренной-тяжелой астмы у субъекта, астма которого неадекватно контролируется умеренно-высокой дозой ингаляционного кортикостероида (ИКС) и второго контролирующего лекарственного средства, включающий последовательное введение субъекту единичной начальной дозы фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R), и где за введением единичной начальной дозы следует введение одной или более дополнительных доз указанной фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164, где указанная фармацевтическая композиция представляет собой дополнительное лечение и понижает пероральное применение стероидов и улучшает функцию легких.
21. Способ по п.20, где системный кортикостероид вводят субъекту до, после и одновременно с фармацевтической композицией.
22. Способ по любому из пп.1-21, где начальная доза содержит и дополнительные дозы фармацевтической композиции каждая содержит одно и то же количество указанных антитела или антигенсвязывающего фрагмента.
23. Способ по любому из пп.1-21, где начальную дозу и дополнительные дозы фармацевтической композиции вводят каждые две недели.
24. Способ по любому из пп.1-21, где начальную дозу и дополнительные дозы фармацевтической композиции вводят каждые четыре недели.
25. Применение антитела или его антигенсвязывающего фрагмента, которые специфично связывают рецептор интерлейкина 4 (IL-4R), для лечения умеренной-тяжелой астмы, которое уменьшает частоту возникновения обострений астмы и улучшает один или более связанных с астмой параметров, у субъекта с умеренной-тяжелой астмой, нуждающегося в этом, включающее последовательное введение субъекту единичной начальной дозы фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R), и где за введением единичной начальной дозы следует введение одной или более дополнительных доз указанной фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164.
26. Применение по п.25, где антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую последовательности областей, определяющих комплементарность (HCDR), тяжелой цепи, включающие SEQ ID NO: 148, 150, 152 соответственно, и последовательности областей, определяющих комплементарность (LCDR), легкой цепи, включающие SEQ ID NO: 156, 158 и 160 соответственно.
27. Применение по п.25, где каждая из начальной дозы и дополнительных доз включают от 75 мг до 600 мг указанных антитела или его антигенсвязывающего фрагмента.
28. Применение по п.25, где фармацевтическую композицию вводят субъекту системно, подкожно, внутривенно или интраназально.
29. Применение по п.25, где указанная фармацевтическая композиция, включающая антитело или его антигенсвязывающий фрагмент, представляет собой дополнительное лечение к умеренно-высокой дозе ингаляционного кортикостероида (ИКС) и второго контролирующего лекарственного средства.
30. Применение по п.29, где второе контролирующее лекарственное средство выбрано из группы, состоящей из: ингибитора фактора некроза опухоли (ФНО), ингибитора интерлейкина-1 (IL-1), ингибитора интерлейкина-5 (IL-5), ингибитора интерлейкина-8 (IL-8), ингибитора интерлейкина Е (IgE), ингибитора лейкотриена, кортикостероида, метилксантина, нестероидного противовоспалительного лекарственного средства (НПВС), недокромила натрия, кромолина натрия, бета2-агонистов длительного действия (БАДД), противогрибкового средства и их комбинации.
31. Применение по п.25, где каждую дополнительную дозу вводят через 1-8 недель после введения непосредственно предшествующей дозы.
32. Применение по п.25, где субъекту вводят по меньшей мере 8 дополнительных доз антитела или его антигенсвязывающего фрагмента, которые специфично связывают рецептор интерлейкина 4 (IL-4R), и где каждую дополнительную дозу вводят через 1 неделю после непосредственно предшествующей дозы.
33. Применение по п.25, где уровень экспрессии одного или более генных продуктов, выбранных из группы, состоящей из тимуса и активацией регулируемого хемокина (TARC), IgE, эотаксина-3, периостина, раково-эмбрионального антигена (РЭА) и YKL-40, снижается у субъекта относительно базового уровня.
34. Применение фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R), в качестве дополнения в лечении умеренной-тяжелой астмы, которое снижает или устраняет зависимость пациента с астмой от ингаляционных кортикостероидов (ИКС) и/или бета-агонистов длительного действия (БАДД) для лечения одного или более обострений астмы, включающее:
(a) отбор пациента с умеренной-тяжелой астмой, который имеет умеренную-тяжелую астму, которая поддается частичному контролю или не поддается контролю с применением базисной терапии астмы, включающей ИКС, БАДД или их комбинацию;
(b) введение пациенту дозы антитела или его антигенсвязывающего фрагмента, которые специфично связывают рецептор интерлейкина 4 (IL-4R), с некоторой частотой в течение начального периода лечения, с сохранением базисной терапии астмы у пациента в течение начального периода лечения; и
(c) постепенное снижение или отмену дозы ИКС и/или БАДД, вводимых пациенту, в течение последующего периода лечения с продолжением введения указанных антитела или его антигенсвязывающего фрагмента в течение начального периода лечения, где указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164.
35. Применение по п.34, где ИКС представляет собой флутиказон, будесонид или мометазон.
36. Применение по п.34, где БАДД представляет собой салметерол или формотерол.
37. Применение по п.34, где комбинация ИКС/БАДД представляет собой флутиказон/салметерол, будесонид/формотерол или мометазон/формотерол.
38. Применение по п.34, где дозу БАДД отменяют в конце начального периода лечения.
39. Применение по п.34, где дозу БАДД и/или ИКС постепенно снижают или отменяют в течение 2-8 недель.
40. Применение по п.34, где антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, включающую последовательности областей, определяющих комплементарность (HCDR), тяжелой цепи, включающие SEQ ID NO: 148, 150, 152 соответственно, и последовательности областей, определяющих комплементарность (LCDR), легкой цепи, включающие SEQ ID NO: 156, 158 и 160 соответственно.
41. Применение по п.34, где каждая из начальной дозы и дополнительных доз включают от 75 мг до 600 мг указанных антитела или его антигенсвязывающего фрагмента.
42. Применение по п.34, где фармацевтическую композицию вводят субъекту системно, подкожно, внутривенно или интраназально.
43. Применение по п.34, где уровень экспрессии одного или более генных продуктов, выбранных из группы, состоящей из тимуса и активацией регулируемого хемокина (TARC), IgE, эотаксина-3, периостина, раково-эмбрионального антигена (РЭА) и YKL-40, снижается у субъекта относительно базового уровня.
44. Применение фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R), в лечении умеренной-тяжелой астмы у субъекта, астма которого неадекватно контролируется умеренно-высокой дозой ингаляционного кортикостероида (ИКС) и второго контролирующего лекарственного средства, включающее последовательно введение субъекту единичной начальной дозы фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент специфично связывают рецептор интерлейкина 4 (IL-4R), и где за введением единичной начальной дозы следует введение одной или более дополнительных доз указанной фармацевтической композиции, включающей антитело или его антигенсвязывающий фрагмент, где указанные антитело или его антигенсвязывающий фрагмент включают последовательности областей, определяющих комплементарность (CDR), тяжелой цепи и легкой цепи из пары последовательностей вариабельной области тяжелой цепи (HCVR) / вариабельной области легкой цепи (LCVR) SEQ ID NO: 162/164, где указанная фармацевтическая композиция представляет собой дополнительное лечение и понижает пероральное применение стероидов и улучшает функцию легких.
45. Применение по п.44, где системный кортикостероид вводят субъекту до, после и одновременно с фармацевтической композицией.
46. Применение по любому из пп.25-45, где начальная доза содержит и дополнительные дозы фармацевтической композиции каждая содержит одно и то же количество указанных антитела или антигенсвязывающего фрагмента.
47. Применение по любому из пп.25-45, где начальную дозу и дополнительные дозы фармацевтической композиции вводят каждые две недели.
48. Применение по любому из пп.25-45, где начальную дозу и дополнительные дозы фармацевтической композиции вводят каждые четыре недели.
| WO 2010053751 A1 14.05.2010 | |||
| CORREN J et al | |||
| "A randomized, controlled, phase 2 study of AMG 317, an IL-4Rα antagonist, in patients with asthma" | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| OTULANA B.A | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| SLAGER R.E | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2019-06-05—Публикация
2013-08-20—Подача