перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет на основании предварительной заявки США № 61/459760, поданной 16 декабря 2010, предварительной заявки США № 61/465425, поданной 18 марта 2011, предварительной заявки США № 61/484650, поданной 10 мая 2011, предварительной заявки США № 61/574485, поданной 2 августа 2011, и предварительной заявки США № 61/557295, поданной 8 ноября 2011, где все указанные заявки включены в настоящее описание в качестве ссылки во всей полноте.
список последовательностей
Настоящая заявка содержит Список последовательностей, предложенный в формате ASCII через EFS-Web и, следовательно, полностью включенный в настоящее описание в качестве ссылки. Указанная копия ASCII, созданная 17 ноября 2011, озаглавлена P4569RlWO_PCTSequenceListing.txt и имеет размер 73118 байт.
область изобретения
Изобретение предлагает способы диагностики и лечения расстройств, связанных с ингибированием TH2, включающих, без ограничения, астму. Изобретение также предлагает способы выбора или идентификации пациентов, подходящих для лечения с помощью определенных терапевтических средств, которые являются ингибиторами пути TH2.
Уровень техники изобретения
Астма представляет собой сложное заболевание и ее встречаемость по всему миру увеличивается. Среди других событий у астматических пациентов наблюдается эозинофильное воспаление в дыхательных путях. Патофизиология заболевания характеризуется непостоянной обструкцией дыхательных путей, воспалением дыхательных путей, гиперсекрецией слизи и субэпителиальным фиброзом. Клинические симптомы включают кашель, свистящее дыхание и одышку. Хотя многие пациенты в достаточной степени поддаются лечению существующими в настоящее время терапевтическими способами, некоторые страдающие от астмы пациенты имеют заболевание, устойчивое к современным терапевтическим способам лечения.
Изобилие лекарственных средств против астмы присутствует на рынке или находится в разработке. Одной из многочисленных мишеней противоастматической терапии является IL-13. IL-13 представляет собой плейотропный цитокин TH2, продуцируемый активированными T-клетками, NKT-клетками, базофилами, эозинофилами и тучными клетками, который активно участвует в патогенезе астмы у предклинических моделей. Несмотря на то, что в литературе описано много фактов, свидетельствующих о связи IL-13 и IL-4 с астмой, клинические испытания многих способов лечения, основанных на применении антагонистов IL-13 и/или IL-4, дают разочаровывающие результаты. В настоящее время не существует способов, основанных на применении антагонистов IL-13 или IL-4, разрешенных для лечения астмы. Кроме того, пациенты с астмой на стадии от умеренной до тяжелой продолжают испытывать недостаток в хороших вариантах альтернативных способов лечения. Таким образом, существует потребность в улучшенных терапевтических способах лечения астмы и в усовершенствованных методах понимания, как лечить астматических пациентов.
Все цитирующиеся здесь документы, в том числе патентные заявки и публикации, полностью включены в настоящее описание в качестве ссылок в любых целях.
сущность изобретения
Настоящая заявка предлагает терапевтические средства для ингибирования пути TH2 и усовершенствованные способы их применения. Настоящая заявка также предлагает усовершенствованные способы диагностики заболевания с целью лечения заболевания, необязательно, с использованием ингибитора пути TH2.
Способы лечения и диагностики, предлагаемые в данном документе, можно применять к пациентам, страдающим от астмы, эозинофильного расстройства, респираторных расстройств, расстройства, опосредованного IL-13, и/или расстройства, опосредованного IgE, или от симптомов, связанных с указанными расстройствами. Пациентов, страдающих от астма-подобных симптомов, которые включают пациентов, у которых не диагностирована астма, можно лечить с помощью описанных здесь способов.
В соответствии с одним воплощением пациент, подлежащий лечению с помощью описанных здесь способов, страдает от астмы, эозинофильного расстройства, респираторного расстройства, расстройства, опосредованного IL-13, и/или расстройства, опосредованного IgE, или от симптомов, связанных с указанными расстройствами, но не имеет рака или новообразования. В соответствии с другим воплощением пациент, подлежащий лечению с помощью описанных здесь способов, страдает от астмы, эозинофильного расстройства, респираторных расстройств, расстройства, опосредованного IL-13, и/или расстройства, опосредованного IgE, или от симптомов, связанных с указанными расстройствами, а возраст указанного пациента составляет 12 лет или старше, 18 лет или старше, 19 лет или старше, от 12 до 17 лет или от 18 до 75 лет.
В одном воплощении пациент, которого лечат ингибитором пути TH2 по настоящему изобретению, также получает одно, два, три или более терапевтических средств. В одном воплощении пациент представляет собой астматического пациента. В соответствии с одним воплощением пациент получает ингибитор пути TH2 и одно, два, три или более терапевтических средств, где по меньшей мере одно терапевтическое средство, отличное от ингибитора TH2, представляет собой кортикостероид, антагонист лейкотриена, LABA, композицию, содержащую сочетание кортикостероид/LABA, теофиллин, кромолин натрия, недокромил натрия, омализумаб, LAMA, MABA, ингибитор белка, активирующего 5-липоксигеназу (FLAP), или ингибитор фермента PDE-4. В соответствии с одним аспектом изобретения ингибитор пути TH2 вводят астматическому пациенту с диагностированным статусом EIP, где диагноз с определением статуса EIP проводят с помощью анализа EID (указанный анализ используют отдельно или в сочетании с другими анализами). В другом воплощении болезненное состояние астматического пациента не контролируют кортикостероидом перед лечением. В другом воплощении астматический пациент также получает второе контролирующее средство. В одном воплощении второе контролирующее средство представляет собой кортикостероид, LABA или антагонист лейкотриена. В следующем воплощении астматический пациент страдает от астмы со степенью тяжести от умеренной до тяжелой. Таким образом, в одном воплощении пациент, подлежащий лечению ингибитором пути TH2, представляет собой пациента с умеренной или тяжелой астмой, состояние которого не контролируют кортикостероидом перед лечением ингибитором пути TH2, а затем лечат ингибитором пути TH2 и одним, двумя, тремя или более контролирующими средствами. В одном воплощении по меньшей мере одно из контролирующих средств представляет собой кортикостероид. В следующем воплощении такой пациент получает ингибитор пути TH2, кортикостероид и другое контролирующее средство. В другом воплощении пациент страдает от легкой стадии астмы и не получает кортикостероид. Следует понимать, что режимы лечения терапевтическими средствами могут отличаться от режима лечения ингибитором TH2, и, следовательно, терапевтические средства и ингибитор TH2, как составные части лечения пациента, можно вводить в разное время. Следовательно, в соответствии с одним воплощением, способ лечения по настоящему изобретению включает стадии введения пациенту ингибитора пути TH2 и, необязательно, введения по меньшей мере одного, двух или трех других терапевтических средств. В одном воплощении ингибитор пути TH2 входит в состав композиции вместе с другим терапевтическим средством. В другом воплощении ингибитор пути TH2 не входит в состав композиции вместе с другим терапевтическим средством.
В соответствии с другим воплощением изобретение предлагает способ лечения астмы, включающий введение антитела против IL-13, содержащего VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, или антитела против IL-13, содержащего HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR имеют соответственно аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, в качестве единообразной дозы. В одном воплощении антитело против IL-13, содержащее VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, вводят в виде единообразной дозы (т.е., не зависящей от массы) 125-1000 мг путем подкожного введения или внутривенного введения с частотой, выбранной из группы, включающей: каждые 2 недели, каждые 3 недели и каждые 4 недели. В одном воплощении антитело против IL-13, содержащее HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR имеют соответственно аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, вводят в виде единообразной дозы (т.е., не зависящей от массы) 125-1000 мг путем подкожного введения или внутривенного введения с частотой, выбранной из группы, включающей: каждые 2 недели, каждые 3 недели и каждые 4 недели. В одном воплощении антитело против IL-13 представляет собой лебрикизумаб, который вводят в виде единообразной дозы (т.е., не зависящей от массы) 125-1000 мг путем подкожного введения или внутривенного введения с частотой, выбранной из группы, включающей: каждые 2 недели, каждые 3 недели и каждые 4 недели. В другом воплощении пациент имеет статус EIP, который диагностируют с помощью анализа общего периостина.
В соответствии с другим воплощением антитело, содержащее VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, вводят с целью лечения астмы в терапевтически эффективном количестве, достаточном для уменьшения с течением времени степени обострения заболевания у пациента или улучшения FEV1. В следующем воплощении изобретение предлагает способ лечения астмы, включающий введение антитела против IL-13, содержащего VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, или антитела против IL-13, содержащего HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR имеют соответственно аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, вводят в виде единообразной дозы (т.е., не зависящей от массы) 37,5 мг, или в виде единообразной дозы 125 мг, или в виде единообразной дозы 250 мг. В некоторых воплощениях дозу вводят путем подкожной инъекции один раз в 4 недели в течение определенного периода времени. В некоторых воплощениях период времени составляет 6 месяцев, один год, два года, пять лет, десять лет, 15 лет, 20 лет, или он равен продолжительности жизни пациента. В некоторых воплощениях астма представляет собой тяжелую астму, и состояние пациента контролируется неадекватно или не контролируется ингаляцией кортикостероидов и вторым контролирующим средством. В другом воплощении для лечения антителом против IL-13, как описано выше, выбирают пациента, имеющего статус EIP, который диагностируют с помощью анализа общего периостина. В другом воплощении способ включает лечение астматического пациента антителом против IL-13, как описано выше, где у пациента заранее диагностирован статус EIP с помощью анализа общего периостина. В одном воплощении возраст астматического пациента составляет 18 лет или старше. В одном воплощении возраст астматического пациента составляет от 12 до 17 лет, а антитело против IL-13 вводят в виде единообразной дозы 250 мг или в виде единообразной дозы 125 мг. В одном воплощении возраст астматического пациента составляет от 6 до 11 лет, а антитело против IL-13 вводят в виде единообразной дозы 125 мг или в виде единообразной дозы 62,5 мг.
Настоящее изобретение предлагает анализ периостина. В одном воплощении анализ периостина представляет собой анализ общего периостина. В другом воплощении анализ общего периостина включает применение одного или нескольких антител против периостина по данному изобретению для связывания общего периостина в биологическом образце, полученном от пациента. В следующем воплощении данного изобретения биологический образец представляет собой сыворотку, полученную из целой крови. В одном воплощении биологический образец получают от астматического пациента. В следующем воплощении астматический пациент представляет собой пациента с умеренной или тяжелой стадией астмы. В следующем воплощении состояние пациента с умеренной или тяжелой стадией астмы не контролируют кортикостероидом, но, необязательно, подвергают лечению одним, двумя, тремя или более контролирующими средствами.
Раскрытые в данном документе анализы с применением антител против периостина и анализы антител можно использовать для диагностики других заболеваний, характеризующихся повышенным уровнем периостина, таких как идиопатический фиброз легких (IPF), неспецифическая интерстициальная пневмония (NSIP) и рак.
Настоящее изобретение предлагает терапевтическое средство, представляющее собой ингибитор пути TH2, для лечения астмы или респираторного расстройства у пациента, где пациент имеет повышенные уровни общего периостина. В одном воплощении мишень, подлежащая ингибированию в пути TH2, выбрана из группы, включающей: IL-9, IL-5, IL-13, IL-4, OX40L, TSLP, IL-25, IL-33 и IgE; а также рецепторы, такие как: рецептор IL-9, рецептор IL-5, рецептор IL-4 альфа, рецептор IL-13 альфа1 и рецептор IL-13 альфа2, OX40, TSLP-R, IL-7R альфа (корецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2, FcepsilonRI и FcepsilonRII/CD23 (рецепторы IgE). В одном воплощении пациент, подлежащий лечению с помощью способов по настоящему изобретению, страдает астмой от умеренной до тяжелой стадии, необязательно астмой от средней до тяжелой стадии, причем такая астма не контролируется кортикостероидом. В следующем воплощении уровень общего периостина в сыворотке пациента с астмой от умеренной до тяжелой стадии, которая не контролируется кортикостероидом, превышает 20 нг/мл, 21 нг/мл, 22 нг/мл, 23 нг/мл, 24 нг/мл или 25 нг/мл по данным анализа E4. В следующем воплощении подлежащий лечению пациент также имеет повышенные уровни экспрессии одного из мРНК или белков CEA, TARC (CCL17) и MCP-4 (CCL13), или сочетания нескольких или всех вышеперечисленных соединений. В следующем воплощении подлежащий лечению пациент помимо повышенных уровней экспрессии периостина, как описано в настоящем документе, имеет уровень FENO, превышающий 21 часть на миллиард или 35 частей на миллиард.
Настоящее изобретение предлагает применение терапевтического средства, которое связывает мишень TH2-индуцированного астматического пути, в способе получения лекарственного средства для лечения пациента, страдающего от астмы или респираторного расстройства, где у пациента наблюдаются повышенные уровни общего периостина, и где мишень представляет собой IL-9, IL-5, IL-13, IL-4, OX40L, TSLP, IL-25, IL-33 и IgE; а также рецепторы, такие как: рецептор IL-9, рецептор IL-5, рецептор IL-4 альфа, рецептор IL-13 альфа1 и рецептор IL-13 альфа2, OX40, TSLP-R, IL-7R альфа (ко-рецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2, FcepsilonRI или FcepsilonRII/CD23 (рецепторы IgE). В одном воплощении пациент имеет статус EIP. В соответствии с одним воплощением у пациента диагностируют статус EIP с помощью анализа по настоящему изобретению. В следующем воплощении анализ представляет собой анализ общего периостина. В другом воплощении с помощью анализа измеряют уровень общего периостина в биологическом образце, полученном от пациента. В одном воплощении с помощью анализа измеряют уровень общего белка периостина в образце сыворотки, полученном от пациента.
Настоящее изобретение включает набор или промышленное изделие для диагностики подтипа астмы у пациента, содержащие:
(1) средства для определения в образце сыворотки, полученном от пациента, общего периостина и, необязательно, уровней экспрессии одного или нескольких белков, выбранных из TARC и MCP-4; и
(2) инструкции по измерению уровней экспрессии общего периостина и, необязательно, белков TARC и/или MCP-4 в образце сыворотки, где повышенные уровни экспрессии одного из указанных белков или сочетания нескольких или всех указанных белков определяют подтип астмы.
В следующем воплощении изобретение предлагает способы идентификации астматического пациента, или пациента с респираторным расстройством, который с большой вероятностью может быть чувствительным к лечению ингибитором пути TH2. В некоторых воплощениях способы включают определение, является ли пациент положительным по эозинофильному воспалению (EIP), с помощью диагностического анализа эозинофильного воспаления (EIDA), где статус EIP свидетельствует о том, что пациент является чувствительным к лечению ингибитором пути TH2.
В другом воплощении изобретение предлагает способы идентификации астматического пациента, или пациента с респираторным расстройством, который с большой вероятностью страдает от тяжелых обострений. В некоторых воплощениях способы включают определение, имеет ли пациент статус EIP, с помощью EIDA, где статус EIP свидетельствует о том, что пациент с большой вероятностью страдает от тяжелых обострений.
В следующем воплощении изобретение предлагает способы идентификации астматического пациента, или пациента с респираторным расстройством, который с меньшей вероятностью может быть чувствительным к лечению ингибитором пути TH2. В некоторых воплощениях способы включают определение, является ли пациент отрицательным по эозинофильному воспалению (EIN), с помощью EIDA, где статус EIN свидетельствует о том, что пациент с меньшей вероятностью является чувствительным к лечению ингибитором пути TH2
В другом воплощении изобретение предлагает способы наблюдения за астматическим пациентом, подлежащим лечению ингибитором пути TH2. В некоторых воплощениях способы включают определение методом EIDA, имеет ли пациент статус EIP или EIN. В одном воплощении способ включает выбор режима лечения ингибитором пути TH2. В одном воплощении статус EIP свидетельствует о необходимости продолжать терапию ингибитором пути TH2, а статус EIN свидетельствует об отсутствии необходимости продолжать терапию ингибитором пути TH2.
В некоторых воплощениях EIDA, используемый в описанных выше способах, включает следующие стадии: (a) определение количества общего периостина в образце, полученном от астматического пациента; (b) сравнение количества общего периостина, определенного на стадии (a), со стандартным количеством; и (c) отнесение указанного пациента к категории чувствительного или не чувствительного к лечению на основе сравнения, проведенного на стадии (b). В некоторых воплощениях общий периостин представляет собой сывороточный периостин, который измеряют с помощью иммунологического анализа. В некоторых воплощениях иммунологический анализ представляет собой иммунологический сэндвич-анализ. В некоторых воплощениях иммунологический сэндвич-анализ проводят с помощью анализатора Elecsys® (Roche Diagnostics GmbH). В некоторых воплощениях иммунологический сэндвич-анализ представляет собой анализ E4. В одном воплощении стандартное количество для EIP составляет 23 нг/мл или больше при использовании анализа E4 на стадии (a). В одном воплощении стандартное количество для EIP составляет 50 нг/мл или больше при использовании анализатора Elecsys® на стадии (a). В одном воплощении стандартное количество для EIN составляет 21 нг/мл или меньше при использовании анализа E4 на стадии (a). В одном воплощении стандартное количество для EIN составляет 48 нг/мл или меньше при использовании анализатора Elecsys® на стадии (a).
В некоторых воплощениях пациент, подходящий для лечения с помощью описанных выше способов, страдает от умеренной или тяжелой астмы. В некоторых воплощениях астма или респираторное расстройство не контролируется кортикостероидом. В некоторых воплощениях кортикостероид вводят путем ингаляции. В некоторых воплощениях ингаляционный кортикостероид представляет собой Qvar®, Pulmicort®, Symbicort®, Aerobid®, Flovent®, Flonase®, Advair® или Azmacort®. В одном воплощении пациент также получает второе контролирующее средство. В некоторых воплощениях второе контролирующее средство представляет собой бронходилататор длительного действия (LABD). В некоторых воплощениях LABD представляет собой агонист бета-2 длительного действия (LABA), антагонист рецептора лейкотриенов (LTRA), мускариновый антагонист длительного действия (LAMA), теофиллин или пероральные кортикостероиды (OCS). В некоторых воплощениях LABD представляет собой Symbicort®, Advair®, Brovana®, Foradil®, PerforomistTM или Serevent®.
В некоторых воплощениях ингибитор пути TH2 в соответствии с описанными выше способами ингибирует мишень ITK, BTK, IL-9 (например, MEDI-528), IL-5 (например, меполизумаб, CAS № 196078-29-2; ресилизумаб), IL-13 (например, IMA-026, IMA-638 (также называемый анрукинзумаб, INN № 910649-32-0; QAX-576; улавливатель IL4/IL13), тралокинумаб (также называемый CAT-354, CAS № 1044515-88-9); AER-001, ABT-308 (также называемый гуманизированное антитело 13C5.5), IL-4 (например, AER-001, улавливатель IL4/IL13), OX40L, TSLP, IL-25, IL-33 и IgE (например, XOLAIR, QGE-031; MEDI-4212); а также рецепторы, такие как: рецептор IL-9, рецептор IL-5 (например, MEDI-563 (бенрализумаб, CAS № 1044511-01-4), рецептор IL-4 альфа (например, AMG-317, AIR-645), рецептор IL-13 альфа1 (например, R-1671) и рецептор IL-13 альфа2, OX40, TSLP-R, IL-7Rальфа (корецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2 (например, AMG-853, AP768, AP-761, MLN6095, ACT129968), FcepsilonRI, FcepsilonRII/CD23 (рецепторы IgE), Flap (например, GSK2190915), Syk-киназа (R-343, PF3526299); CCR4 (AMG-761), TLR9 (QAX-935), или он представляет собой мультицитокиновый игибитор CCR3, IL5, IL3, GM-CSF (например, TPI ASM8). В некоторых воплощениях ингибитор пути TH2 представляет собой ингибитор пути анти-IL13/IL4 или средство, связывающее IgE. В некоторых воплощениях ингибитор пути TH2 представляет собой антитело против IL-13. В некоторых воплощениях антитело против IL-13 представляет собой антитело, содержащее VH с последовательностью SEQ ID NO:9 и VL с последовательностью SEQ ID NO: 10, антитело против IL-13, содержащее HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR соответственно имеют аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, или лебрикизумаб. В некоторых воплощениях антитело против IL-13 представляет собой биспецифическое антитело, которое также связывает IL-4. В некоторых воплощениях ингибитор пути TH2 представляет собой антитело против IgE. В некоторых воплощениях антитело против IgE представляет собой (i) антитело XOLAIR®, (ii) антитело против M1', содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь имеет последовательность SEQ ID NO: 24, а вариабельная легкая цепь имеет последовательность SEQ ID NO: 25, или (iii) антитело против M1', содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь также содержит HVR-H1, HVR-H2 и HVR-H3, а вариабельная легкая цепь также содержит HVR-L1, HVR-L2 и HVR-L3, и: (a) HVR-H1 представляет собой остатки 26-35 SEQ ID NO: 24 [GFTFSDYGIA]; (b) HVR-H2 представляет собой остатки 49-66 SEQ ID NO: 24 [AFISDLAYTIYYADTVTG]; (c) HVR-H3 представляет собой остатки 97-106 SEQ ID NO: 24, [ARDNWDAMDY]; (d) HVR-L1 представляет собой остатки 24-39 SEQ ID NO: 25 [RSSQSLVHNNANTYLH]; (e) HVR-L2 представляет собой остатки 55-61 SEQ ID NO: 25 [KVSNRFS]; (f) HVR-L3 представляет собой остатки 94-102 SEQ ID NO: 25 [SQNTLVPWT].
В другом аспекте набор для детекции общего периостина в образце, полученном от астматического пациента, используют для отнесения/распределения астматических пациентов в группы, характеризующиеся чувствительностью или нечувствительностью к терапевтическому лечению ингибитором пути TH2. В некоторых воплощениях общий периостин определяют с помощью EIDA, который включает следующие стадии: (a) определение количества общего периостина в образце, полученном от астматического пациента; (b) сравнение количества общего периостина, определенного на стадии (a), со стандартным количеством; и (c) отнесение указанного пациента к категории чувствительного или не чувствительного к лечению на основе сравнения, проведенного на стадии (b). В некоторых воплощениях общий периостин представляет собой сывороточный периостин, который измеряют с помощью иммунологического анализа. В некоторых воплощениях иммунологический анализ представляет собой иммунологический сэндвич-анализ. В некоторых воплощениях иммунологический сэндвич-анализ проводят с помощью анализатора Elecsys® (Roche Diagnostics GmbH). В некоторых воплощениях иммунологический сэндвич-анализ представляет собой анализ E4. В одном воплощении стандартное количество для EIP составляет 23 нг/мл или больше при использовании анализа E4 на стадии (a). В одном воплощении стандартное количество для EIP составляет 50 нг/мл или больше при использовании анализатора Elecsys® на стадии (a).
В некоторых воплощениях пациент, подходящий для лечения с помощью описанных выше способов, страдает от умеренной или тяжелой астмы. В некоторых воплощениях астма или респираторное расстройство не контролируется кортикостероидом. В некоторых воплощениях кортикостероид вводят путем ингаляции. В некоторых воплощениях ингаляционный кортикостероид представляет собой Qvar®, Pulmicort®, Symbicort®, Aerobid®, Flovent®, Flonase®, Advair® или Azmacort®. В одном воплощении пациенту также вводят второе контролирующее средство. В некоторых воплощениях второе контролирующее средство представляет собой бронходилататор длительного действия (LABD). В некоторых воплощениях LABD представляет собой агонист бета-2 длительного действия (LABA), антагонист рецептора лейкотриенов (LTRA), мускариновый антагонист длительного действия (LAMA), теофиллин или пероральные кортикостероиды (OCS). В некоторых воплощениях LABD представляет собой Symbicort®, Advair®, Brovana®, Foradil®, PerforomistTM или Serevent®.
В некоторых воплощениях ингибитор пути TH2 в соответствии с описанными выше способами применения ингибирует мишень ITK, BTK, IL-9 (например, MEDI-528), IL-5 (например, меполизумаб, CAS № 196078-29-2; ресилизумаб), IL-13 (например, IMA-026, IMA-638 (также называемый анрукинзумаб, INN № 910649-32-0; QAX-576; улавливатель IL4/IL13), тралокинумаб (также называемый CAT-354, CAS № 1044515-88-9); AER-001, ABT-308 (также называемый гуманизированное антитело 13C5.5), IL-4 (например, AER-001, улавливатель IL4/IL13), OX40L, TSLP, IL-25, IL-33 и IgE (например, XOLAIR, QGE-031; MEDI-4212); а также рецепторы, такие как: рецептор IL-9, рецептор IL-5 (например, MEDI-563 (бенрализумаб, CAS № 1044511-01-4), рецептор IL-4 альфа (например, AMG-317, AIR-645), рецептор IL-13 альфа1 (например, R-1671) и рецептор IL-13 альфа2, OX40, TSLP-R, IL-7Rальфа (корецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2 (например, AMG-853, AP768, AP-761, MLN6095, ACT129968), FcepsilonRI, FcepsilonRII/CD23 (рецепторы IgE), Flap (например, GSK2190915), Syk-киназа (R-343, PF3526299); CCR4 (AMG-761), TLR9 (QAX-935), или он представляет собой мультицитокиновый ингибитор CCR3, IL5, IL3, GM-CSF (например, TPI ASM8). В некоторых воплощениях ингибитор пути TH2 представляет собой ингибитор пути анти-IL13/IL4 или средство, связывающее IgE. В некоторых воплощениях ингибитор пути TH2 представляет собой антитело против IL-13. В некоторых воплощениях антитело против IL-13 представляет собой антитело, содержащее VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, антитело против IL-13, содержащее HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR соответственно имеют аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, или лебрикизумаб. В некоторых воплощениях антитело против IL-13 представляет собой биспецифическое антитело, которое также связывает IL-4. В некоторых воплощениях ингибитор пути TH2 представляет собой антитело против IgE. В некоторых воплощениях антитело против IgE представляет собой (i) антитело XOLAIR®, (ii) антитело против M1', содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь имеет последовательность SEQ ID NO: 24, а вариабельная легкая цепь имеет последовательность SEQ ID NO: 25, или (iii) антитело против M1', содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь также содержит HVR-H1, HVR-H2 и HVR-H3, а вариабельная легкая цепь также содержит HVR-L1, HVR-L2 и HVR-L3, и: (a) HVR-H1 представляет собой остатки 26-35 SEQ ID NO: 24 [GFTFSDYGIA]; (b) HVR-H2 представляет собой остатки 49-66 SEQ ID NO: 24 [AFISDLAYTIYYADTVTG]; (c) HVR-H3 представляет собой остатки 97-106 SEQ ID NO: 24 [ARDNWDAMDY]; (d) HVR-L1 представляет собой остатки 24-39 SEQ ID NO: 25, [RSSQSLVHNNANTYLH]; (e) HVR-L2 представляет собой остатки 55-61 SEQ ID NO: 25 [KVSNRFS]; (f) HVR-L3 представляет собой остатки 94-102 SEQ ID NO: 25 [SQNTLVPWT].
В следующем аспекте изобретение предлагает наборы для измерения общего периостина в биологическом образце, полученном от астматического пациента или от пациента, страдающего от респираторного расстройства, где набор содержит первую молекулу нуклеиновой кислоты, которая гибридизуется со второй молекулой нуклеиновой кислоты, где вторая молекула нуклеиновой кислоты кодирует общий периостин или его часть, или набор содержит антитело, которое связывается с общим периостином. В некоторых воплощениях набор включает вкладыш в упаковку, содержащий информацию по описанным выше способам применения.
В следующем аспекте изобретение предлагает наборы для диагностики подтипа астмы у пациента, которые включают: (1) средства для определения уровней общего периостина в образце сыворотки, полученном от пациента, и, необязательно, уровней экспрессии одного или нескольких белков, выбранных из TARC и MCP-4, в образце сыворотки; и (2) инструкции по измерению уровней общего периостина и, необязательно, TARC и/или MCP-4 в образце сыворотки, где повышенные уровни экспрессии одного из указанных белков, или сочетания нескольких или всех указанных белков, определяют подтип астмы. В некоторых воплощениях набор дополнительно содержит вкладыш в упаковку, позволяющий определить, имеет ли астматический пациент или пациент с респираторным расстройством статус EIP или EIN. В некоторых воплощениях набор дополнительно содержит вкладыш в упаковку, позволяющий определить, обладает ли астматический пациент чувствительностью к ингибитору пути TH2. В некоторых воплощениях набор дополнительно включает вкладыш в упаковку, содержащий информацию по описанным выше способам применения. В некоторых воплощениях набор дополнительно содержит пустой контейнер для биологического образца. В некоторых воплощениях набор содержит два антитела против периостина, которые можно использовать для определения уровней общего периостина с помощью иммунологического анализа.
В другом аспекте способы лечения астмы или респираторного расстройства включают введение антитела против IL-13, содержащего HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR соответственно имеют аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, пациенту, страдающему от астмы или респираторного расстройства, в виде единообразной дозы 125-500 мг каждые 2-8 недель. В некоторых воплощениях пациент страдает от умеренной или тяжелой астмы. В некоторых воплощениях астма или респираторное расстройство не контролируется кортикостероидом. В некоторых воплощениях астма или респираторное расстройство не контролируется ингаляционным кортикостероидом. В некоторых воплощениях астма или респираторное расстройство не контролируется флутиказонпропионатом (FP) в общей суточной дозе, составляющей, по меньшей мере, 500 мкг. В некоторых воплощениях кортикостероид представляет собой ингаляционный кортикостероид Qvar®, Pulmicort®, Symbicort®, Aerobid®, Flovent®, Flonase®, Advair®, Azmacort®. В некоторых воплощениях пациент получает второе контролирующее средство. В некоторых воплощениях пациенту продолжают вводить кортикостероид, необязательно ингаляционный кортикостероид, в процессе лечения антителом против IL-13. В некоторых воплощениях пациенту продолжают вводить второе контролирующее средство в процессе лечения антителом против IL-13. В некоторых воплощениях второе контролирующее средство представляет собой бронходилататор длительного действия. В некоторых воплощениях бронходилататор длительного действия представляет собой LABA, LTRA, LAMA, теофиллин или OCS. В некоторых воплощениях у пациента определяют статус EIP. В некоторых воплощениях у пациента определяют статус EIP с помощью описанного выше набора. В некоторых воплощениях у пациента определяют статус EIP с помощью описанного выше способа. В некоторых воплощениях пациенту вводят базовую дозу 125 мг или 250 мг каждые четыре недели. В некоторых воплощениях возраст пациента составляет 18 лет или старше, или возраст пациента составляет 12-17 лет или 12 лет и старше, или возраст пациента составляет 6-11 лет или 6 лет и старше.
В некоторых воплощениях антитело против IL-13 вводят подкожно. В некоторых воплощениях антитело против IL-13 вводят с помощью предварительно наполненного шприца или автоинжекторного устройства. В некоторых воплощениях возраст астматического пациента, подлежащего лечению в соответствии с описанными выше способами, составляет 18 лет или старше, уровень периостина в сыворотке указанного пациента составляет ≥50 нг/мл, а состояние пациента не контролируется ингаляционным кортикостероидом и вторым контролирующим лекарственным средством. В некоторых воплощениях сывороточный периостин измеряют с помощью иммунологического анализа, выбранного из группы, включающей анализ периостина Elecsys® и анализ E4. В некоторых воплощениях сывороточный периостин измеряют с помощью описанного выше набора. В некоторых воплощениях антитело против IL-13 представляет собой антитело, содержащее VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10. В некоторых воплощениях антитело против IL-13 представляет собой лебрикизумаб. В некоторых воплощениях возраст астматического пациента, подлежащего лечению с помощью описанных выше способов, составляет 12 лет и старше, а состояние указанного пациента не контролируется ингаляционным кортикостероидом и вторым контролирующим лекарственным средством.
В следующем аспекте изобретение предлагает способы лечения астмы или респираторного заболевания, включающие введение пациенту терапевтически эффективного количества лебрикизумаба. В некоторых воплощениях лечение приводит к относительному повышению уровня FEV1, составляющему более 5% по сравнению с уровнем, наблюдающимся до лечения лебрикизумабом. В некоторых воплощениях относительное повышение уровня FEV1 составляет более 8% по сравнению с уровнем, наблюдающимся до лечения лебрикизумабом. В некоторых воплощениях лечение приводит к облегчению тяжелых обострений.
В следующем аспекте изобретение предлагает способы лечения пациента, страдающего от астмы или респираторного заболевания, которые включают введение ингибитора пути TH2 пациенту с диагностированным статусом EIP. В некоторых воплощениях способы включают стадию диагностирования пациента, как имеющего статус EIP, с помощью общего анализа периостина. В некоторых воплощениях способы дополнительно включают стадию повторного лечения пациента ингибитором пути TH2, если у пациента обнаружен статус EIP. В некоторых воплощениях для определения наличия у пациента статуса EIP используют сыворотку.
В некоторых воплощениях для определения статуса EIP в соответствии с описанными выше способами используют EIDA, включающий следующие стадии: (a) определение количества общего периостина в образце, полученном от пациента; (b) сравнение количества общего периостина, определенного на стадии (a), со стандартным количеством; и (c) отнесение указанного пациента к категории чувствительного или не чувствительного к лечению на основе сравнения, проведенного на стадии (b). В некоторых воплощениях общий периостин представляет собой сывороточный периостин, который измеряют с помощью иммунологического анализа. В некоторых воплощениях иммунологический анализ представляет собой иммунологический сэндвич-анализ. В некоторых воплощениях иммунологический сэндвич-анализ проводят с помощью анализатора Elecsys® (Roche Diagnostics GmbH). В некоторых воплощениях иммунологический сэндвич-анализ представляет собой анализ E4. В одном воплощении стандартное количество для EIP составляет 23 нг/мл или больше при использовании анализа E4 на стадии (a). В одном воплощении стандартное количество для EIP составляет 50 нг/мл или больше при использовании анализатора Elecsys® на стадии (a).
В некоторых воплощениях пациент, которого можно лечить с помощью описанных выше способов, страдает от умеренной или тяжелой астмы. В некоторых воплощениях астма или респираторное расстройство не контролируется кортикостероидом. В некоторых воплощениях кортикостероид представляет собой ингаляционный кортикостероид. В некоторых воплощениях ингаляционный кортикостероид представляет собой Qvar®, Pulmicort®, Symbicort®, Aerobid®, Flovent®, Flonase®, Advair® или Azmacort®. В одном воплощении пациенту также вводят второе контролирующее средство. В некоторых воплощениях второе контролирующее средство представляет собой бронходилататор длительного действия (LABD). В некоторых воплощениях LABD представляет собой агонист бета-2 длительного действия (LABA), антагонист рецептора лейкотриенов (LTRA), мускариновый антагонист длительного действия (LAMA), теофиллин или пероральные кортикостероиды (OCS). В некоторых воплощениях LABD представляет собой Symbicort®, Advair®, Brovana®, Foradil®, PerforomistTM или Serevent®.
В некоторых воплощениях ингибитор пути TH2 в соответствии с описанными выше способами ингибирует мишень ITK, BTK, IL-9 (например, MEDI-528), IL-5 (например, меполизумаб, CAS № 196078-29-2; ресилизумаб), IL-13 (например, IMA-026, IMA-638 (также называемый анрукинзумаб, INN № 910649-32-0; QAX-576; улавливатель IL4/IL13), тралокинумаб (также называемый CAT-354, CAS № 1044515-88-9); AER-001, ABT-308 (также называемый гуманизированное антитело 13C5.5), IL-4 (например, AER-001, улавливатель IL4/IL13), OX40L, TSLP, IL-25, IL-33 и IgE (например, XOLAIR®, QGE-031; MEDI-4212); а также рецепторы, такие как: рецептор IL-9, рецептор IL-5 (например, MEDI-563 (бенрализумаб, CAS № 1044511-01-4), рецептор IL-4 альфа (например, AMG-317, AIR-645), рецептор IL-13 альфа1 (например, R-1671) и рецептор IL-13 альфа2, OX40, TSLP-R, IL-7Rальфа (корецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2 (например, AMG-853, AP768, AP-761, MLN6095, ACT129968), FcepsilonRI, FcepsilonRII/CD23 (рецепторы IgE), Flap (например, GSK2190915), Syk-киназа (R-343, PF3526299); CCR4 (AMG-761), TLR9 (QAX-935), или он представляет собой мультицитокиновый ингибитор CCR3, IL5, IL3, GM-CSF (например, TPI ASM8). В некоторых воплощениях ингибитор пути TH2 представляет собой ингибитор пути анти-IL13/IL4 или средство, связывающее IgE. В некоторых воплощениях ингибитор пути TH2 представляет собой антитело против IL-13. В некоторых воплощениях антитело против IL-13 представляет собой антитело, содержащее VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, антитело против IL-13, содержащее HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где HVR соответственно имеют аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, или лебрикизумаб. В некоторых воплощениях антитело против IL-13 представляет собой биспецифическое антитело, которое также связывает IL-4.
В некоторых воплощениях ингибитор пути TH2 представляет собой антитело против IgE. В некоторых воплощениях антитело против IgE представляет собой (i) антитело XOLAIR®, (ii) антитело против M1', содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь имеет последовательность SEQ ID NO: 24, а вариабельная легкая цепь имеет последовательность SEQ ID NO: 25, или (iii) антитело против M1', содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь также содержит HVR-H1, HVR-H2 и HVR-H3, а вариабельная легкая цепь также содержит HVR-L1, HVR-L2 и HVR-L3, и: (a) HVR-H1 представляет собой остатки 26-35 SEQ ID NO: 24 [GFTFSDYGIA]; (b) HVR-H2 представляет собой остатки 49-66 SEQ ID NO: 24 [AFISDLAYTIYYADTVTG]; (c) HVR-H3 представляет собой остатки 97-106 SEQ ID NO: 24, [ARDNWDAMDY]; (d) HVR-L1 представляет собой остатки 24-39 SEQ ID NO: 25 [RSSQSLVHNNANTYLH]; (e) HVR-L2 представляет собой остатки 55-61 SEQ ID NO: 25 [KVSNRFS]; (f) HVR-L3 представляет собой остатки 94-102 SEQ ID NO: 25 [SQNTLVPWT].
В другом аспекте изобретение предлагает способы оценки у пациента неблагоприятных эффектов, связанных с лечением астмы лебрикизумабом. В некоторых воплощениях способы включают стадии мониторинга числа и/или тяжести событий, включающих обострения, домашнюю пневмонию, анафилактическую реакцию, скелетно-мышечные боли, скелетно-мышечные нарушения, боли в соединительной ткани или нарушения соединительной ткани. В некоторых воплощениях скелетно-мышечное нарушение или нарушение соединительной ткани включает артралгию, боль в пояснице, боли в конечностях, миалгию, боль в шее, артрит, нарушение развития кости, бурсит, реберный хондрит, экзостоз, боль в боку, скелетно-мышечную боль в груди, скелетно-мышечную боль, челюстную боль или тендинит.
В следующем аспекте изобретение предлагает антитело против периостина. В некоторых воплощениях антитело против периостина содержит последовательности HVR SEQ ID NO: 1 и последовательности HVR SEQ ID NO: 2. В некоторых воплощениях антитело против периостина содержит последовательности SEQ ID NO: 1 и SEQ ID NO: 2. В некоторых воплощениях антитело против периостина содержит последовательности HVR SEQ ID NO: 3 и последовательности HVR SEQ ID NO: 4. В некоторых воплощениях антитело против периостина содержит последовательности SEQ ID NO: 3 и SEQ ID NO: 4. В некоторых воплощениях изобретение предлагает способы анализы общего периостина, включающие применение описанных выше антител против периостина.
краткое описание фигур
На фигуре 1 приведена схема эксперимента по иммунизации аллергеном, описанного в примере 1.
На фигуре 2 показаны аллерген-индуцированные изменения FEV1 после иммунизации во время скрининга (A) и на 13 неделе (B). FEV1 измеряют каждые 10 минут в течение первых 90 минут и затем каждый час в течение 2-8 часов после иммунизации аллергеном. Планки погрешностей обозначают стандартные отклонения от среднего значения.
На фигуре 3 показаны сывороточные уровни IgE, CCL13 (MCP-4) и CCL17 (TARC). (A) Сывороточные уровни, выраженные в виде % от уровня, наблюдающегося до введения лекарственного средства, у пациентов, получающих плацебо, и (B) у пациентов, получающих лебрикизумаб. Линии обозначают отдельных пациентов; средние значения для групп не указаны. Стрелки обозначают введение лекарственного средства через 0, 4, 8 и 12 недель (0, 28, 56 и 84 дней). (C) Уменьшение уровней IgE, CCL13 и CCL17 через 13 недель у отдельных пациентов по сравнению с базовыми уровнями указанных маркеров.
На фигуре 4 показано лебрикизумаб-индуцированное ингибирование позднего астматического ответа (LAR) в подгруппах пациентов с высоким уровнем биомаркеров и с низким уровнем биомаркеров. Результаты выражают в виде скорректированного по подгруппе, получающей плацебо, среднего уменьшения AUC (площадь под кривой) для LAR на 13 неделе (n=5-8 активных пациентов/группу).
На фигуре 5 приведена схема исследования астмы, описанного в примере 2.
На фигуре 6 приведены базовые характеристики пациентов, участвующих в исследовании астмы, описанном в примере 2.
На фигуре 7 приведены результаты исследования астмы, описанного в примере 2.
На фигуре 8 приведены данные по FEV1, полученные в результате исследования астмы, описанного в примере 2, для всех субъектов с поддающейся оценке эффективностью (A) и только для субъектов с высоким уровнем периостина (B).
На фигуре 9 приведены значения степени уменьшения обострений, полученные при исследовании астмы, описанном в примере 2.
На фигуре 10 приведен процент изменения FENO, полученный при исследовании астмы, описанном в примере 2.
На фигуре 11 приведены результаты анализа безопасности, полученные при исследовании астмы, описанном в примере 2.
На фигуре 12 приведена схема исследования астмы, описанного в примере 3.
На фигуре 13 приведена схема исследования астмы по данным наблюдений, описанного в примере 5.
На фигуре 14 показано сопоставление сывороточных уровней периостина, полученных в процессе нескольких осмотров, у одного пациента из группы BOBCAT, как описано в примере 5. (A) сопоставление осмотра 1 и осмотра 2; (B) сопоставление осмотра 1 и осмотра 3; (C) сопоставление осмотра 2 и осмотра 3; (D) сопоставление осмотра 1 и среднего уровня сывороточного периостина на протяжении всех осмотров; (E) сопоставление осмотра 2 и среднего уровня сывороточного периостина на протяжении всех осмотров; и (F) сопоставление осмотра 3 и среднего уровня сывороточного периостина на протяжении всех осмотров.
На фигуре 15 показано, что FENO позволяет дифференцировать астматических пациентов с неконтролируемой астмой на стадии от средней до тяжелой по высокой дозе ICS в соответствии с эозинофильным воспалением дыхательных путей (группа BOBCAT), как описано в примере 5. (A) У астматических пациентов с содержанием эозинофилов в мокроте >3% FENO значительно выше, чем у пациентов с содержанием эозинофилов в мокроте <3% (p<0,001 в соответствии с критерием суммы рангов Вилкоксона). (B) У астматических пациентов с содержанием эозинофилов/мм2 общей бронхиальной ткани >22 наблюдается тенденция к повышению FENO по сравнению с астматическими пациентами с содержанием эозинофилов/мм2 общей бронхиальной ткани <22 (p=0,07 в соответствии с критерием суммы рангов Вилкоксона). (C) Составная оценка содержания эозинофилов в воздушных путях, где 0 соответствует содержанию эозинофилов в мокроте <3% и содержанию эозинофилов в ткани ("Bx")<22/мм2; 1 соответствует либо содержанию эозинофилов в мокроте >3%, либо содержанию эозинофилов в ткани >22/мм2 (исключительно); 2 соответствует и содержанию эозинофилов в мокроте >3%, и содержанию эозинофилов в ткани >22/мм2, демонстрирует сильную положительную тенденцию к повышению уровня FENO с увеличением составной оценки содержания эозинофилов в воздушных путях (p=0,001 в соответствии с методом логистической регрессии). Статус сывороточного периостина указан в подписях к рисункам. (D) Однако у большинства субъектов с повышенным содержанием эозинофилов в мокроте или ткани наблюдается повышение и уровня сывороточного периостина, и FENO, однако в отдельных подгруппах субъектов наблюдается повышение только уровня периостина или FENO. Большинство субъектов, у которых отсутствует повышение содержания эозинофилов в мокроте или ткани, характеризуются низким уровнем сывороточного периостина и низким FENO. (E) Путем анализа рабочей характеристической кривой (ROC) получают значения чувствительности и специфичности сывороточного периостина, FENO, содержания эозинофилов в крови и уровня IgE в сыворотке для статуса общего содержания эозинофилов в воздушных путях. AUC = площадь под кривой.
На фигуре 16 приведен процент пациентов, у которых отсутствуют неудачные результаты лечения в исследовании астмы, описанном в примере 3.
На фигуре 17 показано сравнение уровней сывороточного периостина, измеренных с помощью анализов, подобных анализу, описанному в примере 4 (анализ E4), или анализу периостина Elecsys® (пример 7), в образцах, полученных в процессе клинических испытаний, описанных в примере 3 и примере 5.
На фигуре 18 показана фармакодинамика сывороточного периостина у пациентов с низким уровнем периостина (A) и у пациентов с высоким уровнем периостина (B), как описано в примере 2.
На фигуре 19 показано процентное изменение средних уровней периостина с течением времени у пациентов, получающих плацебо и лебрикизумаб, как описано в примере 2.
На фигуре 20 показана корреляция % изменения FEV1 на 12 неделе и массы тела у субъектов во II фазе исследования, приведенного в примере 2 (A), и во II фазе исследования, приведенного в примере 3 (B), как описано в примере 6.
На фигуре 21 показана теоретически найденная доля пациентов, у которых равновесные минимальные концентрации превышают разные уровни, как описано в примере 6.
На фигуре 22 показано влияние лебрикизумаба на сывороточные уровни CCL17 (TARC) с течением времени в исследовании примера 2 (A) и в исследовании примера 3 (B), как описано в примере 6.
На фигуре 23 показаны профили PK моделированной популяции для каждой из доз, используемых в фазе III, 250 мг каждые 4 недели, 125 мг каждые 4 недели и 37,5 мг каждые 4 недели, как описано в примере 6.
подробное описание
Если не указано иначе, технические и научные термины, используемые в данном документе, имеют традиционные значения, известные рядовым специалистам в области, к которой принадлежит настоящее изобретение. Singleton et al., Dictionary of Microbiology и Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994), и March, Advanced Organic Chemistry Reactions, Mechanisms и Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992), публикуют общее руководство по многим терминам, используемым в настоящей заявке.
некоторые определения
Нижеследующие определения применяются в целях интерпретации настоящего описания, и в соответствующих случаях термины, используемые в единственном числе, также включают множественное число, и наоборот. Если одно из приведенных ниже определений вступает в противоречие с каким-либо документом, включенным в настоящее описание в качестве ссылки, указанное определение подлежит коррекции.
Если контекст однозначно не указывает иначе, в настоящем описании и в приложенной формуле изобретения термины, используемые в единственной форме, включают множественную форму. Так, например, термин "белок" или "антитело" включает совокупность белков или антител, соответственно; термин "клетка" включает совокупность клеток и т.п.
Термин "общий периостин" в настоящем описании относится, по меньшей мере, к изоформам периостина 1, 2, 3 и 4. В данной области известно, что изоформы человеческого периостина 1, 2, 3 и 4 содержат следующие аминокислотные последовательности: NP_006466.2 (SEQ ID NO: 19); NP_001129406.1 (SEQ ID NO: 20), NP_001129407.1 (SEQ ID NO: 21) и NP_001129408.1 (SEQ ID NO: 22), соответственно, согласно базе данных NCBI. Кроме того, заявители обнаружили другую форму периостина. Эту новую, частично секвенированную изоформу в настоящем описании называют "изоформа 5". Изоформа 5 содержит аминокислотную последовательность SEQ ID NO: 23. В одном воплощении изоформы периостина являются человеческими. В следующем воплощении термин общий периостин помимо изоформ 1-4 включает изоформу 5 человеческого периостина. В другом воплощении общий периостин представляет собой общий сывороточный периостин или общий периостин плазмы (т.е., общий периостин, присутствующий в образце сыворотки, полученной из целой крови, или в образце плазмы, полученной из целой крови, соответственно, где целую кровь получают от пациента).
Термин "общий анализ периостина" относится к анализу, позволяющему измерять уровни общего периостина в биологическом образце. В одном воплощении уровни общего периостина измеряют с помощью антител против периостина. В другом воплощении антитела против периостина представляют собой антитела против периостина, описанные в данном документе. В другом примере уровни общего периостина измеряют с помощью одной или нескольких нуклеотидных последовательностей, антисмысловых по отношению к мРНК, кодирующей изоформы периостина 1-4. В следующем примере анализ общего периостина представляет собой анализ, описанный в примере 4 ("анализ примера 4" или "анализ E4"). В одном воплощении анализ общего периостина включает применение (1) антитела, содержащего последовательности SEQ ID NO: 1 и SEQ ID NO: 2 (антитело "25D4"), и/или антитела, содержащего последовательности SEQ ID NO: 3 и SEQ ID NO: 4 (антитело "23B9"), для связывания периостина в биологическом образце, (2) антитела, содержащего последовательности вариабельных участков SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности вариабельных участков SEQ ID NO: 3 и SEQ ID NO: 4, для связывания периостина в биологическом образце, (3) антитела, содержащего последовательности HVR SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности HVR SEQ ID NO: 3 и SEQ ID NO: 4, для связывания периостина в биологическом образце, (4) антитела, содержащего последовательности HVR, на 95 или более % идентичные последовательностям HVR SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности HVR, на 95 или более % идентичные последовательностям SEQ ID NO: 3 и SEQ ID NO:4.
В данном описании "диагностический анализ эозинофильного воспаления", сокращенно обозначаемый "EIDA", представляет собой анализ, позволяющий диагностировать в организме пациента эозинофильное воспаление или воспаление, опосредуемое путем TH2, посредством измерения уровней маркера эозинофильного воспаления в биологическом образце, полученном от пациента, где маркер выбран из группы, включающей мРНК периостина или белок периостина, мРНК или белок iNOS, уровни FENO, мРНК или белок CCL26, мРНК или белок serpinB2, мРНК или белок serpinB4, мРНК или белок CST1, мРНК или белок CST2, мРНК или белок CST4. В одном воплощении измеряют уровни общего периостина в сыворотке или плазме. Высокоэффективные примеры анализов включают, без ограничения, анализ, описанный ниже в примере 4 (также называемый анализ E4), или другие анализы периостина, позволяющие измерять уровни общего периостина в биологическом образце, включающем сыворотку или плазму. Диагностику эозинофильного воспаления у пациента можно проводить с помощью двух или более анализов. В одном воплощении анализ EID включает анализ общего периостина в сочетании с анализом FENO. В другом воплощении анализ EID включает анализ общего периостина +/- анализ уровней FENO в сочетании с измерением уровней одного или нескольких из следующих маркеров: CST1, CST2, CCL26, CLCA1, PRR4, PRB4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4 и SERPINB10.
Термин "антитело к периостину" или "антитело против периостина" относится к антителу, способному связываться с изоформой периостина. В одном воплощении периостин представляет собой человеческий периостин. В одном воплощении антитело содержит последовательности SEQ ID NO: 1 и SEQ ID NO: 2 (антитело "25D4") или последовательности SEQ ID NO: 3 и SEQ ID NO: 4 (антитело "23B9"). В другом воплощении антитело содержит последовательности вариабельных участков SEQ ID NO: 1 и SEQ ID NO: 2 или последовательности вариабельных участков SEQ ID NO: 3 и SEQ ID NO: 4. В другом воплощении антитело содержит HVR последовательностей SEQ ID NO: 1 и SEQ ID NO: 2, или HVR последовательностей SEQ ID NO: 3 и SEQ ID NO: 4. В другом воплощении антитело содержит последовательности HVR, на 95% или более идентичные последовательностям HVR SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитело содержит последовательности HVR, на 95% или более идентичные последовательностям HVR SEQ ID NO: 3 и SEQ ID NO: 4.
Пациент или статус, положительный по эозинофильному воспалению (EIP): данный термин относится к пациенту, в образце сыворотки или плазмы которого с помощью анализа E4 (пример 4) детектируют уровни общего сывороточного периостина, составляющие 20 нг/мл или выше (положительный по эозинофильному воспалению). В соответствии с одним воплощением уровни общего периостина в сыворотке или плазме пациента, имеющего статус EIP, могут быть выбраны из группы, включающей 21 нг/мл или выше, 22 нг/мл или выше, 23 нг/мл или выше, 24 нг/мл или выше, 25 нг/мл или выше, 26 нг/мл или выше, 27 нг/мл или выше, 28 нг/мл или выше, 29 нг/мл или выше, 30 нг/мл или выше, 31 нг/мл или выше, 32 нг/мл или выше, 33 нг/мл или выше, 34 нг/мл или выше, 35 нг/мл или выше, 36 нг/мл или выше, 37 нг/мл или выше, 38 нг/мл или выше, 39 нг/мл или выше, 40 нг/мл или выше, 41 нг/мл или выше, 42 нг/мл или выше, 43 нг/мл или выше, 44 нг/мл или выше, 45 нг/мл или выше, 46 нг/мл или выше, 47 нг/мл или выше, 48 нг/мл или выше, 49 нг/мл или выше, 50 нг/мл или выше, 51 нг/мл или выше, 52 нг/мл или выше, 53 нг/мл или выше, 54 нг/мл или выше, 55 нг/мл или выше, 56 нг/мл или выше, 57 нг/мл или выше, 58 нг/мл или выше, 59 нг/мл или выше, 60 нг/мл или выше, 61 нг/мл или выше, 62 нг/мл или выше, 63 нг/мл или выше, 64 нг/мл или выше, 65 нг/мл или выше, 66 нг/мл или выше, 67 нг/мл или выше, 68 нг/мл или выше, 69 нг/мл или выше и 70 нг/мл или выше. Следует понимать, что статус EIP представляет собой состояние пациента и не зависит от типа анализа, используемого для определения статуса. Следовательно, для определения статуса, положительного по эозинофильному воспалению, можно использовать или разработать другие диагностические анализы эозинофильного воспаления, включающие другие анализы периостина, такие как анализ периостина Elecsys®, описанный в примере 7.
Термин "пациент или статус, положительный по эозинофильному воспалению" (EIN) относится к пациенту, в образце сыворотки или плазмы которого с помощью анализа E4 детектируют уровни общего сывороточного периостина менее 20 нг/мл. Следует понимать, что статус EIN представляет собой состояние пациента и не зависит от типа анализа, используемого для определения статуса. Следовательно, для определения статуса, отрицательного по эозинофильному воспалению, можно использовать или разработать другие диагностические анализы эозинофильного воспаления, включающие другие анализы периостина, такие как анализ периостина Elecsys®, описанный в примере 7.
Термин "биологический образец" в соответствии с настоящим описанием включает, без ограничения, кровь, сыворотку, плазму, мокроту, биопсийные образцы тканей (например, образцы легких) и назальные образцы, включающие назальные мазки или назальные полипы.
Анализ FENO представляет собой анализ, позволяющий измерять уровни FENO (парциальный оксид азота в выдыхаемом воздухе). Такие уровни можно измерить с помощью, например, портативного переносного устройства, NIOX MINO (Aerocrine, Solna, Sweden), в соответствии с руководствами, опубликованными Американским торакальным обществом (American Thoracic Society, ATS) в 2005 г. FENO можно обозначать другими способами, например, FeNO или FENO, и следует понимать, что все такие вариации имеют одинаковое значение.
Возраст пациентов, подходящих для тестирования или лечения в соответствии с предлагаемыми здесь способами, включает все возрасты. В одном воплощении возраст включает 18+ лет. В другом воплощении возраст включает 12+ лет. В следующем воплощении возраст включает 2+ года. В одном воплощении возраст включает 18-75 лет, 12-75 лет или 2-75 лет.
Астма представляет собой сложное заболевание, характеризующееся изменчивыми и рецидивирующими симптомами, обратимым (например, в результате действия бронхолитического средства) нарушением дыхания и бронхиальной гиперчувствительностью, которая необязательно может быть связана с лежащим в ее основе воспалением. Примеры астмы включают аспирин-чувствительную астму/обострение астмы, атопическую астму, тяжелую астму, легкую астму, умеренную или тяжелую астму, кортикостероид-независимую астму, хроническую астму, кортикостероид-устойчивую астму, кортикостероид-резистентную астму, впервые диагностированную и не леченную астму, астму, обусловленную курением, астму, не контролируемую кортикостероидами, а также другие виды астмы, описанные в J Allergy Clin Immunol (2010) 126(5):926-938.
Термин эозинофильное расстройство относится к расстройству, характеризующемуся избыточным числом эозинофилов, при котором могут проявляться локальные или системные атипичные симптомы, обусловленные уровнем или активностью эозинофилов. Расстройства, связанные с избыточными числом или активностью эозинофилов, включают, без ограничения, астму (в том числе аспирин-чувствительную астму), атопическую астму, атопический дерматит, аллергический ринит (включающий сезонные аллергические риниты), неаллергический ринит, астму, тяжелую астму, хроническую эозинофильную пневмонию, аллергический бронхолегочный аспергиллез, заболевание брюшной полости, синдром Черджа-Строса (узелковый периартериит плюс атопия), синдром эозинофильной миалгии, гиперэозинофильный синдром, отечные реакции, включающие эпизодический ангионевротический отек, инфекции гельминтов, при которых эозинофилы могут играть защитную роль, онхоцеркальный дерматит и ассоциированные с эозинофилами желудочно-кишечные расстройства, включающие, без ограничения, эозинофильный эзофагит, эозинофильный гастрит, эозинофильный гастроэнтерит, эозинофильный энтерит и эозинофильный колит, назальный микрополипоз и полипоз, непереносимость аспирина, астму и обструктивный синдром апноэ во время сна. Секреторные продукты эозинофилов также связаны со стимуляцией ангиогенеза и образованием соединительной ткани в опухолях, а также с фиброзными ответами, наблюдаемыми при таких состояниях, как хроническая астма, болезнь Крона, склеродермия и эндомиокардиальный фиброз (Munitz A, Levi-Schaffer F. Allergy 2004; 59:268-75, Adamko et al. Allergy 2005; 60:13-22, Oldhoff, et al. Allergy 2005; 60:693-6). Другие примеры включают рак (например, глиобластому (такую как полиморфная глиобластома), неходжкинскую лимфому (NHL)), атопический дерматит, аллергический ринит, астму, фиброз, воспалительную болезнь кишечника, фиброз легких (в том числе идиопатический фиброз легких (IPF) и вторичный по отношению к склерозу фиброз легких), COPD, фиброз печени.
Расстройство, опосредованное IL-13, представляет собой расстройство, связанное с избыточными уровнем или активностью IL-13, при котором атипичные симптомы, обусловленные уровнем или активностью IL-13, могут проявляться в организме локально и/или системно. Примеры расстройства, опосредованного IL-13, включают: раковые заболевания (такие как неходжкинская лимфома, глиобластома), атопический дерматит, аллергический ринит, астму, фиброз, воспалительную болезнь кишечника (такую как болезнь Крона), воспалительные заболевания легких (например, фиброз легких, такой как IPF), COPD, фиброз печени.
Расстройство, опосредованное IL-4, представляет собой расстройство, связанное с избыточными уровнем или активностью IL-4, при котором атипичные симптомы, обусловленные уровнем или активностью IL-4, могут проявляться в организме локально и/или системно. Примеры расстройства, опосредованного IL-4, включают: раковые заболевания (такие как неходжкинская лимфома, глиобластома), атопический дерматит, аллергический ринит, астму, фиброз, воспалительную болезнь кишечника (например, болезнь Крона), воспалительные заболевания легких (например, фиброз легких, такой как IPF), COPD, фиброз печени.
Расстройство, опосредованное IL-5, представляет собой расстройство, связанное с избыточными уровнем или активностью IL-5, при котором атипичные симптомы, обусловленные уровнем или активностью IL-5, могут проявляться в организме локально и/или системно. Примеры расстройства, опосредованного IL-5, включают: раковые заболевания (такие как неходжкинская лимфома, глиобластома), атопический дерматит, аллергический ринит, астму, фиброз, воспалительную болезнь кишечника (например, болезнь Крона), воспалительные заболевания легких (например, фиброз легких, такой как IPF), COPD, фиброз печени.
Расстройство, опосредованное IL-9, представляет собой расстройство, связанное с избыточными уровнем или активностью IL-9, при котором атипичные симптомы, обусловленные уровнем или активностью IL-9, могут проявляться в организме локально и/или системно. Примеры расстройства, опосредованного IL-9, включают: раковые заболевания (такие как неходжкинская лимфома, глиобластома), атопический дерматит, аллергический ринит, астму, фиброз, воспалительную болезнь кишечника (например, болезнь Крона), воспалительные заболевания легких (например, фиброз легких, такой как IPF), COPD, фиброз печени.
Расстройство, опосредованное TSLP, представляет собой расстройство, связанное с избыточными уровнем или активностью TSLP, при котором атипичные симптомы, обусловленные уровнем или активностью TSLP, могут проявляться в организме локально и/или системно. Примеры расстройства, опосредованного TSLP, включают: раковые заболевания (такие как неходжкинская лимфома, глиобластома), атопический дерматит, аллергический ринит, астму, фиброз, воспалительную болезнь кишечника (например, болезнь Крона), воспалительные заболевания легких (например, фиброз легких, такой как IPF), COPD, фиброз печени.
Расстройство, опосредованное IgE, представляет собой расстройство, связанное с избыточными уровнем или активностью IgE, при котором атипичные симптомы, обусловленные уровнем или активностью IgE, могут проявляться в организме локально и/или системно. Такие расстройства включают астму, атопический дерматит, аллергический ринит, фиброз (например, фиброз легких, такой как IPF).
Астма-подобный симптом представляет собой симптом, выбранный из группы, включающей одышку, кашель (изменения продукции мокроты и/или качества мокроты и/или частоты кашля), свистящее дыхание, напряжение в грудной клетке, бронхостеноз и ночные пробуждения, приписываемые одному из перечисленных выше симптомов или их сочетанию (Juniper et al. (2000) Am. J. Respir. Crit. Care Med., 162(4), 1330-1334).
Термин "респираторное расстройство" включает, без ограничения, астму (такую как аллергическая и неаллергическая астма (например, астма, обусловленная инфекцией, такой как инфекция респираторно-синцитиального вируса (RSV), например, у маленьких детей)); бронхит (например, хронический бронхит); хроническое обструктивное заболевание легких (COPD) (такое как эмфизема (например, индуцированная курением сигарет эмфизема); состояния, включающие воспаление дыхательных путей, эозинофилию, фиброз и избыточную продукцию слизи, например, кистозный фиброз, фиброз легких и аллергический ринит. Примеры заболеваний, которые могут характеризоваться воспалением дыхательных путей, избыточной секрецией дыхательных путей и обструкцией дыхательных путей, включают астму, хронический бронхит, бронхоэктаз и кистозный фиброз.
Обострения (обычно называемые приступы астмы или острая астма) представляют собой случаи новых или прогрессирующих признаков, включающих одышку, кашель (изменения продукции мокроты и/или качества мокроты и/или частоты кашля), свистящее дыхание, напряжение в грудной клетке, ночные пробуждения, приписываемые одному из перечисленных выше симптомов или их сочетанию. Обострения часто характеризуются уменьшением выдыхаемого воздуха (PEF или FEV1). Однако вариабельность PEF обычно не увеличивается в процессе обострения, хотя может и увеличиваться, приводя к излечению обострения, или она может увеличиваться в процессе обострения. Тяжесть обострений варьирует от легкой до угрожающей жизни, ее степень можно оценить на основе симптомов и легочной функции. Тяжелые обострения астмы в соответствии с данным документом включают обострения, которые сопровождаются одним или несколькими из нижеследующих событий: госпитализация с целью лечения астмы, применение высоких доз кортикостероидов (например, превышение общей суточной дозы в четыре раза, или применение общей суточной дозы, превышающей или равной 500 микрограммам FP, или эквивалентной дозе, используемой в течение трех или более последовательных дней) или пероральное/парентеральное применение кортикостероидов.
Ингибитор пути TH2 представляет собой средство, которое ингибирует путь TH2.
Примеры ингибитора пути TH2 включают ингибиторы активности одной из мишеней, выбранных из группы, включающей: ITK, BTK, IL-9 (например, MEDI-528), IL-5 (например, меполизумаб, CAS № 196078-29-2; ресилизумаб), IL-13 (например, IMA-026, IMA-638 (также называемый анрукинзумаб, INN № 910649-32-0; QAX-576; улавливатель IL4/IL13), тралокинумаб (также называемый CAT-354, CAS № 1044515-88-9); AER-001, ABT-308 (также называемый гуманизированное антитело 13C5.5), IL-4 (например, AER-001, улавливатель IL4/IL13), OX40L, TSLP, IL-25, IL-33 и IgE (например, XOLAIR, QGE-031; MEDI-4212); а также рецепторы, такие как: рецептор IL-9, рецептор IL-5 (например, MEDI-563 (бенрализумаб, CAS № 1044511-01-4), рецептор IL-4 альфа (например, AMG-317, AIR-645), рецептор IL-13 альфа1 (например, R-1671) и рецептор IL-13 альфа2, OX40, TSLP-R, IL-7Rальфа (корецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2 (например, AMG-853, AP768, AP-761, MLN6095, ACT 129968), FcepsilonRI, FcepsilonRII/CD23 (рецепторы IgE), Flap (например, GSK2190915), Syk-киназа (R-343, PF3526299); CCR4 (AMG-761), TLR9 (QAX-935) и мультицитокиновый ингибитор CCR3, IL5, IL3, GM-CSF (например, TPI ASM8). Примеры ингибиторов вышеупомянутых мишеней раскрыты, например, в WO2008/086395; WO2006/085938; US 7615213; US 7501121; WO2006/085938; WO 2007/080174; US 7807788; WO2005007699; WO2007036745; WO2009/009775; WO2007/082068; WO2010/073119; WO2007/045477; WO2008/134724; US2009/0047277; и WO2008/127,271).
Терапевтическое средство, предлагаемое в настоящем изобретении, включает средство, которое может связываться с мишенью, указанной выше, такой как полипептид (полипептиды) (например, антитело, иммуноадгезин или пептидное антитело), аптамер или маленькая молекула, которая может связываться с белком или молекулой нуклеиновой кислоты, кодирующей мишень, указанную в данном документе (например, миРНК).
Термин "ингибитор пути анти-IL13/IL4" относится к терапевтическому средству, которое ингибирует сигнальный путь IL-13 и/или IL-4. Примеры ингибиторов пути анти-IL13/IL4 включают ингибиторы взаимодействия IL13 и/или IL4 с их рецептором (рецепторами), такие ингибиторы включают, без ограничения, средства, связывающие IL13, средства, связывающие IL4, биспецифические средства, связывающие IL13/IL4, средства, связывающие рецептор IL4 альфа, средства, связывающие рецептор IL13 альфа1, и средства, связывающие рецептор IL13 альфа2. Однодоменные антитела, которые могут связывать IL13, IL4, (включающие биспецифическое антитело, содержащее один домен, связывающий IL13, и один домен, связывающий IL4), IL-13R альфаl, IL-13R альфа2 или IL-4Rальфа, отдельно включены в объем изобретения в качестве ингибиторов. Следует понимать, что в объем изобретения также входят молекулы, которые могут связывать несколько мишеней.
"Средства, связывающие IL4" включают средство, способное связываться с человеческим IL-4. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид (полипептиды), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением связывающее средство связывается с последовательностью человеческого IL-4 со сродством, находящимся в диапазоне 1 мкМ - 1 пМ. Конкретные примеры средства, связывающего IL4, могут включать растворимый рецептор IL4 альфа (например, внеклеточный домен рецептора IL4, слитый с участком Fc человека), антитело против IL4 и растворимый рецептор IL13 альфа1 (например, внеклеточный домен рецептора IL13 альфа1, слитый с участком Fc человека).
"Средства, связывающие рецептор IL4 альфа" включают средство, способное связываться с человеческим рецептором IL4 альфа. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид(ы), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением связывающее средство способно связываться с последовательностью человеческого рецептора IL-4 альфа со сродством, находящимся в диапазоне 1 мкМ - 1 пМ. Конкретные примеры средства, связывающего рецептор IL4 альфа, могут включать антитела против рецептора IL4 альфа.
Термин "средство, связывающее IL13" относится к средству, способному связываться с человеческим IL13. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид(ы), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением, связывающее средство связывается с последовательностью человеческого IL-13 со сродством, находящимся в диапазоне 1 мкМ - 1 пМ. Конкретные примеры средств, связывающих IL13, могут включать антитела против IL13, растворимый рецептор IL13 альфа2, слитый с человеческим Fc, растворимый рецептор IL4 альфа, слитый с Fc человека, растворимый рецептор IL13 альфа, слитый с Fc человека. В соответствии с одним воплощением антитело против IL-13 содержит (1) HVRH1, имеющий аминокислотную последовательность SEQ ID NO: 11, (2) HVRH2, имеющий аминокислотную последовательность SEQ ID NO: 12, (3) HVRH3, имеющий аминокислотную последовательность SEQ ID NO: 13, (4) HVRL1, имеющий аминокислотную последовательность SEQ ID NO: 14, (5) HVRL2, имеющий аминокислотную последовательность SEQ ID NO: 15, и (6) HVRL3, имеющий аминокислотную последовательность SEQ ID NO: 16. В другом воплощении антитело против IL-13 содержит домен VH, имеющий аминокислотную последовательность SEQ ID NO: 9, и домен VL, имеющий аминокислотную последовательность SEQ ID NO: 10. В соответствии с одним воплощением антитело представляет собой антитело IgG1. В соответствии с другим воплощением антитело представляет собой антитело IgG4. В соответствии с одним воплощением антитело IgG4 содержит мутацию S228P в константном домене.
"Средства, связывающие рецептор IL13 альфа1" включают средство, способное специфически связываться с человеческим рецептором IL13 альфа1. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид(ы), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением, связывающее средство связывается с последовательностью человеческого рецептора IL-13 альфа1 со сродством, находящимся в диапазоне 1 мкМ - 1 пМ. Конкретные примеры средств, связывающих рецептор IL13 альфа1, могут включать антитела против рецептора IL13 альфа1.
"Средства, связывающие рецептор IL13 альфа2" включают средство, способное специфически связываться с человеческим рецептором IL13 альфа2. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид(ы), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением связывающее средство связывается с последовательностью человеческого рецептора IL-13 альфа2 со сродством, находящимся в диапазоне 1 мкМ - 1 пМ. Конкретные примеры средства, связывающего рецептор IL13 альфа2, могут включать антитела против рецептора IL13 альфа2.
"Средства, связывающие IgE" включают средство, способное специфически связываться с человеческим IgE. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид(ы), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением антитело против IgE содержит последовательность VL, соответствующую аминокислотной последовательности SEQ ID NO: 17, и последовательность VH, соответствующую аминокислотной последовательности SEQ ID NO: 18.
"Средства, связывающие M1'" включают средство, способное специфически связываться с проксимальным по отношению к мембране участком M1' IgE, экспрессированного на поверхности B-клеток. Такие связывающие средства могут включать маленькую молекулу, аптамер или полипептид. Такой полипептид может включать, без ограничения, полипептид(ы), выбранный из группы, включающей иммуноадгезин, антитело, пептидное антитело и пептид. В соответствии с одним воплощением антитело против IgE включает антитело, описанное в WO2008/116149 или его вариант. В соответствии с другим воплощением антитело против M1' содержит вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь имеет последовательность SEQ ID NO: 24, а вариабельная легкая цепь имеет последовательность SEQ ID NO: 25. В соответствии с другим воплощением антитело против IgE/M1’ содержит вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь также содержит HVR-H1, HVR-H2 и HVR-H3, а вариабельная легкая цепь также содержит HVR-L1, HVR-L2 и HVR-L3, и: (a) HVR-H1 представляет собой остатки 26-35 SEQ ID NO: 24 [GFTFSDYGIA]; (b) HVR-H2 представляет собой остатки 49-66 SEQ ID NO: 24 [AFISDLAYTIYYADTVTG]; (c) HVR-H3 представляет собой остатки 97-106 SEQ ID NO: 24 [ARDNWDAMDY]; (d) HVR-L1 представляет собой остатки 24-39 SEQ ID NO: 25 [RSSQSLVHNNANTYLH]; (e) HVR-L2 представляет собой остатки 55-61 SEQ ID NO: 25 [KVSNRFS]; (f) HVR-L3 представляет собой остатки 94-102 SEQ ID NO: 25 [SQNTLVPWT].
Термин "маленькая молекула" относится к органической молекуле с молекулярной массой от 50 Дальтон до 2500 Дальтон.
Термин "антитело" используется в самом широком смысле и конкретно охватывает, например, моноклональные антитела, поликлональные антитела, антитела с полиэпитопной специфичностью, одноцепочечные антитела, полиспецифичные антитела и фрагменты антител. Такие антитела могут быть химерными, гуманизированными, человеческими и синтетическими. Такие антитела и способы их получения более подробно описаны ниже.
Термин "неконтролируемый" или "не поддающийся контролированию" относится к неспособности режима лечения минимизировать симптом заболевания. В данном описании термины "неконтролируемый" и "неадекватно контролируемый", которые можно использовать как взаимозаменяемые, обозначают одно и то же состояние. Статус контролирования состояния пациента может быть определен лечащим врачом на основе ряда факторов, включающих клиническую историю пациента, реакцию на лечение и уровень предписанного текущего лечения. Например, лечащий врач может учитывать такие факторы, как найденный теоретически или наилучший для субъекта уровень FEV1 <75%, частота потребности в SABA в последние 2-4 недели (например, две дозы в неделю или больше), ночные пробуждения/симптомы в последние 2-4 недели (например, 2 ночи в неделю или менее), ограничения активности в последние 2-4 недели, дневные симптомы в последние 2-4 недели
Термин "терапевтическое средство" относится к любому средству, используемому для лечения заболевания.
Термин "контролирующее средство" или "подавляющее средство" относится к любому терапевтическому средству, используемому для подавления астматического воспаления. Примеры контролирующих средств включают кортикостероиды, антагонисты рецепторов лейкотриенов (например, ингибирующие синтез или активность лейкотриенов, такие как монтелукаст, зилейтон, пранлукаст, зафирлукаст), LABA, композиции, содержащие сочетание кортикостероид/LABA, теофиллин (в том числе аминофиллин), кромолин натрия, недокромил натрия, омализумаб, LAMA, MABA (например, бифункциональный мускариновый агонист антагониста бета-2), ингибиторы белка, активирующего 5-липоксигеназу (FLAP), и ингибитор фермента PDE-4 (например, рофлумиласт). Термин "второе контролирующее средство", как правило, относится к контролирующему средству, которое отличается от первого контролирующего средства.
Термин "снижение дозы кортикостероида" или "CS" относится к уменьшению частоты введения и/или количества кортикостероида, или к прекращению приема кортикостероида, используемого для лечения заболевания у пациента, принимающего кортикостероиды для лечения заболевания, вследствие введения другого терапевтического средства. Термин "средство CS" относится к терапевтическому средству, которое может вызвать CS у пациента, принимающего кортикостероид.
Термин "кортикостероид" включает, без ограничения, флутиказон (в том числе флутиказона пропионат (FP)), беклометазон, будезонид, циклезонид, мометазон, флунизолид, бетаметазон и триамцинолон. "Вдыхаемый кортикостероид" представляет собой кортикостероид, подходящий для введения путем ингаляции. Примеры вдыхаемых кортикостероидов включают флутиказон, беклометазона дипропионат, будезонид, мометазона фуроат, циклезонид, флунизолид, триамцинолона ацетонид, а также любой другой кортикостероид, доступный в настоящее время, или который станет доступным в будущем. Примеры кортикостероидов, которые можно вводить путем ингаляции и объединять с агонистом бета-2 длительного действия, включают, без ограничения: будезонид/формотерол и флутиказон/сальметерол.
Примеры сочетания лекарственных средств кортикостероид/LABA включают флутиказона фуроат/вилантерола трифенатат и индакатерол/мометазон.
Термин "LABA" обозначает агонист бета-2 длительного действия, который включает, например, сальметерол, формотерол, бамбутерол, альбутерол, индакатерол, арформотерол и кленбутерол.
Термин "LAMA" обозначает мускариновый антагонист длительного действия, который включает: тиотропий.
Примеры сочетаний LABA/LAMA включают, без ограничения: олодатерол тиотропий (Boehringer Ingelheim's) и индакатерол гликопирроний (Novartis).
Термин "SABA" обозначает агонисты бета-2 кратковременного действия, которые включают, без ограничения, сальбутамол, левосальбутамол, фенотерол, тербуталин, пирбутерол, прокатерол, битолтерол, римитерол, карбутерол, тулобутерол и репротерол.
Антагонисты рецепторов лейкотриенов (иногда называемые leukast) (LTRA) представляют собой средства, способные ингибировать лейкотриены. Примеры ингибиторов лейкотриенов включают монтелукаст, зилейтон, пранлукаст и зафирлукаст.
Термин "FEV1" относится к объему выдыхаемого воздуха в первую секунду форсированного выдоха. Это - мера обструкции дыхательных путей. Побуждающая концентрация метахолина, необходимая для индуцирования 20% уменьшения FEV1 (PC20), является количественным показателем гиперчувствительности дыхательных путей. FEV1 можно обозначить другими способами, например, FEV1, и следует понимать, что все такие вариации имеют одинаковые значения.
Термин "относительное изменение FEV1" = (FEV1 на 12 неделе лечения - FEV1 перед началом лечения)/FEV1.
Термин "легкая астма" относится к состоянию, при котором симптомы и обострения проявляются у пациента менее двух раз в неделю, ночные симптомы проявляются менее двух раз в месяц, а в промежутках между обострениями симптомы отсутствуют. Легкую, перемежающуюся астму часто лечат по мере необходимости с помощью следующих способов: применение вдыхаемых бронхолитических средств (вдыхаемые агонисты бета-2 кратковременного действия); избегание известных провоцирующих факторов; ежегодная противогриппозная вакцинация; пневмококковая вакцинация каждые 6-10 лет, и, в некоторых случаях, применение вдыхаемого агониста бета-2, кромолина или недокромила, перед воздействием идентифицированных провоцирующих факторов. Если у пациента присутствует повышенная потребность в агонисте бета-2 кратковременного действия (например, если пациент принимает агонист бета-2 кратковременного действия более трех-четырех раз в сутки при острых приступах, или использует более одного контейнера в месяц при проявлении симптомов), может потребоваться применение следующей стадии лечения.
Термин "умеренная астма", как правило, относится к астме, при которой пациент испытывает обострения более двух раз в неделю, причем обострения влияют на сон и активность; у пациента наблюдаются ночные пробуждения, обусловленные астмой, более двух раз в месяц; у пациента проявляются симптомы хронической астмы, для подавления которых требуется применение вдыхаемого агониста бета-2 кратковременного действия ежедневно или через день; базовый уровень PEF или FEV1 у пациента до начала лечения составляет 60-80 процентов от ожидаемого значения, а вариабельность PEF составляет от 20 до 30 процентов.
Термин "тяжелая астма", как правило, относится к астме, при которой у пациента непрерывно наблюдаются симптомы, частые обострения, частые ночные пробуждения, обусловленные астмой, ограниченная активность, базовые уровни PEF или FEV1 составляют менее 60 процентов от ожидаемого значения, а вариабельность PEF составляет от 20 до 30 процентов.
Примеры восстанавливающих лекарственных средств включают альбутерол, вентолин и другие.
Термин "стойкий" относится к заболеванию, лечение которого терапевтическим средством приводит к небольшому улучшению или к отсутствию клинически значимого улучшения. Например, к астме, которая требует лечения высокой дозой ICS (такой как учетверенная общая суточная доза кортикостероида или общая суточная доза FP (или эквивалента), превышающая или равная 500 микрограмм) в течение, по меньшей мере, трех или более последовательных дней, или системного введения кортикостероида в течение двухнедельного испытания, чтобы установить, остается ли астма неконтролируемой, а также отсутствие улучшения FEV1 часто считается признаком тяжелой стойкой астмы.
Терапевтическое средство, предлагаемое в настоящем документе, можно вводить с помощью любых подходящих способов, таких как парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение. Парентеральное введение включает внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. В одном воплощении терапевтическое средство вводят путем ингаляции. В соответствии с другим воплощением лекарственное средство вводят путем инъекции, такой как внутривенная или подкожная инъекция. В следующем воплощении терапевтическое средство вводят с помощью шприца (например, предварительно наполненного, или другого) или автоинъектора.
Дозировка терапевтического средства, подходящая для профилактики или лечения заболевания, может зависеть от типа заболевания, подлежащего лечению, тяжести и течения заболевания, независимо от того, вводят ли терапевтическое средство с профилактической или терапевтической целью, предыдущего лечения, клинической истории пациента и чувствительности к терапевтическому средству, а также от усмотрения лечащего врача. Терапевтическое средство можно вводить пациенту однократно или в несколько приемов. Получение, дозировку и введение композиции, содержащей терапевтическое средство, осуществляют с помощью способов, соответствующих успешной медицинской практике. Факторы, учитываемые в данном контексте, включают конкретное заболевание, подлежащее лечению, вид конкретного млекопитающего, подлежащего лечению, клиническое состояние пациента, причину заболевания, участок доставки средства, способ введения, схему введения и другие факторы, известные врачам.
Введение лебрикизумаба с целью лечения эозинофильного расстройства (в том числе астмы) и других заболеваний путем TH2-терапии: лебрикизумаб можно вводить в дозе от 0,1 мг/кг до 100 мг/кг массы тела пациента. В одном воплощении пациенту вводят дозу, находящуюся в диапазоне от 0,1 мг/кг до 20 мг/кг массы тела пациента. В другом воплощении доза находится в диапазоне от 1 мг/кг до 10 мг/кг массы тела пациента.
В альтернативном воплощении лебрикизумаб можно вводить в виде единообразной дозы. В одном воплощении лебрикизумаб вводят в виде единообразной (т.е. не зависящей от массы) дозы 125-1000 мг путем подкожной или внутривенной инъекции с частотой, выбранной из группы, включающей: каждые 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель, 12 недель, 13 недель, 14 недель, 15 недель, 16 недель, 1 месяц, 2 месяца, 3 месяца или 4 месяца. В другом воплощении, если пациент имеет избыточный вес, лебрикизумаб можно вводить, например, в дозе 125-250 мг с частотой 3 раза в месяц. В одном воплощении лебрикизумаб вводят в виде единообразной дозы 125 мг, 250 мг или 500 мг каждые 4 недели. В другом воплощении лебрикизумаб вводят пациенту с массой >40 кг в виде единообразной дозы 37,5 мг, 125 мг, 250 мг или 500 мг каждые 4 недели.
В одном воплощении возраст пациента составляет 18 лет или старше. В одном воплощении возраст астматического пациента составляет от 12 до 17 лет и лебрикизумаб вводят в виде единообразной дозы 250 мг или в виде единообразной дозы 125 мг. В одном воплощении возраст астматического пациента составляет от 6 до 11 лет и лебрикизумаб вводят в виде единообразной дозы 125 мг.
"Чувствительность пациента" или "чувствительность" (в том числе грамматические вариации данного термина) можно оценить с помощью любого конечного параметра, свидетельствующего об улучшении состояния пациента, который включает, без ограничения, (1) подавление в определенной степени развития заболевания, включающее замедление и полное прекращение; (2) уменьшение числа приступов и/или симптомов заболевания; (3) уменьшение размера повреждения; (4) подавление (т.е. уменьшение, замедление или полное прекращение) связанной с болезнью инфильтрации клеток в соседние периферические органы и/или ткани; (5) подавление (т.е. уменьшение, замедление или полное прекращение) распространения заболевания; (6) уменьшение аутоиммунного ответа, которое необязательно может приводить к регрессии или устранению связанного с болезнью повреждения; (7) облегчение в определенной степени одного или нескольких симптомов, связанных с заболеванием; (8) увеличение продолжительности периодов отсутствия проявления заболевания после лечения; и/или (9) уменьшение смертности в определенный период времени после лечения.
Термин "сродство" относится к интенсивности суммарных общих нековалентных взаимодействий между отдельным участком связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иначе, в данном описании термин "сродство связывания" относится к собственному сродству связывания, которое отражает взаимодействие 1:1 между членами участвующей в связывании пары (такими как антитело и антигенсвязывающее плечо). Сродство молекулы X к ее партнеру Y, как правило, можно представить в виде константы диссоциации (Kd). Сродство можно измерить с помощью традиционных методов, известных в данной области, в том числе описанных в данном документе. Конкретные иллюстративные и типичные воплощения, связанные с измерением сродства связывания, описаны ниже.
Термин "аффинно-зрелый" относится к антителу, содержащему одно или несколько изменений, приводящих к повышению сродства антитела к антигену, в одном или нескольких гипервариабельных участках (HVR) по сравнению с исходным антителом, которое не содержит таких изменений.
Термины "антитело против мишени" и "антитело, которое связывается с мишенью" относятся к антителу, способному связываться с мишенью со сродством, достаточным для того, чтобы антитело можно было использовать в качестве диагностического и/или терапевтического средства, направленного на мишень. В одном воплощении степень связывания антитела против мишени с неродственным белком, который не является мишенью, составляет примерно менее 10% от связывания антитела с мишенью по результатам измерения, например, с помощью радиоиммунологического анализа (RIA) или анализа Biacore. В некоторых воплощениях константа диссоциации (Kd) комплекса антитела с мишенью составляет ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 M или менее, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). В некоторых воплощениях антитело против мишени связывается с эпитопом мишени, который является консервативным среди разных видов.
Термин "антитело", используемый в настоящем описании в самом широком смысле, охватывает разные типы антител, включающие, без ограничения, моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают желательной антиген-связывающей активностью.
Термин "фрагмент антитела" относится к молекуле, отличной от интактного антитела, которая содержит фрагмент интактного антитела, способный связываться с тем же антигеном, что и интактное антитело. Примеры фрагментов антител включают, без ограничения, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и полиспецифичные антитела, полученные из фрагментов антител.
Термин "антитело, которое связывается с тем же эпитопом", что и контрольное антитело, относится к антителу, которое блокирует связывание контрольного антитела с его антигеном по данным конкурентного анализа на 50% или более, и наоборот, контрольное антитело блокирует связывание антитела с его антигеном по данным конкурентного анализа на 50% или более. Пример конкурентного анализа описан в данном документе.
"Акцепторный человеческий каркасный участок" в соответствии с настоящим описанием представляет собой каркасный участок, содержащий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), полученный из человеческого каркасного участка иммуноглобулина или человеческого консенсусного каркасного участка, как указано ниже. Акцепторный человеческий каркасный участок, "полученный из" человеческого каркасного участка иммуноглобулина или человеческого консенсусного каркасного участка, может содержать их интактную аминокислотную последовательность, или он может содержать изменения в такой аминокислотной последовательности. В некоторых воплощениях число аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее, или 2 или менее. В некоторых воплощениях акцепторный человеческий каркасный участок VL идентичен последовательности каркасного участка VL человеческого иммуноглобулина или последовательности консенсусного человеческого каркасного участка.
Термин "химерное" антитело относится к антителу, в котором одна часть тяжелой и/или легкой цепи получена из определенного источника, или из определенных видов, а другая часть тяжелой и/или легкой цепи получена из другого источника, или из других видов.
"Класс" антитела определяется типом константного домена или константного участка тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, причем некоторые из них могут дополнительно подразделяться на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называют α, δ, ε, γ и μ, соответственно.
Термин "цитотоксическое средство" в настоящем описании относится к веществу, которое подавляет или предотвращает проявление клеточной функции и/или вызывает гибель или разрушение клетки. Цитотоксические средства включают, без ограничения, радиоактивные изотопы (такие как At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические средства или лекарства (такие как метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие средства); ингибиторы роста; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, в том числе их фрагменты и/или варианты; и разные противоопухолевые или противораковые средства, описанные ниже.
Термин "эффекторные функции" относится к биологической активности, присущей Fc-участку антитела, которая варьирует в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание с рецептором Fc; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию клеточных поверхностных рецепторов (таких как B-клеточный рецептор); и активацию B-клеток.
Термин "эффективное количество" средства, такого как фармацевтическая композиция, относится к количеству, которое при применении в подходящих дозировочных режимах в течение требуемых периодов времени является эффективным для достижения желательного терапевтического или профилактического результата.
Термин "участок Fc" в настоящем описании используют для обозначения C-концевого участка тяжелой цепи иммуноглобулина, который содержит, по меньшей мере, часть константного участка. Термин включает Fc-участки с нативными последовательностями и вариантные Fc-участки. В одном воплощении Fc-участок тяжелой цепи IgG человека продолжается от Cys226, или от Pro230, до карбоксильного конца тяжелой цепи. Однако Fc-участок может необязательно содержать C-концевой лизин (Lys447). Если не указано иначе, нумерация аминокислотных остатков Fc-участка или константного участка соответствует системе нумерации EU, также называемой индекс EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Термин "каркасный участок" или "FR" относится к остаткам вариабельного домена, отличным от остатков гипервариабельного участка (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно присутствуют в VH (или VL) в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термины "полноразмерное антитело", "интактное антитело" и "целое антитело" в настоящем документе используются как взаимозаменяемые и относятся к антителу, обладающему практически такой же структурой, как и нативное антитело, или содержащему тяжелые цепи, в состав которых входит Fc-участок, определенный в настоящем документе.
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" в настоящем документе используются как взаимозаменяемые и относятся к клеткам, в которые введена экзогенная нуклеиновая кислота, в том числе к потомству таких клеток. Клетки-хозяева включают "трансформанты" и "трансформированные клетки", в том числе первично трансформированные клетки и полученное из них потомство, независимо от числа пассажей. Потомство может отличаться от родительской клетки по содержанию нуклеиновых кислот в результате мутаций. В объем изобретения входит мутантное потомство, полученное путем скрининга или отбора, которое обладает такой же функцией или биологической активностью, как и исходно трансформированная клетка.
"Человеческое антитело" представляет собой антитело, которое содержит аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или человеческой клеткой, или полученного из нечеловеческого источника, в котором используются репертуары человеческих антител или другие последовательности, кодирующие человеческие антитела. Данное определение человеческого антитела не включает гуманизированное антитело, содержащее нечеловеческие антиген-связывающие остатки.
"Человеческий консенсусный каркасный участок" представляет собой каркасный участок, который содержит аминокислотные остатки, наиболее часто встречающиеся в наборе последовательностей каркасных участков VL или VH человеческих иммуноглобулинов. Как правило, набор последовательностей VL или VH человеческих иммуноглобулинов относится к подгруппе последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, описанную в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном воплощении подгруппа VL представляет собой подгруппу каппа I, в соответствии с Kabat et al., выше. В одном воплощении подгруппа VH представляет собой подгруппу III, в соответствии с Kabat et al., выше.
Термин "гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки нечеловеческих HVR и аминокислотные остатки человеческих FR. В некоторых воплощениях гуманизированное антитело содержит, по меньшей мере, один, как правило, два вариабельных домена, в которых все или практически все HVR (например, CDR) соответствуют нечеловеческому антителу, и все или практически все FR соответствуют человеческому антителу. Гуманизированное антитело необязательно может содержать, по меньшей мере, часть константного участка антитела, полученного из человеческого антитела. Термин "гуманизированная форма" антитела, такого как нечеловеческое антитело, относится к антителу, полученному в результате гуманизации.
Термин "гипервариабельный участок", или "HVR," в данном описании относится ко всем участкам вариабельного домена антитела, которые характеризуются гипервариабельностью последовательностей и/или образуют определенные структурой петли ("гипервариабельные петли"). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки гипервариабельных петель и/или "участков, определяющих комплементарность" (CDR), где последние обычно обладают наивысшей вариабельностью последовательностей и/или участвуют в распознавании антигенов. Участок HVR в соответствии с настоящим описанием содержит любое число остатков из присутствующих в положениях 24-36 (в случае HVRL1), 46-56 (в случае HVRL2), 89-97 (в случае HVRL3), 26-35B (в случае HVRH1), 47-65 (в случае HVRH2) и 93-102 (в случае HVRH3).
"Иммуноконъюгат" представляет собой антитело, конъюгированное с одной или несколькими из гетерологичных молекул, включающих, без ограничения, цитотоксическое средство.
"Особь" или "субъект" представляет собой млекопитающее. Млекопитающие включают, без ограничения, домашних животных (таких как коровы, овцы, кошки, собаки и лошади), приматов (таких как люди и отличные от человека приматы, например, мартышки), кроликов и грызунов (таких как мыши и крысы). В некоторых воплощениях особь или субъект представляет собой человека.
"Выделенное" антитело представляет собой антитело, отделенное от компонентов среды, окружающей его в природе. В некоторых воплощениях антитело очищают до степени, превышающей 95% или 99%, которую определяют, например, методом электрофореза (такого как SDS-PAGE, изоэлектрическое фокусирование (IEF), капиллярный электрофорез) или хроматографии (такой как ионообменная ВЭЖХ или ВЭЖХ на обращенной фазе). Обзор способов анализа чистоты антител можно найти, например, в Flatman et al., J. Chromatogr. B 848:79-87 (2007).
"Выделенная" нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, отделенную от компонентов среды, окружающей ее в природе. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат такую молекулу нуклеиновой кислоты, однако указанная молекула нуклеиновой кислоты присутствует вне хромосомы или в участке хромосомы, который отличается от природного местонахождения данной молекулы в хромосоме.
Термин "выделенная нуклеиновая кислота, кодирующая антитело против мишени" относится к одной или нескольким молекулам нуклеиновой кислоты, кодирующим тяжелые и легкие цепи антител (или их фрагменты), включающие такие молекулы нуклеиновых кислот, находящиеся в одном векторе, или в разных векторах, и такие молекулы нуклеиновых кислот, присутствующие в одном участке или в нескольких участках клетки-хозяина.
Термин "моноклональные антитело" в настоящем описании относится к антителу, полученному из практически гомогенной популяции антител, т.е., из популяции, отдельные антитела которой являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержащих природные мутации, или образующихся в процессе получения препарата моноклональных антител, причем такие варианты обычно присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), все моноклональные антитела из препарата моноклональных антител направлены на одну детерминанту антигена. Таким образом, определение "моноклональный" означает, что антитело получено из практически гомогенной популяции антител, и не относится к какому-либо конкретному способу получения антитела. Например, моноклональные антитела, предназначенные для применения в способах настоящего изобретения, можно получить с помощью ряда методов, включающих, без ограничения, гибридомный метод, методы рекомбинантных ДНК, методы фаговых дисплеев и методы, в которых используются трансгенные животные, содержащие весь локус человеческих иммуноглобулинов, или его часть, причем такие методы и другие иллюстративные методы получения моноклональных антител описаны в настоящем документе.
Термин "оголенное антитело" относится к антителу, не конъюгированному с гетерологичным фрагментом (таким как цитотоксичный фрагмент) или радиоизотопной меткой. Оголенное антитело может входить в состав фармацевтической композиции.
Термин "нативные антитела" относится к природным молекулам иммуноглобулинов, имеющим разные структуры. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. От N- до C-конца каждая тяжелая цепь содержит вариабельный участок (VH), также называемый вариабельный тяжелый домен, или вариабельный домен тяжелой цепи, сопровождающийся тремя константными доменами (CH1, CH2 и CH3). Подобным образом, от N- до C-конца, каждая легкая цепь содержит вариабельный участок (VL), также называемый вариабельный легкий домен, или вариабельный домен легкой цепи, сопровождающийся константным легким (CL) доменом. В зависимости от аминокислотной последовательности константного домена легкую цепь антитела можно отнести к одному из двух типов, называемых каппа (κ) и лямбда (λ).
Термин "вкладыш в упаковку" относится к инструкциям, которые обычно вкладывают в коммерческие упаковки терапевтических продуктов и которые содержат информацию по показаниям, применению, дозировке, введению, сочетанной терапии, противопоказаниям и/или предупреждениям, касающуюся применения таких терапевтических продуктов. Термин "вкладыш в упаковку" относится к инструкциям, которые обычно вкладывают в коммерческие упаковки диагностических продуктов и которые содержат информацию по предполагаемому применению, принципам тестирования, получению и обработке реагентов, сбору и получению образцов, калибровке анализа, процедуре и проведению анализа, и точности представления данных, такой как чувствительность и специфичность анализа.
"Процент (%) идентичности аминокислотной последовательности" стандартной полипептидной последовательности определяют как процент аминокислотных остатков последовательности-кандидата, идентичных аминокислотным остаткам стандартной полипептидной последовательности, после выравнивания последовательностей и введения гэпов, если это необходимо для достижения максимального процента идентичности последовательностей, причем консервативные замены не учитывают при определении идентичности последовательностей. Выравнивание аминокислотных последовательностей с целью определения процента их идентичности можно осуществить разными способами, известными специалистам в данной области, например, с помощью широко доступного программного обеспечения, такого как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить параметры, подходящие для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания сравниваемых последовательностей по всей длине. Однако в настоящем описании значения % идентичности аминокислотных последовательностей получают с помощью компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана Genentech, Inc., а исходная программа зарегистрирована наряду с информацией для пользователя в Бюро регистрации авторских прав США, Washington D.C., 20559, под номером регистрации авторского права США TXU510087. Программа ALIGN-2 находится в свободном доступе в Genentech, Inc., South San Francisco, California, или ее можно скомпилировать из исходной программы. Для применения в операционной системе UNIX, включающей цифровую версию V4.0D, программу ALIGN-2 нужно компилировать. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не варьируют.
Если ALIGN-2 используют для сравнения аминокислотных последовательностей, % идентичности некоторой аминокислотной последовательности A и некоторой аминокислотной последовательности B (или, другими словами, конкретная аминокислотная последовательность A обладает или характеризуется определенным % идентичности последовательностей по отношению к конкретной аминокислотной последовательности B) рассчитывают следующим образом:
100 умножают на дробь X/Y, где X обозначает число идентичных совпадений аминокислотных остатков, определенное при выравнивании последовательностей A и B программой для выравнивания последовательностей ALIGN-2, а Y обозначает общее число аминокислотных остатков в B. Следует понимать, что, если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A аминокислотной последовательности B не равен % идентичности аминокислотной последовательности B аминокислотной последовательности A. Если не указано иначе, все значения % идентичности аминокислотных последовательностей, используемые в настоящем описании, получают по способу, описанному в предшествующем параграфе, с помощью компьютерной программы ALIGN-2.
Термин "фармацевтическая композиция" относится к препарату, который находится в виде формы, которая обеспечивает эффективную биологическую активность содержащегося в ней активного ингредиента и не содержит других компонентов, обладающих неприемлемой токсичностью для субъекта, которому вводят композицию.
Термин "фармацевтически приемлемый носитель" относится к ингредиенту фармацевтической композиции, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает, без ограничения, буфер, наполнитель, стабилизатор или консервант.
Если не указано иначе, термин "мишень" в данном описании относится к любой нативной молекуле любого позвоночного, включающего млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы). Термин охватывает "полноразмерную", не подвергавшуюся процессингу мишень, а также любую форму мишени, образующуюся в клетке в результате процессинга. Термин также охватывает встречающиеся в природе варианты мишеней, например, варианты, образующиеся в результате сплайсинга, или аллельные варианты.
В данном описании термин "лечение" (а также его грамматические вариации, такие как "лечить" или "лечение") относится к клиническому вмешательству с целью изменения природного состояния субъекта, подлежащего лечению, которое можно проводить для профилактики клинической патологии или в процессе течения клинической патологии. Желательные эффекты лечения включают, без ограничения, предотвращение появления или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение появления метастаз, уменьшение скорости развития заболевания, улучшение или облегчение болезненного состояния, ремиссию или улучшенный прогноз. В некоторых воплощениях антитела используют для отсрочки развития заболевания или для замедления прогрессирования заболевания.
Термин "вариабельный участок" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют подобные структуры, причем каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). Для придания антиген-связывающей специфичности может быть достаточно одного домена VH или VL. Кроме того, антитела, способные связываться с конкретным антигеном, можно выделить, используя домен VH или VL антитела, связывающийся с антигеном, для скрининга библиотеки последовательностей, комплементарных доменам VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Термин "вектор" в данном описании относится к молекуле нуклеиновой кислоты, способной обеспечивать репродукцию другой, связанной с ней нуклеиновой кислоты. Термин включает вектор, находящийся в виде самореплицирующейся нуклеиновой кислоты, а также вектор, способный внедряться в геном клетки-хозяина, в которую его вводят. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они находятся в функциональной связи. Такие векторы в настоящем описании называют "векторы экспрессии".
композиции и способы
В одном аспекте изобретение отчасти основывается на новых диагностических анализах и усовершенствованных способах лечения. В некоторых воплощениях изобретение предлагает антитела, способные связываться с периостином. Антитела по данному изобретению можно использовать, например, для диагностики или лечения астмы и других заболеваний.
Примеры антител
Антитела против периостина
В одном аспекте изобретение предлагает выделенные антитела, способные связываться с периостином. В некоторых воплощениях антитело против периостина способно связываться с изоформами 1-4 человеческого периостина с высоким сродством.
В одном воплощении антитело содержит последовательности SEQ ID NO: 1 и SEQ ID NO: 2 (антитело "25D4") или последовательности SEQ ID NO: 3 и SEQ ID NO: 4 (антитело "23B9"). В другом воплощении антитело содержит последовательности вариабельных участков SEQ ID NO: 1 и SEQ ID NO: 2 или последовательности вариабельных участков SEQ ID NO: 3 и SEQ ID NO: 4. В другом воплощении антитело содержит последовательности HVR SEQ ID NO: 1 и SEQ ID NO: 2 или последовательности HVR SEQ ID NO: 3 и SEQ ID NO: 4. В другом воплощении антитело содержит последовательности HVR, которые на 95% или более идентичны последовательностям HVR SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитело содержит последовательности HVR, которые на 95% или более идентичны последовательностям HVR SEQ ID NO: 3 и SEQ ID NO: 4.
В любом из вышеописанных воплощений антитело против периостина может быть гуманизированным. В одном воплощении антитело против периостина содержит HVR, описанные в любом из вышеперечисленных воплощений, а также акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
В другом аспекте антитело против периостина содержит последовательность вариабельного домена тяжелой цепи (VH), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 1. В некоторых воплощениях последовательность VH, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная исходной последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с исходной последовательностью, однако антитело против периостина, содержащее указанную последовательность, сохраняет способность связывать периостин. В некоторых воплощениях в SEQ ID NO: 1 присутствует всего от 1 до 10 аминокислотных замен, вставок и/или делеций. В некоторых воплощениях замены, вставки или делеции встречаются в участках, находящихся вне HVR (т.е., в FR). Антитело против периостина необязательно содержит последовательность VH SEQ ID NO: 1, содержащую посттрансляционные модификации.
В другом аспекте изобретение предлагает антитело против периостина, которое содержит последовательность вариабельного домена легкой цепи (VL), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 2. В некоторых воплощениях последовательность VL, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная исходной последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с исходной последовательностью, однако антитело против периостина, содержащее указанную последовательность, сохраняет способность связывать периостин. В некоторых воплощениях в SEQ ID NO: 2 присутствует всего от 1 до 10 аминокислотных замен, вставок и/или делеций. В некоторых воплощениях замены, вставки или делеции встречаются в участках, находящихся вне HVR (т.е., в FR). Необязательно, антитело против периостина содержит последовательность VL SEQ ID NO: 2, содержащую посттрансляционные модификации.
В другом аспекте антитело против периостина содержит последовательность вариабельного домена тяжелой цепи (VH), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 3. В некоторых воплощениях последовательность VH, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная исходной последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с исходной последовательностью, однако антитело против периостина, содержащее указанную последовательность, сохраняет способность связывать периостин. В некоторых воплощениях в SEQ ID NO: 3 присутствует всего от 1 до 10 аминокислотных замен, вставок и/или делеций. В некоторых воплощениях замены, вставки или делеции встречаются в участках, находящихся вне HVR (т.е., в FR). Необязательно, антитело против периостина содержит последовательность VH SEQ ID NO: 3, содержащую посттрансляционные модификации.
В другом аспекте изобретение предлагает антитело против периостина, которое содержит последовательность вариабельного домена легкой цепи (VL), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 2. В некоторых воплощениях последовательность VL, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная исходной последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с исходной последовательностью, однако антитело против периостина, содержащее указанную последовательность, сохраняет способность связывать периостин. В некоторых воплощениях в SEQ ID NO: 4 присутствует всего от 1 до 10 аминокислотных замен, вставок и/или делеций. В некоторых воплощениях замены, вставки или делеции встречаются в участках, находящихся вне HVR (т.е., в FR). Необязательно, антитело против периостина содержит последовательность VL SEQ ID NO: 4, содержащую посттрансляционные модификации.
В другом аспекте изобретение предлагает антитело против периостина, которое содержит VH, описанный в любом из вышеперечисленных воплощений, и VL, описанный в любом из вышеперечисленных воплощений.
В другом аспекте изобретение предлагает антитело, способное связываться с тем же эпитопом, что и описанное здесь антитело против периостина. Например, в некоторых воплощениях изобретение предлагает антитело, способное связываться с тем же эпитопом, что и антитело против периостина, содержащее последовательность VH SEQ ID NO: 1 и последовательность VL SEQ ID NO: 2. Например, в некоторых воплощениях изобретение предлагает антитело, способное связываться с тем же эпитопом, что и антитело против периостина содержащее последовательность VH SEQ ID NO: 3 и последовательность VL SEQ ID NO: 4.
В другом аспекте данного изобретения антитело против периостина в соответствии с любым из вышеописанных воплощений представляет собой моноклональное антитело, содержащее химерное, гуманизированное или человеческое антитело. В одном воплощении антитело против периостина представляет собой фрагмент антитела, такой как Fv, Fab, Fab', scFv, диатело или фрагмент F(ab')2. В другом воплощении антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1 или IgG4, или антитело, относящееся к другому классу или изотипу, как указано в настоящем документе. В другом воплощении антитело представляет собой биспецифическое антитело.
В другом аспекте антитело против периостина, описанное в одном из вышеперечисленных воплощений, может иметь один из признаков, описанных в приведенных ниже разделах 1-7, или сочетание указанных признаков:
Антитела против IL-13
В одном аспекте изобретение предлагает выделенные антитела, способные связываться с человеческим IL-13.
В одном воплощении антитело против IL-13 содержит HVR-L1 с аминокислотной последовательностью SEQ ID NO: 14; HVR-L2 с аминокислотной последовательностью SEQ ID NO: 15; HVR-L3 с аминокислотной последовательностью SEQ ID NO: 16; HVR-H1 с аминокислотной последовательностью SEQ ID NO: 11; HVR-H2 с аминокислотной последовательностью SEQ ID NO: 12; и HVR-H3 с аминокислотной последовательностью SEQ ID NO: 13.
В другом воплощении антитело содержит последовательности вариабельных участков SEQ ID NO: 9 и SEQ ID NO: 10.
В любом из вышеперечисленных воплощений антитело против IL-13 может быть гуманизированным. В одном воплощении антитело против IL-13 содержит HVR, описанные в любом из вышеперечисленных воплощений, а также акцепторный человеческий каркасный участок, такой как каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
В другом аспекте антитело против IL-13 содержит последовательность вариабельного домена тяжелой цепи (VH), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 9. В некоторых воплощениях последовательность VH, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная исходной последовательности, содержит замены (например, консервативные замены), вставки или делеции по сравнению с исходной последовательностью, однако антитело против IL-13, содержащее указанную последовательность, сохраняет способность связывать человеческий IL-13. В некоторых воплощениях в SEQ ID NO: 9 присутствует от 1 до 10 аминокислотных замен, изменений, вставок и/или делеций. В некоторых воплощениях замены, вставки или делеции встречаются в участках, находящихся вне HVR (т.е., в FR). Необязательно, антитело против IL-13 содержит последовательность VH SEQ ID NO: 9, содержащую посттрансляционные модификации.
В другом аспекте изобретение предлагает антитело против IL-13, которое содержит последовательность вариабельного домена легкой цепи (VL), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 10. В некоторых воплощениях последовательность VL, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична исходной последовательности и содержит замены (например, консервативные замены), вставки или делеции по сравнению с исходной последовательностью, однако антитело против IL-13, содержащее такую последовательность, сохраняет способность связывать IL-13. В некоторых воплощениях в SEQ ID NO: 10 присутствует всего от 1 до 10 аминокислотных замен, вставок и/или делеций. В некоторых воплощениях замены, вставки или делеции встречаются в участках, находящихся вне HVR (т.е., в FR). Необязательно, антитело против IL-13 содержит последовательность VL SEQ ID NO: 10, содержащую посттрансляционные модификации.
В следующем воплощении антитело против IL-13 содержит участок VL, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичный аминокислотной последовательности SEQ ID NO: 10, и участок VH, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичный аминокислотной последовательности SEQ ID NO: 9. В следующем воплощении антитело против IL-13 содержит HVR-L1 с аминокислотной последовательностью SEQ ID NO: 14; HVR-L2 с аминокислотной последовательностью SEQ ID NO: 15; HVR-L3 с аминокислотной последовательностью SEQ ID NO: 16; HVR-H1 с аминокислотной последовательностью SEQ ID NO: 11; HVR-H2 с аминокислотной последовательностью SEQ ID NO: 12; и HVR-H3 с аминокислотной последовательностью SEQ ID NO: 13.
В другом аспекте изобретение предлагает антитело против IL-13, которое содержит VH, описанный в одном из предшествующих воплощений, и VL, описанный в одном из предшествующих воплощений.
В другом аспекте изобретение предлагает антитело, способное связываться с тем же эпитопом, что и антитело против IL-13, описанное в настоящем документе. Например, в некоторых воплощениях изобретение предлагает антитело, способное связываться с тем же эпитопом, что и антитело против IL-13, или такое связывание может конкурентно ингибироваться антителом против IL-13, содержащим последовательность VH SEQ ID NO: 9 и последовательность VL SEQ ID NO: 10.
В другом аспекте данного изобретения антитело против IL-13, описанное в одном из вышеперечисленных воплощений, может представлять собой моноклональные антитело, включающее химерное, гуманизированное или человеческое антитело. В одном воплощении антитело против IL-13 представляет собой фрагмент антитела, например, фрагмент Fv, Fab, Fab', scFv, диатело или F(ab')2. В другом воплощении антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1 или IgG4, или антитело, относящееся к другому классу или изотипу, как указано в настоящем документе. В соответствии с другим воплощением антитело представляет собой биспецифическое антитело. В одном воплощении биспецифическое антитело содержит описанные выше HVR или участки VH и VL.
В другом аспекте антитело против IL-13, описанное в одном из вышеперечисленных воплощений, может иметь один из признаков, описанных в приведенных ниже разделах 1-7, или сочетание указанных признаков:
1. Аффинность антитела
В некоторых воплощениях предлагаемое в настоящем описании антитело имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤ 0,01 нМ или ≤0,001 нМ (например, 10-8 M или менее, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M).
В одном воплощении Kd измеряют с помощью анализа связывания антигена, меченного радиоактивным изотопом (RIA), с использованием Fab-версии представляющего интерес антитела и его антигена по описанному ниже способу. Сродство связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии ряда титровочных концентраций немеченого антигена с последующим улавливанием связанного антигена на планшете, покрытом антителом против Fab (см., например, Chen et al., J. Mol. Biol. 293:865-881 (1999)). Чтобы определить условия анализа, многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи улавливающим антителом против Fab (Cappel Labs) в концентрации 5 мкг/мл в 50 мМ растворе карбоната натрия (pH 9,6) и затем блокируют 2% (масс/об) раствором бычьего сывороточного альбумина в PBS в течение двух-пяти часов при комнатной температуре (примерно 23ºC). В планшете, не содержащем адсорбента (Nunc #269620), 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела против VEGF, Fab-12, описанного в Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно продолжать в течение более длительного периода (например, в течение приблизительно 65 часов), чтобы гарантировать достижение равновесия. Затем смеси переносят в планшет для улавливания и инкубируют при комнатной температуре (например, в течение одного часа). После инкубации раствор удаляют и планшет промывают восемь раз 0,1% раствором полисорбата 20 (TWEEN-20®) в PBS. Планшеты сушат, затем добавляют 150 мкл/лунку сцинтиллятора (MICROSCINT-20 TM; Packard) и считают на гамма-счетчике TOPCOUNT TM (Packard) в течение десяти минут. Концентрации каждого Fab, обеспечивающие связывание, составляющее 20% или меньше от максимального, выбирают для применения в анализе конкурентного связывания.
В соответствии с другим воплощением Kd измеряют методом поверхностного плазмонного резонанса при 25ºC, используя BIACORE®-2000 или BIACORE ®-3000 (BIAcore, Inc., Piscataway, NJ) и чипы с иммобилизованным антигеном CM5 при ~10 единицах ответа (RU). Коротко говоря, биосенсорные чипы на основе карбоксиметилированного декстрана (CM5, BIACORE, Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) и затем вводят его со скоростью потока 5 мкл/минуту до достижения примерно 10 единиц ответа (RU) от присоединенного белка. После антигена вводят 1 M этаноламин, чтобы блокировать непрореагировавшие группы. Для измерения кинетических параметров вводят двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) в PBS, содержащем 0,05% полисорбата 20 (TWEEN-20TM) в качестве поверхностно-активного вещества (PBST), при 25ºC со скоростью потока, составляющей примерно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) рассчитывают, используя взаимно однозначную модель связывания Лэнгмюра (программа для обработки данных BIACORE®, версия 3.2) путем одновременной подгонки сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации превышает 106 M-1s-1 по данным указанного выше анализа поверхностного плазмонного резонанса, то скорость ассоциации можно определить методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресценции (длина волны возбуждения = 295 нМ; длина волны испускания = 340 нМ, полоса пропускания 16 нМ) при 25ºC в присутствии 20 нМ комплекса антиген-антитело (форма Fab) в PBS, pH 7,2, и повышающихся концентраций антигена с помощью спектрометра, такого как спектрофотометр остановленного потока (Aviv Instruments), или спектрофотометр SLM-AMINCO TM, серия 8000 (ThermoSpectronic), оборудованный перемешиваемой кюветой.
2. Фрагменты антител
В некоторых воплощениях предлагаемое в настоящем описании антитело представляет собой фрагмент антитела. Фрагменты антител включают, без ограничения, фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, а также другие фрагменты, описанные ниже. Обзор некоторых фрагментов антител можно найти в Hudson et al. Nat. Med. 9: 129-134 (2003). Обзор фрагментов scFv можно найти, например, в Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg и Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); а также в WO 93/16185; и патентах США №№ 5571894 и 5587458. Описание фрагментов Fab и F(ab')2, содержащих остатки, связывающие эпитоп реутилизационного рецептора, и имеющие повышенный период полужизни in vivo, можно найти в патенте США № 5869046.
Диатела представляют собой фрагменты антител, содержащие два антиген-связывающих участка, и могут быть бивалентными или биспецифическими. См., например, EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993). В Hudson et al., Nat. Med. 9:129-134 (2003) также описаны триатела и тетратела.
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела, или его часть, или весь вариабельный домен легкой цепи антитела, или его часть. В некоторых воплощениях однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 B1).
Фрагменты антител можно получить разными способами, включающими, без ограничения, протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (такими как E. coli или фаг), как описано в данном документе.
3. Химерные и гуманизированные антитела
В некоторых воплощениях антитело, предлагаемое в настоящем описании, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984). В одном примере химерное антитело содержит нечеловеческий вариабельный участок (например, вариабельный участок, полученный из мыши, крысы, хомяка, кролика или отличного от человека примата, такого как мартышка) и человеческий константный участок. В другом примере химерное антитело представляет собой антитело "переключенного класса", полученное в результате изменения класса или подкласса исходного антитела. Термин химерные антитела включает антиген-связывающие фрагменты таких антител.
В некоторых воплощениях химерные антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют, чтобы уменьшить иммуногенность для человека и сохранить при этом специфичность и сродство исходного нечеловеческого антитела. Обычно гуманизированное антитело содержит один или несколько вариабельных доменов, в состав которых входят HVR, например, CDR (или их фрагменты), полученные из нечеловеческого антитела, и FR (или их фрагменты), полученные из последовательностей человеческих антител. Гуманизированное антитело также необязательно содержит, по меньшей мере, часть человеческого константного участка. В некоторых воплощениях отдельные остатки FR гуманизированного антитела заменены соответствующими остатками нечеловеческого антитела (такого как антитело, из которого получены остатки HVR), например, с целью сохранения или улучшения специфичности или сродства антитела.
Обзоры по гуманизированным антителам и способам их получения можно найти, например, в Almagro и Fransson, Front. Biosci. 13:1619-1633 (2008), а также, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); патентах США №№ 5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36:25-34 (2005) (описывающем прививание SDR (a-CDR)); Padlan, Mol. Immunol. 28:489-498 (1991) (описывающем "изменение поверхности"); Dall'Acqua et al., Methods 36:43-60 (2005) (описывающем "перетасовку FR"); и Osbourn et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описывающем перетасовку FR методом "управляемой селекции").
Человеческие каркасные участки, которые можно использовать для гуманизации, включают, без ограничения: каркасные участки, выбранные методом "наилучшего соответствия" (см., например, Sims et al. J. Immunol. 151:2296 (1993)); каркасные участки консенсусной последовательности человеческих антител, содержащей конкретную подгруппу вариабельных участков легкой или тяжелой цепи (см., например, Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al. J. Immunol, 151:2623 (1993)); человеческие зрелые (образовавшиеся в результате соматических мутаций) каркасные участки или человеческие каркасные участки зародышевого типа (см., например, Almagro и Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные участки, полученные в результате скрининга библиотек FR (см., например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
4. Человеческие антитела
В некоторых воплощениях антитело, предлагаемое в настоящем описании, представляет собой человеческое антитело. Человеческое антитело можно получить с помощью разных методов, известных в данной области. Человеческие антитела описаны в общих чертах в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5:368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Человеческие антитела можно получить путем введения иммуногена трансгенному животному, модифицированному с целью придания ему способности продуцировать интактные человеческие антитела или интактные антитела, содержащие человеческие вариабельные участки, в ответ на введение антигена. Такие животные обычно содержат весь локус человеческих иммуноглобулинов, или его часть, который заменяет эндогенный локус иммуноглобулинов, или который присутствует вне хромосом, или интегрируется случайным образом в хромосомы животного. У таких трансгенных мышей эндогенный локус иммуноглобулинов обычно инактивируют. Обзор способов получения человеческих антител с использованием трансгенных животных можно найти в Lonberg, Nat. Biotech. 23: 1117-1125 (2005). См. также, например, патенты США №№ 6075181 и 6150584, описывающие технологию XENOMOUSETM; патент США № 5770429, описывающий технологию HUMAB®; патент США № 7041870, описывающий технологию K-M MOUSE®, и публикацию патентной заявки США № US 2007/0061900, описывающую технологию VELOCIMOUSE®). Человеческие вариабельные участки интактных антител, полученных с использованием таких животных, можно дополнительно модифицировать, например, путем объединения с другим человеческим константным участком.
Человеческие антитела также можно получить с помощью гибридомных методов. Описаны человеческие миеломные и мышино-человеческие гетеромиеломные клеточные линии, используемые для получения человеческих моноклональных антител. (См., например, Kozbor J. Immunol, 133:3001 (1984); Brodeur et al., Monoclonal Antlbody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol, 147:86 (1991).) Человеческие антитела, полученные с использованием человеческих B-клеточных гибридом, также описаны в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Другие способы включают способы, описанные, например, в патенте США № 7189826 (описывающем получение моноклональных человеческих антител IgM из гибридомных клеточных линий) и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (описывающем полностью человеческие гибридомы). Технология человеческих гибридом (технология Trioma) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
Человеческие антитела также можно получить путем выделения последовательностей вариабельного домена клона Fv, выбранных из человеческих библиотек фаговых дисплеев. Такие последовательности вариабельного домена можно затем объединить с желательным человеческим константным доменом. Методы выбора человеческих антител из библиотек антител описаны ниже.
5. Антитела, полученные из библиотек
Антитела по данному изобретению можно выделить путем скрининга комбинаторных антител на антитела, обладающие желательной активностью или желательными активностями. Например, в данной области известен ряд способов получения библиотек фаговых дисплеев и скрининга таких библиотек на антитела, обладающие желательными характеристиками связывания. Обзор по таким способам можно найти, например, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001), а также, например, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352:624-628 (1991); Marks et al., J. Mol. Biol. 222:581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J. Mol. Biol. 340(5):1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34):12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2):119-132(2004).
В некоторых методах фаговых дисплеев репертуары генов VH и VL отдельно клонируют методом полимеразной цепной реакции (PCR) и воссоединяют случайным образом в фаговых библиотеках, которые затем можно подвергнуть скринингу на антиген-связывающие фаги, как описано в Winter et al., Ann. Rev. Immunol, 12:433-455 (1994). Как правило, фаг экспонирует фрагменты антител, либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки, полученные из иммунизированных источников, содержат антитела, обладающие высоким сродством к иммуногену, следовательно, необходимость конструирования гибридом отпадает. Альтернативно можно клонировать наивный репертуар (например, человеческий) с получением одного источника антитела против широкого ряда собственных и не собственных антигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12:725-734 (1993). Наконец, наивные библиотеки также можно получить синтетически путем клонирования не подвергавшихся реаранжировке сегментов V-гена из стволовых клеток, с использованием праймеров ПЦР, содержащих статистическую последовательность, кодирующую высоко вариабельные участки CDR3, и с проведением реаранжировки in vitro, как описано Hoogenboom и Winter, J. Mol. Biol., 227:381-388 (1992). Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например: патент США № 5750373 и патентные публикации США №№ 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, в данном документе относят к человеческим антителам или фрагментам человеческих антител.
6. Полиспецифичные антитела
В некоторых воплощениях антитело, предлагаемое в настоящем описании, представляет собой полиспецифичное антитело, например биспецифическое антитело. Полиспецифичные антитела представляют собой моноклональные антитела, которые содержат, по меньшей мере, два участка специфичного связывания. В некоторых воплощениях один участок отвечает за специфичное связывание с IL-13, а другой - за специфичное связывание с любым другим антигеном. В некоторых воплощениях биспецифические антитела могут связываться с двумя разными эпитопами IL-13. Биспецифические антитела также можно использовать для направления цитотоксических средств к клеткам. Биспецифические антитела можно получить в виде полноразмерных антител или в виде фрагментов антител.
Методы получения полиспецифичных антител включают, без ограничения, рекомбинантную совместную экспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, обладающих разными специфичностями (см. Milstein and Cuello, Nature 305:537 (1983), WO 93/08829, и Traunecker et al., EMBO J. 10:3655 (1991)), и рекомбинантную технологию "выступ-во-впадину" (см., например, патент США № 5731168). Полиспецифичные антитела также можно получить рекомбинантным методом, обеспечивающим электростатические направляющие эффекты, которые позволяют получать Fc-гетеродимерные молекулы антитела (WO 2009/089004A1); путем поперечной сшивки двух или более антител или фрагментов (см., например, патент США № 4676980, и Brennan et al., Science, 229:81 (1985)); с использованием лейциновых молний, позволяющих получать биспецифические антитела (см., например, Kostelny et al., J. Immunol, 148(5):1547-1553 (1992)); с использованием технологии "диател", позволяющей получать фрагменты биспецифических антител (см., например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и с использованием димеров одноцепочечных Fv (sFv) (см., например, Gruber et al., J. Immunol, 152:5368 (1994)); а также можно получить триспецифичные антитела, как описано, например, в Tutt et al. J. Immunol. 147:60 (1991).
Рекомбинантные антитела, содержащие три или более функциональных антиген-связывающих участка, в том числе "антитела Octopus", также входят в объем настоящего изобретения (см., например. US 2006/0025576A1).
В соответствии с настоящим документом антитело или его фрагмент также включают "Fab двойного действия" или "DAF", содержащий антиген-связывающий участок, способный связываться с IL-13 наряду с другим, отличным от него антигеном (см. US 2008/0069820, например).
7. Варианты антител
В некоторых воплощениях изобретение охватывает варианты аминокислотных последовательностей антител, предлагаемые в настоящем описании. Например, может возникнуть необходимость в улучшении сродства связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антител можно получить путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки и/или замены остатков в аминокислотной последовательности антитела. Чтобы получить конечную конструкцию, можно осуществить любое сочетание делеций, вставок и замен, при условии, что конечная конструкция обладает желательными характеристиками, такими как способность связывать антиген.
Варианты, полученные в результате замен, вставок и делеций
В некоторых воплощениях изобретение предлагает варианты антител, содержащих одну или несколько аминокислотных замен. Участки, представляющие интерес с точки зрения заместительного мутагенеза, включают HVR и FR. Консервативные замены приведены в таблице 1 под заголовком "Консервативные замены". Более конкретные замены приведены в таблице 1 под заголовком "Иллюстративные замены" и, как более подробно описано ниже, с учетом классов боковых цепей аминокислот. Аминокислотные замены вводят в представляющее интерес антитело, после чего полученные продукты подвергают скринингу на желательную активность, например, сохранение/улучшение свойства, включающего способность связывать антиген, пониженную иммуногенность или улучшенные ADCC или CDC.
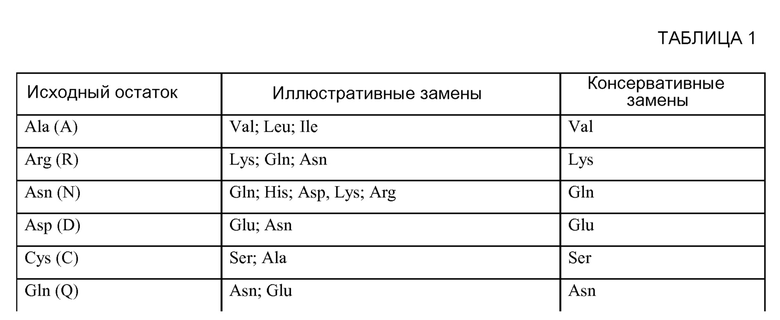
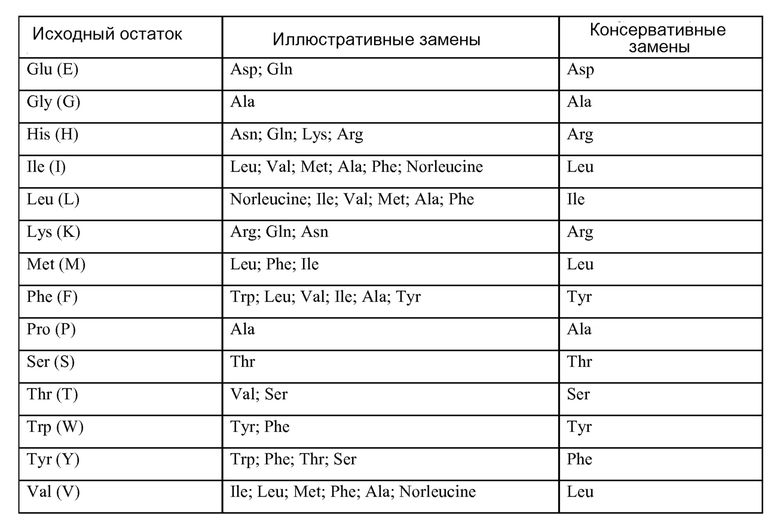
Аминокислоты можно классифицировать в соответствии с общими свойствами боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены представляют собой замену члена одного из указанных классов членом другого класса.
Заместительный вариант одного типа можно получить путем замены одного или нескольких остатков гипервариабельного участка исходного антитела (например, гуманизированного или человеческого антитела). Как правило, полученный вариант (варианты), выбранный для дальнейшего исследования, характеризуется изменением (например, улучшением) некоторых биологических свойств (таких как повышенное сродство, пониженная иммуногенность) по сравнению с исходным антителом и/или практически сохраняет некоторые биологические свойства исходного антитела неизменными. Примером заместительного варианта является аффинно зрелое антитело, которое можно получить, например, с помощью методов аффинного созревания на основе фаговых дисплеев, таких как описанные в данном документе. Коротко говоря, один или несколько остатков HVR изменяют, после чего вариантные антитела, экспонированные на фаге, подвергают скринингу на конкретную биологическую активность (такую как сродство связывания).
Изменения (например, замены) в HVR можно осуществить, например, с целью улучшения сродства антитела. Такие изменения можно осуществить в "горячих точках" HVR, т.е. в остатках, кодируемых кодонами, которые в процессе соматического созревания подвергаются мутациям с высокой частотой (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или SDR (a-CDR), с тестированием полученного варианта VH или VL на сродство связывания. Аффинное созревание путем конструирования и повторного выбора из вторичных библиотек описано, например, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001)). В некоторых воплощениях аффинного созревания в гены вариабельных участков, выбранных для созревания, вводят разнообразие с помощью одного из ряда способов (включающих ПЦР с внесением ошибок, перетасовку цепей или олигонуклеотид-направленный мутагенез). Затем создают вторичную библиотеку. Библиотеку подвергают скринингу с целью идентификации вариантов антител, обладающих желательным сродством. Другой способ введения разнообразия включает HVR-направленные подходы с рандомизацией некоторых остатков HVR (например, 4-6 остатков одновременно). Можно конкретно идентифицировать остатки HVR, участвующие в связывании антигена, например, с помощью сканирующего аланином мутагенеза или моделирования. При этом мишенями часто являются CDR-H3 и CDR-L3.
В некоторых воплощениях замены, вставки или делеции могут встречаться в одном или нескольких HVR, при условии, что такие изменения практически не снижают способность антитела связывать антиген. Например, в HVR можно осуществить консервативные изменения (такие как консервативные замены, указанные в настоящем описании), которые практически не снижают сродство связывания. Такие изменения могут находиться вне "горячих точек" HVR или SDR. В некоторых воплощениях описанных выше вариантных последовательностей VH и VL, каждый HVR либо остается неизменным, либо содержит не более одной, двух или трех аминокислотных замен.
Идентификацию остатков или участков антитела, которые могут служить мишенью для мутагенеза, проводят с помощью способа, называемого "сканирующий аланином мутагенез", описанного в Cunningham and Wells (1989) Science, 244:1081-1085. В данном способе идентифицируют остаток или группу целевых остатков (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют их нейтральными или отрицательно заряженными аминокислотами (такими как аланин или полиаланин), чтобы определить, влияют ли они на взаимодействие антитела с антигеном. В аминокислотные положения, характеризующиеся функциональной чувствительностью к исходным заменам, можно вводить другие замены. Альтернативно, или дополнительно, точки контакта антитела с антигеном идентифицируют с использованием кристаллической структуры комплекса антиген-антитело. Такие контактные или соседние с ними остатки можно использовать в качестве мишеней для замены, или они могут не рассматриваться как кандидаты для замены. Варианты можно подвергнуть скринингу, чтобы определить, обладают ли они желательными свойствами.
Вставки в аминокислотную последовательность включают амино- и/или карбокси-концевые присоединения, которые могут содержать в длину от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки в центральную часть последовательности одного или нескольких аминокислотных остатков. Примеры концевых вставок включают вставку в антитело N-концевого остатка метионила. Другие инсерционные варианты молекулы антитела включают гибрид антитела по N- или C-концу с ферментом (например, ADEPT) или полипептидом, который увеличивает период полужизни антитела в сыворотке.
Варианты, полученные в результате гликозилирования
В некоторых воплощениях антитело, предлагаемое в настоящем описании, изменяют с целью увеличения или уменьшения степени его гликозилирования. Добавление или делецию участков гликозилирования антитела можно осуществить путем изменения аминокислотной последовательности с введением или удалением одного или нескольких участков гликозилирования.
Если антитело содержит Fc-участок, можно изменить присоединенный к нему углевод. Нативные антитела, продуцируемые клетками млекопитающих, как правило, содержат разветвленный, биантеннарный олигосахарид, обычно присоединенный N-связью к Asn297 домена CH2 Fc-участка. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может содержать разные углеводы, такие как манноза, N-ацетилглюкозамин (GlcNAc), галактоза и сиаловая кислота, а также фукозу, присоединенную к GlcNAc в "стволовой" части биантеннарной структуры олигосахарида. В некоторых воплощениях модификации олигосахарида, входящего в состав антитела по данному изобретению, можно осуществить с целью создания вариантов антител, обладающих некоторыми улучшенными свойствами.
В одном воплощении изобретение предлагает варианты антител, содержащие углевод, в котором отсутствует фукоза, присоединенная (непосредственно или косвенно) к Fc-участку. Например, количество фукозы в таком антителе может варьировать 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета отношения среднего количества фукозы в цепи сахара, присоединенного к Asn297, к сумме всех углеводных структур, присоединенных к Asn297 (например, комплексных структур, гибридных структур и структур с высоким содержанием маннозы), используя результаты метода масс-спектрометрии MALDI-TOF, описанного, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, расположенный примерно в положении 297 Fc-участка (Eu-нумерация остатков Fc-участка); однако Asn297 также может находиться на расстоянии примерно ±3 аминокислот выше или ниже положения 297, т.е. между положениями 294 и 300, вследствие минорных вариаций последовательности антитела. Такие фукозилированные варианты могут улучшать функцию ADCC. См., например, патентные публикации США №№ US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, описывающих "дефукозилированные" или "фукоза-дефицитные" варианты антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87:614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 CHO, дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); патентная заявка США № US 2003/0157108 A1, Presta, L.; и WO 2004/056312 A1, Adams et al., особенно, пример 11), и клеточные линии с нокаутом, например, гена альфа-1,6-фукозилтрансферазы, FUT8, нокаутные клетки CHO (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87:614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO2003/085107).
Изобретение также предлагает варианты антител, содержащие бисектные олигосахариды, например, в которых разветвление биантеннарного олигосахарида, присоединенного к Fc-участку антитела, осуществляется по GlcNAc. Такие варианты антител могут характеризоваться пониженным фукозилированием и/или улучшенной функцией ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al); патент США № 6602684 (Umana et al); и US 2005/0123546 (Umana et al). Изобретение также предлагает варианты антител, содержащие, по меньшей мере, один остаток галактозы в олигосахариде, присоединенном к Fc-участку. Такие варианты антител могут характеризоваться улучшенной функцией CDC. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
Варианты Fc-участка
В некоторых воплощениях одну или несколько аминокислотных модификаций можно ввести в Fc-участок антитела, предлагаемого в настоящем описании, с получением варианта Fc-участка. Вариант Fc-участка может содержать человеческую последовательность Fc-участка (например, Fc-участка человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
В некоторых воплощениях изобретение предлагает вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, делающими его желательным кандидатом для применений, в которых важное значение имеет период полужизни антитела in vivo, хотя отдельные эффекторные функции (такие как комплемент и ADCC) не являются необходимыми, или являются вредными. Чтобы подтвердить уменьшение/истощение активности CDC и/или ADCC можно провести анализы цитотоксичности in vitro и/или in vivo. Например, с помощью анализа связывания рецептора Fc (FcR) можно подтвердить, что антитело не связывается с FcγR (следовательно, по всей вероятности, утрачивает активность ADCC), однако сохраняет способность связывать FcRn. Первичные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcRIII, тогда как моноциты экспрессируют FcRI, FcRII и FcRIII. Экспрессия FcR на гематопоэтических клетках приведена в таблице 3 на странице 464 Ravetch и Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры анализов in vitro, позволяющих оценить активность ADCC представляющей интерес молекулы, описаны в патенте США № 5500362 (см., например, Hellstrom, I. et al. Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I. et al., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166:1351-1361 (1987)). Альтернативно можно использовать нерадиоактивные методы анализов (см., например, нерадиоактивный анализ цитотоксичности методом проточной цитометрии ACTITM (CellTechnology, Inc. Mountain View, CA) и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI)). В качестве эффекторных клеток в таких анализах можно использовать мононуклеарные клетки периферической крови (PBMC) и натуральные киллерные (NK) клетки. Альтернативно, или дополнительно, активность ADCC представляющей интерес молекулы можно определить in vivo, например, на животной модели, например, описанной в Clynes et al. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Чтобы подтвердить, что антитело не способно связывать Clq и, следовательно, не обладает активностью CDC, можно провести анализы связывания C1q. См., например, анализ связывания C1q и C3c методом ELISA в WO 2006/029879 и WO 2005/100402. Активацию комплемента можно определить с помощью анализа CDC (см., например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003); и Cragg, M.S. и M.J. Glennie, Blood 103:2738-2743 (2004)). Анализ связывания FcRn и определение клиренса/периода полужизни in vivo можно проводить с помощью известных в данной области методов (см., например, Petkova, S.B. et al., Int'l. Immunol. 18(12):1759-1769 (2006)).
Антитела с пониженной эффекторной функцией включают антитела, содержащие замены одного или нескольких из остатков Fc-участка 238, 265, 269, 270, 297, 327 и 329 (патент США № 6737056). Такие Fc-мутанты включают Fc-мутанты, содержащие замены по двум или более из аминокислотных положений 265, 269, 270, 297 и 327, в том числе так называемый Fc-мутант "DANA", содержащий замену остатков в положениях 265 и 297 на аланин (патент США № 7332581).
Описаны некоторые варианты антител, обладающие улучшенным или ухудшенным связыванием с FcR. (См., например, патент США № 6737056; WO 2004/056312, и Shields et al., J. Biol. Chem. 9(2):6591-6604 (2001).)
В некоторых воплощениях вариант антитела содержит Fc-участок с одной или несколькими аминокислотными заменами, приводящими к улучшению ADCC, такими как замены в положениях 298, 333 и/или 334 Fc-участка (EU-нумерация остатков).
В некоторых воплощениях в Fc-участке осуществляют изменения, которые приводят к изменению (т.е., к улучшению или ухудшению) связывания C1q и/или комплемент-зависимой цитотоксичности (CDC), например, как описано в патенте США № 6194551, WO 99/51642 и Idusogie et al. J. Immunol. 164:4178-4184 (2000).
Антитела с повышенным периодом полужизни и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG зародышу (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US2005/0014934A1 (Hinton et al.). Указанные антитела содержат Fc-участок с одной или несколькими заменами, приводящими к улучшению связывания Fc-участка с FcRn. Такие Fc-варианты включают варианты, содержащие замены по одному или нескольким из следующих остатков Fc-участка: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 Fc-участка (патент США № 7371826).
См. также Duncan & Winter, Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821; и WO 94/29351, описывающие другие примеры вариантов Fc-участка.
Варианты антител, полученные путем введения цистеина
В некоторых воплощениях желательно получать антитела, модифицированные путем введения цистеина, такие как "thioMAb", в котором один или несколько остатков антитела замещены остатками цистеина. В конкретных воплощениях замещаемые остатки находятся в доступных участках антитела. В результате замены указанных остатков цистеином в доступных участках антитела появляются реакционноспособные тиольные группы, которые можно использовать для конъюгирования антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-лекарственное средство, с получением иммуноконъюгата, как описано в настоящем документе. В некоторых воплощениях цистеином можно заменить один или несколько из следующих остатков: V205 (нумерация Кабат) легкой цепи; A118 (нумерация EU) тяжелой цепи; и S400 (нумерация EU) Fc-участка тяжелой цепи. Цистеин-содержащие антитела можно получить способом, описанным, например, в патенте США № 7521541.
Производные антител
В некоторых воплощениях антитело, предлагаемое в настоящем описании, можно также модифицировать путем введения небелковых фрагментов, известных в данной области и легко доступных. Фрагменты, которые можно использовать для дериватизации антитела, включают, без ограничения, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, без ограничения, полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (в виде гомополимеров или статистических сополимеров), декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт, а также их смеси. Преимуществом полиэтиленгликоля пропионового альдегида в промышленном производстве является их стабильность в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и в случае присоединения нескольких полимеров, они могут представлять собой одинаковые или разные молекулы. Как правило, число и/или тип полимеров, используемых для дериватизации, можно определить с учетом факторов, включающих, без ограничения, конкретные свойства или функции антитела, подлежащие улучшению, независимо от того, будет ли производное антитела использоваться в терапии при определенных условиях, и др.
В другом воплощении изобретение предлагает конъюгаты антитела с небелковым фрагментом, который можно избирательно нагревать под действием облучения. В одном воплощении небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102:11600-11605 (2005)). Можно использовать облучение любой длины волны, включающей, без ограничения, длины волн, которые не приносят вреда исходным клеткам, но нагревают небелковый фрагмент до температуры, при которой клетки, находящиеся по соседству с небелковым фрагментом, погибают.
Рекомбинантные методы и композиции
Антитела можно получить с помощью рекомбинантных методов и композиций, например, описанных в патенте США № 4816567. В одном воплощении изобретение предлагает выделенную нуклеиновую кислоту, кодирующую описанное здесь антитело против периостина. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В следующем воплощении изобретение предлагает один или несколько векторов (таких как векторы экспрессии), содержащих такую нуклеиновую кислоту. В следующем воплощении изобретение предлагает клетку-хозяина, содержащую такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, в результате трансформации): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (CHO) или лимфоидную клетку (такую как клетка Y0, NS0, Sp20). В одном воплощении изобретение предлагает способ получения антитела против периостина, который включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как описано выше, в условиях, подходящих для экспрессии антитела, и, необязательно, извлечение антитела из клетки-хозяина (или среды, в которой культивируют клетку-хозяина).
Для рекомбинантного получения антитела против периостина нуклеиновую кислоту, кодирующую антитело, например, описанную выше, выделяют и вставляют в один или несколько векторов с целью последующего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделить и секвенировать с помощью традиционных методов (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела).
Клетки-хозяева, подходящие для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела можно получать в бактериях, в особенности, если гликозилирование и эффекторная функция Fc не являются необходимыми. Способы экспрессии фрагментов антител и полипептидов в бактериях можно найти, например, в патентах США №№ 5648237, 5789199 и 5840523. (См. также Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, описывающих экспрессию фрагментов антител в E. coli). После экспрессии антитело можно перевести из массы бактериальных клеток в растворимую фракцию и затем очистить.
Помимо прокариотов в качестве хозяев, подходящих для клонирования или экспрессии антитело-кодирующих векторов, можно использовать эукариотические микроорганизмы, такие как гифомицеты или дрожжи, включающие штаммы грибков и дрожжей с "гуманизированными" путями гликозилирования, которые позволяют получать антитела с частично или полностью человеческим характером гликозилирования. См. Gerngross, Nat. Biotech. 22:1409-1414 (2004), и Li et al., Nat. Biotech. 24:210-215 (2006).
Клетки-хозяева, подходящие для экспрессии гликозилированного антитела, также можно получить из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также можно использовать культуры растительных клеток. См., например, патенты США №№ 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIESTM, позволяющую получать антитела в трансгенных растениях).
В качестве хозяев также можно использовать клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, адаптированные для роста в суспензии. Другие примеры подходящих, полученных из млекопитающих, линий клеток-хозяев включают линию клеток почки мартышки CV1, трансформированных SV40 (COS-7); линию клеток почки эмбриона человека (клетки 293 или 293, описанные, например, в Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомяка (BHK); мышиные клетки Sertoli (клетки TM4, описанные, например, в Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки мартышки (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы buffalo (BRL 3A); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (MMT 060562); клетки TRI, описанные, например, в Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982); клетки MRC 5; и клетки FS4. Другие подходящие, полученные из млекопитающих, линии клеток-хозяев включают клетки яичника китайского хомячка (CHO), в том числе клетки DHFR-CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и миеломные клеточные линии, такие как Y0, NS0 и Sp2/0. Обзор по некоторым, полученным из млекопитающих, линиям клеток-хозяев, подходящих для получения антител, можно найти, например, в Yazaki и Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
анализы
Антитело против периостина, предлагаемое в настоящем описании, можно идентифицировать, подвергнуть скринингу или характеризовать по физическим/химическим свойствам и/или биологической активности с помощью разных анализов, известных в данной области.
Анализы связывания и другие анализы
В одном аспекте антитело по данному изобретению тестируют на антиген-связывающую активность, например, с помощью известных способов, таких как ELISA, вестерн-блоттинг и др.
В другом аспекте можно использовать конкурентные анализы для идентификации антитела, способного конкурировать с антителом против IL-13 или периостина за связывание с IL13 или периостином, соответственно. В некоторых воплощениях такое конкурентноспособное антитело связывается с тем же эпитопом (таким как линейный или конформационный эпитоп), с которым связывается лебрикизумаб или другое антитело против IL-13, описанное в настоящем документе, или антитело против периостина, описанное в настоящем документе. Подробное описание иллюстративных методов картирования эпитопа, с которым связывается антитело, можно найти в Morris (1996) "Epitope Mapping Protocols," in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
В иллюстративном конкурентном анализе иммобилизованный периостин инкубируют в растворе, содержащем первое меченое антитело, способное связываться с периостином (например, 25D4), и второе немеченое антитело, подлежащее тестированию на способность конкурировать с первым антителом за связывание с периостином. Второе антитело может присутствовать в супернатанте гибридом. В качестве контроля иммобилизованный периостин инкубируют в растворе, который содержит первое меченое антитело, но не содержит второе немеченое антитело. После инкубации в условиях, обеспечивающих связывание первого антитела с периостином, удаляют избыток несвязанного антитела и измеряют количество метки, связанной с иммобилизованным периостином. Если количество метки, связанной с иммобилизованным периостином, в тестируемом образце значительно снижено по сравнению с контрольным образцом, это означает, что второе антитело конкурирует с первым антителом за связывание с периостином. См. Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
Анализы активности
В одном аспекте изобретение предлагает анализы для идентификации антитела против IL-13, обладающего биологической активностью. Биологическая активность может включать, например, активность в отношении астмы. Изобретение также предлагает антитела, обладающие такой биологической активностью in vivo и/или in vitro.
В некоторых воплощениях антитело по данному изобретению тестируют на такую биологическую активность.
Иммуноконъюгаты
Изобретение также предлагает иммуноконъюгаты, содержащие описанное здесь антитело против периостина, конъюгированное с одним или несколькими цитотоксическими средствами, такими как химиотерапевтические средства или лекарства, ингибиторы роста, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты) или радиоактивные изотопы.
В одном воплощении иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), где антитело присоединено к одному или нескольким лекарственным средствам, включающим, без ограничения, майтансиноид (см. патенты США №№ 5208020, 5416064 и Европейский патент EP 0425235 B1); ауристатин, включающий фрагменты лекарства монометилауристатина DE и DF (MMAE и MMAF) (см. патенты США №№ 5635483 и 5780588, и 7498298); доластатин; калихеамицин или его производные (см. патенты США №№ 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296; Hinman et al., Cancer Res. 53:3336-3342 (1993); и Lode et al., Cancer Res. 58:2925-2928 (1998)); антрациклин, такой как дауномицин или доксорубицин (см. Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); и патент США № 6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тесетаксел и ортотаксел; трихотецен; и CC1065.
В другом воплощении иммуноконъюгат содержит описанное здесь антитело, конъюгированное с ферментативно активным токсином или его фрагментом, включающим, без ограничения, A-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модекцина, альфа-сарцин, белки Aleurites fordii, белки dianthin, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
В другом воплощении иммуноконъюгат содержит описанное здесь антитело, конъюгированное с радиоактивным атомом с получением радиоактивного конъюгата. Для получения радиоактивных конъюгатов можно использовать ряд радиоактивных изотопов. Их примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Если радиоактивный конъюгат используют для детекции, он может содержать радиоактивный атом, применяющийся в сцинтиграфических исследованиях, например, tc99m или I123, или спиновую метку, применяющуюся для визуализации ядерного магнитного резонанса (ЯМР) (также известной как магнитно-резонансная томография, МРТ), такую как, опять же, йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела с цитотоксическим средством можно получить с использованием ряда бифункциональных белок-связывающих средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (таких как диметиладипимидат HCl), активированные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бисактивные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получить способом, описанным Vitetta et al., Science 238:1098 (1987). Углерод-14-меченная 1-изотиоцианатобензил-3-метилдиэтилен триаминпентауксусная кислота (MX-DTPA) является примером хелатирующего средства, используемого для присоединения радионуклида к антителу. См. WO 94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического средства в клетке. Например, можно использовать кислоточувствительный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметильный линкер или дисульфид-содержащий линкер (Chari et al., Cancer Res. 52:127-131 (1992); патент США № 5208020).
Описанные здесь иммуноконъюгаты или ADC в явной форме подразумевают, без ограничения, конъюгаты, полученные с использованием перекрестно-сшивающих реагентов, включающих, без ограничения, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, их можно получить от Pierce Biotechnology, Inc., Rockford, IL., U.S.A).
Способы и композиции для диагностики и детекции
В некоторых воплощениях любое из предлагаемых в настоящем описании антител против периостина можно использовать для детекции присутствия периостина в биологическом образце. Термин "детекция" в соответствии с настоящим описанием охватывает количественную или качественную детекцию. В некоторых воплощениях биологический образец включает клетку или ткань, такую как сыворотка, плазма, назальные мазки и мокрота.
В одном воплощении изобретение предлагает антитело против периостина для применения в способе диагностики или детекции. В другом аспекте изобретение предлагает способ детекции присутствия периостина в биологическом образце. В некоторых воплощениях способ включает приведение в контакт биологического образца с антителом против периостина, как описано в данном документе, в условиях, обеспечивающих связывание антитела против периостина с периостином, и детекцию образования комплекса антитела против периостина с периостином. Такой способ можно проводить in vitro или in vivo. В одном воплощении антитело против периостина используют для выбора субъектов, подходящих для лечения с помощью антитела против I3, или любого другого ингибитора пути TH2, например, где периостин представляет собой биомаркер для выбора пациентов.
В данном описании приведены примеры нарушений, которые можно диагностировать с помощью антитела по настоящему изобретению.
В некоторых воплощениях изобретение предлагает меченые антитела против периостина. Метки включают, без ограничения, метки или фрагменты, которые можно детектировать непосредственно (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые можно детектировать косвенно, например, как результат ферментативной реакции или молекулярного взаимодействия. Примеры меток включают, без ограничения, радиоизотопы 32P, 14C, 1251, 3H и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза жука-светляка и бактериальная люцифераза (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизозим, сахаридоксидазы, например, глюкозоксидаза, галактозоксидаза и глюкоза-6-фосфат дегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, присоединенные к ферменту, который использует пероксид водорода для окисления предшественника красителя, такому как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофагальные метки, стабильные свободные радикалы и т.п.
Фармацевтические композиции
Фармацевтические композиции, содержащие антитело против IL-13 или другой ингибитор пути TH2, описанные в данном документе, получают путем смешивания такого антитела или такой молекулы, имеющих желательную степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в виде лиофилизированных препаратов или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, без ограничения: буферы, например, на основе фосфорной, лимонной и других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетония хлорид; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG). Примеры фармацевтически приемлемых носителей в соответствии с настоящим изобретением включают средства, обеспечивающие внутритканевое распределение лекарства, такие как растворимые нейтрально-активные гликобелки, содержащие гиалуронидазу (sHASEGP), например, человеческие растворимые гликобелки PH-20, содержащие гиалуронидазу, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры sHASEGP и способы их применения, в том числе rHuPH20, описаны в патентных публикациях США №№ 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP объединяют с одной или несколькими другими глюкозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в патенте США № 6267958. Водные композиции антител включают композиции, описанные в патенте США № 6171586 и WO2006/044908, причем последние композиции содержат гистидин-ацетатный буфер.
Предлагаемая здесь композиция также может содержать несколько активных ингредиентов, если это необходимо для конкретного показания для лечения, предпочтительно активности таких ингредиентов дополняют друг друга и не оказывают неблагоприятного влияния друг на друга. Например, может быть желательно использовать контролирующее средство наряду с ингибитором пути TH2. Соответственно, такие активные ингредиенты присутствуют в сочетании в количествах, эффективных для предполагаемой цели.
Активные ингредиенты можно заключить в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризации, такие как гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (такие как липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно получить препараты с замедленным высвобождением. Походящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем указанные матрицы могут находиться в виде формованных изделий, таких как пленки или микрокапсулы.
Композиции, предназначенные для введения in vivo, обычно являются стерильными. Стерильности можно легко достичь, например, путем фильтрации через стерильные фильтрационные мембраны.
Терапевтические способы и композиции
Эозинофильное воспаление связано с рядом заболеваний, как аллергических, так и неаллергических (Gonlugur (2006) Immunol. Invest. 35(l):29-45). Воспаление представляет собой репаративный ответ живых тканей на повреждение. Признаком воспалительных реакций является накопление лейкоцитов в поврежденной ткани, обусловленное продукцией в такой ткани определенных химических веществ. Накопление эозинофильных лейкоцитов связано с широким рядом состояний, включающих аллергические нарушения, инфекции гельминтов и новообразования (Kudlacz et al., (2002) Inflammation 26:111-119). Эозинофильные лейкоциты, как компонент иммунной системы, являются защитными элементами поверхностей слизистой оболочки. Они отвечают не только на антигены, но и на паразиты, химические вещества и травмы.
Тканевая эозинофилия встречается при таких заболеваниях кожи, как экзема, пузырчатка, острая крапивница и токсический эпидермальный некролиз, а также при атопическом дерматите ([Rzany et al., 1996]). Эозинофилы накапливаются в ткани и истощают гранулярные белки при IgE-опосредованных аллергических кожных реакциях ([Nielsen et al., 2001]). Эозинофилы в сочетании с тучными клетками, по всей вероятности, вызывают воспаление суставов (Miossec et al., 1997). Эозинофильное воспаление иногда сопутствует травме сустава. Эозинофилия синовиальной жидкости может быть связана с такими заболеваниями, как ревматоидный артрит, паразитарное заболевание, гиперэозинофильный синдром, болезнь Лима и аллергические процессы, а также гемартроз и артрография ([Atanes et al., 1996]). Эозинофильное воспаление также может оказывать влияние на кости ([Yetiser et al., 2002]). Примеры эозинофильной мышечной болезни включают эозинофильный перимиозит, эозинофильный полимиозит и очаговый эозинофильный миозит ([Lakhanpal et al., 1988]). Эозинофильные воспаления, поражающие скелетные мышцы, могут быть связаны с паразитарными инфекциями или лекарственными средствами, или они могут являться признаками некоторых системных нарушений, связанных с гиперэозинофилией (таких как идиопатический гиперэозинофильный синдром и синдром эозинофилии-миалгии). Эозинофилы участвуют в воспалительном ответе на эпитопы, распознаваемые аутоиммунными антителами ([Engineer et al., 2001]). Заболевания соединительной ткани могут приводить к нейтрофильным, эозинофильным или лимфоцитарным сосудистым воспалениям ([Chen et al., 1996]). Эозинофилия тканей и периферической крови может наблюдаться при острых ревматических заболеваниях. Повышение сывороточных уровней ECP при анкилозирующем спондилите, заболевании соединительной ткани, свидетельствует о том, что эозинофилы также участвуют в процессах, лежащих в основе этого заболевания (Feltelius et al., 1987). Гранулематоз Вегенера может иногда сопровождаться легочными узелками, плевральным выпотом и эозинофилией периферической крови ([Krupsky et al., 1993]).
Эозинофилия периферической крови, при которой содержание эозинофилов составляет, по меньшей мере, 400/мм3, может встречаться в 7% случаев системного склероза, 31% случаев очаговой склеродермии и 61% случаев атонического фасциита ([Falanga and Medsger, 1987]). Склеродермия сопровождается воспалительным процессом, очень напоминая сплетения Мейснера и Ауэрбаха, и характеризуется присутствием тучных клеток и эозинофильных лейкоцитов в желудочно-кишечной системе. Продуцируемые эозинофилами нейротоксины могут вносить вклад в нарушение моторики желудочно-кишечного тракта, встречающееся при склеродермии ([de Schryver Kecskemeti и Clouse, 1989]).
Эозинофилы могут сопровождать локальную ([Varga и Kahari, 1997]) или системную ([Bouros et al., 2002]) пролиферацию соединительной ткани. Они могут стимулировать развитие фиброза путем ингибирования деградации протеогликана в фибробластах ([Hernnas et al., 1992]), а фибробласты опосредуют выживание эозинофилов путем секреции GM-CSF ([Vancheri et al., 1989]). Эозинофилы можно обнаружить в тканях назальных ([Bacherct et al., 2001]), бронхиальных ([Arguelles и Blanco, 1983]) и желудочно-кишечных полипов ([Assarian и Sundareson, 1985]). Подобным образом, эозинофилы могут локализоваться в воспалительных псевдоопухолях (миофибробластные опухоли). Эозинофилы часто сопровождают воспалительные псевдоопухоли в области глазницы, которые могут имитировать ангионевротический отек или аллергический риноконъюнктивит ([Li et al., 1992]).
Эозинофильное воспаление можно обнаружить при травме ткани (например, являющейся результатом хирургического вмешательства или повреждения). Эозинофильное воспаление также может быть связано с сердечно-сосудистыми заболеваниями (такими как эозинофильный миокардит, эозинофильный коронарный артериит, ишемическая болезнь сердца, острый инфаркт миокарда, разрыв сердца). Некротические воспалительные процессы также могут включать в эозинофильное воспаление (полимиозит, рассечение коронарной артерии, некротизирующие повреждения при нейро-болезни Бехчета, деменция, церебральный инфаркт).
Настоящее изобретение предлагает способы идентификации пациентов, положительных по эозинофильному воспалению (EIP), которые теоретически могут отвечать на лечение ингибитором пути TH2 (или которые являются чувствительными к такому лечению), путем измерения уровней общего периостина в сыворотке пациента.
Настоящее изобретение также предлагает способы лечения астмы, эозинофильного расстройства, расстройства, опосредованного IL-13, IL4-опосредованного расстройства, IL9-опосредованного расстройства, IL5-опосредованного расстройства, IL33-опосредованного расстройства, IL25-опосредованного расстройства, TSLP-опосредованного расстройства, расстройства, опосредованного IgE, или астма-подобных симптомов, включающие введение ингибитора пути TH2 пациенту, положительному по эозинофильному воспалению, где статус EIP диагностируют у пациента путем измерения уровней общего периостина в сыворотке пациента.
В некоторых воплощениях изобретение предлагает способы лечения астмы, эозинофильного расстройства, расстройства, опосредованного IL-13, IL-4-опосредованного расстройства или расстройства, опосредованного IgE, включающие введение лебрикизумаба пациенту, положительному по эозинофильному воспалению.
В некоторых воплощениях изобретение предлагает способы лечения астмы, эозинофильного расстройства, расстройства, опосредованного IL-13, IL-4-опосредованного расстройства или расстройства, опосредованного IgE, включающие введение 125-500 мг единообразной дозы лебрикизумаба каждые 4 недели пациенту, страдающему от указанного нарушения.
Изобретение также предлагает способы лечения астмы (или респираторного заболевания), включающие введение терапевтически эффективного количества лебрикизумаба астматическому пациенту, где лечение приводит к относительному изменению FEV1, превышающему 5%. В другом воплощении изменение FEV1 составляет более 6%, 7%, 8%, 9% или 10%. В другом воплощении статус EIP диагностируют у пациента с помощью анализа общего периостина. В другом воплощении диагностику астматического пациента проводят путем анализа общего периостина в сыворотке.
В некоторых воплощениях изобретение предлагает способы лечения астмы (или респираторного заболевания), включающие введение терапевтически эффективного количества лебрикизумаба астматическому пациенту, где лечение приводит к уменьшению частоты обострений более чем на 35% (в других воплощениях более чем на 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, вплоть до 85%; другое воплощение относится к пациенту, у которого диагностирован статус EIP).
В некоторых воплощениях изобретение предлагает способы лечения астмы (или респираторного заболевания), включающие введение терапевтически эффективного количества лебрикизумаба астматическому пациенту, где лечение приводит к уменьшению ночных пробуждений. В одном воплощении диагностику пациента проводят путем измерения уровней общего периостина в сыворотке пациента. В другом воплощении астма пациента не контролируется кортикостероидом. В другом воплощении у пациента диагностируют статус EIP.
Изобретение также предлагает способы лечения астмы (или респираторного заболевания), включающие введение терапевтически эффективного количества лебрикизумаба астматическому пациенту, где лечение приводит к улучшению контролирования астмы. В одном воплощении диагностику пациента проводят путем измерения уровней общего периостина в сыворотке пациента. В другом воплощении астма не контролируется введением кортикостероида. В другом воплощении у пациента диагностируют статус EIP.
Изобретение предлагает способы лечения астмы (или респираторного заболевания), включающие введение терапевтически эффективного количества лебрикизумаба астматическому пациенту, где лечение приводит к уменьшению воспаления в легких. В одном воплощении диагностику пациента проводят путем измерения уровней общего периостина в сыворотке пациента. В другом воплощении астма не контролируется введением кортикостероида. В другом воплощении у пациента диагностируют статус EIP.
В некоторых воплощениях изобретение предлагает способы лечения эозинофильного расстройства у пациента, страдающего от эозинофильного расстройства и получающего лечение кортикостероидом, которые включают введение терапевтически эффективного количества лебрикизумаба астматическому пациенту, где лечение позволяет уменьшить или устранить введение кортикостероида (количества или частоты), используемого для лечения заболевания. В одном воплощении диагностику пациента проводят путем измерения уровней общего периостина в сыворотке пациента. В другом воплощении астма у пациента не контролируется кортикостероидом. В другом воплощении у пациента диагностируют статус EIP перед началом лечения.
Изобретение также предлагает способы лечения пациента, страдающего от астмы (или респираторного заболевания), включающие диагностику у пациента статуса EIP с помощью общего анализа периостина, введение астматическому пациенту терапевтически эффективного количества ингибитора пути TH2, диагностику у пациента статуса EIP и повторное лечение пациента ингибитором пути TH2, если статус EIP подтверждается. Диагноз проводят с помощью анализа общего периостина, используемого отдельно или в сочетании с определением уровней FENO, и, необязательно, других маркеров, выбранных из: CST1, CST2, CCL26, CLCA1, PRR4, PRB4, SERPINB2, CEACAM5, iNOS, SERPINB4, CST4 и SERPINB10. В следующем воплощении у пациента, подлежащего лечению, помимо повышенных уровней экспрессии периостина, как описано в данном документе, наблюдается уровень FENO, превышающий 21 часть на миллиард. В другом воплощении у пациента, подлежащего лечению, помимо повышенных уровней экспрессии периостина, как описано в данном документе, наблюдается уровень FENO, превышающий 35 частей на миллиард.
В некоторых воплощениях изобретение предлагает способы идентификации пациентов, отрицательных по эозинофильному воспалению (EIN), включающие стадию измерения уровней общего периостина у пациента и детекцию у пациента статуса EIN.
Любой из ингибиторов пути TH2, предлагаемых в настоящем описании, можно использовать в описанных здесь терапевтических способах, особенно, для лечения астмы. В одном воплощении астматического пациента лечат кортикостероидом, и диагностируют его, как чувствительного к ингибитору пути TH2, с помощью описанного здесь анализа периостина. В следующем воплощении астматический пациент страдает от умеренной или тяжелой астмы. В другом воплощении пациент страдает от легкой астмы, но получает лечение кортикостероидом.
Антитело по данному изобретению (и любое другое терапевтическое средство) можно вводить любым подходящим способом, включающим парентеральное, внутрилегочное, интраназальное введение и, если это необходимо для местного лечения, введение в участок повреждения. Парентеральные инфузии можно осуществлять путем внутримышечного, внутривенного, внутриартериального, внутрибрюшинного или подкожного введения. Лекарственное средство можно вводить любым подходящим способом, который включает инъекции, такие как внутривенные или подкожные инъекции, и отчасти зависит от того, является ли введение кратковременным или постоянным. Настоящее изобретение охватывает разные схемы введения лекарственных препаратов, включающие, без ограничения, однократное или многократное введение в течение разных периодов времени, болюсное введение и импульсную инфузию.
Антитела по данному изобретению можно включать в состав композиции, дозировать и вводить с помощью способов, согласующихся с успешной медицинской практикой. Факторы, учитываемые в данном контексте, включают конкретный вид расстройства, подлежащего лечению, конкретный вид млекопитающего, подлежащего лечению, клиническое состояние отдельного пациента, причину расстройства, участок доставки средства, способ введения, схему введения и другие факторы, известные практикующим врачам. Антитело необязательно может входить в состав композиции вместе с одним или несколькими средствами, используемыми в настоящее время для профилактики или лечения указанного заболевания. Эффективное количество таких других средств зависит от количества антитела, присутствующего в композиции, типа расстройства или лечения и других, описанных выше факторов. Как правило, их используют в дозах, указанных в данном описании, и с помощью описанных здесь способов введения, или в количестве, составляющем примерно от 1 до 99% от указанных здесь доз, или в любой дозировке и с помощью любого способа, подобранных эмпирически/клинически.
Дозировка антитела по настоящему изобретению (используемого отдельно или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), подходящая для профилактики или лечения заболевания, зависит от типа заболевания, подлежащего лечению, типа антитела, тяжести и течения заболевания, цели (профилактической или терапевтической) введения антитела, предыдущей терапии, клинической истории пациента, чувствительности к антителу и предписания лечащего врача. Антитело можно вводить пациенту однократно или в несколько приемов. В зависимости от типа и тяжести заболевания, в качестве исходной подходящей дозы пациенту можно вводить примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг - 10 мг/кг) антитела, например, в один или несколько приемов, или путем непрерывной инфузии. Типичная суточная доза может варьировать примерно от 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. В случае многократного введения в течение нескольких дней или дольше, в зависимости от состояния, лечение, как правило, проводят до достижения желательной степени подавления симптомов заболевания. Типичная доза антитела находится в диапазоне примерно от 0,05 мг/кг до 10 мг/кг. Таким образом, пациенту можно вводить одну или несколько доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или их любое сочетание). Такие дозы можно вводить через определенные интервалы времени, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал примерно от двух до двенадцати, или, например, примерно шесть доз антитела). Однако можно использовать и другие режимы дозирования. Результаты данной терапии можно легко отслеживать с помощью традиционных методов и анализов.
В некоторых воплощениях антитело по данному изобретению вводят в виде единообразной дозы (т.е., не зависящей от массы), составляющей 37,5 мг, или в виде единообразной дозы 125 мг, или в виде единообразной дозы 250 мг. В некоторых воплощениях дозу вводят путем подкожного введения каждые 4 недели в течение определенного периода времени. В некоторых воплощениях период времени составляет 6 месяцев, один год, два года, пять лет, десять лет, 15 лет, 20 лет, или в течение всей жизни пациента. В некоторых воплощениях астма представляет собой тяжелую астму, а состояние пациента неадекватно контролируется или не контролируется ингаляционными кортикостероидами в сочетании со вторым контролирующим лекарственным средством. В другом воплощении для описанного выше лечения антителом против IL-13 выбирают пациента, у которого диагностируют статус EIP с помощью общего анализа периостина. В другом воплощении способ включает лечение астматического пациента антителом против IL-13, как описано выше, если у пациента предварительно диагностируют статус EIP с помощью общего анализа периостина. В одном воплощении возраст астматического пациента составляет 18 лет или старше. В одном воплощении возраст астматического пациента составляет от 12 до 17 лет, а антитело против IL-13 вводят в виде единообразной дозы 250 мг, или в виде единообразной дозы 125 мг. В одном воплощении возраст астматического пациента составляет от 6 до 11 лет, а антитело против IL-13 вводят в виде единообразной дозы 125 мг.
Следует понимать, что во всех вышеописанных композициях или терапевтических способах можно использовать иммуноконъюгат по данному изобретению вместо или помимо антитела против мишени, или антитела против периостина.
Промышленные изделия
В другом аспекте настоящее изобретение предлагает промышленное изделие, содержащее вещества, которые можно использовать для лечения, профилактики и/или диагностики описанных выше расстройств. Промышленное изделие включает контейнер и этикетку, или вкладыш в упаковку, находящийся на контейнере или присоединенный к контейнеру. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешки для растворов для в.в. введения и др. Контейнеры могут быть изготовлены из разных материалов, таких как стекло или пластмасса. Контейнер содержит композицию саму по себе, или в сочетании с другой композицией, эффективной для лечения, профилактики и/или диагностики состояния, кроме того, он может содержать стерильное входное отверстие (например, контейнер может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, которую можно проткнуть иглой для подкожных инъекций). По меньшей мере одно активное средство, входящее в состав композиции, представляет собой антитело по данному изобретению. Этикетка или вкладыш в упаковку указывает на то, что композицию следует использовать для лечения определенного состояния. Кроме того, промышленное изделие может содержать (a) первый контейнер, содержащий композицию, в состав которой входит антитело по данному изобретению; и (b) второй контейнер, содержащий композицию, в состав которой входит другое цитотоксическое или иное терапевтическое средство. Промышленное изделие в данном воплощении настоящего изобретения может дополнительно содержать вкладыш в упаковку, указывающий на то, что композиции можно использовать для лечения конкретного состояния. Альтернативно, или дополнительно, промышленное изделие также может включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно содержать другие вещества, желательные с коммерческой и пользовательской точки зрения, включающие другие буферы, разбавители, фильтры, иглы и шприцы.
Следует понимать, что все вышеописанные промышленные изделия могут содержать иммуноконъюгат по данному изобретению вместо или помимо антитела против мишени, или антитела против периостина.
ПРИМЕРЫ
ПРИМЕР 1 - Клиническое исследование с иммунизацией аллергеном
Фаза II рандомизированного двойного слепого исследования с использованием плацебо в качестве контроля; 5 мг/кг лебрикизумаба:плацебо (в отношении 1:1) вводят подкожно каждые 4 недели в течение 12 недель. Краткое описание схемы эксперимента приведено в таблице 2 и на фигуре 1. Мерой первичного результата является индуцированный аллергеном поздний астматический ответ (LAR) на 13 неделе. Пациентам вводят аллерген и затем, через 18-24 часа, метахолин в процессе скрининга и на 13 неделе. Также анализируют сывороточные биомаркеры, чтобы продемонстрировать ингибирование пути IL-13 и идентифицировать пациентов с повышенным улучшением в результате введения лебрикизумаба.
В исследовании участвуют пациенты возрастом 18-55 лет, страдающие от легкой астмы со следующими признаками: (a) положительная кожная реакция (> или = 3 мм по сравнению с отрицательным контролем) при анализе на клещей домашней пыли, кошачью перхоть или пыльцу; (b) объем выдыхаемого воздуха в 1 секунду (FEV1) > или = 70% от теоретического; и (c) ранний астматический ответ > или = 20% уменьшению FEV1 через 5-30 минут после иммунизации аллергеном, и поздний астматический ответ (LAR) > или = 15% уменьшению FEV1 через 2-8 часов после иммунизации.
Двадцать восемь пациентов участвуют в определении первичного конечного результата (n=16 получающих плацебо, 12 получающих лебрикизумаб). На 13 неделе лебрикизумаб ингибирует LAR. Среднее значение AUC (площадь под кривой) для FEV1 через 2-8 часов после иммунизации аллергеном (LAR) у пациентов, получающих лебрикизумаб, уменьшается на 48% по сравнению с плацебо (26,3% по сравнению с 50,5%; 95% CI: -19 до 90%), при этом влияние на ответ ранней фазы (EAR) на 13 неделе отсутствует. Среднее значение AUC для FEV1 и максимальное уменьшение FEV1 через 0-2 часа после иммунизации аллергеном подобны в группах, получающих лебрикизумаб и плацебо (27,5% и 26,4% для обоих параметров; таблица 3). См. также фигуру 2. Среди групп, получающих лебрикизумаб и плацебо, отсутствует значительное различие в гиперчувствительности дыхательных путей в ответ на метахолин. Среднее арифметическое от удвоенной дозы метахолина в группе, получающей лебрикизумаб, на 0,33 удвоенных доз выше, чем в группе, получающей плацебо (1,58 по сравнению с 1,25, 95% CI -0,64 до 1,3), что не считается клинически значимым ингибированием.
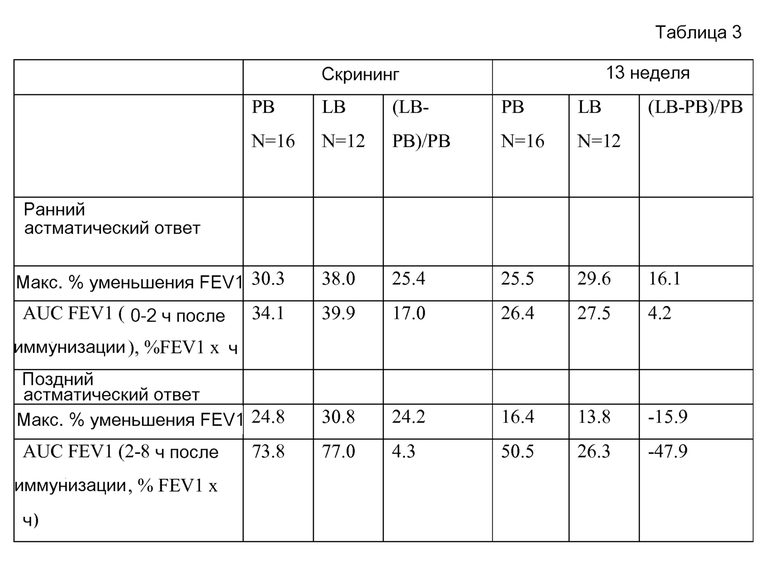
Лечение лебрикизумабом явно оказывает системное влияние на маркеры воспаления Th2, где среднее, скорректированное по плацебо, уменьшение сывороточных уровней IgE, MCP-4/CCL13 и TARC/CCL17 составляет 24%, 25% и 26%, соответственно (P<0,01). См. фигуры 3A и 3B. Сывороточные уровни периостина после лечения немного уменьшаются (5-10%). Сывороточные уровни IL-13 после лечения, чаще всего, ниже уровня детекции (<150 пг/мл). На фигуре 3C показано уменьшение уровней IgE, CCL13 и CCL17 на 13 неделе у отдельных пациентов по сравнению с исходными уровнями указанных маркеров. Как правило, уровни периостина, YKL-40, CEA и эозинофилов крови значительно не изменяются после лечения лебрикизумабом (данные не показаны).
У субъектов с исходными уровнями эозинофилов периферической крови, сывороточного IgE или сывороточного периостина, превышающими средние уровни указанных маркеров, наблюдается более сильное, плацебо-скорректированное лебрикизумаб-зависимое, уменьшение LAR, чем у субъектов, у которых исходные уровни указанных биомаркеров ниже среднего значения. См. фигуру 4.
Пациентов подразделяют на группы "с высоким уровнем биомаркеров" или "с низким уровнем биомаркеров" в зависимости от того, выше или ниже средних уровней исходные уровни воспалительных биомаркеров, включающих: сывороточный IgE, CLL13, CCL17, CEA, периостин, YKL-40 и эозинофилы периферической крови. Как показано на фиг. 4, результаты, полученные для сывороточного IgE, эозинофилов и периостина, свидетельствуют о том, что пациенты с повышенным (по сравнению со средним уровнем) исходным уровнем сывороточного IgE, периостина или эозинофилов периферической крови с большей вероятностью отвечают на блокаду IL-13 (например, под действием лебрикизумаба).
Таким образом, исследование соответствует конечному результату: 48% уменьшение (90% CI [-19%, 90%)]) среднего значения AUC поздней фазы. Лебрикизумаб значительно снижает LAR по сравнению с плацебо. Среди результатов исследования безвредности сигнал безопасности отсутствует. Терапевтическая блокада IL-13 может приводить к эффективному лечению аллергической астмы, особенно, у пациентов с повышенными уровнями маркеров TH2 воспаления дыхательных путей.
ПРИМЕР 2 - Клиническое исследование I астматических пациентов
Рандомизированное, двойное слепое исследование с плацебо в качестве контроля проводят для определения влияния лебрикизумаба на пациентов, страдающих от астмы, которая неадекватно контролируется или не контролируется хронической терапией ICS. Пациенты продолжают получать стандартное лечение, которое включает ингаляционные кортикостероиды (ICS) и дополнительно может включать LABA. Данное исследование проводят в двух группах, где пациентов случайным образом распределяют на получающих лебрикизумаб или плацебо в течение 6 месяцев. В течение 14-20-дневного вводного периода (от визита 1 до визита 3) пациенты выражают согласие на ICS и демонстрируют способность использовать оборудование, необходимое для ежедневного мониторинга результатов лечения на протяжении всего исследования. Затем пациентов оценивают на соответствие требованиям исследования и случайным образом распределяют (1:1) для исследования лекарственного препарата (лебрикизумаб или плацебо) со стратификацией на основе статуса суррогатного профиля IL-13 (подробно описанного ниже), применения LABA и участка исследования. Первую ПК дозу вводят в течение 24 часов после случайного распределения (в 1 день исследования, т.е. в день случайного распределения, независимо от даты первого введения исследуемого лекарственного средства). Введение исследуемого лекарственного средства повторяют каждые 4 недели в течение последующих 20 недель (всего шесть доз исследуемого лекарственного средства в случае 24-недельного периода лечения). Эффективность лебрикизумаба анализируют в течение периода лечения.
Исследуемое лекарственное средство вводят выбранным пациентам путем подкожной (ПК) инъекции в следующие моменты времени: 1 день и на 4, 8, 12, 16 и 20 недели. Каждая доза лебрикизумаба составляет 250 мг. Каждая доза плацебо представляет собой 2 мл такой же жидкости без лебрикизумаба. ПК инъекции вводят в руку, бедро или брюшную полость. Схематическое изображение данного исследования можно найти на фигуре 5.
Первичный анализ проводят после лечения всех (примерно 200) пациентов в течение 24 недель после случайного распределения (1 день). На протяжении всего исследования анализируют безопасность лечения. После введения конечной дозы (20 неделя) исследуемого лекарственного средства пациентов наблюдают в течение еще 12 недель; первые 4 недели после введения конечной дозы считаются частью периода лечения (24-недельного), и последние 8 недель составляют период наблюдения. 8-Недельный период наблюдения, наряду с последними 4 неделями периода лечения, позволяет наблюдать за пациентами в течение 3-4 периодов полужизни лекарства после введения последней дозы. Следовательно, пациенты участвуют в исследовании в общей сложности в течение примерно 34 недель. См. фигуру 5. Идентифицируют пациентов, поддающихся оценке эффективности (n=180), в целях принятия решения исключить субъектов по двум причинам: (1) не являются частью целевой популяции по ключевым характеристикам и (2) недостоверный исходный уровень FEV1, на основе которого измеряют эффект лечения. Исходные характеристики пациентов, участвующих в данном испытании, приведены на фигуре 6.
Относительное изменение FEV1 по сравнению с исходным уровнем на 12 неделе или у пациентов с положительным статусом по суррогатному профилю IL-13.
Частота обострений астмы в течение 24-недельного периода.
Основной критерий включения определяется следующими факторами: способность проводить спирометрию во время 1-3 визитов в качестве специфического для исследования ручного теста легочных функций (PFT); рентгеновские снимки грудной клетки, полученные в течение 12 месяцев после 1 визита, не показывают наличия клинически значимых аномалий; способность пополнять материалы исследования, определяемая по согласию вести дневник и измерять PEF в промежутке между 1-3 визитами; неконтролируемую астму идентифицируют по следующим критериям:
- диагноз астма >12 месяцев
- бронходилататорный ответ во время 1 или 2 визита
- пребронходилататорный FEV1 ≥40% и ≤80%, как прогнозируется во время 1 и 3 визитов
- применение ICS ≥200 мкг и ≤1000 мкг общей суточной дозы флутиказона пропионата (FP) или его эквивалента в течение, по меньшей мере, 6 последовательных месяцев перед 1 визитом
- во время 3 визита оценка по анкетному опросу контроля за астмой (ACQ) >1,5, несмотря на прием ICS.
Основной критерий исключения определяется следующими факторами:
Медицинские состояния:
- Обострение астмы, значительная обструкция дыхательных путей или респираторная инфекция во время 1-3 визитов
- Известное злокачественное заболевание или проводимое в текущий момент обследование на возможное злокачественное заболевание
- Известный иммунодефицит, включающий, без ограничения, инфекцию ВИЧ
- Существующая болезнь легких, отличная от астмы, включающая активные инфекции
- Неконтролируемое клинически значимое медицинское заболевание
Зависимости:
- Курение в текущий момент или ранее с периодом срока курения >10 пачко-лет
- Запрещенные сопутствующие лекарственные средства (стероиды, отличные от ICS, бронходилататоры кратковременного действия, отличные от SABA, иммуномодулирующие средства)
- Беременность или отсутствие согласия на применение высокоэффективной контрацепции
Вследствие практической сложности измерения IL-13 в самом легком в качестве суррогатной меры используют уровни эозинофилов и IgE в периферической крови, обозначаемые как "суррогатный профиль IL-13". Пациентов, положительных по суррогатному профилю IL-13, идентифицируют как пациентов с общим уровнем IgE>100 м.ед./мл и эозинофилов крови >0,14×10xe9 клеток/л, тогда пациенты, отрицательные по суррогатному профилю IL-13, имеют общий уровень IgE<100 м.ед./мл и эозинофилов крови <0,14×10xe9 клеток/л. Критерий, включающий уровни IgE и эозинофилов, которые определяют статус пациентов по суррогатному профилю IL-13, устанавливают с участием астматических пациентов, у которых индуцированная экспрессия гена IL-13 в бронхиальном эпителии (профиль IL-13) коррелирует с уровнями IgE и эозинофилов в периферической крови (Corren et al., N Engl J Med 365:1088-1098 [2011]).
Эффективность лебрикизумаба оценивают путем проведения нескольких измерений астматической активности, включающей легочную функцию (т.е. FEV1, максимальный поток с учетом его вариабельности, ответ на метахолин в некоторых участках, парциальное давление оксида азота в выдыхаемом воздухе [FENO]) и меры активности или подавления заболевания (т.е. эффекты, отмечаемые пациентами [PRO], применение резервной терапии, частота обострений). Изменение FEV1 представляет собой первичный эффект. Для фармакодинамических анализов после лечения лебрикизумабом используют следующие маркеры: TARC (CCL17), MCP-4 (CCL13) и IgE.
Мера первичного эффекта действия
Мерой первичного эффекта действия является относительное изменение пребронходилататорного FEV1 (объем) по сравнению с исходным уровнем до 12 недели.
Меры вторичного эффекта действия
В качестве мер вторичного эффекта действия используют следующие параметры: относительное изменение пребронходилататорного FEV1 (объем) по сравнению с исходным уровнем до 24 недели; относительное изменение пребронходилататорного FEV1 (объем) по сравнению с исходным уровнем до 12 недели у пациентов с положительным статусом по суррогатному профилю IL-13; изменение оценки по анкетному опросу контроля за астмой (ACQ) по сравнению с исходным значением до 12 недели; изменение оценки симптомов астмы, определяемой с помощью ежедневного дневника по контролю за астмой (ACDD), по сравнению с исходным значением до 12 недели; изменение утреннего значения пребронходилататорного максимального потока по сравнению с исходным значением до 12 недели; частота обострений астмы в течение 24-недельного периода лечения; частота тяжелых обострений астмы в течение 24-недельного периода лечения; изменение применения резервной терапии (измеряемое по числу впрыскиваний в день резервного лекарственного средства или ингаляционного резервного лекарственного средства) по сравнению с исходным значением до 12 недели.
Диагностические меры:
Определяют следующие меры диагностического эффекта: изменение числа дней в неделю с хорошо контролируемой астмой, измеряемое с помощью ACDD по сравнению с исходным значением до 12 недели; изменение частоты ночных пробуждений, обусловленных астмой, в течение недели по сравнению с исходным значением до 12 недели; изменение уровней FENO по сравнению с исходным значением до 12 недели.
Исходные наблюдения
В данном исследовании пациентов с плохо контролируемой астмой лечение лебрикизумабом связано со статистически значимым улучшением пребронходилататорного FEV1, переменной первичного эффекта. Улучшение FEV1 наблюдается вскоре после начала лечения, указывая на то, что ингибирование IL-13 относительно быстро оказывает влияние на величину потока воздуха. Хотя лечение лебрикизумабом не приводит к статистически значимому уменьшению протокольных и тяжелых обострений, определенному с помощью анализа периостина Elecsys® (описанного ниже, вследствие получения значений, непригодных для участия в анализе), наблюдается тенденция к уменьшению частоты тяжелых обострений, особенно, у пациентов с высоким уровнем периостина. Однако по данным описанного ниже анализа E4 лечение лебрикизумабом приводит к статистически значимому уменьшению протокольных и тяжелых обострений (84% в подгруппе с высоким уровнем периостина (95% CI 14%, 97%, p=0,03). См. также ниже. Кроме того, анализ FENO в подгруппах показывает статистически значимое уменьшение при тяжелых обострениях (p=0,04). Лечение лебрикизумабом не приводит к улучшению симптомов астмы по результатам симптоматической версии ACQ5 (которая исключает применение резервного SABA и FEV1) или по показаниям ежедневного дневника.
Уменьшение в сыворотке уровней хемокинов Th2, CCL13 и CCL17, а также IgE, подтверждает лебрикизумаб-опосредованный биологический эффект, который лежит в основе клинического результата, измеряемого в дыхательных путях. Небольшое увеличение числа эозинофилов в крови согласуется с общим уменьшением направленной миграции эозинофилов из крови в компартмент легких после ингибирования эозинофил-притягивающих хемокинов. Уменьшение FENO под действием лебрикизумаба согласуется с данным предположением. Однако лебрикизумаб скорее может приводить к снижению FENO путем косвенного ингибирования экспрессии синтазы оксида азота посредством блокады IL-13, чем к изменению эозинофильного воспаления (которое также предположительно влияет на FENO).
Критерий пригодности пациента для данного исследования включает восстановление, по меньшей мере, 12% до 400 мкг альбутерола (без применения SABA в течение, по меньшей мере, 4 часов и без применения LABA в течение, по меньшей мере, 12 часов перед визитами). Это гарантирует, что существует возможность общего относительного изменения легочной функции у пациентов, по меньшей мере, на 10%. Данный простой клинический тест может ограничить возможность распространения полученных результатов на неотобранные, более широкие популяции астматических пациентов. Действительно, наиболее частой причиной непригодности пациента является неспособность пройти данный тест (у 92 из 263 пациентов, не прошедших скрининг).
В данном исследовании авторы вначале выдвигают гипотезу, что сочетание высокого уровня IgE в сыворотке и высокого числа эозинофилов в крови является суррогатным показателем для идентификации пациентов с повышенной экспрессией IL-13-родственных генов в легких (суррогатный профиль IL-13, или высокий Th2). Хотя еще не были получены данные, необходимые для назначения лечения, авторы составили план статистического анализа для применения дифференцировки на основе уровней сывороточного периостина. Как более подробно описано ниже, данный анализ в подгруппах демонстрирует, что эффективность лечения лебрикизумабом выше у пациентов с высоким уровнем периостина, чем у пациентов с низким уровнем периостина, о чем свидетельствует как более значительное увеличение FEV1, так и более сильное снижение FENO, а также тест значительного взаимного влияния. Указанные факты позволяют предположить, что описанный ранее маркер, сывороточный периостин, потенциально можно использовать для отбора астматических пациентов, являющихся более чувствительными к лечению лебрикизумабом.
Исходные характеристики пациентов, участвующих в исследовании, показаны на фигуре 6. Если не указано иначе, числа представляют собой средние значения (SD). Высокий уровень периостина относится к пациентам с исходным уровнем периостина выше 23 нг/мл в соответствии с описанным ниже анализом E4. Низкий уровень периостина относится к пациентам с исходным уровнем периостина ниже 23 нг/мл в соответствии с описанным ниже анализом E4.
Относительные изменения FEV1 (литры) на 12 неделе и на 24 неделе (доверительный интервал 95%) у пациентов, получающих лечение, показаны на фигуре 7. По сравнению с пациентами, положительными по профилю IL-13, у периостин-положительных пациентов наблюдается более высокое относительное изменение FEV1.
На фигуре 7 показано, что скорректированное по плацебо относительное изменение FEV1 по сравнению с исходным уровнем до 12 недели для всех участников составляет 5,9% (95% CI 0,9%, 10,9%, p=0,2), а в подгруппе с высоким уровнем периостина - 10% (95% CI 2,5%, 17,5%, p=0,01)). Скорректированное по плацебо относительное изменение FEV1 по сравнению с исходным уровнем до 24 недели для всех участников составляет 4,8% (95% CI 0,3%, 9,3%, p=0,04), а в подгруппе с высоким уровнем периостина - 6,1% (95%> CI -1,4%, 13,6%, p=0,11). На фигуре 8 показано относительное изменение FEV1 на протяжении всего периода лечения (32 недели) для всех субъектов, подходящих для оценки эффективности (A), и только для субъектов с высоким уровнем периостина (B). Эффективность лебрикизумаба на 32 неделе лечения не уменьшает предположения, что можно уменьшить частоту введения лебрикизумаба.
Авторы также исследуют влияние лечения лебрикизумабом на постбронходилататорный FEV1 как диагностический эффект и косвенный суррогатный показатель ремоделирования дыхательных путей. Изменение постбронходилататорного FEV1 на 20 неделе измеряют после четырех ингаляций 100 мкг альбутерола. Среднее значение исходного, измеренного до введения лекарственного средства, уровня постбронходилататорного FEV1 составляет 2,50 литров (0,71) и 2,54 литра (0,73) в группах, получающих плацебо и лебрикизумаб, соответственно. Это соответствует 77,9% от теоретического значения в обоих группах. Общее скорректированное по плацебо изменение постбронходилататорного FEV1 составляет 4,9% (95% CI от 0,2% до 9,6%; p=0,04). В группе с высоким уровнем периостина лечение лебрикизумабом увеличивает постбронходилататорный FEV1 на 20 неделе (8,5%; 95% CI от 1,1% до 16%; p=0,03). Данные, свидетельствующие об улучшении постбронходилататорного FEV1 в группе с низким уровнем периостина, отсутствуют (1,8%; 95% CI от -4,1 до 7,7; p=0,55). Кроме того, лебрикизумаб повышает абсолютный уровень постбронходилататорного FEV1 в группе с высоким уровнем периостина (170 мл; 95% CI от 10 до 320 мл). Авторы делают вывод, что лебрикизумаб улучшает постбронходилататорный FEV1 у пациентов с неконтролируемой астмой, у которых наблюдается повышенное Th2-опосредованное воспаление дыхательных путей (высокий уровень периостина). Полученные результаты позволяют предположить, что лебрикизумаб может уменьшать ремоделирование дыхательных путей при астме.
На фигуре 9 показана частота обострений и частота тяжелых обострений, наблюдающихся на 24 неделе лечения. Частота обострений уменьшается на 37% у всех участников, получающих лебрикизумаб, по сравнению с группой, получающей плацебо (95% CI -22%, 67%, p=0,17) и на 61% в подгруппе с высоким уровнем периостина (95% CI -6%, 86%, p=0,07). Частота тяжелых обострений уменьшается на 51% (95% CI -33%, 82%, p=0,16) у всех участников и на 84% в подгруппе с высоким уровнем периостина (95% CI 14%, 97%, p=0,03). Авторы также определяют частоту тяжелых обострений на 32 неделе, в конце периода наблюдения, на 12 неделе после введения конечной дозы лебрикизумаба в популяции ITT. Как показано в таблице 10, частота тяжелых обострений у всех пациентов на 32 неделе значительно уменьшается на 50% у пациентов, получающих лебрикизумаб, по сравнению с плацебо (p=0,03). Самая низкая частота тяжелых обострений наблюдается у пациентов с высоким уровнем периостина, получающих лебрикизумаб (0,13); однако степень уменьшения по сравнению с плацебо не достигает статистически значимого значения в субанализах. Авторы делают вывод, что лебрикизумаб приводит к существенному снижению тяжелых обострений у пациентов, неадекватно контролируемых ICS. Максимальное уменьшение тяжелых обострений наблюдается у пациентов, имеющих высокий уровень периостина перед лечением. Для данного конечного результата важна продолжительность наблюдений с регистрацией событий, например, для детекции, по меньшей мере, 50% уменьшения примерно у 200 субъектов может понадобиться 32 недели наблюдений вместо 24 недель.
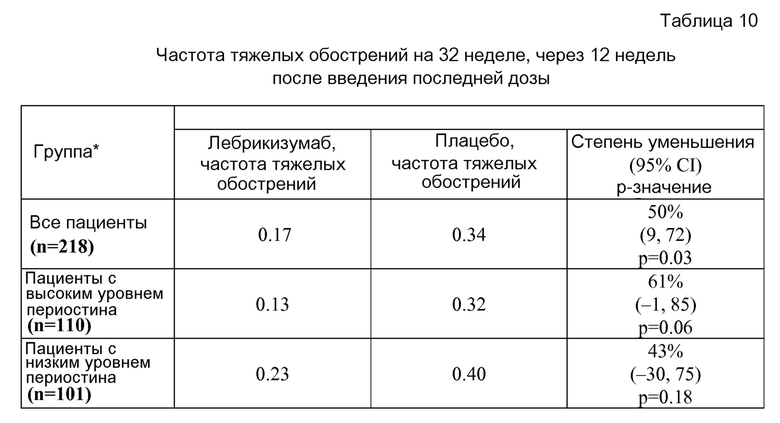
Лебрикизумаб удовлетворяет первичному конечному результату и эффективно снижает тяжелые обострения. Полученные результаты свидетельствуют о том, что статус пациента по периостину позволяет прогнозировать события обострений и, в меньшей степени, FEV1. Результаты подтверждают теоретические значения уровней периостина, необходимые для определения ответа на лечение лебрикизумабом. Например, по данным анализа E4, у пациентов с уровнями периостина в сыворотке или плазме ниже 20 нг/мл меньше вероятность развития улучшения после лечения лебрикизумабом, тогда как у пациентов с уровнями периостина в сыворотке или плазме выше 20 нг/мл больше вероятность развития улучшения после лечения лебрикизумабом. Более того, у пациентов с уровнями периостина в сыворотке или плазме выше 23 нг/мл (по данным анализа E4) вероятность развития улучшения после лечения лебрикизумабом еще выше.
Отмечаемые пациентами эффекты: значимые различия в ACQ и мини-AQLQ среди исследуемых групп не наблюдаются. После нескольких визитов наблюдаются некоторые различия в средних значениях результатов ACDD среди исследуемых групп по хорошо контролируемым дням, симптомам астмы, ночным пробуждениям и применению резервного лекарственного средства, причем все пациенты предпочитают лечение лебрикизумабом. Для всех конечных результатов ACDD (хорошо контролируемые дни, симптомы астмы, ночные пробуждения и применение резервного лекарственного средства), скорректированный по плацебо эффект лечения у субъектов с высоким уровнем периостина выше, чем у всех субъектов; однако среди исследуемых групп на 12 неделе статистически значимые различия отсутствуют.
Легочная функция: улучшение легочной функции (PEF) по сравнению с исходным уровнем наблюдают в большей части временных точек у всех субъектов, получающих лебрикизумаб, и во всех временных точках у субъектов с высоким уровнем периостина, получающих лебрикизумаб. У всех субъектов, получающих плацебо, во всех временных точках наблюдается ухудшение по сравнению с исходным уровнем.
Воспаление легких: снижение (улучшение) FENO наблюдается на протяжении всего исследования как у субъектов, получающих лебрикизумаб, так и в подгруппе с высоким уровнем периостина, тогда как у субъектов, получающих плацебо, наблюдается увеличение (ухудшение) FENO. Процентное изменение FENO на 12 неделе составляет -20,1% у субъектов, получающих лебрикизумаб (n=83), и 15% у субъектов, получающих плацебо (n=86) [p<0,01]. Процентное изменение FENO на 12 неделе составляет -24,2% у субъектов, получающих лебрикизумаб, и 17,5% у субъектов, получающих плацебо (n=44) [p<0,01]. Различия среди исследуемых групп на 12 неделе являются статистически значимыми. См. фигуру 10. В анализе post hoc высокий исходный уровень FENO также связан с эффективным улучшением FEV1, а низкая частота тяжелых обострений сравнима с группой, получающей плацебо. Однако авторы отмечают, что исходный уровень FENO характеризуется большей вариабельностью среди пациентов на протяжении вводного периода, чем уровень периостина (19,8% и 5,0%, соответственно).
Авторы также анализируют данные, чтобы определить, действительно ли у пациентов с низким уровнем периостина и высоким уровнем FENO наблюдается улучшение после лечения лебрикизумабом в той же степени, что и у пациентов с высоким уровнем периостина. На исходном уровне авторы наблюдают умеренную корреляцию между FENO и сывороточным периостином (rs=0,31, P<0,001; N=210 с совпадающими результатами). С использованием средних предельных значений статусы по периостину и FENO, как правило, перекрываются не полностью (таблица 11). В соответствии с результатами, приведенными в таблице 11, предельное значение для периостина составляет 25 нг/мл по данным описанного ниже анализа E4, предельное значение для FENO составляет 21 частей на биллион по данным стандартного метода, используемого в данной области. Определение FEV1 на основе комбинированного статуса по периостину и FENO свидетельствует о том, что в группе с высокими уровнями как периостина, так и FENO наблюдается более высокий скорректированный по плацебо эффект лебрикизумаба на 12 неделе (таблица 12). И наоборот, наблюдаемое в результате лечения улучшение в группе с низким уровнем периостина/высоким уровнем FENO является минимальным (2,3%, P=0,73). Таким образом, FENO не подходит для идентификации подгруппы пациентов с низким уровнем периостина, у которых может наблюдаться улучшение в результате лечения лебрикизумабом. Относительное значение уровней периостина и FENO, позволяющее прогнозировать ответ на лечение лебрикизумабом, определяют в следующем исследовании.

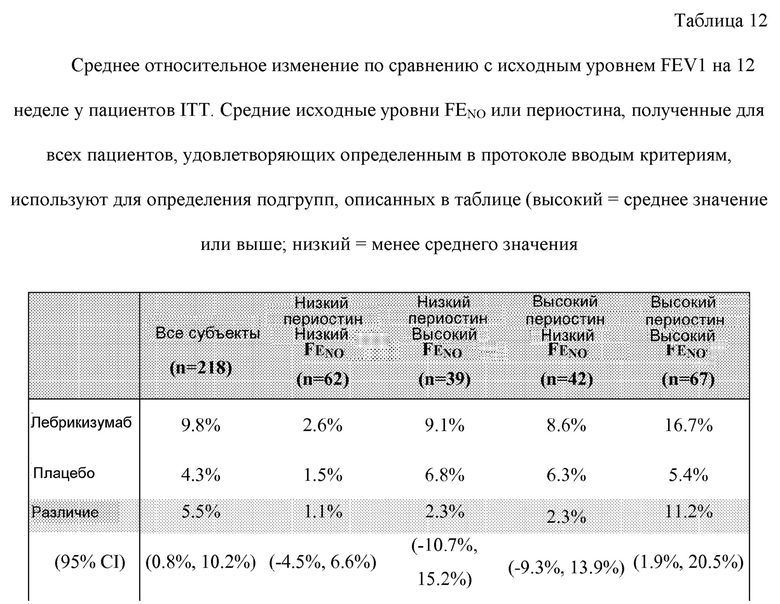
Фармакокинетические характеристики лебрикизумаба подобны характеристикам, наблюдаемым в предыдущих исследованиях. Масса тела оказывает влияние на фармакокинетические характеристики лебрикизумаба.
Некоторые маркеры анализируют на способность давать значение, позволяющее прогнозировать описанное выше улучшение лечения, помимо уровней сывороточного периостина или в качестве альтернативы этим уровням. Указанные маркеры включают CEA, IgE, TARC (CCL17) и MCP-4 (CCL13).
Кроме того, авторы выдвигают гипотезу, что избыточный уровень сывороточного периостина у астматических пациентов с высоким уровнем периостина обусловлен эффектами IL-13. Следовательно, аторы делают попытку проанализировать относительный вклад IL-13 в общие системные уровни периостина у пациентов с неконтролируемой астмой, получающих как плацебо, так и лебрикизумаб. В этих экспериментах сывороточный периостин измеряют с помощью анализа периостина Elecsys®, описанного в примере 7. Как показано на фигурах 18 и 19, авторы обнаружили, что у большей части пациентов (>90%) с низким исходным уровнем периостина данный уровень остается низким в обеих ветвях исследования (фиг. 18A), тогда как у 72% пациентов с высоким уровнем периостина, получающих плацебо, и у 40% пациентов, получающих лебрикизумаб, уровень периостина остается высоким на 12 неделе (фиг. 18B). Авторы делают вывод, что среди взрослых с неконтролируемой астмой, несмотря на введение ICS, у пациентов с высоким уровнем периостина наблюдается значительное уменьшение уровней сывороточного периостина после лечения лебрикизумабом по сравнению с плацебо, однако у пациентов с низким уровнем периостина существенное уменьшение уровня в ответ на лебрикизумаб отсутствует. Полученные данные позволяют предположить, что у пациентов с неконтролируемой астмой избыточный уровень сывороточного периостина обусловлен активностью IL-13, и что ингибирование IL-13 лебрикизумабом приводит к уменьшению уровней сывороточного периостина.
У четырех пациентов, получающих лебрикизумаб, наблюдаются серьезные побочные события (SAE) (обострения астмы [n=2], домашняя пневмония и травматический пневмоторакс, связанный с дорожно-транспортным происшествием). У шести пациентов, получающих плацебо, наблюдается семь SAE (обострения астмы [n=2], головная боль, истечение цереброспинальной жидкости после эпидуральной анестезии, опоясывающий лишай, опоясывающий герпес, острый гнойный менингит и привыкание к обезболивающим средствам). Результаты исследования безопасности данного испытания приведены на фигуре 11.
Общие частоты AE в обеих ветвях исследования являются практически одинаковыми (лебрикизумаб, 74,5%; плацебо, 78,6%), как и частоты серьезных AE (лебрикизумаб, 3,8%; плацебо, 5,4%) (таблица 9). Скелетно-мышечные события более часто встречаются в группе, получающей лебрикизумаб (лебрикизумаб, 13,2%; плацебо, 5,4%; P=0,045) (таблица 9). Двадцать пять пациентов (11,5%) преждевременно прекратили участие в исследовании, в том числе 12 пациентов, получающих плацебо, и 13 пациентов, получающих лебрикизумаб.
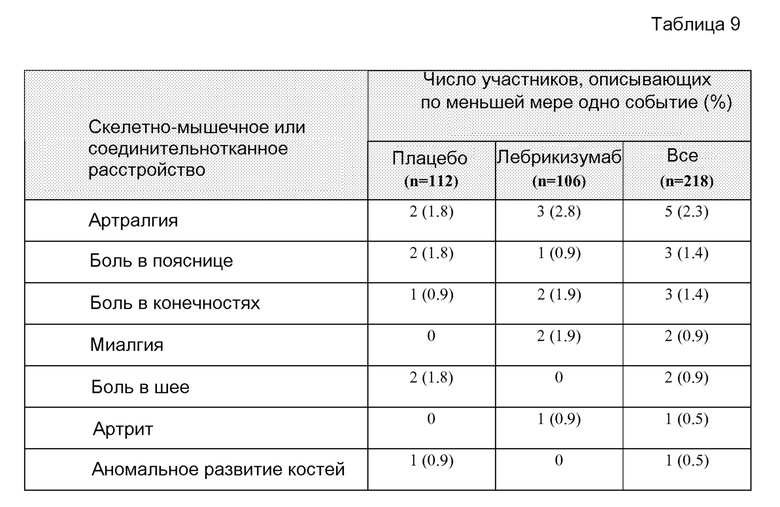
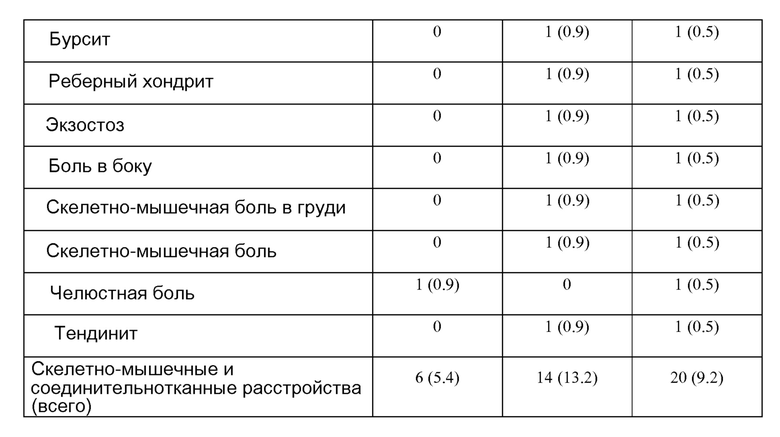
ПРИМЕР 3 - Исследование II астматических пациентов (исследование с целью определения оптимальной дозы)
Рандомизированное, двойное слепое, корректируемое по плацебо исследование с целью определения оптимальной дозы, включающее четыре ветви, проводят, чтобы дополнительно проанализировать взаимозависимость дозы лебрикизумаба и ответа с точки зрения эффективности и безопасности для пациентов, а также сопротивляемости пациентов с астмой, которые не получают ингаляционных кортикостероидов. Схема данного испытания приведена на фигуре 12. У отдельных пациентов наблюдается бронходилататорный ответ, составляющий по меньшей мере 15%, и пребронходилататорный FEV1 ≥60% и ≤85%, прогнозируемый стабильностью заболевания, демонстрируемой в течение вводного периода. Пациенты, выбранные для исследования, ранее подвергавшиеся лечению ICS, не должны принимать ICS в течение минимум 30 дней перед первым визитом в рамках исследования (1 визит). У исследования нет периода отказа; пациенты не должны быть лишены кортикостероидов с единственной целью стать участниками исследования.
С первой, связанной с исследованием, процедуры во время 1 визита начинается примерно 2-недельный вводный период. В течение вводного периода (визиты 1-3) оценивают контролирование астмы (измеряемое с помощью оценки по анкетному опросу контроля за астмой [ACQ]) и легочную функцию. Астму пациентов дополнительно характеризуют путем кожной скарификационной пробы и анализа соответствующих биомаркеров, включающих IgE и эозинофилы периферической крови. Уровни IgE и эозинофилов используют для классификации пациентов по статусу суррогатного профиля IL-13. В конце вводного периода подходящих пациентов случайным образом распределяют по группам (1:1:1:1), получающим одну из трех доз (500 мг, 250 мг или 125 мг) лебрикизумаба или плацебо путем ПК (подкожное) введения. Исследуемое лекарственное средство вводят четыре раза на протяжении 12-недельного периода лечения. После введения последней дозы исследуемого лекарственного средства пациентов наблюдают в течение дополнительного 8-недельного периода наблюдения. Следовательно, большая часть пациентов участвует в исследовании в общей сложности в течение примерно 22 недель после 1 визита и на протяжении указанного промежутка времени периодически получают образцы PK. Интенсивный отбор образцов PK проводят с использованием дополнительных образцов PK, полученных на протяжении периодов исследования и наблюдения, а также дополнительного образца PK, полученного через 16 недель после последнего введения исследуемого лекарственного средства, до завершения интенсивного отбора образцов PK у 70 субъектов. Таким образом, участие в исследовании пациентов из группы интенсивного отбора образцов PK продолжается в течение примерно 26 недель после 1 визита. Безопасность оценивают в течение исследования и заранее определяют пороговые значения для неудачного лечения, чтобы пациенты могли прекратить прием исследуемого препарата и возобновить стандартную терапию, если у них наблюдается клинически значимое ухудшение.
Исходные наблюдения
Эффективность: Скорректированное по плацебо относительное изменение (улучшение) FEV1 по сравнению с исходным уровнем до 12 недели у всех субъектов, получающих лебрикизумаб, составляет 4,1% (95% CI-0,4, 8,6%; p=0,075). На протяжении 12-недельного периода лечения установленный риск неудачного лечения у всех пациентов, получающих лебрикизумаб, на 75% ниже, чем у пациентов, получающих плацебо (HR 0,25, 95% CI: 0,11, 0,78; p=0,001). Полученные результаты являются клинически и статистически значимыми. Данные по эффекту дозы отсутствуют (см. фиг. 16).
Безопасность: Клинически значимые несоответствия между пациентами, получающими лебрикизумаб и плацебо, отсутствуют, за исключением реакций в участках инъекций (23% и 6% для лебрикизумаба и плацебо, соответственно).
ПРИМЕР 4 - АНАЛИЗ ПЕРИОСТИНА (Анализ E4)
Анализ улавливания периостина методом ELISA характеризуется высокой чувствительностью (чувствительность 1,88 нг/мл, как описано ниже. Антитела распознают изоформы периостина 1-4 со сродством на нМ уровне (SEQ ID NO: 5-8)).
80 мкл очищенного препарата моноклонального антитела, 25D4 (покрывающее антитело, SEQ ID NO: 1 и 2, экспрессируемое гибридомой или клеточной линией CHO) разбавляют забуференным фосфатом физиологическим раствором до конечной концентрации 2 мкг/мл. Титрационные микропланшеты покрывают в течение ночи при 2-8ºC покрывающим антителом, 100 мкл на лунку. Планшеты промывают три раза 400 мкл буфера для промывания (PBS/0,05% твин (полисорбат 20) на лунку при комнатной температуре. К планшетам добавляют 200 мкл блокирующего буфера на лунку. Покрытый планшет инкубируют при комнатной температуре и встряхивании в течение 1,5 часов.
Получают стандартную кривую для rhuPeriostin (стандартный исходный раствор rhuPeriostin = изоформа 1 rhuPeriostin, R&D systems #3548-F2, 5,25 нг/мл в разбавителе для анализа (PBS/0,5% бычьего сывороточного альбумина (БСА)/0,05% полисорбат 20/0,05% ProClin300, pH 7,4). Разбавитель для получения стандартной кривой = PBS/0,5%БСА/0,05% полисорбат 20, 0,05% ProClin300, pH 7,4. Например:
Получение контролей и образцов. Три контроля: контроль проверочной пробы поставщика (полноразмерный rhuPeriostin, изоформа 1, R&D Systems #3548-F2), контроль нормальной матрицы (пул нормальной человеческой сыворотки, Bioreclamation, Inc.), контроль насыщенной матрицы (пул нормальной человеческой сыворотки плюс 100 нг/мл проверочной пробы rhuPeriostin).
Например:
10 мкл контроля (или образца) сыворотки+1,99 мл разбавителя для образца/контроля = 1:200
300 мкл разведения 1:200+300 мкл разбавителя для образца/контроля = 1:400
300 мкл разведения 1:400+300 мкл разбавителя для образца/контроля = 1:800
300 мкл разведения 1:800+300 мкл разбавителя для образца/контроля = 1:1600
Каждое разведение используют с одним повтором
Конструируют контроли матриц с использованием пула нормальной человеческой сыворотки. Нормальный контроль получают с использованием не содержащей проверочного образца объединенной человеческой сыворотки. Насыщенный контроль получают путем добавления 100 нг/мл rhuPOSTN к объединенной сыворотке, как описано выше. Среднее значение, стандартное отклонение (SD) и % коэффициента вариантности (CV, выраженный в процентах) рассчитывают для четырех разведений для каждого контроля на каждом планшете. CV представляет собой количественное значение вариантности повторяющихся измерений по отношению к среднему значению повторов. %CV=100*(SD/среднее значение). Указанные средние концентрации рассчитывают для всех планшетов, чтобы определить межпланшетную точность. Затем полученную контрольную таблицу используют для определения критерия прохождения/неудачи нормального и насыщенного контролей, принимая допустимую концентрацию для каждого контроля ±20% от средней концентрации.
Планшет промывают три раза, используя каждый раз 400 мкл на лунку буфера для промывания (PBS/0,05% полисорбат 20). В планшет добавляют разбавленные растворы стандартов (с двойными повторами), контроли (все четыре разведения) и образцы (все четыре разведения) в объеме 100 мкл на лунку. Покрытый планшет инкубируют при комнатной температуре при встряхивании в течение 2 часов при комнатной температуре. 80 мкл исходного раствора I детекционного MAb (биотинилированное мышиное антитело против человеческого периостина, MAb 23B9, 7,5 мкг/мл в разбавителе для анализа) разбавляют до 12 мл разбавителем для анализа = 50 нг/мл. Планшет промывают четыре раза, используя каждый раз 400 мкл на лунку буфера для промывания. В планшет добавляют разбавленное детекционное Mab в объеме 100 мкл на лунку. Покрытый планшет инкубируют при комнатной температуре в течение одного часа при встряхивании. 80 мкл исходного раствора I стрептавидин-HRP (AMDEX стрептавидин-HRP, GE Healthcare #RPN4401, примерно 1 мг/мл), разбавленного в соотношении 1:80 разбавителем для анализа, разбавляют до 12 мл разбавителем для анализа = 1:12k. Планшет промывают четыре раза, используя каждый раз 400 мкл на лунку буфера для промывания. В планшет добавляют разбавленный стрептавидин-HRP в объеме 100 мкл на лунку. Покрытый планшет инкубируют при комнатной температуре в течение 45 мин при встряхивании. Реагенты Kirkegaard and Perry (KPL) для двухстадийного TMB доводят до комнатной температуры; не объединяют. Планшет промывают четыре раза, используя каждый раз 400 мкл на лунку буфера для промывания. Смешивают равные объемы компонентов субстрата KPL TMB и добавляют их в планшет в объеме 100 мкл на лунку. Планшет инкубируют в течение 20 минут при комнатной температуре и при встряхивании. В планшет добавляют 1 M фосфорную кислоту в объеме 100 мкл на лунку. Планшет считывают при длине волны считывания 450 нм и длине волны сравнения 650 нм. Данный анализ или анализ, подобный вышеописанному, используют в клиническом испытании, описанном в примере 3.
Анализ периостина с использованием антител против изоформы 1 (не общего периостина) проверяют на разных образцах астматических пациентов, используя подобный формат улавливания антитела. Предварительные результаты показывают, что изоформа 1 периостина не является таким же надежным маркером TH2-опосредованного воспаления, как общий периостин.
ПРИМЕР 5 - Исследование астматических пациентов путем наблюдений (BOBCAT)
Авторы ранее опубликовали некоторые данные по биомаркерам, полученные в результате исследований биологических образцов, находящихся на хранении в Банке тканей дыхательных путей Калифорнийского университета, San Francisco (UCSF), которые были собраны в процессе бронхоскопии, проводимой с исследовательскими целями на здоровых и астматических добровольцах. См., например, Международную публикацию № WO 2009/124090. Чтобы подтвердить полученные результаты на большой группе пациентов со средней или тяжелой астмой и обобщить их для нескольких клинических центров, авторы проводят исследование путем наблюдений в нескольких центрах в течение 3 визитов ("BOBCAT") пациентов с умеренной или тяжелой астмой (ACQ>1,50, а FEV1 в диапазоне 40-80%), неконтролируемой высокими дозами ICS (>1000 мкг/день флутиказона DPI или его эквивалента) со сбором индуцированной мокроты, эндобронхиальных биопсийных образцов и периферической крови. Авторы получают согласующиеся данные по крови и дыхательным путям от 59 субъектов (см. общую схему исследования на фиг. 13). Подробное описание исследования приведено ниже.
BOBCAT (бронхоскопическое диагностическое исследование биомаркеров при устойчивой к кортикостероидам астме) представляет собой исследование, проводимое в нескольких центрах Соединенных Штатов, Канады и Соединенного Королевства, со сбором согласующихся образцов дыхательных путей и крови примерно у 60 пациентов с умеренной или тяжелой астмой. Для включения в исследование необходим диагноз умеренной или тяжелой астмы (подтвержденный значением FEV1 в диапазоне 40-80% от теоретического и тем фактом, что в течение последних 5 лет наблюдается >12% случаев обратного развития обструкции дыхательных путей после использования бронходилататора кратковременного действия, или чувствительностью к метахолину (PC20) <8 мг/мл), которая не поддается контролированию (что определяют по наличию, по меньшей мере, 2 обострений за прошедший год, или по оценке анкетирования по контролю за астмой (ACQ) >1,50 (Juniper, E.F., et al., Respir Med 100, 616-621 (2006)), несмотря на стабильный (>6 недель) прием высоких доз ICS (>1000 мкг флутиказона или или его эквивалента в день)) отдельно или в сочетании с бета-агонистом длительного действия. Разрешенные лекарственные средства для совместного приема также включают антагонисты рецепторов лейкотриенов и пероральные кортикостероиды. Схема исследования BOBCAT изображена на фиг. 13.
Определение FENO, бронхоскопию, BAL, индуцирование мокроты и иммуногистохимию с целью определения числа эозинофилов проводят по описанному ранее способу (Woodruff, P.G., et al., Am J Respir Crit Care Med 180, 388-395 (2009); Boushey, H.A., et al., N Engl J Med 352, 1519-1528 (2005); Brightling, C.E., et al., Thorax 58, 528-532 (2003); Lemiere, et al., J Allergy Clin Immunol 118, 1033-1039 (2006)). Все протоколы исследования подтверждает соответствующая комиссия по биомедицинской этике и перед регистрацией для участия в исследовании у всех субъектов получают информированное согласие. Данные по демографическим характеристикам и функциям легких пациентов приведены ниже в таблице 5.
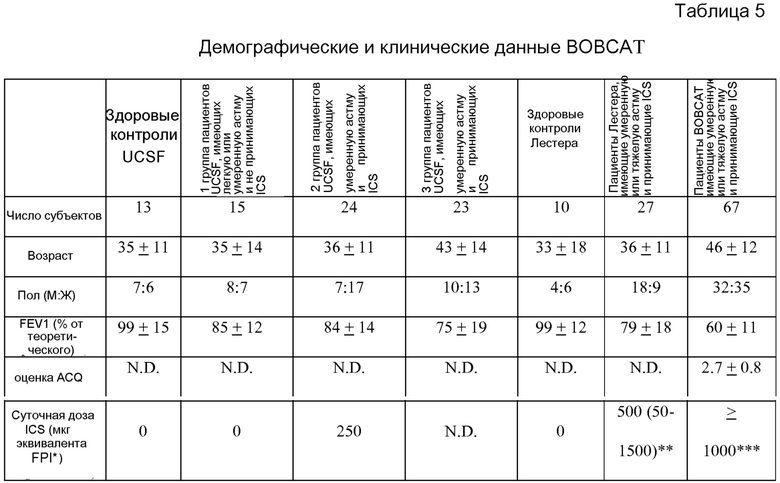
Результаты представлены в виде среднего значения ± SD или середины ряда значений (диапазона)
* FPI - флутиказона дипропионат. Эквивалентное отношение флутиказон:будезонид = 1:1,6
** Среди данных субъектов 6 также получают системное введение кортикостероидов в диапазоне 4-20 мг эквивалентов преднизолона/день
*** Среди данных субъектов 7 также получают системное введение кортикостероидов в диапазоне 5-40 мг эквивалентов преднизолона/день
Авторы используют заранее определенные пороговые значения, согласующиеся с предыдущими исследованиями и включающие 3% для содержания эозинофилов в мокроте (Green, R.H., et al., Lancet 360, 1715-1721 (2002); Haldar, P., et al., N Engl J Med 360, 973-984 (2009)) и 22 для числа эозинофилов/мм2 общей площади биопсии (Miranda, C.A. et al., J Allergy Clin Immunol 113, 101-108 (2004); Silkoff, P.E., et al., J Allergy Clin Immunol 116, 1249-1255 (2005)). Уровни сывороточного периостина являются очень стабильными среди отдельных субъектов на протяжении трех визитов в течение периода времени до 5 недель (результаты не показаны). Средние уровни периостина значительно выше у субъектов с "высоким содержанием эозинофилов", чем у субъектов с "низким содержанием эозинофилов", в соответствии с результатами измерения эозинофилов в мокроте или ткани (результаты не показаны). У субъектов, распределенных по группам в соответствии с суммарной оценкой 0 в случае отсутствия эозинофилии, 1 в случае наличия эозинофилии либо в мокроте, либо в ткани, и 2 в случае наличия эозинофилии и в мокроте, и в ткани, наблюдается значительная тенденция к увеличению сывороточного периостина с увеличением оценки по эозинофилам (данные не показаны). Кроме того, астматические пациенты всех групп с отсутствием эозинофилии согласованно демонстрируют уровни сывороточного периостина ниже 25 нг/мл с использованием описанного выше анализа E4. Используя в качестве предельного значения сывороточного периостина 25 нг/мл, субъектов успешно подразделяют на "содержащих низкий уровень эозинофилов" и "содержащих высокий уровень эозинофилов" в исследовании BOBCAT с положительным прогностическим значением 93% (таблица 6). Число нейтрофилов в ткани положительно коррелирует с числом эозинофилов в ткани и уровнями сывороточного периостина (результаты не показаны). Взятые вместе, полученные результаты демонстрируют, что сывороточный периостин представляет собой системный биомаркер стойкой эозинофилии в воздушных путях пациентов с умеренной или тяжелой астмой, несмотря на лечение стероидами.
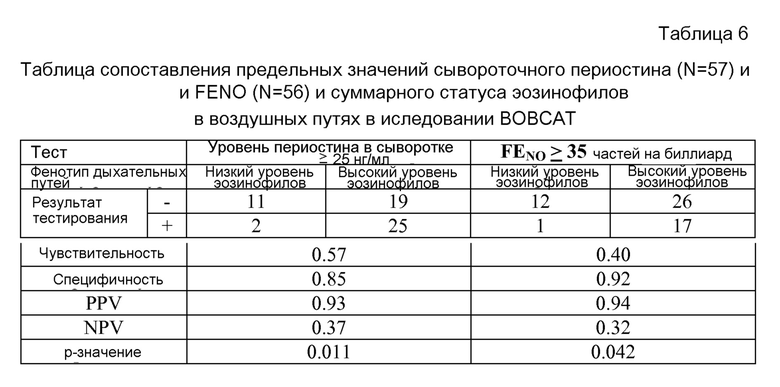
Высокий уровень эозинофилов: Содержание эозинофилов в мокроте >3%, или содержание эозинофилов в биопсийном образце >22/мм2
PPV, положительное прогностическое значение
NPV, отрицательное прогностическое значение
p-значение представляет собой точный критерий Фишера (двусторонний)
Сравнение сывороточного периостина с парциальным давлением оксида азота в выдыхаемом воздухе (FENO), эозинофилами периферической крови, сывороточным IgE и сывороточным YKL-40 в качестве биомаркеров астмы
В последние годы были описаны другие неинвазивные биомаркеры степени тяжести астмы и воспаления дыхательных путей. Четыре маркера, представляющие особый интерес, включают парциальное давление оксида азота в выдыхаемом воздухе (FENO), газа, образующегося в результате действия фермента iNOS (индуцируемая синтаза оксида азота) в воспаленной слизистой оболочке бронхов (Pavord, ID. et al., J Астма 45, 523-531 (2008)); эозинофилы периферической крови; сывороточный IgE; и YKL-40, хитиназа-подобный белок, детектируемый в периферической крови (Chupp, G.L., et al., N Engl J Med 357, 2016-2027 (2007)). Авторы измеряют уровни указанных биомаркеров в исследуемых группах астматических пациентов и сравнивают полученные значения с уровнями эозинофилов в воздушных путях и других биомаркеров.
По результатам исследования BOBCAT периостин, FENO, IgE и эозинофилы крови не коррелируют в существенной степени с ACQ, FEV1, возрастом, полом или индексом массы тела (BMI). В исследовании BOBCAT уровни FENO, подобно уровням сывороточного периостина, как правило, являются сопоставимыми на протяжении нескольких визитов, хотя FENO больше варьирует на более высоких уровнях (данные не показаны), тогда как эозинофилы крови считаются более вариабельными (r2=0,18 для эозинофилов крови между визитами 1 и 3, не показано, по сравнению с r2=0,65 для сывороточного периостина между визитами 1 и 3). Как показано на фиг. 14A-F, уровни сывороточного периостина во время визитов 1, 2 и 3 в высокой степени коррелируют друг с другом и со средним уровнем периостина на протяжении всех визитов в исследовании BOBCAT.
При распределении по статусу эозинофилов в мокроте и биопсийных образцах, как указано в таблице 6, уровни FENO значительно выше у эозинофильных астматиков, чем у неэозинофильных астматиков. Однако, хотя и FENO, и периостин имеют высокую степень специфичности, демонстрируя соответственно низкие значения для субъектов с "низким уровнем эозинофилов", FENO позволяет детектировать меньше субъектов с тканевой эозинофилией и характеризуется большей степенью перекрывания субъектов с "низким уровнем эозинофилов" и субъектов с "высоким уровнем эозинофилов" в соответствии с каждым используемым показателем (фиг. 15A-D). С помощью регрессионной логистической модели, включающей возраст, пол, BMI, эозинофилы крови, сывороточный IgE, FENO и сывороточный периостин (таблица 7), авторы установили, что периостин является наиболее значительным одиночным прогностическим фактором для суммарного статуса эозинофилов в воздушных путях (p=0,007).
Регрессионная логистическая модель биомаркеров по сравнению с эозинофильным статусом, определенным в исследовании BOBCAT (N=59)
Пороговое значение FENO 35 частей на биллиард, как описано ранее (Dweik, R.A., et al., Am J Respir Crit Care Med 181, 1033-1041 (2010)), позволяет подразделять астматиков на "содержащих низкий уровень эозинофилов" и "содержащих высокий уровень эозинофилов" со сравнимой специфичностью, но с более низкой чувствительностью, чем пороговое значение периостина 25 нг/мл (таблица 6). Существует тенденция к повышению уровня эозинофилов в периферической крови у астматиков с "высоким уровнем эозинофилов", однако она не достигает статистической значимости (данные не показаны). Чтобы оценить относительную эффективность каждого маркера на непрерывной основе, авторы проводят рабочий характеристический (ROC) анализ периостина, FENO, эозинофилов крови и сывороточного IgE в сравнении с суммарным статусом эозинофилов в воздушных путях, который показывает, что периостин действует подобно FENO (AUC составляет 0,84 и 0,79 соответственно), тогда как эозинофилы крови и сывороточный IgE действуют гораздо хуже (фиг. 15E).
YKL-40 демонстрирует отсутствие существенных корреляций с периостином и другими маркерами дыхательных путей или периферической эозинофилии во всех группах (данные не показаны). В соответствии с полученными результатами по уровням биомаркеров выдыхаемого воздуха и крови, авторы обнаружили, что уровни экспрессии в бронхиальном эпителии генов периостина и NOS2 (ген, который кодирует iNOS) в значительной степени коррелируют друг с другом и с уровнями экспрессии в бронхиальной слизистой оболочке IL-13 и IL-5, тогда как экспрессия CHI3L1 (ген, который кодирует YKL-40) не коррелирует с периостином, IL-13 и IL-5 (таблица 8). Взятые вместе, полученные результаты позволяют предположить, что периостин периферической крови является более надежным показателем Th2/эозинофильного воспаления дыхательных путей у астматических пациентов, чем FENO, эозинофилы крови, сывороточный IgE или YKL-40 на протяжении ряда степеней тяжести и лечения стероидами.
Уровни экспрессии IL-13 и IL-5 определяют с использованием эндобронхиальных биопсийных образцов методом количественной ПЦР
Уровни генов периостина (POSTN_210809_s_at), NOS2 (NOS2_210037_s_at) и CHI3L1 (CHI3L1_209395_at), гена, кодирующего YKL-40, определяют с использованием бронхиального эпителиального микрочипа, описанного в Truyen, E., L. et al. Thorax 61, 202-208 (2006).
Обсуждение
Хотя астма традиционно считается аллергическим заболеванием, опосредуемым воспалением (1), связанным с Th2, существует очевидное доказательство патофизиологической гетерогенности (3-8). Авторы недавно показали, что среди астматических пациентов с легкой или средней астмой, не принимающих стероиды, только у половины субъектов наблюдается Th2-воспаление дыхательных путей. Отличительной чертой подгруппы с "высоким Th2" являются повышенные уровни маркеров аллергии, эозинофильного воспаления дыхательных путей, бронхиального фиброза и чувствительности к ICS (13). Поскольку цитокины IL-4, IL-5 и IL-13 как антагонисты Th2 активно разрабатываются в качестве терапевтических средств против астмы (35-37), стало важным идентифицировать астматических пациентов, с наибольшей вероятностью склонных к улучшению в результате приема средств, направленных на указанные мишени. Хотя бронхоскопия, взятие образцов индуцированной мокроты и измерение выдыхаемых газов позволяют непосредственно характеризовать воспалительные пути в дыхательных путях, указанные методы могут занимать много времени, они могут являться дорогими, инвазивными и/или не являться широко доступными в учреждениях первичного медицинского обслуживания. Кроме того, аналитические процедуры не стандартизированы в относительно небольшом числе центров, оборудованных для анализа образцов дыхательных путей, которые участвуют в проведении клинических испытаний в нескольких центрах. Следовательно, для выбора пациентов с диагнозом Th2-опосредованного эозинофильного воспаления в дыхательных путях для целевой терапии желательно разработать неинвазивные биомаркеры Th2-опосредованного эозинофильного воспаления дыхательных путей, широко доступные на удобных аналитических платформах. Чтобы решить указанную задачу, авторы используют профиль экспрессии генов в образцах дыхательных путей астматических пациентов для идентификации и характеристики клинически полезных периферических биомаркеров Th2-опосредованного эозинофильного воспаления дыхательных путей.
Периостин представляет собой секретируемый матрицеллюлярный белок, связанный с фиброзом, экспрессия которого повышается под действием рекомбинантных IL-4 и IL-13 в культурах бронхиальных эпителиальных клеток (21, 38) и бронхиальных фибробластов (39). Он экспрессируется на повышенном уровне in vivo у мышиной модели астмы (40) и резус-модели астмы (неопубликованные данные), а также в бронхиальных эпителиальных клетках (21) и субэпителиальном бронхиальном слое (39) людей, страдающих от астмы. У людей, страдающих от астмы, уровни экспрессии периостина коррелируют с утолщением ретикулярной базальной мембраны, являющимся индикатором субэпителиального фиброза (23). Сверхэкспрессия периостина также наблюдается в назальных полипах, связанных с аспирин-чувствительной астмой (41, 42), и в эпителии пищевода пациентов с эозинофильный эзофагитом в IL-13-зависимой манере (43) и, следовательно, может участвовать в инфильтрации эозинофилов в ткани при Th2-опосредованных заболеваниях (44). Повышенная экспрессия периостина также наблюдается при эпителиальных раковых заболеваниях нескольких типов (45-49), и в сыворотке нескольких раковых пациентов обнаружены повышенные уровни растворимого периостина (24-26, 45, 46). До сих пор остается неясным, связана ли локальная и системная экспрессия периостина при астме и других состояниях с непосредственным или косвенным действием IL-13, и решение данной задачи можно осуществить путем сравнения экспрессии периостина до и после терапевтической блокады IL-13.
Периостин детектируют в значительных системных концентрациях в периферической крови неастматических субъектов и его уровень повышается в периферической крови подгруппы астматических пациентов, не получающих лечения ICS. Его экспрессия в бронхиальном эпителии подавляется лечением ICS (13, 21) и у субъектов с умеренной астмой, относительно хорошо контролируемой ICS, системные уровни периостина, как правило, ниже, чем у астматических пациентов, не получающих ICS, хотя эти данные характеризуются значительным разбросом. Учитывая те факты, что ICS в основном оказывают локальное действие на дыхательные пути, и что системные уровни периостина (как ранее показано авторами, например, в международной патентной публикации № WO2009/124090) подавляются у астматических пациентов после лечения ICS, можно сделать вывод, что значительная доля системного периостина образуется в дыхательных путях астматических пациентов и, следовательно, различия в уровнях системного периостина, составляющие 10-20%, являются клинически значимыми в отношении воспаления дыхательных путей.
FENO связан с воспалением дыхательных путей и позволяет прогнозировать чувствительность к ICS у пациентов с астмой разной степени тяжести (11, 34). Однако достоверное соответствие уровней FENO и эозинофилии воздушных путей отсутствует при тяжелой, стероид-зависимой астме, и, кроме того, существуют различия в количественном определении эозинофилов по уровню FENO в мокроте и слизистой оболочке (29, 50). Титрование лечения ICS по подавлению числа эозинофилов в мокроте уменьшает частоту тяжелых обострений астмы (12), в отличие от титрования лечения ICS по уровням FENO (51). Сывороточный YKL-40 идентифицирован как маркер астматического воспаления дыхательных путей, однако его уровни не коррелируют с такими маркерами Th2-воспаления, как IgE или эозинофилы (33). Соответственно, в настоящем исследовании авторы обнаружили, что уровни экспрессии в бронхиальном эпителии генов периостина и NOS2, но не CHI3L1, коррелируют с экспрессией IL-13 и IL-5 в бронхах (таблица 8). Тогда как авторы обнаружили относительно сильные положительные корреляции между бронхиальной или системной эозинофилией и уровнями сывороточного периостина, корреляции между эозинофилией и FENO являются гораздо слабее, а корреляцию между сывороточным YKL-40 и эозинофильным воспалением не удалось обнаружить у исследуемых астматических пациентов. Число эозинофилов в мокроте и крови и уровень FENO характеризуются значительной временной изменчивостью в зависимости от воздействия аллергена, обострений и лечения стероидами (50, 52, 53). Хотя период полужизни периостина в крови в настоящее время неизвестен, если он является относительно длительным, системные уровни периостина могут отражать интеграцию общего Th2-воспаления дыхательных путей в течение продолжительного периода времени. В соответствии с данным предположением авторы обнаружили относительно небольшую вариабельность среди субъектов по уровню сывороточного периостина в 3 измерениях в течение промежутка времени до 5 недель (данные не показаны). Будущие исследования следует направить на сравнительный анализ долговременной вариабельности среди субъектов по уровням сывороточного периостина, эозинофилии воздушных путей, FENO и других предполагаемых биомаркеров Th2-воспаления в течение длительных периодов времени.
Стандартным способом лечения бронхиальной астмы, которая не контролируется симптоматической терапией (такой как β-агонисты), является ингаляция кортикостероидов (ICS). У пациентов с легкой или средней астмой, характеризующейся повышенными уровнями IL-13 в дыхательных путях (19), и у пациентов с эозинофильным эзофагитом, характеризующимся повышенными уровнями экспрессии IL-13 в ткани пищевода (43), лечение ICS значительно уменьшает уровень IL-13 и IL-13-индуцируемых генов в пораженных тканях. Авторы показали, что лечение кортикостероидом значительно снижает уровни IL-13-индуцированной экспрессии генов профиля Th2 (13, 21) в эпителии дыхательных путей астматических пациентов после одной недели лечения ICS и в культуре клеток бронхиального эпителия. Указанная понижающая регуляция может быть результатом ICS-опосредованного уменьшения уровней IL-13, ICS-опосредованного уменьшения экспрессии гена-мишени, или их сочетания. Доля субъектов с тяжелой астмой, устойчивой к лечению ICS (примерно 40%), имеющих детектируемые уровни IL-13 в мокроте, подобна аналогичной доле субъектов с легкой, не подвергавшейся лечению ICS астмой (19), и сравнима с долей субъектов, имеющих описанный авторами (13) профиль Th2 в бронхиальном эпителии. Аналогичные наблюдения описаны в BAL (54) для устойчивости IL-4- и IL-5-экспрессирующих клеток у нечувствительных к стероидам астматиков и эозинофильного воспаления в биопсийных образцах бронхов и мокроте (8). Указанные наблюдения позволяют предположить, что, хотя Th2-опосредованное эозинофильное воспаление подавляется лечением ICS у пациентов с умеренной астмой, оно вновь обнаруживается в подгруппе пациентов с тяжелой астмой, не полностью контролируемой стероидами. Другое осложнение обусловлено неполным соблюдением предписанной терапии ICS, которое может лежать в основе плохого контролирования некоторых пациентов с тяжелой астмой. Следовательно, будущие исследования следует направить на анализ уровней периостина в крови с учетом статуса лечения ICS, дозы ICS, собственной чувствительности к стероидам и соблюдения терапии ICS контролируемыми и не контролируемыми астматиками.
В настоящее время в клинической разработке, использующей в качестве мишени IL-13 и родственные факторы, опосредующие Th2-воспаление при астме (35-37), находится большое число биологических терапевтических средств, включающих описанные в настоящем документе. Важно, чтобы указанные способы лечения применялись к пациентам с подходящей молекулярной патологией, иначе основные эффекты лечения могут быть занижены; исследования терапии против IL5 подтверждают данное предположение (14, 15, 55). Полученные результаты позволяют предположить, что примерно половина не получающих стероиды пациентов с легкой или умеренной астмой характеризуются активностью пути Th2 в дыхательных путях, и такая же доля пациентов с умеренной или тяжелой, устойчивой к стероидам астмой характеризуются активностью данного пути. Таким образом, как описано в данном документе, с помощью биомаркеров, позволяющих идентифицировать астматических пациентов, которые, по всей вероятности, имеют Th2-опосредованное воспаление дыхательных путей, также можно идентифицировать и выбрать пациентов, с наибольшей вероятностью отвечающих на указанные экспериментальные направленные способы лечения.





ПРИМЕР 6 - Исследование III астматических пациентов (целью которого является анализ безопасности, сопротивляемости и эффективности)
Рандомизированное, двойное слепое, корректируемое по плацебо исследование лебрикизумаба проводят в нескольких центрах с использованием параллельных групп пациентов с тяжелой астмой, которая остается неконтролируемой, несмотря на ежедневное введение ICS (500-2000 мкг/день флутиказона пропионата или его эквивалента с помощью ингалятора сухого порошка [DPI]) и второго контролирующего лекарственного средства, такого как β-агонист длительного действия (LABA), антагонист рецептора лейкотриенов (LTRA), мускариновый антагонист длительного действия (LAMA) или теофиллин. С помощью данного исследования также можно определить диагностическое значение исходных уровней сывороточного периостина, которое составляет ≥50 нг/мл (по данным анализа Elecsys®). При продолжении стандартного лечения, которое может включать ICS и второе контролирующее лекарственное средство, пациентов случайным образом распределяют в три группы, получающие лебрикизумаб или плацебо в течение 52-недельного плацебо-контролируемого периода.
В течение 2-недельного вводного периода, также называемого период скрининга, (визиты от 1 до 3), пациентов оценивают по согласию на текущее лечение астмы и способности применять оборудование, необходимое для ежемесячных клинических визитов на протяжении исследования, а также по степени контролирования астмы, обеспечиваемого стандартным лечением. Пациенты, имеющие оценку анкетирования по контролю за астмой (ACQ-5)≥1,5 и один или несколько симптомов астмы, не поддающихся контролированию (пробуждения в ночное время ≥1 раза/неделю, симптомы >2 дней/неделю, применение SABA >2 дней/неделю и/или нарушение дневной активности), считаются неконтролируемыми. Пациенты, симптомы которых остаются не контролируемыми во время 1 или 2 визита и 3 визита, несмотря на соблюдение указаний по приему контролирующего лекарственного средства, подходят для участия в исследовании. Период скрининга можно продлить на 1 неделю, если данные по соблюдению являются неполными, и для пациентов, имеющих значение ACQ-5<1,5 во время 3 визита, если опыт исследователя в отношении данного пациента показывает, что эта неделя является нетипичной для его болезни. Пациенты могут быть выбраны для повторного скрининга по некоторым причинам вплоть до двух дополнительных периодов времени.
В конце вводного периода (периода скрининга) подходящих пациентов случайным образом распределяют по группам (1:1:1:1), в зависимости от дозы исследуемого лекарственного средства (получающих либо плацебо, либо лебрикизумаб в дозе 37,5 мг ПК ежемесячно, 125 мг ПК ежемесячно или 250 мг ПК каждые 4 недели). Рандомизацию осуществляют с учетом исходного уровня сывороточного периостина, измеренного с помощью анализа Elecsys® (<42 нг/мл, ≥42 до <50 нг/мл, ≥50 до <58 нг/мл, ≥58 нг/мл), истории обострений астмы в течение последних 12 месяцев (0, 1-2, ≥3 событий), исходных уровней лекарственных средств против астмы (доза ICS≥1000 мкг/день флутиказона пропионата DPI или его эквивалента плюс LABA [да, нет]), и географического региона (Соединенные штаты/Канада, Европа, Азия, остальные страны). Пациенты продолжают получать стабильные дозы своего стандартного лекарственного средства, которое может включать ICS (500-2000 мкг/день флутиказона пропионата DPI или его эквивалента) и второе контролирующее лекарственное средство, помимо лечения в рамках двойного слепого исследования в течение 52 недель.
Первое подкожное введение исследуемого средства осуществляют в день рандомизации (3 визит [1 день]) и повторяют его каждые 4 недели в течение 52-недельного корректируемого по плацебо периода (с введением в общей сложности всего 13 доз исследуемого средства). Показатели безопасности, эффективности и описанных пациентом эффектов (PRO) оценивают на протяжении всего 52-недельного корректируемого по плацебо периода. Конечный результат первичной эффективности представляет собой частоту обострений астмы, которую оценивают в течение 52-недельного корректируемого по плацебо периода.
Пациенты, завершившие 52-недельный корректируемый по плацебо период (т.е. пациенты, не прервавшие досрочно лечение в рамках исследования), далее участвуют в 52-недельном периоде активного лечения, который является продолжением исследования.
Все пациенты, участвующие в 52-недельном периоде активного лечения в рамках продолжения исследования, получают лебрикизумаб ПК в двойном слепом режиме в дозе, составляющей либо 125 мг, либо 250 мг каждые 4 недели. Пациенты, получавшие 125 мг или 250 мг лебрикизумаба в течение 52-недельного корректируемого по плацебо периода, продолжают принимают назначенную дозу лебрикизумаба. Пациентов, получавших плацебо или 37,5 мг лебрикизумаба ПК каждые 4 недели в течение 52-недельного корректируемого по плацебо периода, случайным образом распределяют в отношении 1:1 по группам, получающим ПК лебрикизумаб в дозе 125 мг или 250 мг каждые 4 недели в течение 52-недельного периода активного лечения в рамках продолжения исследования, причем случайное распределение осуществляют с учетом исходного уровня периостина и назначения предшествующего лечения.
На 76 неделе, во время 52-недельного периода активного лечения в рамках продолжения исследования, у каждого пациента оценивают контролирование астмы с использованием данных, полученных во время трех последних визитов (на 68, 72 и 76 неделе). Пациенты, у которых симптомы астмы контролируются в течение 12 последовательных недель (ACQ-5≤0,75 при каждой оценке) и у которых отсутствуют обострения в течение первой половины периода активного лечения в рамках исследования (недели 52-76), прекращают прием лебрикизумаба и вступают в период наблюдения. В течение периода наблюдения пациентов наблюдают с целью определения безопасности в течение 24 недель после введения последней дозы исследуемого лекарственного средства. Пациенты, у которых остаются симптомы (ACQ-5>0,75) на 76 неделе или у которых встречаются события обострения на протяжении первой половины периода активного лечения (недели 52-76), продолжают принимать лебрикизумаб в течение еще 28 недель. Показатели безопасности, эффективности и PRO анализируют на протяжении 52-недельного периода активного лечения.
В течение периода наблюдения всех пациентов наблюдают с целью определения безопасности в течение 24 недель (>5 периодов полужизни лекарственного средства) после введения последней дозы исследуемого лекарственного средства, где введение последней дозы либо осуществляют в момент, указанный в протоколе, либо оно обусловлено ранним прекращением лечения в рамках исследования. Для пациентов, завершающих исследование после 23 визита (на 76 неделе), которые хорошо контролируются и прекращают лечение в рамках исследования, 23 визит одновременно рассматривается как 1 визит периода наблюдения с целью определения безопасности. Для пациентов, завершающих исследование после 30 визита (на 104 неделе), 30 визит одновременно рассматривается как 1 визит периода наблюдения с целью определения безопасности. В обоих указанных случаях последний визит периода наблюдения представляет собой 2 визит на 12 неделе периода наблюдения за безопасностью. Для всех остальных пациентов первым визитом периода наблюдения является визит 1 на 4 неделе периода наблюдения за безопасностью (примерно через 4 недели после введения последней дозы исследуемого лекарственного средства).
В общей сложности участие в исследовании, которое включает, начиная с рандомизации во время 3 визита (1 день), 52-недельный корректируемый по плацебо период, 52-недельный период активного лечения и период наблюдения за безопасностью, может длиться 124 недели.
Примерно 1400 пациентов (175 пациентов в опытной группе [лебрикизумаб ПК 250 мг, 125 мг, 37,5 мг, или плацебо] с учетом уровня периостина [высокий уровень периостина ≥50 нг/мл, низкий уровень периостина <50 нг/мл]) участвуют в исследовании примерно в 250 центрах, расположенных по всему миру. Минимум 650 пациентов входят в состав группы с высоким уровнем периостина (≥50 нг/мл). В исследовании участвует минимум 450 пациентов, принимающих в качестве ICS флутиказон ≥1000 мкг/день DPI или его эквивалент плюс LABA.
Основной критерий включения определяется следующими факторами: диагноз астмы ≥12 месяцев до скрининга; ответ на бронходилататоры/чувствительность к бронходилататорам: у пациентов может наблюдаться ответ на бронходилататоры ≥12% после четырех вдуваний β-агониста кратковременного действия (такого как альбутерол или сальбутамол) в течение периода скрининга; пребронходилататорный уровень FEV1 составляет 40%-80% от теоретического во время как 2, так и 3 визитов; прием ICS≥500 (например, 500-2000) мкг флутиказона пропионата DPI или его эквивалента (общая суточная доза) в течение ≥6 месяцев до скрининга; прием второго контролирующего лекарственного средства (такого как LABA, LAMA, LTRA или теофиллин в предписанном диапазоне доз) в течение 6 месяцев до скрининга; неконтролируемая астма, идентифицированная в течение периода скрининга (т.е. во время 1 визита [14 день] или 2 визита [7 день]) и во время рандомизации (3 визит [1 день]) по следующим показателям: оценка ACQ-5≥1,5 и наличие, по меньшей мере, одного из нижеследующих симптомов астмы, который не поддается контролированию в соответствии с Национальным институтом сердца, крови и легких и Отчетом группы экспертов по национальной программе информирования об астме и профилактики астмы 3 (2007), а также руководствами Всемирного института астмы (2010):
- симптомы >2 дней/неделю
- ночные пробуждения ≥1 раза/неделю
- применение SABA в качестве резервного лекарства >2 дней/неделю
- препятствование нормальной дневной активности;
с помощью рентгена или компьютерной томографии (КТ) грудной клетки, проводимыми на протяжении 12 месяцев до 1 визита, или рентгена грудной клетки в течение периода скрининга подтверждают отсутствие другого заболевания легких; и демонстрируют соблюдение назначения контролирующего лекарственного средства ≥70% в процессе периода скрининга (соблюдение определяют как утверждение пациентов, что они принимают терапию, контролирующую астму, ≥70% дней на протяжении периода скрининга (от 1 до 3 визита), что регистрируется с помощью пневмотахометра).
Основной критерий исключения определяется следующими факторами: наличие тяжелой аллергической реакции или анафилактической реакции на биологическое средство или известная гиперчувствительность к одному из компонентов препарата лебрикизумаба для инъекций; поддерживающая терапия пероральными кортикостероидами, определенная как поддерживающая терапия пероральными кортикостероидами, принимаемая ежедневно или через день в течение 3 месяцев до 1 визита; обострение астмы за 4 недели до скрининга (1 визит) или в любое время на протяжении скрининга, которое требует системного (перорального, внутривенного (в.в.) или внутримышечного (в.м.)) введения кортикостероидов с любой целью, включающей событие острого обострения; эпизод значительной инфекции, требующий проведения одного из следующих мероприятий:
1. госпитализация в течение ≥24 ч в пределах 4 недель до скрининга (1 визит)
2. лечение антибиотиками IV поколения в течение 4 недель во время скрининга (1 визит)
3. введение пероральных антибиотиков в течение 2 недель до скрининга (1 визит);
активная паразитарная инфекция на протяжении 6 месяцев до 1 визита; туберкулез, требующий лечения в течение 12 месяцев перед скринингом (к исследованию допускаются пациенты, получавшие лечение от туберкулеза и не имеющие рецидивов в течение 12 месяцев после завершения лечения); известный иммунодефицит, включающий, без ограничения, инфекцию ВИЧ; применение в текущий момент иммуномодуляторной терапии; известное на текущий момент злокачественное заболевание или текущее обследование на возможное злокачественное заболевание; признаки активного гепатита B/C или нестабильной болезни печени; активная паразитарная инфекция на протяжении 6 месяцев до скрининга; повышение AST/ALT≥2,0, верхней границы нормы; наличие кистозного фиброза, хронического обструктивного заболевания легких и/или другого клинически значимого заболевания легких, отличного от астмы; курение в текущий момент или ранее с периодом срока курения >10 пачко-лет; применение биологической терапии в любой момент времени на протяжении 6 месяцев до скрининга; пациенты женского пола в репродуктивном возрасте, не желающие применять высокоэффективную контрацепцию на протяжении исследований, или беременные и кормящие; другие нестабильные заболевания внутренних органов; индекс массы тела >38 кг/м2; масса тела <40 кг.
Обоснование режима дозирования в III фазе
Анализ популяции PK
Предварительную модель популяции PK разрабатывают для описания PK профиля лебрикизумаба у взрослых пациентов. Для разработки данной модели и определения зависимости «концентрация в сыворотке – время» используют в общей сложности 4914 образцов от 333 пациентов, получающих лебрикизумаб и участвующих в описанном выше исследовании. На протяжении исследований кажущиеся различия отсутствуют, что подтверждается хорошим соответствием между наблюдаемым средним значением профиля PK в каждом исследовании и теоретическим профилем, полученным с использованием статистических данных.
Двухкомпонентная модель с абсорбцией первого порядка и кинетикой устранения адекватно описывает зависимость концентрации лебрикизумаба в сыворотке от времени. Структурные параметры модели включают клиренс (CL), объем распределения центрального компартмента (V1), объем периферического компартмента (V2), межкомпартментальный клиренс (Q), а также скорость абсорбции первого порядка (Ka) и биодоступность (F) после ПК введения. Допускают, что все параметры, за исключением V2 и Q (которые фиксируют при средних для популяции значениях), имеют нормальное log распределение.
Определяют средние для популяции значения CL и V1, составляющие 0,18 л/день и 3,7 л, соответственно. Средняя биодоступность в популяции составляет 76%. Вариабельность параметров PK среди субъектов является умеренной и варьирует от 15% до 27%. Обнаружено, что масса тела в значительной степени является ковариантной для CL и объемов распределения лебрикизумаба, причем чем больше масса, тем выше клиренс и объемы распределения. Примерно 19% вариабельность CL среди субъектов и 11% вариабельность V1 среди субъектов объясняются вариабельностью массы тела. Рассчитанные популяционные PK параметры приведены в таблице 13. Анализ популяционной PK показывает, что PK характеристики лебрикизумаба соответствуют типичным характеристикам моноклонального антитела IgG.
Влияние периостина на PK параметры анализируют путем сравнения отдельных post hoc значений PK параметров среди пациентов с исходными уровнями периостина выше и ниже среднего значения в исследовании примера 2 и в исследовании примера 3. Различия являются значительными (p>0,05) в обоих исследованиях для CL (p=0,54, 0,11), V1 (p=0,83, 0,79) и F (p=0,74, 0,37).
Популяционные PK параметры лебрикизумаба.
= межкомпартментальный клиренс; SE = стандартная ошибка; V1 = объем распределения в центральном компартменте; V2 = объем распределения в периферическом компартменте.
Примечание: Влияние BW моделируют как степенную функцию, TVPi = Θ1*(BWi/BWref)Θ2, где TVP обозначает типичное значение PK параметра; BWi обозначает массу тела i-го субъекта, BWRef обозначает стандартную массу тела, которая представляет собой среднюю массу тела всех пациентов, входящих в состав популяционной модели PK (82 кг), Θ1 обозначает среднее значение PK параметров в популяции, а Θ2 обозначает влияние массы тела на PK параметр.
Обоснование единообразного дозирования
Единообразную дозу используют в описанной выше фазе II исследований. С учетом влияния массы тела на PK профиль лебрикизумаба, у более тяжелых пациентов, как правило, наблюдается более слабое воздействие препарата. Однако корреляция между массой тела и пропорциональным изменением FEV1 по сравнению с исходным уровнем на 12 неделе у отдельных пациентов, получающих лебрикизумаб, отсутствует, указывая на то, что влияя на воздействие, масса тела не оказывает влияния на эффективность (см. фигуру 20). Кроме того, полученные в указанных исследованиях данные свидетельствуют о том, что безопасность не связана с единообразным дозированием в тестируемом диапазоне масс тела (53-135 кг).
Чтобы оценить влияние единообразного дозирования на общую вариабельность воздействия лебрикизумаба, осуществляют моделирование популяции PK, чтобы сравнить единообразное дозирование и эквивалентные режимы дозирования с учетом массы тела (т.е. мг/кг), принимая, что распределение массы тела подобно наблюдаемому в описанной выше фазе II исследований. Теоретические доли пациентов с равновесными минимальными концентрациями выше разных уровней являются одинаковыми в группах, получающих единообразный и основанный на массе тела режимы дозирования (см. фигуру 21), что свидетельствует об отсутствии очевидного преимущества дозирования с учетом массы тела. Следовательно, для фазы III исследования выбирают единообразное дозирование, преимущество которого включает уменьшение риска ошибки дозирования и функциональной сложности (например, препарата лекарственного средства) по сравнению с индивидуальным дозированием на основе массы тела.
Обоснование целевых концентраций
Анализ воздействие-ответ с использованием результатов фазы II проводят, чтобы определить целевые концентрации лебрикизумаба и обосновать выбор дозы для исследований фазы III. В обоих описанных выше исследованиях фазы II отсутствует четкая корреляция плацебо-скорректированного изменения FEV1 по сравнению с исходным уровнем и сывороточной минимальной концентрацией лекарственного средства на 12 неделе (данные не показаны) у отдельных пациентов, получающих лебрикизумаб, это позволяет предположить, что лебрикизумаб оказывает насыщенное влияние на FEV1 в диапазоне тестируемых воздействий в обоих исследованиях. Кроме того, оценки корреляции изменения биомаркеров PD (FeNO, IgE, CCL17 и CCL13) и сывороточных минимальных концентраций лекарственного средства в исследованиях фазы II позволяет предположить наличие насыщения указанных ответов PD в процессе периода лечения обоих исследований. В группе с высоким уровнем периостина наблюдаются подобные результаты. На основе полученных результатов предложена целевая сывороточная равновесная минимальная концентрация 10 мкг/мл, охватывающая нижний предел наблюдаемого диапазона Ctrough,wk12 в обоих исследованиях (5-95 процентиль: 9,6-50 мкг/мл в исследовании примера 2; 9,4-73 мкг/мл в исследовании примера 3). Кроме того, полагают, что сывороточная концентрация 10 мкг/мл будет поддерживать достаточно высокий уровень лекарственного средства в легких астматических пациентов, чтобы нейтрализовать IL-13, где предполагаемое распределение лебрикизумаба в сыворотке и легких (1:500) и уровень IL-13 в легких определены на основе данных, описанных в литературе. Таким образом, можно ожидать, что эффективная доза, используемая в фазе III, будет поддерживать сывороточную равновесную минимальную концентрацию >10 мкг/мл.
Чтобы выбрать частично эффективную дозу для применения в фазе III, предлагают более низкую равновесную концентрацию 5 мкг/мл, чтобы гарантировать отсутствие перекрывания с наблюдаемым диапазоном Ctrough,wk12 в исследованиях как примера 2, так и примера 3, в которых наблюдают эффективность. Кроме того, при средних сывороточных концентрациях лебрикизумаба >5 мкг/мл в обоих исследованиях влияние лебрикизумаба на сывороточные уровни CCL17 (TARC) возвращается к исходному уровню при отмывании лекарственного средства (см. фигуру 22; (A) исследование примера 2, (B) исследование примера 3). Хотя влияние лебрикизумаба на сывороточный CCL17 (TARC) непосредственно не коррелирует с эффективностью, восстановление данного биомаркера позволяет предположить субоптимальное подавление активности IL-13 в некоторых биологических путях при данной концентрации. Следовательно, частично эффективную дозу предлагают для поддержания сывороточной равновесной минимальной концентрации <5 мкг/мл.
Обоснование доз, предлагаемых для применения в фазе III
С учетом отсутствия четкого эффекта дозы в исследовании примера 3, описанном выше (т.е. дозы 125 мг, 250 мг и 500 мг являются в равной степени эффективными), дозы для применения в фазе III выбирают так, чтобы продемонстрировать эффект дозы лебрикизумаба путем использования как эффективного, так и частично эффективного уровней доз. Для достижения данной цели в программе фазы III используют дозы лебрикизумаба, включающие 250 мг, 125 мг и 37,5 мг, вводимые ПК каждые четыре недели (q4wk). На фигуре 23 показаны PK профили моделированной популяции при использовании указанных доз, с учетом распределения массы тела, подобного наблюдаемому в исследованиях фазы II.
Для демонстрации клинической эффективности в фазе III используют максимальную дозу 250 мг (две ПК инъекции по 1 мл) q4wk. Это единственный дозировочный режим, исследуемый в опытно-экспериментальном исследовании фазы II (пример 2), который демонстрирует эффективность, связанную с частотой тяжелых обострений астмы у пациентов, астма которых не контролируется терапией ICS, из популяции пациентов, предназначенной для лечения. Пациенты, участвующие в исследовании примера 2, имеют астму, не контролируемую лечением ICS в присутствии или в отсутствие другого контролирующего средства, и >90% пациентов, участвующих в исследовании примера 2, принимающих ICS >500 мкг/день, также принимают LABA. При указанном дозировочном режиме почти все (99%) пациенты теоретически достигают целевой Ctrough,ss 10 мкг/мл на основе популяционного моделирования PK (см. таблицу 14), что означает достижение максимальной эффективности. Следовательно, указанную дозу тестируют, чтобы воспроизвести клиническую эффективность, наблюдаемую в фазе II.

Среднюю дозу 125 мг (ПК инъекция объемом 1 мл) q4wk предлагают на основе подобных величин улучшения FEV1, наблюдаемых при 125 и 250 мг q4wk в исследовании фазы II с варьирующей дозой (пример 3). Вполне можно ожидать, что такое же взаимоотношение доза-ответ наблюдается в популяции пациентов с тяжелой астмой для конечного значения частоты обострений, и, следовательно, можно ожидать, что доза 125 мг будет эффективной в исследовании фазы III. Данное предположение дополнительно подтверждается популяционным PK моделированием, которое позволяет предположить, что большая часть (78%) пациентов может достигать целевой Ctrough,ss 10 мкг/мл при использовании указанного дозировочного режима (см. таблицу 14).
Доза 37,5 мг (одна ПК инъекция объемом 0,3 мл) q4wk, предлагаемая для применения в качестве частично эффективной или клинически неэффективной дозы лебрикизумаба, важна для установления зависимости доза-ответ. Указанный режим дозирования выбирают с учетом следующих факторов:
- Способность поддерживать Ctrough,ss ниже 5 мкг/мл у большинства (72%) пациентов и ниже 10 мкг/мл почти у всех (99%) пациентов (см. таблицу 14)
- Достаточное (3,3-кратное) отличие от средней дозы
- Минимальное перекрывание в моделируемом диапазоне воздействия лебрикизумаба на сыворотку со средней дозой (см. таблицу 14), демонстрирующее разные клинические ответы
- Удобный объем инъекции (кратный 0,1 мл), позволяющий уменьшить возможные ошибки дозирования.
Разные показатели эффектов указанного испытания фазы III описаны ниже.
Показатели эффектов
Каждый из нижеследующих конечных эффектов оценивают отдельно у пациентов с высоким уровнем периостина и у пациентов с низким уровнем периостина. Считается, что испытание имеет положительный результат, если первичный конечный эффект наблюдается в группе с высоким уровнем периостина, причем группу, получающую 250 мг лебрикизумаба, сравнивают с группой, получающей плацебо.
ПЕРВИЧНЫЙ РЕЗУЛЬТАТИВНЫЙ ПОКАЗАТЕЛЬ ЭФФЕКТИВНОСТИ
Первичный результативный показатель эффективности представляет собой частоту обострений астмы в течение 52-недельного корректируемого по плацебо периода. В данном испытании обострения астмы определяют как появление новых или усиление старых симптомов астмы (включающих, например, свистящее дыхание, кашель, затруднение дыхания, напряжение в грудной клетке или ночные пробуждения по причине указанных симптомов), которые приводят к необходимости системного введения кортикостероидов или госпитализации. В настоящем документе системное лечение кортикостероидами включает пероральное (т.е. OCS) или парентеральное введение кортикостероидов в течение >3 дней, или посещение отделения неотложной помощи с одной или несколькими дозами парентеральных (в.в. или в.м.) кортикостероидов.
ВТОРИЧНЫЕ РЕЗУЛЬТАТИВНЫЕ ПОКАЗАТЕЛИ ЭФФЕКТИВНОСТИ
Вторичные результативные показатели эффективности на 52 неделе включают: относительное изменение пребронходилататорного FEV1 по сравнению с исходным уровнем на 52 неделе; время до первого обострения астмы в течение 52-недельного периода лечения; изменение парциального давления выдыхаемого оксида азота (FENO) по сравнению с исходным уровнем на 52 неделе; изменение астма-специфического качества жизни, обусловленного здоровьем, оцениваемое по Общей оценке стандартизированной версии анкетного опроса по качеству жизни при астме, (AQLQ(S)) по сравнению с исходным уровнем на 52 неделе; изменение применения резервного лекарственного средства (измеряемое по числу вдыханий в день резервного лекарственного средства или ингаляционного резервного лекарственного средства (т.е. SABA)) по сравнению с исходным уровнем на 52 неделе; частота использования неотложного здравоохранения в связи с астмой (то есть, госпитализации, посещения отделения неотложной помощи и посещения с целью интенсивной терапии при приступах) во время 52-недельного корректируемого по плацебо периода.
ДИАГНОСТИЧЕСКИЕ РЕЗУЛЬТАТИВНЫЕ ПОКАЗАТЕЛИ
Диагностические результативные показатели включают следующие факторы: доля пациентов, которые не испытывают определенных в протоколе обострений астмы в течение 52-недельного корректируемого по плацебо периода; изменение значения утреннего постбронходилататорного максимального потока (л/мин) по сравнению с исходным уровнем на 52 неделе; изменение постбронходилататорного FEV1 по сравнению с исходным уровнем на 52 неделе; время, необходимое для улучшения пребронходилататорного FEV1 на 150 мл в течение 52-недельного корректируемого по плацебо периода; относительное изменение пребронходилататорного FEV1 (литры) по сравнению с исходным уровнем, усредненным для 4-52 недель; относительное изменение форсированной жизненной емкости по сравнению с исходным уровнем на 52 неделе; частота обострений, связанных с ухудшением легочной функции, определенных как обострения, сопровождающиеся снижением PEF или FEVI до уровня, составляющего <60% от максимального значения, на протяжении периода скрининга (визиты 1-3), которые требуют лечения системными кортикостероидами; ухудшение работоспособности, способности к обучению и активности, оцениваемое с помощью Анкетного опроса по связанному с астмой ухудшению производительности и активности (WPAI-Астма), по сравнению с исходным уровнем на 52 неделе; изменение оценки Анкетного опроса-5 по контролю за астмой (ACQ-5) по сравнению с исходным уровнем на 52 неделе; изменение симптомов астмы, измеряемое с помощью Практического индекса симптомов астмы (ASUI) по сравнению с исходным уровнем на 52 неделе; изменение параметров здоровья, оцениваемых с помощью EQ-5D, по сравнению с исходным уровнем на 52 неделе; изменение Общей оценки эффективности лечения (GETE) по сравнению с исходным уровнем на 52 неделе.
Указанные диагностические результативные показатели также можно определить на протяжении 52-недельного периода активного лечения и 24-недельного периода наблюдения. Другие диагностические результативные показатели могут включать частоту и тяжесть побочных эффектов у пациентов, получающих лебрикизумаб в течение >52 недель; изменение уровней интерлейкина-13 (IL-13)/связанных с астмой биомаркеров PD на протяжении 52-недельного периода активного лечения или 24-недельного периода наблюдения; и изменение сывороточных концентраций лебрикизумаба на протяжении 52-недельного периода активного лечения или 24-недельного периода наблюдения.
ОТМЕЧЕННЫЕ ПАЦИЕНТАМИ ЭФФЕКТЫ
Стандартизированная версия анкетного опроса по качеству жизни при астме (AQLQ(S))
AQLQ(S) используют для оценки астма-специфического обусловленного здоровьем качества жизни пациентов (Juniper 2005). Анкетный опрос содержит четыре раздела, включающие ограничение активности, симптомы, эмоциональную функцию и стимулы окружающей среды. Получено разрешение для применения AQLQ(S) в исследуемой здесь популяции. AQLQ(S) содержит описание права отзыва в течение 2 недель. AQLQ(S) дают пациенту до проведения любых других отличных от PRO оценок и перед тем, как пациент получает какую-либо информацию о статусе заболевания или об исследуемом лекарственном средстве, на протяжении данной оценки.
Связанное с астмой ухудшение работоспособности, производительности и активности (WPAI-Астма)
Чтобы оценить ухудшение работоспособности, способности к обучению и активности, дают анкетный опрос WPAI-Астма (Reilly et al. 1993, 1996). Пункты анкетного опроса получены в результате адаптации пунктов аллергия-специфичного анкетного опроса WPAI (WPAI-AS), путем замены всех терминов аллергия на астма. WPAI-AS дают пациенту до проведения любых других отличных от PRO оценок и перед тем, как пациент получает какую-либо информацию о статусе заболевания или об исследуемом лекарственном средстве, на протяжении данной оценки.
Анкетный опрос Euro-QOL 5D (EQ-5D)
EQ-5D представляет собой общий основанный на предпочтении анкетный опрос по обусловленному здоровьем качеству жизни, который дает одно значение показателя состояния здоровья (The EuroQol Group 1990). EQ-5D разработан для самостоятельного заполнения пациентами. EQ-5D дают пациенту до проведения любых других отличных от PRO оценок и перед тем, как пациент получает какую-либо информацию о статусе заболевания или об исследуемом лекарственном средстве, на протяжении данной оценки.
Практический индекс симптомов астмы (ASUI)
ASUI (Revicki 1998) представляет собой анкетный опрос по специфическим для астмы симптомам, включающим кашель, свистящее дыхание, одышку и ночные пробуждения. ASUI дают пациенту до проведения любых других отличных от PRO оценок и перед тем, как пациент получает какую-либо информацию о статусе заболевания или об исследуемом лекарственном средстве, на протяжении данной оценки.
ПРИМЕР 7 - Анализ периостина Elecsys®
Количественное определение периостина проводят с использованием автоматического анализатора Roche cobas e601 Elecsys® (Roche Diagnostics GmbH). Тест проводят в сэндвич-формате, где анализируемый периостин находится между двумя моноклональными антителами, связывающимися с двумя разными эпитопами периостина. Одно антитело является биотинилированным и способно образовывать иммунный комплекс с покрытыми стрептавидином магнитными гранулами. Второе антитело несет комплексообразующий катион рутения в качестве сигнального фрагмента, обеспечивающего потенциалозависимую электрохемилюминесцентную детекцию образованного иммунного комплекса.
А именно, используют следующие реагенты:
- Гранулы (M): Стрептавидин-покрытые магнитные микрочастицы 0,72 мг/мл; консервант.
- Реагент 1 (R1): Антитело против периостина-биотин:
Данное очищенное мышиное моноклональное антитело, соответствующее покрывающему антителу 25D4, используемому в примере 4, применяется в биотинилированной форме >1,0 мг/л; трис-буфер >100 ммоль/л, pH 7,0; консервант.
- Реагент 2 (R2): Антитело против периостина-Ru(bpy):
Данное очищенное мышиное моноклональное антитело против периостина, соответствующее детекционному антителу 23B9, используемому в примере 4, применяется в меченой форме (для мечения антитела используют комплекс (трис(2,2'-бипиридил)рутений(II)-(Ru(bpy))) >1,0 мг/л; трис-буфер >100 ммоль/л, pH 7,0; консервант.
Иммунологический анализ проводят с использованием двух инкубаций. Во время первой инкубации, проводимой в течение примерно 9 минут, периостин в 20 мкл образца и биотинилированное моноклональное антитело против периостина (R1) образуют комплекс. На второй стадии инкубации, также проводимой в течение 9 минут, во флакон, в котором проводили первую инкубацию, добавляют рутенилированное моноклональное антитело против периостина (R2) и покрытые стрептавидином микрочастицы (M), при этом в результате взаимодействия биотина и стрептавидина образуется 3-членный сэндвич-комплекс, связанный с твердой фазой (микрочастицы).
Реакционную смесь переносят в измерительную кювету, где микрочастицы под действием магнитного поля притягиваются к поверхности платинового электрода. Несвязанные вещества отмывают и клетки промывают ProCell, реагентом, содержащим трипропиламин. Затем на электрод подают напряжение, которое индуцирует хемилюминесцентную эмиссию, измеряемую с помощью фотоумножителя.
Результаты рассчитывают с использованием калибровочной кривой, полученной на приборе путем калибровки по двум точкам, и теоретической кривой, полученной с использованием штрих-кода реагента. Калибратор 1 не содержит анализируемого вещества, тогда как калибратор 2 содержит 50 нг/мл рекомбинантного человеческого периостина в забуференной основе. Чтобы проверить калибровку, используют два контроля, содержащие примерно 30 и 80 нг/мл периостина.
ПРИМЕР 8 - Сравнение анализов периостина E4 и Elecsys®
Уровни периостина измеряют в образцах сыворотки пациента, полученных в процессе клинических испытаний, описанных в примере 2 и в примере 3, с помощью способов, подобных анализу E4 (пример 4) и анализу периостина Elecsys® (пример 7). Результаты, полученные с использованием образцов обоих испытаний, показывают, что значения периостина перекрываются. На протяжении анализа сравнивают вариабельность и распространение. Как правило, средние значения результатов анализа Elecsys® = или >2 раз превышают результаты анализа E4. См. фигуру 17, т.е. среднее значение, полученное с помощью анализа периостина Elecsys®, составляет 50-51 нг/мл, а среднее значение, полученное с помощью анализа периостина E4, составляет 23 нг/мл.
Хотя приведенное выше описание изобретения содержит в качестве иллюстрации некоторые подробности и примеры для облегчения понимания, описания и примеры не следует рассматривать как ограничение объема данного изобретения. Описания всей цитирующейся здесь патентной и научной литературы специально включены в настоящий документ в качестве ссылки во всей полноте.

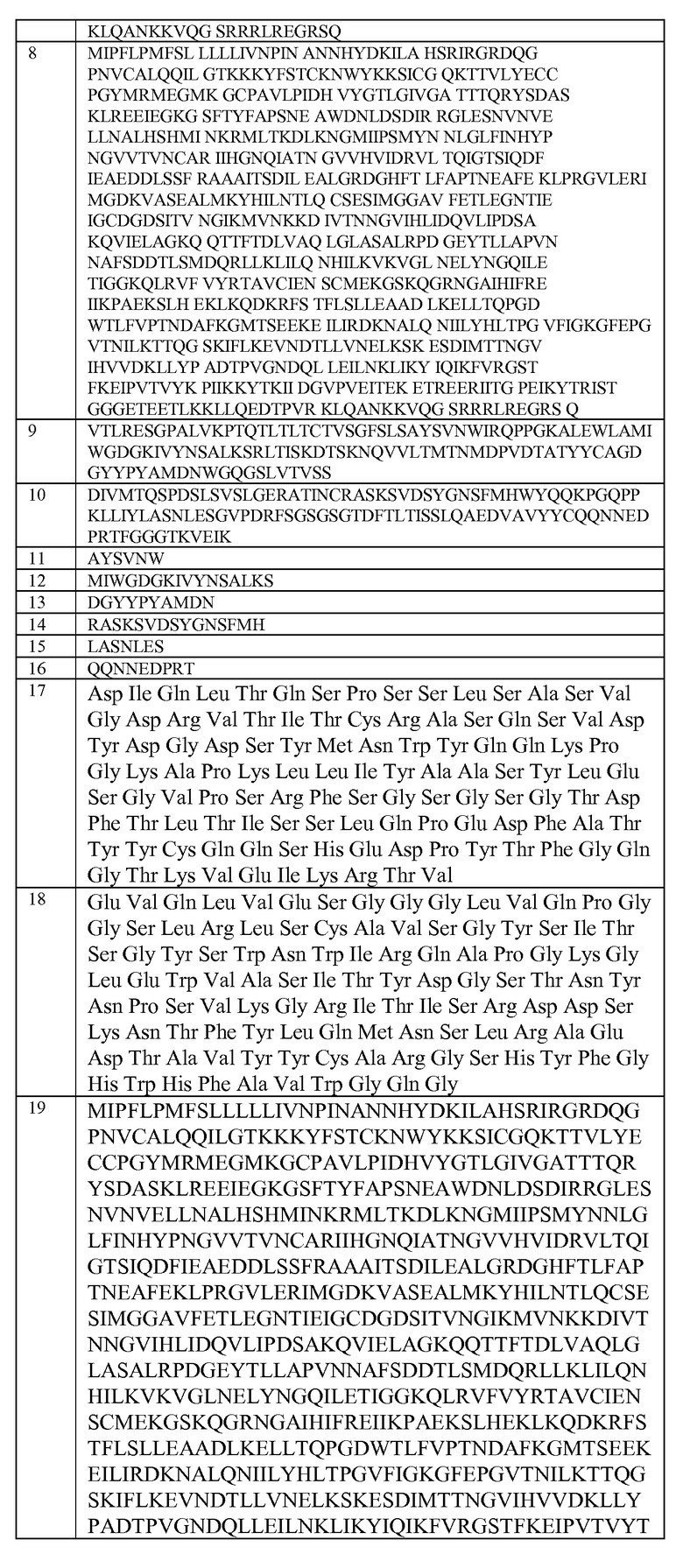


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2011 |
|
RU2578468C2 |
| СПОСОБЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ, СВЯЗАННЫЕ С ИНГИБИРОВАНИЕМ TH2 | 2020 |
|
RU2832013C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ АСТМЫ | 2009 |
|
RU2607569C2 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ IL-13 ДЛЯ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА | 2017 |
|
RU2752785C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-33 | 2020 |
|
RU2838119C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2713406C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2020 |
|
RU2832774C2 |
| ТЕРАПЕВТИЧЕСКИЕ И ДИАГНОСТИЧЕСКИЕ СПОСОБЫ ДЛЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ ТУЧНЫМИ КЛЕТКАМИ | 2019 |
|
RU2795180C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2018 |
|
RU2793745C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ФОРСИРОВАННОГО ОБЪЕМА ВЫДОХА У БОЛЬНЫХ АСТМОЙ С ПРИМЕНЕНИЕМ БЕНРАЛИЗУМАБА | 2014 |
|
RU2703568C2 |
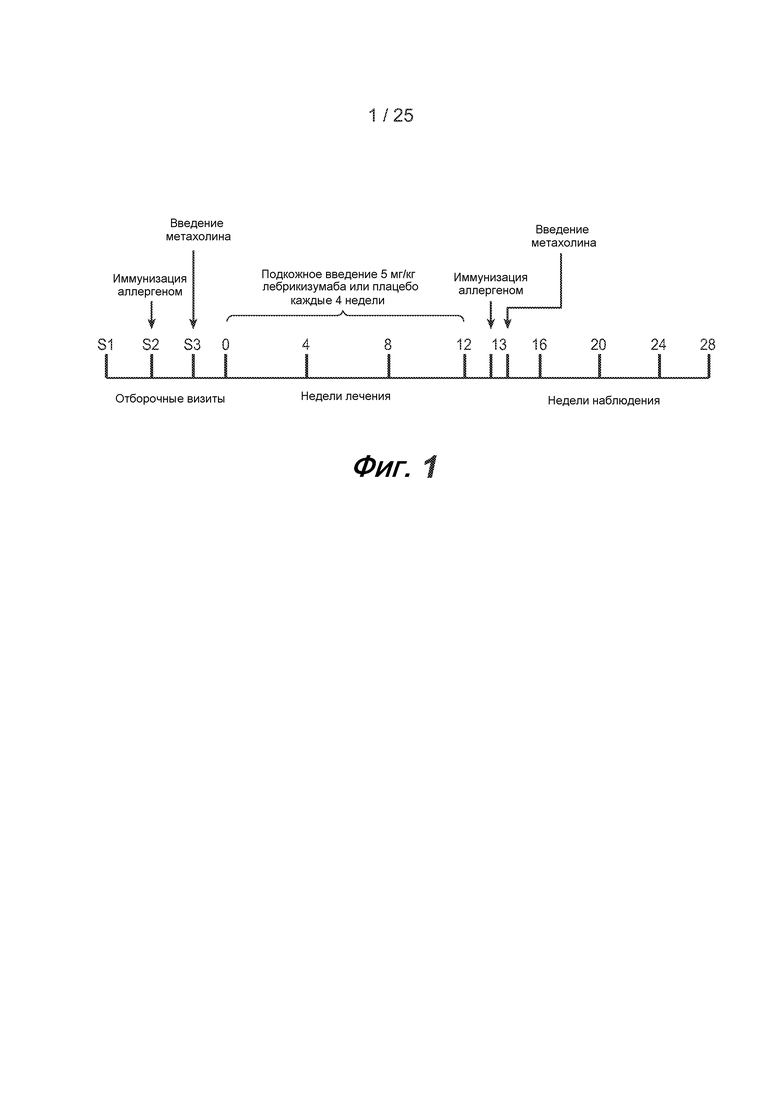
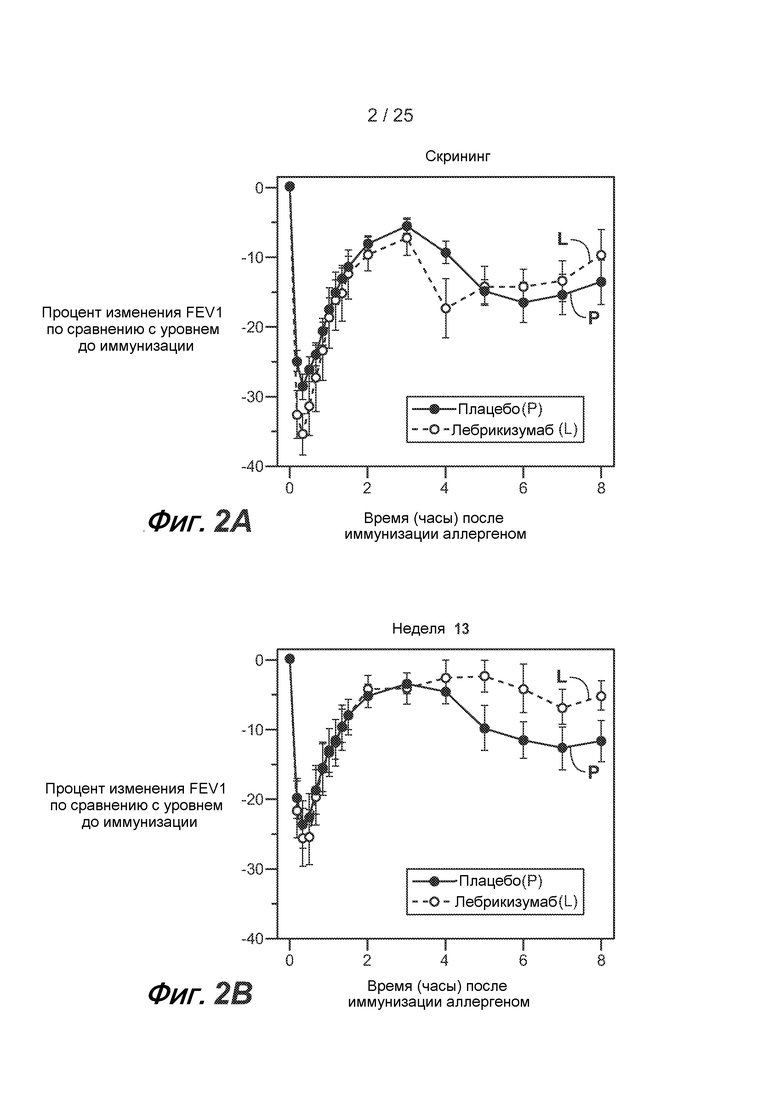
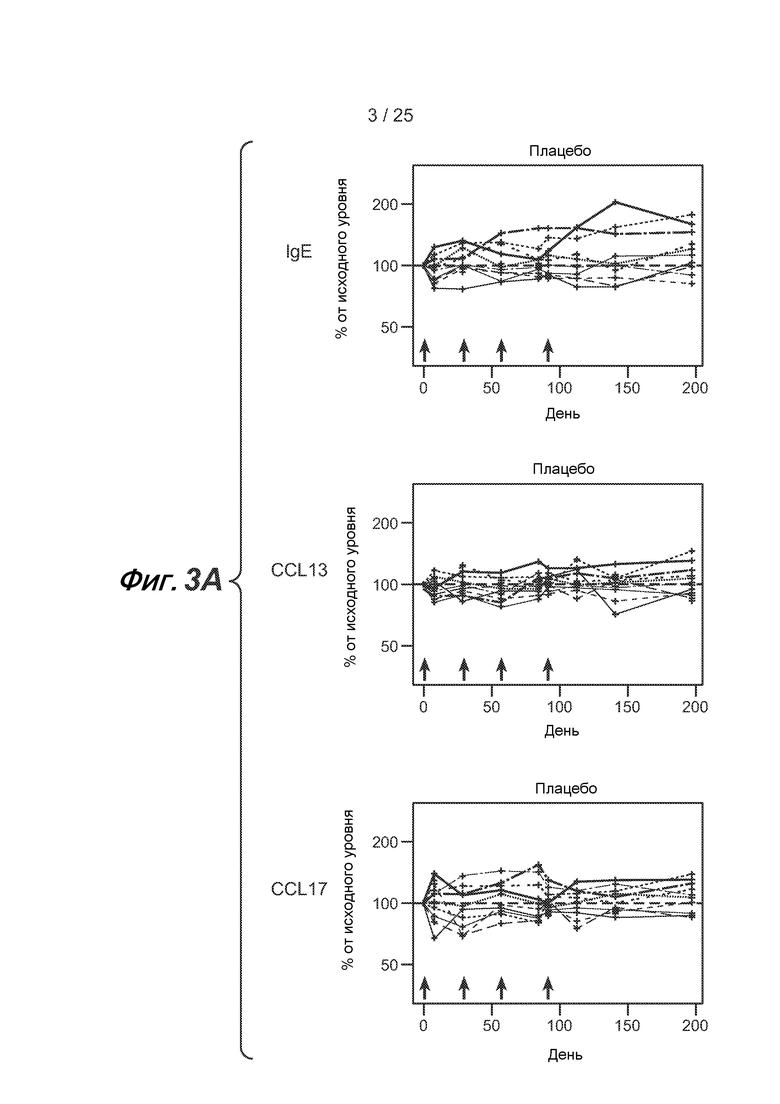
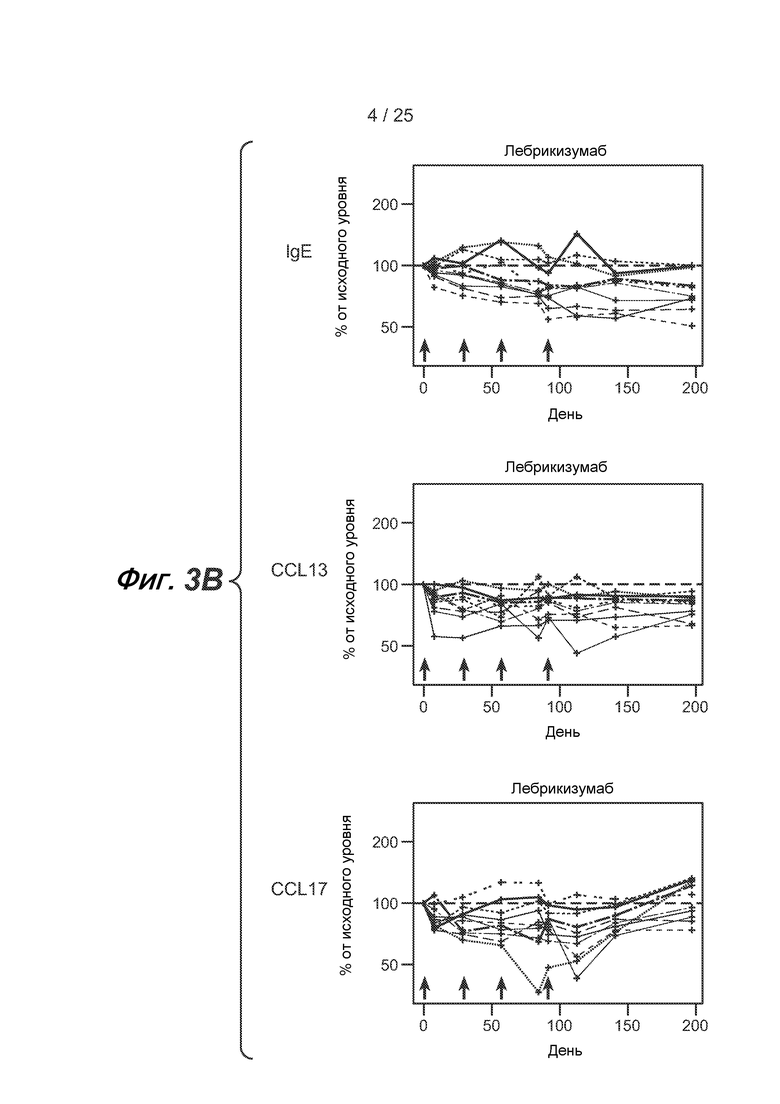
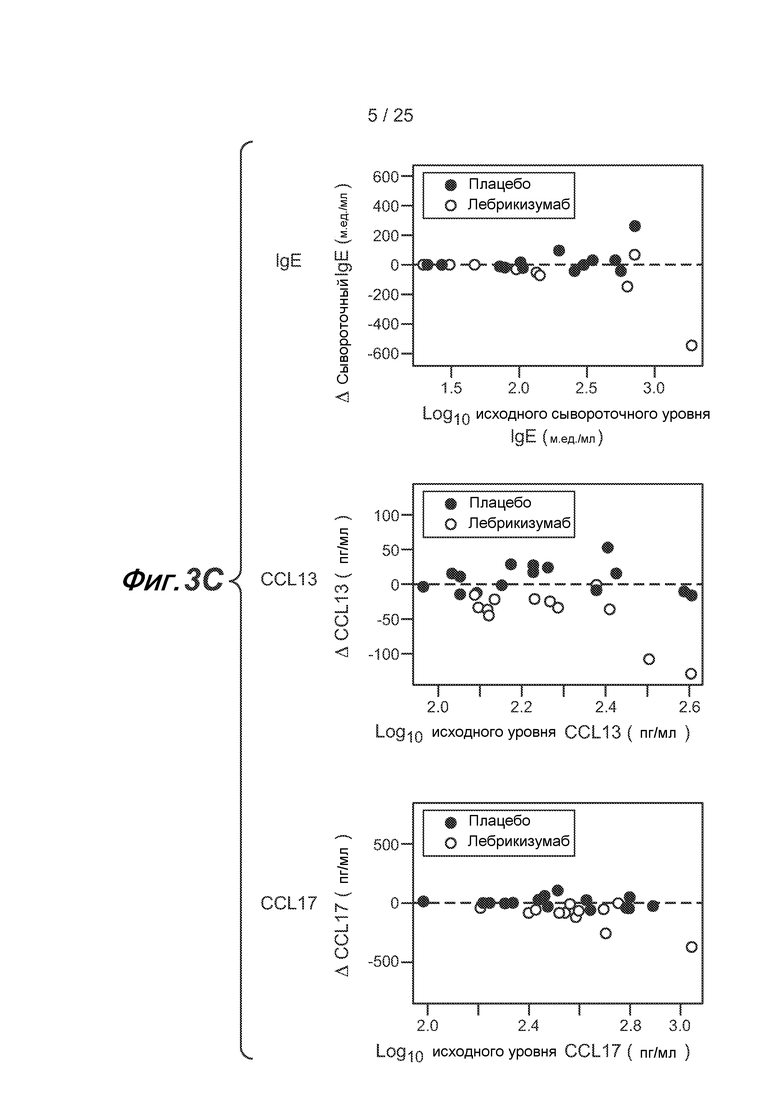
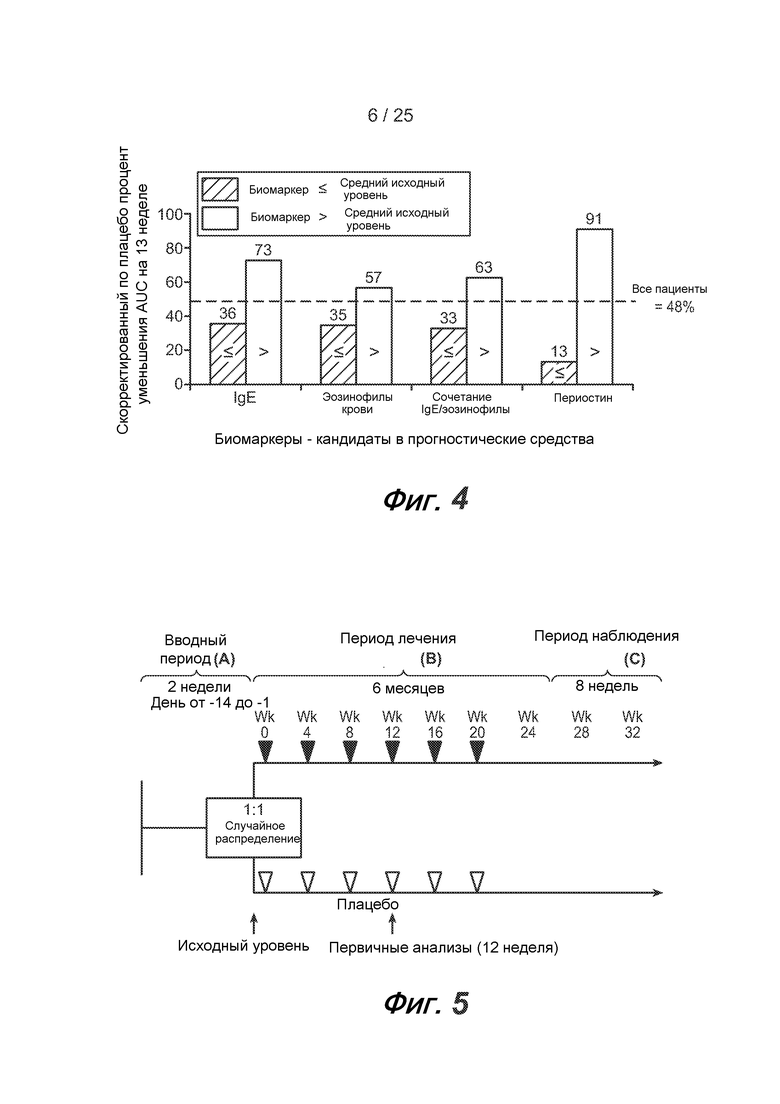
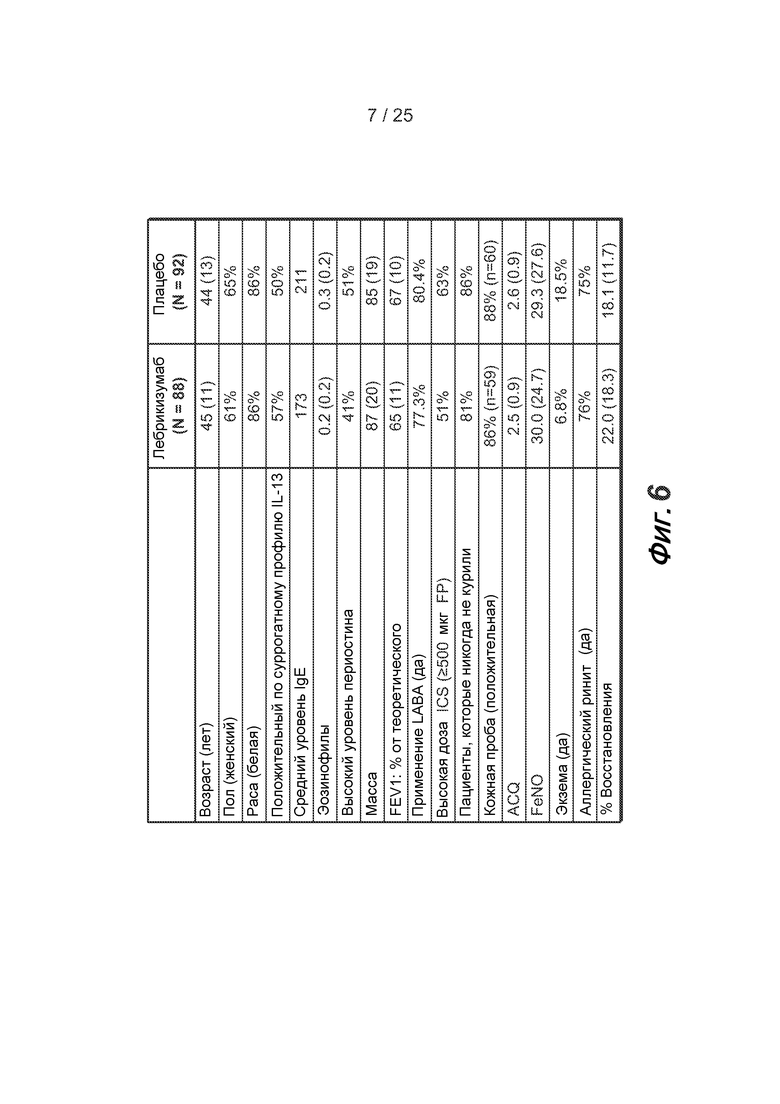
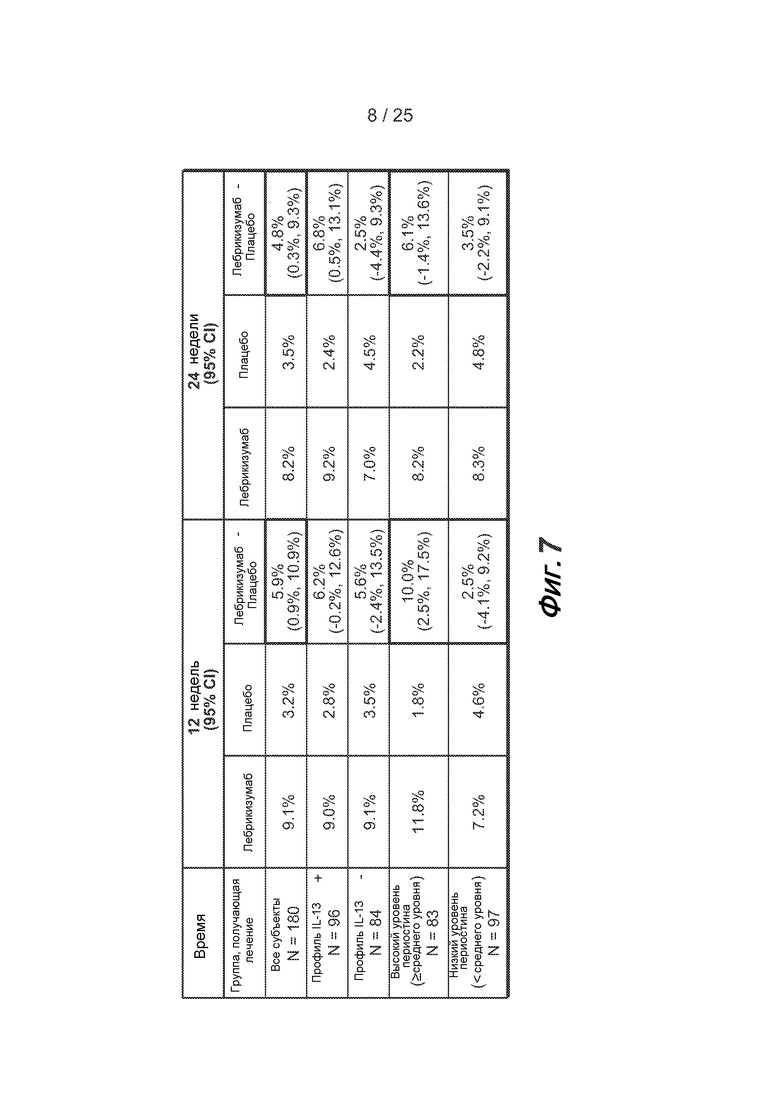
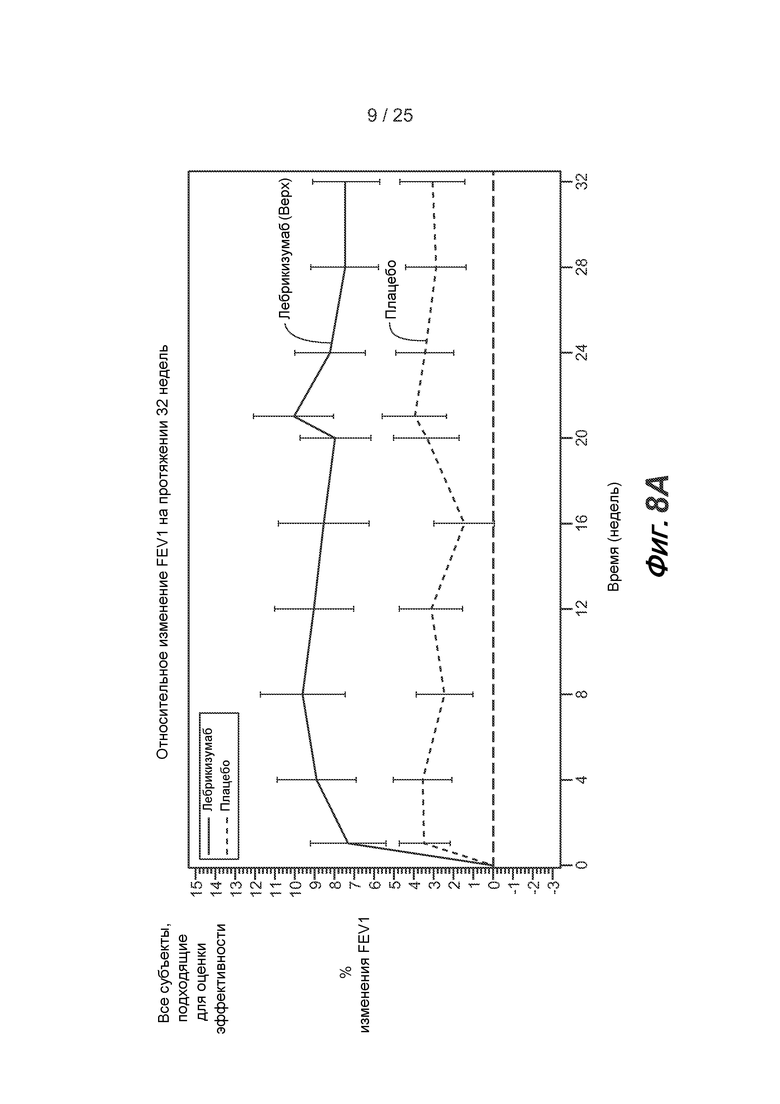
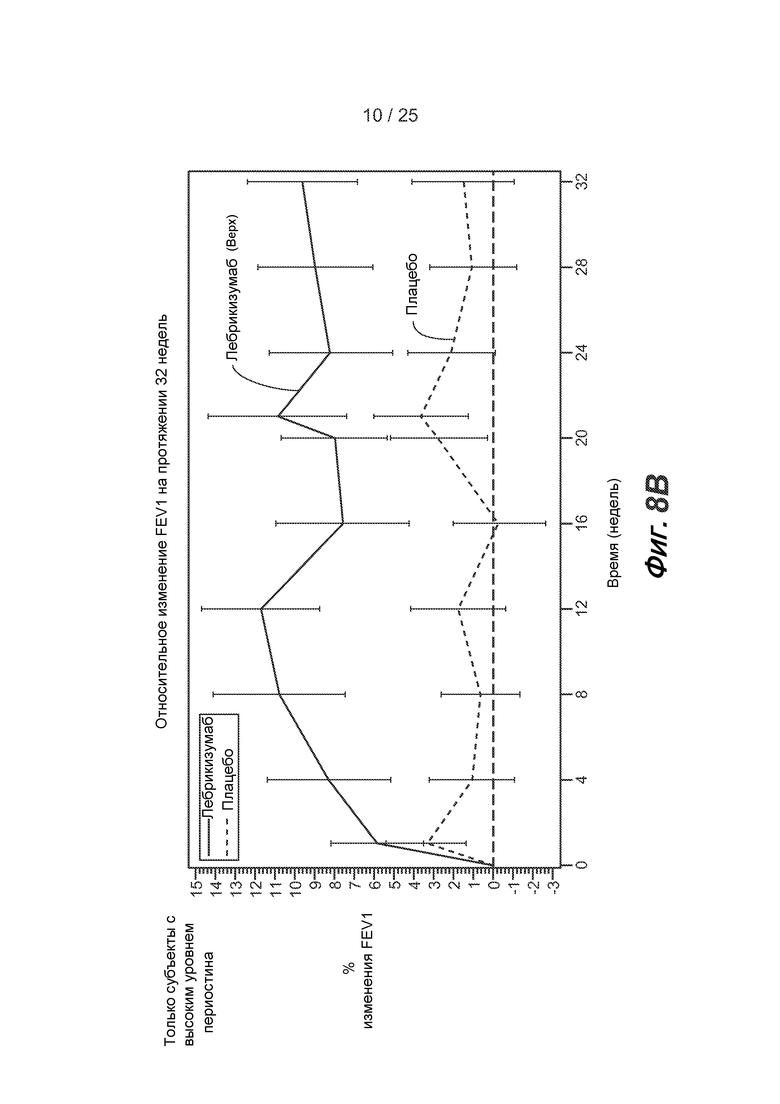
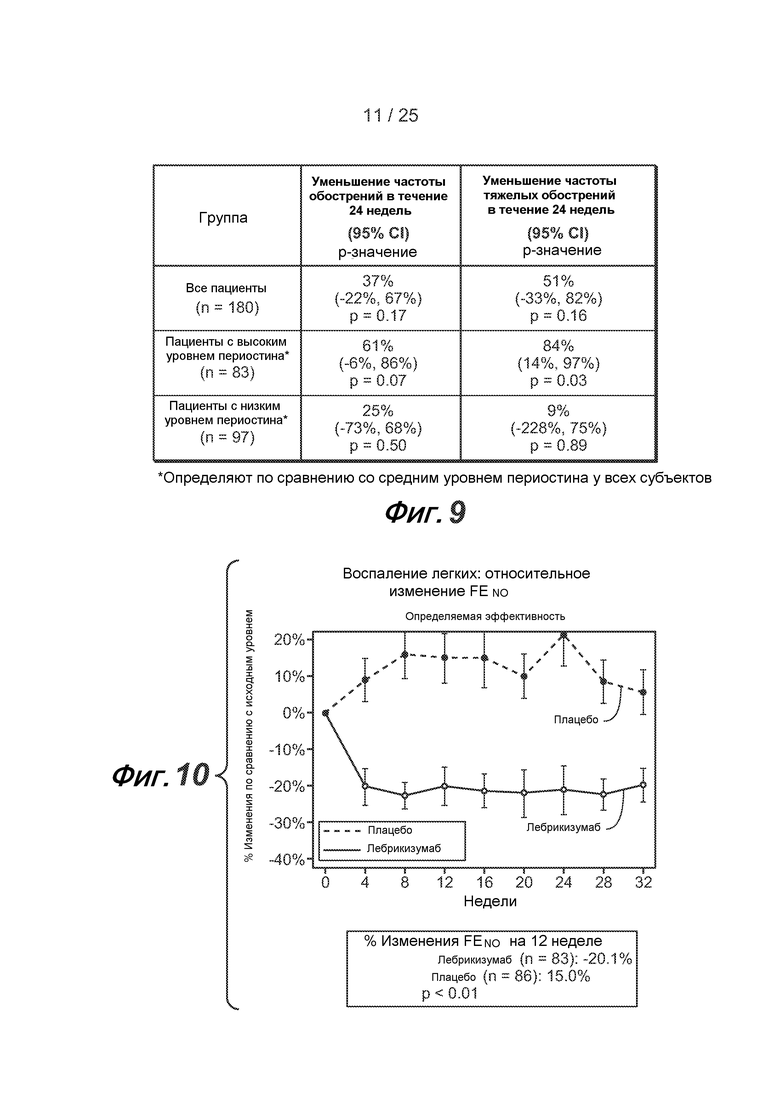

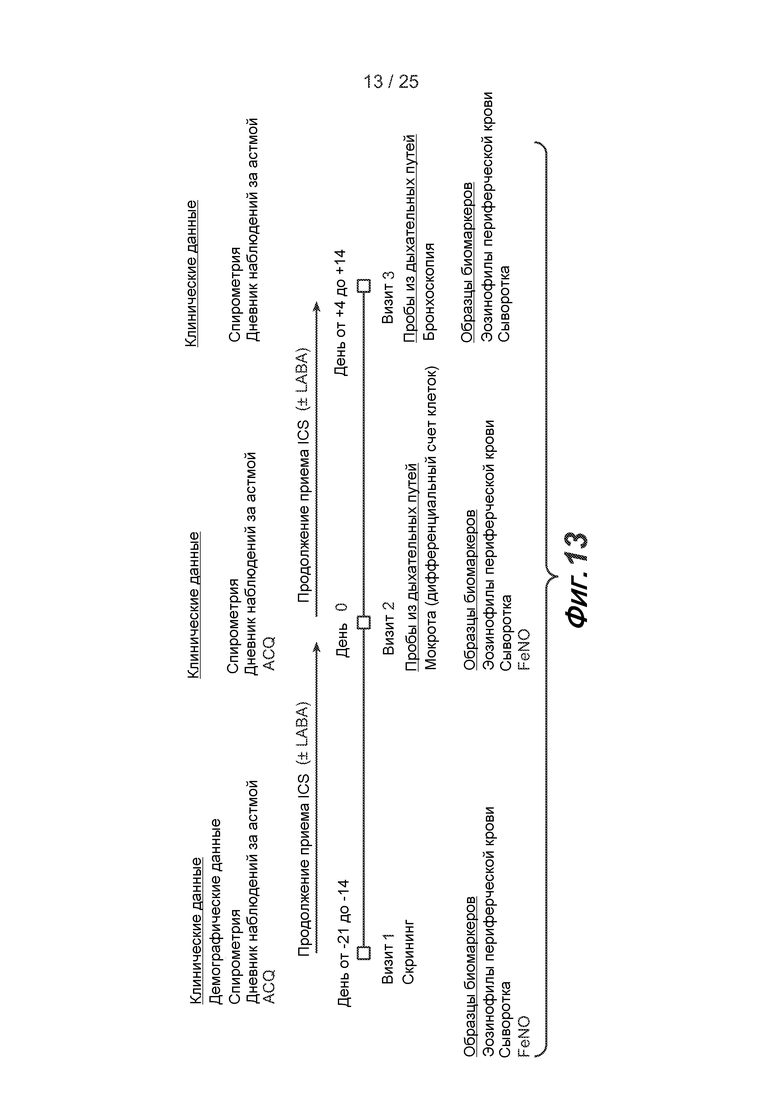
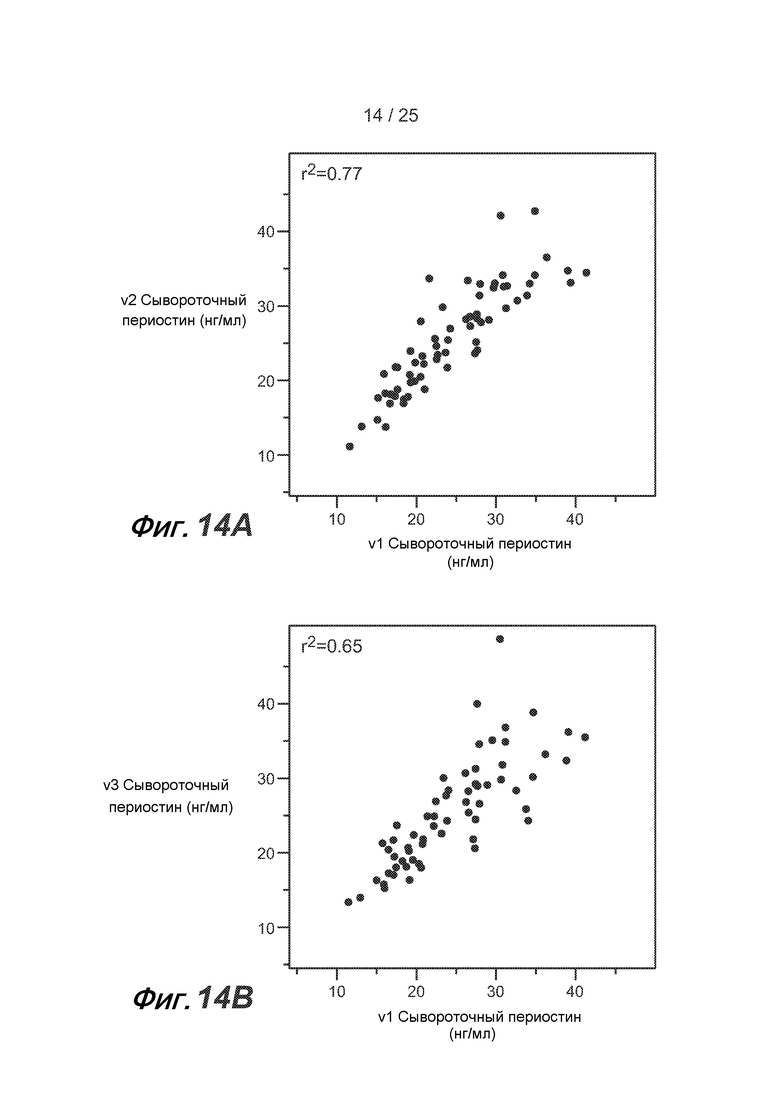
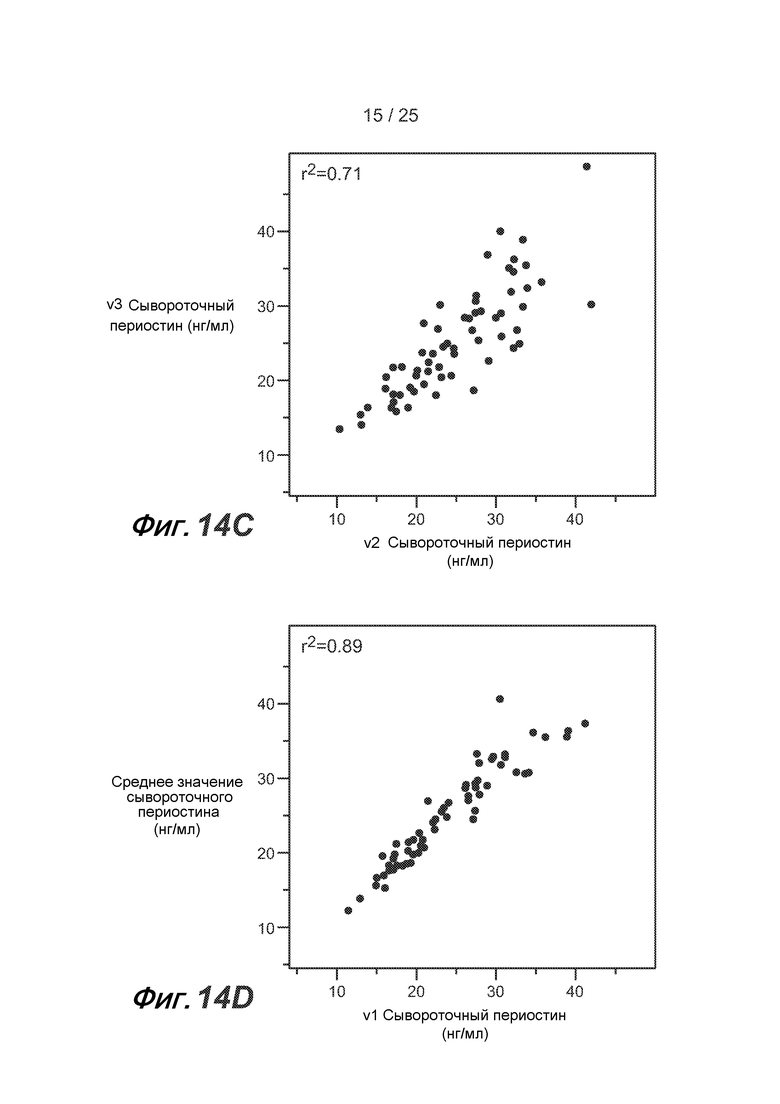
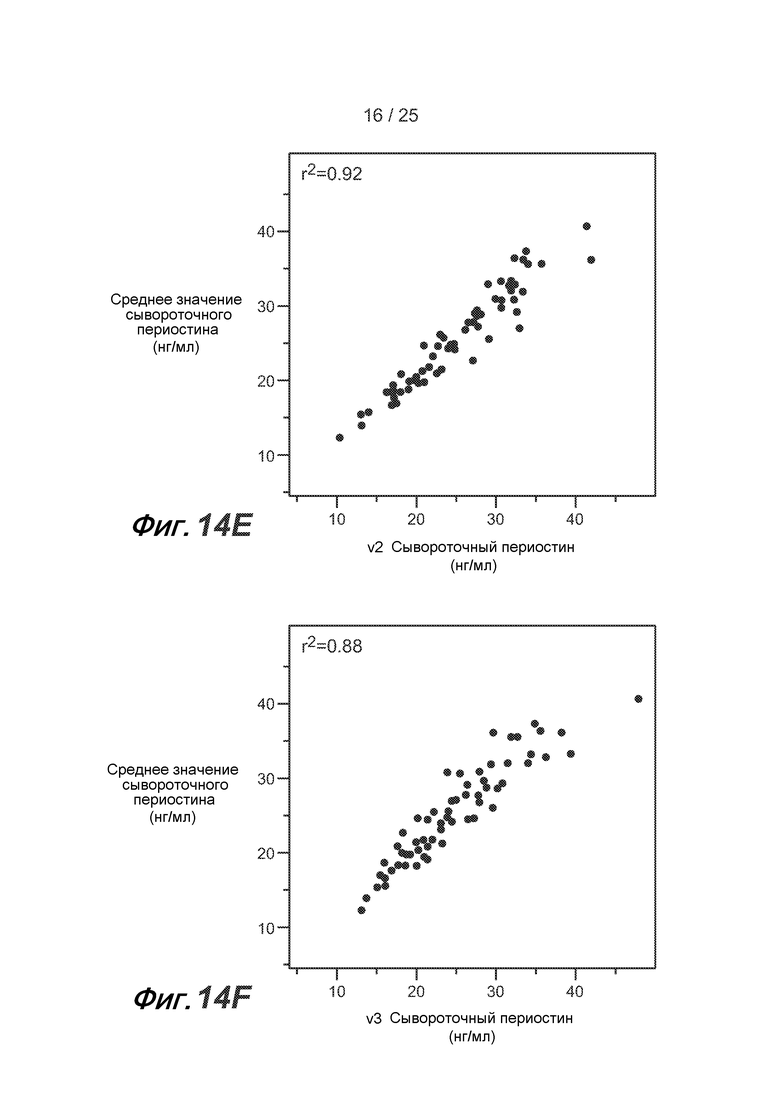
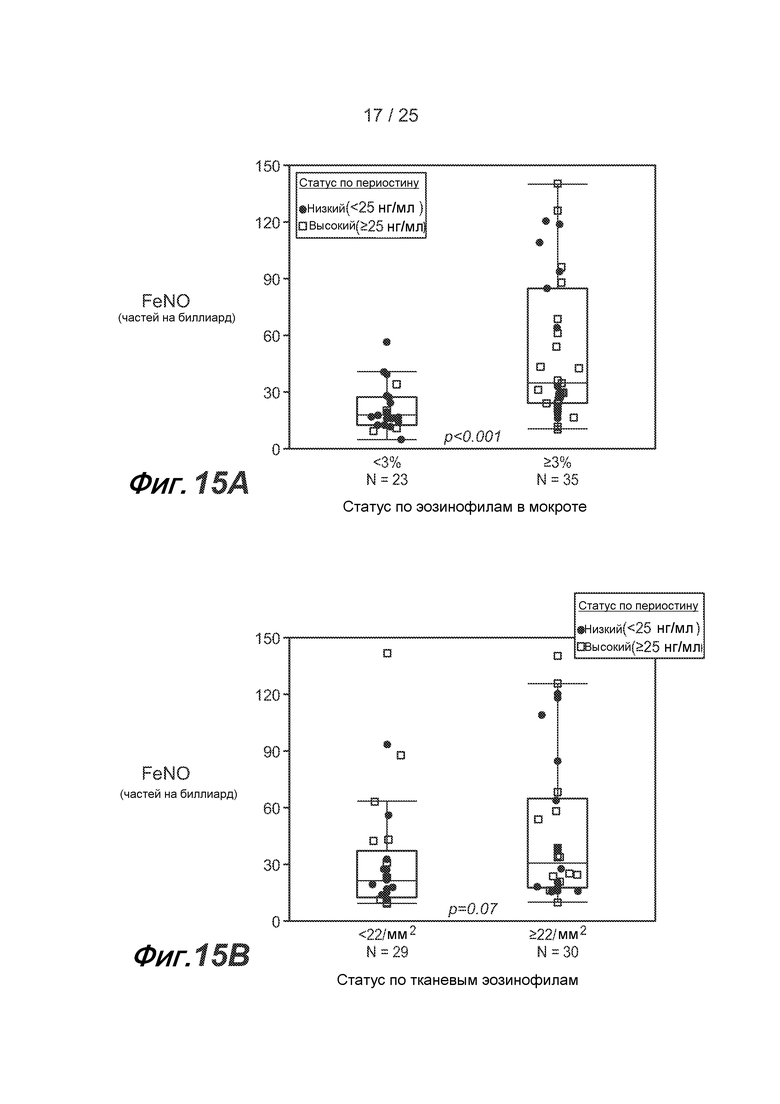
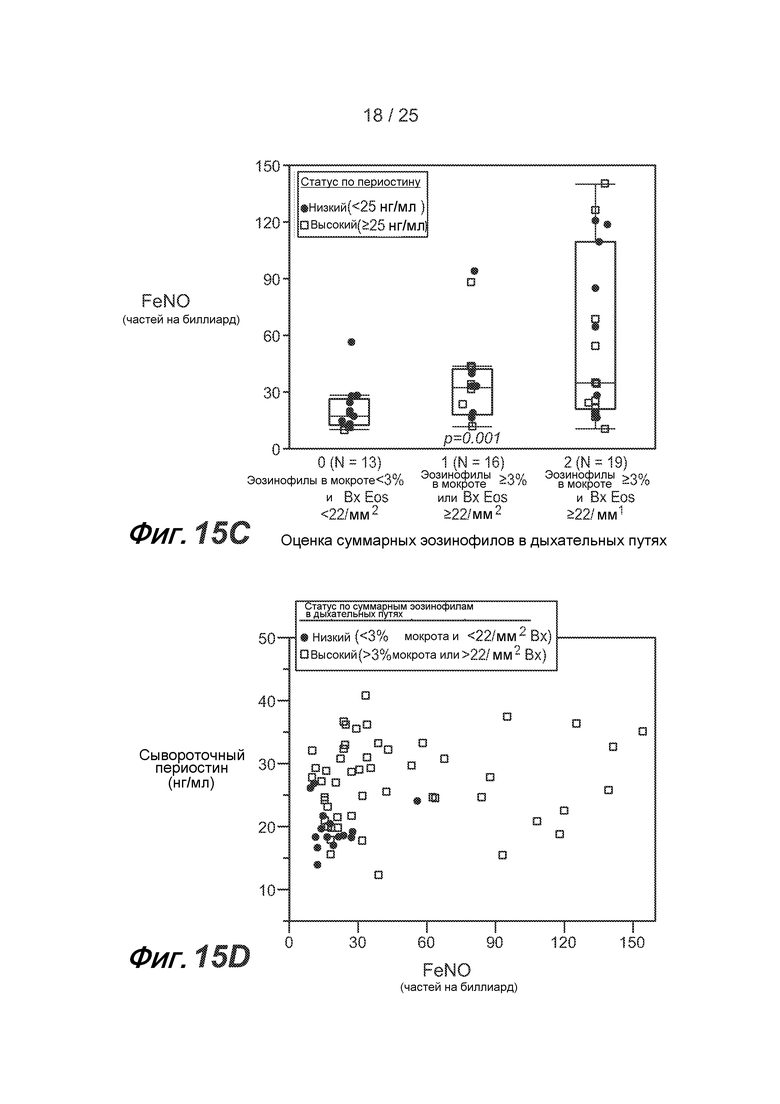
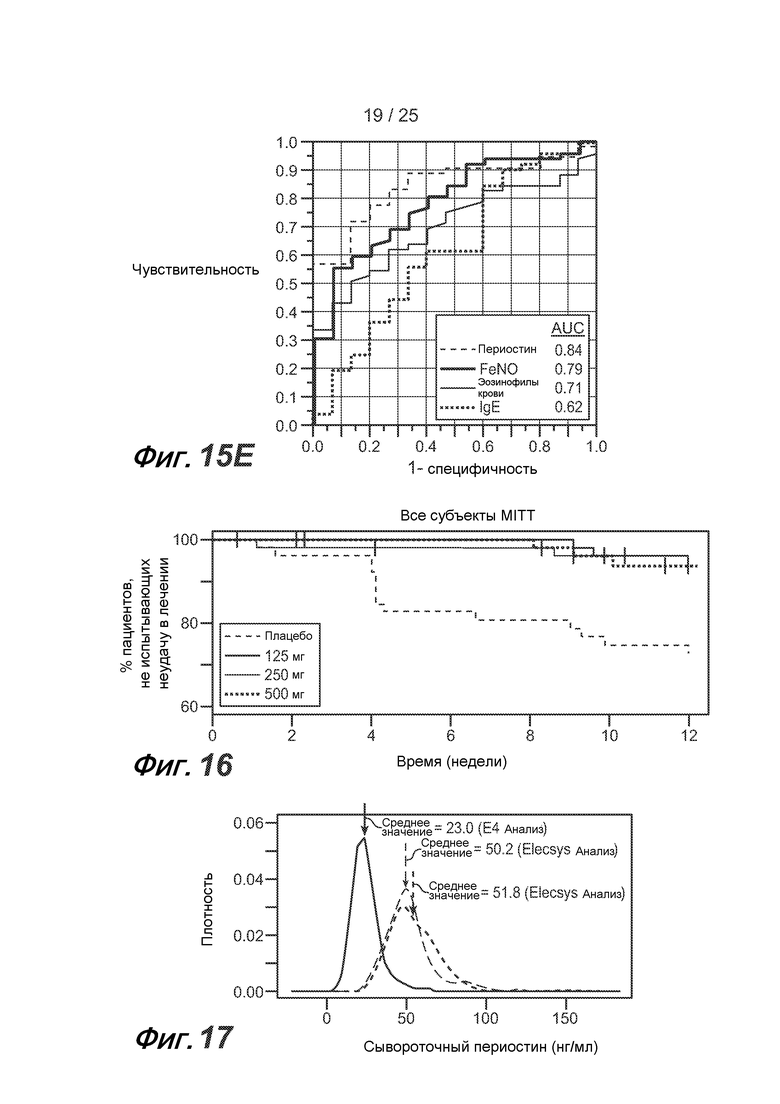
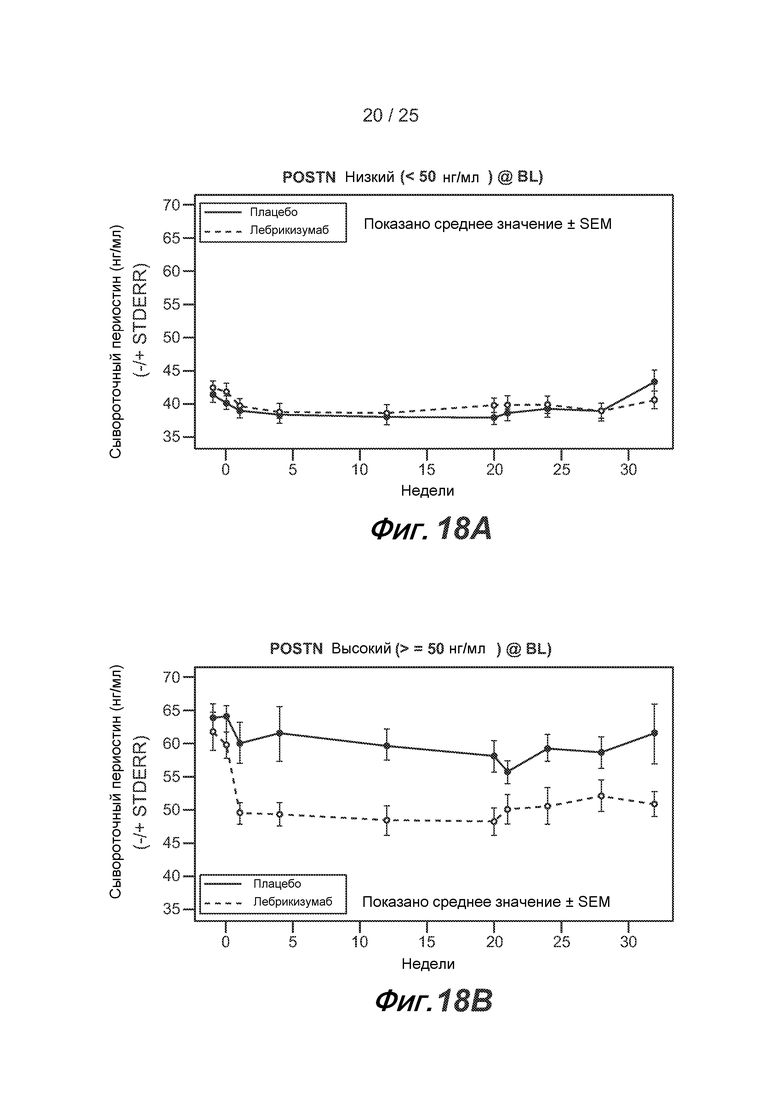
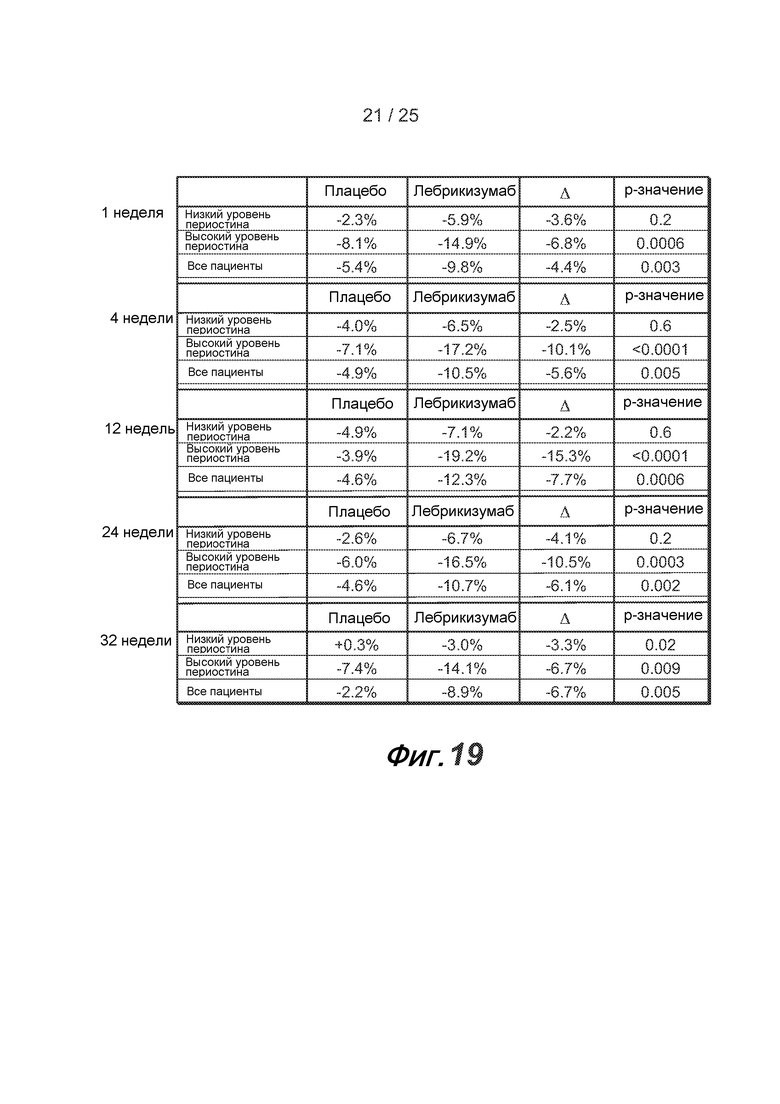
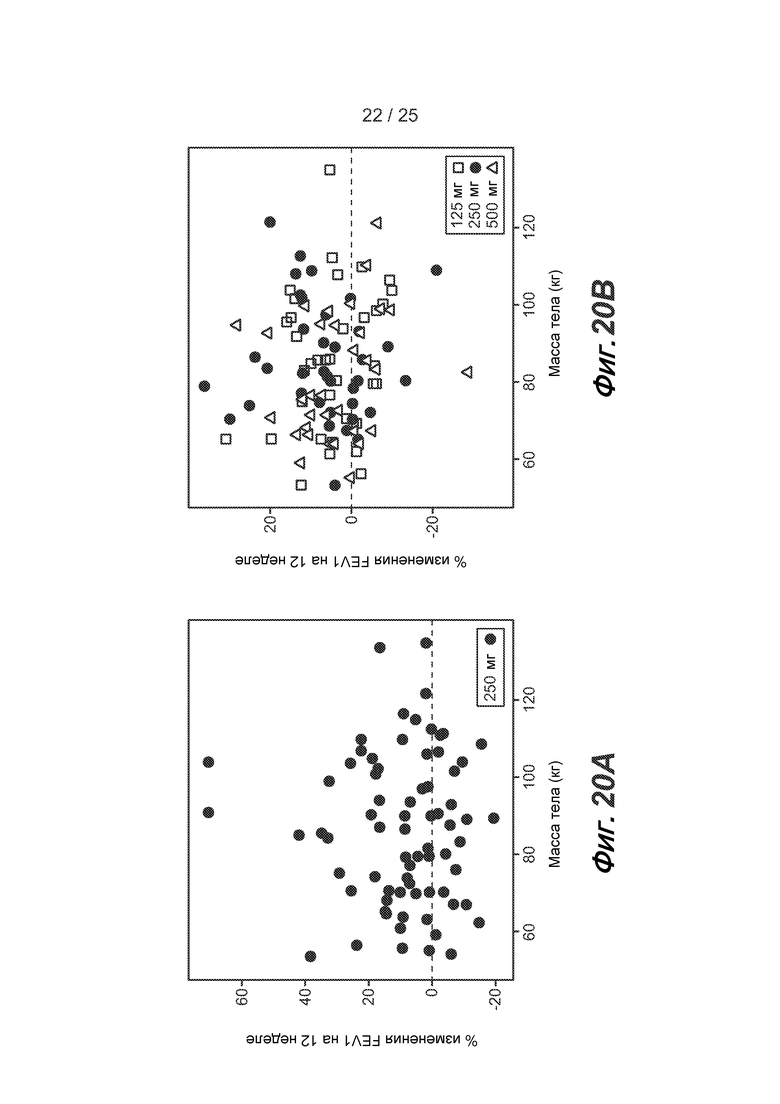
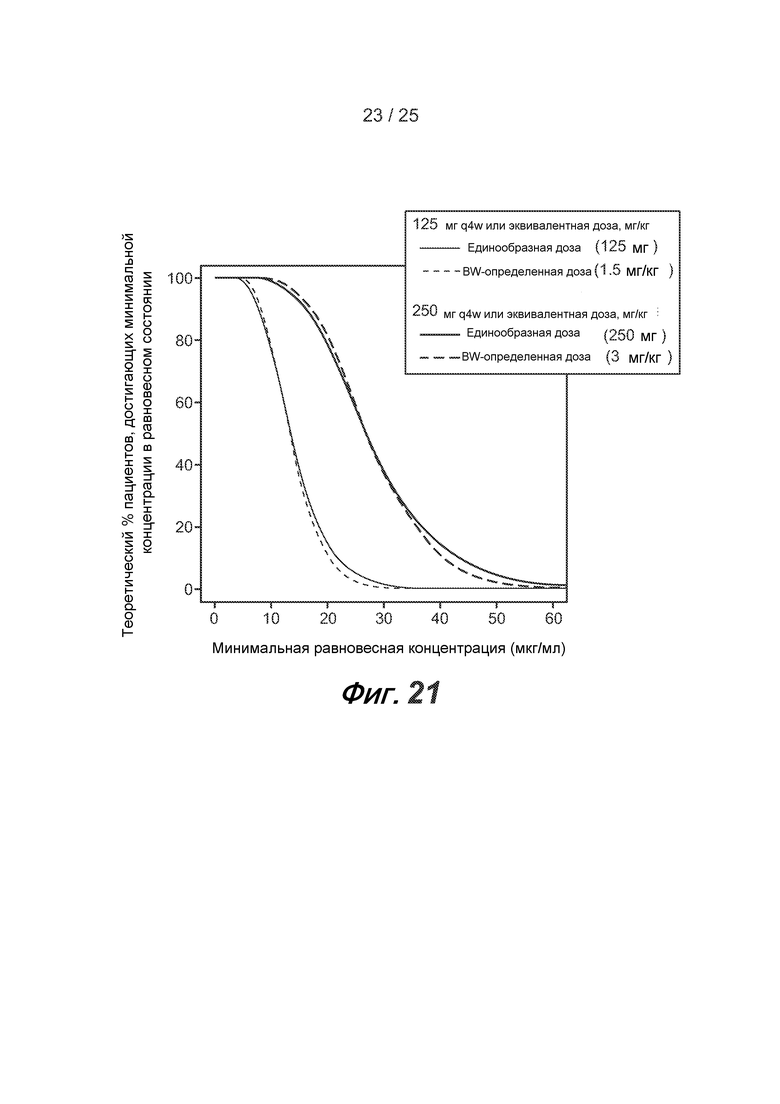
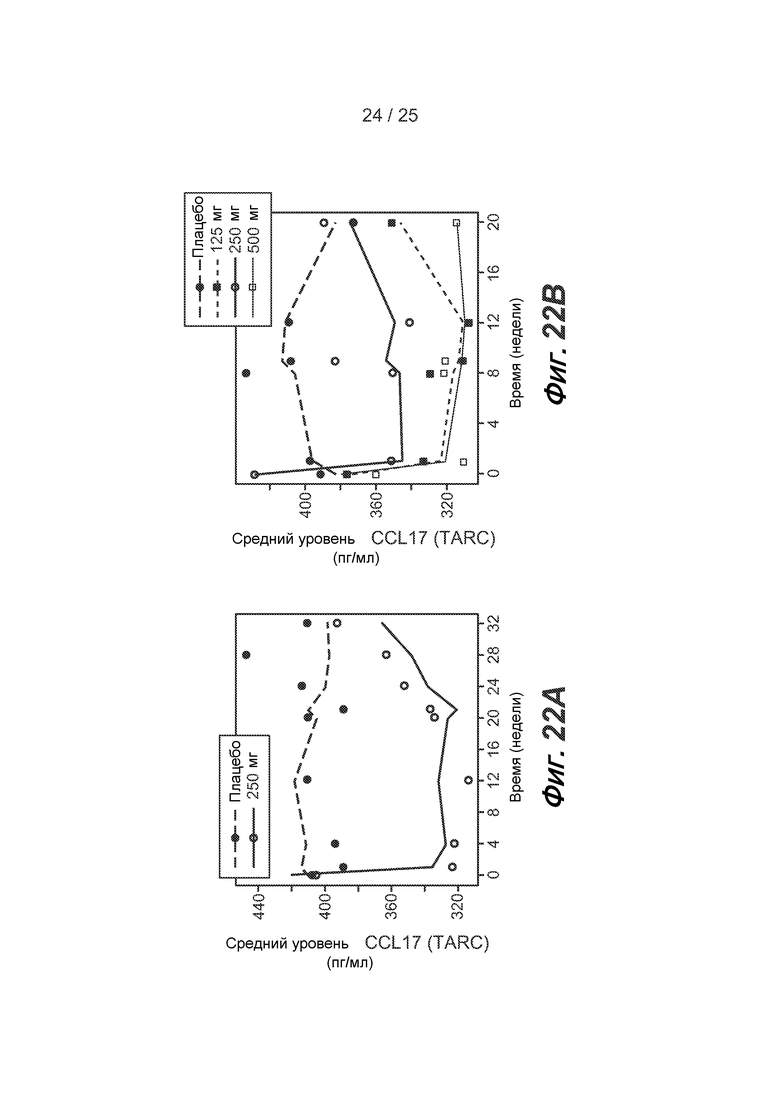
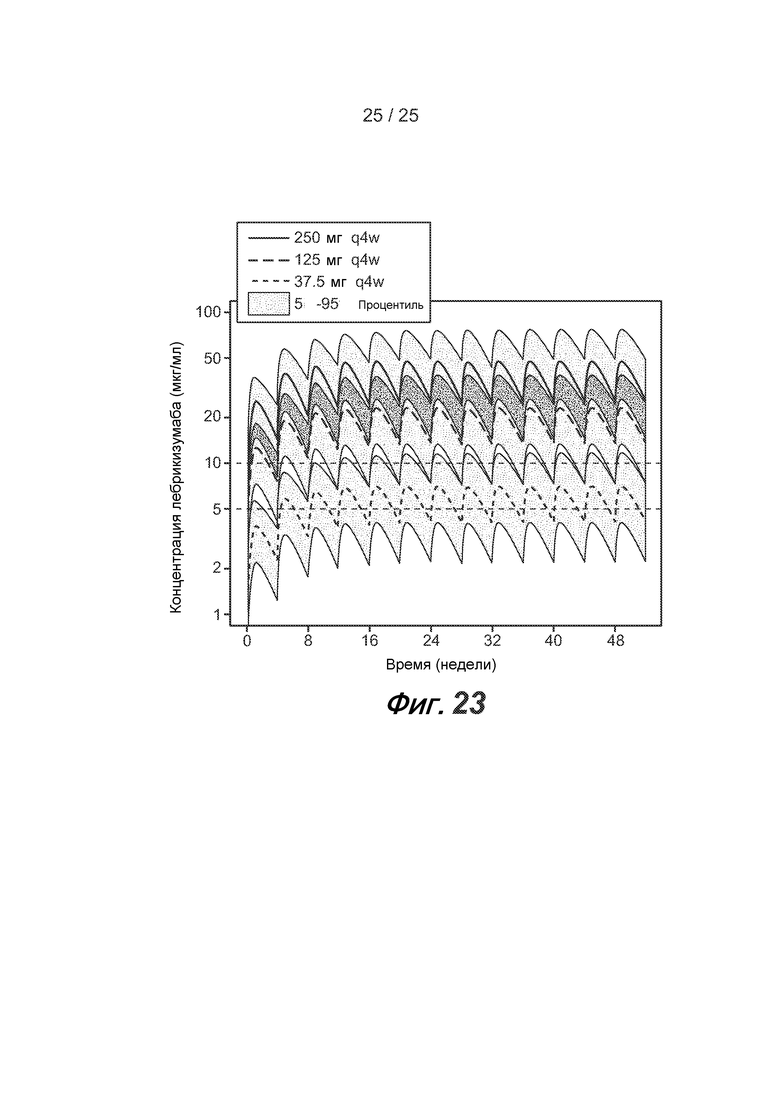
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для определения общего периостина в биологическом образце, полученном от астматического пациента. Для этого с целью стратификации/классификации астматических пациентов на чувствительных и не чувствительных к терапевтическому лечению ингибитором пути TH2 набор содержит антитело, которое связывается с общим периостином, и вкладыш в упаковку, где общий периостин содержит изоформы человеческого периостина 1, 2, 3 и 4. Группа изобретений также относится к набору для измерения общего периостина у астматического пациента, чтобы определить, является ли астматический пациент положительным по эозинофильному воспалению (EIP). Использование данной группы изобретений позволяет провести диагностику у пациента статуса EIP с помощью общего анализа периостина, а также определить чувствительность пациента к терапевтическому лечению ингибитором пути TH2. 3 н. и 61 з.п. ф-лы, 8 пр., 14 табл., 23 ил.
1. Набор для детекции общего периостина в биологическом образце, полученном от астматического пациента, с целью стратификации/классификации астматических пациентов на чувствительных и не чувствительных к терапевтическому лечению ингибитором пути TH2, где указанный набор содержит антитело, которое связывается с общим периостином, и вкладыш в упаковку, где общий периостин содержит изоформы человеческого периостина 1, 2, 3 и 4.
2. Набор по п. 1, где антитело содержит (i) последовательности гипервариабельного участка (HVR) SEQ ID NO: 1 и последовательности HVR SEQ ID NO: 2 или (ii) последовательность HVR SEQ ID NO: 3 и последовательность HVR SEQ ID NO: 4.
3. Набор по п. 2, где антитело содержит последовательности SEQ ID NO: 1 и SEQ ID NO: 2.
4. Набор по п. 2, где антитело содержит последовательности SEQ ID NO: 3 и SEQ ID NO: 4.
5. Набор по п. 1, где антитело представляет собой моноклональное антитело.
6. Набор по п. 1, где антитело представляет собой химерное антитело.
7. Набор по п. 1, где антитело содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 1.
8. Набор по п. 1, где антитело содержит последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 2.
9. Набор по п. 1, где антитело содержит последовательность VH, по меньшей мере на 95% гомологичную последовательности, представленной в SEQ ID NO: 1, и последовательность VL, по меньшей мере на 95% гомологичную последовательности, представленной в SEQ ID NO: 2.
10. Набор по п. 1, где антитело содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 3.
11. Набор по п. 1, где антитело содержит последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 4.
12. Набор по любому из пп. 1-11, где антитело представляет собой Fv, Fab, Fab’, scFv, диатело или фрагмент F(ab')2.
13. Набор по любому из пп. 1-11, где антитело представляет собой антитело IgG1, IgG2, IgG3 или IgG4.
14. Набор по любому из пп. 1-11, где антитело конъюгировано с меткой или фрагментом.
15. Набор по п. 14, где фрагмент представляет собой биотин.
16. Набор по п. 14, где фрагмент представляет собой Ru(bpy).
17. Набор по п. 1, содержащий (i) первое антитело против периостина, содержащее последовательности HVR SEQ ID NO: 1 и последовательности HVR SEQ ID NO: 2, и (ii) второе антитело против периостина, содержащее последовательности HVR SEQ ID NO: 3 и последовательности HVR SEQ ID NO: 4.
18. Набор по любому из пп. 1-11, где общий периостин определяют с помощью EIDA, включающего следующие стадии:
a) определение количества общего периостина в образце, полученном от астматического пациента,
b) сравнение количества общего периостина, определенного на стадии a), со стандартным количеством,
c) отнесение указанного пациента к категории чувствительного или не чувствительного к лечению на основе сравнения, проведенного на стадии b),
где стандартное количество для пациента, чувствительного к лечению, составляет 23 нг/мл или более при использовании анализа E4 на стадии а) и где стандартное количество для пациента, чувствительного к лечению, составляет 50 нг/мл или более при использовании анализа периостина Elecsys® на стадии a).
19. Набор по любому из пп. 1-11, где общий периостин представляет собой сывороточный периостин, который измеряют с помощью иммунологического анализа.
20. Набор по п. 19, где иммунологический анализ представляет собой иммунологический сэндвич-анализ.
21. Набор по п. 20, где иммунологический сэндвич-анализ проводят с помощью анализатора Elecsys®.
22. Набор по любому из пп. 1-11, где пациент страдает умеренной или тяжелой астмой.
23. Набор по любому из пп. 1-11, где астма или респираторное расстройство не контролируется кортикостероидом.
24. Набор по п. 23, где кортикостероид представляет собой ингаляционный кортикостероид.
25. Набор по п. 24, где ингаляционный кортикостероид представляет собой Qvar®, Pulmicort®, Symbicort®, Aerobid®, Flovent®, Flonase®, Advair® или Azmacort®.
26. Набор по любому из пп. 1-11, где пациенту также вводят второе контролирующее средство.
27. Набор по п. 26, где второе контролирующее средство представляет собой бронходилататор длительного действия (LABD).
28. Набор по п. 27, где LABD представляет собой LABA, LTRA, LAMA, теофиллин или OCS.
29. Набор по п. 28, где LABD представляет собой Symbicort®, Advair®, Brovana®, Foradil®, PerforomistTM или Serevent®.
30. Набор по любому из пп. 1-11, где ингибитор пути TH2 ингибирует мишень ITK, BTK, IL-9, IL-5, IL-13, IL-4, OX40L, TSLP, IL-25, IL-33, IgE , рецептор IL-9, рецептор IL-5, рецептор IL-4 альфа, рецептор IL-13 альфа1 , рецептор IL-13 альфа2, OX40, TSLP-R, IL-7Rальфа (корецептор TSLP), IL17RB (рецептор IL-25), ST2 (рецептор IL-33), CCR3, CCR4, CRTH2, FcepsilonRI, FcepsilonRII/CD23 (рецепторы IgE), Flap, Syk киназа, CCR4 или TLR9 или он представляет собой мультицитокиновый ингибитор CCR3, IL5, IL3 или GM-CSF.
31. Набор по п. 30, где ингибитор пути TH2 представляет собой MEDI-528, меполизумаб, ресилизумаб, IMA-026, IMA-638 (или анрукинзумаб), тралокинумаб, AER-001, ABT-308, XOLAIR, QGE-031, MEDI-4212, MEDI-563 (бенрализумаб), AMG-317, R-1671, AMG-853, AP768, AP-761, MLN6095, ACT129968, GSK2190915), R-343, PF3526299, AMG-761, QAX-935 или TPI ASM8.
32. Набор по любому из пп. 1-11, где ингибитор пути TH2 представляет собой ингибитор пути анти-IL13/IL4 или средство, связывающее IgE.
33. Набор по любому из пп. 1-11, где ингибитор пути TH2 представляет собой антитело против IL-13.
34. Набор по п. 33, где антитело против IL-13 представляет собой антитело, содержащее VH с последовательностью SEQ ID NO: 9 и VL с последовательностью SEQ ID NO: 10, антитело против IL-13 содержит HVRH1, HVRH2, HVRH3, HVRL1, HVRL2 и HVRL3, где соответствующие HVR имеют аминокислотные последовательности SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, или лебрикизумаб.
35. Набор по п. 32, где антитело против IL-13 представляет собой биспецифическое антитело, которое также связывает IL-4.
36. Набор по любому из пп. 1-11, где ингибитор пути TH2 представляет собой антитело против IgE.
37. Набор по п. 36, где антитело против IgE представляет собой (i) антитело XOLAIR®, (ii) антитело против M1’, содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь имеет последовательность SEQ ID NO: 24, а вариабельная легкая цепь имеет последовательность SEQ ID NO: 25, или (iii) антитело против M1’, содержащее вариабельную тяжелую цепь и вариабельную легкую цепь, где вариабельная тяжелая цепь также содержит HVR-H1, HVR-H2 и HVR-H3, а вариабельная легкая цепь также содержит HVR-L1, HVR-L2 и HVR-L3, и: (a) HVR-H1 представляет собой остатки 26-35 SEQ ID NO: 24, [GFTFSDYGIA]; (b) HVR-H2 представляет собой остатки 49-66 SEQ ID NO: 24, [AFISDLAYTIYYADTVTG]; (c) HVR-H3 представляет собой остатки 97-106 SEQ ID NO: 24, [ARDNWDAMDY]; (d) HVR-L1 представляет собой остатки 24-39 SEQ ID NO: 25, [RSSQSLVHNNANTYLH]; (e) HVR-L2 представляет собой остатки 55-61 SEQ ID NO: 25, [KVSNRFS]; (f) HVR-L3 представляет собой остатки 94-102 SEQ ID NO: 25, [SQNTLVPWT].
38. Набор для измерения общего периостина в биологическом образце, полученном от астматического пациента или пациента, страдающего от респираторного расстройства, где набор содержит антитело, которое связывается с общим периостином, и вкладыш в упаковку, где общий периостин содержит изоформы человеческого периостина 1, 2, 3 и 4.
39. Набор по п. 38, включающий вкладыш в упаковку, содержащий информацию, описывающую, что указанный набор применяется для стратификации/классификации астматических пациентов на чувствительных и не чувствительных к терапевтическому лечению ингибитором пути TH2.
40. Набор по п. 38, где антитело содержит (i) последовательности гипервариабельного участка (“HVR”) SEQ ID NO: 1 и последовательности HVR SEQ ID NO: 2 или (ii) последовательности HVR SEQ ID NO: 3 и последовательности HVR SEQ ID NO: 4.
41. Набор по п. 40, где антитело содержит последовательности SEQ ID NO: 1 и SEQ ID NO: 2.
42. Набор по п. 40, где антитело содержит последовательности SEQ ID NO: 3 и SEQ ID NO: 4.
43. Набор по п. 38, где антитело представляет собой моноклональное антитело.
44. Набор по п. 38, где антитело представляет собой химерное антитело.
45. Набор по п. 38, где антитело содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 1.
46. Набор по п. 38, где антитело содержит последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 2.
47. Набор по п. 38, где антитело содержит последовательность VH, по меньшей мере на 95% гомологичную последовательности, представленной в SEQ ID NO: 1, и последовательность VL, по меньшей мере на 95% гомологичную последовательности, представленной в SEQ ID NO: 2.
48. Набор по п. 38, где антитело содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 3.
49. Набор по п. 38, где антитело содержит последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 4.
50. Набор по любому из пп. 38-49, где антитело представляет собой Fv, Fab, Fab’, scFv, диатело или фрагмент F(ab')2.
51. Набор по любому из пп. 38-49, где антитело представляет собой антитело IgG1, IgG2, IgG3 или IgG4.
52. Набор по любому из пп. 38-49, где антитело конъюгировано с меткой или фрагментом.
53. Набор по п. 52, где фрагмент представляет собой биотин.
54. Набор по п. 53, где фрагмент представляет собой Ru(bpy).
55. Набор по п. 38, содержащий (i) первое антитело против периостина, содержащее последовательности HVR SEQ ID NO: 1 и последовательности HVR SEQ ID NO: 2, и (ii) второе антитело против периостина, содержащее последовательности HVR SEQ ID NO: 3 и последовательности HVR SEQ ID NO: 4.
56. Набор для измерения общего периостина в биологическом образце, полученном от астматического пациента, чтобы определить, является ли пациент положительным по эозинофильному воспалению (EIP), посредством способа, который включает:
измерение с использованием иммунологического анализа в образце сыворотки, полученном от пациента, уровня общего периостина;
где набор содержит инструкции по измерению уровня общего периостина в образце сыворотки с использованием иммунологического анализа;
и по меньшей мере одно антитело против периостина для применения в указанном иммунологическом анализе, где общий периостин содержит изоформы человеческого периостина 1, 2, 3 и 4;
где статус EIP свидетельствует о том, что пациент является вероятно чувствительным к ингибитору пути TH2, и где, если уровни одной, комбинации или всех изоформ периостина 1, 2, 3 и 4 общего периостина являются повышенными, повышенные уровни свидетельствуют о статусе EIP.
57. Набор по п. 56, где набор содержит инструкции для измерения уровней одного или обоих из TARC и MCP-4, где, если уровни одного или обоих из TARC и MCP-4 являются повышенными, повышенные уровни свидетельствуют о статусе EIP.
58. Набор по п. 56 или 57, где набор дополнительно содержит вкладыш в упаковку для определения, имеет ли астматический пациент статус EIP.
59. Набор по п. 58, где набор дополнительно содержит вкладыш в упаковку для определения, является ли астматический пациент чувствительным к ингибитору пути TH2.
60. Набор по п. 58, где набор дополнительно содержит вкладыш в упаковку, содержащий информацию, описывающую, что указанный набор применяется для стратификации/классификации астматического пациента на вероятно чувствительного или не чувствительного к терапевтическому лечению ингибитором пути TH2.
61. Набор по п. 38 или 56, дополнительно включающий пустой контейнер для биологического образца.
62. Набор по любому из пп. 56-59, где набор содержит два антитела против периостина для применения в иммунологическом анализе для определения уровней общего периостина.
63. Набор по п. 62, содержащий (i) первое антитело против периостина, содержащее последовательности HVR SEQ ID NO: 1 и последовательности HVR SEQ ID NO: 2, и (ii) второе антитело против периостина, содержащее последовательности HVR SEQ ID NO: 3 и последовательности HVR SEQ ID NO: 4.
64. Набор по п. 62, содержащий:
(i) первое антитело против периостина, содержащее последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 1, и последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 2; и
(ii) второе антитело против периостина, содержащее последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 3, и последовательность вариабельного домена легкой цепи (VL), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность аминокислотной последовательности SEQ ID NO: 4.
| WO 2009124090 A1, 08.10.2009 | |||
| US 2003152956 A1, 14.08.2003 | |||
| EP 1978034 A1, 08.10.2008 | |||
| US 2003073137 A1, 17.04.2003. |
Авторы
Даты
2020-11-26—Публикация
2011-12-16—Подача