Изобретение относится к медицине, точнее к онкологии, и может быть использовано для подавления продукции трансформирующего фактора роста – бетта (TGF-β1) в перевитой глиобластоме лабораторных крыс.
Известны способы терапии в онкологии, когда лабораторным крысам вводят гранулоцитарный колониестимулирующий фактор (далее – Г-КСФ).
Linsenmann T, Jawork A, Westermaier T et al. Tumor growth under rhGM-CSF application in an orthotopic rodent glioma model. Oncol Lett. 2019 Jun;17(6):4843-4850.
Недостатком данной модели является акцент на иммобилизацию CD8 лимфоцитов, при этом введение Г-КСФ осуществляется в течение 9 суток без контроля эффективности иммобилизации гемопоэтических стволовых клеток и их хоуминга в опухолевый очаг.
Clavreul A, Delhaye M, Jadaud E, Menei P. Effects of syngeneic cellular vaccinations alone or in combination with GM-CSF on the weakly immunogenic F98 glioma model. J Neurooncol. 2006 Aug;79(1):9 -17.
Недостатком данной модели является синхронное применение Г-КСФ c онковакциной, при этом контроль производится по отношению к CD11b/c и игнорируется их присутствие в опухоли.
Obi R, Tohda M, Zhao Q et al. Chotosan enhances macrophage colony-stimulating factor mRNA expression in the ischemic rat brain and C6Bu-1 glioma cells. Biol Pharm Bull. 2007 Dec;30(12):2250-6.
Недостатком работы является отсутствие акцента на иммобилизации именно гемопоэтических стволовых клеток.
Tseng SH, Chen Y, Chang CJ et al. Induction of T-cell apoptosis in rats by genetically engineered glioma cells expressing granulocyte-macrophage colony-stimulating factor and B7.1. Clin Cancer Res. 2005 Feb 15; 11(4):1639-49.
В данной работе нет акцента на иммобилизацию стволовых клеток костного мозга, более того используются модифицированные генно-инженерным путем опухоли.
Недостатками известных аналогов является тот факт, что стимуляция Г-КСФ не обеспечивает формирование вектора трансформации гемопоэтических стволовых клеток в клетки микроглии, однако в условиях воздействия противовоспалительных цитокинов, продуцируемых опухолевыми клетками (например, трансформирующего фактора роста – бетта (TGF-β1) и интерлейкина-10 (IL-10)), они приобретут М2 фенотип и будут синтезировать wnt- белки, активирующие опухолевые стволовые клетки.
Задачей, на решение которой направлено заявляемое изобретение, является разработка эффективной биотерапии лабораторных крыс с перевитой глиобластомой.
Технический результат, достигаемый при решении поставленной задачи, выражается в подавлении продукции TGF-β1 в перевитой глиобластоме лабораторных крыс и локализации опухолевого очага.
Поставленная задача решается тем, что способ биотерапии лабораторных крыс с перевитой глиобластомой, при котором вводят гранулоцитарный колониестимулирующий фактор, отличается тем, что раз в сутки в течение 7 суток вводят гранулоцитарный колониестимулирующий фактор в количестве 4 мг на 140-160 г массы тела и бактериальный липополисахарид в количестве 5 мг на кг массы тела, а через 4 часа после введения последней дозы бактериального липополисахарида однократно вводят 9 мг интерферона-γ.
Кроме того, гранулоцитарный колониестимулирующий фактор и бактериальный липополисахарид вводят одновременно.
Кроме того, гранулоцитарный колониестимулирующий фактор и бактериальный липополисахарид вводят последовательно.
Сопоставительный анализ совокупности существенных признаков предлагаемого технического решения и совокупности существенных признаков прототипа и аналогов свидетельствует о его соответствии критерию «новизна».
При этом отличительные признаки формулы изобретения решают следующие функциональные задачи.
Признак «вводят гранулоцитарный колониестимулирующий фактор» обеспечивает рекрутирование клеток, включая мононуклеарные CD45+ клетки красного костного мозга, в системный кровоток.
Признаки «вводят гранулоцитарный колониестимулирующий фактор раз в сутки в течение 7 суток в количестве 4 мг на 140-160 г веса» описывают дозу и режим применения Г-КСФ.
Признаки «вводят бактериальный липополисахарид» и «вводят интерферон-γ» обеспечивают запуск системной воспалительной реакции, в условиях которой клетки микроглии поляризуются в М1-активированные макрофаги и продуцируют фактор некроза опухолей – альфа (TNFα), интерлейкин 1 (IL-1) и другие провоспалительные факторы.
Признаки «вводят бактериальный липополисахарид раз в сутки в течение 7 суток в количестве 5 мг на кг веса» описывают дозу и режим применения бактериального липополисахарида.
Признаки «через 4 часа после введения последней дозы бактериального липополисахарида однократно вводят 9 мг интерферона-γ» описывают дозу и режим применения интерферона-γ.
Признаки зависимых пунктов формулы описывают последовательность применения гранулоцитарного колониестимулирующего фактора и бактериального липополисахарида.
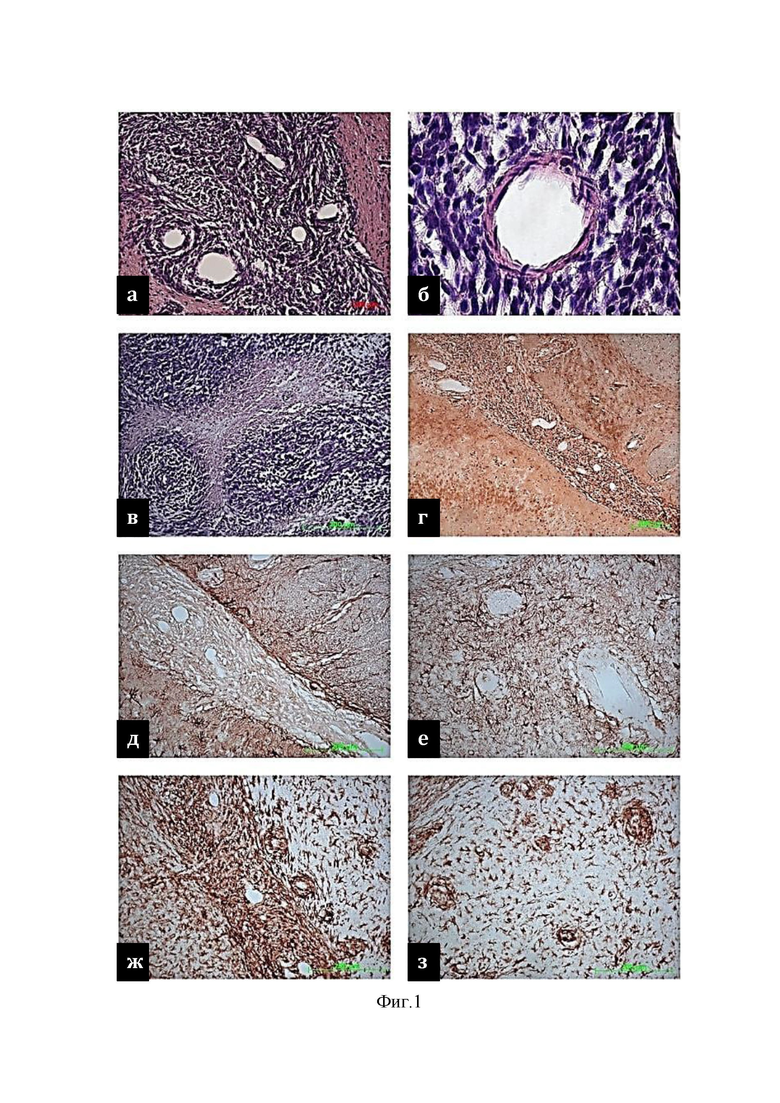
На фиг. 1 изображена ткань глиомы на 14-й день для контрольной группы (группа I):
а – неопластические клетки;
б – кровеносные сосуды;
в – плотные конголомераты;
г – PCNA+ клетки;
д, е – реакция астроцитарной глии,
ж, з – реакция микроглии.
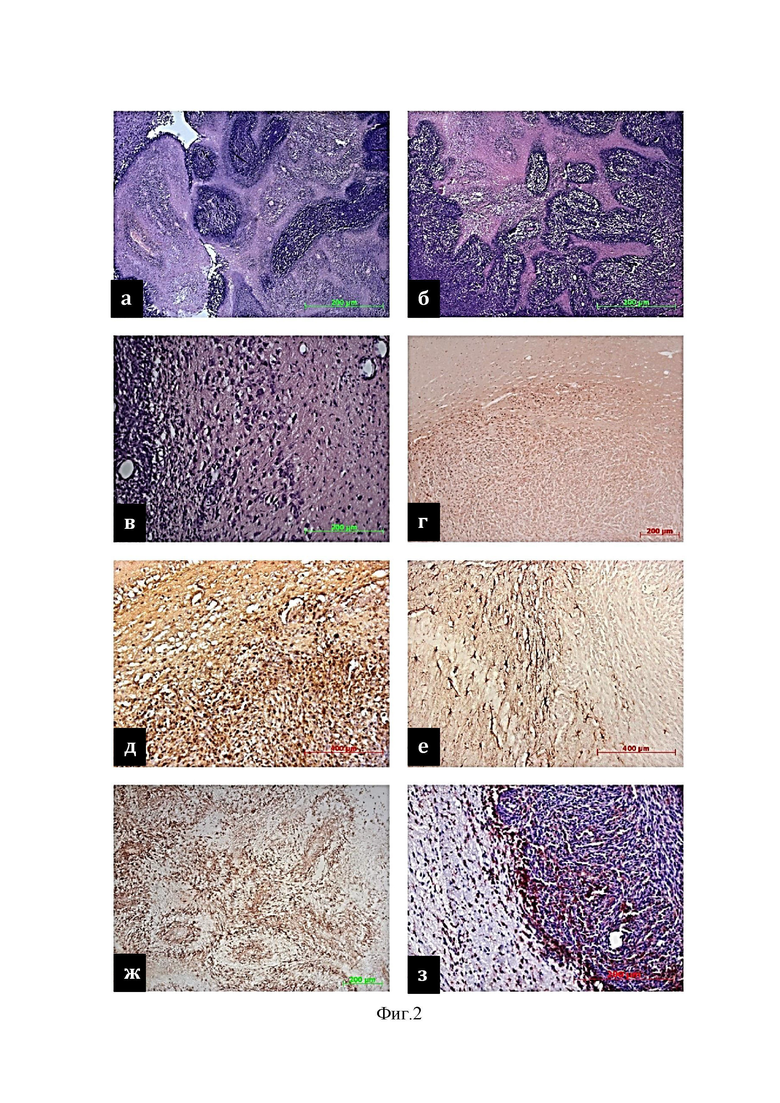
На фиг. 2 изображена ткань глиомы на 28-й день для контрольной группы (группа I):
а, б – зоны некроза;
в, г – PCNA+ клетки;
д – GFAP+ клетки;
е – Iba+ клетки микроглии;
ж, з – инвазивный край опухоли.
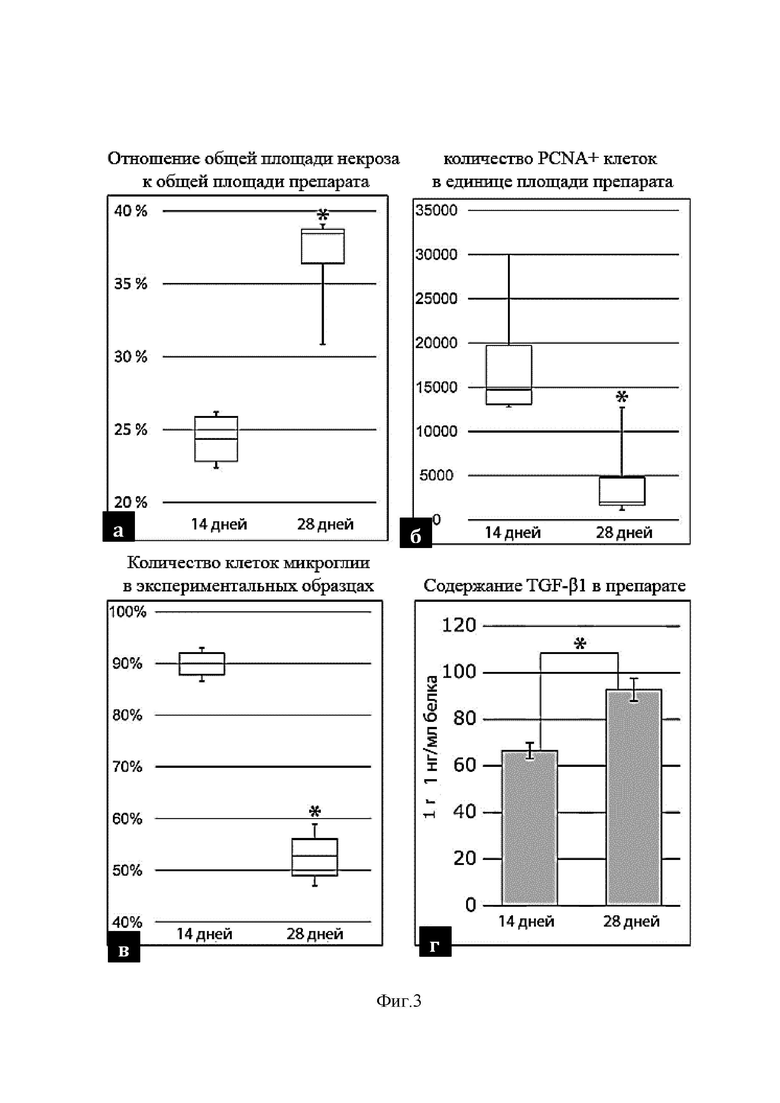
На фиг. 3 изображена морфохимическая характеристика глиомы для контрольной группы (группа I) на 14-й и 28-й день:
а – отношение общей площади некроза к общей площади препарата;
б – количество PCNA+ клеток в единице площади препарата;
в – количество клеток микроглии;
г – содержание TGF-β1.
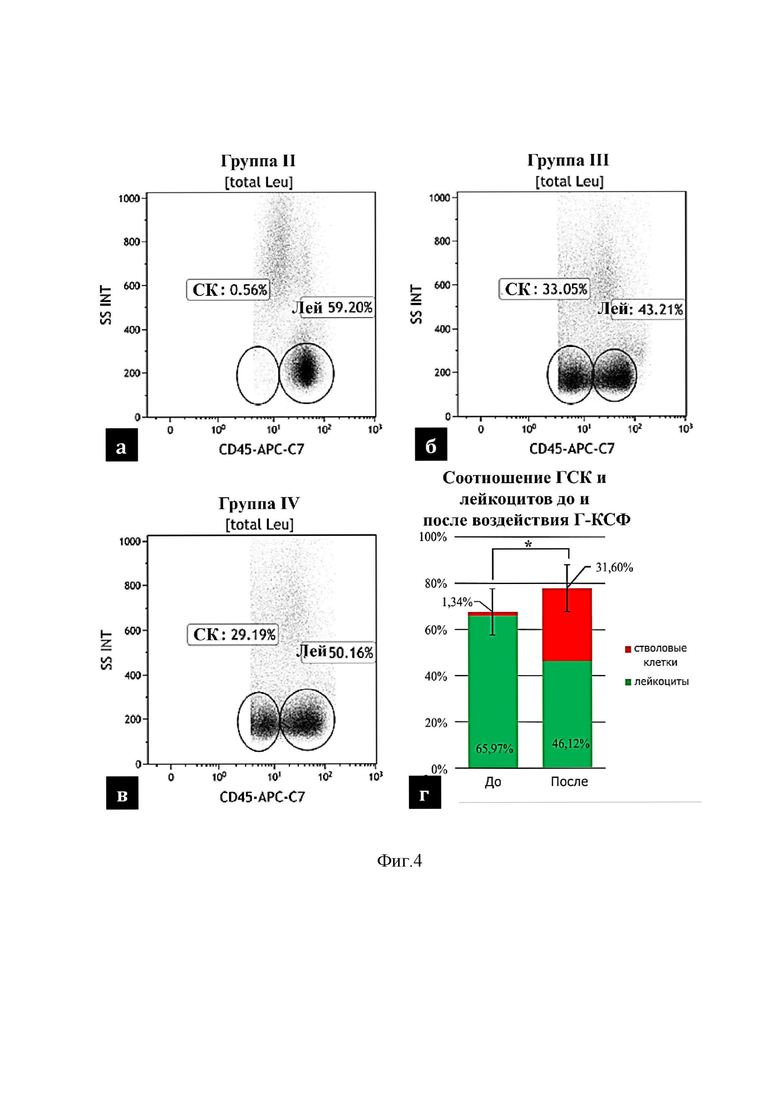
На фиг. 4 изображено количество ГСК (СК) в структуре пула лейкоцитов (Лей):
а – для группы II;
б – для группы III;
в – для группы IV;
г – соотношение ГСК и лейкоцитов до и после воздействия Г-КСФ;
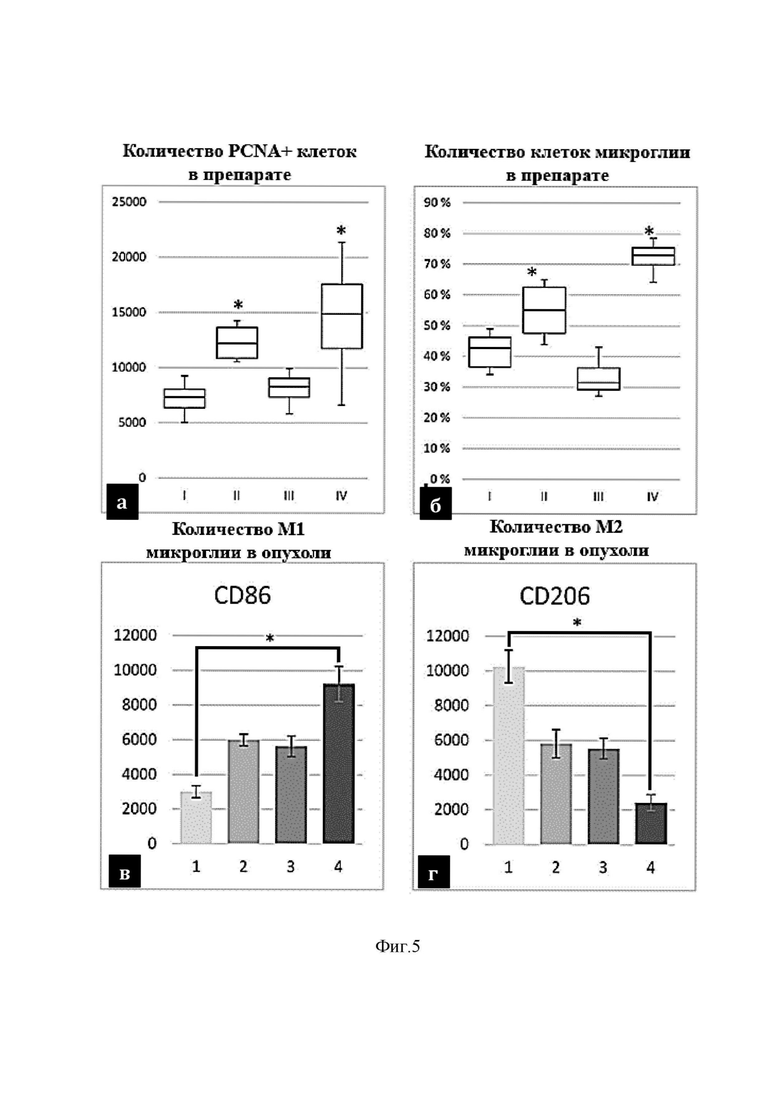
На фиг. 5 изображена морфометрическая характеристика глиомы на 28-й день для разных групп:
а – количество PCNA+ клеток;
б – количество клеток микроглии;
в – провоспалительная популяция микроглии (CD86);
г – противоспалительная популяция микроглии (CD206).
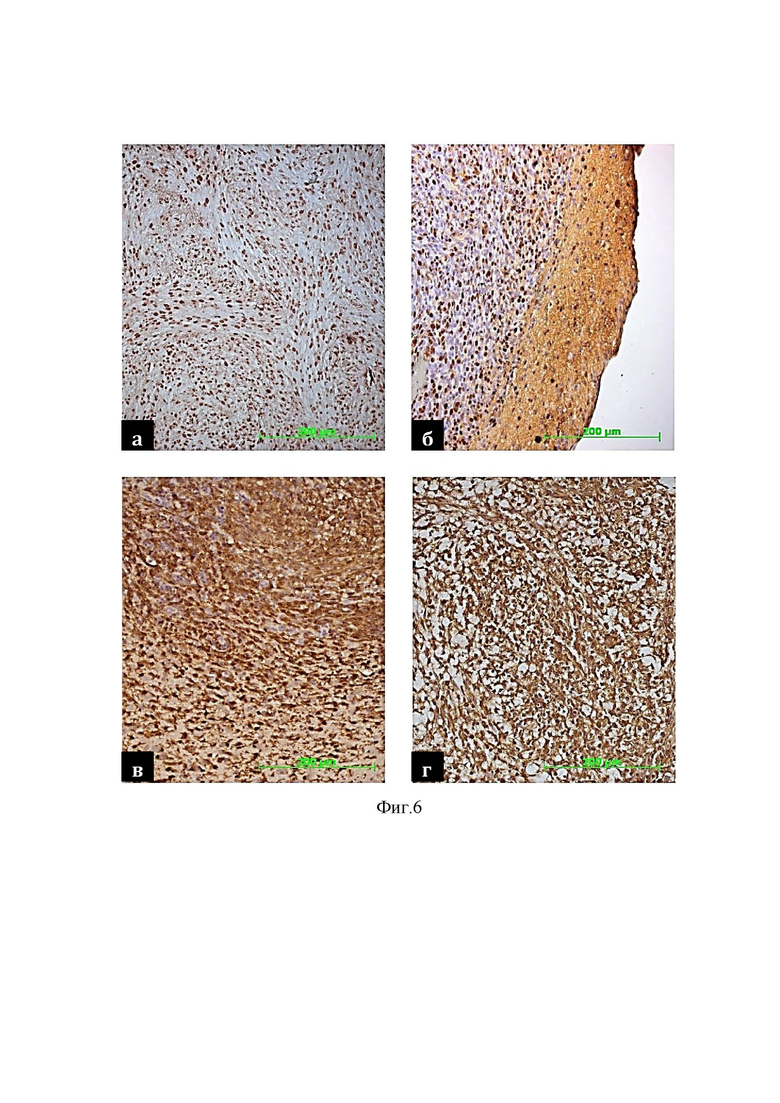
На фиг. 6 изображена ткань глиомы на 28-й день:
а – для группы I по центру;
б – для группы I на периферии;
в – для группы IV по центру;
г – для группы IV на периферии.
На фиг. 7 изображена иммуногистохимическая характеристика глиомы для группы IV:
а – провоспалительные CD86 клетки микроглии по центру;
б – провоспалительные CD86 клетки микроглии на периферии;
в – противоспалительные CD206 клетки микроглии по центру;
г – противоспалительные CD206 клетки микроглии на периферии.
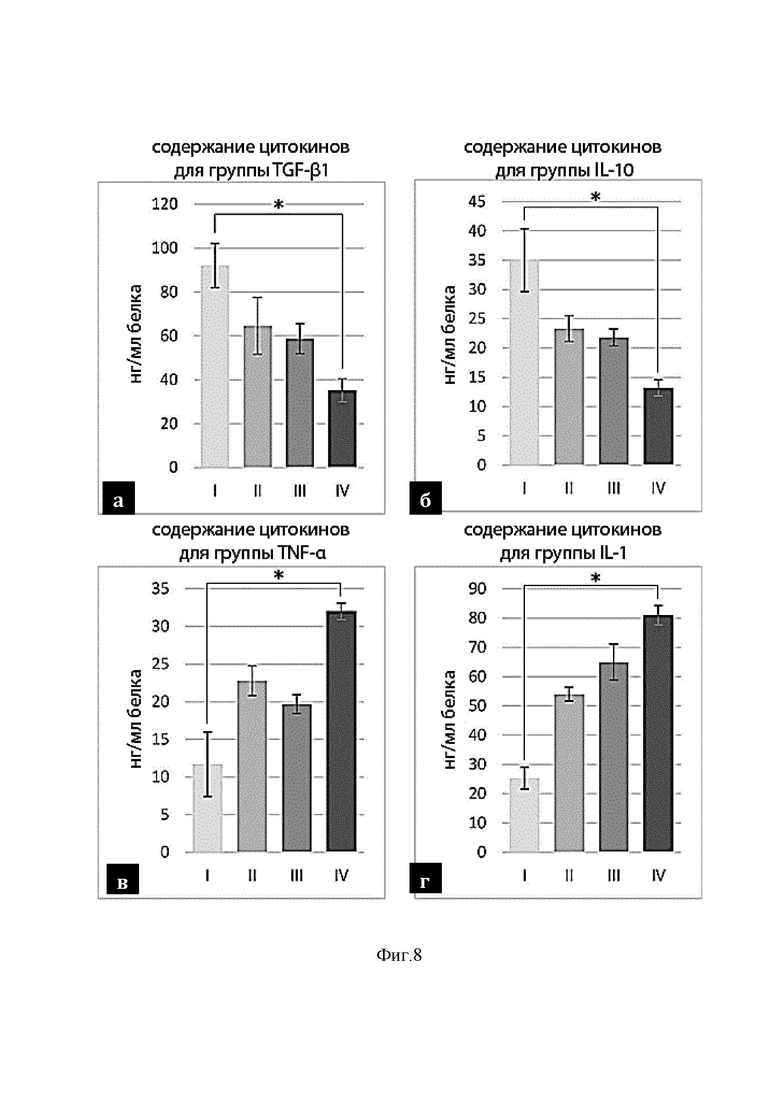
На фиг. 8 изображено содержание цитокинов для разных групп:
а – TGF-β1;
б – IL-10;
в – TNFα;
г – IL-1.
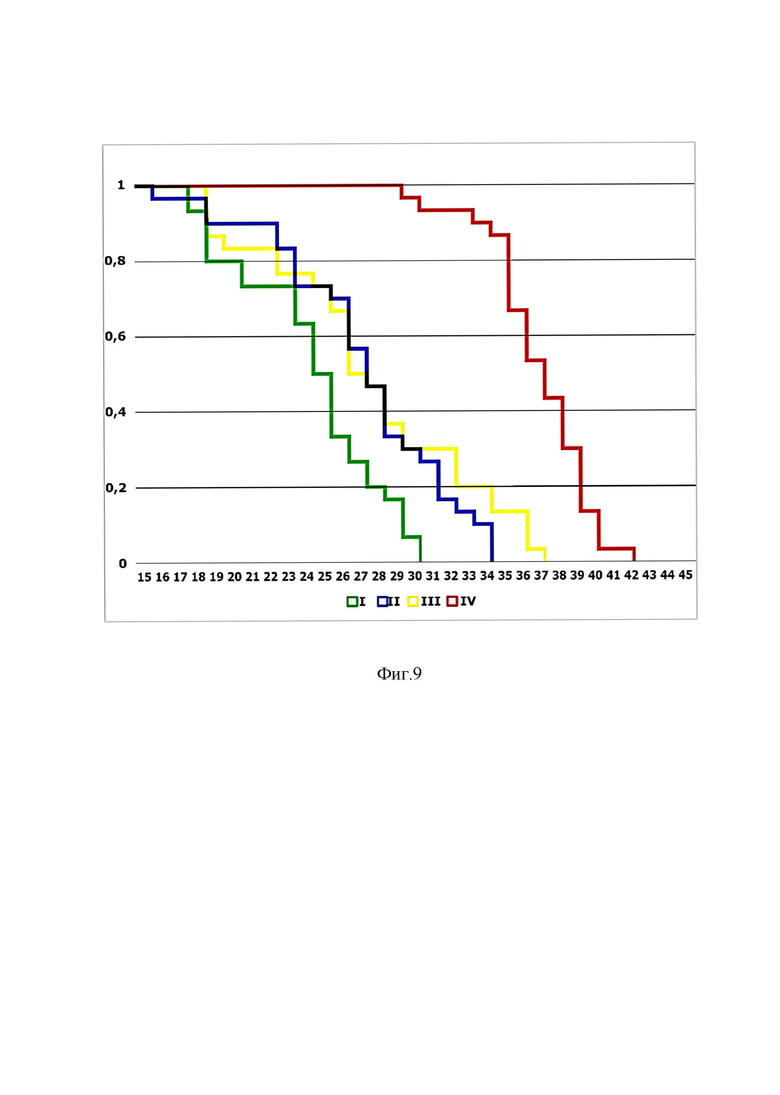
На фиг. 9 изображена кривая выживаемости крыс по Каплану-Майеру.
Заявляемый способ основан на следующих принципах.
Введение гранулоцитарного колониестимулирующего фактора приводит к рекрутированию мононуклеарных CD45+ клеток красного костного мозга, значительную часть которых составляют гемопоэтические стволовые клетки (ГСК), в системный кровоток.
ГСК при введении в кровоток животных с перевитой глиомой мигрируют в опухолевый очаг, проникают в неопластическую ткань, накапливаются в зонах инвазии и некроза и трансформируются в клетки, идентичные по ряду ведущих иммуногистохимических маркеров собственным клеткам микроглии головного мозга, что сопровождается усилением процессов микроглиальной пролиферации и инфильтрации в опухолевой ткани клетками микроглии.
Кроме того, помимо ГСК, при введении в кровоток животных Г-КСФ, происходит рекрутирование CD45+ (CD8+) Т-лимфоцитов /киллеров, распознающих и атакующих клетки, не имеющие антигенов главного комплекса гистосовместимости первого типа.
Мигрируя в опухоль, Т-лимфоциты /киллеры запускают реакцию «трансплантат против опухоли» а с другой стороны, сами подвергаются атаке как чужеродные агенты собственными T-лимфоцитами пациента. В итоге происходит перманентная провоспалительная модификация опухолевого очага, без введения бактериального липополисахарида и интерферона-γ.
Проведение провоспалительной терапии, при которой вводят бактериальный липополисахарид и интерферон-γ, задает вектор трансформации ГСК в клетки микроглии и обеспечивает локальное усиление воспалительной реакции.
Происходит запуск системной воспалительной реакции, в условиях которой клетки микроглии поляризуются в М1-активированные макрофаги, и продуцируют фактор некроза опухолей – альфа (TNFα), интерлейкин 1 (IL-1) и другие провоспалительные факторы. Как известно, провоспалительные факторы снижают содержание в опухоли wnt-белков (ключевой путь пролиферации раковых клеток) и подавляют синтез в очаге трансформирующего фактора роста – бетта (TGF-β1), запускающего процессы инвазии.
Провоспалительная терапия на фоне стимуляции Г-КСФ вызывает поляризацию популяций макроглии/макрофагов, что сопровождается усилением процессов презентации антигена, снижением продукции TGF-β1 и IL-10, усилением синтеза провоспалительных цитокинов TNFα и IL-1 в опухолевом очаге и прилежащем к нему веществе мозга, ремоделированием опухолевого матрикса и увеличением выживаемости экспериментальных животных.
Таким образом, контролируемый ввод Г-КСФ в системный кровоток и рекрутирование в кровь собственных мононуклеарных CD45+ клеток лабораторной крысы обеспечивает постоянную «подкачку» в опухоль М1-активированных макрофагов, продуцирующих провоспалительные цитокины, регулирующих раковые клетки (в том числе раковые стволовые клетки).
Следует отметить, что к 28-му дню наблюдений опухоль становится более плотной и наглядной с формированием четких границ между тканью опухоли и веществом мозга, что позволяет эффективно удалить ее хирургическим путем.
Для осуществления способа использовали следующие исходные материалы.
1. Экспериментальные животные . Данная работа на животных согласована и одобрена Этическим комитетом Школы биомедицины ДВФУ (Протоколы №1 и 2 от 05.03.2019). Содержание и уход за животными осуществлялся в соответствии с требованиями стандартов GLP и Хельсинской декларации о гуманном отношении к животным.
В работе использовали 150 крыс-самцов породы Вистар, массой тела 150 ± 10 г, возрасте 12-14 недель. Крысы получены из питомника научно-производственного подразделения филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова (г. Пущино, Московская область, Россия).
2. Опухолевые клетки . В работе использовали клетки низкодифференцированной глиомы линии С6 (cat.no ATCC® CCL-107™). Клетки культивировали до достижения 80% конфлюэнтности и использовали в эксперименте после третьего пассажа с момента получения от производителя. Клеточная линия протестирована на загрязнение микоплазмой c использованием Universal Mycoplasma Detection Kit (ATCC® 30-1012K™).
3. Реагенты .
ГКС-Ф (Filgrastim, cat.no.Y0001173 Sigma-Aldrich, Saint Louis, MO, US);
бактериальный липополисахарид E.coli serotype O111:B4 (cat. no L2630 Sigma-Aldrich, Saint Louis, MO, US);
рекомбинантный крысиный IFNγ (cat. no. I3275 Sigma-Aldrich, Saint Louis, MO, US).
Заявляемый способ осуществляют по известной технологии в несколько этапов.
1. Животные были разделены на 5 групп:
I) контрольная группа (N=60);
II) группа крыс (N=30), получавших гранулоцитарный колониестимулирующий фактор (Г-КСФ) для рекрутирования мононуклеарных CD45+ костного мозга в системный кровоток (группа – Г-КСФ);
III) группа крыс (N=30), получивших провоспалительную терапию для запуска системной воспалительной реакции путем введения бактериального липополисахарида (LPS) и интерферона-γ (IFNγ) (группа – proinflamation therapy, PT);
IV) крысы (N=30), получившие стимуляцию Г-КСФ c последующей провоспалительной терапией (группа Г-КСФ+PT).
2. Моделирование глиальной опухоли мозга.
Животных наркотизировали путем интраперитонеального введения 2 мг смеси, содержащей золетил 100 (Virbac, France) + рометар (Bioveta a.s. Czech) в соотношении 1:4. Мягкие ткани головы рассекали, накладывали трепанационное отверстие, используя Ideal Micro Drill Surgical Drill (Harvard apparatus, US).
Опухолевые клетки в количестве 0,5×106 в 5 мкл стерильного 0,14M раствора NaCl вводили с помощью гамильтоновского шприца (600 Series, Hamilton, US) со скоростью 1 мкл/мин в область каудопутамена с помощью стереотаксического аппарата для крыс SR-5R-HT (Narishige, Japan) по координатам атласа мозга крысы (Paxinos &Watson, 2007): Ар-1; L-3,0; V-4,5, TBS-2,4 мм.
Верификацию опухоли проводили через 10 дней методом магнитно-резонансной томографии на установке Bruker’s PharmaScan® (Массачусетс, US).
3. Рекрутирование мононуклеарных CD45+ клеток.
Животным раз в сутки в течение 7 суток вводили подкожно гранулоцитарный колониестимулирующий фактор в количестве 4 мг на 140-160 г массы тела.
Иммобилизацию мононуклеарных CD45+ клеток и ГСК подтверждали путем тестирования образцов крови экспериментальных животных на проточном цитофлуориметре Navios™ (Beckman Coulter, US).
В работе использованы антитела против поверхностного CD45+ антигена крысы (клон OX-1, конъюгированные с APC/Cy7, cat.no. 202216, Biolegend Inc., US). Обработку цитофлуориметрических данных проводили при помощи программ Navios Software v.1.2 и Kaluza™ v.1.2 (Beckman Coulter, US).
4. Провоспалительная терапия.
Для запуска системной воспалительной реакции раз в сутки в течение 7 суток одновременно или после введения гранулоцитарного колониестимулирующего фактора вводили внутрибрюшинно бактериальный липополисахарид в количестве 5 мг на кг массы тела (растворен в 0,5 мл стерильного физиологического раствора).
А через 4 часа после введения последней дозы бактериального липополисахарида животным внутрибрюшинно вводили 9 мг рекомбинантного крысиного интерферона-γ (растворен в 0,5 мл стерильного физиологического раствора).
5. Морфологическое исследование.
Ткань мозга крысы получали после декапитации животных. Материал разделяли на две части: одну часть материала использовали для проведения морфологического и иммуногистохимического исследования, вторую часть материала использовали для оценки содержания цитокинов в ткани мозга по описанной ниже методике.
Материал для морфологического и иммуногистохимического исследований фиксировали (4% ПФА) в течение 12 ч с последующей промывкой PBS. Для морфологического анализа парафиновые срезы головного мозга толщиной 7 мкм депарафинировали и окрашивали гематоксилин-эозином по стандартной методике. Все использованные реагенты производства компании Sigma-Aldrich (Saint Louis, MO, US).
6. Иммуногистохимическое исследование.
Исследование выполнено по стандартной методике. Первичные антитела против микроглия/макрофаг-специфического белка iba-1 (ab107159), пролиферирующих клеток ядерного антигена PCNA (ab 29) и мембранному белку антиген-представляющих клеток CD86(ab213044) и маннозному рецептору CD206 (ab64693) использованы в соответствии с инструкциями производителя – компании Аbcam (США). Вторичные антитела, меченые пероксидазой хрена PI-1000 (anti-rabbit); PI-2000 (anti-mouse) использовали в соответствии с инструкциями производителя – компании Vector Laboratories. Для проведения иммунопероксидазной реакции использовали хромоген NovaREDsubstratekit (Vector Laboratories; SK-4800). Срезы тщательно отмывали 0,1 М PBS, обезвоживали и заключали в бальзам, изучали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия).
7. Иммуноферментный анализ.
Твердофазный иммуноферментный анализ (ИФА) ткани мозга на содержание ключевых цитокинов IL-1 (ab100768), IL-10 (ab100765), TNF-α (ab100747) и TGF-β1(ab119558) выполнен с использованием коммерческих наборов фирмы Аbcam (США). Мозг крыс извлекали, отделяли участок для морфологического и иммуногистохимического исследований, а остальной материал немедленно замораживали в жидком азоте при -70ºС. Для анализа брали ткань глиомы с захватом вещества мозга в пределах 5 мм от края. Гомогенаты ткани готовили с использованием буфера: сахароза 0,25 М, Трис-HCl 0,01 М, ЭДТА 0,001 М, HEPES 0,01. Все реагенты производства компании Sigma-Aldrich (Saint Louis, MO, США). Лизирующий буфер добавляли к ткани из расчета 5 мл на 1 мг ткани, проводили гомогенизацию ткани, центрифугирование и отбор надосадочной жидкости для анализа. Содержания белка определяли с использованием коммерческого набора Pierce BCA Protein Assay Kit (Thermo Scientific). Определение оптической плотности производили при длине волны 450 нм на планшетном спектрофотометре (BioRad xMark).
8. Статистическая обработка результатов.
Полученные данные подвергали обработке с использованием пакета Graph Pad Prism 4.00 (GraphPad Software Inc., US). По полученным данным вычисляли среднее арифметическое и его стандартное отклонение. Результаты представлены как M±SEM. Для парных выборок применяли t-критерий Стъюдента. Различия между группами считали достоверными при P<0,05. Анализ выживаемости проводили по Каплану-Майеру.
9. Анализ результатов.
Закономерности продукции TGF-β1 в ткани мозга на различных этапах опухолевого процесса.
Имплантация клеток глиомы приводила к быстрому формированию объемных опухолей, возвышающихся над конвекситальной поверхностью мозга в виде бледно-розового узла, контрастного цвету мозговой ткани. Развитие опухоли сопровождалось отеком и деформацией мозговых структур, сглаженностью основных борозд и извилин, сдавлением желудочков мозга и грубой деформацией мозговых структур.
На 14-й день эксперимента при морфологическом исследовании ткань глиомы была представлена скоплением неопластических клеток (фиг.1а) формирующих многочисленные кровеносные сосуды (фиг.1б). В некоторых участках опухолевого узла группировка клеток глиомы становилась более плотной и, концентрируясь вокруг кровеносных сосудов, они формировали плотные конгломераты в виде шаров или «розеток», ограниченных на периферии очагами некроза (фиг.1в). По периферии опухолевого узла клетки глиомы без четких границ вторгались в вещество мозга, содержащее многочисленные солитарные опухолевые элементы и вторичные конгломераты.
Сформированная опухоль характеризовалась высокими темпами пролиферации. PCNA+ клетки (фиг.1г) были равномерно распределены в центре узла глиомы и прилежащем к опухоли веществе мозга, где были локализованы в кровеносных сосудах и формировали вторичные, сателлитные очаги. Развитие опухоли в головном мозге крыс сопровождалось интенсивной реакцией астроцитарной глии (фиг.1д, 1е). GFAP+ клетки с крупным телом и короткими отростками локализовались в прилежащей к опухоли ткани мозга, прилежащей к опухолевому узлу, а также на некотором расстоянии от него, и при этом отсутствовали в опухолевой ткани. В свою очередь, плотные скопления клеточных элементов иммунореактивных в отношении микроглия/макрофаг-специфического белка iba-1 выявлялись как в центре неопластического узла (фиг.1ж), так и на периферии опухоли (фиг.1з), а также в ткани мозга, кровеносных сосудах, окружающих опухоль.
На 28-е сутки эксперимента основное место в морфологической картине глиомы начинали занимать обширные зоны некроза (фиг.2а, 2б), содержавшие запустевшие кровеносные сосуды, окруженные скоплениями немногочисленных клеточных элементов. Интенсивность процессов пролиферации к этому времени резко снижалась, при этом PCNA+ клетки плотно группировались вдоль границ опухоли и выявлялись в участках инвазии в дистрофически измененное вещество мозга (фиг.2в, 2г). Локализация элементов астроцитарной глии не обнаруживала значимых различий в сравнении с 14-м днем наблюдений. GFAP+ клетки были локализованы вдоль края опухолевого очага (фиг.2д) имели звездчатую форму и многочисленные отростки, тесно контактирующие друг с другом.
Количество клеток микроглии в опухолевой ткани к 28-му дню наблюдений резко уменьшалось. Iba+ клетки в центре узла глиомы были распределены в форме очаговых скоплений или окружали зоны некроза формируя некое подобие «псевдопалисадных» структур (фиг.2е). В области инвазивного края опухоли группировка клеток микроглии значительно уплотнялась, образуя подобие ободка между тканью опухоли и веществом мозга (фиг.2ж, 2з), усеянном опухолевыми клетками. Снижение темпов пролиферации и количества клеток микроглии на фоне интенсивных процессов некроза в центре опухолевого узла к 28-у дню эксперимента сопровождалось увеличением содержания TGF-β1 в мозговой ткани (фиг.3г). В этой связи 28-е сутки были выбраны в качестве контрольной точки для продолжения эксперимента.
Рекрутирование аутологических мононуклеарных CD45+ клеток костного мозга в кровеносное русло животных с перевитой глиомой С6.
Введение Г-КСФ животным с глиомой С6 сопровождалось увеличением доли CD45+ клеток в общем числе лимфоцитов, рекрутированных в кровеносное русло. При этом среди мононуклеарных клеток костного мозга, иммунопозитивных в отношении мембранного антигена CD45, количество ГСК к 7 суткам эксперимента возросло более чем в 19 раз (фиг.4).
Влияние системной воспалительной реакции на продукцию TGF-β1 в опухолевом очаге при иммобилизации мононуклеарных CD45+ клеток костного мозга в кровоток крыс с глиомой С6.
На 28-й день эксперимента у животных групп II (Г-КСФ) и IV (Г-КСФ +PT) было отмечено значимое (фиг.5a) увеличение числа PCNA+ клеток в опухолевой ткани по сравнению с контролем (группа I) и группой крыс, получавших только PT (группа III). Однако в отличие от контроля (фиг.2в, 2г), многочисленные PCNA+ клетки у крыс группы IV (Г-КСФ+PT) были рассредоточены по всей ткани опухолевого узла (фиг.6в) и плотно сгруппированы в зоне инвазии неопластических клеток в вещество мозга (фиг.6г).
Усиление пролиферации в опухолевой ткани у животных групп II (Г-КСФ) и IV (Г-КСФ +PT) сочеталось с увеличением площади окрашивания узла глиомы антителами против белка микроглии /макрофагов iba-1 (фиг.5б). В отличие от контроля (фиг.2е), клетки округлой и амебообразной формы были локализованы как в центре опухолевого узла (фиг.6в), так и в области инвазивного края опухоли (фиг.6г), а также визуализировались в прилежащем к опухоли веществе мозга. У крыс группы III, получивших только PT, общая архитектура реакции микроглии принципиальных отличий от контроля не имела.
На 28-е сутки эксперимента увеличение количества Iba1+ элементов микроглии в опухолевой ткани у крыс II и IV групп сопровождалось поляризацией популяций микроглии (фиг.5в, 5г). У крыс контрольной группы в ткани глиомы и веществе мозга, прилежащей непосредственно к опухолевому очагу, выявлялись единичные клетки микроглии, экспрессирующие маркер CD86, что указывало на низкий уровень презентации антигена в ткани мозга (фиг.7a). У животных групп II и III количество этих клеток заметно возрастало (фиг.5в), а максимума достигало у крыс группы IV, где многочисленные CD86+ клеточные элементы округлой, звездчатой или полигональной формы были плотно сгруппированы вдоль границ опухоли и активно вторгались в неопластическую ткань (фиг.7б).
Напротив, клетки, иммунопозитивные в отношении маннозного рецептора СD206, в большом количестве выявлялись в опухоли (фиг.7в) и прилежащей к опухолевому очагу ткани мозга (фиг.7г). Их количество несколько возрастало у крыс II группы, получавших Г-КСФ, однако у животных III и IV групп их количество было минимальным (фиг.5г).
Иммуноферментный анализ выявил значительные различия в уровне ключевых про- и противовоспалительных цитокинов у крыс экспериментальных групп. К 28-у дню эксперимента у крыс контрольной группы содержание противовоспалительных цитокинов TGF-β1 (фиг.8а) и IL-10 (фиг.8б) в опухоли и прилежащей ткани мозга было максимальным. В группах II (Г-КСФ) и III (PT) содержание этих цитокинов достоверно снижалось и достигало минимума у крыс группы IV (Г-КСФ+PT). Подобный эффект сопровождался резким повышением содержания провоспалительных цитокинов TNFα (фиг.8в) и IL-1 (фиг.8г) у животных этой группы.
Сравнительное исследование выживаемости животных с глиомой С6.
Животные всех экспериментальных групп показали повышение показателей выживаемости по сравнению с контрольной группой, однако наилучшие показатели были зарегистрированы у крыс группы IV (G-Г-КСФ +PT) (фиг.9).
Подведение итогов.
Как следует из результатов эксперимента, стереотаксическая имплантация клеток глиомы С6 в мозг иммунокомпетентных крыс породы Вистар позволяет сформировать глиальную опухоль, которая характеризуется инвазивным ростом, высокой скорость пролиферации раковых клеток, интенсивным ангиогенезом и ранним появлением очагов некроза, что проявляет отнести ее к классу глиом высокой степени злокачественности согласно классификации Ste. Anne-Mayo System (SAMS), или Grade IV, в соответствие с критериями Всемирной Организации Здравоохранения.
Исключительно важно, что эта опухоль в своем развитии воспроизводит основные патофизиологические механизмы, характерные для МГБ. Так, несмотря на интенсивный ангиогенез, уже на 14-е сутки в опухоли формируются очаги некроза, на 28-е сутки наблюдается прогрессирующее увеличение площади этих зон некроза (фиг. 2a, 2б и 3a), которые начинают занимать основное место в морфологической картине, и снижение темпов пролиферации опухолевых клеток, что косвенно указывает на ключевую роль фактора гипоксии как основного регулятора морфологических изменений в опухолевой ткани.
При этом опухоль не погибает, а на границе опухоли с веществом мозга (фиг. 2в) наблюдается активная инвазия неопластических клеток и образование и сателлитных очагов.
Обращает на себя внимание, что пролиферация сохраняется на границах с неизменным веществом мозга (фиг.2в, 2г), где степень оксигенации выше, чем в центре опухолевого узла. В этом случае именно высокий уровень энергозатратной пролиферации множества клеток опухоли и становится, с одной стороны, причиной гипоксии и формирования очагов некроза, а с другой – индуктором синтеза TGF-β1 и VEGF в клетках глиомы. Первый, одновременно с противовоспалительными эффектами, стимулирует формирование структур межклеточного матрикса, в то время как второй фактор запускает ангиогенез, связанный именно со структурами матрикса, и провоцирует тем самым инвазию, что и подтверждается результатами морфологического анализа.
Уже эти результаты морфологического исследования являются достаточным основанием для углубленного анализа роли TGF-β1 в ходе опухолевого процесса и патофизиологического значения его усиленной продукции в области инвазивного края опухоли и веществе мозга.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОМОДИФИЦИРУЮЩИЕ ЧАСТИЦЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2794261C2 |
| ПРОТИВООПУХОЛЕВЫЙ ТАРГЕТНЫЙ КЛЕТОЧНЫЙ ПРОДУКТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2757812C2 |
| УНИВЕРСАЛЬНЫЙ ПРОМОТОР ДЛЯ ЭКСПРЕССИИ ТЕРАПЕВТИЧЕСКИХ ГЕНОВ В КЛЕТКАХ МЛЕКОПИТАЮЩИХ | 2013 |
|
RU2551784C1 |
| БИОМЕДИЦИНСКИЙ КЛЕТОЧНЫЙ ПРОДУКТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2741769C2 |
| УЛУЧШЕННАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 2011 |
|
RU2565542C2 |
| СПОСОБ СТИМУЛЯЦИИ ВЫРАБОТКИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА КЛЕТКАМИ КОСТНОГО МОЗГА IN VITRO | 2013 |
|
RU2527888C1 |
| СПОСОБ РАННЕЙ МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА | 2018 |
|
RU2706714C1 |
| ПРЕПАРАТ СТВОЛОВЫХ КЛЕТОК С РЕПРОГРАММИРОВАННЫМ КЛЕТОЧНЫМ СИГНАЛИНГОМ, СПОСОБ ПОЛУЧЕНИЯ ЭТОГО ПРЕПАРАТА И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2428475C2 |
| КОМПОЗИЦИЯ ДЛЯ НЕЙРОПРОТЕКЦИИ И СТИМУЛЯЦИИ НЕЙРОРЕГЕНЕРАЦИИ ГОЛОВНОГО МОЗГА ПОСЛЕ ПОВРЕЖДЕНИЯ, СРЕДСТВО НА ЕЕ ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803286C1 |
| Таргетное колониестимулирующее средство | 2020 |
|
RU2749509C1 |

Изобретение относится к медицине и онкологии и касается способа биотерапии лабораторных крыс с перевитой глиобластомой. Для этого крысам 1 раз в сутки в течение 7 суток вводят гранулоцитарный колониестимулирующий фактор в количестве 4 мг на 140-160 г массы тела и бактериальный липополисахарид в количестве 5 мг на кг массы тела, а через 4 часа после введения последней дозы бактериального липополисахарида однократно вводят 9 мг интерферона-γ. Изобретение позволяет подавить продукцию TGF-β1 в перевитой глиобластоме лабораторных крыс и локализировать опухолевой очаг. 2 з.п. ф-лы, 9 ил.
1. Способ биотерапии лабораторных крыс с перевитой глиобластомой, при котором вводят гранулоцитарный колониестимулирующий фактор, отличающийся тем, что раз в сутки в течение 7 суток вводят гранулоцитарный колониестимулирующий фактор в количестве 4 мг на 140-160 г массы тела и бактериальный липополисахарид в количестве 5 мг на кг массы тела, а через 4 часа после введения последней дозы бактериального липополисахарида однократно вводят 9 мг интерферона-γ.
2. Способ по п.1, отличающийся тем, что гранулоцитарный колониестимулирующий фактор и бактериальный липополисахарид вводят одновременно.
3. Способ по п.1, отличающийся тем, что гранулоцитарный колониестимулирующий фактор и бактериальный липополисахарид вводят последовательно.
| RU 2015110690 A, 20.10.2016 | |||
| US 7264820 B2, 04.09.2007 | |||
| КОЗЛОВ В.А | |||
| Гранулоцитарный колониестимулирующий фактор: физиологическая активность, патофизиологические и терапевтические проблемы // Цитокины и Воспаление | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| BAUSERO, M | |||
| A | |||
| et al | |||
| Effective Immunization Against Neuroblastoma Using Double-Transduced Tumor Cells | |||
Авторы
Даты
2020-05-28—Публикация
2019-12-06—Подача