Перекрестная ссылка
Настоящая заявка заявляет приоритет по предварительной заявке на патент США №62/028123, поданной 23 июля 2014 года, которая включена в данный документ посредством ссылки в полном объеме.
Введение
Neisseria meningitidis представляет собой грамотрицательную бактерию, которая заселяет верхние дыхательные пути человека и отвечает за распространенные по всему миру спорадические и циклические эпидемические вспышки, в первую очередь, менингита и сепсиса. Самая высокая скорость поражения и заболеваемости наблюдается у детей в возрасте до 2 лет. Как и другие грамотрицательные бактерии, Neisseria meningitidis, как правило, имеют цитоплазматическую мембрану, слой пептидогликана, внешнюю мембрану, которая вместе с капсульным полисахаридом составляют стенки бактерии, и фимбрии, которые проектируются во внешнюю среду. Инкапсулированные штаммы Neisseria meningitidis являются основной причиной бактериального менингита и сепсиса у детей и молодых людей. Распространенность и экономическое значение инвазивных инфекций Neisseria meningitidis обуславливали поиск эффективных вакцин, которые могут обеспечивать иммунитет против разных штаммов и особенно против генетически различных штаммов серогруппы В с различными серотипами или серологическим подтипам.
Фактор Н-связывающий белок (fHbp, также известный в данной области как липопротеин 2086 (Fletcher et al (2004) Infect Immun 72:2088-2100), антиген нейссерии геномного происхождения (GNA) 1870 (Masignani et al. (2003) J Exp Med 197: 789-99) или "741") является белком N.meningitidis, который экспрессируется в бактерии как липопротеин экспонированный на поверхности. Важной функцией fHbp является связывание человеческого фактора комплемента H (fH), что понижающе регулирует активацию комплемента. Связывание fH с бактериальной поверхностью является важным механизмом, с помощью которого возбудитель выживает в неиммунизированной человеческой сыворотке или крови и уклоняется от врожденной защиты хозяина. В последнее время было обнаружено генетическое изменение в кластере гена человеческого фактора Н, которое влияет на восприимчивость к развитию менингококковой инфекции (Davila S et al. (2010) Nat Genetics doi:10.1038/ng.640). Связывание fH с fHbp специфично для человеческого fH и нескольких приматов, не являющихся человеком, и может частично объяснить, почему Neisseria meningitidis является строго патогеном человека. fHbp представляется многими вариантами природной последовательности, которые обозначены регистрационными номерами (ID), присвоенными в базе данных fHbp в Интернете по адресу pubmlst(dot)org/neisseria/fHbp.
Остается потребность в полипептиде fHbp, который может вызвать эффективные бактерицидные ответы антител.
Сущность изобретения
Предусмотрены варианты фактор H-связывающих белков, которые могут вызывать синтез антител, которые обладают бактерицидным действием, по меньшей мере, для одного штамма Neisseria meningitidis, композиции, содержащие такие белки, и способы применения таких белков.
ОСОБЕННОСТИ
Настоящее изобретение предусматривает варианты фактор H-связывающего белка (fHbp) ID 1. Настоящее изобретение предусматривает вариант fHbp, причем вариант содержит аминокислотную замену, выбранную из по меньшей мере одной из: а) замены аминокислоты глутамина в аминокислотном положении 38 (Q38); b) замены аминокислоты глутаминовой кислоты в аминокислотном положении 92 (E92); c) замены глицина на аргинин в аминокислотном положении 130 (R130G); d) замены аминокислоты серина в аминокислотном положении 223 (S223); и е) замены гистидина на лейцин в аминокислотном положении 248 (H248L), при этом аминокислотные замены близки к fHbp ID 1 (SEQ ID NO: 1), при том, что вариант содержит аминокислотную последовательность, имеющую по меньшей мере 80% идентичности аминокислотной последовательности с SEQ ID NO: 1, при том, что вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 1 для человеческого fH, и при этом вариант вызывает бактерицидный гуморальный ответ по меньшей мере к одному штамму Neisseria meningitidis в организме млекопитающего. В некоторых случаях аминокислотная замена по Q38 представляет собой Q38R, Q38K, Q38H, Q38F, Q38Y или Q38W. В некоторых случаях аминокислотная замена по E92 представляет собой E92K, E92R, E92H, E92F, E92Y или E92W. В некоторых случаях аминокислотная замена по S223 представляет собой S223R, S223K, S223H, S223F, S223Y или S223W. В некоторых случаях вариант fHbp может дополнительно содержать R41S или R41A замену близкую к fHbp ID 1. Например, вариант fHbp может содержать R41S или R41A замену и замену в положении S223, например, R41S/S223R, близкую к fHbp ID 1. В других случаях вариант fHbp может дополнительно содержать R41S или R41A замену и замену в положении H248L близкую к fHbp ID 1. В других случаях вариант fHbp может содержать два, три или более замен, описанных в данном документе. В конкретном примере вариант fHbp может содержать следующие замены: S223R и H248L близкую к fHbp ID 1. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая представляет собой 25% или менее от аффинности fHbp ID 1 человеческого fH. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая представляет собой 10% или менее от аффинности fHbp ID 1 человеческого fH. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая представляет собой 5% или менее от аффинности fHbp ID 1 человеческого fH.
Настоящее изобретение предусматривает варианты fHbp ID 22. Настоящее изобретение предусматривает вариант fHbp, причем вариант содержит по меньшей мере одну аминокислотную замену, выбранную из: а) замены изолейцина аспарагином в аминокислотном положении 115 (N115I); b) замены глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G); c) замены треонина на серин в аминокислотном положении 128 (S128T); d) аминокислотной замены валина в положении 131 (V131); е) аминокислотной замены лизина в положении 219 (K219); f) аминокислотной замены глицина в положении 220 (G220), при этом аминокислотные замены близки к fHbp ID 22 (SEQ ID NO: 2), при том, что вариант содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID NO: 2, при том, что вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 22 для человеческого fH, и при этом вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая составляет 25% или менее от аффинности fHbp ID 22 человеческого fH. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая составляет 10% или менее от аффинности fHbp ID 22 человеческого fH. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая составляет 5% или менее от аффинности fHbp ID 22 человеческого fH. В некоторых случаях аминокислотная замена по V131 представляет собой V131D, V131E, V131K, V131R, V131H, V131F, V131Y или V131W. В некоторых случаях аминокислотная замена по K219 представляет собой K219N, K219Q, K219D, K219E, K219F, K219Y,или K219W. В некоторых случаях аминокислотная замена по G220 представляет собой G220S, G220N, G220Q, G220D, G220E, G220K, G220R, G220H, G220F, G220Y или G220W.
В некоторых случаях, вариант fHbp включает двойную мутацию, которая повышает термическую стабильность варианта fHbp по сравнению с термической стабильностью дикого типа (WT) fHbp, например, WT fHbp ID 22. В некоторых случаях, вариант fHbp может включать замены L130R и G133D близкие к fHbp ID 22 (SEQ ID NO: 2), причем вариант fHbp содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID NO: 2, при этом вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 22 для человеческого fH, причем вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего и при этом вариант имеет более высокую термическую стабильность по сравнению с термической стабильностью fHbp ID 22. В некоторых случаях, вариант fHbp может включать комбинацию замен, таких как, L130R, G133D и по меньшей мере одну аминокислотную замену, выбранную из: а) N115I; b) D121G; с) S128T; d) V131; е) K219 (например, K219N); и f) G220 (например, G220S), причем аминокислотные замены близкие к fHbp ID 22 (SEQ ID NO: 2), при этом вариант fHbp содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID No: 2, причем вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от афинности fHbp ID 22 для человеческого fH и при этом вариант индуцирует бактерицидный гуморальный ответ в организме млекопитающего. Термическая стабильность варианта fHbp может быть выше, чем WT fHbp (например, fHbp ID 22), по меньшей мере, на 5°C, 10°C, 15°C, 20°C или более, например, выше на 5°C -30°C, 5°C-25°C, 5°С-20°С, 10°С-20°С или 15°C-20°С. Используемый в данном документе термин "термическая стабильность" относится к стабильности белка при воздействии высокой температуры; термически стабильный белок варианта поддерживает свою конформацию при более высокой температуре, чем белок дикого типа. Например, вариант fHbp, который включает двойную мутацию, которая увеличивает термическую стабильность по сравнению с термической стабильностью дикого типа (WT) fHbp, например, WT fHbp ID 22, может разворачиваться при более высокой температуре по сравнению с WT fHbp. В некоторых случаях N-концевой домен варианта fHbp может разворачиваться при более высокой температуре, чем N-концевой домен WT fHbp (например, fHbp ID 22).
Также описанные в данном документе варианты fHbp, которые включают мутации, повышающие термическую стабильность по сравнению с WT fHbp и дополнительно включающие дополнительные мутации, которые известно уменьшают связывание fH, например, те, которые раскрыты в US2011/0256180. В некоторых вариантах реализации описан вариант фактор H-связывающего белка (fHbp), причем вариант включает аминокислотные замены L130R и G133D и, по меньшей мере, одну из замен: R80A, D211A, E218A, E248A, G236I, T221A и H223A близких к fHbp ID 22 (SEQ ID NO: 2), причем вариант содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID NO: 2, при этом вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 22 для человеческого fH и причем вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего.
Настоящее изобретение предусматривает варианты fHbp ID 55. Настоящее изобретение предусматривает вариант fHbp, причем вариант содержит по меньшей мере одну аминокислотную замену, выбранную из группы, состоящей из: а) аминокислотной замены глутаминовой кислоты в положении 92 (E92); b) аминокислотной замены серина в положении 223 (S223); и с) аминокислотной замены гистидина в положении 248 (H248), при этом аминокислотные замены близки к fHbp ID 55 (SEQ ID NO: 3), при том, что вариант содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности аминокислотной последовательности с SEQ ID NO: 3, при том, что вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 55 для человеческого fH, и при этом вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая составляет 25% или менее от аффинности fHbp ID 55 человеческого fH. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая составляет 10% или менее от аффинности fHbp ID 55 человеческого fH. В некоторых случаях вариант fHbp связывает человеческий fH с аффинностью, которая составляет 5% или менее от аффинности fHbp ID 55 человеческого fH. В некоторых случаях аминокислотная замена по E92 представляет собой E92K, E92R, E92H, E92F, E92Y или E92W. В некоторых случаях аминокислотная замена по S223 представляет собой S223R, S223K, S223H, S223F, S223Y или S223W. В некоторых случаях аминокислотная замена по H248 представляет собой H248L, H248I, H248V, H248D, H248E, H248F, H248Y или H248W.
Настоящее изобретение предусматривает иммуногенные композиции, содержащие вариант fHbp по настоящему изобретению. Настоящее изобретение относится к иммуногенной композиции, содержащей: а) вариант fHbp, охарактеризованный выше; и b) фармацевтически приемлемый наполнитель. В некоторых случаях вариант fHbp находится внутри везикул препарата, полученном из штамма Neisseria meningitidis. В некоторых случаях фармацевтически приемлемый наполнитель содержит адъювант; например, при этом адъювант представляет собой фосфат алюминия или гидроксид алюминия. В некоторых случаях фармацевтическая композиция дополнительно включает поверхностный белок A нейссерии.
Настоящее изобретение предусматривает нуклеиновую кислоту, кодирующую вариант fHbp, охарактеризованный выше. Настоящее изобретение предусматривает рекомбинантный экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую вариант fHbp, охарактеризованный выше. Настоящее изобретение предусматривает in vitro клетку-хозяина, содержащую нуклеиновую кислоту, кодирующую вариант fHbp, охарактеризованный выше. Настоящее изобретение предусматривает in vitro клетку-хозяина, содержащую рекомбинантный экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую вариант fHbp, охарактеризованный выше.
Настоящее изобретение предусматривает способ индукции гуморального ответа у млекопитающего, причем указанный способ включает введение млекопитающему иммуногенной композиции пункта 0011, выше. В некоторых случаях млекопитающее представляет собой человека. В некоторых случаях гуморальный ответ представляет собой бактерицидный гуморальный ответ на один или несколько штаммов N.meningitidis.
Краткое описание графических материалов
Фиг. 1 иллюстрирует очищенные рекомбинантные fHbp ID 1 мутанты окрашенные синим кумасси в полиакриламидном геле. Дорожка 1, маркер молекулярного веса Kaleidoscope (Bio-Rad Laboratories); 2, fHbp ID 1 дикий тип; 3, Q38R; 4, E92K; 5, R130G; 6, S223R; 7, H248L.
Фиг. 2A и 2B иллюстрируют связывание мутантов fHbp ID 1 с человеческим fH, проанализированное с помощью ELISA. Приведены среднее значение и диапазон для повторных измерений.
Фиг. 3A-3E иллюстрируют связывание мутантов fHbp ID 1 с человеческим fH, проанализированное с помощью поверхностного плазмонного резонанса. Для ориентира, одни и те же данные для белка ID 1 дикого типа (WT) приведены на каждой из фиг. 3A-3E.
Фиг. 4A-4E иллюстрируют связывание мышиных моноклональных антител против fHbp (mAb) с fHbp ID 1 мутантными белками, проанализированное с помощью ELISA. Приведены среднее значение и диапазон для дублированных измерений.
Фиг. 5А и 5В иллюстрируют бактерицидную активность сыворотки мышей, иммунизированных fHbp ID 1 мутантами. Каждый символ представляет собой титр отдельной мыши, а горизонтальные полосы представляют собой геометрические средние титры. Фиг. 5А иллюстрирует бактерицидную активность сыворотки мышей дикого типа, иммунизированных fHbp ID 1 мутантами. Фиг. 5B иллюстрирует бактерицидную активность сыворотки трансгенных мышей с человеческим fH, иммунизированных fHbp ID 1 мутантами.
Фиг. 6A и 6B иллюстрируют характеристику одиночных и двойных мутантов fHbp ID 1. Фиг. 6A иллюстрирует связывание человеческого fH с двойными мутантами fHbp ID 1. Фиг. 6B иллюстрирует связывание мышиных моноклональных антител JAR 4 против fHbp (mAb) с мутантами.
Фиг. 7 иллюстрирует бактерицидную активность сыворотки мышей дикого типа, иммунизированных fHbp ID 1 одиночными и двойными мутантами. Каждый символ представляет собой титр отдельной мыши, а горизонтальные полосы представляют собой геометрические средние титры.
Фиг. 8A и 8B иллюстрируют характеристику мутантов fHbp ID 55. Фиг. 8A иллюстрирует связывание человеческого fH с иммобилизованными fHbp ID 55 мутантами, проанализированное с помощью ELISA и фиг. 8B иллюстрирует связывание мышиных моноклональных антител JAR 41 против fHbp (mAb) с fHbp ID 55 мутантными белками, проанализированное с помощью ELISA. Приведены среднее значение и диапазон для двух-четырех повторных измерений.
Фиг. 9 иллюстрирует бактерицидную активность сыворотки мышей дикого типа, иммунизированных fHbp ID 55 мутантами. Каждый символ представляет собой титр отдельной мыши, а горизонтальные полосы представляют собой геометрические средние титры.
Фиг. 10A и 10B иллюстрируют бактерицидную активность сыворотки мышей, иммунизированных fHbp ID 55. Фиг. 10A иллюстрирует бактерицидную активность сыворотки трансгенных мышей с человеческим fH, иммунизированных лицензированной вакциной Trumenba или экспериментальным fHbp ID 55 мутантом S223R. Фиг. 10B иллюстрирует взаимосвязь между концентрациями человеческого fH в сыворотке крови отдельных трансгенных мышей и сывороточных бактерицидных титров антител (круглые символы). Для сравнения приведены титры мышей дикого типа (WT) (квадраты).
Фиг. 11A-11D иллюстрируют характеристику мутантов fHbp ID 22. Фиг. 11A-11C иллюстрируют связывание мутанта fHbp ID 22 с человеческим fH, проанализированное с помощью ELISA. Приведены среднее значение и диапазон двух-четырех повторных измерений. Фиг. 11D отображает связывание мышиных моноклональных антител JAR 4 против fHbp (mAb) с мутантными белками fHbp ID 22, проанализированное с помощью ELISA. fHbp ID 22 дикого типа (WT) и D211A мутант приведены в качестве контрольной группы. Приведены среднее значение и диапазон дублированных измерений.
Фиг. 12A и 12B отображают бактерицидную активность сыворотки мышей, иммунизированных fHbp ID 22 мутантами. Каждый символ представляет собой титр отдельной мыши, а горизонтальные полосы представляют собой геометрические средние титры. Фиг. 12A и фиг. 12B отображает бактерицидную активность сыворотки мышей дикого типа в двух экспериментах с целью протестировать разные мутанты fHbp ID 22.
Фиг. 13 иллюстрирует бактерицидную активность сыворотки трансгенных мышей с человеческим fH, иммунизированных fHbp ID 22 мутантами.
Фиг. 14 иллюстрирует термическое разворачивание fHbp ID 22 дикого типа (WT) и L130R/G133D двойного мутанта, проанализированное с помощью дифференциальной сканирующей микрокалориметрии.
Фиг. 15 иллюстрирует характеристику тройных мутантов fHbp ID 22. Фиг. 15A иллюстрирует связывание человеческого fH с тройными мутантами fHbp ID 22. DM относится к двойному мутанту L130R/G133D. Фиг. 15B иллюстрирует связывание мышиных моноклональных антител JAR 4 против fHbp (mAb) с тройными мутантами fHbp ID 22.
Фиг. 16 иллюстрирует бактерицидную активность сыворотки трансгенных мышей с человеческим fH, иммунизированных тройными мутантами fHbp ID 22. DM относится к двойному мутанту L130R/G133D.
Фиг. 17 иллюстрирует таблицу примерных мутантов fHbp со снижением связывания человеческого fH.
Фиг. 18 иллюстрирует аминокислотную последовательность дикого типа человеческого фактора H.
Фиг. 19 иллюстрирует аминокислотные последовательности fHbp ID 1, ID 22 и ID 55 из штаммов N.meningitidis.
Фиг. 20-24 иллюстрируют аминокислотные последовательности fHbp ID 1 вариантов.
Фиг. 25-30 иллюстрируют аминокислотные последовательности fHbp ID 22 вариантов.
Фиг. 31-33 иллюстрируют аминокислотные последовательности fHbp ID 55 вариантов.
Фиг. 34-36 иллюстрируют аминокислотные последовательности вариантов двойных мутантов fHbp ID 1.
Фиг. 37-39 иллюстрируют аминокислотные последовательности вариантов двойных мутантов и тройных мутантов fHbp ID 22.
Фиг. 40 иллюстрирует аминокислотную последовательность NspA.
Определения
"Фактор Н-связывающий белок" (fHbp), который также известен в литературе как GNA1870, GNA 1870, ORF2086, LP2086 (липопротеин 2086) и "741" относится к классу полипептидов N.meningitidis. Он встречается в природе в виде липопротеина на поверхности бактерии N.meningitidis. fHbp подразделены на три группы вариантов fHbp (упоминаемые как группа варианта 1 (v.1), группа варианта 2 (v.2) и группа варианта 3 (v.3) в некоторых отчетах (Masignani et al. (2003) J Exp Med 197:789-99) и подсемейство А и В в других отчетах (смотрите, например, Fletcher et al. (2004) Infect Immun 72:2088-2100)) на основе вариабельности последовательности аминокислотных и иммунологической перекрестной реактивности (Masignani et al. (2003) J Exp Med 197: 789-99). fHbp также можно классифицировать в одну из шести наиболее распространенных модульных групп fHbp, обозначенных от Модулярной группы I до Модулярной группы VI, как показано на фиг. 2 Vu et al. (2012) Sci. Reports 2:341. Каждый уникальный fHbp, найденный в N.meningitidis, также обозначается как fHbp пептид ID согласно веб-сайту pubmlst.org/neisseria/fHbp/. Поскольку длина варианта 2 (v.2) белка fHbp (из штамма 8047, fHbp ID 77) и варианта 3 (v.3) fHbp (из штамма M1239, fHbp ID 28) отличаются на от -1 до +7 аминокислотных остатков, соответственно, от таковой у штамма МС58 (fHbp ID 1), нумерация, используемая в данном документе для обозначения остатков для v.2 и v.3 fHbp белков отличается от нумерации на основе фактических аминокислотных последовательностей этих белков. Таким образом, например, обозначение лейцинового остатка (L) в положении 166 последовательности v.2 или v.3 fHbp относится к остатку в положении 165 белка v.2 и в положении 173 белка v.3. Если не указано иначе, нумерация аминокислотных замен, присутствующих в вариантах fHbp, является с обозначением нумерации аминокислотных остатков в fHbp ID 1.
Человеческий фактор Н ("человеческий fH"), используемый в данном документе, относится к белку, содержащему аминокислотную последовательность, как проиллюстрировано на фиг. 18 (SEQ ID NO: 4), и встречающимся в природе его человеческим аллельным вариантам.
"Полученный из" в контексте аминокислотной последовательности или полинуклеотидной последовательности (например, аминокислотная последовательность, "полученная из" fHbp ID 1) следует понимать как обозначение того, что полипептид или нуклеиновая кислота имеет последовательность, которая основана на эталонном полипептиде или нуклеиновой кислоте (например, встречающийся в природе белок fHbp или кодирующая нуклеиновая кислота), и не следует понимать как ограничение источника или метода, в котором был получен белок или нуклеиновая кислота. Не ограничивающие примеры эталонных полипептидов и эталонных полинуклеотидов, из которых последовательность аминокислот или полинуклеотидная последовательность может быть "получена из", включают, встречающийся в природе fHbp, fHbp ID 1 и не встречающийся в природе fHbp. "Полученный из" в контексте бактериальных штаммов, следует понимать как обозначение того, что штамм был получен путем пассажа in vivo, или в культуре in vitro, из родительского штамма и/или представляет собой рекомбинантную клетку, полученную путем модификации родительского штамма.
«Консервативная замена аминокислоты» относится к замене одного аминокислотного остатка на другой разделяющий те же химические и физические свойства боковой цепи аминокислоты (например, заряд, размер, гидрофобность/гидрофильность). "Консервативные замены", как предполагается, включают замены в пределах следующих групп аминокислотных остатков: gly, ala; val, ile, leu; asp, glu; asn, gln; ser, thr; lys, arg; и phe, tyr. Руководство для таких замен, можно получить из выравниваний аминокислотных последовательностей полипептидов представляющего интерес эпитопа.
Термин "защитный иммунитет" означает, что график вакцинации или иммунизации, который назначают млекопитающему вызывает иммунный ответ, который предотвращает, задерживает развитие или уменьшает тяжесть заболевания, которое вызвано Neisseria meningitidis, или уменьшает или полностью устраняет симптомы заболевания. Защитный иммунитет может сопровождаться получением бактерицидных антител. Следует отметить, что получение бактерицидных антител против Neisseria meningitidis как принято в данной области является предсказуемый для защитного эффекта вакцины в организме человека. (Goldschneider et al. (1969) J. Exp. Med. 129:1307; Borrow et al. (2001) Infect Immun. 69:1568).
Фраза "заболевание", вызванное штаммом Neisseria meningitidis" охватывает любой клинический симптом или комбинацию клинических симптомов, которые присутствуют при инфекции человека с Neisseria meningitidis. Эти симптомы включают, но не ограничиваются ими: заселение верхних дыхательных путей (например, слизистой оболочки носоглотки и миндалин) патогенным штаммом Neisseria meningitidis, проникновение бактерий в слизистую оболочку и подслизистую сосудистого русла, сепсис, септический шок, воспаление, геморрагические поражения кожи, активацию фибринолиза и свертывания крови, дисфункцию органов, таких как почки, легкие и сердечную недостаточность, кровоподтеки надпочечников и мышечный инфаркт, капиллярную утечку, отек, периферическую ишемию нижних конечностей, респираторный дистресс-синдром, перикардит и менингит.
Фраза "специфически связывается с антителом" или "специфически иммунореактивный с" в контексте антигена (например, антигена полипептида) относится к реакции связывания, которая основана на и/или служит доказательством присутствия антигена в образце, который может также включать гетерогенную популяцию других молекул. Таким образом, при указанных условиях, определенное антитело или антитела связываются с определенным антигеном или антигенами в образце и не связываются в значительном количестве с другими молекулами, присутствующими в образце. "Специфически связывается с антителом" или "специфически иммунореактивный с" в контексте эпитопа антигена (например, эпитопа полипептида) относится к реакции связывания, которая основана на и/или является доказательством присутствия эпитопа в антигене (например, полипептида), который может также включать гетерогенную популяцию других эпитопов, а также гетерогенную популяцию антигенов. Таким образом, при указанных условиях, указанное антитело или антитела связываются с конкретным эпитопом антигена и не связываются в значительном количестве с другими эпитопами, присутствующими в антигене и/или в образце.
Фраза "в количестве, достаточном, чтобы вызвать иммунный ответ" означает, что существует различимая разница между показателем иммунного ответа, измеренном до и после введения конкретного препарата антигена. Показатели иммунного ответа, включают, но не ограничиваются ими: титр антител и специфичность, обнаруженные с помощью анализа, такого как твердофазный иммуноферментный анализ (ELISA), бактерицидный анализ, проточная цитометрия, иммунопреципитация, иммунодиффузия по Оухтерлони; анализов детекции связывания, например, спот, вестерн-блот или антигенные анализы; анализов цитотоксичности и т.д.
"Поверхностный антиген" представляет собой антиген, который присутствует на поверхностной структуре Neisseria meningitidis (например, наружной оболочке, капсуле, фимбриях и т.п.).
"Выделенный" относится к объекту, представляющему интерес, который находится в среде, отличной от той, в которой соединение может встречаться в природе. "Выделенный" означает включение соединений в образцах, которые практически обогащены соединением, представляющим интерес, и/или, в которых соединение, представляющее интерес частично или практически очищено. В некоторых случаях, выделенный компонент (например, полипептид, такой как вариант fHbp настоящего изобретения; нуклеиновая кислота по настоящему изобретению; рекомбинантный вектор по настоящему изобретению) очищенный, например, изолированный компонент на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99% или более, чем 99%, чистый.
"Обогащенный" означает, что образец неприродно регулируется (например, экспериментатором или клиницистом) таким образом, что соединение, представляющее интерес, присутствует в более высокой концентрации (например, по меньшей мере в три раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 8 раз больше, по меньшей мере в 64 раза больше или более), чем концентрация соединения в исходном образце, таком как биологический образец (например, образец, в котором соединение естественно встречается или в котором оно присутствует после введения), или в котором было получено соединение (например, как бактериальный полипептид, антитело, нуклеиновая кислота и тому подобное).
Перед тем как настоящее изобретение будет дополнительно описано, следует понимать, что данное изобретение не ограничено конкретными описанными вариантами реализации, поскольку таковые могут, конечно, варьироваться. Кроме того, следует понимать, что терминология, используемая в настоящем документе, приводится в целях описания конкретных вариантов реализации изобретения и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
В случае, когда предусмотрен диапазон значений, следует понимать, что каждое промежуточное значение, до десятой единицы нижнего предела, если из контекста явно не следует иное, между верхним и нижним пределом этого диапазона и любое другое указанное или промежуточное значение в этом указанном диапазоне охватывается в пределах изобретения. Верхний и нижний пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны, а также включены в данное изобретение, с учетом любого конкретно исключенного предела в указанном диапазоне. Там, где указанный диапазон включает один или оба предела, диапазоны, исключающие любой или оба из этих включенных пределов, также включены в изобретение.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, как общедоступное обычному специалисту в области техники, к которой принадлежит это изобретение. Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, также могут быть использованы на практике или при испытании настоящего изобретения, на данный момент описаны предпочтительные способы и материалы. Все публикации, упомянутые в данном документе, включены в настоящее описание в качестве ссылки для раскрытия и описания способов и/или материалов, в связи с которыми эти публикации цитируются.
Следует отметить, что в данном описании и в прилагаемой формуле изобретения, формы единственного числа включают множественное число, если из контекста явно не следует иное. Таким образом, например, обозначение «фактор Н-связывающего белка" включает множество таких фактор Н-связывающих белков и обозначение «иммуногенной композиции» включает обозначение одной или более иммуногенных композиций и их эквивалентов, известных специалистам в данной области техники, и так далее. Следует также отметить, что формула изобретения может быть составлена для того, чтобы исключить любой необязательный элемент. Таким образом, это утверждение, как предполагается, служит в качестве предшествующей основы для использования такой особой терминологии, как "исключительно", "только" и тому подобное, в связи с перечислением элементов формулы изобретения или использования «отрицательного» ограничения.
Следует понимать, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов реализации, также могут быть представлены в комбинации в одном варианте реализации. Наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного варианта реализации, также могут быть представлены отдельно или в любой подходящей субкомбинации. Все комбинации вариантов реализации, относящихся к настоящему изобретению, в частности, охватываются настоящим изобретением и описаны в данном документе, как если бы каждая комбинация была отдельно и подробно раскрыта. Кроме того, все субкомбинации различных вариантов реализации и их элементы, также, в частности, охватываются настоящим изобретением и описаны в данном документе, как если бы каждая такая субкомбинация была отдельно и подробно раскрыта в данном документе.
Рассмотренные в настоящем документе публикации предоставлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в данном документе не должно быть истолковано как принятие того, что настоящее изобретение не имеет права датировать задним числом такую публикацию в силу предшествующего изобретения. Кроме того, даты публикации могут отличаться от фактических дат публикации, которые могут нуждаться в независимом подтверждении.
Подробное описание
Настоящее изобретение предусматривает вариант фактор Н-связывающих белков (fHbp), которые могут вызывать синтез антител, которые обладают бактерицидным действием для по меньшей мере одного штамма Neisseria meningitidis. Настоящее изобретение предусматривает иммуногенные композиции, включая композиции, содержащие вариант fHbp по настоящему изобретению. Настоящее изобретение обеспечивает способы использования варианта fHbp настоящего изобретения или композицию, содержащую вариант fHbp настоящего изобретения.
Вариант fHbp
Настоящее изобретение обеспечивает вариант fHbp, который отличается по аминокислотной последовательности от дикого типа fHbp N.meningitidis на от 1 до 10 аминокислот (например, от 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот), от 10 аминокислот до 15 аминокислот, от 15 аминокислот до 20 аминокислот, от 20 аминокислот до 30 аминокислот, от 30 аминокислот до 40 аминокислот, или от 40 аминокислот до 50 аминокислот, таким образом, что вариант fHbp проявляет пониженную аффинность к человеческому фактору Н (fH), по сравнению с эталонным fHbp, и где вариант fHbp вызывает бактерицидный иммунный ответ на один или более штаммов N.meningitidis, при введении млекопитающему. В некоторых случаях, вариант fHbp отличается по аминокислотной последовательности от эталонного fHbp дикого типа N.meningitidis, не более чем от 1 до 10 замен кислоты. В некоторых случаях, вариант fHbp отличается отаминокислотной последовательности эталонного fHbp дикого типа N.meningitidis только на одну аминокислотную замену.
В некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с эталонной последовательностью fHbp; причем вариант fHbp содержит одну или несколько аминокислотных замен близких к эталонной последовательности fHbp таким образом, что вариант fHbp проявляет аффинность к человеческому fH, которая составляет 85% или менее от аффинности связывания эталонного fHbp для человеческого fH, например, вариант fHbp проявляет аффинность к человеческому fH, которая составляет от около 85% до около 75%, около от 75% до около 65%, от около 65% до около 55%, от около 55% до около 45%, около от 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1% от аффинности связывания с эталонным fHbp для человеческого fH; и вариант fHbp индуцирует бактерицидный иммунный ответ, по меньшей мере, на один штамм N.meningitidis при введении млекопитающему (например, человеку, или на животной модели, не относящейся к человеку).
Вариант fHbp по настоящему изобретению поддерживает практически ту же конформацию эталонного (например, дикого типа) fHbp, при которой связывается человеческий fH, в то время как эталонный fHbp находится в нативной конформации. С помощью антител, которые связывают fHbp дикого типа когда, в то время как fHbp дикого типа находится в своей нативной конформации, можно определить поддерживает ли вариант fHbp по настоящему изобретению практически ту же конформацию эталонного (например, дикого типа) fHbp, которая связывает человеческий fH. Такие антитела включают, например, JAR 41; JAR 4; и JAR 31. См., например, Vu et al. (2012) Sci. Reports 2:341. Гибридом, продуцирующий JAR 4 моноклональное антитело имеет номер Американской коллекции типовых культур (АТСС), РТА-8943; см. также USPN 8470340. Например, в некоторых случаях, вариант fHbp настоящего изобретения сохраняет связывание с JAR 4; например, вариант fHbp по настоящему изобретению сохраняет по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% связывания с JAR 4 эталонного fHbp (например, fHbp ID 1, fHbp ID 22 или fHbp ID 55) в своей нативной конформации.
Варианты fHbp ID 1
“Эталонный fHbp”, из которого происходит вариант fHbp по настоящему изобретению, в некоторых случаях представляет собой fHbp ID 1. Аминокислотная последовательность fHbp ID 1 изложена ниже.
fHbp ID 1: CSSGGGGVAADIGAGLADALTAPLDHKDKGLQSLTLDQSVRKNEKLKLAAQGAEKTYGNGDSLNTGKLKNDKVSRFDFIRQIEVDGQLITLESGEFQVYKQSHSALTAFQTEQIQDSEHSGKMVAKRQFRIGDIAGEHTSFDKLPEGGRATYRGTAFGSDDAGGKLTYTIDFAAKQGNGKIEHLKSPELNVDLAAADIKPDGKRHAVISGSVLYNQAEKGSYSLGIFGGKAQEVAGSAEVKTVNGIRHIGLAAKQ (SEQ ID NO: 1).
В некоторых случаях вариант fHbp по настоящему изобретению представляет собой группу 1 fHbp. В некоторых случаях вариант fHbp по настоящему изобретению представляет собой группу 1 fHbp и модулярную группу I fHbp. В некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1; причем вариант fHbp содержит одну или несколько аминокислотных замен близких к fHbp ID 1 таким образом, что вариант fHbp проявляет аффинность к человеческому fH, которая составляет 85% или менее от аффинности связывания fHbp ID 1 для человеческого fH, например, вариант fHbp проявляет аффинность к человеческому fH, которая составляет от около 85% до около 75%, около от 75% до около 65%, от около 65% до около 55%, от около 55% до около 45%, около от 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1% от аффинности связывания с fHbp ID 1 для человеческого fH; и вариант fHbp индуцирует бактерицидный иммунный ответ, по меньшей мере, на один штамм N.meningitidis при введении млекопитающему (например, человеку, или на животной модели, не относящейся к человеку).
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену, выбранную из по меньшей мере одной из: а) аминокислотной замены глутамина в аминокислотном положении 38 (Q38); b) аминокислотной замены глутаминовой кислоты в аминокислотном положении 92 (E92); с) замены глицина на аргинин в аминокислотном положении 130 (R130G); d) аминокислотной замены серина в аминокислотном положении 223 (S223); и е) замены гистидина на лейцин в аминокислотном положении 248 (H248L), на основе нумерации fHbp ID 1.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену глутамина в аминокислотном положении 38 (Q38). В некоторых случаях вариант fHbp содержит Q38R замену. Другие аминокислоты с положительно заряженными или ароматическими боковыми цепями, такими как лизин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. В некоторых случаях вариант fHbp содержит Q38K замену, Q38H замену, Q38F замену, Q38Y замену или Q38W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 20 и изложенную в SEQ ID NO: 5.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену глутаминовой кислоты в аминокислотном положении 92 (E92). В некоторых случаях вариант fHbp содержит E92K замену. Другие аминокислоты с положительно заряженными или ароматическими боковыми цепями, такими как аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит E92R замену, E92H замену, E92F замену, E92Y замену или E92W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 21 и изложенную в SEQ ID NO: 6.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит замену глицина на аргинин в аминокислотном положении 130 (R130G). Например, вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 22 и изложенную в SEQ ID NO: 7. Другие аминокислоты с отрицательно заряженными или ароматическими боковыми цепями, такими как аспартат, глутамат, фенилаланин, тирозин или триптофан, могут быть замещены в положении R130. Таким образом, например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит R130D замену, R130E замену, R130F замену, R130Y замену или R130W замену.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену серина в аминокислотном положении 223 (S223). В некоторых случаях вариант fHbp содержит S223R замену. Другие аминокислоты с положительно заряженными или ароматическими боковыми цепями, такими как лизин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит S223K замену, S223H замену, S223F замену, S223Y замену или S223W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 23 и изложенную в SEQ ID NO: 8.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит замену гистидина на лейцин в аминокислотном положении 248 (H248L). Например, вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 24 и изложенную в SEQ ID NO: 9. Другие аминокислоты с неполярными, отрицательно заряженными или ароматическими боковыми цепями, такими как изолейцин, валин, аспартат, глутамат, фенилаланин, тирозин или триптофан, также могут быть замещены в положении H248. Таким образом, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит H248I замену, H248V замену, H248D замену, H248E замену, H248F замену, H248Y замену или H248W замену.
Комбинации аминокислотных замен
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену, выбранную из двух или более: а) аминокислотной замены глутамина в аминокислотном положении 38 (Q38); b) аминокислотной замены глутаминовой кислоты в аминокислотном положении 92 (E92); с) замены глицина на аргинин в аминокислотном положении 130 (R130G); d) аминокислотной замены серина в аминокислотном положении 223 (S223); и е) замены гистидина на лейцин в аминокислотном положении 248 (H248L), на основе нумерации fHbp ID 1.
Могут быть включены комбинации замен, причем две замены в различных структурных доменах, и каждая независимо друг от друга уменьшает связывание fH с fHbp (например, одна замена в N-концевом домене, в комбинации с заменой аминокислоты в С-концевом домене. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах N-концевого домена; и вторую аминокислотную замену в пределах С-концевого домена. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах N-концевого домена; и вторую аминокислотную замену в пределах N-концевого домена. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах C-концевого домена; и вторую аминокислотную замену в пределах С-концевого домена.
Например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит: а) аминокислотную замену глутамина в аминокислотном положении 38 (Q38) и b) аминокислотную замену глутаминовой кислоты в аминокислотном положении 92 (E92); или при этом вариант fHbp содержит: а) аминокислотную замену глутамина в аминокислотном положении 38 (Q38) и с) замену глицина на аргинин в аминокислотном положении 130 (R130G); или при этом вариант fHbp содержит а) аминокислотную замену глутамина в аминокислотном положении 38 (Q38) и d) аминокислотную замену серина в аминокислотном положении 223 (S223); или при этом вариант fHbp содержит а) аминокислотную замену глутамина в аминокислотном положении 38 (Q38) и е) замену гистидина на лейцин в аминокислотном положении 248 (H248L), на основе нумерации fHbp ID 1.
В качестве дополнительных неограничивающих примеров в некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит: b) аминокислотную замену глутаминовой кислоты в аминокислотном положении 92 (E92) и с) замену глицина на аргинин в аминокислотном положении 130 (R130G); или при этом вариант fHbp содержит: b) аминокислотную замену глутаминовой кислоты в аминокислотном положении 92 (E92) и d) аминокислотную замену серина в аминокислотном положении 223 (S223); или при этом вариант fHbp содержит b) аминокислотную замену глутаминовой кислоты в аминокислотном положении 92 (E92) и е) замену гистидина на лейцин в аминокислотном положении 248 (H248L); или при этом вариант fHbp содержит с) аминокислотную замену глицина на аргинин в аминокислотном положении 130 (R130G) и d) аминокислотную замену серина в аминокислотном положении 223 (S223); или при этом вариант fHbp содержит с) аминокислотную замену глицина на аргинин в аминокислотном положении 130 (R130G) и е) замену гистидина на лейцин в аминокислотном положении 248 (H248L), или при этом вариант fHbp содержит d) аминокислотную замену серина в аминокислотном положении 223 (S223) и е) замену гистидина на лейцин в аминокислотном положении 248 (H248L), на основе нумерации fHbp ID 1.
В качестве дополнительных неограничивающих примеров, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 1 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит: i) Q38R замену; и ii) R130G замену, на основе нумерации fHbp ID 1.
Также в данном документе предусмотрены варианты fHbp белков, которые включают fHbp одну или несколько замен подобные аминокислотной последовательности fHbp ID 1, как указано выше, и дополнительно включают замену R41S. Примерный вариант fHbp включает замену R41S и замену в S223, например, R41S/S223R близкую к fHbp ID 1 или замену R41S и H248L замену близкую к fHbp ID 1. В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 1, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis в организме млекопитающего, и при этом вариант fHbp включает две или более из следующих аминокислотных замен: а) замену серина на аргинин глутамина в аминокислотном положении 41 (R41S); b) замену аргинина на серин в аминокислотном положении 223 (S223R); с) замену лейцина на гистидин в аминокислотном положении 248 (H248L), на основе нумерации fHbp ID 1.
Также в данном документе описаны варианты fHbp белков, которые включают одну или несколько замен подобных аминокислотной последовательности fHbp ID 1, как указано выше, и дополнительно включают замены, описанные в US2011/0256180, которые включены в данный документ в полном объеме посредством ссылки.
Варианты fHbp ID 22
“Эталонный fHbp”, из которого происходит вариант fHbp по настоящему изобретению, в некоторых случаях представляет собой fHbp ID 22. Аминокислотная последовательность fHbp ID 22 изложена ниже.
fHbp ID 22: CSSGGGGVAADIGAGLADALTAPLDHKDKSLQSLTLDQSVRKNEKLKLAAQGAEKTYGNGDSLNTGKLKNDKVSRFDFIRQIEVDGQLITLESGEFQIYKQDHSAVVALQIEKINNPDKIDSLINQRSFLVSGLGGEHTAFNQLPSGKAEYHGKAFSSDDPNGRLHYSIDFTKKQGYGRIEHLKTPEQNVELASAELKADEKSHAVILGDTRYGGEEKGTYHLALFGDRAQEIAGSATVKIREKVHEIGIAGKQ (SEQ ID NO: 2).
В некоторых случаях вариант fHbp по настоящему изобретению представляет собой группу 2 fHbp. В некоторых случаях вариант fHbp по настоящему изобретению представляет собой группу 2 fHbp и модулярную III fHbp. В некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2; причем вариант fHbp содержит одну или несколько аминокислотных замен близких к fHbp ID 22 таким образом, что вариант fHbp проявляет аффинность к человеческому fH, которая составляет 85% или менее от аффинности связывания fHbp ID 22 для человеческого fH, например, вариант fHbp проявляет аффинность к человеческому fH, которая составляет от около 85% до около 75%, около от 75% до около 65%, от около 65% до около 55%, от около 55% до около 45%, около от 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1% от аффинности связывания с fHbp ID 22 для человеческого fH; и вариант fHbp индуцирует бактерицидный иммунный ответ, по меньшей мере, на один штамм N.meningitidis при введении млекопитающему (например, человеку, или на животной модели, не относящейся к человеку).
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит аминокислотную замену, выбранную из по меньшей мере одной: а) замены изолейцина на аспарагин в аминокислотном положении 115 (N115I); b) замены глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G); с) замены треонина на серин в аминокислотном положении 128 (S128T); d) замены валина в положении 131 (V131); е) замены аминокислоты лизина в положении 219 (K219); f) замены аминокислоты глицина в положении 220 (G220), близких к аминокислотной последовательности fHbp ID 22. Как указанно в данном документе нумерация аминокислотных остатков основана на такой fHbp ID 1.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит замену гистидина на изолейцина на аспарагин в аминокислотном положении 115 (N115I). Например, вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 25 и изложенную в SEQ ID NO: 10. Другие аминокислоты с неполярными, положительно заряженными или ароматическими боковыми цепями, такими как валин, лейцин, лизин, аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в положении N115. Таким образом, например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит N115V замену, N115L замену, N115K замену, N115R замену, N115H замену, N115F замену, N115Y замену или N115W замену, близкие к аминокислотной последовательности fHbp ID 22.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит замену глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G). Например, вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 26 и изложенную в SEQ ID NO: 11. Другие аминокислоты с неполярными, положительно заряженными или ароматическими боковыми цепями, такими как лейцин, изолейцин, валин, лизин, аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в положении D121. Таким образом, например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит D121L замену, D121I замену, D121V замену, D121K замену, D121R замену, D121H замену, D121F замену, D121Y замену или D121W замену, близкие к аминокислотной последовательности fHbp ID 22.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит замену треонина на серин в аминокислотном положении 128 (S128T). Например, вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 27 и изложенную в SEQ ID NO: 12. Другие аминокислоты с полярными, заряженными или ароматическими боковыми цепями, такими как метионин, аспарагин, глутамин, аспартат, глутамат, лизин, аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в положении S128. Таким образом, например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит S128M замену, S128N замену, S128D замену, S128E замену, S128K замену, S128R замену, S128H замену, S128F замену, S128Y замену или S128W замену, близкие к аминокислотной последовательности fHbp ID 22.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену валина в положении 131 (V131). В некоторых случаях вариант fHbp содержит V131D замену. Другие аминокислоты с заряженными или ароматическими боковыми цепями, такими как глутамат, лизин, аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит V131E замену, V131K замену, V131R замену, V131H замену, V131F замену, V131Y замену или V131W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 28 и изложенную в SEQ ID NO: 13 близкую к аминокислотной последовательности fHbp ID 22.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену лизина в положении 219 (K219). В некоторых случаях вариант fHbp содержит K219N замену. Другие аминокислоты с полярными, отрицательно заряженными или ароматическими боковыми цепями, такими как глутамин, аспартат, глутамат, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит K219Q замену, K219D замену, K219E замену, K219F замену, K219Y замену или K219W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 29 и изложенную в SEQ ID NO: 14.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену глицина в положении 220 (G220). В некоторых случаях вариант fHbp содержит G220S замену. Другие аминокислоты с полярными, заряженными или ароматическими боковыми цепями, такими как аспарагин, глутамин, аспартат, глутамат, лизин, аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит G220N замену, G220Q замену, G220D замену, G220E замену, G220K замену, G220R замену, G220H замену, G220F замену, G220Y замену или G220W замену. Например, вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 30 и изложенную в SEQ ID NO: 15.
Комбинации аминокислотных замен
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит аминокислотную замену, выбранную из двух или более из: а) замены изолейцина на аспарагин в аминокислотном положении 115 (N115I); b) замены глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G); с) замены треонина на серин в аминокислотном положении 128 (S128T); d) замены валина в положении 131 (V131); е) замены аминокислоты лизина в положении 219 (K219); f) замены аминокислоты глицина в положении 220 (G220), близких к аминокислотной последовательности fHbp ID 22. Как указанно в данном документе нумерация аминокислотных остатков основана на нумерации аминокислот в fHbp ID 1.
Могут быть включены комбинации замен, причем две замены в различных структурных доменах, и каждая независимо друг от друга уменьшает связывание fH с fHbp (например, одна замена в N-концевом домене, в комбинации с заменой аминокислоты в С-концевом домене). В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах N-концевого домена; и вторую аминокислотную замену в пределах С-концевого домена. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах N-концевого домена; и вторую аминокислотную замену в пределах N-концевого домена. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах C-концевого домена; и вторую аминокислотную замену в пределах С-концевого домена.
Например, в некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит: а) замену изолейцина на аспарагин в аминокислотном положении 115 (N115I) и b) замену глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G); или при этом вариант fHbp содержит: а) замену изолейцина на аспарагин в аминокислотном положении 115 (N115I) и c) замену треонина на серин в положении 128 (S128T); или при этом вариант fHbp содержит: а) замену изолейцина на аспарагин в аминокислотном положении 115 (N115I) и d) аминокислотную замену валина в аминокислотном положении 131 (V131); или при этом вариант fHbp содержит а) замену изолейцина на аспарагин в аминокислотном положении 115 (N115I) и е) аминокислотную замену лизина в положении 219 (K219); или при этом вариант fHbp содержит: а) замену изолейцина на аспарагин в аминокислотном положении 115 (N115I) и f) аминокислотную замену глицина в положении 220 (G220), близкие с аминокислотной последовательностью fHbp ID 22, нумерация замещенных остатков на основе нумерации аминокислотной последовательности fHbp ID 1.
В качестве дополнительных неограничивающих примеров, в некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит: b) замену глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G) и c) замену треонина на серин в положении 128 (S128T); или при этом вариант fHbp содержит: b) замену глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G) и d) аминокислотную замену валина в аминокислотном положении 131 (V131); или при этом вариант fHbp содержит b) замену глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G) и е) аминокислотную замену лизина в аминокислотном положении 219 (K219); или при этом вариант fHbp содержит: b) замену глицина на аспарагиновую кислоту в аминокислотном положении 121 (D121G) и f) аминокислотную замену глицина в положении 220 (G220), близкие к аминокислотной последовательности fHbp ID 22. Нумерация замещенного остатка(ов) на основе нумерации аминокислотной последовательности fHbp ID 1.
В качестве дополнительных неограничивающих примеров, в некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит: c) замену треонина на серин в аминокислотном положении 128 (S128T) и d) аминокислотную замену валина в положении 131 (V131); или при этом вариант fHbp содержит: c) замену треонина на серин в аминокислотном положении 128 (S128T) и е) аминокислотную замену лизина в положении 219 (K219); или при этом вариант fHbp содержит: c) замену треонина на серин в положении 128 (S128T) и f) аминокислотную замену глицина в положении 220 (G220), или при этом вариант fHbp содержит: d) аминокислотную замену валина в положении 131 (V131) и; е) аминокислотную замену лизина в положении 219 (K219); или при этом вариант fHbp содержит: d) аминокислотную замену валина в положении 131 (V131) и f) аминокислотную замену глицина в положении 220 (G220), или при этом вариант fHbp содержит: е) аминокислотную замену лизина в положении 219 (K219) и f) аминокислотную замену глицина в положении 220 (G220), близкие с аминокислотной последовательностью fHbp ID 22. Нумерация замещенного остатка(ов) на основе нумерации аминокислотной последовательности fHbp ID 1.
Могут быть включены комбинации замен, причем две замены в различных структурных доменах, и каждая независимо друг от друга уменьшает связывание fH с fHbp (например, одна замена в N-концевом домене (например, N115I, D121G, S128T или V131D), в комбинации с одной в С-концевом домене (например, D211A, K219N, G220S).
Например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит: i) N115I замену; и ii) D211A замену.
В качестве другого примера, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит: i) N115I замену; и ii) K219N замену.
В качестве другого примера, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 2, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 22 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis в организме млекопитающего, и при этом вариант fHbp содержит: i) N115I замену; и ii) G220S замену.
Также в данном документе описаны варианты fHbp полипептидов с повышенной термической стабильностью по сравнению с диким типом fHbp ID22. В некоторых случаях, вариант fHbp может включать замены L130R и G133D близкие к fHbp ID 22 (SEQ ID NO: 2), причем вариант fHbp содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID NO: 2, при этом вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 22 для человеческого fH, причем вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего и вариант имеет более высокую термическую стабильность, чем у WT fHbp ID 22. Термическая стабильность варианта fHbp может быть выше, чем у WT fHbp (например, fHbp ID 22), по меньшей мере, на 5°C, 10°C, 15°C, 20°C или более, например, выше на 5°C-30°C, 5°C-25°C, 5°С-20°С, 10°С-20°С или 15°C-20°С. Используемый в данном документе термин "термическая стабильность" относится к стабильности белка при воздействии высокой температуры; термически стабильный белок варианта поддерживает свою конформацию при более высокой температуре, чем белок дикого типа. Например, вариант fHbp, который включает двойную мутацию, которая увеличивает термическую стабильность по сравнению с термической стабильностью дикого типа (WT) fHbp, например, WT fHbp ID 22, может разворачиваться при более высокой температуре по сравнению с WT fHbp. В некоторых случаях N-концевой домен варианта fHbp может разворачиваться при более высокой температуре, чем N-концевой домен WT fHbp (например, fHbp ID 22).
В некоторых вариантах реализации описан вариант фактор H-связывающего белка (fHbp), причем вариант включает аминокислотные замены L130R и G133D и, по меньшей мере, одну из замен: R80A, N115I, D121G, S128T, V131, D211A, E218A, K219 (например, K219N), G220 (например, G220S), E248A, G236I, T221A и H223A близких к fHbp ID 22 (SEQ ID NO: 2), причем вариант содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID NO: 2, при этом вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 22 для человеческого fH и причем вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего.
В некоторых случаях, вариант fHbp может включать комбинацию замен, таких как, L130R, G133D и по меньшей мере одну аминокислотную замену, выбранную из: а) N115I; b) D121G; с) S128T; d) V131D; е) K219 (например, K219N); и f) G220 (например, G220S), причем аминокислотные замены близкие к fHbp ID 22 (SEQ ID NO: 2), при этом вариант fHbp содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID No: 2, причем вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от афинности fHbp ID 22 для человеческого fH и при этом вариант индуцирует бактерицидный гуморальный ответ в организме млекопитающего.
В некоторых вариантах реализации описан вариант фактор H-связывающего белка (fHbp), причем вариант включает аминокислотные замены L130R и G133D и, по меньшей мере, одну из замен: R80A, D211A, E218A, E248A, G236I, T221A и H223A близких к fHbp ID 22 (SEQ ID NO: 2), причем вариант содержит аминокислотную последовательность, имеющую более чем 85% идентичности аминокислотной последовательности с SEQ ID NO: 2, при этом вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или меньше от аффинности fHbp ID 22 для человеческого fH и причем вариант вызывает бактерицидный гуморальный ответ в организме млекопитающего.
Примерный вариант fHbp включает полипептид, имеющий аминокислотную последовательность с более чем 85% идентичности аминокислотной последовательности (например, по меньшей мере 90% идентичности, по меньшей мере 95% идентичности, по меньшей мере 96% идентичности, по меньшей мере 97% идентичности, по меньшей мере 98% идентичности, по меньшей мере 99% идентичности) с SEQ ID NO: 2 и включающей следующие замены, близкие к аминокислотной последовательности SEQ ID NO: 2: L130R и G133D; L130R, G133D и K219N; или L130R, G133D и G220S.
Также в данном документе описаны варианты fHbp белков, которые включают одну или несколько замен подобных аминокислотной последовательности fHbp ID 22, как указано выше, и дополнительно включают замены, описанные в US 2011/0256180, которые включены в данный документ в полном объеме посредством ссылки.
Варианты fHbp ID 55
“Эталонный fHbp”, из которого происходит вариант fHbp по настоящему изобретению, в некоторых случаях представляет собой fHbp ID 55. Аминокислотноая последовательность fHbp ID 55 изложена ниже.
fHbp ID 55: CSSGGGGSGGGGVTADIGTGLADALTAPLDHKDKGLKSLTLEDSISQNGTLTLSAQGAEKTYGNGDSLNTGKLKNDKVSRFDFIRQIEVDGQLITLESGEFQVYKQSHSALTALQTEQEQDPEHSEKMVAKRRFRIGDIAGEHTSFDKLPKDVMATYRGTAFGSDDAGGKLTYTIDFAAKQGHGKIEHLKSPELNVDLAVAYIKPDEKHHAVISGSVLYNQDEKGSYSLGIFGEKAQEVAGSAEVETANGIHHIGLAAKQ (SEQ ID NO: 3).
В некоторых случаях вариант fHbp по настоящему изобретению представляет собой группу 1 fHbp. В некоторых случаях вариант fHbp по настоящему изобретению представляет собой группу 1 fHbp и модулярную IV fHbp.
В некоторых случаях вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3; причем вариант fHbp содержит одну или несколько аминокислотных замен близких к fHbp ID 55 таким образом, что вариант fHbp проявляет аффинность к человеческому fH, которая составляет 85% или менее от аффинности связывания fHbp ID 55 для человеческого fH, например, вариант fHbp проявляет аффинность к человеческому fH, которая составляет от около 85% до около 75%, около от 75% до около 65%, от около 65% до около 55%, от около 55% до около 45%, около от 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1% от аффинности связывания с fHbp ID 55 для человеческого fH; и вариант fHbp индуцирует бактерицидный иммунный ответ, по меньшей мере, на один штамм N.meningitidis при введении млекопитающему (например, человеку, или на животной модели, не относящейся к человеку).
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 55 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену, выбранную из по меньшей мере одной из: а) аминокислотной замены глутаминовой кислоты в положении 92 (E92); b) аминокислотной замены серина в положении 223 (S223); и с) замены гистидина в положении 248 (H248); близких к аминокислотной последовательности fHbp ID 55, при этом нумерация аминокислотных остатков основана на нумерации fHbp ID 1.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 55 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену глутаминовой кислоты в положении 92 (E92). В некоторых случаях вариант fHbp содержит E92K замену. Другие аминокислоты с положительно заряженными или ароматическими боковыми цепями, такими как аргинин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит E92R замену, E92H замену, E92F замену, E92Y замену или E92W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 31 и изложенную в SEQ ID NO: 16.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 55 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену серина в положении 223 (S223). В некоторых случаях вариант fHbp содержит S223R замену. Другие аминокислоты с положительно заряженными или ароматическими боковыми цепями, такими как лизин, гистидин, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит S223K замену, S223H замену, S223F замену, S223Y замену или S223W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную, последовательность отображенную на фиг. 32 и изложенную в SEQ ID NO: 17.
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 55 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, к одному штамму N.meningitidis, в организме млекопитающего, и при этом вариант fHbp включает аминокислотную замену гистидина в положении 248 (H248). В некоторых случаях вариант fHbp содержит H248L замену. Другие аминокислоты с неполярными, отрицательно заряженными или ароматическими боковыми цепями, такими как изолейцин, валин, аспартат, глутамат, фенилаланин, тирозин или триптофан, также могут быть замещены в этом положении. Таким образом, например, в некоторых случаях вариант fHbp содержит H248I замену, H248V замену, H248D замену, H248E замену, H248F замену, H248Y замену или H248W замену. В качестве одного примера вариант fHbp по настоящему изобретению может содержать аминокислотную последовательность, отображенную на фиг. 33 и изложенную в SEQ ID NO: 18.
Комбинации аминокислотных замен
В некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 55 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит две или более аминокислотных замен, выбранных из группы, состоящей из: а) аминокислотной замены глутаминовой кислоты в положении 92 (E92); b) аминокислотной замены серина в положении 223 (S223); и с) аминокислотной замены гистидина в положении 248 (H248), близких к fHbp ID 55; при этом нумерация аминокислотных остатков основана на нумерации fHbp ID 1.
Могут быть включены комбинации замен, причем две замены в различных структурных доменах, и каждая независимо друг от друга уменьшает связывание fH с fHbp (например, одна замена в N-концевом домене, в комбинации с заменой аминокислоты в С-концевом домене. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах N-концевого домена; и вторую аминокислотную замену в пределах С-концевого домена. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах N-концевого домена; и вторую аминокислотную замену в пределах N-концевого домена. В некоторых случаях, вариант fHbp по настоящему изобретению содержит первую аминокислотную замену в пределах C-концевого домена; и вторую аминокислотную замену в пределах С-концевого домена.
Например, в некоторых случаях, вариант fHbp по настоящему изобретению содержит аминокислотную последовательность, имеющую по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3, причем вариант fHbp связывает человеческий fH с аффинностью, которая составляет 50% или менее (например, от около 50% до около 45%, от около 45% до около 35%, от около 35% до около 25%, от около 25% до около 15%, от около 15% до около 10%, от около 10% до около 5%, от около 5% до около 2%, от около 2% до около 1%, или от около 1% до около 0,1%, или менее чем 0,1%) от аффинности fHbp ID 55 для человеческого fH, при том, что вариант вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм N.meningitidis, в организме млекопитающего, и при этом вариант fHbp содержит: а) аминокислотной замены глутаминовой кислоты в положении 92 (E92); b) аминокислотной замены серина в положении 223 (S223); и при этом вариант fHbp содержит: а) аминокислотной замены глутаминовой кислоты в положении 92 (E92); с) замены гистидина в положении 248 (H248); при этом вариант fHbp содержит: b) аминокислотную замену серина в положении 223 (S223) и с) аминокислотную замену гистидина в положении 248 (H248); или при этом вариант fHbp содержит: а) аминокислотную замену глутаминовой кислоты в положении 92 (E92) и b) аминокислотную замену серина в положении 223 (S223) и с) аминокислотную замену гистидина в положении 248 (H248); близких к fHbp ID 55; при этом нумерация аминокислотных остатков основана на нумерации fHbp ID 1.
Также в данном документе описаны варианты fHbp белков, которые включают одну или несколько замен подобных аминокислотной последовательности fHbp ID 55, как указано выше, и дополнительно включают замены, описанные в US 2011/0256180, которые включены в данный документ в полном объеме посредством ссылки.
Слитые полипептиды
Вариант fHbp по настоящему изобретению может представлять собой слитый полипептид, например, полипептид, содержащий вариант fHbp, как описано выше, и гетерологичный полипептид (например, слитый партнер). Слитый партнер может быть на N-конце варианта fHbp, на С-конце варианта fHbp или во внутреннем сайте в пределах fHbp.
Подходящие слитые партнеры включают слитые пептиды и полипептиды, которые придают повышенную стабильность in vivo (например, повышение времени полужизни сыворотки); обеспечивают легкость очистки, например, (His)n, например, 6His и тому подобное; обеспечивают секрецию слитого белка из клетки; обеспечивают метку эпитопа, например, GST, гемагглютинин (HA, например, YPYDVPDYA; SEQ ID NO: 26), FLAG (например, DYKDDDDK; SEQ ID NO: 27), c-myc (например, EQKLISEEDL; SEQ ID NO: 28), и тому подобное; обеспечивают детектируемый сигнал, например, фермент, который образовывает детектируемый продукт (например, в-галактозидаза, люцифераза), или белок, который можно обнаружить самого по себе, например, зеленый флуоресцентный белок, желтый флуоресцентный белок и т.д.; предусмотрены для мультимеризации, например, домен мультимеризации, такой как Fc часть иммуноглобулина; и тому подобное.
СПОСОБЫ ПОЛУЧЕНИЯ
fHbp по настоящему изобретению могут быть получены любым подходящим способом, в том числе рекомбинантными и нерекомбинантными способами (например, химического синтеза). В случае, если субъект fHbp получают с использованием рекомбинантных методов, способы могут включать любую подходящую конструкцию и любую подходящую клетку-хозяина, которая может быть прокариотической или эукариотической клеткой, обычно бактериальной или дрожжевой клеткой-хозяином, чаще бактериальной клеткой. Способы введения генетического материала в клетки-хозяева включают, например, трансформацию, электропорацию, конъюгацию, способы фосфата кальция и тому подобное. Способ переноса может быть выбран таким образом, чтобы обеспечить стабильную экспрессию введенной fHbp-кодирующей нуклеиновой кислоты. FHbp-кодирующая нуклеиновая кислота может быть предусмотрена в качестве наследуемого эписомального элемента (например, плазмиды) или может быть интегрирована в геном.
Настоящее изобретение обеспечивает нуклеиновые кислоты (включая выделенные нуклеиновые кислоты), которые содержат нуклеотидную последовательность, кодирующую вариант fHbp по настоящему изобретению. В некоторых вариантах реализации настоящего изобретения нуклеотидная последовательность, кодирующая вариант fHbp функционально связана с элементом контроля транскрипции, например, промотором. В некоторых случаях промотор является конститутивным. В некоторых случаях промотор является индуцибельным. В некоторых случаях, промотор, подходящий для использования (например, активный в) прокариотической клетки-хозяина. В некоторых случаях, промотор, подходящий для использования (например, активный в) эукариотической клетки-хозяина.
В некоторых случаях, нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую вариант fHbp по настоящему изобретению присутствует в векторе экспрессии. Настоящее изобретение предусматривает рекомбинантный вектор экспрессии (например, выделенный рекомбинантный вектор экспрессии), который содержит нуклеотидную последовательность, кодирующую вариант fHbp по настоящему изобретению. В некоторых вариантах реализации нуклеотидная последовательность, кодирующая вариант fHbp функционально связана с элементом контроля транскрипции, например, промотором. В некоторых случаях промотор является конститутивным. В некоторых случаях промотор является индуцибельным. В некоторых случаях, промотор, подходящий для использования (например, активный в) прокариотической клетки-хозяина. В некоторых случаях, промотор, подходящий для использования (например, активный в) эукариотической клетки-хозяина.
Подходящие векторы для переноса fHbp-кодирующей нуклеиновой кислоты могут варьировать в композиции. Интегративные векторы могут быть при определенных условиях репликативными или плазмидами-самоубийцами, бактериофагами и тому подобное. Эти конструкции могут включать различные элементы, включая, например, промоторы, селективные генетические маркеры (например, гены, придающие устойчивость к антибиотикам (например, канамицин, эритромицин, хлорамфеникол или гентамицина)), сайт инициации репликации (для продвижения репликации в клетке-хозяине, например, бактериальной клетке-хозяине), и тому подобное. Выбор вектора будет зависеть от множества факторов, таких как тип клеток, в которых желательно размножение и цель размножения. Некоторые векторы используются для усиления и получения больших количеств желаемой последовательности ДНК. Другие векторы, подходящие для экспрессии в клетках в культуре. Еще другие векторы, подходящие для переноса и экспрессии в клетках в целом организме. Выбор соответствующего вектора находится в пределах компетенции специалиста в данной области техники. Много таких векторов являются коммерчески доступными.
В одном примере, вектор представляет собой вектор экспрессии на основе эписомальных плазмид, содержащих селективные маркеры устойчивости к лекарствам и элементы, которые предусмотрены для автономной репликации в различных клетках-хозяевах (например, как в E.coli и N.meningitidis). Одним из примеров такого "челночного вектора" является плазмида pFP10 (Pagotto et al. (2000) Gene 244:13-19).
Конструкты (рекомбинантные векторы) могут быть получены, например, с помощью встраивания интересующего полинуклеотида в остов конструкта, как правило, посредством связывания ДНК-лигазой к расщепленному сайту фермента рестрикции в векторе. В качестве альтернативы, необходимая нуклеотидная последовательность может быть вставлена с помощью гомологичной рекомбинации или сайт-специфической рекомбинации. Как правило, гомологичная рекомбинация осуществляется путем присоединения участков гомологии к вектору фланкирующими желательную нуклеотидную последовательность, в то время как сайт-специфическая рекомбинация может осуществляться путем использования последовательностей, которые облегчают сайт-специфичную рекомбинацию (например, cre-lox, att сайты, и т.д.). Нуклеиновая кислота, содержащая такие последовательности, может быть добавлена с помощью, например, лигирования олигонуклеотидов или с помощью полимеразной цепной реакции с использованием праймеров, содержащих оба участка гомологии и часть необходимой нуклеотидной последовательности.
Векторы могут быть предусмотрены для экстрахромосомального поддержания в клетке-хозяине или могут быть предусмотрены для интеграции в геном клетки-хозяина. Векторы подробно описаны в многочисленных публикациях, которые хорошо известны в данной области техники, в том числе, например, Short Protocols in Molecular Biology, (1999) F. Ausubel, et al., eds., Wiley & Sons. Векторы могут быть предусмотрены для экспрессии нуклеиновых кислот, кодирующих субъект fHbp, могут быть предусмотрены для размножения нуклеиновых кислот субъекта или и того, и другого.
Примерами векторов, которые могут быть использованы, включают, но не ограничиваются ими, полученные из рекомбинантной ДНК бактериофага, плазмидной ДНК или космидной ДНК. Например, могут быть использованы плазмидные векторы, такие как pBR322, pUC 19/18, pUC 118, 119 и М13 серии векторов. рЕТ21 также является вектором экспрессии, который может быть использован. Векторы бактериофага могут включать лgt10, лgt11, лgt18-23, лZAP/R и EMBL серии векторов бактериофага. Дополнительные векторы, которые могут быть использованы, включают, но не ограничиваются ими, pJB8, pCV 103, pCV 107, pCV 108, pTM, pMCS, pNNL, pHSG274, COS202, COS203, pWE15, pWE16 и харомиду 9 серии векторов.
Для экспрессии субъекта fHbp, может быть использована кассета экспрессии. Таким образом, настоящее изобретение предусматривает рекомбинантный экспрессирующий вектор, содержащий нуклеиновую кислоту субъекта. Вектор экспрессии предусматривает последовательности, регуляторные для транскрипции и трансляции, и может предусматривать индуцибельную или конститутивную экспрессию, при этом кодирующий участок функционально связан под транскрипционным контролем участка инициации транскрипции, а также участок терминации транскрипции и трансляции. Эти участки контроля могут быть нативным с fHbp, из которого происходит субъект fHbp, или могут быть получены из экзогенных источников. В целом, регуляторные последовательности транскрипции и трансляции могут включать, но не ограничиваются ими, последовательности промотора, сайты связывания рибосом, последовательности старта и остановки транскрипции, последовательности старта и остановки трансляции и последовательности-энхансеры или активаторы. Промоторы могут быть либо конститутивными, либо индуцибельными, и могут быть сильным конститутивным промотором (например, Т7, и тому подобное).
Векторы экспрессии, как правило, имеют подходящие сайты рестрикции, расположенные вблизи промоторной последовательности, чтобы обеспечить вставку последовательностей нуклеиновых кислот, кодирующие белки, представляющие интерес. Селективный маркер, действующий в экспрессирующем хозяине, может присутствовать для облегчения селекции клеток, содержащих вектор. Кроме того, экспрессионная конструкция может включать дополнительные элементы. Например, вектор экспрессии может иметь одну или две системы репликации, что позволяет ему поддерживаться в организмах, например, в клетках млекопитающих или насекомых для экспрессии и в прокариотических хозяевах с целью клонирования и амплификации. Кроме того, экспрессионная конструкция может содержать ген селективного маркера, позволяющий селекцию трансформированных клеток-хозяев. Селективные гены хорошо известны в данной области и будут изменяться в зависимости от используемой клетки-хозяина.
Следует отметить, что fHbp настоящего изобретения могут содержать дополнительные элементы, такие как детектируемая метка, например, радиоактивная метка, флуоресцентная метка, биотиновая метка, иммунологически детектируемая метка (например, гемагглютининовая метка, полигистидиновая метка) и тому подобное. Могут быть предусмотрены дополнительные элементы fHbp для облегчения выделения (например, биотиновая метка, иммунологически детектируемая метка) с помощью различных способов (например, захвата по аффинности и т.д.). Субъект fHbp может быть необязательно иммобилизован на носителе посредством ковалентного или нековалентного связывания.
Выделение и очистка fHbp может быть осуществлено в соответствии со способами, известными в данной области техники. Например, fHbp может быть выделен из лизата клеток, генетически модифицированных для экспрессии fHbp, или из синтетической реакционной смеси путем иммуноаффинной очистки, которая, как правило, включает контактирование образца с антителом против fHbp (например, моноклональным антителом против fHbp (mAb), таким как JAR 4 MAb или другим соответствующим JAR MAb, известным в данной области техники), промывку для удаления неспецифически связанного материала и элюцию специфически связанного fHbp. Изолированный fHbp может быть дополнительно очищен с помощью диализа и других способов, обычно используемых в способах очистки белка. В одном примере, fHbp может быть выделен с помощью методов металл-хелатной хроматографии.
Клетки-хозяева
Любая из множества подходящих клеток - хозяев может быть использована для получения fHbp. В целом, fHbp, описанный в данном документе, может быть экспрессирован в прокариотах или эукариотах, например, бактериях, таких как Escherichia coli или Neisseria (например, N.meningitidis) в соответствии с обычными методами. Таким образом, настоящее изобретение дополнительно предусматривает генетически модифицированную in vitro клетку-хозяина, которая содержит нуклеиновую кислоту, кодирующую субъект fHbp. Клетки-хозяева для получения (включая крупномасштабное получение) субъекта fHbp могут быть выбраны из любой из множества доступных клеток-хозяев. Примеры клеток-хозяев для экспрессии, включая те из прокариотических или эукариотических одноклеточных организмов, такие как бактерии (например, штаммы Escherichia coli), дрожжи (например, Saccharomyces cerevisiae, Pichia spp., и тому подобное) и могут включать клетки-хозяева, первоначально полученные из высшего организма, таких как насекомые, позвоночных животных, например, млекопитающих. Подходящие клеточные линии млекопитающих включают, но не ограничиваясь ими, клетки HeLa (например, номер Американской коллекции типовых культур (ATCC) CCL-2), клетки CHO (например, номера ATCC CRL9618, CCL61, CRL9096), клетки 293 (например, номер ATCC CRL-1573), клетки Vero, клетки NIH 3T3 (например, номер ATCC CRL-1658), клетки Huh-7, клетки BHK (например, номер ATCC CCL10), клетки PC12 (номер ATCC CRL1721), клетки COS, клетки COS-7 (номер ATCC CRL1651), клетки RAT1, L-клетки мыши (номер ATCC CCLI.3), эмбриональные клетки почки человека (HEK) (номер ATCC CRL1573), клетки HLHepG2 и тому подобное). В некоторых случаях бактериальные клетки-хозяева и дрожжевые клетки-хозяева представляют собой особенный интерес для получения субъекта fHbp.
Субъекты fHbp могут быть получены практически чистыми или практически в выделенной форме (т.е. практически свободной от других полипептидов нейссерии или полипептидов клетки-хозяина) или практически в выделенной форме. Субъект fHbp может присутствовать в композиции, которая обогащена полипептидом по отношению к другим компонентам, которые могут присутствовать (например, другим полипептидам или другим компонентам клетки-хозяина). Очищенный субъект fHbp может быть предусмотрен таким образом, что полипептид присутствует в композиции, которая практически не содержит других экспрессированных полипептидов, и, например, менее чем 90%, как правило, менее чем 60% и чаще, как правило, менее чем 50% от композиции состоит из других экспрессированных полипептидов.
Клетки-хозяева для получения везикул
В случае, когда субъект fHbp должен быть предусмотрен в мембранной везикуле (как описано более подробно ниже), клетка-хозяин нейссерии является генетически модифицированной для экспрессии субъекта fHbp. Любой из множества штаммов Neisseria spp. может быть модифицирован для того, чтобы получить субъект fHbp, и, при необходимости, который продуцирует или может быть модифицирован для того, чтобы продуцировать другие антигены, представляющие интерес, такие как PorA, может быть использован в способах, раскрытых в данном документе.
Способы и векторы для обеспечения генетической модификации штаммов нейссерии и экспрессии нужного полипептида известны в данной области техники. Примеры векторов и способов можно найти в WO 02/09746 и O'Dwyer et al. (2004) Infect Immun 72:6511-80. Сильные промоторы, в частности, конститутивные промоторы, представляют собой особый интерес. Примеры промоторов включают промоторы porA, porB, lbpB, tbpB, p110, hpuAB, lgtF, opa, p110, lst, hpuAB и rmp.
Патогенные штаммы Neisseria spp. или штаммы, полученные из патогенной Neisseria spp., в частности, штаммы, патогенные для человека или полученные из патогенных штаммов, или синантропных для человека, представляют особый интерес для использования в получении мембранных везикул. Примеры Neisseria spp. включают N. meningitidis, N. flavescens, N. gonorrhoeae, N. lactamica, N. polysaccharea, N. cinerea, N. mucosa, N. subflava, N. sicca, N. elongata, и тому подобное.
Штаммы N.meningitidis представляют особый интерес для генетической модификации с целью экспрессии субъектов fHbp и для использования в целях получения везикул. Штамм, используемый для получения везикул, может быть выбран в соответствии с множеством различных характеристик, которые могут быть желательны. Например, штамм может быть выбран в соответствии с: желаемым типом PorA ("сероподтип"), капсулярной группой, серотипом и тому подобное; уменьшением получения капсульного полисахарида; и тому подобное. Например, штамм для получения может продуцировать любой желаемый полипептид PorA и может экспрессировать один или несколько полипептидов PorA (естественным путем или благодаря генной инженерии). Примеры штаммов включают те, которые продуцируют полипептид PorA, который предоставляет сероподтип P1.7,16; P1.19,15; P1.7,1; P1.5,2; P1.22a,14; P1.14; P1.5,10; P1.7,4; P1.12,13; а также варианты таких полипептидов PorA, которые могут или не могут сохранять свою активность с помощью обычных серологических реагентов, используемых в сероподтипированию. Также интерес представляют PorA полипептиды, характеризующиеся согласно типированию PorA по вариабельному участку (VR) (см., например, Russell et al. (2004) Emerging Infect Dis 10:674-678; Sacchi CT et al. (1998) Clin Diagn Lab Immunol 5:845-55; Sacchi et al (2000) J. Infect Dis 182:1169-1176). Было идентифицировано значительное количество различных типов VR, которые могут быть классифицированы как VR1 и VR2 семьи "прототипов". Веб-доступ к базе данных, описывающей эту номенклатуру и ее связь с предыдущими схемами типирования, находится на сайте neisseria.org/nm/typing/pora. Выравнивания некоторых PorA VR1 и VR2 типов представлены в Russell et al. (2004) Emerging Infect Dis 10:674-678.
В качестве альтернативы или в дополнение, штамм для получения может представлять собой штамм, дефицитный по капсуле. Штаммы, дефицитные по капсуле, могут обеспечить вакцины на основе везикул, которые обеспечивают снижение риска индукции значительного ответа аутоантител у индивидуума, которому вводят вакцину (например, вследствие продуцирования антител, которые вступают в перекрестную реакцию с сиаловой кислотой на поверхностях клетки-хозяина). "Дефицитный по капсуле" или "дефицитный по полисахариду капсулы", используемый в данном документе, относится к уровню полисахарида капсулы на бактериальной поверхности, который ниже, чем у штамма природного происхождения или, если штамм является генетически модифицированным, ниже, чем у родительского штамма, из которого получен штамм, дефицитный по капсуле. Дефицитный по капсуле штамм включает штаммы, у которых уменьшена продукция поверхностного полисахарида капсулы по меньшей мере на 10%, 20%, 25%, 30%, 40%, 50%, 60%, 75%, 80%, 85%, 90% или более, и включает штаммы, в которых капсульный полисахарид не детектируется на бактериальной поверхности (например, с помощью цельноклеточного твердофазного иммуноферментного анализа (ELISA) с использованием антитела против капсульного полисахарида).
Дефицитные по капсуле штаммы включают те, которые являются дефицитными по капсуле благодаря природной или рекомбинантно-генерируемой генетической модификации. Встречающиеся в естественных условиях штаммы, дефицитные по капсуле (см., например, Dolan-Livengood et al). (2003) J. Infect. Dis. 187: 1616-28), а также способы идентификации и/или получения дефицитных по капсуле штаммов (см, например, Fisseha et al. (2005) Infect. Immun. 73:4070-4080; Stephens et al. (1991) Infect Immun 59:4097-102; Frosch et al. (1990) Mol Microbiol.4:1215-1218) являются известными в данной области техники.
Модификация клетки-хозяина нейссерии с целью обеспечения снижения продукции полисахарида капсулы может включать модификацию одного или нескольких генов, вовлеченных в синтез капсулы, причем модификация предусматривает, например, пониженные уровни полисахарида капсулы по отношению к родительской клетке до модификации. Такие генетические модификации могут включать изменения в нуклеотидной и/или аминокислотной последовательностях одного или нескольких генов биосинтеза капсул, что приводит состояние штамма в дефицитное по капсуле (например, вследствие одной или нескольких вставок, делеций, замен и тому подобное в одном или нескольких генах биосинтеза капсулы). Дефицитные по капсуле штаммы могут не иметь или быть нефункциональными по одному или нескольким генам капсулы.
Особый интерес представляют штаммы, дефицитные по биосинтезуе сиаловой кислоты. Такие штаммы могут обеспечить получение везикул, которые имеют сниженный риск продукции антител против сиаловой кислоты, которые перекрестно реагируют с антигенами сиаловой кислоты человека, и могут дополнительно обеспечивать повышенную безопасность производства. Штаммы, имеющие дефект биосинтеза сиаловой кислоты (либо вследствие модификации естественного происхождения или генно-инженерной модификации) могут быть дефектными по любому из нескольких различных генов в пути биосинтеза сиаловой кислоты. Особый интерес представляют собой штаммы, которые имеют дефекты в продукте гена, кодирующего N-ацетилглюкозамин-6-фосфат 2-эпимеразу (известный как synX AAF40537.1 или ОВСС AAA20475), причем штаммы, имеющие этот инактивированный ген, представляют особый интерес. Например, в одном варианте реализации, дефицитный по капсуле штамм получают путем нарушенного получения функционального продукта гена synX (см, например, Swartley et al. (1994) J Bacteriol. 176:1530-4).
Дефицитные по капсуле штаммы также могут быть получены из штаммов, встречающихся в естественных условиях, с использованием нерекомбинантных методик, например, путем использования бактерицидных антител против капсул для отбора штаммов с пониженными уровнями полисахарида капсулы.
В то время как настоящее изобретение предусматривает использование двух или более штаммов (например, для получения антигенных композиций, содержащих везикулы, презентирующие субъект fHbp, из различных штаммов), штаммы могут быть выбраны таким образом, чтобы отличаться по одной или более характеристикам штамма, например, для обеспечения везикул, те различаются по субъекту fHbp, который используется, PorA и тому подобное.
Получение везикул
Антигенные композиции, рассматриваемые в настоящем изобретении, обычно содержат везикулы, полученные из клеток нейссерии, которые экспрессируют субъект fHbp. Упоминаемый здесь термин "везикулы" подразумевается, что охватывает везикулы наружной мембраны, а также микровезикулы (которые также упоминаются как пузырьки).
Антигенная композиция может содержать везикулы наружной мембраны (OMV), полученные из внешней мембраны культивируемого штамма Neisseria meningitidis spp. генетически модифицированного для того, чтобы экспрессировать субъект fHbp. OMV могут быть получены из Neisseria meningitidis, выращенных в бульоне или на твердой культуральной среде, предпочтительно путем отделения бактериальных клеток от культуральной среды (например, путем фильтрации или низкоскоростным центрифугированием таким образом, чтобы осаждать клетки, или тому подобное), лизиса клеток (например, путем добавления детергента, осмотического шока, обработки ультразвуком, кавитацией, гомогенизацией, или тому подобное) и отделяя фракцию внешней мембраны от цитоплазматических молекул (например, путем фильтрации или с помощью дифференциального осаждения или агрегации внешних мембран и/или везикул внешней мембраны, или методами аффинного разделения с использованием лигандов, которые специфически распознают молекулы внешней мембраны, или с помощью высокоскоростного центрифугирования таким образом, чтобы осаждать внешние мембраны и/или везикулы внешней мембраны, или тому подобное); фракции внешней мембраны могут быть использованы для получения OMV.
Антигенная композиция может содержать микровезикулы (MV) (или «пузырьки»), содержащие субъекты fHbp, при этом MV или пузырьки высвобождаются во время культивирования штамма Neisseria meningitidis генетически модифицированного таким образом, чтобы экспрессировать субъект fHbp. Например, MV могут быть получены путем культивирования штамма Neisseria meningitidis в бульонной культуральной среде, путем отделения целых клеток из бульона культуральной среды (например, путем фильтрации или низкоскоростным центрифугированием таким образом, чтобы осадить только клетки, а не более мелкие пузырьки, или тому подобное), а затем сбора тех MV, которые присутствуют в бесклеточной культуральной среде (например, путем фильтрации, дифференциального осаждения или агрегации MV, или с помощью высокоскоростного центрифугирования таким образом, чтобы осадить пузырьки, или тому подобное). Штаммы для использования при получении MV, как правило, могут быть выбраны на основе количества пузырьков, которые продуцируются в культуре (например, бактерии могут быть культивированы в достаточном количестве для того, чтобы обеспечить продукцию пузырьков, подходящих для выделения и введения в способах, описанных в настоящем документе), Примерный штамм, который производит высокие уровни количества пузырьков, описан в публикации РСТ WO 01/34642. В дополнение к производству пузырьков, штаммы для использования при получении MV также могут быть выбраны на основе получения NspA, при этом штаммы, которые продуцируют более высокие уровни количества NspA могут представлять особый интерес (примеры штаммов N.meningitidis, имеющие различные уровни получения NspA, см., например, Moe et al. (1999 Infect. Immun. 67: 5664). Другие штаммы, представляющие интерес для использования в получении пузырьков включают штаммы, имеющие инактивированный ген GNA33, который кодирует липопротеин, необходимый для разделения клеток, мембранной архитектуры и вирулентности (см., например, ADU-Bobie et al. (2004) Infect Immun.72:1914-1919).
Антигенные композиции по настоящему изобретению могут содержать везикулы из одного штамма или из 2, 3, 4, 5 или более штаммов, при этом штаммы могут быть гомологичными или гетерологичными, обычно гетерологичными по отношению друг к другу. Например, штаммы, из которых получен субъект fHbp, могут быть гомологичными или гетерологичными по отношению к PorA и/или fHbp. Пузырьки могут быть получены из штаммов, которые экспрессируют более чем один субъект fHbp (например, 1, 2, 3 или более субъекта fHbp), которые могут содержаться из аминокислотных последовательностей fHbp из различных вариантов (v.1, v.2 или v.3) или подвариантов (например, подвариантов v.1, v.2 или v.3).
Антигенные композиции могут содержать смесь OMV и MV, которые презентируют одни и те же или различные субъекты fHbp, при этом субъекты fHbp могут необязательно презентировать эпитопы из различных комбинаций вариантов fHbp и/или подвариантов и при этом OMV и/или MV могут быть из одного и того же или различных штаммов. Пузырьки из разных штаммов могут быть введены в виде смеси или могут быть введены последовательно.
Если необходимо (например, в том случае, если штаммы, используемые для получения везикул, связаны с эндотоксином или особенно высоким уровнем эндотоксина), везикулы дополнительно обрабатывают для уменьшения эндотоксина, например, в целях снижения токсичности после введения. Несмотря на то, что менее желательно, как описано ниже, снижение эндотоксина может быть достигнуто путем экстракции с помощью подходящего детергента (например, BRIJ-96, дезоксихолата натрия, лаурилсаркосината натрия, Empigen BB, Triton Х-100, неионного детергента TWEEN 20 (монолаурат сорбита полиоксиэтилен), неионного детергента TWEEN 80 при концентрации 0,1-10%, например, 0,5-2%, и додецилсульфата натрия (SDS)). Там, где используется экстракция детергентом, предпочтительно, использовать детергент, кроме дезоксихолата.
Пузырьки антигенных композиций могут быть получены без детергентов, например, без использования дезоксихолата. Хотя обработка детергентом используется для удаления активности эндотоксина, это может привести к исчерпанию нативного липопротеина fHbp и/или объекта fHbp (включая липидированный fHbp) путем экстракции в процессе получения везикул. Таким образом, может быть особенно желательным уменьшение активности эндотоксина, используя технологию, которая не требует детергента. В одном подходе, штаммы, у которых производительность эндотоксина (липополисахарида, LPS) относительно низкая, используются для того, чтобы избежать необходимости удаления эндотоксинов из окончательного препарата перед использованием в организме человека. Например, везикулы могут быть получены из мутантов нейссерии, в которых количество липополисахарида или других антигенов, которые могут быть нежелательны в вакцине (например, Rmp), уменьшается или исчезает.
Пузырьки могут быть получены из штаммов N. meningitidis, которые содержат генетические модификации, что приводит в результате к снижению или не возможности детектировать токсичную активность липида A. Например, такой штамм может быть генетически модифицированным по биосинтезу липидов (Steeghs et al. (1999) Infect Immun 67:4988-93; van der Ley et al. (2001) Infect Immun 69:5981-90; Steeghs et al. (2004) J Endotoxin Res 10:113-9; Fissha et al, (2005) Infect Immun 73:4070). Иммуногенные композиции могут проходить детоксикацию путем модификации LPS, такой как понижающая регуляция и/или инактивация ферментов, которые кодируются с помощью lpxL1 или lpxL2, соответственно. Получение пента-ацилированного липида А, который образован в lpxL1 мутантах указывает на то, что фермент, кодируемый lpxL1 добавляет С12 N-присоединенным 3-ОН-С14 в положении 2' GlcN II. Основной вид липида А, найденный в lpxL2 мутантах является тетра-ацилированным, что указывает на то, что фермент, кодируемый lpxL2 прибавляет другой С12, то есть, к N-присоединенным 3-ОН-С14 в положении 2 GlcN I. Мутации, которые в результате приводят к уменьшению (или нет) экспрессии этих генов (или уменьшению или отсутствию активности продуктов этих генов) не приводят к изменению токсической активности липида А (van der Ley et al. (2001) Infect Immun 69:5981-90). Тетра-ацилированный (lpxL2 мутант) и пента ацилированный (lpxL1 мутант) липид А являются менее токсичными, чем липид А дикого типа. Мутации в гене, кодирующем 4'-киназу липида А (lpxK), также уменьшают токсичную активность липида А. Особый интерес для использования в получении везикул (например, MV или OMV) представляют штаммы N.meningitidis, генетически модифицированные таким образом, чтобы обеспечить уменьшение или привести к недетектируемому функциональному белку, кодируемом геном LpxL1, например, когда бактерия нейссерии (например, штамма N.meningitidis) генетически модифицирована для обеспечения уменьшения или отсутствия активности продукта гена lpxL1. Например, бактерия нейссерии может быть генетически модифицирована таким образом, чтобы осуществить нокаут гена lpxL1, например, при этом нарушается ген lpxL1. См., например, публикацию патента США № 2009/0035328. Бактерии нейссерии могут быть генетически модифицированы таким образом, чтобы обеспечить уменьшение или отсутствие активности генного продукта гена lpxL2. Бактерии нейссерии могут быть генетически модифицированы таким образом, чтобы обеспечить уменьшение или отсутствие активности генного продукта гена lpxL1 и гена lpxL2. Такие везикулы обеспечивают сниженную токсичность по сравнению со штаммами N.meningitidis, которые представляют собой дикий тип для получения LPS, сохраняя при этом иммуногенность субъекта fHbp.
Токсическая активность LPS может также быть изменена путем введения мутаций в гены/локусы, вовлеченные в устойчивость к полимиксину (такая устойчивость коррелировала с добавлением аминоарабинозы к 4'-фосфату липида А). Эти гены/локусы могут быть pmrE, который кодирует дегидрогеназу УДФ-глюкозы, или участком генов антимикробного пептида резистентности к общим для многих из семейства энтеробактерий, которые могут быть вовлечены в синтез и передачу аминоарабинозы. Ген pmrF, который присутствует в этом участке, кодирует диликол-фосфат маносилтрансферазу (Gunn J. S., Kheng, B. L., Krueger J., Kim K., Guo L., Hackett M., Miller S. I. 1998. Mol. Microbiol. 27: 1171-1182).
Мутации в регуляторной системе PhoP-PhoQ, которая представляет собой регуляторную систему из двух компонентов с фосфорилированием (например, PhoP конститутивный фенотип, PhoPc), или низкий уровень Mg++ окружающей среды или условий культуры (которые активируют регуляторную систему PhoP-PhoQ) приводят к добавлению аминоарабинозы на 4'-фосфат и 2-гидроксимиристат, заменяя миристат (гидроксилирование миристата). Этот модифицированный липид A демонстрирует сниженную способность стимулировать экспрессию Е-селектина эндотелиальными клетками человека и секрецию TNF из моноцитов человека.
Штаммы, устойчивые к полимиксину В, также подходящие для использования, поскольку, как было указано, такие штаммы снижали токсичность LPS (см., например, van der Ley et al. (1994) В: Proceedings of the ninth international pathogenic Neisseria conference. The Guildhall, Winchester, England). В качестве альтернативы, синтетические пептиды, которые мимикрируют под активность связывания полимиксина В, могут быть добавлены к антигенным композициям для снижения LPS токсичной активности (см., например, Rustici et al. (1993) Science 259:361-365; Porro et al. (1998) Prog Clin Biol Res.397:315-25).
Эндотоксин также можно уменьшить путем выбора условий культивирования. Например, культивирование штамма в среде для роста, содержащей 0,1 мг-100 мг аминоарабинозы на литр среды, обеспечивает снижение токсичности липидов (см., например, WO 02/097646).
КОМПОЗИЦИИ И СОСТАВ
"Композиции", "антигенная композиция", "антигенный состав" или "иммуногенная композиция" используется в данном документе для удобства общего обозначения композиций, содержащих субъект fHbp, как раскрыто в данном документе, субъект которой fHbp может быть необязательно конъюгированным для дополнительного повышения иммуногенности. Композиции, которые используются для индукции антител, например, антител против Neisseria meningitidis, например, бактерицидных антител к Neisseria meningitidis, в организме человека являются специально предусмотренными настоящим изобретением. Антигенные композиции могут содержать 1, 2 или более различных субъектов fHbp. Там, где есть более чем один тип fHbp, каждый субъект fHbp может представлять эпитопы из различных комбинаций вариантов fHbp и/или подвариантов.
Антигенные композиции содержат иммунологически эффективное количество субъекта fHbp и может дополнительно включать другие совместимые компоненты по мере необходимости. Композиции по настоящему изобретению могут содержать fHbp, которые являются слабо связывающими fH. Композиция содержит один или более fHbp, в котором по меньшей мере один fHbp является слабо связывающим fH. Там, где есть более одного fHbp в композиции, каждый fHbp может быть различным (например, в аминокислотных последовательностях и/или конъюгации).
В некоторых случаях антигенная композиция по настоящему изобретению включает только один fHbp вариант осуществления настоящего изобретения. В некоторых случаях антигенная композиция по настоящему изобретению включает два или более различных вариантов fHbp по настоящему изобретению. В качестве неограничивающих примеров, в некоторых случаях антигенная композиция по настоящему изобретению содержит:
1) первый вариант fHbp ID 1, причем первый fHbp ID 1 вариант содержит замену аминокислоты в положении Q38 (например, Q38R); и второй вариант fHbp ID 1, при этом второй fHbp ID 1 вариант содержит замену аминокислоты в положении E92 (например, E92K);
2) первый вариант fHbp ID 1, причем первый fHbp ID 1 вариант содержит замену аминокислоты в положении Q38 (например, Q38R); и второй вариант fHbp ID 1, при этом второй fHbp ID 1 вариант содержит замену аминокислоты в положении R130 (например, R130G);
3) первый вариант fHbp ID 1, причем первый fHbp ID 1 вариант содержит замену аминокислоты в положении Q38 (например, Q38R); и второй вариант fHbp ID 1, при этом второй fHbp ID 1 вариант содержит замену аминокислоты в положении S223 (например, S223R);
4) первый вариант fHbp ID 1, причем первый fHbp ID 1 вариант содержит замену аминокислоты в положении Q38 (например, Q38R); и второй вариант fHbp ID 1, при этом второй fHbp ID 1 вариант содержит замену аминокислоты в положении H248 (например, H248L);
5) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении N115 (например, N115I); и вариант fHbp ID 1, при этом вариант fHbp ID 1 содержит замену аминокислоты в положении Q38 (например, Q38R);
6) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении D121 (например, D121G); и вариант fHbp ID 1, при этом вариант fHbp ID 1 содержит замену аминокислоты в положении E92 (например, E92K);
7) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении S128 (например, S128T); и вариант fHbp ID 1, при этом вариант fHbp ID 1 содержит замену аминокислоты в положении H248 (например, H248L);
8) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении V131 (например, V131D); и вариант fHbp ID 1, при этом вариант fHbp ID 1 содержит замену аминокислоты в положении Q38 (например, Q38R);
9) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении K219 (например, K219N); и вариант fHbp ID 1, при этом вариант fHbp ID 1 содержит замену аминокислоты в положении Q38 (например, Q38R);
10) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении G220 (например, G220S); и вариант fHbp ID 1, при этом вариант fHbp ID 1 содержит замену аминокислоты в положении Q38 (например, Q38R);
11) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении N115 (например, N115I); и вариант fHbp ID 55, при этом вариант fHbp ID 55 содержит замену аминокислоты в положении E92 (например, E92K);
12) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении D121 (например, D121G); и вариант fHbp ID 55, при этом вариант fHbp ID 55 содержит замену аминокислоты в положении S223 (например, S223R);
13) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении S128 (например, S128T); и вариант fHbp ID 55, при этом вариант fHbp ID 55 содержит замену аминокислоты в положении H248 (например, H248L);
14) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении V131 (например, V131D); и вариант fHbp ID 55, при этом вариант fHbp ID 55 содержит замену аминокислоты в положении E92 (например, E92K);
15) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении K219 (например, K219N); и вариант fHbp ID 55, при этом вариант fHbp ID 55 содержит замену аминокислоты в положении E92 (например, E92K);
16) вариант fHbp ID 22, причем fHbp ID 22 вариант содержит замену аминокислоты в положении G220 (например, G220S); и вариант fHbp ID 55, при этом вариант fHbp ID 55 содержит замену аминокислоты в положении E92 (например, E92K);
17) первый вариант fHbp ID 1, причем первый fHbp ID 1 вариант содержит замену аминокислоты в положении E92 (например, E92K); и второй вариант fHbp ID 1, при этом второй fHbp ID 1 вариант содержит замену аминокислоты в положении H248 (например, H248L);
18) первый вариант fHbp ID 1, причем первый fHbp ID 1 вариант содержит замену аминокислоты в положении E92 (например, E92K); и второй вариант fHbp ID 1, при этом второй fHbp ID 1 вариант содержит замену аминокислоты в положении S223 (например, S223R);
19) первый вариант fHbp ID 22, причем первый fHbp ID 22 вариант содержит замену аминокислоты в положении N115 (например, N115I); и второй вариант fHbp ID 22, при этом второй fHbp ID 22 вариант содержит замену аминокислоты в положении D211 (например, D211A);
20) первый вариант fHbp ID 22, причем первый fHbp ID 22 вариант содержит замену аминокислоты в положении N115 (например, N115I); и второй вариант fHbp ID 22, при этом второй fHbp ID 22 вариант содержит замену аминокислоты в положении K219 (например, K219N);
21) первый вариант fHbp ID 22, причем первый fHbp ID 22 вариант содержит замену аминокислоты в положении N115 (например, N115I); и второй вариант fHbp ID 22, при этом второй fHbp ID 22 вариант содержит замену аминокислоты в положении G220 (например, G220S);
22) первый вариант fHbp ID 22, причем первый fHbp ID 22 вариант содержит замену аминокислоты в положении D121 (например, D121G); и второй вариант fHbp ID 22, при этом второй fHbp ID 22 вариант содержит замену аминокислоты в положении G220 (например, G220S);
23) первый вариант fHbp ID 22, причем первый fHbp ID 22 вариант содержит замену аминокислоты в положении S128 (например, S128T); и второй вариант fHbp ID 22, при этом второй fHbp ID 22 вариант содержит замену аминокислоты в положении G220 (например, G220S);
24) первый вариант fHbp ID 22, причем первый fHbp ID 22 вариант содержит замену аминокислоты в положении V131 (например, V131D); и второй вариант fHbp ID 22, при этом второй fHbp ID 22 вариант содержит замену аминокислоты в положении G220 (например, G220S);
25) первый вариант fHbp ID 55, причем первый fHbp ID 55 вариант содержит замену аминокислоты в положении E92 (например, E92K); и второй вариант fHbp ID 55, при этом второй fHbp ID 55 вариант содержит замену аминокислоты в положении S223 (например, S223R);
26) первый вариант fHbp ID 55, причем первый fHbp ID 55 вариант содержит замену аминокислоты в положении E92 (например, E92K); и второй вариант fHbp ID 55, при этом второй fHbp ID 55 вариант содержит замену аминокислоты в положении H248 (например, H248L);
27) вариант fHbp ID22, содержащий аминокислотные замены: L130R и G133D и вариант fHbp ID 1, причем fHbp ID 1 вариант содержит замену аминокислоты в положении S223 (например, S223R);
28) вариант fHbp ID22, содержащий аминокислотные замены: L130R и G133D и вариант fHbp ID 1, причем fHbp ID 1 вариант содержит замену аминокислоты в положении H248 (например, H248L);
29) вариант fHbp ID22, содержащий аминокислотные замены: L130R, G133D и K219N и вариант fHbp ID 1, причем fHbp ID 1 вариант содержит замену аминокислоты в положении S223 (например, S223R) или H248 (например, H248L); или
30) вариант fHbp ID22, содержащий аминокислотные замены: L130R, G133D и G220S и вариант fHbp ID 1, причем fHbp ID 1 вариант содержит замену аминокислоты в положении S223 (например, S223R) или H248 (например, H248L).
Иммуногенные композиции, рассматриваемые в настоящем изобретении, включают, но не ограничиваются ими, композиции, содержащие:
1) по меньшей мере один вариант fHbp по настоящему изобретению; и
2) NspA;
при этом fHbp и/или NspA, могут быть предоставлены в виде рекомбинантных белков, и/или на основе композиций везикул (например, OMV или MV). Следует отметить, что, когда композиция содержит как NspA, так и fHbp, бактерицидная активность антител, вызванная введением композиции, может происходить в результате взаимодействия антител с одним или обоими антигенами. Примеры иммуногенных композиций, предусмотренных настоящим изобретением, включают:
а) иммуногенную композицию, которая содержит вариант fHbp, как описано выше (например, где вариант fHbp вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм Neisseria meningitidis);
b) иммуногенную композицию, которая содержит вариант fHbp, как описано выше (например, где вариант fHbp вызывает бактерицидный гуморальный ответ, по меньшей мере, на один штамм Neisseria meningitidis); и рекомбинантный белок NspA;
с) иммуногенную композицию, которая содержит нативный OMV, полученный из генетически модифицированной клетки-хозяина нейссерии, которая является генетически модифицированной с помощью нуклеиновой кислоты, кодирующей вариант fHbp по настоящему изобретению, таким образом, что кодирующий вариант fHbp продуцируется генетически модифицированной клеткой-хозяином, где OMV содержит кодирующий вариант fHbp; и
d) иммуногенную композицию, которая содержит нативный OMV, полученный из генетически модифицированной клетки-хозяина нейссерии, которая является генетически модифицированной с помощью нуклеиновой кислоты, кодирующей вариант fHbp по настоящему изобретению, таким образом, что кодирующий встречающийся в естественных условиях fHbp продуцируется генетически модифицированной клеткой-хозяином, где OMV содержит кодирующий вариант fHbp; и при этом клетка-хозяин нейссерии продуцирует более высокие уровни NspA, таким образом, что OMV также содержит NspA. Например, клетка-хозяин нейссерии может быть одной из тех, которая является генетически модифицированной для увеличения экспрессии NspA.
Под "иммунологически эффективным количеством" подразумевается, что введение такого количества индивидууму, либо в виде однократной дозы, как части серии тех же или различных антигенных композиций, является эффективным для того, чтобы вызвать гуморальный ответ, эффективный для лечения или профилактики симптома или заболевания, вызванного, например, инфекцией, вызванной нейссерией, в частности, N.meningitidis, чаще группой В N.meningitidis. Это количество варьирует в зависимости от состояния здоровья и физического состояния индивидуума, подлежащего лечению, возраста, способности иммунной системы индивидуума вырабатывать антитела, степени необходимой защиты, разработки вакцины, оценки лечащим врачом по медицинской ситуации и других соответствующих факторов. Предполагается, что количество будет попадать в относительно широкий предел, который можно определить с помощью обычных испытаний.
Аминокислотные последовательности NspA полипептидов известны в данной области техники. См., например, WO 96/29412; и Martin et al. (1997) J. Exp. Med. 185:1173; номер доступа GenBank U52066; и номер доступа GenBank AAD53286. "NspA полипептид" может содержать аминокислотную последовательность с по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 98%, по меньшей мере около 99% или 100% идентичности аминокислотной последовательности с непрерывным участком от около 75 аминокислот до около 100 аминокислот, от около 100 аминокислот до около 150 аминокислот или от около 150 аминокислот до около 174 аминокислот аминокислотной последовательности, отображенной на фиг. 40 и указанной в SEQ ID NO: 25. “NspA полипептид” может содержать аминокислотную последовательность с по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 98%, по меньшей мере около 99% или 100% идентичности аминокислотной последовательности с непрерывным участком от около 75 аминокислот до около 100 аминокислот, или от около 100 аминокислот до около 155 аминокислот, от 20 до 174 аминокислот аминокислотной последовательности, отображенной на фиг. 40 и указанной в SEQ ID NO: 25. В некоторых случаях полипептид NspA не имеет сигнальной последовательности; в других случаях (например, для экспрессии в клетке-хозяине), полипептид NspA содержит сигнальную последовательность.
Режим дозирования может представлять собой однократную дозу или многократные дозы (например, включая бустерные дозы) с единичной дозированной формой антигенной композиции, которую вводят в разное время. Термин "единичная дозированная форма", используемый в данном документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для людей или животных, причем каждая единица содержит заданное количество антигенных композиций по настоящему изобретению в количестве, достаточном для получения желаемого эффекта, композиции которых представлены в сочетании с фармацевтически приемлемым наполнителем (например, фармацевтически приемлемый растворитель, носитель или наполнитель). Антигенная композиция может быть введена в сочетании с другими средствами иммунорегуляции.
Антигенные композиции могут быть представлены в фармацевтически приемлемом наполнителе, который может представлять собой раствор, например, в виде стерильный водный раствор, часто физиологический раствор, или они могут быть представлены в виде порошка. Такие наполнители могут быть практически инертными, если это необходимо.
В некоторых вариантах реализации субъект иммуногенной композиции содержит субъект fHbp, который присутствует в везикуле. В некоторых вариантах реализации субъект иммуногенной композиции содержит субъект fHbp, который присутствует в MV. В некоторых вариантах реализации субъект иммуногенной композиции содержит субъект fHbp, который присутствует в ОMV. В некоторых вариантах реализации субъект иммуногенной композиции содержит смесь MV и OMV, содержащие субъект fHbp. Везикулы, такие как MV и OMV, описаны выше.
Антигенные композиции могут дополнительно содержать адъювант. Примеры известных подходящих вспомогательных веществ, которые могут быть использованы в организме человека включают, но не обязательно ограничиваются ими, алюминий в качестве адъюванта (например, фосфат алюминия или гидроксид алюминия), MF59 (4,3% вес/об сквалена, 0,5% вес/об Tween 80™, 0,5% вес/об Span 85), CpG-содержащую нуклеиновую кислоту (где цитозин неметилирован), QS 21, MPL, 3dMPL, экстракты из Aquilla, ISCOMS, LT/КТ мутанты, поли(D,L-лактид-ко-гликолид) (PLG) микрочастицы, Quil А, интерлейкины, и тому подобное. Для экспериментальных животных, можно использовать адъювант Фрейнда (неполный адъювант Фрейнда; полный адъювант Фрейнда), N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил- D-изоглутамин (CGP 11637, называемый нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-DIP-алмитоил-SN-глицеро-3- гидроксифосфорилокси) этиламин (CGP 19835A, называемый МТР-PE) и RIBI, который содержит три компонента, экстрагированных из бактерий, монофосфориллипид А, димиколат трегалозы и скелет клеточной стенки (MPL + TDM + CWS) в 2% сквалена/Tween 80 эмульсии. Эффективность адъюванта может быть определена путем измерения количества антител, направленных против иммуногенного антигена или его антигенного эпитопа.
Дальнейшие примеры адъювантов для повышения эффективности композиции включают, но не ограничиваются ими: (1) эмульсионные композиции типа масло-в-воде (с или без других специфических иммуностимулирующих средств, таких как мурамилпептиды (см. ниже) или компоненты бактериальной клеточной стенки), такие как, например, (а) MF59 (WO 90/14837; глава 10 в Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press, 1995), содержащий 5% сквалена, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий MTP-PE), изготовленный в виде субмикронных частиц с использованием микрофлюидизатора, (b) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% плуроник-заблокированного полимера L121 и thr-MDP либо микрофлюидизированнный в субмикронной эмульсии или вортексированный для создания эмульсии с большим размером частиц, и (с) RIBI адъювантную систему (RAS), (Ribi Immunochem, Гамильтон, Монтана), содержащую 2% сквалена, 0,2% Tween 80 и один или более компонентов бактериальной клеточной стенки, такие как монофосфориллипид A (MPL), трегалозу димиколат (TDM) и скелет клеточной стенки (CWS), например, MPL+CWS (Detox TM ); (2) сапониновые адъюванты, такие как QS21 или Stimulon™ (Cambridge Bioscience, Вустер, Массачусетс), могут быть использованы или частицы, сформированные из них, такие как ISCOMs (иммуностимулирующие комплексы), которые могут быть лишены дополнительного детергента, например, в WO 00/07621; (3) полный адъювант Фрейнда (CFA) или неполный адъювант Фрейнда (IFA); (4) цитокины, такие как интерлейкины (например, ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-12 (WO99/44636), и т.д.), интерфероны (например, гамма-интерфероны), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухолей (TNF), и т.д.; (5) монофосфориллипид А (MPL) или 3-О-деацилированный MPL (3dMPL), например, GB-2220221, ЕР-А-0689454, необязательно, в основном при отсутствии алюминия при использовании с пневмококковыми сахаридами, например, в WO 00/56358; (6) комбинации 3dMPL с, например, QS21 и / или эмульсиями по типу масло-в-воде, например, ЕР-А-0835318, ЕР-А-0735898, ЕР-А-0761231; (7) олигонуклеотиды, содержащие CpG мотивы (см., например, WO 98/52581), например, олигонуклеотид, содержащий по меньшей мере один CG динуклеотид, где цитозин неметилирован; (8) полиоксиэтиленовый эфир или полиоксиэтиленовый сложный эфир (см., например, WO 99/52549); (9) полиоксиэтиленовый эфир сорбита поверхностно-активное вещество в комбинации с октоксинолом (WO 01/21207) или полиоксиэтиленалкиловым эфиром или сложным эфиром поверхностно-активного вещества в комбинации по меньшей мере с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (WO 01/21152); (10) сапонин и иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG) (WO 00/62800); (11) иммуностимулятор и частицу металла соли, например, в WO 00/23105; (12) сапонин и эмульсию по типу масло-в-воде, например, WO 99/11241; (13) сапонин (например, QS21) + 3dMPL + ИМ2 (необязательно + стерол), например, в WO 98/57659; (14) другие вещества, которые действуют в качестве иммуностимулирующих средств, для повышения эффективности композиции. Мурамилпептиды включают N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-25 нормурамил-L-аланил-D-изоглутамин (нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутарнинил-L-аланин-2-(1'-2'-дипалмитоил--SN-глицеро-3-гидроксифосфорилокси) этиламин МТР-РЕ) и т.д. Адъюванты, подходящие для введения в организм человека, представляют особый интерес. В некоторых случаях, адъювант представляет собой адъювантную соль алюминия (например, фосфат алюминия или гидроксид алюминия).
Композиции антигена могут содержать другие компоненты, такие как фармацевтические гранулы маннита, лактозы, крахмала, стеарата магния, сахарина натрия, тальк, целлюлозу, глюкозу, сахарозу, карбонат магния и тому подобное. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для соответствия физиологическим условиям, такие как средства регулирующие рН и буферные средства, средства регулирующие токсичность и т.п., например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное.
Концентрация субъекта fHbp в композиции может варьировать в широких пределах (например, от менее чем около 0,1%, например, на уровне или, по меньшей мере, около 2% до не менее, чем от 20% до 50% или более по весу) и, как правило, выбирается в первую очередь на основе объемов жидкости, вязкости и факторов, в зависимости от состояния пациента, в соответствии с конкретным выбранным способом введения и потребностями пациента.
fHbp-содержащие составы могут быть представлены в виде раствора, суспензии, таблетки, пилюли, капсулы, порошка, геля, крема, лосьона, мази, аэрозоля и тому подобное. Общепризнано, что при пероральном введении может быть необходима защита композиций от воздействия пищеварения. Это, как правило, осуществляется либо путем объединения композиции со средством, которое делает его устойчивым к кислотному и ферментативному гидролизу, или путем упаковки композиции в соответствующий устойчивый носитель. Средства защиты от системы пищеварения хорошо известны в данной области техники.
fHbp-содержащие составы также могут быть обеспечены таким образом, чтобы повысить период полужизни в сыворотке fHbp после введения. Например, в то время как выделенные fHbp составлены для инъекции, fHbp может быть предусмотрен в составе липосомы, приготовленных в виде коллоида, или другими традиционными способами для продления времени полужизни в сыворотке. Различные способы доступны для получения липосом, как описано, например, в Szoka et al., Ann. Rev. Biophys. Bioeng. 9:467 (1980), патенты США № 4235871, № 4501728 и № 4837028. Препараты также могут быть предусмотрены в формах с контролируемым высвобождением или с медленным высвобождением.
СПОСОБЫ ИНДУЦИРОВАНИЯ ИММУННОГО ОТВЕТА
Настоящее изобретение обеспечивает способ индукции иммунного ответа, по меньшей мере, на один штамм Neisseria, в организме млекопитающего. Способы, как правило, включают введение индивидууму, нуждающемуся в этом, эффективного количества иммуногенной композиции субъекта.
fHbp-содержащие антигенные композиции, как правило, вводят субъекту человеку, который подвергается риску заболевания, связанного с нейссерией, для того, чтобы предотвратить или, по меньшей мере частично остановить развитие заболевания и его осложнений. Количество, достаточное для достижения этой цели, определяется как "терапевтически эффективная доза". Количества, эффективные для терапевтического применения будут зависеть от, например, антигенной композиции, способа введения, веса и общего состояния здоровья пациента и решения лечащего врача. Однократные или многократные дозы антигенных композиций можно вводить в зависимости от дозы и необходимой частоты и переносимости пациентом, и пути введения.
fHbp-содержащие антигенные композиции, как правило, вводят в количестве, эффективном для индукции иммунного ответа, в частности, гуморального иммунного ответа, например, это могут быть бактерицидный гуморальный ответ, в организме-хозяине. Как было отмечено выше, количества для иммунизации могут быть различными, и в общем случае могут составлять от около 1 мкг до 100 мкг на 70 кг пациента, обычно от 5 мкг до 50 мкг/70 кг. Значительно более высокие дозы (например, от 10 мг до 100 мг или более) могут быть подходящими для орального, назального или местного путей введения. Начальное введение может сопровождаться бустерной иммунизацией таких же различных fHbp-содержащих антигенную композицию. Вакцинация в некоторых случаях включает по меньшей мере один бустер, а в некоторых случаях два бустера.
В общем, иммунизация может быть достигнута путем введения любым подходящим способом, включая введение композиции перорально, интраназально, назофарингеально, парентерально, энтерально, гастрально, местно, трансдермально, подкожно, внутримышечно, в форме таблетки, твердой, порошкообразной, жидкой, аэрозольной формы, местно или системно, с добавлением или без добавления наполнителей. Актуальные способы получения парентеральных композиций хорошо известны или очевидны специалистам в данной области техники и описаны более подробно в таких публикациях, как Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pa. (1980).
Иммунный ответ против fHbp можно оценить известными способами (например, путем получения сыворотки от индивидуума до и после начальной иммунизации, и демонстрируя изменение иммунного статуса индивидуума, например, по результатам анализа иммунопреципитации ELISA или бактерицидного анализа, вестерн-блот-анализа или анализа проточной цитометрии, или тому подобное).
Вызывает ли вариант fHbp по настоящему изобретению бактерицидный ответ на один или более штаммов N.meningitidis в организме млекопитающего можно определить с помощью любого хорошо известного теста. Например, могут быть использованы трансгенные мыши с человеческим fH, при этом мышь экспрессирует человеческий fH (например, человеческий fH присутствует в сыворотке мыши в концентрации примерно 100 мкг/мл или более, чем 100 мкг/мл). Вариант fHbp по настоящему изобретению вводят трансгенным мышам с человеческим fH. После определенного периода времени, сыворотка от мышей проверяется на наличие бактерицидной активности в отношении одного или нескольких штаммов N.meningitidis. Подходящие контроли включают, например, fHbp ID 1. Пример подходящего анализа описан в Vu et al. (2012) Sci. Reports 2:341.
Антигенные композиции можно вводить млекопитающему (например, субъекту человеку), который иммунологически нативному по отношению к Neisseria meningitidis. В конкретном варианте реализации субъектом является человеческий ребенок около пяти лет или моложе, и предпочтительно от около двух лет или более молодые, и антигенные композиции вводят в любой один или несколько из следующих моментов: две недели, один месяц, 2, 3, 4, 5, 6, 7, 8, 9, 10, или 11 месяцев, или один год, или 15, 18 или 21 месяц после рождения, или в 2, 3, 4 или 5 лет.
Может быть, в общем, желательно, чтобы начать иммунизацию до начала первых признаков симптомов заболевания, или при первых признаках возможного или фактического воздействия инфекции или болезни (например, из-за воздействия или инфекции нейссерией).
Примеры
Следующие примеры указаны таким образом, чтобы обеспечить обычным специалистам в этой области техники полное раскрытие и описание того, как изготавливать и использовать настоящее изобретение, и не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением, и они не предназначены для представления того, что эксперименты, приведенные ниже, это все эксперименты, которые проводились. Были предприняты меры для обеспечения точности в отношении используемых чисел (например, количеств, температуры и т.д.), но некоторые экспериментальные ошибки и отклонения должны учитываться. Если не указано иное, части являются частями по массе, молекулярная масса представляет собой среднее молекулярной массы, температура в градусах Цельсия, а давление равно или близко к атмосферному. Могут быть использованы стандартные сокращения, например, bp, пара оснований (пары оснований); kb, килобаза (килобазы); пл, пиколитр (ы); с или сек, секунда (ы); мин, минута(ы); ч или час, час(ы); аа, аминокислота(ы); kb, килобаза(ы); bp, пара оснований (пары оснований); нт, нуклеотид(ы); i.m., внутримышечный(но); i.p., внутрибрюшинный(но); s.c., подкожно, подкожный(но); и тому подобное.
Пример 1. Идентификация и характеристика fHbp ID 1 мутантов
Материалы и методы
Скрининг библиотек
Библиотека случайных мутантов fHbp была получена с помощью допускающей ошибки полимеразной цепной реакции (ПЦР), за которой последовало клонирование продуктов ПЦР в плазмиду, экспрессирующую pET28, которая включала сигнальную последовательность, чтобы позволить проявление на поверхности Е.coli. Сортировку флуоресцентно-активных клеток использовали для выделения мутантных клонов с низким уровнем связывания человеческого fH и высоким уровнем связывания контроля моноклонального антитела против fHbp, что обеспечивало достаточную экспрессию и правильное сворачивание мутантов fHbp. Собранные клетки высевали на чашки с агаром (LB - агар, содержащий 50 мкг/мл сульфата канамицина), которые инкубировали в течение ночи при 37°С. Одиночные колонии E. coli были использованы в качестве матриц для ПЦР-амплификации, а ампликоны ДНК очищали (PCR Purification Kit; Qiagen) и подвергали секвенированию ДНК гена fHbp с использованием праймеров, которые гибридизировались с Т7 промотором и Т7 терминатором. Подход скрининга библиотеки случайных мутантов fHbp имеет потенциал для того, чтобы определить: 1) положения, которые влияют на связывание fH, которые не являются предсказуемыми только по кристаллической структуре; и 2) замены, отличные от замен аланина, которые влияют на связывание fH в тех случаях, когда замена аланина не приводит в результате к существенному снижению уровня связывания fH.
Отбор мутантов для дополнительного изучения
Положения аминокислотных замен, которые были определены из эксперимента FACS, были исследованы в кристаллической структуре fHbp в комплексе с фрагментом человеческого fH. Мутанты, которые находились в непосредственной близости (<5 Е) с поверхностью связывания fH, были выбраны для сайт-специфического мутагенеза. Повторяемость библиотеки мутантов путем сайт-специфического мутагенеза была необходима для создания растворимых рекомбинантных белков fHbp для дополнительной характеризации. Этот подход также удалял нежелательные вторичные мутации, которые присутствовали во многих из отсортированных клонов и которые были далеки от участка связывания fH. Сайт-специфические мутанты на конкретных участках были сконструированы с помощью набора сайт-направленного мутагенеза Phusion (Thermo Scientific, Inc.).
Экспрессия и очистка растворимых мутантных fHbp
Растворимые, рекомбинантные fHbp были экспрессированы в E.coli и лизаты получали, как описано ранее. fHbp очищали с помощью никель-аффинной хроматографии с использованием колонок HiTrap Chelating HP (5 мл; GE Life Sciences, Inc.) и системы хроматографии Akta Purifier (GE Life Sciences). Буферы для связывания и элюирования с использованием градиента имидазола были получены в соответствии с протоколами производителя колонки. Фракции, содержащие очищенный fHbp, объединяли, диализовали против PBS, содержащего 3% сахарозы, и хранили при -80°C до использования.
Для исследований иммуногенности на мышах, второй этап очистки проводили с применением ионообменной хроматографии с колоннами HiTrap SP HP (5 мл; GE Life Sciences). Связывающие и буферы для элюции были 25 мМ MES, рН 5,5, содержащие 150 мМ и 750 мМ NaCl, соответственно. Связанный fHbp элюировали из колонки SP с линейным градиентом, образованным связывающим и элюирующим буферами. Фракции, содержащие очищенный fHbp, объединяли, диализовали против PBS, содержащего 3% сахарозы, и хранили при -80°C до использования.
Очистка человеческого фактора Н (fH)
Человеческий fH очищали на fHbp аффинной колонке. Колонку получали путем совмещения 5 мг fHbp ID 1 с NHS-активированной колонкой HP (5 мл; GE Life Sciences) с использованием протоколов изготовителя. Человеческую сыворотку от здорового человека донора разбавляли 1: 1 в фосфатно-солевом буфере (PBS). Сыворотку наносили на колонку и колонку промывали 10 объемами PBS (т.е. 50 мл). Связанный fH элюировали 5 объемами колонки 0,1 М глицина-HCl, рН 2,7. Элюированные фракции собирали в пробирки, содержащие 50 мкл 1 М Трис-HCl, рН 9,0. Фракции, содержащие fH, идентифицировали с помощью электрофореза с додецилсульфатом натрия в полиакриламидном геле (SDS-PAGE) (4-12% NuPAGE; Invitrogen). Электрофорез проводили при 200 В в течение 45 мин с использованием 1x MES проточного буфера (Invitrogen). Белки визуализировали окрашиванием кумасси G-250 (SimplyBlue SafeStain; Invitrogen). Фракции, содержащие fH, объединяли и подвергали диализу против PBS и аликвоты Fh хранили при -30°C до использования.
Характеристика fHbp мутантов
SDS-PAGE. Размер и чистота очищенных fHbp мутантных белков оценивали с помощью SDS-PAGE с использованием 4-12% полиакриламидных градиентных гелей (NuPAGE; Invitrogen, Inc.). Два мкг каждого белка загружали на гель. SDS-PAGE проводили, как описано выше для fH.
Связывание fH с fHbp с помощью иммуноферментного анализа (ELISA). Лунки микротитрационного планшета 96-луночного (Immulon 2HB; Thermo Scientific) покрывали 2 мкг/мл очищенного рекомбинантного дикого типа fHbp (положительный контроль) или мутантного fHbp (экспериментальный). Неспецифическое связывание с лунками блокировали PBS, содержащим 1% бычьего сывороточного альбумина (Lifeblood Medical, Inc.) или 5% нежирного сухого молока (Carnation, Nestle, Inc.). Пятикратные серийные разведения очищенного человеческого Fh в диапазоне от 25 до 0,0016 мкг/мл в буфере для разведения (PBS, содержащем 0,1% Tween-20, 0,01% азида натрия и 1% бычьего сывороточного альбумина), были добавлены к лункам и планшет инкубировали при комнатной температуре в течение 2 ч. После трехкратной промывки с PBS, содержащим 0,1% Tween-20 (Sigma) и 0,01% азида натрия (Sigma), связанный fH был детектирован с антителами овцы против человеческого fH (1: 7000; Abcam, Inc.) в буфере для разведения. Планшеты инкубировали при комнатной температуре в течение 1 ч. После того, как лунки снова промывали, связывание первичного антитела детектировали с использованием антител осла против овечьего IgG, конъюгированного со щелочной фосфатазой (1: 5000, Sigma-Aldrich, Inc.) в буфере для разведения. Планшеты инкубировали при комнатной температуре в течение 1 ч, а лунки промывали еще раз. ELISA был проведен с фосфатазным субстратом (1 мг/мл пара-нитрофенил фосфат; Sigma) в субстратном буфере (50 мМ карбонат натрия, 1 мМ MgCl2, рН 9,8). После инкубации при комнатной температуре в течение 30 мин, измеряли оптическую плотность при 405 нм в UV-VIS-ридере (Spectromax 190; Molecular Devices, Inc.).
Связывание моноклональных антител против fHbp с fHbp, проанализированное с помощью ELISA. Лунки микротитрационного планшета покрывали fHbp, блокировали и промывали, как описано выше для fH ELISA. Пятикратные серийные разведения мышиных моноклональных антител против fHbp (mAb) добавляли от 25 до 0,0016 мкг/мл в буфер для разведения, и планшет инкубировали при комнатной температуре в течение 1 ч. После промывки лунок, первичное антитело детектировали с использованием антител козы против IgG мыши, конъюгированных со щелочной фосфатазой (1; 5000, Sigma-Aldrich). ELISA был проведен и проанализирован, как описано выше.
Связывание fH с fHbp с помощью поверхностного плазмонного резонанса (SPR). SPR эксперименты проводились на приборе Biacore X100 Plus (GE Life Sciences). Три тысячи единиц ответа очищенного человеческого fH были соединены с чипом CM5 (GE Life Sciences) с использованием набора Amine Coupling Kit (GE Life Sciences). fH иммобилизовали в проточной ячейке 2, а бланк иммобилизации (без fH) проводили в проточной ячейке 1 в качестве эталона. Три запуска циклов, состоящих из HEPES-буферного солевого растворе, содержащего 3 мМ ЭДТА и 0,05% Поверхностно-активного вещества Р-20 (GE Life Sciences) и регенерация с помощью 100 мМ глицина, 3 М NaCl, рН 2,0, были выполнены, для создания условий поверхности чипа. Разведения очищенного рекомбинантного fHbp в пределах от 100 до 1 нм (дикого типа) или от 316 до 3,16 нМ вводили в течение 150 секунд. Диссоциацию наблюдали в течение 300 сек и данные были проанализированы с помощью программного обеспечения оценки Biacore X100.
Иммуногенность мышей. Группы мышей дикого типа CD-1 (N = 14 до 21) иммунизировали вакцинами fHbp адсорбированных с гидроксидом алюминия. Каждая доза вакцины содержала 10 мкг fHbp и 600 мкг Alhydrogel (Brenntag Biosector) в 10 мМ гистидина, 150 мМ NaCl, рН 6,5. Две дозы были применены в промежутках в три недели друг от друга, и кровь собирали пункцией сердца через три недели после введения второй дозы. Кровь была обработана для получения сыворотки, которую хранили при -80°С в течение длительного хранения (> 2-х недель) или 4°С для кратковременного хранения (<2-х недель).
Трансгенные мыши BALB/c с человеческим fH сначала подвергали скринингу, чтобы идентифицировать животных с сывороточными концентрациями Fh человека > 240 мкг/мл, с помощью ELISA и fHbp стандартной кривой очищенного человеческого fH. ELISA проводили с использованием очищенного fHbp ID 1, иммобилизованного на пластине, а первичные и вторичные антитела для выявления fH были такими же, как описано выше (см. "Связывание Fh с fHbp с помощью ELISA").
Группы из трансгенных мышей (n = 11 до 21) иммунизировали вакцинами fHbp адсорбированными с гидроксидом алюминия (такое же количество антигена и адъюванта как для дикого типа CD-1 мышей, описанного выше). Три дозы вводили при трехнедельных интервалах и отбирали кровь через три недели после третьей дозы вакцины. Сыворотку обрабатывали и хранили, как описано выше.
Сывороточные бактерицидные гуморальные (SBA) ответы. Комплемент-опосредованные ответы SBA человека были измерены против менингококковых штаммов с идентичным или близко соответствующими последовательностями fHbp по сравнению с соответствующим антигеном вакцины. Бактерии выращивали в регулярной среде Frantz (Frasch et al. “Outer membrane protein vesicle vaccines for meningococcal disease.” In Methods in Molecular Medicine, v. 66. Meningococcal Vaccines: Methods and Protocols. Edited by Pollard, A.J. and Maiden, M.C. Humana Press Inc. Totowa, NJ), содержащей 4 мМ лактата и 0,02 мМ CMP-NANA до середины экспоненциальной фазы (OD620 нм = 0,6). Бактерии разводили 1: 25000 в PBS Дульбекко, содержащем 1% бычьего сывороточного альбумина (Equitech Bio.). Человеческий комплемент был от донора без каких-либо собственных бактерицидных антител и был обеднен с IgG антителами с использованием HiTrap Protein G колонки (5 мл; GE Life Sciences). Каждая реакция содержала 25% человеческого комплемента, ~ 400 КОЕ бактерий и разведений тест антисыворотки или антител контроля. Титр SBA рассчитывали как разведение сыворотки, что привело к снижению на 50% в КОЕ относительно лунок негативного контроля после 60 мин инкубации при 37°C. Очистка белка: Рекомбинантные fHbp были экспрессированы в E.coli с С-концевой гекса-гистидиновой меткой и очищены с помощью металл-хелатной хроматографии (HiTrap Chelating HP, GE Life Sciences), а затем с помощью ионообменной хроматографии (HiTrap SP; GE Life Sciences). Белки (2 мкг каждого) разделяли на 4-12% NuPAGE геле (Invitrogen) с использованием MES проточного буфера (Invitrogen), и окрашивание визуализировали с помощью синего кумасси (Simply Blue Safe Stain; Invitrogen).
Результаты
Для идентификации fHbp мутантов с пониженным связыванием человеческого fH был разработан подход на основе библиотеки случайных мутантов. Этот подход был в состоянии идентифицировать мутации, приводящие к уменьшению связывания fH, что может не быть предсказуемым на основе одной только структурной информации, и был в состоянии производить несколько аминокислотных замен в любом заданном положении. Такой подход идет в разрез с общим подходом замены аланина в выбранных положениях, что иногда приводит в результате к небольшому уменьшению в связывании fH.
Используя подход библиотеки случайных мутантов, мы определили пять перспективных новых fHbp ID 1 мутантов. Очищенные антигены рекомбинантного мутанта fHbp ID 1 Q38R, E92K, R130G, S223R и H248L продемонстрированы на фиг. 1.
Фиг. 1. Чистота fHbp ID 1 мутантов. Рекомбинантные fHbp были экспрессированы в E.coli с С-концевой гекса-гистидиновой меткой и очищены с помощью металл-хелатной хроматографии (HiTrap Chelating HP, GE Life Sciences), а затем с помощью ионообменной хроматографии (HiTrap SP; GE Life Sciences). Белки (2 мкг каждого) разделяли в 4-12% NuPAGE геле (Invitrogen) с использованием MES проточного буфера (Invitrogen) и визуализировали с помощью окрашивания синим кумасси (Simply Blue Safe Stain; Invitrogen). Дорожка 1, маркер молекулярного веса Kaleidoscope (Bio-Rad Laboratories); 2, fHbp ID 1 дикий тип; 3, Q38R; 4, E92K; 5, R130G; 6, S223R; 7, H248L.
Эти мутанты демонстрируют уменьшение связывания fH в пределах от ~ 10 раз (R130G) до ~ 20 раз (Q38R), до ~ 100 раз (E92K, S223R и H248L) (фиг. 2).
Фиг. 2A и 2B отображают связывание мутантов fHbp ID 1 проанализированное с помощью ELISA. Лунки микротитрационного планшета покрывали очищенным рекомбинантным ID 1 дикого типа (WT) или одним из шести различных мутантных белков. Различные концентрации очищенного человеческого fH были добавлены к лункам. Связанный fH был обнаружен с овечьими антителами против человеческого fH (Abcam) и антителами осла против овечьего IgG, конъюгированных со щелочной фосфатазой (Sigma). A, Положительный контроль, белок fHbp ID 1 дикого типа (WT) с высоким уровнем связывания человеческого fH. Негативный контроль fHbp ID 1 мутант R41S с низким уровнем связывания fH. B, Новые мутанты fHbp ID 1 с пониженным уровнем связывания fH. Мутант R130G продемонстрировал умеренное связывание fH, Q38R продемонстрировал низкий уровень связывания и E92K, S223R и H248L продемонстрировали значительно более низкий уровень связывания, чем у R41S. Приведены среднее значение и стандартное отклонение для повторных измерений.
Аналогичная картина уменьшенного уровня связывания fH с мутантными белками была получена из экспериментов поверхностного плазмона, в которых R130G и Q38R мутанты демонстрируют некоторый уровень связывания, в то время как остальные три мутанта демонстрируют не детектируемое связывание (фиг. 3А и 3В).
Фиг. 3A-3E. fH связывание fHbp ID 1 мутантов с помощью поверхностного плазмонного резонанса. 3000 единиц ответа очищенного человеческого fH были связаны с чипом CM5 (GE Life Sciences) и 316 нМ очищенного рекомбинантного fHbp вводили в течение 150 секунд. Для ориентира, одни и те же данные для белка ID 1 дикого типа (WT) приведены на каждой панели. Та же картина связывания наблюдалось как в ELISA (фиг. 2, выше); умеренное связывание с fH для R130G мутанта, низкий уровень связывания для Q38R и очень низкий уровень связывания для E92K, S223R и H248L. Во всех экспериментах использовали HBS-EP рабочий буфер и Biacore X100 Plus инструмент поверхностного плазмонного резонанса. Данные были проанализированы с помощью программного обеспечения для оценки Biacore X100.
Все пять белков мутантов fHbp ID 1 сохранили конформационные эпитопы, распознаваемые моноклональными антителами против fHbp. Зависимое от концентрации связывание пяти моноклональных антител против fHbp с диким типом или мутантами fHbp продемонстрировано на фиг. 4.
Фиг. 4A-4E. Связывание мышиных моноклональных антител против fHbp (mAb) с fHbp мутантными белками, проанализированное с помощью ELISA. Аналогичное зависимое от концентрации связывание моноклональных антител против fHbp свидетельствовало о том, что дикий тип и мутантные fHbp присутствовали в количествах, аналогичных как в лунках планшета для микротитрования, и что мутантные fHbp сохранили конформационные эпитопы, распознаваемые пятью различными моноклональными антителами. Вторичное антитело представляло собой антитело козы против мышиных IgG конъюгированное со щелочной фосфатазой (Sigma). Приведены среднее значение и стандартное отклонение для повторных измерений.
Мутантные белки также сохраняют термическую стабильность, аналогичную как для дикого типа fHbp ID 1, за исключением E92K мутанта, который имел несколько сниженную стабильность. И, наконец, мутанты вызывали сходные бактерицидные гуморальные ответы у мышей дикого типа CD-1 при испытании против серогруппы В штамма Н44/76 (фиг. 5А-5В).
Фиг. 5A и 5B. Бактерицидные гуморальные ответы на fHbp ID 1 мутанты у мышей. Фиг. 5A, группы от 12 до 14 мышей дикого типа были иммунизированы внутрибрюшинно с двумя дозами очищенного рекомбинантного fHbp (10 мкг на дозу), которые применялись в трехнедельных интервалах. Сыворотку получали через три недели после введения второй дозы. Бактерицидную активность сыворотки измеряли с использованием IgG-обедненной сыворотки крови человека в качестве источника комплемента и серогруппы В штамма Н44/76 в качестве тестируемого штамма. Н44/76 экспрессировал fHbp ID 1, который соответствует контрольной вакцине fHbp ID 1 WT. Каждый символ представляет собой титр отдельной мыши, а горизонтальные полосы представляют собой геометрические средние титры. Различия между группой WT и каждой из мутантных групп не были статистически значимыми (р> 0,4 с помощью Т-теста). Фиг. 5В, группы от 14 до 15 трансгенных мышей с человеческим fH были иммунизированы внутрибрюшинно тремя дозами очищенного рекомбинантного fHbp (10 мкг на дозу), которые применялись в трехнедельных интервалах. Сыворотку получали через три недели после введения третьей дозы. Бактерицидную активность сыворотки измеряли как описано выше для мышей дикого типа.
Фиг. 6A и 6B. Связывание человеческого fH с fHbp ID 1 одиночных и двойных мутантов проанализированное с помощью ELISA. Эксперименты проводились как описано выше для фиг. 2А-2В. Фиг. 7. Бактерицидные гуморальные ответы на fHbp ID 1 одиночные и двойные мутанты у мышей. Группы из 20 мышей дикого типа были иммунизированы и сывороточные бактерицидные гуморальные ответы определяли, как описано выше для фиг. 5А.
Пример 2. Характеристика fHbp ID 55 мутантов
Материалы и методы
Эксперименты проводились как описано в примере 1.
Результаты
Три перспективных мутанта, которые были определены в fHbp ID 1, также были сконструированы в fHbp ID 55; они включали E92K, S223R и H248L. Все три fHbp ID 55 мутанта имели значительно уменьшенный уровень связывание fH (фиг. 8А). Мутанты сохранили конформационную целостность, судя по связыванию мышиных моноклональных антител JAR 41 против fHbp (фиг. 8B).
Фиг. 8A и 8B отображают связывание мутантов fHbp ID 55. A. Связывание fH с иммобилизованными fHbp ID 55 мутантами, проанализированное с помощью ELISA. Эксперимент был проведен как описано выше в легенде к фиг. 2. Приведены среднее значение и диапазон для двух-четырех повторных измерений. В. Зависимое от концентрации связывание моноклональных антител (mAb) JAR 41 против fHbp показано, что рекомбинантные fHbp присутствовали в количествах, аналогичных как в лунках планшета для микротитрования и сохраняли конформацию в области эпитопа, распознаваемого JAR 41 (N- концевой домен; Vu et al. (2012) Sci. Reports, supra). Вторичное антитело представляло собой антитело козы против мышиных IgG, конъюгированное со щелочной фосфатазой (Sigma).
Фиг. 9. Бактерицидные гуморальные ответы на fHbp ID 55 мутанты у мышей дикого типа. Группы из 12 мышей были иммунизированы и сывороточные бактерицидные гуморальные ответы определяли, как описано выше для фиг. 5А. Бактерицидную активность измеряли против мутантного штамма H44/76, который экспрессирует fHbp ID 55.
Фиг. 10A. бактерицидные гуморальные ответы трансгенных мышей с человеческим fH на fHbp ID 55 S223R мутант. Группы от 11 до 12 трансгенных мышей иммунизировали тремя дозами очищенного рекомбинантного fHbp (12 мкг на дозу) или одной десятой частью человеческой дозы лицензированной Trumenba (Pfizer) вакцины, содержащей в общем 12 мкг fHbp. Трансгенные мыши были иммунизированы и сывороточные бактерицидные гуморальные ответы определяли, как описано выше для фиг. 5B. Фиг. 10B, бактерицидные гуморальные ответы на Trumenba у мышей дикого типа и трансгенных мышей с человеческим fH по отношению к концентрациям fH в сыворотке человека. Сывороточные концентрации fH человека измеряли с помощью ELISA, как описано ранее (Beernink et al. (2011) Journal of Immunology 186(6):3606-14).
Пример 3. Идентификация и характеристика fHbp ID 22 мутантов
Материалы и методы
Эксперименты проводились как описано в примере 1.
Результаты
Независимый поиск случайных мутантов fHbp с уменьшением уровня связывания fH проводили с использованием fHbp ID 22, который является в варианте 2-й группы (подсемейство A). Этот поиск привел в результате к шести новым перспективным мутантам (фиг. 17). fH связывание с ID 22 дикого типа и ранее описанным D211A мутантом ELISA проиллюстрировано на фиг. 11А. fH связывание с шестью новыми мутантными ID 22 белками проиллюстрировано на фиг. 11В.
Фиг. 11A-11D. fH связывание fHbp ID 22 библиотеки мутантов. Фиг. 11A. Позитивный контроль, белок fHbp ID 22 дикого типа (WT) с высоким уровнем связывания человеческого fH. Негативный контроль fHbp ID 22 мутант D211A с низким уровнем связывания fH. Фиг. 11B, Новые мутанты fHbp ID 22 с пониженным уровнем связывания fH. Все мутанты продемонстрировали низкий уровень связывания и V131D продемонстрировали очень низкие уровни связывание подобно как у D211A. Эксперимент был проведен как описано выше в легенде к фиг. 2. Приведены среднее значение и диапазон двух-четырех повторных измерений. Фиг. 11C, fH связывание подмножества fHbp ID 22 мутантов в концентрациях fH до 100 мкг/мл. Фиг. 11D, Связывание моноклонального антитела JAR 4 против fHbp с подгруппой мутантов (одни и те же символы, используемые на фиг. 11C). Новый мутант K219N сохраняет уровень связывания с JAR 4, тогда как G220S мутант уменьшает уровень связывания с JAR 4. Все мутанты имели нормальные уровни связывания другого моноклонального антитела JAR 31 против fHbp (данные не указаны). Приведены среднее значение и стандартное отклонение для повторных измерений.
Бактерицидные гуморальные ответы мышей дикого типа CD-1 на новые мутанты V131D и K219N, наряду с контрольным белком дикого типа ID 22 и ранее охарактеризованного мутанта D211A, проиллюстрированы на фиг. 12.
Фиг. 12A-12B. Бактерицидные гуморальные ответы на fHbp ID 22 библиотеки мутантных мышей дикого типа. Библиотека мутантов с низким уровнем связывания человеческого fH были отобраны для иммунизации. Группы от 10 до 21 мышей были иммунизированы с двумя дозами очищенного рекомбинантного fHbp (10 мкг на дозу), которые применялись в трехнедельных интервалах. Сыворотку получали через три недели после введения второй дозы. Бактерицидную активность сыворотки измеряли с использованием IgG-обедненной сыворотки крови человека в качестве источника комплемента и серогруппы В штамма CH597 в качестве тестируемого штамма. Этот штамм экспрессировал fHbp ID 23, который соответствует контрольной вакцине fHbp ID 22 WT. Фиг. 12А, эксперимент тестирования новых мутантов V131D и K219N. D211A мутант был использован в качестве контроля мутантной fHbp вакцины, который не уменьшал иммуногенность. Каждый символ представляет собой титр отдельной мыши, а горизонтальные полосы представляют собой геометрические средние титры. Фиг. 12B, Второй эксперимент тестирования новых мутантов D121G, S128T, F129S и G220S. За исключением умеренной потери иммуногенности V131D значимой потери иммуногенности для новых мутантных fHbp не наблюдалось.
Фиг. 13. Бактерицидные гуморальные ответы на fHbp ID 22 библиотеку мутанта K219N у трансгенных мышей с человеческим fH. Контрольный мутант D211A демонстрировал более высокие уровни ответов, а K219N мутант демонстрировал ответы, аналогичные антигену fHbp ID 22 дикого типа (WT).
Фиг. 14. Термическая стабильность fHbp ID 22, измеренная с помощью дифференциальной сканирующей микрокалориметрии. FHbp ID 22 дикого типа (WT, сплошная линия) подвергается разворачивающимся переходам при 38 (N-терминаль) и 81°С (С-концевого домена). FHbp ID 22 L130R/G133D двойной мутант проявляет термостабильность на 19°C выше для N-концевого домена по сравнению с тем же из ID 22 WT.
Фиг. 15А-15В. fHbp ID 22 тройные мутанты, сочетающие стабилизирующие замены L130R и G133D (двойной мутант, DM) с библиотекой полученных мутантов для уменьшения fH связывания. A, связывание fH с тройными мутантами fHbp ID 22. B, контрольное связывание мышиного моноклонального антитела (mAb) 4 JAR против fHbp (те же символы, как и в панели A). Все стабилизированные мутанты связывают JAR 4 лучше, чем fHbp ID 22 WT.
Фиг. 16. Бактерицидные гуморальные ответы на fHbp ID 22 тройных мутантов у трансгенных мышей с человеческим fH. Оба мутанта подвергались тестированию сочетания стабильности двойного мутанта (DM) с K219N и G220S, соответственно. Тройные мутанты вызвали в восемь- и 18 раз более высокие уровни ответов, чем WT контрольный антиген ID 22.
Краткое описание примерных fHbp ID 1 и ID 22 мутантов, описанных выше, представлено в таблице на фиг. 17.
В то время как настоящее изобретение было описано со ссылками на конкретные варианты его реализации, специалистам в данной области техники следует понимать, что могут быть проведены различные изменения, и эквиваленты могут быть заменены без отхода от истинной сути и объема настоящего изобретения. Кроме того, многие модификации могут быть произведены для того, чтобы адаптировать конкретную ситуацию, материал, состав вещества, процесс, технологические стадии или стадию к задаче, сути и объему настоящего изобретения. Все такие модификации предназначены для того, чтобы быть в пределах объема прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Beernink, Peter T
<120> Factor H Binding Protein Variants and Methods of Use Thereof
<130> CHOR-076WO
<150> US 62/028,123
<151> 2014-07-23
<160> 28
<170> PatentIn version 3.5
<210> 1
<211> 255
<212> PRT
<213> Neisseria meningitidis
<400> 1
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 2
<211> 254
<212> PRT
<213> Neisseria meningitidis
<400> 2
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 3
<211> 260
<212> PRT
<213> Neisseria meningitidis
<400> 3
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn
50 55 60
Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg
65 70 75 80
Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu
85 90 95
Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr
100 105 110
Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys Met
115 120 125
Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr
130 135 140
Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr
145 150 155 160
Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro
180 185 190
Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys
195 200 205
His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys
210 215 220
Gly Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala
225 230 235 240
Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu
245 250 255
Ala Ala Lys Gln
260
<210> 4
<211> 1231
<212> PRT
<213> Homo sapiens
<400> 4
Met Arg Leu Leu Ala Lys Ile Ile Cys Leu Met Leu Trp Ala Ile Cys
1 5 10 15
Val Ala Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile
20 25 30
Leu Thr Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala
35 40 45
Ile Tyr Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met
50 55 60
Val Cys Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys
65 70 75 80
Gln Lys Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe
85 90 95
Thr Leu Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr
100 105 110
Thr Cys Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu
115 120 125
Cys Asp Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val
130 135 140
Lys Cys Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser
145 150 155 160
Ala Met Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe
165 170 175
Val Cys Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys
180 185 190
Ser Asp Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile
195 200 205
Ser Cys Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys
210 215 220
Ile Ile Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly
225 230 235 240
Tyr Glu Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp
245 250 255
Arg Pro Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile
260 265 270
Pro Asn Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp
275 280 285
Glu Ile Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly
290 295 300
Asn Thr Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys
305 310 315 320
Thr Leu Lys Pro Cys Asp Tyr Pro Asp Ile Lys His Gly Gly Leu Tyr
325 330 335
His Glu Asn Met Arg Arg Pro Tyr Phe Pro Val Ala Val Gly Lys Tyr
340 345 350
Tyr Ser Tyr Tyr Cys Asp Glu His Phe Glu Thr Pro Ser Gly Ser Tyr
355 360 365
Trp Asp His Ile His Cys Thr Gln Asp Gly Trp Ser Pro Ala Val Pro
370 375 380
Cys Leu Arg Lys Cys Tyr Phe Pro Tyr Leu Glu Asn Gly Tyr Asn Gln
385 390 395 400
Asn Tyr Gly Arg Lys Phe Val Gln Gly Lys Ser Ile Asp Val Ala Cys
405 410 415
His Pro Gly Tyr Ala Leu Pro Lys Ala Gln Thr Thr Val Thr Cys Met
420 425 430
Glu Asn Gly Trp Ser Pro Thr Pro Arg Cys Ile Arg Val Lys Thr Cys
435 440 445
Ser Lys Ser Ser Ile Asp Ile Glu Asn Gly Phe Ile Ser Glu Ser Gln
450 455 460
Tyr Thr Tyr Ala Leu Lys Glu Lys Ala Lys Tyr Gln Cys Lys Leu Gly
465 470 475 480
Tyr Val Thr Ala Asp Gly Glu Thr Ser Gly Ser Ile Thr Cys Gly Lys
485 490 495
Asp Gly Trp Ser Ala Gln Pro Thr Cys Ile Lys Ser Cys Asp Ile Pro
500 505 510
Val Phe Met Asn Ala Arg Thr Lys Asn Asp Phe Thr Trp Phe Lys Leu
515 520 525
Asn Asp Thr Leu Asp Tyr Glu Cys His Asp Gly Tyr Glu Ser Asn Thr
530 535 540
Gly Ser Thr Thr Gly Ser Ile Val Cys Gly Tyr Asn Gly Trp Ser Asp
545 550 555 560
Leu Pro Ile Cys Tyr Glu Arg Glu Cys Glu Leu Pro Lys Ile Asp Val
565 570 575
His Leu Val Pro Asp Arg Lys Lys Asp Gln Tyr Lys Val Gly Glu Val
580 585 590
Leu Lys Phe Ser Cys Lys Pro Gly Phe Thr Ile Val Gly Pro Asn Ser
595 600 605
Val Gln Cys Tyr His Phe Gly Leu Ser Pro Asp Leu Pro Ile Cys Lys
610 615 620
Glu Gln Val Gln Ser Cys Gly Pro Pro Pro Glu Leu Leu Asn Gly Asn
625 630 635 640
Val Lys Glu Lys Thr Lys Glu Glu Tyr Gly His Ser Glu Val Val Glu
645 650 655
Tyr Tyr Cys Asn Pro Arg Phe Leu Met Lys Gly Pro Asn Lys Ile Gln
660 665 670
Cys Val Asp Gly Glu Trp Thr Thr Leu Pro Val Cys Ile Val Glu Glu
675 680 685
Ser Thr Cys Gly Asp Ile Pro Glu Leu Glu His Gly Trp Ala Gln Leu
690 695 700
Ser Ser Pro Pro Tyr Tyr Tyr Gly Asp Ser Val Glu Phe Asn Cys Ser
705 710 715 720
Glu Ser Phe Thr Met Ile Gly His Arg Ser Ile Thr Cys Ile His Gly
725 730 735
Val Trp Thr Gln Leu Pro Gln Cys Val Ala Ile Asp Lys Leu Lys Lys
740 745 750
Cys Lys Ser Ser Asn Leu Ile Ile Leu Glu Glu His Leu Lys Asn Lys
755 760 765
Lys Glu Phe Asp His Asn Ser Asn Ile Arg Tyr Arg Cys Arg Gly Lys
770 775 780
Glu Gly Trp Ile His Thr Val Cys Ile Asn Gly Arg Trp Asp Pro Glu
785 790 795 800
Val Asn Cys Ser Met Ala Gln Ile Gln Leu Cys Pro Pro Pro Pro Gln
805 810 815
Ile Pro Asn Ser His Asn Met Thr Thr Thr Leu Asn Tyr Arg Asp Gly
820 825 830
Glu Lys Val Ser Val Leu Cys Gln Glu Asn Tyr Leu Ile Gln Glu Gly
835 840 845
Glu Glu Ile Thr Cys Lys Asp Gly Arg Trp Gln Ser Ile Pro Leu Cys
850 855 860
Val Glu Lys Ile Pro Cys Ser Gln Pro Pro Gln Ile Glu His Gly Thr
865 870 875 880
Ile Asn Ser Ser Arg Ser Ser Gln Glu Ser Tyr Ala His Gly Thr Lys
885 890 895
Leu Ser Tyr Thr Cys Glu Gly Gly Phe Arg Ile Ser Glu Glu Asn Glu
900 905 910
Thr Thr Cys Tyr Met Gly Lys Trp Ser Ser Pro Pro Gln Cys Glu Gly
915 920 925
Leu Pro Cys Lys Ser Pro Pro Glu Ile Ser His Gly Val Val Ala His
930 935 940
Met Ser Asp Ser Tyr Gln Tyr Gly Glu Glu Val Thr Tyr Lys Cys Phe
945 950 955 960
Glu Gly Phe Gly Ile Asp Gly Pro Ala Ile Ala Lys Cys Leu Gly Glu
965 970 975
Lys Trp Ser His Pro Pro Ser Cys Ile Lys Thr Asp Cys Leu Ser Leu
980 985 990
Pro Ser Phe Glu Asn Ala Ile Pro Met Gly Glu Lys Lys Asp Val Tyr
995 1000 1005
Lys Ala Gly Glu Gln Val Thr Tyr Thr Cys Ala Thr Tyr Tyr Lys
1010 1015 1020
Met Asp Gly Ala Ser Asn Val Thr Cys Ile Asn Ser Arg Trp Thr
1025 1030 1035
Gly Arg Pro Thr Cys Arg Asp Thr Ser Cys Val Asn Pro Pro Thr
1040 1045 1050
Val Gln Asn Ala Tyr Ile Val Ser Arg Gln Met Ser Lys Tyr Pro
1055 1060 1065
Ser Gly Glu Arg Val Arg Tyr Gln Cys Arg Ser Pro Tyr Glu Met
1070 1075 1080
Phe Gly Asp Glu Glu Val Met Cys Leu Asn Gly Asn Trp Thr Glu
1085 1090 1095
Pro Pro Gln Cys Lys Asp Ser Thr Gly Lys Cys Gly Pro Pro Pro
1100 1105 1110
Pro Ile Asp Asn Gly Asp Ile Thr Ser Phe Pro Leu Ser Val Tyr
1115 1120 1125
Ala Pro Ala Ser Ser Val Glu Tyr Gln Cys Gln Asn Leu Tyr Gln
1130 1135 1140
Leu Glu Gly Asn Lys Arg Ile Thr Cys Arg Asn Gly Gln Trp Ser
1145 1150 1155
Glu Pro Pro Lys Cys Leu His Pro Cys Val Ile Ser Arg Glu Ile
1160 1165 1170
Met Glu Asn Tyr Asn Ile Ala Leu Arg Trp Thr Ala Lys Gln Lys
1175 1180 1185
Leu Tyr Ser Arg Thr Gly Glu Ser Val Glu Phe Val Cys Lys Arg
1190 1195 1200
Gly Tyr Arg Leu Ser Ser Arg Ser His Thr Leu Arg Thr Thr Cys
1205 1210 1215
Trp Asp Gly Lys Leu Glu Tyr Pro Thr Cys Ala Lys Arg
1220 1225 1230
<210> 5
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 5
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Arg Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 6
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 6
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Lys Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 7
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 7
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Gly Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 8
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 8
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Arg Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 9
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 9
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg Leu Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 10
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 10
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Ile Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 11
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 11
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Gly Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 12
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 12
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Thr
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 13
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 13
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Asp Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 14
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 14
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Asn Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 15
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 15
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Ser Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 16
<211> 260
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 16
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn
50 55 60
Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg
65 70 75 80
Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu
85 90 95
Lys Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr
100 105 110
Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys Met
115 120 125
Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr
130 135 140
Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr
145 150 155 160
Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro
180 185 190
Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys
195 200 205
His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys
210 215 220
Gly Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala
225 230 235 240
Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu
245 250 255
Ala Ala Lys Gln
260
<210> 17
<211> 260
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 17
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn
50 55 60
Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg
65 70 75 80
Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu
85 90 95
Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr
100 105 110
Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys Met
115 120 125
Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr
130 135 140
Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr
145 150 155 160
Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro
180 185 190
Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys
195 200 205
His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys
210 215 220
Gly Ser Tyr Arg Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala
225 230 235 240
Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly Leu
245 250 255
Ala Ala Lys Gln
260
<210> 18
<211> 260
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 18
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Thr Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn
50 55 60
Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg
65 70 75 80
Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu
85 90 95
Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr
100 105 110
Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys Met
115 120 125
Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr
130 135 140
Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr
145 150 155 160
Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp
165 170 175
Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser Pro
180 185 190
Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu Lys
195 200 205
His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys
210 215 220
Gly Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val Ala
225 230 235 240
Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His Leu Ile Gly Leu
245 250 255
Ala Ala Lys Gln
260
<210> 19
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 19
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Ser Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Arg Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 20
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 20
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Ser Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg Leu Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 21
<211> 255
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 21
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Arg Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg Leu Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 22
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 22
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Arg Val Ser Asp Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 23
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 23
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Arg Val Ser Asp Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Asn Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 24
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 24
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Arg Val Ser Asp Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Ser Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 25
<211> 174
<212> PRT
<213> Neisseria meningitidis
<400> 25
Met Lys Lys Ala Leu Ala Thr Leu Ile Ala Leu Ala Leu Pro Ala Ala
1 5 10 15
Ala Leu Ala Glu Gly Ala Ser Gly Phe Tyr Val Gln Ala Asp Ala Ala
20 25 30
His Ala Lys Ala Ser Ser Ser Leu Gly Ser Ala Lys Gly Phe Ser Pro
35 40 45
Arg Ile Ser Ala Gly Tyr Arg Ile Asn Asp Leu Arg Phe Ala Val Asp
50 55 60
Tyr Thr Arg Tyr Lys Asn Tyr Lys Ala Pro Ser Thr Asp Phe Lys Leu
65 70 75 80
Tyr Ser Ile Gly Ala Ser Ala Ile Tyr Asp Phe Asp Thr Gln Ser Pro
85 90 95
Val Lys Pro Tyr Leu Gly Ala Arg Leu Ser Leu Asn Arg Ala Ser Val
100 105 110
Asp Leu Gly Gly Ser Asp Ser Phe Ser Gln Thr Ser Ile Gly Leu Gly
115 120 125
Val Leu Thr Gly Val Ser Tyr Ala Val Thr Pro Asn Val Asp Leu Asp
130 135 140
Ala Gly Tyr Arg Tyr Asn Tyr Ile Gly Lys Val Asn Thr Val Lys Asn
145 150 155 160
Val Arg Ser Gly Glu Leu Ser Val Gly Val Arg Val Lys Phe
165 170
<210> 26
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 26
Tyr Pro Tyr Asp Val Pro Asp Tyr Ala
1 5
<210> 27
<211> 8
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 27
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 28
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 28
Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ ФАКТОР H-СВЯЗЫВАЮЩЕГО БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2811942C2 |
| МОДИФИЦИРОВАННЫЙ БЕЛОК, СВЯЗЫВАЮЩИЙ ФАКТОР Н | 2017 |
|
RU2773464C1 |
| Композиции с Neisseria meningitidis и способы их применения | 2020 |
|
RU2839906C1 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2739504C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| КОМПОЗИЦИЯ ДЛЯ КУЛЬТИВИРОВАНИЯ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И СПОСОБ ПОЛУЧЕНИЯ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2020 |
|
RU2824216C1 |
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| АНТИТЕЛО ПРОТИВ SIRPα | 2019 |
|
RU2791002C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ СВЯЗАННЫХ С IL-8 ЗАБОЛЕВАНИЙ | 2017 |
|
RU2766112C2 |
| АНТИТЕЛА К МИОСТАТИНУ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2789884C2 |


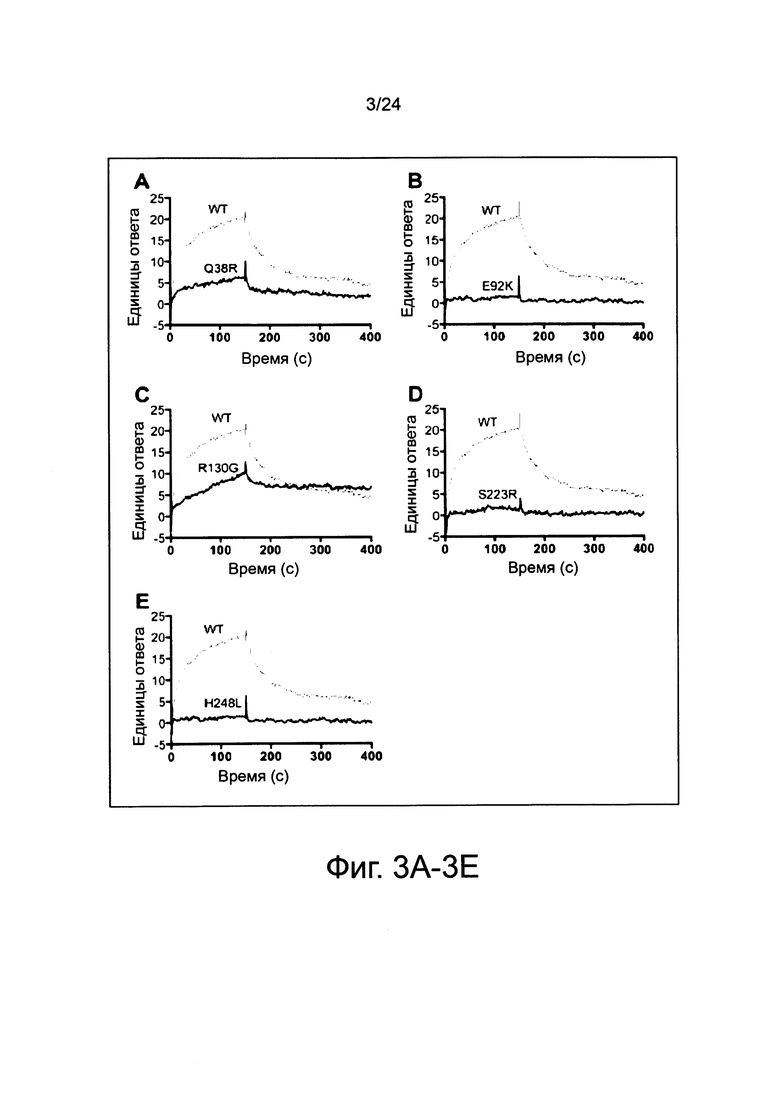
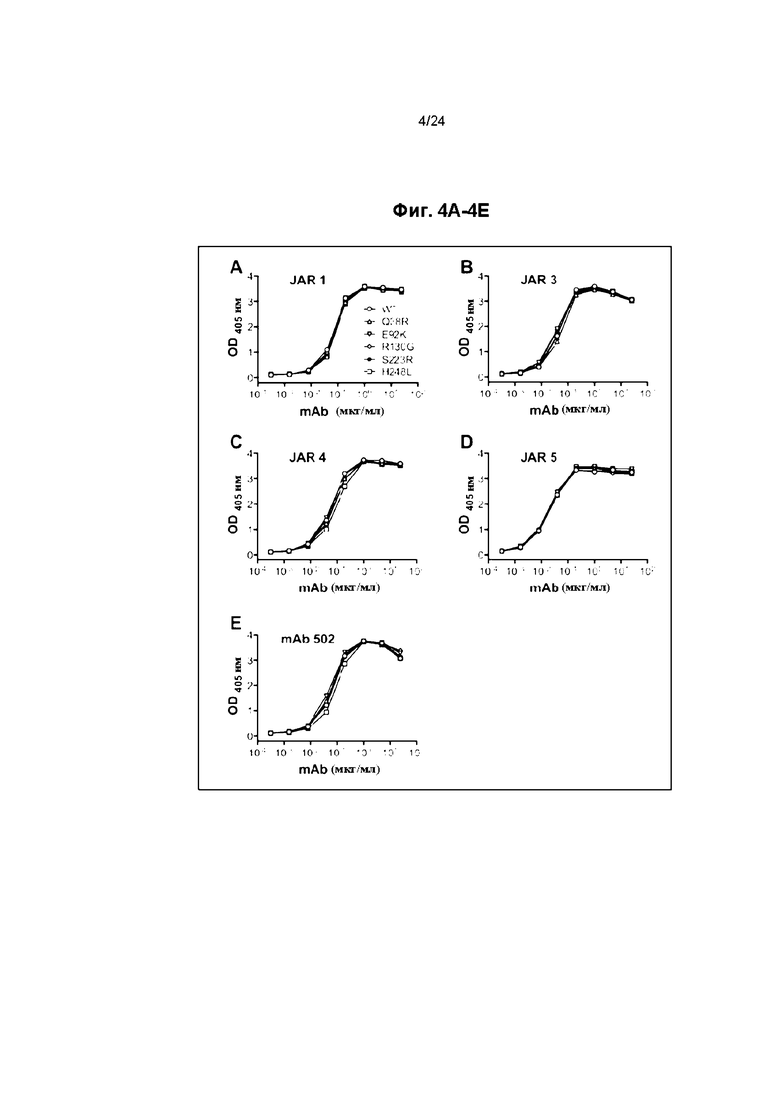

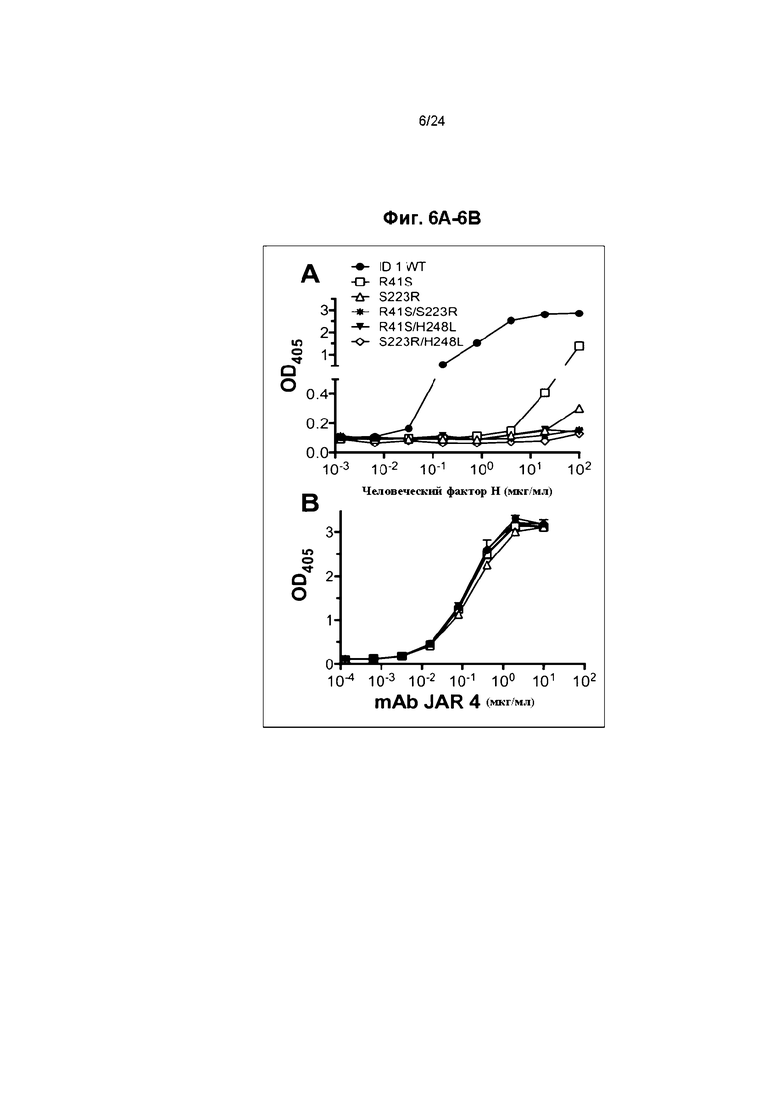


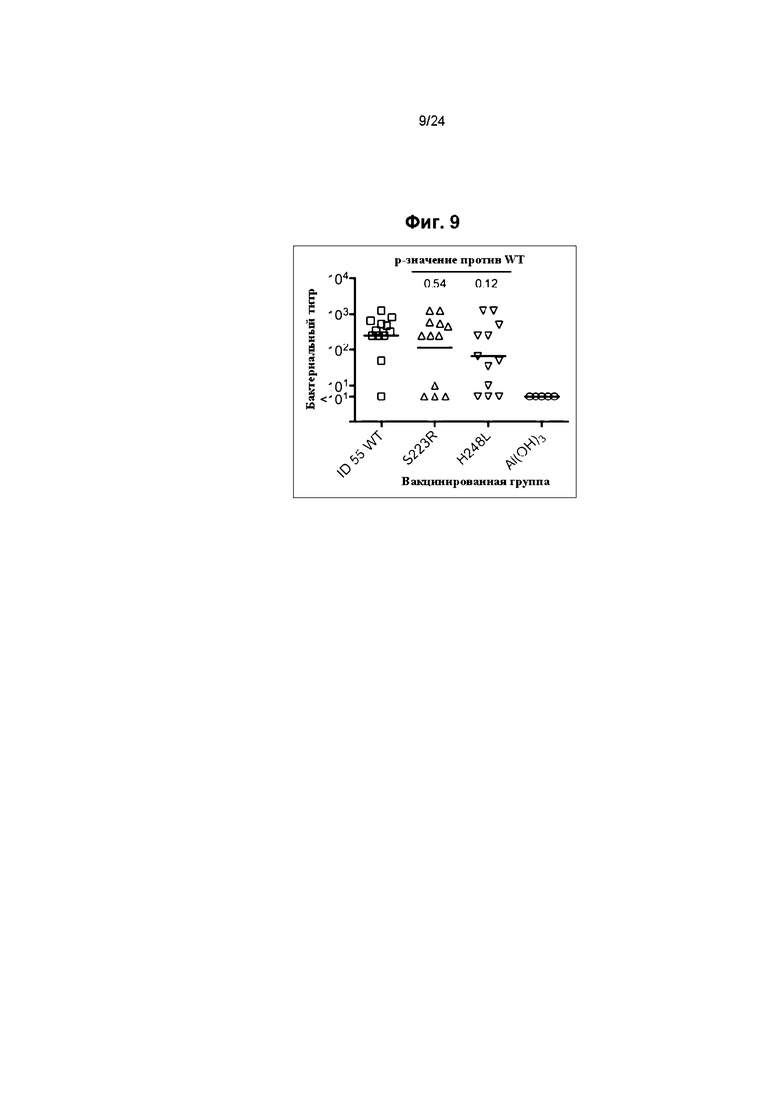
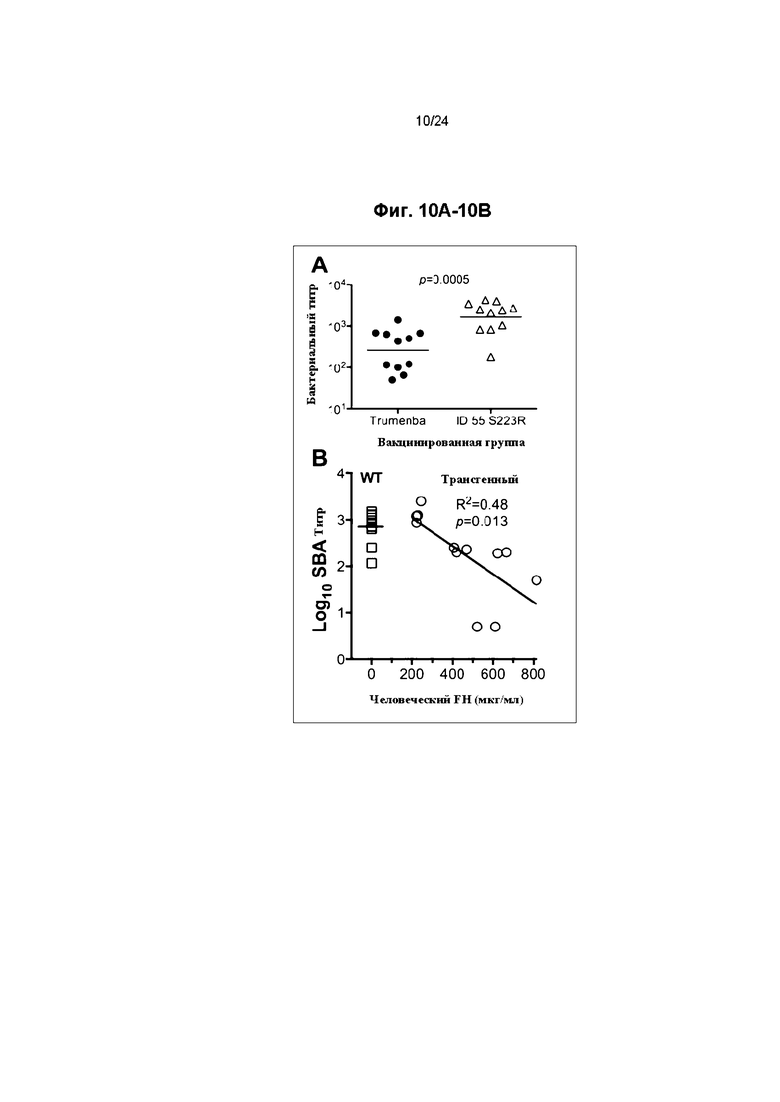
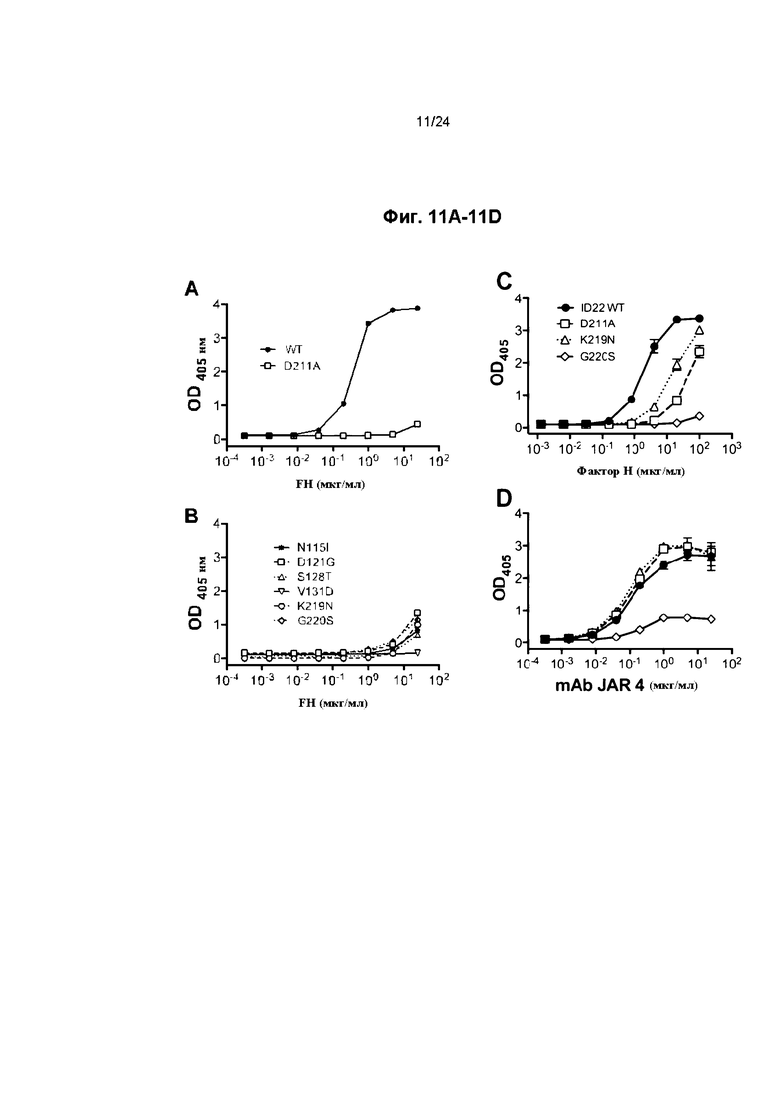
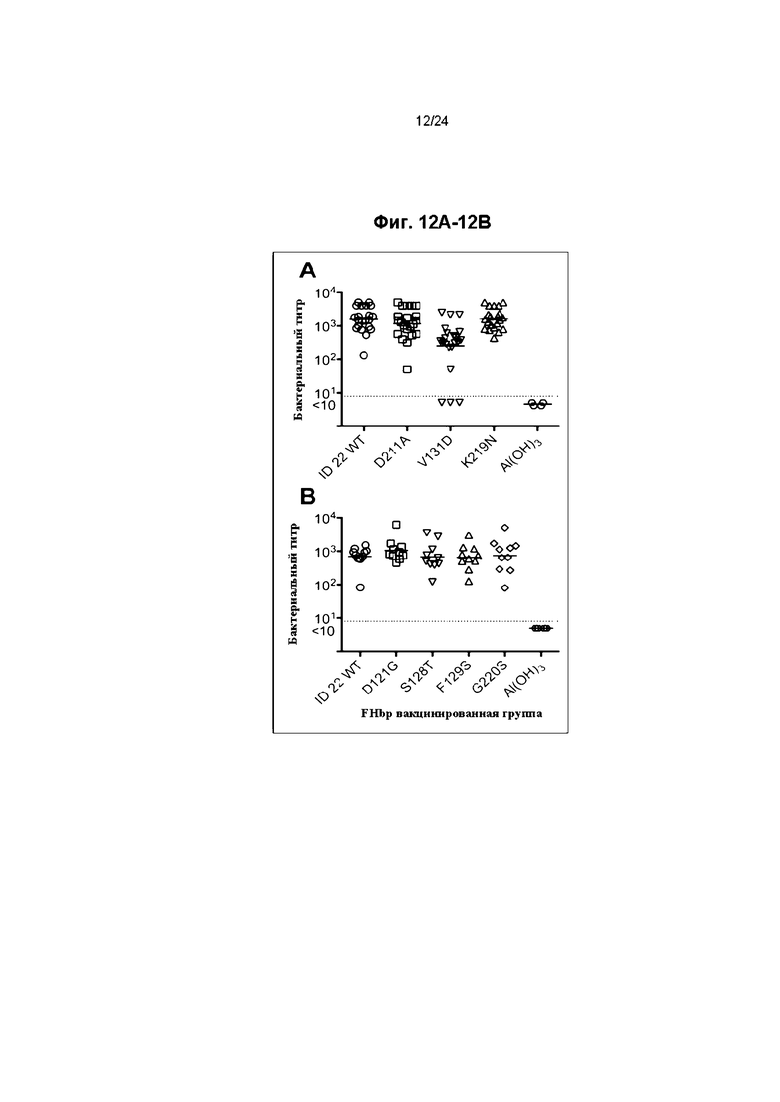
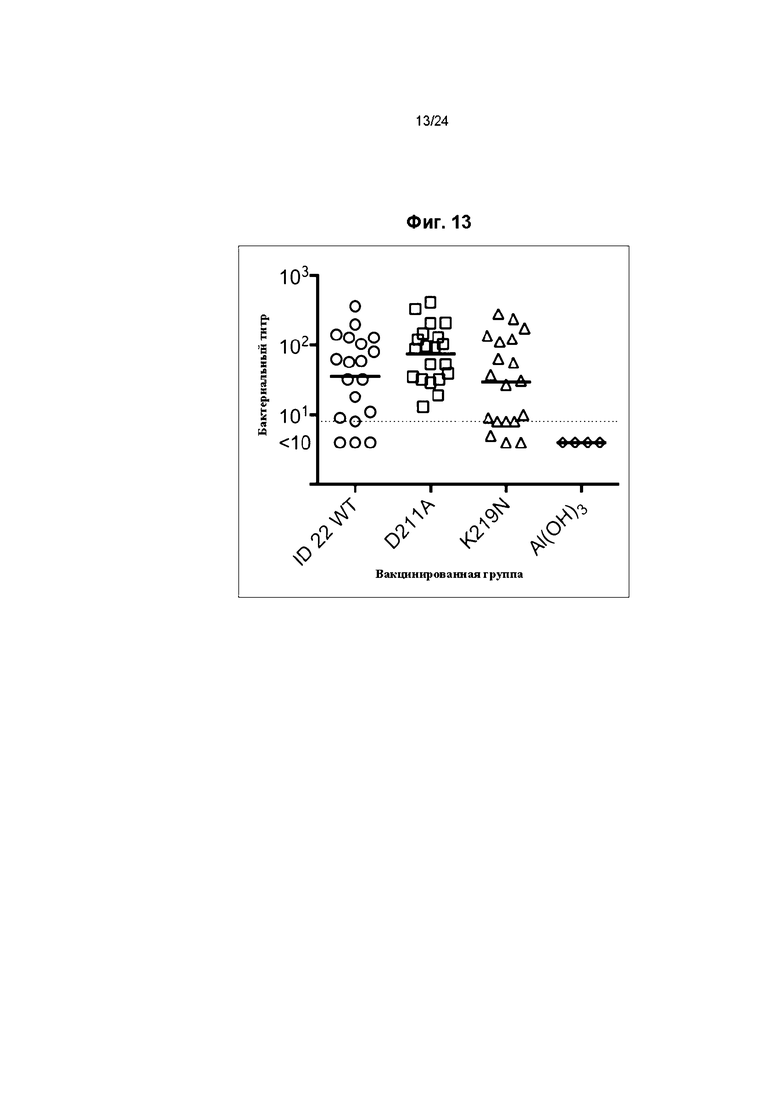

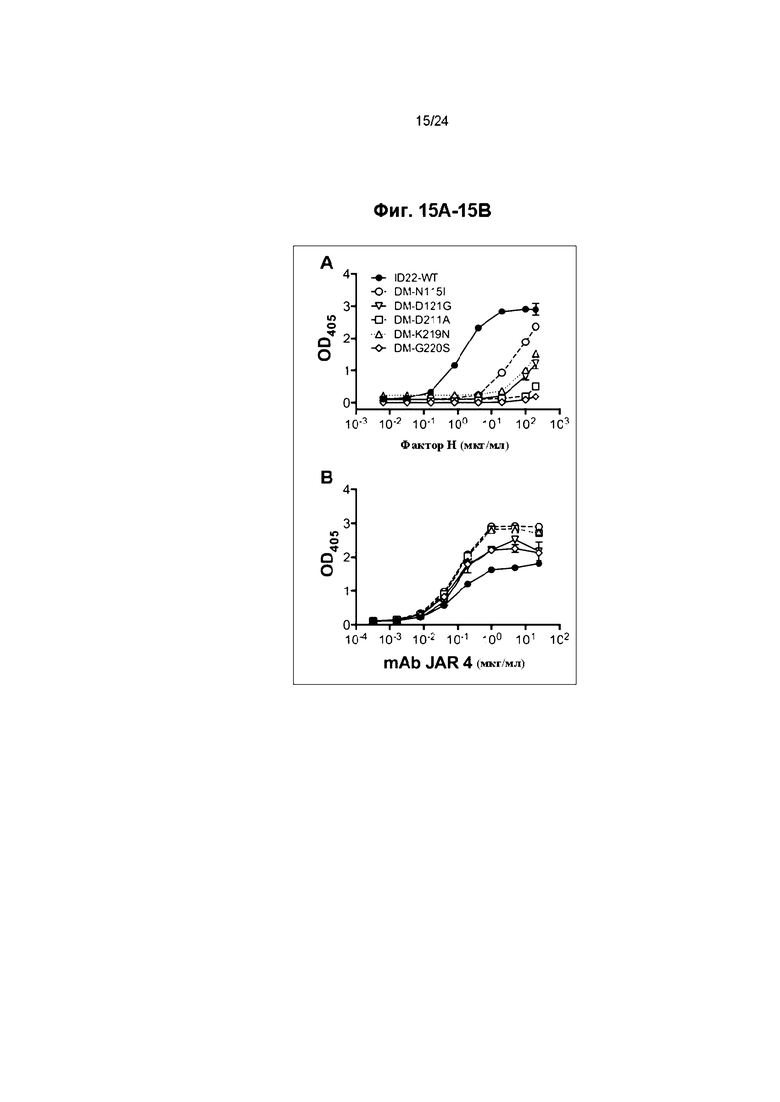
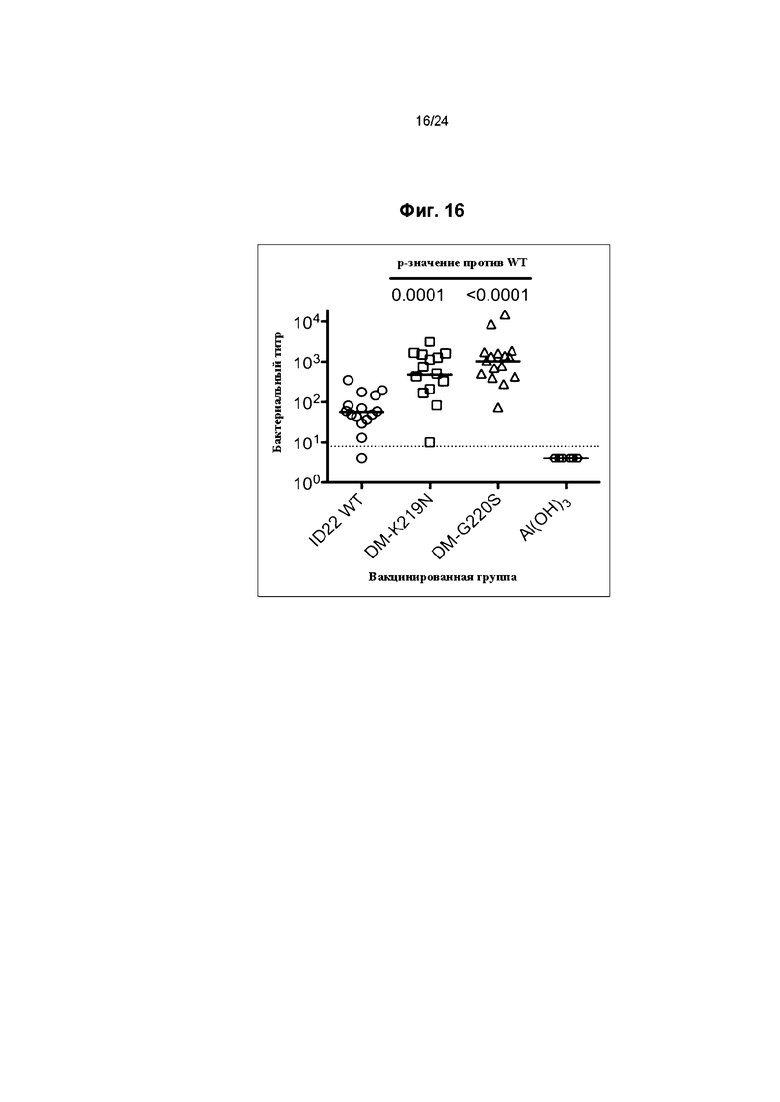








Изобретение относится к области биотехнологии, конкретно к вариантам фактор H-связывающих белков, и может быть использовано в медицине для индукции антительного ответа против N. meningitides у млекопитающих. Получен белок - вариант группы вариантов 1 (v. 1) фактора H-связывающего белка (fHbp) с лейцином (L) в положении аминокислоты 248 и необязательно серином (S) в положении 41 согласно нумерации аминокислотной последовательности fHbp ID1. Изобретение обеспечивает получение варианта fHbp, который связывает человеческий фактор H (fH) с аффинностью 50% или менее от аффинности fHbp ID 55 для человеческого fH и вызывает бактерицидный гуморальный ответ по меньшей мере на один штамм Neisseria meningitidis в организме млекопитающего. 6 н. и 16 з.п. ф-лы, 40 ил., 3 пр.
1. Белок, который представляет собой вариант группы вариантов 1 (v. 1) фактора H-связывающего белка (fHbp), в котором вариант состоит из
лейцина (L) в положении аминокислоты 248 и необязательно серина (S) в положении 41,
причем положения аминокислот нумеруются относительно аминокислотной последовательности fHbp ID1, представленной в SEQ ID NO: 1, причем вариант состоит из аминокислотной последовательности, имеющей по меньшей мере 90% идентичности аминокислотной последовательности с SEQ ID NO: 3, в котором вариант fHbp связывает человеческий фактор H (fH) с аффинностью, которая составляет 50% или менее от аффинности fHbp ID 55 для человеческого fH, и причем вариант вызывает бактерицидный гуморальный ответ по меньшей мере на один штамм Neisseria meningitidis в организме млекопитающего.
2. Вариант fHbp по п. 1, отличающийся тем, что вариант fHbp связывает человеческий fH с аффинностью, которая представляет собой 25% или менее от аффинности fHbp ID 55 для человеческого fH.
3. Вариант fHbp по п. 1, отличающийся тем, что вариант fHbp связывает человеческий fH с аффинностью, которая представляет собой 10% или менее от аффинности fHbp ID 55 для человеческого fH.
4. Вариант fHbp по п. 1, отличающийся тем, что вариант fHbp связывает человеческий fH с аффинностью, которая представляет собой 5% или менее от аффинности fHbp ID 55 для человеческого fH.
5. Вариант fHbp по п. 1, дополнительно содержащий серин в положении аминокислоты 41.
6. Вариант fHbp по п. 1, в котором аминокислотная последовательность имеет по меньшей мере 95% идентичности аминокислотной последовательности с SEQ ID NO: 3.
7. Вариант fHbp по п. 1, в котором аминокислотная последовательность имеет по меньшей мере 98% идентичности аминокислотной последовательности с SEQ ID NO: 3.
8. Вариант fHbp по п. 1, в котором аминокислотная последовательность имеет по меньшей мере 99% идентичности аминокислотной последовательности с SEQ ID NO: 3.
9. Вариант fHbp по п. 1, в котором аминокислотная последовательность представлена в SEQ ID NO: 18.
10. Иммуногенная композиция для индукции антительного ответа против N. meningitides у млекопитающих, содержащая:
а) терапевтически эффективное количество варианта fHbp согласно любому из пп. 1-9, в котором необязательно вариант fHbp представляет собой препарат в везикуле, полученный из штамма Neisseria meningitidis; и
b) фармацевтически приемлемый наполнитель, в котором наполнитель необязательно представляет собой адъювант, и необязательно
c) поверхностный белок А нейссерии.
11. Иммуногенная композиция по п. 10, отличающаяся тем, что вариант fHbp представляет собой препарат в везикуле, полученный из штамма Neisseria meningitidis.
12. Иммуногенная композиция по п. 10, отличающаяся тем, что упомянутый фармацевтически приемлемый наполнитель представляет собой адъювант.
13. Иммуногенная композиция по п. 11, отличающаяся тем, что указанный фармацевтически приемлемый наполнитель представляет собой адъювант.
14. Иммуногенная композиция по п. 10, дополнительно содержащая поверхностный белок А нейссерии.
15. Иммуногенная композиция по п. 12, отличающаяся тем, что адъювант представляет собой фосфат алюминия или гидроксид алюминия.
16. Иммуногенная композиция по п. 13, отличающаяся тем, что адъювант представляет собой фосфат алюминия или гидроксид алюминия.
17. Нуклеиновая кислота, кодирующая вариант fHbp согласно любому из пп. 1-9.
18. Рекомбинантный вектор экспрессии для кодирования варианта fHbp для вызова антительного ответа против N. meningitidis у млекопитающих, содержащий нуклеиновую кислоту по п. 17.
19. Клетка-хозяин in vitro, экспрессирующая вариант fHbp по любому из пп. 1-9 и включающая рекомбинантный вектор экспрессии по п. 18, где клетка-хозяин не является эмбриональной стволовой клеткой человека.
20. Способ индукции гуморального иммунного ответа против N. meningitidis у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества иммуногенной композиции по п.10.
21. Способ по п. 20, отличающийся тем, что млекопитающее представляет собой человека.
22. Способ по п. 20, отличающийся тем, что гуморальный иммунный ответ представляет собой бактерицидный гуморальный иммунный ответ на один или несколько штаммов N. meningitidis.
| US 2011256180 А1, 20.10.2011 | |||
| WO 2011051893, 05.05.2011 | |||
| BEERNINK P | |||
| T | |||
| ET AL., A Meningococcal Factor H Binding Protein Mutant That Eliminates Factor H Binding Enhances Protective Antibody Responses to Vaccination, THE JOURNAL OF IMMUNOLOGY, 2011, v.186, n.6, p.3606 - 3614 | |||
| US 20130022633 А1, 24.01.2013 | |||
| WO 2005102384, 03.11.2005 | |||
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2009 |
|
RU2475496C2 |
Авторы
Даты
2020-02-13—Публикация
2015-07-22—Подача