Область изобретения
Настоящее изобретение относится к иммуноглобулинам с одним вариабельным доменом (ISVD), которые направлены против респираторно-синцитиального вируса (РСВ). Более конкретно, изобретение относится к ISVD, которые связываются с формой «до слияния» белка слияния (F) РСВ. Изобретение дополнительно относится к применению этих ISVD для профилактики и/или лечения инфекций РСВ и к фармацевтическим композициям, содержащим эти ISVD.
Уровень техники
Респираторно-синцитиальный вирус является наиболее важной причиной острых инфекций дыхательных путей у детей грудного возраста и детей младшего возраста. До двухлетнего возраста практически все дети перенесут по меньшей мере одну инфекцию, связанную с респираторно-синцитиальным вирусом. Хотя, как правило, инфекция РСВ вызывает только легкое заболевание, у части пациентов (1-2%) она приводит к серьезному бронхиолиту с необходимостью госпитализации. По оценкам, каждый год 160000 детей умирают из-за инфекции РСВ. В настоящее время нет клинических исследований эффективной профилактической вакцины и терапевтического низкомолекулярного соединения, специфичного для РСВ. Единственный способ, с помощью которого грудные дети с высоким риском могут быть частично защищены от тяжелого заболевания, вызванного предполагаемой инфекцией РСВ, - это ежемесячные инъекции гуманизированного мышиного моноклонального антитела, направленного против конформации F-белка РСВ до и после слияния (паливизумаба). Однако лечение этим антителом является дорогим и используется только в целях профилактики. Разрабатываются несколько других средств, связывающихся с F-белком РСВ, включая специфические моноклональные антитела для формы «до слияния» (Gilmans et al., 2015; McLellan et al., 2013), и ISVD, связывающиеся с F-белком РСВ. Однако, описанные ISVD имеют слабую нейтрализующую активность против серотипа B РСВ, и/или необходимо поливалентное форматирование для того чтобы сделать ISVD сильным (WO2009147248; WO2010139808; WO2011064382; Schepens et al., 2011; Hultberg et al., 2011).
Недавно было показано, что стандартные антитела, которые специфически связываются с конформацией «до слияния» F-белка РСВ, являются гораздо более сильными нейтрализаторами РСВ in vitro, чем антитела, которые связываются с обоими конформациями F-белка, «до слияния» и «после слияния» (WO2008147196, US2012070446, McLellan et al., 2013). Однако стандартные антитела могут быть обременительными для производства, и их стабильность может быть ограниченной. Кроме того, из-за относительно большого размера стандартные антитела могут испытывать пространственные затруднения с распознаванием своего эпитопа в сложных образцах или когда другие антитела и лиганды занимают участки вблизи их эпитопов.
Поэтому, и поскольку отсутствует универсальное лечение, существует неудовлетворенная потребность в мощном лекарственном средстве против РСВ, которое можно использовать для эффективного лечения и/или профилактики инфекций РСВ.
Сущность
В настоящем изобретении неожиданно показано, что моновалентные ISVD могут иметь сильную нейтрализующую активность против обоих серотипов РСВ (A и B). Это неожиданно, поскольку литературные данные позволяют предположить, что для мощного ингибирования обоих серотипов РСВ необходимы поливалентные конструкции. Таким образом, целью изобретения является создание ISVD, направленных против эпитопов F-белка РСВ, которые являются специфическими для конформации «до слияния», и, таким образом, создание высокоактивных ISVD для лечения и/или профилактики инфекций РСВ.
Аспектом настоящего изобретения является создание ISVD, который специфически связывается с формой «до слияния» F-белка РСВ и отличается тем, что указанный ISVD в моновалентном формате показывает сходную нейтрализующую активность для серотипов А и В РСВ.
В одном из вариантов осуществления изобретение предусматривает ISVD, который содержит последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: 1 и SEQ ID NO: 2, последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: 3 и SEQ ID NO: 4 последовательность CDR3, выбранную из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 6, и где CDR1, CDR2 и/или CDR3 имеют различие по одной, двум или трем аминокислотам с любой из вышеуказанных соответствующих SEQ ID NO.
По другому аспекту, изобретение также относится к РСВ-связывающей конструкции, которая содержит по меньшей мере один ISVD, описанный выше.
По другому аспекту, изобретение предусматривает нуклеиновую кислоту, которая кодирует по меньшей мере один ISVD, описанный выше.
Согласно еще одному аспекту, настоящее изобретение относится к клетке-хозяину, которая трансформирована или трансфицирована нуклеиновой кислотой, описанной выше. Также изобретение предусматривает применение вышеописанной клетки-хозяина для получения ISVD, описанного выше.
Также изобретение предусматривает вышеописанный ISVD или вышеописанную РСВ-связывающую конструкцию для применения в качестве лекарственного средства, в частности, для применения для терапевтического лечения или профилактики инфекции РСВ.
По другому аспекту, изобретение предусматривает фармацевтическую композицию, которая содержит по меньшей мере один вышеописанный ISVD. Дополнительно изобретение предусматривает применение указанной фармацевтической композиции в качестве лекарственного средства, в частности, для терапевтического лечения или профилактики инфекции РСВ.
Цели по настоящему изобретению будут понятны из последующего описания.
Краткое описание чертежей
Фигура 1: Нейтрализующая активность в плазме ламы, иммунизированной DS-Cav1. Нейтрализующую активность против РСВ A2 (A) и РСВ B49 (B) тестировали в плазме, полученной после различных иммунизаций DS-Cav1. Монослои клеток Vero, посеянных на 96-луночные планшеты, были инфицированы РСВ A2 или РСВ B49 в присутствии плазмы ламы, которую разводили в три раза, как указано на оси X, начиная с восьмикратного разведения. Число бляшек в каждой лунке было подсчитано и обозначено на оси Y. PreDS-Cav1 соответствует неиммунной сыворотке иммунизированной ламы.
Фигура 2: Отбор VHH, которые связываются с очищенным рекомбинантным белком слияния РСВ (F). Планшеты для ELISA покрывали DS-Cav1 (серые столбики, F «до слияния»), F «после слияния» (черные столбики) или BSA. Планшеты инкубировали с экстрактами периплазматического пространства бактерий, приготовленными из клеток TG1 E. Coli, трансформированных pHEN4-VHH, которые были получены после одного раунда «пэннинга» против DS-Cav1 с VHH-экспонирующей фаговой библиотекой, полученной из PBMC от DS-Cav1-иммунизированной ламы. На графике, связывание F-белка показано как log2 соотношения значений OD450 больше связывания с BSA.
Фигура 3: Выявление нейтрализующей активности по отношению к РСВ в супернатантах Pichia pastoris. Трансформанты pKai61-VHH P. pastoris предварительно культивировали в 2 мл среды YPNG в 24-луночном формате в течение 24 часов. Затем, клетки помещали в среду YPNM в течение 48 часов для индукции экспрессии VHH. Тестировали разведения 1:60, 1:600 и 1:6000 очищенного культурального супернатанта на нейтрализующую активность путем смешивания с РСВ A2 (30 БОЕ/лунку), который использовали для заражения монослоя клеток Vero. Рамки указывают клоны P. pastoris с нейтрализующей активностью. (A) Клоны P. pastoris, полученные после трансформации выбранным набором уникальных плазмид pKai61-VHH, указанных числами. (B) Клоны P. pastoris, полученные после трансформации pKai61, в которые клонировали библиотеку кандидатных F-специфичных VHH. L3, L13, и т.д. относятся к отдельным трансформантам P. pastoris. Лунки в рамках указывают на образцы с РСВ-нейтрализующей активностью.
Фигура 4: Очистка VHH, полученных в Pichia pastoris. Среду для культивирования клеток P. Pastoris, которые были трансформированы pKai-VHH-DS-Cav1-4, pKai-VHH-DS-Cav1-L66, pKai-VHH-F2 или pKai-VHH-F58, собирали после индукции метанолом в течение 96 часов. Повторно растворенный в сульфате аммония осадок бесклеточной среды наносили на колонку HisTrap и после промывания колонки элюировали градиентом имидазола с повышающейся концентрацией (слева). Пиковую фракцию, которую элюировали с колонки HisTrap, затем наносили на колонку для гель-фильтрации Superdex 75 (справа). Хроматограммы показаны для VHH-DS-Cav1-4 (A), VHH-DS-Cav1-L66 (B), VHH-F2 (C) и VHH-F58 (D).
Фигура 5: Нуклеотидные последовательности VHH-DS-Cav1-4 (A) и VHH-DS-Cav1-L66 (B) и предсказанные аминокислотные последовательности рекомбинантных VHH-DS-Cav1-4 и VHH-DS-Cav1-L66, полученных в P. pastoris (C). Определяющие комплементарность области (CDR) и His-метка (6×HIS) указаны подписанными рамками.
Фигура 6: VHH-DS-Cav1-4 и VHH-DS-Cav1-L66 имеют мощную нейтрализующую активность по отношению к РСВ. Клетки Vero заражали РСВ A2 (A) или РСВ B49 (B) в присутствии очищенных VHH (VHH-DS-Cav1-4, VHH-DS-Cav1-L66 или отрицательного контроля NB 1.14), моноклонального антитела D25 или моноклонального антитела AM22. VHH и моноклональные антитела использовали в серии трехкратных разведений, начиная с концентрации 3000 нг/мл. Рассчитывали 50% ингибирующую концентрацию (IC50) на основании уменьшения бляшек, показанного на A и B, и наносили на график (C). Величины IC50 для F-VHH-4 (DS-Cav1-4) и F-VHH-L66 (DS-Cav1-L66) сравнивали с Ctrl-VHH и МАТ против HMPV-A1-GFP, hMPV-B1-GFP и РСВ A2-GFP (D). Заранее определенные количества GFP-экспрессирующих рекомбинантных вирусов hMPV (сублиния NL/1/00 A1 или сублиния NL/1/99 B1, любезный подарок Бернадетты ван ден Хуген и Рона Фуше, Роттердам, Нидерланды) или GFP-hРСВ (штамм A2, любезный подарок Марка Пиплса, Колумбус, Огайо, США) (MOI 0,3 БОЕ/клетку) смешивали с серийными разведениями VHH или МАТ и добавляли в культуры клеток Vero-118 (hMPV), или клеток HEp-2, растущих в 96-луночных планшетах. Через тридцать шесть часов удаляли среду, добавляли PBS и измеряли флуоресценцию GFP в каждой лунке при помощи микроспектрофотометра для чтения планшетов M200 Tecan. Значения флуоресценции были нанесены на график в виде процента от контроля с вирусом без антитела и использованы для расчета соответствующих значений IC50.
Фигура 7: VHH-DS-Cav1-4 и VHH-DS-Cav1-L66 связываются с DS-Cav1, но не с F после слияния. (A) Планшеты ELISA покрывали DS-Cav1 (верхняя панель) или F «после слияния» (нижняя панель). Планшеты инкубировали с сериями разведения 1:3 очищенных VHH-DS-Cav1-4, VHH-DS-Cav1-L66 и VHH-F58, начиная с 30000 нг/мл. Показаны величины OD450. (B) Сенсограммы поверхностного плазмонного резонанса (SPR) для связывания VHH-DS-Cav1-4 и VHH-DS-Cav1-L66 с иммобилизованным F-белком «до слияния» или «после слияния». На верхней панели, показывающей сенсограммы SPR для F «до слияния», образец, содержащий только буфер, инъецировали поверх проточной ячейки с DS-Cav1 (F до слияния) и референсной проточной ячейки, с последующими 2-кратными серийными разведениями VHH-DS-Cav1-4 или VHH-DS-Cav1-L66 в диапазоне от 5 нМ до 39,1 пМ, с дублированием концентрации 1,25 нМ. Из данных вычитали двойную величину референса и подгоняли под модель связывания 1:1 (красные линии). Нижние панели показывают сенсограммы SPR для связывания VHH-DS-Cav1-4 и VHH-DS-Cav1-L66 с иммобилизованным F «после слияния». Образец, содержащий только буфер, инъецировали поверх проточной ячейки с F «после слияния» и референсной проточной ячейки, с последующими 1 мкМ и 500 нМ концентрациями DS-Cav1-4 или DS-Cav1-L66. Из данных вычитали двойную величину референса, но не подгоняли под модель связывания, поскольку не было выявлено связывания с F после слияния.
Фигура 8: VHH-DS-Cav1-4 и VHH-DS-Cav1-L66 связываются с F на поверхности клеток млекопитающих. Клетки HEK-293T трансфицировали вектором, экспрессирующим F-белок РСВ A2 (pCAGGS-Fsyn) в комбинации с GFP-NLS-экспрессирующим вектором (peGFP-NLS) или трансфицировали только GFP-NLS-экспрессирующим вектором. График показывает среднюю интенсивность флуоресценции (FI) указанных VHH и мышиного моноклонального антитела, специфичного к F РСВ (MAB858-1, Millipore) по отношению к GFP-положительным клеткам, экспрессирующим F-белок РСВ (верхний график) или не экспрессирующим F-белок РСВ (график внизу).
Фигура 9: Перекрестное конкурентное связывание антител с DS-Cav1, исследованное с использованием интерферометрии биослоев. DS-Cav1 был иммобилизован на биосенсорах AR2G при помощи реакции связывания аминов в ацетатном буфере. Реакцию гасили 1M этаноламином, и биосенсоры с иммобилизованным DS-Cav1- затем уравновешивали буфером для анализа (PBS с 1% BSA). Биосенсоры погружали в конкурирующие антитела/VHH, а затем в анализируемые антитела/VHH с короткой фоновой стадией между двумя стадиями антитело/VHH. Процент ингибирований определяли путем сравнения максимума связывания анализируемого антитела/VHH в отсутствие и в присутствии каждого конкурента. NB: отсутствие связывания.
Фигура 10: Профилактическое введение DS-Cav1-4 и DS-Cav1-L66 снижает репликацию РСВ in vivo. 30 мкг DS-Cav1-4, DS-Cav1-L66 или F2, и 30 мкг паливизумаба вводили интраназально мышам BALB/c за четыре часа до заражения РСВ A2. Через двадцать четыре часа после заражения все мыши получали 30 мкг F2 интраназально. Мышей умерщвляли через пять суток после заражения и определяли вирусную нагрузку в легких путем анализа бляшкообразования (A) и путем qRT-ПЦР (B). Каждая точка на графике представляет одну мышь, и горизонтальные линии показывают медиану. #: Мышь с титром вируса в гомогенате легкого ниже предела детекции. График (B) представляет относительную экспрессию РНК РСВ, нормализованную по уровням мРНК mRPL13A, присутствующей в образцах каждой мыши в указанных группах.
Фигура 11: VHH-DS-Cav1-4 и VHH-DS-Cav1-L66 связываются с одним и тем же эпитопом на F РСВ с высокой консервативностью структуры. (A) Площадь скрытой поверхности и остатки на F-белке РСВ, стабилизированном в конформации «до слияния» (SEQ ID NO: 16), с которыми контактирует VHH-DS-Cav1-4 (показаны жирным). (B) Площадь скрытой поверхности и остатки на F-белке РСВ, стабилизированном в конформации «до слияния» (SEQ ID NO: 16), с которыми контактирует VHH-DS-Cav1-L66 (показаны жирным). (C) аминокислотные остатки F-белка РСВ, стабилизированного в конформации «до слияния», полной открытой рамки считывания, до процессинга in vivo (SEQ ID NO: 17), с которыми контактирует и VHH-DS-Cav1-4, и VHH-DS-Cav1-L66, подчеркнуты. (D) Совместная кристаллическая структура обоих ISVD F-белком РСВ «до слияния» показывает высокую консервативность структуры ISVD и связывание с одним и тем же эпитопом.
Фигура 12: Особенности связывания VHH-DS-Cav1-4. (A) Петля CDR3 VHH-DS-Cav1-4 связывается с карманом, образованным двумя протомерами F РСВ. (B) Петля CDR2 VHH-DS-Cav1-4 взаимодействует с участком II и присоединяется к CDR3 через дисульфидную связь. P1=протомер 1; P2=протомер 2.
Фигура 13: Особенности связывания VHH-DS-Cav1-L66. (A) Петля CDR3 VHH-DS-Cav1-L66 связывается с карманом, образованным двумя протомерами F РСВ. (B) Петля CDR2 VHH-DS-Cav1-L66 взаимодействует с участком II и присоединяется к CDR3 через дисульфидную связь. P1=протомер 1; P2=протомер 2.
Фигура 14. Структура F-белка в конформации «до слияния» в комплексе с мотавизумабом, AM14, 101F и DS-Cav1-4. Модель F-белка в конформации «до слияния» в комплексе с мотавизумабом, AM14, 101F и DS-Cav1-4. Структуру AM14-Mota-F-белок «до слияния» (4ZYP) и структуру связанного с пептидом Fab 101F (3O41) выравнивали относительно F из структуры DS-Cav1-4, связанного с F «до слияния». Эпитоп DS-Cav1-4, а также эпитоп DS-Cav1-L66, расположен между эпитопами для AM14, мотавизумаба и 101F и частично перекрывается с каждым из них.
Подробное описание
Определения
Настоящее изобретение будет описано в отношении конкретных вариантов осуществления и со ссылкой на определенные чертежи, но изобретение ими не ограничено, а ограничено только формулой изобретения. Любые ссылочные позиции в формуле изобретения не должны истолковываться как ограничивающие объем изобретения. Описанные чертежи являются только схематическими и неограничивающими. На чертежах размер некоторых элементов может быть преувеличен и не нарисован в масштабе для иллюстративных целей. Когда используют термин "содержащий" в настоящем описании или формуле изобретения, это не исключает других элементов или этапов. Когда используют форму единственного числа существительного, она включает множественную форму этого существительного, если конкретно не указано иное.
Кроме того, термины «первый», «второй», «третий» и т.п. в описании и формуле изобретения, используют для различения подобных элементов и не обязательно для описания последовательного или хронологического порядка. Следует понимать, что термины, использованные таким образом, являются взаимозаменяемыми при соответствующих обстоятельствах, и что варианты осуществления изобретения, описываемые в настоящем описании, способны работать в других последовательностях, чем описанные или проиллюстрированные в настоящем описании.
Последующие термины или определения предоставлены исключительно для того, чтобы помочь пониманию изобретения. Если в настоящем описании конкретно не определено иное, все термины, применяемые в настоящем описании, имеют то же самое значение, что и для специалиста в данной области по настоящему изобретению. Специалисты-практики, в частности, адресуются к Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Press, Plainsview, New York (1989); и Ausubel et al., Current Protocols in Molecular Biology (Supplement 47), John Wiley & Sons, New York (1999), для определений и терминов в данной области. Определения, используемые в настоящем описании, не должны толковаться, как имеющие объем, меньший, чем его понимает специалист в данной области.
«Иммуноглобулин с одним вариабельным доменом» или «ISVD» представляет собой фрагмент антитела, состоящий из одного варибельного домена антитела. Как и целое антитело, он способен избирательно связываться со специфическим антигеном. С молекулярной массой всего лишь 12-18 кДа, ISVD гораздо меньше по размеру, чем стандартные антитела (150-160 кДа), которые состоят из двух тяжелых и двух легких белковых цепей, и даже меньше, чем Fab-фрагменты (~50 кДа, одна легкая цепь и половина тяжелой цепи) и одноцепочечные вариабельные фрагменты (~25 кДа, два вариабельных домена, один из легкой и один из тяжелой цепи). В основном, ISVD будут иметь аминокислотную последовательность, содержащую 4 каркасных области (от FR1 до FR4) и 3 определяющие комплементарность области (от CDR1 до CDR3), предпочтительно в соответствии со следующей формулой: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Как применяют в настоящем описании, термин «ISVD», включает, в качестве неограничивающих примеров, вариабельные домены тяжелой цепи антитела верблюда (VHHs), также обозначаемые как Нанотела™, доменные антитела (dAb), и ISVD, полученные от акулы (домены IgNAR).
Как применяют в настоящем описании, термин «специфически связывается с формой «до слияния» F-белка РСВ» относится к способности РСВ-связывающего полипептида (например, антитела, ISVD) измеримо связываться с формой «до слияния» F-белка РСВ, а не с формой «после слияния» F-белка РСВ.
«Форма «до слияния» F-белка РСВ» относится к неустойчивой конформации «до слияния» F-белка РСВ, которая принимается перед взаимодействием вирус-клетка, как описано в McLellan et al., 2013. Она отличается от высокостабильной формы после слияния или конформации «после слияния», которая принимается после слияния вирусной и клеточной мембран.
«Моновалентный формат» антитела, как применяют в настоящем описании, относится к формату антитела, которое может распознавать только одну антигенную детерминанту. Он исключает форматы поливалентных антител, которые могут распознавать более одной антигенной детерминанты, такие как (но не ограничиваясь ими) бивалентные, тривалентные или тетравалентные форматы.
В рамках изобретения, термин «нейтрализующая активность» относится к тому факту, что ISVD может ингибировать заражение вирусом, как измерено в анализе нейтрализации вируса in vitro, таком как (но не ограничиваясь им) анализ подавления бляшкообразования. Нейтрализация, также обозначаемая как ингибирование, может означать полную нейтрализацию (не наблюдается заражения вирусом) или может означать частичную нейтрализацию. Например, нейтрализация может означать 10% нейтрализацию, 20% нейтрализацию, 25% нейтрализацию, 30% нейтрализацию, 40% нейтрализацию или более. В частности, нейтрализация может быть, по меньшей мере, 50%, например, 50% нейтрализацией, 60% нейтрализацией, 70% нейтрализацией, 75% нейтрализацией, 80% нейтрализацией, 90% нейтрализацией, 95% нейтрализацией или более. Нейтрализующую активность, как правило, оценивают по сравнению с подходящим контролем (например, лечение неподходящим ISVD), который может быть легко выбран специалистом. Для ISVD с известной концентрацией нейтрализующую активность можно выражать в виде 50% ингибирующей концентрации (IC50). IC50 представляет собой концентрацию ISVD, при которой достигается 50% ингибирование (или нейтрализация). Это показатель ингибирующего потенциала ISVD, также обозначаемый как активность.
«Сходная нейтрализующая активность», в рамках изобретения, относится к нейтрализующей активности, выраженной в виде IC50, которая, как правило, отличается в 10 раз или менее от нейтрализующей активности, с которой ее сравнивают. Более конкретно, она отличается в пять раз или менее, или даже в два раза или менее.
Термин "определяющая комплементарность область" или "CDR" относится к вариабельной петле внутри вариабельных областей или H (тяжелой), или L (легкой) цепей иммуноглобулинов и содержит аминокислотные последовательности, способные специфически связываться с антигенными мишенями. Эти области CDR обеспечивают основную специфичность антитела или фрагмента антитела по отношению к конкретной структуре антигенной детерминанты.
Термин "эпитоп" относится к участку специфического связывания на антигене или на антигенной структуре, к которой полипептид, такой как ISVD, имеет специфичность и аффинность.
Термин «конформационный эпитоп» относится к эпитопу с признаками трехмерной поверхности антигена, которая позволяет точно соответствовать и связываться с полипептидом, таким как ISVD. Напротив, линейные эпитопы определяются аминокислотной последовательностью (первичной структурой), а не 3D-формой (третичной структурой) белка.
«Терапевтическое лечение инфекции РСВ», в рамках изобретения, означает любую форму лечения инфекции РСВ, которое вводят индивидууму после заражения указанного индивидуума инфекцией РСВ.
«Профилактика инфекции РСВ», в рамках изобретения, означает профилактическое лечение инфекции РСВ, которое вводят индивидууму до заражения указанного индивидуума инфекцией РСВ. Профилактическое лечение может включать применение по настоящему изобретению в виде вакцины.
«Фармацевтическая композиция», в рамках изобретения, может быть любой фармацевтической композицией, известной специалисту в данной области, включая в качестве неограничивающих примеров композиции для системного, перорального и интраназального введения.
«РСВ-связывающая конструкция, которая содержит по меньшей мере один ISVD», в рамках изобретения, относится к любой связывающей конструкции, которая связывается с РСВ и содержит один или несколько ISVD.
«Клетка-хозяин», в рамках изобретения, может быть любой клеткой, которая подходит для получения ISVD или РСВ-связывающих конструкций.
Согласно первому аспекту, задачей по изобретению является создание ISVD, которые направлены против формы «до слияния» F-белка РСВ и/или специфически связываются с формой «до слияния» F-белка РСВ. Специфическое связывание с формой «до слияния» F-белка РСВ означает, что ISVD измеримо связывается с формой «до слияния» F-белка РСВ, а не с формой «после слияния» F-белка РСВ. На специфическое связывание может влиять, например, аффинность ISVD и концентрация ISVD. Специалист в данной области может определить подходящие условия, при которых можно оценить связывающую способность ISVD, описываемого в настоящем описании, такие как титрование ISVD в подходящем анализе связывания, таком как (но не ограничиваясь этим) твердофазный иммуноферментный анализ (ELISA), или анализ связывания на основе поверхностного плазмонного резонанса (SPR) или интерферометрия биослоев (BLI). Как правило, связывание с формой «до слияния» F-белка РСВ означает, что ISVD связывается с формой F-белка дикого типа, а также с любой мутантной формой F-белка, при условии, что F-белок находится в конформации «до слияния». Также включены связывания с F-белком обоих подтипов (A и B) РСВ. В конкретном варианте осуществления вышеописанный ISVD связывается с консенсусной последовательностью F-белка РСВ A, указанной в SEQ ID NO: 18. Консенсусную последовательность, указанную в SEQ ID NO: 18, рассчитывали способами, известными специалистам в данной области, на основании 92 полноразмерных последовательностей F-белка РСВ A, перечисленных в базе данных белков NCBI. Таким образом, вышеописанный ISVD связывается с любой из 92 типичных последовательностей F-белка РСВ A, включенных для получения консенсусной последовательности SEQ ID NO: 18. В конкретном варианте осуществления вышеописанный ISVD связывается с консенсусной последовательностью F-белка РСВ В, указанной в SEQ ID NO: 19. Консенсусную последовательность, указанную в SEQ ID NO: 19, рассчитывали способами, известными специалистам в данной области, на основании 114 полноразмерных последовательностей F-белка РСВ В, перечисленных в базе данных белков NCBI. Таким образом, вышеописанный ISVD связывается с любой из 114 типичных последовательностей F-белка РСВ В, включенных для получения консенсусной последовательности SEQ ID NO: 19. В конкретном варианте осуществления вышеописанный ISVD связывается с обоими, F-белком РСВ A, указанным в SEQ ID NO: 18 и F-белком РСВ В, указанным в SEQ ID NO: 19. В конкретном варианте осуществления вышеописанные ISVD связываются исключительно с формой «до слияния» F-белка. Согласно дополнительным конкретным вариантам осуществления, вышеупомянутые ISVD связываются исключительно с формой «до слияния» F-белка и не связываются с формой «после слияния» F-белка. В конкретном варианте осуществления вышеописанные ISVD связываются со стабилизированным «до слияния» F-белком РСВ из SEQ ID NO: 16. В конкретном варианте осуществления ISVD может быть слит с дополнительными компонентами.
Согласно конкретным вариантам осуществления, вышеописанные ISVD связываются с эпитопом F-белка РСВ «до слияния». В частности, они связываются с конформационным эпитопом F-белка РСВ «до слияния». В конкретном варианте осуществления вышеописанные ISVD связываются с конформационным эпитопом F-белка РСВ «до слияния», содержащим аминокислотные остатки T50, G51, W52, S180, G184, V185, P265, I266, T267, N268, D269, Q270, L305, G307, V308, N345, A346, G347, K421, S425, K427, N428, R429, G430, I431, S451, G453, N454, L456, Y458. В частности, они связываются с конформационным эпитопом F-белка РСВ «до слияния», содержащим аминокислотные остатки T50, G51, W52, S180, G184, V185, P265, I266, T267, N268, D269, Q270, L305, G307, V308, N345, A346, G347, K421, S425, K427, N428, R429, G430, I431, S451, G453, N454, L456, Y458 из F-белка РСВ «до слияния», указанного в SEQ ID NO: 17.
Согласно конкретным вариантам осуществления, ISVD в моновалентном формате показывает сходную нейтрализующую активность для серотипов РСВ A и B. Как правило, это означает, что ISVD препятствует/ингибирует/предотвращает/обращает вспять или замедляет способность вируса заражать клетку. Согласно этим конкретным вариантам осуществления, ISVD препятствует/ингибирует/предотвращает/обращает вспять или замедляет способность вируса заражать клетку в сходной степени для серотипов A и B РСВ.
Согласно конкретным вариантам осуществления, ISVD содержит последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: 1 и SEQ ID NO: 2, последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: 3 и SEQ ID NO: 4 и последовательность CDR3, выбранную из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 6, где CDR1, CDR2 и/или CDR3 имеют различие по одной, двум или трем аминокислотам с любой из вышеуказанных соответствующих SEQ ID NO. Для ISVD DS-Cav1-4 последовательности CDR представляют собой SEQ ID NO: 1, SEQ ID NO: 3 и SEQ ID NO: 5. Для ISVD DS-Cav1-L66 последовательности CDR представляют собой SEQ ID NO: 2, SEQ ID NO: 4 и SEQ ID NO: 6.
Согласно дополнительному аспекту, предлагается РСВ-связывающая конструкция, характеризующаяся тем, что указанная РСВ-связывающая конструкция содержит по меньшей мере один ISVD. По меньшей мере один ISVD означает, что РСВ-связывающая конструкция может содержать более чем один ISVD. Вместе с одним или несколькими ISVD, РСВ-связывающая конструкция может содержать другие компоненты, связанные с ISVD. Указанные дополнительные компоненты могут связываться или не связываться с РСВ. В качестве неограничивающего примера, указанная РСВ-связывающая конструкция может содержать ISVD, который связывается с F-белком РСВ, и может быть связан (химически или иным способом) с одной или несколькими группами или компонентами, которые увеличивают полувыведение (такими как, но без ограничений, полиэтиленгликоль (ПЭГ) или сывороточный альбумин, связывающий VHH), таким образом, чтобы получить производное ISVD по изобретению с увеличенным полувыведением. Как правило, указанная РСВ-связывающая конструкция связывается с F-белком РСВ «до слияния». В конкретном варианте осуществления вышеописанная РСВ-связывающая конструкция связывается с SEQ ID NO: 17 и/или SEQ ID NO: 18 и/или SEQ ID NO: 19. Указанная РСВ-связывающая конструкция может быть любой конструкцией, содержащей один или более чем один РСВ-связывающий ISVD.
Согласно дополнительному аспекту, не предлагаются ISVD как таковые, а предлагаются в виде нуклеиновой кислоты, т.е. молекул нуклеиновой кислоты, кодирующих ISVD против F-белка РСВ, описанного в настоящем описании, в частности, против формы «до слияния» F-белка. Также предлагаются векторы, содержащие такие нуклеиновые кислоты или молекулы нуклеиновой кислоты. Согласно еще одному аспекту, предлагаются клетки-хозяева, содержащие такие нуклеиновые кислоты или такие векторы. Как правило, нуклеиновые кислоты будут введены в клетку-хозяина путем трансфекции или трансформации, хотя путь, которым нуклеиновую кислоту вводят в клетку-хозяина, не ограничивает изобретение.
Согласно еще одним вариантам осуществления, предлагаются клетки-хозяева, содержащие такие нуклеиновые кислоты. Как правило, такие клетки-хозяева будут трансформированы или трансфицированы нуклеиновыми кислотами. Конкретное применение, которое предусмотрено для этих клеток-хозяев, - это выработка ISVD. Таким образом, такое применение для выработки явно предумотрено в настоящем описании. Это означает, что клетки-хозяева, трансформированные или трансфицированные молекулами нуклеиновой кислоты, кодирующими ISVD, можно использовать для получения ISVD.
Согласно дополнительному аспекту, в настоящем описании предлагаются ISVD для применения в медицине. То есть, предлагаются ISVD против F-белок РСВ для применения в качестве лекарственного средства. То же самое касается нуклеиновой кислоты, кодирующей ISVD, или векторов, содержащих такие нуклеиновые кислоты, т.е. предусматривается, что молекулы нуклеиновой кислоты или векторы, кодирующие ISVD, предлагаются для применения в качестве лекарственного средства. Также предлагаются РСВ-связывающие конструкции, содержащие по меньшей мере один ISVD, который связывается с F-белком РСВ, для применения в качестве лекарственного средства. Согласно конкретным вариантам осуществления, предлагаются ISVD (или РСВ-связывающие конструкции, содержащие их, или фармацевтические композиции, содержащие их, или нуклеиновые кислоты, кодирующие их, или векторы, содержащие такие нуклеиновые кислоты) для применения для лечения или профилактики инфекции РСВ. Это эквивалентно тому, что предлагаются способы для лечения или профилактики инфекции РСВ для нуждающегося в этом индивидуума, включающие введение указанному индивидууму ISVD против F-белка РСВ. Также ISVD может быть предложен в виде белка (в виде однодоменного белка, в виде части РСВ-связывающей конструкции или фармацевтической композиции) или его можно вводить в виде молекулы нуклеиновой кислоты, кодирующей ISVD против F-белка РСВ, или в виде вектора, содержащего такую молекулу нуклеиновой кислоты. Если ISVD (или РСВ-связывающую конструкцию) вводят в виде белка, могут быть предусмотрены различные пути введения. В качестве неограничивающих примеров, ISVD можно вводить системно, перорально или интраназально, так как, например, путем назальной ингаляции. В случае, если ISVD предлагается в виде нуклеиновой кислоты или вектора, конкретно предусматривается, что ISVD вводят путем генотерапии.
Согласно дополнительному аспекту, предлагаются фармацевтические композиции, содержащие по меньшей мере один ISVD, направленный на F-белок РСВ «до слияния». Как правило, такие фармацевтические композиции содержат по меньшей мере один ISVD, направленный на форму «до слияния» F-белка РСВ. Указанные фармацевтические композиции могут содержать дополнительные компоненты. Указанные дополнительные компоненты могут связываться или не связываться с РСВ. Предусмотрено в настоящем описании, что фармацевтические композиции предлагаются для применения в качестве лекарственного средства. В частности, они предлагаются для применения в терапевтическом лечении или профилактике инфекций РСВ. Это эквивалентно утверждению, что предлагаются способы для терапевтического лечения или профилактики инфекций РСВ для нуждающегося в этом индивидуума, включающие введение указанному индивидууму фармацевтической композиции, описанной в настоящем описании.
Согласно дополнительным вариантам осуществления, предлагается способ терапевтического лечения или профилактики инфекции РСВ, способ, включающий введение нуждающемуся в этом индивидууму ISVD, как описано выше, РСВ-связывающей конструкции, как описано выше, или фармацевтической композиции, как описано выше. Указанный способ включает введение указанному индивидууму ISVD против F-белка РСВ «до слияния». Такие способы, как правило, будут приводить к улучшению или предотвращению симптомов инфекции у указанного индивидуума. Также ISVD может быть предложен в виде белка (в виде однодоменного белка, в виде части РСВ-связывающей конструкции или фармацевтической композиции) или его можно вводить в виде молекулы нуклеиновой кислоты, кодирующей ISVD против F-белка РСВ, или в виде вектора, содержащего такую молекулу нуклеиновой кислоты, или в виде фармацевтической композиции, содержащей такое антитело. Также, РСВ-связывающие конструкции, описанные в настоящем описании, предусмотрены для введения нуждающемуся в этом индивидууму в способах для терапевтического лечения или профилактики инфекций РСВ.
Следует понимать, что хотя в настоящем описании обусжаются конкретные варианты осуществления, конкретные конфигурации, а также материалы и/или молекулы для клеток и способов по настоящему изобретению, можно производить различные изменения или модификации по форме и деталям в пределах объема и сущности настоящего изобретения. Последующие примеры предоставлены для лучшего иллюстрирования конкретных вариантов осуществления, и их не следует рассматривать, как ограничивающие изобретение. Заявка ограничена только формулой изобретения.
Примеры
Материалы и способы для примеров
Иммунизация и создание библиотеки VHH
Ламу инъецировали подкожно на сутки 0, 7, 14, 21, 28 и 35, каждый раз по 167 мкг очищенного F-белка РСВDS-Cav1. DS-Cav1 представляет собой рекомбинантный F-белок РСВ, стабилизированный в конформации «до слияния» (McLellan et al., 2013). Первые две инъекции проводили с поли-IC (375 мкг на инъекцию) в качестве адъюванта, в то время как для последних четырех инъекций использовали в качестве адъюванта Gerbu LQ # 3000. Перед каждой иммунизацией забирали кровь и получали плазму для оценки сероконверсии. На сутки 40 собирали 100 мл крови с антикоагулянтами для получения лимфоцитов.
Тотальную РНК из лимфоцитов периферической крови использовали в качестве матрицы для синтеза первой цепи кДНК с праймером олигоdT. С использованием этой кДНК амплифицировали путем ПЦР последовательности, кодирующие VHH, расщепляли PstI и NotI и клонировали в участки PstI и NotI фагмидного вектора pHEN4. Электрокомпетентные клетки TG1 E. coli трансформировали рекомбинантным вектором pHEN4, что приводило к получению библиотеки VHH приблизительно из 5×108 независимых трансформантов. 87% трансформантов несли вектор с правильным размером вставки, что было подтверждено ПЦР-анализом девяносто пяти независимых трансформантов.
500 мкл стока библиотеки заражали фагом-помощником VCS M13 для того чтобы расположить последовательности VHH (в слиянии с M13 PIII) на поверхности фага, которого использовали для биопэннинга.
Клетки
Клетки Hep-2 (ATCC, CCL-23), клетки Vero (ATCC, CCL-81) и клетки HEK-293T (подарок от Dr M. Hall) выращивали в среде DMEM, дополненной 10% инактивированной нагреванием эмбриональной телячьей сыворотки (ЭТС), 2 мМ L-глутамина, аминокислотами, не относящимися к незаменимым (Invitrogen, Carlsbad, California) и 1 мМ пируватом натрия.
Вирусы
РСВ A2 (VR-1540, ATCC, Rockville), подтип A РСВ, и РСВ B49, подтип B РСВ (клинический штамм BE/5649/08 полученный от Prof M. Van Ranst, Tan et al., 2013) выращивали, заражая монослои клеток Hep-2, с 0,1 MOI в присутствии среды для выращивания, содержащей 1% ЭТС. Через пять суток после заражения собирали клетки и среду, объединяли и очищали посредством центрифугирования (450×g). Для того чтобы сконцентрировать вирус, очищенный супернатант инкубировали в течение четыре часов при 4°C в присутствии 10% полиэтиленгликоля (ПЭГ6000). После центрифугирования (30 минут при 3000×g), осадок ресуспендировали в сбалансированном солевом растворе Хэнка (HBSS), содержащем 20% сахарозы, делили на аликвоты, быстро замораживали в жидком азоте и хранили при -80°C.
Анализ РСВ-нейтрализующей активности
Плазму ламы тестировали на нейтрализующую активность против РСВ A2 и РСВ B49 путем анализа блящшкообразования. Клетки Vero высевали в 96-луночный планшет (15000 клеток/лунку). На следующие сутки, получали серийные разведения образцов плазмы в Opti-MEM (Gibco), дополненной 1% пенициллином и 1% стрептомицином (серии разведений 1:3, начиная с разведения 1:4). Добавляли к образцам плазмы равный объем суспензии РСВ A2 (разведенной до 1,4 БОЕ/мкл) или РСВ B49 (разведенной до 2,8 БОЕ/мкл) и инкубировали полученные смеси в течение 30 минут при 37°C. Затем, 50 мкл смесей добавляли к клеткам Vero, которые были отмыты Opti-MEM, и клетки инкубировали при 37°C в течение трех часов. Затем, добавляли в каждую лунку 50 мкл 1,2% авицела в среде DMEM, дополненной 2% инактивированной нагреванием ЭТС, 2 мМ L-глутамина, аминокислотами, не относящимися к незаменимым, и 1 мМ пирувата натрия, и оставляли инфекцию развиваться при 37°C в течение трех суток. Клетки фиксировали в течение 30 минут при комнатной температуре, добавляя в лунки 50 мкл 2% раствора параформальдегида. После фиксации, клетки отмывали дважды фосфатно-солевым буфером (PBS), пермеабилизировали 50 мкл PBS с 0,2% Triton X-100 в течение 10 минут и блокировали PBS, содержащим 1% БСА. Затем, добавляли поликлональную козью сыворотку против РСВ (AB1125, Chemicon International) (1:2000 в PBS, содержащем 0,5% БСА и 0,001% Triton X-100 (PBS/БСА)). После трех отмываний PBS/БСА клетки инкубировали с анти-козлиными IgG, конъюгированными с пероксидазой хрена (SC2020, Santa Cruz) в течение 30 минут. Лунки затем промывали четыре раза PBS/БСА и один раз PBS. Наконец, визуализировали бляшки, добавляя субстрат пероксидазы TrueBlue (KPL, Gaithersburg). РСВ-нейтрализующую активность в неочищенном супернатанте Pichia pastoris и в очищенных VHH (см. ниже) также определяли при помощи этого анализа.
Выделение DS-Cav1-связывающих VHH
Мы проводили один раунд пэннинга для обогащения фагами, связвающими F «до слияния» (DS-Cav1). Одну лунку (лунка A1) на планшете для микротитрования (тип II, F96 Maxisorp, Nunc) покрывали в течение ночи 20 мкг DS-Cav1 в PBS. Эту лунку вместе с лункой отрицательного контроля без покрытия (лунка A12) блокировали блокирующим буфером SEA BLOCK (Thermo Scientific) в течение одного часа. Затем, к этим двум лункам добавляли 1012 фагов в объеме 100 мкл блокирующего буфера SEA BLOCK. Через один час удаляли несвязавшиеся фаговые частицы и отмывали лунки десять раз PBST (PBS+0,5% Tween20). Оставшиеся фаги затем элюировали, добавляя щелочной раствор, состоящий из 100 мкл раствора TEA (14% триэтиламин (Sigma) pH 10), в лунки точно на 10 минут. Диссоциировавшие фаги затем переносили в стерильную пробирку со 100 мкл 1M TRIS-HCl pH 8,0. Из элюированных фагов получали десятикратные серийные разведения в PBS, и использовали 10 мкл этих серийных разведений для заражения 90 мкл клеток TG1 (клетки E. Coli, компетентные к фаговому дисплею). Заражение проводили в течение 30 минут при 37°C, после чего бактерии высевали на чашки с LB/агаром со 100 мкг/мл ампициллина и 1% глюкозы. Обогащение антиген-специфических фагов путем этой процедуры пэннинга оценивали, сравнивая число фагмидных частиц, элюированных с лунки, покрытой антигеном, с числом фагмидных частиц, элюированных с лунки с отрицательным контролем.
Девяносто колоний, резистентных к ампицилину, были выбраны случайным образом для дальнейшего анализа путем ELISA на наличие F-специфических VHH в их периплазме. Эти колонии сначала переносили на чашки со свежим LB/агаром с ампициллином, а затем использовали для посева в 1 мл среды Terrific Broth (TB) с 100 мкг/мл ампициллина в планшет с 24 глубокими лунками. Засеянные планшеты инкубировали при 37°C с одновременным встряхиванием в течение пять часов. Экспрессию VHH индуцировали, добавляя изопропил β-D-1-тиогалактопиранозид (IPTG) до концентрации 1 мМ. Планшеты затем инкубировали в течение ночи при 37°C с одновременным встряхиванием. На следующие сутки, бактериальные клетки осаждали посредством центрифугирования (12 минут при 3200 об./мин.) и удаляли супернатант. Клеточный осадок ресуспендировали в 200 мкл буфера TES (0,2 M TRIS-HCl pH 8, 0,5 мМ ЭДТА, 0,5 M сахарозы) и встряхивали планшеты при 4°C в течение 30 минут. Затем в ресуспендированные клетки добавляли воду для того чтобы индуцировать осмотический шок, который приводит к высвобождению периплазматических белов, включающих VHH. Планшеты с глубокими лунками инкубировали в течение одного часа при 4°C с одновременным встряхиванием, центрифугировали и собирали супернатант, содержащий периплазматический экстракт. Четыре планшеты для микротитрования покрывали в течение ночи 100 нг белка на лунку в PBS, два с чередующимися рядами с F в конформации «после слияния» (McLellan et al., 2011) и БСА, два других с чередующимися рядами с DS-Cav1 и БСА. Покрытые планшеты для микротитрования затем отмывали и блокировали 1% порошковым молоком в PBS. После отмывания планшетов для микротитрования в лунки добавляли 100 мкл периплазматического экстракта, и затем инкубировали в течение одного часа при 4°C. Планшеты отмывали и добавляли 50 мкл анти-HA моноклонального антитела (MMS-101P Biolegend) в PBS в разведении 1:2000 на один час при комнатной температуре. После отмывания добавляли антимышиный IgG в разведении 1:2000 в PBS, связанный с пероксидазой хрена (HRP) (NXA931, GE Healthcare), и инкубировали планшеты в течение одного часа. Затем, планшеты отмывали и добавляли в каждую лунку 50 мкл субстрата TMB (тетраметилбензидин, BD OptEIA™). Реакцию останавливали, добавляя 50 мкл 1M H2SO4, после чего измеряли оптическую плотность при 450 нМ при помощи ридера оптической плотности для микропланшетов iMark (Bio Rad). Все периплазматические фракции, для которых значения OD450, полученные для DS-Cav1 или F «после слияния», были, по меньшей мере, в два раза выше, чем значения OD450, полученные для БСА, выбирали для дальнейшего анализа. Соответствующие бактерии выращивали в 3 мл среды LB с 1:2000 ампициллина для выделения плазмид с использованием набора QIAprep Spin Miniprep (Qiagen). Последовательность кДНК клонированных VHH определяли путем секвенирования по Сэнгеру с использованием праймера M13RS (5'CAGGAAACAGCTATGACC3').
Клонирование VHH в экспрессирующий вектор для Pichia pastoris и трансформация Pichia pastoris
Последовательности VHH, а также последовательности VHH, которые сохранились после пэннинга, были амплифицированы путем ПЦР из соответствующих плазмид pHEN4 с использованием следующих прямых и обратных праймеров (5'GGCGGGTATCTCTCGAGAAAAGGCAGGTGCAGCTGCAGGAGTCTGGG3'; 5'CTAACTAGTCTAGTGATGGTGATGGTGGTGGCTGGAGACGGTGACCTGG3'). Полученные продукты ПЦР расщепляли XhoI и SpeI и лигировали в остов pKai61, расщепленный XhoI/SpeI. Исходный вектор pKai61 описан в Schoonooghe et al., 2009. Последовательности VHH клонируют в рамку со слегка измененной версией сигнальной последовательности α-фактора спаривания S. cerevisiae. Эта сигнальная последовательность направляет белки к секреторной системе дрожжей, затем процессируется в ЭР и аппарате Гольджи и полностью удаляется перед секрецией во внеклеточную среду. В отличие от пре-про-сигнальной последовательности дикого типа, эта модифицированная версия не содержит последовательности, которые кодируют повторы GluAla (в этом месте сигнальный пептид эффективно расщепляется эндопептидазой Kex2 без необходимости в этом повторе). Кодируемые гены содержат C-концевую метку 6×His и находятся под контролем промотора AOX1, индуцируемого метанолом. Плазмида содержит маркер устойчивости к зеоцину для отбора в бактериальных, а также в дрожжевых клетках. Векторы были линеаризованы в промоторе AOX1 (при помощи PmeI) перед трансформацией P. pastoris, для того чтобы способствовать гомологичной рекомбинации в эндогенном локусе AOX1 для стабильной интеграции в геном. Полученные векторы были названы pKai-DS-Cav1-4, pKai-DS-Cav1-L66, pKai-VHH-F2 и pKai-VHH-F58 и использовались для трансформации штамма GS115 Pichia pastoris при помощи краткого протокола трансформации, описанного Lin-Cereghino et al., 2005.
Очистка VHH, произведенных Pichia pastoris
Экспрессию VHH в клонах трансформированных Pichia pastoris сначала анализировали в культурах по 2 мл. На первые сутки Использовали отдельных трансформантов для засева 2 мл среды YPNG (2% пептона, 1% бактодрожжевого экстракта, 1,34% YNB, 0,1M фосфата калия pH 6, 0,00004% биотина, 1% глицерина) со 100 мкг/мл зеоцина (Life Technologies) и инкубировали с одновременным встряхиванием при 28°C в течение 24 часов. На следующие сутки, клетки осаждали посредством центрифугирования (8 минут при 500 g) и заменяли среду YPNG на среду YPNM (2% пептона, 1% бактодрожжевого экстракта, 1,34% YNB, 0,1M фосфата калия pH 6, 0,00004% биотина, 1% метанола) для индуцирования экспрессии VHH и инкубировали культуры при 28°С с одновременным встряхиванием в течение 72 часов. 50 мкл 50% метанола добавляли к культурам через 72 часа, 80 часов и 96 часов. Через сто часов после переноса в среду, содержащую метанол, дрожжевые клетки осаждали посредством центрифугирования (8 минут при 500 g) и сохраняли супернатант для оценки присутствия VHH. Неочищенную среду (25 мкл) наносили на 15% гель SDS-PAGE, после чего наличие белка анализировали, окрашивая кумасси бриллиантовым синим. Для отбора VHH с РСВ-нейтрализующей активностью, мы определяли такую активность в неочищенном супернатанте YPNM от отдельных трансформантов Pichia pastoris, применяя серийные разведения супернатанта в анализе бляшкообразования, как описано выше.
Трансформанты Pichia pastoris, которые произвели высокие уровни VHH в среду или с высокой РСВ-нейтрализующей активностью, выбирали для производства в увеличенном масштабе с использованием культур Pichia по 100 или 300 мл. Условия роста и индукции метанолом, и сбор среды были аналогичны условиям указанным выше для культур по 2 мл. Очищенную среду осаждали сульфатом аммония (80% насыщение) в течение четырех часов при 4°C. Нерастворимую фракцию осаждали посредством центрифугирования при 20000 g и растворяли в 10 мл связывающего буфера HisTrap (20 мМ фосфата натрия, 0,5 M NaCl, 20 мМ имидазола, pH 7,4), центрифугировали в течение 10 минут при 4°C, после чего наносили супернатант на 1 мл колонку HisTrap HP (GE Healthcare), предварительно уравновешенную связывающим буфером HisTrap. После отмывания колонки связывающим буфером HisTrap в количестве, по меньшей мере, десяти объемов колонки (до тех пор, пока оптическая плотность не достигнет стабильной базовой линии), связавшиеся белки элюировали линейным градиентом имидазола, начиная с 20 мМ и заканчивая 500 мМ имидазола в связывающем буфере HisTrap до общего объема 20 мл. Фракции, содержащие VHH, как было определено анализом SDS-PAGE, объединяли и концентрировали до 2 мл при помощи центрифужной колонки Viva (порог 5кДа, GE Healthcare). Эти концентрированные фракции затем наносили на колонку Superdex 75 (160 мл, 0,8 мл/мин) в PBS и объединяли пиковые фракции, и концентрировали на центрифужной колонке Viva с порогом 5кДа. Концентрацию белка объединенной фракции определяли по измерению A280 при помощи NanoDrop 1000 с коэффициентом экстинкции для расчета процентности раствора, индивидуальным для каждого VHH. Объединенную и концентрированную фракции разделяли на аликвоты и хранили при -80°C перед дальнейшим использованием.
Расчет 50% ингибирующей концентрации (IC50) очищенных VHH
Для определения IC50 очищенных VHH, произведенных Pichia pastoris оценивали трехкратные серийные разведения этих VHH, приготовленные в Opti-Mem, в анализе нейтрализации РСВ, как описано выше. Моноклональные IgG, D25 и AM22 (Beaumont et al., 2012, Spits et al., 2013), оба специфически направленные на конформацию F-белка «до слияния», использовали в качестве положительных контролей. NB 1.12, VHH, направленный против α-макроглобулина, использовали в качестве отрицательного контроля. Значения IC50 рассчитывали вручную.
Связывание VHH с DS-Cav1 и F-белком «после слияния» in vitro
Связывание очищенных VHH с DS-Cav1 и F-белком «после слияния» тестировали в прямом анализе ELISA. Планшеты для микротитрования (тип II, F96 Maxisorp, Nunc) покрывали 100 мкл 1 мкг/мл раствора DS-Cav1 или 1 мкг/мл раствора F-белка «после слияния» в PBS. После отмывания, планшеты блокировали в течение одного часа 200 мкл 4% молока в PBS, после чего отмывали снова только PBS. Затем наносили серии разведений 1:3 VHH (начиная от 30 мкг/мл) в лунки, покрытые белком. Через час планшеты отмывали и добавляли разведение 1:2000 антитела к гистидиновой метке (AD1.1.10 AbD Serotec) в PBS на один час. После отмывания и добавления антимышиного IgG, связанного с HRP, на один час (в разведении 1:2000), проводили ELISA тем же самым способом, что и PE-ELISA, описанный выше. Для определения аффинности очищенный DS-Cav1 со StrepTag II и меткой 6×His был иммобилизован на сенсорном чипе NTA приблизительно до 537 единиц ответа (РЕ) для каждого цикла с использованием Biacore X100 (GE). Сенсорный чип NTA восстанавливали между циклами с использованием 0,25M ЭДТА, а затем 0,5 мМ NiCl2. Образец, содержащий только буфер, инъецировали поверх проточной ячейки с DS-Cav1 и референсной проточной ячейки, а затем двухкратные разведения Nb4 или Nb66 от 5 нМ до 39,1 пМ в HBS-P+, с дублированием концентрации 1,25 нМ. Из данных вычитали двойную величину референса и подгоняли под модель связывания 1:1 с использованием программы Scrubber.
Связывание VHH с F-белком, экспрессирующимся на поверхности клеток, которые были трансфицированы экспрессирующим вектором с кДНК F-белка РСВ, оценивали путем проточной цитометрии. Клетки HEK293T высевали в количестве 4000000 клеток на 150 мм планшет для культивирования тканей и трансфицировали 6,4 мкг pCAGGS-Fsyn, который кодирует кодон-оптимизированную кДНК F-белка РСВ, с использованием реагента для трансфекции FuGENE HD (Promega). Для того чтобы отследить трансфицированные клетки, трансфекции проводили в присутствии 6,4 мкг peGFP-NLS. Контрольные трансфекции проводили только с peGFP-NLS. Через 18 часов после трансфекции отделяли клетки при помощи 15 мл раствора трипсин-ЭДТА (0,05% трипсина, 0,5 мМ ЭДТА (pH 8,0)), отмывали один раз PBS и инкубировали в течение 30 минут в PBS, содержащем 1% BSA (PBS/БСА). Затем клетки инкубировали с указанным VHH или с мышиным моноклональным антителом, специфическим для РСВ-F (MAB858-1, Chemicon International) в различных концентрациях, как указано на фигуре 8). Через 1 час клетки отмывали один раз PBS/БСА и инкубировали с антителом к гистидиновой метке, разведенным 1:3000 в PBS/БСА, в течение одного часа. Затем, клетки отмывали один раз PBS/БСА и добавляли антимышиный IgG Alexa 633 на 30 минут. После отмывания клеток три раза PBS, клетки анализировали при помощи проточного цитометра FACSCalibur. Отдельные клетки, экспрессирующие GFP, выбирали на основании поверхности пиков сигнала бокового светорассеяния, поверхности пиков и высоты пиков сигнала прямого светорассеяния и поверхности пиков сигнала зеленой флуоресценции. Наконец у этих GFP-положительных отдельных клеток измеряли интенсивность сигнала флуоресценции Alexa 633.
Мыши
Специфических, свободных от патогенной флоры, самок мышей BALB/c получали от Чарльза Ривера (Charles River Wiga, Sulzfeld, Germany). Животных содержали при контроле температуры с 12-часовыми циклами день-ночь; пищу и воду предоставляли без ограничений. Отдел для животных работает по лицензии фламандского правительства с номером LA1400536. Все эксперименты проводили в условиях, установленных законом и разрешенных Институциональным этическим комитетом по экспериментальным животным (Заявка для этического комитета EC2015-019).
Введение VHH и моноклональных антител, и стимуляция мышей РСВ
Мышей слегка обезболивали изофлураном перед интраназальным введением VHH, паливизумаба или вирусным заражением РСВ. VHH, паливизумаб (Synagis, Medimmune) и вирус РСВ вводили в общем объеме 50 мкл в PBS, который равным образом распределяли между двумя ноздрями. Каждая группа из пяти мышей получала 30 мкг DS-Cav1-4, 30 мкг VHH DS-Cav1-L66, 30 мкг VHH-F2 (в качестве отрицательного контроля) или 30 мкг паливизумаба (в качестве положительного контроля) за четыре часа до заражения 1000000 БОЕ РСВ A2. Все группы также получили 30 мкг отрицательного контроля VHH-F2 через 24 часа после заражения.
Определение вирусных титров в легком путем анализа бляшкообразования
Через пять суток после стимуляции мышей умерщвляли, смещая шейные позвонки. Легкие мышей удаляли асептическим путем и гомогенизировали при помощи энергичного встряхивания в миксере Mill MM 2000 (Retsch) в присутствии стерильного металлического шарика в 1 мл HBSS, содержащего 20% сахарозы и дополненного 1% пенициллина и 1% стрептомицина. Гомогенаты легкого затем очищали посредством центрифугирования (10 минут при 2500 об./мин.) при 4°C и использовали в двух повторениях для титрования вируса на клетках Vero. Монослои клеток Vero заражали 50 мкл серийными разведениями 1:3 гомогенатов легкого в 96-луночном планшете в бессывороточной среде Opti-MEM (Invitrogen), дополненной пенициллином и стрептомицином. Анализ бляшкообразования далее проводили, как описано выше. Подсчитывали бляшки в каждой лунке и рассчитывали для каждого разведения число БОЕ на легкое (1 мл) следующим образом: число бляшек, присутствующих в разведении × разведение × 20 (= 1000 мкл общего объема супернатанта/50 мкл супернатанта, использованного для заражения первой лунки из серии разведений). Число БОЕ в каждом легком затем рассчитывали в виде среднего от двух повторений.
Определение вирусного титра в легком при помощи qRT-ПЦР
Для определения нагрузки РСВ в легком при помощи qRT-ПЦР получали тотальную РНК из очищенных гомогенатов легкого с использованием набора High Pure RNA TISSUE (Roche, Mannheim) по инструкциям производителя. кДНК получали с использованием случайных гексамерных праймеров и набора для синтеза первой цепи кДНК Transcriptor (Roche, Mannheim). Относительные уровни геномной кДНК РСВ M определяли путем qRT-ПЦР с использованием праймеров, специфичных для гена M РСВ A2 (5'TCACGAAGGCTCCACATACA3' и 5'GCAGGGTCATCGTCTTTTTC3') и нуклеотидного зонда (#150 Universal Probe Library, Roche), меченого флуоресцеином (FAM) на 5'-конце и с темной краской-гасителем рядом с 3'-концом. Данные qRT-ПЦР нормализовали по уровням мРНК mRPL13A, присутствующей в образцах каждой мыши.
Перекрестная конкуренция антител за связывание с DS-Cav1
Белок DS-Cav1 (10 мкг/мл) был иммобилизован на биосенсорах AR2G при помощи реакции связывания аминов в ацетатном буфере (pH 5,0). Реакцию гасили 1M этаноламином, и биосенсоры с иммобилизованным DS-Cav1 затем уравновешивали буфером для анализа (PBS с 1% БСА). Биосенсоры погружали в конкурирующие антитела (35 мкг/мл в буфере для анализа), а затем в анализируемые антитела (35 мкг/мл в буфере для анализа) с короткой фоновой стадией между двумя стадиями с антителами.
Пример 1: РСВ-нейтрализующая активность в плазме ламы
Для того чтобы оценить индукцию гуморальных ответов против РСВ у ламы после иммунизации DS-Cav1, образцы плазмы, полученные до и после иммунизации, тестировали в анализе нейтрализации РСВ. Образцы тестировали на нейтрализующую активность против РСВ-A2 и клинического штамма РСВ B, РСВ B49. Фигура 1 показывает, что все образцы плазмы, полученные после четвертой иммунизации, имеют высокую нейтрализующую активность против РСВ A2 и РСВ B49.
Пример 2: Выделение DS-Cav1-специфических VHH
Проводили один раунд пэннинга для фаговой библиотеки VHH по белку DS-Cav1. Обогащение по DS-Cav1-специфическим фагам оценивали, сравнивая число фагов, элюированных из лунок, покрытых DS-Cav1 с числом фагов, элюированных из непокрытых лунок. Число элюированных фагов определяли опосредованно путем определения трансдуцирующих единиц с устойчивостью к ампициллину ампициллин, т.е. числа колоний TG1, которые были трансдуцированы фагами, элюированными на стадии пэннинга. Этот эксперимент указывает на то, что популяция фагов была примерно в 140 раз обогащена DS-Cav1-специфическими фагами. Девяносто колоний были выбраны случайным образом и проанализированы ELISA на наличие VHH, специфических для конформации F-белка «до слияния» (DS-Cav1) по сравнению с конформацией F-белка «после слияния» в их периплазматических экстрактах. Результат ELISA показан на фигуре 2. Из 90 колоний, 37 колоний получили положительную оценку (10 получили положительную оценку за связывание с F-белком и «до слияния» и «после слияния», 19 получили положительную оценку за связывание с F-белком только «до слияния» и 8 получили положительную оценку за связывание с F-белком только «после слияния»). Определяли последовательность VHH из всех колоний, которые предположительно связывались с F-белком «до слияния» и «после слияния». Двадцать восемь клонов из 37 имели уникальную последовательность VHH и были выбраны для дальнейшего использования. Последовательности VHH этих клонов клонировали в экспрессирующий вектор Pichia pastoris и полученные плазмиды затем использовали для трансформации Pichia pastoris.
Пример 3: Исследование нейтрализующей активности в супернатантах Pichia pastoris
Авторы также предприняли попытку клонировать библиотеку кДНК VHH, полученную после одного раунда пэннинга по DS-Cav1, в экспрессирующий вектор pKai61 Pichia pastoris. Авторы использовали эту стратегию для того, чтобы попытаться отобрать биологически подходящих кандидатов VHH на основании РСВ-нейтрализующей активности в супернатанте отдельных трансформантов Pichia pastoris. Из 20 отдельных трансформантов Pichia pastoris, выбранных на основании связывания с F-белком, пять имели нейтрализующую активность против РСВ A2 (наиболее мощную по отношению к DS-Cav1-4), в то время как из 18 клонов, полученных из библиотеки, клонированной в pKai61, только один (VHH DS-Cav1-L66) показал нейтрализующую активность(фигура 3).
Последовательность кДНК DS-Cav1-4 и DS-Cav1-L66 определяли секвенированием по Сэнгеру, и нуклеотидная последовательность, а также выведенная аминокислотная последовательность показаны на фигуре 5.
Пример 4: Получение очищенных VHH и определение IC50
Перед очисткой, VHH DS-Cav1-4 и VHH DS-Cav1-L66 имели наиболее мощные РСВ-нейтрализующие VHH, и эти два VHH, а также отрицательный контроль VHH F2 и F58, получали в культурах Pichia pastoris по 300 мл и очищали при помощи очистки на HisTrap с последующей гель-фильтрационной хроматографией с superdex 75 (фигура 4). VHH F2 и VHH F58 представляют собой несоответствующие контрольные VHH, полученные из библиотеки VHH от другой ламы, которая была иммунизирована инактивированным вирусом Джунин. VHH DS-Cav1-4 и VHH DS-Cav1-L66 нейтрализовали РСВ A2 in vitro с IC50 0,021 нМ и 0,032 нМ, соответственно. Относительно нейтрализации РСВ B49 VHH DS-Cav1-4 и VHH DS-Cav1-L66 показали IC50 0,015 нМ и 0,032 нМ, соответственно. Чтобы оценить, могут ли VHH DS-Cav1-4 и VHH DS-Cav1-L66 нейтрализовать серотипы A и/или B метапневмовируса человика, заранее определенные количества GFP-экспрессирующих рекомбинантных вирусов hMPV (сублиния NL/1/00 A1 или сублиния NL/1/99 B1, любезный подарок Бернадетты ван ден Хуген и Рона Фуше, Роттердам, Нидерланды) или GFP-hРСВ (штамм A2, любезный подарок Марка Пиплса, Колумбус, Огайо, США) (MOI 0,3 БОЕ/клетку) смешивали с серийными разведениями VHH или МАТ и добавляли в культуры клеток Vero-118 (hMPV) или клеток HEp-2, растущих в 96-луночных планшетах. Через тридцать шесть часов удаляли среду, добавляли PBS и измеряли интенсивность флуоресценции GFP на лунку при помощи микроспектрофотометра для чтения планшетов M200 Tecan. Значения флуоресценции были нанесены на график в виде процента от контроля с вирусом без антитела и использованы для расчета соответствующих значений IC50.
Пример 5: DS-Cav1-4 и DS-Cav1-L66 связываются с F-белком РСВ в состоянии «до слияния», но не связываются с F-белком РСВ в состоянии «после слияния».
Для оценки связывающей способности DS-Cav1-4 и DS-Cav1-L66 по отношению к F-белку «до слияния» и «после слияния», авторы провели ELISA, в котором F-белок в каждой конформации наносили непосредственно на планшет для микротитрования и добавляли на это планшет серии трехкратных разведений VHH (фигура 7A). Авторы обнаружили, что VHH DS-Cav1-4 и VHH DS-Cav1-L66 специфически связываются с нанесенным F-белком в конформации «до слияния» и не связываются с нанесенным F-белком в конформации «после слияния». Для того чтобы дополнительно охарактеризовать аффинность связывания с F-белком «до слияния», авторы провели эксперименты по связыванию на основе SPR. Авторы обнаружили, что оба ISVD связываются с F-белком РСВ «до слияния» с пикомолярной аффинностью. Неожиданным был тот факт, что ISVD демонстрируют такую высокую аффинность для своей мишени, поскольку они являются моновалентными, в отличие от стандартных моноклональных антител, таких как паливизумаб или AM14 (Gilman et al., 2015), которые бивалентны по своей природе. В частности, скорость диссоциации DS-Cav1-4 очень низкая.
Также оценивали связывание VHH DS-Cav1-4 и VHH DS-Cav1-L66 с F-белком, экспресирующимся клетками млекопитающих. Клетки HEK293T ко-трансфицировали pCAGGS-Fsyn, кодирующим кодон-оптимизированную кДНК F, и peGFP-NLS. Клетки собирали через 18 часов после трансфекции и окрашивали VHH DS-Cav1-4, VHH DS-Cav1-L66, отрицательный контроль VHHs F58 и F2 и моноклональное мышиное антитело IgG, специфичное к РСВ-F. Связывание VHH с GFP-положительными клетками в условиях ко-трансфекции сравнивали со связыванием с GFP-положительными клетками, которые были трансфицированы только вектором, экспрессирующим GFP. Не вызывающее сомнений связывание наблюдали для всех разведений VHH DS-Cav1-4 и VHH DS-Cav1-L66 и для трех наиболее высоких концентраций положительного контроля с моноклональным антителом, направленным против F РСВ (фигура 8).
Пример 6: DS-Cav1-4 и DS-Cav1-L66 связываются с новым эпитопом F РСВ
Для того чтобы исследовать, связываются ли DS-Cav1-4 и DS-Cav1-L66 с недавно описанным специфическим эпитопом ∅ F-белка «до слияния», авторы исследовали при помощи интерферометрии слоев, могут ли эти VHH конкурировать с антителом D25, специфическим к эпитопу ∅, за связывание с F-белком РСВ «до слияния» (фигура 9). Коккурентный анализ показывает, что ни один из VHH не конкурирует с D25. Напротив, оба VHHs конкурируют дркг с дркгом. Эти результаты указывают на то, что VHH связываются с перекрывающимися эпитопами, но эти эпитопы отличаются от эпитопа ∅ от D25.
Дополнительное исследование эпитопов для ISVD подтвердило, что DS-Cav1-4 и DS-Cav1-L66 связываются с одним и тем же эпитопом на F РСВ, с высокой консервативностью структуры (фигура 11A-D). На фигуре 11C подчеркнуты остатки стабилизированного в конформации «до слияния» F-белка РСВ (полная открытая рамка считывания до процессинга in vivo, SEQ ID NO: 17), которые контактируют с обоими, DS-Cav1-4 и DS-Cav1-L66. В частности, следующие аминокислотные остатки F-белка РСВ образуют часть эпитопа для DS-Cav1-4 и DS-Cav1-L66: T50, G51, W52, S180, G184, V185, P265, I266, T267, N268, D269, Q270, L305, G307, V308, N345, A346, G347, K421, S425, K427, N428, R429, G430, I431, S451, G453, N454, L456, Y458. Эти остатки представляют эпитоп и для DS-Cav1-4, и для DS-Cav1-L66. Дополнительные детали связывания петель CDR2 и CDR3 показаны на фигуре 12 (для DS-Cav1-4) и фигуре 13 (для DS-Cav1-L66).
Структура F-белка в конформации «до слияния» в комплексе с мотавизумабом, AM14, 101F и DS-Cav1-4 выявила новый эпитоп для связывания (фигура 14). Все остальные антитела, для которых известна совместная кристаллическая структура с F РСВ, связываются с этим эпитопом, который отличается от того, с которым связываются DS-Cav1-4 и DS-Cav1-L66. Даже антитела, которые конкурируют за связывание с F-белком РСВ, стабилизированным в конформации «до слияния», с DS-Cav1-4 (т.е. AM14 и паливизумаб) и DS-Cav1-L66 (т.е. AM14, паливизумаб и 101F) и для которых эпитоп был однозначно определен путем анализа совместной кристаллической структуры, связываются с другим эпитопом в F РСВ. Это показано на фигуре 14. Отметим, что паливизумаб и мотавизумаб связываются с одним и тем же эпитопом в F РСВ, и что этот эпитоп присутствует и в состоянии «до слияния», и в состоянии «после слияния» F-белка РСВ.
Пример 7: Исследование профилактической активности VHH против РСВ in vivo
Для исследования того, может ли введение VHH DS-Cav1-4 или DS-Cav1-L66 защитить от заражения РСВ in vivo, самки мышей BALB/c (пять мышей на группу) получали 30 мкг VHH DS-Cav1-4, VHH DS-Cav1-L66, F2 VHH или паливизумаб интраназально за четыре часа до заражения 1106 БОЕ РСВ A2. Через двадцать четыре часа после заражения, все мыши получили 30 мкг F2 VHH интраназально. Через пять суток после заражения мышей умерщвляли и гомогенизировали легкие в 1 мл HBSS, дополненного 20% сахарозой, пенициллином и стрептомицином. У мышей, которых лечили DS-Cav1-4, DS-Cav1-L66 или паливизумабом, не было выявляемой репликации вируса в легких (за исключением одной мыши, которую лечили паливизумабом) (фигура 10 A) в отличие от группы, которую лечили F2 VHH и которая демонстрировала высокие уровни реплицирующегося вируса в легких (приблизительно 1×105 БОЕ). Поскольку на анализы бляшкообразования, которые использовали для количественной оценки уровня реплицирующегося вируса в легких, может влиять присутствие нейтрализующих антител или VHH, мы дополнительно количественно оценивали уровень РНК РСВ в гомогенатах легкого путем qRT-ПЦР. Мыши, которых лечили DS-Cav1-4 и DS-Cav1-L66, демонстрировали в среднем более чем в 3000 раз меньше вирусной РНК по сравнению с контрольными мышами, которых лечили F2. Мыши, которых лечили паливизумабом, демонстрировали в среднем приблизительно в 100 раз меньше вирусной РНК по сравнению с контрольными мышами, которых лечили F2.
Ссылки
1. Gilman, M.S.A., et al. Characterization of a prefusion-specific antibody that recognizes a quaternary, cleavage-dependent epitope on the RSV fusion glycoprotein. PLoS Pathog, 11, 1-17 (2015).
2. Hultberg, A., et al. Llama-derived single domain antibodies to build multivalent, superpotent and broadened neutralizing anti-viral molecules. PLoS One, 6, e17665 (2011).
3. Lin-Cereghino, J., et al. Condensed protocol for competent cell preparation and transformation of the methylotrophic yeast Pichia pastoris. Biotechniques, 38, 44, 46, 48 (2005).
4. McLellan, J.S., et al. Structure of respiratory syncytial virus fusion glycoprotein in the postfusion conformation reveals preservation of neutralizing epitopes. J Virol, 85, 7788-96 (2011).
5. McLellan, J.S., et al. Structure of RSV fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody. Science 340, 1113-1117 (2013).
6. McLellan, J.S., et al. Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science 342, 592-598 (2013).
7. Scheppens, B., et al. Nanobodies specific for respiratory syncytial virus fusion protein protect against infection by inhibition of fusion. J. Infect Dis., 11, 1692-701(2011).
8. Schoonooghe, S., et al. Efficient production of human bivalent and trivalent anti-MUC1 Fab-scFv antibodies in Pichia pastoris. BMC Biotechnol., 9, 70 (2009).
9. Tan, L., et al. The comparative genomics of human respiratory syncytial virus subgroups A and B: genetic variability and molecular evolutionary dynamics. J Virol. 87, 8213-26 (2013).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> VIB VZW
UNIVERSITEIT GENT
THE UNITED STATES OF AMERICA, as represented by the
Secretary, Department of Health and Human Services, National
Institutes of Health, Office of Technology Transfer
TRUSTEES OF DARTMOUTH COLLEGE
<120> Иммуноглобулин с одним вариабельным доменом против F-белка РСВ
<130> XS/RSVNb/521
<150> US 62/181,522
<151> 2015-06-18
<150> EP 15178653.0
<151> 2015-07-28
<150> EP 15191868.7
<151> 2015-10-28
<160> 19
<170> PatentIn version 3.5
<210> 1
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность CDR1
<400> 1
Gly Phe Thr Leu Asp Tyr Tyr Tyr Ile Gly
1 5 10
<210> 2
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность CDR1
<400> 2
Gly Phe Thr Leu Asp Tyr Tyr Tyr Ile Gly
1 5 10
<210> 3
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность CDR2
<400> 3
Cys Ile Ser Gly Ser Ser Gly Ser Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 4
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность CDR2
<400> 4
Cys Ile Ser Ser Ser His Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 5
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность CDR3
<400> 5
Ile Arg Ser Ser Ser Trp Gly Gly Cys Val His Tyr Gly Met Asp Tyr
1 5 10 15
<210> 6
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Последовательность CDR3
<400> 6
Val Ala Val Ala His Phe Arg Gly Cys Gly Val Asp Gly Met Asp Tyr
1 5 10 15
<210> 7
<211> 396
<212> ДНК
<213> Искусственная последовательность
<220>
<223> однодоменное антитело DS-Cav1-4
<220>
<221> кодирующая последовательность
<222> (1)..(396)
<400> 7
cag gtg cag ctg cag gag tct ggg gga ggc ttg gtg cag cct ggg ggg 48
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tct ctg aga ctc tcc tgt gca gcc tct gga ttc act ttg gat tat tat 96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Asp Tyr Tyr
20 25 30
tac ata ggc tgg ttc cgc cag gcc cca ggg aag gag cgc gag gca gtc 144
Tyr Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Ala Val
35 40 45
tca tgt att agt ggt agt agt ggt agc aca tac tat cca gac tcc gtg 192
Ser Cys Ile Ser Gly Ser Ser Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
aag ggc cga ttc acc atc tcc aga gac aat gcc aag aac acg gtg tat 240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
ctg caa atg aac agc ctg aaa cct gag gac acg gcc gtt tat tac tgt 288
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aca att cgt agt agt agc tgg ggg ggt tgc gtg cac tac ggc atg 336
Ala Thr Ile Arg Ser Ser Ser Trp Gly Gly Cys Val His Tyr Gly Met
100 105 110
gac tac tgg ggc aaa ggg acc cag gtc acc gtc tcc agc cac cac cat 384
Asp Tyr Trp Gly Lys Gly Thr Gln Val Thr Val Ser Ser His His His
115 120 125
cac cat cac tag 396
His His His
130
<210> 8
<211> 131
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Asp Tyr Tyr
20 25 30
Tyr Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Ala Val
35 40 45
Ser Cys Ile Ser Gly Ser Ser Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ile Arg Ser Ser Ser Trp Gly Gly Cys Val His Tyr Gly Met
100 105 110
Asp Tyr Trp Gly Lys Gly Thr Gln Val Thr Val Ser Ser His His His
115 120 125
His His His
130
<210> 9
<211> 396
<212> ДНК
<213> Искусственная последовательность
<220>
<223> однодоменное антитело DS-Cav1-L66
<220>
<221> кодирующая последовательность
<222> (1)..(396)
<400> 9
cag gtg cag ctg cag gag tct ggg gga ggc ttg gtg cag cct ggg ggg 48
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tct ctg aga ctc tcc tgt gca gcc tct gga ttc act ttg gat tat tat 96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Asp Tyr Tyr
20 25 30
tac ata ggc tgg ttc cgc cag gcc cca ggg aag gag cgc gag ggg gtc 144
Tyr Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
tca tgt att agt agt agt cat ggt agc aca tac tat gca gac tcc gtg 192
Ser Cys Ile Ser Ser Ser His Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
aag ggc cga ttc acc atc tcc aga gac aat gcc aag aac acg gtg tat 240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
ctg cag atg aac agc ctg aaa cct gag gac acg gcc gtt tat tac tgt 288
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcg aca gta gct gta gca cat ttc cgg ggt tgc gga gtc gac ggc atg 336
Ala Thr Val Ala Val Ala His Phe Arg Gly Cys Gly Val Asp Gly Met
100 105 110
gac tac tgg ggc aaa ggg acc cag gtc acc gtc tcc agc cac cac cat 384
Asp Tyr Trp Gly Lys Gly Thr Gln Val Thr Val Ser Ser His His His
115 120 125
cac cat cac tag 396
His His His
130
<210> 10
<211> 131
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Asp Tyr Tyr
20 25 30
Tyr Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Ser His Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Val Ala Val Ala His Phe Arg Gly Cys Gly Val Asp Gly Met
100 105 110
Asp Tyr Trp Gly Lys Gly Thr Gln Val Thr Val Ser Ser His His His
115 120 125
His His His
130
<210> 11
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 11
caggaaacag ctatgacc 18
<210> 12
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 12
ggcgggtatc tctcgagaaa aggcaggtgc agctgcagga gtctggg 47
<210> 13
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 13
ctaactagtc tagtgatggt gatggtggtg gctggagacg gtgacctgg 49
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 14
tcacgaaggc tccacataca 20
<210> 15
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 15
gcagggtcat cgtctttttc 20
<210> 16
<211> 461
<212> Белок
<213> Искусственная последовательность
<220>
<223> стабилизированный "до слияния" F-белок РСВ (фигура 11a+b)
<400> 16
Gln Asn Ile Thr Glu Glu Phe Tyr Gln Ser Thr Cys Ser Ala Val Ser
1 5 10 15
Lys Gly Tyr Leu Ser Ala Leu Arg Thr Gly Trp Tyr Thr Ser Val Ile
20 25 30
Thr Ile Glu Leu Ser Asn Ile Lys Glu Asn Lys Cys Asn Gly Thr Asp
35 40 45
Ala Lys Val Lys Leu Ile Lys Gln Glu Leu Asp Lys Tyr Lys Asn Ala
50 55 60
Val Thr Glu Leu Gln Leu Leu Met Gln Ser Thr Pro Ala Thr Asn Asn
65 70 75 80
Arg Ala Arg Arg Phe Leu Gly Phe Leu Leu Gly Val Gly Ser Ala Ile
85 90 95
Ala Ser Gly Val Ala Val Cys Lys Val Leu His Leu Glu Gly Glu Val
100 105 110
Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser
115 120 125
Leu Ser Asn Gly Val Ser Val Leu Thr Phe Lys Val Leu Asp Leu Lys
130 135 140
Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Leu Asn Lys Gln Ser Cys
145 150 155 160
Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn
165 170 175
Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr
180 185 190
Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu
195 200 205
Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn
210 215 220
Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Cys Ile Ile
225 230 235 240
Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val
245 250 255
Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr
260 265 270
Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly
275 280 285
Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu
290 295 300
Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser
305 310 315 320
Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn
325 330 335
Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser
340 345 350
Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr
355 360 365
Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser
370 375 380
Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser Val
385 390 395 400
Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr
405 410 415
Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro
420 425 430
Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn
435 440 445
Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu
450 455 460
<210> 17
<211> 568
<212> Белок
<213> Искусственная последовательность
<220>
<223> стабилизированный "до слияния" F-белок РСВ (фигура 11c)
<400> 17
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly Val
130 135 140
Gly Ser Ala Ile Ala Ser Gly Val Ala Val Cys Lys Val Leu His Leu
145 150 155 160
Glu Gly Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys
165 170 175
Ala Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Phe Lys Val
180 185 190
Leu Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Leu Asn
195 200 205
Lys Gln Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln
210 215 220
Gln Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn
225 230 235 240
Ala Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu
245 250 255
Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys
260 265 270
Leu Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile
275 280 285
Met Cys Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro
290 295 300
Leu Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro
305 310 315 320
Leu Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg
325 330 335
Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe
340 345 350
Pro Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp
355 360 365
Thr Met Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val
370 375 380
Asp Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr
385 390 395 400
Asp Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys
405 410 415
Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile
420 425 430
Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp
435 440 445
Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly
450 455 460
Lys Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro
465 470 475 480
Leu Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn
485 490 495
Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu
500 505 510
Leu Ser Ala Ile Gly Gly Tyr Ile Pro Glu Ala Pro Arg Asp Gly Gln
515 520 525
Ala Tyr Val Arg Lys Asp Gly Glu Trp Val Leu Leu Ser Thr Phe Leu
530 535 540
Gly Gly Leu Val Pro Arg Gly Ser His His His His His His Ser Ala
545 550 555 560
Trp Ser His Pro Gln Phe Glu Lys
565
<210> 18
<211> 574
<212> Белок
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность F РСВ A
<400> 18
Met Glu Leu Pro Ile Leu Lys Thr Asn Ala Ile Thr Thr Ile Leu Ala
1 5 10 15
Ala Val Thr Leu Cys Phe Ala Ser Ser Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Ala Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Thr Lys Asn Asn Asn Val Thr
115 120 125
Leu Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly Val
130 135 140
Gly Ser Ala Ile Ala Ser Gly Ile Ala Val Ser Lys Val Leu His Leu
145 150 155 160
Glu Gly Glu Val Asn Lys Ile Lys Asn Ala Leu Leu Ser Thr Asn Lys
165 170 175
Ala Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val
180 185 190
Leu Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn
195 200 205
Lys Gln Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln
210 215 220
Gln Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn
225 230 235 240
Ala Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu
245 250 255
Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys
260 265 270
Leu Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile
275 280 285
Met Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro
290 295 300
Leu Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro
305 310 315 320
Leu Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg
325 330 335
Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe
340 345 350
Pro Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp
355 360 365
Thr Met Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Ile
370 375 380
Asp Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr
385 390 395 400
Asp Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys
405 410 415
Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile
420 425 430
Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp
435 440 445
Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly
450 455 460
Lys Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro
465 470 475 480
Leu Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn
485 490 495
Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu
500 505 510
Leu His Asn Val Asn Val Gly Lys Ser Thr Thr Asn Ile Met Ile Thr
515 520 525
Thr Ile Ile Ile Val Ile Ile Val Ile Leu Leu Leu Leu Ile Ala Val
530 535 540
Gly Leu Phe Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser
545 550 555 560
Lys Asp Gln Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 19
<211> 574
<212> Белок
<213> Искусственная последовательность
<220>
<223> консенсусная последовательность F РСВ B
<400> 19
Met Glu Leu Leu Ile His Arg Ser Ser Ala Ile Phe Leu Thr Leu Ala
1 5 10 15
Ile Asn Ala Leu Tyr Leu Thr Ser Ser Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Arg Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Thr Lys Cys Asn Gly Thr Asp Thr Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Asn Thr Pro Ala Ala Asn Asn Arg Ala Arg Arg Glu Ala Pro
100 105 110
Gln Tyr Met Asn Tyr Thr Ile Asn Thr Thr Lys Asn Leu Asn Val Ser
115 120 125
Ile Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly Val
130 135 140
Gly Ser Ala Ile Ala Ser Gly Ile Ala Val Ser Lys Val Leu His Leu
145 150 155 160
Glu Gly Glu Val Asn Lys Ile Lys Asn Ala Leu Leu Ser Thr Asn Lys
165 170 175
Ala Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val
180 185 190
Leu Asp Leu Lys Asn Tyr Ile Asn Asn Gln Leu Leu Pro Ile Val Asn
195 200 205
Gln Gln Ser Cys Arg Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln
210 215 220
Gln Lys Asn Ser Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn
225 230 235 240
Ala Gly Val Thr Thr Pro Leu Ser Thr Tyr Met Leu Thr Asn Ser Glu
245 250 255
Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys
260 265 270
Leu Met Ser Ser Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile
275 280 285
Met Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro
290 295 300
Ile Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro
305 310 315 320
Leu Cys Thr Thr Asn Ile Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg
325 330 335
Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe
340 345 350
Pro Gln Ala Asp Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp
355 360 365
Thr Met Asn Ser Leu Thr Leu Pro Ser Glu Val Ser Leu Cys Asn Thr
370 375 380
Asp Ile Phe Asn Ser Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr
385 390 395 400
Asp Ile Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys
405 410 415
Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile
420 425 430
Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp
435 440 445
Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Leu Glu Gly
450 455 460
Lys Asn Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Tyr Tyr Asp Pro
465 470 475 480
Leu Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn
485 490 495
Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Arg Ser Asp Glu Leu
500 505 510
Leu His Asn Val Asn Thr Gly Lys Ser Thr Thr Asn Ile Met Ile Thr
515 520 525
Ala Ile Ile Ile Val Ile Ile Val Val Leu Leu Ser Leu Ile Ala Ile
530 535 540
Gly Leu Leu Leu Tyr Cys Lys Ala Lys Asn Thr Pro Val Thr Leu Ser
545 550 555 560
Lys Asp Gln Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Lys
565 570
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| САМОСОБИРАЮЩИЕСЯ НАНОСТРУКТУРНЫЕ ВАКЦИНЫ | 2019 |
|
RU2811439C2 |
| БЕЛКИ RSV В ПРЕДШЕСТВУЮЩЕЙ СЛИЯНИЮ КОНФОРМАЦИИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2761631C2 |
| ВАКЦИНА И СПОСОБЫ ОБНАРУЖЕНИЯ И ПРОФИЛАКТИКИ ФИЛЯРИОЗА | 2021 |
|
RU2832185C1 |
| СТАБИЛИЗИРОВАННЫЕ БЕЛКИ F RSV И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795459C2 |
| УСОВЕРШЕНСТВОВАННЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ СЫВОРОТОЧНЫЙ АЛЬБУМИН | 2018 |
|
RU2797270C2 |
| УСОВЕРШЕНСТВОВАННЫЕ СВЯЗЫВАЮЩИЕСЯ С СЫВОРОТОЧНЫМ АЛЬБУМИНОМ ВЕЩЕСТВА | 2018 |
|
RU2789495C2 |
| ММР13-СВЯЗЫВАЮЩИЕ ИММУНОГЛОБУЛИНЫ | 2018 |
|
RU2784069C2 |
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЕГРАДАЦИИ НЕПРАВИЛЬНО УПАКОВАННЫХ БЕЛКОВ | 2016 |
|
RU2761564C2 |
| СВЯЗЫВАЮЩИЕ ADAMTS ИММУНОГЛОБУЛИНЫ | 2018 |
|
RU2781182C2 |
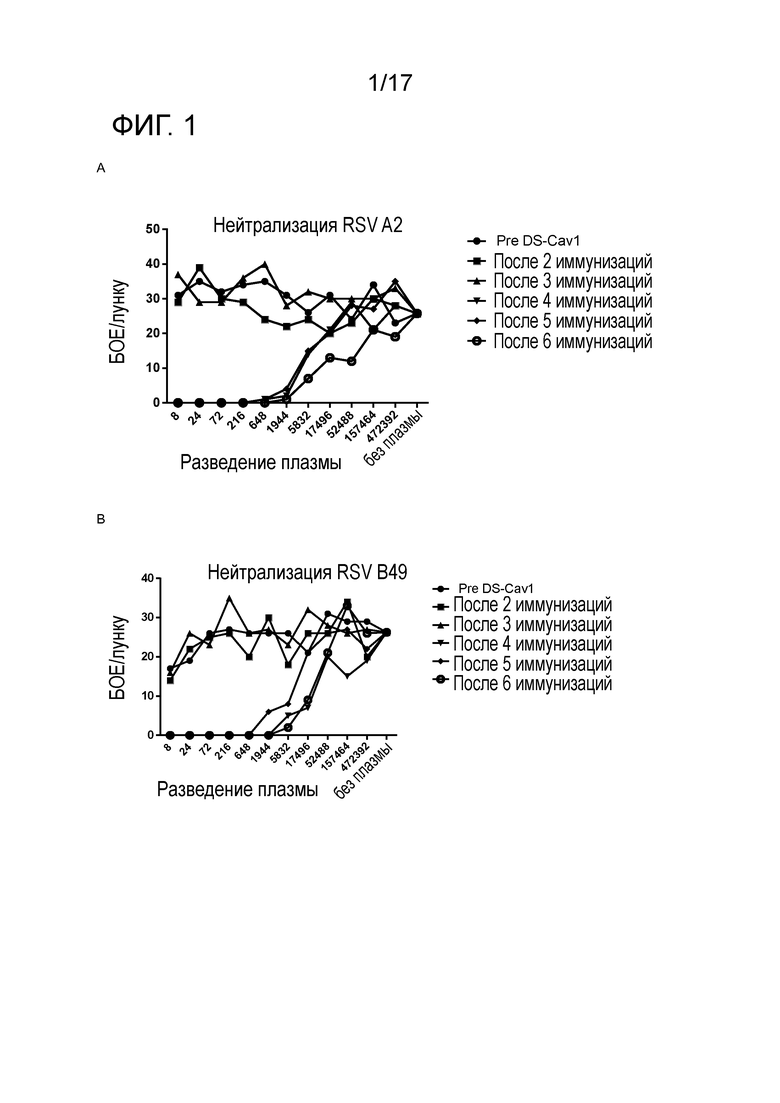



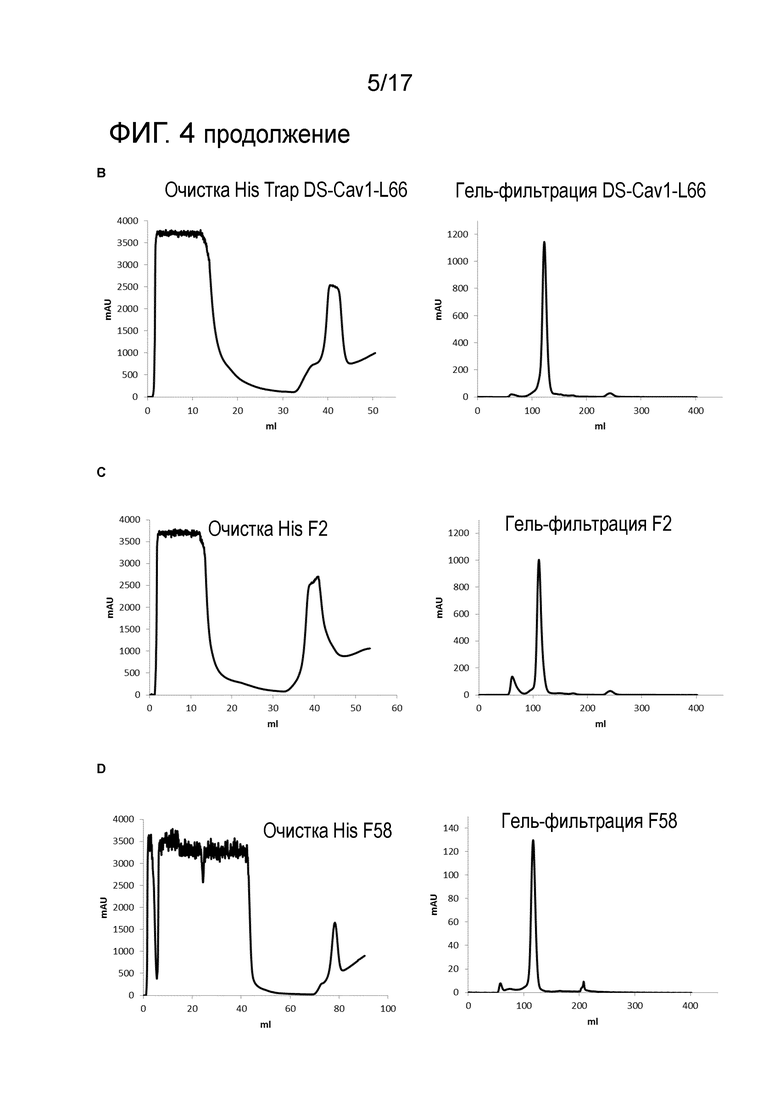

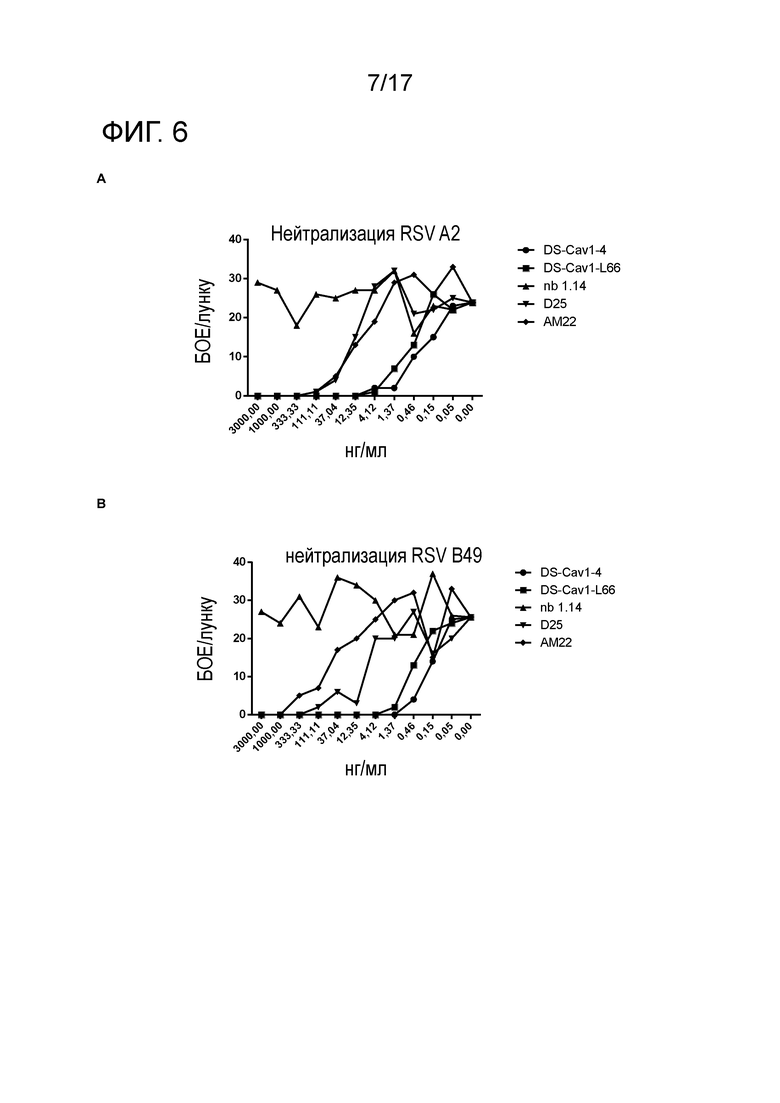


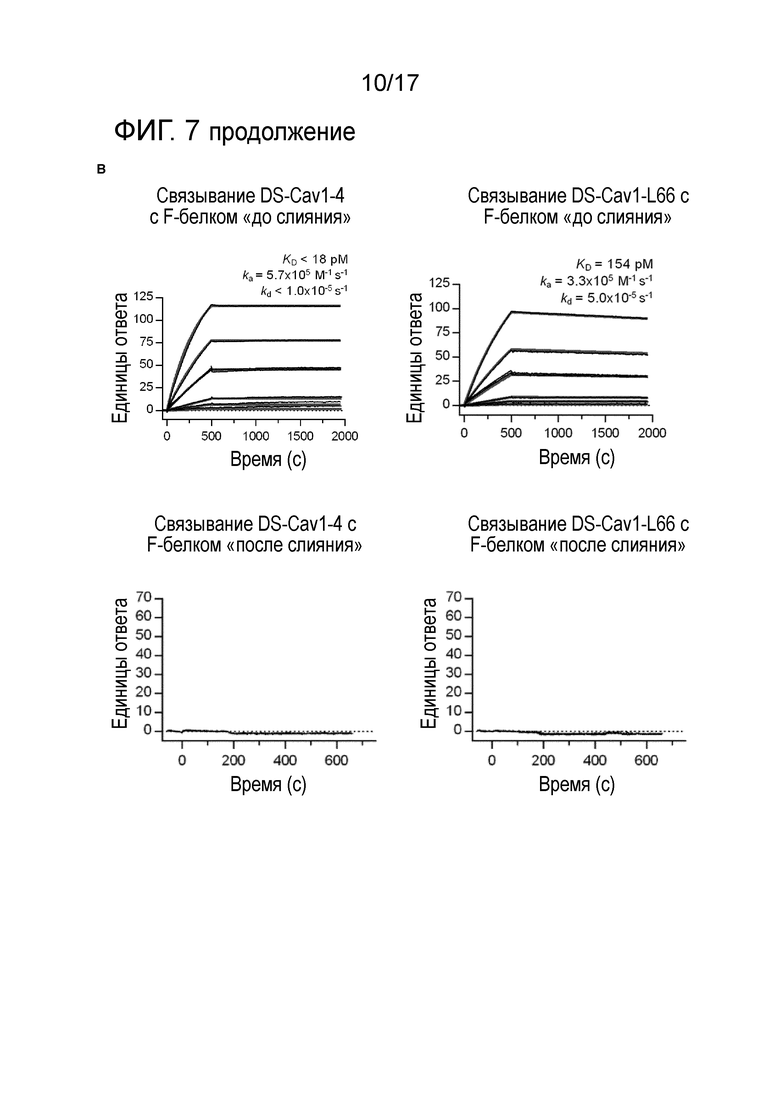







Изобретение относится к биотехнологии. Описан иммуноглобулин с одним вариабельным доменом (ISVD), который специфически связывается с формой «до слияния» белка слияния (F) респираторно-синцитиального вируса (РСВ), отличающийся тем, что указанный ISVD в моновалентном формате показывает сходную нейтрализующую активность для серотипов A и B РСВ, отличающийся тем, что указанный ISVD содержит последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: 1 и SEQ ID NO: 2, последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: 3 и SEQ ID NO: 4 и последовательность CDR3, выбранную из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 6, и где CDR1, CDR2 и/или CDR3 имеют различие по одной, двум или трем аминокислотам с любой из вышеуказанных соответствующих SEQ ID NO. Изобретение дополнительно относится к применению этих ISVD для профилактики и/или лечения инфекций РСВ и к фармацевтическим композициям, содержащим эти ISVD. 8 н. и 2 з.п. ф-лы, 14 ил., 7 пр.
1. Иммуноглобулин с одним вариабельным доменом (ISVD), который специфически связывается с формой «до слияния» белка слияния (F) респираторно-синцитиального вируса (РСВ), отличающийся тем, что указанный ISVD в моновалентном формате показывает сходную нейтрализующую активность для серотипов A и B РСВ, отличающийся тем, что указанный ISVD содержит последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: 1 и SEQ ID NO: 2, последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: 3 и SEQ ID NO: 4 и последовательность CDR3, выбранную из группы, состоящей из SEQ ID NO: 5 и SEQ ID NO: 6, и где CDR1, CDR2 и/или CDR3 имеют различие по одной, двум или трем аминокислотам с любой из вышеуказанных соответствующих SEQ ID NO.
2. РСВ-связывающая конструкция, отличающаяся тем, что указанная РСВ-связывающая конструкция содержит по меньшей мере один ISVD по п.1.
3. Нуклеиновая кислота, отличающаяся тем, что указанная нуклеиновая кислота кодирует по меньшей мере один ISVD по п.1.
4. Клетка-хозяин для получения указанного ISVD, отличающаяся тем, что указанная клетка-хозяин трансформирована или трансфицирована нуклеиновой кислотой по п.3.
5. Применение клетки-хозяина по п.4, для получения указанного ISVD.
6. Применение ISVD по п.1 или РСВ-связывающей конструкции по п.2 в качестве лекарственного средства.
7. Применение ISVD по п.1 или РСВ-связывающей конструкции по п.3 для терапевтического лечения или профилактики инфекции РСВ.
8. Фармацевтическая композиция для терапевтического лечения или профилактики инфекции РСВ, отличающаяся тем, что указанная фармацевтическая композиция содержит по меньшей мере один ISVD по п.1.
9. Применение фармацевтической композиции по п.8 в качестве лекарственного средства.
10. Применение фармацевтической композиции по п.8 для терапевтического лечения или профилактики инфекции РСВ.
| B | |||
| SCHEPENS ET AL | |||
| "Nanobodies(R) Specific for Respiratory Syncytial Virus Fusion Protein Protect Against Infection by Inhibition of Fusion", JOURNAL OF INFECTIOUS DISEASES | |||
| JID,Vol | |||
| Ротационный фильтр-пресс для отжатия торфяной массы, подвергшейся коагулированию, и т.п. работ | 1924 |
|
SU204A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| WO 2011064382 A1, 03.06.2011 | |||
| WO 2010139808 A2, 09.12.2010 | |||
| WO 2016203052 А, 22.12.2016 | |||
| Опока для формовки ящиков | 1929 |
|
SU18897A1 |
Авторы
Даты
2020-08-24—Публикация
2016-06-20—Подача