ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к лечению раковых заболеваний с использованием рекомбинантных поксвирусов, кодирующих опухолевый антиген, в комбинации с одним или более агонистами или антагонистами молекулы иммунной контрольной точки.
УРОВЕНЬ ТЕХНИКИ
Рекомбинантные поксвирусы ранее использовали в качестве вакцин против инфекционных организмов и, совсем недавно, стали использовать против опухолей. Mastrangelo et al. J Clin Invest. 2000;105(8):1031-1034. Было продемонстрировано, что два из этих групп поксвирусов, авипоксвирус и ортопоксвирус, эффективны в борьбе с опухолями, и они были включены в потенциальные способы лечения рака. Id.
Было продемонстрировано, что один иллюстративный вид авипоксвируса, поксвирус домашней птицы, является безопасным носителем для введения человеку, поскольку поксвирус домашней птицы проникает в клетки млекопитающих и экспрессирует белки, но при этом теряет способность к репродукции путем репликации. Skinner et al. Expert Rev Vaccines. 2005 Feb;4(1):63-76. Кроме того, использование поксвируса домашней птицы в качестве носителя для экспрессии в настоящее время оценивают в многочисленных клинических исследованиях вакцины против рака, малярии, туберкулеза и СПИДа. Id.
Вирус коровьей оспы, самый известный из ортопоксвирусов, использовали для вакцинации при ликвидации натуральной оспы во всем мире, и он продемонстрировал пригодность в качестве вектора и/или вакцины. Вектор на основе рекомбинантного вируса коровьей оспы был создан методами генной инженерии для экспрессии широкого диапазона вставленных генов, включая несколько генов, связанных с опухолями таких как p97, HER-2/neu, p53 и ETA (Paoletti, et al., 1993).
Успешно используемым штаммом ортопоксвируса является модифицированный вирус коровьей оспы Анкара (MVA). MVA был создан посредством 516 серийных пассажей вируса коровьей оспы (CVA) на фибробластах куриных эмбрионов штамма Анкара (обзор см. Mayr, A., et al. Infection 3, 6-14 (1975)). Как следствие этих длительных пассажей, геном полученного вируса MVA потерял около 31 тысячи пар оснований своей геномной последовательности и, следовательно, был описан как вирус с крайне ограниченными клетками-хозяевами для репликации в клетках птиц (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038 (1991)). В различных моделях на животных было показано, что полученный MVA был по существу авирулентным (Mayr, A. & Danner, K., Dev. Biol. Stand. 41: 225-34 (1978)). Кроме того, этот штамм MVA был испытан в клинических исследованиях в качестве вакцины для иммунизации против заболевания человеческой натуральной оспой (Mayr et al., Zbl. Bakt. Hyg. I, Abt. Org. B 167, 375-390 (1987); Stickl et al., Dtsch. med. Wschr. 99, 2386-2392 (1974)). В этих исследованиях, проведенных у людей, MVA имел сниженную вирулентность или инфективность по сравнению с вакцинами на основе вируса коровьей оспы, при этом MVA все еще индуцировал хороший специфический иммунный ответ.
В последующие десятилетия были созданы генно-инженерные конструкции MVA для применения их в качестве вирусного вектора для экспрессии рекомбинантных генов или в качестве рекомбинантной вакцины (Sutter, G. et al., Vaccine 12: 1032-40 (1994).
Даже несмотря на то, что Mayr et al. в 1970-е годы показали, что MVA является крайне ослабленным и авирулентным у людей и млекопитающих, в настоящее время некоторые исследователи сообщили, что в клеточных линиях человека и млекопитающих MVA не является полностью аттенуированным, поскольку в этих клетках может происходить остаточная репликация. (Blanchard et al., J Gen Virol 79, 1159-1167 (1998); Carroll & Moss, Virology 238, 198-211 (1997); Altenberger, патент США № 5185146; Ambrosini et al., J Neurosci Res 55(5), 569 (1999)). Предполагается, что результаты, представленные в этих публикациях, получены с различными известными штаммами MVA, поскольку использованные вирусы существенно различаются по своим свойствам, особенно по характеру своего роста в различных клеточных линиях. Такая остаточная репликация является нежелательной по разным причинам, включая проблемы безопасности в связи с использованием у людей.
Были описаны штаммы MVA, имеющие улучшенные профили безопасности, для разработки более безопасных продуктов, таких как вакцины или лекарственные средства. См. Международную публикацию PCT WO2002042480 (см. также, например, патенты США № 6761893 и 6913752), которые все включены в настоящее описание путем ссылки. Такие штаммы способны к репродукции путем репликации в клетках и в клеточных линиях животных, не являющихся человеком, особенно в фибробластах эмбрионов цыплят (CEF), но не способны к значимой репродукции путем репликации в некоторых клеточных линиях человека, в которых, как известно, допускается репликация известных штаммов вируса коровьей оспы. Такие клеточные линии включают клеточную линию кератиноцитов человека HaCat (Boukamp et al. J Cell Biol 106(3): 761-71 (1988)), клеточную линию аденокарциномы шейки матки человека HeLa (ATCC № CCL-2), клеточную линию почки эмбриона человека 293 (ECACC № 85120602) и клеточную линию остеосаркомы кости человека 143B (ECACC № 91112502). Такие штаммы также неспособны к значимой репродукции путем репликации in vivo, например, в некоторых линиях мышей, таких как модель трансгенной мыши AGR 129 с сильно ослабленным иммунитетом и очень восприимчивой к реплицирующемуся вирусу. См. патент США № 6761893. Был описан один такой штамм MVA и его производные и рекомбинанты, называемые MVA-BN. См. Международную публикацию PCT WO2002042480 (см. также, например, патенты США № 6761893 и 6913752).
Были созданы генно-инженерные конструкции MVA и MVA-BN для применения их в качестве вирусного вектора для экспрессии рекомбинантных генов или в качестве рекомбинантной вакцины. См., например, Sutter, G. et al., Vaccine 12: 1032-40 (1994), Международную публикацию PCT WO2002042480 (см. также, например, патенты США № 6761893 и 6913752).
Некоторые подходы к иммунотерапии рака включали вакцинацию антигенами, связанными с опухолью. В некоторых случаях такие подходы предусматривают использование системы доставки для стимуляции иммунного ответа на антигены, связанные с опухолью. В некоторых случаях такие системы доставки включали рекомбинантные вирусные векторы. См., например, Harrop et al., Front. Biosci. 11:804-817 (2006); Arlen et al., Semin. Oncol. 32:549-555 (2005); Liu et al., Proc. Natl. Acad. Sci. USA 101 (suppl. 2):14567-14571 (2004).
HER-2 представляет собой связанный с опухолью антиген, который сверхэкспрессирован в опухолевых клетках у ряда онкологических пациентов. Иммунизацию различными полипептидами HER-2 использовали для генерации иммунного ответа против опухолевых клеток, экспрессирующих этот антиген. См., например, Renard et al., J. Immunology 171:1588-1595 (2003); Mittendorf et al., Cancer 106:2309-2317 (2006).
Было продемонстрировано, что MVA, кодирующий антиген HER-2, MVA-BN-HER2, оказывает мощное противоопухолевое действие в мышиной модели экспериментального легочного метастазирования, несмотря на сильную иммуносупрессивную среду, опосредованную опухолью, которая характеризуется высоким содержанием регуляторных Т-клеток,(Treg) в легких. Mandl et al., Cancer Immunol Immunother (2012) 61:19-29. Было зарегистрировано, что рекомбинантный MVA индуцирует ответы сильно Th1-доминируемого HER-2-специфического антитела и T-клеток. Id. Противоопухолевая активность характеризовалась повышенной инфильтрацией легких высокоактивированными HER-2-специфическими Т-клетками CD8+CD11c+ и сопровождалась уменьшением содержания Treg-клеток в легких, в результате чего значительно увеличивалось соотношение эффекторных Т-клеток к клеткам Treg. Id.
В клинических исследованиях у людей в условиях метастазирования также было продемонстрировано, что MVA-BN-HER2 безопасен и нарушает толерантность, индуцируя специфические реакции Т- и B-клеток. Guardino et al., Cancer Research: December 15, 2009; Volume 69, Issue 24, Supplement 3.
Трастузумаб (герцептин) представляет собой гуманизированное моноклональное антитело (mAb), оказывающее целевое воздействие на внеклеточный домен HER2, и этот препарат продемонстрировал клиническую эффективность при HER2-положительном раке молочной железы. Wang et al., Cancer Res. 2012 September 1; 72(17): 4417-4428. Тем не менее, значительное число пациентов не отвечают на начальное лечение трастузумабом, а после непрерывного лечения во многих чувствительных к трастузумабу опухолях развивается устойчивость. Id.
Ингибирующие рецепторы на иммунных клетках являются ключевыми регуляторами ускользания от иммунного ответа при раке. Woo et al., Cancer Res; 72(4); 917-27, 2011. Среди этих ингибирующих рецепторов CTLA-4 (белок 4, связанный с цитотоксическими T-лимфоцитами) служит в качестве доминирующей функции отключения, в то время как другие рецепторы, такие как PD-1 (рецептор запрограммированной смерти 1, CD279), LAG-3 (ген активации лимфоцитов, CD223) и TIM-3 (T-клеточный иммуноглобулиновый домен и муциновый домен-3), по-видимому, служат в качестве более тонких реостатных функций. Id.
CTLA-4 представляет собой молекулу иммунной контрольной точки, которая положительно регулируется на активированных Т-клетках. Mackiewicz, Wspolczesna onkol 2012; 16 (5):363-370. CTLA-4 представляет собой отрицательную костимуляторную молекулу, экспрессируемую на активированных Т-клетках, которая ингибирует их пролиферацию. См. Mellman, Nature 2011; 480:480-9). Антитело mAb к CTLA-4 может блокировать взаимодействие CTLA-4 и CD80/86, выключать механизм иммуносупрессии и включать непрерывную стимуляцию T-клеток посредством DC. В клинических исследованиях у пациентов с меланомой использовали два mAb IgG, направленных против CTLA-4, ипилимумаб и тремелимумаб. Id.
Хотя эти недавние исследования показали, что использование mAb IgG, направленного против CTLA-4, может обеспечить терапевтический эффект для пациентов с меланомой, наблюдалось, что лечение этими антителами к CTLA-4 вызывает высокий уровень неблагоприятных иммунных явлений. Mellman et al. Nature 2011; 480(7378): 480-489. Такие неблагоприятные явления характеризовались токсичностью «в мишени», где у подвергающихся лечению пациентов развивались неблагоприятные эффекты, включая колит и гипофизит, а также проблемы, связанные с печенью. Id.
Другое человеческое mAb, оказывающее модулирующее влияние на иммунную систему, представляет собой антитело BMS-936558 (MDX-1106), направленное против рецептора смерти-1 (PD-1R), лиганд которого (PD-1L) может быть непосредственно экспрессирован на клетках меланомы. Id. PD-1R является частью семейства костимулирующих молекул B7:CD28, которые регулируют активацию и толерантность Т-клеток, таким образом, антитело к PD-1R может играть определенную роль в нарушении толерантности. Id. Вовлечение путей PD-1/PD-L1 приводит к ингибированию эффекторной функции, секреции цитокинов и пролиферации Т-клеток. Turnis et al., OncoImmunology 1:7, 1172-1174; 2012. Высокие уровни PD-1 связаны с истощенными или хронически стимулированными Т-клетками. Id. Кроме того, увеличение экспрессии PD-1 коррелирует со снижением выживаемости у онкологических пациентов. Id.
Хотя эти недавние исследования показали, что экспрессия PD-1 может быть связана с показателями выживаемости при раке, в ранних исследованиях с ингибированием PD-1 при лечении рака наблюдался широкий спектр неблагоприятных побочных эффектов. Mellman et al. Nature 2011; 480(7378): 480-489; см. также Chow, Am Soc Clin Oncol Educ Book, 2013, Exploring novel immune-related toxicities and endpoints with immune-checkpoint inhibitors in non-small cell lung cancer.
LAG-3 представляет собой отрицательную костимуляторную молекулу, экспрессируемую на различных лимфоидных клетках. В условиях воспаления (например, при стимуляции ИФН-гамма), происходит активация как LAG-3, так и MHC класса II (Triebel Trends Immunol 2003; 24:619-22).
TIM-3 экспрессируется на T-клетках во время хронических инфекций и рака (Jin Proc Natl Acad Sci 2010;107:14733-8, Baghadi Cancer Immunol Immunother 2013; 62:629-37.
Существует явная и по существу неудовлетворенная медицинская потребность в дополнительных видах лечения рака, включая потребность в активных иммунотерапевтических средствах и вакцинах от рака. Кроме того, с учетом неблагоприятных побочных эффектов, наблюдаемых при применении многих существующих противораковых видов терапии, таких как терапия ингибитором контрольной точки, в этой области техники существует необходимость в терапевтических средствах, которые сохраняют эффективность при применении в более низких дозах Эти терапевтические средства с более низкими дозами могут помочь уменьшить и/или устранить упомянутые неблагоприятные эффекты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение охватывает способы, композиции и наборы для лечения онкологических пациентов-людей.
В одном варианте осуществления настоящего изобретения способ включает введение онкологическому пациенту-человеку рекомбинантного поксвируса, кодирующего полипептид, содержащий по меньшей мере один опухолевый антиген; и введение пациенту антагониста PD-1 и антагониста CTLA-4.
В одном предпочтительном варианте осуществления настоящего изобретения рекомбинантный поксвирус представляет собой рекомбинантный ортопоксвирус или рекомбинантный авипоксвирус.
В более предпочтительном варианте осуществления настоящего изобретения рекомбинантный ортопоксвирус представляет собой рекомбинантный вирус коровьей оспы или рекомбинантный модифицированный вирус коровьей оспы Анкара (MVA). В другом более предпочтительном варианте осуществления настоящего изобретения рекомбинантный ортопоксвирус представляет собой MVA-BN.
В другом более предпочтительном варианте осуществления настоящего изобретения рекомбинантный авипоксвирус представляет собой рекомбинантный поксвирус домашней птицы.
В различных предпочтительных вариантах осуществления настоящего изобретения по меньшей мере один опухолевый антиген включает, но не ограничивается перечисленным, CEA, MUC-1, PAP, PSA, HER-2, сурвивин, tyrp1, tyrp2 или антиген брахиурии.
В других предпочтительных вариантах осуществления настоящего изобретения антагонист PD-1 и антагонист CTLA-4 могут включать антагонист-антитело к PD-1 и антитело к CTLA-4, соответственно.
В еще одном варианте осуществления настоящего изобретения виды лечения рака, описанные в настоящем описании, могут быть направлены против раковых заболеваний, таких как, но не ограничиваясь перечисленным, рак молочной железы, рак легких, рак желудка, рак почек, рак печени, меланома, рак поджелудочной железы, рак предстательной железы, рак яичников, колоректальный рак или их комбинации.
В еще одном варианте осуществления настоящего изобретения это раскрытие охватывает способ лечения рака у пациента-человека, причем указанный способ включает введение пациенту комбинации, состоящей из: (a) терапевтически эффективного количества рекомбинантного поксвирусного вектора, причем указанный поксвирусный вектор содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки является таким, что терапевтический эффект введения комбинации повышен по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки, или его комбинации с другим или множеством антагонистов или агонистов иммунной контрольной точки.
В еще большем числе вариантов осуществления настоящее изобретение может включать набор для лечения одного или более онкологических пациентов, причем указанный набор может содержать терапевтически эффективное количество рекомбинантного поксвируса, кодирующего полипептид, содержащий по меньшей мере один опухолевый антиген (TAA); (b) антагонист PD-1; и (c) антагонист CTLA-4.
В еще одном варианте осуществления настоящего изобретения набор может содержать: (a) рекомбинантный поксвирусный вектор, причем указанный поксвирусный вектор содержит по меньшей мере один связанный с опухолью антиген (TAA); (b) по меньшей мере один антагонист или агонист иммунной контрольной точки; и (c) инструкции по введению терапевтически эффективного количества поксвирусного вектора и терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки так, чтобы терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имело повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В еще одном варианте осуществления настоящее изобретение включает способ лечения рака у онкологического пациента-человека, причем указанный способ включает введение пациенту комбинации, состоящей из: (a) терапевтически эффективного количества рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки является таким, что терапевтический эффект комбинации повышен по сравнению с введением или только поксвируса, содержащего по меньшей мере один TAA, или суб-терапевтически эффективного количества только по меньшей мере одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
Дополнительные цели и преимущества настоящего изобретения будут изложены частично в описании, которое следует ниже, и частично будут очевидны из описания, или могут быть изучены посредством осуществления настоящего изобретения на практике. Цели и преимущества настоящего изобретения будут реализованы и достигнуты посредством элементов и комбинаций, в особенности, указанных в прилагаемой формуле изобретения.
Следует понимать, что как вышеизложенное общее описание, так и последующее подробное описание настоящего изобретения являются только иллюстративными и пояснительными, и не предназначаются для ограничения настоящего изобретения, которое заявлено формулой.
Прилагаемые чертежи, которые включены в описание и составляют его часть, иллюстрируют один или более вариантов осуществления настоящего изобретения и вместе с описанием служат для пояснения принципов настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. MVA-BN-HER2 и антитело к CTLA-4 увеличивают количество инфильтрирующих опухоль антиген-специфических T-клеток CD8+. Мышам провели имплантацию, как описано в примере 2, и либо не проводили лечение, либо вводили 200 мкг антитела к CTLA-4 (в 100 мкл PBS, интраперитонеально, и/п) на 3-й и 18-й дни и/или 1 × 107 Инф. Ед.(инфицирующих единиц) MV-BN-HER2 (7,1 мкл, введение посредством скарификации хвоста, с/х) на 4-й и 18-й дни. На 25-й день легкие или селезенки с наличием опухоли объединяли (4 мыши/группа) и повторно стимулировали в течение ночи для измерения и специфических ответов на вирус и опухолевый антиген.
Фигура 2. Введение MVA-BN-HER2 увеличивало в селезенке количество и качество Т-клеток, специфических для опухолевого антигена и вируса. Мышам провели имплантацию, как описано в примере 3. A) Секторные диаграммы представляют собой площадь, взвешенную для отражения количества клеток ИФНγ+ на миллион T-клеток CD8+. B) При комбинированной терапии СИФ ИФНγ увеличивается с полифункциональными Т-клетками.
Фигура 3. В экспериментальной модели легочных метастазов MVA-BN-HER2 оказывает синергический эффект с антителом к CTLA-4 для устранения опухоли и увеличения выживаемости. Мышам провели имплантацию в 1-й день, как описано в примере 4, и вводили MVA-BN-HER2 на 4-й и 18-й дни, и антитело к CTLA-4 на 3-й и 17-й дни. **** p < 0,0001, логранговый критерий.
Фигура 4. Мышей с опухолями легких CT26-HER-2 лечили, как описано в примере 5, и на 25-й день анализировали опухолевую нагрузку. A) Мышей умерщвляли и перфузировали через трахею трипановый синий. Легкие удаляли и на короткое время погружали в перекись водорода, а затем в PBS. Опухоли видны как небольшие массы в не подвергавшихся лечению легких и в легких после лечения антителом к CTLA-4. У мышей, получавших лечение MVA-BN-HER2, не было видимых опухолей. Масштаб деления линейки равен 1 см. B) Мыши, пролеченные MVA-BN-HER2, на 25-й день имеют такую же массу легких, как и у интактных мышей, в то время как масса легких у мышей, не получавших лечение, и у мышей, получавших антитело к CTLA-4, на 25-й день значительно выше. **** p < 0,0001, однофакторный дисперсионный анализ ANOVA с критерием множественных сравнений Даннетта.
Фигура 5. Мышам провели имплантацию опухолей CT26-HER-2, как описано в примере 6. Мышам вводили MVA-BN-HER2 и антитело к CTLA-4 на 4-й и 18-й дни в дозе 200 мкг (A, 10 мг/кг), 66 мкг (B, 3 мг/кг) или 22 мкг (C, 1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, логранговый критерий.
Фигура 6. Мышам провели имплантацию, как описано в примере 7. На 1-й и 15-й дни мышам вводили MVA-BN-HER2 (1E7 Инф. Ед. в 100 мкл TBS, подкожно, п/к в основание хвоста) и 22 мкг антитела к CTLA-4 (1 мг/кг) на 1-й и 15-й дни. Результаты продемонстрировали, что MVA-BN-HER2 в комбинации с низкой дозой антитела к CTLA-4 значительно снижает опухолевую нагрузку к 20-му дню по сравнению с другими видами лечения.
Фигура 7. Мышам провели имплантацию опухолей CT26-HER-2, как описано в примере 8. Мышам вводили MVA-BN-HER2 и антитело к PD-1 на 4-й и 18-й дни в дозе 200 мкг (A, 10 мг/кг), 66 мкг (B, 3 мг/кг) или 22 мкг (C, 1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, * p < 0,05, н. з.=не имеет существенного значения по логранговому критерию.
Фигура 8. Самкам мышей линии BALB/c (в возрасте 6-8 недель, ~ 20 г, Simonsen Laboratories, Gilroy, CA) проводили имплантацию, как описано в примере 9. Мышам вводили MVA-BN-HER2 на 4-й и 18-й дни, и антитело к CTLA-4 и антитело к PD-1 на 3-й и 17-й дни в дозе каждого антитела 200 мкг (A, 10 мг/кг), 66 мкг (B, 3 мг/кг) или 22 мкг (C, 1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, логранговый критерий.
Фигура 9. Самкам мышей линии C57/BL6 ((в возрасте 6-8 недель, ~ 20 г, Simonsen Laboratories, Gilroy, CA) проводили имплантацию на 1-й день, как описано в примере 10. Мышам вводили MVA-BN-CV301, а также антитело к CTLA-4 и антитело к PD-1 (200 мкг каждого) и/п на 4-й и 18-й дни.
Фигура 10. Комбинированная терапия с использованием PROSTVAC и антитела к PD-1 в модели солидной опухоли E6. Мышам провели имплантацию, как описано в примере 12. A) Мышам на 1-й день вводили PROSTVAC-V, а на 8-й и 15-й дни - PROSTVAC-F. Антитело к PD-1 вводили на 1-й и 15-й дни. A) Средний объем опухоли у мышей. B) Рост отдельных опухолей у мышей.
Фигура 11. Комбинированная терапия с использованием PROSTVAC и антитела к LAG-3 в модели солидной опухоли E6. Мышам провели имплантацию, как описано в примере 13. A) Мышам на 1-й день вводили PROSTVAC-V, а на 8-й и 15-й дни - PROSTVAC-F. Антитело к LAG-3 вводили на 1-й и 15-й дни. A) Средний объем опухоли у мышей. B) Рост отдельных опухолей у мышей.
Фигура 12. PROSTVAC в комбинации с антителом к PD-1 и антителом к LAG-3 в модели солидной опухоли E6. Мышам провели имплантацию, как описано в примере 14. A) Мышам на 1-й день вводили PROSTVAC-V, а на 8-й и 15-й дни - PROSTVAC-F. Антитело к PD-1 и антитело к LAG-3 вводили на 1-й и 15-й дни. A) Средний объем опухоли у мышей. B) Рост отдельных опухолей у мышей.
Фигура 13. Мышам провели имплантацию, как описано в примере 15. Мышам вводили MVA-BN-HER2 на 7-й и 22-й дни (1E7 Инф. Ед., с/х) и антитело к ICOS на дни 1, 4, 8, 11, 15, 18, 22, 25 (200 мкг и/п). A) Средний рост опухоли. B) Рост опухоли у отдельных мышей.
Фигура 14. Экспрессия Tim-3 увеличивается при введении MVA-BN-HER2. Мышей лечили, как описано в примере 32. Экспрессию Tim-3 измеряли у мышей после введения на 1-й и 15-й дни MVA-BN-HER2 (1E7 Инф. Ед., с/х).
Фигура 15. Мышей лечили, как описано в примере 33. ICOS увеличивался в легких и крови на T-клетках CD8+ на 10-й день (A) и в легких, крови и селезенке на T-клетках CD4+ (B) после однократного введения MVA-BN-HER2. После второго введения MVA-BN-HER2 на 15-й день, ICOS увеличивался в легких, крови и селезенке на T-клетках CD8+ (C) и T-клетках CD4+ (D). Данные показаны как среднее ± СОС, по три мыши в каждой группе в каждый момент времени.
Фигура 16. Мышей лечили, как описано в примере 34. Экспрессия PD-1 увеличивалась в T-клетках CD8+ в легких и крови при введении в 1-й день MVA-BN-HER2 (A). При втором введении на 15-й день экспрессия PD-1 дополнительно увеличивалась в легких, селезенке и крови (C). Экспрессия PD-1 незначительно увеличивалась на T-клетках CD4+ в легких после однократного введения (B) и оставалась стабильной после второго лечебного введения MVA-BN-HER2 (D).
Фигура 17. Мышей лечили, как описано в примере 35. Экспрессия LAG-3 увеличивалась в T-клетках CD8+ в легких, селезенке и крови после дня 1 (A) или дней 1 и 15 (C) введения MVA-BN-HER2. Экспрессия LAG-3 в T-клетках CD4+ незначительно увеличивалась после дня 1 (B) или дней 1 и 15 (D) введения MVA-BN-HER2.
Фигура 18. MVA-BN-CV301 и антитело к PD-1 замедляют рост опухоли в модели солидной опухоли MC38-CEA. Мышам провели внутрикожную (в/к) имплантацию опухолей MC38-CEA и лечили, как описано в примере 37. Мышам дополнительно вводили MVA-BN-CV301 и антитело к PD-1. A) Средний объем опухоли у мышей. B) Рост отдельных опухолей у мышей.
Фигура 19. Комбинированная терапия с использованием MVA-BN-CV301 и антитела к LAG-3 в модели солидной опухоли MC38-CEA. Мышам провели в/к имплантацию опухолей MC38-CEA и лечили, как описано в примере 38. Мышам дополнительно вводили MVA-BN-CV301 и антитело к LAG-3. A) Средний объем опухоли у мышей. B) Рост отдельных опухолей у мышей.
Фигура 20. MVA-BN-CV-301 в комбинации с антителом к PD-1 и антителом к LAG-3. Мышам провели в/к имплантацию опухолей MC38-CEA и лечили, как описано в примере 39. Мышам дополнительно вводили MVA-BN-CV-301, антитело к LAG-3 и антитело к PD1. A) Средний объем опухоли у мышей. B) Рост отдельных опухолей у мышей.
Фигура 21. Мышей лечили, как описано в примере 40. Объединенные спленоциты анализировали на PSA-специфические ответы посредством анализа ELISPOT ИФНγ (A, B), а на цитотоксическую активность - с помощью проточной цитометрии ( % CD107+ ИФНγ+ T-клеток CD8) (C). Титры IgG к PSA были определены с помощью ИФА для каждой отдельной мыши (D). Для анализа ELISPOT на графиках показаны репрезентативные данные из четырех независимо проведенных экспериментов.
Фигура 22. Мышей лечили, как описано в примере 41. (A) Секторные диаграммы взвешены по размеру для отражения количества обнаруженных клеток (общие количества PSA-специфических CD8 на миллион T-клеток приведены ниже каждой диаграммы). (B) Величина продукции ИФНγ на одну клетку по результатам измерений по средней интенсивности флуоресценции (СИФ). На графиках показаны репрезентативные данные из двух независимо проведенных экспериментов.
Фигура 23. Мышей лечили, как описано в примере 42. Объединенные спленоциты анализировали на специфическую для вируса коровьей оспы (VV) (панели A и C слева) или PSA-специфическую (панели A и C справа) цитотоксическую активность с помощью проточной цитометрии ( % CD107+ ИФНγ+ T-клетки CD8) через 14 дней после последнего введения. На графиках показаны репрезентативные данные из двух независимо проведенных экспериментов.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В ряд текущих клинических исследований включены терапевтические средства с использованием векторов на основе вируса коровьей оспы, модифицированного вируса коровьей оспы Анкара (MVA) и поксвируса домашней птицы, которые были сконструированы для экспрессии одного или более антигенов, связанных с опухолью (TAA). Эти векторы используются в одиночку или в стратегии первичной вакцинации (примирования) и повторной вакцинации (бустинга) для создания активного иммунного ответа против различных раковых заболеваний. В вакцине PROSTVAC® используется стратегия бустер-примирования с использованием вируса коровьей оспы и поксвируса домашней птицы, экспрессирующих PSA, и TRICOMTM, и в настоящее время она проходит глобальное клиническое исследование фазы III (PROSPECT) при метастатическом кастрационно-резистентном раке предстательной железы. В вакцине CV301 (или CV-301) используется стратегия гетерологичного бустер-примирования с использованием вируса коровьей оспы и поксвируса домашней птицы, экспрессирующих антиген MUC-1, CEA и TRICOMTM, и в настоящее время она проходит клиническое исследование фазы II при раке мочевого пузыря.
MVA-BN-HER2 (Mandl et al, 2012) в настоящее время проходит клинические исследования фазы I для лечения HER-2+-рака молочной железы. Этот рекомбинантный вектор получен из очень ослабленного модифицированного вирусного штамма коровьей оспы Анкара (MVA), известного как MVA-BN. Он экспрессирует модифицированную форму HER-2 (обозначенную как HER2), состоящую из внеклеточного домена HER-2, который был разработан с включением в него двух универсальных Т-клеточных эпитопов из столбнячного токсина (TTp2 и TTp30) для облегчения индукции эффективных иммунных ответов против HER-2.
В целях дальнейшего повышения противоопухолевой эффективности иммунотерапии на основе поксвируса, MVA-BN-HER2 комбинировали с моноклональным антителом, которое блокирует активность CTLA-4, белка иммунной контрольной точки, который подавляет активацию T-клеток. В экспериментальной модели легочных метастазов CT26-HER-2 среднее время выживаемости увеличилось с 30 дней у непролеченных мышей до 49,5 дней при лечении MVA-BN-HER2, тогда как лечение только антителом к CTLA-4 показало лишь небольшое преимущество в отношении выживаемости (средняя выживаемость 35 дней). Напротив, MVA-BN-HER2 в комбинации с антителом к CTLA-4 значительно повышает выживаемость до более чем 100 дней (p < 0,0001) у более чем 50% мышей. Через 100 дней изучали легкие выживших мышей и не обнаружили видимых опухолей.
Каждый из PROSTVAC® и MVA-BN-CV301 (MVA, экспрессирующий CEA и MUC-1 с TRICOM или без) также протестировали в различных моделях опухолей в комбинации с различными антителами-антагонистами, направленными против PD-1 и LAG-3. Было обнаружено, что комбинации усиливают эффекты PROSTVAC® и MVA-BN-CV301.
Ввиду токсичности и неблагоприятных эффектов лечения рака с использованием антагонистов CTLA-4 и других антагонистов или агонистов иммунной контрольной точки (см., например, Mellman et al. Nature 2011), были проведены анализы титрования дозы с использованием рекомбинантного поксвируса, кодирующего связанный с опухолью антиген, такого как MVA-BN-HER2, в комбинации с моноклональным антителом, которое блокирует активность CTLA-4. Как проиллюстрировано и описано в настоящем описании, терапия с использованием рекомбинантного поксвирусного препарата, такого как MVA-BN-HER2, в комбинации с ингибированием CTLA-4, обеспечивала достижение улучшенных терапевтических эффектов по сравнению с видами лечения рака с использованием только ингибирования CTLA-4 или только терапии рекомбинантным поксвирусным препаратом. Самое главное, что комбинированная терапия поддерживала терапевтическую эффективность даже при применении более низких доз.
Для определения степени усиления противоопухолевой эффективности иммунотерапии на основе поксвируса с использованием дополнительных антагонистов или агонистов иммунной контрольной точки, MVA-BN-HER2 комбинировали с моноклональным антителом, которое блокирует активность CTLA-4, а также с антагонистическим антителом к PD-1. Как проиллюстрировано и описано в настоящем описании, комбинация терапии с использованием рекомбинантного поксвирусного препарата с антителом к CTLA-4 и антагонистом PD-1 обеспечивала достижение улучшенных терапевтических эффектов по сравнению с видами лечения рака с использованием только комбинации ингибирования CTLA-4 и PD-1 или только терапии рекомбинантным поксвирусным препаратом. Самое главное, что комбинированная терапия поддерживала терапевтическую эффективность даже при применении более низких доз.
Для дальнейшего определения степени усиления противоопухолевой эффективности иммунотерапии на основе поксвируса с использованием дополнительных антагонистов и агонистов иммунной контрольной точки, были проведены анализы титрования дозы с использованием рекомбинантного поксвируса, кодирующего связанный с опухолью антиген, такого как MVA-BN-HER2, в комбинации с различными дополнительными антагонистами или агонистами иммунной контрольной точки, как описано в настоящем описании. Как проиллюстрировано и описано в настоящем описании, комбинация терапии с использованием рекомбинантного поксвирусного препарата с антагонистами или агонистами иммунной контрольной точки, описанными в настоящей заявке, обеспечивала достижение улучшенных терапевтических эффектов. Самое главное, что комбинированная терапия поддерживала терапевтическую эффективность даже при применении более низких доз.
По меньшей мере в одном аспекте способы и композиции настоящего изобретения вместе с их преимущественной терапевтической эффективностью в низких дозах разработаны для максимального увеличения терапевтического эффекта противораковых средств, влияющих на иммунные контрольные точки, и поксвирусных средств, и в то же время они разработаны для того, чтобы свести к минимуму неблагоприятные побочные эффекты, наблюдаемые при применении существующих средств для терапии рака. В одном варианте осуществления настоящего изобретения эти терапевтические преимущества с пониженными неблагоприятными эффектами достигаются за счет введения более низких доз антагониста или агониста иммунной контрольной точки (например, антитела-антагониста CTLA-4) в комбинации с поксвирусным терапевтическим средством. Как предусмотрено в настоящем изобретении, при комбинации с поксвирусным терапевтическим средством, агонист и антагонисты иммунной контрольной точки сохраняют эффективность лечения даже в более низких дозах. Важно отметить, что эти более низкие дозы, сохраняющие терапевтическую эффективность, могут включать в себя дозы, при которых агонист или антагонист иммунной контрольной точки будет терапевтически неэффективен при введении в качестве монотерапии.
В других вариантах осуществления настоящее изобретение включает одну или более схем дозирования и способов введения комбинации поксвирусного терапевтического средства и антагониста или агониста иммунной контрольной точки. По меньшей мере в одном аспекте схемы дозирования и способы введения, представленные в настоящем описании, разработаны для максимального увеличения терапевтического эффекта противораковых средств, влияющих на иммунные контрольные точки, и поксвирусных средств, и в то же время они разработаны для того, чтобы свести к минимуму неблагоприятные побочные эффекты, связанные со средствами для терапии рака.
Поксвирус, кодирующий полипептид, который содержит опухолевый антиген
В одном варианте осуществления настоящего изобретения предложен способ, включающий введение онкологическому пациенту-человеку рекомбинантного поксвируса, кодирующего и/или экспрессирующего полипептид, содержащий по меньшей мере один опухолевый антиген или связанный с опухолью антиген; и введение пациенту по меньшей мере одного антагониста или агониста иммунной контрольной точки.
В одном варианте осуществления настоящего изобретения рекомбинантный поксвирус, экспрессирующий опухолевый антиген, предпочтительно представляет собой ортопоксвирус, такой как, но не ограничиваясь перечисленным, вирус коровьей оспы, модифицированный вирус коровьей оспы Анкара (MVA) или MVA-BN.
Примеры штаммов вируса коровьей оспы представляют собой штаммы Temple of Heaven, Copenhagen, Paris, Budapest, Dairen, Gam, MRIVP, Per, Tashkent, TBK, Tom, Bern, Patwadangar, BIEM, B-15, Lister, EM-63, New York City Board of Health, Elstree, Ikeda и WR. Предпочтительным штаммом вируса коровьей оспы (VV) является штамм Wyeth (DRYVAX) (патент США № 7410644). Другим предпочтительным штаммом VV является модифицированный вирус коровьей оспы Анкара (MVA) (Sutter, G. et al. [1994], Vaccine 12: 1032-40). Другим предпочтительным штаммом VV является MVA-BN.
Примерами штаммов вируса MVA, применяемых при осуществлении на практике настоящего изобретения и депонированных в соответствии с требованиями Будапештского договора, являются штаммы MVA 572, депонированные в Европейской коллекции культур клеток животных (ECACC), Лаборатории исследования и производства вакцин, Лабораторной службе общественного здравоохранения, Центре прикладной микробиологии и исследований в Porton Down, Salisbury, Wiltshire SP4 0JG, United Kingdom (Великобритания) под номером депозита ECACC 94012707 от 27 января 1994 г. и MVA 575, депонированный под номером ECACC 00120707 7 декабря 2000 г. Дополнительными иллюстративными штаммами являются MVA-BN, депонированный 30 августа 2000 г в Европейской коллекции культур клеток (ECACC) под номером V00083008, и его производные.
Хотя MVA-BN является предпочтительным благодаря более высокой безопасности (менее способен к репликации), для данного изобретения пригодны все штаммы MVA. В соответствии с вариантом осуществления настоящего изобретения штамм MVA представляет собой MVA-BN и его производные. Определение MVA-BN и его производных приведено в публикации PCT/EP01/13628, которая включена в настоящий документ путем ссылки.
В одном варианте осуществления настоящее изобретение охватывает применение рекомбинантных ортопоксвирусов, предпочтительно вируса коровьей оспы (VV), штамма Wyeth, ACAM 1000, ACAM 2000, MVA или MVA-BN для терапии рака. Рекомбинантные ортопоксвирусы генерируются путем вставки в ортопоксвирус гетерологичных последовательностей.
В некоторых вариантах осуществления настоящего изобретения ортопоксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA). В предпочтительном варианте осуществления настоящего изобретения TAA включает, но не ограничивается перечисленным, CEA, MUC-1, PAP, PSA, HER-2, сурвивин, tyrp1, tyrp2 или антиген брахиурии.
В дополнительных вариантах осуществления настоящего изобретения связанный с опухолью антиген модифицирован для содержания одного или более чужеродных эпитопов TH. В настоящем описании описаны различные иммунотерапевтические противораковые агенты. По меньшей мере в одном аспекте в настоящем изобретении разрешено применение таких агентов в схемах вакцинации примирования/бустинга у людей и других млекопитающих, в том числе у пациентов с ослабленным иммунитетом; и индуцирование как гуморального, так и клеточного иммунных ответов, например, включая иммунный ответ Th1 в уже существующей среде Th2.
В некоторых вариантах осуществления настоящего изобретения MVA представляет собой MVA-BN, депонированный 30 августа 2000 г в Европейской коллекции культур клеток (ECACC) под номером V00083008, и описанный в международной публикации PCT WO2002042480 (см. также, например, патенты США № 6761893 и 6913752). Как также описано в этих патентных публикациях, в клеточных линиях 293, 143B, HeLa и HaCat не происходит репродукции MVA-BN путем репликации. В частности, в клеточной линии почки эмбриона человека 293 амплификационное отношение MVA-BN составляет от 0,05 до 0,2. В клеточной линии остеосаркомы кости человека 143B амплификационное отношение MVA-BN находится в диапазоне от 0,0 до 0,6. В клеточной линии аденокарциномы шейки матки человека HeLa амплификационное отношение MVA-BN составляет от 0,04 до 0,8, а в клеточной линии кератиноцитов человека HaCat - от 0,02 до 0,8. MVA-BN характеризуется амплификационным отношением от 0,01 до 0,06 в клетках почки африканской зеленой мартышки (CV1: ATCC No. CCL-70).
Амплификационное отношение MVA-BN в фибробластах эмбрионов цыплят (CEF:первичные культуры) превышает 1, как описано в международной публикации PCT WO2002042480 (см. также, например, патенты США № 6761893 и 6913752). Вирус может легко размножаться и амплифицироваться в первичных культурах CEF с отношением выше 500.
В некоторых вариантах осуществления настоящего изобретения рекомбинантный MVA является производным MVA-BN. Такие «производные» включают в себя вирусы, проявляющие по существу те же самые репликационные характеристики, что и депонированный штамм (ECACC № V00083008), но имеющие отличия в одной или более частей своего генома. Вирусы, имеющие те же «репликационные характеристики», что и депонированный вирус, представляют собой вирусы, которые реплицируются со сходными амплификационными отношениями, что и депонированный штамм, в клетках CEF и клеточных линиях HeLa, HaCat и 143B, и которые проявляют подобные репликационные характеристики in vivo при определении, например, на модели трансгенной мыши AGR129.
В некоторых вариантах осуществления настоящего изобретения поксвирус представляет собой рекомбинантный вирус коровьей оспы, содержащий дополнительные нуклеотидные последовательности, которые являются гетерологичными для поксвируса. В некоторых таких вариантах осуществления настоящего изобретения гетерологичные последовательности кодируют эпитопы, которые индуцируют ответ иммунной системы. Таким образом, в некоторых вариантах осуществления настоящего изобретения рекомбинантный поксвирус применяют для вакцинации против белков или агентов, содержащих эпитоп. В одном варианте осуществления настоящего изобретения эпитоп представляет собой связанный с опухолью антиген, предпочтительно, HER-2. В одном варианте осуществления настоящего изобретения антиген HER-2 содержит последовательность с SEQ ID NO: 2.
В других вариантах осуществления настоящего изобретения эпитоп представляет собой связанный с опухолью антиген, выбранный из антигена, такого как, но не ограничиваясь перечисленным, CEA, MUC-1, PAP, PSA, HER-2, сурвивин, tyrp1, tyrp2 или антиген брахиурии.
В некоторых вариантах осуществления настоящего изобретения гетерологичная последовательность нуклеиновой кислоты, кодирующая связанный с опухолью антиген, описанный в настоящем описании, вставлена в несущественную область вирусного генома. В некоторых из таких вариантов осуществления настоящего изобретения гетерологичная последовательность нуклеиновой кислоты вставлена в природный сайт делеции генома MVA, как описано в PCT/EP96/02926. Способы вставки гетерологичных последовательностей в геном поксвируса известны специалисту в данной области.
В другом варианте осуществления настоящего изобретения рекомбинантный поксвирус, экспрессирующий опухолевый антиген, представляет собой авипоксвирус, такой как, но не ограничиваясь перечисленным, поксвирус домашней птицы.
Термин «авипоксвирус» относится к любому авипоксвирусу, такому как Fowlpoxvirus, Canarypoxvirus, Uncopoxvirus, Mynahpoxvirus, Pigeonpoxvirus, Psittacinepoxvirus, Quailpoxvirus, Peacockpoxvirus, Penguinpoxvirus, Sparrowpoxvirus, Starlingpoxvirus и Turkeypoxvirus. Предпочтительными авипоксвирусами являются Canarypoxvirus и Fowlpoxvirus.
Примером поксвируса канареек является штамм Rentschler. Выделенный из бляшки и очищенный штамм Canarypox, обозначенный как ALVAC (патент США № 5766598) был депонирован в соответствии с условиями Будапештского договора в Американской коллекции типовых культур (ATCC) под номером доступа VR-2547. Другой штамм Canarypox, представляющий собой штамм коммерчески доступной вакцины поксвируса канарейки, обозначенный как LF2 CEP 524 24 10 75, доступен от Institute Merieux, Inc.
Примерами поксвируса домашней птицы (Fowlpox) являются штаммы FP-1, FP-5, TROVAC (патент США № 5766598) и POXVAC-TC (патент США № 7410644). FP-1 представляет собой штамм Duvette, модифицированный для использования в качестве вакцины у однодневных цыплят. Этот штамм, представляющий собой штамм коммерчески доступной вакцины поксвируса домашней птицы, был обозначен как O DCEP 25/CEP67/2309, октябрь 1980 г., и доступен от Institute Merieux, Inc. FP-5 представляет собой штамм коммерчески доступной вакцины поксвируса домашней птицы, полученного из эмбриона цыпленка, доступный от Американских научных лабораторий (отдел компании Schering Corp.) Мэдисонн, штат Висконсин., ветеринарная лицензия США № 165, серийный № 30321.
Примеры штаммов вируса коровьей оспы представляют собой штаммы Temple of Heaven, Copenhagen, Paris, Budapest, Dairen, Gam, MRIVP, Per, Tashkent, TBK, Tom, Bern, Patwadangar, BIEM, B-15, Lister, EM-63, New York City Board of Health, Elstree, Ikeda и WR. Предпочтительный штамм вируса коровьей оспы (VV) может включать в себя штамм Wyeth (DRYVAX) (патент США 7410644), ACAM 1000 или ACAM 2000. Другим предпочтительным штаммом VV является модифицированный вирус коровьей оспы Анкара (MVA) (Sutter, G. et al. [1994], Vaccine 12: 1032-40). Другим предпочтительным штаммом VV является MVA-BN.
В некоторых вариантах осуществления настоящего изобретения авипоксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA). В предпочтительном варианте осуществления настоящего изобретения TAA включает, но не ограничивается перечисленным, CEA, MUC-1, PAP, PSA, HER-2, сурвивин, tyrp1, tyrp2 или антиген брахиурии.
В других вариантах осуществления настоящего изобретения рекомбинантный поксвирус, экспрессирующий опухолевый антиген, представляет собой комбинацию вируса коровьей оспы, экспрессирующего опухолевый антиген, и авипоксвируса, такого как поксвирус домашней птицы, экспрессирующего опухолевый антиген. Предполагается, что комбинацию вируса коровьей оспы и поксвируса домашней птицы можно вводить как схему гетерологичного бустер-примирования. В одном неограничивающем примере схема гетерологичного бустер-примирования представляет собой PROSTVAC® или CV301.
Для получения вакцины поксвирус может быть переведен в физиологически приемлемую форму. В некоторых вариантах осуществления настоящего изобретения такой препарат может быть приготовлен на основе опыта получения поксвирусных вакцин для вакцинации против натуральной оспы, как описано, например, в публикации Stickl, H. et al., Dtsch. med. Wschr. 99, 2386-2392 (1974).
Пример получения описан ниже. Очищенный вирус с титром 5×108 TCID50/мл в составе композиции 10 мМ Трис, 140 мМ NaCl, pH 7,4 хранят при -80 °C. Например, для получения препаратов вакцин для инъекций 102-108 частиц вируса лиофилизируют в фосфатно-буферном растворе (PBS) в присутствии 2% пептона и 1% альбумина человека в ампуле, предпочтительно в стеклянной ампуле. Альтернативно, препараты вакцин для инъекций получают путем ступенчатой лиофильной сушки вируса в композиции. В некоторых вариантах осуществления настоящего изобретения композиция может содержать дополнительные добавки, такие как маннит, декстран, сахар, глицин, лактоза, поливинилпирролидон или другие вспомогательные вещества, такие как, включая, но не ограничиваясь перечисленным, антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, сывороточный альбумин человека), подходящие для введения in vivo. Затем ампулу герметизируют, после чего ее можно хранить при подходящей температуре, например, от 4°C до комнатной температуры в течение нескольких месяцев. Однако при отсутствии необходимости в использовании ампулы, ее хранят предпочтительно при температуре ниже -20 °C.
В различных вариантах осуществления настоящего изобретения для вакцинации или терапии лиофилизат может быть растворен в 0,1-0,5 мл водного раствора, предпочтительно, физиологического раствора или буферного раствора трис, и затем введен системно или местно, т. е. парентерально, подкожно, внутривенно, внутримышечно, интраназально, внутрикожно или любым другим способом введения, известным специалистам в данной области. Способ введения, доза и количество введений могут быть оптимизированы специалистом в данной области с использованием известных способов.
В некоторых вариантах осуществления настоящего изобретения ослабленные штаммы вируса коровьей оспы применяют для индуцирования иммунных ответов у животных с ослабленным иммунитетом, например, у обезьян, инфицированных SIV (CD4<400/мкл крови), или у людей с ослабленным иммунитетом. Термин «ослабленный иммунитет» описывает состояние иммунной системы индивидуума, у которого возникают только неполные иммунные ответы или который характеризуется сниженной эффективностью защиты от инфекционных агентов.
Некоторые примеры антигенов, связанных с опухолью
В некоторых вариантах осуществления настоящего изобретения у субъекта продуцируется иммунный ответ против полипептидного антигена, связанного с клеткой. В некоторых таких вариантах осуществления настоящего изобретения полипептидный антиген, связанный с клеткой, представляет собой связанный с опухолью антиген.
Термин «полипептид» относится к полимеру, состоящему из двух или более аминокислот, соединенных друг с другом пептидными связями или модифицированными пептидными связями. Аминокислоты могут быть встречающимися в природе и не встречающимися в природе или представлять собой химический аналог природной аминокислоты. Этот термин также относится к белкам, т. е. к функциональным биомолекулам, содержащим по меньшей мере один полипептид; причем если они содержат по меньшей мере два полипептида, они могут образовывать комплексы, быть ковалентно связанными или могут быть нековалентно связанными. Полипептид (-ы) в белке могут быть гликозилированными и/или липидированными, и/или могут содержать простетические группы.
Предпочтительно, связанный с опухолью антиген включает в себя, но не ограничивается перечисленным, HER-2, PSA, PAP, CEA, MUC-1, сурвивин, tyrp1, tyrp2 или антиген брахиурии, отдельно или в комбинации. Такая иллюстративная комбинация может включать в себя CEA и MUC-1, также известна как CV301. Другие иллюстративные комбинации могут включать в себя PAP и PSA.
Многочисленные антигены, связанные с опухолью, известны в данной области. Иллюстративные антигены, связанные с опухолью, включают в себя, но не ограничиваются перечисленным, 5-альфа-редуктазу, альфа-фетопротеин, AM-1, APC, April, BAGE, бета-катенин, Bcl12, bcr-abl, CA-125, CASP-8/FLICE, катепсины, CD19, CD20, CD21, CD23, CD22, CD33 CD35, CD44, CD45, CD46, CD5, CD52, CD55, CD59, CDC27, CDK4, CEA, c-myc, Cox-2, DCC, DcR3, E6/E7, CGFR, EMBP, Dna78, фарнезилтрансферазу, FGF8b, FGF8a, FLK-1/KDR, рецептор фолиевой кислоты, G250, семейство GAGE, гастрин 17, гастрин-рилизинг гормон, GD2/GD3/GM2, GnRH, GnTV, GP1, gp100/Pmel17, gp-100-in4, gp15, gp75/TRP-1, hCG, гепараназу, Her2/neu, HMTV, Hsp70, hTERT, IGFR1, ИЛ-13R, iNOS, Ki67, KIAA0205, K-ras, H-ras, N-ras, KSA, LKLR-FUT, семейство MAGE, маммаглобин, MAP17, мелан-A/MART-1, мезотелин, MIC A/B, MT-MMP, муцин, NY-ESO-1, остеонектин, p15, P170/MDR1, p53, p97/меланотрансферрин, PAI-1, PDGF, uPA, PRAME, пробазин, прогенипоиентин, PSA, PSM, RAGE-1, Rb, RCAS1, SART-1, семейство SSX, STAT3, STn, TAG-72, TGF-альфа, TGF-бета, тимозин-бета-15, ФНО-альфа, TYRP-, TYRP-2, тирозиназу, VEGF, ZAG, p16INK4 и глутатион-S-трансферазу.
Предпочтительный антиген PSA содержит аминокислотную замену изолейцина на лейцин в положении 155. Патент США № 7247615, включен в настоящий документ путем ссылки.
Один иллюстративный связанный с опухолью антиген, представляет собой HER-2. НER-2 является представителем семейства рецепторов эпидермального фактора роста (c-erbB), которое в настоящее время состоит из четырех различных рецепторов: c-erbB-1 (EGFr), c-erbB-2 (HER-2, c-Neu), c-erbB-3 и c-erbB-4 (Salomon et al, 1995). C-erbB-3 и c-erbB-4 охарактеризованы хуже, чем EGFr и HER-2. HER-2 является интегральным гликопротеином. Зрелый белок имеет молекулярную массу 185 кД со структурными особенностями, которые имеют близкое сходство с рецептором EGFr (Prigent et al, 1992). EGFr также является интегральным мембранным рецептором, состоящим из одной субъединицы. Он имеет явную молекулярную массу 170 кД и состоит из домена, связывающего поверхностный лиганд из 621 аминокислоты, единственного гидрофобного трансмембранного домена из 23 аминокислот и высоко консервативного цитоплазматического тирозинкиназного домена из 542 аминокислот. Белок является N-гликозилированным (Prigent et al, 1994).
Все белки этого семейства являются тирозинкиназами. Взаимодействие с лигандом приводит к димеризации рецептора, которая усиливает каталитическое действие тирозинкиназы (Bernard. 1995, Chantry 1995). Белки в пределах семейства способны к гомо- и гетеродимеризации, которая важна для их активности. EGFr передает стимулирующие рост эффекты и стимулирует поглощение клетками глюкозы и аминокислот (Prigent et al 1992). HER-2 также передает стимулирующие рост сигналы.
Рецептор эпидермального фактора роста экспрессируется в нормальных тканях в небольших количествах, но он сверхэкспрессируется при многих типах раковых заболеваний. EGFr сверхэкспрессируется при разных видах рака молочной железы (Earp et al, 1993, Eppenberger 1994), глиомах (Schlegel et al, 1994), раке желудка (Tkunaga et al, 1995), плоскоклеточном раке кожи (Fujii 1995), раке яичников (van Dam et al, 1994) и других. HER-2 также экспрессируется в немногих нормальных тканях человека в небольшом количестве, наиболее типично в секретирующем эпителии. Сверхэкспрессия HER-2 происходит приблизительно в 30% случаев рака молочной железы, желудка, поджелудочной железы, мочевого пузыря и яичников.
Экспрессия этих рецепторов варьирует в зависимости от степени дифференцировки опухолей и типа рака, например, при раке молочной железы первичные опухоли сверхэкспрессируют оба рецептора; тогда как при раке желудка сверхэкспрессия происходит на последней стадии в метастатических опухолях (Salomon et al, 1995). Количество сверхэкспрессированных рецепторов на клетках карциномы составляет более чем 106/клетка для отдельных видов рака головы и шеи, раковых линий вульвы, молочной железы и яичников, выделенных из организма пациентов (Dean et al, 1994).
Существует несколько причин того, почему семейство рецепторов EGFr составляют пригодные мишени для иммунотерапии опухолей. Во-первых, они сверхэкспрессируются во многих типах рака, и это должно направлять иммунный ответ на опухоль. Во-вторых, опухоли часто экспрессируют или сверхэкспрессируют лиганды для этого семейства рецепторов, и некоторые являются гиперчувствительными к пролиферативным эффектам, опосредованным лигандами. В третьих, пациенты с опухолями, которые сверхэкспрессируют рецепторы факторов роста, часто имеют плохой прогноз. Сверхэкспрессия была тесно связана с плохим прогнозом, особенно при раке молочной железы, раке легких и раке мочевого пузыря и может быть связана с инвазивными/метастатическими фенотипами, которые довольно нечувствительны к традиционному лечению (Eccles et al, 1994).
Модифицированные антигены, связанные с опухолью
В некоторых вариантах осуществления настоящего изобретения полипептидный антиген, связанный с клеткой, модифицирован так, что CTL-ответ индуцируется против клетки, на которой представлены эпитопы, полученные из полипептидного антигена на их поверхности, в случае представления в связи с молекулой класса I МНС на поверхности APC. В некоторых таких вариантах осуществления настоящего изобретения по меньшей мере один первый чужеродный эпитоп TH (в случае представления), связан с молекулой класса II МНС на поверхности APC. В некоторых таких вариантах осуществления настоящего изобретения антиген, связанный с клеткой представляет собой связанный с опухолью антиген.
Типичные APC, способные представлять эпитопы, включают в себя дендритные клетки и макрофаги. Дополнительные типичные APC включают в себя любую пино- или фагоцитирующую клетку АРС, которая способна к одновременному представлению 1) CTL-эпитопов, связанных с молекулами класса I МНС 2) TH эпитопов, связанных с молекулами класса II МНС.
В некоторых вариантах осуществления настоящего изобретения в этом документе представлены модификации одного или более антигенов, связанных с опухолью (TAA), таких как, но не ограничиваясь перечисленным, CEA, MUC-1, PAP, PSA, HER-2, сурвивин, tyrp1, tyrp2 или антиген брахиурии, которые выполнены таким образом, что после введения субъекту, они вызывают выработку поликлональных антител, которые преимущественно реагируют с одним или более из TAA, описанных в настоящем описании. Такие антитела могут атаковать и устранять опухолевые клетки, а также предотвращать развитие метастатических клеток в метастазы. Эффекторный механизм такого противоопухолевого действия будет опосредован комплементом и антителозависимой клеточноопосредованной цитотоксичностью. Кроме того, индуцированные антитела также могут ингибировать рост раковых клеток благодаря ингибированию зависимой от факторов роста олигодимеризации и интернализации рецепторов. В некоторых вариантах осуществления настоящего изобретения такие модифицированные TAA могут индуцировать CTL-ответы, направленные против известных и/или прогнозируемых эпитопов TAA, представляемых опухолевыми клетками.
В некоторых вариантах осуществления настоящего изобретения модифицированный полипептидный антиген TAA содержит CTL-эпитоп полипептидного антигена, связанный с клеткой, и вариант, причем вариант содержит по меньшей мере один CTL-эпитоп чужеродного TH-эпитопа. Некоторые такие модифицированные ТАА могут включать в себя в одном неограничивающем примере один или более полипептидных антигенов HER-2, содержащих по меньшей мере один CTL-эпитоп, и вариант, содержащий по меньшей мере один CTL-эпитоп чужеродного TH-эпитопа, и способы их получения описаны в патенте США № 7005498 и патентных публикациях США № 2004/0141958 и 2006/0008465.
В некоторых вариантах осуществления настоящего изобретения чужеродный TH-эпитоп представляет собой встречающийся в природе «неразборчивый» T-клеточный эпитоп. Такие «неразборчивые» T-клеточные эпитопы активны у большой части представителей вида животного или популяции животных. В некоторых вариантах осуществления настоящего изобретения вакцина содержит такие «неразборчивые» T-клеточные эпитопы. В некоторых таких вариантах осуществления настоящего изобретения использование «неразборчивых» T-клеточных эпитопов уменьшает необходимость в очень большом количестве различных CTL-эпитопов в одной и той же вакцине. Иллюстративные «неразборчивые» T-клеточные эпитопы включают, но не ограничиваются перечисленным, эпитопы из столбнячного токсина, в том числе, но не ограничиваясь перечисленным, эпитопы P2 и P30 (Panina-Bordignon et al., 1989), токсина дифтерии, гемагглютинина вируса гриппа (HA) и антигена CS P. falciparum.
Дополнительные неразборчивые T-клеточные эпитопы включают пептиды, способные к связыванию большой части молекул HLA-DR, кодируемых различными HLA-DR. См., например, WO 98/23635 (Frazer IH et al., права переданы Университету Квинсленда); Southwood S et. al, 1998, J. Immunol. 160: 3363 3373; Sinigaglia F et al., 1988, Nature 336: 778 780; Rammensee HG et al., 1995, Immunogenetics 41: 4 178 228; Chicz RM et al., 1993, J. Exp. Med 178: 27 47; Hammer J et al., 1993, Cell 74: 197 203; и Falk K et al., 1994, Immunogenetics 39: 230 242. Последняя ссылка также связана с HLA-DQ и -DP лигандами. Все эпитопы, перечисленные в этих ссылках, являются подходящими в качестве потенциальных природных эпитопов, описанных в настоящем описании, поскольку являются эпитопами, которые обладают общими мотивами с данными эпитопами.
В некоторых других вариантах осуществления настоящего изобретения «неразборчивый» T-клеточный эпитоп является искусственным T-клеточным эпитопом, который способен связываться с большой частью гаплотипов. В некоторых таких вариантах осуществления настоящего изобретения искусственный T-клеточный эпитоп представляет собой пептид DR-эпитопа, используемый при пэннинге (PADRE), описанный в WO 95/07707 и в соответствующей статье Alexander J et al., 1994, Immunity 1: 751 761.
mHER2
Различные модифицированные полипептидные антигены HER-2 и способы их получения описаны в патенте США № 7005498 и патентных публикациях США № 2004/0141958 и 2006/0008465, которые включены в настоящий документ путем ссылки. В этих документах описаны различные модифицированные полипептидные антигены HER-2, содержащие «неразборчивые» T-клеточные эпитопы в разных положениях полипептида HER-2.
Последовательность HER-2 человека может быть разделена на ряд доменов исключительно только на основании первичной структуры белка. Эти домены являются следующими. Внеклеточный (рецепторный) домен состоит из аминокислот 1-654 и содержит несколько следующих субдоменов: домен I (N-концевой домен зрелого полипептида) состоит из аминокислот 1-173; домен II (богатый цистеином домен, 24 остатка цистеина) состоит из аминокислот 174-323; домен III (лигандсвязывающий домен гомологичного EGF-рецептора) состоит из аминокислот 324-483; и домен IV (богатый цистеином домен, 20 остатков цистеина) состоит из аминокислот 484-623. Трансмембранные остатки состоят из аминокислот 654-675. Внутриклеточный (киназный) домен состоит из аминокислот 655-1235 и содержит тирозинкиназный домен, который состоит из аминокислот 655-1010 (коровый ТК-домен из 725-992); и С-концевой домен, который состоит из аминокислот 1011-1235.
Селекция сайтов аминокислотной последовательности HER-2, заменяемых либо Р2, либо Р30 Т-хелперными эпитопами человека описан в патенте США № 7005498 и патентных публикациях США № 2004/0141958 и 2006/0008465. В итоге были учтены перечисленные ниже параметры.
1. Известные и предсказанные CTL-эпитопы.
2. Гомология с родственными рецепторами (в частности, EGFR).
3. Сохранение остатков цистеина.
4. Предсказанная петля, α-спиральная и ß-складчатая структура.
5. Потенциальные сайты N-гликозилирования.
6. Прогнозирование экспонированных и скрытых аминокислотных остатков.
7. Доменная организация.
CTL-эпитопы, по-видимому, расположены в виде кластеров в домене I, домене III, TM-домене и в двух или трех «горячих точках» в домене ТК. Как описано в патенте США № 7005498 и патентных публикациях США № 2004/0141958 и 2006/0008465, они должны быть сохранены в значительной степени.
Вероятно, области с высокой степенью гомологии с другими рецепторами, структурно важны для «полной» третичной структуры HER-2 и, следовательно, для узнавания антителами, тогда как области с низкой гомологией, возможно, могут быть заменены, следствием чего могут быть только локальные изменения структуры.
Остатки цистеина часто вовлечены в образование внутримолекулярных дисульфидных мостиков и, таким образом, включены в третичную структуру и не должны изменяться. Области, которые предположительно образуют альфа-спиральные или бета-складчатые структуры, должны быть исключены из использования в качестве точек инсерции чужеродных эпитопов, поскольку эти области, могут быть важными для укладки белка.
Потенциальные сайты N-гликозилирования должны быть сохранены, если желательно маннозилирование белка.
Области, которые предположительно (по их гидрофобным свойствам) являющиеся в молекуле внутренними, предпочтительно должны быть сохранены, поскольку они могут быть вовлечены в укладку. Напротив, экспонированные в растворителе области могут служить потенциальными положениями для инсерции модельных TH эпитопов P2 и P30.
Наконец, во внимание должна приниматься доменная организация белка, поскольку она важна для структуры и функционирования белка.
Как описано в патенте США № 7005498 и патентных публикациях США № 2004/0141958 и 2006/0008465, центральным моментом стратегии было сохранение структуры внеклеточной части HER-2 насколько это возможно, поскольку это та часть белка, которая является подходящей в качестве мишени для нейтрализующих антител. Напротив, внутриклеточная часть нативного мембраносвязанного HER-2 на поверхности раковых клеток недоступна для гуморальной иммунной системы.
Различные иллюстративные конструкты с использованием эпитопов P2 и P30 столбнячного токсина, введенные в различные домены HER-2, предложены в патенте США № 7005498 и патентных публикациях США № 2004/0141958 и 2006/0008465. Один иллюстративный полипептидный антиген HER-2, называемый mHER2, содержит внеклеточные домены и девять аминокислот трансмембранного домена; эпитоп P2 вставлен в домен II между аминокислотными остатками 273-287 модифицированного полипептида HER-2; и эпитоп P30 вставлен в домен IV между аминокислотными остатками 655-675 модифицированного полипептида HER-2.
Рекомбинантный MVA-BN-mHER2
В не имеющих ограничительного характера вариантах осуществления настоящего изобретения рекомбинантный MVA, содержащий связанный с опухолью антиген, например, MVA-BN-mHER2, конструируется следующим образом. Исходный вирусный штамм генерируют рекомбинацией в культуре клеток с использованием типа клеток, позволяющих репликацию, например, клеток CEF. Проводят инокулирование клеток ослабленным вирусом коровьей оспы, например MVA-BN, и трансфицируют плазмидой для рекомбинации (например, pBN146), которая кодирует связанный с опухолью антиген, например mHER2, последовательность и фланкирующие области вирусного генома. В одном не имеющем ограничительного характера варианте осуществления настоящего изобретения плазмида pBN146 содержит последовательности, которые также присутствуют в MVA-BN (открытые рамки считывания 14L и 15L). Последовательность mHER2 вставляют между последовательностями MVA-BN обеспечения рекомбинации в вирусный геном MVA-BN. В некоторых вариантах осуществления настоящего изобретения плазмида также содержит кассету для селекции, содержащую один или более генов селекции для обеспечения селекции рекомбинантных конструктов в клетках CEF. В предпочтительном варианте осуществления настоящего изобретения рекомбинантный MVA кодирует полипептид, имеющий SEQ ID NO: 2.
Одновременное инфицирование и трансфицирование культур обеспечивает осуществление гомологичной рекомбинации между вирусным геномом и плазмидой для рекомбинации. Вирус, несущий вставку, затем выделяют, характеризуют и получают вирусные штаммы. В некоторых вариантах осуществления настоящего изобретения проводят пассажи вируса в культурах клеток CEF в отсутствие селекции для обеспечения потери области, кодирующей гены селекции, например gpt и EGFP.
Антагонисты молекул иммунной контрольной точки
Как описано в настоящем описании, по меньшей мере в одном аспекте настоящее изобретение охватывает применение антагонистов иммунной контрольной точки. Такие антагонисты иммунной контрольной точки включают в себя антагонистов молекул иммунной контрольной точки, таких как антиген цитотоксических Т-лимфоцитов 4 (CTLA-4), белок запрограммированной клеточной смерти 1 (PD-1), лиганд запрограммированной смерти 1 (PDL-1), ген активации лимфоцитов 3 (LAG-3) и T-клеточный иммуноглобулиновый домен и муциновый домен-3 (TIM-3). Антагонист CTLA-4, PD-1, PDL-1, LAG-3 или TIM-3 препятствует функционированию CTLA-4, PD-1, PDL-1, LAG-3 или TIM-3, соответственно.
Такие антагонисты CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3 могут включать в себя антитела, которые специфически связываются с CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3, соответственно, и ингибируют и/или блокируют биологическую активность и функцию.
Другие антагонисты CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3 могут включать в себя антисмысловые нуклеиновые кислоты (РНК), которые препятствуют экспрессии CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3; малые интерферирующие РНК, которые препятствуют экспрессии CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3; и низкомолекулярные ингибиторы CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3.
Скрининг потенциальных антагонистов CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3 в отношении их функций можно выполнить с помощью различных методик, известных в данной области и/или раскрытых в настоящей заявке, таких как способность препятствовать функционированию CTLA-4, PD-1, PDL-1, LAG-3 и TIM-3 в мышиной модели in vitro.
Агонисты ICOS
Настоящее изобретение дополнительно охватывает агонистов ICOS. Агонист ICOS активирует ICOS. ICOS представляет собой положительную костимуляторную молекулу, которая экспрессируется на активированных Т-клетках, и связывание с ее лигандом стимулирует их пролиферацию (Dong, Nature 2001; 409:97-101).
В одном варианте осуществления настоящего изобретения агонист представляет собой ICOS-L, природный лиганд ICOS. Агонист может быть мутировавшей формой ICOS-L, сохраняющей свойства связывания и активации. Скрининг на активность мутировавших форм ICOS-L можно провести посредством стимулирования ICOS in vitro.
Антитела
В одном варианте осуществления настоящего изобретения антагонист CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и агонист ICOS являются антителами. Антитела могут быть синтетическими, моноклональными или поликлональными, и могут быть получены с помощью методик, хорошо известных в данной области. Такие антитела специфически связываются с CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS посредством антигенсвязывающих сайтов антител (в отличие от неспецифического связывания). Полипептиды, фрагменты, варианты, гибридные белки и т. д. CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS могут быть использованы в качестве иммуногенов в производстве антител, являющихся по отношению к ним иммунореактивными. Более конкретно, полипептиды, фрагменты, варианты, гибридные белки и т. д. содержат антигенные детерминанты или эпитопы, которые вызывают образование антител.
Эти антигенные детерминанты или эпитопы могут быть либо линейными, либо конформационными (прерывистыми). Линейные эпитопы состоят из одной секции аминокислот полипептида, в то время как конформационные или прерывистые эпитопы состоят из секций аминокислот из разных областей полипептидной цепи, которые были приведены в непосредственную близость при укладке белка (C. A. Janeway, Jr. and P. Travers, Immuno Biology 3:9 (Garland Publishing Inc., 2nd ed. 1996)). Поскольку уложенные белки имеют сложные поверхности, количество доступных эпитопов довольно многочисленно; тем не менее из-за конформации белка и стерических препятствий, количество антител, которые фактически связываются с эпитопами, меньше, чем число доступных эпитопов (C. A. Janeway, Jr. and P. Travers, Immuno Biology 2:14 (Garland Publishing Inc., 2nd ed. 1996)). Эпитопы могут быть идентифицированы с помощью любого из способов, известных в данной области.
Антитела, включая scFV-фрагменты, которые специфически связываются с CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS и либо блокируют их функцию (антитела-антагонисты), или усиливают/активируют их функцию (антитела-агонисты), охватываются настоящим изобретением. Такие антитела могут быть получены с помощью обычных способов.
В одном варианте осуществления настоящее изобретение охватывает моноклональные антитела к CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS, которые либо блокируют (антитела-антагонисты), или усиливают/активируют (антитела-агонисты) функцию CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS молекулы иммунной контрольной точки, соответственно. Иллюстративные блокирующие моноклональные антитела к PD-1 описаны в публикации WO 2011/041613, которая включена в настоящий документ путем ссылки.
Антитела способны связываться с их мишенями с высокой авидностью и специфичностью. Они представляют собой относительно большие молекулы (~ 150 кДа), которые могут стерически ингибировать взаимодействия между двумя белками (например, PD-1 и его целевым лигандом), когда сайт связывания с антителом находится в непосредственной близости от сайта межбелкового взаимодействия. Настоящее изобретение дополнительно охватывает антитела, которые связываются с эпитопами в непосредственной близости от лигандсвязывающего сайта CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS.
В различных вариантах осуществления настоящее изобретение охватывает антитела, которые препятствуют межмолекулярным взаимодействиям (например, межбелковым взаимодействиям), а также антитела, которые вызывают нарушение внутримолекулярных взаимодействий (например, конформационные изменения в молекуле). Можно проводить скрининг антител на способность блокировать или усиливать/активировать биологическую активность CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS, или связывание CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS с лигандом и/или на другие свойства.
Как поликлональные, так и моноклональные антитела могут быть получены с помощью обычных методик.
CTLA-4, PD-1, PDL-1, LAG-3, TIM-3, ICOS и пептиды на основе аминокислотной последовательности CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS, могут быть использованы для получения антител, которые специфически связываются с CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS. Термин «антитела» означает включение поликлональных антител, моноклональных антител, их фрагментов, таких как F(ab')2 и Fab-фрагменты, одноцепочечные вариабельные фрагменты (scFv), фрагменты однодоменных антител (VHH или нанотел), фрагменты двухвалентных антител (диател), а также любых партнеров связывания, полученных рекомбинантными и синтетическими способами.
Антитела определяются как специфически связывающиеся, если они связываются с полипептидами CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS с Ka превышающей или равной приблизительно 107 M-1. Аффинности партнеров связывания или антител могут быть легко определены с использованием обычных методик, например тех, которые описаны в публикации Scatchard et al., Ann. N.Y. Acad. Sci., 51:660 (1949).
Поликлональные антитела могут быть легко получены из различных источников, например, лошадей, коров, коз, овец, собак, кур, кроликов, мышей или крыс с использованием процедур, которые хорошо известны в данной области. В общем, очищенный CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS или пептид на основе аминокислотной последовательности CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS, который конъюгирован соответствующим образом, вводят животному-хозяину, как правило, путем парентеральной инъекции. Иммуногенность CTLA-4, PD-1, PDL-1¸LAG-3, TIM-3 и ICOS может быть повышена за счет использования адъюванта, например полного или неполного адъюванта Фрейнда. После бустерной иммунизации отбирают небольшие пробы сыворотки и тестируют на реакционную способность в отношении полипептидов CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS. Примеры различных анализов, пригодных для такого определения, включают те, которые описаны в публикации Antibodies: A Laboratory Manual, Harlow and Lane (eds.), Cold Spring Harbor Laboratory Press, 1988; а также такие процедуры, как противоточный иммуноэлектрофорез (CIEP), радиоиммуноанализ, радиоиммунопреципитация, твердофазный иммуноферментный анализ (ИФА), анализы дот-блоттинга, и анализы типа «сэндвич». См. патенты США № 4376110 и 4486530.
Моноклональные антитела могут быть легко получены с использованием хорошо известных процедур. См, например, процедуры, описанные в патентах США № RE 32011, 4902614, 4543439 и 4411993; публикации Monoclonal Antibodies, Hybridomas: A New Dimension in Biological Analyses, Plenum Press, Kennett, McKeam, and Bechtol (eds.), 1980.
Например, животным-хозяевам, таким как мыши, можно вводить внутрибрюшинно по меньшей мере один раз, и предпочтительно по меньшей мере два раза, приблизительно с 3-недельными интервалами инъекцию выделенного и очищенного пептида CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS или конъюгированного пептида CTLA-4, PD-1, LAG-3, TIM-3 и ICOS, необязательно, в присутствии адъюванта. Затем мышиную сыворотку анализируют с помощью обычной методики дот-блоттинга или захвата антитела (ABC), чтобы определить, какое животное лучше подходит для слияния. Приблизительно через две-три недели мышам проводят внутривенный бустинг пептидом CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS или конъюгированным пептидом CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS. Позже мышей умерщвляют, и клетки селезенки сливают с коммерчески доступными клетками миеломы, такими как Ag8.653 (ATCC), в соответствии с установленными протоколами. В кратком изложении, клетки миеломы промывают несколько раз в средах и сливают с клетками селезенки мыши в соотношении около трех клеток селезенки к одной миеломной клетке. Агент, вызывающий слияние клеток, может представлять собой любой подходящий агент, используемый в данной области, например, полиэтиленгликоль (PEG). Слитые клетки высевают в планшеты, содержащие среду, которая обеспечивает селективный рост слитых клеток. Слитые клетки затем могут оставить расти в течение приблизительно восьми дней. Супернатанты из полученных гибридом, собирают и добавляют в планшет, изначально покрытый козьим антителом против мышиного Ig. После промываний в каждую лунку добавляют метку, например, меченный полипептид CTLA-4, PD-1, PDL-1¸ LAG-3, TIM-3 и ICOS, после чего проводят инкубацию. Впоследствии можно обнаруживать положительные лунки. Положительные клоны можно выращивать в смешанной культуре, а затем очищать супернатанты на колонке с белком А (Pharmacia).
Моноклональные антитела настоящего изобретения могут быть получены с использованием альтернативных методик, таких как те, которые описаны в публикации Alting-Mees et al., Monoclonal Antibody Expression Libraries: A Rapid Alternative to Hybridomas, Strategies in Molecular Biology 3:1-9 (1990), которая включена в настоящий документ путем ссылки. Подобным образом, партнеры по связыванию могут быть сконструированы с использованием методик рекомбинантной ДНК для включения вариабельных областей гена, кодирующего специфическое связывающее антитело. Такая методика описана в публикации Larrick et al., Biotechnology, 7:394 (1989).
Антигенсвязывающие фрагменты таких антител, которые могут быть получены с помощью традиционных методик, также охватываются настоящим изобретением. Примеры таких фрагментов включают, но не ограничиваются перечисленным, фрагменты Fab и F(ab')2. Также предоставляются фрагменты и производные антител, полученные методами генной инженерии.
Моноклональные антитела по настоящему изобретению включают в себя химерные антитела, например, гуманизированные варианты мышиных моноклональных антител. Такие гуманизированные антитела могут быть получены известными способами, и при введении антител человеку обеспечивают преимущество пониженной иммуногенности. В одном варианте осуществления настоящего изобретения гуманизироанное моноклональное антитело содержит вариабельную область мышиного антитела (или только его антигенсвязывающий сайт) и константную область, полученную из антитела человека. Альтернативно, фрагмент гуманизированного антитела может содержать антигенсвязывающий сайт мышиного моноклонального антитела и фрагмент вариабельной области (не имеющий антигенсвязывающего сайта), полученный из человеческого антитела. Процедуры получения химерных и дополнительно сконструированных моноклональных антител включают способы, описанные в публикациях Riechmann et al. (Nature 332:323, 1988), Liu et al. (PNAS 84:3439, 1987), Larrick et al. (Bio/Technology 7:934, 1989) и Winter and Harris (TIPS 14:139, May, 1993). Процедуры получения антител трансгенным способом можно найти в GB 2272440, патентах США № 5569825 и 5545806, оба из которых включены в настоящий документ путем ссылки.
Можно использовать антитела, полученные с помощью методов генной инженерии, такие как химерные и гуманизированные моноклональные антитела, содержащие части от человека и части не от человека, которые могут быть получены с использованием стандартных методик рекомбинантной ДНК. Такие химерные и гуманизированные моноклональные антитела могут быть получены методами генной инженерии с использованием стандартных методик ДНК, известных в данной области, например, с использованием способов, описанных в международной публикации WO 87/02671 авторов Robinson et al.; европейской патентной заявке 0184187 авторов Akira, et al.; европейской патентной заявке 0171496 авторов Taniguchi, M.; европейской патентной заявке 0173494 авторов Morrison et al.; международной публикации PCT № WO 86/01533 авторов Neuberger et al.; патенте США № 4816567 авторов Cabilly et al.; европейской патентной заявке 0125023 авторов Cabilly et al.; публикациях Better et al., Science 240:1041 1043, 1988; Liu et al., PNAS 84:3439 3443, 1987; Liu et al., J. Immunol. 139:3521 3526, 1987; Sun et al. PNAS 84:214 218, 1987; Nishimura et al., Canc. Res. 47:999 1005, 1987; Wood et al., Nature 314:446 449, 1985; и Shaw et al., J. Natl. Cancer Inst. 80:1553 1559, 1988); Morrison, S. L., Science 229:1202 1207, 1985; Oi et al., BioTechniques 4:214, 1986; патенте США № 5,225,539 автора Winter; публикации Jones et al., Nature 321:552 525, 1986; Verhoeyan et al., Science 239:1534, 1988; и Beidler et al., J. Immunol. 141:4053 4060, 1988.
В связи с синтетическими и полусинтетическими антителами такие термины предназначены для охвата, но не ограничения перечисленным, фрагментов антител, антител с переключением изотипа, гуманизированных антител (например, мышь-человек, человек-мышь), гибридов, антител, имеющих множественные специфичности, и полностью синтетических молекул, подобных антителам.
Для терапевтических видов применения, чтобы свести к минимуму иммунный ответ у пациента против антитела, часто предпочтительны «человеческие» моноклональные антитела, имеющие человеческие константные и вариабельные области. Такие антитела могут быть получены посредством иммунизации трансгенных животных, которые содержат гены человеческого иммуноглобулина. См. публикацию Jakobovits et al. Ann NY Acad Sci 764:525-535 (1995).
Человеческие моноклональные антитела к полипептидам CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS также могут быть получены путем конструирования комбинаторной библиотеки иммуноглобулинов, такой как библиотека фагового дисплея Fab или библиотека фагового дисплея scFv с использованием кДНК легкой цепи иммуноглобулина и тяжелой цепи, полученной из мРНК лимфоцитов субъекта. См., например, публикацию PCT WO 92/01047 авторов McCafferty et al.; публикацию Marks et al. (1991) J. Mol. Biol. 222:581 597; и Griffths et al. (1993) EMBO J 12:725 734. Кроме того, комбинаторная библиотека вариабельных областей антитела может быть получена с помощью проведения мутаций в известном антителе человека. Например, можно осуществить мутацию вариабельной области человеческого антитела, которое, как известно, связывается с CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS, например, с использованием неспецифически измененных подвергнутых мутагенезу олигонуклеотидов, чтобы создать библиотеку мутировавших вариабельных областей, которые затем могут быть подвергнуты скринингу на связывание с CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS. Описание способов индуцирования неспецифического мутагенеза в пределах областей CDR тяжелой и/или легкой цепей иммуноглобулина, способов скрещивания рандомизированных тяжелых и легких цепей с образованием спариваний и способов скрининга можно найти, например, в публикации PCT WO 96/07754 авторов Barbas et al.; публикации Barbas et al. (1992) Proc. Nat'l Acad. Sci. USA 89:4457 4461.
Библиотека иммуноглобулинов может быть экспрессирована популяцией дисплейных блоков, предпочтительно полученной из нитчатого фага, чтобы сформировать дисплейную библиотеку антител. Примеры способов и реагентов, особенно пригодных для использования при генерировании дисплейной библиотеки антител можно найти, например, в патенте США № 5223409 авторов Ladner et al.; публикации PCT WO 92/18619 авторов Kang et al.; публикации PCT WO 91/17271 авторов Dower et al.; публикации PCT WO 92/20791 авторов Winter et al.; публикации PCT WO 92/15679 авторов Markland et al.; публикации PCT WO 93/01288 авторов Breitling et al.; публикации PCT WO 92/01047 авторов McCafferty et al.; публикации PCT WO 92/09690 авторов Garrard et al.; публикации PCT WO 90/02809 авторов Ladner et al.; публикации Fuchs et al. (1991) Bio/Technology 9:1370 1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81 85; Huse et al. (1989) Science 246:1275 1281; Griffths et al. (1993) выше; Hawkins et al. (1992) J Mol Biol 226:889 896; Clackson et al. (1991) Nature 352:624 628; Gram et al. (1992) PNAS 89:3576 3580; Garrad et al. (1991) Bio/Technology 9:1373 1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133 4137; и Barbas et al. (1991) PNAS 88:7978 7982. После отображения на поверхности дисплейного блока (например, нитчатого фага), библиотеку антител подвергают скринингу для идентификации и выделения блоков, которые экспрессируют антитело, связывающееся с полипептидом CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 или ICOS. В предпочтительном варианте осуществления настоящего изобретения первичный скрининг библиотеки включает пэннинг с иммобилизованным полипептидом CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS и выбор дисплейных блоков, которые экспрессируют антитела, связывающиеся с иммобилизованным полипептидом CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS.
В дополнение к антагонистам и агонистам CTLA-4, PD-1, PDL-1, LAG-3, TIM-3 и ICOS, уже описанным в настоящем описании, предполагается, что антагонисты и агонисты могут включать в себя те, которые известны в данной области. Например, известными антителами к CTLA-4 являются Ipilimumab® и тремелимумаб. Дополнительно, известными антителами к PD-1 являются ламбролизумаб, амплиммун-224 (AMP-224), амплиммун -514 (AMP-514), ниволумаб, MK-3475, и B7H1. Некоторые иллюстративные известные антитела к PDL-1 включают: MPDL3280A (Roche), MED14736 (AZN), MSB0010718C (Merck).
В настоящем раскрытии также предусмотрено, что антагонисты или агонисты иммунной контрольной точки могут быть реализованы в малых молекулах, пептидах, растворимых рецепторных белках, а также в других типах гибридных белков.
Комбинированная терапия с использованием поксвируса, экспрессирующего опухолевый антиген и антагониста или агониста иммунной контрольной точки
По меньшей мере в одном аспекте настоящее изобретение охватывает способы лечения с использованием комбинации рекомбинантного поксвируса, кодирующего опухолевый антиген, с одним или более антагонистов или агонистов иммунной контрольной точки.
В одном варианте осуществления настоящего изобретения пациентов с раком, опосредованным клетками, которые сверхэкспрессируют связанный с опухолью антиген HER-2 (например, с раком молочной железы), можно лечить с использованием комбинации: ортопоксвируса (например, вируса коровьей оспы штамма Wyeth, ACAM1000, ACAM2000, MVA или MVA-BN) или авипоксвируса (например, поксвируса домашней птицы POXVAC-TC), кодирующего связанные с опухолью антигены (антиген HER-2), с одним или более антител, агонистов или антагонистов иммунной контрольной точки по настоящему изобретению. В предпочтительном варианте осуществления настоящего изобретения MVA представляет собой MVA-BN. В особенно предпочтительном варианте осуществления настоящего изобретения MVA кодирует полипептид, имеющий SEQ ID NO: 2.
В одном варианте осуществления настоящего изобретения пациентов с раком предстательной железы можно лечить с использованием комбинации ортопоксвируса, например, вируса коровьей оспы (такого как, но не ограничиваясь перечисленным, вируса коровьей оспы штамма Wyeth, ACAM1000, ACAM2000, MVA или MVA-BN), или авипоксвируса (например, поксвируса домашней птицы, например POXVAC-TC), кодирующего антиген PSA и/или PAP, с одним или более антител, агонистов или антагонистов по настоящему изобретению. В особенно предпочтительном варианте осуществления настоящего изобретения вирус коровьей оспы является частью вакцины PROSTVAC®.
В одном варианте осуществления настоящего изобретения пациентов с раком, опосредованным клетками, которые сверхэкспрессируют связанный с опухолью антиген CEA и/или MUC-1 (например, с раком молочной железы, колоректальным раком, раком легких и раком яичников), можно лечить с использованием комбинации: ортопоксвируса, например вируса коровьей оспы (например, вируса коровьей оспы штамма Wyeth, ACAM1000, ACAM2000, MVA, или MVA-BN Wyeth, или MVA) или авипоксвируса (например, поксвируса домашней птицы (например POXVAC-TC)), кодирующего антиген CEA и/или MUC-1, с одним или более антител, агонистов или антагонистов по настоящему изобретению.
Рекомбинантный поксвирус можно вводить системно или локально т. е. посредством парентерального, подкожного, внутривенного, внутримышечного, интраназального, внутрикожного пути введения, путем скарификации или любого другого пути введения, известного специалисту в данной области. Предпочтительно введение осуществляют посредством скарификации. Более предпочтительно введение осуществляют посредством подкожной инъекции. В одном варианте осуществления настоящего изобретения пациенту вводят 105-1010 TCID50 рекомбинантного поксвируса. Предпочтительно пациенту вводят 107-1010 TCID50 рекомбинантного поксвируса. Более предпочтительно пациенту вводят 108-1010 TCID50 рекомбинантного поксвируса. Наиболее предпочтительно пациенту вводят 108-109 TCID50 рекомбинантного поксвируса.
Рак предпочтительно включает, но не ограничивается перечисленным, рак предстательной железы, рак молочной железы, рак легких, рак желудка, рак поджелудочной железы, рак мочевого пузыря или рак яичников. В предпочтительном варианте осуществления настоящего изобретения рак представляет собой метастатический рак молочной железы.
Онкологический пациент может представлять собой любое млекопитающее, включая мышь или крысу. Предпочтительно онкологический пациент является приматом, наиболее предпочтительно человеком.
В одном или более вариантах осуществления настоящего изобретения рекомбинантный поксвирус предназначен для введения в тот же день или через 1, 2, 3, 4, 5, 6 или 7 дней после введения агониста и/или антагониста иммунной контрольной точки. Рекомбинантный поксвирус можно вводить перед или после введения агониста и/или антагониста иммунной контрольной точки.
В одном варианте осуществления настоящего изобретения одно или более антител, агонистов или антагонистов иммунной контрольной точки по настоящему изобретению и поксвирус, кодирующий полипептид, содержащий опухолевый антиген, вводят в одно время. Комбинированное лечение превосходит любое другое лечение, применяемое в качестве монотерапии.
В одном или более предпочтительных вариантах осуществления настоящего изобретения рекомбинантный поксвирус вводят перед введением антагонистов и агонистов иммунной контрольной точки.
Комбинированная терапия с использованием схем гомологичного/гетерологичного бустер-примирования
Можно индуцировать иммунный ответ с помощью однократного введения рекомбинантного поксвируса, как определено выше. Поксвирус по настоящему изобретению также можно применять как часть схемы гомологичного бустер-примирования. При гомологичном примировании-бустинге после первой примирующей вакцинации проводят одну или более последовательных бустинговых вакцинаций. Бустинговые вакцинации разработаны для усиления иммунного ответа, вызванного первой вакцинацией, посредством введения того же рекомбинантного поксвируса, который использовали при первой вакцинации.
Рекомбинантный поксвирус по настоящему изобретению можно также применять в схемах гетерологичного бустер-примирования, в которых одну или более первичных примирующих вакцинаций выполняют с использованием поксвируса, как определено в настоящем описании, и в которых одну или более последующих бустинговых вакцинаций выполняют с использованием другой вакцины, например, другой вирусной вакцины, белковой вакцины или вакцины нуклеиновой кислоты.
В одном варианте осуществления настоящего изобретения одну или более последующих бустинговых вакцинаций схемы гетерологичного бустер-примирования выбирают из родов поксвирусов, отличающихся от родов, используемых в первичных примирующих вакцинациях. В одном неограничивающем примере, если первая или первичная поксвирусная вакцина включает вирус коровьей оспы, вторую и последующие вакцины выбирают из поксвирусов других родов, таких как Suipox, Avipox, Capripox или Orthopox, иммуногенно отличающихся от вируса коровьей оспы.
В одном иллюстративном варианте осуществления настоящего изобретения может применяться схема гомологичного бустер-примирования, в которой поксвирус, такой как MVA-BN, экспрессирующий один или более связанных с опухолью антигенов (TAA), таких как, но не ограничиваясь перечисленным, HER2, вводят в первой дозе в комбинации с одним или более антагонистов или агонистов иммунной контрольной точки. Одно или более последующих введений MVA-BN, экспрессирующего один или более TAA, таких как, но не ограничиваясь перечисленным, HER2, в комбинации с одним или более антагонистов или агонистов иммунной контрольной точки, можно проводить для усиления иммунного ответа, вызванного первой вакцинацией. Предпочтительно, один или более TAA во втором и последующих MVA-BN являются аналогичными или схожими с TAA при первом введении.
В другом иллюстративном варианте осуществления настоящего изобретения может применяться гетерологичное примирование-бустинг, при котором поксвирус, такой как вирус коровьей оспы, экспрессирующий один или более TAA, вводят в первой дозе в комбинации с одним или более антагонистов или агонистов иммунной контрольной точки. После этой первой дозы проводят одно или более введений другого поксвируса, такого как поксвирус домашней птицы, экспрессирующий один или более TAA. Предпочтительно, один или более TAA в поксвирусе домашней птицы являются аналогичными или схожими с теми TAA, которые включены в вирус коровьей оспы для первого введения. Дополнительное описание дополнительных иллюстративных схем гетерологичного бустер-примирования можно найти в патентах США № 6165460; 7598225; и 7247615, все из которых включены в настоящий документ путем ссылки.
В одном предпочтительном варианте осуществления настоящего изобретения один или более TAA в схеме гетерологичного бустер-примирования включают специфический антиген простаты (PSA) и/или антиген простатической кислой фосфатазы (PAP). В более предпочтительном варианте осуществления настоящего изобретения антиген PSA может включать в себя те антигены PSA, которые описаны в патентах США № 7247615 и 7598225, оба из которых включены в настоящий документ путем ссылки. В одном неограничивающем примере схема гетерологичного бустер-примирования, включающая PSA, представляет собой PROSTVAC®.
В другом предпочтительном варианте осуществления настоящего изобретения один или более TAA в схеме гетерологичного бустер-примирования включают антиген муцина 1, связанный с клеточной поверхностью (MUC1), и карциноэмбриональный антиген (CEA). В более предпочтительном варианте осуществления настоящего изобретения антигены MUC1 и CEA могут включать те, что описаны в патентах США № 7118738; 7723096; и заявке PCT № PCT/US2013/020058, все из которых включены в настоящий документ путем ссылки. В одном неограничивающем примере схема гетерологичного бустер-примирования, включающая антиген MUC-1 и CEA представляет собой CV301.
В еще одном иллюстративном варианте осуществления настоящего изобретения может применяться гетерологичное примирование-бустинг, при котором поксвирус, такой как MVA или MVA-BN, экспрессирующий один или более TAA, вводят в первой дозе в комбинации с одним или более антагонистов или агонистов иммунной контрольной точки. После этой первой дозы проводят одно или более введений другого поксвируса, такого как поксвирус домашней птицы, экспрессирующий один или более TAA. Предпочтительно, один или более TAA в поксвирусе домашней птицы являются аналогичными или схожими с теми TAA, которые включены в вирус MVA или MVA-BN для первого введения.
В настоящем раскрытии также предусмотрено, что схемы гомологичного и гетерологичного бустер-примирования, описанные в настоящем описании, могут включать один или более вариантов осуществления настоящего изобретения введения дозы. В качестве примера, в одной или в обеих схемах гомологичного и гетерологичного бустер-примирования суб-терапевтически эффективное количество или дозу антагониста или агониста иммунной контрольной точки можно вводить так, как описано в настоящем описании.
Кроме того, в качестве примера, в одной или в обеих схемах гомологичного и гетерологичного бустер-примирования антагонист или агонист иммунной контрольной точки можно вводить после рекомбинантного поксвируса, кодирующего TAA, как описано в настоящем описании.
Также, в качестве примера, в одной или в обеих схемах гомологичного и гетерологичного бустер-примирования вторая доза или введение антагониста или агониста иммунной контрольной точки может быть увеличено по сравнению с первой дозой или введением.
В некоторых вариантах осуществления настоящего изобретения одну или более бустинговых вакцинаций вводят с интервалами, составляющими дни, недели или месяцы после введения первичной примирующей вакцинации. В некоторых вариантах осуществления настоящего изобретения одну или более бустинговых вакцинаций вводят с интервалами 1, 2, 3, 4, 5, 6, 7 или более дней после введения первичной примирующей вакцинации. В некоторых вариантах осуществления настоящего изобретения одну или более бустинговых вакцинаций вводят с интервалами 1, 2, 3, 4, 5, 6, 7, 8 или более недель после введения первичной примирующей вакцинации. В некоторых вариантах осуществления настоящего изобретения одну или более бустинговых вакцинаций вводят с интервалами 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более месяцев после введения первичной примирующей вакцинации. В некоторых вариантах осуществления настоящего изобретения одну или более бустинговых вакцинаций вводят с любой комбинацией интервалов после введения первичной примирующей вакцинации) (например, 1, 2, 3, 4, 5, 6, 7 или более дней, 1, 2, 3, 4, 5, 6, 7, 8 или более недель или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более месяцев).
Введение доз антагонистов или агонистов иммунной контрольной точки в комбинации с лечением рекомбинантным поксвирусом
Как проиллюстрировано и описано в настоящем описании, лечение рака с использованием рекомбинантного поксвирусного вектора в комбинации с одним или более антагонистов или агонистов иммунной контрольной точки может быть эффективным в разных дозах. Важно отметить, что в отличие от того, что было известно в данной области, в настоящем раскрытии продемонстрировано, что в комбинации с рекомбинантным поксвирусным вектором, кодирующим связанный с опухолью антиген, антагонисты или агонисты иммунной контрольной точки могут быть эффективными при лечении рака, даже если антагонисты или агонисты иммунной контрольной точки вводят в более низких дозах. Эти виды лечения с использованием более низких доз могут уменьшать и/или устранять многие из неблагоприятных побочных эффектов, которые наблюдались при существующих в настоящее время способах лечения рака с использованием антагонистов или агонистов иммунной контрольной точки.
В различных аспектах настоящего раскрытия доза агониста или антагониста, которую вводят пациенту, как описано в настоящем описании, может составлять от приблизительно 0,1 мг/кг до приблизительно 100 мг/кг массы тела пациента. Предпочтительно, пациенту вводят дозу от приблизительно 0,1 мг/кг до приблизительно 20 мг/кг массы тела пациента, более предпочтительно, от приблизительно 1 мг/кг до приблизительно 10 мг/кг массы тела пациента, более предпочтительно, от приблизительно 3 мг/кг до приблизительно 10 мг/кг массы тела пациента и наиболее предпочтительно, от приблизительно 1 мг/кг до приблизительно 3 мг/кг массы тела пациента. Ввиду неблагоприятных эффектов вследствие лечения людей более высокими дозами антагонистов или агонистов иммунной контрольной точки наиболее предпочтительная доза агониста или антагониста составляет от приблизительно 1 мг/кг до приблизительно 3 мг/кг массы тела пациента.
С учетом эффективности более низких доз антагонистов и агонистов иммунной контрольной точки при их комбинации с терапией рекомбинантным поксвирусом, в альтернативных вариантах осуществления настоящего изобретения доза агониста или антагониста составляет от приблизительно 0,1 мг/кг, до приблизительно 3 мг/кг массы тела пациента, от приблизительно 0,1 мг/кг до приблизительно 2 мг/кг массы тела пациента или от приблизительно 0,1 мг/кг до приблизительно 1 мг/кг массы тела пациента. В дополнительных вариантах осуществления настоящего изобретения доза агониста или антагониста составляет приблизительно 0,1 мг/кг, приблизительно 0,5 мг/кг, приблизительно 1 мг/кг, приблизительно 1,5 мг/кг, приблизительно 2 мг/кг, приблизительно 2,5 мг/кг или приблизительно 3 мг/кг массы тела пациента.
В дополнительных аспектах настоящего раскрытия доза агониста или антагониста, которую вводят пациенту, как описано в настоящем описании, может составлять от 0,1 мг/кг до 100 мг/кг массы тела пациента. Предпочтительно, пациенту вводят дозу от 0,1 мг/кг до 20 мг/кг массы тела пациента, более предпочтительно, от 1 мг/кг до 10 мг/кг массы тела пациента, более предпочтительно, от 3 мг/кг до 10 мг/кг массы тела пациента и наиболее предпочтительно, от 1 мг/кг до 3 мг/кг массы тела пациента. Ввиду неблагоприятных эффектов вследствие лечения людей более высокими дозами антагониста или агонистов иммунной контрольной точки наиболее предпочтительная доза агониста или антагониста составляет от 1 мг/кг до 3 мг/кг массы тела пациента.
С учетом эффективности более низких доз антагонистов и агонистов иммунной контрольной точки при их комбинации с терапией рекомбинантным поксвирусом, в альтернативных вариантах осуществления настоящего изобретения доза агониста или антагониста составляет от 0,1 мг/кг, до 3 мг/кг массы тела пациента, от 0,1 мг/кг до 2 мг/кг массы тела пациента или от 0,1 мг/кг до приблизительно 1 мг/кг массы тела пациента. В дополнительных вариантах осуществления настоящего изобретения доза агониста или антагониста составляет 0,1 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг или 3 мг/кг массы тела пациента.
Количества активного ингредиента, необходимые для эффективной терапии, будут зависеть от многих различных факторов, включая средства введения, целевую область, физиологическое состояние пациента, а также от введения других лекарственных средств. Таким образом, лечебные дозы должны быть подобраны с целью оптимизации безопасности, переносимости и эффективности. Обычно в плане количеств активных ингредиентов, используемых для введения in situ, можно успешно руководствоваться дозами, которые применяются in vitro. Тестирование на животных эффективных доз для лечения определенных нарушений будет обеспечивать дополнительное прогностическое указание дозы для человека. Различные мнения обсуждаются, например, в монографии Goodman and Gilman's the Pharmacological Basis of Therapeutics, 7th Edition (1985), MacMillan Publishing Company, New York, и Remington's Pharmaceutical Sciences 18th Edition, (1990) Mack Publishing Co, Easton Pa. Способы введения, включая пероральное, внутривенное, внутрибрюшинное, внутримышечное, чрескожное, назальное введение, введение с помощью электрофореза и т. п., обсуждаются в данном документе.
В зависимости от способа введения, композиции настоящего изобретения можно вводить в различных стандартных лекарственных формах. Например, стандартные лекарственные формы, пригодные для перорального введения, включают твердые лекарственные формы, такие как порошок, таблетки, пилюли, капсулы и драже, и жидкие лекарственные формы, такие как эликсиры, сиропы и суспензии. Активные ингредиенты можно также вводить парентерально в стерильных жидких лекарственных формах. Желатиновые капсулы содержат активный ингредиент, и в качестве неактивных ингредиентов - носители в виде порошка, такие как глюкоза, лактоза, сахароза, маннит, крахмал, целлюлоза или производные целлюлозы, стеарат магния, стеариновая кислота, натриевая соль сахарина, тальк, карбонат магния и т. п. Примерами дополнительных неактивных ингредиентов, которые могут быть добавлены для получения желательного цвета, вкуса, стабильности, буферной емкости, дисперсии или других известных желательных признаков, являются красный оксид железа, силикагель, лаурилсульфат натрия, диоксид титана, пищевой белый краситель и т. п. Подобные разбавители могут быть использованы для получения прессованных таблеток. Для получения непрерывного высвобождения лекарственного средства в течение периода нескольких часов, как таблетки, так и капсулы можно производить как препараты с замедленным высвобождением. Прессованные таблетки могут иметь сахарную оболочку или оболочку из пленки, чтобы замаскировать какой-либо неприятный вкус и защитить таблетку от воздействия атмосферных условий, или кишечнорастворимую оболочку для избирательного разрушения в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать окрашивающий и придающий вкус и запах компоненты для повышения привлекательности для пациента.
Концентрация композиций настоящего изобретения в фармацевтических препаратах может широко варьировать, т. е. от менее чем приблизительно 0,1%, обычно по меньшей мере от приблизительно 2% до 20%-50% мас. или более, и должна выбираться прежде всего по объемам жидкости, показателям вязкости и т. п. в соответствии с определенным выбранным способом введения.
Для твердых композиций могут быть использованы традиционные нетоксичные твердые носители, которые включают, например, маннит, лактозу, крахмал, стеарат магния, натриевую соль сахарина, тальк, целлюлозу, глюкозу, сахарозу, карбонат магния и т. п. фармацевтического качества. Для перорального введения фармацевтически приемлемую нетоксичную композицию получают путем включения любых обычно используемых вспомогательных веществ, таких как вышеперечисленные носители, и, как правило, 10-95% активного ингредиента, как в одной или более композиций настоящего изобретения, и более предпочтительно в концентрации 25%-75%.
Для аэрозольного введения композиции настоящего изобретения предпочтительно применяют в мелкодисперсной форме вместе с поверхностно-активным веществом и пропеллантом. Предпочтительные процентные содержания композиций настоящего изобретения составляют 0,01%-20% мас., предпочтительно 1-10%. Поверхностно-активное вещество должно быть, конечно, нетоксичным и, предпочтительно, растворимым в пропелланте. Типичными такими агентами являются сложные эфиры или частичные сложные эфиры жирных кислот, содержащие от 6 до 22 атомов углерода, такие как капроновая, октановая, лауриновая, пальмитиновая, стеариновая, линолевая, линоленовая, олеостеариновая и олеиновая кислоты с алифатическим многоатомным спиртом или его циклическим ангидридом. Могут быть использованы смешанные сложные эфиры, такие как смешанные или природные глицериды. Поверхностно-активное вещество может составлять 0,1%-20% мас. композиции, предпочтительно 0,25-5%. Баланс композиции обычно обеспечивает пропеллант. Возможно также включение носителя, если это желательно, как, например, при использовании лецитина для интраназальной доставки.
Конструкты настоящего изобретения могут дополнительно доставляться в системе типа депо, инкапсулированной форме или в имплантате известными в данной области способами. Подобным образом, конструкты могут быть доставлены в представляющую интерес ткань с помощью насоса.
Любой из вышеописанных составов может подходить для способов лечения и терапевтических средств, соответствующих настоящему изобретению, при условии, что активный агент в составе композиции не инактивируется составом и состав является физиологически совместимым.
В некоторых вариантах осуществления настоящего изобретения рекомбинантные поксвирусы настоящего изобретения могут быть реализованы в одной или более фармацевтических композициях. В дополнение к рекомбинантному поксвирусу, кодирующему TAA и один или более антагонистов или агонистов иммунной контрольной точки, фармацевтические композиции могут содержать один или более фармацевтически приемлемых и/или одобренных носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такие добавки включают, например, но не ограничиваясь перечисленным, воду, физиологический раствор, глицерин, этанол, увлажняющие или эмульгирующие агенты и вещества, буферизирующие pH. Типичные носители обычно представляют собой большие, медленно метаболизирующиеся молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты и т. п.
Схемы дозирования антагонистов или агонистов иммунной контрольной точки
В дополнительных вариантах осуществления настоящего изобретения концентрации дозы и схемы дозирования антагониста или агониста иммунной контрольной точки разработаны на основании одного или более факторов, связанных с раком, таких как размер опухоли, объем опухоли, стадия рака у онкологического пациента или группы онкологических пациентов (например, пре- или пост-метастатический рак). Кроме того, концентрации дозы и схемы дозирования одного или более антагонистов или агонистов иммунной контрольной точки могут быть разработаны путем мониторинга и проверки эффективности с помощью использования связанного биомаркера или антитела, такого как, но не ограничиваясь перечисленным, антитело к антигену Форсмана или sCD27. В соответствии с этим аспектом для онкологических пациентов-людей или групп онкологических пациентов-людей могут быть разработаны более эффективные схемы дозирования. По меньшей мере в одном аспекте предложены более эффективные схемы дозирования, описанные в настоящем описании, которые могут уменьшать число случаев, когда в ходе лечения пациенту или группе пациентов вводят слишком много или слишком мало антагониста или агониста иммунной контрольной точки.
Как определено в настоящем описании, «схема дозирования» может быть определена как график введения доз терапевтического агента в единицу времени, включая время между введением доз или время, когда необходимо вводить дозы, и количество лекарственного средства или терапевтического агента, которое нужно вводить в каждый конкретный момент времени.
По меньшей мере в одном аспекте способы, раскрытые в настоящем описании, например конкретные схемы дозирования, разработаны для максимального увеличения терапевтического эффекта комбинации по настоящему изобретению при сведении к минимуму неблагоприятных побочных эффектов. В одном варианте осуществления настоящего изобретения антагонист или агонист иммунной контрольной точки вводят пациенту в тот же день, в который вводят рекомбинантный поксвирус, кодирующий один или более TAA. В дополнительных вариантах осуществления настоящего изобретения, как описано в нижеследующих абзацах, антагонист или агонист иммунной контрольной точки вводят пациенту после введения рекомбинантного поксвируса, кодирующего один или более TAA.
Введение антагониста или агониста иммунной контрольной точки после терапии рекомбинантным поксвирусом повышает эффективность лечения рака
Как показано на Фигурах 14-17 и описано в примерах 32-35, субъектам вводили рекомбинантный поксвирус, содержащий TAA, после чего через регулярные интервалы измеряли уровни экспрессии молекулы иммунной контрольной точки, например TIM -3, LAG-3, ICOS и PD-1. Ответом на лечение был начальный период с очень небольшим увеличением экспрессии иммунной контрольной точки. Тем не менее, приблизительно через 1-2 дня Т-клетки увеличивали экспрессию молекул иммунной контрольной точки. Приблизительно от 3 дня до приблизительно 12 дня экспрессия иммунной контрольной точки резко увеличивалась. Повышенная экспрессия все еще наблюдалась приблизительно до 18 дня. Еще более существенно, что это повышение экспрессии иммунной контрольной точки было более полным в Т-клетках CD8 по сравнению с Т-клетками CD4. (См. Фигуры 14-17).
С учетом результатов, показанных на Фигурах 14-17 и в примерах 32-35, наиболее эффективный период времени для введения антагониста или агониста иммунной контрольной точки наступает после введения рекомбинантного поксвируса. Например, как показано на Фигуре 14, после введения MVA-BN-HER2 уровни экспрессии молекулы иммунной контрольной точки TIM-3 повышаются в период от приблизительно 1-3 дней до приблизительно 18 дней, причем наиболее значительное повышение происходит от приблизительно 3 дня до приблизительно 14 дня. В соответствии с этим, более эффективный период времени введения антагониста TIM-3 наступает после введения рекомбинантного поксвируса, в те периоды, когда возникает повышенная экспрессия.
Как показано на Фигурах 15-17, после введения MVA-BN-HER-2, аналогичные повышенные результаты экспрессии наблюдались для молекул иммунной контрольной точки ICOS, PD-1 и LAG-3. В соответствии с этими результатами экспрессии, для достижения большей терапевтической эффективности, каждый антагонист (например, TIM-3, PD-1, PDL-1 и LAG-3) или агонист (например, ICOS) иммунной контрольной точки вводят онкологическому пациенту после введения рекомбинантного поксвируса.
По меньшей мере в одном аспекте более высокая терапевтическая эффективность происходит во время этих периодов повышенной экспрессии молекулы иммунной контрольной точки, по меньшей мере частично потому, что повышение экспрессии обеспечивает больше субстратов, с которыми может связываться введенный антагонист или агонист иммунной контрольной точки, обеспечивая тем самым большее блокирование или активацию молекул иммунной контрольной точки.
В другом аспекте результаты, показанные на Фигурах 14-17, указывают, что важным для повышения эффективности является введение антагониста или агониста иммунной контрольной точки после введения рекомбинантного поксвируса. Это важное значение наглядно демонстрируется периодами повышенной экспрессии молекулы иммунной контрольной точки после введения рекомбинантного поксвируса.
С учетом идей настоящего раскрытия, в одном варианте осуществления настоящего изобретения представлен способ лечения рака, включающий введение пациенту дозы терапевтической противораковой вакцины, такой как, но не ограничиваясь перечисленным, рекомбинантный поксвирус, причем рекомбинантный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) введение пациенту дозы по меньшей мере одного антагониста или агониста иммунной контрольной точки; при этом дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят после введения дозы терапевтической противораковой вакцины.
Предусмотрено, что в одном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят после введения дозы терапевтической противораковой вакцины в тот же день. Дополнительно предусмотрено, что дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят в период от приблизительно 1 до приблизительно 18 дней, от приблизительно 2 до приблизительно 17 дней, от приблизительно 3 до приблизительно 16 дней, от приблизительно 3 до приблизительно 14 дней, от приблизительно 3 до приблизительно 12 дней, от приблизительно 3 до приблизительно 10 дней, от приблизительно 3 до приблизительно 8 дней, от приблизительно 3 до приблизительно 7 дней, от приблизительно 4 до приблизительно 15 дней, от приблизительно 4 до приблизительно 14 дней, от приблизительно 4 до приблизительно 13 дней или от приблизительно 4 до приблизительно 12 дней после введения дозы терапевтической противораковой вакцины. В более предпочтительном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят в период от приблизительно 3 до приблизительно 15 дней после введения дозы терапевтической противораковой вакцины. В более предпочтительном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят в период от приблизительно 3 до приблизительно 7 дней после введения дозы терапевтической противораковой вакцины. В еще более предпочтительном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят через 3 дня или 7 дней после введения дозы терапевтической противораковой вакцины.
Дополнительно предусмотрено, что дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят в тот же день или в период от 1 до 18 дней, от 2 до 17 дней, от 3 до 16 дней, от 3 до 15 дней, от 3 до 14 дней, от 3 до 12 дней, от 4 до 15 дней, от 4 до 14 дней, от 4 до 13 дней или от 4 до 12 дней после введения дозы терапевтической противораковой вакцины. В более предпочтительном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят в период от 3 до 15 дней после введения дозы терапевтической противораковой вакцины. В более предпочтительном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят в период от 3 до 7 дней после введения дозы терапевтической противораковой вакцины. В еще более предпочтительном варианте осуществления настоящего изобретения дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят через 3 дня или 7 дней после введения дозы терапевтической противораковой вакцины.
В дополнительных вариантах осуществления настоящее изобретение включает введение пациенту последующей (относительно дозы, описанной в предыдущем абзаце) или второй дозы терапевтической противораковой вакцины, такой как, но не ограничиваясь перечисленным, рекомбинантный поксвирус, содержащий по меньшей мере один связанный с опухолью антиген (TAA); и (b) введение пациенту последующей (относительно дозы, описанной в предыдущем абзаце) или второй дозы по меньшей мере одного антагониста или агониста иммунной контрольной точки; причем последующую дозу по меньшей мере одного антагониста или агониста иммунной контрольной точки вводят после последующей дозы терапевтической противораковой вакцины. Предусмотрено, что последующую дозу антагониста или агониста иммунной контрольной точки можно вводить через одинаковые интервалы после введения последующей дозы терапевтической противораковой вакцины (например, от приблизительно 1 до приблизительно 18 дней, от приблизительно 2 до приблизительно 17 дней, от приблизительно 3 до приблизительно 16 дней, от приблизительно 3 до приблизительно 15 дней, от приблизительно 3 до приблизительно 14 дней, от приблизительно 3 до приблизительно 12 дней, от приблизительно 4 до приблизительно 15 дней, от приблизительно 4 до приблизительно 14 дней, от приблизительно 4 до приблизительно 13 дней или от приблизительно 4 до приблизительно 12 дней после введения дозы терапевтической противораковой вакцины).
Повышенная эффективность лечения в результате введения антагониста или агониста иммунной контрольной точки после введения терапевтической противораковой вакцины, такой как рекомбинантное поксвирусное терапевтическое средство, дополнительно продемонстрирована в примерах 26-31.
В одном варианте осуществления настоящего изобретения терапевтическая противораковая вакцина содержит рекомбинантный поксвирус, который включает в себя по меньшей мере один TAA. В другом более предпочтительном варианте осуществления настоящего изобретения рекомбинантный поксвирус представляет собой ортопоксвирус или авипоксвирус, который включает в себя по меньшей мере один TAA. В другом более предпочтительном варианте осуществления настоящего изобретения ортопоксвирус представляет собой вирус коровьей оспы, MVA или MVA-BN. В другом варианте осуществления настоящего изобретения авипоксвирус представляет собой поксвирус домашней птицы.
В другом варианте осуществления настоящего изобретения предусмотрено, что антагонист CTLA-4 вводят в тот же день или в период от приблизительно 1 до 3 дней после введения дозы терапевтической противораковой вакцины.
В еще одном варианте осуществления настоящего изобретения предусмотрено, что антагонист PD-1 или антагонист PDL-1 водят в период от приблизительно 2 до 18 дней после введения дозы терапевтической противораковой вакцины.
Увеличение терапевтически эффективного количества антагониста или агониста иммунной контрольной точки для второго введения повышает эффективность лечения рака
Как показано на Фигурах 14-17 и описано в примерах 32-35, субъектам вводили рекомбинантный поксвирус, содержащий TAA, на 1-й день и 15-й день. Уровни экспрессии молекулы иммунной контрольной точки, например TIM -3, LAG-3, ICOS и PD-1, измеряли через регулярные интервалы. Ответом на лечение, проведенное в 1-й день, был начальный период с очень небольшим увеличением экспрессии иммунной контрольной точки. Тем не менее, приблизительно через 1-2 дня после проведенного в 1-й день лечения наблюдалось увеличение экспрессии молекул иммунной контрольной точки Т-клетками. Приблизительно от 3 дня до приблизительно 12 дня экспрессия иммунной контрольной точки резко увеличивалась. Повышенная экспрессия все еще наблюдалась приблизительно до 18 дня.
Наиболее примечательно, после второго или последующего введения рекомбинантного поксвируса на 15-й день наблюдалось еще большее увеличение экспрессии молекул иммунной контрольной точки Т-клетками. Еще более существенно, что это повышение экспрессии иммунной контрольной точки было более полным в Т-клетках CD8 по сравнению с Т-клетками CD4. (См. Фигуры 14-17). Например, как показано на Фигуре 12, после введения на 15-й день MVA-BN-HER-2 наблюдалось небольшое увеличение экспрессии, после чего на 18-й день уровни экспрессии TIM-3 значительно увеличивались. В соответствии с этими результатами экспрессии TIM-3, увеличение второй или последующей дозы антагониста TIM-3 по сравнению с первой дозой позволяет достичь еще большей эффективности лечения.
Как показано на Фигурах 14-17, после второго введения на 15-й день рекомбинантного поксвируса MVA-BN-HER-2 наблюдалось подобное увеличение экспрессии молекул иммунной контрольной точки ICOS, PD-1 и LAG-3. Кроме того, увеличение экспрессии было значительно выше по сравнению с тем, которое наблюдалось после первого введения MVA-BN-HER2. В соответствии с этими результатами экспрессии повышенную дозу антагониста (например, TIM-3, PD-1, PDL-1, LAG-3) или агониста (например, ICOS) иммунной контрольной точки вводят онкологическому пациенту в течение момента времени после второго или последующего введения рекомбинантного поксвируса.
По меньшей мере в одном аспекте более высокая терапевтическая эффективность достигается за счет увеличения дозы или количества антагониста или агониста иммунной контрольной точки при втором или последующем введении по сравнению с первой дозой антагониста или агониста иммунной контрольной точки. Это реализуется, по меньшей мере отчасти потому, что повышение экспрессии после второго введения обеспечивает больше субстратов, с которыми может связываться введенный антагонист или агонист иммунной контрольной точки, обеспечивая тем самым большее блокирование или активацию молекул иммунной контрольной точки.
В другом аспекте результаты, показанные на Фигурах 14-17 указывают, что увеличение второй или последующей дозы антагониста или агониста иммунной контрольной точки по сравнению с первой дозой является важным для достижения повышенной эффективности при введении антагониста иммунной контрольной точки в комбинации с рекомбинантным поксвирусным терапевтическим средством. Это важное значение поддерживается периодами повышенной экспрессии молекулы иммунной контрольной точки после второго введения рекомбинантного поксвируса, описанного и проиллюстрированного в настоящем описании.
В дополнительном аспекте увеличение дозы второго или последующего введения антагониста или агониста иммунной контрольной точки, как описано в настоящем описании, значительно повышает эффективность лечения с учетом последних данных, описывающих заполнение Т-клеточных рецепторов (RO) антагонистом иммунной контрольной точки. После введения первой дозы антагониста иммунной контрольной точки, антитела к PD1, заполнение рецепторов (RO) измеряли на поверхности T-клеток посредством FACS (порог CD45+, CD3) (данные не показаны). Данные показывают, что при введении различных доз антагониста иммунной контрольной точки PD-1 (например, 0,1 мг/кг, 0,4 мг/кг, 1,4 мг/кг и 5 мг/кг) наблюдался высокий процент RO PD-1 на T-клетках в кровотоке (RO для 0, 1 мг/кг=65%, RO для 0,4 мг/кг=84%, RO для 1,4 мг/кг=96% и RO для 5 мг/кг=89%). По сравнению с процентным содержанием RO в крови, RO T-клеток в опухолях было более низким (RO для дозы 0,1 мг/кг=9%, RO для 0,4 мг/кг=41%, RO для 1,4 мг/кг=58% и RO для 5 мг/кг=65%).
Считается, что во время введения начальной дозы антагониста или агониста иммунной контрольной точки в комбинации с рекомбинантным поксвирусом, в периферических областях, таких как кровь и лимфатические узлы, как правило, присутствует больший процент опухолеспецифических Т-клеток (Т-клеток CD8). Ввиду повышенного RO на T-клетках крови антагонистом иммунной контрольной точки первое введение антагониста или агониста иммунной контрольной точки является более эффективным в более низких дозах. Для повышенной эффективности второго или последующего введения дозы антагониста или агониста иммунной контрольной точки в комбинации с рекомбинантным поксвирусом, ввиду более низкого RO на T-клетках в опухолях, вводят повышенную дозу по сравнению с первой дозой.
С учетом идей настоящего раскрытия, в дополнительных вариантах осуществления настоящего изобретения в данном раскрытии предложен способ лечения онкологического пациента-человека с использованием терапевтической противораковой вакцины в комбинации с антагонистом или агонистом иммунной контрольной точки, причем указанный способ включает (a) обеспечение пациенту первого введения терапевтической противораковой вакцины, такой как рекомбинантный поксвирус, в комбинации с дозой по меньшей мере одного антагониста или агониста иммунной контрольной точки; и (b) обеспечение пациенту второго введения терапевтической противораковой вакцины в комбинации с дозой по меньшей мере одного антагониста или агониста иммунной контрольной точки, при этом доза по меньшей мере одного антагониста или агониста иммунной контрольной точки при втором введении повышена по сравнению с дозой по меньшей мере одного антагониста или агониста иммунной контрольной точки при первом введении.
Кроме того, предусмотрено, что в настоящем раскрытии предложен способ обеспечения серии введений пациенту, причем указанные введения содержат терапевтическую противораковую вакцину, такую как рекомбинантный поксвирус, в комбинации с дозой по меньшей мере одного антагониста или агониста иммунной контрольной точки, при этом доза второго введения повышена по сравнению с дозой первого введения.
В различных вариантах осуществления настоящего изобретения доза (или количество) антагониста или агониста иммунной контрольной точки для второго введения повышена в: от приблизительно 2 до приблизительно 100 раз, от приблизительно 3 до приблизительно 100 раз, от приблизительно 5 до приблизительно 100 раз, от приблизительно 10 до приблизительно 100 раз, от приблизительно 5 до приблизительно 90 раз, от приблизительно 10 до приблизительно 80 раз, от приблизительно 10 до приблизительно 70 раз, от приблизительно 10 до приблизительно 60 раз, от приблизительно 10 до приблизительно 50 раз по сравнению с дозой первого введения. В предпочтительных вариантах осуществления настоящего изобретения доза второго введения увеличивается в приблизительно от 10 до приблизительно в 100 раз по сравнению с дозой первого введения. В другом более предпочтительном варианте осуществления настоящего изобретения доза второго введения увеличивается в приблизительно от 10 до приблизительно в 50 раз по сравнению с дозой первого введения. В другом более предпочтительном варианте осуществления настоящего изобретения доза второго введения увеличивается в приблизительно 3, приблизительно 10, приблизительно 30 или приблизительно 100 раз.
В разных дополнительных вариантах осуществления настоящего изобретения доза по меньшей мере одного антагониста или агониста иммунной контрольной точки для второго введения увеличивается в 2-100 раз, 3-100 раз, 5-100 раз, 10-100 раз, 5-90 раз, 10-80 раз, 10-70 раз, 10-60 раз, 10-50 раз по сравнению с дозой для первого введения. В предпочтительных вариантах осуществления настоящего изобретения доза второго введения увеличивается в 10-100 раз по сравнению с дозой первого введения. В другом более предпочтительном варианте осуществления настоящего изобретения доза второго введения увеличивается в 10-50 раз по сравнению с дозой первого введения. В другом более предпочтительном варианте осуществления настоящего изобретения доза второго введения увеличивается в 3, 10, 30 или 100 раз.
Предусмотрено, что в некоторых иллюстративных вариантах осуществления настоящего изобретения первое введение антагониста или агониста иммунной контрольной точки с терапевтической противораковой вакциной, такой как, но не ограничиваясь перечисленным, рекомбинантный поксвирус, включает введение суб-терапевтической или суб-терапевтически эффективной дозы, после чего проводят второе или последующее введение антагониста или агониста иммунной контрольной точки с терапевтической противораковой вакциной, такой как, но не ограничиваясь перечисленным, рекомбинантный поксвирус, которое включает повышение дозы, как указано в схемах дозирования, описанных в настоящем описании. В одном неограничивающем примере первое введение антагониста или агониста иммунной контрольной точки включает дозу от приблизительно 0,1 мг/кг до приблизительно 1 мг/кг. После этого первого введения следует одно или более последующих введений повышенной дозы, составляющей от приблизительно 3 мг/кг до приблизительно 10 мг/кг.
В одном предпочтительном варианте осуществления настоящего изобретения терапевтическая противораковая вакцина содержит рекомбинантный поксвирус, который включает в себя по меньшей мере один TAA. В другом более предпочтительном варианте осуществления настоящего изобретения рекомбинантный поксвирус представляет собой ортопоксвирус или авипоксвирус, который включает в себя по меньшей мере один TAA. В другом более предпочтительном варианте осуществления настоящего изобретения ортопоксвирус представляет собой вирус коровьей оспы, MVA или MVA-BN. В другом варианте осуществления настоящего изобретения авипоксвирус представляет собой поксвирус домашней птицы. Повышенная эффективность лечения в результате введения повышенной второй или последующей дозы антагониста или агониста иммунной контрольной точки по сравнению с первой дозой дополнительно продемонстрирована в примерах 26-31.
Терапевтическая противораковая вакцина представляет собой вакцину, которая демонстрирует одно или более уникальных иммунологических свойств, стимулирующих собственный иммунный ответ у пациента или у группы пациентов для специфического целевого воздействия на опухоль и/или опухолевые клетки. Эти уникальные иммунологические свойства, как правило, представляют собой антигены, которые связаны с опухолью или опухолевой клеткой. По меньшей мере в одном аспекте функция терапевтической противораковой вакцины заключается в задержке или остановке роста раковых клеток для того, чтобы вызвать уменьшение размеров опухоли, предотвратить рецидив рака или устранить раковые клетки, которые не были уничтожены другими видами лечения.
В одном предпочтительном варианте осуществления настоящего изобретения терапевтическая противораковая вакцина является вакциной на основе вируса. Некоторые не ограничивающие примеры вирусов, применяемых в качестве терапевтических противораковых вакцин, включают: поксвирус, аденовирус, альфавирус, вирус кори, вирус простого герпеса (HSV), парвовирус, реовирус и вирус везикулярного стоматита (VSV). В более предпочтительном варианте осуществления настоящего изобретения терапевтическая противораковая вакцина представляет собой терапевтическое средство на основе поксвируса.
В таблице 1 приведены некоторые неограничивающие примеры терапевтической противораковой вакцины на основе вируса, которые в настоящее время находятся в стадии разработки.
Таблица 1.
В другом варианте осуществления настоящего изобретения терапевтическая противораковая вакцина может быть получена на основе дрожжей. См., например, Cancer Immunol Immunother. 2014 Mar; 63(3):225-34. В одном неограничивающем примере терапевтическая противораковая вакцина на основе дрожжей представляет собой рекомбинантную вакцину CEA на основе дрожжей (GI-6207), которая в настоящее время проходит клинические исследования II фазы. См. J Clin Oncol 31, 2013 (suppl; abstr TPS3127).
В еще одном варианте осуществления настоящего изобретения терапевтическая противораковая вакцина может быть получена на основе бактерий. В одном неограничивающем примере бактериальная противораковая вакцина представляет собой вакцину Coley. См. Clin Cancer Res. 2012 Oct 1; 18 (19):5449-59.
Введение антагониста или агониста иммунной контрольной точки после бустинговых доз в схеме гетерологичного бустер-примирования повышает эффективность лечения рака
PROSTVAC® представляет собой схему гетерологичного бустер-примирования, которая включает единственное введение PROSTVAC-V (вирус коровьей оспы, экспрессирующий PSA, и TRICOMTM) для примирования с последующим введением одной или более последующих бустинговых доз PROSTVAC-F (поксвирус домашней птицы, экспрессирующий PSA, и TRICOMTM); что также описано в публикации J Clin Oncol 2010, 28:1099-1105, которая включена в настоящий документ путем ссылки.
Как показано на Фигурах 21-23 и описано в примерах 40-43, при лечении рака гетерологичная схема дозирования PROSTVAC® значительно увеличивает степень и качество PSA-специфического ответа Т-клеток по сравнению с гомологичной схемой введения дозы того же вектора. Кроме того, на фигурах и в примерах продемонстрировано, что примирование PROSTVAC-V и бустинг PROSTVAC-F обеспечивает дополнительное преимущество фокусирования высокофункционального CTL CD8 иммунного ответа в отношении PSA, целевого опухолевого антигена, а не в отношении вектора вируса коровьей оспы.
По меньшей мере в одном аспекте, когда одну или более доз рекомбинантного поксвируса вводят как часть лечения рака, более высокая терапевтическая эффективность достигается за счет введения одного или более антагонистов или агонистов иммунной контрольной точки в комбинации со вторым или последующим дозированием или введением рекомбинантного поксвируса.
В более конкретном аспекте, когда одну или более доз рекомбинантного поксвируса настоящего изобретения вводят как часть лечения рака в качестве части схемы гетерологичного бустер-примирования, более высокая терапевтическая эффективность достигается за счет введения по меньшей мере одного антагониста или агониста контрольной точки в комбинации со вторым или последующим введением бустинговых доз рекомбинантного поксвируса, кодирующего по меньшей мере один TAA. Эта более высокая терапевтическая эффективность реализуется, по меньшей мере отчасти, потому что во время или после введения второй или последующих бустинговых доз в соответствии со схемой гетерологичного бустер-примирования, иммунный T-клеточный ответ пациента больше сфокусирован на опухолевом антигене, чем на рекомбинантном поксвирусе. Соответственно, по меньшей мере в одном аспекте введение антагониста или агониста иммунной контрольной точки во время введения бустинговых доз усиливает иммунный ответа пациента на опухолевый антиген и тем самым более специфично повышает иммунный ответ пациента на опухоль.
По меньшей мере в другом аспекте, включающем схему гетерологичного бустер-примирования как часть лечения рака, введение по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с введением второй или последующих бустинговых доз рекомбинантного поксвируса максимально увеличивает терапевтические эффекты антагониста или агониста иммунной контрольной точки и в то же время сводит к минимуму неблагоприятные побочные эффекты, наблюдавшиеся при лечении средствами, действующими на иммунную контрольную точку.
С учетом идей настоящего раскрытия в дополнительных вариантах осуществления настоящее изобретение включает способ лечения онкологического пациента-человека, при этом способ включает введение пациенту: (a) первой терапевтической противораковой вакцины, такой как но не ограничиваясь перечисленным, первого рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) второй терапевтической противораковой вакцины, такой как, но не ограничиваясь перечисленным, второй рекомбинантный поксвирус, причем указанный второй рекомбинантный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); при этом второй рекомбинантный поксвирус вводят в комбинации с по меньшей мере одним антагонистом или агонистом иммунной контрольной точки. В дополнительном варианте осуществления настоящего изобретения второй рекомбинантный поксвирус отличается от первого рекомбинантного поксвируса. В других вариантах осуществления настоящего изобретения второй рекомбинантный поксвирус принадлежит к другому роду, чем первый рекомбинантный поксвирус.
В другом варианте осуществления настоящего изобретения первый и второй рекомбинантный поксвирусы отличаются или принадлежат к разным родам и их вводят как схему гетерологичного бустер-примирования, причем указанная схема гетерологичного бустер-примирования включает: a) введение первого рекомбинантного поксвируса в качестве первой дозы примирования; и b) введение второго рекомбинантного поксвируса в качестве одной или более доз бустинга в комбинации с по меньшей мере одним антагонистом или агонистом иммунной контрольной точки. В предпочтительном варианте осуществления настоящего изобретения схему гетерологичного бустер-примирования выбирают из PROSTVAC®, CV301 или MVA-BN-CV301.
В еще одном варианте осуществления настоящего изобретения предусмотрено, что первый рекомбинантный поксвирус или рекомбинантный поксвирус первичной или примирующей дозы не включает антагонист или агонист иммунной контрольной точки.
Дополнительно предусмотрено, что первый и второй рекомбинантные поксвирусы могут представлять собой любые поксвирусы, такие как, но не ограничиваясь перечисленным, те, что описаны в настоящем раскрытии. Дополнительно предусмотрено, что по меньшей мере один связанный с опухолью антиген (TAA), может представлять собой любой TAA, такой как, но не ограничиваясь перечисленным, те TAA, что описаны в настоящем раскрытии.
В дополнительных вариантах осуществления настоящего изобретения представлен способ, включающий введение онкологическому пациенту схемы гетерологичного бустер-примирования, которая содержит: (a) первую терапевтическую противораковую вакцину, такую как, но не ограничиваясь перечисленным, первый рекомбинантный поксвирус, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) вторую терапевтическую противораковую вакцину, причем вторую терапевтическую противораковую вакцину вводят в комбинации с по меньшей мере одним антагонистом или агонистом иммунной контрольной точки. предусмотрено, что описанные схемы гетерологичного бустер-примирования
В одном или более вариантах осуществления настоящего изобретения по меньшей мере один антагонист или агонист иммунной контрольной точки вводят в тот же день или в пределах 1, 2, 3, 4, 5, 6 или 7 дней после введения второй или последующих доз рекомбинантного поксвируса, кодирующего по меньшей мере один TAA. В предпочтительном варианте осуществления настоящего изобретения введение по меньшей мере одного антагониста или агониста иммунной контрольной точки осуществляют как часть схемы гетерологичного бустер-примирования, и вводят в тот же день или в пределах 1, 2, 3, 4, 5, 6 или 7 дней после введения второй или последующих бустинговых доз рекомбинантного поксвируса, кодирующего по меньшей мере один TAA.
В одном или более вариантах осуществления настоящего изобретения по меньшей мере один антагонист или агонист иммунной контрольной точки вводят после введения второй или последующих доз рекомбинантного поксвируса, кодирующего по меньшей мере один TAA. В предпочтительном варианте осуществления настоящего изобретения введение по меньшей мере одного антагониста или агониста иммунной контрольной точки осуществляют как часть схемы гетерологичного бустер-примирования после введения второй или последующих бустинговых доз рекомбинантного поксвируса, кодирующего по меньшей мере один TAA. Предусмотрено, что после введения второй или последующих бустинговых доз рекомбинантного поксвируса интервалы времени введения по меньшей мере одного антагониста или агониста иммунной контрольной точки могут включать те интервалы времени, которые описаны в настоящем раскрытии.
Дополнительно предусмотрено, что при введении в комбинации со второй или одной или более последующих бустинговых доз рекомбинантного поксвируса, кодирующего по меньшей мере один TAA, по меньшей мере один антагонист или агонист иммунной контрольной точки можно вводить в дозе или в концентрации, предложенной в настоящем раскрытии.
Терапевтические композиции и виды их применения
Настоящее изобретение дополнительно относится к применению поксвирусных векторов по настоящему изобретению для получения терапевтических композиций или вакцин, способных индуцировать или способствовать возникновению или улучшению иммунологической реакции против опухолевых эпитопов. Таким образом, в настоящем изобретении предложены векторы, которые применяют в качестве лекарственного средства или вакцины.
Соответственно, настоящее изобретение относится к иммуногенной композиции, содержащая вектор MVA по настоящему изобретению в комбинации с одним или более из антитела, агониста или антагониста по настоящему изобретению.
Таким образом, векторы MVA по настоящему изобретению можно использовать для получения терапевтической композиции для лечения рака.
Настоящее изобретение охватывает композицию для применения в профилактических и/или терапевтических протоколах вакцинации для лечения опухолей, и особенно, для применения в качестве противоракового лечения.
В одном варианте осуществления настоящее изобретение охватывает композицию для введения онкологическому пациенту или для лечения онкологического пациента, особенно для лечения видов раковых заболеваний, таких как, но не ограничиваясь перечисленным, рак молочной железы, рак легких, рак желудка, рак мочевого пузыря, рак почек, рак печени, рак поджелудочной железы, рак предстательной железы, рак яичников или колоректальный рак.
В одном варианте осуществления настоящее изобретение охватывает применение композиции для введения онкологическому пациенту или для лечения онкологического пациента, особенно для лечения видов раковых заболеваний, выбранных из рака молочной железы, рака легких, рака желудка, рака мочевого пузыря, рака почек, рака печени, рака поджелудочной железы, рака предстательной железы, рака яичников или колоректального рака.
В дополнительных вариантах осуществления настоящее изобретение охватывает композицию или применение композиции для введения онкологическому пациенту или для лечения онкологического пациента, в частности, пациента с раком молочной железы.
В одном варианте осуществления настоящего изобретения композиция для одновременного или последовательного введения содержит вектор MVA по настоящему изобретению и одно или более антител, агонистов или антагонистов по настоящему изобретению.
В еще дополнительных вариантах осуществления настоящее изобретение охватывает композицию или применение композиции для введения онкологическому пациенту или для лечения онкологического пациента, в частности, пациента с раком предстательной железы.
В одном варианте осуществления настоящего изобретения композиция для одновременного или последовательного введения содержит вектор PROSTVAC® по настоящему изобретению и одно или более антител, агонистов или антагонистов по настоящему изобретению.
В другом варианте осуществления настоящее изобретение охватывает способ лечения рака, включающий введение пациенту (a) терапевтически эффективного количества рекомбинантного поксвирусного вектора, причем указанный поксвирусный вектор содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки является таким, что терапевтический эффект введения комбинации повышен по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки, или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В соответствии с различными вариантами осуществления настоящего изобретения при лечении рака, если антагонист или агонист иммунной контрольной точки комбинировать с поксвирусным вектором, кодирующим TAA, доза, в которой антагонист или агонист иммунной контрольной точки терапевтически эффективен, является более низкой или уменьшается по сравнению либо с 1) терапевтически эффективной дозой антагониста или агониста иммунной контрольной точки без поксвирусного вектора либо с 2) терапевтически эффективной дозой самого по себе антагониста или агониста иммунной контрольной точки. По существу, терапевтически эффективные дозы антагонистов или агонистов иммунной контрольной точки можно вводить в более низких дозах, тем самым уменьшая и/или устраняя токсические и неблагоприятные побочные эффекты лечения, наблюдаемые в существующем уровне техники.
Термин «терапевтически эффективное количество» представляет собой количество композиции, достаточное для достижения желаемого терапевтического или клинического эффекта у субъекта, подлежащего лечению. Например, терапевтически эффективное количество поксвирусного вектора, содержащего нуклеиновую кислоту антигена, связанного с опухолью (TAA) (такого как, но не ограничиваясь перечисленным, CEA, MUC-1, PAP, PSA, HER-2, сурвивин, tyrp1, tyrp2 или антиген брахиурии), функционально связанную с последовательностью, контролирующей экспрессию, будет представлять собой количество, достаточное для того, чтобы вызвать ТАА-специфический иммунный ответ, уменьшить размер опухоли или опухолевую нагрузку, уменьшить количество опухолевых метастазов, замедлить прогрессирование рака или увеличить общую выживаемость пациента или популяции пациентов, имеющих раковое заболевание.
Также в качестве примера, терапевтически эффективное количество антагониста или агониста иммунной контрольной точки может представлять собой количество, достаточное для ингибирования функции целевой молекулы иммунной контрольной точки, для связывания с молекулой иммунной контрольной точки, чтобы уменьшить размер опухоли или опухолевую нагрузку, уменьшить количество опухолевых метастазов, замедлить прогрессирование рака или увеличить общую выживаемость пациента или популяции пациентов, имеющих раковое заболевание.
«Терапевтический эффект» представляет собой желаемый терапевтический или клинический эффект у субъекта. «Терапевтический эффект» в лечении рака может быть охарактеризован: уменьшением размера опухоли, массы опухоли или опухолевой нагрузки; уменьшением количества опухолевых метастазов; замедлением прогрессирования рака или увеличением общей выживаемости пациента или популяции пациентов, имеющих раковое заболевание.
Комбинированное лечение рака антагонистом или агонистом иммунной контрольной точки с рекомбинантным поксвирусом обеспечивает терапевтическую эффективность при введении низких доз антагониста или агониста
Как проиллюстрировано и описано в настоящем описании, при комбинации антагониста или агониста иммунной контрольной точки с поксвирусным вектором, кодирующим TAA, доза, в которой антагонист или агонист иммунной контрольной точки терапевтически эффективен, является более низкой или уменьшается. В разных дополнительных вариантах осуществления настоящего изобретения настоящее раскрытие включает введение онкологическому пациенту-человеку комбинации: (a) терапевтически эффективного количества рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки. В этом варианте осуществления настоящего изобретения суб-терапевтически эффективное количество антагониста или агониста иммунной контрольной точки позволяет достичь повышенного «терапевтического эффекта» по сравнению с введением или только поксвируса, содержащего по меньшей мере один TAA, или суб-терапевтически эффективного количества только по меньшей мере одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
По меньшей мере в одном аспекте суб-терапевтически эффективные дозы разработаны для максимального увеличения терапевтического эффекта при сведении к минимуму неблагоприятных побочных эффектов, наблюдавшихся при лечении средствами, действующими на иммунную контрольную точку, в существующем уровне техники.
«Суб-терапевтически эффективное количество» представляет собой дозу или количество, в которых антагонист иммунной контрольной точки неэффективен сам по себе для оказания «терапевтического эффекта» при введении в виде монотерапии или монотерапевтического средства или при введении в сочетании с другим или множеством других антагонистов или агонистов иммунной контрольной точки.
В одном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет от приблизительно 99% до приблизительно 5%, от приблизительно 90% до приблизительно 5%, от приблизительно 85% до приблизительно 5%, от приблизительно 80% до приблизительно 5%, от 75% до приблизительно 5%, от приблизительно 70% до приблизительно 10%, от приблизительно 65% до приблизительно 15%, от приблизительно 60% до приблизительно 20%, от приблизительно 55% до приблизительно 25%, от приблизительно 50% до приблизительно 30% или от приблизительно 50% до приблизительно 10% терапевтически эффективного количества антагониста или агониста иммунной контрольной точки. В предпочтительном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет от приблизительно 99% уменьшения до приблизительно 30% уменьшения терапевтически эффективного количества антагониста или агониста иммунной контрольной точки. В другом предпочтительном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет от приблизительно 90% уменьшения до приблизительно 30% уменьшения терапевтически эффективного количества антагониста или агониста иммунной контрольной точки. В другом предпочтительном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет приблизительно 99% уменьшения, приблизительно 90% уменьшения или приблизительно 30% уменьшения терапевтически эффективного количества антагониста или агониста иммунной контрольной точки.
В другом варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет от 99% до 5%, от 90% до 5%, от 85% до 5%, от 80% до 5%, от 75% до 5%, от 70% до 10%, от 65% до 15%, от 60% до 20%, от 55% до 25%, от 50% до 30% или от 50% до 10% терапевтически эффективного количества антагониста или агониста иммунной контрольной точки. В предпочтительном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет от 99% уменьшения до 30% уменьшения терапевтически эффективного количества антагониста или агониста иммунной контрольной точки. В другом предпочтительном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет от приблизительно 90% уменьшения до приблизительно 30% уменьшения терапевтически эффективного количества антагониста или агониста иммунной контрольной точки. В другом предпочтительном варианте осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки составляет 99% уменьшения, 90% уменьшения или 30% уменьшения терапевтически эффективного количества антагониста или агониста иммунной контрольной точки.
В одном или более вариантах осуществления настоящего изобретения суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки можно применять в комбинации с рекомбинантным поксвирусом, содержащим по меньшей мере один TAA, как часть схемы гетерологичного или гомологичного бустер-примирования, как описано в настоящем описании.
Наборы
В одном варианте осуществления настоящее изобретение охватывает наборы, содержащие рекомбинантный поксвирус и по меньшей мере один антагонист или агонист иммунной контрольной точки. Каждый из рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки может содержаться во флаконе или в контейнере. В одном варианте осуществления настоящего изобретения рекомбинантный поксвирус кодирует связанный с опухолью антиген (TAA), как описано в настоящем описании. В другом варианте осуществления настоящего изобретения по меньшей мере один антагонист или агонист иммунной контрольной точки выбран из антагониста или агониста иммунной контрольной точки, описанного в настоящем описании. В различных вариантах осуществления настоящего изобретения наборы для вакцинации содержат рекомбинантный поксвирус и антагонист или агонист иммунной контрольной точки для первой вакцинации («примирования») в комплекте первых флаконов или контейнере, а для второй или третьей вакцинации («бустинга») - во втором или в третьем флаконе или контейнере.
В одном варианте осуществления настоящего изобретения набор может содержать комбинацию рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки и инструкции по введению комбинации для профилактики рака. В одном варианте осуществления настоящего изобретения набор может содержать комбинацию и инструкции по введению комбинации для профилактики рак после обнаружения одного или более маркеров, связанных с опухолью.
В одном варианте осуществления настоящего изобретения набор может содержать комбинацию рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки и инструкции по введению терапевтически эффективной дозы или количества поксвируса и терапевтически эффективного количества по меньшей мере одного из антагониста или агониста иммунной контрольной точки так, чтобы терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имело повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В другом варианте осуществления настоящего изобретения набор может содержать комбинацию рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки и инструкции по введению суб-терапевтической дозы или количества по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки является таким, что терапевтический эффект комбинации повышен по сравнению с введением или только поксвируса, содержащего по меньшей мере один TAA, или суб-терапевтически эффективного количества только по меньшей мере одного антагониста или агониста иммунной контрольной точки или в комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В другом варианте осуществления настоящего изобретения набор может содержать комбинацию рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки и инструкции по обеспечению пациента серией введений рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем указанные инструкции включают увеличение дозы второго введения в серии по сравнению с дозой первого введения в серии.
В другом варианте осуществления настоящего изобретения набор может содержать комбинацию рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки и инструкции по обеспечению пациента серией введений рекомбинантного поксвируса и по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем указанные инструкции включают обеспечение введения комбинации с по меньшей мере одним антагонистом или агонистом иммунной контрольной точки, содержащим суб-терапевтически эффективную дозу; а после этого - обеспечение второго введения, в котором повышение дозы по меньшей мере одного антагониста или агониста иммунной контрольной точки происходит так, как изложено в настоящем описании.
В настоящем раскрытии также предусмотрено, что одна или более представленных в настоящем описании инструкций могут быть объединены в одном наборе. Дополнительно предусмотрено, что одна или более представленных в настоящем описании инструкций включают одну или более схем дозирования, предложенных в настоящей заявке.
Дополнительные варианты осуществления настоящего изобретения для комбинаций или лекарственных средств
В дополнительных вариантах осуществления настоящего изобретения это раскрытие охватывает комбинацию или лекарственное средство, предназначенные для применения в лечении онкологического пациента-человека. Комбинация или лекарственное средство содержит рекомбинантный поксвирусный вектор, причем указанный поксвирусный вектор содержит по меньшей мере один связанный с опухолью антиген (TAA); (b) антагонист PD-1; и (c) антагонист CTLA-4. Антагонист PD-1 и антагонист CTLA-4 могут представлять собой антагонист-антитело к PD-1 и антитело к CTLA-4, соответственно.
В еще одном дополнительном варианте осуществления настоящего изобретения это раскрытие может включать комбинацию или лекарственное средство, предназначенные для применения в лечении онкологического пациента-человека, причем указанная комбинация или лекарственное средство содержит: (a) терапевтически эффективное количество рекомбинантного поксвируса, причем указанный поксвирусный вектор содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки; причем терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имеет повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки, или его комбинации с другими антагонистами или агонистами иммунной контрольной точки. В еще одном варианте осуществления настоящего изобретения комбинация или лекарственное средство может содержать антагонист или агонист иммунной контрольной точки, выбранный из антагониста CTLA-4, антагониста PD-1, антагониста PDL-1, антагониста LAG-3, антагониста TIM-3 или агониста ICOS. Предусмотрено, что различные антагонисты или агонисты иммунной контрольной точки могут быть реализованы в одном или более антител.
В другом варианте осуществления настоящего изобретения это раскрытие может включать комбинацию или лекарственное средство, предназначенные для применения с целью повышения показателя общей выживаемости онкологического пациента-человека, причем указанная комбинация или лекарственное средство содержит: (a) поксвирус, содержащий по меньшей мере один связанный с опухолью антиген (TAA); (b) антагонист PD-1; и (c) антагонист CTLA-4. Антагонист PD-1 и антагонист CTLA-4 могут представлять собой антагонист-антитело к PD-1 и антитело к CTLA-4, соответственно.
В еще одном варианте осуществления настоящего изобретения это раскрытие может включать комбинацию или лекарственное средство, предназначенные для применения с целью повышения показателя общей выживаемости онкологического пациента-человека, причем указанная комбинация или лекарственное средство содержит: (a) поксвирус, содержащий по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки; причем терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имеет повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки, или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В еще одном дополнительном варианте осуществления настоящего изобретения это раскрытие может включать комбинацию или лекарственное средство, предназначенные для применения в лечении онкологического пациента-человека, причем указанная комбинация или лекарственное средство содержит: (a) терапевтически эффективного количества рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки, причем суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки является таким, что терапевтический эффект комбинации повышен по сравнению с введением или только поксвируса, содержащего по меньшей мере один TAA, или суб-терапевтически эффективного количества только по меньшей мере одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки. Предусмотрено, что комбинация или лекарственное средство может содержать антагонист или агонист иммунной контрольной точки, выбранный из антагониста CTLA-4, антагониста PD-1, антагониста PDL-1, антагониста LAG-3, антагониста TIM-3 или агониста ICOS. Предусмотрено, что различные антагонисты или агонисты иммунной контрольной точки могут быть реализованы в одном или более антител.
В еще одном дополнительном варианте осуществления настоящего изобретения это раскрытие может включать комбинацию или лекарственное средство, предназначенные для применения в лечении онкологического пациента-человека, причем указанная комбинация или лекарственное средство содержит: (a) терапевтически эффективное количество рекомбинантного поксвируса, причем указанный поксвирусный вектор содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки; причем терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки разработано для введения после терапевтически эффективного количества рекомбинантного поксвируса; и при этом терапевтически эффективное количество и суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имеет повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере только одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В еще одном варианте осуществления настоящего изобретения это раскрытие может включать комбинацию или лекарственное средство, предназначенные для применения в лечении онкологического пациента-человека, причем указанная комбинация или лекарственное средство содержит по меньшей мере первое и второе введение, при этом каждое введение содержит: (a) терапевтически эффективное количество рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки; причем второе введение терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки увеличивается по сравнению с первым введением терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки; и при этом терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусом имеет повышенный терапевтический эффект по сравнению с введением или только поксвируса, содержащего по меньшей мере один TAA, или терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере только одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В еще одном варианте осуществления настоящего изобретения рекомбинантный поксвирус, кодирующий TAA, в комбинации или лекарственных средствах, описанных в настоящем описании, может представлять собой PROSTVAC®. В еще одном варианте осуществления настоящего изобретения рекомбинантный поксвирус, кодирующий TAA, в комбинации или лекарственных средствах, описанных в настоящем описании, может представлять собой CV301.
В еще дополнительном варианте осуществления настоящего изобретения это раскрытие может включать использование: (a) рекомбинантного поксвируса, причем поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); (b) антагониста PD-1; и (c) антагониста CTLA-4 в приготовлении фармацевтической композиции или лекарственного средства. Антагонист PD-1 и антагонист CTLA-4 могут представлять собой антагонист-антитело к PD-1 и антитело к CTLA-4, соответственно. В дополнительном варианте осуществления настоящего изобретения применение раскрытой фармацевтической композиции или лекарственного средства может быть предназначено для лечения онкологического пациента-человека.
В еще дополнительном варианте осуществления настоящего изобретения это раскрытие может включать использование: (a) поксвируса, содержащий по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки в приготовлении фармацевтической композиции или лекарственного средства; причем терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имеет повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или только по меньшей мере одного антагониста или агониста иммунной контрольной точки, или в комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В еще дополнительном варианте осуществления настоящего изобретения настоящее раскрытие может включать применение (a) терапевтически эффективного количества рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки при приготовлении фармацевтической композиции или лекарственного средства; причем суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки является таким, что терапевтический эффект комбинации повышен по сравнению с введением или только поксвируса, содержащего по меньшей мере один TAA, или суб-терапевтически эффективного количества только по меньшей мере одного антагониста или агониста иммунной контрольной точки. Предусмотрено, что по меньшей мере один антагонист или агонист иммунной контрольной точки может быть выбран из антагониста CTLA-4, антагониста PD-1, антагониста PDL-1, антагониста LAG-3, антагонистa TIM-3 или агониста ICOS. Предусмотрено, что различные антагонисты или агонисты иммунной контрольной точки могут быть реализованы в одном или более антител.
В еще дополнительном варианте осуществления настоящего изобретения это раскрытие может включать использование: (a) терапевтически эффективного количества рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере одного антагониста или агониста иммунной контрольной точки в приготовлении фармацевтической композиции или лекарственного средства; причем терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки разработано для введения после терапевтически эффективного количества рекомбинантного поксвируса; и при этом терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имеет повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере только одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
В еще одном варианте осуществления настоящего изобретения это раскрытие может включать использование по меньшей мере первого и второго введения дозы, при этом каждое введение содержит: (a) терапевтически эффективное количество рекомбинантного поксвируса, причем указанный поксвирус содержит по меньшей мере один связанный с опухолью антиген (TAA); и (b) терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки для приготовления фармацевтической композиции или лекарственного средства; причем терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки во втором введении увеличивается по сравнению с первым введением; и при этом терапевтически эффективное количество или суб-терапевтически эффективное количество по меньшей мере одного антагониста или агониста иммунной контрольной точки в комбинации с поксвирусным вектором имеет повышенный терапевтический эффект по сравнению с введением или только поксвирусного вектора, содержащего по меньшей мере один TAA, или терапевтически эффективного количества или суб-терапевтически эффективного количества по меньшей мере только одного антагониста или агониста иммунной контрольной точки или его комбинации с другими антагонистами или агонистами иммунной контрольной точки.
ПРИМЕРЫ
Пример 1
Конструкция MVA-BN-mHER2
Одновременное инфицирование и трансфицирование культур обеспечивало осуществление гомологичной рекомбинации между вирусным геномом и плазмидой для рекомбинации. Вирус, несущий вставку, выделяли, характеризовали и получали вирусные штаммы.
Плазмида pBN146 содержит последовательности, которые также присутствуют в MVA-BN (открытые рамки считывания 14L и 15L). Последовательность mHER2 вставляли между последовательностями MVA-BN для обеспечения рекомбинации в вирусный геном MVA-BN. Таким образом, была сконструирована плазмида, которая содержала последовательность mHER2 ниже от поксвирусного промотора, в частности, промотора гена телец включений А-типа вируса коровьей оспы. Плазмида также содержала кассету селекции, содержащую синтетический промотор вируса коровьей оспы (Ps), ген резистентности к лекарственному средству (ксантин-гуанин-фосфорибозилтрансфераза; Ecogpt), внутренний сайт связывания рибосомы (IRES) и усиленный зеленый флуоресцентный белок (EGFP). Оба гена селекции (gpt и EGFP) были закодированы одним бицистронным транскриптом.
Последовательность HER-2 модифицировали путем добавления нуклеотидных последовательностей, кодирующих эпитопы p2 и p30 столбнячного токсина для усиления иммунного ответа против него. После вставки mHER2 в геном MVA-BN вирусная «область вставки» имела следующую структуру:
промотор ATI - последовательность mHER2 - промотор Ps - gpt - IRES - EGFP. Область вставки была фланкирована последовательностями (F1 и F2) межгенной области MVA-BN I4L в бактериальной плазмиде для рекомбинации pBN146. Нуклеотидная последовательность конструкта показана ниже.


Стартовый и стоп-кодоны HER2 выделены жирным шрифтом. Фланкирующие последовательности выделены курсивом.
Трансляция кодируемого полипептида mHER2 показана ниже:

Последовательности эпитопов p2 и p30 столбнячного токсина выделены жирным шрифтом.
В культуры CEF инокулировали MVA-BN и трансфицировали ДНК плазмиды pBN146. В свою очередь, образцы этих клеточных культур инокулировали в культуры CEF в среде, содержащей лекарственные средства для селекции, и посредством очистки из бляшки выделяли вирусные клоны, экспрессирующие EGFP. Вирусные штаммы, выросшие в присутствии лекарственных средств для селекции и экспрессирующие EGFP, были обозначены как MVA-BN-mHER2. Создание MVA-BN-mHER2 и получение штамма вируса включали двенадцать (12) последовательных пересевов, в том числе пять (5) очисток бляшек.
MVA-BN-mHER2 пересевали в клеточных культурах CEF в отсутствие лекарственных средств для селекции. Отсутствие лекарственных средств для селекции обеспечивало потерю области, кодирующей гены селекции, gpt и EGFP, и связанный промотор (кассета селекции) из вставленной последовательности. Рекомбинация, приводящая к потере кассеты селекции, опосредована областью F1 I4L и частью этой области, повтором F1 (F1 rpt), который фланкирует кассету селекции в плазмиде pBN146. Эти дублированные последовательности были включены для опосредования рекомбинации, которая приводит к потере кассеты селекции, оставляя только последовательность mHER2, вставленную в межгенную область I4L.
Был получен вирус, очищенный из бляшки, без кассеты селекции. Такое получение включало пятнадцать (15) пересевов, в том числе пять (5) очисток бляшек.
Наличие последовательности mHER2 и отсутствие исходного вируса MVA-BN в штамме MVA-BN-mHER2 подтверждали с помощью анализа ПЦР, а для проверки отсутствия кассеты селекции (генов gpt и EGFP) использовали гнездовую ПЦР.
В клетках, инокулированных MVA-BN-mHER2, наблюдалась экспрессия белка mHER2 in vitro.
Пример 2
Повышение уровня ИФНγ в результате лечения с использованием MVA-BN-mHER2 и антитела к CTLA4
Самок мышей линии BALB/c (в возрасте 6-8 недель, масса ~ 20 г) приобретали в Simonsen Laboratories, Gilroy, CA. Для экспериментальной модели легочных метастазов на 1-й день мышам провели в/в имплантацию 5,0 × 104 клеток CT26-HER-2 в 300 мкл DPBS, которые образуют опухоли в легких.
В компании Bio X Cell (West, Lebanon, NH) были приобретены следующие антитела: антитело-агонист к ICOS (клон 17G9), антитело к CTLA-4 (9D9), антитело к PD-1 (RMP1-14) и антитело к LAG-3 (C9B7W). Все антитела вводили в виде и/п инъекций в дозе 200 мкг на мышь в 100 мкл PBS на дни 3 и 17, если не указано иное. В качестве вирусных лечебных средств мышам вводили 7,1 мкл 1,0 × 107 Инф. Ед. MVA-BN-HER2 посредством скарификации хвоста (с/х, производства компании Bavarian Nordic [BN], Martinsried, Germany) на дни 4 и 18, если не указано иное.
Для анализа проточной цитометрии на 25-й день отбирали пул цельной крови, опухоли/легких или селезенки (4 мыши/группа). Спленоциты получали путем сдавливания селезенок между двумя матовыми предметными стеклами, и лизировали эритроциты с помощью буфера для лизиса ACK (Life Technologies, Grand Island, NY). Легкие и связанные с ними опухоли нарезали на кубики размером ~ 1-2 мм3, после чего расщепляли на одноклеточные суспензий в течение 1 ч при температуре 37°C в среде DMEM с добавлением 10% ФБС, 50 Ед/мл ДНКазы I и 250 Ед/мл коллагеназы I (Worthington Biochemical Corporation, Lakewood, NJ). Эритроциты в легких и цельной крови лизировали с помощью буфера для лизиса эритроцитов (eBiosceince).
Антитела к перечисленным белкам приобретали в компании BD Bioscience (San Jose, CA): CD3e (500A2), CD4 (RM4-5), CD8a (53-6.7), CD107a (1D4B), ИФН-γ (XMG1.2); в компании BioLegend (San Diego, CA): CD3e (145-2C11), ИЛ-2 (JES6-5H4), LAG-3 (C9B7W), PD-1 (CD279, 29F.1A12), Tim-3 (RMT3-23), ФНО-α (MP6-XT22); или в eBioscience (San Diego, CA): ICOS (7E.17G9), CD16/CD32 (93).
Для идентификации дегранулирующих Т-клеток, единичные клеточные суспензии спленоцитов (2 × 106 клеток/лунка) или опухоли/легких (1 × 106 клеток/лунка) повторно суспендировали в RPMI-10 (10% ФБС, 1% пенициллина-стрептомицина и 0,1% β-меркаптоэтанола) и повторно стимулировали в течение ночи при 37°C в присутствии антитела к CD107a и ингибитора транспорта белков GolgiStop (BD Bioscience). Для повторной стимуляции использовали следующие пептиды: MVA E3L и F2L (VGPSNSPTF и SPGAAGYDL, 1 мкМ каждого), HER2 p63 (TYLPTNASL, 1 мкМ), HER2 ECD перекрывающаяся пептидная библиотека (HER2 OPL, 1 мкМ) и PSA (HPQKVTKFML, 1 мкМ) (5, 9-11). В качестве положительного контроля использовали конканавалин A (ConA) в дозе 5 мкг/мл. На следующий день клетки промывали, блокировали антителами к CD16/CD32 и окрашивали для обнаружения маркеров клеточной поверхности. Затем клетки промывали, фиксировали/пермеабилизовали с использованием буфера BD Cytofix/Cytoperm, и проводили внутриклеточное окрашивание для обнаружения ИФН-γ.
Проводили дополнительное внутриклеточное окрашивание цитокинов в спленоцитах, как описано выше, за исключением стимуляции антителом к CD107a, добавляли GolgiStop и GolgiPlug и проводили внутриклеточное окрашивание клеток для обнаружения ИФН-γ, ИЛ-2 и ФНО-α.
Все образцы для FACS приобретали в компании BD LSRII или Fortessa и анализировали с использованием программного обеспечения FlowJo версии 9.6.2 (TreeStar Inc., Эшленд, штат Орегон).
Все статистические анализы были проведены с использованием программного обеспечения GraphPad Prism версии 6.01 для Windows (GraphPad Software, Ла-Холья, Калифорния).
Результаты показаны на Фигуре 1. Уровень дегранулирующих клеток, специфических для опухолевого антигена (HER2 p63 CD107+ИФНγ+), повышался в опухоли/легких и селезенки мышей, которым проводили комбинированную терапию с использованием MVA-BN-HER2 и CTLA-4. Уровень дегранулирующих клеток, специфических для вируса (MVA E3L F2L CD107+ ИФНγ+) был высоким и в опухоли/легких и селезенки мышей, которым вводили MVA-BN-HER2.
Пример 3
Повышение выработки ИФНγ и цитокинов в результате лечения с использованием MVA-BN-mHER2 и антитела к CTLA4
Введение MVA-BN-HER2 увеличивало в селезенке количество и качество Т-клеток, специфических для опухолевого антигена и вируса. Мышам провели имплантацию 5 × 104 клеток CT26-HER-2, после чего вводили MVA-BN-HER2 и антитело к CTLA-4, как описано в примере 2. На 25-й день легкие или селезенки с наличием опухоли объединяли (4 мыши/группа) и повторно стимулировали в течение ночи для измерения специфических ответов на вирус и опухолевый антиген, как описано в примере 2.
Результаты показаны на Фигуре 2, A) Секторные диаграммы представляют собой площадь, взвешенную для отражения количества клеток ИФНγ+на миллион T-клеток CD8+. B) При комбинированной терапии СИФ ИФНγ увеличивается с полифункциональными Т-клетками, специфическими для опухолевого антигена (HER2 p63).
В обоих примерах 2 и 3, в результате лечения комбинацией MVA-BN-HER2 и антитела к CTLA-4, количество и качество Т-клеток, специфических для антигена и вируса, увеличивалось. Кроме того, комбинированное лечение способствовало увеличению числа Т-клеток, специфических для антигена и вируса, которые присутствовали в опухоли. Как показано на Фигурах 1 и 2, увеличение Т-клеток, специфических для антигена и вируса, в местах наличия опухоли является заметным улучшением по сравнению с видами лечения с использованием либо только MVA-BN-HER2 или только антитела к CTLA-4. Такое увеличение количества и специфичности Т-клеток, специфических для антигена и вируса, может обеспечить лучшие и более эффективные виды лечения раковых заболеваний человека.
Кроме того, как показано на Фигуре 2, MVA-BN-HER2 индуцирует Т-клетки, специфические для опухолевого антигена, которые вырабатывают ИФНγ. В настоящем раскрытии предусмотрено, что индуцированные вирусом TIL (лимфоциты, инфильтрирующие опухоль), которые секретируют ИФНγ; могут привести к увеличению PD-L1 на опухолевых клетках; что поддерживает блокаду этого пути в комбинации с лечением вируса.
Пример 4
Мышам провели в/в имплантацию 5 × 104 клеток CT26-HER-2, после чего вводили MVA-BN-HER2 и антитело к CTLA-4, как описано в примере 2. **** p < 0,0001, логранговый критерий. Результаты. Как показано на Фигуре 3, результаты демонстрируют, что лечение с использованием MVA-BN-HER2 и антитела к CTLA-4 значительно повышает показатель общей выживаемости субъектов по сравнению с лечением раковых заболеваний либо только MVA-BN-HER2 или только антителом к CTLA-4.
Пример 5
MVA-BN-HER2 значительно уменьшает легочную опухолевую нагрузку к 25-му дню
Мышам провели в/в имплантацию 5 × 104 клеток CT26-HER-2, после чего вводили MVA-BN-HER2 и антитело к CTLA-4, как описано в примере 2. A) Мышей умерщвляли и перфузировали через трахею трипановый синий. Легкие удаляли и на короткое время погружали в перекись водорода, а затем промывали в PBS. Опухоли видны как небольшие массы у не подвергавшихся лечению мышей и у мышей после лечения антителом к CTLA-4. В легких у мышей, получавших MVA-BN-HER2, не было видимых опухолей. Масштаб деления линейки равен 1 см. B) Масса легкого на 25-й день. **** p < 0,0001, однофакторный дисперсионный анализ ANOVA с критерием множественных сравнений Даннетта.
Результаты. Как показано на Фигуре 4, результаты демонстрируют, что лечение с использованием только MVA-BN-HER2 или его комбинации с антителом к CTLA-4 значительно снижает опухолевую нагрузку к 25-му дню по сравнению с отсутствием лечения раковых заболеваний или по сравнению с лечением только с использованием антитела к CTLA-4.
Пример 6
Лечение с использованием MVA-BN-HER2 и антитела к CTLA-4 повышает показатель общей выживаемости
Мышам провели в/в имплантацию 5 × 104 клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 2. Мышам вводили антитело к CTLA-4 на 4-й и 18-й дни в дозе 200 мкг (A, 10 мг/кг), 66 мкг (B, 3 мг/кг) или 22 мкг (C, 1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, логранговый критерий.
Результаты. Как показано на Фигуре 5, результаты демонстрируют, что лечение с использованием MVA-BN-HER2 в комбинации с антителом к CTLA-4 повышает показатель общей выживаемости субъектов в каждой концентрации дозы по сравнению с отсутствием лечения или с лечением только CTLA-4.
Пример 7
Применение MVA-BN-HER2 и антитела к CTLA-4 уменьшает опухолевую нагрузку
В модели солидных опухолей самкам мышей линии BALB/c на 1-й день провели имплантацию клетками CT26-HER-2 (1,0 × 10^5, в/к в боковую часть спинки). На 1-й и 15-й дни мышам вводили MVA-BN-HER2 (1E7 Инф. Ед. в 100 мкл TBS, подкожно, п/к в основание хвоста) и 22 мкг антитела к CTLA-4 (1 мг/кг) на 1-й и 15-й дни. Опухоли измеряли два раза в неделю, а объем опухоли рассчитывали по формуле: объем опухоли (мм3)=(длина × ширина 2)/2.
Результаты. Как показано на Фигуре 6, результаты демонстрируют, что MVA-BN-HER2 в комбинации с низкой дозой антитела к CTLA-4 значительно снижает опухолевую нагрузку к 20-му дню по сравнению с другими видами лечения. **** p < 0,0001, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 8
Лечение с использованием MVA-BN-HER2 и антитела к PD-1
Мышам провели в/в имплантацию 5 × 104 клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 2. Мышам вводили антитело к PD-1 на 4-й и 18-й дни в дозе 200 мкг (A, 10 мг/кг), 66 мкг (B, 3 мг/кг) или 22 мкг (C, 1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, * p<0,05, н. з.=не имеет существенного значения по логранговому критерию.
Результаты. На Фигуре 7 показаны результаты применения MVA-BN-HER2 в комбинации с антителом к PD-1.
Пример 9
MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом 1 к PD-1 повышает показатель общей выживаемости при введении в более низких дозах
Мышам провели в/в имплантацию 5 × 104 клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 2. Мышам вводили антитело к CTLA-4 и антитело к PD-1 на 3-й и 17-й дни в дозе 200 мкг (A, 10 мг/кг), 66 мкг (B, 3 мг/кг) или 22 мкг (C, 1 мг/кг) каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, логранговый критерий.
Результаты. Как показано на Фигуре 8, результаты демонстрируют, что лечение с использованием MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом к PD-1 значительно повышает показатель общей выживаемости субъектов в каждой концентрации дозы по сравнению с лечением раковых заболеваний только MVA-BN-HER2 или только антителом к CTLA-4 и антителом к PD-1. Что еще более важно, при лечении MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом PD-1 показатели выживаемости повышались при применении более низких доз антител (3 мг/кг и 1 мг/кг) по сравнению с только MVA-BN-HER2 или только антителом к CTLA-4 и антителом к PD-1.
Пример 10
Применение MVA-BN-CV301 с антителом к CTLA-4 и антителом к PD-1 повышает показатель общей выживаемости
Самкам мышей линии C57/BL6 (в возрасте 6-8 недель, масса ~ 20 г, Simonsen Laboratories, Gilroy, CA) на 1-й день провели в/в имплантацию 1,0 × 10^6 клеток MC38-MUC1 в 300 мкл DPBS, которые образуют опухоли в легких. Мышам вводили MVA-BN-CV301 (4E5 Инф. Ед. подкожно, п/к выше основания хвоста), а также антитело к CTLA-4 и антитело к PD-1 (200 мкг каждого) и/п на дни 4 и 18.
Результаты. Как показано на Фигуре 9, результаты демонстрируют, что лечение с использованием MVA-BN-CV301 в комбинации с антителом к CTLA-4 и антителом к PD-1 значительно повышает показатель общей выживаемости субъектов по сравнению с лечением раковых заболеваний только MVA-BN-CV301 или только антителом к CTLA-4 и антителом к PD-1.
Пример 11
Индуцирование противоопухолевого ответа у мышей, получавших лечение PROSTVAC и антителами
Самцам мышей линии BALB/c (в возрасте 6-8 недель, масса ~ 20 г, Simonsen Laboratories, Gilroy CA) на 1-й день провели имплантацию клеток E6 (1,5 × 10^5, в/к в боковую часть спинки), которые образуют солидные опухоли. Мышам проводили лечение на 1-й день вакциной PROSTVAC-V (2E7 Инф. Ед., п/к в основание хвоста), и на 8-й и 15-й дни вакциной PROSTVAC-F (1E8 Инф. Ед., п/к в основание хвоста). На 1-й и 15-й дни мышам вводили и/п антитело к PD-1 (200 мкг). Опухоли измеряли два раза в неделю, а объем опухоли рассчитывали по формуле: объем опухоли (мм3)=(длина × ширина 2)/2.
Пример 12
Индуцирование противоопухолевого ответа у мышей, получавших лечение PROSTVAC и антителом к PD-1
Мышам провели в/к имплантацию опухолей E6 и лечили с использованием PROSTVAC и антитела к PD-1, как описано в примере 11. Результаты показаны на Фигуре 10.
Пример 13
Индуцирование противоопухолевого ответа у мышей, получавших лечение PROSTVAC и антителом к LAG-3
Мышам провели в/к имплантацию опухолей E6 и лечили с использованием PROSTVAC и антитела к LAG-3, как описано в примере 11. Результаты показаны на Фигуре 11.
Пример 14
Индуцирование противоопухолевого ответа у мышей, получавших лечение PROSTVAC, антителом к PD-1 и антителом к LAG-3
Мышам провели в/к имплантацию опухолей E6 и лечили с использованием PROSTVAC и антитела к PD-1 и антитела к LAG-3, как описано в примере 11. Результаты показаны на Фигуре 12.
Пример 15
Применение MVA-BN-HER2 и антитела к CTLA-4 уменьшает опухолевую нагрузку
На 1-й день мышам провели в/к имплантацию клетками CT26-HER-2, как описано в примере 7. Мышам вводили MVA-BN-HER2 на 7-й и 22-й дни (1E7 Инф. Ед., с/х) и антитело к ICOS на дни 1, 4, 8, 11, 15, 18, 22, 25 (200 мкг и/п). A) Средний рост опухоли. B) Рост опухоли у отдельных мышей. ****p < 0,0001, ** p < 0,01, двухфакторный дисперсионный анализ ANOVA. Результаты показаны на Фигуре 13.
Пример 16
MVA-BN-HER2 в комбинации с антителом к PD-1 снижает опухолевую нагрузку при введении в более низких дозах
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 на 1-й и 15-й дни в дозе 200 мкг (10 мг/кг), 66 мкг (3 мг/кг) или 22 мкг (1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 17
MVA-BN-HER2 в комбинации с антителом к ICOS снижает опухолевую нагрузку при введении в более низких дозах
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к ICOS на 1-й и 15-й дни в дозе 200 мкг (10 мг/кг), 66 мкг (3 мг/кг) или 22 мкг (1 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 18
MVA-BN-HER2 в комбинации с антителом к PD-1 и антителом к LAG-3 снижает опухолевую нагрузку при введении в более низких дозах
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 и антитело к LAG-3 на 1-й и 15-й дни в дозе 200 мкг (10 мг/кг), 66 мкг (3 мг/кг) или 22 мкг (1 мг/кг) каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 19
MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом к ICOS снижает опухолевую нагрузку при введении в более низких дозах
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к ICOS на 1-й и 15-й дни в дозе 200 мкг (10 мг/кг), 66 мкг (3 мг/кг) или 22 мкг (1 мг/кг) каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 20
MVA-BN-HER2 в комбинации с антителом к CTLA-4 снижает опухолевую нагрузку при повышении второй дозы
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 на 1-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 15-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 21
MVA-BN-HER2 в комбинации с антителом к PD-1 снижает опухолевую нагрузку при повышении второй дозы
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 на 1-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 15-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 22
MVA-BN-HER2 в комбинации с антителом к ICOS снижает опухолевую нагрузку при повышении второй дозы
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к ICOS на 1-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 15-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 23
MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом к PD-1 снижает опухолевую нагрузку при повышении второй дозы
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к PD-1 на 1-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 15-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 24
MVA-BN-HER2 в комбинации с антителом к PD-1 и антителом к LAG-3 снижает опухолевую нагрузку при повышении второй дозы
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 и антитело к LAG-3 на 1-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 15-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 25
MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом к ICOS снижает опухолевую нагрузку при повышении второй дозы
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к ICOS на 1-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 15-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 26
MVA-BN-HER2 в комбинации с антителом к CTLA-4 снижает опухолевую нагрузку при введении поксвируса перед антителом к CTLA-4
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 на 3-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 18-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 на 7-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 21-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 27
MVA-BN-HER2 в комбинации с антителом к PD-1 снижает опухолевую нагрузку при введении поксвируса перед антителом к PD-1
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 на 3-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 18-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 на 7-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 21-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 28
MVA-BN-HER2 в комбинации с антителом к ICOS снижает опухолевую нагрузку при введении поксвируса перед антителом к ICOS
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к ICOS на 3-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 18-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к ICOS на 7-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг), и на 21-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 29
MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом к PD-1 снижает опухолевую нагрузку при введении поксвируса перед антителом к CTLA-4 и антителом к PD-1
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к PD-1 на 3-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 18-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к PD-1 на 7-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 21-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 30
MVA-BN-HER2 в комбинации с антителом к PD-1 и антителом к LAG-3 снижает опухолевую нагрузку при введении поксвируса перед антителом к PD-1 и антителом к LAG-3
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 и антитело к LAG-3 на 3-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 18-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к PD-1 и антитело к LAG-3 на 7-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 21-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 31
MVA-BN-HER2 в комбинации с антителом к CTLA-4 и антителом к ICOS снижает опухолевую нагрузку при введении поксвируса перед антителом к CTLA-4 и антителом к ICOS
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к ICOS на 3-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 18-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Мышам провели имплантацию клеток CT26-HER-2, после чего вводили MVA-BN-HER2, как описано в примере 7. Мышам вводили антитело к CTLA-4 и антитело к ICOS на 7-й день в дозе 66 мкг (3 мг/кг), 22 мкг (1 мг/кг) или 2,2 мкг (0,1 мг/кг) для каждого антитела, и на 21-й день в дозе 200 мкг (10 мг/кг) или 66 мкг (3 мг/кг) для каждого антитела и/п в 100 мкл PBS. **** p < 0,0001, *** p < 0,001, ** p < 0,01, * p < 0,05, двухфакторный дисперсионный анализ ANOVA.
Пример 32
Повышение экспрессии Tim-3 при введении MVA-BN-HER2
Самкам мышей линии BALB/c (в возрасте 6-8 недель, масса ~ 20 г, Simonsen Laboratories, Гилрой, Калифорния) вводили на 1-й день и 15-й день 7,1 мкл 1,0 × 10^7 Инф. Ед. MVA-BN-HER2 посредством скарификации хвоста (с/х, производства компании Bavarian Nordic [BN], Мартинсрид, Германия). Ткани собирали, обрабатывали и окрашивали, как описано в примере 2, и через различные интервалы времени измеряли поверхностную экспрессию Tim-3.
Результаты. Как показано на Фигуре 14, субъектам вводили MVA-BN-HER-2, и после этого через одинаковые интервалы времени измеряли экспрессию Tim-3. Ответом на лечение был начальный период с очень небольшим увеличением экспрессии иммунной контрольной точки. Приблизительно от 3 дня до приблизительно 12 дня экспрессия TIM-3 T-клетками резко увеличивалась. Повышенная экспрессия все еще наблюдалась приблизительно до 18 дня. При втором введении MVA-BN-HER2 на 15-й день экспрессия Tim-3 увеличивалась, начиная с 17-го дня. Еще более существенно, что это повышение экспрессии иммунной контрольной точки было более полным в Т-клетках CD8 по сравнению с Т-клетками CD4.
Как показано на Фигуре 14, введение MVA-BN-HER2 транзиторно индуцировало экспрессию Tim-3 на T-клетках. В одном аспекте упомянутая индуцированная экспрессия Tim-3 на T-клетках свидетельствует о том, что блокирование пути Tim-3 посредством одного или более антагонистов TIM-3 может усиливать T-клеточный ответ онкологического пациента.
Пример 33
Введение MVA-BN-HER2 увеличивает уровень ICOS на T-клетках CD8+ и CD4 +
Мышам вводили MVA-BN-HER2 (1E7 Инф. Ед., с/х) на 1-й и 15-й дни. Ткани собирали, обрабатывали и окрашивали, как описано в примере 2, и через различные интервалы времени измеряли поверхностную экспрессию ICOS.
Результаты. Как показано на Фигуре 15, субъектам вводили MVA-BN-HER-2, и после этого через одинаковые интервалы времени измеряли экспрессию ICOS. Ответом на лечение был начальный период с очень небольшим увеличением экспрессии иммунной контрольной точки. Приблизительно через 1-2 дня наблюдалось незначительное снижение экспрессии ICOS T-клетками. Приблизительно от 3 дня до приблизительно 12 дня экспрессия ICOS T-клетками резко увеличивалась. Повышенная экспрессия все еще наблюдалась приблизительно до 18 дня. При втором введении MVA-BN-HER2 на 15-й день экспрессия ICOS увеличивалась, начиная с 17-го дня. Еще более существенно, что это повышение экспрессии иммунной контрольной точки было более полным в Т-клетках CD8 по сравнению с Т-клетками CD4.
Как показано на Фигуре 15, введение MVA-BN-HER2 транзиторно индуцировало экспрессию ICOS на T-клетках. В одном аспекте упомянутая индуцированная экспрессия ICOS на T-клетках свидетельствует о том, что активация пути ICOS посредством одного или более агонистов ICOS может усиливать T-клеточный ответ онкологического пациента.
Пример 34
Экспрессия PD-1 увеличивается при введении MVA-BN-HER2.
Мышам вводили MVA-BN-HER2 (1E7 Инф. Ед., с/х) на 1-й и 15-й дни. Ткани собирали, обрабатывали и окрашивали, как описано в примере 2, и через различные интервалы времени измеряли поверхностную экспрессию PD-1.
Результаты. Результаты показаны на Фигуре 16. Субъектам вводили MVA-BN-HER-2, и после этого через одинаковые интервалы времени измеряли экспрессию PD-1. Ответом на лечение был начальный период с очень небольшим увеличением экспрессии иммунной контрольной точки. Приблизительно через 1-2 дня наблюдалось незначительное снижение экспрессии PD-1 T-клетками. Приблизительно от 3 дня до приблизительно 12 дня экспрессия PD-1 T-клетками резко увеличивалась. Повышенная экспрессия все еще наблюдалась приблизительно до 18 дня. При втором введении MVA-BN-HER2 на 15-й день экспрессия PD-1 увеличивалась, начиная с 17-го дня. Еще более существенно, что это повышение экспрессии иммунной контрольной точки было более полным в Т-клетках CD8 по сравнению с Т-клетками CD4.
Как показано на Фигуре 16, введение MVA-BN-HER2 транзиторно индуцировало экспрессию PD-1 на T-клетках. В одном аспекте упомянутая индуцированная экспрессия PD-1 на T-клетках свидетельствует о том, что блокирование пути PD-1/PDL-1 посредством одного или более агонистов PD-1/PDL-1 может усиливать T-клеточный ответ онкологического пациента.
Кроме того, предполагается, что блокирование PD-1, индуцированное MVA-BN-HER2, может привести к коэкспрессии LAG-3, и терапевтический эффект может быть достигнут посредством двойной блокады путей PD-1/PD-L1 и LAG-3 в комбинации с использованием MVA-BN-HER2.
Пример 35
Иммунный ответ LAG-3 на MVA-BN-HER2
Мышам вводили MVA-BN-HER2 (1E7 Инф. Ед., с/х) на 1-й и 15-й дни. Ткани собирали, обрабатывали и окрашивали, как описано в примере 2, и через различные интервалы времени измеряли поверхностную экспрессию LAG-3.
Результаты. Результаты показаны на Фигуре 17. Субъектам вводили MVA-BN-HER-2, и после этого через одинаковые интервалы времени измеряли экспрессию LAG-3. После введения MVA-BN-HER2, на T-клетках CD4 или CD8 происходила экспрессия LAG-3.
Пример 36
Индуцирование противоопухолевого ответа у мышей, получавших лечение MVA-BN-CV301 и антителами
Самкам мышей линии C57BL/6 (в возрасте 6-8 недель, масса ~ 20 г, Simonsen Laboratories, Gilroy CA) на 1-й день провели имплантацию клеток MC38-CEA (2 × 105, в/к в боковую часть спинки). На 1-й и 15-й дни мышам вводили MVA-BN-CV301 (1E7 Инф. Ед., п/к выше основания хвоста). Мышам вводили и/п антитело к PD-1 и/или антитело к LAG-3, как представлено на каждой из фигур и в примерах, и как описано в примере 2.
Пример 37
Индуцирование противоопухолевого ответа у мышей, получавших лечение MVA-BN-CV301 и антителом к PD-1
Мышам линии C57/BL6 провели в/к имплантацию опухолей MC38-CEA и лечили, как описано в примере 36. Результаты показаны на Фигуре 18.
Пример 38
Индуцирование противоопухолевого ответа у мышей, получавших лечение MVA-BN-CV301 и антителом к LAG-3
Мышам линии C57/BL6 провели в/к имплантацию опухолей MC38-CEA и лечили, как описано в примере 36. Результаты показаны на Фигуре 19.
Пример 39
Индуцирование противоопухолевого ответа у мышей, получавших лечение MVA-BN-CV301, антителом к PD-1 и антителом к LAG-3
Мышам линии C57/BL6 провели в/к имплантацию опухолей MC38-CEA и лечили, как описано в примере 36. Результаты показаны на Фигуре 20.
Пример 40
Схема гетерологичного бустер-примирования усиливает PSA-специфический ответ T-клеток
Самцам мышей линии BALB/c (5/группа) каждые две недели вводили: буферный раствор (контроль), PROSTVAC-V (VVV) (2E6 Инф. Ед., п/к в основание хвоста), PROSTVAC-F (FFF) (1E7 Инф. Ед., п/к в основание хвоста) или проводили примирование с введением PROSTVAC-V с последующими 2-мя бустингами PROSTVAC-F (VFF). Объединенные спленоциты анализировали на PSA-специфические ответы посредством анализа ELISPOT ИФНγ, как описано в публикации Mandl et al. Cancer Immunol. Immunother (2012), 61:19-29, которая включена в настоящий документ путем ссылки.
(A, B). А анализ на цитотоксическую активность проводили с помощью проточной цитометрии ( % CD107+ ИФНγ+ T-клеток CD8) (C). Титры IgG к PSA были определены с помощью ИФА для каждой отдельной мыши (D). Для анализа ELISPOT спленоциты повторно стимулировали CD4 или CD8 PSA-специфическими пептидами или контролями (контроли не показаны) в указанных концентрациях. Ответы, которых было слишком много для подсчета, отображались как 1000 пятен/миллион клеток. Статистическую значимость определяли с помощью RM-ANOVA с апостериорным критерием Тьюки при 0,01 мкМ. **** P < 0,001 по сравнению с контролем (A и B). Для выявления цитотоксических T-клеток CD8+ спленоциты повторно стимулировали в течение ночи с PSA CD8-специфическим пептидом в присутствии антитела к CD107. На графиках показаны репрезентативные данные из четырех независимо проведенных экспериментов.
Как показано на Фигуре 21, схема гетерологичного бустер-примирования вирусом коровьей оспы с последующим бустингом с введением одной или более доз поксвируса домашней птицы приводит к гораздо более высокой частоте ИФНγ-продуцирующих PSA-специфических T-клеток CD4 (Фигура 21A) и T-клеток CD8 (Фигуры 21B и 22A) по сравнению со схемами гомологичной вакцинации дозами VVV или FFF.
Кроме того, PSA-специфические Т-клетки при введении доз VFF имели более высокую авидность (Фигуры 21A и 21B), что подтверждается более высокой частотой Т-клеток, реагирующих на более низкие концентрации пептидов (0,01 мкМ) по результатам ELISPOT. Важно отметить, что число функционально активных PSA-специфических CTL CD8, созданных в результате применения схемы гетерологичного бустер-примирования VFF, было в 7-20 раз выше, чем созданных в результате любой схемы гомологичного введения доз (Фигура 21C).
В отличие от ответов T-клеток, схема гетерологичного бустер-примирования не улучшала ответы PSA-специфических антител (Фигура 21 D). Эти результаты указывают на то, что гетерологичное введение доз VFF вызывает PSA-специфические ответы Т-клеток CD4 и CD8 с большей величиной и более высокого качества по результатам измерений более высокой авидности и повышенной активности CTL CD8. Как описано в настоящем описании, это способствует улучшению анти-PSA-специфических противоопухолевых ответов после применения гетерологичного дозирования PROSTVAC-V/F.
Пример 41
Гетерологичное примирование-бустинг улучшает качество PSA-специфических Т-клеточных ответов
Самцов мышей линии BALB/c (5/группа) лечили, как описано в примере 40. Селезенки собирали через 14 дней после последнего лечения, и объединенные спленоциты повторно стимулировали в течение ночи PSA OPL или контролями (контроли не показаны). Перед анализом проточной цитометрии проводили внутриклеточное окрашивание клеток для обнаружения ИФНγ, ФНОα и ИЛ-2. (A) Секторные диаграммы взвешены по размеру для отражения количества обнаруженных клеток (общие количества PSA-специфических CD8 на миллион T-клеток приведены ниже каждой диаграммы). (B) Величина продукции ИФНγ на одну клетку по результатам измерений по средней интенсивности флуоресценции (СИФ). На графиках показаны репрезентативные данные из двух независимо проведенных экспериментов.
Как показано на Фигуре 22, дополнительные отличительные особенности качества PSA-специфического ответа Т-клеток CD8 наблюдались при анализе PSA-специфических Т-клеток CD8 на производство некоторых цитокинов ИФНγ, ФНОα и ИЛ-2 посредством проточной цитометрии (Фигура 22). С учетом экспрессии цитокинов T-клетки памяти CD8 классифицировали как двойные положительные эффекторные T-клетки памяти CD8 (ИФНγ+ ФНОα+, TEM и тройные положительные центральные T-клетки памяти CD8 (ИФНγ+ ФНОα+ ИЛ-2+; TCM) См., например, Nat Rev Immunol 2008, 8:247-258.
В дополнение к увеличению интенсивности ответа Т-клеток CD8 (Фигура 21 и Фигура 22A), заметный сдвиг в отношении качества ответа Т-клеток CD8 определялся по более высокой доле двойных положительных TEM и тройных положительных TCM (Фигура 22A) в результате применения схемы гетерологичного вакцинирования PROSTVAC-V/F по сравнению со схемой гомологичного вакцинирования. Примирование с введением в 5 раз более высокой дозы PROSTVAC-V не приводило к дополнительным преимуществам величины или качества ответа T клеток CD8 (данные не показаны). Кроме того, двойные положительные TEM и тройные положительные TCM T-клетки CD8 вырабатывали более высокие уровни ИФНγ на одну клетку, чем одиночные положительные клетки (Фигура 22B). Эта повышенная выработка ИФНγ наблюдалась в T-клетках CD8 TEM и TCM независимо от схемы дозирования.
Кроме того, как показано на Фигуре 22, MVA-BN-HER2 индуцирует Т-клетки, специфические для опухолевого антигена, которые вырабатывают ИФНγ. В настоящем раскрытии предусмотрено, что индуцированные вирусом TIL (лимфоциты, инфильтрирующие опухоль), которые секретируют ИФНγ; могут привести к увеличению PD-L1 на опухолевых клетках; что поддерживает блокаду этого пути в комбинации с лечением вируса.
Пример 42
Иммунное фокусирование Т-клеточного ответа по отношению к PSA
Мышей лечили, как описано в примере 40. Объединенные спленоциты анализировали на специфическую для вируса коровьей оспы (VV) (панели A и C слева) или PSA-специфическую (панели A и C справа) цитотоксическую активность с помощью проточной цитометрии ( % CD107+ ИФНγ+ T-клетки CD8) через 14 дней после последнего введения. Спленоциты повторно стимулировали в течение ночи пептидами E3L и F2L вируса коровьей оспы или PSA OPL в присутствии антитела к CD107. На следующий день проводили внутриклеточное окрашивание клеток для обнаружения ИФНγ и маркеров клеточной поверхности CD127 и KLRG1. % антиген-специфических цитотоксических SLEC и MPEC определяли посредством гейтинга на клетках (CD8 +CD127-KLRG1+) и (CD8+CD127+KLRG1+), соответственно. На графиках показаны репрезентативные данные из двух независимо проведенных экспериментов. Результаты показаны на Фигуре 23.
Анализировали влияние гетерологичной схемы дозирования вакцины PROSTVAC с поксвирусом домашней птицы Fowlpox/F по сравнению с гомологичной схемой вакцинирования на цитотоксические способности вектор-специфических по сравнению с PSA-специфическими подмножеств эффекторных Т-клеток. Схема гомологичного вакцинирования VVV вызывала выработку относительно большого количества специфических для вируса коровьей оспы цитотоксических SLEC (~50%) и DPEC (~20%) (Фигуры 23A и 23C), при этом все же меньше 10% цитотоксических Т-клеток CD8 SLEC или DPEC были PSA-специфическими. И наоборот, после гетерологичного вакцинирования VFF 65% SLEC и 30% высокоактивных DPEC эффекторных T-клеток памяти были PSA-специфическими CTL, в то время как менее 10% составляли специфичные для вируса коровьей оспы CTL (Фигуры 23A и 23C). Таким образом, гетерологичная схема вакцинации PROSTVAC-V/F приводила к 100-кратному улучшению соотношения PSA-нацеленных к нацеленным на вирус коровьей оспы T-клеточных ответов SLEC и DPEC (Фигуры 23B и 23D). И снова, примирование с введением в 5 раз более высокой дозы PROSTVAC-V не приводило к дополнительным преимуществам (данные не показаны).
Пример 43
Комбинированная терапия с использованием CTLA-4 после иммунного фокусирования
Самцам мышей линии BALB/c (5/группа) каждые две недели вводили: буферный раствор (контроль), примирующую дозу PROSTVAC-V с последующими 2-мя дозами бустинга PROSTVAC-F (VFF), как описано в примере 40. Мышам вводили и/п антитело к CTLA-4 (60 мкг) на дни 1, 15 и 29 (A), или на дни 15 и 29 (B), или на дни 16 и 30 (C), или на дни 17 и 31 (D). PSA-специфические T-клеточные ответы анализировали, как описано в примерах 40, 41 и 42.
Как описано в настоящем описании и продемонстрировано в настоящей заявке, введение рекомбинантного поксвируса, содержащего TAA, в комбинации с одним или более антагонистами или агонистами иммунной контрольной точки, является терапевтически эффективным в различных дозах. В частности, раскрытые комбинации эффективны в дозах, которые являются более низкими, чем дозы, применяемые при монотерапии одним или более антагонистами или агонистами иммунной контрольной точки или поксвирусными лекарственными средствами.
Настоящая заявка дополнительно показывает, что эффективность комбинации рекомбинантного поксвируса и антагониста или агониста иммунной контрольной точки значительно усиливается в зависимости от схемы дозирования, используемой во время лечения. Например, введение одного или более антагонистов или агонистов иммунной контрольной точки после лечения рекомбинантным поксвирусом значительно усиливает эффективность комбинированного лечения. Кроме того, увеличение дозы антагониста или агониста иммунной контрольной точки после второго или последующего введения рекомбинантного поксвируса значительно усиливает эффективность комбинированного лечения, описанного в настоящем описании.
В настоящей заявке дополнительно продемонстрировано, что схемы дозирования, описанные в настоящем описании, имеют важное значение для значительного повышения эффективности комбинированной терапии рекомбинантным поксвирусом и антагонистом или агонистом иммунной контрольной точки.
Важно отметить, что настоящее изобретение демонстрирует, что поксвирусный вектор, имеющий TAA, при введении в комбинации с антагонистом или агонистом иммунной контрольной точки, может обеспечить повышенный терапевтический эффект независимо от типа поксвирусного вектора. В частности, настоящее раскрытие демонстрирует повышенный терапевтический эффект при использовании в комбинированном лечении множества типов поксвирусов. Например, терапевтические эффекты были достигнуты, когда поксвирус, такой как ортопоксвирус или авипоксвирус, вводили с антагонистом или агонистом иммунной контрольной точки, как описано в настоящем описании.
Будет очевидно, что точные детали способов или композиций, описанных в настоящем описании, могут быть изменены или модифицированы без отклонения от сущности описанного изобретения. Изобретение охватывает все такие модификации и варианты, попадающие в пределы его объема и сущности, отраженные в приведенной ниже формуле изобретения.
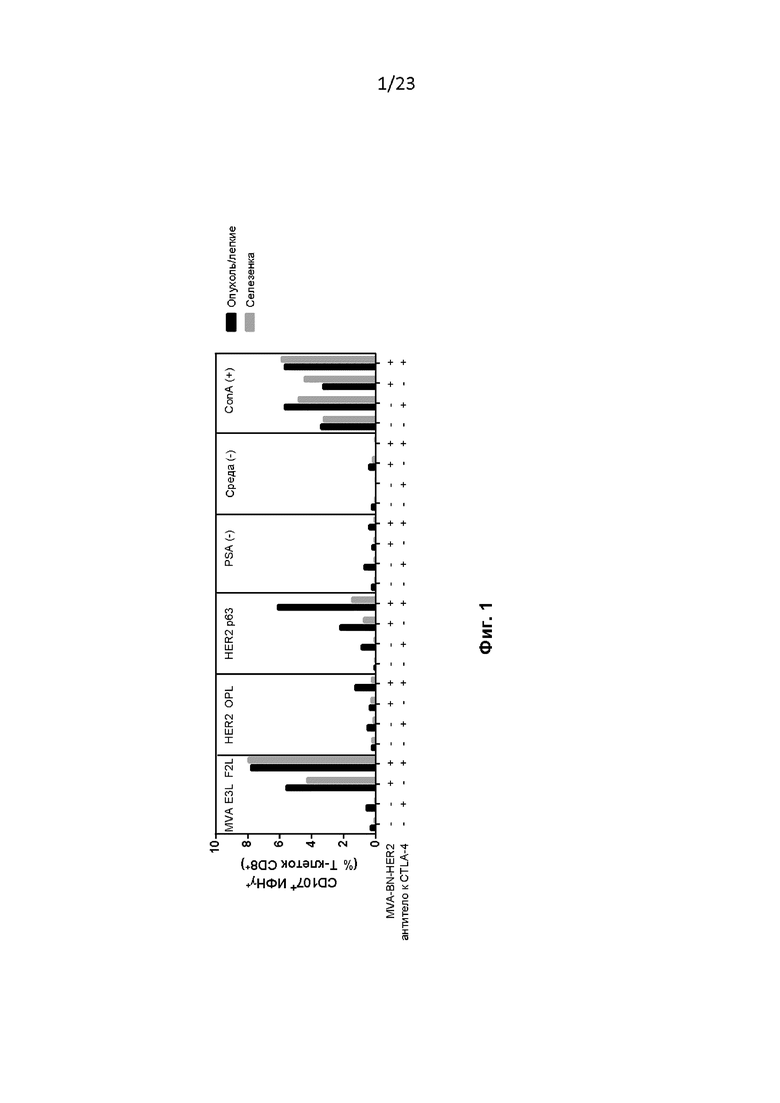
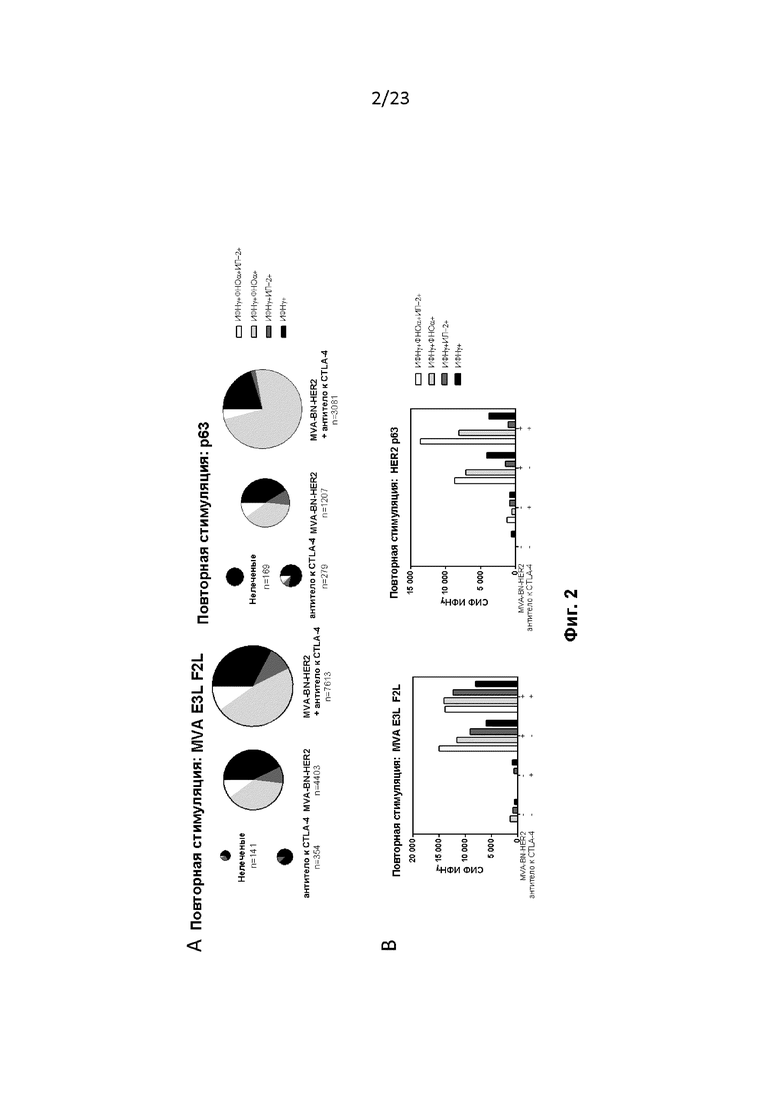

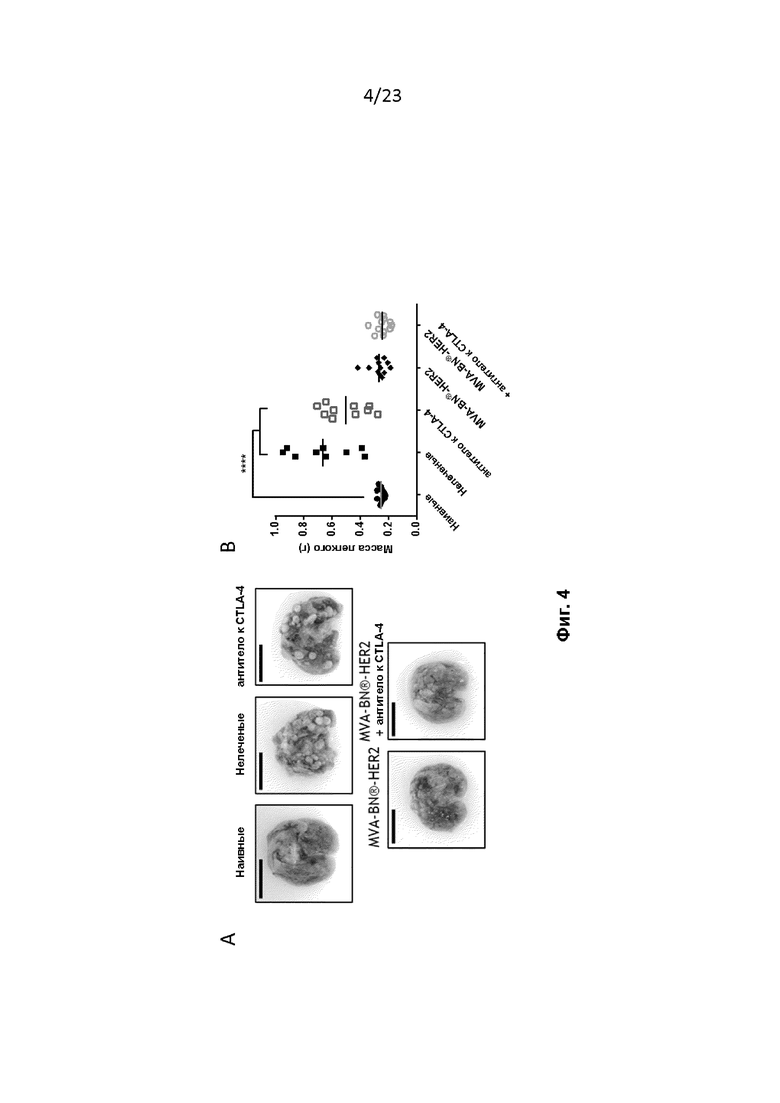
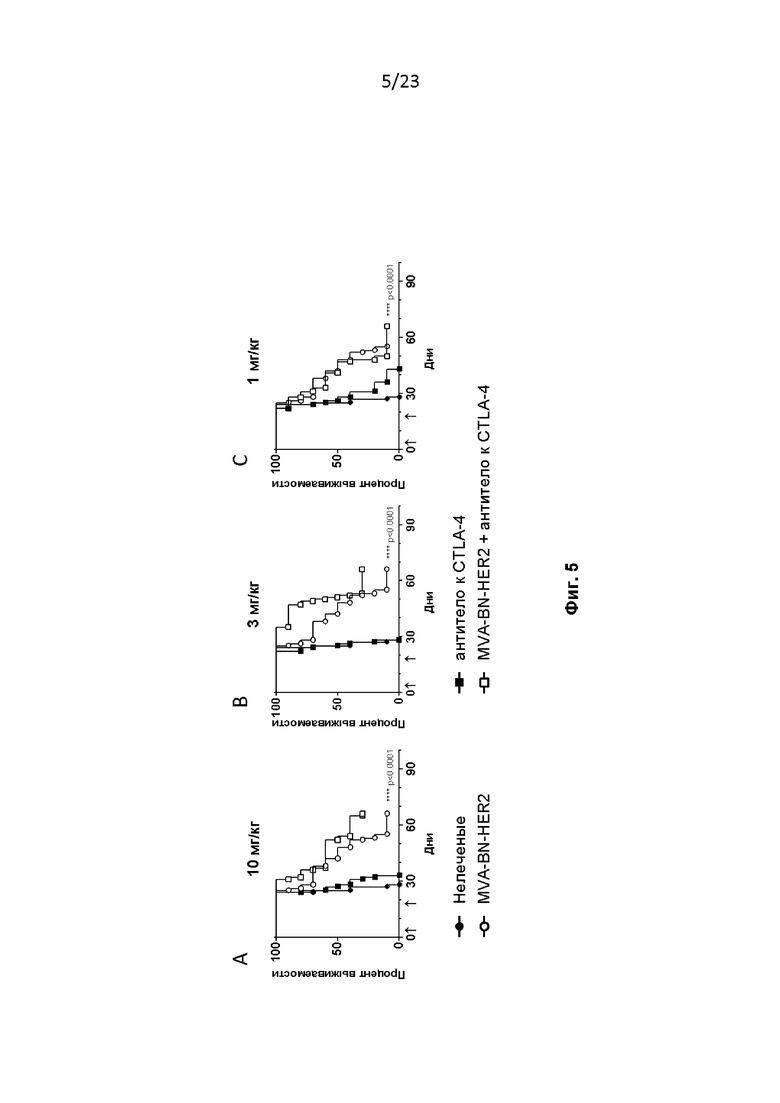
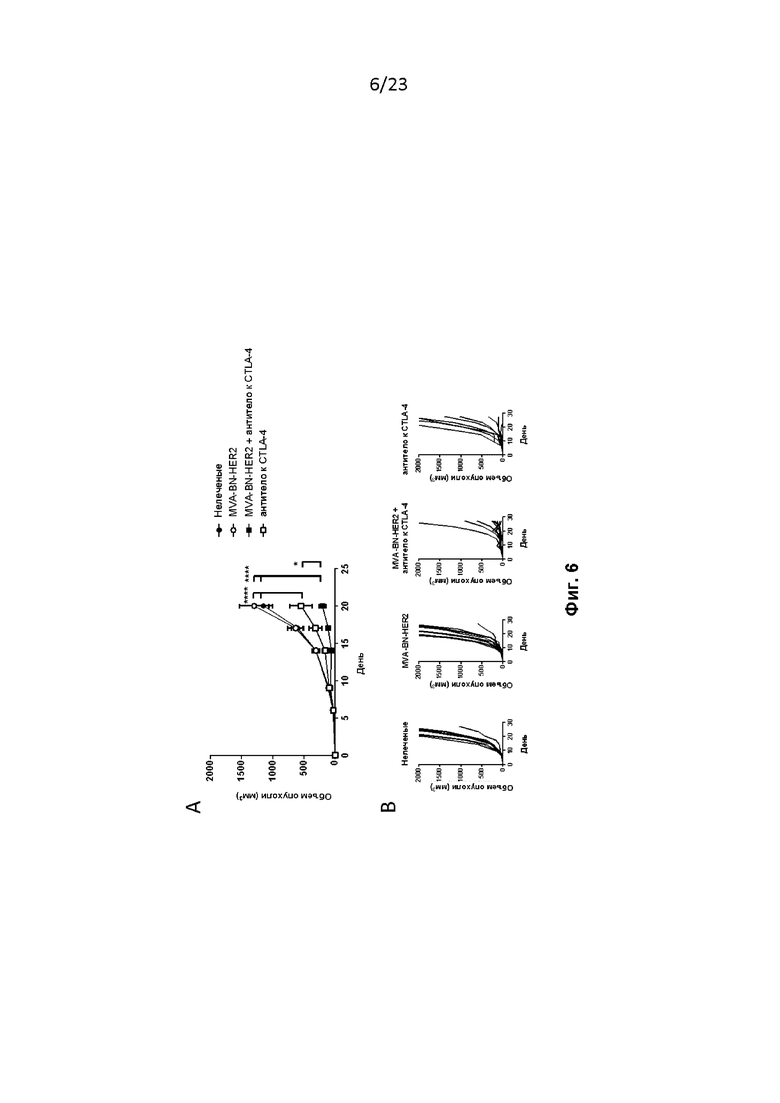
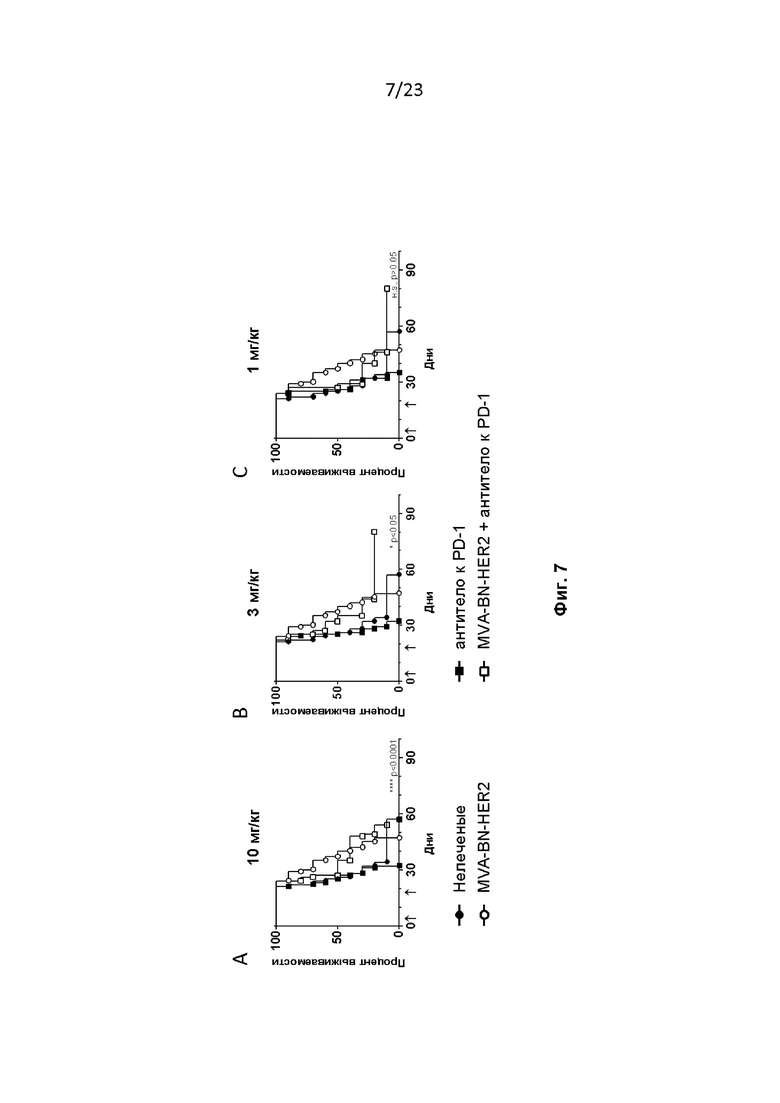
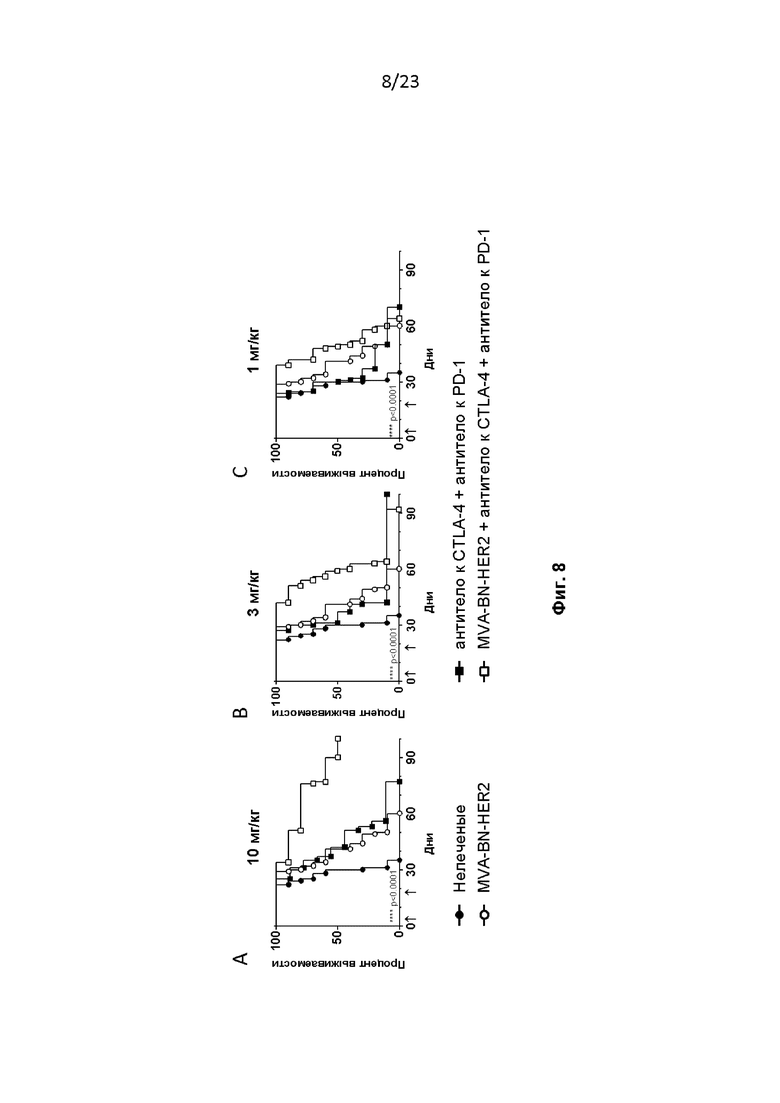
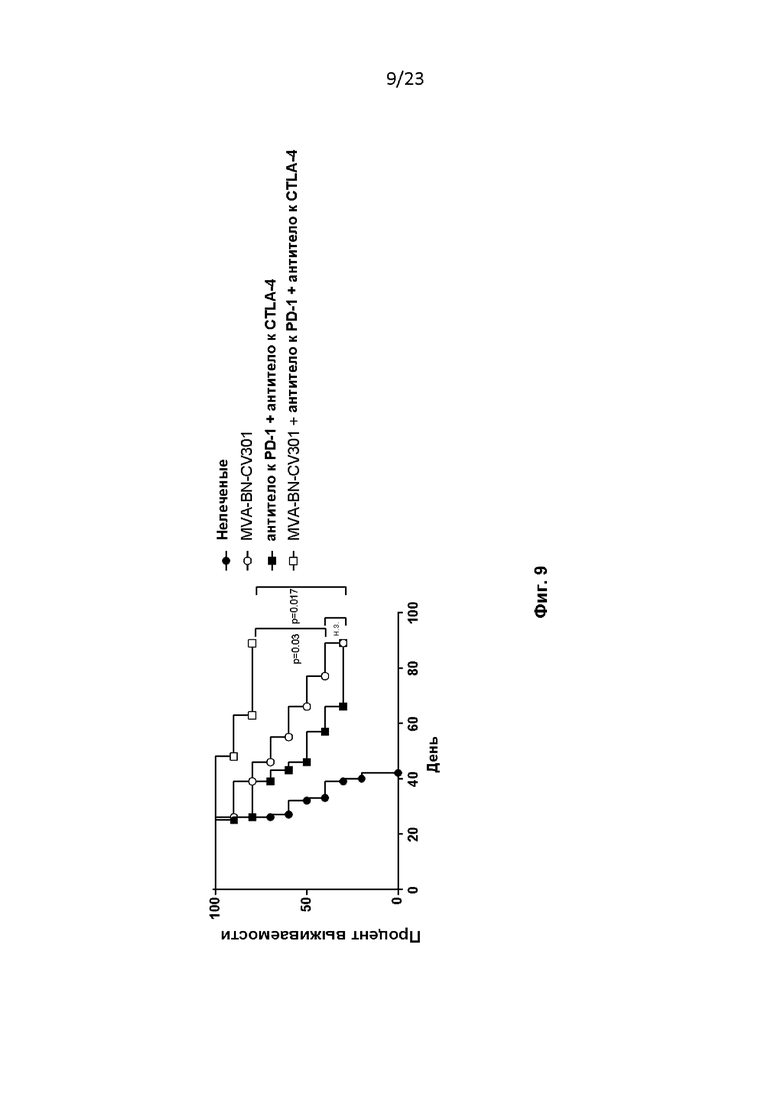

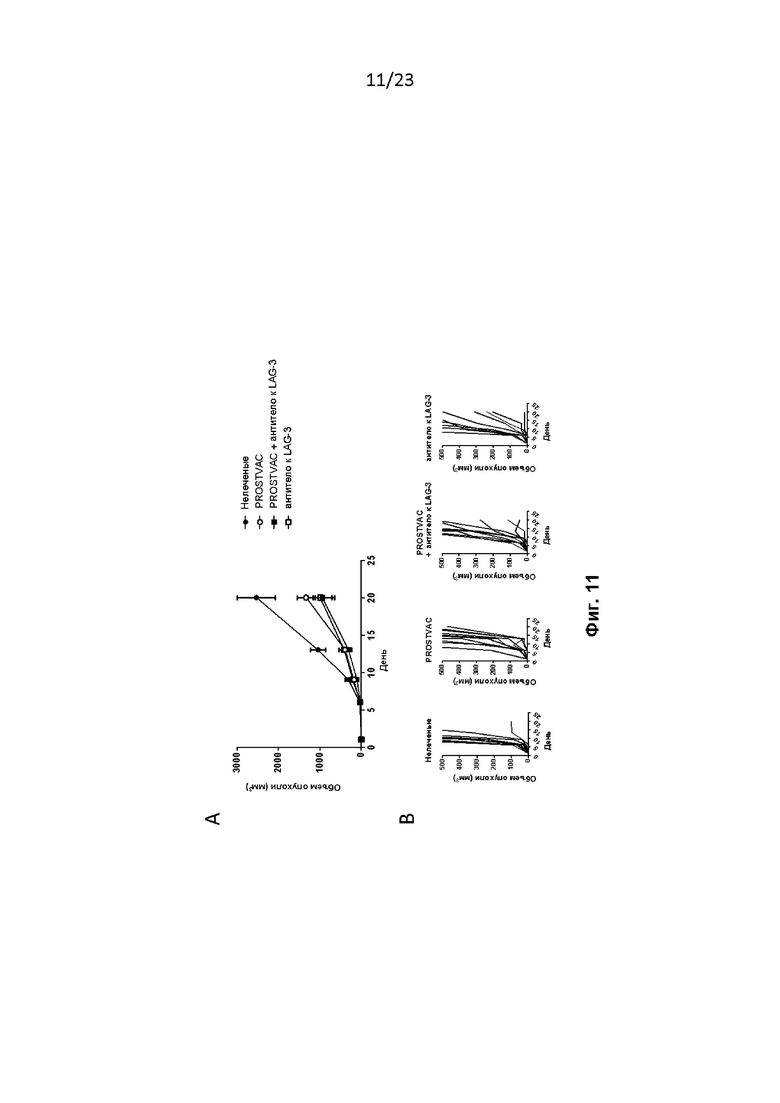
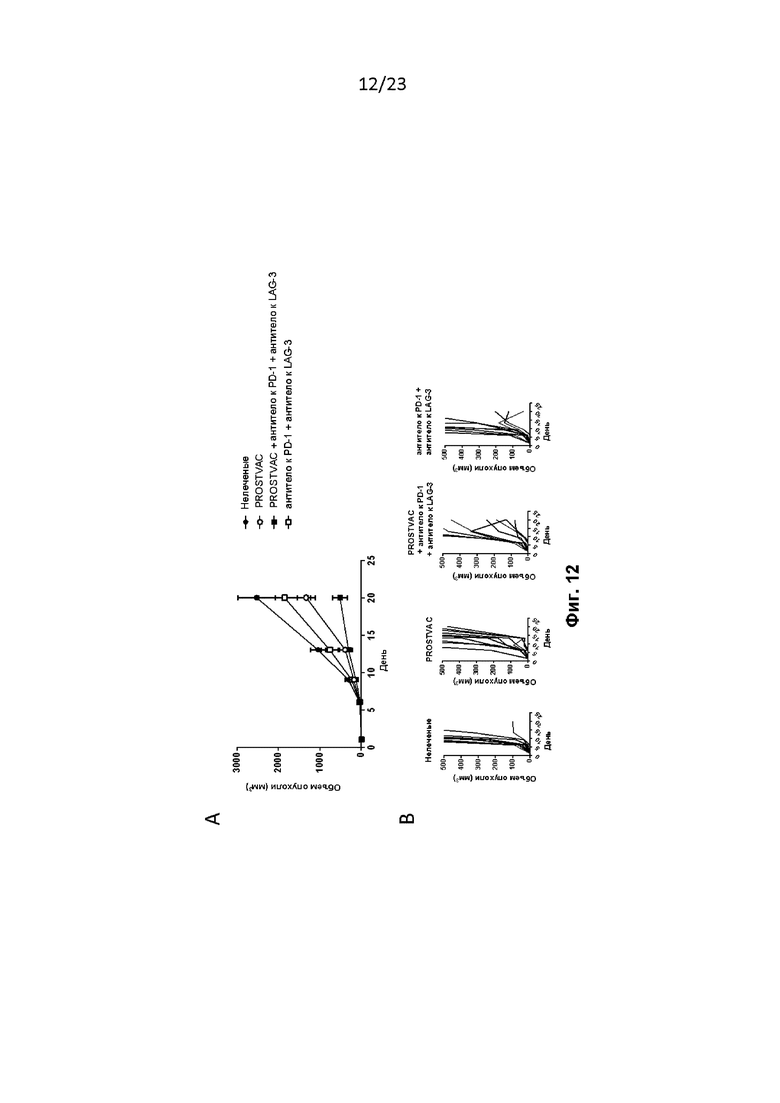
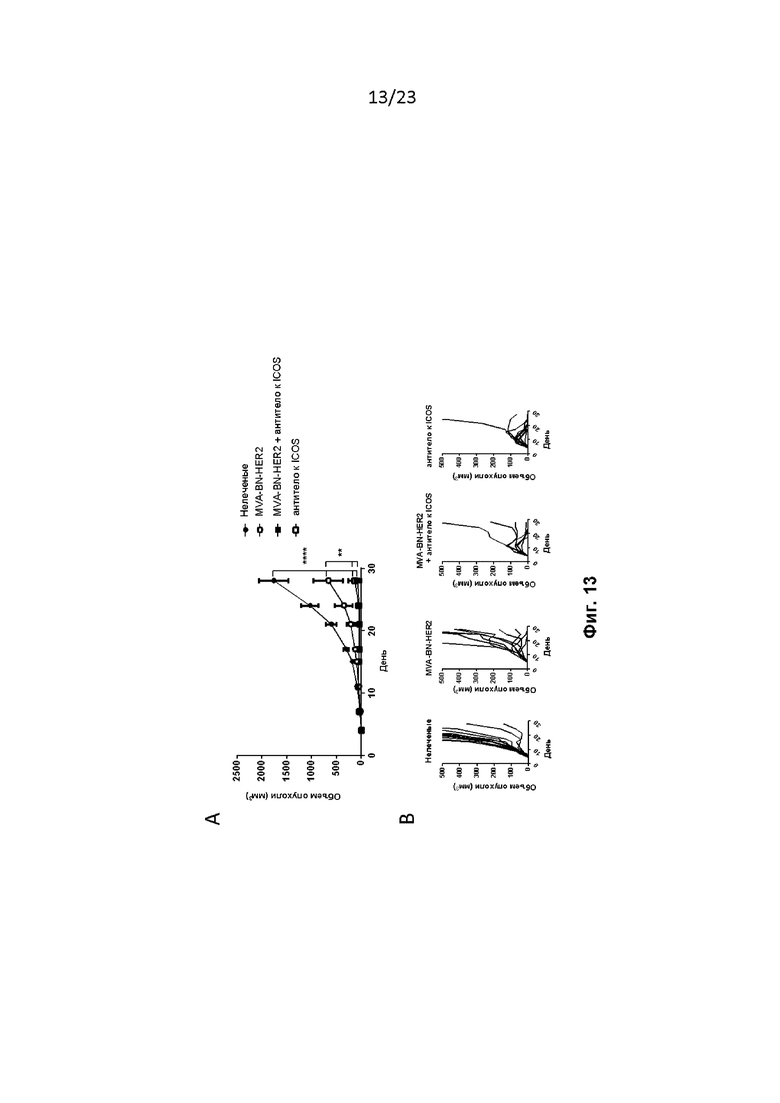

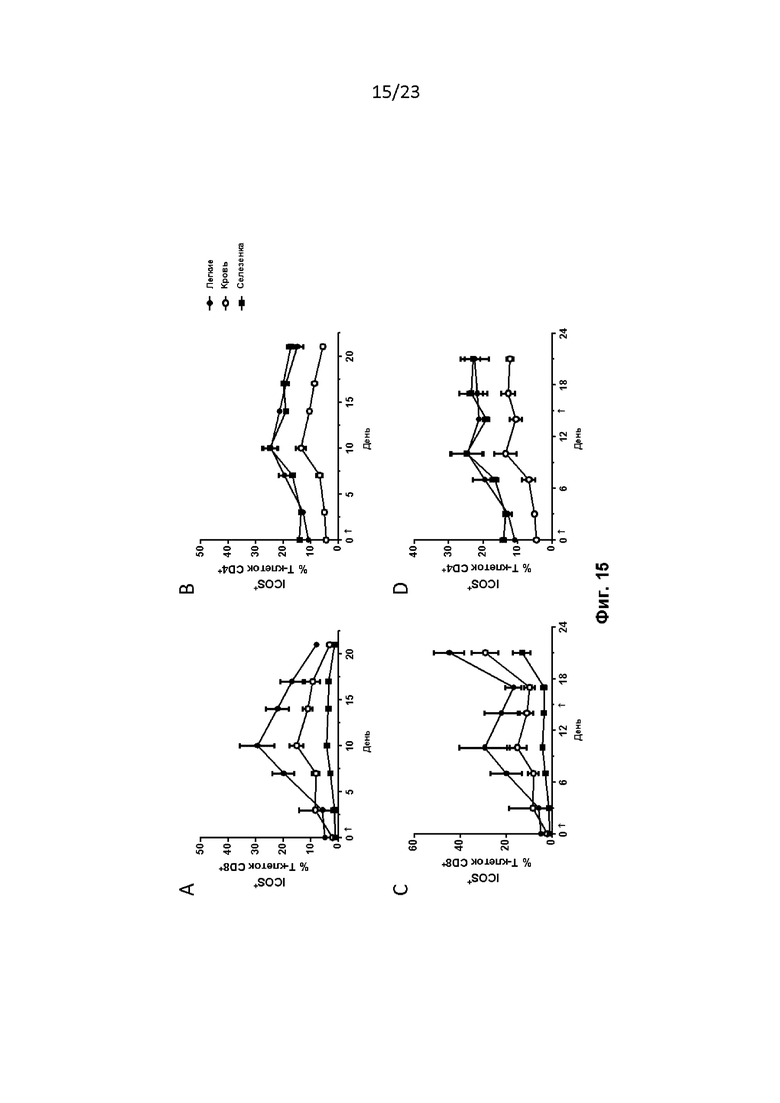
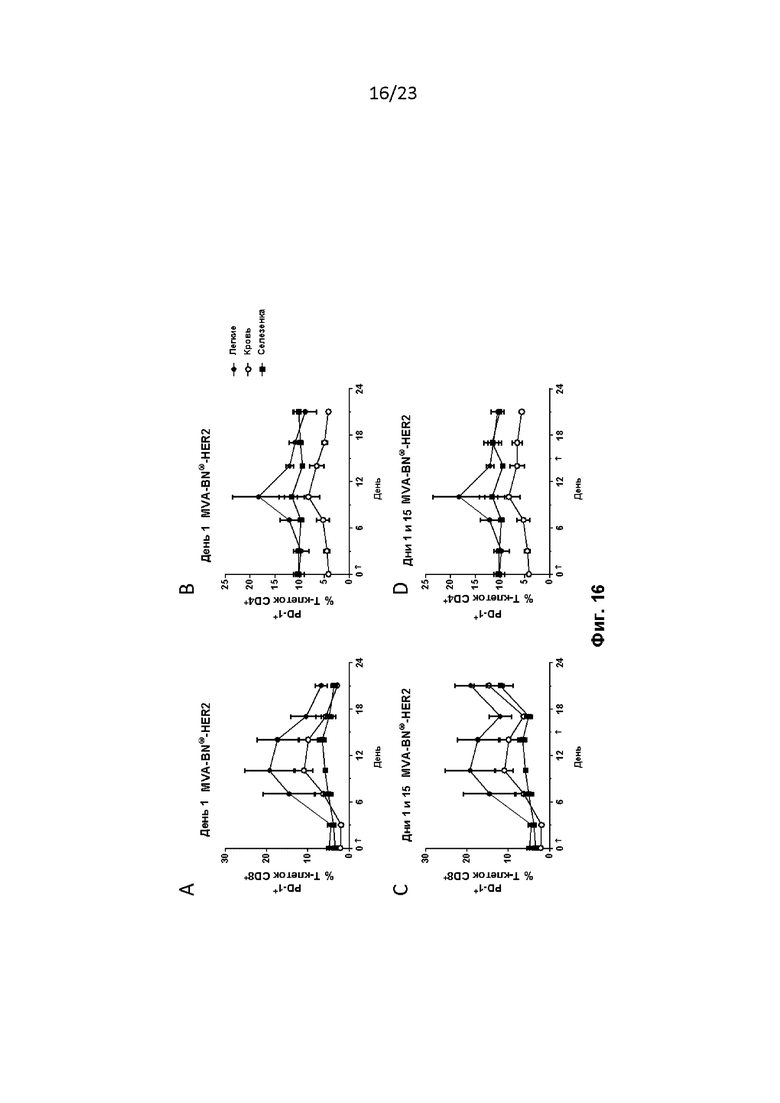
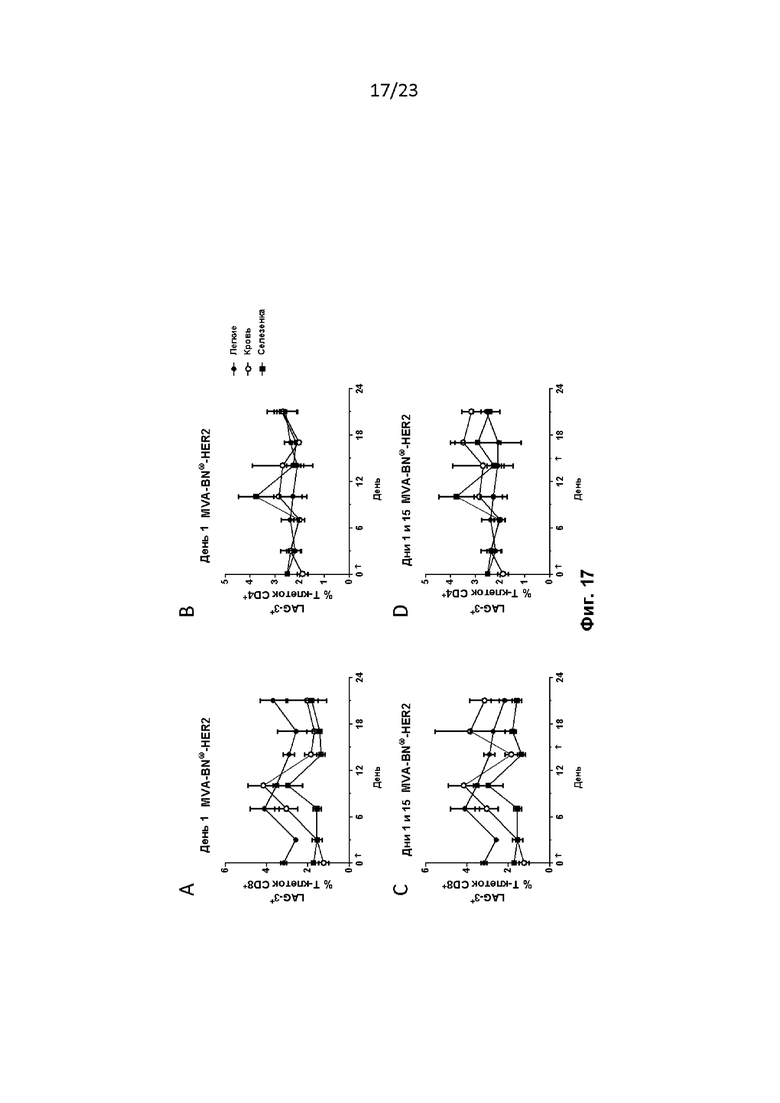
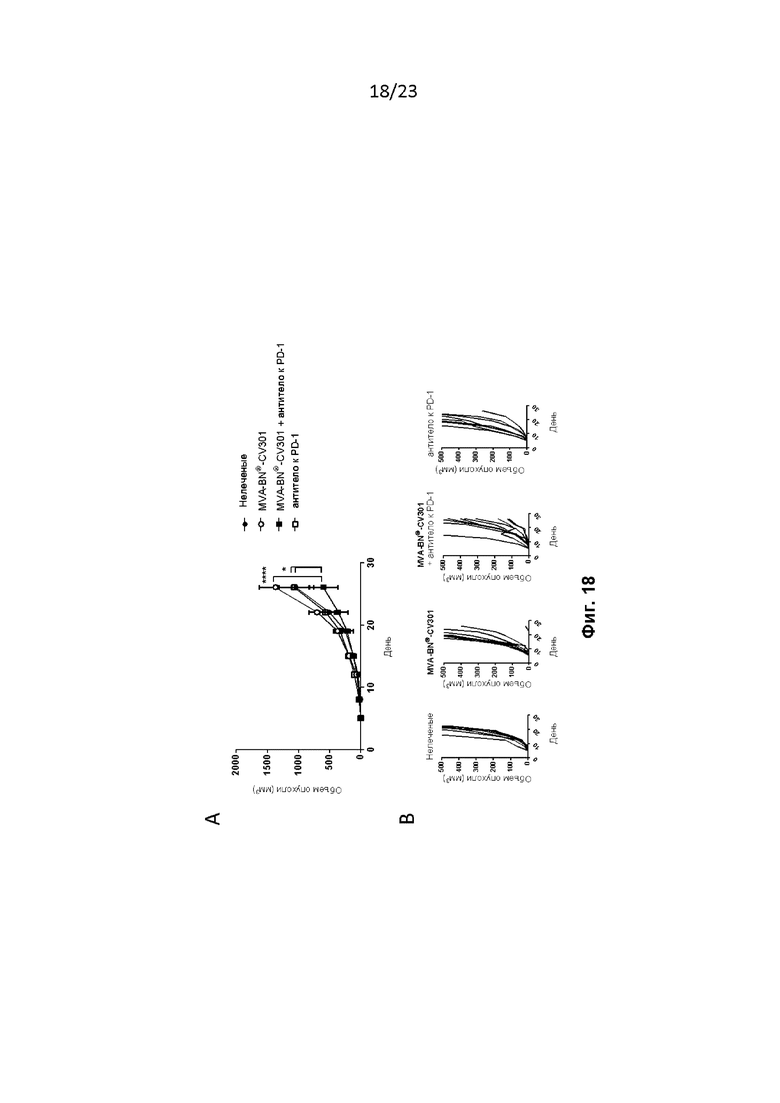
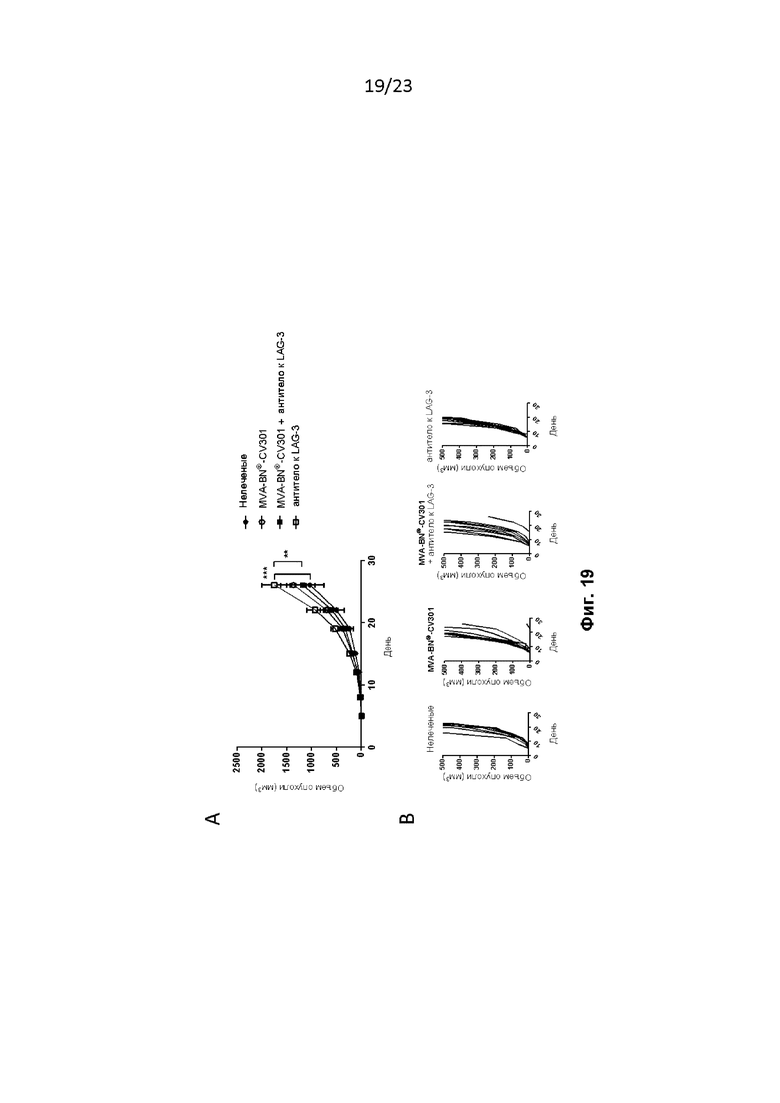
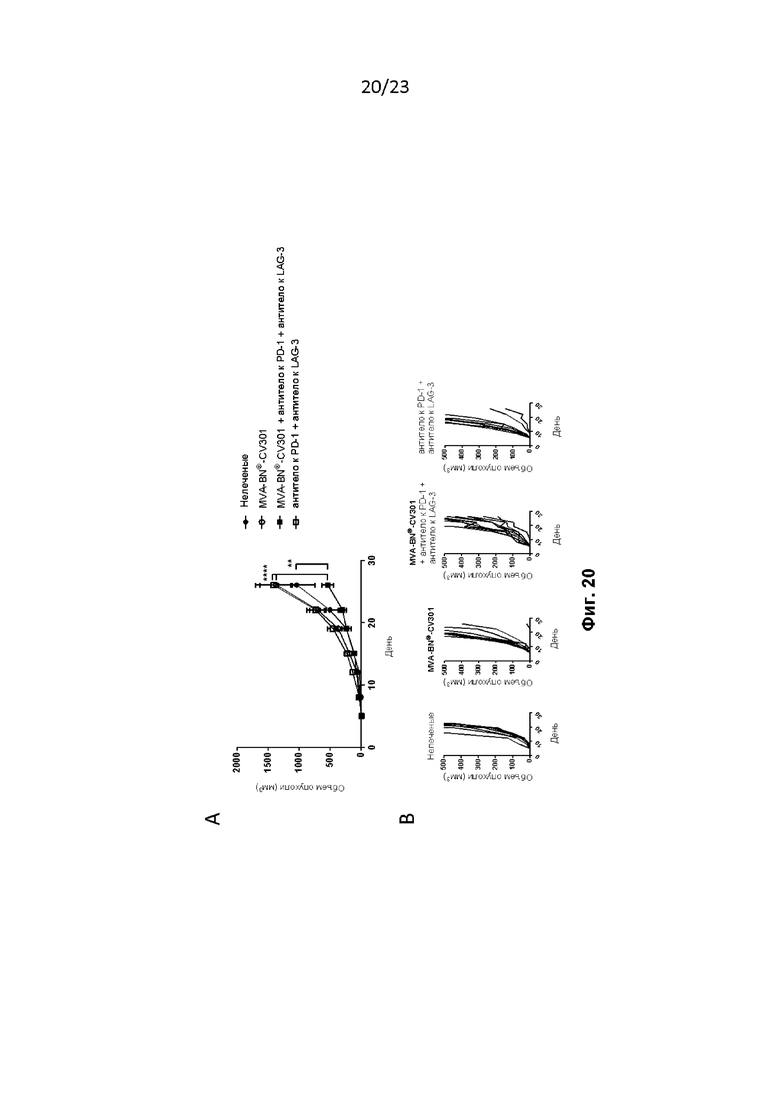
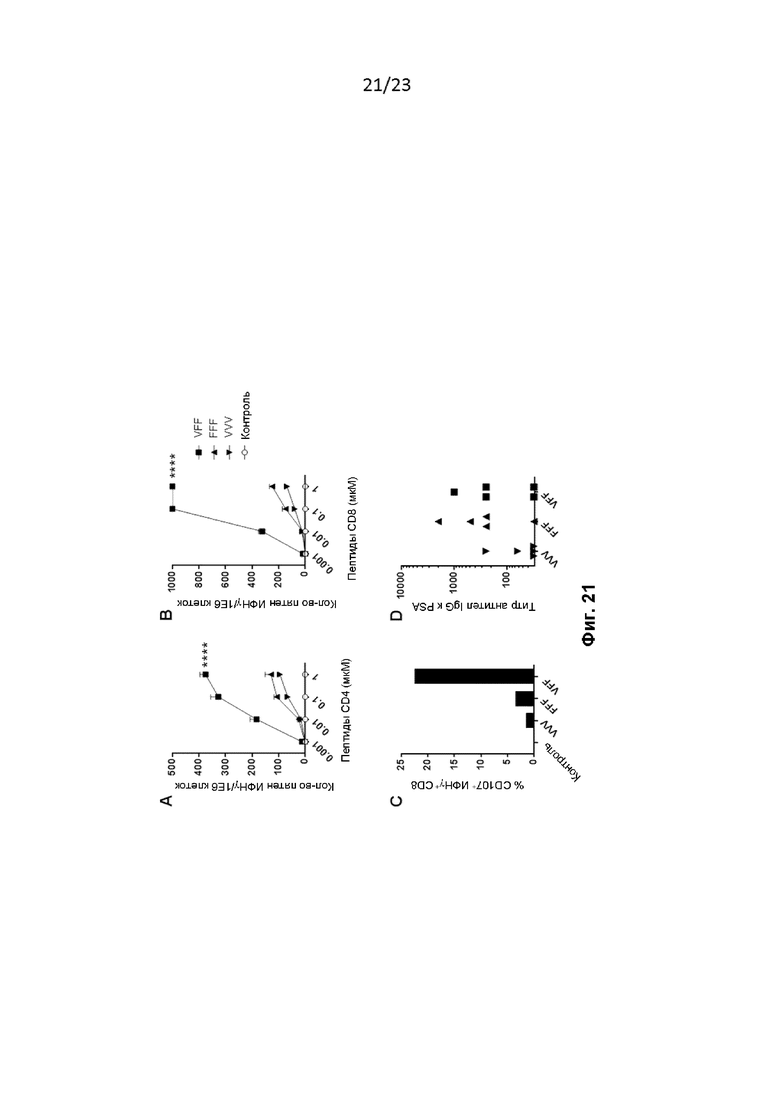
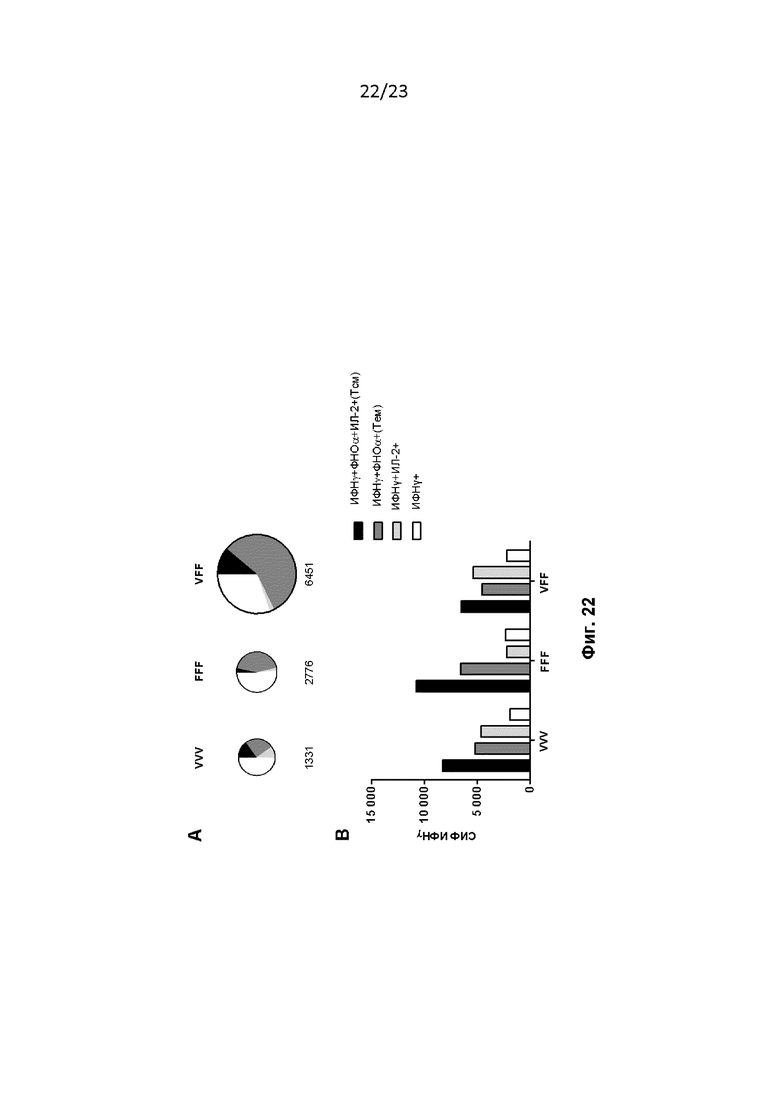
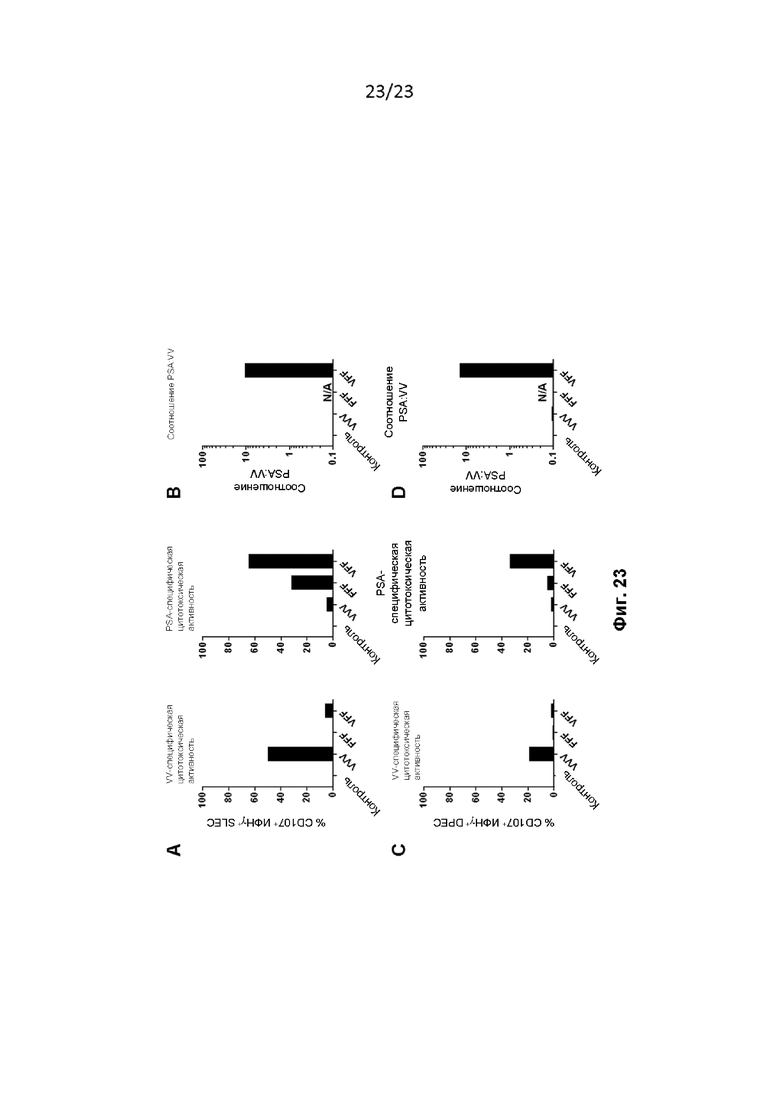
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении рака. Способы по изобретению включают введение пациенту рекомбинантного поксвируса, кодирующего полипептид, содержащий по меньшей мере один опухолеассоциированный антиген (TAA), выбранный из группы, состоящей из карциноэмбрионального антигена (CEA), муцина 1, связанного с клеточной поверхностью (MUC-1), простатспецифического антигена (PSA) и рецептора эпидермального фактора роста человека 2 (HER-2), а также антагониста PD-1, представляющего собой антитело, и антагониста CTLA-4, представляющего собой антитело. Фармацевтические комбинации по изобретению содержат рекомбинантный поксвирус, кодирующий полипептид, содержащий по меньшей мере один ТАА, а также антагонист PD-1 и антагонист CTLA-4, представляющие собой антитела. Использование изобретений позволяет повысить выживаемость, снизить опухолевую нагрузку, усилить Т-клеточный ответ за счет синергетического действия комбинации. 4 н. и 24 з.п. ф-лы, 1 табл., 23 ил., 43 пр.
1. Способ лечения онкологического пациента-человека, включающий:
(a) введение пациенту рекомбинантного поксвируса, кодирующего полипептид, содержащий по меньшей мере один опухолеассоциированный антиген (TAA), выбранный из группы, состоящей из карциноэмбрионального антигена (CEA), муцина 1, связанного с клеточной поверхностью (MUC-1), простатспецифического антигена (PSA) и рецептора эпидермального фактора роста человека 2 (HER-2); и
(b) введение пациенту антагониста PD-1, представляющего собой антитело, и антагониста CTLA-4, представляющего собой антитело.
2. Способ по п.1, отличающийся тем, что поксвирус выбран из ортопоксвируса и авипоксвируса.
3. Способ по п.2, отличающийся тем, что ортопоксвирус представляет собой вирус коровьей оспы.
4. Способ по п.3, отличающийся тем, что вирус коровьей оспы представляет собой модифицированный вирус коровьей оспы Анкара (MVA).
5. Способ по п.4, отличающийся тем, что MVA представляет собой MVA-BN.
6. Способ по п.2, отличающийся тем, что авипоксвирус представляет собой поксвирус домашней птицы.
7. Способ по п.1, отличающийся тем, что по меньшей мере один TAA представляет собой карциноэмбриональный антиген (CEA).
8. Способ по п.1, отличающийся тем, что по меньшей мере один TAA представляет собой MUC-1.
9. Способ по п.1, отличающийся тем, что по меньшей мере один TAA представляет собой PSA.
10. Способ по п.1, отличающийся тем, что по меньшей мере один TAA представляет собой HER-2.
11. Способ по п.1, отличающийся тем, что лечение рака направлено против рака молочной железы, рака легкого, рака головы и шеи, рака щитовидной железы, меланомы, рака желудка, рака мочевого пузыря, рака почки, рака печени, меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника или колоректального рака.
12. Способ по п.11, отличающийся тем, что лечение рака направлено против рака предстательной железы.
13. Способ по п.11, отличающийся тем, что лечение рака направлено против рака, выбранного из рака молочной железы, колоректального рака и рака легкого.
14. Способ лечения рака у онкологического пациента-человека, где указанный способ включает введение пациенту комбинации из:
(a) терапевтически эффективного количества рекомбинантного поксвируса, кодирующего полипептид, содержащий по меньшей мере один опухолеассоциированный антиген (TAA), выбранный из группы, состоящей из карциноэмбрионального антигена (CEA), муцина 1, связанного с клеточной поверхностью (MUC-1), простатспецифического антигена (PSA) и рецептора эпидермального фактора роста человека 2 (HER-2); и
(b) терапевтически эффективного количества антагониста CTLA-4, представляющего собой антитело, и антагониста PD-1, представляющего собой антитело, где терапевтически эффективное количество (b) является таким, что терапевтический эффект комбинации (а) и (b) является повышенным по сравнению с введением (а) или введением (b).
15. Способ по п.14, отличающийся тем, что антагонист CTLA-4 и антагонист PD-1 согласно (b) вводят в количестве от около 1 до около 3 мг/кг массы тела пациента.
16. Способ по п.15, отличающийся тем, что антагонист CTLA-4 и антагонист PD-1 согласно (b) вводят в количестве 1 мг/кг массы тела пациента.
17. Способ по п.14, отличающийся тем, что терапевтически эффективное количество рекомбинантного поксвируса в комбинации с терапевтически эффективным количеством антагониста иммунной контрольной точки вводят как часть схемы гомологичного или гетерологичного бустер-примирования, где схема гомологичного бустер-примирования включает примирование первой дозой рекомбинантного поксвируса в комбинации с антагонистом CTLA-4 и антагонистом PD-1 и последующее введение одной или более бустер-доз этого рекомбинантного поксвируса в комбинации с антагонистом CTLA-4 и антагонистом PD-1 и где схема гетерологичного бустер-примирования включает примирование первой дозой рекомбинантного поксвируса в комбинации с антагонистом CTLA-4 и антагонистом PD-1 и последующее введение одной или более бустер-доз другого рекомбинантного поксвируса в комбинации с антагонистом CTLA-4 и антагонистом PD-1.
18. Способ по п.17, отличающийся тем, что рекомбинантный поксвирус в комбинации с антагонистом иммунной контрольной точки вводят как часть схемы гетерологичного бустер-примирования, причем рекомбинантный поксвирус первой дозы примирования содержит ортопоксвирус, а рекомбинантный поксвирус одной или более бустер-доз содержит авипоксвирус.
19. Способ по п.18, отличающийся тем, что ортопоксвирус выбран из группы, состоящей из вируса коровьей оспы, MVA или MVA-BN.
20. Способ по п.14, отличающийся тем, что по меньшей мере один TAA выбран из группы, состоящей из HER-2, MUC-1, CEA, PSA и их комбинаций.
21. Фармацевтическая комбинация для лечения рака у пациента-человека, где комбинация содержит:
(a) рекомбинантный поксвирус, кодирующий полипептид, содержащий по меньшей мере один опухолеассоциированный антиген (TAA), выбранный из группы, состоящей из карциноэмбрионального антигена (CEA), муцина 1, связанного с клеточной поверхностью (MUC-1), простатспецифического антигена (PSA) и рецептора эпидермального фактора роста человека 2 (HER-2);
(b) антагонист PD-1, представляющий собой антитело; и
(c) антагонист CTLA-4, представляющий собой антитело.
22. Фармацевтическая комбинация по п.21, в которой по меньшей мере один TAA представляет собой CEA.
23. Фармацевтическая комбинация по п.21, в которой по меньшей мере один TAA представляет собой PSA.
24. Фармацевтическая комбинация по п.21, в которой по меньшей мере один TAA представляет собой MUC-1.
25. Фармацевтическая комбинация по п.21, в которой поксвирус представляет собой ортопоксвирус или авипоксвирус.
26. Фармацевтическая комбинация по п.25, в которой поксвирус представляет собой ортопоксвирус, выбранный из вируса коровьей оспы, MVA или MVA-BN.
27. Фармацевтическая комбинация по п.25, в которой авипоксвирус представляет собой поксвирус домашней птицы.
28. Фармацевтическая комбинация для лечения рака у пациента-человека, содержащая:
(a) терапевтически эффективное количество рекомбинантного поксвируса, где указанный поксвирус кодирует полипептид, содержащий по меньшей мере один опухолеассоциированный антиген (TAA), выбранный из группы, состоящей из карциноэмбрионального антигена (CEA), муцина 1, связанного с клеточной поверхностью (MUC-1), простатспецифического антигена (PSA) и рецептора эпидермального фактора роста человека 2 (HER-2); и
(b) терапевтически эффективное количество по меньшей мере одного антагониста иммунной контрольной точки, выбранного из группы, состоящей из антагониста CTLA-4, представляющего собой антитело, и антагониста PD-1, представляющего собой антитело, где терапевтически эффективное количество (b) является таким, что терапевтический эффект комбинации (а) и (b) является повышенным по сравнению с введением (а) или введением (b).
| WO 2006121168, 16.11.2006 | |||
| MANDL S.J | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ESPENSCHIED J | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2020-06-23—Публикация
2015-05-08—Подача