Область техники
Настоящее изобретение относится к суспензии наполненных газом, нацеленных микровезикул, к составу для ее получения и к ее применению в качестве диагностического агента.
Уровень техники
В ходе быстрого развития контрастных агентов в последние годы был получен ряд различных композиций и составов, которые пригодны для контрастной визуализации органов и тканей человеческого или животного организма, а также для их терапевтического лечения.
Класс контрастных агентов, особенно пригодных для ультразвуковой контрастной визуализации, включает в себя суспензии пузырьков газа нано- и/или микрометрового размера, диспергированных в водной среде. Газ, как правило, заключен или инкапсулирован в стабилизирующий пленочный слой, содержащий, например, эмульгаторы, масла, загустители или сахара. Обычно в данной области для обозначения этих стабилизированных пузырьков газа (диспергированных в пригодном физиологическом растворе) применяются различные термины, как правило, в зависимости от стабилизирующего материала, используемого для их получения; эти термины включают в себя, например, ''микросферы'', ''микропузырьки'', ''микрокапсулы'' или ''микрошарики'', в целом в данном описании они называются ''наполненные газом микровезикулы'' (или ''микровезикулы'').
Особый интерес представляют водные суспензии наполненных газом микровезикул, в которых шарики газа связаны на поверхности раздела газ/жидкость очень тонкой оболочкой (пленкой) с помощью стабилизирующего амфифильного материала (как правило, фосфолипида), расположенного на поверхности раздела газ/жидкость. Примеры водной суспензии наполненных газом микровезикул и их получения раскрыты, например, в патентах США 5271928, 5445813, 5413774, 5556610, 5597549, 5827504, WO 97/29783 и WO2004/069284.
В последнее время особое внимание уделяется так называемой ''молекулярной визуализации'', в которой в составе контрастных агентов используются пригодные специфичные к мишени компоненты для обеспечения селективной контрастной визуализации органов или тканей. Примеры нацеливающих лигандов включают, например, пептиды, белки, антитела, аптамеры или углеводы, способные связываться со специфическими рецепторами, экспрессируемыми органами или тканями во время патогенных процессов, таких как, например, ангиогенез, воспаление или образование тромбов.
Например, международные заявки на патент WO 03/74005, WO 03/084574 и WO 2007/067979 описывают пригодные пептиды, которые селективно нацеливаются на рецепторы в нестабильных бляшках и опухолеспецифические рецепторы, такие как область киназного домена (KDR) и комплекс VEGF (фактор роста эндотелия сосудов)/KDR. Как описано в этих заявках на патент, такие пептиды применяют для составления специфических к мишени, наполненных газом микровезикул, пригодных для связывания с KDR или комплексом VEGF/KDR.
Наполненные газом микровезикулы, как правило, получают суспендированием твердого состава (напр., в виде порошкообразного остатка, полученного, например, лиофилизацией) в физиологически приемлемом водном растворе, в присутствии физиологически приемлемого газа. Полученная суспензия наполненных газом микровезикул может быть введена, как правило, посредством (внутривенной) инъекции.
Как обнаружил заявитель, суспендирование твердого состава в водном растворе (также называемое в данной области ''восстановление сухого остатка'') может быть важным этапом процесса получения микровезикул, и многие параметры этапа суспендирования (включая, например, тип изотонического агента и его pH) могут влиять на характеристики микровезикул в готовых суспензиях.
Заявитель обнаружил, что гистидин является особенно пригодным в качестве регулирующего pH агента для получения суспензий наполненных газом микровезикул, содержащих пептид, в физиологически приемлемом водном растворе, содержащем углевод.
Сущность изобретения
Один из аспектов изобретения относится к водной суспензии наполненных газом микровезикул, при этом указанные микровезикулы содержат фосфолипид и нацеливающий лиганд, содержащий пептид, имеющий аминокислотную последовательность, выбранную из AGPTWCEDDWYYCWLFGTGGGK (SEQ ID NO. 01), VCWEDSWGGEVCFRYDPGGGK (SEQ ID NO. 02) или их комбинации, при этом указанная суспензия дополнительно содержит углевод и гистидин.
Предпочтительно указанная микровезикула дополнительно содержит жирную кислоту.
Предпочтительно нацеливающий лиганд представлен в виде димерного пептида, содержащего комбинацию обеих последовательностей SEQ ID NO. 01 и SEQ ID NO. 02.
Более предпочтительно указанный димерный пептид имеет следующую формулу I:
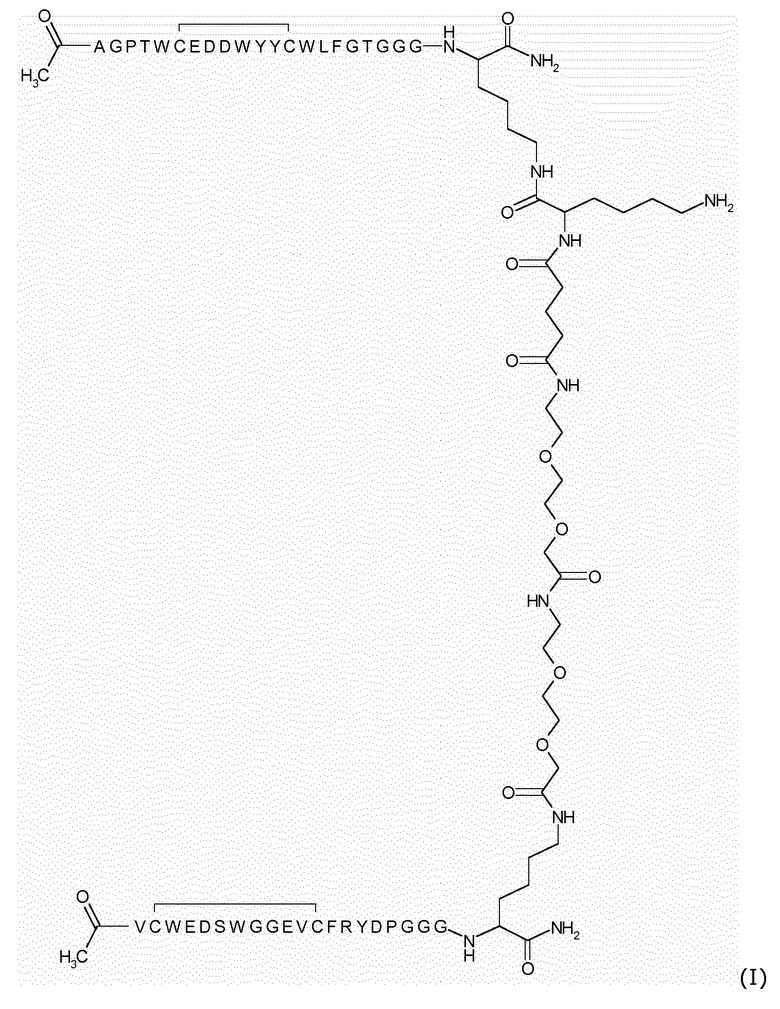
В предпочтительном варианте осуществления нацеливающий лиганд ковалентно связан с фосфолипидом, предпочтительно пегилированным фосфолипидом.
Особенно предпочтительным является нацеливающий лиганд в форме липопептида формулы (II):

Предпочтительно углевод представляет собой глюкозу, сахарозу или маннит, более предпочтительно глюкозу.
Другой аспект изобретения относится к лиофилизированному составу-предшественнику для получения суспензии наполненных газом микровезикул, содержащей:
фосфолипид, нацеливающий лиганд, гистидин, необязательно жирную кислоту, необязательно пегилированный фосфолипид и лиофилизирующий агент.
Другой аспект изобретения относится к фармацевтическому набору, содержащему:
(a) лиофилизированный состав-предшественник, как определено выше; и
(b) водный раствор, содержащий углевод, для восстановления указанного предшественника.
Подробное описание изобретения
Водная суспензия наполненных газом микровезикул, как правило, может быть получена суспендированием лиофилизированного состава-предшественника (содержащего соответствующий компонент для образования наполненной газом микровезикулы) в физиологически приемлемом носителе в присутствии пригодного газа. В целом, предпочтительно, чтобы инъецируемый раствор был изоосмолярным настолько, чтобы его осмоляльность находилась в пределах физиологического диапазона осмоляльности крови, как правило, между 285 и 310 мОсмоль/кг. Как известно в данной области, осмоляльность реального раствора соответствует моляльности идеального раствора, содержащего недиссоциирующие растворяемые компоненты, и выражается в осмолях или милиосмолях на килограмм растворителя (осмоль/кг или мосмоль/кг, соответственно).
Как правило, изоосмолярные солевые (напр., NaCl) растворы представляют собой водный носитель первого выбора, используемый для восстановления сухого состава для получения требуемой суспензии микровезикул для инъекции. Заявитель, однако, обнаружил, что предпочтительно не использовать солевые носители (или более обобщенно носители, содержащие электролиты) для получения микровезикул, содержащих некоторые нацеливающие пептиды, в особенности пептиды, содержащие аминокислотные последовательности, проиллюстрированные выше. Такие наполненные газом микровезикулы, содержащие пептиды, полученные суспендированием с солевым носителем, могут на самом деле иметь склонность к агрегированию друг с другом с образованием более или менее стабильных агрегатов, которые могут затем снизить эффективность препарата, а также вызывать проблемы, связанные с безопасностью, например, если размер агрегатов является слишком большим.
Таким образом, для ограничения таких явлений агрегирования для суспендирования сухих составов могут быть применены альтернативные жидкости, такие как коммерчески доступные углеводные растворы.
Однако коммерческие водные углеводные растворы для инъекции (напр., растворы маннита, сахарозы или глюкозы) могут демонстрировать изменяющиеся величины pH. Например, коммерческие 5% растворы глюкозы для инъекции могут иметь величины pH, варьирующие от приблизительно 3,2 до приблизительно 6,5. В настоящем описании и формуле изобретения, если особым образом не указано иное, термин ''глюкоза'' относится к встречающемуся в природе энантиомеру ''D-глюкоза'', также известному как ''декстроза''.
Заявитель обнаружил, что составы, содержащие нацеливающие пептиды, и в особенности связывающие KDR пептиды, приведенные выше, демонстрируют существенную вариабельность конечных характеристик суспензии микровезикул при диспергировании в растворах углеводов (и в частности глюкозы) при различных величинах pH. В частности было обнаружено, что хотя восстановление сухих составов растворами, имеющими pH приблизительно 6,5, приводит к суспензиям с относительно высоким количеством микровезикул, при восстановлении такого же сухого состава растворами с более низкими значениями pH количество микровезикул в суспензии может быть снижено.
Во избежание негативных эффектов в готовой суспензии, вызываемых такими низкими величинами pH, можно применять регулирующие pH агенты, которые позволят восстанавливать сухой остаток при соответствующем pH (как правило, от приблизительно 6 до приблизительно 8,5, предпочтительно от приблизительно 7 до приблизительно 8). Однако заявитель обнаружил, что большинство общепринятых регулирующих pH агентов имеют ряд недостатков в пределах обычных диапазонов pH углеводных растворов для инъекции.
Например, в случае, когда диспергирующий раствор имеет относительно низкие значения pH, подщелачивающие агенты, такие как гидрокарбонат натрия, следует добавлять в суспензию в относительно высокой концентрации для оптимального редиспергирования образованных микровезикул. С другой стороны, если значение pH диспергирующего раствора является относительно высоким, то такие высокие концентрации подщелачивающего агента могут привести в результате к слишком высоким величинам pH в готовой суспензии, что является несовместимым с внутривенной инъекцией суспензии.
Общепринятые буферные агенты, такие как буфер Трис/HCl или фосфатный буфер следует добавлять в относительно высоких концентрациях для получения требуемого регулирующего pH эффекта во всем диапазоне составов микровезикул; однако было обнаружено, что такие высокие концентрации могут приводить к нежелательным проблемам в процессе получения микровезикул, которые впоследствии могут оказать негативное влияние на характеристики микровезикул в готовой суспензии.
В противоположность негативному влиянию вышеупомянутых регулирующих pH агентов, заявитель обнаружил, что гистидин позволяет получать приемлемые суспензии наполненных газом микровезикул при восстановлении различных сухих остатков, имеющих различные составы (в особенности с различными количествами нацеливающих пептидов), в пределах типичного диапазона величин pH коммерчески доступных углеводных диспергирующих растворов. Также было обнаружено, что гистидин можно использовать в концентрации в пределах относительно большого диапазона без негативного воздействия на свойства готовой суспензии микровезикул.
Жидкая суспензия наполненных газом микровезикул в соответствии с изобретением, как правило, может быть получена путем растворения в водном носителе состава, содержащего фосфолипид. Состав, таким образом, содержит фосфолипид необязательно в комбинации с дополнительными амфифильными веществами (напр., жирными кислотами); нацеливающий пептид предпочтительно представлен в составе в виде липопептида (т.е., пептида, ковалентно связанного с фосфолипидом). Состав, как правило, представлен в форме сублимированного (лиофилизированного) состава, предпочтительно содержащего лиофилизационные добавки. Наполненные газом микровезикулы по изобретению могут быть получены путем перемешивания (или повторного растворения) указанного состава с физиологически приемлемым жидким носителем в присутствии физиологически приемлемого газа.
Фосфолипиды
Как применено в данном описании, термин ''фосфолипид'' охватывает амфифильные соединения, содержащие по меньшей мере одну фосфатную группу и по меньшей мере одну, предпочтительно две, углеводородную цепь(C12-C24), способную образовывать стабилизирующий пленочный слой (как правило, в форме мономолекулярного слоя) на поверхности раздела газ-вода в готовой суспензии микропузырьков. Соответственно, эти материалы также называют в данной области ''образующие пленку фосфолипиды''.
Термин фосфолипиды включает встречающиеся в природе, полусинтетические или синтетические продукты, которые могут быть применены либо по отдельности, либо в виде смесей.
Примеры пригодных фосфолипидов включают сложные эфиры глицерина с одним или предпочтительно двумя (одинаковыми или разными) остатками жирных кислот и ортофосфорной кислотой, при этом остаток ортофосфорной кислоты в свою очередь связан с гидрофильной группой, такой как, например, холин (фосфатидилхолины - PC), серин (фосфатидилсерины - PS), глицерин (фосфатидилглицерины - PG), этаноламин (фосфатидилэтаноламины - PE), инозит (фосфатидилинозит). Сложные эфиры фосфолипидов только с одним остатком жирной кислоты обычно называются в данной области ''лизо'' формами фосфолипида или ''лизофосфолипидами''. Остатки жирных кислот, представленные в фосфолипидах, обычно являются длинноцепочечными алифатическими кислотами, как правило, содержащими от 12 до 24 атомов углерода, предпочтительно от 14 до 22; алифатическая цепь может содержать один или более центров ненасыщенности или предпочтительно является полностью насыщенной. Примерами пригодных жирных кислот, включенных в фосфолипиды, являются, например, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, арахиновая кислота, бегеновая кислота, олеиновая кислота, линолевая кислота и линоленовая кислота. Предпочтительно, применяются насыщенные жирные кислоты, такие как миристиновая кислота, пальмитиновая кислота, стеариновая кислота и арахиновая кислота.
Дополнительными примерами фосфолипида являются фосфатидные кислоты, т.е., сложные диэфиры глицеринфосфата и жирных кислот; сфинголипиды, такие как сфингомиелины, т.е., те аналоги фосфатидилхолина, в которых остаток сложного диэфира глицерина с жирными кислотами замещен церамидной цепью; кардиолипины, т.е., сложные эфиры 1,3-дифосфатидилглицерина с жирной кислотой; гликолипиды, такие как ганглиозиды GM1 (или GM2) или цереброзиды; глюколипиды; сульфатиды и гликосфинголипиды.
Примерами встречающихся в природе фосфолипидов являются природные лецитины (производные фосфатидилхолина (PC)), такие как, например, лецитины сои или яичного желтка.
Примерами полусинтетических фосфолипидов являются частично или полностью гидрогенизованные производные встречающихся в природе лецитинов. Предпочтительными фосфолипидами являются сложные диэфиры жирных кислот и фосфатидилхолина, этилфосфатидилхолина, фосфатидилглицерина, фосфатидной кислоты, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозита или сфингомиелина.
Конкретными примерами фосфолипидов являются, например, дилауроилфосфатидилхолин (DLPC), димиростоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилхолин (DPPC), диарахидоилфосфатидилхолин (DAPC), дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), 1,2-дистеароил-sn-глицеро-3-этилфосфохолин (этил-DSPC), дипентадеканоилфосфатидилхолин (DPDPC), 1-миристоил-2-пальмитоилфосфатидилхолин (MPPC), 1-пальмитоил-2-миристоилфосфатидилхолин (PMPC), 1-пальмитоил-2-стеароилфосфатидилхолин (PSPC), 1-стеароил-2-пальмитоилфосфатидилхолин (SPPC), 1-пальмитоил-2-олеилфосфатидилхолин (POPC), 1-олеил-2-пальмитоилфосфатидилхолин (OPPC), дилауроилфосфатидилглицерин (DLPG) и его соли щелочных металлов, диарахидоилфосфатидилглицерин (DAPG) и его соли щелочных металлов, димиростоилфосфатидилглицерин (DMPG) и его соли щелочных металлов, дипальмитоилфосфатидилглицерин (DPPG) и его соли щелочных металлов, дистеароилфосфатидилглицерин (DSPG) и его соли щелочных металлов, диолеоилфосфатидилглицерин (DOPG) и его соли щелочных металлов, дилауроилфосфатидная кислота (DLPA), димиростоилфосфатидная кислота (DMPA) и ее соли щелочных металлов, дипальмитоилфосфатидная кислота (DPPA) и ее соли щелочных металлов, дистеароилфосфатидная кислота (DSPA), диарахидоилфосфатидная кислота (DAPA) и ее соли щелочных металлов, дилауроилфосфатидилэтаноламин (DLPE), димиростоилфосфатидилэтаноламин (DMPE), дипальмитоилфосфатидилэтаноламин (DPPE), дистеароилфосфатидилэтаноламин (DSPE), диолеилфосфатидилэтаноламин (DOPE), диарахидоилфосфатидилэтаноламин (DAPE), дилинолеилфосфатидилэтаноламин, дилауроилфосфатидилсерин (DLPS), димиростоилфосфатидилсерин (DMPS), диарахидоилфосфатидилсерин (DAPS), дипальмитоилфосфатидилсерин (DPPS), дистеароилфосфатидилсерин (DSPS), диолеоилфосфатидилсерин (DOPS), дипальмитоилсфингомиелин (DPSP), дистеароилсфингомиелин (DSSP), дилауроилфосфатидилинозит (DLPI), диарахидоилфосфатидилинозит (DAPI), димиростоилфосфатидилинозит (DMPI), дипальмитоилфосфатидилинозит (DPPI), дистеароилфосфатидилинозит (DSPI), диолеоилфосфатидилинозит (DOPI).
Пригодные фосфолипиды дополнительно включают фосфолипиды, модифицированные связыванием с гидрофильным полимером, таким как полиэтиленгликоль (PEG) или полипропиленгликоль (PPG). Предпочтительные модифицированные полимером фосфолипиды включают в себя ''пегилированные фосфолипиды'', т.е., фосфолипиды, связанные с полимером PEG. Примерами пегилированных фосфолипидов являются пегилированные фосфатидилэтаноламины (сокращенно ''PE-PEG'') т.е., фосфатидилэтаноламины, в которых группа гидрофильного этаноламина связана с молекулой PEG различной молекулярной массы (напр., от 300 до 20000 дальтон, предпочтительно от 500 до 5000 дальтон), такие как DPPE-PEG (или DSPE-PEG, DMPE-PEG, DAPE-PEG или DOPE-PEG). Например, DPPE-PEG2000 относится к DPPE с присоединенным к нему полимером PEG, имеющим среднюю молекулярную массу приблизительно 2000.
Особенно предпочтительными фосфолипидами являются DAPC, DSPC, DPPC, DMPA, DPPA, DSPA, DMPG, DPPG, DSPG, DMPS, DPPS, DSPS, DPPE, DSPE, DMPE, DAPE, этил-DSPC и их смеси. Наиболее предпочтительными являются DSPG, DSPS, DSPE, DSPC, DAPC и их смеси. Также могут использоваться смеси фосфолипидов, такие как, например, смеси DPPE и/или DSPE (включая пегилированные производные), DPPC, DSPC и/или DAPC с DSPS, DPPS, DSPA, DPPA, DSPG, DPPG, этил-DSPC и/или этил-DPPC.
В соответствии с предпочтительным вариантом осуществления состав содержит по меньшей мере DSPC, предпочтительно в комбинации с DSPE-PEG2000 или DPPE-PEG5000.
Другие амфифильные материалы
Композиция, образующая стабилизирующий слой наполненных газом микровезикул, может необязательно содержать дополнительные амфифильные компоненты, которые также могут вносить вклад в образование стабилизирующего слоя, такие как, например, жирные кислоты, такие как лауриновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, арахиновая кислота, бегеновая кислота, олеиновая кислота, линолевая кислота и линоленовая кислота, предпочтительно насыщенные жирные кислоты, такие как миристиновая кислота, пальмитиновая кислота, стеариновая кислота и арахиновая кислота; липиды, несущие полимеры, такие как хитин, гиалуроновая кислота, поливинилпирролидон или полиэтиленгликоль (PEG), также называемые ''пегилированные липиды''; липиды, несущие сульфированные моно-, ди-, олиго- или полисахариды; холестерин, сульфат холестерина или гемисукцинат холестерина; гемисукцинат токоферола; липиды, связанные c жирными кислотами простой эфирной или сложной эфирной связью; полимеризированные липиды; диацетилфосфат; децитилфосфат; церамиды; сложные эфиры полиоксиэтилена и жирной кислоты (такие как полиоксиэтилен стеараты), жирные спирты полиоксиэтилена, полиоксиэтиленовые простые эфиры жирных спиртов, сложные эфиры полиоксиэтилинированного сорбитана и жирных кислот, рицинолеат глицерин-полиэтиленгликоль, этоксилированные соевые стеролы, этоксилированное касторовое масло или блок-сополимеры этиленоксида (EO) и пропиленоксида (PO); сложные эфиры стерола и алифатической кислоты, включающие, бутират холестерина, изобутират холестерина, пальмитат холестерина, стеарат холестерина, ацетат ланостерола, пальмитат эргостерола или н-бутират фитостерола; сложные эфиры стерола и сахарных кислот, включая глюкурониды холестерина, глюкурониды ланостерола, глюкуронид 7-дегидрохолестерина, глюкуронид эргостерола, глюконат холестерина, глюконат ланостерола или глюконат эргостерола; сложные эфиры сахарных кислот и спиртов, включая лаурилглюкуронид, глюкуронид стеароила, миристоилглюкуронид, лаурилглюконат, миристоилглюконат или стеароилглюконат; сложные эфиры сахаров и алифатических кислот, включая лаурат сахарозы, лаурат фруктозы, пальмитат сахарозы, стеарат сахарозы; сапонины, включая сарсасапогенин, смилагенин, гедерагенин или дигитоксигенин; глицерин или сложные эфиры глицерина, включая трипальмитат глицерина, дистеарат глицерина, тристеарат глицерина, димиристат глицерина, тримиристат глицерина, дилаурат глицерина, трилаурат глицерина, дипальмитат глицерина; длинноцепочечные спирты, включая н-дециловый спирт, лауриловый спирт, миристиловый спирт, цетиловый спирт, или н-октадециловый спирт; 6-(5-холестен-3β-илокси)-1-тио-β-D-галактопиранозид; дигалактозил-диглицерид; 6-(5-холестен-3β-илокси)гексил-6-амино-6-дезокси-1-тио-β-D-галактопиранозид; 6-(5-холестен-3β-илокси)гексил-6-амино-6-деоксил-1-тио-β-D-маннопиранозид; 1,2-диолеил-sn-глицерин; 1,2-дипальмитоил-sn-3-сукцинилглицерин; 1,3-дипальмитоил-2-сукцинилглицерин; пальмитоилгомоцистеин; алкиламины или соли алкиламмония, содержащие по меньшей мере одну (C10-C20), предпочтительно (C14-C18), алкильную цепь, такие как, например, N-стеариламин, N,N'-дистеариламин, N-гексадециламин, N,N'-дигексадециламин, хлорид N-стеариламмония, хлорид N,N'-дистеариламмония, хлорид N-гексадециламмония, хлорид N,N'-дигексадециламмония, бромид диметилдиоктадециламмония (DDAB), бромид гексадецилтриметиламмония (CTAB); третичные или четвертичные соли аммония, содержащие одну или предпочтительно две (C10-C20), предпочтительно (C14-C18) ацильную цепь, связанную с N-атомом через (C3-C6) алкиленовый мостик, такие как, например, 1,2-дистеароил-3-триметиламмоний-пропан (DSTAP), 1,2-дипальмитоил-3-триметиламмоний-пропан (DPTAP), 1,2-олеоил-3-триметиламмоний-пропан (DOTAP), 1,2-дистеароил-3-диметиламмоний-пропан (DSDAP); и их смеси или комбинации.
Эти дополнительные амфифильные соединения, если они присутствуют, могут быть представлены в разных количествах, например, вплоть до 25 мол.% композиции, образующей стабилизирующий слой, предпочтительно вплоть до 20 мол.%.
В соответствии с предпочтительным вариантом осуществления состав для получения наполненных газом микровезикул содержит по меньшей мере одну жирную кислоту, предпочтительно пальмитиновую кислоту, в комбинации с фосфолипидом, как определено выше, предпочтительно DSPC и DPPE-PEG5000, более предпочтительно с соответствующей долей от 5% (молярное соотношение) до 20%.
Нацеливающий лиганд
Нацеливающий лиганд представляет собой пептид, содержащий аминокислотную последовательность, выбранную из AGPTWCEDDWYYCWLFGTGGGK (SEQ ID NO. 01) или VCWEDSWGGEVCFRYDPGGGK (SEQ ID NO. 02)
Более предпочтительно указанный пептид представляет собой димерный пептид формулы I.
Нацеливающий пептид предпочтительно конъюгирован с фосфолипидом, предпочтительно с пегилированным фосфолипидом и даже более предпочтительно с DSPE-PEG. Предпочтительно указанный нацеливающий пептид представляет собой липопептид формулы II. Количество липопептида в составе предпочтительно составляет от 0,1% до 5% в молярном отношении по отношению ко всем липидам (фосфолипид+жирная кислота), более предпочтительно от 0,2% до 1%.
Подробности получения мономерных пептидов, димерного пептида и липопептида проиллюстрированы в WO 2007/067979, включенной в данное описание путем ссылки.
Гистидин
Гистидин, предпочтительно L-гистидин, может быть добавлен либо в сухой состав, подлежащий восстановлению, либо к углеводному раствору для восстановления. Предпочтительно гистидин добавляют в состав, который должен быть лиофилизирован; это позволяет использовать общепринятые редиспергирующие углеводные растворы.
Количество гистидина предпочтительно должно быть таким, чтобы концентрация гистидина в водной суспензии наполненных газом микровезикул, используемой для инъекции составляла от 1,5 мМ до 20 мМ, предпочтительно от 2,5 мМ до 10 мМ и даже более предпочтительно от 3 мМ до 8 мМ.
Водный носитель
Водный носитель для получения суспензии наполненных газом микровезикул представляет собой водный раствор, содержащий углевод, который предпочтительно является изоосмолярным. Предпочтительно углевод представляет собой глюкозу. Концентрация углевода в суспензии составляет предпочтительно от 2% до 20% (мас./мас.), более предпочтительно от 3% до 15%. В частности для глюкозы концентрация в итоговой суспензии составляет предпочтительно от 3% до 8%, более предпочтительно от 4 до 6%.
Получение микровезикул
Микровезикулы в соответствии с изобретением могут быть изготовлены любым способом, известным в данной области. Как правило, способ изготовления включает получение сухого порошкообразного материала, содержащего композицию по изобретению, предпочтительно лиофилизацией (сублимационной сушкой) водной или органической суспензии, содержащей указанную композицию. Затем могут быть получены микровезикулы путем восстановления лиофилизированного состава в водном носителе при слабом перемешивании в присутствии газа.
Предпочтительно, как раскрыто, например, в международной заявке на патент WO2004/069284, композиция, содержащая смесь фосфолипидов и жирных кислот, может быть диспергирована в эмульсии воды с несмешивающимся с водой органическим растворителем (напр., таким как разветвленные или линейные алканы, алкены, циклоалканы, ароматические углеводороды, алкиловые эфиры, кетоны, галогенированные углеводороды, перфторированные углеводороды или их смеси) при перемешивании, предпочтительно в смеси с лиозащитным агентом (таким, как описано выше, в частности углеводами, сахарными спиртами, полигликолями, полиоксиалкиленгликолями и их смесями). Эмульсия может быть получена из водной среды и растворителя в присутствии фосфолипидов и жирных кислот любым подходящим методом изготовления эмульсии, известным в данной области, таким как, например, обработка ультразвуком, встряхивание, гомогенизация под высоким давлением, микроперемешивание, мембранная эмульсификация, эмульсификация проточным фокусированием, высокоскоростное взбалтывание или перемешивание с высоким сдвиговым усилием. Предпочтительно сначала готовят органический раствор, содержащий фосфолипид и жирную кислоту; нацеливающий липопептид и необязательно пегилированный фосфолипид отдельно растворяют в водном растворе, содержащем лиозащитный агент и необязательно гистидин; затем органическую и водную фазы смешивают и эмульгируют, как описано выше. Полученная таким образом микроэмульсия необязательно может быть разбавлена с раствором, содержащим лиозащитный агент и необязательно гистидин. Микроэмульсию, которая содержит микрокапли растворителя, окруженные и стабилизированные фосфолипидами и жирными кислотами, затем лиофилизируют общепринятыми методами для получения лиофилизированного материала.
Сублимированный (или лиофилизированный) продукт обычно находится в виде порошка или таблетки, и может храниться (как правило, во флаконе) в контакте с требуемым газом. Продукт может быть легко восстановлен в пригодном физиологически приемлемом водном жидком носителе, таком как описанный выше водный раствор, содержащий углевод.
Газ
Любой биологически совместимый газ, предшественник газа или их смесь может быть применен с образованием микровезикул по изобретению (далее упоминаемом как ''газ, образующий микровезикулу'').
Газ может содержать, например, воздух; азот; кислород; диоксид углерода; водород; оксид диазота; благородный или инертный газ, такой как гелий, аргон, ксенон или криптон; углеводород низкой молекулярной массы (напр., содержащий вплоть до 7 атомов углерода), например алкан, такой как метан, этан, пропан, бутан, изобутан, пентан или изопентан, циклоалкан, такой как циклобутан или циклопентан, алкен, такой как пропен, бутен или изобутен, или алкен, такой как ацетилен; простой эфир; кетон; сложный эфир; галогенированные газы, предпочтительно фторированные газы, такие как или галогенированные, фторированные, или перфторированные углеводороды низкой молекулярной массы (напр., содержащие вплоть до 7 атомов углерода); или смесь любых из вышеприведенных веществ. Когда применяют галогенированные углеводороды предпочтительно, чтобы по меньшей мере некоторые, более предпочтительно все, атомы галогена в указанном соединении представляли собой атомы фтора.
Фторированные газы являются предпочтительными, в особенности перфторированные газы. Фторированные газы включают материалы, которые содержат по меньшей мере один атом фтора, такие как, например, фторированные углеводороды (органические соединения, содержащие один или более атомов углерода и фтор); гексафторид серы; фторированные, предпочтительно перфторированные, кетоны, такие как перфторацетон; и фторированные, предпочтительно перфторированные, простые эфиры, такие как перфтордиэтиловый простой эфир. Предпочтительными соединениями являются перфторированные газы, такие как SF6 или перфторуглероды (перфторированные углеводороды), т.е., углеводороды, в которых все атомы водорода замещены атомами фтора, которые, как известно, образуют особенно стабильные суспензии микропузырьков, как раскрыто, например, в EP 0554 213, которая включена в данное описание путем ссылки.
Термин перфторуглерод включает насыщенные, ненасыщенные и циклические перфторуглероды. Примерами биологически совместимых, физиологически приемлемых перфторуглеродов являются: перфторалканы, такие как перфторметан, перфторэтан, перфторпропаны, перфторбутаны (напр., перфтор-н-бутан, необязательно в смеси с другими изомерами, такими как перфтор-изобутан), перфторпентаны, перфторгексаны или перфторгептаны; перфторалкены, такие как перфторпропен, перфторбутены (напр., перфторбут-2-ен) или перфторбутадиен; перфторалкины (напр., перфторбут-2-ин); и перфторциклоалканы (напр., перфторциклобутан, перфторметилциклобутан, перфтордиметилциклобутаны, перфтортриметилциклобутаны, перфторциклопентан, перфторметилциклопентан, перфтордиметилциклопентаны, перфторциклогексан, перфторметилциклогексан и перфторциклогептан). Предпочтительные насыщенные перфторуглероды включают, например, CF4, C2F6, C3F8, C4F8, C4F10, C5F12 и C6F12.
Также может быть выгодно применять смесь любых из вышеупомянутых газов в любом соотношении. Например, смесь может содержать обычно используемый газ, такой как азот, воздух или диоксид углерода, и газ, образующий стабильную суспензию микропузырьков, такой как гексафторид серы или перфторуглерод, как указано выше. Примеры пригодных газовых смесей приведены, например, в WO 94/09829, которая включена в данное описание путем ссылки. Следующие комбинации являются особенно предпочтительными: смесь газов (A) и (B), в которой газ (B) является фторированным газом, выбранным из ранее проиллюстрированных, включая их смеси, и (A) выбран из воздуха, кислорода, азота, диоксида углерода или их смесей. Количество газа (B) может составлять от приблизительно 0,5% до приблизительно 95% об./об. от общей смеси, предпочтительно от приблизительно 5% до 80%.
Особенно предпочтительными газами являются SF6, C3F8, C4F10 или их смеси, необязательно в смеси с воздухом, кислородом, азотом, диоксидом углерода или их смесей. Особенно предпочтительным является C4F10, и даже более предпочтительной является смесь азота с C4F10, предпочтительно в соотношении 35/65 об./об.
В некоторых случаях может быть желательно включить в состав предшественник газообразного вещества (т.е., материал, который способен превращаться в газ in vivo). Предпочтительно предшественник газа и газ, получаемый из него, являются физиологически приемлемыми. Предшественник газа может быть pH-активируемым, фотоактивируемым, активируемым температурой и т.д. Например, некоторые перфторуглероды могут быть применены в качестве активируемых температурой газовых предшественников. Эти перфторуглероды, такие как перфторпентан или перфторгексан, имеют температуру фазового перехода жидкость/газ выше комнатной температуры (или температуры получения и/или хранения этих агентов), но ниже температуры тела; таким образом, в человеческом организме они подвергаются фазовому переходу жидкость/газ и превращаются в газ.
Фармацевтический набор и введение
Содержащие микровезикулы суспензии в соответствии с изобретением могут храниться в готовом к применению виде или предпочтительно в виде лиофилизированного предшественника, который может быть восстановлен водным носителем. В соответствии с изобретением предшественник суспензии микровезикул, предпочтительно хранить в виде сухого порошка, в таком виде он может быть успешно упакован в двухкомпонентный диагностический и/или терапевтический набор, предпочтительно для введения с помощью инъекций. Набор предпочтительно содержит первый контейнер, содержащий лиофилизированную композицию-предшественник в контакте с выбранным газом, образующим микровезикулы, и второй контейнер, содержащий физиологически приемлемый водный носитель для восстановления суспензии микровезикул, в частности, углеводный раствор, как отмечалось выше, предпочтительно 5% (мас./мас.) раствор глюкозы. Указанный двухкомпонентный набор может включать два отдельных контейнера или двухкамерный контейнер. В первом случае контейнер предпочтительно представляет собой общепринятый флакон с мембраной, где флакон, содержащий лиофилизированный остаток, закупорен мембраной, через которую может быть инъецирована жидкость-носитель с применением по желанию предварительно наполненного шприца. В таком случае шприц, применяемый в качестве контейнера для второго компонента, впоследствии используется для инъецирования контрастного агента. Во втором случае двухкамерный контейнер предпочтительно представляет собой двухкамерный шприц, и после восстановления лиофилизата и последующего смешивания ответствующим образом или аккуратного встряхивания, контейнер может быть использовать непосредственно для инъецирования контрастного агента.
В соответствии с предпочтительным вариантом осуществления эффективное количество нацеленных микровезикул вводят пациенту, как правило, путем инъекции содержащих их суспензии. Таким образом, визуализация представляющей интерес области (предположительно содержащей ткань, экпрессирующую KDR-рецепторы) улучшается благодаря наличию микровезикул, связанных с рецептором (если они представлены) в представляющей интерес области.
Суспензия микровезикул по изобретению может быть использована многочисленных диагностических и/или терапевтических методах, включая, в частности, контрастно-усиленную ультразвуковую визуализацию.
Примеры методов визуализации, которые могут быть использованы в областях применения ультразвука включают, например, фундаментальную и нелинейную (напр., гармоники) визуализацию в B-режиме, визуализацию пульсовой волны или фазоинверсную тканевую гармонику и фундаментальную и нелинейную допплеровскую визуализацию; если требуется, могут быть применены трех- или четырехмерные методы визуализации. Кроме того, также предусмотрены диагностические методы, вызывающие разрушение наполненных газом микровезикул (напр., посредством ультразвуковых волн при высоком акустическом давлении), что является высокочувствительными способами детектирования.
Как правило, при введении субъекту (напр., млекопитающему), по отношению которому применяют требуемый метод ультразвуковой визуализации, эффективное количество суспензии микровезикул, выбранную представляющую интерес область обрабатывают ультразвуком и собирают полученный в результате эхо-сигнал. Таким образом, собранный сигнал может быть применен, например, для отображения контрастно-усиленного изображения представляющей интерес области; альтернативно сигнал может быть применен для расчета параметрических карт представляющей интерес области.
Суспензию микровезикул в соответствии с изобретением, как правило, можно вводить, предпочтительно, путем внутривенной инъекции, в концентрации от приблизительно 0,01 до приблизительно 1,0 мкл газа на кг веса пациента, в зависимости от, например, их соответствующей композиции, ткани или органа, который должен быть визуализирован, и/или выбранного метода визуализации. Этот общий диапазон концентраций в действительности может меняться в зависимости от конкретных приложении визуализации, например, в случаях, когда сигналы могут наблюдаться при очень низких дозах, как, например, в случае цветного допплеровского картирования или визуализации с инверсией рабочего импульса.
Следующие примеры помогут дополнительно проиллюстрировать изобретение.
ПРИМЕРЫ
Материалы и способы
В приведенных ниже примерах использованы следующие материалы:
Распределение частиц по размерам для микровезикул в суспензии измеряли с помощью счетчика Коултера (Multisizer 3), оснащенного 30 мкм отверстием (разбавление: 50 мкл в 100 мл NaCl 0,9% раствор); величины pH измеряли с помощью pH-метра MP230 (Mettler Toledo), оснащенного электродом Inlab 410 (Mettler Toledo).
Пример 1
Получение лиофилизированных предшественников наполненных газом микровезикул без регулирующих pH добавок
Получение липопептида формулы II
Липопептид формулы II получали, как описано подробно в рабочих примерах PCT заявки на патент WO 2007/067979, включенной в данное описание путем ссылки. Кратко, как объяснено более подробно в вышеприведенной PCT заявке, пептид AGPTWCEDDWYYCWLFGTGGGK (SEQ ID NO. 01) синтезировали твердофазным синтезом пептида (SPPS) с применением Fmoc-защищенных аминокислот. N-конец ацетилировали и Fmoc-Lys (ivDde)-OH (Nα-Fmoc-Nε-[1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)-3-метилбутил]-L-лизин) связывали с боковой цепью Lys22. После удаления защитной группы Fmoc, отщепления от смолы и отщепления других защитных групп (за исключением группы ivDde), пептид циклизовали (образование дисульфидного мостика). Циклизованный пептид очищали методом препаративной ВЭЖХ и лиофилизировали.
Пептид VCWEDSWGGEVCFRYDPGGGK (SEQ ID NO. 02) также синтезировали методом SPPS с применением Fmoc-защищенных аминокислот. N-конец ацетилировали и осуществляли два последовательных связывания Fmoc-Adoa-OH (8-(Fmoc-амино)-3,6-диоксакаприловая кислота) с боковой цепью Lys21. После удаления защитной группы Fmoc, отщепления от смолы и отщепления других защитных групп, пептид циклизовали (образование дисульфидного мостика). Циклизованный пептид очищали методом препаративной ВЭЖХ и лиофилизировали.
Получение димерного пептида (Формула I): дисукцинимидилглутарат (DSG) связывали с α-амино функциональной группой лизина, связанной с ε-амино функциональной группой Lys22 пептида (SEQ ID NO. 01). После очистки продукт подвергали реакции с аминогруппой фрагмента Adoa, связанного с Lys21 пептида (SEQ ID NO. 02). Неочищенный гетеродимер очищали препаративной ВЭЖХ и лиофилизировали. Затем отщепляли оставшуюся защитную группу ivDde и полученный продукт снова очищали препаративной ВЭЖХ, и с помощью ионного обмена получали ацетатную соль. Полученный раствор лиофилизировали с получением димерного пептида (формула I).
Получение липопептида (формула II): дисукцинимидилглутарат (DSG) связывали с предварительно синтезированным димерным пептидом (формула I). После очистки продукт подвергали реакции с DSPE-PEG2000-амином. Продукт очищали препаративной ВЭЖХ и лиофилизировали.
Преп- 01
Лиофилизированный предшественник для получения суспензии наполненных газом микровезикул получали следующим образом:
(i) 60 мг смеси липидов (DSPC и пальмитиновая кислота, с молярным соотношением 80/20) растворяли в циклооктане (4,8 мл) при 70°C.
(ii) Отдельно диспергировали DSPE-PEG 2000 (3% мас./мас.) и липопептид формулы II (0,2% мас./мас.) в 1 мл буфера Tris 20 мМ (pH 7,6); затем дисперсию смешивали с 60 мл 10% раствора PEG4000.
(iii) Препарат циклооктана (i) эмульгировали в водном растворе PEG4000 (ii) с помощью высокоскоростного гомогенизатора (Megatron MT3000) в течение 5 мин при 12000 об/мин.
(iv) Полученную в результате эмульсию нагревали при 80°C в течение 1 часа при перемешивании. После охлаждения до комнатной температуры (~1 час),
(v) эмульсию разбавляли четыре раза, используя 10% водный раствор PEG4000, и разливали по 1 мл во флаконы DIN8R.
(vi) Флаконы помещали в лиофилизатор (лиофилизатор TELSTAR Lyobeta-35), охлаждали до -50°C в течение 2 часов и затем лиофилизировли при -25°C и 0,2 мбар в течение 12 часов, с заключительным этапом сушки при 30°C и 0,1 мбар в течение дополнительных 6 часов.
Смесью 35/65 (по объему) C4F10/N2 заполняли свободное пространство во флаконах, которые затем закупоривали и запаивали.
Преп-02 - Преп-05
Вышеприведенное приготовление Преп-01 повторяли с различным молярным соотношением DSPC/пальмитиновая кислота в органической фазе (см. таблицу 1) с тем отличием, что на этапе (ii) получения водного раствора меняли количества DSPE-PEG 2000 или DPPE-PEG 5000 и липопептида формулы II, как проиллюстрировано в таблице 1. Кроме того, на этапе (v) Преп-03 и Преп-05 разбавляли два раза (вместо четырех раз) и затем разливали во флаконы DIN8R по 1,5 мл.
Таблица 1 ниже суммирует различия в различных препаратах лиофилизированных предшественников.
Таблица 1 Препараты лиофилизированных предшественников
(молярный %)
(молярный %)
(мл во флакон)
Пример 2
Влияние pH диспергирующих сахаридных растворов на агрегирование микровезикул
Препараты, полученные в соответствии с примером 1, редиспергировали в 1 мл воды или различных растворов 5% (мас./мас.) глюкозы при различных величинах pH, а именно 3,5, 3,8 и 6,5.
Для получения 5% раствора глюкозы с pH 6,5, от 30 до 34 мкл NaOH 0,1 N добавляли в 20 мл 5% раствора глюкозы (→ 0,15 до 0,17 мМ NaOH). Для получения 5% раствора глюкозы с pH 3,5, от 32 до 40 мкл 0,1 Н HCl добавляли в 20 мл 5% раствора глюкозы.
Полученная суспензия идентифицирована как Сусп-01 - Сусп-05 (из соответствующих Преп-01 - Преп-05, с индексами для идентификации и восстановления с (a) дистиллированной водой (контроль), (b) раствором глюкозы pH 3,5, (c) раствором глюкозы pH 3,8 и (d) раствором глюкозы pH 6,5, соответственно. Таким образом, например, Сусп.02c идентифицирует суспензию микровезикул, полученную диспергированием вышеприведенного Преп-02 в 1 мл 5% глюкозы при pH 3,8.
Полученные суспензии наполненных газом микровезикул оценивали, используя счетчик Коултера для определения концентрации микровезикул и среднего размера частиц по количеству (DN) микровезикул в суспензии. Результаты проиллюстрированы в таблице 2 и таблице 3, соответственно (в этих и в следующих таблицах значения указывают либо фактические значения, относящиеся к одной суспензии, либо среднее значение в случае многократных получений одной и той же суспензии). pH полученной суспензии также измеряли, и оно приведено в следующей таблице 4.
ТАБЛИЦА 2: концентрация микровезикул при восстановлении различными растворами
*=контроль
ТАБЛИЦА 3: DN микровезикул суспензии при восстановлении различными растворами
*=контроль
ТАБЛИЦА 4: pH микровезикул суспензии при восстановлении различными растворами
*=контроль
Из значений в таблице 2 можно сделать вывод, что концентрация микровезикул в полученной суспензии существенно снижается по сравнению с контролем, если для восстановления лиофилизированных составов используется раствор глюкозы с pH 3,5 или 3,9 (столбцы b и c), тогда как, если используется раствор глюкозы с pH 6,5 (столбец d), концентрация по существу является сходной с контролем (столбец a).
Из таблицы 3 можно сделать вывод, что восстановление лиофилизированных составов растворами глюкозы с низкими значениями pH приводит к нежелательному возрастанию величины DN микровезикул.
Пример 3
Влияние различных регулирующих pH агентов на агрегирование микровезикул при восстановлении Преп-01 растворами сахаридов с разными величинами pH
Пример 3a: Гидрокарбонат натрия
Получение Преп-01 лиофилизированного предшественника повторяли в соответствии с процедурой примера 1, с тем отличием, что к 10% раствору PEG4000, применяемому для разбавления эмульсии на этапе (v), добавляли различные количества гидрокарбоната натрия для получения препарата соответствующего лиофилизированного предшественника с различными количествами гидрокарбоната натрия, включенного в него. Количества гидрокарбоната, добавленного в раствор PEG4000, являлись такими, чтобы получить в эмульсии этапа (v) концентрации гидрокарбоната, равные 0,125, 0,31, 0,38, 0,80, 1,20 и 2,0 мМ, соответственно.
Полученные препараты затем редиспергировали в 1 мл воды или различных растворах 5% (мас./мас.) глюкозы с разыми величинами pH в соответствии с процедурой примера 2.
Таблица 5 демонстрирует концентрацию микровезикул, измеренную в различных суспензиях, полученных из соответствующих препаратов, содержащих различные количества гидрокарбоната натрия.
ТАБЛИЦА 5 - Концентрация микровезикул в суспензиях с гидрокарбонатом натрия
*=контроль
Из данных, проиллюстрированных в вышеприведенной таблице, можно сделать вывод, что концентрации гидрокарбоната натрия по меньшей мере 0,38 мМ в разбавленной эмульсии являются целесообразными для получения приемлемой концентрации микропузырьков во всем диапазоне pH раствора глюкозы, применяемого для восстановления. С другой стороны, более низкие концентрации гидрокарбоната могут обеспечить суспензии с нежелательно более низкой концентрацией микровезикул, в частности, в случае восстановления лиофилизированного предшественника раствором глюкозы с pH 3,5.
Таблица 6 демонстрирует величины pH, измеренные в суспензиях таблицы 5.
ТАБЛИЦА 6 - величины pH суспензий микровезикул с гидрокарбонатом натрия
*=контроль
Как известно в данной области, pH инъецируемых внутривенно растворов с отрегулированным значением pH предпочтительно должно находиться в пределах диапазона pH от приблизительно 6 до приблизительно 8,5, предпочтительно между приблизительно 7 и приблизительно 8. Из таблицы 6 можно сделать вывод, что, когда раствор глюкозы для восстановления имеет pH в верхней части диапазона pH (раствор d, pH=6,5), уже относительно низкие концентрации гидрокарбоната могут повысить pH готовой суспензии микровезикул до величин, превышающих приемлемые для инъекций значения. Таким образом, при рассмотрении таблиц 5 и 6 в комбинации, по всей видимости, относительно высокие концентрации гидрокарбоната натрия (которые необходимы для обеспечения требуемой концентрации микровезикул в растворе глюкозы при относительно низких pH) могут чрезмерно повышать pH инъецируемого раствора. С другой стороны, относительно низкие концентрации гидрокарбоната могут не обеспечивать требуемую концентрацию микровезикул в восстановленной суспензии (в частности при применении растворов глюкозы с низкими pH).
Прим. 3b: буфер Трис/HCl
Пример 3a повторяли с тем отличием, что гидрокарбонат натрия заменяли буферным раствором Трис/HCl (pH=8,0), полученным растворением основания Трис (121,1 г - 1 моль) в дистиллированной воде (750 мл) с добавлением HCl (приблизительно 40 мл), и последующим доведением объема до 1 л дистиллированной водой. Объемы буферного раствора Трис/HCl, добавленные в раствор PEG4000, являлись такими, чтобы получить концентрации Трис/HCl в эмульсии этапа (v), равные 0,125, 2,5, 5,0, 10,0 мМ, соответственно.
Таблица 7 демонстрирует концентрацию микровезикул, измеренную в различных суспензиях, полученных из соответствующих препаратов, содержащих различные количества буфера Трис/HCl.
ТАБЛИЦА 7 - Концентрация микровезикул в суспензиях с буфером Трис/HCl (pH=8,0)
*=контроль
Из данных в вышеприведенной таблице можно сделать вывод, что восстановление препаратов, содержащих буфер Трис/HCl, приводит к относительно более низким концентрациям микровезикул в суспензии (по сравнению с контролем), в частности, при восстановлении препарата растворами глюкозы с низким pH. В частности наблюдалось значительное снижение концентрации микропузырьков, когда применяли высокие концентрации буфера Трис/HCl, в частности 5,0 мМ или выше. По этой причине, в последующих экспериментах выбирали буфер Трис/HCl 2,5 мМ в качестве сравнительного регулирующего pH агента.
Прим. 3c: Фосфатный буфер
Пример 3a повторяли с тем отличием, что гидрокарбонат натрия заменяли фосфатным буфером (pH=7,6), полученным смешиванием 43,5 мл раствора Na2HPO4 (0,2 M) с 6,5 мл раствора NaH2PO4 (0,2 M). Объемы раствора фосфатного буфера, добавленного в раствор PEG4000, являлись такими, чтобы получить концентрацию фосфата в эмульсии этапа (v), равную 2,5, 5,0 и 10,0 мМ, соответственно.
Таблица 8 и Таблица 9 демонстрируют концентрацию микровезикул и значения DN, соответственно, измеренные в различных суспензиях, полученных из соответствующих препаратов, содержащих различные количества фосфатного буфера.
ТАБЛИЦА 8 - Концентрация микровезикул в суспензиях с фосфатным буфером (pH=7,6)
*=контроль
Что касается примера 3b, восстановление препаратов, содержащих фосфатный буфер, дает относительно более низкие концентрации микровезикул в суспензии (по сравнению с контролем), в особенности, при восстановлении препарата растворами глюкозы с низким pH. В частности наблюдали значительное снижение концентрации микропузырьков, когда применяли более высокие концентрации фосфатного буфера. По этой причине в последующих экспериментах выбирали фосфатный буфер 2,5 мМ в качестве сравнительного регулирующего pH агента.
ТАБЛИЦА 9 - значения DN микровезикул в суспензиях с фосфатным буфером (pH=7,6)
*=контроль
Как видно из вышеприведенной таблицы, значения DN микровезикул суспензии немного превышают значения в контроле, в частности для препаратов восстановленных растворами глюкозы с низким pH, а также при более высоких концентрациях фосфатного буфера.
Прим. 3d: Гистидин
Пример 3a повторяли с тем отличием, что гидрокарбонат натрия заменяли гистидином. Количество гистидина, добавленное в раствор PEG4000, было таким, чтобы получить концентрацию гистидина в эмульсии этапа (v), равную 2,5, 5,0 и 10,0 мМ, соответственно.
Таблица 10 демонстрирует концентрацию микровезикул, и таблица 11 значения DN, измеренные в различных суспензиях, полученных из соответствующих препаратов, содержащих различные количества гистидина. Концентрация гистидина в готовой суспензии микровезикул составляла 2,5, 5,0 и 10,0 мМ, соответственно.
ТАБЛИЦА 10 - Концентрация микровезикул в суспензиях с гистидином при различных концентрациях
*=контроль
ТАБЛИЦА 11 - DN микровезикул в суспензии с гистидином при различных концентрациях
*=контроль
Как видно из вышеприведенной таблицы значения DN микровезикул суспензии с гистидином сравнимы или немного ниже значений контроля, что указывает на то, что микровезикулы в суспензиях, содержащих гистидин, имеют сопоставимые с контролем размеры независимо от pH раствора глюкозы и концентрации гистидина.
Пример 4
Влияние различных регулирующих pH агентов на агрегирование микровезикул при восстановлении Преп-02 растворами сахаридов с разными величинами pH
Пример 4a: суспензия микровезикул со сравнительными регулирующими pH агентами
Получение лиофилизированного предшественника Преп-02 повторяли в соответствии с процедурой примера 1, с тем отличием, что гидрокарбонат натрия, буфер Трис/HCl или фосфатный буфер добавляли в 10% раствор PEG4000, применяемый для разбавления эмульсии на этапе v, для получения препаратов соответствующего лиофилизированного предшественника. Количества регулирующего pH агента, добавленного в раствор PEG4000, были такими, чтобы получить оптимизированную концентрацию (как определено в примере 3) соответствующего регулирующего pH агента в разбавленной эмульсии, как указано в таблицах 12 и 13.
Полученные препараты затем редиспергировали в 1 мл воды или различных 5% (мас./мас.) растворов глюкозы с разными величинами pH в соответствии с процедурой примера 2.
Таблицы 12 и 13 демонстрируют концентрацию микровезикул и значения DN, измеренные в различных суспензиях, полученных из соответствующих препаратов, содержащих выбранный регулирующий pH агент.
ТАБЛИЦА 12 - Концентрация микровезикул в суспензиях с различными регулирующими pH агентами
0,5 мМ
2,5 мМ
2,5 мМ
*=контроль
ТАБЛИЦА 13 - Значение DN микровезикул в суспензиях с различными регулирующими pH агентами
0,5 мМ
2,5 мМ
2,5 мМ
*=контроль
Из данных можно сделать вывод, что проиллюстрированное в таблицах 12 и 13 количество частиц в суспензиях с различными общепринятыми регулирующими pH агентами обычно является более низким, чем в контроле, в частности при восстановлении растворами глюкозы с низким pH - 02(b), тогда как значение DN обычно является более высоким.
Пример 4b: суспензия микровезикул с гистидином
Пример 4a повторяли с тем отличием, что сравнительные регулирующие pH агенты заменяли гистидином при различных концентрациях, как проиллюстрировано в таблицах 14 и 15. Также в этом случае концентрация гистидина в готовой суспензии микровезикул составляла 2,5 мМ, 5,0 мМ и 10 мМ, соответственно.
ТАБЛИЦА 14 - Концентрация микровезикул в суспензиях с гистидином
*=контроль
ТАБЛИЦА 15 - значение DN микровезикул в суспензиях с гистидином
*=контроль
Из данных можно сделать вывод, что проиллюстрированные в таблицах 14 и 15 количества частиц и значения DN микровезикул, измеренные в суспензиях с гистидином обычно являются сопоставимыми с измеренными в контрольном растворе при любом pH восстанавливающего раствора глюкозы и при любой концентрации гистидина.
Пример 5
Влияние фосфатного буфера и гистидина на агрегирование микровезикул при восстановлении Преп-03 растворами сахаридов с разными величинами pH
Получение лиофилизированного предшественника Преп.-03 повторяли в соответствии с процедурой примера 1, с тем отличием, что фосфатный буфер или гистидин добавляли в 10% раствор PEG4000, применяемый для разбавления эмульсии (этап v) для получения препаратов соответствующего лиофилизированного предшественника. Количества фосфата или гистидина, добавленные в раствор PEG4000 были такими, чтобы получить концентрацию фосфата 2,5 мМ и концентрации гистидина, равные 5 мМ, 10 мМ и 20 мМ в разбавленной эмульсии этапа (v); как указано в таблицах 16 и 17, соответствующие концентрации гистидина в готовой суспензии микровезикул составляли приблизительно 3,75 мМ, 7,5 мМ и 15 мМ.
Полученные препараты затем редиспергировали в 2 мл различных 5% (мас./мас.) растворов глюкозы с разными величинами pH в соответствии с процедурой примера 2.
Таблицы 16 и 17 демонстрируют концентрацию и значения DN в различных суспензиях с соответствующими препаратами, содержащими выбранный регулирующий pH агент.
ТАБЛИЦА 16 - Концентрация микровезикул в суспензиях
2,5 мМ
5,0 мМ
10 мМ
20 мМ
ТАБЛИЦА 17 - значение DN микровезикул в суспензиях с различными регуляторами pH
2,5 мМ
5,0 мМ
10 мМ
20 мМ
Из данных в таблице 16 можно сделать вывод, что количество частиц микровезикул, измеренное в суспензиях с гистидином при различных концентрациях, обычно является более высоким, чем количество, измеренное в сравнительном буферизированном фосфатом препарате, в частности при высоких величинах pH раствора глюкозы и высоких концентрациях гистидина. Из данных можно сделать вывод, что в таблице 17, значения DN микровезикул, измеренные в суспензиях с гистидином при различных концентрациях, обычно являются более низкими, чем значения DN, измеренные в сравнительном буферизированном фосфатом препарате.
Пример 5
Влияние фосфатного буфера и гистидина на агрегирование микровезикул при восстановлении Преп.-04 растворами сахаридов с разными величинами pH
Получение лиофилизированного предшественника Преп.-04 повторяли в соответствии с процедурой примера 1, с тем отличием, что добавляли сравнительные регулирующие pH агенты (т.е., гидрокарбонат, Трис/HCl или фосфат) или гистидин в 10% раствор PEG4000, применяемый для разбавления эмульсии (этап v), для получения соответствующих препаратов лиофилизированного предшественника. Количества добавленных регулирующих pH агентов были такими, чтобы получить следующие концентрации в разбавленной эмульсии, как указано в таблицах 18 и 19: 0,38 мМ гидрокарбонат, 2,5 мМ Трис/HCl, 2,5 мМ фосфат или 2,5 мМ гистидин.
Полученные препараты затем редиспергировали в 1 мл различных 5% (мас./мас.) растворов глюкозы при различных величинах pH в соответствии с процедурой примера 2.
Таблицы 18 и 19 демонстрируют концентрацию микровезикул и значения DN, измеренные в различных суспензиях, полученных из соответствующих препаратов, содержащих выбранный регулирующий pH агент.
ТАБЛИЦА 18 - Концентрация микровезикул в суспензиях
(0,38 мМ)
(2,5 мМ)
(2,5 мМ)
(2,5 мМ)
*=контроль
ТАБЛИЦА 19 - значение DN микровезикул в суспензиях с различными регуляторами pH
(0,38 мМ)
(2,5 мМ)
(2,5 мМ)
(2,5 мМ)
Из данных в таблице 18 можно сделать вывод, что количество частиц в суспензиях с различными общепринятыми регулирующими pH агентами обычно является более низким, чем количество, измеренное в суспензии с гистидином, в частности в растворах глюкозы с низким pH. Из данных в таблице 19 можно сделать вывод, что значения DN микровезикул в суспензиях с различными общепринятыми регулирующими pH агентами обычно являются более высокими, чем значение DN, измеренное в суспензии с гистидином, в частности в растворах глюкозы с низким pH.
Пример 7
Влияние фосфатного буфера и гистидина на агрегирование микровезикул при восстановлении Преп.-05 растворами сахаридов при различных величинах pH
Получение лиофилизированного предшественника Преп.-05 повторяли в соответствии с процедурой примера 1, с тем отличием, что добавляли фосфатный буфер или гистидин в 10% раствор PEG4000, применяемый для разбавления эмульсии (этап v), для получения соответствующих препаратов лиофилизированного предшественника. Количества фосфата или гистидина, добавленные в раствор PEG4000, были такими, чтобы получить концентрацию 2,5 мМ фосфата и концентрации гистидина в разбавленной эмульсии, равные 2,5 мМ, 5 мМ или 10 мМ, как указано в таблицах 20 и 21.
Полученные препараты затем редиспергировали в 2 мл воды или различных 5% растворов глюкозы с разными величинами pH в соответствии с процедурой примера 2.
Таблицы 20 и 21 демонстрируют концентрацию микровезикул и значения DN, измеренные в различных суспензиях, полученных из соответствующих препаратов, содержащих выбранный регулирующий pH агент.
ТАБЛИЦА 20 - Концентрация микровезикул в суспензиях
2,5 мМ
5 мМ
10 мМ
ТАБЛИЦА 21 - значение DN микровезикул в суспензиях
2,5 мМ
5 мМ
10 мМ
Из данных, проиллюстрированных в таблице 20, можно сделать вывод, что, количество частиц в суспензиях с фосфатным буфером обычно является более низким, чем количество, измеренное в суспензии с гистидином при различных концентрациях, в частности в растворах глюкозы с низким pH. Из данных, проиллюстрированных в таблице 21, можно сделать вывод, что значения DN микровезикул в суспензиях с фосфатным буфером обычно являются более высокими, чем значение DN, измеренное в суспензии с гистидином при различных концентрациях, в частности в растворах глюкозы с низким pH.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BRACCO SUISSE SA
<120> СОСТАВЛЕНИЕ НАПОЛНЕННЫХ НАЦЕЛЕННЫМ ГАЗОМ МИКРОВИЗИКУЛ
<130> ID1304
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> PRT
<213> искусственная
<220>
<223> Синтетический пептид
<220>
<221> MOD_RES
<222> (1)..(1)
<223> АЦЕТИЛИРОВАНИЕ
<220>
<221> ДИСУЛЬФИД
<222> (6)..(13)
<400> 1
Ala Gly Pro Thr Trp Cys Glu Asp Asp Trp Tyr Tyr Cys Trp Leu Phe
1 5 10 15
Gly Thr Gly Gly Gly Lys
20
<210> 2
<211> 21
<212> PRT
<213> искусственная
<220>
<223> Синтетический пептид
<220>
<221> MOD_RES
<222> (1)..(1)
<223> АЦЕТИЛИРОВАНИЕ
<220>
<221> ДИСУЛЬФИД
<222> (2)..(12)
<400> 2
Val Cys Trp Glu Asp Ser Trp Gly Gly Glu Val Cys Phe Arg Tyr Asp
1 5 10 15
Pro Gly Gly Gly Lys
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИОФИЛИЗИРОВАННЫЙ ПРОДУКТ И СУСПЕНЗИЯ НАПОЛНЕННЫХ ГАЗОМ МИКРОВЕЗИКУЛ | 2020 |
|
RU2827409C2 |
| УЛЬТРАЗВУКОВЫЕ КОНТРАСТНЫЕ ВЕЩЕСТВА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2004 |
|
RU2345793C2 |
| ОБОГАЩЕННЫЕ ФОСФОЛИПИДАМИ ВЕЗИКУЛЫ, НЕСУЩИЕ ТКАНЕВОЙ ФАКТОР, ОБЛАДАЮЩИЕ ГЕМОСТАТИЧЕСКОЙ АКТИВНОСТЬЮ, И ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2595406C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БУФЕР | 2017 |
|
RU2757768C2 |
| ЛИОФИЛИЗИРОВАННЫЙ СОСТАВ ДЛЯ ЗАПОЛНЕННЫХ ГАЗОМ МИКРОВЕЗИКУЛ | 2019 |
|
RU2803236C2 |
| СТАБИЛИЗИРОВАННЫЕ ТВЕРДЫЕ ПОЛИПЕПТИДНЫЕ ЧАСТИЦЫ | 2003 |
|
RU2329823C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ САПОЗИНА С И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2767199C1 |
| БЕЛКОВАЯ КОМПОЗИЦИЯ, УСТОЙЧИВАЯ К СТЕРИЛИЗАЦИИ ОБЛУЧЕНИЕМ | 2013 |
|
RU2678828C2 |
| ВЕЗИКУЛЫ С РЕГУЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ АКТИВНЫХ ИНГРЕДИЕНТОВ | 1994 |
|
RU2160093C2 |
| Стабильные водные композиции белка MIA/CD-RAP | 2011 |
|
RU2739078C2 |
Изобретение относится к области биотехнологии, конкретно к водным суспензиям наполненных газом микровезикул с пептидным нацеливающим лигандом, и может быть использовано для визуализации представляющей интерес области. Предложена водная суспензия наполненных газом микровезикул, содержащих фосфолипид и нацеливающий пептидный лиганд, суспензия дополнительно содержит глюкозу и гистидин в концентрации от 1,5 мМ до 20 мМ. Способ визуализации включает ультразвуковое облучение указанной представляющей интерес области у субъекта, которому было предварительно введено эффективное количество указанной суспензии, и сбор соответствующих эхо-сигналов из указанной области. Также предложен фармацевтический набор, содержащий (a) первый контейнер с физиологически приемлемым газом в контакте с лиофилизированным составом, содержащим (i) фосфолипид, (ii) нацеливающий пептидный лиганд, и (iii) гистидин, и (b) второй контейнер с физиологически приемлемым раствором, содержащим глюкозу, для восстановления лиофилизированного состава в суспензию наполненных газом микровезикул. Изобретение обеспечивает визуализацию представляющей интерес области, которая содержит ткань, экпрессирующую рецепторы, содержащие домен киназы (KDR). 3 н. и 13 з.п. ф-лы, 21 табл., 7 пр.
1. Водная суспензия наполненных газом микровезикул для визуализации представляющей интерес области, где указанные микровезикулы содержат фосфолипид и нацеливающий лиганд, содержащий пептид, имеющий аминокислотную последовательность, выбранную из SEQ ID NO. 01, SEQ ID NO. 02, или их комбинацию, при этом указанная суспензия дополнительно содержит глюкозу и гистидин, где концентрация гистидина в суспензии составляет от 1,5 мМ до 20 мМ.
2. Водная суспензия по п.1, где указанный нацеливающий лиганд представлен в виде димерного пептида, содержащего комбинацию SEQ ID NO. 01 и SEQ ID NO. 02.
3. Водная суспензия по любому из предшествующих пп., где указанные микровезикулы содержат фосфолипид, выбранный из группы, состоящей из дилауроилфосфатидилхолина (DLPC), димиростоилфосфатидилхолина (DMPC), дипальмитоилфосфатидилхолина (DPPC), диарахидоилфосфатидилхолина (DAPC), дистеароилфосфатидилхолина (DSPC), диолеоилфосфатидилхолина (DOPC), 1,2-дистеароил-sn-глицеро-3-этилфосфохолина (этил-DSPC), дипентадеканоилфосфатидилхолина (DPDPC), 1-миристоил-2-пальмитоилфосфатидилхолина (MPPC), 1-пальмитоил-2-миристоилфосфатидилхолина (PMPC), 1-пальмитоил-2-стеароилфосфатидилхолина (PSPC), 1-стеароил-2-пальмитоилфосфатидилхолина (SPPC), 1-пальмитоил-2-олеилфосфатидилхолина (POPC), 1-олеил-2-пальмитоилфосфатидилхолина (OPPC), дилауроилфосфатидилглицерина (DLPG) и его солей щелочных металлов, диарахидоилфосфатидилглицерина (DAPG) и его солей щелочных металлов, димиростоилфосфатидилглицерина (DMPG) и его солей щелочных металлов, дипальмитоилфосфатидилглицерина (DPPG) и его солей щелочных металлов, дистеароилфосфатидилглицерина (DSPG) и его солей щелочных металлов, диолеоилфосфатидилглицерина (DOPG) и его солей щелочных металлов, дилауроилфосфатидной кислоты (DLPA), димиростоилфосфатидной кислоты (DMPA) и ее солей щелочных металлов, дипальмитоилфосфатидной кислоты (DPPA) и ее солей щелочных металлов, дистеароилфосфатидной кислоты (DSPA), диарахидоилфосфатидной кислоты (DAPA) и ее солей щелочных металлов, дилауроилфосфатидилэтаноламина (DLPE), димиростоилфосфатидилэтаноламина (DMPE), дипальмитоилфосфатидилэтаноламина (DPPE), дистеароилфосфатидилэтаноламина (DSPE), диолеоилфосфатидилэтаноламина (DOPE), диарахидоилфосфатидилэтаноламина (DAPE), дилинолеилфосфатидилэтаноламина, дилауроилфосфатидилсерина (DLPS), димиростоилфосфатидилсерина (DMPS), диарахидоилфосфатидилсерина (DAPS), дипальмитоилфосфатидилсерина (DPPS), дистеароилфосфатидилсерина (DSPS), диолеоилфосфатидилсерина (DOPS), дипальмитоилсфингомиелина (DPSP), дистеароилсфингомиелина (DSSP), дилауроилфосфатидилинозита (DLPI), диарахидоилфосфатидилинозита (DAPI), димиростоилфосфатидилинозита (DMPI), дипальмитоилфосфатидилинозита (DPPI), дистеароилфосфатидилинозита (DSPI), диолеоилфосфатидилинозита (DOPI).
4. Водная суспензия по п.3, где указанные микровезикулы дополнительно содержат пегилированный фосфолипид.
5. Водная суспензия по п.3 или 4, где указанные микровезикулы дополнительно содержат жирные кислоты, выбранные из группы, состоящей из лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты, арахиновой кислоты, бегеновой кислоты, олеиновой кислоты, линолевой кислоты и линоленовой кислоты.
6. Водная суспензия по п.5, где указанные микровезикулы содержат смесь DSPC, пальмитиновой кислоты и DSPE-PEG2000 или DPPE-PEG5000.
7. Водная суспензия по п.6, где пальмитиновая кислота представлена в молярном количестве от 5% до 20%.
8. Водная суспензия по любому из предшествующих пунктов, где пептид конъюгирован с фосфолипидом с образованием липопептида.
9. Водная суспензия по п.8, где указанный липопептид представлен в молярном количестве от 0,1% до 5% в молярном отношении по отношению к другим компонентам микровезикул.
10. Водная суспензия по любому из предшествующих пунктов, где указанный нацеливающий лиганд представляет собой липопептид формулы II:

11. Водная суспензия по любому из предшествующих пунктов, где указанные наполненные газом микровезикулы содержат фторированный физиологически приемлемый газ.
12. Водная суспензия по п.1, где концентрация гистидина в суспензии составляет от 2,5 мМ до 10 мМ.
13. Фармацевтический набор, содержащий:
(a) первый контейнер, содержащий физиологически приемлемый газ в контакте с лиофилизированным составом, содержащим (i) фосфолипид, (ii) нацеливающий лиганд, содержащий аминокислотную последовательность, выбранную из SEQ ID NO. 01, SEQ ID NO. 02, или их комбинацию, и (iii) гистидин, где количество гистидина является таким, что концентрация гистидина в восстановленной водной суспензии наполненных газом микровезикул составляет от 1,5 мМ до 20 мМ; и
(b) второй контейнер, содержащий физиологически приемлемый раствор, содержащий глюкозу, для восстановления лиофилизированного состава в суспензию наполненных газом микровезикул.
14. Фармацевтический набор по п.13, где указанный нацеливающий лиганд находится в виде димерного пептида, содержащего комбинацию SEQ ID NO. 01 и SEQ ID NO. 02.
15. Фармацевтический набор по п.13, где количество гистидина является таким, что концентрация гистидина в восстановленной водной суспензии наполненных газом микровезикул составляет от 2,5 мМ до 10 мМ.
16. Способ визуализации представляющей интерес области, которая предположительно содержит ткань, экпрессирующую рецепторы, содержащие домен киназы (KDR), у субъекта, которому было предварительно введено эффективное количество суспензии наполненных газом микровезикул по любому из пп.1-12, который включает ультразвуковое облучение указанной представляющей интерес области и сбор соответствующих эхо-сигналов из указанной представляющей интерес области.
| US 20080107607, 08.05.2008 | |||
| КОНЪЮГАТЫ ФОСФОЛИПИДОВ И НАПРАВЛЯЮЩИХ ВЕКТОРНЫХ МОЛЕКУЛ | 2006 |
|
RU2433137C2 |
| US 2013156706 A1, 20.06.2013 | |||
| ВЫСУШЕННЫЕ ВОССТАНОВЛЕННЫЕ ВЕЗИКУЛЫ ДЛЯ ФАРМАЦЕВТИЧЕСКОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2443412C2 |
Авторы
Даты
2020-07-06—Публикация
2015-12-17—Подача