Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к лечению кровоизлияний и заживлению ран у субъекта с использованием прокоагулянта на основе тканевого фактора. Более конкретно, изобретение относится к несущей тканевой фактор (TF) микровезикуле (несущей TF микровезикуле), содержащей мембрану из эукариотической клетки в форме микровезикулы, белок тканевого фактора и отрицательно заряженный фосфолипид (NCP), а также к ее применениям в качестве прокоагулянта, полезного при лечении кровоизлияний у субъекта, а также для усиления ангиогенеза и миграции клеток. Изобретение дополнительно относится к способам получения указанных несущих TF микровезикул.
Предпосылки создания изобретения
Гемостаз представляет собой механизм, посредством которого живые организмы отвечают на кровоизлияние, и включает участие двух процессов, которые запускаются непосредственно после поражения и остаются активными в течение длительного периода времени. Первый из них известен как первичный гемостаз и характеризуется возникновением вазоконстрикции на месте поражения сосуда c образованием агрегата тромбоцитов. Второй из них известен как вторичный гемостаз, являясь фазой, в которой образуется фибриновый сгусток вследствие действия различных протеолитических ферментов коагуляционного каскада крови.
Во второй фазе процесса коагуляции крови участвуют несколько кофакторов и протеолитических ферментов, называемых факторами коагуляции, и она составляют несколько стадий, оканчивающихся образованием фибрина после гидролиза фибриногена в результате действия тромбина. Тромбин перед этим образуется в результате протеолитического гидролиза его апофермента, протромбина. Данный протеолиз осуществляется активированным фактором коагуляции Х (FXa), который связывается с поверхностью активированных тромбоцитов и только в присутствии своего кофактора, активированного фактора коагуляции V (FVa), и ионов кальция способен гидролизовать протромбин. Активация фактора коагуляции X (FX) может происходить двумя отдельными путями, внутренним и внешним.
Внутренний путь состоит из серий реакций, на которых каждый профермент гидролизуется, давая в результате свою активную форму протеазы. На каждой стадии только что активированный протеолитический фермент будет катализировать активацию следующего профермента с последовательным образованием активных форм.
Во внешнем пути коагуляции крови тканевой фактор, экспонированный на адвентициальных клетках в месте поражения, связывается с находящимся в кровотоке фактором VII/активированным фактором коагуляции VII (FVII/FVIIa), образуя комплекс TF::FVIIa и в присутствии кальция действуя в качестве субстрата, так что происходит активация FX. В настоящее время внешний путь считается наиболее значимым путем в коагуляции крови, и признано, что в случае кровоизлияния, образуемого поражением сосуда, свертывание крови запускается вследствие активации внешнего пути, включающего взаимодействие TF с его лигандом, FVII/FVIIa.
Широко признано, что TF является главным элементом, отвечающим за скорость инициации коагуляции крови, и он необходим для активации FX, который, в свою очередь, начинает гидролизовать протромбин.
Опубликована очистка TF из различных тканей, таких как: мозг человека, мозг крупного рогатого скота; плацента человека; мозг овцы; и легкие. Широко признано, что структура белка TF различается между биологическими видами, между ними не наблюдается функциональных отличий, измеряемых методами анализа коагуляции крови in vitro.
Общепризнанно, что для проявления биологической активности TF должен быть ассоциирован с фосфолипидами in vitro. Было показано, что удаление фосфолипидного компонента TF, например, с помощью фосфолипазы, приводит к потере его биологической активности in vitro.
В WO 2008080989 описаны полученные из дрожжей микровезикулы, несущие тканевой фактор, которые содержат дрожжевую мембрану и белок тканевого фактора, и их применение в качестве прокоагулянтов при лечении кровоизлияний у субъекта.
В WO 2006004675 описана экспрессия тканевого фактора в растительных клетках, неочищенные экстракты, полученные из растений, экспрессирующих TF, и искусственные везикулы, содержащие рекомбинантный TF, полученный из растительных клеток.
В EP 19359021 описана экспрессия тканевого фактора в клетках насекомых, а также релипидированный TF, который включает рекомбинантный TF (rTF), экспрессированный в клетках насекомых.
Однако в данной области необходимы дополнительные прокоагулянтные средства на основе TF.
Краткое изложение сущности изобретения
В первом аспекте изобретение относится к способу получения несущей TF микровезикулы, обладающей прокоагулянтной активностью, включающему:
(i) экспрессию TF или его варианта, обладающего прокоагулянтной активностью в эукариотической клетке,
(ii) выделение несущих TF микровезикул из клеток со стадии (i), и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения указанного фосфолипида в указанные везикулы.
Во втором аспекте изобретение относится к способу получения несущей TF микровезикулы, обладающей прокоагулянтной активностью, включающему:
(i) предоставление липидных микровезикул, полученных из эукариотической клетки,
(ii) приведение в контакт TF или его варианта, обладающего прокоагулянтной активностью, с липидными микровезикулами, как определено в (i), в условиях, подходящих для включения указанного белка TF или его варианта в указанные микровезикулы, и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения указанных фосфолипидов в указанную везикулу,
где стадии (ii) и (iii) можно проводить в любом порядке.
В другом аспекте изобретение относится к несущей TF микровезикуле, полученной с использованием способа настоящего изобретения.
В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей несущую TF микровезикулу настоящего изобретения и фармацевтически приемлемый наполнитель.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей:
(i) микровезикулу, полученную способом, включающим стадии:
а) экспрессии TF или его функционально эквивалентного варианта, обладающего прокоагулянтной активностью, в эукариотической клетке, и
b) выделения несущих TF микровезикул из клеток со стадии (а),
(ii) по меньшей мере стимулятор коагуляции, и
(iii) фармацевтически эффективный наполнитель.
В другом аспекте изобретение относится к несущей TF микровезикуле настоящего изобретения или к фармацевтической композиции настоящего изобретения для применения в качестве лекарственного средства.
В другом аспекте изобретение относится к несущей TF микровезикуле настоящего изобретения или к фармацевтической композиции настоящего изобретения для применения в лечении кровоизлияния, для стимуляции заживления ран или для лечения связанного с ангиогенезом заболевания.
В другом аспекте изобретение относится к применению несущей TF микровезикулы настоящего изобретения для определения протромбинового времени в образце.
В другом аспекте изобретение относится к набору для определения фактора антикоагулянтной терапии, содержащему микровезикулу настоящего изобретения.
Краткое описание фигур
Фиг.1. Экспрессия rTF с использованием экстрактов TT-173. Вестерн-блот анализ экстрактов из очищенных TT-173 (ретентат при фильтрации через мембрану с размером пор 0,1 мкм (MFR 0,1)) после четырех независимых фильтраций в тангенциальном потоке. Блот окрашивали очищенными мышиными антителами к TF человека (BD Biosciences Pharmingen). Маркеры молекулярной массы в кДа показаны на левой стороне фигуры.
Фиг.2. Прокоагулянтная активность ТТ-173 после инкубации с фосфатидилсерином (PS). (А) для испытания эффекта PS на биологическую активность TT-173, PS (0,1 мМ) добавляли к TT-173 (1 мл) и смешанный раствор выдерживали при комнатной температуре в течение эксперимента при комнатной температуре (R/T). В различные временные точки, указанные на фигуре, одну аликвоту смеси (10 мкл) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра (Stago). Эксперимент прекращали через 300 секунд (объединенная плазма от 5 доноров). (В) Результаты, полученные, как описано в (А), также представлены в Ед/мл. Единицу определяли как количество TT-173, требуемое для свертывания нормальной объединенной плазмы за 30 секунд в стандартном коагулометрическом анализе (130 мкл плазмы, 20 мкл хлорида кальция (100 мМ) и 10 мкл продукта).
Фиг.3. Прокоагулянтная активность ТТ-173 или липидированного rTF после инкубации с различными концентрациями PS. Для испытания эффекта PS на биологическую активность либо TT-173, либо релипидированного rTF, PS (в концентрациях, указанных на фигуре) добавляли либо к TT-173 (1 мл), либо к релипидированному rTF. Оба смешанных раствора выдерживали при комнатной температуре на 2 часа. После этого времени одну аликвоту каждой смеси (10 мкл) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра (Stago). Эксперимент прекращали через 300 секунд (объединенная плазма от 5 доноров). Полученные результаты представлены в Ед/мл.
Фиг.4. Прокоагулянтная активность rTF после заключения в подходящие фосфолипидные везикулы. Коммерческий очищенный rTF релипидировали в везикулы, содержащие фосфатидилхолин/фосфатидилсерин (PC/PS), следуя стандартному способу, описанному Mimms et al. (Biochemistry 20, 833. 1981). Кратко, 100 нг rTF (American Diagnostica Inc. Stanford, CT, USA) инкубировали с: PC/PS (Sigma Aldrich Inc, Saint Louis, MO, USA) в указанных соотношениях PC:PS (100:0, 95:5, 90:10, 80:20, 70:30) (конечная концентрация - 2,6 мМ) и детергентом (N-октил-β-D-галактопиранозидом, конечная концентрация - 40 мМ). Смесь гомогенизировали и интенсивно диализовали (в течение 48 ч с несколькими сменами буфера). В результате этой процедуры происходило медленное удаление детергента и спонтанное образование липидных мицелл, содержащих rTF. После процедуры релипидации содержащие rTF мицеллы тестировали на их прокоагулянтную активность (темные столбики). Параллельно, различные содержащие rTF мицеллы инкубировали в течение 2 ч с PS с конечной концентрацией 0,1 мМ. После этого времени, мицеллы, содержащие избыток PS, также тестировали на их прокоагулянтную активность. Коагулометрические анализы проводили, как описано ниже: аликвоты (10 мкл) релипидированного rTF с везикулами PC/PS добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра (Diagnostica Stago, Inc. NJ, USA).
Фиг.5. Эффект добавления PS к различным содержащим rTF везикулам. При 4°С приготавливали по две аликвоты (2 мл каждая) либо из: i) релипидированного rTF при соотношении концентраций PC:PS-80:20; ii) релипидированного rTF при соотношении концентраций PC:PS-70:30; или iii) везикул TT-173, выделенных из рекомбинантных дрожжей, экспрессирующих TF. К одной аликвоте каждой из содержащих rTF везикул добавляли PS до концентрации 0,1 мМ и инкубировали при R/T в течение 2 ч. В течение этого времени другую аликвоту выдерживали при 4°C. После этого обе аликвоты для каждого варианта содержащих rTF везикул тестировали на прокоагулянтную активность, как описано в описании к фиг.1.
Фиг.6. Прокоагулянтная активность релипидированного rTF после инкубации с PS и различными концентрациями TT-100. Аликвоты (10 мкл) релипидированного rTF (0,3 мкг/мл), инкубированные в течение 2 ч с PS (0,1 мМ) и различными концентрациями TT-100 (0, 0,03, 0,1, 0,3 и 0,36 мг/мл), добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра.
Фиг.7. Амидолитическая активность FVIIa. Для количественной оценки ферментативной активности каталитического комплекса TF:FVIIa проводили стандартный хромогенный анализ с использованием субстрата S-2238. Активность TF:FVIIa измеряли по разнице в поглощении (оптической плотности) между субстратом S-2238 и полученным продуктом процессинга п-нитроаналином (pNA). Скорость образования pNA пропорциональна ферментативной активности, и ее удобно определять с помощью фотометра. В этом эксперименте различные концентрации TT-173, содержащие или не содержащие PS, тестировали на их способность взаимодействовать с FVIIa и в присутствии S-2238 продуцировать детектируемый pNA.
Фиг.8. Свертывающая активность ТТ-173 в цельной крови и эффект PS. Была тестирована способность ТТ-173, содержащего или не содержащего PS (0,1 мМ), коагулировать образцы здоровой плазмы и цельной крови. (А) Аликвоты (10 мкл) ТТ-173 и ТТ-173, инкубированного в течение 2 ч с PS (конечная концентрация 0,1 мМ), добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (Объединенная плазма от 5 доноров). (В) Аликвоты (200 мкл) ТТ-173 или TT-173+PS (0,1 мМ), содержащие количество rTF, указанное на фигуре, добавляли к аликвотам (800 мкл) крови, недавно полученной от здоровых доноров. Время коагуляции измеряли с помощью хронометра от начала забора крови до появления стабильного и хорошо затвердевшего сгустка крови. N=3.
Фиг.9. Предполагаемый механизм действия ТТ-173.
Фиг.10. Свертывающая активность ТТ-173 в плазме, в которой отсутствуют факторы коагуляции VIII, IX или XI. (A) Аликвоты (10 мкл) ТТ-173 или TT-173+PS (0,1 мМ) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, обедненной тромбоцитами, сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (Объединенная плазма от 5 доноров). (В) Аналогичные аликвоты (10 мкл), как описано в (А), добавляли в нагретые кюветы, содержащие 130 мкл плазмы с удаленными факторами VIII, IX или XI. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (N=3).
Фиг.11. Свертывающая активность ТТ-173 в плазме, в которой отсутствуют факторы коагуляции V или VII. Аликвоты (10 мкл) ТТ-173 или TT-173+PS (0,1 мМ) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, с удаленными факторами V или VII. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (N=3).
Фиг.12. Свертывающая активность ТТ-173 в плазме пациентов, получающих варфарин. Аликвоты (10 мкл) ТТ-173 или TT-173+PS (0,1 мМ) добавляли в нагретые кюветы, содержащие 130 мкл нормальной плазмы, с удаленными факторами V или VII. Сразу добавляли 20 мкл хлорида кальция (100 мМ), и время коагуляции (в секундах) определяли с помощью коагулометра. (N=3).
Фиг.13. Эффект восстановления TT-173 на его прокоагулянтную активность. При разрушении везикул ТТ-173 с добавлением или без PS в результате действия детергента, который можно удалить диализом, и последующего восстановления in vitro с помощью диализа, терялось приблизительно 50% исходной активности (панель А). Однако при проведении аналогичного эксперимента с использованием везикул с релипидированным rTF не наблюдалось заметной разницы до и после диализа (панель В).
Фиг.14. Эффект добавления PS к различным содержащим rTF везикулам. При 4°С приготавливали по две аликвоты (2 мл каждая) либо из: i) релипидированного rTF при соотношении концентраций PC:PS-80:20; ii) релипидированного rTF при соотношении концентраций PC:PS-70:30; iii) везикул TT-173, выделенных из рекомбинантных дрожжей, экспрессирующих TF, или iv) везикул TT-173, выделенных из клеток насекомых, инфицированных экспрессирующими рекомбинантными бакуловирусами. К одной аликвоте каждой из содержащих rTF везикул добавляли PS до концентрации 0,1 мМ и инкубировали при R/T в течение 2 ч. В течение этого времени другую аликвоту выдерживали при 4°C. После этого обе аликвоты для каждого варианта содержащих rTF везикул тестировали на прокоагулянтную активность, как описано в описании к фиг.1.
Фиг.15. Добавление PS придает стабильность везикулам ТТ-173. В данном исследовании использовали по четыре аликвоты (по 10 мл каждая) из трех независимых партий ТТ-173. Две аликвоты из каждой партии инкубировали с PS (0,1 мМ) при R/T в течение двух часов, и остальные выдерживали при 4°C. После этого по 10 мкл для каждого из двенадцати образцов ТТ-173 использовали для определения свертывающей активности (время 0), следуя методике, описанной в описании к фиг.1. Сразу после этого, половину аликвот (3 аликвоты TT-173-PS и 3 аликвоты TT-173+PS, каждая из которых соответствовала одному из трех лотов) выдерживали при 4°C на протяжении эксперимента на стабильность, и остальные (3 аликвоты TT-173-PS и 3 аликвоты TT-173+PS) выдерживали при 20°C. В указанных на фигурах временных точках использовали по 10 мкл из каждой аликвоты для определения свертывающей активности либо в аликвотах, выдержанных при 4°C (A), либо при 20°C (B). Результаты представлены на графике со стандартным отклонением. Также показаны средние значения минимальной стабильности для различных партий при 4°C (C) и при 20°C (D).
Фиг.16. Добавление FVII, FVIIa, FX и FXa усиливает прокоагулянтный эффект ТТ-173. Различные концентрации FVII (20 нМ и 60 нМ), FVIIa (20 нМ и 60 нМ), FX (1000 нМ и 3000 нМ) и FXa (1000 нМ) добавляли к TT-173+PS 0,1 (мМ). Аликвоты смесей TT-173+PS 0,1 (мМ)/FVII, TT-173+PS 0,1 (мМ)/FVIIa, TT-173+PS 0,1 (мМ)/FX и TT-173+PS 0,1(мМ)/FXa проверяли на свертывающую активность в стандартном коагулометрическом анализе с конечной концентрацией TF в плазме, составляющей 45 нг/мл. Как показано, добавление FVII, FVIIa и FX сокращает время свертывания крови приблизительно на 2 с, и добавление FXa уменьшает время свертывания крови приблизительно на 7 с.
Подробное описание изобретения
Авторы изобретения обнаружили, что добавление дополнительного фосфатидилсерина (PS) в отсутствие детергентов к несущим TF микровезикулам, полученным из дрожжевых клеток и уже содержащим PS, неожиданно приводит к улучшению прокоагулянтных свойств указанных везикул, а также к повышению стабильности указанных везикул. Улучшение прокоагулянтных свойств можно наблюдать, например, в экспериментах, приведенных в примерах 2 и 3 настоящего изобретения, где ясно показано, что добавление фосфатидилсерина к полученным из дрожжей микровезикулам, содержащим TF, дает везикулы, имеющие улучшенные прокоагулянтные свойства (меньшее время свертывания крови) относительно везикул, которые не вступали в контакт с фосфолипидом (см., например, фиг.2 и таблицу 2). Без привязки к какой-либо теории, предполагают, что PS взаимодействует с несущими TF микровезикулами, что приводит к увеличению способности везикул захватывать плазматические факторы, вовлеченные в образование комплексов как протромбиназы, так и протеазы фактора X, что, в свою очередь, приводит к увеличению продукции тромбина. Увеличенная стабильность везикул показана, например, в примере 4 настоящего изобретения, где показано, что везикулы, предварительно обработанные PS, имеют повышенную стабильность как при 20°C, так и при 4°C.
Первый способ настоящего изобретения
В первом аспекте изобретение относится к способу (далее первому способу настоящего изобретения) получения несущей TF микровезикулы, обладающей прокоагулянтной активностью, который включает:
(i) экспрессию TF или его варианта, обладающего прокоагулянтной активностью, в эукариотической клетке,
(ii) выделение несущих TF микровезикул из клеток со стадии (i), и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом (NCP) в условиях, подходящих для включения указанного фосфолипида в указанные микровезикулы.
Используемый в настоящем описании термин «несущая TF микровезикула» относится к любой липидной микровезикуле, которая содержит TF, встроенный в указанную липидную микровезикулу, и которая получена из эукариотической клетки. Липидная микровезикула относится к малой и замкнутой камере, которая по существу состоит из липидных моно и бислоев. Размер несущей TF микровезикулы настоящего изобретения может варьировать в относительно широких пределах, обычно, указанный размер равен или меньше 10 мкм, обычно, равен или меньше 0,5 мкм. В конкретном варианте осуществления размер полученных из дрожжей несущих TF микровезикул настоящего изобретения варьирует в диапазоне от 10 до 0,01 мкм.
Микровезикулы образованы липидными мембранами или их фрагментами из эукариотических клеток. Мембрана относится, в основном, к организованному слою толщиной в несколько молекул (липидов и белков), образующему границу клетки (а именно, клеточной или плазматической мембране) или границы внутриклеточных органелл. Как правило, мембрана состоит из двух направленных липидных слоев (например, липидного бислоя), в которые могут быть включены белки. Липидный бислой, который представляет собой основную структуру мембран клетки, обычно образован амфипатическими молекулами (например, фосфолипидами, жирными кислотами и т.д.) в водном окружении, причем каждая молекула ориентирована гидрофильной группой в направлении внешней стороны слоя, и гидрофобной группой вовнутрь слоя.
На первой стадии первый способ настоящего изобретения включает экспрессию TF или его варианта, обладающего прокоагулянтной активностью, в эукариотической клетке.
В качестве «аукариотической клетки» в настоящем изобретении приведены любые клетки, которые содержат комплексные структуры, заключенные в мембраны, как, например, ядро. Примерами эукариотических клеток, которые можно использовать в первом способе настоящего изобретения, являются клетки грибов, дрожжевые клетки, растительные клетки и животные клетки (как, например, клетки млекопитающих, клетки рыб, клетки рептилий, клетки насекомых и т.д.).
В контексте настоящего изобретения термин «дрожжевые клетки» включает любые аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, относящиеся к Fungi imperfecti (Blastomycetes). Поскольку в будущем классификация дрожжей может измениться, в целях настоящего изобретения дрожжи должны быть определены, как описано в Skinner, F. et al, (Biology and Activities of Yeast, Soc. App. Bacteriol. Symp. Series No. 9). Подходящие штаммы дрожжей включают, но без ограничения, любые виды Торула, пекарских дрожжей, пивных дрожжей, виды Saccharomyces, такие как S. cerevisiae, виды Schizosaccharomyces, виды Pichia, такие как Pichia pastoris, виды Candida, виды Hansenula, такие как Hansenula polymorpha, и виды Klyuveromyces, такие как Klyuveromyces lactis, а также различные штаммы вышеуказанных видов дрожжей, такие как штамм S. cerevisiae T73. Также можно использовать смесь любых указанных видов и штаммов.
В контексте настоящего изобретения термин «растительные клетки» включает клетки растений, включая, но без ограничения, водоросли, однодольные, двудольные и, особенно, зерновые (например, кукурузу, рис, овес и т.д.), бобовые (например, сою и т.д.), крестоцветные (например, Arabidopsis thaliana, рапс и т.д.) или пасленовые (например, картофель, томат, табак и т.д.). Клетки растений включают суспензионные культуры, зародыши, меристемные ткани, каллусные ткани, листья, корни, побеги, гаметофиты, спорофиты, пыльцу, семена и микроспоры. Специалисту в данной области будет понятно, что клетка растения может представлять собой часть растения или целое растение, на которое ссылаются как на «систему растения-хозяина». «Система растения-хозяина» или выделенные клетки растения могут находиться на различных стадиях зрелости. Система растения-хозяина также относится к любому клону такого растения, семени, потомству, полученному самоопылением, или гибридному потомству, используемому для размножения части растения, полученной либо половым путем, либо бесполым, и потомкам любого из них, таким как черенки или семена.
Используемый в настоящем описании термин «животные клетки» включает любую клетку животного. Животные клетки включают клетки млекопитающих, клетки рыб, клетки рептилий, клетки насекомых и т.д. Животные клетки могут быть получены из любой ткани животного (первичные культуры клеток) или могут представлять собой иммортализованные клетки. Иммортализованные клетки могут быть получены из опухолевых тканей или они могут быть иммортализованы с использованием методик, известных специалисту в данной области, например, заражением вирусами (например, EP1212420), или представлять собой результат слияния нормальных клеток с иммортализованной клеточной линией.
Клетки насекомых включают, но без ограничения, клетки Sf9, клетки SF21, клетки SF+, клетки Hi-Five или клетки личинок насекомых.
Млекопитающие, из которых можно получить клетки, включают крыс, мышей, обезьян, человека и т.д. Клетки млекопитающих, подходящие для настоящего изобретения, включают линии клеток эпителия, линии клеток остеосаркомы, линии клеток нейробластомы, карциномы эпителия, глиальные клетки, линии клеток печени, клетки СНО (яичника китайского хомячка), клетки COS, клетки BHK, клетки HeLa, клетки 911, клетки AT1080, клетки A549, клетки 293 или клетки PER.C6, клетки ECC NTERA-2 человека, клетки D3 линии mESC, эмбриональные стволовые клетки человека, такие как HS293 и BGV01, SHEF1, SHEF2 и HS181, клетки NIH3T3, клетки 293T, клетки REH и клетки MCF-7, а также клетки hMSC.
Термин «тканевой фактор», или «TF», также известный как «тромбопластин», «тромбоцитарный тканевой фактор», «CD 142» или «фактор свертывания III» в контексте настоящего изобретения относится к встроенному в мембрану гликопротеину, широко распространенному в животном мире, который встречается в субэндотелиальной ткани, тромбоцитах и лейкоцитах, и необходим для инициации образования тромбина из зимогена протромбина. Полипептиды TF, подходящие для применения в настоящем изобретении, включают природный TF (или дикого типа (wt)) из любого вида животных, включая человека. Примеры белков TF, которые можно использовать в настоящем изобретении, включают TF человека (номер доступа в базе данных UniProtKB P13726), TF мыши (номер доступа в базе данных UniProtKB P20352), TF крысы (номер доступа в базе данных UniProtKB P42533), TF свиньи (номер доступа в базе данных NCBI Prot NP_998950), бычий TF (номер доступа в базе данных NCBI Prot AAB20755), TF собаки (номер доступа в базе данных NCBI Prot BAD98568), TF морской свинки (номер доступа в базе данных NCBI Prot AAF36523) и белки TF из других организмов.
Поскольку природный TF содержит несколько сайтов гликозилирования, можно получить варианты TF с различной степенью гликозилирования в результате экспрессии TF в хозяевах, способных проводить реакции N-гликозилирования. Зрелый TF содержит три потенциальных сайта N-гликозилирования, имеющих консенсусную последовательность Asn-Xaa-Ser/Thr, расположенную в положениях Asn11 (последовательность Asn11-Leu12-Thr13), Asn124 (последовательность Asn124-Val125-Thr126) и Asn137 (последовательность Asn137-Asn138-Thr139). Таким образом, молекулы TF для использования в настоящем изобретении включают варианты TF, имеющие различную степень N-гликозилирования по одному или нескольким сайтам N-гликозилирования. В дрожжах гликозилирование, как правило, включает внутреннее ядро примерно из десяти остатков маннозы, соединенных с аспарагином через два остатка GlcNAc, и разветвленную внешнюю цепь примерно из 50-100 остатков маннозы. Поэтому, N-гликозилирование сможет потенциально добавлять до 300 остатков маннозы к TF, увеличивая молекулярную массу примерно на 60 кДа. Кроме того, также возможно, что несколько остатков маннозы могут быть присоединены к различным (более 25) сайтам О-гликозилирования. В конкретном варианте осуществления несущая TF микровезикула, полученная из дрожжей, содержит гликозилированный белок TF. Используемый в настоящем описании термин «гликозилированный» включает любую степень гликозилирования.
Термин «вариант TF, обладающий прокоагулянтной активностью» относится к соединениям, демонстрирующим по существу такую же биологическую активность (биологические активности), как TF, и являющимся результатом вставки, делеции или замены одного или более аминокислотных остатков. Подходящими функциональными методами анализа, которые можно использовать для оценки того, является ли данный полипептид функционально эквивалентным вариантом TF, являются методы анализа, основанные на определении способности варианта TF специфично связывать FVIIa, или основанные на in vitro определении времени коагуляции плазмы или цельной крови, или осуществляемые анализом in vivo на животной модели острого кровотечения или анализом in vivo на животной модели кровотечения с летальным исходом. Методики проведения этих анализов описаны в предшествующем уровне техники и обобщены в примерах настоящего изобретения (раздел «Способы»), а также в заявке WO 2008080989.
Варианты согласно настоящему изобретению включают аминокислотные последовательности, которые по меньшей мере на 60%, 70%, 80%, 90%, 95% или 96% аналогичны или идентичны природным молекулам TF, указанным выше. Как известно в данной области, «аналогию» между двумя белками определяют сравнением аминокислотной последовательности и ее консервативных аминокислотных замен одного белка с последовательностью второго белка. Степень идентичности между двумя белками определяют, используя компьютерные алгоритмы и способы, широко известные специалистам в данной области. Идентичность между двумя аминокислотными последовательностями предпочтительно определяют с использованием алгоритма BLASTP [BLASTManual, Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894, Altschul, S., et al., J. Mol. Biol. 215: 403-410 (1990)].
Белок TF имеет явно выраженную доменную структуру, которая включает (1) сигнальный пептид или область с 32-аминокислотной лидерной последовательностью, которая пост-трансляционно отщепляется в ходе процессинга белка из незрелой в зрелую форму; (2) N-гликозилированный гидрофильный внеклеточный домен, содержащий примерно 219 концевых аминокислот; (3) фрагмент примерно из 23 аминокислот, в основном, гидрофобных, которые, как полагают, образуют трансмембранный домен; и (4) 21-аминокислотный карбоксильный конец, которые, как полагают, представляют собой аминокислоты, образующие часть цитоплазматического фрагмента белка. Доменная структура белка hTF дает возможность продуцирования, например, внеклеточного домена белка или его функциональных фрагментов.
В конкретном варианте осуществления фрагмент TF, обладающий прокоагулянтной активностью, содержит зрелый белок TF. Термин «зрелый TF» в контексте настоящего описания относится к белку TF, в чьей аминокислотной последовательности отсутствует сигнальный пептид. В предпочтительном варианте осуществления указанный зрелый белок TF содержит зрелый белок TF человека. Кроме того, в конкретном варианте осуществления указанный зрелый белок TF имеет аминокислотную последовательность, приведенную в SEQ ID NO:1.
Фрагмент белка TF, обладающий прокоагулянтной активностью, может быть гликозилированным, частично гликозилированным или негликозилированным. Таким образом, в конкретном варианте осуществления несущая TF липидная микровезикула настоящего изобретения содержит негликозилированный фрагмент белка TF, обладающий прокоагулянтной активностью, в то время как в другом конкретном варианте осуществления указанная полученная из дрожжей несущая TF микровезикула настоящего изобретения содержит гликозилированный фрагмент белка TF, обладающий прокоагулянтной активностью. Как указано выше, термин «гликозилированный» включает любую степень гликозилирования. В предпочтительном варианте осуществления TF или его функциональный вариант, обладающий прокоагулянтной активностью, содержит по меньшей мере один нефункциональный сайт N-гликозилирования.
В предпочтительном варианте осуществления сайтом или сайтами N-гликозилирования являются соответствующие сайтам N-гликозилирования NLT в положении 11-13, NVT в положении 124-126 или NNT в положении 137-139 в зрелом TF человека. В более предпочтительном варианте осуществления TF несет одну или более замен остатков Asn остатками, которые не являются акцепторами N-гликозилирования. В еще более предпочтительном варианте осуществления вариант TF одержит одну или более мутаций Asn→Ala по остаткам Asn в положениях, соответствующих положениям 11, 124 или 137 в зрелом TF человека.
Гликозилирование может варьировать в зависимости от системы экспрессии, используемой для получения несущих TF липидных везикул. Поэтому, изобретение относится к рекомбинантному белку тканевого фактора млекопитающих, который включает по меньшей мере один специфичный для растений гликан, специфичный для дрожжей гликан или специфичный для животных гликан.
В дополнение, как и в случае белка TF, используемый для осуществления настоящего изобретения фрагмент белка TF, обладающий прокоагулянтной активностью, может входить в слитый белок, причем указанный слитый белок включает первую область, содержащую указанный фрагмент белка TF, обладающий прокоагулянтной активностью, связанную со второй областью, содержащей другой пептид или белок. Указанная вторая область может быть связана с амино-концевой областью указанного фрагмента белка TF или, альтернативно, указанная вторая область может быть связана с карбокси-концевой областью указанного фрагмента белка TF. Как первая, так и вторая области могут быть соединены напрямую или соединены через линкерный полипептид между указанными первой и второй областями.
В конкретном варианте осуществления указанный слитый белок содержит фрагмент белка TF, обладающий прокоагулянтной активностью, и tag, соединенный с С-коцевым или N-концевым доменом указанного фрагмента белка TF. Указанный tag обычно является пептидом или аминокислотной последовательностью, которые можно использовать при выделении или очистке указанного слитого белка. Иллюстративные неограничивающие примеры tag, подходящих для получения данного слитого белка, включают указанные выше в связи со слитым белком, причем первой областью являлся белок TF. В конкретном варианте осуществления указанный tag представляет собой His-tag, соединенный с С-концевым доменом указанного белка TF или его фрагментом, обладающим прокоагулянтной активностью. В другом варианте осуществления указанный tag представляет собой His-tag, соединенный с N-концевым доменом указанного белка TF или его фрагментом, обладающим прокоагулянтной активностью. В конкретном варианте осуществления слитый белок включает зрелый белок TF, предпочтительно, зрелый белок TF человека. Данный слитый белок также обладает прокоагулянтной активностью, причем его прокоагулянтную активность можно проанализировать описанным выше методом, например, с помощью любого из анализов коагуляции крови, указанных в примере 2.
В дополнение, белок TF может быть представлен в виде части слитого белка, причем указанный слитый белок включает первую область, содержащую белок TF, соединенную со второй областью, содержащей другой пептид или белок. Указанная вторая область может быть связана с аминоконцевой областью указанного белка TF или, альтернативно, указанная вторая область может быть связана с карбокси-концевой областью указанного белка TF. Как первая, так и вторая области могут быть связаны напрямую или соединены через линкерный полипептид между указанным первой и второй областями.
В конкретном варианте осуществления указанный слитый белок включает белок TF и tag, обычно, пептидный tag, связанный с С-концевым или N-концевым доменом указанного белка TF. Указанный tag обычно представляет собой пептид или аминокислотную последовательность, которые можно использовать при выделении или очистке указанного слитого белка. Таким образом, указанный tag способен с высокой аффинностью связывать один или несколько лигандов, таких как, например, один или более лигандов аффинного матрикса, такого как хроматографическая подложка или шарики. Примером указанного tag является гистидиновый tag (His-tag или HT), такой как tag, включающий 6 остатков гистидина (His6 или H6), который может связываться с никелевой (Ni2+) или кобальтовой (Co2+) колонкой с высокой аффинностью. His-tag, как показано в примере 1 (фиг.4), обладает искомым признаком, поскольку он может связываться со своими лигандами в условиях, денатурирующих для большинства белков и разрушительных для большинства белок-белковых взаимодействий. Поэтому, его можно использовать для удаления «белка-наживки» с присоединенным tag Н6 после разрушения белок-белковых взаимодействий, в которых участвует «белок-наживка».
Дополнительные иллюстративные неограничивающие примеры tag, пригодных для выделения или очистки слитого белка, включают Arg-tag, FLAG-tag, Strep-tag, эпитоп, распознаваемый антителом, такой как c-myc-tag (распознаваемый анти-c-myc антителом), SBP-tag, S-tag, кальмодулин-связывающий пептид, целлюлоза-связывающий домен, хитин-связывающий домен, глутатион-S-трансферазный tag, мальтоза-связывающий белок, NusA, TrxA, DsbA, Avi-tag и т.д. (Terpe K., Appl. Microbiol. Biotechnol. (2003), 60: 523-525), аминокислотную последовательность, такую как Ala-His-Gly-His-Arg-Pro (SEQ ID NO:2); Pro-Ile-His-Asp-His-Asp-His-Pro-His-Leu-Val-Ile-His-Ser (SEQ ID NO:3); Gly-Met-Thr-Cys-X-X-Cys (SEQ ID NO:4); β-галактозидазу и т.п.
В конкретном варианте осуществления указанный tag представляет собой His-tag, связанный с С-концевым доменом указанного белка TF. В другом варианте осуществления указанный tag представляет собой His-tag, связанный с N-концевым доменом указанного белка TF.
В конкретном варианте осуществления слитый белок включает TF человека, у которого отсутствует сигнальная последовательность, или его вариант, обладающий прокоагулянтной активностью, который имеет мутацию N124A в сайте гликозилирования и гексагистидиновый tag на С-конце и представленный (SEQ ID NO:5).
Указанный слитый белок можно получить общепринятыми методами, например, путем экспрессии нуклеотидной последовательности, кодирующей указанный слитый белок, в подходящей дрожжевой клетке. При желании, можно использовать tag для выделения или очистки указанного слитого белка.
В другом конкретном варианте осуществления первая стадия первого способа настоящего изобретения включает экспрессию в эукариотической клетке фрагмента TF, обладающего прокоагулянтной активностью.
Согласно изобретению участок указанного белка TF или его фрагмент, обладающий прокоагулянтной активностью, встроен в указанную липидную мембрану. Обычно, указанный участок включает липофильную область указанного белка или фрагмента (например, центральный домен TF), тогда как его гидрофильные области (то есть, аминоконцевая область и карбокси-концевая область указанного белка TF) обращены к экзоплазматической или эндоплазматической стороне мембраны. Информацию о липофильных и гидрофильных областях белка TF можно получить из WO 2008080989. В конкретном варианте осуществления N-концевой домен белка TF или его фрагмента, обладающего прокоагулянтной активностью, обращен к экзоплазматической стороне указанной мембраны, тогда как в другом конкретном варианте осуществления N-концевой домен белка TF или его фрагмента, обладающего прокоагулянтной активностью, обращен к эндоплазматической стороне указанной мембраны.
Способ экспрессии TF или его варианта зависит от используемой эукариотической клетки. В общем, эукариотическую клетку трансформируют экспрессионным вектором, содержащим нуклеотидную последовательность, кодирующую белок TF или его фрагмент, обладающий прокоагулянтной активностью, функционально соединенную с промотором функциональным, в любых клетках, которые можно использовать в настоящем изобретении: клетках грибов, дрожжей, растений или животных (рыб, рептилий, млекопитающих, насекомых и т.д.).
кДНК, кодирующую белок TF или его фрагмент, обладающий прокоагулянтной активностью, можно амплифицировать с помощью полимеразной цепной реакции (ПЦР), используя кДНК-библиотеку в качестве матрицы и соответствующие праймеры. В примере 1 описана амплификация кДНК, кодирующей зрелый белок TF человека (hTF) с 18 дополнительными нуклеотидами (кодирующими шесть гистидинов) на 3'-конце.
«Вектор» в контексте настоящего изобретения относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой он соединен. Термин «дрожжевой экспрессионный вектор» в контексте настоящего изобретения относится к ДНК-экспрессионным конструкциям, например, фрагментам нуклеиновых кислот, плазмидам, космидам, фагам, вирусам или вирусным частицам, способным синтезировать целевые белки, кодируемые их соответствующими рекомбинантными генами (а именно, белок TF или его фрагмент, обладающий прокоагулянтной активностью), переносимыми вектором в дрожжи. Альтернативно, фрагменты нуклеиновых кислот также можно использовать для создания трансгенных дрожжевых клеток, используя непрямую или гомологичную рекомбинацию, при которой представляющие интерес ген или гены стабильно встраивают в геном дрожжей. Обычно, дрожжевой экспрессионный вектор включает нуклеотидную последовательность, кодирующую TF или его фрагмент, обладающий прокоагулянтной активностью, функционально соединенную с промотором, функциональным в дрожжевых клетках (то есть, дрожжевой функциональный промотор). Векторами для использования в изобретении являются, например, векторы, способные к автономной репликации и/или экспрессии нуклеиновых кислот, с которыми они соединены, в дрожжевых клетках. В настоящем описании термины «плазмида» и «вектор» используются взаимозаменяемо, так как плазмида является наиболее широко используемой формой вектора. Более того, предполагается, что изобретение включает другие такие формы экспрессионных векторов, которые выполняют такие же функции, и которые станут известны в данной области после настоящего изобретения. Указанным дрожжевым экспрессионным вектором может быть дрожжевой эписомальный экспрессионный вектор или дрожжевой встраиваемый экспрессионный вектор, и их можно получить с помощью общепринятых методик, известных специалисту в данной области.
Таким образом, в варианте осуществления указанным экспрессионным вектором является дрожжевой эписомальный экспрессионный вектор. Термин «дрожжевой эписомальный экспрессионный вектор» в контексте настоящего изобретения относится к экспрессионному вектору, который поддерживается в виде внехромосомной молекулы ДНК в цитоплазме дрожжей. В конкретном варианте осуществления указанный дрожжевой эписомальный экспрессионный вектор в дополнение к нуклеотидной последовательности, кодирующей белок TF или его фрагмент, обладающий прокоагулянтной активностью, функционально связанной с дрожжевым функциональным промотором, кроме того, включает: (i) ген для селекции в дрожжах; (ii) дрожжевую точку инициации репликации; (iii) ген для селекции в бактериях; и (iv) дрожжевой сигнал терминации транскрипции. Предпочтительно, указанный дрожжевой эписомальный экспрессионный вектор дополнительно содержит уникальный сайт рестрикции для клонирования выбранного гена (белка TF или его фрагмента, обладающего прокоагулянтной активностью) под контролем дрожжевого функционального промотора и следующего за ним дрожжевого сигнала терминации транскрипции.
Для получения указанного дрожжевого эписомального экспрессионного вектора можно использовать практически любой дрожжевой функциональный промотор, ген для селекции в дрожжах, дрожжевую точку инициации репликации, ген для селекции в бактериях, дрожжевой сигнал терминации транскрипции и сайт рестрикции для клонирования; тем не менее, в конкретном варианте осуществления изобретения в качестве дрожжевого функционального промотора используют промотор глицеральдегид-3-фосфат-дегидрогеназы (pGPD); в другом конкретном варианте осуществления в качестве гена для селекции в дрожжах используют ген URA3 (URA3); в другом конкретном варианте осуществления изобретения в качестве дрожжевой точки инициации репликации используют дрожжевую точку инициации репликации 2 микрона (2 мк); в другом конкретном варианте осуществления изобретения в качестве гена селекции в бактериях используют ген устойчивости к ампициллину (Amp); и в другом конкретном варианте осуществления изобретения в качестве специфичного дрожжевого сигнала терминации транскрипции используют сигнал терминации транскрипции фосфоглицераткиназы (PGKt). Поэтому, в конкретном варианте осуществления (пример 1-2) дрожжевой эписомальный экспрессионный вектор включает: (i) ген URA3; (ii) ген Amp для отбора и размножения вектора в E. coli; (iii) дрожжевую точку инициации репликации 2 мк; (iv) pGPD; (v) специфичный дрожжевой сигнал терминации транскрипции PGKt; и (vi) уникальный сайт рестрикции BamHI, который дает возможность клонирования выбранных генов под контролем pGPD, за которым следует последовательность PGKt. В другом варианте осуществления указанным дрожжевым экспрессионным вектором является дрожжевой встраиваемый экспрессионный вектор. Термин «дрожжевой встраиваемый экспрессионный вектор» в контексте настоящего изобретения относится к вектору, который способен встраиваться в геном дрожжей. В конкретном варианте осуществления указанный дрожжевой встраиваемый экспрессионный вектор включает: (i) ген для селекции в бактериях; и (ii) экспрессионную кассету, встроенную в ген для селекции в дрожжах, причем указанная экспрессионная кассета дополнительно включает дрожжевой функциональный промотор, сигнал терминации транскрипции в дрожжах и уникальный сайт рестрикции для клонирования и отбора гена (белка TF или его фрагмента, обладающего прокоагулянтной активностью).
Для изготовления указанного дрожжевого встраиваемого экспрессионного вектора можно использовать практически любые ген для селекции в бактериях, экспрессионную кассету, встроенную в ген для селекции в дрожжах, дрожжевой функциональный промотор, дрожжевой сигнал терминации транскрипции и уникальный сайт рестрикции для клонирования выбранного гена; тем не менее, в конкретном варианте осуществления изобретения в качестве гена селекции в бактериях используют ген устойчивости к ампициллину (Amp); в другом конкретном варианте осуществления в качестве экспрессионной кассеты, содержащей дрожжевой функциональный промотор (pGDP), дрожжевой сигнал терминации транскрипции (PGKt) и уникальный сайт рестрикции (BamHI) для клонирования выбранного гена в центральную область гена URA3, используют экспрессионную кассету pGPD-BamHI-PGKt, встроенную в центральную область гена URA3.
Практически любую дрожжевую клетку, восприимчивую к трансформации указанным дрожжевым экспрессионным вектором, содержащим нуклеотидную последовательность, кодирующую белок TF или его фрагмент, обладающий прокоагулянтной активностью, функционально соединенную с дрожжевым функциональным промотором, можно использовать в настоящем изобретении. Трансформацию дрожжевых клеток указанным дрожжевым экспрессионным вектором можно повести стандартными методами, известными специалисту в данной области (Sambrook et al, 2001, Molecular Cloning: A Laboratory Manual).
В предпочтительном варианте осуществления указанными дрожжами являются нефлокулирующие дрожжи (то есть, дрожжевые клетки, которые будучи диспергированными в процессе ферментации не флокулируют (агрегируют)). Предпочтительно, указанными клетками дрожжей являются клетки дрожжей GRAS (безопасные). Иллюстративными неограничивающими примерами дрожжевых клеток, которые можно использовать в способе настоящего изобретения, являются так называемые спиртовые виды дрожжей (дрожжи, используемые для производства спирта), которые продуцируют спирт, углекислый газ, пивные дрожжи и т.п., метаболизирующие жидкое сырье для брожения. Более конкретно, предпочтительные дрожжи выбраны из S. cerevisiae. Примеры таких спиртовых дрожжей включают клетки пивных дрожжей, клетки винных дрожжей и клетки дрожжей для получения сакэ. В предпочтительном варианте осуществления дрожжевой клеткой является клетка винных дрожжей, таких как S. cerevisae T73 ura3- (пример 1).
Термин «растительный экспрессионный вектор» в контексте настоящего изобретения относится к ДНК-экспрессионным конструкциям, например, фрагментам нуклеиновых кислот, плазмидам, космидам, фагам, вирусам или вирусным частицам, способным синтезировать целевые белки, кодируемые их соответствующими рекомбинантными генами (а именно, белок TF или его фрагмент, обладающий прокоагулянтной активностью), переносимыми вектором в растение. Альтернативно, фрагменты нуклеиновых кислот также можно использовать для создания трансгенных клеток растения, используя непрямую или гомологичную рекомбинацию, при которой представляющий интерес ген или гены, стабильно встраивают в геном растения. Обычно, растительный экспрессионный вектор включает нуклеотидную последовательность, кодирующую TF или его фрагмент, обладающий прокоагулянтной активностью, функционально соединенную с промотором, функциональным в растительных клетках (то есть, растительным функциональным промотором). Растительные функциональные промоторы, которые можно использовать в настоящем изобретении, могут быть выбраны из группы, состоящей из промоторов сахарозосинтетазы 1 кукурузы, алкоголь-дегидрогеназы 1 кукурузы, светособирающего комплекса кукурузы, белка теплового шока кукурузы, малой субъединицы RuBP-карбоксилазы гороха, маннопин-синтетазы Ti-плазмиды, нопалин-синтетазы Ti-плазмиды, халкон-изомеразы петунии, глицин-богатого белка 1 фасоли, потатина картофеля, лектина, CaMV 35S и малой субъединицы S-E9 RuBP-карбоксилазы. Трансформацию систем растений-хозяев можно проводить, используя стандартные способы. Обзор генетического переноса в растения можно найти в руководстве, озаглавленном «Ingenieria genetica and transferencia genica», авторства Marta Izquierdo, Ed. Piramide (1999), в частности, в главе 9, «Transferencia genica a plantas», страницы 283-316.
Векторами для использования в изобретении являются, например, векторы, способные к автономной репликации и/или экспрессии нуклеиновых кислот, с которыми они соединены, в дрожжевых клетках. В настоящем описании термины «плазмида» и «вектор» используются взаимозаменяемо, так как плазмида является наиболее широко используемой формой вектора. Более того, изобретение предполагает включение таких других форм экспрессионных векторов, которые выполняют такие же функции, и которые станут известны в данной области после настоящего изобретения. Указанным дрожжевым экспрессионным вектором может быть растительный эписомальный экспрессионный вектор или растительный встраиваемый экспрессионный вектор, и их можно получить с помощью общепринятых методик, известных специалисту в данной области. Для изготовления указанного растительного эписомального экспрессионного вектора можно использовать практически любой растительный функциональный промотор, ген для селекции в растениях, растительную точку инициации репликации, ген для селекции в бактериях, растительный сигнал терминации транскрипции и сайт рестрикции для клонирования.
Было разработано большое число систем продукции в определенных растениях. Они включают экспрессию белка в масляных тельцах (Rooijen et al., (1995) Plant Physiology 109: 1353-61; Liu et al., (1997) Molecular Breeding 3:463-70), посредством ризосекреции (Borisjuk et al., (1999) Nature Biotechnology 17:466-69), в семенах (Hood et al., (1997) Molecular Breeding 3:291-306; Hood et al., (1999) In Chemicals via Higher Plant Bioengineering (ed. Shahidi et al.) Plenum Publishing Corp. pp. 127-148; Kusnadi et al., (1997) Biotechnology and Bioengineering 56:473-84; Kusnadi et al., (1998) Biotechnology and Bioengineering 60:44-52; Kusnadi et al., (1998) Biotechnology Progress 14: 149-55; Witcher et al., (1998) Molecular Breeding 4:301-12), в качестве эпитопов на поверхности вируса (Verch et al., (1998) J. Immunological Methods 220:69-75; Brennan et al., (1999) J. Virology 73:930-38; Brennan et al., (1999) Microbiology 145:211-20) и путем стабильной экспрессии белков в клубнях картофеля (Arakawa et al., (1997) Transgenic Research 6:403-13; Arakawa et al., (1998) Nature Biotechnology 16:292-97; Tacket et al., (1998) Nature Medicine 4:607-09). Экспрессию рекомбинантных белков также можно направить в семена, хлоропласты, или их можно секретировать для того, чтобы идентифицировать местоположение, которое дает наибольший уровень накопления белка. Каждый из этих способов можно адаптировать для экспрессии тканевого фактора или фрагмента в соответствующем растении-хозяине.
Опубликованы дополнительные общие способы экспрессии белков в растениях. См. PCT/US02/23624 на имя Bascomb, N. et al.; и PCT/US02/17927 на имя Hall, G. et al. Эти способы легко адаптировать для экспрессии белка или фрагмента тканевого фактора, например, в Arabidopsis, а также во множестве других растений.
Опубликованы дополнительные способы экспрессии гетерологичных белков в однодольных и двудольных растениях. Они включают следующие подходы, которые приводят к стабильной и конститутивной экспрессии представляющего интерес белка: 1) опосредованный агробактериями перенос генов; 2) прямое поглощение ДНК, включая способы прямого поглощения ДНК протопластами; 3) поглощение ДНК, вызванное кратким электрическим шоком растительных клеток; 4) инъекцию ДНК в растительные клетки или ткани с помощью бомбардировки частицами, использования системы микропипеток или прямой инкубации ДНК с созревающей пыльцой; и 5) использование растительных вирусов в качестве генных векторов. Один из этих способов или их комбинацию можно использовать для создания растений, которые экспрессируют тканевой фактор и его функциональные фрагменты.
Перенос генов посредством генно-инженерных штаммов агробактерий стал рутинным для большинства двудольных растений и для некоторых однодольных растений. См., например, Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803. Дополнительные векторы для использования в изобретении включают «супербинарные векторы», раскрытые, например, в патенте США 5591616 и EPA 0604662A1. См., также Hood et al. (1984) Biotechnol. 2:702-709; Hood et al. (1986) J. Bacteriol. 168: 1283-1290; Komari et al. (1986) J. Bacteriol. 166:88-94; Jin et al. (1987) J. Bacteriol. 169:4417-4425; Komari T. (1989) Plant Science 60:223-229; номер доступа в ATCC 37394).
Термин «животный экспрессионный вектор» в контексте настоящего изобретения относится к ДНК-экспрессионным конструкциям, например, фрагментам нуклеиновых кислот, плазмидам, космидам, фагам, вирусам или вирусным частицам, способным синтезировать целевые белки, кодируемые их соответствующими рекомбинантными генами (а именно, белок TF или его фрагмент, обладающий прокоагулянтной активностью), переносимыми вектором в животную клетку. Альтернативно, фрагменты нуклеиновых кислот также можно использовать для создания трансгенных клеток животного, используя непрямую или гомологичную рекомбинацию, при которой представляющий интерес ген или гены стабильно встраивают в геном животного. Обычно, животный экспрессионный вектор включает нуклеотидную последовательность, кодирующую TF или его фрагмент, обладающий прокоагулянтной активностью, функционально соединенную с промотором, функциональным в животных клетках (то есть, животный функциональный промотор).
В конкретном варианте осуществления изобретения животными клетками являются клетки насекомых. Пример трансфекционных систем для клеток насекомых включают специфичные для насекомых вирусы, такие как рекомбинантные бакуловирусы, используемые в настоящем изобретении (см. примеры), и другие, такие как описано в патенте США US 6130074A.
В тех вариантах осуществления изобретения, где клетка, в которой должен экспрессироваться TF или его вариант, является дрожжевой клеткой, причем манипуляции с дрожжами выполняют, используя стандартные методики для работы с дрожжами и генетику дрожжей. См., например, Bacila et al., eds. (1978, Biochemistry and Genetics of Yeast, Academic Press, New York); и Rose and Harrison (1987, The Yeasts (2.sup.nd ed.) Academic Press, London). Способы введения экзогенной ДНК в дрожжи-хозяева хорошо известны в данной области. Существует множество способов трансформации дрожжей. Трансформация сферопластов описана Hinnen et al (1978, Proc. Natl. Acad. Sci. USA 75: 1919-1933); Beggs, (1978, Nature 275(5676): 104-109); и Stinchcomb et al., (EPO публикация № 45573; включенная в настоящее описание посредством ссылки); электропорация описана Becker и Gaurante (1991, Methods Enzymol. 194: 182-187); трансформация с помощью ацетата лития описана Gietz et al. (2002, Methods Enzymol. 350:87-96) и Mount et al. (1996, Methods Mol. Biol. 53: 139-145). Для обзора систем трансформации дрожжей кроме Saccharomyces см. Wang et al. (Crit. Rev Biotechnol. 2001; 21(3): 177-218). Общие методики генной инженерии дрожжей см. у Barr et al. (1989, в Yeast genetic engineering, Butterworths, Boston).
После трансформации эукариотической клетки выбранным вектором, экспрессирующим TF, следующая стадия состоит из выращивания культуры рекомбинантных эукариотических клеток, которые экспрессируют белок TF или его фрагмент, обладающий прокоагулянтной активностью, в условиях, которые дают возможность экспрессии указанного белка TF или его фрагмента, обладающего прокоагулянтной активностью. В конкретном варианте осуществления указанную эукариотическую клетку выращивают в подходящей среде, где указанная эукариотическая клетка может экспрессировать целевой гетерологичный продукт (белок TF или его фрагмент, обладающий прокоагулянтной активностью). Соответствующая культуральная среда для выращивания клеток дрожжей, растений, насекомых, рыб, млекопитающих иди других эукариотических клеток хорошо известны специалистам в данной области и будут выбираться в соответствии с типом культивируемых эукариотических клеток. Можно использовать любой материал для осуществления ферментации или выращивания продукта, при условии, что он подходит для ферментации или выращивания используемых эукариотических клеток, и по желанию можно использовать любые известные материалы. При необходимости к среде могут быть добавлены соответствующие питательные вещества и т.п.
Условия ферментации или культивирования клеток по существу не отличаются от известных условий, и их может установить специалист в данной области. Ростовыми условиями, которые необходимо регулировать, являются состав газа (кислород и т.д.), температура, рН и т.д. В документах US 5618676, US 5854018, US 5856123 и US 5919651 описаны способы и реактивы, подходящие для экспрессии рекомбинантных белков с использованием дрожжевых промоторов. В конкретном варианте осуществления ферментацию дрожжевых клеток отслеживают, контролируя изменения основных параметров на протяжении всего процесса ферментации, и его останавливают, когда давление кислорода (PO2) достигает стационарного состояния.
На второй стадии первый способ настоящего изобретения включает выделение несущих TF микровезикул из клеток, полученных на стадии (i).
Термин «выделение» в контексте настоящего изобретения относится к процессу отделения несущих TF микровезикул от интактных или лизированных клеток, а также от других клеточных компонентов, таких как ДНК, белки и т.д., и, таким образом, получая частично или полностью очищенный препарат несущих TF микровезикул. В предпочтительном варианте осуществления чистота выделенной фракции составляет по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 99% и 100%.
Выделение требует лизиса клеток в отсутствие детергентов или, когда используют детергенты, использования концентраций указанных детергентов ниже критической концентрации мицеллообразования (CMC). В том случае, когда клетки получают в форме целого организма, например, трансгенного растения или трансгенного животного, выделение может включать стадию измельчения ткани до суспензии клеток с использованием механических или ферментативных способов.
Суспензию клеток или клетки из клеточной культуры в том случае, когда TF-несущие микровезикулы выделяют из клеточных культур, можно осадить стандартными способами, такими как центрифугирование, и ресуспендировать в подходящем буфере для лизиса перед проведением гомогенизации указанного продукта.
Клетки растений и грибов имеют целлюлозные и хитиновые стенки. Поэтому, перед гомогенизацией может потребоваться дополнительная стадия для удаления клеточной стенки. Эту стадию можно провести, используя механические (например, используя пестик и ступку, французский пресс, измельчитель и т.п.) или ферментативные способы (например, используя целлюлазу, хитиназу и т.п.) в присутствии фармацевтически приемлемого раствора буфера для лизиса (воды, забуференного фосфатом солевого раствора (PBS) и т.п.).
Более того, перед гомогенизацией можно удалить дебрис с помощью фильтрации или мягкого центрифугирования, обычно, с ускорением примерно 1000×g на протяжении примерно менее 30 минут, предпочтительно, на протяжении примерно 5-20 минут.
Способы выделения несущих TF микровезикул из клеток, полученных на первой стадии первого способа настоящего изобретения, могут варьировать в зависимости от используемых эукариотических клеток и включают, но без ограничений, центрифугирование, гель-фильтрационную хроматографию, фильтрацию в тангенциальном потоке или их комбинацию.
В предпочтительном варианте осуществления изобретения клетки лизируют механически, и ядра, неразрушенные клетки и дебрис удаляют низкоскоростным центрифугированием, получая супернатант после удаления ядер (PNS). Таким образом, в предпочтительном варианте осуществления изобретения препаратом липидных микровезикул является супернатант после удаления ядер.
В конкретном случае, когда для получения несущих TF микровезикул в качестве клеток-хозяев используют дрожжевые клетки, их можно гомогенизировать стандартными способами, такими как высокое давление в гомогенизаторе для получения ферментационного гомогената. Ферментационный гомогенат затем разделяют стандартным способами, такими как центрифугирование, для получения осадка и осветленного дрожжевого экстракта (CYE), содержащего указанные полученные из дрожжей несущие TF микровезикулы, обладающие прокоагулянтной активностью (то есть, полученную из дрожжей несущую TF микровезикулу настоящего изобретения), которые можно собрать отдельно.
Присутствие белка TF или его фрагмента, обладающего прокоагулянтной активностью, можно определить стандартными способами, такими как, например, Вестерн-блот анализ с использованием специфичного к белку TF моноклонального антитела (mAb). Кроме того, прокоагулянтную активность CYE можно определить любым стандартным анализом, например, с помощью любого из анализов коагуляции крови, указанных в примере 4, например, как правило, с помощью in vitro анализа коагуляции плазмы или цельной крови без антикоагулянтов и т.д.
С целью установления присутствия TF в микровезикулах из дрожжей или других эукариотических клеток можно дополнительно исследовать образцы с помощью иммуноэлектронной микроскопии с мечеными анти-TF mAb. Указанные микровезикулы, которые содержит белок TF или его фрагмент, обладающий прокоагулянтной активностью, также обладают прокоагулянтной активностью и соответствуют полученным из эукариотических клеток несущим TF микровезикулам настоящего изобретения.
Необязательно, при желании, указанные полученные из эукариотических клеток несущие TF микровезикулы (такие как полученная из дрожжей микровезикула), обладающие прокоагулянтной активностью, можно концентрировать, выделять или очищать стандартными способами, известными специалисту в данной области. В качестве иллюстрации, аффинная хроматографическая очистка белков, содержащих пептидный tag (например, His-tag, и т.д.), либо на С-, либо на N-конце, представляет собой стандартизированный способ, используемый для получения высокочистых препаратов большого числа белков. Как и любой хроматографический способ, указанный способ можно легко масштабировать в сторону увеличения. Можно провести альтернативные процедуры очистки, такие как иммуно-аффинная хроматография, хотя для нее необходим доступ высоко стандартизированных запасов специфичных моно- или поликлональных антител к TF, особенно в случае крупномасштабного получения.
Поэтому, способ выделения и очистки будет зависеть, среди прочих факторов, от природы белка TF или его фрагмента, обладающего прокоагулянтной активностью, а именно, если он является слитым белком, имеющим tag для связывания одного или более лигандов аффинного матрикса, такого как хроматографический носитель или шарики с высокой аффинностью (например, His-tag и т.д.), или эпитоп, распознаваемый антителом, такой как c-myc-tag (распознаваемый анти-c-myc антителом) и т.д.
В предпочтительном варианте осуществления полученные из дрожжей несущие TF микровезикулы с гистидиновым tag настоящего изобретения получают из осветленного дрожжевого экстракта (CYE) согласно ранее раскрытому способу. Как правило, CYE фильтруют (например, через фильтр с размером пор 0,1 мкм фильтрацией в тангенциальном потоке) перед нанесением на соответствующую аффинную колонку (например, аффинную колонку HiTrap); затем, после нанесения образца собирают проскок (несвязавшийся материал), и колонку промывают несколько раз, и после последней промывки полученные из дрожжей микровезикулы, несущие белок TF-His-tag, элюируют, нанося на колонку соответствующий буфер (например, буфер, содержащий имидазол), и собирают и диализуют элюируемые фракции, с получением выделенных и очищенных полученных из дрожжей липидных микровезикул, несущих белок TF-His-tag.
Также, в другом варианте осуществления несущие TF микровезикулы настоящего изобретения можно очистить на оборудовании AKTA prime. AKTA prime представляет собой автоматизированную систему жидкостной хроматографии от General Electric Healthcare, которую можно использовать для усовершенствования стандартных методик очистки с использованием эксклюзионных хроматографических колонок, масштаб которых легко увеличить для крупных партий. В другом варианте осуществления можно использовать фильтрацию в тангенциальном потоке или высокоэффективную фильтрацию в тангенциальном потоке (HPTFF).
В конкретном варианте осуществления несущие TF микровезикулы выделяют, используя комбинацию одной или нескольких стадий фильтрации в тангенциальном потоке и/или одной или нескольких стадий эксклюзионной хроматографии.
В конкретном варианте осуществления несущие TF микровезикулы выделяют, используя одну стадию фильтрации в тангенциальном потоке, за которой следует одна эксклюзионная хроматография и еще одна фильтрация в тангенциальном потоке. В предпочтительном варианте осуществления размер пор в первой фильтрации в тангенциальном потоке больше размера пор во второй (и последующих) фильтрациях в тангенциальном потоке. В более предпочтительном варианте осуществления размер пор в первой фильтрации в тангенциальном потоке составляет от 0,5 до 0,1 мкм, и размер пор во второй фильтрации в тангенциальном потоке составляет от 0,2 мкм.
На третьей стадии первый способ настоящего изобретения включает приведение в контакт микровезикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения указанного фосфолипида в указанные микровезикулы.
Термин «фосфолипид» в контексте настоящего изобретения относится к липиду, который содержит одну или более фосфатных групп. Фосфолипиды являются амфипатическими по природе; то есть каждая молекула состоит из гидрофильной («водолюбивой») части и гидрофобной («водонепереносимую») части. В настоящем описании термин «фосфолипид» включает фармацевтически приемлемые соли и сложные эфиры таких соединений.
Фосфолипиды можно классифицировать по типу спирта на фосфоглицериды (или глицерофосфолипиды), когда они несут глицериновый каркас, и сфинголипиды, в которых липиды содержат сфингозин. Оба класса присутствуют в биологической мембране. Фосфоглицериды представляют собой наиболее распространенный класс фосфолипидов, обнаруженных в природе, и включают, но без ограничений, фосфатидилхолин (лецитин), фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит, фосфатидилглицерин и кардиолипин. Структурное разнообразие в пределах каждого типа фосфоглицерида является следствием непостоянства длины цепей и степени насыщения групп сложных эфиров жирных кислот.
Сфингомиелин является основным, содержащим сфингозин фосфолипидом. Его общая структура состоит из жирной кислоты, присоединенной к сфингозину амидной связью.
Термин «отрицательно заряженный фосфолипид» или «NCP» относится к фосфолипидам, которые несут общий отрицательный заряд при физиологических уровнях рН, то есть в диапазоне примерно от 7,3 до примерно 7,5. Примеры отрицательно заряженных фосфолипидов, которые можно использовать в настоящем изобретении, включают фосфатидилсерин (PS), дипальмитоил- и дистеароилфосфатидовую кислоту (DPPA, DSPA), дипальмитоил- и дистеароилфосфатидилсерин (DPPS, DSPS), дипальмитоил- и дистеароилфосфатидилглицерин (DPPG, DSPG), фосфатидилглицерин, фосфатидилинозит, кардиолипин, сфинголипиды (церамиды-1-фосфаты; гликозилированный фосфатидилэтаноламин; сульфатиды (гидроксилированные или нет); ганглиозиды), фосфатидилинозитолфосфаты и фосфатидовую кислоту.
В предпочтительном варианте осуществления изобретения отрицательно заряженным фосфолипидом является фосфатидилсерин (PS), который представляет собой фосфолипид, образуемый в результате реакции этерификации между фосфатной группой в молекуле фосфатидовой кислоты и гидроксильной группой серина, имеющий структуру, представленную формулой:
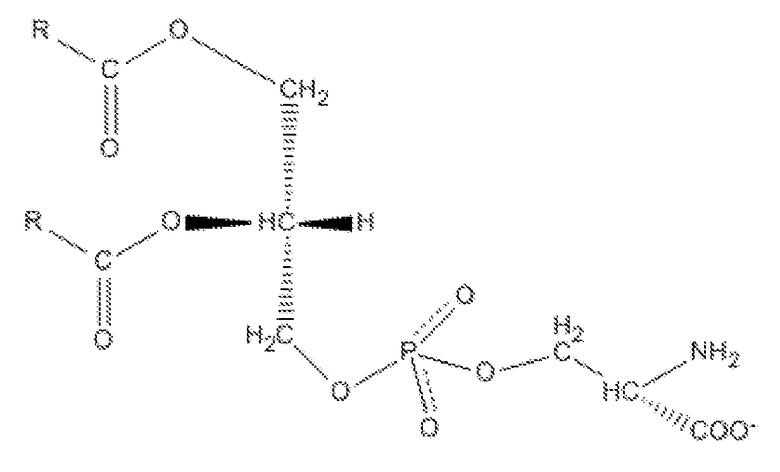
где R представляет собой жирную кислоту. Термин «жирная кислота» в контексте настоящего изобретения относится к длинноцепочечным алифатическим кислотам (алкановым кислотам) с различной длиной цепи, от С12 до С22, не содержащим, содержащим одну или более ненасыщенных связей. Предпочтительно, жирная кислота выбрана из группы стеариновой (18:0 или октадекановой кислоты), олеиновой кислоты (18:1 цис-9 или (9Z)-октадец-9-еновой кислоты), пальмитиновой кислоты (16:0 или гексадекановой), линолевой кислоты (18:2 (ω-6) или цис,цис-9,12-октадекадиеновой кислоты), арахидоновой кислоты (20:4 (ω-6) или полностью цис-5,8,11,14-эйкозатетраеновой кислоты), докозагексаеновой кислоты (22:6 (n-3 или (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеновой кислоты).
Отрицательно заряженные фосфолипиды для использования в настоящем изобретения могут быть очищены или выделены, либо могут быть по существу чистыми. Соединение является «по существу чистым», когда оно отделено от компонентов, которые сопровождают его в природе. Как правило, соединение является по существу чистым, когда оно составляет по меньшей мере 60%, в более общем смысле, 75% или больше 90% по массе от общего вещества в образце. По существу чистый фосфолипид может быть получен, например, экстракцией из природного источника или химическим синтезом. Поэтому, например, химически синтезированный фосфолипид будет, в основном, по существу свободным от компонентов, ассоциированных с ним в природе. Чистоту можно измерить, используя любой соответствующий способ, такой как колоночная хроматография, гель электрофорез, ВЭЖХ и т.д. Однако очистка отрицательно заряженного фосфолипида не является необходимой перед использованием его в настоящем изобретении, при условии, что фосфолипид не ассоциирован с компонентами, которые существенно препятствуют его применению. Специалисту в данной области будет очевидно, какой природный источник или частично-очищенный источник отрицательно заряженного фосфолипида можно использовать в изобретении, и что компонент отрицательно заряженного фосфолипида может составлять небольшой процент (например, 10-20%, но предпочтительно, по меньшей мере 30%, 40%, 50% или более) от общего вещества, полученного из такого источника.
Процесс контакта микровезикул, полученных на второй стадии (ii) первого способа настоящего изобретения, с отрицательно заряженным фосфолипидом осуществляют в условиях, подходящих для включения отрицательно заряженного фосфолипида в липидную микровезикулу. Переменные, которые можно оптимизировать в процессе стадии инкубации, включают температуру, рН, подходящие буферы, влажность, концентрацию компонентов, растворы, стадии промывки и т.д. При необходимости эти переменные можно регулировать, чтобы получить оптимальное соотношение микровезикула/фосфолипид.
Как описано выше, препарат везикул, полученный на стадии (i) первого способа настоящего изобретения, состоит из мембранных липидов, а также из белков, которые включают тканевой фактор или его вариант, экспрессированный в клетке-хозяине, а также мембранно-ассоциированные белки, эндогенные для хозяина. Однако для целей количественной оценки выхода микровезикул, как правило, более удобно выражать концентрацию микровезикул в виде микрограммов белка на единицу объема. Концентрацию белка в микровезикулах можно определить, используя стандартные методики количественного определения белка, такие как анализ по Брэдфорд, ВСА-анализ, биуретовый анализ и т.п.
После определения концентрации белка в микровезикулах можно проводить стадию приведения в контакт, используя любое подходящее соотношение фосфолипида к микровезикулам. Для специалиста в данной области будет очевидно, что для получения препарата везикул, обладающего наилучшими свойствами, при необходимости можно варьировать соотношение фосфолипида к везикулам на стадии приведения в контакт. Предпочтительно, подходящую конечную концентрацию отрицательно заряженного фосфолипида можно вычислить, используя «анализ кривой насыщения» путем смешивания конкретного используемого отрицательно заряженного фосфолипида и увеличивающихся концентраций микровезикул, полученных на стадии (ii), и определения времени коагуляции для полученных везикул до определения оптимальной концентрации двух компонентов. Хотя это соотношение концентраций обычно соответствует соотношению концентраций, которое приводит к практически полному отсутствию свободного отрицательно заряженного фосфолипида (то есть, не включенного в микровезикулы), изобретение также предусматривает соотношения двух компонентов, которые приводят к избытку невключенного фосфолипида, который можно удалить стандартными способами. Для специалиста в данной области также будет понятно, что отрицательно заряженный фосфолипид будет включаться в липидный бислой микровезикулы, полученной на стадии (ii), в различной степени в зависимости от природы отрицательно заряженного фосфолипида и природы микровезикулы, полученной на стадии (ii) (то есть, полученной из дрожжей микровезикулы, полученной из клеток насекомых микровезикулы и т.д.).
В предпочтительном варианте осуществления стадию приведения в контакт проводят, используя концентрацию белка примерно от 0,1 до 1000 мкг/мл, от 1 до 100 мкг/мл, 10-90 мкг/мл, 20-80 мкг/мл, 30-70 мкг/мл, 40-60 мкг/мл, 45-55 мкг/мл или мкг/мл. Концентрация фосфолипида на стадии приведения в контакт предпочтительно составляет 0,001 мМ-1 мМ, 0,005 мМ-0,5 мМ, 0,1 мМ-0,4 мМ, 0,2 мМ-0,3 мМ.
В предпочтительном варианте осуществления стадию приведения в контакт проводят, используя соотношение белка к фосфолипиду примерно от Х мкг белка примерно к 0,005-1 мкмоль фосфолипида, причем Х составляет примерно 5, 10, 30, 40, 50, 60, 70, 80, 90 или 100. В еще более предпочтительном варианте осуществления стадию приведения в контакт проводят, используя 0,05 мкмоль фосфолипида для препарата везикул, имеющего 50 или менее 50 мкг белка, 1 мкмоль фосфолипида для препарата везикул, имеющего по меньшей мере 50 мкг белка.
Хотя стадию приведения в контакт обычно проводят в условиях, подходящих для включения большинства фосфолипида в везикулы, не оставляя никакого существенного избытка фосфолипида, это может быть необязательным, в случае чего можно провести дополнительную стадию, в которой избыток отрицательно заряженного фосфолипида удаляют из препарата обогащенных фосфолипидами микровезикул, полученного на стадии (ii). Специалисту в данной области известны различные способы удаления избытка фосфолипида, такие как дополнительные стадии промывки, расслоение, центрифугирование, хроматография и т.д.
Избыток фосфолипида можно удалить из обогащенных фосфолипидами микровезикул с помощью ряда способов, обеспечивающих в результате стабильную композицию несущих TF микровезикул, содержащих тканевой фактор, ассоциированный с липидным бислоем и проходящий через него. Подходящие способы удаления детергента включают диализ, диафильтрацию в тангенциальном потоке, фильтрацию через полые волокна в перекрестном потоке, обработку гидрофобной хроматографической смолой и простое разбавление.
Второй способ настоящего изобретения
Во втором аспекте изобретение относится к способу получения несущей TF микровезикулы, или второй микровезикулы настоящего изобретения, обладающей прокоагулянтной активностью, который включает стадии:
(i) предоставление липидной микровезикулы, полученной из эукариотической клетки;
(ii) приведение в контакт белка TF или его варианта, обладающего прокоагулянтной активностью, с липидной микровезикулой, как определено в (i), в условиях, подходящих для включения указанного белка TF или его варианта в указанные микровезикулы; и
(iii) приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения указанных фосфолипидов в указанную везикулу,
где стадии (ii) и (iii) можно проводить в любом порядке.
Термины «TF», «вариант TF, обладающий прокоагулянтной активностью» и «отрицательно заряженный фосфолипид» подробно описаны в контексте первого способа настоящего изобретения и в равной степени применимы ко второму способу настоящего изобретения.
На первой стадии второго способа настоящего изобретения обеспечивают липидные микровезикулы, полученные из эукариотических клеток. Липидные микровезикулы, используемые во втором способе настоящего изобретения, могут представлять собой микровезикулы, полученные из любого типа эукариотических клеток, описанных в первом способе настоящего изобретения, с применением способов, описанных в первом способе настоящего изобретения, и включают, но без ограничения, везикулы, выделенные из дрожжевых клеток, клеток млекопитающих, клеток насекомых, клеток рыб и растительных клеток. Как описано в контексте первого способа настоящего изобретения, липидные микровезикулы, как правило, получены в отсутствии детергентов или в присутствии детергентов, когда их концентрация находится ниже критической концентрации мицеллообразования.
На второй стадии липидные микровезикулы приводят в контакт с белком TF или его вариантом, обладающим прокоагулянтной активностью, в условиях, подходящих для включения указанного белка TF или его варианта в указанные микровезикулы. Микровезикулы, полученные, как описано выше, затем приводят в контакт с белком TF, который можно получить из тканевых экстрактов, или он может быть предоставлен в виде (частично) очищенного рекомбинантного белка. Получение экстрактов и очистку TF можно проводить из нескольких тканей, таких как ткани головного мозга, плаценты и легкого, и из различных животных, таких как овцы, коровы, кролики, собаки и человек. Получение экстрактов и очистку белка TF может быть проведено, как описано, но без ограничения, в US 5622931. Используемый TF может представлять собой рекомбинантный TF (rTF), который можно получить из любой клеточной системы экспрессии, предпочтительно, из эукариотических клеток. rTF, используемый для проведения настоящего изобретения, может, кроме того, являться частью слитого белка, как описано выше. Эукариотические клетки и способы гетерологичной экспрессии белков, которые можно использовать во втором способе настоящего изобретения, описаны выше.
Второй способ настоящего изобретения может дополнительно включать стадию удаления избытка TF со стадии (ii). Способы удаления избытка TF на стадии (ii) являются по существу такими же, как указанные в контексте первого способа настоящего изобретения, и включают гель-фильтрационную хроматографию, дифференциальное центрифугирование, центрифугирование в градиенте плотности и т.п.
На третьей стадии второй способ настоящего изобретения включает приведение в контакт везикул, полученных на стадии (ii), с отрицательно заряженным фосфолипидом в условиях, подходящих для включения фосфолипидов в указанные везикулы.
Отрицательно заряженный фосфолипид, который можно использовать в настоящем изобретении, а также условия, подходящие для включения фосфолипидов в указанные везикулы, подробно описаны в первом способе настоящего изобретения. В предпочтительном варианте осуществления используемым отрицательно заряженным фосфолипидом является фосфатидилсерин.
Выражение «условия, подходящие для включения фосфолипидов в везикулы» в контексте настоящего описания следует понимать, как любое условие, которое дает возможность фосфолипидам свободно двигаться и встраиваться в микровезикулы. Без каких-либо конкретных ограничений, эти условия обычно включают температуру примерно от 4°С до 90°С, от 10°С до 80°С, от 15°С до 70°С, от 20°С до 60°С, от 25°С до 50°С, от 30°С до 40°С или комнатную температуру, рН 2-12, 3-11, 4-10, 5-9, 6-8 или 7, и физиологические концентрации соли.
В предпочтительном варианте осуществления стадию приведения в контакт проводят, используя препарат везикул, имеющий концентрацию белка примерно от 0,1 до 1000 мкг/мл, от 1 до 100 мкг/мл, 10-90 мкг/мл, 20-80 мкг/мл, 30-70 мкг/мл, 40-60 мкг/мл, 45-55 мкг/мл или мкг/мл. Концентрация фосфолипида на стадии приведения в контакт предпочтительно составляет 0,001 мМ-1 мМ, 0,005 мМ-0,5 мМ, 0,1 мМ-0,4 мМ, 0,2 мМ-0,3 мМ.
В предпочтительном варианте осуществления стадию приведения в контакт проводят, используя соотношение белка к фосфолипиду примерно от Х мкг белка примерно к 0,005-1 мкмоль фосфолипида, причем Х составляет примерно 5, 10, 30, 40, 50, 60, 70, 80, 90 или 100 мкг белка. В еще более предпочтительном варианте осуществления стадию приведения в контакт проводят, используя 0,05 мкмоль фосфолипида для препарата везикул, имеющего 50 или менее 50 мкг белка, или 1 мкмоль фосфолипида для препарата везикул, имеющего по меньшей мере 50 мкг белка.
Второй способ настоящего изобретения может дополнительно включать стадию удаления избытка PS на стадии (iii). Способы удаления избытка PS на стадии (iii) являются по существу такими же, как указано в контексте первого способа настоящего изобретения, и включают гель-фильтрационную хроматографию, дифференциальное центрифугирование, центрифугирование в градиенте плотности и т.п.
Второй способ настоящего изобретения также можно осуществить, проводя стадии (ii) и (iii) в обратном порядке, то есть, сначала осуществляя приведение в контакт везикулы с отрицательно заряженным фосфолипидом, за которым следует приведение в контакт везикулы, полученной на первой стадии, с TF. Таким образом, в другом аспекте изобретение включает первую стадию, на которой липидную микровезикулу приводят в контакт с отрицательно заряженным фосфолипидом в условиях, подходящих для включения фосфолипидов в указанные везикулы, и вторую стадию, на которой везикулы, полученные на первой стадии, приводят в контакт с рекомбинантным TF или его вариантом, обладающим прокоагулянтной активностью, в условиях, подходящих для включения рекомбинантного TF в микровезикулы.
Условиями, подходящими для проведения первой и второй стадии, по существу являются описанные выше.
Микровезикулы настоящего изобретения
Как первый, так и второй способы настоящего изобретения обеспечивают в результате несущие TF микровезикулы, которые имеют улучшенные прокоагулянтные свойства и повышенную стабильность по сравнению с микровезикулами, которые не подвергались контакту с отрицательно заряженными фосфолипидами. Поэтому, в другом аспекте изобретение относится к микровезикуле, которая получена с использованием первого или второго способа настоящего изобретения.
Термин «микровезикула» подробно описан выше и относится по существу к замкнутой камере, по существу содержащей липидный монослой или липидный бислой. Диаметр микровезикул может варьировать в широких пределах. Как правило, указанный размер равен или меньше 10 мкм, как правило, равен или меньше 0,5 мкм. В конкретном варианте осуществления размер полученных из дрожжей несущих TF микровезикул настоящего изобретения варьирует в диапазоне от 10 до 0,01 мкм. Поскольку микровезикулы, полученные по способам изобретения, получены из эукариотических клеток, то их белковый и липидный состав будет отражать состав мембран организма, из которого они получены.
В конкретном случае, когда микровезикулы получены из дрожжевых клеток, они, как правило, содержат специфичные для дрожжей фосфолипиды, такие как эргостерол и кардиолипин.
Когда микровезикулы получены из растительных клеток, то они содержат липиды, специфичные для мембран растительных клеток, такие как, фитостерол, станолы, сложные эфиры станолов, токоферолы, d-альфа токоферолы, d,I-альфа токоферолы, токотриенолы, фитостерол или тритерпен, содержащий бета-ситостерол, кампестерол, стигмастерол, стигмастанол, бета-ситостанол, ситостанол, десмостерол, халинастерол, пориферастерол, клионастерол или брассикастерол.
Когда микровезикулы получены из животных клеток, то они содержат липиды, специфичные для мембран животных клеток, такие как холестерин, или липидный состав, типичный для мембран млекопитающих.
Когда микровезикулы получены из клеток насекомых, они содержат липиды, специфичные для мембран клеток насекомых, или липидный состав, типичный для мембран насекомых, например, высокое количество диацилглицерина. (Insect Lipids: Chemistry, Biochemistry, and Biology Book by David W. Stanley-Samuelson, Dennis R. Nelson; University of Nebraska Press, 1993).
Хотя предпочтительно, микровезикулы настоящего изобретения свободны от других частиц, прокоагулянтный эффект наблюдается в широком диапазоне степени чистоты микровезикул. Поэтому, микровезикулы настоящего изобретения могут быть представлены в препарате, содержащим относительно частиц, не являющихся микровезикулами, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% микровезикул.
Лиофилизированные композиции настоящего изобретения
Как будет очевидно специалистам в данной области, любую из композиций микровезикул настоящего изобретения можно лиофилизировать для хранения и восстановить, например, водной средой (такой, как стерильная вода, раствор фосфатного буфера или водный солевой раствор) с помощью интенсивного взбалтывания.
Термины «лиофилизация», «сушка при замораживании» или их грамматически эквивалентные варианты, относятся к процессу дегидратации, как правило, используемому для сохранения скоропортящегося материала или для создания более транспортабельного материала, который осуществляют замораживанием материла, затем снижением окружающего давления и нагреванием в достаточной степени, чтобы обеспечить прямую сублимацию замороженной воды в материале из твердой фазы в газообразную.
Специалисту в данной области известны различные методики лиофилизации и замораживания, которые можно использовать. Лиофилизацию можно провести, используя стандартное оборудование, такое как роторные испарители, коллекторные лиофилизаторы и лотковые лиофилизаторы. В конкретном варианте осуществления фармацевтические композиции настоящего изобретения можно замораживать на сухом льду, затем лиофилизировать, используя цикл, начинающийся при -40°C и заканчивающийся при комнатной температуре, в течение 48 часов. Полученный реагент можно восстановить до рабочей концентрации добавлением 0,1М Tris, pH 7,5, 150 мМ трегалозы, с получением раствора, содержащего первые или вторые везикулы настоящего изобретения с концентрацией приблизительно 10-250 мкг/мл.
Для предупреждения агглютинации или слияния липидов и/или везикул в результате лиофилизации, может быть полезно включать криопротекторы, которые предупреждают возникновение такого слияния или агглютинации. Термин «криопротектор» относится к агенту, который защищает липидную частицу, подвергающуюся дегидратации-регидратации, замораживанию-оттаиванию или лиофилизации-регидратации, от слияния везикул и/или от вытекания содержимого везикул и включают, но без ограничений, сорбит, маннит, хлорид натрия, глюкозу, трегалозу, поливинилпирролидон или полиэтиленгликоль (ПЭГ), например, ПЭГ-400. Эти и другие добавки, описаны в литературе, такой как Фармакопея США, USP XXII, NF XVII, Фармакопея Соединенных Штатов Америки, Национальный формуляр, United States Pharmacopeial Convention Inc., 12601 Twinbrook Parkway, Rockville, Md. 20852, описание которых, таким образом, полностью включено в настоящее описание посредством ссылки. Лиофилизированные препараты, как правило, имеют преимущественно более длительный срок хранения.
Первые фармацевтические композиции настоящего изобретения
В другом аспекте изобретение относится к фармацевтической композиции настоящего изобретения, которая содержит везикулы, полученные по первому и второму способу настоящего изобретения, либо в растворе/суспензии или в лиофилизированной форме, и фармацевтически активный наполнитель. Указанную фармацевтическую композицию затем формулируют в фармацевтически вводимую форму, подходящую для введения субъекту.
Фармацевтические композиции настоящего изобретения содержат микровезикулы настоящего изобретения, содержащие белок TF человека или любой из его вариантов, обладающий прокоагулянтной активностью, и которые подробно описаны выше, включая зрелый TF человека, укороченный TF человека, варианты гликозилирования TF, TF с присоединенным tag и варианты, несущие более одной из вышеперечисленных модификаций, например, зрелый TF, несущий гексагистидиновый tag на С-конце и мутацию N124A.
Термин «фармацевтически приемлемый наполнитель» в контексте настоящего изобретения относится к любому веществу, подходящему для доставки терапевтической композиции, пригодной в способе по настоящему изобретению, в подходящее местоположение in vivo или ex vivo, не вызывая нежелательных побочных эффектов, таких как токсичность, раздражение, аллергическая реакция или другие проблемы или осложнения, с достаточным риском возникновения. На практике, в указанных композициях настоящего изобретения можно использовать любой наполнитель, который не влияет отрицательно на первые или вторые микровезикулы настоящего изобретения. В варианте осуществления указанным наполнителем является по существу жидкая среда, такая как среда, окружающая несущие TF микровезикулы настоящего изобретения, полученные в результате осуществления способа настоящего изобретения. Поэтому в конкретном варианте осуществления первая композиция настоящего изобретения включает осветленный эукариотический экстракт, полученный при осуществлении способа настоящего изобретения, в который добавлен отрицательно заряженный фосфолипид.
Информацию о носителях и эксципиентах, а также об указанных формах введения, подходящих для введения указанного продукта настоящего изобретения, можно найти в трудах по галенофармацевтике. Обзор различных фармацевтических форм введения лекарственных средств в основном и способов их получения можно найти в книге, озаглавленной "Tratado de Farmacia Galénica", C. Faulí i Trillo, 1st Edition, 1993, Luzán 5, S.A. of Ediciones.
В конкретном варианте осуществления микровезикулы, полученные первым и вторым способами настоящего изобретения, можно совместно формулировать в композицию.
В конкретном варианте осуществления фармацевтическую композицию, содержащую несущую TF микровезикулу настоящего изобретения, можно формулировать совместно со стимулятором коагуляции.
В настоящем изобретении «стимулятор коагуляции» можно рассматривать как любое средство, которое стимулирует процесс, в результате которого образуется сгусток крови.
Средствами, пригодными в качестве стимуляторов коагуляции, являются адсорбирующие химические вещества, такие как зеолин; тромбин; компоненты коагуляционного каскада, такие как факторы коагуляции II, VII, VIII, IX, X, XI, XII, XIII и т.д.; кофакторы, такие как кальций, витамин К; и т.п. В предпочтительном варианте осуществления используемый стимулятор коагуляции выбран из группы фактора VII (в виде предшественника или в виде активной формы), фактора Х (в виде предшественника или в виде активной формы) и их комбинаций.
Хотя предпочтительно, чтобы фармацевтические композиции настоящего изобретения содержали очищенные микровезикулы, также возможно, что композиция содержит по существу очищенные микровезикулы. Микровезикулы можно очистить любым из способов, указанных выше, чтобы получить препарат, содержащий относительно частиц, не являющихся микровезикулами, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% микровезикул.
Фармацевтические композиции настоящего изобретения содержат терапевтически эффективное количество несущих TF микровезикул. Указанное количество может варьировать в широких пределах в зависимости от дозировки, пути введения и т.п. Как правило, фармацевтические композиции настоящего изобретения могут содержать примерно от 10 мкг активных микровезикул настоящего изобретения на мл до 300 мкг активных микровезикул настоящего изобретения на мл, предпочтительно, от 20 мкг активного белка на мл до 200 мкг активного белка на мл, и, еще более предпочтительно, примерно от 50 мкг активных микровезикул настоящего изобретения на мл до 100 мкг активных микровезикул настоящего изобретения на мл.
Доза для введения субъекту может варьировать в очень широких пределах, например, примерно от 1,0 пг активных микровезикул настоящего изобретения на мл до 1,0 мг активных микровезикул настоящего изобретения на мл, предпочтительно, примерно от 0,05 мкг активных микровезикул настоящего изобретения на мл до 100 мкг активных микровезикул настоящего изобретения на мл, и, еще более предпочтительно, примерно от 0,1 мкг активных микровезикул настоящего изобретения на мл до 50 мкг активных микровезикул настоящего изобретения на мл. Доза первых или вторых микровезикул настоящего изобретения для введения будет зависеть от нескольких факторов, включая среди них свойства используемого белка TF или его фрагмента, обладающего прокоагулянтной активностью, такие как, например, их активность или биологическое время полужизни, концентрация белка TF или его фрагмента, обладающего прокоагулянтной активностью, в составе, клиническое состояние субъекта или пациента, геморрагическое расстройство, против которого проводится лечение, и т.д. Вследствие этого, указанные в настоящем описании дозы следует рассматривать только в качестве руководства для специалиста в данной области, и этот человек должен корректировать дозы в соответствии с указанными выше переменными. Тем не менее, для профилактических или терапевтических целей фармацевтическую композицию настоящего изобретения можно вводить один или несколько раз в день.
Если несущие TF микровезикулы лиофилизированы, перед введением животному их можно ресуспендировать в растворителе для повторной сборки везикул. При введении в лиофилизированном виде микровезикулы спонтанно образуются повторно при контакте композиции с гидрофильным окружением внутри организма животного.
Вторые фармацевтические композиции настоящего изобретения
Авторы настоящего изобретения обнаружили, что прокоагулянтную активность содержащих TF микровезикул, полученных из эукариотической клетки, можно синергически усилить, объединяя везикулы со стимулятором коагуляции.
Поэтому в другом аспекте изобретение относится к фармацевтической композиции, содержащей:
(i) микровезикулу, полученную способом, включающим стадии:
а) экспрессии TF или его варианта, обладающего прокоагулянтной активностью, в эукариотической клетке, и
b) выделения несущих TF микровезикул из клеток со стадии (i);
(ii) по меньшей мере средство, которое стимулирует коагуляцию; и
(iii) фармацевтически эффективный наполнитель.
Термины «микровезикула», «TF», «функционально эквивалентный вариант TF», «эукариотическая клетка», «средство, которое стимулирует коагуляцию» и «фармацевтически эффективный наполнитель» подробно описаны выше и используются по существу аналогично в отношении второй фармацевтической композиции настоящего изобретения.
Первым компонентом вторых фармацевтических композиций настоящего изобретения является микровезикула, полученная способом, включающим стадии:
а) экспрессии TF или его функционально эквивалентного варианта, обладающего прокоагулянтной активностью, в эукариотической клетке; и
b) выделения несущих TF микровезикул из клеток из стадии (I).
В предпочтительном варианте осуществления эукариотической клеткой является дрожжевая клетка, в случае которого мембрана микровезикул получена из дрожжевых клеток, используемых для получения несущей TF дрожжевой микровезикулы настоящего изобретения, и она содержит липиды, которые обычно образуют часть дрожжевых мембран, белки, которые, как правило, включены в дрожжевые мембраны. Как правило, мембрана состоит из двух направленных липидных слоев (например, липидного бислоя), в которые могут быть включены белки. Липидный бислой, который представляет собой основную структуру мембран клетки, обычно образован амфипатическими молекулами (например, фосфолипидами, жирными кислотами и т.д.) в водном окружении, причем каждая молекула ориентирована гидрофильной группой в направлении внешней стороны слоя, и гидрофобной группой вовнутрь слоя. Микровезикулы образованы из мембран дрожжевых клеток или их фрагментов, таких как, например, плазматические мембраны дрожжевых клеток или их фрагменты. В другом конкретном варианте осуществления указанные полученные из дрожжей микровезикулы образованы из мембран внутриклеточных органелл дрожжевых клеток или их фрагментов, таких как ядро, аппарат Голджи, эндоплазматический ретикулум и т.п.
Указанные дрожжевые микровезикулы получают, как правило, из дрожжевых клеток, используемых в их продукции (например, после проведения гомогенизации продукта ферментации дрожжей, как показано в способе, раскрытом в примере 1). Практически любую дрожжевую клетку можно использовать для получения указанных дрожжевых микровезикул, предпочтительно, нефлокулирующие дрожжи и, предпочтительно, дрожжевые клетки, классифицированные Федеральным управлением по лекарственным средствам (FDA) как «В общем безопасные» (или GRAS) дрожжевые клетки для потребления человеком, поскольку указные GRAS-одобренные вещества не требуют предпродажного одобрения FDA, так как они по существу безвредны для животных, включая человека. Иллюстративными неограничивающими примерами дрожжевых клеток, которые можно использовать в способе получения несущей TF дрожжевой микровезикулы настоящего изобретения, являются так называемые спиртовые виды дрожжей, которые продуцируют спирт, углекислый газ, пивные дрожжи и т.п., метаболизирующие жидкое сырье для брожения. Более конкретно, предпочтительные дрожжевые клетки включают дрожжевые клетки из видов S. cerevisae и т.п., например, штамм S. cerevisiae T73 ura3-, производное штамма S. cerevisiae T73, широко используемый в винном производстве (пример 1), или видов Pichia.
Подходящий способ получения TF или его функционально эквивалентного варианта, а также выделения микровезикул из эукариотических клеток, подробно описан в контексте первого способа настоящего изобретения, и в равной степени применим к способу получения микровезикул, являющихся частью второй фармацевтической композиции настоящего изобретения.
Термин «TF» по существу соответствует описанному выше и включает как природный TF из любого биологического вида, так и его функционально эквивалентные варианты, которые подробно описаны выше, включая зрелый TF человека, укороченный TF человека, варианты гликозилирования TF, TF с присоединенным tag и варианты, несущие более одной из вышеперечисленных модификаций, например, зрелый TF, несущий гексагистидиновый tag на С-конце и мутацию N124A. В предпочтительном варианте осуществления TF представляет собой зрелый белок TF. В еще более предпочтительном варианте осуществления TF представляет собой зрелый белок TF человека. В другом предпочтительном варианте осуществления TF представляет собой зрелый белок TF человека, который несет мутацию N124A и/или несет гексагистидиновый tag на С-конце.
Указанную фармацевтическую композицию затем формулируют фармацевтически вводимую лекарственную форму, подходящую для ее введения субъекту.
На практике, в указанных композициях настоящего изобретения можно использовать любой наполнитель, который не влияет отрицательно на первые или вторые микровезикулы настоящего изобретения. В варианте осуществления указанным носителем является по существу жидкая среда, такая как среда, окружающая несущие TF микровезикулы настоящего изобретения, полученные в результате осуществления способа настоящего изобретения. Поэтому, в конкретном варианте осуществления первая композиция настоящего изобретения включает осветленный эукариотический экстракт, полученный при осуществлении способа настоящего изобретения, в который добавлен отрицательно заряженный фосфолипид.
Информацию о носителях и эксципиентах, а также об указанных лекарственных формах введения, подходящих для введения указанного продукта настоящего изобретения, можно найти в трудах по галенофармацевтике. Обзор различных фармацевтически вводимых форм лекарственных средств в основном и способов их получения можно найти в книге, озаглавленной "Tratado de Farmacia Galénica" ("Galenic Pharmacy Treatise"), C. Faulí i Trillo, 1st Edition, 1993, Luzán 5, S.A. of Ediciones.
Хотя предпочтительно, чтобы фармацевтические композиции настоящего изобретения содержали очищенные микровезикулы, также возможно, чтобы композиция содержала по существу очищенные микровезикулы. Микровезикулы можно очистить любым из способов, указанных выше, чтобы получить препарат, содержащий относительно частиц, не являющихся микровезикулами, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% микровезикул.
Вторые фармацевтические композиции настоящего изобретения содержат терапевтически эффективное количество несущих TF микровезикул. Указанное количество может варьировать в широких пределах в зависимости от дозировки, пути введения и т.п. Как правило, фармацевтические композиции настоящего изобретения могут содержать примерно от 10 мкг активных микровезикул настоящего изобретения на мл до 300 мкг активных микровезикул настоящего изобретения на мл, предпочтительно, от 20 мкг активного белка на мл до 200 мкг активного белка на мл, и, еще более предпочтительно, примерно от 50 мкг активных микровезикул настоящего изобретения на мл до 100 мкг активных микровезикул настоящего изобретения на мл.
Доза для введения субъекту может варьировать в очень широких пределах, например, примерно от 1,0 пг активных микровезикул настоящего изобретения на мл до 1,0 мг активных микровезикул настоящего изобретения на мл, предпочтительно, примерно от 0,05 мкг активных микровезикул настоящего изобретения на мл до 100 мкг активных микровезикул настоящего изобретения на мл, и, еще более предпочтительно, примерно от 0,1 мкг активных микровезикул настоящего изобретения на мл до 50 мкг активных микровезикул настоящего изобретения на мл. Доза первых или вторых микровезикул настоящего изобретения для введения будет зависеть от нескольких факторов, включая среди них свойства используемого белка TF или его фрагмента, обладающего прокоагулянтной активностью, такие как, например, их активность или биологическое время полужизни, концентрация белка TF или его фрагмента, обладающего прокоагулянтной активностью, в составе, клиническое состояние субъекта или пациента, геморрагическое расстройство, против которого проводится лечение, и т.д. Вследствие этого, указанные в настоящем описании дозы следует рассматривать только в качестве руководства для специалиста в данной области, и этот человек должен корректировать дозы в соответствии с указанными выше переменными. Тем не менее, для профилактических или терапевтических целей фармацевтическую композицию настоящего изобретения можно вводить один или несколько раз в день.
Вторые фармацевтические композиции настоящего изобретения можно предоставить в лиофилизированной форме, в которой один или более компонентов лиофилизированы. Специалисту в данной области будет очевидно, что композиции могут быть предоставлены в различных формах, таких как:
- лиофилизированные микровезикулы и стимулятор коагуляции в суспензии,
- микровезикулы в суспензии и лиофилизированный стимулятор коагуляции,
- лиофилизированные микровезикулы и лиофилизированный стимулятор коагуляции.
Когда, как микровезикулы, так и стимулятор коагуляции предоставлены в лиофилизированной форме, то оба компонента можно объединить в одном препарате, или их можно предоставить в отдельных контейнерах. Если несущие TF микровезикулы лиофилизированы, то перед введением животному их можно ресуспендировать в растворителе для повторной сборки везикул. При введении в лиофилизированном виде микровезикулы спонтанно образуются повторно при контакте композиции с гидрофильным окружением внутри организма животного. Аналогичным образом, если стимулятор коагуляции является лиофилизированным, то перед введением животному его можно ресуспендировать в растворителе для повторной сборки. При введении в лиофилизированном виде стимулятор коагуляции восстанавливается при контакте с гидрофильным окружением внутри организма животного.
Варианты терапевтического применения изобретения
Варианты применения, связанные со свертыванием крови
Различными анализами было показано, что микровезикулы настоящего изобретения, которые содержат несущие TF микровезикулы, обработанные отрицательно заряженным фосфолипидом, обладают увеличенной прокоагулянтной активностью и повышенной стабильностью. В примере 2 приведены in vitro анализы, демонстрирующие, что микровезикулы настоящего изобретения вызывают образование фибринового сгустка и коагуляцию крови как у здоровых, так и у больных индивидуумов, включая плазму и кровь здоровых пациентов, плазму с недостаточностью FVIII, FIX или FXI (анализы коагуляции в плазме); кровь от пациентов, имеющих приобретенную тромбоцитопению (анализы коагуляции в крови, обедненной тромбоцитами); плазму с недостаточностью FXI в присутствии анти-FVII антитела (анализы коагуляции в плазме); а также кровь от пациентов с гемофилией, болезнью фон Виллебранда и получающих варфарин. Эти результаты ясно показывают, что несущие TF полученные из дрожжей микровезикулы настоящего изобретения представляют собой прокоагулянтные или антигеморрагические средства, пригодные для местного лечения кровоизлияний у субъекта.
Поэтому в другом аспекте микровезикулы настоящего изобретения и фармацевтические композиции настоящего изобретения можно использовать в качестве лекарственного средства, а именно прокоагулянтного средства или в качестве антигеморрагического средства, в частности в качестве антигеморрагического средства для местного введения, при лечении кровоизлияний у субъекта. Таким образом, в другом аспекте изобретение относится к первой или второй микровезикуле настоящего изобретения для применения в качестве лекарственного средства. В дополнительных аспектах изобретение относится к способу лечения кровоизлияний у субъекта, включающему введение микровезикул или композиций настоящего изобретения указанному субъекту, к применению микровезикул или композиций настоящего изобретения для изготовления лекарственного средства для лечения кровоизлияний у субъекта, а также к микровезикуле или композиции настоящего изобретения для применения в лечении кровоизлияний.
Микровезикулы настоящего изобретения можно напрямую использовать местно для лечения кровоизлияния у субъекта, то есть, без объединения с фармацевтически приемлемым наполнителем, поскольку эти микровезикулы по существу безопасны для субъекта. Однако, как правило, предпочтительно, микровезикулы настоящего изобретения формулируют в фармацевтически вводимую форму, подходящую для их введения, предпочтительно, для их местного введения для местного (локального) лечения кровоизлияния.
Затем микровезикулы настоящего изобретения можно формулировать в фармацевтически вводимую форму, предпочтительно, в фармацевтически вводимую форму, подходящую для ее местного введения, в которую будут включены фармацевтически приемлемые носители и эксципиенты, подходящие для получения желаемой фармацевтически вводимой лекарственной формы. Информацию об указанных носителях и эксципиентах, а также об указанных вводимых формах, подходящих для введения указанного продукта настоящего изобретения, можно найти в трудах по галенофармацевтике. Обзор различных фармацевтически вводимых форм лекарственных средств в основном и способов их получения можно найти в книге, озаглавленной "Tratado de Farmacia Galénica" ("Galenic Pharmacy Treatise"), автора C. Faulí i Trillo, 1st Edition, 1993, Luzán 5, S.A. of Ediciones.
Хотя можно использовать различные фармацевтически вводимые формы микровезикул настоящего изобретения, местное введения указанного продукта является наиболее предпочтительным на практике; поэтому, указанные первые или вторые микровезикулы настоящего изобретения будут сформулированы в фармацевтическую форму, подходящую для их местного введения. Иллюстративные неограничивающие примеры указанных фармацевтических форм включают аэрозоли, растворы, суспензии, эмульсии, гели, бальзамы, кремы, повязки, пластыри, мази, ополаскиватели для рта и т.д. Для этого, первая и вторая фармацевтическая композиция настоящего изобретения будут содержать фармацевтически приемлемые наполнители, носители и/или эксципиенты, необходимые для изготовления фармацевтически вводимой формы микровезикул настоящего изобретения для местного введения.
Поэтому в конкретном варианте осуществления фармацевтические композиции настоящего изобретения представляют собой фармацевтические композиции для местного введения микровезикул настоящего изобретения, содержащие указанный продукт и фармацевтически приемлемый наполнитель, носитель или эксципиент, подходящие для местного введения указанной микровезикулы настоящего изобретения.
Иллюстративные неограничивающие примеры фармацевтически приемлемых наполнителей, носителей или эксципиентов, подходящих для местного введения указанных первых или вторых микровезикул настоящего изобретения, можно найти в трудах по галенофармацевтике.
Микровезикулы настоящего изобретения и их комбинации, и фармацевтические композиции настоящего изобретения или их комбинации можно использовать вместе с другими дополнительными лекарственными средствами, пригодными для профилактики и/или лечения геморрагического диатеза (например, факторов коагуляции, плазмы человека и т.д.), обеспечивая комбинационную терапию. Указанные дополнительные лекарственные средства могут быть частью той же фармацевтической композиции или, альтернативно, они могут быть предоставлены в виде отдельной композиции для их одновременного или последовательного (во времени) введения относительно введения фармацевтической композиции настоящего изобретения.
Фармацевтические композиции настоящего изобретения также можно поместить на подложку-носитель. Поэтому, в другом аспекте изобретение относится к продукту, содержащему фармацевтическую композицию настоящего изобретения или их комбинации и подложку-носитель. Термин «подложка-носитель» в контексте настоящего описания относится к субстрату из подходящего материала, дающему возможность помещать на него фармацевтические композиции настоящего изобретения, транспортировать их и высвобождать их в заданном месте, например, там, где фармацевтические композиции настоящего изобретения проявляют свой терапевтический эффект. Указанная подложка-носитель может представлять собой твердую подложку-носитель или нетвердую подложку-носитель, например, жидкую подложку-носитель или газообразную подложку-носитель. Иллюстративные неограничивающие примеры твердых подложек-носителей включают повязки, лейкопластыри, компрессы, пластыри и т.д. Иллюстративные неограничивающие примеры жидких подложек-носителей включают гели, спреи, ополаскиватели для рта и т.д. Иллюстративные неограничивающие примеры газообразных подложек-носителей включают воздух, пропелленты и т.д. Данный продукт, содержащий микровезикулы настоящего изобретения или фармацевтические композиции настоящего изобретения, может быть получен стандартными способами, например, смешивая микровезикулы настоящего изобретения и подложку-носитель. Взаимодействие между микровезикулами настоящего изобретения и подложкой-носителем может быть физическим или химическим в зависимости от природы компонентов везикул, композиций или фармацевтической композиции настоящего изобретения и используемой подложки-носителя.
В другом аспекте изобретение относится к микровезикулам настоящего изобретения или фармацевтической композиции настоящего изобретения или их комбинациям для лечения кровоизлияний у субъекта, в частности, для местного лечения кровоизлияний у здорового субъекта или у субъекта с геморрагическим диатезом.
Термин «местное лечение» в контексте настоящего изобретения относится к применению лечения напрямую в месте, где оно требуется, например, на участках кожи с нарушенной целостностью (порезы и т.д.) и ткани сосудов (в местах разрывов сосудов и т.д.) при венозном и артериальном кровотечении вследствие отрытых ран, хирургического вмешательства и т.д., а также при кожно-слизистных и капиллярных кровоизлияниях.
Согласно настоящему изобретению и как показано в примере 2, микровезикулы настоящего изобретения могут действовать в качестве прокоагулянтного или антигеморрагического средства, и, соответственно, указанный продукт можно использовать для лечения или корректировки геморрагических расстройств, в частности, геморрагических расстройств, ассоциированных с геморрагическим диатезом.
Термин «геморрагический диатез» относится к процессу, вызывающему нарушение гемостаза, и в результате приводящему к возникновению геморрагического синдрома, который может время от времени проявляться продолжительным и массированным кровотечением. Геморрагический диатез может быть вызван врожденной или приобретенной коагулопатией и/или врожденной или приобретенной патологией тромбоцитов.
Термин «коагулопатия» относится к патологии факторов коагуляции. Это расстройство может быть следствием недостатка или дефицита конкретного фактора коагуляции, следствием чего будет возникновение геморрагического синдрома, или оно может быть следствием нарушения функции факторов коагуляции. Коагулопатия, как правило, может являться врожденной коагулопатией или приобретенной коагулопатией.
В качестве иллюстративных неограничивающих примеров врожденных коагулопатий можно привести недостаточность факторов коагуляции, выбранных из фактора коагуляции V (FV), фактора коагуляции VII (FVII), фактора коагуляции VIII (FVIII), дефицит или недостаточность которых вызывают гемофилию А, фактора коагуляции IX (FIX), дефицит или недостаточность которого вызывают гемофилию B, фактора коагуляции X (FX), фактора коагуляции XI (FXI), дефицит или недостаточность которых вызывают гемофилию C, фактора коагуляции XII (FXII), фактора коагуляции XIII (FXIII) и их комбинаций.
Приобретенные коагулопатии могут иметь различное происхождение. Иллюстративные примеры включают недостаточный синтез факторов коагуляции при тяжелой печеночной недостаточности, антикоагулянтную терапию (такую как терапия гепарином, низкомолекулярным гепарином, варфарином, производными кумарина, дикумаринами и т.д.). Альтернативный механизм основан на избыточном потреблении факторов коагуляции, так что они не доступны для образования сгустка в месте кровотечения. Этот механизм встречается при синдроме диссеминированного внутрисосудистого свертывания или коагулопатии вследствие истощения факторов, возникающего при множестве заболеваний, например при тяжелом сепсисе, повреждающем эндотелий капилляров, активирующем тромбоциты и факторы коагуляции с образованием множества микротромбов; при выбросе TF в кровь, например при отделении плаценты; нахождения мертвого плода в матке; при множественных травмах с повреждением тканей; при укусах ядовитых змей и т.д. При васкулите пристеночное и эндотелиальное повреждение высвобождает активаторы коагуляции. Истощение факторов коагуляции осложняется лизисом фибрина множественных микротромбов вследствие воздействия плазмина с высвобождением PDF, который обладает антитромбоцитарным и антикоагулянтным действием.
Термин «патология тромбоцитов» относится к нарушению, как числа, так и функций тромбоцитов, результатом чего является возникновение геморрагического синдрома. Указанная патология тромбоцитов может быть врожденной или приобретенной.
В конкретном варианте осуществления указанной патологией тромбоцитов является врожденная патология тромбоцитов. Иллюстративные неограничивающие примеры врожденных патологий тромбоцитов включают болезнь Гланцмана, болезнь Бернара-Сулье, синдром Болина-Джемесона, синдром Вискотта-Олдрича, синдром Пари-Труссо-Якобсена, Х-сцепленную тромбоцитопению, тромбоцитарный синдром Грея, синдром Себастьяна и анемию Фанкони.
В другом конкретном варианте осуществления указанной патологией тромбоцитов является приобретенная патология тромбоцитов. Иллюстративные неограничивающие примеры приобретенных патологий тромбоцитов включают миелопролиферативные заболевания, такие как тромбоцитоз, полицитемия, хроническая миелоцитарная лейкемия и т.д.; существуют функциональные патологии тромбоцитов при миелоидной метаплазии с увеличенным временем кровотечения, нарушением задерживания на стеклянных шариках, нарушением агрегации тромбоцитов, аномальным высвобождением и нарушением фактора тромбоцитов III. Функциональные нарушения тромбоцитов были найдены при диспротеинемиях при цинге и врожденном пороке сердца, а также при циррозе.
Термины «приобретенная коагулопатия» и «приобретенная патология тромбоцитов» относятся к происхождению заболевания, которое может быть ятрогенным или вторичным относительно другого заболевания.
Термин «субъект» в контексте настоящего описания включает любого члена животного вида, включая человека; в качестве иллюстративного неограничивающиего примера указанным субъектом может быть млекопитающее, такое как примат, домашнее животное, грызун и т.д., причем указанным субъектом предпочтительно является мужчина или женщина любого возраста и расы. В конкретном варианте осуществления указанным субъектом является человек, до этого не имевший нарушений гемостаза, такой как индивидуум, не имеющий коагулопатий или патологий тромбоцитов. В других конкретных вариантах осуществления указанным субъектом является человек, у которого ранее диагностировали нарушения гемостаза, такой как индивидуум, имеющий геморрагический диатез, например коагулопатию, такую как врожденная или приобретенная коагулопатия, или патологию тромбоцитов, такую как врожденная или приобретенная патология тромбоцитов.
Поэтому в конкретных вариантах осуществления изобретение относится к микровезикулам настоящего изобретения или фармацевтическим композициям настоящего изобретения при получении лекарственного средства для местного лечения кровоизлияний у человека, не имеющего истории нарушений гемостаза. В другом конкретном варианте осуществления изобретение относится к применению микровезикул настоящего изобретения или фармацевтических композиций настоящего изобретения при получении лекарственного средства для местного лечения кровоизлияния у человека, имеющего геморрагический диатез.
Варианты применения в области заживления ран
Кроме своей роли в коагуляции крови TF стимулирует восстановление и заживление ран (Nakagawa, et al. (1998) Seminars in Thromb. and Hemostasis 24:207-210; Philippart, et al. (2003) The Internatl. J. of Oral and Maxillofacial Implants 3:411-416).
Таким образом, в другом аспекте изобретение относится к применению микровезикул настоящего изобретения или фармацевтической композиции настоящего изобретения при получении лекарственного средства для заживления ран. Альтернативно, изобретение относится к микровезикуле настоящего изобретения или фармацевтическим композициям для применения при получении лекарственного средства для заживления ран. Альтернативно, изобретение относится к способу заживления ран у пациента, включающему введение указанному субъекту микровезикулы настоящего изобретения или фармацевтической композиции настоящего изобретения.
Выражение «заживление ран» относится к заживлению ран любого типа и в любом месте. Это может быть нормальное и нарушенное заживление ран. Последнее встречается, в частности, в случае заболеваний, таких как сахарный диабет, васкулит, артериально-окклюзионная болезнь, хроническая венозная или инфицированная язва, а также плохо заживающая язва желудка. Нарушенное заживление ран также встречается в случае нарушения иннервации, такого как параплегия, лепра, нейропатия и т.д., и пролежни у людей, нуждающихся в уходе. Нарушенное заживление ран также встречается, если после операционного вмешательства встречаются слабые швы и нарушенное заживление раны, в частности, кишечника, и при пересадке кожи и других органов, соответственно. Нарушенное заживление ран также встречается в случае переломов костей, ожогов и лечения с использованием стероидов.
В настоящем изобретении «заживление раны» или «восстановление раны» относится к сложному процессу, в котором кожа (или какой-либо другой орган) восстанавливается после повреждения. В контексте настоящего описания термин «рана» включает повреждение любой ткани, включая, например, медленно или сложно заживающие раны и хронические раны. Примеры ран могут включать как открытые, так и закрытые раны. Термин «рана» также может включать, например, повреждения кожи и подкожной ткани, вызванные различными причинами (например, пролежни в результате продолжительного лежачего положения и раны в результате травмы) и с различными характеристиками. Раны можно классифицировать по четырем степеням в зависимости от глубины раны: i) раны I степени, ограниченные эпителием; ii) раны II степени, затрагивающие дерму; iii) раны III степени, затрагивающие подкожную ткань; и iv) раны IV степени (или полнослойные раны), которые открывают кость (например, костная точка пережатия, такая как большой вертел бедренной кости или крестец).
Термин «хроническая рана» в основном относится к ране, которая не заживает. Например, хроническими считают раны, которые не заживают в течение трех месяцев. Хроническими ранами считают венозные язвы, венозные трофические язвы, артериальные язвы, пролежни, диабетические язвы, диабетические язвы на ногах, язвы при васкулите, пролежни, ожоговые язвы, травматические язвы, инфекционные язвы, смешанные язвы и гангренозную пиодермию. Хронической раной может быть артериальная язва, которая включает изъязвление, возникающее в результате полной или частичной закупорки артерии. Хронической раной может быть венозная или венозная трофическая язва, которая включает изъязвление в результате нарушения функции венозных клапанов и ассоциирована с сосудистым заболеванием. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана характеризуется одной или несколькими стадиями пролежней по классификации AHCPR: стадия 1, стадия 2, стадия 3 и/или стадия 4.
В контексте настоящего описания хроническая рана может относиться, например, к ране, которая характеризуется, по меньшей мере, частично, одним или несколькими следующими признаками: (1) хроническое постоянное воспаление раны; (2) недостаточный и нарушенный внеклеточный матрикс раны; (3) плохо отвечающие (замершие) клетки раны, особенно фибробласты, ограничивающие продукцию внеклеточного матрикса; и/или (4) неспособность к реэпителизации вследствие частичного отсутствия необходимой организации матрикса и отсутствия каркаса для миграции. Хронические раны также могут отличаться: (1) продолжительным воспалением и протеолитической активностью, приводящей к язвенным повреждениям, включая, например, диабетические, пролежневые, венозные и артериальные язвы; (2) прогрессирующее отложение матрикса в пораженной области; (3) длительное заживление; (4) меньшее закрытие раны; (5) замедленная реэпителизация; и (6) утолщение грануляционной ткани.
Примеры хронических ран могут включать «пролежневые язвы». Типичные пролежневые язвы можно разделить на 4 стадии, исходя из руководства AHCPR (Агентства по политике и исследованиям в области здравоохранения и социального обеспечения). Стадией 1 пролежневой язвы является заметное связанное с давлением изменение интактной кожи, чьи признаки по сравнению с прилегающей или противоположной областью на теле могут включать изменения одного из следующих признаков: температура кожи (теплая или холодная), прочность кожи (плотная или дряблая на ощупь) и/или ощущения (боль, зуд). Язва представляется в виде четко очерченной области постоянной красноты на слегка пигментированной коже, в то время как на более темной коже, язва может проявляться постоянно красным, голубым или пурпурным цветом. Стадия 1 язвенного поражения может включать не бледнеющую эритему на интактной коже и первичное язвенное поражение кожи. У индивидуумов с более темной кожей, индикаторами образования язвы 1-й степени могут быть депигментация кожи, повышение температуры, отек, уплотнение или одеревенение. Стадию 2 язвенного поражения можно охарактеризовать потерей части кожного слоя, включая эпидермис, дерму или оба слоя. Язва является поверхностной и клинически представлена в виде эрозии, волдыря или мелкой полости. Стадию 3 язвенного поражения можно охарактеризовать потерей полного слоя кожи, включая повреждение или некроз подкожной ткани, который может достигать, но не затрагивать предлежащую фасцию. Клинически язва представляет собой глубокую полость с или без разрушения прилегающей ткани. Стадию 4 язвенного поражения можно охарактеризовать потерей полного слоя кожи с интенсивным разложением, некрозом ткани или повреждением мышцы, кости или поддерживающих структур (например, сухожилий, суставной сумки). В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана характеризуется одной или несколькими стадиями пролежневой язвы по классификации AHCPR: стадия 1, стадия 2, стадия 3 и/или стадия 4.
Примеры хронических ран также могут включать «пролежни». Типичные пролежни могут возникнуть в результате продолжительного и не устраняемого давления на тело в области костных выступов, которое приводит к ишемии. Рана обычно возникает у пациентов, которые неспособны перемещать свое тело для смены нагрузки, таких как парализованные, находящиеся в бессознательном состоянии или сильно ослабленные пациенты. Согласно данным Департамента здравоохранения и социальной защиты населения США основные профилактические меры включают идентификацию пациентов с высокой степенью риска; частые осмотры и профилактические меры, такие как изменение положения тела по расписанию, соответствующее ложе со сниженным давлением на тело, влагоизолирующие прокладки и подходящее питание. Варианты лечения могут включать, например, снижение давления на тело, хирургическое или ферментативное удаление омертвевших тканей, уход за мокнущей раной и контроль бактериальной обсемененности. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хронической раной является пролежень или язвенное поражение, возникшие в результате продолжительного и не устраняемого давления на тело в области костных выступов, которое приводит к ишемии.
Хронические раны могут включать «артериальные язвы». Под хроническими артериальными язвами, как правило, понимают язвенные поражения, сопровождающие атеросклеротическое и гипертоническое сердечно-сосудистое заболевание. Они болезненны, имеют четко очерченные края и часто возникают по бокам нижних конечностей и на пальцах ног. Артериальные язвы могут отличаться полной или частичной закупоркой артерии, что может привести к некрозу и/или язвенному поражению ткани. Признаки артериальной язвы могут включать, например, отсутствие пульса в конечности; болезненное язвенное поражение; мелкие точечные язвы, которые обычно хорошо очерчены; прохладную или холодную кожу; увеличенное время заполнения капилляров (быстро нажать на конец пальца и отпустить, нормальный цвет должен вернуться к пальцу в течение 3 секунд или меньше); атрофический вид кожи (например, блестящая, тонкая, сухая); и потерю волос на пальцах и ногах. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой артериальные язвы или язвенные поражения вследствие полной или частичной закупорки артерии.
Примеры хронических ран могут включать «венозные язвы». Типичные венозные язвы являются наиболее часто встречающимся типом язвы, затрагивающим нижние конечности и характеризуются нарушением функций венозных клапанов. Здоровая вена имеет клапаны, которые предупреждают обратный ток крови. Когда эти клапаны перестают работать, то обратный ток венозной крови вызывает венозный застой. Гемоглобин вытекает из красных клеток крови и проникает во внесосудистое пространство, вызывая часто отмечаемую коричневатую пигментацию. Было показано снижение чрескожного давления кислорода на кожу, окружающую венозную язву, позволяя предположить присутствие сил, препятствующих нормальной васкуляризации области. Лимфатический дренаж и кровоток также играют роль в возникновении данных язв. Венозная язва может появиться около внутренней лодыжки и обычно возникает в сочетании с отекшей и уплотненной нижней конечностью; она может быть неглубокой, не очень болезненной и может сопровождаться мокнущими выделениями из пораженного участка. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой венозные язвы или язвенные поражения вследствие нарушения функций венозных клапанов и ассоциированных с сосудистым заболеванием. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой артериальные язвы или язвенные поражения вследствие полной или частичной закупорки артерии.
Примеры хронических ран могут включать «венозные трофические язвы». Трофические язвы представляют собой поражения, ассоциированные с венозной недостаточностью, и наиболее часто представлены над внутренней лодыжкой, обычно, в сочетании с выраженным отеком (остается ямка после надавливания), варикозным расширением вен, пятнистой пигментацией, эритемой и непальпируемыми петехиями и пурпурой. Застойный дерматит и язвы обычно вызывают зуд, и не являются болезненными. Типичные венозные трофические язвы могут характеризоваться хроническим пассивным венозным застоем в нижних конечностях, приводящим к локальной гипоксии. Один возможный механизм этих ран включает препятствие диффузии кислорода в ткани через околососудистые отложения фибрина. Другим механизмом является захват макромолекулами, проникающими в околососудистые ткани, факторов роста, необходимых для поддержания целостности кожи. Дополнительно, скорость движения крупных белых клеток крови замедляется вследствие венозного застоя, закупоривающего капилляры, они активируются и повреждают сосудистый эпителий, создавая предрасположенность к образованию язвы. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой венозные язвы или язвенные поражения вследствие нарушения функции венозных клапанов и ассоциированного сосудистого заболевания. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой венозные трофические язвы или язвенные поражения вследствие хронического пассивного венозного застоя в нижних конечностях и/или возникающей в результате локальной гипоксии.
Примеры хронических ран могут включать «диабетические язвы». Пациенты с диабетом склонны к образованию язв, включая язвенные поражения ступней вследствие как неврологических, так и сосудистых осложнений. Периферическая нейропатия может вызвать изменение или полную потерю чувствительности в ступнях и/или ногах. Имеющие диабет пациенты с выраженной нейропатией полностью теряют способность различать острые и тупые объекты. У пациента с нейропатией любой порез или травма стопы может оставаться полностью незамеченной в течение дней или недель. Довольно часто встречается, что пациент с нейропатией замечает, что язва «только что появилась», тогда как в действительности язва присутствовала уже в течение достаточно длительного времени. Для пациентов с нейропатией было показано, что жесткий контроль уровня глюкозы замедляет развитие заболевания. В результате снижения чувствительности также может возникнуть стопа Шарко. Люди с «нормальной» чувствительностью в стопах способны автоматически чувствовать, когда на область стопы прилагается слишком большое давление. При этом наше тело инстинктивно изменяет положение для снятия стресса. Пациент с выраженной нейропатией теряет способность чувствовать постоянное воздействие давления, поэтому, в результате могут возникнуть ишемия ткани и некроз, приводящие, например, к язвенному поражению подошвы. Дополнительно, микротрещины в костях стопы, оставаясь незамеченными и невылеченными, могут приводить к деформации, хроническому отеку стопы и дополнительным костным выступам. Болезнь капилляров является одним из серьезных осложнений диабета, которое также может привести к образованию язв. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой язвы и/или язвенные поражения диабетической стопы вследствие как неврологических, так и сосудистых осложнений диабета.
Примеры хронических ран могут включать «травматические язвы». Травматические язвы могут возникнуть в результате травматических повреждений тела. Эти травмы включают, например, нарушения артериальной, венозной или лимфатической систем; изменение расположения костей скелета; потерю слоев ткани - эпидермиса, дермы, подкожной мягкой ткани, мышцы или кости; повреждение частей тела или органов и потерю частей тела или органов. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой язвенные поражения, ассоциированные с травматическими повреждениями тела.
Примеры хронических ран могут включать «ожоговые язвы», включая ожог 1-й степени (то есть, поверхностный, покрасневшая область кожи); ожог 2-й степени (пузыри на месте поражения, которые могут зажить спонтанно после удаления содержимого волдыря); ожог 3-й степени (ожог, затрагивающий весь слой кожи и обычно требующий хирургического вмешательства для заживления раны); ошпаривание (может возникнуть после ошпаривания горячей водой, маслом или радиаторной жидкостью); термический ожог (может возникнуть в результате действия пламени, обычно это глубокие ожоги); химический ожог (может быть следствием действия кислоты и щелочи, обычно это глубокие ожоги); электрический ожог (либо при воздействии низкого напряжения в жилом доме, либо при воздействии высокого напряжения на рабочем месте); ожог в результате вспышки при взрыве (обычно поверхностные повреждения); и контактный ожог (обычно глубокий и может возникнуть при контакте с выхлопной трубой глушителя, горячим утюгом и плитой). В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой язвенные поражения, ассоциированные с ожоговыми поражениями тела. Примеры хронических ран могут включать «язвы при васкулите». Язвы при васкулите также возникают на нижних конечностях и являются болезненными, четко очерченными повреждениями, которые могут быть ассоциированы с пальпируемой пурпурой и геморрагическими пузырями. Коллагеновые болезни, септицемии и различные гематологические нарушения (например, тромбоцитопения, диспротеинемия) могут быть причиной этого тяжелого острого состояния. Примеры хронических ран могут включать гангренозную пиодермию. Гангренозная пиодермия возникает в виде одного или множественных очень легко повреждаемых язв в нижней части ног. Углубленные границы, окружающие гноящееся центральное повреждение, имеют цвет от темно-красного до малинового. Биопсия, как правило, не выявляет васкулита. У половины пациентов она ассоциирована с системным заболеванием, таким как язвенный колит, регионарный илеит или лейкемия. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой язвенные поражения, ассоциированные с гангренозной пиодермией. Примеры хронических ран могут включать инфекционные язвы. Инфекционные язвы образуются после прямого заражения множеством организмов и могут быть ассоциированы со значительной регионарной аденопатией. Примерами являются микобактериальная инфекция, сибирская язва, дифтерия, бластомикоз, споротрихоз, туляремия и болезнь «кошачьей царапины». Генитальные язвы при первичном сифилисе, как правило, являются жесткими с чистым, плотным основанием. Мягкий шанкр и венерическая гранулема скорее будут неровными, грязными и более нестандартного вида поражениями. В некоторых вариантах осуществления изобретение относится к способу лечения хронической раны, в котором хроническая рана представляет собой язвенные поражения, ассоциированные с инфекцией. В контексте настоящего описания термин «открытая рана» относится к ране, обычно, хирургической ране, которая разорвана или открыта. В некоторых вариантах осуществления изобретение относится к способу лечения раны, которая не заживает с ожидаемой скоростью, причем рана представляет собой открытую рану.
Подходящие носители, которые можно использовать, описаны выше. Лекарственное средство, которое содержит первую и вторую микровезикулу настоящего изобретения и их комбинацию, может также содержать другие соединения, используемые для заживления ран.
Варианты применения, связанные с ангиогенезом
В дополнение к своей роли в коагуляции крови TF участвует в ангиогенезе. Это открытие было сделано, когда обнаружили, что мыши с нокаутом гена TF не способны развиваться после эмбрионального дня 9-10 из-за невозможности развития кровеносных сосудов (Carmeliet, et al., 1996, Nature 383:73-75; Bugge et al., 1996, Proc.Natl.Acad.Sci.USA, 93: 6258-6263; Toomey, et al., 1996, Blood 88: 1583-1587). Дополнительные исследования показали, что активация протеаз, задействованных в коагуляции, может приводить к активации протеаз-активируемых рецепторов, что вызывает увеличение продукции факторов роста сосудистого эндотелия, которые стимулируют ангиогенез (Richard, et al., 2002, Oncogene 20: 1556-1562; Milia, et al., 2002, Circ. Res. 91: 346-352). В дополнение, сверхэкспрессия TF в опухолевых клетках стимулирует рост, васкуляризацию и метастазирование опухоли (Mueller, et al., 1992, Proc.Natl.Acad.Sci.USA, 89: 11832-11836).
Поэтому в другом аспекте изобретение относится к применению первой или второй микровезикулы настоящего изобретения или их комбинаций, первой или второй композиции настоящего изобретения или их комбинаций, или первой, или второй фармацевтической композиции настоящего изобретения или их комбинаций при получении лекарственного средства для лечения заболевания, ассоциированного с недостаточным ангиогенезом.
Ангиогенез представляет собой процесс, с помощью которого образуются новые кровеносные или лимфатические сосуды в результате развития из существующих сосудов. Термин «заболевание, ассоциированное с недостаточным ангиогенезом» в контексте настоящего изобретения относится к заболеваниям, которые можно излечить, активируя образование сосудов. Выражение «образование сосудов» относится к любому типу и любому месту. Стимуляция образования сосудов может быть полезна при ряде клинических состояний. Например, проангиогенные TF-несущие микровезикулы настоящего изобретения можно использовать для стимуляции ангиогенеза коллатеральных сосудистых путей в ткани миокарда в течение или после ишемической болезни, инфаркта миокарда или после коронарного шунтирования. Другие заболевания или состояния, которые можно лечить с помощью несущих TF микровезикул настоящего изобретения, включают сосудистые заболевания и/или ишемические заболевания, вызывающие патологические изменения в периферической или центральной нервной системе. Такие состояния/заболевания могут включать инсульты, например, вызванные тромбоэмболией или разрывом аневризмы, или общую/локальную ишемию, взывающую гибель нейронов или периферическое функциональное нарушение, такое как в моторных или сенсорных функциях, или нарушение речи, ишемическую кардиомиопатию, или заболевание периферических артерий, такое как перемежающаяся хромота, вызванная хронической ишемией конечностей (скелетных мышц), боль в состоянии покоя/ишемическое язвенное поражение/гангрена. Более того, стимуляция образования сосудов подходит для замены нарушенных, например, старых кровеносных сосудов. Они могу присутствовать, например, в мозге или сердце, так что можно предупредить или лечить инсульт или инфаркт. Профилактические меры также можно осуществлять в отношении пресбиофрении. В дополнение, изобретение относится к образованию сосудов при лечении атеросклероза, болезни Крона и язвенного колита, диабетической ретинопатии и тромбоза глубоких ножных вен/тромбофлебита, а также для профилактики рецидивов.
Пациента, страдающего от заболевания, ассоциированного с недостаточным ангиогенезом, можно лечить микровезикулами настоящего изобретения или с помощью фармацевтической композиции настоящего изобретения, или их комбинациями в сочетании с анти-ангиогенной терапией, противораковой терапией или другим типом терапии, известным для лечении заболевания или состояния.
В контексте настоящего описания «терапия» включает, но не ограничена этим, известное лекарственное средство. Раковые заболевания, которые поддаются лечению способами по настоящему изобретению, включают все солидные опухоли и метастазирующие раковые заболевания, включая, но без ограничения, раковые заболевания, выбранные из раковых заболеваний мочевого пузыря, молочных желез, печени, костной ткани, почки, толстой кишки, яичников, предстательной железы, поджелудочной железы, легких, головного мозга и кожи. Изобретение включает, но не ограничено этим, лечение ракового заболевания первыми или вторыми микровезикулами настоящего изобретения или их комбинацией, индивидуально или в комбинации с химиотерапией, или в комбинации с радиационной терапией способами, известными в данной области (см. патент США 6596712).
Наборы настоящего изобретения
В другом аспекте изобретение относится к набору, содержащему микровезикулу настоящего изобретения, а также к применению указанной микровезикулы для определения фактора антикоагулянтной терапии в образце.
В контексте настоящего описания термин «набор» используют в отношении комбинации изделий, которые облегчают процесс, способ, метод, анализ или манипуляцию с образцом. Эти наборы обеспечивают материалы, необходимые для осуществления способов, описанных в настоящем описании.
Термин «фактор антикоагулянтной терапии» (ATF) в контексте настоящего описания относится к параметру, который полезен при решении о необходимости для пациента антикоагулянтной терапии. Факторы антикоагулянтной терапии включают, но без ограничения, протромбиновое время (PT), международное нормализованное отношение (INR), модифицированный ATF (MATF), корректированный ATF (CATF), протромбиновое отношение (PR) и скорость трансформации фибриногена (FTR).
Термин «протромбиновое время», «PT» или его грамматические эквиваленты в контексте настоящего описания означает тесты на время свертывания крови, которые пригодны для наблюдения за лечением индивидуумов, имеющих риск избыточного тромбообразования (тромбоза). Протромбиновое время относится к периоду времени, вычисленного от момента добавления тканевого фактора - кальция к образцу до момента, когда начинается превращение фибриногена в фибрин. Протромбиновое время обычно определяют приведением в контакт различных разведений нормальной плазмы крови (предпочтительно, разведений 1:2, 1:4, 1:10, 1:20 и 1:40 в 0,15M NaCl), получая образцы, имеющие сниженную активность фактора (50, 25, 10, 5 и 2,5%, соответственно). Первые или вторые везикулы настоящего изобретения добавляют к образцам, и время, необходимое для формирования сгустка в образце, измеряют оптически.
Протромбиновое отношение (PR) в контексте настоящего изобретения относится к другому измерению свертывания крови, которое вычисляют делением PT плазмы пациента на PT пула плазмы здоровых индивидуумов.
Наборы и варианты применения изобретения можно использовать в лаборатории, занимающейся исследованиями свертывания крови. Варианты данного теста имеют ряд применений (White, et al., Hemostasis and Thrombosis, Basic Principles and Clinical Practice, Coleman, et al., eds., J. B. Lippencott Co., Philadelphia, pp. 1048-1060, 1987). Одним вариантом применения является оценка нарушений во внешнем пути коагуляции крови (факторы VII, X, V и протромбин). Вторым вариантом применения является наблюдение за пациентами, получающими пероральную антикоагулянтную терапию в течение длительного времени, направленную против заболеваний, таких как рецидивирующий венозный тромбоз и рак (Hirsh, J., Seminars in Thrombosis and Hemostasis, 12: 1-11, 1986). Третьим вариантом применения является оценка печеночной дисфункции.
Терапевтический диапазон антикоагулянтной терапии основан на предупреждении кровотечения и тромболитических осложнений. При мониторинге пероральной антикоагулянтной терапии, а также других различных состояний, с помощью PT-теста, увеличение протромбинового времени в два раза является наиболее желательным для продолжительной терапии (O'Reilly, Hemostasis and Thrombosis, Basic Principles and Clinical Practice, Coleman, et al., eds., J. B. Lippencott Co., Philadelphia, pp. 1367-1372, 1987). Этот фактор увеличения определяют как протромбиновое отношение (PR) и вычисляют делением PT для плазмы пациента на РТ для пула плазмы здоровых индивидуумов. Более высокое PR указывает на более чувствительный PT-реагент. Выгодой более чувствительного реагента для мониторинга антикоагулянтной терапии является применение меньших доз антикоагулянтного лекарственного средства. Эти более низкие дозы все еще обеспечивают подходящую защиту от тромбоэмболического заболевания, одновременно минимизируя осложнения в виде кровотечений.
В дополнение, набор может содержать упаковку, которая дает возможность хранить реагенты в определенных пределах. Подходящие материалы для изготовления таких упаковок включают стеклянные, пластиковые (полиэтиленовые, полипропиленовые, поликарбонатные и т.п.) флаконы, ампулы, бумагу, саше и т.п. Набор настоящего изобретения может дополнительно содержать инструкции по применению реагента или реагентов в способе настоящего изобретения. Указанные инструкции могут представлять собой печатный материал или могут быть представлены в электронной форме, на которой могут храниться инструкции, доступные для чтения субъекту, такой как электронные носители (магнитные диски, пленки и т.п.), оптические носители (CD-ROM, DVD) и т.п. Дополнительно или альтернативно, носители могут содержать интернет-вебсайты, на которых представлены указанные инструкции.
Изобретение подробно описано посредством следующих примеров, которые следует считать только иллюстративными и не ограничивающими объем изобретения.
ПРИМЕРЫ
Способы
Анализы коагуляции в плазме
Спонтанную прокоагулянтную активность (нестимулированную) в плазме измеряли двухстадийным анализом коагуляции в 4-канальном коагулометре (Start 4, Diagnostica Stago). Кратко, 50 мкл обедненной тромбоцитами плазмы добавляли в подготовленные кюветы и добавляли 50 мкл образца (TF или дистиллированной воды в качестве контроля). Эту смесь оставляли инкубироваться в течение 60 секунд при 37°C, после этого сразу добавляли 50 мкл 25 мМ раствора хлорида кальция, и определяли время коагуляции в секундах в коагулометре, проверяемое образованием сгустка. Обедненную тромбоцитами плазму получали центрифугированием, и число тромбоцитов определяли с помощью Coulter.
Прокоагулянтный эффект TF на плазму крови с недостаточностью факторов коагуляции (FVIII, FIX или FXI), соответствующую гемофилии А, В или С, соответственно, исследовали, используя коммерчески доступные плазмы (Dade Behring Marburg GmbH), истощенные по факторам посредством иммуно-аффинных методик. В каждом случае конечное содержание указанных факторов коагуляции было менее 1%.
Прокоагулянтный эффект при состоянии, аналогичном тромбоцитопении, исследовали на плазме, истощенной по тромбоцитам с помощью последовательного центрифугирования.
Анализы коагуляции в цельной крови
Прокоагулянтную активность в цельной крови (с сохраненной системой свертывания) определяли анализом коагуляции. Различные исследуемые агенты (mTF) добавляли в конечном объеме 0,2 мл к 0,8 мл цельной крови (с сохраненной системой свертывания), и время коагуляции измеряли хронометром от начала забора крови до появления стабильного и хорошо затвердевшего сгустка крови. Эффект различных агентов оценивали по их способности укорачивать или удлинять время коагуляции.
Образцы цельной крови получали от пациентов или здоровых добровольцев.
ПРИМЕР 1
Получение прокоагулянтного продукта на основе экспрессии в дрожжах полноразмерного белка TF, модифицированного his-tag (ТТ-173)
Описанный в WO 2008080989 дрожжевой эписомальный вектор, содержащий ген URA3, ген устойчивости к ампициллину, дрожжевую точку инициации репликации 2 мк, промотор глицеральдегид-3-фосфат-дегидрогеназы (GPD) и дрожжевой сигнал терминации транскрипции фосфоглицераткиназы использовали для клонирования под контролем GPD-промотора кДНК, кодирующей зрелый белок hTF (аминокислоты 33-295 в SEQ ID NO:1) с 18 дополнительными нуклеотидами (кодирующими шесть гистидинов) на 3'-конце и мутацией Asn124Ala, которая инактивирует один из потенциальных сайтов N-гликозилирования в последовательности природного hTF (SEQ ID NO:6).
После трансформации дрожжевого штамма T73 ura3- отбирали штаммы, способные расти на среде без урацила, и тестировали на их способность экспрессировать hTF с помощью Вестерн-блот анализа дрожжевых экстрактов, по существу, как описано в WO 2008080989.
Для того чтобы оценить возможность масштабирования до предпромышленного уровня получения дрожжевых экстрактов, проводили ферментацию в 2-литровом биореакторе (Biostat B-2L. BRAUN), выращивая клетки при 30°C и скорости перемешивания 250-300 об/мин, рН 4,5 и токе воздуха 6 л/л. Состав культуральной среды: CSM-URA: 0,78 г/л; YNB: 6,7 г/л; сахароза: 20 г/л. Ферментацию останавливали, когда культура достигала OD 8,0.
Продукт, получающийся в результате ферментации, собирали центрифугированием при 3000 об/мин (1200×g) в течение 10 мин и ресуспендировали в 200 мл буфера для лизиса (20 мМ фосфатный буфер (pH 7,4), 50 мМ NaCl). Дрожжи гомогенизировали высоким давлением (1000 бар (108 Па)) (гомогенизатор NIRO SOAVIS. Panda 2K), и гомогенат центрифугировали при 13000 об/мин (13000×g) в течение 30 мин при 4°C. Осадок отбрасывали, и собирали супернатант, называемый осветленным дрожжевым экстрактом (CYE).
Полученный CYE, содержащий rTF, фракционировали последовательными стадиями фильтрации в тангенциальном потоке в Crossflow Filtration System (Sartorius sartoflow Slice 200 Benchtop), используя фильтры с постепенным уменьшением размера пор (мембраны с размером пор 0,45 мкм, 0,2 мкм и 0,1 мкм (Sartorius, полисульфон).
Прокоагулянтная активность различных ретентатов (удерживаемое фильтром) и пермеатов (пропускаемое фильтром), полученных из четырех независимых CYE после последовательных стадий фильтрации представлена в таблице 1. Присутствие TF в каждой из четырех фракций MFR 0,1 (ретентата при фильтрации на мембране с размером пор 0,1 мкм) показано на фиг.1.
Средняя прокоагулянтная активность ретентатов при микрофильтрации (MFR) и пермеатов при микрофильтрации (MFP) для четырех независимых CYE после фильтрации в тангенциальном потоке. Метод анализа коагуляции описан в разделе «Способы»
Таким путем получали очищенный препарат дрожжевых везикул (далее называемый ТТ-173), обладающий прокоагулянтными свойствами, определенными с использованием различных in vitro и in vivo анализов, по существу, как описано в WO 2008080989. Этот результат указывает на то, что применение методик фильтрации в тангенциальном потоке для очистки продукта ТТ-173 дает возможность выделить биологически активный hTF, который ассоциирован с дрожжевыми мембранными микровезикулами.
ПРИМЕР 2
Усиление биологической активности ТТ-173 добавлением PS
2.1. Воздействие фосфатидилсерина (PS) на биологическую активность ТТ-173
PS (0,1 мМ) добавляли к ТТ-173, и смесь инкубировали до 4 ч. В различных временных точках, начиная со времени добавления PS (время 0), аликвоту смеси TT-173/PS проверяли на свертывающую активность в стандартном коагулометрическом анализе.
Результаты, представленные на фиг.2, явно показывают, что добавление PS уменьшает время коагуляции приблизительно на 10 с (панель А), что соответствует увеличению специфичной активности в шесть раз (панель В), и эта амплификация зависит от времени, достигая максимума через 1-2 часа после добавления PS.
Незначительный эффект самого PS на время коагуляции (не показан) и увеличение в наблюдаемом стимулирующем действии в течение первого часа после его добавления к TT-173, дает возможность предположить возникновение некоторого взаимодействия между ТТ-173 и PS, и что это взаимодействие важно для ускорения свертывания.
Этот эффект был специфичен для отрицательно заряженных фосфолипидов, поскольку добавление незаряженных или положительно заряженных фосфолипидов в аналогичных концентрациях (0,1 мМ) не вызывало детектируемого увеличения свертывающей активности ТТ-173. В частности, ни один из фосфатидилсерина (PS), фосфатидилэтаноламина (PE), сфингомиелина (SM) или фосфатидилхолина (PC) не вызывал детектируемого увеличения свертывающей активности.
Затем проводили исследования, ограничено ли взаимодействие PS/TT-173 полученными из дрожжей структурами, или его можно воспроизвести на искусственно изготовленных везикулах. Для этого PS в различных концентрациях (в диапазоне от 0,05 до 1 мМ) добавляли к аликвотам с равной свертывающей активностью либо ТТ-173, либо in vitro релипидированного rTF. После инкубации смеси в течение 2 ч при R/T образцы из двух содержащих rTF продуктов тестировали на их свертывающую активность. Результаты показаны на фиг.3. Как наблюдалось ранее, добавление PS к TT-173 явно увеличивает активность приблизительно в шесть раз. Этот эффект наблюдался в диапазоне концентраций от 0,05 до 0,5 мМ PS. При более высокой концентрации (1 мМ) PS проявлял явный ингибирующий эффект в отношении свертывания. Неожиданно, добавление PS к релипидированному rTF не приводило к заметному увеличению в прокоагулянтной активности ни при одной из используемых концентраций PS. Кроме того, более высокая протестированная концентрация PS (1 мМ) оказывала явно ингибирующий эффект. Такой ингибирующий эффект более высоких концентраций PS на образцы либо TT-173, либо релипидированного rTF, можно было бы объяснить, если PS-везикулы при высоких концентрациях эффективно взаимодействовали с растворимыми факторами коагуляции, изолируя их, и, таким образом, ограничивая их взаимодействие с rTF-содержащими везикулами.
Это было дополнительно подтверждено тестированием эффекта на свертывающую активность, как результат добавления увеличивающихся концентраций PS к уже существующим мицеллам, содержащим rTF, с различным соотношением РС к PS. Оптимальная концентрация фосфолипидов для восстановления полной активности rTF точно установлена, и она соответствует соотношению фосфатидилхолина (РС) и фосфатидилсерина (PS) в диапазоне от 80:20 до 70:30. На фиг.4 (черные столбики) показан конкретный эксперимент по свертыванию, в котором rTF релипидирован только с использованием PC (концентрация PC:PS составляет 100:0), или с использованием увеличивающихся соотношений концентраций PS относительно PC (соотношения концентраций PC:PS составляли 95:5, 90:10 и 80:20, соответственно). Результат ясно показывает, что добавление увеличивающихся количеств PS приводит к уменьшению времени коагуляции. Однако при добавлении избытка PS к уже существующим мицеллам при любом протестированном соотношении PC:PS не вызывало какого-либо усиления свертывающей активности (фиг.4, серые столбики).
Для дополнительного подтверждения того, что наблюдаемый эффект ограничен только полученными из эукариот структурами, и не может быть воссоздан в искусственно изготовленных посредством релипидации везикулах, PS в концентрации 0,1 мМ добавляли к аликвотам с равной свертывающей активностью либо везикул ТТ-173, полученных в клетках дрожжей, либо к in vitro релипидированному rTF при соотношениях PC:PS 80:20 и 70:30. После инкубации различных везикул с PS в течение 2 ч при R/T образцы из различных содержащих rTF продуктов тестировали на их свертывающую активность. Результаты показаны на фиг.5. Как наблюдалось ранее, добавление PS к TT-173 дрожжевого происхождения явно уменьшало время свертывания, в то время, как и ожидалось, добавление PS к релипидированному rTF не приводило в результате к заметному увеличению прокоагулянтной активности при любых пропорциях PC:PS, используемых для релипидации.
Для того чтобы проверить, эффективно ли добавление PS, когда он ассоциирован только с полученными из дрожжей везикулами, проводили эксперимент с использованием релипидированного rTF и везикул TT-100 (микровезикул, полученных из рекомбинантных дрожжей, трансформированных плазмидой без последовательности белка TF), полученных из нерекомбинантных дрожжей по такой же методике очистки, как и для ТТ-173. Аликвоты релипидированного rTF смешивали с различными концентрациями везикул ТТ-100, которые ранее инкубировали с PS (0,1 мМ) в течение 2 ч. Через 30 мин определяли свертывающую активность каждой аликвоты. Результаты (фиг.6) ясно показывают, что независимо от используемого количества ТТ-100, смесь ТТ-100/PS не имела детектируемого эффекта на релипидированный rTF.
Этот результат демонстрирует, что воздействие PS на свертывающую активность зависит от его ассоциации с полученными из дрожжей везикулами, и что эти везикулы должны содержать rTF.
В свете приведенных выше результатов, стимуляцию свертывающего эффекта, вызываемого PS у TT-173 (см. фиг.2, 3 и 5) можно было бы объяснить, если: (i) PS способствует взаимодействию между rTF и FVII, обеспечивая более подходящую пространственную укладку для взаимодействия; (ii) добавленный PS вызывает структурные эффекты в везикулах, образуя области, обогащенные PS, как в активированных тромбоцитах, более подходящие для образования протромбиназного комплекса; или (iii) существует комбинация двух эффектов.
Для тестирования возможного эффекта PS на взаимодействие rTF:FVII, использовали стандартный амидолитический анализ, предназначенный для количественной оценки активности комплекса TF:FVII. Для этого эксперимента три концентрации ТТ-173 с добавленным PS или без него инкубировали с двумя различными концентрациями очищенного коммерчески доступного FVIIa. После добавления FVIIa к TT-173 активность TF/FVIIa детектировали по способности комплекса ферментативно превращать специфичный хромогенный субстрат S-2288. Как показано на фиг.5, не наблюдалось какой-либо заметной разницы в амидолитической активности между ТТ-173 с или без PS при всех трех протестированных концентрациях ТТ-173, и при двух используемых концентрациях FVIIa, 50 нМ (не показано) или 500 нМ (фиг.7). Эти результаты ясно демонстрируют, что добавление PS к TT-173 не оказывает значимого эффекта на исходное взаимодействие rTF-FVII.
Однако когда эти же образцы ТТ-173 были протестированы на прокоагулянтную активность либо на нормальной плазме (фиг.8, панель А), либо на нормальной цельной крови (фиг.8, панель В), наблюдалось весьма значимое увеличение в свертывающей активности, когда PS был ассоциирован с TT-173.
Поэтому стимулирующий эффект PS на активность TT-173 следует отнести к эффекту на коагуляционный каскад ниже исходного взаимодействия TF:FVII. Авторы изобретения полагают, что PS модифицирует поверхность везикул TT-173, обеспечивая зависимый от PS пространственный каркас, аналогичный наблюдаемому у активированных тромбоцитов.
2.2. Механизмы действия ТТ-173 и ТТ-173 PS
При нормальном гемостазе время, требуемое для достижения стадии активации (время, необходимое для достижения концентрации тромбина, требуемой для активации FV, FVIII и тромбоцитов), составляет приблизительно 4 минуты. Это является временем, требующимся для прохождения взаимодействия между молекулами TF и FVII, обе из которых присутствуют в относительно низкой концентрации либо в плазме, либо в мембране поврежденных клеток. Столкновение молекул и получаемое в результате взаимодействие между TF и FVII приводит к трансформации FX в Fxa, что, в свою очередь, продуцирует тромбин.
Поэтому увеличение концентрации TF, включенного в подходящую мембрану, например, путем добавления ТТ-173 к плазме или крови, будет увеличивать возможность осуществления столкновений между TF и FVII. Это приводит к более быстрой и более высокоэффективной продукции FXa, и, следовательно, более быстрой продукции количества тромбина, необходимого для активации тромбоцитов, FVIII и FV.
В ТТ-173, TF встроен в мембранный отдел, также несущий обособленные участки PS. Поэтому добавление ТТ-173 к плазме или крови обеспечивает не только более высокую концентрацию инициатора коагуляционного каскада, но также соответствующую поверхность, которая обеспечивает соответствующий, содержащий PS физиологический каркас для образования активных протромбиназных комплексов. На фиг.9 обобщен предполагаемый механизм действия TT-173.
В ходе коагуляции нормальной крови активация коагуляции занимает приблизительно четыре минуты. Это является следствием относительно низкой концентрации белка TF в поврежденных тканях, прилегающих к кровеносным сосудам, и недостаточного количества FVIIa, циркулирующего в кровотоке.
Эта модель, в которой увеличивается продукция FXa, объясняет сильное уменьшение времени свертывания крови, наблюдаемое при добавлении ТТ-173 с или без PS к нормальной плазме (фиг.10, слева). Более того, через образование протромбиназных комплексов эта модель объясняет наблюдаемое нормальное время коагуляции при отсутствии или очень низкой концентрации FVIII или FIX (недостаточности при гемофилии А и В) (фиг.10, справа). В случае недостаточности факторов коагуляции добавление PS к TT-173 явно уменьшает время свертывания крови. Этот эффект более очевиден на образцах плазмы, в которых концентрация FVII или FV составляет менее 1% (фиг.11).
Как предсказывает модель, время коагуляции для плазмы с приобретенной недостаточностью по FVII и FX в результате действия варфарина также нормализуется добавлением ТТ-173 (фиг.10).
2.3. Роль дрожжевых мембран в активности ТТ-173
Компоненты дрожжевых везикул проявляют ограниченную прокоагулянтную активность сами по себе, но все из них должны быть необходимы для целостности микрочастиц. Когда везикулы ТТ-173 с добавлением PS или без него разбиваются обработкой диализуемого детергента и затем восстанавливаются диализом in vitro, то теряется приблизительно 50% активности (фиг.13, панель А). Однако когда аналогичный эксперимент проводили с везикулами релипидированного rTF, то не наблюдалось какой-либо заметной разницы до и после диализа (фиг.13, панель В).
Этот результат показывает, что свертывающая активность зависит не только от относительного количества rTF, дрожжевых белков и дрожжевых липидов, но также и от пространственного расположения/ориентации всех этих компонентов. Когда везикулы образуются спонтанно in vitro, все мембранные компоненты ТТ-173 включаются случайным образом в ново образующиеся мембраны, и не приобретают комплексную конформацию, которую можно приобрести только в контексте, который может обеспечить живая эукариотическая клетка.
ПРИМЕР 3
Получение прокоагулянтного продукта на основе экспрессии полноразмерного белка TF в клетках насекомых
3.1. Создание рекомбинантных бакуловирусов
Рекомбинантные бакуловирусы (rBV), экспрессирующие полноразмерный тканевой фактор (TF) человека конструировали следующим образом:
кДНК, кодирующую зрелый белок TF человека (аминокислоты 33-295), амплифицировали в виде фрагмента 816 п.о. с помощью полимеразной цепной реакции (ПЦР). Для ПЦР в качестве матрицы использовали плазмиду рТТ-103, содержащую ген, кодирующий TF, и в качестве праймеров использовали олигонуклеотиды А:
и В:
гибридизующиеся соответственно на 5' или 3'-конце гена TF. Полученный ДНК-фрагмент расщепляли рестриктазами NcoI и HindIII и встраивали в бакуловирусный трансферный вектор pFastBacl-mAV-MCS, расщепленный теми же ферментами рестрикции. Для оценки правильности встроенной последовательности TF проводили нуклеотидное секвенирование полученной плазмиды, pFB-TF, и ее использовали для получения соответствующих rBV, используя систему Bac-to-Bac и следуя рекомендациям изготовителя (Invitrogen). Для получения и очистки активных TF-содержащих везикул клетки насекомых High Five инфицировали rBV, экспрессирующими TF с множественностью инфекции 5 БОЕ/клетка. Клетки собирали через 72 часа после инфицирования, промывали дважды забуференным фосфатном солевым раствором, ресуспендировали в буфере для лизиса (50 нМ Tris-HCl, pH 8,0, 500 мМ NaCl). Далее, клеточные экстракты разрушали с помощью гомогенизатора Доунса. Аликвоты клеточных экстрактов тестировали на свертывающую активность, следуя методике, описанной выше в примере 2. В таблице 2 показана свертывающая активность, проявляемая экстрактами.
Время коагуляции и концентрация белка TF в контрольных везикулах, рекомбинантном TF, in vitro липидированном TF и TT-172 (полученных в клетках насекомых микровезикулах, несущих TF дикого типа (wt-TF))
3.2. Эффект фосфатидилсерина (PS) на биологическую активность ТТ-173 (полученных в клетках насекомых микровезикул, несущих wt-TF)
Для дополнительного доказательства того, что наблюдаемый и заявляемый в настоящем изобретении эффект ограничен полученными из эукариотических клеток структурами и не может быть воссоздан в искусственно изготовленных с помощью релипидации везикулах, PS добавляли в концентрации 0,1 мМ к аликвотам с равной свертывающей активностью либо везикул ТТ-173, полученных в дрожжевых клетках, либо везикул ТТ-172, полученных в клетках насекомых, либо in vitro релипидированного rTF при соотношении PC:PS, составляющем 80:20 и 70:30. После инкубации различных везикул с PS в течение 2 ч при R/T, образцы из различных содержащих rTF продуктов тестировали на их свертывающую активность. Результаты показаны на фиг.14. Как наблюдалось ранее, добавление PS к TT-170 из клеток насекомых приводило к сокращению времени свертывания крови аналогично эффекту, полученному с дрожжевыми клетками, явно снижая время свертывания. Однако как ожидалось, добавление PS к релипидированному rTF не приводило к заметному увеличению прокоагулянтной активности, ни при одном из соотношений PC:PS, используемых для релипидации.
ПРИМЕР 4
Другим неожиданным эффектом добавления PS было его влияние на стабильность везикул ТТ-173. Для исследования этого эффекта, аликвоты из трех независимых партий ТТ-173, инкубированные или неинкубированные с PS, как описано в примере 2, хранили при двух различных температурах (4°C и 20°C) в течение продолжительного периода времени. В различные временные точки проводили анализ свертывающей активности для аликвот из каждого образца. Результаты этого эксперимента показаны на фиг.15. Как показано выше, добавление PS к образцам TT-173 сокращает время коагуляции до 10 секунд во временной точке 0, и, неожиданно, стабильность образцов, содержащих PS, увеличивалась по сравнению с образцами без PS. Этот стабилизирующий эффект был особенно очевиден при 20°C, когда образцы TT-173 без дополнительного PS теряли более 50% активности через 5 часов, и образцы, в которые был добавлен PS, оставались стабильными по меньшей мере в течение 4 дней.
Затем определяли среднее значение минимальной стабильности различных партий ТТ-173 с добавлением или без добавления PS при 20°C и 4°C.
Средняя минимальная стабильность показана на фиг.15 (панели С и D).
ПРИМЕР 5
Усиление прокоагулянтного эффекта ТТ-173 прокоагулянтными агентами
К ТТ-173 добавляли различные концентрации FVII (20 нМ и 60 нМ), FVIIa (20 нМ и 60 нМ), FX (1000 нМ и 3000 нМ) и FXa (1000 нМ). В различные временные точки, начиная со времени добавления PS (временная точка 0), аликвоты смесей TT-173/FVII и TT-173/FX тестировали на свертывающую активность в стандартном коагулометрическом анализе. Результаты, представленные на фиг.16, ясно показывают, что добавление FVII, FVIIa и FX сокращает время коагуляции приблизительно на 2 с, и что добавление FXa уменьшает время коагуляции приблизительно на 7 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОВЕЗИКУЛЫ, ПОЛУЧЕННЫЕ ИЗ РЕКОМБИНАНТНЫХ ДРОЖЖЕЙ, ОБЛАДАЮЩИЕ ГЕМОСТАТИЧЕСКИМИ АКТИВНОСТЯМИ, И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2492184C2 |
| НОВЫЕ СЛИТЫЕ БЕЛКИ ТРОМБОМОДУЛИНА, ОБЕСПЕЧИВАЮЩИЕ НАПРАВЛЕННЫЙ ПЕРЕНОС К ТКАНЕВОМУ ФАКТОРУ, В КАЧЕСТВЕ АНТИКОАГУЛЯНТОВ | 2003 |
|
RU2320366C2 |
| GLA ДОМЕНЫ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2014 |
|
RU2705786C2 |
| ПОЛИПЕПТИДЫ НА ОСНОВЕ МОДИФИЦИРОВАННОГО ФАКТОРА VII И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2571931C2 |
| GLA ДОМЕНЫ В КАЧЕСТВЕ НАЦЕЛИВАЮЩИХ АГЕНТОВ | 2014 |
|
RU2731507C1 |
| ВЕЗИКУЛЫ, СОДЕРЖАЩИЕ ИНГИБИТОР PTEN, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2800729C2 |
| Способ оценки степени образования везикул эритроцитов | 2017 |
|
RU2667125C1 |
| НАБОР ДЛЯ ИЗМЕРЕНИЯ ОБРАЗОВАНИЯ ТРОМБИНА В ОБРАЗЦЕ КРОВИ ИЛИ ПЛАЗМЫ ПАЦИЕНТА | 2005 |
|
RU2360970C2 |
| GLA ДОМЕНЫ В КАЧЕСТВЕ НАЦЕЛИВАЮЩИХ АГЕНТОВ | 2014 |
|
RU2711091C2 |
| ПОЛИПЕПТИД ФАКТОРА КОАГУЛЯЦИИ VII ЧЕЛОВЕКА, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2002 |
|
RU2325401C2 |
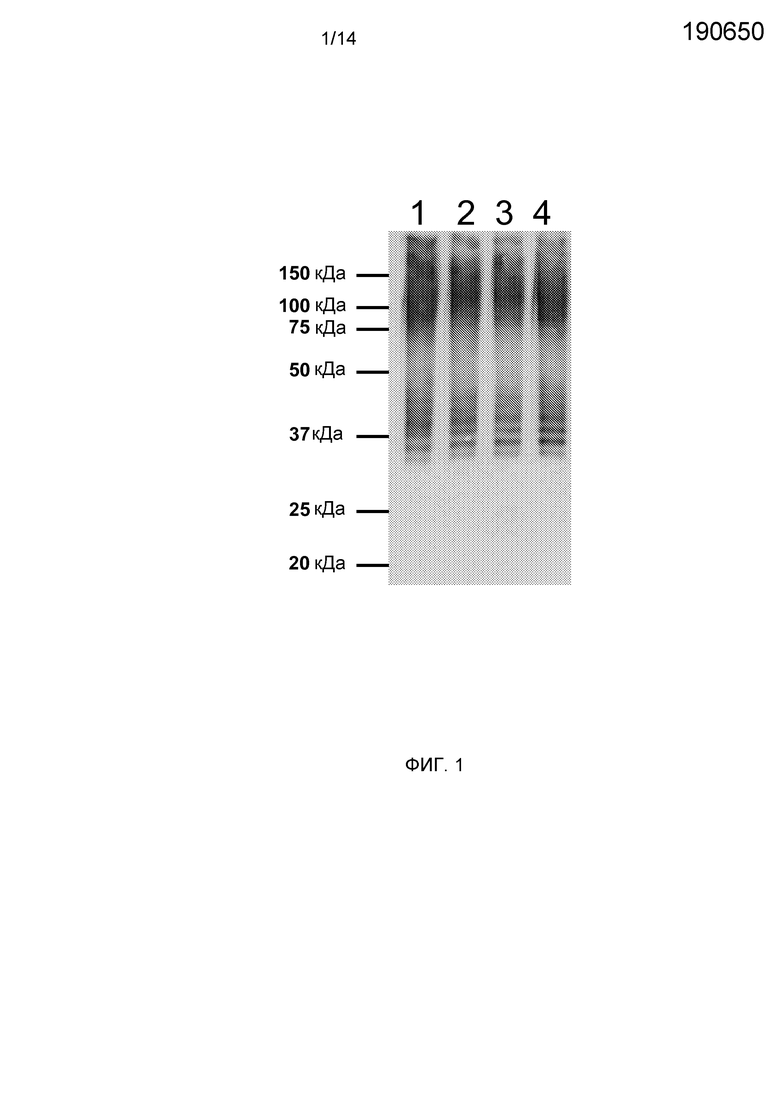
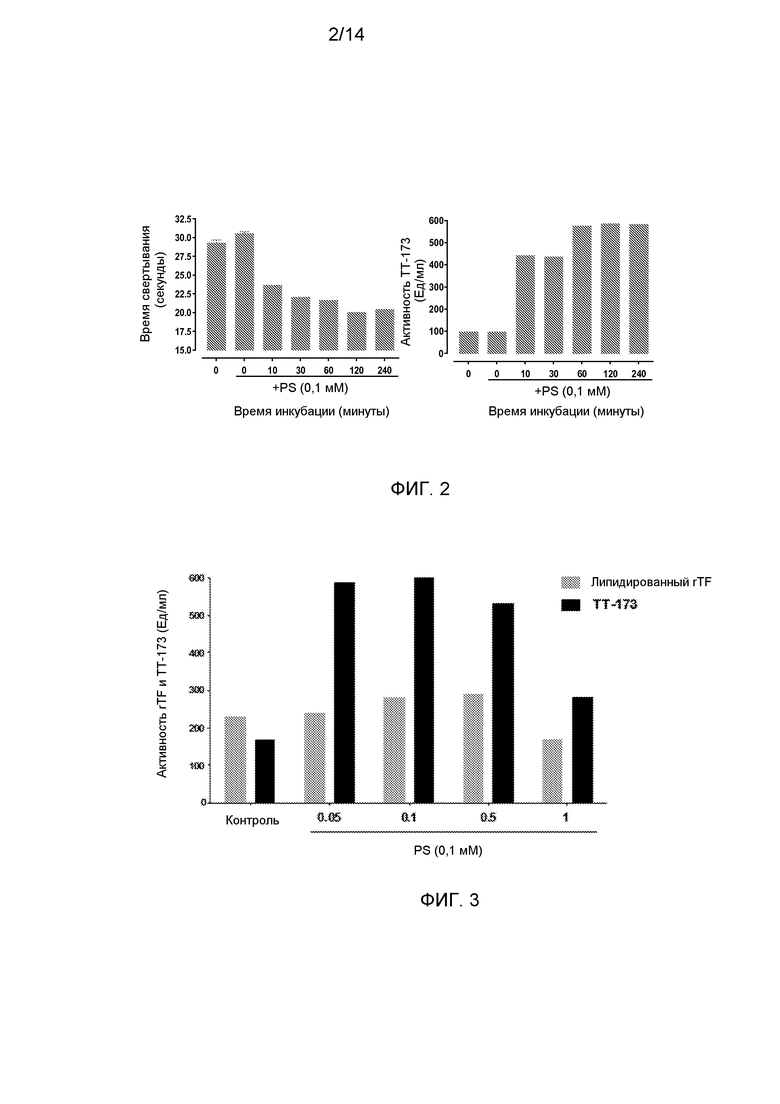
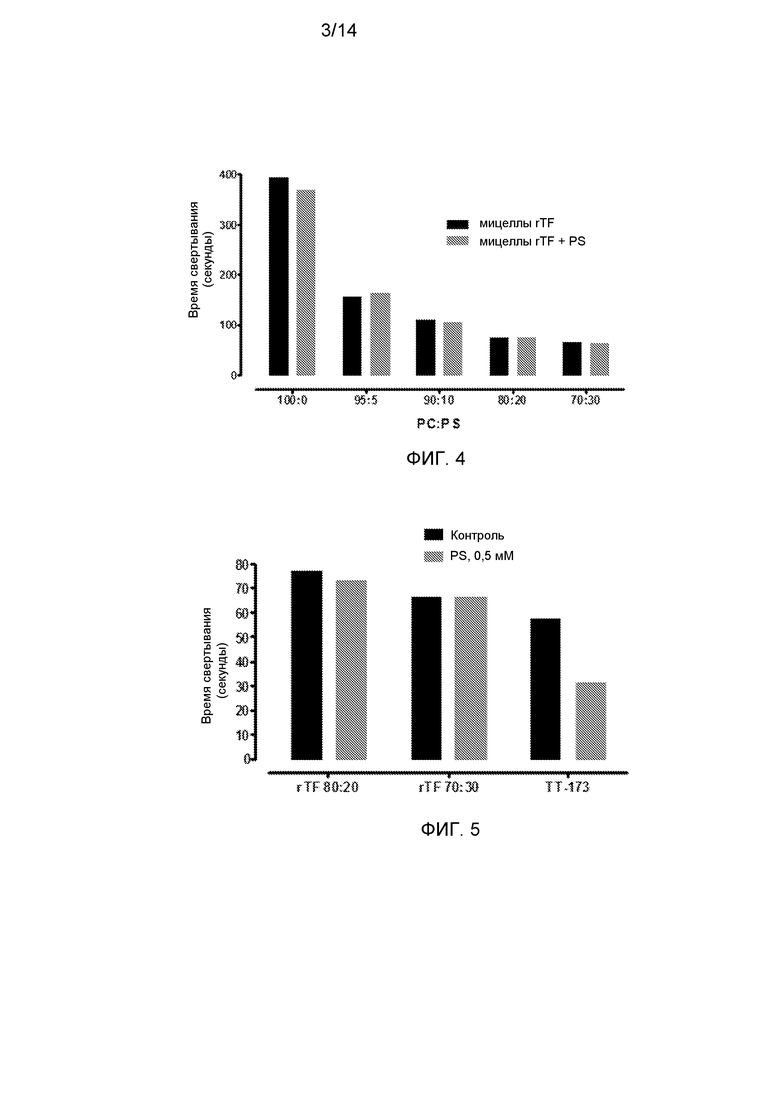
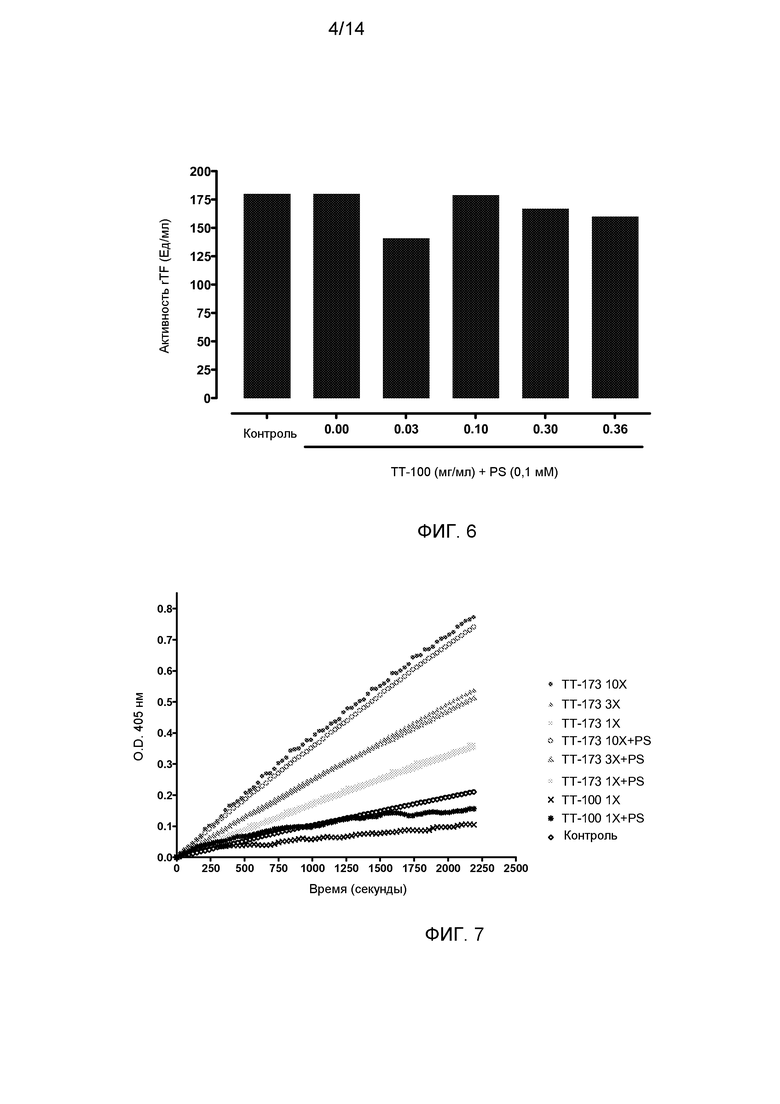
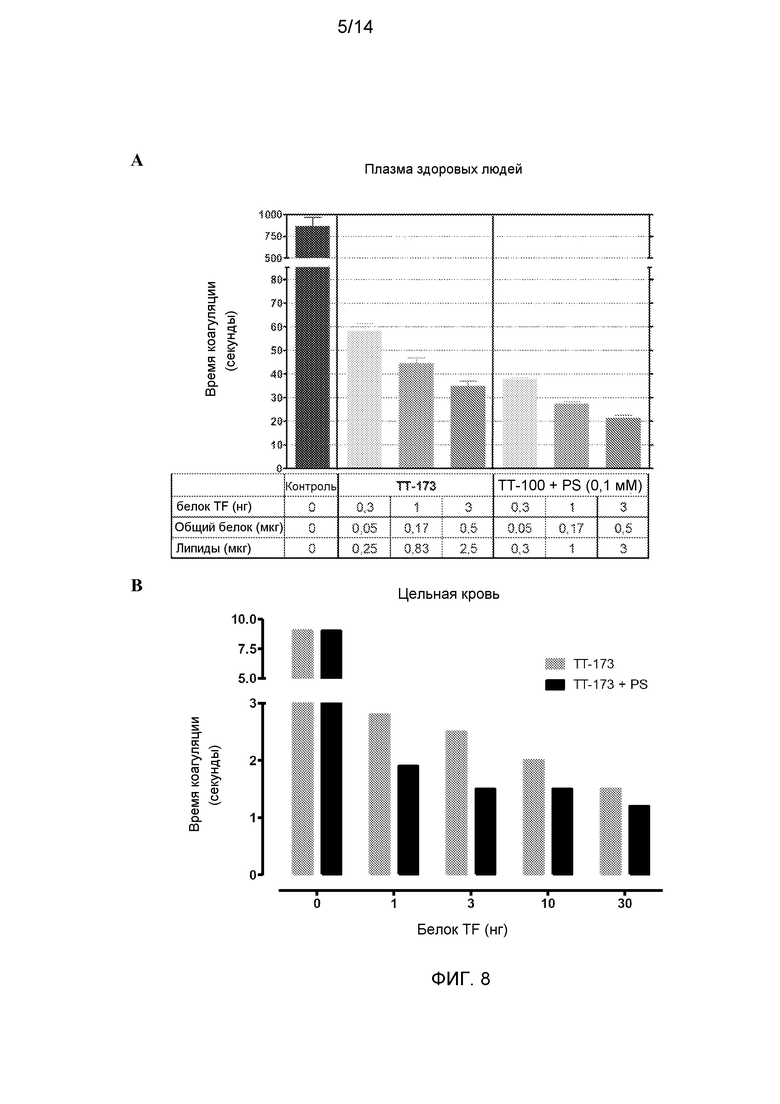
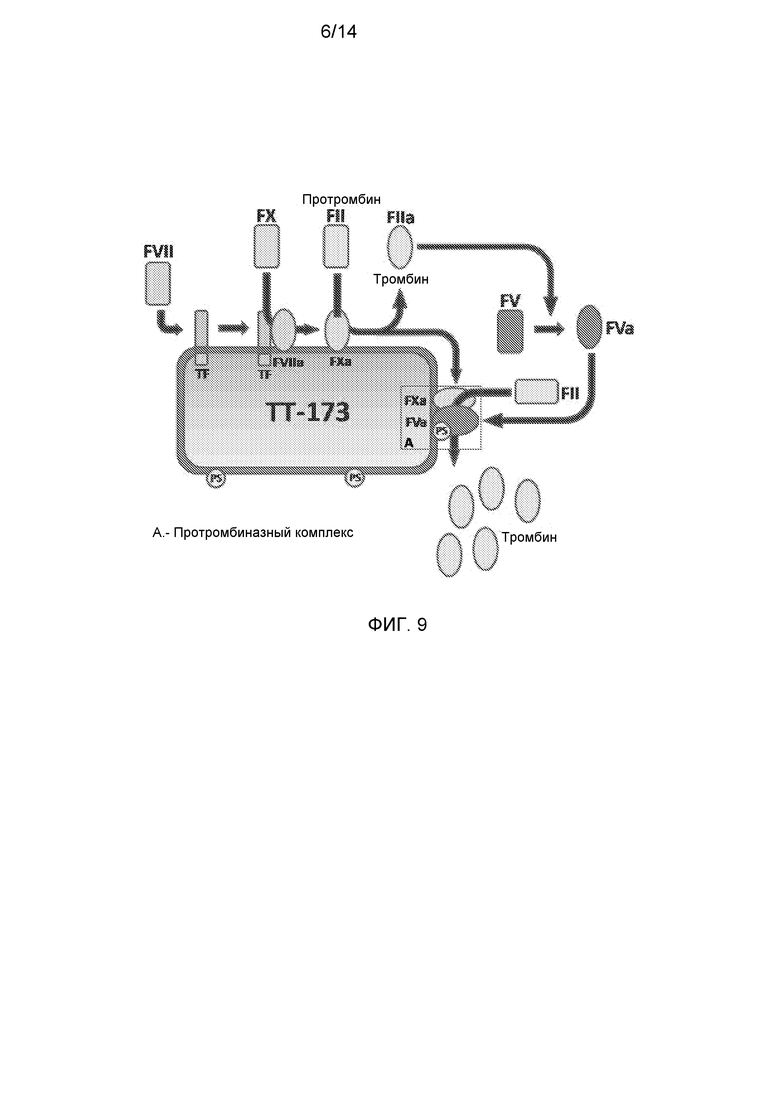
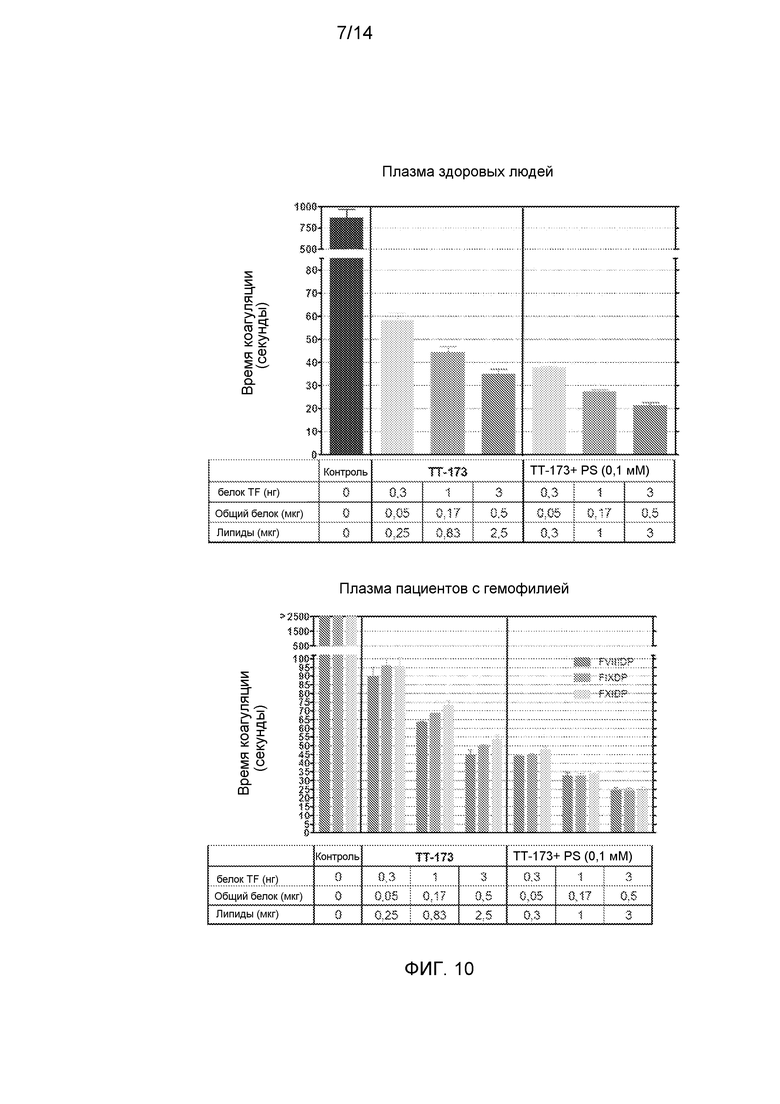
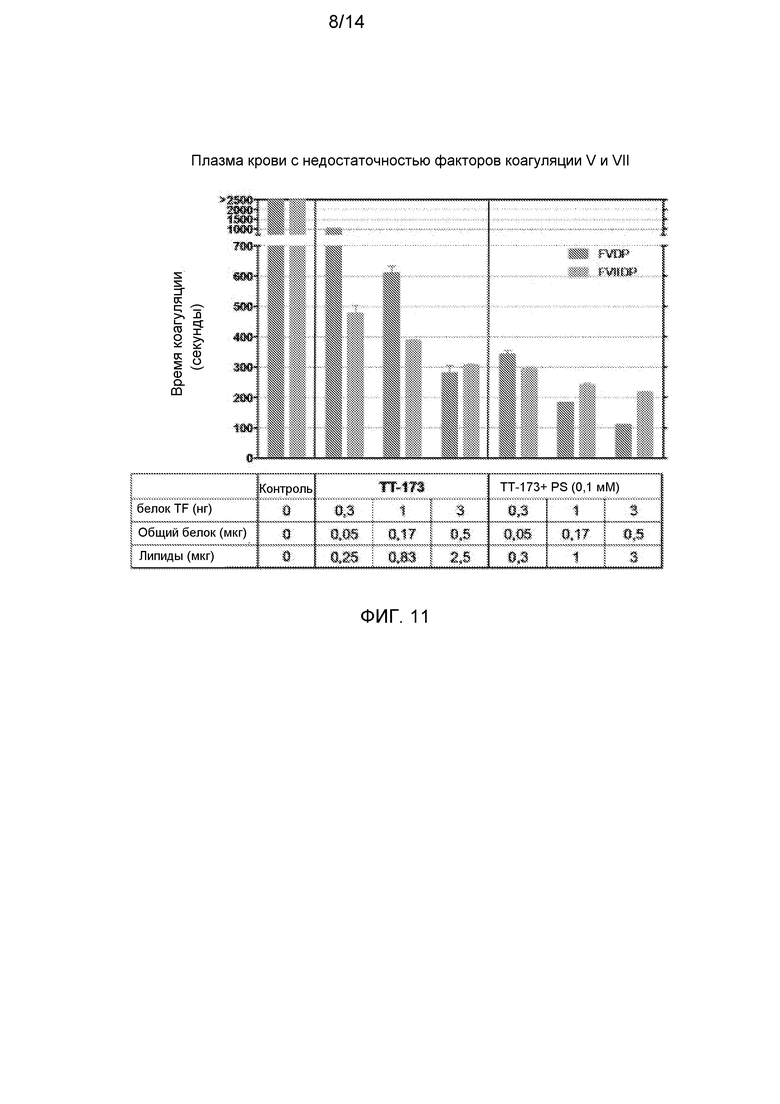
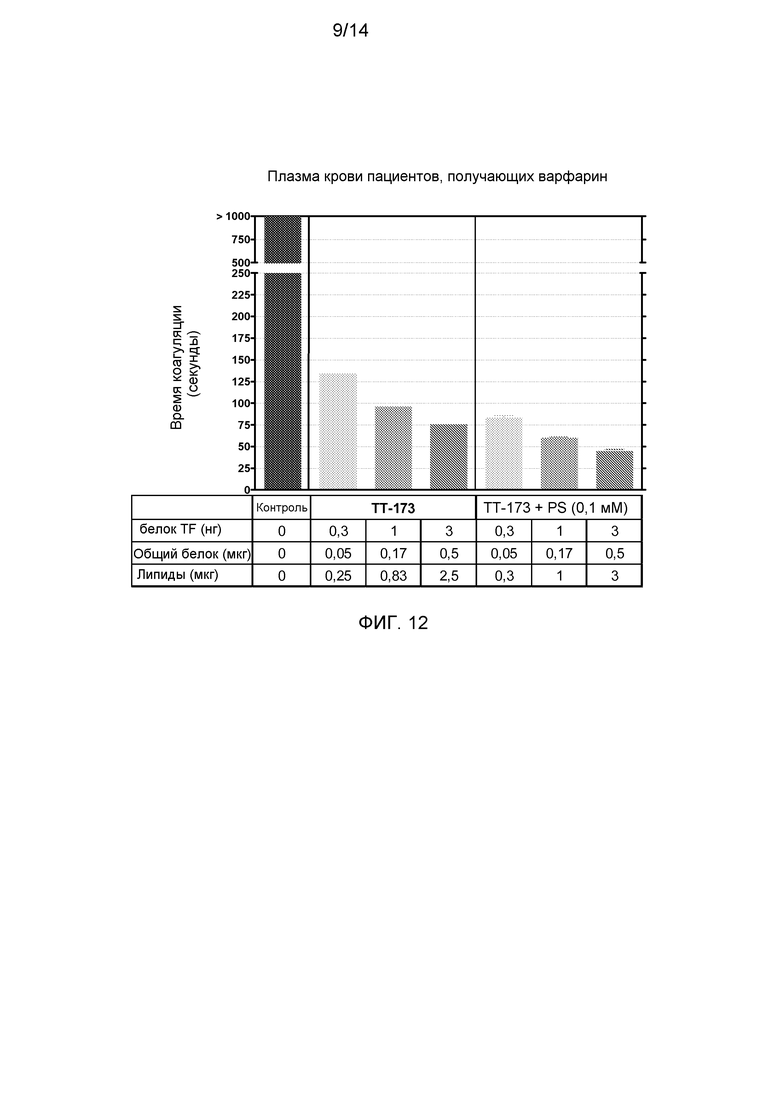
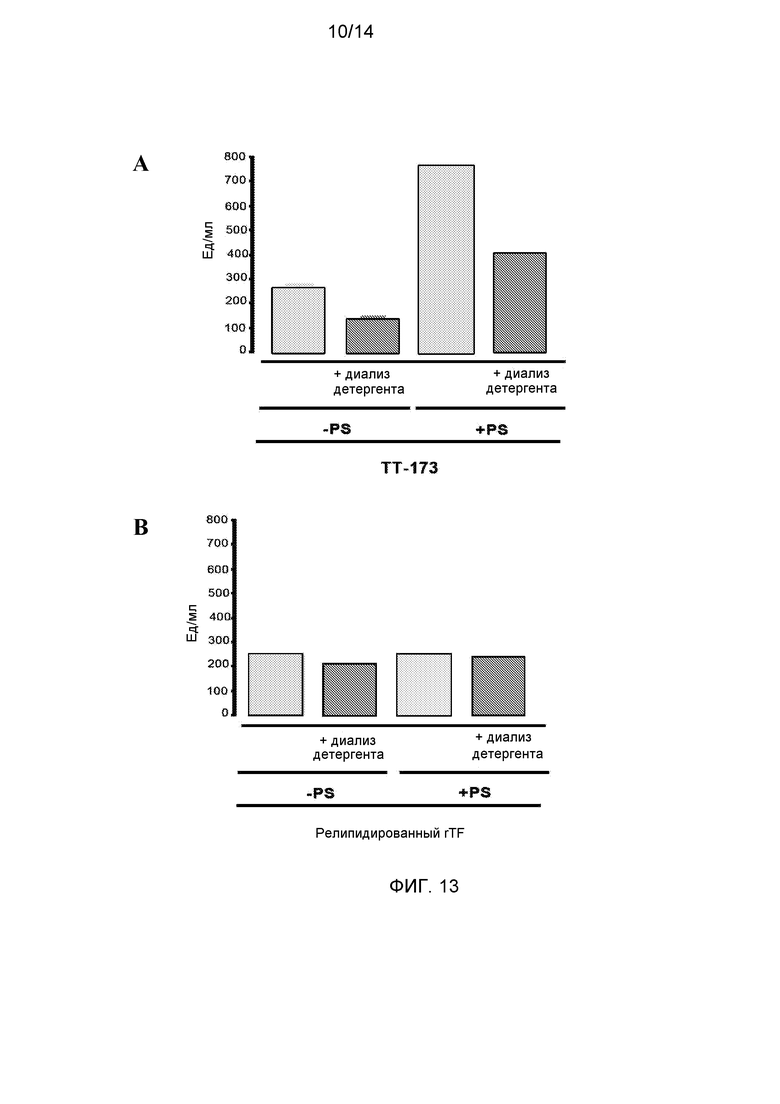
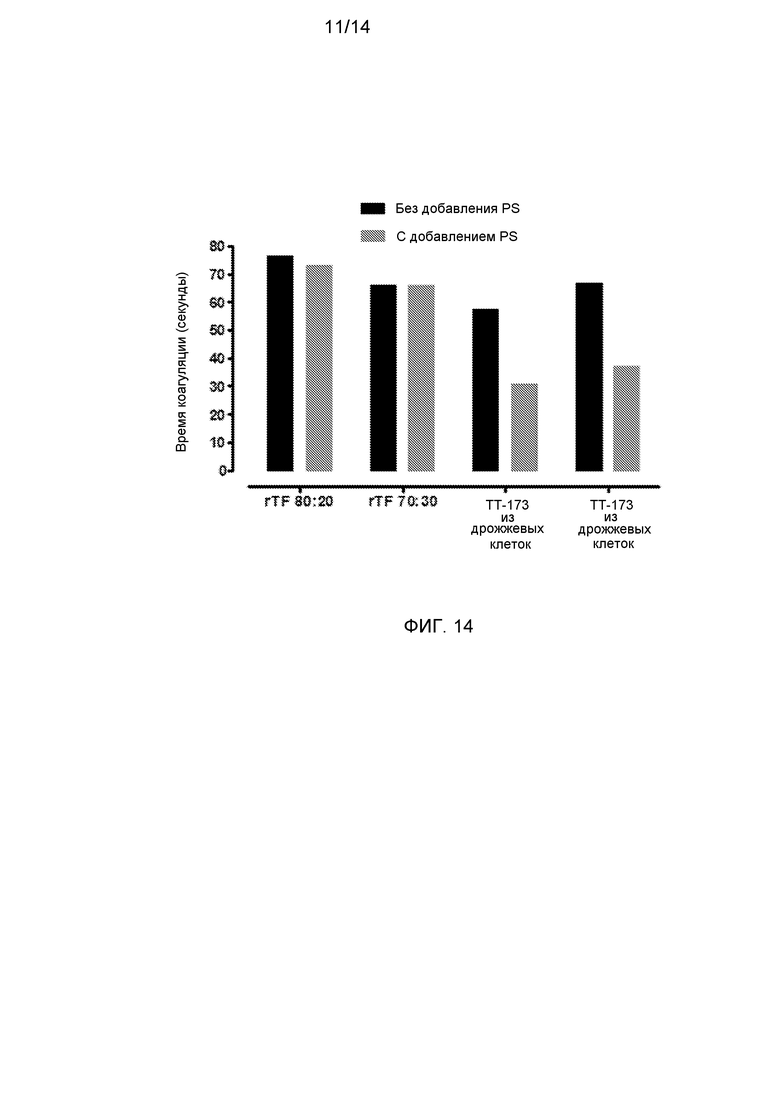
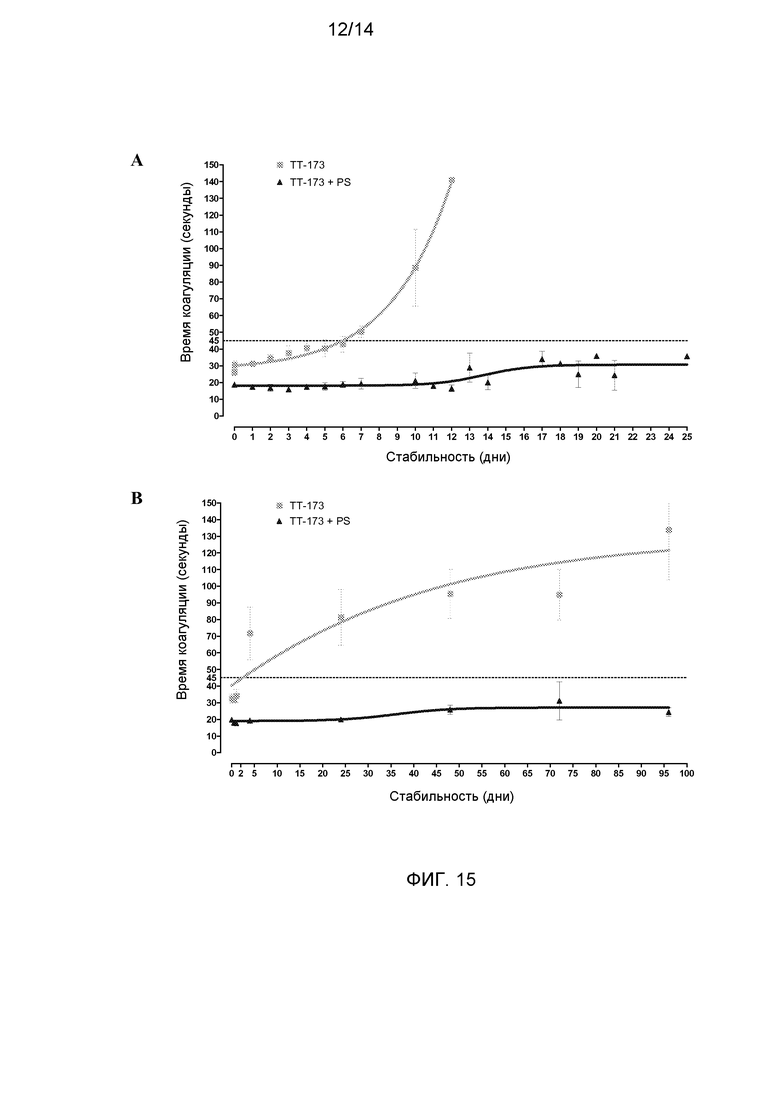
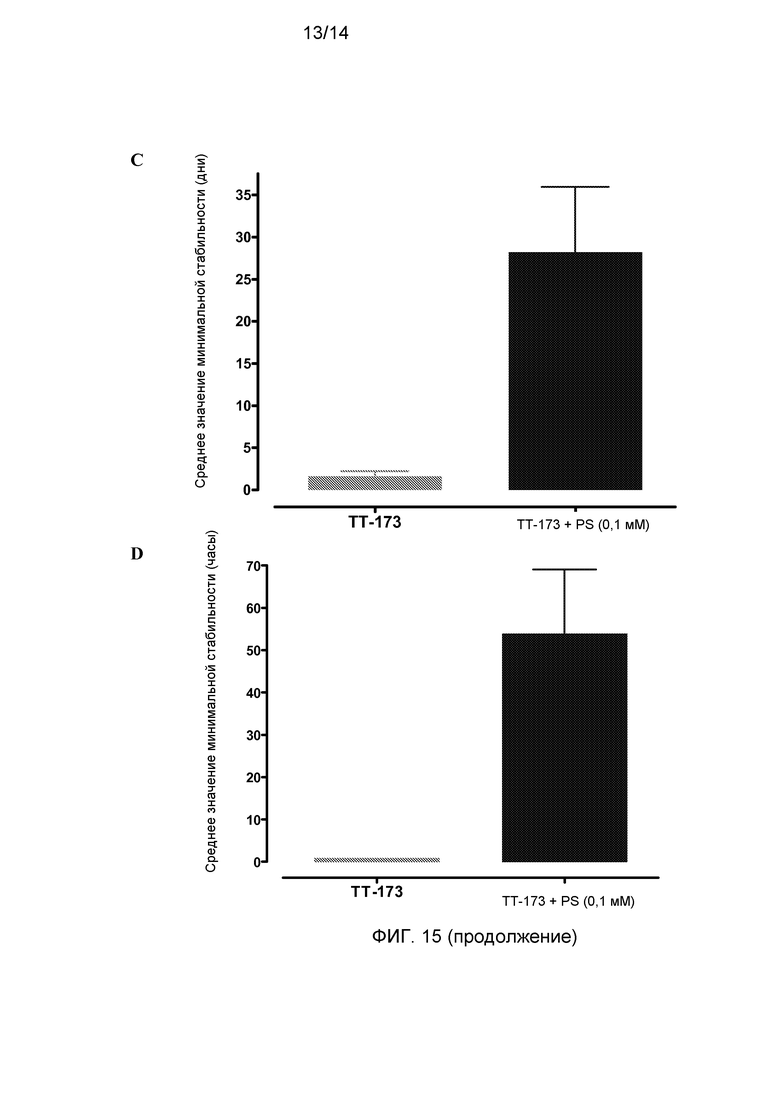
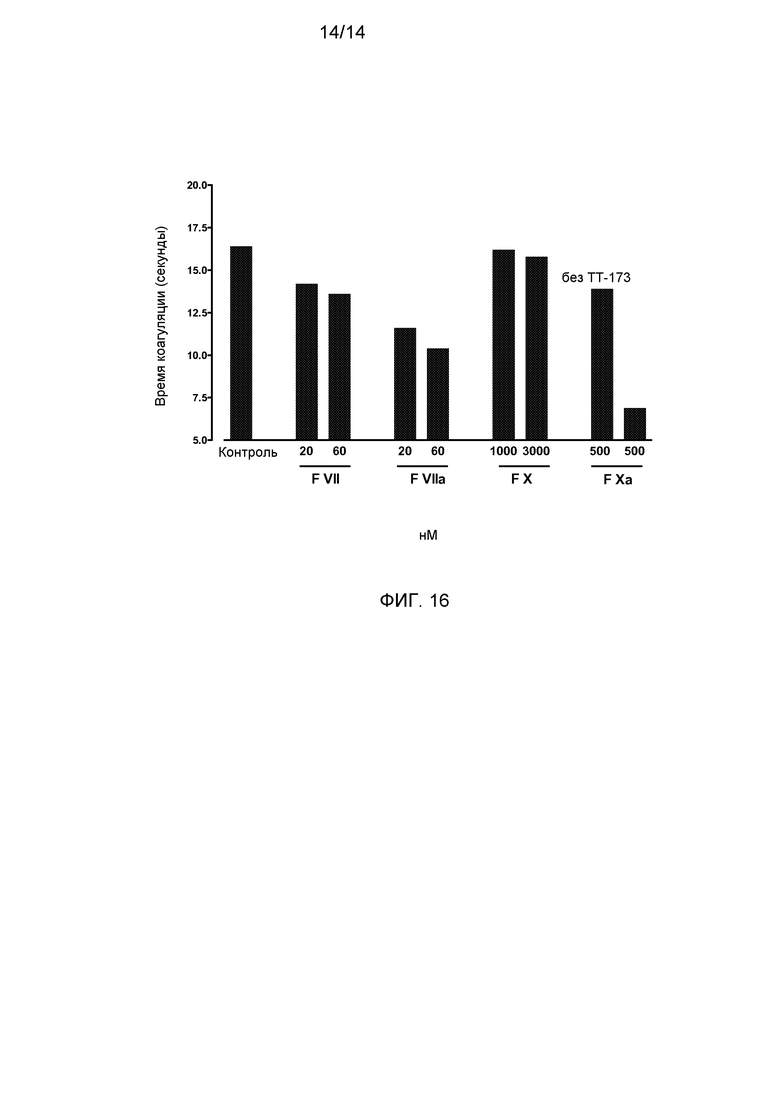





Настоящее изобретение относится к области биотехнологии, конкретно к способу улучшения прокоагулянтных свойств тканевого фактора (TF), экспрессированного в эукариотических клетках, и может быть использовано в медицине. Полученная в соответствии с настоящим изобретением модифицированная несущая тканевый фактор микровезикула может применяться в качестве прокоагулянтного средства для лечения кровоизлияний, заживления ран и стимуляции ангиогенеза в тканях. Изобретение позволяет улучшить прокоагуляторные свойства тканевого фактора за счет того, что полученная несущая TF микровезикула формируется из липидных мембран или их фрагментов из эукариотических клеток, в которых экспрессируется тканевый фактор, а также дополнительной добавки отрицательно заряженного фосфолипида. 7 н. и 11 з.п. ф-лы, 16 ил., 2 табл., 5 пр.
1. Способ получения несущей тканевой фактор (TF) микровезикулы, обладающей прокоагулянтной активностью, включающий:
(i) экспрессию TF или его варианта, обладающего прокоагулянтной активностью, в эукариотической клетке, где указанный вариант, обладающий прокоагулянтной активностью, соответствует белку тканевого фактора, обладающему по меньшей мере одной модификацией, выбранной из группы, состоящей из
a) включения tag, соединенного с С-концевым или N-концевым доменом указанного фрагмента белка TF;
b) элиминации сигнального пептида для получения зрелого белка TF;
c) модификации сайта N-гликозилирования, соответствующего остаткам NLT в положениях 11-13 в зрелом TF человека, указанная модификация делает указанный сайт нефункциональным;
d) модификации сайта N-гликозилирования, соответствующего остаткам NVT в положениях 124-126 в зрелом TF человека, указанная модификация делает указанный сайт нефункциональным;
e) модификации сайта N-гликозилирования, соответствующего остаткам NNT в положениях 137-139 в зрелом TF человека, указанная модификация делает указанный сайт нефункциональным;
(ii) лизис TF-экспрессирующих клеток со стадии (i) в отсутствие детергентов или, в том случае, если детергенты используются, применение концентраций указанных детергентов ниже критической концентрации мицеллообразования;
(iii) выделение несущей TF микровезикулы из клеток со стадии (ii), и
(iv) приведение в контакт везикул, полученных на стадии (iii), с отрицательно заряженным фосфолипидом, используя соотношение 0,05-0,8 мкмоль отрицательно заряженных фосфолипидов на 50 мкг белка, содержащегося в TF-микровезикуле в отсутствие детергентов или, в том случае, если детергенты используются, применение концентраций указанных детергентов ниже критической концентрации мицеллообразования,
где указанная микровезикула образована липидными мембранами или их фрагментами из указанной эукариотической клетки.
2. Способ по п. 1, в котором эукариотической клеткой является дрожжевая клетка.
3. Способ по п. 1 или 2, в котором стадию приведения в контакт проводят, используя соотношение 0,05-0,5 мкмоль отрицательно заряженных фосфолипидов на 50 мкг белка, содержащегося в TF-микровезикуле.
4. Способ по п. 1, в котором отрицательно заряженный фосфолипид выбран из группы сфингозинсодержащего фосфолипида или глицеринсодержащего фосфолипида.
5. Способ по п. 4, в котором глицеринсодержащим фосфолипидом является фосфатидилсерин.
6. Способ по п. 1, в котором указанный TF или его вариант, обладающий прокоагулянтной активностью, гликозилирован.
7. Способ по п. 1, в котором TF является зрелым белком TF, предпочтительно зрелым белком TF человека.
8. Способ по п. 7, в котором TF несет мутацию N124A и гексагистидиновый tag на С-конце.
9. Несущая TF микровезикула для сокращения времени коагуляции, полученная с использованием способа по п. 1.
10. Фармацевтическая композиция для сокращения времени коагуляции, содержащая от 1 пг/мл до 1 мг/мл несущей TF микровезикулы по п. 9, фармацевтически приемлемый наполнитель.
11. Фармацевтическая композиция по п. 10, дополнительно содержащая стимулятор коагуляции.
12. Фармацевтическая композиция по п. 10, где композиция является лиофилизированной.
13. Комбинация для сокращения времени коагуляции, содержащая композицию по п. 10 и стимулятор коагуляции.
14. Способ определения протромбинового времени в образце, включающий стадии добавления несущей TF микровезикулы по п. 9 и кальция в образец, содержащий плазму крови, и измерения времени, за которое образец коагулирует.
15. Набор для определения протромбинового времени, содержащий микровезикулу по п. 9 и инструкции для применения указанной микровезикулы для определения протромбинового времени в образце.
16. Способ лечения кровоизлияния, стимуляции заживления ран или лечения связанного с ангиогенезом заболевания путем введения несущей TF микровезикулы по п. 9 нуждающемуся в этом субъекту.
17. Способ по п. 16, в котором лечение кровоизлияния проводят у субъекта с геморрагическим диатезом, где указанный геморрагический диатез выбран из группы врожденной коагулопатии, приобретенной коагулопатии, патологии тромбоцитов и их комбинации.
18. Способ по п. 17, в котором несущую TF микровезикулу вводят местно.
| WO 99848283 A1, 29.10.1998 | |||
| СПИРАЛЬНОЕ СВЕРЛО | 0 |
|
SU234109A1 |
| EP 1939218 A1, 02.07.2008 | |||
| McGEE M.P | |||
| et al., Electrostatic interactions during activation of coagulation factor IX via the tissue pathway effect of univalent salts, BIOCHIMICA ET BIOPHYSICA ACTA, 1999, p | |||
| Коловратный насос с кольцевым поршнем, перемещаемым эксцентриком | 1921 |
|
SU239A1 |
| US 2006088524 A1, 27.04.2004 | |||
| RU 2006138237 A1, 10.05.2008. | |||
Авторы
Даты
2016-08-27—Публикация
2011-04-19—Подача