Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который представлен в электронном виде в формате ASCII и тем самым полностью включен в качестве ссылки. Указанная копия в формате ASCII, созданная 11 ноября 2015 г., обозначена как 32401_SL.txt и имеет размер 527137 байтов.
Область техники, к которой относится изобретение
Настоящее изобретение к комбинированным терапиям на основе активирующей Т-клетки биспецифической антигенсвязывающей молекулы и антагониста, связывающегося с осью PD-1, и необязательно антагониста TIM3 и к применению указанных комбинированных терапий для лечения рака.
Предпосылки создания изобретения
Моноклональные антитела являются сильными терапевтическими агентами для лечения рака благодаря их избирательному направленному воздействию на антигены, которые характеризуются специфической схемой экспрессии на раковых клетках.
В последние годы повысился интерес к биспецифическим антителам, созданным таким образом, чтобы они связывались с помощью одного антигенсвязывающего фрагмента с поверхностным антигеном на клетках-мишенях и с помощью второго антигенсвязывающего фрагмента с активирующим инвариантным компонентом комплекса Т-клеточного рецептора (TCR). Одновременное связывание такого антитела с обеими его мишенями должно приводить к временному взаимодействию между клеткой-мишенью и Т-клеткой, вызывая активацию любой цитотоксической Т-клетки и последующий лизис клетки-мишени. Таким образом, иммунный ответ переориентируется на клетки-мишени и не зависит от презентации пептидного антигена клеткой-мишенью или специфичности Т-клетки, что имеет место при нормальной ограниченной ГКГС активации CTL. В этом контексте решающее значение имеет то, что CTL активируются только тогда, когда клетка-мишень презентует им биспецифическое антитело, т.е. имеет место имитация иммунологического синапса. Наиболее предпочтительными являются биспецифические антитела, для которых не требуется предварительное кондиционирование или костимуляция лимфоцитов для того, чтобы вызывать эффективный лизис клеток-мишеней. Пока не установлено, каким образом ТСВ (активирующие Т-клетки биспецифические молекулы) влияют на сами Т-клетки помимо активации определенной эффекторной функции.
Для активации покоящихся Т-лимфоцитов или Т-клеток антигенпрезентирующими клетками (АРС), по-видимому, требуется два входных сигнала (Lafferty и др., Aust. J. Exp. Biol. Med. ScL 53, 1975, cc. 27-42). Первичный сигнал или антигенспецифический сигнал трансдуцируется через Т-клеточный рецептор (TCR) после распознавания «чужого» антигенного пептида, презентируемого в контексте главного комплекса гистосовместимости (ГКГС). Второй или костимуляторный сигнал доставляется к Т-клеткам костимуляторными молекулами, которые экспрессируются на антигенпрезентующих клетках (АРС) и индуцируют усиление клональной экспансии, секреции цитокинов и эффекторной функции Т-клеток (Lenschow и др., Ann. Rev. Immunol. 14, 1996, с. 233). В отсутствии костимуляции Т-клетки могут становиться устойчивыми к антигенной стимуляции, не могут обеспечивать эффективный иммунный ответ, и это также может приводить к (иммунному) истощению или толерантности к «чужим» антигенам.
Т-клетки могут получать как положительные, так и отрицательные вторичные костимуляторные сигналы. Баланс положительных и отрицательных сигналов является важным для создания эффективных иммунных ответов, поддерживая при этом иммунологическую толерантность и предупреждая аутоиммунитет. Отрицательные вторичные сигналы, по-видимому, необходимы для индукции Т-клеточной толерантности, а положительные сигналы ускоряют Т-клеточную активацию.
В последние годы установлено, что Т-клеточная дисфункция или анергия существует одновременно с индуцированной и сохраняющейся экспрессией ингибирующего рецептора, полипептида запрограммированной гибели клеток 1 (PD-1). Один из его лигандов, PD-L1, сверхэкспрессируется при многих видах рака и часто ассоциирован с плохим прогнозом (Okazaki Т. и др., Intern. Immun. 19(7), 2007, с. 813; Thompson R.H. и др., Cancer Res 66(7), 2006, c. 3381). Важно отметить, что большинство инфильтрующих опухоль Т-лимфоцитов главным образом экспрессируют PD-1 в отличие от Т-лимфоцитов в здоровых тканях и Т-лимфоцитов периферической крови, это свидетельствует о том, что повышающая регуляция PD-1 на опухольреактивных Т-клетках может принимать участие в нарушенных противоопухолевых иммунных ответах (Blood, 114(8), 2009, с. 1537).
Для иммунной регуляции важной является молекула, содержащая Т-клеточный иммуноглобулин и домен 3 муцина (TIM3). Этот присутствующий на клеточной поверхности белок экспрессируется главным образом Т-клетками-хелперами типа 1 и участвует в регуляции активации макрофагов, воспалительных состояний и рака (Majeti R. и др., PNAS, 106, 2009, сс. 3396-3401 и WO 2009/091547). Связывание молекулы TIM3 с одним из ее лигандов (например, с галектином-9) может подавлять Th1-ответ путем индукции запрограммированной гибели клеток, поддерживая тем самым периферическую толерантность. Обработка siPHK TIM3 или антагонистическим антителом к TIM3 повышает секрецию интерферона альфа CD4-позитивными Т клетками, что подтверждает ингибирующую роль TIM3 в человеческих Т-клетках. Примеры моноклональные антител к TIM3 включают антитела, описанные в WO 2013/06490 и US 2012/189617 (Ngiow и др., Cancer Res 7, 2011, с. 6567).
FOLR1 экспрессируется на опухолевых клетках различного происхождения, например, клетках рака яичника и рака легкого. Описано несколько подходов для нацеливания на FOLR1 терапевтических антител, таких как фарлетузумаб, конъюгатов антитело-лекарственное средство, или для визуализации опухолей при адоптивной Т-клеточной терапии (Kandalaft и др., J Transl Med.; 10, 3 августа 2012 г., с. 157. doi: 10.1186/1479-5876-10-157; van Dam и др., Nat Med.; 17(10), 18 сентября 2011 г., сс. 1315-1319. doi: 10.1038/нМ.2472; Clifton и др., Hum Vaccin.; 7(2), февраль 2011 г., Epub 1 февраля 2011 г.; Kelemen и др., Int J Cancer.; 119(2), 15 июля 2006 г., сс. 243-150; Vaitilingam и др., J Nucl Med.; 53(7), июль 2012 г.; Teng и др., 9(8), август 2012 г., сс. 901-908. doi: 10.1517/17425247.2012.694863, Epub 5 июля 2012 г.). Было предпринято несколько попыток направленного воздействия на позитивные по фолатному рецептору опухоли с помощью конструкций, мишенью которых являются фолатный рецептор и CD3 (Kranz и др., Proc Natl Acad Sci USA.; 92(20), сентябрь 1995 г., сс. 9057-9061; Roy и др., Adv Drug Deliv Rev.; 56(8), 29 апреля 2004 г., сс. 1219-1231; Huiting Cui и др Biol Chem.; 287(34), 17 августа 2012 г., сс. 28206-28214; Lamers и др., Int. J. Cancer. 60(4), 1995, с. 450; Thompson и др., MAbs.; 1(4), июль-август 2009 г., сс. 348-356, Epub 19 июля 2009 г.; Mezzanzanca и др., Int. J. Cancer, 41, 1988, сс. 609-615).
При этом сохраняется потребность в указанной оптимальной терапии для лечения, стабилизации, предупреждения и/или замедления развития различных видов рака.
Краткое изложение сущности изобретения
В широком смысле настоящее изобретение относится к биспецифическим антителам, в которых объединен нацеленный на фолатный рецептор 1 (FolR1) антигенсвязывающий сайт со вторым антигенсвязывающим сайтом, нацеленным на CD3, и к их применению в комбинации с антагонистом, связывающимся с осью PD-1, например, для лечения рака. В одном из вариантов осуществления изобретения комбинация содержит также антагонист TIM3. Способы и комбинации, предлагаемые в настоящем изобретении, могут усиливать иммунотерапию. Преимуществом по сравнению с общепринятым лечением является специфическая индукция Т-клеточной активации только в области, в которой происходит экспрессия FolR1, а также снижение и/или реверсия низкой обусловленной Т-клетками активности, называемой также Т-клеточным истощением, в результате объединения с антагонистом, связывающимся с осью PD-1, и необязательно с антагонистом TIM3.
Таким образом, одним из объектов настоящего изобретения является способ лечения или замедление развития рака у индивидуума, включающий введение индивидууму в эффективном количестве активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антагониста, связывающегося с осью PD-1. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, и второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1). В одном из вариантов осуществления изобретения первый антигенсвязывающий фрагмент содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34. В одном из вариантов осуществления изобретения первый антигенсвязывающий фрагмент содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36 и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит также третий антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR1. В одном из вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи. В одном из вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту. В одном из вариантов осуществления изобретения по меньшей мере один из первого, второго и третьего антигенсвязывающего фрагмента представляет собой молекулу Fab.
В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1) содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и по меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34. В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 15, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31. В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 8, SEQ ID NO: 56 и SEQ ID NO: 57, и по меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 65. В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 55, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64. В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 50, и по меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54. В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR1, содержит:
(а) аминокислотную последовательность гипервариабельного участка 1 тяжелой цепи (CDR-H1) SEQ ID NO: 8;
(б) аминокислотную последовательность CDR-H2 SEQ ID NO: 9;
(в) аминокислотную последовательность CDR-H3 SEQ ID NO: 50;
(г) аминокислотную последовательность гипервариабельного участка легкой цепи 1 (CDR-L1) SEQ ID NO: 52;
(д) аминокислотную последовательность CDR-L2 SEQ ID NO: 53 и
(е) аминокислотную последовательность CDR-L3 SEQ ID NO: 54.
В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR1, содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1, FolR1 обезьян циномолгус и мышиным FolR1.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует пролиферацию человеческой CD3-позитивной Т-клетки in vitro.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый мононуклеарной клеткой периферической крови человека цитолиз экспрессирующей FolR1 человеческой опухолевой клетки in vitro.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый Т-клеткой цитолиз экспрессирующей FolR1 человеческой опухолевой клетки in vitro. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый Т-клеткой цитолиз экспрессирующей FolR1 человеческой опухолевой клетки in vitro, характеризующийся величиной ЕС50, составляющей от примерно 36 до примерно 39573пМ через 24 ч. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует повышающую регуляцию экспрессии на клеточной поверхности Т-клетки по меньшей мере одного из CD25 и CD69 по данным измерений методом проточной цитометрии. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1 с кажущейся величиной KD, составляющей от примерно 5,36пМ до примерно 4нМ. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с FolR1 человека и обезьян циномолгус с кажущейся величиной KD, составляющей примерно 4нМ. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с мышиным FolR1 с кажущейся величиной KD, составляющей примерно 1,5нМ. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1 с величиной KD, характеризующей одновалентное связывание, которая составляет примерно 1000 нМ.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с FolR1, экспрессируемым на человеческой опухолевой клетке. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с конформационным эпитопом на человеческом FolR1. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула не связывается с человеческим фолатным рецептором 2 (FolR2) или человеческим фолатным рецептором 3 (FolR3). В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент связывается с полипептидом FolR1, содержащим аминокислоты с 25 по 234 человеческого FolR1 (SEQ ID NO: 227). В одном из вариантов осуществления изобретения связывающий антиген FolR1 фрагмент связывается с полипептидом FolR1, содержащим аминокислотные последовательности SEQ ID NO: 227, 230 и 231, и при этом связывающий антиген FolR1 фрагмент не связывается с полипептидом FolR, содержащим аминокислотные последовательности SEQ ID NO: 228 и 229. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит а) первый антигенсвязывающий сайт, который конкурирует за связывание с человеческим FolR1 с референс-антителом, содержащим вариабельный домен тяжелой цепи (VH), который имеет SEQ ID NO: 49, и вариабельный домен легкой цепи, который имеет SEQ ID NO: 51; и б) второй антигенсвязывающий сайт, который конкурирует за связывание с человеческим CD3 с референс-антителом, содержащим вариабельный домен тяжелой цепи (VH), который имеет SEQ ID NO: 36, и вариабельный домен легкой цепи, который имеет SEQ ID NO: 31, где конкуренцию за связывание оценивают методом поверхностного плазмонного резонанса.
Одним из объектов изобретения является активирующая Т-клетку биспецифическая антигенсвязывающая молекула, где антигенсвязывающая молекула содержит первую, вторую, третью, четвертую и пятую полипептидные цепи, которые образуют первый, второй и третий антигенсвязывающий фрагменты, где первый антигенсвязывающий фрагмент обладает способностью связываться с CD3, а второй и третий антигенсвязывающий фрагмент каждый обладает способностью связываться с фолатным рецептором 1 (FolR1), где а) первая и вторая полипептидные цепи содержат в направлении от амино (N)-конца к карбоксильному (С)-концу VLD1 и CLD1; б) третья полипептидная цепь содержит в направлении от N-конца к С-концу VLD2 и CH1D2; в) четвертая полипептидная цепь содержит в направлении от N-конца к С-концу VHD1, CH1D1, CH2D1 и CH3D1; г) пятая полипептидная цепь содержит VHD1, CH1D1, VHD2, CLD2, CH2D2 и CH3D2; где VLD1 представляет собой вариабельный домен первой легкой цепи, VLD2 представляет собой вариабельный домен второй легкой цепи, CLD1 представляет собой константный домен первой легкой цепи, CLD2 представляет собой константный домен второй легкой цепи, VHD1 представляет собой вариабельный домен первой тяжелой цепи, VHD2 представляет собой вариабельный домен второй тяжелой цепи, CH1D1 представляет собой константный домен 1 первой тяжелой цепи, CH1D2 представляет собой константный домен 1 второй тяжелой цепи, CH2D1 представляет собой константный домен 2 первой тяжелой цепи, CH2D2 представляет собой константный домен 2 второй тяжелой цепи, CH3D1 представляет собой константный домен 3 первой тяжелой цепи, и CH3D2 представляет собой константный домен 3 второй тяжелой цепи.
В одном из указанных вариантов осуществления изобретении
а. третья полипептидная цепь и VHD2 и CLD2 пятой полипептидной цепи образуют первый антигенсвязывающий фрагмент, обладающий способностью связываться с CD3;
б. первая полипептидная цепь и VHD1 и CH1D1 четвертой полипептидной цепи образуют второй связывающий фрагмент, обладающий способностью связываться с FolR1; и
в. вторая полипептидная цепь и VHD1 и CH1D1 пятой полипептидной цепи образуют третий антигенсвязывающий фрагмент, обладающий способностью связываться с FolR1.
В одном из указанных вариантов осуществления изобретения первая и вторая полипептидные цепи содержат аминокислотную последовательность SEQ ID NO: 399. В одном из указанных вариантов осуществления изобретения третья полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 86. В одном из указанных вариантов осуществления изобретения четвертая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 394. В одном из указанных вариантов осуществления изобретения пятая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 397. В одном из указанных вариантов осуществления изобретения
а. первая и вторая полипептидные цепи содержат аминокислотную последовательность SEQ ID NO: 399;
б. третья полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 86;
в. четвертая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 394; и
г. пятая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 397.
В некоторых вариантах осуществления изобретения биспецифическое антитело является двухвалентным касательно FolR1 и CD3.
В некоторых вариантах осуществления изобретения биспецифическое антитело содержит один или несколько Fab-фрагмент(ов), содержащий(их) антигенсвязывающий сайт, специфический в отношении CD3, в котором(ых) вариабельные домены или константные домены тяжелой и легкой цепи обменены.
В одном из вариантов осуществления изобретения биспецифическое антитело содержит Fc-домен, по меньшей мере один Fab-фрагмент, который содержит антигенсвязывающий сайт, специфический для FolR1, и по меньшей мере один Fab-фрагмент, который содержит антигенсвязывающий сайт, специфический для CD3, в котором либо вариабельные области, либо константные области тяжелой и легкой цепи по меньшей мере одного Fab-фрагмента обменены.
В некоторых вариантах осуществления изобретения биспецифическое антитело содержит:
а) Fc-домен,
б) первый и второй Fab-фрагменты, каждый из которых содержит антигенсвязывающий сайт, специфический для FolR1,
в) третий Fab-фрагмент, содержащий антигенсвязывающий сайт, специфический для CD3, в котором третий Fab-фрагмент соединен на С-конце вариабельной тяжелой цепи (VH) со второй субъединицей Fc-домена и в котором третий Fab-фрагмент соединен на N-конце вариабельной тяжелой цепи с С-концом второго Fab-фрагмента.
В одном из вариантов осуществления изобретения по меньшей мере один из указанных Fab-фрагментов соединен с Fc-доменом через пептидный линкер.
В одном из вариантов осуществления изобретения указанное биспецифическое антитело содержит Fc-домен, содержащий одну или несколько аминокислотную(ых) замену(н), которая(ые) снижает(ют) связывание с Fc-рецепторами и/или эффекторную функцию. В одном из вариантов осуществления изобретения указанная(ые) одна или несколько аминокислотная(ых) замена(н) находится в одном или нескольких положениях, выбранных из группы L234, L235 и Р329. В одном из вариантов осуществления изобретения каждая субъединица Fc-домена содержит три аминокислотные замены, которые аннулируют связывание с активирующим или ингибирующим Fc-рецептором и/или эффекторную функцию, где указанные аминокислотные замены представляют собой L234A, L235A и P329G.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с осью PD-1, выбирают из группы, состоящей из антагониста, связывающегося с PD-1, антагониста, связывающегося с PD-L1, и антагониста, связывающегося с PD-L2.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антагонист, связывающийся с PD-1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с его партнером по связыванию, таким как лиганд. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L2. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 и с PD-L1, и с PD-L2. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой антитело. В некоторых вариантах осуществления изобретения антитело к PD-1 представляет собой моноклональное антитело. В некоторых вариантах осуществления изобретения антитело к PD-1 представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab-, Fab'-SH-, Fv-, scFv- и (Fab')2-фрагментов. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой ниволумаб, пембролизумаб, СТ-011 или АМР-224.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антагонист, связывающийся с PD-L1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с PD-1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с В7-1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PDL1, ингибирует связывание и с PD-1, и с В7-1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, представляет собой антитело к PD-L1. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой моноклональное антитело. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab-, Fab'-SH-, Fv-, scFv- и (Fab')2-фрагментов. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой гуманизированное антитело или человеческое антитело. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, выбирают из группы, состоящей из: YW243.55.S70, MPDL3280A, MDX-1105 и MEDI4736.
В некоторых вариантах осуществления изобретения антитело к PD-L1 содержит тяжелую цепь, которая содержит последовательность HVR-H1 SEQ ID NO: 289, последовательность HVR-H2 SEQ ID NO: 290 и последовательность HVR-H3 SEQ ID NO: 291; и легкую цепь, которая содержит последовательность HVR-L1 SEQ ID NO: 292, последовательность HVR-L2 SEQ ID NO: 293 и последовательность HVR-L3 SEQ ID NO: 294. В некоторых вариантах осуществления изобретения антитело к PDL1 содержит вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 280 или SEQ ID NO: 281, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 383. В некоторых вариантах осуществления изобретения антитело к PD-L1 содержит тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 278 и/или легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 279.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антагонист, ввязывающийся с PD-L2. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L2, представляет собой антитело. В некоторых вариантах осуществления изобретения антитело к PD-L2 представляет собой моноклональное антитело. В некоторых вариантах осуществления изобретения антитело к PD-L2 представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab-, Fab'-SH-, Fv-, scFv- и (Fab')2-фрагментов. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L2, представляет собой иммуноадгезин.
В одном из вариантов осуществления изобретения способ по любому из указанных выше вариантов осуществления изобретения дополнительно включает введение индивидууму антагониста Т-клеточного иммуноглобулина-муцина 3 (TIM3). В одном из вариантов осуществления изобретении антагонист TIM3 представляет собой антитело к TIM3. В одном из вариантов осуществления изобретения антитело к TIM3 индуцирует интернализацию TIM3 экспрессирующей TIM3 клеткой, составляющую по меньшей мере 45% через 120 мин при 37°С, когда интернализацию определяют с помощью FACS-анализа. В одном из вариантов осуществления изобретения антитело к TIM3 обладает одним или несколькими из следующих свойств:
а) конкурирует за связывание с TIM3 с антителом к TIM3, содержащим VH, которая имеет SEQ ID NO: 7, и VL, которая имеет SEQ ID NO: 8,
б) связывается с TIM3 человека и обезьян циномолгус,
в) обладает в виде иммуноконъюгата цитотоксической активностью в отношении экспрессирующих TIM3 клеток,
г) индуцирует высвобождение интерферона-гамма.
В одном из вариантов осуществления изобретения антитело к TIM3 обладает одним или несколькими из следующих свойств:
а. конкурирует за связывание с TIM3 с антителом к TIM3, содержащим VH, которая имеет SEQ ID NO: 7, и VL, которая имеет SEQ ID NO: 8,
б. связывается с TIM3 человека и обезьян циномолгус,
в. обладает в виде иммуноконъюгата цитотоксической активностью в отношении экспрессирующих TIM3 клеток,
г. индуцирует высвобождение интерферона-гамма.
В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой моноклональное антитело. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой человеческое, гуманизированное или химерное антитело. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой фрагмент антитела, который связывается с TIM3. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой Fab-фрагмент. В одном из вариантов осуществления изобретения антитело к TIM3 содержит:
А) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309; или
Б) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309; или
В) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309; или
Г) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 316, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 317, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 318; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 319; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 320, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 321; или
Д) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 324, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 325, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 326; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 327; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 328, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 329; или
Е) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 332, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 333, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 334; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 335; (И) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 336, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 337; или
Ж) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 340, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 341, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 342; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 343; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 344, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 345; или
З) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 348, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 349, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 350; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 351; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 353, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 353; или
И) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 356, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 357, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 358; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 359; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 360, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 361; или
К) (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 364, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 365, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 366; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 367; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 368, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 369.
В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой полноразмерное антитело IgGl-изотипа с мутациями S228P, L235E и P329G, где нумерация соответствует EU-индексу Кэбота. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой любое из антител, описанных в WO 2011/155607, WO 2013/006490, WO 03/063792, WO 2009/097394 и WO 2011/159877. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой F38-2E2.
В одном из вариантов осуществления изобретения рак содержит ген KRAS дикого типа. В одном из вариантов осуществления изобретения рак содержит активирующую мутацию в гене KRAS.
В одном из вариантов осуществления изобретения лечение приводит к продолжительному ответу у индивидуума после прекращения лечения. В одном из вариантов осуществления изобретения по меньшей мере одну активирующую Т-клетку биспецифическую антигенсвязывающую молекулу и антагонист, связывающийся с осью PD-1, вводят непрерывно. В одном из вариантов осуществления изобретения по меньшей мере одну активирующую Т-клетку биспецифическую антигенсвязывающую молекулу и антагонист, связывающийся с осью PD-1, вводят с перерывами. В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, вводят перед FolR1-ТСВ (ТСВ, мишенью которой является FolR1). В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, вводят одновременно с FolR1-ТСВ. В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, вводят после FolR1-ТСВ. В одном из вариантов осуществления изобретения рак выбирают из группы, состоящей из рака яичника, рака легкого, рака молочной железы, рака почки, колоректального рака, рака эндометрия. В одном из вариантов осуществления изобретения по меньшей мере одну активирующую Т-клетку биспецифическую антигенсвязывающую молекулу и антагонист, связывающийся с осью PD-1, вводят внутривенно, внутримышечно, подкожно, местно, орально, чрескожно, внутрибрюшинно, внутриглазнично, путем имплантации, путем ингаляции, внутритрахеально, внутрь желудочков или внутриназально.
В одном из вариантов осуществления изобретения Т-клетки у индивидуума обладают повышенной активацией, пролиферацией и/или эффекторной функцией по сравнению с клеткой до введения комбинации. В одном из вариантов осуществления изобретения Т-клетки у индивидуума обладают повышенной активацией, пролиферацией и/или эффекторной функцией по сравнению с клеткой до введения только активирующей Т-клетку биспецифической антигенсвязывающей молекулы. В одном из вариантов осуществления изобретения Т-клеточная эффекторная функция представляет собой секрецию по меньшей мере одного из IL-2, IFN-γ и TNF-α. В одном из вариантов осуществления изобретения индивидуум содержит менее чем примерно 15% экспрессирующих PD-1hi инфильтрующих опухоль Т-клеток.
Одним из объектов изобретения является способ усиления иммунной функции у индивидуума с FolR1-позитивным раком, включающий введение индивидууму в эффективном количестве комбинации активирующей Т-клетку биспецифической антигенсвязывающей молекулы, специфической в отношении фолатного рецептора 1 (FolR1) и CD3, и антагониста, связывающегося с осью PD-1. В одном из вариантов осуществления изобретения Т-клетки у индивидуума обладают повышенной активацией, пролиферацией и/или эффекторной функцией по сравнению с клеткой до введения комбинации. В одном из вариантов осуществления изобретения Т-клетки у индивидуума обладают повышенной активацией, пролиферацией и/или эффекторной функцией по сравнению с клеткой до введения только активирующей Т-клетку биспецифической антигенсвязывающей молекулы. В одном из вариантов осуществления изобретения Т-клеточная эффекторная функция представляет собой секрецию по меньшей мере одного из IL-2, IFN-γ и TNF-α.
В одном из вариантов осуществления изобретения индивидуум содержит менее чем примерно 15% экспрессирующих PD-1hi инфильтрующих опухоль Т-клеток.
Другим объектом изобретения является способ отбора пациента для лечения комбинацией активирующей Т-клетку биспецифической антигенсвязывающей молекулы, специфической в отношении фолатного рецептора 1 (FolR1) и CD3, и антагониста, связывающегося с осью PD-1, включающий измерение уровня экспрессии PD-1, и отбор пациента для лечения комбинацией, который имеет менее чем примерно 15% экспрессирующих PD-1hi Т-клеток.
Другим объектом изобретения является набор, который содержит активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, и листовку-вкладыш в упаковку с инструкциями по применению активирующей Т-клетку биспецифической антигенсвязывающей молекулы в сочетании с антагонистом, связывающимся с осью PD-1, для лечения или замедления развития рака у индивидуума. В одном из вариантов осуществления изобретения набор дополнительно содержит инструкции по применения активирующей Т-клетку биспецифической антигенсвязывающей молекулы в сочетании с антагонистом TIM3.
Другим объектом изобретения является набор, который содержит активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, антагонист, связывающийся с осью PD-1, и листовку-вкладыш в упаковку с инструкциями по применению активирующей Т-клетку биспецифической антигенсвязывающей молекулы в сочетании с антагонистом, связывающимся с осью PD-1, для лечения или замедления развития рака у индивидуума. В одном из вариантов осуществления изобретения набор дополнительно содержит антагонист TIM3. В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антитело к PD-1 или антитело к PD-L1. В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антитело к PD-1 иммуноадгезин.
Другим объектом изобретения является фармацевтическая композиция, содержащая активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, антагонист, связывающийся с осью PD-1, и фармацевтический приемлемый носитель. В одном из вариантов осуществления изобретения фармацевтическая композиция дополнительно содержит антагонист TIM3.
Следующим объектом изобретения является применение комбинации активирующей Т-клетку биспецифической антигенсвязывающей молекулы, специфической в отношении фолатного рецептора 1 (FolR1) и CD3, антагониста, связывающегося с осью PD-1, для приготовления лекарственного средства, предназначенного для лечения рака. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения рака яичника, рака легкого, рака молочной железы, рака почки, колоректального рака, рака эндометрия.
В некоторых вариантах осуществления всех объектов настоящего изобретения предпочтительно указанная активирующая Т-клетку биспецифическая антигенсвязывающая молекула и/или антагонист, связывающийся с осью PD-1, являются человеческими или гуманизированными.
В некоторых вариантах осуществления изобретения биспецифическое антитело содержит Fc-домен, по меньшей мере один Fab-фрагмент, который содержит антигенсвязывающий сайт, специфический в отношении FolR1, и по меньшей мере один Fab-фрагмент, который содержит антигенсвязывающий сайт, специфический в отношении CD3.
Одним из объектов изобретения является способ лечения или замедления развития рака у индивидуума, включающий введение индивидууму в эффективном количестве активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антагониста TIM3. В некоторых из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит Fc-домен, два Fab-фрагмента, каждый из которых содержит антигенсвязывающий сайт, специфический в отношении FolR1, и один Fab-фрагмент, который содержит антигенсвязывающий сайт, специфический в отношении CD3.
Следующим объектом настоящего изобретения является применение комбинации активирующей Т-клетку биспецифической антигенсвязывающей молекулы, которая связывается с FolR1 и CD3, и антагониста, связывающегося с осью PD-1, для приготовления лекарственного средства, предназначенного для лечения рака.
Следующим объектом настоящего изобретения является применение комбинации активирующей Т-клетку биспецифической антигенсвязывающей молекулы, которая связывается с FolR1 и CD3, антагониста, связывающегося с осью PD-1, и антагониста TIM3 для приготовления лекарственного средства, предназначенного для лечения рака.
Варианты осуществления настоящего изобретения будут ниже описаны с целью примера, которые не ограничивают объем изобретения, и со ссылкой на прилагаемые чертежи. Однако различные другие объекты и варианты осуществления настоящего изобретения должны стать очевидными специалистам в данной области в свете настоящего описания.
В контексте настоящего описания «и/или» рассматривается как специфическое описание каждой из двух специфических особенностей или компонентов вместе или отдельно друг от друга. Например, «А и/или Б» следует рассматривать как специфическое описание каждого из следующих вариантов (I) А, (II) Б и (III) А и Б, так, как если бы каждый из них упоминался индивидуально.
Если из контекста не следует иное, то описания и определения описанных выше особенностей не ограничены каким-либо конкретным объектом или вариантом осуществления изобретения и равным образом относятся ко всем описанным объектам и вариантам осуществления изобретения.
Краткое описание чертежей
На чертежах показано:
на фиг. 1А-И - проиллюстрированы примеры конфигураций активирующих Т-клетку биспецифических антигенсвязывающих молекул (ТСВ), предлагаемых в изобретении. Все конструкции за исключением каппа-лямбда-формата (представленного на фиг. 1И) имеют мутации P329G LALA и содержат «knob-into-hole»-Fc-фрагменты с модификациями типа «knob-into-hole». На фиг. 1А проиллюстрирована конструкция «FolR1-ТСВ 2+1 инвертированная (общая легкая цепь)». FolR1-связывающий агент слит на С-конце тяжелой цепи Fab с N-концом первой субъединицы Fc-домена, содержащей модификацию, приводящую к образованию «выступа». Эти конструкции не являются «скрещенными» и имеют встречающуюся три раза одну и ту же легкую цепь (содержат три одинаковые) VLCL. На фиг. 1Б проиллюстрирована конструкция «FolR1-ТСВ 1+1 «голова-к хвосту» (общая легкая цепь)». Эти конструкции не являются «скрещенными» и имеют встречающуюся два раза одну и ту же легкую цепь VLCL. На фиг. 1В проиллюстрирована конструкция «FolR1-ТСВ 1+1 классическая (общая легкая цепь)». Эти конструкции не являются «скрещенными» и имеют встречающуюся два раза одну и ту же легкую цепь VLCL. На фиг. 1Г проиллюстрирована конструкция «FolR1-ТСВ 2+1 классическая (общая легкая цепь)». CD3-связывающий агент слит на С-конце тяжелой цепи Fab с N-концом первой субъединицы Fc-домена, содержащей модификацию, приводящую к образованию «выступа». Эти конструкции не являются «скрещенными» и имеют встречающуюся три раза одну и ту же легкую цепь VLCL. На фиг. 1Д проиллюстрирована конструкция «FolR1 ТСВ 2+1 crossfab классическая». Эти конструкции содержат цепь Ck-VH для CD3-связывающего агента вместо канонической цепи CH1-VH. CD3-связывающий агент слит на С-конце тяжелой цепи Fab с N-концом первой субъединицы Fc-домена, содержащей модификацию, приводящую к образованию «выступа». На фиг. 1Е проиллюстрирована конструкция «FolR1-ТСВ 2+1 crossfab инвертированная». Эти конструкции содержат цепь Ck-VH для CD3-связывающего агента вместо канонической цепи CH1-VH. FolR1-связывающий агент слит на С-конце тяжелой цепи Fab с N-концом первой субъединицы Fc-домена, содержащей модификацию, приводящую к образованию «выступа». На фиг. 1Ж проиллюстрирована конструкция «FolR1-ТСВ 1+1 crossfab «голова-к хвосту»». Эти конструкции содержат цепь Ck-VH для CD3-связывающего агента вместо канонической цепи CH1-VH. На фиг. 1З проиллюстрирована конструкция «FolR1-ТСВ 1+1 crossfab классическая». Эти конструкции содержат цепь Ck-VH для CD3-связывающего агента вместо канонической цепи CH1-VH. На фиг. 1И проиллюстрирован каппа-лямбда-формат антитела к CD3/FolR1. Эти конструкции содержат «скрещенную» общую легкую цепь VLCH1 и одну «скрещенную» цепь VHCL, специфическую в отношении CD3, и одну «скрещенную» цепь VHCL, специфическую в отношении FolR1;
на фиг. 2А-В - графики, на которых обобщены данные о связывании FolR1-связывающих агентов в виде IgG с клетками HeLa. Связывание новых созданных FolR1-связывающих агентов с FolR1, экспрессируемым на клетках HeLa, оценивали с помощью проточной цитометрии. Связанные антитела обнаруживали с использованием флуоресцентно меченного вторичного античеловеческого антитела;
на фиг. 3А-Б - графики, на которых обобщены данные о специфичности FolR1-связывающих агентов в отношении FolR1. Связывание IgG к FolR1 с клетками НЕК, кратковременно трансфектированными либо FolR1, либо FolR2, анализировали с помощью проточной цитометрии для идентификации клонов, которые специфически связывались с FolR1 и не связывались с FolR2. Антитела обнаруживали с использованием флуоресцентно меченного вторичного античеловеческого антитела;
на фиг. 4А-Б - графики, на которых обобщены данные о кросс-реактивности FolR1-связывающих агентов с cyFoLR1. Кросс-реактивность антител к FolR1 с cynoFolR1 анализировали на клетках НЕК, кратковременно трансфектированных cyFolR1, с помощью проточной цитометрии. Антитела обнаруживали с использованием флуоресцентно меченного вторичного античеловеческого антитела;
на фиг. 5 - график, иллюстрирующий интернализацию ТСВ к FolR1 (FolR1-ТСВ) после связывания. Интернализацию четырех FolR1-ТСВ после связывания с FolR1 тестировали на клетках HeLa. Оставшиеся на поверхности FolR1-ТСВ обнаруживали с использованием флуоресцентно меченного вторичного античеловеческого антитела в указанные моменты времени после инкубации при 37°С. Рассчитывали процент интернализации;
на фиг. 6А-Д - графики, на которых обобщены данные о связывании антител к FolR1 в виде IgG с клетками, характеризующимися различными уровнями экспрессии FolR1. Связывание IgG 9D11, 16D5 и Mov19 с опухолевыми клетками, характеризующимися различными уровнями экспрессии FolR1, анализировали с помощью проточной цитометрии. IgG DP47 включали в качестве контроля изотипа, a MKN-45 включали в качестве FolR1-негативной клеточной линии. Антитела обнаруживали с использованием флуоресцентно меченного вторичного античеловеческого антитела;
на фиг. 7А-М - графики, на которых обобщены данные об опосредуемом Т-клетками цитолизе клеток НТ-29 и SKOV3. FolR1-ТСВ применяли для тестирования опосредуемого Т-клетками цитолиза опухолевых клеток НТ-29 и SKOV3 и повышающей регуляции маркера активации на Т-клетках после цитолиза. На фиг. 7А-Г представлены данные об опосредуемом Т-клетками цитолизе клеток НТ-29 и SKOV3 в присутствии FolR1-TCB 19D11 и FolR1-TCB 16D5, который оценивали по высвобождению ЛДГ через 24 и 48 ч. ТСВ DP47 включали в качестве отрицательного контроля. После инкубации в течение 48 ч оценивали повышающую регуляцию маркеров активации CD25 и CD69 на CD8-Т-клетках и CD4-Т-клетках после цитолиза опухолевых клеток SKOV3 (фиг. 7Е-З) или НТ-29 (фиг. 7И-М) с помощью проточной цитометрии;
на фиг. 8 - график, демонстрирующий отсутствие связывания антител к FolR1 (анти-FolR1) с эритроцитами. Эритроциты выявляли с помощью дискриминационного окна как CD235a-позитивную популяцию и связывание IgG 9D11, IgG 16D5, IgG Mov19 и IgG DP47 с указанной популяцией обнаруживали с помощью проточной цитометрии. Антитела обнаруживали с использованием флуоресцентно меченного вторичного античеловеческого антитела;
на фиг. 9А-Г - графики, на которых представлено обобщение данных о повышающей регуляции маркера активации в цельной крови. Повышающую регуляцию маркеров активации CD25 и CD69 на СВ4-Т-клетках и CD8-T-клетках через 24 ч после добавления FolR1-ТСВ 9D11, FolR1-ТСВ 16D5, FolR1-ТСВ Mov19 и ТСВ DP47 анализировали с помощью проточной цитометрии;
на фиг. 10А-В - данные о цитолизе человеческих опухолевых клеток Hela (высокий уровень FolR1) (фиг. 24А), SKov-3 (средний уровень FolR1) (фиг. 24Б) и НТ-29 (низкий уровень FolR1) (фиг. 24В) Т-клетками, индуцируемом ТСВ 36F2, ТСВ 16D5, 16D5 в формате «ТСВ классическая», 16D5 в формате «ТСВ 1+1» и 16D5 в формате «ТСВ НТ (голова-к хвосту)» (Е:Т = 10:1, эффекторные клетки представляли собой человеческие РВМС, время инкубации 24 ч). ТСВ DP47 включали в качестве несвязывающегося контроля;
на фиг. 11А-Б - данные об экспрессии ингибирующих рецепторов на инфильтрующих опухоль Т-клетках. CD8+- и CD4+-Т-клетки в образцах опухоли характеризовали в отношении экспрессии ингибирующих рецепторов с помощью проточной цитометрии;
на фиг. 12А-П - данные об активации CD8+-Т-клеток в ферментативно расщепленных образцах опухолей и злокачественных выпотах после экспозиции FolR1-ТСВ. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или в отсутствии FolR1-ТСВ или ТСВ DP47 в качестве контроля. Экспрессию маркеров активации или маркеров Т-клеточной функции на CD8+-Т-клетках определяли с помощью проточной цитометрии (фиг. 12А-Н). На фиг. 12К-Л показаны репрезентативные FACS-графики, демонстрирующие индуцированную FolR1-ТСВ Т-клеточную активацию у «высокореагирующих» (с высоким ответом) пациентов (BS-269) или «низкореагирующих» пациентов (BS-212). На фиг. 12М показаны FACS-графики, демонстрирующие индуцированную FolR1-ТСВ экспрессию маркеров активации в Т-клетках репрезентативного пациента. На графиках, представленных на фиг. 12Н, проиллюстрировано повышение уровня экспрессии маркера после обработки FolR1-ТСВ в виде среднего значения и стандартных отклонений. Для сравнения РВМС из здоровых доноров совместно культивировали с опухолевыми клетками линии Skov3 и стимулировали FolR1-TCB. На фиг. 12O представлены уровни IFN-γ, IL-2, TNF и перфорина в супернатантах клеточных культур по данным, полученным с помощью анализа методом Cytometric Bead Array (цитометрический анализ на гранулах множества агентов) или ELISA, и стандартизованных относительно количества 1×105 CD3+-Т-клеток (IFN-γ, TNF, IL-2) или CD3+ CD8+ -Т-клеток (перфорин) в культуре. На фиг. 12П продемонстрировано, что индуцированный FolR1-ТСВ цитолиз опухолевых клеток значительно варьируется в ферментативно расщепленных образцах опухолей и злокачественных выпотах. FolR1-позитивные и FolR1-негативные ферментативно расщепленные образцы опухолей, злокачественные выпоты или РВМС из здоровых доноров совместно культивировали с экзогенно добавленными флуоресцентно меченными FolR1+-Skov3-клетками при соотношении Е:Т 1:1 в течение 24 ч в присутствии или в отсутствии FolR1-ТСВ. Индуцированный FolR1-ТСВ специфический цитолиз клеток Skov3 определяли с помощью проточной цитометрии путем измерения активированной каспазы 3 и маркера живых/мертвых клеток LIVE/DEAD®-near-IR (LIVE/DEAD® для ближней инфракрасной области). Опосредуемый FolR1-ТСВ цитолиз рассчитывали следующим образом: % специфического цитолиза = 100-[(% живых Skov3-клеток в обработанном FolR1-ТСВ образце / % живых Skov3-клеток в необработанном образце)×100]. На FACS-графиках продемонстрирован индуцированный FolR1-ТСВ цитолиз у репрезентативного пациента, р-значения рассчитывали с помощью непарного критерия Манна-Уитни;
на фиг. 13А-В - данные, демонстрирующие, что индуцированная FolR1-ТСВ Т-клеточная активация не коррелирует с соотношением Е:Т (фиг. 13А) или количеством опухолевых FolR1+-клеток (фиг. 13Б). Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или отсутствии FolR1-ТСВ. Индуцированная FolR1-ТСВ экспрессия CD25 коррелировала с соотношением Е:Т или количеством клеток-мишеней. MFI: среднее значение интенсивности флуоресценции;
на фиг. 14А-М - данные, демонстрирующие, что индуцированная FolR1-ТСВ Т-клеточная активация обратно коррелирует с уровнем экспрессии PD-1 и TIM3. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или отсутствии FolR1-ТСВ. Экспрессию маркеров активации или маркеров Т-клеточной функции на CD8+-Т-клетках определяли с помощью проточной цитометрии. Индуцированная FolR1-ТСВ экспрессия CD25 (фиг. 14А-В), CD137 (фиг. 14Г-Е), ICOS (фиг. 14Ж-И) и гранзима В (фиг. 14К-М) коррелировали с исходным уровнем индивидуально или совместно экспрессируемых ингибирующих рецепторов PD-1 и TIM3;
на фиг. 15А-В - данные, демонстрирующие что индуцированная FolR1-ТСВ секреция IL-2 обратно коррелирует с совместной экспрессией PD-1 и TIM3. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или отсутствии FolR1-ТСВ. IL-2 в супернатантах клеточных культур определяли с помощью ELISA и стандартизовали относительно количества Т-клеток. Индуцированная FolR1-ТСВ секреция IL-2 коррелировала с исходным уровнем индивидуально или совместно экспрессируемых ингибирующих рецепторов PD-1 и TIM3;
на фиг. 16А-Е - данные, демонстрирующие, что индуцированный FolR1-ТСВ цитолиз опухолевых клеток обратно коррелирует с совместной экспрессией PD-1 и TIM3. Ферментативно расщепленные образцы опухолей или злокачественные выпоты совместно культивировали с экзогенно добавленными флуоресцентно меченными Skov3-клетками при соотношении Т-клеток и клеток-мишеней 1:1 в течение 24 ч в присутствии или отсутствии FolR1-ТСВ. FolR1-ТСВ-специфический цитолиз Skov3-клеток определяли с помощью проточной цитометрии путем измерения активированной каспазы 3 и маркера живых/мертвых клеток Live/Dead-near-IR. Специфический цитолиз коррелировал с исходным уровнем индивидуально или совместно экспрессируемых ингибирующих рецепторов PD-1, TIM3 и CTLA-4;
на фиг. 17А-З - данные об активации инфильтрующих опухоль CD8+-Т-клеток после экспозиции катумаксомаба. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или в отсутствии катумаксомаба. На фиг. 17А-Г - данные об экспрессии маркеров активации или маркеров Т-клеточной функции на CD8+-T-клетках, которые определяли с помощью проточной цитометрии. На фиг. 17Д-З - графики, демонстрирующие исходную экспрессию ингибирующих рецепторов;
на фиг. 18А-Т - данные, демонстрирующие, что индуцированная катумаксомабом Т-клеточная активация обратно коррелирует с совместной экспрессией ингибирующих рецепторов. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или в отсутствии катумаксомаба. Т-клеточная активация и эффекторные функции коррелировали с экспрессией PD-1 (фиг. 18А-Е), TIM3 (фиг. 18Ж-М) или комбинацией PD-1 и TIM3 (фиг. 18Н-Т):
на фиг. 19А-З - экспрессия ингибирующих рецепторов на инфильтрующих опухоли Т-клетках у пациентов с немелкоклеточным раком легких. CD8+- и CD4+-Т-клетки в образцах опухоли характеризовали с помощью проточной цитометрии в отношении экспрессии в них ингибирующих рецепторов (фиг. 19А-Е). На фиг. 19Ж продемонстрирована стратегия установки дискриминационных окон для одного репрезентативного донора. На фиг. 19З - результаты анализа и мозаичная теплокарта указанных субпопуляций клеток на основе процента экспрессии, полученная с помощью программы условного форматирования Excel;
на фиг. 20А-Д - данные о Т-клеточной активации и эффекторных функциях после поликлональной стимуляции с помощью антител к CD3/CD28. Экспрессию CD25 и гранзима В (фиг. 20А-Б), а также IL-2, IFN-γ и TNF-α (фиг. 20В-Д) в качестве маркеров Т-клеточной активации и эффекторной функции соответственно анализировали в Т-клетках из ферментативно расщепленных образцов опухолей после стимуляции ферментативно расщепленной всей опухоли с помощью антител к CD3 и CD28;
на фиг. 21A-O - данные об экспрессии ингибирующих рецепторов и дисфункции Т-клеток. Экспрессия CD25 и гранзима В (фиг. 21А-Б), а также IL-2, IFN-γ и TNF-α (фиг. 21В-Д) после поликлональной стимуляции антителами к CD3/к CD28 коррелировала с кумулятивной экспрессией ингибирующих рецепторов, по данным, полученным на основе iR-балла. На фиг. 21Е - пример расчета iR-баллов. Процент экспрессии PD-1, TIM3, CTLA-4, LAG-3 и BTLA анализировали во всех образцах NSCLC и определяли медианные значения, а также межквартильные размахи. Для расчета iR-балла каждому пациенту начисляли «очки» в зависимости от уровня экспрессии каждого из анализируемых ингибирующих рецепторов, которые определяли на основе квартиля, в который попадал уровень экспрессии. Максимально достижимое количество составляло 15 «очков»; рассчитанный балл для каждого образца стандартизовали относительно максимального количества «очков». На фиг. 21Ж-Л продемонстрировано, что экспрессия ингибирующих рецепторов повышалась в зависимости от стадии опухоли. Экспрессия ингибирующих рецепторов на инфильтрующих опухоли СВ8+-Т-клетках коррелировала со TNM-стадией (международная классификация злокачественных опухолей) опухоли. На фиг. 21М-О представлены данные о кумулятивной экспрессии ингибирующих рецепторов по мере развития опухоли. Кумулятивная экспрессия ингибирующих рецепторов PD-1, TIM3, CTLA-4, LAG-3 и BTLA, выраженная в виде iR-балла, коррелировала с нодальным статусом и TNM-стадией;
на фиг. 22А-И - данные, демонстрирующие, что экспрессия PD-1 и TIM3 коррелировала с дисфункцией Т-клеток. Экспрессия CD25 и гранзима В (фиг. 22А-В), а также IL-2, IFN-γ и TNF-α (фиг. 22Г-Е) после поликлональной стимуляции CD3/CD28 коррелировала с экспрессией PD-1 (фиг. 22А-В), TIM3 (фиг. 22Г-Е) или PD-1/TIM3 (фиг. 22Ж-И) на инфильтрующих опухоль Т-клетках;
на фиг. 23А-Д - данные, демонстрирующие, что воздействие блокады PD-1 или комбинированный блокады PD-1/TIM3 варьируется межу пациентами. Ферментативно расщепленные образцы стимулировали агонистическими антителами к CD3/к CD28 в дополнение к блокирующим антителам к PD-1 индивидуально или в комбинации с TIM3. Секрецию IFN-γ, TNF-α и IL-2 определяли с помощью ELISA и стандартизовали относительно 1×106 Т-клеток. На фиг. 23А-В представлены данные для Т-клеток из пациента, у которого функции Т-клеток можно восстанавливать («спасать») путем добавления блокирующих Ат (BS-268), и Т-клеток из пациента, не отвечающего на блокаду PD-1 или PD-1/TIM3. Представлены данные в виде различия в экспрессии ([% экспрессии при обработке Ат]-[% экспрессии без обработки]). На фиг. 23Г представлены соответствующие полученные с помощью проточной цитометрии графики для субпопуляций PD-1hi и PD-1int. На фиг. 23Д обобщены данные о секреции IL-2, TNF-α и IFN-γ Т-клетками из шести пациентов, полученные с помощью ELISA и стандартизованные относительно 1×106 CD3+-Т-клеток;
на фиг. 24А-Е - данные, демонстрирующие, что воздействие блокады PD-1 или комбинированной блокады PD-1/TIM3 различается у субпопуляций PD-1hi и PD-1int. Корреляцию повышения производства цитокинов при блокаде PD-1 или комбинированной блокаде PD-1/TIM3 с субпопуляциями PD-1hi и PD-1int определяли с использованием соотношения PD-1hi/PD-1int;
на фиг. 25А-И - данные, демонстрирующие активацию CD4+-Т-клеток в ферментативно расщепленных образцах опухолей и злокачественных выпотах после экспозиции FolR1-ТСВ. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или отсутствии FolR1-ТСВ или применяемой в качестве контроля ТСВ DP47. Экспрессию маркеров активации или маркеров Т-клеточной функции определяли на CD8+-Т-клетках с помощью проточной цитометрии;
на фиг. 26А-В - данные, демонстрирующие, что индуцированная FolR1-ТСВ Т-клеточная активация не зависит от экспрессии CTLA-4, Lag-3 и BTLA. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или отсутствии FolR1-ТСВ. Экспрессию CD25 на CD8+-Т-клетках определяли с помощью проточной цитометрии. Индуцированная FolR1-ТСВ экспрессия CD25 коррелировала с исходным уровнем экспрессии CTLA-4, Lag-3 и BTLA;
на фиг. 27А-В - данные, демонстрирующие, что FolR1-ТСВ индуцирует секрецию цитокинов только у пациентов с низким процентом экспресирующих PD-1hi CD8+-Т-клеток. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч в присутствии или отсутствии FolR1-ТСВ. IFN-γ, TNF и IL-2 в супернатантах клеточных культур определяли и стандартизовали относительно количества 1×105 Т-клеток в культуре. Индуцированная FolR1-ТСВ секреция цитокинов коррелировала с исходным уровнем экспрессии PD-1hi;
на фиг. 28А-Е - данные, демонстрирующие, что обработка блокирующим антителом к PD-1 не индуцирует секрецию цитокинов в ферментативно расщепленных образцах опухолей или злокачественных выпотах пациентов с раком легкого и яичника, имеющих низкий процент экспрессирующих PD-1hi клеток. Ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в течение 24 ч с FolR1-ТСВ в присутствии или отсутствии блокирующего PD-1 антитела (фиг. 28А-В) или комбинации блокирующих PD-1 и TIM3 антител (фиг. 28Г-Е). Определяли IFN-γ, TNF и IL-2 в супернатантах клеточных культур и стандартизовали относительно количества 1×105 Т-клеток в культуре. Секреция цитокинов, индуцированная блокирующими антителами, по сравнению с обработкой только FolR1-ТСВ коррелировала с исходным уровнем экспрессии PD-1hi;
на фиг. 29А-Б - результаты анализа интернализации на основе FACS. Данные демонстрируют, что Fab-фрагмент (<TIM3> Fab) антитела к TIM3 Tim3_0022 (сокращенно <TIM3> Ab(022)) интернализировался в rec (рекомбинантные) CHOK1-клетки, экспрессирующие huTIM3, после инкубации при 37°С, при этом кинетика была сходной с кинетикой антитела в полноразмерном IgG-формате;
на фиг. 30А-Б - данные, демонстрирующие связывание антител к TIM3 с клетками RPMI-8226 (антитело, обозначенное как клон 0016, относится к антителу Tim3_0016, клон 0016, которое обозначает вариант антитела Tim3_0016 (антитело Tim3_0018), клон 0022 относится к антителу Tim3_00122 и т.д.). На фиг. 30Б - данные, демонстрирующие связывание антител к TIM3 с клетками Пфайффера (антитело, обозначенное как клон 0016, относится к антителу Tim3_0016, клон 0016 относится к варианту антитела Tim3_0016 (антитело Tim3_0018), клон 0022 относится к антителу Tim3_00122 и т.д.);
на фиг. 31 - данные, демонстрирующие уровень экспрессии TIM3 на различных образцах клеток пациента с AML, определенный с помощью FACS с использованием МАт к TIM3;
на фиг 32 - мозаичная теплокарта экспрессии ингибирующих рецепторов на ассоциированных с NSCLC TIL (опухоль-инфильтрующие лимфоциты).
Совместная экспрессия ингибирующих рецепторов на инфильтрующих опухоль CD8+-Т-клетках, позитивных по указанным иммунными контрольным точкам (чекпойнты), приведена в виде мозаичной теплокарты, на которой представлен процент экспрессии дополнительных рецепторов;
на фиг. 33 - радарный график экспрессии ингибирующих рецепторов на ассоциированных с NSCLC TIL. Совместная экспрессия ингибирующих рецепторов на инфильтрующих опухоль CD8+-Т-клетках, позитивных по указанным иммунными контрольным точкам, представлена в виде радарного графика, на котором показаны среднее значение экспрессии и стандартное отклонение для четырех других рецепторов;
на фиг. 34А-Г - процент PD-1hi или PD-1int CD8+-Т-клеток, экспрессирующих дополнительные иммунные контрольные точки. На графиках каждая точка обозначает образцы из одного пациента. Величины р рассчитывали, используя критерий суммы рангов Вилкоксона;
на фиг. 35А-Е - данные об экспрессии ингибирующих Т-клеточных рецепторах и Т-клеточной функции внутри опухоли. На фиг. 35А продемонстрирована стратегия установки дискриминационных окон для идентификации PD-1hi, PD-1int и PD-1neg субпопуляций CD8+-Т-клеток из двух репрезентативных пациентов. На фиг. 35Б продемонстрировано распределение указанных Т-клеточных субпопуляций в проанализированных образцах опухолей. На фиг. 35В продемонстрировано, что Т-клеточные функции, индуцированные стимуляцией антител к CD3/к CD28, зависят от уровня экспрессии PD-1 на CD8+-Т-клетках. Ферментативно расщепленные образцы опухолей и злокачественные выпоты культивировали в течение 24 ч в присутствии или в отсутствии агонистических антител к CD3/к CD28. Повышение уровня экспрессии CD25 на CD8+-Т-клетках (фиг. 35В) и повышение уровня эффекторных цитокинов IFN-γ, IL-2 и TNF (фиг. 35Г) определяли в опухолях с низким и высоким уровнем PD-1hi. p-значения рассчитывали с помощью непарного критерия Манна-Уитни. Образцы опухолей разделяли на основе процента экспрессирующих PD-1hi CD8+-клеток на две группы с низким и высоким уровнем экспрессии PD-1hi соответственно (фиг. 35Д). Уровень экспрессии ингибирующих рецепторов PD-1, TIM3, CTLA-4, Lag-3 и BTLA определяли с помощью проточной цитометрии на CD8+-Т-клетках из ферментативно расщепленных образцов опухолей и злокачественных выпотов (фиг. 35Е);
на фиг. 36А-Д - схемы экспрессии ингибирующих рецепторов и процент CD8+-Т-клеток с низким и высоким уровнем экспрессии. На фиг. 36А-Г представлены данные о совместной экспрессии TIM3, CTLA-4, Lag-3 и BTLA на PD-1hi, PD-1int и PD-1neg CD8+-Т-клетках. p-значения рассчитывали с помощью одностороннего дисперсионного анализа с использованием апостериорного критерия Бонферрони. Образцы FolR1+-опухолей разделяли на основе экспрессирующих PD-1hi CD8+-клеток на две группы с низким и высоким уровнем экспрессии PD-1hi соответственно (фиг. 36Д);
на фиг. 37А-З - данные, демонстрирующие, что индуцированные FolR1-ТСВ Т-клеточные функции зависят от уровня экспрессии PD-1 на CD8+-T-клетках. Ферментативно расщепленные образцы FolR1+-опухолей и злокачественные выпоты культивировали в течение 24 ч в присутствии или в отсутствии FolR1-ТСВ. Повышение уровня экспрессии маркеров активации на СВ8+-Т-клетках (фиг. 37А-В) и повышение производства эффекторных цитокинов IFN-γ, IL-2, TNF и перфорина (фиг. 37Г-Ж) определяли в опухолях с низким и высоким уровнем экспрессии PD-1hi. На фиг. 37З представлены данные о цитолизе клеток-мишеней. Уровень клеток в образцах и FolR1-позитивных, и негативных опухолей регулировали, добавляя клеточную линию FolR1+ Skov3 до достижения соотношения Е:Т=1:1, и сравнивали цитолиз в опухолях с высоким и низким уровнем PD-1hi. р-значения рассчитывали с помощью непарного критерия Манна-Уитни;
на фиг. 38А-Д - данные, демонстрирующие, что блокада PD-1 повышает производство цитокинов, но не их цитолитическую функцию только в Т-клетках из опухолей с низким уровнем PD-1hi. На фиг. 38А-Г: ферментативно расщепленные образцы FolR1+-опухолей или злокачественные выпоты культивировали в течение 24 ч с FolR1-ТСВ в присутствии или в отсутствии блокирующего антитела к PD-1. Содержание IFN-γ, IL-2, TNF и перфорина в супернатантах клеточных культур определяли с помощью анализа Cytometric Bead Array или ELISA и стандартизовали относительно количества 1×105 CD3+-Т-клеток (IFN-γ, IL-2, TNF, фиг. 38А-В) или CD3+ CD8+-Т-клеток (перфорин, фиг. 38Г). Повышение секреции цитокинов после комбинированной обработки FolR1-ТСВ и антителом к PD-1 по сравнению с обработкой только FolR1-ТСВ определяли в опухолях с низким и высоким уровнем PD-1hi. На фиг. 38Д: ферментативно расщепленные образцы опухолей или злокачественные выпоты совместно культивировали с экзогенно добавленными флуоресцентно меченными клетками Skov3 при соотношении Е:Т 1:1 в течение 24 ч в присутствии или в отсутствии блокирующего PD-1 антитела и FolR1-ТСВ. Повышение специфического цитолиза при применении антитела к PD-1 сравнивали в опухолях с низким и высоким уровнем PD-1hi. p-значения рассчитывали с помощью непарного критерия Манна-Уитни;
на фиг. 39 - подробные характеристики пациентов;
на фиг. 40А-В - данные об активации CD8+-Т-клеток после экспозиции повышенными концентрациями FolR1-ТСВ. РВМС совместно культивировали с Skov3-клетками в течение 24 ч в присутствии или отсутствии FolR1-ТСВ или применяемой в качестве неспецифического контроля ТСВ DP47. На фиг. 40А продемонстрированы данные об экспрессии FolR1 на Skov3. Закрашенная гистограмма: контроль изотипа; незакрашенная гистограмма: антитело к FolR1. На фиг. 40Б - данные об экспрессии маркеров активации CD25, CD137 и ICOS на CD8+-Т-клетках, которые определяли с помощью проточной цитометрии. На фиг. 40В - данные об уровне IFN-γ, IL-2 и TNF в супернатантах клеточных культур, которые определяли с помощью ELISA и стандартизовали относительно количества 1×105 CD3+-Т-клеток.
Подробное описание вариантов осуществления изобретения
I. Определения
В контексте настоящего описания «акцепторный человеческий каркасный участок» означает каркасный участок, содержащий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), имеющий происхождение из каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, указанного ниже.
Акцепторный человеческий каркасный участок «имеющий происхождение из» каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, может содержать такую же аминокислотную последовательность или может содержать изменения в аминокислотной последовательности. В некоторых вариантах осуществления изобретения количество аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления изобретения последовательность акцепторного человеческого каркасного участка VL идентична последовательности каркасного участка VL человеческого иммуноглобулина или последовательности консенсусного человеческого каркасного участка.
Понятие «аффинность» относится к суммарной силе всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). В контексте настоящего описания, если не указано иное, «аффинность связывания» относится к присущей молекуле аффинности связывания, отражающей взаимодействие по типу 1:1 между компонентами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y, как правило, можно характеризовать с помощью константы диссоциации (Kd). Аффинность можно оценивать с помощью общепринятых методов, известных в данной области, включая те, которые представлены в настоящем описании. Ниже в качестве иллюстрации представлены конкретные варианты измерения аффинности связывания.
Антитело «с созревшей аффинностью» означает антитело с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (HVR) по сравнению с родительским антителом, которое не содержит указанных изменений, указанные изменения приводят к повышению аффинности антитела к антигену.
Понятия «биспецифическое антитело, которое специфически связывается с фолатным рецептором 1 (FolR1) и CD3», «активирующая Т-клетку биспецифическая антигенсвязывающая молекула, специфическая в отношении FolR1 и CD3» и «FolR1-ТСВ» в контексте настоящего описания применяют взаимозаменяемо, и они относятся к биспецифическому антителу, которое обладает способностью связывать FolR1 и CD3 с аффинностью, достаточной для того, чтобы антитело можно было применять в качестве диагностического и/или терапевтического агента для таргетинга CD3+-Т-клеток к FolR1+-клеткам-мишеням.
Понятия «анти-TIM3 антитело» и «антитело к TIM3» в контексте настоящего описания используют в качестве синонимов для обозначения антитела, которое специфически связывается с TIM3. Антитело к TIM3, указанное в настоящем описании, относится к антителу, которое обладает способностью связывать TIM3, прежде всего полипептид TIM3, экспрессируемый на клеточной поверхности, с аффинностью, достаточной для того, чтобы антитело можно было применять в качестве диагностического и/или терапевтического агента. В одном из вариантов осуществления изобретения уровень связывания антитела, которое специфически связывается с TIM3, с неродственным белком, который не представляет собой TIM3, составляет менее чем примерно 10% от связывания антитела с TIM3 по данным измерений, полученным, например, с помощью радиоиммуноанализа (РИА) или проточной цитометрии (FACS). В некоторых вариантах осуществления изобретения антитело, которое специфически связывается с TIM3, характеризуется величиной константы диссоциации (KD), составляющей ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах осуществления изобретения антитело, которое специфически связывается с TIM3, связывается с эпитопом TIM3, который является консервативным среди DR5 различных видов. Предпочтительно указанное антитело связывается с TIM3 человека и обезьян циномолгус. Под понятие «антитело, которое специфически связывается с TIM3» подпадают также биспецифические антитела, которые обладают способностью связываться с TIM3 и вторым антигеном.
В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится к различным структурам антител, включая (но, не ограничиваясь только ими) моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают требуемой антигенсвязывающей активностью.
В контексте настоящего описания «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примеры фрагментов антител включают (но, не ограничиваясь только ими) Fv, Fab, Fab', Fab'-SH, F(ab')2; димерные антитела (диабоди), cross-Fab-фрагменты; линейные антитела; одноцепочечные молекулы антител (например, scFv); и мультиспецифические антитела, образованные из фрагментов антител. Антитела в виде scFv описаны, например, у Houston J.S. Methods in Enzymol. 203, 1991, сс. 46-96). Кроме того, фрагменты антител содержат одноцепочечные полипептиды, имеющие характеристики VH-домена, т.е. обладающие способностью к сборке с VL-доменом, или VL-домена, т.е. обладающие способностью к сборке с VH-доменом, с образованием антигенсвязывающего сайта и поэтому обладают антигенсвязывающей особенностью полноразмерных антител.
В контексте настоящего описания «Fab-фрагмент» относится фрагменту антитела, содержащему фрагмент легкой цепи, который содержит VL-домен и константный домен легкой цепи (CL), и VH-домен и первый константный домен (СН1) тяжелой цепи. В одном из вариантов осуществления изобретения биспецифические антитела, предлагаемые в изобретении, содержат по меньшей мере один Fab-фрагмент, в котором либо вариабельные области, либо константные области тяжелой и легкой цепей обменены. В результате обмена либо вариабельных областей, либо константных областей указанный Fab фрагмент обозначают также как «cross-Fab-фрагмент» или «xFab-фрагмент» или «Кроссовер-Fab-фрагмент». Возможны две различные композиции цепи кроссовер-молекулы Fab, и они могут входить в биспецифические антитела, предлагаемые в изобретении: с одной стороны, имеет место обмен вариабельными областями тяжелой и легкой цепи Fab, т.е. кроссовер-молекула Fab содержит пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1), и пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL). Указанную кроссовер-молекулу Fab обозначают также как CrossFab(VLVH). С другой стороны, когда друг на друга обменены константные области тяжелой и легкой цепи Fab, то кроссовер-молекула Fab содержит пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL), и пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1). Указанную кроссовер-молекулу Fab обозначают также как CrossFab(CLCH1). Форматы биспецифических антител, содержащих кроссовер-Fab-фрагменты, описаны, например, в WO 2009/080252, WO 2009/080253, WO 2009/080251, WO 2009/080254, WO 2010/136172, WO 2010/145792 и WO 2013/026831.
«Одноцепочечный Fab-фрагмент» или «scFab» представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи (VH) антитела, константного домена 1 (СН1) антитела, вариабельного домена легкой цепи (VL) антитела, константного домена легкой цепи (CL) антитела и линкера, в котором указанные домены антитела и указанный линкер имеют один из следующих порядков расположения в направлении от N-конца к С-концу:
а) VH-СН1-линкер-VL-CL, б) VL-CL-линкер-VH-СН1, в) VH-CL-линкер-VL-CH1 или г) VL-CH1-линкер-VH-CL; и в котором указанный линкер представляет собой полипептид, состоящий по меньшей мере из 30 аминокислот, предпочтительно примерно от 32 до 50 аминокислот. Указанные одноцепочечные Fab-фрагменты a) VH-CH1-линкер-VL-CL, б) VL-CL-линкер-VH-CH1, в) VH-CL-линкер-VL-СН1 и г) VL-CH1-линкер-VH-CL стабилизируют с помощью встречающейся в естественных условиях дисульфидной связи между CL-доменом и СН1-доменом. Кроме того, указанные одноцепочечные молекулы Fab можно дополнительно стабилизировать посредством создания межцепочечных дисульфидных связей путем встраивания остатков цистеина (например, в положение 44 в вариабельной тяжелой цепи и в положение 100 в вариабельной легкой цепи согласно нумерации Кэбота).
Понятие «N-конец» означает последнюю аминокислоту N-конца. Понятие «С-конец» означает последнюю аминокислоту С-конца.
Под понятием «слитый» или «связанный» подразумевают, что компоненты (например, молекула Fab и субъединица Fc-домена) соединены пептидными связями либо непосредственно, либо через один или несколько пептидных линкеров.
Понятие «линкер» в контексте настоящего описания означает пептидный линкер и предпочтительно пептид с аминокислотной последовательностью, состоящей по меньшей мере из 5 аминокислот, предпочтительно из 5-100, более предпочтительно 10-50 аминокислот. В одном из вариантов осуществления изобретения указанный пептидный линкер представляет собой (GxS)n (SEQ ID NO: 384 и 385) или (GxS)nGm (SEQ ID NO: 429 и 430), где G обозначает глицин, S обозначает серин и (х=3, n=3, 4, 5 или 6 и m=0, 1, 2 или 3) или (х=4, n=2, 3, 4 или 5 и m=0, 1, 2 или 3), предпочтительно х=4 и n=2. В одном из вариантов осуществления изобретения указанный пептидный линкер представляет собой (G4S)2 (SEQ ID NO: 386).
Понятие «молекула иммуноглобулина» относится к белку, имеющему структуру встречающегося в естественных условиях антитела. Например, иммуноглобулины класса IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух легких цепей и двух тяжелых цепей, связанных дисульфидными мостиками. В направлении от N-конца к С-концу каждая тяжелая цепь содержит вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой расположены три константных домена (CH1, СН2 и СН3), которые называют также константной областью тяжелой цепи. Аналогично этому, в направлении от N- конца к С-концу каждая легкая цепь содержит вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой расположен константный домен легкой цепи (CL), который называют также константной областью легкой цепи. Тяжелая цепь иммуноглобулина может относиться к одному из пяти типов, обозначенных как α (IgA), δ (IgD), ε (IgE), γ (IgG) или μ (IgM), некоторые из которых дополнительно подразделяют на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь иммуноглобулина может относиться к одному из двух типов, обозначенных как каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена. Иммуноглобулин, как правило, состоит из двух молекул Fab и Fc-домена, которые соединены через шарнирную область иммуноглобулина.
«Антитело, которое связывается с тем же эпитопом», что и референс-антитело, означает антитело, которое блокирует связывание референс-антитела с его антигеном при оценке в анализе в условиях конкуренции на 50% или более, и наоборот, референс-антитело блокирует связывание антитела с его антигеном при оценке в анализе в условиях конкуренции на 50% или более. Пример анализа в условиях конкуренции представлен в настоящем описании.
Понятие «антигенсвязывающий домен» относится к части антигенсвязывающей молекулы, которая содержит область, специфически связывающуюся и являющуюся комплементарной части антигена или полному антигену. Если антиген является крупным, то антигенсвязывающая молекула может связываться только с конкретной частью антигена, которую называют эпитопом. Антигенсвязывающий домен может представлять собой, например, один или несколько вариабельных доменов антитела (которые называют также вариабельными областями). Предпочтительно антигенсвязывающий домен содержит вариабельную область легкой цепи (VL) антитела и вариабельную область тяжелой цепи антитела (VH).
Понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или конкретных видов, а остальная часть тяжелой и/или легкой цепи происходит из другого источника или других видов, которое, как правило, получают методами рекомбинантной ДНК. Химерные антитела, содержащие кроличью вариабельную область и человеческую константную область, являются предпочтительными. Другие предпочтительные формы «химерных антител», подпадающие по объем настоящего изобретения, представляют собой антитела, в которых константная область модифицирована или изменена по сравнению с исходным антителом для получения свойств, указанных в настоящем изобретении, прежде всего касающихся связывания с C1q и/или связывания с Fc-рецептором (FcR). Указанные химерные антитела обозначают также как «антитела переключенного класса». Химерные антитела являются продуктом экспрессированных генов иммуноглобулинов, содержащих ДНК-сегменты, которые кодируют вариабельные области иммуноглобулина, и ДНК-сегменты, которые кодируют константные области иммуноглобулина. Методы получения химерных антител включают общепринятый метод рекомбинантной ДНК и методы трансфекции генов, хорошо известные в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad. Sci. USA 81, 1984, сс. 6851-6855; US №№5202238 и 5204244).
В контексте настоящего описания понятие «цитотоксический агент» относится к субстанции, которая ингибирует или препятствует клеточной функции и/или вызывает гибель или деструкцию клетки. Цитотоксические агенты включают (но, не ограничиваясь только ими) радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибирующие рост агенты; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или обладающие ферментативной активностью токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты; и различные противоопухолевые или противораковые агенты, описанные ниже.
Понятие «эффекторные функции» относится к тем видам биологической активности, которые связаны с Fc-областью антитела, которые варьируются в зависимости от изотипа антитела. Примерами эффекторных функций антитела являются: способность связываться с C1q и комплементзависимая цитотоксичность (CDC), способность связываться с Fc-рецептором, антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), секреция цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, понижающая регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора); и активация В-клеток.
В контексте настоящего описания подразумевается, что понятия «конструирование, сконструированный, инженерия» включают любую манипуляцию с пептидным каркасом или пост-трансляционные модификации встречающегося в естественных условиях или рекомбинантного полипептида или его фрагмента. Инженерия включает модификации аминокислотной последовательности, схемы гликозилирования или группы боковых цепей индивидуальных аминокислот, а также комбинации указанных подходов.
В контексте настоящего описания подразумевается, что понятие «аминокислотная мутация» относится к аминокислотным заменам, делециям, инсерциям и модификациям. Можно применять любую комбинацию замены, делеции, инсерции и модификации для создания конечной конструкции при условии, что конечная конструкция обладает требуемыми характеристиками, например, пониженной способностью связываться с Fc-рецептором или повышенной ассоциацией с другим пептидом. Аминокислотная последовательность с делециями и инсерциями включает амино- и/или карбоксиконцевые делеции и инсерции аминокислот. Конкретными аминокислотными мутациями являются аминокислотные замены. Для изменения, например, характеристик связывания Fc-области, наиболее предпочтительными являются неконсервативные аминокислотные замены, т.е. замена одной аминокислоты на другую аминокислоту, имеющую другие структурные и/или химические свойства. Аминокислотные замены включают замену на не встречающиеся в естественных условиях аминокислоты или на производные встречающихся в естественных условиях двадцати стандартных аминокислот (например, на 4-гидроксипролин, 3-метилгистидин, орнитин, гомосерин, 5-гидроксилизин). Аминокислотные мутации можно создавать с помощью генетических или химических методов, хорошо известных в данной области. Генетические методы могут включать сайтнаправленный мутагенез, ПЦР, синтез генов и т.п. Подразумевается, что можно применять также методы изменения боковой группы аминокислоты, отличные от методов генетической инженерии, такие как химическая модификация. Для обозначения одной и той же аминокислотной мутации можно использовать различные обозначения. Например, замену пролина в положении 329 Fc-домена на глицин можно обозначать как 329G, G329, G329, P329G или Pro329Gly.
Понятие «эффективное количество» агента, например, фармацевтической композиции, означает количество, эффективное в дозах и в течение периода времени, необходимых для достижения требуемого терапевтического или профилактического результата.
Понятие «Fc-домен» или «Fc-область» в контексте настоящего описания относится к С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Понятие включает нативную последовательность Fc-областей и вариант Fc-областей. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может либо присутствовать, либо отсутствовать. Если специально не указано иное, то нумерация аминокислотных остатков в Fc-области или константном участке соответствует системе EU-нумерации, которую называют также EU-индексом, описанной у Kabat и др., Sequences of Proteins of Immunological Interest, 5-oe изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Понятие «субъединица» Fc-домена в контексте настоящего описания относится к одному из двух полипептидов, образующих димерный Fc-домен, т.е. к полипептиду, который содержит С-концевые константные области тяжелой цепи иммуноглобулина, обладающие способностью к стабильной самоассоциации. Например, субъединица Fc-домена IgG содержит константный домен СН2 IgG и СН3 IgG.
«Модификация, способствующая ассоциации первой и второй субъединиц Fc-домена» представляет собой манипуляцию с пептидным каркасом или пост-трансляционные модификации субъединицы Fc-домена, которые уменьшают или препятствуют ассоциации полипептида, содержащего субъединицу Fc-домена, с идентичным полипептидом с образованием гомодимера. В контексте настоящего описания модификация, способствующая ассоциации, включает, прежде всего, различные модификации, осуществляемые с каждой из двух субъединиц Fc-домена, предназначенных для ассоциации (например, первой и второй субъединиц Fc-домена), при этом, модификации дополняют друг друга таким образом, чтобы способствовать ассоциации двух субъединиц Fc-домена. Например, модификация, способствующая ассоциации, может изменять структуру или заряд одной или обеих субъединиц Fc-домена таким образом, чтобы улучшать их ассоциацию стерически или электростатически соответственно. Так, (гетеро)димеризация имеет место между полипептидом, который содержит первую субъединицу Fc-домена, и полипептидом, который содержит вторую субъединицу Fc-домена, которые могут быть неидентичными, поскольку дополнительные компоненты, слитые с каждой из субъединиц (например, антигенсвязывающие фрагменты), не являются одинаковыми. В некоторых вариантах осуществления изобретения модификация, способствующая ассоциации, представляет собой аминокислотную мутацию в Fc-домене, в частности, аминокислотную замену. В конкретном варианте осуществления изобретения модификация, способствующая ассоциации, представляет собой индивидуальную аминокислотную мутацию, в частности, аминокислотную замену, в каждой из двух субъединиц Fc-домена.
«Каркасные участки» или «FR»-участки представляют собой участки вариабельных доменов, отличные от остатков гипервариабельных участков (HVR). FR вариабельного домена, как правило, представлены четырьмя FR-доменами: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, расположены в VH (или VL) в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятия «полноразмерное антитело», «интактное антитело» и «цельное антитело» в контексте настоящего описания используют взаимозаменяемо для обозначения антитела, имеющего структуру, практически сходную с нативной структурой антитела, или имеющего тяжелые цепи, которые содержат представленную в настоящем описании Fc-область.
Понятия «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используют взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство безотносительно к количеству пересевов. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. Под объем изобретения подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или отобрана у исходной трансформированной клетки.
«Человеческое антитело» представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или человеческой клеткой, или полученную из источника, отличного от человека, с использованием спектра человеческих антител или других кодирующих человеческое антитело последовательностей. Из указанного определения человеческого антитела специально исключено гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки. Следует отметить, что как уже было отмечено для химерных и гуманизированных антител, предлагаемых в изобретении, понятие «человеческое антитело» включает также такие антитела, константная область которых модифицирована с целью получения свойств, предлагаемых в изобретении, прежде всего касательно связывания C1q и/или связывания FcR, например, путем «переключения класса», т.е. замены или мутации Fc-областей (например, IgG1 на IgG4 и/или IgG1/IgG4-мутация).
Понятие «рекомбинантное человеческое антитело» в контексте настоящего описания относится ко всем человеческим антителам, которые получают, экспрессируют, создают или выделяют с помощью методов рекомбинации, например, к антителам, выделенным из клетки-хозяина, такой как NS0- или СНО-клетка, или из животного (например, мыши), которое является трансгенным из-за присутствия человеческих генов иммуноглобулинов или антител, экспрессируемых с использованием рекомбинантного экспрессионного вектора, которым трансфектирована клетка-хозяин. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, которые находятся в преобразованной форме. Рекомбинантные человеческие антитела, предлагаемые в изобретении, подвергают соматической гипермутации in vivo. Таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, хотя и выведены из последовательностей VH и VL человеческой зародышевой линии и родственных им линий, могут не существовать в естественных условиях в спектре зародышевой линии человеческих антител in vivo.
«Человеческий консенсусный каркасный участок» представляет собой каркасный участок, в который входят наиболее часто встречающиеся аминокислотные остатки в выбранных последовательностях каркасных участков VL или VH человеческого иммуноглобулина. Как правило, выбор последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, описанную у Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., публикация NIH 91-3242, Bethesda MD, т.т. 1-3, 1991. В одном из вариантов осуществления изобретения касательно VL подгруппа представляет собой подгруппу каппа I согласно Kabat и др., выше. В одном из вариантов осуществления изобретения касательно VH подгруппа представляет собой подгруппу III согласно Kabat и др., выше.
Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Понятие «гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергали гуманизации. Другие формы «гуманизированных антител», подпадающих под объем настоящего изобретения, представляют собой формы, константная область которых дополнительно модифицирована или изменена относительно исходного антитела с целью получения свойств, предлагаемых в изобретении, прежде всего касательно связывания C1q и/или связывания с Fc-рецептором (FcR).
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными («определяющие комплементарность участки» или «CDR») и/или формируют петли определенной структуры («гипервариабельные петли»), и/или содержат контактирующие с антигеном остатки («контакты с антигеном»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из «определяющих комплементарность участков» (CDR), последние отличаются наиболее выраженной вариабельностью последовательности и/или участвуют в распознавании антигенов. Приведенные в качестве примера гипервариабельные петли включают аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2), и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol. 196, 1987, сс. 901-917). Приведенные в качестве примера CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) включают аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35В (H1), 50-65 (Н2) и 95-102 (Н3) (Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Гипервариабельные участки (HVR) часто обозначают как «определяющие комплементарность участки» (CDR), и эти понятия в контексте настоящего описания используют взаимозаменяемо, и они относятся к участкам вариабельной области, которые образуют антигенсвязывающие области. Эта конкретная область описана у Kabat и др., U.S. Dept. of Health and Human Services, «Sequences of Proteins of Immunological Interest», 1983 и у Chothia и др., J. Mol. Biol. 196, 1987, cc. 901-917, причем эти определения относятся к перекрывающимся аминокислотным остаткам или поднаборам аминокислотных остатков при их сравнении друг с другом. Однако в контексте настоящего описания подразумевается возможность применения любого определения CDR антитела или его вариантов. Соответствующие аминокислотные остатки, из которых состоят CDR, как они определены в каждой из процитированных выше ссылок, представлены в сравнении ниже в таблице А. Точные номера остатков, которые образуют конкретный CDR, должны варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области на основе данных об аминокислотной последовательности вариабельной области антитела легко могут определять, какие остатки входят в конкретный CDR.
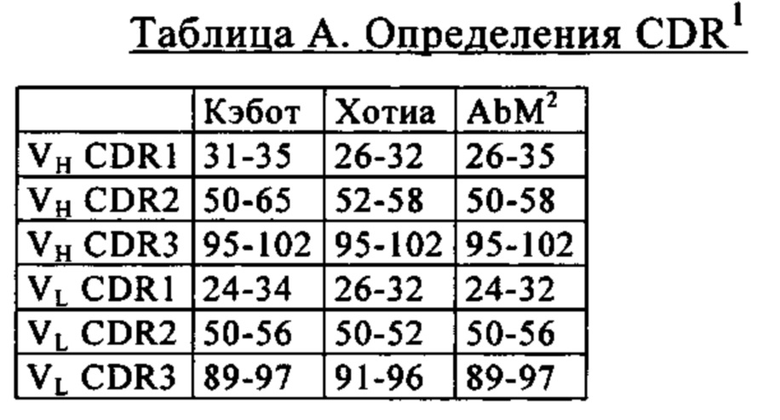
1 Нумерация всех входящих в CDR остатков в таблице А дана в соответствии с номенклатурой, предложенной Кэботом с соавторами (см. ниже).
2 Обозначение «AbM» с прописной буквой «b», использованное в таблице А, относится к CDR, как они определены программой для моделирования антител «AbM» компании Oxford Molecular Group.
Кэбот с соавторами предложили также систему нумерации (номенклатуру) последовательностей вариабельных областей, которую можно применять для любого антитела. Обычный специалист в данной области может однозначно применять эту систему «нумерации по Кэботу» к любой последовательности вариабельной области, не имея никаких экспериментальных данных, кроме сведений о самой последовательности. В контексте настоящего описания понятие «нумерация по Кэботу» относится к системе нумерации, описанной у Kabat и др., «Sequence of Proteins of Immunological Interest», изд-во U.S. Dept. of Health and Human Services, 1983. Если не указано иное, то ссылки на нумерацию положений конкретных аминокислотных остатков в вариабельной области антитела даны в соответствии с системой нумерации по Кэботу.
За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR содержат также «определяющие специфичность остатки» или «SDR», которые представляют собой остатки, контактирующие с антигеном. SDR, содержащиеся в областях CDR, обозначают как укороченные -CDR или a-CDR. Приведенные в качестве примера a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) содержат аминокислотные остатки 31-34 (L1), 50-55 (L2), 89-96 (L3), 31-35B (H1), 50-58 (H2) и 95-102 (Н3) (см. Almagro и Fransson, Front. Biosci. 13, 2008, cc. 1619-1633). Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) в настоящем описании нумеруют согласно Kabat и др., выше.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или несколькими гетерологичной(ыми) молекулой(ами), включая (но, не ограничиваясь только им) цитотоксический агент.
«Индивидуум» или «субъект» представляет собой млекопитающее. Млекопитающие представляют собой (но, не ограничиваясь только ими) одомашненных животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, люди и приматы кроме человека, такие как мартышки), кроликов и грызунов (например, мыши и крысы). В некоторых вариантах осуществления изобретения индивидуум или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до чистоты, превышающей 95% или 99% по данным, например, электрофоретических анализов (таких, например, как ДСН-ПААГ, изоэлектрическое фокусирование (ИЭФ), капиллярный электрофорез) или хроматографических анализов (таких, например, как ионообменная хроматография или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител см., например, у Flatman S. и др., J. Chrom. В 848, 2007, сс. 79-87.
«Выделенная» нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, которая отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетке, которая в норме включает молекулу нуклеиновой кислоты, но в которой молекула нуклеиновой кислоты присутствует вне хромосомы или в которой ее локализация на хромосоме отличается от ее встречающейся в естественных условиях локализации на хромосоме.
Понятие «выделенная нуклеиновая кислота, кодирующая биспецифическое антитело, которое специфически связывается с DR5 и FAP» относится к одной или нескольким молекулам нуклеиновых кислот, кодирующим тяжелые и легкие цепи антитела (или его фрагменты), включая указанную(ые) молекулу(ы) нуклеиновой(ых) кислоты(т), которая(ые) находится(ятся) в одном векторе или в разных векторах, и указанная(ые) молекула(ы) нуклеиновой(ых) кислоты(т) присутствует(ют) в одной или нескольких областях в клетке-хозяине.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих встречающиеся в естественных условиях мутации или возникающих в процессе производства препарата моноклонального антитела, указанные варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, прилагательное «моноклональный» определяет особенность антитела, характеризуя его как полученное из практически гомогенной популяции антител, а не сконструированное в соответствии с требованиями к получению антитела с помощью какого-либо конкретного метода. Например, моноклональные антитела, которые можно применять согласно настоящему изобретению, можно создавать с помощью различных технологий, включая (но, не ограничиваясь только ими) метод гибридом, методы рекомбинантной ДНК, методы фагового дисплея и методы на основе трансгенных животных, которые содержат все или часть локусов иммуноглобулина, указанные методы и другие приведенные в качестве примера методы получения моноклональных антител представлены в настоящем описании.
Понятие «голое» антитело» относится к антителу, не конъюгированному с гетерологичным фрагментом (например, цитотоксическим фрагментом) или радиоактивной меткой. «Голое» антитело может присутствовать в фармацевтической композиции.
Понятие «нативные антитела» относятся к встречающимся в естественных условиях молекулам иммуноглобулинов с различными структурами. Например, нативные антитела в виде IgG представляют собой гетеротетрамерные гликопротеины массой примерно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. Каждая тяжелая цепь в направлении от N- к С-концу содержит вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой расположены три константных домена (CH1, СН2 и СН3), которые называют также константной областью тяжелой цепи. Аналогично этому каждая легкая цепь в направлении от N- к С-концу содержит вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой расположен константный легкий (CL) домен, который называют также константной областью легкой цепи. Легкая цепь может относиться к одному из двух типов, обозначенных как каппа (κ) или лямбда (λ), на основе аминокислотной последовательности ее константного домена.
«Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. В некоторых вариантах осуществления изобретения блокирующие антитела или антагонистические антитела практически полностью ингибируют биологическую активность антигена. Например, антитела к PD-L1, предлагаемые в изобретении, блокируют передачу сигнала через PD-1 так, чтобы восстанавливать функциональный ответ Т-клеток (например, пролиферацию, производство цитокинов, цитолиз клеток-мишеней) из состояния с нарушенной функцией в ответ на стимуляцию антигеном.
«Агонистическое» или активирующее антитело представляет собой антитело, которое повышает или инициирует передачу сигнала антигеном, с которым оно связывается. В некоторых вариантах осуществления изобретения агонистические антитела вызывают или активируют передачу сигнала без присутствия встречающегося в естественных условиях лиганда.
Понятие «листовка-вкладыш в упаковку» в контексте настоящего описания относится к инструкциям, которые обычно помещают в поступающие в продажу упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности при применении указанных терапевтических продуктов.
Понятие «не обладает значительной перекрестной реактивностью» означает, что молекула (например, антитело) не распознает или не связывается специфически с антигеном, отличным от фактического антигена-мишени молекулы (например, антигеном, близкородственным антигену-мишени), прежде всего по сравнению с антигеном-мишенью. Например, уровень связывания антитела с антигеном, отличным от фактического антигена-мишени, может составлять от менее чем примерно 10% до менее чем примерно 5%, или уровень связывания с указанным антигеном, отличным от фактического антигена-мишени, может составлять менее чем примерно 10%, 9%, 8% 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,2% или 0,1%, предпочтительно менее чем примерно 2%, 1% или 0,5% и наиболее предпочтительно уровень связывания с антигеном, отличным от фактического антигена-мишени, может составлять менее чем примерно 0,2% или 0,1%.
«Процент (%) идентичности аминокислотной последовательности» относительно полипептидной референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивания последовательностей и интродукции при необходимости брешей для достижения максимального процента идентичности последовательностей, и при этом какие-либо консервативные замены не учитываются при оценке идентичности последовательностей. Сравнительный анализ для определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, которые находятся в компетенции специалиста в данной области, например, с использованием публично доступных компьютерных программ, таких как программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величину % идентичности аминокислотных последовательностей получают с использованием предназначенной для сравнения последовательностей компьютерной программы ALIGN-2. Предназначенная для сравнения последовательностей компьютерная программа ALIGN-2 разработана фирмой Genentech, Inc., и исходный код помещен на хранение вместе с документацией для пользователя в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под регистрационным номером U.S. Copyright Registration, №TXU510087. Программа ALIGN-2 представляет собой публично доступную программу фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать из исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую версию UNIX V4.0D. В программе ALIGN-2 все параметры для сравнения последовательностей являются заданными и не должны изменяться. В ситуациях, когда ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А относительно или по сравнению с данной аминокислотной последовательностью Б (которую другими словами можно обозначать как данная аминокислотная последовательность А, которая имеет или отличается определенным % идентичности аминокислотной последовательности относительно или по сравнению с данной аминокислотной последовательностью Б), рассчитывают следующим образом:
100 × частное X/Y,
где X обозначает количество аминокислотных остатков, оцененных программой сравнительного анализа последовательностей ALIGN-2 как идентичные совпадения при сравнительном анализе последовательностей А и Б с помощью указанной программы, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотной последовательности А относительно аминокислотной последовательности Б не должен быть равен % идентичности аминокислотной последовательности Б относительно аминокислотной последовательности А. Если специально не указано иное, то в контексте настоящего описания все величины % идентичности аминокислотных последовательностей получают согласно процедуре, описанной в последнем из предшествующих параграфов, с помощью компьютерной программы ALIGN-2.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, которые обладают неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемые носители включают (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
Понятие «антагонист, связывающийся с осью PD-1» относится к молекуле, которая ингибирует взаимодействие связывающегося с осью PD-1 партнера с одним или несколькими его партнерами по связыванию, таким образом, чтобы устранять Т-клеточную дисфункцию, являющуюся результатом передачи сигналов по оси передачи сигналов PD-1, что приводит к восстановлению или повышению Т-клеточной функции (например, пролиферация, производство цитокинов, цитолиз клеток-мишеней). В контексте настоящего описания антагонист, связывающийся с осью PD-1, включает связывающийся с PD-1 антагонист, связывающийся с PD-L1 антагонист и связывающийся с PD-L2 антагонист.
Понятие «антагонисты, связывающееся с PD-1» относится к молекуле, которая снижает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала, образовавшегося в результате взаимодействия PD-1 с одним или несколькими его партнерами по связыванию, такими как PD-L1, PD-L2. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой молекулу, которая ингибирует связывание PD-1 с его партнерами по связыванию. В конкретном объекте изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L1 и/или PD-L2. Например, антагонисты, связывающиеся с PD-1, включают антитела к PD-1, их антигенсвязывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды и другие молекулы, которые снижают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, образовавшегося в результате взаимодействия PD-1 с PD-L1 и/или PD-L2. В одном из вариантов осуществления изобретения, антагонист, связывающийся с PD-1, уменьшает отрицательный костимуляторный сигнал, опосредуемый или проходящий через белки клеточной поверхности, которые экспрессируются на Т-лимфоцитах, опосредуемый передачей сигнала через PD-1, что снижает дисфункцию Т-клеток с нарушенной функцией (например, повышает эффекторные ответы на распознаваемый антиген). В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой антитело к PD-1. В конкретном объекте изобретения антагонист, связывающийся с PD-1, представляет собой MDX-1106, указанный в настоящем описании. В другом конкретном объекте изобретения антагонист, связывающийся с PD-1, представляет собой Merck 3745, указанный в настоящем описании. В другом конкретном объекте изобретения антагонист, связывающийся с PD-1, представляет собой СТ-01 1, указанный в настоящем описании.
Понятие «антагонисты, связывающиеся с PD-L1» относится к молекуле, которая снижает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала, образовавшегося в результате взаимодействия PD-L1 с одним или несколькими его партнерами по связыванию, такими как PD-1, В7-1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, представляет собой молекулу, которая ингибирует связывание PD-L1 с его партнерами по связыванию. В конкретном объекте изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с PD-1 и/или В7-1. В некоторых вариантах осуществления изобретения антагонисты, связывающиеся с PD-L1, включают антитела к PD-L1, их антигенсвязывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды и другие молекулы, которые снижают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, образовавшегося в результате взаимодействия PD-L1 с одним или несколькими его партерами по связыванию, такими как PD-1, В7-1. В одном из вариантов осуществления изобретения, антагонист, связывающийся с PD-L1, уменьшает отрицательный костимуляторный сигнал, опосредуемый или проходящий через белки клеточной поверхности, которые экспрессируются на Т-лимфоцитах, опосредуемый передачей сигнала через PD-L1, что снижает дисфункцию Т-клеток с нарушенной функцией (например, повышает эффекторные ответы на распознаваемый антиген). В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, представляет собой антитело к PD-L1. В конкретном объекте изобретения антитело к PD-L1 представляет собой YW243.55.S70, указанное в настоящем описании. В другом конкретном объекте изобретения антитело к PD-L1 представляет собой MDX-1105, указанное в настоящем описании. В следующем конкретном объекте изобретения антитело к PD-L1 представляет собой MPDL3280A, указанное в настоящем описании.
Понятие «антагонисты, связывающиеся с PD-L2» относится к молекуле, которая снижает, блокирует, ингибирует, аннулирует или препятствуют трансдукции сигнала, образовавшегося в результате взаимодействия PD-L2 с его партнерами по связыванию, такими как PD-1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L2, представляет собой молекулу, которая ингибирует связывание PD-L2 с его партнерами по связыванию. В конкретном объекте изобретения антагонист, связывающийся с PD-L2, ингибирует связывание PD-L2 с PD-1. В некоторых вариантах осуществления изобретения антагонисты, связывающиеся с PD-L2, включают антитела к PD-L2, их антигенсвязывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды и другие молекулы, которые снижают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, образовавшегося в результате взаимодействия PD-L2 с одним или несколькими его партерами по связыванию, такими как PD-1. В одном из вариантов осуществления изобретения, антагонист, связывающийся с PD-L2, уменьшает отрицательный костимуляторный сигнал, опосредуемый или проходящий через белки клеточной поверхности, которые экспрессируются на Т-лимфоцитах, опосредуемый передачей сигнала через PD-L2, что снижает дисфункцию Т-клеток с нарушенной функцией (например, повышает эффекторные ответы на распознаваемый антиген). В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L2, представляет собой иммуноадгезин.
«Олигопептид PD-1», «олигопептид PD-L1» или «олигопептид PD-L2» представляет собой олигопептид, который связывается, предпочтительно специфически, с вызывающим отрицательную костимуляцию полипептидом PD-1, PD-L1 или PD-L2 соответственно, включая рецептор, лиганд или компонент пути передачи сигнала, которые указаны в настоящем описании. Такие олигопептиды можно синтезировать химически с использованием известной методологии синтеза олигопептидов или можно получать и очищать с использованием технологии рекомбинантной ДНК. Указанные олигопептиды, как правило, состоят по меньшей мере примерно из 5 аминокислот, альтернативно этому, по меньшей мере примерно из 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот или более. Указанные олигопептиды можно идентифицировать с использованием методик, хорошо известных в данной области. В этой связи следует упомянуть, что методики скрининга библиотек олигопептидов в отношении олигопептидов, которые обладают способностью специфически связываться с полипептидом-мишенью, хорошо известны в данной области (см., например, US №№5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; публикации РСТ WO 84/03506 и WO 84/03564; Geysen и др., Proc. Natl. Acad. Sci. U.S.A., 81, 1984, сс. 3998-4002; Geysen и др., Proc. Natl. Acad. Sci. U.S.A., 82, 1985, сс. 178-182; Geysen и др. в: Synthetic Peptides as Antigens, 1986, cc. 130-149; Geysen и др., J. Immunol. Metk, 102, 1987, cc. 259-274); Schoofs и др., J. Immunol., 140, 1988, cc. 611-616; Cwirla S.E. и др. Proc. Natl. Acad. Sci. USA, 87, 1990, c. 6378; Lowman H.B. и др., Biochemistry, 30, 1991, с. 10832; Clackson Т. и др., Nature, 352, 1991, с. 624; Marks J.D. и др., J. Mol. Biol., 222, 1991, c. 581; Kang A.S. и др., Proc. Natl. Acad. Sci. USA, 88, 1991, c. 8363 и Smith G.P., Current Opin. Biotechnol, 2, 1991, c. 668).
Понятие «анергия» означает состояние нечувствительности к стимуляции антигеном, обусловленное неполным или недостаточным уровнем сигналов, проходящих через Т-клеточный рецептор (например, повышение внутриклеточного Са+2 в отсутствии ras-активации). Т-клеточная анергия может являться также результатом стимуляции антигеном в отсутствии костимуляции, это приводит к тому, что клетки становятся устойчивыми к последующей активации антигеном даже в контексте костимуляции. Состояние нечувствительности часто может аннулироваться в результате присутствия интерлейкина -2. Анергическим Т-клеткам не присуща клональная экспансия и/или приобретение эффекторных функций.
Понятие «истощение Т-клеток» относится к Т-клеточному истощению в качестве состояния Т-клеточной дисфункции, возникающей в результате постоянной передачи сигналов TCR, что имеет место при многих хронических инфекциях и раке. Оно отличается от анергии тем, что возникает не в результате неполного уровня передачи сигналов или их дефицита, а в результате постоянной передачи сигналов. Это проявляется в низкой эффекторной функции, постоянной экспрессии ингибирующих рецепторов и особенностях транскрипции, которые отличаются от присущих функциональным эффекторным Т-клеткам или Т-клеткам памяти. Истощение препятствует оптимальному контролю инфекции и опухолей. Истощение может обусловливаться как внешними отрицательными регуляторным путями (например, иммунорегуляторные цитокины), так и присущими клетке отрицательными регуляторным (костимуляторными) путями (PD-1, В7-Н3, В7-Н4 и т.д.).
«Повышение Т-клеточной функции» означает индукцию, мотивацию или стимуляцию Т-клетки для придания ей длительной или усиленной биологической функции или возобновление или реактивацию функции у истощенных или неактивных Т-клеток. Примеры повышенной Т-клеточной функции включают: повышенную секрецию γ-интерферона из СБ8+-Т-клеток, повышенную пролиферацию, повышенную чувствительность к антигенам (например, вирус, патоген или клиренс опухоли) относительно уровней перед вмешательством. В одном из вариантов осуществления изобретения степень повышения составляет по меньшей мере 50%, альтернативно этому, 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%. Пути измерения указанного повышения известны специалисту в данной области.
«Иммунитет опухоли» означает процесс, с помощью которого опухоли уклоняются от иммунного распознавания и клиренса. Таким образом, в качестве терапевтической концепции иммунитет опухоли «излечивается», когда указанное уклонение снижается, и опухоли распознаются и атакуются иммунной системой. Примеры распознавания опухоли включают связывание с опухолью, сокращение опухоли и клиренс опухоли.
«Иммуногенность» относится к способности конкретной субстанции провоцировать иммунный ответ. Опухоли являются иммуногенными, и повышенная иммуногенность опухоли способствует клиренсу опухолевых клеток под воздействием иммунного ответа. Примеры повышения иммуногенности опухолей включают обработку антителом к PDL и ингибитором ME.
«Постоянный (длительный) ответ» означает постоянное воздействие, приводящее к уменьшению роста опухоли после прекращения лечения. Например, размер опухоли может оставаться таким же или снижаться по сравнению с размером в начале фазы лечения. В некоторых вариантах осуществления изобретения постоянный ответ имеет продолжительность, которая по меньшей мере совпадает с продолжительностью лечения, по меньшей мере в 1,5, 2, 2,5 или 3 раза превышает продолжительность лечения.
В контексте настоящего описания понятие «фибробласт-активирующий белок (FAP)» относится любому нативному FAP из любого применяемого в качестве источника позвоночного животного, включая, если не указано иное, млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы). Под понятие подпадает «полноразмерный» непроцессированний FAP, а также любая форма FAP, полученная в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты FAP, например, сплайсинговые варианты или аллельные варианты. Предпочтительно антитело к FAP, предлагаемое в изобретении, связывается с внеклеточным доменом FAP. Аминокислотные последовательности приведенных в качестве примеров полипептидов FAP, включая последовательность человеческого FAP, описаны в WO 2012/020006.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики, либо в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезни и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
В контексте настоящего описания понятие «рак» относится к пролиферативным заболеваниям, таким, например, как колоректальный рак, саркома, рак головы и шеи, плоскоклеточная карцинома, рак молочной железы, рак поджелудочной железы, рак желудка, немелкоклеточная карцинома легкого, мелкоклеточный рак легкого и мезотелиома, включая рефракторные варианты любого из указанных выше видов рака и комбинации одного или нескольких видов рака. В одном из вариантов осуществления изобретения рак представляет собой колоректальный рак и необязательно применяемое для его лечения химиотерапевтическое средство представляет собой иринотекан. В некоторых вариантах осуществления изобретения, в которых рак представляет собой саркому, саркома необязательно представляет собой хондросаркому, лейомиосаркому, опухоли стромы желудочно-кишечного тракта, фибросаркому, остеосаркому, липосаркому или злокачественную фиброзную гистиоцитому.
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделять, используя VH- или VL-домен из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano и др., J. Immunol. 150, 1993, сс. 880-887; Clarkson и др., Nature 352, 1991, cc. 624-628).
В контексте настоящего описания понятие «антигенсвязывающая молекула» в наиболее широком смысле относится к молекуле, которая специфически связывается с антигенной детерминантой. Примерами антигенсвязывающих молекул являются иммуноглобулины и их производные, например, фрагменты.
В контексте настоящего описания понятие «антигенсвязывающий сайт антитела» относится к аминокислотным остаткам, которые ответственны за связывание антигена. Антигенсвязывающий участок антитела содержит аминокислотные остатки из «определяющих комплементарность участков» «CDR». «Каркасные участки» или «FR»-участки представляют собой участки вариабельных областей, отличные от остатков гипервариабельных участков, указанных в настоящем описании. Таким образом, вариабельные домены тяжелых и легких цепей антитела содержат в направлении от N-конца к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В частности, CDR3 тяжелой цепи представляет собой область, которая вносит основной вклад в связывание антигена и определяет свойства антитела. CDR- и FR-участки определяют согласно стандартному описанию, предложенному Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991), и/или они представляют собой остатки из «гипервариабельной петли».
Специфичность антитела относится к избирательному распознаванию антителом конкретного эпитопа антигена. Встречающиеся в естественных условиях антитела являются, например, моноспецифическими. «Биспецифические антитела», предлагаемые в настоящем изобретении, представляют собой антитела, которые имеют две различные антигенсвязывающие специфичности. Антитела, предлагаемые в настоящем изобретении, обладают специфичностью в отношении двух различных антигенов, т.е. в отношении DR5 в качестве первого антигена и FAP в качестве второго антигена.
В контексте настоящего описания понятие «моноспецифическое» антитело означает антитело, которое имеет один или несколько сайтов связывания, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена.
Понятие «биспецифическая» означает, что антигенсвязывающая молекула обладает способностью специфически связываться по меньшей мере с двумя различными антигенными детерминантами. Как правило, биспецифическая антигенсвязывающая молекула содержит по меньшей мере два антигенсвязывающих сайта, каждый из которых обладает специфичностью в отношении различных антигенных детерминант. В некоторых вариантах осуществления изобретения биспецифическая антигенсвязывающая молекула обладает способностью одновременно связываться с двумя антигенными детерминантами, прежде всего двумя антигенными детерминантами, которые экспрессируются на двух различных клетках.
Антитело, предлагаемое в изобретении, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые имеют связывающие специфичности по меньшей мере для двух различных сайтов. В изобретении предложено биспецифическое антитело, имеющее связывающие специфичности для FAP и DR5. В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с двумя различными эпитопами DR5. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках, которые экспрессируют DR5. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методы создания мультиспецифических антител включают (но, не ограничиваясь только ими) рекомбинантную коэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, которые обладают различными специфичностями (см. Milstein и Cuello, Nature 305, 1983, с. 537, WO 93/08829 и Traunecker и др., ЕМВО J. 10, 1991, с. 3655), и конструирование на основе технологии «knob-in-hole» (см., например, US №5731168). Мультиспецифические антитела можно получать также путем создания обусловленных электростатическим действием эффектов для создания молекул антител с гетеродимерной Fc-областью (WO 2009/089004 A1); путем поперечного сшивания двух или большего количества антител или их фрагментов (см., US №4676980 и Brennan и др., Science 229, 1985, с. 81); с использованием «лейциновых молний» для получения биспецифических антител (см., например, Kostelny и др., J. Immunol. 148(5), 1992, сс. 1547-1553); с использованием технологии «диабоди» (димерных антител) для создания фрагментов биспецифических антител (см., например, Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, 1993, cc. 6444-6448); и с использованием димеров одноцепочечных Fv (scFv) (см., например, Gruber и др., J. Immunol., 152, 1994, с. 5368); путем получения триспецифических антител согласно методу, описанному, например, у Tutt и др., J. Immunol. 147, 1991, с. 60.
Под объем настоящего изобретения подпадают также сконструированные антитела с тремя или большим количеством функциональных антигенсвязывающих сайтов, включая «антитела-осьминоги» (см., например, US 2006/0025576 A1).
Согласно настоящему описанию антитело или его фрагмент может включать также «Fab двойного действия» или «DAF», которые содержат по меньшей мере один антигенсвязывающий сайт, который связывается с FAP или DR5, а также с другим, отличным от него антигеном (см. например, US 2008/0069820).
В контексте настоящего описания понятие «валентность» означает присутствие определенного количества связывающих сайтов в молекуле антитела. Так, понятие «двухвалентная», «четырехвалентная» и «шестивалентная» означает присутствие двух связывающих сайтов, четырех связывающих сайтов и шести связывающих сайтов соответственно в молекуле антитела. Биспецифические антитела, предлагаемые в изобретении, являются по меньшей мере «двухвалентными», и они могут быть «трехвалентными» и «многовалентными» (например, «четырехвалентными» или «шестивалентными»).
Антитела, предлагаемые в настоящем изобретении, имеют два или большее количество связывающих сайтов и являются биспецифическими. Это означает, что антитела могут быть биспецифическими даже в случаях, когда имеют более двух связывающих сайтов (т.е. антитело является трехвалентным или многовалентным). Биспецифические антитела, предлагаемые в изобретении, включают, например, многовалентные одноцепочечные антитела, димерные антитела и тримерные антитела, а также антитела, которые имеют структуру константного домена полноразмерных антител, с которым связаны дополнительные антигенсвязывающие сайты (например, одноцепочечный Fv, VH-домен и/или VL-домен, Fab или (Fab)2) через один или несколько пептидных линкеров. Антитела могут представлять собой полноразмерные антитела, полученные из одного вида, или могут быть химерными или гуманизированными.
В контексте настоящего описания понятие «вектор» относится к молекуле нуклеиновой кислоты, которая обладает способностью амплифицировать другую нуклеиновую кислоту, с которой она связна. Понятие относится к вектору как самореплицирующейся содержащей нуклеиновую кислоту структуре, а также к вектору, встроенному в геном клетки-хозяина, в которую интродуцирован вектор. Некоторые векторы обладают способностью контролировать экспрессию нуклеиновых кислот, с которым они функционально связаны. Такие векторы в контексте настоящего описания обозначают как «экспрессионные векторы».
В контексте настоящего описания понятие «аминокислота» обозначает группу встречающихся в естественных условиях карбокси-α-аминокислот, включающую аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, E), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серин (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
В контексте настоящего описания понятия «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и они все включают потомство. Так, понятия «трансфектанты» и «трансфектированные клетки» включают первичную рассматриваемую клетку и выведенные из нее культуры безотносительно к количеству пересевов. Следует понимать также, что потомство может не быть полностью идентичным по составу ДНК из-за произвольных или преднамеренных мутаций. Под объем изобретения подпадает вариант потомства, который обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или отобрана у исходной трансформированной клетки.
Понятие «аффинность» относится к суммарной силе всех нековалентных взаимодействий между индивидуальным сайтом связывания молекулы (например, антитела) и ее партнера по связыванию (например, антигена). Если не указано иное, то в контексте настоящего описания понятие «аффинность связывания» относится к присущей компонентам связывающейся пары (например, антителу и антигену) аффинности связывания, отражающей взаимодействие по типу 1:1. Аффинность молекулы Х к ее партнеру Y можно, как правило, характеризовать с помощью константы диссоциации (KD). Аффинность можно оценивать общепринятыми методами, известными в данной области, включая представленные в настоящем описании методы. Ниже описаны конкретные служащие в качестве иллюстрации и примера варианты подходов к оценке аффинности связывания.
В контексте настоящего описания понятие «связывание» или «специфическое связывание» относится к связыванию антитела с эпитопом антигена в анализе in vitro, предпочтительно в анализе методом поверхностного плазменного резонанса (SPR, BIAcore, фирма GE-Healthcare, Уппсала, Швеция). Аффинность связывания определяют в понятиях ka (константа скорости реакции ассоциации антитела при образовании комплекса антитело/антиген), kd (константа скорости реакции диссоциации) и KD (kd/ka). Связывание или специфическое связывание означает, что аффинность связывания (KD) составляет 10-8 моля/л или менее, предпочтительно от 10-9 М до 10-13 моля/л.
Связывание антитела с рецептором смерти можно оценивать с помощью BIAcore-анализа (фирма GE-Healthcare, Упсала, Швеция). Аффинность связывания определяют в понятиях ka (константа скорости реакции ассоциации антитела при образовании комплекса антитело/антиген), kd (константа скорости реакции диссоциации) и kd (kd/ka).
Понятие «пониженное связывание (пониженная способность к связыванию)», например, пониженная способность к связыванию с Fc-рецептором, относится к снижению аффинности касательно соответствующего взаимодействия, измеренной, например, с помощью SPR. Для ясности следует отметить, что понятие включает также снижение аффинности до нуля (или ниже предела обнаружения аналитического метода), т.е. полную элиминацию взаимодействия. И, наоборот, «повышенное связывание (повышенная способность к связыванию)» относится к повышению аффинности связывания касательно соответствующего взаимодействия.
Понятие «Т-клеточная активация (активация Т-клеток)» в контексте настоящего описания относится к одному или нескольким клеточным ответам Т-лимфоцита, в частности, цитотоксического Т-лимфоцита, выбранным из: пролиферации, дифференцировки, секреции цитокинов, высвобождения цитотоксических эффекторных молекул, цитотоксической активности и экспрессии маркеров активации. Активирующие Т-клетки биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, обладают способностью индуцировать Т-клеточную активацию. Приемлемые анализы оценки Т-клеточной активации, известные в данной области, представлены в настоящем описании.
Понятие «антиген клетки-мишени» в контексте настоящего описания относится к антигенной детерминанте, которая присутствует на поверхности клетки-мишени, например, клетки в опухоли, такой как раковая клетка или клетка стромы опухоли. В частности, понятие «антиген клетки-мишени» относится к фолатному рецептору 1.
В контексте настоящего описания понятия «первый» и «второй» касательно антигенсвязывающих фрагментов и т.д. применяют с целью удобства различения, когда присутствует более одного типа каждого из фрагментов. Применение этих понятий не подразумевает их конкретный порядок или ориентацию в активирующей Т-клетки биспецифической антигенсвязывающей молекуле, если специально не указано иное.
Понятие «эпитоп» относится к любой полипептидной детерминанте, обладающей способностью специфически связываться с антителом. В некоторых вариантах осуществления изобретения эпитопная детерминанта включает химические активные поверхностные группы молекул, таких как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил, и в некоторых вариантах осуществления изобретения может иметь специфические характеристики трехмерной структуры или специфические характеристики заряда. Эпитоп представляет собой область антигена, с которой связывается антитело.
В контексте настоящего описания понятие «антигенная детерминанта» является синонимом понятий «антиген» и «эпитоп» и относится к сайту (например, участку, состоящему из смежных аминокислот, или конформационной конфигурации, состоящей из различных областей несмежных аминокислот) на полипептидной макромолекуле, с которой связывается антигенсвязывающий фрагмент с образованием комплекса антигенсвязывающий фрагмент-антиген. Пригодные антигенные детерминанты могут присутствовать, например, на поверхности опухолевых клеток, на поверхности инфицированных вирусом клеток, на поверхности других больных клеток, на поверхности иммунных клеток, клеток, находящихся в свободном состоянии в сыворотке крови и/или во внеклеточном матриксе (ЕСМ). В контексте настоящего описания белки, относящиеся к антигенам, например, FolR1 и CD3, если не указано иное, могут представлять собой любые нативные формы белков из любого применяемого в качестве источника позвоночного животного, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы). В конкретном варианте осуществления изобретения антиген представляет собой человеческий белок. В контексте настоящего описания при ссылке на конкретный белок подразумевается «полноразмерный», непроцессированный белок, а также любая форма белка, полученная в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты белка, например, сплайсинговые варианты или аллельные варианты. Примерами человеческих белков, пригодных в качестве антигенов, являются (но, не ограничиваясь только ими): FolR1 (фолатный рецептор альфа (FRA); фолатсвязывающий белок (FBP); человеческий FolR1, UniProt № Р15328; мышиный FolR1, UniProt № Р35846; FolR1 обезьян циномолгус, UniProt № G7PR14) и CD3, прежде всего эпсилон-субъединица CD3 (см. UniProt № Р07766 (версия 130), NCBI RefSeq № NP_000724.1, SEQ ID NO: 150, человеческая последовательность; или UniProt № Q95LI5 (версия 49), NCBI GenBank, № BAB71849.1, последовательность обезьян циномолгус [Macaca fascicularis]). Активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, связывается с эпитопом CD3 или антигеном клетки-мишени, который является консервативным для CD3 или антигена-мишени из различных видов. В некоторых вариантах осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, связывается с CD3 и FolR1, но не связывается с FolR2 (фолатный рецептор бета; FRB; человеческий FolR2, UniProt № Р14207) или FolR3 (фолатный рецептор гамма; человеческий FolR3, UniProt № Р41439).
В контексте настоящего описания понятие «инженерия» (создание), «созданный с помощью инженерии», «процесс создания с помощью инженерии», прежде всего с приставкой «глико», а также понятие «инженерия гликозилирования» (гликоинженерия, конструирование схемы гликозилирования), относятся к любой манипуляции, которой подвергают схему гликозилирования встречающегося в естественных условиях или рекомбинантного полипептида или его фрагмента. Конструирование схемы гликозилирования включает метаболическое конструирование механизма гликозилирования клетки, в том числе генетические манипуляции, касающиеся путей олигосахаридного синтеза, с целью получения измененного гликозилирования гликопротеинов, экспрессируемых в клетках. Кроме того, инженерия гликозилирования включает воздействия мутаций и клеточного окружения на гликозилирование. В одном из вариантов осуществления изобретения инженерию гликозилирования осуществляют с целью изменения гликозилтрансферазной активности. В конкретном варианте осуществления изобретения инженерия позволяет изменять активность глюкозаминилтрансферазы и/или активность фукозилтрансферазы.
II Композиции и способы
Одним из объектов изобретения является применение терапевтической комбинации активирующей Т-клетку биспецифической антигенсвязывающей молекулы, например, активирующей Т-клетку биспецифической антигенсвязывающей молекулы, которая содержит первый антигенсвязывающий сайт, специфический для фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический для CD3, и антагонист, связывающийся с осью PD-1, например, для лечения рака. В некоторых вариантах осуществления изобретения терапевтическая комбинация дополнительно включает антагонист TIM3.
А. Комбинированные терапии на основе активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антагониста, связывающегося с осью PD-1
В широком смысле настоящее изобретение относится к активирующим Т-клетки биспецифическим антигенсвязывающим молекулам и их применению в комбинации с антагонистами, связывающимися с осью PD-1. Преимущество комбинации относительно монотерапии состоит в том, активирующие Т-клетки биспецифические антигенсвязывающие молекулы, применяемые согласно настоящему изобретению, могут обеспечивать переориентацию к клеткам-мишеням и активацию Т-клеток, а антагонист, связывающийся с осью PD-1, усиливает Т-клеточную функцию путем уменьшения истощения Т-клеток.
Одним из объектов изобретения является способ лечения или замедление развития рака у индивидуума, включающий введение индивидууму в эффективном количестве активирующих Т-клетки биспецифических антигенсвязывающих молекул, например, FolR1-TCB, и антагониста, связывающегося с осью PD-1. В некоторых вариантах осуществления изобретения лечение приводит к длительному ответу индивидуума после прекращения лечения. Способы, предлагаемые в настоящем изобретении, могут найти применение для лечения состояний, при которых требуется повышенная иммуногенность, например, повышенная иммуногенность опухоли, для лечения рака. Можно лечить или замедлять развитие широкого разнообразия видов рака, включая (но, не ограничиваясь только ими) рак, который может содержать мутацию BRAF V600E, рак, который может содержать BRAF дикого типа, рак, который может содержать KRAS дикого типа, или рак, который может содержать активирующую KRAS мутацию.
В некоторых вариантах осуществления изобретения индивидуум имеет рак эндометрия. Рак эндометрия может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет меланому. Меланома может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет колоректальный рак. Колоректальный рак может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет рак легкого, например, немелкоклеточный рак легкого. Немелкоклеточный рак легкого может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет рак поджелудочной железы. Рак поджелудочной железы может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет гематологическое злокачественное заболевание. Гематологическое злокачественное заболевание может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет рак яичника. Рак яичника может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет рак молочной железы. Рак молочной железы может находиться на ранней стадии или поздней стадии. В некоторых вариантах осуществления изобретения индивидуум имеет почечно-клеточную карциному. Почечно-клеточная карцинома может находиться на ранней стадии или поздней стадии.
В некоторых вариантах осуществления изобретения индивидуум представляет собой млекопитающее, такое как одомашненные животные (например, коровы, овцы, кошки, собаки и лошади), приматы (например, люди и приматы кроме человека, такие как мартышки), кролики и грызуны (например, мыши и крысы). В некоторых вариантах осуществления изобретения подлежащий лечению индивидуум представляет собой человека.
Другим объектом изобретения является способ повышения иммунной функции у индивидуума, который имеет рак, включающий введение в эффективном количестве активирующих Т-клетки биспецифических антигенсвязывающих молекул, в частности, FolR1-TCB, и антагониста, связывающегося с осью PD-1.
В некоторых вариантах осуществления изобретения Т-клетки у индивидуума обладают повышенными примированием, активацией, пролиферации и/или эффекторной функцией относительно состояния до введения активирующих Т-клетки биспецифических антигенсвязывающих молекул и антагониста, связывающегося с осью PD-1. В некоторых вариантах осуществления изобретения Т-клеточная эффекторная функция представляет собой секрецию по меньшей мере одного из IL-2, IFN-γ и TNF-α. В одном из вариантов осуществления изобретения введение FolR1-TCB и антитела к PDL-1 приводит к повышенной Т-клеточной секреции IL-2, ifn-γ и TNF-α. В некоторых вариантах осуществления изобретения Т-клетка представляет собой CD8+-Т-клетку. В некоторых вариантах осуществления изобретения Т-клеточное примирование характеризуется повышенным уровнем экспрессии CD44 и/или повышенной цитолитической активностью CD8-Т-клеток. В некоторых вариантах осуществления изобретения активация CD8-T-клеток характеризуется повышенной частотой встречаемости γ-IFT^T CD8-Т-клеток. В некоторых вариантах осуществления изобретения CD8-T-клетка представляет собой антигенспецифическую Т-клетку. В некоторых вариантах осуществления изобретения ингибируется ускользание от иммунологического надзора путем передачи сигналов через экспрессируемый на поверхности PD-L1. В некоторых вариантах осуществления изобретения рак характеризуется повышенными уровнями Т-клеточной инфильтрации.
В некоторых вариантах осуществления изобретения комбинированная терапия, предлагаемая в изобретении, предусматривает введение FolR1-TCB и антагониста, связывающегося с осью PD-1. FolR1-TCB и антагонист, связывающий с осью PD-1, можно вводить любым приемлемым путем, известным в данной области. Например, FolR1-TCB и антагонист, связывающийся с осью PD-1, можно вводить последовательно (в различные моменты времени) или параллельно (одновременно). В некоторых вариантах осуществления изобретения FolR1-TCB вводят постоянно. В некоторых вариантах осуществления изобретения FolR1-TCB вводят прерывисто (периодически). В некоторых вариантах осуществления изобретения FolR1-TCB вводят перед введением антагониста, связывающего с осью PD-1. В некоторых вариантах осуществления изобретения FolR1-TCB вводят одновременно с введением антагониста, связывающегося с осью PD-1. В некоторых вариантах осуществления изобретения FolR1-TCB вводят после введения антагониста, связывающегося с осью PD-1.
Некоторые варианты осуществления изобретения относятся к способу лечения или замедления развития рака у индивидуума, включающий введенное индивидууму в эффективном количестве активирующих Т-клетки биспецифических антигенсвязывающих молекул, например, FolR1-TCB, и антагониста, связывающегося с осью PD-1, предусматривающий также применении дополнительной терапии. Согласно конкретному указанному варианту осуществления изобретения дополнительная терапия включает антагонист TIM3. Таким образом, одним из объектов изобретения является способ лечения или замедления развития рака у индивидуума, включающий введение индивидууму в эффективном количестве активирующих Т-клетки биспецифических антигенсвязывающих молекул, например, FolR1-TCB, антагониста, связывающегося с осью PD-1, и антагониста TIM3. Можно применять любой антагонист TIM3, например, указанный в настоящем описании. Дополнительная терапия может представлять собой также лучевую терапию, хирургию (например, лампэктомию и мастэктомию), химиотерапию, генную терапию, ДНК-терапию, вирусную терапию, RA-терапию, иммунотерапию, трансплантацию костного мозга, нанотерапию, терапию моноклональным антителом или комбинацию вышеуказанных путей. Дополнительная терапия может иметь форму адъювантной или неоадъювантной терапии. В некоторых вариантах осуществления изобретения дополнительная терапия предусматривает введение низкомолекулярного ингибитора ферментов или антиметастатического агента. В некоторых вариантах осуществления изобретения дополнительная терапия предусматривает введение агентов, ограничивающих побочные действия (например, агентов, предназначенных для снижения возникновения и/или серьезности побочных действий лечения, таких как противотошнотные средства и т.д.). В некоторых вариантах осуществления изобретения дополнительная терапия представляет собой лучевую терапию. В некоторых вариантах осуществления изобретения дополнительная терапия представляет собой хирургию. В некоторых вариантах осуществления изобретения дополнительная терапия представляет собой комбинацию лучевой терапии и хирургии. В некоторых вариантах осуществления изобретения дополнительная терапия представляет собой гамма-облучение. В некоторых вариантах осуществления изобретения дополнительная терапия представляет собой терапию, мишенью которой является путь P13K/А T/mTOR, ингибитор HSP90, ингибитор тубулина, ингибитор апоптоза и/или химиопревентивное средство. Дополнительная терапия может включать одно или несколько описанных выше химиотерапевтических средств.
Активирующие Т-клетки биспецифические антигенсвязывающие молекулы, например, FolR1-TCB, и антагонист, связывающийся с осью PD-1, можно вводить с использованием одинакового пути введения или различных путей введения. В некоторых вариантах осуществления изобретения активирующие Т-клетки биспецифические антигенсвязывающие молекулы, например, FolR1-TCB, вводят внутривенно, внутримышечно, подкожно, местно, орально, чрескожно, внутрибрюшинно, внутриглазнично, путем имплантации, путем ингаляции, внутритрахеально, внутрь желудочков или внутриназально. В некоторых вариантах осуществления изобретения антагонист, связывающийся с осью PD-1, вводят внутривенно, внутримышечно, подкожно, местно, орально, чрескожно, внутрибрюшинно, внутриглазнично, путем имплантации, путем ингаляции, внутритрахеально, внутрь желудочков или внутриназально. Для предупреждения или лечения заболевания активирующие Т-клетки биспецифические антигенсвязывающие молекулы и антагонист, связывающийся с осью PD-1, можно вводить в эффективном количестве. Требуемую дозу активирующих Т-клетки биспецифических антигенсвязывающих молекул и/или антагониста, связывающегося с осью PD-1, можно определять с учетом типа заболевания, подлежащего лечению, типа активирующих Т-клетки биспецифических антигенсвязывающих молекул и антагониста, связывающегося с осью PD-1, серьезности и течения заболевания, клинического состояния индивидуума, истории болезни индивидуума и ответа на лечение и предписания лечащего врача.
В способах можно применять любые активирующие Т-клетки биспецифические антигенсвязывающие молекулы, антагонисты, связывающиеся с осью PD-1, и антагонисты TIM3, известные в данной области или описанные ниже.
Следующим объектом настоящего изобретения является фармацевтическая композиция, содержащая активирующие Т-клетки биспецифические антигенсвязывающие молекулы, указанные в настоящем описании, антагонисты, связывающиеся с осью PD-1, указанные в настоящем описании, и фамацевтически приемлемый носитель. В некоторых вариантах осуществления изобретения фармацевтическая композиция дополнительно содержит антагонист TIM3.
Следующим объектом изобретения является набор, который содержит активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, и листовку-вкладыш в упаковку, которая содержит инструкции по применению активирующей Т-клетку биспецифической антигенсвязывающей молекулы в сочетании с антагонистом, связывающимся с осью PD-1, для лечения или замедления развития рака у индивидуума. В некоторых вариантах осуществления изобретения набор дополнительно содержит инструкции по применению активирующей Т-клетку биспецифической антигенсвязывающей молекулы в сочетании с антагонистом TIM3.
Следующим объектом изобретения является набор, который содержит активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, и антагонист, связывающийся с осью PD-1, и листовку-вкладыш в упаковку, которая содержит инструкции по применению активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антагониста, связывающегося с осью PD-1, для лечения или замедления развития рака у индивидуума. В некоторых вариантах осуществления изобретения набор дополнительно содержит инструкции по применению активирующей Т-клетку биспецифической антигенсвязывающей молекулы в сочетании с антагонистом TIM3. В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антитело к PD-1 или антитело к PD-L1. В одном из вариантов осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антитело к PD-1, такое как иммуноадгезин.
Следующим объектом изобретения является набор, содержащий:
(I) первый контейнер, который содержит композицию, содержащую активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, указанную в настоящем описании; и
(II) второй контейнер, который содержит композицию, содержащую антагонист, связывающийся с осью PD-1.
Следующим объектом изобретения является набор, содержащий:
(I) первый контейнер, который содержит композицию, содержащую активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, указанную в настоящем описании; и
(II) второй контейнер, который содержит композицию, содержащую антагонист, связывающийся с осью PD-1 и
(III) третий контейнер, который содержит композицию, содержащую антагонист TIM3.
Б. Примеры активирующей Т-клетку биспецифической антигенсвязывающей молекулы, предназначенной для применения согласно изобретению
Активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, является биспецифической, т.е. она содержит по меньшей мере два антигенсвязывающих фрагмента, обладающих способностью специфически связываться с двумя различными антигенными детерминантами, а именно, с CD3 и с FolR1. Согласно изобретению антигенсвязывающие фрагменты представляют собой молекулы Fab (т.е. антигенсвязывающие домены, состоящие из тяжелой и легкой цепи, каждая из которых содержит вариабельную и константную области). В одном из вариантов осуществления изобретения указанные молекулы Fab являются человеческими. В другом варианте осуществления изобретения указанные молекулы Fab являются гуманизированными. Еще в одном варианте осуществления изобретения указанные молекулы Fab содержат человеческие константные области тяжелой и легкой цепи.
Активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, обладает способностью одновременно связываться с антигеном клетки-мишени FolR1 и CD3. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула обладает способностью к перекрестному связыванию с Т-клеткой и экспрессирующей FolR1 клеткой-мишенью посредством одновременного связывания с антигеном клетки-мишени FolR1 и CD3. В еще более конкретном варианте осуществления изобретения такое одновременное связывание приводит к лизису экспрессирующей FolR1 клетки-мишени, прежде всего экспрессирующей FolR1 опухолевой клетки. В одном из вариантов осуществления изобретения такое одновременное связывание приводит к активации Т-клетки. В других вариантах осуществления изобретения такое одновременное связывание приводит к клеточному ответу Т-лимфоцита, прежде всего цитотоксического Т-лимфоцита, выбранному из следующей группы: пролиферация, дифференцировка, секреция цитокинов, высвобождение цитотоксической эффекторной молекулы, цитотоксическая активность и экспрессия маркеров активации. В одном из вариантов осуществления изобретения связывание активирующей Т-клетку биспецифической антигенсвязывающей молекулы с CD3 без одновременного связывания с антигеном клетки-мишени FolR1 не приводит к активации Т-клетки.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула обладает способностью перенаправлять цитотоксическую активность Т-клетки на экспрессирующую FolR1 клетку-мишень. В конкретном варианте осуществления изобретения указанное перенаправление не зависит от опосредуемой ГКГС презентации пептидного антигена клеткой-мишенью и/или от специфичности Т-клетки.
В частности, согласно некоторым вариантам осуществления изобретения Т-клетка представляет собой цитотоксическую Т-клетку. В некоторых вариантах осуществления изобретения Т-клетка представляет собой CD4+- или CD8+-Т-клетку, прежде всего CD8+-Т-клетку.
Активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержит по меньшей мере один антигенсвязывающий фрагмент, обдающий способностью связываться с CD3 (в настоящем описании его обозначают также как «связывающий антиген CD3 фрагмент» или «первый антигенсвязывающий фрагмент»). В конкретном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит не более одного антигенсвязывающего фрагмента, обладающего способностью специфически связываться с CD3. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула характеризуется одновалентным связыванием с CD3. В конкретном варианте осуществления изобретения CD3 представляет собой CD3 человека или CD3 обезьян циномолгус, более конкретно, человеческий CD3. В конкретном варианте осуществления изобретения связывающий антиген CD3 фрагмент обладает перекрестной реактивностью с (т.е. специфически связывается с) человеческим CD3 и CD3 обезьян циномолгус. В некоторых вариантах осуществления изобретения первый антигенсвязывающий фрагмент обладает способностью специфически связываться с эпсилон-субъединицей CD3 (см. UniProt № Р07766 (версия 130), NCBI RefSeq № NP_000724.1, SEQ ID NO: 150, человеческая последовательность; UniProt № Q95LI5 (версия 49), NCBI GenBank № BAB71849.1, последовательность обезьян циномолгус [Macaca fascicularis]).
В некоторых вариантах осуществления изобретения связывающий антиген CD3 фрагмент содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
В одном из вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34.
В одном из вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
В одном из вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 36, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31.
Активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержит по меньшей мере один антигенсвязывающий фрагмент, обладающий способностью связываться с антигеном клетки-мишени FolR1 (в настоящее описании его обозначают также как «связывающий FolR1 фрагмент» или «второй» или «третий» антигенсвязывающий фрагмент). В одном из вариантов осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью связываться с антигеном клетки-мишени FolR1, не связывается с FolR2 или FolR3. В конкретном варианте осуществления изобретения связывающий антиген FolR1 фрагмент обладает перекрестной реактивностью с (т.е. специфически связывается с) FolR1 человека и FolR1 обезьян циномолгус. В конкретных вариантах осуществления изобретения, активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит два антигенсвязывающих фрагмента, обладающих способностью связываться с антигеном клетки-мишени FolR1. В одном из таких конкретных вариантов осуществления изобретения каждый из указанных антигенсвязывающих фрагментов специфически связывается с одной и той же антигенной детерминантой. В еще более конкретном варианте осуществления изобретения все указанные антигенсвязывающие фрагменты являются идентичными. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит не более двух антигенсвязывающих фрагментов, обладающих способностью связываться с FolR1.
FolR1-связывающий фрагмент, как правило, представляет собой молекулу Fab, которая специфически связывается с FolR1 и обладает способностью направлять активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, с которой она соединена, к сайту-мишени, например, к специфическому типу опухолевой клетки, которая экспрессирует FolR1.
Одним из объектов настоящего изобретения является активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34; и
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1).
В одном из вариантов осуществления изобретения первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит
(III) третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с FolR1.
В одном из таких вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи. В одном из таких вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в любом из представленных выше вариантов осуществления изобретения, дополнительно содержит Fc-домен, состоящий из первой и второй субъединиц, обладающих способностью к стабильной ассоциации.
В одном из вариантов осуществления изобретения первый антигенсвязывающий фрагмент и второй антигенсвязывающий фрагмент каждый слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена.
В одном из вариантов осуществления изобретения третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента, необязательно через пептидный линкер.
В следующем конкретном варианте осуществления изобретения в активирующей Т-клетку биспецифической антигенсвязывающей молекуле присутствует не более одного антигенсвязывающего фрагмента, обладающего способностью специфически связываться с CD3, (т.е. активирующая Т-клетку биспецифическая антигенсвязывающая молекула характеризуется одновалентным связыванием с CD3).
Активирующая Т-клетку биспецифическая антигенсвязывающая молекула с общей легкой цепью
При создании настоящего изобретения было разработано биспецифическое антитело, в котором связывающие фрагменты обладают общей легкой цепью, которое сохраняет специфичность и эффективность родительского моноспецифического антитела к CD3 и может связываться со вторым антигеном (например, FolR1) с помощью такой же легкой цепи. Создание биспецифической молекулы с общей легкой цепью, которая сохраняет характеристики связывания, присущие родительскому антителу, не является очевидным, поскольку общие CDR гибридной легкой цепи должны обеспечивать специфичность связывания с обеими мишенями. Одним из объектов настоящего изобретения является активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая первый и второй антигенсвязывающие фрагменты, один из которых представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, а другой из которых представляет собой молекулу Fab, обладающую способностью специфически связываться с FolR1, в которой первая и вторая молекулы Fab имеют идентичные легкие цепи VLCL. В одном из вариантов осуществления изобретения указанная идентичная легкая цепь (VLCL) содержит CDR легкой цепи, имеющие SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34. В одном из вариантов осуществления изобретения указанная идентичная легкая цепь (VLCL) содержит SEQ ID NO: 35.
В одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 16, CDR2 тяжелой цепи, имеющий SEQ ID NO: 17, CDR3 тяжелой цепи, имеющий SEQ ID NO: 18, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34.
В одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит вариабельную тяжелую цепь содержащую аминокислотную последовательность SEQ ID NO: 15, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
В следующем варианте осуществления изобретения, антигенсвязывающий фрагмент, который обладает специфичностью в отношении FolR1, содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 15, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31, или их варианты, которые сохраняют функциональность.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 36, полипептидную последовательность, которая по меньшей мере примерно 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 15, и полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит
(III) третий антигенсвязывающий фрагмент (который представляет собой молекулу Fab), обладающий способностью специфически связываться с FolR1.
В одном из таких вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи. В одном из таких вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту.
Таким образом, в одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
(III) третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 16, CDR2 тяжелой цепи, имеющий SEQ ID NO: 17, CDR3 тяжелой цепи, имеющий SEQ ID NO: 18, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34.
В одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 15, вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(III) третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит вариабельную тяжелую цеп, содержащую аминокислотную последовательность SEQ ID NO: 15, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
В одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 402 и SEQ ID NO: 400, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 16, CDR2 тяжелой цепи, имеющий SEQ ID NO: 402, CDR3 тяжелой цепи, имеющий SEQ ID NO: 400, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34.
В одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 401, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
В следующем варианте осуществления изобретения, антигенсвязывающий фрагмент, который обладает специфичностью в отношении FolR1, содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 401, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31, или их варианты, которые сохраняют функциональность.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 36, полипептидную последовательность, которая по меньшей мере примерно 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 401, и полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит
(III) третий антигенсвязывающий фрагмент (который представляет собой молекулу Fab), обладающий способностью специфически связываться с FolR1.
В одном из таких вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и последовательности CDR легкой цепи. В одном из таких вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту.
Таким образом, в одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 402 и SEQ ID NO: 400, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
(III) третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 402 и SEQ ID NO: 400, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 16, CDR2 тяжелой цепи, имеющий SEQ ID NO: 402, CDR3 тяжелой цепи, имеющий SEQ ID NO: 400, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34.
В одном из вариантов осуществления настоящего изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая
(I) первый антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с CD3, и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 401, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31;
(III) третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), и который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 401, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
Так, один из вариантов осуществления изобретения относится к биспецифическим молекулам, в которых по меньшей мере два связывающих фрагмента имеют идентичные легкие цепи и соответствующие реконструированные тяжелые цепи, которые обеспечивают специфическое связывание с активирующим Т-клетку антигеном CD3 и антигеном клетки-мишени FolR1 соответственно. Применение так называемого принципа «общей легкой цепи», т.е. объединения двух связывающих агентов, которые обладают одной легкой цепью, но имеют различные специфичности, предупреждает ошибочной спаривание легких цепей. Таким образом, в процессе производства образуется меньшее количество побочных продуктов, что облегчает получение гомогенных активирующих Т-клетку биспецифических антигенсвязывающих молекул.
Компоненты активирующей Т-клетку биспецифической антигенсвязывающей молекулы можно сливать друг с другом в различных конфигурациях. Примеры конфигураций представлены на фиг. 1А-И и более подробно описаны ниже.
В некоторых вариантах осуществления изобретения указанная активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит Fc-домен, состоящий из первой и второй субъединиц, обладающих способностью к стабильной ассоциации. В представленных ниже в качестве примера вариантах осуществления изобретения описана активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая Fc-домен.
Активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая кроссовер-Fab-фрагмент
При создании настоящего изобретения был создан второй формат биспецифического антитела, в котором один из связывающих фрагментов представляет собой кроссовер-Fab-фрагмент. Одним из объектов изобретения является одновалентное биспецифическое антитело, в котором один из Fab-фрагментов молекулы IgG заменен на кроссовер-Fab-фрагмент. Кроссовер-Fab-фрагменты представляют собой Fab-фрагменты, в которых обменены либо вариабельные области, либо константные области тяжелой и легкой цепей. Форматы биспецифического антитела, содержащего кроссовер-Fab-фрагменты, описаны, например, в WO 2009/080252, WO 2009/080253, WO 2009/080251, WO 2009/080254, WO 2010/136172, WO 2010/145792 и WO 2013/026831. В конкретном варианте осуществления изобретения первый антигенсвязывающий фрагмент представляет собой кроссовер-молекулу Fab, в которой обменены либо вариабельные области, либо константные области легкой цепи Fab и тяжелой цепи Fab. Такая модификация предупреждает ошибочное спаривание тяжелых и легких цепей из различных молекул Fab, что повышает выход и чистоту активирующей Т-клетку антигенсвязывающей молекулы, предлагаемой в изобретении, при ее получении методами рекомбинации. В конкретной кроссовер-молекуле Fab, которую можно использовать в активирующей Т-клетку биспецифической антигенсвязывающей молекуле, предлагаемой в изобретении, обменены вариабельные области легкой цепи Fab и тяжелой цепи Fab. В другой кроссовер-молекуле Fab, которую можно использовать в активирующей Т-клетку биспецифической антигенсвязывающей молекуле, предлагаемой в изобретении, обменены константные области легкой цепи Fab и тяжелой цепи Fab.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 8, SEQ ID NO: 56 и SEQ ID NO: 57, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 65.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 56, CDR3 тяжелой цепи, имеющий SEQ ID NO: 57, CDR1 легкой цепи, имеющий SEQ ID NO: 59, CDR2 легкой цепи, имеющий SEQ ID NO: 60, и CDR3 легкой цепи, имеющий SEQ ID NO: 65.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой каноническую молекулу Fab.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 55, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой каноническую молекулу Fab.
В следующем варианте осуществления изобретения антигенсвязывающий фрагмент, обладающий специфичностью в отношении FolR1, содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 55, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 64, или их варианты, которые сохраняют функциональность.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 36, полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31, полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 55, и полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 64.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит
(III) третий антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR1.
В одном из вариантов осуществления изобретения третий антигенсвязывающий фрагмент представляет собой каноническую молекулу Fab. В одном из вариантов осуществления изобретения третий антигенсвязывающий фрагмент представляет собой кроссовер-молекулу Fab.
В одном из таких вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи. В одном из таких вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 8, SEQ ID NO: 56 и SEQ ID NO: 57, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 65;
(III) третий антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 8, SEQ ID NO: 56 и SEQ ID NO: 57, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 65.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 56, CDR3 тяжелой цепи, имеющий SEQ ID NO: 57, CDR1 легкой цепи, имеющий SEQ ID NO: 59, CDR2 легкой цепи, имеющий SEQ ID NO: 60, и CDR3 легкой цепи, имеющий SEQ ID NO: 65.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент и третий антигенсвязывающие фрагменты оба представляют собой каноническую молекулу Fab.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31,
(II) второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 55, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64,
(III) третий антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 55, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент и третий антигенсвязывающий фрагмент оба представляют собой каноническую молекулу Fab.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 50, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой каноническую молекулу Fab. В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой кроссовер-молекулу Fab.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой каноническую молекулу Fab. В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой кроссовер-молекулу Fab.
В следующем варианте осуществления изобретения антигенсвязывающий фрагмент, который обладает специфичностью в отношении FolR1, содержит последовательность вариабельной области тяжелой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 49, и последовательность вариабельной области легкой цепи, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 51, или их варианты, которые сохраняют функциональность.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 36, полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 31, полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 49, полипептидную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 51.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит
(III) третий антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR1.
В одном из вариантов осуществления изобретения третий антигенсвязывающий фрагмент представляет собой каноническую молекулу Fab. В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент представляет собой кроссовер-молекулу Fab.
В одном из таких вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи. В одном из таких вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34;
(II) второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 49, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54;
(III) третий антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, состоящей из SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 50, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54.
В одном из таких вариантов осуществления изобретения связывающий антиген CD3 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и связывающий антиген FolR1 фрагмент содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент и третий антигенсвязывающий фрагмент оба представляют собой каноническую молекулу Fab.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит
(I) первый антигенсвязывающий фрагмент, который представляет собой кроссовер-молекулу Fab, обладающую способностью специфически связываться с CD3, который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31,
(II) второй антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49 и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51,
(III) третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с фолатным рецептором 1 (FolR1), который содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент и третий антигенсвязывающий фрагмент оба представляют собой каноническую молекулу Fab.
Так, один из вариантов осуществления изобретения относится к биспецифическим молекулам, в которых два связывающих фрагмента обеспечивают специфическое связыванием с FolR1 и один связывающий фрагмент обеспечивает специфичность в отношении активирующего Т-клетку антигена CD3. Одну из тяжелых цепей модифицируют для обеспечения правильного спаривания тяжелой и легкой цепей, исключая тем самым необходимость применения подхода, основанного на использовании общей легкой цепи. Наличие двух сайтов связывания FolR1 позволяет осуществлять требуемое взаимодействие с антигеном-мишенью FolR1 и активацию Т-клеток.
Компоненты активирующей Т-клетку биспецифической антигенсвязывающей молекулы можно сливать друг с другом в различных конфигурациях. Примеры конфигураций представлены на фиг. 1А-И и более подробно описаны ниже.
В некоторых вариантах осуществления изобретения указанная активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит Fc-домен, состоящий из первой и второй субъединиц, обладающих способностью к стабильной ассоциации. Ниже описаны примеры вариантов активирующей Т-клетку биспецифической антигенсвязывающей молекулы, содержащей Fc-домен.
Форматы активирующей Т-клетку биспецифической антигенсвязывающей молекулы
Как указано выше и проиллюстрировано на фиг. 1А-И, в одном из вариантов осуществления изобретения активирующие Т-клетки биспецифические антигенсвязывающие молекулы содержат по меньшей мере два Fab-фрагмента, имеющие идентичные легкие цепи (VLCL) и различные тяжелые цепи (VHCL), которые обеспечивают специфичности в отношении двух различных антигенов, а именно, один Fab-фрагмент обладает способностью специфически связываться с активирующим Т-клетку антигеном CD3, а другой Fab-фрагмент обладает способностью специфически связываться с антигеном клетки-мишени FolR1.
В другом варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит по меньшей мере два антигенсвязывающих фрагмента (молекул Fab), один из которых представляет собой кроссовер-молекулу Fab, а другой представляет собой каноническую молекулу Fab. В одном из таких вариантов осуществления изобретения первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, а второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR, представляет собой каноническую молекулу Fab.
Указанные компоненты активирующей Т-клетку биспецифической антигенсвязывающей молекулы можно сливать друг с другом в различных конфигурациях. Примеры конфигураций представлены на фиг. 1А-И.
В некоторых вариантах осуществления изобретения первый и второй антигенсвязывающие фрагменты каждый слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена. В одном конкретном таком варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула практически состоит из первого и второго антигенсвязывающих фрагментов, Fc-домена, состоящего из первой и второй субъединиц, и необязательно одного или нескольких пептидных линкеров, где первый и второй антигенсвязывающий фрагмент каждый слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена. В одном из таких вариантов осуществления изобретения первый и второй антигенсвязывающие фрагменты оба представляют собой Fab-фрагменты и имеют идентичные легкие цепи (VLCL). В другом таком варианте осуществления изобретения первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, а второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR, представляет собой каноническую молекулу Fab.
В одном из вариантов осуществления изобретения второй антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена, а первый антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab второго антигенсвязывающего фрагмента. В конкретном указанном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула практически состоит из первого и второго антигенсвязывающих фрагментов, Fc-домена, состоящего из первой и второй субъединиц, и необязательно одного или нескольких пептидных линкеров, где первый антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab второго антигенсвязывающего фрагмента, а второй антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена. В одном из таких вариантов осуществления изобретения первый и второй антигенсвязывающие фрагменты оба представляют собой Fab-фрагменты и имеют идентичные легкие цепи (VLCL). В другом таком варианте осуществления изобретения первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, а второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR, представляет собой каноническую молекулу Fab. Необязательно легкая цепь Fab первого антигенсвязывающего фрагмента и легкая цепь Fab второго антигенсвязывающего фрагмента могут быть дополнительно слиты друг с другом.
В других вариантах осуществления изобретения первый антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена. В конкретном указанном варианте осуществления изобретения второй антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента. В конкретном указанном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула практически состоит из первого и второго антигенсвязывающих фрагментов, Fc-домена, состоящего из первой и второй субъединиц, и необязательно одного или нескольких пептидных линкеров, где второй антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента, а первый антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена. В одном из таких вариантов осуществления изобретения первый и второй антигенсвязывающие фрагменты оба представляют собой Fab-фрагменты и имеют идентичные легкие цепи (VLCL). В другом таком варианте осуществления изобретения первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, а второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с FolR, представляет собой каноническую молекулу Fab. Необязательно легкая цепь Fab первого антигенсвязывающего фрагмента и легкая цепь Fab второго антигенсвязывающего фрагмента могут быть дополнительно слиты друг с другом.
Антигенсвязывающие фрагменты могут быть слиты с Fc-доменом или друг с другом непосредственно или через пептидный линкер, содержащий одну или несколько аминокислот, как правило, примерно 2-20 аминокислот. Пептидные линкеры известны в данной области, и они представлены в настоящем описании. Пригодные неиммуногенные пептидные линкеры включают, например, пептидные линкеры (G4S)n (SEQ ID NO: 387), (SG4)n (SEQ ID NO: 388), (G4S)n (SEQ ID NO: 387) или G4(SG4)n (SEQ ID NO: 389). Как правило, «n» обозначает число от 1 до 10, как правило, от 2 до 4. Наиболее пригодным пептидным линкером для слияния легких цепей Fab первого и второго антигенсвязывающих фрагментов друг с другом является (G4S)2 (SEQ ID NO: 386). Примером пептидного линкера, пригодного для соединения тяжелых цепей Fab первого и второго антигенсвязывающих фрагментов является EPKSC(D)-(G4S)2 (SEQ ID NO: 390 и 391). Линкеры могут дополнительно содержать шарнирную область иммуноглобулина (ее часть). В частности, когда антигенсвязывающий фрагмент слит на N-конце субъединицы Fc-домена, то он может быть слит посредством шарнирной области иммуноглобулина или ее части с использованием или без использования дополнительного пептидного линкера.
При создании настоящего изобретения было установлено, что активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая два связывающих фрагмента, специфических в отношении антигена клетки-мишени FolR, обладает более предпочтительными характеристиками по сравнению с активирующей Т-клетку биспецифической антигенсвязывающей молекулой, содержащей только один связывающий фрагмент, специфический в отношении антигена клетки-мишени FolR.
В соответствии с этим в конкретных вариантах осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержит также третий антигенсвязывающий фрагмент, который представляет собой молекулу Fab, обладающую способностью специфически связываться с FolR. В одном из таких вариантов осуществления изобретения второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи, т.е. последовательности CDR тяжелой цепи второго антигенсвязывающего фрагмента являются такими же, что и последовательности CDR тяжелой цепи третьего антигенсвязывающего фрагмента, а последовательности CDR легкой цепи второго антигенсвязывающего фрагмента являются такими же, что и последовательности CDR легкой цепи третьего антигенсвязывающего фрагмента. В одном из таких вариантов осуществления изобретения третий антигенсвязывающий фрагмент идентичен второму антигенсвязывающему фрагменту (т.е. они содержат одинаковые аминокислотные последовательности).
В одном из вариантов осуществления изобретения первый и второй антигенсвязывающий фрагмент каждый слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена, а третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента. В конкретном таком варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула практически состоит из первого, второго и третьего антигенсвязывающих фрагментов, Fc-домена, состоящего из первой и второй субъединиц, и необязательно одного или нескольких пептидных линкеров, где первый и второй антигенсвязывающий фрагмент каждый слит на С-конце тяжелой цепи Fab с N-концом первой субъединицы Fc-домена, а третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента. В одном из таких вариантов осуществления изобретения первый, второй и третий антигенсвязывающие фрагменты представляют собой канонические Fab-фрагменты и имеют идентичные легкие цепи (VLCL). В другом таком варианте осуществления изобретения первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, а второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR, представляют собой каноническую молекулу Fab. Необязательно легкая цепь Fab первого антигенсвязывающего фрагмента и легкая цепь Fab третьего антигенсвязывающего фрагмента дополнительно могут быть слиты друг с другом.
Другим объектом изобретения является биспецифическое антитело, содержащее а) первый антигенсвязывающий сайт, который конкурирует за связывание с человеческим FolR1 с референс-антителом, которое содержит вариабельный домен тяжелой цепи (VH), имеющий SEQ ID NO: 49, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 51; и б) второй антигенсвязывающий сайт, который конкурирует за связывание с человеческим CD3 с референс-антителом, которое содержит вариабельный домен тяжелой цепи (VH), имеющий SEQ ID NO: 36, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 31, где конкуренцию за связывание измеряют методом поверхностного плазменного резонанса.
Другим объектом изобретения является активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, и второй антигенсвязывающий фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), где активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с тем же эпитопом на человеческом FolR1, что и первое референс-антитело, которое содержит вариабельный домен тяжелой цепи (VH), имеющий SEQ ID NO: 49, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 51; и где активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с тем же эпитопом на человеческом CD3, что и второе референс-антитело, которое содержит вариабельный домен тяжелой цепи (VH), имеющий SEQ ID NO: 36, и вариабельный домен легкой цепи, имеющий SEQ ID NO: 31.
Другим объектом изобретения является активирующая Т-клетку биспецифическая антигенсвязывающая молекула, которая содержит первую, вторую, третью, четвертую и пятую полипептидную цепь, которые образуют первый, второй и третий антигенсвязывающие фрагменты, где первый антигенсвязывающий фрагмент обладает способностью связываться с CD3, а второй и третий антигенсвязывающий фрагмент каждый обладает способностью связываться с фолатным рецептором 1 (FolR1). Первая и вторая полипептидные цепи содержат в направлении от амино-(N)-конца к карбоксильному (С)-концу вариабельный домен первой легкой цепи (VLD1) и константный домен первой легкой цепи (CLD1). Третья полипептидная цепь содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи (VLD2) и константный домен 1 второй тяжелой цепи (CH1D2). Четвертая полипептидная цепь содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи (VHD1), константный домен 1 первой тяжелой цепи (CH1D1), константный домен 2 первой тяжелой цепи (CH2D1) и константный домен 3 первой тяжелой цепи (CH3D1). Пятая полипептидная цепь содержит VHD1, CH1D1, вариабельный домен второй тяжелой цепи (VHD2), константный домен второй легкой цепи (CLD2), константный домен 2 второй тяжелой цепи (CH2D2) и константный домен 3 второй тяжелой цепи (CH3D2). Третья полипептидная цепь и VHD2 и CLD2 пятой полипептидной цепи образуют первый антигенсвязывающий фрагмент, обладающий способностью связываться с CD3. Вторая полипептидная цепь и VHD1 и CH1D1 пятой полипептидной цепи образуют третий связывающий фрагмент, обладающий способностью связываться с FolR1. Первая полипептидная цепь и VHD1 и CH1D1 четвертой полипептидной цепи образуют второй связывающий фрагмент, обладающий способностью связываться с FolR1.
В другом варианте осуществления изобретения второй и третий антигенсвязывающий фрагмент каждый слит на С-конце тяжелой цепи Fab с N-концом первой или второй субъединицы Fc-домена, а первый антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab второго антигенсвязывающего фрагмента. В конкретном таком варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула практически состоит из первого, второго и третьего антигенсвязывающих фрагментов, Fc-домена, состоящего из первой и второй субъединиц, и необязательно одного или нескольких пептидных линкеров, где второй и третий антигенсвязывающий фрагмент каждый слит на С-конце тяжелой цепи Fab с N-концом первой субъединицы Fc-домена, а первый антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab третьего антигенсвязывающего фрагмента. В одном из таких вариантов осуществления изобретения первый, второй и третий антигенсвязывающие фрагменты представляют собой канонические Fab-фрагменты, и они имеют идентичные легкие цепи (VLCL). В другом таком варианте осуществления изобретения первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, а второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR, представляют собой каноническую молекулу Fab. Необязательно легкая цепь Fab первого антигенсвязывающего фрагмента и легкая цепь Fab второго антигенсвязывающего фрагмента могут быть дополнительно слиты друг с другом.
Антигенсвязывающие фрагменты могут быть слиты с Fc-доменом непосредственно или через пептидный линкер. В конкретном варианте осуществления изобретения каждый из антигенсвязывающих фрагментов слит с Fc-доменом через шарнирную область иммуноглобулина. В конкретном варианте осуществления изобретения шарнирная область иммуноглобулина представляет собой шарнирную область человеческого IgG1.
В одном из вариантов осуществления изобретения первый и второй антигенсвязывающие фрагменты и Fc-домен являются частью молекулы иммуноглобулина. В конкретном варианте осуществления изобретения молекула иммуноглобулина представляет собой иммуноглобулин IgG-класса. В еще более конкретном варианте осуществления изобретения иммуноглобулин представляет собой иммуноглобулин IgG1-подкласса. В другом варианте осуществления изобретения иммуноглобулин представляет собой иммуноглобулин IgG4-подкласса. В другом варианте осуществления изобретения иммуноглобулин представляет собой человеческий иммуноглобулин. В других вариантах осуществления изобретения иммуноглобулин представляет собой химерный иммуноглобулин или гуманизированный иммуноглобулин.
В конкретном варианте указанной активирующей Т-клетку биспецифической антигенсвязывающей молекулы первый и второй антигенсвязывающие фрагменты и Fc-домен являются частью молекулы иммуноглобулина, а третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента, где первый, второй и третий антигенсвязывающие фрагменты представляют собой канонические Fab-фрагменты и имеют идентичные легкие цепи (VLCL), где первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, содержит по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34; и второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34.
В конкретном варианте указанной активирующей Т-клетку биспецифической антигенсвязывающей молекулы первый и второй антигенсвязывающие фрагменты и Fc-домен являются частью молекулы иммуноглобулина, а третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента, где первый, второй и третий антигенсвязывающие фрагменты представляют собой канонические Fab-фрагменты и имеют идентичные легкие цепи (VLCL), где первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, содержит вариабельную тяжелую цепь, содержащую последовательность SEQ ID NO: 36, вариабельную легкую цепь, содержащую последовательность SEQ ID NO: 31; а второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат вариабельную тяжелую цепь, содержащую последовательность SEQ ID NO: 15, вариабельную легкую цепь, содержащую последовательность SEQ ID NO: 31.
В конкретном варианте указанной активирующей Т-клетку биспецифической антигенсвязывающей молекулы первый и второй антигенсвязывающие фрагменты и Fc-домен представляют собой часть молекулы иммуноглобулина, а третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента, а первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, в которой либо вариабельные, либо константные области легкой цепи Fab и тяжелой цепи Fab обменены, содержащую по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34; и второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат по меньшей мере один гипервариабельный участок (CDR) тяжелой цепи, выбранный из группы, которая состоит из SEQ ID NO: 8, SEQ ID NO: 56 и SEQ ID NO: 57, и по меньшей мере один CDR легкой цепи, выбранный из группы SEQ ID NO: 59, SEQ ID NO: 60 и SEQ ID NO: 65.
В конкретном варианте указанной активирующей Т-клетку биспецифической антигенсвязывающей молекулы первый и второй антигенсвязывающие фрагменты и Fc-домен являются частью молекулы иммуноглобулина, а третий антигенсвязывающий фрагмент слит на С-конце тяжелой цепи Fab с N-концом тяжелой цепи Fab первого антигенсвязывающего фрагмента, и первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, представляет собой кроссовер-молекулу Fab, в которой либо вариабельные, либо константные области легкой цепи Fab и тяжелой цепи Fab обменены, где первый антигенсвязывающий фрагмент, обладающий способностью специфически связываться с CD3, содержит вариабельную тяжелую цепь, содержащую последовательность SEQ ID NO: 36, вариабельную легкую цепь, содержащую последовательность SEQ ID NO: 31; а второй и третий антигенсвязывающие фрагменты, обладающие способностью специфически связываться с FolR1, содержат вариабельную тяжелую цепь, содержащую последовательность SEQ ID NO: 55, вариабельную легкую цепь, содержащую последовательность SEQ ID NO: 65.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула является одновалентной в отношении каждого антигена. В конкретном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула может связываться с человеческим CD3 и человеческим фолатным рецептором альфа (FolR1), и она сконструирована без применения подхода на основе гетеродимеризации, такого, например, как технология «knob-into-hole». Например, молекулу можно получать с использованием библиотеки общих легких цепей и технологии CrossMab. В конкретном варианте осуществления изобретения вариабельную область CD3-связывающего агента сливают с СН1-доменом стандартного человеческого антитела в виде IgG1 с образованием VLVH-«скрещенной» молекулы (слитой с Fc), которая является общей для обеих специфичностей. Для создания скрещенных «копий» (VHCL) специфический в отношении CD3 вариабельный домен тяжелой цепи сливают с человеческой константной легкой λ-цепью, в то время как вариабельный домен тяжелой цепи, специфический в отношении человеческого FolR1 (например, выделенный из библиотеки общих легких цепей) сливают с человеческой константной легкой κ-цепью. Полученная в результате этого требуемая молекула с правильно спаренными цепями содержит легкие и каппа-, и лямбда-цепи или их фрагменты. Затем эти требуемые виды биспецифической молекулы можно очищать от неправильно спаренных или гомодимерных видов, осуществляя последовательно стадии очистки для легкой каппа- и лямбда-цепи в любом порядке. В одном из конкретных вариантов осуществления изобретения очистку требуемого биспецифического антитела проводят с помощью последовательных стадий очистки на колонках с KappaSelect и LambdaFabSelect (фирма GE Healthcare) для удаления нежелательных гомодимерных антител.
Fc-домен
Fc-домен активирующей Т-клетку биспецифической антигенсвязывающей молекулы состоит из пары полипептидных цепей, содержащих домены тяжелой цепи молекулы иммуноглобулина. Например, Fc-домен молекулы иммуноглобулина G (IgG) представляет собой димер, каждая субъединица которого содержит константные домены СН2 и СН3 тяжелой цепи IgG. Две субъединицы Fc-домена обладают способностью к стабильной ассоциации друг с другом. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержит не более одного Fc-домена.
В одном из вариантов осуществления изобретения Fc-домен активирующей Т-клетку биспецифической антигенсвязывающей молекулы представляет собой Fc-домен IgG. В конкретном варианте осуществления изобретения Fc-домен представляет собой Fc-домен IgG1. В другом варианте осуществления изобретения Fc-домен представляет собой Fc-домен IgG4. В более конкретном варианте осуществления изобретения Fc-домен представляет собой Fc-домен IgG4, содержащий аминокислотную замену в положении S228 (нумерация по Кэботу), прежде всего аминокислотную замену S228P. Указанная аминокислотная замена снижает in vivo обмен в Fab-плече антител в виде IgG4 (см. Stubenrauch и др., Drug Metabolism and Disposition 38, 2010, cc. 84-91). В другом конкретном варианте осуществления изобретения Fc-домен является человеческим.
Модификации Fc-домена, способствующие гетеродимеризации
Активирующие Т-клетку биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, содержат различные антигенсвязывающие фрагменты, слитые с одной или другой из двух субъединиц Fc-домена, при этом две субъединицы Fc-домена, как правило, содержатся в двух неидентичных полипептидных цепях. Рекомбинантная совместная экспрессия этих полипептидов и последующая димеризация приводит к нескольким возможным комбинациям двух полипептидов. Для повышения выхода и чистоты активирующих Т-клетки биспецифических антигенсвязывающих молекул при их получении методами рекомбинации целесообразно интродуцировать в Fc-домен активирующей Т-клетки биспецифической антигенсвязывающей молекулы модификацию, которая способствует ассоциации требуемых полипептидов.
Таким образом, в конкретных вариантах осуществления изобретения Fc-домен активирующей Т-клетки биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, содержит модификацию, которая способствует ассоциации первой и второй субъединиц Fc-домена. Сайт наиболее сильного белок-белкового взаимодействия двух субъединиц Fc-домена человеческого IgG находится в СН3-домене Fc-домена. Таким образом, в одном из вариантов осуществления изобретения указанная модификация находится в СН3-домене Fc-домена.
В конкретном варианте осуществления изобретения указанная модификация представляет собой так называемую модификацию типа «knob-in-hole» (типа «выступ-впадина»), которая включает модификацию, приводящую к образованию «выступа» на одной из двух субъединиц Fc-домена и модификацию, приводящую к образованию «впадины» в другой одной из двух субъединиц Fc-домена.
Технология «knob-into-hole» описана, например, в US №5731168; US №7695936; у Ridgway и др., Prot Eng 9, 1996, cc. 617-621 и Carter, J Immunol Meth 248, 2001, cc. 7-15. В целом, метод включает интродукцию выпуклости («выступ») на поверхности раздела первого полипептида и соответствующей полости («впадина») в поверхности раздела второго полипептида, в результате выпуклость может помещаться в полость, способствуя тем самым образованию гетеродимера и препятствуя образованию гомодимера. Выпуклости конструируют путем замены аминокислот с небольшими боковыми цепями на поверхности раздела первого полипептида на аминокислоты с более крупными боковыми цепями (например, на тирозин или триптофан). Компенсирующие полости идентичного или сходного с выпуклостями размера создают в поверхности раздела второго полипептида путем замены аминокислот с крупными боковыми цепями на аминокислоты с менее крупными боковыми цепями (например, аланин или треонин).
Таким образом, в конкретном варианте осуществления изобретения в СН3-домене первой субъединицы Fc-домена активирующей Т-клетки биспецифической антигенсвязывающей молекулы аминокислотный остаток заменен аминокислотным остатком, который имеет больший объем боковой цепи, что приводит к образованию выпуклости на СН3-домене первой субъединицы, которая может помещаться в полость в СН3-домене второй субъединицы, и в СН3-домене второй субъединицы Fc-домена аминокислотный остаток заменен аминокислотным остатком, который имеет меньший объем боковой цепи, что приводит к образованию полости в СН3-домене второй субъединицы, в которую может помещаться выпуклость на СН3-домене первой субъединицы.
Выпуклость и полость можно создавать путем изменения нуклеиновых кислот, кодирующих полипептиды, например, с помощью сайтнаправленного мутагенеза или путем пептидного синтеза.
В конкретном варианте осуществления изобретения в СН3-домене первой субъединицы Fc-домена остаток треонина в положении 366 заменен остатком триптофана (T366W), а в СН3-домене второй субъединицы Fc-домена остаток тирозина в положении 407 заменен на остаток валина (Y407V). В одном из вариантов осуществления изобретения во второй субъединице Fc-домена дополнительно остаток треонина в положении 366 заменен на остаток серина (T366S) и остаток лейцина в положении 368 заменен на остаток аланина (L368A).
В следующем варианте осуществления изобретения в первой субъединице Fc-домена дополнительно остаток серина в положении 354 заменен на остаток цистеина (S354C), а во второй субъединице Fc-домена дополнительно остаток тирозина в положении 349 заменен на остаток цистеина (Y349C). Интродукция указанных двух остатков цистеина приводит к образованию дисульфидного мостика между двумя субъединицами Fc-домена, тем самым дополнительно стабилизируя димер (Carter, J Immunol Methods 248, 2001, cc. 7-15).
В конкретном варианте осуществления изобретения антигенсвязывающий фрагмент, обладающий способностью связываться с CD3, слит (необязательно через антигенсвязывающий фрагмент, обладающий способностью связываться с антигеном FolR1 на клетки-мишени) с первой субъединицей Fc-домена (которая содержит модификацию, приводящую к образованию «выступа»).
Не вдаваясь в какую-либо теорию, можно считать, что слияние антигенсвязывающего фрагмента, обладающего способностью связываться с CDS, с содержащей «выступ» субъединицей Fc-домена должно (дополнительно) минимизировать образование антигенсвязывающих молекул, содержащих два антигенсвязывающих фрагмента, обладающих способностью связываться с CD3 (стерическое «столкновение» двух содержащих «выступ» полипептидов).
В альтернативном варианте осуществления изобретения модификация, способствующая ассоциации первой и второй субъединиц Fc-домена, представляет собой модификацию, опосредующую определяемые электростатическим действием воздействия, например, описанные в публикации РСТ WO 2009/089004. В целом, указанный метод включает замену одного или нескольких аминокислотных остатков на поверхности раздела двух субъединиц Fc-домена на заряженные аминокислотные остатки, в результате чего образование гомодимера становится электростатически невыгодным, а гетеродимеризация становится электростатически выгодной.
Модификации Fc-домена, приводящие к аннулированию связывания с Fc-рецептором и/или эффекторной функции
Fc-домен придает активирующей Т-клетку биспецифической антигенсвязывающей молекуле предпочтительные фармакокинетические свойства, включая продолжительное время полужизни в сыворотке, что обеспечивает хорошее накопление в ткани-мишени и предпочтительное соотношение распределения в ткани-крови. Однако в то же время он может приводить к нежелательной направленности активирующей Т-клетку биспецифической антигенсвязывающей молекулы к клеткам, которые экспрессируют Fc-рецепторы, а не к предпочтительным несущим антиген клеткам. Кроме того, совместная активация путей передачи сигналов Fc-рецептора может приводить к высвобождению цитокинов, что в сочетании с обусловливающими активацию Т-клетки свойствами и продолжительным временем полужизни антигенсвязывающей молекулы, приводит к избыточной активации цитокиновых рецепторов и серьезным побочным действиям при системном введении. Активация (несущих Fc-рецептор) иммунных клеток, отличных от Т-клеток, может даже снижать эффективность активирующей Т-клетки биспецифической антигенсвязывающей молекулы из-за возможной деструкции Т-клеток, например, NK-клетками.
Таким образом, согласно конкретным вариантам осуществления изобретения Fc-домен активирующих Т-клетки биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, обладает пониженной аффинностью связывания с Fc-рецептором и/или пониженной эффекторной функцией по сравнению с нативным Fc-доменом IgG1. В одном из указанных вариантов осуществления изобретения Fc-домен (или активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая указанный Fc-домен) характеризуется аффинностью связывания, составляющей менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10% и наиболее предпочтительно менее чем 5% от аффинности связывания с Fc-рецептором нативного Fc-домена IgG1 (или активирующей Т-клетку биспецифической антигенсвязывающей молекулы, содержащей указанный нативный Fc-домен IgG1), и/или эффекторной функцией, составляющей менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10% и наиболее предпочтительно менее чем 5% от эффекторной функции нативного Fc-домена IgG1 (или активирующей Т-клетку биспецифической антигенсвязывающей молекулы, содержащей указанный нативный Fc-домен IgG1). В одном из вариантов осуществления изобретения Fc-домен (или активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая указанный Fc-домен) практически не связывается с Fc-рецептором и/или не индуцирует эффекторную функцию. В конкретном варианте осуществления изобретения Fc-рецептор представляет собой Fcγ-рецептор. В одном из вариантов осуществления изобретения Fc-рецептор представляет собой человеческий Fc-рецептор. В одном из вариантов осуществления изобретения Fc-рецептор представляет собой активирующий Fc-рецептор. В конкретном варианте осуществления изобретения Fc-рецептор представляет собой активирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIIa, FcγRI или FcγRIIa, наиболее предпочтительно человеческий FcγRIIIa. В одном из вариантов осуществления изобретения эффекторная функция представляет собой одну или несколько функций, выбранных из группы, включающей CDC, ADCC, ADCP и секрецию цитокинов. В конкретном варианте осуществления изобретения эффекторная функция представляет собой ADCC. В одном из вариантов осуществления изобретения Fc-домен характеризуется практической такой же аффинностью связывания с неонатальным Fc-рецептором (FcRn), что и нативный Fc-домен IgG1. Практически такое же связывание с FcRn достигается, когда Fc-домен (или активирующая Т-клетку биспецифическая антигенсвязывающая молекула, содержащая указанный Fc-домен), характеризуется аффинностью связывания, составляющей более чем примерно 70%, предпочтительно более чем примерно 80%, более предпочтительно более чем примерно 90%, от аффинности связывания нативного Fc-домена IgG1 (или активирующей Т-клетку биспецифической антигенсвязывающей молекулы, содержащий нативный Fc домен IgG1) с FcRn.
Согласно некоторым вариантам осуществления изобретения Fc-домен конструируют так, чтобы он обладал пониженной аффинностью связывания с Fc-рецептором и/или пониженной эффекторной функцией по сравнению с не подвергнутым инженерии Fc-доменом. В конкретных вариантах осуществления изобретения Fc-домен активирующей Т-клетку биспецифической антигенсвязывающей молекулы содержит одну или несколько аминокислотных мутаций, которые снижают аффинность связывания Fc-домена с Fc-рецептором и/или эффекторную функцию. Как правило, в каждой из двух субъединиц Fc-домена присутствует(ют) одна или несколько одинаковых аминокислотных мутаций. В одном из вариантов осуществления изобретения аминокислотная мутация снижает аффинность связывания Fc-домена с Fc-рецептором. В одном из вариантов осуществления изобретения аминокислотная мутация снижает аффинность связывания Fc-домена с Fc-рецептором по меньшей мере в 2 раза, по меньшей мере в 5 раз или по меньшей мере в 10 раз. Согласно вариантам осуществления изобретения, в которых имеет место более одной аминокислотной мутации, которые снижают аффинность связывания Fc-домена с Fc-рецептором, комбинация указанных аминокислотных мутаций может снижать аффинность связывания Fc-домена с Fc-рецептором по меньшей мере в 10 раз, по меньшей мере в 20 раз или по меньшей мере в 50 раз. В одном из вариантов осуществления изобретения активирующая Т-клетки биспецифическая антигенсвязывающая молекула, содержащая сконструированный Fc-домен, характеризуется аффинностью связывания, составляющей менее чем 20%, в частности, менее чем 10%, более предпочтительно менее чем 5% от аффинности связывания с Fc-рецептором, характерной для активирующей Т-клетки биспецифической антигенсвязывающей молекулы, содержащей не подвергнутый инженерии Fc-домен. В конкретном варианте осуществления изобретения Fc-рецептор представляет собой Fcγ-рецептор. В некоторых вариантах осуществления изобретения Fc-рецептор представляет собой человеческий Fc-рецептор. В некоторых вариантах осуществления изобретения Fc-рецептор представляет собой активирующий Fc-рецептор. В конкретном варианте осуществления изобретения Fc-рецептор представляет собой активирующий человеческий Fc-рецептор, более конкретно человеческий FcγRIIIa, FcγRI или FcγRIIa, наиболее предпочтительно человеческий FcγRIIIa. Предпочтительно уменьшается связывание с каждым из этих рецепторов. Согласно некоторым вариантам осуществления изобретения снижается также аффинность связывания с компонентом системы комплемента, в частности, аффинность связывания с C1q. Согласно одному из вариантов осуществления изобретения не снижается аффинность связывания с неонатальным Fc-рецептором (FcRn). Практически такое же связывание с FcRn, т.е. сохранение аффинности связывания Fc-домена с указанным рецептором, достигается, когда Fc-домен (или активирующая Т-клетки биспецифическая антигенсвязывающая молекула, содержащая указанный Fc-домен) характеризуется аффинностью связывания с FcRn, составляющей более чем примерно 70% от аффинности связывания с FcRn не подвергнутой инженерии формы Fc-домена (или активирующей Т-клетки биспецифической антигенсвязывающей молекулы, содержащей указанную не подвергнутую инженерии форму Fc-домена). Fc-домен или активирующие Т-клетки биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, содержащие указанный Fc-домен, могут характеризоваться аффинностью, составляющей более чем примерно 80% и даже более чем примерно 90% от указанной выше аффинности. В некоторых вариантах осуществления изобретения Fc-домен активирующей Т-клетки биспецифической антигенсвязывающей молекулы создают так, чтобы он обладал пониженной эффекторной функцией по сравнению с не подвергнутым инженерии Fc-доменом Пониженная эффекторная функция может представлять собой (но, не ограничиваясь только ими) пониженную(ые) одну или несколько из следующих функций: пониженная комплементзависимая цитотоксичность (CDC), пониженная антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), пониженный антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), пониженная секреция цитокинов, пониженное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, пониженное связывание с NK-клетками, пониженное связывание с макрофагами, пониженное связывание с моноцитами, пониженное связывание с полиморфоядерными клетками, пониженная непосредственная передача сигнала, индуцирующего апоптоз, пониженное перекрестное сшивание связанных с мишенью антител, пониженное созревание дендритных клеток или пониженное Т-клеточное примирование. В одном из вариантов осуществления изобретения пониженная эффекторная функция представляет собой одну или несколько функций, выбранных из группы, включающей пониженную CDC, пониженную ADCC, пониженный ADCP и пониженную секрецию цитокинов. В конкретном варианте осуществления изобретения пониженная эффекторная функция представляет собой пониженную ADCC. В одном из вариантов осуществления изобретения пониженная ADCC составляет меньше 20% от ADCC, индуцируемой не подвергнутым инженерии Fc-доменом (или активирующей Т-клетки биспецифической антигенсвязывающей молекулой, содержащей не подвергнутый инженерии Fc-домен).
В одном из вариантов осуществления изобретения аминокислотная мутация, которая снижает аффинность связывания Fc-домена с Fc-рецептором и/или эффекторную функцию, представляет собой аминокислотную замену. В одном из вариантов осуществления изобретения Fc-домен содержит аминокислотную замену в положении, выбранном из Е233, L234, L235, N297, Р331 и Р329. В более конкретном варианте осуществления изобретения Fc-домен содержит аминокислотную замену в положении, выбранном из L234, L235 и Р329. В некоторых вариантах осуществления изобретения Fc-домен содержит аминокислотные замены L234A и L235A. В одном из указанных вариантов осуществления изобретения Fc-домен представляет собой Fc-домен IgG1, в частности, Fc-домен человеческого IgG1. В одном из вариантов осуществления изобретения Fc-домен содержит аминокислотную замену в положении Р329. В более конкретном варианте осуществления изобретения аминокислотная замена представляет собой Р329А или P329G, прежде всего P329G. В одном из вариантов осуществления изобретения Fc-домен содержит аминокислотную замену в положении Р329 и, кроме того, аминокислотную замену в положении, выбранном из Е233, L234, L235, N297 и Р331. В более конкретном варианте осуществления изобретения дополнительная аминокислотная замена представляет собой Е233Р, L234A, L235A, L235E, N297A, N297D или P331S. В конкретном варианте осуществления изобретения Fc-домен содержит аминокислотные замены в положениях Р329, L234 и L235. В более конкретном варианте осуществления изобретения Fc-домен содержит аминокислотные мутации L234A, L235A и P329G («P329G LALA»). В одном из указанных вариантов осуществления изобретения Fc-домен представляет собой Fc-домен IgG1, прежде всего Fc-домен человеческого IgG1. Комбинация аминокислотных замен «P329G LALA» практически полностью элиминирует связывание с Fcγ-рецептором Fc-домена человеческого IgG1, что описано в публикации РСТ WO 2012/130831, которая полностью включена в настоящее описание в качестве ссылки. В WO 2012/130831 описаны также методы получения указанных мутантных Fc-доменов, методы изучения их свойств, таких как связывание с Fc-рецептором или эффекторные функции.
Антитела подкласса IgG4 обладают пониженной аффинностью к связыванию с Fc-рецепторами и пониженными эффекторными функциями по сравнению с антителами подкласса IgG1. Таким образом, в некоторых вариантах осуществления изобретения Fc-домен активирующих Т-клетки биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, представляет собой Fc-домен IgG4, в частности Fc-домен человеческого IgG4. В одном из вариантов осуществления изобретения Fc-домен IgG4 содержит аминокислотные замены в положении S228, конкретно аминокислотную замену S228P. Для дополнительного снижения аффинности связывания с Fc-рецептором и/или его эффекторной функции в одном из вариантов осуществления изобретения Fc-домен IgG4 содержит аминокислотную замену в положении L235, в частности, аминокислотную замену L235E. В другом варианте осуществления изобретения Fc-домен IgG4 содержит аминокислотную замену в положении Р329, в частности, аминокислотную замену P329G. В конкретном варианте осуществления изобретения Fc-домен IgG4 содержит аминокислотные замены в положениях S228, L235 и Р329, в частности, аминокислотные замены S228P, L235E и P329G. Указанные мутанты Fc-домена IgG4 и их особенности связывания с Fcγ-рецептором описаны в публикации РСТ WO 2012/130831, которая полностью включена в настоящее описание в качестве ссылки.
В конкретном варианте осуществления изобретения Fc-домен, характеризующийся пониженной аффинностью связывания с Fc-рецептором и/или пониженной эффекторной функцией по сравнению с нативным Fc-доменом IgG1, представляет собой Fc-домен человеческого IgG1, содержащий аминокислотные замены L234A, L235A и необязательно P329G, или Fc-домен человеческого IgG4, содержащий аминокислотные замены S228P, L235E и необязательно P329G.
В некоторых вариантах осуществления изобретения элиминировали N-гликозилирование Fc-домена. В одном из указанных вариантов осуществления изобретения Fc-домен содержит аминокислотную мутацию в положении N297, в частности, аминокислотную замену аспарагина на аланин (N297A) или аспарагиновую кислоту (N297D).
Помимо Fc-доменов, описанных выше и в публикации РСТ WO 2012/130831, Fc-домены с пониженной способностью связываться с Fc-рецептором и/или эффекторной функцией включают также Fc-домены с заменой одного или нескольких остатков 238, 265, 269, 270, 297, 327 и 329 (US №637056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из аминокислотных положений 265, 269, 270, 297 и 327, включая так называемый мутант Fc-домена «DANA» с заменой остатков 265 и 297 на аланин (US №7332581).
Мутантные Fc-домены можно получать путем аминокислотной делеции, замены, инсерции или модификации с использованием генетических или химических методов, хорошо известных в данной области. Генетические методы могут включать сайтнаправленный мутагенез кодирующей ДНК последовательности, ПЦР, синтез генов и т.п. Правильность нуклеотидных замен можно подтверждать, например, секвенированием.
Связывание с Fc-рецепторами можно легко определять, например, с помощью ELISA или поверхностного плазмонного резонанса (SPR) с использованием стандартного оборудования, такого как устройство BIAcore (фирма GE Healthcare), и с применением таких Fc-рецепторов, которые можно получать методом рекомбинантной экспрессии. Приемлемый указанный анализ связывания представлен в настоящем описании. Альтернативно этому, аффинность связывания Fc-доменов или активирующих клетки биспецифических антигенсвязывающих молекул, содержащих Fc-домен, с Fc-рецепторами можно оценивать с использованием клеточных линий, для которых известно, что они экспрессируют конкретные Fc-рецепторы, такие как человеческие NK-клетки, экспрессирующие FcγIIIa-рецептор.
Эффекторную функцию Fc-домена или активирующей Т-клетки биспецифической антигенсвязывающей молекулы, содержащей Fc-домен, можно оценивать методами, известными в данной области. Приемлемый анализ для оценки ADCC представлен в настоящем описании. Другие примеры анализов in vitro, предназначенных для оценки ADCC-активности представляющей интерес молекулы, описаны в US №5500362; у Hellstrom и др., Proc Natl Acad Sci USA 83, 1986, cc. 7059-7063 и Hellstrom и др., Proc Natl Acad Sci USA 82, 1985, cc. 1499-1502; US №5821337; у Bruggemann и др., J Exp Med 166, 1987, cc. 1351-1361. Альтернативно этому, можно применять методы, основанные на нерадиоактивном анализе (см., например, ACTI™ - нерадиоактивный анализ цитотоксичности с помощью проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и CytoTox 96® - нерадиоактивный анализ цитотоксичности (фирма Promega, Мэдисон, шт. Висконсин)). Приемлемыми эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, с использованием созданных на животных моделей, описанных у Clynes и др., Proc Natl Acad Sci USA 95, 1998, cc. 652-656.
В некоторых вариантах осуществления изобретения снижают связывание Fc-домена с компонентом системы комплемента, в частности с C1q. Таким образом, в некоторых вариантах осуществления изобретения, в которых Fc-домен конструируют так, чтобы он обладал пониженной эффекторной функцией, указанная пониженная эффекторная функция включает пониженную CDC. Можно осуществлять анализы связывания C1q для решения вопроса о том, может ли активирующая Т-клетки биспецифическая антигенсвязывающая молекула связываться с C1q и, как следствие, обладает ли она CDC-активностью (см., например, анализы связывания с C1q и С3 с с помощью ELISA, описанные в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять анализ CDC (см., например, Gazzano-Santoro и др., J Immunol Methods 202, 1996, с. 163; Cragg и др., Blood 101, 2003, сс. 1045-1052 и Cragg и Glennie, Blood 103, 2004, сс. 2738-2743).
Модификации Fc-домена, способствующие гетеродимеризации
Активирующие Т-клетку биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, содержат различные антигенсвязывающие фрагменты, слитые с одной или другой из двух субъединиц Fc-домена, при этом две субъединицы Fc-домена, как правило, содержатся в двух неидентичных полипептидных цепях. Рекомбинантная совместная экспрессия этих полипептидов и последующая димеризация приводит к нескольким возможным комбинациям двух полипептидов. Для повышения выхода и чистоты биспецифических антител, предлагаемых в изобретении, при их получении методами рекомбинации целесообразно интродуцировать в Fc-домен биспецифических антител, предлагаемых в изобретении, модификацию, которая способствует ассоциации требуемых полипептидов.
Таким образом, в конкретных вариантах осуществления изобретения Fc-домен биспецифических антител, предлагаемых в изобретении, содержит модификацию, которая способствует ассоциации первой и второй субъединиц Fc-домена. Сайт наиболее сильного белок-белкового взаимодействия двух субъединиц Fc-домена человеческого IgG находится в СН3-домене Fc-домена.
В конкретном варианте осуществления изобретения указанная модификация представляет собой, так называемую модификацию типа «knob-in-hole» (типа «выступ-впадина»), которая включает модификацию, приводящую к образованию «выступа» на одной из двух субъединиц Fc-домена и модификацию, приводящую к образованию «впадины» в другой одной из двух субъединиц Fc-домена. Технология «knob-into-hole» описана, например, в US №5731168; US №7695936; у Ridgway и др., Prot Eng 9, 1996, сс. 617-621 и Carter, J Immunol Meth 248, 2001, сс. 7-15.
В целом, метод включает интродукцию выпуклости («выступ») на поверхности раздела первого полипептида и соответствующей полости («впадина») в поверхности раздела второго полипептида, в результате выпуклость может помещаться в полость, способствуя тем самым образованию гетеродимера и препятствуя образованию гомодимера. Выпуклости конструируют путем замены аминокислот с небольшими боковыми цепями на поверхности раздела первого полипептида на аминокислоты с более крупными боковыми цепями (например, на тирозин или триптофан). Компенсирующие полости идентичного или сходного с выпуклостями размера создают в поверхности раздела второго полипептида путем замены аминокислот с крупными боковыми цепями на аминокислоты с менее крупными боковыми цепями (например, аланин или треонин).
Таким образом, в конкретном варианте осуществления изобретения в СН3-домене первой субъединицы Fc-домена биспецифических антител, предлагаемых в изобретении, аминокислотный остаток заменен аминокислотным остатком, который имеет больший объем боковой цепи, что приводит к образованию выпуклости в СН3-домене первой субъединицы, которая может помещаться в полость в СН3-домене второй субъединицы, и в СН3-домене второй субъединицы Fc-домена аминокислотный остаток заменен аминокислотным остатком, который имеет меньший объем боковой цепи, что приводит к образованию полости в СН3-домене второй субъединицы, в которую может помещаться выпуклость в СН3-домене первой субъединицы.
Выпуклость и полость можно создавать путем изменения нуклеиновых кислот, кодирующих полипептиды, например, с помощью сайтнаправленного мутагенеза или путем пептидного синтеза.
В конкретном варианте осуществления изобретения в СН3-домене первой субъединицы Fc-домена остаток треонина в положении 366 заменен остатком триптофана (T366W), и в СН3-домене второй субъединицы Fc-домена остаток тирозина в положении 407 заменен остатком валина (Y407V). В одном из вариантов осуществления изобретения во второй субъединице Fc-домена дополнительно остаток треонина в положении 366 заменен остатком серина (T366S) и остаток лейцина в положении 368 заменен остатком аланина (L368A).
В следующем варианте осуществления изобретения в первой субъединице Fc-домена дополнительно остаток серина в положении 354 заменен остатком цистеина (S354C) и во второй субъединице Fc-домена дополнительно остаток тирозина в положении 349 заменен остатком цистеина (Y349C). Интродукция этих двух остатков цистеина приводит к образованию дисульфидного мостика между двумя субъединицами Fc-домена, дополнительно стабилизирующего димер (Carter, J Immunol Methods 248, 2001, cc. 7-15).
В альтернативном варианте осуществления изобретения модификация, способствующая ассоциации первой и второй субъединиц Fc-домена, представляет собой модификацию, которая опосредует определяемые электростатическим действием воздействия, например, описанные в WO 2009/089004. В целом, указанный метод включает замену одного или нескольких аминокислотных остатков на поверхности раздела двух субъединиц Fc-домена на заряженные аминокислотные остатки, в результате чего образование гомодимера становится электростатически невыгодным, а гетеродимеризация становится электростатически выгодной.
В одном из указанных выше вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, которая связывается с FolR1 и CD3, содержит молекулу иммуноглобулина G (IgG) с двумя сайтами связывания, специфическими в отношении FolR1, в которой Fc-область первой тяжелой цепи содержит первой модуль димеризации, а Fc-область второй тяжелой цепи содержит второй модуль димеризации, что обеспечивает гетердимеризацию двух тяжелых цепей молекулы IgG.
В другом предпочтительном варианте первой модуль димеризации содержит «выступы», а второй модуль димеризации содержит «впадины» в соответствии со стратегией «knobs -in-holes» (см. Carter P., Ridgway J.В.В, Presta L.G: Immunotechnology, т. 2, №1, февраль 1996 г., cc. 73-73(1)).
Биологические свойства и функциональные характеристики активирующих Т-клетки биспецифических антигенсвязывающих молекул
Специалисту в данной области должно быть очевидно, что молекула, обладающая способностью избирательно различать раковые и нераковые здоровые клетки, обладает преимуществом с точки зрения эффективности. Одним из путей достижения указанной цели является соответствующая направленная селекция. Маркеры, которые экспрессируются исключительно на опухолевых клетках, можно применять для избирательного нацеливания эффекторных молекул или клеток на опухолевые клетки, не затрагивая здоровые клетки, которые не экспрессируют такой маркер. Однако, в некоторых случаях так называемые маркеры опухолевых клеток экспрессируются также и в здоровой ткани, хотя и с более низкими уровнями. Такая экспрессия в здоровой ткани может вызывать токсичность. Таким образом, в данной области существует необходимость в молекулах, которые могут более избирательно нацеливаться на опухолевые клетки. В изобретении, представленном в настоящем описании, предложены активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые избирательно нацеливаются на FolR1-позитивные опухолевые клетки, а не на здоровые нераковые клетки, которые характеризуются низкими уровнями экспрессии FolR1 или полным отсутствием его экспрессии. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит по меньшей мере два, предпочтительно два, FolR1-связывающих фрагмента, обладающих относительно низкой аффинностью, что обеспечивает эффект авидности, который позволяет различать клетки с высоким и низким уровнем экспрессии FolR1. Поскольку опухолевые клетки характеризуются высоким или промежуточным уровнем экспрессии FolR1, то молекула, предлагаемая в этом варианте осуществления изобретения, избирательно связывается с опухолевыми клетками и/или индуцирует цитолиз опухолевых клеток, но не здоровых нераковых клеток, характеризующихся низкими уровнями экспрессии FolR1 или полным ее отсутствием. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула имеет формат «2+1 инвертированная». В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый Т-клеткой цитолиз FolR1-позитивных опухолевых клеток, но не неопухолевых клеток, и содержит связывающий антиген CD3 фрагмент, который содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и два связывающих антиген FolR1 фрагмента, каждый из которых содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54.
В одном конкретном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула не индуцирует цитолиз здоровых клеток, на поверхности которых присутствует менее чем примерно 1000 копий FolR1.
Помимо указанных выше предпочтительных характеристик в одном из вариантов осуществления изобретения для получения молекулы не требуется осуществлять химическим путем перекрестное сшивание или применять подход на основе гибридов. В соответствии с этим в одном из вариантов осуществления изобретения предложена активирующая Т-клетку биспецифическая антигенсвязывающая молекула, которая может продуцироваться в клетках СНО. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит гуманизированные и человеческие полипептиды. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула не приводит к перекрестному связыванию с FcgR. В одном из таких вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула может продуцироваться в клетках СНО и содержит связывающий антиген CD3 фрагмент, который содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и два связывающих антиген FolR1 фрагмента, каждый из которых содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54.
Как указано выше, в некоторых вариантах осуществления изобретения, представленных в настоящем описании, предложены активирующие Т-клетки биспецифические антигенсвязывающие молекулы, имеющие два связывающих фрагмента, которые обеспечивают специфическое связывание с FolR1, и один связывающий фрагмент, который обеспечивает специфичность в отношении активирующего Т-клетку антигена CD3, где каждый индивидуальный связывающий FolR1 фрагмент характеризуется низкой аффинностью к антигену. Но, тем не менее, поскольку молекула содержит два антигенсвязывающих фрагмента, которые обеспечивают связывание с FolR1, то общая авидность молекулы обеспечивает эффективное связывание с экспрессирующими FolR1 клетками-мишенями и активацию Т-клеток для индукции Т-клеточной эффекторной функции. Учитывая, что хотя FolR1 экспрессируется в различных уровнях на опухолевых клетках, он экспрессируется также в очень малых уровнях (например, в количестве менее чем 1000 копий/поверхность клетки) в определенных здоровых клетках, специалист в данной области легко может понять, что такая молекула обладает преимуществом с точки зрения эффективности при применении в качестве терапевтического агента. Такая молекула избирательно нацеливается на опухолевые клетки по сравнению со здоровыми клетками. Таким образом, указанную молекулу можно вводить индивидууму, нуждающемуся в этом, с меньшим опасением касательно токсичности в отношении FolR1-позитивных здоровых клеток по сравнению с молекулами, которые связываются с FolR1 с высокой аффинностью, индуцируя эффекторную функцию.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1 с кажущейся величиной KD, составляющей от примерно 5,36 пМ до примерно 4 нМ. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1 и FolR1 обезьян циномолгус с кажущейся величиной KD, составляющей примерно 4 нМ. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с мышиным FolR1 с кажущейся величиной KD, составляющей примерно 1,5 нМ. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1 с величиной KD, характеризующей одновалентное связывание, составляющей по меньшей мере примерно 1000 нМ. В конкретном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с человеческим FolR1 и FolR1 обезьян циномолгус с кажущейся величиной KD, составляющей примерно 4 нМ, связывается с мышиным FolR1 с кажущейся величиной KD, составляющей примерно 1,5 нМ, и содержит связывающий антиген CD3 фрагмент, который содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и два связывающих антиген FolR1 фрагмента, каждый из которых содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула связывается с FolR1 с величиной KD, характеризующей одновалентное связывание, составляющей по меньшей мере примерно 1000 нМ, и содержит связывающий антиген CD3 фрагмент, который содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и два связывающих антиген FolR1 фрагмента, каждый из которых содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54.
Как указано выше, активирующие Т-клетки биспецифические антигенсвязывающие молекулы, представленные в настоящем описании, могут индуцировать Т-клеточную эффекторную функцию, например, экспрессию маркера клеточной поверхности, производство цитокинов, опосредуемый Т-клеткой цитолиз. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый Т-клеткой цитолиз экспрессирующей FolR1 клетки-мишени, такой как человеческая опухолевая клетка, in vitro. В одном из вариантов осуществления изобретения Т-клетка представляет собой CD8-позитивную Т-клетку. Примеры экспрессирующих FolR1 человеческих опухолевых клеток включают (но, не ограничиваясь только ими) клетки Hela, Skov-3, НТ-29 и HRCEpiC. Специалисту в данной области легко доступны и другие FolR1-позитивные человеческие раковые клетки, которые можно применять для тестирования in vitro. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый Т-клеткой цитолиз экспрессирующих FolR1 человеческих опухолевых клеток in vitro с величиной ЕС50, составляющей от примерно 36 пМ до примерно 39573 пМ, через 24 ч. Конкретно предложены активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые индуцируют опосредуемый Т-клеткой цитолиз экспрессирующей FolR1 опухолевой клетки in vitro с величиной ЕС50, составляющей примерно 36 пМ, через 24 ч. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула индуцирует опосредуемый Т-клеткой цитолиз экспрессирующей FolR1 опухолевой клетки in vitro с величиной ЕС50, составляющей примерно 178,4 пМ, через 24 ч. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула опосредуемый Т-клеткой цитолиз экспрессирующей FolR1 опухолевой клетки in vitro с величиной ЕС50, составляющей примерно 134,5 пМ или более, через 48 ч. Величину ЕС50 можно измерять методами, известными в данной области, например, методами, которые представлены в настоящем описании в разделе «Примеры».
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в любом из представленных выше вариантах осуществления изобретения, индуцирует повышающую регуляцию экспрессии на поверхности Т-клетки по меньшей мере одного из CD25 и CD69 по данным измерений с помощью проточной цитометрии. В одном из вариантов осуществления изобретения Т-клетка представляет собой CD4-позитивную Т-клетку или CD8-позитивную Т-клетку.
В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в любом из представленных выше вариантов осуществления изобретения, связывается с FolR1, экспрессируемым на человеческой опухолевой клетке. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в любом из представленных выше вариантов осуществления изобретения, связывается с конформационным эпитопом на человеческом FolR1. В одном из вариантов осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула, предлагаемая в любом из представленных выше вариантов осуществления изобретения, не связывается с человеческим фолатным рецептором 2 (FolR2) или с человеческим фолатным рецептором 3 (FolR3). В одном из вариантов активирующей Т-клетку биспецифической антигенсвязывающей молекулы, предлагаемой в любом из представленных выше вариантов осуществления изобретения, антигенсвязывающий фрагмент связывается с полипептидом FolR1, содержащим аминокислоты с 25 по 234 человеческого FolR1 (SEQ ID NO: 227). В одном из вариантов активирующей Т-клетку биспецифической антигенсвязывающей молекулы, предлагаемой в любом из представленных выше вариантов осуществления изобретения, связывающий антиген FolR1 фрагмент связывается с полипептидом FolR1, содержащим аминокислотную последовательность SEQ ID NO: 227, 230 и 231, связывающий антиген FolR1 фрагмент не связывается с полипептидом FolR, содержащим аминокислотную последовательность SEQ ID NO: 228 и 229. В одном конкретном варианте осуществления изобретения активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит связывающий антиген FolR1 фрагмент, который связывается с полипептидом FolR1, содержащим аминокислотные последовательности SEQ ID NO: 227, 230 и 231, и при этом связывающий антиген FolR1 фрагмент не связывается с полипептидом FolR, содержащим аминокислотную последовательность SEQ ID NO: 228 и 229, и содержит связывающий антиген CD3 фрагмент, который содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 37, CDR2 тяжелой цепи, имеющий SEQ ID NO: 38, CDR3 тяжелой цепи, имеющий SEQ ID NO: 39, CDR1 легкой цепи, имеющий SEQ ID NO: 32, CDR2 легкой цепи, имеющий SEQ ID NO: 33, и CDR3 легкой цепи, имеющий SEQ ID NO: 34, и два связывающих антиген FolR1 фрагмента, каждый из которых содержит CDR1 тяжелой цепи, имеющий SEQ ID NO: 8, CDR2 тяжелой цепи, имеющий SEQ ID NO: 9, CDR3 тяжелой цепи, имеющий SEQ ID NO: 50, CDR1 легкой цепи, имеющий SEQ ID NO: 52, CDR2 легкой цепи, имеющий SEQ ID NO: 53, и CDR3 легкой цепи, имеющий SEQ ID NO: 54.
В отношении FolR1 активирующие Т-клетку биспецифические антигенсвязывающие молекулы, представленные в настоящем описании, могут обладать агонистическим, антагонистическим или нейтральным действием. Примеры агонистического действия включают индукцию или усиление передачи сигнала через FolR1 после контакта связывающего FolR1 фрагмента с рецептором FolR1 на клетке-мишени. Примеры антагонистической активности включают аннулирование или снижение передачи сигнала через FolR1 после контакта связывающего FolR1 фрагмента с рецептором FolR1 на клетке-мишени. Это может, например, иметь место в результате блокады или ослабления взаимодействия фолата с FolR1.
Примеры связывающихся с осью PD-1 антагонистов, предназначенных для применения согласно изобретению
В изобретении предложены способы лечения или замедления развития рака у индивидуума, включающий введение индивидууму в эффективном количестве активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антагониста, связывающегося с осью PD-1. К антагонистам, связывающимся с осью PD-1, относятся, например, антагонист, связывающийся с PD-1, антагонист, связывающийся с PD-L1, и антагонист, связывающийся с PD-L2.
Альтернативные обозначения «PD-1» включают CD279 и SLEB2.
Альтернативные обозначения «PD-L1» включают В7-Н1, В7-4, CD274 и В7-Н.
Альтернативные обозначения «PD-L2» включают B7-DC, Btdc и CD273. В некоторых вариантах осуществления изобретения PD-1, PD-L1 и PD-L2 представляют собой человеческие PD-1, PD-L1 и PD-L2.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой молекулу, которая ингибирует связывание PD-1 с его партнерами по связыванию, такими как лиганды. В конкретном объекте изобретения лиганды для PD-1, представляющие собой партнеров по связыванию, представляют собой PD-L1 и/или PD-L2. В другом вариант осуществления изобретения антагонист, связывающийся с PD-L1, представляет собой молекулу, которая ингибирует связывание PD-L1 с его партнерами по связыванию. В конкретном объекте изобретения партнерами по связыванию PDL1 являются PD-1 и/или В7-1. В другом варианте осуществления изобретения антагонист, связывающийся с PDL2, представляет собой молекулу, которая ингибирует связывание PD-L2 с его партнерами по связыванию. В конкретном объекте изобретения партнером по связыванию PD-L2 является PD-1. Антагонист может представлять собой антитело, его антигенсвязывающий фрагмент, иммуноадгезин, слитый белок или олигопептид.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой антитело к PD-1 (например, человеческое антитело, гуманизированное антитело или химерное антитело). В некоторых вариантах осуществления изобретения антитело к PD-1 выбирают из группы, включающей ниволумаб, пембролизумаб и СТ-011. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой иммуноадгезин (например, иммуноадгезин, который содержит внеклеточную или связывающую PD-L1 или PD-L2 область PD-1, слитую с константной областью (например, Fc-область последовательности иммуноглобулина). В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой АМР-224. Ниволумаб, который известен также как MDX-1106-04, MDX-1106, ONO-4538, BMS-936558, и OPDIVO®, представляет собой антитело к PD-1, описанное в WO 2006/121168. Пембролизумаб, который известен также как МК-3475, Merck 3475, ламбролизумаб, KEYTRUDA® и SCH-900475, представляет собой антитело к PD-1, описанное в WO 2009/114335. СТ-011, который известен также как hBAT или hBAT-1, представляет собой антитело к PD-1, описанное в WO 2009/101611. АМР-224, который известен также как B7-DCIg, представляет собой слитый растворимый рецептор PD-L2-Fc, описанный в WO 2010/027827 и WO 2011/066342.
В некоторых вариантах осуществления изобретения антитело к PD-1 представляет собой ниволумаб (регистрационный номер CAS: 946414-94-4). Следующим вариантом осуществления изобретения является выделенное антитело к PD-1, которое содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 274, и/или вариабельную область легкой цепи, содержащую аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 275. Следующим вариантом осуществления изобретения является выделенное антитело к PD-1, содержащее последовательность тяжелой цепи и/или легкой цепи, в котором:
(а) последовательность тяжелой цепи по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности тяжелой цепи:
QVQLVESGGGVVQPGRSLRLDCKASGITFSNSGMHWVRQAPGKGLEWVAVIWYDGSKRYYADSVKGRFTISRDNSKNTLFLQMNSLRAEDTAVYYCATNDDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPE VQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO: 274), или
(б) последовательность легкой цепи по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности легкой цепи:
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 275).
В некоторых вариантах осуществления изобретения антитело к PD-1 представляет собой пембролизумаб (регистрационный номер CAS: 1374853-91-4). Следующим вариантом осуществления изобретения является выделенное антитело к PD-1, которое содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 276 и/или вариабельную область легкой цепи, содержащую аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 277. Следующим вариантом осуществления изобретения является выделенное антитело к PD-1, содержащее последовательность тяжелой цепи и/или легкой цепи, в котором:
(а) последовательность тяжелой цепи по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности тяжелой цепи:
QVQLVQSGVEVKKPGASVKVSCKASGYTFTNYYMYWVRQAPGQGLEWMGGINPSNGGTNFNEKFKNRVTLTTDSSTTTAYMELKSLQFDDTAVYYCARRDYRFDMGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKS LSLSLGK (SEQ ID NO: 276), или
(б) последовательность легкой цепи по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности легкой цепи: EIVLTQSPATLSLSPGERATLSCRASKGVSTSGYSYLHWYQQKPGQAPRLLIYLASYLESGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQHSRDLPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 277).
В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, представляет собой антитело к PD-L1. В некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-L1, выбирают из группы, включающей YW243.55.S70, MPDL3280A, MDX-1105 и MEDI4736. MDX-1105, известный также как BMS-936559, представляет собой антитело к PD-L1, описанное в WO 2007/005874. Антитело YW243.55.S70 (последовательности вариабельных областей тяжелой и легкой цепи представлены в SEQ ID NO: 20 и 21 соответственно) представляет собой антитело к PD-L1, описанное в WO 2010/077634 A1. MEDI4736 представляет собой антитело к PD-L1, описанное в WO 2011/066389 и US 2013/034559, каждый документ полностью включен в настоящее описание в качестве ссылки.
Примеры антител к PD-L1, которые можно применять в способах, предлагаемых в настоящем изобретении, и методы их получения описаны в публикации РСТ WO 2010/077634 А1 и US №8217149, каждый документ полностью включен в настоящее описание в качестве ссылки.
В некоторых вариантах осуществления изобретения антагонист, связывающийся с осью PD-1, представляет собой антитело к PD-L1. В некоторых вариантах осуществления изобретения антитело к PD-L1 может ингибировать связывание между PD-L1 и PD-1 и/или между PD-L1 и В7-1. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой моноклональное антитело. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab-, Fab'-SH-, Fv-, scFv- и (Fab')2-фрагментов. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения антитело к PD-L1 представляет собой человеческое антитело.
Антитела к PD-L1, которые можно применять согласно настоящему изобретению, включая композиции, содержащие указанные антитела, такие как описанные в WO 2010/077634 А1, можно применять в комбинации с активирующей Т-клетку антигенсвязывающей молекулой и необязательно антагонистическим антителом к TIM3 для лечения рака. В некоторых вариантах осуществления изобретения антитело к PD-L1 содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 382, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 383.
В одном из вариантов осуществления изобретения антитело к PD-L1 содержит полипептид вариабельной области тяжелой цепи, который содержит последовательности HVR-H1, HVR-H2 и HVR-H3, где:
(а) последовательность HVR-H1 представляет собой GFTFSX1SWIH (SEQ ID NO: 283);
(б) последовательность HVR-H2 представляет собой AWIX2PYGGSX3YYADSVKG (SEQ ID NO: 284);
(в) последовательность HVR-H3 представляет собой RHWPGGFDY (SEQ ID NO: 285);
в которых также: X1 обозначает D или G; Х2 обозначает S или L; Х3 обозначает Т или S.
В одном из конкретных объектов изобретения X1 обозначает D; Х2 обозначает S и Х3 обозначает Т. В другом объекте изобретения полипептид дополнительно содержит последовательности каркасных участков вариабельной области тяжелой цепи, расположенные между HVR согласно формуле: (НС-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVRH3)-(HC-FR4). Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. В другом объекте изобретения последовательности каркасных участков относятся к подгруппе III VH консенсусного каркасного участка. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка представляет собой:
HC-FR1: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 295),
HC-FR2: WVRQAPGKGLEWV (SEQ ID NO: 296),
HC-FR3: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 297),
HC-FR4: WGQGTLVTVSA (SEQ ID NO: 298).
Согласно следующему объекту изобретения полипептид тяжелой цепи объединен также с вариабельной областью легкой цепи, содержащей HVR-L1, HVR-L2 и HVR-L3, где:
(а) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO: 286);
(б) последовательность HVR-L2 представляет собой SASX9LX10S (SEQ ID NO: 287);
(в) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T (SEQ ID NO: 288),
в которых также: Х4 обозначает D или V; Х5 обозначает V или I; Х6 обозначает S или N; Х7 обозначает А или F; Х8 обозначает V или L; Х9 обозначает F или Т; X10 обозначает Y или А; X11 обозначает Y, G, F или S; Х12 обозначает L, Y, F или W; X13 обозначает Y, N, А, Т, G, F или I; X14 обозначает Н, V, Р, Т или I; X15 обозначает A, W, R, Р или Т.
В следующем объекте изобретения Х4 обозначает D; Х5 обозначает V; Х6 обозначает S; Х7 обозначает А; Х8 обозначает V; Х9 обозначает F; X10 обозначает Y; X11 обозначает Y; X12 обозначает L; X13 обозначает Y; X14 обозначает Н; X15 обозначает А. В другом объекте изобретения легкая цепь дополнительно содержит последовательности каркасных участков вариабельной области легкой цепи, расположенные между HVR согласно формуле: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LCFR4).
Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. Еще в одном объекте изобретения последовательности каркасных участков относятся к консенсусному каркасному участку VL каппа I. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка представляет собой:
LC-FR1: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 300),
LC-FR2: WYQQKPGKAPKLLIY (SEQ ID NO: 301),
LC-FR3: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 302),
LC-FR4: FGQGTKVEIKR (SEQ ID NO: 303).
Другим вариантом осуществления изобретения является выделенное антитело к PDL1 или антигенсвязывающий фрагмент, которое/который содержит последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(а) тяжелая цепь содержит HVR-H1, HVR-H2 и HVR-H3 и при этом:
(I) последовательность HVR-H1 представляет собой GFTFSX1SWIH (SEQ ID NO: 283),
(II) последовательность HVR-H2 представляет собой AWIX2PYGGSX3YYADSVKG (SEQ ID NO: 284),
(III) последовательность HVR-H3 представляет собой RHWPGGFDY (SEQ ID NO: 285),
(б) легкая цепь содержит HVR-L1, HVR-L2 и HVR-L3 и при этом:
(I) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO: 286),
(II) последовательность HVR-L2 представляет собой SASX9LX10S (SEQ ID NO: 287),
(III) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T (SEQ ID NO: 288),
в которых также: X1 обозначает D или G; Х2 обозначает S или L; Х3 обозначает Т или S; Х4 обозначает D или V; Х5 обозначает V или I; Х6 обозначает S или N; Х7 обозначает А или F; Х8 обозначает V или L; Х9 обозначает F или Т; X10 обозначает Y или А; X11 обозначает Y, G, F или S; X12 обозначает L, Y, F или W; X13 обозначает Y, N, А, Т, G, F или I; X14 обозначает Н, V, Р, Т или I; X15 обозначает A, W, R, Р или Т.
Согласно конкретному объекту изобретения X1 обозначает D; Х2 обозначает S и Х3 обозначает Т. В другом объекте изобретения Х4 обозначает D; Х5 обозначает V; Х6 обозначает S; Х7 обозначает А; Х8 обозначает V; Х9 обозначает F; Х10 обозначает Y; X11 обозначает Y; Х12 обозначает L; Х13 обозначает Y; X14 обозначает Н; X15 обозначает А. В следующем объекте изобретения X1 обозначает D; Х2 обозначает S и Х3 обозначает Т, Х4 обозначает D; Х5 обозначает V; Х6 обозначает S; Х7 обозначает А; Х8 обозначает V; Х9 обозначает F; Х10 обозначает Y; X11 обозначает Y; Х12 обозначает L; X13 обозначает Y; Х14 обозначает Н и X15 обозначает А.
Согласно следующему объекту изобретения вариабельная область тяжелой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. В другом объекте изобретения последовательности каркасных участков тяжелой цепи относятся к подгруппе I, II или III согласно Кэботу. В другом объекте изобретения последовательности каркасных участков тяжелой цепи относятся к подгруппе III VH консенсусного каркасного участка. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка тяжелой цепи представляет собой:
HC-FR1: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 295),
HC-FR2: WVRQAPGKGLEWV (SEQ ID NO: 296),
HC-FR3: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 297),
HC-FR4: WGQGTLVTVSA (SEQ ID NO: 298).
Еще в одном объекте изобретения последовательности каркасных участков легкой цепи получают из последовательности подгруппы каппа I, II, II или IV по Кэботу. В следующем объекте изобретения последовательности каркасного участка легкой цепи относятся к консенсусному каркасному участку VL каппа I. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка легкой цепи представляет собой:
LC-FR1: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 300),
LC-FR2: WYQQKPGKAPKLLIY (SEQ ID NO: 301),
LC-FR3: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 302),
LC-FR4: FGQGTKVEIKR (SEQ ID NO: 303).
кусок
В следующем объекте изобретения антитело содержит также человеческую или мышиную константную область. Еще в одном объекте изобретения человеческую константную область выбирают из группы, состоящей из константных областей IgG1, IgG2, IgG2, IgG3, IgG4. В следующем конкретном объекте изобретения человеческая константная область соответствует константной области IgG1. Еще в одном объекте изобретения мышиную константную область выбирают из группы, состоящей из константных областей IgG1, IgG2A, IgG2B, IgG3. В следующем объекте изобретения мышиная константная область соответствует константной области IgG2A. Еще в одном конкретном объекте изобретения антитело обладает пониженной или минимальной эффекторной функцией. В другом конкретном объекте изобретения минимальная эффекторная функция является результатом мутации Fc, приводящей к снижению эффекторной функции («effectorless»-мутация Fc), или агликозилирования. В следующем варианте осуществления изобретения «effectorless»-мутация Fc представляет собой замену N297A или D265A/N297A в константной области.
Другим вариантом осуществления изобретения является антитело к PDL1, которое содержит последовательности вариабельной области тяжелой цепи и легкой цепи, в котором:
(а) тяжелая цепь содержит также последовательности HVR-H1, HVR-H2 и HVRH3, последовательности которых идентичны по меньшей мере на 85% последовательностям GFTFSDSWIH (SEQ ID NO: 289), AWISPYGGSTYYADSVKG (SEQ ID NO: 290) и RHWPGGFDY (SEQ ID NO: 291) соответственно, или
(б) легкая цепь содержит также последовательности HVR-L1, HVR-L2 и HVR-L3, последовательности которых идентичны по меньшей мере на 85% последовательностям RASQDVSTAVA (SEQ ID NO: 292), SASFLYS (SEQ ID NO: 293) и QQYLYHPAT (SEQ ID NO: 294) соответственно.
В конкретном объекте изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Согласно следующему объекту изобретения вариабельная область тяжелой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (НС-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. В другом объекте изобретения последовательности каркасных участков тяжелой цепи получают из последовательности подгруппы I, II или III согласно Кэботу. В другом объекте изобретения последовательность каркасного участка тяжелой цепи относится к подгруппе III VH консенсусного каркасного участка. Еще в одном объекте изобретения одна или несколько последовательностей каркасного участка тяжелой цепи представляет собой:
HC-FR1: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 295),
HC-FR2: WVRQAPGKGLEWV (SEQ ID NO: 296),
HC-FR3: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 297),
HC-FR4: WGQGTLVTVSA (SEQ ID NO: 298).
Еще в одном объекте изобретения последовательности каркасных участков легкой цепи получают из последовательности подгруппы каппа I, II, II или IV по Кэботу. В следующем объекте изобретения последовательности каркасного участка легкой цепи относятся к консенсусному каркасному участку VL каппа I. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка легкой цепи представляет собой:
LC-FR1: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 300),
LC-FR2: WYQQKPGKAPKLLIY (SEQ ID NO: 301),
LC-FR3: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 302),
LC-FR4: FGQGTKVEIKR (SEQ ID NO: 303).
В следующих конкретных объектах изобретения антитело содержит также человеческую или мышиную константную область. В следующем объекте изобретения человеческую константную область выбирают из группы, состоящей из константных областей IgG1, IgG2, IgG2, IgG3, IgG4. Еще в одном конкретном объекте изобретения человеческая константная область соответствует константной области IgG1. Еще в одном объекте изобретения мышиную константную область выбирают из группы, состоящей из константных областей IgG1, IgG2A, IgG2B, IgG3. В следующем объекте изобретения мышиная константная область соответствует константной области IgG2A. Еще в одном конкретном объекте изобретения антитело обладает пониженной или минимальной эффекторной функцией. В другом конкретном объекте изобретения минимальная эффекторная функция является результатом мутации Fc, приводящей к снижению эффекторной функции («effectorless»-мутация Fc) или агликозилирования. В следующем варианте осуществления изобретения «effectorless»-мутация Fc представляет собой замену N297A или D265A/N297A в константной области.
Другим вариантом осуществления изобретения является выделенное антитело к PD-L1, которое содержит последовательности вариабельной области тяжелой цепи и легкой цепи, в котором:
(а) тяжелая цепь содержит последовательность, которая по меньшей мере на 85% идентична последовательности тяжелой цепи:
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSA (SEQ ID NO: 382), или
(б) легкая цепь содержит последовательность, которая по меньшей мере на 85% идентична последовательности легкой цепи:
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR (SEQ ID NO: 383).
В конкретном объекте изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Согласно следующему объекту изобретения вариабельная область тяжелой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (НС-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. В другом объекте изобретения последовательности каркасных участков тяжелой цепи получают из последовательности подгруппы I, II или III согласно Кэботу. В другом объекте изобретения последовательность каркасного участка тяжелой цепи относится к подгруппе III VH консенсусного каркасного участка. Еще в одном объекте изобретения одна или несколько последовательностей каркасного участка тяжелой цепи представляет собой:
HC-FR1: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 295),
HC-FR2: WVRQAPGKGLEWV (SEQ ID NO: 296),
HC-FR3: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 297),
HC-FR4: WGQGTLVTVSA (SEQ ID NO: 298).
Еще в одном объекте изобретения последовательности каркасных участков легкой цепи получают из последовательности подгруппы каппа I, II, II или IV по Кэботу. В следующем объекте изобретения последовательности каркасного участка легкой цепи относятся к консенсусному каркасному участку VL каппа I. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка легкой цепи представляет собой:
LC-FR1: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 300),
LC-FR2: WYQQKPGKAPKLLIY (SEQ ID NO: 301),
LC-FR3: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 302),
LC-FR4: FGQGTKVEIKR (SEQ ID NO: 303).
В следующих конкретных объектах изобретения антитело содержит также человеческую или мышиную константную область. В следующем объекте изобретения человеческую константную область выбирают из группы, состоящей из константных областей IgG1, IgG2, IgG2, IgG3, IgG4. Еще в одном конкретном объекте изобретения человеческая константная область соответствует константной области IgG1. Еще в одном объекте изобретения мышиную константную область выбирают из группы, состоящей из константных областей IgG1, IgG2A, IgG2B, IgG3. В следующем объекте изобретения мышиная константная область соответствует константной области IgG2A. Еще в одном конкретном объекте изобретения антитело обладает пониженной или минимальной эффекторной функцией. В следующем объекте изобретения минимальная эффекторная функция является результатом получения в прокариотических клетках. В другом конкретном объекте изобретения минимальная эффекторная функция является результатом мутации Fc, приводящей к снижению эффекторной функции («effectorless»-мутация Fc), или агликозилирования. В следующем варианте осуществления изобретения «effectorless»-мутация Fc представляет собой замену N297A или D265A/N297A в константной области.
Другим вариантом осуществления изобретения является выделенное антитело к PDL1, которое содержит последовательности вариабельной области тяжелой цепи и легкой цепи, в котором:
(а) тяжелая цепь содержит последовательность, которая по меньшей мере на 85% идентична последовательности тяжелой цепи:
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSS (SEQ ID NO: 280), или
(б) легкая цепь содержит последовательность, которая по меньшей мере на 85% идентична последовательности легкой цепи:
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR (SEQ ID NO: 383).
Еще одним вариантом осуществления изобретения является выделенное антитело к PDL1, которое содержит последовательности вариабельной области тяжелой цепи и легкой цепи, в котором:
(а) тяжелая цепь содержит последовательность, которая по меньшей мере на 85% идентична последовательности тяжелой цепи:
EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSSASTK (SEQ ID NO: 281), или
(б) легкая цепь содержит последовательность, которая по меньшей мере на 85% идентична последовательности легкой цепи:
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKR (SEQ ID NO: 282).
В конкретном объекте изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Согласно следующему объекту изобретения вариабельная область тяжелой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (НС-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. В другом объекте изобретения последовательности каркасных участков тяжелой цепи получают из последовательности подгруппы I, II или III согласно Кэботу. В другом объекте изобретения последовательность каркасного участка тяжелой цепи относится к подгруппе III VH консенсусного каркасного участка. Еще в одном объекте изобретения одна или несколько последовательностей каркасного участка тяжелой цепи представляет собой:
HC-FR1: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 295),
HC-FR2: WVRQAPGKGLEWV (SEQ ID NO: 296),
HC-FR3: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 297),
HC-FR4: WGQGTLVTVSS (SEQ ID NO: 299).
Еще в одном объекте изобретения последовательности каркасных участков легкой цепи получают из последовательности подгруппы каппа I, II, II или IV по Кэботу. В следующем объекте изобретения последовательности каркасного участка легкой цепи относятся к консенсусному каркасному участку VL каппа I. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка легкой цепи представляет собой:
LC-FR1: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 300),
LC-FR2: WYQQKPGKAPKLLIY (SEQ ID NO: 301),
LC-FR3: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 302),
LC-FR4: FGQGTKVEIKR (SEQ ID NO: 303).
В следующих конкретных объектах изобретения антитело содержит также человеческую или мышиную константную область. В следующем объекте изобретения человеческую константную область выбирают из группы, состоящей из константных областей IgG1, IgG2, IgG2, IgG3, IgG4. Еще в одном конкретном объекте изобретения человеческая константная область соответствует константной области IgG1. Еще в одном объекте изобретения мышиную константную область выбирают из группы, состоящей из константных областей IgG1, IgG2A, IgG2B, IgG3. В следующем объекте изобретения мышиная константная область соответствует константной области IgG2A. Еще в одном конкретном объекте изобретения антитело обладает пониженной или минимальной эффекторной функцией. В следующем объекте изобретения минимальная эффекторная функция является результатом получения в прокариотических клетках. В другом конкретном объекте изобретения минимальная эффекторная функция является результатом мутации Fc, приводящей к снижению эффекторной функции («effectorless»-мутация Fc) или агликозилирования. В следующем варианте осуществления изобретения «effectorless»-мутация Fc представляет собой замену N297A или D265A/N297A в константной области.
В другом варианте осуществления изобретения антитело к PD-L1 представляет собой MPDL3280A (регистрационный номер CAS: 1422185-06-5). Следующим вариантом осуществления изобретения является выделенное антитело к PD-L1, которое содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 24 или SEQ ID NO: 28, и/или вариабельную область легкой цепи, содержащую аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 21. Следующим вариантом осуществления изобретения является выделенное антитело к PD-L1, содержащее последовательность тяжелой цепи и/или легкой цепи, в котором:
(а) последовательность тяжелой цепи по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности тяжелой цепи: EVQLVESGGGLVQPGGSLRLSCAASGFTFSDSWIHWVRQAPGKGLEWVAWISPYGGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARRHWPGGFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYASTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO: 278), или
(б) последовательность легкой цепи по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична последовательности легкой цепи: DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 279).
Следующим вариантом осуществления изобретения являются композиции, содержащее любое из описанных выше антител к PDL1 в сочетании по меньшей мере с одним фармацевтически приемлемым носителем.
Другим вариантом осуществления изобретения является выделенная нуклеиновая кислота, которая кодирует последовательность вариабельной области легкой цепи или тяжелой цепи антитела к PDL1 в котором:
(а) тяжелая цепь содержит также последовательности HVR-H1, HVR-H2 и HVRH3, идентичные по меньшей мере на 85% последовательности GFTFSDSWIH (SEQ ID NO: 289), AWISPYGGSTYYADSVKG (SEQ ID NO: 290) и RHWPGGFDY (SEQ ID NO: 291) соответственно, и
(б) легкая цепь содержит также последовательности HVR-L1, HVR-L2 и HVR-L3, идентичные по меньшей мере на 85% последовательности RASQDVSTAVA (SEQ ID NO: 292), SASFLYS (SEQ ID NO: 293) и QQYLYHPAT (SEQ ID NO: 294) соответственно.
В конкретном объекте изобретения идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Согласно следующему объекту изобретения вариабельная область тяжелой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR следующим образом: (НС-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или несколько последовательностей каркасных участков, расположенных между HVR, следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). Еще в одном объекте изобретения последовательности каркасных участков получают из последовательностей человеческих консенсусных каркасных участков. В другом объекте изобретения последовательности каркасных участков тяжелой цепи получают из последовательности подгруппы I, II или III согласно Кэботу. В другом объекте изобретения последовательность каркасного участка тяжелой цепи относится к подгруппе III VH консенсусного каркасного участка. Еще в одном объекте изобретения одна или несколько последовательностей каркасного участка тяжелой цепи представляет собой:
HC-FR1: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 295),
HC-FR2: WVRQAPGKGLEWV (SEQ ID NO: 296),
HC-FR3: RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 297),
HC-FR4: WGQGTLVTVSA (SEQ ID NO: 298).
Еще в одном объекте изобретения последовательности каркасных участков легкой цепи получают из последовательности подгруппы каппа I, II, II или IV по Кэботу. В следующем объекте изобретения последовательность каркасного участка легкой цепи относится к консенсусному каркасному участку VL каппа I. Еще в одном объекте изобретения по меньшей мере одна из последовательностей каркасного участка легкой цепи представляет собой:
LC-FR1: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 300),
LC-FR2: WYQQKPGKAPKLLIY (SEQ ID NO: 301),
LC-FR3: GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 302),
LC-FR4: FGQGTKVEIKR (SEQ ID NO: 303).
В следующих конкретных объектах изобретения антитело, указанное в настоящем описании (такое как антитело к PD-1, антитело к PDL1 или антитело к PDL2), содержит также человеческую или мышиную константную область. В следующем объекте изобретения человеческую константную область выбирают из группы, состоящей из константных областей IgG1, IgG2, IgG2, IgG3, IgG4. Еще в одном конкретном объекте изобретения человеческая константная область соответствует константной области IgG1. Еще в одном объекте изобретения мышиную константную область выбирают из группы, состоящей из константных областей IgG1, IgG2A, IgG2B, IgG3. В следующем объекте изобретения мышиная константная область соответствует константной области IgG2A. Еще в одном конкретном объекте изобретения антитело обладает пониженной или минимальной эффекторной функцией. В следующем объекте изобретения минимальная эффекторная функция является результатом получения в прокариотических клетках. В другом конкретном объекте изобретения минимальная эффекторная функция является результатом мутации Fc, приводящей к снижению эффекторной функции («effectorless»-мутация Fc) или агликозилирования. В следующем варианте осуществления изобретения «effectorless»-мутация Fc представляет собой замену N297A или D265A/N297A в константной области.
Другим объектом изобретения являются нуклеиновые кислоты, которые кодируют любое из антител, указанных в настоящем описании. В некоторых вариантах осуществления изобретения нуклеиновая кислота содержится также в векторе, пригодном для экспрессии нуклеиновой кислоты, которая кодирует описанные выше антитела к PDL1, к PD-1 или к PDL2. В еще одном конкретном объекте изобретения вектор содержится также в клетке-хозяине, пригодной для экспрессии нуклеиновой кислоты. В другом конкретном объекте изобретения клетка-хозяин представляет собой эукариотическую клетку или прокариотическую клетку. В следующем конкретном объекте изобретения эукариотическая клетка представляет собой клетку млекопитающего, такую как клетка яичника китайского хомячка (СНО).
Антитело или его антигенсвязывающий фрагмент можно получать методами, известными в данной области, например, с помощью процесса, включающего культивирование клетки-хозяина, которая содержит нуклеиновую кислоту, кодирующую любое из указанных выше антител к PDL1, к PD-1 или к PDL2, или их антигенсвязывающий фрагмент, в форме, пригодной для экспрессии, в условиях, в которых можно получать указанное антитело или фрагмент, и выделение антитела или фрагмента.
В некоторых вариантах осуществления изобретения выделенное антитело к PDL1 является агликозилированным.
Гликозилирование антител, как правило, бывает либо N-связанным, либо О-связанным. N-связанное гликозилирование относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, в которых X обозначает любую аминокислоту кроме пролина, представляют собой распознаваемые последовательности для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров, таких как N-ацетилгалактозамин, галактоза или ксилоза, к гидроксиаминокислоте, наиболее часто к серину или треонину, хотя можно использовать также 5-гидроксипролин или 5-гидроксилизин. Удаление сайтов гликозилирования из антитела, как правило, сопровождается изменением аминокислотной последовательности, таким как удаление одной из вышеуказанных трипептидных последовательностей (в случае N-связанных сайтов гликозилирования). Изменение можно осуществлять путем замены остатка аспарагина, серина или треонина в сайте гликозилирования на другой аминокислотный остаток (например, глицин, аланин или консервативная замена).
В любом из указанных выше вариантов осуществления изобретения выделенное антитело к PD-L1 может связываться с человеческим PD-L1, например, человеческим PD-L1, который имеет код доступа UniProtKB/Swiss-Prot. №Q9NZQ7.1, или его вариантом.
Еще одним вариантом осуществления изобретения является композиция, которая содержит указанное в настоящем описании антитело к PD-L1, к PD-1 или к PD-L2 или его антигенсвязывающий фрагмент, и по меньшей мере один фармацевтически приемлемый носитель. В некоторых вариантах осуществления изобретения антитело к PD-L1, к PD-1 или к PD-L2 или его антигенсвязывающий фрагмент, которые вводят индивидууму, находятся в составе композиции, которая содержит один или несколько фармацевтически приемлемых носителей.
Можно применять любые фармацевтически приемлемые носители, указанные в настоящем описании или известные в данной области.
В некоторых вариантах осуществления изобретения антитело к PD-L1, указанное в настоящем описании, находится в препаративной форме, которая содержит антитело в количестве примерно 60 мг/мл, ацетат гистидина в концентрации примерно 20 мМ, сахарозу в концентрации примерно 120 мМ и полисорбат (например, полисорбат 20) в концентрации 0,04% (мас./об.), и препаративная форма имеет рН примерно 5,8. В некоторых вариантах осуществления изобретения антитело к PD-L1, указанное в настоящем описании, находится в препаративной форме, которая содержит антитело в количестве примерно 125 мг/мл, ацетат гистидина в концентрации примерно 20 мМ, сахарозу в концентрации примерно 240 мМ и полисорбат (например, полисорбат 20) в концентрации 0,02% (мас./об.), и препаративная форма имеет рН примерно 5,5.
Примеры антагонистов к TIM3, которые можно применять согласно изобретению
В настоящем описании предложны способы лечения или замедления развития рака у индивидуума, включающие введение индивидууму в эффективном количестве активирующей Т-клетку биспецифической антигенсвязывающей молекулы, антагониста, связывающегося с осью PD-1, и антагониста TIM3. В одном из вариантов осуществления изобретения антагонист TIM3 представляет собой антитело к TIM3. В некоторых вариантах осуществления изобретения антитело к TIM3 индуцирует интернализацию TIM3, экспрессируемого на клетках, по меньшей мере на уровне 45% через 120 мин при 37°С по данным, полученным с помощью FACS-анализа. Клетка представляет собой, например, RPMI8226-клетки (АТСС® CCL-155™). В одном из вариантов осуществления изобретения антитело индуцирует интернализацию TIM3 на экспрессирующих TIM3 RPMI8226-клетках (АТСС® CCL-155™) по меньшей мере на уровне 55% через 120 мин при 37°С по данным, полученным с помощью FACS-анализа. В одном из вариантов осуществления изобретения антитело индуцирует интернализацию TIM3 на экспрессирующих TIM3 RPMI8226-клетках (АТСС® CCL-155™) по меньшей мере на уровне 60% через 240 мин при 37°С по данным, полученным с помощью FACS-анализа. В одном из вариантов осуществления изобретения антитело индуцирует интернализацию TIM3 на экспрессирующих TIM3 RPMI8226-клетках (АТСС® CCL-155™) по меньшей мере на уровне 65% через 240 мин при 37°С по данным, полученным с помощью FACS-анализа.
В некоторых вариантах осуществления изобретения антитело к TIM3 конкурирует за связывание с TIM3 с антителом к Tim3, которое содержит VH и VL антитела Tim3_0016. В некоторых вариантах осуществления изобретения антитело к TIM3 связывается с TIM3 человека и обезьян циномолгус.В некоторых вариантах осуществления изобретения антитело к TIM3 проявляет в виде иммуноконъюгата цитотоксическую активность на экспрессирующих TIM3 клетках. В одном из указанных вариантов осуществления изобретения иммуноконъюгат имеет относительную величину IC50, характеризующую цитотоксическую активность в виде конъюгата с экзотоксином A Pseudomonas в отношении RPMI-8226-клеток, составляющую 0,1 или менее. В одном из вариантов осуществления изобретения антитело к TIM3 индуцирует высвобождение интерферона-гамма по данным MLR-анализа.
В некоторых вариантах осуществления изобретения антитело к TIM3 связывается с TIM3 человека и обезьян циномолгус и индуцирует высвобождение интерферона-гамма по данным MLR-анализа.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 306; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; или HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 307; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 314; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 304, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 305, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 306; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 315; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 308, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 309.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 310 и VL-последовательность SEQ ID NO: 311;
II) VH-последовательность SEQ ID NO: 312 и VL-последовательность SEQ ID NO: 313;
III) или гуманизированный вариант VH и VL антитела, указанного в подпункте I) или II).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 316; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 317; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 318; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 319; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 320; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 321.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 316; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 317; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 318; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 319; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 320; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 321.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 316, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 317, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 318; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 319; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 320, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 321.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 316, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 317, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 318; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 319; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 320, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 321.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 322 и VL-последовательность SEQ ID NO: 323;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 324; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 325; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 326; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 327; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 328; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 329.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 324; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 325; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 326; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 327; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 328; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 329.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 324, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 325, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 326; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 327; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 328, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 329.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 324, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 325, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 326; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 327; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 328, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 329.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 330 и VL-последовательность SEQ ID NO: 331;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 332; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 333; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 334; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 335; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 336; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 337.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 332; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 333; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 334; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 335; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 336; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 337.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 332, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 333, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 334; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 335; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 336, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 337.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 332, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 333, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 334; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 335; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 336, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 337.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 338 и VL-последовательность SEQ ID NO: 339;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 340; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 341; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 342; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 343; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 344; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 345.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 340; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 341; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 342; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 343; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 344; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 345.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 340, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 341, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 342; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 343; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 344, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 345.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 340, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 341, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 342; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 343; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 344, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 345.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 346 и VL-последовательность SEQ ID NO: 347;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 348; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 349; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 350; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 351; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 352; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 353.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 348; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 349; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 350; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 351; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 352; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 353.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 348, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 349, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 350; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 351; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 352, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 353.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 348, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 349, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 350; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 351; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 352, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 353.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 354 и VL-последовательность SEQ ID NO: 355;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 356; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 357; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 358; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 359; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 360; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 361.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 356; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 357; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 358; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 359; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 360; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 361.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 356, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 357, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 358; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 359; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 360, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 361.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 356, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 357, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 358; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 359; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 360, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 361.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 362 и VL-последовательность SEQ ID NO: 363;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В одном из вариантов осуществления изобретения антитело к TIM3 содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 364; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 365; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 366; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 367; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 368; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 369.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 364; (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 365; (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 366; (г) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 367; (д) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 368; и (е) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 369.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VH, выбранные из (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 364, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 365, и (III) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 366; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности HVR VL, выбранные из (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 367; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 368, и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 369.
В одном из вариантов осуществления изобретения антитело к TIM3 содержит (а) VH-домен, содержащий (I) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 364, (II) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 365, и (III) HVR-H3, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 366; и (б) VL-домен, содержащий (I) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 367; (II) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 368, и (III) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 369.
В одном из вариантов осуществления изобретения указанное антитело к TIM3 содержит:
I) VH-последовательность SEQ ID NO: 370 и VL-последовательность SEQ ID NO: 371;
II) или гуманизированный вариант VH и VL антитела, указанного в подпункте I).
В любом из указанных выше вариантов осуществления изобретения антитело к TIM3 является гуманизированным. В одном из вариантов осуществления изобретения антитело к TIM3 содержит HVR, указанные в любом из приведенных выше вариантов осуществления изобретения, и дополнительно содержит акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок. В другом варианте осуществления изобретения антитело к TIM3 содержит HVR, указанные в любом из приведенных выше вариантов осуществления изобретения, и дополнительно содержит VH и VL, содержащие указанные HVR. В другом объекте изобретения антитело к TIM3 связывается с таким же эпитопом, что и антитело к TIM3, представленное в настоящем описании. Например, в некоторых вариантах осуществления изобретения антитело к TIM3 связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH- последовательность SEQ ID NO: 310 и VL-последовательность SEQ ID NO: 311, или антитело к TIM3 связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 312 и VL-последовательность SEQ ID NO: 313, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 322 и VL-последовательность SEQ ID NO: 323, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 330 и VL-последовательность SEQ ID NO: 331, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 338 и VL-последовательность SEQ ID NO: 339, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 346 и VL-последовательность SEQ ID NO: 347, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 354 и VL-последовательность SEQ ID NO: 355, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 362 и VL-последовательность SEQ ID NO: 363, или предложено антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 370 и VL-последовательность SEQ ID NO: 371. Одним из предпочтительных вариантов осуществления изобретения является антитело, которое связывается с таким же эпитопом, что и антитело к TIM3, содержащее VH-последовательность SEQ ID NO: 310 и VL-последовательность SEQ ID NO: 311.
В одном из вариантов осуществления изобретения антитело к TIM3 конкурирует за связывание с человеческим TIM3 с антителом к TIM3, которое содержит VH-последовательность SEQ ID NO: 310 и VL-последовательность SEQ ID NO: 311, по данным анализа в условиях конкуренции с использованием экспрессирующих TIM3 RPMI-8226-клеток (АТСС® CCL-155™).
В одном из вариантов осуществления изобретения антитело к TIM3, указанное в любом из приведенных выше вариантов осуществления изобретения, представляет собой моноклональное антитело, включая химерное, гуманизированное или человеческое антитело. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой фрагмент антитела, такой, например, как Fv-, Fab-, Fab'-, scFv-фрагмент, димерное антитело или F(ab')2-фрагмент.В другом варианте осуществления изобретения антитело представляет собой полноразмерное антитело, например, интактное антитело изотипа IgG1 или IgG4 или антитело другого класса или изотипа, указанного в настоящем описании.
В другом объекте изобретения антитело к TIM3, указанное в любом из приведенных выше вариантов осуществления изобретения, может обладать любой особенностью, индивидуально или в сочетании, указанной в настоящем описании.
В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой любое из антител, указанных в WO 2011/155607, WO 2013/006490, WO 03/063792, WO 2009/097394 или WO 2011/159877. В одном из вариантов осуществления изобретения антитело к TIM3 представляет собой F38-2E2. В некоторых вариантах осуществления изобретения антитела к TIM3 представляют собой антитела из гибридом 8 В.2С12 и 25F.1D6 и их получают согласно методам, описанным в заявках на патент США №№2004/0005322 и 2005/0191721, у Sabatos С.А. и др., Nature Immunol. 4, 2003, сс. 1102-1110 и Sanchez-Fueyo А. и др., Nature Immunol. 4, 2003, сс. 1093-1101, которые все полностью включены в настоящее описание в качестве ссылки. Под объем изобретения подпадают другие специфические в отношении TIM3 антитела и антитела, которые можно получать, например, методами, указанными в настоящем описании. Нуклеотидные и белковые последовательности человеческого TIM3 можно получать из Genbank, код доступа AF251707.1 и Uniprot, код доступа Q8TDQ0. Приведенная в качестве примера аминокислотная последовательность человеческого TIM3 представлена в SEQ ID NO: 380; приведенная в качестве примера аминокислотная последовательность внеклеточного домена человеческого TIM3 представлена в SEQ ID NO: 381.
Получение антител
Как указано выше, в некоторых вариантах осуществления изобретения антагонист, связывающийся с PD-1, представляет собой антитело (например, антитело к PD-1, антитело к PD-L1 или антитело к PD-L2). В некоторых вариантах осуществления изобретения антагонист TIM3 представляет собой антитело (например, антагонистическое антитело к TIM3). Антитела, указанные в настоящем описании, можно получать с использованием методик, известных в данной области для создания антител, например, методов, которые описаны более подробно в приведенных ниже разделах.
Антитело направлено против представляющего интерес антигена. Например, антитело может быть направлено против PD-1 (такого как человеческий PD-1), PD-L1 (такого как человеческий PD-L1), PD-L2 (такого как человеческий PD-L2), TIM3 (такого как человеческий TIM3). Предпочтительно антиген представляет собой биологически важный полипептид, и введение антитела млекопитающему, которое страдает нарушением, может приводить к терапевтической пользе для указанного млекопитающего.
В некоторых вариантах осуществления изобретения антитело, представленное в настоящем описании, имеет константу диссоциации (Kd), составляющую 1 мкМ, 150 нМ, 100 нМ, 50 нМ, 10 нМ, 1 нМ, 0,1 нМ, 0,01 нМ или 0,001 нМ ((например, 10-8 М или менее, например, от 10-8 до 10-13 М, например, от 10-9 М до 10-13 М).
В одном из вариантов осуществления изобретения Kd измеряют путем анализа связывания радиоактивномеченного антигена (РИА), используя версию Fab представляющего интерес антитела и его антиген, согласно следующему анализу. Аффинность связывания в растворе Fab к антигену измеряют путем уравновешивания Fab минимальной концентрацией (125I)-меченного антигена в присутствии полученных титрованием серий немеченого антигена, затем «захватывают» связанный антиген с использованием сенсибилизированного антителом к Fab планшета (см., например, Chen и др., J. Mol. Biol. 293, 1999, cc. 865-881). Для создания условий для анализа многолуночные планшеты MICROTITER® (фирма Thermo Scientific) сенсибилизируют в течение ночи 5 мкг/мл «захватывающего» антитела к Fab (фирма Cappel Labs) в 50 мМ карбонате натрия (рН 9,6) и затем блокируют 2% (мас./об.) бычьего сывороточного альбумина в ЗФР в течение 2-5 ч при комнатной температуре (примерно 23°С). В неадсорбирующем планшете (фирма Nunc, №269620) смешивают [125I]-антиген (100 пМ или 26 пМ) с серийными разведениями представляющего интерес Fab. Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно осуществлять и в течение более длительного периода (например, примерно 65 ч) для гарантии достижения равновесия. Затем смеси переносят в иммобилизующий («захватывающий») планшет для инкубации при комнатной температуре (например, в течение 1 ч). Затем раствор удаляют и планшет промывают 8 раз 0,1% полисорбатом 20 (TWEEN-20®) в ЗФР. Затем планшеты сушат, добавляют 150 мкл/лунку сцинтилляционной жидкости (MICROSCINT-20™; фирма Packard) и осуществляют подсчет содержимого планшетов с помощью счетчика гамма-лучей TOPCOUNT™ (фирма Packard) в течение 10 мин. Концентрации каждого Fab, при которых связывание ниже или равно 20% от максимального связывания, выбирают для применения в анализах связывания в условиях конкуренции.
Согласно другому варианту осуществления изобретения Kd измеряют с помощью анализов методом поверхностного плазмонного резонанса с использованием устройства BIACORE®-2000 или BIACORE®-3000 (фирма BIAcore, Inc., Пискатавей, шт. Нью-Джерси) при 25°С с использованием антигена, иммобилизованного на СМ5-чипах с уровнем иммобилизации, соответствующим ~ 10 единицам ответа (RU). В целом, метод состоит в следующем: биосенсорные чипы из карбоксиметилированного декстрана (СМ5, фирма BIACORE, Inc.) активируют с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям поставщика. Антиген разводят 10 мМ ацетатом натрия, рН 4,8 до концентрации 5 мкг/мл (~ 0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин для достижения уровня иммобилизации, соответствующего примерно 10 единицам ответа (RU) связанного белка. После инъекции антигена инъецируют 1М этаноламин для блокады непрореагировавших групп. Для кинетических измерений инъецируют двукратные серийные разведения (Fab) (от 0,78 до 500 нМ) в ЗФР, дополненном 0,05% полисорбата 20 (TWEEN-20™) в качестве сурфактанта (ЗФРТ), при 25°С со скоростью потока примерно 25 мкл/мин. Скорость реакции ассоциации (kon) и реакции диссоциации (koff) рассчитывают с использованием простой модели связывания Ленгмюра 1:1 (программное обеспечение BIACORE® Evaluation, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации.
Константу равновесия реакции диссоциации (Kd) рассчитывают как соотношение koff/kon (см., например, Chen и др., J Mol Biol 293, 1999, cc. 865-881). Если скорость реакции ассоциации превышает 106 М-1 с-1 при оценке с помощью описанного выше метода поверхностного плазмонного резонанса, то скорость реакции ассоциации можно определять с помощью метода гашения флуоресценции, который позволяет измерять повышение или снижение интенсивности излучения флуоресценции (длина волны возбуждения = 295 нм; длина волны испускания = 340 нм, полоса пропускания 16 нм) при 25°С применяемого в концентрации 20 нМ антитела к антигену (Fab-формат) в ЗФР, рН 7,2, в присутствии возрастающих концентраций антигена, осуществляя измерения с помощью спектрометра, такого как спектрофотометр, снабженный блоком для остановки потока (фирма Aviv Instruments), или спектрофотометр SLM-AMINCO™ серии 8000 (фирма ThermoSpectronic), при перемешивании содержимого кюветы.
В некоторых вариантах осуществления изобретения антитело TIM3, представленное в настоящем описании, характеризуется аффинностью связывания, составляющей по меньшей мере 100 пМ или менее в отношении человеческого TIM3, аффинностью связывания, составляющей по меньшей мере 300 пМ или менее в отношении человеческого TIM3, аффинностью связывания, составляющей по меньшей мере 400 пМ или менее в отношении человеческого TIM3, нейтрализующей способностью, составляющей по меньшей мере 40 нМ или менее в отношении человеческого TIM3, нейтрализующей способностью, составляющей по меньшей мере 120 нМ или менее в отношении человеческого TIM3, и нейтрализующей способностью, составляющей по меньшей мере 31 нМ или менее в отношении человеческого TIM3. В этих вариантах осуществления изобретения аффинность связывания можно измерять с помощью поверхностного плазмонного резонанса, описанного в US №8771697.
Фрагменты антител
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой фрагмент антитела. Фрагменты антитела представляют собой (но, не ограничиваясь только ими) Fab-, Fab'-, Fab'-SH-, F(ab')2-, Fv- и scFv-фрагменты и другие фрагменты, описанные ниже. Обзор конкретных фрагментов антител см. у Hudson и др., Nat. Med. 9, 2003, сс 129-134. Обзор scFv-фрагментов см, например, у  в: The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore (изд-во Springer-Verlag, New York), т. 113, 1994, сс. 269-315; см. также WO 93/16185 и US №№5571894 и 5587458. Обсуждение Fab- и F(ab')2-фрагментов, содержащих остатки эпитопа, связывающегося с рецептором «спасения», и обладающих удлиненным временем полужизни in vivo, см. в US №5869046.
в: The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore (изд-во Springer-Verlag, New York), т. 113, 1994, сс. 269-315; см. также WO 93/16185 и US №№5571894 и 5587458. Обсуждение Fab- и F(ab')2-фрагментов, содержащих остатки эпитопа, связывающегося с рецептором «спасения», и обладающих удлиненным временем полужизни in vivo, см. в US №5869046.
Димерные антитела (диабоди) представляют собой фрагменты антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или юниспецифическими (см., например, ЕР 404097; WO 1993/01161; Hudson и др., Nat. Med. 9, 2003, сс. 129-134 и Hollinger и др., Proc. Natl. Acad. Sci. USA 90, 1993, сс. 6444-6448). Тримерные антитело (триабоди) и тетрамерные антитела (тетрабоди) описаны также у Hudson и др. Nat. Med. 9, 2003, сс. 129-134. Одноцепочечные антитела представляют собой фрагменты антител, которые содержат весь вариабельный домен тяжелой цепи или его часть или вес вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления одноцепочечное антитело представляет собой человеческое одноцепочечное антитело (фирма Domantis, Inc., Валтам, шт.Массачусетс, см., например, US №6248516 В1).
Фрагменты антител можно получать различными методами, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с использованием рекомбинантных клеток-хозяев (например, Е. coli или фага), как указано в настоящем описании.
Химерные и гуманизированные антитела
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US №4816567 и у Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, сс. 6851-6855. В одном из примеров химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область из антитела мышей, крыс, хомяков, кроликов или приматов кроме человека, таких как обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело «переключенного класса», класс или подкласс которого изменен по сравнению с родительским антителом. К химерным антителам относятся также их антигенсвязывающие фрагменты. В некоторых вариантах осуществления изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для уменьшения иммуногенности для людей с сохранением специфичности и аффинности родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в котором(ых) HVR, например, CDR (или их фрагменты) выводят из нечеловеческого антитела, a FR (или их фрагменты) выводят из последовательностей человеческих антител. Гуманизированное антитело необязательно может содержать также по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления изобретения некоторые остатки FR в гуманизированном антителе заменяют на соответствующие остатки из нечеловеческого антитела (например, антитела, из которого выведены остатки HVR), например, для сохранения или повышения специфичности или аффинности антитела.
Сведения о гуманизированных антителах и методах их получения обобщены, например, у Almagro и Fransson, Front. Biosci. 13, 2008, сс. 1619-1633, и они описаны также, например, у Riechmann и др., Nature 332, 1988, сс. 323-329; Queen и др., Proc. Nat'l Acad. Sci. USA 86, 1989, сс. 10029-10033; US №№. 5821337, 7527791, 6982321 и 7087409; Jones и др., Nature 321, 1986, сс. 522-525; Morrison и др., Proc. Natl. Acad. Sci. 81, 1984, сс. 6851-6855; Morrison и Oi, Adv. Immunol. 44, 1988, сс. 65-92; Verhoeyen и др., Science 239, 1988, сс. 1534-1536; Padlan, Molec. Immun. 31(3), 1994, cc. 169-217; Kashmiri и др., Methods 36, 2005, cc. 25-34 (описание трансплантации SDR (a-CDR)); Padlan, Mol. Immunol. 28, 1991, cc. 489-498 (описание «нанесения нового покрытия»);  и др., Methods 36, 2005, cc. 43-60 (описание «перестановки FR»); и Osbourn и др., Methods 36, 2005, cc. 61-68 и у Klimka и др., Br. J. Cancer 83, 2000, cc. 252-260 (описание подхода на основе «целенаправленной селекции» для перестановки FR).
и др., Methods 36, 2005, cc. 43-60 (описание «перестановки FR»); и Osbourn и др., Methods 36, 2005, cc. 61-68 и у Klimka и др., Br. J. Cancer 83, 2000, cc. 252-260 (описание подхода на основе «целенаправленной селекции» для перестановки FR).
Человеческие каркасные участки, которые можно применять для гуманизации, включают (но, не ограничиваясь только ими): каркасные участки, выбранные на основе метода «наилучшего подбора» (см., например, Sims и др., J. Immunol. 151, 1993, с. 2296); каркасные участки, выведенные из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легких или тяжелых цепей (см., например, Carter и др., Proc. Natl. Acad. Sci. USA, 89, 1992, с. 4285; и Presta и др., J. Immunol., 151, 1993, с. 2623); человеческие зрелые (подвергнутые соматической мутации) каркасные участки или каркасные участки человеческой зародышевой линии (см., например, Almagro и Fransson, Front. Biosci. 13, 2008, cc. 1619-1633); и каркасные участки, полученные в результате скрининга FR-библиотек (см., например, Васа и др., J. Biol. Chem. 272, 1997, cc. 10678-10684) и Rosok и др., J. Biol. Chem. 271, 1996, cc. 22611-22618).
Человеческие антитела
В конкретных вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой человеческое антитело. Человеческие антитела можно получать различными методами, известными в данной области. Человечески антитела описаны в целом у van Dijk и van de Winkel, Curr. Opin. Pharmacol. 5, 2001, cc. 368-374 и Lonberg, Curr. Opin. Immunol. 20, 2008, cc. 450-459.
Человеческие антитела можно получать путем введения иммуногена трансгенному животному, которое модифицировано таким образом, что продуцирует интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном. Указанные животные, как правило, содержат все или часть локусов человеческого иммуноглобулина, которыми заменены эндогенные локусы иммуноглобулина, или которые присутствуют вне хромосом или интегрированы произвольно в хромосомы животного. У таких трансгенных мышей эндогенные локусы иммуноглобулина, как правило, инактивированы. Обзор методов получения человеческих антител в трансгенных животных см. у Lonberg, Nat. Biotech. 23, 2005, cc. 1117-1125. Они описаны также, например, в US №№6075181 и 6150584 в которых описана технология XENOMOUSE™; US №5770429, в котором описана технология HuMab®; US 7041870, в котором описана технология K-М MOUSE® и в публикации заявки на патент США №2007/0061900, в котором описана технология VelociMouse®. Человеческие вариабельные области интактных антител, полученные в таких животных, можно дополнительно модифицировать, например, объединяя с человеческой константной областью из другого антитела.
Человеческие антитела можно получать также с помощью методов, основанных на применении гибридом. Описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, предназначенные для получения человеческих моноклональных антител (см., например, Kozbor, J. Immunol., 133, 1984, с. 3001; Brodeur и др., Monoclonal Antibody Production Techniques and Applications, 1987, cc. 51-63 (изд-во Marcel Dekker, Inc., New York); и Boerner и др., J. Immunol., 147, 1991, c. 86). Человеческие антитела, созданные с помощью технологии, основанной на применении человеческих В-клеточных гибридом, описаны также у Li и др., Proc. Natl. Acad. Sci. USA, 103, 2006, cc. 3557-3562. Дополнительные методы представляют методы, описанные, например, в US №7189826 (описание получения моноклональных человеческих антител типа IgM из клеточных линий гибридом) и у Ni, Xiandai Mianyixue, 26(4), 2006, cc. 265-268 (описание человеческих-человеческих гибридом). Технология, основанная на применении человеческих гибридом (Trioma-технология), описана также у Vollmers и Brandlein, Histology and Histopathology, 20(3), 2005, cc. 927-937 и Vollmers и Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3), 2005, cc. 185-191.
Человеческие антитела можно создавать также путем выделения последовательностей вариабельных доменов Fv-клона, выбранных из фаговых дисплейных библиотек, для создания которых использовали человеческие антитела. Указанные последовательности вариабельных доменов затем можно объединять с требуемым человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
Полученные из библиотек антитела
Антитела, предлагаемые в изобретении, можно выделять путем скрининга комбинаторных библиотек антител с требуемой активностью или видами активности. Например, в данной области известны разнообразные методы для создания фаговых дисплейных библиотек и скрининга указанных библиотек в отношении антител, обладающих требуемыми характеристиками связывания. Указанные методы обобщены, например, у Hoogenboom и др., в: Methods in Molecular Biology, под ред.  и др., изд-во, Human Press, Totowa, NJ, 178, 2001, сс.1-37 и описаны также, например, у McCafferty и др., Nature 348, сс.552-554; Clackson и др., Nature 352, 1991, сс. 624-628; Marks и др., J. Mol. Biol. 222, 1992, сс. 581-597); Marks и Bradbury, в: Methods in Molecular Biology, под ред. Lo и др., изд-во, Human Press, Totowa, NJ, 248, 2003, сс. 161-175; Sidhu и др., J. Mol. Biol. 338(2), 2004, сс. 299-310; Lee и др., J. Mol. Biol. 340(5), 2004, cc. 1073-1093; Fellouse, Proc. Natl. Acad. Sci. USA 101(34), 2004, cc. 12467-12472; и Lee и др., J. Immunol. Methods 284(1-2), 2004, cc. 119-132.
и др., изд-во, Human Press, Totowa, NJ, 178, 2001, сс.1-37 и описаны также, например, у McCafferty и др., Nature 348, сс.552-554; Clackson и др., Nature 352, 1991, сс. 624-628; Marks и др., J. Mol. Biol. 222, 1992, сс. 581-597); Marks и Bradbury, в: Methods in Molecular Biology, под ред. Lo и др., изд-во, Human Press, Totowa, NJ, 248, 2003, сс. 161-175; Sidhu и др., J. Mol. Biol. 338(2), 2004, сс. 299-310; Lee и др., J. Mol. Biol. 340(5), 2004, cc. 1073-1093; Fellouse, Proc. Natl. Acad. Sci. USA 101(34), 2004, cc. 12467-12472; и Lee и др., J. Immunol. Methods 284(1-2), 2004, cc. 119-132.
При осуществлении некоторых методов фагового дисплея популяции VH- и VL-генов клонируют по отдельности с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют произвольно в фаговых библиотеках, которые затем подвергают скринингу в отношении антигенсвязывающего фага согласно методу, описанному у Winter и др., Ann. Rev. Immunol., 12, 1994, сс. 433-455. Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-фрагментов (scFv), либо в виде Fab-фрагментов. Библиотеки, полученные из иммунизированных источников, включают антитела, обладающие высокой аффинностью к иммуногену, при этом отсутствует необходимость в создании гибридом. В альтернативном варианте можно клонировать необработанную («наивную») популяцию (например, из организма человека), получая один источник антител к широкому спектру чужих, а также своих антигенов без какой-либо иммунизации, что описано у Griffiths и др., EMBO J, 12, 1993, сс.725-734. И, наконец, «наивные» библиотеки можно получать также методами синтеза путем клонирования неперегруппированных сегментов V-гена из стволовых клеток и с помощью ПЦР-праймеров, содержащих случайную последовательность, для кодирования гипервариабельных CDR3-участков и для осуществления перегруппировки in vitro согласно методу, описанному у Hoogenboom и Winter, J. Mol. Biol., 227, 1992, сс. 381-388. Фаговые библиотеки человеческих антител описаны, например, в следующих патентных публикациях: US №5750373 и публикации заявок на патент США №№2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, рассматриваются как человеческие антитела или фрагменты человеческих антител.
Мультиспецифические антитела
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые имеют специфичности, связывающиеся по меньшей мере с двумя различными сайтами. Их примерами являются активирующие Т-клетки биспецифические антигенсвязывающие молекулы, специфические в отношении FolR1 и CD3, указанные в настоящем описании. В некоторых вариантах осуществления изобретения антагонист компонента оси PD1 является мультиспецифическим. Одна из специфичностей связывается с компонентом оси PD-1 (например, PD-1, PD-L1 или PD-L2), а другая с любым другим антигеном. В некоторых вариантах осуществления изобретения одна из специфичностей связывается с IL-17 или IL-17R, а другая с любым другим антигеном. В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с различными эпитопами компонента оси PD-1 (например, PD-1, PD-L1 или PD-L2), IL-17 или IL-17R. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
В некоторых вариантах осуществления изобретения одна из специфичностей связывается с компонентом оси PD-1 (например, PD-1, PD-L1 или PD-L2), а другая с IL-17 или IL-17R. В настоящем описании предложены способы лечения или замедления развития рака у индивидуума, включающие введение индивидууму в эффективном количестве мультиспецифического антитела, где мультиспецифическое антитело содержит первую специфичность, связывающуюся с компонентом оси PD-1 (например, PD-1, PDL1 или PDL2), и вторую специфичность, связывающуюся с IL-17 или IL-17R. В некоторых вариантах осуществления изобретения мультиспецифические антитела можно получать с помощью любых методов, указанных выше и ниже в настоящем описании.
Методы создания мультиспецифических антител включают (но, не ограничиваясь только ими) рекомбинантную коэкспрессию двух пар тяжелая цепь - легкая цепь иммуноглобулина, которые обладают различными специфичностями (см. Milstein и Cuello, Nature 305, 1983, с. 537, WO 93/08829 и Traunecker и др., EMBO J. 10, 1991, с. 3655), и конструирование на основе технологии «knob-in-hole» (взаимодействие по типу выступ - во впадину) (см., например, US №5731168). Мультиспецифические антитела можно получать также путем создания обусловленных электростатическим действием эффектов для создания молекул антител с гетеродимерной Fc-областью (WO 2009/089004 А1); путем поперечного сшивания двух или большего количеств антител или их фрагментов (см., US №4676980 и Brennan и др., Science 229, 1985, с. 81); с использованием «лейциновых молний» для получения биспецифических антител (см., например, Kostelny и др., J. Immunol. 148(5), 1992, сс. 1547-1553); с использованием технологии «диабоди» для создания фрагментов биспецифических антител (см., например, Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, 1993, сс. 6444-6448); и с использованием димеров одноцепочечных Fv (scFv) (см., например, Gruber и др., J. Immunol., 152, 1994, с. 5368); и путем получения триспецифических антител согласно методу, описанному, например, у Tutt и др., J. Immunol. 147, 1991, с. 60.
Под объем настоящего изобретения подпадают также сконструированные антитела с тремя или большим количеством антигенсвязывающих сайтов, включая «антитела-осьминоги» (см., например, US 2006/0025576 А1).
Согласно настоящему описанию антитело или его фрагмент может включать также « Fab двойного действия» или «DAF», которые содержат антигенсвязывающий сайт, который связывается с компонентом оси PD-1 (например, PD-1, PD-L1 или PD-L2), IL-17 или IL-17R, а также с другим, отличным от него антигеном (см. например, US 2008/0069820).
В. Нуклеотидные последовательности, векторы и методы их получения Полинуклеотиды, кодирующие активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, например, активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, которая содержит первый антигенсвязывающий сайт, специфический для фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический для CD3, и антитела можно применять для получения активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антител, указанных в настоящем описании. Активирующую Т-клетку биспецифическую антигенсвязывающую молекулу и антитела, предлагаемые в изобретении, можно экспрессировать в виде индивидуального полинуклеотида, который кодирует полную биспецифическую антигенсвязывающую молекулу, или в виде нескольких (например, двух или большего количества) совместно экспрессируемых полинуклеотидов. Полипептиды, кодируемые совместно экспрессируемыми полинуклеотидами, можно соединять, например, через дисульфидные связи или другими путями с образованием функциональной активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антитела. Например, часть Fab-фрагмента, представляющая собой легкую цепь, может кодироваться полинуклеотидом, отличным от полинуклеотида, кодирующего часть биспецифического антитела или антитела, связывающегося с FolR1, которая содержит часть Fab-фрагмента, представляющую собой тяжелую цепь, субъединицу Fc-домена и необязательно (часть) другого Fab-фрагмента. При совместной экспрессии полипептиды тяжелой цепи должны связываться с полипептидами легкой цепи с образованием Fab-фрагмента. В другом примере часть активирующей Т-клетку биспецифической антиген связывающей молекулы или ее связывающая антиген FolR1 часть, указанная в настоящем описании, содержащая одну из двух субъединиц Fc-домена и необязательно один или несколько (часть одного или нескольких) Fab-фрагментов, может кодироваться полинуклеотидом, отличным от полинуклеотида, кодирующего часть биспецифического антитела или антитела, связывающуюся с FolR1, представленную в настоящем описании, содержащую вторую из двух субъединиц Fc-домена и необязательно (часть) Fab-фрагмента. При совместной экспрессии субъединицы Fc-домена должны связываться с образованием Fc-домена.
В некоторых вариантах осуществления изобретения полинуклеотид или нуклеиновая кислота представляет собой ДНК. В других вариантах осуществления изобретения полинуклеотид, предлагаемый в настоящем изобретении, представляет собой РНК, например, в форме матричной РНК (мРНК). РНК, предлагаемая в настоящем изобретении, может быть одноцепочечной или двухцепочечной.
Г. Варианты антител
В некоторых вариантах осуществления изобретения помимо описанных выше в настоящем изобретении предложены варианты аминокислотных последовательностей активирующей Т-клетку биспецифической антигенсвязывающей молекулы, специфической в отношении FolR1 и CD3, и антител. Например, может требоваться повышение аффинности связывания и/или других биологических свойств активирующей Т-клетку биспецифической антигенсвязывающей молекулы. Аминокислотные последовательности вариантов активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антитела можно получать путем интродукции соответствующих модификаций в нуклеотидную последовательность, кодирующую активирующую Т-клетку биспецифическую антигенсвязывающую молекулу или антитело, или путем пептидного синтеза. Указанные модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно использовать любую комбинацию делеций, инсерций и замен, при условии, что конечная конструкция обладает требуемыми характеристиками, например, способностью связываться с антигеном.
1. Варианты, полученные путем замены, инсерции и делеции
Конкретными вариантами осуществления изобретения являются варианты, которые имеют одну или несколько аминокислотных замен. Представляющими интерес сайтами для замещающего мутагенеза являются HVR и FR.
Консервативные замены представлены в таблице Б под заголовком «консервативные замены». Более общие замены представлены в таблице Б под заголовком «приведенные в качестве примера замены», и они дополнительно описаны ниже, со ссылкой на классы боковых цепей аминокислот. Аминокислотные замены можно интродуцировать в представляющее интерес антитело и продукты подвергать скринингу в отношении требуемой активности, например, в отношении сохранения/повышения способности к связыванию антигена, пониженной иммуногенности или улучшенной ADCC или CDC.
Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Один тип полученного в результате замены варианта включает замену одного или нескольких остатков в гипервариабельном участке родительского антитела (например, гуманизированного или человеческого антитела). Как правило, образовавшийся(еся) вариант(ы), выбранный(ые) для дальнейшего изучения, должен(ны) иметь модификации (например, улучшения) определенных биологических свойств (например, повышенная аффинность, пониженная иммуногенность) относительно родительского антитела и/или должен(ны) практически сохранять определенные биологические свойства родительского антитела. Примером полученного в результате замены варианта является антитело с созревшей аффинностью, которое можно легко получать, например, с помощью методов созревания аффинности на основе фагового дисплея, которые указаны в настоящем описании. В целом, метод состоит в следующем: один или несколько остатков HVR подвергают мутации и представляющие собой варианты антитела экспонируют на фаге и подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания).
Изменения (например, замены) можно осуществлять в HVR, например, для повышения аффинности антитела. Указанные изменения можно делать в «горячих (активных) точках» в HVR, т.е. остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации в процессе соматического мутагенеза (см., например, Chowdhury, Methods Mol. Biol. 207, 2008, cc. 179-196), и/или SDR (a-CDR), осуществляя оценку полученного варианта VH или VL в отношении аффинности связывания. Созревание аффинности путем создания и повторной селекции вторичных библиотек описано, например, у Hoogenboom и др., в: Methods in Molecular Biology, под ред.  и др., изд-во, Human Press, Totowa, NJ, 178, 2001, cc. 1-37. Согласно некоторым вариантам созревания аффинности вносят разнообразие в гены вариабельных областей, выбранные для созревания, с помощью любого из многочисленных методов (таких, например, как ПЦР пониженной точности, перестановка цепи или сайтнаправленный мутагенез с использованием олигонуклеотидов). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации любых вариантов антител с требуемой аффинностью. Другой метод внесения разнообразия включает подходы, связанные с HVR, при осуществлении которых рандомизируют несколько остатков в HVR (например, 4-6 остатков одновременно). Конкретные остатки HVR, участвующие в связывании антигена, можно специфически идентифицировать, например, с помощью аланин-сканирующего мутагенеза, или посредством моделирования. В частности, мишенями часто являются CDR-H3 и CDR-L3.
и др., изд-во, Human Press, Totowa, NJ, 178, 2001, cc. 1-37. Согласно некоторым вариантам созревания аффинности вносят разнообразие в гены вариабельных областей, выбранные для созревания, с помощью любого из многочисленных методов (таких, например, как ПЦР пониженной точности, перестановка цепи или сайтнаправленный мутагенез с использованием олигонуклеотидов). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации любых вариантов антител с требуемой аффинностью. Другой метод внесения разнообразия включает подходы, связанные с HVR, при осуществлении которых рандомизируют несколько остатков в HVR (например, 4-6 остатков одновременно). Конкретные остатки HVR, участвующие в связывании антигена, можно специфически идентифицировать, например, с помощью аланин-сканирующего мутагенеза, или посредством моделирования. В частности, мишенями часто являются CDR-H3 и CDR-L3.
Согласно некоторым вариантам осуществления изобретения замены, инсерции или делеции могут иметь место в одном или нескольких HVR, если указанные изменения не существенно снижают способность антитела связываться с антигеном. Например, в HVR можно осуществлять консервативные изменения (например, указанные в настоящем описании консервативные замены), которые не приводят к существенному снижению аффинности связывания. Указанные изменения могут находиться вне «горячих (активных) точек» HVR или SDR. В некоторых из описанных выше вариантов последовательностей VH и VL каждый HVR либо является неизмененным, либо содержит не более одной, двух или трех аминокислотных замен.
Ценным методом для идентификации остатков или участков антитела, которые можно подвергать мутагенезу, является метод, получивший называние «аланин-сканирующий мутагенез», он описан у Cunningham и Wells, Science, 244, 1989, сс. 1081-1085. При осуществлении этого метода идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для определения того, оказывает ли такая замена влияние на взаимодействие антитела с антигеном. В аминокислотные положения, для которых продемонстрирована функциональная чувствительность к начальным заменам, можно интродуцировать дополнительные замены. В альтернативном или дополнительном варианте может оказаться ценным анализировать кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Указанные участвующие в контакте остатки и соседние остатки можно рассматривать в качестве мишеней или исключать из рассмотрения в качестве кандидатов для замены. Варианты можно подвергать скринингу для определения, обладают ли они требуемыми свойствами.
Инсерции аминокислотных последовательностей включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примером результата осуществления терминальных инсерций является антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекулы антитела включают слияние N- или С-конца антитела с ферментом (как, например, в случае ADEPT (антитело-направленный фермент пролекарственной терапии) или с полипептидом, который удлиняет время полужизни антитела в сыворотке.
2. Варианты гликозилирования
В некоторых вариантах осуществления изобретения активирующую Т-клетку биспецифическую антигенсвязывающую молекулу или антитело, представленные в настоящем описании, изменяют с целью повышения или понижения степени гликозилирования антитела. Добавление или делецию сайтов гликозилирования в антителе можно легко осуществлять путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять один или несколько сайтов гликозилирования.
Если активирующая Т-клетку биспецифическая антигенсвязывающая молекула или антитело содержит Fc-область, то можно изменять присоединенный к ней углевод. Нативные антитела, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный биантенный олигосахарид, присоединенный с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright и др., TIBTECH 15, 1997, сс. 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения модификации олигосахарида в биспецифическом антителе или антителе, связывающемся с DR5, представленном в настоящем описании, можно осуществлять для создания вариантов с определенными улучшенными свойствами.
Одним из вариантов осуществления изобретения являются варианты биспецифического антитела или варианты антител, имеющие углеводную структуру, в которой снижено содержание фукозы, присоединенной (прямо или косвенно) к Fc-области. Например, содержание фукозы в указанном антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета среднего содержания фукозы в сахарной цепи на Asn297 относительно суммы всех гликоструктур, присоединенных к Asn 297 (например, комплексные, гибридные структуры и структуры с высоким содержанием маннозы), которое измеряют с помощью MALDI-TOF-масс-спектрометрии согласно методу, описанному, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, присутствующий примерно в положении 297 в Fc-области (EU-нумерация остатков Fc-области); однако вследствие минорных вариаций последовательности антитела Asn297 может располагаться также примерно на ±3 аминокислоты в прямом или обратном направлении относительно положения 297, т.е. между положениями 294 и 300. Указанные фукозилированные варианты могут обладать улучшенной ADCC-функцией (см., например, US 2003/0157108 (Presta L.); US 2004/0093621 (фирма Kyowa Hakko Kogyo Co., Ltd). Примерами публикаций, касающихся «дефукозилированных» вариантов антител или вариантов антител «с дефицитом фукозы» являются: US №2003/0157108; WO 2000/61739; WO 2001/29246; US №2003/0115614; US №2002/0164328; US №2004/0093621; US №2004/0132140; US №2004/0110704; US №2004/0110282; US №2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki и др., J. Mol. Biol. 336, 2004, cc. 1239-1249; Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, cc. 614-622). Примерами клеточных линий, которые обладают способностью продуцировать дефукозилированные антитела, являются Lec13 СНО-клетки с дефицитом белкового фукозилирования (Ripka и др., Arch. Biochem. Biophys. 249, 1986, сс. 533-545; заявка на патент США 2003/0157108 А1 (Presta L.) и WO 2004/056312 (Adams и др.) см., прежде всего, пример 11), и клеточные линии с «выключенным» геном, например, СНО-клетки с «выключенным» геном альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, с. 614-622); Kanda Y. и др., Biotechnol. Bioeng., 94(4), 2006, сс. 680-688; и WO 2003/085107).
Предложены также варианты активирующих Т-клетки биспецифических антигенсвязывающих молекул и варианты антител с бисекционными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области активирующей Т-клетку биспецифической антигенсвязывающей молекулы, связывающейся с FolR1, бисекционируется с помощью GlcNAc. Указанные варианты активирующей Т-клетку биспецифической антигенсвязывающей молекулы могут отличаться пониженным фукозилированием и/или повышенной ADCC-функцией. Примеры указанных вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet и др.); US №6602684 (Umana и др.); и US 2005/0123546 (Umana и др.). Предложены также варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Указанные варианты антител могут обладать повышенной CDC-функцией. Указанные варианты антител описаны, например, в WO 1997/30087 (Patel и др.); WO 1998/58964 (Raju S.) и WO 1999/22764 (Raju S.).
3. Варианты антител, сконструированные с использованием цистеина
В конкретных вариантах осуществления изобретения может оказаться желательным конструировать активирующие Т-клетки биспецифические антигенсвязывающие молекулы и антитела, с использованием цистеина, например, «тиоМАт»», в которых один или несколько остатков в активирующей Т-клетку биспецифической антигенсвязывающей молекуле заменены на остатки цистеина. В конкретных вариантах осуществления изобретения замененные остатки присутствуют в доступных сайтах активирующей Т-клетку биспецифической антигенсвязывающей молекулы. Путем замены указанных остатков на цистеин реактивные тиольные группы вносятся в доступные сайты антитела и могут использоваться для конъюгации антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкера - лекарственного средства, для создания иммуноконъюгата. В конкретных вариантах осуществления изобретения любой один или несколько следующих остатков можно заменять на цистеин: V205 (нумерации по Кэботу) легкой цепи; А118 (EU-нумерация) тяжелой цепи и S400 (EU-нумерация) Fc-области тяжелой цепи. Сконструированные с помощью цистеина антитела можно создавать, например, согласно методу, описанному в US №7521541.
Д. Методы рекомбинации и композиции
Активирующую Т-клетку биспецифическую антигенсвязывающую молекулу и антитела, предлагаемые в изобретении, можно получать, например, путем твердофазного пептидного синтеза (например, твердофазного синтеза Меррифилда) или методами рекомбинации. Для рекомбинантного получения один или несколько полинуклеотидов, кодирующих активирующую Т-клетку биспецифическую антигенсвязывающую молекулу или антитела (или фрагменты), например, описанные выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Указанный полинуклеотид легко выделять и секвенировать с помощью общепринятых процедур. Одним из вариантов осуществления изобретения является вектор, предпочтительно экспрессионный вектор, содержащий один или несколько полинуклеотидов, предлагаемых в изобретении. Методы, хорошо известные специалистам в данной области, можно применять для конструирования экспрессионных векторов, содержащих кодирующую последовательность активирующей Т-клетку биспецифической молекулы или антитела наряду с приемлемыми контролирующими транскрипцию/трансляцию сигналами. Эти методы включают технологии рекомбинантной ДНК in vitro, методы синтеза и in vivo рекомбинации/генетической рекомбинации (см., например, методы, описанные у Maniatis и др., Maniatis и др., Molecular Cloning A Laboratory Manual, изд-во Cold Spring Harbor Laboratory, N.Y., 1989; и Ausubel и др., Current Protocols in Molecular Biology, изд-во Greene Publishing Associates and Wiley Interscience, N.Y., 1989). Экспрессионный вектор может представлять собой часть плазмиды, вируса или может представлять собой фрагмент нуклеиновой кислоты. Экспрессионный вектор включает кассету экспрессии, в которой полинуклеотид, кодирующий активирующую Т-клетку биспецифическую антигенсвязывающую молекулу (фрагмент) или антитело (фрагмент) (т.е. кодирующую область), клонируют с обеспечением функциональной связи с промотором и/или другими элементами, контролирующими транскрипцию или трансляцию. В контексте настоящего описания «кодирующая область» представляет собой часть нуклеиновой кислоты, которая состоит из кодонов, транслируемых в аминокислоты. Хотя «стоп-кодон» (TAG, TGA или ТАА) не транслируется в аминокислоту, он, в случае его присутствия, может рассматриваться как часть кодирующей области, однако любые фланкирующие последовательности, например, промоторы, сайты связывания рибосом, терминаторы транскрипции, интроны, 5'- и 3'- нетранслируемые области и т.п., не являются частью кодирующей области. Две или большее количество кодирующих областей может присутствовать в индивидуальной полинуклеотидной конструкции, например, индивидуальном векторе, или в различных полинуклеотидных конструкциях, например, в различных (отдельных) векторах. Кроме того, любой вектор может содержать одну кодирующую область или может содержать две или большее количество кодирующих областей, например, вектор, предлагаемый в настоящем изобретении, может кодировать один или несколько полипептидов, которые пост- или котранляционно разделяются на конечные белки посредством протеолитического расщепления. Кроме того, вектор, полинуклеотид или нуклеиновая кислота, предлагаемый/предлагаемая в изобретении, может кодировать гетерологичные кодирующие области, либо слитые, либо не слитые с полинуклеотидом, который кодирует активирующую Т-клетку биспецифическую антигенсвязывающую молекулу (фрагмент) или антитело, или их вариант, или производное. Гетерологичные кодирующие области включают (но, не ограничиваясь только ими) специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен. Функциональная связь имеет место, когда кодирующая область генного продукта, например полипептида, ассоциирована с одной или несколькими регуляторными последовательностями таким образом, чтобы экспрессия генного продукта находилась под воздействием или контролем регуляторной(ых) последовательности(ей). Два ДНК-фрагмента (таких как кодирующая область полипептида и ассоциированный с ней промотор) являются «функционально связанными», если индукция промоторной функции приводит к транскрипции мРНК, кодирующей требуемый генный продукт, и если природа связи между двумя ДНК-фрагментами не оказывает воздействия на способность регулирующих экспрессию последовательностей направлять экспрессию генного продукта, или не оказывает воздействия на способность ДНК-матрицы к транскрипции. Таким образом, промоторная область должна быть функционально связана с нуклеиновой кислотой, кодирующей полипептид, если промотор обладает способностью осуществлять транскрипцию указанной нуклеиновой кислоты. Промотор может представлять собой специфический для клетки промотор, который обеспечивает значительную транскрипцию ДНК только в предварительно отобранных клетках.
Другие контролирующие транскрипцию элементы, помимо промотора, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, можно функционально связывать с полинуклеотидом для обеспечения специфической для клетки транскрипции. Приемлемые промоторы и другие контролирующие транскрипцию области представлены в настоящем описании. Специалистам в данной области известно широкое разнообразие контролирующих транскрипцию областей. Они включают (но, не ограничиваясь только ими) контролирующие транскрипцию области, которые функционируют в клетках позвоночных животных, такие как (но, не ограничиваясь только ими) сегменты промоторов и энхансеров из цитомегаловирусов (например, немедленно-ранний промотор в сочетании с интроном-А), обезьяньего вируса 40 (например, ранний промотор) и ретровирусов (таких как вирус саркомы Рауса). Другие контролирующие транскрипцию области включают области, выведенные из генов позвоночных животных, таких как ген актина, белка теплового шока, бычьего гормона роста и кроличьего β-глобина, а также другие последовательности, которые могут контролировать экспрессию генов в эукариотических клетках. Дополнительные приемлемые контролирующие транскрипцию области включают тканеспецифические промоторы и энхансеры, а также индуцибельные промоторы (например, промоторы, индуцируемые тетрациклином). Аналогично этому, обычным специалистам в данной области известно широкое разнообразие контролирующих трансляцию элементов. Они включают (но, не ограничиваясь только ими) сайты связывания рибосом, кодоны инициации трансляции и терминирующие кодоны и элементы, выведенные из вирусных систем (в частности, внутренний сайт связывания (посадки) рибосом или IRES, который обозначают также как CITE-последовательность). Кассета экспрессии может включать также другие характерные структуры, такие как сайт инициации репликации и/или интегрированные в хромосому элементы, такие как длинные концевые повторы (LTR) ретровирусов, или инвертированные концевые повторы (ITR) аденоассоциированного вируса (AAV).
Кодирующие области полинуклеотида и нуклеиновой кислоты, предлагаемые в настоящем изобретении, могут быть ассоциированы с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, которые направляют секрецию полипептида, кодируемого полинуклеотидом, предлагаемым в настоящем изобретении. Например, если требуется секреция активирующей Т-клетку биспецифической антигенсвязывающей молекулы или антитела, то ДНК, кодирующую сигнальную последовательность, можно помещать против хода транскрипции относительно нуклеиновой кислоты, кодирующей биспецифическое антитело, предлагаемое в изобретении, или антитело, связывающееся с DR5, предлагаемое в изобретении, или его фрагмент. Согласно гипотезе, касающейся сигналов, белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, который/которая отщепляется от зрелого белка после инициации экспорта растущей белковой цепи через шероховатый эндоплазматический ретикулум. Обычным специалистам в данной области должно быть очевидно, что полипептиды, секретируемые клетками позвоночных животных, как правило, имеют сигнальный пептид, слитый с N-концом полипептида, который отщепляется от транслируемого полипептида с образованием секретируемой или «зрелой» формы полипептида. В некоторых вариантах осуществления изобретения используют нативный сигнальный пептид, например, сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина или функциональное производное указанной последовательности, которое сохраняет способность обеспечивать секрецию полипептида, функционально связанного с ним. Альтернативно этому, можно применять гетерологичный сигнальный пептид млекопитающих или его функциональное производное. Например, лидерную последовательность дикого типа можно заменять на лидерную последовательность человеческого тканевого активатора плазминогена (TPA) или мышиной β-глюкуронидазы.
ДНК, кодирующую короткую белковую последовательность, которую можно применять для облегчения дальнейшей очистки (например, гистидиновую метку), или предназначенную для мечения активирующей Т-клетку биспецифической антигенсвязывающей молекулы можно включать внутрь или на концы полинуклеотида, кодирующего активирующую Т-клетку биспецифическцю антигенсвязывающую молекулу (фрагмент) или антитело (фрагмент).
Другим вариантом осуществления изобретения является клетка-хозяин, содержащая один или несколько полинуклеотидов, предлагаемых в изобретении. Некоторыми вариантами осуществления изобретения является клетка-хозяин, содержащая один или несколько векторов, предлагаемых в изобретении.
Полинуклеотиды и векторы могут обладать любыми особенностями, индивидуально или в сочетании, указанными в настоящем описании касательно полинуклеотидов и векторов соответственно. В одном из таких вариантов осуществления изобретения клетка-хозяин содержит вектор (например, трансформирована или трансфектирована им), содержащий полинуклеотид, который кодирует активирующую Т-клетку биспецифическую антигенсвязывающую молекулу или антитело, предлагаемую/предлагаемое в изобретении, или их фрагмент. В контексте настоящего описания понятие «клетка-хозяин» относится к любому типу клеточной системы, которую можно конструировать для получения активирующей Т-клетку биспецифической антигенсвязывающей молекулы, например, анти-FolR1 активирующих Т-клетки биспецифических антигенсвязывающих молекул, указанных в настоящем описании, или антител, например, антител к PD-1, антител к-PD-L1 и антител к TIM3, предлагаемых в изобретении, или их фрагментов. Клетки-хозяева, пригодные для репликации и для поддержания экспрессии активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антител, предлагаемых в изобретении, хорошо известны в данной области. Такие клетки можно трансфектировать или трансдуцировать соответствующим образом конкретным экспрессионным вектором и можно выращивать большее количество содержащих вектор клеток с целью внесения в ферментеры для крупномасштабных процессов получения активирующих Т-клетки биспецифических антигенсвязывающих молекул и антител, в достаточных для клинических применений количествах. Приемлемыми клетками-хозяевами являются прокариотические микроорганизмы, такие как Е. coli, или различные эукариотические клетки, такие как клетки яичника китайского хомячка (СНО), клетки насекомых или т.п. Например, полипептиды можно получать в бактериях, прежде всего в тех случаях, когда отсутствует потребность в гликозилировании. После экспрессии полипептид можно выделять из пасты бактериальных клеток в растворимой фракции и можно дополнительно очищать. Помимо прокариот в качестве хозяев для клонирования или экспрессии векторов, которые кодируют полипептид, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать полипептид с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, сс. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, сс. 210-215). Клетки-хозяева, которые можно использовать для экспрессии (гликозилированных) полипептидов, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные бакуловирусные штаммы и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda. В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях). В качестве хозяев можно применять также клетки позвоночных животных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная с помощью SV40 (COS-7); линия клеток почки эмбриона человека (293 или клетки линии 293, субклонированные с целью выращивания в суспензионной культуре, Graham и др., J. Gen. Virol., 36, 1977, с. 59); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая dhfr-CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, с. 4216); и клеточные линии миеломы, такие как Y0, NS0, Р3Х63 и Sp2/0 Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства белка, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.K.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 255-268. Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, клетки дрожжей, клетки насекомых, клетки бактерий и клетки растений (но не ограничиваясь только ими), а также клетки, находящиеся в организме трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, предпочтительно клетку млекопитающего, такую как клетка яичника китайского хомячка (СНО), клетку почки человеческого эмбриона (HEK) или лимфоидную клетку (например, клетку Y0, NS0, Sp20).
В данной области известны стандартные технологии для экспрессии чужеродных генов в этих системах. Клетки, экспрессирующие полипептид, содержащий либо тяжелую, либо легкую цепью антигенсвязывающего домена такой, как антитело, можно конструировать таким образом, чтобы в них происходила экспрессия также других цепей антитела, так, чтобы экспрессируемый продукт, представляя собой антитело, которое содержит как тяжелую, так и легкую цепь.
Любые виды антител, фрагментов антител, антигенсвязывающих доменов или вариабельных областей животного происхождения можно применять в активирующих Т-клетки биспецифических антигенсвязывающих молекулах, предлагаемых в изобретении. Примерами антител, фрагментов антител, антигенсвязывающих доменов или вариабельных областей, которые можно применять согласно настоящему изобретению, являются (но, не ограничиваясь только ими) конструкции, полученные из организма мышей, приматов или человека. Если активирующая Т-клетку биспецифическая антигенсвязывающая молекула предназначена для применения на человеке, то можно применять химерную форму антитела, в которой константные области антитела получают из человеческого антитела. Гуманизированную или полностью человеческую форму антитела можно получать также с помощью методов, хорошо известных в данной области (см., например, US №5565332 на имя Winter). Для осуществления гуманизации можно применять различные методы, такие как (но, не ограничиваясь только ими) (а) трансплантация нечеловеческих (например, из антитела-донора) CDR в человеческий (например, антитело-реципиент) каркасный участок и константные области, сохраняющие или не сохраняющие имеющие решающее значение остатки каркасного участка (например, остатки, важные для сохранения хорошей антигенсвязывающей аффинности или функций антитела), (б) трансплантация только нечеловеческих определяющих специфичность участков (SDR или a-CDR; остатки имеют решающее значение для взаимодействия антитело-антиген) в человеческий каркасный участок и константные области, или (в) трансплантация полных нечеловеческих вариабельных доменов, но их «маскировка» напоминающим человеческий сегментом путем замены поверхностных остатков. Обзор гуманизированных антител и методов их получения см., например, у Almagro и Fransson, Front Biosci 13, 12008, сс. 1619-1633, и они описаны также, например, у Riechmann и др., Nature 332, 1988, сс. 323-329; Queen и др., Proc Natl Acad Sci USA 86, 1989, cc. 10029-10033; U.S. №№5821337, 7527791, 6982321 и 7087409; Jones и др., Nature 321, 1986, cc. 522-525; Morrison и др., Proc Natl Acad Sci 81, 1984, cc. 6851-6855; Morrison и Oi, Adv Immunol 44, 1988, cc. 65-92; Verhoeyen и др., Science 239, 1988, cc. 1534-1536; Padlan, Molec Immun 31(3), 1994, cc. 169-217; Kashmiri и др., Methods 36, 2005, cc. 25-34) (описание трансплантации SDR (a-CDR)); Padlan, Mol Immunol 28, 1991, cc. 489-498 (описание метода «перекладки»);  и др., Methods 36, 2005, сс. 43-60 (описание метода «перестановки FR») и Osbourn и др., Methods 36, 2005, сс. 61-68, и Klimka и др., Br J Cancer 83, 2000, сс. 252-260 (описание подхода на основе «целенаправленной селекции» для перестановки FR). Человеческие антитела и человеческие вариабельные области можно получать с помощью различных методик, известных в данной области. Человеческие антитела описаны в целом у van Dijk и van de Winkel, Curr Opin Pharmacol 5, 2001, cc. 368-374 и Lonberg, Curr Opin Immunol 20, 2008, cc. 450-459. Человеческие вариабельные области могут образовывать часть человеческих моноклональных антител или могут быть получены из них с помощью метода гибридом (см., например, Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63). Человеческие антитела и человеческие вариабельные области можно получать также путем введения иммуногена трансгенному животному, которое модифицировано таким образом, что может продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном (см., например, Lonberg, Nat Biotech 23, 2005, cc. 1117-1125). Человеческие антитела и человеческие вариабельные области можно создавать также путем выделения последовательностей вариабельных областей Fv-клона, отобранных из человеческих фаговых дисплейных библиотек (см., например, Hoogenboom и др. в: Methods in Molecular Biology, под ред.
и др., Methods 36, 2005, сс. 43-60 (описание метода «перестановки FR») и Osbourn и др., Methods 36, 2005, сс. 61-68, и Klimka и др., Br J Cancer 83, 2000, сс. 252-260 (описание подхода на основе «целенаправленной селекции» для перестановки FR). Человеческие антитела и человеческие вариабельные области можно получать с помощью различных методик, известных в данной области. Человеческие антитела описаны в целом у van Dijk и van de Winkel, Curr Opin Pharmacol 5, 2001, cc. 368-374 и Lonberg, Curr Opin Immunol 20, 2008, cc. 450-459. Человеческие вариабельные области могут образовывать часть человеческих моноклональных антител или могут быть получены из них с помощью метода гибридом (см., например, Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63). Человеческие антитела и человеческие вариабельные области можно получать также путем введения иммуногена трансгенному животному, которое модифицировано таким образом, что может продуцировать интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном (см., например, Lonberg, Nat Biotech 23, 2005, cc. 1117-1125). Человеческие антитела и человеческие вариабельные области можно создавать также путем выделения последовательностей вариабельных областей Fv-клона, отобранных из человеческих фаговых дисплейных библиотек (см., например, Hoogenboom и др. в: Methods in Molecular Biology, под ред.  и др., изд-во Human Press, Totowa, NJ, 178, 2001, cc. 1-37); и McCafferty и др., Nature 348, 552-554; Clackson и др., Nature 352, 1991, cc. 624-628). Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv- (scFv)-фрагментов, либо в виде Fab-фрагментов.
и др., изд-во Human Press, Totowa, NJ, 178, 2001, cc. 1-37); и McCafferty и др., Nature 348, 552-554; Clackson и др., Nature 352, 1991, cc. 624-628). Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv- (scFv)-фрагментов, либо в виде Fab-фрагментов.
В некоторых вариантах осуществления изобретения антигенсвязывающие фрагменты, предлагаемые в настоящем изобретении, создают так, чтобы они обладали повышенной аффинностью связывания, например, с помощью методов, описанных в публикации заявки на патент США №2004/0132066, полное содержание которой включено в настоящее описание в качестве ссылки. Способность активирующей Т-клетку биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, связываться со специфической антигенной детерминантой, можно оценивать количественно либо с помощью твердофазного ферментного анализа (ELISA), либо другими методиками, известными специалисту в данной области, например, с помощью метода поверхностного плазмонного резонанса (осуществляя анализ с использованием системы BIACORE Т100) (Liljeblad и др., Glyco J 17, 2000, cc. 323-329), и традиционных анализов связывания (Heeley, Endocr Res 28, 2002, cc. 217-229). Анализы в условиях конкуренции (конкурентные анализы) можно применять для идентификации антитела, фрагмента антитела, антигенсвязывающего домена или вариабельного домена, конкурирующего с референс-антителом за связывание с конкретным антигеном, например, антитела, которое конкурирует с антителом V9 за связывание с CD3. В некоторых вариантах осуществления изобретения указанное конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается референс-антитело. Подробные приведенные в качестве примеров методы картирования эпитопа, с которым связывается антитело, представлены у Morris, «Epitope Mapping Protocols», в: Methods in Molecular Biology, изд-во Humana Press, Totowa, NJ, т. 66, 1996. При осуществлении приведенного в качестве примера анализа в условиях конкуренции иммобилизованный антиген (например, CD3) инкубируют в растворе, содержащем первое меченое антитело, которое связывается с антигеном (например, антитело V9), и вторым немеченым антителом, которое подлежит тестированию в отношении его способности конкурировать с первым антителом за связывание с антигеном. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный антиген инкубируют в растворе, содержащем первое меченое антитело, но не содержащем второе немеченое антитело. После инкубации в условиях, обеспечивающих связывание первого антитела с антигеном, избыток несвязанного антитела удаляют и оценивают количество метки, ассоциированной с иммобилизованным антигеном. Если количество метки, ассоциированной с иммобилизованным антигеном, существенно снижено в тестируемом образце по сравнению с контрольным образцом, то это свидетельствует о том, что второе антитело конкурирует с первым антителом за связывание с антигеном (см. Harlow и Lane. Antibodies: A Laboratory Manual, изд-во Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, гл. 14, 1988).
В некоторых вариантах осуществления изобретения антигенсвязывающие фрагменты, предлагаемые в настоящем изобретении, создают так, чтобы они обладали повышенной аффинностью связывания, например, с помощью методов, описанных в публикации заявки на патент США №2004/0132066, полное содержание которой включено в настоящее описание в качестве ссылки. Способность активирующей Т-клетку биспецифической антигенсвязывающей молекулы или антитела, предлагаемой/предлагаемого в изобретении, связываться со специфической антигенной детерминантой, можно оценивать количественно либо с помощью твердофазного ферментного анализа (ELISA), либо другими методиками, известными специалисту в данной области, например, с помощью метода поверхностного плазмонного резонанса (осуществляя анализ с использованием системы BIACORE Т100) (Liljeblad и др., Glyco J 17, 2000, cc. 323-329), и традиционных анализов связывания (Heeley, Endocr Res 28, 2002, cc. 217-229). Анализы в условиях конкуренции можно применять для идентификации антитела, фрагмента антитела, антигенсвязывающего домена или вариабельного домена, конкурирующего с референс-антителом за связывание с конкретным антигеном. В некоторых вариантах осуществления изобретения указанное конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается референс-антитело. Подробные приведенные в качестве примеров методы картирования эпитопа, с которым связывается антитело, представлены у Morris, ((Epitope Mapping Protocols)), BiMethods in Molecular Biology, изд-во Humana Press, Totowa, NJ, т. 66, 1996. При осуществлении приведенного в качестве примера анализа в условиях конкуренции иммобилизованный антиген инкубируют в растворе, содержащем первое меченое антитело, которое связывается с антигеном, и второе немеченое антитело, которое подлежит тестированию в отношении его способности конкурировать с первым антителом за связывание с антигеном. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный антиген инкубируют в растворе, содержащем первое меченое антитело, но не содержащем второе немеченое антитело.
После инкубации в условиях, обеспечивающих связывание первого антитела с антигеном, избыток несвязанного антитела удаляют и оценивают количество метки, ассоциированной с иммобилизованным антигеном. Если количество метки, ассоциированной с иммобилизованным антигеном, существенно снижено в тестируемом образце по сравнению с контрольным образцом, то это свидетельствует о том, что второе антитело конкурирует с первым антителом за связывание с антигеном (см. Harlow и Lane. Antibodies: А Laboratory Manual, изд-во Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, гл. 14, 1988).
Активирующие Т-клетки биспецифические антигенсвязывающие молекулы и антитела, полученные с помощью представленных в настоящем описании методов, можно очищать с использованием известных в данной области методик, таких как жидкостная хроматография высокого разрешения, ионообменная хроматография, гель-электрофорез, аффинная хроматография, гель-фильтрация и т.п. Фактические условия, применяемые для очистки конкретного белка, зависят, в частности, от таких факторов, как чистый заряд, гидрофобность, гидрофильность и т.д., и они должны быть очевидны специалисту в данной области. Для очистки антитела с помощью аффинной хроматографии можно использовать лиганд, рецептор или антиген, с которым связывается биспецифическое антитело или антитело, связывающееся с DR5. Например, для очистки с помощью аффинной хроматографии биспецифических антител, предлагаемых в изобретении, можно использовать матрикс с белком А или белком G. Например, последовательное применение аффинной хроматографии на белке А или G и гель-фильтрации можно использовать для выделения биспецифического антитела, практически согласно методу, описанному в разделе «Примеры». Чистоту биспецифического антитела или антитела, связывающегося с DR5, можно определять с помощью любого из широкого разнообразия хорошо известных аналитических методов, включая гель-электрофорез, жидкостную хроматографию высокого давления и т.п.
Е. Анализы
Активирующие Т-клетки биспецифические антигенсвязывающие молекулы, например, активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые содержат первый антигенсвязывающий сайт, специфический в отношении фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический в отношении CD3, и антитела, например, антагонистические антитела, связывающиеся с осью PD-1, и антагонистические антитела к TIM3, представленные в настоящем описании, можно идентифицировать, подвергать скринингу или характеризовать их физические/химические свойства и/или виды биологической активности с помощью различных анализов, известных в данной области.
1. Анализы аффинности
Аффинность активирующих Т-клетки биспецифических антигенсвязывающих молекул, например, активирующих Т-клетки биспецифических антигенсвязывающих молекул, которые содержат первый антигенсвязывающий сайт, специфический в отношении фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический в отношении CD3, и антител, например, антагонистических антител, которые связываются с осью PD-1, и антагонистических антител к TIM3, представленных в настоящем описании, с соответствующим антигеном, например, FolR1, PD-1, PD-L1, TIM3, можно определять с помощью методов, изложенных в разделе «Примеры», с помощью метода поверхностного плазмонного резонанса (SPR), используя стандартную инструментальную базу, например, устройство BIAcore (фирма GE Healthcare), и рецепторы или белки-мишени, которые можно получать с помощью рекомбинантной экспрессии. Альтернативно этому, связывание активирующих Т-клетки биспецифических антигенсвязывающих молекул и антител, представленных в настоящем описании, с соответствующим антигеном можно оценивать с использованием клеточных линий, экспрессирующих конкретный рецептор или антиген-мишень, например, с помощью проточной цитометрии (FACS).
Величину KDможно измерять методом поверхностного плазмонного резонанса с помощью устройства BIACORE® Т100 (фирма GE Healthcare) при 25°С. Для анализа взаимодействия между Fc-областью и Fc-рецепторами меченный с помощью His рекомбинантный Fc-рецептор «захватывают» с использованием антитела к пента-His (фирма Qiagen) («пента-His» представлена в виде SEQ ID NO: 392), иммобилизованного на СМ5-чипах, и биспецифические конструкции применяют в качестве аналитов. В целом, метод состоит в следующем: биосенсорные чипы из карбоксиметилированного декстрана (СМ5, фирма GE Healthcare) активируют с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям поставщика. Антитело к пента-His (последовательность «пента-His» представлена в SEQ ID NO: 392) разводят 10 мМ ацетатом натрия, рН 5,0 до концентрации 40 мкг/мл перед инъекцией со скоростью потока 5 мкл/мин для достижения уровня иммобилизации, соответствующего примерно 6500 единиц ответа (RU) связанного белка. После инъекции лиганда инъецируют 1М этаноламин для блокады непрореагировавших групп. Затем осуществляют «захват» Fc-рецептора в течение 60 с в концентрации 4 или 10 нМ. Для кинетических измерений инъецируют четырехкратные серийные разведения биспецифической конструкции (диапазон от 500 до 4000 нМ) в буфере HBS-EP + (фирма GE Healthcare, 10 мМ HEPES, 150 мМ NaCl, 3 мМ ЭДТА, 0,05% сурфактанта Р20, рН 7,4) при 25°С со скоростью потока 30 мкл/мин в течение 120 с.
Для определения аффинности к антигену-мишени биспецифические конструкции «захватывают» с помощью специфического в отношении человеческого Fab антитела (фирма GE Healthcare), которое иммобилизуют на поверхности активированного сенсорного СМ5-чипа согласно методу, описанному для антитела к пента-His («пента-His» представлена в виде SEQ ID NO: 392). Конечное количество сшитого белка соответствовало примерно 12000 RU. Осуществляют «захват» биспецифических конструкций в течение 90 с в концентрации 300 нМ. Антигены-мишени пропускают через проточные ячейки в течение 180 с в диапазоне концентраций от 250 до 1000 нМ со скоростью потока 30 мкл/мин. Мониторинг диссоциации осуществляют в течение 180 с. Различия всех показателей преломления корректируют путем вычитания ответа, полученного в проточной референс-ячейке. Ответ на стационарной стадии используют для определения константы диссоциации (KD) с помощью аппроксимации нелинейной кривой изотермы связывания Ленгмюра. Скорость реакции ассоциации (kon) и реакции диссоциации (koff) рассчитывают с использованием простой модели связывания Ленгмюра 1:1 (программное обеспечение BIACORE ® Т100 Evaluation, версия 1.1.1) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия реакции диссоциации (KD) рассчитывали как соотношение koff/kon (см., например, Chen и др., J Mol Biol 293, 1999, cc. 865-881).
2. Анализы связывания и другие анализы
Согласно одному из объектов изобретения активирующие Т-клетки биспецифические антигенсвязывающие молекулы, например, активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые содержат первый антигенсвязывающий сайт, специфический в отношении фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический в отношении CD3, и антитела, например, антагонистические антитела, которые связываются с осью PD-1, и антагонистические антитела к TIM3, предлагаемые в изобретении, тестируют в отношении их антигенсвязывающей активности, например, с помощью известных методов, таких как ELISA, Вестерн-блоттинг и т.д.
Согласно другому объекту изобретения можно использовать анализы в условиях конкуренции для идентификации антитела или фрагмента, которое/который конкурирует со специфическим референс-антителом за связывание с соответствующими антигенами. В конкретных вариантах осуществления изобретения, такое конкурирующие антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается специфическое референс-антитело. Подробное описание примеров методов картирования эпитопов, с которыми связывается антитело, представлено у Morris, «Epitope Mapping Protocols)), в: Methods in Molecular Biology, изд-во Humana Press, Totowa, NJ, т. 66, 1996. Другие методы описаны в разделе «Примеры».
3. Анализы активности
Одним из объектов изобретения являются анализы, предназначенные для идентификации активирующих Т-клетки биспецифических антигенсвязывающих молекул, например, активирующих Т-клетки биспецифических антигенсвязывающих молекул, которые содержат первый антигенсвязывающий сайт, специфический в отношении фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический в отношении CD3, и антител, например, антагонистических антител, которые связываются с осью PD-1, и антагонистических антител к TIM3, представленных в настоящем описании, в отношении наличия биологической активности. Биологическая активность может включать, например, индукцию ДНК-фрагментации, индукцию апоптоза и лизис клеток-мишеней. Предложены также антитела, обладающие указанной биологической активностью in vivo и/или in vitro.
В некоторых вариантах осуществления изобретения активирующую Т-клетку антигенсвязывающую молекулу и антитело, предлагаемую/предлагаемое в изобретении, тестировали в отношении указанной биологической активности. Анализы, предназначенные для оценки лизиса клеток (например, на основе оценки высвобождения ЛДГ) или апоптоза (например, с помощью TUNEL-анализа) хорошо известны в данной области. Анализы оценки ADCC или CDC описаны в WO 2004/065540 (см. пример 1 в указанной заявке), полное содержание которой включено в настоящее описание в качестве ссылки.
Ж. Фармацевтические композиции
Фармацевтические композиции активирующих Т-клетки биспецифических антигенсвязывающих молекул, например, активирующей Т-клетку биспецифической антигенсвязывающей молекулы, которая содержит первый антигенсвязывающий сайт, специфический в отношении фолатного рецептора 1 (FolR1), и второй антигенсвязывающий сайт, специфический в отношении CD3, и антител, например, антагонистических антител, которые связываются с осью PD-1, и антагонистических антител к TIM3, представленных в настоящем описании, получают путем смешения указанных активирующих Т-клетки биспецифических антигенсвязывающих молекул или антител, имеющих необходимую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями ( Pharmaceutical Sciences, под ред. A. Osol, 1980) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими) буферы, такие как фосфатный, цитратный, ацетатный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания фармацевтически приемлемые носители включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Pharmaceutical Sciences, под ред. A. Osol, 1980) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими) буферы, такие как фосфатный, цитратный, ацетатный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания фармацевтически приемлемые носители включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в US №6267958. Водные композиции антител включают композиции, описанные в US №6171586 и WO 2006/044908, последние композиции включают гистидин-ацетатный буфер.
Композиция, предлагаемая в изобретении, может содержать также более одного действующего вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Такие действующие вещества должны присутствовать в комбинации в количествах, эффективных для решения поставленной задачи.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксипропилметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в  Pharmaceutical Sciences, под ред. A. Osol, 1980.
Pharmaceutical Sciences, под ред. A. Osol, 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Это легко можно осуществлять путем фильтрации через стерильные фильтрующие мембраны.
3. Терапевтические способы и композиции
Представленные в настоящем описании терапевтические комбинации, которые содержат одну или несколько активирующих Т-клетки биспецифических антигенсвязывающих молекул и антагонистическое антитело, связывающееся с осью PD-1, и необязательно, антагонист TIM3, можно применять в терапевтических способах.
Одним из объектов изобретения являются активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые связываются с фолатным рецептором 1 (FolR1) и CD3, предназначенные для применения в качестве лекарственного средства, в комбинации с антагонистическим антителом, связывающимся с осью PD-1. Некоторыми вариантами осуществления изобретения являются активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые связываются с FolR1 и CD3, предназначенные для применения в комбинации с антагонистическим антителом, связывающимся с осью PD-1, для применения в способе лечения. В некоторых вариантах осуществления изобретения комбинация содержит также антагонист TIM3, например, антагонистическое антитело к TIM3. Некоторыми вариантами осуществления изобретения являются активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые связываются с FolR1 и CD3, и антагонистические антитела, которые связываются с осью PD-1, для применения в способе лечения индивидуума, который имеет рак, включающий введение индивидууму в эффективном количестве активирующих Т-клетки биспецифических антигенсвязывающих молекул, которые связываются с FolR1 и CD3, и антагонистического антитела, которое связывается с осью PD-1. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного антагониста TIM3, например, описанного ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека. В одном из предпочтительных вариантов осуществления изобретения указанный рак представляет собой рак поджелудочной железы, саркому или колоректальную карциному. В других вариантах осуществления изобретения рак представляет собой колоректальный рак, саркому, рак головы и шеи, плоскоклеточые карциномы, рак молочной железы, рак поджелудочной железы, рак желудка, немелкоклеточную карциному легкого, мелкоклеточный рак легкого или мезотелиому. В вариантах осуществления изобретения, в которых рак представляет собой рак молочной железы, рак молочной железы может представлять собой трижды негативный рак молочной железы.
Следующим объектом изобретения является применение терапевтической комбинации, содержащей активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые связываются с FolR1 и CD3, и антагонистическое антитело, которое связывается с осью PD-1, для производства или приготовления лекарственного средства. В одном из вариантов осуществления изобретения комбинация содержит также антагонист TIM3. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения рака. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе лечения рака, включающем введение индивидууму, который имеет рак, в эффективном количестве лекарственного средства. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства, например, указанного ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является способ лечения рака. В одном из вариантов осуществления изобретения способ включает введение индивидууму, который имеет рак, в эффективном количестве терапевтической комбинации, содержащей активирующие Т-клетки биспецифические антигенсвязывающие молекулы, которые связываются с FolR1 и CD3, и антагонистическое антитело, которое связывается с осью PD-1. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства, например, указанного ниже. В одном из указанных вариантов осуществления изобретения по меньшей мере одно дополнительное терапевтическое средство представляет собой антагонистическое антитело к TIM3. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека. В одном из предпочтительных вариантов осуществления изобретения указанный рак представляет собой рак поджелудочной железы, саркому или колоректальную карциному. В других вариантах осуществления изобретения рак представляет собой колоректальный рак, саркому, виды рака головы и шеи, плоскоклеточые карциномы, рак молочной железы, рак поджелудочной железы, рак желудка, немелкоклеточную карциному легкого, мелкоклеточный рак легкого или мезотелиому.
Следующим объектом изобретения являются фармацевтические композиции, содержащие любую из представленных в настоящем описании активирующих Т-клетки биспецифических антигенсвязывающих молекул, которые связываются с FolR1 и CD3, например, для применения в любом из указанных выше терапевтических способов, и антагонистическое антитело, которое связывается с осью PD-1. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит любую из представленных в настоящем описании активирующих Т-клетки биспецифических антигенсвязывающих молекул, которые связываются с FolR1, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любую из активирующих Т-клетки биспецифических антигенсвязывающих молекул, которые связываются с FolR1 и CD3, и представленное в настоящем описании антагонистическое антитело, которое связывается с осью PD-1, и по меньшей мере одно дополнительное терапевтическое средство, например, указанное ниже.
Биспецифическое антитело можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный, и при необходимости применять для местной обработки, осуществлять введение в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но, не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Биспецифические антитела можно включать в состав композиций, дозировать и вводить в соответствии с надлежащей клинической практикой.
Рассматриваемые в этом контексте факторы включают конкретное заболевание, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину заболевания, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Биспецифическое антитело можно, но это не является обязательным, включать в композицию в сочетании с одним или несколькими другими агентами, которые в настоящее время применяют для предупреждения рассматриваемого заболевания. Эффективное количество указанных других агентов зависит от количества антитела, присутствующего в композиции, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в настоящем описании, или в любой дозе и с помощью любого пути, который по данным эмпирической/клинической оценки является пригодным.
Для предупреждения или лечения заболевания соответствующая доза биспецифического антитела должна зависеть от типа заболевания, подлежащего лечению, типа антитела, серьезности и течения болезни, применяют ли биспецифическое антитело, для профилактических или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на биспецифическое антитело, а также предписания лечащего врача. Биспецифическое антитело можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-10 мг/кг) биспецифического антитела или нового антитела, которое связывается с DR5, может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз биспецифического антитела является доза, составляющая от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5, 2,0, 4,0 или 10 мг/кг. Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз биспецифического антитела). Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. Однако можно применять другие схемы введения доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
Очевидно, что любые из вышеуказанных композиций или терапевтических способов можно применять с использованием иммуноконъюгата, предлагаемого в изобретении, вместо или в дополнение к активирующим Т-клетки биспецифическим антигенсвязывающим молекулам, которые связываются с FolR1 и CD3, и антагонистическому антителу, которое связывается с осью PD-1, и необязательно антагонистическому антителу к TIM3.
II. Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для IV-раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой биспецифическое антитело, а дополнительное действующее вещество представляет собой дополнительное химиотерапевтическое средство, указанное в настоящем описании. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит биспецифическое антитело; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этому варианту осуществления изобретения изделие может содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Как должно быть очевидно, любое из указанных выше изделий может включать иммуноконъюгат, предлагаемый в изобретении, вместо или в дополнение к активирующим Т-клетки биспецифическим антигенсвязывающим молекулам, которые связываются с FolR1 и CD3, и антагонистическому антителу, которое связывается с осью PD-1, и необязательно антагонистическому антителу к TIM3.
III. Примеры
Ниже представлены примеры способов и композиций, предлагаемых в изобретении. Как должно быть очевидно, в целом можно воплощать на практике различные другие варианты осуществления изобретения с учетом представленного выше описания изобретения.
Общие методы
Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии применяли согласно инструкциям производителей. Общую информацию, касающуюся нуклеотидных последовательностей легких и тяжелых цепей человеческих иммуноглобулинов, см. у: Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во NIH, публикация N 91-3242, 1991.
Секвенирование ДНК
Последовательности ДНК определяли путем стандартного секвенирования двух цепей.
Синтез генов
Требуемые сегменты генов либо создавали с помощью ПЦР с использованием соответствующих матриц, либо синтезировали на фирме Geneart AG (Регенсбург, Германия) из синтетических олигонуклеотидов и ПЦР-продуктов посредством автоматического синтеза генов. В тех случаях, когда точная генная последовательность не была доступна, создавали олигонуклеотидные праймеры на основе последовательностей ближайших гомологов и гены выделяли с помощью ОТ-ПЦР из РНК, полученной из соответствующей ткани. Сегменты генов, фланкированные единичными сайтами, распознаваемыми рестрикционными эндонуклеазами, клонировали в стандартных клонирующих/секвенирующих векторах. Плазмидную ДНК очищали из трансформированных бактерий и определяли концентрацию с помощью УФ-спектроскопии. Последовательность ДНК субклонированных фрагментов генов подтверждали ДНК-секвенированием. Создавали сегменты генов с требуемыми сайтами рестрикции, позволяющими субклонировать их в соответствующих экспрессионных векторах. Все конструкции создавали с 5'-концевой последовательностью ДНК, кодирующей лидерный пептид, который направляет секрецию белков в эукариотических клетках.
Выделение первичных человеческих пан-Т-клеток из РВМС
Мононуклеарные клетки периферической крови (РВМС) получали путем центрифугирования в градиенте плотности Histopaque из обогащенных лимфоцитами препаратов (лейкоцитарные пленки), полученных из местных банков крови или из свежей крови здоровых доноров. В целом, метод состоял в следующем: кровь разводили стерильным ЗФР и осторожно наслаивали на градиент Histopaque (фирма Sigma, Н8889). После центрифугирования в течение 30 мин при 450×g при комнатной температуре (отключенное тормозное устройство), часть плазмы, находящуюся над содержащей РВМС интерфазой, отбрасывали. РВМС переносили в новые 50-миллилитровые фальконовские пробирки и пробирки заполняли ЗФР до полного объема 50 мл. Смесь центрифугировали при комнатной температуре в течение 10 мин при 400×g (включенное тормозное устройство). Супернатант отбрасывали и дебрис РВМС отмывали дважды стерильным ЗФР (стадии центрифугирования при 4°С в течение 10 мин при 350×g). Осуществляли автоматический подсчет полученной популяции РВМС (устройство ViCell) и хранили в среде RPMI 1640, содержащей 10% FCS и 1% L-аланил-L-глутамина (фирма Biochrom, K0302) при 37°С, 5% СО2 в инкубаторе вплоть до начала анализа.
Для получения фракции, обогащенной Т-клетками, из РВМС, использовали набор для выделения пан-Т-клеток (Pan Т Cell Isolation Kit II) (фирма Miltenyi Biotec, №130-091-156) согласно инструкциям производителя. В целом, метод состоял в следующем: клеточный дебрис разводили, используя 40 мкл холодного буфера на 10 миллионов клеток (ЗФР с 0,5% БСА, 2 мМ ЭДТА, простерилизованный фильтрацией), и инкубировали, используя 10 мкл коктейля биотин-антитело на 10 миллионов клеток, в течение 10 мин при 4°С. Добавляли 30 мкл холодного буфера и 20 мкл магнитных гранул с антителом к биотину на 10 миллионов клеток и смесь инкубировали в течение еще 15 мин при 4°С. Клетки промывали, добавляя буфер в объеме, превышающем в 10-20 раз имевшийся объем, и затем осуществляли стадию центрифугирования при 300×g в течение 10 мин. Вплоть до 100 миллионов клеток ресуспендировали в 500 мкл буфера. Магнитную сепарацию немеченых человеческих пан-Т-клеток осуществляли с помощью LS-колонок (фирма Miltenyi Biotec, №130-042-401) согласно инструкциям производителя. Осуществляли автоматический подсчет полученной популяции Т-клеток (устройство ViCell) и хранили их в среде AIM-V при 37°С, 5% СО2 в инкубаторе вплоть до начала анализа (не более 24 ч).
Выделение первичных человеческих наивных Т-клеток из РВМС
Мононуклеарные клетки периферической крови (РВМС) выделяли путем центрифугирования в градиенте плотности Histopaque из обогащенных лимфоцитами препаратов (лейкоцитарные пленки), полученных из местных банков крови или из свежей крови здоровых доноров. Для получения фракции, обогащенной Т-клетками из РВМС, использовали набор для выделения наивных CD8+-Т-клеток (Naive CD8+Т cell isolation Kit) фирмы Miltenyi Biotec (№130-093-244), согласно инструкциям производителя, но, пропуская последнюю стадию выделения CD8+-Т-клеток (см. также описание выделения первичных человеческих пан-Т-клеток).
Выделение мышиных пан-Т-клеток из спленоцитов
Изымали селезенки из мышей линии C57BL/6, переносили их в С-пробирку GentleMACS (фирма Miltenyi Biotech, №130-093-237), содержащую MACS-буфер (ЗФР + 0,5% БСА + 2 мМ ЭДТА), и расщепляли с помощью устройства для диссоциации тканей GentleMACS с получением суспензии единичных клеток согласно инструкциям производителя. Клеточную суспензию пропускали через фильтр предварительной очистки для удаления недиссоциированных частиц ткани. После центрифугирования при 400×g в течение 4 мин при 4°С добавляли буфер для лизиса ACK для лизирования эритроцитов (инкубация в течение 5 мин при комнатной температуре). Оставшиеся клетки дважды промывали MACS-буфером, подсчитывали и применяли для выделения мышиных пан-Т-клеток. Негативную (магнитную) селекцию осуществляли, используя набор для выделения пан-Т-клеток фирмы Miltenyi Biotec (№130-090-861) согласно инструкциям производителя. Осуществляли автоматический подсчет полученной популяции Т-клеток (устройство ViCell) и сразу применяли для дополнительных анализов.
Выделение первичных РВМС обезьян циномолгус из гепаризированной крови
Мононуклеарные клетки периферической крови (РВМС) получали путем центрифугирования в градиенте плотности из свежей крови здоровых обезьян циномолгус следующим образом: гепаринизированную кровь разводили в соотношении 1:3 стерильным ЗФР и среду Lymphoprep (фирма Axon Lab, №1114545) разводили до 90% стерильным ЗФР. Два объема разведенной крови наслаивали на один объем разведенного градиента плотности и фракцию РВМС разделяли путем центрифугирования в течение 30 мин при 520×g без торможения при комнатной температуре. Полосу, соответствующую РВМС, переносили в свежую 50-миллилитровую фальконовскую пробирку, и промывали стерильным ЗФР путем центрифугирования в течение 10 мин при 400×g при 4°С. Осуществляли одну стадию низкоскоростного центрифугирования для удаления тромбоцитов (15 мин при 150×g, 4°С) и осуществляли автоматический подсчет полученной популяции РВМС (устройство ViCell) и сразу применяли для дополнительных анализов.
Пример 1
Очистка слияний биотинилированный фолатный рецептор-Fc
Для создания новых антител к человеческому FolR1 конструировали указанные ниже антигены и «инструменты» для скрининга в виде одновалентных слитых белков, содержащих Fc (внеклеточный домен антигена, сцепленный с шарнирной областью Fc с «выступом», который совместно экспрессировали с молекулой, содержащей Fc с «впадиной»). Гены антигена синтезировали (фирма Geneart, Регенсбург, Германия) на основе последовательностей, полученных из GenBank или SwissProt, и встраивали в экспрессионные векторы для создания слитых белков, содержащих Fc с «выступом», с С-концевой Avi-меткой для биотинилирования in vivo или in vitro. Биотинилирование in vivo осуществляли путем совместной экспрессии бактериального гена birA, кодирующего бактериальную биотинлигазу, в процессе получения. Экспрессию всех генов осуществляли под контролем химерного промотора MPSV на плазмиде, содержащей элемент oriP для поддержания стабильности плазмид в содержащих EBNA клеточных линиях.
Для получения биотинилированных мономерных слитых молекул антиген/Fc, клетки HEK293 EBNA, растущие в суспензии на экспоненциальной фазе роста, совместно трансфектировали тремя векторами, кодирующими два компонента слитого белка (цепи с «выступом» и с «впадиной»), а также BirA, фермент, необходимый для реакции биотинилирования. Соответствующие векторы применяли в соотношении 9,5:9,5:1 («антиген ECD-Fc с «выступом»-avi-метка»:«Fc с «впадиной»:«BirA»).
Для получения белка во встряхиваемых колбах вместимостью 500 мл высевали 400 млн клеток HEK293 EBNA за 24 ч до трансфекции. Для трансфекции клетки центрифугировали в течение 5 мин при 210 g и супернатант заменяли предварительно нагретой средой CD СНО. Экспрессионный векторы ресуспендировали в 20 мл среды CD СНО, содержащей 200 мкг векторной ДНК. После добавления 540 мкл полиэтиленимина (ПЭИ) раствор перемешивали в течение 15 с и инкубировали в течение 10 мин при комнатной температуре. Затем клетки смешивали с раствором ДНК/ПЭИ, переносили в 500-миллилитровую встряхиваемую колбу и инкубировали в течение 3 ч при 37°С в инкубаторе в атмосфере, содержащей 5% СО2. После инкубации добавляли 160 мл среды F17 и клетки культивировали в течение 24 ч. Через один день после трансфекции к культуре добавляли 1 мМ вальпроевую кислоту и 7% Feed 1 (фирма Lonza). Среду для производства дополняли также 100 мкМ биотином. После культивирования в течение 7 дней супернатант собирали путем осаждения центрифугированием в течение 15 мин при 210×g. Раствор стерилизовали фильтрацией (фильтр с размером пор 0,22 мкм), дополняли азидом натрия до конечной концентрации 0,01% (мас./об.), выдерживали при 4°С.
Секретированные белки очищали из супернатантов клеточных культур с помощью аффинной хроматографии на белке А с последующей гель-фильтрацией. Для осуществления аффинной хроматографии супернатант вносили на колонку HiTrap ProteinA HP (CV = 5 мл, фирма GE Healthcare), уравновешенную 40 мл буфера, содержащего 20 мМ фосфат натрия, 20 мМ цитрат натрия, рН 7,5. Несвязанный белок удаляли промывкой, используя равный по меньшей мере 10 объемам колонки объем буфера, содержащего 20 мМ фосфат натрия, 20 мМ цитрат натрия, рН 7,5. Связанный белок элюировали, применяя линейный рН-градиент, который создавали, используя равный 20 объемам колонки объем буфера, содержащего 20 мМ цитрат натрия, 100 мМ хлорид натрия, 100 мМ глицин, рН 3,0. Затем колонку промывали, используя равный 10 объемам колонки объем буфера, содержащего 20 мМ цитрат натрия, 100 мМ хлорид натрия, 100 мМ глицин, рН 3,0.
Величину рН собранных фракций регулировали, добавляя 1/10 (об./об.) 0,5 М фосфат кальция, рН 8,0. Белок концентрировали и фильтровали перед внесением на колонку HiLoad Супердекс 200 (фирма GE Healthcare), уравновешенную буфером, содержащим 20 мМ гистидин, 140 мМ хлорид натрия, рН 6,0.
Концентрацию белка определяли путем измерения оптической плотности (ОП) при 280 нм, использую коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности. Чистоту и молекулярную массу FolR1-Fc-слияния анализировали с помощью капиллярного электрофореза в присутствии ДСН (КЭ-ДСН) с восстановителем и без него (система Caliper LabChip GXII, фирма Perkin Elmer) согласно инструкциям производителя.
Содержание агрегатов в образцах белков анализировали с помощью аналитической колонки для гель-фильтрации TSKgel G3000 SW XL (фирма Tosoh), уравновешенной в подвижном буфере, содержащем 25 мМ K2HPO4, 125 мМ NaCl, 200 мМ моногидрохлорид L-аргинина, 0,02% (мас./об.) NaN3, рН 6,7, при 25°С.
Очищенные слитые белки антиген-Fc анализировали с помощью метода поверхностного плазмонного резонанса с использованием поступающих в продажу антител для подтверждения правильной и встречающейся в естественных условиях конформации антигенов (данные не представлены).
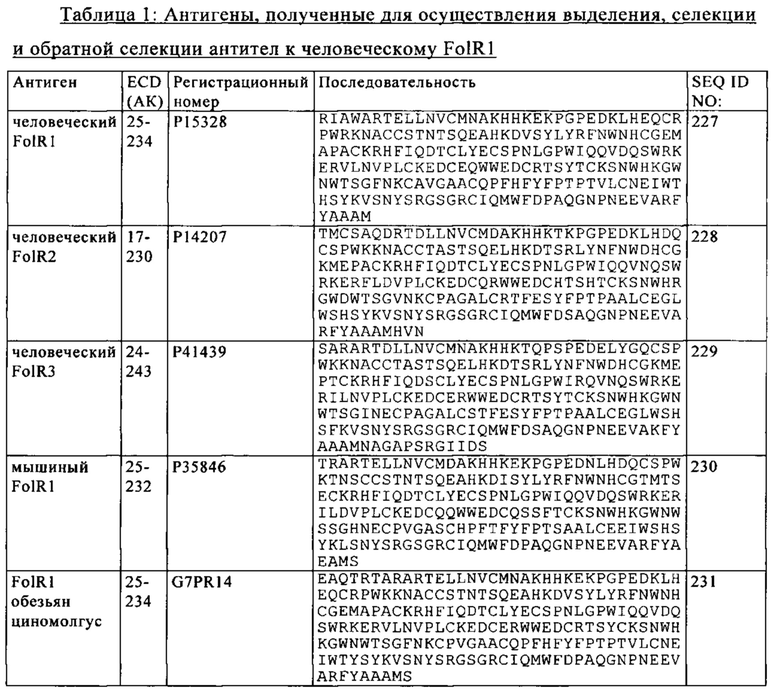
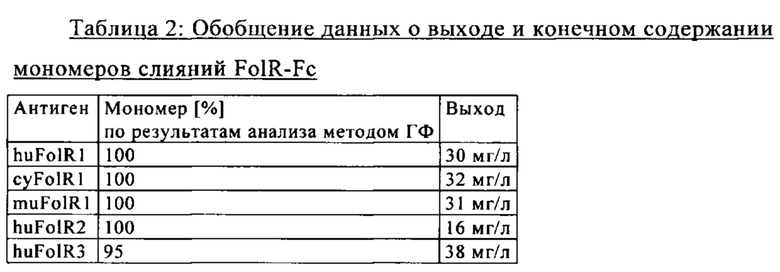
Пример 2
Создание общей легкой цепи, обладающей специфичностью в отношении CD3ε
Активирующие Т-клетку биспецифические молекулы, представленные в настоящем описании, содержат по меньшей мере один связывающий CD3 фрагмент. Этот фрагмент можно создавать путем иммунизации лабораторных животных, скрининга фаговой библиотеки или с использованием известных антител к CD3. Общую легкую цепь, обладающую специфичностью в отношении CD3ε, создавали путем гуманизации легкой цепи родительского мышиного антитела к CD3ε (СН2527). Для гуманизации антитела из организма кроме человека CDR-остатки из нечеловеческого антитела (донора) необходимо трансплантировать в каркасный участок человеческого (акцепторного) антитела. Как правило, последовательности акцепторного каркасного участка отбирают путем выравнивания последовательности донора с коллекцией потенциальных акцепторных последовательностей и выбора одной, которая либо обладает достаточной гомологией с донором, либо характеризуется наличием сходных аминокислот в некоторых положениях, имеющих решающее значение с точки зрения структуры и активности. В данном случае поиск акцепторного каркасного участка антитела осуществляли путем выравнивания последовательности мышиного VL-домена родительского антитела с коллекцией последовательностей человеческой зародышевой линии и отбора человеческой последовательности, характеризующейся высокой степенью идентичности последовательности. Неожиданно было установлено, что хорошее соответствие с точки зрения гомологии последовательности каркасного участка имеет место в случае довольно редко встречающейся человеческой легкой цепи, относящейся к семейству 7 V-доменов лямбда-типа, более точно hVL_7_46 (номенклатура IMGT, GenBank, код доступа Z73674). Вследствие этого указанная редко встречающаяся человеческая легкая цепь была выбрана в качестве акцепторного каркасного участка для гуманизации легкой цепи СН2527. Три гипервариабельных участка (CDR) вариабельного домена мышиной легкой цепи были трансплантированы в указанный акцепторный каркасный участок. Поскольку область каркасного участка 4 не является частью вариабельной области V-гена зародышевой линии, то выравнивание в этой области (J-элемент) осуществляли индивидуально. Таким образом, последовательность IGLJ3-02 была выбрана для гуманизации указанной легкой цепи.
Было создано тринадцать гуманизированных вариантов (CH2527-VL7_46-1-VL7_46-10, VL7_46-12 - VL7_46-14). Они различались остатками каркасного участка (и их комбинациями), которые были подвергнуты обратной мутации в направлении последовательности мышиного V-домена, или CDR-остатками (определение по Кэботу), которые могли сохраниться идентичными остаткам в последовательности человеческой зародышевой линии. Ниже представлены остатки каркасного участка, находящиеся вне CDR, которые посредством обратной мутации были превращены в мышиные остатки в конечном варианте гуманизированного VL-домена варианта VL7_46-13 (перечислены мышиные остатки): V36, Е38, F44, G46, G49 и G57, соответственно. Человеческий J-элемент IGLJ3-02 был на 100% идентичен J-элементу мышиного родительского антитела.
Пример 3
Оценка методом SPR гуманизированных вариантов, обладающих специфичностью в отношении CD3ε
Оценивали гуманизированные варианты VL в виде химеры в формате «2+1 классическая», т.е. когда гуманизированные V-домены легкой цепи спарены с мышиными V-доменами тяжелой цепи. Оценку методом SPR проводили с использованием устройства ProteOn XPR36 (фирма Bio-Rad). Более точно процедура заключалась в следующем: варианты иммобилизовали непосредственно из супернатанта культуры на дериватизированном антителом к Fab сенсорном чипе GLM (козий античеловеческий IgG, F(ab')2-фрагментспецифический, фирма Jackson ImmunoResearch) в вертикальной ориентации. Для оценки связывания с CD3ε человека и обезьян циномолгус последовательно инъецировали в горизонтальной ориентации в одной концентрации, перечисленные ниже аналиты: hu CD3ε(-1-26)-Fc(«выступ»)-avi (ID807), 3 мкМ, и су CD3ε-(-1-26)-Fc(«выступ»)-Avi-Рс(«впадина») (ID873), 2,5 мкМ, соответственно. Ответы, характеризующие связывание, качественно сравнивали со связыванием мышиной контрольной конструкции и ранжировали следующим образом: + (выявлен сопоставимый уровень связывания), ± (выявлен пониженный уровень связывания) и - (не выявлено связывания). «Захватывающее» антитело регенерировали после каждого цикла иммобилизации лиганда и связывания аналита, и после окончания исследования повторно инъецировали мышиную конструкцию для подтверждения активности «захватывающей» поверхности. Результаты обобщены в таблице 3.
Таблица 3. Качественная оценка методом SPR связывания конструкций, содержащих гуманизированные варианты легкой цепи, объединенные с мышиной тяжелой цепью СН2527. В конечном итоге был выбран только гуманизированный вариант легкой цепи CH2527-VL7_46-13, выделенный жирным шрифтом, который характеризовался сопоставимым связыванием с CD3ε человека и обезьян циномолгус.
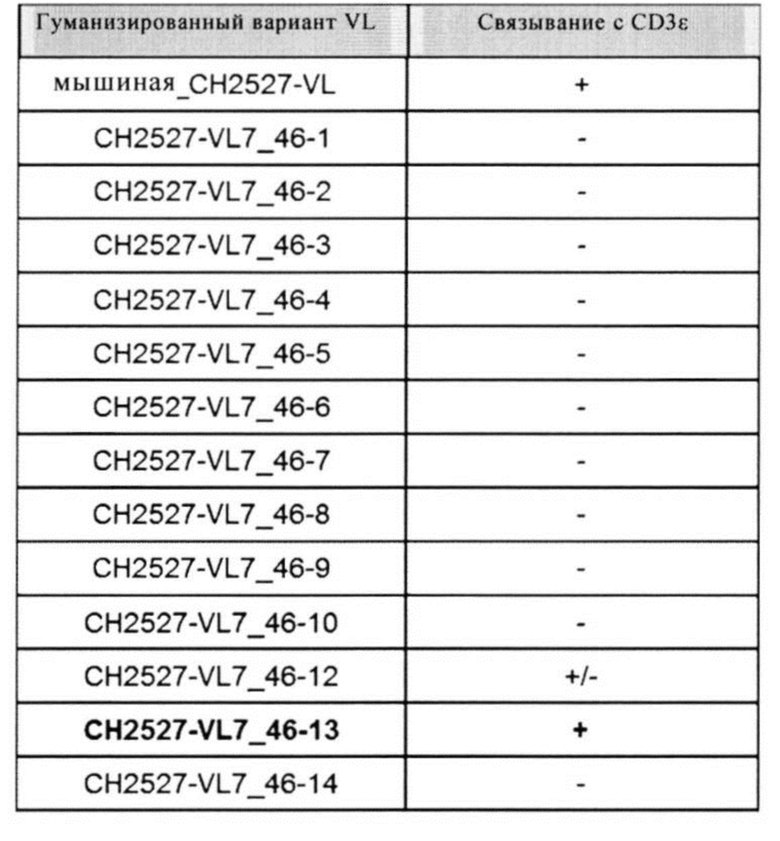
Пример 4
Свойства гуманизированной общей легкой цепи, обладающей специфичностью в отношении CD3ε
Вариант V-домена легкой цепи, который был выбран для гуманизированной лидерной молекулы, представлял собой VL7_46-13. Определяли степень гуманизации, т.е. гомологию последовательности гуманизированного V-домена с последовательностью V-домена человеческой зародышевой линии. Для VL7_46-13 общая степень идентичности последовательности с наиболее близким гомологом человеческой зародышевой линии составляла 65% до гуманизации и 80% после гуманизации. Если исключить CDR-участки, то степень идентичности последовательности с наиболее близким гомологом человеческой зародышевой линии составляла 92%. Как продемонстрировано в таблице 3, VL7_46-13 является единственным гуманизированным вариантом VL из панели, включающей 13 вариантов, который характеризовался уровнем связывания, сопоставимым с уровнем связывания родительского мышиного антитела, и сохранял также перекрестную реактивность с CD3ε обезьян циномолгус. Этот результат свидетельствует о том, что гуманизация мышиного VL-домена без потери аффинности связывания с CD3ε, является нетривиальной задачей, которая требует осуществления нескольких обратных мутаций для восстановления остатков мышиного каркасного участка (в частности G46), сохраняя при этом G24 в CDR1. Кроме того, этот результат демонстрирует, что VL-домен играет решающую роль в распознавании мишени. Важным является то, что гуманизированный VL-домен VL7_46-13 на основе редко встречающейся человеческой зародышевой линии, относящийся к семейству 7 V-доменов лямбда-типа и сохраняющий аффинность и специфичность в отношении CD3ε, пригоден также для применения в качестве общей легкой цепи в фаговых дисплейных библиотеках антител Fab-формата и позволяет осуществлять успешную селекцию новых специфичностей, что значительно облегчает создание и производство биспецифических молекул, связывающихся с CD3ε и, например, с мишенью на опухоли, и обладающих одной и той же «общей» легкой цепью.
Пример 5
Создание фаговой дисплейной библиотеки антител с использованием общей легкой цепи на основе человеческой зародышевой линии, происходящей из HVK1-39
В нескольких подходах к созданию биспецифических антител, напоминающих полноразмерный человеческий IgG, применяли модификации Fc-области, которые индуцировали гетеродимеризацию двух различных тяжелых цепей. Соответствующие примеры включают технологии «knobs-into-holes» (Merchant и др., Nat Biotechnol.; 16(7), июль 1998 г., сс. 677-681), технологию SEED (Davis и др., Protein Eng Des Sel.; 23(4), апрель 2010 г., cc. 195-202) и технологии на основе электростатического взаимодействия (Gunasekaran и др., J Biol Chem.; 285(25), июнь 2010 г., сс. 19637-19646). Хотя эти подходы позволяют осуществлять эффективную гетеродимеризацию двух различных тяжелых цепей, правильное спаривание когнатных легких и тяжелых цепей остается проблемой. Применение общей легкой цепи (LC) может позволить решить эту проблему (Merchant и др., Nat Biotech 16, 1998, сс. 677-681).
В настоящем изобретении описано создание библиотеки антител для дисплея на фаге М13. Важным является то, что согласно изобретению создают многокаркасную библиотеку для тяжелой цепи с одной постоянной (или «общей) легкой цепью. Указанная библиотека предназначена для создания мультиспецифических антител без необходимости применения сложных технологий для того, чтобы избежать ошибочного спаривания легких цепей.
Благодаря применению общей легкой цепи получение указанных молекул может быть облегчено, поскольку в этом случае более не происходит ошибочного спаривания и облегчается выделение высокоочищенного биспецифического антитела. По сравнению с другими форматами применение Fab-фрагментов в качестве конструктивных элементов в отличие, например, от применения scFv-фрагментов, приводит к более высокой термостабильности и отсутствию агрегирования scFv и образования межмолекулярных scFv.
Создание библиотеки
Ниже описано создание библиотеки антител для дисплея на фаге М13. Важным является то, что согласно изобретению создают многокаркасную библиотеку для тяжелой цепи с одной постоянной (или «общей) легкой цепью.
Согласно изобретению в библиотеке используют следующие тяжелые цепи (коды доступа в GenBank указаны в скобках):
IGHV1-46*01 (Х92343) (SEQ ID NO: 104),
IGHVl-69*06 (L22583), (SEQ ID NO: 105),
IGHV3-15*01 (X92216), (SEQ ID NO: 106),
IGHV3-23*01 (M99660), (SEQ ID NO: 107),
IGHV4-59*01 (AB019438), (SEQ ID NO: 108),
IGHV5-51*01 (M99686), (SEQ ID NO: 109).
Во всех тяжелых цепях применяли IGHJ2 в качестве J-элемента, за исключением IGHV 1-69*06, в которой применяли последовательность IGHJ6. Осуществляли рандомизацию CDR-H1, CDR-H2 и CDR-H3. Для CDR-H1 и CDR-Н2 была выбрана стратегия «мягкой» рандомизации, и рандомизацию олигонуклеотидов осуществляли таким образом, чтобы кодон, кодирующий аминокислоту последовательности зародышевой линии, присутствовал в 50% случаев. На долю всех остальных аминокислот, за исключением цистеина, в сумме приходились оставшиеся 50%. В CDR-H3, в котором отсутствовала аминокислота зародышевой линии вследствие присутствия генетического D-элемента, создавали такие олигонуклеотиды, которые допускали применение рандомизированных вставок между V-элементом и J-элементом длиной от 4 до 9 аминокислот. Олигонуклеотиды, содержавшиеся в этих рандомизированных участках, включали, например, следующие аминокислоты. Три аминокислоты G/Y/S присутствовали в количестве 15% каждая, аминокислоты A/D/T/R/P/L/V/N/W/F/I/E присутствовали в количестве 4,6% каждая.
Примеры методов создания библиотек антител описаны у Hoogenboom и др., Nucleic Acids Res., 19, 1991, сс. 4133-413; Lee и др., J. Mol. Biol., 340, 2004, cc. 1073-1093.
Легкую цепь получали на основе человеческой последовательности hVK1-39 и применяли в немодифицированной и нерандомизированной форме. Это должно гарантировать, что можно использовать одну и ту же легкую цепь для других проектов без дополнительных модификаций.
Пример селекции с использованием библиотеки:
Селекцию с использованием библиотек с созревшей аффинностью осуществляли в растворе согласно представленной ниже процедуре с использованием мономерного и биотинилированного внеклеточного домена антигена-мишени X.
1. 1012 фагмидных частиц каждой библиотеки связывали с 100 нМ биотинилированным растворимым антигеном в течение 0,5 ч в общем объеме 1 мл. 2. Биотинилированный антиген «захватывали» и выделяли специфически связанные фаговые частицы путем добавления ~5×107 покрытых стрептавидином магнитных гранул в течение 10 мин. 3. Гранулы промывали с использованием 5-10×1 мл ЗФР/Твин 20 и 5-10×1 мл ЗФР. 4. Элюцию фаговых частиц осуществляли в течение 10 мин путем добавления 1 мл 100 мМ ТЭА (триэтиламин) и нейтрализации путем добавления 500 мкл 1М Трис/HCl, рН 7,4, и 5. На последующих раундах селекции осуществляли повторное заражение бактерии штамма TG1 Е. coli на экспоненциальной фазе роста, заражение хелперным фагом VCSM13 и последующее осаждение фагмидных частиц с помощью ПЭГ/NaCl. Селекции проводили, осуществляя 3-5 раундов с использованием постоянных или снижающихся (от 10-7 М до 2×10-9 М) концентраций антигена. При осуществлении раунда 2 проводили «захват» комплексов антиген/фаг с использованием нейтравидиновых планшетов вместо стрептавидиновых гранул. Все реакционные смеси для связывания дополняли либо 100 нМ бычьим сывороточным альбумином, либо порошкообразным обезжиренным молоком для конкуренции с нежелательными клонам, возникающими вследствие простого липкого связывания антител с пластиковой подложкой.
Селекции проводили, осуществляя три или четыре раунда с использованием снижающихся концентраций антигена, начиная с 100 нМ и снижая их до 5 нМ в конечном раунде селекции. Специфические связывающие агенты определяли по сигналам, превышающим примерно в 5 раз фоновый уровень, и идентифицировали с помощью ELISA. Специфические связывающие агенты идентифицировали с помощью ELISA следующим образом: по 100 мкл 10 нМ биотинилированного антигена на лунку иммобилизовали на сенсибилизированные нейтравидином планшеты. Добавляли содержащие Fab бактериальные супернатанты и проводили обнаружение связанных Fab по их Flag-меткам с использованием вторичного антитела анти-Flag/HRP. Позитивные по данным ELISA клоны экспрессировали в бактериях в виде растворимых Fab-фрагментов в 96-луночном формате и проводили эксперимент по скринингу супернатантов в отношении кинетических характеристик с помощью SPR-анализа с использованием ProteOn XPR36 (фирма BioRad). Идентифицировали экспрессирующие Fab клоны с наиболее высокими константами аффинности и секвенировали соответствующие фагмиды. Для дополнительной характеризации последовательности Fab амплифицировали с помощью ПЦР из фагмид и клонировали с использованием соответствующих сайтов рестрикции в экспрессионных векторах для человеческого IgG1 с целью получения в клетках млекопитающих.
Создание библиотеки антител для фагового дисплея с использованием гуманизированной CD3ε-специфической общей легкой цепи
В данном разделе описано создание библиотеки антител для дисплея на фаге М13. Важным является то, что согласно изобретению создавали многокаркасную библиотеку для тяжелой цепи с одной постоянной (или «общей) легкой цепью. Эту библиотеку создавали для конструирования содержащих Fc, но не обладающих активностью в отношении связывания с FcgR, активирующих Т-клетки биспецифических антител изотипа IgG1 P329G LALA или IgG4 SPLE PG, в которых один или два Fab распознают опухолевый поверхностный антиген, экспрессируемый на опухолевой клетке, в то время как оставшееся Fab-плечо антитела распознает CD3ε на Т-клетке.
Создание библиотеки
Ниже описано создание библиотеки антител для дисплея на фаге М13. Важным является то, что согласно изобретению создавали многокаркасную библиотеку для тяжелой цепи с одной постоянной (или «общей) легкой цепью. Эту библиотеку создавали исключительно для конструирования содержащих Fc, но не обладающих активностью в отношении связывания с FcgR на Т-клетках, биспецифических антител изотипа IgG1 P329G LALA или IgG4 SPLE PG.
Разнообразие вносили посредством рандомизации олигонуклеотидов только в CDR3 различных тяжелых цепей. Методы создания библиотек антител хорошо известны в данной области и описаны у Hoogenboom и др., Nucleic Acids Res., 19, 1991, сс. 4133-4413; или у Lee и др., J. Mol. Biol., 340, 2004, сс. 1073-1093.
При создании библиотеки применяли следующие тяжелые цепи:
IGHV1-46*01 (Х92343), (SEQ ID NO: 104),
IGHV1-69*06 (L22583), (SEQ ID NO: 105),
IGHV3-15*01 (X92216), (SEQ ID NO: 106),
IGHV3-23*01 (M99660), (SEQ ID NO: 107),
IGHV4-59*01 (AB019438), (SEQ ID NO: 108),
IGHV5-51*01 (M99686), (SEQ ID NO: 109).
В библиотеке применяли легкую цепь, полученную на основе специфического в отношении CD3ε человека и обезьян циномолгус гуманизированного антитела СН2527: (VL7_46-13; SEQ ID NO: 112). Эту легкую цепь не рандомизировали и применяли без дополнительных модификаций для того, чтобы гарантировать совместимость с другими биспецифическими связывающими агентами.
Во всех тяжелых цепях применяли IGHJ2 в качестве J-элемента, за исключением IGHV 1-69*06, в которой применяли последовательность IGHJ6. Стратегия рандомизации была сфокусирована только на CDR-H3, и создавали ПЦР-олигонуклеотиды, которые позволяли применять рандомизированные вставки между V-элементом и J-элементом длиной от 4 до 9 аминокислот.
Пример 6
Отбор фрагментов антител к FolR1 из библиотек общих легких цепей (CLCL) (содержащих легкую цепь со специфичностью в отношении CD3ε)
Антитела 16А3, 15А1, 18D3, 19Е5, 19А4, 15Н7, 15В6, 16D5, 15Е12, 21D1, 16F12, 21А5, 21G8, 19Н3, 20G6 и 20Н7, содержащие общую легкую цепь VL7_46-13 со специфичностью к CD3ε, получали посредством селекции методом фагового дисплея в отношении различных видов (человеческого, обезьяньего (циномолгус) и мышиного) FolR1. Клоны 16А3, 15А1, 18D3, 19Е5, 19А4, 15Н7, 15В6, 21D1, 16F12, 19Н3, 20G6 и 20Н7 отбирали из подбиблиотеки, в которой общая легкая цепь была спарена со спектром тяжелых цепей на основе человеческой зародышевой линии VH1_46. В этой подбиблиотеке CDR3 VH1_46 был рандомизирован с использованием 6 различных по длине CDR3. Клоны 16D5, 15Е12, 21А5 и 21G8 отбирали из подбиблиотеки, в которой общая легкая цепь была спарена со спектром тяжелых цепей на основе человеческой зародышевой линии VH3_15. В этой подбиблиотеке CDR3 VH3_15 был рандомизирован с использованием 6 различных по длине CDR3. Для получения обладающих видовой кросс-реактивностью (или реактивностью к мышиному FolR1) антител, при осуществлении 3 раундов биопэннинга чередовали различным образом различные виды FolR1 (или сохраняли постоянными): 16A3 и 15А1 (FolR1 человека - обезьян циномолгус - человека); 18D3 (FolR1 обезьян циномолгус - человека - мышей); 19Е5 и 19А4 (3 раунда селекции против FolR1 мышей); 15Н7, 15 В6, 16D5, 15Е12, 21D1, 16F12, 21А5, 21G8 (FolR1 человека-обезьян циномолгус - человека); 19Н3, 20G6 и 20Н7 (3 раунда селекции против FolR1 мышей).
FolR1 человека, мышей и обезьян циномолгус в качестве антигенов для селекции методом фагового дисплея, а также для скринингов на основе ELISA и SPR, кратковременно экспрессировали в виде N-концевого мономерного Fc-слияния в клетках HEK EBNA и in vivo сайт-специфически биотинилировали посредством совместной экспрессии биотинлигазы BirA на распознаваемой avi-меткой последовательности, расположенной на С-конце несущей Fc-фрагмент рецепторной цепи (Fc-цепь с «выступом»). Для оценки специфичности в отношении FolR1 создавали таким же образом два родственных рецептора, а именно человеческие FolR2 и FolR3.
Раунды селекции (биопэннинг) осуществляли в растворе согласно следующей схеме:
1. Преклиринг ~1012 фагмидных частиц на планшетах Maxisorp, сенсибилизированных 10 мкг/мл неродственного человеческого IgG, для истощения библиотек антител, распознающих Fc-область, слитую с антигеном.
2. Инкубация не связывающихся с Fc фагмидных частиц с 100 нМ биотинилированным человеческим, обезьяньим (циномолгус) или мышиным FolR1 в течение 0,5 ч в присутствии 100 нМ неродственной небиотинилированной Fc-конструкции, созданной с помощью технологии «knob-into-hole», для дополнительного истощения связывающих Fc агентов в общем объеме 1 мл.
3. «Захват» биотинилированного FolR1 и присоединенного специфически связывающегося фага путем переноса в 4 лунки предварительно покрытого нейтравидином титрационного микропланшета в течение 10 мин (в раундах 1 и 3).
4. Промывка соответствующих лунок с использованием 5×ЗФР/Твин20 и 5×ЗФР.
5. Элюция фаговых частиц путем добавления по 250 мкл 100 мМ ТЭА (триэтиламин) на лунку в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/HCl, рН 7,4 к объединенным элюатам, полученным в 4 лунках.
6. Последующая очистка нейтрализованных элюатов путем инкубации на предварительно покрытом нейтравидином титрационном микропланшете с использованием 100 нМ связанного с биотином FolR2 или FolR3 для окончательного удаления связывающихся с Fc и неспецифических агентов.
7. Повторное заражение находящихся на логарифмической стадии клеток Е. coli TG1 супернатантом элюированных фаговых частиц, заражение хелперным фагом VCSM13, инкубация на шейкере при 30°С в течение ночи и последующее осаждение фагмидных частиц с помощью ПЭГ/NaCl для использования на следующем раунде селекции.
Селекции проводили, осуществляя 3 раунда с использованием постоянных концентраций антигена, составлявших 100 нМ. В раунде 2 во избежание обогащения агентами, связывающимися с нейтравидином, осуществляли «захват» комплексов антигенгфаг путем добавления 5,4×107 покрытых стрептавидином магнитных гранул. Специфические связывающиеся агенты идентифицировали с помощью ELISA следующим образом: 100 мкл 25 нМ биотинилированного человеческого, обезьяньего (циномолгус) или мышиного FolR1 и 10 мкг/мл человеческого IgG наносили на нейтравидиновый планшет и планшет Maxisorp соответственно. Добавляли содержащие Fab бактериальные супернатанты и связывание Fab обнаруживали по их Flag-меткам с использованием вторичного антитела анти-Flag/HRP. Составляли шорт-лист клонов, дающих сигналы на человеческом FolR1 и дающих негативный ответ на человеческом IgG, для дальнейшего анализа и проводили их тестирование аналогичным образом в отношении оставшихся двух видов FolR1. Их экспрессировали в бактериях в объеме культуры, составлявшем 0,5 л, осуществляли аффинную очистку и проводили дополнительную характеризацию с помощью SPR-анализа с использованием биосенсора ProteOn XPR36 фирмы BioRad.
Аффинности (KD) отобранных клонов измеряли методом поверхностного плазмонного резонанса (SPR) с помощью устройства ProteOn XPR36 (фирма Biorad) при 25°С с использованием биотинилированного FolR1 человека, обезьян циномолгус или мышей, а также FolR2 и FolR3 человека (отрицательные контроли), иммобилизованных на чипах NLC посредством «захвата» нейтравидином. Иммобилизация антигенов (лиганд): рекомбинантные антигены разводили с помощью ЗФРТ (10 мМ фосфат, 150 мМ хлорид натрия, рН 7,4, 0,005% Твин 20) до 10 мкг/мл, затем инъецировали со скоростью 30 мкл/мин в вертикальной ориентации. Инъекция аналитов: Для измерений кинетических характеристик за один прогон («one-shot»-кинетика) направление инъекции изменяли на горизонтальную ориентацию, инъецировали двукратные серийные разведения очищенного Fab (варьируя диапазоны концентраций) одновременно вдоль отдельных каналов 1-5, продолжительность ассоциации составляла 200 с, а продолжительность диссоциации составляла 600 с. Вдоль шестого канала инъецировали буфер (ЗФРТ), создавая «параллельный» («in-line») пустой контроль для сопоставления. Константы скорости диссоциации (koff) рассчитывали с использованием простой модели связывания 1:1 Ленгмюра с помощью программного обеспечения ProteOn Manager v 3.1 путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия диссоциации (KD) рассчитывали в виде отношения koff/kon. В таблице 4 перечислены константы равновесия диссоциации (KD) отобранных клонов, обладающих специфичностью в отношении FolR1.
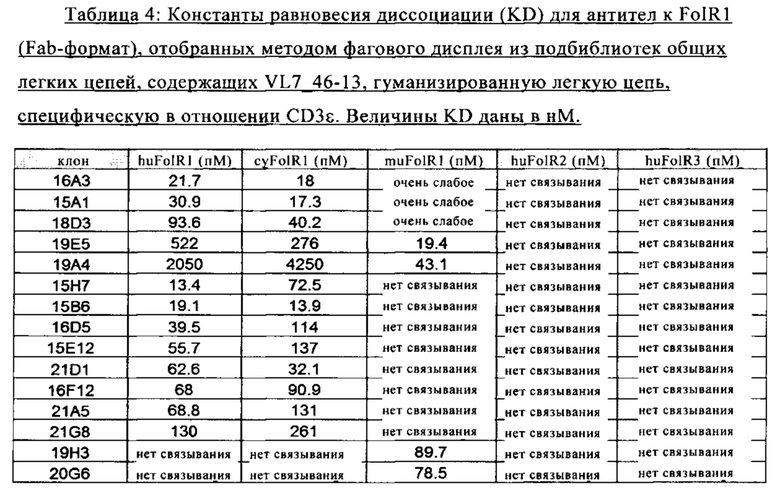
Пример 7
Отбор фрагментов антител к FolR1 из генерических (родовых) мультикаркасных библиотек
Антитела 11F8, 36F2, 9D11, 5D9, 6В6 и 14Е4 получали путем селекции методом фагового дисплея с использованием родовых мультикаркасных подбиблиотек против FolR1 различных видов (человека, обезьян циномолгус или мышей). В этих мультикаркасных подбиблиотеках различные VL-домены с рандомизированными CDR3 (3 различные длины) спаривали с различными VH-доменами с рандомизированными CDR3 (6 различных длин). Отобранные клоны имели следующие спаренные VL/VH: 11F8 (Vk_1_5/VH_1_69), 36F2 (Vk_3_20/VH_1_46), 9D11 (Vk2D_28/VH1_46), 5D9 (Vk3_20/VH1_46), 6B6 (Vk3_20/VH1_46) и 14E4 (Vk3_20/VH3_23). Для получения обладающих видовой кросс-реактивностью (или реактивностью к мышиному FolR1) антител, при осуществлении 3 или 4 раундов биопэннинга чередовали различным образом FolR1 различных видов (или сохраняли их постоянными): 11F8 (FolR1 обезьян циномолгус - мышей - человека); 36F2 (FolR1 человека - мышей - обезьян циномолгус - мышей); 9D11 (FolR1 обезьян циномолгус - человека - обезьян циномолгус); 5D9 (FolR1 человека - обезьян циномолгус - человека); 6В6 (FolR1 человека - обезьян циномолгус - человека) и 14Е4 (3 раунда против FolR1 мышей).
FolR1 человека, мышей и обезьян циномолгус, применяемые в качестве антигенов для селекции методом фагового дисплея, а также скринингов на основе ELISA и SPR, кратковременно экспрессировали в виде N-концевого мономерного Fc-слияния в клетках HEK EBNA и сайт-специфически биотинилировали in vivo посредством совместной экспрессии биотинлигазы BirA на распознаваемой avi-меткой последовательности, расположенной на С-конце несущей Fc-область рецепторной цепи (Fc-цепь с «выступом»). Для оценки специфичности в отношении FolR1 создавали таким же образом два родственных рецептора, а именно человеческие FolR2 и FolR3.
Раунды селекции (биопэннинг) осуществляли в растворе согласно следующей схеме:
1. Преклиринг ~1012 фагмидных частиц на планшетах maxisorp сенсибилизированных 10 мкг/мл неродственного человеческого IgG для истощения библиотек антител, распознающих Fc-область, слитую с антигеном.
2. Инкубация не связывающихся с Fc фагмидных частиц с 100 нМ биотинилированным FolR1 человека, обезьян циномолгус или мышей в течение 0,5 ч в присутствии 100 нМ неродственной небиотинилированной Реконструкции, созданной с помощью технологии «knob-into-hole», для дополнительного истощения связывающих Fc агентов в общем объеме 1 мл.
3. «Захват» биотинилированного FolR1 и присоединенного специфически связывающегося фага путем переноса в 4 лунки предварительно покрытого нейтравидином титрационного микропланшета в течение 10 мин (в раундах 1 и 3).
4. Промывка соответствующих лунок с использованием 5×ЗФР/Твин20 и 5×ЗФР.
5. Элюция фаговых частиц путем добавления по 250 мкл 100 мМ ТЭА (триэтиламин) на лунку в течение 10 мин и нейтрализация путем добавления 500 мкл 1М Трис/HCl, рН 7.4 к объединенным элюатам, полученным в 4 лунках.
6. Последующая очистка нейтрализованных элюатов путем инкубации на предварительно покрытом нейтравидином титрационном микропланшете с использованием 100 нМ связанного с биотином FolR2 или FolR3 для окончательного удаления связывающихся с Fc и неспецифических агентов.
7. Повторное заражение находящихся на логарифмической стадии клеток Е. coli TG1 супернатантом элюированных фаговых частиц, заражение хелперным фагом VCSM13, инкубация на шейкере при 30°С в течение ночи и последующее осаждение фагмидных частиц с помощью ПЭГ/NaCl для использования на следующем раунде селекции.
Селекции проводили, осуществляя 3 раунда с использованием постоянных концентраций антигена, составлявших 100 нМ. В раундах 2 и 4 во избежание обогащения агентами, связывающимися с нейтравидином, осуществляли «захват» комплексов антигенгфаг путем добавления 5,4×107 покрытых стрептавидином магнитных гранул. Специфические связывающие агенты идентифицировали с помощью ELISA следующим образом: 100 мкл 25 нМ биотинилированного FolR1 человека, обезьян циномолгус или мышей и 10 мкг/мл человеческого IgG наносили на нейтравидиновые планшеты и планшеты Maxisorp соответственно. Добавляли содержащие Fab бактериальные супернатанты и связывание Fab обнаруживали по их Flag-меткам с использованием вторичного антитела анти-Flag/HRP. Составляли шорт-лист клонов, дающих сигналы на человеческом FolR1 и дающих негативный ответ на человеческом IgG, для дальнейшего анализа и проводили их тестирование аналогичным образом в отношении FolR1 оставшихся двух видов. Их экспрессировали в бактериях в объеме культуры, составлявшем 0,5 л, осуществляли аффинную очистку и проводили дополнительную характеризацию с помощью SPR-анализа с использованием биосенсора ProteOn XPR36 фирмы BioRad. Аффинности (KD) отобранных клонов измеряли методом поверхностного плазмонного резонанса (SPR) с помощью устройства ProteOn XPR36 (фирма Biorad) при 25°С с использованием биотинилированного FolR1 человека, обезьян циномолгус или мышей, а также FolR2 и FolR3 человека (отрицательные контроли), иммобилизованных на чипах NLC посредством «захвата» нейтравидином. Иммобилизация антигенов (лиганд): рекомбинантные антигены разводили с помощью ЗФРТ (10 мМ фосфат, 150 мМ хлорид натрия, рН 7,4, 0,005% Твин 20) до 10 мкг/мл, затем инъецировали со скоростью 30 мкл/мин в вертикальной ориентации. Инъекция аналитов: Для измерений кинетических характеристик за один прогон («one-shot»-кинетика) направление инъекции изменяли на горизонтальную ориентацию, инъецировали двукратные серийные разведения очищенного Fab (варьируя диапазоны концентраций) одновременно вдоль отдельных каналов 1-5, продолжительность ассоциации составляла 200 с, а продолжительность диссоциации составляла 600 с. Вдоль шестого канала инъецировали буфер (ЗФРТ), создавая «параллельный» («in-line») пустой контроль для сопоставления. Константы скорости диссоциации (koff) рассчитывали с использованием простой модели связывания 1:1 Ленгмюра с помощью программного обеспечения ProteOn Manager v 3.1 путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия диссоциации (KD) рассчитывали в виде отношения koff/kon. - В таблице 5 перечислены константы равновесия диссоциации (KD) отобранных клонов, обладающих специфичностью в отношении FolR1.
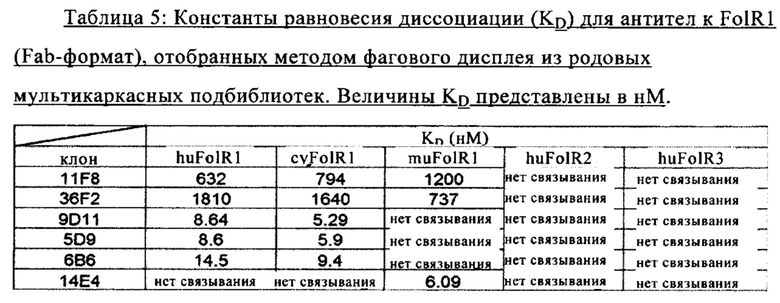
Пример 8
Получение и очистка новых FolR1-связывающих агентов в формате IgG и форматах активирующих Т-клетку биспецифических молекул
Для идентификации FolR1-связывающих агентов, которые обладают способностью индуцировать зависящий от Т-клеток цитолиз выбранных клеток-мишеней, антитела, выделенные из библиотеки общих легких цепей или Fab-фрагментов, превращали в соответствующий формат человеческого IgG1. В целом метод заключался в следующем. Вариабельные тяжелые и вариабельные легкие цепи уникальных FolR1-связывающих агентов, полученных с помощью фагового дисплея, амплифицировали, осуществляя стандартные ПЦР-реакции с использованием клонов Fab в качестве матрицы. ПЦР-продукты очищали и встраивали (либо посредством клонирования, основанного на применении рестрикционной эндонуклеазы и лигазы, либо посредством «рекомбинации» с использованием набора InFusion фирмы Invitrogen) в пригодные экспрессионные векторы, в которых их сливали с соответствующей человеческой константной тяжелой или человеческой константной легкой цепью. Кассеты экспрессии в этих векторах включали химерный промотор MPSV и синтетический сайт полиаденилирования. Кроме того, плазмиды содержали область oriP из вируса Эпштейна-Барра для поддержания плазмид в стабильном состоянии в клетках HEK293, несущих ядерный антиген EBV (EBNA). После опосредованной ПЭИ трансфекции антитела кратковременно продуцировали в клетках HEK293 EBNA и очищали с помощью стандартной аффинной хроматографии с использованием белка А и последующей гель-фильтрации согласно описанному методу:
Кратковременная трансфекция и получение
Все используемые согласно настоящему изобретению (биспецифические) антитела (если их не приобретали у коммерческих поставщиков) кратковременно получали в клетках HEK293 EBNA с применением описанной ниже процедуры опосредуемой ПЭИ трансфекции с использованием соответствующих векторов. Клетки HEK293 EBNA культивировали в бессывороточной суспензии в среде CD СНО. Для получения во встряхиваемую колбу вместимостью 500 мл высевали за 24 ч до трансфекции 400 млн клеток HEK293 EBNA (для других масштабов производства все количества регулировали соответствующим образом). Для осуществления трансфекции клетки центрифугировали в течение 5 мин при 210×g, супернатант заменяли на 20 мл предварительно нагретой среды CD СНО. Экспрессионные векторы смешивали в 20 мл среды CD СНО до получения конечного количества 200 мкг ДНК. После добавления 540 мкл ПЭИ раствор интенсивно перемешивали в течение 15 с и затем инкубировали в течение 10 мин при комнатной температуре. Затем клетки смешивали с раствором ДНК/ПЭИ, переносили в 500-миллилитровую встряхиваемую колбу и инкубировали в течение 3 ч при 37°С в инкубаторе в атмосфере с 5% СО2. После инкубации добавляли 160 мл среды F17 и клетки культивировали в течение 24 ч. Через 1 день после трансфекции добавляли 1 мМ вальпроевую кислоту и 7% Feed 1. После культивирования в течение 7 дней супернатант собирали для очистки путем центрифугирования в течение 15 мин при 210×g, раствор стерилизовали фильтрацией (фильтр с размером пор 0,22 мкм), добавляли азид натрия в конечной концентрации 0,01% (мас./об.) и выдерживали при 4°С. После завершения производства супернатанты собирали, фильтровали содержащие антитело супернатанты через стерильные фильтры с размером пор 0,22 мкм и хранили при 4°С до очистки.
Очистка антител
Все молекулы подвергали двухстадийной очистке с применением стандартных процедур, таких как аффинная очистка с использованием белка А (фирма  Explorer) и гель-фильтрация. Значение рН супернатанта, полученного посредством кратковременного производства, доводили до рН 8,0 (используя 2М Трис, рН 8,0) и вносили в колонку HiTrap PA FF (фирма GE Healthcare, объем колонки (cv) = 5 мл), уравновешенную взятым в объеме, равном 8 объемам колонки (cv), буфером А (20 мМ фосфат натрия, 20 мМ цитрат натрия, рН 7,5). После промывки с использованием 10 cv буфера А белок элюировали, применяя градиент рН до буфера Б (20 мМ цитрат натрия, рН 3, 100 мМ NaCl, 100 мМ глицин) с использованием объема, равного 12 cv. Объединяли фракции, содержащие представляющий интерес белок и значение рН раствора осторожно доводили до рН 6,0 (используя 0,5М Na2HPO4, рН 8,0). Образцы концентрировали до 2 мл с использованием ультра-концентраторов (Vivaspin 15R 30.000 MWCO HY, фирма Sartorius) и затем вносили в колонку для препаративной хроматографии HiLoad™ 16/60 Superdex™ 200 (фирма GE Healthcare), уравновешенную буфером, содержащим 20 мМ гистидин, рН 6,0, 140 мМ NaCl, 0,01% Твин-20. Содержание агрегатов в элюированных фракциях анализировали с помощью аналитической гель-фильтрации. Для этого по 30 мкл каждой фракции вносили в колонку для аналитической гель-фильтрации TSKgel G3000 SW XL (фирма Tosoh), уравновешенную подвижным буфером, содержащим 25 мМ K2HPO4, 125 мМ NaCl, 200 мМ моногидрохлорид L-аргинина, 0,02% (мас./об.) NaN3, рН 6,7 при 25°С. Фракции, содержащие менее 2% олигомеров, объединяли и концентрировали до конечной концентрации 1-1,5 мг/мл с использованием ультра-концентраторов (Vivaspin 15R 30.000 MWCO HY, фирма Sartorius). Концентрацию белка определяли путем измерения оптической плотности (ОП) при 280 нм, используя коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности. Чистоту и молекулярную массу конструкций анализировали с помощью капиллярного электрофореза в присутствии ДСН с восстанавливающим агентом и без него согласно инструкциям производителя (устройство Caliper LabChipGX, фирма Perkin Elmer). Очищенные белки замораживали в жидком N2 и хранили при -80°С.
Explorer) и гель-фильтрация. Значение рН супернатанта, полученного посредством кратковременного производства, доводили до рН 8,0 (используя 2М Трис, рН 8,0) и вносили в колонку HiTrap PA FF (фирма GE Healthcare, объем колонки (cv) = 5 мл), уравновешенную взятым в объеме, равном 8 объемам колонки (cv), буфером А (20 мМ фосфат натрия, 20 мМ цитрат натрия, рН 7,5). После промывки с использованием 10 cv буфера А белок элюировали, применяя градиент рН до буфера Б (20 мМ цитрат натрия, рН 3, 100 мМ NaCl, 100 мМ глицин) с использованием объема, равного 12 cv. Объединяли фракции, содержащие представляющий интерес белок и значение рН раствора осторожно доводили до рН 6,0 (используя 0,5М Na2HPO4, рН 8,0). Образцы концентрировали до 2 мл с использованием ультра-концентраторов (Vivaspin 15R 30.000 MWCO HY, фирма Sartorius) и затем вносили в колонку для препаративной хроматографии HiLoad™ 16/60 Superdex™ 200 (фирма GE Healthcare), уравновешенную буфером, содержащим 20 мМ гистидин, рН 6,0, 140 мМ NaCl, 0,01% Твин-20. Содержание агрегатов в элюированных фракциях анализировали с помощью аналитической гель-фильтрации. Для этого по 30 мкл каждой фракции вносили в колонку для аналитической гель-фильтрации TSKgel G3000 SW XL (фирма Tosoh), уравновешенную подвижным буфером, содержащим 25 мМ K2HPO4, 125 мМ NaCl, 200 мМ моногидрохлорид L-аргинина, 0,02% (мас./об.) NaN3, рН 6,7 при 25°С. Фракции, содержащие менее 2% олигомеров, объединяли и концентрировали до конечной концентрации 1-1,5 мг/мл с использованием ультра-концентраторов (Vivaspin 15R 30.000 MWCO HY, фирма Sartorius). Концентрацию белка определяли путем измерения оптической плотности (ОП) при 280 нм, используя коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности. Чистоту и молекулярную массу конструкций анализировали с помощью капиллярного электрофореза в присутствии ДСН с восстанавливающим агентом и без него согласно инструкциям производителя (устройство Caliper LabChipGX, фирма Perkin Elmer). Очищенные белки замораживали в жидком N2 и хранили при -80°С.
На основе результатов характеризации in vitro отобранные связывающие агенты конвертировали в формат активирующей Т-клетку биспецифической молекулы. В этих молекулах связывающие FolR1:CD3 фрагменты расположены в соответствии со схемой 2:1, при этом связывающие FolR1 Fab-фрагменты локализованы на N-конце. Для клонов, выделенных из стандартной библиотеки Fab, CD3-связывающий фрагмент создавали в виде CrossFab (скрещивание СН1Сκ), в то время как для клонов, полученных с использованием библиотеки общих легких цепей, скрещивание не требовалось осуществлять. Указанные биспецифические молекулы получали и очищали аналогично процедуре, которую применяли для IgG.
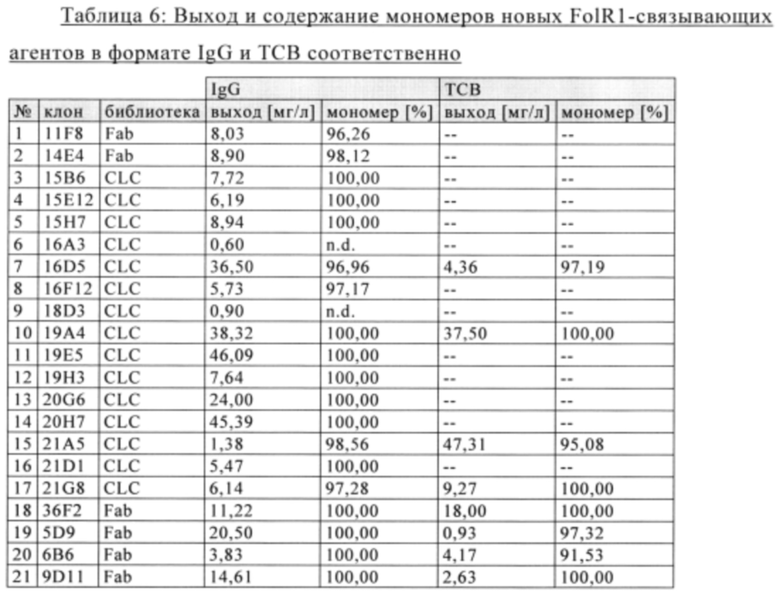
CLC: общая легкая цепь
Пример 9
Форматы «2+1» и «1+1» активирующих Т-клетку биспецифических молекул
Получали четыре различных формата активирующих Т-клетку биспецифических молекул для имеющего одну общую легкую цепь связывающего агента (16D5) и три формата для одного связывающего агента из библиотеки Fab (9D11) для сравнения их способности к цитолизу in vitro.
Стандартным форматом является уже описанный формат «2+1 инвертированная» (FolR1:CD3-связывающие фрагменты, расположенные в соответствии со схемой 2:1, где FolR1-связывающие Fab находятся на N-конце). В классическом формате 2+1 FolR1:CD3-связывающие фрагменты расположены в соответствии со схемой 2:1, где CD3-связывающий Fab находится на N-конце. Получали также два одновалентных формата. В формате «1+1 «голова-к хвосту»» FolR1:CD3-связывающие фрагменты расположены в соответствии со схемой 1:1 на одном и том же плече молекулы, при этом FolR1-связывающий Fab находится на N-конце. В классическом формате «1+1» присутствует по любому из FolR1:CD3-связывающих фрагментов, каждый из которых находится на одном плече молекулы. Для клона 9D11, выделенного из стандартной библиотеки Fab, CD3-связывающий фрагмент создавали в виде CrossFab (скрещивание СН1Сκ), в то время как для 16D5, полученного с использованием библиотеки общих легких цепей, скрещивание не требовалось. Указанные биспецифические молекулы получали и очищали аналогично процедуре, которую применяли для стандартного инвертированного формата активирующей Т-клетку биспецифической молекулы.
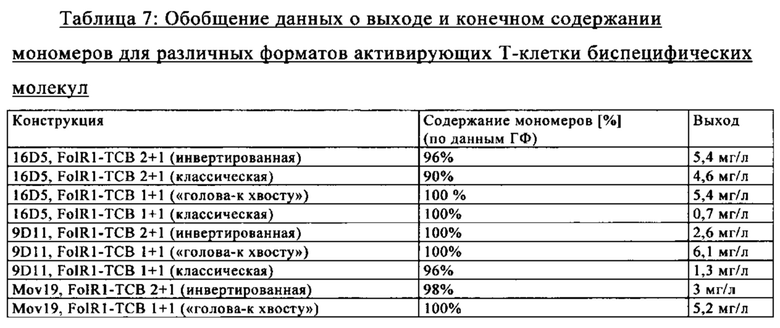
Пример 10
Определение биохимических характеристик FolR1-связывающих агентов с помощью поверхностного плазмонного резонанса
Связывание FolR1-связывающих агентов в виде IgG или в формате активирующей Т-клетку биспецифической молекулы с различными рекомбинантными фолатными рецепторами (человеческие FolR1, 2 и 3, мышиный FolR1 и FolR1 обезьян циномолгус; все в виде слияний с Fc) оценивали с помощью поверхностного плазмонного резонанса (SPR). Все эксперименты с применением SPR осуществляли на устройстве Biacore T200 при 25°С с использованием HBS-EP в качестве подвижного буфера (0,01М HEPES, рН 7,4, 0.15М NaCl, 3мМ ЭДТА, 0,005% сурфактант Р20, фирма Biacore, Фрейбург, Германия).
Однократные инъекции
Сначала анализировали анти-FolR1 IgG, осуществляя однократные инъекции (таблица 1), для характеризации их кросс-реактивности (к FolR1 человека, мышей и обезьян циномолгус) и специфичности (в отношении человеческого FolR1, человеческого FolR2, человеческого FolR3). Осуществляли непосредственное сочетание слияний рекомбинантного биотинилированного мономерного Fc с фолатным рецептором 1 человека, обезьян циномолгус и мышей (FolR1-Fc) или человеческим фолатным рецептором 2 и 3 (FolR2-Fc, FolR3-Fc) с SA-чипом согласно инструкции по осуществлению стандартного сочетания (фирма Biacore, Фрейбург, Германия). Уровень иммобилизации составлял примерно 300-400 RU. IgG инъецировали в течение 60 с в концентрации 500нМ. Антитела в виде IgG, связывающиеся с huFolR2 и huFolR3, отбраковывали вследствие отсутствия специфичности. Большинство связывающих агентов обладали кросс-реактивностью только к человеческому и cynoFolR1, дополнительная кросс-реактивность к мышиному FolR1 в большинстве случаев сопровождалась потерей специфичности.
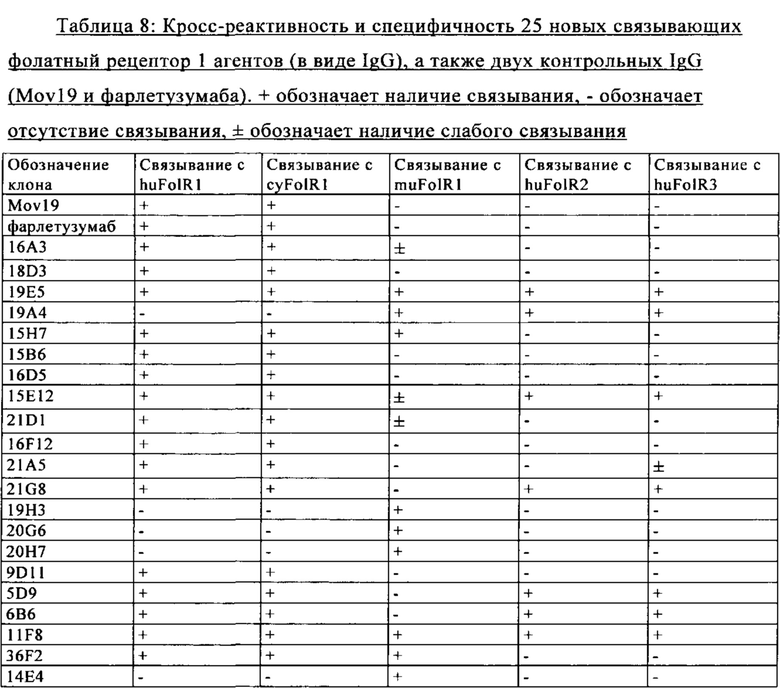
Авидность к фолатному рецептору 1
Авидность взаимодействия между анти-FolR1 IgG или активирующими Т-клетку биспецифическими молекулами и рекомбинантными фолатными рецепторами определяли согласно описанному ниже методу (таблица 9).
Осуществляли непосредственное сочетание слияний рекомбинантного биотинилированного мономерного Fc с фолатным рецептором 1 человека, обезьян циномолгус и мышей (FolR1-Fc) с SA-чипом согласно инструкции по осуществлению стандартного сочетания (фирма Biacore, Фрейбург, Германия). Уровень иммобилизации составлял примерно 300-400 RU. Анти-FolR1 IgG или активирующие Т-клетку биспецифические молекулы в диапазоне концентраций от 2,1 до 500нМ пропускали со скоростью 30 мкл/мин через проточные ячейки в течение 180 с. Мониторинг диссоциации осуществляли в течение 600 с. Все различия в коэффициенте преломления корректировали путем вычитания ответа, полученного в проточной референс-ячейке с иммобилизованным слиянием рекомбинантный биотинилированный рецептор IL2-Fc. Для анализа взаимодействия между 19Н3 IgG и мышиным фолатным рецептором 1, добавляли фолат (фирма Sigma, каталожный номер F7876) в проточном буфере HBS-EP в концентрации 2,3мкМ. Кривые связывания, полученные в результате двухвалентного связывания IgG или активирующих Т-клетку биспецифических молекул, аппроксимировали на основе модели связывания по типу 1:1 Ленгмюра и подгоняли к этой модели (что не является корректным, но позволяет судить об авидности). Кажущиеся константы авидности, характеризующие взаимодействия, получали на основе констант скорости, определенных в результате подгонки с использованием программного обеспечения Bia Evaluation (фирма GE Healthcare).
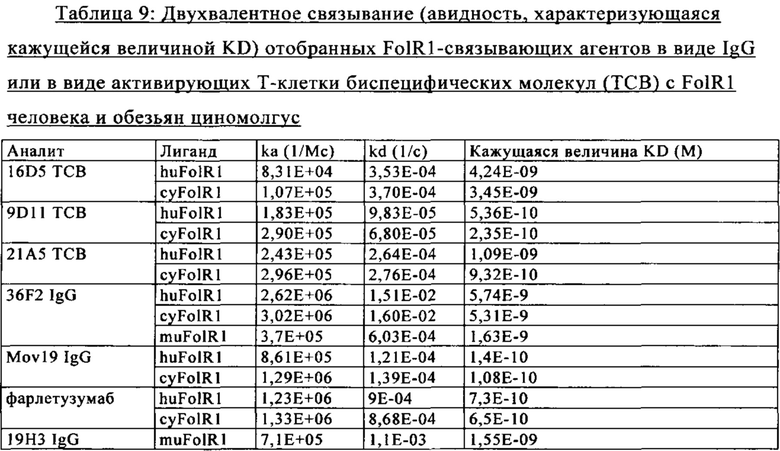
Аффинность к фолатному рецептору 1
Аффинность взаимодействия между анти-FolR1 IgG или активирующими Т-клетку биспецифическими молекулами и рекомбинантными фолатными рецепторами определяли согласно описанному ниже методу (таблица 10).
Для измерения аффинности осуществляли непосредственное сочетание античеловеческого Fab-специфического антитела (набор для «захвата» Fab, фирма GE Healthcare) до достижения уровня, соответствующего примерно 6000-7000 резонансных единиц (RU), на СМ5-чипе при рН 5,0 с использованием набора для осуществления стандартного аминного сочетания (фирма GE Healthcare). Анти-FolR1 IgG или активирующие Т-клетки биспецифические молекулы в концентрации 20нМ «захватывали» при скорости потока 10 мкл/мин в течение 20 или 40 с, в проточной референс-ячейке «захват» не осуществляли. Через все проточные ячейки пропускали серийные разведения (от 6,17 до 500нМ или от 12,35 до 3000нМ) слияний человеческий или обезьяний (циномолгус) фолатный рецептор 1-Fc при скорости потока 30 мкл/мин в течение 120 или 240 с для регистрации фазы ассоциации. Мониторинг фазы диссоциации осуществляли в течение 240 с и для запуска заменяли раствор для образца на HBS-EP. Поверхность чипа регенерировали после каждого цикла, используя две инъекции по 60 с с использованием 10мМ глицина-HCl, рН 2,1. Различия всех показателей преломления корректировали путем вычитания ответа, полученного в проточной референс-ячейке 1. Константы аффинности, характеризующие взаимодействия, определяли на основе констант скорости путем подгонки к модели связывания 1:1 Ленгмюра, используя программное обеспечение Bia Evaluation (фирма GE Healthcare).

Аффинность к CD3
Аффинность взаимодействия между анти-FolR1 активирующими Т-клетку биспецифическими молекулами и слиянием рекомбинантный человеческий CD3εδ-Fc определяли согласно описанному ниже методу (таблица 11).
Для измерения аффинности осуществляли непосредственное сочетание античеловеческого Fab-специфического антитела (набор для «захвата» Fab, фирма GE Healthcare) до достижения уровня, соответствующего примерно 9000 резонансных единиц (RU), с СМ5-чипом при рН 5,0 с использованием набора для осуществления стандартного аминного сочетания (фирма GE Healthcare). Анти-FolR1 активирующие Т-клетки биспецифические молекулы в концентрации 20 нМ «захватывали» при скорости потока 10 мкл/мин в течение 40 с, в проточной референс-ячейке «захват» не осуществляли. Через все проточные ячейки пропускали серийные разведения (от 6,17 до 500нМ) слияния человеческий CD3εδ-Fc при скорости потока 30 мкл/мин в течение 240 с для регистрации фазы ассоциации. Мониторинг фазы диссоциации осуществляли в течение 240 с и для запуска заменяли раствор образца на HBS-EP. Поверхность чипа регенерировали после каждого цикла с помощью двух инъекций глицина-HCl в концентрации 10мМ, рН 2,1, в течение 60 с каждая. Различия всех показателей преломления корректировали путем вычитания ответа, полученного в проточной референс-ячейке 1. Константы аффинности, характеризующие взаимодействия, определяли на основе констант скорости путем подгонки к модели связывания 1:1 Ленгмюра, используя программное обеспечение Bia Evaluation (фирма GE Healthcare).

CD3-связывающий фрагмент был одинаковым для всех конструкций и аффинность оказалась сходной для проанализированных активирующих Т-клетки биспецифических молекул (величины KD находились в диапазоне от 60 до 90нМ).
Пример 11
Одновременное связывание активирующих Т-клетки биспецифических молекул с фолатным рецептором 1 и CD3
Одновременное связывание анти-FolR1 активирующих Т-клетки биспецифических молекул с рекомбинантным фолатным рецептором 1 и слиянием рекомбинантный человеческий CD3εδ-Fc определяли с помощью поверхностного плазменного резонанса согласно описанному ниже методу. Осуществляли непосредственное сочетание слияний рекомбинантного биотинилированного мономерного Fc с рецептором 1 человека, обезьян циномолгус и мышей (FolR1-Fc) с SA-чипом согласно стандартным инструкциям по осуществлению сочетаний (фирма Biacore, Фрейбург, Германия). Уровень иммобилизации составлял примерно 300-400 RU. Анти-FolR1 активирующие Т-клетки биспецифические молекулы в концентрации 500нМ инъецировали в течение 60 с при скорости потока 30 мкл/мин через проточные ячейки, после чего осуществляли инъекцию hu CD3εδ-Fc в концентрации 500нМ в течение 60 с. Различия всех показателей преломления корректировали путем вычитания ответа, полученного в проточной референс-ячейке с иммобилизованным слиянием рекомбинантный биотинилированный рецептор IL2-Fc. Четыре протестированные активирующие Т-клетки биспецифические молекулы (16D5 ТСВ, 21А5 ТСВ, 51С7 ТСВ и 45D2 ТСВ), как и ожидалось, обладали способностью к одновременному связыванию с фолатным рецептором 1 и человеческим CD3.
Пример 12
Группировка в зависимости от эпитопа
Для группировки в зависимости от эпитопа осуществляли непосредственную иммобилизацию анти-FolR1 IgG или активирующих Т-клетки биспецифических молекул на СМ5-чипе при рН 5,0 с использованием набора для стандартного аминного сочетания (фирма GE Healthcare) до достижения конечного ответа, соответствующего примерно 700 RU. После этого осуществляли «захват» 500нМ huFolR1-Fc в течение 60 с, а затем различных связывающих агентов в концентрации 500нМ в течение 30 с. Поверхность регенерировали, осуществляя две инъекции с использованием 10мМ глицина, рН 2, в течение 30 с каждая. Оценивали, могут ли различные связывающие агенты связываться с huFolR1, «захваченном» иммобилизованными связывающими агентами (таблица 12).

На основе этих результатов и дополнительных данных об одновременном связывании на иммобилизованном huFolR1 связывающие агенты были разделены на три группы. Осталось невыясненным, имеет ли 9D11 отдельный эпитоп, поскольку его вытесняли все другие связывающие агенты. 16D5 и 21А5, по-видимому, входят в одну группу, a Mov19, фарлетузумаб (Coney и др.. Cancer Res., 51(22), 15 ноября 1991 г., сс. 6125-6132; Kalli и др., Curr Opin Investig Drugs., 8(12), декабрь 2007 г., сс. 1067-1073) и 36F2 входят в другую группу (таблица 13). Однако 36F2 связывался с эпитопом, отличным от того, с которым связывались Mov 19 и фарлетузумаб, поскольку он связывался с FolR1 человека, обезьян циномолгус и мышей.

Пример 13
Отбор связывающих агентов
Осуществляли скрининг FolR1-связывающих агентов в формате IgG с помощью поверхностного плазменного резонанса (SPR) и анализа in vitro на клетках для отбора наиболее перспективных кандидатов.
Анти-FolR1 IgG анализировали с помощью SPR для характеризации их кросс-реактивности (к FolR1 человека, мышей и обезьян циномолгус) и специфичности (в отношении человеческого FolR1, человеческого FolR2, человеческого FolR3). Неспецифическое связывание с человеческим FolR2 и 3 рассматривали как критерий исключения. Данные о связывании и специфичности в отношении человеческого FolR1 подтверждали на клетках.
Некоторые связывающие агенты не связывались на клетках, экспрессирующих FolR1, даже несмотря на то, что они распознавали рекомбинантный человеческий FolR1 по данным анализа методом SPR. Определяли температуру агрегации, но ее не рассматривали в качестве критерия исключения, поскольку все отобранные связывающие агенты были стабильными. Отобранные связывающие агенты тестировали с помощью ELISA для определения полиреактивности с целью проверки наличия неспецифического связывания, что привело к исключению четырех связывающих агентов. В результате этого процесса сначала были отобраны три связывающих агента: 36F2 (библиотека Fab), 9D11 (библиотека Fab) и 16D5 (общая легкая цепь). Диссоциация 36F2 из комплекса с huFolR1 происходила слишком быстро, и, следовательно, сразу было очевидно, что он не обладал преимуществом.
Пример 14
Специфическое связывание новых сконструированных FolR1-связывающих агентов с позитивными по человеческому FolR1 опухолевыми клетками
Новые FolR1-связывающие агенты конструировали с помощью метода фагового дисплея с использованием либо библиотеки Fab, либо библиотеки общих легких цепей, созданных с использованием легкой цепи CD3. Идентифицированные связывающие агенты конвертировали в формат человеческого IgG1 и анализировали связывание с характеризующимися высоким уровнем экспрессии FolR1 клетками HeLa. В качестве референс-молекулы применяли связывающий человеческий FolR1 клон Mov19. Большинство из протестированных в этом опыте связывающих агентов характеризовались уровнем связывания с FolR1 от промежуточного до высокого, при этом некоторые клоны обладали такой же способностью к связыванию, что и Mov19 (см. фиг. 2). Клоны 16А3, 18D3, 15Н7, 15В6, 21D1, 14Е4 и 16F12 были исключены, поскольку их связывание с FolR1 на клетках не удалось подтвердить с помощью проточной цитометрии. На следующей стадии отобранные клоны тестировали в отношении специфичности к человеческому FolR1, исключая клоны, которые связывались с близко родственным человеческим FolR2. Для анализа специфичности клетки НЕК кратковременно трансфектировали либо человеческим FolR1, либо человеческим FolR2. Клоны 36F2 и 9D11, полученные из библиотеки Fab, и клоны 16D5 и 21А5, полученные из библиотеки CLC, специфически связывались с человеческим FolR1 и не связывались с человеческим FolR2 (см. фиг. 3А-Б). Все другие протестированные клоны обладали по меньшей мере небольшой способностью связываться с человечески FolR2 (см. фиг. 3А-Б). Вследствие этого указанные клоны были исключены при проведении дальнейшей характеризации. Параллельно анализировали кросс-реактивность связывающих FolR1 клонов с cynoFolR1, изучая способность к связыванию с клетками НЕК, кратковременно трансфектированными cynoFolR1. Все протестированные клоны обладали способностью к связыванию с cynoFolR1, а четыре отобранных специфических в отношении человеческого FoLR1 клона 36F2, 9D11, 16D5 и 21А5 обладали сопоставимой высокой способностью к связыванию с человеческим FoLR1 и cynoFoLR1 (фиг. 4). Затем три специфических в отношении человеческого FolR1 связывающих агента, обладающих кросс-реактивностью с cynoFolR1, конвертировали в формат ТСВ и тестировали в отношении индукции опосредованного Т-клеткой цитолиза и активации Т-клеток. Указанные клоны представляли собой клон 9D11, полученный из библиотеки Fab и клоны 16D5 и 21А5 из библиотеки CLC. В качестве референс-молекулы во всех исследованиях применяли FolR1-ТСВ Mov19. Затем указанные FolR1-TCB применяли для сравнения индукции интернализации после связывания с FolR1 на клетках HeLa. Все три протестированных клона характеризовались интернализацией после связывания с FolR1, сопоставимой с интернализацией после связывания FoLR1-ТСВ Mov19 (фиг. 5). Изучение FolR1-TCB 21А5 прекратили вследствие обнаружения признаков полиреактивности.
Пример 15
Опосредуемый Т-клеткой цитолиз экспрессирующих FolR1 опухолевых клеток-мишеней, индуцируемый антителами FolR1-TCB
FolR1-TCB применяли для оценки опосредуемого Т-клеткой цитолиза опухолевых клеток, экспрессирующих FoLR1. Для определения сайтов связывания FoLR1 с помощью анализа с использованием набора Qifikit применяли панель линий потенциальных клеток-мишеней.
Применяемая панель опухолевых клеток включала опухолевые клетки с высоким, промежуточным и низким уровнем экспрессии FolR1 и FolR1-негативную линию клеток.
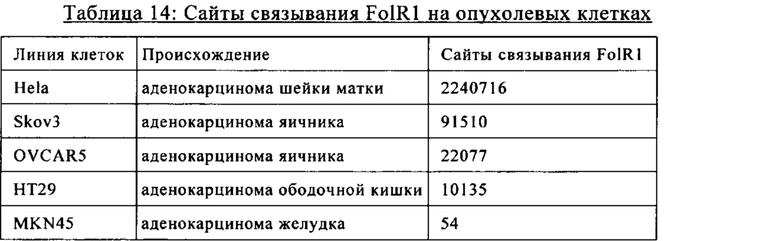
Оценивали связывание трех различных FoLR1-TCB (включая связывающие агенты 9D11, 16D5 и Mov19) с указанной панелью линий опухолевых клеток и было продемонстрировано, что FoLR1-TCB специфически связывались с экспрессирующими FolR1 опухолевыми клетками и не связывались с FoLR1-негативной линией опухолевых клеток. Количество связанных конструкций пропорционально уровню экспрессии FolR1 и при этом оказалось возможным обнаружить все еще достаточно высокий уровень связывания с линией клеток НТ-29, характеризующейся низким уровнем экспрессии FolR1. Кроме того, не было выявлено связывания служащей в качестве отрицательного контроля ТСВ DP47 ни с одной из применявшихся клеточных линий (фиг. 6А-Д).
Затем клеточную линию SKOV3, характеризующуюся промежуточным уровнем экспрессии, и клеточную линию НТ-29, характеризующуюся низким уровнем экспрессии, использовали для тестирования опосредуемого Т-клетками цитолиза и активации Т-клеток с использованием ТСВ 16D5 и ТСВ 9D11; ТСВ DP47 включали в качестве отрицательного контроля. Обе клеточные линии погибали уже в присутствии низких уровней ТСВ 16D5 и ТСВ 9D11, и при этом не было обнаружено различия в активности между обеими ТСВ даже несмотря на то, что ТСВ 9D11 обладала более сильной способностью к связыванию с FolR1, чем ТСВ 16D5. Общий уровень цитолиза клеток SKOV3 был выше по сравнению с НТ-29, что отражает более высокие уровни экспрессии FolR1 на клетках SKOV3 (фиг. 7А-Г). С этим согласуется и то, что была выявлена сильная повышающая регуляция маркера активации CD25 и CD69 на CD4+-Т-клетках и CD8+-Т-клетках. Активация Т-клеток оказалась очень сходной в присутствии как клеток SKOV3, так и клеток НТ-29. Применяемая в качестве отрицательного контроля ТСВ DP47 не индуцировала цитолиз в применявшихся концентрациях, и не было выявлено значимой повышающей регуляции CD25 и CD69 на Т-клетках.
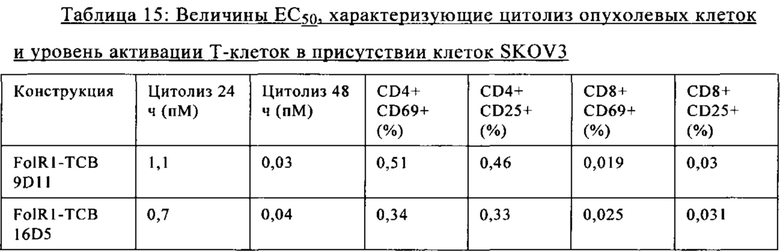
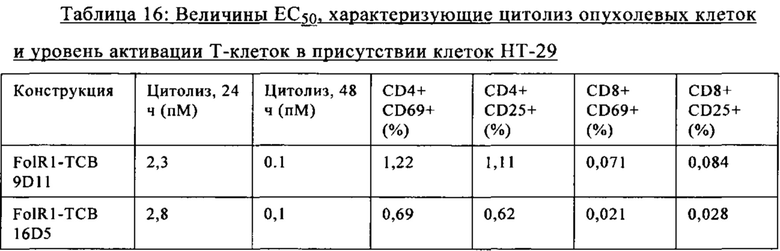
Пример 16
Связывание с эритроцитами и активация Т-клеток в цельной крови
Для доказательства того, что спонтанная активация не имеет места в отсутствии экспрессирующих FoLR1 опухолевых клеток, при создании изобретения было проведено исследование вопроса о том, происходит ли связывание FolR1-связывающих клонов с эритроцитами, которые потенциально могут экспрессировать FolR1. Не было выявлено никакого специфического связывания IgG 9D11, IgG 16D5 и IgG Mov19 с эритроцитами, при этом в качестве отрицательного контроля применяли IgG DP47 (фиг. 8).
Для того чтобы исключить любое другое неспецифическое связывание с клетками крови или неспецифическую активацию через FoLR1-TCB, в цельную кровь добавляли ТСВ 9D11, ТСВ 16D5 и ТСВ Mov19 и анализировали повышающую регуляцию CD25 и CD69 на CD4+-Т-клетках CD8+-Т-клетках с помощью проточной цитометрии. ТСВ DP47 включали в качестве отрицательного контроля. При анализе повышающей регуляции CD25 и CD69 на CD4+-Т-клетках CD8+-Т-клетках не было обнаружено активации Т-клеток любой из протестированных конструкций (фиг. 9).
Пример 17
Опосредуемый Т-клетками цитолиз, индуцированный ТСВ 36F2 и ТСВ 16D5 в различных одновалентных и двухвалентных форматах активирующих Т-клетки биспецифических молекул
Оценивали опосредуемый Т-клетками цитолиз человеческих опухолевых клеток Hela, Skov-3 (средний уровень FolR1, примерно 70000-90000 копий) и НТ-29 (низкий уровень FolR1, примерно 10000 копий), индуцированный антителами ТСВ 36F2, ТСВ 16D5, ТСВ 16D5 в формате «ТСВ классическая», ТСВ 16D5 в формате «ТСВ 1+1» и ТСВ 16D5 в формате «ТСВ НТ». Антитело, представляющее собой ТСВ DP47, включали в качестве отрицательного контроля. Человеческие РВМС применяли в качестве эффекторных клеток, и цитолиз оценивали после инкубации в течение 24 ч с биспецифическим антителом. В целом метод состоял в следующем: клетки-мишени собирали с использованием трипсина/ЭДТА, промывали и высевали с плотностью 25000 клеток/лунку в плоскодонные 96-луночные планшеты. Клеткам давали прикрепиться в течение ночи. Мононуклеарные клетки периферической крови (РВМС) получали путем центрифугирования в градиенте плотности Histopaque из обогащенных лимфоцитами препаратов (лейкоцитарные пленки), полученных из крови здоровых доноров. Свежую кровь разводили стерильным ЗФР и наслаивали на градиент Histopaque (фирма Sigma, H8889). После центрифугирования (450 × g, 30 мин, комнатная температура) часть плазмы, находящуюся над содержащей РВМС интерфазой, отбрасывали и РВМС переносили в новую фальконовскую пробирку, которую затем заполняли 50 мл ЗФР. Смесь центрифугировали (400 × g, 10 мин, комнатная температура), супернатант отбрасывали и дебрис РВМС промывали дважды стерильным ЗФР (стадии центрифугирования при 350 × g, 10 мин). Осуществляли автоматический подсчет полученной популяции РВМС (устройство ViCell) и хранили в среде RPMI 1640, содержащей 10% FCS и 1% L-аланил-L-глутамина (фирма Biochrom, K0302) при 37°С, 5% СО2 в инкубаторе для клеток до дальнейшего использования (не более 24 ч). Для анализа цитолиза антитело добавляли в указанных концентрациях (в диапазоне от 0,01 пМ до 100 нМ в трех повторностях). Добавляли РВМС к клеткам-мишеням в конечном соотношении Е:Т = 10:1. Цитолиз клеток-мишеней оценивали после инкубации в течение 24 ч при 37°С, 5% СО2 путем количественной оценки высвобождения ЛДГ в клеточные супернатанты апоптозными/некротическими клетками (набор для обнаружения ЛДГ, фирма Roche Applied Science, каталожный номер 11644793001). Максимальный лизис клеток-мишеней (=100%) достигался при инкубации клеток-мишеней в присутствии 1% Тритона Х-100. Минимальный лизис (=0%) соответствовал лизису при совместной инкубации клеток-мишеней с эффекторными клетками без биспецифических конструкций.
Результаты продемонстрировали мишень-специфический цитолиз всех трех линий FolR1+ - клеток-мишеней, индуцированный ТСВ 36F2 и ТСВ 16D5 (фиг. 10).
Пример 18
Создание антител к TIM3
Иммунизация мышей Мышей линии NMRI иммунизировали генетически, используя плазмидный экспрессионный вектор, кодирующий полноразмерный человеческий TIM3, путем внутрикожного введения 100 мкг векторной ДНК (плазмида 15304_hTIM3-f1) с последующей электропорацией (2 квадратных импульса по 1000 В/см, продолжительность 0,1 мс, интервал 0,125 с; затем 4 квадратных импульса по 287,5 В/см, продолжительность 10 мс, интервал 0,125 с. Мышей подвергали любым 6 последовательным иммунизациям в дни 0, 14, 28, 42, 56, 70 и 84. Образцы крови брали в дни 36, 78 и 92 и получали сыворотку, которую использовали для определения титра с помощью ELISA (см. ниже).
Животных с наиболее высокими титрами отбирали для бустерной иммунизации в день 96 путем внутривенной инъекции 50 мкг химеры рекомбинантный человеческий TIM3-человеческий Fc и моноклональные антитела выделяли, используя технологию гибридом, путем слияния спленоцитов с клеточной линией миеломы через 3 дня после бустерной иммунизации.
Определение титров в сыворотке (ELISA) Химеру человеческий рекомбинантный TIM3-человеческий Fc иммобилизовали на 96-луночном планшете Maxisorp (фирма NUNC) в концентрации 0,3 мкг/мл, 100 мкл/лунку в ЗФР, после чего: блокировали планшет с помощью 2% Crotein С в ЗФР, 200 мкл/лунку; вносили серийные разведения антисыворотки в двух повторностях в 0,5% Crotein С в ЗФР, 100 мкл/лунку; осуществляли обнаружения с помощью конъюгированного с HRP козьего антимышиного антитела (фирма Jackson Immunoresearch/Dianova 115-036-071; 1/16 000). При осуществлении всех стадий планшеты инкубировали в течение 1 ч при 37°С. Между всеми стадиями планшеты промывали 3 раза 0,05% Твин 20 в ЗФР. Сигнал выявляли путем добавления растворимого субстрата ВМ Blue POD (фирма Roche), 100 мкл/лунку; и реакцию прекращали путем добавления 1М HCl, 100 мкл/лунку. Абсорбцию определяли при 450 нм, используя волну длиной 690 нм в качестве референс-волны. Титр определяли как разведение антисыворотки, обеспечивающее сигнал, составляющий половину от максимального.
Пример 19
Характеризация антител к Tim3
ELISA для Tim3. Сенсибилизированные стрептавидином планшеты Nunc-Maxi Sorp (фирма MicroCoat, №1974998/МС1099) покрывали, применяя из расчета 25 мкл/лунку Tim3-ECD-His-биотин (биотинилированный с помощью лигазы BirA) и инкубировали при КТ в течение 1 ч при встряхивании при скорости вращения 400 об/мин. После промывки (3×90 мкл/лунку ЗФРТ-буфера) добавляли 25 мкл образцов антител к Tim3 или разведенное (серийные разведения 1:2) референс-антитело к Tim3 F38-2E2 (фирма Biolegend) и инкубировали в течение 1 ч при КТ. После промывки (3×90 мкл/лунку ЗФРТ-буфера) добавляли 25 мкл/лунку овечьего антимышиного антитела-POD (фирма GE, NA9310V) в разведении 1:9000 и инкубировали при КТ в течение 1 ч при встряхивании при скорости вращения 400 об/мин. После промывки (4×90 мкл/лунку ЗФРТ-буфера) добавляли 25 мкл/лунку ТМВ-субстрата (фирма Calbiochem, №CL07) и инкубировали до достижения ОП 1,5-2,5. Затем реакцию прекращали путем добавления 25 мкл/лунку 1н. раствора HCl. Измерения проводили при 370/492 нм. Результаты ELISA, выраженные в виде величин ЕС50 [нг/мл], обобщены ниже в таблице 17.
Клеточный ELISA для Tim3. Прикрепленные клетки линии СНО-K1, стабильно трансфектированные плазмидой 15312_hTIM3-f1_pUC_Neo, кодирующей полноразмерный человеческий Tim3 и маркер селекции G418 (маркер устойчивости к неомицину на плазмиде), высевали в концентрации 1,2×10Е6 клеток/мл в 384-луночные плоскодонные планшеты и выращивали в течение ночи.
На следующий день добавляли по 25 мкл/лунку образца Tim3 или референс-антитела к Tim3 F38-2E2, свободного от азида (фирма Biolegend, 354004), и инкубировали в течение 2 ч при 4°С (во избежание интернализиации). После промывки (3×90 мкл/лунку ЗФРТ (фирма BIOTEK Washer: Prog. 29, 1×90) клетки фиксировали путем быстрого удаления остаточного буфера и добавления 50 мкл/лунку 0,05% глутарового альдегида: разведение 1:500 25%-ного глутарового альдегида (фирма Sigma, каталожный №G5882) в 1×ЗФР-буфере и инкубировали в течение 1 ч при КТ. После промывка (3×90 мкл/лунку ЗФРТ (фирма BIOTEK Washer: Prog. 21, 3×90 GreinLysin) добавляли из расчета по 25 мкл/лунку вторичное идентифицирующее антитело (овечье антимышиное-POD; связанное с пероксидазой из хрена (POD), F(ab')2-фрагмент; (фирма GE, NA9310) с последующей инкубацией в течение 2 ч при КТ при встряхивании при 400 об/мин. После промывки (3×90 мкл/лунку ЗФРТ (фирма BIOTEK Washer: Prog. 21, 3×90 GreinLysin) добавляли 25 мкл/лунку раствора ТМВ-субстрата (фирма Roche, 11835033001) и инкубировали вплоть до достижения ОП 1,5-2,5. Затем реакцию прекращали путем добавления 25 мкл/лунку 1н. раствора HCl. Измерения проводили при 370/492 нм. Результаты ELISA, выраженные в виде величин «ЕС50 CHO-Tim3» [нг/мл], обобщены ниже в таблице 17.
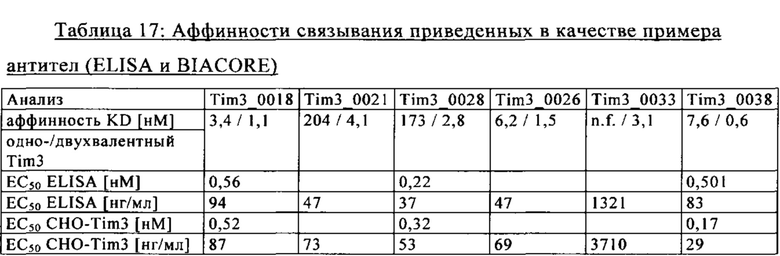
Biacore-характеризация Ат к Tim3 Анализ на основе поверхностного плазменного резонанса (SPR) применяли для определения кинетических параметров связывания для нескольких связывающих мышиный Tim3 агентов, а также поступающих в продажу связывающихся с человеческими Tim3 референс-антител. Для этой цели антимышиный IgG иммобилизовали с помощью аминного сочетания на поверхности сенсорного СМ5-чипа (фирма Biacore). Затем «захватывали» образцы и связывали с ними hu/cy Tim3-ECD. Поверхность сенсорного чипа регенерировали после каждого цикла анализа. И, наконец, определяли константу равновесия KD путем аппроксимации данных к модели взаимодействия по типу 1:1 Ленгмюра. Сшивали с каждым из пятен 1, 2, 4 и 5 проточных ячеек 1-4 сенсорного СМ5-чипа (пятна 1,5 представляли собой активные пятна, а пятна 2,4 - референс-пятна) антимышиный IgG (фирма GE Healthcare, №BR-1008-38) в концентрации 30 мкг/мл, уровень иммобилизации соответствовал примерно 12000 единицам ответа, в устройстве Biacore B4000 при рН 5,0 с помощью набора для аминного сочетания, поставляемого фирмой GE Healthcare.
Буфер для образов и подвижный буфер представлял собой HBS-EP+(0,01М HEPES, 0.15M NaCl, 3мМ ЭДТА, 0,05 об.% сурфактанта Р20, рН 7,4). Температуру проточной ячейки устанавливали на 25°С, а температуру компартмента для образца на 12°С. Систему примировали с помощью подвижного буфера. Образцы инъецировали в течение 30 с в концентрации 200 мкг/мл и связывали с пятнами 1 и 5 каждой проточной ячейки, что позволяло оценивать 8 образцов параллельно. Затем инъецировали полный набор образцов (мономерный cyno, мономерный человеческий и слитый с huFc димерный человеческий Tim3-ECD) в различных концентрациях (см. таблицу X) по поверхности каждого образца в течение 240 с, после чего давали пройти диссоциации в течение 30/1800 с (см. таблицу 1). После каждого цикла анализа («захват» образца, пятна 1 и 5 - инъекция Tim3-ECD) осуществляли регенерацию с использованием инъекции продолжительностью 30 с глицина -HCl, рН 1,7. Во время всего погона скорость потока составляла 30 мкл/мин. И, наконец, полученные с использованием двойного стандарта данные аппроксимировали на основе модели взаимодействия по типу 1:1 Ленгмюра с помощью программного обеспечения Biacore B4000 Evaluation. Полученные величины KD представлены в таблицах 17 и 18.
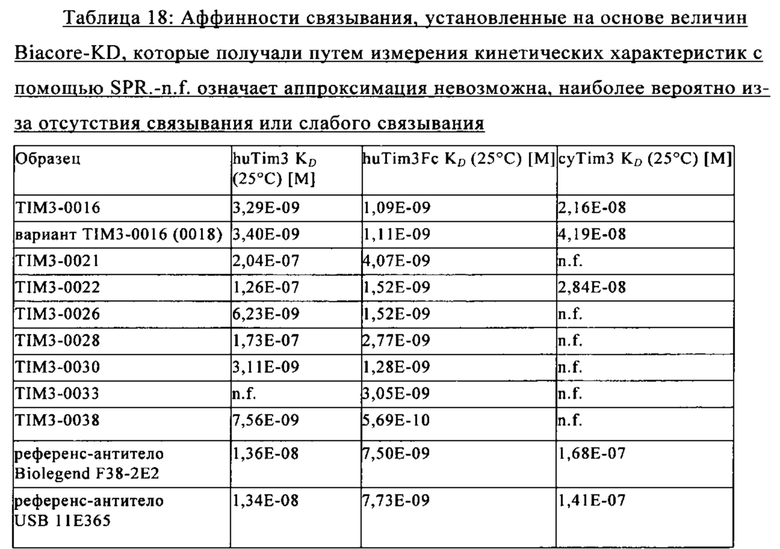
Пример 20
Создание производных антител к Tim3
Производные в виде химерных антител. Химерные антитела к Tim3 создавали путем амплификации вариабельных областей тяжелой и легкой цепей мышиных антител к TIM3 Tim3-0016, вариант Tim3-0016 (0018), Tim3-0021, Tim3-0022, Tim3-0026, Tim3-0028, Tim3-0030 и Tim3-0033, Tim3-0038 путем ПЦР и их клонирования в экспрессионных векторах для тяжелых цепей в виде слитых белков с человеческими IgGI-каркасами/человеческими CH1-шарнир-СН2-СН3 с мутациями LALA и PG (замена лейцина 234 на аланин, лейцина 235 на аланин, пролина 329 на глицин), которые элиминируют эффекторные функции, и в экспрессионных векторах для легких цепей в виде слитых белков с человеческой С-каппа. Затем LC- и НС-плазмидами совместно трансфектировали HEK293 и антитела очищали через 7 дней из супернатантов с помощью стандартных методов очистки антител.
Удаление сайта гликозилирования NYT: Модификация 1 положения в HVR-L1 антител Tim3-0016, вариант Tim3_0016 (обозначенный как 0018 или Tim3 0018) путем замены N на О или S. Мутации в вариабельной области легкой цепи Tim3_0016 и варианта Tim3_0016 (0018) создавали путем мутагенеза in vitro, используя набор фирмы Agilent «Quick Change Lightning Site-directed Mutagenesis» согласно инструкциям производителя. С помощью этого метода аспарагин (N) в мотиве NYT сайта гликозилирования в HVR-L1 легкой цепи (SEQ ID NO: 4) заменяли на глутамин (Q) (получая SEQ ID NO: 11, которая соответствует Tim3_0016_HVR-L1 вариант 1_NQ) или альтернативно этому, аспарагин (N) заменяли на серин (S) (получая SEQ ID NO: 12, которая соответствует Tim3_0016_HVR-L1 вариант 2_NS). В обоих случаях это приводило к успешной модификации мотива NYT сайта гликозилирования. Затем LC- и НС-плазмидами, кодирующими эти варианты, совместно трансфектировали HEK293 и антитела очищали через 7 дней из супернатантов с помощью стандартных методов очистки антител. Созданные мутанты тестировали с помощью ELISA с использованием человеческого Tim3, ELISA с использованием Tim3 обезьян циномолгус и клеточного ELISA, который осуществляли на прикрепленных СНО-K1-клетках, экспрессирующих полноразмерный человеческий Tim3. Установлено, что все созданные мутанты отличались еще более выраженным функциональным связыванием с человеческим TIM3 (человеческий), cynoT1M3 (супо) или человеческим TIMR на СНО-клетках по сравнению с родительскими антителами Tim3_0016 или вариантом антитела Tim3_0016 т.е. Tim3_0018 соответственно.
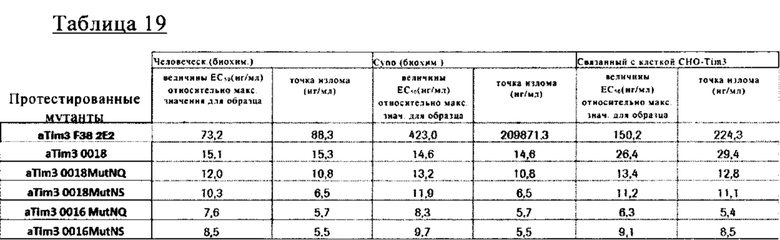
Пример 21
Флуоресцентное мечение очищенного моноклонального антитела
Флуоресцентное мечение полученного из гибридомы моноклонального антитела осуществляли, используя набор для мечения моноклональных антител Alexa Fluor 488 (производство фирмы Invitrogen), согласно инструкциям производителя. После мечения подтверждали, что каждое антитело является позитивно меченным с помощью Alexa Fluor 488 (далее в контексте настоящего описания обозначено как «Alexa-488»), используя устройство FACSCalibur (производство фирмы BD Biosciences) для анализа экспрессирующих TIM3 клеток RPMI-8226 и клеток Пфайффера.
Пример 22
Классификация в зависимости от связывания с группами эпитопов с использованием конкурентного анализа на основе FACS
Анализировали соответствие эпитопов между созданными антителами к TIM3 и 6 референс-антителами к TIM3 с помощью конкурентного анализа связывания на основе FACS. Использовали следующие референс-антитела к TIM3: антитела 4177 и 8213, описанные в US 2012/189617, антитела 1.7Е10 и 27.12Е12, описанные в WO 2013/06490; антитело 344823 (клон 344823, производство фирмы R&D Systems) и антитело F38-2E2 (клон F38-2E2, производство фирм BioLegend и R&D Systems). В целом, метод состоял в следующем: тестируемому антителу давали взаимодействовать и связываться с экспрессирующими TIM3 клетками RPMI-8226 (АТСС® CCL-155™) и затем оценивали с помощью метода проточной цитометрии, может ли другое антитело к TIM3 также связываться с экспрессирующими TIM3 клетками.
В целом метод состоял в следующем: экспрессирующие человеческий TIM3 клетки RPMI-8226 инкубировали с реагентом фирмы BD, блокирующим человеческий Fc, в течение 10 мин при КТ и окрашивали с использованием двух различных экспериментальных схем для исключения влияния различий в аффинности тестируемых антител на связывание:
1) с использованием описанных очищенных антител к TIM3 (10 мкг/мл в буфере для окрашивания фирмы BD (BD SB) в течение 0,5 ч при 4°С), которые конъюгировали с Alexa*488 согласно инструкциям производителя (фирма Molecular Probes, A-20181) из расчета в среднем 2,7 флуорофоров на антитело. Затем а) добавляли немеченые (1-4) рекомбинантные референс-антитела к TIM3 или контроль изотипа 10 мкг/мл) в течение 0,5 ч при 4°С в BD SB и после промывки с помощью BD SB окрашивали меченными РЕ Ат к huFcγ (фирма JIR, 109-116-098, 1:200, 0,5 ч при 4°С в BD SB), или б) добавляли меченные РЕ (5-6) доступные референс-антитела к TIM3 или соответствующие контроли изотипа (10 мкг/мл) в течение 0,5 ч при 4°С в BD SB. После промывки и центрифугирования анализировали MFI-сигналы окрашенных RPMI-8226-клеток с помощью проточного цитометра фирмы BD Biosciences FACSCanto.
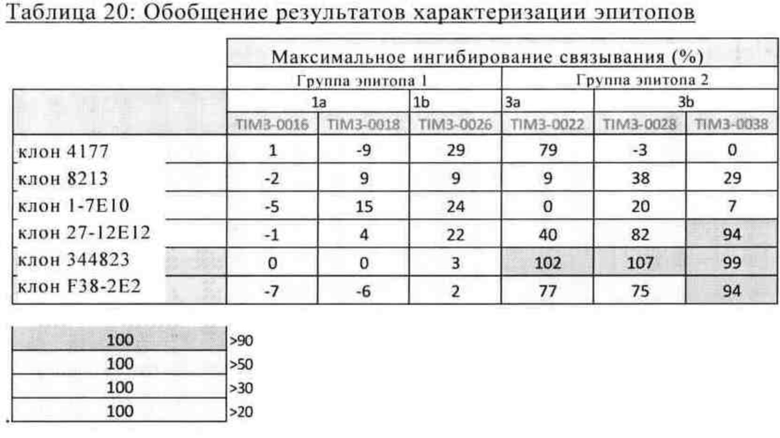
Результаты основанного на FACS картирования в зависимости от групп эпитопов продемонстрировали, что Tim3_0016 и вариант Tim3_0016, т.е. Tim3_0018, не конкурировали за связывание с протестированными референс-антителами к TIM3, и это позволяет предположить, что указанные Ат распознают новый эпитоп, отличный от эпитопов, которые распознаются описанными ранее референс-антителами к TIM3, в то время как Tim3_0022, Tim3_0026, Tim3_0028 и Tim3_0038 конкурировали в разной степени за связывание с TIM3, экспрессируемым на поверхности клеток JRPMI-8226, с различными конкурентами.
Пример 23
Воздействие антител к человеческому TIM3 на производство цитокинов при изучении с использованием реакции лимфоцитов в смешанной культуре (MLR)
Реакцию лимфоцитов в смешанной культуре применяли для демонстрации явления блокирования пути TIM3 у эффекторных форм лимфоцитов. В этом анализе тестировали активацию Т-клеток и секрецию ими IFN-гамма в присутствии или отсутствии МАт к TIM3.
Человеческие лимфоциты выделяли из периферической крови здорового донора путем центрифугирования в градиенте плотности, используя устройство Leukosep (фирма Greiner Bio One, 227 288). В целом, метод состоял в следующем: гепаринизированную кровь разводили трехкратным объемом ЗФР и аликвоты по 25 мл разбавленной крови наслаивали в 50-миллилитровых Leukosep-пробирках. После центрифугирования при 800 × g в течение 15 мин при комнатной температуре (без перерыва) содержащие лимфоциты фракции собирали, промывали в ЗФР и непосредственно применяли для функционального анализа или ресуспендировали в среде для замораживания (10% ДМСО, 90% FCS) из расчета 1,0Е+07 клеток/мл и хранили в жидком азоте. Применяли соотношение 1:1 клеток-мишеней/респондеров в MLR-анализе (т.е. каждая MLR-культуру содержала - 2,0Е+05 РВМС из каждого донора в общем объеме 200 мкл). Добавляли моноклональные антитела к TIM3, т.е. Tim3_0016, вариант Tim3_0016 (Tim3_0018), Tim3_0021, Tim3_0022, Tim3_0026, Tim3_0028, Tim3_0030, Tim3_0033, Tim3_0038 и F38-2E2 (фирма BioLegend) в каждую культуру, применяя антитела в различных концентрациях. В качестве отрицательного контроля применяли либо реакцию без антитела, либо с антителом, применяемым в качестве контроля изотипа, и rec hu IL-2 (20 EU/мл) применяли в качестве положительного контроля. Клетки культивировали в течение 6 дней при 37°С. Через 6 дней по 100 мкл среды отбирали из каждой культуры для измерения уровня цитокинов. Для определения уровней IFN-гамма применяли набор OptEIA ELISA (фирма BD Biosciences).
Результаты представлены в таблице 21 (секреция/высвобождение IFN-g). Моноклональные антитела к TIM3 повышали Т-клеточную активацию и секрецию IFN-гамма в зависимости от концентрации. Антитела к TIM3 Tim3_0021, Tim3_0022, Tim3_0028 и Tim3_0038 снижали высвобождение провоспалительного цитокина IFN-гамма в большей степени, чем антитело F38-2Е2. Для Tim3_0016, варианта Tim3_0016 (Tim3_0018), Tim3_0033 и Tim3_0038 обнаружено, что высвобождение было сходным с высвобождением при применении антитела F38-2E2. В противоположность этому, в культурах, содержащих антитело, применяемое в качестве контроля изотипа, не обнаружено повышение секреции IFN-гамма.
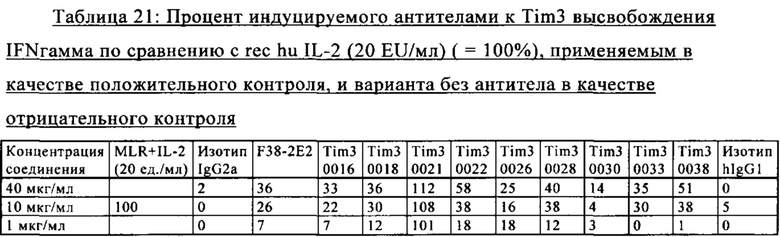
Пример 24
Интернализация антител к TIM3 экспрессирующими TIM3 клетками
TIM3-специфические антитела, указанные в настоящем описании, могут интернализироваться экспрессирующими TIM3 клетками, включая экспрессирующие TIM3 клетки лимфомы, множественной миеломы и AML. Например, установлено, что TIM3-специфические антитела и их фрагменты могут интернализироваться recTIM3-СНО-клетками, которые стабильно экспрессируют человеческий TIM3, по данным, полученным с помощью клеточного ELISA, проточной цитометрии (FACS) и конфокальной микроскопии.
Стабильно трансфектированные Tim3 клетки СНО-K1 (клон 8) (4×104 клеток/лунку/100 мкл) высевали в 98-луночный титрационный микропланшет (МТР), применяя свежую культуральную среду. После прикрепления клеток в течение ночи среду для культуры клеток удаляли, тестируемые антитела добавляли к клеткам (10 мкг/мл в среде для культуры клеток) и инкубировали в течение 0,5 ч при 4°С. В качестве референс-эталона применяли поступающее в продажу мышиное античеловеческое антитело (TIM3 МАВ 11Е365 (фирма US Biological, T5469-92P). После промывки (2× с помощью среды для культуры клеток) и центрифугирования клетки инкубировали в течение 3 ч при а) 4°С или б) 37°С в 200 мкл среды для культуры клеток. Интернализация, как правило, происходит при 37°С, но не происходит при 4°С, что является дополнительным контролем реакции. Затем клетки фиксировали, используя 100 мкл/лунку 0,05%-ного глутарового альдегида (фирма Sigma, каталожный № G5882) в 1×ЗФР в течение 10 мин при комнатной температуре (КТ). После чего осуществляли три стадии промывки с помощью 200 мкл ЗФР-Т и добавляли в качестве вторичного антитела овечье антимышиное антитело-POD (связанное с POD из хрена, F(ab')2-фрагмент); GE NA9310)) в течение 1 ч при КТ. После конечных стадий промывки (3×ЗФР-Т) добавляли ТМВ-субстрат (фирма Roche, № заказа 11835033001) в течение 15 мин и цветную реакцию прекращали с помощью 1н. HCl. Конечные ОП определяли, осуществляя измерения при 450/620 нм, в ридере для ELISA. Указанную процедуру клеточного ELISA применяли для определения при средней пропускной способности интернализирующей способности тестируемых антител, которые очищали из супернатантов гибридомы.
Процент интернализации рассчитывали следующим образом:
интернализация [%]=(1 - ОПобразца_37°C/ОПобразца_4°C)×100
Результаты представлены на фиг. 29А и Б (интернализация). Практически все протестированные моноклональные антитела к TIM3 одинаково хорошо интернализировались стабильно трансфектированными Tim3 CHO-K1-клетками после инкубации в течение 3 ч при 37°С (представлены не все данные).
Для отобранных кандидатов осуществляли с помощью FACS определение величин ЕС50, характеризующих уровни интернализации (в зависимости от времени), а также сравнение кинетики интернализации в зависимости от одновалентного относительно двухвалентного связывания.
В целом, метод состоял в следующем: стабильно экспрессирующие человеческий TIM3 CHO-K1-клетки высевали (4×105 клеток/лунку/50 мкл) в 98-луночный с v-образным дном МТР, используя свежую культуральную среду, и инкубировали с жидким Redimune® NF в течение 10 мин при КТ для блокады неспецифического связывания. Затем добавляли из расчета 50 мкл/лунку отобранные очищенные антитела к TIM3 (10 мкг/мл в среде для культуры клеток) и инкубировали в течение 1 ч при 4°С. После промывки (средой для культуры клеток) и центрифугирования клетки инкубировали в течение 0,25, 0,5, 1, 2, 3, 4, 6 и 24 ч при а) 4°С или б) 37°С в 200 мкл среды для культуры клеток. Затем клетки промывали ЗФР/1% БСА и добавляли в качестве вторичного антитела меченный Alexa Fluor 488 козий антимышиный IgG, F(ab)2 в течение 1 ч при 4°С. После промывки и центрифугирования добавляли 125 мкл CellFix (фирма BD Bioscience, 1:1000) и анализировали MFI-сигналы окрашенных клеток с помощью проточного цитометра фирмы BD Biosciences FACSCanto.
Процент интернализации рассчитывали следующим образом:
интернализация [%]=(1-MFIобразца_37°C/MFIобразца_4°C)×100.
Пример оценки в зависимости от времени интернализации антител к TIM3, таких как Tim3 0016. вариант Tim3 0016 (Tim3 0018). Tim3 0021. Tim3 0028, Tim3 0030. Tim3 0033. Tim3 0038 на RPMI-8226-клетках (АТСС® CCL-155™):
Указанные в настоящем описании антитела к TIM3 отличались быстрой интернализацией экспресирующими TIM3 RPMI-8226-клетками (АТСС® CCL-155™) и достигали высокого уровня в клетках. Эксперименты проводили согласно описанному выше методу с использованием экспрессирующих TIM3 RPMI-8226-клеток (АТСС® CCL-155™) вместо rec CHOK1-клеток, экспрессирующих huTIM3. Результаты представлены в таблице 22. Следующие антитела применяли в качестве анти-TIM3 референс-антител: антитело 8213, описанное в US2012/189617, антитело 27.12Е12, описанное в WO 2013/06490. Tim3_0016, вариант Tim3_0016 (Tim3_0018), Tim3_0038 применяли в качестве химерных версий человеческих IgG1.

Результаты продемонстрировали, что протестированные антитела быстро и с высоким по сравнению с референс-антителами процентом интернализовались RPMI-8226-клетками (АТСС® CCL-155™).
Пример 25
Связывание антител к TIM3 с выделенными человеческими моноцитами, экспрессирующими TIM3
CD14+-моноциты выделяли из обработанной антикоагулянтом периферической крови здоровых доноров путем центрифугирования в градиенте плотности, с использованием фиколл-пака (фирма GE Healthcare) (см. общие протоколы в руководствах для пользователей или на сайте www.miltenyibiotec.com/protocols) и затем подвергали позитивной селекции с использованием CD14-микрогранул (MicroBeads). Сначала CD14+-клетки метили магнитными частицами с использованием CD14-микрогранул. Затем суспензию клеток вносили на колонку MACS®, которую помещали в магнитное поле MACS-сепаратора. Меченные магнитными частицами CD14+-клетки задерживались на колонке. Немеченые клетки проходили через колонку, эта клеточная фракция была истощена по CD14+-клеткам. После удаления колонки из магнитного поля сохранившие магнитные свойства CD14+-клетки можно элюировать в качестве клеточной фракции, прошедшей позитивную селекцию. После центрифугирования при 200 × g в течение 10 мин при комнатной температуре моноциты собирали и применяли непосредственно для анализа связывания или ресуспендировали в среде для замораживания (10% ДМСО, 90% FCS) из расчета 1,0Е+07 клеток/мл и хранили в жидком азоте.
Как известно из литературы, моноциты экспрессируют конститутаивно TIM3 на их поверхности. 1×10 выделенных человеческих CD14+-моноцитов (50 мкл/лунку) вносили в 98-луночный с v-образным дном МТР в свежей культуральной среде и инкубировали с жидким Redimune® NF в течение 15 мин при КТ для блокады неспецифического связывания. Затем добавляли из расчета 50 мкл/лунку описанные МАт к TIM3 или референс-МАт к TIM3 344823 (фирма R&D) и F38-2E2 (фирма BioLegend) (10 мкг/мл в среде для культивирования клеток) и инкубировали в течение 1 ч при 4°С. Затем клетки промывали ЗФР/1% БСА и добавляли в качестве вторичного антитела меченный РЕ козий антимышиный F(ab')2 (фирма Jackson Lab, 115-006-072) в течение 1 ч при 4°С. После промывки и центрифугирования MFI-сигналы окрашенных клеток анализировали с помощью проточного цитометра фирмы BD Biosciences FACSCanto.
Специфическое связывание рассчитывали следующим образом:
специфическое связывание [MFI]=среднее геометрическое МFIобразца - среднее геометрическое MFIконтроля изотипа.
Результаты представлены в таблице 23: (Связывание с человеческими моноцитами). Клоны антител к TIM3, такие как Tim3_0016, Tim3_0018, Tim3_0020, Tim3_0028 и Tim3_0038 связывались с человеческими моноцитами различных доноров даже лучше, чем референс-Ат к TIM3.
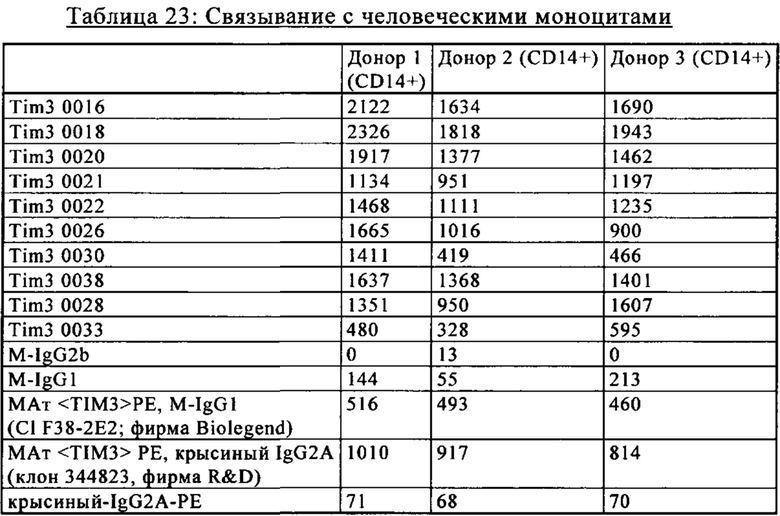
Пример 26
Связывание антител к TIM3 с выделенными моноцитами обезьян циномолгус (cyno), экспрессирующими TIM3
CD14+-моноциты выделяли из обработанной антикоагулянтом периферической крови обезьян циномолгус путем центрифугирования в градиенте плотности, с использованием фиколл-пака (фирма GE Healthcare) (см. общие протоколы в руководствах для пользователей или на сайте www.miltenyibiotec.com/protocols) и затем подвергали позитивной селекции с использованием NHP CD14-микрогранул. Сначала CD14+-клетки метили магничными частицами с использованием CD14-микрогранул. Затем суспензию клеток вносили на колонку MACS®, которую помещали в магнитное поле MACS-сепаратора. Меченные магнитными частицами CD14+-клетки задерживались на колонке. Немеченые клетки проходили через колонку, эта клеточная фракция была истощена по CD14+-клеткам. После удаления колонки из магнитного поля сохранившие магнитные свойства CD14+-клетки можно элюировать в качестве клеточной фракции, прошедшей позитивную селекцию. После центрифугирования при 200 × g в течение 10 мин при комнатной температуре моноциты собирали и применяли непосредственно для анализа связывания или ресуспендировали в среде для замораживания (10% ДМСО, 90% FCS) из расчета 1,0Е+07 клеток/мл и хранили в жидком азоте.
Как известно из литературы, моноциты экспрессируют конститутаивно TIM3 на их поверхности. 1×105 выделенных обезьяньих (cyno) CD14+-моноцитов (50 мкл/лунку) вносили в 98-луночный с v-образным дном МТР в свежей культуральной среде и инкубировали с жидким Redimune® NF в течение 15 мин при КТ для блокады неспецифического связывания. Затем добавляли из расчета 50 мкл/лунку меченные Alexa488 антитела к TIM3 (10 мкг/мл в среде для культивирования клеток) и инкубировали в течение 1 ч при 4°С. После промывки и центрифугирования MFI-сигналы окрашенных клеток анализировали с помощью проточного цитометра фирмы BD Biosciences FACSCanto.
Специфическое связывание рассчитывали следующим образом:
специфическое связывание [MFI]=среднее геометрическое МFIобразца - среднее геометрическое MFIконтроля изотипа.
Результаты представлены в таблице 24 (Связывание с моноцитами обезьян циномолгус). Клоны антител к TIM3, такие как Tim3_0016, Tim3_0018, Tim3_0026, Tim3_0028 и Tim3_0030 связывались с моноцитами cyno из различных обезьян-доноров.

Пример 27
Связывание антител к TIM3 с клеточными линиями NHL (неходжскинская лимфома) и ММ (множественная миелома), экспресирующими TIM3
Способность к связыванию описанных антител к TIM3 и двух клонов референс-антител к TIM3 (1) 4177 и (2) 8213 (фирма Kyowa) анализировали с помощью FACS. В целом, метод состоял в следующем: экспрессирующие человеческий TIM3 клетки В-клеточной лимфомы (примером которых являются клетки Пфайффера) и клетки множественной миеломы (примером которых являются RPMI-8226-клетки) инкубировали с реагентом фирмы BD, блокирующим человеческий Fc, в течение 10 мин при КТ для блокады неспецифического связывания. Затем 2×105 клеток (50 мкл/лунку) вносили в 98-луночный с v-образным дном МТР и добавляли из расчета 50 мкл/лунку меченные Alexa488 антитела к TIM3 (10 мкг/мл в буфере для окрашивания фирмы BD) и инкубировали в течение 1 ч при 4°С. После промывки и центрифугирования MFI-сигналы окрашенных клеток анализировали с помощью проточного цитометра фирмы BD Biosciences FACSCanto.
Специфическое связывание рассчитывали следующим образом:
специфическое связывание [MFI]=среднее геометрическое MFIобразца - среднее геометрическое MFIконтроля изотипа.
Результаты представлены на фиг. 2А и 2Б (Связывание с клетками RPMI-8226 и клетками Пфайффера).
Цитотоксическая активность антител к TIM3 на экспрессирующих TIM3 клетках NHL и ММ
TIM3-специфические антитела, конъюгированные с экзотоксином Pseudomonas (РЕ 24), эффективно уничтожали экпрессирующие TIM3 клетки. Цитотоксическую активность описанных антител к TIM3 и одного поступающего в продажу референс-антитела к TIM3 клона 11Е365 (доступно от фирмы US Biological) анализировали с использованием люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega (CellTiter-Glo Luminescent Cell Viability Assay). В целом, метод состоял в следующем: к 5×103 (50 мкл/лунку в 98-луночном МТР, в трех повторностях) рекомбинантных СНО K1-клеток, стабильно экспрессирующих человеческий TIM3, или 2×104 клеток (50 мкл/лунку в 98-луночном МТР, в трех повторностях) экспрессирующих человеческий TIM3 клеток В-клеточной лимфомы (например, клетки Пфайффера) или клеток множественной миеломы (например, RPMI-8226-клетки) добавляли из расчета 25 мкл/лунку серийное разведение 1:5 описанных антител к TIM3 в наиболее высокой из изученных концентраций 10 мкг/мл или добавляли соответствующие среды к необработанным клеткам, или контроль изотипа к обработанным клеткам, которые не являются мишенями. Для обработок применяли антитела в диапазоне от 10 мкг/мл до 1 нг/мл в трех повторностях. Все антитела применяли в виде полноразмерных мышиных Fcγ-версий. Для конъюгации с экзотоксином Pseudomonas добавляли специфические в отношении мышиного Fcγ-фрагмента Fab, конъюгированные с РЕ 24 (10 мкг/мл), и инкубировали в течение 3 дней при 37°С. В качестве положительного контроля применяли циклогексимид, известный ингибитор синтеза белков у эукариот. Жизнеспособность обработанных клеток измеряли с помощью люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega.
Цитотоксическую активность рассчитывали следующим образом:
относительное ингибирование [%]=(1-(Еобразца - Еотрицательного контроля)/(Еположительного контроля - Eотрицательного контроля))×100
Результаты представлены в таблице 25.
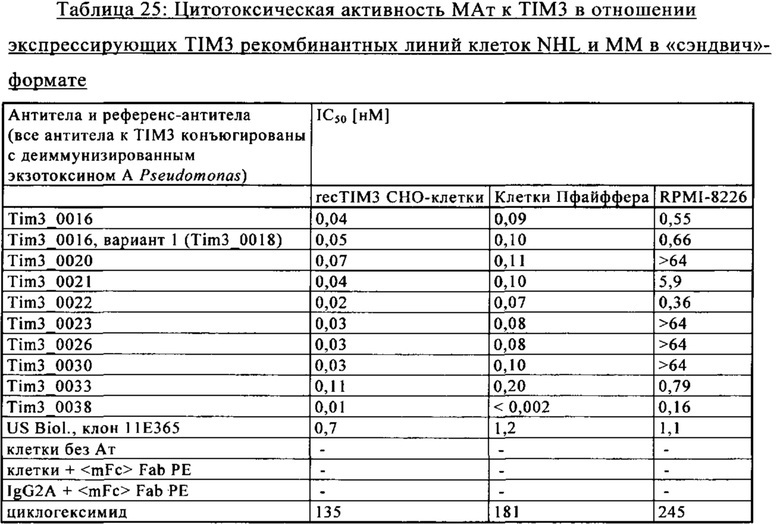
Все протестированные клоны антител к TIM3 обладали высокой эффективностью (диапазон IC50 0,01-0,2нМ) в отношении рекомбинантных клеток СНО K1, стабильно экспрессирующих человеческий TIM3, и клеток Пфайффера, экспрессирующих высокие и средние уровни TIM3, и являлись даже более эффективными касательно их цитотоксической активности, чем сильно интернализирующееся референс-Ат к TIM-3 клона 11Е365 (фирма US Biological). Клоны анти-Т1М3 0016, 0018, 0021, 0022, 0033 и 0038 обладали также эффективностью в отношении RPMI-8226-клеток, которые экспресировали в 5 раз более низкие уровни TIM3 по сравнению с рекомбинантными клетками СНО TIM3.
Пример 28: Сравнение цитотоксической активности описанных антител к TIM3 и двух референс-антител к TIM3 1.7.Е10 и 27-12Е12 (описанных в WO 2013/06490)
Цитотоксическую активность описанных антител к TIM3 и двух референс-антител к TIM3 1.7.Е10 и 27-12Е12, которые описаны в WO 2013/06490, анализировали с помощью описанного выше люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega. Все антитела применяли в формате полноразмерного человеческого IgG1, включающего Fсгамма-область. В этом эксперименте конъюгацию экзотоксина Pseudomonas осуществляли через специфические в отношении человеческого Fcγ-фрагмента Fab, конъюгированные с РЕ 24 (10 мкг/мл), которые добавляли и инкубировали в течение 5 дней при 37°С.
Результаты представлены в таблице 26.
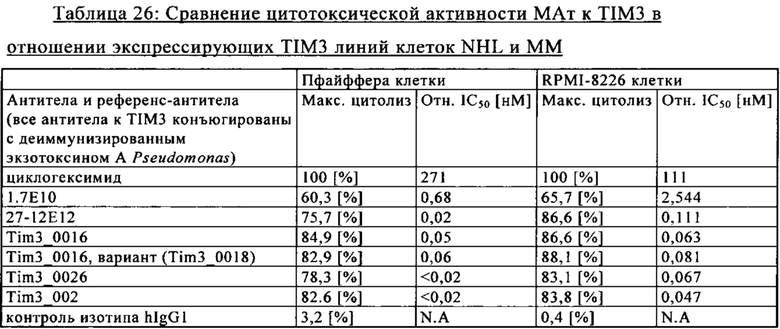
Все описанные клоны антител к TIM3 обладали высокой активностью (диапазон IC50 0,02-0,08нМ) в отношении клеток Пфайффера и RPMI-8226, экспрессирующих TIM3, и являлись даже более эффективными касательно их цитотоксической активности, чем сильно интернализирующееся референс-Ат к TIM-3 клона 27-12Е12. Все антитела сравнивали в виде конъюгатов с экзотоксином Pseudomonas (PE24) с использованием одного и того же экзотоксина Pseudomonas в одинаковых условиях.
Пример 28
Цитотоксическая активность Fab-РЕ24-конструкций описанных антител к TIM3 в отношении клеточных линий MM, NHL и AML (которые экспрессируют TIM3. но не PSMA)
Цитотоксическую активность анализировали с помощью описанного выше люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega. Серийные разведения 1:5 Fab-фрагментов описанных антител к TIM3, непосредственно конъюгированных с PE24, в наиболее высокой из изученных концентраций 50 мкг/мл или соответствующие среды в случае необработанных клеток, или несвязывающися контрольные анти-PSMA Fab-PE24 в случае обработанных клеток, которые не являются мишенями, инкубировали с 7,5×103 клеток Пфайффера или 2×103 RPMI-8226-клеток (50 мкл/лунку в 98-луночном МТР) в течение 4 дней при 37°С. Для обработок применяли антитела в диапазоне от 50 мкг/мл до 8 нг/мл в трех повторностях. Циклогексимид применяли в качестве положительного контроля. Результаты представлены в таблице 27.
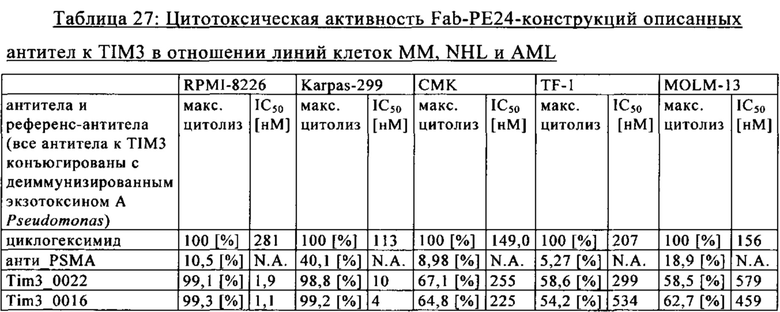
Все протестированные Fab-РЕ24-конструкции описанных антител к TIM3 обладали высокой эффективностью (диапазон IC50 1-10нМ) в отношении клеток MM (RPMI-8226) и NHL (Karpas-299), экспрессирующих средние уровни TIM3, и обладали выраженной цитотоксической активностью в отношении линий клеток AML (CMK, TF-1, MOLM-13), экспрессирующих очень низкие уровни TIM3.
Пример 29
Цитотоксическая активность иммуноконъюгатов (конъюгаты с экзотоксином A Pseudomonas (Fab-РЕ24-конструкции) описанных антител к TIM3 в отношении первичных лейкозных стволовых клеток/клеток-предшественников AML из пациентов с рецидивирующими/рефрактерными формами заболевания
CD34+-клетки из периферической крови пациентов с рецидивирующими/рефрактерными формами получали от фирмы AllCells, LLC, Аламеда, шт. Калифорния. После подтверждения чистоты и жизнеспособности всех образцов (диапазон чистоты 84-94% и диапазон жизнеспособности 95-99%) оценивали уровень экспрессии TIM3 согласно методу, описанному в примере 7, используя МАт к TIM3 344823 (фирма R&D) (см. фиг. 31). Для всех протестированных (4/4) образцов (CD34+) AML из крови пациентов с рецидивирующими/рефрактерными формами продемонстрировано наличие гомогенной экспрессии различных уровней TIM3.
Для оценки цитотоксической активности Fab-РЕ24-конструкций описанных клонов антител к TIM3 0016 и 0022 в отношении первичных CD34+-клеток AML 1×104 клеток (50 мкл/лунку в 98-луночном МТР, в трех повтороностях) инкубировали с серийными разведениями 1:5 Fab-фрагментов в наиболее высокой из изученных концентраций 50 мкг/мл или с соответствующими средами в случае необработанных клеток или с несвязывающимся контрольным анти-PSMA Fab-PE24 в случае обработанных клеток, которые не являются мишенями, в течение 3 дней при 37°С. Циклогексимид применяли в качестве положительного контроля. Цитотоксическую активность анализировали с помощью описанного выше люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega согласно методу, описанному в выше примере 28.
Результаты представлены в таблице 28. (Цитотоксическая активность Fab-РЕ24-конструкций описанных антител к TIM3 в отношении первичных CD34+-клеток AML).
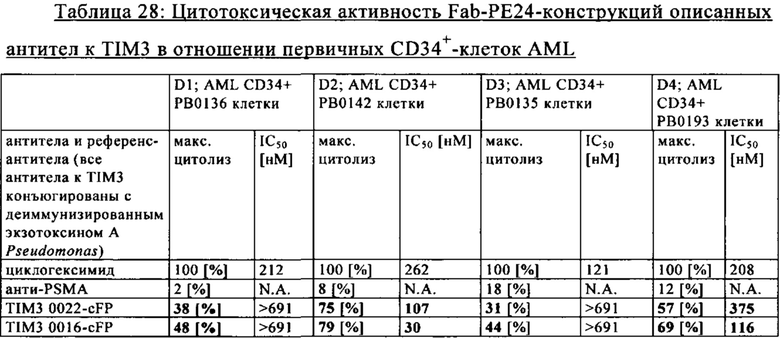
Fab-РЕ24-конструкции антител к TIM3 Tim3_0016 и Tim3_0022 обладали высокой эффективностью в отношении (2/4) образцов первичных AML-клеток (РВ0142 и РВ0135) (диапазон IC50 30-116нМ) и обладали существенной цитотоксической активностью в отношении всех (4/4) первичных лейкозных стволовых клеток/клеток-предшественников (CD34+) AML-клеток, экспрессирующих различные уровни TIM3.
Пример 30
Сравнение эффективности Fab-РЕ24-конструкций отобранных антител к TIM3 в отношении линий клеток NHL и ММ
Цитотоксическую активность сшитых с сортазой Fab-РЕ24-конструкций отобранных антител к TIM3 анализировали с помощью люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega, описанного выше в примере 28.
Результаты представлены в таблице 29.
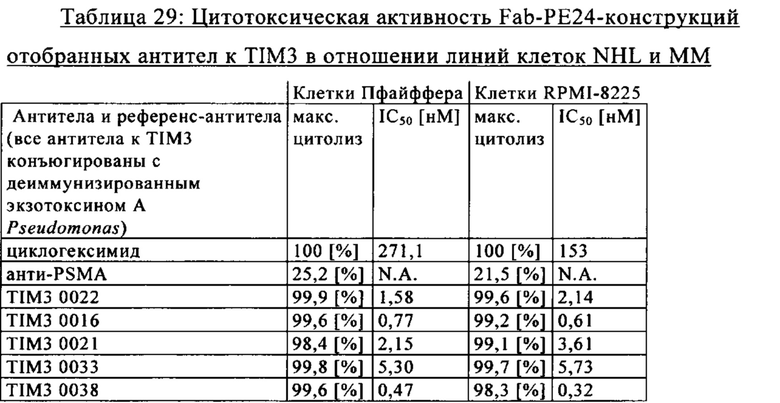
Продемонстрирована высокая цитотоксическая эффективность для Fab-РЕ24-конструкций всех отобранных описанных антител к TIM3 (диапазон IC50 0,3-5нМ) в отношении клеток NHL (клетки Пфайффера) и ММ (клетки RPMI-8226), которые экспрессировали средний уровень TIM3.
Наиболее высокая цитотоксическая активность обнаружена при применении Fab-РЕ24-конструкций описанных антител к TIM-3 Tim3_ 0016 и Tim3 0038.
Пример 31
Сравнение цитотоксической активности Fab-РЕ24-конструкции и конъюгата полный IgG-аматоксин одного и того же клона описанного антитела к TIM3 в отношении клеток Пфайффера
Оценку цитотоксической активности конъюгированной с Fab-PE24 конструкции описанного антитела к TIM3 клона 0016 в сравнении с полным IgG этого же клона, конъюгированного с аматоксином (полученным согласно процедуре, описанной в WO 2012/041504 (конъюгация через 6' С-атом аминокислоты 4 аматоксина, прежде всего через атом кислорода, связанный с 6' С-атомом аминокислоты аматоксина, и с которым антитело к TIM3 связано с помощью линкера через остаток мочевины), осуществляли с помощью люминисцентного анализа жизнеспособности клеток CellTiter-Glo фирмы Promega, описанного выше в примере 12.
Результаты представлены в таблице 30.

Цитотоксическая активность конъюгированного с аманитином (аматотоксин) антитела к TIM3 клона 0016 (IC50 0,8нМ) оказалась сопоставимой с цитотоксической активностью Fab-РЕ24-конструкции этого же клона (IC50 0,3нМ) в отношении клеток NHL (клетки Пфайффера), которые экспрессируют средний уровень TIM3.
Пример 32
Обработка пациентов и образцов опухолей
Свежевырезанные пораженные солидными опухолями образцы, и злокачественные выпоты собирали у 34 пациентов с немелкоклеточным раком легкого, 7 пациентов с раком яичника и 1 пациента с почечно-клеточной карциномой (RCC). Образцы пораженных солидными опухолями тканей механически измельчали и расщепляли аккутазой (фирма РАА), коллагеназой IV (фирма Worthington), гиалуронидазой (фирма Sigma) и ДНКазой типа IV (фирма Sigma) непосредственно после иссечения. Получали суспензии единичных клеток. Клеточную фракцию злокачественных выпотов выделяли путем центрифугирования в градиенте плотности, используя Histopaque-1119 (фирма Sigma). Все образцы хранили в жидком азоте до дальнейшего использования. Исследование одобрено местным наблюдательным советом по этике (Ethikkommission Nordwestschweiz, Комиссия по этике Северо-Западной Швейцарии).
Пример 33
Характеризация образцов опухолей
Все образцы опухолей всесторонне характеризовали с помощью многоцветной проточной цитометрии. Для анализа методом проточной цитометрии использовали следующие антитела: α(анти)-CD4-РЕ, α-CD8-PE-Cy7, α-CD11b-PerCP-eFluor710, α-CD45-PE-Cy7, α-CD45-PerCP-Cy5.5, α-CD137-ФИТЦ, α-BTLA-биотин, α-CTLA-4-PE, α-ICOS-ФИТЦ, α-IFN-γ-ФИТЦ, α-Lag-3-APC (все фирмы eBioscience), α-CD3-PECF594, α-CD25-BV605, α-CD69-ФИТЦ, α-ЕрСАМ-ФИТЦ, α-гранзим В-РЕ, α-активная каспаза 3-РЕ, α-PD-1-BV605, стрептавидин-BV711 (все фирмы BD Bioscience), α-CD45RA-BV421, α-CCR7-AlexaFluor647, α-FoxP3-AlexaFluor647, α-TIM3-BV421, α-TIM3-BV605 (все фирмы Biolegend). Мертвые клетки окрашивали с помощью набора для фиксации и окрашивания мертвых клеток в ближней инфракрасной области LIVE/DEAD® (LIVE/DEAD® Fixable Near-IR Dead Cell Stain) или с помощью набора для фиксации и окрашивания синим цветом мертвых клеток LIVE/DEAD® (LIVE/DEAD® Fixable Blue Dead Cell Stain) (фирма Invitrogen). Для внутриклеточного окрашивания применяли буферы для фиксации и пермеабилизации фирмы eBioscience. Данные для образцов получали с помощью проточной цитометрии с использованием устройства фирмы BD LSR Fortessa. Все наборы для ELISA, предназначенные для оценки человеческих IL-2, IFN-γ и TNF, получали от фирмы BD Bioscience.
CD8+- и CD4+-Т-клетки (CD45+CD3+) характеризовали в отношении экспрессии поверхностных маркеров PD-1, TIM3, CTLA-4, Lag-3, BTLA, CD25, CD69, CD137, ICOS, CD45RA и CCR7. Опухолевые клетки (CD45-EpCAM+) характеризовали в отношении экспрессии FolR1 в сравнении со связыванием FolR1-специфического антитела с его контролем соответствующего изотипа. Только образцы, позитивные по экспрессии FolR1 применяли для обработки FolR1-TCB, а образцы, экспрессирующие ЕрСАМ, для обработки катумаксомабом соответственно.
Пример 34
Обработка ex vivo образцов опухолей с помощью FolR1-TCB
FolR1-позитивные ферментативно расщепленные образцы опухолей или злокачественные выпоты подвергали оттаиванию, промывали и высевали в 96-луночные плоскодонные планшеты для культуры клеток (фирма BD Falcon) с плотностью 3×105 клеток/200 мкл/лунку в полную среду (DMEM+пируват натрия (1 мМ)+заменимые аминокислоты MEM (1x)+L-глутамин (2 мМ)+пенициллин/стрептомицин (100 нг/мл)+2-меркаптоэтанол (50нМ)+ципроксин (1 мг/мл)+10% человеческой сыворотки). Образцы культивировали в присутствии или в отсутствии FolR1-TCB или DP47 ТСВ в концентрации 2нМ в течение 24 ч. Активацию CD8+- и CD4+-Т-клеток (CD45+CD3+) после обработки FolR1-ТСВ определяли с помощью многоцветной проточной цитометрии, измеряя уровень экспрессии маркеров клеточной поверхности CD25, CD69, CD137, ICOS, PD-1 и TIM3. Кроме того, определяли уровень экспрессии гранзима В и IFN-γ с помощью внутриклеточного окрашивания. Концентрацию IL-2 в супернатантах клеточных культур измеряли с помощью ELISA (набор ELISA для человеческого IL-2, фирма BD OptEIA) согласно инструкциям производителя.
Пример 35
Обработка ех vivo образцов опухолей катумаксомабом
Трехфункциональную ТСВ-молекулу катумаксомаб (Removab®) получали от фирмы Fresenius. Применяли экспериментальные условия, сходные с описанными выше для FolR1-ТСВ. В целом, метод состоял в следующем:
ЕрСАМ-позитивные ферментативно расщепленные образцы опухолей или злокачественные выпоты культивировали в присутствии или в отсутствии катумаксомаба в концентрации 10 нг/мл в течение 24 ч. Анализ CD8+- и CD4+-позитивных Т-клеток (CD45+CD3+) осуществляли согласно описанному выше методу.
Пример 36
Анализ цитолиза
Для определения индуцированного FolR1-TCB цитолиза опухолевых клеток 3×104 меченных CFSE Skov3-клеток совместно культивировали с образцами опухолей в присутствии или отсутствии FolR1-TCB в концентрации 2нМ в течение 24 ч в 96-луночных плоскодонных планшетах для культуры клеток. Соотношение Е:Т (Е: эффекторные CD45+CD3+-Т-клетки; Т: FolR1+-клетки-мишени из опухоли и добавленные Skov3-клетки) доводили до 1:1 в каждой лунке и количество клеток в добавленных образцах опухолей рассчитывали для каждого образца с помощью предварительной характеризации с использованием проточной цитометрии. Клеточную гибель Skov3-клеток определяли с помощью проточной цитометрии, измеряя уровень активированной касапазы 3 и маркера живых/мертвых клеток с помощью анализа Live/Dead® в ближней инфракрасной области. Анализ проводили в трех повторностях. Опосредуемый FolR1-TCB цитолиз рассчитывали согласно следующему уравнению: % специфического цитолиза = 100 - [(% живых клеток Skov3 в обработанном FolR1-TCB образце/% живых клеток Skov3 в необработанном образце) × 100].
Для сравнения индуцированной FolR1-TCB цитолитической способности Т-клеток между образцами опухолей и для исключения дополнительных факторов, подавляющих функциональность Т-клеток, таких как экспрессия PD-L1 на опухолевых клетках, при создании изобретения экзогенно добавляли меченные CFSE FolR1+-клетки линии Skov3 к ферментативно расщепленным образцам опухолей и доводили соотношение Е:Т до 1:1, в целом, согласно описанному выше методу. Затем измеряли индуцированный FolRl-TCB цитолиз меченных CFSE Skov3-клеток, что позволяло включать в анализ также FolR1--образцы опухолей. Поскольку некоторые опухоли из первоначальной группы нельзя было использовать для характеризации опосредуемого ТСВ цитолиза опухолевых клеток из-за очень низкого количества эффекторных клеток, анализировали другую группу, состоящую из 12 ферментативно расщепленных образцов опухолей и 5 злокачественных выпотов из 15 пациентов с немелколклеточным раком легкого (NSCLC) и двух пациентов с эпителиальной карциномой яичника (ЕОС). Все образцы анализировали в отношении содержания в них CD3+- эффекторных клеток и FolR1+-клеток-мишеней (фиг. 39). Вызывающие цитолиз клеток опухолей CD3+-Т-клетки из пациентов сравнивали с полученными из РВМС здоровых доноров Т-клетками. Обнаружена значительная гетерогенность в цитолизе опухолевых клеток между отдельными пациентами (26±11,8%) через 24 ч (фиг. 12П). Следует отметить, что CD3+-Т-клетки из здоровых доноров индуцировали существенно более высокий цитолиз, чем TIL (опухольинфильтрующий лимфоцит) (42,8±9,7%, p=0,013). Экспозиция контрольной ТСВ, которая не связывалась с опухолевым антигеном (ТСВ DP47), не индуцировала никакого цитолиза опухолевых клеток.
Пример 37
Поликлональная стимуляция антителами к CD3/CD28
96-луночный плоскодонный планшет предварительно сенсибилизировали 0,5 мкг/мл антитела к CD3ε (клон ОКТ3, фирма Biolegend) в течение 2 ч при 37°С. Затем раствор антитела удаляли и планшет интенсивно промывали. Суспензии замороженных опухолей подвергали оттаиванию, промывали и культивировали из расчета 3×105 клеток/200 мкл/лунку в полной среде с 2 мкг/мл антитела к CD28 (клон 28.2, фирма eBioscience) в течение 24 ч. После инкубации в течение 24 ч клетки собирали, промывали и анализировали с помощью проточной цитометрии в отношении экспрессии маркеров активации, например, CD25, и маркеров эффекторных функций Т-клеток, например, гранзима В и IFN-γ на CD8+-Т-клетках. Супернатанты собирали для осуществления ELISA-анализа в отношении IL-2, IFN-γ и TNF-α, который осуществляли согласно инструкциям производителя.
Пример 38
Восстановление Т-клеточной функции путем блокады PD-1
Ферментативно расщепленные образцы опухолей стимулировали агонистическими антителами к CD3 и к CD28, описанными выше, в присутствии 10 мкг/мл/лунку антитела к PD-1 (MDX5C4) или без антитела и инкубировали в течение 24 ч. Через 24 ч клетки собирали, промывали и анализировали с помощью проточной цитометрии. Супернатанты собирали для осуществления ELISA-анализа в отношении IL-2, IFN-γ и TNF-α, который осуществляли согласно инструкциям производителя.
Пример 39
Активация Т-клеток в ферментативно расщепленных образцах опухолей и злокачественных выпотах с помощью FolR1-TCB
Активирующие Т-клетки биспецифические антитела, связывающиеся с CD3 и фолатным рецептором 1 (Mov19 на основе FolR1-TCB), и контрольное антитело ТСВ DP47 получали от фирмы Roche Glycart. Антитело к PD-15C4 описано в US №800,449. В качестве антитела к TIM3 применяли антитело F38-2EL. Для характеризации с помощью проточной цитометрии экспрессии FolR1 применяли антитело к FolR1-APC (ак 25-233) фирма LifeSpanBiosciences и контрольное антитело соответствующего изотипа (фирма Biolegend). В образцах пораженных опухолями тканей из 15 пациентов с FolR1+-опухолями характеризовали активацию Т-клеток, индуцированную FolR1-TCB. Образцы включали 9 суспензий единичных клеток и 6 злокачественных выпотов пациентов с NSCLC (n=7), раком яичника (n=7) и почечно-клеточным раком (n=1). Количество CD3+-Т-клеток и опухолевых FolR1+-клеток сильно варьировало между пациентами (CD3+: среднее 33,9%±стандартное отклонение 16,6%, FolR1+: 17,1%±16,8%). Характеризация экспрессии ингибирующих рецепторов PD-1, TIM3, CTLA-4, Lag-3 и BTLA на Т-клетках подтвердило высокую гетерогенность между пациентами (фиг. 11А-Б). В то время как для инфильтрующих опухоли CD8+-Т-клеток характерны высокие уровни PD-1, TIM3 и CTLA-4 (31,6%±25%; 22,2%±20,8% и 18,7%±14,4% соответственно), Lag-3 и BTLA экспрессировались только в очень небольшом количестве клеток у всех пациентов этой группы (3,5%±4,9% и 2,3%±1,7% соответственно). Ингибирующие рецепторы на CD4+-Т-клетках распределялись аналогичным образом с некоторым преобладанием экспрессии CTLA-4.
Для определения индуцированной FolR1-TCB активации Т-клеток образцы опухолей культивировали в присутствии или отсутствии FolR1-TCB или контрольной молекулы ТСВ DP47. Затем Т-клетки характеризовали с помощью многоцветной проточной цитометрии в отношении экспрессии маркеров активации и Т-клеточных эффекторных функций согласно описанному выше методу. На фиг. 12А-П продемонстрировано наличие высокой гетерогенности индуцированной FolR1-TCB активации Т-клеток между пациентами. В частности, у основного большинства пациентов обнаружена экспрессия CD69 уже на исходном уровне, установлена повышающая регуляция CD25, CD137 и ICOS, варьирующая на уровне 9-80%, 2,5-50% и 3,5-71% соответственно. Обнаружено приобретение эффекторных функций, таких как секреция IFN-γ, дегрануляция CD107 и экспрессия гранзима В, варьирующая от 3,7 до 59%, кратность изменения от 1 до 7 или от 1,3 до 64 соответственно (фиг. 12А-И). После обработки FolR1-TCB обнаружена также повышающая регуляция, вне зависимости от исходного уровня экспрессии, ингибирующих рецепторов PD-1 и TIM3, являющихся маркером активации. Экспозиция ТСВ DP47 не индуцировала никакой Т-клеточной активации. Повышающая регуляция CD25 и ICOS, индуцированная стимуляцией FolR1-TCB, оказалась существенно более сильной в периферических CD8+-Т-клетках из здоровых доноров, чем в полученных из опухолей CD8+-клетках (p=0,002 и p<0,001 соответственно; фиг. 12К, фиг. 12М, фиг. 12Н). Секреция эффекторными Т-клетками цитокинов IFN-γ, IL-2 и TNF после стимуляции FolR1-TCB значительно снижалось среди TIL в большинстве опухолей по сравнению с РВМС из здоровых доноров (p=0,0047, p<0,001 и p=0,006 соответственно; фиг. 12O). Индуцированная FolR1-TCB секреция перфорина сильно варьировала в TIL и серьезно нарушалась в субпопуляции пациентов (фиг.12O).
Аналогично этому, несмотря на более низкую повышающую регуляцию гранзима В, FolR1-TCB индуцировали активацию и приобретение эффекторных функций CD4+-Т-клетками (фиг. 25А-И). Для решения вопроса о том, влияет ли избыток Т-клеток внутри опухолей или экспрессия FolR1 на активацию Т-клеток после экспозиции ТСВ, оценивали корреляцию повышающей регуляции маркеров активации с соотношением Е:Т (Е: эффекторные CD45+CD3+-Т-клетки; Т: FolR1+-клетки) и с процентом и уровнем экспрессии опухолевого антигена FolR1+-клетками (фиг. 13А-В). Последний показатель определяли на основе среднего значения интенсивности флуоресцении FolR1 на опухолевых клетках (CD45-EpCAM+) с помощью проточной цитометрии (фиг. 13В). Однако ни один из указанных параметров не влиял на активацию Т-клеток, т.е. для эффективной повышающей регуляции маркеров активации и функции оказалось достаточно даже небольшого количества FolR1+-клеток, высоких соотношений Е:Т или слабой Т-клеточной инфильтрации. Кроме того, присутствие потенциально иммуносупрессорных клеточных популяций, таких как регуляторные Т-клетки или незрелые миелоидные клетки, не оказывало влияния на Т-клеточную активацию или Т-клеточную функцию.
Пример 40
Индуцированная FolR1-TCB активация Т-клеток обратно коррелирует с экспрессии PD-1 и TIM3
Высокий уровень экспрессии ингибирующих рецепторов описан в качестве отличительного признака истощенных Т-клеток. Такие образом дисфункциональное состояние инфильтрующих опухоли Т-клеток может влиять на эффективность FolR1-TCB и может отвечать, по меньше мере частично, за гетерогенность Т-клеточной активации после экспозиции ТСВ. Поэтому совместная экспрессия ингибирующих рецепторов, измеренная при определении исходного уровня, коррелировала с индуцированной FolR1-TCB повышающей регуляцией маркеров активации и Т-клеточными эффекторными функциями. Поэтому экспрессия и PD-1 и TIM3 на CD8+-Т-клетках отрицательно коррелировала с активацией Т-клеток, определенной по экспрессии CD25, CD137 и ICOS. Для CD8+-Т-клеток с высоким уровнем экспрессии PD-1 или TIM3 характерен маргинальный эффект после обработки FolR1-TCB, в то время как Т-клетки с низким уровнем экспрессии этих ингибирующих рецепторов могли сильно активироваться обработкой FolR1-TCB (фиг. 14А-И). Измерение индуцированной FolR1-TCB секреции IL-2, стандартизованной относительно содержания Т-клеток в образцах, позволило установить такие же зависимости от уровня экспрессии PD-1 и TIM3 (фиг. 15А-В), хотя индуцированная FolR1-TCB повышающая регуляция гранзима В в меньшей степени зависела от предшествующей экспрессии указанных ингибирующих рецепторов (фиг. 14К-М). Важно отметить, что исходный уровень экспрессии CTLA-4, Lag-3 и BTLA на CD8+-Т-клетках не коррелировал с индуцированной FolR1-TCB Т-клеточной активацией (фиг. 26А-В). Экспрессия ингибирующих рецепторов на CD4+-Т-клетках была существенно в меньшей степени прогностической для индуцированной FolR1-TCB активации CD4+-Т-клеток по сравнению с экспрессией этих же рецепторов на CD8+-Т-клетках.
Пример 41
Индуцированный FolR1-TCB цитолиз опухолевых клеток обратно коррелирует с экспрессией PD-1 и TIM3
Для изучения индуцированного FolR1-TCB цитолиза опухолевых клеток при отрегулированном соотношении Е:Т 1:1 экзогенно добавляли меченные CFSE Skov3-клетки к ферментативно расщепленным образцам опухолей, которые содержали предварительно определенное количество CD3+-Т-клеток с использованием многоцветной проточной цитометрии. Индуцированный FolR1-TCB цитолиз Skov3-клеток определяли путем измерения активированной каспазы 3 и маркера живых/мертвых клеток. Аналогично с индуцированной FolR1-TCB Т-клеточной активацией, которую измеряли по повышающей регуляции CD25, специфический цитолиз после экспозиции FolR1-TCB отрицательно коррелировал с индивидуальной или совместной экспрессией PD-1 и TIM3 на CD8+-Т-клетках. Кроме того, на индуцированный FolR1-TCB цитолиз влиял также исходный уровень экспрессии CTLA-4 и совместной экспрессии PD-1 и CTLA-4. Однако влияние экспрессии CTLA-4 на индуцированный FolR1-TCB цитолиз опухолевых клеток было менее выраженным по сравнению с экспрессией PD-1 и TIM3.
Пример 42
Обработка свежих образцов пораженных опухолями тканей катумаксомабом - активация инфильтрующих опухоли Т-клеток при использовании катумаксомаба и корреляция с экспрессией ингибирующих рецепторов
Для определения степени, в которой катумаксомаб индуцирует активацию Т-клеток, и для подтверждения описанных выше данных, полученных с использованием второй независимой от Т-клеток биспецифической молекулы, 4 ферментативно расщепленных образца опухолей из пациентов с NSCLC обрабатывали катумаксомабом, трехфункциональным биспецифическим антителом, которое распознает CD3 на Т-клетках и ЕрСАМ на опухолевых клетках. Затем Т-клетки характеризовали с помощью проточной цитометрии в отношении экспрессии маркеров активации и Т-клеточных эффекторных функций (фиг. 17А-Г). При валидации полученных при создании изобретения описанных выше данных для FolR1-TCB, установлена значительная гетерогенность индуцированной катумаксомабом активации Т-клеток. Поэтому исходный уровень экспрессии ингибирующих рецепторов различался между пациентами (фиг. 17Д-З).
Анализ Т-клеточной активации и эффекторной функции после обработки катумаксомабом выявил две группы пациентов на основе экспрессии PD-1 и/или TIM3 на CD8+-Т-клетках, подтверждающий полученные при создании изобретения данные для FolR1-TCB (фиг. 18А-Т). Клетки, экспрессирующиее PD-1low, TIM3low и, в более выраженном случае PD-1low /TIM3low не могли активироваться катумаксомабом, в то время как в PD-1high, TIM3high и PD-1high /TIM3high Т-клетках имела место выраженная повышающая регуляция CD25, CD69, CD137, ICOS, гранзима В и IFN-γ.
Пример 43
Поликлональная стимуляция инфильтрующих опухоль Т-клеток с помощью CD3/CD28 - иммунное фенотипирование инфильтрующих опухоли субпопуляций Т-клеток в образцах немелкоклеточного рака легкого
При создании изобретения исследовали экспрессию коингибирующих Т-клеточных рецепторов и дифференцированных маркеров на инфильтрующих опухоли субпопуляциях CD3+CD8+- и CD3+CD4+-Т-клеток из 34 пациентов с NSCLC с помощью многоцветной проточной цитометрии. В большинстве опухолей обнаружен высокий уровень экспрессии ингибирующего рецептора PD-1 (фиг. 19А-Б), основного регулятора Т-клеточного истощения. Следует отметить, что экспрессия других ингибиторов контрольных точек (чекпойнтов), таких как TIM3, CTLA-4, LAG-3 или BTLA, характеризовалась значительной вариацией между Т-клетками, полученными из различных опухолей (фиг.19А-Б).
Пример 44
Кумулятивная экспрессия ингибирующих рецепторов определяет Т-клеточную дисфункцию
В этом примере поликлональную стимуляцию применяли в субоптимальной дозе для оценки воздействия ингибирующих рецепторов на Т-клеточную функцию. Воздействие стимуляции агонистическими антителами к CD3 и к CD28 на активацию Т-клеток, например, на экспрессию CD25, и на эффекторную функцию Т-клеток, которую оценивали на основе производства IFN-γ, TNF-α и IL-2, а также экспрессии гранзима В, значительно варьировалось между пациентами при определении с помощью проточной цитометрии (фиг. 20А-Б) и ELISA (фиг. 20В-Д). Следует отметить, что при создании изобретения обнаружены различные уровни Т-клеточной функции, варьирующие от популяций Т-клеток, которые имели в значительной степени сохраненную Т-клеточную функцию (т.е. характеризовались стабильной экспрессией CD25 и экспрессией гранзима В, а также стабильным производством IL-2, IFN-γ и TNF-α), до популяций Т-клеток с нарушенной Т-клеточной функцией (характеризовавшихся снижением экспрессии CD25 и гранзима В и производства цитокинов).
Для анализа воздействия нескольких ингибирующих рецепторов на функциональность Т-клеток при создании изобретения определяли балл ингибирующих рецепторов (iR) в качестве маркера кумулятивной экспрессии ингибирующих рецепторов на Т-клетках. Для этой цели процент экспрессии PD-1, TIM3, CTLA-4, Lag-3 и BTLA анализировали во всех NSCLC-образцах и определяли балл на основе медианы и межквартильных размахов каждого из экспрессируемых рецепторов и рассчитывали для каждого образца (например, фиг. 21Е). Для инфильтрующих опухоли CD8+-Т-клеток, экспрессия которых соответствовала высокому iR-баллу, свидетельствующему об экспрессии нескольких ингибирующих рецепторов, характерен маргинальный эффект после поликлональной стимуляции, коррелирующий с их высоким статусом дисфункции, в то время как Т-клетки с низким iR-баллом могли сильно активироваться в результате поликлональной стимуляции (фиг. 21А-Д). Повышающая регуляция Т-клеточных эффекторных функций, характеризующаяся производством IL-2, IFN-γ и TNF-α, не только коррелировала с кумулятивной экспрессией ингибирующих рецепторов, но также и с экспрессией PD-1 и TIM3, а также и с совместной экспрессией обоих рецепторов (фиг. 22А-И), что свидетельствует о существенном вкладе PD-1 и TIM3 в дисфункцию Т-клеток.
Пример 45
Экспрессия ингибирующих рецепторов
Индивидуальная и кумулятивная экспрессия ингибирующих рецепторов возрастала по мере развития опухолей. Экспрессия ингибирующих рецепторов коррелировала со стадией опухоли и развитием опухоли. Количество позитивных по PD-1, TIM3 и LAG-3 клеток четко возрастало по мере по мере повышения стадий опухоли (фиг. 21Ж-Л). Не обнаружено четкой корреляции с экспрессией CTLA-4, что может свидетельствовать о том, что этот рецептор действует посредством другого механизма ингибирования. Для BTLA, как правило, характерен низкий уровень экспрессии и лишь небольшое увеличение обнаружено на поздних стадиях развития опухолей (фиг. 21Л). Существенное повышение кумулятивной экспрессии ингибирующих рецепторов, выраженной в виде iR-балла, обнаружено у пациентов с нодальным позитивным раком и на поздних стадиях опухолей, в то время как размер первичных опухолей не коррелировал значимо с iR-баллом (фиг. 21М-Н). Эти данные позволяют предположить наличие постепенной и постоянной повышающей регуляции ингибирующих рецепторов в процессе развития опухолей, что наиболее вероятно влияет на Т-клеточное истощение при NSCLC.
Ингибирующие рецепторы постепенно экспрессируются на инфильтрующих опухоли Т-клетках. Для объяснения роли одновременной экспрессии различных ингибирующих рецепторов на единичных Т-клетках анализировали совместную экспрессию этих рецепторов в CD8+-Т-клетках (фиг. 32, 33) относительно экспрессии любого из пяти проанализированных рецепторов. Экспрессия выражена в виде мозаичной теплокарты, на которой представлен процент экспрессии для индивидуальных пациентов (фиг. 32), или в виде радарного графика, на котором экспрессия четырех соответствующих рецепторов на CD8+-Т-клетках выражена в виде среднего значения и стандартного отклонения, относительно пятого рецептора, обозначающего иммунную контрольную точку (фиг. 33). Для CD8+PD-1+-Т-клеток установлен наиболее низкий процент среднего уровня экспрессии относительно других ингибирующих рецепторов, в то время как на CD8+BTLA+-Т-клетках экспрессировались с высоким уровнем все из четырех остальных ингибирующих рецепторов, что свидетельствует о том, что BTLA является маркером наиболее истощенной субпопуляции Т-клеток (фиг. 32, 33). Обнаружено повышение количества совместно экспрессируемых ингибирующих рецепторов от CD8+TIM3+-Т-клеток к CD8+CTLA-4+-Т-клеткам и к CD8+LAG-3+-T-клеткам (фиг. 32, 33). Эти результаты позволяют предположить постепенное вовлечение ингибирующих рецепторов, при этом широко экспрессируемый PD-1 является ранним маркером, а повышающая регуляция BTLA скорее имеет место позднее в процессе истощения Т-клеток.
Пример 46
Блокада PD-1 позволяет частично восстанавливать Т-клеточную функцию Восстановление Т-клеточной функции путем блокады антителами к PD-1 зависит от уровня экспрессии PD-1. При создании изобретения выявлена четкая корреляция между уровнем экспрессии ингибирующих рецепторов, прежде всего PD-1 и TIM3, и активацией Т-клеток после поликлональной стимуляции, блокада путей PD-1 или PD-1/TIM3 может восстанавливать Т-клеточную функцию. Однако добавление блокирующего антитела к PD-1 (5С4) или совместная блокада PD-1 и TIM3 после стимуляции агонистическими антителами к CD3 и к CD28 восстанавливали эффекторную функцию Т-клеток, такую как производство и секреция IL-2, IFN-γ и TNF-α, только у некоторых пациентов, в то время как воздействие на других пациентов оказалось лишь маргинальным (фиг. 23А-Г). В соответствии с указанным для мышиной модели хронической LCMV (вирус лимфоцитарного хориоменингита)-инфекции (Blackburn и др., PNAS 105(39), 2008, с. 15016), при создании изобретения идентифицировали субпопуляции PD-1hi и PD-1int инфильтрующих опухоли CD8+-Т-клеток из пациентов с NSCLC. В целом метод состоял в следующем: субпопуляции PD-1hi, PD-1int и PD-1neg можно идентифицировать на основе измеренных уровней интенсивности флуоресценции. Клетки из 33 пациентов анализировали в отношении экспрессии PD-1 для определения единых параметров для воспроизводимого распознавания трех субпопуляций. Анализ перекрывал полный спектр уровней экспрессии PD-1 и включал образцы опухолей с четко разделенными популяциями PD-1neg или PD-1hi. Это позволяло устанавливать дискриминационные окна при осуществлении этого анализа, которые затем применяли для всех образцов.
Установлено, что только субпопуляции экспрессирующих PD-1int-Т-клеток могли восстанавливать активацию после блокады PD-1 или комбинированной блокады PD-1/TIM3, в то время как никакого воздействия на активацию Т-клеток не обнаружено при блокаде PD-1hi-клеток (фиг. 24). Последнее может свидетельствовать об «истощенном» в большей степени фенотипе, который может обладать устойчивостью к блокаде только PD-1.
При создании изобретения этот результат был подтвержден на Т-клетках, активированных FolR1-TCB. Т-клетки стимулировали FolR1 согласно описанному выше методу. Блокада PD-1 еще более усиливала индуцированную FolR1-TCB Т-клеточную активацию Т-клеток из субпопуляции пациентов.
Измерение индуцированной FolR1-TCB секреции IFN-γ, TNF и IL-2, стандартизованной относительно содержания Т-клеток в образцах, подтвердило, что полученные из пациентов популяции клеток со значительным количеством экспрессирующих PD-1hi (примерно>15%) клеток, не могли секретировать указанные цитокины. В противоположность этому, секрецию цитокинов удалось индуцировать в большинстве полученных из пациентов популяциях клеток с более низким количеством экспрессирующих PD-1hi (примерно <15%) клеток (фиг. 27А-В). В последней группе добавление блокирующего антитела к PD-1 или комбинированной блокады PD-1 и TIM3 после стимуляции с помощью FolR1-TCB стимулировало повышенное производство IL-2, IFN-γ и TNF-α (фиг. 28А-Е). Таким образом, субпопуляция, экспрессирующая PD-1hi, может иметь в большей степени «истощенный» фенотип, который может обладать устойчивостью к блокаде только PD-1.
Таким образом, эффекторные функции Т-клеток, такие как производство IL-2, ifn-γ и TNF-α, можно восстанавливать в TIL из некоторых пациентов с NSCLC, в то время как у других пациентов можно достигать лишь маргинальное восстановление функций Т-клеток. Повышение производства цитокинов в ответ на стимуляцию антителами к CD3/CD28 в комбинации с обработкой блокирующим антителом к PD-1 сравнивали с процентом PD-1hi CD8+-Т-клеток на пациента из PD-1-позитивной популяции. Повышение экспрессии цитокинов после блокады PD-1 обратно коррелировало с процентом PD-1hi Т-клеток, что свидетельствует о том, что пациенты, у которых имеет место экспрессия PD-1hi- Т-клеток в большем количестве, слабо реагируют на блокаду только PD-1 (фиг. 24А-В). Поскольку дисфункция Т-клеток коррелирует с экспрессией нескольких ингибирующих рецепторов (т.е. пациенты с высоким iR-баллом), и ответ на направленную на PD-1 терапию коррелирует с уровнями экспрессии PD-1 на CD8+-Т-клетках, при создании изобретения анализировали также экспрессию TIM3, CTLA-4, LAG-3 и BTLA в PD-1hi и PD-1int CD8-Т-клетках. Важно отметить, что PD-1hi Т-клетки экспрессировали значительно более высокие уровни дополнительных рецепторов по сравнению с PD-1int субпопуляциями (фиг. 34). Таким образом, по уровню PD-1hi и PD-1int можно идентифицировать две различные популяции Т-клеток, при этом PD-1hi Т-клетки могут иметь в большей степени «истощенный» фенотип, который не может восстанавливаться при блокаде только PD-1.
В настоящем изобретении представлены полученные впервые результаты всестороннего фенотипического и функционального анализа инфильтрующих опухоли CD8+-Т-клеток из пациентов с NSCLC. Данные свидетельствуют о том, что эти клетки главным образом имеют эффекторный фенотип, характерный для клеток памяти (CCR7-CD45RAlow), и обладают значительной гетерогенностью касательно экспрессии ингибирующих рецепторов, таких как PD-1, TIM3, CTLA-4, LAG-3 и BTLA. Однако обнаружено четкое увеличение количества рецепторов, экспрессируемых на инфильтрующих опухоли лимфоцитах (TIL) из опухолей на более поздних стадиях, что отражает прогрессивное развитие дисфункции Т-клеток в процессе развития опухолей. Представленные в настоящем описании данные свидетельствуют о том, что эффекторные функции TIL могут нарушаться у огромного большинства пациентов, и это нарушение коррелирует с экспрессией ингибирующих рецепторов. Для восстановления Т-клеточной функции с помощью приемлемого для клинического применения процесса при создании настоящего изобретения объединяли поликлональную стимуляцию Т-клеток с опосредуемым антителом ингибированием PD-1. Воздействие блокады PD-1 на функциональность Т-клеток варьировало между TIL из различных пациентов, но его можно прогнозировать путем оценки процента CD8+-Т-клеток, экспрессирующих высокие уровни PD-1.
Таким образом, при создании изобретения удалось продемонстрировать, что функциональность TIL может коррелировать и на нее может оказывать значительное воздействие количество и уровень экспрессии ингибирующих рецепторов. Следует отметить, что даже Т-клетки, экспрессирующие низкие уровни ингибирующих рецепторов, имели в некоторой степени нарушенную функциональность, так секреция IL-2 оказалась нарушенной у огромного большинства пациентов. В целом, активация и эффекторная функция CD8+-Т-клеток обратно коррелировали с кумулятивной экспрессией ингибирующих рецепторов, что свидетельствует о непосредственном вкладе различных ингибирующих путей в дисфункцию Т-клеток при NSCLC.
Проведенный при создания изобретения анализ пяти ингибирующих рецепторов на инфильтрующих опухоли CD8+-Т-клетках продемонстрировал четкое повышение индивидуальной и кумулятивной экспрессии этих ингибирующих рецепторов в тканях опухолей из пациентов с NSCLC, которые имеют пораженные опухолью лимфатические узлы и поздней стадии развития опухолей. Экспрессия CTLA-4 отличалась от экспрессии других четырех рецепторов наиболее высоким процентом позитивных клеток на ранних стадиях, что может свидетельствовать об отличной от других рецепторов роли CTLA-4 в регуляции Т-клеточного иммунитета (Topalian и др., Safety, activity, and immune correlates of anti-PD-1 антитело in cancer. N. Engl. J. Med. 366, 28 июня 2012, с. 2443). Анализ совместной экспрессии дополнительных ингибирующих рецепторов на единичных клетках относительно экспрессии одного из указанных рецепторов продемонстрировал постепенное увеличение от ранней к более поздней стадии повышающей регуляции PD-1 и BTLA соответственно. Это может отражать динамический процесс Т-клеточного истощения.
Результаты, представленные в настоящем описании, свидетельствуют о клинической значимости экспрессии ингибирующих рецепторов при развитии NSCLC, что ассоциировано с прогрессирующим недостатком иммунного контроля при росте опухолей. При создании изобретения задокументированы две популяции инфильтрующих опухоли CD8+-Т-клеток, характеризующиеся различными уровнями экспрессии PD-1 (субпопуляции PD-1hi и PD-1int). Частота встречаемости PD-1hi-Т-клеток не коррелировала с процентом экспрессии PD-1.
Важно отметить, что при создании изобретения было обнаружено, что воздействие блокады PD-1 коррелировало с уровнями экспрессии PD-1, что характеризовалось минимальным воздействиями на чувствительность TIL с наиболее высоким относительным содержанием субпопуляцией PD-1hi. Эти результаты согласуются с данными экспериментов, проведенных на мышиной модели с хронической LCMV-инфекцией, согласно которым субпопуляция PD-1int DbGP33-специфических CD8+-Т-клеток могла восстанавливаться после блокады PD-1. В противоположность этому, субпопуляция PD-1hi по-видимому была более «истощенной», т.е. имела признаки функционального истощения и слабо реагировала на блокаду PD-1. Таким образом, уровень экспрессии PD-1 может являться новым маркером, который позволяет различать субпопуляции Т-клеток при некоторых видах человеческого рака и может служить прогностическим фактором ответов на лечение антителами, блокирующими PD-1.
Пример 47
Активация Т-клеток из здоровых доноров и страдающих раком пациентов с помощью FolR1-TCB
Для оценки воздействия FolR1-TCB на активацию Т-клеток мононуклеарные клетки периферической крови (РВМС) здоровых доноров совместно культивировали с линией FolR1+-клеток рака яичника Skov3 (фиг. 40А). После воздействия возрастающих концентраций FolR1-TCB от 0,6пМ до 2нМ в течение 24 ч обнаружена сильная активация CD8+-Т-клеток с повышающей регуляцией CD25, CD137 и ICOS. Кроме того, Т-клетки секретировали IL-2, IFN-γ и TNF. Экспозиция ТСВ DP47, т.е. ТСВ, направленной против нерелевантного антигена, не индуцировала какую-либо активацию Т-клеток (фиг. 40Б и В).
Пример 48
Экспрессия ингибирующих рецепторов сильно различается в инфильтрующих опухоли CD8+-Т-клетках
Поскольку присутствующие в опухолях Т-клетки часто отличаются фенотипом с высокой степенью дисфункциональности, обнаруженная гетерогенность касательно активации Т-клеток среди различных пациентов после стимуляции FolR1-TCB, может являться следствием нарушенной функциональности TIL. Отличительным признаком дисфункциональности Т-клеток как при хронических вирусных инфекциях, так и в опухолях является сверхэкпрессия ингибирующих рецепторов. По этой причине при создании изобретения определяли экспрессию иммунных контрольных точек PD-1, TIM3, CTLA-4, Lag-3 и BTLA на инфильтрующих опухоли CD8+-Т-клетках во всех образцах опухолей. При создании изобретения обнаружено высокое разнообразие в частоте и объединенной экспрессии этих рецепторов для различных опухолей; было установлено, что PD-1 является наиболее часто встречающимся ингибирующим рецептором с наиболее высоким процентом экспрессии (60,2±30%), далее в порядке убывания за ним следовали TIM3 (29,5±24,4%), CTLA-4 (24,6±17,6%), Lag-3 (7,0±5,9%) и BTLA (3,9±2,6%) (фиг. 35Е). Как описано выше для мышиной модели хронической вирусной инфекции (Blackburn и др., Proc Nati Acad Sci USA 105(39), 2008, ее. 15016-15021) и как продемонстрировано в настоящем описании, в человеческих опухолях PD-1+-популяцию можно разделять на экспрессирующие PD-1hi и PD-1int субпопуляции (фиг. 35А). Анализ дополнительных ингибирующих рецепторов, экспрессируемых в указанных конкретных субпопуляциях, продемонстрировал существенно более высокий уровень экспрессии всех других ингибирующих рецепторов, включая TIM3, CTLA-4, Lag-3 и BTLA, в PD-1hi-субпопуляции по сравнению с экспрессией этих рецепторов в PD-1int - и PD-1neg - субпопуляциях (фиг. 36А-Г). По этой причине при создании изобретения применяли процент PD-1hi Т-клеток в CD8+-субпопуляции в качестве суррогатного маркера кумулятивной экспрессии ингибирующих рецепторов. Образцы опухолей разделяли в зависимости от частоты встречаемости PD-1hi-клеток на две группы с высокой («богатые» PD-1hi опухоли) и низкой частотой встречаемости экспрессирующих PD-1hi-Т-клеток («бедные» PD-1hi опухоли) соответственно. В качестве отсекающего значения экспрессии PD-1hi для разделения двух групп выбран уровень, равный 30%. Процент PD-1hi-клеток составлял 39,1-60,5% в «богатой» PD-1hi (49,5±7,9%) и 2,65-19,5% в «бедной» PD-1hi группе (8,4±5,7%; фиг. 36Д). Отсекающее значение подтверждали во второй группе пациентов, включающей 14 пациентов с NSCLC и 2 с раком яичника, со сходным распределением частоты встречаемости PD-1hi-клеток, в которой были получены сопоставимые результаты после поликлональной стимуляции с использованием антител к CD3/к CD28 (фиг. 39).
Пример 49
Индуцированная FolR1-TCB активация Т-клеток сильно зависит от уровня экспрессии PD-1 на CD8+-Т-клетках
При создании изобретения анализировали, может ли экспрессия ингибирующих рецепторов коррелировать со сниженной функциональностью Т-клеток после обработки FolR1-TCB. В соответствии с результатами, описанными выше в примере 41, индуцированная FolR1-TCB активация Т-клеток, изученная на примере экспрессии CD25, CD 137 и ICOS (p=0,028; p<0,001 и p=0,008 соответственно), и эффекторные функции Т-клеток, оцененные по секреции IFN-γ, IL-2, TNF, а также перфорина, существенно нарушались в «богатых» PD-1hi опухолях по сравнению с «бедными» PD-1hi опухолями (p=0,019; p=0,007; p=0,028 и p=0,029 соответственно; фиг. 37А-Ж). Аналогично этому, в «богатых» PD-1hi опухолях имела место существенно пониженная цитотоксичность после стимуляции FolR1-TCB, в то время как сильный цитолиз опухолевых клеток удалось обнаружить в большинстве «бедных» PD-1hi опухолях (p=0,021; фиг. 373).
Пример 50
Блокада PD-1 восстанавливает индуцированную FolR1-TCB Т-клеточную функцию только в «бедных» PD-1hi опухолях
Поскольку уровень экспрессии PD-1 на TIL коррелирует с эффективностью FolR1-TCB, при создании изобретения анализировали, может ли блокада оси PD-1/PD-L1 в комбинации с обработкой FolR1-TCB восстанавливать Т-клеточную функцию. Было установлено, что после совместной обработки FolR1-TCB и блокирующим PD-1 антителом ниволумабом (MDX5C4) секреция эффекторных цитокинов ifn-γ, TNF и IL-2, а также перфорина может повышаться только в некоторых «бедных» PD-1hi опухолях. В противоположность этому, в «богатых» PD-1hi опухолях блокада PD-1 не приводила к какому-либо ответу (фиг. 38А-Г). Следует отметить, что дополнительная блокада PD-1 не приводила к повышению цитотоксического лизиса опухолевых клеток в Т-клетках ни в «бедных» PD-1, ни в «богатых» PD-1hi опухолях (фиг. 38Д).
В приведенных выше примерах продемонстрирована иммуномодулирующая способность CD3 × FolR1-специфических ТСВ в пораженных первичными опухолями образцах из пациентов с немелкоклеточным раком легкого (NSCLC), эпителиальной карциномой яичника (ЕОС) и почечно-клеточной карциномой (RCC). По сравнению с полностью функциональными периферическими Т-клетками из здоровых доноров обнаружена выраженная гетерогенность в отношении индуцированного FolR1-ТСВ цитолиза опухолевых клеток и Т-клеточной активации между различными образцами человеческих опухолей, что приводило к частичному или полному нарушению Т-клеточной функции у большинства пациентов. Всесторонний анализ экспрессии ингибирующих рецепторов на клеточной поверхности находящихся внутри опухолей Т-клеток продемонстрировал, что эффективность активации Т-клеток FolR1-TCB обратно коррелировала с уровнями экспрессии PD-1. Пациенты с опухолями, «богатыми» PD-1hi, характеризовались нарушенной активацией Т-клеток и нарушенной эффекторной функцией после обработки FolR1-TCB. Кроме того, указанные пациенты не реагировали на блокаду PD-1 в отличие от соответствующих пациентов с низким уровнем экспрессии PD-1hi. Таким образом, биологическая активность биспецифических антител значительно затруднялась вследствие дисфункции Т-клеток, что являлось результатом, по меньшей мере частично, постоянной и отличающейся высоким разнообразием экспрессией ингибирующих рецепторов.
При создании изобретения обнаружили сильную повышающую регуляцию маркеров активации Т-клеток, секреции эффекторных цитокинов и цитолиза опухолевых клеток после стимуляции FolR1-TCB в РВМС из здоровых доноров (фиг. 40). Однако в полной противоположности этому, эффекторные функции Т-клеток варьировались в большей степени и, как правило, снижались в находящихся внутри опухолей Т-клетках. В частности, цитолитическая активность и производство эффекторных цитокинов оказались существенно более низкими в TIL с полной утратой производства IL-2 и серьезным нарушением секреции TNF и IFN-γ в большинстве опухолей.
При создании изобретения задокументирована экспрессия ингибирующих рецепторов PD-1, TIM3, CTLA-4, Lag-3 и BTLA на находящихся внутри опухолей CD8+-Т-клетках. Для PD-1 характерен наиболее широкий диапазон экспрессии всех проанализированных ингибирующих рецепторов. Данные, полученные при исследовании на мышиной модели хронических LCMV-инфекций, проведенном Blackburn, позволяют предположить присутствие функционально различных PD-1-позитивных субпопуляций Т-клеток, которые можно разделять на основе уровней MFI с помощью проточной цитометрии (Blackburn и др., PNAS 105(39), 2008, с. 15016). Следует отметить, что субпопуляции PD-1hi-Т-клеток отличались высоким уровнем совместной экспрессии TIM3 и CTLA-4 и меньшим уровнем Lag-3 и BTLA, в то время субпопуляции PD-1int экспрессировали лишь невысокие уровни других ингибирующих рецепторов, сопоставимые с PD-1neg-Т-клетками. Частота встречаемости PD-1hi CD8+-Т-клеток сильно различалась между пациентами и позволила авторам настоящего изобретения выявлять различие между «богатыми» и «бедными» PD-1hi опухолями. В отличие от пациентов с «бедным» PD-1hi фенотипом опосредованная FolR1-TCB активация Т-клеток и цитолиз опухолевых клеток существенно нарушался в опухолях с «богатым» PD-1hi фенотипом. Эти данные расширяют и подтверждают сделанные ранее наблюдения о том, что активация и эффекторная функция CD8+-Т-клеток коррелирует с совместной экспрессией множества иммунных контрольных точек (Sakuishi и др., J Exp Med 207(10), 2010, cc. 2187-2194; Fourcade и др., J Exp Med 207(10), 2010, cc. 2175-2186; Grosso и др., J Immunol 182(11), 2009, cc. 6659-6669; Matsuzaki и др., Proc Nati Acad Sci USA 107(17), 2010, cc. 7875-7880; Fourcade и др., Cancer Res 72(4), 2012, cc. 887-896). Таким образом, частоту встречаемости PD-1hi Т-клеток можно применять в качестве суррогатного маркера функциональности TIL после активации с помощью ТСВ, а также она может служить в качестве прогностического маркера терапевтических ответов на обработку ТСВ. Указанный иммунный профиль может способствовать отбору пациентов, которые, вероятно, будут отвечать на иммунотерапию, например, на основе ТСВ. Эту корреляцию с клинической пользой следует определить в перспективных клинических исследованиях.
Перспективным путем повышения терапевтической эффективности ТСВ является блокада ингибирующих сигналов на Т-клетках. Поскольку PD-1 оказался наиболее заметным экспрессируемым ингибирующим рецептором во всех проанализированных опухолях, при создании изобретения оценивали, может ли блокада PD-1 повышать эффекторные функции Т-клеток после активации с помощью ТСВ. Была выявлена повышенная секреция эффекторных цитокинов после объединенной обработки FolR1-TCB и антителом к PD-1, однако только в «бедных» PD-1hi опухолях. Таким образом, существует необходимость в новых терапевтических стратегиях, позволяющих трансформировать PD-1hi в PD-1int Т-клетки, для повышения чувствительности к блокаде PD-1/PD-L1.
Важно отметить, что при создании изобретения не обнаружено повышения цитолиза опухолевых клеток после одновременной блокады PD-1 во всех образцах опухолей. Таким образом, блокады единичной иммунной контрольной точки может оказаться недостаточно для восстановления способности к цитолизу у TIL. Однако на мышиной модели опухоли установлено, что блокада оси PD-1/PD-L1 повышает Т-клеточную инфильтрацию опухоли (Curran и др., Proc Nati Acad Sci USA 107(9), 2010, cc. 4275-4280), что является особенностью указанной обработки, отличной от подхода in vitro, который применен в настоящем описании. Так, терапевтическое действие блокады PD-1 in vivo может являться результатом не только повышения Т-клеточной цитотоксичности находящихся внутри опухолей Т-клеток, но и устойчивой функциональности вновь инфильтрующих Т-клеток. Установлено, что индуцированная ТСВ активация Т-клеток приводит к повышающей регуляции экспрессии PD-1, что может приводить к вторичной устойчивости в присутствии PD-L1, который экспрессируется и на опухолевых клетках, и на инфильтрующих иммунных клетках, что в последнее время продемонстрировано как для Her2-специфических ТСВ, так и для специфических для карциноэмбрионального антигена (СЕА) ТСВ (Junttila и др., Cancer Res 74(19), 2014, cc. 5561-5571; Osada и др.. Cancer Immunol Immunother 2015). Важно отметить, что блокада оси PD-1/PD-L1 может полностью восстанавливать индуцированную ТСВ Т-клеточную функцию как in vitro, так и на мышиной модели опухоли. Эти результаты свидетельствуют о том, что совместное введение ингибиторов контрольных точек позволяет предупреждать вторичную устойчивость, что может увеличивать дисфункциональный статус TIL и ограничивать терапевтическую эффективность ТСВ. Существует выраженная необходимость в дальнейшем исследовании для определения оптимальных комбинированных режимов ингибиторов контрольных точек и ТСВ. Также решающее значение имеет идентификация ингибирующих и активирующих Т-клеточных рецепторов, не обладающих избыточной функцией, в качестве потенциальных терапевтических мишеней.
Полученные при создании изобретения данные четко свидетельствуют о том, что биспецифические антитела, такие как FolR1-TCB, обладают способностью принуждать Т-клетки осуществлять повышающую регуляцию костимуляторных молекул, продуцировать провоспалительные цитокины и приобретать цитолитическую функцию. Были обнаружены различные статусы Т-клеточной дисфункции, обусловленные, по меньшей мере частично, экспрессией ингибирующих рецепторов, и в некоторых случаях они снижают эффективность ТСВ. Поскольку индуцированные FolR1-TCB эффекторные функции могут лишь частично восстанавливаться блокадой PD-1, результаты, полученные при создании изобретения, позволяют скорее предположить наличие комплексной иммунной регуляции, в которой используется несколько и, в конечном счете, не дублирующих путей, для поддержания Т-клеточной дисфункция в окружении опухолей.
Аминокислотные последовательности для представленных в качестве примера вариантов осуществления изобретения
1) FolR-связывающие агенты, пригодные для применения в формате с общей легкой цепью, вариабельная тяжелая цепь

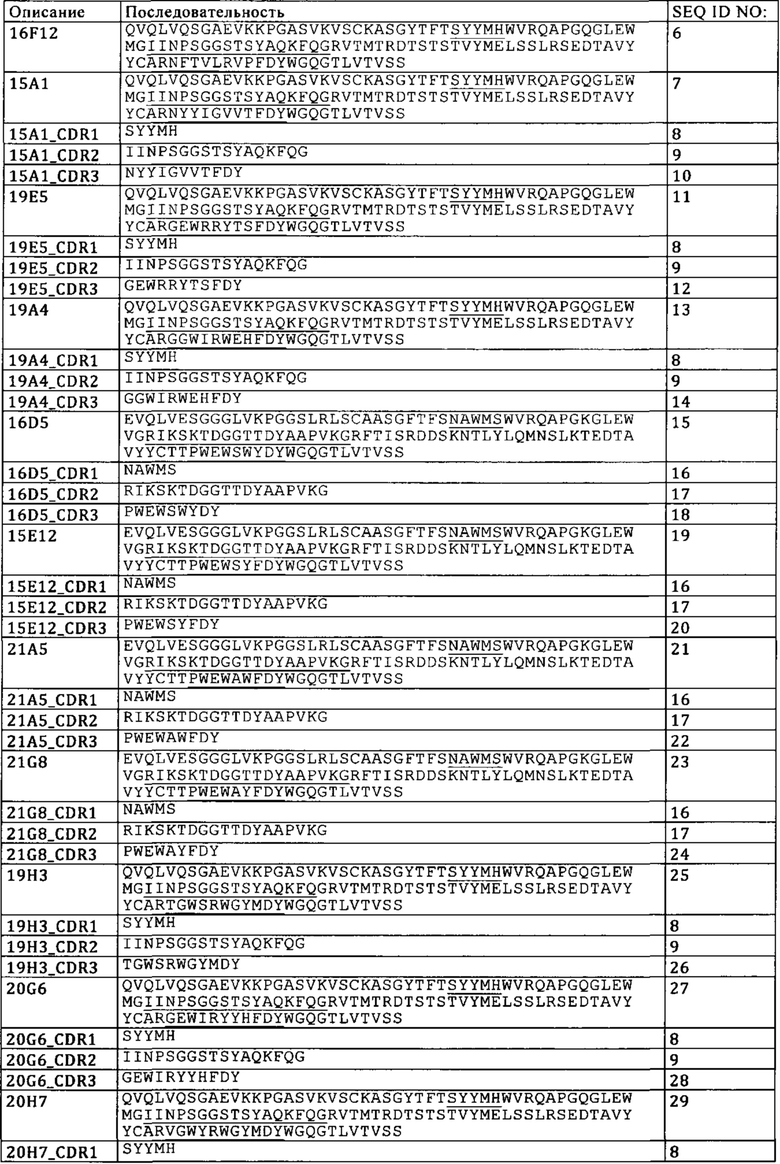

2) CD3-связывающий агент, общая легкая цепь (CLC)

3) CD3-связывающий агент, тяжелая цепь


4) FolR-связывающие агенты, которые можно применять для Crossfab-формата
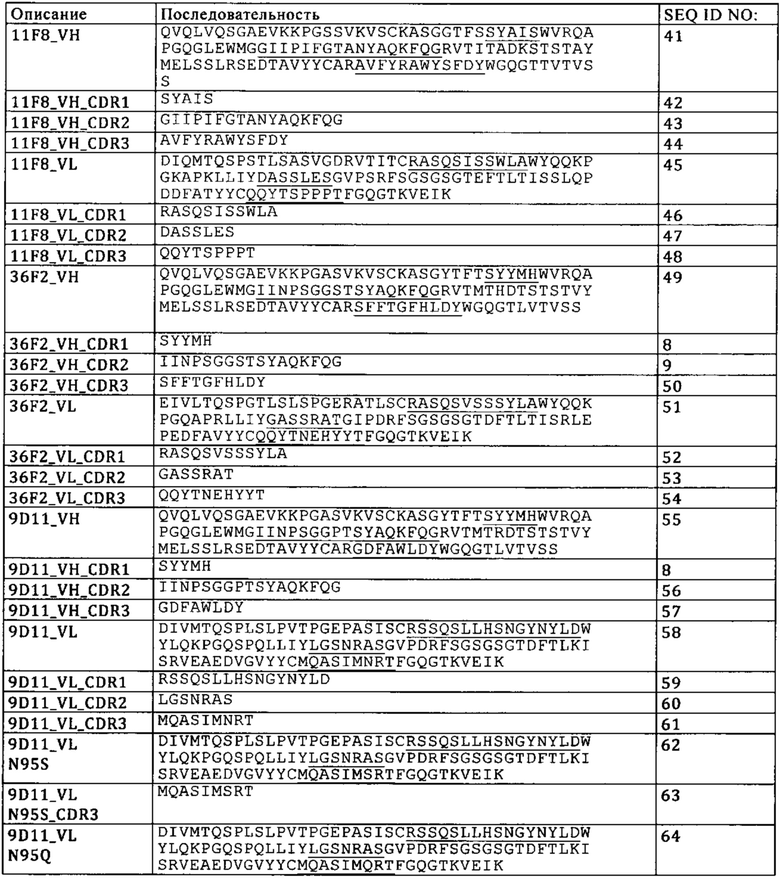
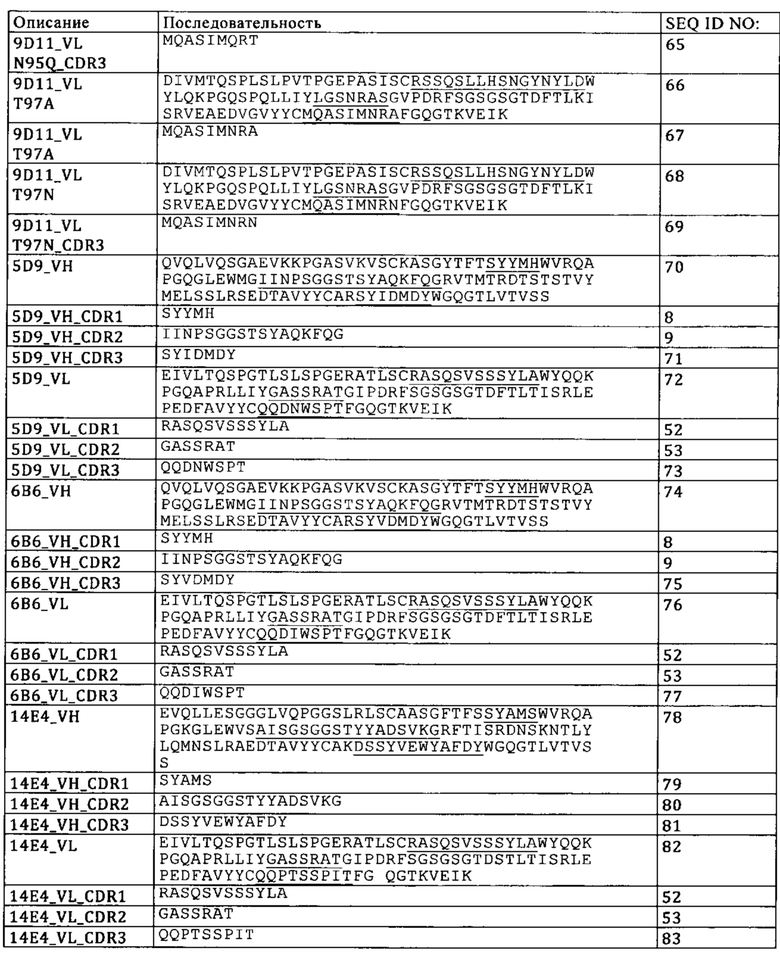
5) CD3-связывающие агенты, которые можно применять для Crossfab-формата
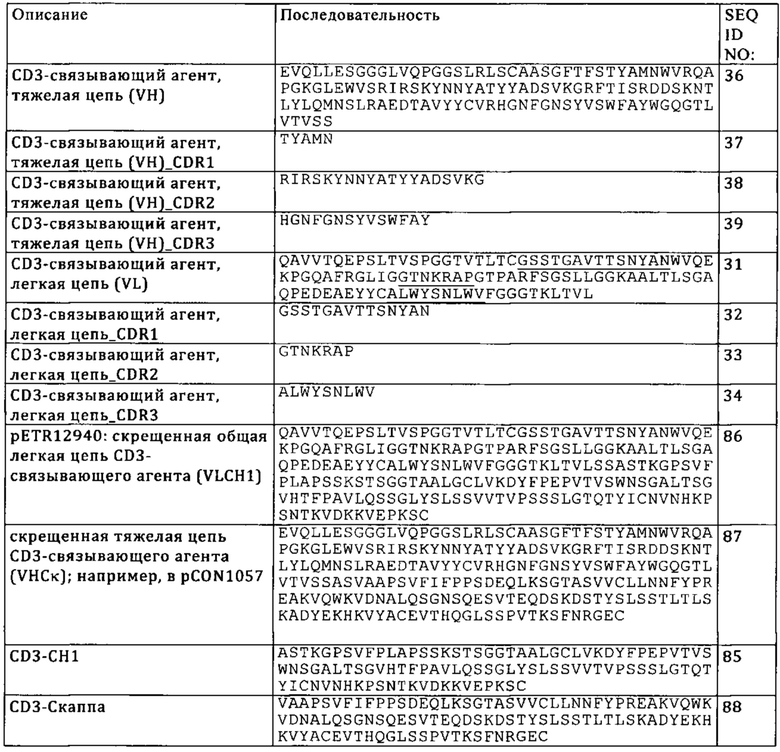
6) Примеры аминокислотных последовательностей биспецифических антител к CD3-FolR в формате «2+1 инвертированная, Crossmab»

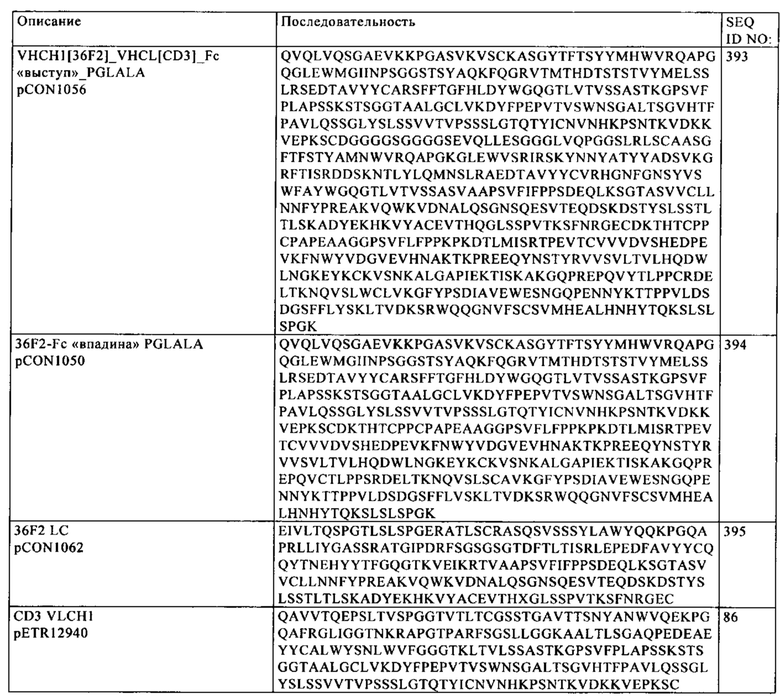
7) Примеры аминокислотных последовательностей биспецифических антител к CD3-FolR с общей легкой цепью




8) Примеры вариантов 16D5 с пониженной аффинностью
а. Примеры вариантов легкой цепи с пониженной аффинностью

б. Примеры вариантов тяжелой цепи с пониженной аффинностью


9) Дополнительные примеры вариантов осуществления изобретения, созданных с использованием фаговой дисплейной библиотеки (CDR подчеркнуты)
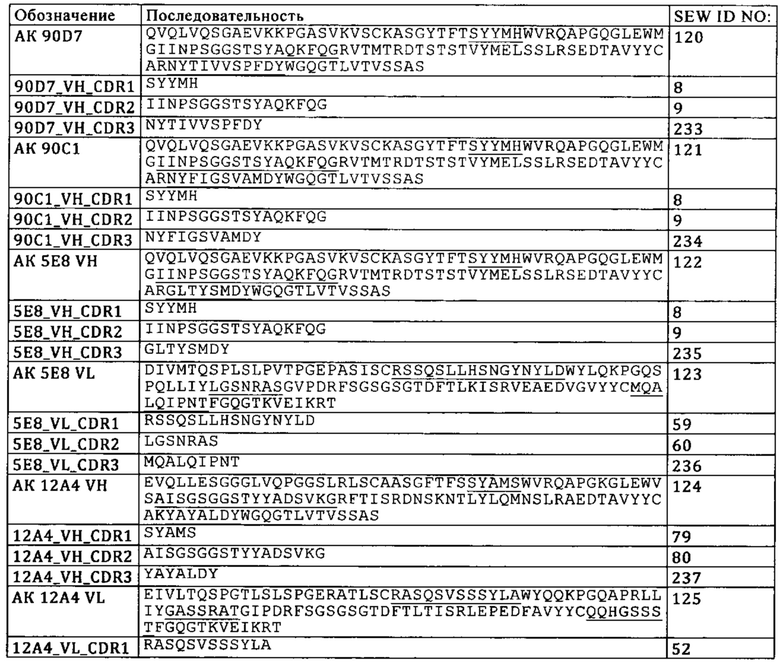
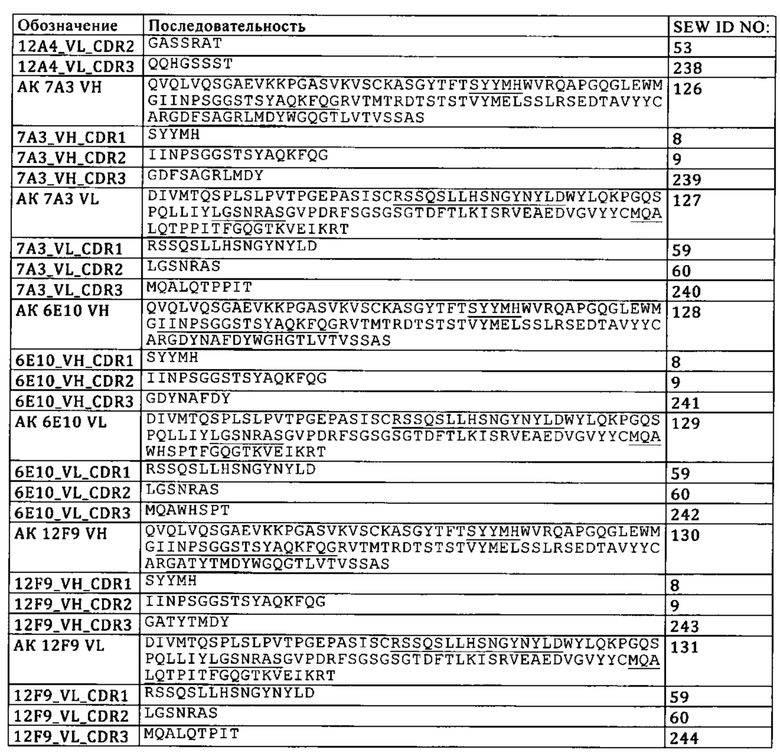
10) Гликозилированные варианты 9D11: вариабельная легкая цепь представленных в качестве примеров вариантов осуществления изобретения (CDR подчеркнуты)


11) Варианты с удаленными сайтами деамидирования
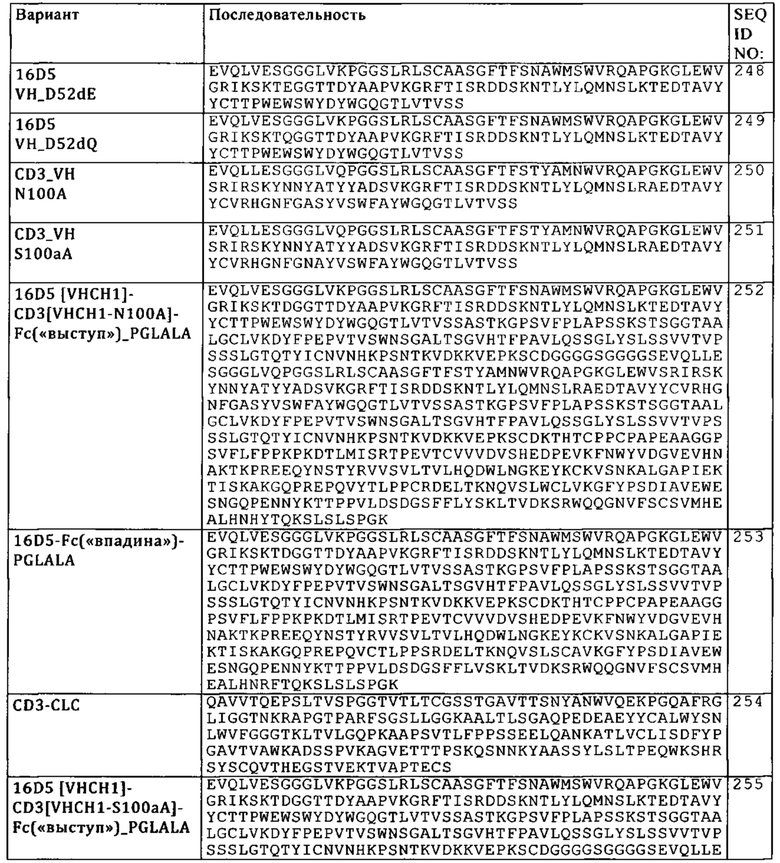

12) Представленные в качестве примеров варианты ТСВ на основе Mov19 (CDR подчеркнуты)


13) Дополнительные FolR1-TCB с промежуточной аффинностью (CDR, определенные согласно Кэботу, подчеркнуты):

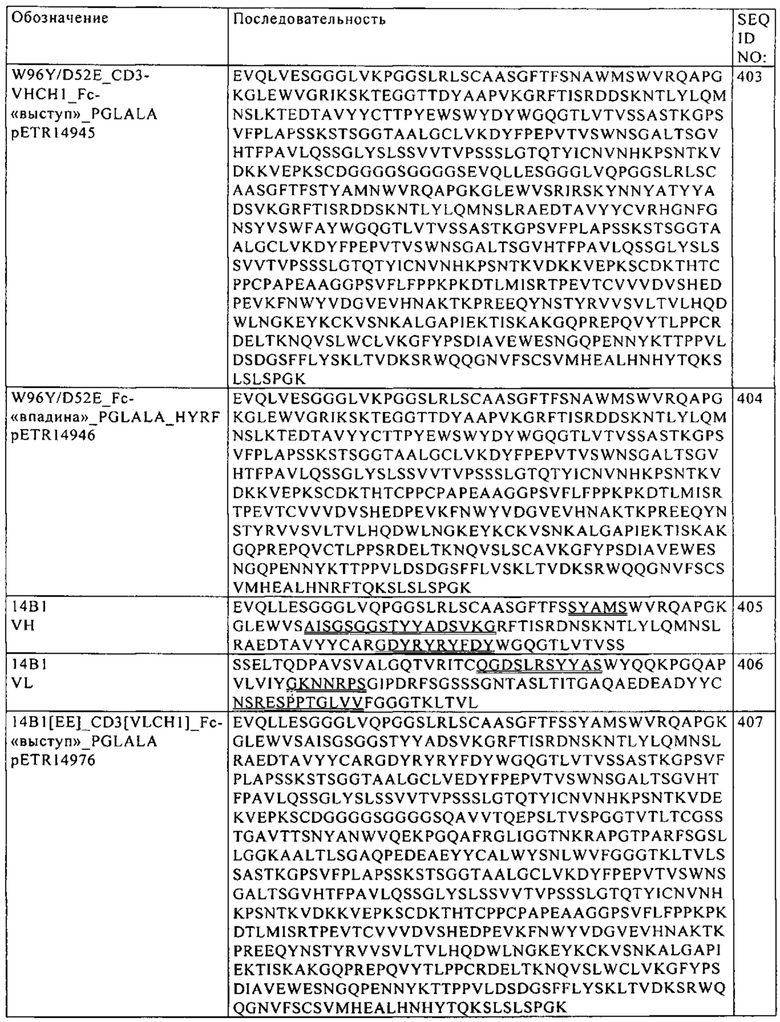


14) Последовательности антигенов
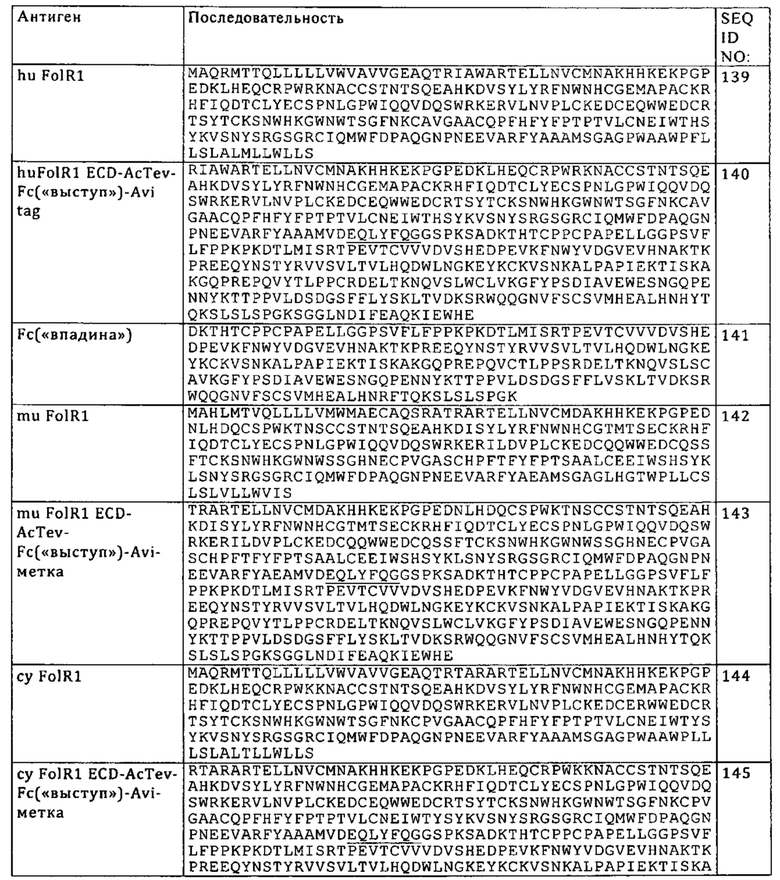
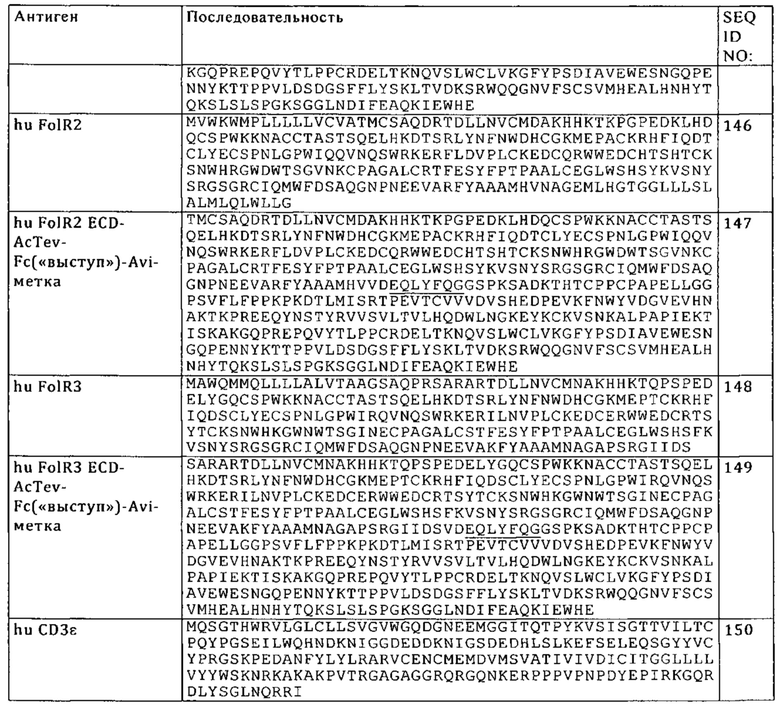
15) Нуклеотидные последовательности для представленных в качестве примеров вариантов осуществления изобретения












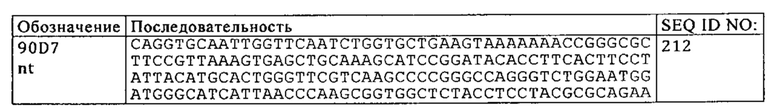















Примеры последовательностей антагонистов PD1


Приведенные в качестве примера последовательности антител к TIM3
Ниже в перечне последовательностей представлены приведенные в качестве примера аминокислотные последовательности антител к TIM3 и приведенные в качестве примера последовательности TIM3:
SEQ ID NO: 304 HVR-H1 тяжелой цепи, Tim3_0016
SEQ ID NO: 305 HVR-H2 тяжелой цепи, Tim3_0016
SEQ ID NO: 306 HVR-H3 тяжелой цепи, Tim3_0016
SEQ ID NO: 307 HVR-L1 легкой цепи, Tim3_0016
SEQ ID NO: 308 HVR-L2 легкой цепи, Tim3_0016
SEQ ID NO: 309 HVR-L3 легкой цепи, Tim3_0016
SEQ ID NO: 310 вариабельный домен тяжелой цепи VH, Tim3_0016
SEQ ID NO: 311 вариабельный домен легкой цепи VL, Tim3_0016
SEQ ID NO: 312 вариабельный домен тяжелой цепи VH, Tim3_0016, вариант (0018)
SEQ ID NO: 313 вариабельный домен легкой цепи VL, Tim3_0016, вариант (0018)
SEQ ID NO: 314 HVR-L1 легкой цепи, Tim3_0016_HVR-L1 вариант 1_NQ (удален сайт гликозилирования в результате мутации N на Q)
SEQ ID NO: 315 HVR-L1 легкой цепи, Tim3_0016_HVR-L1 вариант 2_NS (удален сайт гликозилирования в результате мутации N на S)
SEQ ID NO: 316 HVR-H1 тяжелой цепи, Tim3_0021
SEQ ID NO: 317 HVR-H2 тяжелой цепи, Tim3_0021
SEQ ID NO: 318 HVR-H3 тяжелой цепи, Tim3_0021
SEQ ID NO: 319 HVR-L1 легкой цепи, Tim3_0021
SEQ ID NO: 320 HVR-L2 легкой цепи, Tim3_0021
SEQ ID NO: 321 HVR-L3 легкой цепи, Tim3_0021
SEQ ID NO: 322 вариабельный домен тяжелой цепи VH, Tim3_0021
SEQ ID NO: 323 вариабельный домен легкой цепи VL, Tim3_0021
SEQ ID NO: 324 HVR-H1 тяжелой цепи, Tim3_0022
SEQ ID NO: 325 HVR-H2 тяжелой цепи, Tim3_0022
SEQ ID NO: 326 HVR-H3 тяжелой цепи, Tim3_0022
SEQ ID NO: 327 HVR-L1 легкой цепи, Tim3_0022
SEQ ID NO: 328 HVR-L2 легкой цепи, Tim3_0022
SEQ ID NO: 329 HVR-L3 легкой цепи, Tim3_0022
SEQ ID NO: 330 вариабельный домен тяжелой цепи VH, Tim3_0022
SEQ ID NO: 331 вариабельный домен легкой цепи VL, Tim3_0022
SEQ ID NO: 332 HVR-H1 тяжелой цепи, Tim3_0026
SEQ ID NO: 333 HVR-H2 тяжелой цепи, Tim3_0026
SEQ ID NO: 334 HVR-H3 тяжелой цепи, Tim3_0026
SEQ ID NO: 335 HVR-L1 легкой цепи, Tim3_0026
SEQ ID NO: 336 HVR-L2 легкой цепи, Tim3_0026
SEQ ID NO: 337 HVR-L3 легкой цепи, Tim3_0026
SEQ ID NO: 338 вариабельный домен тяжелой цепи VH, Tim3_0026
SEQ ID NO: 339 вариабельный домен легкой цепи VL, Tim3_0026
SEQ ID NO: 340 HVR-H1 тяжелой цепи, Tim3_0028
SEQ ID NO: 341 HVR-H2 тяжелой цепи, Tim3_0028
SEQ ID NO: 342 HVR-H3 тяжелой цепи, Tim3_0028
SEQ ID NO: 343 HVR-L1 легкой цепи, Tim3_0028
SEQ ID NO: 344 HVR-L2 легкой цепи, Tim3_0028
SEQ ID NO: 345 HVR-L3 легкой цепи, Tim3_0028
SEQ ID NO: 346 вариабельный домен тяжелой цепи VH, Tim3_0028
SEQ ID NO: 347 вариабельный домен легкой цепи VL, Tim3_0028
SEQ ID NO: 348 HVR-H1 тяжелой цепи, Tim3_0030
SEQ ID NO: 349 HVR-H2 тяжелой цепи, Tim3_0030
SEQ ID NO: 350 HVR-H3 тяжелой цепи, Tim3_0030
SEQ ID NO: 351 HVR-L1 легкой цепи, Tim3_0030
SEQ ID NO: 352 HVR-L2 легкой цепи, Tim3_0030
SEQ ID NO: 353 HVR-L3 легкой цепи, Tim3_0030
SEQ ID NO: 354 вариабельный домен тяжелой цепи VH, Tim3_0030
SEQ ID NO: 355 вариабельный домен легкой цепи VL, Tim3_0030
SEQ ID NO: 356 HVR-H1 тяжелой цепи, Tim3_0033
SEQ ID NO: 357 HVR-H2 тяжелой цепи, Tim3_0033
SEQ ID NO: 358 HVR-H3 тяжелой цепи, Tim3_0033
SEQ ID NO: 359 HVR-L1 легкой цепи, Tim3_0033
SEQ ID NO: 360 HVR-L2 легкой цепи, Tim3_0033
SEQ ID NO: 361 HVR-L3 легкой цепи, Tim3_0033
SEQ ID NO: 362 вариабельный домен тяжелой цепи VH, Tim3_0033
SEQ ID NO: 363 вариабельный домен легкой цепи VL, Tim3_0033
SEQ ID NO: 364 HVR-H1 тяжелой цепи, Tim3_0038
SEQ ID NO: 365 HVR-H2 тяжелой цепи, Tim3_0038
SEQ ID NO: 366 HVR-H3 тяжелой цепи, Tim3_0038
SEQ ID NO: 367 HVR-L1 легкой цепи, Tim3_0038
SEQ ID NO: 368 HVR-L2 легкой цепи, Tim3_0038
SEQ ID NO: 369 HVR-L3 легкой цепи, Tim3_0038
SEQ ID NO: 370 вариабельный домен тяжелой цепи VH, Tim3_0038
SEQ ID NO: 371 вариабельный домен легкой цепи VL, Tim3_0038
SEQ ID NO: 372 пример варианта 1 экзотоксина A Pseudomonas (пример деиммунизированного PE24)
SEQ ID NO: 373 пример варианта 2 экзотоксина A Pseudomonas (пример деиммунизированного PE24)
SEQ ID NO: 374 константная область человеческой легкой каппа-цепи
SEQ ID NO: 375 константная область человеческой легкой лямбда-цепи
SEQ ID NO: 376 константная область человеческой тяжелой цепи, полученной из IgG1
SEQ ID NO: 377 константная область человеческой тяжелой цепи, полученной из IgG1 с мутациями L234A и L235A
SEQ ID NO: 378 константная область человеческой тяжелой цепи, полученной из IgG1 с мутациями L234A, L235A и P329G
SEQ ID NO: 379 константная область человеческой тяжелой цепи, полученной из IgG4
SEQ ID NO: 380 пример последовательностей человеческого TIM3
SEQ ID NO: 381 внеклеточный домен (ECD) человеческого TIM3
Хотя представленное выше изобретение подробно описано для целей лучшего понимания с помощью иллюстраций и примеров, описание и примеры не следует рассматривать как ограничивающие объем изобретения. Содержание всех процитированных патентов и научной литературы полностью включено в настоящее описание в качестве ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ф.Хоффманн-Ля Рош АГ
<120> Комбинированная терапия на основе активирующих T-клетки
биспецифических антигенсвязывающих молекул против CD3 и
фолатного рецептора 1 (FOLR1) и антагонистов, связывающихся
с осью PD-1
<130> 32401
<140>
<141>
<150> EP 15167173.2
<151> 2015-05-11
<150> EP 15152141.6
<151> 2015-01-22
<150> EP 14194136.9
<151> 2014-11-20
<160> 430
<170> PatentIn, версия 3.5
<210> 1
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Tyr Ala Gly Val Thr Pro Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 2
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Tyr Thr Gly Gly Ser Ser Ala Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser
115 120
<210> 3
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Tyr Leu Phe Ser Thr Ser Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Tyr Ile Gly Ile Val Pro Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 5
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Tyr Val Gly Val Ser Pro Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 6
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 6
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Phe Thr Val Leu Arg Val Pro Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 7
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 7
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Tyr Ile Gly Val Val Thr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 8
Ser Tyr Tyr Met His
1 5
<210> 9
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 9
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 10
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 10
Asn Tyr Tyr Ile Gly Val Val Thr Phe Asp Tyr
1 5 10
<210> 11
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 11
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Trp Arg Arg Tyr Thr Ser Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 12
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 12
Gly Glu Trp Arg Arg Tyr Thr Ser Phe Asp Tyr
1 5 10
<210> 13
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Trp Ile Arg Trp Glu His Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 14
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 14
Gly Gly Trp Ile Arg Trp Glu His Phe Asp Tyr
1 5 10
<210> 15
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 16
Asn Ala Trp Met Ser
1 5
<210> 17
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 17
Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala Pro
1 5 10 15
Val Lys Gly
<210> 18
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 18
Pro Trp Glu Trp Ser Trp Tyr Asp Tyr
1 5
<210> 19
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 20
Pro Trp Glu Trp Ser Tyr Phe Asp Tyr
1 5
<210> 21
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ala Trp Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 22
Pro Trp Glu Trp Ala Trp Phe Asp Tyr
1 5
<210> 23
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ala Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 24
Pro Trp Glu Trp Ala Tyr Phe Asp Tyr
1 5
<210> 25
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 25
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Ser Arg Trp Gly Tyr Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 26
Thr Gly Trp Ser Arg Trp Gly Tyr Met Asp Tyr
1 5 10
<210> 27
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 27
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Trp Ile Arg Tyr Tyr His Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 28
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 28
Gly Glu Trp Ile Arg Tyr Tyr His Phe Asp Tyr
1 5 10
<210> 29
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Trp Tyr Arg Trp Gly Tyr Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 30
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 30
Val Gly Trp Tyr Arg Trp Gly Tyr Met Asp Tyr
1 5 10
<210> 31
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 31
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 32
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 32
Gly Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn
1 5 10
<210> 33
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 33
Gly Thr Asn Lys Arg Ala Pro
1 5
<210> 34
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 34
Ala Leu Trp Tyr Ser Asn Leu Trp Val
1 5
<210> 35
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 35
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser
210 215
<210> 36
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 36
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 37
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 37
Thr Tyr Ala Met Asn
1 5
<210> 38
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 38
Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser
1 5 10 15
Val Lys Gly
<210> 39
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 39
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 40
<211> 228
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 40
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys
225
<210> 41
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Val Phe Tyr Arg Ala Trp Tyr Ser Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 42
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 42
Ser Tyr Ala Ile Ser
1 5
<210> 43
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 43
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 44
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 44
Ala Val Phe Tyr Arg Ala Trp Tyr Ser Phe Asp Tyr
1 5 10
<210> 45
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Thr Ser Pro Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 46
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 46
Arg Ala Ser Gln Ser Ile Ser Ser Trp Leu Ala
1 5 10
<210> 47
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 47
Asp Ala Ser Ser Leu Glu Ser
1 5
<210> 48
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 48
Gln Gln Tyr Thr Ser Pro Pro Pro Thr
1 5
<210> 49
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 49
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr His Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Phe Phe Thr Gly Phe His Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 50
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 50
Ser Phe Phe Thr Gly Phe His Leu Asp Tyr
1 5 10
<210> 51
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Thr Asn Glu His
85 90 95
Tyr Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 52
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 53
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 53
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 54
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 54
Gln Gln Tyr Thr Asn Glu His Tyr Tyr Thr
1 5 10
<210> 55
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Trp Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 56
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 56
Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 57
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 57
Gly Asp Phe Ala Trp Leu Asp Tyr
1 5
<210> 58
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 58
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Asn Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 59
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 59
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 60
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 60
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 61
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 61
Met Gln Ala Ser Ile Met Asn Arg Thr
1 5
<210> 62
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 62
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Ser Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 63
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 63
Met Gln Ala Ser Ile Met Ser Arg Thr
1 5
<210> 64
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 64
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Gln Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 65
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 65
Met Gln Ala Ser Ile Met Gln Arg Thr
1 5
<210> 66
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 66
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Asn Arg Ala Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 67
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 67
Met Gln Ala Ser Ile Met Asn Arg Ala
1 5
<210> 68
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 68
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Asn Arg Asn Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 69
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 69
Met Gln Ala Ser Ile Met Asn Arg Asn
1 5
<210> 70
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Ile Asp Met Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 71
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 71
Ser Tyr Ile Asp Met Asp Tyr
1 5
<210> 72
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 72
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asn Trp Ser Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 73
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 73
Gln Gln Asp Asn Trp Ser Pro Thr
1 5
<210> 74
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 74
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Val Asp Met Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 75
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 75
Ser Tyr Val Asp Met Asp Tyr
1 5
<210> 76
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 76
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Ile Trp Ser Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 77
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 77
Gln Gln Asp Ile Trp Ser Pro Thr
1 5
<210> 78
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 78
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Ser Tyr Val Glu Trp Tyr Ala Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 79
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 79
Ser Tyr Ala Met Ser
1 5
<210> 80
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 80
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 81
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 81
Asp Ser Ser Tyr Val Glu Trp Tyr Ala Phe Asp Tyr
1 5 10
<210> 82
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 82
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Ser Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Pro Thr Ser Ser Pro
85 90 95
Ile Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 83
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 83
Gln Gln Pro Thr Ser Ser Pro Ile Thr
1 5
<210> 84
<211> 103
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 84
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys
100
<210> 85
<211> 103
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 85
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys
100
<210> 86
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 86
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
115 120 125
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
180 185 190
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
195 200 205
Val Glu Pro Lys Ser Cys
210
<210> 87
<211> 232
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 87
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val
115 120 125
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
130 135 140
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
145 150 155 160
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
165 170 175
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
180 185 190
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
195 200 205
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
210 215 220
Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 88
<211> 105
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 88
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
1 5 10 15
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
20 25 30
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
35 40 45
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
50 55 60
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
65 70 75 80
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
85 90 95
Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 89
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 89
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu
225 230 235 240
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
245 250 255
Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg
260 265 270
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys
275 280 285
Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly
325 330 335
Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 90
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 90
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 91
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 91
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
225 230 235 240
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly Ser
245 250 255
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala Trp
260 265 270
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
275 280 285
Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala Pro
290 295 300
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu
305 310 315 320
Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr
325 330 335
Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 92
<211> 455
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 92
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 93
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 93
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 94
<211> 690
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 94
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Trp Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Gly Gly Gly
210 215 220
Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly
225 230 235 240
Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser
245 250 255
Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro
260 265 270
Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys Tyr Asn Asn
275 280 285
Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
290 295 300
Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
305 310 315 320
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly
325 330 335
Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
340 345 350
Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro
355 360 365
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
370 375 380
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
385 390 395 400
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
405 410 415
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
420 425 430
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
435 440 445
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp
450 455 460
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
465 470 475 480
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
485 490 495
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
500 505 510
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
515 520 525
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
530 535 540
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
545 550 555 560
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
565 570 575
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
580 585 590
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
595 600 605
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
610 615 620
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
625 630 635 640
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
645 650 655
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
660 665 670
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
675 680 685
Gly Lys
690
<210> 95
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 95
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Trp Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 96
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 96
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Asn Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 97
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (603)..(603)
<223> a, c, t, g, неизвестное или другое
<400> 97
gaaatcgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcttgca gggccagtca gagtgttagc agcagctact tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggagcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg atccgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagtatacca acgaacatta ttatacgttc 300
ggccagggga ccaaagtgga aatcaaacgt acggtggctg caccatctgt cttcatcttc 360
ccgccatctg atgagcagtt gaaatctgga actgcctctg ttgtgtgcct gctgaataac 420
ttctatccca gagaggccaa agtacagtgg aaggtggata acgccctcca atcgggtaac 480
tcccaggaga gtgtcacaga gcaggacagc aaggacagca cctacagcct cagcagcacc 540
ctgacgctga gcaaagcaga ctacgagaaa cacaaagtct acgcctgcga agtcacccat 600
canggcctga gctcgcccgt cacaaagagc ttcaacaggg gagagtgt 648
<210> 98
<211> 459
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 98
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val
115 120 125
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
130 135 140
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
145 150 155 160
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
165 170 175
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
180 185 190
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
195 200 205
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
210 215 220
Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His Thr Cys Pro Pro
225 230 235 240
Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro
245 250 255
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
260 265 270
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
275 280 285
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
290 295 300
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
305 310 315 320
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
325 330 335
Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
340 345 350
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp
355 360 365
Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe
370 375 380
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
385 390 395 400
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
405 410 415
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
420 425 430
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
435 440 445
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 99
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 99
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu
225 230 235 240
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
245 250 255
Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg
260 265 270
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys
275 280 285
Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly
325 330 335
Asn Phe Gly Ala Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 100
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 100
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu
225 230 235 240
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
245 250 255
Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg
260 265 270
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys
275 280 285
Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly
325 330 335
Asn Phe Gly Asn Ala Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 101
<211> 441
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 101
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
115 120 125
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
180 185 190
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
195 200 205
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
210 215 220
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
340 345 350
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 102
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 102
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val
115 120 125
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
130 135 140
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
145 150 155 160
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
165 170 175
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
180 185 190
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
195 200 205
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
210 215 220
Gly Glu Cys
225
<210> 103
<211> 231
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 103
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Pro
115 120 125
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
130 135 140
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
145 150 155 160
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
165 170 175
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
180 185 190
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
195 200 205
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
210 215 220
Val Ala Pro Thr Glu Cys Ser
225 230
<210> 104
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 104
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Gly Gly Ser Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 105
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 105
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Gly Gly Ser Met Asp Ala Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 106
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 106
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Gly Gly Ser Gly Gly Ser Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 107
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 107
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Gly Ser Gly Gly Ser Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 108
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 108
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Gly Ser Gly Gly Ser Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 109
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 109
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Gly Gly Ser Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 110
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 110
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 111
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 111
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 112
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 112
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 113
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 113
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Ala Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 114
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 114
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ala Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 115
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 115
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 116
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 116
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 117
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 117
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Ser Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 118
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 118
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Tyr Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 119
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 119
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 120
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 120
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Thr Ile Val Val Ser Pro Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 121
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 121
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Tyr Phe Ile Gly Ser Val Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 122
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 122
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Thr Tyr Ser Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser
115
<210> 123
<211> 114
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 123
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Ile Pro Asn Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 124
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 124
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Ala Tyr Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser
115
<210> 125
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 125
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Gly Ser Ser Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105
<210> 126
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 126
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ser Ala Gly Arg Leu Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 127
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 127
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Pro Ile Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr
115
<210> 128
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 128
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Asn Ala Phe Asp Tyr Trp Gly His Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser
115
<210> 129
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 129
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Trp His Ser Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr
<210> 130
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 130
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Thr Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser
115
<210> 131
<211> 114
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 131
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Ile Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr
<210> 132
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 132
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Ser Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 133
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 133
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Gln Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 134
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 134
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Asn Arg Ala Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 135
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 135
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Asn Arg Asn Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 136
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 136
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 137
<211> 691
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 137
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
225 230 235 240
Gly Gly Leu Val Gln Pro Lys Gly Ser Leu Lys Leu Ser Cys Ala Ala
245 250 255
Ser Gly Phe Thr Phe Asn Thr Tyr Ala Met Asn Trp Val Arg Gln Ala
260 265 270
Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg Ser Lys Tyr Asn
275 280 285
Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile
290 295 300
Ser Arg Asp Asp Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Asn Leu
305 310 315 320
Lys Thr Glu Asp Thr Ala Met Tyr Tyr Cys Val Arg His Gly Asn Phe
325 330 335
Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
340 345 350
Val Thr Val Ser Ala Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe
355 360 365
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
370 375 380
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
385 390 395 400
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
405 410 415
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
420 425 430
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
435 440 445
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
450 455 460
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
465 470 475 480
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
485 490 495
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
500 505 510
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
515 520 525
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
530 535 540
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
545 550 555 560
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
565 570 575
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
580 585 590
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
595 600 605
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
610 615 620
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
625 630 635 640
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
645 650 655
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
660 665 670
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
675 680 685
Pro Gly Lys
690
<210> 138
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 138
Asp Ile Glu Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Thr
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 139
<211> 257
<212> PRT
<213> Homo sapiens
<400> 139
Met Ala Gln Arg Met Thr Thr Gln Leu Leu Leu Leu Leu Val Trp Val
1 5 10 15
Ala Val Val Gly Glu Ala Gln Thr Arg Ile Ala Trp Ala Arg Thr Glu
20 25 30
Leu Leu Asn Val Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly
35 40 45
Pro Glu Asp Lys Leu His Glu Gln Cys Arg Pro Trp Arg Lys Asn Ala
50 55 60
Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr
65 70 75 80
Leu Tyr Arg Phe Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys
85 90 95
Lys Arg His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn
100 105 110
Leu Gly Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg
115 120 125
Val Leu Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Gln Trp Trp Glu
130 135 140
Asp Cys Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp
145 150 155 160
Asn Trp Thr Ser Gly Phe Asn Lys Cys Ala Val Gly Ala Ala Cys Gln
165 170 175
Pro Phe His Phe Tyr Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile
180 185 190
Trp Thr His Ser Tyr Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg
195 200 205
Cys Ile Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu
210 215 220
Val Ala Arg Phe Tyr Ala Ala Ala Met Ser Gly Ala Gly Pro Trp Ala
225 230 235 240
Ala Trp Pro Phe Leu Leu Ser Leu Ala Leu Met Leu Leu Trp Leu Leu
245 250 255
Ser
<210> 140
<211> 468
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 140
Arg Ile Ala Trp Ala Arg Thr Glu Leu Leu Asn Val Cys Met Asn Ala
1 5 10 15
Lys His His Lys Glu Lys Pro Gly Pro Glu Asp Lys Leu His Glu Gln
20 25 30
Cys Arg Pro Trp Arg Lys Asn Ala Cys Cys Ser Thr Asn Thr Ser Gln
35 40 45
Glu Ala His Lys Asp Val Ser Tyr Leu Tyr Arg Phe Asn Trp Asn His
50 55 60
Cys Gly Glu Met Ala Pro Ala Cys Lys Arg His Phe Ile Gln Asp Thr
65 70 75 80
Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln Gln Val
85 90 95
Asp Gln Ser Trp Arg Lys Glu Arg Val Leu Asn Val Pro Leu Cys Lys
100 105 110
Glu Asp Cys Glu Gln Trp Trp Glu Asp Cys Arg Thr Ser Tyr Thr Cys
115 120 125
Lys Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly Phe Asn Lys
130 135 140
Cys Ala Val Gly Ala Ala Cys Gln Pro Phe His Phe Tyr Phe Pro Thr
145 150 155 160
Pro Thr Val Leu Cys Asn Glu Ile Trp Thr His Ser Tyr Lys Val Ser
165 170 175
Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Pro
180 185 190
Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala Ala Ala
195 200 205
Met Val Asp Glu Gln Leu Tyr Phe Gln Gly Gly Ser Pro Lys Ser Ala
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Ser Gly Gly Leu Asn Asp Ile Phe Glu Ala Gln Lys Ile
450 455 460
Glu Trp His Glu
465
<210> 141
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 141
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 142
<211> 255
<212> PRT
<213> Mus musculus
<400> 142
Met Ala His Leu Met Thr Val Gln Leu Leu Leu Leu Val Met Trp Met
1 5 10 15
Ala Glu Cys Ala Gln Ser Arg Ala Thr Arg Ala Arg Thr Glu Leu Leu
20 25 30
Asn Val Cys Met Asp Ala Lys His His Lys Glu Lys Pro Gly Pro Glu
35 40 45
Asp Asn Leu His Asp Gln Cys Ser Pro Trp Lys Thr Asn Ser Cys Cys
50 55 60
Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Ile Ser Tyr Leu Tyr
65 70 75 80
Arg Phe Asn Trp Asn His Cys Gly Thr Met Thr Ser Glu Cys Lys Arg
85 90 95
His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly
100 105 110
Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg Ile Leu
115 120 125
Asp Val Pro Leu Cys Lys Glu Asp Cys Gln Gln Trp Trp Glu Asp Cys
130 135 140
Gln Ser Ser Phe Thr Cys Lys Ser Asn Trp His Lys Gly Trp Asn Trp
145 150 155 160
Ser Ser Gly His Asn Glu Cys Pro Val Gly Ala Ser Cys His Pro Phe
165 170 175
Thr Phe Tyr Phe Pro Thr Ser Ala Ala Leu Cys Glu Glu Ile Trp Ser
180 185 190
His Ser Tyr Lys Leu Ser Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile
195 200 205
Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu Val Ala
210 215 220
Arg Phe Tyr Ala Glu Ala Met Ser Gly Ala Gly Leu His Gly Thr Trp
225 230 235 240
Pro Leu Leu Cys Ser Leu Ser Leu Val Leu Leu Trp Val Ile Ser
245 250 255
<210> 143
<211> 466
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 143
Thr Arg Ala Arg Thr Glu Leu Leu Asn Val Cys Met Asp Ala Lys His
1 5 10 15
His Lys Glu Lys Pro Gly Pro Glu Asp Asn Leu His Asp Gln Cys Ser
20 25 30
Pro Trp Lys Thr Asn Ser Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala
35 40 45
His Lys Asp Ile Ser Tyr Leu Tyr Arg Phe Asn Trp Asn His Cys Gly
50 55 60
Thr Met Thr Ser Glu Cys Lys Arg His Phe Ile Gln Asp Thr Cys Leu
65 70 75 80
Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln Gln Val Asp Gln
85 90 95
Ser Trp Arg Lys Glu Arg Ile Leu Asp Val Pro Leu Cys Lys Glu Asp
100 105 110
Cys Gln Gln Trp Trp Glu Asp Cys Gln Ser Ser Phe Thr Cys Lys Ser
115 120 125
Asn Trp His Lys Gly Trp Asn Trp Ser Ser Gly His Asn Glu Cys Pro
130 135 140
Val Gly Ala Ser Cys His Pro Phe Thr Phe Tyr Phe Pro Thr Ser Ala
145 150 155 160
Ala Leu Cys Glu Glu Ile Trp Ser His Ser Tyr Lys Leu Ser Asn Tyr
165 170 175
Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Pro Ala Gln
180 185 190
Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala Glu Ala Met Val
195 200 205
Asp Glu Gln Leu Tyr Phe Gln Gly Gly Ser Pro Lys Ser Ala Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys Ser Gly Gly Leu Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp
450 455 460
His Glu
465
<210> 144
<211> 257
<212> PRT
<213> Macaca fascicularis
<400> 144
Met Ala Gln Arg Met Thr Thr Gln Leu Leu Leu Leu Leu Val Trp Val
1 5 10 15
Ala Val Val Gly Glu Ala Gln Thr Arg Thr Ala Arg Ala Arg Thr Glu
20 25 30
Leu Leu Asn Val Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly
35 40 45
Pro Glu Asp Lys Leu His Glu Gln Cys Arg Pro Trp Lys Lys Asn Ala
50 55 60
Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr
65 70 75 80
Leu Tyr Arg Phe Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys
85 90 95
Lys Arg His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn
100 105 110
Leu Gly Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg
115 120 125
Val Leu Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Arg Trp Trp Glu
130 135 140
Asp Cys Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp
145 150 155 160
Asn Trp Thr Ser Gly Phe Asn Lys Cys Pro Val Gly Ala Ala Cys Gln
165 170 175
Pro Phe His Phe Tyr Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile
180 185 190
Trp Thr Tyr Ser Tyr Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg
195 200 205
Cys Ile Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu
210 215 220
Val Ala Arg Phe Tyr Ala Ala Ala Met Ser Gly Ala Gly Pro Trp Ala
225 230 235 240
Ala Trp Pro Leu Leu Leu Ser Leu Ala Leu Thr Leu Leu Trp Leu Leu
245 250 255
Ser
<210> 145
<211> 468
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 145
Arg Thr Ala Arg Ala Arg Thr Glu Leu Leu Asn Val Cys Met Asn Ala
1 5 10 15
Lys His His Lys Glu Lys Pro Gly Pro Glu Asp Lys Leu His Glu Gln
20 25 30
Cys Arg Pro Trp Lys Lys Asn Ala Cys Cys Ser Thr Asn Thr Ser Gln
35 40 45
Glu Ala His Lys Asp Val Ser Tyr Leu Tyr Arg Phe Asn Trp Asn His
50 55 60
Cys Gly Glu Met Ala Pro Ala Cys Lys Arg His Phe Ile Gln Asp Thr
65 70 75 80
Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln Gln Val
85 90 95
Asp Gln Ser Trp Arg Lys Glu Arg Val Leu Asn Val Pro Leu Cys Lys
100 105 110
Glu Asp Cys Glu Gln Trp Trp Glu Asp Cys Arg Thr Ser Tyr Thr Cys
115 120 125
Lys Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly Phe Asn Lys
130 135 140
Cys Pro Val Gly Ala Ala Cys Gln Pro Phe His Phe Tyr Phe Pro Thr
145 150 155 160
Pro Thr Val Leu Cys Asn Glu Ile Trp Thr Tyr Ser Tyr Lys Val Ser
165 170 175
Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Pro
180 185 190
Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala Ala Ala
195 200 205
Met Val Asp Glu Gln Leu Tyr Phe Gln Gly Gly Ser Pro Lys Ser Ala
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys Ser Gly Gly Leu Asn Asp Ile Phe Glu Ala Gln Lys Ile
450 455 460
Glu Trp His Glu
465
<210> 146
<211> 255
<212> PRT
<213> Homo sapiens
<400> 146
Met Val Trp Lys Trp Met Pro Leu Leu Leu Leu Leu Val Cys Val Ala
1 5 10 15
Thr Met Cys Ser Ala Gln Asp Arg Thr Asp Leu Leu Asn Val Cys Met
20 25 30
Asp Ala Lys His His Lys Thr Lys Pro Gly Pro Glu Asp Lys Leu His
35 40 45
Asp Gln Cys Ser Pro Trp Lys Lys Asn Ala Cys Cys Thr Ala Ser Thr
50 55 60
Ser Gln Glu Leu His Lys Asp Thr Ser Arg Leu Tyr Asn Phe Asn Trp
65 70 75 80
Asp His Cys Gly Lys Met Glu Pro Ala Cys Lys Arg His Phe Ile Gln
85 90 95
Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln
100 105 110
Gln Val Asn Gln Ser Trp Arg Lys Glu Arg Phe Leu Asp Val Pro Leu
115 120 125
Cys Lys Glu Asp Cys Gln Arg Trp Trp Glu Asp Cys His Thr Ser His
130 135 140
Thr Cys Lys Ser Asn Trp His Arg Gly Trp Asp Trp Thr Ser Gly Val
145 150 155 160
Asn Lys Cys Pro Ala Gly Ala Leu Cys Arg Thr Phe Glu Ser Tyr Phe
165 170 175
Pro Thr Pro Ala Ala Leu Cys Glu Gly Leu Trp Ser His Ser Tyr Lys
180 185 190
Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe
195 200 205
Asp Ser Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala
210 215 220
Ala Ala Met His Val Asn Ala Gly Glu Met Leu His Gly Thr Gly Gly
225 230 235 240
Leu Leu Leu Ser Leu Ala Leu Met Leu Gln Leu Trp Leu Leu Gly
245 250 255
<210> 147
<211> 472
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 147
Thr Met Cys Ser Ala Gln Asp Arg Thr Asp Leu Leu Asn Val Cys Met
1 5 10 15
Asp Ala Lys His His Lys Thr Lys Pro Gly Pro Glu Asp Lys Leu His
20 25 30
Asp Gln Cys Ser Pro Trp Lys Lys Asn Ala Cys Cys Thr Ala Ser Thr
35 40 45
Ser Gln Glu Leu His Lys Asp Thr Ser Arg Leu Tyr Asn Phe Asn Trp
50 55 60
Asp His Cys Gly Lys Met Glu Pro Ala Cys Lys Arg His Phe Ile Gln
65 70 75 80
Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln
85 90 95
Gln Val Asn Gln Ser Trp Arg Lys Glu Arg Phe Leu Asp Val Pro Leu
100 105 110
Cys Lys Glu Asp Cys Gln Arg Trp Trp Glu Asp Cys His Thr Ser His
115 120 125
Thr Cys Lys Ser Asn Trp His Arg Gly Trp Asp Trp Thr Ser Gly Val
130 135 140
Asn Lys Cys Pro Ala Gly Ala Leu Cys Arg Thr Phe Glu Ser Tyr Phe
145 150 155 160
Pro Thr Pro Ala Ala Leu Cys Glu Gly Leu Trp Ser His Ser Tyr Lys
165 170 175
Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe
180 185 190
Asp Ser Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala
195 200 205
Ala Ala Met His Val Val Asp Glu Gln Leu Tyr Phe Gln Gly Gly Ser
210 215 220
Pro Lys Ser Ala Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys Ser Gly Gly Leu Asn Asp Ile Phe Glu
450 455 460
Ala Gln Lys Ile Glu Trp His Glu
465 470
<210> 148
<211> 243
<212> PRT
<213> Homo sapiens
<400> 148
Met Ala Trp Gln Met Met Gln Leu Leu Leu Leu Ala Leu Val Thr Ala
1 5 10 15
Ala Gly Ser Ala Gln Pro Arg Ser Ala Arg Ala Arg Thr Asp Leu Leu
20 25 30
Asn Val Cys Met Asn Ala Lys His His Lys Thr Gln Pro Ser Pro Glu
35 40 45
Asp Glu Leu Tyr Gly Gln Cys Ser Pro Trp Lys Lys Asn Ala Cys Cys
50 55 60
Thr Ala Ser Thr Ser Gln Glu Leu His Lys Asp Thr Ser Arg Leu Tyr
65 70 75 80
Asn Phe Asn Trp Asp His Cys Gly Lys Met Glu Pro Thr Cys Lys Arg
85 90 95
His Phe Ile Gln Asp Ser Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly
100 105 110
Pro Trp Ile Arg Gln Val Asn Gln Ser Trp Arg Lys Glu Arg Ile Leu
115 120 125
Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Arg Trp Trp Glu Asp Cys
130 135 140
Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp Asn Trp
145 150 155 160
Thr Ser Gly Ile Asn Glu Cys Pro Ala Gly Ala Leu Cys Ser Thr Phe
165 170 175
Glu Ser Tyr Phe Pro Thr Pro Ala Ala Leu Cys Glu Gly Leu Trp Ser
180 185 190
His Ser Phe Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile
195 200 205
Gln Met Trp Phe Asp Ser Ala Gln Gly Asn Pro Asn Glu Glu Val Ala
210 215 220
Lys Phe Tyr Ala Ala Ala Met Asn Ala Gly Ala Pro Ser Arg Gly Ile
225 230 235 240
Ile Asp Ser
<210> 149
<211> 479
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 149
Ser Ala Arg Ala Arg Thr Asp Leu Leu Asn Val Cys Met Asn Ala Lys
1 5 10 15
His His Lys Thr Gln Pro Ser Pro Glu Asp Glu Leu Tyr Gly Gln Cys
20 25 30
Ser Pro Trp Lys Lys Asn Ala Cys Cys Thr Ala Ser Thr Ser Gln Glu
35 40 45
Leu His Lys Asp Thr Ser Arg Leu Tyr Asn Phe Asn Trp Asp His Cys
50 55 60
Gly Lys Met Glu Pro Thr Cys Lys Arg His Phe Ile Gln Asp Ser Cys
65 70 75 80
Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Arg Gln Val Asn
85 90 95
Gln Ser Trp Arg Lys Glu Arg Ile Leu Asn Val Pro Leu Cys Lys Glu
100 105 110
Asp Cys Glu Arg Trp Trp Glu Asp Cys Arg Thr Ser Tyr Thr Cys Lys
115 120 125
Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly Ile Asn Glu Cys
130 135 140
Pro Ala Gly Ala Leu Cys Ser Thr Phe Glu Ser Tyr Phe Pro Thr Pro
145 150 155 160
Ala Ala Leu Cys Glu Gly Leu Trp Ser His Ser Phe Lys Val Ser Asn
165 170 175
Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Ser Ala
180 185 190
Gln Gly Asn Pro Asn Glu Glu Val Ala Lys Phe Tyr Ala Ala Ala Met
195 200 205
Asn Ala Gly Ala Pro Ser Arg Gly Ile Ile Asp Ser Val Asp Glu Gln
210 215 220
Leu Tyr Phe Gln Gly Gly Ser Pro Lys Ser Ala Asp Lys Thr His Thr
225 230 235 240
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
245 250 255
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
260 265 270
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
275 280 285
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
290 295 300
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
305 310 315 320
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
325 330 335
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
340 345 350
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
355 360 365
Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
370 375 380
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
385 390 395 400
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
405 410 415
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
420 425 430
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
435 440 445
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Ser Gly
450 455 460
Gly Leu Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp His Glu
465 470 475
<210> 150
<211> 207
<212> PRT
<213> Homo sapiens
<400> 150
Met Gln Ser Gly Thr His Trp Arg Val Leu Gly Leu Cys Leu Leu Ser
1 5 10 15
Val Gly Val Trp Gly Gln Asp Gly Asn Glu Glu Met Gly Gly Ile Thr
20 25 30
Gln Thr Pro Tyr Lys Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr
35 40 45
Cys Pro Gln Tyr Pro Gly Ser Glu Ile Leu Trp Gln His Asn Asp Lys
50 55 60
Asn Ile Gly Gly Asp Glu Asp Asp Lys Asn Ile Gly Ser Asp Glu Asp
65 70 75 80
His Leu Ser Leu Lys Glu Phe Ser Glu Leu Glu Gln Ser Gly Tyr Tyr
85 90 95
Val Cys Tyr Pro Arg Gly Ser Lys Pro Glu Asp Ala Asn Phe Tyr Leu
100 105 110
Tyr Leu Arg Ala Arg Val Cys Glu Asn Cys Met Glu Met Asp Val Met
115 120 125
Ser Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Gly Gly Leu
130 135 140
Leu Leu Leu Val Tyr Tyr Trp Ser Lys Asn Arg Lys Ala Lys Ala Lys
145 150 155 160
Pro Val Thr Arg Gly Ala Gly Ala Gly Gly Arg Gln Arg Gly Gln Asn
165 170 175
Lys Glu Arg Pro Pro Pro Val Pro Asn Pro Asp Tyr Glu Pro Ile Arg
180 185 190
Lys Gly Gln Arg Asp Leu Tyr Ser Gly Leu Asn Gln Arg Arg Ile
195 200 205
<210> 151
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 151
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
tacgctggtg ttactccgtt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 152
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 152
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
tacatcggtg ttgttacttt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 153
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 153
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
tacactggtg gttcttctgc tttcgactat tggggtcaag gcaccctcgt aacggtttct 360
tct 363
<210> 154
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (47)..(47)
<223> a, c, t, g, неизвестное или другое
<400> 154
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgnttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgaa 300
tggcgtcgtt acacttcttt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 155
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 155
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtggt 300
tggatccgtt gggaacattt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 156
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 156
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
tacctgttct ctacttcttt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 157
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 157
caggtgcaat tggttcaatc tggtgctgag gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
tacatcggta tcgttccgtt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 158
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 158
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
<210> 159
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (53)..(53)
<223> a, c, t, g, неизвестное или другое
<400> 159
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc ccngcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaacc gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttactt cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
<210> 160
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 160
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
tacgttggtg tttctccgtt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 161
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (47)..(47)
<223> a, c, t, g, неизвестное или другое
<220>
<221> модифицированное_основание
<222> (177)..(177)
<223> a, c, t, g, неизвестное или другое
<400> 161
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgnttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcntac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaacttc 300
actgttctgc gtgttccgtt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 162
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 162
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat gggcttggtt cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
<210> 163
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 163
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaacc gaagacaccg cagtctacta ctgtactacc 300
ccttgggaat gggcttactt cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
<210> 164
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 164
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcactggt 300
tggtctcgtt ggggttacat ggactattgg ggccaaggca ccctcgtaac ggtttcttct 360
<210> 165
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 165
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgaa 300
tggatccgtt actaccattt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 166
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 166
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcgttggt 300
tggtaccgtt ggggttacat ggactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
<210> 167
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 167
caggtgcaat tggtgcagtc tggggctgag gtgaagaagc ctgggtcctc ggtgaaggtc 60
tcctgcaagg cctccggagg cacattcagc agctacgcta taagctgggt gcgacaggcc 120
cctggacaag ggctcgagtg gatgggaggg atcatcccta tctttggtac agcaaactac 180
gcacagaagt tccagggcag ggtaaccatt actgcagaca aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac accgccgtgt attactgtgc gagagctgtt 300
ttctaccgtg cttggtactc tttcgactac tggggccaag ggaccaccgt gaccgtctcc 360
tca 363
<210> 168
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 168
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga ccgtgtcacc 60
atcacttgcc gtgccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgat gcctccagtt tggaaagtgg ggtcccatca 180
cgtttcagcg gcagtggatc cgggacagaa ttcactctca ccatcagcag cttgcagcct 240
gatgattttg caacttatta ctgccaacag tataccagcc caccaccaac gtttggccag 300
ggcaccaaag tcgagatcaa g 321
<210> 169
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 169
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccatgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgctctttc 300
ttcactggtt tccatctgga ctattggggt caaggcaccc tcgtaacggt ttcttct 357
<210> 170
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 170
gaaatcgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcttgca gggccagtca gagtgttagc agcagctact tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggagcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg atccgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagtatacca acgaacatta ttatacgttc 300
ggccagggga ccaaagtgga aatcaaa 327
<210> 171
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 171
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggccc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttcgcttggc tggactattg gggtcaaggc accctcgtaa cggtttcttc t 351
<210> 172
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 172
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgaac 300
cggacttttg gtcaaggcac caaggtcgaa attaaa 336
<210> 173
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 173
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgagc 300
cggacttttg gtcaaggcac caaggtcgaa attaaa 336
<210> 174
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 174
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgcag 300
cggacttttg gtcaaggcac caaggtcgaa attaaa 336
<210> 175
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 175
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgaac 300
cgggcttttg gtcaaggcac caaggtcgaa attaaa 336
<210> 176
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 176
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgaac 300
cggaattttg gtcaaggcac caaggtcgaa attaaa 336
<210> 177
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 177
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgctcttac 300
atcgacatgg actattgggg tcaaggcacc ctcgtaacgg tttcttct 348
<210> 178
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 178
gaaatcgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcttgca gggccagtca gagtgttagc agcagctact tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggagcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg atccgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag caggataact ggagcccaac gttcggccag 300
gggaccaaag tggaaatcaa a 321
<210> 179
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 179
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgctcttac 300
gttgacatgg actattgggg tcaaggcacc ctcgtaacgg tttcttct 348
<210> 180
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 180
gaaatcgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcttgca gggccagtca gagtgttagc agcagctacc tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggagcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg atccgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag caggatattt ggagcccaac gttcggccag 300
gggaccaaag tggaaatcaa a 321
<210> 181
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 181
gaggtgcaat tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctccggatt cacctttagc agttatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcagatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagactct 300
tcttacgttg aatggtacgc tttcgactac tggggccaag gaaccctggt caccgtctcg 360
agt 363
<210> 182
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 182
gaaatcgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcttgca gggccagtca gagtgttagc agcagctact tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggagcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg atccgggaca gactccactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagccaacca gcagcccaat tacgttcggc 300
caggggacca aagtggaaat caaa 324
<210> 183
<211> 684
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 183
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaacag ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt caagcgctag taccaagggc cccagcgtgt tccccctggc acccagcagc 420
aagagcacat ctggcggaac agccgctctg ggctgtctgg tgaaagacta cttccccgag 480
cccgtgaccg tgtcttggaa ctctggcgcc ctgaccagcg gcgtgcacac ctttccagcc 540
gtgctgcaga gcagcggcct gtactccctg tcctccgtgg tcaccgtgcc ctctagctcc 600
ctgggaacac agacatatat ctgtaatgtc aatcacaagc cttccaacac caaagtcgat 660
aagaaagtcg agcccaagag ctgc 684
<210> 184
<211> 696
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 184
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaacag ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt caagcgctag tgtggccgct ccctccgtgt ttatctttcc cccatccgat 420
gaacagctga aaagcggcac cgcctccgtc gtgtgtctgc tgaacaattt ttaccctagg 480
gaagctaaag tgcagtggaa agtggataac gcactgcagt ccggcaactc ccaggaatct 540
gtgacagaac aggactccaa ggacagcacc tactccctgt cctccaccct gacactgtct 600
aaggctgatt atgagaaaca caaagtctac gcctgcgaag tcacccatca gggcctgagc 660
tcgcccgtca caaagagctt caacagggga gagtgt 696
<210> 185
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
праймер"
<400> 185
gcaggcaagc attatgcagc ggacttttgg tcaagg 36
<210> 186
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
праймер"
<400> 186
caggcaagca ttatgagccg gacttttggt caagg 35
<210> 187
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
праймер"
<400> 187
cattatgaac cgggcttttg gtcaaggcac caaggtc 37
<210> 188
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
праймер"
<400> 188
cattatgaac cggaattttg gtcaaggcac caaggtc 37
<210> 189
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 189
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacaa agggccctag cgtgttccct ctggccccca gcagcaagag cacaagcggc 420
ggaacagccg ccctgggctg cctcgtgaag gactacttcc ccgagcccgt gacagtgtct 480
tggaacagcg gagccctgac aagcggcgtg cacactttcc ctgccgtgct gcagagcagc 540
ggcctgtact ccctgagcag cgtggtcacc gtgcctagca gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaaag tggacaagaa ggtggagccc 660
aagagctgtg atggcggagg agggtccgga ggcggaggat ccgaggtgca gctgctggaa 720
tctggcggcg gactggtgca gcctggcgga tctctgagac tgagctgtgc cgccagcggc 780
ttcaccttca gcacctacgc catgaactgg gtgcgccagg cccctggcaa aggcctggaa 840
tgggtgtccc ggatcagaag caagtacaac aactacgcca cctactacgc cgacagcgtg 900
aagggccggt tcaccatcag ccgggacgac agcaagaaca ccctgtacct gcagatgaac 960
agcctgcggg ccgaggacac cgccgtgtac tattgtgtgc ggcacggcaa cttcggcaac 1020
agctatgtgt cttggtttgc ctactggggc cagggcaccc tcgtgaccgt gtcaagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 190
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 190
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacca agggcccctc cgtgttcccc ctggccccca gcagcaagag caccagcggc 420
ggcacagccg ctctgggctg cctggtcaag gactacttcc ccgagcccgt gaccgtgtcc 480
tggaacagcg gagccctgac ctccggcgtg cacaccttcc ccgccgtgct gcagagttct 540
ggcctgtata gcctgagcag cgtggtcacc gtgccttcta gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaagg tggacaagaa ggtggagccc 660
aagagctgcg acaaaactca cacatgccca ccgtgcccag cacctgaagc tgcaggggga 720
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 780
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 840
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 900
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 960
gagtacaagt gcaaggtctc caacaaagcc ctcggcgccc ccatcgagaa aaccatctcc 1020
aaagccaaag ggcagccccg agaaccacag gtgtgcaccc tgcccccatc ccgggatgag 1080
ctgaccaaga accaggtcag cctctcgtgc gcagtcaaag gcttctatcc cagcgacatc 1140
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1200
ctggactccg acggctcctt cttcctcgtg agcaagctca ccgtggacaa gagcaggtgg 1260
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccgcttcacg 1320
cagaagagcc tctccctgtc tccgggtaaa 1350
<210> 191
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 191
caggccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcaggaa 120
aagcccggcc aggccttcag aggactgatc ggcggcacca acaagagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgcc 240
cagccagaag atgaggccga gtactactgc gccctgtggt acagcaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtcctaggt caacccaagg ctgcccccag cgtgaccctg 360
ttccccccca gcagcgagga actgcaggcc aacaaggcca ccctggtctg cctgatcagc 420
gacttctacc caggcgccgt gaccgtggcc tggaaggccg acagcagccc cgtgaaggcc 480
ggcgtggaga ccaccacccc cagcaagcag agcaacaaca agtacgccgc cagcagctac 540
ctgagcctga cccccgagca gtggaagagc cacaggtcct acagctgcca ggtgacccac 600
gagggcagca ccgtggagaa aaccgtggcc cccaccgagt gcagc 645
<210> 192
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 192
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaacag ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt catctgctag cacaaagggc cctagcgtgt tccctctggc ccccagcagc 420
aagagcacaa gcggcggaac agccgccctg ggctgcctcg tgaaggacta cttccccgag 480
cccgtgacag tgtcttggaa cagcggagcc ctgacaagcg gcgtgcacac cttccctgcc 540
gtgctgcaga gcagcggcct gtactccctg agcagcgtgg tcaccgtgcc tagcagcagc 600
ctgggcaccc agacctacat ctgcaacgtg aaccacaagc ccagcaacac caaagtggac 660
aagaaggtgg agcccaagag ctgtgatggc ggaggagggt ccggaggcgg aggatccgag 720
gtgcaattgg ttgaatctgg tggtggtctg gtaaaaccgg gcggttccct gcgtctgagc 780
tgcgcggctt ccggattcac cttctccaac gcgtggatga gctgggttcg ccaggccccg 840
ggcaaaggcc tcgagtgggt tggtcgtatc aagtctaaaa ctgacggtgg caccacggat 900
tacgcggctc cagttaaagg tcgttttacc atttcccgcg acgatagcaa aaacactctg 960
tatctgcaga tgaactctct gaaaactgaa gacaccgcag tctactactg tactaccccg 1020
tgggaatggt cttggtacga ttattggggc cagggcacgc tggttacggt gtctagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 193
<211> 1365
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 193
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaacag ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt catctgctag caccaagggc ccatcggtct tccccctggc accctcctcc 420
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 480
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 540
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 600
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtggac 660
aagaaagttg agcccaaatc ttgtgacaaa actcacacat gcccaccgtg cccagcacct 720
gaagctgcag ggggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 780
atctcccgga cccctgaggt cacatgcgtg gtggtggacg tgagccacga agaccctgag 840
gtcaagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccgcgg 900
gaggagcagt acaacagcac gtaccgtgtg gtcagcgtcc tcaccgtcct gcaccaggac 960
tggctgaatg gcaaggagta caagtgcaag gtctccaaca aagccctcgg cgcccccatc 1020
gagaaaacca tctccaaagc caaagggcag ccccgagaac cacaggtgta caccctgccc 1080
ccatgccggg atgagctgac caagaaccag gtcagcctgt ggtgcctggt caaaggcttc 1140
tatcccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 1200
accacgcctc ccgtgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 1260
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 1320
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaa 1365
<210> 194
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 194
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 60
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 120
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 180
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 240
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 300
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 360
gggcagcccc gagaaccaca ggtgtgcacc ctgcccccat cccgggatga gctgaccaag 420
aaccaggtca gcctctcgtg cgcagtcaaa ggcttctatc ccagcgacat cgccgtggag 480
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 540
gacggctcct tcttcctcgt gagcaagctc accgtggaca agagcaggtg gcagcagggg 600
aacgtcttct catgctccgt gatgcatgag gctctgcaca accgcttcac gcagaagagc 660
ctctccctgt ctccgggtaa a 681
<210> 195
<211> 2070
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 195
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggccc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttcgcttggc tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagcaca 360
aagggcccca gcgtgttccc tctggcccct agcagcaaga gcacatctgg cggaacagcc 420
gccctgggct gcctcgtgaa ggactacttt cccgagcctg tgaccgtgtc ctggaactct 480
ggcgccctga caagcggcgt gcacaccttt ccagccgtgc tgcagagcag cggcctgtac 540
tctctgagca gcgtggtcac cgtgcctagc agcagcctgg gcacccagac ctacatctgc 600
aacgtgaacc acaagcccag caacaccaaa gtggacaaga aggtggagcc caagagctgt 660
gatggcggag gagggtccgg aggcggagga tccgaggtgc agctgctgga atctggcggc 720
ggactggtgc agcctggcgg atctctgaga ctgagctgtg ccgccagcgg cttcaccttc 780
agcacctacg ccatgaactg ggtgcgccag gcccctggca aaggcctgga atgggtgtcc 840
cggatcagaa gcaagtacaa caactacgcc acctactacg ccgacagcgt gaagggccgg 900
ttcaccatca gccgggacga cagcaagaac accctgtacc tgcagatgaa cagcctgcgg 960
gccgaggaca ccgccgtgta ctattgtgtg cggcacggca acttcggcaa cagctatgtg 1020
tcttggtttg cctactgggg ccagggcacc ctcgtgaccg tgtcaagcgc tagtgtggcc 1080
gctccctccg tgtttatctt tcccccatcc gatgaacagc tgaaaagcgg caccgcctcc 1140
gtcgtgtgtc tgctgaacaa tttttaccct agggaagcta aagtgcagtg gaaagtggat 1200
aacgcactgc agtccggcaa ctcccaggaa tctgtgacag aacaggactc caaggacagc 1260
acctactccc tgtcctccac cctgacactg tctaaggctg attatgagaa acacaaagtc 1320
tacgcctgcg aagtcaccca tcagggcctg agctcgcccg tcacaaagag cttcaacagg 1380
ggagagtgtg acaagaccca cacctgtccc ccttgtcctg cccctgaagc tgctggcggc 1440
ccttctgtgt tcctgttccc cccaaagccc aaggacaccc tgatgatcag ccggaccccc 1500
gaagtgacct gcgtggtggt ggatgtgtcc cacgaggacc ctgaagtgaa gttcaattgg 1560
tacgtggacg gcgtggaagt gcacaacgcc aagacaaagc cgcgggagga gcagtacaac 1620
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 1680
gagtacaagt gcaaggtctc caacaaagcc ctcggcgccc ccatcgagaa aaccatctcc 1740
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatg ccgggatgag 1800
ctgaccaaga accaggtcag cctgtggtgc ctggtcaaag gcttctatcc cagcgacatc 1860
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1920
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 1980
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 2040
cagaagagcc tctccctgtc tccgggtaaa 2070
<210> 196
<211> 1341
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 196
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggccc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttcgcttggc tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagcacc 360
aagggcccct ccgtgttccc cctggccccc agcagcaaga gcaccagcgg cggcacagcc 420
gctctgggct gcctggtcaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc 480
ggagccctga cctccggcgt gcacaccttc cccgccgtgc tgcagagttc tggcctgtat 540
agcctgagca gcgtggtcac cgtgccttct agcagcctgg gcacccagac ctacatctgc 600
aacgtgaacc acaagcccag caacaccaag gtggacaaga aggtggagcc caagagctgc 660
gacaaaactc acacatgccc accgtgccca gcacctgaag ctgcaggggg accgtcagtc 720
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 780
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 840
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 900
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 960
tgcaaggtct ccaacaaagc cctcggcgcc cccatcgaga aaaccatctc caaagccaaa 1020
gggcagcccc gagaaccaca ggtgtgcacc ctgcccccat cccgggatga gctgaccaag 1080
aaccaggtca gcctctcgtg cgcagtcaaa ggcttctatc ccagcgacat cgccgtggag 1140
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1200
gacggctcct tcttcctcgt gagcaagctc accgtggaca agagcaggtg gcagcagggg 1260
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1320
ctctccctgt ctccgggtaa a 1341
<210> 197
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 197
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgaac 300
cggacttttg gtcaaggcac caaggtcgaa attaaacgta cggtggctgc accatctgtc 360
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 420
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 480
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctc 540
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 600
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgt 657
<210> 198
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 198
caggccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcaggaa 120
aagcccggcc aggccttcag aggactgatc ggcggcacca acaagagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgcc 240
cagccagaag atgaggccga gtactactgc gccctgtggt acagcaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtgctgagc agcgcttcca ccaaaggccc ttccgtgttt 360
cctctggctc ctagctccaa gtccacctct ggaggcaccg ctgctctcgg atgcctcgtg 420
aaggattatt ttcctgagcc tgtgacagtg tcctggaata gcggagcact gacctctgga 480
gtgcatactt tccccgctgt gctgcagtcc tctggactgt acagcctgag cagcgtggtg 540
acagtgccca gcagcagcct gggcacccag acctacatct gcaacgtgaa ccacaagccc 600
agcaacacca aggtggacaa gaaggtggaa cccaagtctt gt 642
<210> 199
<211> 1377
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 199
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaacag ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt catctgctag cgtggccgct ccctccgtgt ttatctttcc cccatccgat 420
gaacagctga aaagcggcac cgcctccgtc gtgtgtctgc tgaacaattt ttaccctagg 480
gaagctaaag tgcagtggaa agtggataac gcactgcagt ccggcaactc ccaggaatct 540
gtgacagaac aggactccaa ggacagcacc tactccctgt cctccaccct gacactgtct 600
aaggctgatt atgagaaaca caaagtctac gcctgcgaag tcacccatca gggcctgagc 660
tcgcccgtca caaagagctt caacagggga gagtgtgaca agacccacac ctgtccccct 720
tgtcctgccc ctgaagctgc tggcggccct tctgtgttcc tgttcccccc aaagcccaag 780
gacaccctga tgatcagccg gacccccgaa gtgacctgcg tggtggtgga tgtgtcccac 840
gaggaccctg aagtgaagtt caattggtac gtggacggcg tggaagtgca caacgccaag 900
acaaagccgc gggaggagca gtacaacagc acgtaccgtg tggtcagcgt cctcaccgtc 960
ctgcaccagg actggctgaa tggcaaggag tacaagtgca aggtctccaa caaagccctc 1020
ggcgccccca tcgagaaaac catctccaaa gccaaagggc agccccgaga accacaggtg 1080
tacaccctgc ccccatgccg ggatgagctg accaagaacc aggtcagcct gtggtgcctg 1140
gtcaaaggct tctatcccag cgacatcgcc gtggagtggg agagcaatgg gcagccggag 1200
aacaactaca agaccacgcc tcccgtgctg gactccgacg gctccttctt cctctacagc 1260
aagctcaccg tggacaagag caggtggcag caggggaacg tcttctcatg ctccgtgatg 1320
catgaggctc tgcacaacca ctacacgcag aagagcctct ccctgtctcc gggtaaa 1377
<210> 200
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 200
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacaa agggccctag cgtgttccct ctggccccca gcagcaagag cacaagcggc 420
ggaacagccg ccctgggctg cctcgtgaag gactacttcc ccgagcccgt gacagtgtct 480
tggaacagcg gagccctgac aagcggcgtg cacactttcc ctgccgtgct gcagagcagc 540
ggcctgtact ccctgagcag cgtggtcacc gtgcctagca gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaaag tggacaagaa ggtggagccc 660
aagagctgtg atggcggagg agggtccgga ggcggaggat ccgaggtgca gctgctggaa 720
tctggcggcg gactggtgca gcctggcgga tctctgagac tgagctgtgc cgccagcggc 780
ttcaccttca gcacctacgc catgaactgg gtgcgccagg cccctggcaa aggcctggaa 840
tgggtgtccc ggatcagaag caagtacaac aactacgcca cctactacgc cgacagcgtg 900
aagggccggt tcaccatcag ccgggacgac agcaagaaca ccctgtacct gcagatgaac 960
agcctgcggg ccgaggacac cgccgtgtac tattgtgtgc ggcacggcaa cttcggcgcc 1020
agctatgtgt cttggtttgc ctactggggc cagggcaccc tcgtgaccgt gtcaagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 201
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 201
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacaa agggccctag cgtgttccct ctggccccca gcagcaagag cacaagcggc 420
ggaacagccg ccctgggctg cctcgtgaag gactacttcc ccgagcccgt gacagtgtct 480
tggaacagcg gagccctgac aagcggcgtg cacactttcc ctgccgtgct gcagagcagc 540
ggcctgtact ccctgagcag cgtggtcacc gtgcctagca gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaaag tggacaagaa ggtggagccc 660
aagagctgtg atggcggagg agggtccgga ggcggaggat ccgaggtgca gctgctggaa 720
tctggcggcg gactggtgca gcctggcgga tctctgagac tgagctgtgc cgccagcggc 780
ttcaccttca gcacctacgc catgaactgg gtgcgccagg cccctggcaa aggcctggaa 840
tgggtgtccc ggatcagaag caagtacaac aactacgcca cctactacgc cgacagcgtg 900
aagggccggt tcaccatcag ccgggacgac agcaagaaca ccctgtacct gcagatgaac 960
agcctgcggg ccgaggacac cgccgtgtac tattgtgtgc ggcacggcaa cttcggcaac 1020
gcctatgtgt cttggtttgc ctactggggc cagggcaccc tcgtgaccgt gtcaagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 202
<211> 1323
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 202
caggccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcaggaa 120
aagcccggcc aggccttcag aggactgatc ggcggcacca acaagagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgcc 240
cagccagaag atgaggccga gtactactgc gccctgtggt acagcaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtgctgagc agcgctagca ccaagggccc atcggtcttc 360
cccctggcac cctcctccaa gagcacctct gggggcacag cggccctggg ctgcctggtc 420
aaggactact tccccgaacc ggtgacggtg tcgtggaact caggcgccct gaccagcggc 480
gtgcacacct tcccggctgt cctacagtcc tcaggactct actccctcag cagcgtggtg 540
accgtgccct ccagcagctt gggcacccag acctacatct gcaacgtgaa tcacaagccc 600
agcaacacca aggtggacaa gaaagttgag cccaaatctt gtgacaaaac tcacacatgc 660
ccaccgtgcc cagcacctga agctgcaggg ggaccgtcag tcttcctctt ccccccaaaa 720
cccaaggaca ccctcatgat ctcccggacc cctgaggtca catgcgtggt ggtggacgtg 780
agccacgaag accctgaggt caagttcaac tggtacgtgg acggcgtgga ggtgcataat 840
gccaagacaa agccgcggga ggagcagtac aacagcacgt accgtgtggt cagcgtcctc 900
accgtcctgc accaggactg gctgaatggc aaggagtaca agtgcaaggt ctccaacaaa 960
gccctcggcg cccccatcga gaaaaccatc tccaaagcca aagggcagcc ccgagaacca 1020
caggtgtaca ccctgccccc atcccgggat gagctgacca agaaccaggt cagcctgacc 1080
tgcctggtca aaggcttcta tcccagcgac atcgccgtgg agtgggagag caatgggcag 1140
ccggagaaca actacaagac cacgcctccc gtgctggact ccgacggctc cttcttcctc 1200
tacagcaagc tcaccgtgga caagagcagg tggcagcagg ggaacgtctt ctcatgctcc 1260
gtgatgcatg aggctctgca caaccactac acgcagaaga gcctctccct gtctccgggt 1320
aaa 1323
<210> 203
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 203
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcgtgg ccgctccctc cgtgttcatc ttcccacctt ccgacgagca gctgaagtcc 420
ggcaccgctt ctgtcgtgtg cctgctgaac aacttctacc cccgcgaggc caaggtgcag 480
tggaaggtgg acaacgccct gcagtccggc aacagccagg aatccgtgac cgagcaggac 540
tccaaggaca gcacctactc cctgtcctcc accctgaccc tgtccaaggc cgactacgag 600
aagcacaagg tgtacgcctg cgaagtgacc caccagggcc tgtctagccc cgtgaccaag 660
tctttcaacc ggggcgagtg c 681
<210> 204
<211> 693
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 204
gaagtgcagc tgctggaatc cggcggagga ctggtgcagc ctggcggatc tctgagactg 60
tcttgtgccg cctccggctt caccttctcc acctacgcca tgaactgggt gcgacaggct 120
cctggcaagg gcctggaatg ggtgtcccgg atcagatcca agtacaacaa ctacgccacc 180
tactacgccg actccgtgaa gggccggttc accatctctc gggacgactc caagaacacc 240
ctgtacctgc agatgaactc cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaactc ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt catctgctag ccccaaggct gcccccagcg tgaccctgtt tccccccagc 420
agcgaggaac tgcaggccaa caaggccacc ctggtctgcc tgatcagcga cttctaccca 480
ggcgccgtga ccgtggcctg gaaggccgac agcagccccg tgaaggccgg cgtggagacc 540
accaccccca gcaagcagag caacaacaag tacgccgcca gcagctacct gagcctgacc 600
cccgagcagt ggaagagcca caggtcctac agctgccagg tgacccacga gggcagcacc 660
gtggagaaaa ccgtggcccc caccgagtgc agc 693
<210> 205
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 205
cagaccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcagcag 120
aagccaggcc aggctcccag aggactgatc ggcggcacca acgccagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgtg 240
cagcctgaag atgaggccga gtactactgc gccctgtggt acagcaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtccta 327
<210> 206
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 206
cagaccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcagcag 120
aagccaggcc aggctcccag aggactgatc ggcggcacca acaagagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgtg 240
cagcctgaag atgaggccga gtactactgc gccctgtggt acgccaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtccta 327
<210> 207
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 207
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgcactgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggacgg atcaagagca agaccgatgg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctgggagt ggtcttggta cgactattgg ggccagggca ccctcgtgac cgtgtcctct 360
gctagc 366
<210> 208
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 208
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgtcccgg atcaagagca agaccgatgg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctgggagt ggtcttggta cgactattgg ggccagggca ccctcgtgac cgtgtcctct 360
gctagc 366
<210> 209
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 209
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggatct atcaagagca agaccgacgg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctgggagt ggtcttggta cgactattgg ggccagggca ccctcgtgac cgtgtcctct 360
gctagc 366
<210> 210
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 210
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggacgg atcaagagca agaccgatgg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctacgagt ggtcttggta cgactactgg ggccagggca ccctcgtgac cgtgtcatct 360
gctagc 366
<210> 211
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 211
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggacgg atcaagagca agaccgatgg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctgggagt actcttggta cgactactgg ggccagggca ccctcgtgac cgtgtcatct 360
gctagc 366
<210> 212
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 212
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
actatcgttg tttctccgtt cgactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
gctagc 366
<210> 213
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 213
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcaactac 300
ttcatcggtt ctgttgctat ggactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
gctagc 366
<210> 214
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 214
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtctg 300
acttactcta tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagc 357
<210> 215
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 215
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcact gcagattcca 300
aacacttttg gtcaaggcac caaggtcgaa attaaacgta cg 342
<210> 216
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 216
gaggtgcaat tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctccggatt cacctttagc agttatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcagatga acagcctgag agccgaggac acggccgtat attactgtgc gaaatacgct 300
tacgctctgg actactgggg ccaaggaacc ctggtcaccg tctcgagtgc tagc 354
<210> 217
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 217
gaaatcgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcttgca gggccagtca gagtgttagc agcagctact tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat ggagcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg atccgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagcatggca gcagcagcac gttcggccag 300
gggaccaaag tggaaatcaa acgtacg 327
<210> 218
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 218
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttctctgctg gtcgtctgat ggactattgg ggtcaaggca ccctcgtaac ggtttcttct 360
gctagc 366
<210> 219
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 219
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcact gcagacccca 300
ccaattacct ttggtcaagg caccaaggtc gaaattaaac gtacg 345
<210> 220
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 220
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
tacaacgctt tcgactattg gggtcacggc accctcgtaa cggtttcttc tgctagc 357
<210> 221
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 221
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcatg gcatagccca 300
acttttggtc aaggcaccaa ggtcgaaatt aaacgtacg 339
<210> 222
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 222
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgct 300
acttacacta tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagc 357
<210> 223
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 223
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcact gcagacccca 300
attacttttg gtcaaggcac caaggtcgaa attaaacgta cg 342
<210> 224
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 224
caggtgcagc tgcagcagtc tggcgccgag ctcgtgaaac ctggcgcctc cgtgaagatc 60
agctgcaagg ccagcggcta cagcttcacc ggctacttca tgaactgggt caagcagagc 120
cacggcaaga gcctggaatg gatcggcaga atccacccct acgacggcga caccttctac 180
aaccagaact tcaaggacaa ggccaccctg accgtggaca agagcagcaa caccgcccac 240
atggaactgc tgagcctgac cagcgaggac ttcgccgtgt actactgcac cagatacgac 300
ggcagccggg ccatggatta ttggggccag ggcaccaccg tgacagtgtc cagcgctagc 360
accaagggcc cctccgtgtt ccccctggcc cccagcagca agagcaccag cggcggcaca 420
gccgctctgg gctgcctggt caaggactac ttccccgagc ccgtgaccgt gtcctggaac 480
agcggagccc tgacctccgg cgtgcacacc ttccccgccg tgctgcagag ttctggcctg 540
tatagcctga gcagcgtggt caccgtgcct tctagcagcc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggaca agaaggtgga gcccaagagc 660
tgcgacaaaa ctcacacatg cccaccgtgc ccagcacctg aagctgcagg gggaccgtca 720
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 780
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg 900
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 960
aagtgcaagg tctccaacaa agccctcggc gcccccatcg agaaaaccat ctccaaagcc 1020
aaagggcagc cccgagaacc acaggtgtgc accctgcccc catcccggga tgagctgacc 1080
aagaaccagg tcagcctctc gtgcgcagtc aaaggcttct atcccagcga catcgccgtg 1140
gagtgggaga gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac 1200
tccgacggct ccttcttcct cgtgagcaag ctcaccgtgg acaagagcag gtggcagcag 1260
gggaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag 1320
agcctctccc tgtctccggg taaa 1344
<210> 225
<211> 2073
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 225
caggtgcagc tgcagcagtc tggcgccgag ctcgtgaaac ctggcgcctc cgtgaagatc 60
agctgcaagg ccagcggcta cagcttcacc ggctacttca tgaactgggt caagcagagc 120
cacggcaaga gcctggaatg gatcggcaga atccacccct acgacggcga caccttctac 180
aaccagaact tcaaggacaa ggccaccctg accgtggaca agagcagcaa caccgcccac 240
atggaactgc tgagcctgac cagcgaggac ttcgccgtgt actactgcac cagatacgac 300
ggcagccggg ccatggatta ttggggccag ggcaccaccg tgacagtgtc cagcgctagc 360
acaaagggcc ccagcgtgtt ccctctggcc cctagcagca agagcacatc tggcggaaca 420
gccgccctgg gctgcctcgt gaaggactac tttcccgagc ctgtgaccgt gtcctggaac 480
tctggcgccc tgacaagcgg cgtgcacacc tttccagccg tgctgcagag cagcggcctg 540
tactctctga gcagcgtggt caccgtgcct agcagcagcc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc cagcaacacc aaagtggaca agaaggtgga gcccaagagc 660
tgtgatggcg gaggagggtc cggaggcgga ggatccgaag tgcagctggt ggaaagcggc 720
ggaggcctgg tgcagcctaa gggctctctg aagctgagct gtgccgccag cggcttcacc 780
ttcaacacct acgccatgaa ctgggtgcgc caggcccctg gcaaaggcct ggaatgggtg 840
gcccggatca gaagcaagta caacaattac gccacctact acgccgacag cgtgaaggac 900
cggttcacca tcagccggga cgacagccag agcatcctgt acctgcagat gaacaacctg 960
aaaaccgagg acaccgccat gtactactgc gtgcggcacg gcaacttcgg caacagctat 1020
gtgtcttggt ttgcctactg gggccagggc accctcgtga cagtgtctgc tgctagcgtg 1080
gccgctccct ccgtgtttat ctttccccca tccgatgaac agctgaaaag cggcaccgcc 1140
tccgtcgtgt gtctgctgaa caatttttac cctagggaag ctaaagtgca gtggaaagtg 1200
gataacgcac tgcagtccgg caactcccag gaatctgtga cagaacagga ctccaaggac 1260
agcacctact ccctgtcctc caccctgaca ctgtctaagg ctgattatga gaaacacaaa 1320
gtctacgcct gcgaagtcac ccatcagggc ctgagctcgc ccgtcacaaa gagcttcaac 1380
aggggagagt gtgacaagac ccacacctgt cccccttgtc ctgcccctga agctgctggc 1440
ggcccttctg tgttcctgtt ccccccaaag cccaaggaca ccctgatgat cagccggacc 1500
cccgaagtga cctgcgtggt ggtggatgtg tcccacgagg accctgaagt gaagttcaat 1560
tggtacgtgg acggcgtgga agtgcacaac gccaagacaa agccgcggga ggagcagtac 1620
aacagcacgt accgtgtggt cagcgtcctc accgtcctgc accaggactg gctgaatggc 1680
aaggagtaca agtgcaaggt ctccaacaaa gccctcggcg cccccatcga gaaaaccatc 1740
tccaaagcca aagggcagcc ccgagaacca caggtgtaca ccctgccccc atgccgggat 1800
gagctgacca agaaccaggt cagcctgtgg tgcctggtca aaggcttcta tcccagcgac 1860
atcgccgtgg agtgggagag caatgggcag ccggagaaca actacaagac cacgcctccc 1920
gtgctggact ccgacggctc cttcttcctc tacagcaagc tcaccgtgga caagagcagg 1980
tggcagcagg ggaacgtctt ctcatgctcc gtgatgcatg aggctctgca caaccactac 2040
acgcagaaga gcctctccct gtctccgggt aaa 2073
<210> 226
<211> 654
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 226
gacatcgagc tgacccagag ccctgcctct ctggccgtgt ctctgggaca gagagccatc 60
atcagctgca aggccagcca gagcgtgtcc tttgccggca cctctctgat gcactggtat 120
caccagaagc ccggccagca gcccaagctg ctgatctaca gagccagcaa cctggaagcc 180
ggcgtgccca caagattttc cggcagcggc agcaagaccg acttcaccct gaacatccac 240
cccgtggaag aagaggacgc cgccacctac tactgccagc agagcagaga gtacccctac 300
accttcggcg gaggcaccaa gctggaaatc aagcgtacgg tggctgcacc atctgtcttc 360
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 420
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 480
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 540
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 600
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgt 654
<210> 227
<211> 209
<212> PRT
<213> Homo sapiens
<400> 227
Arg Ile Ala Trp Ala Arg Thr Glu Leu Leu Asn Val Cys Met Asn Ala
1 5 10 15
Lys His His Lys Glu Lys Pro Gly Pro Glu Asp Lys Leu His Glu Gln
20 25 30
Cys Arg Pro Trp Arg Lys Asn Ala Cys Cys Ser Thr Asn Thr Ser Gln
35 40 45
Glu Ala His Lys Asp Val Ser Tyr Leu Tyr Arg Phe Asn Trp Asn His
50 55 60
Cys Gly Glu Met Ala Pro Ala Cys Lys Arg His Phe Ile Gln Asp Thr
65 70 75 80
Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln Gln Val
85 90 95
Asp Gln Ser Trp Arg Lys Glu Arg Val Leu Asn Val Pro Leu Cys Lys
100 105 110
Glu Asp Cys Glu Gln Trp Trp Glu Asp Cys Arg Thr Ser Tyr Thr Cys
115 120 125
Lys Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly Phe Asn Lys
130 135 140
Cys Ala Val Gly Ala Ala Cys Gln Pro Phe His Phe Tyr Phe Pro Thr
145 150 155 160
Pro Thr Val Leu Cys Asn Glu Ile Trp Thr His Ser Tyr Lys Val Ser
165 170 175
Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Pro
180 185 190
Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala Ala Ala
195 200 205
Met
<210> 228
<211> 214
<212> PRT
<213> Homo sapiens
<400> 228
Thr Met Cys Ser Ala Gln Asp Arg Thr Asp Leu Leu Asn Val Cys Met
1 5 10 15
Asp Ala Lys His His Lys Thr Lys Pro Gly Pro Glu Asp Lys Leu His
20 25 30
Asp Gln Cys Ser Pro Trp Lys Lys Asn Ala Cys Cys Thr Ala Ser Thr
35 40 45
Ser Gln Glu Leu His Lys Asp Thr Ser Arg Leu Tyr Asn Phe Asn Trp
50 55 60
Asp His Cys Gly Lys Met Glu Pro Ala Cys Lys Arg His Phe Ile Gln
65 70 75 80
Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln
85 90 95
Gln Val Asn Gln Ser Trp Arg Lys Glu Arg Phe Leu Asp Val Pro Leu
100 105 110
Cys Lys Glu Asp Cys Gln Arg Trp Trp Glu Asp Cys His Thr Ser His
115 120 125
Thr Cys Lys Ser Asn Trp His Arg Gly Trp Asp Trp Thr Ser Gly Val
130 135 140
Asn Lys Cys Pro Ala Gly Ala Leu Cys Arg Thr Phe Glu Ser Tyr Phe
145 150 155 160
Pro Thr Pro Ala Ala Leu Cys Glu Gly Leu Trp Ser His Ser Tyr Lys
165 170 175
Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe
180 185 190
Asp Ser Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala
195 200 205
Ala Ala Met His Val Asn
210
<210> 229
<211> 220
<212> PRT
<213> Homo sapiens
<400> 229
Ser Ala Arg Ala Arg Thr Asp Leu Leu Asn Val Cys Met Asn Ala Lys
1 5 10 15
His His Lys Thr Gln Pro Ser Pro Glu Asp Glu Leu Tyr Gly Gln Cys
20 25 30
Ser Pro Trp Lys Lys Asn Ala Cys Cys Thr Ala Ser Thr Ser Gln Glu
35 40 45
Leu His Lys Asp Thr Ser Arg Leu Tyr Asn Phe Asn Trp Asp His Cys
50 55 60
Gly Lys Met Glu Pro Thr Cys Lys Arg His Phe Ile Gln Asp Ser Cys
65 70 75 80
Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Arg Gln Val Asn
85 90 95
Gln Ser Trp Arg Lys Glu Arg Ile Leu Asn Val Pro Leu Cys Lys Glu
100 105 110
Asp Cys Glu Arg Trp Trp Glu Asp Cys Arg Thr Ser Tyr Thr Cys Lys
115 120 125
Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly Ile Asn Glu Cys
130 135 140
Pro Ala Gly Ala Leu Cys Ser Thr Phe Glu Ser Tyr Phe Pro Thr Pro
145 150 155 160
Ala Ala Leu Cys Glu Gly Leu Trp Ser His Ser Phe Lys Val Ser Asn
165 170 175
Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Ser Ala
180 185 190
Gln Gly Asn Pro Asn Glu Glu Val Ala Lys Phe Tyr Ala Ala Ala Met
195 200 205
Asn Ala Gly Ala Pro Ser Arg Gly Ile Ile Asp Ser
210 215 220
<210> 230
<211> 208
<212> PRT
<213> Mus musculus
<400> 230
Thr Arg Ala Arg Thr Glu Leu Leu Asn Val Cys Met Asp Ala Lys His
1 5 10 15
His Lys Glu Lys Pro Gly Pro Glu Asp Asn Leu His Asp Gln Cys Ser
20 25 30
Pro Trp Lys Thr Asn Ser Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala
35 40 45
His Lys Asp Ile Ser Tyr Leu Tyr Arg Phe Asn Trp Asn His Cys Gly
50 55 60
Thr Met Thr Ser Glu Cys Lys Arg His Phe Ile Gln Asp Thr Cys Leu
65 70 75 80
Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp Ile Gln Gln Val Asp Gln
85 90 95
Ser Trp Arg Lys Glu Arg Ile Leu Asp Val Pro Leu Cys Lys Glu Asp
100 105 110
Cys Gln Gln Trp Trp Glu Asp Cys Gln Ser Ser Phe Thr Cys Lys Ser
115 120 125
Asn Trp His Lys Gly Trp Asn Trp Ser Ser Gly His Asn Glu Cys Pro
130 135 140
Val Gly Ala Ser Cys His Pro Phe Thr Phe Tyr Phe Pro Thr Ser Ala
145 150 155 160
Ala Leu Cys Glu Glu Ile Trp Ser His Ser Tyr Lys Leu Ser Asn Tyr
165 170 175
Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp Phe Asp Pro Ala Gln
180 185 190
Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr Ala Glu Ala Met Ser
195 200 205
<210> 231
<211> 213
<212> PRT
<213> Macaca fascicularis
<400> 231
Glu Ala Gln Thr Arg Thr Ala Arg Ala Arg Thr Glu Leu Leu Asn Val
1 5 10 15
Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly Pro Glu Asp Lys
20 25 30
Leu His Glu Gln Cys Arg Pro Trp Lys Lys Asn Ala Cys Cys Ser Thr
35 40 45
Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr Leu Tyr Arg Phe
50 55 60
Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys Lys Arg His Phe
65 70 75 80
Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn Leu Gly Pro Trp
85 90 95
Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg Val Leu Asn Val
100 105 110
Pro Leu Cys Lys Glu Asp Cys Glu Arg Trp Trp Glu Asp Cys Arg Thr
115 120 125
Ser Tyr Cys Lys Ser Asn Trp His Lys Gly Trp Asn Trp Thr Ser Gly
130 135 140
Phe Asn Lys Cys Pro Val Gly Ala Ala Cys Gln Pro Phe His Phe Tyr
145 150 155 160
Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile Trp Thr Tyr Ser Tyr
165 170 175
Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg Cys Ile Gln Met Trp
180 185 190
Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu Val Ala Arg Phe Tyr
195 200 205
Ala Ala Ala Met Ser
210
<210> 232
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 232
Pro Trp Glu Tyr Ser Trp Tyr Asp Tyr
1 5
<210> 233
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 233
Asn Tyr Thr Ile Val Val Ser Pro Phe Asp Tyr
1 5 10
<210> 234
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 234
Asn Tyr Phe Ile Gly Ser Val Ala Met Asp Tyr
1 5 10
<210> 235
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 235
Gly Leu Thr Tyr Ser Met Asp Tyr
1 5
<210> 236
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 236
Met Gln Ala Leu Gln Ile Pro Asn Thr
1 5
<210> 237
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 237
Tyr Ala Tyr Ala Leu Asp Tyr
1 5
<210> 238
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 238
Gln Gln His Gly Ser Ser Ser Thr
1 5
<210> 239
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 239
Gly Asp Phe Ser Ala Gly Arg Leu Met Asp Tyr
1 5 10
<210> 240
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 240
Met Gln Ala Leu Gln Thr Pro Pro Ile Thr
1 5 10
<210> 241
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 241
Gly Asp Tyr Asn Ala Phe Asp Tyr
1 5
<210> 242
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 242
Met Gln Ala Trp His Ser Pro Thr
1 5
<210> 243
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 243
Gly Ala Thr Tyr Thr Met Asp Tyr
1 5
<210> 244
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 244
Met Gln Ala Leu Gln Thr Pro Ile Thr
1 5
<210> 245
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 245
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 246
<211> 2076
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 246
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccatgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgctctttc 300
ttcactggtt tccatctgga ctattggggt caaggcaccc tcgtaacggt ttcttctgct 360
agcacaaagg gccccagcgt gttccctctg gcccctagca gcaagagcac atctggcgga 420
acagccgccc tgggctgcct cgtgaaggac tactttcccg agcctgtgac cgtgtcctgg 480
aactctggcg ccctgacaag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 540
ctgtactctc tgagcagcgt ggtcaccgtg cctagcagca gcctgggcac ccagacctac 600
atctgcaacg tgaaccacaa gcccagcaac accaaagtgg acaagaaggt ggagcccaag 660
agctgtgatg gcggaggagg gtccggaggc ggaggatccg aggtgcagct gctggaatct 720
ggcggcggac tggtgcagcc tggcggatct ctgagactga gctgtgccgc cagcggcttc 780
accttcagca cctacgccat gaactgggtg cgccaggccc ctggcaaagg cctggaatgg 840
gtgtcccgga tcagaagcaa gtacaacaac tacgccacct actacgccga cagcgtgaag 900
ggccggttca ccatcagccg ggacgacagc aagaacaccc tgtacctgca gatgaacagc 960
ctgcgggccg aggacaccgc cgtgtactat tgtgtgcggc acggcaactt cggcaacagc 1020
tatgtgtctt ggtttgccta ctggggccag ggcaccctcg tgaccgtgtc aagcgctagt 1080
gtggccgctc cctccgtgtt tatctttccc ccatccgatg aacagctgaa aagcggcacc 1140
gcctccgtcg tgtgtctgct gaacaatttt taccctaggg aagctaaagt gcagtggaaa 1200
gtggataacg cactgcagtc cggcaactcc caggaatctg tgacagaaca ggactccaag 1260
gacagcacct actccctgtc ctccaccctg acactgtcta aggctgatta tgagaaacac 1320
aaagtctacg cctgcgaagt cacccatcag ggcctgagct cgcccgtcac aaagagcttc 1380
aacaggggag agtgtgacaa gacccacacc tgtccccctt gtcctgcccc tgaagctgct 1440
ggcggccctt ctgtgttcct gttcccccca aagcccaagg acaccctgat gatcagccgg 1500
acccccgaag tgacctgcgt ggtggtggat gtgtcccacg aggaccctga agtgaagttc 1560
aattggtacg tggacggcgt ggaagtgcac aacgccaaga caaagccgcg ggaggagcag 1620
tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat 1680
ggcaaggagt acaagtgcaa ggtctccaac aaagccctcg gcgcccccat cgagaaaacc 1740
atctccaaag ccaaagggca gccccgagaa ccacaggtgt acaccctgcc cccatgccgg 1800
gatgagctga ccaagaacca ggtcagcctg tggtgcctgg tcaaaggctt ctatcccagc 1860
gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct 1920
cccgtgctgg actccgacgg ctccttcttc ctctacagca agctcaccgt ggacaagagc 1980
aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac 2040
tacacgcaga agagcctctc cctgtctccg ggtaaa 2076
<210> 247
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 247
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccatgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgctctttc 300
ttcactggtt tccatctgga ctattggggt caaggcaccc tcgtaacggt ttcttctgct 360
agcaccaagg gcccctccgt gttccccctg gcccccagca gcaagagcac cagcggcggc 420
acagccgctc tgggctgcct ggtcaaggac tacttccccg agcccgtgac cgtgtcctgg 480
aacagcggag ccctgacctc cggcgtgcac accttccccg ccgtgctgca gagttctggc 540
ctgtatagcc tgagcagcgt ggtcaccgtg ccttctagca gcctgggcac ccagacctac 600
atctgcaacg tgaaccacaa gcccagcaac accaaggtgg acaagaaggt ggagcccaag 660
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 780
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 960
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga accacaggtg tgcaccctgc ccccatcccg ggatgagctg 1080
accaagaacc aggtcagcct ctcgtgcgca gtcaaaggct tctatcccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctcgtgagc aagctcaccg tggacaagag caggtggcag 1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1320
aagagcctct ccctgtctcc gggtaaa 1347
<210> 248
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 248
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Glu Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 249
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 249
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Gln Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 250
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 250
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Ala Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 251
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 251
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ala Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 252
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 252
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu
225 230 235 240
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
245 250 255
Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg
260 265 270
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys
275 280 285
Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly
325 330 335
Asn Phe Gly Ala Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 253
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 253
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 254
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 254
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser
210 215
<210> 255
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 255
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Trp Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu
225 230 235 240
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
245 250 255
Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg
260 265 270
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys
275 280 285
Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly
325 330 335
Asn Phe Gly Asn Ala Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 256
<211> 690
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 256
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Trp Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Gly Gly Gly
210 215 220
Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly
225 230 235 240
Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser
245 250 255
Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro
260 265 270
Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys Tyr Asn Asn
275 280 285
Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
290 295 300
Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
305 310 315 320
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly
325 330 335
Ala Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
340 345 350
Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro
355 360 365
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
370 375 380
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
385 390 395 400
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
405 410 415
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
420 425 430
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
435 440 445
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp
450 455 460
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
465 470 475 480
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
485 490 495
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
500 505 510
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
515 520 525
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
530 535 540
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
545 550 555 560
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
565 570 575
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
580 585 590
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
595 600 605
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
610 615 620
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
625 630 635 640
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
645 650 655
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
660 665 670
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
675 680 685
Gly Lys
690
<210> 257
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 257
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Trp Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 258
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 258
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Ser Ile Met Gln Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 259
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 259
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Gly Gln Ala Phe Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Ala
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
115 120 125
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
180 185 190
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
195 200 205
Val Glu Pro Lys Ser Cys
210
<210> 260
<211> 690
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 260
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Pro Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Phe Ala Trp Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Gly Gly Gly
210 215 220
Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly
225 230 235 240
Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser
245 250 255
Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro
260 265 270
Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys Tyr Asn Asn
275 280 285
Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
290 295 300
Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
305 310 315 320
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly
325 330 335
Asn Ala Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
340 345 350
Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro
355 360 365
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
370 375 380
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
385 390 395 400
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
405 410 415
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
420 425 430
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
435 440 445
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp
450 455 460
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
465 470 475 480
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
485 490 495
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
500 505 510
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
515 520 525
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
530 535 540
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
545 550 555 560
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
565 570 575
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
580 585 590
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
595 600 605
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
610 615 620
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
625 630 635 640
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
645 650 655
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
660 665 670
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
675 680 685
Gly Lys
690
<210> 261
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 261
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgaggg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
<210> 262
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 262
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactcaggg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
<210> 263
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 263
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcgccag ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt caagc 375
<210> 264
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 264
gaggtgcagc tgctggaatc tggcggcgga ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc acctacgcca tgaactgggt gcgccaggcc 120
cctggcaaag gcctggaatg ggtgtcccgg atcagaagca agtacaacaa ctacgccacc 180
tactacgccg acagcgtgaa gggccggttc accatcagcc gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgcgggcc gaggacaccg ccgtgtacta ttgtgtgcgg 300
cacggcaact tcggcaacgc ctatgtgtct tggtttgcct actggggcca gggcaccctc 360
gtgaccgtgt caagc 375
<210> 265
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 265
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacaa agggccctag cgtgttccct ctggccccca gcagcaagag cacaagcggc 420
ggaacagccg ccctgggctg cctcgtgaag gactacttcc ccgagcccgt gacagtgtct 480
tggaacagcg gagccctgac aagcggcgtg cacactttcc ctgccgtgct gcagagcagc 540
ggcctgtact ccctgagcag cgtggtcacc gtgcctagca gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaaag tggacaagaa ggtggagccc 660
aagagctgtg atggcggagg agggtccgga ggcggaggat ccgaggtgca gctgctggaa 720
tctggcggcg gactggtgca gcctggcgga tctctgagac tgagctgtgc cgccagcggc 780
ttcaccttca gcacctacgc catgaactgg gtgcgccagg cccctggcaa aggcctggaa 840
tgggtgtccc ggatcagaag caagtacaac aactacgcca cctactacgc cgacagcgtg 900
aagggccggt tcaccatcag ccgggacgac agcaagaaca ccctgtacct gcagatgaac 960
agcctgcggg ccgaggacac cgccgtgtac tattgtgtgc ggcacggcaa cttcggcgcc 1020
agctatgtgt cttggtttgc ctactggggc cagggcaccc tcgtgaccgt gtcaagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 266
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 266
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacca agggcccctc cgtgttcccc ctggccccca gcagcaagag caccagcggc 420
ggcacagccg ctctgggctg cctggtcaag gactacttcc ccgagcccgt gaccgtgtcc 480
tggaacagcg gagccctgac ctccggcgtg cacaccttcc ccgccgtgct gcagagttct 540
ggcctgtata gcctgagcag cgtggtcacc gtgccttcta gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaagg tggacaagaa ggtggagccc 660
aagagctgcg acaaaactca cacatgccca ccgtgcccag cacctgaagc tgcaggggga 720
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 780
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 840
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 900
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 960
gagtacaagt gcaaggtctc caacaaagcc ctcggcgccc ccatcgagaa aaccatctcc 1020
aaagccaaag ggcagccccg agaaccacag gtgtgcaccc tgcccccatc ccgggatgag 1080
ctgaccaaga accaggtcag cctctcgtgc gcagtcaaag gcttctatcc cagcgacatc 1140
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1200
ctggactccg acggctcctt cttcctcgtg agcaagctca ccgtggacaa gagcaggtgg 1260
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccgcttcacg 1320
cagaagagcc tctccctgtc tccgggtaaa 1350
<210> 267
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 267
caggccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcaggaa 120
aagcccggcc aggccttcag aggactgatc ggcggcacca acaagagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgcc 240
cagccagaag atgaggccga gtactactgc gccctgtggt acagcaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtcctaggt caacccaagg ctgcccccag cgtgaccctg 360
ttccccccca gcagcgagga actgcaggcc aacaaggcca ccctggtctg cctgatcagc 420
gacttctacc caggcgccgt gaccgtggcc tggaaggccg acagcagccc cgtgaaggcc 480
ggcgtggaga ccaccacccc cagcaagcag agcaacaaca agtacgccgc cagcagctac 540
ctgagcctga cccccgagca gtggaagagc cacaggtcct acagctgcca ggtgacccac 600
gagggcagca ccgtggagaa aaccgtggcc cccaccgagt gcagc 645
<210> 268
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 268
gaggtgcaat tggttgaatc tggtggtggt ctggtaaaac cgggcggttc cctgcgtctg 60
agctgcgcgg cttccggatt caccttctcc aacgcgtgga tgagctgggt tcgccaggcc 120
ccgggcaaag gcctcgagtg ggttggtcgt atcaagtcta aaactgacgg tggcaccacg 180
gattacgcgg ctccagttaa aggtcgtttt accatttccc gcgacgatag caaaaacact 240
ctgtatctgc agatgaactc tctgaaaact gaagacaccg cagtctacta ctgtactacc 300
ccgtgggaat ggtcttggta cgattattgg ggccagggca cgctggttac ggtgtcttcc 360
gctagcacaa agggccctag cgtgttccct ctggccccca gcagcaagag cacaagcggc 420
ggaacagccg ccctgggctg cctcgtgaag gactacttcc ccgagcccgt gacagtgtct 480
tggaacagcg gagccctgac aagcggcgtg cacactttcc ctgccgtgct gcagagcagc 540
ggcctgtact ccctgagcag cgtggtcacc gtgcctagca gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaaag tggacaagaa ggtggagccc 660
aagagctgtg atggcggagg agggtccgga ggcggaggat ccgaggtgca gctgctggaa 720
tctggcggcg gactggtgca gcctggcgga tctctgagac tgagctgtgc cgccagcggc 780
ttcaccttca gcacctacgc catgaactgg gtgcgccagg cccctggcaa aggcctggaa 840
tgggtgtccc ggatcagaag caagtacaac aactacgcca cctactacgc cgacagcgtg 900
aagggccggt tcaccatcag ccgggacgac agcaagaaca ccctgtacct gcagatgaac 960
agcctgcggg ccgaggacac cgccgtgtac tattgtgtgc ggcacggcaa cttcggcaac 1020
gcctatgtgt cttggtttgc ctactggggc cagggcaccc tcgtgaccgt gtcaagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 269
<211> 2070
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 269
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggccc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttcgcttggc tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagcaca 360
aagggcccca gcgtgttccc tctggcccct agcagcaaga gcacatctgg cggaacagcc 420
gccctgggct gcctcgtgaa ggactacttt cccgagcctg tgaccgtgtc ctggaactct 480
ggcgccctga caagcggcgt gcacaccttt ccagccgtgc tgcagagcag cggcctgtac 540
tctctgagca gcgtggtcac cgtgcctagc agcagcctgg gcacccagac ctacatctgc 600
aacgtgaacc acaagcccag caacaccaaa gtggacaaga aggtggagcc caagagctgt 660
gatggcggag gagggtccgg aggcggagga tccgaggtgc agctgctgga atctggcggc 720
ggactggtgc agcctggcgg atctctgaga ctgagctgtg ccgccagcgg cttcaccttc 780
agcacctacg ccatgaactg ggtgcgccag gcccctggca aaggcctgga atgggtgtcc 840
cggatcagaa gcaagtacaa caactacgcc acctactacg ccgacagcgt gaagggccgg 900
ttcaccatca gccgggacga cagcaagaac accctgtacc tgcagatgaa cagcctgcgg 960
gccgaggaca ccgccgtgta ctattgtgtg cggcacggca acttcggcgc cagctatgtg 1020
tcttggtttg cctactgggg ccagggcacc ctcgtgaccg tgtcaagcgc tagtgtggcc 1080
gctccctccg tgtttatctt tcccccatcc gatgaacagc tgaaaagcgg caccgcctcc 1140
gtcgtgtgtc tgctgaacaa tttttaccct agggaagcta aagtgcagtg gaaagtggat 1200
aacgcactgc agtccggcaa ctcccaggaa tctgtgacag aacaggactc caaggacagc 1260
acctactccc tgtcctccac cctgacactg tctaaggctg attatgagaa acacaaagtc 1320
tacgcctgcg aagtcaccca tcagggcctg agctcgcccg tcacaaagag cttcaacagg 1380
ggagagtgtg acaagaccca cacctgtccc ccttgtcctg cccctgaagc tgctggcggc 1440
ccttctgtgt tcctgttccc cccaaagccc aaggacaccc tgatgatcag ccggaccccc 1500
gaagtgacct gcgtggtggt ggatgtgtcc cacgaggacc ctgaagtgaa gttcaattgg 1560
tacgtggacg gcgtggaagt gcacaacgcc aagacaaagc cgcgggagga gcagtacaac 1620
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 1680
gagtacaagt gcaaggtctc caacaaagcc ctcggcgccc ccatcgagaa aaccatctcc 1740
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatg ccgggatgag 1800
ctgaccaaga accaggtcag cctgtggtgc ctggtcaaag gcttctatcc cagcgacatc 1860
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1920
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 1980
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 2040
cagaagagcc tctccctgtc tccgggtaaa 2070
<210> 270
<211> 1341
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 270
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggccc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttcgcttggc tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagcacc 360
aagggcccct ccgtgttccc cctggccccc agcagcaaga gcaccagcgg cggcacagcc 420
gctctgggct gcctggtcaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc 480
ggagccctga cctccggcgt gcacaccttc cccgccgtgc tgcagagttc tggcctgtat 540
agcctgagca gcgtggtcac cgtgccttct agcagcctgg gcacccagac ctacatctgc 600
aacgtgaacc acaagcccag caacaccaag gtggacaaga aggtggagcc caagagctgc 660
gacaaaactc acacatgccc accgtgccca gcacctgaag ctgcaggggg accgtcagtc 720
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 780
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 840
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 900
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 960
tgcaaggtct ccaacaaagc cctcggcgcc cccatcgaga aaaccatctc caaagccaaa 1020
gggcagcccc gagaaccaca ggtgtgcacc ctgcccccat cccgggatga gctgaccaag 1080
aaccaggtca gcctctcgtg cgcagtcaaa ggcttctatc ccagcgacat cgccgtggag 1140
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1200
gacggctcct tcttcctcgt gagcaagctc accgtggaca agagcaggtg gcagcagggg 1260
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1320
ctctccctgt ctccgggtaa a 1341
<210> 271
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 271
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcaag cattatgcag 300
cggacttttg gtcaaggcac caaggtcgaa attaaacgta cggtggctgc accatctgtc 360
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 420
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 480
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctc 540
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 600
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgt 657
<210> 272
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 272
caggccgtcg tgacccagga acccagcctg acagtgtctc ctggcggcac cgtgaccctg 60
acatgtggca gttctacagg cgccgtgacc accagcaact acgccaactg ggtgcaggaa 120
aagcccggcc aggccttcag aggactgatc ggcggcacca acaagagagc ccctggcacc 180
cctgccagat tcagcggatc tctgctggga ggaaaggccg ccctgacact gtctggcgcc 240
cagccagaag atgaggccga gtactactgc gccctgtggt acagcaacct gtgggtgttc 300
ggcggaggca ccaagctgac agtgctgagc agcgcttcca ccaaaggccc ttccgtgttt 360
cctctggctc ctagctccaa gtccacctct ggaggcaccg ctgctctcgg atgcctcgtg 420
aaggattatt ttcctgagcc tgtgacagtg tcctggaata gcggagcact gacctctgga 480
gtgcatactt tccccgctgt gctgcagtcc tctggactgt acagcctgag cagcgtggtg 540
acagtgccca gcagcagcct gggcacccag acctacatct gcaacgtgaa ccacaagccc 600
agcaacacca aggtggacaa gaaggtggaa cccaagtctt gt 642
<210> 273
<211> 2070
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 273
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggccc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
ttcgcttggc tggactattg gggtcaaggc accctcgtaa cggtttcttc tgctagcaca 360
aagggcccca gcgtgttccc tctggcccct agcagcaaga gcacatctgg cggaacagcc 420
gccctgggct gcctcgtgaa ggactacttt cccgagcctg tgaccgtgtc ctggaactct 480
ggcgccctga caagcggcgt gcacaccttt ccagccgtgc tgcagagcag cggcctgtac 540
tctctgagca gcgtggtcac cgtgcctagc agcagcctgg gcacccagac ctacatctgc 600
aacgtgaacc acaagcccag caacaccaaa gtggacaaga aggtggagcc caagagctgt 660
gatggcggag gagggtccgg aggcggagga tccgaggtgc agctgctgga atctggcggc 720
ggactggtgc agcctggcgg atctctgaga ctgagctgtg ccgccagcgg cttcaccttc 780
agcacctacg ccatgaactg ggtgcgccag gcccctggca aaggcctgga atgggtgtcc 840
cggatcagaa gcaagtacaa caactacgcc acctactacg ccgacagcgt gaagggccgg 900
ttcaccatca gccgggacga cagcaagaac accctgtacc tgcagatgaa cagcctgcgg 960
gccgaggaca ccgccgtgta ctattgtgtg cggcacggca acttcggcaa cgcctatgtg 1020
tcttggtttg cctactgggg ccagggcacc ctcgtgaccg tgtcaagcgc tagtgtggcc 1080
gctccctccg tgtttatctt tcccccatcc gatgaacagc tgaaaagcgg caccgcctcc 1140
gtcgtgtgtc tgctgaacaa tttttaccct agggaagcta aagtgcagtg gaaagtggat 1200
aacgcactgc agtccggcaa ctcccaggaa tctgtgacag aacaggactc caaggacagc 1260
acctactccc tgtcctccac cctgacactg tctaaggctg attatgagaa acacaaagtc 1320
tacgcctgcg aagtcaccca tcagggcctg agctcgcccg tcacaaagag cttcaacagg 1380
ggagagtgtg acaagaccca cacctgtccc ccttgtcctg cccctgaagc tgctggcggc 1440
ccttctgtgt tcctgttccc cccaaagccc aaggacaccc tgatgatcag ccggaccccc 1500
gaagtgacct gcgtggtggt ggatgtgtcc cacgaggacc ctgaagtgaa gttcaattgg 1560
tacgtggacg gcgtggaagt gcacaacgcc aagacaaagc cgcgggagga gcagtacaac 1620
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 1680
gagtacaagt gcaaggtctc caacaaagcc ctcggcgccc ccatcgagaa aaccatctcc 1740
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatg ccgggatgag 1800
ctgaccaaga accaggtcag cctgtggtgc ctggtcaaag gcttctatcc cagcgacatc 1860
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1920
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 1980
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 2040
cagaagagcc tctccctgtc tccgggtaaa 2070
<210> 274
<211> 440
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 274
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 275
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 275
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 276
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 276
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 277
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 277
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 278
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 278
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 279
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 279
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 280
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 280
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 281
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 281
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120
<210> 282
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 282
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 283
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Gly"
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях для
положений варианта"
<400> 283
Gly Phe Thr Phe Ser Asp Ser Trp Ile His
1 5 10
<210> 284
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Leu"
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 284
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 285
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 285
Arg His Trp Pro Gly Gly Phe Asp Tyr
1 5
<210> 286
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> /замена="Val"
<220>
<221> MOD_RES
<222> (6)..(6)
<223> /замена="Ile"
<220>
<221> MOD_RES
<222> (7)..(7)
<223> /замена="Asn"
<220>
<221> MOD_RES
<222> (9)..(9)
<223> /замена="Phe"
<220>
<221> MOD_RES
<222> (10)..(10)
<223> /замена="Leu"
<220>
<221> misc_feature
<222> (1)..(11)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях для
положений варианта"
<400> 286
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 287
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (4)..(4)
<223> /замена="Thr"
<220>
<221> MOD_RES
<222> (6)..(6)
<223> /замена="Ala"
<220>
<221> misc_feature
<222> (1)..(7)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 287
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 288
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> /замена="Gly" или "Phe" или "Ser"
<220>
<221> MOD_RES
<222> (4)..(4)
<223> /замена="Tyr" или "Phe" или "Trp"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> /замена="Asn" или "Ala" или "Thr" или "Gly" или "Phe" или "Ile"
<220>
<221> MOD_RES
<222> (6)..(6)
<223> /замена="Val" или "Pro" или "Thr" или "Ile"
<220>
<221> MOD_RES
<222> (8)..(8)
<223> /замена="Trp" или "Arg" или "Pro" или "Thr"
<220>
<221> misc_feature
<222> (1)..(9)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 288
Gln Gln Tyr Leu Tyr His Pro Ala Thr
1 5
<210> 289
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 289
Gly Phe Thr Phe Ser Asp Ser Trp Ile His
1 5 10
<210> 290
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 290
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 291
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 291
Arg His Trp Pro Gly Gly Phe Asp Tyr
1 5
<210> 292
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 292
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 293
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 293
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 294
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 294
Gln Gln Tyr Leu Tyr His Pro Ala Thr
1 5
<210> 295
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 295
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 296
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 296
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
1 5 10
<210> 297
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 297
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 298
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 298
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
1 5 10
<210> 299
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 299
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 300
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 300
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 301
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 301
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 302
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 302
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 303
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 303
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
1 5 10
<210> 304
<211> 9
<212> PRT
<213> Mus musculus
<400> 304
Gly Phe Ser Leu Ser Thr Ser Gly Met
1 5
<210> 305
<211> 3
<212> PRT
<213> Mus musculus
<400> 305
Leu Asn Asp
1
<210> 306
<211> 8
<212> PRT
<213> Mus musculus
<400> 306
Asn Gly Tyr Leu Tyr Ala Leu Asp
1 5
<210> 307
<211> 6
<212> PRT
<213> Mus musculus
<400> 307
Ser Ser Ser Val Asn Tyr
1 5
<210> 308
<211> 3
<212> PRT
<213> Mus musculus
<400> 308
Asp Ala Phe
1
<210> 309
<211> 7
<212> PRT
<213> Mus musculus
<400> 309
Trp Ser Ser Tyr Pro Trp Thr
1 5
<210> 310
<211> 120
<212> PRT
<213> Mus musculus
<400> 310
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Arg Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Ser Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Leu Asn Asp Asp Val Phe Phe Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Gln Ile Ala Ser Val Val Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Val Arg Ala Asn Gly Tyr Leu Tyr Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 311
<211> 106
<212> PRT
<213> Mus musculus
<400> 311
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Gln Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Asn Tyr Thr
20 25 30
Gln Trp Tyr Gln Gln Lys Leu Gly Ser Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Asp Ala Phe Lys Leu Ala Pro Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Thr Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 312
<211> 120
<212> PRT
<213> Mus musculus
<400> 312
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Ser Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Leu Asn Asp Asp Val Phe Phe Asn Pro Ala
50 55 60
Leu Lys Arg Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Gln Ile Ala Ser Val Val Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Val Arg Ala Asn Gly Tyr Leu Tyr Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Ile Ser Val Thr Val Ser Ser
115 120
<210> 313
<211> 106
<212> PRT
<213> Mus musculus
<400> 313
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Gln Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Asn Tyr Thr
20 25 30
Gln Trp Tyr Gln Gln Lys Leu Gly Ser Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Asp Ala Phe Lys Leu Ala Pro Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Thr Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 314
<211> 6
<212> PRT
<213> Mus musculus
<400> 314
Ser Ser Ser Val Gln Tyr
1 5
<210> 315
<211> 6
<212> PRT
<213> Mus musculus
<400> 315
Ser Ser Ser Val Ser Tyr
1 5
<210> 316
<211> 7
<212> PRT
<213> Mus musculus
<400> 316
Gly Tyr Ser Phe Thr Ser Tyr
1 5
<210> 317
<211> 3
<212> PRT
<213> Mus musculus
<400> 317
Ser Asp Ser
1
<210> 318
<211> 9
<212> PRT
<213> Mus musculus
<400> 318
Gly Tyr Tyr Ala Trp Tyr Tyr Phe Asp
1 5
<210> 319
<211> 7
<212> PRT
<213> Mus musculus
<400> 319
Ser Gln Ser Ile Gly Asn Asn
1 5
<210> 320
<211> 3
<212> PRT
<213> Mus musculus
<400> 320
Tyr Ala Ser
1
<210> 321
<211> 6
<212> PRT
<213> Mus musculus
<400> 321
Ser Asn Ser Trp Pro Leu
1 5
<210> 322
<211> 120
<212> PRT
<213> Mus musculus
<400> 322
Gln Val Gln Leu Gln Gln Ser Gly Pro Gln Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Gln Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Leu Leu His Trp Leu Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Tyr Tyr Ala Trp Tyr Tyr Phe Asp Cys Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 323
<211> 107
<212> PRT
<213> Mus musculus
<400> 323
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Asp Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Asn Asn
20 25 30
Leu His Trp Tyr Gln Gln Lys Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser His Ser Ile Ser Gly Ile Pro Ser Lys Phe Ser Gly
50 55 60
Thr Gly Ser Gly Thr Asp Phe Thr Leu Ser Phe Asn Ser Val Glu Thr
65 70 75 80
Glu Asp Phe Gly Met Tyr Phe Cys Gln Gln Ser Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 324
<211> 5
<212> PRT
<213> Mus musculus
<400> 324
Gly Asp Ser Ile Ala
1 5
<210> 325
<211> 3
<212> PRT
<213> Mus musculus
<400> 325
Tyr Ser Gly
1
<210> 326
<211> 4
<212> PRT
<213> Mus musculus
<400> 326
Asp Tyr Phe Asp
1
<210> 327
<211> 7
<212> PRT
<213> Mus musculus
<400> 327
Arg Gln Asp Val Arg Lys Asn
1 5
<210> 328
<211> 3
<212> PRT
<213> Mus musculus
<400> 328
Tyr Thr Ser
1
<210> 329
<211> 6
<212> PRT
<213> Mus musculus
<400> 329
Tyr Asp Asn Leu Pro Phe
1 5
<210> 330
<211> 114
<212> PRT
<213> Mus musculus
<400> 330
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Ala Ser Ala
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Lys Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Asn Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Gln Asn Gln Tyr Tyr Leu
65 70 75 80
Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Val
85 90 95
Thr Gly Asp Tyr Phe Asp Tyr Trp Gly Arg Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 331
<211> 107
<212> PRT
<213> Mus musculus
<400> 331
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Tyr Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Lys Ala Arg Gln Asp Val Arg Lys Asn
20 25 30
Ile Gly Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
Trp Tyr Thr Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Asn Ile Asn Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Pro Phe
85 90 95
Thr Phe Gly Thr Gly Thr Lys Leu Glu Ile Arg
100 105
<210> 332
<211> 5
<212> PRT
<213> Mus musculus
<400> 332
Gly Tyr Thr Phe Thr
1 5
<210> 333
<211> 3
<212> PRT
<213> Mus musculus
<400> 333
Glu Thr Tyr
1
<210> 334
<211> 4
<212> PRT
<213> Mus musculus
<400> 334
Gly Tyr Pro Ala
1
<210> 335
<211> 12
<212> PRT
<213> Mus musculus
<400> 335
Ser Arg Thr Ile Leu His Ser Ser Gly Asn Thr Tyr
1 5 10
<210> 336
<211> 3
<212> PRT
<213> Mus musculus
<400> 336
Lys Val Ser
1
<210> 337
<211> 6
<212> PRT
<213> Mus musculus
<400> 337
Asp Ser His Val Pro Phe
1 5
<210> 338
<211> 115
<212> PRT
<213> Mus musculus
<400> 338
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Met His Trp Val Lys Gln Ala Pro Gly Arg Gly Leu Lys Trp Met
35 40 45
Gly Tyr Ile Asn Thr Glu Thr Tyr Glu Pro Thr Phe Gly Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Asp Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Ser Leu Lys Thr Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Gly Gly Gly Gly Tyr Pro Ala Tyr Trp Gly Gln Gly Thr Val Val Ile
100 105 110
Val Ser Ala
115
<210> 339
<211> 112
<212> PRT
<213> Mus musculus
<400> 339
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Arg Thr Ile Leu His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Asp
85 90 95
Ser His Val Pro Phe Thr Phe Gly Thr Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 340
<211> 7
<212> PRT
<213> Mus musculus
<400> 340
Gly Phe Asn Ile Lys Thr Thr
1 5
<210> 341
<211> 3
<212> PRT
<213> Mus musculus
<400> 341
Ala Asp Asp
1
<210> 342
<211> 8
<212> PRT
<213> Mus musculus
<400> 342
Phe Gly Tyr Val Ala Trp Phe Ala
1 5
<210> 343
<211> 7
<212> PRT
<213> Mus musculus
<400> 343
Ser Gln Ser Val Asp Asn Tyr
1 5
<210> 344
<211> 3
<212> PRT
<213> Mus musculus
<400> 344
Tyr Ala Ser
1
<210> 345
<211> 6
<212> PRT
<213> Mus musculus
<400> 345
His Tyr Ser Ser Pro Tyr
1 5
<210> 346
<211> 119
<212> PRT
<213> Mus musculus
<400> 346
Glu Val Gln Leu Gln Gln Ser Val Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Thr Thr
20 25 30
Tyr Met His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asp Asp Asn Thr Lys Tyr Ala Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Ala Ala Ile Tyr Tyr Cys
85 90 95
Val Arg Asp Phe Gly Tyr Val Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Phe Ser Ala
115
<210> 347
<211> 107
<212> PRT
<213> Mus musculus
<400> 347
Asn Ile Val Met Thr Pro Thr Pro Lys Phe Leu Pro Val Ser Ser Gly
1 5 10 15
Asp Arg Val Thr Met Thr Cys Arg Ala Ser Gln Ser Val Asp Asn Tyr
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Ile Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Val
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln His Tyr Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 348
<211> 7
<212> PRT
<213> Mus musculus
<400> 348
Gly Tyr Pro Phe Ser Glu Tyr
1 5
<210> 349
<211> 3
<212> PRT
<213> Mus musculus
<400> 349
Glu Thr Gly
1
<210> 350
<211> 4
<212> PRT
<213> Mus musculus
<400> 350
Gly Tyr Pro Ala
1
<210> 351
<211> 12
<212> PRT
<213> Mus musculus
<400> 351
Ser Arg Ser Ile Val His Ser Ser Gly Asn Thr Tyr
1 5 10
<210> 352
<211> 3
<212> PRT
<213> Mus musculus
<400> 352
Lys Val Ser
1
<210> 353
<211> 5
<212> PRT
<213> Mus musculus
<400> 353
Asp Ser His Val Pro
1 5
<210> 354
<211> 115
<212> PRT
<213> Mus musculus
<400> 354
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Pro Phe Ser Glu Tyr
20 25 30
Ser Ile His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Val Tyr Val Asn Thr Glu Thr Gly Gln Pro Ile Val Gly Asp Asp Phe
50 55 60
Arg Gly Arg Phe Val Leu Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Gly Gly Gly Gly Tyr Pro Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 355
<211> 112
<212> PRT
<213> Mus musculus
<400> 355
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Ile Val His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Asp
85 90 95
Ser His Val Pro Phe Thr Phe Gly Thr Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 356
<211> 7
<212> PRT
<213> Mus musculus
<400> 356
Gly Phe Thr Phe Ser Ser Ser
1 5
<210> 357
<211> 3
<212> PRT
<213> Mus musculus
<400> 357
Ala Thr Gly
1
<210> 358
<211> 8
<212> PRT
<213> Mus musculus
<400> 358
Tyr Pro His Tyr Tyr Ala Met Asp
1 5
<210> 359
<211> 7
<212> PRT
<213> Mus musculus
<400> 359
Ser Glu Asn Ile Phe Ser Asn
1 5
<210> 360
<211> 3
<212> PRT
<213> Mus musculus
<400> 360
Ser Ala Thr
1
<210> 361
<211> 6
<212> PRT
<213> Mus musculus
<400> 361
Phe Tyr Lys Ile Pro Phe
1 5
<210> 362
<211> 121
<212> PRT
<213> Mus musculus
<400> 362
Gln Gly Gln Met His Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Phe Ile Ser Trp Leu Lys Gln Lys Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Ala Trp Ile Tyr Ala Ala Thr Gly Ser Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Thr Asn Lys Ala Gln Leu Thr Val Asp Thr Ser Ser Ser Ala Ala Tyr
65 70 75 80
Met Gln Phe Ser Ser Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg His Ala Gly Tyr Pro His Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 363
<211> 107
<212> PRT
<213> Mus musculus
<400> 363
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Phe Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ser Ala Thr Asn Leu Gly Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Asn Tyr Tyr Cys Gln His Phe Tyr Lys Ile Pro Phe
85 90 95
Thr Phe Gly Thr Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 364
<211> 7
<212> PRT
<213> Mus musculus
<400> 364
Gly Phe Asn Ile Lys Asp Tyr
1 5
<210> 365
<211> 3
<212> PRT
<213> Mus musculus
<400> 365
Glu Asp Gly
1
<210> 366
<211> 8
<212> PRT
<213> Mus musculus
<400> 366
His Gly Tyr Val Gly Trp Phe Ala
1 5
<210> 367
<211> 8
<212> PRT
<213> Mus musculus
<400> 367
Ala Ser Glu Asn Val Asp Thr Tyr
1 5
<210> 368
<211> 3
<212> PRT
<213> Mus musculus
<400> 368
Gly Ala Ser
1
<210> 369
<211> 6
<212> PRT
<213> Mus musculus
<400> 369
Ser Tyr Ser Tyr Pro Trp
1 5
<210> 370
<211> 119
<212> PRT
<213> Mus musculus
<400> 370
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Pro Leu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Thr Cys Thr Thr Ser Gly Phe Asn Ile Lys Asp Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Ser Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Glu Asp Gly Glu Leu Ile Tyr Ala Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Ile Thr Val Asp Thr Ser Ser Asn Ile Ala Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp His Gly Tyr Val Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 371
<211> 107
<212> PRT
<213> Mus musculus
<400> 371
Asn Val Val Met Thr Gln Ser Pro Lys Ser Met Ile Met Ser Val Gly
1 5 10 15
Gln Arg Val Thr Leu Asn Cys Lys Ala Ser Glu Asn Val Asp Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Arg Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gly Gln Ser Tyr Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Phe Arg
100 105
<210> 372
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 372
Pro Thr Gly Ala Glu Phe Leu Gly Asp Gly Gly Asp Val Ser Phe Ser
1 5 10 15
Thr Arg Gly Thr Gln Asn Trp Thr Val Glu Arg Leu Leu Gln Ala His
20 25 30
Ala Gln Leu Glu Glu Arg Gly Tyr Val Phe Val Gly Tyr His Gly Thr
35 40 45
Phe Leu Glu Ala Ala Gln Ser Ile Val Phe Gly Gly Val Ala Ala Arg
50 55 60
Ser Gln Asp Leu Ala Ala Ile Trp Ala Gly Phe Tyr Ile Ala Gly Asp
65 70 75 80
Pro Ala Leu Ala Tyr Gly Tyr Ala Gln Asp Gln Glu Pro Asp Ala Ala
85 90 95
Gly Arg Ile Arg Asn Gly Ala Leu Leu Arg Val Tyr Val Pro Ala Ser
100 105 110
Ser Leu Pro Gly Phe Tyr Arg Thr Ser Leu Thr Leu Ala Ala Pro Glu
115 120 125
Ala Ala Gly Glu Val Glu Arg Leu Ile Gly His Pro Leu Pro Leu Ala
130 135 140
Leu Asp Ala Ile Thr Gly Pro Glu Glu Glu Gly Gly Arg Leu Glu Thr
145 150 155 160
Ile Leu Gly Trp Pro Leu Ala Glu Arg Thr Val Val Ile Pro Ser Ala
165 170 175
Ile Pro Thr Asp Pro Arg Asn Val Gly Gly Asp Leu Asp Pro Ser Ser
180 185 190
Ile Pro Asp Lys Glu Gln Ala Ile Ser Ala Leu Pro Asp Tyr Ala Ser
195 200 205
Gln Pro Gly Lys Pro Pro Arg Glu Asp Leu Lys
210 215
<210> 373
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 373
Pro Thr Gly Ala Glu Phe Leu Gly Asp Gly Gly Asp Val Ser Phe Ser
1 5 10 15
Thr Arg Gly Thr Gln Asn Trp Thr Val Glu Arg Leu Leu Gln Ala His
20 25 30
Ala Gln Leu Glu Glu Arg Gly Tyr Val Phe Val Gly Tyr His Gly Thr
35 40 45
Ala Leu Glu Ala Ala Gln Ser Ile Val Phe Gly Gly Val Arg Ala Arg
50 55 60
Ser Gln Asp Leu Arg Ala Ile Trp Arg Gly Phe Tyr Ile Ala Gly Asp
65 70 75 80
Pro Ala His Ala Tyr Gly Tyr Ala Gln Asp Gln Glu Pro Asp Ala Arg
85 90 95
Gly Arg Ile Ala Asn Gly Ala Leu Leu Arg Val Tyr Val Pro Ala Ser
100 105 110
Ser Leu Pro Gly Phe Tyr Arg Thr Ser Leu Thr Leu Ala Ala Pro Glu
115 120 125
Ala Ala Gly Glu Val Glu Arg Leu Ile Gly His Pro Leu Pro Leu Arg
130 135 140
Leu Asp Ala Ile Thr Gly Pro Glu Glu Glu Gly Gly Arg Glu Glu Thr
145 150 155 160
Ile Leu Gly Trp Pro Leu Ala Glu Arg Thr Val Val Ile Pro Ser Ala
165 170 175
Ile Pro Thr Asp Pro Arg Asn Val Gly Gly Asp Leu Asp Pro Ser Ser
180 185 190
Ile Pro Asp Lys Glu Gln Ala Ile Ser Ala Leu Pro Asp Tyr Ala Ser
195 200 205
Gln Pro Gly Lys Pro Pro Arg Glu Asp Leu Lys
210 215
<210> 374
<211> 107
<212> PRT
<213> Homo sapiens
<400> 374
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 375
<211> 105
<212> PRT
<213> Homo sapiens
<400> 375
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 376
<211> 330
<212> PRT
<213> Homo sapiens
<400> 376
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 377
<211> 330
<212> PRT
<213> Homo sapiens
<400> 377
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 378
<211> 330
<212> PRT
<213> Homo sapiens
<400> 378
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 379
<211> 327
<212> PRT
<213> Homo sapiens
<400> 379
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 380
<211> 280
<212> PRT
<213> Homo sapiens
<400> 380
Ser Glu Val Glu Tyr Arg Ala Glu Val Gly Gln Asn Ala Tyr Leu Pro
1 5 10 15
Cys Phe Tyr Thr Pro Ala Ala Pro Gly Asn Leu Val Pro Val Cys Trp
20 25 30
Gly Lys Gly Ala Cys Pro Val Phe Glu Cys Gly Asn Val Val Leu Arg
35 40 45
Thr Asp Glu Arg Asp Val Asn Tyr Trp Thr Ser Arg Tyr Trp Leu Asn
50 55 60
Gly Asp Phe Arg Lys Gly Asp Val Ser Leu Thr Ile Glu Asn Val Thr
65 70 75 80
Leu Ala Asp Ser Gly Ile Tyr Cys Cys Arg Ile Gln Ile Pro Gly Ile
85 90 95
Met Asn Asp Glu Lys Phe Asn Leu Lys Leu Val Ile Lys Pro Ala Lys
100 105 110
Val Thr Pro Ala Pro Thr Arg Gln Arg Asp Phe Thr Ala Ala Phe Pro
115 120 125
Arg Met Leu Thr Thr Arg Gly His Gly Pro Ala Glu Thr Gln Thr Leu
130 135 140
Gly Ser Leu Pro Asp Ile Asn Leu Thr Gln Ile Ser Thr Leu Ala Asn
145 150 155 160
Glu Leu Arg Asp Ser Arg Leu Ala Asn Asp Leu Arg Asp Ser Gly Ala
165 170 175
Thr Ile Arg Ile Gly Ile Tyr Ile Gly Ala Gly Ile Cys Ala Gly Leu
180 185 190
Ala Leu Ala Leu Ile Phe Gly Ala Leu Ile Phe Lys Trp Tyr Ser His
195 200 205
Ser Lys Glu Lys Ile Gln Asn Leu Ser Leu Ile Ser Leu Ala Asn Leu
210 215 220
Pro Pro Ser Gly Leu Ala Asn Ala Val Ala Glu Gly Ile Arg Ser Glu
225 230 235 240
Glu Asn Ile Tyr Thr Ile Glu Glu Asn Val Tyr Glu Val Glu Glu Pro
245 250 255
Asn Glu Tyr Tyr Cys Tyr Val Ser Ser Arg Gln Gln Pro Ser Gln Pro
260 265 270
Leu Gly Cys Arg Phe Ala Met Pro
275 280
<210> 381
<211> 181
<212> PRT
<213> Homo sapiens
<400> 381
Ser Glu Val Glu Tyr Arg Ala Glu Val Gly Gln Asn Ala Tyr Leu Pro
1 5 10 15
Cys Phe Tyr Thr Pro Ala Ala Pro Gly Asn Leu Val Pro Val Cys Trp
20 25 30
Gly Lys Gly Ala Cys Pro Val Phe Glu Cys Gly Asn Val Val Leu Arg
35 40 45
Thr Asp Glu Arg Asp Val Asn Tyr Trp Thr Ser Arg Tyr Trp Leu Asn
50 55 60
Gly Asp Phe Arg Lys Gly Asp Val Ser Leu Thr Ile Glu Asn Val Thr
65 70 75 80
Leu Ala Asp Ser Gly Ile Tyr Cys Cys Arg Ile Gln Ile Pro Gly Ile
85 90 95
Met Asn Asp Glu Lys Phe Asn Leu Lys Leu Val Ile Lys Pro Ala Lys
100 105 110
Val Thr Pro Ala Pro Thr Arg Gln Arg Asp Phe Thr Ala Ala Phe Pro
115 120 125
Arg Met Leu Thr Thr Arg Gly His Gly Pro Ala Glu Thr Gln Thr Leu
130 135 140
Gly Ser Leu Pro Asp Ile Asn Leu Thr Gln Ile Ser Thr Leu Ala Asn
145 150 155 160
Glu Leu Arg Asp Ser Arg Leu Ala Asn Asp Leu Arg Asp Ser Gly Ala
165 170 175
Thr Ile Arg Ile Gly
180
<210> 382
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 382
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 383
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 383
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 384
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> ВАРИАНТ
<222> (13)..(24)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(24)
<223> /note="Эта последовательность может содержать 3-6 повторяющихся
звеньев "Gly Gly Gly Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(24)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 384
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser
20
<210> 385
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> ВАРИАНТ
<222> (11)..(25)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(25)
<223> /note="Эта последовательность может содержать 2-5 повторяющихся
звеньев "Gly Gly Gly Gly Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(25)
<223> /note= Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 385
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 386
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 386
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 387
<211> 50
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> ВАРИАНТ
<222> (6)..(50)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(50)
<223> /note="Эта последовательность может содержать 1-10 повторяющихся
звеньев "Gly Gly Gly Gly Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(50)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 387
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
35 40 45
Gly Ser
50
<210> 388
<211> 50
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> ВАРИАНТ
<222> (6)..(50)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(50)
<223> /note="Эта последовательность может содержать 1-10 повторяющихся
звеньев "Ser Gly Gly Gly Gly"
<220>
<221> MISC_FEATURE
<222> (1)..(50)
<223> /note= "Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 388
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
35 40 45
Gly Gly
50
<210> 389
<211> 54
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> ВАРИАНТ
<222> (10)..(54)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (5)..(54)
<223> /note="Эта область может включать 1-10 "Ser Gly Gly Gly Gly"
<220>
<221> MISC_FEATURE
<222> (1)..(54)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 389
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
35 40 45
Gly Ser Gly Gly Gly Gly
50
<210> 390
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 390
Glu Pro Lys Ser Cys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 391
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 391
Glu Pro Lys Ser Cys Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 392
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетическая
5×His-метка"
<400> 392
His His His His His
1 5
<210> 393
<211> 692
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 393
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr His Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Phe Phe Thr Gly Phe His Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser
225 230 235 240
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
245 250 255
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
260 265 270
Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys Tyr
275 280 285
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
325 330 335
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
340 345 350
Leu Val Thr Val Ser Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile
355 360 365
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
370 375 380
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
385 390 395 400
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
405 410 415
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
420 425 430
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
435 440 445
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
450 455 460
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
465 470 475 480
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
485 490 495
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
500 505 510
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
515 520 525
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
530 535 540
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
545 550 555 560
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
565 570 575
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
580 585 590
Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val
595 600 605
Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
610 615 620
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
625 630 635 640
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
645 650 655
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
660 665 670
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
675 680 685
Ser Pro Gly Lys
690
<210> 394
<211> 449
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 394
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr His Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Phe Phe Thr Gly Phe His Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 395
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (201)..(201)
<223> Любая аминокислота
<400> 395
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Thr Asn Glu His
85 90 95
Tyr Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Xaa Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 396
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 396
Gly Thr Asn Ala Arg Ala Pro
1 5
<210> 397
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 397
Ala Leu Trp Tyr Ala Asn Leu Trp Val
1 5
<210> 398
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 398
Asn Ala Trp Met His
1 5
<210> 399
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 399
Ser Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala Pro
1 5 10 15
Val Lys Gly
<210> 400
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 400
Pro Tyr Glu Trp Ser Trp Tyr Asp Tyr
1 5
<210> 401
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 401
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Glu Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Tyr Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 402
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<400> 402
Arg Ile Lys Ser Lys Thr Glu Gly Gly Thr Thr Asp Tyr Ala Ala Pro
1 5 10 15
Val Lys Gly
<210> 403
<211> 689
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 403
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Glu Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Tyr Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu
225 230 235 240
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
245 250 255
Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg
260 265 270
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Arg Ile Arg Ser Lys
275 280 285
Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly
325 330 335
Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly
340 345 350
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 404
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 404
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Glu Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr Pro Tyr Glu Trp Ser Trp Tyr Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 405
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 405
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Arg Tyr Arg Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 406
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 406
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Glu Ser Pro Pro Thr Gly
85 90 95
Leu Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 407
<211> 674
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 407
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Arg Tyr Arg Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Ala Val Val Thr Gln Glu
225 230 235 240
Pro Ser Leu Thr Val Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Gly
245 250 255
Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn Trp Val Gln
260 265 270
Glu Lys Pro Gly Gln Ala Phe Arg Gly Leu Ile Gly Gly Thr Asn Lys
275 280 285
Arg Ala Pro Gly Thr Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly
290 295 300
Lys Ala Ala Leu Thr Leu Ser Gly Ala Gln Pro Glu Asp Glu Ala Glu
305 310 315 320
Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn Leu Trp Val Phe Gly Gly Gly
325 330 335
Thr Lys Leu Thr Val Leu Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
340 345 350
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
355 360 365
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
370 375 380
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
385 390 395 400
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
405 410 415
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
420 425 430
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
435 440 445
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
450 455 460
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
465 470 475 480
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
485 490 495
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
500 505 510
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
515 520 525
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
530 535 540
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
545 550 555 560
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
565 570 575
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
580 585 590
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
595 600 605
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
610 615 620
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
625 630 635 640
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
645 650 655
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
660 665 670
Gly Lys
<210> 408
<211> 449
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 408
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Arg Tyr Arg Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 409
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 409
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Glu Ser Pro Pro Thr Gly
85 90 95
Leu Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Lys Lys Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser
210 215
<210> 410
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 410
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Trp Ser Tyr Tyr Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 411
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 411
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Arg Gln Thr Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 412
<211> 673
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 412
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Trp Ser Tyr Tyr Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Gln Ala Val Val Thr Gln Glu Pro
225 230 235 240
Ser Leu Thr Val Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Gly Ser
245 250 255
Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn Trp Val Gln Glu
260 265 270
Lys Pro Gly Gln Ala Phe Arg Gly Leu Ile Gly Gly Thr Asn Lys Arg
275 280 285
Ala Pro Gly Thr Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys
290 295 300
Ala Ala Leu Thr Leu Ser Gly Ala Gln Pro Glu Asp Glu Ala Glu Tyr
305 310 315 320
Tyr Cys Ala Leu Trp Tyr Ser Asn Leu Trp Val Phe Gly Gly Gly Thr
325 330 335
Lys Leu Thr Val Leu Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
340 345 350
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
355 360 365
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
370 375 380
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
385 390 395 400
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
405 410 415
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
420 425 430
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
435 440 445
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
450 455 460
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
465 470 475 480
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
485 490 495
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
500 505 510
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
515 520 525
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
530 535 540
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
545 550 555 560
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
565 570 575
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
580 585 590
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
595 600 605
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
610 615 620
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
625 630 635 640
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
645 650 655
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
660 665 670
Lys
<210> 413
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 413
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Trp Ser Tyr Tyr Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Glu Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 414
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 414
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Arg Gln Thr Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Arg Lys
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 415
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 415
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggacgg atcaagagca agaccgaggg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctacgagt ggtcttggta cgactactgg ggccagggca ccctcgtgac cgtgtcatct 360
<210> 416
<211> 2067
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 416
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggacgg atcaagagca agaccgaggg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctacgagt ggtcttggta cgactactgg ggccagggca ccctcgtgac cgtgtcatct 360
gctagcacaa agggccctag cgtgttccct ctggccccca gcagcaagag cacaagcggc 420
ggaacagccg ccctgggctg cctcgtgaag gactacttcc ccgagcccgt gacagtgtct 480
tggaacagcg gagccctgac aagcggcgtg cacaccttcc ctgccgtgct gcagagcagc 540
ggcctgtact ccctgagcag cgtggtcacc gtgcctagca gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaaag tggacaagaa ggtggagccc 660
aagagctgtg atggcggagg agggtccgga ggcggaggat ccgaggtgca gctgctggaa 720
tctggcggcg gactggtgca gcctggcgga tctctgagac tgagctgtgc cgccagcggc 780
ttcaccttca gcacctacgc catgaactgg gtgcgccagg cccctggcaa aggcctggaa 840
tgggtgtccc ggatcagaag caagtacaac aactacgcca cctactacgc cgacagcgtg 900
aagggccggt tcaccatcag ccgggacgac agcaagaaca ccctgtacct gcagatgaac 960
agcctgcggg ccgaggacac cgccgtgtac tattgtgtgc ggcacggcaa cttcggcaac 1020
agctatgtgt cttggtttgc ctactggggc cagggcaccc tcgtgaccgt gtcaagcgct 1080
agtaccaagg gccccagcgt gttccccctg gcacccagca gcaagagcac atctggcgga 1140
acagccgctc tgggctgtct ggtgaaagac tacttccccg agcccgtgac cgtgtcttgg 1200
aactctggcg ccctgaccag cggcgtgcac acctttccag ccgtgctgca gagcagcggc 1260
ctgtactccc tgtcctccgt ggtcaccgtg ccctctagct ccctgggaac acagacatat 1320
atctgtaatg tcaatcacaa gccttccaac accaaagtcg ataagaaagt cgagcccaag 1380
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 1440
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 1500
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 1560
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 1620
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 1680
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1740
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatgccg ggatgagctg 1800
accaagaacc aggtcagcct gtggtgcctg gtcaaaggct tctatcccag cgacatcgcc 1860
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1920
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1980
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 2040
aagagcctct ccctgtctcc gggtaaa 2067
<210> 417
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 417
gaggtgcaat tggtggaaag cggaggcggc ctcgtgaagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc aacgcctgga tgagctgggt gcgccaggcc 120
cctggaaaag gactcgagtg ggtgggacgg atcaagagca agaccgaggg cggcaccacc 180
gactatgccg cccctgtgaa gggccggttc accatcagca gggacgacag caagaacacc 240
ctgtacctgc agatgaacag cctgaaaacc gaggacaccg ccgtgtacta ctgcaccacc 300
ccctacgagt ggtcttggta cgactactgg ggccagggca ccctcgtgac cgtgtcatct 360
gctagcacca agggcccctc cgtgttcccc ctggccccca gcagcaagag caccagcggc 420
ggcacagccg ctctgggctg cctggtcaag gactacttcc ccgagcccgt gaccgtgtcc 480
tggaacagcg gagccctgac ctccggcgtg cacaccttcc ccgccgtgct gcagagttct 540
ggcctgtata gcctgagcag cgtggtcacc gtgccttcta gcagcctggg cacccagacc 600
tacatctgca acgtgaacca caagcccagc aacaccaagg tggacaagaa ggtggagccc 660
aagagctgcg acaaaactca cacatgccca ccgtgcccag cacctgaagc tgcaggggga 720
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 780
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 840
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 900
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 960
gagtacaagt gcaaggtctc caacaaagcc ctcggcgccc ccatcgagaa aaccatctcc 1020
aaagccaaag ggcagccccg agaaccacag gtgtgcaccc tgcccccatc ccgggatgag 1080
ctgaccaaga accaggtcag cctctcgtgc gcagtcaaag gcttctatcc cagcgacatc 1140
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1200
ctggactccg acggctcctt cttcctcgtg agcaagctca ccgtggacaa gagcaggtgg 1260
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccgcttcacg 1320
cagaagagcc tctccctgtc tccgggtaaa 1350
<210> 418
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 418
gaggtgcaat tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctccggatt cacctttagc agttatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcagatga acagcctgag agccgaggac acggccgtat attactgtgc gcgtggtgac 300
taccgttacc gttacttcga ctactggggc caaggaaccc tggtcaccgt ctcgagt 357
<210> 419
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 419
tcttctgaac tgactcaaga tccagctgtt agcgtggctc tgggtcagac tgtacgtatc 60
acctgccaag gcgattctct gcgctcctac tacgcaagct ggtaccagca gaaaccgggt 120
caggccccag ttctggtgat ttacggcaaa aacaaccgtc cgtctgggat cccggaccgt 180
ttctccggca gctcttccgg taacacggcg agcctcacca tcactggcgc tcaagcagaa 240
gacgaggccg actattactg taactctcgg gaaagcccac caaccggcct ggttgtcttc 300
ggtggcggta ccaagctgac cgtccta 327
<210> 420
<211> 2022
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 420
gaggtgcaat tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctccggatt cacctttagc agttatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcagatga acagcctgag agccgaggac acggccgtat attactgtgc gcgtggtgac 300
taccgttacc gttacttcga ctactggggc caaggaaccc tggtcaccgt ctcgagtgct 360
agcaccaagg gcccctccgt gtttcctctg gccccttcca gcaagtccac ctctggcgga 420
actgccgctc tgggctgcct ggtggaagat tacttccccg agcccgtgac cgtgtcctgg 480
aattctggcg ctctgacctc cggcgtgcac acctttccag ctgtgctgca gtcctccggc 540
ctgtactccc tgtcctccgt cgtgacagtg ccctccagct ctctgggcac ccagacctac 600
atctgcaacg tgaaccacaa gccctccaac accaaggtgg acgagaaggt ggaacccaag 660
tcctgcgacg gtggcggagg ttccggaggc ggaggatccc aggctgtcgt gacccaggaa 720
ccctccctga cagtgtctcc tggcggcacc gtgaccctga cctgtggatc ttctaccggc 780
gctgtgacca cctccaacta cgccaattgg gtgcaggaaa agcccggcca ggccttcaga 840
ggactgatcg gcggcaccaa caagagagcc cctggcaccc ctgccagatt ctccggttct 900
ctgctgggcg gcaaggctgc cctgactctg tctggtgctc agcctgagga cgaggccgag 960
tactactgcg ccctgtggta ctccaacctg tgggtgttcg gcggaggcac caagctgacc 1020
gtgctgtcca gcgcttccac caagggaccc agtgtgttcc ccctggcccc cagctccaag 1080
tctacatccg gtggcacagc tgccctggga tgtctcgtga aggactactt tcctgagcct 1140
gtgacagtgt cttggaacag cggagccctg accagcggag tgcacacatt ccctgcagtg 1200
ctgcagagca gcggcctgta tagcctgagc agcgtcgtga ccgtgccttc ctctagcctg 1260
ggaacacaga catatatctg taatgtgaat cataagccca gtaataccaa agtggataag 1320
aaagtggaac ctaagagctg cgataagacc cacacctgtc ccccctgccc tgctcctgaa 1380
gctgctggtg gccctagcgt gttcctgttc cccccaaagc ccaaggacac cctgatgatc 1440
tcccggaccc ccgaagtgac ctgcgtggtg gtggatgtgt cccacgagga ccctgaagtg 1500
aagttcaatt ggtacgtgga cggcgtggaa gtgcacaacg ccaagaccaa gcctagagag 1560
gaacagtaca actccaccta ccgggtggtg tccgtgctga cagtgctgca ccaggactgg 1620
ctgaacggca aagagtacaa gtgcaaggtg tccaacaagg ccctgggcgc tcccatcgaa 1680
aagaccatct ccaaggccaa gggccagccc cgggaacccc aggtgtacac cctgccccca 1740
tgccgggatg agctgaccaa gaaccaggtc agcctgtggt gcctggtcaa aggcttctat 1800
cccagcgaca tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1860
acgcctcccg tgctggactc cgacggctcc ttcttcctct acagcaagct caccgtggac 1920
aagagcaggt ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 1980
aaccactaca cgcagaagag cctctccctg tctccgggta aa 2022
<210> 421
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 421
gaggtgcaat tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctccggatt cacctttagc agttatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcagatga acagcctgag agccgaggac acggccgtat attactgtgc gcgtggtgac 300
taccgttacc gttacttcga ctactggggc caaggaaccc tggtcaccgt ctcgagtgct 360
agcaccaagg gcccctccgt gttccccctg gcccccagca gcaagagcac cagcggcggc 420
acagccgctc tgggctgcct ggtcgaggac tacttccccg agcccgtgac cgtgtcctgg 480
aacagcggag ccctgacctc cggcgtgcac accttccccg ccgtgctgca gagttctggc 540
ctgtatagcc tgagcagcgt ggtcaccgtg ccttctagca gcctgggcac ccagacctac 600
atctgcaacg tgaaccacaa gcccagcaac accaaggtgg acgagaaggt ggagcccaag 660
agctgcgaca aaactcacac atgcccaccg tgcccagcac ctgaagctgc agggggaccg 720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 780
gtcacatgcg tggtggtgga cgtgagccac gaagaccctg aggtcaagtt caactggtac 840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 960
tacaagtgca aggtctccaa caaagccctc ggcgccccca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga accacaggtg tgcaccctgc ccccatcccg ggatgagctg 1080
accaagaacc aggtcagcct ctcgtgcgca gtcaaaggct tctatcccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctcgtgagc aagctcaccg tggacaagag caggtggcag 1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1320
aagagcctct ccctgtctcc gggtaaa 1347
<210> 422
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 422
tcttctgaac tgactcaaga tccagctgtt agcgtggctc tgggtcagac tgtacgtatc 60
acctgccaag gcgattctct gcgctcctac tacgcaagct ggtaccagca gaaaccgggt 120
caggccccag ttctggtgat ttacggcaaa aacaaccgtc cgtctgggat cccggaccgt 180
ttctccggca gctcttccgg taacacggcg agcctcacca tcactggcgc tcaagcagaa 240
gacgaggccg actattactg taactctcgg gaaagcccac caaccggcct ggttgtcttc 300
ggtggcggta ccaagctgac cgtcctaggt caacccaagg ctgcccccag cgtgaccctg 360
ttccccccca gcagcaagaa actgcaggcc aacaaggcca ccctggtctg cctgatcagc 420
gacttctacc caggcgccgt gaccgtggcc tggaaggccg acagcagccc cgtgaaggcc 480
ggcgtggaga ccaccacccc cagcaagcag agcaacaaca agtacgccgc cagcagctac 540
ctgagcctga cccccgagca gtggaagagc cacaggtcct acagctgcca ggtgacccac 600
gagggcagca ccgtggagaa aaccgtggcc cccaccgagt gcagc 645
<210> 423
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 423
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
tggtcttact acatggacta ttggggtcaa ggcaccctcg taacggtttc ttct 354
<210> 424
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 424
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcacg gcagacccca 300
acttttggtc aaggcaccaa ggtcgaaatt aaa 333
<210> 425
<211> 2019
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 425
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
tggtcttact acatggacta ttggggtcaa ggcaccctcg taacggtttc ttctgctagc 360
accaagggcc cctccgtgtt tcctctggcc ccttccagca agtccacctc tggcggaact 420
gccgctctgg gctgcctggt ggaagattac ttccccgagc ccgtgaccgt gtcctggaat 480
tctggcgctc tgacctccgg cgtgcacacc tttccagctg tgctgcagtc ctccggcctg 540
tactccctgt cctccgtcgt gacagtgccc tccagctctc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc ctccaacacc aaggtggacg agaaggtgga acccaagtcc 660
tgcgacggtg gcggaggttc cggaggcgga ggatcccagg ctgtcgtgac ccaggaaccc 720
tccctgacag tgtctcctgg cggcaccgtg accctgacct gtggatcttc taccggcgct 780
gtgaccacct ccaactacgc caattgggtg caggaaaagc ccggccaggc cttcagagga 840
ctgatcggcg gcaccaacaa gagagcccct ggcacccctg ccagattctc cggttctctg 900
ctgggcggca aggctgccct gactctgtct ggtgctcagc ctgaggacga ggccgagtac 960
tactgcgccc tgtggtactc caacctgtgg gtgttcggcg gaggcaccaa gctgaccgtg 1020
ctgtccagcg cttccaccaa gggacccagt gtgttccccc tggcccccag ctccaagtct 1080
acatccggtg gcacagctgc cctgggatgt ctcgtgaagg actactttcc tgagcctgtg 1140
acagtgtctt ggaacagcgg agccctgacc agcggagtgc acacattccc tgcagtgctg 1200
cagagcagcg gcctgtatag cctgagcagc gtcgtgaccg tgccttcctc tagcctggga 1260
acacagacat atatctgtaa tgtgaatcat aagcccagta ataccaaagt ggataagaaa 1320
gtggaaccta agagctgcga taagacccac acctgtcccc cctgccctgc tcctgaagct 1380
gctggtggcc ctagcgtgtt cctgttcccc ccaaagccca aggacaccct gatgatctcc 1440
cggacccccg aagtgacctg cgtggtggtg gatgtgtccc acgaggaccc tgaagtgaag 1500
ttcaattggt acgtggacgg cgtggaagtg cacaacgcca agaccaagcc tagagaggaa 1560
cagtacaact ccacctaccg ggtggtgtcc gtgctgacag tgctgcacca ggactggctg 1620
aacggcaaag agtacaagtg caaggtgtcc aacaaggccc tgggcgctcc catcgaaaag 1680
accatctcca aggccaaggg ccagccccgg gaaccccagg tgtacaccct gcccccatgc 1740
cgggatgagc tgaccaagaa ccaggtcagc ctgtggtgcc tggtcaaagg cttctatccc 1800
agcgacatcg ccgtggagtg ggagagcaat gggcagccgg agaacaacta caagaccacg 1860
cctcccgtgc tggactccga cggctccttc ttcctctaca gcaagctcac cgtggacaag 1920
agcaggtggc agcaggggaa cgtcttctca tgctccgtga tgcatgaggc tctgcacaac 1980
cactacacgc agaagagcct ctccctgtct ccgggtaaa 2019
<210> 426
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 426
caggtgcaat tggttcaatc tggtgctgaa gtaaaaaaac cgggcgcttc cgttaaagtg 60
agctgcaaag catccggata caccttcact tcctattaca tgcactgggt tcgtcaagcc 120
ccgggccagg gtctggaatg gatgggcatc attaacccaa gcggtggctc tacctcctac 180
gcgcagaaat tccagggtcg cgtcacgatg acccgtgaca ctagcacctc taccgtttat 240
atggagctgt ccagcctgcg ttctgaagat actgcagtgt actactgtgc acgcggtgac 300
tggtcttact acatggacta ttggggtcaa ggcaccctcg taacggtttc ttctgctagc 360
accaagggcc cctccgtgtt ccccctggcc cccagcagca agagcaccag cggcggcaca 420
gccgctctgg gctgcctggt cgaggactac ttccccgagc ccgtgaccgt gtcctggaac 480
agcggagccc tgacctccgg cgtgcacacc ttccccgccg tgctgcagag ttctggcctg 540
tatagcctga gcagcgtggt caccgtgcct tctagcagcc tgggcaccca gacctacatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggacg agaaggtgga gcccaagagc 660
tgcgacaaaa ctcacacatg cccaccgtgc ccagcacctg aagctgcagg gggaccgtca 720
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 780
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg 900
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 960
aagtgcaagg tctccaacaa agccctcggc gcccccatcg agaaaaccat ctccaaagcc 1020
aaagggcagc cccgagaacc acaggtgtgc accctgcccc catcccggga tgagctgacc 1080
aagaaccagg tcagcctctc gtgcgcagtc aaaggcttct atcccagcga catcgccgtg 1140
gagtgggaga gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac 1200
tccgacggct ccttcttcct cgtgagcaag ctcaccgtgg acaagagcag gtggcagcag 1260
gggaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag 1320
agcctctccc tgtctccggg taaa 1344
<210> 427
<211> 654
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 427
gatattgtta tgactcaatc tccactgtct ctgccggtga ctccaggcga accggcgagc 60
atttcttgcc gttccagcca gtctctgctg cactccaacg gctacaacta tctcgattgg 120
tacctgcaaa aaccgggtca gagccctcag ctgctgatct acctgggctc taaccgcgct 180
tccggtgtac cggaccgttt cagcggctct ggatccggca ccgatttcac gttgaaaatc 240
agccgtgttg aagcagaaga cgtgggcgtt tattactgta tgcaggcacg gcagacccca 300
acttttggtc aaggcaccaa ggtcgaaatt aaacgtacgg tggctgcacc atctgtcttc 360
atcttcccgc catctgatcg gaagttgaaa tctggaactg cctctgttgt gtgcctgctg 420
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 480
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 540
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 600
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgt 654
<210> 428
<211> 104
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
полипептид"
<400> 428
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp
100
<210> 429
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> ВАРИАНТ
<222> (13)..(24)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(24)
<223> /note="Эта область может содержать 3-6 повторяющихся звеньев
"Gly Gly Gly Ser"
<220>
<221> ВАРИАНТ
<222> (25)..(27)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(27)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 429
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
20 25
<210> 430
<211> 28
<212> PRT
<213> Искусственная последовательность
<220>
<221> источник
<223> /note="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> ВАРИАНТ
<222> (11)..(25)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(25)
<223> /note="Эта область может содержать 2-5 повторяющихся звеньев
"Gly Gly Gly Gly Ser"
<220>
<221> ВАРИАНТ
<222> (26)..(28)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(28)
<223> /note="Остатки варианта, представленные в последовательности,
не имеют предпочтения относительно указанных в аннотациях
для положений варианта"
<400> 430
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2740479C2 |
| БИСПЕЦИФИЧНЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2800779C2 |
| МЕЖВИДОВЫЕ АНТИТЕЛА К ЛАТЕНТНОМУ TGF-БЕТА 1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2837609C2 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| ДИАГНОСТИЧЕСКИЕ АНАЛИЗЫ И НАБОРЫ ДЛЯ ДЕТЕКЦИИ ФОЛАТНОГО РЕЦЕПТОРА 1 | 2018 |
|
RU2788126C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С PD1 И LAG3 | 2018 |
|
RU2778805C2 |
| МУЛЬТИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ОБЛАДАЮЩАЯ ЗАМЕЩАЮЩЕЙ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ КОФАКТОРА КОАГУЛИРУЮЩЕГО ФАКТОРА КРОВИ VIII, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ МОЛЕКУЛУ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2018 |
|
RU2812909C2 |
| АКТИВИРУЕМЫЕ ПРОТЕАЗОЙ СВЯЗЫВАЮЩИЕ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ | 2017 |
|
RU2830288C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758596C2 |








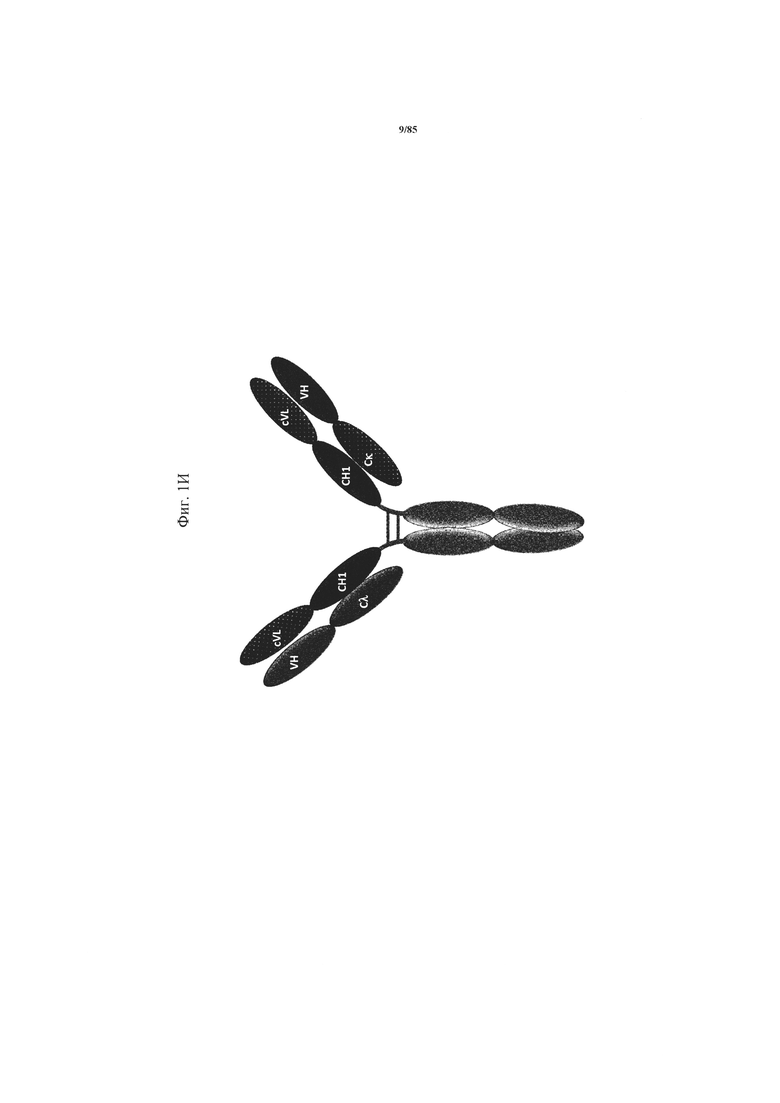
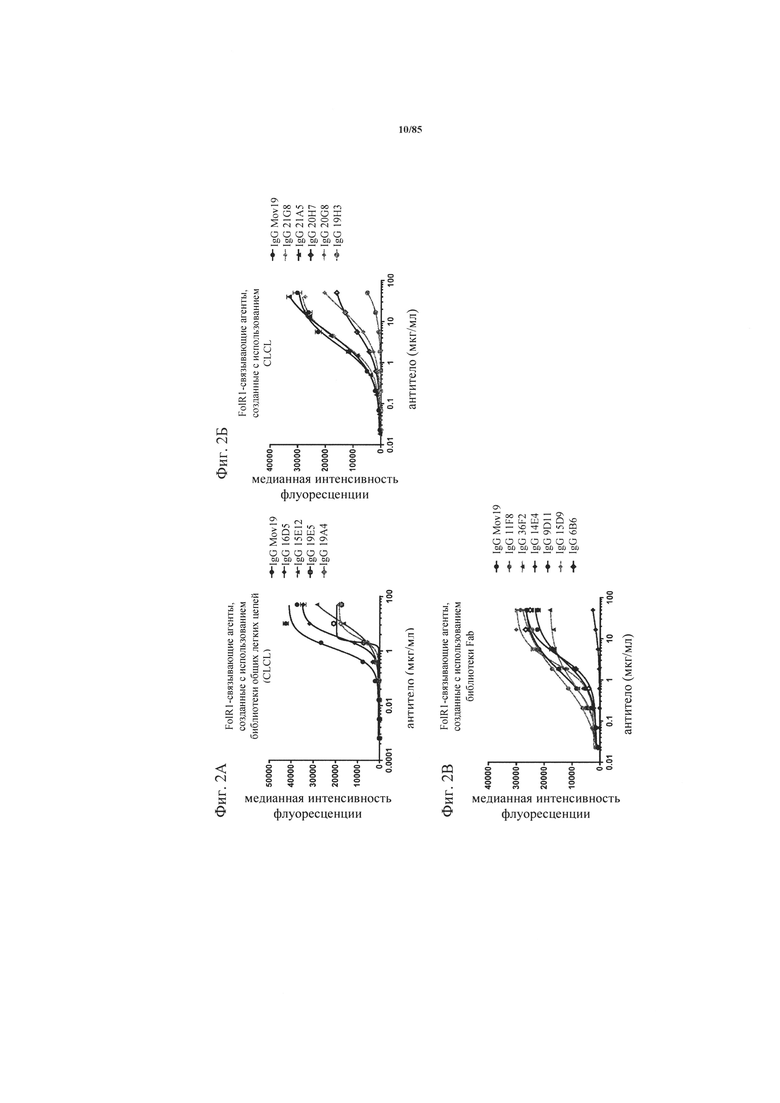
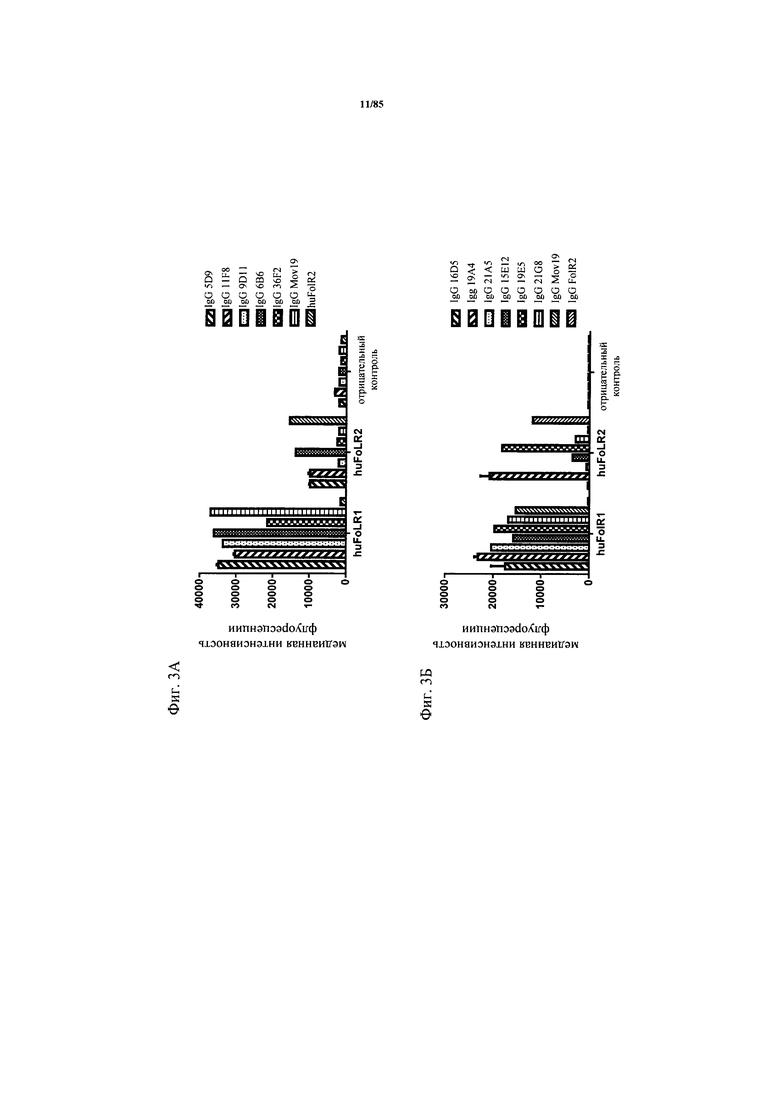
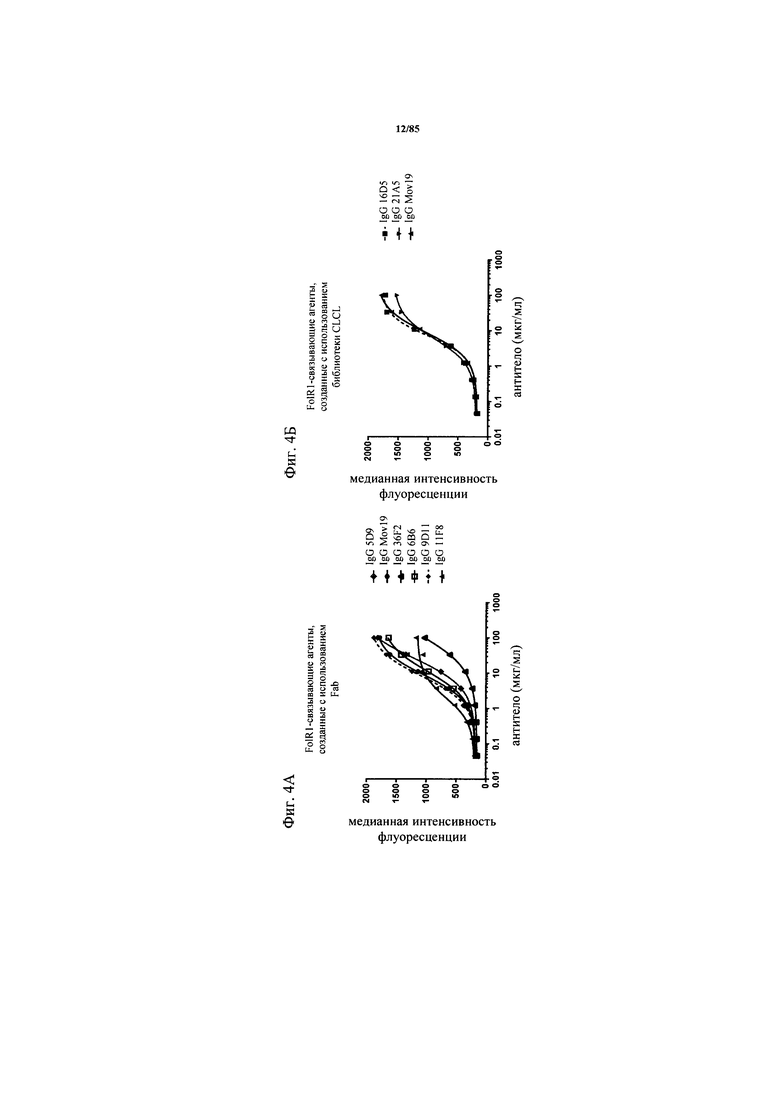
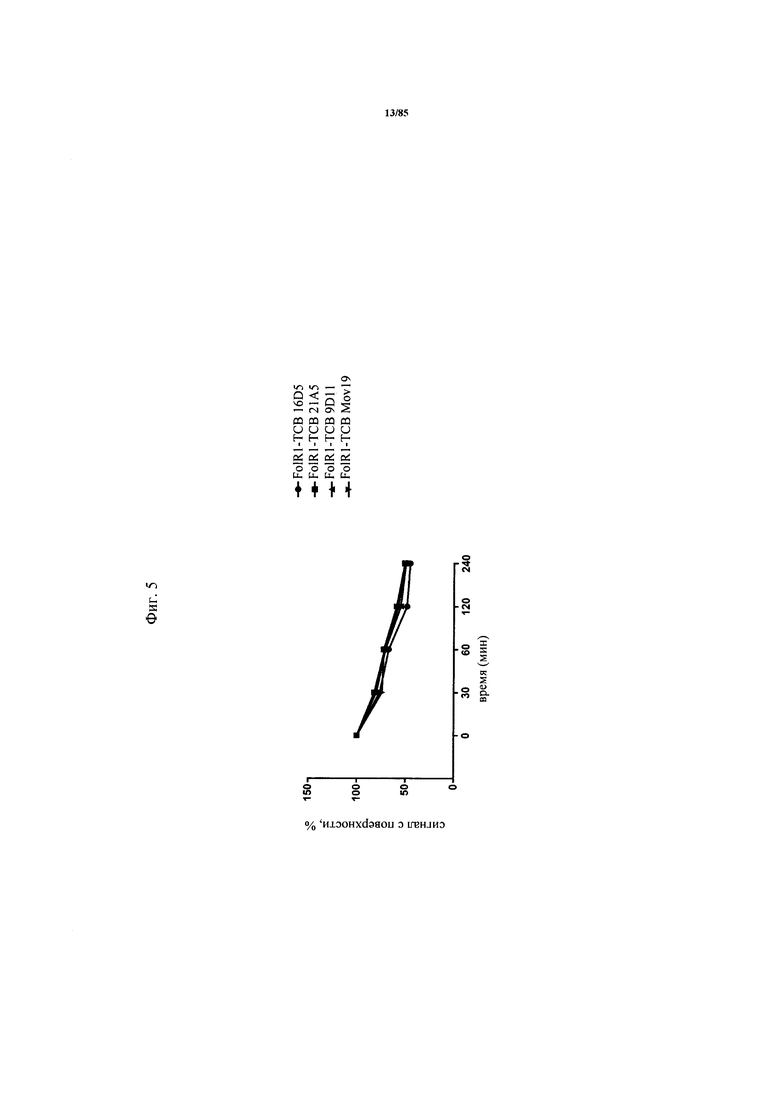
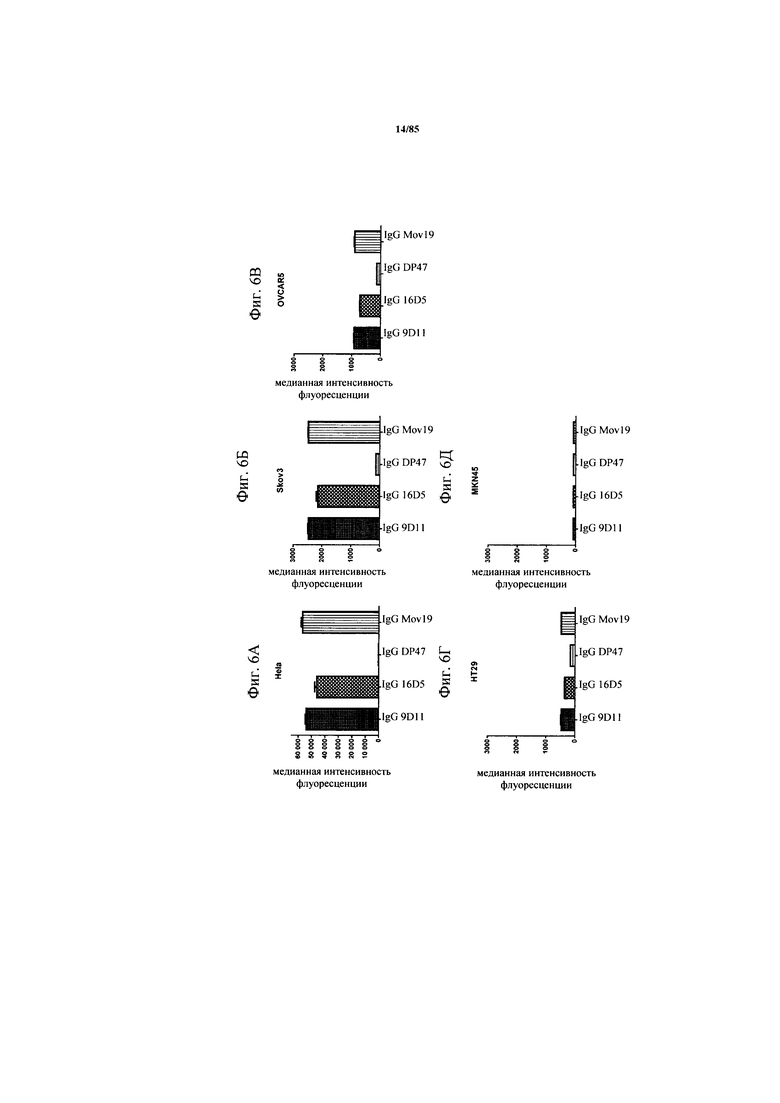
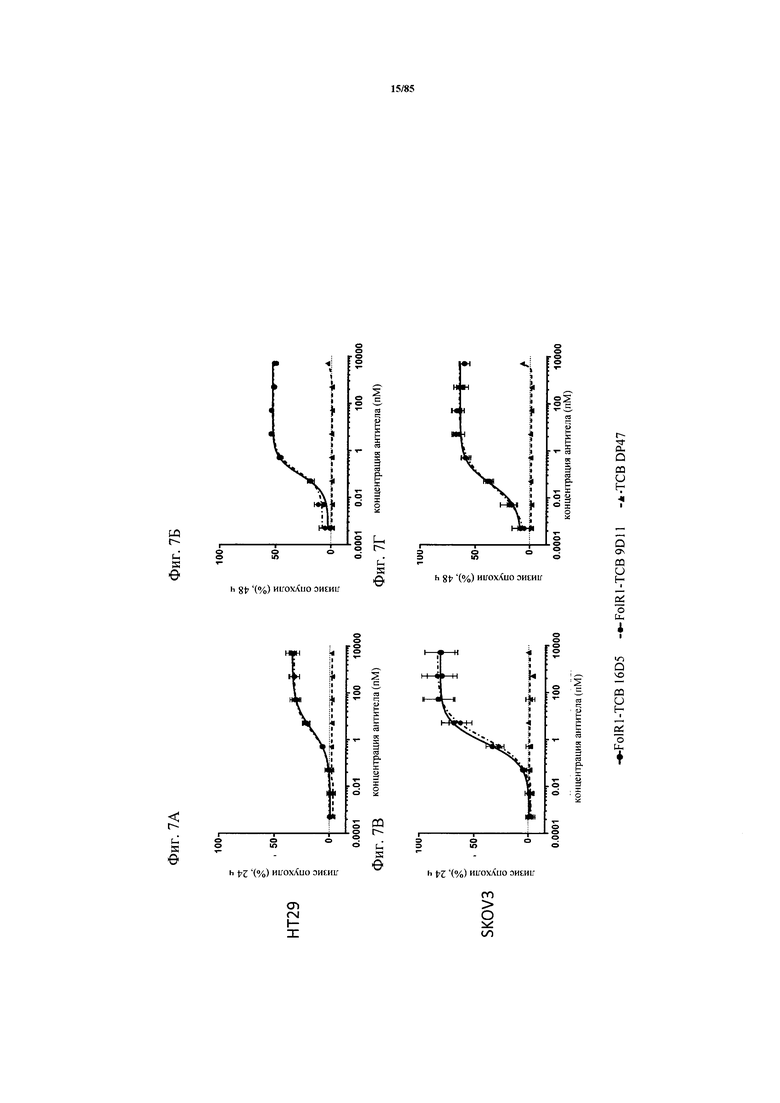
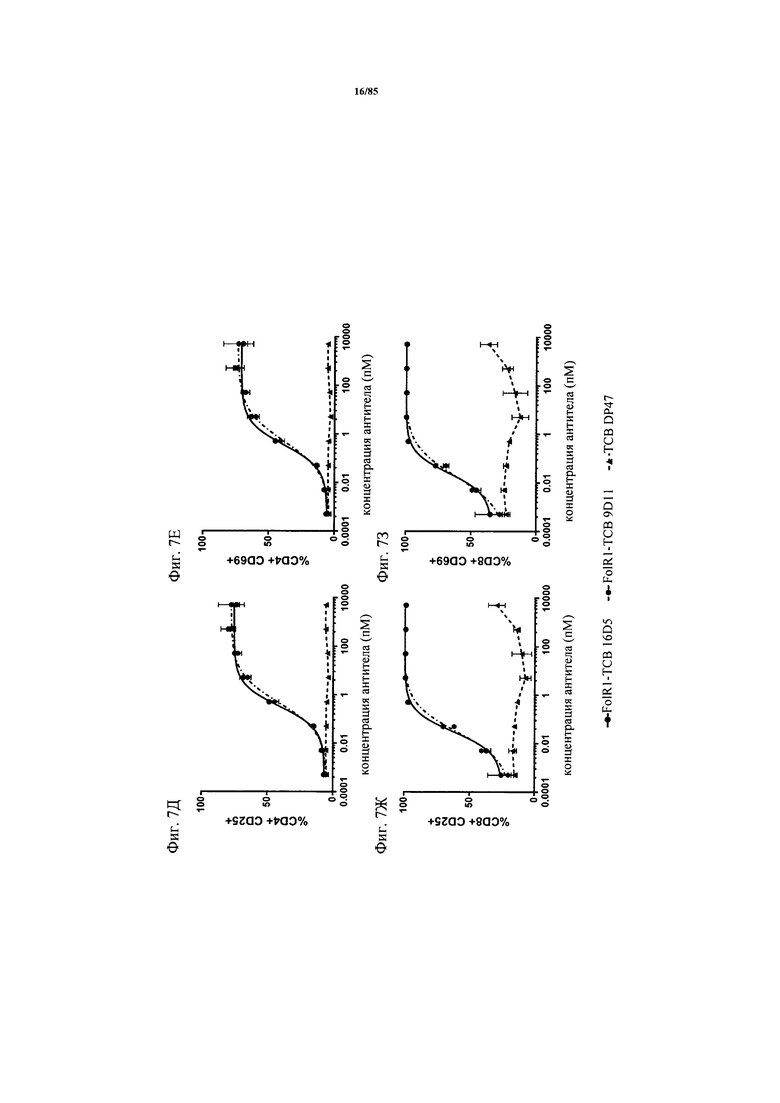
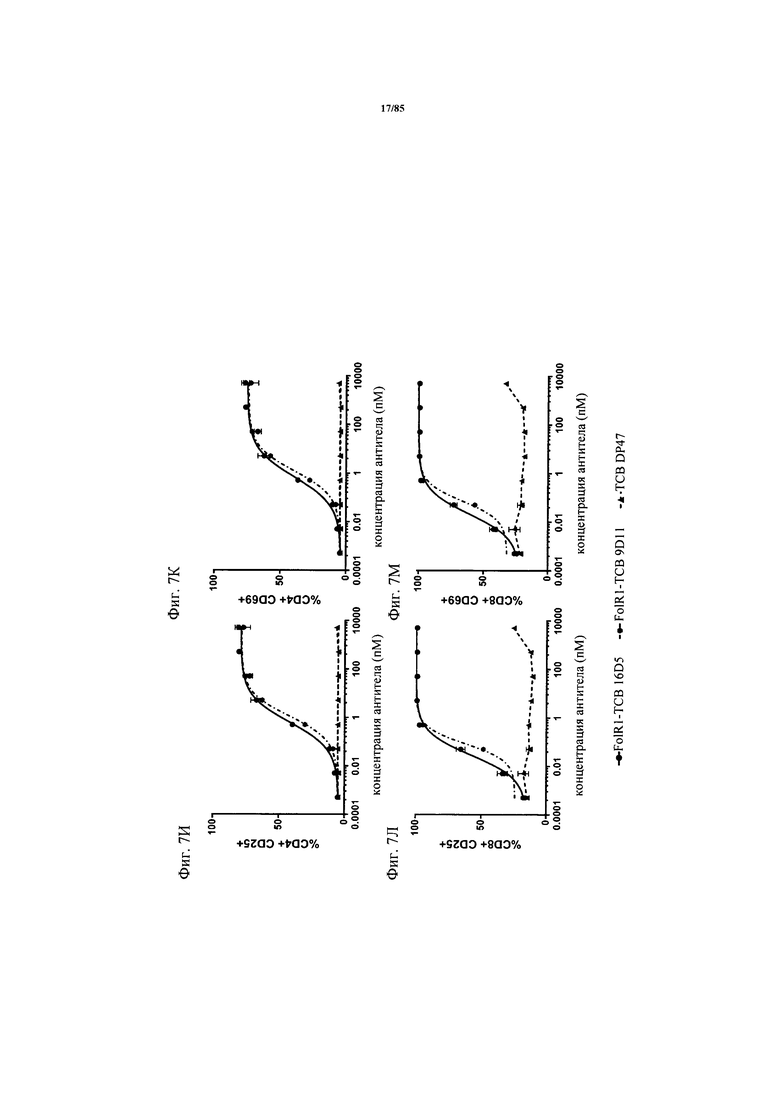
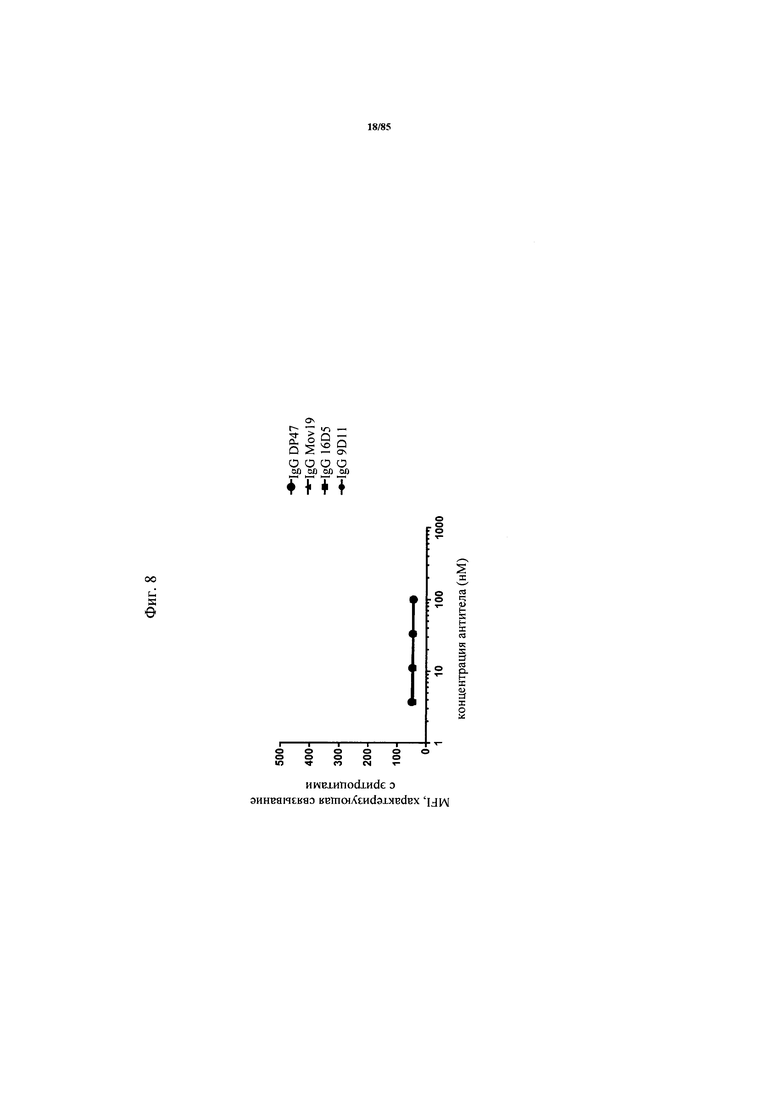
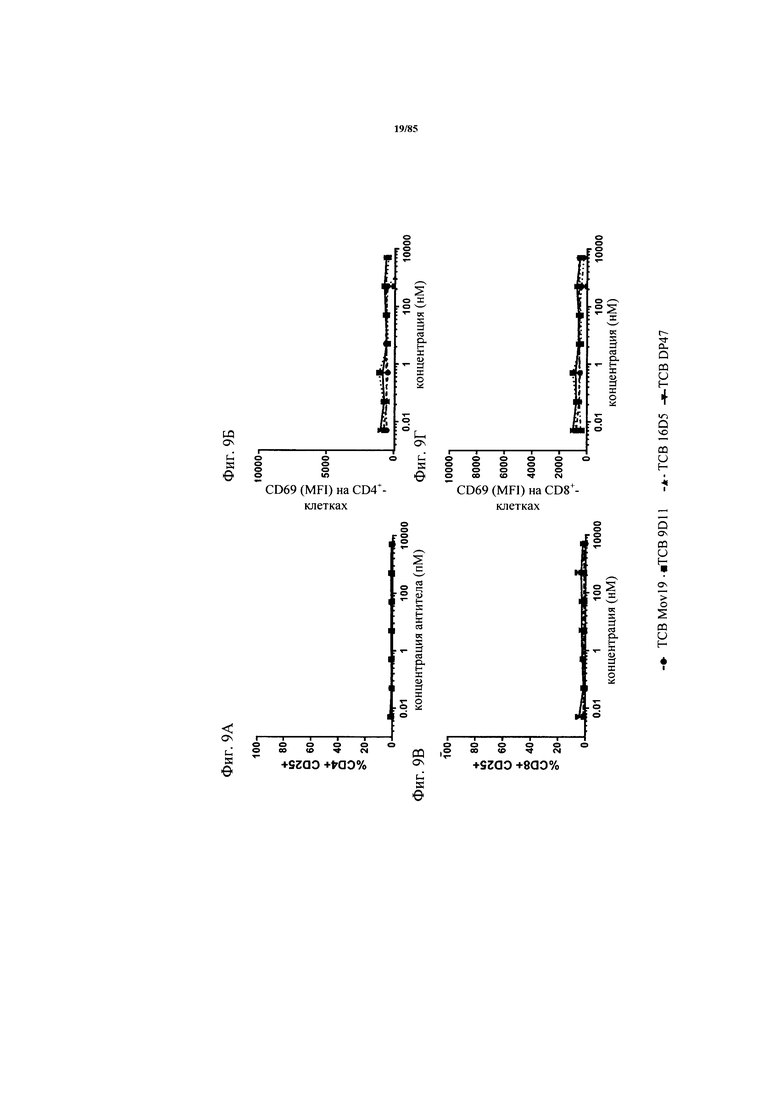
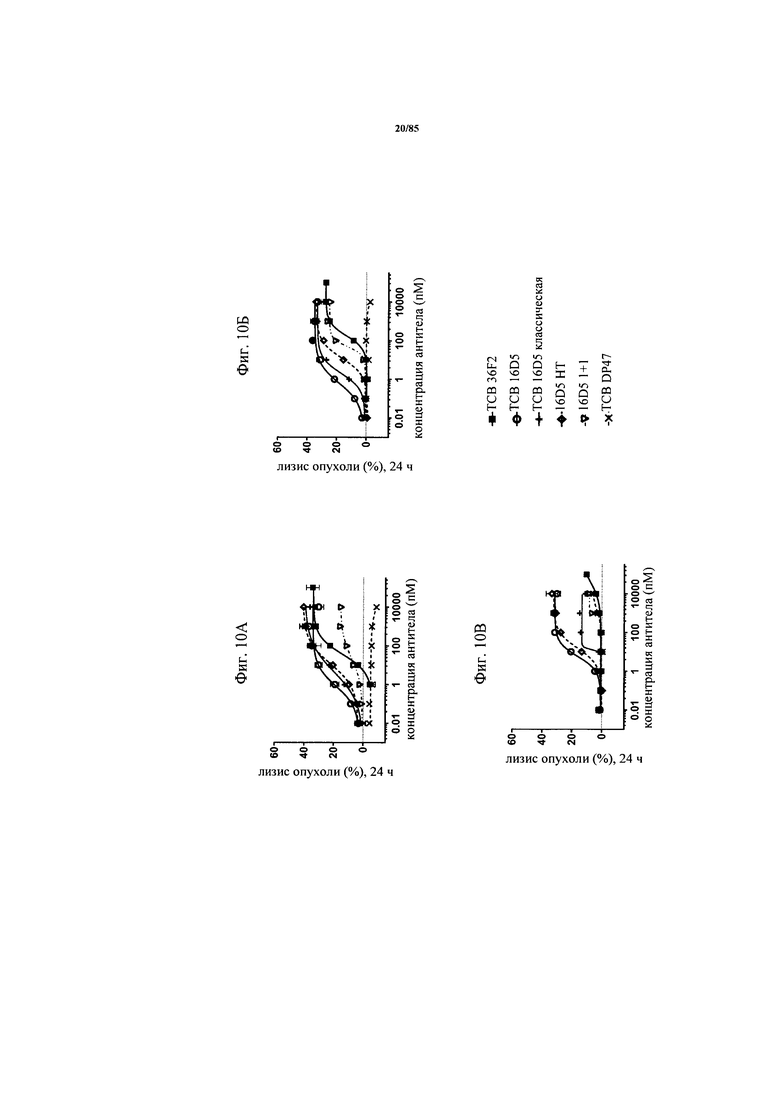
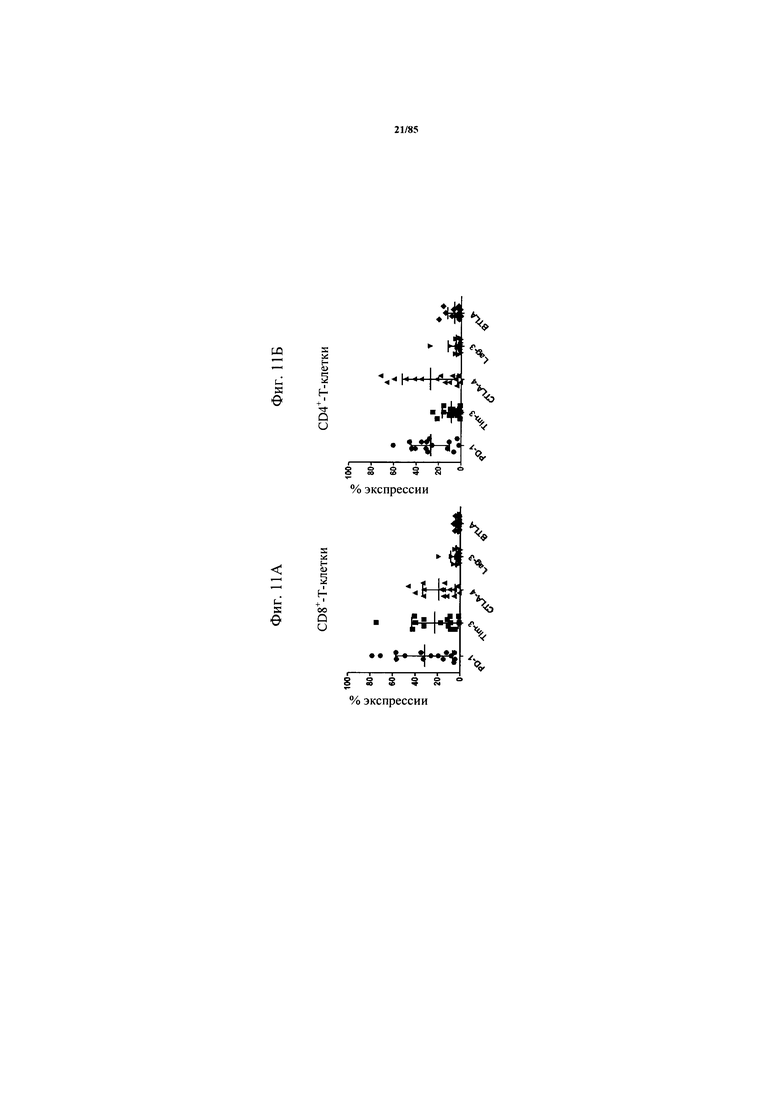

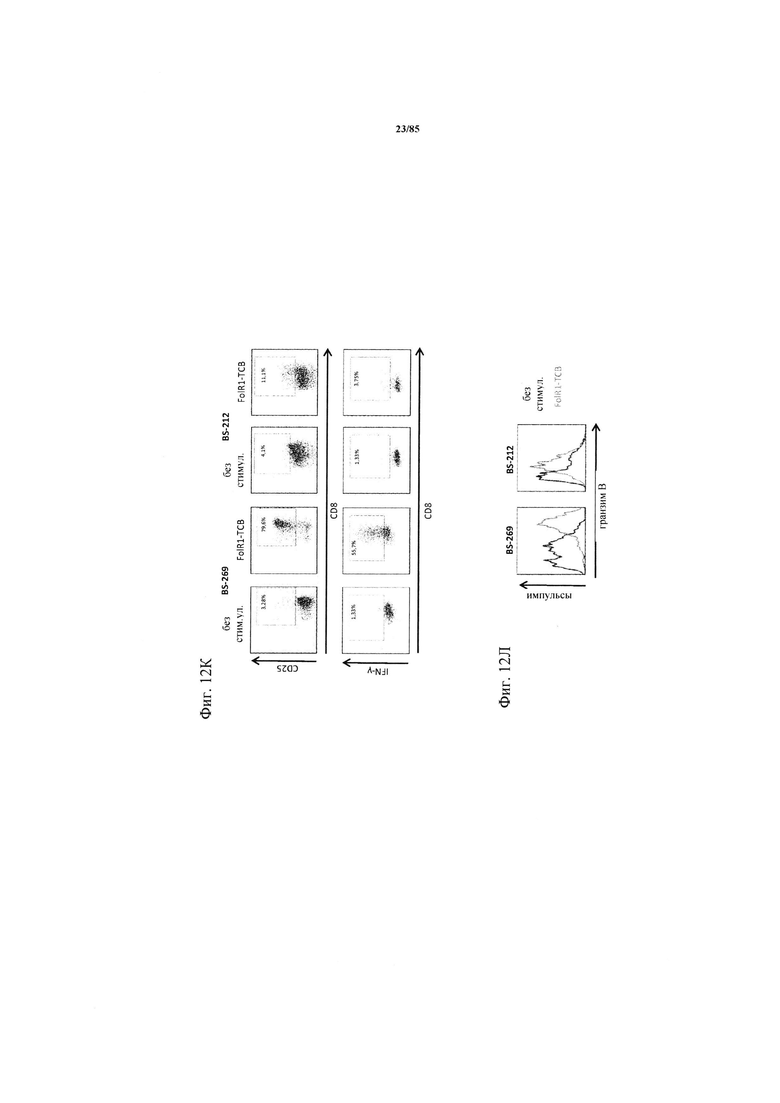
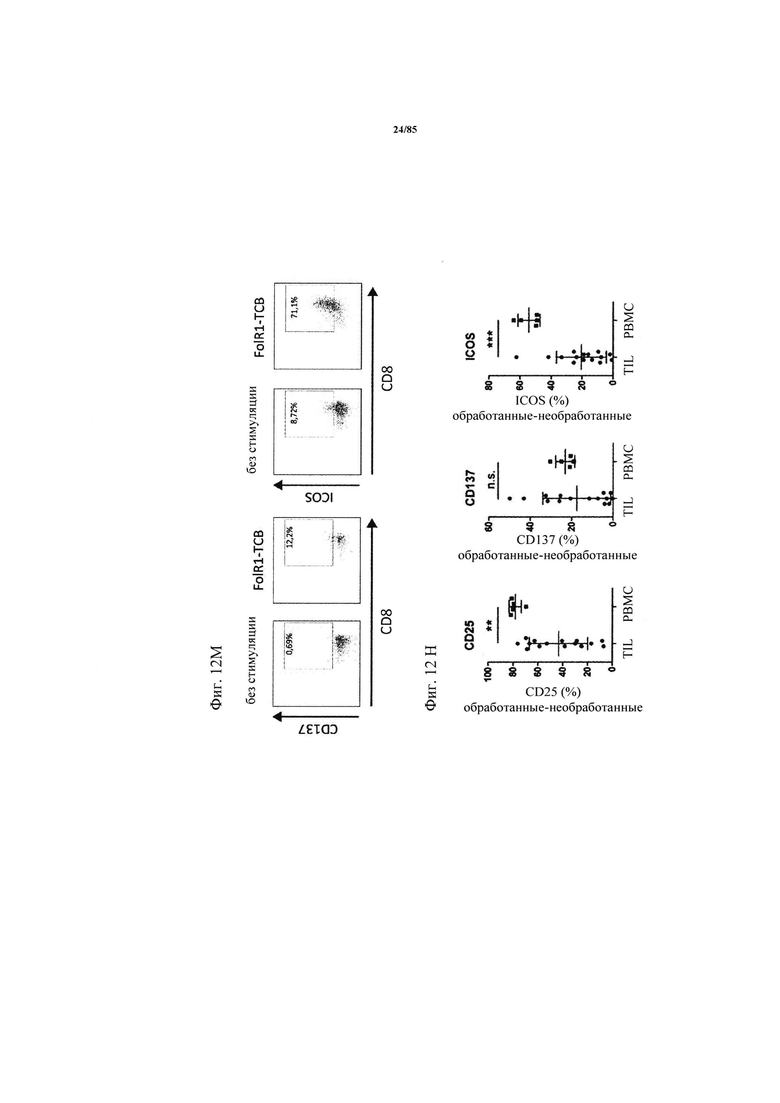
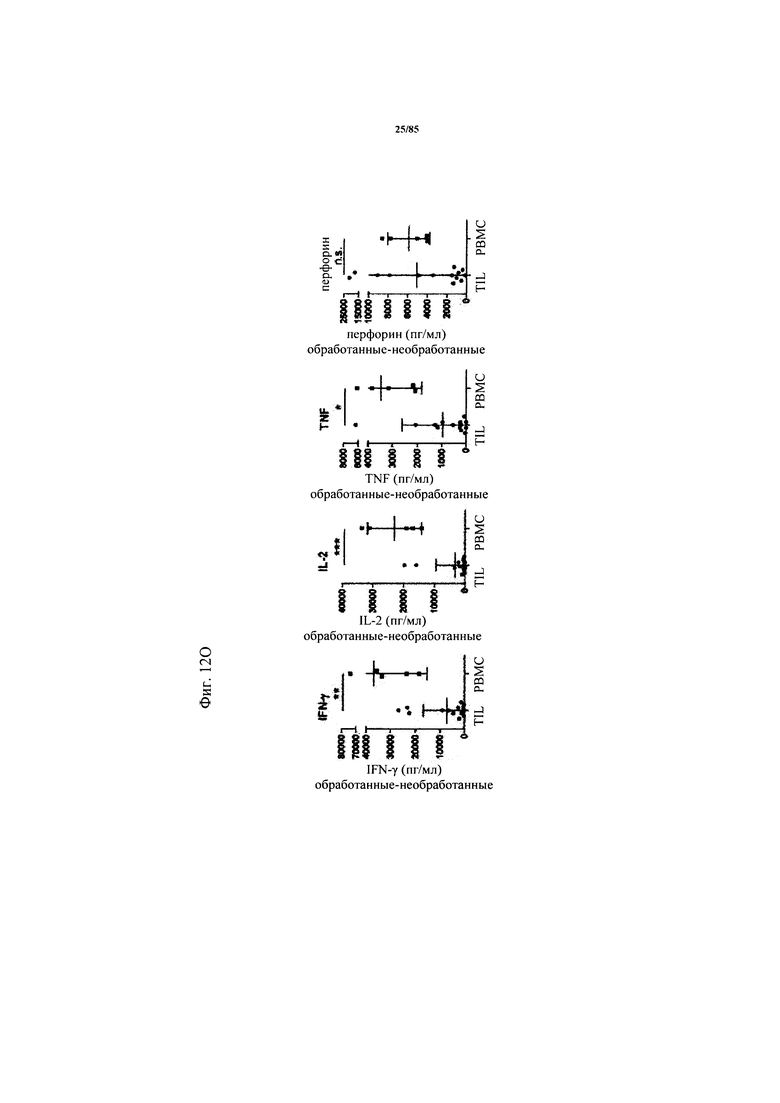

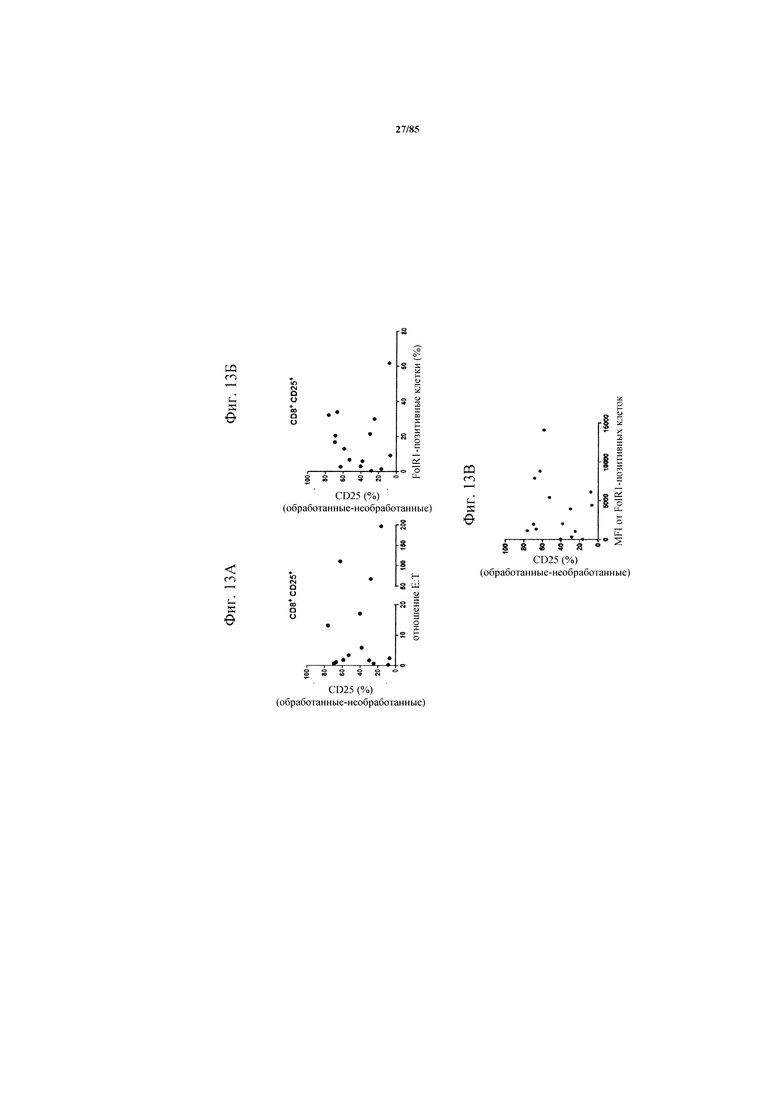
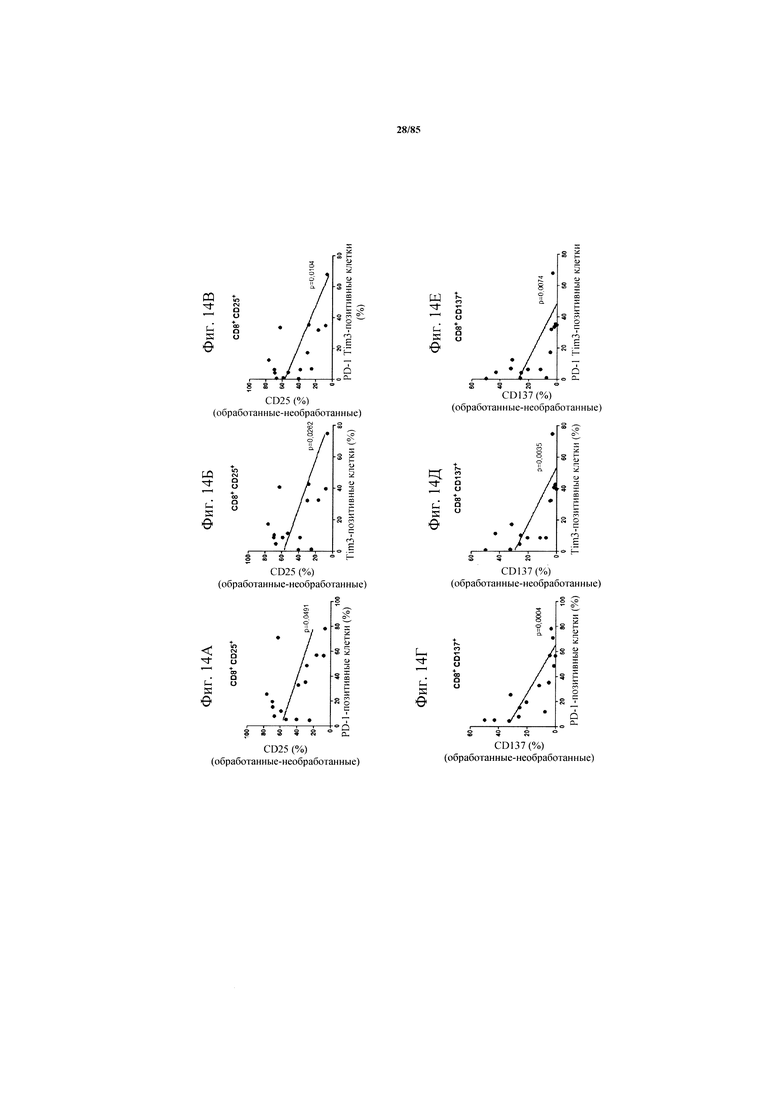
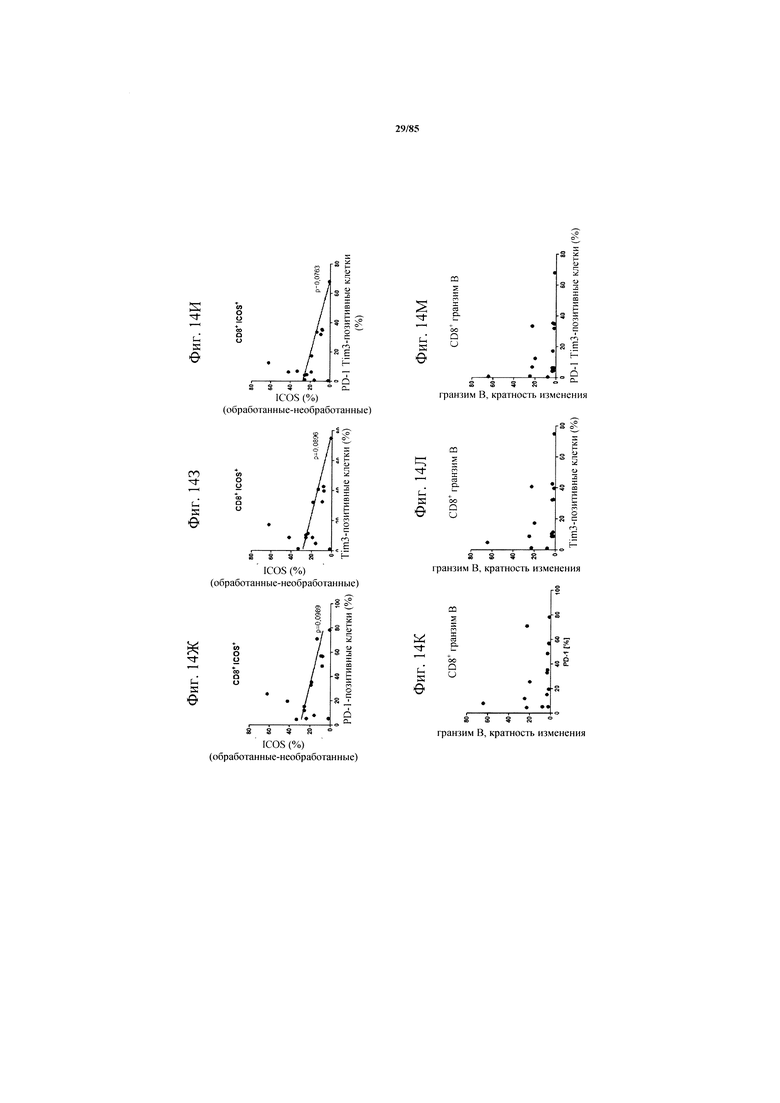

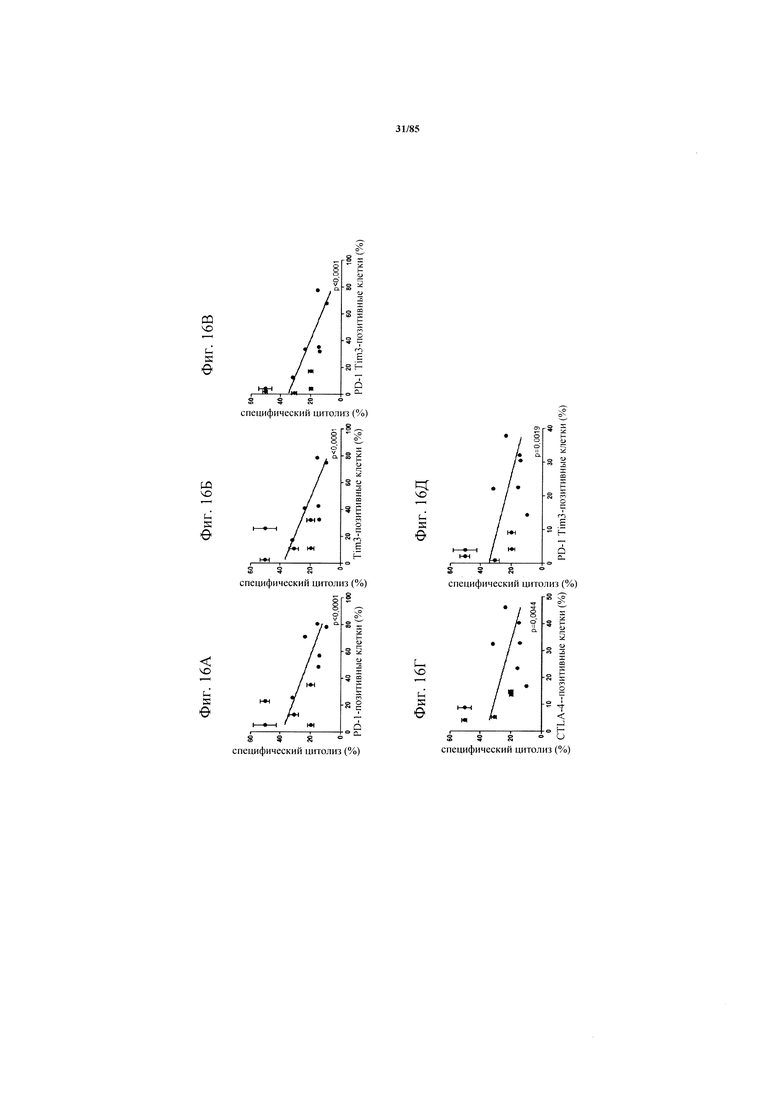

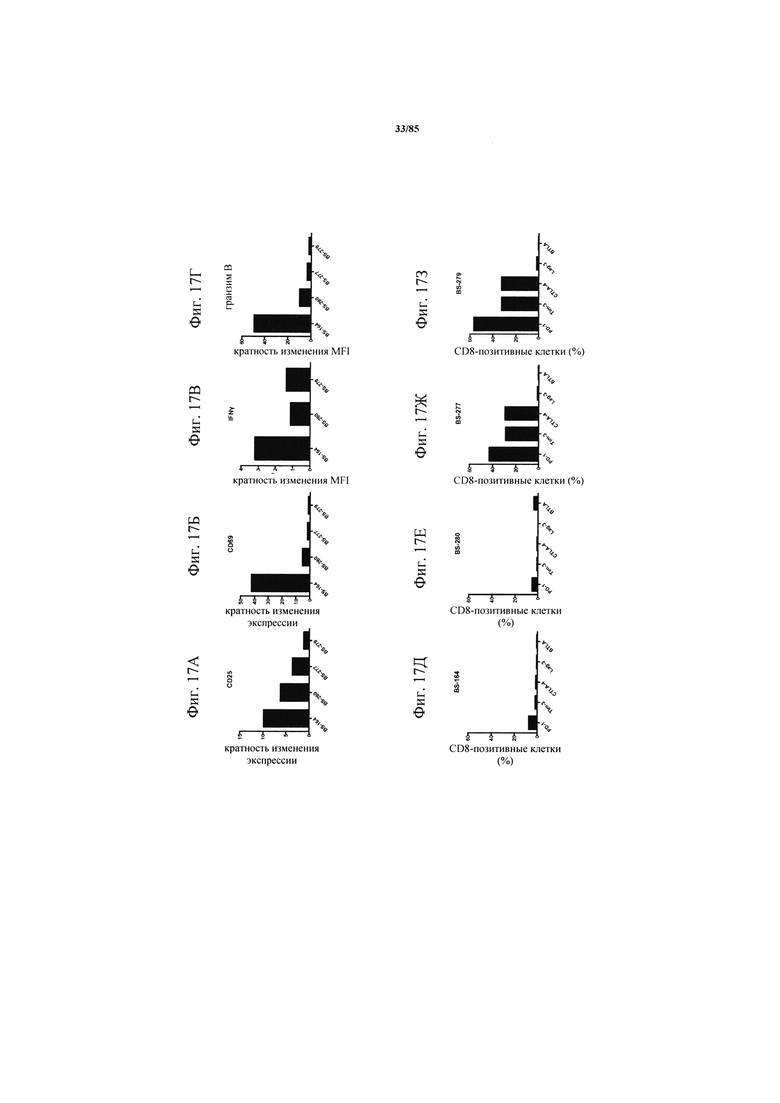
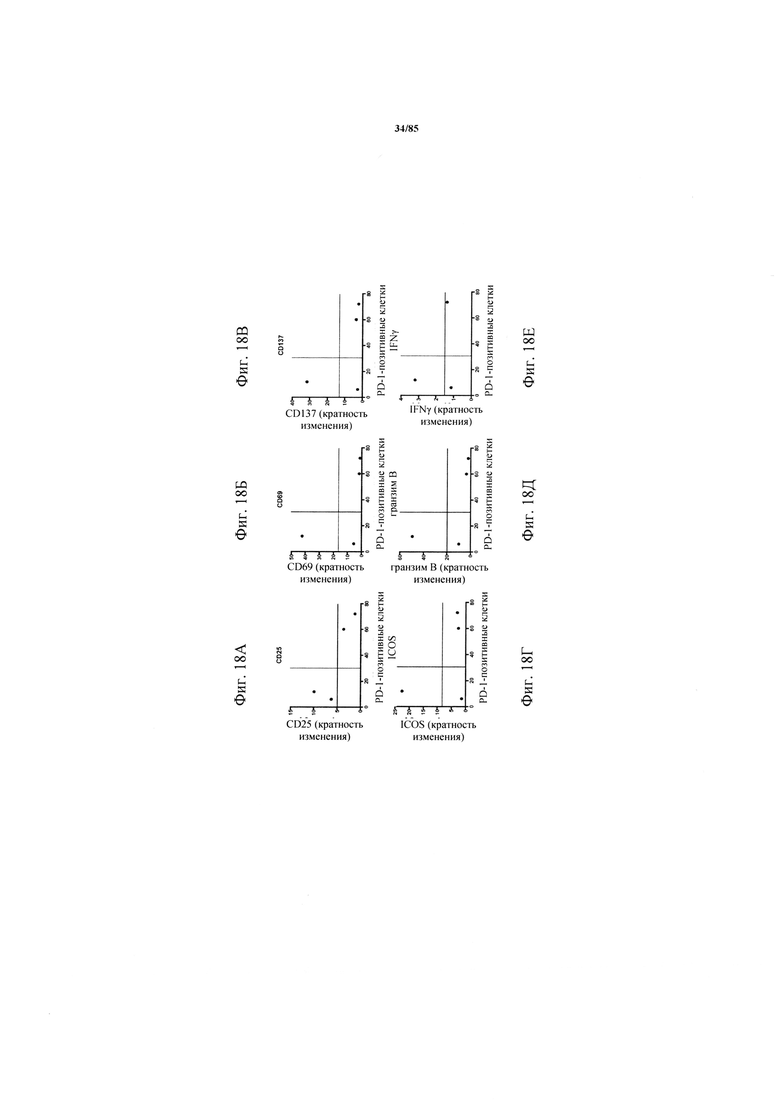
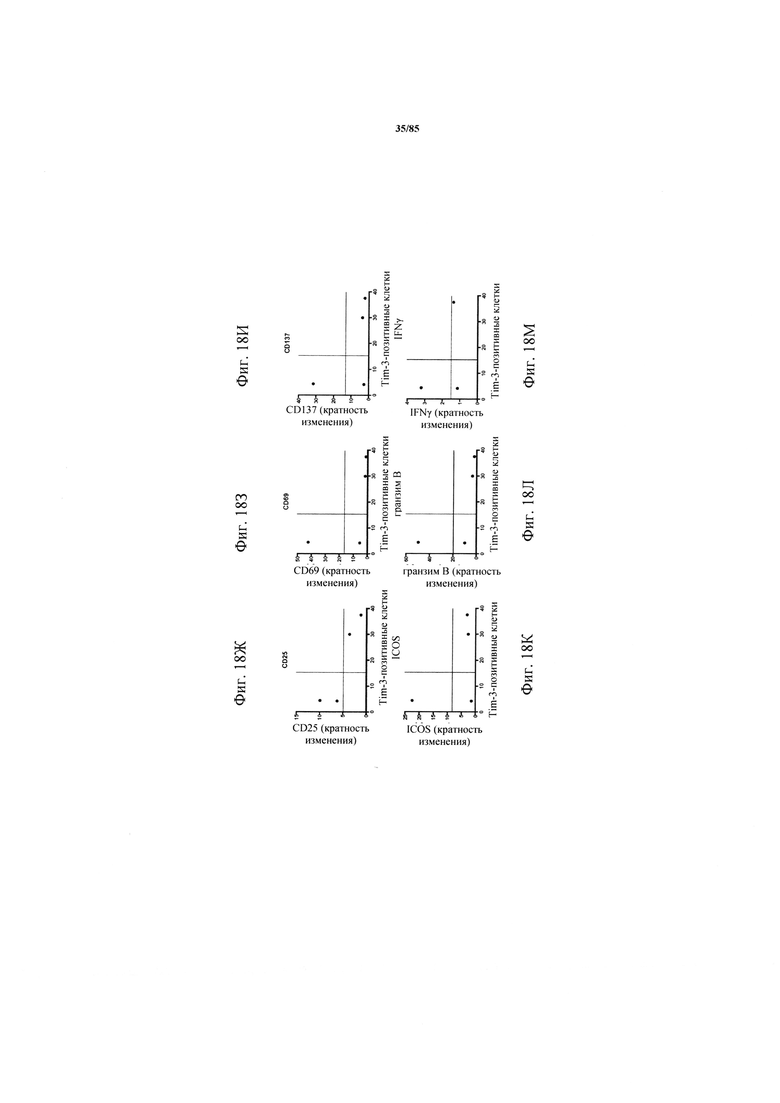
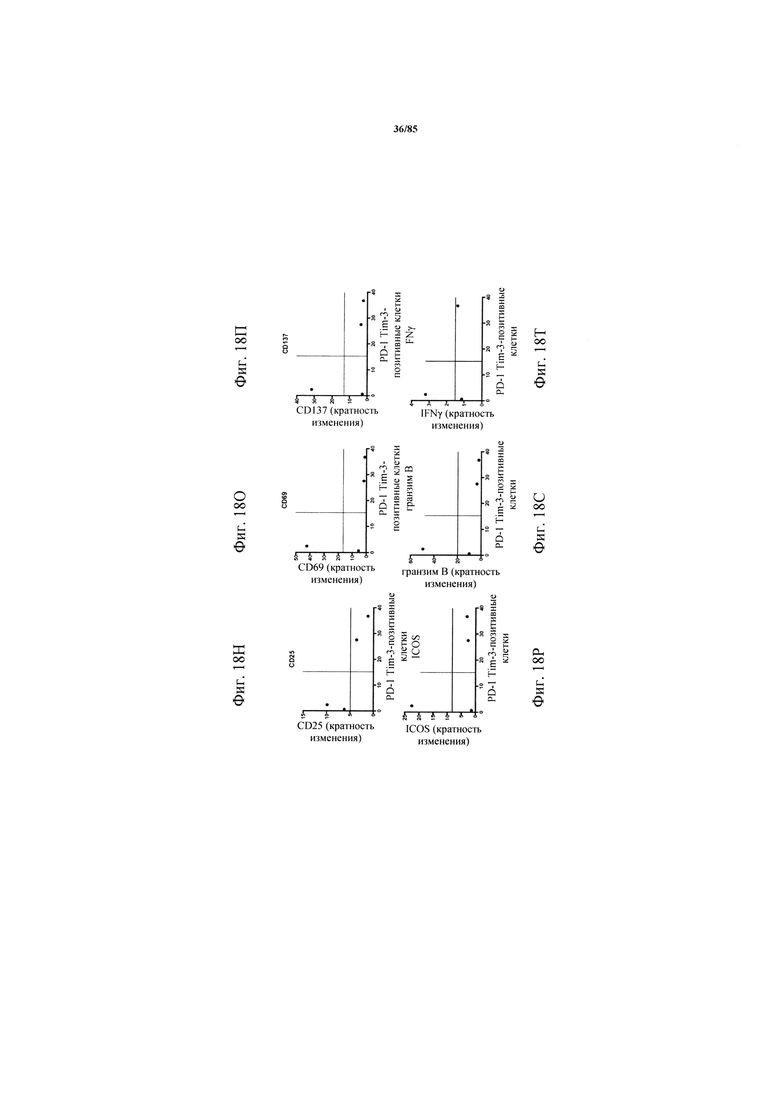
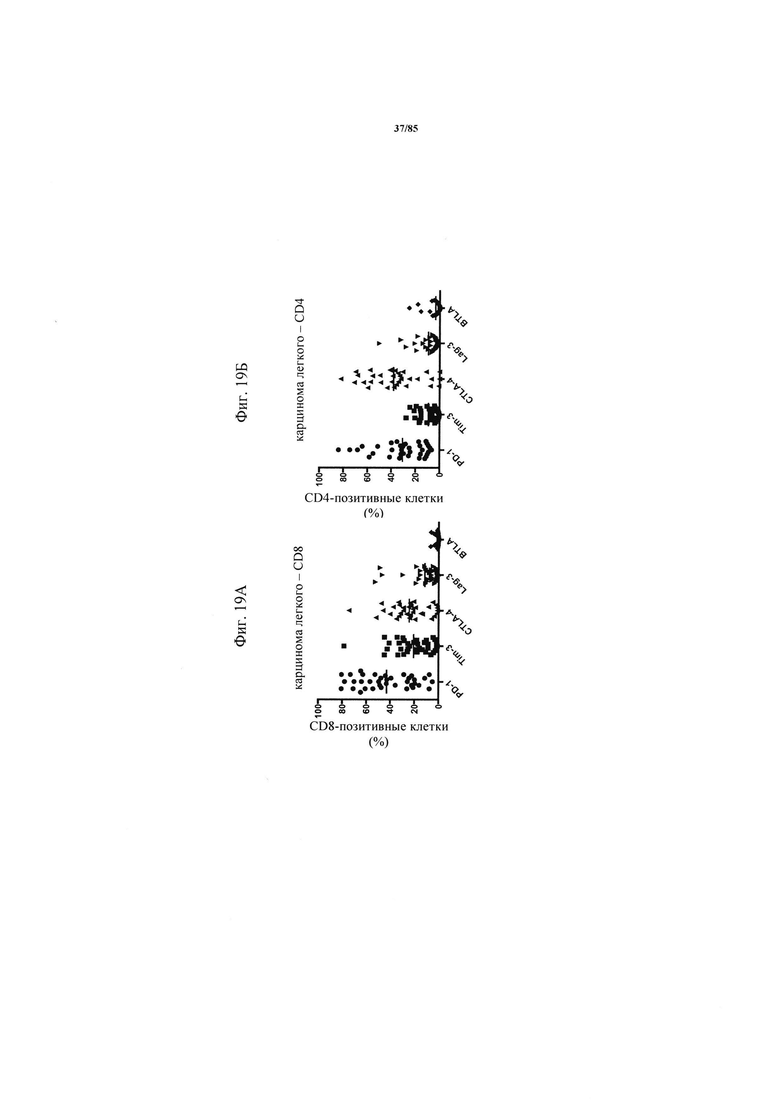
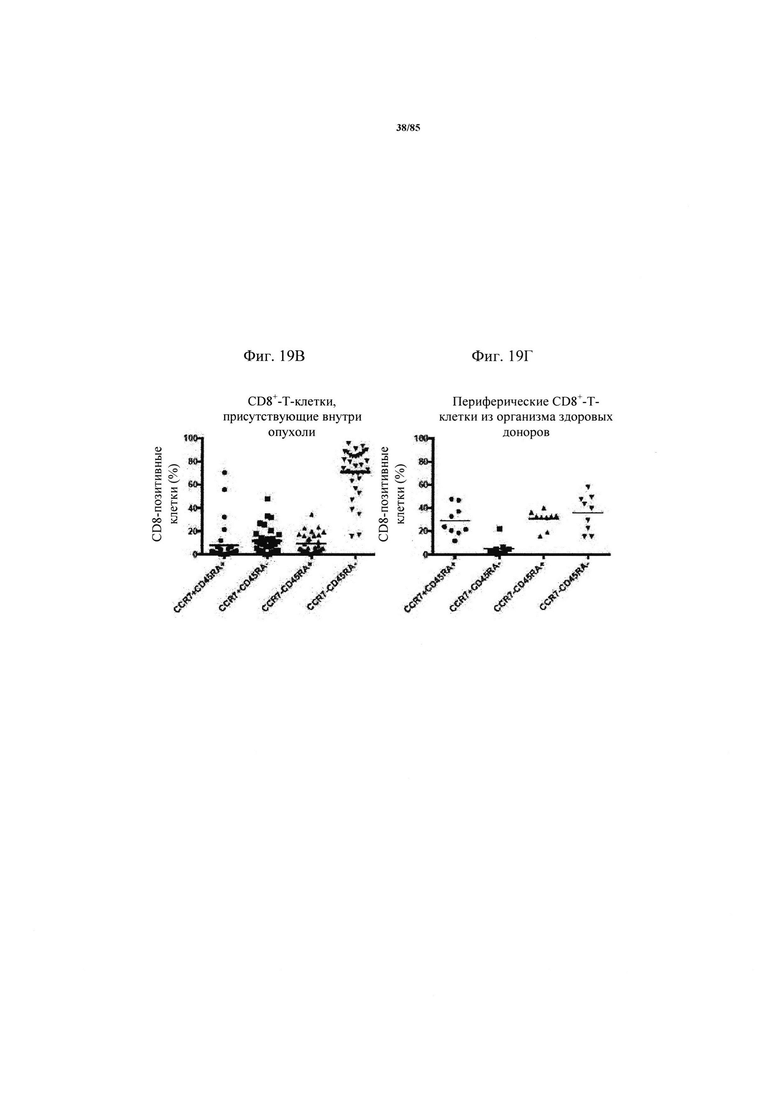
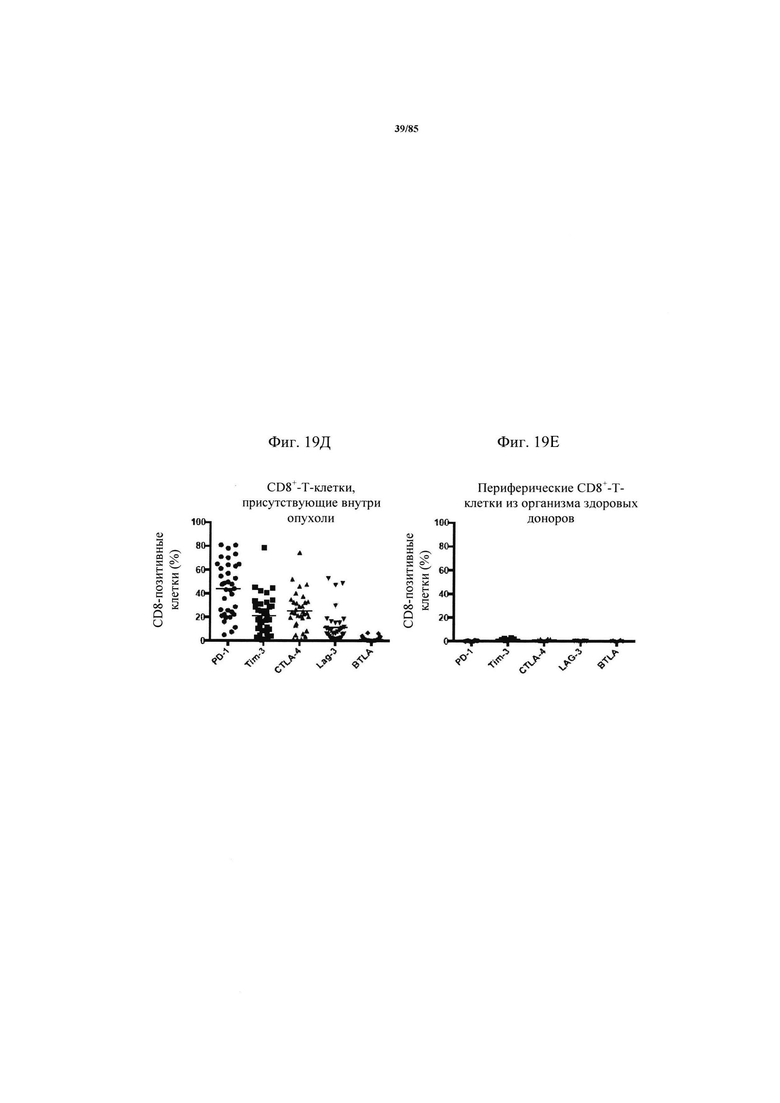


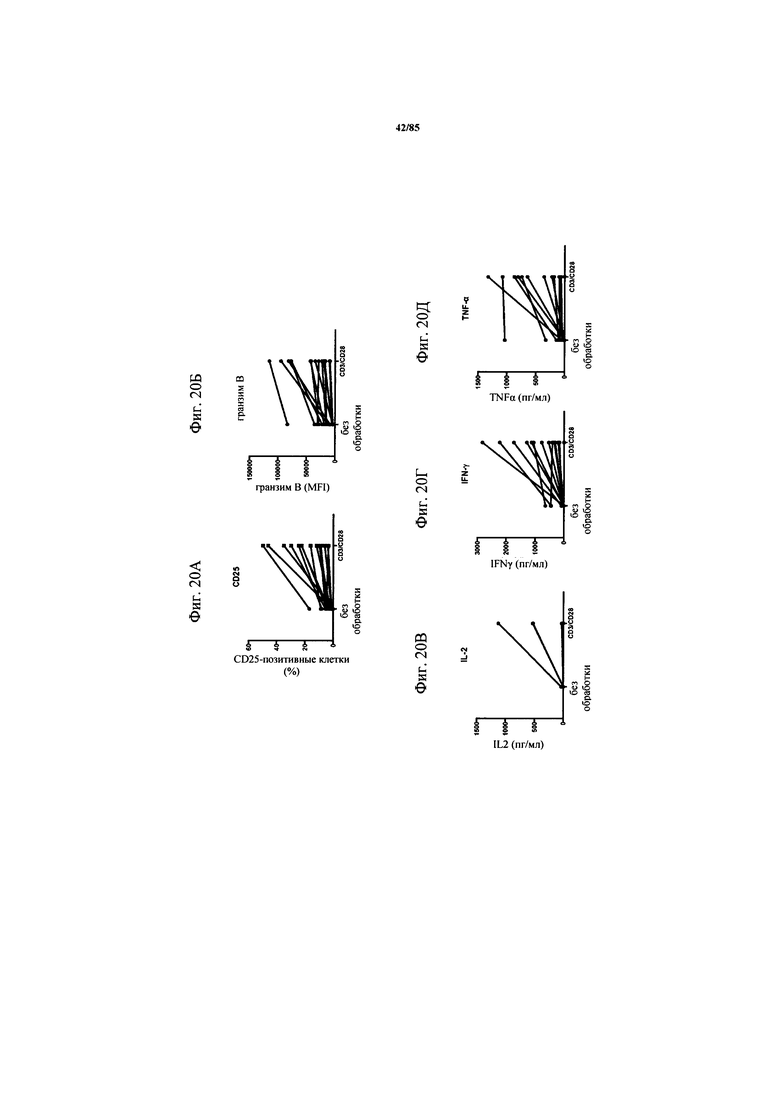
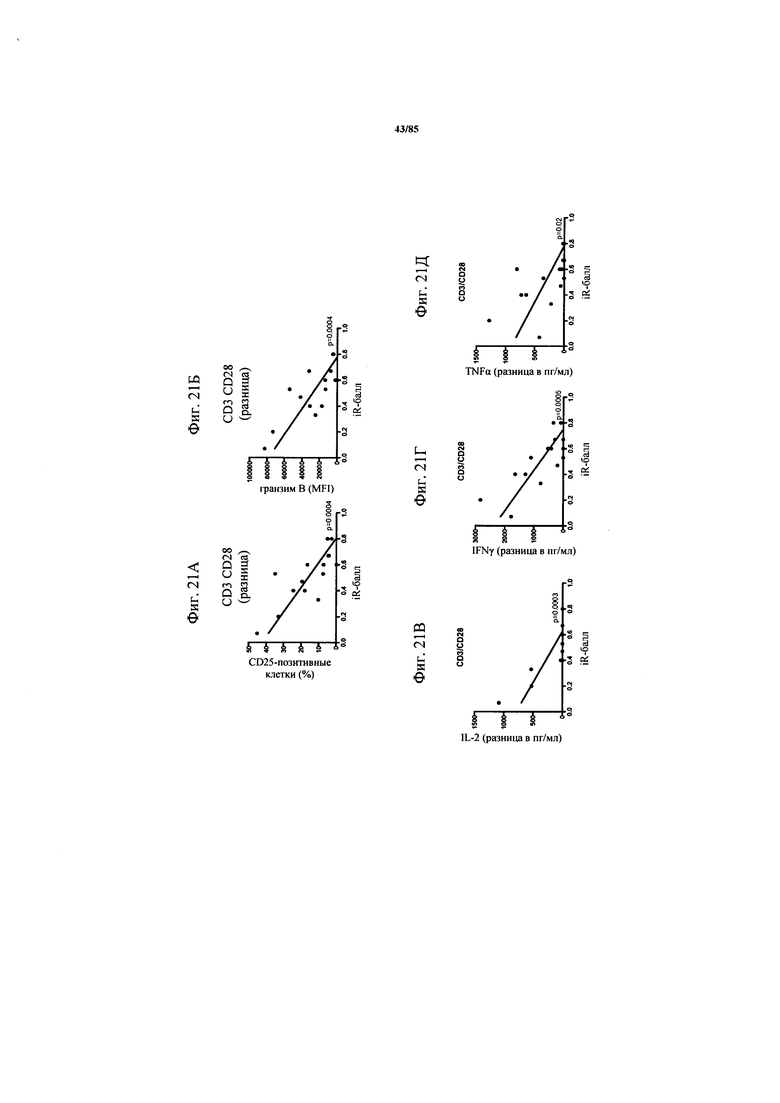
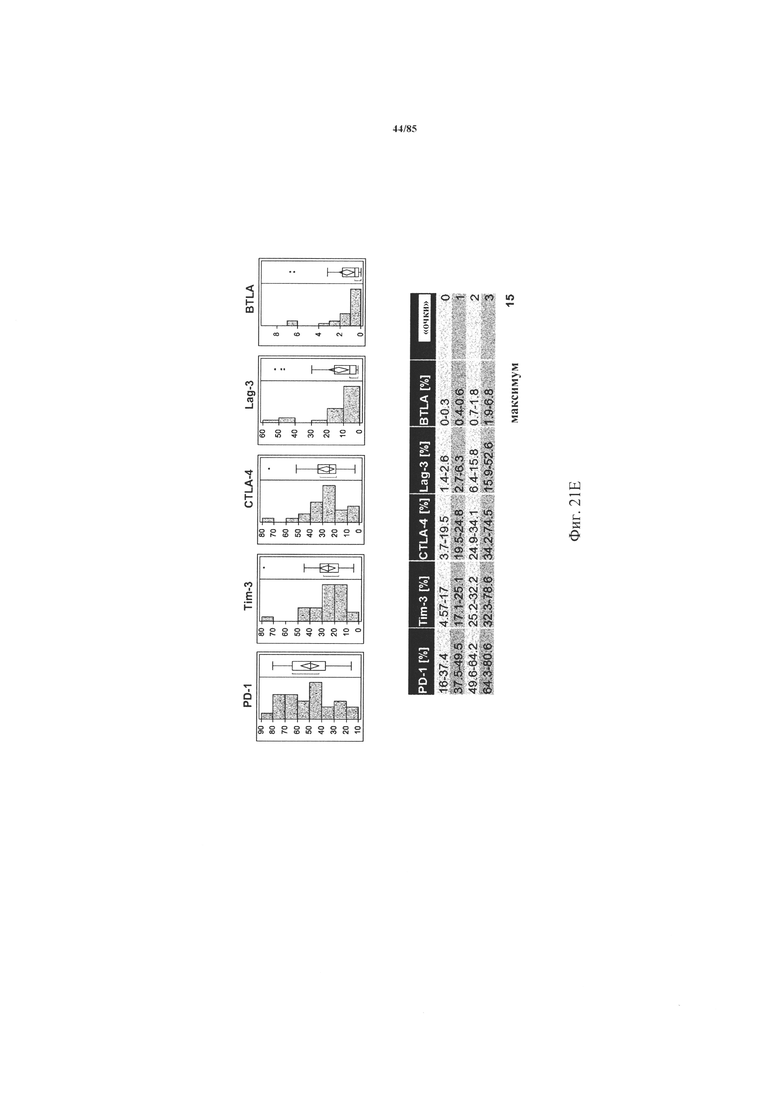
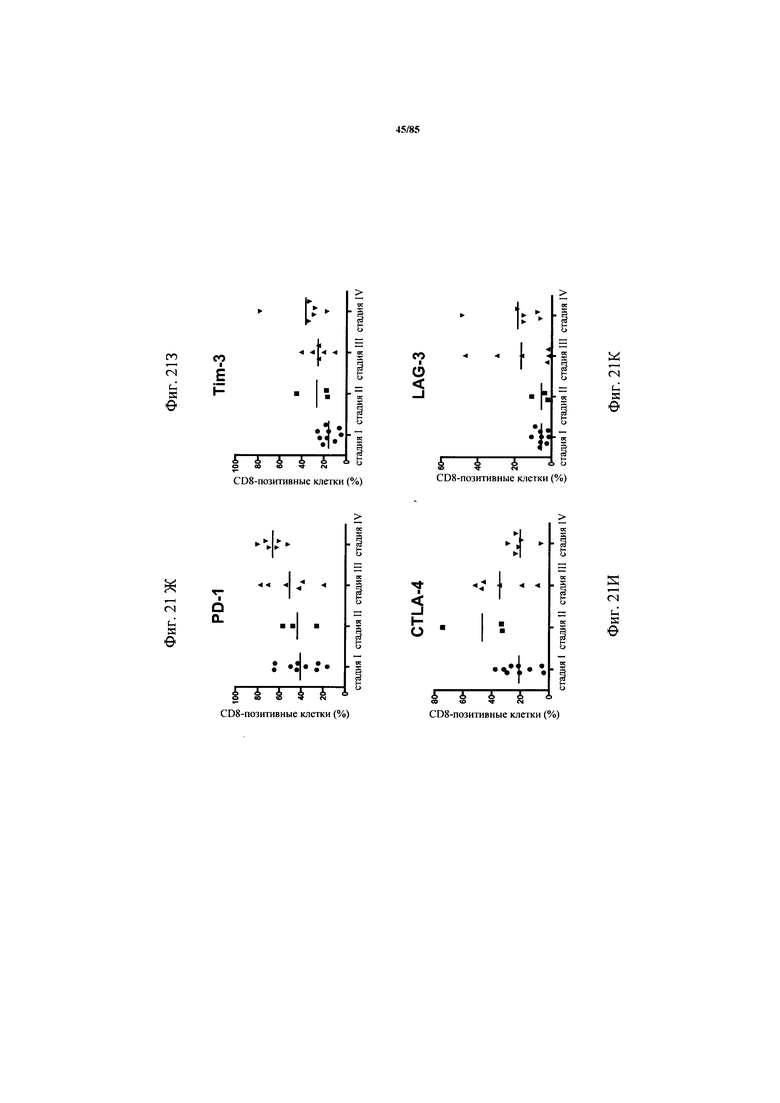

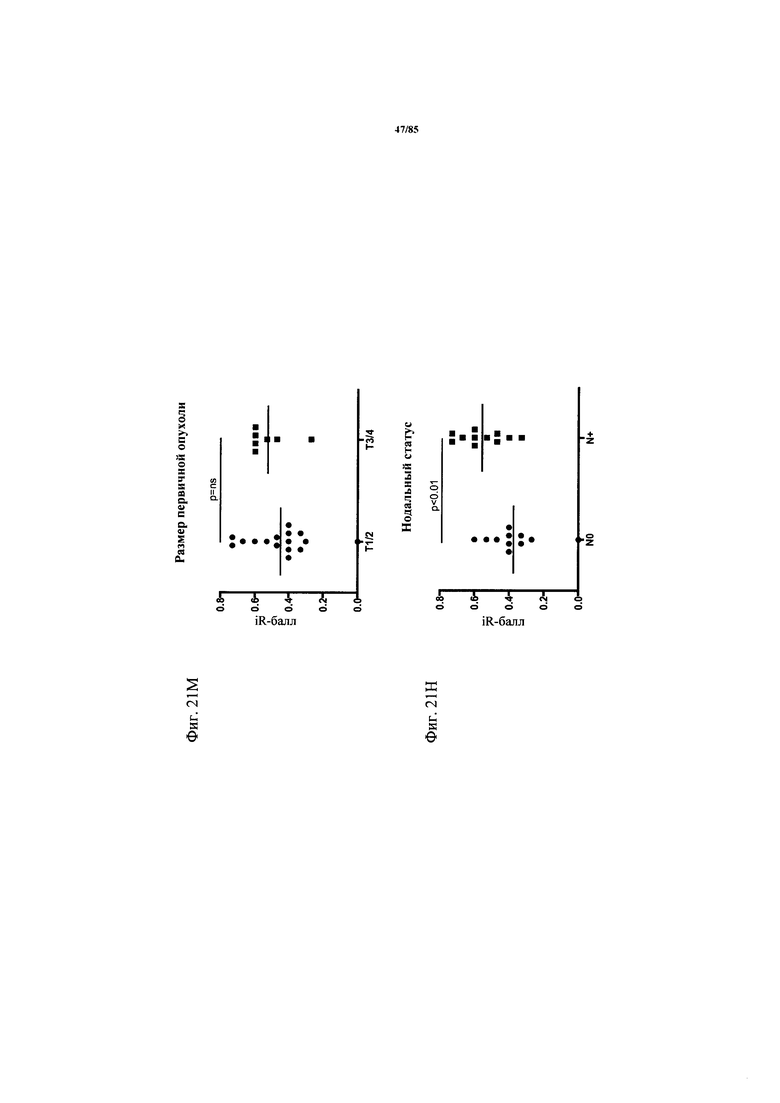


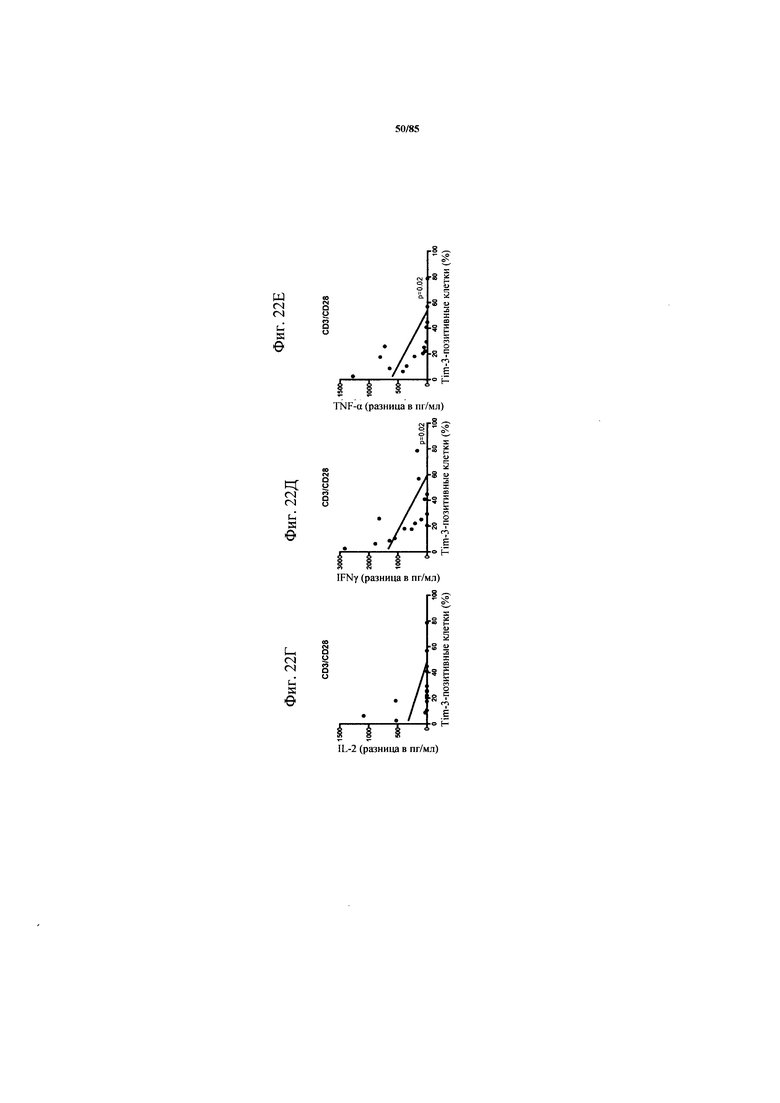
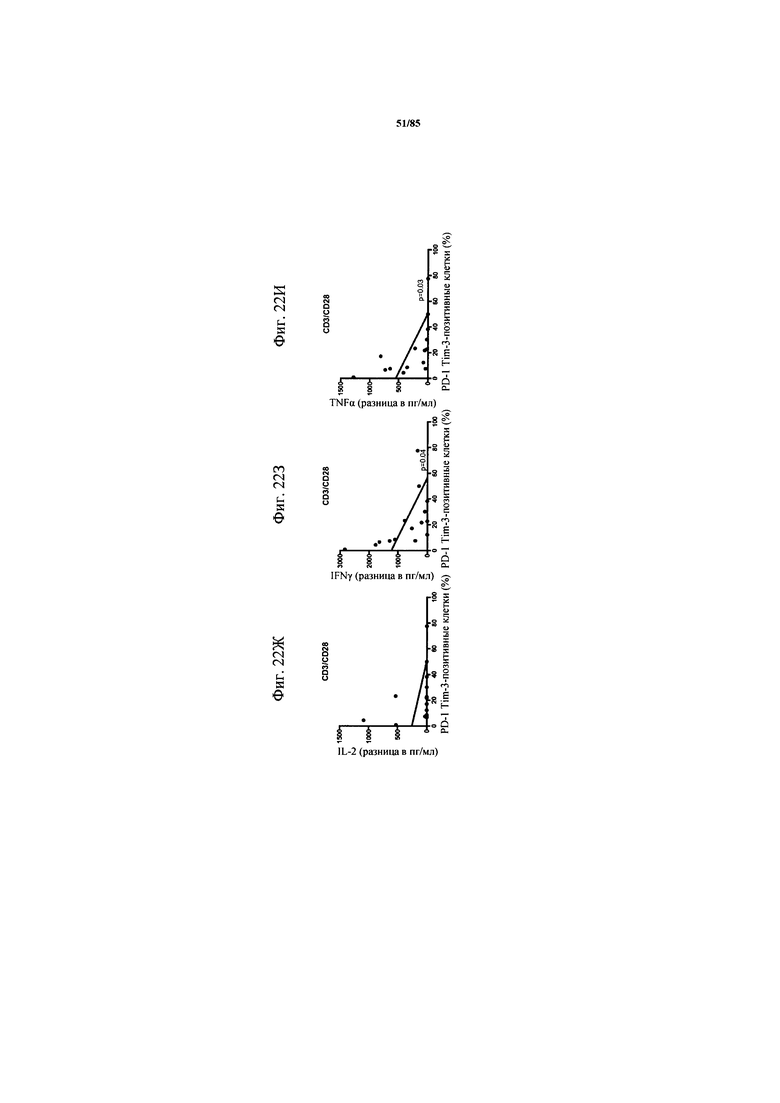

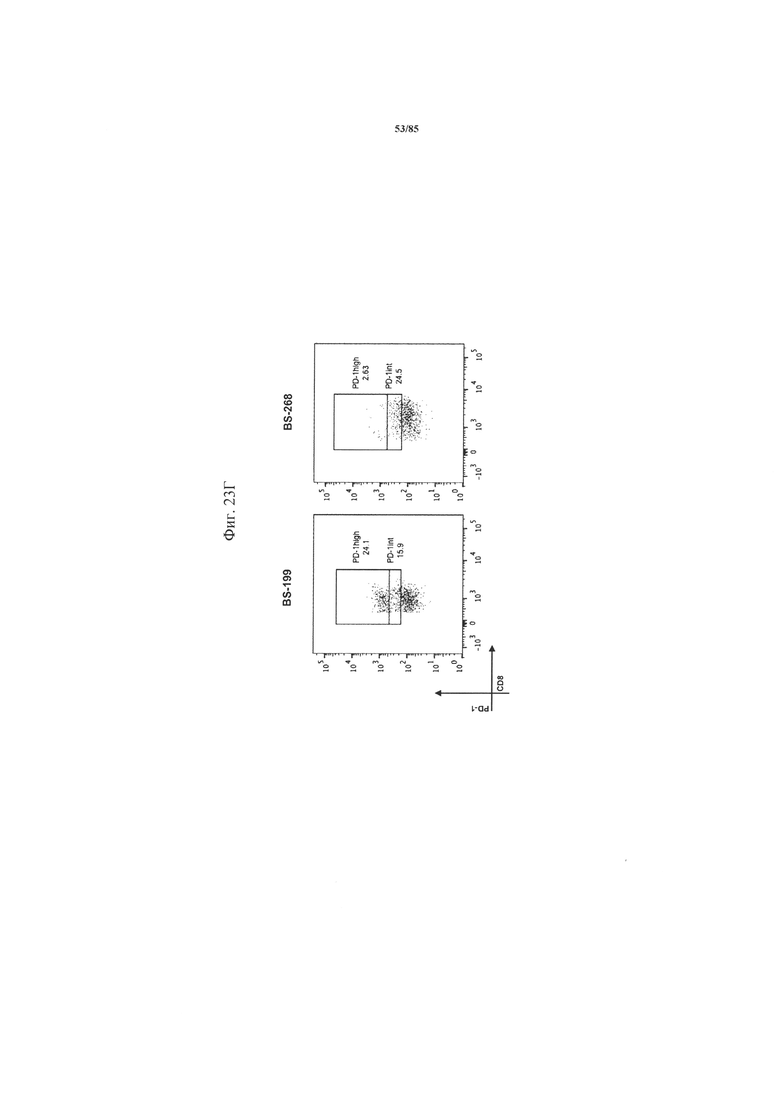


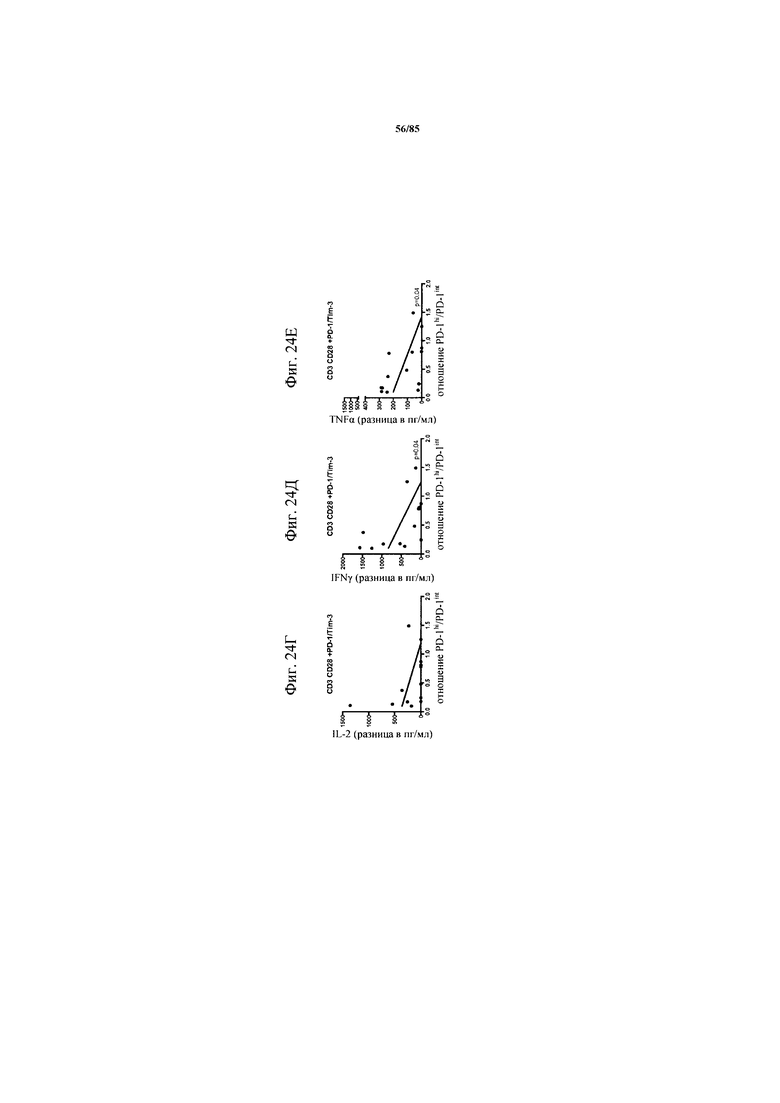


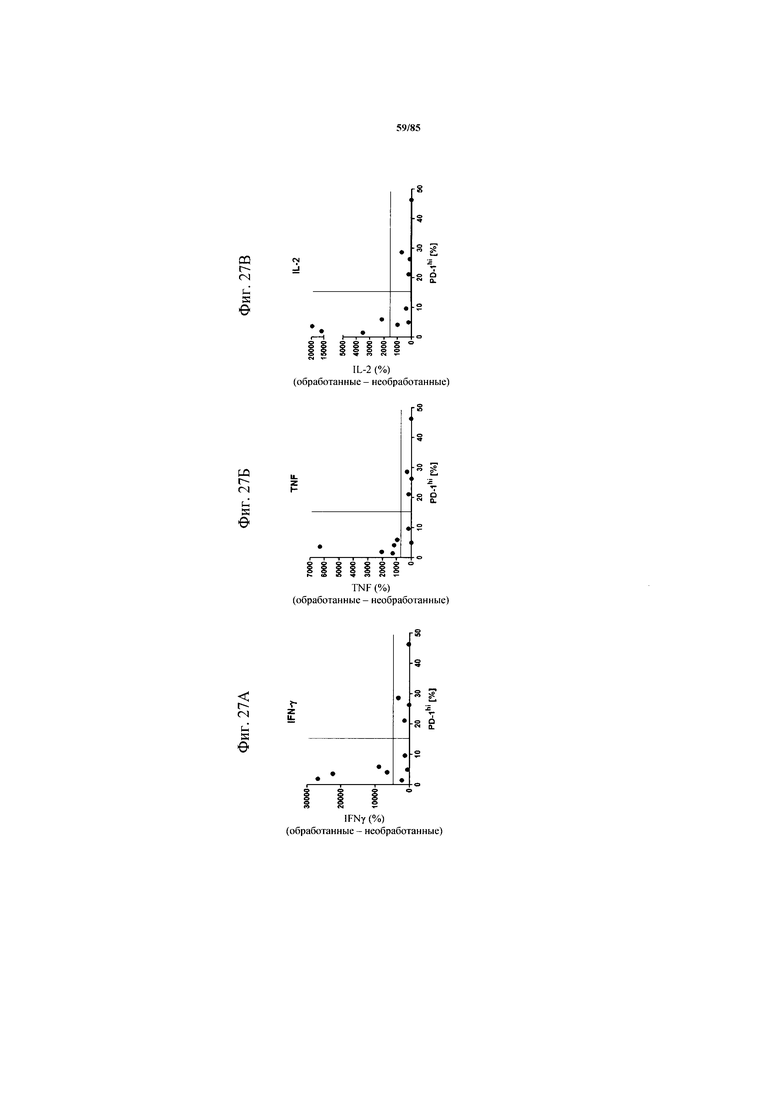
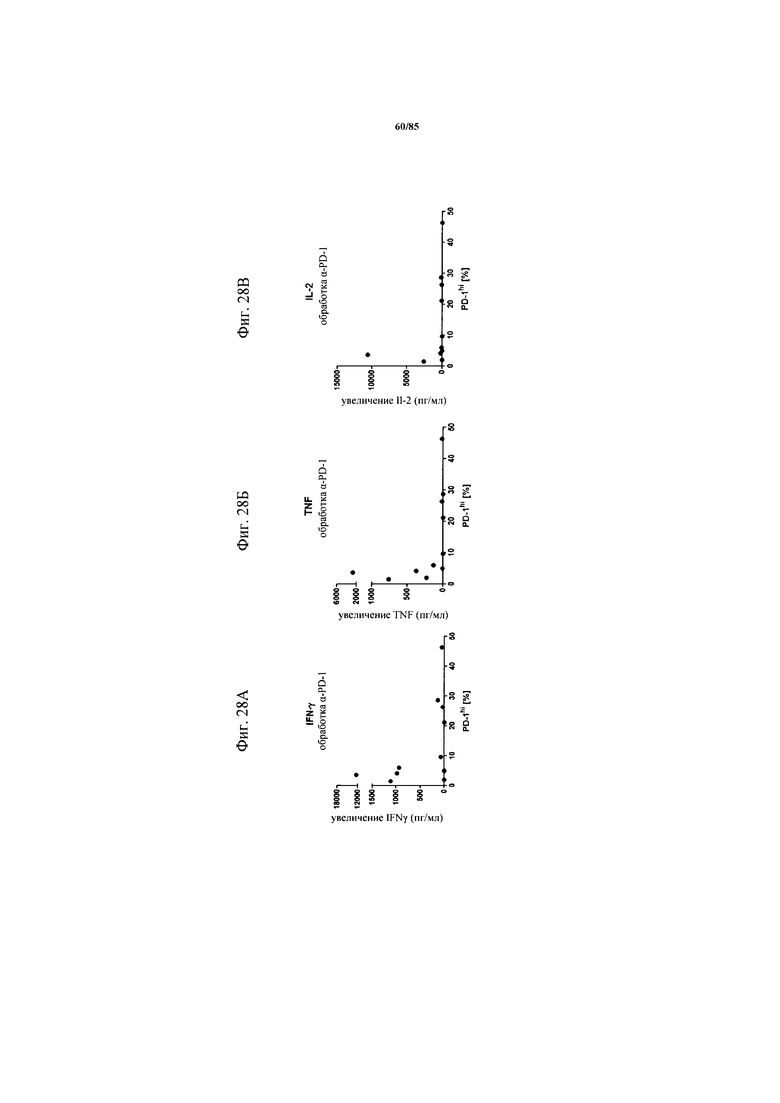
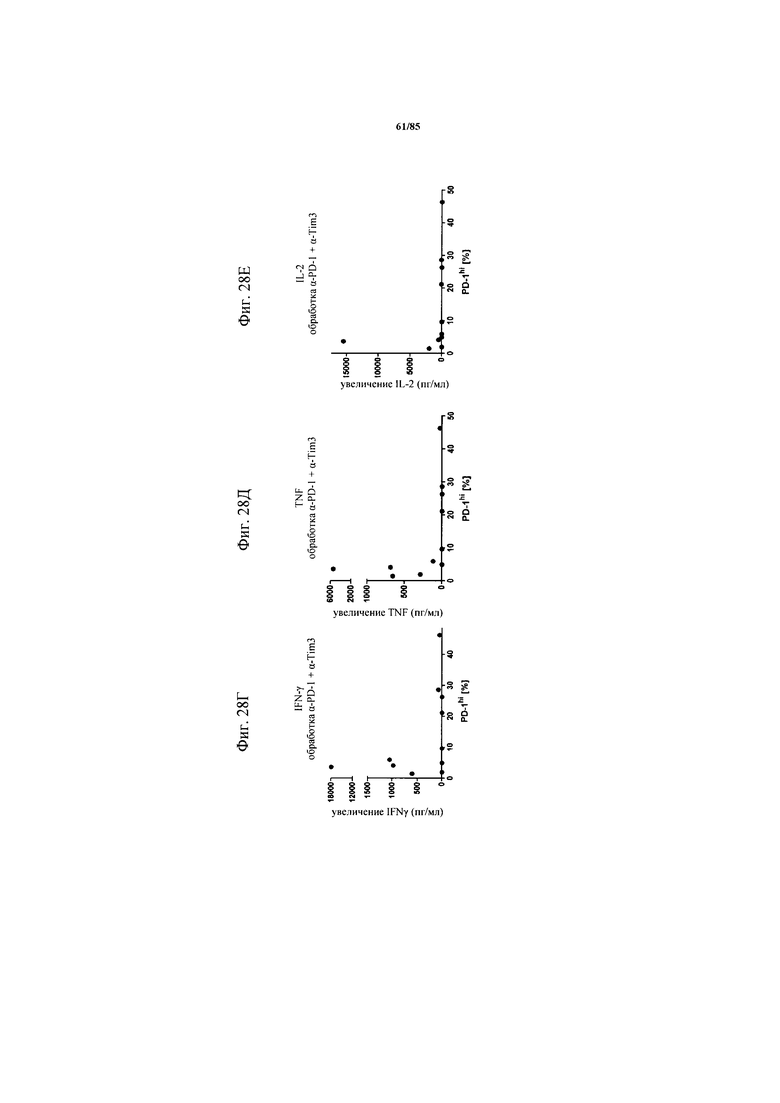

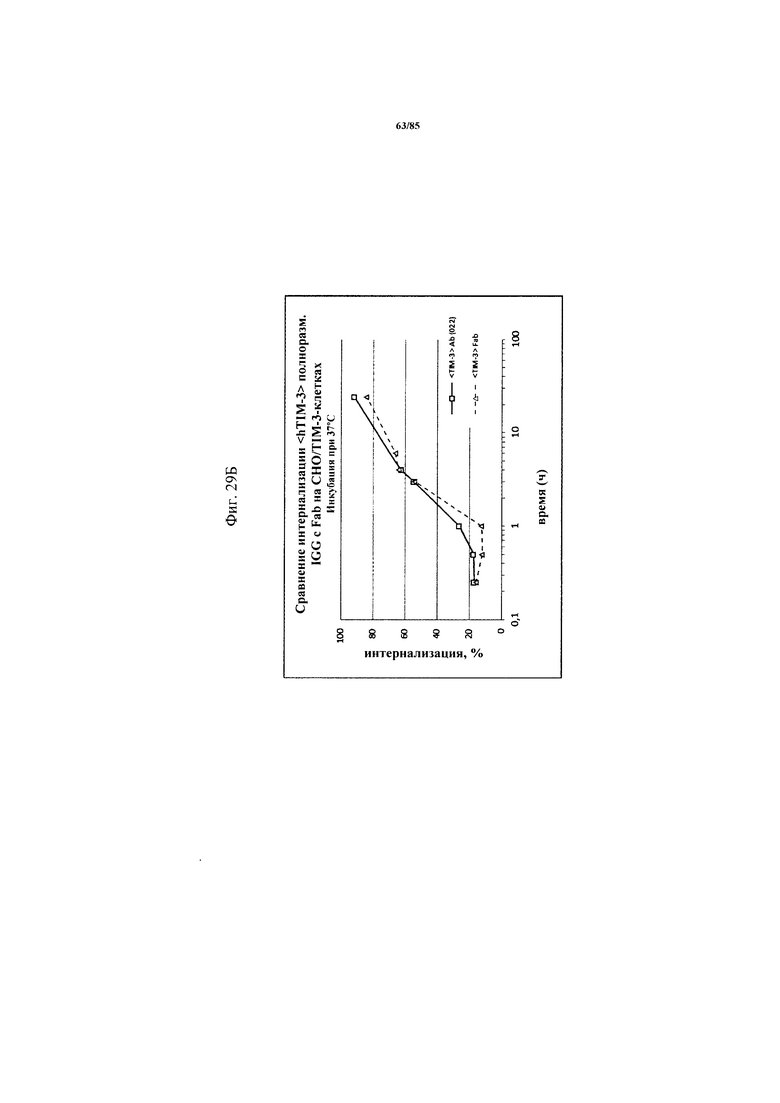


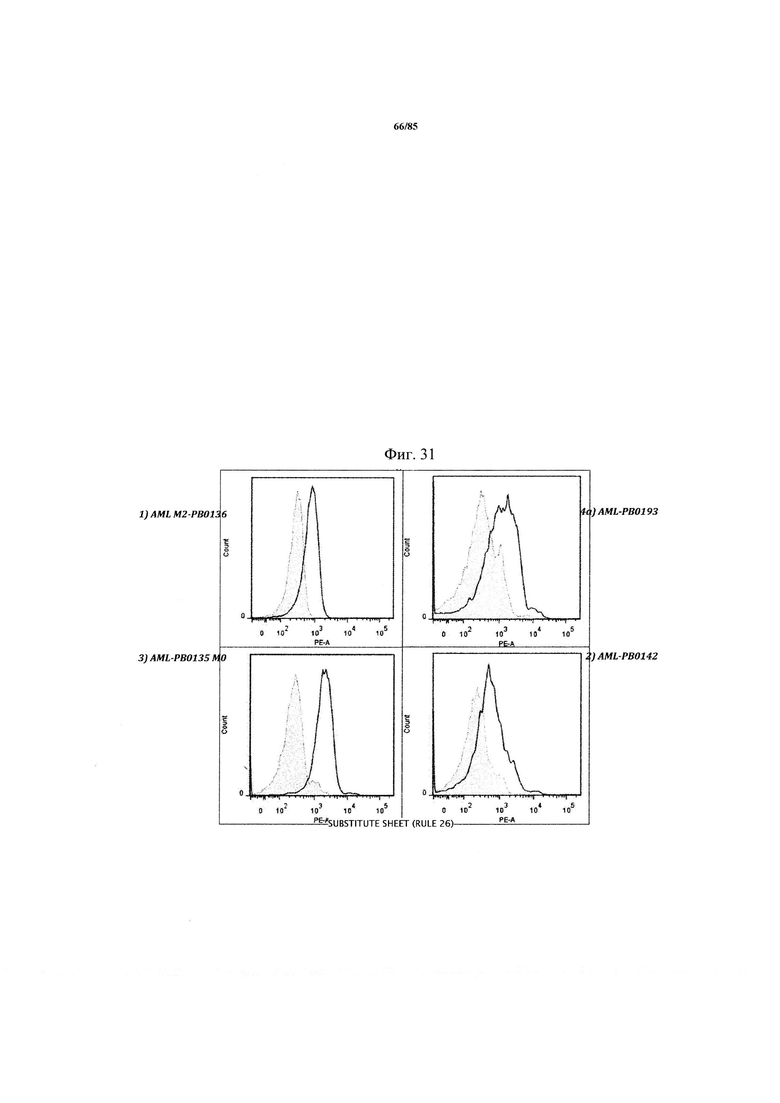
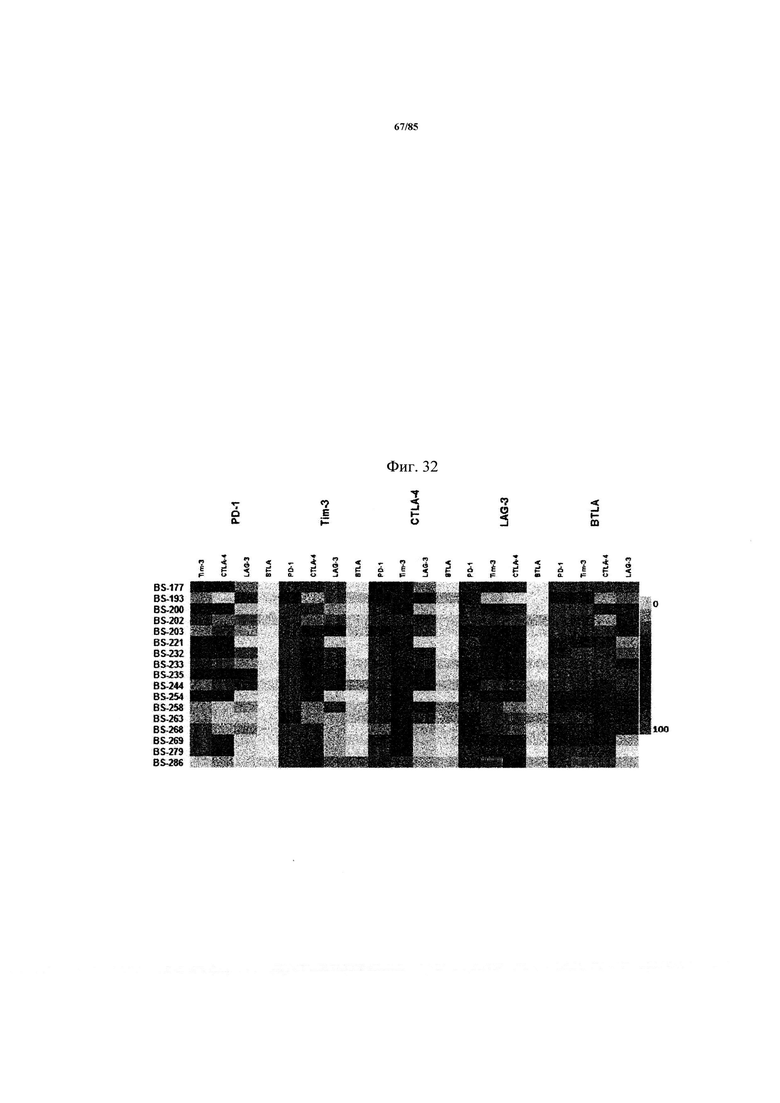
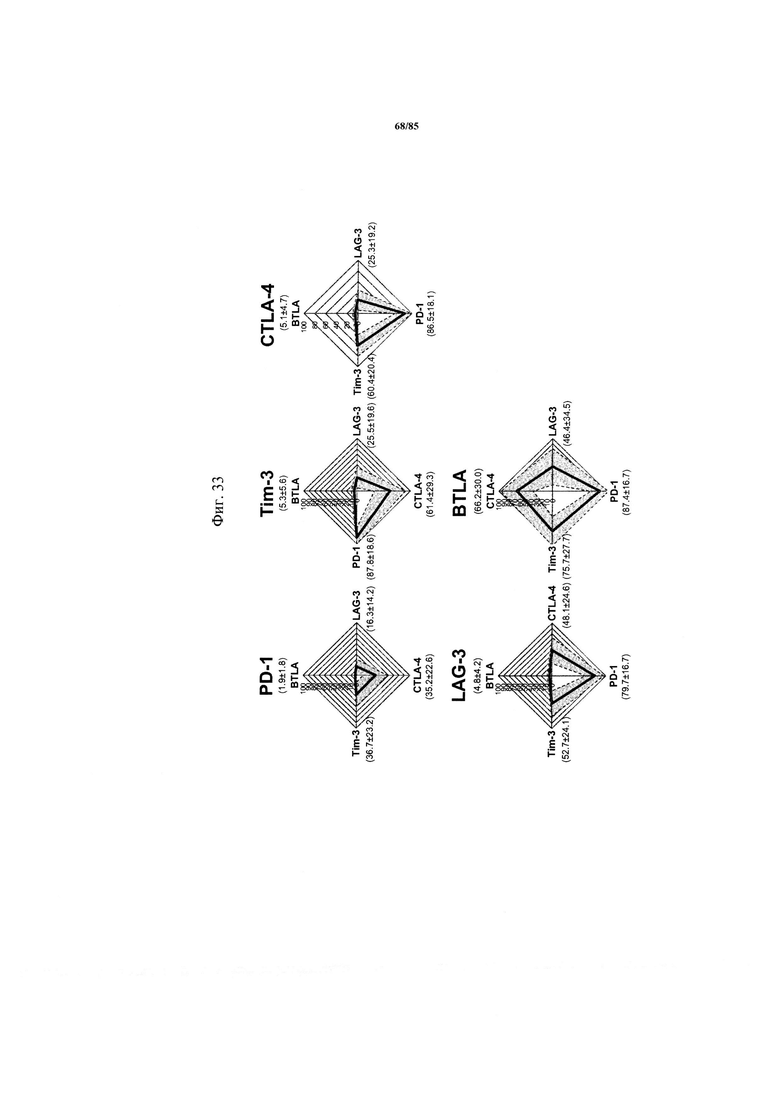
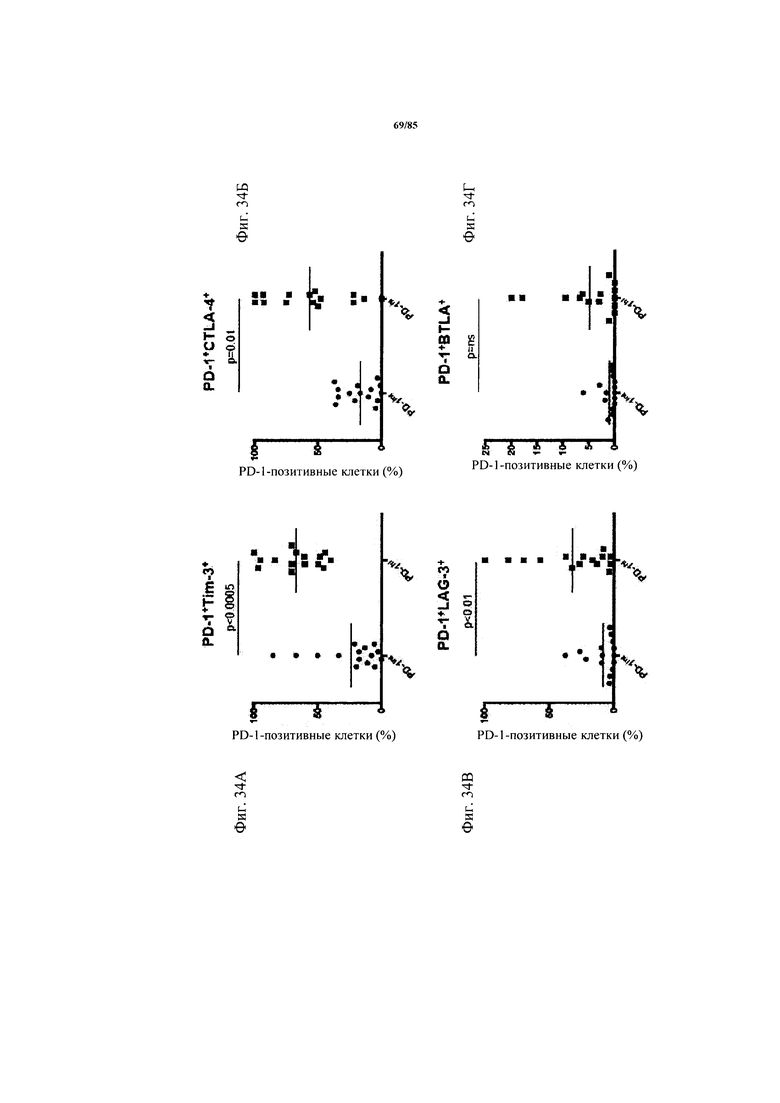
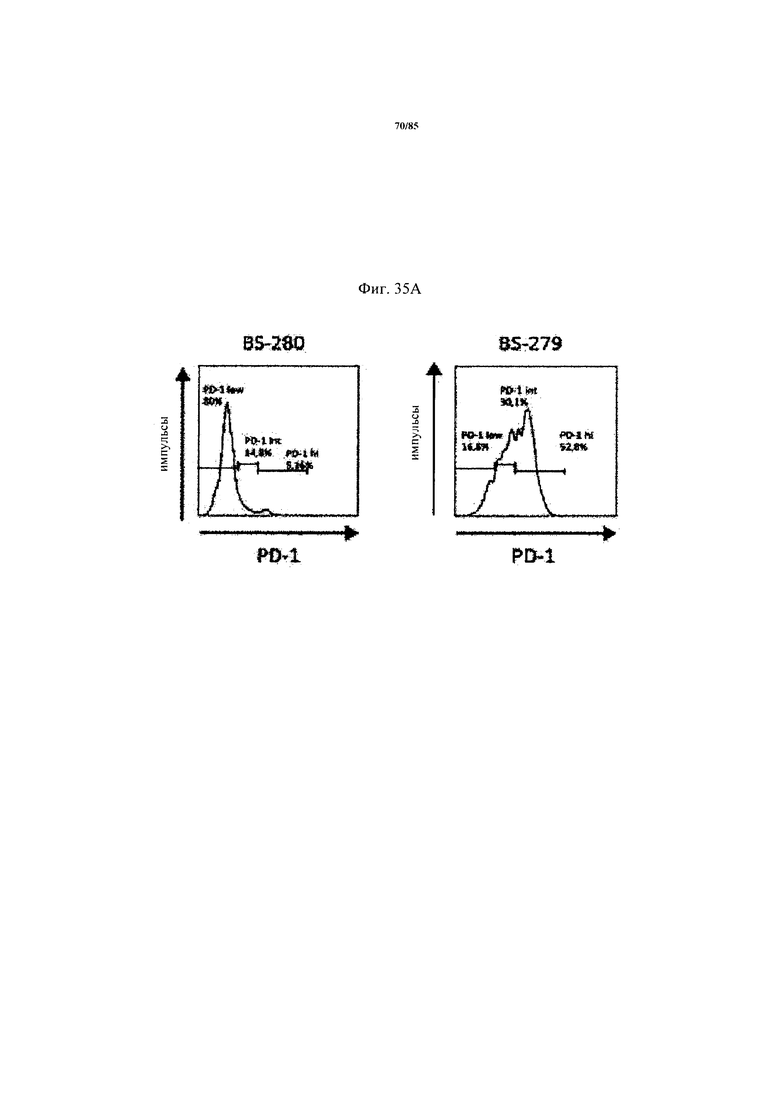
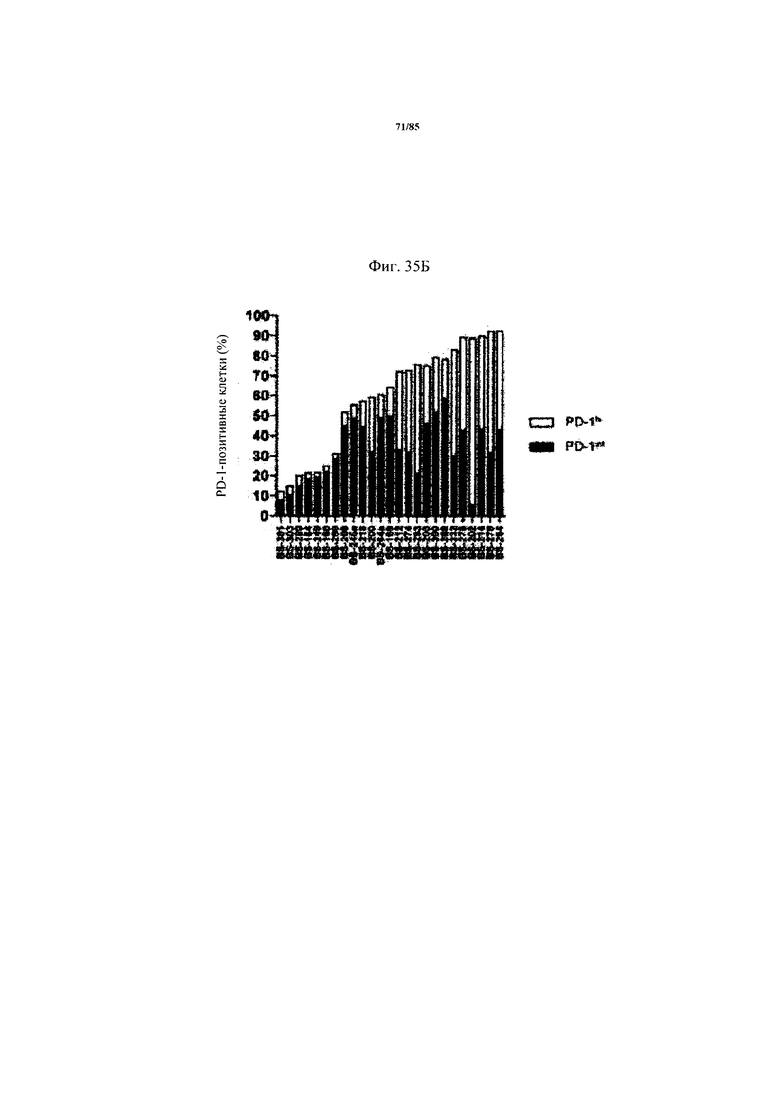
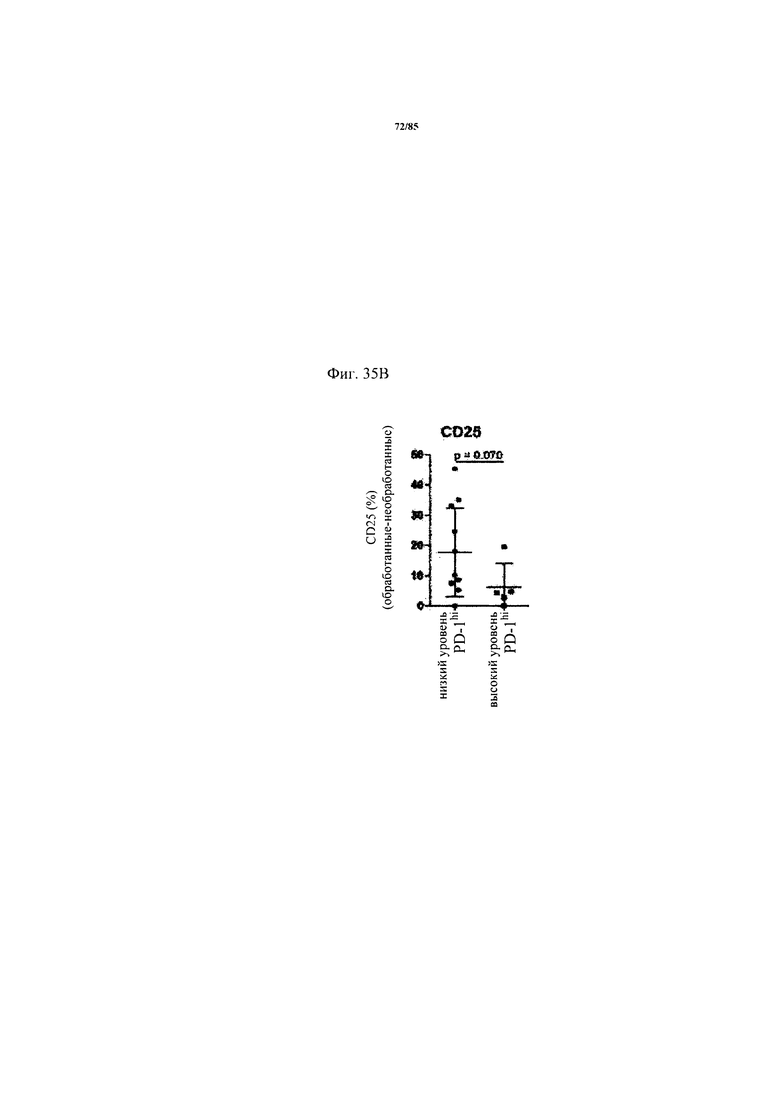
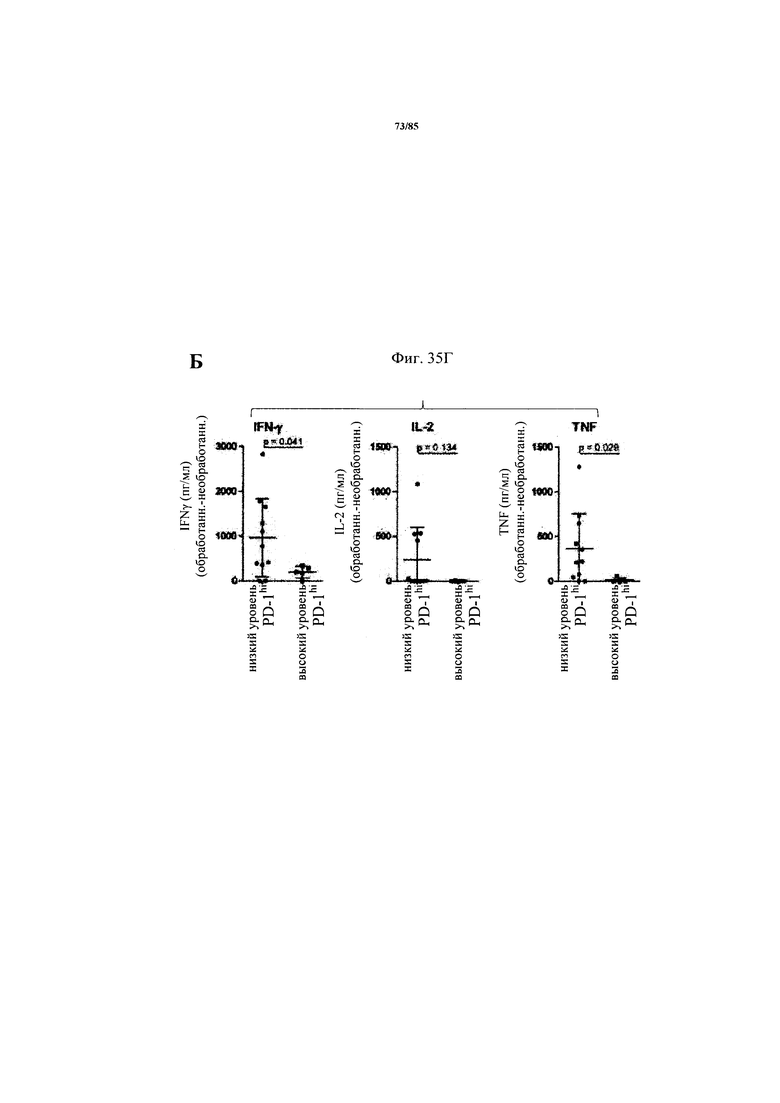
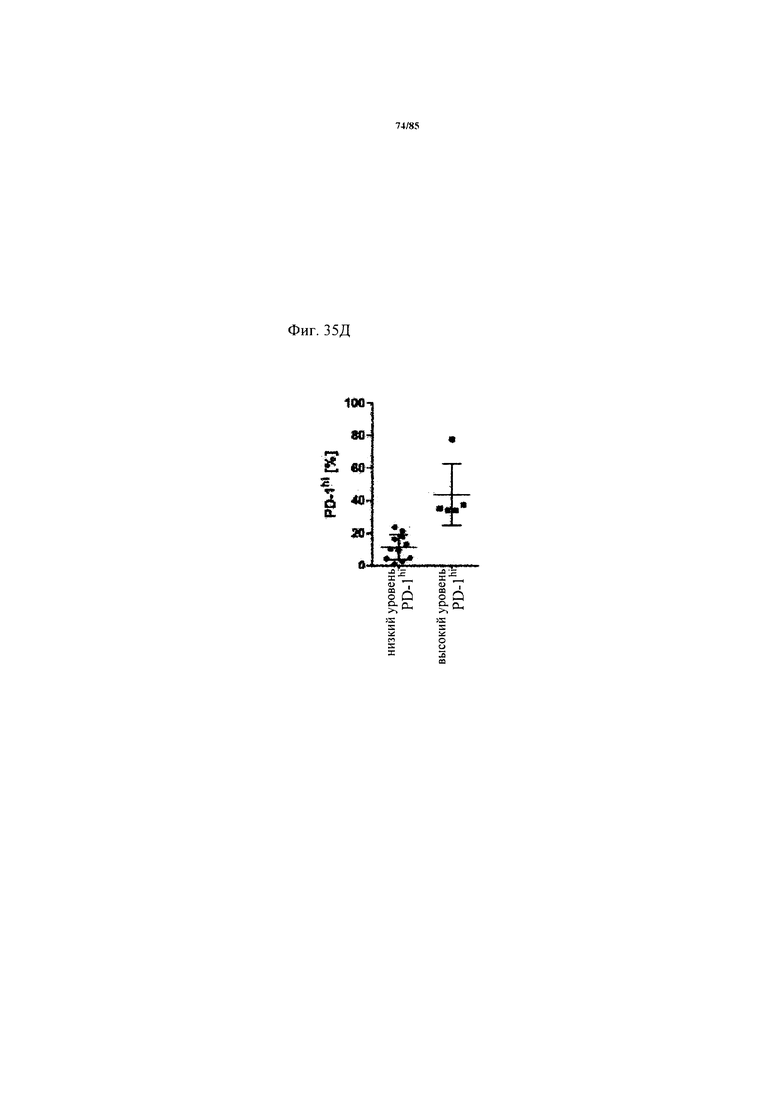
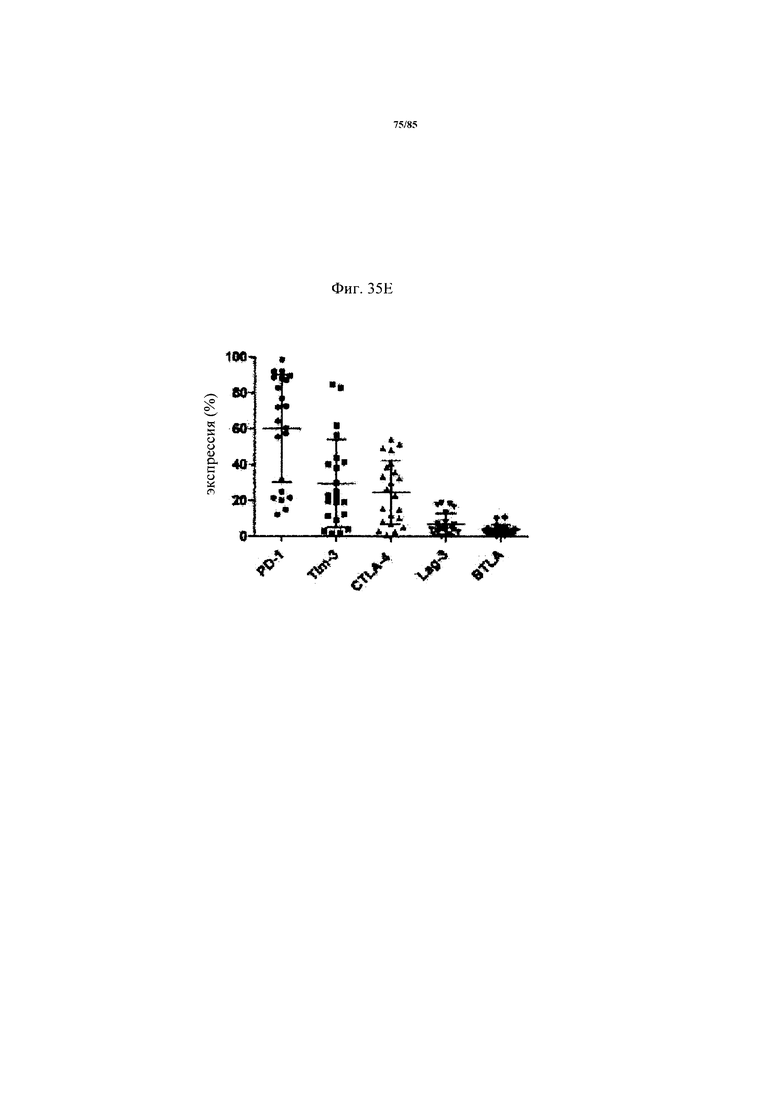
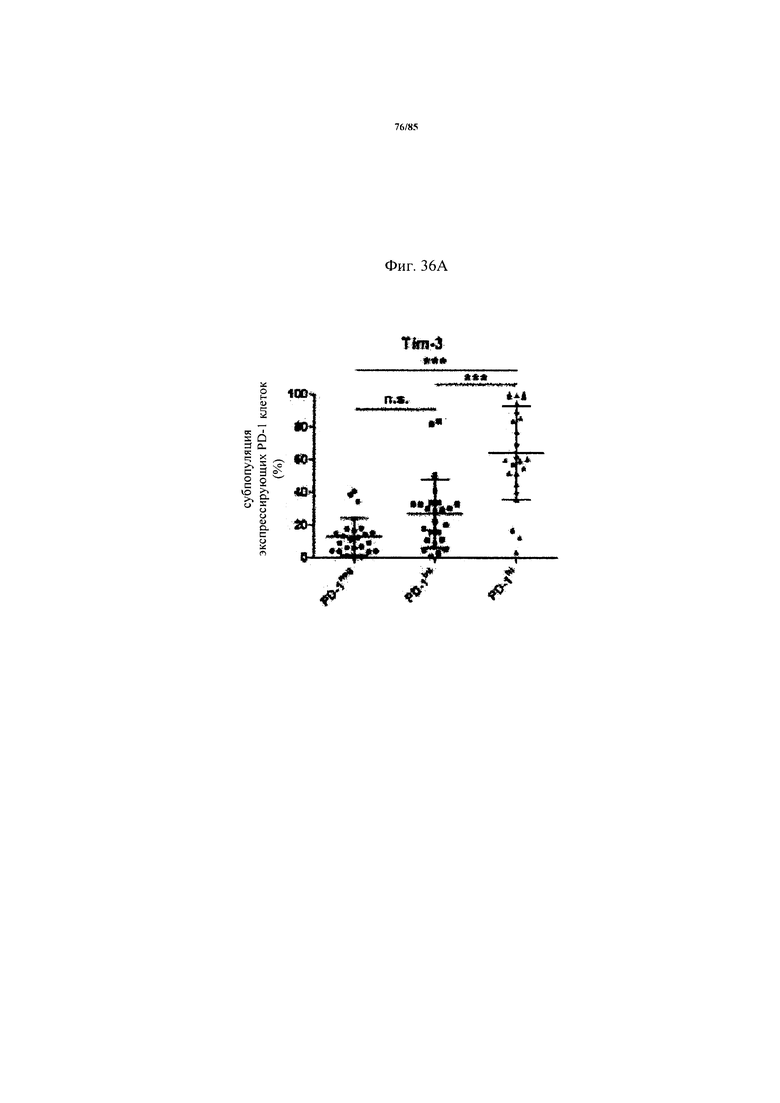
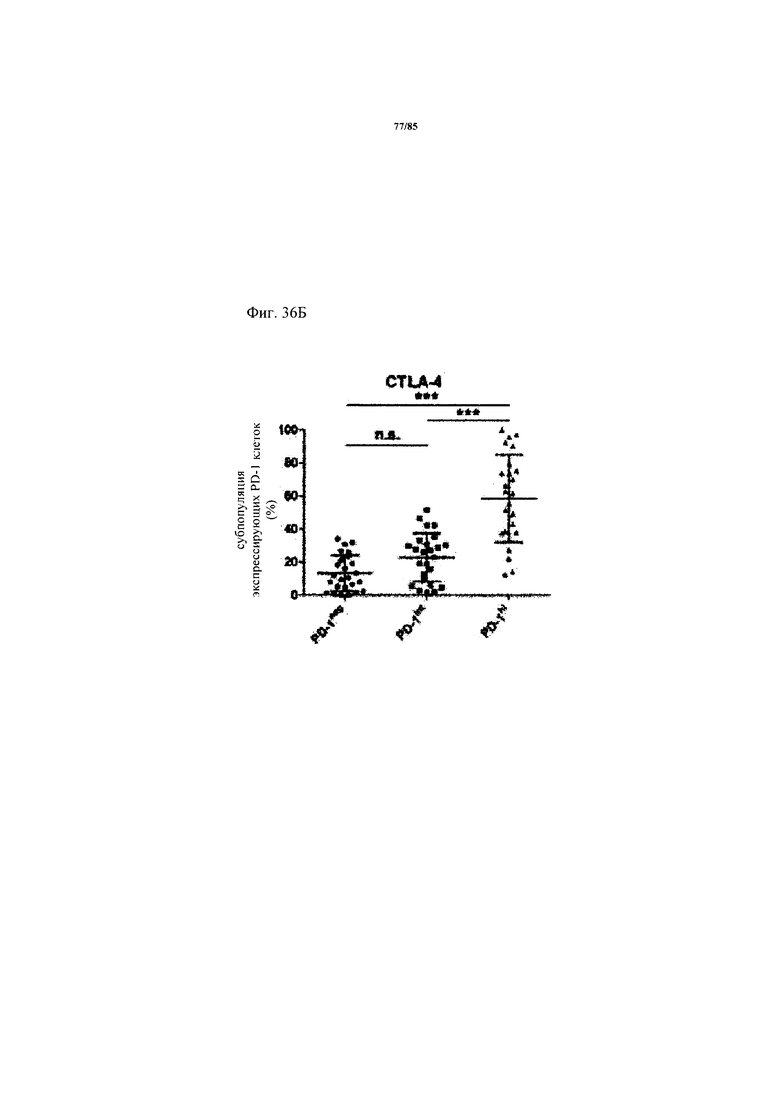
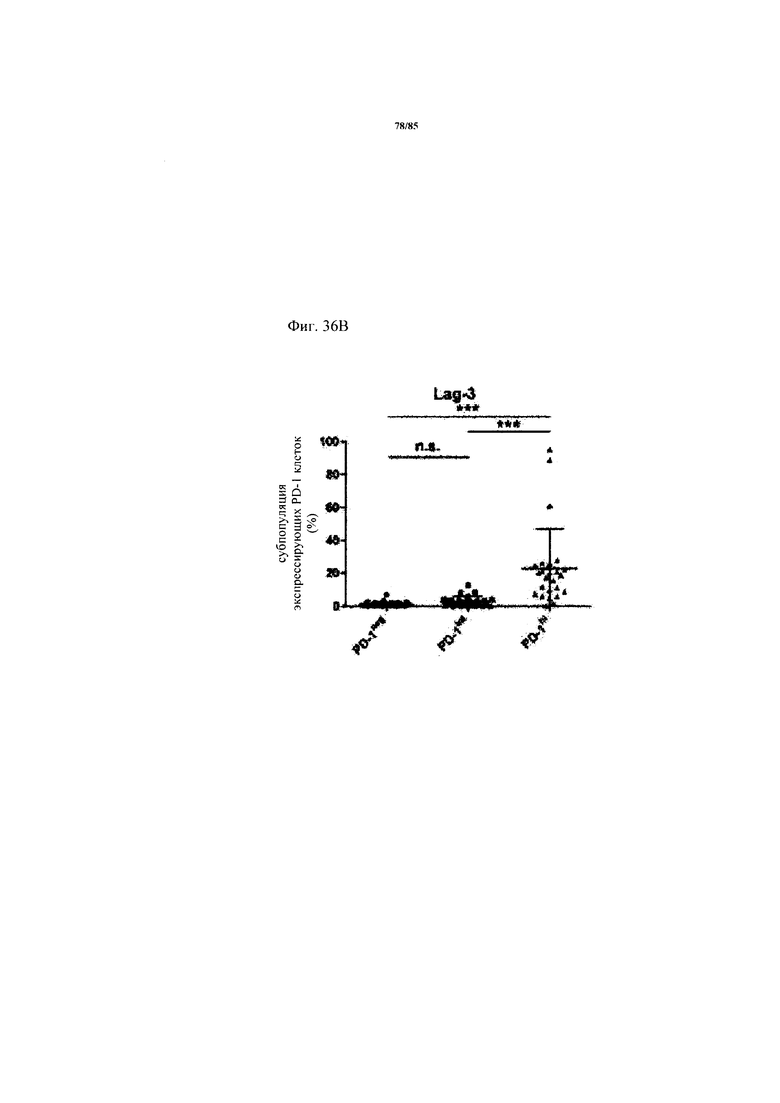
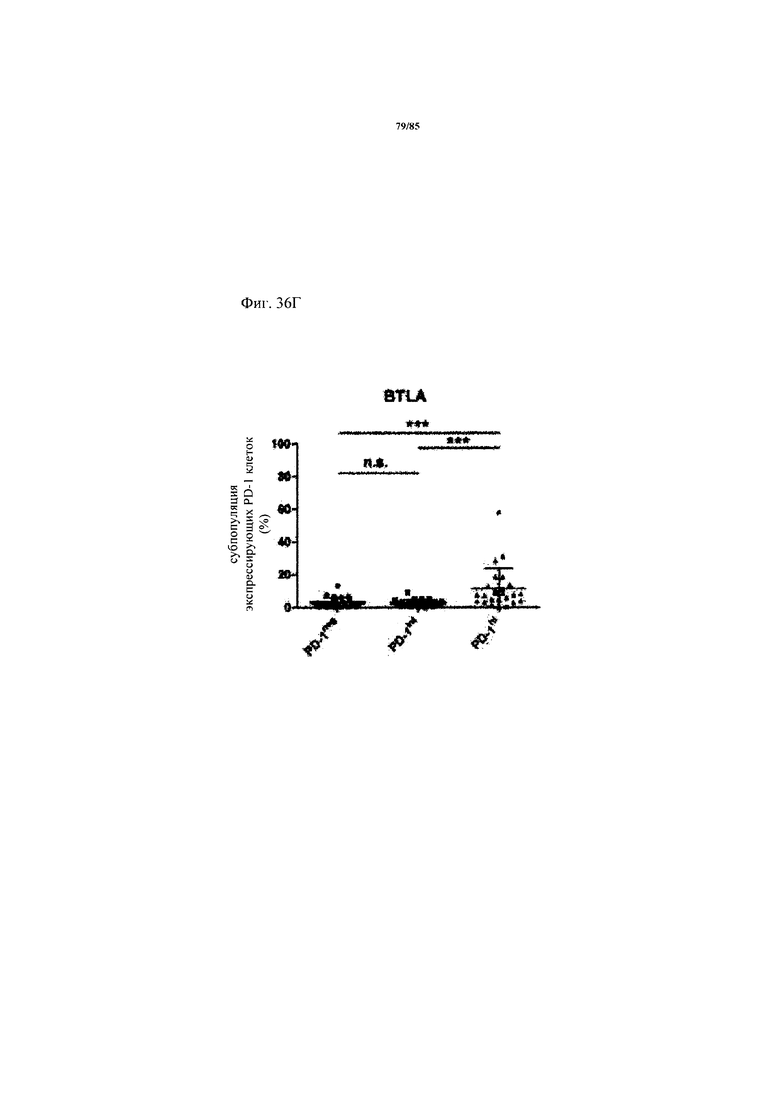
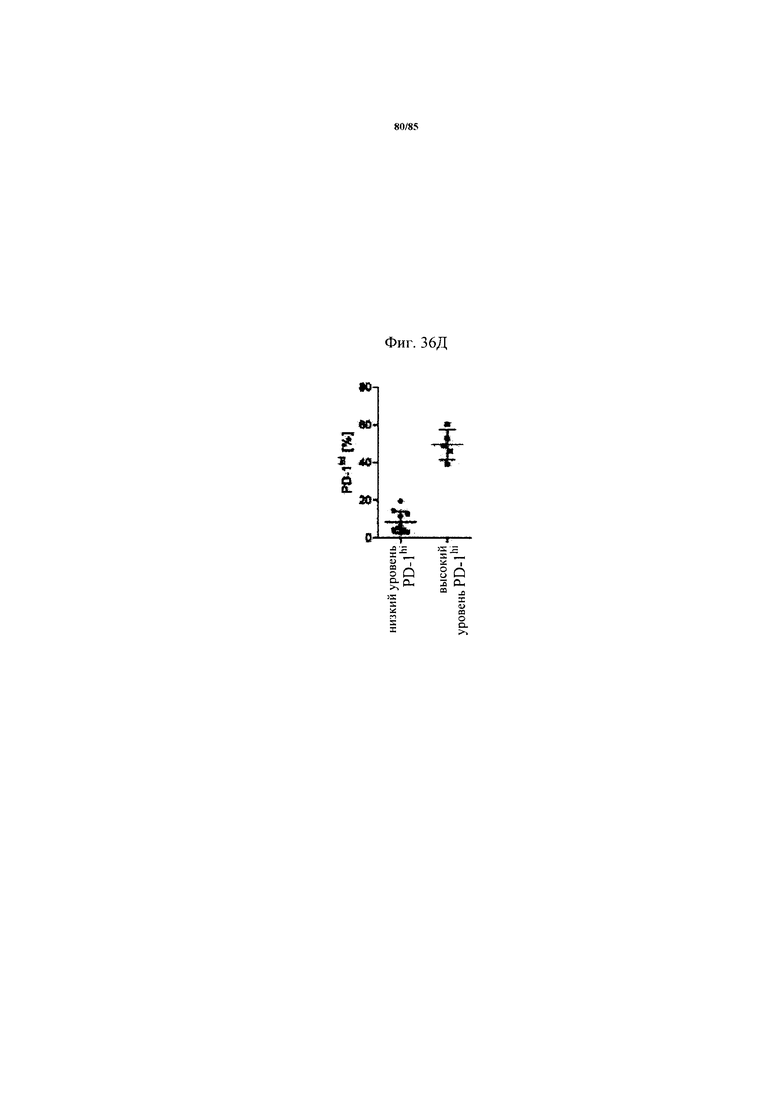
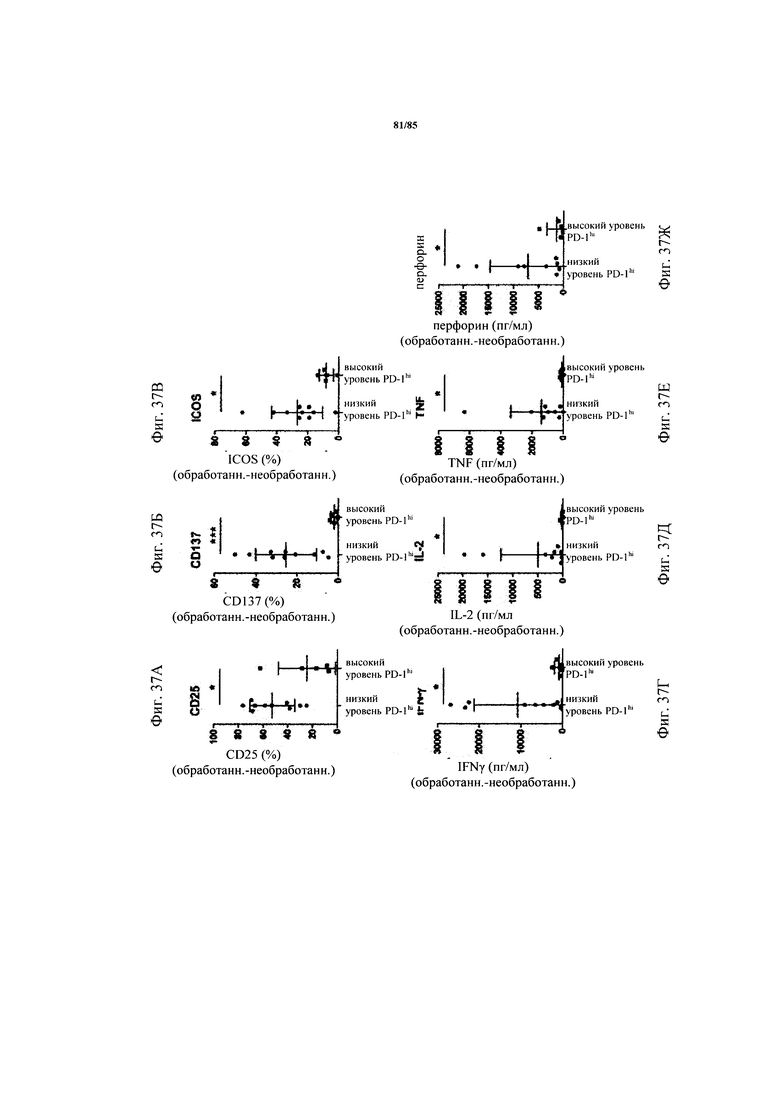
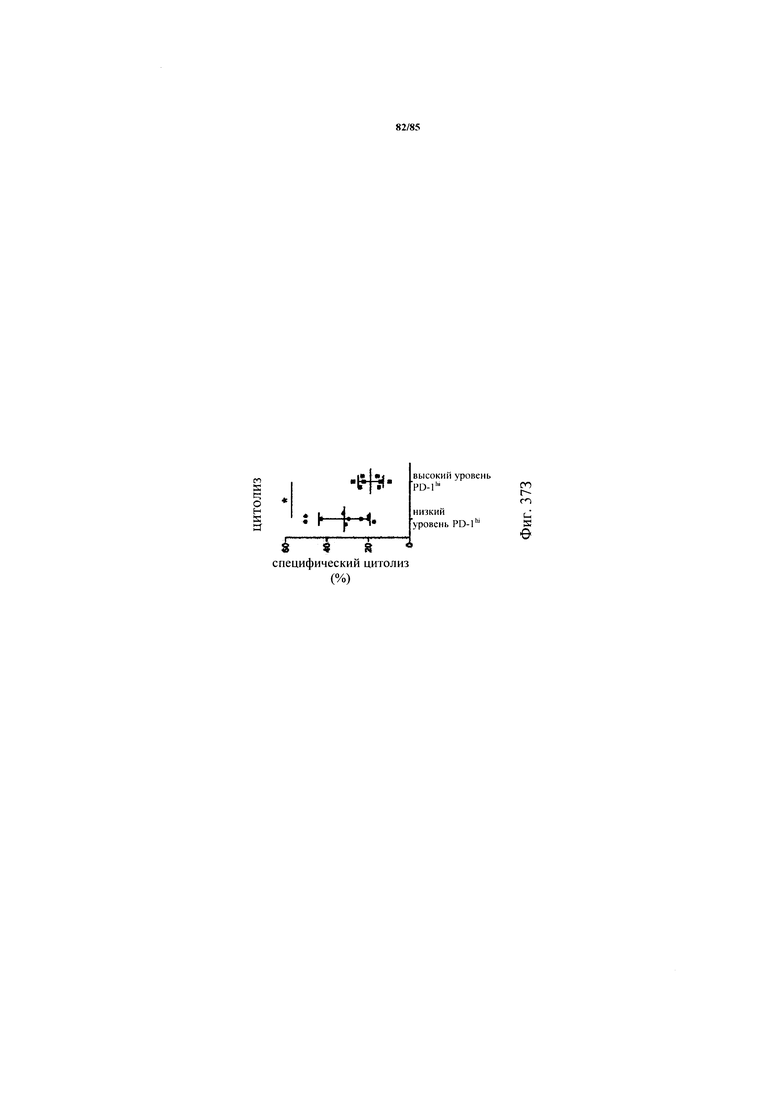
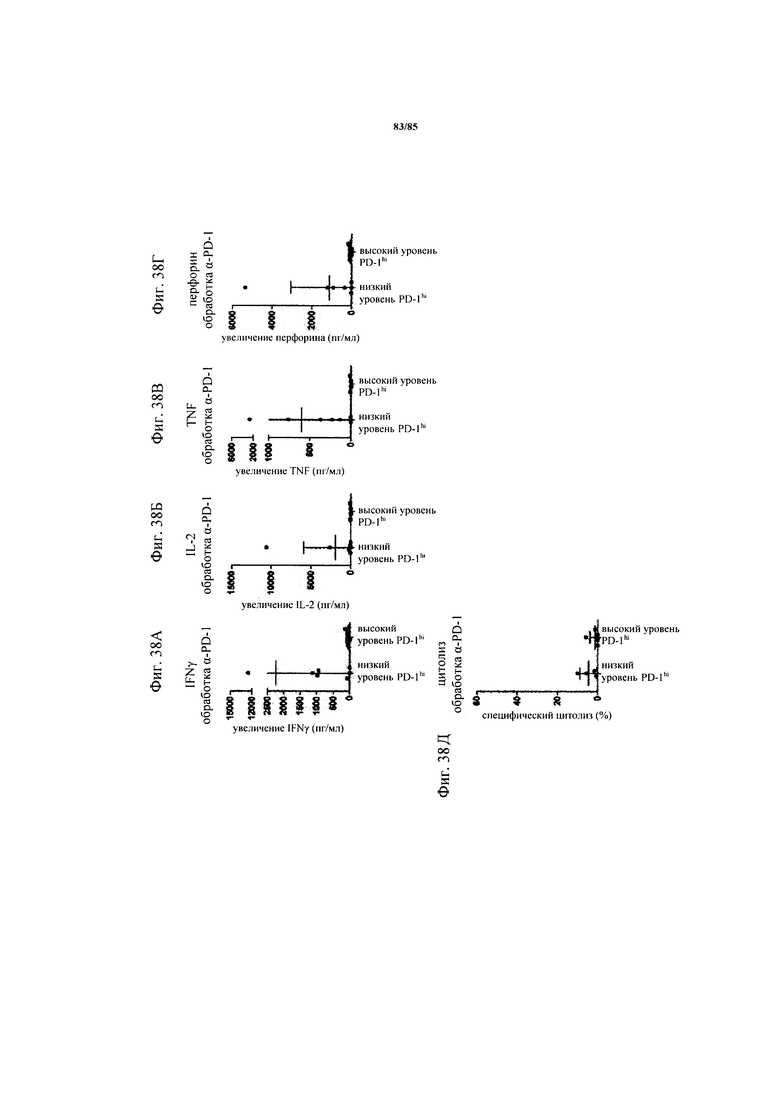

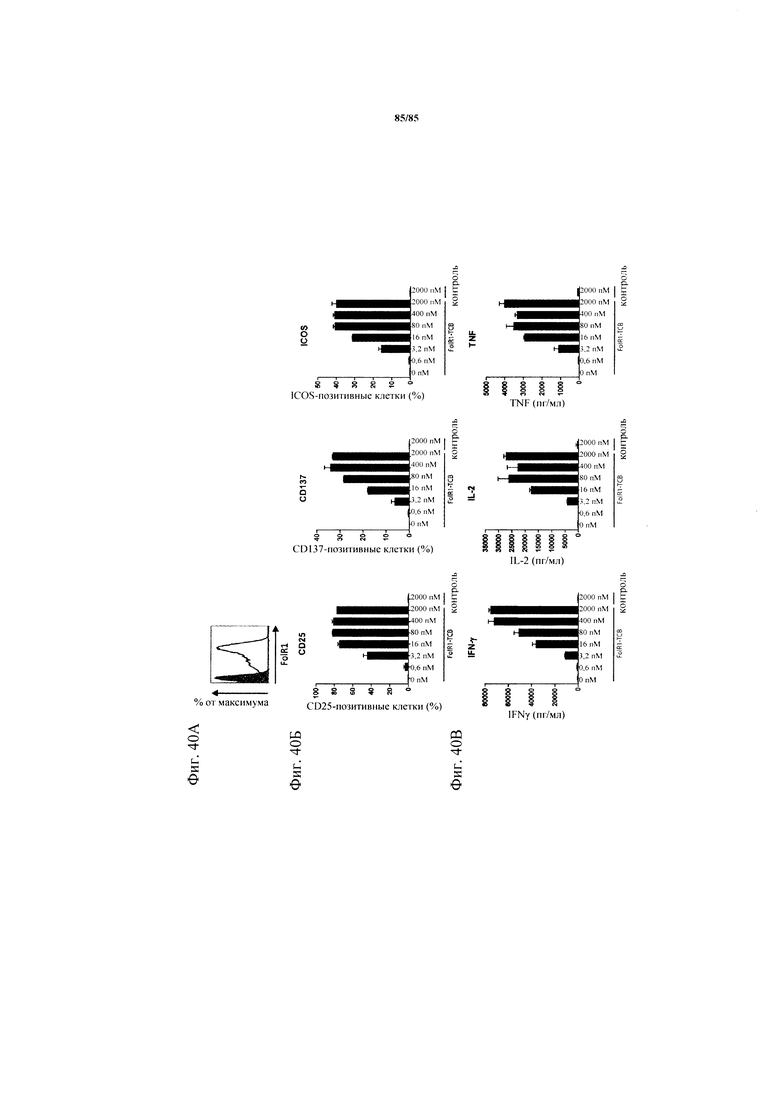
Изобретение относится к области биотехнологии, конкретно к способу лечения или замедления развития экспрессирующего FolR1-рака у индивидуума. Способ включает введение индивидууму биспецифической антигенсвязывающей молекулы, связывающейся с CD3 и FolR1, и антагониста, связывающегося с осью PD-1. 2 н. и 28 з.п. ф-лы, 40 ил., 49 табл., 50 пр.
1. Способ лечения или замедления развития экспрессирующего FolR1-рака у индивидуума, включающий введение индивидууму в эффективном количестве активирующей Т-клетку биспецифической антигенсвязывающей молекулы и антагониста, связывающегося с осью PD-1, где активирующая Т-клетку биспецифическая антигенсвязывающая молекула содержит первый Fab-фрагмент, обладающий способностью связываться с CD3, а второй Fab-фрагмент обладает способностью связываться с фолатным рецептором 1 (FolR1), и Fc-домен, в котором антагонист связывания оси PD-1 ингибирует связывание PD-1 с его партнерами по связыванию лиганда, при этом антагонист связывания оси PD-1 выбран из группы, состоящей из антитела анти-PD-1, антитела PD-L1 и антитела анти-РD-L2.
2. Способ по п. 1, в котором первый антигенсвязывающий фрагмент содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, которая состоит из SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, и пo меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
3. Способ по п. 1 или 2, в котором первый Fab-фрагмент содержит вариабельную тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31.
4. Способ по любому из пп. 1-3, в котором активирующая Т-клетку биспецифическая антигенсвязывающая молекула дополнительно содержит третий Fab-фрагмент, обладающий способностью специфически связываться с FolR1.
5. Способ по п. 4, в котором второй и третий Fab-фрагменты, обладающие способностью специфически связываться с FolR1, содержат идентичные последовательности гипервариабельного участка (CDR) тяжелой цепи и CDR легкой цепи.
6. Способ по п. 5, в котором третий Fab-фрагмент идентичен второму Fab-фрагменту.
7. Способ по любому из предыдущих пунктов, в котором Fab-фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18, и пo меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
8. Способ пo п. 7, в котором Fab-фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит вариабельную тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 15, и вариабельную легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 31.
9. Способ по любому из пп. 1-6, в котором Fab-фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, которая состоит из SEQ ID NO: 8, SEQ ID NO: 56 и SEQ ID NO: 57, и пo меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 65.
10. Способ пo п. 9, в котором Fab-фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит вариабельную тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 55, и вариабельную легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 64.
11. Способ по любому из пп. 1-6, в котором Fab-фрагмент, обладающий способностью специфически связываться с фолатным рецептором 1 (FolR1), содержит аминокислотную последовательность по меньшей мере одного гипервариабельного участка (CDR) тяжелой цепи, выбранную из группы, которая состоит из SEQ ID NO: 16, SEQ ID NO: 402 и SEQ ID NO: 400, и пo меньшей мере одного CDR легкой цепи, выбранную из группы SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34.
12. Способ по п. 11, в котором Fab-фрагмент, обладающий способностью специфически связываться FolR1, содержит:
(а) аминокислотную последовательность гипервариабельного участка 1 тяжелой цепи (CDR-H1) SEQ ID NO: 16;
(б) аминокислотную последовательность CDR-H2 SEQ ID NO: 402;
(в) аминокислотную последовательность CDR-H3 SEQ ID NO: 400;
(г) аминокислотную последовательность гипервариабельного участка 1 легкой цепи (CDR-L1) SEQ ID NO: 32;
(д) аминокислотную последовательность CDR-L2 SEQ ID NO: 33, и
(е) аминокислотную последовательность CDR-L3 SEQ ID NO: 34.
13. Способ по п. 12, в котором Fab-фрагмент, обладающий способностью специфически связываться с FolR1, содержит вариабельную тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 401, и вариабельную легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 31.
14. Способ по любому из предыдущих пунктов, в котором антитело к PD-L1 представляет собой моноклональное антитело.
15. Способ по любому из предыдущих пунктов, в котором антитело к PD-L1 представляет собой фрагмент антитела, выбранный из группы, которая состоит из Fab-, Fab’-SH-, Fv-, scFv- и (Fab’)2-фрагментов.
16. Способ по любому из предыдущих пунктов, в котором антитело к PD-L1 представляет собой гуманизированное антитело или человеческое антитело.
17. Способ по любому из предыдущих пунктов, в котором антитело к PD-L1 содержит тяжелую цепь, содержащую HVR-H1, который имеет SEQ ID NO: 289, HVR-H2, который имеет SEQ ID NO: 290, и HVR-H3, который имеет SEQ ID NO: 291; и легкую цепь, содержащую HVR-L1, который имеет SEQ ID NO: 292, HVR-L2, который имеет SEQ ID NO: 293, и HVR-L3, который имеет SEQ ID NO: 294.
18. Способ по любому из предыдущих пунктов, в котором антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 280 или SEQ ID NO: 281, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 383.
19. Способ по любому из пп. 1-18, включающий также дополнительное введение индивидууму антагониста Т-клеточного иммуноглобулина и домена 3 муцина (TIM3), где TIM3 антагонист является анти-ТIМ3 антителом.
20. Способ по п. 19, в котором антитело к TIM3 представляет собой моноклональное антитело.
21. Способ по п.19 или 20, в котором антитело к TIM3 представляет собой человеческое, гуманизированное или химерное антитело.
22. Способ по любому из пп. 19-21, в котором антитело к TIM3 представляет собой фрагмент антитела, который связывается с TIM3.
23. Способ по любому из пп. 19-22, в котором антитело к TIM3 представляет собой Fab-фрагмент.
24. Способ по любому из пп. 1-23, в котором антагонист, связывающийся с осью PD-1, вводят перед FolR1-TCB.
25. Способ по любому из пп. 1-23, в котором антагонист, связывающийся с осью PD-1, вводят одновременно с FolR1-TCB.
26. Способ по любому из пп. 1-23, в котором антагонист, связывающийся с осью PD-1, вводят после FolRl-TCB.
27. Способ по любому из пп. 1-26, в котором рак выбирают из группы, состоящей из рака яичника, рака легкого, рака молочной железы, рак почки, колоректального рака, рака эндометрия.
28. Способ по любому из пп. 1-27, в котором по меньшей мере один из таких компонентов, как активирующая Т-клетку биспецифическая антигенсвязывающая молекула и антагонист, связывающийся с осью PD-1, вводят внутривенно, внутримышечно, подкожно, местно, орально, чрескожно, внутрибрюшинно, внутриглазнично, путем имплантации, путем ингаляции, внутритрахеально, внутрь желудочков или внутриназально.
29. Набор, содержащий активирующую Т-клетку биспецифическую антигенсвязывающую молекулу, специфическую в отношении фолатного рецептора 1 (FolR1) и CD3, и антагонист, связывающийся с осью PD-1, для лечения или замедления развития экспрессирующего FolR1-рака у индивидуума, где связывающийся с осью PD-1 антагонист является анти-PD-l антителом или анти-PDL-l антителом.
30. Набор по п. 29, который дополнительно содержит антагонист TIM3, где антагонистом TIM3 является анти-ТIМ3 антитело.
| CUI H | |||
| et al., Chemically programmed bispecific antibodies that recruit and activate T cells, Journal of Biological Chemistry, 2012, V | |||
| СПОСОБ ИЗГОТОВЛЕНИЯ ЧЕРТЕЖЕЙ ДЛЯ ОДНООБРАЗНОЙ РАСКРОЙКИ ПРЕДМЕТОВ ОДЕЖДЫ | 1919 |
|
SU287A1 |
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| WO 2006121168 A1, 16.11.2006 | |||
| WO 2014131712 A1, 04.09.2014 | |||
| WO 2011159877 A2, 22.12.2011 | |||
| KOPANTZEV E | |||
| P | |||
| et al., Differences in gene expression levels between early and later stages of | |||
Авторы
Даты
2021-08-24—Публикация
2015-11-16—Подача