Изобретение относится к области онкологии, иммунологии, клеточных технологий и биоинженерии и может быть использовано для терапии солидных опухолей, в частности, рака молочной железы и рака яичников.
Известно, что применение клеточных продуктов на основе генетически модифицированных лимфоцитов, экспрессирующих CAR (chimeric antigen receptor, химерный антигенный рецептор) к различным дифференцировочным и опухоль-ассоциированным антигенам (в частности, HER 2), перспективно для лечения рецидивирующих или рефрактерных В-клеточных лейкозов и солидных опухолей различного гистогенеза.
Из уровня техники известен БМКП, аналогичный заявляемому, для терапии солидных опухолей «CAR-экспрессирующие NK-92 клетки в качестве клеточных терапевтических агентов» [WO 2015/193411 А1, 23.12.2015]. Патент описывает клеточный продукт, полученный из опухолевых клеток линии NK-92 с CAR к рецептору эпидермального фактора роста ErbB2, и включает в себя методы получения и идентификации эффекторных клеток из опухолевой клеточной культуры NK-92, экспрессирующих специфичный химерный антигенный рецептор к ErbB2 (содержащие лентивирусный вектор, кодирующий химерный антигенный рецептор ErbB2, состоящий из ErbB2-специфичного scFv фрагмента, шарнирного участка, трансмембранного и внутриклеточного доменов CD28 и внутриклеточного домена зета CD3). Основным недостатком описанного в патенте продукта является применение in vivo клеточной линии NK-92, являющейся злокачественной неходжкинской лимфомой, что несет в себе риски экспансии злокачественного клона с вытеснением нативного и бактериальной или вирусной контаминации. Помимо этого, использование
данной клеточной линии требует предварительного гамма-облучения, что чревато логистическими трудностями, или инкубирования с митомицином С, который, в свою очередь, невозможно полностью элиминировать из суспензии клеток, планируемой к введению пациенту.
Другим известным аналогом является терапевтический продукт на основе однородной популяции CAR-T, либо CAR-NK клеток «Терапия конструктами химерных антигенных рецепторов (CAR) и Т-клетками (CAR-Т) или NK клетками (CAR-NK), экспрессирующими CAR конструкты» [WO 2016/201300 A1, 15.12.2016]. Изобретение характеризует клеточный продукт, состоящий из однородного пула CAR-клеток (CAR-T клеток или CAR-NK), подвергшихся предварительной селекции, последующей трансфекции и добавлением цитокинов и антиген-стимулирующих агентов. Недостатком данного продукта является однородность его популяционного состава CAR-клеток: CAR-T или CAR-NK, что сопряжено с методологическими трудностями, т.к. на этапе селекции таргетной популяции CAR - клеток происходят значительные потери клеточного продукта.
Другой аналогичный клеточный продукт на основе CAR-T, описанный в патенте «Универсальные Т-клетки киллеры» [WO 2016116601, 28.07.2016], предполагается получать из генетически модифицированных неиммуногенных NK, несущих рецептор Т-клеток. Недостатком приведенного продукта является происхождение CAR-T клеток, которые в данном случаев являются аллогенными, что, помимо необходимости в предварительной селекции и последующей модификации NK клеток в Т-клетки с экспрессией TcR рецептора, сопряжено с модификацией клеток с целью снижения их иммуногенности.
Известен аналогичный продукт для CAR-T клеточной терапии, описанный в патенте «Химерные антигенные рецепторы для терапии опухолей» [WO 2018067992, 12.04.2018], представленный пулом Т или NK клеток с химерным рецептором к антигенам В-клеток, генетически
модифицированных в целях экспрессии рецептора к новым антиген связывающим сайтам молекул CD20 или CD22. Предназначен для терапии В-клеточных лейкозов. Основное показание к применению продукта и является, с другой стороны, его основным недостатком, т.к. данный продукт не может применяться в терапии солидных опухолей ввиду их значительного отличия от гемобластозов.
Известен продукт на основе CAR-T клеток, описанный в патенте «Химерные антигенные рецепторы, направленные на TIM1» [WO/2018/132695, 19.07.2018], который включает в себя однородный пул либо Т-, либо NK- клеток с химерным антигенным рецептором к Т-клеточному иммуноглобулину и опухоль-ассоциированному антигену муциновому домену 1 (TIM1, T-cell immunoglobulin and mucin domain 1). Недостатком данного продукта, помимо однородного состава применяемой клеточной популяции, является невозможность его назначения при раке яичника и/или раке молочной железы ввиду значимого повышения уровня экспрессии рецептора TIM1 на злокачественных клеток при колоректальном раке.
Также известен клеточный продукт, описанный в патенте «Методы и компоненты для трансдукции и обогащения лимфоцитов и их регулирования» [WO/2018/161064, 07.09.2018], представленный только популяцией трансдуцированных Т и/или NK клеток. Данный продукт не содержит популяции лимфокин-активированных киллеров, что является его основным недостатком, т.к. наличие данной популяции наряду с CAR-T клетками обеспечивает более высокую эффективность продукта в сравнении с применением CAR-T-NK без лимфокин-активированных киллеров.
Прототипом заявляемого изобретения является БМКП, описанный в патенте «Улучшенный метод генерации генетически модифицированных клеток» [ЕР 3018200 A1, 11.05.2016]. Прототип описывает БМКП на основе популяций CAR-T-NK клеток, подвергнутых поэтапно трансдукции и активации различными цитокинами (предпочтительно INFγ), антиген-
стимулирующими агентами и антиген-презентирующими клетками, подвернутыми гамма-излучению или обработке митомицином С. Упомянутый метод включает в себя следующие этапы вне зависимости от их очередности: невирусную трансфекцию культуры мононуклеарных клеток (в том числе цитокин-индуцированных клеток) одной или более нуклеиновой кислотой, кодирующей Т-клеточный рецептор и/или химерный антигенный рецептор (к рецепторам CD19, CD123, CD20, CD23, CRLF2, CD44v6, CD33, CS1 CD38, Her2, EGFr и СА125) или их комбинацию; добавление к культуре мононуклеарных клеток / цитокин-индуцированных клеток антиген презентирующих («вспомогательных» или «питательных») клеток; добавление одного или более антиген стимулирующих агентов. Недостатком этого метода является необходимость в генерации искусственных антиген презентирующих клеток, для чего необходимо их инкубирование с препаратом митомицин С, который невозможно полностью элиминировать перед введением реципиенту клеточного продукта, или подвергание клеток гамма-облучению, что являет собой технические и логистические затруднения. Отказаться от этапа добавления искусственных антиген презентирующих клеток также не представляется целесообразным ввиду их благотворного влияния на трансфицированные клетки [1], в связи с чем в предлагаемом нами методе может использоваться супернатант от антиген презентирующих клеток при культивировании цитокин-индуцированных клеток с химерным антигенным рецептором. Другим недостатком этого метода является использование векторов с различными вариантами генетических структур (транспозоны, транспозазы, нуклеазы «цинковые пальцы», sleeping beauty, PiggyBac, TALEs и проч), обеспечивающих интеграцию вводимого генетического конструкта в геном клетки, что требует проведения глубокого секвенирования перед введением клеточного продукта реципиенту и сопряжено с необходимостью в генерации более многочисленного клеточного продукта. Помимо этого, подобные процессы несут риски эктопической вставки, что может иметь неблагоприятные
последствия в виде потери эффективности вводимого реципиенту клеточного продукта или формирования из последнего злокачественных клонов. [2]
Целью представляемого нами изобретения является терапия рака яичника и молочной железы биомедицинским клеточным продуктом на основе анти-HER2 CAR-T-NK и лимфокин-активированных киллеров.
Предлагаемое нами изобретение представляет собой БМКП со специфической противоопухолевой активностью, представленный тремя популяциями клеток: анти-HER2 CAR-T, анти-HER2 CAR -NK и лимфокин-активированными киллерами с ограниченным периодом экспрессии химерного антигенного рецептора (3-5 суток), характеризующийся ускоренным периодом получения (менее чем 9 суток), чья эффективность сопровождается одновременной активацией врожденного и адоптивного иммунного ответов, предназначенный для лечения пациентов с солидными опухолями, экспрессирующими рецептор эпидермального фактора роста (HER2). Заявляемый продукт получен из аутологичных мононуклеарных лимфоцитов, активированных препаратом человеческого рекомбинатного цитокина и подвергнутых генетической модификации с целью экспрессии анти-HER2 CAR.
Сходство прототипа с заявляемым изобретением заключается в выборе аутологичного биологического материала как источника эффекторных клеток, включение популяции цитокин-активированных клеток (в том числе, генетически модифицированных), использование HER2 в качестве мишени для конструкции химерного антигенного рецептора.
Преимуществами заявленного изобретения в сравнении с прототипом являются: 1) в состав предлагаемого БМКП входят 3 клеточные эффекторные популяции, которые формируют состав заявляемого продукта, обеспечивая его эффективность посредством прямого специфического противоопухолевого воздействия и через активацию врожденного звена иммунитета; 2) четко ограниченный во времени (3-5 суток) период существования клона CAR-T и CAR-NK клеток, экспрессирующего
таргетный рецептор, что обеспечивает снижение побочных эффектов, обусловленных неспецифическим межклеточным взаимодействием, а также замещением аутологичного клона Т-лимфоцитов химерным; 3) отсутствие необходимости в глубоком секвенировании продукта перед его использованием, требующем увеличенного объема продукта в сравнении с заявляемым; 4) отсутствие необходимости введения дополнительной клеточной фракции (антиген-презентирующих клеток), сопряженной с опасностью использования гамма-излучения и контаминации продукта митамицином; 5) отсутствие контаминации конечного продукта нефармакопейными препаратами (в частности, OKT3, рекомбинантные цитокины и т.д.); 6) снижение риска контаминации конечного продукта микроорганизмами за счет ускоренного (менее чем 9 суток) периода его получения.
Техническим результатом заявленного изобретения является получение биомедицинского клеточного продукта (БМКП) со специфической противоопухолевой активностью, представленного тремя популяциями клеток: анти-HER2 CAR-NK, анти-HER2 CAR-T-клетками и лимфокин-активированныи киллерами с ограниченным периодом экспрессии химерного антигенного рецептора (3-5 суток), характеризующегося ускоренным периодом получения (менее чем 9 суток), чья эффективность сопровождается одновременной активацией врожденного и адоптивного иммунного ответов.
Пример 1. Получение БМКП с заявленными характеристиками
Из донорской лейкотромбомассы были выделены периферические мононуклеарные лимфоциты, на вторые сутки ряда были получены лимфокин-активированные киллеры, на третьи сутки с момента выделения провели трансфекцию лимфокин-активированных киллеров вектором с химерным антигенным рецептором HER2. На 4-5 сутки после выделения периферических мононуклеарных клеток провели иммунофенотипическое исследование полученных популяций клеток методом проточной цитофлюориметрии (BD FACSCanto II, США), согласно которому CAR-T
клетки составили 25% и имели фенотип анти-HER2+CD25+CD3+; CAR-NK клетки достигали 2% и имели фенотип анти-HER2+CD16+CD56+; в общей сложности доля анти-HER2 CAR-T-NK клеток составила 34%. Лимфокин-активированные киллеры составили 43% и имели фенотипам CD16+CD56+CD38+, CD16+CD56+CD25+, CD16+CD58+CD38+ и CD16+CD58+CD25+. Повторно иммунофенотип клеток оценили спустя 5 суток после проведения трансфекции, при этом выявилось значительное снижение анти-HER2 CAR-T-NK клеток (анти-HER2 положительных клеток): с 34% до 3%. Цитотоксическая способность полученных пулов клеток оценивалась на вторые сутки после проведения трансфекции с помощью МТТ-теста (Labsystems Multiscan MS, США, длина волны 540 нм) на HER2 позитивных культур SKOV3 (рак яичника) и SkBr3 (рак молочной железы). В соотношении клеток-эффекторов к опухолевым 5:1 цитотоксичность на культуре SKOV3 составила 85%, на SkBr3 - 89%. Данный пример продемонстрировал наличие в продукте двух популяций клеток (анти-HER2 CAR-T-NK и ЛАКи); ограниченный период экспрессии химерного антигенного рецептора анти-HER2 (5 суток); специфическую противоопухолевую активность на HER2 экспрессирующих опухолевых клеточных линиях и ускоренный период получения - клетки были получены в течение 4 суток.
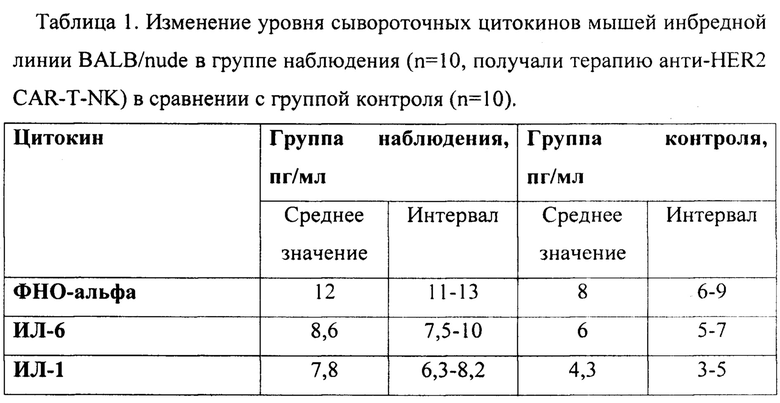
Пример 2. Влияние заявленного БМКП на показатели врожденного иммунитета у реципиента
Иммунодефицитные мыши модели инбредной линии BALB/nude с привитой опухолью SKOV3 (n=10) получали терапию лимфокин-активированными киллерами и анти-HER2 CAR-T-NK в течение 15 дней в режиме 5*10^5 клеток каждый 3й день с момента привития опухоли. В результате в сравнении с контрольной группой наблюдалось торможение роста опухоли (ТРО) 38%. Сывороточные цитокины в группе наблюдения были повышены в сравнении с контрольной группой (результаты представлены в табл. 1): ФНО-альфа на 50% (среднее значение 8 пг/мл
(интервал 6-9 пг/мл) в контрольной группе и 12 пг/мл (11-13 пг/мл) в группе наблюдения); ИЛ6 на 44% (среднее значение 6 пг/мл (интервал 5-7 пг/мл) и 8,6 пг/мл (7,5-10 пг/мл) соответственно) и ИЛ1 на 82% (среднее значение 4,3 пг/мл (интервал 3-5 пг/мл) и 7,8 пг/мл (6,3-8,2 пг/мл) соответственно). Данный пример продемонстрировал специфическую противоопухолевую активность в виде TPO38% у мышей с привитой HER-2 положительной опухолью и активацию врожденного иммунитета в виде повышения концентрации сывороточных цитокинов.
Список литературы
1. Roy A., Krzykwa Е., Lemieux R. Increased efficiency of gamma-irradiated versus mitomycin C-treated feeder cells for the expansion of normal human cells in long-term cultures. Journal of hematotherapy and stem cell research 2001; 10(6):873-80. https://doi.org/10.1089/152581601317210962
2. Li Y., Huo Y., Yu L. Quality Control and Nonclinical Research on CAR-T Cell Products: General Principles and Key Issues. Research Immunology 2019; 5 (1):122-131. https://doi.org/10.1016/j.eng.2018.12.003
| название | год | авторы | номер документа |
|---|---|---|---|
| Биомедицинский клеточный продукт со специфической противоопухолевой активностью, представленный популяциями лимфокин-активированных киллеров и анти-HER2 CAR-γδΤ-ОИЛ и анти-HER2 CAR-T-NK | 2022 |
|
RU2786210C1 |
| Биомедицинский клеточный продукт для терапии злокачественных новообразований | 2023 |
|
RU2813531C1 |
| Биодеградируемый металлический имплантат для локальной иммунотерапии пациентов с солидными опухолями | 2021 |
|
RU2780927C1 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С МУТИРОВАННЫМИ КОСТИМУЛЯТОРНЫМИ ДОМЕНАМИ CD28 | 2018 |
|
RU2800922C2 |
| УНИВЕРСАЛЬНЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809113C2 |
| СПОСОБЫ EX VIVO ЭКСПАНСИИ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2814083C2 |
| Титановый имплантат с функцией локальной иммунотерапии для остеореконструктивной хирургии и профилактики местного рецидива онкологического заболевания и способ его изготовления | 2021 |
|
RU2779367C1 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2012 |
|
RU2688185C2 |
| Биодеградируемый имплантат для локальной иммунотерапии онкологических больных | 2021 |
|
RU2780932C1 |
| БИОМАРКЕР ДЛЯ ОТБОРА ПАЦИЕНТОВ И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2009 |
|
RU2517719C2 |
Изобретение относится к области биотехнологии, конкретно к биомедицинским клеточным продуктам, и может быть использовано для экспрессии анти-HER2 CAR. Полученный продукт обладает анти-HER2 специфической противоопухолевой активностью и представлен популяциями анти-HER2 CAR-NK и анти-HER2 CAR-T клеток, а также лимфокин активированными киллерами с ограниченным периодом экспрессии химерного антигенного рецептора (3-5 суток). Продукт характеризуется ускоренным периодом получения (менее чем 9 суток), эффективность которого сопровождается одновременной активацией врожденного и адоптивного иммунного ответов, предназначенный для лечения пациентов с солидными опухолями, экспрессирующими рецептор эпидермального фактора роста (HER2). Заявляемый продукт получен из аутологичных мононуклеарных лимфоцитов, активированных препаратом человеческого рекомбинатного цитокина и подвергнутых генетической модификации с целью экспрессии анти-HER2 CAR. 1 табл., 2 пр.
Биомедицинский клеточный продукт с анти-HER2 специфической противоопухолевой активностью, представленный популяциями анти-HER2 CAR-NK клеток с фенотипом анти-HER2+CD16+CD56+CD3-, анти-HER2 CAR-T клеток с фенотипом анти-HER2+CD25+CD3+, лимфокин активированных киллеров с фенотипом CD16+CD56+CD38+, CD16+CD56+25+, CD16+CD58+CD25+, CD16+CD58+CD38+, которые получают путем выделения из донорской лейкотромбомассы периферических мононуклеарных лимфоцитов с получением из них лимфокин-активированных киллеров, последующей модификацией части клеток этой популяции путем введения нуклеиновой кислоты с целью экспрессии химерного антигенного рецептора HER2 для получения популяций анти-HER2 CAR-NK клеток и анти-HER2 CAR-T-клеток.
| ЕР 3018200 А1, 11.05.2016 | |||
| EA 201791442 A1, 31.05.2018 | |||
| СПОСОБ ПОЛУЧЕНИЯ ДЕПОНИРОВАННЫХ ЛИМФОКИН-АКТИВИРОВАННЫХ КИЛЛЕРОВ | 2009 |
|
RU2400238C1 |
| GAURAV NAYYAR et al., Overcoming Resistance to Natural Killer Cell Based Immunotherapies for Solid Tumors, 2019, Front Oncol, v.9, art | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
Авторы
Даты
2020-07-29—Публикация
2019-10-16—Подача